細胞判別方法、細胞判別用の参照データ生成方法、および細胞判別装置
【課題】細胞を非侵襲且つ高精度で判別すること
【解決手段】被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、細胞を判別するための参照データを生成する参照データ生成ステップと、細胞の振動を定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して周波数解析を行った結果を、参照データ生成ステップにて生成された参照データと照らし合わせることにより、被検体の細胞を判別する細胞判別ステップと、を備える。
【解決手段】被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、細胞を判別するための参照データを生成する参照データ生成ステップと、細胞の振動を定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して周波数解析を行った結果を、参照データ生成ステップにて生成された参照データと照らし合わせることにより、被検体の細胞を判別する細胞判別ステップと、を備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞判別方法、細胞判別用の参照データ生成方法、および細胞判別装置に関するものである。
【背景技術】
【0002】
規則正しく振動する細胞の代表的な一例として、心筋細胞がある。しかし、一般的に、細胞の多くは心筋細胞のように規則的に振動するわけではないので(例えば、下記の非特許文献1を参照)、細胞の振動に伴う規則的な周波数を用いた細胞判別は、一般的な細胞には適用できない。
【0003】
また、蛍光ラベルをせずに、生細胞の細胞膜の状態を測定する技術として、例えば走査型プローブ顕微鏡(SPM;Scanning probe microscope)や、原子間力顕微鏡(AFM;Atomic force microscope、下記の非特許文献2を参照)などが知られている。いずれもプローバーであるカンチレバーを細胞に接触あるいはオングストローム単位で接近させて細胞全体をスキャンする方式であるが、このような装置を用いて細胞判別を行うには以下のような問題点が存在する。すなわち、測定には細胞に機械的応力を加えることが必要であるため、細胞への影響を避けられない。また、生きた細胞を簡便に測定するにはある程度の熟練を要する。更に、1個1個の細胞をカンチレバーで走査する必要があるために、複数の細胞について細胞膜の変位の時間変化を計測するには長時間がかかり、現実的でない。更にまた、細胞膜の変動を指標とした細胞の識別や状態の把握にまで踏み込んだ技術はまだ公開されていない。特に、細胞診断への応用を考えた際に、生細胞に対して非侵襲で計測を実現することが重要であるが、上記の従来技術はその要件を満たしていない。
【0004】
一方で、光学顕微鏡における位相差コントラスト観察や微分干渉コントラスト観察は細胞の形態を非侵襲で光学的に観察する手段として広く利用されている。しかしながら、上記の観察方法によると、細胞内の構造の変化は明瞭に観察できるが、細胞膜の状態を例えばナノメートルの高精度で計測することはできない。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Jan Domke, "Mappingthe mechanical pulse of signal cardiomyocytes with the atomic forcemicroscope", Eur. Biophys.J, 28, 179, 1999
【非特許文献2】Balint Szabo, "Atomicforce microscopy of height fluctuations of fibroblast cells", Phy. ReviewE, 65, 041910, 2002
【発明の概要】
【発明が解決しようとする課題】
【0006】
ここで、上記の非特許文献2によれば、原子間力顕微鏡(以下、AFM)を用いる場合には細胞の高さの変動をナノメータスケールの高精度で捉えることができるとされている。その一方で、細胞1つにおける各部位の高さ方向の変動の様子の差異は、生物学的な活動が異なることに起因していることとしている。すなわち、上記の事実は、AFMを用いて細胞を振動によって判別しようとした場合、高い精度で細胞の振動を計測できたとしても、細胞の特徴的な変動を示す部位を何らかの方法で予め知っておく必要があることを示唆する。しかし、非特許文献2にも記述されているように、AFMは探針を使うため、1つの細胞に複数の探針を配置することは物理的に難しい。そのため、1つのみの探針により細胞の特徴的な変動を示す部位を探し出すのは現実的でなく、結果的に、AFMを用いて細胞を判別することには難があるということとなる。また、細胞全体の走査のために分単位で時間がかかるという事実からも、AFMを用いて細胞判別をすることが困難であることが分かる。
【0007】
そこで、本発明は上記に鑑みてなされたもので、細胞を非侵襲且つ高精度で判別することが可能な細胞判別方法、細胞判別用の参照データ生成方法、および細胞判別装置を提供することを目的とする。
【課題を解決するための手段】
【0008】
上記課題を解決するために、本発明の細胞判別方法は、被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、前記細胞を判別するための参照データを生成する参照データ生成ステップと、前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して前記周波数解析を行った結果を、前記参照データ生成ステップにて生成された前記参照データと照らし合わせることにより、前記被検体の前記細胞を判別する細胞判別ステップと、を備えることを特徴とする。
【0009】
また、本発明の細胞判別用の参照データ生成方法は、細胞の振動を定量位相顕微鏡を用いて一定時間計測する振動計測ステップと、前記振動計測ステップにおける当該計測結果に対して周波数解析を行う周波数解析ステップと、前記周波数解析ステップにおける当該周波数解析結果を近似することにより、前記振動の特性を数値化する数値化ステップと、前記数値化ステップにおける当該数値化の結果を元に散布図を作成する散布図作成ステップと、前記散布図作成ステップにて作成された前記散布図における所定領域を前記細胞を判別するための判別領域として区画する領域区画ステップと、を備えることを特徴とする。
【0010】
また、本発明の細胞判別装置は、被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、前記細胞を判別するための参照データを生成する参照データ生成手段と、前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して前記周波数解析を行った結果を、前記参照データ生成手段が生成した前記参照データと照らし合わせることにより、前記被検体の前記細胞を判別する細胞判別手段と、を備えることを特徴とする。
【0011】
このような本発明の細胞判別方法、細胞判別用の参照データ生成方法、および細胞判別装置によれば、細胞の振動を定量位相顕微鏡を用いて計測する。定量位相顕微鏡を用いた計測方法によれば、光を使った非侵襲で、更にナノメータスケールの高精度で、細胞の振動を計測することができる。また、AFMの場合と異なり、多点計測ができるため、細胞の特徴的な変動を示す部位を知らなくても、細胞全体としての特徴を捉えることができる。更に、計測時間面において、AFMの場合でのような長時間はかからないというメリットがある。そして、以上のような定量位相顕微鏡による計測方法を用いて、参照データを生成し、また当該参照データを用いて被検体の細胞を判別するため、結果的に、非侵襲、高精度、更に高速で細胞判別を行うことができる。
【0012】
また、本発明において、前記参照データ生成ステップは、前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測する振動計測ステップと、前記振動計測ステップにおける当該計測結果に対して前記周波数解析を行う周波数解析ステップと、前記周波数解析ステップにおける当該周波数解析結果を近似することにより、前記振動の特性を数値化する数値化ステップと、前記数値化ステップにおける当該数値化の結果を元に散布図を作成する散布図作成ステップと、前記散布図作成ステップにて作成された前記散布図における所定領域を前記細胞を判別するための判別領域として区画する領域区画ステップと、を備え、前記参照データは、前記領域区画ステップにて当該領域区画された当該散布図であっても良い。
【0013】
また、本発明において、前記参照データ生成手段は、前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測する振動計測手段と、前記振動計測手段による当該計測結果に対して前記周波数解析を行う周波数解析手段と、前記周波数解析手段による当該周波数解析結果を近似することにより、前記振動の特性を数値化する数値化手段と、前記数値化手段による当該数値化の結果を元に散布図を作成する散布図作成手段と、前記散布図作成手段が作成した前記散布図における所定領域を前記細胞を判別するための判別領域として区画する領域区画手段と、を備え、前記参照データは、前記領域区画手段が当該領域区画した当該散布図であっても良い。
【0014】
この発明によれば、細胞判別を行う際に用いられる参照データを生成するための具体的な方法が提供される。
【0015】
また、本発明において、前記振動計測ステップでは、前記細胞に設けられた複数の計測領域に対してそれぞれ当該計測を行い、前記周波数解析ステップでは、それぞれの前記計測領域の当該計測結果に対して前記周波数解析を行い、且つ当該周波数解析結果を平均化することにより前記細胞全体としての周波数解析結果を得ても良い。
【0016】
この発明によれば、細胞の振動計測および当該計測結果に対する周波数解析の具体的な方法が提供される。一つの細胞に対して多点計測を行った結果を平均化することにより、細胞全体としての周波数解析結果が得られる。このため、細胞の特徴的な変動を示す部位を知らなくても、細胞全体としての周波数解析結果を得ることができ、これをもって細胞判別を行うことができる。
【0017】
また、本発明において、前記周波数解析ステップでは、周波数およびパワースペクトルにより前記周波数解析が行われ、前記数値化ステップでは、前記周波数に対する前記パワースペクトルの値を近似化した近似線、および前記近似線における傾きを求め、前記散布図作成ステップでは、前記傾きを一の軸とし且つ所定の周波数における前記パワースペクトルの値を他の軸とする2次元上に、前記傾きに対して前記パワースペクトルの値を前記被検体の前記細胞ごとにプロットした図を、前記散布図として作成しても良い。
【0018】
この発明によれば、周波数解析、近似による数値化、および参照データ生成の具体的な方法が提供される。
【0019】
また、本発明において、前記散布図作成ステップでは、複数の前記所定の周波数に応じて複数の前記散布図が作成され、当該複数の前記散布図のうち、プロットされた前記パワースペクトルの値における決定係数の値が所定の値以下である前記散布図を、前記領域区画ステップにて当該領域区画される前記散布図として選択する散布図選択ステップを更に備えても良い。
【0020】
この発明によれば、複数の散布図のうち細胞判別に適した散布図を選択するための具体的な方法が提供される。
【0021】
また、本発明において、前記領域区画ステップにおける当該領域区画は、前記散布図上で区画線を設定することにより行われても良い。
【0022】
この発明によれば、散布図上に細胞判別を行うための判別領域を区画する具体的な方法が提供される。区画線を設定することにより、領域区画を容易に行うことができる。
【発明の効果】
【0023】
本発明によれば、細胞を非侵襲且つ高精度で判別することが可能な細胞判別方法、細胞判別用の参照データ生成方法、および細胞判別装置を提供することができる。
【図面の簡単な説明】
【0024】
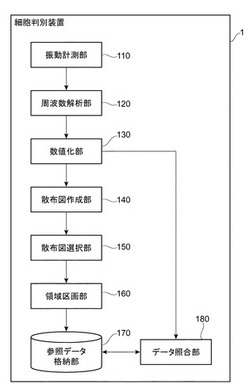
【図1】細胞判別装置1の構成概要図である。
【図2】細胞判別装置1のハードウェア構成図である。
【図3】定量位相顕微鏡の構成図である。
【図4】撮像部251または受光部261に到達する光の強度と光路長差との関係を示す図である。
【図5】被測定物209の一構成例を示す図である。
【図6】定量位相顕微鏡における干渉像の撮像を説明するための図である。
【図7】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図8】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図9】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図10】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図11】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図12】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図13】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図14】参照データ生成手順を示すフローチャートである。
【図15】本実施形態における周波数解析および数値化を説明するための図である。
【図16】図15のグラフから作成される散布図の一例を示す図である。
【図17】第1実施形態における散布図の選択方法を説明するための図である。
【図18】第1実施形態における散布図の選択方法を説明するための図である。
【図19】細胞判別手順を示すフローチャートである。
【図20】図19の細胞判別手順により細胞を判別した一例を示す図である。
【図21】第2実施形態における散布図の選択方法を説明するための図である。
【図22】第2実施形態における散布図の選択方法を説明するための図である。
【発明を実施するための形態】
【0025】
以下、添付図面を参照して本発明にかかる細胞判別方法、細胞判別用の参照データ生成方法、および細胞判別装置の好適な実施形態を詳細に説明する。なお、図面の説明において同一の要素には同一の符号を付し、重複する説明を省略する。
【0026】
[第1実施形態]
(細胞判別装置1の構成)
まず、本発明の第1実施形態に係る細胞判別装置1の構成について説明する。図1は細胞判別装置1の構成概要図であり、図2は細胞判別装置1のハードウェア構成図である。
【0027】
図2に示すように、細胞判別装置1は、物理的には、CPU11、ROM12及びRAM13等の主記憶装置、キーボード及びマウス等の入力デバイス14、ディスプレイ等の出力デバイス15、他の装置との間でデータの送受信を行うためのネットワークカード等の通信モジュール16、ハードディスク等の補助記憶装置17などを含む通常のコンピュータシステムとして構成される。後述する細胞判別装置1の各機能は、CPU11、ROM12、RAM13等のハードウェア上に所定のコンピュータソフトウェアを読み込ませることにより、CPU11の制御の元で入力デバイス14、出力デバイス15、通信モジュール16を動作させると共に、主記憶装置12,13や補助記憶装置17におけるデータの読み出し及び書き込みを行うことで実現される。
【0028】
図1に示すように、細胞判別装置1は、機能的には、振動計測部110(特許請求の範囲における「振動計測手段」に対応)、周波数解析部120(特許請求の範囲における「周波数解析手段」に対応)、数値化部130(特許請求の範囲における「数値化手段」に対応)、散布図作成部140(特許請求の範囲における「散布図作成手段」に対応)、散布図選択部150、領域区画部160(特許請求の範囲における「領域区画手段」に対応)、参照データ格納部170、およびデータ照合部180を備えて構成される。
【0029】
細胞判別装置1は、被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、細胞を判別するための参照データを生成する参照データ生成部(特許請求の範囲における「参照データ生成手段」に対応)と、細胞の振動を定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して周波数解析を行った結果を、参照データ生成部が生成した参照データと照らし合わせることにより、被検体の細胞を判別する細胞判別部(特許請求の範囲における「細胞判別手段」に対応)に大別される。参照データ生成部には、振動計測部110、周波数解析部120、数値化部130、散布図作成部140、散布図選択部150、領域区画部160、および参照データ格納部170が含まれる。細胞判別部には、振動計測部110、周波数解析部120、数値化部130、およびデータ照合部180が含まれる。
【0030】
振動計測部110は、細胞の振動を定量位相顕微鏡を用いて一定時間計測するものである。定量位相顕微鏡については、後述する。
【0031】
周波数解析部120は、振動計測部110による当該計測結果に対して周波数解析を行うものである。
【0032】
数値化部130は、周波数解析部120による当該周波数解析結果を近似することにより、振動の特性を数値化するものである。
【0033】
散布図作成部140は、数値化部130による当該数値化の結果を元に散布図を作成するものである。散布図作成部140は、複数の所定の周波数に応じて複数の散布図を作成する。
【0034】
散布図選択部150は、散布図作成部140が作成した当該複数の散布図のうち、プロットされたパワースペクトルの値における決定係数の値が所定の値以下である散布図を、領域区画部160により当該領域区画される散布図として選択するものである。
【0035】
領域区画部160は、散布図作成部140により作成され散布図選択部150により選択された散布図における所定領域を細胞を判別するための判別領域として区画するものである。「参照データ」とは、領域区画部160が当該領域区画した当該散布図をいう。
【0036】
参照データ格納部170は、参照データを格納するものである。
【0037】
データ照合部180は、被検体の細胞の振動を定量位相顕微鏡を用いて一定時間計測し、当該計測結果に対して周波数解析し、更に数値化した結果を、参照データ格納部170に格納されている参照データと照らし合わせることにより、被検体の細胞を判別するものである。
【0038】
(定量位相顕微鏡)
次に、図1に示した振動計測部110を構成し、細胞の振動を計測する際に用いられる定量位相顕微鏡について説明する。振動計測部110は定量位相顕微鏡そのものであっても良く、定量位相顕微鏡を備えた測定モジュールであっても良い。なお、定量位相顕微鏡に関する以下の説明は、下記の参考文献1および参考文献2を更に参考にすることで、より容易に理解できる。
<参考文献1> 特開2009−122033号公報
<参考文献2> Toyohiko Yamauchi,"Low-coherent quantitative phase microscope for nanometer-scalemeasurement of living cells morphology", Opt. Exp.、16, 12227, 2008
【0039】
図3は、定量位相顕微鏡の構成図である。この図に示される定量位相顕微鏡は、被測定物209の表面形状を測定するものであって、光源211,212、レンズ221〜225、アパーチャ231、光合波器241、光分波器242、ハーフミラー243、撮像部251、解析部252、受光部261、変位検出部262、ピエゾアクチュエータ271、駆動部272、ミラー273、ステージ281、駆動部282および制御部290を備える。
【0040】
光源211は、コヒーレント長が比較的短い光λ1を出力するものであり、例えば波長帯域600nm〜900nmの広帯域光を出力することができるタングステンランプまたはハロゲンランプである。一方、光源212は、コヒーレント長が比較的長い光λ2を出力するものであり、例えば波長1.31μmのレーザ光を出力する半導体レーザ光源である。光合波器241は、光源211から出力されてレンズ221およびアパーチャ231を経て到達した光λ1を反射させるとともに、光源212から出力されて到達した光λ2を透過させて、これらの光を合波してレンズ222へ出力する。
【0041】
ハーフミラー243は、光合波器241により合波されてレンズ222を経て到達した光λ1,λ2を2分岐して第1分岐光および第2分岐光とし、第1分岐光をレンズ223へ出力し、第2分岐光をレンズ224へ出力する。また、ハーフミラー243は、第1分岐光がレンズ223を経てミラー273により反射されて生じる第1反射光を再びレンズ223を経て入力するとともに、第2分岐光がレンズ224を経て被測定物209により反射されて生じる第2反射光を再びレンズ224を経て入力して、これら第1反射光と第2反射光とを干渉させて当該干渉光をレンズ225へ出力する。すなわち、ハーフミラー243は、干渉光学系を構成する要素である。
【0042】
光分波器242は、ハーフミラー243から出力されてレンズ225を経た光を入力し、そのうち光λ1を反射させて撮像部251へ出力し、光λ2を透過させて受光部261へ出力する。レンズ223〜225は、ハーフミラー243から出力されて光分波器242により分波された干渉光λ1を撮像部251の撮像面上に結像する結像光学系を構成する要素である。撮像部251は、その結像された干渉光λ1の干渉パターンを撮像するものであり、例えばCCDカメラである。受光部261は、ハーフミラー243から出力されて光分波器242により分波された光λ2の強度を検出するものであり、例えばフォトダイオードである。
【0043】
ここで、ハーフミラー243からミラー273により反射されて再びハーフミラー243に到るまでの光路長と、ハーフミラー243から被測定物209により反射されて再びハーフミラー243に到るまでの光路長との光路長差をΔLとする。前述したように、光源212から出力され受光部261に到達する光λ2のコヒーレント長は比較的長いので、図4(a)に示されるように、受光部51に到達する光λ2の強度は、比較的広い光路長差ΔLの範囲において周期的に変化する。これに対して、光源211から出力され撮像部251に到達する光λ1のコヒーレント長は比較的短いので、図4(b)に示されるように、撮像部251に到達する光λ1の強度は、比較的狭い光路長差ΔLの範囲において周期的に変化し、しかも、光路長差ΔLが値0に近いほど干渉の振幅が大きい。
【0044】
このことを利用して、解析部252は、光路長差が複数の目標値それぞれに設定されたときに撮像部251により撮像された光λ1の干渉パターン像を取得し、それらの複数の干渉パターン像に基づいて、像の各位置において干渉の振幅が最大となる光路長差を求め、これにより被測定物209の表面形状(高さ分布)を求める。
【0045】
ここで、被測定物209は、好適には例えば図5に示されるように、略平坦な基板291の主面に薄膜292が形成され、その薄膜292の上に半透明な測定対象物293が置かれたものである。薄膜292は、光λ2を高い反射率で反射させることで、後述するフィードバック制御の際の基準面として好適に用いられる。また、測定対象物293は細胞であるのが好適である。
【0046】
また、被測定物209の表面形状が波長未満の微小な凹凸を持つ場合には、干渉の振幅が最大となる光路長差付近において、光λ2の中心波長をλ20とおいて、λ20/4ずつ4回光路長差をシフトさせると共に干渉パターン像を取得し、それら4つの干渉パターン像に基づいて、像の各位置において干渉波形の位相オフセット値を求めることにより、被測定物209の表面形状(高さ分布)を求めることも可能である。
【0047】
さらには、干渉の振幅が最大となる光路長差を求める方法と、干渉波形の位相オフセット値を求める方法の両方によって得られた高さ分布を総合することによって、広い高さ範囲の表面形状を、波長未満の精度で得ることもできる。
【0048】
また、変位検出部262は、受光部261により検出された光λ2の強度の変化から、光路長差の変化量を求める。すなわち、光源212、受光部261および変位検出部262は、光路長差を検出する光路長差検出手段を構成する要素である。なお、ピエゾアクチュエータ271によりミラー273に微小振動を与えて、或る光路長差を中心にして変調を与えることで、より正確に光路長差を検出することができる。
【0049】
ピエゾアクチュエータ271、駆動部272、ステージ281および駆動部282は、光路長差を調整する光路長差調整手段を構成する要素である。ステージ281は、駆動部282により駆動され、ハーフミラー243と被測定物209との間の光学系の光軸に平行な方向に被測定物209を移動させる。このとき、レンズ224を移動させることなく、ハーフミラー243と被測定物209との間の光学系を維持したままとする。すなわち、ハーフミラー243から測った被測定物209側のフォーカス面までの距離を維持したままとする。ピエゾアクチュエータ271は、駆動部272により駆動され、ハーフミラー243とミラー273との間の光学系の光軸に平行な方向に、ミラー273を移動させる。このとき、レンズ223を移動させることなく、ハーフミラー243とミラー273との間の光学系を維持したままとする。ピエゾアクチュエータ271(第1移動手段)の作動範囲は、ステージ281(第2移動手段)の作動範囲より狭い。また、ピエゾアクチュエータ271の位置精度は、ステージ281の位置精度より高い。なお、ステージ281を移動させるための駆動部282としては、例えば長距離移動型のピエゾアクチュエータや、ステッピングモータによる回転機構を用いることが可能である。
【0050】
制御部290は、変位検出部262による光路長差検出結果に基づいて、光路長差が複数の目標値に順次になるように、駆動部272,282を介してピエゾアクチュエータ271およびステージ281による光路長差調整動作を制御する。特に、制御部290は、複数の目標値それぞれにおいて、ピエゾアクチュエータ271による移動量が作動範囲内の所定範囲内となるように、ステージ281による移動動作を連続的または断続的に行わせる。また、制御部290は、ステージ281による移動動作の際にも、変位検出部262による光路長差検出結果に基づいて、光路長差が各目標値になるようにピエゾアクチュエータ271による移動動作をフィードバック制御する。
【0051】
以上で説明した定量位相顕微鏡は、二光束干渉顕微鏡において、細胞膜からの反射光の位相計測を行う装置であり、細胞の厚みよりも十分に短い(例えば細胞の厚みの1/3未満)コヒーレンス長の光源を有し、焦点深度が1μm未満の対物レンズを備え、二光束の分岐点から測った被測定細胞の細胞膜表面までの光路長と、同分岐点から測った参照鏡までの光路長との差をコヒーレンス長未満に制御し、且つサンプル側対物レンズの焦点位置を当細胞膜表面に合わせこんだ状態で、一定時間連続して(例えば1秒間隔で3分間など)干渉画像を得る。
【0052】
具体的には、図6に示すように、波長フィルタリングしたハロゲンランプ(中心波長850nm)を用いて対物レンズを通して目的の細胞に照明光を照射し、フィードバック制御しながら細胞膜表面にフォーカスを合わせると同時に、物体光と参照光の光路長を合わせることにより、細胞膜からの反射光の干渉像を撮像する。干渉像の撮像には、参照光の光路長を光源波長の1/4ずつ変化させながら、7枚で1組の画像、すなわちI1、I2、I3、I4、I5、I6、I7を取得する。これら7枚1組の画像から、
A=I1−3*I3+3*I5−I7…(1)
B=−2*I2+4*I4−2*I6…(2)
を求め、更には、
φ=tan−1(A/B)…(3)
を求める(位相抽出)。
【0053】
(定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例)
次に、以上で説明した定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例について、図7〜図13を参照しながら説明する。細胞膜にフォーカスを合わせて得られた位相画像(図7)では、なだらかに連続する細胞膜の形状を反映して、細胞膜の高さに応じて干渉縞が空間的に連続して表示される。一方、細胞膜が、定量位相顕微鏡の測定領域に存在していない領域は連続した位相が得られず、干渉縞は見られない。干渉縞が空間的に連続する領域と位相がランダムになる領域との境界を検出することは容易であり、境界に対して位相が空間的に連続する側の領域を細胞膜の存在領域として特定する(図8において白線で囲まれた領域)。
【0054】
その上で、時間的に連続する位相画像の各画素において、時間的に位相アンラッピングを行い、すべての隣接する撮像フレーム同士の間で、ある閾値φmaxを超えるような不連続な位相の変化のない画素を細胞膜の時間変動情報が得られた画素と判定する。本実施例では、φmaxをπ/2とし、π/2を超えるような不連続な位相の変化のない画素を細胞膜の時間変動情報が得られた画素と判定した(図9における白色画素)。すなわち、空間位相から特定した細胞膜領域内に存在する画素(図8において白線で囲まれた領域の画素)、および時間位相アンラッピングにて連続する位相が得られた画素(図9における白色画素)の共通部分を、細胞膜からの時間変動情報が記録できた画素として特定する(図10における白線内の白色画素)。
【0055】
次に、それぞれの個々の細胞における細胞膜の変位を数値化する段階に進む。細胞膜の振動は細胞膜上で波のようにダイナミックに変化しているため、振動の周波数に共通性はあっても計測する空間的な場所に応じて振動の位相が異なる。そのため、一つの細胞に対して細胞全体を含むようにすべての画素の平均値の変位を求めても、細胞膜の振動は打ち消されて細胞膜の挙動を十分に反映することはできない。そこで、一つの細胞につき5〜7箇所の複数の計測領域を設ける。
【0056】
図11は各々の細胞に設けた複数の計測領域を示しており、計測領域が四角のマークで表示されている。設定した複数の計測領域において、領域を構成する画素の平均値について時間変化を求める。細胞膜の変位の時間変化は測定開始後からの変化量として評価してよい。
【0057】
このようにして、一つの細胞に対して細胞膜の領域を複数領域に細分し、複数の領域の細胞膜の時間変位を求めると、図12および図13に示すような、各計測領域における時間と変位のグラフを描くことができる。図12および図13では2つの種類の異なる細胞の細胞膜の時間変位を示しており、細胞の種類によって細胞膜の時間的な挙動が異なることを示唆するものである。図12は未分化な幹細胞の時間変位を示しており、図13は分化した破骨細胞の時間変位を示している。
【0058】
なお、細胞の膜の変位を計測する際には温度により細胞膜の変動の大きさが変化するので、一定の温度管理下で計測することが望ましい。
【0059】
(細胞判別装置1により行われる動作)
続いて、細胞判別装置1により行われる動作(特許請求の範囲における「細胞判別用の参照データ生成方法」および「細胞判別方法」に対応)の一例として、被検体の細胞の種類を判別する方法について説明する。被検体の細胞の種類を判別する手順は、被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、細胞を判別するための参照データを生成する参照データ生成手順(特許請求の範囲における「参照データ生成ステップ」に対応)と、細胞の振動を定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して周波数解析を行った結果を、参照データ生成手順にて生成された参照データと照らし合わせることにより、被検体の細胞を判別する細胞判別手順(特許請求の範囲における「細胞判別ステップ」に対応)に大別される。以下、各手順の詳細について説明する。
【0060】
(参照データ生成手順)
図14は、参照データ生成手順を示すフローチャートである。参照データ生成手順では、予め細胞の種類が判別されている細胞集団を用意し、当該細胞集団の細胞を計測した結果から参照データを作成する。
【0061】
図14に示すように、最初に、レファランス(参照)となる細胞集団を2種類以上用意する(ステップS101)。
【0062】
次に、ステップS101にて用意した複数の細胞集団における細胞の振動を定量位相顕微鏡を用いて一定時間計測する。具体的には、それぞれの細胞について複数の計測領域を設定し、当該複数の計測領域のそれぞれに対して振動計測を行い、細胞の振動の時間変位量を得る(ステップS102、特許請求の範囲における「振動計測ステップ」に対応)。
【0063】
次に、ステップS102で得た複数の計測領域のそれぞれにおける細胞振動の時間変位量(計測結果)に対して、周波数およびパワースペクトルによる周波数解析を行う(ステップS103、特許請求の範囲における「周波数解析ステップ」に対応)。周波数解析の指標であるパワースペクトル(PSD)は、以下の数式(4)および(5)で計算される。
【数1】

【数2】

上記の数式(4)および(5)において、Nは時間軸上でのサンプリング点数である。Δtはサンプリングの時間間隔である。Δh(m)は、t=Δt*mの時点での計測開始時からの細胞膜の変位量である。なお、m=0、1、2、3、…(N−1)である。
【0064】
次に、ステップS103で求めたパワースペクトルを平均化することにより細胞全体としての周波数解析結果を得る(ステップS104)。つまり、一つの細胞における周波数パワースペクトルを得るには、一つの細胞に複数の計測領域を設けて得られたそれぞれの計測領域の細胞膜の時間変位データからそれぞれ周波数解析を行いパワースペクトルデータを取得し、複数の計測領域のパワースペクトルを平均化して、一つの細胞の全体としての周波数パワースペクトルを得る。
【0065】
次に、ステップS103およびステップS104における当該周波数解析結果を近似することにより、細胞の振動の特性を数値化する。この手順では、周波数に対するパワースペクトルの値を近似化した近似線、および当該近似線における傾きを求める(ステップS105、特許請求の範囲における「数値化ステップ」に対応)。
【0066】
具体的には、離散化された周波数を横軸に、且つパワースペクトルを縦軸に取って、ステップS103およびステップS104における当該周波数解析結果を両対数でプロットすると、図15に示すようなパワースペクトルのグラフが得られる。図15には特性の異なる4種類のパワースペクトル(A〜D)の例を模式的に示した。グラフAは、振幅が大きく、パワースペクトルが周波数の−1乗に比例するような特性、グラフBは、振幅が大きく、パワースペクトルが周波数によらず一定であるような特性、グラフCは、振幅が小さく、パワースペクトルが周波数の−1乗に比例するような特性、グラフDは、振幅が小さく、パワースペクトルが周波数によらず一定であるような特性である。
【0067】
この細胞膜の振動のパワースペクトルを、両対数グラフ上において直線で近似することで、つまり図15のグラフA〜Dを直線で近似することで、振動の特性を数値化することができる。なお、両対数グラフ上での直線は、パラメータAとsを用いて、式(6)によって表される。Aは図15においてf=1Hzにおける近似直線の値であり、sは両対数グラフ上に引いた直線の傾き(つまりグラフA〜Dの傾き)である。
PSDfit(f)=A*fs…(6)
【0068】
次に、ステップS105における当該数値化の結果を元に散布図を作成する。この手順では、傾きを一の軸とし且つ所定の周波数におけるパワースペクトルの値を他の軸とする2次元上に、傾きに対してパワースペクトルの値を被検体の細胞ごとにプロットした図を、散布図として作成する(ステップS106、特許請求の範囲における「散布図作成ステップ」に対応)。
【0069】
具体的に、細胞集団の中のそれぞれの細胞について、細胞膜の振動計測を行い、パワースペクトルを集計するにあたって、得られたパワースペクトルの近似直線の傾きsを横軸に、ある周波数f=f0におけるパワースペクトルの近似直線の値(PSDfit(f0))を縦軸に取ってプロットすると、視覚的に分かりやすく、また統計的にも処理しやすい散布図を得ることができる。例えば、所定の周波数としてf0=0.1Hzを用いて、図15の4つのパワースペクトルを散布図にプロットすると、図16のような散布図が得られる。
【0070】
次に、ステップS106にて作成された散布図における所定領域を細胞を判別するための判別領域として区画する(ステップS108、特許請求の範囲における「領域区画ステップ」に対応)。この手順における当該領域区画は、散布図上で区画線を設定することにより行われる。そして、この手順にて当該領域区画された当該散布図を、細胞を判別するための判断基準となる参照データとして参照データ格納部170に格納する(ステップS109)。以下、散布図作成や領域区画について、より詳しく説明する。
【0071】
散布図を作成するにあたっては、上述したステップS106にて複数の所定の周波数に対して散布図が作成され、当該複数の散布図のうち、プロットされたパワースペクトルの値における決定係数の値が所定の値以下である散布図を、ステップS108にて当該領域区画される散布図として選択する手順を更に含む(ステップS107、特許請求の範囲における「散布図選択ステップ」に対応)。
【0072】
図17に、異なるf0を用いて作成した、細胞膜のパワースペクトルの近似直線の散布図を示す。元となるデータは生細胞を用いた実験によって得られたものである。元データは、ヒト乳癌細胞由来の細胞株MCF7(細胞数N=11)のものと、マウス膵臓由来の細胞株INS1(細胞数N=10)のものからなる。図17(a)は、f0=0.02Hzを用いて、細胞集団のパワースペクトルの特性をプロットしたものである。図17(b)は、f0=0.1Hzを用いて、細胞集団のパワースペクトルの特性をプロットしたものである。図11(c)は、f0=1Hzを用いて、細胞集団のパワースペクトルの特性をプロットしたものである。それぞれのグラフにおいて、横軸はパワースペクトルの近似直線の傾きであり、縦軸は近似直線のf=f0におけるパワースペクトル値の常用対数(log10(PSDfit(f0)))である。図17においては細胞の種類を区別せずに、被測定細胞すべてを対象にしてプロットした。
【0073】
図17のそれぞれについて、最小二乗法により一次関数による近似直線を引いて、決定係数R2を求めた。f0=0.02Hzを用いた場合は決定係数R2=0.8537、f0=0.1Hzを用いた場合は決定係数R2=0.5779、f0=1Hzを用いた場合は決定係数R2=0.2726となった。図からも視覚的に明らかなように、f0=0.02Hzを用いた場合(図17(a))では横軸と縦軸の相関が大きく(R2>0.6)、二変数でプロットしている意義が失われてしまっている。したがって、f0=0.02Hzを用いるのは適切ではないと判断する。
【0074】
次に、細胞集団ごとの違いを定量化するため、被測定細胞に含まれるMCF7とINS1を区別してプロットしたのが図18である。決定係数R2が大きいf0=0.02Hzを用いた場合のグラフは除外した。f0=0.1Hzを用いた場合(図18(a))と、f0=1Hzを用いた場合(図18(b))を比べると、図18(a)の場合には垂直線と水平線を用いた単純な区画線でINS1の細胞集団とMCF7の細胞集団を区別することができる。この細胞弁別を、細胞集団からMCF7のみを区別する試験と考えた場合、図18(a)の場合は図に示した太線の区画線を用いて、感度91%、特異度100%で弁別ができるのに対し、図18(b)の場合は感度72%、特異度90%となり、明らかに弁別の性能が劣る。
【0075】
したがって、これらの結果から、上記示した実施例において、散布図の縦軸PSDfit(f0)に用いるf0としては、f0=0.1Hzが適切であることが分かる。f0=0.1Hzを用いた散布図(図18(a))を用いることで、細胞一個一個の違いが2変数を用いて分布的に示され、細胞集団同士の弁別も容易になる。このようにして特定の2種類の細胞集団の細胞弁別を行う判断基準が設定できる。これをリファレンスデータ(参照データ)とする。リファレンスデータは種類や状態の異なる2種類以上の細胞集団について取得し、格納しておく。
【0076】
(細胞判別手順)
引き続き、細胞判別手順について説明する。細胞判別手順は、被検体となる未知の細胞の細胞膜の振動を一定時間計測し、細胞膜の振動の周波数解析を行い、既に格納されているリファレンスデータの2成分散布図に当てはめることによって行う。弁別したい被検体の細胞は、リファレンスデータとして既に取得済みである種類と同種類の細胞である。以下、図19を参照しながら細胞判別手順の詳細について説明する。図19は、細胞判別手順を示すフローチャートである。
【0077】
図19に示すように、最初に、被検体となる未知の細胞を用意する(ステップS201)。
【0078】
次に、ステップS201にて用意した被検体の細胞の振動を定量位相顕微鏡を用いて一定時間計測する。具体的には、被検体細胞について複数の計測領域を設定し、当該複数の計測領域のそれぞれに対して振動計測を行い、細胞の振動の時間変位量を得る(ステップS202)。
【0079】
次に、ステップS202で得た複数の計測領域のそれぞれにおける細胞振動の時間変位量(計測結果)に対して、周波数およびパワースペクトルによる周波数解析を行う(ステップS203、ステップS204)。周波数解析の手法は上述のステップS103およびステップS104と同様であるため、ここでは説明を省略する。
【0080】
次に、ステップS203およびステップS204における当該周波数解析結果を近似することにより、細胞の振動の特性を数値化する(ステップS205)。数値化の手法は上述のステップS105と同様であるため、ここでは説明を省略する。
【0081】
次に、ステップS205における当該数値化の結果を、参照データ生成手順で作成した参照データに当てはめる。図20に示すように、参照データには2種類の細胞(MCF7とINS1)を識別するための区画線Mが引かれており、判別領域LがMCF7を判別するための判別領域である。図20のような参照データを用いて、被検体となる未知の細胞の振動の特性を数値化したものが判別領域L内に位置するのであれば、当該未知の細胞はMCF7であると判別することができる(ステップS206)。
【0082】
(参照データ生成手順および細胞判別手順のまとめ)
以上、参照データ生成手順および細胞判別手順を説明した。以上の説明を簡単にまとめると次のようである。(1)細胞一個一個の細胞膜の変動の周波数パワースペクトルを計算し、それぞれを式(6)に基づきフィッティングし、フィッティング直線の傾きsとフィッティング直線の複数のf=f0におけるパワースペクトルの値を求め、各細胞の細胞膜振動の周波数パラメータとする。(2)リファレンスとなる2種類以上の細胞集団についてフィッティング直線の傾きsを横軸、フィッティング直線のf=f0における値を縦軸にして、各細胞のパワースペクトルの特性を2変数の散布図にプロットする。(3)異なるf0を用いて複数の2変数散布図を作成する。(4)2変数散布図の中で、プロットされた点の決定係数の大きいものを除外し、決定係数の値が所定の値以下のものを選択する。上記の例においては決定係数が例えば0.6以下のものを選択した。(5)2変数散布図を、細胞集団ごとに別のシンボルや色を用いてプロットし、細胞集団同士の弁別が単純な区画線を用いて可能となるようなf0を採用し、2変数散布図と区画線を決定し、2種類の細胞集団を弁別するためのリファレンスデータとする。(6)被検体である未知細胞について細胞膜の変動を計測し、得られた周波数パラメータをリファレンスデータの2変数散布図と区画線に当てはめて細胞を弁別する。このような手続きを経ることで、細胞膜の変動の周波数解析をもとにして細胞を弁別する方法および装置を提供することができる。
【0083】
[第2実施形態]
引き続き、本発明の第2実施形態について説明する。第2実施形態では、複数作成した散布図の選択方法が、第1実施形態と主に相違している。つまり、第1実施形態における図14のステップS107において相違点がある。以下ではこの相違点を中心に説明する。
【0084】
第1実施形態で既に説明したステップS101〜ステップS106を経て、異なるf0を複数用いて複数作成した、細胞膜のパワースペクトルの近似直線の散布図を図21に示す。元となるデータは生細胞を用いた実験によって得られたものである。元データは、ヒト乳癌細胞由来の細胞株MCF7(細胞数N=11)のものと、マウス膵臓由来の細胞株INS1(細胞数N=10)のものからなり、細胞の種類が区別できるようにプロットしたものである。それぞれのグラフにおいて、横軸はパワースペクトルの近似直線の傾き、縦軸は近似直線のf=f0における値の常用対数(log10(PSDfit(f0)))である。図21(a)は、f0=0.02Hzを用いて、細胞集団のパワースペクトルの特性をプロットしたものである。図21(b)は、f0=0.1Hzを用いて、細胞集団のパワースペクトルの特性をプロットしたものである。図21(c)は、f0=1Hzを用いて、細胞集団のパワースペクトルの特性をプロットしたものである。
【0085】
図21において、INS1の細胞集団とMCF7の細胞集団をもっとも良く区別するために直線と水平線を用いた単純な区画線を引くことを行う。この細胞弁別を、細胞集団からMCF7のみを区別する試験と考えた場合、図21(a)の場合は図に示した太線の区画線を用いて、感度100%、特異度85%、図21(b)の場合は感度91%、特異度100%で弁別できるのに対し、図21(c)の場合は感度72%、特異度90%となり明らかに弁別の性能が劣る。そこで、この中で、f0=0.02Hzを用いた場合(図21(a))とf0=0.1Hzを用いた場合(図21(b))を弁別能力の高い候補として残し、f0=1Hzを用いた場合(図21(c))を候補から除く。
【0086】
次に、絞られた候補に対し、すべての細胞のプロットに対して、最小二乗法により一次関数による近似直線を引いて、決定係数R2を求めた(図22)。ここでは、細胞の種類を区別せずに、被測定細胞すべてを対象にしてプロットした。f0=0.02Hzを用いた場合は決定係数R2=0.8537、f0=0.1Hzを用いた場合は決定係数R2=0.5779となった。図からも視覚的に明らかなように、f0=0.02Hzを用いた場合(図22(a))では横軸と縦軸の相関が大きく(R2>0.6)、二変数でプロットしている意義が失われてしまっている。したがって、f0=0.02Hzを用いるのは適切ではないと判断する。
【0087】
したがって、これらの結果から、上記示した実施例において、散布図の縦軸PSDfit(f0)に用いるf0としては、f0=0.1Hzが適切であることが分かる。f0=0.1Hzを用いた散布図(図22(b))を用いることで、細胞一個一個の違いが2変数を用いて分布的に示され、細胞集団同士の弁別も容易になる。このようにして特定の2種類の細胞集団の細胞弁別を行う判断基準が設定できる。これをリファレンスデータ(参照データ)とする。リファレンスデータは種類や状態の異なる2種類以上の細胞集団について取得し、格納しておく。
【0088】
(本実施形態の作用・効果、そして応用)
本実施形態によれば、細胞の振動を定量位相顕微鏡を用いて計測する。定量位相顕微鏡を用いた計測方法によれば、光を使った非侵襲で、更にナノメータスケールの高精度で、細胞の振動を計測することができる。また、AFMの場合と異なり、多点計測ができるため、細胞の特徴的な変動を示す部位を知らなくても、細胞全体としての特徴を捉えることができる。更に、計測時間面において、AFMの場合でのような長時間はかからないというメリットがある。そして、以上のような定量位相顕微鏡による計測方法を用いて、参照データを生成し、また当該参照データを用いて被検体の細胞を判別するため、結果的に、非侵襲、高精度、更に高速で細胞判別を行うことができる。
【0089】
従来、培養した細胞の状態を把握したり、分化/未分化やがん化などの細胞の変化を判断する手段としては、観測者が光学顕微鏡を用いて細胞の形態を肉眼で観察し、経験的な判断に委ねられることが多く、再現性や品質の安定性のうえでは十分とは言いがたかった。また、定量的に判断する手段として、蛍光試薬や蛍光で標識された細胞特異的な抗体等で処理して判断する方法が用いられているが、標識した細胞の培養を継続することは事実上困難であるので、判定した細胞を引き続き培養するなど、生きたまま再利用することができなかった。
【0090】
本実施形態では生きた細胞のまま細胞膜の状態を測定することによって細胞を非侵襲に評価、識別することができるため、蛍光ラベルができない用途に広く利用できると考えられる。具体的には培養している細胞の状態をモニタリングする装置が考えられる。細胞の状態モニタリング装置は細胞選別装置の前処理として、目的の細胞を非侵襲に識別してその座標を記憶する装置としても役立つ。また細胞の状態モニタリング装置は細胞を用いた創薬スクリーニングにおける試験の前処理として、試験に用いる培養した細胞の状態を把握して測定結果に重みづけをする装置としても役に立つ。応用面では、ES細胞、iPS細胞を含む幹細胞からの分化誘導における分化/未分化状態の識別、正常細胞とがん細胞の識別、異なる細胞集団が混在する環境における細胞の種類の識別、凍結解凍直後における細胞蘇生率の迅速判定などに利用することができる。
【符号の説明】
【0091】
1…細胞判別装置、110…振動計測部、120…周波数解析部、130…数値化部、140…散布図作成部、150…散布図選択部160…領域区画部、170…参照データ格納部、180…データ照合部。
【技術分野】
【0001】
本発明は、細胞判別方法、細胞判別用の参照データ生成方法、および細胞判別装置に関するものである。
【背景技術】
【0002】
規則正しく振動する細胞の代表的な一例として、心筋細胞がある。しかし、一般的に、細胞の多くは心筋細胞のように規則的に振動するわけではないので(例えば、下記の非特許文献1を参照)、細胞の振動に伴う規則的な周波数を用いた細胞判別は、一般的な細胞には適用できない。
【0003】
また、蛍光ラベルをせずに、生細胞の細胞膜の状態を測定する技術として、例えば走査型プローブ顕微鏡(SPM;Scanning probe microscope)や、原子間力顕微鏡(AFM;Atomic force microscope、下記の非特許文献2を参照)などが知られている。いずれもプローバーであるカンチレバーを細胞に接触あるいはオングストローム単位で接近させて細胞全体をスキャンする方式であるが、このような装置を用いて細胞判別を行うには以下のような問題点が存在する。すなわち、測定には細胞に機械的応力を加えることが必要であるため、細胞への影響を避けられない。また、生きた細胞を簡便に測定するにはある程度の熟練を要する。更に、1個1個の細胞をカンチレバーで走査する必要があるために、複数の細胞について細胞膜の変位の時間変化を計測するには長時間がかかり、現実的でない。更にまた、細胞膜の変動を指標とした細胞の識別や状態の把握にまで踏み込んだ技術はまだ公開されていない。特に、細胞診断への応用を考えた際に、生細胞に対して非侵襲で計測を実現することが重要であるが、上記の従来技術はその要件を満たしていない。
【0004】
一方で、光学顕微鏡における位相差コントラスト観察や微分干渉コントラスト観察は細胞の形態を非侵襲で光学的に観察する手段として広く利用されている。しかしながら、上記の観察方法によると、細胞内の構造の変化は明瞭に観察できるが、細胞膜の状態を例えばナノメートルの高精度で計測することはできない。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Jan Domke, "Mappingthe mechanical pulse of signal cardiomyocytes with the atomic forcemicroscope", Eur. Biophys.J, 28, 179, 1999
【非特許文献2】Balint Szabo, "Atomicforce microscopy of height fluctuations of fibroblast cells", Phy. ReviewE, 65, 041910, 2002
【発明の概要】
【発明が解決しようとする課題】
【0006】
ここで、上記の非特許文献2によれば、原子間力顕微鏡(以下、AFM)を用いる場合には細胞の高さの変動をナノメータスケールの高精度で捉えることができるとされている。その一方で、細胞1つにおける各部位の高さ方向の変動の様子の差異は、生物学的な活動が異なることに起因していることとしている。すなわち、上記の事実は、AFMを用いて細胞を振動によって判別しようとした場合、高い精度で細胞の振動を計測できたとしても、細胞の特徴的な変動を示す部位を何らかの方法で予め知っておく必要があることを示唆する。しかし、非特許文献2にも記述されているように、AFMは探針を使うため、1つの細胞に複数の探針を配置することは物理的に難しい。そのため、1つのみの探針により細胞の特徴的な変動を示す部位を探し出すのは現実的でなく、結果的に、AFMを用いて細胞を判別することには難があるということとなる。また、細胞全体の走査のために分単位で時間がかかるという事実からも、AFMを用いて細胞判別をすることが困難であることが分かる。
【0007】
そこで、本発明は上記に鑑みてなされたもので、細胞を非侵襲且つ高精度で判別することが可能な細胞判別方法、細胞判別用の参照データ生成方法、および細胞判別装置を提供することを目的とする。
【課題を解決するための手段】
【0008】
上記課題を解決するために、本発明の細胞判別方法は、被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、前記細胞を判別するための参照データを生成する参照データ生成ステップと、前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して前記周波数解析を行った結果を、前記参照データ生成ステップにて生成された前記参照データと照らし合わせることにより、前記被検体の前記細胞を判別する細胞判別ステップと、を備えることを特徴とする。
【0009】
また、本発明の細胞判別用の参照データ生成方法は、細胞の振動を定量位相顕微鏡を用いて一定時間計測する振動計測ステップと、前記振動計測ステップにおける当該計測結果に対して周波数解析を行う周波数解析ステップと、前記周波数解析ステップにおける当該周波数解析結果を近似することにより、前記振動の特性を数値化する数値化ステップと、前記数値化ステップにおける当該数値化の結果を元に散布図を作成する散布図作成ステップと、前記散布図作成ステップにて作成された前記散布図における所定領域を前記細胞を判別するための判別領域として区画する領域区画ステップと、を備えることを特徴とする。
【0010】
また、本発明の細胞判別装置は、被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、前記細胞を判別するための参照データを生成する参照データ生成手段と、前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して前記周波数解析を行った結果を、前記参照データ生成手段が生成した前記参照データと照らし合わせることにより、前記被検体の前記細胞を判別する細胞判別手段と、を備えることを特徴とする。
【0011】
このような本発明の細胞判別方法、細胞判別用の参照データ生成方法、および細胞判別装置によれば、細胞の振動を定量位相顕微鏡を用いて計測する。定量位相顕微鏡を用いた計測方法によれば、光を使った非侵襲で、更にナノメータスケールの高精度で、細胞の振動を計測することができる。また、AFMの場合と異なり、多点計測ができるため、細胞の特徴的な変動を示す部位を知らなくても、細胞全体としての特徴を捉えることができる。更に、計測時間面において、AFMの場合でのような長時間はかからないというメリットがある。そして、以上のような定量位相顕微鏡による計測方法を用いて、参照データを生成し、また当該参照データを用いて被検体の細胞を判別するため、結果的に、非侵襲、高精度、更に高速で細胞判別を行うことができる。
【0012】
また、本発明において、前記参照データ生成ステップは、前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測する振動計測ステップと、前記振動計測ステップにおける当該計測結果に対して前記周波数解析を行う周波数解析ステップと、前記周波数解析ステップにおける当該周波数解析結果を近似することにより、前記振動の特性を数値化する数値化ステップと、前記数値化ステップにおける当該数値化の結果を元に散布図を作成する散布図作成ステップと、前記散布図作成ステップにて作成された前記散布図における所定領域を前記細胞を判別するための判別領域として区画する領域区画ステップと、を備え、前記参照データは、前記領域区画ステップにて当該領域区画された当該散布図であっても良い。
【0013】
また、本発明において、前記参照データ生成手段は、前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測する振動計測手段と、前記振動計測手段による当該計測結果に対して前記周波数解析を行う周波数解析手段と、前記周波数解析手段による当該周波数解析結果を近似することにより、前記振動の特性を数値化する数値化手段と、前記数値化手段による当該数値化の結果を元に散布図を作成する散布図作成手段と、前記散布図作成手段が作成した前記散布図における所定領域を前記細胞を判別するための判別領域として区画する領域区画手段と、を備え、前記参照データは、前記領域区画手段が当該領域区画した当該散布図であっても良い。
【0014】
この発明によれば、細胞判別を行う際に用いられる参照データを生成するための具体的な方法が提供される。
【0015】
また、本発明において、前記振動計測ステップでは、前記細胞に設けられた複数の計測領域に対してそれぞれ当該計測を行い、前記周波数解析ステップでは、それぞれの前記計測領域の当該計測結果に対して前記周波数解析を行い、且つ当該周波数解析結果を平均化することにより前記細胞全体としての周波数解析結果を得ても良い。
【0016】
この発明によれば、細胞の振動計測および当該計測結果に対する周波数解析の具体的な方法が提供される。一つの細胞に対して多点計測を行った結果を平均化することにより、細胞全体としての周波数解析結果が得られる。このため、細胞の特徴的な変動を示す部位を知らなくても、細胞全体としての周波数解析結果を得ることができ、これをもって細胞判別を行うことができる。
【0017】
また、本発明において、前記周波数解析ステップでは、周波数およびパワースペクトルにより前記周波数解析が行われ、前記数値化ステップでは、前記周波数に対する前記パワースペクトルの値を近似化した近似線、および前記近似線における傾きを求め、前記散布図作成ステップでは、前記傾きを一の軸とし且つ所定の周波数における前記パワースペクトルの値を他の軸とする2次元上に、前記傾きに対して前記パワースペクトルの値を前記被検体の前記細胞ごとにプロットした図を、前記散布図として作成しても良い。
【0018】
この発明によれば、周波数解析、近似による数値化、および参照データ生成の具体的な方法が提供される。
【0019】
また、本発明において、前記散布図作成ステップでは、複数の前記所定の周波数に応じて複数の前記散布図が作成され、当該複数の前記散布図のうち、プロットされた前記パワースペクトルの値における決定係数の値が所定の値以下である前記散布図を、前記領域区画ステップにて当該領域区画される前記散布図として選択する散布図選択ステップを更に備えても良い。
【0020】
この発明によれば、複数の散布図のうち細胞判別に適した散布図を選択するための具体的な方法が提供される。
【0021】
また、本発明において、前記領域区画ステップにおける当該領域区画は、前記散布図上で区画線を設定することにより行われても良い。
【0022】
この発明によれば、散布図上に細胞判別を行うための判別領域を区画する具体的な方法が提供される。区画線を設定することにより、領域区画を容易に行うことができる。
【発明の効果】
【0023】
本発明によれば、細胞を非侵襲且つ高精度で判別することが可能な細胞判別方法、細胞判別用の参照データ生成方法、および細胞判別装置を提供することができる。
【図面の簡単な説明】
【0024】
【図1】細胞判別装置1の構成概要図である。
【図2】細胞判別装置1のハードウェア構成図である。
【図3】定量位相顕微鏡の構成図である。
【図4】撮像部251または受光部261に到達する光の強度と光路長差との関係を示す図である。
【図5】被測定物209の一構成例を示す図である。
【図6】定量位相顕微鏡における干渉像の撮像を説明するための図である。
【図7】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図8】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図9】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図10】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図11】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図12】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図13】定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例を説明するための図である。
【図14】参照データ生成手順を示すフローチャートである。
【図15】本実施形態における周波数解析および数値化を説明するための図である。
【図16】図15のグラフから作成される散布図の一例を示す図である。
【図17】第1実施形態における散布図の選択方法を説明するための図である。
【図18】第1実施形態における散布図の選択方法を説明するための図である。
【図19】細胞判別手順を示すフローチャートである。
【図20】図19の細胞判別手順により細胞を判別した一例を示す図である。
【図21】第2実施形態における散布図の選択方法を説明するための図である。
【図22】第2実施形態における散布図の選択方法を説明するための図である。
【発明を実施するための形態】
【0025】
以下、添付図面を参照して本発明にかかる細胞判別方法、細胞判別用の参照データ生成方法、および細胞判別装置の好適な実施形態を詳細に説明する。なお、図面の説明において同一の要素には同一の符号を付し、重複する説明を省略する。
【0026】
[第1実施形態]
(細胞判別装置1の構成)
まず、本発明の第1実施形態に係る細胞判別装置1の構成について説明する。図1は細胞判別装置1の構成概要図であり、図2は細胞判別装置1のハードウェア構成図である。
【0027】
図2に示すように、細胞判別装置1は、物理的には、CPU11、ROM12及びRAM13等の主記憶装置、キーボード及びマウス等の入力デバイス14、ディスプレイ等の出力デバイス15、他の装置との間でデータの送受信を行うためのネットワークカード等の通信モジュール16、ハードディスク等の補助記憶装置17などを含む通常のコンピュータシステムとして構成される。後述する細胞判別装置1の各機能は、CPU11、ROM12、RAM13等のハードウェア上に所定のコンピュータソフトウェアを読み込ませることにより、CPU11の制御の元で入力デバイス14、出力デバイス15、通信モジュール16を動作させると共に、主記憶装置12,13や補助記憶装置17におけるデータの読み出し及び書き込みを行うことで実現される。
【0028】
図1に示すように、細胞判別装置1は、機能的には、振動計測部110(特許請求の範囲における「振動計測手段」に対応)、周波数解析部120(特許請求の範囲における「周波数解析手段」に対応)、数値化部130(特許請求の範囲における「数値化手段」に対応)、散布図作成部140(特許請求の範囲における「散布図作成手段」に対応)、散布図選択部150、領域区画部160(特許請求の範囲における「領域区画手段」に対応)、参照データ格納部170、およびデータ照合部180を備えて構成される。
【0029】
細胞判別装置1は、被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、細胞を判別するための参照データを生成する参照データ生成部(特許請求の範囲における「参照データ生成手段」に対応)と、細胞の振動を定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して周波数解析を行った結果を、参照データ生成部が生成した参照データと照らし合わせることにより、被検体の細胞を判別する細胞判別部(特許請求の範囲における「細胞判別手段」に対応)に大別される。参照データ生成部には、振動計測部110、周波数解析部120、数値化部130、散布図作成部140、散布図選択部150、領域区画部160、および参照データ格納部170が含まれる。細胞判別部には、振動計測部110、周波数解析部120、数値化部130、およびデータ照合部180が含まれる。
【0030】
振動計測部110は、細胞の振動を定量位相顕微鏡を用いて一定時間計測するものである。定量位相顕微鏡については、後述する。
【0031】
周波数解析部120は、振動計測部110による当該計測結果に対して周波数解析を行うものである。
【0032】
数値化部130は、周波数解析部120による当該周波数解析結果を近似することにより、振動の特性を数値化するものである。
【0033】
散布図作成部140は、数値化部130による当該数値化の結果を元に散布図を作成するものである。散布図作成部140は、複数の所定の周波数に応じて複数の散布図を作成する。
【0034】
散布図選択部150は、散布図作成部140が作成した当該複数の散布図のうち、プロットされたパワースペクトルの値における決定係数の値が所定の値以下である散布図を、領域区画部160により当該領域区画される散布図として選択するものである。
【0035】
領域区画部160は、散布図作成部140により作成され散布図選択部150により選択された散布図における所定領域を細胞を判別するための判別領域として区画するものである。「参照データ」とは、領域区画部160が当該領域区画した当該散布図をいう。
【0036】
参照データ格納部170は、参照データを格納するものである。
【0037】
データ照合部180は、被検体の細胞の振動を定量位相顕微鏡を用いて一定時間計測し、当該計測結果に対して周波数解析し、更に数値化した結果を、参照データ格納部170に格納されている参照データと照らし合わせることにより、被検体の細胞を判別するものである。
【0038】
(定量位相顕微鏡)
次に、図1に示した振動計測部110を構成し、細胞の振動を計測する際に用いられる定量位相顕微鏡について説明する。振動計測部110は定量位相顕微鏡そのものであっても良く、定量位相顕微鏡を備えた測定モジュールであっても良い。なお、定量位相顕微鏡に関する以下の説明は、下記の参考文献1および参考文献2を更に参考にすることで、より容易に理解できる。
<参考文献1> 特開2009−122033号公報
<参考文献2> Toyohiko Yamauchi,"Low-coherent quantitative phase microscope for nanometer-scalemeasurement of living cells morphology", Opt. Exp.、16, 12227, 2008
【0039】
図3は、定量位相顕微鏡の構成図である。この図に示される定量位相顕微鏡は、被測定物209の表面形状を測定するものであって、光源211,212、レンズ221〜225、アパーチャ231、光合波器241、光分波器242、ハーフミラー243、撮像部251、解析部252、受光部261、変位検出部262、ピエゾアクチュエータ271、駆動部272、ミラー273、ステージ281、駆動部282および制御部290を備える。
【0040】
光源211は、コヒーレント長が比較的短い光λ1を出力するものであり、例えば波長帯域600nm〜900nmの広帯域光を出力することができるタングステンランプまたはハロゲンランプである。一方、光源212は、コヒーレント長が比較的長い光λ2を出力するものであり、例えば波長1.31μmのレーザ光を出力する半導体レーザ光源である。光合波器241は、光源211から出力されてレンズ221およびアパーチャ231を経て到達した光λ1を反射させるとともに、光源212から出力されて到達した光λ2を透過させて、これらの光を合波してレンズ222へ出力する。
【0041】
ハーフミラー243は、光合波器241により合波されてレンズ222を経て到達した光λ1,λ2を2分岐して第1分岐光および第2分岐光とし、第1分岐光をレンズ223へ出力し、第2分岐光をレンズ224へ出力する。また、ハーフミラー243は、第1分岐光がレンズ223を経てミラー273により反射されて生じる第1反射光を再びレンズ223を経て入力するとともに、第2分岐光がレンズ224を経て被測定物209により反射されて生じる第2反射光を再びレンズ224を経て入力して、これら第1反射光と第2反射光とを干渉させて当該干渉光をレンズ225へ出力する。すなわち、ハーフミラー243は、干渉光学系を構成する要素である。
【0042】
光分波器242は、ハーフミラー243から出力されてレンズ225を経た光を入力し、そのうち光λ1を反射させて撮像部251へ出力し、光λ2を透過させて受光部261へ出力する。レンズ223〜225は、ハーフミラー243から出力されて光分波器242により分波された干渉光λ1を撮像部251の撮像面上に結像する結像光学系を構成する要素である。撮像部251は、その結像された干渉光λ1の干渉パターンを撮像するものであり、例えばCCDカメラである。受光部261は、ハーフミラー243から出力されて光分波器242により分波された光λ2の強度を検出するものであり、例えばフォトダイオードである。
【0043】
ここで、ハーフミラー243からミラー273により反射されて再びハーフミラー243に到るまでの光路長と、ハーフミラー243から被測定物209により反射されて再びハーフミラー243に到るまでの光路長との光路長差をΔLとする。前述したように、光源212から出力され受光部261に到達する光λ2のコヒーレント長は比較的長いので、図4(a)に示されるように、受光部51に到達する光λ2の強度は、比較的広い光路長差ΔLの範囲において周期的に変化する。これに対して、光源211から出力され撮像部251に到達する光λ1のコヒーレント長は比較的短いので、図4(b)に示されるように、撮像部251に到達する光λ1の強度は、比較的狭い光路長差ΔLの範囲において周期的に変化し、しかも、光路長差ΔLが値0に近いほど干渉の振幅が大きい。
【0044】
このことを利用して、解析部252は、光路長差が複数の目標値それぞれに設定されたときに撮像部251により撮像された光λ1の干渉パターン像を取得し、それらの複数の干渉パターン像に基づいて、像の各位置において干渉の振幅が最大となる光路長差を求め、これにより被測定物209の表面形状(高さ分布)を求める。
【0045】
ここで、被測定物209は、好適には例えば図5に示されるように、略平坦な基板291の主面に薄膜292が形成され、その薄膜292の上に半透明な測定対象物293が置かれたものである。薄膜292は、光λ2を高い反射率で反射させることで、後述するフィードバック制御の際の基準面として好適に用いられる。また、測定対象物293は細胞であるのが好適である。
【0046】
また、被測定物209の表面形状が波長未満の微小な凹凸を持つ場合には、干渉の振幅が最大となる光路長差付近において、光λ2の中心波長をλ20とおいて、λ20/4ずつ4回光路長差をシフトさせると共に干渉パターン像を取得し、それら4つの干渉パターン像に基づいて、像の各位置において干渉波形の位相オフセット値を求めることにより、被測定物209の表面形状(高さ分布)を求めることも可能である。
【0047】
さらには、干渉の振幅が最大となる光路長差を求める方法と、干渉波形の位相オフセット値を求める方法の両方によって得られた高さ分布を総合することによって、広い高さ範囲の表面形状を、波長未満の精度で得ることもできる。
【0048】
また、変位検出部262は、受光部261により検出された光λ2の強度の変化から、光路長差の変化量を求める。すなわち、光源212、受光部261および変位検出部262は、光路長差を検出する光路長差検出手段を構成する要素である。なお、ピエゾアクチュエータ271によりミラー273に微小振動を与えて、或る光路長差を中心にして変調を与えることで、より正確に光路長差を検出することができる。
【0049】
ピエゾアクチュエータ271、駆動部272、ステージ281および駆動部282は、光路長差を調整する光路長差調整手段を構成する要素である。ステージ281は、駆動部282により駆動され、ハーフミラー243と被測定物209との間の光学系の光軸に平行な方向に被測定物209を移動させる。このとき、レンズ224を移動させることなく、ハーフミラー243と被測定物209との間の光学系を維持したままとする。すなわち、ハーフミラー243から測った被測定物209側のフォーカス面までの距離を維持したままとする。ピエゾアクチュエータ271は、駆動部272により駆動され、ハーフミラー243とミラー273との間の光学系の光軸に平行な方向に、ミラー273を移動させる。このとき、レンズ223を移動させることなく、ハーフミラー243とミラー273との間の光学系を維持したままとする。ピエゾアクチュエータ271(第1移動手段)の作動範囲は、ステージ281(第2移動手段)の作動範囲より狭い。また、ピエゾアクチュエータ271の位置精度は、ステージ281の位置精度より高い。なお、ステージ281を移動させるための駆動部282としては、例えば長距離移動型のピエゾアクチュエータや、ステッピングモータによる回転機構を用いることが可能である。
【0050】
制御部290は、変位検出部262による光路長差検出結果に基づいて、光路長差が複数の目標値に順次になるように、駆動部272,282を介してピエゾアクチュエータ271およびステージ281による光路長差調整動作を制御する。特に、制御部290は、複数の目標値それぞれにおいて、ピエゾアクチュエータ271による移動量が作動範囲内の所定範囲内となるように、ステージ281による移動動作を連続的または断続的に行わせる。また、制御部290は、ステージ281による移動動作の際にも、変位検出部262による光路長差検出結果に基づいて、光路長差が各目標値になるようにピエゾアクチュエータ271による移動動作をフィードバック制御する。
【0051】
以上で説明した定量位相顕微鏡は、二光束干渉顕微鏡において、細胞膜からの反射光の位相計測を行う装置であり、細胞の厚みよりも十分に短い(例えば細胞の厚みの1/3未満)コヒーレンス長の光源を有し、焦点深度が1μm未満の対物レンズを備え、二光束の分岐点から測った被測定細胞の細胞膜表面までの光路長と、同分岐点から測った参照鏡までの光路長との差をコヒーレンス長未満に制御し、且つサンプル側対物レンズの焦点位置を当細胞膜表面に合わせこんだ状態で、一定時間連続して(例えば1秒間隔で3分間など)干渉画像を得る。
【0052】
具体的には、図6に示すように、波長フィルタリングしたハロゲンランプ(中心波長850nm)を用いて対物レンズを通して目的の細胞に照明光を照射し、フィードバック制御しながら細胞膜表面にフォーカスを合わせると同時に、物体光と参照光の光路長を合わせることにより、細胞膜からの反射光の干渉像を撮像する。干渉像の撮像には、参照光の光路長を光源波長の1/4ずつ変化させながら、7枚で1組の画像、すなわちI1、I2、I3、I4、I5、I6、I7を取得する。これら7枚1組の画像から、
A=I1−3*I3+3*I5−I7…(1)
B=−2*I2+4*I4−2*I6…(2)
を求め、更には、
φ=tan−1(A/B)…(3)
を求める(位相抽出)。
【0053】
(定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例)
次に、以上で説明した定量位相顕微鏡を用いて細胞の振動に対する時間変動を計測した一例について、図7〜図13を参照しながら説明する。細胞膜にフォーカスを合わせて得られた位相画像(図7)では、なだらかに連続する細胞膜の形状を反映して、細胞膜の高さに応じて干渉縞が空間的に連続して表示される。一方、細胞膜が、定量位相顕微鏡の測定領域に存在していない領域は連続した位相が得られず、干渉縞は見られない。干渉縞が空間的に連続する領域と位相がランダムになる領域との境界を検出することは容易であり、境界に対して位相が空間的に連続する側の領域を細胞膜の存在領域として特定する(図8において白線で囲まれた領域)。
【0054】
その上で、時間的に連続する位相画像の各画素において、時間的に位相アンラッピングを行い、すべての隣接する撮像フレーム同士の間で、ある閾値φmaxを超えるような不連続な位相の変化のない画素を細胞膜の時間変動情報が得られた画素と判定する。本実施例では、φmaxをπ/2とし、π/2を超えるような不連続な位相の変化のない画素を細胞膜の時間変動情報が得られた画素と判定した(図9における白色画素)。すなわち、空間位相から特定した細胞膜領域内に存在する画素(図8において白線で囲まれた領域の画素)、および時間位相アンラッピングにて連続する位相が得られた画素(図9における白色画素)の共通部分を、細胞膜からの時間変動情報が記録できた画素として特定する(図10における白線内の白色画素)。
【0055】
次に、それぞれの個々の細胞における細胞膜の変位を数値化する段階に進む。細胞膜の振動は細胞膜上で波のようにダイナミックに変化しているため、振動の周波数に共通性はあっても計測する空間的な場所に応じて振動の位相が異なる。そのため、一つの細胞に対して細胞全体を含むようにすべての画素の平均値の変位を求めても、細胞膜の振動は打ち消されて細胞膜の挙動を十分に反映することはできない。そこで、一つの細胞につき5〜7箇所の複数の計測領域を設ける。
【0056】
図11は各々の細胞に設けた複数の計測領域を示しており、計測領域が四角のマークで表示されている。設定した複数の計測領域において、領域を構成する画素の平均値について時間変化を求める。細胞膜の変位の時間変化は測定開始後からの変化量として評価してよい。
【0057】
このようにして、一つの細胞に対して細胞膜の領域を複数領域に細分し、複数の領域の細胞膜の時間変位を求めると、図12および図13に示すような、各計測領域における時間と変位のグラフを描くことができる。図12および図13では2つの種類の異なる細胞の細胞膜の時間変位を示しており、細胞の種類によって細胞膜の時間的な挙動が異なることを示唆するものである。図12は未分化な幹細胞の時間変位を示しており、図13は分化した破骨細胞の時間変位を示している。
【0058】
なお、細胞の膜の変位を計測する際には温度により細胞膜の変動の大きさが変化するので、一定の温度管理下で計測することが望ましい。
【0059】
(細胞判別装置1により行われる動作)
続いて、細胞判別装置1により行われる動作(特許請求の範囲における「細胞判別用の参照データ生成方法」および「細胞判別方法」に対応)の一例として、被検体の細胞の種類を判別する方法について説明する。被検体の細胞の種類を判別する手順は、被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、細胞を判別するための参照データを生成する参照データ生成手順(特許請求の範囲における「参照データ生成ステップ」に対応)と、細胞の振動を定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して周波数解析を行った結果を、参照データ生成手順にて生成された参照データと照らし合わせることにより、被検体の細胞を判別する細胞判別手順(特許請求の範囲における「細胞判別ステップ」に対応)に大別される。以下、各手順の詳細について説明する。
【0060】
(参照データ生成手順)
図14は、参照データ生成手順を示すフローチャートである。参照データ生成手順では、予め細胞の種類が判別されている細胞集団を用意し、当該細胞集団の細胞を計測した結果から参照データを作成する。
【0061】
図14に示すように、最初に、レファランス(参照)となる細胞集団を2種類以上用意する(ステップS101)。
【0062】
次に、ステップS101にて用意した複数の細胞集団における細胞の振動を定量位相顕微鏡を用いて一定時間計測する。具体的には、それぞれの細胞について複数の計測領域を設定し、当該複数の計測領域のそれぞれに対して振動計測を行い、細胞の振動の時間変位量を得る(ステップS102、特許請求の範囲における「振動計測ステップ」に対応)。
【0063】
次に、ステップS102で得た複数の計測領域のそれぞれにおける細胞振動の時間変位量(計測結果)に対して、周波数およびパワースペクトルによる周波数解析を行う(ステップS103、特許請求の範囲における「周波数解析ステップ」に対応)。周波数解析の指標であるパワースペクトル(PSD)は、以下の数式(4)および(5)で計算される。
【数1】

【数2】

上記の数式(4)および(5)において、Nは時間軸上でのサンプリング点数である。Δtはサンプリングの時間間隔である。Δh(m)は、t=Δt*mの時点での計測開始時からの細胞膜の変位量である。なお、m=0、1、2、3、…(N−1)である。
【0064】
次に、ステップS103で求めたパワースペクトルを平均化することにより細胞全体としての周波数解析結果を得る(ステップS104)。つまり、一つの細胞における周波数パワースペクトルを得るには、一つの細胞に複数の計測領域を設けて得られたそれぞれの計測領域の細胞膜の時間変位データからそれぞれ周波数解析を行いパワースペクトルデータを取得し、複数の計測領域のパワースペクトルを平均化して、一つの細胞の全体としての周波数パワースペクトルを得る。
【0065】
次に、ステップS103およびステップS104における当該周波数解析結果を近似することにより、細胞の振動の特性を数値化する。この手順では、周波数に対するパワースペクトルの値を近似化した近似線、および当該近似線における傾きを求める(ステップS105、特許請求の範囲における「数値化ステップ」に対応)。
【0066】
具体的には、離散化された周波数を横軸に、且つパワースペクトルを縦軸に取って、ステップS103およびステップS104における当該周波数解析結果を両対数でプロットすると、図15に示すようなパワースペクトルのグラフが得られる。図15には特性の異なる4種類のパワースペクトル(A〜D)の例を模式的に示した。グラフAは、振幅が大きく、パワースペクトルが周波数の−1乗に比例するような特性、グラフBは、振幅が大きく、パワースペクトルが周波数によらず一定であるような特性、グラフCは、振幅が小さく、パワースペクトルが周波数の−1乗に比例するような特性、グラフDは、振幅が小さく、パワースペクトルが周波数によらず一定であるような特性である。
【0067】
この細胞膜の振動のパワースペクトルを、両対数グラフ上において直線で近似することで、つまり図15のグラフA〜Dを直線で近似することで、振動の特性を数値化することができる。なお、両対数グラフ上での直線は、パラメータAとsを用いて、式(6)によって表される。Aは図15においてf=1Hzにおける近似直線の値であり、sは両対数グラフ上に引いた直線の傾き(つまりグラフA〜Dの傾き)である。
PSDfit(f)=A*fs…(6)
【0068】
次に、ステップS105における当該数値化の結果を元に散布図を作成する。この手順では、傾きを一の軸とし且つ所定の周波数におけるパワースペクトルの値を他の軸とする2次元上に、傾きに対してパワースペクトルの値を被検体の細胞ごとにプロットした図を、散布図として作成する(ステップS106、特許請求の範囲における「散布図作成ステップ」に対応)。
【0069】
具体的に、細胞集団の中のそれぞれの細胞について、細胞膜の振動計測を行い、パワースペクトルを集計するにあたって、得られたパワースペクトルの近似直線の傾きsを横軸に、ある周波数f=f0におけるパワースペクトルの近似直線の値(PSDfit(f0))を縦軸に取ってプロットすると、視覚的に分かりやすく、また統計的にも処理しやすい散布図を得ることができる。例えば、所定の周波数としてf0=0.1Hzを用いて、図15の4つのパワースペクトルを散布図にプロットすると、図16のような散布図が得られる。
【0070】
次に、ステップS106にて作成された散布図における所定領域を細胞を判別するための判別領域として区画する(ステップS108、特許請求の範囲における「領域区画ステップ」に対応)。この手順における当該領域区画は、散布図上で区画線を設定することにより行われる。そして、この手順にて当該領域区画された当該散布図を、細胞を判別するための判断基準となる参照データとして参照データ格納部170に格納する(ステップS109)。以下、散布図作成や領域区画について、より詳しく説明する。
【0071】
散布図を作成するにあたっては、上述したステップS106にて複数の所定の周波数に対して散布図が作成され、当該複数の散布図のうち、プロットされたパワースペクトルの値における決定係数の値が所定の値以下である散布図を、ステップS108にて当該領域区画される散布図として選択する手順を更に含む(ステップS107、特許請求の範囲における「散布図選択ステップ」に対応)。
【0072】
図17に、異なるf0を用いて作成した、細胞膜のパワースペクトルの近似直線の散布図を示す。元となるデータは生細胞を用いた実験によって得られたものである。元データは、ヒト乳癌細胞由来の細胞株MCF7(細胞数N=11)のものと、マウス膵臓由来の細胞株INS1(細胞数N=10)のものからなる。図17(a)は、f0=0.02Hzを用いて、細胞集団のパワースペクトルの特性をプロットしたものである。図17(b)は、f0=0.1Hzを用いて、細胞集団のパワースペクトルの特性をプロットしたものである。図11(c)は、f0=1Hzを用いて、細胞集団のパワースペクトルの特性をプロットしたものである。それぞれのグラフにおいて、横軸はパワースペクトルの近似直線の傾きであり、縦軸は近似直線のf=f0におけるパワースペクトル値の常用対数(log10(PSDfit(f0)))である。図17においては細胞の種類を区別せずに、被測定細胞すべてを対象にしてプロットした。
【0073】
図17のそれぞれについて、最小二乗法により一次関数による近似直線を引いて、決定係数R2を求めた。f0=0.02Hzを用いた場合は決定係数R2=0.8537、f0=0.1Hzを用いた場合は決定係数R2=0.5779、f0=1Hzを用いた場合は決定係数R2=0.2726となった。図からも視覚的に明らかなように、f0=0.02Hzを用いた場合(図17(a))では横軸と縦軸の相関が大きく(R2>0.6)、二変数でプロットしている意義が失われてしまっている。したがって、f0=0.02Hzを用いるのは適切ではないと判断する。
【0074】
次に、細胞集団ごとの違いを定量化するため、被測定細胞に含まれるMCF7とINS1を区別してプロットしたのが図18である。決定係数R2が大きいf0=0.02Hzを用いた場合のグラフは除外した。f0=0.1Hzを用いた場合(図18(a))と、f0=1Hzを用いた場合(図18(b))を比べると、図18(a)の場合には垂直線と水平線を用いた単純な区画線でINS1の細胞集団とMCF7の細胞集団を区別することができる。この細胞弁別を、細胞集団からMCF7のみを区別する試験と考えた場合、図18(a)の場合は図に示した太線の区画線を用いて、感度91%、特異度100%で弁別ができるのに対し、図18(b)の場合は感度72%、特異度90%となり、明らかに弁別の性能が劣る。
【0075】
したがって、これらの結果から、上記示した実施例において、散布図の縦軸PSDfit(f0)に用いるf0としては、f0=0.1Hzが適切であることが分かる。f0=0.1Hzを用いた散布図(図18(a))を用いることで、細胞一個一個の違いが2変数を用いて分布的に示され、細胞集団同士の弁別も容易になる。このようにして特定の2種類の細胞集団の細胞弁別を行う判断基準が設定できる。これをリファレンスデータ(参照データ)とする。リファレンスデータは種類や状態の異なる2種類以上の細胞集団について取得し、格納しておく。
【0076】
(細胞判別手順)
引き続き、細胞判別手順について説明する。細胞判別手順は、被検体となる未知の細胞の細胞膜の振動を一定時間計測し、細胞膜の振動の周波数解析を行い、既に格納されているリファレンスデータの2成分散布図に当てはめることによって行う。弁別したい被検体の細胞は、リファレンスデータとして既に取得済みである種類と同種類の細胞である。以下、図19を参照しながら細胞判別手順の詳細について説明する。図19は、細胞判別手順を示すフローチャートである。
【0077】
図19に示すように、最初に、被検体となる未知の細胞を用意する(ステップS201)。
【0078】
次に、ステップS201にて用意した被検体の細胞の振動を定量位相顕微鏡を用いて一定時間計測する。具体的には、被検体細胞について複数の計測領域を設定し、当該複数の計測領域のそれぞれに対して振動計測を行い、細胞の振動の時間変位量を得る(ステップS202)。
【0079】
次に、ステップS202で得た複数の計測領域のそれぞれにおける細胞振動の時間変位量(計測結果)に対して、周波数およびパワースペクトルによる周波数解析を行う(ステップS203、ステップS204)。周波数解析の手法は上述のステップS103およびステップS104と同様であるため、ここでは説明を省略する。
【0080】
次に、ステップS203およびステップS204における当該周波数解析結果を近似することにより、細胞の振動の特性を数値化する(ステップS205)。数値化の手法は上述のステップS105と同様であるため、ここでは説明を省略する。
【0081】
次に、ステップS205における当該数値化の結果を、参照データ生成手順で作成した参照データに当てはめる。図20に示すように、参照データには2種類の細胞(MCF7とINS1)を識別するための区画線Mが引かれており、判別領域LがMCF7を判別するための判別領域である。図20のような参照データを用いて、被検体となる未知の細胞の振動の特性を数値化したものが判別領域L内に位置するのであれば、当該未知の細胞はMCF7であると判別することができる(ステップS206)。
【0082】
(参照データ生成手順および細胞判別手順のまとめ)
以上、参照データ生成手順および細胞判別手順を説明した。以上の説明を簡単にまとめると次のようである。(1)細胞一個一個の細胞膜の変動の周波数パワースペクトルを計算し、それぞれを式(6)に基づきフィッティングし、フィッティング直線の傾きsとフィッティング直線の複数のf=f0におけるパワースペクトルの値を求め、各細胞の細胞膜振動の周波数パラメータとする。(2)リファレンスとなる2種類以上の細胞集団についてフィッティング直線の傾きsを横軸、フィッティング直線のf=f0における値を縦軸にして、各細胞のパワースペクトルの特性を2変数の散布図にプロットする。(3)異なるf0を用いて複数の2変数散布図を作成する。(4)2変数散布図の中で、プロットされた点の決定係数の大きいものを除外し、決定係数の値が所定の値以下のものを選択する。上記の例においては決定係数が例えば0.6以下のものを選択した。(5)2変数散布図を、細胞集団ごとに別のシンボルや色を用いてプロットし、細胞集団同士の弁別が単純な区画線を用いて可能となるようなf0を採用し、2変数散布図と区画線を決定し、2種類の細胞集団を弁別するためのリファレンスデータとする。(6)被検体である未知細胞について細胞膜の変動を計測し、得られた周波数パラメータをリファレンスデータの2変数散布図と区画線に当てはめて細胞を弁別する。このような手続きを経ることで、細胞膜の変動の周波数解析をもとにして細胞を弁別する方法および装置を提供することができる。
【0083】
[第2実施形態]
引き続き、本発明の第2実施形態について説明する。第2実施形態では、複数作成した散布図の選択方法が、第1実施形態と主に相違している。つまり、第1実施形態における図14のステップS107において相違点がある。以下ではこの相違点を中心に説明する。
【0084】
第1実施形態で既に説明したステップS101〜ステップS106を経て、異なるf0を複数用いて複数作成した、細胞膜のパワースペクトルの近似直線の散布図を図21に示す。元となるデータは生細胞を用いた実験によって得られたものである。元データは、ヒト乳癌細胞由来の細胞株MCF7(細胞数N=11)のものと、マウス膵臓由来の細胞株INS1(細胞数N=10)のものからなり、細胞の種類が区別できるようにプロットしたものである。それぞれのグラフにおいて、横軸はパワースペクトルの近似直線の傾き、縦軸は近似直線のf=f0における値の常用対数(log10(PSDfit(f0)))である。図21(a)は、f0=0.02Hzを用いて、細胞集団のパワースペクトルの特性をプロットしたものである。図21(b)は、f0=0.1Hzを用いて、細胞集団のパワースペクトルの特性をプロットしたものである。図21(c)は、f0=1Hzを用いて、細胞集団のパワースペクトルの特性をプロットしたものである。
【0085】
図21において、INS1の細胞集団とMCF7の細胞集団をもっとも良く区別するために直線と水平線を用いた単純な区画線を引くことを行う。この細胞弁別を、細胞集団からMCF7のみを区別する試験と考えた場合、図21(a)の場合は図に示した太線の区画線を用いて、感度100%、特異度85%、図21(b)の場合は感度91%、特異度100%で弁別できるのに対し、図21(c)の場合は感度72%、特異度90%となり明らかに弁別の性能が劣る。そこで、この中で、f0=0.02Hzを用いた場合(図21(a))とf0=0.1Hzを用いた場合(図21(b))を弁別能力の高い候補として残し、f0=1Hzを用いた場合(図21(c))を候補から除く。
【0086】
次に、絞られた候補に対し、すべての細胞のプロットに対して、最小二乗法により一次関数による近似直線を引いて、決定係数R2を求めた(図22)。ここでは、細胞の種類を区別せずに、被測定細胞すべてを対象にしてプロットした。f0=0.02Hzを用いた場合は決定係数R2=0.8537、f0=0.1Hzを用いた場合は決定係数R2=0.5779となった。図からも視覚的に明らかなように、f0=0.02Hzを用いた場合(図22(a))では横軸と縦軸の相関が大きく(R2>0.6)、二変数でプロットしている意義が失われてしまっている。したがって、f0=0.02Hzを用いるのは適切ではないと判断する。
【0087】
したがって、これらの結果から、上記示した実施例において、散布図の縦軸PSDfit(f0)に用いるf0としては、f0=0.1Hzが適切であることが分かる。f0=0.1Hzを用いた散布図(図22(b))を用いることで、細胞一個一個の違いが2変数を用いて分布的に示され、細胞集団同士の弁別も容易になる。このようにして特定の2種類の細胞集団の細胞弁別を行う判断基準が設定できる。これをリファレンスデータ(参照データ)とする。リファレンスデータは種類や状態の異なる2種類以上の細胞集団について取得し、格納しておく。
【0088】
(本実施形態の作用・効果、そして応用)
本実施形態によれば、細胞の振動を定量位相顕微鏡を用いて計測する。定量位相顕微鏡を用いた計測方法によれば、光を使った非侵襲で、更にナノメータスケールの高精度で、細胞の振動を計測することができる。また、AFMの場合と異なり、多点計測ができるため、細胞の特徴的な変動を示す部位を知らなくても、細胞全体としての特徴を捉えることができる。更に、計測時間面において、AFMの場合でのような長時間はかからないというメリットがある。そして、以上のような定量位相顕微鏡による計測方法を用いて、参照データを生成し、また当該参照データを用いて被検体の細胞を判別するため、結果的に、非侵襲、高精度、更に高速で細胞判別を行うことができる。
【0089】
従来、培養した細胞の状態を把握したり、分化/未分化やがん化などの細胞の変化を判断する手段としては、観測者が光学顕微鏡を用いて細胞の形態を肉眼で観察し、経験的な判断に委ねられることが多く、再現性や品質の安定性のうえでは十分とは言いがたかった。また、定量的に判断する手段として、蛍光試薬や蛍光で標識された細胞特異的な抗体等で処理して判断する方法が用いられているが、標識した細胞の培養を継続することは事実上困難であるので、判定した細胞を引き続き培養するなど、生きたまま再利用することができなかった。
【0090】
本実施形態では生きた細胞のまま細胞膜の状態を測定することによって細胞を非侵襲に評価、識別することができるため、蛍光ラベルができない用途に広く利用できると考えられる。具体的には培養している細胞の状態をモニタリングする装置が考えられる。細胞の状態モニタリング装置は細胞選別装置の前処理として、目的の細胞を非侵襲に識別してその座標を記憶する装置としても役立つ。また細胞の状態モニタリング装置は細胞を用いた創薬スクリーニングにおける試験の前処理として、試験に用いる培養した細胞の状態を把握して測定結果に重みづけをする装置としても役に立つ。応用面では、ES細胞、iPS細胞を含む幹細胞からの分化誘導における分化/未分化状態の識別、正常細胞とがん細胞の識別、異なる細胞集団が混在する環境における細胞の種類の識別、凍結解凍直後における細胞蘇生率の迅速判定などに利用することができる。
【符号の説明】
【0091】
1…細胞判別装置、110…振動計測部、120…周波数解析部、130…数値化部、140…散布図作成部、150…散布図選択部160…領域区画部、170…参照データ格納部、180…データ照合部。
【特許請求の範囲】
【請求項1】
被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、前記細胞を判別するための参照データを生成する参照データ生成ステップと、
前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して前記周波数解析を行った結果を、前記参照データ生成ステップにて生成された前記参照データと照らし合わせることにより、前記被検体の前記細胞を判別する細胞判別ステップと、
を備えることを特徴とする細胞判別方法。
【請求項2】
前記参照データ生成ステップは、
前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測する振動計測ステップと、
前記振動計測ステップにおける当該計測結果に対して前記周波数解析を行う周波数解析ステップと、
前記周波数解析ステップにおける当該周波数解析結果を近似することにより、前記振動の特性を数値化する数値化ステップと、
前記数値化ステップにおける当該数値化の結果を元に散布図を作成する散布図作成ステップと、
前記散布図作成ステップにて作成された前記散布図における所定領域を前記細胞を判別するための判別領域として区画する領域区画ステップと、
を備え、
前記参照データは、前記領域区画ステップにて当該領域区画された当該散布図である、
ことを特徴とする請求項1に記載の細胞判別方法。
【請求項3】
前記振動計測ステップでは、前記細胞に設けられた複数の計測領域に対してそれぞれ当該計測を行い、
前記周波数解析ステップでは、それぞれの前記計測領域の当該計測結果に対して前記周波数解析を行い、且つ当該周波数解析結果を平均化することにより前記細胞全体としての周波数解析結果を得る、
ことを特徴とする請求項2に記載の細胞判別方法。
【請求項4】
前記周波数解析ステップでは、周波数およびパワースペクトルにより前記周波数解析が行われ、
前記数値化ステップでは、前記周波数に対する前記パワースペクトルの値を近似化した近似線、および前記近似線における傾きを求め、
前記散布図作成ステップでは、前記傾きを一の軸とし且つ所定の周波数における前記パワースペクトルの値を他の軸とする2次元上に、前記傾きに対して前記パワースペクトルの値を前記被検体の前記細胞ごとにプロットした図を、前記散布図として作成する、
ことを特徴とする請求項2または3に記載の細胞判別方法。
【請求項5】
前記散布図作成ステップでは、複数の前記所定の周波数に応じて複数の前記散布図が作成され、
当該複数の前記散布図のうち、プロットされた前記パワースペクトルの値における決定係数の値が所定の値以下である前記散布図を、前記領域区画ステップにて当該領域区画される前記散布図として選択する散布図選択ステップを更に備える、
ことを特徴とする請求項4に記載の細胞判別方法。
【請求項6】
前記領域区画ステップにおける当該領域区画は、前記散布図上で区画線を設定することにより行われる、
ことを特徴とする請求項2〜5の何れか1項に記載の細胞判別方法。
【請求項7】
細胞の振動を定量位相顕微鏡を用いて一定時間計測する振動計測ステップと、
前記振動計測ステップにおける当該計測結果に対して周波数解析を行う周波数解析ステップと、
前記周波数解析ステップにおける当該周波数解析結果を近似することにより、前記振動の特性を数値化する数値化ステップと、
前記数値化ステップにおける当該数値化の結果を元に散布図を作成する散布図作成ステップと、
前記散布図作成ステップにて作成された前記散布図における所定領域を前記細胞を判別するための判別領域として区画する領域区画ステップと、
を備えことを特徴とする細胞判別用の参照データ生成方法。
【請求項8】
被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、前記細胞を判別するための参照データを生成する参照データ生成手段と、
前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して前記周波数解析を行った結果を、前記参照データ生成手段が生成した前記参照データと照らし合わせることにより、前記被検体の前記細胞を判別する細胞判別手段と、
を備えることを特徴とする細胞判別装置。
【請求項9】
前記参照データ生成手段は、
前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測する振動計測手段と、
前記振動計測手段による当該計測結果に対して前記周波数解析を行う周波数解析手段と、
前記周波数解析手段による当該周波数解析結果を近似することにより、前記振動の特性を数値化する数値化手段と、
前記数値化手段による当該数値化の結果を元に散布図を作成する散布図作成手段と、
前記散布図作成手段が作成した前記散布図における所定領域を前記細胞を判別するための判別領域として区画する領域区画手段と、
を備え、
前記参照データは、前記領域区画手段が当該領域区画した当該散布図である、
ことを特徴とする請求項8に記載の細胞判別装置。
【請求項1】
被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、前記細胞を判別するための参照データを生成する参照データ生成ステップと、
前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して前記周波数解析を行った結果を、前記参照データ生成ステップにて生成された前記参照データと照らし合わせることにより、前記被検体の前記細胞を判別する細胞判別ステップと、
を備えることを特徴とする細胞判別方法。
【請求項2】
前記参照データ生成ステップは、
前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測する振動計測ステップと、
前記振動計測ステップにおける当該計測結果に対して前記周波数解析を行う周波数解析ステップと、
前記周波数解析ステップにおける当該周波数解析結果を近似することにより、前記振動の特性を数値化する数値化ステップと、
前記数値化ステップにおける当該数値化の結果を元に散布図を作成する散布図作成ステップと、
前記散布図作成ステップにて作成された前記散布図における所定領域を前記細胞を判別するための判別領域として区画する領域区画ステップと、
を備え、
前記参照データは、前記領域区画ステップにて当該領域区画された当該散布図である、
ことを特徴とする請求項1に記載の細胞判別方法。
【請求項3】
前記振動計測ステップでは、前記細胞に設けられた複数の計測領域に対してそれぞれ当該計測を行い、
前記周波数解析ステップでは、それぞれの前記計測領域の当該計測結果に対して前記周波数解析を行い、且つ当該周波数解析結果を平均化することにより前記細胞全体としての周波数解析結果を得る、
ことを特徴とする請求項2に記載の細胞判別方法。
【請求項4】
前記周波数解析ステップでは、周波数およびパワースペクトルにより前記周波数解析が行われ、
前記数値化ステップでは、前記周波数に対する前記パワースペクトルの値を近似化した近似線、および前記近似線における傾きを求め、
前記散布図作成ステップでは、前記傾きを一の軸とし且つ所定の周波数における前記パワースペクトルの値を他の軸とする2次元上に、前記傾きに対して前記パワースペクトルの値を前記被検体の前記細胞ごとにプロットした図を、前記散布図として作成する、
ことを特徴とする請求項2または3に記載の細胞判別方法。
【請求項5】
前記散布図作成ステップでは、複数の前記所定の周波数に応じて複数の前記散布図が作成され、
当該複数の前記散布図のうち、プロットされた前記パワースペクトルの値における決定係数の値が所定の値以下である前記散布図を、前記領域区画ステップにて当該領域区画される前記散布図として選択する散布図選択ステップを更に備える、
ことを特徴とする請求項4に記載の細胞判別方法。
【請求項6】
前記領域区画ステップにおける当該領域区画は、前記散布図上で区画線を設定することにより行われる、
ことを特徴とする請求項2〜5の何れか1項に記載の細胞判別方法。
【請求項7】
細胞の振動を定量位相顕微鏡を用いて一定時間計測する振動計測ステップと、
前記振動計測ステップにおける当該計測結果に対して周波数解析を行う周波数解析ステップと、
前記周波数解析ステップにおける当該周波数解析結果を近似することにより、前記振動の特性を数値化する数値化ステップと、
前記数値化ステップにおける当該数値化の結果を元に散布図を作成する散布図作成ステップと、
前記散布図作成ステップにて作成された前記散布図における所定領域を前記細胞を判別するための判別領域として区画する領域区画ステップと、
を備えことを特徴とする細胞判別用の参照データ生成方法。
【請求項8】
被検体である細胞の振動を定量位相顕微鏡を用いて一定時間計測し、且つ当該計測結果に対して周波数解析を行うことにより、前記細胞を判別するための参照データを生成する参照データ生成手段と、
前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測し且つ当該計測結果に対して前記周波数解析を行った結果を、前記参照データ生成手段が生成した前記参照データと照らし合わせることにより、前記被検体の前記細胞を判別する細胞判別手段と、
を備えることを特徴とする細胞判別装置。
【請求項9】
前記参照データ生成手段は、
前記細胞の前記振動を前記定量位相顕微鏡を用いて一定時間計測する振動計測手段と、
前記振動計測手段による当該計測結果に対して前記周波数解析を行う周波数解析手段と、
前記周波数解析手段による当該周波数解析結果を近似することにより、前記振動の特性を数値化する数値化手段と、
前記数値化手段による当該数値化の結果を元に散布図を作成する散布図作成手段と、
前記散布図作成手段が作成した前記散布図における所定領域を前記細胞を判別するための判別領域として区画する領域区画手段と、
を備え、
前記参照データは、前記領域区画手段が当該領域区画した当該散布図である、
ことを特徴とする請求項8に記載の細胞判別装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2011−147400(P2011−147400A)
【公開日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願番号】特願2010−12125(P2010−12125)
【出願日】平成22年1月22日(2010.1.22)
【出願人】(504300181)国立大学法人浜松医科大学 (96)
【出願人】(000236436)浜松ホトニクス株式会社 (1,479)
【Fターム(参考)】
【公開日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願日】平成22年1月22日(2010.1.22)
【出願人】(504300181)国立大学法人浜松医科大学 (96)
【出願人】(000236436)浜松ホトニクス株式会社 (1,479)
【Fターム(参考)】
[ Back to top ]

