細胞単離方法およびその使用
【課題】細胞の分離および単離のための新規の方法およびデバイス。
【解決手段】本発明により、密度勾配遠心分離において有用な遠心管であって、ここで、該管の中央部における遠心管内径が、該管の上部および底部での直径よりも狭い遠心管が提供される。さらに本発明により、誘電泳動単離デバイスであって、該デバイスは、2つの誘電泳動チップ、ガスケット、シグナル発生器およびポンプを備え、ここで、該ガスケットは、チャネル を備え、そして該ガスケットは、該2つの誘電泳動チップ間に位置し、そして該誘電泳動チップ、該ガスケットおよび該ポンプは、流体接続される、誘電泳動単離デバイスもまた、提供される。
【解決手段】本発明により、密度勾配遠心分離において有用な遠心管であって、ここで、該管の中央部における遠心管内径が、該管の上部および底部での直径よりも狭い遠心管が提供される。さらに本発明により、誘電泳動単離デバイスであって、該デバイスは、2つの誘電泳動チップ、ガスケット、シグナル発生器およびポンプを備え、ここで、該ガスケットは、チャネル を備え、そして該ガスケットは、該2つの誘電泳動チップ間に位置し、そして該誘電泳動チップ、該ガスケットおよび該ポンプは、流体接続される、誘電泳動単離デバイスもまた、提供される。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願)
本願は、2001年3月22日に出願した、表題「CELL ISOLATION METHOD AND USES THEREOF」の中国特許出願第01110015.X号に関連する。上記の参照特許出願の開示は、その全体において参考として援用される。
【0002】
(技術分野)
本発明は、一般的に細胞の分離または単離の分野に関する。特に、本発明は細胞の分離のための方法を提供し、この方法は、以下の工程を包含する:a)分離されるべき細胞を、色素により選択的に染色する工程であって、差示的に染色された細胞の分離可能な特性において十分な差異が存在するようにする、工程;およびb)上記分離可能な特性を介してその差示的に染色された細胞を分離する工程。好ましくは、上記分離可能な特性は、差示的に染色された細胞の誘電泳動特性であり、上記差示的に染色された細胞が誘電泳動を介して分離または単離される。血液サンプルにおいて種々の型の細胞を選択する方法もまた提供される。密度勾配遠心分離において有用な遠心管および種々の型の細胞を分離または単離するために有用な誘電泳動単離デバイスがさらに提供される。
【背景技術】
【0003】
(背景技術)
出生前診断は、30年前に始まった(例えば、Williamson and Bob、Towards Non−invasive Prenatal Diagnosis、Nature Genetics、14:239−240(1996)を参照のこと)。現在、出生前診断は、非常に将来有望な分野となってきた。現在、胎児の細胞は、羊水穿刺または絨毛膜サンプリング(CVS)を使用することによって得られる。羊水穿刺は、母体の腹部を通して子宮および羊膜嚢内に挿入された針を介する羊水の取り出しである。CVSは、妊娠の10〜11週の間に実行され、そして胎盤が位置している場所に依存して、経腹部または経子宮頸部のいずれかで実行され;胎盤が前部にある場合は、経腹部アプローチが使用され得る。CVSは、針(腹部)またはカテーテル(子宮頸部)を、胎盤の実質に挿入する工程を包含し、但し、この工程は羊膜嚢内に達したまま維持する。次いで、吸引はシリンジによって適用され、そして組織の約10〜15ミリグラムがこのシリンジ内に吸引される。この組織は母体の子宮組織から手動で取り除かれ、次いで培養にて増殖される。核型は、羊水穿刺と同様の方法にて作製される。羊水穿刺および絨毛膜サンプリングの各々は、しばしば胎児の死亡を増加させる。羊水穿刺について、その可能性は、約0.5%であり、一方CVSについて、その可能性は約1.5%である(米国特許第5,948,278号;およびHolzgreveら、Fetal Cells In the Maternal Circulation、Journal of Reproductive Medicine、37(5):410−418(1992))。従って、これらは、35歳に達した女性のほとんど(異常な核型を有する子供を出産する危険性が、手順に関連する危険性に匹敵する)に提供される。
【0004】
羊水穿刺およびCVSの手順により誘導される危険性の不確定性に起因して、妊娠した胎児の情報についての非侵襲的方法の開発は、考慮されるべき関心事である。母体の循環における胎児細胞の存在は、考慮されるべき研究のトピックであり、そして長年にわたって試験されている。胎児細胞には、3つの主要な型が存在することが、現在理解されている:リンパ球、栄養膜および有核胎児赤血球。(SimpsonおよびElias、Isolating Fetel Cells in Maternal Circulation for Prenatal Diagnosis,Prenatal Diagnosis、14:1229−1242(1994);Cheungら、Prenatal Diagnosis of Sickle Cell Anaemia and Thalassaemia by Analysis of Fetal Cells in Maternal Blood、Nature Genetics、14:264−268(1996);Bianchiら、Isolation of Fetal DNA from Nucleated Erythrocytes in Maternal Blood、Proc.Natl.Acad.Sci.USA、86:3279−3283(1990);ならびに米国特許第5,641,628号)。種々の提案は、母体血液サンプル由来のこれらの細胞型の1つの単離または濃縮に役立ち、染色体異常についての試験のために、これらの単離細胞または濃縮細胞を使用することが提案されている。栄養膜は、細胞の3つの型のうち最も大きな細胞である。しかし、これらは、分離の研究において広範な適用を見出さない。なぜなら、これらは、母体の循環に最初に入るときに、母体の肺において分解されるからである。胎児のリンパ球は、母体の血液中でかなり長い間生存することが可能であるので、偽性診断は、以前の胎児に由来するリンパ球の継続に起因する可能性がある。有核赤血球(NRBC)は、妊娠初期の間に、胎児血液において最も共通な細胞である。これまでに試験された分離方法は、蛍光活性化細胞選別器(FACS)、磁気活性化細胞選別器(MACS)、電荷フロー分離器(charge flow separateion)(CFS)および密度勾配遠心分離である。これらの方法の全ては、結果として、母体細胞の大きな集団から胎児の細胞を濃縮させる。これらは、胎児細胞の純粋な集団の回収は可能ではない(Cheungら、Nature Genetics、14:264−268(1996))。
【0005】
この困難さには2つの理由がある。第一に、胎児のNRBCは、母体の血球中に非常にわずかに存在するが、これらの数は、胎児の栄養膜および胎児のリンパ球と比較すると非常に高い。母体の血液において、有核細胞と胎児NRBCとの比率は、4.65×106〜6×106である。約7〜22個の胎児NRBCは、MACSによって20mlの母体血球から得られ得る(Cheungら、Nature Genetics、14:264−268(1996))。第二に、胎児NRBCと母体細胞との間に、差異はほとんどない。胎児NRBCおよび母体NRBCについて、これらの間のわずかな差異は、胎児NRBCにおける特異的なヘモグロビンγおよびヘモグロビンζの存在である。
【0006】
生物学、化学および臨床診断のような多様な分野における種々の技術は、細胞分離のために適用されてきた。これらの技術により、細胞型間の差異は、細胞の特定の型を単離するために利用されている。これらの差異としては、細胞表面特性、ならびに細胞集団間の物理的および機能的な差異が挙げられる。いくつかの場合において、細胞型間の差異は非常に些細なものであり、現在利用可能な技術によってこれらを分離することは非常に困難である。
【発明の開示】
【発明が解決しようとする課題】
【0007】
当該分野において、細胞の分離および単離のための新規の方法およびデバイスの必要性が存在する。本発明は、この必要性および当該分野における他の関連した必要性を解決する。
【課題を解決するための手段】
【0008】
(発明の開示)
1つの局面において、本発明は、細胞を分離するための方法を提供し、その方法は、a)分離されるべき細胞を、色素により選択的に染色して、差示的に染色された細胞の分離可能な特性において十分な差異が存在するようにする工程;およびb)その分離可能な特性を介して、その差示的に染色された細胞を分離する工程、を包含する。好ましくは、上記分離可能な特性が、上記差次的に染色された細胞の誘電泳動特性であり、そしてその差次的に選択された細胞が、誘電泳動を介して分離または単離される。
【0009】
別の局面において、本発明は、母体の血液サンプルから有核赤血球(NRBC)を単離する方法に関し、その方法は、a)母体の血液サンプル中の少なくとも1つの細胞型を、色素により選択的に染色して、差示的に染色された細胞の誘電泳動特性において十分な差異が存在するようにする工程;およびb)誘電泳動を介して、その母体の血液サンプルから胎児NRBC細胞を単離する工程、を包含する。
【0010】
なお別の局面において、本発明は、白血球から赤血球を分離する方法に関し、その方法は、a)緩衝液中に、赤血球および白血球を含むサンプルを調製する工程;b)その調製したサンプル中のその赤血球および/または白血球を選択的に染色して、差示的に染色された細胞の誘電泳動特性において十分な差異が存在するようにする工程;c)誘電泳動を介して、その白血球からその赤血球を分離する工程、を包含する。
【0011】
なお別の局面において、本発明は、密度勾配遠心において有用な遠心管に関し、その管の中央部における遠心管内径は、その管の上部および底部での直径よりも狭い。
【0012】
なお別の局面において、本発明は、誘電泳動単離デバイスに関し、そのデバイスは、2つの誘電泳動チップ、ガスケット、シグナル発生器およびポンプを備え、ここで、そのガスケットは、チャネルを備え、そしてそのガスケットは、その2つの誘電泳動チップ間に存在し、そしてその誘電泳動チップ、そのガスケットおよびそのポンプは、流体接続している。
【発明を実施するための最良の形態】
【0013】
(発明を実行する様式)
開示を明確にするためであり、限定のためではないが、本発明の詳細な説明が、以下の小節へと分割される。
【0014】
(A.定義)
他のように定義されない限り、本明細書中で使用されるすべての技術用語および科学用語は、本発明が属する分野の当業者により一般的に理解されるのと同じ意味を有する。本明細書中で言及されるすべての特許、出願、公開された出願、および他の刊行物は、その全体が、参考として援用される。この節において示される定義が、本明細書中で参考として援用されている特許、出願、公開された出願、および他の刊行物において示されている定義と反対であるかまたは一致しない場合は、この節において示される定義が、本明細書中で参考として援用される定義にまさる。
【0015】
本明細書中で使用される場合、「a」または「an」は、「少なくとも1つ」または「1つ以上」を意味する。
【0016】
本明細書中で使用される場合、「チップ」とは、特定のプロセス(例えば、物理的プロセス、化学的プロセス、生物学的プロセス、生物物理学的プロセスまたは生化学的プロセスなど)が実行され得る、複数の1次元、2次元、もしくは3次元の、微小構造または微小尺度構造を備える、固体基材をさす。その微小構造または微小尺度構造(例えば、チャネルおよびウェル、電極素子、電磁素子)は、そのチップ上での物理的、生物物理的、生物学的、生化学的、化学的な、反応またはプロセスを容易にするために、その基材へと組み込まれるか、その基材上で製造されるか、さもなければ、その基材に取り付けられる。そのチップは、1次元では薄くあり得、そして他の次元では種々の形状(例えば、矩形、円形、楕円形、もしくは他の不規則な形状)を有し得る。本発明において使用されるチップの主要な表面の大きさは、かなり(例えば、約1mm2〜約0.25m2)変動し得る。好ましくは、このチップの大きさは、約4mm2〜約25cm2であり、特徴的寸法は、約1mm〜約7.5cmである。このチップの表面は、平らであってもまたは平らでなくてもよい。平らでない表面を有するチップは、その表面上に製造されたチャネルまたはウェルを備え得る。チップの1つの例は、複数の型のDNA分子もしくはタンパク質分子または細胞が固定される、固体基材である。
【0017】
本明細書中で使用される場合、「媒体」とは、細胞が中に溶解されているか、懸濁されているか、または含まれている、流体キャリア(例えば、液体または気体)を指す。
【0018】
本明細書中で使用される場合、「ミクロ流体適用」とは、微小尺度デバイス(例えば、基礎的構造要素の特徴的寸法が、1ミクロン未満〜1cmの間の尺度範囲にある)を、流体ベースの設定における操作およびプロセスのため(代表的には、特定の生物学的、生化学的、または化学的な、反応および手順を実施するため)に使用することを指す。その特定の領域としては、バイオチップ(すなわち、生物学的に関連する反応およびプロセスのためのチップ)、化学チップ(すなわち、化学反応のためのチップ)、またはそれらの組み合わせが挙げられるが、これらに限定されない。その基本的要素の特徴的寸法とは、1次元の大きさを指す。例えば、円形状構造(例えば、丸い電極パッド)を有する微小尺度デバイスについて、その特徴的寸法とは、その丸い電極の直径を指す。基本的構造として薄い矩形の線を有するデバイスについて、その特徴的寸法とは、これらの線の幅または長さを指し得る。
【0019】
本明細書中で使用される場合「微小尺度構造」とは、その構造が、約1ミクロン〜約20mmの尺度範囲にある、基本的構造要素の特徴的寸法を有することを意味する。
【0020】
本明細書中で使用される場合、「植物」とは、特徴として胚(葉緑体を含む)を生成し、セルロース細胞壁を有し、かつ移動運動を欠く、植物界の種々の光合成真核多細胞生物のいずれかを指す。
【0021】
本明細書中で使用される場合、「動物」とは、移動運動能力、非光合成代謝、刺激に対する顕著な応答、制限された成長および固定された身体構造によって特徴付けられる、動物界の多細胞生物をさす。動物の非限定的例としては、鳥類(例えば、ニワトリ)、脊椎動物(例えば、魚類および哺乳動物(例えば、マウス、ラット、ウサギ、ネコ、イヌ、ブタ、雌ウシ、雄ウシ、ヒツジ、ヤギ、ウマ、サル、および他の非ヒト霊長類))が、挙げられる。
【0022】
本明細書中で使用される場合、「細菌」とは、区画化されていない環状DNAおよび約70Sのリボソームを備える、小さい原核生物(直線寸法約1ミクロン)を指す。細菌のタンパク質合成は、真核生物のタンパク質合成とは異なる。多くの抗菌抗生物質は、細菌タンパク質の合成を妨害するが、感染した宿主には影響しない。
【0023】
本明細書中で使用される場合、「真正細菌」とは、古細菌を除く、細菌の主要な亜門を指す。ほとんどのグラム陽性細菌、シアノバクテリア、マイコプラズマ、腸内細菌、シュードモナス、および葉緑体は、真正細菌である。真正細菌の細胞質膜は、エステル結合脂質を含み;その細胞壁(存在する場合)中にはペプチドグリカンが存在し;そして真正細菌においてイントロンは発見されていない。
【0024】
本明細書中で使用される場合、「古細菌」とは、真正細菌を除く、細菌の主要な亜門を指す。古細菌の3つの主要な目(高度好塩菌、メタン産生菌、および硫黄依存性高度好熱菌)が存在する。古細菌は、リボソーム構造、イントロンのプロセシング(いくらかの場合)、および膜組成を含む他の特徴において、真正細菌と異なる。
【0025】
本明細書中で使用される場合、「真菌」とは、根も幹も葉も有さずに不規則な塊の状態で増殖し、かつ葉緑素も光合成可能な他の色素も欠く、真核生物の門を指す。各生物(葉状体)は、単細胞から繊維状までであり、そして細胞壁により囲まれる分枝状体細胞構造(菌糸)(グルカンもしくはキチンまたはその両方を含み、そして真の核を含む)を保有する。
【0026】
本明細書中で使用される場合、「サンプル」とは、本発明の方法および/またはデバイスを使用して分離または単離されるべき細胞を含み得る、任意のものを指す。そのサンプルは、生物学的サンプル(例えば、生物学的流体または生物学的組織)であり得る。生物学的流体の例としては、尿、血液、血漿、血清、唾液、精液、糞便、痰、脳脊髄液、涙、粘液、羊水などが、挙げられる。生物学的組織は、(通常は特定の種類の)細胞の凝集物であり、ヒト、動物、植物、細菌、真菌またはウイルス構造の構造物質(結合組織、上皮組織、筋組織、および神経組織を含む)の1つを形成するその細胞内物質を伴う。生物学的組織の例としては、器官、腫瘍、リンパ節、動脈、および個々の細胞もまた、挙げられる。生物学的組織は、細胞懸濁物サンプルを得るように処理され得る。このサンプルはまた、インビトロで調製された細胞の混合物であり得る。このサンプルはまた、培養細胞懸濁物であり得る。生物学的サンプルの場合、そのサンプルは、もとのサンプルに対する種々の処理または調製後に得られる、粗製サンプルまたは処理済みサンプルであり得る。例えば、種々の細胞分離法(例えば、磁気活性化細胞ソーティング)が、体液サンプル(例えば、血液)から標的細胞を分離または濃縮するために適用され得る。本発明のために使用されるサンプルは、このような標的細胞濃縮細胞調製物を包含する。
【0027】
本明細書中で使用される場合、「液体(流体)サンプル」とは、液体または流体(例えば、生物学的流体)として天然で存在するサンプルを指す。「液体サンプル」とはまた、非液体状態(例えば、固体または気体)にて天然で存在するがその固体サンプル物質または気体サンプル物質を含む液体、流体、溶液または懸濁物として調製される、サンプルを指す。例えば、液体サンプルは、生物学的組織を含む、液体、流体、溶液、または懸濁物を包含し得る。
【0028】
(B.細胞を分離するための方法)
1つの局面において、本発明は、細胞を分離するための方法に関し、その方法は、a)分離されるべき細胞を、色素により選択的に染色して、差示的に染色された細胞の分離可能な特性において十分な差異が存在するようにする工程;およびb)その分離可能な特性を介して、その差示的に染色された細胞を分離する工程、を包含する。
【0029】
その差次的に染色された細胞の分離可能な特性における差異は、差次的に染色された細胞が、その分離可能な特性における差異に基づいて、互いから分離され得るかまたはそのサンプルから単離され得るように、十分に大きくあるべきである。その差異は、種類の差異であり得、例えば、いくつかの細胞が染色される一方で、他の細胞は染色されない。この差異はまた、程度の差異であり得、例えば、いくつかの細胞がより多く染色されるが、他の細胞はそれよりも染色されない。
【0030】
適切な任意の分離可能な特性が、本発明の方法において使用され得る。例えば、差次的に染色された細胞の異なる形状が、これらの細胞を分離または単離するために使用され得る。
【0031】
好ましい実施形態において、本発明は、誘電泳動を使用して細胞を分離するための方法に関し、この方法は、a)分離されるべき細胞を、色素により選択的に染色して、差示的に染色された細胞の誘電泳動特性において十分な差異が存在するようにする工程;およびb)誘電泳動特性を介して、その差示的に染色された細胞を分離する工程、を包含する。
【0032】
その差次的に染色された細胞の誘電泳動特性における差異は、差次的に染色された細胞が、その誘電泳動特性における差異に基づいて互いから分離され得るかまたはそのサンプルから単離され得るように、十分に大きくあるべきである。その差異は、種類の差異であり得、例えば、いくつかの細胞が染色される一方で、他の細胞は染色されないか、またはいくつかの細胞が正の誘電泳動に対して反応性であるように染色される一方、他の細胞が、負の誘電泳動に対して反応性であるように染色される。この差異はまた、程度の差異であり得、例えば、同じ種類の誘電泳動に対して、いくつかの細胞は、より大きく反応性であるように染色される一方、他の細胞はそれらよりも反応性が低いように染色される。
【0033】
本方法は、任意の細胞型を分離または単離するために使用され得る。例えば、本発明の方法は、動物細胞、植物細胞、真菌細胞、細菌細胞、組換え細胞、または培養細胞を分離または単離するために使用され得る。
【0034】
分離または単離されるべき細胞は、適切な任意の条件下で染色され得る。例えば、細胞は、固体状態または液体状態で染色され得る。好ましくは、細胞は、固定されることなく、液体状態で染色される。
【0035】
本方法は、異なる細胞型を互いから分離するために使用され得る。例えば、本方法は、2つ以上の異なる細胞型を分離するために使用され得る。
【0036】
本方法は、サンプルから目的とする細胞を単離するために使用され得る。1つの特定の実施形態において、本方法は、そのサンプル中の他の細胞と同一または類似する誘電泳動特性を有する細胞を、染色する前に分離または単離するために使用される。別の特定の実施形態において、本方法は、同一または類似の誘電泳動特性を有する細胞を、染色する前に分離または単離するために使用され、そしてその染色は、適切な色素濃度条件および染色時間条件下で、同一または類似の誘電泳動特性を有する細胞が差次的にその色素を吸収するように、実行される。好ましくは、その染色は、少なくとも1つの細胞型が染色され、そして少なくとも1つの別の細胞型が染色されないように、制御される。
【0037】
適切な任意の染色方法または染色色素が、本方法において使用され得る。例えば、Giemsa染色法、Wright染色法、Romannowsky染色法、Kleihauser−Betke染色法、およびそれらの組み合わせ(例えば、Wright−Giemsa染色法)が、本方法において使用され得る。好ましくは、Giemsa染色法が、使用される。
【0038】
適切な任意の誘電泳動が、本方法において使用され得る。例えば、従来の誘電泳動または進行波誘電泳動が、本方法において使用され得る。
【0039】
下記の原理によって拘束されるべきではないが、以下の誘電泳動(DEP)力の原理が、本方法または本デバイス、ならびに以下の節CおよびDにおいて記載される方法において、使用され得る。粒子に対するDEP力は、その粒子が供されるAC電界の不均一分布から生じる。特に、DEP力は、電界が誘導する分極電荷と、不均一電界との間の相互作用から生じる。その分極電荷は、印加された電界によって粒子中で誘導され、そして生じる双極子の大きさおよび方向は、その粒子と、その粒子が懸濁されている媒体との間の誘電特性の差異に関連する。
【0040】
DEP力は、進行波誘電泳動(twDEP)力または従来の誘電泳動(cDEP)力のいずれかであり得る。twDEP力とは、進行波電界から生じる、粒子上に生じる力を指す。その進行波電界は、位相値について不均一分布を有するAC電界成分によって、特徴付けられる。一方、cDEP力とは、AC電界の大きさの不均一分布から生じる、粒子上に生じる力を指す。twDEP力およびcDEP力の起源は、以下により詳細に記載される(Huangら、Electrokinetic behavior of colloidal particles in travelling electric fields:studies using yeast cells、J.Phys.D:Appl.Phys.,26:1528−1535(1993);Wangら、A unified theory of dielectrophoresis and travelling−wave dielectrophoresis,J.Phys.D:Appl.Phys.27:1571−1574(1994);Wangら、Dielectrophoretic Manipulation of Cells Using Spiral Electrodes、Biophys.J.,72:1887−1899(1997);X−B.Wangら、Dielectrophoretic manipulation of particles、IEEE/IAS Trans.,33:660−669(1997);Fuhrら、Positioning and manipulation of cells and microparticles
using miniaturized electric field traps
and travelling waves,Sensors and Materials,7:131−146(1995);およびWangら、Non−uniform
spatial distributions of both the magniture and phase of AC electric fields determine dielectrophoretic forces、Biochim Biophys Acta,1243:185−194(1995))。
【0041】
単一の高調波の電場は、一般に、以下のような時間領域で表現され得る:
【0042】
【数1】

【0043】
ここで、
【0044】
【数2】

【0045】
(α=x,y,z)は、直角座標系における単位ベクトルであり、そしてEα0およびφαは、3つの電場成分(field component)のそれぞれの大きさおよびフェーズである。細胞のような粒子が、不均一な電場に供される(Eα0および/またはφαは、位置により変化することに注目のこと)場合、粒子における電場と電場が誘導した双極子モーメントとの間の電気的相互作用に起因して、正味の誘電泳動力(dielectrophoretic force)が粒子に与えられる。DEP力は、Wangら(Wangら、A unified theory of dielectrophoresis and travelling−wave dielectrophoresis,J.Phys.D:Appl.Phys.,27:1571−1574(1994))により提供される:
【0046】
【数3】

【0047】
ここで、rは粒子半径であり、εmは、粒子懸濁媒質の誘電体誘電率であり、そしてErmsは、電場のRMSの大きさである。係数fCM=(ε*p−ε*m)/(ε*p+2ε*m)は、誘電分極係数(いわゆる、クラウジウス−モソッティの係数)である。複素誘電率は、ε*x=εx−jσx/(2πf)と定義される。この誘電分極係数は、印加された電場の周波数f、粒子(pで示される)およびその懸濁している媒質(mで示される)の導電率σx、および誘電率εxに依存する。
【0048】
式(2)に示されるように、誘電泳動(DEP)力は、一般的に、2つの成分(すなわち、従来のDEP(cDEP)力および進行波DEP(twDEP)力)を有する。cDEP力は、電場の大きさの傾き
【0049】
【数4】

【0050】
と相互作用する、電場が誘導した分極の同位相成分(用語Re(fCM)(すなわち、係数fCMの実数部分)により反映され、これは、従来のDEP分極係数である)と関係する。この進行波DEP力は、電場の相の傾き
【0051】
【数5】

【0052】
と相互作用する、電場が誘導した分極の損失成分(用語Im(fCM)(すなわち、係数fCMの虚数部分)により反映され、これは、twDEP分極係数である)と関係する。電場成分の相の値の不均一な分布を有する電場は、移動(traveling)電場であることを示すことは価値がある。この電場は、位置と共に相の値が減少する方向に移動する。理想的移動電場(以下を参照のこと)は、電場の移動方向に沿った位置の一次関数である相分布を有する。従って、cDEP力とは、AC電場の大きさの不均一な分布に起因して、粒子(単数または複数)に対して発生される力をいう。従来のDEP力は、文献において、単にDEP力と時折いわれるが、用語法のこの単純化は、本明細書中では避けられている(Wangら、A unified theory of dielectrophoresis and travelling−wave dielectrophoresis,J.Phys.D:Appl.Phys.,27:1571−1574(1994);Wangら、Non−uniform spatial distributions of both the magnitude and phase of
AC electric fields determine dielectrophoretic forces,Biochim Biophys Acta,1243:185−194(1995);Wangら、Dielectrophoretic manipulation of particles,IEEE/IAS Trans.,33:660−669(1997);およびWangら、Dielectrophoretic Manipulation of Cells Using Spiral Electrodes,Biophys.J.,72:1887−1899(1997))。
【0053】
不均一な大きさの電場に供される半径rの粒子に対して作用するcDEP力
【0054】
【数6】

【0055】
は、
【0056】
【数7】

【0057】
により与えられ、
ここで、Ermsは、電場の強さのRMS値であり、そしてεmは、媒質の誘電率である。cDEP力についての式(3)は、上記で利用されるDEP力の一般的表現と一致する。係数χcDEPは、粒子のcDEP分極係数であり、
【0058】
【数8】

【0059】
により与えられる。
【0060】
ここで「Re」とは、「複素数」の実数部をいう。記号ε*x=εx−jσx/(2πf)は、複素誘電率である。パラメーターεpおよびσpは、それぞれ、粒子の有効誘電率および導電率であり、そして周波数に依存し得る。例えば、代表的な生物学的細胞は、周波数に依存した導電率および誘電率(これらは、原形質膜分極(膜変化は、誘電泳動および電気回転(electrorotation)(Huangら、Biochim.Biophys.Acta,1282:76−84(1996);およびBeckerら、Separation of human breast cancer cells from blood by differential dielectric affinity,Proc.Nat.Acad.Sci.(USA),29:860−864(1995))から決定されるようなラット腎臓細胞の温度感受性P85 gag−mos−依存形質転換と関連していた)に起因して、少なくとも一部で生じる)を有する。
【0061】
従来のDEP力についての上記の式はまた、
【0062】
【数9】

【0063】
として書かれ得る。
【0064】
ここで、p=p(x,y,z)は、電極に対する単位電圧励振(電圧V=1V)についての矩形の電場の分布(square−field distribution)であり、そしてVは、印加された電圧である。
【0065】
粒子が正のcDEP分極係数(χcDEP>0)を示す場合、粒子は、cDEP力により、強力な電場の領域に向かって移動される。このことは、正のcDEPといわれる。粒子に正のcDEPを与えるcDEP力は、正のcDEP力である。粒子が、負のcDEP分極係数(χcDEP<0)を示す場合、粒子は、cDEP力により、強い場の領域から離れて、そして弱い場の領域に向かって移動する。粒子に負のcDEPを与えるcDEP力は、負のcDEP力である。
【0066】
半径rの粒子に作用し、そして進行波電場
【0067】
【数10】

【0068】
に供される、理想的な進行波場についてのtwDEP力FtwDEP(すなわち、z方向における電場移動のx成分である、電場のx成分の相の値は、z方向に沿った位置の一次関数である)は、
【0069】
【数11】

【0070】
により与えられ、
ここで、Eは、電場の強さの大きさであり、そしてεmは、媒質の誘電体誘電率である。ζtwDEPは、粒子のtwDEP分極係数であり、そして
【0071】
【数12】

【0072】
により与えられ、
ここで、「Im」は、対応する複素数の虚数部分をいう。記号ε*x=εx−jσx/(2πf)は、複素誘電率である。パラメーターεpおよびσpは、それぞれ、粒子の有効誘電率および導電率であり、そして周波数に依存し得る。
【0073】
従って、DEP力の進行波力成分は、twDEP分極係数が、それぞれ、正であるか、または負であるかに依存して、進行波電場の伝達の方向に方向付けられるか、または進行波電場の伝達の方向の反対に方向図けられるかのいずれかの方向で粒子に作用する。粒子が、操作の周波数で、正のtwDEP−分極係数(ζTWD>0)を示す場合、twDEP力は、電場が移動する方向の反対の方向で粒子に働く。他方、粒子が、操作の周波数で、負のtwDEP−分極係数(ζTWD<0)を示す場合、twDEP力は、電場が移動する方向と同じ方向で粒子に働く。粒子(生物学的細胞を含む)の進行波DEP操作について、10ミクロンの直径を有する粒子に作用する進行波DEP力は、0.01〜10000pNのオーダーである。
【0074】
誘電泳動について、良好な分離結果は、細胞(例えば、血液細胞およびE.coli細胞、生酵母細胞および死酵母細胞)の誘電特性の間に大きな差異が存在する場合にのみ、得られ得る(Chengら、Preparation and Hybridization Analysis of DNA/RNA from E.coli on Microfabricated Bioelectronic Chips,Nature
Biotechnology,16(6):541−546(1998);およびPething,Dielectrophoresis:Using Inhomogenous AC Electrical Fields to Separate and Manipulate Cells,Critical Reviews in Biotechnology,16(4):331−348(1996))。類似の誘電特性を有する細胞について、良好な分離結果を得ることは困難である。誘電泳動および流れ場画分、または従来の誘電泳動および進行波誘電泳動は、より良好な分離を得るために共に適用され得るが、非常に類似した誘電特性を有する、胎児NRBC、母体NRBCおよび母リンパ球を分離することは、これらの細胞の間の誘電泳動特性の差異を増大させることなしには困難である(Huangら、Introducing Dielectrophoresis as a New Force Field for Field Flow Fractionation,Biophysical Journal,73:1118−1129(1997);およびWangら、Dielectrophretic Manipuration of Cells with Spiral Electrodes,Biophysical Journal,72:1887−1899(1997))。
【0075】
分離または単離は、任意の適切な形式で用いられ得る。例えば、分離または単離は、チップ形式で行われ得る。任意の適切なチップが、本発明の方法において用いられ得る。例えば、従来の誘電泳動チップ、進行波誘電泳動チップまたは誘電泳動に基づく粒子スイッチチップ(particle switch chip)が、任意の適切な形式で用いられ得る。好ましくは、本発明の方法において用いられる粒子スイッチチップは、多チャネル粒子スイッチを含む。
【0076】
あるいは、分離または単離は、非チップ形式で行われ得る。例えば、分離または単離は、液体容器(例えば、ビーカー、フラスコ、シリンダー、試験管、エッペンドルフチューブ、遠心管、培養皿、マルチウェルプレートおよびフィルター膜)中で行われ得る。
【0077】
細胞は、十分な時間(約10秒〜約10分、または少なくとも30分またはそれよりも長く)で染色されるべきである。
【0078】
本発明の方法は、さらに、チップまたは液体容器から、分離または単離された細胞を収集する工程を包含し得る。分離または単離された細胞は、任意の適切な方法によって(例えば、外部のポンプを介して)、チップまたは液体容器から収集され得る。
【0079】
(C.細胞を分離する方法)
別の局面では、本発明は、母体血液サンプルから有核赤血球(NRBC)を単離する方法に関し、この方法は、以下を包含する:a)示差的に染色された細胞の誘電泳動特性の十分な差異が存在するように、母体血液サンプル中の細胞の少なくとも1つの型を色素で選択的に染色する工程;およびb)胎児NRBC細胞を、誘電泳動を介して、この母体血液サンプルから単離する工程。
【0080】
本発明の方法は、母体血液サンプルから、任意のNRBC(母体NRBCおよび/または胎児NRBC)を単離するために用いられ得る。好ましくは、本発明の方法は、さらに、母体NRBCを胎児NRBCから分離するために用いられ得る。
【0081】
本発明の方法は、さらに、細胞の少なくとも1つの型を選択的に染色する前に、赤血球を母体血液サンプルから実質的に取り出す工程(例えば、赤血球の少なくとも50%、60%、70%、80%、90%、95%、99%、または100%を取り出す工程)を包含し得る。
【0082】
母体赤血球サンプルは、細胞の少なくとも1つの型を選択的に染色する前に、適切な緩衝液(好ましくは、等張性緩衝液)に添加される。1つの例では、母体血液サンプルは、細胞の少なくとも1つの型を選択的に染色する前に、等張性(isosmotic)または等張性(isotonic)グルコース緩衝液へと添加される。このグルコース緩衝液は、任意の適切な導電性(例えば、約10μs/cm〜約1.5ms/cmの範囲)を有し得る。
【0083】
任意の適切な染色法または色素が、本発明の方法に用いられ得る。例えば、Giemsa染色、Wright染色、Romannowsky染色、Kleihauser−Betke染色、およびこれらの組み合わせ(例えば、Wright−Giemsa染色)が本発明の方法に用いられ得る。好ましくは、Giemsa染色が用いられる。色素(例えば、Giemsa色素)が、任意の適切な濃度で用いられ得る。例えば、Giemsa色素対緩衝液の比率は、約1:5(v/v)〜約1:500(v/v)の範囲であり得る。好ましい実施形態では、この色素は、胎児ヘモグロビンに特異的に結合する。
【0084】
分離または単離は、任意の適切な形式で用いられ得る。例えば、分離または単離は、チップ形式で行われ得る。任意の適切なチップが、本発明の方法において用いられ得る。例えば、従来の誘電泳動チップ、進行波誘電泳動チップ、または進行波誘電泳動に基づく粒子スイッチチップは、任意の適切な形式で用いられ得る。好ましくは、本発明の方法において用いられる粒子スイッチチップは、多チャネル粒子スイッチを含む。特定の実施形態では、母体白血球が、チップの電極に捕捉され、そして染色されたNRBCが、電場が、チップ上で最も弱い位置に再パルス(repulse)される。別の実施形態では、多チャンネル粒子スイッチを含むチップが、母体赤血球、母体白血球、母体NRBC、および胎児NRBCを、並行して、単離および検出するために用いられる。
【0085】
あるいは、分離または単離は、非チップ形式で行われ得る。例えば、分離または単離は、液体容器(例えば、ビーカー、フラスコ、シリンダー、試験管、エッペンドルフチューブ、遠心管、培養皿、マルチウェルプレートおよびフィルター膜)中で行われ得る。
【0086】
任意の単一の型または複数の型の細胞が、本発明の方法に従って、母体血液サンプルから単離され得る。複数の型の細胞が、母体血液サンプルから単離される場合、複数の型の細胞は、母体血液サンプルから、連続してまたは同時に単離され得る。1つの例では、母体血液サンプルは、異なる型の細胞を連続して単離するために、誘電泳動を介して、複数の単離に供される。
【0087】
細胞は、十分な時間(約10秒〜約10分、または少なくとも30分またはそれよりも長く)で染色されるべきである。
【0088】
さらに別の局面では、本発明は、白血球から赤血球を単離する方法に関し、この方法は、以下を包含する:a)緩衝液中に赤血球および白血球を含むサンプルを調整する工程;b)示差的に染色された細胞の誘電泳動特性の十分な差異が存在するように、この調製されたサンプル中の赤血球および/または白血球を選択的に染色する工程;およびc)赤血球を、誘電泳動を介して、この白血球サンプルから単離する工程。
【0089】
任意の適切な染色法または色素が、本発明の方法に用いられ得る。例えば、Giemsa染色、Wright染色、Romannowsky染色、Kleihauser−Betke染色、およびこれらの組み合わせ(例えば、Wright−Giemsa染色)が本発明の方法に用いられ得る。好ましくは、Giemsa染色が用いられる。色素(例えば、Giemsa色素)が、任意の適切な濃度で用いられ得る。例えば、Giemsa色素対緩衝液の比率は、約1:5(v/v)〜約1:500(v/v)の範囲であり得る。
【0090】
細胞は、十分な時間(約10秒〜約10分)で染色されるべきである。好ましくは、赤血球および/または白血球は、少なくとも30分またはそれよりも長い間染色される。
【0091】
分離または単離は、任意の適切な形式で用いられ得る。例えば、分離または単離は、チップ形式で行われ得る。任意の適切なチップが、本発明の方法において用いられ得る。例えば、従来の誘電泳動チップ、進行波誘電泳動チップ、または進行波誘電泳動に基づく粒子スイッチチップは、任意の適切な形式で用いられ得る。好ましくは、本発明の方法において用いられる粒子スイッチチップは、多チャネル粒子スイッチを含む。特定の実施形態では、赤血球が、正の誘電泳動に供され、そしてチップの電極上に捕捉され、そして染色された白血球は、負の誘電泳動に供され、そして電場が最も弱い位置に再パルスされる。
【0092】
本発明の方法は、さらに、チップから赤血球および/または白血球を収集する工程を包含する。分離された赤血球および/または白血球は、チップから、任意の適切な方法によって(例えば、外部のポンプを介して)、収集され得る。
【0093】
あるいは、分離または単離は、非チップ形式で行われ得る。例えば、分離または単離は、液体容器(例えば、ビーカー、フラスコ、シリンダー、試験管、エッペンドルフチューブ、遠心管、培養皿、マルチウェルプレートおよびフィルター膜)中で行われ得る。
【0094】
(D.遠心分離チューブおよび誘電泳動分離デバイス)
なお別の局面において、本発明は、密度勾配遠心分離に有用な遠心分離チューブに関する。このチューブの中央部分における遠心分離チューブの内径は、このチューブの頂部および底部での直径より小さい。遠心分離チューブは、任意の適切な材料(例えば、ポリマー、プラスチック、または他の適切な複合材料)から作製され得る。
【0095】
なお別の局面において、本発明は、誘電泳動分離デバイスに関する。このデバイスは、2つの誘電泳動チップ、ガスケット、シグナル発生器、およびポンプを備える。ここで上記ガスケットは、チャネルを備え、上記ガスケットは、上記2つの誘電泳動チップの間にあり、上記誘電泳動チップ、上記ガスケットおよび上記ポンプは、流体接続している。このポンプは、任意の適切な様式にて、誘電泳動チップと接続され得る。1つの特定の実施形態において、外部ポンプには2つのチュービングがある。一方は入り口であり、他方は出口である。ポンプの入り口は、誘電泳動チップの入り口と接続され、ポンプの出口は、誘電泳動チップの出口と接続される。
【0096】
誘電泳動チップの一方または両方は、入力ポートおよび/または出力ポートと接続され得る。同様に、誘電泳動チップの一方または両方が、複数の入力ポートおよび/または出力ポートと接続される。1つの例において、ガスケットの上にある誘電泳動チップは、入力ポートおよび/または出力ポートと接続される。
【0097】
ガスケット上のチャネルは、任意の適切な形状を有し得る。好ましくは、ガスケット上のチャネルの形状は、誘電泳動チップ上の電極の形状に対応する。ガスケット上のチャネルは、任意の適切な直径を有し得る。好ましくは、電極効果領域内のチャネルの直径は、電極効果領域の外側のチャネルの直径より大きい。
【0098】
(D.例示的実施形態)
1つの特定の実施形態において、サンプル細胞は、まず、誘電特性の差異を増幅するために染色される。次いで、誘電泳動チップは、迅速で、簡便かつ正確な出生前診断のための胎児NRBCを濃縮および精製するために適用される。この手順は、以下のとおりである。
【0099】
まず、母体由来の母体血液を、赤血球の大部分を除去するために、密度勾配遠心分離により処理する。密度勾配遠心分離は、異なる型の細胞を分離するための従来の生物学的かつ医学的方法である。血漿および種々の血球については、密度値が異なる。血液サンプルを、Ficoll媒体中で遠心分離する場合、異なる密度を有する細胞は、異なる層へと分離される。NRBCおよびリンパ球は、類似の密度を有するので、同じ層にある。
【0100】
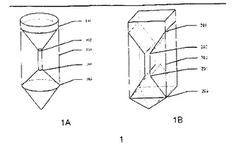
密度勾配遠心分離の後、Ficoll中で4つの層が形成される。赤血球は、底部にあり、続いて顆粒球、リンパ球とNRBCの複合体、および血漿がある。本発明者らに必要なものは、リンパ球とNRBCの複合体である。ここで従来の遠心分離チューブを使用して操作される場合、標的細胞がかなり失われる。なぜなら、ごくわずかなリンパ球およびNRBCがチューブの中間層に固定されるからである。濃縮の効率を増大させるために、図1Aおよび図1Bに示される特別に設計された遠心分離チューブが使用され得る。遠心分離チューブは、図1Aに示される円筒形または図1Bに示される矩形のいずれかとして設計され得る。最良の濃縮結果を得るために、チューブの寸法を決定するために予備実験を行うことが必要である。例えば、円筒形チューブは、図1Aに示されるように設計される。底部における円錐105の容積は、赤血球および顆粒球の容積に等しい。中央部の細い円筒部103について、その容積は、リンパ球およびNRBCの容積に等しい。このようにすると、チューブの頂部に血漿のみが存在する。分離効率は、中央部分の直径が非常に小さく、界面101および104にて異なる層を区別することが容易であるので、実質的に増大される。図1Bに示されるように、中央部分203は、細い矩形スリットとして設計され得る。底部201および頂部205は、三角形として設計される。界面202および204は、分離効率を増大させるために非常に小さい。分離効率をさらに改善するために、液体窒素銃(liquid nitrogen gun)を使用した迅速な凍結が、中央部分と、頂部および底部との境界面に適用され得る。頂部層と凍結した部分は、まず、中央層が回収される前に取り出される。
【0101】
2回の遠心分離および緩衝液での洗浄を行った後、胎児NRBC、母体NRBC、母体リンパ球、顆粒球、および母体赤血球を含むサンプルを、母体血漿中に保存する。この分野での研究者は、母体血液から赤血球を除去するための他の方法(例えば、濾過)が存在することを知っているはずである。処理されたサンプルは、等浸透圧緩衝液(8.5% グルコース、0.3% デキストロース(10μs/cm〜1.5ms/cmの導電性を有する)から構成される)中に希釈される。次いで、適切な色素が、溶液に添加される(例えば、Giemsa色素)。色素の容積および染色時間を制御することにより、NRBC全てが染色されるが、母体リンパ球はまったく染色されない。染色後、形態および誘電特性の両方において、NRBCと母体リンパ球との間には大きな差異が存在する。その理由は、異なる細胞または細胞オルガネラが、異なる効率で色素を吸収することである。結果は、誘電特性の差異が、増幅されることである。染色は、液体中で処理されるので、Giemsa色素と緩衝液との間の比は、1:5〜1:500であり得る。代表的な値は、約1:10である。色素の濃度が高すぎると、溶液の色が濃いので、染色された細胞を同定することは困難である。そして全ての細胞(NRBCおよび母体リンパ球を含む)が染色される。色素の濃度が低すぎると、いくつかのNRBCが染色されず、分離結果がよくない。染色のための時間は、別の重要なパラメーターである。色素の濃度が1:100である場合、染色のための時間は、10秒〜10分であるべきである。時間が長すぎると、細胞全て(NRBCおよび母体リンパ球を含む)が染色される。時間が短すぎれば、いくつかのNRBCが染色されず、分離結果がよくない。特定の染色時間の後、サンプルを、誘電泳動チップに添加する。適切な周波数および振幅を、関数発生器を通して印加することにより、母体リンパ球は、正の誘電泳動力により電極に誘引される;その一方で、染色されているNRBCは、負の誘電泳動力により、最も弱い電場を有する領域に反発される。次いで、NRBCは、外部ポンプを適用することにより収集され得る。収集されたNRBCには、胎児NRBCまたは母体NRBCのいずれかが存在する。胎児ヘモグロビンに対する特定の免疫染色を行った後、胎児NRBCを、形態により母体NRBCから区別し得る(Cheungら,Prenatal Diagnosis of Sickle Cell Anaemia and Thalassaemia by Analysis of Fetal Cells in Maternal Blood,Nature Genetics,14:264−268(1996))。再び誘電泳動チップを適用することにより、純粋な胎児NRBCが、さらなる出生前診断のために得られ得る。
【0102】
色素の濃度および染色のための時間は、色素および細胞型の特徴的な特性に従って決定されるべきである。この分野の研究者らは、cDEPチップ、cDEPチップとtwDEPチップとの複合および粒子操作チップが母体細胞と胎児細胞とを分離するために適用され得ることを知っているはずである(WO02/16647、PCT/US01/42426、PCT/US01/42280、およびPCT/US01/29762)。次いで、外部ポンプの助けを借りて、胎児細胞が回収され得る。母体血液中に非常にわずかな胎児NRBCが存在するので、誘電泳動分離は、好ましくは、純粋な胎児細胞を得るために、2回以上適用される。
【0103】
Giemsa色素はまた、類似の誘電特性を有する他の型の細胞(例えば、赤血球および白血球)を分離するために使用され得る。色素の濃度が1:100である場合、染色のための時間は、30分を超える必要がある。全ての白血球が染色されるが、赤血球は染色されない。なぜなら、Giemsa色素によって核のみが染色され得、赤血球には核がないからである。次いで、サンプルは、誘電泳動チップに添加され得る。適切な周波数および振幅を、関数発生器を通じて印加することにより、赤血球は、正の誘電泳動力により電極に誘引される;その一方で、染色された白血球は、負の誘電泳動力により、最も弱い電
場を有する領域に反発される。次いで、染色された白血球は、外部ポンプを適用することにより回収され得る。
【0104】
例示的な誘電泳動システムは、図2に示される。チュービング1は、バルブ7の入り口と接続される;バルブ7の出口は、チュービング8を通じてカバーガラス3の入り口と接続される;そしてカバーガラス3の出口は、チュービング9を通じてチュービング2と接続される。緩衝液(容器13)、サンプル(容器12)、標的サンプル(容器10)および廃液(容器11)の流れは、それぞれ、バルブF1、F2、F3およびF4により制御される。誘電泳動チップ5およびガスケット4は、サンプルが分離される反応チャンバを備える。シグナル発生器6により、電圧を誘電泳動チップに印加する。ガスケット4の厚みは、分離についての重要な値である。厚すぎると、細胞の移動時間が長くなり、このことにより、次には、分離時間が長くなる。ガスケットが薄すぎると、反応チャンバの容積が小さくなり、分離時間がまた長くなる。ガスケットの適切な高さは、迅速かつ効率的な分離をもたらし得る。誘電泳動場の有効範囲を増大させるために、このシステムを、三次元構造として設計し得る。カバーガラス3は、別の誘電泳動チップ14により置換され、入り口141および出口142の2つの孔は穿孔することにより形成され、チュービング8および9により接続される。この構造は、分離システムの効率を倍化させる。誘電泳動の範囲が倍加するので、ガスケット4の厚みは、2倍に増大し得、このことにより、反応チャンバの容積の倍加が導かれ得る。ガスケット4におけるフローチャネル41は、誘電泳動チップ5、14の表面上の電極51、143の構造に従って設計され得る。図4に示されるように、このチャネルは、電極より広く、他の領域より細い。これは、チャネル断面積を減少させることにより、電極がない表面への細胞の非特異的結合を減少させる。
【0105】
電極51および143の形状は、図5Aおよび図5Bに示されるように設計され得る。異なる寸法および形状のフローチャネルは、異なる寸法および形状の電極に従って設計され得る。電極は、同様に他の形状にも設計され得る。
【0106】
この分野の研究者らは、cDEPチップ、twDEPチップ、粒子操作チップまたはcDEPチップとtwDEPチップの組み合わせは、全て、母体細胞と胎児細胞とを分離するために使用され得ることを知っているはずである。例えば、複数の細胞操作スイッチが、母体赤血球、母体リンパ球、母体NRBCおよび胎児NRBCの並行した分離を実現するための誘電泳動の波を移動させる機構に従って設計され得る。例示的なプロセスは、以下に記載される。
【0107】
Giemsa色素で染色した後に、サンプルを、フローチャネル15に添加する。このフローチャネル15において、母体RBCおよび母体リンパ球は染色されないが、母体NRBCおよび胎児NRBCは染色される。適切な電圧シグナルが印加されると、母体NRBCおよび胎児NRBCは、分岐b2に回収される一方、母体RBCおよび母体リンパ球は、分岐b1に回収される。次いで、分岐b1における母体NRBCおよび胎児NRBCは、胎児ヘモグロビンに特異的なイムノアッセイ法により染色される。母体NRBCと胎児NRBCとの間の誘電差は増幅され、形態もまた同様である。最終的に、母体NRBCおよび胎児NRBCは、適切な電圧シグナルを印加することにより、それぞれ、分岐b5およびb6に回収され得る。そして母体RBCおよび母体リンパ球は、適切な電圧シグナルを印加することにより、それぞれ、分岐b3およびb4にて回収される(PCT/US01/42426,Wangら,Dielectrophretic Manipulation of Cells with Spiral Electrodes,Biophysical Journal,72:1887−1899(1997);Hughesら,Dielectrophretic Forces on Particles
in Traveling Electric Fields,J.Phys.Appl.Phys,29:474−482(1997);およびMuller,A 3−D Microelectrode System for Handling and Caging Single Cells and Particles,Biosensors&Bioelectronics,14:247−256(1999))。チャネル幅の寸法は、別の重要な値である。その寸法は、単一の細胞が容易に操作され得るように細胞と同じ位であり得る。
【0108】
染色する前、母体リンパ球と胎児NRBCの誘電特性および形態は、非常に似ている。よって、誘電泳動によりそれらを分離することは困難である。誘電特性の差異は、染色により増幅される。なぜなら、細胞は、色素を吸収する能力が異なるからである。この分野の研究者は、任意の適切な染色法が細胞間の誘電特性の差異を増幅するために適用され得ることを知っているはずである。特定の色素の濃度および染色時間は、染色のための重要な値である。適切な値を用いれば、ある種の細胞は染色され得るが、他の種の細胞は染色されない。このことは、それらの誘電特性の増幅をもたらす。本明細書中に開示されたプロセス全体が、液体中で操作されるという点で、この方法と従来の染色方法との間には非常に重要な差異がある。従来の染色方法において、細胞は、まず、ホルムアミド、メタノール、エタノールまたは他の有機溶媒中で処理されて、スライドガラスに固定される。水で洗浄し、風乾させた後、細胞を色素で染色する。この実施形態において、従来の染色法に対していくつかの改良が行われた。適切な条件下では、ある種の細胞が染色されるが、他の細胞は染色されず、このことは、それらの誘電特性の増幅をもたらす。次いで、細胞は、誘電泳動チップにより容易に分離され得る。結果は、従来方法の結果とは大きく異なる。使用され得る他の従来染色法としては、Giemsa染色、Wright染色、Wright−Giemsa染色、Romannowsky染色およびKleihauser−Betke染色が挙げられる(Bianchi Diana,ら,Isolation of Fetal DNA from Nucleated Erythrocytes in Maternal Blood,Proc.Natl.Acad.Sci.USA,86:3279−3283 (1990))。
【0109】
改善された細胞染色法が適用されて、母体細胞と胎児細胞との間の誘電性および形態の差異が増幅された。次いで、種々の誘電泳動チップの助けを借りて、胎児NRBCが、分離、濃縮および精製され得る。最後に、従来の分子生物学方法が、迅速で、簡便かつ正確な出生前診断のために胎児細胞に適用される。
【0110】
上記の実施例は、例示目的で含められるに過ぎず、本発明の範囲を限定することを意図しない。上記の実施例に対する多くのバリエーションが可能である。上記の実施例に対する改変およびバリエーションは、当業者に明らかであるので、本発明は、添付の特許請求の範囲によってのみ制限されることが意図される。
【0111】
(発明の要旨)
本発明は、以下を提供する。
(1)細胞を分離するための方法であって、上記方法は以下の工程:
a)分離されるべき細胞を、色素により選択的に染色し、差示的に染色された細胞の誘電泳動特性において十分な差異が存在するようにする、工程;および
b)誘電泳動を介して、上記差示的に染色された細胞を分離する工程、
を包含する、方法。
(2)上記分離されるべき細胞が、動物細胞、植物細胞、真菌細胞、細菌細胞、組換え細胞および培養細胞からなる群より選択される、項目1に記載の方法。
(3)上記分離されるべき細胞が、少なくとも2つの異なる細胞型を含む、項目1に記載の方法。
(4)上記細胞が、固定されずに液体中で染色される、項目1に記載の方法。
(5)サンプルから目的の細胞を単離するために使用される、項目1に記載の方法。
(6)上記単離されるべき細胞が、染色前のサンプルにおいて、他の細胞と同一または類似の誘電泳動特性を有する、項目5に記載の方法。
(7)項目1に記載の方法であって、上記分離されるべき細胞は、染色前と同一または類似の誘電泳動特性を有し、そして上記染色は、同一または類似の誘電泳動特性を有する細胞が、上記色素を差示的に吸収するように、適切な色素濃度および染色時間の条件下で実施される、方法。
(8)上記染色は、少なくとも1つの細胞型が染色され、そして少なくとも別の細胞型が染色されないように制御される、項目7に記載の方法。
(9)上記染色が、Giemsa染色、Wright染色、Romannowsky染色、Kleihauser−Betke染色およびそれらの組み合わせからなる群より選択される、項目1に記載の方法。
(10)上記染色が、Wright−Giemsa染色である、項目9に記載の方法。
(11)上記誘電泳動が、従来型の誘電泳動または進行波誘電泳動である、項目1に記載の方法。
(12)上記分離がチップ形式で実施される、項目1に記載の方法。
(13)上記チップが、従来型の誘電泳動チップ、進行波誘電泳動チップおよび進行波誘電泳動に基づく粒子スイッチチップからなる群から選択される、項目12に記載の方法。
(14)上記粒子スイッチチップが、多チャネル粒子スイッチを備える、項目13に記載の方法。
(15)上記分離がビーカー、フラスコ、シリンダー、試験管、エップンドルフチューブ、遠心管、培養皿、マルチウェルプレートおよびフィルター膜からなる群より選択される液体容器内で実施される、項目1に記載の方法。
(16)
母体の血液サンプルから有核赤血球(NRBC)を単離する方法であって、上記方法は、以下の工程:
a)母体の血液サンプル中の少なくとも1つの細胞型を、色素により選択的に染色して、差示的に染色された細胞の誘電泳動特性において十分な差異が存在するようにする工程;および
b)誘電泳動を介して、上記母体の血液サンプルから胎児NRBC細胞を単離する工程、を包含する、方法。
(17)上記母体の血球サンプルから単離した上記NRBCが、母体のNRBCおよび/または胎児のNRBCである、項目16に記載の方法。
(18)少なくとも1つの細胞型を選択的に染色する工程の前に、上記母体の血液サンプルから赤血球を実質的に取り出す工程をさらに包含する、項目16に記載の方法。
(19)少なくとも1つの細胞型を選択的に染色する工程の前に、上記母体の血液サンプルが、等浸透圧性または等張性のグルコース緩衝液に添加される、項目16に記載の方法。
(20)上記グルコース緩衝液が、約10μs/cm〜約1.5ms/cmの範囲の伝導性を有する、項目19に記載の方法。
(21)上記色素がGiemsa色素である、項目16に記載の方法。
(22)上記Giemsa色素の緩衝液に対する割合が、約1:5(v/v)〜約1:500(v/v)の範囲である、項目21に記載の方法。
(23)上記色素が、胎児ヘモグロビンに特異的に結合する、項目16に記載の方法。
(24)上記単離がチップ形式において実施される、項目16に記載の方法。
(25)母体の白血球は、上記チップの電極上に捕捉され、そして染色したNRBCは、上記チップ上の電場が最も弱い場所にリパルスされる、項目24に記載の方法。
(26)多チャネル粒子スイッチを備えるチップが、母体の赤血球、母体の白血球、母体のNRBCおよび胎児のNRBCを、同時に単離および検出するために使用される、項目24に記載の方法。
(27)上記母体の血液サンプルが、誘電泳動を介して複数単離に供される、項目16に記載の方法。
(28)染色の時間が、約10秒〜約10分の範囲である、項目16に記載の方法。
(29)染色の時間が、約10秒〜約10分の範囲である、項目22に記載の方法。
(30)白血球から赤血球を分離する方法であって、上記方法は、以下の工程:
a)緩衝液中に、赤血球および白血球を含むサンプルを調製する工程;
b)上記調製したサンプル中の上記赤血球および/または上記白血球を選択的に染色して、差示的に染色した細胞の誘電泳動特性において十分な差異が存在するようにする工程;ならびに
c)誘電泳動を介して、上記白血球から上記赤血球を分離する工程、
を包含する、方法。
(31)上記赤血球および/または上記白血球が、Giemsa色素によって染色され、そして緩衝液に対する上記色素の割合が、約1:5(v/v)〜約1:500(v/v)の範囲である、項目30に記載の方法。
(32)上記赤血球および/または上記白血球が、少なくとも30分間染色される、項目30に記載の方法。
(33)上記赤血球および/または上記白血球が、少なくとも30分間染色される、項目31に記載の方法。
(34)上記分離が、チップ形式において実施される、項目30に記載の方法。
(35)上記赤血球は、ポジティブ誘電泳動に供され、そして上記チップの電極上に捕捉され、そして上記染色された白血球は、ネガティブ誘電泳動に供され、そして電場が最も弱い場所にリパルスされる、項目34に記載の方法。
(36)上記チップから白血球を回集する工程をさらに包含する、項目34に記載の方法。
(37)上記白血球が、外部ポンプを介して上記チップから回収される、項目36に記載の方法。
(38)密度勾配遠心分離において有用な遠心管であって、ここで、上記管の中央部における遠心管内径が、上記管の上部および底部での直径よりも狭い、遠心管。
(39)誘電泳動単離デバイスであって、上記デバイスは、2つの誘電泳動チップ、ガスケット、シグナル発生器およびポンプを備え、ここで、上記ガスケットは、チャネルを備え、そして上記ガスケットは、上記2つの誘電泳動チップ間に位置し、そして上記誘電泳動チップ、上記ガスケットおよび上記ポンプは、流体接続される、誘電泳動単離デバイス。
(40)上記誘電泳動チップの1つが、入力ポートおよび/または出力ポートに接続される、項目39に記載の誘電泳動単離デバイス。
(41)上記誘電泳動チップの1つが、複数の入力ポートおよび/または出力ポートに接続される、項目40に記載の誘電泳動単離デバイス。
(42)上記ガスケット上の上記誘電泳動チップが、入力ポートおよび/または出力ポートに接続される、項目40に記載の誘電泳動単離デバイス。
(43)上記ガスケット上の上記チャネルの形状が、上記誘電泳動チップ上の電極の形状に一致する、項目39に記載の誘電泳動単離デバイス。
(44)電極効果領域内の上記チャネルの直径が、上記電極効果領域外部の上記チャネルの直径よりも幅広い、項目39に記載の誘電泳動単離デバイス。
(45)電極効果領域内の上記チャネルの直径が、上記電極効果領域外部の上記チャネルの直径よりも幅広い、項目43に記載の誘電泳動単離デバイス。
【図面の簡単な説明】
【0112】
【図1】図1は、密度勾配遠心分離において有用な、例示的遠心管を示す。
【図2】図2は、例示的な誘電泳動単離デバイスを示す。
【図3】図3は、図2における誘電泳動単離デバイスにおける、誘電泳動チップおよびガスケットならびにそれらの接続を示す。
【図4】図4は、図2における誘電泳動単離デバイスにおける、ガスケット上のチャネルの形状を示す。
【図5】図5は、図2における誘電泳動単離デバイスにおける、誘電泳動チップ上の電極の形状を示す。
【図6】図6は、多チャネル粒子スイッチを含む例示的粒子スイッチチップを示す。
【技術分野】
【0001】
(関連出願)
本願は、2001年3月22日に出願した、表題「CELL ISOLATION METHOD AND USES THEREOF」の中国特許出願第01110015.X号に関連する。上記の参照特許出願の開示は、その全体において参考として援用される。
【0002】
(技術分野)
本発明は、一般的に細胞の分離または単離の分野に関する。特に、本発明は細胞の分離のための方法を提供し、この方法は、以下の工程を包含する:a)分離されるべき細胞を、色素により選択的に染色する工程であって、差示的に染色された細胞の分離可能な特性において十分な差異が存在するようにする、工程;およびb)上記分離可能な特性を介してその差示的に染色された細胞を分離する工程。好ましくは、上記分離可能な特性は、差示的に染色された細胞の誘電泳動特性であり、上記差示的に染色された細胞が誘電泳動を介して分離または単離される。血液サンプルにおいて種々の型の細胞を選択する方法もまた提供される。密度勾配遠心分離において有用な遠心管および種々の型の細胞を分離または単離するために有用な誘電泳動単離デバイスがさらに提供される。
【背景技術】
【0003】
(背景技術)
出生前診断は、30年前に始まった(例えば、Williamson and Bob、Towards Non−invasive Prenatal Diagnosis、Nature Genetics、14:239−240(1996)を参照のこと)。現在、出生前診断は、非常に将来有望な分野となってきた。現在、胎児の細胞は、羊水穿刺または絨毛膜サンプリング(CVS)を使用することによって得られる。羊水穿刺は、母体の腹部を通して子宮および羊膜嚢内に挿入された針を介する羊水の取り出しである。CVSは、妊娠の10〜11週の間に実行され、そして胎盤が位置している場所に依存して、経腹部または経子宮頸部のいずれかで実行され;胎盤が前部にある場合は、経腹部アプローチが使用され得る。CVSは、針(腹部)またはカテーテル(子宮頸部)を、胎盤の実質に挿入する工程を包含し、但し、この工程は羊膜嚢内に達したまま維持する。次いで、吸引はシリンジによって適用され、そして組織の約10〜15ミリグラムがこのシリンジ内に吸引される。この組織は母体の子宮組織から手動で取り除かれ、次いで培養にて増殖される。核型は、羊水穿刺と同様の方法にて作製される。羊水穿刺および絨毛膜サンプリングの各々は、しばしば胎児の死亡を増加させる。羊水穿刺について、その可能性は、約0.5%であり、一方CVSについて、その可能性は約1.5%である(米国特許第5,948,278号;およびHolzgreveら、Fetal Cells In the Maternal Circulation、Journal of Reproductive Medicine、37(5):410−418(1992))。従って、これらは、35歳に達した女性のほとんど(異常な核型を有する子供を出産する危険性が、手順に関連する危険性に匹敵する)に提供される。
【0004】
羊水穿刺およびCVSの手順により誘導される危険性の不確定性に起因して、妊娠した胎児の情報についての非侵襲的方法の開発は、考慮されるべき関心事である。母体の循環における胎児細胞の存在は、考慮されるべき研究のトピックであり、そして長年にわたって試験されている。胎児細胞には、3つの主要な型が存在することが、現在理解されている:リンパ球、栄養膜および有核胎児赤血球。(SimpsonおよびElias、Isolating Fetel Cells in Maternal Circulation for Prenatal Diagnosis,Prenatal Diagnosis、14:1229−1242(1994);Cheungら、Prenatal Diagnosis of Sickle Cell Anaemia and Thalassaemia by Analysis of Fetal Cells in Maternal Blood、Nature Genetics、14:264−268(1996);Bianchiら、Isolation of Fetal DNA from Nucleated Erythrocytes in Maternal Blood、Proc.Natl.Acad.Sci.USA、86:3279−3283(1990);ならびに米国特許第5,641,628号)。種々の提案は、母体血液サンプル由来のこれらの細胞型の1つの単離または濃縮に役立ち、染色体異常についての試験のために、これらの単離細胞または濃縮細胞を使用することが提案されている。栄養膜は、細胞の3つの型のうち最も大きな細胞である。しかし、これらは、分離の研究において広範な適用を見出さない。なぜなら、これらは、母体の循環に最初に入るときに、母体の肺において分解されるからである。胎児のリンパ球は、母体の血液中でかなり長い間生存することが可能であるので、偽性診断は、以前の胎児に由来するリンパ球の継続に起因する可能性がある。有核赤血球(NRBC)は、妊娠初期の間に、胎児血液において最も共通な細胞である。これまでに試験された分離方法は、蛍光活性化細胞選別器(FACS)、磁気活性化細胞選別器(MACS)、電荷フロー分離器(charge flow separateion)(CFS)および密度勾配遠心分離である。これらの方法の全ては、結果として、母体細胞の大きな集団から胎児の細胞を濃縮させる。これらは、胎児細胞の純粋な集団の回収は可能ではない(Cheungら、Nature Genetics、14:264−268(1996))。
【0005】
この困難さには2つの理由がある。第一に、胎児のNRBCは、母体の血球中に非常にわずかに存在するが、これらの数は、胎児の栄養膜および胎児のリンパ球と比較すると非常に高い。母体の血液において、有核細胞と胎児NRBCとの比率は、4.65×106〜6×106である。約7〜22個の胎児NRBCは、MACSによって20mlの母体血球から得られ得る(Cheungら、Nature Genetics、14:264−268(1996))。第二に、胎児NRBCと母体細胞との間に、差異はほとんどない。胎児NRBCおよび母体NRBCについて、これらの間のわずかな差異は、胎児NRBCにおける特異的なヘモグロビンγおよびヘモグロビンζの存在である。
【0006】
生物学、化学および臨床診断のような多様な分野における種々の技術は、細胞分離のために適用されてきた。これらの技術により、細胞型間の差異は、細胞の特定の型を単離するために利用されている。これらの差異としては、細胞表面特性、ならびに細胞集団間の物理的および機能的な差異が挙げられる。いくつかの場合において、細胞型間の差異は非常に些細なものであり、現在利用可能な技術によってこれらを分離することは非常に困難である。
【発明の開示】
【発明が解決しようとする課題】
【0007】
当該分野において、細胞の分離および単離のための新規の方法およびデバイスの必要性が存在する。本発明は、この必要性および当該分野における他の関連した必要性を解決する。
【課題を解決するための手段】
【0008】
(発明の開示)
1つの局面において、本発明は、細胞を分離するための方法を提供し、その方法は、a)分離されるべき細胞を、色素により選択的に染色して、差示的に染色された細胞の分離可能な特性において十分な差異が存在するようにする工程;およびb)その分離可能な特性を介して、その差示的に染色された細胞を分離する工程、を包含する。好ましくは、上記分離可能な特性が、上記差次的に染色された細胞の誘電泳動特性であり、そしてその差次的に選択された細胞が、誘電泳動を介して分離または単離される。
【0009】
別の局面において、本発明は、母体の血液サンプルから有核赤血球(NRBC)を単離する方法に関し、その方法は、a)母体の血液サンプル中の少なくとも1つの細胞型を、色素により選択的に染色して、差示的に染色された細胞の誘電泳動特性において十分な差異が存在するようにする工程;およびb)誘電泳動を介して、その母体の血液サンプルから胎児NRBC細胞を単離する工程、を包含する。
【0010】
なお別の局面において、本発明は、白血球から赤血球を分離する方法に関し、その方法は、a)緩衝液中に、赤血球および白血球を含むサンプルを調製する工程;b)その調製したサンプル中のその赤血球および/または白血球を選択的に染色して、差示的に染色された細胞の誘電泳動特性において十分な差異が存在するようにする工程;c)誘電泳動を介して、その白血球からその赤血球を分離する工程、を包含する。
【0011】
なお別の局面において、本発明は、密度勾配遠心において有用な遠心管に関し、その管の中央部における遠心管内径は、その管の上部および底部での直径よりも狭い。
【0012】
なお別の局面において、本発明は、誘電泳動単離デバイスに関し、そのデバイスは、2つの誘電泳動チップ、ガスケット、シグナル発生器およびポンプを備え、ここで、そのガスケットは、チャネルを備え、そしてそのガスケットは、その2つの誘電泳動チップ間に存在し、そしてその誘電泳動チップ、そのガスケットおよびそのポンプは、流体接続している。
【発明を実施するための最良の形態】
【0013】
(発明を実行する様式)
開示を明確にするためであり、限定のためではないが、本発明の詳細な説明が、以下の小節へと分割される。
【0014】
(A.定義)
他のように定義されない限り、本明細書中で使用されるすべての技術用語および科学用語は、本発明が属する分野の当業者により一般的に理解されるのと同じ意味を有する。本明細書中で言及されるすべての特許、出願、公開された出願、および他の刊行物は、その全体が、参考として援用される。この節において示される定義が、本明細書中で参考として援用されている特許、出願、公開された出願、および他の刊行物において示されている定義と反対であるかまたは一致しない場合は、この節において示される定義が、本明細書中で参考として援用される定義にまさる。
【0015】
本明細書中で使用される場合、「a」または「an」は、「少なくとも1つ」または「1つ以上」を意味する。
【0016】
本明細書中で使用される場合、「チップ」とは、特定のプロセス(例えば、物理的プロセス、化学的プロセス、生物学的プロセス、生物物理学的プロセスまたは生化学的プロセスなど)が実行され得る、複数の1次元、2次元、もしくは3次元の、微小構造または微小尺度構造を備える、固体基材をさす。その微小構造または微小尺度構造(例えば、チャネルおよびウェル、電極素子、電磁素子)は、そのチップ上での物理的、生物物理的、生物学的、生化学的、化学的な、反応またはプロセスを容易にするために、その基材へと組み込まれるか、その基材上で製造されるか、さもなければ、その基材に取り付けられる。そのチップは、1次元では薄くあり得、そして他の次元では種々の形状(例えば、矩形、円形、楕円形、もしくは他の不規則な形状)を有し得る。本発明において使用されるチップの主要な表面の大きさは、かなり(例えば、約1mm2〜約0.25m2)変動し得る。好ましくは、このチップの大きさは、約4mm2〜約25cm2であり、特徴的寸法は、約1mm〜約7.5cmである。このチップの表面は、平らであってもまたは平らでなくてもよい。平らでない表面を有するチップは、その表面上に製造されたチャネルまたはウェルを備え得る。チップの1つの例は、複数の型のDNA分子もしくはタンパク質分子または細胞が固定される、固体基材である。
【0017】
本明細書中で使用される場合、「媒体」とは、細胞が中に溶解されているか、懸濁されているか、または含まれている、流体キャリア(例えば、液体または気体)を指す。
【0018】
本明細書中で使用される場合、「ミクロ流体適用」とは、微小尺度デバイス(例えば、基礎的構造要素の特徴的寸法が、1ミクロン未満〜1cmの間の尺度範囲にある)を、流体ベースの設定における操作およびプロセスのため(代表的には、特定の生物学的、生化学的、または化学的な、反応および手順を実施するため)に使用することを指す。その特定の領域としては、バイオチップ(すなわち、生物学的に関連する反応およびプロセスのためのチップ)、化学チップ(すなわち、化学反応のためのチップ)、またはそれらの組み合わせが挙げられるが、これらに限定されない。その基本的要素の特徴的寸法とは、1次元の大きさを指す。例えば、円形状構造(例えば、丸い電極パッド)を有する微小尺度デバイスについて、その特徴的寸法とは、その丸い電極の直径を指す。基本的構造として薄い矩形の線を有するデバイスについて、その特徴的寸法とは、これらの線の幅または長さを指し得る。
【0019】
本明細書中で使用される場合「微小尺度構造」とは、その構造が、約1ミクロン〜約20mmの尺度範囲にある、基本的構造要素の特徴的寸法を有することを意味する。
【0020】
本明細書中で使用される場合、「植物」とは、特徴として胚(葉緑体を含む)を生成し、セルロース細胞壁を有し、かつ移動運動を欠く、植物界の種々の光合成真核多細胞生物のいずれかを指す。
【0021】
本明細書中で使用される場合、「動物」とは、移動運動能力、非光合成代謝、刺激に対する顕著な応答、制限された成長および固定された身体構造によって特徴付けられる、動物界の多細胞生物をさす。動物の非限定的例としては、鳥類(例えば、ニワトリ)、脊椎動物(例えば、魚類および哺乳動物(例えば、マウス、ラット、ウサギ、ネコ、イヌ、ブタ、雌ウシ、雄ウシ、ヒツジ、ヤギ、ウマ、サル、および他の非ヒト霊長類))が、挙げられる。
【0022】
本明細書中で使用される場合、「細菌」とは、区画化されていない環状DNAおよび約70Sのリボソームを備える、小さい原核生物(直線寸法約1ミクロン)を指す。細菌のタンパク質合成は、真核生物のタンパク質合成とは異なる。多くの抗菌抗生物質は、細菌タンパク質の合成を妨害するが、感染した宿主には影響しない。
【0023】
本明細書中で使用される場合、「真正細菌」とは、古細菌を除く、細菌の主要な亜門を指す。ほとんどのグラム陽性細菌、シアノバクテリア、マイコプラズマ、腸内細菌、シュードモナス、および葉緑体は、真正細菌である。真正細菌の細胞質膜は、エステル結合脂質を含み;その細胞壁(存在する場合)中にはペプチドグリカンが存在し;そして真正細菌においてイントロンは発見されていない。
【0024】
本明細書中で使用される場合、「古細菌」とは、真正細菌を除く、細菌の主要な亜門を指す。古細菌の3つの主要な目(高度好塩菌、メタン産生菌、および硫黄依存性高度好熱菌)が存在する。古細菌は、リボソーム構造、イントロンのプロセシング(いくらかの場合)、および膜組成を含む他の特徴において、真正細菌と異なる。
【0025】
本明細書中で使用される場合、「真菌」とは、根も幹も葉も有さずに不規則な塊の状態で増殖し、かつ葉緑素も光合成可能な他の色素も欠く、真核生物の門を指す。各生物(葉状体)は、単細胞から繊維状までであり、そして細胞壁により囲まれる分枝状体細胞構造(菌糸)(グルカンもしくはキチンまたはその両方を含み、そして真の核を含む)を保有する。
【0026】
本明細書中で使用される場合、「サンプル」とは、本発明の方法および/またはデバイスを使用して分離または単離されるべき細胞を含み得る、任意のものを指す。そのサンプルは、生物学的サンプル(例えば、生物学的流体または生物学的組織)であり得る。生物学的流体の例としては、尿、血液、血漿、血清、唾液、精液、糞便、痰、脳脊髄液、涙、粘液、羊水などが、挙げられる。生物学的組織は、(通常は特定の種類の)細胞の凝集物であり、ヒト、動物、植物、細菌、真菌またはウイルス構造の構造物質(結合組織、上皮組織、筋組織、および神経組織を含む)の1つを形成するその細胞内物質を伴う。生物学的組織の例としては、器官、腫瘍、リンパ節、動脈、および個々の細胞もまた、挙げられる。生物学的組織は、細胞懸濁物サンプルを得るように処理され得る。このサンプルはまた、インビトロで調製された細胞の混合物であり得る。このサンプルはまた、培養細胞懸濁物であり得る。生物学的サンプルの場合、そのサンプルは、もとのサンプルに対する種々の処理または調製後に得られる、粗製サンプルまたは処理済みサンプルであり得る。例えば、種々の細胞分離法(例えば、磁気活性化細胞ソーティング)が、体液サンプル(例えば、血液)から標的細胞を分離または濃縮するために適用され得る。本発明のために使用されるサンプルは、このような標的細胞濃縮細胞調製物を包含する。
【0027】
本明細書中で使用される場合、「液体(流体)サンプル」とは、液体または流体(例えば、生物学的流体)として天然で存在するサンプルを指す。「液体サンプル」とはまた、非液体状態(例えば、固体または気体)にて天然で存在するがその固体サンプル物質または気体サンプル物質を含む液体、流体、溶液または懸濁物として調製される、サンプルを指す。例えば、液体サンプルは、生物学的組織を含む、液体、流体、溶液、または懸濁物を包含し得る。
【0028】
(B.細胞を分離するための方法)
1つの局面において、本発明は、細胞を分離するための方法に関し、その方法は、a)分離されるべき細胞を、色素により選択的に染色して、差示的に染色された細胞の分離可能な特性において十分な差異が存在するようにする工程;およびb)その分離可能な特性を介して、その差示的に染色された細胞を分離する工程、を包含する。
【0029】
その差次的に染色された細胞の分離可能な特性における差異は、差次的に染色された細胞が、その分離可能な特性における差異に基づいて、互いから分離され得るかまたはそのサンプルから単離され得るように、十分に大きくあるべきである。その差異は、種類の差異であり得、例えば、いくつかの細胞が染色される一方で、他の細胞は染色されない。この差異はまた、程度の差異であり得、例えば、いくつかの細胞がより多く染色されるが、他の細胞はそれよりも染色されない。
【0030】
適切な任意の分離可能な特性が、本発明の方法において使用され得る。例えば、差次的に染色された細胞の異なる形状が、これらの細胞を分離または単離するために使用され得る。
【0031】
好ましい実施形態において、本発明は、誘電泳動を使用して細胞を分離するための方法に関し、この方法は、a)分離されるべき細胞を、色素により選択的に染色して、差示的に染色された細胞の誘電泳動特性において十分な差異が存在するようにする工程;およびb)誘電泳動特性を介して、その差示的に染色された細胞を分離する工程、を包含する。
【0032】
その差次的に染色された細胞の誘電泳動特性における差異は、差次的に染色された細胞が、その誘電泳動特性における差異に基づいて互いから分離され得るかまたはそのサンプルから単離され得るように、十分に大きくあるべきである。その差異は、種類の差異であり得、例えば、いくつかの細胞が染色される一方で、他の細胞は染色されないか、またはいくつかの細胞が正の誘電泳動に対して反応性であるように染色される一方、他の細胞が、負の誘電泳動に対して反応性であるように染色される。この差異はまた、程度の差異であり得、例えば、同じ種類の誘電泳動に対して、いくつかの細胞は、より大きく反応性であるように染色される一方、他の細胞はそれらよりも反応性が低いように染色される。
【0033】
本方法は、任意の細胞型を分離または単離するために使用され得る。例えば、本発明の方法は、動物細胞、植物細胞、真菌細胞、細菌細胞、組換え細胞、または培養細胞を分離または単離するために使用され得る。
【0034】
分離または単離されるべき細胞は、適切な任意の条件下で染色され得る。例えば、細胞は、固体状態または液体状態で染色され得る。好ましくは、細胞は、固定されることなく、液体状態で染色される。
【0035】
本方法は、異なる細胞型を互いから分離するために使用され得る。例えば、本方法は、2つ以上の異なる細胞型を分離するために使用され得る。
【0036】
本方法は、サンプルから目的とする細胞を単離するために使用され得る。1つの特定の実施形態において、本方法は、そのサンプル中の他の細胞と同一または類似する誘電泳動特性を有する細胞を、染色する前に分離または単離するために使用される。別の特定の実施形態において、本方法は、同一または類似の誘電泳動特性を有する細胞を、染色する前に分離または単離するために使用され、そしてその染色は、適切な色素濃度条件および染色時間条件下で、同一または類似の誘電泳動特性を有する細胞が差次的にその色素を吸収するように、実行される。好ましくは、その染色は、少なくとも1つの細胞型が染色され、そして少なくとも1つの別の細胞型が染色されないように、制御される。
【0037】
適切な任意の染色方法または染色色素が、本方法において使用され得る。例えば、Giemsa染色法、Wright染色法、Romannowsky染色法、Kleihauser−Betke染色法、およびそれらの組み合わせ(例えば、Wright−Giemsa染色法)が、本方法において使用され得る。好ましくは、Giemsa染色法が、使用される。
【0038】
適切な任意の誘電泳動が、本方法において使用され得る。例えば、従来の誘電泳動または進行波誘電泳動が、本方法において使用され得る。
【0039】
下記の原理によって拘束されるべきではないが、以下の誘電泳動(DEP)力の原理が、本方法または本デバイス、ならびに以下の節CおよびDにおいて記載される方法において、使用され得る。粒子に対するDEP力は、その粒子が供されるAC電界の不均一分布から生じる。特に、DEP力は、電界が誘導する分極電荷と、不均一電界との間の相互作用から生じる。その分極電荷は、印加された電界によって粒子中で誘導され、そして生じる双極子の大きさおよび方向は、その粒子と、その粒子が懸濁されている媒体との間の誘電特性の差異に関連する。
【0040】
DEP力は、進行波誘電泳動(twDEP)力または従来の誘電泳動(cDEP)力のいずれかであり得る。twDEP力とは、進行波電界から生じる、粒子上に生じる力を指す。その進行波電界は、位相値について不均一分布を有するAC電界成分によって、特徴付けられる。一方、cDEP力とは、AC電界の大きさの不均一分布から生じる、粒子上に生じる力を指す。twDEP力およびcDEP力の起源は、以下により詳細に記載される(Huangら、Electrokinetic behavior of colloidal particles in travelling electric fields:studies using yeast cells、J.Phys.D:Appl.Phys.,26:1528−1535(1993);Wangら、A unified theory of dielectrophoresis and travelling−wave dielectrophoresis,J.Phys.D:Appl.Phys.27:1571−1574(1994);Wangら、Dielectrophoretic Manipulation of Cells Using Spiral Electrodes、Biophys.J.,72:1887−1899(1997);X−B.Wangら、Dielectrophoretic manipulation of particles、IEEE/IAS Trans.,33:660−669(1997);Fuhrら、Positioning and manipulation of cells and microparticles
using miniaturized electric field traps
and travelling waves,Sensors and Materials,7:131−146(1995);およびWangら、Non−uniform
spatial distributions of both the magniture and phase of AC electric fields determine dielectrophoretic forces、Biochim Biophys Acta,1243:185−194(1995))。
【0041】
単一の高調波の電場は、一般に、以下のような時間領域で表現され得る:
【0042】
【数1】

【0043】
ここで、
【0044】
【数2】

【0045】
(α=x,y,z)は、直角座標系における単位ベクトルであり、そしてEα0およびφαは、3つの電場成分(field component)のそれぞれの大きさおよびフェーズである。細胞のような粒子が、不均一な電場に供される(Eα0および/またはφαは、位置により変化することに注目のこと)場合、粒子における電場と電場が誘導した双極子モーメントとの間の電気的相互作用に起因して、正味の誘電泳動力(dielectrophoretic force)が粒子に与えられる。DEP力は、Wangら(Wangら、A unified theory of dielectrophoresis and travelling−wave dielectrophoresis,J.Phys.D:Appl.Phys.,27:1571−1574(1994))により提供される:
【0046】
【数3】

【0047】
ここで、rは粒子半径であり、εmは、粒子懸濁媒質の誘電体誘電率であり、そしてErmsは、電場のRMSの大きさである。係数fCM=(ε*p−ε*m)/(ε*p+2ε*m)は、誘電分極係数(いわゆる、クラウジウス−モソッティの係数)である。複素誘電率は、ε*x=εx−jσx/(2πf)と定義される。この誘電分極係数は、印加された電場の周波数f、粒子(pで示される)およびその懸濁している媒質(mで示される)の導電率σx、および誘電率εxに依存する。
【0048】
式(2)に示されるように、誘電泳動(DEP)力は、一般的に、2つの成分(すなわち、従来のDEP(cDEP)力および進行波DEP(twDEP)力)を有する。cDEP力は、電場の大きさの傾き
【0049】
【数4】

【0050】
と相互作用する、電場が誘導した分極の同位相成分(用語Re(fCM)(すなわち、係数fCMの実数部分)により反映され、これは、従来のDEP分極係数である)と関係する。この進行波DEP力は、電場の相の傾き
【0051】
【数5】

【0052】
と相互作用する、電場が誘導した分極の損失成分(用語Im(fCM)(すなわち、係数fCMの虚数部分)により反映され、これは、twDEP分極係数である)と関係する。電場成分の相の値の不均一な分布を有する電場は、移動(traveling)電場であることを示すことは価値がある。この電場は、位置と共に相の値が減少する方向に移動する。理想的移動電場(以下を参照のこと)は、電場の移動方向に沿った位置の一次関数である相分布を有する。従って、cDEP力とは、AC電場の大きさの不均一な分布に起因して、粒子(単数または複数)に対して発生される力をいう。従来のDEP力は、文献において、単にDEP力と時折いわれるが、用語法のこの単純化は、本明細書中では避けられている(Wangら、A unified theory of dielectrophoresis and travelling−wave dielectrophoresis,J.Phys.D:Appl.Phys.,27:1571−1574(1994);Wangら、Non−uniform spatial distributions of both the magnitude and phase of
AC electric fields determine dielectrophoretic forces,Biochim Biophys Acta,1243:185−194(1995);Wangら、Dielectrophoretic manipulation of particles,IEEE/IAS Trans.,33:660−669(1997);およびWangら、Dielectrophoretic Manipulation of Cells Using Spiral Electrodes,Biophys.J.,72:1887−1899(1997))。
【0053】
不均一な大きさの電場に供される半径rの粒子に対して作用するcDEP力
【0054】
【数6】

【0055】
は、
【0056】
【数7】

【0057】
により与えられ、
ここで、Ermsは、電場の強さのRMS値であり、そしてεmは、媒質の誘電率である。cDEP力についての式(3)は、上記で利用されるDEP力の一般的表現と一致する。係数χcDEPは、粒子のcDEP分極係数であり、
【0058】
【数8】

【0059】
により与えられる。
【0060】
ここで「Re」とは、「複素数」の実数部をいう。記号ε*x=εx−jσx/(2πf)は、複素誘電率である。パラメーターεpおよびσpは、それぞれ、粒子の有効誘電率および導電率であり、そして周波数に依存し得る。例えば、代表的な生物学的細胞は、周波数に依存した導電率および誘電率(これらは、原形質膜分極(膜変化は、誘電泳動および電気回転(electrorotation)(Huangら、Biochim.Biophys.Acta,1282:76−84(1996);およびBeckerら、Separation of human breast cancer cells from blood by differential dielectric affinity,Proc.Nat.Acad.Sci.(USA),29:860−864(1995))から決定されるようなラット腎臓細胞の温度感受性P85 gag−mos−依存形質転換と関連していた)に起因して、少なくとも一部で生じる)を有する。
【0061】
従来のDEP力についての上記の式はまた、
【0062】
【数9】

【0063】
として書かれ得る。
【0064】
ここで、p=p(x,y,z)は、電極に対する単位電圧励振(電圧V=1V)についての矩形の電場の分布(square−field distribution)であり、そしてVは、印加された電圧である。
【0065】
粒子が正のcDEP分極係数(χcDEP>0)を示す場合、粒子は、cDEP力により、強力な電場の領域に向かって移動される。このことは、正のcDEPといわれる。粒子に正のcDEPを与えるcDEP力は、正のcDEP力である。粒子が、負のcDEP分極係数(χcDEP<0)を示す場合、粒子は、cDEP力により、強い場の領域から離れて、そして弱い場の領域に向かって移動する。粒子に負のcDEPを与えるcDEP力は、負のcDEP力である。
【0066】
半径rの粒子に作用し、そして進行波電場
【0067】
【数10】

【0068】
に供される、理想的な進行波場についてのtwDEP力FtwDEP(すなわち、z方向における電場移動のx成分である、電場のx成分の相の値は、z方向に沿った位置の一次関数である)は、
【0069】
【数11】

【0070】
により与えられ、
ここで、Eは、電場の強さの大きさであり、そしてεmは、媒質の誘電体誘電率である。ζtwDEPは、粒子のtwDEP分極係数であり、そして
【0071】
【数12】

【0072】
により与えられ、
ここで、「Im」は、対応する複素数の虚数部分をいう。記号ε*x=εx−jσx/(2πf)は、複素誘電率である。パラメーターεpおよびσpは、それぞれ、粒子の有効誘電率および導電率であり、そして周波数に依存し得る。
【0073】
従って、DEP力の進行波力成分は、twDEP分極係数が、それぞれ、正であるか、または負であるかに依存して、進行波電場の伝達の方向に方向付けられるか、または進行波電場の伝達の方向の反対に方向図けられるかのいずれかの方向で粒子に作用する。粒子が、操作の周波数で、正のtwDEP−分極係数(ζTWD>0)を示す場合、twDEP力は、電場が移動する方向の反対の方向で粒子に働く。他方、粒子が、操作の周波数で、負のtwDEP−分極係数(ζTWD<0)を示す場合、twDEP力は、電場が移動する方向と同じ方向で粒子に働く。粒子(生物学的細胞を含む)の進行波DEP操作について、10ミクロンの直径を有する粒子に作用する進行波DEP力は、0.01〜10000pNのオーダーである。
【0074】
誘電泳動について、良好な分離結果は、細胞(例えば、血液細胞およびE.coli細胞、生酵母細胞および死酵母細胞)の誘電特性の間に大きな差異が存在する場合にのみ、得られ得る(Chengら、Preparation and Hybridization Analysis of DNA/RNA from E.coli on Microfabricated Bioelectronic Chips,Nature
Biotechnology,16(6):541−546(1998);およびPething,Dielectrophoresis:Using Inhomogenous AC Electrical Fields to Separate and Manipulate Cells,Critical Reviews in Biotechnology,16(4):331−348(1996))。類似の誘電特性を有する細胞について、良好な分離結果を得ることは困難である。誘電泳動および流れ場画分、または従来の誘電泳動および進行波誘電泳動は、より良好な分離を得るために共に適用され得るが、非常に類似した誘電特性を有する、胎児NRBC、母体NRBCおよび母リンパ球を分離することは、これらの細胞の間の誘電泳動特性の差異を増大させることなしには困難である(Huangら、Introducing Dielectrophoresis as a New Force Field for Field Flow Fractionation,Biophysical Journal,73:1118−1129(1997);およびWangら、Dielectrophretic Manipuration of Cells with Spiral Electrodes,Biophysical Journal,72:1887−1899(1997))。
【0075】
分離または単離は、任意の適切な形式で用いられ得る。例えば、分離または単離は、チップ形式で行われ得る。任意の適切なチップが、本発明の方法において用いられ得る。例えば、従来の誘電泳動チップ、進行波誘電泳動チップまたは誘電泳動に基づく粒子スイッチチップ(particle switch chip)が、任意の適切な形式で用いられ得る。好ましくは、本発明の方法において用いられる粒子スイッチチップは、多チャネル粒子スイッチを含む。
【0076】
あるいは、分離または単離は、非チップ形式で行われ得る。例えば、分離または単離は、液体容器(例えば、ビーカー、フラスコ、シリンダー、試験管、エッペンドルフチューブ、遠心管、培養皿、マルチウェルプレートおよびフィルター膜)中で行われ得る。
【0077】
細胞は、十分な時間(約10秒〜約10分、または少なくとも30分またはそれよりも長く)で染色されるべきである。
【0078】
本発明の方法は、さらに、チップまたは液体容器から、分離または単離された細胞を収集する工程を包含し得る。分離または単離された細胞は、任意の適切な方法によって(例えば、外部のポンプを介して)、チップまたは液体容器から収集され得る。
【0079】
(C.細胞を分離する方法)
別の局面では、本発明は、母体血液サンプルから有核赤血球(NRBC)を単離する方法に関し、この方法は、以下を包含する:a)示差的に染色された細胞の誘電泳動特性の十分な差異が存在するように、母体血液サンプル中の細胞の少なくとも1つの型を色素で選択的に染色する工程;およびb)胎児NRBC細胞を、誘電泳動を介して、この母体血液サンプルから単離する工程。
【0080】
本発明の方法は、母体血液サンプルから、任意のNRBC(母体NRBCおよび/または胎児NRBC)を単離するために用いられ得る。好ましくは、本発明の方法は、さらに、母体NRBCを胎児NRBCから分離するために用いられ得る。
【0081】
本発明の方法は、さらに、細胞の少なくとも1つの型を選択的に染色する前に、赤血球を母体血液サンプルから実質的に取り出す工程(例えば、赤血球の少なくとも50%、60%、70%、80%、90%、95%、99%、または100%を取り出す工程)を包含し得る。
【0082】
母体赤血球サンプルは、細胞の少なくとも1つの型を選択的に染色する前に、適切な緩衝液(好ましくは、等張性緩衝液)に添加される。1つの例では、母体血液サンプルは、細胞の少なくとも1つの型を選択的に染色する前に、等張性(isosmotic)または等張性(isotonic)グルコース緩衝液へと添加される。このグルコース緩衝液は、任意の適切な導電性(例えば、約10μs/cm〜約1.5ms/cmの範囲)を有し得る。
【0083】
任意の適切な染色法または色素が、本発明の方法に用いられ得る。例えば、Giemsa染色、Wright染色、Romannowsky染色、Kleihauser−Betke染色、およびこれらの組み合わせ(例えば、Wright−Giemsa染色)が本発明の方法に用いられ得る。好ましくは、Giemsa染色が用いられる。色素(例えば、Giemsa色素)が、任意の適切な濃度で用いられ得る。例えば、Giemsa色素対緩衝液の比率は、約1:5(v/v)〜約1:500(v/v)の範囲であり得る。好ましい実施形態では、この色素は、胎児ヘモグロビンに特異的に結合する。
【0084】
分離または単離は、任意の適切な形式で用いられ得る。例えば、分離または単離は、チップ形式で行われ得る。任意の適切なチップが、本発明の方法において用いられ得る。例えば、従来の誘電泳動チップ、進行波誘電泳動チップ、または進行波誘電泳動に基づく粒子スイッチチップは、任意の適切な形式で用いられ得る。好ましくは、本発明の方法において用いられる粒子スイッチチップは、多チャネル粒子スイッチを含む。特定の実施形態では、母体白血球が、チップの電極に捕捉され、そして染色されたNRBCが、電場が、チップ上で最も弱い位置に再パルス(repulse)される。別の実施形態では、多チャンネル粒子スイッチを含むチップが、母体赤血球、母体白血球、母体NRBC、および胎児NRBCを、並行して、単離および検出するために用いられる。
【0085】
あるいは、分離または単離は、非チップ形式で行われ得る。例えば、分離または単離は、液体容器(例えば、ビーカー、フラスコ、シリンダー、試験管、エッペンドルフチューブ、遠心管、培養皿、マルチウェルプレートおよびフィルター膜)中で行われ得る。
【0086】
任意の単一の型または複数の型の細胞が、本発明の方法に従って、母体血液サンプルから単離され得る。複数の型の細胞が、母体血液サンプルから単離される場合、複数の型の細胞は、母体血液サンプルから、連続してまたは同時に単離され得る。1つの例では、母体血液サンプルは、異なる型の細胞を連続して単離するために、誘電泳動を介して、複数の単離に供される。
【0087】
細胞は、十分な時間(約10秒〜約10分、または少なくとも30分またはそれよりも長く)で染色されるべきである。
【0088】
さらに別の局面では、本発明は、白血球から赤血球を単離する方法に関し、この方法は、以下を包含する:a)緩衝液中に赤血球および白血球を含むサンプルを調整する工程;b)示差的に染色された細胞の誘電泳動特性の十分な差異が存在するように、この調製されたサンプル中の赤血球および/または白血球を選択的に染色する工程;およびc)赤血球を、誘電泳動を介して、この白血球サンプルから単離する工程。
【0089】
任意の適切な染色法または色素が、本発明の方法に用いられ得る。例えば、Giemsa染色、Wright染色、Romannowsky染色、Kleihauser−Betke染色、およびこれらの組み合わせ(例えば、Wright−Giemsa染色)が本発明の方法に用いられ得る。好ましくは、Giemsa染色が用いられる。色素(例えば、Giemsa色素)が、任意の適切な濃度で用いられ得る。例えば、Giemsa色素対緩衝液の比率は、約1:5(v/v)〜約1:500(v/v)の範囲であり得る。
【0090】
細胞は、十分な時間(約10秒〜約10分)で染色されるべきである。好ましくは、赤血球および/または白血球は、少なくとも30分またはそれよりも長い間染色される。
【0091】
分離または単離は、任意の適切な形式で用いられ得る。例えば、分離または単離は、チップ形式で行われ得る。任意の適切なチップが、本発明の方法において用いられ得る。例えば、従来の誘電泳動チップ、進行波誘電泳動チップ、または進行波誘電泳動に基づく粒子スイッチチップは、任意の適切な形式で用いられ得る。好ましくは、本発明の方法において用いられる粒子スイッチチップは、多チャネル粒子スイッチを含む。特定の実施形態では、赤血球が、正の誘電泳動に供され、そしてチップの電極上に捕捉され、そして染色された白血球は、負の誘電泳動に供され、そして電場が最も弱い位置に再パルスされる。
【0092】
本発明の方法は、さらに、チップから赤血球および/または白血球を収集する工程を包含する。分離された赤血球および/または白血球は、チップから、任意の適切な方法によって(例えば、外部のポンプを介して)、収集され得る。
【0093】
あるいは、分離または単離は、非チップ形式で行われ得る。例えば、分離または単離は、液体容器(例えば、ビーカー、フラスコ、シリンダー、試験管、エッペンドルフチューブ、遠心管、培養皿、マルチウェルプレートおよびフィルター膜)中で行われ得る。
【0094】
(D.遠心分離チューブおよび誘電泳動分離デバイス)
なお別の局面において、本発明は、密度勾配遠心分離に有用な遠心分離チューブに関する。このチューブの中央部分における遠心分離チューブの内径は、このチューブの頂部および底部での直径より小さい。遠心分離チューブは、任意の適切な材料(例えば、ポリマー、プラスチック、または他の適切な複合材料)から作製され得る。
【0095】
なお別の局面において、本発明は、誘電泳動分離デバイスに関する。このデバイスは、2つの誘電泳動チップ、ガスケット、シグナル発生器、およびポンプを備える。ここで上記ガスケットは、チャネルを備え、上記ガスケットは、上記2つの誘電泳動チップの間にあり、上記誘電泳動チップ、上記ガスケットおよび上記ポンプは、流体接続している。このポンプは、任意の適切な様式にて、誘電泳動チップと接続され得る。1つの特定の実施形態において、外部ポンプには2つのチュービングがある。一方は入り口であり、他方は出口である。ポンプの入り口は、誘電泳動チップの入り口と接続され、ポンプの出口は、誘電泳動チップの出口と接続される。
【0096】
誘電泳動チップの一方または両方は、入力ポートおよび/または出力ポートと接続され得る。同様に、誘電泳動チップの一方または両方が、複数の入力ポートおよび/または出力ポートと接続される。1つの例において、ガスケットの上にある誘電泳動チップは、入力ポートおよび/または出力ポートと接続される。
【0097】
ガスケット上のチャネルは、任意の適切な形状を有し得る。好ましくは、ガスケット上のチャネルの形状は、誘電泳動チップ上の電極の形状に対応する。ガスケット上のチャネルは、任意の適切な直径を有し得る。好ましくは、電極効果領域内のチャネルの直径は、電極効果領域の外側のチャネルの直径より大きい。
【0098】
(D.例示的実施形態)
1つの特定の実施形態において、サンプル細胞は、まず、誘電特性の差異を増幅するために染色される。次いで、誘電泳動チップは、迅速で、簡便かつ正確な出生前診断のための胎児NRBCを濃縮および精製するために適用される。この手順は、以下のとおりである。
【0099】
まず、母体由来の母体血液を、赤血球の大部分を除去するために、密度勾配遠心分離により処理する。密度勾配遠心分離は、異なる型の細胞を分離するための従来の生物学的かつ医学的方法である。血漿および種々の血球については、密度値が異なる。血液サンプルを、Ficoll媒体中で遠心分離する場合、異なる密度を有する細胞は、異なる層へと分離される。NRBCおよびリンパ球は、類似の密度を有するので、同じ層にある。
【0100】
密度勾配遠心分離の後、Ficoll中で4つの層が形成される。赤血球は、底部にあり、続いて顆粒球、リンパ球とNRBCの複合体、および血漿がある。本発明者らに必要なものは、リンパ球とNRBCの複合体である。ここで従来の遠心分離チューブを使用して操作される場合、標的細胞がかなり失われる。なぜなら、ごくわずかなリンパ球およびNRBCがチューブの中間層に固定されるからである。濃縮の効率を増大させるために、図1Aおよび図1Bに示される特別に設計された遠心分離チューブが使用され得る。遠心分離チューブは、図1Aに示される円筒形または図1Bに示される矩形のいずれかとして設計され得る。最良の濃縮結果を得るために、チューブの寸法を決定するために予備実験を行うことが必要である。例えば、円筒形チューブは、図1Aに示されるように設計される。底部における円錐105の容積は、赤血球および顆粒球の容積に等しい。中央部の細い円筒部103について、その容積は、リンパ球およびNRBCの容積に等しい。このようにすると、チューブの頂部に血漿のみが存在する。分離効率は、中央部分の直径が非常に小さく、界面101および104にて異なる層を区別することが容易であるので、実質的に増大される。図1Bに示されるように、中央部分203は、細い矩形スリットとして設計され得る。底部201および頂部205は、三角形として設計される。界面202および204は、分離効率を増大させるために非常に小さい。分離効率をさらに改善するために、液体窒素銃(liquid nitrogen gun)を使用した迅速な凍結が、中央部分と、頂部および底部との境界面に適用され得る。頂部層と凍結した部分は、まず、中央層が回収される前に取り出される。
【0101】
2回の遠心分離および緩衝液での洗浄を行った後、胎児NRBC、母体NRBC、母体リンパ球、顆粒球、および母体赤血球を含むサンプルを、母体血漿中に保存する。この分野での研究者は、母体血液から赤血球を除去するための他の方法(例えば、濾過)が存在することを知っているはずである。処理されたサンプルは、等浸透圧緩衝液(8.5% グルコース、0.3% デキストロース(10μs/cm〜1.5ms/cmの導電性を有する)から構成される)中に希釈される。次いで、適切な色素が、溶液に添加される(例えば、Giemsa色素)。色素の容積および染色時間を制御することにより、NRBC全てが染色されるが、母体リンパ球はまったく染色されない。染色後、形態および誘電特性の両方において、NRBCと母体リンパ球との間には大きな差異が存在する。その理由は、異なる細胞または細胞オルガネラが、異なる効率で色素を吸収することである。結果は、誘電特性の差異が、増幅されることである。染色は、液体中で処理されるので、Giemsa色素と緩衝液との間の比は、1:5〜1:500であり得る。代表的な値は、約1:10である。色素の濃度が高すぎると、溶液の色が濃いので、染色された細胞を同定することは困難である。そして全ての細胞(NRBCおよび母体リンパ球を含む)が染色される。色素の濃度が低すぎると、いくつかのNRBCが染色されず、分離結果がよくない。染色のための時間は、別の重要なパラメーターである。色素の濃度が1:100である場合、染色のための時間は、10秒〜10分であるべきである。時間が長すぎると、細胞全て(NRBCおよび母体リンパ球を含む)が染色される。時間が短すぎれば、いくつかのNRBCが染色されず、分離結果がよくない。特定の染色時間の後、サンプルを、誘電泳動チップに添加する。適切な周波数および振幅を、関数発生器を通して印加することにより、母体リンパ球は、正の誘電泳動力により電極に誘引される;その一方で、染色されているNRBCは、負の誘電泳動力により、最も弱い電場を有する領域に反発される。次いで、NRBCは、外部ポンプを適用することにより収集され得る。収集されたNRBCには、胎児NRBCまたは母体NRBCのいずれかが存在する。胎児ヘモグロビンに対する特定の免疫染色を行った後、胎児NRBCを、形態により母体NRBCから区別し得る(Cheungら,Prenatal Diagnosis of Sickle Cell Anaemia and Thalassaemia by Analysis of Fetal Cells in Maternal Blood,Nature Genetics,14:264−268(1996))。再び誘電泳動チップを適用することにより、純粋な胎児NRBCが、さらなる出生前診断のために得られ得る。
【0102】
色素の濃度および染色のための時間は、色素および細胞型の特徴的な特性に従って決定されるべきである。この分野の研究者らは、cDEPチップ、cDEPチップとtwDEPチップとの複合および粒子操作チップが母体細胞と胎児細胞とを分離するために適用され得ることを知っているはずである(WO02/16647、PCT/US01/42426、PCT/US01/42280、およびPCT/US01/29762)。次いで、外部ポンプの助けを借りて、胎児細胞が回収され得る。母体血液中に非常にわずかな胎児NRBCが存在するので、誘電泳動分離は、好ましくは、純粋な胎児細胞を得るために、2回以上適用される。
【0103】
Giemsa色素はまた、類似の誘電特性を有する他の型の細胞(例えば、赤血球および白血球)を分離するために使用され得る。色素の濃度が1:100である場合、染色のための時間は、30分を超える必要がある。全ての白血球が染色されるが、赤血球は染色されない。なぜなら、Giemsa色素によって核のみが染色され得、赤血球には核がないからである。次いで、サンプルは、誘電泳動チップに添加され得る。適切な周波数および振幅を、関数発生器を通じて印加することにより、赤血球は、正の誘電泳動力により電極に誘引される;その一方で、染色された白血球は、負の誘電泳動力により、最も弱い電
場を有する領域に反発される。次いで、染色された白血球は、外部ポンプを適用することにより回収され得る。
【0104】
例示的な誘電泳動システムは、図2に示される。チュービング1は、バルブ7の入り口と接続される;バルブ7の出口は、チュービング8を通じてカバーガラス3の入り口と接続される;そしてカバーガラス3の出口は、チュービング9を通じてチュービング2と接続される。緩衝液(容器13)、サンプル(容器12)、標的サンプル(容器10)および廃液(容器11)の流れは、それぞれ、バルブF1、F2、F3およびF4により制御される。誘電泳動チップ5およびガスケット4は、サンプルが分離される反応チャンバを備える。シグナル発生器6により、電圧を誘電泳動チップに印加する。ガスケット4の厚みは、分離についての重要な値である。厚すぎると、細胞の移動時間が長くなり、このことにより、次には、分離時間が長くなる。ガスケットが薄すぎると、反応チャンバの容積が小さくなり、分離時間がまた長くなる。ガスケットの適切な高さは、迅速かつ効率的な分離をもたらし得る。誘電泳動場の有効範囲を増大させるために、このシステムを、三次元構造として設計し得る。カバーガラス3は、別の誘電泳動チップ14により置換され、入り口141および出口142の2つの孔は穿孔することにより形成され、チュービング8および9により接続される。この構造は、分離システムの効率を倍化させる。誘電泳動の範囲が倍加するので、ガスケット4の厚みは、2倍に増大し得、このことにより、反応チャンバの容積の倍加が導かれ得る。ガスケット4におけるフローチャネル41は、誘電泳動チップ5、14の表面上の電極51、143の構造に従って設計され得る。図4に示されるように、このチャネルは、電極より広く、他の領域より細い。これは、チャネル断面積を減少させることにより、電極がない表面への細胞の非特異的結合を減少させる。
【0105】
電極51および143の形状は、図5Aおよび図5Bに示されるように設計され得る。異なる寸法および形状のフローチャネルは、異なる寸法および形状の電極に従って設計され得る。電極は、同様に他の形状にも設計され得る。
【0106】
この分野の研究者らは、cDEPチップ、twDEPチップ、粒子操作チップまたはcDEPチップとtwDEPチップの組み合わせは、全て、母体細胞と胎児細胞とを分離するために使用され得ることを知っているはずである。例えば、複数の細胞操作スイッチが、母体赤血球、母体リンパ球、母体NRBCおよび胎児NRBCの並行した分離を実現するための誘電泳動の波を移動させる機構に従って設計され得る。例示的なプロセスは、以下に記載される。
【0107】
Giemsa色素で染色した後に、サンプルを、フローチャネル15に添加する。このフローチャネル15において、母体RBCおよび母体リンパ球は染色されないが、母体NRBCおよび胎児NRBCは染色される。適切な電圧シグナルが印加されると、母体NRBCおよび胎児NRBCは、分岐b2に回収される一方、母体RBCおよび母体リンパ球は、分岐b1に回収される。次いで、分岐b1における母体NRBCおよび胎児NRBCは、胎児ヘモグロビンに特異的なイムノアッセイ法により染色される。母体NRBCと胎児NRBCとの間の誘電差は増幅され、形態もまた同様である。最終的に、母体NRBCおよび胎児NRBCは、適切な電圧シグナルを印加することにより、それぞれ、分岐b5およびb6に回収され得る。そして母体RBCおよび母体リンパ球は、適切な電圧シグナルを印加することにより、それぞれ、分岐b3およびb4にて回収される(PCT/US01/42426,Wangら,Dielectrophretic Manipulation of Cells with Spiral Electrodes,Biophysical Journal,72:1887−1899(1997);Hughesら,Dielectrophretic Forces on Particles
in Traveling Electric Fields,J.Phys.Appl.Phys,29:474−482(1997);およびMuller,A 3−D Microelectrode System for Handling and Caging Single Cells and Particles,Biosensors&Bioelectronics,14:247−256(1999))。チャネル幅の寸法は、別の重要な値である。その寸法は、単一の細胞が容易に操作され得るように細胞と同じ位であり得る。
【0108】
染色する前、母体リンパ球と胎児NRBCの誘電特性および形態は、非常に似ている。よって、誘電泳動によりそれらを分離することは困難である。誘電特性の差異は、染色により増幅される。なぜなら、細胞は、色素を吸収する能力が異なるからである。この分野の研究者は、任意の適切な染色法が細胞間の誘電特性の差異を増幅するために適用され得ることを知っているはずである。特定の色素の濃度および染色時間は、染色のための重要な値である。適切な値を用いれば、ある種の細胞は染色され得るが、他の種の細胞は染色されない。このことは、それらの誘電特性の増幅をもたらす。本明細書中に開示されたプロセス全体が、液体中で操作されるという点で、この方法と従来の染色方法との間には非常に重要な差異がある。従来の染色方法において、細胞は、まず、ホルムアミド、メタノール、エタノールまたは他の有機溶媒中で処理されて、スライドガラスに固定される。水で洗浄し、風乾させた後、細胞を色素で染色する。この実施形態において、従来の染色法に対していくつかの改良が行われた。適切な条件下では、ある種の細胞が染色されるが、他の細胞は染色されず、このことは、それらの誘電特性の増幅をもたらす。次いで、細胞は、誘電泳動チップにより容易に分離され得る。結果は、従来方法の結果とは大きく異なる。使用され得る他の従来染色法としては、Giemsa染色、Wright染色、Wright−Giemsa染色、Romannowsky染色およびKleihauser−Betke染色が挙げられる(Bianchi Diana,ら,Isolation of Fetal DNA from Nucleated Erythrocytes in Maternal Blood,Proc.Natl.Acad.Sci.USA,86:3279−3283 (1990))。
【0109】
改善された細胞染色法が適用されて、母体細胞と胎児細胞との間の誘電性および形態の差異が増幅された。次いで、種々の誘電泳動チップの助けを借りて、胎児NRBCが、分離、濃縮および精製され得る。最後に、従来の分子生物学方法が、迅速で、簡便かつ正確な出生前診断のために胎児細胞に適用される。
【0110】
上記の実施例は、例示目的で含められるに過ぎず、本発明の範囲を限定することを意図しない。上記の実施例に対する多くのバリエーションが可能である。上記の実施例に対する改変およびバリエーションは、当業者に明らかであるので、本発明は、添付の特許請求の範囲によってのみ制限されることが意図される。
【0111】
(発明の要旨)
本発明は、以下を提供する。
(1)細胞を分離するための方法であって、上記方法は以下の工程:
a)分離されるべき細胞を、色素により選択的に染色し、差示的に染色された細胞の誘電泳動特性において十分な差異が存在するようにする、工程;および
b)誘電泳動を介して、上記差示的に染色された細胞を分離する工程、
を包含する、方法。
(2)上記分離されるべき細胞が、動物細胞、植物細胞、真菌細胞、細菌細胞、組換え細胞および培養細胞からなる群より選択される、項目1に記載の方法。
(3)上記分離されるべき細胞が、少なくとも2つの異なる細胞型を含む、項目1に記載の方法。
(4)上記細胞が、固定されずに液体中で染色される、項目1に記載の方法。
(5)サンプルから目的の細胞を単離するために使用される、項目1に記載の方法。
(6)上記単離されるべき細胞が、染色前のサンプルにおいて、他の細胞と同一または類似の誘電泳動特性を有する、項目5に記載の方法。
(7)項目1に記載の方法であって、上記分離されるべき細胞は、染色前と同一または類似の誘電泳動特性を有し、そして上記染色は、同一または類似の誘電泳動特性を有する細胞が、上記色素を差示的に吸収するように、適切な色素濃度および染色時間の条件下で実施される、方法。
(8)上記染色は、少なくとも1つの細胞型が染色され、そして少なくとも別の細胞型が染色されないように制御される、項目7に記載の方法。
(9)上記染色が、Giemsa染色、Wright染色、Romannowsky染色、Kleihauser−Betke染色およびそれらの組み合わせからなる群より選択される、項目1に記載の方法。
(10)上記染色が、Wright−Giemsa染色である、項目9に記載の方法。
(11)上記誘電泳動が、従来型の誘電泳動または進行波誘電泳動である、項目1に記載の方法。
(12)上記分離がチップ形式で実施される、項目1に記載の方法。
(13)上記チップが、従来型の誘電泳動チップ、進行波誘電泳動チップおよび進行波誘電泳動に基づく粒子スイッチチップからなる群から選択される、項目12に記載の方法。
(14)上記粒子スイッチチップが、多チャネル粒子スイッチを備える、項目13に記載の方法。
(15)上記分離がビーカー、フラスコ、シリンダー、試験管、エップンドルフチューブ、遠心管、培養皿、マルチウェルプレートおよびフィルター膜からなる群より選択される液体容器内で実施される、項目1に記載の方法。
(16)
母体の血液サンプルから有核赤血球(NRBC)を単離する方法であって、上記方法は、以下の工程:
a)母体の血液サンプル中の少なくとも1つの細胞型を、色素により選択的に染色して、差示的に染色された細胞の誘電泳動特性において十分な差異が存在するようにする工程;および
b)誘電泳動を介して、上記母体の血液サンプルから胎児NRBC細胞を単離する工程、を包含する、方法。
(17)上記母体の血球サンプルから単離した上記NRBCが、母体のNRBCおよび/または胎児のNRBCである、項目16に記載の方法。
(18)少なくとも1つの細胞型を選択的に染色する工程の前に、上記母体の血液サンプルから赤血球を実質的に取り出す工程をさらに包含する、項目16に記載の方法。
(19)少なくとも1つの細胞型を選択的に染色する工程の前に、上記母体の血液サンプルが、等浸透圧性または等張性のグルコース緩衝液に添加される、項目16に記載の方法。
(20)上記グルコース緩衝液が、約10μs/cm〜約1.5ms/cmの範囲の伝導性を有する、項目19に記載の方法。
(21)上記色素がGiemsa色素である、項目16に記載の方法。
(22)上記Giemsa色素の緩衝液に対する割合が、約1:5(v/v)〜約1:500(v/v)の範囲である、項目21に記載の方法。
(23)上記色素が、胎児ヘモグロビンに特異的に結合する、項目16に記載の方法。
(24)上記単離がチップ形式において実施される、項目16に記載の方法。
(25)母体の白血球は、上記チップの電極上に捕捉され、そして染色したNRBCは、上記チップ上の電場が最も弱い場所にリパルスされる、項目24に記載の方法。
(26)多チャネル粒子スイッチを備えるチップが、母体の赤血球、母体の白血球、母体のNRBCおよび胎児のNRBCを、同時に単離および検出するために使用される、項目24に記載の方法。
(27)上記母体の血液サンプルが、誘電泳動を介して複数単離に供される、項目16に記載の方法。
(28)染色の時間が、約10秒〜約10分の範囲である、項目16に記載の方法。
(29)染色の時間が、約10秒〜約10分の範囲である、項目22に記載の方法。
(30)白血球から赤血球を分離する方法であって、上記方法は、以下の工程:
a)緩衝液中に、赤血球および白血球を含むサンプルを調製する工程;
b)上記調製したサンプル中の上記赤血球および/または上記白血球を選択的に染色して、差示的に染色した細胞の誘電泳動特性において十分な差異が存在するようにする工程;ならびに
c)誘電泳動を介して、上記白血球から上記赤血球を分離する工程、
を包含する、方法。
(31)上記赤血球および/または上記白血球が、Giemsa色素によって染色され、そして緩衝液に対する上記色素の割合が、約1:5(v/v)〜約1:500(v/v)の範囲である、項目30に記載の方法。
(32)上記赤血球および/または上記白血球が、少なくとも30分間染色される、項目30に記載の方法。
(33)上記赤血球および/または上記白血球が、少なくとも30分間染色される、項目31に記載の方法。
(34)上記分離が、チップ形式において実施される、項目30に記載の方法。
(35)上記赤血球は、ポジティブ誘電泳動に供され、そして上記チップの電極上に捕捉され、そして上記染色された白血球は、ネガティブ誘電泳動に供され、そして電場が最も弱い場所にリパルスされる、項目34に記載の方法。
(36)上記チップから白血球を回集する工程をさらに包含する、項目34に記載の方法。
(37)上記白血球が、外部ポンプを介して上記チップから回収される、項目36に記載の方法。
(38)密度勾配遠心分離において有用な遠心管であって、ここで、上記管の中央部における遠心管内径が、上記管の上部および底部での直径よりも狭い、遠心管。
(39)誘電泳動単離デバイスであって、上記デバイスは、2つの誘電泳動チップ、ガスケット、シグナル発生器およびポンプを備え、ここで、上記ガスケットは、チャネルを備え、そして上記ガスケットは、上記2つの誘電泳動チップ間に位置し、そして上記誘電泳動チップ、上記ガスケットおよび上記ポンプは、流体接続される、誘電泳動単離デバイス。
(40)上記誘電泳動チップの1つが、入力ポートおよび/または出力ポートに接続される、項目39に記載の誘電泳動単離デバイス。
(41)上記誘電泳動チップの1つが、複数の入力ポートおよび/または出力ポートに接続される、項目40に記載の誘電泳動単離デバイス。
(42)上記ガスケット上の上記誘電泳動チップが、入力ポートおよび/または出力ポートに接続される、項目40に記載の誘電泳動単離デバイス。
(43)上記ガスケット上の上記チャネルの形状が、上記誘電泳動チップ上の電極の形状に一致する、項目39に記載の誘電泳動単離デバイス。
(44)電極効果領域内の上記チャネルの直径が、上記電極効果領域外部の上記チャネルの直径よりも幅広い、項目39に記載の誘電泳動単離デバイス。
(45)電極効果領域内の上記チャネルの直径が、上記電極効果領域外部の上記チャネルの直径よりも幅広い、項目43に記載の誘電泳動単離デバイス。
【図面の簡単な説明】
【0112】
【図1】図1は、密度勾配遠心分離において有用な、例示的遠心管を示す。
【図2】図2は、例示的な誘電泳動単離デバイスを示す。
【図3】図3は、図2における誘電泳動単離デバイスにおける、誘電泳動チップおよびガスケットならびにそれらの接続を示す。
【図4】図4は、図2における誘電泳動単離デバイスにおける、ガスケット上のチャネルの形状を示す。
【図5】図5は、図2における誘電泳動単離デバイスにおける、誘電泳動チップ上の電極の形状を示す。
【図6】図6は、多チャネル粒子スイッチを含む例示的粒子スイッチチップを示す。
【特許請求の範囲】
【請求項1】
密度勾配遠心分離において有用な遠心管であって、ここで、該管の中央部における遠心管内径が、該管の上部および底部での直径よりも狭い、遠心管。
【請求項2】
誘電泳動単離デバイスであって、該デバイスは、2つの誘電泳動チップ、ガスケット、シグナル発生器およびポンプを備え、ここで、該ガスケットは、チャネル を備え、そして該ガスケットは、該2つの誘電泳動チップ間に位置し、そして該誘電泳動チップ、該ガスケットおよび該ポンプは、流体接続される、誘電泳動単離デバイス。
【請求項3】
前記誘電泳動チップの1つが、入力ポートおよび/または出力ポートに接続される、請求項2に記載の誘電泳動単離デバイス。
【請求項4】
前記誘電泳動チップの1つが、複数の入力ポートおよび/または出力ポートに接続される、請求項3に記載の誘電泳動単離デバイス。
【請求項5】
前記ガスケット上の前記誘電泳動チップが、入力ポートおよび/または出力ポートに接続される、請求項3に記載の誘電泳動単離デバイス。
【請求項6】
前記ガスケット上の前記チャネルの形状が、前記誘電泳動チップ上の電極の形状に一致する、請求項2に記載の誘電泳動単離デバイス。
【請求項7】
電極効果領域内の前記チャネルの直径が、該電極効果領域外部の該チャネルの直径よりも幅広い、請求項2に記載の誘電泳動単離デバイス。
【請求項8】
電極効果領域内の前記チャネルの直径が、該電極効果領域外部の該チャネルの直径よりも幅広い、請求項6に記載の誘電泳動単離デバイス。
【請求項9】
明細書に記載された誘電泳動単離デバイス。
【請求項1】
密度勾配遠心分離において有用な遠心管であって、ここで、該管の中央部における遠心管内径が、該管の上部および底部での直径よりも狭い、遠心管。
【請求項2】
誘電泳動単離デバイスであって、該デバイスは、2つの誘電泳動チップ、ガスケット、シグナル発生器およびポンプを備え、ここで、該ガスケットは、チャネル を備え、そして該ガスケットは、該2つの誘電泳動チップ間に位置し、そして該誘電泳動チップ、該ガスケットおよび該ポンプは、流体接続される、誘電泳動単離デバイス。
【請求項3】
前記誘電泳動チップの1つが、入力ポートおよび/または出力ポートに接続される、請求項2に記載の誘電泳動単離デバイス。
【請求項4】
前記誘電泳動チップの1つが、複数の入力ポートおよび/または出力ポートに接続される、請求項3に記載の誘電泳動単離デバイス。
【請求項5】
前記ガスケット上の前記誘電泳動チップが、入力ポートおよび/または出力ポートに接続される、請求項3に記載の誘電泳動単離デバイス。
【請求項6】
前記ガスケット上の前記チャネルの形状が、前記誘電泳動チップ上の電極の形状に一致する、請求項2に記載の誘電泳動単離デバイス。
【請求項7】
電極効果領域内の前記チャネルの直径が、該電極効果領域外部の該チャネルの直径よりも幅広い、請求項2に記載の誘電泳動単離デバイス。
【請求項8】
電極効果領域内の前記チャネルの直径が、該電極効果領域外部の該チャネルの直径よりも幅広い、請求項6に記載の誘電泳動単離デバイス。
【請求項9】
明細書に記載された誘電泳動単離デバイス。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2006−126195(P2006−126195A)
【公開日】平成18年5月18日(2006.5.18)
【国際特許分類】
【出願番号】特願2005−310561(P2005−310561)
【出願日】平成17年10月25日(2005.10.25)
【分割の表示】特願2002−575311(P2002−575311)の分割
【原出願日】平成14年3月20日(2002.3.20)
【出願人】(503012199)キャピタル バイオチップ カンパニー リミテッド (3)
【出願人】(503012203)ツィンフア ユニバーシティ (10)
【Fターム(参考)】
【公開日】平成18年5月18日(2006.5.18)
【国際特許分類】
【出願日】平成17年10月25日(2005.10.25)
【分割の表示】特願2002−575311(P2002−575311)の分割
【原出願日】平成14年3月20日(2002.3.20)
【出願人】(503012199)キャピタル バイオチップ カンパニー リミテッド (3)
【出願人】(503012203)ツィンフア ユニバーシティ (10)
【Fターム(参考)】
[ Back to top ]

