細胞含有流動性組成物の最小侵襲投与のための材料および方法
【課題】細胞含有流動性組成物の最小侵襲投与のための材料および方法の提供。
【解決手段】開示される本発明は、細胞ベースの治療法が、血管介入又は心血管疾病に関連した臨床的続発症、特に閉塞性血栓症、再狭窄、内膜過形成、炎症及び血管拡張の進行を処置、回復、管理及び/又は低下させるために使用できるという発見に基づいている。本発明は更に、これまでに記述されていない移植可能な流動性組成物が、十分に生存可能な細胞のコンフルエントな集団を維持することができ、又、細胞の臨床的有効性又は生存率を低下させることなく、低侵襲性外科手技によって有効に投与することができるという更なる発見から利益を得るものである。開示される本発明は、血管系、並びにファロピウス管のような非血管の管状構造の処置に使用することができる。
【解決手段】開示される本発明は、細胞ベースの治療法が、血管介入又は心血管疾病に関連した臨床的続発症、特に閉塞性血栓症、再狭窄、内膜過形成、炎症及び血管拡張の進行を処置、回復、管理及び/又は低下させるために使用できるという発見に基づいている。本発明は更に、これまでに記述されていない移植可能な流動性組成物が、十分に生存可能な細胞のコンフルエントな集団を維持することができ、又、細胞の臨床的有効性又は生存率を低下させることなく、低侵襲性外科手技によって有効に投与することができるという更なる発見から利益を得るものである。開示される本発明は、血管系、並びにファロピウス管のような非血管の管状構造の処置に使用することができる。
【発明の詳細な説明】
【技術分野】
【0001】
2005年12月6日に出願された、この本出願は、35U.S.C.Section 119(e)の下、2004年12月8日に出願された仮特許出願U.S.S.N.60/634,155号;2005年3月21日に出願された仮特許出願U.S.S.N.60/663,859号;および2005年3月19日に出願された仮特許出願U.S.S.N.60/682,054号;_________に出願された仮特許出願U.S.S.N._______号の利益を主張し、同日付で出願された係属中の国際出願PCT/US____________号(代理人整理番号ELV−002PCとしても知られる)および同日付で出願された係属中の国際出願PCT/US____________号(代理人整理番号ELV−008PCとしても知られる)に対する優先権を、35U.S.C.Section 120,363および/または365の下で主張する。上述の出願の各々の全内容が、本明細書中に参考として援用される。
【背景技術】
【0002】
心血管疾病は、毎年世界中で5000万人を超える人々の死因となっており、米国では100万を超える人々の死因となっている。米国では毎年、これら疾患から自然発生する閉塞性動脈病変を軽減する試みにおいて、約150万件の治療が行われている。前記治療の例として幾つかを挙げると、バルーン及びレーザー血管形成術、アテローム切除術、血管内ステント、並びにバイパス術等がある。血管形成術、血管バイパス術、更には臓器移植の長期間の効果は、当該治療後の動脈症の急速な発達により制限されている。内皮の完全性の損失、閉塞性血栓症、痙攣、並びに内膜過形成を招く平滑筋細胞の移動及び増殖が、当該動脈症の典型となっている。例えば、再狭窄は、当該患者の20〜50%で閉塞性動脈病変を誘導している。冠動脈血管形成術後の3〜6ヶ月以内に、患者の3分の1以上が更なる治療介入、別の血管形成術、又はバイパス手術さえも必要となる。アテローム切除術デバイスも同様であり;前記治療を受けた患者の数が増えるにつれて、再狭窄率が10から47%に上昇している。この観点から、血管内ステントの使用も幾分期待外れとなっている。最近の研究では、挿入後数日以内に急性冠閉塞等の急性合併症を患う約5%の患者に加えて、35%の患者の再狭窄率も報告されている。
【0003】
同様の問題が、血管バイパス手術を受けた患者にも観察されている。伏在静脈、大動脈冠動脈導入移植片の平均寿命は7年のみである。当該全移植片の10%が術後数週間以内に閉塞する。1年後及び5年後には、移植片のそれぞれ20%及び35%が閉塞する。透析患者の動静脈瘻も、血液透析の効果を制限する同一の疾病に曝されている。
【0004】
例えば再狭窄のような急速に発達する動脈症の特徴としては、平滑筋細胞の盛んな増殖、及び前記細胞により生成される大量の細胞外基質の沈着がある。現在、自然のアテローム性動脈硬化症と、機械的介入後の急速に発達する動脈症の両者は、共通する最初の病理学的事象、内皮細胞の完全性及び機能の損失を共有することが明らかとなっている。
【0005】
内皮単層は、動脈壁の内側を覆い、血管の生理機能の二重のバイオレギュレーターの役割を果たしている。内皮は、循環する血液と動脈壁の間に、連続した、選択的透過性且つ抗血栓性の障壁を形成することにより、血管に構造的完全性をもたらしている。内皮は又、血流、血管緊張、閉塞性血栓症、血小板の活性化、接着及び凝集、白血球の接着、単球の浸潤、並びに平滑筋細胞の移動及び増殖を制御する生成物も産生することが次第に理解されてきている。平滑筋細胞のマイトジェンは動脈壁内の至る所に存在するため、無傷の内皮の存在が正常な血管を静止状態に維持している。内皮の損傷又は除去により、内皮によって分泌される化合物も除去され、閉塞性動脈病変をもたらす平滑筋細胞の無制限な増殖及び移動に繋がる一連の事象が開始される。
【0006】
現在、心血管疾病の治療には、冠動脈血管形成術、冠動脈ステント留置術、及びアテローム切除術等の多くの臨床的介入が使用されており、これらは非侵襲性の閉鎖的外科治療を使用して実施することができる。前記の非侵襲性血管内介入計画は同時に、同様の低侵襲性血管内様式により治療物質を血管介入部位へ送達して、結果として生じる損傷又は疾病した標的内皮を処置する必要がある。
【0007】
更に、血管内より治療物質を送達する現在の方法は、血管の管腔内面への物質の投与に依存している。しかし、循環血液との接触は活性の効力及び持続時間を制限するため、治療物質又は治療薬を管腔内面へ投与しても、損傷又は疾病した標的内皮に一過性の利益しかもたらさない。
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明の一つの目的は、損傷又は疾病した管腔内皮部位における、該部位に隣接する、又は該部位の近くにおける管腔外又は血管周囲の部位に、細胞の治療製剤を非侵襲的又は低侵襲的に送達して、血管介入又は心血管疾病に関連した閉塞性血栓症、再狭窄、内膜過形成、及びその他の臨床的続発症の発現を低減するための材料及び方法を提供することにある。
【課題を解決するための手段】
【0009】
(発明の要旨)
本発明は、移植可能な流動性組成物中、該組成物上、又は該組成物内に移植した細胞が、例えば、血管内投与、並びに血管を含むが、これに限定されない管状の解剖学的構造の管腔外面における、該外面に隣接した、又は該外面近くにおける血管周囲の沈着のような、多くの低侵襲的送達様式のために処方できるという発見を利用するものである。本明細書では、管状の解剖学的構造の外面への、該外面上への、又は該外面周囲への低侵襲送達も想定している。血管の場合、本発明の材料及び方法は、血管介入又は心血管疾病に関連した臨床的続発症の治療及び管理に適している。
【0010】
一態様では、本発明が、管状の解剖学的構造の管腔内側上の損傷又は疾病部位を処置するための流動性組成物となり、ここで該流動性組成物は、生体適合性基質及び細胞を含み、該流動性組成物は、損傷又は疾病部位を処置する上で有効な量となる。一実施形態によれば、該管状の解剖学的構造が血管となる。幾つかの実施形態によれば、該流動性組成物が、例えば幾つかの例として、損傷又は疾病部位の平滑筋細胞増殖、閉塞性血栓症、内膜過形成、再狭窄、急性若しくは慢性炎症、又は血管拡張を減少させる上で有効な量で提供される。本発明において、流動性組成物とは、針、注射器又はカテーテルを含むが、これらに限定されない注入又は注入型送達デバイスを使用した投与が可能な組成物を意味する。本明細書では、押出、駆出又は放出を使用するその他の送達デバイスも想定している。
【0011】
一実施形態によれば、該流動性組成物の細胞が、内皮細胞、又は内皮様の表現型を有する細胞となる。別の実施形態によれば、該細胞が、複数の細胞型の共培養物となる。複数の細胞型は、内皮細胞、上皮細胞、平滑筋細胞、神経芽細胞、幹細胞、内皮前駆細胞及び心筋細胞からなる群より選択される。本発明で使用する上で適した細胞の標本は、単一のドナー又は多数のドナーから得ることができる。
【0012】
別の実施形態によれば、該生体適合性基質が、ゲル、フォーム、又は懸濁液となる。更に別の実施形態では、該生体適合性基質が粒子又はマイクロキャリアを含む。特定の実施形態では、粒子又はマイクロキャリアが更に、ゼラチン、コラーゲン、フィブロネクチン、フィブリン、ラミニン又は結合ペプチドを含む。結合ペプチドの一例としては、アルギニン−グリシン−アスパラギン酸(RGD)配列のペプチドがある。別の実施形態によれば、粒子又はマイクロキャリアが、約20ミクロン〜約500ミクロン、好ましくは約200ミクロンの直径を有する。
【0013】
別の実施形態では、該流動性組成物が更に、キャリア流体を含む。特に好ましい実施形態では、該流動性組成物が形状保持性を有し、それにより開業医は、特定の沈着部位を考慮して、沈着を必要な程度に制御することができる。
【0014】
別の態様では、本発明が、管状の解剖学的構造の管腔内側上の損傷又は疾病部位の治療方法となる。本方法は、管状の解剖学的構造の管腔内側上の損傷又は疾病部位における、又は該部位に隣接する、又は該部位の近くにおける、管状の解剖学的構造の管腔外面を、流動性組成物と接触させる工程を含む。本明細書では、管腔外面とも称される非管腔面が、脈管の外側又は管周囲の表面となってもよいことが想定されている。本発明において、非管腔又は管腔外部位は、管腔の内面を除いた任意の部位である。例えば、血管の場合には、管腔外又は非管腔部位が、血管の外膜、中膜又は内膜内にあってもよく、非血管の管状の解剖学的構造の場合には、対応する非管腔部位が本発明の範囲内に含まれる。
【0015】
一実施形態によれば、管状の解剖学的構造の内壁を横断又は貫通した後、損傷若しくは疾病部位において、又は該部位に隣接して、又は該部位の近くにおいて、流動性組成物を管状の解剖学的構造の外面に沈着させることにより、送達が達成される。別の実施形態によれば、本方法が更に、管状の解剖学的構造の管腔外面上において流動性組成物を沈着させる部位を同定する工程を含む。一実施形態によれば、該同定工程が、該横断又は貫通工程の前に、又は該工程と同時に行われる。一実施形態では、該同定工程が画像化により実施される。別の実施形態では、該同定工程が触覚による腹部触診により実施される。
【0016】
一実施形態では、経皮投与により血管周囲腔に進入した後、損傷又は疾病状態において、又は該状態に隣接して、又は該状態の近くにおいて、流動性組成物を管状の解剖学的構造の外面に沈着させることにより、送達が実施される。別の実施形態によれば、本方法が更に、管状の解剖学的構造の外面において流動性組成物を沈着させる部位を同定する工程を含む。該同定工程は、該進入工程の前に、又は該工程と同時に行われてもよい。一実施形態によれば、該同定工程が画像化により実施される。別の実施形態では、該同定工程が触覚による腹部触診により実施される。
【0017】
本方法の種々の実施形態によれば、管状の解剖学的構造の外面が、本明細書の他の箇所に記載する通り、非管腔面となるか、又は血管周囲腔を占めるかの何れかとなる。好ましい一実施形態によれば、管状の解剖学的構造が血管となる。別の好ましい実施形態によれば、血管がステントを含む。更に別の好ましい実施形態では、処置した管状の解剖学的構造が、ファロピウス管を含むが、これに限定されない非血管構造となる。
例えば、本願発明は以下の項目を提供する。
(項目1)
管状の解剖学的構造の損傷又は病変部位を処置するための流動性組成物であって、該流動性組成物は、生体適合性基質及び細胞を含み、且つ損傷又は病変部位を処置する上で有効な量である、流動性組成物。
(項目2)
前記細胞が、内皮細胞、又は内皮様の表現型を有する細胞である、項目1に記載の流動性組成物。
(項目3)
前記細胞が、内皮細胞、上皮細胞、平滑筋細胞、神経芽細胞、幹細胞、内皮前駆細胞及び心筋細胞からなる群より選択される複数の細胞の共培養物である、項目1に記載の流動性組成物。
(項目4)
前記流動性組成物が形状保持性を有する、項目1に記載の流動性組成物。
(項目5)
前記生体適合性基質が粒子又はマイクロキャリアを含む、項目1に記載の流動性組成物。
(項目6)
前記粒子又はマイクロキャリアが更に、ゼラチン、コラーゲン、フィブロネクチン、フィブリン、ラミニン又は結合ペプチドを含む、項目5に記載の流動性組成物。
(項目7)
前記結合ペプチドがアルギニン−グリシン−アスパラギン酸(RGD)配列のペプチドを含む、項目6に記載の流動性組成物。
(項目8)
粒子又はマイクロキャリアが約20ミクロン〜約500ミクロンの直径を有する、項目5に記載の流動性組成物。
(項目9)
粒子又はマイクロキャリアが約200ミクロンの直径を有する、項目5に記載の流動性組成物。
(項目10)
更に細胞増殖培地を含む、項目1に記載の流動性組成物。
(項目11)
前記有効量により、損傷又は病変部位における平滑筋細胞の増殖が低減される、項目1に記載の流動性組成物。
(項目12)
前記有効量により、損傷又は病変部位における閉塞性血栓症が低減される、項目1に記載の流動性組成物。
(項目13)
前記有効量により、損傷又は病変部位における内膜過形成が低減される、項目1に記載の流動性組成物。
(項目14)
前記有効量により、損傷又は病変部位における狭窄又は再狭窄が低減される、項目1に記載の流動性組成物。
(項目15)
前記有効量により、損傷又は病変部位における急性炎症が低減される、項目1に記載の流動性組成物。
(項目16)
前記有効量により、損傷又は病変部位における慢性炎症が低減される、項目1に記載の流動性組成物。
(項目17)
前記有効量により、損傷又は病変部位における血管拡張又は血管痙攣が低減される、項目1に記載の流動性組成物。
(項目18)
前記管状の解剖学的構造が血管である、項目1に記載の流動性組成物。
(項目19)
管状の解剖学的構造の損傷又は病変部位を処置する方法であって、
該管状の解剖学的構造の損傷若しくは病変部位において、又は該部位に隣接して、又は該部位の近くにおいて、該管状の解剖学的構造の管腔外面と流動性組成物とを接触させる工程を含み、ここで該組成物は生体適合性基質及び細胞を含み、該流動性組成物が損傷又は病変部位を処置する上で有効な量である、方法。
(項目20)
前記管状の解剖学的構造の内壁を横断又は貫通した後、損傷若しくは病変部位において、又は該部位に隣接して、又は該部位の近くにおいて、流動性組成物を該管状の解剖学的構造の外面に沈着させることにより、沈着が達成される、項目19に記載の方法。
(項目21)
更に、前記管状の解剖学的構造の外面において流動性組成物を沈着させる部位を同定する工程を含む、項目20に記載の方法。
(項目22)
前記同定工程が、前記横断又は貫通工程の前に、又は横断又は貫通工程と同時に行われる、項目21に記載の方法。
(項目23)
前記同定工程が画像化により達成される、項目21に記載の方法。
(項目24)
前記同定工程が触覚による腹部触診により達成される、項目21に記載の方法。
(項目25)
経皮投与により血管周囲腔に進入させた後、損傷若しくは病変部位において、又は該部位に隣接して、又は該部位の近くにおいて、前記流動性組成物を前記管状の解剖学的構造の外面に沈着させることにより、前記接触工程が達成される、項目19に記載の方法。
(項目26)
更に、前記管状の解剖学的構造の外面において流動性組成物を沈着させる部位を同定する工程を含む、項目25に記載の方法。
(項目27)
前記同定工程が、前記進入工程の前にか、又は進入工程と同時に行われる、項目26に記載の方法。
(項目28)
前記同定工程は画像化により達成される、項目26に記載の方法。
(項目29)
前記同定工程が触覚による腹部触診により達成される、項目26に記載の方法。
(項目30)
前記管状の解剖学的構造の外面が非管腔面である、項目19に記載の方法。
(項目31)
前記管状の解剖学的構造の外面が血管周囲腔を占める、項目19に記載の方法。
(項目32)
前記管状の解剖学的構造が血管である、項目19に記載の方法。
(項目33)
前記血管がステントを含む、項目32に記載の方法。
(項目34)
前記損傷又は病変部位がステントの近くに存在する、項目33に記載の方法。
(項目35)
前記有効量により、損傷又は病変部位における平滑筋細胞の増殖が低減される、項目19に記載の方法。
(項目36)
前記有効量により、損傷又は病変部位における閉塞性血栓症が低減される、項目19に記載の方法。
(項目37)
前記有効量により、損傷又は病変部位における内膜過形成が低減される、項目19に記載の方法。
(項目38)
前記有効量により、損傷又は病変部位における狭窄又は再狭窄が低減される、項目19に記載の方法。
(項目39)
前記有効量により、損傷又は病変部位における急性炎症が低減される、項目19に記載の方法。
(項目40)
前記有効量により、損傷又は病変部位における慢性炎症が低減される、項目19に記載の方法。
(項目41)
前記有効量により、損傷又は病変部位における血管拡張又は血管痙攣が低減される、項目19に記載の方法。
(項目42)
前記管状の解剖学的構造がファロピウス管となる、項目19に記載の方法。
(項目43)
前記細胞が、コンフルエントな細胞集団;ほぼコンフルエントな細胞集団;コンフルエント後の細胞集団;及び前述の表現型の何れか一つを有する細胞集団からなる群より選択される、項目1に記載の流動性組成物。
【図面の簡単な説明】
【0018】
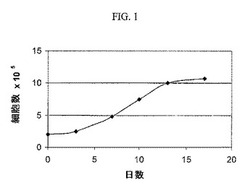
【図1】本発明の例示的実施形態に従った、代表的な細胞増殖曲線。
【発明を実施するための形態】
【0019】
本明細書で説明する通り、本発明は、細胞ベースの治療法が、血管介入又は心血管疾病に関連した臨床的続発症、特に閉塞性血栓症、再狭窄、内膜過形成、炎症及び血管拡張の進行を処置、回復、管理及び/又は低下させるために使用できるという発見に基づいている。本発明は更に、これまでに記載されていない流動性組成物、例えば微粒子製剤が、十分に生存可能な細胞のコンフルエントな集団を維持することができ、又、生体適合性基質、例えば移植可能な微粒子材料中に、該材料上に、又は該材料の内部に移植されている細胞を含む前記組成物は、移植可能な流動性組成物に移植された細胞の臨床的有効性又は生存率を低下させることなく、閉鎖的治療中に低侵襲性投与様式、例えば血管内又は局所経皮送達を使用して有効に投与することができるという更なる発見から利益を得るものである。以下に示す教示は、本発明の材料及び方法を製造及び使用する上で十分な案内を提供し、更に、適切な基準及び対象を同定して本発明の材料及び方法の性能を試験、測定及び監視する上で十分な案内を提供する。
【0020】
従って、血管介入又は心血管疾病を臨床的に管理する細胞ベースの治療法が開発されている。本発明の例示的実施形態は、本明細書に記載の処置範例と共に使用する上で適した生体適合性基質及び細胞を含む。具体的に、好ましい一実施形態では、移植可能な流動性組成物が、生体適合性基質及び内皮細胞又は内皮様細胞を含む。別の好ましい実施形態では、移植可能な流動性組成物が、内皮細胞又は内皮様細胞、好ましくはヒト大動脈内皮細胞及び微粒子型の生体適合性基質を含む。
【0021】
本発明の移植可能な流動性組成物は、生体適合性基質上に、該基質中に、及び/又は該基質の内部に移植されている細胞を含む。「移植されている」とは、細胞が本明細書に開示される準備操作の過酷さに耐えるように、細胞対細胞の及び/又は細胞対基質の相互作用を介して確実に結合されていることを意味する。本明細書の他の箇所で説明する通り、移植可能な流動性組成物の有効な実施形態は、好ましい表現型を有する、ほぼコンフルエントな、コンフルエントな、又はコンフルエント後の細胞集団を含む。移植可能な流動性組成物の実施形態は、準備操作中に細胞を脱落する可能性があり、及び/又は特定の細胞が他の細胞のように確実に結合していない可能性があることが理解される。必要なことは、移植可能な流動性組成物が、本明細書に示す機能的又は表現型の基準を満たす細胞を含むことである。
【0022】
本発明の移植可能な流動性組成物は、組織工学の原則に基づき開発されたものであり、前述の臨床的必要性に対処する新規の手法を表す。本発明の移植可能な流動性組成物は、生体適合性基質中、該基質上、及び/又は該基質の内部に移植されている生存細胞が、生理的なフィードバック制御下において多数の細胞ベースの生成物を生理的な比率で管状の解剖学的構造に供給することができるという点で固有のものである。本明細書の他の箇所で説明する通り、移植可能な流動性組成物と共に使用する上で適した細胞は、内皮又は内皮様細胞である。前記細胞による多数の化合物の局所送達及び生理的に動的な投与は、機能的な管腔内皮を維持する役割を果たすプロセスをより効果的に調節する。重要な点として、例えば、本発明の移植可能な流動性組成物中の内皮細胞は、非管腔又は管腔外部位における該組成物の好ましい配置により、血管内腔の浸食性の血流から保護される。
【0023】
本発明の移植可能な流動性組成物は、損傷又は疾病した標的管腔において、該管腔に隣接して、又は該管腔の近くにおいて、管腔外又は非管腔部位により包囲、沈着、又は別様に接触されると、恒常性を再確立するよう作用する。即ち、本発明の移植可能な流動性組成物は、管腔外に投与されると、支持的な生理機能を模倣する環境を提供することができ、機能的な内腔を促進する上での助けとなる。本明細書で想定されるように、管状の解剖学的構造は、管腔内面及び管腔外面を有する構造である。特定の構造では、管腔内面が内皮細胞層であり;その他の特定の構造では、管腔内面が非内皮細胞層である。更に又、本発明において、管腔外面又は非管腔面は、本明細書の他の箇所に記載するように、管状の構造の外面となってもよいが、これに限定されない。
【0024】
例えば、内皮細胞は様々な薬剤を放出することができ、該薬剤は、組み合わせることで、血管介入又は心血管疾病後の急性合併症に関連した不都合な生理学的事象を抑制又は軽減することができる。本明細書に例示するように、正常な生理機能及び投与を再現する組成物及び使用方法は、内皮の機能性を向上する上で、並びに当該管腔内皮の長期間の開存性を促進する上で有用である。一般的に、処置には、本発明の移植可能な流動性組成物を、例えば、対象の血管系の管腔の外側の血管周囲腔において、損傷又は疾病した標的内皮において、該内皮に隣接して、又は該内皮の近くにおいて沈着させることが含まれる。損傷、外傷又は病変した血管に沈着又は別様に接触させると、移植可能な流動性組成物の細胞は、増殖調節化合物を対象の血管系に、例えば血管内の根底にある平滑筋細胞に提供することができる。血管外に存在すると、本発明の移植可能な流動性組成物は、細胞からの多数の調節化合物を効果的に供給する一方で、血管の内腔内の血流の機械的効果から保護される。
【0025】
本発明の好ましい実施形態による損傷又は疾病血管の処置は、正常な又はほぼ正常な治癒及び正常な生理機能を促進することができる。対照的に、本発明の好ましい実施形態による処置が不在の場合は、正常な生理的治癒が損なわれ、例えば、自然の内皮細胞及び平滑筋細胞は、血管介入又は心血管疾病後に、過剰な又は無制御な速度で異常に増殖する可能性がある。従って、本明細書で想定されるように、本発明の移植可能な流動性組成物を使用した処置は、例えば正常な又はほぼ正常な血管開存性を維持する上で十分なように、血管介入又は心血管疾病部位において自然の組織を正常に又はほぼ正常に治癒すると思われる。
【0026】
本発明の移植可能な流動性組成物は、処置する血管系において多様な形状で配置することができる。血管は全体又は部分的に接触させることができ;例えば、本発明の移植可能な流動性組成物は、血管の周囲に又は弧の形状で適用することができる。血管は、血管系の機能を改善する上で十分な量の移植可能な流動性組成物とのみ接触させる必要がある。
【0027】
本発明において、「接触」とは、本明細書の他の箇所で定義される管腔外面又は非管腔面と直接又は間接的に相互作用することを意味する。特定の好ましい実施形態では、実際の物理的接触が有効性に必要でないが、その他の実施形態では、実際の物理的接触が好ましい。本発明の実施に必要なことは、損傷又は疾病部位において、該部位に隣接して、又は該部位の近くにおいて移植可能な材料を、損傷又は病変部位の処置に有効な量で管腔外又は非管腔に沈着することである。特定の疾病又は損傷では、疾病又は損傷部位が管腔内面に臨床的に発現する可能性があり、その他の疾病又は損傷では、疾病又は損傷部位が管腔外面又は非管腔面上に臨床的に発現する可能性がある。幾つかの疾病又は損傷では、疾病又は損傷部位が、管腔内面及び管腔外面又は非管腔面の両方上に臨床的に発現する可能性がある。本発明は、前述の何れの臨床的発現の処置にも有効である。
【0028】
本発明の移植可能な流動性組成物の実施形態は、介入的治療法を必要とする任意の管状の解剖学的構造に適用して、恒常性を維持することができる。本明細書で想定されるように、管状の解剖学的構造は、管腔内面及び管腔外面又は非管腔面を有する構造である。本発明において、管腔外面は、管状構造の外面となってもよいが、これに限定されない。特定の管状構造では、管腔内面が内皮細胞層であり;その他の特定の他の構造では、管腔内面が非内皮細胞層である。本発明は、内皮で覆われた又は内皮で覆われていない管状構造の処置に有効である。
【0029】
管状の解剖学的構造には、血管系、生殖器系、泌尿生殖器系、胃腸系、肺系、呼吸器系、並びに脳及び脊髄の脳室系の構造が含まれる。管状の解剖学的構造の代表的な例には、動脈及び静脈、涙管、気管、気管支、気管支梢、鼻腔(洞を含む)及びその他の気道、耳管、外耳道、口腔、食道、胃、十二指腸、小腸、大腸、胆管、尿管、膀胱、尿道、ファロピウス管、子宮、膣及び女性生殖器管のその他の通路、精管及び男性生殖器管のその他の通路、血管鞘、並びに脳及び脊髄の脳室系(脳脊髄液)が含まれる。本発明において、管状の解剖学的構造は、自然発生のものもあれば、例えば、外科的に形成された吻合等のように非自然発生のものもある。
【0030】
損傷又は病変した内皮: 特定の好ましい実施形態では、本発明による処置が可能な血管損傷をもたらす血管介入には、血管形成術、アテローム切除術、並びに金属製ステント及び薬剤溶出ステントを含む血管ステント留置術、並びに動脈バイパス術及び末梢バイパス術を含む血管バイパス術、臓器移植、並びに動静脈瘻及びその他の血管吻合形成、動静脈、並びに末梢及びその他のグラフト形成、並びに透析又はその他の介入的治療法のために血管へアクセスする際に生じる針の突き刺し等の、血管へのアクセスに関連したその後の損傷が含まれるが、これらに限定されない。何れの介入でも、血管管腔の内皮細胞層にある程度の損傷をもたらす。次に、損傷した血管管腔は、閉塞性血栓症、再狭窄、内膜過形成、急性及び慢性炎症、平滑筋細胞の増殖、血管再構築、血管拡張及び不安定プラーク病変の形成を含むが、これらに限定されない臨床的に識別可能な多様な続発症を引き起こす、生化学的事象のカスケードを経験する。
【0031】
血栓症又は閉塞性血栓症は、血小板の接着、凝集及び組織化に関連し、閉塞性血栓症は一般的に、組織化した血栓に関連する。血栓症は、血栓が形成された領域内における血流の損失により特徴付けられる。内皮又は内皮様細胞は、ヘパラン硫酸プロテオグリカン、プロスタサイクリン及び一酸化窒素を含むが、これらに限定されない抗血栓化合物を放出する。本発明の移植可能な流動性組成物による処置によって、処置血管の開存性が改善される。
【0032】
狭窄、再狭窄、内膜過形成、及び平滑筋細胞の増殖は、管腔内への平滑筋細胞の盛んな増殖に関連した血管内腔の閉塞性の病変により特徴付けられる。内皮又は内皮様細胞は、平滑筋細胞の増殖を抑制する化合物を管腔領域内に放出する。内皮又は内皮様細胞により産生される代表的な治療用化合物には、ヘパラン硫酸、TGFβ及び一酸化窒素が含まれるが、これらに限定されない。狭窄、再狭窄、内膜過形成、及び平滑筋細胞の増殖は、例えば、血管造影、血管内超音波又はその他の超音波技法により同定される。本発明の移植可能な流動性組成物による処置は、狭窄の割合、即ち、閉塞の程度を低下させ、及び/又は処置血管に関連した開存性を改善する。
【0033】
炎症は、顆粒球、好中球、単球、マクロファージ及びリンパ球を含むが、これらに限定されない炎症性細胞の動員、接着及び浸潤に関連する。更に、血管透過性の増大によって、損傷部位に隣接する組織における流体、免疫グロブリン、補体及びその他の血液タンパク質の局所蓄積を生じ、これらが次に、接着分子の発現を誘導する。前記接着分子は、循環する単球及び好中球の表面に結合して、前記食細胞が管腔面を横断して隣接する組織内へ移動することができる速度を大きく増進する。活性化により、前記細胞は、加水分解酵素、サイトカイン、ケモカイン及び増殖因子を放出することができる。炎症の進行した慢性段階では、損傷部位が、脂質及び壊死組織のコアを覆う線維のキャップで覆われている。内皮又は内皮様細胞は、炎症応答を低下させる抗炎症化合物を管腔領域内に放出する。本発明の移植可能な流動性組成物による治療は、炎症性細胞の活性及び/又は蓄積を抑制して、増殖因子の産生及び分泌を低下させ、マクロファージの局所血管浸潤を低下させて、血管損傷部位における急性炎症反応を防止、低減又は回復することができる。急性炎症反応の回復又は防止により、慢性炎症を招く事象が妨害され、それにより最終的な管腔の損傷、及び/又は血管機能不全が最小限に低減される。更に、慢性炎症組織の回復又はリハビリテーションにより、例えば、不安定プラーク又はアテローム性動脈硬化症を含むが、これらに限定されない血管疾病のような、長期の危険性が発生する危険性を低減することができる。不安定プラーク及びアテローム性動脈硬化症を含むが、これらに限定されない血管疾病の更なる考察は、本明細書と同一日に出願され、全内容が参考として本明細書に組み入れられる、(代理人整理番号ELV−008PCとしても周知の)同時係属出願PCT/US_______に開示されている。
【0034】
更に、本発明による治療が可能な自然発生の心血管疾病には、幾つかの例を挙げると、急性及び慢性炎症、閉塞性血栓症、内膜過形成、再狭窄、平滑筋細胞の増殖、血管拡張、負の血管形成、血管構造の管腔内の不安定プラーク病変、及び種々の不安定動脈症候群が含まれるが、これらに限定されない。本発明により治療可能な更なる脆弱な血管状態には、血液供給が需要に対して不十分な任意の虚血、低酸素又は損傷状態が含まれる。脆弱な血管状態は、血液供給に負の影響を与える任意の損傷又は修復から生じる可能性がある。代表的な脆弱性には、幾つかの例を挙げると、不安定動脈症候群、例えば虚血、運動により誘導される狭心症から安静時の狭心症にわたる不安定性の範囲を含む心臓の不安定狭心症、大動脈虚血、間欠性跛行から壊疽にわたる広範な状態を含む末梢虚血、腸内の腸管虚血、及び腎虚血が含まれる。
【0035】
本発明の特定の実施形態では、損傷又は疾病した標的内皮が、本発明の移植可能な流動性組成物により、最初の血管介入、例えば、血管形成術、ステント留置術又は吻合形成時に処置される。当該処置により、該血管介入に起因する損傷、例えば、血管形成術に起因する内皮剥離を低減することができる。他の実施形態によれば、移植可能な流動性組成物が、例えば、血管介入の後、並びに再狭窄又は閉塞性血栓症を含むが、これらに限定されない、介入に関連した臨床的動脈症の発現の後に、損傷又は疾病した標的内皮を救助するために投与される。
【0036】
本発明の特定の実施形態では、移植可能な流動性組成物の投与前、投与と同時、及び/又は投与後に、更なる治療薬が投与される。例えば、血塊形成、血小板凝集、又はその他の同様の妨害物を防止するか又は減少させる薬剤を投与することができる。代表的な薬剤には、例えば、ヘパラン硫酸及びTGF−βが含まれる。移植片の適応に応じて、再内皮化を促進するVEGF、及び血管統合を促進するb−FGFを含めたその他のサイトカイン又は増殖因子も、移植可能な流動性組成物に組み込むことができる。他の種類の治療薬には、抗増殖薬及び抗悪性腫瘍薬が含まれるが、これらに限定されない。例としては、ラパマイシン、パクリタキセル及びE2Fデコイ薬が含まれる。前述の何れも局所又は全身に投与することができるが、局所投与の場合は、移植可能な流動性組成物中に特定の薬剤が含有されてもよい。
【0037】
細胞源:本明細書で説明するように、本発明の移植可能な材料は、細胞を含む。細胞は、同種異形細胞、異種細胞、または自己細胞とすることができる。特定の実施形態においては、生体細胞株は、適切なドナーから導出することができる。特定の他の実施形態においては、細胞株は、死体からまたは細胞バンクから導出することができる。
【0038】
1つの現在好適な実施形態においては、細胞は、内皮細胞である。特に好適な実施形態においては、当該内皮細胞は、血管組織、好ましくは、動脈組織(であるが、これに限定されない)から取得することができる。以下に例示するように、使用に適切な1つの種類の血管内皮細胞は、大動脈内皮細胞である。使用に適切な別の種類の血管内皮細胞は、臍帯静脈内皮細胞である。また、使用に適切な別の種類の血管内皮細胞は、冠動脈内皮細胞である。更に、本発明との使用に適切な別の種類の血管内皮細胞としては、肺動脈内皮細胞、腸骨動脈内皮細胞がある。
【0039】
別の現在好適な実施形態においては、適切な内皮細胞は、非血管組織から取得することができる。非血管組織は、本明細書の他の部分で説明するような任意の管状解剖学的構造体から導出することができるか、または、任意の非血管組織前駆細胞または器官から導出することができる。
【0040】
更に別の実施形態においては、内皮細胞は、血管内皮前駆細胞または幹細胞から導出することができ、尚も別の実施形態においては、内皮細胞は一般的に、前駆細胞または幹細胞から導出することができる。他の好適な実施形態においては、細胞は、血管組織または非血管組織または器官から導出される、非内皮の同種異形細胞、異種細胞、自己細胞とすることができる。また、本発明は、遺伝子学的に変更、改変、または加工される前出細胞のいずれも企図している。
【0041】
更なる実施形態においては、本発明の組成物を形成するために2つまたはそれ以上の種類の細胞が共培養される。例えば、第1の細胞を生体適合性移植可能な材料に導入して、融合するまで培養することができる。第1の細胞型としては、平滑筋細胞、線維芽細胞、幹細胞、内皮前駆細胞、平滑筋細胞と線維芽細胞の組み合わせ、任意の他の所望の細胞型、または、内皮細胞成長を助長する環境の創出に適切な所望の細胞型の組み合わせを挙げることができる。第1の細胞型が融合に到達すると、第2の細胞型が、生体適合性基質内、生体適合性基質上、または生体適合性基質の範囲内で第1の融合細胞型上に播種され、第1の細胞型と第2の細胞型が融合に到達するまで培養される。第2の細胞型としては、例えば、内皮細胞または任意の他の所望の細胞型または細胞型の組み合わせを挙げることができる。第1及び第2の細胞型を段階的に、または、単一の混合体として導入することができることが企図されている。また、平滑筋細胞と内皮細胞の比率を変えるために細胞密度を改変することができることが企図されている。
【0042】
平滑筋細胞または過度の増殖になりやすい別の細胞型の過剰増殖を防止するために、培養法を改変することができる。例えば、第1の細胞型の融合後、培養体に、第2の細胞型導入前に第2の細胞型に適切な付着因子を被覆することができる。例示的な付着因子としては、内皮細胞の付着を向上させるために行われるゼラチンでの培養体の被覆がある。別の実施形態によれば、第2の細胞型培養中にヘパリンを培地に添加して、第1の細胞型の増殖を低減し、かつ、所望の第1の細胞型と第2の細胞型の比率を最適化することができる。例えば、平滑筋細胞の初期成長後、ヘパリンを投与して、平滑筋細胞の成長を抑制して、より大きな内皮細胞と平滑筋細胞の比率を達成することができる。
【0043】
好適な実施形態においては、共培養体の形成は、まず、生体適合性移植可能な材料に平滑筋細胞を播種して血管構造体を形成することによって行われる。平滑筋細胞が融合に到達すると、移植可能な材料上の培養平滑筋細胞上に内皮細胞を播種して、擬似血管を形成する。本明細書で説明する方法に従ってこの実施形態を、例えば、AV移植片または末梢バイパス移植片に投与すると、プロテーゼ移植片材料の整合を促進することができる。
【0044】
本発明の組成物の細胞に必要なのは、1つまたはそれ以上の好適な表現型または機能特性を示すことである。本明細書で先述したように、本発明は、好適な基質(本明細書の他の部分で説明)と関連づけられたときに容易に特定可能な表現型を有する細胞は、動静脈瘻または動静脈移植片などの血管アクセス構造体の処置に関連した血管内皮細胞の生理機能および内腔ホメオスタシス、もしくは血管内皮細胞の生理機能または内腔ホメオスタシスを助長し、回復し、かつ、他の方法で調節するか、もしくは、助長するか、回復するか、かつ、他の方法で調節することができるという発見事項に基づくものである。
【0045】
本発明の目的上、本発明の細胞の特色を示す1つの当該好適な、容易に特定可能な表現型は、以下で説明する体外分析で判断されるような平滑筋細胞の増殖を抑制するかまたは他の方法で妨げることができる点である。これは、本明細書では抑制性表現型という。
【0046】
本発明の組成物の細胞によって示される別の容易に特定可能な表現型は、抗血栓性であるか、または、血小板付着または凝集を抑制することができるという点である。抗血栓性作用は、以下で説明する体外ヘパラン硫酸分析および体外血小板凝集分析、もしくは体外ヘパラン硫酸分析または体外血小板凝集分析で判断することができる。
【0047】
本発明の一般的な具体実施形態においては、細胞は、前出の表現型のうち、2つ以上を示さなくてもよい。特定の実施形態においては、細胞は、前出の表現型のうち、2つ以上を示すことができる。
【0048】
前出の表現型は、各々、血管内皮細胞(であるがこれに限定されない)など、機能的内皮細胞の典型であるが、上記の表現型を示す非内皮細胞は、本発明の目的上、内皮的であり、したがって、本発明との使用に適切であると考えられる。内皮的である細胞は、本明細書では、内皮細胞の機能的類似体または内皮細胞の機能的模倣体ともいう。したがって、一例のみとして、本明細書で開示する材料および方法との使用に適切な細胞としては、内皮的細胞を生じる幹細胞または前駆細胞、元は非内皮細胞であるが本明細書で定めるパラメータを使用して機能的に内皮細胞的に機能する細胞、本明細書で定めるパラメータを使用して内皮的な機能性を有するように加工または他の方法で改変される任意の起源の細胞がある。
【0049】
一般的に、本発明の細胞は、融合、近融合、または融合後の集団内にあってかつ本明細書の別の部分で説明するものなどの好適な生体適合性基質と関連づけられたときに前出の表現型の1つまたはそれ以上を示す。当業者によって認識されるように、細胞の融合、近融合、または融合後の集団は、様々な手法によって容易に特定可能であり、様々な手法のうち最も一般的でありかつ広く容認されているものは、直接鏡検である。その他には、血球計または自動血球計数装置など(であるがこれらの限定されない)の標準細胞数算定法を用いて細胞数/表面積の評価がある。
【0050】
更に、本発明の目的上、内皮的細胞としては、本明細書で定めるパラメータによって判断されるような融合、近融合、または融合後の内皮細胞を機能的および表現型的にエミュレートする、または模倣する細胞があるが、これらに限定されない。
【0051】
したがって、以下に定める詳細な説明および手引きを用いて、当業者である施術者は、本明細書で開示する移植可能な材料の具体実施形態を形成、使用、試験、および特定する方法を認識するであろう。即ち、本明細書で提示する教示内容では、本発明の移植可能な材料の形成および使用に必要な全てが開示されている。また、更に、本明細書で提示する教示内容では、動作面で均等な細胞含有組成物の特定、形成および使用に必要な全てが開示されている。根本的には、必要なのは、均等な細胞含有組成物が本明細書で開示する方法に従って血管アクセス構造体を処置するのに有効であることである。熟練施術者によって理解されるように、本発明の組成物の均等な実施形態は、本明細書で提示する教示内容と共に通常の実験のみを用いて特定することができる。
【0052】
特定の好適な実施形態においては、本発明の移植可能な材料で使用される内皮細胞は、ヒトの死体ドナーの大動脈から単離される。細胞の各ロットは、内皮細胞清潔度、生物学的機能、細菌、カビ、公知のヒト病原体および他の偶発性物質の存在について広範囲に試験された単一のまたは複数のドナーから導出される。細胞は、生体適合性移植可能な材料におけるその後の形成に備えて、培養におけるその後の伸長に向けて周知の手法を用いて凍結保存されて貯蔵される。
【0053】
細胞調製:上述したように、適切な細胞は、様々な組織型および細胞型から取得することができる。特定の好適な実施形態においては、本移植可能な材料において使用されるヒト大動脈内皮細胞は、死体ドナーの大動脈から単離される。他の実施形態においては、ブタ大動脈内皮細胞(Cell Applications、カリフォルニア州サンディエゴ)は、ヒト大動脈内皮細胞の単離に使用されるのと類似の手順によって正常なブタ大動脈から単離される。細胞の各ロットは、内皮細胞生存力、清潔度、生物学的機能、マイコプラズマ、細菌、カビ、酵母、公知のヒト病原体および他の偶発性物質の存在について広範囲に試験された単一のまたは複数のドナーから導出される。細胞は更に、培養におけるその後の伸長に向けて、および、生体適合性移植可能な材料におけるその後の調製に向けて、周知の手法を用いて、伸長され、特徴づけられて、3回から6回の通過で作業用細胞バンクを調製するために凍結保存される。
【0054】
ヒトまたはブタ大動脈内皮細胞の調製は、フラスコ当たり約15mlの内皮細胞成長培地の添加で予め準備されたT−75フラスコ内で行われる。ヒト大動脈内皮細胞は、Endothelial Growth Media(EGM−2、Cambrex Biosciences、ニュージャージ州イーストラザーフォード)で調製される。EGM−2は、2%FBSを含むEGM−2 Singlequotsで補足されたEndothelial Cell Basal Media(EBM−2、Cambrex Biosciences)からなる。ブタ細胞は、5% FBSと50μg/mlゲンタミシンとで補足されたEBM−2で調製される。フラスコを、約37℃、5%CO2/95%空気、90%湿度にて維持された培養器内に30分間設置する。細胞の1つまたは2つのバイアルを−160℃から−140℃の冷凍装置から取り出して、約37℃で解凍する。各バイアルの解凍した細胞を2つのT−75フラスコ内に約3x103細胞/cm3、好ましくは1.0x103を上回るが7.0x103を下回る密度で播種して、細胞が入ったフラスコを培養器に戻す。約8時間から24時間後、使用済み培地を取り出して新しい培地と交換する。培地は、細胞が約85%から100%の融合、好ましくは、60%を上回るが100%を上回らない融合に到達するまで、2日から3日毎に変える。移植可能な材料が臨床的用途を目的としたとしたものであるとき、抗生物質なしの培地のみが、ヒト大動脈内皮細胞の解凍後の培養体内で、かつ、本発明の移植可能な材料の製造において使用される。
【0055】
その後、内皮細胞成長培地を取り出して、細胞の単層を10mlのHEPES緩衝食塩水(HEPES)で洗浄処理する。HEPESを取り除いて、2mlのトリプシンを加えて、細胞をT−75フラスコから脱離させる。脱離が行われたら、3mlのトリプシン中和液(TNS)を加えて酵素反応を停止させる。更に、5mlのHEPESを加えて、血球計を使用して細胞数を数える。細胞浮遊を遠心分離処理して、ヒト細胞の場合には、抗生物質なしでEGM−2を使用して約1.75x106個のセル、ブタ細胞の場合には、5%FBSと50μg/mlゲンタミシンで補足されたEBM−2を使用して約1.50x106個の細胞/mlの密度に調整する。
【0056】
生体適合性基質: 本発明によれば、移植可能な流動性組成物の好ましい一実施形態が、ゲル、フォーム、懸濁液、マイクロキャリア、マイクロカプセル、流動性線維構造、又はその他の流動性材料の形態の生体適合性基質を含む。該生体適合性基質は、細胞の増殖、並びに基質に対する、基質上の又は基質内部における結合に許容性がある。該生体適合性基質は、例えば血管の外面に移植されると、生物浸食する約7〜90日間、好ましくは少なくとも約7〜14日間、より好ましくは少なくとも約14〜28日間、最も好ましくは少なくとも約28〜90日間移植部位に留まることができる。
【0057】
本発明において、流動性組成物とは、針、注射器又はカテーテルを含むが、これらに限定されない注入又は注入型の送達デバイスを使用した投与が可能な組成物を意味する。押出、放出又は駆出を使用するその他の送達デバイスも、本発明で想定される。血管内部の長さに沿って誘導される血管内投与、又は局所経皮投与の何れかが可能な注入型送達デバイスと共に使用する生体適合性基質の任意の非固体製剤が、本明細書で想定される。好ましい流動性組成物は、形状保持性を有する。本明細書で想定される、流動性微粒子基質に移植された細胞を含む移植可能な流動性組成物は、内径が22ゲージ〜26ゲージの範囲の針、長さが約1〜20mmの範囲の針を含む任意の注入用送達デバイスと共に使用するよう処方される。好ましい注入用送達デバイスは、培地約1〜約3ml中に約100万細胞を含有する移植可能な微粒子材料約50mgを送達することができる。
【0058】
本発明の目下好ましい実施形態によれば、該流動性組成物が、生体適合性微粒子基質、例えば豚皮膚ゼラチン由来の製品であるGelfoamO粒子、GelfoamO粉末、又は微粉砕GelfoamO(Pfizer Inc.[米国ニューヨーク州ニューヨーク])(以下「Gelfoam粒子」と称する)を含む。別の実施形態によれば、該生体適合性微粒子材料が、架橋したデキストラン基質に結合した変性コラーゲンを含むCytodex−3(Amersham Biosciences[米国ニュージャージー州ピスカタウェイ])マイクロキャリアとなる。代替の実施形態によれば、生体適合性の移植可能な微粒子基質が、修飾アルギネート粒子;加水分解により分解される合成ポリマーのような生体適合性ポリマー、例えば、ポリ酢酸、ポリグリコール酸及びそのコポリマーのようなポリヒドロキシ酸;ポリオルトエステル;ポリ無水物;ゼラチン、コラーゲン、フィブリンゲルのようなタンパク質;又はセルロース及びセルロース誘導体、キトサン、アルギネート若しくはその組み合わせのような炭水化物若しくは多糖類を含む。生体適合性基質は、流動性組成物の投与後数日間、数週間又は数ヶ月の間に徐々に消失することができる材料である。分解の速度は、選択する生体適合性基質に依存しており、処置及び臨床的状況の性質に基づき変更することができる。
【0059】
別の実施形態によれば、移植可能な微粒子基質が、変更した微粒子基質となってもよい。移植可能な微粒子基質の変更は、細胞が移植可能な微粒子基質と結合する場合、前述のような細胞の表現型(例えば、抑制表現型)を含む細胞機能を最適化及び/又は調節するように選択することができる。一実施形態によれば、移植可能な微粒子基質の変更に、平滑筋細胞の増殖を抑制し、炎症を低下させ、ヘパラン硫酸産生を増大させ、プロスタサイクリン産生を増大させ、及び/又はTGF−β1産生を増大させる細胞の能力を向上させる付着因子又は接着ペプチドで粒子を被覆することが含まれる。代表的な付着因子には、例えば、フィブロネクチン、フィブリンゲル、及び標準的な水性カルボジイミド化学構造を使用する共有結合した細胞接着リガンド(例えばRGDを含む)が含まれる。更なる細胞接着リガンドには、RGDY、REDVY、GRGDF、GPDSGR、GRGDY及びREDVを含むが、これらに限定されない細胞接着認識配列を有するペプチドが含まれる。
【0060】
別の実施形態によれば、移植可能な微粒子基質が、Gelfoam以外の粒子となる。更なる代表的な微粒子基質には、例えば、フィブリンゲル、アルギネート、硫酸ポリスチレンナトリウムマイクロキャリア、コラーゲン被覆デキストランマイクロキャリア、PLA/PGA及びpHEMA/MMAコポリマー(各コポリマーのポリマー比率は1〜100%の範囲)が含まれる。好ましい実施形態によれば、前記の更なる微粒子基質が、上に列挙及び記載するような付着因子又は接着ペプチドを含むよう変更される。代表的な付着因子には、例えば、ゼラチン、コラーゲン、フィブロネクチン、フィブリンゲル、及び標準的な水性カルボジイミド化学構造を使用する共有結合した細胞接着リガンド(RGDを含む)が含まれる。更なる細胞接着リガンドには、RGDY、REDVY、GRGDF、GPDSGR、GRGDY及びREDVを含むが、これらに限定されない細胞接着認識配列を有するペプチドが含まれる。
【0061】
別の実施形態によれば、移植可能な微粒子基質が、細胞付着を改善するために物理的に変更されている。一実施形態によれば、移植可能な微粒子基質が、その機械的特性を向上させ、且つ細胞付着及び増殖特性を改善するために架橋されている。好ましい実施形態によれば、最初に硫酸カルシウムを使用してアルギネート粒子が架橋され、続いて塩化カルシウム及び日常的なプロトコールを使用した第二の架橋工程が行われる。別の実施形態によれば、ヘパリン又はヘパラン硫酸源、例えばヘパリン−セファロースが、細胞培養前に基質内に組み込まれる。
【0062】
生体適合性微粒子基質を含む移植可能な流動性組成物は、好ましくは22ゲージ〜26ゲージの内径を有する針を使用して送達できることが想定される。従って、当該基質を形成する粒子は、好ましくは、本明細書に定義するような適切な針の穴を通過することができる直径を有する。好ましい実施形態によれば、当該基質の粒子が、約20μm〜約1000μmの直径、好ましくは約100μm〜約500μmの直径、最も好ましくは約200μmの直径を有する。
【0063】
好ましい微粒子基質の各粒子は、その表面に接着した少なくとも一つの細胞、好ましくは複数の細胞を有する必要がある。従って、各粒子は、選択された細胞型の展開直径よりも大きい直径を有する必要がある。例えば、内皮細胞は、約18μmの展開直径を有する;粒子への複数の内皮細胞の付着を促進するために、各粒子は少なくとも20μmの直径を有する必要がある。
【0064】
好ましい培養管: 本明細書で想定される特定の実施形態では、約50〜60mgのGelfoam粒子が、0.2μmフィルターキャップを有する個々の50mL管(Evergreen[米国カリフォルニア州ロサンゼルス])内に配置される。培地交換時の粒子数の損失を低減するため、培養管は、例えば、キャップ領域又は培養管の内部にフィルターを加えて、培地排除時における粒子の吸引又はその他の意図されない除去を防止することによって、或いは、培養管に仕切りを加えて、培地を通過させるが粒子を通過させない流体連通手段を間に有する、培地と粒子の個別の部分を形成することによって、或いは、粒子を乱さずに開放して培地を注ぎ出すことができる吐水口を培養管の底に加えることによって、変更することができる。
【0065】
移植可能な材料の細胞播種: 細胞播種に先立ち、70%エタノールを添加した後、PBS又はHEPES中で数回漱ぐことによって粒子を調製する。次に、抗生物質を含まないEGM−2中で、約37℃及び5%CO2/95%空気にて12〜24時間粒子を再水和する。更に、粒子約50〜60mgのアリコートを再水和容器から除去して、個々の組織培養皿に入れる。粒子のアリコートを好ましい密度である粒子1mg当たり2×103〜2×104の細胞で播種する。細胞と基質の該混合物をピペットで数回上下させて、均質の懸濁液を形成する。続いて、管を、細胞の付着を促進するように定期的に3〜4時間撹拌して、37℃、5%CO2、湿度90%にてインキュベートする。次に、管毎に更に9mLのEGM−2を添加して(最終培地容積=10mL)、最終粒子容積約5mg粒子/mL培地を得る。
【0066】
その後、細胞がコンフルエンスに達するまで、培地を2〜3日に1回交換する。好ましい一実施形態では、細胞が好ましくは6代継代となるが、より少数回又はより複数回継代した細胞も使用することができる。
【0067】
細胞増殖曲線及びコンフルエンス: 移植可能な流動性組成物のサンプルを、3日目又は4日目、6日目又は7日目、9日目又は10日目、及び12日目又は13日目、又はそれらの前後に除去して、細胞を計数し、生存率を評価する。そして、増殖曲線を構成及び評価して、増殖特性を測定し、ほぼコンフルエンス、コンフルエンス、又はコンフルエンス後が達成されたか否かを判定する。豚大動脈内皮細胞移植ロットを含む移植可能な流動性組成物の調製品による代表的な増殖曲線を、図1に示す。前記例では、移植可能な材料が微粒子形態となる。一般的に、当業者は、早期、中間及び後期の時点における許容可能な細胞増殖の徴候を理解すると思われる。当該徴候には例えば、早期の時点における細胞数の増加の観察(図1を参照すると、約3〜10日目の間)、次にほぼコンフルエントな相(図1を参照すると、約10〜13日目の間)、次に、細胞がコンフルエンスに達した段階での細胞数の横ばい(図1を参照すると、約13〜15日目の間)、並びに細胞がコンフルエント後になった時の細胞数の維持(図1を参照すると、約15〜17日目の間)がある。本発明においては、少なくとも72時間横ばいの状態にある細胞集団が好ましい。
【0068】
細胞の計数は、移植可能な流動性組成物のアリコートを、Gelfoam粒子の場合は0.8mg/mlのコラゲナーゼのトリプシン−EDTA溶液により、又はCytodex−3粒子の場合はデキストラナーゼ及びトリプシン−EDTAの溶液により完全に消化することで達成される。消化された移植可能な流動性組成物の容積を測定した後、既知の容積の細胞懸濁液を0.4%トリパンブルーで希釈して(細胞対トリパンブルー比4:1)、生存率をトリパンブルーの排除により評価する。生存細胞、非生存細胞及び総細胞を、血球計を使用して計数する。生存細胞数対培地中の日数をプロットして、増殖曲線を構成する。細胞は出荷し、コンフルエンスに達した後移植する。
【0069】
本発明において、コンフルエンスとは、生体適合性粒子1mg当たり少なくとも約8×103の細胞、好ましくは50〜70mg粒子のアリコート当たり約7×105〜約1×106の総細胞の存在、並びに好ましくは少なくとも約90%であるが、約80%を下回らない生存率として定義される。細胞生存率は、好ましくは少なくとも約90%であるが、約80%を下回ることはない。細胞が12日目又は13日目までにコンフルエントにならない場合は、培地を交換し、更に一日インキュベーションを継続する。前記工程は、コンフルエンスに達するまで、又は播種後約14日間継続する。工程間検査を実施した結果、細胞がコンフルエントであると判定された場合は、最後の培地交換を実施する。前記の最後の培地交換は、フェノールレッド及び抗生物質を含まないEGM−2を使用して実施する。培地交換の直後、出荷のために管に無菌密封栓キャップを装着する。
【0070】
機能性の評価:本明細書で説明する本発明の目的上、移植可能な材料は、更に、移植前に機能性の兆候がないか試験される。例えば、ならし培地を培養期間中に回収して、培養内皮細胞によって生成される成長因子−β1(TGF−β1)、基本線維芽細胞増殖因子(b−FGF)、窒素酸化物を変換してヘパラン硫酸のレベルを確かめる。特定の好適な実施形態においては、移植可能な材料が本明細書で説明する目的に使用することができるのは、総細胞数が少なくとも約2x105個の細胞/cm3、好ましくは、可撓性平面形態の少なくとも約4x105個の細胞/cm3、生存可能細胞の割合が少なくとも約80%から90%、好ましくは≧90%、最も好ましくは少なくとも約90%、ならし培地中のヘパラン硫酸が少なくとも約0.5microg/106個の細胞/日から1.0microg/106個の細胞/日、好ましくは少なくとも約1.0microg/106個の細胞/日のときである。ならし培地中のTGF−β1は、少なくとも約200picog/ml/日から300picog/ml/日、好ましくは少なくとも約300picog/ml/日、ならし培地中のb−FGFは、約200picog/ml未満、好ましくはわずか約400picog/mlである。
【0071】
ヘパラン硫酸レベルは、通常のジメチルメチレン・ブルーコンドロイチナーゼABC分離分光光度計検定を用いて計ることができる。全硫酸化グリコサミノグリカン(GAG)レベルの判断は、回収培地中で希釈した公知の量の精製コンドロイチン硫酸を使用して生成した標準的曲線と未知の試料を比較するジメチルメチレンブルー(DMB)色素結合検定を用いて行う。DMB発色試薬の添加前にコンドロイチンおよびデルマタン硫酸を分離するようにならし培地の更なる試料をコンドロイチナーゼABCと混合させる。一般的に515nmから525nmであるGAG標準と混合させたDMB色素の最大波長吸収度にて全ての吸収度を判断する。ヘパラン硫酸/106個の細胞/日の濃度の計算は、方法としては、ならし培地試料中の全硫酸化グリコサミノグリカン濃度からコンドロイチンおよびデルマタン硫酸の濃度を差し引く。コンドロイチナーゼABC活性は、精製コンドロイチン硫酸の試料を分離することとで確認する。ならし培地試料は、分離量が精製コンドロイチン硫酸の100%未満であった場合は妥当に補正する。また、ヘパラン硫酸レベルは、単クローン抗体を採用するELISA検定を用いて計ることができる。
【0072】
TGF−β1レベルおよびb−FGFレベルは、単クローン抗体または多クローン抗体、好ましくは多クローンを採用するELISA検定を用いて計ることができる。また、調製回収培地は、ELISA検定を用いて計ることができ、試料は、調製培地に存在するTGF−β1レベルおよびb−FGFレベルについて妥当に補正することができる。
【0073】
窒素酸化物(NO)レベルは、標準的なGries反応検定を用いて計ることができる。窒素酸化物の性質が過渡的かつ揮発性であるために、大半の検出方法には不適切なものとなっている。しかしながら、窒素酸化物の2つの安定した分解生成物、硝酸塩(NO3)および亜硝酸塩(NO2)は、通常の分光法を用いて検出することができる。Gries反応検定では、硝酸還元酵素がある場合には亜硝酸塩が硝酸塩に酵素によって変換される。亜硝酸塩は、約540nmの範囲の可視光を吸収する着色アゾ染料生成物として比色分析で検出される。システム中に存在する窒素酸化物のレベルの判断は、全ての亜硝酸塩を硝酸塩に変換し、未知の試料中の亜硝酸塩の総濃度を判断し、その後、亜硝酸塩に変換された硝酸塩の公知の量を用いて生成された標準的な曲線と結果的に得られる亜硝酸塩濃度を標準的な曲線と比較することで行う。
【0074】
先述した好適な抑制表現型の評価は、上述した定量的ヘパラン硫酸検定、TGF−β1検定、NOおよびb−FGF検定、もしくはヘパラン硫酸検定、TGF−β1検定、NOまたはb−FGF検定、ならびに、以下のような平滑筋細胞成長および血栓症抑制の定量的体外検定を用いて行う。本発明の目的上、移植可能な材料は、これらの代替体外検定の1つまたはそれ以上によって移植可能な材料が好適な抑制表現型を示していると確認されたときに移植準備完了状態である。
【0075】
体外で平滑筋細胞成長の抑制を評価するために、培養内皮細胞に関連した抑制の大きさを判断する。平滑筋細胞成長培地(SmGM−2、Cambrex Bioscience)中で24穴組織培養プレート内にブタ大動脈平滑筋細胞またはヒト大動脈平滑筋細胞をまばらに播種する。細胞を24時間かけて自然付着させる。その後、48時間から72時間かけて、培地を、0.2%FBSを含む平滑筋細胞基本培地(SmBM)と入れ換えて細胞の成長を抑止する。ならし培地をコンフルエント後の内皮細胞培養液から形成し、2X SMC成長培地と1:1で希釈して、培養液に加える。平滑筋細胞成長抑制の正の制御が、各検定において含まれる。3日から4日後、コールターカウンタを使用して各試料内の細胞数を数え上げる。平滑筋細胞増殖に対するならし培地の効果の判断は、ならし培地の添加直前のウェル当たりの平滑筋細胞数を、3日から4日間ならし培地と調製培地(成長因子の有無を問わず標準的な成長培地)とに晒した後のウェル当たりの平滑筋細胞数を比較することで行う。ならし培地試料に関連した抑制の大きさを正の制御に関連した抑制の大きさと比較する。好適な実施形態によれば、移植可能な材料は、ヘパラン制御が可能である抑制の約20%をならし培地が示した場合には抑制力があるみなされる。
【0076】
体外で血栓症を評価するために、培養内皮細胞にかけたヘパラン硫酸のレベルを判断する。ヘパラン硫酸は、抗増殖性特性も抗血栓性特性も有する。通常のジメチルメチレン・ブルーコンドロイチナーゼABC分離分光光度計検定またはELISA検定を用いて(両検定は、詳細に先に説明)、106個の細胞当たりのヘパラン硫酸の濃度を計算する。ならし培地中のヘパラン硫酸が少なくとも約0.5microg/106個の細胞/日から1.0microg/106個の細胞/日、好ましくは少なくとも約1.0microg/106個の細胞/日であるとき、本明細書で説明する目的に向けて移植可能な材料を使用することができる。
【0077】
血栓症の抑制を評価する別の方法では、多血小板血漿に関連した体外にて血小板凝集能の抑制の大きさを判断する。室温でクエン酸ナトリウムをブタ血液試料に添加してブタ血漿を取得する。緩やかな速度で、遠心分離機でクエン酸塩添加血漿を分離させて、赤血球および白血球を小球状にすると、血漿中に浮遊する血小板が残る。コンフルエント後の内皮細胞培養液からならし培地を形成して、一定分量の多血小板血漿に添加する。血小板凝集剤(作用薬)を対照として血漿に添加する。血小板作用薬としては、一般に、アラキドン酸、ADP、コラーゲン、エピネフリン、リストセチン(ミズーリ州セントルイスのSigma−Aldrich Co.より販売)がある。更なる一定分量の血漿では、基線自然血小板凝集について評価するために血小板作用薬またはならし培地は添加されない。また、血小板凝集の正の制御は、各検体に含められる。血小板凝集抑制の例示的な正の制御としては、アスピリン、ヘパリン、アブシキマブ(ReoPro(登録商標)、Eli Lilly、インディアナ州インディアナポリス)、チロフィバン(Aggrastat(登録商標)、Merck & Co.、Inc.、ニュージャージ州ホワイトハウスステーション)、またはエプチフィバチド(Integrilin(登録商標)、Millennium Pharmaceuticals, Inc.、マサチューセッツ州ケンブリッジ)がある。その後、全ての試験条件の結果的に得られる血小板凝集を、血小板凝集計を使用して測定する。血小板凝集計は、光学的密度をモニタすることで血小板凝集を測定するものである。血小板が凝集するにつれて、試料を通過することができる光が増える。血小板凝集計は、「血小板凝集単位」、つまり、血小板が凝集する速度の関数での結果を知らせる。凝集能の判断は、作用薬添加後6分にて最大凝集能と評価される。血小板凝集に対するならし培地の効果は、ならし培地添加前の基線血小板凝集をならし培地を正の制御と多血小板血漿が晒された後の基線血小板凝集と比較することで行う。結果は、基線の百分率で表される。ならし培地試料に関連した抑制の大きさを正の制御に関連した抑制の大きさと比較する。好適な実施形態によれば、移植可能な材料は、ならし培地が正の制御が可能である制御の約20%を示した場合には抑制力があるとみなされる。
【0078】
輸送容器: 培地交換の直後、出荷のために移植可能な流動性組成物を包装する。一実施形態によれば、移植可能な材料上での細胞の培養に使用した同一の培養管に、出荷のために無菌密封栓キャップを装着する。最終の濯ぎ中に粒子及び/又は細胞をデカントする危険性を低減するため、出荷容器は、例えば、培養液及び濯ぎ溶液を通過させるが、粒子及び/又は細胞をデカントできない大きさの穴を有するフィルター又はその他の封入デバイスを含むように変更することができる。
【0079】
移植可能な流動性組成物が、血清を含有する培地中で出荷される場合、移植直前に、移植可能な流動性組成物を、好ましくは培養管内で濯ぐ。次に、輸送容器からフィルター又はその他の封入手段を取り外して、細胞が移植された粒子を送達のために注射器内に引き入れる。過剰な濯ぎ溶液を注射器及び針から排出し、処置部位への送達のためにカテーテル又はその他の送達デバイスを注射器に取り付ける。次に、流動性組成物を、例えば、以下に述べる代表的な投与方法の一つに従って患者に送達する。移植可能な流動性組成物が血清フリー培地中で輸送される場合、臨床の現場では最終の濯ぎ工程を実施する必要はない。
【0080】
代替の実施形態によれば、移植可能な流動性組成物が、約1〜20mlの培地と共に、即ち輸送及び保管に十分な容積の培地と共に培養管から注射器内に引き入れられ、注射器にキャップが装着されて、材料が密封した注射器内に出荷される。移植の現場において、過剰の培地は注射器から排出される。次に、針、カテーテル又はその他の送達デバイスが、処置部位への送達のために、注射器に取り付けられる。本実施形態によれば、流動性組成物が、輸送用注射器から直接、患者に送達される。
【0081】
本発明の移植可能な組成物は、例えばフィルターキャップで変更された50ml又は60mlの密封した組織培養容器、又は予め充填された注射器を含む最終製品容器内で供給されてもよく、それぞれ、好ましくは、アリコート当たり約45〜60ml、好ましくは約50mlの内皮細胞増殖培地中で、約7×105〜約1×106の総内皮細胞が移植された約50〜60mgの微粒子材料を含有する。患者当たりの総細胞負荷は、好ましくは体重1kg当たり約0.6〜12×104細胞となるが、体重1kg当たり2×103細胞を下回ることはなく、2×105細胞を超えることはない。
【0082】
本明細書で想定されるように、本発明の材料は、一実施形態において粒子1mg当たり好ましくは約1.4〜2.1×104細胞の密度で、好ましくは約90%の生存率の細胞、好ましくは血管内皮細胞を含み、又、コンフルエント又はほぼコンフルエントな時に、少なくとも約0.5〜1.0、好ましくは少なくとも約1.0microg/106細胞/日のヘパラン硫酸を含有する馴化培地を生成する。馴化培地中のTGF−β1は、少なくとも約200〜300、好ましくは少なくとも約300picog/ml/日であり;馴化培地中のb−FGFは、約200picog/ml未満、好ましくは約400picog/ml未満である。
【0083】
別の実施形態によれば、投与前に、1種以上の更なる物質が流動性組成物に添加される。当該物質には、抗炎症薬、グリコサミノグリカン、プロスタグランジン、プロスタノイド、並びにTGF及びVEGFを含むが、これらに限定されないサイトカイン、並びにアンジオテンシン及び関連する化合物、チロシンキナーゼ阻害剤、免疫抑制剤、ビタミン、グルココルチコイド、酸化防止剤、フリーラジカル捕捉剤、ペプチドホルモン、血管形成及び血管形成抑制因子が含まれるが、これらに限定されない。
【0084】
キャリア: 場合により、一実施形態によれば、移植可能な流動性組成物に、キャリア流体が含まれる。好ましいキャリア流体は、投与を容易にするための細胞増殖培地である。移植可能な流動性組成物の研究室における模擬投与では、流動性組成物を取り扱う際に細胞の完全性を保存する上でキャリアが必要ないことが示されている。本明細書に記載したような細胞製剤は、細胞の完全性を保存するために一般的に使用されるキャリア若しくはその他の薬剤;又は非固体若しくは流動性製剤の取り扱いを改善するために、及びせん断力に誘導される破壊を低減するために一般的に使用される薬剤を含まない可能性があることは、予想していない。
【0085】
しかし、キャリアは、例えば、馴化培地の排除及び新しい培地の投入時、輸送前の移植可能な流動性組成物の操作時、材料を送達用注射器に引き入れる時、及び/又は注射器から材料を排出して、血管周囲腔若しくはその他の標的部位内へ送達する時を含めた細胞培養時に、流動性組成物中で細胞のコンフルエンシー及び生存率を向上させる役割を果たす可能性がある。
【0086】
該キャリアは、細胞培養工程の間の様々な時点において、移植可能な材料に投入することができる。例えば、キャリアは、粒子の水和時(細胞播種前)、細胞播種の直前又は播種時に微粒子基質に添加される場合があり、及び/又は細胞培養工程における予定した培地交換中に徐々に微粒子基質に添加される場合がある。キャリアを早期に細胞培養に投入することによって、悪影響を受ける可能性がある細胞が脱落し、残留する細胞が増殖して、十分な細胞集団を維持することができる。
【0087】
或いは、該キャリアは、最終の培地交換中、細胞がコンフルエント又はほぼコンフルエントな時、及び移植の直前に投入してもよい。しかし、未希釈グリセロールキャリアを投与直前に添加すると、おそらく細胞にショックが加わり、所望の細胞生存率及び効力を許容可能なレベル未満に低下させるほどに、窒細胞を息死させる可能性があることが観察されている。前記の所見から、流動性組成物に高粘度のキャリア流体、例えばグリセロールを一度に添加することは、細胞に悪影響を与える可能性があり、回避すべきであることが予想される。
【0088】
その他の候補キャリア流体の効力を評価するため、高い粒子対キャリア比によって最初の試験を実施し、所望の利益を達成する上で必要なキャリアの最小量を判定する。評価する所望の利益には、例えば、細胞の生存率及び効力を維持したままでの取り扱いの改善及び組成物の流動性の改善が含まれる。更に、細胞生存率又は機能に影響を与えることなく、移植可能な組成物の平面形態を移植可能な微粒子の流動性組成物に転換する能力を試験する試験を実施する(全内容が参考として本明細書に組み入れられる、ELV−002PCとしても周知の同時係属出願PCT/USを_______を参照)。例えば、最初の試験溶液には、50mgの粒子に対して僅か約0.1〜1%のキャリア溶液が含まれる。前記濃度を、50mgの粒子に対して最大約10%のキャリア溶液になるまで徐々に増加させる。
【0089】
続く試験を実施し、該試験では、粒子の水和時又は細胞播種時から、培養の全過程を通してキャリア流体を徐々に添加し、移植可能な流動性組成物中の細胞がコンフルエンスに達し、出荷及び/又は患者への投与の準備が整うまで、移植可能な材料中のキャリア流体の濃度を、早期の細胞付着に許容される低いキャリア流体対粒子比からより高い最適比まで増大させる。例えば、代表的なプロトコールによれば、最終的な1%キャリア溶液になるまで、最初の水和時と後の各培地交換時に0.1%のキャリア溶液が微粒子材料に添加される。一部の細胞はキャリア流体の各投入時に損失するものの、殆どの細胞は、キャリアで馴化された移植可能な流動性組成物内に組み込まれ、前記環境でコンフルエンス又はほぼコンフルエンスに達するまで増殖できることが予想される。
【0090】
キャリアには、希釈したグリセロール、アルギネート(好ましくは約1%アルギネート溶液)、デキストラン又は右旋糖(好ましくは約1〜10%デキストラン又はデキストローズ溶液)、並びに例えばブドウ糖、ショ糖及び果糖等のその他の糖、澱粉(好ましくは約6%ヒドロキシエチル澱粉溶液)、ゼラチン(好ましくは約1〜2%ゼラチン溶液)、内皮細胞増殖培地、内皮細胞基礎培地、その他の細胞増殖培地又は中性の緩衝生理食塩水が含まれるが、これらに限定されない。更なる溶液の比率の範囲が想定されるが、本明細書では明確に定義していない。使用する生体適合性基質、該基質に移植される細胞型、及び送達のために選択される投与様式に一部応じた変化が予想される。例えば、最初の水和及びその後の培地交換に使用される細胞培養培地には、選択されるキャリアに応じて、約0.5容積%〜約10容積%のキャリア流体が含まれてもよい。一般的に、選択されるキャリアは、使用する投与量及び濃度にて非細胞毒性でなければならず、又、空気及び栄養物を移植可能な組成物に流入させ(細胞増殖を補助するため)、該組成物から流出させる(細胞老廃物を除去するため)上で十分な透過性を有する必要がある。
【0091】
未希釈グリセロールキャリアの細胞生存率に対する効果: 豚大動脈内皮細胞を100mgのGelfoam粒子上に播種し、コンフルエンスに達するまで増殖させた。該微粒子流動性組成物を回収して、50ml管に入れ、3mlの未希釈グリセロールのアリコートと混合した後、24、26又は27ゲージ針に取り付けた注射器に入れた。全注射器の内容物を、取り付けた針からゆっくりと排出し、50ml管に収集した。排出後に確認できた全細胞の内生存していたのは僅か0〜5%のみであり(細胞の95〜100%が死亡)、グリセロールを添加しない同一試験の細胞の86〜93%という生存率と比べると、コンフルエント細胞に単回投与にて未希釈で添加する前記キャリア液体の細胞生存率に対する有害な影響がはっきりと示されている。前記キャリア流体の使用が、細胞単層のコンフルエンスの維持に有益であるか否かについては判定されていない。
【0092】
平面材料の押出及び変更: 別の実施形態によれば、細胞が移植可能な組成物に十分移植されて、コンフルエンスに達した後、注入用送達デバイスを介して送達できる粒子を形成するように、固体、半固体又は大径の組成物が変更される。一実施形態によれば、材料変更時に細胞のコンフルエンシー及び完全性を維持するように、上で詳述する通り、キャリア流体の存在下で該細胞が培養される。
【0093】
該変更方法の一実施形態によれば、該細胞が移植可能な組成物の平面形態上でコンフルエンスに達した段階で、該組成物が注射器に移される。平面形態に適合するように、該注射器には針がなくてもよければ、穴の大きな針があってもよい。該注射器が可撓性の平面形態を吸引した後、加圧下で、該細胞移植組成物が注射器の開口部から押し出されて、非平面流動性組成物が形成される。好ましい粒子サイズを得るため、注射器からの数回の通過が必要となる場合がある。例えば、材料は、該材料が所望の粒子サイズ及び流動性に達するまで、最初に針のない注射器に通し、次に穴の大きな針に通した後、より穴の小さな針に通することができる。当該材料変更時に細胞の破損量を低減し、細胞のコンフルエンシーを維持するため、複数回の通過及び粒子サイズの漸進的変更が望ましい。
【0094】
外科シーラント: その他の特定の実施形態では、本発明の流動性組成物が更に、特に吻合術のシーラント、又は一般的に外科シーラントの役割を果たすこともできる。当該二重目的の実施形態では、該組成物が又、管状構造の外面と接触する、又は外面上の弧に適用する、又は周囲に適用する際に、複数の管状構造の接合点を封止する、又は管状構造の隙間を封止する上で有効である。当該シーラントは、例えば、血管組織を更に破損し、管腔内皮外傷の原因となる可能性がある、縫合を不要にすることができる。当該シーラントは又、吻合の近くに更なる安定性をもたらすことにより、何れの縫合修復も補強することができる。必要なことは、この二重目的の組成物のシーラントタイプの機能又は性質が、細胞の所望の表現型の同時発現、及び組成物の細胞ベースの機能を妨害せず、損なわないことである。
【0095】
特定のシーラントの実施形態おいて、該流動性組成物は、それ自体が内皮又は内皮様細胞集団を補助する上で必要不可欠な特性を有すると共に、例えばフィブリンネットワーク等のシーラント特性を有する成分を含む生体適合性基材を含む。又、生体適合性基材自体が、シーラント特性、並びに細胞集団の補助に必要な特性の両方を有してもよい。その他の実施形態の場合は、シーラントの機能性が、少なくとも部分的には細胞により寄与される可能性がある。例えば、組成物に結合した細胞は、基材が必要不可欠な細胞の機能性を示す/維持する一方で、シーラント特性を得るように、該基材を変更することができる物質を産生することが想定される。細胞によっては、前記物質を自然に産生できるものもあれば、前記物質を産生するように操作できるものもある。
【0096】
移植可能な流動性組成物の有効期間: コンフルエントな、ほぼコンフルエントな又はコンフルエント後の細胞集団を含む移植可能な流動性組成物は、室温にて安定且つ生存した状態で、少なくとも2週間保持することができる。好ましくは、当該移植可能な流動性組成物が、追加のFBSを含んでも含まなくてもよい約45〜60ml、より好ましくは約50mlの輸送培地中で保持される。輸送培地は、フェノールレッドを含まないEGM−2培地を含む。FBSは、FBS約10%又は総FBS濃度約12%になるまで、輸送培地の容積に添加することができる。しかし、FBSは、移植前に移植可能な流動性組成物から除去する必要があるため、輸送培地中に使用するFBSの量を制限して、移植前に要する濯ぎ時間を短縮することが好ましい。
【0097】
移植可能な流動性組成物の凍結保存: コンフルエントな、ほぼコンフルエントな又はコンフルエント後の細胞集団を含む移植可能な流動性組成物は、最終的な解凍時に臨床的有効性又は完全性を低下させることなく、保管及び/又は診療所への輸送のために凍結保存することができる。好ましくは、移植可能な流動性組成物が、15mlクライオバイアル(Nalgene(R)、Nalge Nunc Int’l[米国ニューヨーク州ロチェスター])内で、約10%のDMSO、約2〜8%のデキストラン及び約50〜75%のFBSを含有する約5mlのCryoStor CS−10溶液(BioLife Solutions[米国ニューヨーク州オスウィーゴ])の溶液中で凍結保存される。クライオバイアルは、冷イソプロパノール水浴内に入れて、−80℃の冷凍庫に4時間移され、その後液体窒素(−150〜−165℃)に移される。
【0098】
次に、移植可能な流動性組成物の凍結保存アリコートを、室温で約15分間かけてゆっくり解凍した後、室温の水浴内で更に約15分間解凍する。次に、該材料を約15mlの洗浄培地中で約3回洗浄する。洗浄培地は、フェノールレッドを含まず、50μg/mlゲンタマイシンを含んでも含まなくてもよいEBMを含む。最初の2回の濯ぎ工程は、室温にて約5分間実施し、最後の濯ぎ工程は、5%CO2中で37℃にて約30分間実施する。
【0099】
解凍及び濯ぎ工程の後、該凍結保存材料を約10mlの回収溶液中で約48時間静止させる。豚内皮細胞の場合は、回収溶液が、5%CO2中で37℃にて5%FBS及び50μg/mlゲンタマイシンで補充したEBM−2となる。ヒト内皮細胞の場合は、回収溶液が、抗生物質を含まないEGM−2となる。使用前及び/又は保管若しくは輸送のための包装の前に、更に解凍後の調整を少なくとも24時間実施することができる。
【0100】
送達デバイス内の充填及び取り込み: 上に詳述する通り、流動性組成物のアリコートを、血清を含んでも含まなくてもよい約45〜60ml、好ましくは約50mlの輸送培地中で、培養管又は注射器にて包装及び輸送し、細胞を培地交換せずに14日目まで保持することができる。移植に先立ち、過剰な培地をデカントし、輸送培地中に血清が存在する場合は、移植可能な流動性組成物を数回濯いで、残留する全血清を除去する。微粒子形態の移植可能な流動性組成物の特定の調製品は、分離しやすく、従って細胞コンフルエンスを損失しやすいため、該組成物は、最終の濯ぎ工程時に輸送容器内に残留させる必要がある。更に、操作時に移植可能な流動性組成物の完全性を保持するため、フィルター及び/又は別個の培地区画を含むが、これらに限定されない輸送容器に変更することが好ましい。
【0101】
移植可能な流動性組成物を数回濯いだ後、約1〜3mlの濯ぎ溶液を移植可能な流動性組成物の上に残留させることで、材料の送達デバイス、例えば注射器内への取り込みが容易になるようにする。次に、送達デバイスを操作して、コンフルエント細胞層の破壊が最小限となるように注意しながら、移植可能な流動性組成物を送達デバイスに引き込む。別の実施形態によれば、材料充填デバイス、例えば輸送容器の開口部と送達注射器の間にある漏斗形状の接合部分を使用して、材料を送達デバイスに移し、細胞の破壊を低減する。材料を送達デバイスに移した後、残留液の一部、約1mlを送達デバイスから排出して、送達デバイスを充填し、空隙容積を満たす。患者に送達する移植可能な流動性組成物中には、約0〜2mlの濯ぎ溶液が残留している。以上で移植可能な流動性組成物は、処置部位への送達の準備が完了となる。
【0102】
針通過: 本発明の有用性を示すために、好ましい移植可能な微粒子の流動性組成物(Gelfoam粒子に移植したHAE)の一種を、22ゲージ針(内径0.016インチ)の開口部から通過させた。或いは、別の好ましい組成物(Gelfoam粒子に移植したPAE)を、約21ゲージ針(内径0.019インチ)〜28ゲージ針(内径0.007インチ)の範囲内の針の開口部から通過させた。
【0103】
以下の表1に示すように、前記範囲内の内径を有する針を介した本発明の実施形態の通過は、針通過細胞の細胞数、生存率又は機能性に悪影響を与えることはない。細胞調製品が、コンフルエンス又は機能性に影響又は損失を与えることなく、21ゲージ(内径0.019インチ)〜30ゲージ(内径0.006インチ)の範囲、好ましくは24ゲージ(内径0.012インチ)の開口部から取り込まれ及び放出される可能性があることは、予想していない。又、該細胞が、キャリア流体としての細胞増殖培地のみを伴って針を通過した後にこのように良好に働くことも予想していなかった。
【0104】
前述の通り、細胞は微粒子基質と混合され、コンフルエンスに達するまで増殖された。コンフルエンスから3日後に、得られた流動性組成物を、約0.007インチ〜約0.018インチの範囲の内径を有する無菌針に通過させ、収集し、内皮細胞増殖培地(EGM−2)中で48時間回復させた。回復期間の後、培地を24時間馴化し、次に、通過後の細胞の馴化培地を評価した。通過後の馴化培地は、基本の線維芽細胞増殖因子(b−FGF)、ヘパラン硫酸(HS)及び形質転換増殖因子−β1(TGF−β1)産生の許容可能なレベルについて評価した。更に、培地による平滑筋細胞増殖の抑制を示すために、平滑筋細胞アッセイを実施し、針通過組成物のアッセイの結果を、針を通過させていないサンプルの結果と比較した。
【0105】
【表1】

カテーテル通過: 本発明の流動性組成物の予想外の性質に関する別の証明では、好ましい製剤が注入及び/又は貫通手段、例えば、針カテーテルに充填され、該手段を介して投与されている(表2)。一試験では、該針カテーテルが、薄壁のニチノール針(外経24ゲージ;内径22ゲージ)を組み込んだ6フレンチカテーテル(Trans Vascular Corp.[米国カリフォルニア州パロアルト])であった。
【0106】
前記範囲内の内径を有する針カテーテルを介した流動性組成物の通過は、通過後の細胞の細胞数、生存率又は生物学的産出量に悪影響を与えることはなかった。好ましい実施形態によれば、細胞は微粒子基質上に播種され、コンフルエンスに達するまで増殖された。コンフルエンスから3日後、流動性組成物を、約0.007インチ〜約0.018インチの範囲内の内径を有する無菌針カテーテルに通過させ、収集し、内皮細胞増殖培地(EGM−2)中で24時間回復させた。回復期間の後、培地を24時間調整した。次に、針通過細胞の馴化培地を評価した。通過後の馴化培地を、基本の線維芽細胞増殖因子(bFGF)、ヘパラン硫酸(HS)及び形質転換増殖因子−β1(TGF−β1)産生の許容可能なレベルについて評価した。更に、培地による平滑筋細胞増殖の抑制を示すために、平滑筋細胞アッセイを実施し、針通過細胞のアッセイの結果を、針カテーテルを通過していない細胞移植微粒子材料サンプルの結果と比較した(表2を参照)。
【0107】
【表2】

血管内投与: 該流動性組成物は、腔内に、即ち血管内に投与することができる。例えば、該組成物は、処置する血管内に挿入可能な任意のデバイスにより送達することができる。内視鏡誘導システムを使用して、送達デバイスを投与部位に配置する場合もあり、該システムには、例えば、血管内超音波(IVUS)、カラードップラー超音波、複合超音波、その他の日常的な超音波、血管造影、磁気共鳴血管造影(MRA)、磁気共鳴映像法(MRI)、CTスキャン、ステントの位置を特定する透視検査、及び/又は当該技術分野にて周知のその他の内視鏡誘導システムが含まれる。更に、投与部位は、触覚による腹部触診により特定される場合もある。投与部位への製剤の血管内送達は単独で行ってもよければ、他の血管内工程、例えばバルーン血管形成術又はステント若しくはその他のデバイスの移植の前に、これと同時に、又はこの後に組み合わせて行ってもよい。
【0108】
一例では、該腔内送達デバイスが、血管の管腔壁を貫通して、血管の非管腔面に達する横断又は貫通デバイスを備えている。次いで、該流動性組成物を、損傷又は病変した標的部位における、該部位に隣接する、又は該部位の近くにおける血管の非管腔面に沈着させる。
【0109】
本明細書では、管腔外面とも称される非管腔面が、血管の外面又は血管周囲面を含んでもよければ、例えば血管の外膜、中膜又は内膜の内部にあってもよいことが想定される。本発明において、非管腔又は管腔外とは、管腔の内面を除いた任意の面である。
【0110】
本明細書で想定される貫通デバイスでは、例えば、単一の送達ポイント、又は所望の幾何学的構造にて構成された複数の送達ポイントにて、損傷又は病変した標的部位を破壊することなく、血管の非管腔面に流動性組成物を送達することが可能となる。複数の送達ポイントは、幾つかの例を挙げると、例えば、円形、ブルズアイ、又は線状配列にて配列することができる。貫通デバイスは又、例えば複数の送達ポイントを含むバルーンステントのようなステント穿孔機の形態でもあってもよい。
【0111】
経皮投与: 一般的に本発明において、流動性組成物の投与は、処置が必要な部位に、該部位に隣接して、又は該部位の近くに局在化する。移植可能な流動性組成物の沈着部位は管腔外である。本明細書で想定されるように、局在化した管腔外沈着は、以下のように経皮達成されてもよい。
【0112】
流動性組成物は、針、カテーテル又はその他の適切な送達デバイスを使用して、経皮送達されてもよい。該流動性組成物は、誘導法の使用と同時に経皮送達され、処置を必要とする部位への送達を容易にしてもよい。該誘導工程は任意である。内視鏡誘導システムを使用して、管腔外の投与部位を特定してもよく、該システムには、例えば、血管内超音波(IVUS)、カラードップラー超音波、複合超音波、その他の日常的な超音波、血管造影、磁気共鳴血管造影(MRA)、磁気共鳴映像法(MRI)、CTスキャン、ステントの位置を特定する透視検査、及び/又は当該技術分野にて周知のその他の内視鏡誘導システムが含まれる。更に、投与部位は、触覚による腹部触診により特定される場合もある。血管周囲腔内に進入したら、臨床医は、処置が必要な部位における、該部位に隣接する、又は該部位の近くにおける管腔外部位上に流動性組成物を沈着させる。該誘導又は同定工程は、任意で実施され、本発明の方法の実施に必須のものではない。
【0113】
別の実施形態では、移植可能な流動性組成物が、処置が必要な部位における、該部位に隣接する、又は該部位の近くにおける、外科的に露出された管腔外部位に局所送達される。この場合、送達は、処置が必要な部位を直接観察することによって誘導及び指向される。又この場合、送達は、前述の同定工程の同時使用により補助されてもよい。繰り返しになるが、該同定工程は任意である。
【0114】
投与部位: 本発明の好ましい実施形態によれば、貫通デバイスが、血管内送達デバイスを使用して血管の管腔内面に、又は経皮送達にて周囲組織に挿入される。投与は、損傷又は病変した標的部位の近位、遠位又は該部位の位置に指向されてもよい。一部の臨床対象では、損傷又は病変した標的部位における貫通デバイスの挿入によって、損傷又は病変した標的部位が破壊される可能性がある。従って、当該対象においては、損傷又は病変した標的部位から一定の距離を置いた位置、好ましくは、当面の特定の状況によって左右される臨床医によって決定される距離を置いた位置に貫通デバイスを挿入するように、注意する必要がある。
【0115】
好ましくは、流動性組成物が、処置する損傷又は病変標的部位における、該部位に隣接する、又は該部位の近くにおける血管周囲面に沈着される。該組成物は、損傷又は病変標的部位に関連した広範な位置、例えば、損傷又は病変した標的部位に、損傷又は病変した標的部位に隣接して、例えば、損傷又は病変した標的部位の上流に、損傷又は病変した標的部位の反対側の血管外面上に沈着されてもよい。好ましい実施形態によれば、隣接部位が、損傷又は病変した標的部位の約2mm〜20mmの範囲内にある。別の好ましい実施形態では、沈着部位が約21mm〜40mmの範囲内にあり;更に別の好ましい実施形態では、沈着部位が約41mm〜60mmの範囲内にある。別の好ましい実施形態では、沈着部位が約61mm〜100mmの範囲内にある。或いは、隣接部位は、該沈着組成物が所望の効果を示すことができる、臨床医が決定したその他何れかの隣接位置となる。
【0116】
一実施形態によれば、移植可能な流動性組成物の投与前に、任意の平面投与領域が管腔外標的部位内に形成される。平面投与領域は、移植可能な流動性組成物の容積を受容するように形成された領域であり、例えば、鈍的切開、バルーン切開、流体切開、又は当該技術分野にて周知の別の切開技法を使用して形成し得る。投与領域は、血管内又は血管周囲の切開デバイスを使用して形成することができる。標的部位における流動性組成物の移植は、投与領域を形成することで容易になる。投与領域は、本発明の実践に必須のものではない。
【0117】
移植可能な流動性組成物は、多様な形態で投与部位に投与できることが想定される。例えば、移植可能な流動性組成物は、血流方向に平行した線状適用;血流方向に直行した周囲適用;又は投与部位の主要部内に投与することができる。前述の切開工程及び流動性組成物の送達は、同時に又は連続して実行できることも想定される。例えば、移植可能な流動性組成物は、加圧下で送達される場合に、それ自体を流体切開に使用することができる。しかし、前記切開法は、流動性組成物の加圧送達による組織外傷の危険性があり、血管周囲腔への移植可能な流動性組成物の加圧通過によって、細胞のコンフルエンシーが破壊される可能性がある。或いは、送達デバイスを管腔外の腔内に挿入して鈍的切開を達成することができ、送達デバイスを新しく形成された平面投与領域から後退させると、移植可能な流動性組成物を投与することができる。
【0118】
脈管の視覚化: 本発明の好ましい実施形態によれば、投与部位が誘導システムの補助によって特定される。一実施形態によれば、該誘導システムが、内視鏡誘導システム、例えば、血管内超音波(IVUS)となる。血管内超音波は、周囲構造及び血管等の血管管腔の360°断面図を提供する。
【0119】
別の好ましい実施形態では、該内視鏡誘導システムが血管造影となる。特定の実施形態では、微粒子細胞懸濁液に造影剤を添加することで、例えばコントラスト血管造影により、貫通デバイスの画像化、並びに患者の身体内における貫通デバイスの位置及び微粒子細胞懸濁液の配置の決定が可能になる。
【0120】
管腔外投与部位を特定する更なる内視鏡誘導システムには、カラードップラー超音波、複合超音波、その他の日常的な超音波、磁気共鳴血管造影(MRA)、磁気共鳴映像法(MRI)、CTスキャン、ステントの位置を同定する透視検査、及び/又は当該技術分野にて周知のその他の内視鏡誘導システムが含まれるが、これらに限定されない。更に、投与部位は、触覚による腹部触診により特定される場合もある。
【0121】
移植可能な流動性組成物は、例えば、血管造影又はIVUSを使用して、投与後に管腔外の腔内にて可視化させることができる。一実施形態によれば、移植可能な流動性組成物が管腔内ではなく管腔外の腔に送達されていることを確認するために、投与後の可視化が実施される。
【0122】
用量: 本発明の好ましい実施形態では、流動性組成物の送達可能な各投与が、移植可能な粒子約50〜60mgの容積中に約1×106細胞を含有する。流動性組成物の単回投与又は複数回投与が単一の処置部位に送達できることが想定される。又、流動性組成物の複数回投与が単一の患者に送達できることも想定される。複数回投与の種類には、単一の処置部位への複数回投与、多様な処置部位への単回若しくは複数回投与、及び/又は単回の処置時における、若しくは処置の延長過程にわたる複数回投与が含まれる。
【0123】
流動性組成物の各投与は、空隙容積、即ち、投与後に送達デバイス内に残留する、割り当てられた投与容積の一部分を含むことになる。該空隙容積は、送達デバイスに充填された流動性組成物の容積の約1%〜約50%の範囲内となる場合がある。空隙容積を考慮の上、実際の患者への投与に意図されるよりも多い数の細胞及び粒子が、送達デバイスに充填される。当然、空隙容積、並びに送達デバイスに充填された流動性組成物の容積の付随する調整は、選択した送達デバイスによって異なることになる。
【0124】
好ましい実施形態によれば、流動性組成物の送達可能な各投与が、単回投与として包装される。単一の処置部位への投与に複数の用量が必要な時には、所望の用量を単一の送達デバイスに充填し、単回投与中に投与することができる。しかし、単一の患者の複数の処置部位への投与に複数の用量が必要な時には、より多量の用量を複数回に分割して投与するよりも、固定量の送達可能な生成物のアリコートを多数使用することの方が好ましい。固定量のアリコートの投与の利点には、より多量の用量をより少量の多数の用量に分けて投入される用量の不正確性の低減、送達デバイスに固有の測定限界により投入される用量の不正確性の低減、及びより多量の組成物のアリコートに必要な輸送媒体の過剰容積により投入される用量の変動性の低減が含まれる。更に、より多量の用量をより少量のアリコートに分割することには、隣接する粒子の分裂、コンフルエント細胞単層の分裂、及び細胞への他の損傷の誘引のような、組成物の不必要な操作が必要となる。
【0125】
移植可能な流動性組成物の複数回投与は、処置の延長過程にわたり提供することができる。好ましい実施形態によれば、移植可能な流動性組成物の最初の用量が、一次処置、即ち血管介入時に投与され、続いて1〜3ヶ月に1回、又は臨床医が決定する必要性に応じて、低侵襲的に投与される。
【0126】
逆流: Gelfoam粒子の血管内投与を受けている一匹の豚の試験対象を使用して、前臨床試験を実施した。造影剤と混合した水和Gelfoam粒子の懸濁液を、カテーテルベースの送達機構に充填し、該カテーテルを試験対象の血管系内に挿入した。カテーテルを処置部位に指向させ、血管壁を介して針を血管周囲腔内に挿入し、懸濁液を血管周囲腔内に注入した。注入工程及び経過観察は、コントラスト血管造影を使用して視覚化した。
【0127】
血管管腔内への懸濁液の逆流は、注入時又は投与後及び針の除去時の何れにおいても、コントラスト血管造影から全く示されなかった。更に、Verhoeffのエラスチン染料で染色した処置組織切片の組織学的評価をその後行ったが、外膜から血管管腔内又は周辺組織内の何れかに漏洩した懸濁液の証拠は全く示されなかった。
【0128】
移植可能な流動性組成物の血管管腔内への逆流を起こす上で十分な血管周囲腔からの加圧の前に、移植可能な流動性組成物の治療量、約0.1ml〜約2mlが血管周囲腔内の単一の注入部位へ注入できることが想定される。
【実施例】
【0129】
(実施例1:動物血管介入試験)
本実施例は、動物の試験対象における血管介入に関連した臨床的続発症の発生率を低下させるために、本発明の好ましい実施形態を試験及び使用する実験プロトコールを提供する。標準的な外科手技では、大腿動脈上で実施する経皮バルーン血管形成術及びステント留置により、内腔面に損傷が誘導される。次に、本発明の移植可能な流動性組成物を、血管形成術及びステント処置血管の部位に隣接した血管周囲腔内に留置する。以下では、代表的な一工程の詳細を説明する。前述の通り、移植可能な流動性組成物の配置及び処方は変更することができる。
【0130】
具体的に、本試験は、経皮バルーン血管形成術及びステント移植を受けた26匹の豚試験対象により構成される。まず、標準的な手技に従って、従来の経皮バルーン血管形成術及びステント移植治療を実施する。血管形成術及びステント留置術が完了し、処置血管への流れが確立された後、前述の通り、移植可能な流動性組成物をバルーン膨張及びステント留置部位並びに周囲に適用する。
【0131】
外科手技: 経皮バルーン血管形成術及びステント移植を受けた各試験対象の場合、対象は挿管され、仰臥位にて心臓モニター装置に繋がれる。7フレンチシースを使用した右頸動脈への接近は、切開を介して行われ、直径5.0mmの血管形成バルーン(Guidant Corp.[米国インディアナ州インディアナポリス])を透視下で大腿動脈に前進させる。血管造影を実施し、X線動画撮影により記録する。右及び左大腿動脈は、8〜10気圧の30秒のバルーン膨張(重複したセグメントにおける、側部毎の3膨張)により損傷される。Megalink胆管ステント(Guidant、6.0〜8.0mm×18mm)を透視下で大腿動脈に前進させ、血管形成術の部位に留置する。
【0132】
血管形成術及びステント留置後、内皮細胞及び微粒子基質を含む、微粒子基質のみを含む、又は何れも含まない流動性組成物を、針注入カテーテルにより左及び右大腿動脈の血管周囲面に送達する。該針注入カテーテルは、ステントの位置を特定するために、例えば、血管造影又は血管内超音波を使用して、投与部位へ誘導される。移植可能な流動性組成物は、ステントの近位(例えば、ステントの近位端に対して約1〜20mm近位)の位置、ステントの遠位(例えば、ステントの遠位端に対して約1〜20mm遠位)の位置、及びステントの長さに沿った部位に投与される。各注入位置は、約0.8〜2.5×104細胞/mgの密度で約40〜70mg粒子を含有する移植可能な流動性組成物約0.1〜1.0mlを受容する。全試験対象は、術中ヘパリンを受容し、手後毎日アスピリンを投与される。
【0133】
試験対象の内の10匹が、手術日に移植可能な流動性組成物を受容し、又10匹の試験対象が、手術日に対照の微粒子基質を単独で受容する。更に6匹の試験対象が、ステントを受容するが、何れの種類の移植片も受容しない。前記6匹の試験対象は、治療の標準と比較するために使用される。体重に基づく総細胞負荷は、約1〜8×104細胞/kgとなる。
【0134】
血管形成術、ステント留置、及び隣接した血管周囲腔内への移植可能な流動性組成物の注入の完了後、CアームX線透視装置を対象の首上に配置して、処置血管を視覚化する。連続透視下で、10〜15ccのヨウ化造影剤(Renograffin、全濃度)を注入する。血管映画撮影図を記録し、犠牲前の血管造影図との比較のために保存する。最終的な血管造影を行って、血管開存性と、移植可能な微粒子材料の注入部位の状態を評価する。
【0135】
血管形成術の前にヘパリンを100U/kgのボーラス投与と35U/kg/時の持続点滴として投与し、手術の終了まで維持する。必要に応じて、更なるボーラス用量(100U/kg)を投与して、ACTを200秒以上に維持する。
【0136】
脈管の開存性: 処置血管の開存性は、カラーフロードップラー超音波を使用したアクセスフロー測定により、手術直後、手術から3〜7日後、及びそれ以降1週間毎に確認する。処置血管は血流を厳密に監視する。血管の血流は、試験に付された試験対象について、手術後7日目まで(7日目を含む)検出する。7日目以前又は当日に血管の血流が検出されない場合は、試験対象を試験から除去し、対象/群の元の数を維持するために試験対象を交換するあらゆる試みを実施する。
【0137】
病理学的工程: 動物試験対象の半分(処置群5匹;対照群5匹;非移植群3匹)を、手術から3〜5日後に安楽死させる。残りの動物試験対象(処置群5匹;対照群5匹;非移植群3匹)を、手術から1ヶ月後に安楽死させる。
【0138】
動物試験対象は、ペントバルビタールナトリウム(65mg/kg、IV)を使用して安楽死させる。処置血管を露出し、処置血管及び周囲組織並びに血管系のデジタル写真を撮影する。次に、動物の首上にCアームX線透視装置を配置して、処置血管を可視化し得る。連続透視下で、10〜15ccのヨウ化造影剤(Renograffin、全濃度)を注入する。処置血管に対して0°及び90°の角度で血管映画撮影図を記録する。管の開存性及び狭窄の程度を、留置後の血管造影図との一対比較において、剖検血管造影図を盲検により判断して測定する。血管造影図内で観察した狭窄の程度に応じて、血管造影図を0〜5のスケールに等級分けした。使用した等級分け基準は、以下の通りである:0=0%狭窄、1=20%狭窄、2=40%狭窄、3=60%狭窄、4=80%狭窄、及び5=100%狭窄。本発明の移植可能な流動性組成物で処置した血管は、血管造影図を調べると、対照群と比べて狭窄が低減されていることが示される。
【0139】
組織学: 動物試験対象の半分(処置群5匹;対照群5匹;非移植群3匹)を、手術から3日後に安楽死させる。残りの動物試験対象(処置群5匹;対照群5匹;非移植群3匹)を、手術から1ヶ月後に安楽死させる。
【0140】
全試験対象について、投与部位及び排出リンパ節等の周辺組織の肉眼検査と定義される限定的な剖検を実施する。手術から1ヶ月後に安楽死させた全試験対象について、脳、肺、腎臓、肝臓、心臓及び脾臓等の主要な器官の組織を収集し、保存する。身体の外面の肉眼検査、又は投与部位及び周辺組織の顕微鏡検査から異常が発見された場合のみ、器官を分析する。
【0141】
処置血管及び周辺組織の全てを整え、10%ホルマリン(又は等価物)中で固定し、グリコールメタクリレート(又は等価物)中に埋め込む。C−プロファイルのステンレス鋼ナイフ(又は等価物)で切断した厚さ約3μmの切片を使用して、処置血管の3つのセグメント:即ち、注入可能な材料の近位;注入可能な材料の部位;注入可能な材料の遠位、の各々から切片を調製する。前記切片をゼラチン被覆(又は等価物)ガラススライド上に置いて、ヘマトキシリン及びエオシン又はVerhoeffのエラスチン染料で染色する。染色したスライドを検査して、血管周囲及び管腔の炎症(急性及び慢性)、血管の変性、血栓及び線維化、並びに平滑筋細胞及び内皮細胞の存在についてスコアを付ける。1ヶ月試験対象由来の更なる組織切片を、Verhoeffのエラスチンで染色し、血管サイズ、血管損傷の範囲、内膜過形成及び再狭窄について検査し、スコアを付ける。又更なる切片を、PECAM−1及びα−SMCアクチンを含むが、これらに限定されない特定の内皮及び平滑筋細胞マーカーで染色する場合もある。損傷及び修復後の血管形状の変化に応じて、残りの管腔も試験する。Verhoeff染色切片は又、ビデオ顕微鏡及び専用のソフトウエアによるコンピュータ化デジタル面積測定を使用した形態計測分析にも供される。
【0142】
血管周囲及び管腔の炎症を、急性(3〜5日対象)及び慢性(1ヶ月対象)の両方について測定する。急性炎症は顆粒球、主に好中球により印され、慢性炎症はマクロファージ及びリンパ球により印される。更に、切片は又、以下の特定のマーカーにより染色する場合がある:白血球を同定する抗CD45、T細胞を同定する抗CD3、B細胞を同定するCD79a、及び単球/マクロファージを同定するMAC387。
【0143】
染色スライドを、平滑筋細胞及び内皮細胞の存在について試験し、スコアを付ける。内膜/偽内膜、管腔近くの中膜の内部、外膜近くの中膜の外側(外膜部位)部分、及び外膜のような、処置血管の全切片を評価し、スコアを付ける。各組織区画、例えば、内膜、中膜及び外膜のサイズをミクロン単位で測定する。各切片を、以下の各基準の存在及び/又は範囲について評価する。好中球、リンパ球、マクロファージ、好酸球、巨細胞及び血漿細胞の存在及び範囲を含むが、これらに限定されない、炎症の徴候を評価する。又、神経芽細胞、新血管形成、石灰化、出血、鬱血、フィブリン、移植片線維化及び移植片浸潤の存在について、組織切片を評価し、更に、変性、エラスチンの損失及び/又は組織部分の不在、平滑筋筋原線維の空胞化及び/又は組織の石灰化を含むが、これらに限定されない、変性の徴候についても評価する。組織切片は又、新血管形成を含むが、これに限定されない内皮細胞増殖、内膜下の細胞増殖、並びに平滑筋筋原線維、神経芽細胞及び線維化の存在についても評価する。測定した各組織切片は又、組織壊死及び異質物質の存在についても評価する。各変数に関して、0〜4のスケールでスコアを付ける(0=有意な変化なし;1=微度;2=軽度;3=中度;及び4=重度)。
【0144】
1ヶ月動物試験対象由来の組織の更なる切片のみを、形態計測分析のためにガラススライド上に置いて(Verhoeffのエラスチンで)染色する。ビデオ顕微鏡及び専用のソフトウエアによるコンピュータ化デジタル面積測定を使用して、各切片の管腔、中膜、内膜及び総血管容積を測定する。狭窄の割合も各切片について測定する。内膜過形成を定量化する一つの方法は、内膜面積を内膜及び管腔面積で除算する方法である[(内膜、mm2)/(内膜+管腔、mm2)]。
【0145】
血管の肉眼検査によって、上記の部位の外部に任意の局所性病変、血管壁の菲薄化又は膨張が観察された場合は、病理学者の判断で更なる切片も得る。染色スライドは全て、委員会により認定された獣医病理学者が盲検形式で検査し、スコアを付ける。
【0146】
動物血管介入対象に期待される結果
前述の通り本発明の流動性組成物を使用して処置した対象は、閉塞性血栓症の減少、開存率の上昇、狭窄の減少、内膜過形成の減少、並びに急性及び慢性の管腔及び/又は血管周囲の炎症の低下を含むが、これらに限定されない、血管介入に関連した臨床的続発症の発生率の低下の1種以上の徴候を示すことが期待される。
【0147】
処置に成功した血管の別の徴候としては、十分な管腔直径がある。本発明の注入可能な材料は、血管狭窄を減少させることで十分な管腔直径を維持し、それによって正常又はほぼ正常な速度の妨害のない血流を可能にすることが期待される。管腔の直径及び狭窄の割合は、処置日及び犠牲から丁度30日前に、処置血管の血管造影を使用して監視する。手術後の管腔の狭窄は、標準的なドップラー超音波プロトコールを使用して、血流速度と相関させる。本発明は、血流を正常又はほぼ正常な速度未満に妨害する狭窄を防止又は遅延させることが期待される。
【0148】
良好に機能するステント留置血管の更なる徴候としては、エッジ効果の不在がある。本発明の注入可能な材料は、ステントの遠位及び近位の血管部分における処置血管の閉塞性血栓症又は狭窄(しばしばエッジ効果と称される)の発生率及び/又は範囲を低下させることが期待される。エッジ効果、即ちキャンディーラッパー(candy wrapper)効果とは、ステント留置後にステントの関節及びエッジに発生する狭窄の領域である。エッジ効果は、早期の新生内膜組織増殖及び後期の狭窄により特徴付けられ、閉塞性血栓症を誘発する可能性がある。エッジ効果は、処置日及び犠牲から丁度30日前に、処置血管の血管造影を使用して監視する。本発明は、本明細書に記載する通り、ステント留置した血管のエッジ効果に関連した血栓症及び血管の狭窄を防止又は遅延させることが期待される。エッジ効果の存在又は非存在も又、ステントのエッジの両方向における約2〜3mm上流又は下流の極近位及び極遠位の切片を得て、組織学的に測定する。エッジ効果の存在を評価するため、極近位及び極遠位の切片を、損傷、炎症、新生内膜形成及び血栓についてスコアを付ける。
【0149】
一群として、処置対象は、対照と比べて、前述の機能性の徴候の少なくとも一つにおける少なくとも増分的な差異を示すことが期待される。
【0150】
(実施例2:ヒト血管介入試験)
本実施例は、ヒト臨床的試験対象の血管介入に関連した臨床的続発症の発生率を低下させるために、移植した血管内皮細胞及び微粒子形態の生体適合性基質を含む流動性組成物を試験及び使用する実験プロトコールを提供する。標準的な外科手技では、内科医指定による経皮バルーン血管形成術及びステント留置術を実施して、臨床的症状を緩和する。次に、移植可能な流動性組成物を、血管形成術及びステント留置部位における、該部位に隣接する、又は該部位の近くにおける血管周囲腔内に配置する。以下では、代表的な一工程を詳細に説明する。前述の通り、移植可能な流動性組成物の配置及び処方は、熟練した開業医により日常的な方法で変更することができる。
【0151】
具体的に、本試験は、末梢肢内に経皮バルーン血管形成術及びステント留置術を受けたヒト試験対象により構成される。まず、標準的な手技に従って、従来の経皮バルーン血管形成術及びステント留置術を実施する。血管形成術及びステント留置術が完了し、処置血管への流れが確立された後に、前述の通り、本発明の移植可能な流動性組成物をバルーン膨張部位及び周囲に適用する。体重に基づく総細胞負荷は、約1.0×104細胞/kg〜約8.0×104細胞/kgとなる。
【0152】
5日目、2週間目、並びに1、3及び6ヶ月目に、臨床的な経過観察を実施する。ベースラインレベルを確立するため、5日目にカラーフロードップラー超音波を使用した血流測定が必要であり、その後、手術から2週間後、1、3及び6ヶ月後にも測定を行う。350mL/分未満の絶対流量、又は以前の測定から25%を超える流量の低下、又は50%を超える面積の狭窄(ドップラー超音波により測定)を示す試験対象は、血管造影を受ける。血管形成術等の治療上の臨床的介入は、血管造影により50%を超える狭窄損傷が測定された場合に容認される。
【0153】
処置血管及び周囲組織並びに血管系の造影剤血管造影を、ベースライン及び3ヶ月目に実施する。各領域に関して管腔直径を計算し、ピーク収縮期血流速度を測定する。
【0154】
ヒト血管介入試験に期待される結果
前述の通り本発明の流動性組成物を使用して処置した対象は、閉塞性血栓症、再狭窄、内膜過形成、並びに急性及び慢性炎症を含むが、これらに限定されない、血管介入に関連した臨床的続発症の発生率の低下の1種以上の徴候を示すことが期待される。
【0155】
良好に機能する血管の徴候の一つとしては、十分な管腔直径がある。本発明は、十分な管腔直径を維持し、それによって正常又はほぼ正常な末梢循環を維持する上で十分な速度の妨害のない血流を可能にすることが期待される。管腔の直径は、最初にベースライン(処置から約5日後)に、その後は手術から少なくとも3ヶ月後に、処置血管の血管造影を使用して監視する。手術後の管腔の狭窄は、標準的なドップラー超音波プロトコールを使用して、血流速度と相関させる。本発明の移植可能な流動性組成物は、本明細書に記載する通りに使用すると、血流を、本明細書に記載する末梢循環に適した速度未満に妨害する狭窄を防止又は遅延させることが期待される。本発明の移植可能な流動性組成物による処置によって、臨床的に許容される循環を可能にする、又は正常な速度に近似する血流速度がもたらされることが更に期待される。血管の処置部分への流入量、及び該部分からの流出量は同程度となる。「同程度」とは、臨床目的において実質的に同様であることを意味する。例えば、血流速度は、約150〜500mL/分、好ましくは約300〜500mL/分、及びより好ましくは約350〜400mL/分となる。
【0156】
一群として、処置対象は、対照と比べて、前述の機能性の徴候の少なくとも一つにおける少なくとも増分的な差異を示すことが期待される。
【0157】
(実施例3:動物骨盤再癒着試験)
本実施例は、動物試験対象の骨盤及びその周囲における癒着の発生率を低下させるために、生体適合性微粒子基質及び移植内皮細胞又は内皮様細胞を含む流動性組成物を試験及び使用する実験プロトコールを提供する。本発明の移植可能な流動性組成物及び方法による卵管再建手術の後、実験用ラットモデル(変更子宮角モデル、J. Invest. Surg. 7: 409−15 (1994))を使用して、術後癒着の処置を試験する。子宮角の両側を擦過し、互いに縫合する。14日後、再開腹時に、縫合した子宮角の両側の間の強固な接続を切断する。そして、子宮角の片側及び周囲には、前述の通り本発明の移植可能な流動性組成物を適用する。子宮角の反対側は、対照として移植可能な流動性組成物を受容しない。一定の時間にわたり、癒着の存在又は非存在を監視する。本発明の移植可能な流動性組成物で処置したラットでは、骨盤及びその周囲における癒着の発生率が低減されることが期待される。
【0158】
(実施例4:動物ファロピウス管閉塞試験)
本実施例は、動物試験対象におけるファロピウス管閉塞の発生率を低下させるために、生体適合性微粒子基質と移植内皮又は内皮様細胞を試験及び使用する、実験プロトコールを提供する。実験用ウサギモデル(J. Vase. Interv. Radiol.
13: 399−404 (2002))を使用して、本発明の移植可能な流動性組成物及び方法によるファロピウス管閉塞の処置を試験する。透視下で、同軸技法を使用して、右及び左ファロピウス管の経膣カテーテル法を実施する。活性電極カテーテルから突出する金属ガイドワイヤを使用して、RF電気凝固法を実施する。一方のファロピウス管及び周囲には、前述の通り本発明の移植可能な流動性組成物を適用する。他方のファロピウス管は、対照として移植可能な流動性組成物を受容しない。一定の時間にわたり、卵管の開存性及び組織学的変化を評価する。本発明の移植可能な流動性組成物で処置したウサギでは、ファロピウス管及びそれらの周囲における閉塞、狭窄及び壊死の発生率が低減されることが期待される。
【0159】
本発明は又、子宮外妊娠の発生率を低下させるために、及び/又は子宮外妊娠と同時の若しくはその後の介入療法として、有効に使用することもできる。
【0160】
本発明は、その趣旨又は本質的な特徴から逸脱することなく、他の特定の形態で具体化される場合がある。従って、本実施形態は限定のためではなく、説明のためのものと考え、本発明の範囲は、前記の説明によらず、不随する特許請求の範囲により示されると考えるべきであり、特許請求範囲の意味及び等価の範囲内に含まれる変更は全て、本発明の範囲内に包含されるものとして意図される。
【技術分野】
【0001】
2005年12月6日に出願された、この本出願は、35U.S.C.Section 119(e)の下、2004年12月8日に出願された仮特許出願U.S.S.N.60/634,155号;2005年3月21日に出願された仮特許出願U.S.S.N.60/663,859号;および2005年3月19日に出願された仮特許出願U.S.S.N.60/682,054号;_________に出願された仮特許出願U.S.S.N._______号の利益を主張し、同日付で出願された係属中の国際出願PCT/US____________号(代理人整理番号ELV−002PCとしても知られる)および同日付で出願された係属中の国際出願PCT/US____________号(代理人整理番号ELV−008PCとしても知られる)に対する優先権を、35U.S.C.Section 120,363および/または365の下で主張する。上述の出願の各々の全内容が、本明細書中に参考として援用される。
【背景技術】
【0002】
心血管疾病は、毎年世界中で5000万人を超える人々の死因となっており、米国では100万を超える人々の死因となっている。米国では毎年、これら疾患から自然発生する閉塞性動脈病変を軽減する試みにおいて、約150万件の治療が行われている。前記治療の例として幾つかを挙げると、バルーン及びレーザー血管形成術、アテローム切除術、血管内ステント、並びにバイパス術等がある。血管形成術、血管バイパス術、更には臓器移植の長期間の効果は、当該治療後の動脈症の急速な発達により制限されている。内皮の完全性の損失、閉塞性血栓症、痙攣、並びに内膜過形成を招く平滑筋細胞の移動及び増殖が、当該動脈症の典型となっている。例えば、再狭窄は、当該患者の20〜50%で閉塞性動脈病変を誘導している。冠動脈血管形成術後の3〜6ヶ月以内に、患者の3分の1以上が更なる治療介入、別の血管形成術、又はバイパス手術さえも必要となる。アテローム切除術デバイスも同様であり;前記治療を受けた患者の数が増えるにつれて、再狭窄率が10から47%に上昇している。この観点から、血管内ステントの使用も幾分期待外れとなっている。最近の研究では、挿入後数日以内に急性冠閉塞等の急性合併症を患う約5%の患者に加えて、35%の患者の再狭窄率も報告されている。
【0003】
同様の問題が、血管バイパス手術を受けた患者にも観察されている。伏在静脈、大動脈冠動脈導入移植片の平均寿命は7年のみである。当該全移植片の10%が術後数週間以内に閉塞する。1年後及び5年後には、移植片のそれぞれ20%及び35%が閉塞する。透析患者の動静脈瘻も、血液透析の効果を制限する同一の疾病に曝されている。
【0004】
例えば再狭窄のような急速に発達する動脈症の特徴としては、平滑筋細胞の盛んな増殖、及び前記細胞により生成される大量の細胞外基質の沈着がある。現在、自然のアテローム性動脈硬化症と、機械的介入後の急速に発達する動脈症の両者は、共通する最初の病理学的事象、内皮細胞の完全性及び機能の損失を共有することが明らかとなっている。
【0005】
内皮単層は、動脈壁の内側を覆い、血管の生理機能の二重のバイオレギュレーターの役割を果たしている。内皮は、循環する血液と動脈壁の間に、連続した、選択的透過性且つ抗血栓性の障壁を形成することにより、血管に構造的完全性をもたらしている。内皮は又、血流、血管緊張、閉塞性血栓症、血小板の活性化、接着及び凝集、白血球の接着、単球の浸潤、並びに平滑筋細胞の移動及び増殖を制御する生成物も産生することが次第に理解されてきている。平滑筋細胞のマイトジェンは動脈壁内の至る所に存在するため、無傷の内皮の存在が正常な血管を静止状態に維持している。内皮の損傷又は除去により、内皮によって分泌される化合物も除去され、閉塞性動脈病変をもたらす平滑筋細胞の無制限な増殖及び移動に繋がる一連の事象が開始される。
【0006】
現在、心血管疾病の治療には、冠動脈血管形成術、冠動脈ステント留置術、及びアテローム切除術等の多くの臨床的介入が使用されており、これらは非侵襲性の閉鎖的外科治療を使用して実施することができる。前記の非侵襲性血管内介入計画は同時に、同様の低侵襲性血管内様式により治療物質を血管介入部位へ送達して、結果として生じる損傷又は疾病した標的内皮を処置する必要がある。
【0007】
更に、血管内より治療物質を送達する現在の方法は、血管の管腔内面への物質の投与に依存している。しかし、循環血液との接触は活性の効力及び持続時間を制限するため、治療物質又は治療薬を管腔内面へ投与しても、損傷又は疾病した標的内皮に一過性の利益しかもたらさない。
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明の一つの目的は、損傷又は疾病した管腔内皮部位における、該部位に隣接する、又は該部位の近くにおける管腔外又は血管周囲の部位に、細胞の治療製剤を非侵襲的又は低侵襲的に送達して、血管介入又は心血管疾病に関連した閉塞性血栓症、再狭窄、内膜過形成、及びその他の臨床的続発症の発現を低減するための材料及び方法を提供することにある。
【課題を解決するための手段】
【0009】
(発明の要旨)
本発明は、移植可能な流動性組成物中、該組成物上、又は該組成物内に移植した細胞が、例えば、血管内投与、並びに血管を含むが、これに限定されない管状の解剖学的構造の管腔外面における、該外面に隣接した、又は該外面近くにおける血管周囲の沈着のような、多くの低侵襲的送達様式のために処方できるという発見を利用するものである。本明細書では、管状の解剖学的構造の外面への、該外面上への、又は該外面周囲への低侵襲送達も想定している。血管の場合、本発明の材料及び方法は、血管介入又は心血管疾病に関連した臨床的続発症の治療及び管理に適している。
【0010】
一態様では、本発明が、管状の解剖学的構造の管腔内側上の損傷又は疾病部位を処置するための流動性組成物となり、ここで該流動性組成物は、生体適合性基質及び細胞を含み、該流動性組成物は、損傷又は疾病部位を処置する上で有効な量となる。一実施形態によれば、該管状の解剖学的構造が血管となる。幾つかの実施形態によれば、該流動性組成物が、例えば幾つかの例として、損傷又は疾病部位の平滑筋細胞増殖、閉塞性血栓症、内膜過形成、再狭窄、急性若しくは慢性炎症、又は血管拡張を減少させる上で有効な量で提供される。本発明において、流動性組成物とは、針、注射器又はカテーテルを含むが、これらに限定されない注入又は注入型送達デバイスを使用した投与が可能な組成物を意味する。本明細書では、押出、駆出又は放出を使用するその他の送達デバイスも想定している。
【0011】
一実施形態によれば、該流動性組成物の細胞が、内皮細胞、又は内皮様の表現型を有する細胞となる。別の実施形態によれば、該細胞が、複数の細胞型の共培養物となる。複数の細胞型は、内皮細胞、上皮細胞、平滑筋細胞、神経芽細胞、幹細胞、内皮前駆細胞及び心筋細胞からなる群より選択される。本発明で使用する上で適した細胞の標本は、単一のドナー又は多数のドナーから得ることができる。
【0012】
別の実施形態によれば、該生体適合性基質が、ゲル、フォーム、又は懸濁液となる。更に別の実施形態では、該生体適合性基質が粒子又はマイクロキャリアを含む。特定の実施形態では、粒子又はマイクロキャリアが更に、ゼラチン、コラーゲン、フィブロネクチン、フィブリン、ラミニン又は結合ペプチドを含む。結合ペプチドの一例としては、アルギニン−グリシン−アスパラギン酸(RGD)配列のペプチドがある。別の実施形態によれば、粒子又はマイクロキャリアが、約20ミクロン〜約500ミクロン、好ましくは約200ミクロンの直径を有する。
【0013】
別の実施形態では、該流動性組成物が更に、キャリア流体を含む。特に好ましい実施形態では、該流動性組成物が形状保持性を有し、それにより開業医は、特定の沈着部位を考慮して、沈着を必要な程度に制御することができる。
【0014】
別の態様では、本発明が、管状の解剖学的構造の管腔内側上の損傷又は疾病部位の治療方法となる。本方法は、管状の解剖学的構造の管腔内側上の損傷又は疾病部位における、又は該部位に隣接する、又は該部位の近くにおける、管状の解剖学的構造の管腔外面を、流動性組成物と接触させる工程を含む。本明細書では、管腔外面とも称される非管腔面が、脈管の外側又は管周囲の表面となってもよいことが想定されている。本発明において、非管腔又は管腔外部位は、管腔の内面を除いた任意の部位である。例えば、血管の場合には、管腔外又は非管腔部位が、血管の外膜、中膜又は内膜内にあってもよく、非血管の管状の解剖学的構造の場合には、対応する非管腔部位が本発明の範囲内に含まれる。
【0015】
一実施形態によれば、管状の解剖学的構造の内壁を横断又は貫通した後、損傷若しくは疾病部位において、又は該部位に隣接して、又は該部位の近くにおいて、流動性組成物を管状の解剖学的構造の外面に沈着させることにより、送達が達成される。別の実施形態によれば、本方法が更に、管状の解剖学的構造の管腔外面上において流動性組成物を沈着させる部位を同定する工程を含む。一実施形態によれば、該同定工程が、該横断又は貫通工程の前に、又は該工程と同時に行われる。一実施形態では、該同定工程が画像化により実施される。別の実施形態では、該同定工程が触覚による腹部触診により実施される。
【0016】
一実施形態では、経皮投与により血管周囲腔に進入した後、損傷又は疾病状態において、又は該状態に隣接して、又は該状態の近くにおいて、流動性組成物を管状の解剖学的構造の外面に沈着させることにより、送達が実施される。別の実施形態によれば、本方法が更に、管状の解剖学的構造の外面において流動性組成物を沈着させる部位を同定する工程を含む。該同定工程は、該進入工程の前に、又は該工程と同時に行われてもよい。一実施形態によれば、該同定工程が画像化により実施される。別の実施形態では、該同定工程が触覚による腹部触診により実施される。
【0017】
本方法の種々の実施形態によれば、管状の解剖学的構造の外面が、本明細書の他の箇所に記載する通り、非管腔面となるか、又は血管周囲腔を占めるかの何れかとなる。好ましい一実施形態によれば、管状の解剖学的構造が血管となる。別の好ましい実施形態によれば、血管がステントを含む。更に別の好ましい実施形態では、処置した管状の解剖学的構造が、ファロピウス管を含むが、これに限定されない非血管構造となる。
例えば、本願発明は以下の項目を提供する。
(項目1)
管状の解剖学的構造の損傷又は病変部位を処置するための流動性組成物であって、該流動性組成物は、生体適合性基質及び細胞を含み、且つ損傷又は病変部位を処置する上で有効な量である、流動性組成物。
(項目2)
前記細胞が、内皮細胞、又は内皮様の表現型を有する細胞である、項目1に記載の流動性組成物。
(項目3)
前記細胞が、内皮細胞、上皮細胞、平滑筋細胞、神経芽細胞、幹細胞、内皮前駆細胞及び心筋細胞からなる群より選択される複数の細胞の共培養物である、項目1に記載の流動性組成物。
(項目4)
前記流動性組成物が形状保持性を有する、項目1に記載の流動性組成物。
(項目5)
前記生体適合性基質が粒子又はマイクロキャリアを含む、項目1に記載の流動性組成物。
(項目6)
前記粒子又はマイクロキャリアが更に、ゼラチン、コラーゲン、フィブロネクチン、フィブリン、ラミニン又は結合ペプチドを含む、項目5に記載の流動性組成物。
(項目7)
前記結合ペプチドがアルギニン−グリシン−アスパラギン酸(RGD)配列のペプチドを含む、項目6に記載の流動性組成物。
(項目8)
粒子又はマイクロキャリアが約20ミクロン〜約500ミクロンの直径を有する、項目5に記載の流動性組成物。
(項目9)
粒子又はマイクロキャリアが約200ミクロンの直径を有する、項目5に記載の流動性組成物。
(項目10)
更に細胞増殖培地を含む、項目1に記載の流動性組成物。
(項目11)
前記有効量により、損傷又は病変部位における平滑筋細胞の増殖が低減される、項目1に記載の流動性組成物。
(項目12)
前記有効量により、損傷又は病変部位における閉塞性血栓症が低減される、項目1に記載の流動性組成物。
(項目13)
前記有効量により、損傷又は病変部位における内膜過形成が低減される、項目1に記載の流動性組成物。
(項目14)
前記有効量により、損傷又は病変部位における狭窄又は再狭窄が低減される、項目1に記載の流動性組成物。
(項目15)
前記有効量により、損傷又は病変部位における急性炎症が低減される、項目1に記載の流動性組成物。
(項目16)
前記有効量により、損傷又は病変部位における慢性炎症が低減される、項目1に記載の流動性組成物。
(項目17)
前記有効量により、損傷又は病変部位における血管拡張又は血管痙攣が低減される、項目1に記載の流動性組成物。
(項目18)
前記管状の解剖学的構造が血管である、項目1に記載の流動性組成物。
(項目19)
管状の解剖学的構造の損傷又は病変部位を処置する方法であって、
該管状の解剖学的構造の損傷若しくは病変部位において、又は該部位に隣接して、又は該部位の近くにおいて、該管状の解剖学的構造の管腔外面と流動性組成物とを接触させる工程を含み、ここで該組成物は生体適合性基質及び細胞を含み、該流動性組成物が損傷又は病変部位を処置する上で有効な量である、方法。
(項目20)
前記管状の解剖学的構造の内壁を横断又は貫通した後、損傷若しくは病変部位において、又は該部位に隣接して、又は該部位の近くにおいて、流動性組成物を該管状の解剖学的構造の外面に沈着させることにより、沈着が達成される、項目19に記載の方法。
(項目21)
更に、前記管状の解剖学的構造の外面において流動性組成物を沈着させる部位を同定する工程を含む、項目20に記載の方法。
(項目22)
前記同定工程が、前記横断又は貫通工程の前に、又は横断又は貫通工程と同時に行われる、項目21に記載の方法。
(項目23)
前記同定工程が画像化により達成される、項目21に記載の方法。
(項目24)
前記同定工程が触覚による腹部触診により達成される、項目21に記載の方法。
(項目25)
経皮投与により血管周囲腔に進入させた後、損傷若しくは病変部位において、又は該部位に隣接して、又は該部位の近くにおいて、前記流動性組成物を前記管状の解剖学的構造の外面に沈着させることにより、前記接触工程が達成される、項目19に記載の方法。
(項目26)
更に、前記管状の解剖学的構造の外面において流動性組成物を沈着させる部位を同定する工程を含む、項目25に記載の方法。
(項目27)
前記同定工程が、前記進入工程の前にか、又は進入工程と同時に行われる、項目26に記載の方法。
(項目28)
前記同定工程は画像化により達成される、項目26に記載の方法。
(項目29)
前記同定工程が触覚による腹部触診により達成される、項目26に記載の方法。
(項目30)
前記管状の解剖学的構造の外面が非管腔面である、項目19に記載の方法。
(項目31)
前記管状の解剖学的構造の外面が血管周囲腔を占める、項目19に記載の方法。
(項目32)
前記管状の解剖学的構造が血管である、項目19に記載の方法。
(項目33)
前記血管がステントを含む、項目32に記載の方法。
(項目34)
前記損傷又は病変部位がステントの近くに存在する、項目33に記載の方法。
(項目35)
前記有効量により、損傷又は病変部位における平滑筋細胞の増殖が低減される、項目19に記載の方法。
(項目36)
前記有効量により、損傷又は病変部位における閉塞性血栓症が低減される、項目19に記載の方法。
(項目37)
前記有効量により、損傷又は病変部位における内膜過形成が低減される、項目19に記載の方法。
(項目38)
前記有効量により、損傷又は病変部位における狭窄又は再狭窄が低減される、項目19に記載の方法。
(項目39)
前記有効量により、損傷又は病変部位における急性炎症が低減される、項目19に記載の方法。
(項目40)
前記有効量により、損傷又は病変部位における慢性炎症が低減される、項目19に記載の方法。
(項目41)
前記有効量により、損傷又は病変部位における血管拡張又は血管痙攣が低減される、項目19に記載の方法。
(項目42)
前記管状の解剖学的構造がファロピウス管となる、項目19に記載の方法。
(項目43)
前記細胞が、コンフルエントな細胞集団;ほぼコンフルエントな細胞集団;コンフルエント後の細胞集団;及び前述の表現型の何れか一つを有する細胞集団からなる群より選択される、項目1に記載の流動性組成物。
【図面の簡単な説明】
【0018】
【図1】本発明の例示的実施形態に従った、代表的な細胞増殖曲線。
【発明を実施するための形態】
【0019】
本明細書で説明する通り、本発明は、細胞ベースの治療法が、血管介入又は心血管疾病に関連した臨床的続発症、特に閉塞性血栓症、再狭窄、内膜過形成、炎症及び血管拡張の進行を処置、回復、管理及び/又は低下させるために使用できるという発見に基づいている。本発明は更に、これまでに記載されていない流動性組成物、例えば微粒子製剤が、十分に生存可能な細胞のコンフルエントな集団を維持することができ、又、生体適合性基質、例えば移植可能な微粒子材料中に、該材料上に、又は該材料の内部に移植されている細胞を含む前記組成物は、移植可能な流動性組成物に移植された細胞の臨床的有効性又は生存率を低下させることなく、閉鎖的治療中に低侵襲性投与様式、例えば血管内又は局所経皮送達を使用して有効に投与することができるという更なる発見から利益を得るものである。以下に示す教示は、本発明の材料及び方法を製造及び使用する上で十分な案内を提供し、更に、適切な基準及び対象を同定して本発明の材料及び方法の性能を試験、測定及び監視する上で十分な案内を提供する。
【0020】
従って、血管介入又は心血管疾病を臨床的に管理する細胞ベースの治療法が開発されている。本発明の例示的実施形態は、本明細書に記載の処置範例と共に使用する上で適した生体適合性基質及び細胞を含む。具体的に、好ましい一実施形態では、移植可能な流動性組成物が、生体適合性基質及び内皮細胞又は内皮様細胞を含む。別の好ましい実施形態では、移植可能な流動性組成物が、内皮細胞又は内皮様細胞、好ましくはヒト大動脈内皮細胞及び微粒子型の生体適合性基質を含む。
【0021】
本発明の移植可能な流動性組成物は、生体適合性基質上に、該基質中に、及び/又は該基質の内部に移植されている細胞を含む。「移植されている」とは、細胞が本明細書に開示される準備操作の過酷さに耐えるように、細胞対細胞の及び/又は細胞対基質の相互作用を介して確実に結合されていることを意味する。本明細書の他の箇所で説明する通り、移植可能な流動性組成物の有効な実施形態は、好ましい表現型を有する、ほぼコンフルエントな、コンフルエントな、又はコンフルエント後の細胞集団を含む。移植可能な流動性組成物の実施形態は、準備操作中に細胞を脱落する可能性があり、及び/又は特定の細胞が他の細胞のように確実に結合していない可能性があることが理解される。必要なことは、移植可能な流動性組成物が、本明細書に示す機能的又は表現型の基準を満たす細胞を含むことである。
【0022】
本発明の移植可能な流動性組成物は、組織工学の原則に基づき開発されたものであり、前述の臨床的必要性に対処する新規の手法を表す。本発明の移植可能な流動性組成物は、生体適合性基質中、該基質上、及び/又は該基質の内部に移植されている生存細胞が、生理的なフィードバック制御下において多数の細胞ベースの生成物を生理的な比率で管状の解剖学的構造に供給することができるという点で固有のものである。本明細書の他の箇所で説明する通り、移植可能な流動性組成物と共に使用する上で適した細胞は、内皮又は内皮様細胞である。前記細胞による多数の化合物の局所送達及び生理的に動的な投与は、機能的な管腔内皮を維持する役割を果たすプロセスをより効果的に調節する。重要な点として、例えば、本発明の移植可能な流動性組成物中の内皮細胞は、非管腔又は管腔外部位における該組成物の好ましい配置により、血管内腔の浸食性の血流から保護される。
【0023】
本発明の移植可能な流動性組成物は、損傷又は疾病した標的管腔において、該管腔に隣接して、又は該管腔の近くにおいて、管腔外又は非管腔部位により包囲、沈着、又は別様に接触されると、恒常性を再確立するよう作用する。即ち、本発明の移植可能な流動性組成物は、管腔外に投与されると、支持的な生理機能を模倣する環境を提供することができ、機能的な内腔を促進する上での助けとなる。本明細書で想定されるように、管状の解剖学的構造は、管腔内面及び管腔外面を有する構造である。特定の構造では、管腔内面が内皮細胞層であり;その他の特定の構造では、管腔内面が非内皮細胞層である。更に又、本発明において、管腔外面又は非管腔面は、本明細書の他の箇所に記載するように、管状の構造の外面となってもよいが、これに限定されない。
【0024】
例えば、内皮細胞は様々な薬剤を放出することができ、該薬剤は、組み合わせることで、血管介入又は心血管疾病後の急性合併症に関連した不都合な生理学的事象を抑制又は軽減することができる。本明細書に例示するように、正常な生理機能及び投与を再現する組成物及び使用方法は、内皮の機能性を向上する上で、並びに当該管腔内皮の長期間の開存性を促進する上で有用である。一般的に、処置には、本発明の移植可能な流動性組成物を、例えば、対象の血管系の管腔の外側の血管周囲腔において、損傷又は疾病した標的内皮において、該内皮に隣接して、又は該内皮の近くにおいて沈着させることが含まれる。損傷、外傷又は病変した血管に沈着又は別様に接触させると、移植可能な流動性組成物の細胞は、増殖調節化合物を対象の血管系に、例えば血管内の根底にある平滑筋細胞に提供することができる。血管外に存在すると、本発明の移植可能な流動性組成物は、細胞からの多数の調節化合物を効果的に供給する一方で、血管の内腔内の血流の機械的効果から保護される。
【0025】
本発明の好ましい実施形態による損傷又は疾病血管の処置は、正常な又はほぼ正常な治癒及び正常な生理機能を促進することができる。対照的に、本発明の好ましい実施形態による処置が不在の場合は、正常な生理的治癒が損なわれ、例えば、自然の内皮細胞及び平滑筋細胞は、血管介入又は心血管疾病後に、過剰な又は無制御な速度で異常に増殖する可能性がある。従って、本明細書で想定されるように、本発明の移植可能な流動性組成物を使用した処置は、例えば正常な又はほぼ正常な血管開存性を維持する上で十分なように、血管介入又は心血管疾病部位において自然の組織を正常に又はほぼ正常に治癒すると思われる。
【0026】
本発明の移植可能な流動性組成物は、処置する血管系において多様な形状で配置することができる。血管は全体又は部分的に接触させることができ;例えば、本発明の移植可能な流動性組成物は、血管の周囲に又は弧の形状で適用することができる。血管は、血管系の機能を改善する上で十分な量の移植可能な流動性組成物とのみ接触させる必要がある。
【0027】
本発明において、「接触」とは、本明細書の他の箇所で定義される管腔外面又は非管腔面と直接又は間接的に相互作用することを意味する。特定の好ましい実施形態では、実際の物理的接触が有効性に必要でないが、その他の実施形態では、実際の物理的接触が好ましい。本発明の実施に必要なことは、損傷又は疾病部位において、該部位に隣接して、又は該部位の近くにおいて移植可能な材料を、損傷又は病変部位の処置に有効な量で管腔外又は非管腔に沈着することである。特定の疾病又は損傷では、疾病又は損傷部位が管腔内面に臨床的に発現する可能性があり、その他の疾病又は損傷では、疾病又は損傷部位が管腔外面又は非管腔面上に臨床的に発現する可能性がある。幾つかの疾病又は損傷では、疾病又は損傷部位が、管腔内面及び管腔外面又は非管腔面の両方上に臨床的に発現する可能性がある。本発明は、前述の何れの臨床的発現の処置にも有効である。
【0028】
本発明の移植可能な流動性組成物の実施形態は、介入的治療法を必要とする任意の管状の解剖学的構造に適用して、恒常性を維持することができる。本明細書で想定されるように、管状の解剖学的構造は、管腔内面及び管腔外面又は非管腔面を有する構造である。本発明において、管腔外面は、管状構造の外面となってもよいが、これに限定されない。特定の管状構造では、管腔内面が内皮細胞層であり;その他の特定の他の構造では、管腔内面が非内皮細胞層である。本発明は、内皮で覆われた又は内皮で覆われていない管状構造の処置に有効である。
【0029】
管状の解剖学的構造には、血管系、生殖器系、泌尿生殖器系、胃腸系、肺系、呼吸器系、並びに脳及び脊髄の脳室系の構造が含まれる。管状の解剖学的構造の代表的な例には、動脈及び静脈、涙管、気管、気管支、気管支梢、鼻腔(洞を含む)及びその他の気道、耳管、外耳道、口腔、食道、胃、十二指腸、小腸、大腸、胆管、尿管、膀胱、尿道、ファロピウス管、子宮、膣及び女性生殖器管のその他の通路、精管及び男性生殖器管のその他の通路、血管鞘、並びに脳及び脊髄の脳室系(脳脊髄液)が含まれる。本発明において、管状の解剖学的構造は、自然発生のものもあれば、例えば、外科的に形成された吻合等のように非自然発生のものもある。
【0030】
損傷又は病変した内皮: 特定の好ましい実施形態では、本発明による処置が可能な血管損傷をもたらす血管介入には、血管形成術、アテローム切除術、並びに金属製ステント及び薬剤溶出ステントを含む血管ステント留置術、並びに動脈バイパス術及び末梢バイパス術を含む血管バイパス術、臓器移植、並びに動静脈瘻及びその他の血管吻合形成、動静脈、並びに末梢及びその他のグラフト形成、並びに透析又はその他の介入的治療法のために血管へアクセスする際に生じる針の突き刺し等の、血管へのアクセスに関連したその後の損傷が含まれるが、これらに限定されない。何れの介入でも、血管管腔の内皮細胞層にある程度の損傷をもたらす。次に、損傷した血管管腔は、閉塞性血栓症、再狭窄、内膜過形成、急性及び慢性炎症、平滑筋細胞の増殖、血管再構築、血管拡張及び不安定プラーク病変の形成を含むが、これらに限定されない臨床的に識別可能な多様な続発症を引き起こす、生化学的事象のカスケードを経験する。
【0031】
血栓症又は閉塞性血栓症は、血小板の接着、凝集及び組織化に関連し、閉塞性血栓症は一般的に、組織化した血栓に関連する。血栓症は、血栓が形成された領域内における血流の損失により特徴付けられる。内皮又は内皮様細胞は、ヘパラン硫酸プロテオグリカン、プロスタサイクリン及び一酸化窒素を含むが、これらに限定されない抗血栓化合物を放出する。本発明の移植可能な流動性組成物による処置によって、処置血管の開存性が改善される。
【0032】
狭窄、再狭窄、内膜過形成、及び平滑筋細胞の増殖は、管腔内への平滑筋細胞の盛んな増殖に関連した血管内腔の閉塞性の病変により特徴付けられる。内皮又は内皮様細胞は、平滑筋細胞の増殖を抑制する化合物を管腔領域内に放出する。内皮又は内皮様細胞により産生される代表的な治療用化合物には、ヘパラン硫酸、TGFβ及び一酸化窒素が含まれるが、これらに限定されない。狭窄、再狭窄、内膜過形成、及び平滑筋細胞の増殖は、例えば、血管造影、血管内超音波又はその他の超音波技法により同定される。本発明の移植可能な流動性組成物による処置は、狭窄の割合、即ち、閉塞の程度を低下させ、及び/又は処置血管に関連した開存性を改善する。
【0033】
炎症は、顆粒球、好中球、単球、マクロファージ及びリンパ球を含むが、これらに限定されない炎症性細胞の動員、接着及び浸潤に関連する。更に、血管透過性の増大によって、損傷部位に隣接する組織における流体、免疫グロブリン、補体及びその他の血液タンパク質の局所蓄積を生じ、これらが次に、接着分子の発現を誘導する。前記接着分子は、循環する単球及び好中球の表面に結合して、前記食細胞が管腔面を横断して隣接する組織内へ移動することができる速度を大きく増進する。活性化により、前記細胞は、加水分解酵素、サイトカイン、ケモカイン及び増殖因子を放出することができる。炎症の進行した慢性段階では、損傷部位が、脂質及び壊死組織のコアを覆う線維のキャップで覆われている。内皮又は内皮様細胞は、炎症応答を低下させる抗炎症化合物を管腔領域内に放出する。本発明の移植可能な流動性組成物による治療は、炎症性細胞の活性及び/又は蓄積を抑制して、増殖因子の産生及び分泌を低下させ、マクロファージの局所血管浸潤を低下させて、血管損傷部位における急性炎症反応を防止、低減又は回復することができる。急性炎症反応の回復又は防止により、慢性炎症を招く事象が妨害され、それにより最終的な管腔の損傷、及び/又は血管機能不全が最小限に低減される。更に、慢性炎症組織の回復又はリハビリテーションにより、例えば、不安定プラーク又はアテローム性動脈硬化症を含むが、これらに限定されない血管疾病のような、長期の危険性が発生する危険性を低減することができる。不安定プラーク及びアテローム性動脈硬化症を含むが、これらに限定されない血管疾病の更なる考察は、本明細書と同一日に出願され、全内容が参考として本明細書に組み入れられる、(代理人整理番号ELV−008PCとしても周知の)同時係属出願PCT/US_______に開示されている。
【0034】
更に、本発明による治療が可能な自然発生の心血管疾病には、幾つかの例を挙げると、急性及び慢性炎症、閉塞性血栓症、内膜過形成、再狭窄、平滑筋細胞の増殖、血管拡張、負の血管形成、血管構造の管腔内の不安定プラーク病変、及び種々の不安定動脈症候群が含まれるが、これらに限定されない。本発明により治療可能な更なる脆弱な血管状態には、血液供給が需要に対して不十分な任意の虚血、低酸素又は損傷状態が含まれる。脆弱な血管状態は、血液供給に負の影響を与える任意の損傷又は修復から生じる可能性がある。代表的な脆弱性には、幾つかの例を挙げると、不安定動脈症候群、例えば虚血、運動により誘導される狭心症から安静時の狭心症にわたる不安定性の範囲を含む心臓の不安定狭心症、大動脈虚血、間欠性跛行から壊疽にわたる広範な状態を含む末梢虚血、腸内の腸管虚血、及び腎虚血が含まれる。
【0035】
本発明の特定の実施形態では、損傷又は疾病した標的内皮が、本発明の移植可能な流動性組成物により、最初の血管介入、例えば、血管形成術、ステント留置術又は吻合形成時に処置される。当該処置により、該血管介入に起因する損傷、例えば、血管形成術に起因する内皮剥離を低減することができる。他の実施形態によれば、移植可能な流動性組成物が、例えば、血管介入の後、並びに再狭窄又は閉塞性血栓症を含むが、これらに限定されない、介入に関連した臨床的動脈症の発現の後に、損傷又は疾病した標的内皮を救助するために投与される。
【0036】
本発明の特定の実施形態では、移植可能な流動性組成物の投与前、投与と同時、及び/又は投与後に、更なる治療薬が投与される。例えば、血塊形成、血小板凝集、又はその他の同様の妨害物を防止するか又は減少させる薬剤を投与することができる。代表的な薬剤には、例えば、ヘパラン硫酸及びTGF−βが含まれる。移植片の適応に応じて、再内皮化を促進するVEGF、及び血管統合を促進するb−FGFを含めたその他のサイトカイン又は増殖因子も、移植可能な流動性組成物に組み込むことができる。他の種類の治療薬には、抗増殖薬及び抗悪性腫瘍薬が含まれるが、これらに限定されない。例としては、ラパマイシン、パクリタキセル及びE2Fデコイ薬が含まれる。前述の何れも局所又は全身に投与することができるが、局所投与の場合は、移植可能な流動性組成物中に特定の薬剤が含有されてもよい。
【0037】
細胞源:本明細書で説明するように、本発明の移植可能な材料は、細胞を含む。細胞は、同種異形細胞、異種細胞、または自己細胞とすることができる。特定の実施形態においては、生体細胞株は、適切なドナーから導出することができる。特定の他の実施形態においては、細胞株は、死体からまたは細胞バンクから導出することができる。
【0038】
1つの現在好適な実施形態においては、細胞は、内皮細胞である。特に好適な実施形態においては、当該内皮細胞は、血管組織、好ましくは、動脈組織(であるが、これに限定されない)から取得することができる。以下に例示するように、使用に適切な1つの種類の血管内皮細胞は、大動脈内皮細胞である。使用に適切な別の種類の血管内皮細胞は、臍帯静脈内皮細胞である。また、使用に適切な別の種類の血管内皮細胞は、冠動脈内皮細胞である。更に、本発明との使用に適切な別の種類の血管内皮細胞としては、肺動脈内皮細胞、腸骨動脈内皮細胞がある。
【0039】
別の現在好適な実施形態においては、適切な内皮細胞は、非血管組織から取得することができる。非血管組織は、本明細書の他の部分で説明するような任意の管状解剖学的構造体から導出することができるか、または、任意の非血管組織前駆細胞または器官から導出することができる。
【0040】
更に別の実施形態においては、内皮細胞は、血管内皮前駆細胞または幹細胞から導出することができ、尚も別の実施形態においては、内皮細胞は一般的に、前駆細胞または幹細胞から導出することができる。他の好適な実施形態においては、細胞は、血管組織または非血管組織または器官から導出される、非内皮の同種異形細胞、異種細胞、自己細胞とすることができる。また、本発明は、遺伝子学的に変更、改変、または加工される前出細胞のいずれも企図している。
【0041】
更なる実施形態においては、本発明の組成物を形成するために2つまたはそれ以上の種類の細胞が共培養される。例えば、第1の細胞を生体適合性移植可能な材料に導入して、融合するまで培養することができる。第1の細胞型としては、平滑筋細胞、線維芽細胞、幹細胞、内皮前駆細胞、平滑筋細胞と線維芽細胞の組み合わせ、任意の他の所望の細胞型、または、内皮細胞成長を助長する環境の創出に適切な所望の細胞型の組み合わせを挙げることができる。第1の細胞型が融合に到達すると、第2の細胞型が、生体適合性基質内、生体適合性基質上、または生体適合性基質の範囲内で第1の融合細胞型上に播種され、第1の細胞型と第2の細胞型が融合に到達するまで培養される。第2の細胞型としては、例えば、内皮細胞または任意の他の所望の細胞型または細胞型の組み合わせを挙げることができる。第1及び第2の細胞型を段階的に、または、単一の混合体として導入することができることが企図されている。また、平滑筋細胞と内皮細胞の比率を変えるために細胞密度を改変することができることが企図されている。
【0042】
平滑筋細胞または過度の増殖になりやすい別の細胞型の過剰増殖を防止するために、培養法を改変することができる。例えば、第1の細胞型の融合後、培養体に、第2の細胞型導入前に第2の細胞型に適切な付着因子を被覆することができる。例示的な付着因子としては、内皮細胞の付着を向上させるために行われるゼラチンでの培養体の被覆がある。別の実施形態によれば、第2の細胞型培養中にヘパリンを培地に添加して、第1の細胞型の増殖を低減し、かつ、所望の第1の細胞型と第2の細胞型の比率を最適化することができる。例えば、平滑筋細胞の初期成長後、ヘパリンを投与して、平滑筋細胞の成長を抑制して、より大きな内皮細胞と平滑筋細胞の比率を達成することができる。
【0043】
好適な実施形態においては、共培養体の形成は、まず、生体適合性移植可能な材料に平滑筋細胞を播種して血管構造体を形成することによって行われる。平滑筋細胞が融合に到達すると、移植可能な材料上の培養平滑筋細胞上に内皮細胞を播種して、擬似血管を形成する。本明細書で説明する方法に従ってこの実施形態を、例えば、AV移植片または末梢バイパス移植片に投与すると、プロテーゼ移植片材料の整合を促進することができる。
【0044】
本発明の組成物の細胞に必要なのは、1つまたはそれ以上の好適な表現型または機能特性を示すことである。本明細書で先述したように、本発明は、好適な基質(本明細書の他の部分で説明)と関連づけられたときに容易に特定可能な表現型を有する細胞は、動静脈瘻または動静脈移植片などの血管アクセス構造体の処置に関連した血管内皮細胞の生理機能および内腔ホメオスタシス、もしくは血管内皮細胞の生理機能または内腔ホメオスタシスを助長し、回復し、かつ、他の方法で調節するか、もしくは、助長するか、回復するか、かつ、他の方法で調節することができるという発見事項に基づくものである。
【0045】
本発明の目的上、本発明の細胞の特色を示す1つの当該好適な、容易に特定可能な表現型は、以下で説明する体外分析で判断されるような平滑筋細胞の増殖を抑制するかまたは他の方法で妨げることができる点である。これは、本明細書では抑制性表現型という。
【0046】
本発明の組成物の細胞によって示される別の容易に特定可能な表現型は、抗血栓性であるか、または、血小板付着または凝集を抑制することができるという点である。抗血栓性作用は、以下で説明する体外ヘパラン硫酸分析および体外血小板凝集分析、もしくは体外ヘパラン硫酸分析または体外血小板凝集分析で判断することができる。
【0047】
本発明の一般的な具体実施形態においては、細胞は、前出の表現型のうち、2つ以上を示さなくてもよい。特定の実施形態においては、細胞は、前出の表現型のうち、2つ以上を示すことができる。
【0048】
前出の表現型は、各々、血管内皮細胞(であるがこれに限定されない)など、機能的内皮細胞の典型であるが、上記の表現型を示す非内皮細胞は、本発明の目的上、内皮的であり、したがって、本発明との使用に適切であると考えられる。内皮的である細胞は、本明細書では、内皮細胞の機能的類似体または内皮細胞の機能的模倣体ともいう。したがって、一例のみとして、本明細書で開示する材料および方法との使用に適切な細胞としては、内皮的細胞を生じる幹細胞または前駆細胞、元は非内皮細胞であるが本明細書で定めるパラメータを使用して機能的に内皮細胞的に機能する細胞、本明細書で定めるパラメータを使用して内皮的な機能性を有するように加工または他の方法で改変される任意の起源の細胞がある。
【0049】
一般的に、本発明の細胞は、融合、近融合、または融合後の集団内にあってかつ本明細書の別の部分で説明するものなどの好適な生体適合性基質と関連づけられたときに前出の表現型の1つまたはそれ以上を示す。当業者によって認識されるように、細胞の融合、近融合、または融合後の集団は、様々な手法によって容易に特定可能であり、様々な手法のうち最も一般的でありかつ広く容認されているものは、直接鏡検である。その他には、血球計または自動血球計数装置など(であるがこれらの限定されない)の標準細胞数算定法を用いて細胞数/表面積の評価がある。
【0050】
更に、本発明の目的上、内皮的細胞としては、本明細書で定めるパラメータによって判断されるような融合、近融合、または融合後の内皮細胞を機能的および表現型的にエミュレートする、または模倣する細胞があるが、これらに限定されない。
【0051】
したがって、以下に定める詳細な説明および手引きを用いて、当業者である施術者は、本明細書で開示する移植可能な材料の具体実施形態を形成、使用、試験、および特定する方法を認識するであろう。即ち、本明細書で提示する教示内容では、本発明の移植可能な材料の形成および使用に必要な全てが開示されている。また、更に、本明細書で提示する教示内容では、動作面で均等な細胞含有組成物の特定、形成および使用に必要な全てが開示されている。根本的には、必要なのは、均等な細胞含有組成物が本明細書で開示する方法に従って血管アクセス構造体を処置するのに有効であることである。熟練施術者によって理解されるように、本発明の組成物の均等な実施形態は、本明細書で提示する教示内容と共に通常の実験のみを用いて特定することができる。
【0052】
特定の好適な実施形態においては、本発明の移植可能な材料で使用される内皮細胞は、ヒトの死体ドナーの大動脈から単離される。細胞の各ロットは、内皮細胞清潔度、生物学的機能、細菌、カビ、公知のヒト病原体および他の偶発性物質の存在について広範囲に試験された単一のまたは複数のドナーから導出される。細胞は、生体適合性移植可能な材料におけるその後の形成に備えて、培養におけるその後の伸長に向けて周知の手法を用いて凍結保存されて貯蔵される。
【0053】
細胞調製:上述したように、適切な細胞は、様々な組織型および細胞型から取得することができる。特定の好適な実施形態においては、本移植可能な材料において使用されるヒト大動脈内皮細胞は、死体ドナーの大動脈から単離される。他の実施形態においては、ブタ大動脈内皮細胞(Cell Applications、カリフォルニア州サンディエゴ)は、ヒト大動脈内皮細胞の単離に使用されるのと類似の手順によって正常なブタ大動脈から単離される。細胞の各ロットは、内皮細胞生存力、清潔度、生物学的機能、マイコプラズマ、細菌、カビ、酵母、公知のヒト病原体および他の偶発性物質の存在について広範囲に試験された単一のまたは複数のドナーから導出される。細胞は更に、培養におけるその後の伸長に向けて、および、生体適合性移植可能な材料におけるその後の調製に向けて、周知の手法を用いて、伸長され、特徴づけられて、3回から6回の通過で作業用細胞バンクを調製するために凍結保存される。
【0054】
ヒトまたはブタ大動脈内皮細胞の調製は、フラスコ当たり約15mlの内皮細胞成長培地の添加で予め準備されたT−75フラスコ内で行われる。ヒト大動脈内皮細胞は、Endothelial Growth Media(EGM−2、Cambrex Biosciences、ニュージャージ州イーストラザーフォード)で調製される。EGM−2は、2%FBSを含むEGM−2 Singlequotsで補足されたEndothelial Cell Basal Media(EBM−2、Cambrex Biosciences)からなる。ブタ細胞は、5% FBSと50μg/mlゲンタミシンとで補足されたEBM−2で調製される。フラスコを、約37℃、5%CO2/95%空気、90%湿度にて維持された培養器内に30分間設置する。細胞の1つまたは2つのバイアルを−160℃から−140℃の冷凍装置から取り出して、約37℃で解凍する。各バイアルの解凍した細胞を2つのT−75フラスコ内に約3x103細胞/cm3、好ましくは1.0x103を上回るが7.0x103を下回る密度で播種して、細胞が入ったフラスコを培養器に戻す。約8時間から24時間後、使用済み培地を取り出して新しい培地と交換する。培地は、細胞が約85%から100%の融合、好ましくは、60%を上回るが100%を上回らない融合に到達するまで、2日から3日毎に変える。移植可能な材料が臨床的用途を目的としたとしたものであるとき、抗生物質なしの培地のみが、ヒト大動脈内皮細胞の解凍後の培養体内で、かつ、本発明の移植可能な材料の製造において使用される。
【0055】
その後、内皮細胞成長培地を取り出して、細胞の単層を10mlのHEPES緩衝食塩水(HEPES)で洗浄処理する。HEPESを取り除いて、2mlのトリプシンを加えて、細胞をT−75フラスコから脱離させる。脱離が行われたら、3mlのトリプシン中和液(TNS)を加えて酵素反応を停止させる。更に、5mlのHEPESを加えて、血球計を使用して細胞数を数える。細胞浮遊を遠心分離処理して、ヒト細胞の場合には、抗生物質なしでEGM−2を使用して約1.75x106個のセル、ブタ細胞の場合には、5%FBSと50μg/mlゲンタミシンで補足されたEBM−2を使用して約1.50x106個の細胞/mlの密度に調整する。
【0056】
生体適合性基質: 本発明によれば、移植可能な流動性組成物の好ましい一実施形態が、ゲル、フォーム、懸濁液、マイクロキャリア、マイクロカプセル、流動性線維構造、又はその他の流動性材料の形態の生体適合性基質を含む。該生体適合性基質は、細胞の増殖、並びに基質に対する、基質上の又は基質内部における結合に許容性がある。該生体適合性基質は、例えば血管の外面に移植されると、生物浸食する約7〜90日間、好ましくは少なくとも約7〜14日間、より好ましくは少なくとも約14〜28日間、最も好ましくは少なくとも約28〜90日間移植部位に留まることができる。
【0057】
本発明において、流動性組成物とは、針、注射器又はカテーテルを含むが、これらに限定されない注入又は注入型の送達デバイスを使用した投与が可能な組成物を意味する。押出、放出又は駆出を使用するその他の送達デバイスも、本発明で想定される。血管内部の長さに沿って誘導される血管内投与、又は局所経皮投与の何れかが可能な注入型送達デバイスと共に使用する生体適合性基質の任意の非固体製剤が、本明細書で想定される。好ましい流動性組成物は、形状保持性を有する。本明細書で想定される、流動性微粒子基質に移植された細胞を含む移植可能な流動性組成物は、内径が22ゲージ〜26ゲージの範囲の針、長さが約1〜20mmの範囲の針を含む任意の注入用送達デバイスと共に使用するよう処方される。好ましい注入用送達デバイスは、培地約1〜約3ml中に約100万細胞を含有する移植可能な微粒子材料約50mgを送達することができる。
【0058】
本発明の目下好ましい実施形態によれば、該流動性組成物が、生体適合性微粒子基質、例えば豚皮膚ゼラチン由来の製品であるGelfoamO粒子、GelfoamO粉末、又は微粉砕GelfoamO(Pfizer Inc.[米国ニューヨーク州ニューヨーク])(以下「Gelfoam粒子」と称する)を含む。別の実施形態によれば、該生体適合性微粒子材料が、架橋したデキストラン基質に結合した変性コラーゲンを含むCytodex−3(Amersham Biosciences[米国ニュージャージー州ピスカタウェイ])マイクロキャリアとなる。代替の実施形態によれば、生体適合性の移植可能な微粒子基質が、修飾アルギネート粒子;加水分解により分解される合成ポリマーのような生体適合性ポリマー、例えば、ポリ酢酸、ポリグリコール酸及びそのコポリマーのようなポリヒドロキシ酸;ポリオルトエステル;ポリ無水物;ゼラチン、コラーゲン、フィブリンゲルのようなタンパク質;又はセルロース及びセルロース誘導体、キトサン、アルギネート若しくはその組み合わせのような炭水化物若しくは多糖類を含む。生体適合性基質は、流動性組成物の投与後数日間、数週間又は数ヶ月の間に徐々に消失することができる材料である。分解の速度は、選択する生体適合性基質に依存しており、処置及び臨床的状況の性質に基づき変更することができる。
【0059】
別の実施形態によれば、移植可能な微粒子基質が、変更した微粒子基質となってもよい。移植可能な微粒子基質の変更は、細胞が移植可能な微粒子基質と結合する場合、前述のような細胞の表現型(例えば、抑制表現型)を含む細胞機能を最適化及び/又は調節するように選択することができる。一実施形態によれば、移植可能な微粒子基質の変更に、平滑筋細胞の増殖を抑制し、炎症を低下させ、ヘパラン硫酸産生を増大させ、プロスタサイクリン産生を増大させ、及び/又はTGF−β1産生を増大させる細胞の能力を向上させる付着因子又は接着ペプチドで粒子を被覆することが含まれる。代表的な付着因子には、例えば、フィブロネクチン、フィブリンゲル、及び標準的な水性カルボジイミド化学構造を使用する共有結合した細胞接着リガンド(例えばRGDを含む)が含まれる。更なる細胞接着リガンドには、RGDY、REDVY、GRGDF、GPDSGR、GRGDY及びREDVを含むが、これらに限定されない細胞接着認識配列を有するペプチドが含まれる。
【0060】
別の実施形態によれば、移植可能な微粒子基質が、Gelfoam以外の粒子となる。更なる代表的な微粒子基質には、例えば、フィブリンゲル、アルギネート、硫酸ポリスチレンナトリウムマイクロキャリア、コラーゲン被覆デキストランマイクロキャリア、PLA/PGA及びpHEMA/MMAコポリマー(各コポリマーのポリマー比率は1〜100%の範囲)が含まれる。好ましい実施形態によれば、前記の更なる微粒子基質が、上に列挙及び記載するような付着因子又は接着ペプチドを含むよう変更される。代表的な付着因子には、例えば、ゼラチン、コラーゲン、フィブロネクチン、フィブリンゲル、及び標準的な水性カルボジイミド化学構造を使用する共有結合した細胞接着リガンド(RGDを含む)が含まれる。更なる細胞接着リガンドには、RGDY、REDVY、GRGDF、GPDSGR、GRGDY及びREDVを含むが、これらに限定されない細胞接着認識配列を有するペプチドが含まれる。
【0061】
別の実施形態によれば、移植可能な微粒子基質が、細胞付着を改善するために物理的に変更されている。一実施形態によれば、移植可能な微粒子基質が、その機械的特性を向上させ、且つ細胞付着及び増殖特性を改善するために架橋されている。好ましい実施形態によれば、最初に硫酸カルシウムを使用してアルギネート粒子が架橋され、続いて塩化カルシウム及び日常的なプロトコールを使用した第二の架橋工程が行われる。別の実施形態によれば、ヘパリン又はヘパラン硫酸源、例えばヘパリン−セファロースが、細胞培養前に基質内に組み込まれる。
【0062】
生体適合性微粒子基質を含む移植可能な流動性組成物は、好ましくは22ゲージ〜26ゲージの内径を有する針を使用して送達できることが想定される。従って、当該基質を形成する粒子は、好ましくは、本明細書に定義するような適切な針の穴を通過することができる直径を有する。好ましい実施形態によれば、当該基質の粒子が、約20μm〜約1000μmの直径、好ましくは約100μm〜約500μmの直径、最も好ましくは約200μmの直径を有する。
【0063】
好ましい微粒子基質の各粒子は、その表面に接着した少なくとも一つの細胞、好ましくは複数の細胞を有する必要がある。従って、各粒子は、選択された細胞型の展開直径よりも大きい直径を有する必要がある。例えば、内皮細胞は、約18μmの展開直径を有する;粒子への複数の内皮細胞の付着を促進するために、各粒子は少なくとも20μmの直径を有する必要がある。
【0064】
好ましい培養管: 本明細書で想定される特定の実施形態では、約50〜60mgのGelfoam粒子が、0.2μmフィルターキャップを有する個々の50mL管(Evergreen[米国カリフォルニア州ロサンゼルス])内に配置される。培地交換時の粒子数の損失を低減するため、培養管は、例えば、キャップ領域又は培養管の内部にフィルターを加えて、培地排除時における粒子の吸引又はその他の意図されない除去を防止することによって、或いは、培養管に仕切りを加えて、培地を通過させるが粒子を通過させない流体連通手段を間に有する、培地と粒子の個別の部分を形成することによって、或いは、粒子を乱さずに開放して培地を注ぎ出すことができる吐水口を培養管の底に加えることによって、変更することができる。
【0065】
移植可能な材料の細胞播種: 細胞播種に先立ち、70%エタノールを添加した後、PBS又はHEPES中で数回漱ぐことによって粒子を調製する。次に、抗生物質を含まないEGM−2中で、約37℃及び5%CO2/95%空気にて12〜24時間粒子を再水和する。更に、粒子約50〜60mgのアリコートを再水和容器から除去して、個々の組織培養皿に入れる。粒子のアリコートを好ましい密度である粒子1mg当たり2×103〜2×104の細胞で播種する。細胞と基質の該混合物をピペットで数回上下させて、均質の懸濁液を形成する。続いて、管を、細胞の付着を促進するように定期的に3〜4時間撹拌して、37℃、5%CO2、湿度90%にてインキュベートする。次に、管毎に更に9mLのEGM−2を添加して(最終培地容積=10mL)、最終粒子容積約5mg粒子/mL培地を得る。
【0066】
その後、細胞がコンフルエンスに達するまで、培地を2〜3日に1回交換する。好ましい一実施形態では、細胞が好ましくは6代継代となるが、より少数回又はより複数回継代した細胞も使用することができる。
【0067】
細胞増殖曲線及びコンフルエンス: 移植可能な流動性組成物のサンプルを、3日目又は4日目、6日目又は7日目、9日目又は10日目、及び12日目又は13日目、又はそれらの前後に除去して、細胞を計数し、生存率を評価する。そして、増殖曲線を構成及び評価して、増殖特性を測定し、ほぼコンフルエンス、コンフルエンス、又はコンフルエンス後が達成されたか否かを判定する。豚大動脈内皮細胞移植ロットを含む移植可能な流動性組成物の調製品による代表的な増殖曲線を、図1に示す。前記例では、移植可能な材料が微粒子形態となる。一般的に、当業者は、早期、中間及び後期の時点における許容可能な細胞増殖の徴候を理解すると思われる。当該徴候には例えば、早期の時点における細胞数の増加の観察(図1を参照すると、約3〜10日目の間)、次にほぼコンフルエントな相(図1を参照すると、約10〜13日目の間)、次に、細胞がコンフルエンスに達した段階での細胞数の横ばい(図1を参照すると、約13〜15日目の間)、並びに細胞がコンフルエント後になった時の細胞数の維持(図1を参照すると、約15〜17日目の間)がある。本発明においては、少なくとも72時間横ばいの状態にある細胞集団が好ましい。
【0068】
細胞の計数は、移植可能な流動性組成物のアリコートを、Gelfoam粒子の場合は0.8mg/mlのコラゲナーゼのトリプシン−EDTA溶液により、又はCytodex−3粒子の場合はデキストラナーゼ及びトリプシン−EDTAの溶液により完全に消化することで達成される。消化された移植可能な流動性組成物の容積を測定した後、既知の容積の細胞懸濁液を0.4%トリパンブルーで希釈して(細胞対トリパンブルー比4:1)、生存率をトリパンブルーの排除により評価する。生存細胞、非生存細胞及び総細胞を、血球計を使用して計数する。生存細胞数対培地中の日数をプロットして、増殖曲線を構成する。細胞は出荷し、コンフルエンスに達した後移植する。
【0069】
本発明において、コンフルエンスとは、生体適合性粒子1mg当たり少なくとも約8×103の細胞、好ましくは50〜70mg粒子のアリコート当たり約7×105〜約1×106の総細胞の存在、並びに好ましくは少なくとも約90%であるが、約80%を下回らない生存率として定義される。細胞生存率は、好ましくは少なくとも約90%であるが、約80%を下回ることはない。細胞が12日目又は13日目までにコンフルエントにならない場合は、培地を交換し、更に一日インキュベーションを継続する。前記工程は、コンフルエンスに達するまで、又は播種後約14日間継続する。工程間検査を実施した結果、細胞がコンフルエントであると判定された場合は、最後の培地交換を実施する。前記の最後の培地交換は、フェノールレッド及び抗生物質を含まないEGM−2を使用して実施する。培地交換の直後、出荷のために管に無菌密封栓キャップを装着する。
【0070】
機能性の評価:本明細書で説明する本発明の目的上、移植可能な材料は、更に、移植前に機能性の兆候がないか試験される。例えば、ならし培地を培養期間中に回収して、培養内皮細胞によって生成される成長因子−β1(TGF−β1)、基本線維芽細胞増殖因子(b−FGF)、窒素酸化物を変換してヘパラン硫酸のレベルを確かめる。特定の好適な実施形態においては、移植可能な材料が本明細書で説明する目的に使用することができるのは、総細胞数が少なくとも約2x105個の細胞/cm3、好ましくは、可撓性平面形態の少なくとも約4x105個の細胞/cm3、生存可能細胞の割合が少なくとも約80%から90%、好ましくは≧90%、最も好ましくは少なくとも約90%、ならし培地中のヘパラン硫酸が少なくとも約0.5microg/106個の細胞/日から1.0microg/106個の細胞/日、好ましくは少なくとも約1.0microg/106個の細胞/日のときである。ならし培地中のTGF−β1は、少なくとも約200picog/ml/日から300picog/ml/日、好ましくは少なくとも約300picog/ml/日、ならし培地中のb−FGFは、約200picog/ml未満、好ましくはわずか約400picog/mlである。
【0071】
ヘパラン硫酸レベルは、通常のジメチルメチレン・ブルーコンドロイチナーゼABC分離分光光度計検定を用いて計ることができる。全硫酸化グリコサミノグリカン(GAG)レベルの判断は、回収培地中で希釈した公知の量の精製コンドロイチン硫酸を使用して生成した標準的曲線と未知の試料を比較するジメチルメチレンブルー(DMB)色素結合検定を用いて行う。DMB発色試薬の添加前にコンドロイチンおよびデルマタン硫酸を分離するようにならし培地の更なる試料をコンドロイチナーゼABCと混合させる。一般的に515nmから525nmであるGAG標準と混合させたDMB色素の最大波長吸収度にて全ての吸収度を判断する。ヘパラン硫酸/106個の細胞/日の濃度の計算は、方法としては、ならし培地試料中の全硫酸化グリコサミノグリカン濃度からコンドロイチンおよびデルマタン硫酸の濃度を差し引く。コンドロイチナーゼABC活性は、精製コンドロイチン硫酸の試料を分離することとで確認する。ならし培地試料は、分離量が精製コンドロイチン硫酸の100%未満であった場合は妥当に補正する。また、ヘパラン硫酸レベルは、単クローン抗体を採用するELISA検定を用いて計ることができる。
【0072】
TGF−β1レベルおよびb−FGFレベルは、単クローン抗体または多クローン抗体、好ましくは多クローンを採用するELISA検定を用いて計ることができる。また、調製回収培地は、ELISA検定を用いて計ることができ、試料は、調製培地に存在するTGF−β1レベルおよびb−FGFレベルについて妥当に補正することができる。
【0073】
窒素酸化物(NO)レベルは、標準的なGries反応検定を用いて計ることができる。窒素酸化物の性質が過渡的かつ揮発性であるために、大半の検出方法には不適切なものとなっている。しかしながら、窒素酸化物の2つの安定した分解生成物、硝酸塩(NO3)および亜硝酸塩(NO2)は、通常の分光法を用いて検出することができる。Gries反応検定では、硝酸還元酵素がある場合には亜硝酸塩が硝酸塩に酵素によって変換される。亜硝酸塩は、約540nmの範囲の可視光を吸収する着色アゾ染料生成物として比色分析で検出される。システム中に存在する窒素酸化物のレベルの判断は、全ての亜硝酸塩を硝酸塩に変換し、未知の試料中の亜硝酸塩の総濃度を判断し、その後、亜硝酸塩に変換された硝酸塩の公知の量を用いて生成された標準的な曲線と結果的に得られる亜硝酸塩濃度を標準的な曲線と比較することで行う。
【0074】
先述した好適な抑制表現型の評価は、上述した定量的ヘパラン硫酸検定、TGF−β1検定、NOおよびb−FGF検定、もしくはヘパラン硫酸検定、TGF−β1検定、NOまたはb−FGF検定、ならびに、以下のような平滑筋細胞成長および血栓症抑制の定量的体外検定を用いて行う。本発明の目的上、移植可能な材料は、これらの代替体外検定の1つまたはそれ以上によって移植可能な材料が好適な抑制表現型を示していると確認されたときに移植準備完了状態である。
【0075】
体外で平滑筋細胞成長の抑制を評価するために、培養内皮細胞に関連した抑制の大きさを判断する。平滑筋細胞成長培地(SmGM−2、Cambrex Bioscience)中で24穴組織培養プレート内にブタ大動脈平滑筋細胞またはヒト大動脈平滑筋細胞をまばらに播種する。細胞を24時間かけて自然付着させる。その後、48時間から72時間かけて、培地を、0.2%FBSを含む平滑筋細胞基本培地(SmBM)と入れ換えて細胞の成長を抑止する。ならし培地をコンフルエント後の内皮細胞培養液から形成し、2X SMC成長培地と1:1で希釈して、培養液に加える。平滑筋細胞成長抑制の正の制御が、各検定において含まれる。3日から4日後、コールターカウンタを使用して各試料内の細胞数を数え上げる。平滑筋細胞増殖に対するならし培地の効果の判断は、ならし培地の添加直前のウェル当たりの平滑筋細胞数を、3日から4日間ならし培地と調製培地(成長因子の有無を問わず標準的な成長培地)とに晒した後のウェル当たりの平滑筋細胞数を比較することで行う。ならし培地試料に関連した抑制の大きさを正の制御に関連した抑制の大きさと比較する。好適な実施形態によれば、移植可能な材料は、ヘパラン制御が可能である抑制の約20%をならし培地が示した場合には抑制力があるみなされる。
【0076】
体外で血栓症を評価するために、培養内皮細胞にかけたヘパラン硫酸のレベルを判断する。ヘパラン硫酸は、抗増殖性特性も抗血栓性特性も有する。通常のジメチルメチレン・ブルーコンドロイチナーゼABC分離分光光度計検定またはELISA検定を用いて(両検定は、詳細に先に説明)、106個の細胞当たりのヘパラン硫酸の濃度を計算する。ならし培地中のヘパラン硫酸が少なくとも約0.5microg/106個の細胞/日から1.0microg/106個の細胞/日、好ましくは少なくとも約1.0microg/106個の細胞/日であるとき、本明細書で説明する目的に向けて移植可能な材料を使用することができる。
【0077】
血栓症の抑制を評価する別の方法では、多血小板血漿に関連した体外にて血小板凝集能の抑制の大きさを判断する。室温でクエン酸ナトリウムをブタ血液試料に添加してブタ血漿を取得する。緩やかな速度で、遠心分離機でクエン酸塩添加血漿を分離させて、赤血球および白血球を小球状にすると、血漿中に浮遊する血小板が残る。コンフルエント後の内皮細胞培養液からならし培地を形成して、一定分量の多血小板血漿に添加する。血小板凝集剤(作用薬)を対照として血漿に添加する。血小板作用薬としては、一般に、アラキドン酸、ADP、コラーゲン、エピネフリン、リストセチン(ミズーリ州セントルイスのSigma−Aldrich Co.より販売)がある。更なる一定分量の血漿では、基線自然血小板凝集について評価するために血小板作用薬またはならし培地は添加されない。また、血小板凝集の正の制御は、各検体に含められる。血小板凝集抑制の例示的な正の制御としては、アスピリン、ヘパリン、アブシキマブ(ReoPro(登録商標)、Eli Lilly、インディアナ州インディアナポリス)、チロフィバン(Aggrastat(登録商標)、Merck & Co.、Inc.、ニュージャージ州ホワイトハウスステーション)、またはエプチフィバチド(Integrilin(登録商標)、Millennium Pharmaceuticals, Inc.、マサチューセッツ州ケンブリッジ)がある。その後、全ての試験条件の結果的に得られる血小板凝集を、血小板凝集計を使用して測定する。血小板凝集計は、光学的密度をモニタすることで血小板凝集を測定するものである。血小板が凝集するにつれて、試料を通過することができる光が増える。血小板凝集計は、「血小板凝集単位」、つまり、血小板が凝集する速度の関数での結果を知らせる。凝集能の判断は、作用薬添加後6分にて最大凝集能と評価される。血小板凝集に対するならし培地の効果は、ならし培地添加前の基線血小板凝集をならし培地を正の制御と多血小板血漿が晒された後の基線血小板凝集と比較することで行う。結果は、基線の百分率で表される。ならし培地試料に関連した抑制の大きさを正の制御に関連した抑制の大きさと比較する。好適な実施形態によれば、移植可能な材料は、ならし培地が正の制御が可能である制御の約20%を示した場合には抑制力があるとみなされる。
【0078】
輸送容器: 培地交換の直後、出荷のために移植可能な流動性組成物を包装する。一実施形態によれば、移植可能な材料上での細胞の培養に使用した同一の培養管に、出荷のために無菌密封栓キャップを装着する。最終の濯ぎ中に粒子及び/又は細胞をデカントする危険性を低減するため、出荷容器は、例えば、培養液及び濯ぎ溶液を通過させるが、粒子及び/又は細胞をデカントできない大きさの穴を有するフィルター又はその他の封入デバイスを含むように変更することができる。
【0079】
移植可能な流動性組成物が、血清を含有する培地中で出荷される場合、移植直前に、移植可能な流動性組成物を、好ましくは培養管内で濯ぐ。次に、輸送容器からフィルター又はその他の封入手段を取り外して、細胞が移植された粒子を送達のために注射器内に引き入れる。過剰な濯ぎ溶液を注射器及び針から排出し、処置部位への送達のためにカテーテル又はその他の送達デバイスを注射器に取り付ける。次に、流動性組成物を、例えば、以下に述べる代表的な投与方法の一つに従って患者に送達する。移植可能な流動性組成物が血清フリー培地中で輸送される場合、臨床の現場では最終の濯ぎ工程を実施する必要はない。
【0080】
代替の実施形態によれば、移植可能な流動性組成物が、約1〜20mlの培地と共に、即ち輸送及び保管に十分な容積の培地と共に培養管から注射器内に引き入れられ、注射器にキャップが装着されて、材料が密封した注射器内に出荷される。移植の現場において、過剰の培地は注射器から排出される。次に、針、カテーテル又はその他の送達デバイスが、処置部位への送達のために、注射器に取り付けられる。本実施形態によれば、流動性組成物が、輸送用注射器から直接、患者に送達される。
【0081】
本発明の移植可能な組成物は、例えばフィルターキャップで変更された50ml又は60mlの密封した組織培養容器、又は予め充填された注射器を含む最終製品容器内で供給されてもよく、それぞれ、好ましくは、アリコート当たり約45〜60ml、好ましくは約50mlの内皮細胞増殖培地中で、約7×105〜約1×106の総内皮細胞が移植された約50〜60mgの微粒子材料を含有する。患者当たりの総細胞負荷は、好ましくは体重1kg当たり約0.6〜12×104細胞となるが、体重1kg当たり2×103細胞を下回ることはなく、2×105細胞を超えることはない。
【0082】
本明細書で想定されるように、本発明の材料は、一実施形態において粒子1mg当たり好ましくは約1.4〜2.1×104細胞の密度で、好ましくは約90%の生存率の細胞、好ましくは血管内皮細胞を含み、又、コンフルエント又はほぼコンフルエントな時に、少なくとも約0.5〜1.0、好ましくは少なくとも約1.0microg/106細胞/日のヘパラン硫酸を含有する馴化培地を生成する。馴化培地中のTGF−β1は、少なくとも約200〜300、好ましくは少なくとも約300picog/ml/日であり;馴化培地中のb−FGFは、約200picog/ml未満、好ましくは約400picog/ml未満である。
【0083】
別の実施形態によれば、投与前に、1種以上の更なる物質が流動性組成物に添加される。当該物質には、抗炎症薬、グリコサミノグリカン、プロスタグランジン、プロスタノイド、並びにTGF及びVEGFを含むが、これらに限定されないサイトカイン、並びにアンジオテンシン及び関連する化合物、チロシンキナーゼ阻害剤、免疫抑制剤、ビタミン、グルココルチコイド、酸化防止剤、フリーラジカル捕捉剤、ペプチドホルモン、血管形成及び血管形成抑制因子が含まれるが、これらに限定されない。
【0084】
キャリア: 場合により、一実施形態によれば、移植可能な流動性組成物に、キャリア流体が含まれる。好ましいキャリア流体は、投与を容易にするための細胞増殖培地である。移植可能な流動性組成物の研究室における模擬投与では、流動性組成物を取り扱う際に細胞の完全性を保存する上でキャリアが必要ないことが示されている。本明細書に記載したような細胞製剤は、細胞の完全性を保存するために一般的に使用されるキャリア若しくはその他の薬剤;又は非固体若しくは流動性製剤の取り扱いを改善するために、及びせん断力に誘導される破壊を低減するために一般的に使用される薬剤を含まない可能性があることは、予想していない。
【0085】
しかし、キャリアは、例えば、馴化培地の排除及び新しい培地の投入時、輸送前の移植可能な流動性組成物の操作時、材料を送達用注射器に引き入れる時、及び/又は注射器から材料を排出して、血管周囲腔若しくはその他の標的部位内へ送達する時を含めた細胞培養時に、流動性組成物中で細胞のコンフルエンシー及び生存率を向上させる役割を果たす可能性がある。
【0086】
該キャリアは、細胞培養工程の間の様々な時点において、移植可能な材料に投入することができる。例えば、キャリアは、粒子の水和時(細胞播種前)、細胞播種の直前又は播種時に微粒子基質に添加される場合があり、及び/又は細胞培養工程における予定した培地交換中に徐々に微粒子基質に添加される場合がある。キャリアを早期に細胞培養に投入することによって、悪影響を受ける可能性がある細胞が脱落し、残留する細胞が増殖して、十分な細胞集団を維持することができる。
【0087】
或いは、該キャリアは、最終の培地交換中、細胞がコンフルエント又はほぼコンフルエントな時、及び移植の直前に投入してもよい。しかし、未希釈グリセロールキャリアを投与直前に添加すると、おそらく細胞にショックが加わり、所望の細胞生存率及び効力を許容可能なレベル未満に低下させるほどに、窒細胞を息死させる可能性があることが観察されている。前記の所見から、流動性組成物に高粘度のキャリア流体、例えばグリセロールを一度に添加することは、細胞に悪影響を与える可能性があり、回避すべきであることが予想される。
【0088】
その他の候補キャリア流体の効力を評価するため、高い粒子対キャリア比によって最初の試験を実施し、所望の利益を達成する上で必要なキャリアの最小量を判定する。評価する所望の利益には、例えば、細胞の生存率及び効力を維持したままでの取り扱いの改善及び組成物の流動性の改善が含まれる。更に、細胞生存率又は機能に影響を与えることなく、移植可能な組成物の平面形態を移植可能な微粒子の流動性組成物に転換する能力を試験する試験を実施する(全内容が参考として本明細書に組み入れられる、ELV−002PCとしても周知の同時係属出願PCT/USを_______を参照)。例えば、最初の試験溶液には、50mgの粒子に対して僅か約0.1〜1%のキャリア溶液が含まれる。前記濃度を、50mgの粒子に対して最大約10%のキャリア溶液になるまで徐々に増加させる。
【0089】
続く試験を実施し、該試験では、粒子の水和時又は細胞播種時から、培養の全過程を通してキャリア流体を徐々に添加し、移植可能な流動性組成物中の細胞がコンフルエンスに達し、出荷及び/又は患者への投与の準備が整うまで、移植可能な材料中のキャリア流体の濃度を、早期の細胞付着に許容される低いキャリア流体対粒子比からより高い最適比まで増大させる。例えば、代表的なプロトコールによれば、最終的な1%キャリア溶液になるまで、最初の水和時と後の各培地交換時に0.1%のキャリア溶液が微粒子材料に添加される。一部の細胞はキャリア流体の各投入時に損失するものの、殆どの細胞は、キャリアで馴化された移植可能な流動性組成物内に組み込まれ、前記環境でコンフルエンス又はほぼコンフルエンスに達するまで増殖できることが予想される。
【0090】
キャリアには、希釈したグリセロール、アルギネート(好ましくは約1%アルギネート溶液)、デキストラン又は右旋糖(好ましくは約1〜10%デキストラン又はデキストローズ溶液)、並びに例えばブドウ糖、ショ糖及び果糖等のその他の糖、澱粉(好ましくは約6%ヒドロキシエチル澱粉溶液)、ゼラチン(好ましくは約1〜2%ゼラチン溶液)、内皮細胞増殖培地、内皮細胞基礎培地、その他の細胞増殖培地又は中性の緩衝生理食塩水が含まれるが、これらに限定されない。更なる溶液の比率の範囲が想定されるが、本明細書では明確に定義していない。使用する生体適合性基質、該基質に移植される細胞型、及び送達のために選択される投与様式に一部応じた変化が予想される。例えば、最初の水和及びその後の培地交換に使用される細胞培養培地には、選択されるキャリアに応じて、約0.5容積%〜約10容積%のキャリア流体が含まれてもよい。一般的に、選択されるキャリアは、使用する投与量及び濃度にて非細胞毒性でなければならず、又、空気及び栄養物を移植可能な組成物に流入させ(細胞増殖を補助するため)、該組成物から流出させる(細胞老廃物を除去するため)上で十分な透過性を有する必要がある。
【0091】
未希釈グリセロールキャリアの細胞生存率に対する効果: 豚大動脈内皮細胞を100mgのGelfoam粒子上に播種し、コンフルエンスに達するまで増殖させた。該微粒子流動性組成物を回収して、50ml管に入れ、3mlの未希釈グリセロールのアリコートと混合した後、24、26又は27ゲージ針に取り付けた注射器に入れた。全注射器の内容物を、取り付けた針からゆっくりと排出し、50ml管に収集した。排出後に確認できた全細胞の内生存していたのは僅か0〜5%のみであり(細胞の95〜100%が死亡)、グリセロールを添加しない同一試験の細胞の86〜93%という生存率と比べると、コンフルエント細胞に単回投与にて未希釈で添加する前記キャリア液体の細胞生存率に対する有害な影響がはっきりと示されている。前記キャリア流体の使用が、細胞単層のコンフルエンスの維持に有益であるか否かについては判定されていない。
【0092】
平面材料の押出及び変更: 別の実施形態によれば、細胞が移植可能な組成物に十分移植されて、コンフルエンスに達した後、注入用送達デバイスを介して送達できる粒子を形成するように、固体、半固体又は大径の組成物が変更される。一実施形態によれば、材料変更時に細胞のコンフルエンシー及び完全性を維持するように、上で詳述する通り、キャリア流体の存在下で該細胞が培養される。
【0093】
該変更方法の一実施形態によれば、該細胞が移植可能な組成物の平面形態上でコンフルエンスに達した段階で、該組成物が注射器に移される。平面形態に適合するように、該注射器には針がなくてもよければ、穴の大きな針があってもよい。該注射器が可撓性の平面形態を吸引した後、加圧下で、該細胞移植組成物が注射器の開口部から押し出されて、非平面流動性組成物が形成される。好ましい粒子サイズを得るため、注射器からの数回の通過が必要となる場合がある。例えば、材料は、該材料が所望の粒子サイズ及び流動性に達するまで、最初に針のない注射器に通し、次に穴の大きな針に通した後、より穴の小さな針に通することができる。当該材料変更時に細胞の破損量を低減し、細胞のコンフルエンシーを維持するため、複数回の通過及び粒子サイズの漸進的変更が望ましい。
【0094】
外科シーラント: その他の特定の実施形態では、本発明の流動性組成物が更に、特に吻合術のシーラント、又は一般的に外科シーラントの役割を果たすこともできる。当該二重目的の実施形態では、該組成物が又、管状構造の外面と接触する、又は外面上の弧に適用する、又は周囲に適用する際に、複数の管状構造の接合点を封止する、又は管状構造の隙間を封止する上で有効である。当該シーラントは、例えば、血管組織を更に破損し、管腔内皮外傷の原因となる可能性がある、縫合を不要にすることができる。当該シーラントは又、吻合の近くに更なる安定性をもたらすことにより、何れの縫合修復も補強することができる。必要なことは、この二重目的の組成物のシーラントタイプの機能又は性質が、細胞の所望の表現型の同時発現、及び組成物の細胞ベースの機能を妨害せず、損なわないことである。
【0095】
特定のシーラントの実施形態おいて、該流動性組成物は、それ自体が内皮又は内皮様細胞集団を補助する上で必要不可欠な特性を有すると共に、例えばフィブリンネットワーク等のシーラント特性を有する成分を含む生体適合性基材を含む。又、生体適合性基材自体が、シーラント特性、並びに細胞集団の補助に必要な特性の両方を有してもよい。その他の実施形態の場合は、シーラントの機能性が、少なくとも部分的には細胞により寄与される可能性がある。例えば、組成物に結合した細胞は、基材が必要不可欠な細胞の機能性を示す/維持する一方で、シーラント特性を得るように、該基材を変更することができる物質を産生することが想定される。細胞によっては、前記物質を自然に産生できるものもあれば、前記物質を産生するように操作できるものもある。
【0096】
移植可能な流動性組成物の有効期間: コンフルエントな、ほぼコンフルエントな又はコンフルエント後の細胞集団を含む移植可能な流動性組成物は、室温にて安定且つ生存した状態で、少なくとも2週間保持することができる。好ましくは、当該移植可能な流動性組成物が、追加のFBSを含んでも含まなくてもよい約45〜60ml、より好ましくは約50mlの輸送培地中で保持される。輸送培地は、フェノールレッドを含まないEGM−2培地を含む。FBSは、FBS約10%又は総FBS濃度約12%になるまで、輸送培地の容積に添加することができる。しかし、FBSは、移植前に移植可能な流動性組成物から除去する必要があるため、輸送培地中に使用するFBSの量を制限して、移植前に要する濯ぎ時間を短縮することが好ましい。
【0097】
移植可能な流動性組成物の凍結保存: コンフルエントな、ほぼコンフルエントな又はコンフルエント後の細胞集団を含む移植可能な流動性組成物は、最終的な解凍時に臨床的有効性又は完全性を低下させることなく、保管及び/又は診療所への輸送のために凍結保存することができる。好ましくは、移植可能な流動性組成物が、15mlクライオバイアル(Nalgene(R)、Nalge Nunc Int’l[米国ニューヨーク州ロチェスター])内で、約10%のDMSO、約2〜8%のデキストラン及び約50〜75%のFBSを含有する約5mlのCryoStor CS−10溶液(BioLife Solutions[米国ニューヨーク州オスウィーゴ])の溶液中で凍結保存される。クライオバイアルは、冷イソプロパノール水浴内に入れて、−80℃の冷凍庫に4時間移され、その後液体窒素(−150〜−165℃)に移される。
【0098】
次に、移植可能な流動性組成物の凍結保存アリコートを、室温で約15分間かけてゆっくり解凍した後、室温の水浴内で更に約15分間解凍する。次に、該材料を約15mlの洗浄培地中で約3回洗浄する。洗浄培地は、フェノールレッドを含まず、50μg/mlゲンタマイシンを含んでも含まなくてもよいEBMを含む。最初の2回の濯ぎ工程は、室温にて約5分間実施し、最後の濯ぎ工程は、5%CO2中で37℃にて約30分間実施する。
【0099】
解凍及び濯ぎ工程の後、該凍結保存材料を約10mlの回収溶液中で約48時間静止させる。豚内皮細胞の場合は、回収溶液が、5%CO2中で37℃にて5%FBS及び50μg/mlゲンタマイシンで補充したEBM−2となる。ヒト内皮細胞の場合は、回収溶液が、抗生物質を含まないEGM−2となる。使用前及び/又は保管若しくは輸送のための包装の前に、更に解凍後の調整を少なくとも24時間実施することができる。
【0100】
送達デバイス内の充填及び取り込み: 上に詳述する通り、流動性組成物のアリコートを、血清を含んでも含まなくてもよい約45〜60ml、好ましくは約50mlの輸送培地中で、培養管又は注射器にて包装及び輸送し、細胞を培地交換せずに14日目まで保持することができる。移植に先立ち、過剰な培地をデカントし、輸送培地中に血清が存在する場合は、移植可能な流動性組成物を数回濯いで、残留する全血清を除去する。微粒子形態の移植可能な流動性組成物の特定の調製品は、分離しやすく、従って細胞コンフルエンスを損失しやすいため、該組成物は、最終の濯ぎ工程時に輸送容器内に残留させる必要がある。更に、操作時に移植可能な流動性組成物の完全性を保持するため、フィルター及び/又は別個の培地区画を含むが、これらに限定されない輸送容器に変更することが好ましい。
【0101】
移植可能な流動性組成物を数回濯いだ後、約1〜3mlの濯ぎ溶液を移植可能な流動性組成物の上に残留させることで、材料の送達デバイス、例えば注射器内への取り込みが容易になるようにする。次に、送達デバイスを操作して、コンフルエント細胞層の破壊が最小限となるように注意しながら、移植可能な流動性組成物を送達デバイスに引き込む。別の実施形態によれば、材料充填デバイス、例えば輸送容器の開口部と送達注射器の間にある漏斗形状の接合部分を使用して、材料を送達デバイスに移し、細胞の破壊を低減する。材料を送達デバイスに移した後、残留液の一部、約1mlを送達デバイスから排出して、送達デバイスを充填し、空隙容積を満たす。患者に送達する移植可能な流動性組成物中には、約0〜2mlの濯ぎ溶液が残留している。以上で移植可能な流動性組成物は、処置部位への送達の準備が完了となる。
【0102】
針通過: 本発明の有用性を示すために、好ましい移植可能な微粒子の流動性組成物(Gelfoam粒子に移植したHAE)の一種を、22ゲージ針(内径0.016インチ)の開口部から通過させた。或いは、別の好ましい組成物(Gelfoam粒子に移植したPAE)を、約21ゲージ針(内径0.019インチ)〜28ゲージ針(内径0.007インチ)の範囲内の針の開口部から通過させた。
【0103】
以下の表1に示すように、前記範囲内の内径を有する針を介した本発明の実施形態の通過は、針通過細胞の細胞数、生存率又は機能性に悪影響を与えることはない。細胞調製品が、コンフルエンス又は機能性に影響又は損失を与えることなく、21ゲージ(内径0.019インチ)〜30ゲージ(内径0.006インチ)の範囲、好ましくは24ゲージ(内径0.012インチ)の開口部から取り込まれ及び放出される可能性があることは、予想していない。又、該細胞が、キャリア流体としての細胞増殖培地のみを伴って針を通過した後にこのように良好に働くことも予想していなかった。
【0104】
前述の通り、細胞は微粒子基質と混合され、コンフルエンスに達するまで増殖された。コンフルエンスから3日後に、得られた流動性組成物を、約0.007インチ〜約0.018インチの範囲の内径を有する無菌針に通過させ、収集し、内皮細胞増殖培地(EGM−2)中で48時間回復させた。回復期間の後、培地を24時間馴化し、次に、通過後の細胞の馴化培地を評価した。通過後の馴化培地は、基本の線維芽細胞増殖因子(b−FGF)、ヘパラン硫酸(HS)及び形質転換増殖因子−β1(TGF−β1)産生の許容可能なレベルについて評価した。更に、培地による平滑筋細胞増殖の抑制を示すために、平滑筋細胞アッセイを実施し、針通過組成物のアッセイの結果を、針を通過させていないサンプルの結果と比較した。
【0105】
【表1】

カテーテル通過: 本発明の流動性組成物の予想外の性質に関する別の証明では、好ましい製剤が注入及び/又は貫通手段、例えば、針カテーテルに充填され、該手段を介して投与されている(表2)。一試験では、該針カテーテルが、薄壁のニチノール針(外経24ゲージ;内径22ゲージ)を組み込んだ6フレンチカテーテル(Trans Vascular Corp.[米国カリフォルニア州パロアルト])であった。
【0106】
前記範囲内の内径を有する針カテーテルを介した流動性組成物の通過は、通過後の細胞の細胞数、生存率又は生物学的産出量に悪影響を与えることはなかった。好ましい実施形態によれば、細胞は微粒子基質上に播種され、コンフルエンスに達するまで増殖された。コンフルエンスから3日後、流動性組成物を、約0.007インチ〜約0.018インチの範囲内の内径を有する無菌針カテーテルに通過させ、収集し、内皮細胞増殖培地(EGM−2)中で24時間回復させた。回復期間の後、培地を24時間調整した。次に、針通過細胞の馴化培地を評価した。通過後の馴化培地を、基本の線維芽細胞増殖因子(bFGF)、ヘパラン硫酸(HS)及び形質転換増殖因子−β1(TGF−β1)産生の許容可能なレベルについて評価した。更に、培地による平滑筋細胞増殖の抑制を示すために、平滑筋細胞アッセイを実施し、針通過細胞のアッセイの結果を、針カテーテルを通過していない細胞移植微粒子材料サンプルの結果と比較した(表2を参照)。
【0107】
【表2】

血管内投与: 該流動性組成物は、腔内に、即ち血管内に投与することができる。例えば、該組成物は、処置する血管内に挿入可能な任意のデバイスにより送達することができる。内視鏡誘導システムを使用して、送達デバイスを投与部位に配置する場合もあり、該システムには、例えば、血管内超音波(IVUS)、カラードップラー超音波、複合超音波、その他の日常的な超音波、血管造影、磁気共鳴血管造影(MRA)、磁気共鳴映像法(MRI)、CTスキャン、ステントの位置を特定する透視検査、及び/又は当該技術分野にて周知のその他の内視鏡誘導システムが含まれる。更に、投与部位は、触覚による腹部触診により特定される場合もある。投与部位への製剤の血管内送達は単独で行ってもよければ、他の血管内工程、例えばバルーン血管形成術又はステント若しくはその他のデバイスの移植の前に、これと同時に、又はこの後に組み合わせて行ってもよい。
【0108】
一例では、該腔内送達デバイスが、血管の管腔壁を貫通して、血管の非管腔面に達する横断又は貫通デバイスを備えている。次いで、該流動性組成物を、損傷又は病変した標的部位における、該部位に隣接する、又は該部位の近くにおける血管の非管腔面に沈着させる。
【0109】
本明細書では、管腔外面とも称される非管腔面が、血管の外面又は血管周囲面を含んでもよければ、例えば血管の外膜、中膜又は内膜の内部にあってもよいことが想定される。本発明において、非管腔又は管腔外とは、管腔の内面を除いた任意の面である。
【0110】
本明細書で想定される貫通デバイスでは、例えば、単一の送達ポイント、又は所望の幾何学的構造にて構成された複数の送達ポイントにて、損傷又は病変した標的部位を破壊することなく、血管の非管腔面に流動性組成物を送達することが可能となる。複数の送達ポイントは、幾つかの例を挙げると、例えば、円形、ブルズアイ、又は線状配列にて配列することができる。貫通デバイスは又、例えば複数の送達ポイントを含むバルーンステントのようなステント穿孔機の形態でもあってもよい。
【0111】
経皮投与: 一般的に本発明において、流動性組成物の投与は、処置が必要な部位に、該部位に隣接して、又は該部位の近くに局在化する。移植可能な流動性組成物の沈着部位は管腔外である。本明細書で想定されるように、局在化した管腔外沈着は、以下のように経皮達成されてもよい。
【0112】
流動性組成物は、針、カテーテル又はその他の適切な送達デバイスを使用して、経皮送達されてもよい。該流動性組成物は、誘導法の使用と同時に経皮送達され、処置を必要とする部位への送達を容易にしてもよい。該誘導工程は任意である。内視鏡誘導システムを使用して、管腔外の投与部位を特定してもよく、該システムには、例えば、血管内超音波(IVUS)、カラードップラー超音波、複合超音波、その他の日常的な超音波、血管造影、磁気共鳴血管造影(MRA)、磁気共鳴映像法(MRI)、CTスキャン、ステントの位置を特定する透視検査、及び/又は当該技術分野にて周知のその他の内視鏡誘導システムが含まれる。更に、投与部位は、触覚による腹部触診により特定される場合もある。血管周囲腔内に進入したら、臨床医は、処置が必要な部位における、該部位に隣接する、又は該部位の近くにおける管腔外部位上に流動性組成物を沈着させる。該誘導又は同定工程は、任意で実施され、本発明の方法の実施に必須のものではない。
【0113】
別の実施形態では、移植可能な流動性組成物が、処置が必要な部位における、該部位に隣接する、又は該部位の近くにおける、外科的に露出された管腔外部位に局所送達される。この場合、送達は、処置が必要な部位を直接観察することによって誘導及び指向される。又この場合、送達は、前述の同定工程の同時使用により補助されてもよい。繰り返しになるが、該同定工程は任意である。
【0114】
投与部位: 本発明の好ましい実施形態によれば、貫通デバイスが、血管内送達デバイスを使用して血管の管腔内面に、又は経皮送達にて周囲組織に挿入される。投与は、損傷又は病変した標的部位の近位、遠位又は該部位の位置に指向されてもよい。一部の臨床対象では、損傷又は病変した標的部位における貫通デバイスの挿入によって、損傷又は病変した標的部位が破壊される可能性がある。従って、当該対象においては、損傷又は病変した標的部位から一定の距離を置いた位置、好ましくは、当面の特定の状況によって左右される臨床医によって決定される距離を置いた位置に貫通デバイスを挿入するように、注意する必要がある。
【0115】
好ましくは、流動性組成物が、処置する損傷又は病変標的部位における、該部位に隣接する、又は該部位の近くにおける血管周囲面に沈着される。該組成物は、損傷又は病変標的部位に関連した広範な位置、例えば、損傷又は病変した標的部位に、損傷又は病変した標的部位に隣接して、例えば、損傷又は病変した標的部位の上流に、損傷又は病変した標的部位の反対側の血管外面上に沈着されてもよい。好ましい実施形態によれば、隣接部位が、損傷又は病変した標的部位の約2mm〜20mmの範囲内にある。別の好ましい実施形態では、沈着部位が約21mm〜40mmの範囲内にあり;更に別の好ましい実施形態では、沈着部位が約41mm〜60mmの範囲内にある。別の好ましい実施形態では、沈着部位が約61mm〜100mmの範囲内にある。或いは、隣接部位は、該沈着組成物が所望の効果を示すことができる、臨床医が決定したその他何れかの隣接位置となる。
【0116】
一実施形態によれば、移植可能な流動性組成物の投与前に、任意の平面投与領域が管腔外標的部位内に形成される。平面投与領域は、移植可能な流動性組成物の容積を受容するように形成された領域であり、例えば、鈍的切開、バルーン切開、流体切開、又は当該技術分野にて周知の別の切開技法を使用して形成し得る。投与領域は、血管内又は血管周囲の切開デバイスを使用して形成することができる。標的部位における流動性組成物の移植は、投与領域を形成することで容易になる。投与領域は、本発明の実践に必須のものではない。
【0117】
移植可能な流動性組成物は、多様な形態で投与部位に投与できることが想定される。例えば、移植可能な流動性組成物は、血流方向に平行した線状適用;血流方向に直行した周囲適用;又は投与部位の主要部内に投与することができる。前述の切開工程及び流動性組成物の送達は、同時に又は連続して実行できることも想定される。例えば、移植可能な流動性組成物は、加圧下で送達される場合に、それ自体を流体切開に使用することができる。しかし、前記切開法は、流動性組成物の加圧送達による組織外傷の危険性があり、血管周囲腔への移植可能な流動性組成物の加圧通過によって、細胞のコンフルエンシーが破壊される可能性がある。或いは、送達デバイスを管腔外の腔内に挿入して鈍的切開を達成することができ、送達デバイスを新しく形成された平面投与領域から後退させると、移植可能な流動性組成物を投与することができる。
【0118】
脈管の視覚化: 本発明の好ましい実施形態によれば、投与部位が誘導システムの補助によって特定される。一実施形態によれば、該誘導システムが、内視鏡誘導システム、例えば、血管内超音波(IVUS)となる。血管内超音波は、周囲構造及び血管等の血管管腔の360°断面図を提供する。
【0119】
別の好ましい実施形態では、該内視鏡誘導システムが血管造影となる。特定の実施形態では、微粒子細胞懸濁液に造影剤を添加することで、例えばコントラスト血管造影により、貫通デバイスの画像化、並びに患者の身体内における貫通デバイスの位置及び微粒子細胞懸濁液の配置の決定が可能になる。
【0120】
管腔外投与部位を特定する更なる内視鏡誘導システムには、カラードップラー超音波、複合超音波、その他の日常的な超音波、磁気共鳴血管造影(MRA)、磁気共鳴映像法(MRI)、CTスキャン、ステントの位置を同定する透視検査、及び/又は当該技術分野にて周知のその他の内視鏡誘導システムが含まれるが、これらに限定されない。更に、投与部位は、触覚による腹部触診により特定される場合もある。
【0121】
移植可能な流動性組成物は、例えば、血管造影又はIVUSを使用して、投与後に管腔外の腔内にて可視化させることができる。一実施形態によれば、移植可能な流動性組成物が管腔内ではなく管腔外の腔に送達されていることを確認するために、投与後の可視化が実施される。
【0122】
用量: 本発明の好ましい実施形態では、流動性組成物の送達可能な各投与が、移植可能な粒子約50〜60mgの容積中に約1×106細胞を含有する。流動性組成物の単回投与又は複数回投与が単一の処置部位に送達できることが想定される。又、流動性組成物の複数回投与が単一の患者に送達できることも想定される。複数回投与の種類には、単一の処置部位への複数回投与、多様な処置部位への単回若しくは複数回投与、及び/又は単回の処置時における、若しくは処置の延長過程にわたる複数回投与が含まれる。
【0123】
流動性組成物の各投与は、空隙容積、即ち、投与後に送達デバイス内に残留する、割り当てられた投与容積の一部分を含むことになる。該空隙容積は、送達デバイスに充填された流動性組成物の容積の約1%〜約50%の範囲内となる場合がある。空隙容積を考慮の上、実際の患者への投与に意図されるよりも多い数の細胞及び粒子が、送達デバイスに充填される。当然、空隙容積、並びに送達デバイスに充填された流動性組成物の容積の付随する調整は、選択した送達デバイスによって異なることになる。
【0124】
好ましい実施形態によれば、流動性組成物の送達可能な各投与が、単回投与として包装される。単一の処置部位への投与に複数の用量が必要な時には、所望の用量を単一の送達デバイスに充填し、単回投与中に投与することができる。しかし、単一の患者の複数の処置部位への投与に複数の用量が必要な時には、より多量の用量を複数回に分割して投与するよりも、固定量の送達可能な生成物のアリコートを多数使用することの方が好ましい。固定量のアリコートの投与の利点には、より多量の用量をより少量の多数の用量に分けて投入される用量の不正確性の低減、送達デバイスに固有の測定限界により投入される用量の不正確性の低減、及びより多量の組成物のアリコートに必要な輸送媒体の過剰容積により投入される用量の変動性の低減が含まれる。更に、より多量の用量をより少量のアリコートに分割することには、隣接する粒子の分裂、コンフルエント細胞単層の分裂、及び細胞への他の損傷の誘引のような、組成物の不必要な操作が必要となる。
【0125】
移植可能な流動性組成物の複数回投与は、処置の延長過程にわたり提供することができる。好ましい実施形態によれば、移植可能な流動性組成物の最初の用量が、一次処置、即ち血管介入時に投与され、続いて1〜3ヶ月に1回、又は臨床医が決定する必要性に応じて、低侵襲的に投与される。
【0126】
逆流: Gelfoam粒子の血管内投与を受けている一匹の豚の試験対象を使用して、前臨床試験を実施した。造影剤と混合した水和Gelfoam粒子の懸濁液を、カテーテルベースの送達機構に充填し、該カテーテルを試験対象の血管系内に挿入した。カテーテルを処置部位に指向させ、血管壁を介して針を血管周囲腔内に挿入し、懸濁液を血管周囲腔内に注入した。注入工程及び経過観察は、コントラスト血管造影を使用して視覚化した。
【0127】
血管管腔内への懸濁液の逆流は、注入時又は投与後及び針の除去時の何れにおいても、コントラスト血管造影から全く示されなかった。更に、Verhoeffのエラスチン染料で染色した処置組織切片の組織学的評価をその後行ったが、外膜から血管管腔内又は周辺組織内の何れかに漏洩した懸濁液の証拠は全く示されなかった。
【0128】
移植可能な流動性組成物の血管管腔内への逆流を起こす上で十分な血管周囲腔からの加圧の前に、移植可能な流動性組成物の治療量、約0.1ml〜約2mlが血管周囲腔内の単一の注入部位へ注入できることが想定される。
【実施例】
【0129】
(実施例1:動物血管介入試験)
本実施例は、動物の試験対象における血管介入に関連した臨床的続発症の発生率を低下させるために、本発明の好ましい実施形態を試験及び使用する実験プロトコールを提供する。標準的な外科手技では、大腿動脈上で実施する経皮バルーン血管形成術及びステント留置により、内腔面に損傷が誘導される。次に、本発明の移植可能な流動性組成物を、血管形成術及びステント処置血管の部位に隣接した血管周囲腔内に留置する。以下では、代表的な一工程の詳細を説明する。前述の通り、移植可能な流動性組成物の配置及び処方は変更することができる。
【0130】
具体的に、本試験は、経皮バルーン血管形成術及びステント移植を受けた26匹の豚試験対象により構成される。まず、標準的な手技に従って、従来の経皮バルーン血管形成術及びステント移植治療を実施する。血管形成術及びステント留置術が完了し、処置血管への流れが確立された後、前述の通り、移植可能な流動性組成物をバルーン膨張及びステント留置部位並びに周囲に適用する。
【0131】
外科手技: 経皮バルーン血管形成術及びステント移植を受けた各試験対象の場合、対象は挿管され、仰臥位にて心臓モニター装置に繋がれる。7フレンチシースを使用した右頸動脈への接近は、切開を介して行われ、直径5.0mmの血管形成バルーン(Guidant Corp.[米国インディアナ州インディアナポリス])を透視下で大腿動脈に前進させる。血管造影を実施し、X線動画撮影により記録する。右及び左大腿動脈は、8〜10気圧の30秒のバルーン膨張(重複したセグメントにおける、側部毎の3膨張)により損傷される。Megalink胆管ステント(Guidant、6.0〜8.0mm×18mm)を透視下で大腿動脈に前進させ、血管形成術の部位に留置する。
【0132】
血管形成術及びステント留置後、内皮細胞及び微粒子基質を含む、微粒子基質のみを含む、又は何れも含まない流動性組成物を、針注入カテーテルにより左及び右大腿動脈の血管周囲面に送達する。該針注入カテーテルは、ステントの位置を特定するために、例えば、血管造影又は血管内超音波を使用して、投与部位へ誘導される。移植可能な流動性組成物は、ステントの近位(例えば、ステントの近位端に対して約1〜20mm近位)の位置、ステントの遠位(例えば、ステントの遠位端に対して約1〜20mm遠位)の位置、及びステントの長さに沿った部位に投与される。各注入位置は、約0.8〜2.5×104細胞/mgの密度で約40〜70mg粒子を含有する移植可能な流動性組成物約0.1〜1.0mlを受容する。全試験対象は、術中ヘパリンを受容し、手後毎日アスピリンを投与される。
【0133】
試験対象の内の10匹が、手術日に移植可能な流動性組成物を受容し、又10匹の試験対象が、手術日に対照の微粒子基質を単独で受容する。更に6匹の試験対象が、ステントを受容するが、何れの種類の移植片も受容しない。前記6匹の試験対象は、治療の標準と比較するために使用される。体重に基づく総細胞負荷は、約1〜8×104細胞/kgとなる。
【0134】
血管形成術、ステント留置、及び隣接した血管周囲腔内への移植可能な流動性組成物の注入の完了後、CアームX線透視装置を対象の首上に配置して、処置血管を視覚化する。連続透視下で、10〜15ccのヨウ化造影剤(Renograffin、全濃度)を注入する。血管映画撮影図を記録し、犠牲前の血管造影図との比較のために保存する。最終的な血管造影を行って、血管開存性と、移植可能な微粒子材料の注入部位の状態を評価する。
【0135】
血管形成術の前にヘパリンを100U/kgのボーラス投与と35U/kg/時の持続点滴として投与し、手術の終了まで維持する。必要に応じて、更なるボーラス用量(100U/kg)を投与して、ACTを200秒以上に維持する。
【0136】
脈管の開存性: 処置血管の開存性は、カラーフロードップラー超音波を使用したアクセスフロー測定により、手術直後、手術から3〜7日後、及びそれ以降1週間毎に確認する。処置血管は血流を厳密に監視する。血管の血流は、試験に付された試験対象について、手術後7日目まで(7日目を含む)検出する。7日目以前又は当日に血管の血流が検出されない場合は、試験対象を試験から除去し、対象/群の元の数を維持するために試験対象を交換するあらゆる試みを実施する。
【0137】
病理学的工程: 動物試験対象の半分(処置群5匹;対照群5匹;非移植群3匹)を、手術から3〜5日後に安楽死させる。残りの動物試験対象(処置群5匹;対照群5匹;非移植群3匹)を、手術から1ヶ月後に安楽死させる。
【0138】
動物試験対象は、ペントバルビタールナトリウム(65mg/kg、IV)を使用して安楽死させる。処置血管を露出し、処置血管及び周囲組織並びに血管系のデジタル写真を撮影する。次に、動物の首上にCアームX線透視装置を配置して、処置血管を可視化し得る。連続透視下で、10〜15ccのヨウ化造影剤(Renograffin、全濃度)を注入する。処置血管に対して0°及び90°の角度で血管映画撮影図を記録する。管の開存性及び狭窄の程度を、留置後の血管造影図との一対比較において、剖検血管造影図を盲検により判断して測定する。血管造影図内で観察した狭窄の程度に応じて、血管造影図を0〜5のスケールに等級分けした。使用した等級分け基準は、以下の通りである:0=0%狭窄、1=20%狭窄、2=40%狭窄、3=60%狭窄、4=80%狭窄、及び5=100%狭窄。本発明の移植可能な流動性組成物で処置した血管は、血管造影図を調べると、対照群と比べて狭窄が低減されていることが示される。
【0139】
組織学: 動物試験対象の半分(処置群5匹;対照群5匹;非移植群3匹)を、手術から3日後に安楽死させる。残りの動物試験対象(処置群5匹;対照群5匹;非移植群3匹)を、手術から1ヶ月後に安楽死させる。
【0140】
全試験対象について、投与部位及び排出リンパ節等の周辺組織の肉眼検査と定義される限定的な剖検を実施する。手術から1ヶ月後に安楽死させた全試験対象について、脳、肺、腎臓、肝臓、心臓及び脾臓等の主要な器官の組織を収集し、保存する。身体の外面の肉眼検査、又は投与部位及び周辺組織の顕微鏡検査から異常が発見された場合のみ、器官を分析する。
【0141】
処置血管及び周辺組織の全てを整え、10%ホルマリン(又は等価物)中で固定し、グリコールメタクリレート(又は等価物)中に埋め込む。C−プロファイルのステンレス鋼ナイフ(又は等価物)で切断した厚さ約3μmの切片を使用して、処置血管の3つのセグメント:即ち、注入可能な材料の近位;注入可能な材料の部位;注入可能な材料の遠位、の各々から切片を調製する。前記切片をゼラチン被覆(又は等価物)ガラススライド上に置いて、ヘマトキシリン及びエオシン又はVerhoeffのエラスチン染料で染色する。染色したスライドを検査して、血管周囲及び管腔の炎症(急性及び慢性)、血管の変性、血栓及び線維化、並びに平滑筋細胞及び内皮細胞の存在についてスコアを付ける。1ヶ月試験対象由来の更なる組織切片を、Verhoeffのエラスチンで染色し、血管サイズ、血管損傷の範囲、内膜過形成及び再狭窄について検査し、スコアを付ける。又更なる切片を、PECAM−1及びα−SMCアクチンを含むが、これらに限定されない特定の内皮及び平滑筋細胞マーカーで染色する場合もある。損傷及び修復後の血管形状の変化に応じて、残りの管腔も試験する。Verhoeff染色切片は又、ビデオ顕微鏡及び専用のソフトウエアによるコンピュータ化デジタル面積測定を使用した形態計測分析にも供される。
【0142】
血管周囲及び管腔の炎症を、急性(3〜5日対象)及び慢性(1ヶ月対象)の両方について測定する。急性炎症は顆粒球、主に好中球により印され、慢性炎症はマクロファージ及びリンパ球により印される。更に、切片は又、以下の特定のマーカーにより染色する場合がある:白血球を同定する抗CD45、T細胞を同定する抗CD3、B細胞を同定するCD79a、及び単球/マクロファージを同定するMAC387。
【0143】
染色スライドを、平滑筋細胞及び内皮細胞の存在について試験し、スコアを付ける。内膜/偽内膜、管腔近くの中膜の内部、外膜近くの中膜の外側(外膜部位)部分、及び外膜のような、処置血管の全切片を評価し、スコアを付ける。各組織区画、例えば、内膜、中膜及び外膜のサイズをミクロン単位で測定する。各切片を、以下の各基準の存在及び/又は範囲について評価する。好中球、リンパ球、マクロファージ、好酸球、巨細胞及び血漿細胞の存在及び範囲を含むが、これらに限定されない、炎症の徴候を評価する。又、神経芽細胞、新血管形成、石灰化、出血、鬱血、フィブリン、移植片線維化及び移植片浸潤の存在について、組織切片を評価し、更に、変性、エラスチンの損失及び/又は組織部分の不在、平滑筋筋原線維の空胞化及び/又は組織の石灰化を含むが、これらに限定されない、変性の徴候についても評価する。組織切片は又、新血管形成を含むが、これに限定されない内皮細胞増殖、内膜下の細胞増殖、並びに平滑筋筋原線維、神経芽細胞及び線維化の存在についても評価する。測定した各組織切片は又、組織壊死及び異質物質の存在についても評価する。各変数に関して、0〜4のスケールでスコアを付ける(0=有意な変化なし;1=微度;2=軽度;3=中度;及び4=重度)。
【0144】
1ヶ月動物試験対象由来の組織の更なる切片のみを、形態計測分析のためにガラススライド上に置いて(Verhoeffのエラスチンで)染色する。ビデオ顕微鏡及び専用のソフトウエアによるコンピュータ化デジタル面積測定を使用して、各切片の管腔、中膜、内膜及び総血管容積を測定する。狭窄の割合も各切片について測定する。内膜過形成を定量化する一つの方法は、内膜面積を内膜及び管腔面積で除算する方法である[(内膜、mm2)/(内膜+管腔、mm2)]。
【0145】
血管の肉眼検査によって、上記の部位の外部に任意の局所性病変、血管壁の菲薄化又は膨張が観察された場合は、病理学者の判断で更なる切片も得る。染色スライドは全て、委員会により認定された獣医病理学者が盲検形式で検査し、スコアを付ける。
【0146】
動物血管介入対象に期待される結果
前述の通り本発明の流動性組成物を使用して処置した対象は、閉塞性血栓症の減少、開存率の上昇、狭窄の減少、内膜過形成の減少、並びに急性及び慢性の管腔及び/又は血管周囲の炎症の低下を含むが、これらに限定されない、血管介入に関連した臨床的続発症の発生率の低下の1種以上の徴候を示すことが期待される。
【0147】
処置に成功した血管の別の徴候としては、十分な管腔直径がある。本発明の注入可能な材料は、血管狭窄を減少させることで十分な管腔直径を維持し、それによって正常又はほぼ正常な速度の妨害のない血流を可能にすることが期待される。管腔の直径及び狭窄の割合は、処置日及び犠牲から丁度30日前に、処置血管の血管造影を使用して監視する。手術後の管腔の狭窄は、標準的なドップラー超音波プロトコールを使用して、血流速度と相関させる。本発明は、血流を正常又はほぼ正常な速度未満に妨害する狭窄を防止又は遅延させることが期待される。
【0148】
良好に機能するステント留置血管の更なる徴候としては、エッジ効果の不在がある。本発明の注入可能な材料は、ステントの遠位及び近位の血管部分における処置血管の閉塞性血栓症又は狭窄(しばしばエッジ効果と称される)の発生率及び/又は範囲を低下させることが期待される。エッジ効果、即ちキャンディーラッパー(candy wrapper)効果とは、ステント留置後にステントの関節及びエッジに発生する狭窄の領域である。エッジ効果は、早期の新生内膜組織増殖及び後期の狭窄により特徴付けられ、閉塞性血栓症を誘発する可能性がある。エッジ効果は、処置日及び犠牲から丁度30日前に、処置血管の血管造影を使用して監視する。本発明は、本明細書に記載する通り、ステント留置した血管のエッジ効果に関連した血栓症及び血管の狭窄を防止又は遅延させることが期待される。エッジ効果の存在又は非存在も又、ステントのエッジの両方向における約2〜3mm上流又は下流の極近位及び極遠位の切片を得て、組織学的に測定する。エッジ効果の存在を評価するため、極近位及び極遠位の切片を、損傷、炎症、新生内膜形成及び血栓についてスコアを付ける。
【0149】
一群として、処置対象は、対照と比べて、前述の機能性の徴候の少なくとも一つにおける少なくとも増分的な差異を示すことが期待される。
【0150】
(実施例2:ヒト血管介入試験)
本実施例は、ヒト臨床的試験対象の血管介入に関連した臨床的続発症の発生率を低下させるために、移植した血管内皮細胞及び微粒子形態の生体適合性基質を含む流動性組成物を試験及び使用する実験プロトコールを提供する。標準的な外科手技では、内科医指定による経皮バルーン血管形成術及びステント留置術を実施して、臨床的症状を緩和する。次に、移植可能な流動性組成物を、血管形成術及びステント留置部位における、該部位に隣接する、又は該部位の近くにおける血管周囲腔内に配置する。以下では、代表的な一工程を詳細に説明する。前述の通り、移植可能な流動性組成物の配置及び処方は、熟練した開業医により日常的な方法で変更することができる。
【0151】
具体的に、本試験は、末梢肢内に経皮バルーン血管形成術及びステント留置術を受けたヒト試験対象により構成される。まず、標準的な手技に従って、従来の経皮バルーン血管形成術及びステント留置術を実施する。血管形成術及びステント留置術が完了し、処置血管への流れが確立された後に、前述の通り、本発明の移植可能な流動性組成物をバルーン膨張部位及び周囲に適用する。体重に基づく総細胞負荷は、約1.0×104細胞/kg〜約8.0×104細胞/kgとなる。
【0152】
5日目、2週間目、並びに1、3及び6ヶ月目に、臨床的な経過観察を実施する。ベースラインレベルを確立するため、5日目にカラーフロードップラー超音波を使用した血流測定が必要であり、その後、手術から2週間後、1、3及び6ヶ月後にも測定を行う。350mL/分未満の絶対流量、又は以前の測定から25%を超える流量の低下、又は50%を超える面積の狭窄(ドップラー超音波により測定)を示す試験対象は、血管造影を受ける。血管形成術等の治療上の臨床的介入は、血管造影により50%を超える狭窄損傷が測定された場合に容認される。
【0153】
処置血管及び周囲組織並びに血管系の造影剤血管造影を、ベースライン及び3ヶ月目に実施する。各領域に関して管腔直径を計算し、ピーク収縮期血流速度を測定する。
【0154】
ヒト血管介入試験に期待される結果
前述の通り本発明の流動性組成物を使用して処置した対象は、閉塞性血栓症、再狭窄、内膜過形成、並びに急性及び慢性炎症を含むが、これらに限定されない、血管介入に関連した臨床的続発症の発生率の低下の1種以上の徴候を示すことが期待される。
【0155】
良好に機能する血管の徴候の一つとしては、十分な管腔直径がある。本発明は、十分な管腔直径を維持し、それによって正常又はほぼ正常な末梢循環を維持する上で十分な速度の妨害のない血流を可能にすることが期待される。管腔の直径は、最初にベースライン(処置から約5日後)に、その後は手術から少なくとも3ヶ月後に、処置血管の血管造影を使用して監視する。手術後の管腔の狭窄は、標準的なドップラー超音波プロトコールを使用して、血流速度と相関させる。本発明の移植可能な流動性組成物は、本明細書に記載する通りに使用すると、血流を、本明細書に記載する末梢循環に適した速度未満に妨害する狭窄を防止又は遅延させることが期待される。本発明の移植可能な流動性組成物による処置によって、臨床的に許容される循環を可能にする、又は正常な速度に近似する血流速度がもたらされることが更に期待される。血管の処置部分への流入量、及び該部分からの流出量は同程度となる。「同程度」とは、臨床目的において実質的に同様であることを意味する。例えば、血流速度は、約150〜500mL/分、好ましくは約300〜500mL/分、及びより好ましくは約350〜400mL/分となる。
【0156】
一群として、処置対象は、対照と比べて、前述の機能性の徴候の少なくとも一つにおける少なくとも増分的な差異を示すことが期待される。
【0157】
(実施例3:動物骨盤再癒着試験)
本実施例は、動物試験対象の骨盤及びその周囲における癒着の発生率を低下させるために、生体適合性微粒子基質及び移植内皮細胞又は内皮様細胞を含む流動性組成物を試験及び使用する実験プロトコールを提供する。本発明の移植可能な流動性組成物及び方法による卵管再建手術の後、実験用ラットモデル(変更子宮角モデル、J. Invest. Surg. 7: 409−15 (1994))を使用して、術後癒着の処置を試験する。子宮角の両側を擦過し、互いに縫合する。14日後、再開腹時に、縫合した子宮角の両側の間の強固な接続を切断する。そして、子宮角の片側及び周囲には、前述の通り本発明の移植可能な流動性組成物を適用する。子宮角の反対側は、対照として移植可能な流動性組成物を受容しない。一定の時間にわたり、癒着の存在又は非存在を監視する。本発明の移植可能な流動性組成物で処置したラットでは、骨盤及びその周囲における癒着の発生率が低減されることが期待される。
【0158】
(実施例4:動物ファロピウス管閉塞試験)
本実施例は、動物試験対象におけるファロピウス管閉塞の発生率を低下させるために、生体適合性微粒子基質と移植内皮又は内皮様細胞を試験及び使用する、実験プロトコールを提供する。実験用ウサギモデル(J. Vase. Interv. Radiol.
13: 399−404 (2002))を使用して、本発明の移植可能な流動性組成物及び方法によるファロピウス管閉塞の処置を試験する。透視下で、同軸技法を使用して、右及び左ファロピウス管の経膣カテーテル法を実施する。活性電極カテーテルから突出する金属ガイドワイヤを使用して、RF電気凝固法を実施する。一方のファロピウス管及び周囲には、前述の通り本発明の移植可能な流動性組成物を適用する。他方のファロピウス管は、対照として移植可能な流動性組成物を受容しない。一定の時間にわたり、卵管の開存性及び組織学的変化を評価する。本発明の移植可能な流動性組成物で処置したウサギでは、ファロピウス管及びそれらの周囲における閉塞、狭窄及び壊死の発生率が低減されることが期待される。
【0159】
本発明は又、子宮外妊娠の発生率を低下させるために、及び/又は子宮外妊娠と同時の若しくはその後の介入療法として、有効に使用することもできる。
【0160】
本発明は、その趣旨又は本質的な特徴から逸脱することなく、他の特定の形態で具体化される場合がある。従って、本実施形態は限定のためではなく、説明のためのものと考え、本発明の範囲は、前記の説明によらず、不随する特許請求の範囲により示されると考えるべきであり、特許請求範囲の意味及び等価の範囲内に含まれる変更は全て、本発明の範囲内に包含されるものとして意図される。
【特許請求の範囲】
【請求項1】
本願明細書に記載された発明。
【請求項1】
本願明細書に記載された発明。
【図1】




【公開番号】特開2013−39431(P2013−39431A)
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−256581(P2012−256581)
【出願日】平成24年11月22日(2012.11.22)
【分割の表示】特願2007−545539(P2007−545539)の分割
【原出願日】平成17年12月6日(2005.12.6)
【出願人】(507188913)パーバシス セラピューティクス, インコーポレイテッド (8)
【Fターム(参考)】
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願番号】特願2012−256581(P2012−256581)
【出願日】平成24年11月22日(2012.11.22)
【分割の表示】特願2007−545539(P2007−545539)の分割
【原出願日】平成17年12月6日(2005.12.6)
【出願人】(507188913)パーバシス セラピューティクス, インコーポレイテッド (8)
【Fターム(参考)】
[ Back to top ]

