細胞品質管理方法及び細胞の生産方法
【課題】より実用的な細胞の品質管理方法及び細胞の生産方法を提供する。
【解決手段】細胞の品質管理を管理するのにあたり、一つの細胞集団の仮想的に複数に区画された培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得する工程を備える。その後、区画内累積細胞移動情報に基づいて前記細胞集団の品質を評価する。
【解決手段】細胞の品質管理を管理するのにあたり、一つの細胞集団の仮想的に複数に区画された培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得する工程を備える。その後、区画内累積細胞移動情報に基づいて前記細胞集団の品質を評価する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞品質管理方法及び細胞の生産方法に関する。
【背景技術】
【0002】
近年の再生医療では、細胞医療、特に、幹細胞治療が注目されている。細胞治療においては、その有効性は、細胞の分化度、活性などの品質に大きく依存している。現在、幹細胞を含む各種の細胞培養のプロセスの多くは熟練作業者にその管理を依存している。すなわち、細胞の品質管理の基準で簡易でかつ明確なものは未だ提供されていないのが現状であり、複数の基礎的な手技の組み合わせによって行うのが通常である。また、細胞を非破壊的に評価することも困難であった。したがって、効率よくかつ安定的に、的確な品質の細胞を適時に提供するのは困難な現状がある。
【0003】
そこで、例えば、非破壊的に細胞の画像から得られる細胞の形態情報を利用して細胞の品質を予測する方法が提案されている(特許文献1)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2009−44974号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
細胞の形態情報を的確に取得するには、細胞を輪郭を検出するなど煩雑な操作が必要であることが通常であり、実用上は未だ困難性があった。さらに、細胞形態情報は、ある程度細胞密度が低密度でないと形態認識が困難となる。したがって、細胞形態情報を利用する方法では、サブコンフレント(コンフレント(細胞が培養面全体に増殖した状態)の80%程度の細胞培養密度)以下であることが必要など培養状態が限定されていた。
【0006】
一方、細胞の移動は、高度に制御された細胞活動であると考えられる。したがって、細胞の移動量や移動速度などを指標とできる可能性もある。しかしながら、細胞は、その観察位置や時間により全く異なる挙動を示すことから、細胞の移動量や速度など動的な挙動変化を捉えることは困難を伴うとともに、その定量化も困難であった。
【0007】
以上のとおり、再生医療の実用化を促進するには、細胞培養等に関わる作業を支援する工学的技術の開発が強く求められている。そこで、本明細書の開示は、より実用的な細胞の品質管理方法及び細胞の生産方法を提供することを一つの目的とする。より具体的には、効率的かつ定量的に品質を評価できる細胞の品質管理方法等を提供することを一つの目的とする。
【課題を解決するための手段】
【0008】
本発明者らは、細胞の画像から得られる細胞の移動距離などの移動情報に着目するとともに、一定条件下に累積した移動情報の分布を取得することで、細胞の分化度などの品質を、細胞密度に関わらず定量的にしかも早期に取得できるという知見を得た。本明細書の開示は、こうした知見に基づいて提供される。
【0009】
(1)細胞の品質管理方法であって、
一又は二以上の細胞集団の仮想的に複数に区画された培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得する工程を備え、
前記区画内累積細胞移動情報に基づいて、前記一又は二以上の細胞集団の品質を評価する、品質管理方法。
(2) 前記区画内累積細胞移動情報を取得する工程は、前記一又は二以上の細胞集団の培養領域について取得した画像情報を利用して行う、(1)に記載の品質管理方法。
(3) 前記細胞変位情報は、前記所定期間の開始時点に前記区画内に存在する前記1又は2以上の細胞の始点位置情報と、これらの細胞の前記所定期間の終了時点における終点位置情報と、に基づく、(1)又は(2)に記載の品質管理方法。
(4) 以下の(a)〜(d):
(a)一又は二以上の細胞集団についての時間tn(nは1以上の整数であってN以下)及び時間tn+1において細胞の培養状態に関する二つの画像情報を取得し、
(b)前記二つの画像情報における前記各区画の時間tnにおける1又は2以上の細胞の位置情報と、時間tn+1におけるこれらの細胞の位置情報とに基づいて、前記1又は2以上の細胞についての前記細胞変位情報を取得するとともに、前記細胞変位情報に基づいてtn〜tn+1における前記各区画の前記区画内細胞移動情報を取得し、
(c)前記(a)及び(b)をt=Nとなるまで繰り返して、
(d)各区画について取得したN−1個の前記区画内細胞移動情報に基づいて前記各区画についての前記区画内累積細胞移動情報を取得する、(1)〜(3)のいずれかに記載の品質管理方法。
(5) 前記細胞の変位は、前記細胞の重心の変位に基づいて取得する、(1)〜(4)のいずれかに記載の品質管理方法。
(6) 前記区画内累積細胞移動情報を対応する前記培養領域上の前記区画に割り当てた二次元分布図化して評価する、(1)〜(5)のいずれかに記載の品質管理方法。
(7) 前記区画内累積細胞移動情報をヒストグラム化して評価する、(1)〜(6)のいずれかに記載の品質管理方法。
(8) 前記区画毎に前記一又は二以上の細胞集団の品質を評価する、(1)〜(7)のいずれかに記載の品質管理方法。
(9) 前記品質は、細胞の分化度である、(1)〜(8)のいずれかに記載の品質管理方法。
(10) 細胞集団の生産方法であって、
前記細胞集団の起源細胞を培養して前記細胞集団を取得する細胞集団生産工程、
を備え、
前記生産工程において、仮想的に複数に区画された前記細胞集団の培養領域の少なくとも二つの前記各区画における所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得して、前記区画内累積細胞移動情報に基づいて、前記細胞集団の品質評価を実施する、生産方法。
(11) 前記細胞集団生産工程は、前記区画内累積細胞移動情報に基づいて細胞を選択的に培養する、(10)に記載の生産方法。
(12) 前記細胞集団生産工程は、前記起源細胞を所望の分化状態に分化させる条件下で実施する、(10)又は(11)に記載の生産方法。
(13) 細胞の検査方法であって、
仮想的に複数に区画された前記細胞に由来する細胞集団の培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得する工程を備え、
前記区画内累積細胞移動情報に基づいて、前記細胞の質を検査する、検査方法。
【図面の簡単な説明】
【0010】
【図1】本開示の品質管理の手法の概要を示す図である。
【図2】速度の積算効果を示す図である。耐熱化候補変異体とその耐熱温度を示す図である。
【図3】「一つの期間ごとに区画内に存在する細胞の変位」の累積効果を示す図である。
【図4】「仮想的な区画において得られた細胞変位」を利用することの効果を示す図である。
【図5】本品質管理方法を実施するためのフローの一例を示す図である。
【図6】積算時間と各積算時間における積算速度の変動係数(CV)との関係を示す図である。
【図7】各培養時間における速度の積算の有無と骨格分化条件との関係を示す図である。
【図8】速度の積算効果と骨分化条件との関係(細胞株毎)を示す図である。
【図9】速度の積算効果と骨分化条件との関係(継代数の相違とともに)を示す図である。
【図10】速度の積算効果(40hにおける積算速度の平均値)とALP活性との関係を示す。
【図11】ヒトiPSの由来のRPE細胞の解析対象視野の画像を示す図である。
【図12】ヒトiPS細胞由来RPE細胞のメラニン蓄積を一つの指標とした成熟度と積算マップとの関係(ヒストグラム)を示す図である。
【図13】ヒトiPS細胞由来RPE細胞のメラニン蓄積を一つの指標とした成熟度と積算マップとの関係(散布図)を示す図である。
【図14】ヒトiPS細胞由来RPE細胞のメラニン蓄積を一つの指標とした成熟度(輝度ヒストグラム)と形/速度との関係(ヒストグラム)を示す図である。
【図15】ヒトiPS細胞由来RPE細胞のメラニン蓄積を一つの指標とした成熟度(画素)と形/速度との関係(速度中央値)を示す図である。
【発明を実施するための形態】
【0011】
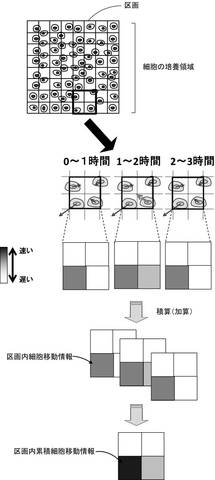
本明細書の開示は、細胞の品質管理方法及び細胞集団の生産方法等に関する。本開示に係る品質管理方法によれば、図1に示すように、細胞集団の培養領域に想定される複数の区画において、複数の期間についての複数の区画内細胞移動情報を取得し、これを積算するなどして、区画内累積細胞移動情報を得る。この区画内累積細胞移動情報を用いて、細胞集団の区画ごとにあるいはある領域ごとの、さらには細胞集団全体の品質を、効率的かつ定量的に評価することができるようになる。
【0012】
本品質管理方法の一つの利点は、細胞集団の培養工程における複数の期間での細胞の変位の「累積」(積算)に基づくため、評価方法の不安定性を抑制又は回避できる。換言すれば、培養工程における単一時点でもなく、単一時間でもないため、測定時間の短さが細胞の動的挙動のバラツキを反映してしまうことによる測定精度の低下が抑制又は回避される。また、長時間連続でもないために誤差等による測定精度の低下が抑制又は回避される。さらに、この結果、図2に示すように、早期に細胞集団の品質の評価が可能となる。
【0013】
また、他の一つの利点は、本品質管理方法では、図3上段に示すように、「一つの期間ごとに区画内に存在する細胞の変位」の累積を利用するのであり、図3下段に示すように、複数の期間を通じて特定細胞をトラッキングすることに限定するものではない。1つの期間が細胞分裂時間よりも充分に短い時間であり、かつ細胞移動度に対しても区画内を通りすぎる時間以下であるように設定してあると、細胞分裂や融合、細胞移動による細胞交差や画面からの消失等によって生じる細胞トラッキング技術の困難な点を全て解決し、良好なトラッキング精度を確保することができ、この結果、区画内累積細胞移動情報の精度が向上する。また、操作の簡便性や効率性を向上させることができる。なお、特定細胞をトラッキングすることによる細胞の変位を利用することを排除するものではない。
【0014】
また、他の一つの利点は、細胞集団の培養領域の「仮想的な区画において得られた細胞変位」を利用するため、個々の区画についての品質管理が可能であるほか、細胞集団全体の品質管理も可能となる。また、図4に示すように、区画別の情報を二次元分布図(マップ)とすることで培養領域における品質の局所的相違を明確化できる同時に細胞集団全体の性質も把握しやすくなる。また、区画別の情報をヒストグラム化することで、数量的比較を容易化できるとともに、ヒストグラムの形態から細胞集団全体の評価も容易化できる。
【0015】
さらに、他の一つの利点は、「複数の期間における細胞の変位を区画ごと及び期間ごとに独立して抽出し累積する」ために、得られた情報の測定方法に由来する精度低下が抑制又は回避されており、区画内累積細胞移動情報を数値化でき、かつその定量性が良好であることである。この結果、区画ごとの比較や細胞集団としての比較が容易となる。定量性は、上記した二次元分布図化やヒストグラム化において、極めて有効に作用する。
【0016】
さらに、他の一つの利点は、本品質管理方法で、細胞の変位を利用するために、細胞形態検出することを回避することができることにより、細胞の培養状態にかかわらず、細胞の品質を管理できることである。
【0017】
本開示の他の形態である細胞集団の生産方法やプログラムにおいても、上記した本品質管理方法に対応した利点を得ることができる。
【0018】
本開示において「細胞」とは、特に限定されない。例えば、哺乳動物(ヒト、サル、ウシ、ウマ、ウサギ、マウス、ラット、モルモット、ハムスター等)の各種細胞、例えば心筋細胞、平滑筋細胞、脂肪細胞、線維芽細胞、骨細胞、軟骨細胞、破骨細胞、実質細胞、表皮角化細胞(ケラチノサイト)、上皮細胞(皮膚表皮細胞、角膜上皮細胞、結膜上皮細胞、口腔粘膜上皮、毛包上皮細胞、口腔粘膜上皮細胞、気道粘膜上皮細胞、腸管粘膜上皮細胞など)、内皮細胞(角膜内皮細胞、血管内皮細胞など)、神経細胞、グリア細胞、脾細胞、膵臓β細胞、メサンギウム細胞、ランゲルハンス細胞、肝細胞、又はこれらの前駆細胞、或いは間葉系幹細胞(MSC)、胚性幹細胞(ES細胞)、胚性生殖細胞(EG細胞)、成体幹細胞又は人工多能性幹細胞(iPS細胞)などを使用することができる。また、正常細胞の他、癌細胞など何らかの異常を来した細胞、或いはHeLa細胞、CHO細胞、Vero細胞、HEK293細胞、HepG2細胞、Cos−7細胞、NIH3T3細胞、Sf9細胞などの株化された細胞等を採用することができる。上皮細胞、間葉系細胞、iPS細胞などの接着性の細胞は、その二次元的な画像解析が容易である点において、本開示に有用である。
【0019】
本開示において「細胞の品質」又は「細胞の質」とは、増殖率、残存分裂可能時間、残存分裂可能回数(残存ダブリング数)、分化度、活性度、特定の因子やタンパク質などの産生能、異常度、腫瘍化度、癌化度等が挙げられる。細胞の運動は、こうした「細胞の品質」又は「細胞の質」である細胞状態と大きく関連しており、細胞の運動を特徴付ける、細胞の変位は、これらの各種の細胞状態を評価ないし管理できる。例えば、細胞の分化度や活性度については、細胞の変位が小さいと分化程度が進んでおり活性度が高いことを本発明者らは確認している。
【0020】
本開示において「細胞の分化度」とは、培養中に分化(例えば前駆細胞から成熟細胞への分化や、多分化能幹細胞から特定の細胞系譜への分化など)が予定された細胞がどの分化段階にあるかを示す指標である。分化度を決定するために、一般的には、細胞の形態、細胞表面マーカー(タンパク質)の発現の有無又は発現量、特定の因子の産生の有無又は産生量などが利用されている。
【0021】
本開示において、一つ又は二以上の細胞集団の培養領域は仮想的に複数に区画される。「仮想的に複数に区画される」とは、培養領域が物理的に溝や障壁によって区画されることではなく、培養領域内の複数個の細胞をその位置によって分類するためにのみに区画されることを意味する。したがって、「仮想的な区画」とは、透明な培養基材に付与された識別可能なグリッドなどによって培養領域の下方に視認可能に形成される区画であってもよい。また、培養領域の上方に重ねられるグリッドなどが形成された透明なシート状体によって培養領域を透過して視認するような区画であってもよい。さらに、培養領域について取得した画像情報に対して付与されるグリッドなどの画像によって形成される区画であってもよい。
【0022】
本開示において、「区画」の大きさは、細胞が1〜2個程度が分画される大きさであることが好ましい。より多数の細胞が分画されると、所定期間における細胞の変位の検出が困難になりがちであり、細胞が分画されないのでは、情報のない区画が生じてしまうからである。区画の大きさは、細胞の種類にもよるが、通常、実寸として10μm以上100μm以下を基準とすることが好ましい。10μm未満であると細胞が分画されない区画が増大し、100μmを超えると、区画内に3個以上の細胞が分画されてしまうからである。区画は、標的とする細胞の進展性・移動速度に応じて最適化する必要があるため、目的の細胞を正確に評価するためには予め評価する細胞集団の培養領域の観察結果等に基づいて設定することが好ましい。こうした基準寸法を一片として有する正方形状、長方形状、あるいは半径とする円形状等とすることができるが、好ましくは正方形状である。
【0023】
また、本開示において、「区画」の個数は、特に限定されないが、全区画を総計した場合に、培養画像中の細胞が約200個以上となる区画数であることが望ましい。
【0024】
本明細書において「画像情報」とは、その記録媒体やその記録形態も特に限定されない。好ましくは、コンピュータに適用可能な記憶媒体に記録可能で公知の画像ファイルの形態であることが好ましい。
【0025】
本開示において「細胞の変位」とは、細胞が所定期間内に移動した結果得られる移動量を意味している。すなわち、「細胞の変位」とは、所定期間内の開始時点における細胞の始点位置と所定期間の終了時点における細胞の終点位置とから求める移動量と、所定期間内における経時的に細胞が移動した距離に基づく移動量と、を含んでいる。なお、細胞の変位は、細胞の重心、細胞の輪郭、細胞の輪郭上の適数個の点、核などの内部器官あるいはその他検出可能な特徴(輝度や蛍光等)などの各種の二次元的な特徴点の変位に基づいて取得することができる。
【0026】
また、細胞の変位に関する「細胞変位情報」とは、上記した細胞の移動量のほか、細胞の移動量を当該移動量が生じた時間で除算して得られる速度であってもよい。細胞変位情報として、速度を採用することで、細胞の変位を求めるための期間によらないデータとすることができる。
【0027】
本開示において「区画内細胞移動情報」とは、細胞変位情報に基づくものであればよいが、例えば、該当する細胞変位情報を平均または統計的数量(中央値や標準偏差等)に算出しなおしたものであってもよい。
【0028】
本開示において「区画内累積細胞移動情報」とは、複数の区画内細胞移動情報に基づくものであればよいが、例えば、複数の区画内細胞移動情報を平均または統計的数量(中央値や標準偏差等)に算出しなおしたものであってもよい。
【0029】
以下、本開示の実施形態について詳細に説明する。
【0030】
(細胞の品質管理方法)
本品質管理方法は、細胞集団の培養工程において適用されるのが好ましい。細胞集団の培養工程は、培養工程の開始においては、単一又は複数個の細胞が用いられるほか、生体から採取された組織や器官の一部が細胞として用いられる場合があるが、これらを起源として培養を開始して最終的にはこれらに基づく細胞集団を得る工程をいう。なお、細胞集団の培養工程においては、細胞の増殖を伴っていてもよい。
【0031】
以下、本品質管理方法における区画内累積細胞移動情報の取得工程について説明し、さらに得られた区画内累積細胞移動情報に基づいて細胞集団の品質評価を行う一実施形態について説明する。図5は、本品質管理方法を実施するためのフローの一例を示す。
【0032】
以下に説明する実施形態においては、細胞培養装置と、培養領域の画像情報を得るための撮像装置と、撮像装置に接続されたコンピュータなどのCPUと記憶媒体を備えた制御装置と、ディスプレイと備える、細胞の品質管理システムとを用いる。なお、以下の工程においては、種々取得された情報は、特に言及しなくても、コンピュータ等に備えられる一時記録媒体やハードディスクなどの各種形態の記憶媒体に適宜保存されるものとする。
【0033】
(区画内累積細胞移動情報取得工程)
本工程では、予め準備された細胞を培養工程に伴って、あるいは培養工程後において実施される。培養工程は、培養の目的により種々の形態があり特に限定されない。例えば、採取した細胞の品質評価、培養細胞の品質の評価、再生医療等に用いる細胞の品質評価、採取ないし培養した細胞の検査等、目的に応じた培養条件が設定される。こうした培養条件は、当業者であれば目的に応じて適宜設定することができる。また、細胞の変位の検出性の容易さの観点等から、培養領域は、平坦な培養基材上に形成されていることが好ましい。
【0034】
本実施形態では、時間t1を0時としたとき、時間t6(N=6)までの合計40時間にわたって、8時間ごとに断続的に6枚の画像情報を取得して、合計5個の区画内細胞移動情報を取得する。すなわち、区画内画像情報t1(0時)、t2(8時)、t3(16時)、t4(24時)、t5(32時)を取得する。
【0035】
(ステップS10)
本工程では、まず、時間t1における細胞の培養領域について画像情報t1を取得する(ステップS10)。画像情報t1を取得する対象となる培養領域は、予め所定の領域に固定されていることが好ましい。
【0036】
撮像対象となる培養領域は、細胞集団の全体にわたっていても一部であってもよい。さらに、対象領域の大きさは特に限定しないが、より広ければ好ましいが、例えば、好ましくは細胞数が200個以上となる大きさである。また、撮像対象となる培養領域の面積は、長さの単位で規定するよりもむしろ、各種細胞の細胞1個の大きさ、細胞密度、細胞移動速度とを加味して選択することができる。
【0037】
ステップS10では、平坦な培養領域にそって動く細胞の変位を検知可能に、培養領域の上方から平面視するように画像情報t1を取得する。画像情報の取得方法は、ある時点における細胞の位置を認識でき、同時に一定期間後において当該細胞の移動先の位置を認識できるものであればよく、特に限定されない。
【0038】
画像情報の取得は、典型的には、顕微鏡を介して撮像装置により撮像されることが好ましく、より好ましくは位相差顕微鏡を介して撮像される。時間t1は、特に限定されないが、培養中の細胞の品質を評価するのに適した培養状態に到達しているとみなせる時間であることが好ましい。
【0039】
取得した画像情報t1は、所定の形態の画像ファイルとしてコンピュータの記憶媒体に保存される。
【0040】
(ステップS20)
この後、CPUは、一定時間毎に時間t1からの経過時間を確認して8時間経過後に、ステップS30を開始する。
【0041】
(ステップS30)
時間t1から8時間経過して時間t2に到達したとき、時間t2における細胞の培養領域についての画像情報t2をステップS10と同様に取得し、コンピュータの記憶媒体に保存する(ステップS20)。画像情報t2は、画像情報t1と同一の培養領域を撮像したものとなっている。
【0042】
時間t1と時間t2との間隔は、本実施形態では8時間である。当該時間間隔は、細胞の種類や培養条件によっても異なるが、品質評価等の一層の確度の向上の観点からは、例えば、1以上4時間以下が好ましい。こうした範囲であるとどんな接着性細胞の移動速度であっても同じ区画内で捕らえられる可能性が高く、細胞分裂も画面中で生じる率が非常に少ないためである。一方、品質評価をより省力的により効率的に行う観点からは、例えば、時間間隔を6時間以上と時間間隔を長くとることが好ましい。時間間隔を長くすることで、画像情報量を制限できるとともに解析のための処理も効率化できるからである。
【0043】
(ステップS40)
ついで、画像情報t1と画像情報t2とを対比して、画像情報t1で視認できた細胞の時間t1から時間t2への移動量を取得する(ステップS40)。具体的には、画像情報t1において視認できる全ての細胞につき識別情報を付与した上で、各細胞の重心を各細胞の位置情報t1として取得する。細胞の重心の検出は、例えば、Image Jなどの画像処理プログラムを用いて実施することができる。
【0044】
そして、画像情報t1と画像情報t2とを対比して、画像情報t1で視認された個々の細胞と同一細胞を画像情報t2において抽出し関連付けを行う。画像情報t2において関連付けられた細胞については、その細胞の重心を位置情報t2として取得する。
【0045】
こうして画像情報t1で視認された細胞であってかつ画像情報t2で同一細胞として抽出された細胞について、その位置情報t2から位置情報t1を差分して、個々の細胞の移動量を取得する。こうした移動量は、Image Jなどの通常の画像処理においてはピクセルを単位として取得される。さらに、この移動量を時間t2−時間t1の時間間隔で除算して移動速度を算出して、個々の細胞につき、細胞変位情報を取得する。
【0046】
なお、画像情報t1においては視認できた細胞でも、画像情報t2において同一細胞として関連付けられない場合には、変位量の取得対象とはしない。また、画像情報t2において画像情報t1において関連付けられない細胞もまた、移動量の取得対象とはしない。
【0047】
(ステップS50)
次に、区画内細胞移動情報を取得する(ステップS50)。まず、画像情報t1と画像情報t2のそれぞれに、撮像対象となった培養領域を画像情報上で複数に分画するグリッド画像(50ピクセル×50ピクセル、約200個の細胞網羅個数分以上=約200枚)を重ねる。グリッド画像によって形成される複数個のマス目(区画)にはそれぞれ番号等の識別情報が付与されている。画像情報t1の全ての各区画において視認される細部を特定し、これらの細胞のうち細胞変位情報1が取得されているかどうかを判定し、細胞変位情報が取得されている細胞の当該細胞変位情報の平均値を区画内細胞移動情報として取得する。区画内細胞移動情報t1を全ての区画について取得し記憶媒体に保存する。なお、画像情報t1において区画に細胞が存在しない場合には、当該区画についての区画内細胞移動情報はヌル(null)となる。
【0048】
(ステップS60〜S20〜S50)
ステップS50終了後は、CPUは、予め設定した数(本実施形態では5回)の区画内細胞移動情報を取得したか否かを判定し(ステップS60)、所定数を終了していない場合には、さらにステップS20〜ステップS50を繰り返し実施して、所定数の区画内細胞移動情報を取得する。なお、新たにステップS30を実施して時間t3において画像情報t3を取得し、次いでステップS40にて、改めて画像情報t2と画像情報t3を対比して、画像情報t2で視認できた細胞の時間t2から時間t3への変位量を取得する。すなわち、画像情報t1での細胞の特定や識別情報はキャンセルして、時間t2と時間t3における画像情報に基づいて、改めて細胞の変位情報を取得する。以下、同じようにして細胞の変位情報を取得する。一方、所定数の区画内細胞移動情報を取得したら、ステップS70を実施する。
【0049】
(ステップS70)
所定数の区画内細胞移動情報を取得したら、各区画の識別情報に基づいて、区画毎に区画内細胞移動情報を全て加算して、区画内累積細胞移動情報を取得する(ステップS70)。
【0050】
(ステップS80)
各区画につき区画内累積細胞移動情報を取得したら、これらの情報(ここでは速度の総和)に基づいて、色別二次元分布図情報を取得する(ステップS80)。より具体的には、データ値が上位90%以上となる区画に第1の色情報、下位10%以下となる区画に第2の色情報、これら以外の区画に第3の色情報ないしはさらに多くの適数の色情報を付与する。さらに、各区画に付与されたこれらの色情報を、用いたグリッド画像上の区画に色情報に対応した色別に表示可能な二次元分布図情報を取得する。
【0051】
品質管理者は、こうした二次元分布図情報をディスプレイ上に表示させて、色分布により区画毎のあるいは複数の区画からなる領域ごとの全体的または局所的な細胞の品質(例えば、分化程度)を効率にかつ定量的に評価できる。また、同時に、細胞集団全体の品質を効率的かつ定量的に評価することができるようになる。
【0052】
上記した実施形態では、培養領域について取得した画像情報を利用して区画内累積細胞移動情報を取得したので、非破壊的に品質評価が可能となっている。さらに、培養工程に伴って品質評価を適時に行うことができるともに、培養工程後においても品質評価を行うことができる。また、事後的な検証も可能となっている。なお、画像情報を利用して細胞の変位情報を取得するには、人的作業によってもよいし、Image Jなど入手可能なプログラムを利用してもよい。
【0053】
上記した実施形態では、特に対照となる細胞集団を採用せずに、一つの細胞集団についてのみ区画内累積細胞移動情報を取得する工程を行ったが、特定の細胞集団についての精度及び再現性の良好な品質評価を行うためには、対照となる細胞集団を準備し、これについても同様にして区画内累積細胞移動情報を取得する工程を実施することが好ましい。例えば、分化誘導を行い分化程度について品質評価する場合には、同じ起源の細胞集団について分化誘導を行わない集団を、対照細胞集団とするなどすることが好ましい。こうした対照細胞集団を採用することで検定などを利用して特定の細胞集団における変化を高精度に検出できるようになる。
【0054】
また、対照細胞集団でなく、異なる処理を施した異なる細胞集団につき、区画内累積細胞移動情報を取得する工程を行って、処理の影響を評価することもできる。さらに、対照細胞集団の区画内累積細胞移動情報の取得工程を組み合わせてもよい。
【0055】
上記した実施形態では、細胞変位情報を、所定期間の開始時点に一つの区画内に存在する1又は2以上の細胞の重心などの始点位置情報と、これらの細胞の前記所定期間の終了時点における重心などの終点位置情報とに基づいて取得した。すなわち、細胞の連続的なトラッキングでなく、断片的なトラッキングを行って、細胞変位情報を取得した。このため、トラッキングが簡易であり、また、トラッキング誤差を減少させて高いトラッキング精度を確保できる。このため、細胞変位情報の精度や定量性も向上している。なお、所定期間において一つの区画内に存在する細胞の重心などの連続的トラッキングを一定以上の精度で実施できるプログラムを用いることで、細胞変位情報の精度や定量性も向上させることができる。
【0056】
上記した実施形態では、時間t1を0時とする、時間t6までの合計40時間にわたって、8時間ごとに断続的に6枚の画像情報を取得し、合計5個の区画内細胞移動情報を取得したため、安定した区画内累積細胞移動情報が得られているが、これに限定するものではない。画像情報は、細胞の種類にもよるが、好ましくは10時間以上、より好ましくは20時間以上、さらに好ましくは30時間以上、より一層好ましくは35時間以上、さらに好ましくは40時間以上の期間(画像取得時間)にわたって複数回取得されることが好ましい。特に、30時間以上であると、多くの細胞につき安定した区画内累積細胞移動情報が得られる。また、こうした画像取得時間は、好ましくは30時間以上、より好ましくは35時間以上、さらに好ましくは40時間以上であれば、どの培養時間帯であってもおおよそ安定した区画内累積細胞移動情報を得ることができる。また、本実施形態では、N=6としたがこれに限定するものではなく、細胞の種類や品質管理の目的等に応じて適宜設定される。さらに、本実施形態では、一定時間毎に画像情報を取得して各画像情報を用いて区画内細胞移動情報を取得した。すなわち、各区画内細胞移動情報の取得期間にはインターバルを備えていないが、これに限定するものではない。例えば、後述する実施例2に開示されるように、所定期間のインターバルをおいた複数の期間(実施例6では、4時間のインターバルを置いて1時間内の区画内細胞移動情報を取得することを3回繰り返し実施して、3個の区画内細胞移動情報を取得している)につき、複数の区画内細胞移動情報を取得するようにしてもよい。
【0057】
上記した実施形態では、画像情報に対してグリッド画像を付与して得た複数の区画の全ての区画について、区画内細胞変位情報を取得するようにした。このため、培養領域の全体について緻密に細胞品質を評価することができる。なお、予めこうした区画内変位情報を取得する区画を限定しておいてもよい。取得する情報量を制限しつつも広い培養領域についての品質評価が必要である場合には、有効である。
【0058】
上記した実施形態では、細胞の変位を細胞の重心に基づいて取得した。重心に基づくことで、細胞の輪郭情報を利用する場合に比べてハードウェアの誤差や輝度画像中の細胞の輪郭情報は、高密度状態の培養(コンフレント画像)ではどの細胞も同じ形態をとってしまうためほとんど意味がない。これに比べて、重心座標はどんな簡便なソフトウェアであっても標準装備されている画像解析の基礎算出指標の一つであり、ハードウェアの共通化がなくとも、画質の誤差の影響をあまり受けずに安定して取得することができる。また、細胞の一部の輝度情報に基づく場合に比べて、ハードウェアの装備を簡略化効率化できる。輝度情報は撮像環境によって大きく変化してしまい定量的な環境を作るには暗室的撮像環境や、画素のbit数の統一のためのカメラの機種の統一などのハードウェアの共通化が必須であるからである。なお、細胞の重心に基づいて細胞の変位を取得する場合、細胞の大きさの約25%もの重心の誤差に対してほぼ安定であることがわかっている。また、重心の誤差が細胞の大きさの約12.5%の範囲であれば、f検定等によりほぼ同一結果が取得されることがわかっている。なお、Particle Tracking Velocimetry (PTV)などの画像中の粒子トラッキングアルゴリズムを利用すれば上記の視認細胞の重心検出および変位情報は自動的に算出できる。
【0059】
上記した実施形態では、異なる時間における2枚の画像情報tnと画像情報t+1を取得した上で、これらを対比した上で、両情報における細胞の重心を検出して位置情報を取得したが、これに限定するものではない。画像情報tnを取得したときに、画像情報t+1の取得に先立って、予め、画像情報tnについて細胞を特定し識別情報を付与して位置情報を取得しておいてもよい。
【0060】
上記した実施形態では、所定数の区画内細胞移動情報を取得した後に、これらに基づいて区画内累積細胞移動情報を取得し、また、評価も行ったが、これに限定するものではない。区画内累積細胞移動情報の取得形態は、必要に応じて適宜変更が可能であるし、区画内累積細胞移動情報は、区画内累積細胞移動情報は、t1〜tNまでの、どの時点の情報に基づくものであってもよい。典型的には、t1を含んで任意の時間までを累積することができる。例えば、区画内細胞移動情報を取得したら、適時にあるいは逐次に、これらを累積し及び/又は評価してもよい。さらには、所定枚数の画像情報を全部取得した上で、細胞変位情報、区画内細胞移動情報及び区画内累積移動情報を取得してもよい。
【0061】
上記した実施形態では、区画内累積細胞移動情報を色情報を利用して二次元分布図情報を取得したが、これに限定するものではない。区画内累積細胞移動情報は、細胞の変位に基づく情報であって、数値情報とすることができるため、各種の評価方法が可能である。また、二次元分布図情報は、色情報によらないで濃淡情報や模様などの他の画像情報によっても当然構成できる。また、こうした色情報や濃淡情報を付与する基準(上位90%等など)も適宜変更することが可能である。さらに、区画内累積細胞移動情報は、二次元分布図情報によらないでも効率的な評価が可能である。例えば、各区画に情報に対応した棒グラフ等の高さ情報を付与して3次元的に表示することもできる。さらに、区画内累積細胞移動情報をヒストグラム化してもよい。すなわち、区画内累積細胞移動情報を、シャリエの法則などに基づいて決定した度数を用いてヒストグラム情報を取得してもよい。ヒストグラム情報を取得することで、比較したい2種の条件下でのヒストグラム情報でのF検定やT検定などの検定を行うことができる。あるいは、ヒストグラムと中心値や平均値などの統計的手法によって得られる数値情報を組み合わせて評価することも可能となる。
【0062】
(細胞集団の生産方法)
本開示に係る細胞集団の生産方法は、細胞集団の起源細胞を培養して前記細胞集団を取得する細胞集団生産工程、を備え、前記生産工程において、仮想的に複数に区画された一つの細胞集団の培養領域の少なくとも二つの各区画における所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得して、区画内累積細胞移動情報に基づいて、細胞集団の品質評価を実施することができる。この生産方法によれば、良好な品質の細胞集団を効率的にかつ安定的に製造することができる。この生産方法における区画内累積細胞移動情報の取得及び当該区画内累積細胞移動情報に基づく品質評価については、既に説明した本品質管理方法における各種態様を適用することができる。また、本生産方法においても、対照細胞集団についての区画内累積細胞移動情報を取得する工程を実施して、対照細胞集団についての区画内累積細胞移動情報も利用して品質評価をしてもよい。
【0063】
細胞集団生産工程は、区画内累積細胞移動情報に基づいて細胞を選択的に培養するようにしても良い。すなわち、区画内累積細胞移動情報に基づいて、特定区画の細胞の品質が低いことあるいは劣化を検出することができたら、当該区画に対応する培養領域の一部の細胞をレーザー等で消滅させるなどすることができる。あるいは、当該区画以外の培養領域の細胞のみを別培養ないし継代培養することもできる。こうすることで品質的により優れた細胞集団を得ることができる。
【0064】
細胞集団生産工程は、起源細胞を所望の分化状態に分化させる条件下で実施することが好ましい。こうした細胞集団生産工程によれば、再生医療などに用いる細胞集団を効率的にかつ良好な品質で安定的に製造することができる。
【0065】
(細胞の検査方法)
本開示に係る細胞の検査方法は、仮想的に複数に区画された前記細胞に由来する細胞集団の培養領域の少なくとも二つの各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得する工程を備え、区画内累積細胞移動情報に基づいて、前記細胞の質を検査するものとすることができる。この検査方法によれば、区画内累積細胞移動情報に基づいて細胞を検査するため、効率的かつ的確に細胞の質を評価できる。特に、検査対象たる細胞の個人差や細胞の動的挙動のバラツキを回避又は抑制して、細胞の質を評価できる。この検査方法における区画内累積細胞移動情報の取得及び当該区画内累積細胞移動情報に基づく細胞の質の評価については、既に説明した本品質管理方法における各種態様を適用することができる。また、本検査方法においても、対照細胞集団についての区画内累積細胞移動情報を取得する工程を実施して、対照細胞集団についての区画内累積細胞移動情報も利用して質評価をしてもよい。
【0066】
(細胞の品質管理装置及びシステム)
本開示に係る細胞の品質管理装置は、細胞培養装置と、前記細胞培養装置内の細胞の培養領域を撮像可能な撮像手段と、前記撮像手段により取得した前記培養領域についての画像情報を処理可能な制御手段を備える制御装置と、前記制御手段による処理結果を出力する出力手段と、
を備え、前記制御手段は、一又は二以上の細胞集団の仮想的に複数に区画された培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得して前記各区画についての区画内累積細胞移動情報を取得するステップと、前記区画内累積細胞移動情報に基づいて、前記一又は二以上の細胞集団の品質を評価するステップとを実行する手段である、装置とすることができる。本装置によれば、効率的かつ定量的に品質を評価できる細胞の品質管理装置を提供できる。細胞培養装置は各種形態を取得することができ、撮像手段は、細胞画像において画像処理による輪郭抽出が行えるものであれば位相差顕微鏡に限らず明視野画像を取得するものであってもよい。また、出力手段は、ディスプレイのほかプリンタであってもよい。
【0067】
本装置は、また、上記した制御手段を備える細胞の品質管理制御装置の形態を採ることができるほか、コンピュータ等の制御手段に、上記ステップを実行させるための細胞の品質管理プログラムの形態を採ることもできる。さらに、こうした品質管理プログラムを記憶した記憶媒体の形態を採ることもできる。
【0068】
本装置は、例えば、システムとして構成されていてもよい。すなわち、装置の構成要素の一部のみが装置を構成しており、残余の構成要素は装置外の構成として品質管理システムを構成してもよい。また、本装置の構成要素の全てが別個の装置として品質管理システムを構成していてもよい。
【0069】
本開示にかかる、細胞の品質管理方法、細胞の品質管理装置、細胞の品質管理プログラム等は、細胞の質や品質を評価することを目的とする限り、細胞の品質を管理しなくても、細胞の評価、検査のための方法、装置、プログラム等として実施される。本開示は、こうした形態も包含している。
【実施例】
【0070】
以下、本開示を具現化した実施例について説明する。これらの実施例は、本開示を説明するためのものであって、限定するものではない。
【実施例1】
【0071】
(ヒトMSCの骨分化誘導画像を用いた品質評価)
本実施例では、以下の3種の細胞の正常ヒト間葉系幹細胞MSC (KURABO, Japan)を用いて、その骨格分化誘導画像を経時的に取得し、画像情報に基づいて品質評価を行った。
【0072】
(細胞)
Cell line1 (strain number 15000-1, unknown race, Male, 19-year-old),
Cell line2 (strain number 17174, Oriental, Male, 20-year-old),
Cell line3 (strain number 11533, Black, Male, 22-year-old
【0073】
(培養条件)
(1)37℃、5%CO2、95%Air下のCO2インキュベータ内
(2)細胞培養ディッシュ(Greiner Bio-One, Frickenhausen, Germany)
(3)増殖用培地
分化培養開始までの1週間は、基礎培地:Medium 106S(KURABO), 低血清増殖添加剤:LSGS(KURABO)、抗生物質:ゲンタマイシン(GA) (KURABO)を用い、その後分化誘導培地へと交換し、2週間培養、培地交換は3日に一度とした。分化誘導培地は、基礎培地:Minimum Essential Medium (MEM , Invitrogen, Gaithersburg, MD, U.S.A.)、血清:10%fetal bovine serum(FBS, Invitrogen, Gaithersburg, MD, U.S.A.)、抗生物質:ペニシリンストレプトマイシン(PS, Invitrogen, Gaithersburg, MD, U.S.A.)とした。
(4)培養画像撮影
培養中、細胞の位相差画像取得を位相差顕微鏡を用いて8時間間隔で行い、1well中5視野の画像を取得した。倍率は4倍とした。このうち、誘導開始から0,8,16,24,32,40,48,56,64及び72時間後の画像をランダムに1枚ずつピックアップし(各ロット毎)、画像解析に用いた。
【0074】
(1)細胞の移動量の取得にはフリーの画像解析ソフトウェアImageJを用い、画像中から約200細胞が含まれる視野領域を切り出し、その中の画像における各細胞を全て手でマーキングし、8時間ごとに各細胞の位置情報(重心座標)を算出した。
(2)各8時間間隔の前後の画像において、同じ細胞と認識されるものの重心2点間の移動距離[pixel]を算出し、8時間の培養時間で割ることにより速度を算出した。
V={((X-X0)2+(Y-Y0)2)0.5}/8
(3)各画像において50pixelx50pixelの区画を形成できるグリッドを付与し、各細胞の重心情報からこれらの区画内に含まれる全細胞の前画像から次画像までの移動距離を平均値として算出し、各区画内の「細胞速度」として定義した。
(4)これを、全区画について算出し、上位90%以上を最大値、下位10%以下を最小値、中間の%をグラデーションにより色で示し、画像面積に対応する区画の2次元展開画像として描画することで「速度マップ」を各時間で作製した。
(5)各時間で算出された「速度マップ」における、同一区画の速度情報を、経時的に積算(加算)し、「積算速度」とし、全経時内・全区画内での上位90%以上を最大値、下位10%以下を最小値、中間の%をグラデーションにより色で図示しなおして、これを「積算速度マップ」とした。
(6)さらに、これらの積算速度マップ(32h以上の積算マップ)内の各区画の値を、シャリエの法則し従って各階調の頻度(区画の個数)をカウントし、度数分布表(ヒストグラム)を作製した。ヒストグラムは、細胞株毎と、異なる継代数について、それぞれのヒストグラムおよび、細胞株をまとめたもの、継代数をまとめたものも作製した。
(7)作製した条件ごとの度数分布表の比較検討は、中央値と標準偏差での比較、および、f検定による分布としての同一状態検定(統計的手法)を用いて評価した。
(8)さらに、誘導あり/なしの双方の細胞群につき、培養開始から2週間後に骨分化程度の一般的指標であるALP活性を測定した。
【0075】
図6に、積算時間と各積算時間における積算速度の変動係数(CV)との関係を示し、図7に、各培養時間における速度の積算の有無と骨格分化条件との関係を示し、図8に、速度の積算効果と骨分化条件との関係(細胞株毎)を示し、図9に、速度の積算効果と骨分化条件との関係(継代数の相違とともに)を示し、図10に、速度の積算効果(40hにおける積算速度の平均値)とALP活性との関係を示す。
【0076】
図6に示すように、各培養時間間隔に得られた細胞速度のCV値は、培養の時間経過と無関係に不安定な傾向を示したのに対し、各培養時間間隔で得られた細胞速度を積算して得た積算速度のCV値は、全体として小さく、また、積算時間が延びてくると、よりCV値が小さくより安定する傾向があることがわかった。特に、積算時間が24時間(画像取得時間としては32時間)以上、より好ましくは32時間(画像取得時間としては40時間)以上となると一層小さく安定化することがわかった。
【0077】
図7に示すように、各培養時間間隔で得られた速度マップによれば(図7上段)、分化誘導あり/なしの相違が、経時的変化をもってしてもわかりにくいのに対し、積算速度マップによれば、経時的経過、すなわち、積算時間の増大とともに、分化誘導あり/なしの相違を明確に把握できるともに、培養早期においても、その相違を確認できることがわかった。
【0078】
図8に示すように、異なる患者に由来するMSCであっても、積算速度をヒストグラム化することで分化誘導あり/なしをその積算速度分布から明確に区別できることがわかった。また、図9に示すように、3種の細胞株をまとめて継代数別(P3〜P6またはP5〜P8)に比較した場合でも、分化誘導あり/なしの相違を明確に見分けることができた。つまりこれは細胞 の状態がある程度異なっていても本手法が汎用的に応用できる可能性を示したものである。また、継代数が少ない細胞株群の方が、移動速度は遅くまとまった分布であることがわかり、継代数が多いものは人為的な操作でダメージが蓄積してしまい、細胞のバラツキが大きくなって「速度が速い集団=分化から遠ざかっている集団」の存在比率が増えている、というような品質の度合いの変化まで表現できる可能性が示唆された。
【0079】
図10に示すように、分化誘導ありのために積算速度が小さいとALP活性が高く、分化誘導なしのために積算速度が大きいとALP活性が低いことがわかった。すなわち、積算速度とALP活性との間には相関性の高い(相関係数=-0.81)負の相関(逆相関)があることがわかった。
【実施例2】
【0080】
(ヒトiPS細胞を用いた網膜色素上皮(RPE)細胞への培養画像を用いた品質評価)
本実施例では、ヒトiPS細胞(201B7株、理研セルバンク、日本)を用いて、そのRPEへの分化誘導画像を経時的に取得し、画像情報に基づいて品質評価を行った。
【0081】
(細胞)
ヒトiPS細胞(201B7株、理研セルバンク、日本)
(継代培養条件)
マイトマイシン−C処理により不活化したマウス胚線維芽細胞をフィーダー細胞として利用し、京都大学iPS細胞培養プロトコル(http://www.cira.kyoto-u.ac.jp/j/research/protocol.html)に従った。
(RPEへの分化培養)
下記の文献で報告されている培養プロトコルに従って、約90日かけてヒト網膜色素上皮細胞(RPE)へと分化させた。
Jin Z. B, et al. Modeling retinal degeneration using patient-specific induced
pluripotent stem cells. PLoS One 6.e17084 (2011), Jin ZB, et al. Induced pluripotent stem cells for retinal degenerative diseases: a new perspective on the challenges, J Genetics 88. 417-24 (2009)
【0082】
(画像情報の取得)
呈色したiPS細胞由来RPE細胞誘導コロニーの播種から5日後を0経時とし、10分おき、8視野、合計27.5時間培養画像のうち、
A:見た目で、メラニンが少ない(分化程度低い)
B:見た目でメラニンがまばら(分化程度中間)
C:見た目でメラニンがまばら(分化程度中間)
D:見た目でメラニンが濃い(分化程度高い)
の4視野を選抜し、これらの経時画像を3.5、4.5、7.5、8.5、10.5、11.5時間の6つの経時ポイントについて取得し、解析した。図11に、ヒトiPS細胞の由来のRPE細胞の解析対象視野の画像を示す。以下、視野Aについて「NEGA」と称し、視野Dについて[POSI」と称する場合がある。
【0083】
(1)動的情報の取得にはフリーの画像解析ソフトウェアImageJを用い、3.5−4.5、7.5−8.5、10.5−11.5時間間隔の各1時間間隔の画像中から約200細胞が含まれる視野領域を切り出し、その中の画像における各細胞を全て手でマーキングし、1時間ごとに各細胞の位置情報(重心座標)を算出した。
(2)各1時間間隔の前後の画像において、同じ細胞と認識されるものの重心2点間の移動距離[pixel]を算出し、1時間の培養時間で割ることにより速度を算出した。
V= V={((X-X0)2+(Y-Y0)2)0.5}/1(=時間間隔)
(3)各画像において50pixelx50pixelの区画を形成できるグリッドを付与し、各細胞の重心情報からこれらの区画内に含まれる全細胞の前画像から次画像までの移動距離を平均値として算出し、各区画内の「細胞速度」として定義した。
(4)これを、全区画について算出し、上位90%以上を最大値、下位10%以下を最小値、中間の%をグラデーションにより色で示し、画像面積に対応する区画の2次元展開画像として描画することで「速度マップ」を各時間で作製した。
(5)各時間で算出された「速度マップ」における、同一区画の速度情報を、経時的に積算(加算)し、「積算速度」とし、全経時内・全区画内での上位90%以上を最大値、下位10%以下を最小値、中間の%をグラデーションにより色で図示しなおして、これを「積算速度マップ」とした。
(6)さらに、これらの速度マップ、積算速度マップ内の各区画の値を、シャリエの法則し従って各階調の頻度(区画個数)をカウントし、度数分布表(ヒストグラム)を作製した。
(7)作製した条件ごとの度数分布表の比較検討は、中央値と標準偏差での比較、および、f検定による分布としての同一状態検定(統計的手法)を用いて評価した。
(8)さらに、各視野について、現状の細胞培養においてRPE分化度の目安とされているメラニンの蓄積度(輝度)、細胞の大きさ、周囲長、円形度についても、移動速度と同様に、区画内の数値を算出し、3.5〜11.5における積算マップ及び各種数値マップを作成し、ヒストグラムを作成した。
【0084】
図12に、ヒトiPS細胞由来RPE細胞のメラニン蓄積成熟度と積算マップとの関係(ヒストグラム)を示し、図13に、ヒトiPS細胞由来RPE細胞のメラニン蓄積成熟度と積算マップとの関係(散布図)を示し、図14に、ヒトiPS細胞由来RPE細胞のメラニン蓄積成熟度(輝度ヒストグラム)と形/速度との関係(ヒストグラム)を示し、図15に、ヒトiPS細胞由来RPE細胞のメラニン蓄積成熟度(画素)と形(中央値)/速度との関係(中央値)を示す。
【0085】
図12に示すように、各種速度マップ及び積算速度マップから作製したヒストグラムによれば、NEGAでは、速度が広く分散しているとともに高いのに対し、POSIでは、低い速度に集中していることを把握できることがわかった。さらに、図13に示すように、散布図によれば、NEGA及びPOSIに置いて、バラツキ程度、平均的な存在、イレギュラーな存在を明確に把握できるとともに、経時的な変化、例えば、POSIでは速度の安定化傾向も把握できることがわかった。また、図14に示すように、メラニン(積算)のヒストグラム(下側)と、細胞の大きさ(積算)、周囲長(積算)、円形度(積算)及び速度(積算)のヒストグラム(上側)とを対比すると、速度のヒストグラムが最もメラニンヒストグラムの分布と対応していることがわかった。さらに、図15に示すように、各速度マップの速度中央値とメラニン(画素)とは、高い正の相関を示した。一方、面積や円形度の各マップの中央値と画素は、低い相関しか示さなかった。また、図15に示すように、各速度マップから得られた速度中央値はNEGAについてもPOSIについても積算時間帯が遅くなるのに伴い、小さくなる傾向があり、速度による品質評価の確度が高いことがわかった。以上のことから、区画における積算速度を利用することで、各種の統計的手法において積算速度と分化度とよく相関しており、積算速度が分化度の良好な指標になることがわかった。また、積算速度に各種の統計的手法を組み合わせることで、細胞の分化度などの品質を効率的にかつ高い精度で評価できることがわかった。
【技術分野】
【0001】
本発明は、細胞品質管理方法及び細胞の生産方法に関する。
【背景技術】
【0002】
近年の再生医療では、細胞医療、特に、幹細胞治療が注目されている。細胞治療においては、その有効性は、細胞の分化度、活性などの品質に大きく依存している。現在、幹細胞を含む各種の細胞培養のプロセスの多くは熟練作業者にその管理を依存している。すなわち、細胞の品質管理の基準で簡易でかつ明確なものは未だ提供されていないのが現状であり、複数の基礎的な手技の組み合わせによって行うのが通常である。また、細胞を非破壊的に評価することも困難であった。したがって、効率よくかつ安定的に、的確な品質の細胞を適時に提供するのは困難な現状がある。
【0003】
そこで、例えば、非破壊的に細胞の画像から得られる細胞の形態情報を利用して細胞の品質を予測する方法が提案されている(特許文献1)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2009−44974号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
細胞の形態情報を的確に取得するには、細胞を輪郭を検出するなど煩雑な操作が必要であることが通常であり、実用上は未だ困難性があった。さらに、細胞形態情報は、ある程度細胞密度が低密度でないと形態認識が困難となる。したがって、細胞形態情報を利用する方法では、サブコンフレント(コンフレント(細胞が培養面全体に増殖した状態)の80%程度の細胞培養密度)以下であることが必要など培養状態が限定されていた。
【0006】
一方、細胞の移動は、高度に制御された細胞活動であると考えられる。したがって、細胞の移動量や移動速度などを指標とできる可能性もある。しかしながら、細胞は、その観察位置や時間により全く異なる挙動を示すことから、細胞の移動量や速度など動的な挙動変化を捉えることは困難を伴うとともに、その定量化も困難であった。
【0007】
以上のとおり、再生医療の実用化を促進するには、細胞培養等に関わる作業を支援する工学的技術の開発が強く求められている。そこで、本明細書の開示は、より実用的な細胞の品質管理方法及び細胞の生産方法を提供することを一つの目的とする。より具体的には、効率的かつ定量的に品質を評価できる細胞の品質管理方法等を提供することを一つの目的とする。
【課題を解決するための手段】
【0008】
本発明者らは、細胞の画像から得られる細胞の移動距離などの移動情報に着目するとともに、一定条件下に累積した移動情報の分布を取得することで、細胞の分化度などの品質を、細胞密度に関わらず定量的にしかも早期に取得できるという知見を得た。本明細書の開示は、こうした知見に基づいて提供される。
【0009】
(1)細胞の品質管理方法であって、
一又は二以上の細胞集団の仮想的に複数に区画された培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得する工程を備え、
前記区画内累積細胞移動情報に基づいて、前記一又は二以上の細胞集団の品質を評価する、品質管理方法。
(2) 前記区画内累積細胞移動情報を取得する工程は、前記一又は二以上の細胞集団の培養領域について取得した画像情報を利用して行う、(1)に記載の品質管理方法。
(3) 前記細胞変位情報は、前記所定期間の開始時点に前記区画内に存在する前記1又は2以上の細胞の始点位置情報と、これらの細胞の前記所定期間の終了時点における終点位置情報と、に基づく、(1)又は(2)に記載の品質管理方法。
(4) 以下の(a)〜(d):
(a)一又は二以上の細胞集団についての時間tn(nは1以上の整数であってN以下)及び時間tn+1において細胞の培養状態に関する二つの画像情報を取得し、
(b)前記二つの画像情報における前記各区画の時間tnにおける1又は2以上の細胞の位置情報と、時間tn+1におけるこれらの細胞の位置情報とに基づいて、前記1又は2以上の細胞についての前記細胞変位情報を取得するとともに、前記細胞変位情報に基づいてtn〜tn+1における前記各区画の前記区画内細胞移動情報を取得し、
(c)前記(a)及び(b)をt=Nとなるまで繰り返して、
(d)各区画について取得したN−1個の前記区画内細胞移動情報に基づいて前記各区画についての前記区画内累積細胞移動情報を取得する、(1)〜(3)のいずれかに記載の品質管理方法。
(5) 前記細胞の変位は、前記細胞の重心の変位に基づいて取得する、(1)〜(4)のいずれかに記載の品質管理方法。
(6) 前記区画内累積細胞移動情報を対応する前記培養領域上の前記区画に割り当てた二次元分布図化して評価する、(1)〜(5)のいずれかに記載の品質管理方法。
(7) 前記区画内累積細胞移動情報をヒストグラム化して評価する、(1)〜(6)のいずれかに記載の品質管理方法。
(8) 前記区画毎に前記一又は二以上の細胞集団の品質を評価する、(1)〜(7)のいずれかに記載の品質管理方法。
(9) 前記品質は、細胞の分化度である、(1)〜(8)のいずれかに記載の品質管理方法。
(10) 細胞集団の生産方法であって、
前記細胞集団の起源細胞を培養して前記細胞集団を取得する細胞集団生産工程、
を備え、
前記生産工程において、仮想的に複数に区画された前記細胞集団の培養領域の少なくとも二つの前記各区画における所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得して、前記区画内累積細胞移動情報に基づいて、前記細胞集団の品質評価を実施する、生産方法。
(11) 前記細胞集団生産工程は、前記区画内累積細胞移動情報に基づいて細胞を選択的に培養する、(10)に記載の生産方法。
(12) 前記細胞集団生産工程は、前記起源細胞を所望の分化状態に分化させる条件下で実施する、(10)又は(11)に記載の生産方法。
(13) 細胞の検査方法であって、
仮想的に複数に区画された前記細胞に由来する細胞集団の培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得する工程を備え、
前記区画内累積細胞移動情報に基づいて、前記細胞の質を検査する、検査方法。
【図面の簡単な説明】
【0010】
【図1】本開示の品質管理の手法の概要を示す図である。
【図2】速度の積算効果を示す図である。耐熱化候補変異体とその耐熱温度を示す図である。
【図3】「一つの期間ごとに区画内に存在する細胞の変位」の累積効果を示す図である。
【図4】「仮想的な区画において得られた細胞変位」を利用することの効果を示す図である。
【図5】本品質管理方法を実施するためのフローの一例を示す図である。
【図6】積算時間と各積算時間における積算速度の変動係数(CV)との関係を示す図である。
【図7】各培養時間における速度の積算の有無と骨格分化条件との関係を示す図である。
【図8】速度の積算効果と骨分化条件との関係(細胞株毎)を示す図である。
【図9】速度の積算効果と骨分化条件との関係(継代数の相違とともに)を示す図である。
【図10】速度の積算効果(40hにおける積算速度の平均値)とALP活性との関係を示す。
【図11】ヒトiPSの由来のRPE細胞の解析対象視野の画像を示す図である。
【図12】ヒトiPS細胞由来RPE細胞のメラニン蓄積を一つの指標とした成熟度と積算マップとの関係(ヒストグラム)を示す図である。
【図13】ヒトiPS細胞由来RPE細胞のメラニン蓄積を一つの指標とした成熟度と積算マップとの関係(散布図)を示す図である。
【図14】ヒトiPS細胞由来RPE細胞のメラニン蓄積を一つの指標とした成熟度(輝度ヒストグラム)と形/速度との関係(ヒストグラム)を示す図である。
【図15】ヒトiPS細胞由来RPE細胞のメラニン蓄積を一つの指標とした成熟度(画素)と形/速度との関係(速度中央値)を示す図である。
【発明を実施するための形態】
【0011】
本明細書の開示は、細胞の品質管理方法及び細胞集団の生産方法等に関する。本開示に係る品質管理方法によれば、図1に示すように、細胞集団の培養領域に想定される複数の区画において、複数の期間についての複数の区画内細胞移動情報を取得し、これを積算するなどして、区画内累積細胞移動情報を得る。この区画内累積細胞移動情報を用いて、細胞集団の区画ごとにあるいはある領域ごとの、さらには細胞集団全体の品質を、効率的かつ定量的に評価することができるようになる。
【0012】
本品質管理方法の一つの利点は、細胞集団の培養工程における複数の期間での細胞の変位の「累積」(積算)に基づくため、評価方法の不安定性を抑制又は回避できる。換言すれば、培養工程における単一時点でもなく、単一時間でもないため、測定時間の短さが細胞の動的挙動のバラツキを反映してしまうことによる測定精度の低下が抑制又は回避される。また、長時間連続でもないために誤差等による測定精度の低下が抑制又は回避される。さらに、この結果、図2に示すように、早期に細胞集団の品質の評価が可能となる。
【0013】
また、他の一つの利点は、本品質管理方法では、図3上段に示すように、「一つの期間ごとに区画内に存在する細胞の変位」の累積を利用するのであり、図3下段に示すように、複数の期間を通じて特定細胞をトラッキングすることに限定するものではない。1つの期間が細胞分裂時間よりも充分に短い時間であり、かつ細胞移動度に対しても区画内を通りすぎる時間以下であるように設定してあると、細胞分裂や融合、細胞移動による細胞交差や画面からの消失等によって生じる細胞トラッキング技術の困難な点を全て解決し、良好なトラッキング精度を確保することができ、この結果、区画内累積細胞移動情報の精度が向上する。また、操作の簡便性や効率性を向上させることができる。なお、特定細胞をトラッキングすることによる細胞の変位を利用することを排除するものではない。
【0014】
また、他の一つの利点は、細胞集団の培養領域の「仮想的な区画において得られた細胞変位」を利用するため、個々の区画についての品質管理が可能であるほか、細胞集団全体の品質管理も可能となる。また、図4に示すように、区画別の情報を二次元分布図(マップ)とすることで培養領域における品質の局所的相違を明確化できる同時に細胞集団全体の性質も把握しやすくなる。また、区画別の情報をヒストグラム化することで、数量的比較を容易化できるとともに、ヒストグラムの形態から細胞集団全体の評価も容易化できる。
【0015】
さらに、他の一つの利点は、「複数の期間における細胞の変位を区画ごと及び期間ごとに独立して抽出し累積する」ために、得られた情報の測定方法に由来する精度低下が抑制又は回避されており、区画内累積細胞移動情報を数値化でき、かつその定量性が良好であることである。この結果、区画ごとの比較や細胞集団としての比較が容易となる。定量性は、上記した二次元分布図化やヒストグラム化において、極めて有効に作用する。
【0016】
さらに、他の一つの利点は、本品質管理方法で、細胞の変位を利用するために、細胞形態検出することを回避することができることにより、細胞の培養状態にかかわらず、細胞の品質を管理できることである。
【0017】
本開示の他の形態である細胞集団の生産方法やプログラムにおいても、上記した本品質管理方法に対応した利点を得ることができる。
【0018】
本開示において「細胞」とは、特に限定されない。例えば、哺乳動物(ヒト、サル、ウシ、ウマ、ウサギ、マウス、ラット、モルモット、ハムスター等)の各種細胞、例えば心筋細胞、平滑筋細胞、脂肪細胞、線維芽細胞、骨細胞、軟骨細胞、破骨細胞、実質細胞、表皮角化細胞(ケラチノサイト)、上皮細胞(皮膚表皮細胞、角膜上皮細胞、結膜上皮細胞、口腔粘膜上皮、毛包上皮細胞、口腔粘膜上皮細胞、気道粘膜上皮細胞、腸管粘膜上皮細胞など)、内皮細胞(角膜内皮細胞、血管内皮細胞など)、神経細胞、グリア細胞、脾細胞、膵臓β細胞、メサンギウム細胞、ランゲルハンス細胞、肝細胞、又はこれらの前駆細胞、或いは間葉系幹細胞(MSC)、胚性幹細胞(ES細胞)、胚性生殖細胞(EG細胞)、成体幹細胞又は人工多能性幹細胞(iPS細胞)などを使用することができる。また、正常細胞の他、癌細胞など何らかの異常を来した細胞、或いはHeLa細胞、CHO細胞、Vero細胞、HEK293細胞、HepG2細胞、Cos−7細胞、NIH3T3細胞、Sf9細胞などの株化された細胞等を採用することができる。上皮細胞、間葉系細胞、iPS細胞などの接着性の細胞は、その二次元的な画像解析が容易である点において、本開示に有用である。
【0019】
本開示において「細胞の品質」又は「細胞の質」とは、増殖率、残存分裂可能時間、残存分裂可能回数(残存ダブリング数)、分化度、活性度、特定の因子やタンパク質などの産生能、異常度、腫瘍化度、癌化度等が挙げられる。細胞の運動は、こうした「細胞の品質」又は「細胞の質」である細胞状態と大きく関連しており、細胞の運動を特徴付ける、細胞の変位は、これらの各種の細胞状態を評価ないし管理できる。例えば、細胞の分化度や活性度については、細胞の変位が小さいと分化程度が進んでおり活性度が高いことを本発明者らは確認している。
【0020】
本開示において「細胞の分化度」とは、培養中に分化(例えば前駆細胞から成熟細胞への分化や、多分化能幹細胞から特定の細胞系譜への分化など)が予定された細胞がどの分化段階にあるかを示す指標である。分化度を決定するために、一般的には、細胞の形態、細胞表面マーカー(タンパク質)の発現の有無又は発現量、特定の因子の産生の有無又は産生量などが利用されている。
【0021】
本開示において、一つ又は二以上の細胞集団の培養領域は仮想的に複数に区画される。「仮想的に複数に区画される」とは、培養領域が物理的に溝や障壁によって区画されることではなく、培養領域内の複数個の細胞をその位置によって分類するためにのみに区画されることを意味する。したがって、「仮想的な区画」とは、透明な培養基材に付与された識別可能なグリッドなどによって培養領域の下方に視認可能に形成される区画であってもよい。また、培養領域の上方に重ねられるグリッドなどが形成された透明なシート状体によって培養領域を透過して視認するような区画であってもよい。さらに、培養領域について取得した画像情報に対して付与されるグリッドなどの画像によって形成される区画であってもよい。
【0022】
本開示において、「区画」の大きさは、細胞が1〜2個程度が分画される大きさであることが好ましい。より多数の細胞が分画されると、所定期間における細胞の変位の検出が困難になりがちであり、細胞が分画されないのでは、情報のない区画が生じてしまうからである。区画の大きさは、細胞の種類にもよるが、通常、実寸として10μm以上100μm以下を基準とすることが好ましい。10μm未満であると細胞が分画されない区画が増大し、100μmを超えると、区画内に3個以上の細胞が分画されてしまうからである。区画は、標的とする細胞の進展性・移動速度に応じて最適化する必要があるため、目的の細胞を正確に評価するためには予め評価する細胞集団の培養領域の観察結果等に基づいて設定することが好ましい。こうした基準寸法を一片として有する正方形状、長方形状、あるいは半径とする円形状等とすることができるが、好ましくは正方形状である。
【0023】
また、本開示において、「区画」の個数は、特に限定されないが、全区画を総計した場合に、培養画像中の細胞が約200個以上となる区画数であることが望ましい。
【0024】
本明細書において「画像情報」とは、その記録媒体やその記録形態も特に限定されない。好ましくは、コンピュータに適用可能な記憶媒体に記録可能で公知の画像ファイルの形態であることが好ましい。
【0025】
本開示において「細胞の変位」とは、細胞が所定期間内に移動した結果得られる移動量を意味している。すなわち、「細胞の変位」とは、所定期間内の開始時点における細胞の始点位置と所定期間の終了時点における細胞の終点位置とから求める移動量と、所定期間内における経時的に細胞が移動した距離に基づく移動量と、を含んでいる。なお、細胞の変位は、細胞の重心、細胞の輪郭、細胞の輪郭上の適数個の点、核などの内部器官あるいはその他検出可能な特徴(輝度や蛍光等)などの各種の二次元的な特徴点の変位に基づいて取得することができる。
【0026】
また、細胞の変位に関する「細胞変位情報」とは、上記した細胞の移動量のほか、細胞の移動量を当該移動量が生じた時間で除算して得られる速度であってもよい。細胞変位情報として、速度を採用することで、細胞の変位を求めるための期間によらないデータとすることができる。
【0027】
本開示において「区画内細胞移動情報」とは、細胞変位情報に基づくものであればよいが、例えば、該当する細胞変位情報を平均または統計的数量(中央値や標準偏差等)に算出しなおしたものであってもよい。
【0028】
本開示において「区画内累積細胞移動情報」とは、複数の区画内細胞移動情報に基づくものであればよいが、例えば、複数の区画内細胞移動情報を平均または統計的数量(中央値や標準偏差等)に算出しなおしたものであってもよい。
【0029】
以下、本開示の実施形態について詳細に説明する。
【0030】
(細胞の品質管理方法)
本品質管理方法は、細胞集団の培養工程において適用されるのが好ましい。細胞集団の培養工程は、培養工程の開始においては、単一又は複数個の細胞が用いられるほか、生体から採取された組織や器官の一部が細胞として用いられる場合があるが、これらを起源として培養を開始して最終的にはこれらに基づく細胞集団を得る工程をいう。なお、細胞集団の培養工程においては、細胞の増殖を伴っていてもよい。
【0031】
以下、本品質管理方法における区画内累積細胞移動情報の取得工程について説明し、さらに得られた区画内累積細胞移動情報に基づいて細胞集団の品質評価を行う一実施形態について説明する。図5は、本品質管理方法を実施するためのフローの一例を示す。
【0032】
以下に説明する実施形態においては、細胞培養装置と、培養領域の画像情報を得るための撮像装置と、撮像装置に接続されたコンピュータなどのCPUと記憶媒体を備えた制御装置と、ディスプレイと備える、細胞の品質管理システムとを用いる。なお、以下の工程においては、種々取得された情報は、特に言及しなくても、コンピュータ等に備えられる一時記録媒体やハードディスクなどの各種形態の記憶媒体に適宜保存されるものとする。
【0033】
(区画内累積細胞移動情報取得工程)
本工程では、予め準備された細胞を培養工程に伴って、あるいは培養工程後において実施される。培養工程は、培養の目的により種々の形態があり特に限定されない。例えば、採取した細胞の品質評価、培養細胞の品質の評価、再生医療等に用いる細胞の品質評価、採取ないし培養した細胞の検査等、目的に応じた培養条件が設定される。こうした培養条件は、当業者であれば目的に応じて適宜設定することができる。また、細胞の変位の検出性の容易さの観点等から、培養領域は、平坦な培養基材上に形成されていることが好ましい。
【0034】
本実施形態では、時間t1を0時としたとき、時間t6(N=6)までの合計40時間にわたって、8時間ごとに断続的に6枚の画像情報を取得して、合計5個の区画内細胞移動情報を取得する。すなわち、区画内画像情報t1(0時)、t2(8時)、t3(16時)、t4(24時)、t5(32時)を取得する。
【0035】
(ステップS10)
本工程では、まず、時間t1における細胞の培養領域について画像情報t1を取得する(ステップS10)。画像情報t1を取得する対象となる培養領域は、予め所定の領域に固定されていることが好ましい。
【0036】
撮像対象となる培養領域は、細胞集団の全体にわたっていても一部であってもよい。さらに、対象領域の大きさは特に限定しないが、より広ければ好ましいが、例えば、好ましくは細胞数が200個以上となる大きさである。また、撮像対象となる培養領域の面積は、長さの単位で規定するよりもむしろ、各種細胞の細胞1個の大きさ、細胞密度、細胞移動速度とを加味して選択することができる。
【0037】
ステップS10では、平坦な培養領域にそって動く細胞の変位を検知可能に、培養領域の上方から平面視するように画像情報t1を取得する。画像情報の取得方法は、ある時点における細胞の位置を認識でき、同時に一定期間後において当該細胞の移動先の位置を認識できるものであればよく、特に限定されない。
【0038】
画像情報の取得は、典型的には、顕微鏡を介して撮像装置により撮像されることが好ましく、より好ましくは位相差顕微鏡を介して撮像される。時間t1は、特に限定されないが、培養中の細胞の品質を評価するのに適した培養状態に到達しているとみなせる時間であることが好ましい。
【0039】
取得した画像情報t1は、所定の形態の画像ファイルとしてコンピュータの記憶媒体に保存される。
【0040】
(ステップS20)
この後、CPUは、一定時間毎に時間t1からの経過時間を確認して8時間経過後に、ステップS30を開始する。
【0041】
(ステップS30)
時間t1から8時間経過して時間t2に到達したとき、時間t2における細胞の培養領域についての画像情報t2をステップS10と同様に取得し、コンピュータの記憶媒体に保存する(ステップS20)。画像情報t2は、画像情報t1と同一の培養領域を撮像したものとなっている。
【0042】
時間t1と時間t2との間隔は、本実施形態では8時間である。当該時間間隔は、細胞の種類や培養条件によっても異なるが、品質評価等の一層の確度の向上の観点からは、例えば、1以上4時間以下が好ましい。こうした範囲であるとどんな接着性細胞の移動速度であっても同じ区画内で捕らえられる可能性が高く、細胞分裂も画面中で生じる率が非常に少ないためである。一方、品質評価をより省力的により効率的に行う観点からは、例えば、時間間隔を6時間以上と時間間隔を長くとることが好ましい。時間間隔を長くすることで、画像情報量を制限できるとともに解析のための処理も効率化できるからである。
【0043】
(ステップS40)
ついで、画像情報t1と画像情報t2とを対比して、画像情報t1で視認できた細胞の時間t1から時間t2への移動量を取得する(ステップS40)。具体的には、画像情報t1において視認できる全ての細胞につき識別情報を付与した上で、各細胞の重心を各細胞の位置情報t1として取得する。細胞の重心の検出は、例えば、Image Jなどの画像処理プログラムを用いて実施することができる。
【0044】
そして、画像情報t1と画像情報t2とを対比して、画像情報t1で視認された個々の細胞と同一細胞を画像情報t2において抽出し関連付けを行う。画像情報t2において関連付けられた細胞については、その細胞の重心を位置情報t2として取得する。
【0045】
こうして画像情報t1で視認された細胞であってかつ画像情報t2で同一細胞として抽出された細胞について、その位置情報t2から位置情報t1を差分して、個々の細胞の移動量を取得する。こうした移動量は、Image Jなどの通常の画像処理においてはピクセルを単位として取得される。さらに、この移動量を時間t2−時間t1の時間間隔で除算して移動速度を算出して、個々の細胞につき、細胞変位情報を取得する。
【0046】
なお、画像情報t1においては視認できた細胞でも、画像情報t2において同一細胞として関連付けられない場合には、変位量の取得対象とはしない。また、画像情報t2において画像情報t1において関連付けられない細胞もまた、移動量の取得対象とはしない。
【0047】
(ステップS50)
次に、区画内細胞移動情報を取得する(ステップS50)。まず、画像情報t1と画像情報t2のそれぞれに、撮像対象となった培養領域を画像情報上で複数に分画するグリッド画像(50ピクセル×50ピクセル、約200個の細胞網羅個数分以上=約200枚)を重ねる。グリッド画像によって形成される複数個のマス目(区画)にはそれぞれ番号等の識別情報が付与されている。画像情報t1の全ての各区画において視認される細部を特定し、これらの細胞のうち細胞変位情報1が取得されているかどうかを判定し、細胞変位情報が取得されている細胞の当該細胞変位情報の平均値を区画内細胞移動情報として取得する。区画内細胞移動情報t1を全ての区画について取得し記憶媒体に保存する。なお、画像情報t1において区画に細胞が存在しない場合には、当該区画についての区画内細胞移動情報はヌル(null)となる。
【0048】
(ステップS60〜S20〜S50)
ステップS50終了後は、CPUは、予め設定した数(本実施形態では5回)の区画内細胞移動情報を取得したか否かを判定し(ステップS60)、所定数を終了していない場合には、さらにステップS20〜ステップS50を繰り返し実施して、所定数の区画内細胞移動情報を取得する。なお、新たにステップS30を実施して時間t3において画像情報t3を取得し、次いでステップS40にて、改めて画像情報t2と画像情報t3を対比して、画像情報t2で視認できた細胞の時間t2から時間t3への変位量を取得する。すなわち、画像情報t1での細胞の特定や識別情報はキャンセルして、時間t2と時間t3における画像情報に基づいて、改めて細胞の変位情報を取得する。以下、同じようにして細胞の変位情報を取得する。一方、所定数の区画内細胞移動情報を取得したら、ステップS70を実施する。
【0049】
(ステップS70)
所定数の区画内細胞移動情報を取得したら、各区画の識別情報に基づいて、区画毎に区画内細胞移動情報を全て加算して、区画内累積細胞移動情報を取得する(ステップS70)。
【0050】
(ステップS80)
各区画につき区画内累積細胞移動情報を取得したら、これらの情報(ここでは速度の総和)に基づいて、色別二次元分布図情報を取得する(ステップS80)。より具体的には、データ値が上位90%以上となる区画に第1の色情報、下位10%以下となる区画に第2の色情報、これら以外の区画に第3の色情報ないしはさらに多くの適数の色情報を付与する。さらに、各区画に付与されたこれらの色情報を、用いたグリッド画像上の区画に色情報に対応した色別に表示可能な二次元分布図情報を取得する。
【0051】
品質管理者は、こうした二次元分布図情報をディスプレイ上に表示させて、色分布により区画毎のあるいは複数の区画からなる領域ごとの全体的または局所的な細胞の品質(例えば、分化程度)を効率にかつ定量的に評価できる。また、同時に、細胞集団全体の品質を効率的かつ定量的に評価することができるようになる。
【0052】
上記した実施形態では、培養領域について取得した画像情報を利用して区画内累積細胞移動情報を取得したので、非破壊的に品質評価が可能となっている。さらに、培養工程に伴って品質評価を適時に行うことができるともに、培養工程後においても品質評価を行うことができる。また、事後的な検証も可能となっている。なお、画像情報を利用して細胞の変位情報を取得するには、人的作業によってもよいし、Image Jなど入手可能なプログラムを利用してもよい。
【0053】
上記した実施形態では、特に対照となる細胞集団を採用せずに、一つの細胞集団についてのみ区画内累積細胞移動情報を取得する工程を行ったが、特定の細胞集団についての精度及び再現性の良好な品質評価を行うためには、対照となる細胞集団を準備し、これについても同様にして区画内累積細胞移動情報を取得する工程を実施することが好ましい。例えば、分化誘導を行い分化程度について品質評価する場合には、同じ起源の細胞集団について分化誘導を行わない集団を、対照細胞集団とするなどすることが好ましい。こうした対照細胞集団を採用することで検定などを利用して特定の細胞集団における変化を高精度に検出できるようになる。
【0054】
また、対照細胞集団でなく、異なる処理を施した異なる細胞集団につき、区画内累積細胞移動情報を取得する工程を行って、処理の影響を評価することもできる。さらに、対照細胞集団の区画内累積細胞移動情報の取得工程を組み合わせてもよい。
【0055】
上記した実施形態では、細胞変位情報を、所定期間の開始時点に一つの区画内に存在する1又は2以上の細胞の重心などの始点位置情報と、これらの細胞の前記所定期間の終了時点における重心などの終点位置情報とに基づいて取得した。すなわち、細胞の連続的なトラッキングでなく、断片的なトラッキングを行って、細胞変位情報を取得した。このため、トラッキングが簡易であり、また、トラッキング誤差を減少させて高いトラッキング精度を確保できる。このため、細胞変位情報の精度や定量性も向上している。なお、所定期間において一つの区画内に存在する細胞の重心などの連続的トラッキングを一定以上の精度で実施できるプログラムを用いることで、細胞変位情報の精度や定量性も向上させることができる。
【0056】
上記した実施形態では、時間t1を0時とする、時間t6までの合計40時間にわたって、8時間ごとに断続的に6枚の画像情報を取得し、合計5個の区画内細胞移動情報を取得したため、安定した区画内累積細胞移動情報が得られているが、これに限定するものではない。画像情報は、細胞の種類にもよるが、好ましくは10時間以上、より好ましくは20時間以上、さらに好ましくは30時間以上、より一層好ましくは35時間以上、さらに好ましくは40時間以上の期間(画像取得時間)にわたって複数回取得されることが好ましい。特に、30時間以上であると、多くの細胞につき安定した区画内累積細胞移動情報が得られる。また、こうした画像取得時間は、好ましくは30時間以上、より好ましくは35時間以上、さらに好ましくは40時間以上であれば、どの培養時間帯であってもおおよそ安定した区画内累積細胞移動情報を得ることができる。また、本実施形態では、N=6としたがこれに限定するものではなく、細胞の種類や品質管理の目的等に応じて適宜設定される。さらに、本実施形態では、一定時間毎に画像情報を取得して各画像情報を用いて区画内細胞移動情報を取得した。すなわち、各区画内細胞移動情報の取得期間にはインターバルを備えていないが、これに限定するものではない。例えば、後述する実施例2に開示されるように、所定期間のインターバルをおいた複数の期間(実施例6では、4時間のインターバルを置いて1時間内の区画内細胞移動情報を取得することを3回繰り返し実施して、3個の区画内細胞移動情報を取得している)につき、複数の区画内細胞移動情報を取得するようにしてもよい。
【0057】
上記した実施形態では、画像情報に対してグリッド画像を付与して得た複数の区画の全ての区画について、区画内細胞変位情報を取得するようにした。このため、培養領域の全体について緻密に細胞品質を評価することができる。なお、予めこうした区画内変位情報を取得する区画を限定しておいてもよい。取得する情報量を制限しつつも広い培養領域についての品質評価が必要である場合には、有効である。
【0058】
上記した実施形態では、細胞の変位を細胞の重心に基づいて取得した。重心に基づくことで、細胞の輪郭情報を利用する場合に比べてハードウェアの誤差や輝度画像中の細胞の輪郭情報は、高密度状態の培養(コンフレント画像)ではどの細胞も同じ形態をとってしまうためほとんど意味がない。これに比べて、重心座標はどんな簡便なソフトウェアであっても標準装備されている画像解析の基礎算出指標の一つであり、ハードウェアの共通化がなくとも、画質の誤差の影響をあまり受けずに安定して取得することができる。また、細胞の一部の輝度情報に基づく場合に比べて、ハードウェアの装備を簡略化効率化できる。輝度情報は撮像環境によって大きく変化してしまい定量的な環境を作るには暗室的撮像環境や、画素のbit数の統一のためのカメラの機種の統一などのハードウェアの共通化が必須であるからである。なお、細胞の重心に基づいて細胞の変位を取得する場合、細胞の大きさの約25%もの重心の誤差に対してほぼ安定であることがわかっている。また、重心の誤差が細胞の大きさの約12.5%の範囲であれば、f検定等によりほぼ同一結果が取得されることがわかっている。なお、Particle Tracking Velocimetry (PTV)などの画像中の粒子トラッキングアルゴリズムを利用すれば上記の視認細胞の重心検出および変位情報は自動的に算出できる。
【0059】
上記した実施形態では、異なる時間における2枚の画像情報tnと画像情報t+1を取得した上で、これらを対比した上で、両情報における細胞の重心を検出して位置情報を取得したが、これに限定するものではない。画像情報tnを取得したときに、画像情報t+1の取得に先立って、予め、画像情報tnについて細胞を特定し識別情報を付与して位置情報を取得しておいてもよい。
【0060】
上記した実施形態では、所定数の区画内細胞移動情報を取得した後に、これらに基づいて区画内累積細胞移動情報を取得し、また、評価も行ったが、これに限定するものではない。区画内累積細胞移動情報の取得形態は、必要に応じて適宜変更が可能であるし、区画内累積細胞移動情報は、区画内累積細胞移動情報は、t1〜tNまでの、どの時点の情報に基づくものであってもよい。典型的には、t1を含んで任意の時間までを累積することができる。例えば、区画内細胞移動情報を取得したら、適時にあるいは逐次に、これらを累積し及び/又は評価してもよい。さらには、所定枚数の画像情報を全部取得した上で、細胞変位情報、区画内細胞移動情報及び区画内累積移動情報を取得してもよい。
【0061】
上記した実施形態では、区画内累積細胞移動情報を色情報を利用して二次元分布図情報を取得したが、これに限定するものではない。区画内累積細胞移動情報は、細胞の変位に基づく情報であって、数値情報とすることができるため、各種の評価方法が可能である。また、二次元分布図情報は、色情報によらないで濃淡情報や模様などの他の画像情報によっても当然構成できる。また、こうした色情報や濃淡情報を付与する基準(上位90%等など)も適宜変更することが可能である。さらに、区画内累積細胞移動情報は、二次元分布図情報によらないでも効率的な評価が可能である。例えば、各区画に情報に対応した棒グラフ等の高さ情報を付与して3次元的に表示することもできる。さらに、区画内累積細胞移動情報をヒストグラム化してもよい。すなわち、区画内累積細胞移動情報を、シャリエの法則などに基づいて決定した度数を用いてヒストグラム情報を取得してもよい。ヒストグラム情報を取得することで、比較したい2種の条件下でのヒストグラム情報でのF検定やT検定などの検定を行うことができる。あるいは、ヒストグラムと中心値や平均値などの統計的手法によって得られる数値情報を組み合わせて評価することも可能となる。
【0062】
(細胞集団の生産方法)
本開示に係る細胞集団の生産方法は、細胞集団の起源細胞を培養して前記細胞集団を取得する細胞集団生産工程、を備え、前記生産工程において、仮想的に複数に区画された一つの細胞集団の培養領域の少なくとも二つの各区画における所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得して、区画内累積細胞移動情報に基づいて、細胞集団の品質評価を実施することができる。この生産方法によれば、良好な品質の細胞集団を効率的にかつ安定的に製造することができる。この生産方法における区画内累積細胞移動情報の取得及び当該区画内累積細胞移動情報に基づく品質評価については、既に説明した本品質管理方法における各種態様を適用することができる。また、本生産方法においても、対照細胞集団についての区画内累積細胞移動情報を取得する工程を実施して、対照細胞集団についての区画内累積細胞移動情報も利用して品質評価をしてもよい。
【0063】
細胞集団生産工程は、区画内累積細胞移動情報に基づいて細胞を選択的に培養するようにしても良い。すなわち、区画内累積細胞移動情報に基づいて、特定区画の細胞の品質が低いことあるいは劣化を検出することができたら、当該区画に対応する培養領域の一部の細胞をレーザー等で消滅させるなどすることができる。あるいは、当該区画以外の培養領域の細胞のみを別培養ないし継代培養することもできる。こうすることで品質的により優れた細胞集団を得ることができる。
【0064】
細胞集団生産工程は、起源細胞を所望の分化状態に分化させる条件下で実施することが好ましい。こうした細胞集団生産工程によれば、再生医療などに用いる細胞集団を効率的にかつ良好な品質で安定的に製造することができる。
【0065】
(細胞の検査方法)
本開示に係る細胞の検査方法は、仮想的に複数に区画された前記細胞に由来する細胞集団の培養領域の少なくとも二つの各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得する工程を備え、区画内累積細胞移動情報に基づいて、前記細胞の質を検査するものとすることができる。この検査方法によれば、区画内累積細胞移動情報に基づいて細胞を検査するため、効率的かつ的確に細胞の質を評価できる。特に、検査対象たる細胞の個人差や細胞の動的挙動のバラツキを回避又は抑制して、細胞の質を評価できる。この検査方法における区画内累積細胞移動情報の取得及び当該区画内累積細胞移動情報に基づく細胞の質の評価については、既に説明した本品質管理方法における各種態様を適用することができる。また、本検査方法においても、対照細胞集団についての区画内累積細胞移動情報を取得する工程を実施して、対照細胞集団についての区画内累積細胞移動情報も利用して質評価をしてもよい。
【0066】
(細胞の品質管理装置及びシステム)
本開示に係る細胞の品質管理装置は、細胞培養装置と、前記細胞培養装置内の細胞の培養領域を撮像可能な撮像手段と、前記撮像手段により取得した前記培養領域についての画像情報を処理可能な制御手段を備える制御装置と、前記制御手段による処理結果を出力する出力手段と、
を備え、前記制御手段は、一又は二以上の細胞集団の仮想的に複数に区画された培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得して前記各区画についての区画内累積細胞移動情報を取得するステップと、前記区画内累積細胞移動情報に基づいて、前記一又は二以上の細胞集団の品質を評価するステップとを実行する手段である、装置とすることができる。本装置によれば、効率的かつ定量的に品質を評価できる細胞の品質管理装置を提供できる。細胞培養装置は各種形態を取得することができ、撮像手段は、細胞画像において画像処理による輪郭抽出が行えるものであれば位相差顕微鏡に限らず明視野画像を取得するものであってもよい。また、出力手段は、ディスプレイのほかプリンタであってもよい。
【0067】
本装置は、また、上記した制御手段を備える細胞の品質管理制御装置の形態を採ることができるほか、コンピュータ等の制御手段に、上記ステップを実行させるための細胞の品質管理プログラムの形態を採ることもできる。さらに、こうした品質管理プログラムを記憶した記憶媒体の形態を採ることもできる。
【0068】
本装置は、例えば、システムとして構成されていてもよい。すなわち、装置の構成要素の一部のみが装置を構成しており、残余の構成要素は装置外の構成として品質管理システムを構成してもよい。また、本装置の構成要素の全てが別個の装置として品質管理システムを構成していてもよい。
【0069】
本開示にかかる、細胞の品質管理方法、細胞の品質管理装置、細胞の品質管理プログラム等は、細胞の質や品質を評価することを目的とする限り、細胞の品質を管理しなくても、細胞の評価、検査のための方法、装置、プログラム等として実施される。本開示は、こうした形態も包含している。
【実施例】
【0070】
以下、本開示を具現化した実施例について説明する。これらの実施例は、本開示を説明するためのものであって、限定するものではない。
【実施例1】
【0071】
(ヒトMSCの骨分化誘導画像を用いた品質評価)
本実施例では、以下の3種の細胞の正常ヒト間葉系幹細胞MSC (KURABO, Japan)を用いて、その骨格分化誘導画像を経時的に取得し、画像情報に基づいて品質評価を行った。
【0072】
(細胞)
Cell line1 (strain number 15000-1, unknown race, Male, 19-year-old),
Cell line2 (strain number 17174, Oriental, Male, 20-year-old),
Cell line3 (strain number 11533, Black, Male, 22-year-old
【0073】
(培養条件)
(1)37℃、5%CO2、95%Air下のCO2インキュベータ内
(2)細胞培養ディッシュ(Greiner Bio-One, Frickenhausen, Germany)
(3)増殖用培地
分化培養開始までの1週間は、基礎培地:Medium 106S(KURABO), 低血清増殖添加剤:LSGS(KURABO)、抗生物質:ゲンタマイシン(GA) (KURABO)を用い、その後分化誘導培地へと交換し、2週間培養、培地交換は3日に一度とした。分化誘導培地は、基礎培地:Minimum Essential Medium (MEM , Invitrogen, Gaithersburg, MD, U.S.A.)、血清:10%fetal bovine serum(FBS, Invitrogen, Gaithersburg, MD, U.S.A.)、抗生物質:ペニシリンストレプトマイシン(PS, Invitrogen, Gaithersburg, MD, U.S.A.)とした。
(4)培養画像撮影
培養中、細胞の位相差画像取得を位相差顕微鏡を用いて8時間間隔で行い、1well中5視野の画像を取得した。倍率は4倍とした。このうち、誘導開始から0,8,16,24,32,40,48,56,64及び72時間後の画像をランダムに1枚ずつピックアップし(各ロット毎)、画像解析に用いた。
【0074】
(1)細胞の移動量の取得にはフリーの画像解析ソフトウェアImageJを用い、画像中から約200細胞が含まれる視野領域を切り出し、その中の画像における各細胞を全て手でマーキングし、8時間ごとに各細胞の位置情報(重心座標)を算出した。
(2)各8時間間隔の前後の画像において、同じ細胞と認識されるものの重心2点間の移動距離[pixel]を算出し、8時間の培養時間で割ることにより速度を算出した。
V={((X-X0)2+(Y-Y0)2)0.5}/8
(3)各画像において50pixelx50pixelの区画を形成できるグリッドを付与し、各細胞の重心情報からこれらの区画内に含まれる全細胞の前画像から次画像までの移動距離を平均値として算出し、各区画内の「細胞速度」として定義した。
(4)これを、全区画について算出し、上位90%以上を最大値、下位10%以下を最小値、中間の%をグラデーションにより色で示し、画像面積に対応する区画の2次元展開画像として描画することで「速度マップ」を各時間で作製した。
(5)各時間で算出された「速度マップ」における、同一区画の速度情報を、経時的に積算(加算)し、「積算速度」とし、全経時内・全区画内での上位90%以上を最大値、下位10%以下を最小値、中間の%をグラデーションにより色で図示しなおして、これを「積算速度マップ」とした。
(6)さらに、これらの積算速度マップ(32h以上の積算マップ)内の各区画の値を、シャリエの法則し従って各階調の頻度(区画の個数)をカウントし、度数分布表(ヒストグラム)を作製した。ヒストグラムは、細胞株毎と、異なる継代数について、それぞれのヒストグラムおよび、細胞株をまとめたもの、継代数をまとめたものも作製した。
(7)作製した条件ごとの度数分布表の比較検討は、中央値と標準偏差での比較、および、f検定による分布としての同一状態検定(統計的手法)を用いて評価した。
(8)さらに、誘導あり/なしの双方の細胞群につき、培養開始から2週間後に骨分化程度の一般的指標であるALP活性を測定した。
【0075】
図6に、積算時間と各積算時間における積算速度の変動係数(CV)との関係を示し、図7に、各培養時間における速度の積算の有無と骨格分化条件との関係を示し、図8に、速度の積算効果と骨分化条件との関係(細胞株毎)を示し、図9に、速度の積算効果と骨分化条件との関係(継代数の相違とともに)を示し、図10に、速度の積算効果(40hにおける積算速度の平均値)とALP活性との関係を示す。
【0076】
図6に示すように、各培養時間間隔に得られた細胞速度のCV値は、培養の時間経過と無関係に不安定な傾向を示したのに対し、各培養時間間隔で得られた細胞速度を積算して得た積算速度のCV値は、全体として小さく、また、積算時間が延びてくると、よりCV値が小さくより安定する傾向があることがわかった。特に、積算時間が24時間(画像取得時間としては32時間)以上、より好ましくは32時間(画像取得時間としては40時間)以上となると一層小さく安定化することがわかった。
【0077】
図7に示すように、各培養時間間隔で得られた速度マップによれば(図7上段)、分化誘導あり/なしの相違が、経時的変化をもってしてもわかりにくいのに対し、積算速度マップによれば、経時的経過、すなわち、積算時間の増大とともに、分化誘導あり/なしの相違を明確に把握できるともに、培養早期においても、その相違を確認できることがわかった。
【0078】
図8に示すように、異なる患者に由来するMSCであっても、積算速度をヒストグラム化することで分化誘導あり/なしをその積算速度分布から明確に区別できることがわかった。また、図9に示すように、3種の細胞株をまとめて継代数別(P3〜P6またはP5〜P8)に比較した場合でも、分化誘導あり/なしの相違を明確に見分けることができた。つまりこれは細胞 の状態がある程度異なっていても本手法が汎用的に応用できる可能性を示したものである。また、継代数が少ない細胞株群の方が、移動速度は遅くまとまった分布であることがわかり、継代数が多いものは人為的な操作でダメージが蓄積してしまい、細胞のバラツキが大きくなって「速度が速い集団=分化から遠ざかっている集団」の存在比率が増えている、というような品質の度合いの変化まで表現できる可能性が示唆された。
【0079】
図10に示すように、分化誘導ありのために積算速度が小さいとALP活性が高く、分化誘導なしのために積算速度が大きいとALP活性が低いことがわかった。すなわち、積算速度とALP活性との間には相関性の高い(相関係数=-0.81)負の相関(逆相関)があることがわかった。
【実施例2】
【0080】
(ヒトiPS細胞を用いた網膜色素上皮(RPE)細胞への培養画像を用いた品質評価)
本実施例では、ヒトiPS細胞(201B7株、理研セルバンク、日本)を用いて、そのRPEへの分化誘導画像を経時的に取得し、画像情報に基づいて品質評価を行った。
【0081】
(細胞)
ヒトiPS細胞(201B7株、理研セルバンク、日本)
(継代培養条件)
マイトマイシン−C処理により不活化したマウス胚線維芽細胞をフィーダー細胞として利用し、京都大学iPS細胞培養プロトコル(http://www.cira.kyoto-u.ac.jp/j/research/protocol.html)に従った。
(RPEへの分化培養)
下記の文献で報告されている培養プロトコルに従って、約90日かけてヒト網膜色素上皮細胞(RPE)へと分化させた。
Jin Z. B, et al. Modeling retinal degeneration using patient-specific induced
pluripotent stem cells. PLoS One 6.e17084 (2011), Jin ZB, et al. Induced pluripotent stem cells for retinal degenerative diseases: a new perspective on the challenges, J Genetics 88. 417-24 (2009)
【0082】
(画像情報の取得)
呈色したiPS細胞由来RPE細胞誘導コロニーの播種から5日後を0経時とし、10分おき、8視野、合計27.5時間培養画像のうち、
A:見た目で、メラニンが少ない(分化程度低い)
B:見た目でメラニンがまばら(分化程度中間)
C:見た目でメラニンがまばら(分化程度中間)
D:見た目でメラニンが濃い(分化程度高い)
の4視野を選抜し、これらの経時画像を3.5、4.5、7.5、8.5、10.5、11.5時間の6つの経時ポイントについて取得し、解析した。図11に、ヒトiPS細胞の由来のRPE細胞の解析対象視野の画像を示す。以下、視野Aについて「NEGA」と称し、視野Dについて[POSI」と称する場合がある。
【0083】
(1)動的情報の取得にはフリーの画像解析ソフトウェアImageJを用い、3.5−4.5、7.5−8.5、10.5−11.5時間間隔の各1時間間隔の画像中から約200細胞が含まれる視野領域を切り出し、その中の画像における各細胞を全て手でマーキングし、1時間ごとに各細胞の位置情報(重心座標)を算出した。
(2)各1時間間隔の前後の画像において、同じ細胞と認識されるものの重心2点間の移動距離[pixel]を算出し、1時間の培養時間で割ることにより速度を算出した。
V= V={((X-X0)2+(Y-Y0)2)0.5}/1(=時間間隔)
(3)各画像において50pixelx50pixelの区画を形成できるグリッドを付与し、各細胞の重心情報からこれらの区画内に含まれる全細胞の前画像から次画像までの移動距離を平均値として算出し、各区画内の「細胞速度」として定義した。
(4)これを、全区画について算出し、上位90%以上を最大値、下位10%以下を最小値、中間の%をグラデーションにより色で示し、画像面積に対応する区画の2次元展開画像として描画することで「速度マップ」を各時間で作製した。
(5)各時間で算出された「速度マップ」における、同一区画の速度情報を、経時的に積算(加算)し、「積算速度」とし、全経時内・全区画内での上位90%以上を最大値、下位10%以下を最小値、中間の%をグラデーションにより色で図示しなおして、これを「積算速度マップ」とした。
(6)さらに、これらの速度マップ、積算速度マップ内の各区画の値を、シャリエの法則し従って各階調の頻度(区画個数)をカウントし、度数分布表(ヒストグラム)を作製した。
(7)作製した条件ごとの度数分布表の比較検討は、中央値と標準偏差での比較、および、f検定による分布としての同一状態検定(統計的手法)を用いて評価した。
(8)さらに、各視野について、現状の細胞培養においてRPE分化度の目安とされているメラニンの蓄積度(輝度)、細胞の大きさ、周囲長、円形度についても、移動速度と同様に、区画内の数値を算出し、3.5〜11.5における積算マップ及び各種数値マップを作成し、ヒストグラムを作成した。
【0084】
図12に、ヒトiPS細胞由来RPE細胞のメラニン蓄積成熟度と積算マップとの関係(ヒストグラム)を示し、図13に、ヒトiPS細胞由来RPE細胞のメラニン蓄積成熟度と積算マップとの関係(散布図)を示し、図14に、ヒトiPS細胞由来RPE細胞のメラニン蓄積成熟度(輝度ヒストグラム)と形/速度との関係(ヒストグラム)を示し、図15に、ヒトiPS細胞由来RPE細胞のメラニン蓄積成熟度(画素)と形(中央値)/速度との関係(中央値)を示す。
【0085】
図12に示すように、各種速度マップ及び積算速度マップから作製したヒストグラムによれば、NEGAでは、速度が広く分散しているとともに高いのに対し、POSIでは、低い速度に集中していることを把握できることがわかった。さらに、図13に示すように、散布図によれば、NEGA及びPOSIに置いて、バラツキ程度、平均的な存在、イレギュラーな存在を明確に把握できるとともに、経時的な変化、例えば、POSIでは速度の安定化傾向も把握できることがわかった。また、図14に示すように、メラニン(積算)のヒストグラム(下側)と、細胞の大きさ(積算)、周囲長(積算)、円形度(積算)及び速度(積算)のヒストグラム(上側)とを対比すると、速度のヒストグラムが最もメラニンヒストグラムの分布と対応していることがわかった。さらに、図15に示すように、各速度マップの速度中央値とメラニン(画素)とは、高い正の相関を示した。一方、面積や円形度の各マップの中央値と画素は、低い相関しか示さなかった。また、図15に示すように、各速度マップから得られた速度中央値はNEGAについてもPOSIについても積算時間帯が遅くなるのに伴い、小さくなる傾向があり、速度による品質評価の確度が高いことがわかった。以上のことから、区画における積算速度を利用することで、各種の統計的手法において積算速度と分化度とよく相関しており、積算速度が分化度の良好な指標になることがわかった。また、積算速度に各種の統計的手法を組み合わせることで、細胞の分化度などの品質を効率的にかつ高い精度で評価できることがわかった。
【特許請求の範囲】
【請求項1】
細胞の品質管理方法であって、
一又は二以上の細胞集団の仮想的に複数に区画された培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得する工程を備え、
前記区画内累積細胞移動情報に基づいて、前記一又は二以上の細胞集団の品質を評価する、品質管理方法。
【請求項2】
前記区画内累積細胞移動情報を取得する工程は、前記一又は二以上の細胞集団の培養領域について取得した画像情報を利用して行う、請求項1に記載の品質管理方法。
【請求項3】
前記細胞変位情報は、前記所定期間の開始時点に前記区画内に存在する前記1又は2以上の細胞の始点位置情報と、これらの細胞の前記所定期間の終了時点における終点位置情報と、に基づく、請求項1又は2に記載の品質管理方法。
【請求項4】
以下の(a)〜(c):
(a)一又は二以上の細胞集団についての時間tn(nは1以上の整数であってN以下)及び時間tn+1において細胞の培養状態に関する二つの画像情報を取得し、
(b)前記二つの画像情報における前記各区画の時間tnにおける1又は2以上の細胞の位置情報と、時間tn+1におけるこれらの細胞の位置情報とに基づいて、前記1又は2以上の細胞についての前記細胞変位情報を取得するとともに、前記細胞変位情報に基づいてtn〜tn+1における前記各区画の前記区画内細胞移動情報を取得し、
(c)前記(a)及び(b)をt=Nとなるまで繰り返して、
(d)各区画について取得したN−1個の前記区画内細胞移動情報に基づいて前記各区画についての前記区画内累積細胞移動情報を取得する、請求項1〜3のいずれかに記載の品質管理方法。
【請求項5】
前記細胞の変位は、前記細胞の重心の変位に基づいて取得する、請求項1〜4のいずれかに記載の品質管理方法。
【請求項6】
前記区画内累積細胞移動情報を対応する前記培養領域上の前記区画に割り当てた二次元分布図化して評価する、請求項1〜5のいずれかに記載の品質管理方法。
【請求項7】
前記区画内累積細胞移動情報をヒストグラム化して評価する、請求項1〜6のいずれかに記載の品質管理方法。
【請求項8】
前記区画毎に前記一又は二以上の細胞集団の品質を評価する、請求項1〜7のいずれかに記載の品質管理方法。
【請求項9】
前記品質は、細胞の分化度である、請求項1〜8のいずれかに記載の品質管理方法。
【請求項10】
細胞集団の生産方法であって、
前記細胞集団の起源細胞を培養して前記細胞集団を取得する細胞集団生産工程、
を備え、
前記生産工程において、仮想的に複数に区画された一つの細胞集団の培養領域の少なくとも二つの前記各区画における所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得して、前記区画内累積細胞移動情報に基づいて、前記細胞集団の品質を評価を実施する、生産方法。
【請求項11】
前記細胞集団生産工程は、前記区画内累積細胞移動情報に基づいて細胞を選択的に培養する、請求項10に記載の生産方法。
【請求項12】
前記細胞集団生産工程は、前記起源細胞を所望の分化状態に分化させる条件下で実施する、請求項10又は11に記載の生産方法。
【請求項13】
細胞の検査方法であって、
仮想的に複数に区画された前記細胞に由来する細胞集団の培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得する工程を備え、
前記区画内累積細胞移動情報に基づいて、前記細胞の質を検査する、検査方法。
【請求項14】
細胞の品質管理装置であって、
細胞培養装置と、
前記細胞培養装置内の細胞の培養領域を撮像可能な撮像手段と、
前記撮像手段により取得した前記培養領域についての画像情報を処理可能な制御手段を備える制御装置と、
前記制御手段による処理結果を出力する出力手段と、
を備え、
前記制御手段は、一又は二以上の細胞集団の仮想的に複数に区画された培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得して前記各区画についての区画内累積細胞移動情報を取得するステップと、前記区画内累積細胞移動情報に基づいて、前記一又は二以上の細胞集団の品質を評価するステップと、を実行する手段である、装置。
【請求項1】
細胞の品質管理方法であって、
一又は二以上の細胞集団の仮想的に複数に区画された培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得する工程を備え、
前記区画内累積細胞移動情報に基づいて、前記一又は二以上の細胞集団の品質を評価する、品質管理方法。
【請求項2】
前記区画内累積細胞移動情報を取得する工程は、前記一又は二以上の細胞集団の培養領域について取得した画像情報を利用して行う、請求項1に記載の品質管理方法。
【請求項3】
前記細胞変位情報は、前記所定期間の開始時点に前記区画内に存在する前記1又は2以上の細胞の始点位置情報と、これらの細胞の前記所定期間の終了時点における終点位置情報と、に基づく、請求項1又は2に記載の品質管理方法。
【請求項4】
以下の(a)〜(c):
(a)一又は二以上の細胞集団についての時間tn(nは1以上の整数であってN以下)及び時間tn+1において細胞の培養状態に関する二つの画像情報を取得し、
(b)前記二つの画像情報における前記各区画の時間tnにおける1又は2以上の細胞の位置情報と、時間tn+1におけるこれらの細胞の位置情報とに基づいて、前記1又は2以上の細胞についての前記細胞変位情報を取得するとともに、前記細胞変位情報に基づいてtn〜tn+1における前記各区画の前記区画内細胞移動情報を取得し、
(c)前記(a)及び(b)をt=Nとなるまで繰り返して、
(d)各区画について取得したN−1個の前記区画内細胞移動情報に基づいて前記各区画についての前記区画内累積細胞移動情報を取得する、請求項1〜3のいずれかに記載の品質管理方法。
【請求項5】
前記細胞の変位は、前記細胞の重心の変位に基づいて取得する、請求項1〜4のいずれかに記載の品質管理方法。
【請求項6】
前記区画内累積細胞移動情報を対応する前記培養領域上の前記区画に割り当てた二次元分布図化して評価する、請求項1〜5のいずれかに記載の品質管理方法。
【請求項7】
前記区画内累積細胞移動情報をヒストグラム化して評価する、請求項1〜6のいずれかに記載の品質管理方法。
【請求項8】
前記区画毎に前記一又は二以上の細胞集団の品質を評価する、請求項1〜7のいずれかに記載の品質管理方法。
【請求項9】
前記品質は、細胞の分化度である、請求項1〜8のいずれかに記載の品質管理方法。
【請求項10】
細胞集団の生産方法であって、
前記細胞集団の起源細胞を培養して前記細胞集団を取得する細胞集団生産工程、
を備え、
前記生産工程において、仮想的に複数に区画された一つの細胞集団の培養領域の少なくとも二つの前記各区画における所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得して、前記区画内累積細胞移動情報に基づいて、前記細胞集団の品質を評価を実施する、生産方法。
【請求項11】
前記細胞集団生産工程は、前記区画内累積細胞移動情報に基づいて細胞を選択的に培養する、請求項10に記載の生産方法。
【請求項12】
前記細胞集団生産工程は、前記起源細胞を所望の分化状態に分化させる条件下で実施する、請求項10又は11に記載の生産方法。
【請求項13】
細胞の検査方法であって、
仮想的に複数に区画された前記細胞に由来する細胞集団の培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得し、前記各区画についての区画内累積細胞移動情報を取得する工程を備え、
前記区画内累積細胞移動情報に基づいて、前記細胞の質を検査する、検査方法。
【請求項14】
細胞の品質管理装置であって、
細胞培養装置と、
前記細胞培養装置内の細胞の培養領域を撮像可能な撮像手段と、
前記撮像手段により取得した前記培養領域についての画像情報を処理可能な制御手段を備える制御装置と、
前記制御手段による処理結果を出力する出力手段と、
を備え、
前記制御手段は、一又は二以上の細胞集団の仮想的に複数に区画された培養領域の少なくとも二つの前記各区画の所定期間における1又は2以上の細胞の変位に関する細胞変位情報に基づく区画内細胞移動情報を異なる期間につき複数取得して前記各区画についての区画内累積細胞移動情報を取得するステップと、前記区画内累積細胞移動情報に基づいて、前記一又は二以上の細胞集団の品質を評価するステップと、を実行する手段である、装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公開番号】特開2013−39113(P2013−39113A)
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願番号】特願2011−179975(P2011−179975)
【出願日】平成23年8月19日(2011.8.19)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 化学工学会第76年会研究発表講演要旨集、公益社団法人化学工学会、平成23年2月22日発行
【出願人】(504139662)国立大学法人名古屋大学 (996)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願日】平成23年8月19日(2011.8.19)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 化学工学会第76年会研究発表講演要旨集、公益社団法人化学工学会、平成23年2月22日発行
【出願人】(504139662)国立大学法人名古屋大学 (996)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
[ Back to top ]

