細胞固定化材
【課題】 標的細胞を基材上に固定する固定化材及びその製造方法を提供する。
【解決手段】 シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する固定化材であって、基材と、該基材の表面に単分子膜状に配列した所定の鎖長のリンカーと、該リンカーを介して前記基材上に配置されたシデロフォア又はそのアナログとを備える。前記リンカーの鎖長は、前記基材上に配置された状態の前記標的細胞の細胞膜を理論上貫通しない長さに規定されている。
【解決手段】 シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する固定化材であって、基材と、該基材の表面に単分子膜状に配列した所定の鎖長のリンカーと、該リンカーを介して前記基材上に配置されたシデロフォア又はそのアナログとを備える。前記リンカーの鎖長は、前記基材上に配置された状態の前記標的細胞の細胞膜を理論上貫通しない長さに規定されている。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、所定の標的細胞を基材上に固定する細胞固定化材及びその製造方法に関する。また本発明は、そのような固定化材の製造に適した新規な人工シデロフォアに関する。
【背景技術】
【0002】
細胞内に鉄(Fe)を取り込む機構の一つとしてシデロフォアを介する機構が知られている。シデロフォアは、細菌や真菌がFeイオンを取り込むために体外に分泌する分子である。分泌されたシデロフォアは環境中のFeを捕捉して錯体(シデロフォア−Fe複合体)を形成する。この錯体は、膜タンパク質であるシデロフォアレセプターにより認識され、該レセプター部位を透過して細胞内に取り込まれる。そして、取り込まれた錯体からFeイオンが遊離され、細胞活動に利用される。なお、自らシデロフォアの生産及び分泌を行わない細菌等のなかにも、他の細菌等により生産され分泌された(外来性の)シデロフォアを利用して同様にFeを取り込むものがある。
特許文献1には、基板表面から少なくとも所定長さ離して該基材表面にリンカーで繋ぎ止めたリガンド(ヘム、シデロフォア、多糖類等)を用いて、生物学的分析対象物を同定する方法が記載されている。シデロフォア等を利用して病原体を同定する技術に関する他の従来技術文献として特許文献2が挙げられる。
【0003】
【特許文献1】特開2003−185668号公報
【特許文献2】米国特許出願公開第2004/0137428号明細書
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明は、シデロフォアを介するFe取込機構を利用して所定の標的細胞をより適切に固定することのできる固定化材を提供することを一つの目的とする。本発明の他の一つの目的は、かかる固定化材の好適な製造方法を提供することである。さらに他の目的は、そのような固定化材の製造等に用いる材料として好適な人工シデロフォアを提供することである。また、該固定化材を用いて細胞を固定する方法を提供することである。
【課題を解決するための手段】
【0005】
本発明によると、シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞(例えば細菌細胞)を基材上に固定する細胞固定化材が提供される。その固定化材は、基材と、該基材の表面に単分子膜状に配列した所定の鎖長のリンカーとを備える。また、該リンカーに結合し、該リンカーを介して前記基材上に配置されたシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログを備える。ここで、前記リンカーの鎖長は、前記基材上に配置された状態の前記標的細胞の細胞膜を理論上貫通しない長さに規定されている。
かかる構成の固定化材は、リンカーを介して基材上に配置されたシデロフォア又はアナログを備える。したがって、該シデロフォア又はアナログと標的細胞との親和性(典型的には、標的細胞がシデロフォア又はアナログの金属錯体を認識して細胞内に取り込もうとする性質)を利用して、該標的細胞を効率よく捕捉することができる。ここで、リンカーの鎖長は「標的細胞の細胞膜を貫通しない長さ」に規定されている。したがって標的細胞は、上記シデロフォア又はアナログの金属錯体を細胞膜より内側まで取り込むことはできない。このため、細胞内(細胞膜よりも内側)に取り込んだシデロフォア−金属複合体(錯体)から金属を遊離させて利用する、という本来の金属取り込み機構が完遂されない。換言すれば、該取り込み機構の途中で、複合体が細胞膜の内側までは取り込まれないことによって、その進行が妨げられる。このことを利用して、標的細胞がシデロフォア又はそのアナログに捕捉された状態(すなわち、標的細胞が基材上に固定された状態)を安定して維持することができる。
【0006】
上記固定化材が備える基材の材質や形状等は特に限定されず、固定化材の用途等に応じて適当な基材を種々選択することができる。例えば、ガラス、鉱物、樹脂、金属又はこれらを適宜複合させて成る複合材料を主構成材料とする基材を好ましく使用することができる。後述するように該基材とシデロフォア又はアナログ(以下、単に「シデロフォア」ということもある。)との間で電子伝達が可能な固定化材を構成する場合には、少なくともシデロフォアの配置される表面が導電性材料からなる基材が好ましい。そのような導電性表面を有する基材として、例えば、ガラス、鉱物(例えば雲母)、樹脂等の表面に、金(Au)、銀(Ag)、銅(Cu)、ニッケル(Ni)等の導電性金属の薄膜を有する基材を用いることができる。また、導電性金属からなる金属板を基材としてもよい。
【0007】
該基材上に配列されたリンカーの鎖長は、標的細胞の細胞膜を理論上貫通しない長さの範囲内にある。細胞の細胞膜の状態(厚さ)は周囲の環境等によって異なり得るが、ここに開示される一つの細胞固定化材は、基材上に配置された状態の細胞の細胞膜の厚さ(すなわち、顕微鏡観察等により把握された標的細胞の細胞膜あるいは細胞膜および細胞壁の厚さ)を基準として、その状態における細胞膜の厚さを超えない長さのリンカーを備える。細胞膜の厚さは、その細胞(標的細胞)の種類によっても異なる得る。例えば大腸菌の場合、その外膜の厚さは数十Å程度(膜全体では250Å程度)である。このように、標的細胞に応じて適切な長さのリンカー(当該標的細胞の細胞膜の厚さを超えない鎖長のリンカー)を有する固定化材を設計することができる。リンカーの鎖長が短すぎると標的細胞を固定化する効率が低下傾向となる場合があるため、通常は、リンカーの鎖長を少なくとも凡そ6Å以上とすることが好ましい。かかる鎖長のリンカーが基材表面に単分子膜状に配列していることは、この固定化材の表面の各部における特性(細胞固定特性)が均一化されるという点で有利である。
ここに開示される固定化材の一つの好ましい態様では、リンカーの長さが概ね50Å(5nm)未満である。典型的には、リンカーの長さが概ね6Å以上50Å未満である。他の好ましい態様では、リンカーの長さが概ね30Å未満(典型的には、6Å以上30Å未満)である。より好ましい態様では、リンカーの長さが概ね6Å以上15Å未満である。
【0008】
上記固定化材は、前記シデロフォア又はアナログにキレートされた金属を含む態様であり得る。このような固定化材によると、あらかじめ金属がキレートされたシデロフォア又はアナログ(すなわち、シデロフォア又はアナログの金属錯体)が標的細胞によって速やかに認識されることから、標的細胞をより効率よく固定することができる。
シデロフォア又はアナログにキレートさせる金属は、そのキレート錯体(複合体)が標的細胞のレセプターによって認識され得るものであればよい。そのような金属の典型例は鉄(Fe)である。また、前述の条件を具備する限り、Fe以外の各種金属をシデロフォア又はアナログにキレートさせてもよい。キレートさせる金属の好適例(Fe以外)としては、Cr(クロム)、Ru(ルテニウム)、Rh(ロジウム)、Os(オスミウム)等の重金属(密度4g/cm3以上の金属をいう。)が挙げられる。
【0009】
本発明により提供される他の一つの細胞固定化材は、シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞(例えば細菌細胞)を基材上に固定する固定化材であって、基材と、該基材の表面に単分子膜状に配列した所定の鎖長のリンカーとを備える。また、該リンカーに結合し、該リンカーを介して前記基材上に配置されたシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログを備える。さらに、前記シデロフォア又はアナログにキレートされた重金属であって前記標的細胞内において該シデロフォア又はアナログから実質的に遊離されない重金属を備える。そのような重金属の好適例としてはCr,Ru,Rh及びOsが挙げられる。
かかる構成の固定化材は、基材上に配置されたシデロフォア又はアナログの重金属錯体(すなわち、重金属をキレートしているシデロフォア又はアナログ)と標的細胞との親和性を利用して、該標的細胞を効率よく捕捉することができる。一方、上記錯体を構成する重金属は前記標的細胞内において該シデロフォア又はアナログから実質的に遊離されない。このため、細胞内に取り込んだシデロフォア−金属複合体(錯体)から金属を遊離させて利用する、という本来の金属取り込み機構を完遂することができない。換言すれば、該取り込み機構の途中で(少なくとも、該錯体を構成する金属が実質的に遊離されないことによって)その進行が妨げられる。このことを利用して、シデロフォア又はそのアナログに標的細胞が捕捉された状態を安定して維持することができる。
【0010】
この種の固定化材に使用する基材としては、先に説明した固定化材と同様のものを使用することができる。リンカーの鎖長は、基材上に配置された状態の標的細胞の細胞膜を理論上「貫通しない」長さであってもよく、あるいは該細胞膜を理論上「貫通する」長さであってもよい。標的細胞内でシデロフォアから実質的に遊離されない重金属が該シデロフォアにキレートされている本態様の固定化材では、リンカーの鎖長に拘わらず、金属の取り込み機構の進行をいずれかの段階で妨げることができるからである。すなわち、(1).シデロフォア錯体が標的細胞のレセプターに認識される段階、(2).該標的細胞がシデロフォア錯体を取り込もうとすることによって該標的細胞にシデロフォア錯体が結合する段階、(3).シデロフォア錯体が細胞膜よりも内部まで移送される段階、及び、(4).その細胞内においてシデロフォア錯体から金属を遊離させる段階、のうち、標的細胞の細胞膜を貫通しない鎖長のリンカーを有する固定化材では上記(3).の段階で、細胞膜を貫通する鎖長のリンカーを有する固定化材では上記(4).の段階で、金属取り込み機構の進行が妨げられる。このことを利用して、標的細胞が基材に固定された状態(シデロフォアに捕捉された状態)を安定して維持することができる。
【0011】
標的細胞内においてシデロフォアから遊離しない重金属をキレートさせたタイプの細胞固定化材における好ましい一つの態様では、前記リンカーの鎖長が、前記基材上に配置された状態の前記標的細胞の細胞膜を理論上「貫通する」長さに規定されている。かかる態様によると、シデロフォア−金属複合体が標的細胞の細胞膜の内側まで取り込まれた状態で該標的細胞を固定することができる。したがって、標的細胞をより安定的に固定することができる。
【0012】
ここに開示される固定化材は、上記シデロフォア又はアナログと基材との間で上記リンカーを介した電子伝達が可能な固定化材とすることができる。そのような固定化材の一つの好適例では、前記基材、前記リンカー及び前記シデロフォア又はアナログが、該基材とシデロフォア又はアナログとの間で該リンカーを介した電子伝達が可能となる物質により構成されている。
かかる構成によると、例えば、基材上に固定化された標的細胞の活動に伴う電流の発生(電気信号)を、リンカーを介して基材側で検出することができる。このことを利用して、基材上に固定化された標的細胞の状態をモニターし得る。また、かかる構成によると、例えば、基材からリンカーを介してシデロフォアに電流を印加することによって、シデロフォアにキレートされている金属の酸化数を制御し得る。これにより、例えば、上記金属とシデロフォア又はアナログとの相互作用の程度を調節することができる。
このような電子伝達が可能な固定化材は、少なくともシデロフォアの配置される表面が導電性材料(Au,Ag,Cu,Ni等)からなる基材を備えることが好ましい。リンカーとしては、(1).鎖長が概ね15Å未満である、及び、(2).鎖の一部又は全体が共役系を構成している、の少なくとも一方を満たすものが好ましい。
【0013】
上記シデロフォア又はアナログは、例えば、下記式(1):
−C[R1N(OH)C(=O)R2]3 (1);
表される構造部分を備えるシデロフォア又はアナログであり得る。ここで、上記式中のR1は二価の有機基である。該式中のR2は、炭素数1〜6(好ましくは1〜3)のアルキル基である。
上記式(1)は、ヒドロキサム酸(アミドのN−ヒドロキシアミド置換体)部分を有する置換基が一つの炭素(左端の炭素)に三つ結合しているタイプの、三脚構造の配位子である。このような三脚型配位子を構成するシデロフォア又はアナログは、上記ヒドロキサム酸部分を利用して金属(例えば、Fe,Cr,Ru,Rh及びOsのうち一又は二以上)を適切にキレートすることができるので好ましい。
【0014】
より好ましい態様では、上記シデロフォア又はアナログが、下記式(1’):
−C[R3NHC(=O)R4N(OH)C(=O)R5]3 (1’);
表される構造部分を備える。上記式中のR3及びR4は、同一の又は異なるアルキレン基であって、R3の炭素数とR4の炭素数との合計は3〜6である。また、上記式中のR5は、炭素数1〜6(さらに好ましくは1〜3)のアルキル基である。R3が炭素数2〜4のアルキレン基であり、R4が炭素数1〜3のアルキレン基であり、かつ、R3の炭素数とR4の炭素数との合計が3〜6であるシデロフォア又はアナログが好ましい。
【0015】
このような固定化材は、シデロフォアを介して鉄を内部に取り込む機構を有する種々の標的細胞(細菌細胞のような原核細胞、真菌細胞、動物細胞、植物細胞のような真核細胞)の固定に利用することができる。特に好ましい固定対象(標的細胞)としては、各種の細菌細胞が挙げられる。
【0016】
本発明によると、また、シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する細胞固定化材の製造方法が提供される。その製造方法は、所定の鎖長のリンカーが表面に単分子膜状に配列した基材を用意する工程を含む。ここで、該リンカーの鎖長は、該基材上に配置された状態の前記標的細胞の細胞膜を理論上貫通しない長さに規定される。この製造方法は、また、少なくとも一種のシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログを、前記リンカーに結合する工程を含む。この製造方法は、例えば、標的細胞の細胞膜を理論上貫通しない長さに規定された鎖長のリンカーを有する上記固定化材を製造する方法として好ましく採用され得る。
【0017】
上記製造方法では、まず、所定の鎖長のリンカーが表面に単分子膜状に配列した基材を用意する。基材表面にリンカーを配列する方法としては、従来公知の各種の方法を適宜採用することができる。例えば、基材の表面を構成する材質がガラス又は樹脂である場合には、上記所定の鎖長に対応した構造の公知のシランカップリング剤等を基材表面に結合させることによってリンカーを形成することができる。また、基材の表面を構成する材質が金(特に好ましくは、真空蒸着された金薄膜)である場合には、チオール基(SH)あるいはジスルフィド基(SS)を有する有機化合物を用いて、該金表面に良好な自己組織化膜を形成し得る。このとき基材表面に配列されているリンカーは、典型的には、その先端(基材上に配置されていない側の端部、すなわち自由端)に、後続する工程でシデロフォア又はアナログを結合するための官能基を有する。
【0018】
次いで、用意した基材の表面に配列したリンカーにシデロフォアを結合させる。かかる結合を適切に行うために、リンカーの先端にある官能基(リンカー側官能基)の種類に応じて、該官能基と反応し得る官能基(シデロフォア側官能基)を備えたシデロフォアを使用することが好ましい。リンカー側官能基とシデロフォア側官能基との好ましい組み合わせとしては、スクシンイミド基で活性化されたエステルとアミノ基との組み合わせ、カルボキシル基とアミノ基との組み合わせ、アルデヒド基とアミノ基との組み合わせ、等を例示することができる。
ここに開示される製造方法は、さらに、前記シデロフォア又はアナログに所定の金属をキレートする工程を含むことができる。この金属キレート工程は、従来公知の各種の方法を適用して実施することができる。
【0019】
本発明により提供される他の一つの固定化材製造方法は、所定の鎖長のリンカーが表面に単分子膜状に配列した基材を用意する工程を含む。好ましい一つの態様では、該リンカーの鎖長は、該基材上に配置された際の前記標的細胞の細胞膜を理論上貫通する長さに規定される。この製造方法は、また、少なくとも一種のシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログを、前記リンカーに結合する工程を含む。さらに、前記シデロフォア又はアナログに、少なくとも一種の重金属であって前記標的細胞内において該シデロフォア又はアナログから実質的に遊離されない重金属をキレートする工程を含む。この製造方法は、例えば、標的細胞内において該シデロフォアから実質的に遊離しない重金属が該シデロフォアにキレートされた上記固定化材を製造する方法として好ましく採用され得る。
【0020】
好ましい一つの態様では、前記リンカーに結合させるシデロフォア又はアナログとして、下記式(2):
X−C[R1N(OH)C(=O)R2]3 (2);
で表される人工シデロフォア、又は、上記式(2)で表される人工シデロフォアのアナログを使用する。ここで、上記式中のR1は二価の有機基である。該式中のR2は、炭素数1〜6(好ましくは1〜3)のアルキル基である。また、Xは、リンカーの先端と結合し得る官能基である。用意した基材に配置されたリンカーが先端にイミド基(好ましくはスクシンイミド基)を有する場合、Xの好適例としては、アミノ基(NH2)又はアルキルアミノ基(NHR0,ここでR0はアルキル基であり、好ましくはメチル基又はエチル基である。)が挙げられる。
【0021】
本発明によると、下記式(3):
Y−C[R3NHC(=O)R4N(OH)C(=O)R5]3 (3);
で表される人工シデロフォアが提供される。ここで、上記式中のR3及びR4は、同一の又は異なるアルキレン基であって、R3の炭素数とR4の炭素数との合計は3〜6である。また、上記式中のR5は、炭素数1〜6(さらに好ましくは1〜3)のアルキル基である。また、上記式中のYは、アミノ基(NH2)、アルキルアミノ基(NHR0,ここで、R0はアルキル基であり、好ましくはメチル基又はエチル基である。)又はニトロ基(NO2)である。R3が炭素数2〜4のアルキレン基であり、R4が炭素数1〜3のアルキレン基であり、かつ、R3の炭素数とR4の炭素数との合計が3〜6であるシデロフォア又はアナログが好ましい。
【0022】
上記式(3)で表される化合物の典型例は、下記式(4)で表される人工シデロフォアである。これは、上記式(3)におけるR3がプロピレン基であり、R4が炭素数1〜4の直鎖アルキル基であり、R5がメチル基であり、Yがアミノ基である化合物に相当する。
【0023】
【化1】

【0024】
本発明によると、シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する方法が提供される。その方法は、上述したいずれかの固定化材を用意する工程を含む。また、該固定化材に含まれるシデロフォア又はアナログによってキレートされ得る少なくとも一種の金属の存在下において該固定化材に前記標的細胞を接触させる工程を含む。かかる細胞固定化方法によると、上述したいずれかの固定化材を使用して、該固定化材に標的細胞を適切に固定することができる。
【発明を実施するための最良の形態】
【0025】
以下、本発明に関する具体的な実施例につき説明するが、本発明をかかる具体例に示すものに限定することを意図したものではない。また、本明細書において特に言及している内容以外の技術的事項であって本発明の実施に必要な事項は、従来技術に基づく当業者の設計事項として把握され得る。本発明は、本明細書及び図面によって開示されている技術内容と当該分野における技術常識とに基づいて実施することができる。
【0026】
<実施例1:人工シデロフォア[S1]の合成>
(合成例1)
以下に示す合成スキームにより、人工シデロフォア合成用の中間体(三脚部分)を合成した。
【0027】
【化2】

【0028】
ニトロメタン30.5g及びトリトンB(ベンジルトリメチルアンモニウムヒドロキシド)5gをジオキサン50gに溶解させた。該ジオキサン溶液を撹拌しながらアクリロニトリル79.5gを加えた。その際、反応液の温度が約30℃が保たれるようにコントロールした。該反応液を室温で18時間撹拌した後、希塩酸で中和した。これを同量のジクロロエタンに加え、水25mLで洗浄した後に濃縮して沈殿を得た。該沈殿をエタノールに溶解させて再結晶を行った。このようにして、上記合成スキームに示す化合物[1]の結晶49gを得た。
上記で得られた化合物[1]の結晶5.00g(22.7mmol)をテトラヒドロフラン(THF)50mLに溶解させた。このTHF溶液を撹拌しながら、1M(mol/L)のBH3を含むTHF溶液120mLを滴下した。この反応液を4時間還流した。反応液を室温に冷却した後、pHが1〜2になるまで2Mの塩酸を加え、NaOHで中和した。この溶液を濃縮することにより、上記合成スキームに示す化合物[2]の沈殿を得た。
【0029】
(合成例2)
以下に示す合成スキームにより、人工シデロフォア合成用の中間体(ヒドロキサム酸構造を提供する部分)を合成した。なお、下記スキーム中の「Bzl」はベンジル基を表している。
【0030】
【化3】

【0031】
無水フタル酸44g(0.3mol)と塩酸ヒドロキシルアミン26g(0.32mol)とを水100mLに懸濁させた。この懸濁液に無水炭酸ナトリウム20g(0.19mol)を徐々に加えた。その後、60〜70℃で一時間加熱し、室温に冷却した。得られた結晶を濾過し、熱エタノールに溶解させた。ここに濃塩酸を加え、室温に冷却した。このようにして、N−ヒドロキシフタルイミドの白色針状結晶を得た。収量は39g、収率は80%であった。
【0032】
得られたN−ヒドロキシフタルイミド15.01g(9.20×10-2mol)をジメチルスルホキシド(DMSO)150mLに溶解させた。この溶液を撹拌しつつ、無水炭酸カリウム9.65g(6.98×10-2mol)を徐々に加え、塩化ベンジル22.85g(1.80×10-1mol)を滴下して加えた。これを室温で24時間撹拌した後、300mLの冷水に注ぎ込み、0〜5℃に数分間放置した。析出した結晶を濾過し、10mLの水で3回洗浄した。得られた粗結晶を熱エタノールから再結晶して、N−ベンジルオキシフタルイミドの白色針状結晶を得た。収量は17.41g、収率は74.6%であった。
【0033】
得られたN−ベンジルオキシフタルイミド10.13g(4.00×10-2mol)とヒドラジン一水和物2.76g(5.51×10-2mol)とをエタノール300mLに溶解させた。この溶液を加熱して2時間還流した。室温まで放冷した後、濃塩酸4.83mLを加え、氷冷水中に十数分間放置した。析出した沈殿物を濾取し、エタノール16.6mLで3回、冷水100mLで1回洗浄した。この洗浄液と濾液とを混合し、ロータリーエバポレータで減圧乾固した。その残渣に200mLの冷水を加え、不溶物を濾過した。得られた濾液に粒状水酸化ナトリウムを、油相が分離してくるまで加えた。この溶液をジエチルエーテル70mLで4回抽出し、エーテル相を無水硫酸マグネシウムで乾燥した。この溶液を濾過し、ロータリーエバポレータで減圧濃縮して、油状のN−ベンジルオキシアミン(上記合成スキームに示す化合物[3])を得た。収量は4.71g、収率は95.5%であった。
【0034】
得られたN−ベンジルオキシアミン12.26g(0.10mol)と3−ブロモプロピオン酸5.10g(0.033mol)とをメタノール80mLに溶解させた。この溶液を加熱して5時間還流した。その後、反応液を濃縮し、その残渣に10%炭酸ナトリウム水溶液を加えて溶解させた。この溶液をジエチルエーテルで抽出して未反応のN−ベンジルオキシアミンを除去した。水相に塩酸を加えてpHを1〜2とし、ジエチルエーテルで抽出して未反応の3−ブロモプロピオン酸を除去した。次いで、この水相に炭酸水素ナトリウムを加えてpH3〜4に調整し、ジエチルエーテルで目的物を抽出した。そのエーテル相を無水硫酸マグネシウムで乾燥し、濃縮して、無色油状の3−ベンジルオキシアミノプロピオン酸を得た。収量は2.53g、収率は38.9%であった。
【0035】
得られた3−ベンジルオキシアミノプロピオン酸2.08g(10.7mmol)とトリエチルアミンとを酢酸エチル100mLに溶解させた。この溶液を氷冷及び撹拌しつつ、塩化アセチル1.26g(16.0mmol)を含む酢酸エチル溶液30mLを滴下して加えた。析出したトリエチルアミン塩酸塩を濾去した後、反応液を10%クエン酸水溶液40mLで2回、水40mLで1回、飽和食塩水40mLで1回洗浄した。これを無水硫酸マグネシウムで乾燥し、濃縮して、無色油状の3−(N−アセチル−N−ベンジルオキシアミノ)プロピオン酸(上記合成スキームに示す化合物[4])を得た。収量は1.49g、収率は58.7%であった。
【0036】
(合成例3)
これらの合成例により得られた化合物を使用して、以下に示す合成スキームによって人工シデロフォア[S1]を合成した。なお、下記スキーム中の「DMT−MM」は、4−(4,6−ジメトキシ−1,3,5−トリアジン−2−イル)−4−メチルモルフォリニウムクロライド(下記化学式(5)に示す化合物)を表している。また、下記スキーム中のnはいずれも2である。
【0037】
【化4】

【0038】
【化5】

【0039】
化合物[2]0.42g(1.79mmol)及び化合物[4]1.49g(6.28mmol)を水−メタノール混合溶媒(水:メタノールの体積比1:4)に溶解した溶液50mL中に、少量のトリエチルアミンと、縮合剤としてのDMT−MM 1.74g(6.91mmol)とを加え、室温で数日間攪拌した。
反応液を濃縮した後、水100mLを加えて酢酸エチル100mLで3回抽出した。これを無水硫酸マグネシウムで乾燥し、濃縮して白色油状物を得た。ESI−MASS(エレクトロスプレーイオン化質量分析)の結果から、上記合成スキームに示す化合物[5]が得られたことを確認した。分析データを以下に示す。
ESI−MASS:m/Z=912.0[M+Na]+ 。
【0040】
得られた化合物[5]を水/メタノール混合溶媒(水:メタノールの体積比1:4)に溶解した。これを約3.04×105Pa(3atm)のH2雰囲気下でPd/C触媒により接触還元して油状の固体を得た。ESI−MASSの結果から、上記合成スキームに示す化合物[S1]が得られたことを確認した(m/Z=590.3[M+H]+)。この化合物[S1]は、一つの炭素に、各々ヒドロキサム酸型の配位子を有する三つの置換基及び一つのアミノ基が結合した、三脚型ヒドロキサム酸構造の人工シデロフォアの一例である。
【0041】
(合成例4)
得られた人工シデロフォア[S1]と、これと等モルのFe(ClO4)3・nH2Oとを水中で混合した。溶液の色は速やかにオレンジ色に変化した。その結果物につき、UV−Vis(紫外−可視光)スペクトル及びESI−MASS分析を行った。それらの分析データを以下に示す。
UV−Visスペクトル(水中):λmax=422nm。
ESI−MASS:m/Z=643.4[M+H]+ 。
上記UV−Visスペクトルのデータにより、三本の腕(ヒドロキサム酸型の配位子を有する三つの置換基)によるFe(III)イオンへのキレート配位が示唆された。また、上記のESI−MASSスペクトルは、目的とする化合物にH+が付加したものに相当する。これらの結果から、以下に示す錯体[S1−Fe]の形成を確認した。これは、人工シデロフォア[S1]をリガンドとするFe(III)錯体であって、該シデロフォアの三本の腕がFeイオンに6座でキレート配位した構造を有する。
【0042】
【化6】

【0043】
<実施例2:人工シデロフォア[S2]の合成>
合成例2により得られたN−ベンジルオキシアミン(化合物[3])を出発物質として、以下に示す合成スキームにより、人工シデロフォア合成用の中間体(ヒドロキサム酸構造を提供する部分)を合成した。
【0044】
【化7】

【0045】
N−ベンジルオキシアミン14.65g(0.119mol)をメタノール100mLに溶解し、ブロモ酢酸5.51g(0.040mol)を加えた後、15〜20℃で3日間放置した。その後、反応液をロータリーエバポレータで減圧乾固した。その残渣に10%炭酸ナトリウム水溶液100mLを加えて溶解させ、ジエチルエーテル100mLで5回抽出した。水相に塩酸を加えてpHを2まで下げ、一時間冷却して沈殿を完全に析出させた。析出物を濾過し、冷水で洗浄した後に乾燥した。このようにして、N−ベンジルオキシグリシン(N−ベンジルオキシアミノ酢酸)の白色粉末を得た。収量は6.18g、収率は85.0%であった。
【0046】
得られたN−ベンジルオキシグリシンを酢酸t−ブチルに加え(N−ベンジルオキシグリシン1gあたり酢酸t−ブチル100mL)、70%HClO4を4〜6mL加えて溶解させた。室温にて2〜3日放置した後、飽和炭酸ナトリウム水溶液を加えて反応液を中和した。有機相を無水硫酸マグネシウムで乾燥した後、濃縮して無色油状のN−ベンジルオキシグリシンt−ブチルエステルを得た。
【0047】
得られたN−ベンジルオキシグリシンt−ブチルエステルを酢酸エチル150〜200mLに溶解した。これにトリエチルアミンを加え(N−ベンジルオキシグリシンを基準として0.5当量)、−5℃で攪拌しながら塩化アセチルの酢酸エチル溶液30mL(N−ベンジルオキシグリシンを基準として0.5当量の塩化アセチルを含む)を1〜2時間かけて滴下した。滴下終了後、再びトリエチルアミンと塩化アセチルとを同様にして加え、さらに30分間攪拌した。析出したトリエチルアミン塩酸塩を濾去した後、反応液を5%炭酸ナトリウム水溶液、0.1N塩酸、及び飽和食塩水でそれぞれ洗浄し、無水硫酸マグネシウムで乾燥して濃縮した。これを水−メタノール混合溶媒(又はジエチルエーテル−ヘキサン混合溶媒)により結晶化して、N−アセチル−N−ベンジルオキシグリシンt−ブチルエステルの白色結晶を得た。N−ベンジルオキシグリシンを基準とした収率は67〜82%であった。
【0048】
得られたN−アセチル−N−ベンジルオキシグリシンt−ブチルエステルにトリフルオロ酢酸(TFA)5〜10mLを加え、40℃で2〜5時間攪拌した。反応液を減圧濃縮し、水−メタノール混合溶媒(又はジエチルエーテル−ヘキサン混合溶媒)により結晶化して、N−アセチル−N−ベンジルオキシグリシン(上記合成スキームに示す化合物[6])を得た。収率は78〜87%であった。
【0049】
合成例3における3−(N−アセチル−N−ベンジルオキシアミノ)プロピオン酸に代えてN−アセチル−N−ベンジルオキシグリシン(化合物[6])を使用して、合成例3と同様の合成経路によって下記の化学式で表される人工シデロフォア[S2]を合成した。なお、この化学式中のnはいずれも1である。
【0050】
【化8】

【0051】
<実施例3:人工シデロフォアの機能の確認>
上記実施例により得られた人工シデロフォア[S1]の機能を確認するため、該シデロフォアの菌体への取込実験を行った。菌体としては、自らはシデロフォアの合成・分泌を行わず、外来のシデロフォアを利用してFeイオンを取り込むMicrobacterium flavescensを使用した。
ペプトン1g、乾燥酵母1g、K2HPO4 200mg及び鉄キレート剤(天然シデロフォア)2μgを、Milli−Q水(商標「Milli−Q」(ミリポア社製品)により精製した精製水)100mLに溶かし、pH7.4に調整した後、高温高圧で滅菌処理して液体培地を調製した。この培地に人工シデロフォア[S1]を1μM(1μmol/リットル)の濃度となるように加えて30℃で数日間インキュベーションを行った。その間、培地の濁度を濁度計にて測定することによって菌体の培養(増殖)をモニターした。また、コントロール(対照)として、人工シデロフォア[S1]に代えて同濃度(1μM)の天然シデロフォア(商品名「Deferoxamine mesylate」、SIGMA社製品)を使用した点以外は上記と同様にインキュベーションを行って菌体の培養をモニターした。
培養時間の経過に伴う濁度の変化を図1に示す。この図からわかるように、人工シデロフォアを用いた培地においても、天然シデロフォアを用いた場合(コントロール)と同様に菌体の増殖が可能であった。この結果は、Microbacterium flavescensが上記人工シデロフォアをFeイオンの取り込みに利用し得ること、換言すれば、該人工シデロフォアが菌体に取り込まれることを示唆している。また、この人工シデロフォアが、天然シデロフォアと同様に菌体のシデロフォアレセプターに認識されることが確認された。
なお、大腸菌(Escherichia Coli)を用いて同様の培養試験を行ったところ、上記と同様の生理活性が観測された。
【0052】
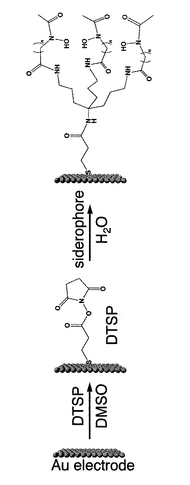
<実施例4:固定化材の製造>
上記人工シデロフォア[S1]を用いて、図2に示す手順で細胞固定化材を製造した。基材としては、真空蒸着法により形成された厚さ100nmの金(Au)薄膜を表面に有する雲母板(14mm×14mm角)を使用した。上記金薄膜(金電極)を水素炎でアニール処理した後、Milli−Q水及びDMSOで洗浄した。次いで、この基材をDTSP(ジチオビス(N−スクシンイミジルプロピオネート))のDMSO溶液(20mM)に室温で15分間浸漬した。これにより、金薄膜の表面をDTSP残基(N−スクシンイミジル−3−チオプロピオネート(NSTP))で修飾した。なお、実際には多数のDTSP残基が金表面に単分子膜状に配列するが、図では見易さのため一単位のDTSP残基のみを表示している。
【0053】
上記表面修飾が施された基材をDMSO及びMilli−Q水で洗浄した後、人工シデロフォア[S1]の水溶液(1mM)に一日間浸漬した。人工シデロフォア[S1]のアミノ基(−NH2)とDTSP残基の先端(自由端、すなわち基材に結合していない側の端部)との縮合反応によって、人工シデロフォア[S1]とDTSP残基とが結合した。このようにして、人工シデロフォア[S1]がリンカー(DTSP残基)を介して金薄膜に結合された構造の固定化材を得た。
【0054】
<実施例5:固定化性能の確認>
実施例3と同様の組成及び方法で調製した液体培地に、実施例4で製造した固定化材(人工シデロフォア修飾基材)を浸漬させ、菌体(Microbacterium flavescens)を添加した後、30℃で数日間のインキュベーションを行った。また、対照として人工シデロフォアによる修飾がされていない基材(非修飾基材)を使用し、同様に菌体のインキュベーションを行った。これらの固定化材及び非修飾基材(未処理の金薄膜)の表面をリン酸バッファ溶液(50mM、pH7.4)で十分に洗浄した後、それらの表面を光学顕微鏡で観察した。その結果を、固定化材については図3に、非修飾基材については図4に示す。図示するように、人工シデロフォアで修飾された基材(固定化材)の表面には菌体がみられた。これに対して、未処理の金薄膜の表面には菌体がみられなかった。図3と同じ表面をさらに走査型電子顕微鏡(SEM)で観察したところ、図5に示すように、菌体が基材上に固定されている様子がはっきりと確認された。
【0055】
以上、本発明の具体例を詳細に説明したが、これらは例示にすぎず、特許請求の範囲を限定するものではない。特許請求の範囲に記載の技術には、以上に例示した具体例を様々に変形、変更したものが含まれる。
また、本明細書又は図面に説明した技術要素は、単独であるいは各種の組み合わせによって技術的有用性を発揮するものであり、出願時請求項記載の組み合わせに限定されるものではない。また、本明細書又は図面に例示した技術は複数目的を同時に達成するものであり、そのうちの一つの目的を達成すること自体で技術的有用性を持つものである。
【図面の簡単な説明】
【0056】
【図1】人工シデロフォア存在下における菌体の培養時間と濁度の変化との関係を示すグラフである。
【図2】実施例4における細胞固定化材の製造方法を示す説明図である。
【図3】菌体培養後の固定化材の表面の光学顕微鏡写真である。
【図4】菌体培養後の金薄膜の表面の光学顕微鏡写真である。
【図5】菌体培養後の固定化材の表面を観察したSEM像である。
【技術分野】
【0001】
本発明は、所定の標的細胞を基材上に固定する細胞固定化材及びその製造方法に関する。また本発明は、そのような固定化材の製造に適した新規な人工シデロフォアに関する。
【背景技術】
【0002】
細胞内に鉄(Fe)を取り込む機構の一つとしてシデロフォアを介する機構が知られている。シデロフォアは、細菌や真菌がFeイオンを取り込むために体外に分泌する分子である。分泌されたシデロフォアは環境中のFeを捕捉して錯体(シデロフォア−Fe複合体)を形成する。この錯体は、膜タンパク質であるシデロフォアレセプターにより認識され、該レセプター部位を透過して細胞内に取り込まれる。そして、取り込まれた錯体からFeイオンが遊離され、細胞活動に利用される。なお、自らシデロフォアの生産及び分泌を行わない細菌等のなかにも、他の細菌等により生産され分泌された(外来性の)シデロフォアを利用して同様にFeを取り込むものがある。
特許文献1には、基板表面から少なくとも所定長さ離して該基材表面にリンカーで繋ぎ止めたリガンド(ヘム、シデロフォア、多糖類等)を用いて、生物学的分析対象物を同定する方法が記載されている。シデロフォア等を利用して病原体を同定する技術に関する他の従来技術文献として特許文献2が挙げられる。
【0003】
【特許文献1】特開2003−185668号公報
【特許文献2】米国特許出願公開第2004/0137428号明細書
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明は、シデロフォアを介するFe取込機構を利用して所定の標的細胞をより適切に固定することのできる固定化材を提供することを一つの目的とする。本発明の他の一つの目的は、かかる固定化材の好適な製造方法を提供することである。さらに他の目的は、そのような固定化材の製造等に用いる材料として好適な人工シデロフォアを提供することである。また、該固定化材を用いて細胞を固定する方法を提供することである。
【課題を解決するための手段】
【0005】
本発明によると、シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞(例えば細菌細胞)を基材上に固定する細胞固定化材が提供される。その固定化材は、基材と、該基材の表面に単分子膜状に配列した所定の鎖長のリンカーとを備える。また、該リンカーに結合し、該リンカーを介して前記基材上に配置されたシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログを備える。ここで、前記リンカーの鎖長は、前記基材上に配置された状態の前記標的細胞の細胞膜を理論上貫通しない長さに規定されている。
かかる構成の固定化材は、リンカーを介して基材上に配置されたシデロフォア又はアナログを備える。したがって、該シデロフォア又はアナログと標的細胞との親和性(典型的には、標的細胞がシデロフォア又はアナログの金属錯体を認識して細胞内に取り込もうとする性質)を利用して、該標的細胞を効率よく捕捉することができる。ここで、リンカーの鎖長は「標的細胞の細胞膜を貫通しない長さ」に規定されている。したがって標的細胞は、上記シデロフォア又はアナログの金属錯体を細胞膜より内側まで取り込むことはできない。このため、細胞内(細胞膜よりも内側)に取り込んだシデロフォア−金属複合体(錯体)から金属を遊離させて利用する、という本来の金属取り込み機構が完遂されない。換言すれば、該取り込み機構の途中で、複合体が細胞膜の内側までは取り込まれないことによって、その進行が妨げられる。このことを利用して、標的細胞がシデロフォア又はそのアナログに捕捉された状態(すなわち、標的細胞が基材上に固定された状態)を安定して維持することができる。
【0006】
上記固定化材が備える基材の材質や形状等は特に限定されず、固定化材の用途等に応じて適当な基材を種々選択することができる。例えば、ガラス、鉱物、樹脂、金属又はこれらを適宜複合させて成る複合材料を主構成材料とする基材を好ましく使用することができる。後述するように該基材とシデロフォア又はアナログ(以下、単に「シデロフォア」ということもある。)との間で電子伝達が可能な固定化材を構成する場合には、少なくともシデロフォアの配置される表面が導電性材料からなる基材が好ましい。そのような導電性表面を有する基材として、例えば、ガラス、鉱物(例えば雲母)、樹脂等の表面に、金(Au)、銀(Ag)、銅(Cu)、ニッケル(Ni)等の導電性金属の薄膜を有する基材を用いることができる。また、導電性金属からなる金属板を基材としてもよい。
【0007】
該基材上に配列されたリンカーの鎖長は、標的細胞の細胞膜を理論上貫通しない長さの範囲内にある。細胞の細胞膜の状態(厚さ)は周囲の環境等によって異なり得るが、ここに開示される一つの細胞固定化材は、基材上に配置された状態の細胞の細胞膜の厚さ(すなわち、顕微鏡観察等により把握された標的細胞の細胞膜あるいは細胞膜および細胞壁の厚さ)を基準として、その状態における細胞膜の厚さを超えない長さのリンカーを備える。細胞膜の厚さは、その細胞(標的細胞)の種類によっても異なる得る。例えば大腸菌の場合、その外膜の厚さは数十Å程度(膜全体では250Å程度)である。このように、標的細胞に応じて適切な長さのリンカー(当該標的細胞の細胞膜の厚さを超えない鎖長のリンカー)を有する固定化材を設計することができる。リンカーの鎖長が短すぎると標的細胞を固定化する効率が低下傾向となる場合があるため、通常は、リンカーの鎖長を少なくとも凡そ6Å以上とすることが好ましい。かかる鎖長のリンカーが基材表面に単分子膜状に配列していることは、この固定化材の表面の各部における特性(細胞固定特性)が均一化されるという点で有利である。
ここに開示される固定化材の一つの好ましい態様では、リンカーの長さが概ね50Å(5nm)未満である。典型的には、リンカーの長さが概ね6Å以上50Å未満である。他の好ましい態様では、リンカーの長さが概ね30Å未満(典型的には、6Å以上30Å未満)である。より好ましい態様では、リンカーの長さが概ね6Å以上15Å未満である。
【0008】
上記固定化材は、前記シデロフォア又はアナログにキレートされた金属を含む態様であり得る。このような固定化材によると、あらかじめ金属がキレートされたシデロフォア又はアナログ(すなわち、シデロフォア又はアナログの金属錯体)が標的細胞によって速やかに認識されることから、標的細胞をより効率よく固定することができる。
シデロフォア又はアナログにキレートさせる金属は、そのキレート錯体(複合体)が標的細胞のレセプターによって認識され得るものであればよい。そのような金属の典型例は鉄(Fe)である。また、前述の条件を具備する限り、Fe以外の各種金属をシデロフォア又はアナログにキレートさせてもよい。キレートさせる金属の好適例(Fe以外)としては、Cr(クロム)、Ru(ルテニウム)、Rh(ロジウム)、Os(オスミウム)等の重金属(密度4g/cm3以上の金属をいう。)が挙げられる。
【0009】
本発明により提供される他の一つの細胞固定化材は、シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞(例えば細菌細胞)を基材上に固定する固定化材であって、基材と、該基材の表面に単分子膜状に配列した所定の鎖長のリンカーとを備える。また、該リンカーに結合し、該リンカーを介して前記基材上に配置されたシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログを備える。さらに、前記シデロフォア又はアナログにキレートされた重金属であって前記標的細胞内において該シデロフォア又はアナログから実質的に遊離されない重金属を備える。そのような重金属の好適例としてはCr,Ru,Rh及びOsが挙げられる。
かかる構成の固定化材は、基材上に配置されたシデロフォア又はアナログの重金属錯体(すなわち、重金属をキレートしているシデロフォア又はアナログ)と標的細胞との親和性を利用して、該標的細胞を効率よく捕捉することができる。一方、上記錯体を構成する重金属は前記標的細胞内において該シデロフォア又はアナログから実質的に遊離されない。このため、細胞内に取り込んだシデロフォア−金属複合体(錯体)から金属を遊離させて利用する、という本来の金属取り込み機構を完遂することができない。換言すれば、該取り込み機構の途中で(少なくとも、該錯体を構成する金属が実質的に遊離されないことによって)その進行が妨げられる。このことを利用して、シデロフォア又はそのアナログに標的細胞が捕捉された状態を安定して維持することができる。
【0010】
この種の固定化材に使用する基材としては、先に説明した固定化材と同様のものを使用することができる。リンカーの鎖長は、基材上に配置された状態の標的細胞の細胞膜を理論上「貫通しない」長さであってもよく、あるいは該細胞膜を理論上「貫通する」長さであってもよい。標的細胞内でシデロフォアから実質的に遊離されない重金属が該シデロフォアにキレートされている本態様の固定化材では、リンカーの鎖長に拘わらず、金属の取り込み機構の進行をいずれかの段階で妨げることができるからである。すなわち、(1).シデロフォア錯体が標的細胞のレセプターに認識される段階、(2).該標的細胞がシデロフォア錯体を取り込もうとすることによって該標的細胞にシデロフォア錯体が結合する段階、(3).シデロフォア錯体が細胞膜よりも内部まで移送される段階、及び、(4).その細胞内においてシデロフォア錯体から金属を遊離させる段階、のうち、標的細胞の細胞膜を貫通しない鎖長のリンカーを有する固定化材では上記(3).の段階で、細胞膜を貫通する鎖長のリンカーを有する固定化材では上記(4).の段階で、金属取り込み機構の進行が妨げられる。このことを利用して、標的細胞が基材に固定された状態(シデロフォアに捕捉された状態)を安定して維持することができる。
【0011】
標的細胞内においてシデロフォアから遊離しない重金属をキレートさせたタイプの細胞固定化材における好ましい一つの態様では、前記リンカーの鎖長が、前記基材上に配置された状態の前記標的細胞の細胞膜を理論上「貫通する」長さに規定されている。かかる態様によると、シデロフォア−金属複合体が標的細胞の細胞膜の内側まで取り込まれた状態で該標的細胞を固定することができる。したがって、標的細胞をより安定的に固定することができる。
【0012】
ここに開示される固定化材は、上記シデロフォア又はアナログと基材との間で上記リンカーを介した電子伝達が可能な固定化材とすることができる。そのような固定化材の一つの好適例では、前記基材、前記リンカー及び前記シデロフォア又はアナログが、該基材とシデロフォア又はアナログとの間で該リンカーを介した電子伝達が可能となる物質により構成されている。
かかる構成によると、例えば、基材上に固定化された標的細胞の活動に伴う電流の発生(電気信号)を、リンカーを介して基材側で検出することができる。このことを利用して、基材上に固定化された標的細胞の状態をモニターし得る。また、かかる構成によると、例えば、基材からリンカーを介してシデロフォアに電流を印加することによって、シデロフォアにキレートされている金属の酸化数を制御し得る。これにより、例えば、上記金属とシデロフォア又はアナログとの相互作用の程度を調節することができる。
このような電子伝達が可能な固定化材は、少なくともシデロフォアの配置される表面が導電性材料(Au,Ag,Cu,Ni等)からなる基材を備えることが好ましい。リンカーとしては、(1).鎖長が概ね15Å未満である、及び、(2).鎖の一部又は全体が共役系を構成している、の少なくとも一方を満たすものが好ましい。
【0013】
上記シデロフォア又はアナログは、例えば、下記式(1):
−C[R1N(OH)C(=O)R2]3 (1);
表される構造部分を備えるシデロフォア又はアナログであり得る。ここで、上記式中のR1は二価の有機基である。該式中のR2は、炭素数1〜6(好ましくは1〜3)のアルキル基である。
上記式(1)は、ヒドロキサム酸(アミドのN−ヒドロキシアミド置換体)部分を有する置換基が一つの炭素(左端の炭素)に三つ結合しているタイプの、三脚構造の配位子である。このような三脚型配位子を構成するシデロフォア又はアナログは、上記ヒドロキサム酸部分を利用して金属(例えば、Fe,Cr,Ru,Rh及びOsのうち一又は二以上)を適切にキレートすることができるので好ましい。
【0014】
より好ましい態様では、上記シデロフォア又はアナログが、下記式(1’):
−C[R3NHC(=O)R4N(OH)C(=O)R5]3 (1’);
表される構造部分を備える。上記式中のR3及びR4は、同一の又は異なるアルキレン基であって、R3の炭素数とR4の炭素数との合計は3〜6である。また、上記式中のR5は、炭素数1〜6(さらに好ましくは1〜3)のアルキル基である。R3が炭素数2〜4のアルキレン基であり、R4が炭素数1〜3のアルキレン基であり、かつ、R3の炭素数とR4の炭素数との合計が3〜6であるシデロフォア又はアナログが好ましい。
【0015】
このような固定化材は、シデロフォアを介して鉄を内部に取り込む機構を有する種々の標的細胞(細菌細胞のような原核細胞、真菌細胞、動物細胞、植物細胞のような真核細胞)の固定に利用することができる。特に好ましい固定対象(標的細胞)としては、各種の細菌細胞が挙げられる。
【0016】
本発明によると、また、シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する細胞固定化材の製造方法が提供される。その製造方法は、所定の鎖長のリンカーが表面に単分子膜状に配列した基材を用意する工程を含む。ここで、該リンカーの鎖長は、該基材上に配置された状態の前記標的細胞の細胞膜を理論上貫通しない長さに規定される。この製造方法は、また、少なくとも一種のシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログを、前記リンカーに結合する工程を含む。この製造方法は、例えば、標的細胞の細胞膜を理論上貫通しない長さに規定された鎖長のリンカーを有する上記固定化材を製造する方法として好ましく採用され得る。
【0017】
上記製造方法では、まず、所定の鎖長のリンカーが表面に単分子膜状に配列した基材を用意する。基材表面にリンカーを配列する方法としては、従来公知の各種の方法を適宜採用することができる。例えば、基材の表面を構成する材質がガラス又は樹脂である場合には、上記所定の鎖長に対応した構造の公知のシランカップリング剤等を基材表面に結合させることによってリンカーを形成することができる。また、基材の表面を構成する材質が金(特に好ましくは、真空蒸着された金薄膜)である場合には、チオール基(SH)あるいはジスルフィド基(SS)を有する有機化合物を用いて、該金表面に良好な自己組織化膜を形成し得る。このとき基材表面に配列されているリンカーは、典型的には、その先端(基材上に配置されていない側の端部、すなわち自由端)に、後続する工程でシデロフォア又はアナログを結合するための官能基を有する。
【0018】
次いで、用意した基材の表面に配列したリンカーにシデロフォアを結合させる。かかる結合を適切に行うために、リンカーの先端にある官能基(リンカー側官能基)の種類に応じて、該官能基と反応し得る官能基(シデロフォア側官能基)を備えたシデロフォアを使用することが好ましい。リンカー側官能基とシデロフォア側官能基との好ましい組み合わせとしては、スクシンイミド基で活性化されたエステルとアミノ基との組み合わせ、カルボキシル基とアミノ基との組み合わせ、アルデヒド基とアミノ基との組み合わせ、等を例示することができる。
ここに開示される製造方法は、さらに、前記シデロフォア又はアナログに所定の金属をキレートする工程を含むことができる。この金属キレート工程は、従来公知の各種の方法を適用して実施することができる。
【0019】
本発明により提供される他の一つの固定化材製造方法は、所定の鎖長のリンカーが表面に単分子膜状に配列した基材を用意する工程を含む。好ましい一つの態様では、該リンカーの鎖長は、該基材上に配置された際の前記標的細胞の細胞膜を理論上貫通する長さに規定される。この製造方法は、また、少なくとも一種のシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログを、前記リンカーに結合する工程を含む。さらに、前記シデロフォア又はアナログに、少なくとも一種の重金属であって前記標的細胞内において該シデロフォア又はアナログから実質的に遊離されない重金属をキレートする工程を含む。この製造方法は、例えば、標的細胞内において該シデロフォアから実質的に遊離しない重金属が該シデロフォアにキレートされた上記固定化材を製造する方法として好ましく採用され得る。
【0020】
好ましい一つの態様では、前記リンカーに結合させるシデロフォア又はアナログとして、下記式(2):
X−C[R1N(OH)C(=O)R2]3 (2);
で表される人工シデロフォア、又は、上記式(2)で表される人工シデロフォアのアナログを使用する。ここで、上記式中のR1は二価の有機基である。該式中のR2は、炭素数1〜6(好ましくは1〜3)のアルキル基である。また、Xは、リンカーの先端と結合し得る官能基である。用意した基材に配置されたリンカーが先端にイミド基(好ましくはスクシンイミド基)を有する場合、Xの好適例としては、アミノ基(NH2)又はアルキルアミノ基(NHR0,ここでR0はアルキル基であり、好ましくはメチル基又はエチル基である。)が挙げられる。
【0021】
本発明によると、下記式(3):
Y−C[R3NHC(=O)R4N(OH)C(=O)R5]3 (3);
で表される人工シデロフォアが提供される。ここで、上記式中のR3及びR4は、同一の又は異なるアルキレン基であって、R3の炭素数とR4の炭素数との合計は3〜6である。また、上記式中のR5は、炭素数1〜6(さらに好ましくは1〜3)のアルキル基である。また、上記式中のYは、アミノ基(NH2)、アルキルアミノ基(NHR0,ここで、R0はアルキル基であり、好ましくはメチル基又はエチル基である。)又はニトロ基(NO2)である。R3が炭素数2〜4のアルキレン基であり、R4が炭素数1〜3のアルキレン基であり、かつ、R3の炭素数とR4の炭素数との合計が3〜6であるシデロフォア又はアナログが好ましい。
【0022】
上記式(3)で表される化合物の典型例は、下記式(4)で表される人工シデロフォアである。これは、上記式(3)におけるR3がプロピレン基であり、R4が炭素数1〜4の直鎖アルキル基であり、R5がメチル基であり、Yがアミノ基である化合物に相当する。
【0023】
【化1】

【0024】
本発明によると、シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する方法が提供される。その方法は、上述したいずれかの固定化材を用意する工程を含む。また、該固定化材に含まれるシデロフォア又はアナログによってキレートされ得る少なくとも一種の金属の存在下において該固定化材に前記標的細胞を接触させる工程を含む。かかる細胞固定化方法によると、上述したいずれかの固定化材を使用して、該固定化材に標的細胞を適切に固定することができる。
【発明を実施するための最良の形態】
【0025】
以下、本発明に関する具体的な実施例につき説明するが、本発明をかかる具体例に示すものに限定することを意図したものではない。また、本明細書において特に言及している内容以外の技術的事項であって本発明の実施に必要な事項は、従来技術に基づく当業者の設計事項として把握され得る。本発明は、本明細書及び図面によって開示されている技術内容と当該分野における技術常識とに基づいて実施することができる。
【0026】
<実施例1:人工シデロフォア[S1]の合成>
(合成例1)
以下に示す合成スキームにより、人工シデロフォア合成用の中間体(三脚部分)を合成した。
【0027】
【化2】

【0028】
ニトロメタン30.5g及びトリトンB(ベンジルトリメチルアンモニウムヒドロキシド)5gをジオキサン50gに溶解させた。該ジオキサン溶液を撹拌しながらアクリロニトリル79.5gを加えた。その際、反応液の温度が約30℃が保たれるようにコントロールした。該反応液を室温で18時間撹拌した後、希塩酸で中和した。これを同量のジクロロエタンに加え、水25mLで洗浄した後に濃縮して沈殿を得た。該沈殿をエタノールに溶解させて再結晶を行った。このようにして、上記合成スキームに示す化合物[1]の結晶49gを得た。
上記で得られた化合物[1]の結晶5.00g(22.7mmol)をテトラヒドロフラン(THF)50mLに溶解させた。このTHF溶液を撹拌しながら、1M(mol/L)のBH3を含むTHF溶液120mLを滴下した。この反応液を4時間還流した。反応液を室温に冷却した後、pHが1〜2になるまで2Mの塩酸を加え、NaOHで中和した。この溶液を濃縮することにより、上記合成スキームに示す化合物[2]の沈殿を得た。
【0029】
(合成例2)
以下に示す合成スキームにより、人工シデロフォア合成用の中間体(ヒドロキサム酸構造を提供する部分)を合成した。なお、下記スキーム中の「Bzl」はベンジル基を表している。
【0030】
【化3】

【0031】
無水フタル酸44g(0.3mol)と塩酸ヒドロキシルアミン26g(0.32mol)とを水100mLに懸濁させた。この懸濁液に無水炭酸ナトリウム20g(0.19mol)を徐々に加えた。その後、60〜70℃で一時間加熱し、室温に冷却した。得られた結晶を濾過し、熱エタノールに溶解させた。ここに濃塩酸を加え、室温に冷却した。このようにして、N−ヒドロキシフタルイミドの白色針状結晶を得た。収量は39g、収率は80%であった。
【0032】
得られたN−ヒドロキシフタルイミド15.01g(9.20×10-2mol)をジメチルスルホキシド(DMSO)150mLに溶解させた。この溶液を撹拌しつつ、無水炭酸カリウム9.65g(6.98×10-2mol)を徐々に加え、塩化ベンジル22.85g(1.80×10-1mol)を滴下して加えた。これを室温で24時間撹拌した後、300mLの冷水に注ぎ込み、0〜5℃に数分間放置した。析出した結晶を濾過し、10mLの水で3回洗浄した。得られた粗結晶を熱エタノールから再結晶して、N−ベンジルオキシフタルイミドの白色針状結晶を得た。収量は17.41g、収率は74.6%であった。
【0033】
得られたN−ベンジルオキシフタルイミド10.13g(4.00×10-2mol)とヒドラジン一水和物2.76g(5.51×10-2mol)とをエタノール300mLに溶解させた。この溶液を加熱して2時間還流した。室温まで放冷した後、濃塩酸4.83mLを加え、氷冷水中に十数分間放置した。析出した沈殿物を濾取し、エタノール16.6mLで3回、冷水100mLで1回洗浄した。この洗浄液と濾液とを混合し、ロータリーエバポレータで減圧乾固した。その残渣に200mLの冷水を加え、不溶物を濾過した。得られた濾液に粒状水酸化ナトリウムを、油相が分離してくるまで加えた。この溶液をジエチルエーテル70mLで4回抽出し、エーテル相を無水硫酸マグネシウムで乾燥した。この溶液を濾過し、ロータリーエバポレータで減圧濃縮して、油状のN−ベンジルオキシアミン(上記合成スキームに示す化合物[3])を得た。収量は4.71g、収率は95.5%であった。
【0034】
得られたN−ベンジルオキシアミン12.26g(0.10mol)と3−ブロモプロピオン酸5.10g(0.033mol)とをメタノール80mLに溶解させた。この溶液を加熱して5時間還流した。その後、反応液を濃縮し、その残渣に10%炭酸ナトリウム水溶液を加えて溶解させた。この溶液をジエチルエーテルで抽出して未反応のN−ベンジルオキシアミンを除去した。水相に塩酸を加えてpHを1〜2とし、ジエチルエーテルで抽出して未反応の3−ブロモプロピオン酸を除去した。次いで、この水相に炭酸水素ナトリウムを加えてpH3〜4に調整し、ジエチルエーテルで目的物を抽出した。そのエーテル相を無水硫酸マグネシウムで乾燥し、濃縮して、無色油状の3−ベンジルオキシアミノプロピオン酸を得た。収量は2.53g、収率は38.9%であった。
【0035】
得られた3−ベンジルオキシアミノプロピオン酸2.08g(10.7mmol)とトリエチルアミンとを酢酸エチル100mLに溶解させた。この溶液を氷冷及び撹拌しつつ、塩化アセチル1.26g(16.0mmol)を含む酢酸エチル溶液30mLを滴下して加えた。析出したトリエチルアミン塩酸塩を濾去した後、反応液を10%クエン酸水溶液40mLで2回、水40mLで1回、飽和食塩水40mLで1回洗浄した。これを無水硫酸マグネシウムで乾燥し、濃縮して、無色油状の3−(N−アセチル−N−ベンジルオキシアミノ)プロピオン酸(上記合成スキームに示す化合物[4])を得た。収量は1.49g、収率は58.7%であった。
【0036】
(合成例3)
これらの合成例により得られた化合物を使用して、以下に示す合成スキームによって人工シデロフォア[S1]を合成した。なお、下記スキーム中の「DMT−MM」は、4−(4,6−ジメトキシ−1,3,5−トリアジン−2−イル)−4−メチルモルフォリニウムクロライド(下記化学式(5)に示す化合物)を表している。また、下記スキーム中のnはいずれも2である。
【0037】
【化4】

【0038】
【化5】

【0039】
化合物[2]0.42g(1.79mmol)及び化合物[4]1.49g(6.28mmol)を水−メタノール混合溶媒(水:メタノールの体積比1:4)に溶解した溶液50mL中に、少量のトリエチルアミンと、縮合剤としてのDMT−MM 1.74g(6.91mmol)とを加え、室温で数日間攪拌した。
反応液を濃縮した後、水100mLを加えて酢酸エチル100mLで3回抽出した。これを無水硫酸マグネシウムで乾燥し、濃縮して白色油状物を得た。ESI−MASS(エレクトロスプレーイオン化質量分析)の結果から、上記合成スキームに示す化合物[5]が得られたことを確認した。分析データを以下に示す。
ESI−MASS:m/Z=912.0[M+Na]+ 。
【0040】
得られた化合物[5]を水/メタノール混合溶媒(水:メタノールの体積比1:4)に溶解した。これを約3.04×105Pa(3atm)のH2雰囲気下でPd/C触媒により接触還元して油状の固体を得た。ESI−MASSの結果から、上記合成スキームに示す化合物[S1]が得られたことを確認した(m/Z=590.3[M+H]+)。この化合物[S1]は、一つの炭素に、各々ヒドロキサム酸型の配位子を有する三つの置換基及び一つのアミノ基が結合した、三脚型ヒドロキサム酸構造の人工シデロフォアの一例である。
【0041】
(合成例4)
得られた人工シデロフォア[S1]と、これと等モルのFe(ClO4)3・nH2Oとを水中で混合した。溶液の色は速やかにオレンジ色に変化した。その結果物につき、UV−Vis(紫外−可視光)スペクトル及びESI−MASS分析を行った。それらの分析データを以下に示す。
UV−Visスペクトル(水中):λmax=422nm。
ESI−MASS:m/Z=643.4[M+H]+ 。
上記UV−Visスペクトルのデータにより、三本の腕(ヒドロキサム酸型の配位子を有する三つの置換基)によるFe(III)イオンへのキレート配位が示唆された。また、上記のESI−MASSスペクトルは、目的とする化合物にH+が付加したものに相当する。これらの結果から、以下に示す錯体[S1−Fe]の形成を確認した。これは、人工シデロフォア[S1]をリガンドとするFe(III)錯体であって、該シデロフォアの三本の腕がFeイオンに6座でキレート配位した構造を有する。
【0042】
【化6】

【0043】
<実施例2:人工シデロフォア[S2]の合成>
合成例2により得られたN−ベンジルオキシアミン(化合物[3])を出発物質として、以下に示す合成スキームにより、人工シデロフォア合成用の中間体(ヒドロキサム酸構造を提供する部分)を合成した。
【0044】
【化7】

【0045】
N−ベンジルオキシアミン14.65g(0.119mol)をメタノール100mLに溶解し、ブロモ酢酸5.51g(0.040mol)を加えた後、15〜20℃で3日間放置した。その後、反応液をロータリーエバポレータで減圧乾固した。その残渣に10%炭酸ナトリウム水溶液100mLを加えて溶解させ、ジエチルエーテル100mLで5回抽出した。水相に塩酸を加えてpHを2まで下げ、一時間冷却して沈殿を完全に析出させた。析出物を濾過し、冷水で洗浄した後に乾燥した。このようにして、N−ベンジルオキシグリシン(N−ベンジルオキシアミノ酢酸)の白色粉末を得た。収量は6.18g、収率は85.0%であった。
【0046】
得られたN−ベンジルオキシグリシンを酢酸t−ブチルに加え(N−ベンジルオキシグリシン1gあたり酢酸t−ブチル100mL)、70%HClO4を4〜6mL加えて溶解させた。室温にて2〜3日放置した後、飽和炭酸ナトリウム水溶液を加えて反応液を中和した。有機相を無水硫酸マグネシウムで乾燥した後、濃縮して無色油状のN−ベンジルオキシグリシンt−ブチルエステルを得た。
【0047】
得られたN−ベンジルオキシグリシンt−ブチルエステルを酢酸エチル150〜200mLに溶解した。これにトリエチルアミンを加え(N−ベンジルオキシグリシンを基準として0.5当量)、−5℃で攪拌しながら塩化アセチルの酢酸エチル溶液30mL(N−ベンジルオキシグリシンを基準として0.5当量の塩化アセチルを含む)を1〜2時間かけて滴下した。滴下終了後、再びトリエチルアミンと塩化アセチルとを同様にして加え、さらに30分間攪拌した。析出したトリエチルアミン塩酸塩を濾去した後、反応液を5%炭酸ナトリウム水溶液、0.1N塩酸、及び飽和食塩水でそれぞれ洗浄し、無水硫酸マグネシウムで乾燥して濃縮した。これを水−メタノール混合溶媒(又はジエチルエーテル−ヘキサン混合溶媒)により結晶化して、N−アセチル−N−ベンジルオキシグリシンt−ブチルエステルの白色結晶を得た。N−ベンジルオキシグリシンを基準とした収率は67〜82%であった。
【0048】
得られたN−アセチル−N−ベンジルオキシグリシンt−ブチルエステルにトリフルオロ酢酸(TFA)5〜10mLを加え、40℃で2〜5時間攪拌した。反応液を減圧濃縮し、水−メタノール混合溶媒(又はジエチルエーテル−ヘキサン混合溶媒)により結晶化して、N−アセチル−N−ベンジルオキシグリシン(上記合成スキームに示す化合物[6])を得た。収率は78〜87%であった。
【0049】
合成例3における3−(N−アセチル−N−ベンジルオキシアミノ)プロピオン酸に代えてN−アセチル−N−ベンジルオキシグリシン(化合物[6])を使用して、合成例3と同様の合成経路によって下記の化学式で表される人工シデロフォア[S2]を合成した。なお、この化学式中のnはいずれも1である。
【0050】
【化8】

【0051】
<実施例3:人工シデロフォアの機能の確認>
上記実施例により得られた人工シデロフォア[S1]の機能を確認するため、該シデロフォアの菌体への取込実験を行った。菌体としては、自らはシデロフォアの合成・分泌を行わず、外来のシデロフォアを利用してFeイオンを取り込むMicrobacterium flavescensを使用した。
ペプトン1g、乾燥酵母1g、K2HPO4 200mg及び鉄キレート剤(天然シデロフォア)2μgを、Milli−Q水(商標「Milli−Q」(ミリポア社製品)により精製した精製水)100mLに溶かし、pH7.4に調整した後、高温高圧で滅菌処理して液体培地を調製した。この培地に人工シデロフォア[S1]を1μM(1μmol/リットル)の濃度となるように加えて30℃で数日間インキュベーションを行った。その間、培地の濁度を濁度計にて測定することによって菌体の培養(増殖)をモニターした。また、コントロール(対照)として、人工シデロフォア[S1]に代えて同濃度(1μM)の天然シデロフォア(商品名「Deferoxamine mesylate」、SIGMA社製品)を使用した点以外は上記と同様にインキュベーションを行って菌体の培養をモニターした。
培養時間の経過に伴う濁度の変化を図1に示す。この図からわかるように、人工シデロフォアを用いた培地においても、天然シデロフォアを用いた場合(コントロール)と同様に菌体の増殖が可能であった。この結果は、Microbacterium flavescensが上記人工シデロフォアをFeイオンの取り込みに利用し得ること、換言すれば、該人工シデロフォアが菌体に取り込まれることを示唆している。また、この人工シデロフォアが、天然シデロフォアと同様に菌体のシデロフォアレセプターに認識されることが確認された。
なお、大腸菌(Escherichia Coli)を用いて同様の培養試験を行ったところ、上記と同様の生理活性が観測された。
【0052】
<実施例4:固定化材の製造>
上記人工シデロフォア[S1]を用いて、図2に示す手順で細胞固定化材を製造した。基材としては、真空蒸着法により形成された厚さ100nmの金(Au)薄膜を表面に有する雲母板(14mm×14mm角)を使用した。上記金薄膜(金電極)を水素炎でアニール処理した後、Milli−Q水及びDMSOで洗浄した。次いで、この基材をDTSP(ジチオビス(N−スクシンイミジルプロピオネート))のDMSO溶液(20mM)に室温で15分間浸漬した。これにより、金薄膜の表面をDTSP残基(N−スクシンイミジル−3−チオプロピオネート(NSTP))で修飾した。なお、実際には多数のDTSP残基が金表面に単分子膜状に配列するが、図では見易さのため一単位のDTSP残基のみを表示している。
【0053】
上記表面修飾が施された基材をDMSO及びMilli−Q水で洗浄した後、人工シデロフォア[S1]の水溶液(1mM)に一日間浸漬した。人工シデロフォア[S1]のアミノ基(−NH2)とDTSP残基の先端(自由端、すなわち基材に結合していない側の端部)との縮合反応によって、人工シデロフォア[S1]とDTSP残基とが結合した。このようにして、人工シデロフォア[S1]がリンカー(DTSP残基)を介して金薄膜に結合された構造の固定化材を得た。
【0054】
<実施例5:固定化性能の確認>
実施例3と同様の組成及び方法で調製した液体培地に、実施例4で製造した固定化材(人工シデロフォア修飾基材)を浸漬させ、菌体(Microbacterium flavescens)を添加した後、30℃で数日間のインキュベーションを行った。また、対照として人工シデロフォアによる修飾がされていない基材(非修飾基材)を使用し、同様に菌体のインキュベーションを行った。これらの固定化材及び非修飾基材(未処理の金薄膜)の表面をリン酸バッファ溶液(50mM、pH7.4)で十分に洗浄した後、それらの表面を光学顕微鏡で観察した。その結果を、固定化材については図3に、非修飾基材については図4に示す。図示するように、人工シデロフォアで修飾された基材(固定化材)の表面には菌体がみられた。これに対して、未処理の金薄膜の表面には菌体がみられなかった。図3と同じ表面をさらに走査型電子顕微鏡(SEM)で観察したところ、図5に示すように、菌体が基材上に固定されている様子がはっきりと確認された。
【0055】
以上、本発明の具体例を詳細に説明したが、これらは例示にすぎず、特許請求の範囲を限定するものではない。特許請求の範囲に記載の技術には、以上に例示した具体例を様々に変形、変更したものが含まれる。
また、本明細書又は図面に説明した技術要素は、単独であるいは各種の組み合わせによって技術的有用性を発揮するものであり、出願時請求項記載の組み合わせに限定されるものではない。また、本明細書又は図面に例示した技術は複数目的を同時に達成するものであり、そのうちの一つの目的を達成すること自体で技術的有用性を持つものである。
【図面の簡単な説明】
【0056】
【図1】人工シデロフォア存在下における菌体の培養時間と濁度の変化との関係を示すグラフである。
【図2】実施例4における細胞固定化材の製造方法を示す説明図である。
【図3】菌体培養後の固定化材の表面の光学顕微鏡写真である。
【図4】菌体培養後の金薄膜の表面の光学顕微鏡写真である。
【図5】菌体培養後の固定化材の表面を観察したSEM像である。
【特許請求の範囲】
【請求項1】
シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する固定化材であって、
基材と、
該基材の表面に単分子膜状に配列した所定の鎖長のリンカーと、
該リンカーに結合し、該リンカーを介して前記基材上に配置されたシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログと、
を備えており、ここで前記リンカーの鎖長は、前記基材上に配置された状態の前記標的細胞の細胞膜を理論上貫通しない長さに規定されていることを特徴とする細胞固定化材。
【請求項2】
前記シデロフォア又はアナログにキレートされた金属を含む、請求項1に記載の細胞固定化材。
【請求項3】
シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する固定化材であって、
基材と、
該基材の表面に単分子膜状に配列した所定の鎖長のリンカーと、
該リンカーに結合し、該リンカーを介して前記基材上に配置されたシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログと、
前記シデロフォア又はアナログにキレートされた重金属であって前記標的細胞内において該シデロフォア又はアナログから実質的に遊離されない重金属と、
を備えることを特徴とする細胞固定化材。
【請求項4】
前記リンカーの鎖長は、前記基材上に配置された状態の前記標的細胞の細胞膜を理論上貫通する長さに規定されている、請求項3に記載の細胞固定化材。
【請求項5】
前記標的細胞が細菌細胞である、請求項1〜4のいずれかに記載の細胞固定化材。
【請求項6】
前記基材、前記リンカー及び前記シデロフォア又はアナログは、該基材とシデロフォア又はアナログとの間で該リンカーを介した電子伝達が可能となる物質により構成されている、請求項1〜5のいずれかに記載の細胞固定化材。
【請求項7】
前記シデロフォア又はアナログは、下記式(1):
−C[R1N(OH)C(=O)R2]3 (1)
(式中、R1は二価の有機基である。R2は炭素数1〜6のアルキル基である。);
で表される構造部分を備える、請求項1〜6のいずれかに記載の細胞固定化材。
【請求項8】
シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する固定化材を製造する方法であって、以下の工程:
所定の鎖長のリンカーが表面に単分子膜状に配列した基材を用意する工程、ここで該リンカーの鎖長は、該基材上に配置された状態の前記標的細胞の細胞膜を理論上貫通しない長さに規定される;及び
少なくとも一種のシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログを、前記リンカーに結合する工程;
を包含する方法。
【請求項9】
前記シデロフォア又はアナログに所定の金属をキレートする工程をさらに含む、請求項8に記載の方法。
【請求項10】
シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する固定化材を製造する方法であって、以下の工程:
所定の鎖長のリンカーが表面に単分子膜状に配列した基材を用意する工程;及び
少なくとも一種のシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログを、前記リンカーに結合する工程;及び
前記シデロフォア又はアナログに、少なくとも一種の重金属であって前記標的細胞内において該シデロフォア又はアナログから実質的に遊離されない重金属をキレートする工程;
を包含する方法。
【請求項11】
前記リンカーに結合させるシデロフォア又はアナログとして、下記式(2):
X−C[R1N(OH)C(=O)R2]3 (2)
(式中、R1は二価の有機基である。R2は炭素数1〜6のアルキル基である。Xは前記リンカーの先端と結合し得る官能基である。);
で表される人工シデロフォア又はそのアナログを使用する、請求項8〜10のいずれかに記載の方法。
【請求項12】
下記式(3):
Y−C[R3NHC(=O)R4N(OH)C(=O)R5]3 (3)
(式中、R3及びR4は同一の又は異なるアルキレン基であってR3の炭素数とR4の炭素数との合計は3〜6である。R5は炭素数1〜6のアルキル基である。Yはアミノ基、アルキルアミノ基又はニトロ基である。)
で表される人工シデロフォア。
【請求項13】
下記式(4):
【化1】

で表される、人工シデロフォア。
【請求項14】
シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する方法であって、以下の工程:
請求項1〜7のいずれかに記載の固定化材を用意する工程;及び
前記固定化材に含まれるシデロフォア又はアナログによってキレートされ得る少なくとも一種の金属の存在下において該固定化材に前記標的細胞を接触させる工程;
を包含する方法。
【請求項1】
シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する固定化材であって、
基材と、
該基材の表面に単分子膜状に配列した所定の鎖長のリンカーと、
該リンカーに結合し、該リンカーを介して前記基材上に配置されたシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログと、
を備えており、ここで前記リンカーの鎖長は、前記基材上に配置された状態の前記標的細胞の細胞膜を理論上貫通しない長さに規定されていることを特徴とする細胞固定化材。
【請求項2】
前記シデロフォア又はアナログにキレートされた金属を含む、請求項1に記載の細胞固定化材。
【請求項3】
シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する固定化材であって、
基材と、
該基材の表面に単分子膜状に配列した所定の鎖長のリンカーと、
該リンカーに結合し、該リンカーを介して前記基材上に配置されたシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログと、
前記シデロフォア又はアナログにキレートされた重金属であって前記標的細胞内において該シデロフォア又はアナログから実質的に遊離されない重金属と、
を備えることを特徴とする細胞固定化材。
【請求項4】
前記リンカーの鎖長は、前記基材上に配置された状態の前記標的細胞の細胞膜を理論上貫通する長さに規定されている、請求項3に記載の細胞固定化材。
【請求項5】
前記標的細胞が細菌細胞である、請求項1〜4のいずれかに記載の細胞固定化材。
【請求項6】
前記基材、前記リンカー及び前記シデロフォア又はアナログは、該基材とシデロフォア又はアナログとの間で該リンカーを介した電子伝達が可能となる物質により構成されている、請求項1〜5のいずれかに記載の細胞固定化材。
【請求項7】
前記シデロフォア又はアナログは、下記式(1):
−C[R1N(OH)C(=O)R2]3 (1)
(式中、R1は二価の有機基である。R2は炭素数1〜6のアルキル基である。);
で表される構造部分を備える、請求項1〜6のいずれかに記載の細胞固定化材。
【請求項8】
シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する固定化材を製造する方法であって、以下の工程:
所定の鎖長のリンカーが表面に単分子膜状に配列した基材を用意する工程、ここで該リンカーの鎖長は、該基材上に配置された状態の前記標的細胞の細胞膜を理論上貫通しない長さに規定される;及び
少なくとも一種のシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログを、前記リンカーに結合する工程;
を包含する方法。
【請求項9】
前記シデロフォア又はアナログに所定の金属をキレートする工程をさらに含む、請求項8に記載の方法。
【請求項10】
シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する固定化材を製造する方法であって、以下の工程:
所定の鎖長のリンカーが表面に単分子膜状に配列した基材を用意する工程;及び
少なくとも一種のシデロフォア又は該シデロフォアのアナログであって少なくとも一種の金属をキレートし得る部分を備えたアナログを、前記リンカーに結合する工程;及び
前記シデロフォア又はアナログに、少なくとも一種の重金属であって前記標的細胞内において該シデロフォア又はアナログから実質的に遊離されない重金属をキレートする工程;
を包含する方法。
【請求項11】
前記リンカーに結合させるシデロフォア又はアナログとして、下記式(2):
X−C[R1N(OH)C(=O)R2]3 (2)
(式中、R1は二価の有機基である。R2は炭素数1〜6のアルキル基である。Xは前記リンカーの先端と結合し得る官能基である。);
で表される人工シデロフォア又はそのアナログを使用する、請求項8〜10のいずれかに記載の方法。
【請求項12】
下記式(3):
Y−C[R3NHC(=O)R4N(OH)C(=O)R5]3 (3)
(式中、R3及びR4は同一の又は異なるアルキレン基であってR3の炭素数とR4の炭素数との合計は3〜6である。R5は炭素数1〜6のアルキル基である。Yはアミノ基、アルキルアミノ基又はニトロ基である。)
で表される人工シデロフォア。
【請求項13】
下記式(4):
【化1】

で表される、人工シデロフォア。
【請求項14】
シデロフォアを介して鉄を内部に取り込む機構を有する所定の標的細胞を基材上に固定する方法であって、以下の工程:
請求項1〜7のいずれかに記載の固定化材を用意する工程;及び
前記固定化材に含まれるシデロフォア又はアナログによってキレートされ得る少なくとも一種の金属の存在下において該固定化材に前記標的細胞を接触させる工程;
を包含する方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2006−124346(P2006−124346A)
【公開日】平成18年5月18日(2006.5.18)
【国際特許分類】
【出願番号】特願2004−317106(P2004−317106)
【出願日】平成16年10月29日(2004.10.29)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2004年9月13日 社団法人日本化学会生体機能関連化学部会発行の「第19回 生体機能関連化学シンポジウム 講演要旨集」に発表
【出願人】(304021277)国立大学法人 名古屋工業大学 (784)
【Fターム(参考)】
【公開日】平成18年5月18日(2006.5.18)
【国際特許分類】
【出願日】平成16年10月29日(2004.10.29)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2004年9月13日 社団法人日本化学会生体機能関連化学部会発行の「第19回 生体機能関連化学シンポジウム 講演要旨集」に発表
【出願人】(304021277)国立大学法人 名古屋工業大学 (784)
【Fターム(参考)】
[ Back to top ]

