細胞培養容器
【課題】培養細胞の自動判別に適した培養容器を提供することを目的とする。
【解決手段】本発明は、個別管理が必要とされる細胞を培養するための、底壁と側壁とを有する培養容器であって、底壁に、凹部を有する細胞収容部が配置されており、凹部が4個以上近接しており、凹部の壁面が、凹部の最も低い位置から凹部の外縁に進むに従って高くなるような傾斜面を有し、近接する凹部間のピッチが1mm以下である、培養容器に関する。
【解決手段】本発明は、個別管理が必要とされる細胞を培養するための、底壁と側壁とを有する培養容器であって、底壁に、凹部を有する細胞収容部が配置されており、凹部が4個以上近接しており、凹部の壁面が、凹部の最も低い位置から凹部の外縁に進むに従って高くなるような傾斜面を有し、近接する凹部間のピッチが1mm以下である、培養容器に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、受精卵などの個別管理が必要な細胞を培養するための培養容器、ならびに該培養容器を用いた培養細胞の判別方法に関する。
【背景技術】
【0002】
培養系で精子と卵子とを体外受精させて受精卵(接合子)を作製して、さらに受精卵を卵割、桑実胚、胚盤胞の段階を経て、透明帯から孵化した脱出胚盤胞の段階まで培養することが可能となり、この卵割から胚盤胞の段階にある受精卵を子宮に移植して産子を得る補助的生殖技術(ART)が、家畜領域のみならずヒトの不妊医療でも確立されている。
【0003】
しかし、体外受精による妊娠成功率は必ずしも高くはなく、たとえばヒトにおいては、その妊娠成功率は、依然として25〜35%程度に留まっている。その原因の一つとして、培養において子宮への移植に適した良質な受精卵を得られる確率が高くないことが挙げられる。培養された受精卵は、専門家が顕微鏡で個別に観察することにより、子宮への移植に適した良質な受精卵であるか否か判別されている。従って、その判別にはコスト及び時間がかかるという問題がある。そこで、子宮への移植に適した良質な受精卵を低コストかつ短時間で判別する技術が求められている。また、良質な受精卵の判断が個人により異なるという問題もあり、良質な受精卵だという基準や選別する技術が必要とされている。
【0004】
従来、受精卵の培養は、培養容器上のウェル内に500μL程度の培養液を入れ、該培養液中で受精卵を培養する方法、培養容器上のウェル内に20μL程度の微小滴を載せ、該微小滴の表面をミネラルオイルで被覆し、その中に受精卵を入れる方法(非特許文献1)等により行われていた。また、非特許文献2及び3は、培養容器上に複数の窪みを設け、それぞれの窪みごとに受精卵を導入して培養することにより受精卵を個別に管理する方法を開示している。非特許文献4は、培養容器上にメッシュ体を配置し、メッシュの編目ごとに受精卵を導入して培養することにより受精卵を個別に管理する方法を開示している。
【0005】
さらに近年では、細胞治療・再生医療の研究開発が進み、細胞培養中の無菌環境を維持することや、細胞の品質確保、あるいは細胞を迅速且つ大量に培養し判別することについてのニーズが高まっている。しかし従来は、上記非特許文献1〜4に示すような培養容器を用い、手作業で培養細胞の状態を観察しているため、連続的な細胞状態の観察が困難であること、培養環境の変化や雑菌による汚染リスクなど細胞への影響が懸念されること、培養細胞の判別にコストと時間がかかり効率が悪いことなどが課題となっていた。したがって、培養細胞を自動的に判別する技術の開発が望まれていた。また、例えば畜産の分野においても、国により「家畜改良増殖目標」が策定され、この目標達成のため受精卵移植を活用した肉専用種の増頭の推進が図られている中、細胞の自動判別技術は非常に有用と考えられる。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】菅原,尾川(編)、「生殖機能細胞の培養法」、日本、学会出版センター、1993年6月出版、第25〜153頁
【非特許文献2】M. Taka, et al. Journal of Reproduction and Development, 51, 533-537 (2005)
【非特許文献3】Vajta G., et al. Molecular Reproduction and Development, 55, 256-264 (2000)
【非特許文献4】P. J. Booth, et al. Biology of Reproduction, 77, 765-779 (2007)
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明者らは、上記従来の状況に鑑み、子宮への移植に適した良質な受精卵を低コストかつ短時間で判別すべく、受精卵の判別の自動化の可能性を検討した。そして、非特許文献1に記載される培養容器を用いて自動化を検討したところ、培養している複数の受精卵がプレート内や微小滴内で移動してしまい、それぞれ質の異なる受精卵を個別に管理することができず、受精卵の判別を自動で行うのには適してないことが明らかとなった。また、受精卵の自動判別においては、CCDカメラ等を用いて受精卵の画像を撮像することが考えられるが、従来の培養容器では受精卵を個別に撮影することが困難であることも明らかとなった。
【0008】
そこで、非特許文献2〜4に記載される複数の窪みを設けた培養容器や、メッシュを配置した培養容器を用いて自動化を検討したところ、受精卵の密度も高く、受精卵を個別に管理することは可能であるが、窪み内やメッシュの編目内で受精卵が移動して窪みの側壁やメッシュに接触した場合には、取得した画像の輪郭抽出処理により受精卵の画像を抽出することが困難であることを見出した。
【0009】
従って、本発明は、培養細胞の自動判別に適した培養容器を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者らは、上記課題を解決すべく検討を行った結果、壁面が、最も低い位置から外縁に進むに従って高くなるような傾斜面を有する凹部が密に配置された細胞収容部を有する培養容器を用いて細胞を培養することにより、培養細胞の撮影画像における細胞の輪郭抽出処理が効率よく実施でき、従って、培養細胞の自動判別に適していることを見出し、本発明を完成した。
【0011】
すなわち、本発明は以下の発明を包含する。
(1)個別管理が必要とされる細胞を培養するための、底壁と側壁とを有する培養容器であって、
底壁に、凹部を有する細胞収容部が配置されており、
凹部が4個以上近接しており、
凹部の壁面が、凹部の最も低い位置から凹部の外縁に進むに従って高くなるような傾斜面を有し、
近接する凹部間のピッチが1mm以下である、
前記培養容器。
【0012】
(2)凹部の壁面が、直線部分を含む傾斜面を有する、(1)に記載の培養容器。
(3)傾斜面の表面粗さについて、最大高さRyが1.0μm未満である、(2)に記載の培養容器。
(4)凹部の開口部の開口幅が100μm〜300μmである、(1)〜(3)のいずれかに記載の培養容器。
【0013】
(5)凹部の深さが50μm〜200μmである、(1)〜(4)のいずれかに記載の培養容器。
(6)凹部の開口部が円形である、(1)〜(5)のいずれかに記載の培養容器。
(7)凹部の壁面が円錐状又は円錐台状の部分を有する、(6)に記載の培養容器。
【0014】
(8)円錐又は円錐台の中心線と母線とのなす角度が89〜45°である、(7)に記載の培養容器。
(9)近接する凹部が、1mm2あたり1個以上の密度で配置されている、(1)〜(8)のいずれかに記載の培養容器。
(10)近接する4個以上の凹部が正方格子状又は最密充填状に配置されている、請求項(1)〜(9)のいずれかに記載の培養容器。
【0015】
(11)凹部が24個以上配置されている、(1)〜(10)のいずれかに記載の培養容器。
(12)細胞が、受精卵、卵細胞、ES細胞及びiPS細胞からなる群から選択される、(1)〜(11)のいずれかに記載の培養容器。
(13)細胞が、ウシの受精卵である、(12)に記載の培養容器。
【0016】
(14)近接する4個以上の凹部が、それらを囲む内壁により、培養容器内のその他の部分と隔てられている、(1)〜(13)のいずれかに記載の培養容器。
(15)培養容器の外周部であって細胞収容部を有しない部分に液体収容部を有する、(14)に記載の培養容器。
(16)培養細胞の自動判別に使用するための、(1)〜(15)のいずれかに記載の培養容器。
【0017】
(17)倍率4倍の対物レンズを用いて細胞収容部を顕微鏡観察したときに、観察視野内に4個以上の凹部が含まれる、(16)に記載の培養容器。
(18)培養細胞の判別方法であって、(1)〜(17)のいずれかに記載の培養容器の細胞収容部の凹部に、受精卵、卵細胞、ES細胞及びiPS細胞からなる群から選択される細胞をそれぞれ導入して培養し、顕微鏡により取得した培養細胞の画像を検出装置によって撮像し、得られた像を輪郭抽出処理に付すことを含む、前記判別方法。
【発明の効果】
【0018】
本発明により、培養細胞の自動判別に適した培養容器が提供される。
【図面の簡単な説明】
【0019】
【図1a】本発明の実施形態を示す概略図である。
【図1b】本発明の実施形態を示す概略図である。
【図2a】本発明の実施形態である培養容器Aを示す概略図である。
【図2b】本発明の実施形態を示す概略図である。
【図3】近接した凹部を最密充填状に配置する場合の平面図である。
【図4】比較例で用いた培養容器Bを示す。
【図5】本発明の培養容器Aで培養した受精卵の顕微鏡写真である。
【図6】図5の画像に対して閾値処理を行った結果を示す。
【図7】比較例で用いた培養容器Bで培養した受精卵の顕微鏡写真である。
【図8】図7の画像に対して閾値処理を行った結果を示す。
【図9】比較例で用いた培養容器Bで培養した受精卵の顕微鏡写真である。
【図10】図9の画像に対して閾値処理を行った結果を示す。
【図11】本発明の実施形態である培養容器Cを示す平面図である。
【図12】図11のIIIa−IIIa断面図である。
【図13】図11における細胞収容部の部分拡大図である。
【図14】図13のIIIb−IIIb断面図である。
【図15】図13における凹部の部分拡大図である。
【図16】図15のIIIc−IIIc断面図である。
【図17】培養容器Cの外観写真である。
【図18】培養容器Cの細胞収容部の断面形状計測結果を示すグラフである。
【図19】培養容器Cの凹部の断面形状計測結果を示すグラフである。
【図20】図19の右側傾斜面に対して線形フィッティングを行い、傾きを補正した図である。
【図21】培養容器Dの凹部の断面形状計測結果を示すグラフである。
【図22】図21の右側傾斜面に対して線形フィッティングを行い、傾きを補正した図である。
【図23】本発明の実施形態である培養容器Eを示す平面図である。
【図24】図23のIVa−IVa断面図である。
【図25】図23における細胞収容部の部分拡大図である。
【図26】図25のIVb−IVb断面図である。
【図27】図25における凹部の部分拡大図である。
【図28】図27のIVc−IVc断面図である。
【図29】培養容器Eの凹部の断面形状計測結果を示すグラフである。
【図30】図29の右側傾斜面に対して線形フィッティングを行い、傾きを補正した図である。
【図31】本発明の培養容器Cで培養したマウス受精卵の顕微鏡写真である。
【図32】図31の画像に対して閾値処理を行った結果を示す。
【図33】本発明の培養容器Cで培養したウシ受精卵の顕微鏡写真である。
【図34】図33の画像に対して閾値処理を行った結果を示す。
【発明を実施するための形態】
【0020】
本発明は、個別管理が必要とされる細胞を培養するための、底壁と側壁とを有する培養容器であって、
底壁に、凹部を有する細胞収容部が配置されており、
凹部が4個以上近接しており、
凹部の壁面が、凹部の最も低い位置から凹部の外縁に進むに従って高くなるような傾斜面を有し、
近接する凹部間のピッチが1mm以下である、
前記培養容器に関する。
【0021】
個別管理が必要とされる細胞とは、培養中及び培養後において個々の細胞を特定する必要があるものをさし、複数の細胞を培養している培養容器において互いに混同してしまうことが望ましくない細胞をさす。個別管理が必要とされる細胞としては、例えば、受精卵、卵細胞、ES細胞(胚性幹細胞)及びiPS細胞(人工多能性幹細胞)が挙げられる。卵細胞は、未受精の卵細胞をさし、未成熟卵母細胞及び成熟卵母細胞が含まれる。受精卵は、受精後、卵割により2細胞期、4細胞期、8細胞期と細胞数が増えていき、桑実胚を経て、胚盤胞へと発生する。受精卵には、2細胞胚、4細胞胚及び8細胞胚などの初期胚、桑実胚、胚盤胞(初期胚盤胞、拡張胚盤胞及び脱出胚盤胞を含む)が含まれる。胚盤胞は、胎盤を形成する潜在能力がある外部細胞と胚を形成する潜在能力がある内部細胞塊からなる胚を意味する。ES細胞は胚盤胞の内部細胞塊から得られる未分化な多能性又は全能性細胞をさす。iPS細胞は、体細胞(主に線維芽細胞)へ数種類の遺伝子(転写因子)を導入することにより、ES細胞に似た分化万能性を持たせた細胞をさす。すなわち、本発明において培養の対象となる細胞には、受精卵や胚盤胞のように複数の細胞の集合体も包含される。本発明の培養容器は、好ましくは哺乳動物及び鳥類の細胞、特に哺乳動物の細胞の培養に好適である。哺乳動物は、温血脊椎動物をさし、例えば、ヒト及びサルなどの霊長類、マウス、ラット及びウサギなどの齧歯類、イヌ及びネコなどの愛玩動物、ならびにウシ、ウマ及びブタなどの家畜が挙げられる。本発明の培養容器は、ウシの受精卵の培養に特に好適である。
【0022】
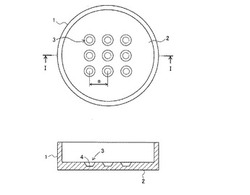
本発明の培養容器は、底壁と側壁とを有し、底壁と側壁とから形成される空間に液体を収容可能である。底壁の形状は特に制限されず、三角形及び四角形等の多角形の形状でもよく、円(円形及び楕円形を含む)の形状でもよく、側壁は底壁の外縁を囲うように形成される。本発明の培養容器において、通常、底壁と反対側は開口している。なお、本発明の培養容器は、通常のシャーレと同様に蓋を有していてもよい。本発明の培養容器の底壁と側壁は、好ましくは慣用のシャーレと同様の形状を形成する。そして、培養容器の底壁には、凹部を有する細胞収容部が形成されている。細胞収容部の凹部は、培養容器の底壁に直接窪みとして設けられた凹部でもよいし(図1a)、底壁から突出した部材により形成される凹部でもよい(図1b)。
【0023】
凹部は、4個以上、好ましくは6個以上、より好ましくは8個以上が、近接して形成されている。凹部は、少なくとも4個が近接して形成されていればよく、さらに近接していない凹部が別途形成されていてもよい。また、4個以上近接して形成された凹部の群が、複数群配置されていてもよく、それらの群は互いに近接していなくてもよい。
【0024】
凹部は、壁面及び開口部を有し、開口部の外縁の形状は特に制限されないが、好ましくは円形(円形及び楕円形を含む)である。
【0025】
近接する凹部間のピッチは1mm以下である。ただし、上記ピッチは収容する細胞の種類に依存して異なる。
【0026】
例えば、ウシ受精卵を収容する場合、近接する凹部間のピッチは通常1mm以下、好ましくは0.7mm以下、さらに好ましくは0.45mm以下である。観察装置として、1/2インチのCCD素子、4、10、20倍の対物レンズを備えたものがよく用いられる。このような観察装置で、4倍の対物レンズを選択した場合の観察可能な視野はおよそ1.6mm×1.2mmであり、この観察視野内に4個以上の凹部が含まれるように設計することが好ましい。凹部の直径がウシ受精卵の直径(0.25mm)より大きく、0.3mmだとすると、ピッチが0.9mm以下の場合、1.6mm×1.2mmの顕微鏡視野内に2×2=4個の受精卵を観察することができ、ピッチが0.65mm以下の場合、1.6mm×1.2mmの顕微鏡視野内に3×2=6個の受精卵を観察することができ、ピッチが0.43mm以下の場合、1.6mm×1.2mmの顕微鏡視野内に4×3=12個の受精卵を観察することができる。観察視野内に4個以上の凹部が含まれるように設計することで、例えば培養細胞の自動判別を行う場合に、一度に多数個の細胞を処理でき、また視野内の一つの受精卵と他の受精卵との比較判別が容易になるため、判別操作をより効率的に行うことができる。
【0027】
凹部間のピッチは近接する凹部の中心間の距離である(図1のa)。凹部の中心は、凹部の開口部の外縁が形成する図形の重心位置とし、外縁が円形であればその円の中心をさす。上記凹部間のピッチは通常平均ピッチをさし、平均ピッチは、ある凹部に関しては、近接する全ての凹部とのピッチから平均値を算出したものをさす。凹部間のピッチは、凹部の開口部の外縁の寸法より大きい。凹部の開口部の外縁の寸法は、開口部の外縁が円形であればその直径をさし、そうでなければ開口部の外縁が形成する図形の最大径と最短径の平均値とする。換言すれば、近接する凹部は、1mm2あたり1個以上、好ましくは4個以上の密度で配置されている。近接する4個以上の凹部は、正方格子状又は最密充填状に配置されていることが好ましい。例えば、25個の凹部を5×5の正方格子状に配置する場合を挙げることができる。正方格子状又は最密充填状に配置することにより、培養容器の底壁における各凹部の位置の特定が容易になり、自動化処理に適用しやすい。また、凹部は、培養容器1個あたり、合計で好ましくは24個以上、より好ましくは50個以上配置されている。培養容器1個あたりに多くの凹部を設けることにより、一定数の細胞を培養するのに必要な培養容器の数を低減することができ、経済的に有利である。
【0028】
凹部の開口部の外縁が円形である場合、近接する凹部間のピッチは、X+m+n(ここで、Xは細胞の最大径を表し、mは凹部の開口部の外縁が形成する円の直径から細胞の最大径を引いた長さを表し、nは凹部間の仕切りの長さを表す)と規定することもできる。凹部間の仕切りとは、近接する凹部間の外縁と外縁の最短距離をさす。ここでmは通常0.1mm以下、好ましくは0.07mm以下、さらに好ましくは0.05mm以下であり、nは通常0.6mm以下、好ましくは0.35mm以下、さらに好ましくは0.15mm以下である。
【0029】
上記のようなピッチで凹部を密に配置することにより、細胞を個別に管理しつつ多くの細胞を同時に培養でき、さらに顕微鏡の一視野に多くの細胞が入るため、一度に多くの細胞の画像を取得することができる。
【0030】
細胞収容部の凹部の開口部は、細胞を収容可能な開口幅を有する。ここで、凹部の開口部の開口幅は、凹部の開口部の外縁が形成する図形の最短径の長さをさす。従って、凹部の開口部の外縁が円形である場合、開口幅は円の直径に等しく、その直径は、培養する細胞の最大寸法より大きいものとなる。本発明の培養容器により受精卵を培養する場合、胚盤胞の段階まで培養することが望ましいため、円形の開口部の直径は、胚盤胞の段階の細胞の最大寸法より大きいものであることが望ましい。胚盤胞の段階の細胞の最大寸法は通常100μm〜280μmであることから、円形の開口部の直径は、通常100μm以上である。また、上述のように、凹部の開口部の外縁の寸法(開口部の外縁が形成する図形の最大径と最短径の平均値)は、凹部間のピッチより小さい。開口部の外縁が円形である場合、その直径は、凹部間のピッチ、すなわち円の中心間の距離より短く、通常1mm未満である。上記開口幅及び寸法は収容する細胞の種類に依存して異なるが、通常は、凹部の開口部の開口幅を、例えば100μm〜300μmとすることが好ましい。
【0031】
例えば、ウシ受精卵の場合、凹部の開口部の開口幅(凹部が円形である場合は直径)は、通常0.25mm以上、好ましくは0.26mm以上、さらに好ましくは0.27mm以上であり、通常1mm未満、好ましくは0.7mm未満、さらに好ましくは0.45mm未満である。また、上記凹部の開口部の開口幅は、X+m(ここでXは細胞の最大径を表す)と規定することもできる。ここで、mは、好ましくは0.01mm以上、さらに好ましくは0.02mm以上である。
【0032】
細胞収容部の凹部の壁面は、凹部の最も低い位置から凹部の外縁に進むに従って高くなるような傾斜面を有する。細胞収容部の凹部は、通常、培養容器の底壁側に底がくるように形成される。凹部の傾斜面の形状(プロファイル)は、凹部の最も低い位置から凹部の外縁へ向かって曲線状に高くなる場合、階段状に高くなる場合等、適宜採用することができるが、特に直線部分を含むこと、すなわち凹部の最も低い位置から凹部の外縁へ進むに従い、その経路の全区間もしくは一部の区間が直線状に高くなる傾斜面であることが好ましい。直線部分を含むことで、凹部内に配置した細胞の移動が抑制され、細胞を凹部の最深部に固定し易くなる。したがって、顕微鏡で観察した場合に鮮明な画像を得ることができる。
【0033】
傾斜面の表面粗さは、大きい値であると、顕微鏡で透過観察を行った画像を輪郭抽出処理に付す際に、傾斜面上の凹凸に起因して明瞭な輪郭が得られない恐れがあるため、可能な限り小さい値であることが好ましい。具体的には、最大高さRy(粗さ曲線からその平均線の方向に基準長さだけを抜き取り、この抜き取り部分における山頂線と谷底線との間隔をいう)が1.0μm未満、特に0.5μm未満であることが好ましい。なお、傾斜面の表面粗さは、培養容器の鋳型を作製する際に磨き処理を施す等して、鋳型の加工精度を高めることにより小さくすることができる。
【0034】
細胞収容部の凹部の壁面は、好ましくは円錐状又は円錐台状の部分を含む。円錐状又は円錐台状の部分は、培養容器の底壁側に、円錐の頂点又は円錐台の上面及び下面のうち面積の狭い方がくるように形成される。円錐状には、円錐及び楕円錐、これらに類似の形状、例えば、円錐又は楕円錐の頂点が丸みを帯びている形状、円錐面が外側に膨らんでいる形状、円錐面が内側に凹んでいる形状などが含まれる。円錐台状には、円錐台及び楕円錐台、これらに類似の形状、例えば、円錐台又は楕円錐台の上面又は下面と円錐面との接合部が丸みを帯びている形状、円錐面が外側に膨らんでいる形状、円錐面が内側に凹んでいる形状などが含まれる。細胞収容部の凹部の壁面が、円錐台状の部分を含む場合、円錐台の上面及び下面のうち培養容器の底壁側にくる面積の狭い方の直径は、細胞の最大径より小さいことが好ましい。具体的には、面積の狭い方の直径が、細胞の最大径の2分の1以下であることが好ましい。2分の1以下であると、細胞が凹部の中心に配置されやすくなり、移動も抑制され、細胞の撮影が容易になる。また、特に、面積の狭い方の直径が、10μm以下であることが好ましい。直径が10μm以下であると、撮影の際に、光の屈折、散乱などの影響を受けて観察しにくくなる中央の領域が狭くなり、鮮明な画像が得られるため有効である。なお、凹部の円錐状及び円錐台状の部分において円錐面は曲面であり、平面を含まないことが好ましい。細胞収容部の凹部の壁面は、通常、培養容器の底壁側に、上記のような傾斜面、好ましくは円錐状又は円錐台状の部分を有する。細胞収容部の凹部の壁面は、上記のような傾斜面より開口部側に、培養容器の底壁に垂直な壁面を有していてもよい。
【0035】
細胞収容部の凹部の壁面が円錐状又は円錐台状の部分を含む場合、円錐又は円錐台の中心線と母線とのなす角度は、通常89〜45°、好ましくは88〜65°、より好ましくは85〜80°である。一定の角度以上とすることにより、重力を駆動源として、細胞を配置したい場所(最深部)へ移動させやすく、一定の角度以下とすることにより、顕微鏡で透過観察する際の傾斜面での反射、散乱が起こりにくくなり、鮮明な観察像を得ることができる。
【0036】
細胞収容部の凹部が培養容器の底壁に平行な底面とそれに垂直な側面とからなる場合は、細胞が凹部内で移動して側面に接触する場合があり、その状態で細胞の撮像を行うと、撮影された画像において輪郭抽出処理により細胞の画像を抽出することが困難であるという問題があるが、細胞収容部の凹部の壁面が、凹部の最も低い位置から凹部の外縁に進むに従って高くなるような傾斜面を有する場合、好ましくは円錐状又は円錐台状の部分を含む場合は、培養される細胞は自動的に凹部の底の部分に存在することとなり、凹部が培養容器の底壁に垂直な側面を傾斜面より開口部側に有していたとしても、これに接触したままとなることはなく、撮像された細胞の画像の輪郭抽出処理を問題なく実施することができる。
【0037】
また、細胞収容部の凹部の深さは、特に限定されるものではないが、浅過ぎると、培養容器の輸送時や細胞の分裂時などに細胞が動き、細胞が凹部の範囲外に出てしまう恐れがあるため、確実に細胞を凹部内に保持できるように適宜設定される。例えば、細胞を凹部内に保持するには、深さが細胞の最大径の1/3以上であることが好ましく、1/2以上であることがさらに好ましい。一方、深過ぎると、凹部内に培養液や細胞を導入することが難しくなるため、細胞を凹部内に保持しつつ、深過ぎない値になるよう適宜設定される。例えば、深さの上限を凹部の開口部の直径に対して3倍以下とすることができる。さらに、培養液の導入を容易にするためには、深さは凹部直径の1倍以下であることが好ましく、1/2以下であることが特に好ましい。また、凹部の直径が小さく、深さが深いほど対流が起きにくくなるため、細胞の呼吸や代謝に伴って、周辺の培養液の組成変化が起きやすくなる可能性がある。細胞は、周辺の培養液の組成の影響を受けて成長しやすさが変化するため、細胞の成長を促すように生物学的な影響を考慮して直径と深さを設定することが好ましい。一般的には、細胞の種類によっても異なるが、凹部の深さを50μm〜200μm程度とすることが好ましい。例えば、ウシ受精卵の場合、最大径が250μm程度であるため、深さは80μm以上、さらに好ましくは125μm以上とすることが好ましい。なお、この深さは、傾斜面と、さらに存在する場合は培養容器の底壁に垂直な側面とを有する凹部において、開口部から最深部までを垂直に測った深さをいう。
【0038】
4個以上近接して形成された凹部は、それらを囲む内壁により、培養容器内のその他の部分と隔てられていてもよい。当該実施形態では、近接した凹部(細胞収容部)の群ごとに内壁で囲まれており、複数の凹部の群が培養容器の底壁に存在する場合は、各群ごとに内壁で囲まれることになる。通常、受精卵等の培養においては、培養容器に受精卵を含む培地の液滴を形成し、液滴をオイルで覆うことにより培地の乾燥が防止されている。4個以上近接して形成された凹部の群をさらに内壁で囲むことにより、その内部(中心側)に培地を収容して培地の分散を防ぐことができる。培地をミネラルオイル等のオイルで覆う場合も同様である。
【0039】
さらに、本発明の培養容器は、培養容器の外周部であって細胞収容部を有しない部分に液体収容部を有していてもよい。換言すれば、細胞収容部が存在する部分より外周側に、さらなる内壁と培養容器の側壁によって形成される、液体を収容可能な外堀があるような形状である。近接した凹部を囲む内壁の内部(中心側)には上記と同様に培地を収容し、外堀より内側(中心側)にミネラルオイル等のオイルを収容し、外堀に培地や水などを収容することができる。外堀の容量は、通常1ml以上である。この外堀に培地や水を収容することにより、凹部に細胞を入れる際にピペットやガラスキャピラリーを洗うのに用いることができたり、培養器内の湿度を高められる。従って、培地の乾燥を防止するためのミネラルオイルを使わなくてもすむ場合がある。
【0040】
また、4個以上近接して形成された凹部は、その内部の培地が互いに連通しうるような溝を有していてもよい。溝が存在することにより、細胞培養中に培地が凹部間を循環することができ、オートクライン・パラクライン効果により凹部にそれぞれ収容される細胞の成長を増進させることができる。
【0041】
本発明の培養容器の材質は、特に制限されない。具体的には、金属、ガラス、及びシリコン等の無機材料、プラスチック(例えば、ポリスチレン樹脂、ポリエステル樹脂、ポリエチレン樹脂、ポリプロピレン樹脂、ABS樹脂、ナイロン、アクリル樹脂、フッ素樹脂、ポリカーボネート樹脂、ポリウレタン樹脂、メチルペンテン樹脂、フェノール樹脂、メラミン樹脂、エポキシ樹脂、塩化ビニル樹脂)で代表される有機材料を挙げることができる。本発明の培養容器は、当業者に公知の方法で製造することができる。例えば、プラスチック材料からなる培養容器を製造する場合には、慣用の成形法、例えば射出成形により製造することができる。
【0042】
本発明の培養容器は、受精卵の発育を促進するような表面処理又は表面コートがなされていてもよい。特に、受精卵の発育を促進するために、他の器官の細胞(例えば、子宮内膜細胞や卵管上皮細胞)と共培養をする場合、これらの細胞をあらかじめ培養容器に接着させる必要がある。このような場合に、培養容器の表面に細胞接着性の材料をコートすると有利である。
【0043】
図2aに本発明の培養容器の一実施形態を示す。図2aは、細胞収容部の凹部の壁面が、培養容器の底壁側に円錐状(頂点が丸みを帯びている形状)の部分を有し、それより開口部側に、培養容器の底壁に垂直な壁面を有する実施形態である。図2aに示すとおり、培養容器は、側壁1と底壁2を有し、底壁2には細胞収容部3の凹部4が9個近接して形成され、凹部4の9個の群が4群形成されている。凹部4には細胞6が収容されており、凹部4は円錐状の部分を有し、その壁面(円錐面)7は、凹部の外縁13に進むに従って高くなるように傾斜している。円錐の中心線と母線とのなす角度はαで表される。図2aの実施形態では、9個の近接する凹部の群が、それらを囲む内壁5により、培養容器内のその他の部分と隔てられている。内壁5の内部には培地8が収容され、さらに培養容器全体にミネラルオイル9が収容されている。
【0044】
図2bに本発明の培養容器の別の実施形態を示す。図2bは、細胞収容部の凹部の壁面が、培養容器の底壁側に円錐状(頂点が丸みを帯びている形状)の部分を有し、それより開口部側に、培養容器の底壁に垂直な壁面を有する実施形態である。図2bに示すとおり、培養容器は、側壁1と底壁2を有し、底壁2には細胞収容部3の凹部4が9個近接して形成され、凹部4の9個の群が4群形成されている。凹部4には細胞6が収容されており、凹部4は円錐状の部分を有し、その壁面(円錐面)7は、凹部の外縁13に進むに従って高くなるように傾斜している。図2bの実施形態では、9個の近接する凹部の群が、それらを囲む内壁5により、培養容器内のその他の部分と隔てられている。さらに、培養容器の外周部であって細胞収容部を有しない部分に液体収容部が存在する。すなわち、培養容器の外周部に、さらなる内壁10と培養容器の側壁とにより形成される外堀11があるような形状である。近接した凹部を囲む内壁の内部(中心側)には培地8が収容され、外堀の内側(中心側)にミネラルオイル9が収容され、外堀11に培地や水12が収容される。ミネラルオイル9は省略することができる。なお、図2a及び図2bでは、近接した凹部が正方格子状に配置されている。
【0045】
本発明の培養容器は、培養細胞を自動判別する場合に特に好適に用いられる。培養細胞の判別には、培養細胞の質の判別が含まれる。培養細胞の質の判別には、例えば受精卵を培養する場合には、子宮への移植に適した良質な受精卵であるか否かの判別が含まれる。
【0046】
培養細胞の自動判別においては、顕微鏡により取得された培養容器内の細胞の画像をCCDカメラ等の検出装置によって撮像し、得られた像を輪郭抽出処理に付し、画像中の細胞に該当する部分を抽出し、抽出された細胞の画像を画像解析装置で解析することによりその質を判別することができる。画像の輪郭抽出処理については、例えば、特開2006−337110号公報に記載された処理を利用できる。
【0047】
従って一実施形態において本発明は、培養細胞の判別方法に関する。本発明の判別方法は、本発明の培養容器の細胞収容部の凹部に、受精卵、卵細胞、ES細胞及びiPS細胞からなる群から選択される細胞をそれぞれ導入して培養し、顕微鏡により取得された培養細胞の画像をCCDカメラ等の検出装置で撮像し、得られた像を輪郭抽出処理に付すことを含む。
【0048】
培養は、通常、培養容器を培養細胞の発育及び維持に必要なガスを含む環境雰囲気及び一定の環境温度をもたらすインキュベータに入れることにより実施される。必要なガスには、水蒸気、遊離酸素(O2)及び二酸化炭素(CO2)が含まれる。環境温度とCO2含有量を調節することにより、培地のpHを一定時間内に安定させることができる。安定なCO2含有量と安定な温度により安定なpHが得られる。培養のための培地は、細胞を培養する能力を有するものであれば特に制限はないが、受精卵培養用の培養液としては、例えば、M16が挙げられる。画像比較プログラムにより、培養中の細胞の画像を予め保存された画像と比較することにより、培養の際の温度、ガス及び培地などの培養条件を調節することもできる。
【0049】
培養細胞の判別は、例えば、特許第3693907号公報に記載の方法を採用できる。
以下、本発明を実施例により説明するが、本発明は実施例の範囲に限定されるものではない。
【実施例】
【0050】
製造例1 培養容器Aの製造
図2aに示す培養容器を、一般的な射出成形加工により製造した。まず、図2aの逆パターンの鋳型を加工し、該鋳型上へ加熱溶融したポリスチレン材料を流し込み、冷却、離型して傾斜付き培養容器Aを得た。該傾斜付き培養容器Aは、バイオクリーンベンチ内のUVライト下に40分程度置いて滅菌してから培養に用いた。
【0051】
製造例2 培養容器Bの製造
直径約35mmのポリスチレン製ディッシュを用意し、その底面へ直径0.4mmの貫通口を1mm間隔で加工して貫通口付きディッシュを得た。次に、貫通口付きディッシュの底面へ、ディッシュの外側からカバーガラスを接着して培養容器Bを得た(図4)。貫通孔の側面はカバーガラス接着には、接着剤を用いた。該培養容器Bは、バイオクリーンベンチ内のUVライト下に40分程度置いて滅菌してから培養に用いた。
【0052】
製造例3 培養容器Cの製造
図11〜16に示す培養容器Cを、一般的な射出成形加工により製造した。まず、図11の逆パターンの鋳型を加工し、磨き加工により平滑性を高めた。該鋳型上へ加熱溶融したポリスチレン材料を流し込み、冷却、離型して傾斜付き培養容器Cを得た。この培養容器Cの細胞収容部3には、5×5の正方格子状に配置された25個の凹部4が形成されている。製造した培養容器Cの外観写真を図17に示す。該傾斜付き培養容器Cは、エタノール中に1時間浸漬して洗浄した後、バイオクリーンベンチ内のUVライト下に40分程度置いて滅菌してから培養に用いた。なお、図12において、内壁5で囲まれた領域の直径dは7mmであり、図13及び14で示す凹部4のピッチaは420μmである。また、図15及び16において、凹部の直径rは270μm、深さLは150μmに設定した。さらに、円錐状に形成した壁面7について、円錐の中心線と母線とのなす角度αは83°に設定した。
【0053】
図18に、製造した培養容器Cの細胞収容部3の断面形状計測結果(計測装置:キーエンス社製ダブルスキャン高精度レーザ測定器LT−9010M及び高精度形状測定システムKS−1100、測定間隔5μm)、図19に凹部4の断面形状計測結果(計測装置及び測定条件は上記と同様)をそれぞれ示す。また、図20には、図19の右側傾斜面に対して、線形フィッティングを行い、さらに傾きを補正した図を示す。図20から、最大高さRyは0.47μmと求められた。
【0054】
製造例4 培養容器Dの製造
鋳型の製造時に、磨き処理を施さない以外は上記製造例3と同様の手順で培養容器Dを製造した。図21に培養容器Dの凹部4の断面形状計測結果を示す。また、図22には、図21の右側傾斜面に対して、線形フィッティングを行い、さらに傾きを補正した図を示す。図22から、最大高さRyは4.9μmと求められた。
【0055】
製造例5 培養容器Eの製造
図23〜図28に示す培養容器Eを、上記製造例3と同様の手順で製造した。なお、培養容器Eでは、凹部4の壁面7を、凹部の最深部から凹部の外縁13へ向かって曲線状に高くなるような傾斜面としている。培養容器Eのその他の寸法は図11〜16に示す培養容器Cと同一である。
【0056】
図29に培養容器Eの凹部4の断面形状計測結果を示す。また、図30には、図29の右側傾斜面に対して、線形フィッティングを行い、さらに傾きを補正した図を示す。図30から、最大高さRyは2.9μmと求められた。
【0057】
(実施例1)
製造例1で製造した培養容器Aを用いて、ラット受精卵を培養し、観察した画像を用いて、受精卵の輪郭抽出処理を行った。
【0058】
ラット受精卵を製造例1の培養容器Aの細胞収容部の凹部にガラスキャピラリーを用いて導入した。さらに、培地の蒸発を防ぐために、培地を覆うようにミネラルオイルを入れた。培養は、CO2インキュベータ(5%CO2、5%O2及び90%空気、37℃、湿度飽和)にて行った。
【0059】
受精卵が初期の卵割をした後に、倍率20倍の観察装置(高倍率のレンズと撮像用カメラを備えている)で撮影した写真を図5に示す。
受精卵の輪郭を抽出するため、以下のような閾値処理を施した。
【0060】
図6は図5に対して閾値処理を行った画像である。製造例1の培養容器Aを用いた場合、閾値処理を施すことによって、図6に示すように、凹部の壁面の影響無く受精卵の輪郭を識別することが可能であった。
【0061】
閾値処理は、例えばカメラで撮影した受精卵画像の各画素値(=輝度値)を予め設定された第1の閾値と第2の閾値(第1の閾値<第2の閾値)に基づいて、第1の閾値以上かつ第2の閾値以下の場合には1(白)0(黒)を設定し、第1の閾値より小さい又は2の閾値より大きい場合には0(黒)1(白)を設定するといった処理である(=2値化処理)。
【0062】
(実施例2)
製造例3で製造した培養容器Cを用いて、マウス受精卵を培養し、観察した画像を用いて、受精卵の輪郭抽出処理を行った。
【0063】
マウス受精卵を製造例3の培養容器Cの細胞収容部の凹部にガラスキャピラリーを用いて導入した。さらに、培地の蒸発を防ぐために、培地を覆うようにミネラルオイルを入れた。培養は、CO2インキュベータ(5%CO2、5%O2及び90%空気、37℃、湿度飽和)にて行った。
【0064】
受精卵が初期の卵割をした後に、倍率10倍の観察装置(高倍率のレンズと撮像用カメラを備えている)で撮影した写真を図31に示す。実施例1と同様の閾値処理により、受精卵の輪郭を抽出した。図32は図31に対して閾値処理を行った画像である。製造例3の培養容器Cを用いた場合、閾値処理を施すことによって、図32に示すように、凹部の壁面の影響無くマウス受精卵の輪郭を識別することが可能であった。
【0065】
(実施例3)
実施例2と同様に培養容器Cにウシ受精卵を導入した直後に、倍率4倍の観察装置(高倍率のレンズと撮像用カメラを備えている)で撮影し、一部を切り出した写真を図33に示す。実施例1と同様の閾値処理により、受精卵の輪郭を抽出した。図34は図33に対して閾値処理を行った画像である。製造例3の培養容器Cを用いた場合、閾値処理を施すことによって、図34に示すように、凹部の壁面の影響無くウシ受精卵の輪郭を識別することが可能であった。
【0066】
(実施例4)
実施例2と同様に培養容器Dにマウス受精卵を導入し初期の卵割をした後に、倍率10倍の観察装置(高倍率のレンズと撮像用カメラを備えている)で撮影した。実施例1と同様の閾値処理により、受精卵の輪郭を抽出したところ、凹部の壁面の影響無くマウス受精卵の輪郭を識別することが可能であった。しかしながら、細胞収容部の凹部の傾斜面が平滑化されていないため、透過率が低く、ノイズの影響があり、実施例2よりも識別が困難であった。
【0067】
(実施例5)
実施例2と同様に培養容器Eにマウス受精卵を導入し初期の卵割をした後に、倍率10倍の観察装置(高倍率のレンズと撮像用カメラを備えている)で撮影した。実施例1と同様の閾値処理により、受精卵の輪郭を抽出したところ、凹部の壁面の影響無くマウス受精卵の輪郭を識別することが可能であった。しかしながら、細胞収容部の凹部における傾斜面が培養容器Cのように直線状ではなく、曲率を有するため、受精卵が凹部の壁面に接触している確率が実施例2よりも高かった。以上の実施例2、4及び5の結果から、凹部の傾斜面は直線部分を含み且つRy値が小さいほど、細胞を凹部の中央に集めることができ、細胞の判別に有利であることが分かった。
【0068】
(比較例1)
比較例1として、製造例2で製造した培養容器Bを用いて、マウス受精卵を培養し、観察した画像を用いて、受精卵の輪郭抽出処理を行った。
【0069】
マウス受精卵を製造例2の培養容器Bの細胞収容部の凹部にガラスキャピラリーを用いて導入した。さらに、培地の蒸発を防ぐために、培地を覆うようにミネラルオイルを入れた。培養は、CO2インキュベータ(5%CO2、5%O2及び90%空気、37℃、湿度飽和)にて行った。
【0070】
製造例2で製造した培養容器Bに受精卵を導入した直後に、倍率10の観察装置(高倍率のレンズと撮像用カメラを備えている)で撮影した写真を図7及び9に示す。
【0071】
実施例1と同様の閾値処理により、受精卵の輪郭を抽出した。図8は図7に対して閾値処理をしたもの、図10は図9に対して閾値処理をしたものである。
【0072】
図8のように、偶然に細胞収容部の凹部の壁面から離れている受精卵については、受精卵の輪郭を抽出できたが、図10のように、細胞収容部の凹部の壁面に接触している受精卵については、受精卵の輪郭を抽出することができなかった。
【符号の説明】
【0073】
1:側壁、2:底壁、3:細胞収容部、4:細胞収容部の凹部、5:内壁、6:細胞、7:凹部の壁面(円錐面)、8:培地、9:ミネラルオイル、10:内壁、11:外堀、12:培地又は水、13:外縁
【技術分野】
【0001】
本発明は、受精卵などの個別管理が必要な細胞を培養するための培養容器、ならびに該培養容器を用いた培養細胞の判別方法に関する。
【背景技術】
【0002】
培養系で精子と卵子とを体外受精させて受精卵(接合子)を作製して、さらに受精卵を卵割、桑実胚、胚盤胞の段階を経て、透明帯から孵化した脱出胚盤胞の段階まで培養することが可能となり、この卵割から胚盤胞の段階にある受精卵を子宮に移植して産子を得る補助的生殖技術(ART)が、家畜領域のみならずヒトの不妊医療でも確立されている。
【0003】
しかし、体外受精による妊娠成功率は必ずしも高くはなく、たとえばヒトにおいては、その妊娠成功率は、依然として25〜35%程度に留まっている。その原因の一つとして、培養において子宮への移植に適した良質な受精卵を得られる確率が高くないことが挙げられる。培養された受精卵は、専門家が顕微鏡で個別に観察することにより、子宮への移植に適した良質な受精卵であるか否か判別されている。従って、その判別にはコスト及び時間がかかるという問題がある。そこで、子宮への移植に適した良質な受精卵を低コストかつ短時間で判別する技術が求められている。また、良質な受精卵の判断が個人により異なるという問題もあり、良質な受精卵だという基準や選別する技術が必要とされている。
【0004】
従来、受精卵の培養は、培養容器上のウェル内に500μL程度の培養液を入れ、該培養液中で受精卵を培養する方法、培養容器上のウェル内に20μL程度の微小滴を載せ、該微小滴の表面をミネラルオイルで被覆し、その中に受精卵を入れる方法(非特許文献1)等により行われていた。また、非特許文献2及び3は、培養容器上に複数の窪みを設け、それぞれの窪みごとに受精卵を導入して培養することにより受精卵を個別に管理する方法を開示している。非特許文献4は、培養容器上にメッシュ体を配置し、メッシュの編目ごとに受精卵を導入して培養することにより受精卵を個別に管理する方法を開示している。
【0005】
さらに近年では、細胞治療・再生医療の研究開発が進み、細胞培養中の無菌環境を維持することや、細胞の品質確保、あるいは細胞を迅速且つ大量に培養し判別することについてのニーズが高まっている。しかし従来は、上記非特許文献1〜4に示すような培養容器を用い、手作業で培養細胞の状態を観察しているため、連続的な細胞状態の観察が困難であること、培養環境の変化や雑菌による汚染リスクなど細胞への影響が懸念されること、培養細胞の判別にコストと時間がかかり効率が悪いことなどが課題となっていた。したがって、培養細胞を自動的に判別する技術の開発が望まれていた。また、例えば畜産の分野においても、国により「家畜改良増殖目標」が策定され、この目標達成のため受精卵移植を活用した肉専用種の増頭の推進が図られている中、細胞の自動判別技術は非常に有用と考えられる。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】菅原,尾川(編)、「生殖機能細胞の培養法」、日本、学会出版センター、1993年6月出版、第25〜153頁
【非特許文献2】M. Taka, et al. Journal of Reproduction and Development, 51, 533-537 (2005)
【非特許文献3】Vajta G., et al. Molecular Reproduction and Development, 55, 256-264 (2000)
【非特許文献4】P. J. Booth, et al. Biology of Reproduction, 77, 765-779 (2007)
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明者らは、上記従来の状況に鑑み、子宮への移植に適した良質な受精卵を低コストかつ短時間で判別すべく、受精卵の判別の自動化の可能性を検討した。そして、非特許文献1に記載される培養容器を用いて自動化を検討したところ、培養している複数の受精卵がプレート内や微小滴内で移動してしまい、それぞれ質の異なる受精卵を個別に管理することができず、受精卵の判別を自動で行うのには適してないことが明らかとなった。また、受精卵の自動判別においては、CCDカメラ等を用いて受精卵の画像を撮像することが考えられるが、従来の培養容器では受精卵を個別に撮影することが困難であることも明らかとなった。
【0008】
そこで、非特許文献2〜4に記載される複数の窪みを設けた培養容器や、メッシュを配置した培養容器を用いて自動化を検討したところ、受精卵の密度も高く、受精卵を個別に管理することは可能であるが、窪み内やメッシュの編目内で受精卵が移動して窪みの側壁やメッシュに接触した場合には、取得した画像の輪郭抽出処理により受精卵の画像を抽出することが困難であることを見出した。
【0009】
従って、本発明は、培養細胞の自動判別に適した培養容器を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者らは、上記課題を解決すべく検討を行った結果、壁面が、最も低い位置から外縁に進むに従って高くなるような傾斜面を有する凹部が密に配置された細胞収容部を有する培養容器を用いて細胞を培養することにより、培養細胞の撮影画像における細胞の輪郭抽出処理が効率よく実施でき、従って、培養細胞の自動判別に適していることを見出し、本発明を完成した。
【0011】
すなわち、本発明は以下の発明を包含する。
(1)個別管理が必要とされる細胞を培養するための、底壁と側壁とを有する培養容器であって、
底壁に、凹部を有する細胞収容部が配置されており、
凹部が4個以上近接しており、
凹部の壁面が、凹部の最も低い位置から凹部の外縁に進むに従って高くなるような傾斜面を有し、
近接する凹部間のピッチが1mm以下である、
前記培養容器。
【0012】
(2)凹部の壁面が、直線部分を含む傾斜面を有する、(1)に記載の培養容器。
(3)傾斜面の表面粗さについて、最大高さRyが1.0μm未満である、(2)に記載の培養容器。
(4)凹部の開口部の開口幅が100μm〜300μmである、(1)〜(3)のいずれかに記載の培養容器。
【0013】
(5)凹部の深さが50μm〜200μmである、(1)〜(4)のいずれかに記載の培養容器。
(6)凹部の開口部が円形である、(1)〜(5)のいずれかに記載の培養容器。
(7)凹部の壁面が円錐状又は円錐台状の部分を有する、(6)に記載の培養容器。
【0014】
(8)円錐又は円錐台の中心線と母線とのなす角度が89〜45°である、(7)に記載の培養容器。
(9)近接する凹部が、1mm2あたり1個以上の密度で配置されている、(1)〜(8)のいずれかに記載の培養容器。
(10)近接する4個以上の凹部が正方格子状又は最密充填状に配置されている、請求項(1)〜(9)のいずれかに記載の培養容器。
【0015】
(11)凹部が24個以上配置されている、(1)〜(10)のいずれかに記載の培養容器。
(12)細胞が、受精卵、卵細胞、ES細胞及びiPS細胞からなる群から選択される、(1)〜(11)のいずれかに記載の培養容器。
(13)細胞が、ウシの受精卵である、(12)に記載の培養容器。
【0016】
(14)近接する4個以上の凹部が、それらを囲む内壁により、培養容器内のその他の部分と隔てられている、(1)〜(13)のいずれかに記載の培養容器。
(15)培養容器の外周部であって細胞収容部を有しない部分に液体収容部を有する、(14)に記載の培養容器。
(16)培養細胞の自動判別に使用するための、(1)〜(15)のいずれかに記載の培養容器。
【0017】
(17)倍率4倍の対物レンズを用いて細胞収容部を顕微鏡観察したときに、観察視野内に4個以上の凹部が含まれる、(16)に記載の培養容器。
(18)培養細胞の判別方法であって、(1)〜(17)のいずれかに記載の培養容器の細胞収容部の凹部に、受精卵、卵細胞、ES細胞及びiPS細胞からなる群から選択される細胞をそれぞれ導入して培養し、顕微鏡により取得した培養細胞の画像を検出装置によって撮像し、得られた像を輪郭抽出処理に付すことを含む、前記判別方法。
【発明の効果】
【0018】
本発明により、培養細胞の自動判別に適した培養容器が提供される。
【図面の簡単な説明】
【0019】
【図1a】本発明の実施形態を示す概略図である。
【図1b】本発明の実施形態を示す概略図である。
【図2a】本発明の実施形態である培養容器Aを示す概略図である。
【図2b】本発明の実施形態を示す概略図である。
【図3】近接した凹部を最密充填状に配置する場合の平面図である。
【図4】比較例で用いた培養容器Bを示す。
【図5】本発明の培養容器Aで培養した受精卵の顕微鏡写真である。
【図6】図5の画像に対して閾値処理を行った結果を示す。
【図7】比較例で用いた培養容器Bで培養した受精卵の顕微鏡写真である。
【図8】図7の画像に対して閾値処理を行った結果を示す。
【図9】比較例で用いた培養容器Bで培養した受精卵の顕微鏡写真である。
【図10】図9の画像に対して閾値処理を行った結果を示す。
【図11】本発明の実施形態である培養容器Cを示す平面図である。
【図12】図11のIIIa−IIIa断面図である。
【図13】図11における細胞収容部の部分拡大図である。
【図14】図13のIIIb−IIIb断面図である。
【図15】図13における凹部の部分拡大図である。
【図16】図15のIIIc−IIIc断面図である。
【図17】培養容器Cの外観写真である。
【図18】培養容器Cの細胞収容部の断面形状計測結果を示すグラフである。
【図19】培養容器Cの凹部の断面形状計測結果を示すグラフである。
【図20】図19の右側傾斜面に対して線形フィッティングを行い、傾きを補正した図である。
【図21】培養容器Dの凹部の断面形状計測結果を示すグラフである。
【図22】図21の右側傾斜面に対して線形フィッティングを行い、傾きを補正した図である。
【図23】本発明の実施形態である培養容器Eを示す平面図である。
【図24】図23のIVa−IVa断面図である。
【図25】図23における細胞収容部の部分拡大図である。
【図26】図25のIVb−IVb断面図である。
【図27】図25における凹部の部分拡大図である。
【図28】図27のIVc−IVc断面図である。
【図29】培養容器Eの凹部の断面形状計測結果を示すグラフである。
【図30】図29の右側傾斜面に対して線形フィッティングを行い、傾きを補正した図である。
【図31】本発明の培養容器Cで培養したマウス受精卵の顕微鏡写真である。
【図32】図31の画像に対して閾値処理を行った結果を示す。
【図33】本発明の培養容器Cで培養したウシ受精卵の顕微鏡写真である。
【図34】図33の画像に対して閾値処理を行った結果を示す。
【発明を実施するための形態】
【0020】
本発明は、個別管理が必要とされる細胞を培養するための、底壁と側壁とを有する培養容器であって、
底壁に、凹部を有する細胞収容部が配置されており、
凹部が4個以上近接しており、
凹部の壁面が、凹部の最も低い位置から凹部の外縁に進むに従って高くなるような傾斜面を有し、
近接する凹部間のピッチが1mm以下である、
前記培養容器に関する。
【0021】
個別管理が必要とされる細胞とは、培養中及び培養後において個々の細胞を特定する必要があるものをさし、複数の細胞を培養している培養容器において互いに混同してしまうことが望ましくない細胞をさす。個別管理が必要とされる細胞としては、例えば、受精卵、卵細胞、ES細胞(胚性幹細胞)及びiPS細胞(人工多能性幹細胞)が挙げられる。卵細胞は、未受精の卵細胞をさし、未成熟卵母細胞及び成熟卵母細胞が含まれる。受精卵は、受精後、卵割により2細胞期、4細胞期、8細胞期と細胞数が増えていき、桑実胚を経て、胚盤胞へと発生する。受精卵には、2細胞胚、4細胞胚及び8細胞胚などの初期胚、桑実胚、胚盤胞(初期胚盤胞、拡張胚盤胞及び脱出胚盤胞を含む)が含まれる。胚盤胞は、胎盤を形成する潜在能力がある外部細胞と胚を形成する潜在能力がある内部細胞塊からなる胚を意味する。ES細胞は胚盤胞の内部細胞塊から得られる未分化な多能性又は全能性細胞をさす。iPS細胞は、体細胞(主に線維芽細胞)へ数種類の遺伝子(転写因子)を導入することにより、ES細胞に似た分化万能性を持たせた細胞をさす。すなわち、本発明において培養の対象となる細胞には、受精卵や胚盤胞のように複数の細胞の集合体も包含される。本発明の培養容器は、好ましくは哺乳動物及び鳥類の細胞、特に哺乳動物の細胞の培養に好適である。哺乳動物は、温血脊椎動物をさし、例えば、ヒト及びサルなどの霊長類、マウス、ラット及びウサギなどの齧歯類、イヌ及びネコなどの愛玩動物、ならびにウシ、ウマ及びブタなどの家畜が挙げられる。本発明の培養容器は、ウシの受精卵の培養に特に好適である。
【0022】
本発明の培養容器は、底壁と側壁とを有し、底壁と側壁とから形成される空間に液体を収容可能である。底壁の形状は特に制限されず、三角形及び四角形等の多角形の形状でもよく、円(円形及び楕円形を含む)の形状でもよく、側壁は底壁の外縁を囲うように形成される。本発明の培養容器において、通常、底壁と反対側は開口している。なお、本発明の培養容器は、通常のシャーレと同様に蓋を有していてもよい。本発明の培養容器の底壁と側壁は、好ましくは慣用のシャーレと同様の形状を形成する。そして、培養容器の底壁には、凹部を有する細胞収容部が形成されている。細胞収容部の凹部は、培養容器の底壁に直接窪みとして設けられた凹部でもよいし(図1a)、底壁から突出した部材により形成される凹部でもよい(図1b)。
【0023】
凹部は、4個以上、好ましくは6個以上、より好ましくは8個以上が、近接して形成されている。凹部は、少なくとも4個が近接して形成されていればよく、さらに近接していない凹部が別途形成されていてもよい。また、4個以上近接して形成された凹部の群が、複数群配置されていてもよく、それらの群は互いに近接していなくてもよい。
【0024】
凹部は、壁面及び開口部を有し、開口部の外縁の形状は特に制限されないが、好ましくは円形(円形及び楕円形を含む)である。
【0025】
近接する凹部間のピッチは1mm以下である。ただし、上記ピッチは収容する細胞の種類に依存して異なる。
【0026】
例えば、ウシ受精卵を収容する場合、近接する凹部間のピッチは通常1mm以下、好ましくは0.7mm以下、さらに好ましくは0.45mm以下である。観察装置として、1/2インチのCCD素子、4、10、20倍の対物レンズを備えたものがよく用いられる。このような観察装置で、4倍の対物レンズを選択した場合の観察可能な視野はおよそ1.6mm×1.2mmであり、この観察視野内に4個以上の凹部が含まれるように設計することが好ましい。凹部の直径がウシ受精卵の直径(0.25mm)より大きく、0.3mmだとすると、ピッチが0.9mm以下の場合、1.6mm×1.2mmの顕微鏡視野内に2×2=4個の受精卵を観察することができ、ピッチが0.65mm以下の場合、1.6mm×1.2mmの顕微鏡視野内に3×2=6個の受精卵を観察することができ、ピッチが0.43mm以下の場合、1.6mm×1.2mmの顕微鏡視野内に4×3=12個の受精卵を観察することができる。観察視野内に4個以上の凹部が含まれるように設計することで、例えば培養細胞の自動判別を行う場合に、一度に多数個の細胞を処理でき、また視野内の一つの受精卵と他の受精卵との比較判別が容易になるため、判別操作をより効率的に行うことができる。
【0027】
凹部間のピッチは近接する凹部の中心間の距離である(図1のa)。凹部の中心は、凹部の開口部の外縁が形成する図形の重心位置とし、外縁が円形であればその円の中心をさす。上記凹部間のピッチは通常平均ピッチをさし、平均ピッチは、ある凹部に関しては、近接する全ての凹部とのピッチから平均値を算出したものをさす。凹部間のピッチは、凹部の開口部の外縁の寸法より大きい。凹部の開口部の外縁の寸法は、開口部の外縁が円形であればその直径をさし、そうでなければ開口部の外縁が形成する図形の最大径と最短径の平均値とする。換言すれば、近接する凹部は、1mm2あたり1個以上、好ましくは4個以上の密度で配置されている。近接する4個以上の凹部は、正方格子状又は最密充填状に配置されていることが好ましい。例えば、25個の凹部を5×5の正方格子状に配置する場合を挙げることができる。正方格子状又は最密充填状に配置することにより、培養容器の底壁における各凹部の位置の特定が容易になり、自動化処理に適用しやすい。また、凹部は、培養容器1個あたり、合計で好ましくは24個以上、より好ましくは50個以上配置されている。培養容器1個あたりに多くの凹部を設けることにより、一定数の細胞を培養するのに必要な培養容器の数を低減することができ、経済的に有利である。
【0028】
凹部の開口部の外縁が円形である場合、近接する凹部間のピッチは、X+m+n(ここで、Xは細胞の最大径を表し、mは凹部の開口部の外縁が形成する円の直径から細胞の最大径を引いた長さを表し、nは凹部間の仕切りの長さを表す)と規定することもできる。凹部間の仕切りとは、近接する凹部間の外縁と外縁の最短距離をさす。ここでmは通常0.1mm以下、好ましくは0.07mm以下、さらに好ましくは0.05mm以下であり、nは通常0.6mm以下、好ましくは0.35mm以下、さらに好ましくは0.15mm以下である。
【0029】
上記のようなピッチで凹部を密に配置することにより、細胞を個別に管理しつつ多くの細胞を同時に培養でき、さらに顕微鏡の一視野に多くの細胞が入るため、一度に多くの細胞の画像を取得することができる。
【0030】
細胞収容部の凹部の開口部は、細胞を収容可能な開口幅を有する。ここで、凹部の開口部の開口幅は、凹部の開口部の外縁が形成する図形の最短径の長さをさす。従って、凹部の開口部の外縁が円形である場合、開口幅は円の直径に等しく、その直径は、培養する細胞の最大寸法より大きいものとなる。本発明の培養容器により受精卵を培養する場合、胚盤胞の段階まで培養することが望ましいため、円形の開口部の直径は、胚盤胞の段階の細胞の最大寸法より大きいものであることが望ましい。胚盤胞の段階の細胞の最大寸法は通常100μm〜280μmであることから、円形の開口部の直径は、通常100μm以上である。また、上述のように、凹部の開口部の外縁の寸法(開口部の外縁が形成する図形の最大径と最短径の平均値)は、凹部間のピッチより小さい。開口部の外縁が円形である場合、その直径は、凹部間のピッチ、すなわち円の中心間の距離より短く、通常1mm未満である。上記開口幅及び寸法は収容する細胞の種類に依存して異なるが、通常は、凹部の開口部の開口幅を、例えば100μm〜300μmとすることが好ましい。
【0031】
例えば、ウシ受精卵の場合、凹部の開口部の開口幅(凹部が円形である場合は直径)は、通常0.25mm以上、好ましくは0.26mm以上、さらに好ましくは0.27mm以上であり、通常1mm未満、好ましくは0.7mm未満、さらに好ましくは0.45mm未満である。また、上記凹部の開口部の開口幅は、X+m(ここでXは細胞の最大径を表す)と規定することもできる。ここで、mは、好ましくは0.01mm以上、さらに好ましくは0.02mm以上である。
【0032】
細胞収容部の凹部の壁面は、凹部の最も低い位置から凹部の外縁に進むに従って高くなるような傾斜面を有する。細胞収容部の凹部は、通常、培養容器の底壁側に底がくるように形成される。凹部の傾斜面の形状(プロファイル)は、凹部の最も低い位置から凹部の外縁へ向かって曲線状に高くなる場合、階段状に高くなる場合等、適宜採用することができるが、特に直線部分を含むこと、すなわち凹部の最も低い位置から凹部の外縁へ進むに従い、その経路の全区間もしくは一部の区間が直線状に高くなる傾斜面であることが好ましい。直線部分を含むことで、凹部内に配置した細胞の移動が抑制され、細胞を凹部の最深部に固定し易くなる。したがって、顕微鏡で観察した場合に鮮明な画像を得ることができる。
【0033】
傾斜面の表面粗さは、大きい値であると、顕微鏡で透過観察を行った画像を輪郭抽出処理に付す際に、傾斜面上の凹凸に起因して明瞭な輪郭が得られない恐れがあるため、可能な限り小さい値であることが好ましい。具体的には、最大高さRy(粗さ曲線からその平均線の方向に基準長さだけを抜き取り、この抜き取り部分における山頂線と谷底線との間隔をいう)が1.0μm未満、特に0.5μm未満であることが好ましい。なお、傾斜面の表面粗さは、培養容器の鋳型を作製する際に磨き処理を施す等して、鋳型の加工精度を高めることにより小さくすることができる。
【0034】
細胞収容部の凹部の壁面は、好ましくは円錐状又は円錐台状の部分を含む。円錐状又は円錐台状の部分は、培養容器の底壁側に、円錐の頂点又は円錐台の上面及び下面のうち面積の狭い方がくるように形成される。円錐状には、円錐及び楕円錐、これらに類似の形状、例えば、円錐又は楕円錐の頂点が丸みを帯びている形状、円錐面が外側に膨らんでいる形状、円錐面が内側に凹んでいる形状などが含まれる。円錐台状には、円錐台及び楕円錐台、これらに類似の形状、例えば、円錐台又は楕円錐台の上面又は下面と円錐面との接合部が丸みを帯びている形状、円錐面が外側に膨らんでいる形状、円錐面が内側に凹んでいる形状などが含まれる。細胞収容部の凹部の壁面が、円錐台状の部分を含む場合、円錐台の上面及び下面のうち培養容器の底壁側にくる面積の狭い方の直径は、細胞の最大径より小さいことが好ましい。具体的には、面積の狭い方の直径が、細胞の最大径の2分の1以下であることが好ましい。2分の1以下であると、細胞が凹部の中心に配置されやすくなり、移動も抑制され、細胞の撮影が容易になる。また、特に、面積の狭い方の直径が、10μm以下であることが好ましい。直径が10μm以下であると、撮影の際に、光の屈折、散乱などの影響を受けて観察しにくくなる中央の領域が狭くなり、鮮明な画像が得られるため有効である。なお、凹部の円錐状及び円錐台状の部分において円錐面は曲面であり、平面を含まないことが好ましい。細胞収容部の凹部の壁面は、通常、培養容器の底壁側に、上記のような傾斜面、好ましくは円錐状又は円錐台状の部分を有する。細胞収容部の凹部の壁面は、上記のような傾斜面より開口部側に、培養容器の底壁に垂直な壁面を有していてもよい。
【0035】
細胞収容部の凹部の壁面が円錐状又は円錐台状の部分を含む場合、円錐又は円錐台の中心線と母線とのなす角度は、通常89〜45°、好ましくは88〜65°、より好ましくは85〜80°である。一定の角度以上とすることにより、重力を駆動源として、細胞を配置したい場所(最深部)へ移動させやすく、一定の角度以下とすることにより、顕微鏡で透過観察する際の傾斜面での反射、散乱が起こりにくくなり、鮮明な観察像を得ることができる。
【0036】
細胞収容部の凹部が培養容器の底壁に平行な底面とそれに垂直な側面とからなる場合は、細胞が凹部内で移動して側面に接触する場合があり、その状態で細胞の撮像を行うと、撮影された画像において輪郭抽出処理により細胞の画像を抽出することが困難であるという問題があるが、細胞収容部の凹部の壁面が、凹部の最も低い位置から凹部の外縁に進むに従って高くなるような傾斜面を有する場合、好ましくは円錐状又は円錐台状の部分を含む場合は、培養される細胞は自動的に凹部の底の部分に存在することとなり、凹部が培養容器の底壁に垂直な側面を傾斜面より開口部側に有していたとしても、これに接触したままとなることはなく、撮像された細胞の画像の輪郭抽出処理を問題なく実施することができる。
【0037】
また、細胞収容部の凹部の深さは、特に限定されるものではないが、浅過ぎると、培養容器の輸送時や細胞の分裂時などに細胞が動き、細胞が凹部の範囲外に出てしまう恐れがあるため、確実に細胞を凹部内に保持できるように適宜設定される。例えば、細胞を凹部内に保持するには、深さが細胞の最大径の1/3以上であることが好ましく、1/2以上であることがさらに好ましい。一方、深過ぎると、凹部内に培養液や細胞を導入することが難しくなるため、細胞を凹部内に保持しつつ、深過ぎない値になるよう適宜設定される。例えば、深さの上限を凹部の開口部の直径に対して3倍以下とすることができる。さらに、培養液の導入を容易にするためには、深さは凹部直径の1倍以下であることが好ましく、1/2以下であることが特に好ましい。また、凹部の直径が小さく、深さが深いほど対流が起きにくくなるため、細胞の呼吸や代謝に伴って、周辺の培養液の組成変化が起きやすくなる可能性がある。細胞は、周辺の培養液の組成の影響を受けて成長しやすさが変化するため、細胞の成長を促すように生物学的な影響を考慮して直径と深さを設定することが好ましい。一般的には、細胞の種類によっても異なるが、凹部の深さを50μm〜200μm程度とすることが好ましい。例えば、ウシ受精卵の場合、最大径が250μm程度であるため、深さは80μm以上、さらに好ましくは125μm以上とすることが好ましい。なお、この深さは、傾斜面と、さらに存在する場合は培養容器の底壁に垂直な側面とを有する凹部において、開口部から最深部までを垂直に測った深さをいう。
【0038】
4個以上近接して形成された凹部は、それらを囲む内壁により、培養容器内のその他の部分と隔てられていてもよい。当該実施形態では、近接した凹部(細胞収容部)の群ごとに内壁で囲まれており、複数の凹部の群が培養容器の底壁に存在する場合は、各群ごとに内壁で囲まれることになる。通常、受精卵等の培養においては、培養容器に受精卵を含む培地の液滴を形成し、液滴をオイルで覆うことにより培地の乾燥が防止されている。4個以上近接して形成された凹部の群をさらに内壁で囲むことにより、その内部(中心側)に培地を収容して培地の分散を防ぐことができる。培地をミネラルオイル等のオイルで覆う場合も同様である。
【0039】
さらに、本発明の培養容器は、培養容器の外周部であって細胞収容部を有しない部分に液体収容部を有していてもよい。換言すれば、細胞収容部が存在する部分より外周側に、さらなる内壁と培養容器の側壁によって形成される、液体を収容可能な外堀があるような形状である。近接した凹部を囲む内壁の内部(中心側)には上記と同様に培地を収容し、外堀より内側(中心側)にミネラルオイル等のオイルを収容し、外堀に培地や水などを収容することができる。外堀の容量は、通常1ml以上である。この外堀に培地や水を収容することにより、凹部に細胞を入れる際にピペットやガラスキャピラリーを洗うのに用いることができたり、培養器内の湿度を高められる。従って、培地の乾燥を防止するためのミネラルオイルを使わなくてもすむ場合がある。
【0040】
また、4個以上近接して形成された凹部は、その内部の培地が互いに連通しうるような溝を有していてもよい。溝が存在することにより、細胞培養中に培地が凹部間を循環することができ、オートクライン・パラクライン効果により凹部にそれぞれ収容される細胞の成長を増進させることができる。
【0041】
本発明の培養容器の材質は、特に制限されない。具体的には、金属、ガラス、及びシリコン等の無機材料、プラスチック(例えば、ポリスチレン樹脂、ポリエステル樹脂、ポリエチレン樹脂、ポリプロピレン樹脂、ABS樹脂、ナイロン、アクリル樹脂、フッ素樹脂、ポリカーボネート樹脂、ポリウレタン樹脂、メチルペンテン樹脂、フェノール樹脂、メラミン樹脂、エポキシ樹脂、塩化ビニル樹脂)で代表される有機材料を挙げることができる。本発明の培養容器は、当業者に公知の方法で製造することができる。例えば、プラスチック材料からなる培養容器を製造する場合には、慣用の成形法、例えば射出成形により製造することができる。
【0042】
本発明の培養容器は、受精卵の発育を促進するような表面処理又は表面コートがなされていてもよい。特に、受精卵の発育を促進するために、他の器官の細胞(例えば、子宮内膜細胞や卵管上皮細胞)と共培養をする場合、これらの細胞をあらかじめ培養容器に接着させる必要がある。このような場合に、培養容器の表面に細胞接着性の材料をコートすると有利である。
【0043】
図2aに本発明の培養容器の一実施形態を示す。図2aは、細胞収容部の凹部の壁面が、培養容器の底壁側に円錐状(頂点が丸みを帯びている形状)の部分を有し、それより開口部側に、培養容器の底壁に垂直な壁面を有する実施形態である。図2aに示すとおり、培養容器は、側壁1と底壁2を有し、底壁2には細胞収容部3の凹部4が9個近接して形成され、凹部4の9個の群が4群形成されている。凹部4には細胞6が収容されており、凹部4は円錐状の部分を有し、その壁面(円錐面)7は、凹部の外縁13に進むに従って高くなるように傾斜している。円錐の中心線と母線とのなす角度はαで表される。図2aの実施形態では、9個の近接する凹部の群が、それらを囲む内壁5により、培養容器内のその他の部分と隔てられている。内壁5の内部には培地8が収容され、さらに培養容器全体にミネラルオイル9が収容されている。
【0044】
図2bに本発明の培養容器の別の実施形態を示す。図2bは、細胞収容部の凹部の壁面が、培養容器の底壁側に円錐状(頂点が丸みを帯びている形状)の部分を有し、それより開口部側に、培養容器の底壁に垂直な壁面を有する実施形態である。図2bに示すとおり、培養容器は、側壁1と底壁2を有し、底壁2には細胞収容部3の凹部4が9個近接して形成され、凹部4の9個の群が4群形成されている。凹部4には細胞6が収容されており、凹部4は円錐状の部分を有し、その壁面(円錐面)7は、凹部の外縁13に進むに従って高くなるように傾斜している。図2bの実施形態では、9個の近接する凹部の群が、それらを囲む内壁5により、培養容器内のその他の部分と隔てられている。さらに、培養容器の外周部であって細胞収容部を有しない部分に液体収容部が存在する。すなわち、培養容器の外周部に、さらなる内壁10と培養容器の側壁とにより形成される外堀11があるような形状である。近接した凹部を囲む内壁の内部(中心側)には培地8が収容され、外堀の内側(中心側)にミネラルオイル9が収容され、外堀11に培地や水12が収容される。ミネラルオイル9は省略することができる。なお、図2a及び図2bでは、近接した凹部が正方格子状に配置されている。
【0045】
本発明の培養容器は、培養細胞を自動判別する場合に特に好適に用いられる。培養細胞の判別には、培養細胞の質の判別が含まれる。培養細胞の質の判別には、例えば受精卵を培養する場合には、子宮への移植に適した良質な受精卵であるか否かの判別が含まれる。
【0046】
培養細胞の自動判別においては、顕微鏡により取得された培養容器内の細胞の画像をCCDカメラ等の検出装置によって撮像し、得られた像を輪郭抽出処理に付し、画像中の細胞に該当する部分を抽出し、抽出された細胞の画像を画像解析装置で解析することによりその質を判別することができる。画像の輪郭抽出処理については、例えば、特開2006−337110号公報に記載された処理を利用できる。
【0047】
従って一実施形態において本発明は、培養細胞の判別方法に関する。本発明の判別方法は、本発明の培養容器の細胞収容部の凹部に、受精卵、卵細胞、ES細胞及びiPS細胞からなる群から選択される細胞をそれぞれ導入して培養し、顕微鏡により取得された培養細胞の画像をCCDカメラ等の検出装置で撮像し、得られた像を輪郭抽出処理に付すことを含む。
【0048】
培養は、通常、培養容器を培養細胞の発育及び維持に必要なガスを含む環境雰囲気及び一定の環境温度をもたらすインキュベータに入れることにより実施される。必要なガスには、水蒸気、遊離酸素(O2)及び二酸化炭素(CO2)が含まれる。環境温度とCO2含有量を調節することにより、培地のpHを一定時間内に安定させることができる。安定なCO2含有量と安定な温度により安定なpHが得られる。培養のための培地は、細胞を培養する能力を有するものであれば特に制限はないが、受精卵培養用の培養液としては、例えば、M16が挙げられる。画像比較プログラムにより、培養中の細胞の画像を予め保存された画像と比較することにより、培養の際の温度、ガス及び培地などの培養条件を調節することもできる。
【0049】
培養細胞の判別は、例えば、特許第3693907号公報に記載の方法を採用できる。
以下、本発明を実施例により説明するが、本発明は実施例の範囲に限定されるものではない。
【実施例】
【0050】
製造例1 培養容器Aの製造
図2aに示す培養容器を、一般的な射出成形加工により製造した。まず、図2aの逆パターンの鋳型を加工し、該鋳型上へ加熱溶融したポリスチレン材料を流し込み、冷却、離型して傾斜付き培養容器Aを得た。該傾斜付き培養容器Aは、バイオクリーンベンチ内のUVライト下に40分程度置いて滅菌してから培養に用いた。
【0051】
製造例2 培養容器Bの製造
直径約35mmのポリスチレン製ディッシュを用意し、その底面へ直径0.4mmの貫通口を1mm間隔で加工して貫通口付きディッシュを得た。次に、貫通口付きディッシュの底面へ、ディッシュの外側からカバーガラスを接着して培養容器Bを得た(図4)。貫通孔の側面はカバーガラス接着には、接着剤を用いた。該培養容器Bは、バイオクリーンベンチ内のUVライト下に40分程度置いて滅菌してから培養に用いた。
【0052】
製造例3 培養容器Cの製造
図11〜16に示す培養容器Cを、一般的な射出成形加工により製造した。まず、図11の逆パターンの鋳型を加工し、磨き加工により平滑性を高めた。該鋳型上へ加熱溶融したポリスチレン材料を流し込み、冷却、離型して傾斜付き培養容器Cを得た。この培養容器Cの細胞収容部3には、5×5の正方格子状に配置された25個の凹部4が形成されている。製造した培養容器Cの外観写真を図17に示す。該傾斜付き培養容器Cは、エタノール中に1時間浸漬して洗浄した後、バイオクリーンベンチ内のUVライト下に40分程度置いて滅菌してから培養に用いた。なお、図12において、内壁5で囲まれた領域の直径dは7mmであり、図13及び14で示す凹部4のピッチaは420μmである。また、図15及び16において、凹部の直径rは270μm、深さLは150μmに設定した。さらに、円錐状に形成した壁面7について、円錐の中心線と母線とのなす角度αは83°に設定した。
【0053】
図18に、製造した培養容器Cの細胞収容部3の断面形状計測結果(計測装置:キーエンス社製ダブルスキャン高精度レーザ測定器LT−9010M及び高精度形状測定システムKS−1100、測定間隔5μm)、図19に凹部4の断面形状計測結果(計測装置及び測定条件は上記と同様)をそれぞれ示す。また、図20には、図19の右側傾斜面に対して、線形フィッティングを行い、さらに傾きを補正した図を示す。図20から、最大高さRyは0.47μmと求められた。
【0054】
製造例4 培養容器Dの製造
鋳型の製造時に、磨き処理を施さない以外は上記製造例3と同様の手順で培養容器Dを製造した。図21に培養容器Dの凹部4の断面形状計測結果を示す。また、図22には、図21の右側傾斜面に対して、線形フィッティングを行い、さらに傾きを補正した図を示す。図22から、最大高さRyは4.9μmと求められた。
【0055】
製造例5 培養容器Eの製造
図23〜図28に示す培養容器Eを、上記製造例3と同様の手順で製造した。なお、培養容器Eでは、凹部4の壁面7を、凹部の最深部から凹部の外縁13へ向かって曲線状に高くなるような傾斜面としている。培養容器Eのその他の寸法は図11〜16に示す培養容器Cと同一である。
【0056】
図29に培養容器Eの凹部4の断面形状計測結果を示す。また、図30には、図29の右側傾斜面に対して、線形フィッティングを行い、さらに傾きを補正した図を示す。図30から、最大高さRyは2.9μmと求められた。
【0057】
(実施例1)
製造例1で製造した培養容器Aを用いて、ラット受精卵を培養し、観察した画像を用いて、受精卵の輪郭抽出処理を行った。
【0058】
ラット受精卵を製造例1の培養容器Aの細胞収容部の凹部にガラスキャピラリーを用いて導入した。さらに、培地の蒸発を防ぐために、培地を覆うようにミネラルオイルを入れた。培養は、CO2インキュベータ(5%CO2、5%O2及び90%空気、37℃、湿度飽和)にて行った。
【0059】
受精卵が初期の卵割をした後に、倍率20倍の観察装置(高倍率のレンズと撮像用カメラを備えている)で撮影した写真を図5に示す。
受精卵の輪郭を抽出するため、以下のような閾値処理を施した。
【0060】
図6は図5に対して閾値処理を行った画像である。製造例1の培養容器Aを用いた場合、閾値処理を施すことによって、図6に示すように、凹部の壁面の影響無く受精卵の輪郭を識別することが可能であった。
【0061】
閾値処理は、例えばカメラで撮影した受精卵画像の各画素値(=輝度値)を予め設定された第1の閾値と第2の閾値(第1の閾値<第2の閾値)に基づいて、第1の閾値以上かつ第2の閾値以下の場合には1(白)0(黒)を設定し、第1の閾値より小さい又は2の閾値より大きい場合には0(黒)1(白)を設定するといった処理である(=2値化処理)。
【0062】
(実施例2)
製造例3で製造した培養容器Cを用いて、マウス受精卵を培養し、観察した画像を用いて、受精卵の輪郭抽出処理を行った。
【0063】
マウス受精卵を製造例3の培養容器Cの細胞収容部の凹部にガラスキャピラリーを用いて導入した。さらに、培地の蒸発を防ぐために、培地を覆うようにミネラルオイルを入れた。培養は、CO2インキュベータ(5%CO2、5%O2及び90%空気、37℃、湿度飽和)にて行った。
【0064】
受精卵が初期の卵割をした後に、倍率10倍の観察装置(高倍率のレンズと撮像用カメラを備えている)で撮影した写真を図31に示す。実施例1と同様の閾値処理により、受精卵の輪郭を抽出した。図32は図31に対して閾値処理を行った画像である。製造例3の培養容器Cを用いた場合、閾値処理を施すことによって、図32に示すように、凹部の壁面の影響無くマウス受精卵の輪郭を識別することが可能であった。
【0065】
(実施例3)
実施例2と同様に培養容器Cにウシ受精卵を導入した直後に、倍率4倍の観察装置(高倍率のレンズと撮像用カメラを備えている)で撮影し、一部を切り出した写真を図33に示す。実施例1と同様の閾値処理により、受精卵の輪郭を抽出した。図34は図33に対して閾値処理を行った画像である。製造例3の培養容器Cを用いた場合、閾値処理を施すことによって、図34に示すように、凹部の壁面の影響無くウシ受精卵の輪郭を識別することが可能であった。
【0066】
(実施例4)
実施例2と同様に培養容器Dにマウス受精卵を導入し初期の卵割をした後に、倍率10倍の観察装置(高倍率のレンズと撮像用カメラを備えている)で撮影した。実施例1と同様の閾値処理により、受精卵の輪郭を抽出したところ、凹部の壁面の影響無くマウス受精卵の輪郭を識別することが可能であった。しかしながら、細胞収容部の凹部の傾斜面が平滑化されていないため、透過率が低く、ノイズの影響があり、実施例2よりも識別が困難であった。
【0067】
(実施例5)
実施例2と同様に培養容器Eにマウス受精卵を導入し初期の卵割をした後に、倍率10倍の観察装置(高倍率のレンズと撮像用カメラを備えている)で撮影した。実施例1と同様の閾値処理により、受精卵の輪郭を抽出したところ、凹部の壁面の影響無くマウス受精卵の輪郭を識別することが可能であった。しかしながら、細胞収容部の凹部における傾斜面が培養容器Cのように直線状ではなく、曲率を有するため、受精卵が凹部の壁面に接触している確率が実施例2よりも高かった。以上の実施例2、4及び5の結果から、凹部の傾斜面は直線部分を含み且つRy値が小さいほど、細胞を凹部の中央に集めることができ、細胞の判別に有利であることが分かった。
【0068】
(比較例1)
比較例1として、製造例2で製造した培養容器Bを用いて、マウス受精卵を培養し、観察した画像を用いて、受精卵の輪郭抽出処理を行った。
【0069】
マウス受精卵を製造例2の培養容器Bの細胞収容部の凹部にガラスキャピラリーを用いて導入した。さらに、培地の蒸発を防ぐために、培地を覆うようにミネラルオイルを入れた。培養は、CO2インキュベータ(5%CO2、5%O2及び90%空気、37℃、湿度飽和)にて行った。
【0070】
製造例2で製造した培養容器Bに受精卵を導入した直後に、倍率10の観察装置(高倍率のレンズと撮像用カメラを備えている)で撮影した写真を図7及び9に示す。
【0071】
実施例1と同様の閾値処理により、受精卵の輪郭を抽出した。図8は図7に対して閾値処理をしたもの、図10は図9に対して閾値処理をしたものである。
【0072】
図8のように、偶然に細胞収容部の凹部の壁面から離れている受精卵については、受精卵の輪郭を抽出できたが、図10のように、細胞収容部の凹部の壁面に接触している受精卵については、受精卵の輪郭を抽出することができなかった。
【符号の説明】
【0073】
1:側壁、2:底壁、3:細胞収容部、4:細胞収容部の凹部、5:内壁、6:細胞、7:凹部の壁面(円錐面)、8:培地、9:ミネラルオイル、10:内壁、11:外堀、12:培地又は水、13:外縁
【特許請求の範囲】
【請求項1】
個別管理が必要とされる細胞を培養するための、底壁と側壁とを有する培養容器であって、
底壁に、凹部を有する細胞収容部が配置されており、
凹部が4個以上近接しており、
凹部の壁面が、凹部の最も低い位置から凹部の外縁に進むに従って高くなるような傾斜面を有し、
近接する凹部間のピッチが1mm以下である、
前記培養容器。
【請求項2】
凹部の壁面が、直線部分を含む傾斜面を有する、請求項1に記載の培養容器。
【請求項3】
傾斜面の表面粗さについて、最大高さRyが1.0μm未満である、請求項2に記載の培養容器。
【請求項4】
凹部の開口部の開口幅が100μm〜300μmである、請求項1〜3のいずれか1項に記載の培養容器。
【請求項5】
凹部の深さが50μm〜200μmである、請求項1〜4のいずれか1項に記載の培養容器。
【請求項6】
凹部の開口部が円形である、請求項1〜5のいずれか1項に記載の培養容器。
【請求項7】
凹部の壁面が円錐状又は円錐台状の部分を有する、請求項6に記載の培養容器。
【請求項8】
円錐又は円錐台の中心線と母線とのなす角度が89〜45°である、請求項7に記載の培養容器。
【請求項9】
近接する凹部が、1mm2あたり1個以上の密度で配置されている、請求項1〜8のいずれか1項に記載の培養容器。
【請求項10】
近接する4個以上の凹部が正方格子状又は最密充填状に配置されている、請求項1〜9のいずれか1項に記載の培養容器。
【請求項11】
凹部が24個以上配置されている、請求項1〜10のいずれか1項に記載の培養容器。
【請求項12】
細胞が、受精卵、卵細胞、ES細胞及びiPS細胞からなる群から選択される、請求項1〜11のいずれか1項に記載の培養容器。
【請求項13】
細胞が、ウシの受精卵である、請求項12に記載の培養容器。
【請求項14】
近接する4個以上の凹部が、それらを囲む内壁により、培養容器内のその他の部分と隔てられている、請求項1〜13のいずれか1項に記載の培養容器。
【請求項15】
培養容器の外周部であって細胞収容部を有しない部分に液体収容部を有する、請求項14に記載の培養容器。
【請求項16】
培養細胞の自動判別に使用するための、請求項1〜15のいずれか1項に記載の培養容器。
【請求項17】
倍率4倍の対物レンズを用いて細胞収容部を顕微鏡観察したときに、観察視野内に4個以上の凹部が含まれる、請求項16に記載の培養容器。
【請求項18】
培養細胞の判別方法であって、請求項1〜17のいずれか1項に記載の培養容器の細胞収容部の凹部に、受精卵、卵細胞、ES細胞及びiPS細胞からなる群から選択される細胞をそれぞれ導入して培養し、顕微鏡により取得した培養細胞の画像を検出装置によって撮像し、得られた像を輪郭抽出処理に付すことを含む、前記判別方法。
【請求項1】
個別管理が必要とされる細胞を培養するための、底壁と側壁とを有する培養容器であって、
底壁に、凹部を有する細胞収容部が配置されており、
凹部が4個以上近接しており、
凹部の壁面が、凹部の最も低い位置から凹部の外縁に進むに従って高くなるような傾斜面を有し、
近接する凹部間のピッチが1mm以下である、
前記培養容器。
【請求項2】
凹部の壁面が、直線部分を含む傾斜面を有する、請求項1に記載の培養容器。
【請求項3】
傾斜面の表面粗さについて、最大高さRyが1.0μm未満である、請求項2に記載の培養容器。
【請求項4】
凹部の開口部の開口幅が100μm〜300μmである、請求項1〜3のいずれか1項に記載の培養容器。
【請求項5】
凹部の深さが50μm〜200μmである、請求項1〜4のいずれか1項に記載の培養容器。
【請求項6】
凹部の開口部が円形である、請求項1〜5のいずれか1項に記載の培養容器。
【請求項7】
凹部の壁面が円錐状又は円錐台状の部分を有する、請求項6に記載の培養容器。
【請求項8】
円錐又は円錐台の中心線と母線とのなす角度が89〜45°である、請求項7に記載の培養容器。
【請求項9】
近接する凹部が、1mm2あたり1個以上の密度で配置されている、請求項1〜8のいずれか1項に記載の培養容器。
【請求項10】
近接する4個以上の凹部が正方格子状又は最密充填状に配置されている、請求項1〜9のいずれか1項に記載の培養容器。
【請求項11】
凹部が24個以上配置されている、請求項1〜10のいずれか1項に記載の培養容器。
【請求項12】
細胞が、受精卵、卵細胞、ES細胞及びiPS細胞からなる群から選択される、請求項1〜11のいずれか1項に記載の培養容器。
【請求項13】
細胞が、ウシの受精卵である、請求項12に記載の培養容器。
【請求項14】
近接する4個以上の凹部が、それらを囲む内壁により、培養容器内のその他の部分と隔てられている、請求項1〜13のいずれか1項に記載の培養容器。
【請求項15】
培養容器の外周部であって細胞収容部を有しない部分に液体収容部を有する、請求項14に記載の培養容器。
【請求項16】
培養細胞の自動判別に使用するための、請求項1〜15のいずれか1項に記載の培養容器。
【請求項17】
倍率4倍の対物レンズを用いて細胞収容部を顕微鏡観察したときに、観察視野内に4個以上の凹部が含まれる、請求項16に記載の培養容器。
【請求項18】
培養細胞の判別方法であって、請求項1〜17のいずれか1項に記載の培養容器の細胞収容部の凹部に、受精卵、卵細胞、ES細胞及びiPS細胞からなる群から選択される細胞をそれぞれ導入して培養し、顕微鏡により取得した培養細胞の画像を検出装置によって撮像し、得られた像を輪郭抽出処理に付すことを含む、前記判別方法。
【図1a】


【図1b】


【図2a】


【図2b】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】




【図1b】


【図2a】


【図2b】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【公開番号】特開2010−200748(P2010−200748A)
【公開日】平成22年9月16日(2010.9.16)
【国際特許分類】
【出願番号】特願2010−22463(P2010−22463)
【出願日】平成22年2月3日(2010.2.3)
【出願人】(000002897)大日本印刷株式会社 (14,506)
【出願人】(301029403)独立行政法人家畜改良センター (12)
【Fターム(参考)】
【公開日】平成22年9月16日(2010.9.16)
【国際特許分類】
【出願日】平成22年2月3日(2010.2.3)
【出願人】(000002897)大日本印刷株式会社 (14,506)
【出願人】(301029403)独立行政法人家畜改良センター (12)
【Fターム(参考)】
[ Back to top ]

