細胞培養支持体
【課題】本発明は細胞シート形成速度が速く、形成された細胞シートの剥離が容易である細胞培養支持体を提供することを目的とする。
【解決手段】本発明は、天面を有する複数の凸部と該凸部間に形成される凹部とを備えた、細胞を培養させて細胞シートを形成するための細胞培養支持体であって、該凹部の開口部の寸法が、培養される細胞が潜入できない寸法であり、且つ、該細胞シートが剥離可能であることを特徴とする、前記細胞培養支持体に関する。本発明はまた、当該支持体を用いた細胞シートの作製方法、及びその方法により作製された細胞シートに関する。
【解決手段】本発明は、天面を有する複数の凸部と該凸部間に形成される凹部とを備えた、細胞を培養させて細胞シートを形成するための細胞培養支持体であって、該凹部の開口部の寸法が、培養される細胞が潜入できない寸法であり、且つ、該細胞シートが剥離可能であることを特徴とする、前記細胞培養支持体に関する。本発明はまた、当該支持体を用いた細胞シートの作製方法、及びその方法により作製された細胞シートに関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は細胞シートを作製するための細胞培養支持体に関する。
【背景技術】
【0002】
細胞シートとは、細胞間結合で細胞同士が少なくとも単層で連結されたシート状の細胞集合体である。細胞シートは再生医療などで用いられる。細胞シートはシャーレなどの支持体上で細胞培養を行うことにより得られるが、支持体上で形成された細胞シートは接着分子などを介して支持体表面と強固に結合しているため、細胞−細胞間の結合を壊さずに培養支持体から細胞シートを迅速に剥離することは容易ではない。
【0003】
そこで、細胞培養支持体から細胞シートを効率的に剥離する方法がこれまで検討されてきた。剥離方法は2つに大別できる。第一の方法は、酵素反応を用いて支持体と細胞間の結合を弱める方法である。第二の方法は、細胞接着力の弱い支持体や細胞接着力の変化する支持体を用いる方法である。
【0004】
第一の方法は、具体的には、酵素を用いて、プロテアーゼ(タンパク質分解酵素)やコラーゲナーゼ(コラーゲン分解酵素)といった細胞間接着分子(密着結合、接着結合、デスモゾーム結合、ギャップ結合、ヘミデスモゾーム結合)を構成するタンパク質や、培養物の周囲を取り巻くコラーゲン結合織や、細胞と支持体間に形成される細胞外マトリクス(Extracellular Matrix: ECM)を分解する方法である。この方法では細胞−支持体表面の結合だけでなく、細胞−細胞間の結合も弱まる。この方法は細胞培養の分野で古くから使われている。この方法で分解される結合物質は、培養される細胞、組織、器官において作られる物質であるから、剥離後においても一定の条件と期間で分解された結合物質を再生することができる。
【0005】
しかしながら、結合物質の再生には時間がかかるという問題がある。また、この方法では、細胞シートが少なからず損傷を受けるため、再生医療に用いられる細胞シートの作出方法としては望ましくないといえる。
【0006】
そこで、第二の方法が新たに開発されている。
細胞接着力の弱い支持体としては特許文献1や特許文献2に開示されているものが挙げられる。これらの文献には、支持体表面にナノピラーと呼ばれる極微小の柱を立て、その上で培養を行う技術が開示されている。この技術では支持体と培養材料は非常に小さい面積でしか接着されず、回収剥離が容易でダメージも少ないとされる。
【0007】
しかしながら非特許文献1及び2に記載されているように、細胞接着や接着した細胞の挙動は平面に接着する場合と凹凸表面に接着する場合とでは異なり、ナノピラー上では細胞の接着、伸展が遅くなったり、細胞表面から仮足が発生するという問題がある。また凹部が20μm以上の幅を有する場合には細胞が潜入してしまうという問題もある。
【0008】
細胞接着力の変化する支持体として、本発明者らはこれまでに細胞増殖表面を温度応答性ポリマーで被覆した支持体を開発している(特許文献3)。細胞接着力を変化させる目的には、温度応答性ポリマーを用いることが最も好ましいが、それ以外でもpH応答性ポリマーや、イオン応答性ポリマーを用いることもできる。特許文献1及び2では温度応答性ポリマーをナノピラーを用いた培養に組合せることが言及されている。細胞培養において温度応答性ポリマーを用いることについては特許文献4にも言及がある。
【0009】
しかしながら既存の応答性ポリマーを用いた場合であっても剥離の速度はいまだ十分ではない。既存技術では細胞シートの剥離に1〜3時間を要しているが、より短時間、例えば30分以内で剥離が可能であれば、手術の現場で剥離を開始して完了させることができるためより適切な治療が可能となる。
【0010】
また本発明者らは非特許文献3に記載のように支持体としてポーラスなメンブランフィルム上に温度応答性ポリマーを配したものを用いて細胞シートを得た場合に、多孔質でない平滑なメンブランフィルムを用いて細胞シートを得た場合と比較して、細胞シートの剥離、回収が早いことを確かめている。
【0011】
しかしながら非特許文献3に記載の方法をもってしても迅速にコントロールして細胞シートを剥離回収することはできなかった。
【0012】
ところで本出願人はフォトレジスト材料や微細加工技術の分野で多くの技術を有する。特許文献5にはサブミクロンの回折格子等の複製品とその製造方法等が記載されている。
【0013】
本発明に関連する文献として次の文献が上げられる。
【特許文献1】特開2004−170935号公報
【特許文献2】特開2005−168494号公報
【特許文献3】特公平6−104061号公報
【特許文献4】特開2005−27532号公報
【特許文献5】特開2005−84561号公報
【特許文献6】特許第312660号公報
【特許文献7】特許第3491917号公報
【特許文献8】特開平9−12651号公報
【特許文献9】特開平10−248557号公報
【特許文献10】特開平11−349643号公報
【特許文献11】特開2001−329183号公報
【特許文献12】特開2002−18270号公報
【特許文献13】特開平5−244938号公報
【特許文献14】国際公開WO01/068799号パンフレット
【非特許文献1】M. J. Dalby et al., Biomaterials 25 (2004) 5415-5422
【非特許文献2】C. C. Berry et al., Biomaterials 25 (2004) 5781-5788
【非特許文献3】O. H. Kwon, J. Biomed. Mater. Res., (2000) Apr.; 50(1):82-9
【非特許文献4】A. Kushida et al., J. Biomed. Mater. Res., (1999) Jun.; 45(4):355-62.
【発明の開示】
【発明が解決しようとする課題】
【0014】
上記の通り、細胞シートを作製するための従来の細胞培養支持体は、支持体からの剥離の際に細胞シートを損傷するおそれがあるという問題や、支持体上で均質な細胞シートが形成されないという問題や、支持体上での細胞シート形成速度が遅いという問題や、支持体からの細胞シートの剥離に時間がかかるという問題があった。
本発明は上記問題点を解消した細胞培養支持体を提供することを目的とする。
【課題を解決するための手段】
【0015】
本出願は以下の発明を包含する。
(1)天面を有する複数の凸部と該凸部間に形成される凹部とを備えた、細胞を培養させて細胞シートを形成するための細胞培養支持体であって、該凹部の開口部の寸法が、培養される細胞が潜入できない寸法であり、且つ、該細胞シートが剥離可能であることを特徴とする、前記細胞培養支持体。
(2)前記天面が温度応答性ポリマー、pH応答性ポリマー、及びイオン応答性ポリマーからなる群から選択される少なくとも1種により被覆されていることを特徴とする(1)記載の細胞培養支持体。
(3)前記凹部の開口部の寸法が培養される細胞の外郭寸法よりも小さいことを特徴とする(1)又は(2)記載の細胞培養支持体。
(4)前記凹部の開口部の総面積が、前記天面の総面積と前記凹部の開口部の総面積との合計に対して10〜60%であることを特徴とする(1)〜(3)のいずれか1項に記載の細胞培養支持体。
(5)前記凹部の開口部の幅が0.1〜10μmであることを特徴とする(1)〜(4)のいずれか1項に記載の細胞培養支持体。
(6)前記凹部の深さが0.01μm以上であることを特徴とする(1)〜(5)のいずれか1項に記載の細胞培養支持体。
(7)前記天面の寸法が培養される細胞の外郭寸法と同一であるか又はそれより大きいことを特徴とする(1)〜(6)のいずれか1項に記載の細胞培養支持体。
(8)前記天面の幅が1〜20μmであることを特徴とする(1)〜(7)のいずれか1項に記載の細胞培養支持体。
(9)前記凹部が格子状溝として形成されていることを特徴とする(1)〜(8)のいずれか1項に記載の細胞培養支持体。
(10)前記凹部が複数本のストライプ状溝として形成されていることを特徴とする(1)〜(8)のいずれか1項に記載の細胞培養支持体。
(11)(1)〜(8)のいずれか1項に記載の細胞培養支持体を用いて細胞を培養させて細胞シートを形成することを特徴とする細胞シートの作製方法。
(12)(11)記載の方法により作製された細胞シート。
【発明の効果】
【0016】
本発明に係る細胞培養支持体を用いて細胞シートを作製した場合、細胞シートの剥離を迅速に行うことができる。剥離に要する時間が短いことから、剥離作業中における細胞シートの変性が起こりにくい。
【0017】
本発明に係る細胞培養支持体を用いて作製された細胞シートは表面の接着因子が損なわれていないため再生医療などへの利用に適する。
【発明を実施するための最良の形態】
【0018】
以下、天面を有する複数の凸部と該凸部間に形成される凹部とを備えた本発明に係る細胞培養支持体の典型的な実施形態について図面を参照して具体的に説明する。
【0019】
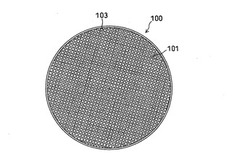
図1aに多数の凸部(101)と凸部間に形成される格子状溝である凹部(103)とを有する細胞培養支持体(100)の上面図を示す。図1bには細胞培養支持体(100)の凸部及び凹部を拡大した斜視図を示す。凸部(101)は基台部(105)から起立して形成されている。凹部(103)は基台部(105)を底部とする有底溝である。凸部(101)は平滑な正方形の天面(107)を有しており、細胞は凹部を乗り越えて複数の天面上に亘って増殖し、細胞シートを形成する。
【0020】
図2及び3には細胞培養支持体の他の実施形態を示す。
細胞培養支持体(200)は、基台部(205)から起立した平行に配置された複数の凸条である凸部(201)と、その間に形成される複数本のストライプ状溝である凹部(203)とからなる。凸部(201)は平滑な帯状の天面(207)を有している。図1の実施形態と同様に、細胞は凹部を乗り越えて複数の天面上に亘って増殖し、細胞シートを形成する。
【0021】
本発明に係る細胞培養支持体は「複数の凸部」を必須の構成要件とするが、各凸部は他の凸部との間に凹部を形成することができる限り、その一部分が互いに連結していてもよい。例えば、図1bに示す各凸部(101)は隣接する凸部と一部が繋がって図3に示す細胞培養支持体(300)を形成してもよい。細胞培養支持体(300)もまた本発明の好ましい実施形態である。この実施形態では、凹部(303)は開口部の形状が正方形である有底凹部である。細胞培養支持体(300)においても細胞は凹部(303)を乗り越えて天面(307)上に亘って増殖し、細胞シートを形成する。
【0022】
本発明において凸部の天面(107、207、307)は、同一支持体上にある他の凸部の天面と同一平面上に位置することが好ましい。
【0023】
本発明に係る細胞培養支持体の材質は通常細胞培養に用いられるガラス類、プラスチック類、セラミックス、金属等が挙げられるが、細胞培養が可能な材質である限りこれらには限定されない。支持体の表面または中間層に本発明の目的を妨げない限り任意の層を設けてもよいし、任意の処理を施してもよい。例えば、支持体表面にオゾン処理、プラズマ処理、スパッタリング等の処理技術を用いて親水化を施すことができる。
【0024】
本発明に係る細胞培養支持体は当業者に知られている種々の微細加工技術を用いて製造することができる。微細加工技術としては特許文献5に示すようなリソグラフィー技術が挙げられるがこれに限定されない。
【0025】
本発明に係る細胞培養支持体は、細胞培養の足場となる天面を有する複数の凸部と、該凸部間に形成される凹部とを備えている限り、全体としてはいかなる形状を有していてもよい。例えば当該分野で通常用いられる培養皿(シャーレ)や培養容器の底面に図1〜3に示すような微細パターンを形成することにより本発明に係る細胞培養支持体とすることができる。
【0026】
本発明に係る細胞培養支持体の全体の大きさは、作製しようとする細胞シートの大きさに応じて適宜選択することができる。
【0027】
凸部の天面は、細胞シートの剥離をより促進する目的で温度応答性ポリマー、pH応答性ポリマー、及びイオン応答性ポリマーからなる群から選択される少なくとも1種、好ましくは温度応答性ポリマーにより被覆されていることが好ましい。なお、これらの応答性ポリマーの被覆は、凸部天面上以外の面、例えば凸部の側面や凹部底面に施されても問題はない。
【0028】
本発明に好適に使用できる温度応答性ポリマーは細胞培養温度下(通常、37℃程度)において疎水性を示し、培養した細胞シートの回収時の温度下において親水性を示すものが好ましい。なお、温度応答性ポリマーが、疎水性から親水性に変化する温度(水に対する臨界溶解温度(T))としては、特に限定されないが、培養後の細胞シートの回収の容易さの観点からは、細胞培養温度よりも低い温度であることが好ましい。このような温度応答性ポリマー成分を含むことで、細胞培養時においては、細胞の足場(細胞接着面)が充分に確保されるため細胞培養を効率よく行うことができる。その一方、培養後の細胞シートの回収時においては、疎水性部分を親水性に変化させ、培養された細胞シートを細胞培養基材から分離させることで、細胞シートの回収をより一層容易にすることができる。
【0029】
本発明に好適に使用できる温度応答性ポリマーは具体的にはTが0〜80℃、好ましくは0〜50℃であるポリマーが好ましい。Tが80℃を越えると細胞が死滅する可能性があるので好ましくない。またTが0℃より低いと、一般に細胞増殖速度が極度に低下するか、または細胞が死滅してしまうため好ましくない。そのような好適なポリマーとしては、例えば特許文献3に記載のポリマーが挙げられる。具体的には適当なポリマーとしては、例えばポリ−N−イソ,プロピルアクリルアミド(T=32℃)、ポリ−N−n−プロピルアクリルアミド(T=21℃)、ポリ−N−n−プロピルメタクリルアミド(T=32℃)、ポリ−N−エトキシエチルアクリルアミド(T=約35℃)、ポリ−N−テトラヒドロフルフリルアクリルアミド(T=約28℃)、ポリ−N−テトラヒドロフルフリルメタクリルアミド(T=約35℃)、及びポリ−N,N−ジエチルアクリルアミド(T=32℃)等が挙げられる。その他のポリマーとしては、例えばポリ−N−エチルアクリルアミド、ポリ−N−イソプロピルメタクリルアミド、ポリ−N−シクロプロピルアクリルアミド、ポリ−N−シクロプロピルメタクリルアミド、ポリ−N−アクリロイルピロリジン、ポリ−N−アクリロイルピペリジン、ポリメチルビニルエーテル、メチルセルロース、エチルセルロース、ヒドロキシプロピルセルロース等のアルキル置換セルロース誘導体や、ポリポリプロピレンオキサイドとポリエチレンオキサイドとのブロック共重合体等に代表されるポリアルキレンオキサイドブロック共重合体や、ポリアルキレンオキサイドブロック共重合体が挙げられる。これらのポリマーは、例えばモノマーの単独重合体がT=0〜80℃を有するようなモノマーの単独若しくは共重合により調製される。モノマーとしては例えば、(メタ)アクリルアミド化合物、N−(若しくはN,N−ジ)アルキル置換(メタ)アクリルアミド誘導体、環状基を有する(メタ)アクリルアミド誘導体、及びビニルエーテル誘導体等が挙げられ、これらの1種以上を使用してよい。また、増殖細胞の種類によってTを調節する必要がある場合や、被覆物質と細胞培養支持体との相互作用を高める必要が生じた場合や、細胞支持体の親水・疎水性のバランスを調整する必要がある場合などには、上記以外の他のモノマー類を更に加えて共重合してよい。更に本発明に使用する上記ポリマーとその他のポリマーとのグラフトまたはブロック共重合体、あるいは本発明のポリマーと他のポリマーとの混合物を用いてもよい。また、ポリマー本来の性質が損なわれない範囲で架橋することも可能である。
【0030】
pH応答性ポリマーおよびイオン応答性ポリマーは作製しようとする細胞シートに適したものを適宜選択することができる。
【0031】
凸部天面における各種応答性ポリマーの被覆量は、5〜80μg/cm2、好ましくは6〜40μg/cm2である。ポリマー被覆量が80μg/cm2を超過すると細胞は細胞培養支持体表面上に付着せず、逆に被覆量が5μg/cm2未満だと細胞は単層の状態で培養され組織状とならず、また培養細胞を支持体から剥離回収するのも困難となる。このようなポリマー被覆量は、例えばフーリエ変換赤外分光計全反射法(FT-IR-ATR法)、被覆部若しくは非被覆部の染色や蛍光物質の染色による分析、更に接触角測定等による表面分析を単独或は併用して求めることが出来る。
【0032】
凸部天面の表面へのポリマーの被覆方法は、後述するような化学的方法や物理的方法を単独でまたは併用して行うことができる。被覆時に前記モノマーを使用する場合、そのモノマーは気体、液体、固体いずれの状態でも良い。また、ポリマーを使用する場合にはおいても、そのポリマーは、液体、固体状態のいずれの状態でも良い。これらのものを化学的な反応によって結合させる場合、電子線照射(EB)、γ線照射、紫外線照射、プラズマ処理、コロナ処理、さらに天面の表面の素材と被覆材料が適当な反応性官能基を有する場合はラジカル及びイオン反応等の一般に用いられる有機反応、を用いることができる。物理的な相互作用による方法としては、被覆材料単独または天面の表面の素材との相溶性の良いマトリックスを媒体とし、塗布、混練等の物理的吸着を用いる方法等があるが、これらに限られるわけではない。
【0033】
各種応答性ポリマーの被覆層は微細パターン形成後に凹凸部全面に設けてもよいし、凸部天面上のみに設けてもよいし、ポリマーの層と微細パターンを別個に準備して両者を結合させてもよいし、微細パターンに影響しない範囲で中間層を介して設けてもよいし、微細パターンの形成とポリマー被覆とを同時に行ってもよい。
【0034】
本発明に係る細胞培養支持体は、凹部の開口部の寸法が、培養される細胞が潜入できない寸法であることを特徴の一つとする。凹部内に細胞が潜入できないため、細胞シートは凹部に遮られることなく複数の天面に亘って平滑に形成され得る。また、剥離の速度も速くなる。特に、凹部の開口部の寸法が培養後の細胞の外郭寸法よりも小さいことが好ましい。ここで「細胞の外郭寸法よりも小さい」とは、細胞の外郭の短手方向の長さ(幅)と比較して凹部の開口部の短手方向の長さ(幅)がより短いことを意味する。凹部の開口部の短手方向の長さとは、凹部の開口部の短手方向に長短がある場合には最短部の長さを指す。開口部の幅の一例を挙げれば0.1〜10μm、より好ましくは0.3〜2.5μmであるが、培養される細胞の種類に応じて適宜選択可能である。凹部は水を蓄えることにより細胞シートの剥離の際に剥離される部位に水を供給する役割を担うと考えられるから、凹部は水を蓄えることが可能な一定の深さを持っていることが好ましい。例えば、0.01μm以上の深さを有することが好ましい。深さの上限は特にないが加工効率を考えれば20μm程度が上限であろう。
【0035】
凹部の形状は特に限定されない。典型的なものとしては、図1に示すような格子状溝や、図2に示すような複数本の直線状のストライプ状溝や、図3に示すような開口部が正方形または長方形の凹穴が挙げられるが、後述する形状を有する凸部の間に形成される凹部であればよい。なお本発明において格子状溝とは直交格子のみならず斜交格子も包含する。またストライプ状溝とは直線状のものだけでなく、図4に示すような曲線状のものも包含する。凹部の短手方向の断面形状は、図1〜3に示すような長方形の上辺を欠いた形状には限定されず任意の形状であってよい。
【0036】
本発明に係る細胞培養支持体上では、特許文献1及び2に記載されているナノピラー上での細胞培養とは異なり、培養開始時に細胞が存在する位置から細胞培養支持体の周縁方向に向けて全方向に連続的に細胞シートの伸展が進み、均一な品質を有する細胞シートを得ることが可能である。この特徴は、好ましくは、凹部の開口部が上記寸法を有していることに加えて、ナノピラーと異なり凸部の天面が一定以上の寸法を有していることにより実現される。天面の寸法は培養される細胞の外郭寸法と同一であるか又はそれより大きいことが好ましい。天面の寸法がこの範囲内である場合には、培養細胞は凹部の無い平滑面上におけるのと同様の挙動を示す。ここで、「細胞の外郭寸法と同一であるか又はそれより大きい」とは、細胞の外郭の短手方向の長さ(幅)と比較して凸部の天面の短手方向の長さ(幅)が同一であるかより長いことを意味する。天面の短手方向の長さ(幅)とは、凸部の天面の短手方向に長短がある場合には最短部の長さを指す。天面の幅の一例を挙げれば1〜20μm、より好ましくは2〜15μmであるが、培養される細胞の種類に応じて適宜選択可能である。天面の幅が余り広すぎると細胞シートとの接触面(密着面)が広くなるため、凹部に蓄えた水が応答ポリマーへ移行する距離が長くなり、如いては剥離に時間がかかるという問題が起こり得る。
【0037】
凸部の天面の、細胞接着面の方向からみた形状は特に限定されないが、典型的には円形、三角形、四角形、五角形、六角形等の多角形、或いは細長い直線状または曲線状の帯形状である。凸部の断面視形状において、凸部の側方端辺は垂直線であってもテーパー状であってもよいし、外側又は内側に湾曲した曲線上であってもよい。
【0038】
本発明に係る細胞培養支持体はまた、細胞シートが迅速に剥離可能であることを特徴の一つとする。この特徴は各種応答性ポリマーの使用だけでは十分には達成されず、上記のように天面の寸法を余り大きくしすぎないことや、微細な寸法を有する凹部の開口部が、天面間に適度な割合で配置されていることを組合せることにより達成される。ただし、開口部の割合が高い場合は剥離は容易となるが細胞シートの形成速度は遅くなるという問題があり、開口部の割合が低い場合は剥離が困難となるという問題がある。そこで天面の総面積と開口部の総面積の合計に対する開口部の総面積の百分率(%)は10〜60%であることが好ましく、15〜50%であることがより好ましく、20〜45%であることが最も好ましい。
【0039】
本発明に係る細胞培養支持体を用いて、種々の細胞、例えば生体内の各組織、臓器を構成する上皮細胞や内皮細胞、収縮性を示す骨格筋細胞、平滑筋細胞、心筋細胞、神経系を構成するニューロン、グリア細胞、繊維芽細胞、生体の代謝に関係する肝実質細胞、非肝実質細胞や脂肪細胞、分化能を有する細胞として、種々組織に存在する幹細胞、さらには骨髄細胞、ES細胞等から細胞シートを作製することができる。こうして作製された細胞シートは表面の接着因子が損なわれていないため再生医療などへの利用に適したものである。また、細胞シートを利用することでバイオセンサー等の検出デバイスへの応用へも展開できる。
【実施例】
【0040】
細胞培養支持体の作製
実施例1〜6として、図1に示すような、正方形の凸部天面と格子状の溝とを有する細胞培養支持体を作成した。半径13mmの円形基板上に、表1に示す溝巾(A、図1c参照)とピッチ(B、図1c参照)を微細パターンを形成した。溝の深さ(C、図1c参照)は0.5μmに固定した。また後述する比較例と同様に、実施例1〜6に係る細胞培養支持体の断面視形状は端部に一段の段落ち部を有しており、該段落ち部の段落ち高さ(H,図6b参照)は0.5μmであり、下方の段の張出し幅(I,図6a及びb参照)は200μmである。
【0041】
参考例1として、図4に示すような、複数本の平行なL字型の溝(401)を一部分に有する細胞培養支持体(400)を作成した。半径13mmの円形基板上に、溝巾1.5μm、溝の深さ0.5μm、ピッチ7.5μmを有する複数本の平行なL字型の溝(401)を形成した。また後述する比較例と同様に、参考例1に係る細胞培養支持体の断面視形状は端部に一段の段落ち部を有しており、該段落ち部の段落ち高さ(H,図6b参照)は0.5μmであり、下方の段の張出し幅(I,図6a及びb参照)は200μmである。図4中の各寸法は次の通りである。D:7.00mm、E:7.28mm、F:7.04mm、G:5.20mm。
【0042】
参考例2として、図5に示すような、複数本の平行なストライプ状溝(501)を半分に有する細胞培養支持体(500)を作成した。半径13mmの円形基板上に、溝巾1.5μm、溝の深さ0.5μm、ピッチ7.5μmを有する複数本の平行なストライプ状溝(501)を形成した。また後述する比較例と同様に、参考例2に係る細胞培養支持体の断面視形状は端部に一段の段落ち部を有しており、該段落ち部の段落ち高さ(H,図6b参照)は0.5μmであり、下方の段の張出し幅(I,図6a及びb参照)は200μmである。
【0043】
比較例として図6a及びbに示すように微細パターンを設けない細胞培養支持体(600)を作成した。半径13mmの円形基板上に天面が平滑な台状部を形成した。比較例に係る細胞培養支持体の断面視形状は端部に一段の段落ち部を有しており、該段落ち部の段落ち高さ(H,図6b参照)は0.5μmであり、下方の段の張出し幅(I,図6a及びb参照)は200μmである。
【0044】
【表1】

【0045】
実施例1〜6の細胞培養支持体は、微細パターン加工は特許文献5実施例2記載の手順に従って、半径13mmのソーダガラスを基台部(105)とし、該基台部上に下記成形用樹脂組成物からなる凸部(101)を形成することにより製造した。その手順を具体的に説明する。
【0046】
厚みが6.35mmの合成石英基板上に厚みが0.11μmのCr層を形成したものの上にフォトレジスト層を形成し、所定のパターン状露光および現像を経てレジストパターンを形成した後、レジストパターンを利用してCr層のエッチング、続いて石英基板のドライエッチングを行った後、レジストパターンを溶解除去して、表1に示す溝巾及びピッチ並びに溝深さ0.5μmで規定される天面が正方形の整列した凸部に対応する凹状溝を形成した後、酸でエッチングして、Cr層を除去し、さらにフッ酸処理して成型用型を製造した。
紫外線感光性の成型用樹脂組成物として次の組成のものを準備した。
【0047】
【表2】

【0048】
上記のように製造した成型用型を用いて、凹状溝を有する側に表2に示す成型用樹脂組成物を滴下し、アンカー処理を施した厚みが1.1mmのソーダガラスを、その処理面側が成型用型側となるようにして重ね合せた後、成型用型側より高圧水銀灯を用いて、170mJ/cm2(365nm)の条件で紫外線照射して、間の成型用樹脂組成物を硬化させた。その後、成型用型を剥離して、図1に示すような微細パターン形成体を得た。得られた微細パターン形成体にはパターンの欠落がなく、また、剥離した成型用型の凹状溝内には、硬化した成型用樹脂組成物の残留は無かった。
【0049】
参考例1及び2の支持体は、凸部の形状が異なることを除いて実施例1〜6と同様に製造した。
比較例の支持体は、微細バターンを設けないことを除いて実施例1〜6と同様に製造した。
【0050】
温度応答性ポリマーによる被覆
以下の手順で温度応答性ポリマー層を上記で作製した基板上に被覆した。(基板はあらかじめ凹凸面に対し、酸素プラズマ処理で表面の清浄性と一様の濡れ性を確保した。)
40重量%に調整したN−イソプロピルアクリルアミドのイソプロピルアルコール溶液を上記で作製した各基板の凹凸面上に12μl添加後、電子線を30Mrad照射することにより、各基板の凹凸表面上にポリ−N−イソプロピルアクリルアミドを被覆した。電子線照射後、イオン交換水により、各基板を洗浄し、残存モノマー及び遊離ポリ−N−イソプロピルアクリルアミドを取り除き、クリーンベンチ内で乾燥し、さらに、エチレンオキサイド(EO)によりガス滅菌し、さらに十分に脱気を行うことにより細胞培養支持体を得た。
【0051】
細胞培養支持体上での細胞シート作製
上記で得られた各細胞培養支持体をシャーレの底部に載せ、各細胞培養支持体上において常法によりウシ大動脈血管内皮細胞を培養した(使用培地:ウシ胎児血清(FCS)を10%含むダルベッコー改変イーグル培地(DMEM)。37℃、5%CO2下)。
【0052】
培養開始5日後に、コンフルエントになった血管内皮細胞シートが接着した各細胞培養支持体をシャーレごと20℃、5%CO2下のチャンバー内に移し、顕微鏡で観察するとともにシャーレ全体をデジタルビデオ撮影した。
【0053】
凹凸の有無に関係なく、実験に供した各細胞培養支持体間で細胞の接着やシートの伸展に大きな違いは観察されず、全て良好であった。コンフルエントになる時間も3μmの溝巾を持つパターン(実施例1)で最大半日程度の遅れを観察した程度で問題はなかった。
【0054】
剥離の程度は、顕微鏡写真、タイムラップ及びデジタルビデオムービーから得た画像の解析により得られた、コンフルエント細胞シートの剥離率(%)の経時変化に基づき評価した。結果を図7に示す。実施例1〜6はいずれも比較例と比較して迅速に剥離が完了したことが分る。参考例1及び2では平滑部分から剥離が開始し、次いで凹凸部が剥離を始め、凹凸部は比較的速やかに剥離が完了し、最後に残った平滑部分が完全に剥離するのに時間がかかった。支持体の全面に複数本の直線状または曲線状のストライプ状溝を設ければ、格子状溝同様に迅速に剥離が完了するものと推測される。
【0055】
実験に用いたいずれの細胞培養支持体においても、支持体上への細胞残りは認められず、良好に剥離が完了した。3μmの溝巾を持つパターン(実施例1)においてのみ顕微鏡下の観察で細胞の一部が溝部にひっかかり、細胞シートの剥離とともにシート内に引き戻されるものが観察されたが、他のパターンではそれも観察されなかった。
【0056】
細胞外マトリクス(ECM)形成過程の観察
実施例1及び5、比較例で作製される細胞シートにおいて、細胞外マトリクス(以下「ECM」と略記する)の形成状態を観察した。ECMの観察は、主構成成分であるフィブロネクチンを蛍光染色することにより行った。蛍光染色は非特許文献4のMATERIALS AND METHODS記載の手順に従って行った。蛍光染色は、培養開始3日後のサブコンフレント状態の細胞シートと5日後のコンフレント状態の細胞シートについて行った。以下にその手順を説明する。
【0057】
上記細胞シート作製工程において3日後および5日後の、支持体に接着したシート状の培養細胞から培地を除き、37℃のリン酸緩衝液(以下PBS)で2回洗浄する。37℃の4%パラホルムアルデヒド/PBSで20分固定し、PBS洗浄、0.5%TritonX−100/PBS洗浄、PBS洗浄を行った。その後、0.1%牛血清アルブミン/PBSで1時間固定し、一次抗体/牛フィブロネクチン兎ポリクローナルを結合させ、PBS洗浄後、さらに2次蛍光抗体/Alexa488結合抗兎ヤギIgGを結合させ、PBS洗浄を行った。
【0058】
ECMの蛍光観察は蛍光顕微鏡で行った。実施例1の観察結果を図8aに、実施例5の観察結果を図8bに、比較例の観察結果を図8Cにそれぞれ示す。
【0059】
図8aにおいて、培養3日後の左上の写真は支持体上に接着した細胞シートを真上方向からみた実態可視光写真であり、薄く格子状に見えているのが格子状溝(凹部)の輪郭である。培養3日後の右上の写真は同じ細胞シートを同じ方向から撮影した蛍光顕微鏡写真である。培養3日後の中央下の写真は左上の実態可視光写真と右上の蛍光顕微鏡写真とを重ね合わせた写真(スーパーインポーズ)である。図8aの培養5日後の左側の写真は支持体上に接着した細胞シートを真上方向からみた実態可視光写真である。培養5日後の右側の写真は同じ細胞シートを同じ方向から撮影した蛍光顕微鏡写真である。培養5日後のこれらの写真の部位では、蛍光顕微鏡写真の中央部を斜めに横切る線から右下側において細胞シートが支持体上から剥離して写真の手前側(写真面から垂直な方向)に浮いた状態になっている。蛍光顕微鏡写真の中央部を斜めに横切る明るい線から左上側では細胞シートが支持体上に接着している。培養3日後の各写真から、培養3日後に細胞周囲にECMが形成されていること、ECMが凹部上でも天面上と同じように形成されていることがわかる。培養5日後の各写真から、剥離された細胞シートの支持体への接着面の全面に細胞シートが形成されていること、細胞シートが剥離されるときはECMを結合したまま剥離されることがわかる。
【0060】
図8bの各写真は実施例5の支持体を用いた培養細胞を図8aと同一の条件で撮影したものである。培養5日後においては、蛍光顕微鏡写真の右上の明るい部分において細胞シートが支持体上から剥離しており、写真の手前側(写真面から垂直な方向)に浮いた状態になっている。培養3日後の各写真から、実施例5でも培養3日後に細胞周囲にECMが形成されていること、ECMが凹部上でも天面上と同じように形成されていることがわかる。培養5日後の各写真から、実施例5でも剥離された細胞シートの支持体への接着面の全面に細胞シートが形成されていること、細胞シートが剥離されるときはECMを結合したまま剥離されることがわかる。
【0061】
図8cの各写真は比較例の支持体を用いた培養細胞を図8aと同一の条件で撮影したものである。図8cの培養5日後の写真では細胞シートの左上の領域が手前側に剥離している。比較例におけるECMの形成状態は実施例1および5と差異が無いことがわかる。
【0062】
すなわち、ECMは本発明に係る支持体の天面でも凹溝上でも細胞周囲に同等に形成され、細胞シート剥離時には天面と凹溝上のECMはともに細胞シート側に残り、支持体側への残存がなかったことが明らかとなった。
【図面の簡単な説明】
【0063】
【図1a】多数の凸部(101)と凸部間に形成される格子状溝である凹部(103)とを有する細胞培養支持体(100)の上面図である。
【図1b】細胞培養支持体(100)の凸部(101)及び凹部(103)を拡大した斜視図である。
【図1c】溝巾、ピッチ、深さの定義を示す図である。
【図2】本発明に係る細胞培養支持体の他の好ましい実施形態を示す図である。
【図3】本発明に係る細胞培養支持体の他の好ましい実施形態を示す図である。
【図4】参考例1の細胞培養支持体の上面図である。
【図5】参考例2の細胞培養支持体の上面図である。
【図6a】比較例の細胞培養支持体の上面図である。
【図6b】比較例の細胞培養支持体の断面図である。
【図7】コンフルエント細胞シートの剥離率の経時変化を示す図である。
【図8a】実施例1の支持体を用いた培養細胞の細胞外マトリクスの形成および剥離の観察を示す写真である。
【図8b】実施例5の支持体を用いた培養細胞の細胞外マトリクスの形成および剥離の観察を示す写真である。
【図8c】比較例の支持体を用いた培養細胞の細胞外マトリクスの形成および剥離の観察を示す写真である。
【符号の説明】
【0064】
100,200,300,400,500,600・・・細胞培養支持体;101,201,301・・・凸部;103,203,303・・・凹部;105,205・・・基台部;107,207,307・・・凸部の天面;401・・・L字型の溝;501・・・ストライプ状溝
【技術分野】
【0001】
本発明は細胞シートを作製するための細胞培養支持体に関する。
【背景技術】
【0002】
細胞シートとは、細胞間結合で細胞同士が少なくとも単層で連結されたシート状の細胞集合体である。細胞シートは再生医療などで用いられる。細胞シートはシャーレなどの支持体上で細胞培養を行うことにより得られるが、支持体上で形成された細胞シートは接着分子などを介して支持体表面と強固に結合しているため、細胞−細胞間の結合を壊さずに培養支持体から細胞シートを迅速に剥離することは容易ではない。
【0003】
そこで、細胞培養支持体から細胞シートを効率的に剥離する方法がこれまで検討されてきた。剥離方法は2つに大別できる。第一の方法は、酵素反応を用いて支持体と細胞間の結合を弱める方法である。第二の方法は、細胞接着力の弱い支持体や細胞接着力の変化する支持体を用いる方法である。
【0004】
第一の方法は、具体的には、酵素を用いて、プロテアーゼ(タンパク質分解酵素)やコラーゲナーゼ(コラーゲン分解酵素)といった細胞間接着分子(密着結合、接着結合、デスモゾーム結合、ギャップ結合、ヘミデスモゾーム結合)を構成するタンパク質や、培養物の周囲を取り巻くコラーゲン結合織や、細胞と支持体間に形成される細胞外マトリクス(Extracellular Matrix: ECM)を分解する方法である。この方法では細胞−支持体表面の結合だけでなく、細胞−細胞間の結合も弱まる。この方法は細胞培養の分野で古くから使われている。この方法で分解される結合物質は、培養される細胞、組織、器官において作られる物質であるから、剥離後においても一定の条件と期間で分解された結合物質を再生することができる。
【0005】
しかしながら、結合物質の再生には時間がかかるという問題がある。また、この方法では、細胞シートが少なからず損傷を受けるため、再生医療に用いられる細胞シートの作出方法としては望ましくないといえる。
【0006】
そこで、第二の方法が新たに開発されている。
細胞接着力の弱い支持体としては特許文献1や特許文献2に開示されているものが挙げられる。これらの文献には、支持体表面にナノピラーと呼ばれる極微小の柱を立て、その上で培養を行う技術が開示されている。この技術では支持体と培養材料は非常に小さい面積でしか接着されず、回収剥離が容易でダメージも少ないとされる。
【0007】
しかしながら非特許文献1及び2に記載されているように、細胞接着や接着した細胞の挙動は平面に接着する場合と凹凸表面に接着する場合とでは異なり、ナノピラー上では細胞の接着、伸展が遅くなったり、細胞表面から仮足が発生するという問題がある。また凹部が20μm以上の幅を有する場合には細胞が潜入してしまうという問題もある。
【0008】
細胞接着力の変化する支持体として、本発明者らはこれまでに細胞増殖表面を温度応答性ポリマーで被覆した支持体を開発している(特許文献3)。細胞接着力を変化させる目的には、温度応答性ポリマーを用いることが最も好ましいが、それ以外でもpH応答性ポリマーや、イオン応答性ポリマーを用いることもできる。特許文献1及び2では温度応答性ポリマーをナノピラーを用いた培養に組合せることが言及されている。細胞培養において温度応答性ポリマーを用いることについては特許文献4にも言及がある。
【0009】
しかしながら既存の応答性ポリマーを用いた場合であっても剥離の速度はいまだ十分ではない。既存技術では細胞シートの剥離に1〜3時間を要しているが、より短時間、例えば30分以内で剥離が可能であれば、手術の現場で剥離を開始して完了させることができるためより適切な治療が可能となる。
【0010】
また本発明者らは非特許文献3に記載のように支持体としてポーラスなメンブランフィルム上に温度応答性ポリマーを配したものを用いて細胞シートを得た場合に、多孔質でない平滑なメンブランフィルムを用いて細胞シートを得た場合と比較して、細胞シートの剥離、回収が早いことを確かめている。
【0011】
しかしながら非特許文献3に記載の方法をもってしても迅速にコントロールして細胞シートを剥離回収することはできなかった。
【0012】
ところで本出願人はフォトレジスト材料や微細加工技術の分野で多くの技術を有する。特許文献5にはサブミクロンの回折格子等の複製品とその製造方法等が記載されている。
【0013】
本発明に関連する文献として次の文献が上げられる。
【特許文献1】特開2004−170935号公報
【特許文献2】特開2005−168494号公報
【特許文献3】特公平6−104061号公報
【特許文献4】特開2005−27532号公報
【特許文献5】特開2005−84561号公報
【特許文献6】特許第312660号公報
【特許文献7】特許第3491917号公報
【特許文献8】特開平9−12651号公報
【特許文献9】特開平10−248557号公報
【特許文献10】特開平11−349643号公報
【特許文献11】特開2001−329183号公報
【特許文献12】特開2002−18270号公報
【特許文献13】特開平5−244938号公報
【特許文献14】国際公開WO01/068799号パンフレット
【非特許文献1】M. J. Dalby et al., Biomaterials 25 (2004) 5415-5422
【非特許文献2】C. C. Berry et al., Biomaterials 25 (2004) 5781-5788
【非特許文献3】O. H. Kwon, J. Biomed. Mater. Res., (2000) Apr.; 50(1):82-9
【非特許文献4】A. Kushida et al., J. Biomed. Mater. Res., (1999) Jun.; 45(4):355-62.
【発明の開示】
【発明が解決しようとする課題】
【0014】
上記の通り、細胞シートを作製するための従来の細胞培養支持体は、支持体からの剥離の際に細胞シートを損傷するおそれがあるという問題や、支持体上で均質な細胞シートが形成されないという問題や、支持体上での細胞シート形成速度が遅いという問題や、支持体からの細胞シートの剥離に時間がかかるという問題があった。
本発明は上記問題点を解消した細胞培養支持体を提供することを目的とする。
【課題を解決するための手段】
【0015】
本出願は以下の発明を包含する。
(1)天面を有する複数の凸部と該凸部間に形成される凹部とを備えた、細胞を培養させて細胞シートを形成するための細胞培養支持体であって、該凹部の開口部の寸法が、培養される細胞が潜入できない寸法であり、且つ、該細胞シートが剥離可能であることを特徴とする、前記細胞培養支持体。
(2)前記天面が温度応答性ポリマー、pH応答性ポリマー、及びイオン応答性ポリマーからなる群から選択される少なくとも1種により被覆されていることを特徴とする(1)記載の細胞培養支持体。
(3)前記凹部の開口部の寸法が培養される細胞の外郭寸法よりも小さいことを特徴とする(1)又は(2)記載の細胞培養支持体。
(4)前記凹部の開口部の総面積が、前記天面の総面積と前記凹部の開口部の総面積との合計に対して10〜60%であることを特徴とする(1)〜(3)のいずれか1項に記載の細胞培養支持体。
(5)前記凹部の開口部の幅が0.1〜10μmであることを特徴とする(1)〜(4)のいずれか1項に記載の細胞培養支持体。
(6)前記凹部の深さが0.01μm以上であることを特徴とする(1)〜(5)のいずれか1項に記載の細胞培養支持体。
(7)前記天面の寸法が培養される細胞の外郭寸法と同一であるか又はそれより大きいことを特徴とする(1)〜(6)のいずれか1項に記載の細胞培養支持体。
(8)前記天面の幅が1〜20μmであることを特徴とする(1)〜(7)のいずれか1項に記載の細胞培養支持体。
(9)前記凹部が格子状溝として形成されていることを特徴とする(1)〜(8)のいずれか1項に記載の細胞培養支持体。
(10)前記凹部が複数本のストライプ状溝として形成されていることを特徴とする(1)〜(8)のいずれか1項に記載の細胞培養支持体。
(11)(1)〜(8)のいずれか1項に記載の細胞培養支持体を用いて細胞を培養させて細胞シートを形成することを特徴とする細胞シートの作製方法。
(12)(11)記載の方法により作製された細胞シート。
【発明の効果】
【0016】
本発明に係る細胞培養支持体を用いて細胞シートを作製した場合、細胞シートの剥離を迅速に行うことができる。剥離に要する時間が短いことから、剥離作業中における細胞シートの変性が起こりにくい。
【0017】
本発明に係る細胞培養支持体を用いて作製された細胞シートは表面の接着因子が損なわれていないため再生医療などへの利用に適する。
【発明を実施するための最良の形態】
【0018】
以下、天面を有する複数の凸部と該凸部間に形成される凹部とを備えた本発明に係る細胞培養支持体の典型的な実施形態について図面を参照して具体的に説明する。
【0019】
図1aに多数の凸部(101)と凸部間に形成される格子状溝である凹部(103)とを有する細胞培養支持体(100)の上面図を示す。図1bには細胞培養支持体(100)の凸部及び凹部を拡大した斜視図を示す。凸部(101)は基台部(105)から起立して形成されている。凹部(103)は基台部(105)を底部とする有底溝である。凸部(101)は平滑な正方形の天面(107)を有しており、細胞は凹部を乗り越えて複数の天面上に亘って増殖し、細胞シートを形成する。
【0020】
図2及び3には細胞培養支持体の他の実施形態を示す。
細胞培養支持体(200)は、基台部(205)から起立した平行に配置された複数の凸条である凸部(201)と、その間に形成される複数本のストライプ状溝である凹部(203)とからなる。凸部(201)は平滑な帯状の天面(207)を有している。図1の実施形態と同様に、細胞は凹部を乗り越えて複数の天面上に亘って増殖し、細胞シートを形成する。
【0021】
本発明に係る細胞培養支持体は「複数の凸部」を必須の構成要件とするが、各凸部は他の凸部との間に凹部を形成することができる限り、その一部分が互いに連結していてもよい。例えば、図1bに示す各凸部(101)は隣接する凸部と一部が繋がって図3に示す細胞培養支持体(300)を形成してもよい。細胞培養支持体(300)もまた本発明の好ましい実施形態である。この実施形態では、凹部(303)は開口部の形状が正方形である有底凹部である。細胞培養支持体(300)においても細胞は凹部(303)を乗り越えて天面(307)上に亘って増殖し、細胞シートを形成する。
【0022】
本発明において凸部の天面(107、207、307)は、同一支持体上にある他の凸部の天面と同一平面上に位置することが好ましい。
【0023】
本発明に係る細胞培養支持体の材質は通常細胞培養に用いられるガラス類、プラスチック類、セラミックス、金属等が挙げられるが、細胞培養が可能な材質である限りこれらには限定されない。支持体の表面または中間層に本発明の目的を妨げない限り任意の層を設けてもよいし、任意の処理を施してもよい。例えば、支持体表面にオゾン処理、プラズマ処理、スパッタリング等の処理技術を用いて親水化を施すことができる。
【0024】
本発明に係る細胞培養支持体は当業者に知られている種々の微細加工技術を用いて製造することができる。微細加工技術としては特許文献5に示すようなリソグラフィー技術が挙げられるがこれに限定されない。
【0025】
本発明に係る細胞培養支持体は、細胞培養の足場となる天面を有する複数の凸部と、該凸部間に形成される凹部とを備えている限り、全体としてはいかなる形状を有していてもよい。例えば当該分野で通常用いられる培養皿(シャーレ)や培養容器の底面に図1〜3に示すような微細パターンを形成することにより本発明に係る細胞培養支持体とすることができる。
【0026】
本発明に係る細胞培養支持体の全体の大きさは、作製しようとする細胞シートの大きさに応じて適宜選択することができる。
【0027】
凸部の天面は、細胞シートの剥離をより促進する目的で温度応答性ポリマー、pH応答性ポリマー、及びイオン応答性ポリマーからなる群から選択される少なくとも1種、好ましくは温度応答性ポリマーにより被覆されていることが好ましい。なお、これらの応答性ポリマーの被覆は、凸部天面上以外の面、例えば凸部の側面や凹部底面に施されても問題はない。
【0028】
本発明に好適に使用できる温度応答性ポリマーは細胞培養温度下(通常、37℃程度)において疎水性を示し、培養した細胞シートの回収時の温度下において親水性を示すものが好ましい。なお、温度応答性ポリマーが、疎水性から親水性に変化する温度(水に対する臨界溶解温度(T))としては、特に限定されないが、培養後の細胞シートの回収の容易さの観点からは、細胞培養温度よりも低い温度であることが好ましい。このような温度応答性ポリマー成分を含むことで、細胞培養時においては、細胞の足場(細胞接着面)が充分に確保されるため細胞培養を効率よく行うことができる。その一方、培養後の細胞シートの回収時においては、疎水性部分を親水性に変化させ、培養された細胞シートを細胞培養基材から分離させることで、細胞シートの回収をより一層容易にすることができる。
【0029】
本発明に好適に使用できる温度応答性ポリマーは具体的にはTが0〜80℃、好ましくは0〜50℃であるポリマーが好ましい。Tが80℃を越えると細胞が死滅する可能性があるので好ましくない。またTが0℃より低いと、一般に細胞増殖速度が極度に低下するか、または細胞が死滅してしまうため好ましくない。そのような好適なポリマーとしては、例えば特許文献3に記載のポリマーが挙げられる。具体的には適当なポリマーとしては、例えばポリ−N−イソ,プロピルアクリルアミド(T=32℃)、ポリ−N−n−プロピルアクリルアミド(T=21℃)、ポリ−N−n−プロピルメタクリルアミド(T=32℃)、ポリ−N−エトキシエチルアクリルアミド(T=約35℃)、ポリ−N−テトラヒドロフルフリルアクリルアミド(T=約28℃)、ポリ−N−テトラヒドロフルフリルメタクリルアミド(T=約35℃)、及びポリ−N,N−ジエチルアクリルアミド(T=32℃)等が挙げられる。その他のポリマーとしては、例えばポリ−N−エチルアクリルアミド、ポリ−N−イソプロピルメタクリルアミド、ポリ−N−シクロプロピルアクリルアミド、ポリ−N−シクロプロピルメタクリルアミド、ポリ−N−アクリロイルピロリジン、ポリ−N−アクリロイルピペリジン、ポリメチルビニルエーテル、メチルセルロース、エチルセルロース、ヒドロキシプロピルセルロース等のアルキル置換セルロース誘導体や、ポリポリプロピレンオキサイドとポリエチレンオキサイドとのブロック共重合体等に代表されるポリアルキレンオキサイドブロック共重合体や、ポリアルキレンオキサイドブロック共重合体が挙げられる。これらのポリマーは、例えばモノマーの単独重合体がT=0〜80℃を有するようなモノマーの単独若しくは共重合により調製される。モノマーとしては例えば、(メタ)アクリルアミド化合物、N−(若しくはN,N−ジ)アルキル置換(メタ)アクリルアミド誘導体、環状基を有する(メタ)アクリルアミド誘導体、及びビニルエーテル誘導体等が挙げられ、これらの1種以上を使用してよい。また、増殖細胞の種類によってTを調節する必要がある場合や、被覆物質と細胞培養支持体との相互作用を高める必要が生じた場合や、細胞支持体の親水・疎水性のバランスを調整する必要がある場合などには、上記以外の他のモノマー類を更に加えて共重合してよい。更に本発明に使用する上記ポリマーとその他のポリマーとのグラフトまたはブロック共重合体、あるいは本発明のポリマーと他のポリマーとの混合物を用いてもよい。また、ポリマー本来の性質が損なわれない範囲で架橋することも可能である。
【0030】
pH応答性ポリマーおよびイオン応答性ポリマーは作製しようとする細胞シートに適したものを適宜選択することができる。
【0031】
凸部天面における各種応答性ポリマーの被覆量は、5〜80μg/cm2、好ましくは6〜40μg/cm2である。ポリマー被覆量が80μg/cm2を超過すると細胞は細胞培養支持体表面上に付着せず、逆に被覆量が5μg/cm2未満だと細胞は単層の状態で培養され組織状とならず、また培養細胞を支持体から剥離回収するのも困難となる。このようなポリマー被覆量は、例えばフーリエ変換赤外分光計全反射法(FT-IR-ATR法)、被覆部若しくは非被覆部の染色や蛍光物質の染色による分析、更に接触角測定等による表面分析を単独或は併用して求めることが出来る。
【0032】
凸部天面の表面へのポリマーの被覆方法は、後述するような化学的方法や物理的方法を単独でまたは併用して行うことができる。被覆時に前記モノマーを使用する場合、そのモノマーは気体、液体、固体いずれの状態でも良い。また、ポリマーを使用する場合にはおいても、そのポリマーは、液体、固体状態のいずれの状態でも良い。これらのものを化学的な反応によって結合させる場合、電子線照射(EB)、γ線照射、紫外線照射、プラズマ処理、コロナ処理、さらに天面の表面の素材と被覆材料が適当な反応性官能基を有する場合はラジカル及びイオン反応等の一般に用いられる有機反応、を用いることができる。物理的な相互作用による方法としては、被覆材料単独または天面の表面の素材との相溶性の良いマトリックスを媒体とし、塗布、混練等の物理的吸着を用いる方法等があるが、これらに限られるわけではない。
【0033】
各種応答性ポリマーの被覆層は微細パターン形成後に凹凸部全面に設けてもよいし、凸部天面上のみに設けてもよいし、ポリマーの層と微細パターンを別個に準備して両者を結合させてもよいし、微細パターンに影響しない範囲で中間層を介して設けてもよいし、微細パターンの形成とポリマー被覆とを同時に行ってもよい。
【0034】
本発明に係る細胞培養支持体は、凹部の開口部の寸法が、培養される細胞が潜入できない寸法であることを特徴の一つとする。凹部内に細胞が潜入できないため、細胞シートは凹部に遮られることなく複数の天面に亘って平滑に形成され得る。また、剥離の速度も速くなる。特に、凹部の開口部の寸法が培養後の細胞の外郭寸法よりも小さいことが好ましい。ここで「細胞の外郭寸法よりも小さい」とは、細胞の外郭の短手方向の長さ(幅)と比較して凹部の開口部の短手方向の長さ(幅)がより短いことを意味する。凹部の開口部の短手方向の長さとは、凹部の開口部の短手方向に長短がある場合には最短部の長さを指す。開口部の幅の一例を挙げれば0.1〜10μm、より好ましくは0.3〜2.5μmであるが、培養される細胞の種類に応じて適宜選択可能である。凹部は水を蓄えることにより細胞シートの剥離の際に剥離される部位に水を供給する役割を担うと考えられるから、凹部は水を蓄えることが可能な一定の深さを持っていることが好ましい。例えば、0.01μm以上の深さを有することが好ましい。深さの上限は特にないが加工効率を考えれば20μm程度が上限であろう。
【0035】
凹部の形状は特に限定されない。典型的なものとしては、図1に示すような格子状溝や、図2に示すような複数本の直線状のストライプ状溝や、図3に示すような開口部が正方形または長方形の凹穴が挙げられるが、後述する形状を有する凸部の間に形成される凹部であればよい。なお本発明において格子状溝とは直交格子のみならず斜交格子も包含する。またストライプ状溝とは直線状のものだけでなく、図4に示すような曲線状のものも包含する。凹部の短手方向の断面形状は、図1〜3に示すような長方形の上辺を欠いた形状には限定されず任意の形状であってよい。
【0036】
本発明に係る細胞培養支持体上では、特許文献1及び2に記載されているナノピラー上での細胞培養とは異なり、培養開始時に細胞が存在する位置から細胞培養支持体の周縁方向に向けて全方向に連続的に細胞シートの伸展が進み、均一な品質を有する細胞シートを得ることが可能である。この特徴は、好ましくは、凹部の開口部が上記寸法を有していることに加えて、ナノピラーと異なり凸部の天面が一定以上の寸法を有していることにより実現される。天面の寸法は培養される細胞の外郭寸法と同一であるか又はそれより大きいことが好ましい。天面の寸法がこの範囲内である場合には、培養細胞は凹部の無い平滑面上におけるのと同様の挙動を示す。ここで、「細胞の外郭寸法と同一であるか又はそれより大きい」とは、細胞の外郭の短手方向の長さ(幅)と比較して凸部の天面の短手方向の長さ(幅)が同一であるかより長いことを意味する。天面の短手方向の長さ(幅)とは、凸部の天面の短手方向に長短がある場合には最短部の長さを指す。天面の幅の一例を挙げれば1〜20μm、より好ましくは2〜15μmであるが、培養される細胞の種類に応じて適宜選択可能である。天面の幅が余り広すぎると細胞シートとの接触面(密着面)が広くなるため、凹部に蓄えた水が応答ポリマーへ移行する距離が長くなり、如いては剥離に時間がかかるという問題が起こり得る。
【0037】
凸部の天面の、細胞接着面の方向からみた形状は特に限定されないが、典型的には円形、三角形、四角形、五角形、六角形等の多角形、或いは細長い直線状または曲線状の帯形状である。凸部の断面視形状において、凸部の側方端辺は垂直線であってもテーパー状であってもよいし、外側又は内側に湾曲した曲線上であってもよい。
【0038】
本発明に係る細胞培養支持体はまた、細胞シートが迅速に剥離可能であることを特徴の一つとする。この特徴は各種応答性ポリマーの使用だけでは十分には達成されず、上記のように天面の寸法を余り大きくしすぎないことや、微細な寸法を有する凹部の開口部が、天面間に適度な割合で配置されていることを組合せることにより達成される。ただし、開口部の割合が高い場合は剥離は容易となるが細胞シートの形成速度は遅くなるという問題があり、開口部の割合が低い場合は剥離が困難となるという問題がある。そこで天面の総面積と開口部の総面積の合計に対する開口部の総面積の百分率(%)は10〜60%であることが好ましく、15〜50%であることがより好ましく、20〜45%であることが最も好ましい。
【0039】
本発明に係る細胞培養支持体を用いて、種々の細胞、例えば生体内の各組織、臓器を構成する上皮細胞や内皮細胞、収縮性を示す骨格筋細胞、平滑筋細胞、心筋細胞、神経系を構成するニューロン、グリア細胞、繊維芽細胞、生体の代謝に関係する肝実質細胞、非肝実質細胞や脂肪細胞、分化能を有する細胞として、種々組織に存在する幹細胞、さらには骨髄細胞、ES細胞等から細胞シートを作製することができる。こうして作製された細胞シートは表面の接着因子が損なわれていないため再生医療などへの利用に適したものである。また、細胞シートを利用することでバイオセンサー等の検出デバイスへの応用へも展開できる。
【実施例】
【0040】
細胞培養支持体の作製
実施例1〜6として、図1に示すような、正方形の凸部天面と格子状の溝とを有する細胞培養支持体を作成した。半径13mmの円形基板上に、表1に示す溝巾(A、図1c参照)とピッチ(B、図1c参照)を微細パターンを形成した。溝の深さ(C、図1c参照)は0.5μmに固定した。また後述する比較例と同様に、実施例1〜6に係る細胞培養支持体の断面視形状は端部に一段の段落ち部を有しており、該段落ち部の段落ち高さ(H,図6b参照)は0.5μmであり、下方の段の張出し幅(I,図6a及びb参照)は200μmである。
【0041】
参考例1として、図4に示すような、複数本の平行なL字型の溝(401)を一部分に有する細胞培養支持体(400)を作成した。半径13mmの円形基板上に、溝巾1.5μm、溝の深さ0.5μm、ピッチ7.5μmを有する複数本の平行なL字型の溝(401)を形成した。また後述する比較例と同様に、参考例1に係る細胞培養支持体の断面視形状は端部に一段の段落ち部を有しており、該段落ち部の段落ち高さ(H,図6b参照)は0.5μmであり、下方の段の張出し幅(I,図6a及びb参照)は200μmである。図4中の各寸法は次の通りである。D:7.00mm、E:7.28mm、F:7.04mm、G:5.20mm。
【0042】
参考例2として、図5に示すような、複数本の平行なストライプ状溝(501)を半分に有する細胞培養支持体(500)を作成した。半径13mmの円形基板上に、溝巾1.5μm、溝の深さ0.5μm、ピッチ7.5μmを有する複数本の平行なストライプ状溝(501)を形成した。また後述する比較例と同様に、参考例2に係る細胞培養支持体の断面視形状は端部に一段の段落ち部を有しており、該段落ち部の段落ち高さ(H,図6b参照)は0.5μmであり、下方の段の張出し幅(I,図6a及びb参照)は200μmである。
【0043】
比較例として図6a及びbに示すように微細パターンを設けない細胞培養支持体(600)を作成した。半径13mmの円形基板上に天面が平滑な台状部を形成した。比較例に係る細胞培養支持体の断面視形状は端部に一段の段落ち部を有しており、該段落ち部の段落ち高さ(H,図6b参照)は0.5μmであり、下方の段の張出し幅(I,図6a及びb参照)は200μmである。
【0044】
【表1】

【0045】
実施例1〜6の細胞培養支持体は、微細パターン加工は特許文献5実施例2記載の手順に従って、半径13mmのソーダガラスを基台部(105)とし、該基台部上に下記成形用樹脂組成物からなる凸部(101)を形成することにより製造した。その手順を具体的に説明する。
【0046】
厚みが6.35mmの合成石英基板上に厚みが0.11μmのCr層を形成したものの上にフォトレジスト層を形成し、所定のパターン状露光および現像を経てレジストパターンを形成した後、レジストパターンを利用してCr層のエッチング、続いて石英基板のドライエッチングを行った後、レジストパターンを溶解除去して、表1に示す溝巾及びピッチ並びに溝深さ0.5μmで規定される天面が正方形の整列した凸部に対応する凹状溝を形成した後、酸でエッチングして、Cr層を除去し、さらにフッ酸処理して成型用型を製造した。
紫外線感光性の成型用樹脂組成物として次の組成のものを準備した。
【0047】
【表2】

【0048】
上記のように製造した成型用型を用いて、凹状溝を有する側に表2に示す成型用樹脂組成物を滴下し、アンカー処理を施した厚みが1.1mmのソーダガラスを、その処理面側が成型用型側となるようにして重ね合せた後、成型用型側より高圧水銀灯を用いて、170mJ/cm2(365nm)の条件で紫外線照射して、間の成型用樹脂組成物を硬化させた。その後、成型用型を剥離して、図1に示すような微細パターン形成体を得た。得られた微細パターン形成体にはパターンの欠落がなく、また、剥離した成型用型の凹状溝内には、硬化した成型用樹脂組成物の残留は無かった。
【0049】
参考例1及び2の支持体は、凸部の形状が異なることを除いて実施例1〜6と同様に製造した。
比較例の支持体は、微細バターンを設けないことを除いて実施例1〜6と同様に製造した。
【0050】
温度応答性ポリマーによる被覆
以下の手順で温度応答性ポリマー層を上記で作製した基板上に被覆した。(基板はあらかじめ凹凸面に対し、酸素プラズマ処理で表面の清浄性と一様の濡れ性を確保した。)
40重量%に調整したN−イソプロピルアクリルアミドのイソプロピルアルコール溶液を上記で作製した各基板の凹凸面上に12μl添加後、電子線を30Mrad照射することにより、各基板の凹凸表面上にポリ−N−イソプロピルアクリルアミドを被覆した。電子線照射後、イオン交換水により、各基板を洗浄し、残存モノマー及び遊離ポリ−N−イソプロピルアクリルアミドを取り除き、クリーンベンチ内で乾燥し、さらに、エチレンオキサイド(EO)によりガス滅菌し、さらに十分に脱気を行うことにより細胞培養支持体を得た。
【0051】
細胞培養支持体上での細胞シート作製
上記で得られた各細胞培養支持体をシャーレの底部に載せ、各細胞培養支持体上において常法によりウシ大動脈血管内皮細胞を培養した(使用培地:ウシ胎児血清(FCS)を10%含むダルベッコー改変イーグル培地(DMEM)。37℃、5%CO2下)。
【0052】
培養開始5日後に、コンフルエントになった血管内皮細胞シートが接着した各細胞培養支持体をシャーレごと20℃、5%CO2下のチャンバー内に移し、顕微鏡で観察するとともにシャーレ全体をデジタルビデオ撮影した。
【0053】
凹凸の有無に関係なく、実験に供した各細胞培養支持体間で細胞の接着やシートの伸展に大きな違いは観察されず、全て良好であった。コンフルエントになる時間も3μmの溝巾を持つパターン(実施例1)で最大半日程度の遅れを観察した程度で問題はなかった。
【0054】
剥離の程度は、顕微鏡写真、タイムラップ及びデジタルビデオムービーから得た画像の解析により得られた、コンフルエント細胞シートの剥離率(%)の経時変化に基づき評価した。結果を図7に示す。実施例1〜6はいずれも比較例と比較して迅速に剥離が完了したことが分る。参考例1及び2では平滑部分から剥離が開始し、次いで凹凸部が剥離を始め、凹凸部は比較的速やかに剥離が完了し、最後に残った平滑部分が完全に剥離するのに時間がかかった。支持体の全面に複数本の直線状または曲線状のストライプ状溝を設ければ、格子状溝同様に迅速に剥離が完了するものと推測される。
【0055】
実験に用いたいずれの細胞培養支持体においても、支持体上への細胞残りは認められず、良好に剥離が完了した。3μmの溝巾を持つパターン(実施例1)においてのみ顕微鏡下の観察で細胞の一部が溝部にひっかかり、細胞シートの剥離とともにシート内に引き戻されるものが観察されたが、他のパターンではそれも観察されなかった。
【0056】
細胞外マトリクス(ECM)形成過程の観察
実施例1及び5、比較例で作製される細胞シートにおいて、細胞外マトリクス(以下「ECM」と略記する)の形成状態を観察した。ECMの観察は、主構成成分であるフィブロネクチンを蛍光染色することにより行った。蛍光染色は非特許文献4のMATERIALS AND METHODS記載の手順に従って行った。蛍光染色は、培養開始3日後のサブコンフレント状態の細胞シートと5日後のコンフレント状態の細胞シートについて行った。以下にその手順を説明する。
【0057】
上記細胞シート作製工程において3日後および5日後の、支持体に接着したシート状の培養細胞から培地を除き、37℃のリン酸緩衝液(以下PBS)で2回洗浄する。37℃の4%パラホルムアルデヒド/PBSで20分固定し、PBS洗浄、0.5%TritonX−100/PBS洗浄、PBS洗浄を行った。その後、0.1%牛血清アルブミン/PBSで1時間固定し、一次抗体/牛フィブロネクチン兎ポリクローナルを結合させ、PBS洗浄後、さらに2次蛍光抗体/Alexa488結合抗兎ヤギIgGを結合させ、PBS洗浄を行った。
【0058】
ECMの蛍光観察は蛍光顕微鏡で行った。実施例1の観察結果を図8aに、実施例5の観察結果を図8bに、比較例の観察結果を図8Cにそれぞれ示す。
【0059】
図8aにおいて、培養3日後の左上の写真は支持体上に接着した細胞シートを真上方向からみた実態可視光写真であり、薄く格子状に見えているのが格子状溝(凹部)の輪郭である。培養3日後の右上の写真は同じ細胞シートを同じ方向から撮影した蛍光顕微鏡写真である。培養3日後の中央下の写真は左上の実態可視光写真と右上の蛍光顕微鏡写真とを重ね合わせた写真(スーパーインポーズ)である。図8aの培養5日後の左側の写真は支持体上に接着した細胞シートを真上方向からみた実態可視光写真である。培養5日後の右側の写真は同じ細胞シートを同じ方向から撮影した蛍光顕微鏡写真である。培養5日後のこれらの写真の部位では、蛍光顕微鏡写真の中央部を斜めに横切る線から右下側において細胞シートが支持体上から剥離して写真の手前側(写真面から垂直な方向)に浮いた状態になっている。蛍光顕微鏡写真の中央部を斜めに横切る明るい線から左上側では細胞シートが支持体上に接着している。培養3日後の各写真から、培養3日後に細胞周囲にECMが形成されていること、ECMが凹部上でも天面上と同じように形成されていることがわかる。培養5日後の各写真から、剥離された細胞シートの支持体への接着面の全面に細胞シートが形成されていること、細胞シートが剥離されるときはECMを結合したまま剥離されることがわかる。
【0060】
図8bの各写真は実施例5の支持体を用いた培養細胞を図8aと同一の条件で撮影したものである。培養5日後においては、蛍光顕微鏡写真の右上の明るい部分において細胞シートが支持体上から剥離しており、写真の手前側(写真面から垂直な方向)に浮いた状態になっている。培養3日後の各写真から、実施例5でも培養3日後に細胞周囲にECMが形成されていること、ECMが凹部上でも天面上と同じように形成されていることがわかる。培養5日後の各写真から、実施例5でも剥離された細胞シートの支持体への接着面の全面に細胞シートが形成されていること、細胞シートが剥離されるときはECMを結合したまま剥離されることがわかる。
【0061】
図8cの各写真は比較例の支持体を用いた培養細胞を図8aと同一の条件で撮影したものである。図8cの培養5日後の写真では細胞シートの左上の領域が手前側に剥離している。比較例におけるECMの形成状態は実施例1および5と差異が無いことがわかる。
【0062】
すなわち、ECMは本発明に係る支持体の天面でも凹溝上でも細胞周囲に同等に形成され、細胞シート剥離時には天面と凹溝上のECMはともに細胞シート側に残り、支持体側への残存がなかったことが明らかとなった。
【図面の簡単な説明】
【0063】
【図1a】多数の凸部(101)と凸部間に形成される格子状溝である凹部(103)とを有する細胞培養支持体(100)の上面図である。
【図1b】細胞培養支持体(100)の凸部(101)及び凹部(103)を拡大した斜視図である。
【図1c】溝巾、ピッチ、深さの定義を示す図である。
【図2】本発明に係る細胞培養支持体の他の好ましい実施形態を示す図である。
【図3】本発明に係る細胞培養支持体の他の好ましい実施形態を示す図である。
【図4】参考例1の細胞培養支持体の上面図である。
【図5】参考例2の細胞培養支持体の上面図である。
【図6a】比較例の細胞培養支持体の上面図である。
【図6b】比較例の細胞培養支持体の断面図である。
【図7】コンフルエント細胞シートの剥離率の経時変化を示す図である。
【図8a】実施例1の支持体を用いた培養細胞の細胞外マトリクスの形成および剥離の観察を示す写真である。
【図8b】実施例5の支持体を用いた培養細胞の細胞外マトリクスの形成および剥離の観察を示す写真である。
【図8c】比較例の支持体を用いた培養細胞の細胞外マトリクスの形成および剥離の観察を示す写真である。
【符号の説明】
【0064】
100,200,300,400,500,600・・・細胞培養支持体;101,201,301・・・凸部;103,203,303・・・凹部;105,205・・・基台部;107,207,307・・・凸部の天面;401・・・L字型の溝;501・・・ストライプ状溝
【特許請求の範囲】
【請求項1】
天面を有する複数の凸部と該凸部間に形成される凹部とを備えた、細胞を培養させて細胞シートを形成するための細胞培養支持体であって、該凹部の開口部の寸法が、培養される細胞が潜入できない寸法であり、且つ、該細胞シートが剥離可能であることを特徴とする、前記細胞培養支持体。
【請求項2】
前記天面が温度応答性ポリマー、pH応答性ポリマー、及びイオン応答性ポリマーからなる群から選択される少なくとも1種により被覆されていることを特徴とする請求項1記載の細胞培養支持体。
【請求項3】
前記凹部の開口部の寸法が培養される細胞の外郭寸法よりも小さいことを特徴とする請求項1又は2記載の細胞培養支持体。
【請求項4】
前記凹部の開口部の総面積が、前記天面の総面積と前記凹部の開口部の総面積との合計に対して10〜60%であることを特徴とする請求項1〜3のいずれか1項記載の細胞培養支持体。
【請求項5】
前記凹部の開口部の幅が0.1〜10μmであることを特徴とする請求項1〜4のいずれか1項記載の細胞培養支持体。
【請求項6】
前記凹部の深さが0.01μm以上であることを特徴とする請求項1〜5のいずれか1項記載の細胞培養支持体。
【請求項7】
前記天面の寸法が培養される細胞の外郭寸法と同一であるか又はそれより大きいことを特徴とする請求項1〜6のいずれか1項記載の細胞培養支持体。
【請求項8】
前記天面の幅が1〜20μmであることを特徴とする請求項1〜7のいずれか1項記載の細胞培養支持体。
【請求項9】
前記凹部が格子状溝として形成されていることを特徴とする請求項1〜8のいずれか1項記載の細胞培養支持体。
【請求項10】
前記凹部が複数本のストライプ状溝として形成されていることを特徴とする請求項1〜8のいずれか1項記載の細胞培養支持体。
【請求項11】
請求項1〜10のいずれか1項記載の細胞培養支持体を用いて細胞を培養させて細胞シートを形成することを特徴とする細胞シートの作製方法。
【請求項12】
請求項11記載の方法により作製された細胞シート。
【請求項1】
天面を有する複数の凸部と該凸部間に形成される凹部とを備えた、細胞を培養させて細胞シートを形成するための細胞培養支持体であって、該凹部の開口部の寸法が、培養される細胞が潜入できない寸法であり、且つ、該細胞シートが剥離可能であることを特徴とする、前記細胞培養支持体。
【請求項2】
前記天面が温度応答性ポリマー、pH応答性ポリマー、及びイオン応答性ポリマーからなる群から選択される少なくとも1種により被覆されていることを特徴とする請求項1記載の細胞培養支持体。
【請求項3】
前記凹部の開口部の寸法が培養される細胞の外郭寸法よりも小さいことを特徴とする請求項1又は2記載の細胞培養支持体。
【請求項4】
前記凹部の開口部の総面積が、前記天面の総面積と前記凹部の開口部の総面積との合計に対して10〜60%であることを特徴とする請求項1〜3のいずれか1項記載の細胞培養支持体。
【請求項5】
前記凹部の開口部の幅が0.1〜10μmであることを特徴とする請求項1〜4のいずれか1項記載の細胞培養支持体。
【請求項6】
前記凹部の深さが0.01μm以上であることを特徴とする請求項1〜5のいずれか1項記載の細胞培養支持体。
【請求項7】
前記天面の寸法が培養される細胞の外郭寸法と同一であるか又はそれより大きいことを特徴とする請求項1〜6のいずれか1項記載の細胞培養支持体。
【請求項8】
前記天面の幅が1〜20μmであることを特徴とする請求項1〜7のいずれか1項記載の細胞培養支持体。
【請求項9】
前記凹部が格子状溝として形成されていることを特徴とする請求項1〜8のいずれか1項記載の細胞培養支持体。
【請求項10】
前記凹部が複数本のストライプ状溝として形成されていることを特徴とする請求項1〜8のいずれか1項記載の細胞培養支持体。
【請求項11】
請求項1〜10のいずれか1項記載の細胞培養支持体を用いて細胞を培養させて細胞シートを形成することを特徴とする細胞シートの作製方法。
【請求項12】
請求項11記載の方法により作製された細胞シート。
【図1a】


【図1b】


【図1c】


【図2】


【図3】


【図4】


【図5】


【図6a】


【図6b】


【図7】


【図8a】


【図8b】


【図8c】




【図1b】


【図1c】


【図2】


【図3】


【図4】


【図5】


【図6a】


【図6b】


【図7】


【図8a】


【図8b】


【図8c】


【公開番号】特開2008−11766(P2008−11766A)
【公開日】平成20年1月24日(2008.1.24)
【国際特許分類】
【出願番号】特願2006−185666(P2006−185666)
【出願日】平成18年7月5日(2006.7.5)
【出願人】(593064630)
【出願人】(000002897)大日本印刷株式会社 (14,506)
【Fターム(参考)】
【公開日】平成20年1月24日(2008.1.24)
【国際特許分類】
【出願日】平成18年7月5日(2006.7.5)
【出願人】(593064630)

【出願人】(000002897)大日本印刷株式会社 (14,506)
【Fターム(参考)】
[ Back to top ]

