細胞培養用中空糸モジュールおよび細胞培養方法
【課題】培養細胞の回収ロスを抑制すること。
【解決手段】生分解性材料からなり、半透膜機能を有する中空糸を1本以上含み、かつ、中空糸の内部空間に培養液を供給することにより中空糸の外部空間(ECS)に存在する細胞に生育必須成分を供給するための中空糸束30と、中空糸束30を格納するハウジングと、を少なくとも有し、かつ、ハウジング20の任意の部分が脱着可能であると共に、中空糸束30の少なくとも一部が外部に露出可能な構造を有することを特徴とする細胞培養用中空糸モジュールおよびこれを用いた細胞培養方法。
【解決手段】生分解性材料からなり、半透膜機能を有する中空糸を1本以上含み、かつ、中空糸の内部空間に培養液を供給することにより中空糸の外部空間(ECS)に存在する細胞に生育必須成分を供給するための中空糸束30と、中空糸束30を格納するハウジングと、を少なくとも有し、かつ、ハウジング20の任意の部分が脱着可能であると共に、中空糸束30の少なくとも一部が外部に露出可能な構造を有することを特徴とする細胞培養用中空糸モジュールおよびこれを用いた細胞培養方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞培養用中空糸モジュールおよび細胞培養方法に関するものである。
【背景技術】
【0002】
従来、慢性的臓器機能不全疾患に対する有用な治療方法として、臓器移植や人工臓器埋設が行われている。しかし、臓器移植は、拒絶反応や免疫抑制剤の投与が必要といった医学的問題および深刻なドナー不足といった社会的問題を伴う。また、人工臓器は、生体適合性、機能性、利便性といった生体機能代替性という点で、満足できる治療手段とは言えない。
【0003】
このような問題を解決する方法として、再生医療が注目されている。再生医療は、機能不全に陥った臓器等の生体組織を再生する方法として有用であり、既に、皮膚や骨の分野においては実用化され、世界的にも臨床への応用が開始されている。しかし、臓器に関しては、未だ臨床応用には至っていない。臓器の形成には、大量の生体組織細胞を必要とするが、現在のところ、生体組織細胞の大量培養技術が確立されていないためである。従って、再生医療が、広く臨床に応用可能となるためには、細胞の大量培養技術の開発が必要
となる。
【0004】
近年、遺伝子組換えあるいはハイブリドーマの技術開発に伴い、インターフェロン、エリスロポエチン等の種々のヒト由来生理活性タンパクを製造するための大量細胞培養方法が開発されている。かかる細胞培養法は、好気的条件下で増殖する動物細胞を用いるものであり、一般にジャーファーメンター法によって細胞培養を行う技術である。しかし、このような技術は、医薬品原料の生産手段としての細胞培養技術であり、細胞固有の生理特性あるいは機能を発現、維持した細胞を利用する方法ではない。
【0005】
一方、細胞固有の機能を発現させるための生体組織細胞培養法としては、三次元培養法が提案されている。かかる技術は、コラーゲン等による細胞付着マトリックスを核として三次元的に細胞を増殖させるものであり、そのためには、細胞が増殖するための空間と、マトリックスを介して付着した細胞が増殖するための担体を提供することが必要である。
【0006】
このような培養方法に、上記ジャーファーメンター法を応用することも考えられる。しかし、ジャーファーメンター法では、撹拌による細胞の物理的損傷が発生するおそれがあることに加え、交差汚染の防止を十分に図ることが困難なため、各個人に応じた個別識別細胞培養が必要とされる再生医療に適した方法とはいえない。
【0007】
そこで、細胞付着担体を有し、培養細胞の物理的損傷および交差汚染を抑制した大量細
胞培養法として、中空糸モジュールを用いた細胞培養技術が提案されている(特許文献1〜3参照)。これらの中空糸モジュールを用いた細胞培養技術の中でも、特許文献3に記載の技術は、特許文献1,2に記載の技術に対して、培養細胞の回収を従来よりも一層効果的に行うことができ、培養細胞の生産性を高めることができる。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開昭49−419579号公報
【特許文献2】特開平6−169755号公報
【特許文献3】特開2006−345778号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかしながら、特許文献3に記載の技術を利用して、中空糸モジュール内で細胞を培養した後、この培養細胞を回収するためには、中空糸に付着した細胞を、中空糸から分離する必要がある。中空糸自体は、培養細胞の移植においては不要なものであるためである。このため、分離作業の際に、培養細胞の回収ロスが発生する。これに加えて、培養細胞を回収するためには、培養細胞を中空糸から分離する必要があるため、この分離処理に伴い、培養細胞がダメージを受け、培養細胞の活性度が低下しやすくなる。
【0010】
本発明は、上記事情に鑑みてなされたものであり、培養細胞の回収ロスを抑制することが可能な細胞培養用中空糸モジュール、および、当該細胞培養用中空糸モジュールを用いた細胞培養方法を提供することを課題とする。
【課題を解決するための手段】
【0011】
上記課題は以下の本発明により達成される。すなわち、
本発明の細胞培養用中空糸モジュールは、生分解性材料からなり、半透膜機能を有する中空糸を1本以上含み、かつ、中空糸の内部空間に培養液を供給することにより中空糸の外部空間(ECS)に存在する細胞に生育必須成分を供給するための中空糸束と、該中空糸束を格納するハウジングと、を少なくとも有し、かつ、ハウジングの任意の部分が脱着可能であると共に、中空糸束の少なくとも一部が外部に露出可能な構造を有することを特徴とする。
【0012】
本発明の細胞培養中空糸モジュールの一実施態様は、生分解性材料が、(i)ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、脂肪族ポリエステル、ポリアミド、(ii)(i)に示す高分子材料からなる群より選択される少なくとも2種類以上の高分子材料を含む混合材料、および、(iii)(i)に示す高分子材料からなる群より選択される少なくとも2種類以上の高分子材料の重合に用いる各々の単量体を共重合させた共重合体、から選択される材料であることが好ましい。
【0013】
本発明の細胞培養中空糸モジュールの他の実施態様は、生分解性材料の重量平均分子量が、30000〜500000の範囲内であることが好ましい。
【0014】
本発明の細胞培養方法は、本発明の細胞培養用中空糸モジュールを用いて、細胞を培養した後に、ハウジングの任意の部分を分離し、中空糸束の少なくとも一部を外部に露出し、中空糸に付着した細胞を、中空糸に付着した状態で回収することを特徴とする。
【0015】
本発明の細胞培養方法の一実施態様は、細胞が軟骨細胞であることが好ましい。
【発明の効果】
【0016】
本発明によれば、培養細胞の回収ロスを抑制することが可能な細胞培養用中空糸モジュール、および、当該細胞培養用中空糸モジュールを用いた細胞培養方法を提供することができる。
【図面の簡単な説明】
【0017】
【図1】本実施形態の細胞培養中空糸モジュールの一例を示す概略模式図である。
【図2】実施例1の細胞培養テストに用いた中空糸と同じ重量平均分子量を有する多孔体の生体内における生分解性を示す位相差顕微鏡像である。
【発明を実施するための形態】
【0018】
(細胞培養中空糸モジュール)
本実施形態の細胞培養用中空糸モジュール(以下、「モジュール」と略す場合がある。)は、生分解性材料からなり、半透膜機能を有する中空糸を1本以上含み、かつ、中空糸の内部空間(以下、「ルーメン」と称す場合がある。)に培養液を供給することにより中空糸の外部空間(Extracapillary Space、以下、「ECS」と称す場合がる)に存在する細胞に生育必須成分を供給するための中空糸束と、該中空糸束を格納するハウジングと、を少なくとも有し、かつ、ハウジングの任意の部分が脱着可能であると共に、中空糸束の少なくとも一部が外部に露出可能な構造を有することを特徴とする。
【0019】
本実施形態のモジュールを用いた細胞の培養は、モジュール内に細胞を配置した状態で、ルーメン内に培養液を供給することにより行われる。なお、ルーメンとECSとは、互いに隔離されているため、細胞が培養液中に流出することは無い。一方、細胞は、中空糸を介して十分な栄養成分および酸素の供給を受けることができるため、高密度に増殖することが可能である。そして、ECS内で高密度化した培養細胞は、中空糸に付着する。なお、「培養細胞が中空糸に付着」とは、培養細胞が中空糸表面に直接付着、または、細胞付着担体を介して間接的に付着することを意味し、中空糸同士の間隙あるいは中空糸とハウジングとの間隙に存在することも含む。
【0020】
−中空糸および中空糸束−
本実施形態のモジュールでは、中空糸が生分解性材料からなる。このため、この中空糸を生体内に配置しても、中空糸は生体内で分解され、体内に吸収されるため、生体に対して何らの悪影響を与えるおそれも無い。それゆえ、本実施形態のモジュールを用いて細胞の培養を行った場合、培養細胞が中空糸に付着した状態で回収することができる。この場合、培養細胞を中空糸に付着した状態で、中空糸と共に生体内に移植することができる。それゆえ、本実施形態の細胞培養用中空糸モジュールを用いて細胞を培養した場合、特許文献3に記載の技術と比較して、細胞移植等の各種治療に利用できる培養細胞の利用効率をさらに高めることができ、また、培養細胞の回収に際して培養細胞の活性度が低下するのを抑制できる。
【0021】
また、中空糸は、生分解性材料から構成される。この生分解性材料としては公知の生分解性材料が利用できる。しかしながら、細胞との親和性等を考慮した場合、生分解性材料としては、下記(i)〜(iii)に示す材料から選択することが好ましい。
(i)ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、脂肪族ポリエステル、ポリアミド
(ii)(i)に示す高分子材料からなる群より選択される少なくとも2種類以上の高分子材料を含む混合材料
(iii)(i)に示す高分子材料からなる群より選択される少なくとも2種類以上の高分子材料の重合に用いる各々の単量体を共重合させた共重合体
【0022】
なお、中空糸は、この中空糸を培養細胞と共に生体中に移植した場合において、生体親和性に優れ、材料の分解に伴う生体への負荷も小さいことが必要である。これに加えて、細胞の培養においては、予め中空糸モジュールを滅菌しておくことが必要である。従って、中空糸を構成する生分解性材料は、生体親和性に優れること、材料分解に伴う生体への負荷が低いこと、および、効果的かつ簡易な滅菌処理が可能な高圧蒸気滅菌処理に耐えうる高い耐熱性を有していることが必要である。これらの特性をバランス良く満たすという観点からは、上記に列挙した生分解性材料の中でも、ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、あるいは、これら高分子材料の重合に用いる各々の単量体を2種以上重合させた共重合体が特に好ましい。
【0023】
また、生分解性材料の重量平均分子量としては、30000〜500000の範囲内が好ましく、70000〜180000の範囲内がより好ましい。重量平均分子量を30000以上とすることにより、中空糸を紡糸する際に用いる紡糸用原料の粘性が増大し、紡糸が容易となる。また、重量平均分子量を500000以下とすることにより、モジュール内での細胞の培養に必要な期間(通常、最大で6カ月)中においては、生分解性材料の分解の進行に伴う中空糸の著しい強度の低下を防ぎつつ、生体内への移植後においては速やかな分解が可能となるため、移植治療に好適である。さらに、中空糸が、円筒状の膜からなり、この膜の厚み方向に貫通する孔が設けられることで半透膜機能を発揮する場合、紡糸用原料の粘性の著しい増大を防ぐことができるため、孔の形成が容易となる。
【0024】
また、中空糸は、その表面が親水化処理されたものであることがより好ましい。親水化処理を行うことによって、細胞に対する親和性が増すと共に、培養液の膜透過性も向上するからである。親水化処理方法として、たとえば、ポリビニルピロリドン、エチレンビニルアルコール共重合体、ポリビニルアセタールジエチルアミノアセテート、アルコールなどによる処理が挙げられ、アルコールとしては、エタノール、イソプロパノール等が挙げられる。これらの親水化処理方法の中でも、ポリビニルピロリドン処理が好ましい。中空糸の表面により安定的な親水性を付与することができるからである。
【0025】
また、本実施形態の細胞培養用中空糸モジュールに用いられる中空糸束は、1本以上の中空糸を含むものである。なお、中空糸束が2本以上の中空糸から構成される場合、通常、各々の中空糸は互いに平行に配置される。また、中空糸は、直線を成すようにその両端がハウジング内に固定される。たとえば、ハウジングが円筒体である場合、中空糸が、ハウジングの軸方向と平行を成すように、中空糸の両端をハウジング内に固定することができる。
【0026】
中空糸束を構成する中空糸は、半透膜機能を有する。ここで、半透膜機能とは、ルーメン側からESC側へ、あるいは、ESC側からルーメン側へと、溶液中に含まれる一部の成分は通すが、他の成分は通さない機能を意味する。半透膜機能を有する中空糸は、たとえば、孔径によって通過可能な成分を変化させることができる多孔質膜や、濃度勾配による通過のみならず様々な膜通過機能を有する生体膜と同様の機能を有する膜や部材等から構成することができ、培養しようとする細胞の種類や培養液等に応じて、中空糸を構成する部材を適宜選択して用いることができる。なお、以下の説明においては、中空糸が、円筒状の膜からなり、この膜の厚み方向に貫通する孔が設けられることで半透膜機能を発揮する場合について説明する。
【0027】
ここで、中孔糸を構成する膜に設けられる孔の孔径(以下、「膜孔径」と称す場合がある。)は、培養液をルーメン側からESC側に通過させることができ、培養しようとする細胞がESC側からルーメン側へと通過できないものであれば特に限定されるものではない。なお、膜孔径が小さくなれば膜強度は強くなるが、物質交換率は小さくなり、一方、膜孔径が大きくなれば膜強度は弱くなるが、物質交換率は大きくなる。したがって、膜強度、すなわち中空糸の強度と、大きな物質交換率とを、バランス良く両立させるためには、中空糸の平均膜孔径は、0.01μm〜0.8μmの範囲内が好ましく、0.1μm〜0.4μmの範囲内がより好ましい。
【0028】
中空糸の内径としては、培養液を供給することができる太さであれば、特に限定されないが、高い膜透過性を確保する観点から、0.1mm〜3mmの範囲内が好ましい。また、加工が容易であることや、培養液中に生じた不溶成分による目詰まりを抑制する観点も考慮した場合、内径は、0.5mm〜1.5mmの範囲内がより好ましい。なお、内径は、0.5mm〜1.5mmの範囲内とする場合、外径は、0.2mm〜3.0mmの範囲内とすることが好ましい。
【0029】
また、中空糸束を構成する中空糸の本数や、膜厚は、細胞の培養が可能であれば特に限定されないが、後述する様に、必要とする細胞数、培養細胞が必要とする栄養量および酸素量、モジュール内のECSの体積のいずれか1つまたは複数との関係等で適宜調整することが好ましい。
【0030】
中空糸束が2本以上の中空糸から構成される場合、中空糸束の両端部分は、一般に使用される封止材を用いて中空糸間の間隙を封鎖すると共に、たとえば、糊付け等することでハウジングの内壁に固定することができる。封止材としては、たとえば、ウレタン樹脂、エポキシ樹脂などの公知の樹脂を利用できる。
【0031】
−培養液−
また、中空糸は、ルーメンに培養液を供給することによりECSに存在する細胞に生育必須成分を供給すると共に、細胞の代謝成分を拡散除去する。ここで、培養液は、培養しようとする細胞の生育必須成分を含有するものであれば、従来公知のいかなる培養液も用いることができ、特に限定されない。ここで、「生育必須成分」とは、培養しようとする細胞が増殖する上で必要不可欠な成分を意味し、通常は、種々の有機物および無機物から構成され、細胞に酸素等を供給するための溶存ガスも含まれる。生育必須成分としては、たとえば、ダルベッコMEM、RPMI1640、ハムF12等の汎用培地に、血清あるいは各種増殖因子、分化誘導因子を添加して作成した培地等が用いられる。
【0032】
なお、ルーメン内への培養液の供給は、通常、容器に収納された培養液を、ポンプにてルーメン内を繰り返し循環させることにより実施されるが、ルーメン内に供給された培養液を循環させない一過性の供給であってもよい。
【0033】
−ハウジング−
ハウジングは、中空糸束を格納する。また、モジュールが組み立てられた状態において、ハウジングは、その内部に配置された中空糸の外周表面とハウジングの内壁との間に密閉空間、すなわちECSを形成する。このため、このECS内で細胞培養を行うことができる。また、ハウジングには、通常、ハウジング内に固定された中空糸のルーメンに培養液を供給およびルーメン内に供給された培養液を再び外部に排出するためのチューブ接続用導管(ルーメン用導管)、および、ECS内に細胞を投入すると共に、ECS内への細胞の投入に伴い投入した細胞の体積に相当するECS内のその他の成分を外部に排出するためのチューブ接続用導管(ECS用導管)が設けられる。そして、ECS用導管から細胞をECS内に投入した後、ルーメン用導管を利用してルーメン内に培養液を供給することにより、細胞の培養を行うことができる。ここで、ECSおよびルーメンは、お互いに隔離されているため、培養液と細胞とは直接接触せず、半透膜機能を有する中空糸の孔を通過した培養液中の所定の成分のみが細胞と接触する。なお、ルーメン用導管は、通常、ハウジングに2つ設けられ、ECS用導管も、通常、ハウジングに2つ設けられる。
【0034】
ハウジングを構成する材質は、特に限定されるものではないが、たとえば、ポリカーボネート樹脂、ポリスルホン樹脂、ポリプロピレン樹脂、ポリスチレン樹脂、ポリエチレン樹脂、アクリル樹脂などの樹脂材料を利用することができる。これらの樹脂材料の中でも、ポリカーボネート樹脂およびポリスルホン樹脂が好ましい。ポリカーボネート樹脂およびポリスルホン樹脂は、耐熱性に優れるため、ハウジングの高圧蒸気滅菌が可能となり、効率的な滅菌処理を行うことができる。また、ポリカーボネート樹脂およびポリスルホン樹脂は、透明性が高いため、肉眼により細胞の培養状態を容易に確認することができる。
【0035】
また、本実施形態のモジュールでは、ハウジングの任意の部分が脱着可能である。ここで、「ハウジングの任意の部分が脱着可能」とは、ハウジングの任意の部分(脱着可能部分)がハウジングのその他の部分(本体部分)から分離可能であり、かつ、脱着可能部分は、本体部分に装着可能であることを意味する。また、「脱着可能」とは、脱着可能部分を、本体部分と接触させたまま開閉することが可能な態様、または、脱着可能部分を本体部分から完全に離間するように分離できると共に、分離した脱着可能部分を再び本体部分に取り付け可能な態様を意味する。
【0036】
さらに、本実施形態のモジュールでは、中空糸束の少なくとも一部が外部に露出可能な構造を有する。ここで、「中空糸の少なくとも一部が外部に露出可能」とは、モジュール内に密閉され外部環境から遮断された状態にある中空糸束の少なくとも一部が、ハウジングの脱着可能部分を本体部分から分離することによって、外部環境に露出できることを意味する。ここで、ハウジングの脱着可能部分を本体部分から分離した場合における、中空糸束の外部環境に対する露出の度合は、特に限定されないが、露出の度合は大きければ大きい程好ましく、中空糸束全体が外部環境に露出可能であることが特に好ましい。この場合、中空糸に付着した状態で培養した細胞を回収することがより容易になるためである。
【0037】
ハウジングの形状・サイズとしては、特に限定されず、必要に応じて適宜設定することができる。しかしながら、モジュール内のデッドスペースの減少や、細胞の培養のし易さ等の実用上の観点からは、ハウジングは筒状部材を有することが好ましく、この筒状部材は円筒状部材であることがより好ましい。ハウジングが筒状部材を有する場合、中空糸束は、たとえば、中空糸の軸方向とハウジングの軸方向とが一致するように筒状部材内に配置される。そして、中空糸束は、中空糸束の両端部分が封止材を介して筒状部材の内壁に固定される。また、筒状部材両端の開口部は、キャップを用いて密閉される。すなわち、この場合、ハウジングは、その主要部が、筒状部材とキャップとから構成される。
【0038】
次に、ハウジングの主要部が、筒状部材とキャップとから構成される場合について、より詳細に説明する。この場合、細胞培養後に、筒状部材の両端を封止する2つのキャップのうち、少なくとも一方のキャップを筒状部材から取り外すことにより、培養細胞が付着した中空糸束をハウジングから取り出すことが可能となり、中空糸束を完全に外部環境へ露出させることができる。その結果、中空糸束に付着した状態で培養細胞を回収することができる。ここで、キャップは、筒状部材の両端部に脱着可能なものであれば公知のいかなるキャップも用いることができ、特に限定されないが、たとえば、はめ込み式キャップを用いることができる。また、筒状部材が、円筒状部材である場合には、スクリュー式キャップを用いることができる。なお、ハウジングを構成する筒状部材およびキャップを構成する材料としては、上述した樹脂材料などが利用できる。筒状部材およびキャップを構成する各々の材料は、同じ材料を用いてもよく、異なる材料を用いてもよい。
【0039】
−モジュールの具体例−
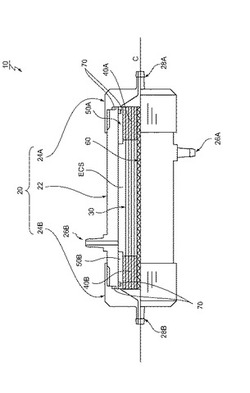
次に、本実施形態の細胞培養中空糸モジュールの具体例について、図面を用いて説明する。図1は、本実施形態の細胞培養中空糸モジュールの一例を示す概略模式図である。ここで、図1中の水平方向に伸びる中心軸Cの上側がモジュールの内部構造を示す断面図であり、中心線の下側がモジュールの外観を示す側面図である。
【0040】
図1に示すモジュール10は、その主要部が、ハウジング20と、このハウジング20内に配置された中空糸束30と、から構成される。ここで、ハウジング20は、図面の中央部に配置される円筒状部材22と、円筒状部材22の両端開口部を封止するキャップ24A、24Bと、を有している。また、円筒状部材22の外周面側には、キャップ24Aが配置された側に第一のECS用導管26Aが設けられ、キャップ24Bが配置された側に第二のECS用導管26Bが設けられている。また、キャップ24Aの軸方向の外面側には、第一のルーメン用導管28Aが設けられ、キャップ24Bの軸方向の外面側には、第二のルーメン用導管28Bが設けられている。
【0041】
中空糸束30は、複数本の互いに平行に配置された中空糸から構成され、その長手方向が、円筒状部材22の軸方向Cと平行となるようにハウジング20内に配置されている。また、中空糸束30の両端部分には、この中空糸束30を構成する個々の中空糸間の間隙を満たすと共に中空糸束30の外周部分を覆うように封止材が充填されており、この封止材からなる円柱状の封止材ブロック40A、40Bが形成されている。そして、封止材ブロック40A、40Bの外周面を保持すると共に、封止材ブロック40A、40Bと円筒状部材22の内周面との間の隙間を塞ぐように、円筒状のスリーブ50A、50Bが配置されている。このため、中空糸束30は、その両端部分が、スリーブ50A、50Bを介して、ハウジング20を構成する円筒状部材22の内周側に固定して配置されることになる。また、中空糸束30内には、その中心軸を貫通するように円柱状の芯棒60が設けられている。なお、中空糸束30に設けられるスリーブ50A,50Bおよび芯棒60は、中空糸束30の保持および取り扱いを容易にするために設けられるものである。このため、スリーブ50Aの内周面と封止材ブロック40Aの外周面との間、および、スリーブ50Bの内周面と封止材ブロック40Bの外周面との間は、糊などの接着剤を介して接着される。
【0042】
さらに、円筒状スリーブ50Aのキャップ24Aが配置された側の外周面と円筒状部材22の内周面との間、円筒状スリーブ50Bのキャップ24Bが配置された側の外周面と円筒状部材22の内周面との間、円筒状部材22の端面とキャップ24Aの内面との間、および、円筒状部材22の端面とキャップ24Bの内面との間には、気密性を確保するために、Oリング70が配置される。
【0043】
なお、中空糸束30の長さは、円筒状部材22の長さと略同程度に設定される。また、中空糸束30の両端を保持するスリーブ50A、50Bの直径は、円筒状部材22に対する中空糸束30の出し入れを容易とするために、円筒状部材22の内径よりも若干小さめに設定されることが好ましい。ここで、円筒状部材22の外周面側に設けられるECS用導管26A、26Bの各孔の軸方向Cに対する配置位置は、円筒状部材22の端部側からスリーブ50A、50Bの長さを加えた領域と重複しない位置に設定される。すなわち、ECS導管26A、26Bの各孔の位置は、スリーブ50A,50Bと重複しない位置とされる。
【0044】
芯棒60およびスリーブ50A,50Bを構成する材料としては、ハウジングを構成する材料と同様のもの、または、ステンレス等の金属など、適度な剛性を有するものが利用できる。なお、図1に示す例では、芯棒60は、中空糸束30の中心軸上に1本配置されているが、中空糸束30中に複数本設けられていてもよい。また、芯棒60は、角柱状であってもよく、省略することもできる。
【0045】
図1に示すモジュール10を用いて細胞培養を行う場合、まず、モジュール10の組み立てを行う。この場合、中心軸を貫通するように芯棒60が設けられた中空糸束30と、この中空糸束30の端部に位置する封止材ブロック40A、40Bを各々覆うスリーブ50A、50Bと、から構成される中空糸束ユニットを、円筒状部材22の内側に挿入する。その後、円筒状部材22の両端を、キャップ24A、24Bにより封止する。なお、この組立作業に際しては、Oリング70を、上述した位置に配置する。この場合、中空糸束ユニットと、円筒状部材22の内周面との間に形成される空間がECSとなる。
【0046】
続いて、第一のECS用導管26Aもしくは第二のECS用導管26BまたはこれらECS用導管26A、26Bの双方からECS内へと、培養対象となる細胞を投入する。次に、たとえば、第一のルーメン用導管28A側から、ハウジング20内へと培養液を供給する。この培養液は、まず最初に、キャップ24Aと、中空糸束30のキャップ24Aが配置された側の端面との間に形成される空間に流れ込む。そして、培養液は、中空糸束30の端面に露出する個々の中空糸の開口部から、中空糸の内部空間(ルーメン)を流れる。さらに、ルーメン中を流れる培養液は、中空糸束30のキャップ24B側の端面に露出する個々の中空糸の開口部から、キャップ24Bと、中空糸束30のキャップ24Bが配置された側の端面との間に形成される空間に排出され、さらにこの空間から、第二のルーメン用導管28Bを経て、モジュール10外へと排出される。
【0047】
ここで、ルーメン内を流れる培養液中に含まれる生育必須成分は、中空糸の外周面に設けられた孔を介して、ECSに存在する細胞に供給される。このため、細胞の培養が促進される。そして、細胞の培養が完了した後は、円筒状部材22からキャップ24Aおよび/またはキャップ24Bを取り外した後、円筒状部材22内から中空糸ユニットを取り出す。このため、個々の中空糸に培養細胞が付着した状態の中空糸束30を回収することができる。なお、生体内への移植に際しては、中空糸ユニットから、芯棒30を引き抜くと共に、封止材ブロック40A、40Bを、スリーブ50A、50Bと共に切断する等により除去することで、生分解性材料から構成される中空糸のみからなる中空糸束30と、培養細胞とのみからなる部分を利用できる。
【0048】
なお、中空糸束30の体積Wに対する、ECSの体積Xの比率(X/W)は、培養しようとする細胞の種類、ECS内で培養された細胞の密度等必要に応じて適宜設定することができるが、1〜20の範囲内が好ましく、2〜6の範囲内がより好ましい。この体積比率を1以上とすることにより、モジュール10内に投入する細胞量を多くすることができ、細胞が増殖する空間も十分に確保することができる。また、上記の体積比率を20以下とすることにより、モジュール10内の細胞への生育必須成分の供給不足を回避することが可能となる。このため、中空糸束30に含まれる中空糸の本数・サイズ等は、上述した体積比率が実現できるように設定することが好ましい。なお、「中空糸束30の体積」とは、中空糸束30を構成する各中空糸のうち、モジュール10内でECSと接触する部分の体積を意味し、中空糸の断面外周によって形成される中空部分を含む断面積と中空糸長さの積の総和で表すことができる。
【0049】
(細胞培養方法)
以上に説明したように、本実施形態のモジュール10を用いて細胞の培養を行った場合、中空糸に付着した細胞を、中空糸に付着した状態で回収することができる。ここで、「細胞が、中空糸に付着する」とは、培養された細胞が中空糸表面に直接付着、または、細胞付着担体を介して間接的に付着すること意味する。この場合、中空糸の外周面から脱落しないように細胞が保持されているのであれば、中空糸同士の間隙あるいは中空糸とハウジングとの間隙に存在する細胞も、中空糸に付着するものに該当する。
【0050】
本実施形態のモジュール10を用いた細胞培養方法では、生体組織を構成する細胞であれば、如何なる細胞を培養してもよいが、培養対象となる細胞としては、医療上のニーズが最も大きい軟骨細胞であることが特に好ましい。
【0051】
本実施形態のモジュール10を用いた細胞培養方法において、生物学上、利用可能な細胞培養法としては、公知な細胞培養法が利用できるが、生体組織細胞を立体的に培養し、再生医療に適用する観点から、三次元培養法が好ましい。
【0052】
三次元培養法としては、マイクロキャリア法、ゲル包埋法などが挙げられる。マイクロキャリア法は、ガラス、ゼラチン、セルロースなどでできたビーズに細胞を付着させて培養する方法である。また、ゲル包埋培養法は、コラーゲンあるいはアガロース中で細胞を三次元的に培養する方法である。
【0053】
これらの細胞培養法では、細胞とともにマイクロキャリアあるいはゲルを、ECS用導管26A(またはECS用導管26B)から投入し、上述した培養液をルーメンに供給することによって細胞を培養することができる。また、培養液の供給速度、培地交換の有無、酸素添加方法といった培養条件は、細胞の種類、細胞濃度等に応じて適宜設定することができる。
【実施例】
【0054】
以下に、本発明を実施例を挙げてより具体的に説明するが、本発明は以下の実施例にのみ限定されるものではない。
【0055】
(実施例1)
−細胞培養テスト−
図1に示すモジュール10を用いて、細胞の培養を以下の手順で実施した。まず、中空糸束30を構成する個々の中空糸としては、重量平均分子量145800のポリ乳酸製の中空糸(Durect社製、内径0.7mm、外径1.3mm、平均膜孔径:0.1μm)を用いた。中空糸束30は、70本の中空糸から構成され、その長さは64mmである。また、封止材ブロック40A,40Bを構成する封止材としてはウレタン樹脂を用い、円筒状部材22、キャップ24A、24B、スリーブ50A、50B、芯棒60としては、ポリカーボネート樹脂製のものを用いた。なお、円筒状部材22のサイズは、外径32mm、内径26mm、長さ100mmである。また、キャップ24A、24Bはねじ込み式キャップである。
【0056】
図1に示すモジュール10を組み立てた後、ルーメンに、5%ヒト血清、FGF−2(Fibroblast Growth Facter−2)およびinsulinを含む軟骨細胞増殖培地を、ルーメン用導管28A、28Bを介して流速5mL/minで循環させた。
【0057】
この状態で、軟骨細胞(ヒト耳介軟骨由来、細胞数:約4000個)を、0.3%ウシアテロペプチドコラーゲン10mL中に包埋し、ECS用導管26Aを介してECS内に投入した。その後、ECS用導管26A、26Bを密封して、細胞の培養を開始した。細胞の培養は、37℃に設定した恒温槽中にモジュール10を配置した状態で実施し、培養液のpHを約7、酸素分圧を約20体積%に保持して行った。
【0058】
細胞の増殖を確認するために、細胞の培養開始から、2週間後に、モジュール10を分解して、中空糸に培養した細胞が付着した状態の中空糸ユニットを取り出した。取り出した時点の細胞数は、中空糸中の培養液の透水量を400(L/m2・h・atm)とした場合には約8000個であり中空糸中の培養液の透水量を1000(L/m2・h・atm)とした場合には約18000個であり細胞が増殖していることが確認された。
【0059】
次に、中空糸に培養した細胞が付着した状態の中空糸ユニットから、芯棒60を引き抜いて除去すると共に、スリーブ50A、50Bと共に、封止材ブロック40A、40Bを切断して除去した。この除去作業に際して、中空糸に付着した細胞の損失は殆どなかった。また、中空糸ユニットの取り出し作業や、中空糸ユニットから、細胞および生分解性材料以外の部分を除去する除去作業に際して、中空糸束30は、型崩れすることが無く、十分な強度を有していることが確認された。
【0060】
−生分解性テスト−
生分解性の評価は、細胞培養テストに用いた中空糸と同一の重量平均分子量を有するポリ乳酸からなる多孔体を耳介軟骨細胞と共にビーグル犬(生後8ヶ月目オス)の背部皮下に移植し、移植後から1カ月目、2カ月目および6カ月目における移植サンプルの凍結切片について、多孔体を構成するポリ乳酸の結晶度を位相差顕微鏡により評価することで実施した。結果を図2に示す。
【0061】
図2に示されるように、結晶度の高さを示す白い部分が、移植後から1カ月目、2カ月目、6カ月目と、時間が経過するに従い少なくなっている。このことから、時間の経過と共に、ポリ乳酸は生体内で分解することが判った。なお、図中、左側の位相差顕微鏡像が移植後から1カ月目の状態を示し、中央の位相差顕微鏡像が移植後から2カ月目の状態を示し、右側の位相差顕微鏡像が移植後から6カ月目の状態を示す。また、3つの位相差顕微鏡写真中の右下に示されるバーの長さは50μmを意味する。
【0062】
(実施例2)
−細胞培養テスト−
中空糸束30を構成する個々の中空糸として、重量平均分子量133000のポリ乳酸製の中空糸(Durect社製、内径0.7mm、外径1.3mm、平均膜孔径:0.1μm)を用いた以外は、実施例1と同様にして、細胞培養テストを実施した。その結果、実施例1と同程度に細胞が増殖していることが確認された。
【0063】
次に、中空糸に培養した細胞が付着した状態の中空糸ユニットから、芯棒60を引き抜いて除去すると共に、スリーブ50A、50Bと共に、封止材ブロック40A、40Bを切断して除去した。この除去作業に際して、中空糸に付着した細胞の損失は殆どなかった。また、中空糸ユニットの取り出し作業や、中空糸ユニットから、細胞および生分解性材料以外の部分を除去する除去作業に際して、中空糸束30は、実施例1と比べて若干の型崩れが生じたものの、十分な強度を有していることが確認された。
【0064】
(実施例3)
−細胞培養テスト−
中空糸束30を構成する個々の中空糸として、重量平均分子量145800のポリ乳酸製の中空糸(Durect社製、内径0.7mm、外径1.3mm、平均膜孔径:0.05μm)を用いた以外は、実施例1と同様にして、細胞培養テストを実施した。その結果、実施例1と同程度に細胞が増殖していることが確認された。
【0065】
次に、中空糸に培養した細胞が付着した状態の中空糸ユニットから、芯棒60を引き抜いて除去すると共に、スリーブ50A、50Bと共に、封止材ブロック40A、40Bを切断して除去した。この除去作業に際して、中空糸に付着した細胞の損失は殆どなかった。また、中空糸ユニットの取り出し作業や、中空糸ユニットから、細胞および生分解性材料以外の部分を除去する除去作業に際して、中空糸束30は、十分な強度を有していることが確認された。
【0066】
(中空糸の強度評価)
実施例1〜実施例3において用いた中空糸を、37℃の生理食塩水中に浸漬した場合の中空糸の引っ張り強度を以下の条件で評価した。結果を以下の表1に示す。
・浸漬時間:0月、1月、2月、5月
・中空糸サンプルの長さ:60mm
・測定サンプル数:8
・引っ張り強度の測定装置および測定条件:インストロン社4443型を用いて、引っ張り速度:60mm/minで測定
【0067】
【表1】

【符号の説明】
【0068】
10 モジュール(細胞培養中空糸モジュール)
20 ハウジング
22 円筒状部材
24A、24B キャップ
26A 第一のECS用導管
26B 第二のECS用導管
28A 第一のルーメン用導管
28B 第二のルーメン用導管
30 中空糸束
40A、40B 封止材ブロック
50A、50B スリーブ
60 芯棒
70 Oリング
【技術分野】
【0001】
本発明は、細胞培養用中空糸モジュールおよび細胞培養方法に関するものである。
【背景技術】
【0002】
従来、慢性的臓器機能不全疾患に対する有用な治療方法として、臓器移植や人工臓器埋設が行われている。しかし、臓器移植は、拒絶反応や免疫抑制剤の投与が必要といった医学的問題および深刻なドナー不足といった社会的問題を伴う。また、人工臓器は、生体適合性、機能性、利便性といった生体機能代替性という点で、満足できる治療手段とは言えない。
【0003】
このような問題を解決する方法として、再生医療が注目されている。再生医療は、機能不全に陥った臓器等の生体組織を再生する方法として有用であり、既に、皮膚や骨の分野においては実用化され、世界的にも臨床への応用が開始されている。しかし、臓器に関しては、未だ臨床応用には至っていない。臓器の形成には、大量の生体組織細胞を必要とするが、現在のところ、生体組織細胞の大量培養技術が確立されていないためである。従って、再生医療が、広く臨床に応用可能となるためには、細胞の大量培養技術の開発が必要
となる。
【0004】
近年、遺伝子組換えあるいはハイブリドーマの技術開発に伴い、インターフェロン、エリスロポエチン等の種々のヒト由来生理活性タンパクを製造するための大量細胞培養方法が開発されている。かかる細胞培養法は、好気的条件下で増殖する動物細胞を用いるものであり、一般にジャーファーメンター法によって細胞培養を行う技術である。しかし、このような技術は、医薬品原料の生産手段としての細胞培養技術であり、細胞固有の生理特性あるいは機能を発現、維持した細胞を利用する方法ではない。
【0005】
一方、細胞固有の機能を発現させるための生体組織細胞培養法としては、三次元培養法が提案されている。かかる技術は、コラーゲン等による細胞付着マトリックスを核として三次元的に細胞を増殖させるものであり、そのためには、細胞が増殖するための空間と、マトリックスを介して付着した細胞が増殖するための担体を提供することが必要である。
【0006】
このような培養方法に、上記ジャーファーメンター法を応用することも考えられる。しかし、ジャーファーメンター法では、撹拌による細胞の物理的損傷が発生するおそれがあることに加え、交差汚染の防止を十分に図ることが困難なため、各個人に応じた個別識別細胞培養が必要とされる再生医療に適した方法とはいえない。
【0007】
そこで、細胞付着担体を有し、培養細胞の物理的損傷および交差汚染を抑制した大量細
胞培養法として、中空糸モジュールを用いた細胞培養技術が提案されている(特許文献1〜3参照)。これらの中空糸モジュールを用いた細胞培養技術の中でも、特許文献3に記載の技術は、特許文献1,2に記載の技術に対して、培養細胞の回収を従来よりも一層効果的に行うことができ、培養細胞の生産性を高めることができる。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開昭49−419579号公報
【特許文献2】特開平6−169755号公報
【特許文献3】特開2006−345778号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかしながら、特許文献3に記載の技術を利用して、中空糸モジュール内で細胞を培養した後、この培養細胞を回収するためには、中空糸に付着した細胞を、中空糸から分離する必要がある。中空糸自体は、培養細胞の移植においては不要なものであるためである。このため、分離作業の際に、培養細胞の回収ロスが発生する。これに加えて、培養細胞を回収するためには、培養細胞を中空糸から分離する必要があるため、この分離処理に伴い、培養細胞がダメージを受け、培養細胞の活性度が低下しやすくなる。
【0010】
本発明は、上記事情に鑑みてなされたものであり、培養細胞の回収ロスを抑制することが可能な細胞培養用中空糸モジュール、および、当該細胞培養用中空糸モジュールを用いた細胞培養方法を提供することを課題とする。
【課題を解決するための手段】
【0011】
上記課題は以下の本発明により達成される。すなわち、
本発明の細胞培養用中空糸モジュールは、生分解性材料からなり、半透膜機能を有する中空糸を1本以上含み、かつ、中空糸の内部空間に培養液を供給することにより中空糸の外部空間(ECS)に存在する細胞に生育必須成分を供給するための中空糸束と、該中空糸束を格納するハウジングと、を少なくとも有し、かつ、ハウジングの任意の部分が脱着可能であると共に、中空糸束の少なくとも一部が外部に露出可能な構造を有することを特徴とする。
【0012】
本発明の細胞培養中空糸モジュールの一実施態様は、生分解性材料が、(i)ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、脂肪族ポリエステル、ポリアミド、(ii)(i)に示す高分子材料からなる群より選択される少なくとも2種類以上の高分子材料を含む混合材料、および、(iii)(i)に示す高分子材料からなる群より選択される少なくとも2種類以上の高分子材料の重合に用いる各々の単量体を共重合させた共重合体、から選択される材料であることが好ましい。
【0013】
本発明の細胞培養中空糸モジュールの他の実施態様は、生分解性材料の重量平均分子量が、30000〜500000の範囲内であることが好ましい。
【0014】
本発明の細胞培養方法は、本発明の細胞培養用中空糸モジュールを用いて、細胞を培養した後に、ハウジングの任意の部分を分離し、中空糸束の少なくとも一部を外部に露出し、中空糸に付着した細胞を、中空糸に付着した状態で回収することを特徴とする。
【0015】
本発明の細胞培養方法の一実施態様は、細胞が軟骨細胞であることが好ましい。
【発明の効果】
【0016】
本発明によれば、培養細胞の回収ロスを抑制することが可能な細胞培養用中空糸モジュール、および、当該細胞培養用中空糸モジュールを用いた細胞培養方法を提供することができる。
【図面の簡単な説明】
【0017】
【図1】本実施形態の細胞培養中空糸モジュールの一例を示す概略模式図である。
【図2】実施例1の細胞培養テストに用いた中空糸と同じ重量平均分子量を有する多孔体の生体内における生分解性を示す位相差顕微鏡像である。
【発明を実施するための形態】
【0018】
(細胞培養中空糸モジュール)
本実施形態の細胞培養用中空糸モジュール(以下、「モジュール」と略す場合がある。)は、生分解性材料からなり、半透膜機能を有する中空糸を1本以上含み、かつ、中空糸の内部空間(以下、「ルーメン」と称す場合がある。)に培養液を供給することにより中空糸の外部空間(Extracapillary Space、以下、「ECS」と称す場合がる)に存在する細胞に生育必須成分を供給するための中空糸束と、該中空糸束を格納するハウジングと、を少なくとも有し、かつ、ハウジングの任意の部分が脱着可能であると共に、中空糸束の少なくとも一部が外部に露出可能な構造を有することを特徴とする。
【0019】
本実施形態のモジュールを用いた細胞の培養は、モジュール内に細胞を配置した状態で、ルーメン内に培養液を供給することにより行われる。なお、ルーメンとECSとは、互いに隔離されているため、細胞が培養液中に流出することは無い。一方、細胞は、中空糸を介して十分な栄養成分および酸素の供給を受けることができるため、高密度に増殖することが可能である。そして、ECS内で高密度化した培養細胞は、中空糸に付着する。なお、「培養細胞が中空糸に付着」とは、培養細胞が中空糸表面に直接付着、または、細胞付着担体を介して間接的に付着することを意味し、中空糸同士の間隙あるいは中空糸とハウジングとの間隙に存在することも含む。
【0020】
−中空糸および中空糸束−
本実施形態のモジュールでは、中空糸が生分解性材料からなる。このため、この中空糸を生体内に配置しても、中空糸は生体内で分解され、体内に吸収されるため、生体に対して何らの悪影響を与えるおそれも無い。それゆえ、本実施形態のモジュールを用いて細胞の培養を行った場合、培養細胞が中空糸に付着した状態で回収することができる。この場合、培養細胞を中空糸に付着した状態で、中空糸と共に生体内に移植することができる。それゆえ、本実施形態の細胞培養用中空糸モジュールを用いて細胞を培養した場合、特許文献3に記載の技術と比較して、細胞移植等の各種治療に利用できる培養細胞の利用効率をさらに高めることができ、また、培養細胞の回収に際して培養細胞の活性度が低下するのを抑制できる。
【0021】
また、中空糸は、生分解性材料から構成される。この生分解性材料としては公知の生分解性材料が利用できる。しかしながら、細胞との親和性等を考慮した場合、生分解性材料としては、下記(i)〜(iii)に示す材料から選択することが好ましい。
(i)ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、脂肪族ポリエステル、ポリアミド
(ii)(i)に示す高分子材料からなる群より選択される少なくとも2種類以上の高分子材料を含む混合材料
(iii)(i)に示す高分子材料からなる群より選択される少なくとも2種類以上の高分子材料の重合に用いる各々の単量体を共重合させた共重合体
【0022】
なお、中空糸は、この中空糸を培養細胞と共に生体中に移植した場合において、生体親和性に優れ、材料の分解に伴う生体への負荷も小さいことが必要である。これに加えて、細胞の培養においては、予め中空糸モジュールを滅菌しておくことが必要である。従って、中空糸を構成する生分解性材料は、生体親和性に優れること、材料分解に伴う生体への負荷が低いこと、および、効果的かつ簡易な滅菌処理が可能な高圧蒸気滅菌処理に耐えうる高い耐熱性を有していることが必要である。これらの特性をバランス良く満たすという観点からは、上記に列挙した生分解性材料の中でも、ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、あるいは、これら高分子材料の重合に用いる各々の単量体を2種以上重合させた共重合体が特に好ましい。
【0023】
また、生分解性材料の重量平均分子量としては、30000〜500000の範囲内が好ましく、70000〜180000の範囲内がより好ましい。重量平均分子量を30000以上とすることにより、中空糸を紡糸する際に用いる紡糸用原料の粘性が増大し、紡糸が容易となる。また、重量平均分子量を500000以下とすることにより、モジュール内での細胞の培養に必要な期間(通常、最大で6カ月)中においては、生分解性材料の分解の進行に伴う中空糸の著しい強度の低下を防ぎつつ、生体内への移植後においては速やかな分解が可能となるため、移植治療に好適である。さらに、中空糸が、円筒状の膜からなり、この膜の厚み方向に貫通する孔が設けられることで半透膜機能を発揮する場合、紡糸用原料の粘性の著しい増大を防ぐことができるため、孔の形成が容易となる。
【0024】
また、中空糸は、その表面が親水化処理されたものであることがより好ましい。親水化処理を行うことによって、細胞に対する親和性が増すと共に、培養液の膜透過性も向上するからである。親水化処理方法として、たとえば、ポリビニルピロリドン、エチレンビニルアルコール共重合体、ポリビニルアセタールジエチルアミノアセテート、アルコールなどによる処理が挙げられ、アルコールとしては、エタノール、イソプロパノール等が挙げられる。これらの親水化処理方法の中でも、ポリビニルピロリドン処理が好ましい。中空糸の表面により安定的な親水性を付与することができるからである。
【0025】
また、本実施形態の細胞培養用中空糸モジュールに用いられる中空糸束は、1本以上の中空糸を含むものである。なお、中空糸束が2本以上の中空糸から構成される場合、通常、各々の中空糸は互いに平行に配置される。また、中空糸は、直線を成すようにその両端がハウジング内に固定される。たとえば、ハウジングが円筒体である場合、中空糸が、ハウジングの軸方向と平行を成すように、中空糸の両端をハウジング内に固定することができる。
【0026】
中空糸束を構成する中空糸は、半透膜機能を有する。ここで、半透膜機能とは、ルーメン側からESC側へ、あるいは、ESC側からルーメン側へと、溶液中に含まれる一部の成分は通すが、他の成分は通さない機能を意味する。半透膜機能を有する中空糸は、たとえば、孔径によって通過可能な成分を変化させることができる多孔質膜や、濃度勾配による通過のみならず様々な膜通過機能を有する生体膜と同様の機能を有する膜や部材等から構成することができ、培養しようとする細胞の種類や培養液等に応じて、中空糸を構成する部材を適宜選択して用いることができる。なお、以下の説明においては、中空糸が、円筒状の膜からなり、この膜の厚み方向に貫通する孔が設けられることで半透膜機能を発揮する場合について説明する。
【0027】
ここで、中孔糸を構成する膜に設けられる孔の孔径(以下、「膜孔径」と称す場合がある。)は、培養液をルーメン側からESC側に通過させることができ、培養しようとする細胞がESC側からルーメン側へと通過できないものであれば特に限定されるものではない。なお、膜孔径が小さくなれば膜強度は強くなるが、物質交換率は小さくなり、一方、膜孔径が大きくなれば膜強度は弱くなるが、物質交換率は大きくなる。したがって、膜強度、すなわち中空糸の強度と、大きな物質交換率とを、バランス良く両立させるためには、中空糸の平均膜孔径は、0.01μm〜0.8μmの範囲内が好ましく、0.1μm〜0.4μmの範囲内がより好ましい。
【0028】
中空糸の内径としては、培養液を供給することができる太さであれば、特に限定されないが、高い膜透過性を確保する観点から、0.1mm〜3mmの範囲内が好ましい。また、加工が容易であることや、培養液中に生じた不溶成分による目詰まりを抑制する観点も考慮した場合、内径は、0.5mm〜1.5mmの範囲内がより好ましい。なお、内径は、0.5mm〜1.5mmの範囲内とする場合、外径は、0.2mm〜3.0mmの範囲内とすることが好ましい。
【0029】
また、中空糸束を構成する中空糸の本数や、膜厚は、細胞の培養が可能であれば特に限定されないが、後述する様に、必要とする細胞数、培養細胞が必要とする栄養量および酸素量、モジュール内のECSの体積のいずれか1つまたは複数との関係等で適宜調整することが好ましい。
【0030】
中空糸束が2本以上の中空糸から構成される場合、中空糸束の両端部分は、一般に使用される封止材を用いて中空糸間の間隙を封鎖すると共に、たとえば、糊付け等することでハウジングの内壁に固定することができる。封止材としては、たとえば、ウレタン樹脂、エポキシ樹脂などの公知の樹脂を利用できる。
【0031】
−培養液−
また、中空糸は、ルーメンに培養液を供給することによりECSに存在する細胞に生育必須成分を供給すると共に、細胞の代謝成分を拡散除去する。ここで、培養液は、培養しようとする細胞の生育必須成分を含有するものであれば、従来公知のいかなる培養液も用いることができ、特に限定されない。ここで、「生育必須成分」とは、培養しようとする細胞が増殖する上で必要不可欠な成分を意味し、通常は、種々の有機物および無機物から構成され、細胞に酸素等を供給するための溶存ガスも含まれる。生育必須成分としては、たとえば、ダルベッコMEM、RPMI1640、ハムF12等の汎用培地に、血清あるいは各種増殖因子、分化誘導因子を添加して作成した培地等が用いられる。
【0032】
なお、ルーメン内への培養液の供給は、通常、容器に収納された培養液を、ポンプにてルーメン内を繰り返し循環させることにより実施されるが、ルーメン内に供給された培養液を循環させない一過性の供給であってもよい。
【0033】
−ハウジング−
ハウジングは、中空糸束を格納する。また、モジュールが組み立てられた状態において、ハウジングは、その内部に配置された中空糸の外周表面とハウジングの内壁との間に密閉空間、すなわちECSを形成する。このため、このECS内で細胞培養を行うことができる。また、ハウジングには、通常、ハウジング内に固定された中空糸のルーメンに培養液を供給およびルーメン内に供給された培養液を再び外部に排出するためのチューブ接続用導管(ルーメン用導管)、および、ECS内に細胞を投入すると共に、ECS内への細胞の投入に伴い投入した細胞の体積に相当するECS内のその他の成分を外部に排出するためのチューブ接続用導管(ECS用導管)が設けられる。そして、ECS用導管から細胞をECS内に投入した後、ルーメン用導管を利用してルーメン内に培養液を供給することにより、細胞の培養を行うことができる。ここで、ECSおよびルーメンは、お互いに隔離されているため、培養液と細胞とは直接接触せず、半透膜機能を有する中空糸の孔を通過した培養液中の所定の成分のみが細胞と接触する。なお、ルーメン用導管は、通常、ハウジングに2つ設けられ、ECS用導管も、通常、ハウジングに2つ設けられる。
【0034】
ハウジングを構成する材質は、特に限定されるものではないが、たとえば、ポリカーボネート樹脂、ポリスルホン樹脂、ポリプロピレン樹脂、ポリスチレン樹脂、ポリエチレン樹脂、アクリル樹脂などの樹脂材料を利用することができる。これらの樹脂材料の中でも、ポリカーボネート樹脂およびポリスルホン樹脂が好ましい。ポリカーボネート樹脂およびポリスルホン樹脂は、耐熱性に優れるため、ハウジングの高圧蒸気滅菌が可能となり、効率的な滅菌処理を行うことができる。また、ポリカーボネート樹脂およびポリスルホン樹脂は、透明性が高いため、肉眼により細胞の培養状態を容易に確認することができる。
【0035】
また、本実施形態のモジュールでは、ハウジングの任意の部分が脱着可能である。ここで、「ハウジングの任意の部分が脱着可能」とは、ハウジングの任意の部分(脱着可能部分)がハウジングのその他の部分(本体部分)から分離可能であり、かつ、脱着可能部分は、本体部分に装着可能であることを意味する。また、「脱着可能」とは、脱着可能部分を、本体部分と接触させたまま開閉することが可能な態様、または、脱着可能部分を本体部分から完全に離間するように分離できると共に、分離した脱着可能部分を再び本体部分に取り付け可能な態様を意味する。
【0036】
さらに、本実施形態のモジュールでは、中空糸束の少なくとも一部が外部に露出可能な構造を有する。ここで、「中空糸の少なくとも一部が外部に露出可能」とは、モジュール内に密閉され外部環境から遮断された状態にある中空糸束の少なくとも一部が、ハウジングの脱着可能部分を本体部分から分離することによって、外部環境に露出できることを意味する。ここで、ハウジングの脱着可能部分を本体部分から分離した場合における、中空糸束の外部環境に対する露出の度合は、特に限定されないが、露出の度合は大きければ大きい程好ましく、中空糸束全体が外部環境に露出可能であることが特に好ましい。この場合、中空糸に付着した状態で培養した細胞を回収することがより容易になるためである。
【0037】
ハウジングの形状・サイズとしては、特に限定されず、必要に応じて適宜設定することができる。しかしながら、モジュール内のデッドスペースの減少や、細胞の培養のし易さ等の実用上の観点からは、ハウジングは筒状部材を有することが好ましく、この筒状部材は円筒状部材であることがより好ましい。ハウジングが筒状部材を有する場合、中空糸束は、たとえば、中空糸の軸方向とハウジングの軸方向とが一致するように筒状部材内に配置される。そして、中空糸束は、中空糸束の両端部分が封止材を介して筒状部材の内壁に固定される。また、筒状部材両端の開口部は、キャップを用いて密閉される。すなわち、この場合、ハウジングは、その主要部が、筒状部材とキャップとから構成される。
【0038】
次に、ハウジングの主要部が、筒状部材とキャップとから構成される場合について、より詳細に説明する。この場合、細胞培養後に、筒状部材の両端を封止する2つのキャップのうち、少なくとも一方のキャップを筒状部材から取り外すことにより、培養細胞が付着した中空糸束をハウジングから取り出すことが可能となり、中空糸束を完全に外部環境へ露出させることができる。その結果、中空糸束に付着した状態で培養細胞を回収することができる。ここで、キャップは、筒状部材の両端部に脱着可能なものであれば公知のいかなるキャップも用いることができ、特に限定されないが、たとえば、はめ込み式キャップを用いることができる。また、筒状部材が、円筒状部材である場合には、スクリュー式キャップを用いることができる。なお、ハウジングを構成する筒状部材およびキャップを構成する材料としては、上述した樹脂材料などが利用できる。筒状部材およびキャップを構成する各々の材料は、同じ材料を用いてもよく、異なる材料を用いてもよい。
【0039】
−モジュールの具体例−
次に、本実施形態の細胞培養中空糸モジュールの具体例について、図面を用いて説明する。図1は、本実施形態の細胞培養中空糸モジュールの一例を示す概略模式図である。ここで、図1中の水平方向に伸びる中心軸Cの上側がモジュールの内部構造を示す断面図であり、中心線の下側がモジュールの外観を示す側面図である。
【0040】
図1に示すモジュール10は、その主要部が、ハウジング20と、このハウジング20内に配置された中空糸束30と、から構成される。ここで、ハウジング20は、図面の中央部に配置される円筒状部材22と、円筒状部材22の両端開口部を封止するキャップ24A、24Bと、を有している。また、円筒状部材22の外周面側には、キャップ24Aが配置された側に第一のECS用導管26Aが設けられ、キャップ24Bが配置された側に第二のECS用導管26Bが設けられている。また、キャップ24Aの軸方向の外面側には、第一のルーメン用導管28Aが設けられ、キャップ24Bの軸方向の外面側には、第二のルーメン用導管28Bが設けられている。
【0041】
中空糸束30は、複数本の互いに平行に配置された中空糸から構成され、その長手方向が、円筒状部材22の軸方向Cと平行となるようにハウジング20内に配置されている。また、中空糸束30の両端部分には、この中空糸束30を構成する個々の中空糸間の間隙を満たすと共に中空糸束30の外周部分を覆うように封止材が充填されており、この封止材からなる円柱状の封止材ブロック40A、40Bが形成されている。そして、封止材ブロック40A、40Bの外周面を保持すると共に、封止材ブロック40A、40Bと円筒状部材22の内周面との間の隙間を塞ぐように、円筒状のスリーブ50A、50Bが配置されている。このため、中空糸束30は、その両端部分が、スリーブ50A、50Bを介して、ハウジング20を構成する円筒状部材22の内周側に固定して配置されることになる。また、中空糸束30内には、その中心軸を貫通するように円柱状の芯棒60が設けられている。なお、中空糸束30に設けられるスリーブ50A,50Bおよび芯棒60は、中空糸束30の保持および取り扱いを容易にするために設けられるものである。このため、スリーブ50Aの内周面と封止材ブロック40Aの外周面との間、および、スリーブ50Bの内周面と封止材ブロック40Bの外周面との間は、糊などの接着剤を介して接着される。
【0042】
さらに、円筒状スリーブ50Aのキャップ24Aが配置された側の外周面と円筒状部材22の内周面との間、円筒状スリーブ50Bのキャップ24Bが配置された側の外周面と円筒状部材22の内周面との間、円筒状部材22の端面とキャップ24Aの内面との間、および、円筒状部材22の端面とキャップ24Bの内面との間には、気密性を確保するために、Oリング70が配置される。
【0043】
なお、中空糸束30の長さは、円筒状部材22の長さと略同程度に設定される。また、中空糸束30の両端を保持するスリーブ50A、50Bの直径は、円筒状部材22に対する中空糸束30の出し入れを容易とするために、円筒状部材22の内径よりも若干小さめに設定されることが好ましい。ここで、円筒状部材22の外周面側に設けられるECS用導管26A、26Bの各孔の軸方向Cに対する配置位置は、円筒状部材22の端部側からスリーブ50A、50Bの長さを加えた領域と重複しない位置に設定される。すなわち、ECS導管26A、26Bの各孔の位置は、スリーブ50A,50Bと重複しない位置とされる。
【0044】
芯棒60およびスリーブ50A,50Bを構成する材料としては、ハウジングを構成する材料と同様のもの、または、ステンレス等の金属など、適度な剛性を有するものが利用できる。なお、図1に示す例では、芯棒60は、中空糸束30の中心軸上に1本配置されているが、中空糸束30中に複数本設けられていてもよい。また、芯棒60は、角柱状であってもよく、省略することもできる。
【0045】
図1に示すモジュール10を用いて細胞培養を行う場合、まず、モジュール10の組み立てを行う。この場合、中心軸を貫通するように芯棒60が設けられた中空糸束30と、この中空糸束30の端部に位置する封止材ブロック40A、40Bを各々覆うスリーブ50A、50Bと、から構成される中空糸束ユニットを、円筒状部材22の内側に挿入する。その後、円筒状部材22の両端を、キャップ24A、24Bにより封止する。なお、この組立作業に際しては、Oリング70を、上述した位置に配置する。この場合、中空糸束ユニットと、円筒状部材22の内周面との間に形成される空間がECSとなる。
【0046】
続いて、第一のECS用導管26Aもしくは第二のECS用導管26BまたはこれらECS用導管26A、26Bの双方からECS内へと、培養対象となる細胞を投入する。次に、たとえば、第一のルーメン用導管28A側から、ハウジング20内へと培養液を供給する。この培養液は、まず最初に、キャップ24Aと、中空糸束30のキャップ24Aが配置された側の端面との間に形成される空間に流れ込む。そして、培養液は、中空糸束30の端面に露出する個々の中空糸の開口部から、中空糸の内部空間(ルーメン)を流れる。さらに、ルーメン中を流れる培養液は、中空糸束30のキャップ24B側の端面に露出する個々の中空糸の開口部から、キャップ24Bと、中空糸束30のキャップ24Bが配置された側の端面との間に形成される空間に排出され、さらにこの空間から、第二のルーメン用導管28Bを経て、モジュール10外へと排出される。
【0047】
ここで、ルーメン内を流れる培養液中に含まれる生育必須成分は、中空糸の外周面に設けられた孔を介して、ECSに存在する細胞に供給される。このため、細胞の培養が促進される。そして、細胞の培養が完了した後は、円筒状部材22からキャップ24Aおよび/またはキャップ24Bを取り外した後、円筒状部材22内から中空糸ユニットを取り出す。このため、個々の中空糸に培養細胞が付着した状態の中空糸束30を回収することができる。なお、生体内への移植に際しては、中空糸ユニットから、芯棒30を引き抜くと共に、封止材ブロック40A、40Bを、スリーブ50A、50Bと共に切断する等により除去することで、生分解性材料から構成される中空糸のみからなる中空糸束30と、培養細胞とのみからなる部分を利用できる。
【0048】
なお、中空糸束30の体積Wに対する、ECSの体積Xの比率(X/W)は、培養しようとする細胞の種類、ECS内で培養された細胞の密度等必要に応じて適宜設定することができるが、1〜20の範囲内が好ましく、2〜6の範囲内がより好ましい。この体積比率を1以上とすることにより、モジュール10内に投入する細胞量を多くすることができ、細胞が増殖する空間も十分に確保することができる。また、上記の体積比率を20以下とすることにより、モジュール10内の細胞への生育必須成分の供給不足を回避することが可能となる。このため、中空糸束30に含まれる中空糸の本数・サイズ等は、上述した体積比率が実現できるように設定することが好ましい。なお、「中空糸束30の体積」とは、中空糸束30を構成する各中空糸のうち、モジュール10内でECSと接触する部分の体積を意味し、中空糸の断面外周によって形成される中空部分を含む断面積と中空糸長さの積の総和で表すことができる。
【0049】
(細胞培養方法)
以上に説明したように、本実施形態のモジュール10を用いて細胞の培養を行った場合、中空糸に付着した細胞を、中空糸に付着した状態で回収することができる。ここで、「細胞が、中空糸に付着する」とは、培養された細胞が中空糸表面に直接付着、または、細胞付着担体を介して間接的に付着すること意味する。この場合、中空糸の外周面から脱落しないように細胞が保持されているのであれば、中空糸同士の間隙あるいは中空糸とハウジングとの間隙に存在する細胞も、中空糸に付着するものに該当する。
【0050】
本実施形態のモジュール10を用いた細胞培養方法では、生体組織を構成する細胞であれば、如何なる細胞を培養してもよいが、培養対象となる細胞としては、医療上のニーズが最も大きい軟骨細胞であることが特に好ましい。
【0051】
本実施形態のモジュール10を用いた細胞培養方法において、生物学上、利用可能な細胞培養法としては、公知な細胞培養法が利用できるが、生体組織細胞を立体的に培養し、再生医療に適用する観点から、三次元培養法が好ましい。
【0052】
三次元培養法としては、マイクロキャリア法、ゲル包埋法などが挙げられる。マイクロキャリア法は、ガラス、ゼラチン、セルロースなどでできたビーズに細胞を付着させて培養する方法である。また、ゲル包埋培養法は、コラーゲンあるいはアガロース中で細胞を三次元的に培養する方法である。
【0053】
これらの細胞培養法では、細胞とともにマイクロキャリアあるいはゲルを、ECS用導管26A(またはECS用導管26B)から投入し、上述した培養液をルーメンに供給することによって細胞を培養することができる。また、培養液の供給速度、培地交換の有無、酸素添加方法といった培養条件は、細胞の種類、細胞濃度等に応じて適宜設定することができる。
【実施例】
【0054】
以下に、本発明を実施例を挙げてより具体的に説明するが、本発明は以下の実施例にのみ限定されるものではない。
【0055】
(実施例1)
−細胞培養テスト−
図1に示すモジュール10を用いて、細胞の培養を以下の手順で実施した。まず、中空糸束30を構成する個々の中空糸としては、重量平均分子量145800のポリ乳酸製の中空糸(Durect社製、内径0.7mm、外径1.3mm、平均膜孔径:0.1μm)を用いた。中空糸束30は、70本の中空糸から構成され、その長さは64mmである。また、封止材ブロック40A,40Bを構成する封止材としてはウレタン樹脂を用い、円筒状部材22、キャップ24A、24B、スリーブ50A、50B、芯棒60としては、ポリカーボネート樹脂製のものを用いた。なお、円筒状部材22のサイズは、外径32mm、内径26mm、長さ100mmである。また、キャップ24A、24Bはねじ込み式キャップである。
【0056】
図1に示すモジュール10を組み立てた後、ルーメンに、5%ヒト血清、FGF−2(Fibroblast Growth Facter−2)およびinsulinを含む軟骨細胞増殖培地を、ルーメン用導管28A、28Bを介して流速5mL/minで循環させた。
【0057】
この状態で、軟骨細胞(ヒト耳介軟骨由来、細胞数:約4000個)を、0.3%ウシアテロペプチドコラーゲン10mL中に包埋し、ECS用導管26Aを介してECS内に投入した。その後、ECS用導管26A、26Bを密封して、細胞の培養を開始した。細胞の培養は、37℃に設定した恒温槽中にモジュール10を配置した状態で実施し、培養液のpHを約7、酸素分圧を約20体積%に保持して行った。
【0058】
細胞の増殖を確認するために、細胞の培養開始から、2週間後に、モジュール10を分解して、中空糸に培養した細胞が付着した状態の中空糸ユニットを取り出した。取り出した時点の細胞数は、中空糸中の培養液の透水量を400(L/m2・h・atm)とした場合には約8000個であり中空糸中の培養液の透水量を1000(L/m2・h・atm)とした場合には約18000個であり細胞が増殖していることが確認された。
【0059】
次に、中空糸に培養した細胞が付着した状態の中空糸ユニットから、芯棒60を引き抜いて除去すると共に、スリーブ50A、50Bと共に、封止材ブロック40A、40Bを切断して除去した。この除去作業に際して、中空糸に付着した細胞の損失は殆どなかった。また、中空糸ユニットの取り出し作業や、中空糸ユニットから、細胞および生分解性材料以外の部分を除去する除去作業に際して、中空糸束30は、型崩れすることが無く、十分な強度を有していることが確認された。
【0060】
−生分解性テスト−
生分解性の評価は、細胞培養テストに用いた中空糸と同一の重量平均分子量を有するポリ乳酸からなる多孔体を耳介軟骨細胞と共にビーグル犬(生後8ヶ月目オス)の背部皮下に移植し、移植後から1カ月目、2カ月目および6カ月目における移植サンプルの凍結切片について、多孔体を構成するポリ乳酸の結晶度を位相差顕微鏡により評価することで実施した。結果を図2に示す。
【0061】
図2に示されるように、結晶度の高さを示す白い部分が、移植後から1カ月目、2カ月目、6カ月目と、時間が経過するに従い少なくなっている。このことから、時間の経過と共に、ポリ乳酸は生体内で分解することが判った。なお、図中、左側の位相差顕微鏡像が移植後から1カ月目の状態を示し、中央の位相差顕微鏡像が移植後から2カ月目の状態を示し、右側の位相差顕微鏡像が移植後から6カ月目の状態を示す。また、3つの位相差顕微鏡写真中の右下に示されるバーの長さは50μmを意味する。
【0062】
(実施例2)
−細胞培養テスト−
中空糸束30を構成する個々の中空糸として、重量平均分子量133000のポリ乳酸製の中空糸(Durect社製、内径0.7mm、外径1.3mm、平均膜孔径:0.1μm)を用いた以外は、実施例1と同様にして、細胞培養テストを実施した。その結果、実施例1と同程度に細胞が増殖していることが確認された。
【0063】
次に、中空糸に培養した細胞が付着した状態の中空糸ユニットから、芯棒60を引き抜いて除去すると共に、スリーブ50A、50Bと共に、封止材ブロック40A、40Bを切断して除去した。この除去作業に際して、中空糸に付着した細胞の損失は殆どなかった。また、中空糸ユニットの取り出し作業や、中空糸ユニットから、細胞および生分解性材料以外の部分を除去する除去作業に際して、中空糸束30は、実施例1と比べて若干の型崩れが生じたものの、十分な強度を有していることが確認された。
【0064】
(実施例3)
−細胞培養テスト−
中空糸束30を構成する個々の中空糸として、重量平均分子量145800のポリ乳酸製の中空糸(Durect社製、内径0.7mm、外径1.3mm、平均膜孔径:0.05μm)を用いた以外は、実施例1と同様にして、細胞培養テストを実施した。その結果、実施例1と同程度に細胞が増殖していることが確認された。
【0065】
次に、中空糸に培養した細胞が付着した状態の中空糸ユニットから、芯棒60を引き抜いて除去すると共に、スリーブ50A、50Bと共に、封止材ブロック40A、40Bを切断して除去した。この除去作業に際して、中空糸に付着した細胞の損失は殆どなかった。また、中空糸ユニットの取り出し作業や、中空糸ユニットから、細胞および生分解性材料以外の部分を除去する除去作業に際して、中空糸束30は、十分な強度を有していることが確認された。
【0066】
(中空糸の強度評価)
実施例1〜実施例3において用いた中空糸を、37℃の生理食塩水中に浸漬した場合の中空糸の引っ張り強度を以下の条件で評価した。結果を以下の表1に示す。
・浸漬時間:0月、1月、2月、5月
・中空糸サンプルの長さ:60mm
・測定サンプル数:8
・引っ張り強度の測定装置および測定条件:インストロン社4443型を用いて、引っ張り速度:60mm/minで測定
【0067】
【表1】

【符号の説明】
【0068】
10 モジュール(細胞培養中空糸モジュール)
20 ハウジング
22 円筒状部材
24A、24B キャップ
26A 第一のECS用導管
26B 第二のECS用導管
28A 第一のルーメン用導管
28B 第二のルーメン用導管
30 中空糸束
40A、40B 封止材ブロック
50A、50B スリーブ
60 芯棒
70 Oリング
【特許請求の範囲】
【請求項1】
生分解性材料からなり、半透膜機能を有する中空糸を1本以上含み、かつ、上記中空糸の内部空間に培養液を供給することにより上記中空糸の外部空間に存在する細胞に生育必須成分を供給するための中空糸束と、
該中空糸束を格納するハウジングと、を少なくとも有し、かつ、
上記ハウジングの任意の部分が脱着可能であると共に、上記中空糸束の少なくとも一部が外部に露出可能な構造を有することを特徴とする細胞培養用中空糸モジュール。
【請求項2】
請求項1に記載の細胞培養中空糸モジュールにおいて、
前記生分解性材料が、
(i)ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、脂肪族ポリエステル、ポリアミド、
(ii)上記(i)に示す高分子材料からなる群より選択される少なくとも2種類以上の高分子材料を含む混合材料、および、
(iii)上記(i)に示す高分子材料からなる群より選択される少なくとも2種類以上の高分子材料の重合に用いる各々の単量体を共重合させた共重合体、
から選択される材料であることを特徴とする細胞培養用中空糸モジュール。
【請求項3】
請求項1または請求項2に記載の細胞培養中空糸モジュールにおいて、
前記生分解性材料の重量平均分子量が、30000〜500000の範囲内であることを特徴とする細胞培養中空糸モジュール。
【請求項4】
請求項1〜3のいずれか1つに記載の細胞培養用中空糸モジュールを用いて、細胞を培養した後に、上記ハウジングの任意の部分を分離し、上記中空糸束の少なくとも一部を外部に露出し、
上記中空糸に付着した上記細胞を、上記中空糸に付着した状態で回収することを特徴とする細胞培養方法。
【請求項5】
請求項4に記載の細胞培養方法において、
前記細胞が軟骨細胞であることを特徴とする細胞培養方法。
【請求項1】
生分解性材料からなり、半透膜機能を有する中空糸を1本以上含み、かつ、上記中空糸の内部空間に培養液を供給することにより上記中空糸の外部空間に存在する細胞に生育必須成分を供給するための中空糸束と、
該中空糸束を格納するハウジングと、を少なくとも有し、かつ、
上記ハウジングの任意の部分が脱着可能であると共に、上記中空糸束の少なくとも一部が外部に露出可能な構造を有することを特徴とする細胞培養用中空糸モジュール。
【請求項2】
請求項1に記載の細胞培養中空糸モジュールにおいて、
前記生分解性材料が、
(i)ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、脂肪族ポリエステル、ポリアミド、
(ii)上記(i)に示す高分子材料からなる群より選択される少なくとも2種類以上の高分子材料を含む混合材料、および、
(iii)上記(i)に示す高分子材料からなる群より選択される少なくとも2種類以上の高分子材料の重合に用いる各々の単量体を共重合させた共重合体、
から選択される材料であることを特徴とする細胞培養用中空糸モジュール。
【請求項3】
請求項1または請求項2に記載の細胞培養中空糸モジュールにおいて、
前記生分解性材料の重量平均分子量が、30000〜500000の範囲内であることを特徴とする細胞培養中空糸モジュール。
【請求項4】
請求項1〜3のいずれか1つに記載の細胞培養用中空糸モジュールを用いて、細胞を培養した後に、上記ハウジングの任意の部分を分離し、上記中空糸束の少なくとも一部を外部に露出し、
上記中空糸に付着した上記細胞を、上記中空糸に付着した状態で回収することを特徴とする細胞培養方法。
【請求項5】
請求項4に記載の細胞培養方法において、
前記細胞が軟骨細胞であることを特徴とする細胞培養方法。
【図1】


【図2】




【図2】


【公開番号】特開2012−44908(P2012−44908A)
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願番号】特願2010−188831(P2010−188831)
【出願日】平成22年8月25日(2010.8.25)
【出願人】(505227043)野村ユニソン株式会社 (25)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(504150450)国立大学法人神戸大学 (421)
【Fターム(参考)】
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願日】平成22年8月25日(2010.8.25)
【出願人】(505227043)野村ユニソン株式会社 (25)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(504150450)国立大学法人神戸大学 (421)
【Fターム(参考)】
[ Back to top ]

