細胞応答評価用マイクロチップ
【課題】細胞の機能並びに応答を評価するマイクロチップを提供する。
【解決手段】細胞培養部の溶液及び微粒子の導入口の最小幅を微粒子の最大直径より大きくし、出口の幅を微粒子の最大直径より小さくして細胞を付着した微粒子を流路内に捕捉し、細胞培養と細胞数の正確な測定を可能としたマイクロチップ。
【解決手段】細胞培養部の溶液及び微粒子の導入口の最小幅を微粒子の最大直径より大きくし、出口の幅を微粒子の最大直径より小さくして細胞を付着した微粒子を流路内に捕捉し、細胞培養と細胞数の正確な測定を可能としたマイクロチップ。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、創薬やバイオテクノロジーの研究などに用いられ、特に細胞を培養しその機能や応答を評価するのに用いられるマイクロチップに関する。
【背景技術】
【0002】
医薬品、農薬などの創薬や食品検査、診断、遺伝子工学等の分野において、細胞を用いた評価が幅広く行われている。従来より、細胞の機能や応答を評価する場合には、細胞はシャーレなどに入れられた培地等により培養され、様々な実験に用いられている。しかし、数多くの薬品や導入物質による反応を調べる場合には、細胞の特定の反応を効率よく、短時間で多種類の分析を行い、しかもより少ない試料で結果が得られる評価方法が望まれていた。
【0003】
このような状況において、マイクロチップと呼ばれるガラス等の基板上で保持した細胞の化学反応を観察あるいは測定する試みは、操作の簡便化・自動化による分析時間の短縮などのメリットをもたらすと期待され、近年盛んに行われてきている。マイクロチップを利用したシステムの利点としては、サンプルや試薬の使用量あるいは廃液の排出量が軽減され、省スペースで持ち運び可能な安価なシステムの実現が考えられている。実際にこのような利点を活かし、流路壁面に細胞を付着させたマイクロチップを用いて細胞の機能や応答を評価する研究もなされている。(例えば、非特許文献1及び非特許文献2、特許文献1参照。)
【非特許文献1】Analytical Chemistry 2005:77,p.2125-2131
【非特許文献2】Analytical Chemistry 2005:77,p.667-672
【特許文献1】特開2003−294741号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかしながら、従来のマイクロチップを用いた細胞培養では、基板の材料が細胞の接着に最適なものではなく、さらに極微量の溶液中では微弱な流れの影響が大きいためマイクロ流路内において細胞が流路壁面に効率的に接着せず、流路内に一定数の細胞を一定の領域に保持することが困難であった。流路内面を化学的または物理的に修飾する手法によって細胞の接着を促進する方法もあるが、この場合には流路壁面がすべて修飾されるため、目的とする場所のみで細胞を培養することが困難であったり、様々な種類の細胞にとって最適である流路表面を有したマイクロチップを細胞の種類毎に作製しなければならないといった問題がある。この際、細胞接着に適した材料を用いて微細加工を施し、細密なマイクロチップ流路を作成することは困難である。また、細胞機能や応答評価の前後に、流路内に接着した細胞数を測定する際には、一定領域の流路内の細胞数を発色試薬などで測定できない場合は顕微鏡で数える必要があり、煩雑で時間がかかることに問題があった。さらに、マイクロチップ流路内の表面積が少ないため、流路壁面の一定領域内に接着できる細胞数を増やすことが困難であった。
【0005】
本発明の目的は、簡便かつ効率的な手段によって細胞をマイクロチップ流路内に特定の場所で定量的に保持し、この場所で細胞培養とその後の細胞機能評価を行うことができるようにしたマイクロチップを提供することである。
【課題を解決するための手段】
【0006】
本発明は、
(1) 細胞が接着した微粒子を保持できる細胞培養部を有することを特徴とする細胞応答
評価用マイクロチップ。
(2) マイクロチップ内部に形成され液体を流すことのできる流路と、前記流路の両端部
につながる液出入口とを有し、前記流路の内部に直径1mm以下の微粒子を保持できる細胞培養部を有することを特徴とする(1)記載のマイクロチップ。
(3) 細胞培養部の流路後半に細胞の分泌物を測定するための物質分析部を有する(1)または(2)記載のマイクロチップ。
(4) (1)または(2)記載のマイクロチップの流路の出口と、物質分析部を有するマイクロチップの流路の入り口とを、外部のチューブにて連結させたマイクロチップ。
(5) (3)または(4)記載のマイクロチップを用いた細胞の分泌物の測定方法。
(6) (3)または(4)記載の物質分析部において酵素免疫定量を行うことによる細胞分泌物の測定方法。
(7) マイクロチップの流路に液体を連続的に流しながら測定する(5)または(6)記載の測
定方法。
(8) 細胞分泌物がアポリポ蛋白質A1である(5)ないし(7)の何れか1つに記載の測定方
法。
(9) 細胞分泌物がアポリポ蛋白質Bである(5)ないし(7)の何れか1つに記載の測定方法
。
(10) (5)ないし(7)の何れか1つに記載の測定方法を用いる、細胞の分泌物の量を変化
させる活性を有する薬剤のスクリーニング方法。
(11) 細胞分泌物がアポリポ蛋白質A1である(10)記載の薬剤のスクリーニング方法。
(12) 細胞分泌物がアポリポ蛋白質Bである(10)記載の薬剤のスクリーニング方法。
(13) 細胞がHepG2細胞である(11)記載の薬剤のスクリーニング方法。
(14) 細胞がCaco−2細胞である(12)記載の薬剤のスクリーニング方法。
に関する。
【0007】
本発明のマイクロチップは、基板に流路その他の溶液の反応や処理に必要な部分が形成されているものを指しており、大きさに関しては特に制約はない。
本発明は、流路中に細胞培養部を設け、その出口の幅を細胞付着が可能である微粒子の最大直径よりも十分に小さくすることにより、細胞を付着させた微粒子を細胞培養部に充填した際にその微粒子の細胞培養部外への流出を抑制して、マイクロチップ中の一定の領域で細胞培養や薬剤添加等の処理をできるようにしたものである。さらに、細胞培養部以降の流路に物質分析部を設けることにより、細胞培養部にて細胞から分泌された物質を連続的に測定できるようにしたものである。
【0008】
物質分析部は、細胞培養部にて細胞が産生した物質を高感度で、選択的に検出できるものであればよく、方法に関しては特に制約はない。
すなわち、本発明のマイクロチップは、基板内部に形成され液体と微粒子を流すことのできる流路と、その流路の両端部につながる液出入口と、基板内部で前記流路の途中に設けられ、細胞を付着した微粒子を捕捉することが可能である細胞培養部と、それと一つの流路にて接続された物質分析部とを基板に一体的に備えたものである。さらに、本発明は、前記細胞培養部を有するマイクロチップの流路と物質分析部を有する異なるマイクロチップの流路とをチューブにて連結させたマイクロチップをも含む。
【発明の効果】
【0009】
細胞培養部は溶液または微粒子が流れる流路に対してより大きな容量となる様に設定できるため、細胞を接着させた微粒子を数多く保持することができる。このため、流路壁面に細胞を接着させた場合に比べて、より数多くの細胞を細胞培養部に保持することが可能となる。また、微粒子に接着している細胞数を予め測定しておけば、細胞培養部に導入する微粒子の数を調整する事により、一定数の細胞を目的の数で、一定の領域に保持することが可能となる。この際、微粒子上の細胞数の測定には発色法や蛍光法を用いることが可
能であるため、細胞数の測定は顕微鏡観察などに比べて容易である。また、細胞培養部は内部に微粒子が充填されているため、導入された溶液は乱流となって撹拌され、細胞培養部内に保持された細胞に対して薬剤などのサンプルを効率的に作用させることができる。さらに、微粒子は細胞の接着に適した様々な材料よりなるものを予め選択できるので、マイクロチップの流路壁面を修飾する方法では培養できないような細胞の保持と培養が可能である。
【0010】
更に、本発明のマイクロチップは、細胞培養部と物質分析部が一つの流路にて接続されているため、細胞培養部にて細胞から分泌された物質は流路内の液体の流れに乗って直接物質分析部へと運ばれて捕捉される。これにより、液体の流れの無い静置条件を用いるマイクロタイタープレートのような機器からは得られない、以下に示す優れた効果を示しうる。
1.細胞培養部にて分泌された物質が細胞培養部内で飽和してフィードバックによる分泌阻害が起こることを避けられる。
2.分泌された物質が再び細胞へと吸着或いは吸収されることが無く、細胞から分泌される物質の全てを分析することができる。
3.単位時間あたりの物質分泌を測定するのが容易である。
4.流体によるせん断応力に応答して細胞から分泌される物質を分析することが容易である。
【0011】
これにより、例えば、アポリポ蛋白質A1(以下、ApoA1)の受容体を細胞表面に発現しているため、静置条件ではApoA1が再び細胞へと吸着されると考えられるHepG2細胞からのApoA1蛋白質の分泌を容易に測定することができる。
同様に、ヒト結腸癌由来のCaco−2細胞からのアポリポ蛋白質B(以下、ApoB)の分泌量も容易に測定できる。
また、特定の刺激に対して一過性の発現・分泌を示す物質(例えばβ細胞から分泌されるインスリン)等の分泌も容易に測定することができる。
さらに、流路内の流速を変化させることが容易であるため、せん断応力に依存して分泌される物質(例えば、血管内皮細胞から分泌される一酸化窒素)等も容易に測定できる。
そして、上記のような測定は、液体の流れの無い静置条件を用いる既存の機器では達成することができないものであった。
【発明を実施するための最良の形態】
【0012】
以下、更に詳細に本発明を説明する。
本発明のマイクロチップにより細胞応答を評価しうる細胞としては、例えば、動物細胞、植物細胞、細菌、カビ、酵母、ウイルス等が挙げられるが、これらの中でも、特に医薬品等の薬剤のスクリーニングに用いる際には動物細胞が好ましい。動物細胞とは、ヒトを含む動物体内の臓器、組織等の生体組織から摘出される細胞をいい、生体組織から得られる細胞であれば特に制限はない。当該細胞としては、例えば、上皮細胞、内皮細胞、間充織細胞または血球細胞等を挙げることができ、上皮細胞としては、例えば、表皮細胞、毛乳頭細胞、角膜上皮細胞、肺胞上皮細胞、消化器系の粘膜上皮細胞、腎臓子球体上皮細胞又は肝実質細胞等を、内皮細胞としては、例えば、腎臓子球体毛細胞、血管内皮細胞、肺動脈血管内皮細胞、胎盤静脈血管内皮細胞又は大動脈血管内皮細胞等を、間充織細胞としては、例えば、線維芽細胞、血管平滑筋細胞、筋細胞、脂肪細胞、グリア細胞、シュワン細胞又は神経細胞等を、血球細胞としてはマクロファージ等を具体的に例示することができる。
【0013】
薬剤の評価には、初代培養技術が応用可能な正常組織由来細胞および樹立細胞が用いられるが、より好ましくは樹立細胞が用いられる。肝細胞の樹立細胞株としては、特に好ましい細胞株としてFLC−1、FLC−2、FLC−3、FLC−4、FLC−5、FL
C−6、FLC−7、HuH−6、HuH−7、C3A、HLE、HLF、HepG2細胞等を挙げることができる。
また、腸管細胞の樹立細胞株としては、特に好ましい細胞としてHT−29、IEC−6、Caco−2細胞等を挙げることができる。
【0014】
細胞培養部に細胞を付着させた微粒子を捕捉するためには、細胞培養部の溶液及び微粒子の導入口の最小幅を微粒子の最大直径より大きくし、出口の幅を微粒子の最大直径より小さくすればよい。このようにすることによって、細胞が接着する場としての微粒子は、細胞培養部以降に流入することはなく、せき止められることになる。そして必要に応じて、微粒子から脱着された細胞、その分解物、或いはその分泌物のみが細胞培養部以降に流入することができるようになる。
【0015】
細胞培養部と一つの流路で繋がった物質分析部において目的の細胞産生物の量を測定するには、抗原抗体反応、マイクロチップ電気泳動、質量分析などを用いることができる。また、目的の蛋白質を蛍光、アイソトープ、酵素、金コロイド、オリゴヒスチジンタグ、ストレプトアビジン、ビオチンなどで標識し、特異的に検出する方法も有効である。
【0016】
物質分析部にて抗原抗体反応を実施するためには、物質分析部の流路内に、細胞産生物質を抗原として認識する抗体を予め固定化し、細胞培養部から流れた細胞産生物質を特異的に捕捉すればよい。抗体は流路壁面に直接固定化させるか、抗体を予め固定化した担体を流路に保持させればよい。
【0017】
担体を用いて抗体を固定化させた例として、特開2001−4628号公報にて記述されているような抗原抗体反応を行うための構造と方法を用いることができる。すなわち、細胞産生物質を抗原として認識する抗体を微粒子上に固定化し、該抗体固定化微粒子を、物質分析部の溶液及び微粒子の導入口の最小幅を微粒子の最大直径より大きくし、流路内あるいは出口の幅を微粒子の最大直径より小さくすることによりせき止め、その微粒子に固定化された抗体に対して細胞培養部から流れた細胞産生物質が特異的に捕捉されればよい。抗体に捕捉された細胞産生物質の量を測定するには、該物質を抗原として認識する抗体を酵素、蛍光物質、アイソトープあるいは金コロイドなどで予め標識しておき、該標識抗体を物質分析部に導入すればよい。その後、酵素によって発色する基質を導入してその発色量を測定したり、蛍光発色や金コロイドの光吸収を直接分析することにより、微粒子上に捕捉された該物質の量を測定することができる。この際、物質分析部の抗体あるいは微粒子の量を調節することにより、細胞からの産生物質の全てが微粒子上に捕捉される様に設定することができる。
【0018】
基板の材質としては、合成石英基板や強化ガラス製の基板を初め、シリコン基板、耐薬品性のあるプラスチックなどを用いることができる。
そのような基板に流路、細胞培養部、物質分析部及び貫通穴を形成するには、半導体製造技術を基盤とするマイクロマシニング技術を用いることができる。
【0019】
雑菌による汚染を防ぐには、プラスチック等の樹脂成形品であればエチレンオキサイドガス滅菌や放射線滅菌を、ガラス製のチップであればオートクレーブを行なうことで滅菌処理を行い、以後クリーンベンチ等の雑菌がいない環境下でマイクロチップを扱えばよい。
【0020】
細胞培養部に導入される微粒子はその直径が1mm以下、例えば10〜300μm、より好ましくは、例えば20〜200μmであり、評価する細胞の大きさにより適宜選択できる。細胞を捕捉しやすくするためには、細胞の接着力を高める材質から成ることが好ましい。
【0021】
該微粒子の材質としては、例えば、ポリスチレン、リン酸カルシウム(チタン)、アルギン酸、ポリ(乳酸-グリコール酸)、キトサン、ポリビニルアルコール、カルシウムカ
ーボネート、ハイドロキシアパタイト、磁性微粒子、セルロース、コラーゲン、ポリ(メチルメタクリレート)、セファデックス、ポリ(ビニル-ピリジン)、デキストラン、ア
ガロースなどが挙げられる。
【0022】
また、細胞付着を促進する様な表面修飾をこれらの微粒子に施すことが可能であり、そのような修飾材料としてはコラーゲンI、コラーゲンIII、コラーゲンIV、コラーゲンV、ポリ−L−リシン、ポリ−D−リシン、マトリゲル、フィブロネクチン、ラミニン、セルタック、ビトロネクチン、アタチンなどが挙げられる。当該修飾材料のうち、目的とする細胞の培養に最も適したものを用いればよいが、例えば肝細胞であるHepG2細胞の場
合は、コラーゲンI、コラーゲンIII、コラーゲンIV、コラーゲンVが好ましい。
【0023】
上記の微粒子に対して細胞を接着させるには、細胞懸濁液に対して一定量の上記微粒子を添加した後、2時間〜1晩の間撹拌培養を行えばよい。撹拌培養終了後は、細胞が接着した微粒子を、ろ紙や膜を用いてろ過することにより、微粒子に接着しなかった細胞を除去することができる。微粒子に接着した細胞数は、トリプシン処理などにより剥がした後、血球計算板を用いて測定できる。或いは、3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2H tetrazolium bromide(MTT)や2-(2-methoxy-4-nitrophenyl)-3-(4-nitrophenyl)- 5-(2,4-disulfophenyl)-2H- tetrazolium, monosodium salt(WST−8)などの発色試薬
を、細胞が接着した微粒子溶液に対して37℃にて1〜3時間一定量添加し、生成したホルマゾン色素の吸光度を測定することにより細胞数を計測することができる。
また、発色法と同様に、2',7'-bis-(carboxyethyl)-5-(and-6)-carboxyfluorescein)やアラマーブルー等の蛍光色素を微粒子溶液に添加し、蛍光強度を測定することにより細胞数を測定することができる。
【0024】
抗体を流路壁面或いは微粒子に固定化させるには、物理的あるいは化学的方法を用いればよい。物理的方法の例としては、流路内あるいは微粒子に抗体溶液を設置し、37℃にて2〜3時間あるいは4℃にて一晩放置すればよい。化学的方法の例としては、流路或いは微粒子の表面にカルボキシル其或いはアミノ其等の官能其を導入し、共有結合を介して抗体を固定化させればよい。
【0025】
本発明の実施の形態について以下に説明する。
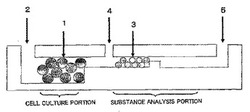
まず、本発明のマイクロチップの構成は、たとえば図1に沿って例示説明することができる。図1に示したように、本発明のマイクロチップは、細胞を接着させた直径1mm以下の微粒子(1)とともに、この微粒子(1)の径よりも大きい最小幅を有する微粒子及び溶液の導入部(2)と前記微粒子(1)の径よりも小さい幅を有する分離部とを備える前記細胞培養部を有し、細胞から分泌される抗原を捕捉する抗体を固定化した微粒子(3)と標識抗体や抗原抗体反応試薬を別々に前記物質分析部へと導く導入部(4)を有している。
また、図1の例では、物質分析部の端部には、廃液部(5)が設けられている。
【0026】
抗体を固定化した微粒子(3)は、免疫抗原抗体反応のための反応固相としての役割を果たすものであって、たとえばガラスビーズ、あるいはポリスチレン等の高分子ビーズ等が用いられる。この微粒子(3)は、この発明のマイクロチップにおいては、直径が1mm以下、たとえば15〜85μm、好ましくは直径40〜65μmのものとして用いられる。
導入部(2)と(4)への溶液または微粒子の導入には、分析用のクロマトグラフィーに用いられるポンプやシリンジポンプが利用できる。さらに、流路への導入前にチェック
バルブシステムを設けることにより、様々な試薬やサンプルの導入の切り換えを行うことができる。これらにより、各溶液、試薬、サンプル及び微粒子の導入とそれに伴う反応を全て機械により自動化することができる。
【0027】
抗原抗体反応の結果得られた発色光分析については、たとえばその代表例としては特開2001−4628号公報にて記述されているような熱レンズ顕微鏡による分析がある。この分析は、反応生成物が吸着されている微粒子(3)に対して直接行われもよいし、物質分析部以降の流路に対して行われてもよい。また、熱レンズ顕微鏡による分析以外に、蛍光分析や化学発光分析などにより測定できる。
【0028】
図2には多数のサンプルを測定する際の例を挙げる。
図2に示したように、本発明のマイクロチップは、一つの基板に対して一つまたは二つ以上の前記の流路構成を形成したものとしてもよいし、あるいは、一つの細胞培養部に対して一つまたは二つ以上の物質分析部を接続させたものとしてもよい。また、細胞培養部を有するマイクロチップ流路の出口と物質分析部を有するマイクロチップ流路の入り口とを外部のチューブなどにより連結し、一連の測定を行うこともできる。この際には、細胞培養部と物質分析部の温度調節を別個に行うことが容易となる。
いずれの場合においても本発明のマイクロチップによって、簡便に短い反応時間で薬剤に対する細胞応答の評価が可能となる。
【0029】
細胞応答の評価の方法としては、例えば、つぎのような方法が挙げられる。
予め細胞を付着させた微粒子(1)を細胞培養部に、評価対象となる細胞産生物質に対する抗体を固定化した微粒子(3)を分析部にそれぞれ導入し、つぎに、導入部(2)より、薬剤を添加した培地を連続的に導入し、生じた培養液をそのまま微粒子(3)へと導き、培養液中の目的の細胞産生物質を微粒子(3)上に捕捉する。その後、流入部(4)より標識抗体及び発色試薬を導入して抗体の微粒子(3)上での反応を行い、生じた溶液をそのまま物質分析部に流し、該溶液について熱レンズ顕微鏡などにより発色を分析する。
【0030】
発色試薬を利用する際の標識抗体としては、代表的には、西洋わさび由来ペルオキシゾーム(HRP)標識抗体が適当なものとして例示される。また、場合により金コロイドや蛍
光標識抗体も利用できるが、その際は微粒子(3)に対して直接分析を行えばよい。
【0031】
抗原抗体反応の測定終了後、導入部(2)より細胞数測定に用いられる発色試薬を導入し、導入部(4)から流出する溶液の発色を吸光光度計などにより検出することにより、細胞培養部の細胞数を測定することが可能である。
以上のとおり本発明によって、細胞培養と細胞分泌物質の測定及び細胞数の測定を簡便に、短時間で、しかも高精度で行うことができる。
【実施例】
【0032】
以下に実施例を示し本発明を更に詳細に説明するが、本発明はこれら実施例に限定されるものではない。
試験例1 肝細胞より分泌されるアポリポ蛋白質の定量
本発明のマイクロチップを用いて、ヒト肝癌由来のHepG2細胞からのApoA1の薬剤による分泌誘導を測定した。実験に用いたマイクロチップは、深さ100μm、幅200μmのマイクロチャンネル流路を有し、細胞培養部では導入部の深さ300μm、出口の深さ100μm、幅200μmであり、物質分析部では深さ15μmのマイクロチャンネル分離部を強化ガラス基板内に作製したものであり、微粒子を捕捉できる構造を有している。
【0033】
(1)細胞及び培養
HepG2細胞を10%ウシ胎児血清(FCS)含有Dulbecco's Modified Eagle's Medium(DMEM)−低グルコース培地に懸濁させ、0.4g/mLの濃度のコラーゲンコートマイクロキャリアー(SOLOHILL ENGINEERING,INC.製、平均直径108μm、以下キ
ャリアー)と共に2×106cells/mL(10ml)の濃度で20mL容ビーカーに添加し、37℃で一晩撹拌培養した。培養終了後、セルストレーナー(70μmナイロンメッシュ、BDファルコン社製)によりキャリアーをろ過し、本キャリアーを培地にて洗浄して再懸濁した。さらに、細胞が付着したキャリアー懸濁液の一部を分注し、WST-8試薬(岸
田化学社製)を用いて、添付の説明書に従い細胞数の測定を行った。すなわち、キャリアー懸濁液を適宜希釈した溶液100μLに10μLの5 mMのWST-8試薬溶液を添加し、3
7℃にて2時間加温した。生成したホルマザン色素は96穴マイクロプレートリーダー(BIORAD社製)を用いて450 nmの吸光度を測定した。細胞数測定後、細胞数が1×104cells/流路となるようにキャリアー懸濁液(約2000個/流路)を前記のマイクロチ
ップ細胞培養部に注入した後、マイクロシリンジポンプを用いて流速0.5μL/分にて前記培地を37℃、1時間導入して、微粒子に接着していない細胞を細胞培養部から除去した。
【0034】
(2)薬剤添加及びApoA1−ELISA
抗ヒトApoA1モノクローナル抗体HDL110(MABTECH社製)を、直径25μmポリスチレンビーズ(フナコシ社製)/PBS(phosphate buffered saline)溶液に添加し、4℃にて18時間放置した。PBSにて洗浄した後
、1%。BSA(ウシ血清アルブミン)を添加し、室温中、1.5時間放置した。本抗体結合ビーズを0.05%Tween20含有PBS(PBS−T)で洗浄した後、再度PBS−Tに懸濁した。本抗体ビーズ溶液を上記細胞培養が終了したマイクロチップの物質分析部に注入し(約10000個/流路)、引き続きApoA1分泌促進効果が報告されている薬剤(特開2002−053557号公報記載の実施例番号27番化合物(以下、化合物1と称す。))を適宜培地にて希釈した溶液を、流速0.5μL/分にて37℃、17時間導入した。この際、細胞培養液へと導入された溶液は、全て物質分析部にある抗体ビーズを経由して排出した。導入終了後、流速0.5μL/分にて0.5 mMのWST-8試
薬溶液を37℃、1時間導入し、生成したホルマザン色素を96穴マイクロプレートリーダー(BIORAD社製)を用いて450 nmの吸光度を計測し、各流路あたりの細胞数を測定
した。物質分析部においては、PBS−Tで抗体ビーズを洗浄した後、ビオチン標識された抗ヒトApoA1モノクローナル抗体HDL44(MABTECH社製)を流速1μL/分にて前記培地を37℃、10分間導入し、PBS−Tで洗浄した。さらに、ストレプトアビジン−horseradish peroxidase(HRP)を同上条件にて
導入し、PBS−Tで洗浄した。引き続き、ABTS溶液(シグマ社製)を発色基質として流速1μL/分にて導入し、生成した発色物を特開2000−356611号公報及び特開2001−4628号公報にて記述されているような方法を用いて熱レンズ顕微鏡にて測定した。すなわち、抗体ビーズより1cm下流の流路に対して633nmの励起光を照射し、熱レンズ信号を488nmのプローブ光にて発色物を検出した。なお、標準曲線用にはPBS−Tで希釈した精製ヒトApoA1(ALP10;Chemicon inte
rnational社製)を用いた。
【0035】
(3)薬剤に対する応答の評価
HepG2細胞より培地中に分泌されたApoA1の量を細胞数(450 nmの吸光度
)で補正した後、コントロールに対する変化量(% of control)を算出し、上記薬剤によるApoA1の産生促進作用を評価した。その結果を第1表に示した。
第1表
───────────────────────────
DMSO 化合物1(μM)
10 100
───────────────────────────
変化量(%) 100 130 200
───────────────────────────
第1表に示したように、本発明のマイクロチップを用いることにより細胞への薬剤刺激に基づくApoA1の分泌促進が有効に評価できることが明らかとなった。
【0036】
試験例2 腸管細胞より分泌されるアポリポ蛋白質の定量
本発明のマイクチップを用いて、ヒト結腸癌由来のCaco−2細胞からのApoBの分泌量を測定した。実験に用いたマイクロチップは細胞培養用チップと物質分析用チップの2種類であり、両者共に深さ100μm、幅200μmのマイクロチャンネル流路を有する。細胞培養用チップは導入部に深さ300μm、出口の深さ100μm、幅200μmの細胞培養部を有し、物質分析用チップは物質分析部として深さ15μmのマイクロチャンネル分離部を強化ガラス基板内に作製したものであり、微粒子を捕捉できる構造を有している。
【0037】
(1)細胞及び培養
Caco−2細胞を10%ウシ胎児血清(FBS)含有RPMI−1640培地(コージンバイオ社製)に懸濁させ、0.4g/mLの濃度のコラーゲンコートマイクロキャリアー(SOLOHILL ENGINEERING,INC.製、平均直径108μm、以下キャリアー)と共に6
×106cells/mL(10ml)の濃度で20mL容ビーカーに添加し、37℃で1週間撹拌培養した。培養終了後、キャリアー懸濁液(約2000個/流路)を前記の細胞培養用チップの細胞培養部に注入した後、マイクロシリンジポンプを用いて流速0.2μL/分にて前記培地を37℃にて導入した。この際、細胞が付着していないキャリアーを無細胞コントロールとして別の細胞培養部に注入し、同様に前記培地を導入した。
【0038】
(2)ApoB−ELISA
抗ヒトApoBモノクローナル抗体2−B4(Intracell社製)を、直径25μmポリスチレンビーズ(フナコシ社製)/PBS(phosphate buffered saline)溶液に添加し、4℃にて18時間放置した。PBSにて洗浄した後、
1%BSA(ウシ血清アルブミン)を添加し、室温中、1.5時間放置した。本抗体結合ビーズを0.05%Tween20含有PBS(PBS−T)で洗浄した後、再度PBS−Tに懸濁した。ApoB生産量を測定する際には、本抗体ビーズ溶液を物質分析用チップの物質分析部に注入し(約10000個/流路)、引き続き細胞培養チップの流路出口と物質分析用チップ入口とをキャピラリーチューブで連結し、流速0.5μL/分、37℃にて、17時間FBSを含まないRPMI−1640培地を細胞培養用チップから導入した。この際、細胞培養液へと導入された溶液は、全て物質分析用チップの流路内にある抗体ビーズを経由して排出した。導入終了後、物質分析部においては、PBS−Tで抗体ビーズを洗浄した後、Horseradish peroxidase(HRP)標識さ
れた抗ヒトApoBポリクローナル抗体(The Binding Site社製)を流速5μL/分にて室温、10分間導入し、PBS−Tで洗浄した。引き続き、TMB溶液(シグマ社製)を発色基質として流速5μL/分にて室温、20分間導入し、溶出液100μLの吸光度(650nm)を96穴マイクロプレートリーダー(日本モレキュラーデバイス社製)にて測定した。
【0039】
(3)経時的ApoB生産の評価
キャリアーに付着したCaco−2細胞より培地中に分泌されたApoBの量を、無細胞コントロールに対する相対吸光強度(% of control)から算出し、培養時間あたりに生産されたApoBの量を評価した。その結果を第2表に示した。
第2表
─────────────────────────────
Control 細胞培養液
培養時間(日)
7 18
─────────────────────────────
変化量(%) 100 70 600
─────────────────────────────
第2表に示したように、本発明のマイクロチップを用いることによりCaco−2細胞から分泌されるApoB量の培養時間あたりの生産量が有効に評価できることが明らかとなった。
【産業上の利用可能性】
【0040】
本発明のマイクロチップは、細胞培養と細胞から分泌される物質の分析が連続的に行うことが可能なため、細胞の機能や薬剤に対する応答を評価する器具として有用である。
【図面の簡単な説明】
【0041】
【図1】本発明のマイクロチップの横断図である。
【図2】本発明のマイクロチップの上面図である。
【符号の説明】
【0042】
1 細胞保持微粒子
2 細胞、培地及びサンプル導入部
3 抗体保持微粒子
4 抗体及び試薬導入部
5 廃液部
【技術分野】
【0001】
本発明は、創薬やバイオテクノロジーの研究などに用いられ、特に細胞を培養しその機能や応答を評価するのに用いられるマイクロチップに関する。
【背景技術】
【0002】
医薬品、農薬などの創薬や食品検査、診断、遺伝子工学等の分野において、細胞を用いた評価が幅広く行われている。従来より、細胞の機能や応答を評価する場合には、細胞はシャーレなどに入れられた培地等により培養され、様々な実験に用いられている。しかし、数多くの薬品や導入物質による反応を調べる場合には、細胞の特定の反応を効率よく、短時間で多種類の分析を行い、しかもより少ない試料で結果が得られる評価方法が望まれていた。
【0003】
このような状況において、マイクロチップと呼ばれるガラス等の基板上で保持した細胞の化学反応を観察あるいは測定する試みは、操作の簡便化・自動化による分析時間の短縮などのメリットをもたらすと期待され、近年盛んに行われてきている。マイクロチップを利用したシステムの利点としては、サンプルや試薬の使用量あるいは廃液の排出量が軽減され、省スペースで持ち運び可能な安価なシステムの実現が考えられている。実際にこのような利点を活かし、流路壁面に細胞を付着させたマイクロチップを用いて細胞の機能や応答を評価する研究もなされている。(例えば、非特許文献1及び非特許文献2、特許文献1参照。)
【非特許文献1】Analytical Chemistry 2005:77,p.2125-2131
【非特許文献2】Analytical Chemistry 2005:77,p.667-672
【特許文献1】特開2003−294741号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかしながら、従来のマイクロチップを用いた細胞培養では、基板の材料が細胞の接着に最適なものではなく、さらに極微量の溶液中では微弱な流れの影響が大きいためマイクロ流路内において細胞が流路壁面に効率的に接着せず、流路内に一定数の細胞を一定の領域に保持することが困難であった。流路内面を化学的または物理的に修飾する手法によって細胞の接着を促進する方法もあるが、この場合には流路壁面がすべて修飾されるため、目的とする場所のみで細胞を培養することが困難であったり、様々な種類の細胞にとって最適である流路表面を有したマイクロチップを細胞の種類毎に作製しなければならないといった問題がある。この際、細胞接着に適した材料を用いて微細加工を施し、細密なマイクロチップ流路を作成することは困難である。また、細胞機能や応答評価の前後に、流路内に接着した細胞数を測定する際には、一定領域の流路内の細胞数を発色試薬などで測定できない場合は顕微鏡で数える必要があり、煩雑で時間がかかることに問題があった。さらに、マイクロチップ流路内の表面積が少ないため、流路壁面の一定領域内に接着できる細胞数を増やすことが困難であった。
【0005】
本発明の目的は、簡便かつ効率的な手段によって細胞をマイクロチップ流路内に特定の場所で定量的に保持し、この場所で細胞培養とその後の細胞機能評価を行うことができるようにしたマイクロチップを提供することである。
【課題を解決するための手段】
【0006】
本発明は、
(1) 細胞が接着した微粒子を保持できる細胞培養部を有することを特徴とする細胞応答
評価用マイクロチップ。
(2) マイクロチップ内部に形成され液体を流すことのできる流路と、前記流路の両端部
につながる液出入口とを有し、前記流路の内部に直径1mm以下の微粒子を保持できる細胞培養部を有することを特徴とする(1)記載のマイクロチップ。
(3) 細胞培養部の流路後半に細胞の分泌物を測定するための物質分析部を有する(1)または(2)記載のマイクロチップ。
(4) (1)または(2)記載のマイクロチップの流路の出口と、物質分析部を有するマイクロチップの流路の入り口とを、外部のチューブにて連結させたマイクロチップ。
(5) (3)または(4)記載のマイクロチップを用いた細胞の分泌物の測定方法。
(6) (3)または(4)記載の物質分析部において酵素免疫定量を行うことによる細胞分泌物の測定方法。
(7) マイクロチップの流路に液体を連続的に流しながら測定する(5)または(6)記載の測
定方法。
(8) 細胞分泌物がアポリポ蛋白質A1である(5)ないし(7)の何れか1つに記載の測定方
法。
(9) 細胞分泌物がアポリポ蛋白質Bである(5)ないし(7)の何れか1つに記載の測定方法
。
(10) (5)ないし(7)の何れか1つに記載の測定方法を用いる、細胞の分泌物の量を変化
させる活性を有する薬剤のスクリーニング方法。
(11) 細胞分泌物がアポリポ蛋白質A1である(10)記載の薬剤のスクリーニング方法。
(12) 細胞分泌物がアポリポ蛋白質Bである(10)記載の薬剤のスクリーニング方法。
(13) 細胞がHepG2細胞である(11)記載の薬剤のスクリーニング方法。
(14) 細胞がCaco−2細胞である(12)記載の薬剤のスクリーニング方法。
に関する。
【0007】
本発明のマイクロチップは、基板に流路その他の溶液の反応や処理に必要な部分が形成されているものを指しており、大きさに関しては特に制約はない。
本発明は、流路中に細胞培養部を設け、その出口の幅を細胞付着が可能である微粒子の最大直径よりも十分に小さくすることにより、細胞を付着させた微粒子を細胞培養部に充填した際にその微粒子の細胞培養部外への流出を抑制して、マイクロチップ中の一定の領域で細胞培養や薬剤添加等の処理をできるようにしたものである。さらに、細胞培養部以降の流路に物質分析部を設けることにより、細胞培養部にて細胞から分泌された物質を連続的に測定できるようにしたものである。
【0008】
物質分析部は、細胞培養部にて細胞が産生した物質を高感度で、選択的に検出できるものであればよく、方法に関しては特に制約はない。
すなわち、本発明のマイクロチップは、基板内部に形成され液体と微粒子を流すことのできる流路と、その流路の両端部につながる液出入口と、基板内部で前記流路の途中に設けられ、細胞を付着した微粒子を捕捉することが可能である細胞培養部と、それと一つの流路にて接続された物質分析部とを基板に一体的に備えたものである。さらに、本発明は、前記細胞培養部を有するマイクロチップの流路と物質分析部を有する異なるマイクロチップの流路とをチューブにて連結させたマイクロチップをも含む。
【発明の効果】
【0009】
細胞培養部は溶液または微粒子が流れる流路に対してより大きな容量となる様に設定できるため、細胞を接着させた微粒子を数多く保持することができる。このため、流路壁面に細胞を接着させた場合に比べて、より数多くの細胞を細胞培養部に保持することが可能となる。また、微粒子に接着している細胞数を予め測定しておけば、細胞培養部に導入する微粒子の数を調整する事により、一定数の細胞を目的の数で、一定の領域に保持することが可能となる。この際、微粒子上の細胞数の測定には発色法や蛍光法を用いることが可
能であるため、細胞数の測定は顕微鏡観察などに比べて容易である。また、細胞培養部は内部に微粒子が充填されているため、導入された溶液は乱流となって撹拌され、細胞培養部内に保持された細胞に対して薬剤などのサンプルを効率的に作用させることができる。さらに、微粒子は細胞の接着に適した様々な材料よりなるものを予め選択できるので、マイクロチップの流路壁面を修飾する方法では培養できないような細胞の保持と培養が可能である。
【0010】
更に、本発明のマイクロチップは、細胞培養部と物質分析部が一つの流路にて接続されているため、細胞培養部にて細胞から分泌された物質は流路内の液体の流れに乗って直接物質分析部へと運ばれて捕捉される。これにより、液体の流れの無い静置条件を用いるマイクロタイタープレートのような機器からは得られない、以下に示す優れた効果を示しうる。
1.細胞培養部にて分泌された物質が細胞培養部内で飽和してフィードバックによる分泌阻害が起こることを避けられる。
2.分泌された物質が再び細胞へと吸着或いは吸収されることが無く、細胞から分泌される物質の全てを分析することができる。
3.単位時間あたりの物質分泌を測定するのが容易である。
4.流体によるせん断応力に応答して細胞から分泌される物質を分析することが容易である。
【0011】
これにより、例えば、アポリポ蛋白質A1(以下、ApoA1)の受容体を細胞表面に発現しているため、静置条件ではApoA1が再び細胞へと吸着されると考えられるHepG2細胞からのApoA1蛋白質の分泌を容易に測定することができる。
同様に、ヒト結腸癌由来のCaco−2細胞からのアポリポ蛋白質B(以下、ApoB)の分泌量も容易に測定できる。
また、特定の刺激に対して一過性の発現・分泌を示す物質(例えばβ細胞から分泌されるインスリン)等の分泌も容易に測定することができる。
さらに、流路内の流速を変化させることが容易であるため、せん断応力に依存して分泌される物質(例えば、血管内皮細胞から分泌される一酸化窒素)等も容易に測定できる。
そして、上記のような測定は、液体の流れの無い静置条件を用いる既存の機器では達成することができないものであった。
【発明を実施するための最良の形態】
【0012】
以下、更に詳細に本発明を説明する。
本発明のマイクロチップにより細胞応答を評価しうる細胞としては、例えば、動物細胞、植物細胞、細菌、カビ、酵母、ウイルス等が挙げられるが、これらの中でも、特に医薬品等の薬剤のスクリーニングに用いる際には動物細胞が好ましい。動物細胞とは、ヒトを含む動物体内の臓器、組織等の生体組織から摘出される細胞をいい、生体組織から得られる細胞であれば特に制限はない。当該細胞としては、例えば、上皮細胞、内皮細胞、間充織細胞または血球細胞等を挙げることができ、上皮細胞としては、例えば、表皮細胞、毛乳頭細胞、角膜上皮細胞、肺胞上皮細胞、消化器系の粘膜上皮細胞、腎臓子球体上皮細胞又は肝実質細胞等を、内皮細胞としては、例えば、腎臓子球体毛細胞、血管内皮細胞、肺動脈血管内皮細胞、胎盤静脈血管内皮細胞又は大動脈血管内皮細胞等を、間充織細胞としては、例えば、線維芽細胞、血管平滑筋細胞、筋細胞、脂肪細胞、グリア細胞、シュワン細胞又は神経細胞等を、血球細胞としてはマクロファージ等を具体的に例示することができる。
【0013】
薬剤の評価には、初代培養技術が応用可能な正常組織由来細胞および樹立細胞が用いられるが、より好ましくは樹立細胞が用いられる。肝細胞の樹立細胞株としては、特に好ましい細胞株としてFLC−1、FLC−2、FLC−3、FLC−4、FLC−5、FL
C−6、FLC−7、HuH−6、HuH−7、C3A、HLE、HLF、HepG2細胞等を挙げることができる。
また、腸管細胞の樹立細胞株としては、特に好ましい細胞としてHT−29、IEC−6、Caco−2細胞等を挙げることができる。
【0014】
細胞培養部に細胞を付着させた微粒子を捕捉するためには、細胞培養部の溶液及び微粒子の導入口の最小幅を微粒子の最大直径より大きくし、出口の幅を微粒子の最大直径より小さくすればよい。このようにすることによって、細胞が接着する場としての微粒子は、細胞培養部以降に流入することはなく、せき止められることになる。そして必要に応じて、微粒子から脱着された細胞、その分解物、或いはその分泌物のみが細胞培養部以降に流入することができるようになる。
【0015】
細胞培養部と一つの流路で繋がった物質分析部において目的の細胞産生物の量を測定するには、抗原抗体反応、マイクロチップ電気泳動、質量分析などを用いることができる。また、目的の蛋白質を蛍光、アイソトープ、酵素、金コロイド、オリゴヒスチジンタグ、ストレプトアビジン、ビオチンなどで標識し、特異的に検出する方法も有効である。
【0016】
物質分析部にて抗原抗体反応を実施するためには、物質分析部の流路内に、細胞産生物質を抗原として認識する抗体を予め固定化し、細胞培養部から流れた細胞産生物質を特異的に捕捉すればよい。抗体は流路壁面に直接固定化させるか、抗体を予め固定化した担体を流路に保持させればよい。
【0017】
担体を用いて抗体を固定化させた例として、特開2001−4628号公報にて記述されているような抗原抗体反応を行うための構造と方法を用いることができる。すなわち、細胞産生物質を抗原として認識する抗体を微粒子上に固定化し、該抗体固定化微粒子を、物質分析部の溶液及び微粒子の導入口の最小幅を微粒子の最大直径より大きくし、流路内あるいは出口の幅を微粒子の最大直径より小さくすることによりせき止め、その微粒子に固定化された抗体に対して細胞培養部から流れた細胞産生物質が特異的に捕捉されればよい。抗体に捕捉された細胞産生物質の量を測定するには、該物質を抗原として認識する抗体を酵素、蛍光物質、アイソトープあるいは金コロイドなどで予め標識しておき、該標識抗体を物質分析部に導入すればよい。その後、酵素によって発色する基質を導入してその発色量を測定したり、蛍光発色や金コロイドの光吸収を直接分析することにより、微粒子上に捕捉された該物質の量を測定することができる。この際、物質分析部の抗体あるいは微粒子の量を調節することにより、細胞からの産生物質の全てが微粒子上に捕捉される様に設定することができる。
【0018】
基板の材質としては、合成石英基板や強化ガラス製の基板を初め、シリコン基板、耐薬品性のあるプラスチックなどを用いることができる。
そのような基板に流路、細胞培養部、物質分析部及び貫通穴を形成するには、半導体製造技術を基盤とするマイクロマシニング技術を用いることができる。
【0019】
雑菌による汚染を防ぐには、プラスチック等の樹脂成形品であればエチレンオキサイドガス滅菌や放射線滅菌を、ガラス製のチップであればオートクレーブを行なうことで滅菌処理を行い、以後クリーンベンチ等の雑菌がいない環境下でマイクロチップを扱えばよい。
【0020】
細胞培養部に導入される微粒子はその直径が1mm以下、例えば10〜300μm、より好ましくは、例えば20〜200μmであり、評価する細胞の大きさにより適宜選択できる。細胞を捕捉しやすくするためには、細胞の接着力を高める材質から成ることが好ましい。
【0021】
該微粒子の材質としては、例えば、ポリスチレン、リン酸カルシウム(チタン)、アルギン酸、ポリ(乳酸-グリコール酸)、キトサン、ポリビニルアルコール、カルシウムカ
ーボネート、ハイドロキシアパタイト、磁性微粒子、セルロース、コラーゲン、ポリ(メチルメタクリレート)、セファデックス、ポリ(ビニル-ピリジン)、デキストラン、ア
ガロースなどが挙げられる。
【0022】
また、細胞付着を促進する様な表面修飾をこれらの微粒子に施すことが可能であり、そのような修飾材料としてはコラーゲンI、コラーゲンIII、コラーゲンIV、コラーゲンV、ポリ−L−リシン、ポリ−D−リシン、マトリゲル、フィブロネクチン、ラミニン、セルタック、ビトロネクチン、アタチンなどが挙げられる。当該修飾材料のうち、目的とする細胞の培養に最も適したものを用いればよいが、例えば肝細胞であるHepG2細胞の場
合は、コラーゲンI、コラーゲンIII、コラーゲンIV、コラーゲンVが好ましい。
【0023】
上記の微粒子に対して細胞を接着させるには、細胞懸濁液に対して一定量の上記微粒子を添加した後、2時間〜1晩の間撹拌培養を行えばよい。撹拌培養終了後は、細胞が接着した微粒子を、ろ紙や膜を用いてろ過することにより、微粒子に接着しなかった細胞を除去することができる。微粒子に接着した細胞数は、トリプシン処理などにより剥がした後、血球計算板を用いて測定できる。或いは、3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2H tetrazolium bromide(MTT)や2-(2-methoxy-4-nitrophenyl)-3-(4-nitrophenyl)- 5-(2,4-disulfophenyl)-2H- tetrazolium, monosodium salt(WST−8)などの発色試薬
を、細胞が接着した微粒子溶液に対して37℃にて1〜3時間一定量添加し、生成したホルマゾン色素の吸光度を測定することにより細胞数を計測することができる。
また、発色法と同様に、2',7'-bis-(carboxyethyl)-5-(and-6)-carboxyfluorescein)やアラマーブルー等の蛍光色素を微粒子溶液に添加し、蛍光強度を測定することにより細胞数を測定することができる。
【0024】
抗体を流路壁面或いは微粒子に固定化させるには、物理的あるいは化学的方法を用いればよい。物理的方法の例としては、流路内あるいは微粒子に抗体溶液を設置し、37℃にて2〜3時間あるいは4℃にて一晩放置すればよい。化学的方法の例としては、流路或いは微粒子の表面にカルボキシル其或いはアミノ其等の官能其を導入し、共有結合を介して抗体を固定化させればよい。
【0025】
本発明の実施の形態について以下に説明する。
まず、本発明のマイクロチップの構成は、たとえば図1に沿って例示説明することができる。図1に示したように、本発明のマイクロチップは、細胞を接着させた直径1mm以下の微粒子(1)とともに、この微粒子(1)の径よりも大きい最小幅を有する微粒子及び溶液の導入部(2)と前記微粒子(1)の径よりも小さい幅を有する分離部とを備える前記細胞培養部を有し、細胞から分泌される抗原を捕捉する抗体を固定化した微粒子(3)と標識抗体や抗原抗体反応試薬を別々に前記物質分析部へと導く導入部(4)を有している。
また、図1の例では、物質分析部の端部には、廃液部(5)が設けられている。
【0026】
抗体を固定化した微粒子(3)は、免疫抗原抗体反応のための反応固相としての役割を果たすものであって、たとえばガラスビーズ、あるいはポリスチレン等の高分子ビーズ等が用いられる。この微粒子(3)は、この発明のマイクロチップにおいては、直径が1mm以下、たとえば15〜85μm、好ましくは直径40〜65μmのものとして用いられる。
導入部(2)と(4)への溶液または微粒子の導入には、分析用のクロマトグラフィーに用いられるポンプやシリンジポンプが利用できる。さらに、流路への導入前にチェック
バルブシステムを設けることにより、様々な試薬やサンプルの導入の切り換えを行うことができる。これらにより、各溶液、試薬、サンプル及び微粒子の導入とそれに伴う反応を全て機械により自動化することができる。
【0027】
抗原抗体反応の結果得られた発色光分析については、たとえばその代表例としては特開2001−4628号公報にて記述されているような熱レンズ顕微鏡による分析がある。この分析は、反応生成物が吸着されている微粒子(3)に対して直接行われもよいし、物質分析部以降の流路に対して行われてもよい。また、熱レンズ顕微鏡による分析以外に、蛍光分析や化学発光分析などにより測定できる。
【0028】
図2には多数のサンプルを測定する際の例を挙げる。
図2に示したように、本発明のマイクロチップは、一つの基板に対して一つまたは二つ以上の前記の流路構成を形成したものとしてもよいし、あるいは、一つの細胞培養部に対して一つまたは二つ以上の物質分析部を接続させたものとしてもよい。また、細胞培養部を有するマイクロチップ流路の出口と物質分析部を有するマイクロチップ流路の入り口とを外部のチューブなどにより連結し、一連の測定を行うこともできる。この際には、細胞培養部と物質分析部の温度調節を別個に行うことが容易となる。
いずれの場合においても本発明のマイクロチップによって、簡便に短い反応時間で薬剤に対する細胞応答の評価が可能となる。
【0029】
細胞応答の評価の方法としては、例えば、つぎのような方法が挙げられる。
予め細胞を付着させた微粒子(1)を細胞培養部に、評価対象となる細胞産生物質に対する抗体を固定化した微粒子(3)を分析部にそれぞれ導入し、つぎに、導入部(2)より、薬剤を添加した培地を連続的に導入し、生じた培養液をそのまま微粒子(3)へと導き、培養液中の目的の細胞産生物質を微粒子(3)上に捕捉する。その後、流入部(4)より標識抗体及び発色試薬を導入して抗体の微粒子(3)上での反応を行い、生じた溶液をそのまま物質分析部に流し、該溶液について熱レンズ顕微鏡などにより発色を分析する。
【0030】
発色試薬を利用する際の標識抗体としては、代表的には、西洋わさび由来ペルオキシゾーム(HRP)標識抗体が適当なものとして例示される。また、場合により金コロイドや蛍
光標識抗体も利用できるが、その際は微粒子(3)に対して直接分析を行えばよい。
【0031】
抗原抗体反応の測定終了後、導入部(2)より細胞数測定に用いられる発色試薬を導入し、導入部(4)から流出する溶液の発色を吸光光度計などにより検出することにより、細胞培養部の細胞数を測定することが可能である。
以上のとおり本発明によって、細胞培養と細胞分泌物質の測定及び細胞数の測定を簡便に、短時間で、しかも高精度で行うことができる。
【実施例】
【0032】
以下に実施例を示し本発明を更に詳細に説明するが、本発明はこれら実施例に限定されるものではない。
試験例1 肝細胞より分泌されるアポリポ蛋白質の定量
本発明のマイクロチップを用いて、ヒト肝癌由来のHepG2細胞からのApoA1の薬剤による分泌誘導を測定した。実験に用いたマイクロチップは、深さ100μm、幅200μmのマイクロチャンネル流路を有し、細胞培養部では導入部の深さ300μm、出口の深さ100μm、幅200μmであり、物質分析部では深さ15μmのマイクロチャンネル分離部を強化ガラス基板内に作製したものであり、微粒子を捕捉できる構造を有している。
【0033】
(1)細胞及び培養
HepG2細胞を10%ウシ胎児血清(FCS)含有Dulbecco's Modified Eagle's Medium(DMEM)−低グルコース培地に懸濁させ、0.4g/mLの濃度のコラーゲンコートマイクロキャリアー(SOLOHILL ENGINEERING,INC.製、平均直径108μm、以下キ
ャリアー)と共に2×106cells/mL(10ml)の濃度で20mL容ビーカーに添加し、37℃で一晩撹拌培養した。培養終了後、セルストレーナー(70μmナイロンメッシュ、BDファルコン社製)によりキャリアーをろ過し、本キャリアーを培地にて洗浄して再懸濁した。さらに、細胞が付着したキャリアー懸濁液の一部を分注し、WST-8試薬(岸
田化学社製)を用いて、添付の説明書に従い細胞数の測定を行った。すなわち、キャリアー懸濁液を適宜希釈した溶液100μLに10μLの5 mMのWST-8試薬溶液を添加し、3
7℃にて2時間加温した。生成したホルマザン色素は96穴マイクロプレートリーダー(BIORAD社製)を用いて450 nmの吸光度を測定した。細胞数測定後、細胞数が1×104cells/流路となるようにキャリアー懸濁液(約2000個/流路)を前記のマイクロチ
ップ細胞培養部に注入した後、マイクロシリンジポンプを用いて流速0.5μL/分にて前記培地を37℃、1時間導入して、微粒子に接着していない細胞を細胞培養部から除去した。
【0034】
(2)薬剤添加及びApoA1−ELISA
抗ヒトApoA1モノクローナル抗体HDL110(MABTECH社製)を、直径25μmポリスチレンビーズ(フナコシ社製)/PBS(phosphate buffered saline)溶液に添加し、4℃にて18時間放置した。PBSにて洗浄した後
、1%。BSA(ウシ血清アルブミン)を添加し、室温中、1.5時間放置した。本抗体結合ビーズを0.05%Tween20含有PBS(PBS−T)で洗浄した後、再度PBS−Tに懸濁した。本抗体ビーズ溶液を上記細胞培養が終了したマイクロチップの物質分析部に注入し(約10000個/流路)、引き続きApoA1分泌促進効果が報告されている薬剤(特開2002−053557号公報記載の実施例番号27番化合物(以下、化合物1と称す。))を適宜培地にて希釈した溶液を、流速0.5μL/分にて37℃、17時間導入した。この際、細胞培養液へと導入された溶液は、全て物質分析部にある抗体ビーズを経由して排出した。導入終了後、流速0.5μL/分にて0.5 mMのWST-8試
薬溶液を37℃、1時間導入し、生成したホルマザン色素を96穴マイクロプレートリーダー(BIORAD社製)を用いて450 nmの吸光度を計測し、各流路あたりの細胞数を測定
した。物質分析部においては、PBS−Tで抗体ビーズを洗浄した後、ビオチン標識された抗ヒトApoA1モノクローナル抗体HDL44(MABTECH社製)を流速1μL/分にて前記培地を37℃、10分間導入し、PBS−Tで洗浄した。さらに、ストレプトアビジン−horseradish peroxidase(HRP)を同上条件にて
導入し、PBS−Tで洗浄した。引き続き、ABTS溶液(シグマ社製)を発色基質として流速1μL/分にて導入し、生成した発色物を特開2000−356611号公報及び特開2001−4628号公報にて記述されているような方法を用いて熱レンズ顕微鏡にて測定した。すなわち、抗体ビーズより1cm下流の流路に対して633nmの励起光を照射し、熱レンズ信号を488nmのプローブ光にて発色物を検出した。なお、標準曲線用にはPBS−Tで希釈した精製ヒトApoA1(ALP10;Chemicon inte
rnational社製)を用いた。
【0035】
(3)薬剤に対する応答の評価
HepG2細胞より培地中に分泌されたApoA1の量を細胞数(450 nmの吸光度
)で補正した後、コントロールに対する変化量(% of control)を算出し、上記薬剤によるApoA1の産生促進作用を評価した。その結果を第1表に示した。
第1表
───────────────────────────
DMSO 化合物1(μM)
10 100
───────────────────────────
変化量(%) 100 130 200
───────────────────────────
第1表に示したように、本発明のマイクロチップを用いることにより細胞への薬剤刺激に基づくApoA1の分泌促進が有効に評価できることが明らかとなった。
【0036】
試験例2 腸管細胞より分泌されるアポリポ蛋白質の定量
本発明のマイクチップを用いて、ヒト結腸癌由来のCaco−2細胞からのApoBの分泌量を測定した。実験に用いたマイクロチップは細胞培養用チップと物質分析用チップの2種類であり、両者共に深さ100μm、幅200μmのマイクロチャンネル流路を有する。細胞培養用チップは導入部に深さ300μm、出口の深さ100μm、幅200μmの細胞培養部を有し、物質分析用チップは物質分析部として深さ15μmのマイクロチャンネル分離部を強化ガラス基板内に作製したものであり、微粒子を捕捉できる構造を有している。
【0037】
(1)細胞及び培養
Caco−2細胞を10%ウシ胎児血清(FBS)含有RPMI−1640培地(コージンバイオ社製)に懸濁させ、0.4g/mLの濃度のコラーゲンコートマイクロキャリアー(SOLOHILL ENGINEERING,INC.製、平均直径108μm、以下キャリアー)と共に6
×106cells/mL(10ml)の濃度で20mL容ビーカーに添加し、37℃で1週間撹拌培養した。培養終了後、キャリアー懸濁液(約2000個/流路)を前記の細胞培養用チップの細胞培養部に注入した後、マイクロシリンジポンプを用いて流速0.2μL/分にて前記培地を37℃にて導入した。この際、細胞が付着していないキャリアーを無細胞コントロールとして別の細胞培養部に注入し、同様に前記培地を導入した。
【0038】
(2)ApoB−ELISA
抗ヒトApoBモノクローナル抗体2−B4(Intracell社製)を、直径25μmポリスチレンビーズ(フナコシ社製)/PBS(phosphate buffered saline)溶液に添加し、4℃にて18時間放置した。PBSにて洗浄した後、
1%BSA(ウシ血清アルブミン)を添加し、室温中、1.5時間放置した。本抗体結合ビーズを0.05%Tween20含有PBS(PBS−T)で洗浄した後、再度PBS−Tに懸濁した。ApoB生産量を測定する際には、本抗体ビーズ溶液を物質分析用チップの物質分析部に注入し(約10000個/流路)、引き続き細胞培養チップの流路出口と物質分析用チップ入口とをキャピラリーチューブで連結し、流速0.5μL/分、37℃にて、17時間FBSを含まないRPMI−1640培地を細胞培養用チップから導入した。この際、細胞培養液へと導入された溶液は、全て物質分析用チップの流路内にある抗体ビーズを経由して排出した。導入終了後、物質分析部においては、PBS−Tで抗体ビーズを洗浄した後、Horseradish peroxidase(HRP)標識さ
れた抗ヒトApoBポリクローナル抗体(The Binding Site社製)を流速5μL/分にて室温、10分間導入し、PBS−Tで洗浄した。引き続き、TMB溶液(シグマ社製)を発色基質として流速5μL/分にて室温、20分間導入し、溶出液100μLの吸光度(650nm)を96穴マイクロプレートリーダー(日本モレキュラーデバイス社製)にて測定した。
【0039】
(3)経時的ApoB生産の評価
キャリアーに付着したCaco−2細胞より培地中に分泌されたApoBの量を、無細胞コントロールに対する相対吸光強度(% of control)から算出し、培養時間あたりに生産されたApoBの量を評価した。その結果を第2表に示した。
第2表
─────────────────────────────
Control 細胞培養液
培養時間(日)
7 18
─────────────────────────────
変化量(%) 100 70 600
─────────────────────────────
第2表に示したように、本発明のマイクロチップを用いることによりCaco−2細胞から分泌されるApoB量の培養時間あたりの生産量が有効に評価できることが明らかとなった。
【産業上の利用可能性】
【0040】
本発明のマイクロチップは、細胞培養と細胞から分泌される物質の分析が連続的に行うことが可能なため、細胞の機能や薬剤に対する応答を評価する器具として有用である。
【図面の簡単な説明】
【0041】
【図1】本発明のマイクロチップの横断図である。
【図2】本発明のマイクロチップの上面図である。
【符号の説明】
【0042】
1 細胞保持微粒子
2 細胞、培地及びサンプル導入部
3 抗体保持微粒子
4 抗体及び試薬導入部
5 廃液部
【特許請求の範囲】
【請求項1】
細胞が接着した微粒子を保持できる細胞培養部を有することを特徴とする細胞応答評価用マイクロチップ。
【請求項2】
マイクロチップ内部に形成され液体を流すことのできる流路と、前記流路の両端部につながる液出入口とを有し、前記流路の内部に直径1mm以下の微粒子を保持できる細胞培養部を有することを特徴とする請求項1記載のマイクロチップ。
【請求項3】
細胞培養部の流路後半に細胞の分泌物を測定するための物質分析部を有する請求項1または2記載のマイクロチップ。
【請求項4】
請求項1または2記載のマイクロチップの流路の出口と、物質分析部を有するマイクロチップの流路の入り口とを、外部のチューブにて連結させたマイクロチップ。
【請求項5】
請求項3または4記載のマイクロチップを用いた細胞の分泌物の測定方法。
【請求項6】
請求項3または4記載の物質分析部において酵素免疫定量を行うことによる細胞分泌物の測定方法。
【請求項7】
マイクロチップの流路に液体を連続的に流しながら測定する請求項5または6記載の測定方法。
【請求項8】
細胞分泌物がアポリポ蛋白質A1である請求項5ないし7の何れか1項に記載の測定方法。
【請求項9】
細胞分泌物がアポリポ蛋白質Bである請求項5ないし7の何れか1項に記載の測定方法。
【請求項10】
請求項5ないし7の何れか1項に記載の測定方法を用いる、細胞の分泌物の量を変化させる活性を有する薬剤のスクリーニング方法。
【請求項11】
細胞分泌物がアポリポ蛋白質A1である請求項10記載の薬剤のスクリーニング方法。
【請求項12】
細胞分泌物がアポリポ蛋白質Bである請求項10記載の薬剤のスクリーニング方法。
【請求項13】
細胞がHepG2細胞である請求項11記載の薬剤のスクリーニング方法。
【請求項14】
細胞がCaco−2細胞である請求項12記載の薬剤のスクリーニング方法。
【請求項1】
細胞が接着した微粒子を保持できる細胞培養部を有することを特徴とする細胞応答評価用マイクロチップ。
【請求項2】
マイクロチップ内部に形成され液体を流すことのできる流路と、前記流路の両端部につながる液出入口とを有し、前記流路の内部に直径1mm以下の微粒子を保持できる細胞培養部を有することを特徴とする請求項1記載のマイクロチップ。
【請求項3】
細胞培養部の流路後半に細胞の分泌物を測定するための物質分析部を有する請求項1または2記載のマイクロチップ。
【請求項4】
請求項1または2記載のマイクロチップの流路の出口と、物質分析部を有するマイクロチップの流路の入り口とを、外部のチューブにて連結させたマイクロチップ。
【請求項5】
請求項3または4記載のマイクロチップを用いた細胞の分泌物の測定方法。
【請求項6】
請求項3または4記載の物質分析部において酵素免疫定量を行うことによる細胞分泌物の測定方法。
【請求項7】
マイクロチップの流路に液体を連続的に流しながら測定する請求項5または6記載の測定方法。
【請求項8】
細胞分泌物がアポリポ蛋白質A1である請求項5ないし7の何れか1項に記載の測定方法。
【請求項9】
細胞分泌物がアポリポ蛋白質Bである請求項5ないし7の何れか1項に記載の測定方法。
【請求項10】
請求項5ないし7の何れか1項に記載の測定方法を用いる、細胞の分泌物の量を変化させる活性を有する薬剤のスクリーニング方法。
【請求項11】
細胞分泌物がアポリポ蛋白質A1である請求項10記載の薬剤のスクリーニング方法。
【請求項12】
細胞分泌物がアポリポ蛋白質Bである請求項10記載の薬剤のスクリーニング方法。
【請求項13】
細胞がHepG2細胞である請求項11記載の薬剤のスクリーニング方法。
【請求項14】
細胞がCaco−2細胞である請求項12記載の薬剤のスクリーニング方法。
【図1】


【図2】




【図2】


【公表番号】特表2009−505634(P2009−505634A)
【公表日】平成21年2月12日(2009.2.12)
【国際特許分類】
【出願番号】特願2008−505685(P2008−505685)
【出願日】平成18年8月31日(2006.8.31)
【国際出願番号】PCT/JP2006/317715
【国際公開番号】WO2007/026963
【国際公開日】平成19年3月8日(2007.3.8)
【出願人】(000003986)日産化学工業株式会社 (510)
【出願人】(591243103)財団法人神奈川科学技術アカデミー (271)
【Fターム(参考)】
【公表日】平成21年2月12日(2009.2.12)
【国際特許分類】
【出願日】平成18年8月31日(2006.8.31)
【国際出願番号】PCT/JP2006/317715
【国際公開番号】WO2007/026963
【国際公開日】平成19年3月8日(2007.3.8)
【出願人】(000003986)日産化学工業株式会社 (510)
【出願人】(591243103)財団法人神奈川科学技術アカデミー (271)
【Fターム(参考)】
[ Back to top ]

