細胞検出装置
【課題】目的とする細胞種の有無を高精度に検出できる細胞検出装置を提供する。
【解決手段】本発明に係る細胞検出装置は基板1及び基板1上に配置される容量検出素子を備える。容量検出素子は、基板1に対してその一部が接して及び他の部分が離間して及び該他の部分の端部であって該一部と反対側の端部が基板1に接して配置される配置される第1の電極P1、及び、第1の電極P1の離間した部分と少なくとも一部対向して且つ基板1と接して配置される第2の電極P2からなる。細胞検出装置は第1の電極P1の離間した部分と基板1の間に形成される細胞の流路を備える。
【解決手段】本発明に係る細胞検出装置は基板1及び基板1上に配置される容量検出素子を備える。容量検出素子は、基板1に対してその一部が接して及び他の部分が離間して及び該他の部分の端部であって該一部と反対側の端部が基板1に接して配置される配置される第1の電極P1、及び、第1の電極P1の離間した部分と少なくとも一部対向して且つ基板1と接して配置される第2の電極P2からなる。細胞検出装置は第1の電極P1の離間した部分と基板1の間に形成される細胞の流路を備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞検出装置に関する。より詳細は、細胞の大きさ毎にその存在を感知する装置、または細胞の大きさ毎の細胞数を計測する装置に関する。
【背景技術】
【0002】
従来、目的物質を感知するために2つの電極間の容量及びその周波数特性を計測する技術が用いられてきた。具体的には特許文献1に示される技術がある。この技術では基板に溝を形成し、溝の壁面に平行な電極を形成する。溝の底部に目的物質特異的に結合するプローブ分子を配置することで電極間に目的物質を留め、目的物質が存在することで生じる電極間の容量変化を検出し、目的物質の検知を行っている。
【0003】
また、細胞を大きさ毎にふるい分ける技術としては特許文献2に示される技術がある。この技術では、大きさの異なる流路を形成し、細胞が含まれる液体を該流路に流し込むことで細胞がその大きさに応じた流路に流れ、その結果として細胞の大きさ毎に分画を作ることができる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特表2009−529683号公報
【特許文献2】特開8−23967号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
先に示した2つの技術のうち、特許文献1の技術については、目的物質が球状の場合、目的物質と電極又は目的物質と溝の底が接触する場合に点接触となるため、目的物質を捕捉するプローブ分子数が少ない。その結果、目的物質が電極間外に遊離し易くなってしまう。従って、電極間の容量変化を感知することが難しくなり、装置の目的物質検出能力は小さいものとなる。また、特許文献2の技術については、サンプルに含まれる細胞の大きさ毎に分画を行えるが、目的とする細胞種の有無を感知することはできない。
【0006】
そこで、本発明の目的は、目的とする細胞種の有無を、高精度に検出することが可能な細胞検出装置を提供することである。
【課題を解決するための手段】
【0007】
本出願の発明者は上記課題を解決するために鋭意検討した結果、基板及び前記基板上に配置される容量検出素子を備える細胞検出装置であって、前記容量検出素子は、前記基板に対してその一部が接して及び他の部分が離間して及び該他の部分の端部であって前記一部と反対側の端部が前記基板に接して配置される第1の電極、及び、該第1の電極の該離間した部分と対向して且つ前記基板と接して配置される第2の電極からなり、該第1の電極の該離間した部分と前記基板の間に形成される細胞の流路を備えることを特徴とする細胞検出装置により、上記課題を解決できることを見出し、本発明を完成させた。
【発明の効果】
【0008】
本発明によれば、目的とする細胞種の有無を、高精度に検出することが可能な細胞検出装置を提供することが可能になる。
【図面の簡単な説明】
【0009】
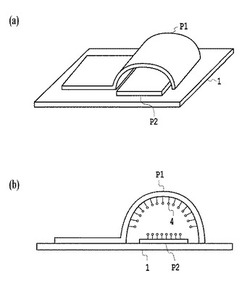
【図1】本発明に係る細胞検出装置の具体的な構造の一実施例を概略的に示す斜視図(a)及び側面図(b)である。
【図2】本発明に係る細胞検出装置における電極対の断面または側面形状の種々変形例を概略的に示す側面図である。
【図3】本発明に係る細胞検出装置に用いる電極対の形成方法のフローを表す図である。
【図4】図3に表されたフローに続く、第1の電極の形状が異なる種々電極対の形成方法のフローを表す図である。
【図5】本発明に係る細胞検出装置が備える目標物特異性のメカニズムを説明する図である。
【図6】本発明に係る細胞検出装置の一応用例である診断装置を表す側面図である。
【発明を実施するための形態】
【0010】
以下、本発明による細胞検出装置の一実施例を説明する。本発明に係る細胞検出装置は、任意の材料からなる基板と基板上に配置される容量検出素子とを備える。容量検出素子は、基板に対してその一部が接して及び他の部分が離間して及び該他の部分の端部であって該一部と反対側の端部が該基板に接して配置される第1の電極、及び、第1の電極の離間した部分と少なくとも一部が対向して且つ該基板と接して配置される第2の電極からなる。第1の電極及び第2の電極を、以下、電極対と称することがある。本発明に係る細胞検出装置は第1の電極の離間した部分と基板の間に形成される細胞の流路を備え、第2の電極の少なくとも一部が細胞の流路内に存在する。
【0011】
図1は本発明に係る細胞検出装置の具体的な構造の一実施例を示す。図1では基板1と一部が平坦で他の部分が湾曲した第1の電極(P1)とで、第2の電極(P2)を挟み込むような形状を採っている。図1に表された例では第1の電極(P1)と基板1とで形成する細胞の流路の断面または側面は弧形状になっているが、流路の断面形状または側面形状はこのような形状に限らない。曲線状でなく角を持つ形状であっても良く、例えば、図2(a)に示すような矩形であっても、図2(b)に示すような三角形であっても良い。
【0012】
本発明において、細胞の流路とは、細胞を含む溶液が浸入することが可能な空間を意味する。すなわち、第1の電極P1と基板1との間の空間を、それ以外の空間と連通させる部分(以下、開口部と称する)が存在することで細胞の流路が形成される。開口部は少なくとも1つあればよく、2つ以上あることが好ましい。すなわち、開口部を2つ以上有し、一の開口部から他の開口部に溶液が流れる形態であることが、検出効率の観点から好ましい。このとき、常に一の開口部から他の開口部に溶液が流れる形態であることがより好ましい。
【0013】
この第1の電極および/または第2の電極の表面には、図1及び2に示したように、目的物質を第1の電極P1と第2の電極P2の間に留めるためのプローブ分子4が固定されていても良い。プローブ分子4の具体例としては、無機能性分子、単一の機能性分子、2機能性分子、多機能性分子、オリゴマー、ポリマー、触媒、細胞、バクテリア、ウイルス、酵素、タンパク質、ヘプタン、糖類、脂質、グリコーゲン、酵素阻害剤、酵素基質、神経伝達物質、ホルモン、抗原、抗体、DNA,RNAが挙げられる。また基板1の材質の具体例としては例えばSi、GaAsといった半導体材料や、SiO2、SiN、TiO2等の酸化物、窒化物絶縁体やアクリル板といった有機構造物が挙げられ、これらが積層された構造とすることができる。
【0014】
細胞検出には、時間依存電圧を第1の電極P1および第2の電極P2のうちの少なくとも一つの電極に印加し、該電圧印加により生じる電流を測定する。その結果、電圧の振幅及び位相に対する電流の振幅及び位相を測定することができる。このような測定を行なうことによって、電極対の容量を測定することができる。このとき、電極対間に細胞が存在すれば電極対の容量に変化が生じる。この容量変化を測定することによって、細胞を検出することができる。
【0015】
次に、第1の電極P1および第2の電極P2の形成方法の一例を、図3及び図4を用いて説明する。まず図3に示すように、基板1上にフォトレジストを用いて第2の電極(P2)を形成するため、1次現像によるパターニングを行う。続いて、蒸着やスパッタ等の金属成膜法を用いて金属6a,6bを積層して下部電極を成膜氏した後に、リフトオフまたはエッチングによって余分な金属6aとフォトレジスト2を基板1上から除去することにより第2の電極6b(P2)が形成される。に続いて、再度フォトレジスト3を塗布する。
【0016】
フォトレジスト3を塗布した後、図4のフローに進んでフォトレジスト3のパターニングを行うが、この際に第1の電極P1の形状を決定するための操作を行う。すなわち、このフォトレジスト3のパターンサイズにより第1の電極のサイズを決定することができ、フォトレジスト3のパターンの立体構造により細胞の流路の空間形状を決定することができる。
【0017】
例えば、第1の電極P1を湾曲させ、細胞の流路の断面形状または側面形状を弧形状とする際には、図4(a)に表されるフローに従ってフォトレジストパターニング後に加熱処理を行うことにより、パターニング形状を所望の弧形状とすることができる。
【0018】
また、細胞の流路の断面形状または側面形状を三角形とする第1の電極P12のパターニングの場合には、図4(b)に表されるフローに従ってフォトレジストに照射する露光光線7の照射量に変化を持たせ、三角形の頂点としたい部位の露光量を最も少なくすることで所望の三角形のパターニング形状を得ることができる。
【0019】
所望のパターニング形状が得られた後は、第1の電極P1,P12を形成するためのフォトレジストパターンを形成した後に、第2の電極6b(P2)を形成したときと同様に、蒸着やスパッタ等の金属成膜法を用いて金属を積層し、リフトオフまたはエッチングによって余分な金属とフォトレジストを基板1上から除去することで任意の形状を持つ第1の電極P1,P12が形成される。第1の電極P1,P12および/または第2の電極6b(P2)の表面にプローブ分子4を形成する場合は、さらに電極の任意に部分が露出するようにパターニングを行い、プローブ分子4を電極表面に固定すればよい。
【0020】
本発明の細胞検出装置の使用時のメカニズムを、図5を用いて説明する。例えば血液中の好酸球を検出対象の細胞(目標物)とする場合、電極対表面のプローブ分子4を好酸球に特異的に結合する抗好酸球抗体8とすることで、好酸球9が選択的に電極対間に長時間留まることができる。そしてこの効果は、図1に示した湾曲した上部電極である第1の電極P1の構造により、より強められるものとなる。すなわち、湾曲した第1の電極P1の曲率半径を好酸球9の直径である15μmとすることで、直径15μm以上の細胞は電極対間に侵入することができなくなる。従って本発明の構造とすることで、電極対間に侵入しうる物質に大きさの制限を課することができる。その結果、目標物に対する特異性が向上する。さらに、図5(a)に示す湾曲した第1の電極P1の構造は、球形である好酸球9の表面に沿うような電極構造を採るため、図5(b)に示す第1の電極P13が第2の電極P2に対して平行な場合と比べて、好酸球9に結合できる電極上の抗体数が増加する。その結果、電極対間に目標物である好酸球9を極めて強く保持することができるようになり、好酸球細胞に対するセンシング能力を格段に向上させることができる。
【0021】
以上のような電極対についてそのサイズ、形状及びプローブ分子を変え、縦横に並べることで細胞の選別、スクリーニングに応用することが可能である。具体例として、血液を用いた疾病診断検査に用いることが可能な診断装置の例を図6に示す。
【0022】
健康管理、疾病診断において血液検査はよく用いられる検査である。この血中に含まれうる病原細胞として、例えば肝炎ウイルス13、結核菌17、ガン細胞21はその直径がそれぞれ40nm、400nm、5μmである。これらのサイズと同程度の曲率半径を持つ湾曲した第1の電極P1a,P1b,P1cをそれぞれ有する3つの電極対を1つの基板1上に形成し、さらに各電極表面に各病原細胞に対応した抗体12,16,20などのプローブ分子を結合させ、これらの電極対を縦横に並べたいわばアレイを形成することによって少量の血液からその血液に含まれる病原細胞を高精度にセンシングすることができる。従って、本発明に係る細胞検出装置を用い、少量の血液から他項目の病原細胞について簡便に且つ高精度に疾病診断を行うことが可能な診断装置を構成することができる。
【符号の説明】
【0023】
1:基板
2,3:フォトレジスト
4:プローブ分子
6a,6b:金属
7:露光光線
8:抗好酸球抗体
9:好酸球
12:抗肝炎ウイルス抗体
13:肝炎ウイルス
16:抗結核菌抗体
17:結核菌
20:抗ガン細胞抗体
21:ガン細胞
P1,P11,P1a,P1b,P1c,P12,P13:第1の電極
P2、P2a,P2b,P2c:第2の電極
【技術分野】
【0001】
本発明は、細胞検出装置に関する。より詳細は、細胞の大きさ毎にその存在を感知する装置、または細胞の大きさ毎の細胞数を計測する装置に関する。
【背景技術】
【0002】
従来、目的物質を感知するために2つの電極間の容量及びその周波数特性を計測する技術が用いられてきた。具体的には特許文献1に示される技術がある。この技術では基板に溝を形成し、溝の壁面に平行な電極を形成する。溝の底部に目的物質特異的に結合するプローブ分子を配置することで電極間に目的物質を留め、目的物質が存在することで生じる電極間の容量変化を検出し、目的物質の検知を行っている。
【0003】
また、細胞を大きさ毎にふるい分ける技術としては特許文献2に示される技術がある。この技術では、大きさの異なる流路を形成し、細胞が含まれる液体を該流路に流し込むことで細胞がその大きさに応じた流路に流れ、その結果として細胞の大きさ毎に分画を作ることができる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特表2009−529683号公報
【特許文献2】特開8−23967号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
先に示した2つの技術のうち、特許文献1の技術については、目的物質が球状の場合、目的物質と電極又は目的物質と溝の底が接触する場合に点接触となるため、目的物質を捕捉するプローブ分子数が少ない。その結果、目的物質が電極間外に遊離し易くなってしまう。従って、電極間の容量変化を感知することが難しくなり、装置の目的物質検出能力は小さいものとなる。また、特許文献2の技術については、サンプルに含まれる細胞の大きさ毎に分画を行えるが、目的とする細胞種の有無を感知することはできない。
【0006】
そこで、本発明の目的は、目的とする細胞種の有無を、高精度に検出することが可能な細胞検出装置を提供することである。
【課題を解決するための手段】
【0007】
本出願の発明者は上記課題を解決するために鋭意検討した結果、基板及び前記基板上に配置される容量検出素子を備える細胞検出装置であって、前記容量検出素子は、前記基板に対してその一部が接して及び他の部分が離間して及び該他の部分の端部であって前記一部と反対側の端部が前記基板に接して配置される第1の電極、及び、該第1の電極の該離間した部分と対向して且つ前記基板と接して配置される第2の電極からなり、該第1の電極の該離間した部分と前記基板の間に形成される細胞の流路を備えることを特徴とする細胞検出装置により、上記課題を解決できることを見出し、本発明を完成させた。
【発明の効果】
【0008】
本発明によれば、目的とする細胞種の有無を、高精度に検出することが可能な細胞検出装置を提供することが可能になる。
【図面の簡単な説明】
【0009】
【図1】本発明に係る細胞検出装置の具体的な構造の一実施例を概略的に示す斜視図(a)及び側面図(b)である。
【図2】本発明に係る細胞検出装置における電極対の断面または側面形状の種々変形例を概略的に示す側面図である。
【図3】本発明に係る細胞検出装置に用いる電極対の形成方法のフローを表す図である。
【図4】図3に表されたフローに続く、第1の電極の形状が異なる種々電極対の形成方法のフローを表す図である。
【図5】本発明に係る細胞検出装置が備える目標物特異性のメカニズムを説明する図である。
【図6】本発明に係る細胞検出装置の一応用例である診断装置を表す側面図である。
【発明を実施するための形態】
【0010】
以下、本発明による細胞検出装置の一実施例を説明する。本発明に係る細胞検出装置は、任意の材料からなる基板と基板上に配置される容量検出素子とを備える。容量検出素子は、基板に対してその一部が接して及び他の部分が離間して及び該他の部分の端部であって該一部と反対側の端部が該基板に接して配置される第1の電極、及び、第1の電極の離間した部分と少なくとも一部が対向して且つ該基板と接して配置される第2の電極からなる。第1の電極及び第2の電極を、以下、電極対と称することがある。本発明に係る細胞検出装置は第1の電極の離間した部分と基板の間に形成される細胞の流路を備え、第2の電極の少なくとも一部が細胞の流路内に存在する。
【0011】
図1は本発明に係る細胞検出装置の具体的な構造の一実施例を示す。図1では基板1と一部が平坦で他の部分が湾曲した第1の電極(P1)とで、第2の電極(P2)を挟み込むような形状を採っている。図1に表された例では第1の電極(P1)と基板1とで形成する細胞の流路の断面または側面は弧形状になっているが、流路の断面形状または側面形状はこのような形状に限らない。曲線状でなく角を持つ形状であっても良く、例えば、図2(a)に示すような矩形であっても、図2(b)に示すような三角形であっても良い。
【0012】
本発明において、細胞の流路とは、細胞を含む溶液が浸入することが可能な空間を意味する。すなわち、第1の電極P1と基板1との間の空間を、それ以外の空間と連通させる部分(以下、開口部と称する)が存在することで細胞の流路が形成される。開口部は少なくとも1つあればよく、2つ以上あることが好ましい。すなわち、開口部を2つ以上有し、一の開口部から他の開口部に溶液が流れる形態であることが、検出効率の観点から好ましい。このとき、常に一の開口部から他の開口部に溶液が流れる形態であることがより好ましい。
【0013】
この第1の電極および/または第2の電極の表面には、図1及び2に示したように、目的物質を第1の電極P1と第2の電極P2の間に留めるためのプローブ分子4が固定されていても良い。プローブ分子4の具体例としては、無機能性分子、単一の機能性分子、2機能性分子、多機能性分子、オリゴマー、ポリマー、触媒、細胞、バクテリア、ウイルス、酵素、タンパク質、ヘプタン、糖類、脂質、グリコーゲン、酵素阻害剤、酵素基質、神経伝達物質、ホルモン、抗原、抗体、DNA,RNAが挙げられる。また基板1の材質の具体例としては例えばSi、GaAsといった半導体材料や、SiO2、SiN、TiO2等の酸化物、窒化物絶縁体やアクリル板といった有機構造物が挙げられ、これらが積層された構造とすることができる。
【0014】
細胞検出には、時間依存電圧を第1の電極P1および第2の電極P2のうちの少なくとも一つの電極に印加し、該電圧印加により生じる電流を測定する。その結果、電圧の振幅及び位相に対する電流の振幅及び位相を測定することができる。このような測定を行なうことによって、電極対の容量を測定することができる。このとき、電極対間に細胞が存在すれば電極対の容量に変化が生じる。この容量変化を測定することによって、細胞を検出することができる。
【0015】
次に、第1の電極P1および第2の電極P2の形成方法の一例を、図3及び図4を用いて説明する。まず図3に示すように、基板1上にフォトレジストを用いて第2の電極(P2)を形成するため、1次現像によるパターニングを行う。続いて、蒸着やスパッタ等の金属成膜法を用いて金属6a,6bを積層して下部電極を成膜氏した後に、リフトオフまたはエッチングによって余分な金属6aとフォトレジスト2を基板1上から除去することにより第2の電極6b(P2)が形成される。に続いて、再度フォトレジスト3を塗布する。
【0016】
フォトレジスト3を塗布した後、図4のフローに進んでフォトレジスト3のパターニングを行うが、この際に第1の電極P1の形状を決定するための操作を行う。すなわち、このフォトレジスト3のパターンサイズにより第1の電極のサイズを決定することができ、フォトレジスト3のパターンの立体構造により細胞の流路の空間形状を決定することができる。
【0017】
例えば、第1の電極P1を湾曲させ、細胞の流路の断面形状または側面形状を弧形状とする際には、図4(a)に表されるフローに従ってフォトレジストパターニング後に加熱処理を行うことにより、パターニング形状を所望の弧形状とすることができる。
【0018】
また、細胞の流路の断面形状または側面形状を三角形とする第1の電極P12のパターニングの場合には、図4(b)に表されるフローに従ってフォトレジストに照射する露光光線7の照射量に変化を持たせ、三角形の頂点としたい部位の露光量を最も少なくすることで所望の三角形のパターニング形状を得ることができる。
【0019】
所望のパターニング形状が得られた後は、第1の電極P1,P12を形成するためのフォトレジストパターンを形成した後に、第2の電極6b(P2)を形成したときと同様に、蒸着やスパッタ等の金属成膜法を用いて金属を積層し、リフトオフまたはエッチングによって余分な金属とフォトレジストを基板1上から除去することで任意の形状を持つ第1の電極P1,P12が形成される。第1の電極P1,P12および/または第2の電極6b(P2)の表面にプローブ分子4を形成する場合は、さらに電極の任意に部分が露出するようにパターニングを行い、プローブ分子4を電極表面に固定すればよい。
【0020】
本発明の細胞検出装置の使用時のメカニズムを、図5を用いて説明する。例えば血液中の好酸球を検出対象の細胞(目標物)とする場合、電極対表面のプローブ分子4を好酸球に特異的に結合する抗好酸球抗体8とすることで、好酸球9が選択的に電極対間に長時間留まることができる。そしてこの効果は、図1に示した湾曲した上部電極である第1の電極P1の構造により、より強められるものとなる。すなわち、湾曲した第1の電極P1の曲率半径を好酸球9の直径である15μmとすることで、直径15μm以上の細胞は電極対間に侵入することができなくなる。従って本発明の構造とすることで、電極対間に侵入しうる物質に大きさの制限を課することができる。その結果、目標物に対する特異性が向上する。さらに、図5(a)に示す湾曲した第1の電極P1の構造は、球形である好酸球9の表面に沿うような電極構造を採るため、図5(b)に示す第1の電極P13が第2の電極P2に対して平行な場合と比べて、好酸球9に結合できる電極上の抗体数が増加する。その結果、電極対間に目標物である好酸球9を極めて強く保持することができるようになり、好酸球細胞に対するセンシング能力を格段に向上させることができる。
【0021】
以上のような電極対についてそのサイズ、形状及びプローブ分子を変え、縦横に並べることで細胞の選別、スクリーニングに応用することが可能である。具体例として、血液を用いた疾病診断検査に用いることが可能な診断装置の例を図6に示す。
【0022】
健康管理、疾病診断において血液検査はよく用いられる検査である。この血中に含まれうる病原細胞として、例えば肝炎ウイルス13、結核菌17、ガン細胞21はその直径がそれぞれ40nm、400nm、5μmである。これらのサイズと同程度の曲率半径を持つ湾曲した第1の電極P1a,P1b,P1cをそれぞれ有する3つの電極対を1つの基板1上に形成し、さらに各電極表面に各病原細胞に対応した抗体12,16,20などのプローブ分子を結合させ、これらの電極対を縦横に並べたいわばアレイを形成することによって少量の血液からその血液に含まれる病原細胞を高精度にセンシングすることができる。従って、本発明に係る細胞検出装置を用い、少量の血液から他項目の病原細胞について簡便に且つ高精度に疾病診断を行うことが可能な診断装置を構成することができる。
【符号の説明】
【0023】
1:基板
2,3:フォトレジスト
4:プローブ分子
6a,6b:金属
7:露光光線
8:抗好酸球抗体
9:好酸球
12:抗肝炎ウイルス抗体
13:肝炎ウイルス
16:抗結核菌抗体
17:結核菌
20:抗ガン細胞抗体
21:ガン細胞
P1,P11,P1a,P1b,P1c,P12,P13:第1の電極
P2、P2a,P2b,P2c:第2の電極
【特許請求の範囲】
【請求項1】
前記第2の電極の少なくとも一部が、前記細胞の流路内に存在し、
基板及び前記基板上に配置される容量検出素子を備える細胞検出装置であって、
前記容量検出素子は、前記基板に対してその一部が接して及び他の部分が離間して及び該他の部分の端部であって前記一部と反対側の端部が前記基板に接して配置される第1の電極、及び、該第1の電極の該離間した部分と少なくとも一部対向して且つ前記基板と接して配置される第2の電極からなり、
該第1の電極の該離間した部分と前記基板の間に形成される細胞の流路を備えることを特徴とする細胞検出装置。
【請求項2】
前記容量検出素子が前記基板上に2つ以上配置され、
各容量検出素子が備える前記第1の電極の前記他の部分の形状が夫々異なることで、2つ以上の前記細胞の流路が夫々異なった形状で提供されることを特徴とする請求項1に記載の細胞検出装置。
【請求項1】
前記第2の電極の少なくとも一部が、前記細胞の流路内に存在し、
基板及び前記基板上に配置される容量検出素子を備える細胞検出装置であって、
前記容量検出素子は、前記基板に対してその一部が接して及び他の部分が離間して及び該他の部分の端部であって前記一部と反対側の端部が前記基板に接して配置される第1の電極、及び、該第1の電極の該離間した部分と少なくとも一部対向して且つ前記基板と接して配置される第2の電極からなり、
該第1の電極の該離間した部分と前記基板の間に形成される細胞の流路を備えることを特徴とする細胞検出装置。
【請求項2】
前記容量検出素子が前記基板上に2つ以上配置され、
各容量検出素子が備える前記第1の電極の前記他の部分の形状が夫々異なることで、2つ以上の前記細胞の流路が夫々異なった形状で提供されることを特徴とする請求項1に記載の細胞検出装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2012−196189(P2012−196189A)
【公開日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願番号】特願2011−63908(P2011−63908)
【出願日】平成23年3月23日(2011.3.23)
【出願人】(303046277)旭化成エレクトロニクス株式会社 (840)
【Fターム(参考)】
【公開日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願日】平成23年3月23日(2011.3.23)
【出願人】(303046277)旭化成エレクトロニクス株式会社 (840)
【Fターム(参考)】
[ Back to top ]

