細胞機能の評価方法、細胞機能の評価システム、蛍光顕微鏡システム、光治療方法、及び光治療システム
【課題】本発明は、生体細胞に関する光毒性(細胞機能)を正確に評価することを目的とする。
【解決手段】本発明の細胞機能の評価方法は、前記生体細胞(40)の特定部位(41)を蛍光色素で染色する染色手順と、前記生体細胞(40)に対し光を照射し、それに応じて前記特定部位(41)の隣接部位(43)で発生する蛍光の輝度変化を測定する測定手順と、前記輝度変化に基づき前記光毒性を評価する評価手順とを含むことを特徴とする。仮に、特定部位(41)が機能低下を起こすと、その膜の内側に蛍光色素を保持しきれなくなり、それを隣接部位(43)の側へ滲出させるが、本発明によると、この滲出の程度を測定することができる。よって、本発明では、光毒性を正確に評価することができる。
【解決手段】本発明の細胞機能の評価方法は、前記生体細胞(40)の特定部位(41)を蛍光色素で染色する染色手順と、前記生体細胞(40)に対し光を照射し、それに応じて前記特定部位(41)の隣接部位(43)で発生する蛍光の輝度変化を測定する測定手順と、前記輝度変化に基づき前記光毒性を評価する評価手順とを含むことを特徴とする。仮に、特定部位(41)が機能低下を起こすと、その膜の内側に蛍光色素を保持しきれなくなり、それを隣接部位(43)の側へ滲出させるが、本発明によると、この滲出の程度を測定することができる。よって、本発明では、光毒性を正確に評価することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ライフサイエンスにおける光化学、光生理、phot-dynamic effects等に適用可能な細胞機能の評価方法、細胞機能の評価システム、蛍光顕微鏡システム、光治療方法、及び光治療システムに関する。
【背景技術】
【0002】
光治療の手法に、レーザ分子不活性化法(CALI:chromophore-assisted laser inactivation)や光線力学療法(PDT:phot dynamic therapy)がある。前者は、分子の活性を抑制する方法であり、後者は、細胞膜、小器官(オルガネラ)、DNAの損傷を誘導し、死に至らせる方法である。後者は、癌細胞の死滅に効果がある。
その原理は、細胞の持つ蛍光色素が光を吸収し、蛍光を発するときの副産物として一重項酸素等を生成し、それが細胞の一部に損傷を与え、細胞の機能低下、若しくは細胞死を誘発するというものである(特許文献1,非特許文献1等を参照)。
【0003】
この光治療では、治療効果や副作用を知るために、光照射によって生体細胞が受けるダメージ(機能低下)を正確に評価することが重要である。本明細書では、光照射による生体細胞の機能低下の程度を「光毒性」と呼ぶ。
【特許文献1】特開2001−4542号公報
【非特許文献1】吉田孝人,河野栄治,桜井孝司,”基礎実験モデルから臨床でのPDTモニタリングの可能性を探る”,日本レーザ治療学会誌,第2巻第二号,P67−P71,2004年1月発行
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかし、従来、光毒性は、光照射後に細胞が死滅したか否かによって大まかに評価されるだけであった。一部、光照射中の光毒性をリアルタイムで評価するために、発生する蛍光の退色速度や退色程度を測定することもあったが、退色(蛍光輝度の減衰)と光毒性(生体細胞の機能低下)との相関はあまり高くないので、不正確である。
そこで本発明は、光毒性を正確に評価することのできる細胞機能の評価方法、細胞機能の評価システム、及び蛍光顕微鏡システムを提供することを目的とする。また、本発明は、適切な治療を行うことのできる光治療方法、及びそれに好適な光治療システムを提供することを目的とする。
【課題を解決するための手段】
【0005】
本発明の細胞機能の評価方法は、生体細胞に関する細胞機能の評価方法であって、前記生体細胞の特定部位を蛍光色素で染色する染色手順と、前記染色された生体細胞へ光を照射し、それに応じて前記特定部位の隣接部位で発生する蛍光の輝度値を測定する測定手順と、前記測定された輝度値の変化に基づき前記細胞機能を評価する評価手順とを含むことを特徴とする。
【0006】
なお、本発明の細胞機能の評価方法は、さらに、前記細胞機能評価に応じて所定のタイミングで、前記染色された生体細胞への光照射の制御を行う手順を含んでもよい。
また、前記評価手順では、前記輝度変化カーブのピークに基づき、前記細胞機能を評価してもよい。
また、前記評価手順では、前記輝度変化カーブがピークをとるまでの光照射量に基づき、前記細胞機能を評価してもよい。
【0007】
また、前記評価手順では、前記輝度変化カーブがピークをとるときの輝度値に基づき、前記細胞機能を評価してもよい。
また、前記特定部位の隣接部位は、該特定部位とそれに隣接する領域を包含する領域から前記特定部位を除くように自由曲線リング状枠又は多角形リング状枠で特定された領域、或は矩形状枠で特定された領域であってもよい。
【0008】
また、前記隣接部位から測定された複数の蛍光の輝度値のうち、最大輝度値を前記輝度値とするか、或は前記隣接部位から測定された複数の蛍光の輝度値の平均輝度値を前記輝度値としてもよい。
また、前記特定部位は、ミトコンドリアであり、前記隣接部位は、細胞質であってもよい。
【0009】
また、本発明の細胞機能の評価システムは、生体細胞に関する細胞機能の評価システムであって、前記生体細胞の特定部位は、予め蛍光色素で染色されており、前記染色された生体細胞へ光を照射する照射手段と、前記光の照射に応じて前記特定部位の隣接部位で発生する蛍光の輝度値を測定する測定手段と、前記測定された輝度値の変化に基づき前記細胞機能を評価する評価手段とを備えたことを特徴とする。
【0010】
なお、本発明の細胞機能の評価システムは、さらに、前記細胞機能評価に応じて所定のタイミングで、前記染色された生体細胞への光照射の制御を行う制御手段を備えてもよい。
また、前記評価手段は、前記輝度変化カーブのピークに基づき、前記細胞機能を評価してもよい。
【0011】
また、前記評価手段は、前記輝度変化カーブがピークをとるまでの光照射量に基づき、前記細胞機能を評価してもよい。
また、前記評価手段は、前記輝度変化カーブがピークをとるときの輝度値に基づき、前記細胞機能を評価してもよい。
また、前記特定部位の隣接部位は、該特定部位とそれに隣接する領域を包含する領域から前記特定部位を除くように自由曲線リング状枠又は多角形リング状枠で特定された領域、或は矩形状枠で特定された領域であってもよい。
【0012】
また、前記隣接部位から測定された複数の蛍光の輝度値のうち、最大輝度値を前記輝度値とするか、或は前記隣接部位から測定された複数の蛍光の輝度値の平均輝度値を前記輝度値としてもよい。
また、本発明の蛍光顕微鏡システムは、生体細胞に対し励起光を照射する励起手段と、前記生体細胞の蛍光画像を取得する観察手段と、本発明の何れかの細胞機能の評価システムとを備え、前記励起手段及び前記観察手段は、前記評価システムの前記照射手段及び前記測定手段に兼用されることを特徴とする。
【0013】
また、本発明の光治療方法は、生体細胞に対し光を照射する光治療方法であって、前記生体細胞の特定部位を蛍光色素で染色する染色手順と、前記染色された生体細胞に対し光を照射する治療手順と、本発明の何れかの細胞機能の評価方法により前記生体細胞に関する細胞機能を評価する評価手順とを含むことを特徴とする。
また、本発明の光治療システムは、生体細胞に対し光を照射する光治療システムであって、前記生体細胞の特定部位は、予め蛍光色素で染色されており、前記染色された生体細胞へ光を照射する治療手段と、前記光の照射に応じて前記特定部位の隣接部位で発生する蛍光の輝度値を測定する測定手段と、前記測定された輝度値の変化をオペレータへリアルタイムで呈示する呈示手段とを備えたことを特徴とする。
【0014】
なお、前記特定部位の隣接部位は、該特定部位とそれに隣接する領域を包含する領域から前記特定部位を除くように自由曲線リング状枠又は多角形リング状枠で特定された領域、或は矩形状枠で特定された領域であってもよい。
また、前記隣接部位から測定された複数の蛍光の輝度値のうち、最大輝度値を前記輝度値とするか、或は前記隣接部位から測定された複数の蛍光の輝度値の平均輝度値を前記輝度値としてもよい。
【発明の効果】
【0015】
本発明によれば、光毒性を正確に評価することのできる細胞機能の評価方法、細胞機能の評価システム、蛍光顕微鏡システムが実現する。また、本発明によれば、適切な治療を行うことのできる光治療方法、及びそれに好適な光治療システムが実現する。
【発明を実施するための最良の形態】
【0016】
[第1実施形態]
本発明の第1実施形態を説明する。本実施形態は、細胞機能を評価する機能を搭載した焦点蛍光顕微鏡システムの実施形態である。
先ず、本システムの構成を説明する。
図1は、本システムの構成図である。図1に示すとおり、本システムには、顕微鏡本体10、コンピュータ20、モニタ30等が備えられる。
【0017】
顕微鏡本体10には、生体細胞を含む標本17が配置されており、標本17には、予め、ミトコンドリア用の蛍光色素(例えば、RH123:Rhodamin123)が添加されている。この蛍光色素により、生体細胞中のミトコンドリアのみが染色され、他の小器官は何ら染色されない。
顕微鏡本体10の励起光源11からは、レーザ光が放出される。このレーザ光には、少なくとも、前述した蛍光色素の励起光となりうる波長成分(例えば、507nmの波長成分)が含まれている。このレーザ光の少なくともこの波長成分は、ダイクロイックミラー13にて反射し、光スキャナ15及び対物レンズ16を介して標本17へ向かい、標本17上の1点に光スポットを形成する。その光スポットに位置する蛍光色素からは、蛍光(529nm)が発生し、その蛍光は、対物レンズ16及び光スキャナ15を介してダイクロイックミラー13へ入射する。その蛍光は、ダイクロイックミラー13を透過し、結像レンズ19を介してピンホールマスク101へ入射する。
【0018】
このピンホールマスク101は、標本17と共役関係にあり、入射した蛍光の必要な光線のみを通過させる働きがある。このピンホールマスク101を通過した蛍光は、光センサ102へ入射し、その光センサ102によって光電変換され、電気信号となってコンピュータ20へと取り込まれる。コンピュータ20に取り込まれた電気信号は、ディジタル信号に変換され、コンピュータ20内のフレームメモリ21へと蓄積される。
【0019】
ここで、顕微鏡本体10は、光スキャナ15と光センサ12とを同期駆動することにより、標本17上を光スポットで二次元走査しながら電気信号を繰り返し生成する。これによって、標本17の1フレーム分の蛍光画像が取得(イメージング)される。上述した対物レンズ16及び結像レンズ19の結像倍率は、生体細胞の微細構造(小器官)を観察するのに適した値に設定されており、この蛍光画像には1個〜数個の生体細胞が現れるとする。
【0020】
本システムの顕微鏡本体10は、このイメージングを連続的又は間欠的にN回繰り返し、Nフレーム分の蛍光画像を取得する。このイメージングの回数Nは、例えば、200〜300程度であり、各フレームのイメージングでは、光スポットの走査速度及び励起光源11のパワーは一定値に保たれる。また、各フレームのイメージング中以外の期間には、標本17へは光が入射しないものとする。このとき、イメージングの回数と、標本17に対する光の照射量とが比例関係を持つことになる。
【0021】
一方、コンピュータ20のCPU22は、イメージングが1回行われる毎に、フレームメモリ21に蓄積されたディジタル信号を読み出し、標本17の蛍光画像Iを作成すると、それをハードディスクドライブ25へ格納する。N回のイメージングの後には、ハードディスクドライブ25には、Nフレーム分の蛍光画像I1,I2,…,INが蓄積されることになる。これらの蛍光画像I1,I2,…,INは、必要に応じてインターフェース回路26を介してモニタ30へ出力される。
【0022】
なお、コンピュータ20のROM23は、CPU22の基本動作プログラムを予め格納したメモリであって、RAM24は、コンピュータ20が動作するときに適宜使用されるメモリである。また、ハードディスクドライブ25には、本システム用のCPU22の動作プログラムが格納されており、それは適当なタイミングで読み出され、CPU22に対し各種の処理を実行させる。本システムでは、この処理の中に、後述する「光毒性の評価処理」も含まれる。
【0023】
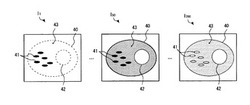
さて、以上の本システムで取得された蛍光画像I1,I2,…,INを図示すると、例えば、図2のとおりになる。図2では、輝度の高い部分を濃い色で示し、輝度の低い部分を薄い色で示した。また、蛍光画像Iiの添え字iは、フレーム番号であり、フレーム番号iが小さいほど先に取得された蛍光画像であることを示している。
先ず、図2の左側に示すとおり、1番目の蛍光画像I1には、細胞40のうち、染色部位であるミトコンドリア41のみが明るく写っており、非染色部位である細胞核42や、その他の細胞小器官(点線部)は、写っていない。細胞質43も真っ暗である。
【0024】
一方、図2の中央に示すとおり、50番目の蛍光画像I50では、染色部位であるミトコンドリア41は、退色して若干暗くなり、その代わりに、その隣接部位である細胞質43が発色し、若干明るく写っている。
この現象は、イメージング時の光照射でミトコンドリア41が機能低下を起こし、ミトコンドリア膜の内側に蛍光色素を保持しきれなくなり、それを細胞質43の側へ滲出させたことを示している。但し、ミトコンドリア41中の全ての蛍光色素が細胞質43へ滲出するのではなく、ある時点で滲出は終了する。
【0025】
さらに、図2の右側に示すとおり、200番目の蛍光画像I200では、細胞質43も退色して暗くなり、ミトコンドリア41と共に低い輝度値で安定する。
以上のとおり、細胞40では、染色部位であるミトコンドリア41だけでなく、その隣接部位である細胞質43も発色しており、その発色は、ミトコンドリア41から細胞質43への蛍光色素の滲出、つまり、ミトコンドリア41の機能低下と関係している。
【0026】
そこで、本システムでは、細胞質43上に参照ポイントを定め、その参照ポイントの輝度変化に基づき光毒性を評価する。
次に、CPU22による光毒性の評価処理を説明する。この処理は、蛍光画像I1,…,INの取得後に実行される。
図3は、CPU22による光毒性の評価処理の動作フローチャートである。図3に示すとおり、CPU22は、参照ポイントの決定処理(ステップS1)、参照ポイントの輝度変化の参照処理(ステップS2)、評価値の算出処理(ステップS3)、評価値の表示処理(ステップS4)を順に実行する。以下、各ステップを順に説明する。
【0027】
ステップS1(参照ポイントの決定処理):
本ステップのCPU22は、先ず、図4(A)に示すとおり、1番目の蛍光画像I1を参照し、その蛍光画像I1の各画素の輝度値を閾値と比較し、閾値を上回るような輝度値を示す画素を見出す。そして、それら画素の存在する領域を、染色領域44Aとみなす。1番目の蛍光画像I1で発色しているのはミトコンドリア41のみなので、そのミトコンドリア41の存在領域が、染色領域44Aとみなされることになる。
【0028】
さらに、CPU23は、その染色領域44Aから若干の所定座標だけ外れた座標を、参照ポイント40Pと定める。この所定座標は、参照ポイント40Pが細胞質43上に位置するよう、予め適当な値に設定されている。
ステップS2(参照ポイントの輝度変化の参照処理):
本ステップのCPU22は、蛍光画像I1,…,INから、参照ポイント40Pの輝度値P1,…,PNを抽出する。輝度値Pの添え字iは、フレーム番号である。これら輝度値P1,…,PNの各々は、参照ポイント40Pに位置する単一画素の輝度値であってもよいが、好ましくは、参照ポイント40Pに位置する複数画素(任意形状領域内の複数画素)の輝度平均値、或は複数画素のうちの最大輝度値である。なお、図4(B)の説明は、後述する。
【0029】
図5(A)は、参照ポイント40Pの輝度値P1,…,PNをグラフ化したものであり、横軸がフレーム番号、縦軸が輝度値である。これらのデータから、CPU22は参照ポイント40Pの輝度変化を認識する。
図5(A)に示すとおり、参照ポイント40Pの輝度値は、フレーム番号が大きくなる(光照射量が増える)に従って上昇し、或るフレーム(図では、50番目のフレーム)でピークを採った後に下降し、その後、或るフレーム(図では、100番目のフレーム)の辺りから、低い輝度値で安定し始める。この輝度値の上昇速度が、細胞質43の発色速度、つまり、ミトコンドリア41の機能低下速度を示している。
【0030】
ここで、輝度値がピークを採るフレーム番号をfとおくと、フレーム番号fは、ミトコンドリア41の機能低下速度が速いほど小さくなり、ミトコンドリア41の機能低下速度が遅いほど大きくなる。実際、その機能低下速度を遅くするために、他の条件を同じにして励起光源11のパワーだけを弱めてみると、図5(B)に示すとおりフレーム番号fは大きくなった。
【0031】
ステップS3(評価値の算出処理):
本ステップのCPU22は、図5(A)中に矢印で示すとおり、参照ポイント40Pの輝度値がピークを採るようなフレーム番号f(図では、50)を算出し、そのフレーム番号fに基づき、光毒性の評価値Eを算出する。この評価値Eは、ミトコンドリア41の機能低下速度が速いときほど大きな値を採るように、例えば、E=1/f,E=α/f,E=fA−f,或いはE=fA−αfなどと定義される(但し、α,fAは定数)。
【0032】
ステップS4(評価値の表示処理):
本ステップのCPU22は、算出した評価値Eを、モニタ30上に表示する。このとき、CPU22は、評価値Eと共に、最新の蛍光画像INを表示し、オペレータの確認用に、前述した参照ポイント40Pに十字カーソルや矩形枠等のマークを重畳して表示することが望ましい。
【0033】
以上、本システムは、顕微鏡本体10による標本17のイメージングを繰り返し行い、染色部位(ここではミトコンドリア41)の輝度変化を参照する代わりに、その隣接部位(ここでは細胞質43)の輝度変化(図5)を参照し、それに基づき光毒性を評価する。前述したとおり、隣接部位(ここでは細胞質43)の輝度変化は、染色部位(ここではミトコンドリア41)の機能低下と相関が高いので、この評価は、適正に行われる。
【0034】
しかも、本システムでは、隣接部位(ここでは細胞質43)の輝度値がピークを採るときのフレーム番号fが評価値Eへ反映されるので、その評価値Eは、隣接部位(ここでは細胞質43)の発色速度、染色部位(ここではミトコンドリア41)の機能低下速度、つまり光毒性の強さを、正確に示す。
ここで、比較のため、染色部位(ここではミトコンドリア41)の輝度変化を図6(A),(B)に示した。図6(A)は励起光源11のパワーが強いときのグラフ、図6(B)は、励起光源11のパワーが弱いときのグラフである。図6(A),(B)に示すとおり、染色部位(ここではミトコンドリア41)の輝度変化カーブは、励起光源11のパワーが異なっても、同じ位置にピークを持っている(フレーム番号1)。このため、この輝度変化カーブから光毒性の評価値を算出することは難しい。
【0035】
しかも、上述したとおり、染色部位(ここではミトコンドリア41)の輝度変化カーブは、染色部位(ここではミトコンドリア41)の退色を示してはいるものの、機能低下を示しているとは限らないので、この輝度変化カーブから光毒性の評価値を仮に算出したとしても、その正確性は、本実施形態の評価値Eのそれよりも低くなる。
(その他)
なお、本システムにおいて、フレーム番号fから評価値Eへの算出式については、実際の光毒性と評価値Eとが直線関係となるよう適切に選定されることが望ましい。そのためには、光毒性が既知の系を用いた実験やシミュレーションを何度か行えばよい。
【0036】
また、本システムでは、光毒性の評価値Eを、輝度値がピークを採るときのフレーム番号fによって定義したが、輝度値がピークを採ったときの輝度値(ピーク輝度値)によって定義してもよい。また、フレーム番号fとピーク輝度値との双方によって評価値Eを定義してもよい。
また、本実施形態では、参照ポイント40Pの輝度値変化を用いて染色領域44Aの光毒性が評価できることを説明するために200フレーム程度の蛍光画像を取得した例を示したが、細胞に必要以上のダメージを与えないという観点から、参照ポイント40Pの輝度値が上昇し、ピークを採った後に下降し始めたら直に又は所定時間(数秒程度)経過後、励起光源11からのレーザ光照射を停止させる、或はレーザ光の強度を弱めて照射し続けることが好ましい。
【0037】
また、本システムでは、顕微鏡本体10として共焦点顕微鏡を用いたので、セクショニングの異なる複数枚の蛍光画像を取得することが可能である。よって、それら複数枚の蛍光画像を利用することにより、評価値Eの算出精度を向上させてもよい。
また、本実施形態では、染色部位をミトコンドリア41としたが、他の小器官や、細胞膜よりも外側の部位(すなわち培養液)としてもよい。因みに、染色部位が細胞核であるときには、細胞質43上に参照ポイントを採ればよい。また、染色部位が細胞質43であるときには、培養液上に参照ポイントを採ればよい。また、染色部位が培養液であるときには、細胞質43上に参照ポイントを採ればよい。何れにせよ、参照ポイントは、染色部位と膜を隔てて隣接する部位に定められる。
【0038】
また、本システムでは、各処理がコンピュータ20によって実行されたが、コンピュータ20の一部又は全部の動作は、顕微鏡本体10に専用の装置(制御・画像処理装置)、又はオペレータによって実行されてもよい。
例えば、本システムでは、参照ポイント40Pをコンピュータ20が自動的に決定したが、不図示の入力器(キーボード,マウスなど)を介してオペレータに入力させてもよい。オペレータに入力させる際には、図4(A),(B)に示すようにモニタ30上に蛍光画像I1を表示し、その上に十字カーソル(図4(A))や矩形枠のマーク、或いは、染色領域44A(ミトコンドリア41)とそれに隣接する細胞質43を含む領域から染色領域44Aを除くように自由曲線リング状枠又は多角形リング状枠などの任意の形状枠のマーク(図4(B))などを重畳表示するとよい。図4(B)の場合、このリング状枠内の領域が、参照ポイント40Pとなる。また、参照ポイント40Pの任意形状枠のサイズを可変としてもよい。
【0039】
また、本システムの顕微鏡本体10は、蛍光画像を取得する顕微鏡であったが、蛍光画像と微分干渉画像との双方を取得可能な顕微鏡に変形してもよい。その場合、モニタ30へ蛍光画像を表示する際に、微分干渉画像を重畳表示するとよい。微分干渉画像が重畳表示されれば、発色していない器官(透明な器官)の観察が可能になる。また、微分干渉画像を利用して参照ポイントを定めれば、参照ポイントの設定に失敗する可能性は低くなる。
【0040】
また、本システムでは、CPU22の動作プログラムがハードディスクドライブ25に予め格納されていたが、そのプログラムの一部又は全部は、例えば、不図示のインターネットやCD−ROMなどを介してコンピュータ20にインストールされたものであってもよい。
また、本システムの顕微鏡本体10は、標本17からの光を共焦点検出するコンフォーカル顕微鏡であるが、その共焦点検出の機能を省略しても構わない。その場合、ピンホールマスク101は不要となる。或いは、ピンホールマスク以外の方法で共焦点効果を得る多光子顕微鏡に変形しても構わない。
【0041】
また、本システムの顕微鏡本体10は、標本17上を光走査する走査型顕微鏡であるが、共焦点検出の機能を省略する場合は、非走査型顕微鏡としても構わない。その場合、光スキャナ15は不要となり、光センサ102の代わりに撮像素子が配置される。
また、本システムを用いて、ミトコンドリア41に蛍光色素とともに薬剤も添加することにより、薬剤による細胞機能の評価への応用が可能である。また、光照射とともに熱を加える又は放射線を照射することにより、熱又は放射線による細胞機能の評価への応用が可能である。
【0042】
[第2実施形態]
本発明の第2実施形態を説明する。本実施形態は、光治療システム及びそれを用いた光治療方法の実施形態である。
図7は、本システムの構成図である。図7に示すとおり、本システムは、主に、治療対象ST1、治療系ST2、観察系ST3、励起系ST4の4系統からなる。
【0043】
治療対象ST1は、例えば、癌細胞を含む生体の患部であり、予め、ミトコンドリア用の蛍光色素(例えば、RH123)が添加されている。この蛍光色素は、光毒性の評価(治療効果の評価)に用いられる。
治療系ST2は、癌細胞の損傷又は死滅を誘導するために、治療対象ST1へ向けて放射線(ガンマ線等)又は治療用のレーザ光(紫外域,可視域,赤外域)を照射する。放射線は、単独で細胞の障害を誘導する効果があり、治療用のレーザ光は、治療対象ST1に添加された蛍光色素と反応することで細胞の障害を誘導する効果(又は死滅を誘導する効果)がある。ここでは、後者が採用された場合(PDT)を説明する。
【0044】
治療用のレーザ光は、治療系ST2内の放射装置51にて生成され、治療系ST2の先端に設けられた直径数mm〜数cmの筒状先端部(ヘッド)52から治療対象ST1へ向けてパルス発振される。ヘッド52は、治療用のレーザ光のエネルギーを治療対象ST1へ効率よく集中させる働きがある。
励起系ST4は、励起光源11とダイクロイックミラー13とを有し、観察系ST3の対物レンズ16を介して、治療対象ST1へ向けて励起光(例えば、波長507nm)をパルス発振する。この励起光は、治療用のレーザ光と交互に照射される。
【0045】
観察系ST3は、対物レンズ16、結像レンズ19、撮像素子102’、回路部20’、モニタ30などを備える。励起光の照射時に治療対象ST1にて発生した蛍光は、観察系ST3の対物レンズ16及び結像レンズ19で捉えられ、治療対象ST1の蛍光画像を撮像素子102’上に形成する。この蛍光画像は、撮像素子102’によって連続的に撮像され、回路部20’を介してモニタ30へ順次出力される。
【0046】
ここで、観察系ST3の対物レンズ16及び結像レンズ19の結像倍率は、細胞の微細構造(小器官)を観察するのに適した値に設定されている。したがって、モニタ30上には、治療対象ST1の細胞40の様子が、リアルタイムで表示される。
なお、観察系ST3及び励起系ST4のヘッドと治療系ST2のヘッド52は、治療対象ST1の略同一のポイントに正対しており、蛍光画像の取得ポイントと、治療用のレーザ光の照射ポイントとは略一致しているものとする。両者のズレを抑えるために、両者のヘッドを固定、或いは共通化してもよい。
【0047】
治療時、オペレータは、治療対象ST1に対し治療用のレーザ光を照射しながら、モニタ30上で染色部位(ここではミトコンドリア41)と、その隣接部位(ここでは細胞質43)とを観察する。このとき、オペレータは、隣接部位(ここでは細胞質43)の輝度に注目し、その輝度がピークを迎えたタイミングや、ピークを迎えたときの輝度の程度により、治療系ST2の光毒性(つまり治療効果)を評価する。そして、その評価に応じて、オペレータは、適当なタイミングで治療用のレーザ光の照射を止めたり、治療系ST2のパワーを適当な値に調節したりする。
【0048】
このように、本システムによれば、オペレータは、治療効果をリアルタイムで評価しながら光治療をすることができるので、治療用のレーザ光の照射不足による癌組織の取り残しや、治療用のレーザ光の照射過多による副作用を回避し、適切な治療を行うことができる。
なお、本システムでは、隣接部位(ここでは細胞質43)の輝度をオペレータが目視検出したが、その輝度の検出は、自動化されてもよい。その場合、観察系ST3の回路部20’は、撮像素子102’の出力から隣接部位(ここでは細胞質43)の輝度信号を抽出し、かつ、その輝度信号の大きさを、リアルタイムでオペレータへ通知する。その通知は、モニタ30上の映像によって行われてもよいが、音声出力器(スピーカ)を用意し、そのスピーカからの音声によって行われてもよい。
【0049】
また、本システムでは、励起光と治療用の光とが別々に用意されたが、治療用の光に励起光の波長成分が含まれている場合は、治療用の光を励起光に兼用してもよい。
また、第2実施形態で説明した治療装置のうち治療系ST2を診断系に置き換えるだけで、診断装置にすることができる。診断系は、診断用波(音波、電磁波等)発生源と患部を照明する照明光学系と、撮像素子と、照明された患部からの反射光を撮像素子上に結像する結像光学系とを備える。
【実施例】
【0050】
第1実施形態の焦点蛍光顕微鏡システムを用いて、本発明にかかる細胞機能評価を行った例を説明する。
蛍光色素としてRH123を用い、生体細胞中のミトコンドリアに添加して、標本を作成した。まず、励起光源11から所定強度のアルゴンレーザ(488nm)を照射させて標本上を二次元走査させながら、1フレーム分の蛍光画像を取得した。
【0051】
図8(A)は、1番目に取得した実際の蛍光画像である。ミトコンドリア(染色領域)と細胞質(参照ポイント)の所定位置をそれぞれ矩形状枠で特定し、それら特定画素の輝度値の平均値をそれぞれミトコンドリアの輝度値、細胞質の輝度値とするように設定した。
その後、同様な条件で蛍光画像取得を繰り返しながら、ミトコンドリアの輝度値、及び細胞質の輝度値を測定した。図8(B)は、50番目に取得した実際の蛍光画像であり、図8(C)は150番目に取得した実際の蛍光画像である。図8からは、第1実施形態において図2を用いて説明したような蛍光画像の変化があったことがわかる。
【0052】
また、図9(A)は所定強度のアルゴンレーザを照射した時のミトコンドリアの輝度値と細胞質の輝度値をそれぞれグラフ化した実際の画像である。図9(A)からミトコンドリアの輝度値の低下は、RH123の細胞質への放出及び褪色の両方によるものであり、細胞質の輝度値の上昇は、ミトコンドリアからのRH123によるものであり、そのピークは細胞質へのRH123放出の完了を示している。即ち、細胞質の輝度値がピークとなるフレーム番号(50番)の画像取得時に、ミトコンドリアの完全な機能低下が生じたことがわかる。
【0053】
さらに、他の条件は同じにして励起光源11から照射されるレーザ光の強度だけを弱めて、ミトコンドリアの輝度値、及び細胞質の輝度値を測定した。図9(B)は、図9(A)で示したレーザ強度に比べて強度が弱いレーザ光を照射したときのミトコンドリアの輝度値、及び細胞質の輝度値をそれぞれグラフ化した実際の画像である。図9(B)から細胞質の輝度値がピークとなるフレーム番号は70番であり、励起レーザ光の強度が弱くなるとミトコンドリアの機能低下が遅くなることがわかる。
【産業上の利用可能性】
【0054】
本発明の評価方法は、レーザ走査顕微鏡等の光源評価(装置実効性評価)、抗酸化剤等の薬剤評価(薬剤スクリーニング等)、蛍光色素の評価(蛍光寿命評価)等に応用することができる。
【図面の簡単な説明】
【0055】
【図1】第1実施形態のシステムの構成図である。
【図2】蛍光画像I1,I2,…,INを説明する図である。
【図3】CPU22による光毒性の評価処理の動作フローチャートである。
【図4】ステップS1を説明する図である。
【図5】ステップS2,S3を説明する図である。
【図6】染色部位(ミトコンドリア41)の輝度変化を示す図である。
【図7】第2実施形態のシステムの構成図である。
【図8】実施例で取得した蛍光画像である。
【図9】実施例で測定された輝度値のグラフである。
【符号の説明】
【0056】
10…顕微鏡本体,17…標本,13…ダイクロイックミラー,15…光スキャナ,16…対物レンズ,19…結像レンズ,101…ピンホールマスク,102…光センサ,20…コンピュータ,30…モニタ
【技術分野】
【0001】
本発明は、ライフサイエンスにおける光化学、光生理、phot-dynamic effects等に適用可能な細胞機能の評価方法、細胞機能の評価システム、蛍光顕微鏡システム、光治療方法、及び光治療システムに関する。
【背景技術】
【0002】
光治療の手法に、レーザ分子不活性化法(CALI:chromophore-assisted laser inactivation)や光線力学療法(PDT:phot dynamic therapy)がある。前者は、分子の活性を抑制する方法であり、後者は、細胞膜、小器官(オルガネラ)、DNAの損傷を誘導し、死に至らせる方法である。後者は、癌細胞の死滅に効果がある。
その原理は、細胞の持つ蛍光色素が光を吸収し、蛍光を発するときの副産物として一重項酸素等を生成し、それが細胞の一部に損傷を与え、細胞の機能低下、若しくは細胞死を誘発するというものである(特許文献1,非特許文献1等を参照)。
【0003】
この光治療では、治療効果や副作用を知るために、光照射によって生体細胞が受けるダメージ(機能低下)を正確に評価することが重要である。本明細書では、光照射による生体細胞の機能低下の程度を「光毒性」と呼ぶ。
【特許文献1】特開2001−4542号公報
【非特許文献1】吉田孝人,河野栄治,桜井孝司,”基礎実験モデルから臨床でのPDTモニタリングの可能性を探る”,日本レーザ治療学会誌,第2巻第二号,P67−P71,2004年1月発行
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかし、従来、光毒性は、光照射後に細胞が死滅したか否かによって大まかに評価されるだけであった。一部、光照射中の光毒性をリアルタイムで評価するために、発生する蛍光の退色速度や退色程度を測定することもあったが、退色(蛍光輝度の減衰)と光毒性(生体細胞の機能低下)との相関はあまり高くないので、不正確である。
そこで本発明は、光毒性を正確に評価することのできる細胞機能の評価方法、細胞機能の評価システム、及び蛍光顕微鏡システムを提供することを目的とする。また、本発明は、適切な治療を行うことのできる光治療方法、及びそれに好適な光治療システムを提供することを目的とする。
【課題を解決するための手段】
【0005】
本発明の細胞機能の評価方法は、生体細胞に関する細胞機能の評価方法であって、前記生体細胞の特定部位を蛍光色素で染色する染色手順と、前記染色された生体細胞へ光を照射し、それに応じて前記特定部位の隣接部位で発生する蛍光の輝度値を測定する測定手順と、前記測定された輝度値の変化に基づき前記細胞機能を評価する評価手順とを含むことを特徴とする。
【0006】
なお、本発明の細胞機能の評価方法は、さらに、前記細胞機能評価に応じて所定のタイミングで、前記染色された生体細胞への光照射の制御を行う手順を含んでもよい。
また、前記評価手順では、前記輝度変化カーブのピークに基づき、前記細胞機能を評価してもよい。
また、前記評価手順では、前記輝度変化カーブがピークをとるまでの光照射量に基づき、前記細胞機能を評価してもよい。
【0007】
また、前記評価手順では、前記輝度変化カーブがピークをとるときの輝度値に基づき、前記細胞機能を評価してもよい。
また、前記特定部位の隣接部位は、該特定部位とそれに隣接する領域を包含する領域から前記特定部位を除くように自由曲線リング状枠又は多角形リング状枠で特定された領域、或は矩形状枠で特定された領域であってもよい。
【0008】
また、前記隣接部位から測定された複数の蛍光の輝度値のうち、最大輝度値を前記輝度値とするか、或は前記隣接部位から測定された複数の蛍光の輝度値の平均輝度値を前記輝度値としてもよい。
また、前記特定部位は、ミトコンドリアであり、前記隣接部位は、細胞質であってもよい。
【0009】
また、本発明の細胞機能の評価システムは、生体細胞に関する細胞機能の評価システムであって、前記生体細胞の特定部位は、予め蛍光色素で染色されており、前記染色された生体細胞へ光を照射する照射手段と、前記光の照射に応じて前記特定部位の隣接部位で発生する蛍光の輝度値を測定する測定手段と、前記測定された輝度値の変化に基づき前記細胞機能を評価する評価手段とを備えたことを特徴とする。
【0010】
なお、本発明の細胞機能の評価システムは、さらに、前記細胞機能評価に応じて所定のタイミングで、前記染色された生体細胞への光照射の制御を行う制御手段を備えてもよい。
また、前記評価手段は、前記輝度変化カーブのピークに基づき、前記細胞機能を評価してもよい。
【0011】
また、前記評価手段は、前記輝度変化カーブがピークをとるまでの光照射量に基づき、前記細胞機能を評価してもよい。
また、前記評価手段は、前記輝度変化カーブがピークをとるときの輝度値に基づき、前記細胞機能を評価してもよい。
また、前記特定部位の隣接部位は、該特定部位とそれに隣接する領域を包含する領域から前記特定部位を除くように自由曲線リング状枠又は多角形リング状枠で特定された領域、或は矩形状枠で特定された領域であってもよい。
【0012】
また、前記隣接部位から測定された複数の蛍光の輝度値のうち、最大輝度値を前記輝度値とするか、或は前記隣接部位から測定された複数の蛍光の輝度値の平均輝度値を前記輝度値としてもよい。
また、本発明の蛍光顕微鏡システムは、生体細胞に対し励起光を照射する励起手段と、前記生体細胞の蛍光画像を取得する観察手段と、本発明の何れかの細胞機能の評価システムとを備え、前記励起手段及び前記観察手段は、前記評価システムの前記照射手段及び前記測定手段に兼用されることを特徴とする。
【0013】
また、本発明の光治療方法は、生体細胞に対し光を照射する光治療方法であって、前記生体細胞の特定部位を蛍光色素で染色する染色手順と、前記染色された生体細胞に対し光を照射する治療手順と、本発明の何れかの細胞機能の評価方法により前記生体細胞に関する細胞機能を評価する評価手順とを含むことを特徴とする。
また、本発明の光治療システムは、生体細胞に対し光を照射する光治療システムであって、前記生体細胞の特定部位は、予め蛍光色素で染色されており、前記染色された生体細胞へ光を照射する治療手段と、前記光の照射に応じて前記特定部位の隣接部位で発生する蛍光の輝度値を測定する測定手段と、前記測定された輝度値の変化をオペレータへリアルタイムで呈示する呈示手段とを備えたことを特徴とする。
【0014】
なお、前記特定部位の隣接部位は、該特定部位とそれに隣接する領域を包含する領域から前記特定部位を除くように自由曲線リング状枠又は多角形リング状枠で特定された領域、或は矩形状枠で特定された領域であってもよい。
また、前記隣接部位から測定された複数の蛍光の輝度値のうち、最大輝度値を前記輝度値とするか、或は前記隣接部位から測定された複数の蛍光の輝度値の平均輝度値を前記輝度値としてもよい。
【発明の効果】
【0015】
本発明によれば、光毒性を正確に評価することのできる細胞機能の評価方法、細胞機能の評価システム、蛍光顕微鏡システムが実現する。また、本発明によれば、適切な治療を行うことのできる光治療方法、及びそれに好適な光治療システムが実現する。
【発明を実施するための最良の形態】
【0016】
[第1実施形態]
本発明の第1実施形態を説明する。本実施形態は、細胞機能を評価する機能を搭載した焦点蛍光顕微鏡システムの実施形態である。
先ず、本システムの構成を説明する。
図1は、本システムの構成図である。図1に示すとおり、本システムには、顕微鏡本体10、コンピュータ20、モニタ30等が備えられる。
【0017】
顕微鏡本体10には、生体細胞を含む標本17が配置されており、標本17には、予め、ミトコンドリア用の蛍光色素(例えば、RH123:Rhodamin123)が添加されている。この蛍光色素により、生体細胞中のミトコンドリアのみが染色され、他の小器官は何ら染色されない。
顕微鏡本体10の励起光源11からは、レーザ光が放出される。このレーザ光には、少なくとも、前述した蛍光色素の励起光となりうる波長成分(例えば、507nmの波長成分)が含まれている。このレーザ光の少なくともこの波長成分は、ダイクロイックミラー13にて反射し、光スキャナ15及び対物レンズ16を介して標本17へ向かい、標本17上の1点に光スポットを形成する。その光スポットに位置する蛍光色素からは、蛍光(529nm)が発生し、その蛍光は、対物レンズ16及び光スキャナ15を介してダイクロイックミラー13へ入射する。その蛍光は、ダイクロイックミラー13を透過し、結像レンズ19を介してピンホールマスク101へ入射する。
【0018】
このピンホールマスク101は、標本17と共役関係にあり、入射した蛍光の必要な光線のみを通過させる働きがある。このピンホールマスク101を通過した蛍光は、光センサ102へ入射し、その光センサ102によって光電変換され、電気信号となってコンピュータ20へと取り込まれる。コンピュータ20に取り込まれた電気信号は、ディジタル信号に変換され、コンピュータ20内のフレームメモリ21へと蓄積される。
【0019】
ここで、顕微鏡本体10は、光スキャナ15と光センサ12とを同期駆動することにより、標本17上を光スポットで二次元走査しながら電気信号を繰り返し生成する。これによって、標本17の1フレーム分の蛍光画像が取得(イメージング)される。上述した対物レンズ16及び結像レンズ19の結像倍率は、生体細胞の微細構造(小器官)を観察するのに適した値に設定されており、この蛍光画像には1個〜数個の生体細胞が現れるとする。
【0020】
本システムの顕微鏡本体10は、このイメージングを連続的又は間欠的にN回繰り返し、Nフレーム分の蛍光画像を取得する。このイメージングの回数Nは、例えば、200〜300程度であり、各フレームのイメージングでは、光スポットの走査速度及び励起光源11のパワーは一定値に保たれる。また、各フレームのイメージング中以外の期間には、標本17へは光が入射しないものとする。このとき、イメージングの回数と、標本17に対する光の照射量とが比例関係を持つことになる。
【0021】
一方、コンピュータ20のCPU22は、イメージングが1回行われる毎に、フレームメモリ21に蓄積されたディジタル信号を読み出し、標本17の蛍光画像Iを作成すると、それをハードディスクドライブ25へ格納する。N回のイメージングの後には、ハードディスクドライブ25には、Nフレーム分の蛍光画像I1,I2,…,INが蓄積されることになる。これらの蛍光画像I1,I2,…,INは、必要に応じてインターフェース回路26を介してモニタ30へ出力される。
【0022】
なお、コンピュータ20のROM23は、CPU22の基本動作プログラムを予め格納したメモリであって、RAM24は、コンピュータ20が動作するときに適宜使用されるメモリである。また、ハードディスクドライブ25には、本システム用のCPU22の動作プログラムが格納されており、それは適当なタイミングで読み出され、CPU22に対し各種の処理を実行させる。本システムでは、この処理の中に、後述する「光毒性の評価処理」も含まれる。
【0023】
さて、以上の本システムで取得された蛍光画像I1,I2,…,INを図示すると、例えば、図2のとおりになる。図2では、輝度の高い部分を濃い色で示し、輝度の低い部分を薄い色で示した。また、蛍光画像Iiの添え字iは、フレーム番号であり、フレーム番号iが小さいほど先に取得された蛍光画像であることを示している。
先ず、図2の左側に示すとおり、1番目の蛍光画像I1には、細胞40のうち、染色部位であるミトコンドリア41のみが明るく写っており、非染色部位である細胞核42や、その他の細胞小器官(点線部)は、写っていない。細胞質43も真っ暗である。
【0024】
一方、図2の中央に示すとおり、50番目の蛍光画像I50では、染色部位であるミトコンドリア41は、退色して若干暗くなり、その代わりに、その隣接部位である細胞質43が発色し、若干明るく写っている。
この現象は、イメージング時の光照射でミトコンドリア41が機能低下を起こし、ミトコンドリア膜の内側に蛍光色素を保持しきれなくなり、それを細胞質43の側へ滲出させたことを示している。但し、ミトコンドリア41中の全ての蛍光色素が細胞質43へ滲出するのではなく、ある時点で滲出は終了する。
【0025】
さらに、図2の右側に示すとおり、200番目の蛍光画像I200では、細胞質43も退色して暗くなり、ミトコンドリア41と共に低い輝度値で安定する。
以上のとおり、細胞40では、染色部位であるミトコンドリア41だけでなく、その隣接部位である細胞質43も発色しており、その発色は、ミトコンドリア41から細胞質43への蛍光色素の滲出、つまり、ミトコンドリア41の機能低下と関係している。
【0026】
そこで、本システムでは、細胞質43上に参照ポイントを定め、その参照ポイントの輝度変化に基づき光毒性を評価する。
次に、CPU22による光毒性の評価処理を説明する。この処理は、蛍光画像I1,…,INの取得後に実行される。
図3は、CPU22による光毒性の評価処理の動作フローチャートである。図3に示すとおり、CPU22は、参照ポイントの決定処理(ステップS1)、参照ポイントの輝度変化の参照処理(ステップS2)、評価値の算出処理(ステップS3)、評価値の表示処理(ステップS4)を順に実行する。以下、各ステップを順に説明する。
【0027】
ステップS1(参照ポイントの決定処理):
本ステップのCPU22は、先ず、図4(A)に示すとおり、1番目の蛍光画像I1を参照し、その蛍光画像I1の各画素の輝度値を閾値と比較し、閾値を上回るような輝度値を示す画素を見出す。そして、それら画素の存在する領域を、染色領域44Aとみなす。1番目の蛍光画像I1で発色しているのはミトコンドリア41のみなので、そのミトコンドリア41の存在領域が、染色領域44Aとみなされることになる。
【0028】
さらに、CPU23は、その染色領域44Aから若干の所定座標だけ外れた座標を、参照ポイント40Pと定める。この所定座標は、参照ポイント40Pが細胞質43上に位置するよう、予め適当な値に設定されている。
ステップS2(参照ポイントの輝度変化の参照処理):
本ステップのCPU22は、蛍光画像I1,…,INから、参照ポイント40Pの輝度値P1,…,PNを抽出する。輝度値Pの添え字iは、フレーム番号である。これら輝度値P1,…,PNの各々は、参照ポイント40Pに位置する単一画素の輝度値であってもよいが、好ましくは、参照ポイント40Pに位置する複数画素(任意形状領域内の複数画素)の輝度平均値、或は複数画素のうちの最大輝度値である。なお、図4(B)の説明は、後述する。
【0029】
図5(A)は、参照ポイント40Pの輝度値P1,…,PNをグラフ化したものであり、横軸がフレーム番号、縦軸が輝度値である。これらのデータから、CPU22は参照ポイント40Pの輝度変化を認識する。
図5(A)に示すとおり、参照ポイント40Pの輝度値は、フレーム番号が大きくなる(光照射量が増える)に従って上昇し、或るフレーム(図では、50番目のフレーム)でピークを採った後に下降し、その後、或るフレーム(図では、100番目のフレーム)の辺りから、低い輝度値で安定し始める。この輝度値の上昇速度が、細胞質43の発色速度、つまり、ミトコンドリア41の機能低下速度を示している。
【0030】
ここで、輝度値がピークを採るフレーム番号をfとおくと、フレーム番号fは、ミトコンドリア41の機能低下速度が速いほど小さくなり、ミトコンドリア41の機能低下速度が遅いほど大きくなる。実際、その機能低下速度を遅くするために、他の条件を同じにして励起光源11のパワーだけを弱めてみると、図5(B)に示すとおりフレーム番号fは大きくなった。
【0031】
ステップS3(評価値の算出処理):
本ステップのCPU22は、図5(A)中に矢印で示すとおり、参照ポイント40Pの輝度値がピークを採るようなフレーム番号f(図では、50)を算出し、そのフレーム番号fに基づき、光毒性の評価値Eを算出する。この評価値Eは、ミトコンドリア41の機能低下速度が速いときほど大きな値を採るように、例えば、E=1/f,E=α/f,E=fA−f,或いはE=fA−αfなどと定義される(但し、α,fAは定数)。
【0032】
ステップS4(評価値の表示処理):
本ステップのCPU22は、算出した評価値Eを、モニタ30上に表示する。このとき、CPU22は、評価値Eと共に、最新の蛍光画像INを表示し、オペレータの確認用に、前述した参照ポイント40Pに十字カーソルや矩形枠等のマークを重畳して表示することが望ましい。
【0033】
以上、本システムは、顕微鏡本体10による標本17のイメージングを繰り返し行い、染色部位(ここではミトコンドリア41)の輝度変化を参照する代わりに、その隣接部位(ここでは細胞質43)の輝度変化(図5)を参照し、それに基づき光毒性を評価する。前述したとおり、隣接部位(ここでは細胞質43)の輝度変化は、染色部位(ここではミトコンドリア41)の機能低下と相関が高いので、この評価は、適正に行われる。
【0034】
しかも、本システムでは、隣接部位(ここでは細胞質43)の輝度値がピークを採るときのフレーム番号fが評価値Eへ反映されるので、その評価値Eは、隣接部位(ここでは細胞質43)の発色速度、染色部位(ここではミトコンドリア41)の機能低下速度、つまり光毒性の強さを、正確に示す。
ここで、比較のため、染色部位(ここではミトコンドリア41)の輝度変化を図6(A),(B)に示した。図6(A)は励起光源11のパワーが強いときのグラフ、図6(B)は、励起光源11のパワーが弱いときのグラフである。図6(A),(B)に示すとおり、染色部位(ここではミトコンドリア41)の輝度変化カーブは、励起光源11のパワーが異なっても、同じ位置にピークを持っている(フレーム番号1)。このため、この輝度変化カーブから光毒性の評価値を算出することは難しい。
【0035】
しかも、上述したとおり、染色部位(ここではミトコンドリア41)の輝度変化カーブは、染色部位(ここではミトコンドリア41)の退色を示してはいるものの、機能低下を示しているとは限らないので、この輝度変化カーブから光毒性の評価値を仮に算出したとしても、その正確性は、本実施形態の評価値Eのそれよりも低くなる。
(その他)
なお、本システムにおいて、フレーム番号fから評価値Eへの算出式については、実際の光毒性と評価値Eとが直線関係となるよう適切に選定されることが望ましい。そのためには、光毒性が既知の系を用いた実験やシミュレーションを何度か行えばよい。
【0036】
また、本システムでは、光毒性の評価値Eを、輝度値がピークを採るときのフレーム番号fによって定義したが、輝度値がピークを採ったときの輝度値(ピーク輝度値)によって定義してもよい。また、フレーム番号fとピーク輝度値との双方によって評価値Eを定義してもよい。
また、本実施形態では、参照ポイント40Pの輝度値変化を用いて染色領域44Aの光毒性が評価できることを説明するために200フレーム程度の蛍光画像を取得した例を示したが、細胞に必要以上のダメージを与えないという観点から、参照ポイント40Pの輝度値が上昇し、ピークを採った後に下降し始めたら直に又は所定時間(数秒程度)経過後、励起光源11からのレーザ光照射を停止させる、或はレーザ光の強度を弱めて照射し続けることが好ましい。
【0037】
また、本システムでは、顕微鏡本体10として共焦点顕微鏡を用いたので、セクショニングの異なる複数枚の蛍光画像を取得することが可能である。よって、それら複数枚の蛍光画像を利用することにより、評価値Eの算出精度を向上させてもよい。
また、本実施形態では、染色部位をミトコンドリア41としたが、他の小器官や、細胞膜よりも外側の部位(すなわち培養液)としてもよい。因みに、染色部位が細胞核であるときには、細胞質43上に参照ポイントを採ればよい。また、染色部位が細胞質43であるときには、培養液上に参照ポイントを採ればよい。また、染色部位が培養液であるときには、細胞質43上に参照ポイントを採ればよい。何れにせよ、参照ポイントは、染色部位と膜を隔てて隣接する部位に定められる。
【0038】
また、本システムでは、各処理がコンピュータ20によって実行されたが、コンピュータ20の一部又は全部の動作は、顕微鏡本体10に専用の装置(制御・画像処理装置)、又はオペレータによって実行されてもよい。
例えば、本システムでは、参照ポイント40Pをコンピュータ20が自動的に決定したが、不図示の入力器(キーボード,マウスなど)を介してオペレータに入力させてもよい。オペレータに入力させる際には、図4(A),(B)に示すようにモニタ30上に蛍光画像I1を表示し、その上に十字カーソル(図4(A))や矩形枠のマーク、或いは、染色領域44A(ミトコンドリア41)とそれに隣接する細胞質43を含む領域から染色領域44Aを除くように自由曲線リング状枠又は多角形リング状枠などの任意の形状枠のマーク(図4(B))などを重畳表示するとよい。図4(B)の場合、このリング状枠内の領域が、参照ポイント40Pとなる。また、参照ポイント40Pの任意形状枠のサイズを可変としてもよい。
【0039】
また、本システムの顕微鏡本体10は、蛍光画像を取得する顕微鏡であったが、蛍光画像と微分干渉画像との双方を取得可能な顕微鏡に変形してもよい。その場合、モニタ30へ蛍光画像を表示する際に、微分干渉画像を重畳表示するとよい。微分干渉画像が重畳表示されれば、発色していない器官(透明な器官)の観察が可能になる。また、微分干渉画像を利用して参照ポイントを定めれば、参照ポイントの設定に失敗する可能性は低くなる。
【0040】
また、本システムでは、CPU22の動作プログラムがハードディスクドライブ25に予め格納されていたが、そのプログラムの一部又は全部は、例えば、不図示のインターネットやCD−ROMなどを介してコンピュータ20にインストールされたものであってもよい。
また、本システムの顕微鏡本体10は、標本17からの光を共焦点検出するコンフォーカル顕微鏡であるが、その共焦点検出の機能を省略しても構わない。その場合、ピンホールマスク101は不要となる。或いは、ピンホールマスク以外の方法で共焦点効果を得る多光子顕微鏡に変形しても構わない。
【0041】
また、本システムの顕微鏡本体10は、標本17上を光走査する走査型顕微鏡であるが、共焦点検出の機能を省略する場合は、非走査型顕微鏡としても構わない。その場合、光スキャナ15は不要となり、光センサ102の代わりに撮像素子が配置される。
また、本システムを用いて、ミトコンドリア41に蛍光色素とともに薬剤も添加することにより、薬剤による細胞機能の評価への応用が可能である。また、光照射とともに熱を加える又は放射線を照射することにより、熱又は放射線による細胞機能の評価への応用が可能である。
【0042】
[第2実施形態]
本発明の第2実施形態を説明する。本実施形態は、光治療システム及びそれを用いた光治療方法の実施形態である。
図7は、本システムの構成図である。図7に示すとおり、本システムは、主に、治療対象ST1、治療系ST2、観察系ST3、励起系ST4の4系統からなる。
【0043】
治療対象ST1は、例えば、癌細胞を含む生体の患部であり、予め、ミトコンドリア用の蛍光色素(例えば、RH123)が添加されている。この蛍光色素は、光毒性の評価(治療効果の評価)に用いられる。
治療系ST2は、癌細胞の損傷又は死滅を誘導するために、治療対象ST1へ向けて放射線(ガンマ線等)又は治療用のレーザ光(紫外域,可視域,赤外域)を照射する。放射線は、単独で細胞の障害を誘導する効果があり、治療用のレーザ光は、治療対象ST1に添加された蛍光色素と反応することで細胞の障害を誘導する効果(又は死滅を誘導する効果)がある。ここでは、後者が採用された場合(PDT)を説明する。
【0044】
治療用のレーザ光は、治療系ST2内の放射装置51にて生成され、治療系ST2の先端に設けられた直径数mm〜数cmの筒状先端部(ヘッド)52から治療対象ST1へ向けてパルス発振される。ヘッド52は、治療用のレーザ光のエネルギーを治療対象ST1へ効率よく集中させる働きがある。
励起系ST4は、励起光源11とダイクロイックミラー13とを有し、観察系ST3の対物レンズ16を介して、治療対象ST1へ向けて励起光(例えば、波長507nm)をパルス発振する。この励起光は、治療用のレーザ光と交互に照射される。
【0045】
観察系ST3は、対物レンズ16、結像レンズ19、撮像素子102’、回路部20’、モニタ30などを備える。励起光の照射時に治療対象ST1にて発生した蛍光は、観察系ST3の対物レンズ16及び結像レンズ19で捉えられ、治療対象ST1の蛍光画像を撮像素子102’上に形成する。この蛍光画像は、撮像素子102’によって連続的に撮像され、回路部20’を介してモニタ30へ順次出力される。
【0046】
ここで、観察系ST3の対物レンズ16及び結像レンズ19の結像倍率は、細胞の微細構造(小器官)を観察するのに適した値に設定されている。したがって、モニタ30上には、治療対象ST1の細胞40の様子が、リアルタイムで表示される。
なお、観察系ST3及び励起系ST4のヘッドと治療系ST2のヘッド52は、治療対象ST1の略同一のポイントに正対しており、蛍光画像の取得ポイントと、治療用のレーザ光の照射ポイントとは略一致しているものとする。両者のズレを抑えるために、両者のヘッドを固定、或いは共通化してもよい。
【0047】
治療時、オペレータは、治療対象ST1に対し治療用のレーザ光を照射しながら、モニタ30上で染色部位(ここではミトコンドリア41)と、その隣接部位(ここでは細胞質43)とを観察する。このとき、オペレータは、隣接部位(ここでは細胞質43)の輝度に注目し、その輝度がピークを迎えたタイミングや、ピークを迎えたときの輝度の程度により、治療系ST2の光毒性(つまり治療効果)を評価する。そして、その評価に応じて、オペレータは、適当なタイミングで治療用のレーザ光の照射を止めたり、治療系ST2のパワーを適当な値に調節したりする。
【0048】
このように、本システムによれば、オペレータは、治療効果をリアルタイムで評価しながら光治療をすることができるので、治療用のレーザ光の照射不足による癌組織の取り残しや、治療用のレーザ光の照射過多による副作用を回避し、適切な治療を行うことができる。
なお、本システムでは、隣接部位(ここでは細胞質43)の輝度をオペレータが目視検出したが、その輝度の検出は、自動化されてもよい。その場合、観察系ST3の回路部20’は、撮像素子102’の出力から隣接部位(ここでは細胞質43)の輝度信号を抽出し、かつ、その輝度信号の大きさを、リアルタイムでオペレータへ通知する。その通知は、モニタ30上の映像によって行われてもよいが、音声出力器(スピーカ)を用意し、そのスピーカからの音声によって行われてもよい。
【0049】
また、本システムでは、励起光と治療用の光とが別々に用意されたが、治療用の光に励起光の波長成分が含まれている場合は、治療用の光を励起光に兼用してもよい。
また、第2実施形態で説明した治療装置のうち治療系ST2を診断系に置き換えるだけで、診断装置にすることができる。診断系は、診断用波(音波、電磁波等)発生源と患部を照明する照明光学系と、撮像素子と、照明された患部からの反射光を撮像素子上に結像する結像光学系とを備える。
【実施例】
【0050】
第1実施形態の焦点蛍光顕微鏡システムを用いて、本発明にかかる細胞機能評価を行った例を説明する。
蛍光色素としてRH123を用い、生体細胞中のミトコンドリアに添加して、標本を作成した。まず、励起光源11から所定強度のアルゴンレーザ(488nm)を照射させて標本上を二次元走査させながら、1フレーム分の蛍光画像を取得した。
【0051】
図8(A)は、1番目に取得した実際の蛍光画像である。ミトコンドリア(染色領域)と細胞質(参照ポイント)の所定位置をそれぞれ矩形状枠で特定し、それら特定画素の輝度値の平均値をそれぞれミトコンドリアの輝度値、細胞質の輝度値とするように設定した。
その後、同様な条件で蛍光画像取得を繰り返しながら、ミトコンドリアの輝度値、及び細胞質の輝度値を測定した。図8(B)は、50番目に取得した実際の蛍光画像であり、図8(C)は150番目に取得した実際の蛍光画像である。図8からは、第1実施形態において図2を用いて説明したような蛍光画像の変化があったことがわかる。
【0052】
また、図9(A)は所定強度のアルゴンレーザを照射した時のミトコンドリアの輝度値と細胞質の輝度値をそれぞれグラフ化した実際の画像である。図9(A)からミトコンドリアの輝度値の低下は、RH123の細胞質への放出及び褪色の両方によるものであり、細胞質の輝度値の上昇は、ミトコンドリアからのRH123によるものであり、そのピークは細胞質へのRH123放出の完了を示している。即ち、細胞質の輝度値がピークとなるフレーム番号(50番)の画像取得時に、ミトコンドリアの完全な機能低下が生じたことがわかる。
【0053】
さらに、他の条件は同じにして励起光源11から照射されるレーザ光の強度だけを弱めて、ミトコンドリアの輝度値、及び細胞質の輝度値を測定した。図9(B)は、図9(A)で示したレーザ強度に比べて強度が弱いレーザ光を照射したときのミトコンドリアの輝度値、及び細胞質の輝度値をそれぞれグラフ化した実際の画像である。図9(B)から細胞質の輝度値がピークとなるフレーム番号は70番であり、励起レーザ光の強度が弱くなるとミトコンドリアの機能低下が遅くなることがわかる。
【産業上の利用可能性】
【0054】
本発明の評価方法は、レーザ走査顕微鏡等の光源評価(装置実効性評価)、抗酸化剤等の薬剤評価(薬剤スクリーニング等)、蛍光色素の評価(蛍光寿命評価)等に応用することができる。
【図面の簡単な説明】
【0055】
【図1】第1実施形態のシステムの構成図である。
【図2】蛍光画像I1,I2,…,INを説明する図である。
【図3】CPU22による光毒性の評価処理の動作フローチャートである。
【図4】ステップS1を説明する図である。
【図5】ステップS2,S3を説明する図である。
【図6】染色部位(ミトコンドリア41)の輝度変化を示す図である。
【図7】第2実施形態のシステムの構成図である。
【図8】実施例で取得した蛍光画像である。
【図9】実施例で測定された輝度値のグラフである。
【符号の説明】
【0056】
10…顕微鏡本体,17…標本,13…ダイクロイックミラー,15…光スキャナ,16…対物レンズ,19…結像レンズ,101…ピンホールマスク,102…光センサ,20…コンピュータ,30…モニタ
【特許請求の範囲】
【請求項1】
生体細胞に関する細胞機能の評価方法であって、
前記生体細胞の特定部位を蛍光色素で染色する染色手順と、
前記染色された生体細胞へ光を照射し、それに応じて前記特定部位の隣接部位で発生する蛍光の輝度値を測定する測定手順と、
前記測定された輝度値の変化に基づき前記細胞機能を評価する評価手順と
を含むことを特徴とする細胞機能の評価方法。
【請求項2】
請求項1に記載の細胞機能の評価方法において、
さらに、前記細胞機能評価に応じて所定のタイミングで、前記染色された生体細胞への光照射の制御を行う手順を含む
ことを特徴する細胞機能の評価方法。
【請求項3】
請求項1又は請求項2に記載の細胞機能の評価方法において、
前記評価手順では、
前記輝度変化カーブのピークに基づき、前記細胞機能を評価する
ことを特徴とする細胞機能の評価方法。
【請求項4】
請求項3に記載の細胞機能の評価方法において、
前記評価手順では、
前記輝度変化カーブがピークをとるまでの光照射量に基づき、前記細胞機能を評価する
ことを特徴とする細胞機能の評価方法。
【請求項5】
請求項3に記載の細胞機能の評価方法において、
前記評価手順では、
前記輝度変化カーブがピークをとるときの輝度値に基づき、前記細胞機能を評価する
ことを特徴とする細胞機能の評価方法。
【請求項6】
請求項1又は請求項2に記載の細胞機能の評価方法において、
前記特定部位の隣接部位は、該特定部位とそれに隣接する領域を包含する領域から前記特定部位を除くように自由曲線リング状枠又は多角形リング状枠で特定された領域、或は矩形状枠で特定された領域である
ことを特徴する細胞機能の評価方法。
【請求項7】
請求項6に記載の細胞機能の評価方法において、
前記隣接部位から測定された複数の蛍光の輝度値のうち、最大輝度値を前記輝度値とする、或は前記隣接部位から測定された複数の蛍光の輝度値の平均輝度値を前記輝度値とする
ことを特徴とする細胞機能の評価方法。
【請求項8】
請求項1〜請求項7の何れか一項に記載の細胞機能の評価方法において、
前記特定部位は、ミトコンドリアであり、前記隣接部位は、細胞質である
ことを特徴とする細胞機能の評価方法。
【請求項9】
生体細胞に関する細胞機能の評価システムであって、
前記生体細胞の特定部位は、予め蛍光色素で染色されており、
前記染色された生体細胞へ光を照射する照射手段と、
前記光の照射に応じて前記特定部位の隣接部位で発生する蛍光の輝度値を測定する測定手段と、
前記測定された輝度値の変化に基づき前記細胞機能を評価する評価手段と
を備えたことを特徴とする細胞機能の評価システム。
【請求項10】
請求項9に記載の細胞機能の評価システムにおいて、
さらに、前記細胞機能評価に応じて所定のタイミングで、前記染色された生体細胞への光照射の制御を行う制御手段を備える
ことを特徴する細胞機能の評価システム。
【請求項11】
請求項9又は請求項10に記載の細胞機能の評価システムにおいて、
前記評価手段は、
前記輝度変化カーブのピークに基づき、前記細胞機能を評価する
ことを特徴とする細胞機能の評価システム。
【請求項12】
請求項11に記載の細胞機能の評価システムにおいて、
前記評価手段は、
前記輝度変化カーブがピークをとるまでの光照射量に基づき、前記細胞機能を評価する
ことを特徴とする細胞機能の評価システム。
【請求項13】
請求項11に記載の細胞機能の評価システムにおいて、
前記評価手段は、
前記輝度変化カーブがピークをとるときの輝度値に基づき、前記細胞機能を評価する
ことを特徴とする細胞機能の評価システム。
【請求項14】
請求項9又は請求項10に記載の細胞機能の評価システムにおいて、
前記特定部位の隣接部位は、該特定部位とそれに隣接する領域を包含する領域から前記特定部位を除くように自由曲線リング状枠又は多角形リング状枠で特定された領域、或は矩形状枠で特定された領域である
ことを特徴する細胞機能の評価システム。
【請求項15】
請求項14に記載の細胞機能の評価システムにおいて、
前記隣接部位から測定された複数の蛍光の輝度値のうち、最大輝度値を前記輝度値とする、或は前記隣接部位から測定された複数の蛍光の輝度値の平均輝度値を前記輝度値とする
ことを特徴とする細胞機能の評価システム。
【請求項16】
生体細胞に対し励起光を照射する励起手段と、
前記生体細胞の蛍光画像を取得する観察手段と、
請求項9〜請求項15の何れか一項に記載の細胞機能の評価システムとを備え、
前記励起手段及び前記観察手段は、
前記評価システムの前記照射手段及び前記測定手段に兼用される
ことを特徴とする蛍光顕微鏡システム。
【請求項17】
生体細胞に対し光を照射する光治療方法であって、
前記生体細胞の特定部位を蛍光色素で染色する染色手順と、
前記染色された生体細胞に対し光を照射する治療手順と、
請求項1〜請求項8の何れか一項に記載の細胞機能の評価方法により前記生体細胞に関する細胞機能を評価する評価手順と
を含むことを特徴とする光治療方法。
【請求項18】
生体細胞に対し光を照射する光治療システムであって、
前記生体細胞の特定部位は、予め蛍光色素で染色されており、
前記染色された生体細胞へ光を照射する治療手段と、
前記光の照射に応じて前記特定部位の隣接部位で発生する蛍光の輝度値を測定する測定手段と、
前記測定された輝度値の変化をオペレータへリアルタイムで呈示する呈示手段と
を備えたことを特徴とする光治療システム。
【請求項19】
請求項18記載の光治療システムにおいて、
前記特定部位の隣接部位は、該特定部位とそれに隣接する領域を包含する領域から前記特定部位を除くように自由曲線リング状枠又は多角形リング状枠で特定された領域、或は矩形状枠で特定された領域である
ことを特徴する光治療システム。
【請求項20】
請求項19に記載の光治療システムにおいて、
前記隣接部位から測定された複数の蛍光の輝度値のうち、最大輝度値を前記輝度値とする、或は前記隣接部位から測定された複数の蛍光の輝度値の平均輝度値を前記輝度値とする
ことを特徴とする光治療システム。
【請求項1】
生体細胞に関する細胞機能の評価方法であって、
前記生体細胞の特定部位を蛍光色素で染色する染色手順と、
前記染色された生体細胞へ光を照射し、それに応じて前記特定部位の隣接部位で発生する蛍光の輝度値を測定する測定手順と、
前記測定された輝度値の変化に基づき前記細胞機能を評価する評価手順と
を含むことを特徴とする細胞機能の評価方法。
【請求項2】
請求項1に記載の細胞機能の評価方法において、
さらに、前記細胞機能評価に応じて所定のタイミングで、前記染色された生体細胞への光照射の制御を行う手順を含む
ことを特徴する細胞機能の評価方法。
【請求項3】
請求項1又は請求項2に記載の細胞機能の評価方法において、
前記評価手順では、
前記輝度変化カーブのピークに基づき、前記細胞機能を評価する
ことを特徴とする細胞機能の評価方法。
【請求項4】
請求項3に記載の細胞機能の評価方法において、
前記評価手順では、
前記輝度変化カーブがピークをとるまでの光照射量に基づき、前記細胞機能を評価する
ことを特徴とする細胞機能の評価方法。
【請求項5】
請求項3に記載の細胞機能の評価方法において、
前記評価手順では、
前記輝度変化カーブがピークをとるときの輝度値に基づき、前記細胞機能を評価する
ことを特徴とする細胞機能の評価方法。
【請求項6】
請求項1又は請求項2に記載の細胞機能の評価方法において、
前記特定部位の隣接部位は、該特定部位とそれに隣接する領域を包含する領域から前記特定部位を除くように自由曲線リング状枠又は多角形リング状枠で特定された領域、或は矩形状枠で特定された領域である
ことを特徴する細胞機能の評価方法。
【請求項7】
請求項6に記載の細胞機能の評価方法において、
前記隣接部位から測定された複数の蛍光の輝度値のうち、最大輝度値を前記輝度値とする、或は前記隣接部位から測定された複数の蛍光の輝度値の平均輝度値を前記輝度値とする
ことを特徴とする細胞機能の評価方法。
【請求項8】
請求項1〜請求項7の何れか一項に記載の細胞機能の評価方法において、
前記特定部位は、ミトコンドリアであり、前記隣接部位は、細胞質である
ことを特徴とする細胞機能の評価方法。
【請求項9】
生体細胞に関する細胞機能の評価システムであって、
前記生体細胞の特定部位は、予め蛍光色素で染色されており、
前記染色された生体細胞へ光を照射する照射手段と、
前記光の照射に応じて前記特定部位の隣接部位で発生する蛍光の輝度値を測定する測定手段と、
前記測定された輝度値の変化に基づき前記細胞機能を評価する評価手段と
を備えたことを特徴とする細胞機能の評価システム。
【請求項10】
請求項9に記載の細胞機能の評価システムにおいて、
さらに、前記細胞機能評価に応じて所定のタイミングで、前記染色された生体細胞への光照射の制御を行う制御手段を備える
ことを特徴する細胞機能の評価システム。
【請求項11】
請求項9又は請求項10に記載の細胞機能の評価システムにおいて、
前記評価手段は、
前記輝度変化カーブのピークに基づき、前記細胞機能を評価する
ことを特徴とする細胞機能の評価システム。
【請求項12】
請求項11に記載の細胞機能の評価システムにおいて、
前記評価手段は、
前記輝度変化カーブがピークをとるまでの光照射量に基づき、前記細胞機能を評価する
ことを特徴とする細胞機能の評価システム。
【請求項13】
請求項11に記載の細胞機能の評価システムにおいて、
前記評価手段は、
前記輝度変化カーブがピークをとるときの輝度値に基づき、前記細胞機能を評価する
ことを特徴とする細胞機能の評価システム。
【請求項14】
請求項9又は請求項10に記載の細胞機能の評価システムにおいて、
前記特定部位の隣接部位は、該特定部位とそれに隣接する領域を包含する領域から前記特定部位を除くように自由曲線リング状枠又は多角形リング状枠で特定された領域、或は矩形状枠で特定された領域である
ことを特徴する細胞機能の評価システム。
【請求項15】
請求項14に記載の細胞機能の評価システムにおいて、
前記隣接部位から測定された複数の蛍光の輝度値のうち、最大輝度値を前記輝度値とする、或は前記隣接部位から測定された複数の蛍光の輝度値の平均輝度値を前記輝度値とする
ことを特徴とする細胞機能の評価システム。
【請求項16】
生体細胞に対し励起光を照射する励起手段と、
前記生体細胞の蛍光画像を取得する観察手段と、
請求項9〜請求項15の何れか一項に記載の細胞機能の評価システムとを備え、
前記励起手段及び前記観察手段は、
前記評価システムの前記照射手段及び前記測定手段に兼用される
ことを特徴とする蛍光顕微鏡システム。
【請求項17】
生体細胞に対し光を照射する光治療方法であって、
前記生体細胞の特定部位を蛍光色素で染色する染色手順と、
前記染色された生体細胞に対し光を照射する治療手順と、
請求項1〜請求項8の何れか一項に記載の細胞機能の評価方法により前記生体細胞に関する細胞機能を評価する評価手順と
を含むことを特徴とする光治療方法。
【請求項18】
生体細胞に対し光を照射する光治療システムであって、
前記生体細胞の特定部位は、予め蛍光色素で染色されており、
前記染色された生体細胞へ光を照射する治療手段と、
前記光の照射に応じて前記特定部位の隣接部位で発生する蛍光の輝度値を測定する測定手段と、
前記測定された輝度値の変化をオペレータへリアルタイムで呈示する呈示手段と
を備えたことを特徴とする光治療システム。
【請求項19】
請求項18記載の光治療システムにおいて、
前記特定部位の隣接部位は、該特定部位とそれに隣接する領域を包含する領域から前記特定部位を除くように自由曲線リング状枠又は多角形リング状枠で特定された領域、或は矩形状枠で特定された領域である
ことを特徴する光治療システム。
【請求項20】
請求項19に記載の光治療システムにおいて、
前記隣接部位から測定された複数の蛍光の輝度値のうち、最大輝度値を前記輝度値とする、或は前記隣接部位から測定された複数の蛍光の輝度値の平均輝度値を前記輝度値とする
ことを特徴とする光治療システム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2007−271503(P2007−271503A)
【公開日】平成19年10月18日(2007.10.18)
【国際特許分類】
【出願番号】特願2006−98712(P2006−98712)
【出願日】平成18年3月31日(2006.3.31)
【出願人】(000004112)株式会社ニコン (12,601)
【出願人】(504300181)国立大学法人浜松医科大学 (96)
【Fターム(参考)】
【公開日】平成19年10月18日(2007.10.18)
【国際特許分類】
【出願日】平成18年3月31日(2006.3.31)
【出願人】(000004112)株式会社ニコン (12,601)
【出願人】(504300181)国立大学法人浜松医科大学 (96)
【Fターム(参考)】
[ Back to top ]

