細胞死誘導効果を有する中鎖飽和脂肪酸と不飽和脂肪酸を含有する組成物
【課題】本発明は、より優れた細胞死誘導効果を有する、脂肪酸からなる組成物の提供を課題とする。
【解決手段】本発明によれば、中鎖飽和脂肪酸と、不飽和脂肪酸と、を含む細胞死誘導効果抗を有する組成物が提供される。前記中鎖飽和脂肪酸としては、炭素数が7〜13の直鎖または分岐鎖からなる脂肪酸群から選択される少なくとも1つが好ましい。前記不飽和脂肪酸としては、不飽和度1以上である脂肪酸群から選択される少なくとも1つが好ましい。
【解決手段】本発明によれば、中鎖飽和脂肪酸と、不飽和脂肪酸と、を含む細胞死誘導効果抗を有する組成物が提供される。前記中鎖飽和脂肪酸としては、炭素数が7〜13の直鎖または分岐鎖からなる脂肪酸群から選択される少なくとも1つが好ましい。前記不飽和脂肪酸としては、不飽和度1以上である脂肪酸群から選択される少なくとも1つが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞死誘導効果を有する組成物に関する。詳しくは中鎖飽和脂肪酸と不飽和脂肪酸を含有する組成物に関する。
【背景技術】
【0002】
長鎖飽和脂肪酸は細胞死誘導効果を有する。例えば、膵臓β細胞に過剰に取り込まれた長鎖飽和脂肪酸はβ細胞死を引き起こし、その結果として糖尿病が進行する(非特許文献1)。当該の効果は、ERストレス、PI3-kinaseの阻害などに起因するとされている(非特許文献2、3)。かかる効果を利用した抗がん剤の開発が行われている。
【0003】
一方、不飽和脂肪酸は、炭素数に関わらず、飽和脂肪酸と同様の濃度では細胞毒性はなく、更には長鎖飽和脂肪酸による細胞死誘導効果から細胞を保護、すなわち効果を阻害する特徴を有する(非特許文献4)。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Shimabukuro M, Zhou YT, Levi M, Unger RH. Fatty acid-induced beta cell apoptosis: a link between obesity and diabetes. Proc Natl Acad Sci USA. 1998 Mar; 95(5):2498-502.
【非特許文献2】Akazawa Y, Cazanave S, Mott JL, Elmi N, Bronk SF, Kohno S, Charlton MR & Gores GJ. Palmitoleate attenuates palmitate-induced Bim and PUMA up-regulation and hepatocyte lipoapoptosis. J Hepatol. 2010 April;52(4):586-93.
【非特許文献3】Hardy S, El-Assaad W, Przybytkowski E, Joly E, Prentki M, Langelier Y. Saturated fatty acid-induced apoptosis in MDA-MB-231 breast cancer cells. A role for cardiolipin. J Biol Chem. 2003 Aug;278(34):31861-70.
【非特許文献4】Coll T, Eyre E, Rodriguez-Calvo R, Palomer X, Sanchez RM, Merlos M, Laguna JC & Vazquez-Carrera M. Oleate reverses palmitate-induced insulin resistance and inflammation in skeletal muscle cells. J Biol Chem. 2008 April; 283(17):11107-16.
【発明の概要】
【発明が解決しようとする課題】
【0005】
長鎖飽和脂肪酸は細胞死誘導効果が十分に得られないことがある。また、溶媒に溶解しにくく取り扱いに難点がある。
中鎖飽和脂肪酸においては、細胞死誘導効果の程度、およびその機構に関しては十分な検討は行われていない。
【0006】
本発明は、より優れた細胞死誘導効果を有する、脂肪酸からなる組成物の提供を課題とする。
【課題を解決するための手段】
【0007】
本発明者らは、より優れた細胞死誘導効果を有する脂肪酸を含有する組成物を鋭意検討したところ、中鎖飽和脂肪酸単独と比較して、不飽和脂肪酸と組合せることで、細胞死誘導効果が著しく促進されることを見出し、本発明を完成するに至った。前述のとおり、長鎖飽和脂肪酸と不飽和脂肪酸を組み合わせることで細胞死誘導効果が抑制されることが報告されているが、本発明者らの検討の末に明らかとなった上記知見は、従来の報告からは全く予想できない事実を示すものであり、学術的、産業的な意義は極めて大きいものである。
【0008】
すなわち本発明では、
〔1〕中鎖飽和脂肪酸と、飽和脂肪酸と、を含む組成物。
〔2〕前記中鎖飽和脂肪酸が、炭素数が7〜13の直鎖または分岐鎖からなる脂肪酸群から少なくとも1つが選択される、請求項1に記載の組成物。
〔3〕前記不飽和脂肪酸が、不飽和度1以上である脂肪酸群から少なくとも1つが選択される、請求項1または2に記載の組成物。
を提供する。
【図面の簡単な説明】
【0009】
【図1】図1は、中鎖飽和脂肪酸の添加による細胞死誘導効果を示すグラフである。図中のC7、C8、C9、C10、C12、C16はそれぞれの脂肪酸の炭素数を示す。図1において、値は平均値±標準偏差により示した。図2以降でも同様である。
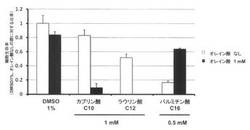
【図2】図2は、HT1080細胞における、中鎖飽和脂肪酸と不飽和脂肪酸の細胞死誘導効果を示すグラフである。図中のC8、C10、C12、C16はそれぞれの脂肪酸の炭素数を示す。
【図3】図3は、A549細胞における、中鎖飽和脂肪酸と不飽和脂肪酸の細胞死誘導効果を示すグラフである。図中のC8、C10、C12、C16はそれぞれの脂肪酸の炭素数を示す。
【図4】図4は、中鎖飽和脂肪酸と不飽和脂肪酸がCaspase-3活性に与える影響を示すグラフである。図中のC12、C16はそれぞれの脂肪酸の炭素数を示す。
【図5】図5は、中鎖飽和脂肪酸と不飽和脂肪酸が細胞内ROS産生に与える影響である。図中のC12、C16はそれぞれの脂肪酸の炭素数を示す。
【発明を実施するための形態】
【0010】
本発明において中鎖飽和脂肪酸とは、下記の一般式(1)で示される脂肪酸、その塩、またはハロゲン化物である。
【0011】
【化1】

【0012】
式中R1は炭素原子数6〜12の炭化水素基を示し、直鎖状、分岐鎖状、環状、又はそれらの組合せからなる基のいずれかであれば特に限定されない。直鎖の中鎖飽和脂肪酸としては炭素数7のエナント酸(ヘプタン酸)、炭素数8のカプリル酸(オクタン酸)、炭素数9のペラルゴン酸(ノナン酸)、炭素数10のカプリン酸(デカン酸)、炭素数11のウンデシル酸(ウンデカン酸)、炭素数12のラウリン酸(ドデカン酸)、炭素数13のトリデシル酸(トリデカン酸)が例示される。好ましくは直鎖状であり、さらに好ましくは炭素数10のカプリン酸(デカン酸)、炭素数11のウンデシル酸(ウンデカン酸)、炭素数12のラウリン酸(ドデカン酸)、または炭素数13のトリデシル酸(トリデカン酸)である。最も好ましくは炭素数12のラウリン酸(ドデカン酸)である。
【0013】
本発明において不飽和脂肪酸とは下記の一般式(2)で示される脂肪酸、その塩、ハロゲン化物である。
【0014】
【化2】

【0015】
式中R2は炭素原子数2〜23で、少なくとも1つ以上の不飽和基を有する炭化水素基を示し、直鎖状、分岐鎖状、環状、又はそれらの組合せからなる基のいずれかであれば特に限定されない。直鎖の不飽和脂肪酸としては、アクリル酸、クロトン酸、イソクロトン酸、ウンデシレン酸、オレイン酸、エライジン酸、セトレイン酸、エルカ酸、ブラシジン酸、ソルビン酸、リノール酸、リノレン酸、アラキドン酸、プロピオール酸、ステアロール酸、パルミチン酸、パルミトオレイン酸、ステアリン酸、オレイン酸、バクセン酸、エレオステアリン酸、アラキジン酸、ネルボン酸が例示される。本発明に用いられる不飽和脂肪酸は、好ましくは直鎖状であり、さらに好ましくは、オレイン酸、リノール酸、リノレン酸、パルミトオレイン酸である。最も好ましくはオレイン酸である。
【0016】
中鎖飽和脂肪酸および不飽和脂肪酸は適当な溶媒(例えばジメチルスルホキシドやオリーブオイル等)に溶解することによって、摂取・投与が容易となる剤形にすることができる。組成物としては、1つの組成物に中鎖脂肪酸と不飽和脂肪酸の両方が含まれているものでもよいし、別々の複数の組成物のセットであって、各組成物に中鎖飽和脂肪酸または不飽和脂肪酸が含まれる多剤式であってもよい。各脂肪酸の濃度は、使用目的、対象疾患、適用対象の性別、年齢、体重、患部の状態などを考慮して適宜調整することができる。また、添加物として酸化防止剤、増粘剤などを加えることも可能である。
【0017】
本発明の組成物の摂取・投与される対象は典型的にはヒトである。但し、ヒト以外の哺乳動物(ペット動物、家畜、実験動物を含む。具体的には例えばマウス、ラット、モルモット、ハムスター、サル、ウシ、ブタ、ヤギ、ヒツジ、イヌ、ネコ等)用に投与することもできる。
【0018】
本発明の組成物の摂取・投与経路は特に限定されない。例えば、経口摂取、経皮摂取、静脈内注射、動脈内注射、門脈内注射、皮内注射、皮下注射、筋肉内注射、又は腹腔内注射によって本発明の組成物を投与する。
【0019】
摂取・投与スケジュールは、対象の性別、年齢、体重、病態などを考慮して作成すればよい。単回投与の他、連続的又は定期的に複数回投与することにしてもよい。複数回投与する際の投与間隔は特に限定されず、例えば1日〜1月である。また、投与回数も特に限定されない。投与回数の例は2回〜10回である。
【実施例】
【0020】
1.予備実験
予備実験として、中鎖飽和脂肪酸の細胞死誘導効果を調査する上で適切な鎖長の脂肪酸を検討した。Jurkat細胞(ヒト急性T細胞性白血病由来細胞株)に、炭素数7、8、9、10、または12の直鎖中鎖飽和脂肪酸、すなわちエナント酸、カプリル酸、ペラルゴン酸、カプリン酸、またはラウリン酸(全て和光純薬工業(株))をそれぞれ1mMの最終濃度で添加した。添加にあたっては、各脂肪酸をジメチルスルホキシド(以降DMSO)(シグマアルドリッチジャパン)に溶解することで100 mMストック溶液を調製し、当該濃度となるように細胞培養液に加えた。細胞培養液は10%(v/v)ウシ胎児血清(EQUITECH-BIO社)を加えたRPMI培地(シグマアルドリッチジャパン(株))を用い、Jurkat細胞は2x105 cells/200μLとして培養した。直鎖中鎖飽和脂肪酸を添加した24時間後にプロピジウ
ムイオダイド(以降PI)(和光純薬工業(株))で細胞を染色し、フローサイトメーターにて陽性細胞(死細胞)の割合を測定した。その結果、炭素数が8以上で細胞死誘導効果が見られ、炭素数12のラウリン酸の効果が最も強いことを認めた(図1)。以降の実験では、カプリン酸、ラウリン酸を用いることとした。
【0021】
2.直鎖中鎖飽和脂肪酸と直鎖不飽和脂肪酸の細胞死誘導効果
不飽和脂肪酸の添加が直鎖中鎖飽和脂肪酸の細胞死誘導効果に与える影響を調べた。
(1)方法
96ウェルプレートにHT1080細胞(ヒト繊維芽肉腫由来細胞株)を5,000 cells/wellで播種し、24時間後に1 mMの直鎖中鎖脂肪酸であるカプリン酸、またはラウリン酸を含む培養液に交換し、1 mMの直鎖不飽和脂肪酸であるオレイン酸(和光純薬工業(株))の有無の条件下で培養した。オレイン酸はDMSOに溶解し、1 Mストック溶液を調整し、当該濃度となるように直鎖中鎖脂肪酸と同時に細胞培養液に加えた。比較対象として同量のDMSOを添加した群、および直鎖長鎖飽和脂肪酸であるパルミチン酸(和光純薬工業(株))を0.5 mM添加した群を設け、同様の操作を行った。細胞培養液は10%(v/v)ウシ胎児血清(EQUITECH-BIO社)と0.5%(w/v)アルブミン・脂肪酸フリーパウダー(Integren社)を加えたDMEM培地(シグマアルドリッチジャパン(株))を用いた。脂肪酸の添加から48時間後にMTTアッセイにより生細胞数を測定した。
【0022】
(2)結果
図2にMTTアッセイの結果を示す。鎖長が長くなるに伴い細胞死誘導効果の増加が認められた。オレイン酸がある場合には、直鎖長鎖飽和脂肪酸(パルミチン酸)においては細胞死誘導効果が抑制されたが、中鎖脂肪鎖(カプリン酸、ラウリン酸)では効果が促進された。驚くべきことにラウリン酸とオレイン酸を組合せることで著しい増強効果が認められ、その細胞死誘導効果によってほぼすべての細胞が死滅した。
【0023】
3.他の細胞種に対する効果
直鎖中鎖飽和脂肪酸と不飽和脂肪酸の組合せが、他の細胞種に対しても細胞死誘導効果を発揮するか否かを調べた。
【0024】
(1)方法
96ウェルプレートにA549細胞(ヒト扁平上皮肺癌由来細胞株)を播種し、24時間後に1 mMのカプリン酸、またはラウリン酸を含む培養液に交換し、1 mMの不飽和脂肪酸であるオレイン酸の有無の条件下で培養した。オレイン酸はDMSOに溶解し、1 Mストック溶液を調製し、当該濃度となるように直鎖中鎖脂肪酸と同時に細胞培養液に加えた。比較対象として同量のDMSOを添加した群、および直鎖長鎖飽和脂肪酸であるパルミチン酸を0.5 mM添加した群を設け、同様の操作を行った。細胞培養液は10%(v/v)ウシ胎児血清と0.5%(v/v)アルブミン・脂肪酸フリーパウダーを加えたDMEM培地を用いた。脂肪酸の添加から48時間後にMTTアッセイにより生細胞数を測定した。
【0025】
(2)結果
図3にA549細胞およびHela細胞におけるMTTアッセイの結果を示す。両細胞ともに、上記HT1080細胞と同様の傾向が認められ、同じくラウリン酸とオレイン酸を組合せることで顕著な細胞死誘導効果があることを認めた。
【0026】
4.脂肪酸がアポトーシスに与える影響の評価
脂肪酸の細胞死誘導効果がアポトーシスの誘起によるものであることを確認するため、caspase-3の活性を測定・評価した。
(方法)
Jurkat細胞2x105 cells/200μLにラウリン酸を1 mM添加し、オレイン酸0.5 mM有無の
条件下で5時間培養した後、NucViewTM 488 Caspase-3 substrate(Biotium社)を用いてcaspase-3活性を測定した。なお、オレイン酸を加える場合には、ラウリン酸と同時に細胞培養液に添加した。比較対象として同量のDMSOを添加した群、および直鎖長鎖飽和脂肪酸であるパルミチン酸を1 mM添加した群を設け、同様の操作を行った。
【0027】
(結果)
Caspase-3活性の変化を図4に示す。DMSOと比して、パルミチン酸添加によりcaspase-3活性が8倍程度に上昇したが、オレイン酸を更に添加することでDMSOと同程度まで減少した。すなわち、パルミチン酸によりアポトーシスが促進されるが、オレイン酸によりこの効果のほぼすべてが抑制されることを認めた。一方、ラウリン酸においては、DMSOと比して5倍程度に上昇し、オレイン酸を更に添加することで11倍にまで上昇した。すなわち、ラウリン酸によりアポトーシスが促進され、オレイン酸はこれを更に促進することを認めた。
【0028】
上記の結果は、ラウリン酸とオレイン酸の組合せによる細胞死誘導効果は、アポトーシスの促進が起因の一つであり、これにより顕著な細胞死誘導効果が実現されることを示す。
【0029】
5.脂肪酸が細胞内活性酸素種(以降ROS)の産生に与える影響の評価
細胞内で過剰に産生されるROSはアポトーシスの起因の一つである。脂肪酸による細胞のアポトーシス誘導が、過剰なROS産生によるものであることを確認するため、細胞内ROSを検出・評価した。
【0030】
(方法)
Jurkat細胞2x105 cells/200μLにラウリン酸を1 mM添加し、オレイン酸0.5 mM有無の
条件下で4時間培養した後、2',7'-dichlorodihydrofluorescein diacetate, acetyl ester(以降DCFDA)(Invitrogen社)で処理したのち、フローサイトメーターにより蛍光強度を測定した。DCFDAは、細胞透過性を有するROSの蛍光指示物質である。なお、オレイン酸を加える場合には、ラウリン酸と同時に細胞培養液に添加した。比較対象として同量のDMSOを添加した群、および直鎖長鎖飽和脂肪酸であるパルミチン酸を0.5 mM添加した群を設け、同様の操作を行った。
【0031】
(結果)
ROS産生の変化を図5に示す。DMSOと比して、パルミチン酸添加によりROS産生が5倍程度に上昇したが、オレイン酸を更に添加することで3倍程度まで減少した。すなわち、パルミチン酸によりROS産生が促進されるが、オレイン酸によりこの効果は抑制されることを認めた。一方、ラウリン酸においては、DMSOと比して4倍程度に上昇し、オレイン酸を更に添加することで10倍にまで上昇した。すなわち、ラウリン酸によりROS産生が促進され、オレイン酸はこれを更に促進することを認めた。
【0032】
上記の結果は、ラウリン酸とオレイン酸の組合せによるアポトーシス促進効果は細胞内ROS産生の亢進が起因の一つであり、これにより顕著な細胞死誘導効果が実現されることを示す。
【0033】
6.まとめ
以上の通り、中鎖飽和脂肪酸と不飽和脂肪酸を組合せることで、種々の細胞において、これまでに知られていなかった顕著な細胞死誘導効果を実現できることが判明した。
【産業上の利用可能性】
【0034】
本発明の細胞死誘導効果を有する組成物は、種々の癌腫に対する抗がん剤や食品に使用される。
この発明は、上記発明の実施の形態及び実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【0035】
前記実施形態では、まず、中鎖飽和脂肪酸またはオレイン酸のどちらか一方を含む培養液で培養し、その後に残りの一方を加えてもよい。この場合も略同様の効果が得られる。
本明細書の中で明示した論文、公開特許公報、及び特許公報などの内容は、その全ての内容を援用によって引用することとする。
【技術分野】
【0001】
本発明は、細胞死誘導効果を有する組成物に関する。詳しくは中鎖飽和脂肪酸と不飽和脂肪酸を含有する組成物に関する。
【背景技術】
【0002】
長鎖飽和脂肪酸は細胞死誘導効果を有する。例えば、膵臓β細胞に過剰に取り込まれた長鎖飽和脂肪酸はβ細胞死を引き起こし、その結果として糖尿病が進行する(非特許文献1)。当該の効果は、ERストレス、PI3-kinaseの阻害などに起因するとされている(非特許文献2、3)。かかる効果を利用した抗がん剤の開発が行われている。
【0003】
一方、不飽和脂肪酸は、炭素数に関わらず、飽和脂肪酸と同様の濃度では細胞毒性はなく、更には長鎖飽和脂肪酸による細胞死誘導効果から細胞を保護、すなわち効果を阻害する特徴を有する(非特許文献4)。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Shimabukuro M, Zhou YT, Levi M, Unger RH. Fatty acid-induced beta cell apoptosis: a link between obesity and diabetes. Proc Natl Acad Sci USA. 1998 Mar; 95(5):2498-502.
【非特許文献2】Akazawa Y, Cazanave S, Mott JL, Elmi N, Bronk SF, Kohno S, Charlton MR & Gores GJ. Palmitoleate attenuates palmitate-induced Bim and PUMA up-regulation and hepatocyte lipoapoptosis. J Hepatol. 2010 April;52(4):586-93.
【非特許文献3】Hardy S, El-Assaad W, Przybytkowski E, Joly E, Prentki M, Langelier Y. Saturated fatty acid-induced apoptosis in MDA-MB-231 breast cancer cells. A role for cardiolipin. J Biol Chem. 2003 Aug;278(34):31861-70.
【非特許文献4】Coll T, Eyre E, Rodriguez-Calvo R, Palomer X, Sanchez RM, Merlos M, Laguna JC & Vazquez-Carrera M. Oleate reverses palmitate-induced insulin resistance and inflammation in skeletal muscle cells. J Biol Chem. 2008 April; 283(17):11107-16.
【発明の概要】
【発明が解決しようとする課題】
【0005】
長鎖飽和脂肪酸は細胞死誘導効果が十分に得られないことがある。また、溶媒に溶解しにくく取り扱いに難点がある。
中鎖飽和脂肪酸においては、細胞死誘導効果の程度、およびその機構に関しては十分な検討は行われていない。
【0006】
本発明は、より優れた細胞死誘導効果を有する、脂肪酸からなる組成物の提供を課題とする。
【課題を解決するための手段】
【0007】
本発明者らは、より優れた細胞死誘導効果を有する脂肪酸を含有する組成物を鋭意検討したところ、中鎖飽和脂肪酸単独と比較して、不飽和脂肪酸と組合せることで、細胞死誘導効果が著しく促進されることを見出し、本発明を完成するに至った。前述のとおり、長鎖飽和脂肪酸と不飽和脂肪酸を組み合わせることで細胞死誘導効果が抑制されることが報告されているが、本発明者らの検討の末に明らかとなった上記知見は、従来の報告からは全く予想できない事実を示すものであり、学術的、産業的な意義は極めて大きいものである。
【0008】
すなわち本発明では、
〔1〕中鎖飽和脂肪酸と、飽和脂肪酸と、を含む組成物。
〔2〕前記中鎖飽和脂肪酸が、炭素数が7〜13の直鎖または分岐鎖からなる脂肪酸群から少なくとも1つが選択される、請求項1に記載の組成物。
〔3〕前記不飽和脂肪酸が、不飽和度1以上である脂肪酸群から少なくとも1つが選択される、請求項1または2に記載の組成物。
を提供する。
【図面の簡単な説明】
【0009】
【図1】図1は、中鎖飽和脂肪酸の添加による細胞死誘導効果を示すグラフである。図中のC7、C8、C9、C10、C12、C16はそれぞれの脂肪酸の炭素数を示す。図1において、値は平均値±標準偏差により示した。図2以降でも同様である。
【図2】図2は、HT1080細胞における、中鎖飽和脂肪酸と不飽和脂肪酸の細胞死誘導効果を示すグラフである。図中のC8、C10、C12、C16はそれぞれの脂肪酸の炭素数を示す。
【図3】図3は、A549細胞における、中鎖飽和脂肪酸と不飽和脂肪酸の細胞死誘導効果を示すグラフである。図中のC8、C10、C12、C16はそれぞれの脂肪酸の炭素数を示す。
【図4】図4は、中鎖飽和脂肪酸と不飽和脂肪酸がCaspase-3活性に与える影響を示すグラフである。図中のC12、C16はそれぞれの脂肪酸の炭素数を示す。
【図5】図5は、中鎖飽和脂肪酸と不飽和脂肪酸が細胞内ROS産生に与える影響である。図中のC12、C16はそれぞれの脂肪酸の炭素数を示す。
【発明を実施するための形態】
【0010】
本発明において中鎖飽和脂肪酸とは、下記の一般式(1)で示される脂肪酸、その塩、またはハロゲン化物である。
【0011】
【化1】

【0012】
式中R1は炭素原子数6〜12の炭化水素基を示し、直鎖状、分岐鎖状、環状、又はそれらの組合せからなる基のいずれかであれば特に限定されない。直鎖の中鎖飽和脂肪酸としては炭素数7のエナント酸(ヘプタン酸)、炭素数8のカプリル酸(オクタン酸)、炭素数9のペラルゴン酸(ノナン酸)、炭素数10のカプリン酸(デカン酸)、炭素数11のウンデシル酸(ウンデカン酸)、炭素数12のラウリン酸(ドデカン酸)、炭素数13のトリデシル酸(トリデカン酸)が例示される。好ましくは直鎖状であり、さらに好ましくは炭素数10のカプリン酸(デカン酸)、炭素数11のウンデシル酸(ウンデカン酸)、炭素数12のラウリン酸(ドデカン酸)、または炭素数13のトリデシル酸(トリデカン酸)である。最も好ましくは炭素数12のラウリン酸(ドデカン酸)である。
【0013】
本発明において不飽和脂肪酸とは下記の一般式(2)で示される脂肪酸、その塩、ハロゲン化物である。
【0014】
【化2】

【0015】
式中R2は炭素原子数2〜23で、少なくとも1つ以上の不飽和基を有する炭化水素基を示し、直鎖状、分岐鎖状、環状、又はそれらの組合せからなる基のいずれかであれば特に限定されない。直鎖の不飽和脂肪酸としては、アクリル酸、クロトン酸、イソクロトン酸、ウンデシレン酸、オレイン酸、エライジン酸、セトレイン酸、エルカ酸、ブラシジン酸、ソルビン酸、リノール酸、リノレン酸、アラキドン酸、プロピオール酸、ステアロール酸、パルミチン酸、パルミトオレイン酸、ステアリン酸、オレイン酸、バクセン酸、エレオステアリン酸、アラキジン酸、ネルボン酸が例示される。本発明に用いられる不飽和脂肪酸は、好ましくは直鎖状であり、さらに好ましくは、オレイン酸、リノール酸、リノレン酸、パルミトオレイン酸である。最も好ましくはオレイン酸である。
【0016】
中鎖飽和脂肪酸および不飽和脂肪酸は適当な溶媒(例えばジメチルスルホキシドやオリーブオイル等)に溶解することによって、摂取・投与が容易となる剤形にすることができる。組成物としては、1つの組成物に中鎖脂肪酸と不飽和脂肪酸の両方が含まれているものでもよいし、別々の複数の組成物のセットであって、各組成物に中鎖飽和脂肪酸または不飽和脂肪酸が含まれる多剤式であってもよい。各脂肪酸の濃度は、使用目的、対象疾患、適用対象の性別、年齢、体重、患部の状態などを考慮して適宜調整することができる。また、添加物として酸化防止剤、増粘剤などを加えることも可能である。
【0017】
本発明の組成物の摂取・投与される対象は典型的にはヒトである。但し、ヒト以外の哺乳動物(ペット動物、家畜、実験動物を含む。具体的には例えばマウス、ラット、モルモット、ハムスター、サル、ウシ、ブタ、ヤギ、ヒツジ、イヌ、ネコ等)用に投与することもできる。
【0018】
本発明の組成物の摂取・投与経路は特に限定されない。例えば、経口摂取、経皮摂取、静脈内注射、動脈内注射、門脈内注射、皮内注射、皮下注射、筋肉内注射、又は腹腔内注射によって本発明の組成物を投与する。
【0019】
摂取・投与スケジュールは、対象の性別、年齢、体重、病態などを考慮して作成すればよい。単回投与の他、連続的又は定期的に複数回投与することにしてもよい。複数回投与する際の投与間隔は特に限定されず、例えば1日〜1月である。また、投与回数も特に限定されない。投与回数の例は2回〜10回である。
【実施例】
【0020】
1.予備実験
予備実験として、中鎖飽和脂肪酸の細胞死誘導効果を調査する上で適切な鎖長の脂肪酸を検討した。Jurkat細胞(ヒト急性T細胞性白血病由来細胞株)に、炭素数7、8、9、10、または12の直鎖中鎖飽和脂肪酸、すなわちエナント酸、カプリル酸、ペラルゴン酸、カプリン酸、またはラウリン酸(全て和光純薬工業(株))をそれぞれ1mMの最終濃度で添加した。添加にあたっては、各脂肪酸をジメチルスルホキシド(以降DMSO)(シグマアルドリッチジャパン)に溶解することで100 mMストック溶液を調製し、当該濃度となるように細胞培養液に加えた。細胞培養液は10%(v/v)ウシ胎児血清(EQUITECH-BIO社)を加えたRPMI培地(シグマアルドリッチジャパン(株))を用い、Jurkat細胞は2x105 cells/200μLとして培養した。直鎖中鎖飽和脂肪酸を添加した24時間後にプロピジウ
ムイオダイド(以降PI)(和光純薬工業(株))で細胞を染色し、フローサイトメーターにて陽性細胞(死細胞)の割合を測定した。その結果、炭素数が8以上で細胞死誘導効果が見られ、炭素数12のラウリン酸の効果が最も強いことを認めた(図1)。以降の実験では、カプリン酸、ラウリン酸を用いることとした。
【0021】
2.直鎖中鎖飽和脂肪酸と直鎖不飽和脂肪酸の細胞死誘導効果
不飽和脂肪酸の添加が直鎖中鎖飽和脂肪酸の細胞死誘導効果に与える影響を調べた。
(1)方法
96ウェルプレートにHT1080細胞(ヒト繊維芽肉腫由来細胞株)を5,000 cells/wellで播種し、24時間後に1 mMの直鎖中鎖脂肪酸であるカプリン酸、またはラウリン酸を含む培養液に交換し、1 mMの直鎖不飽和脂肪酸であるオレイン酸(和光純薬工業(株))の有無の条件下で培養した。オレイン酸はDMSOに溶解し、1 Mストック溶液を調整し、当該濃度となるように直鎖中鎖脂肪酸と同時に細胞培養液に加えた。比較対象として同量のDMSOを添加した群、および直鎖長鎖飽和脂肪酸であるパルミチン酸(和光純薬工業(株))を0.5 mM添加した群を設け、同様の操作を行った。細胞培養液は10%(v/v)ウシ胎児血清(EQUITECH-BIO社)と0.5%(w/v)アルブミン・脂肪酸フリーパウダー(Integren社)を加えたDMEM培地(シグマアルドリッチジャパン(株))を用いた。脂肪酸の添加から48時間後にMTTアッセイにより生細胞数を測定した。
【0022】
(2)結果
図2にMTTアッセイの結果を示す。鎖長が長くなるに伴い細胞死誘導効果の増加が認められた。オレイン酸がある場合には、直鎖長鎖飽和脂肪酸(パルミチン酸)においては細胞死誘導効果が抑制されたが、中鎖脂肪鎖(カプリン酸、ラウリン酸)では効果が促進された。驚くべきことにラウリン酸とオレイン酸を組合せることで著しい増強効果が認められ、その細胞死誘導効果によってほぼすべての細胞が死滅した。
【0023】
3.他の細胞種に対する効果
直鎖中鎖飽和脂肪酸と不飽和脂肪酸の組合せが、他の細胞種に対しても細胞死誘導効果を発揮するか否かを調べた。
【0024】
(1)方法
96ウェルプレートにA549細胞(ヒト扁平上皮肺癌由来細胞株)を播種し、24時間後に1 mMのカプリン酸、またはラウリン酸を含む培養液に交換し、1 mMの不飽和脂肪酸であるオレイン酸の有無の条件下で培養した。オレイン酸はDMSOに溶解し、1 Mストック溶液を調製し、当該濃度となるように直鎖中鎖脂肪酸と同時に細胞培養液に加えた。比較対象として同量のDMSOを添加した群、および直鎖長鎖飽和脂肪酸であるパルミチン酸を0.5 mM添加した群を設け、同様の操作を行った。細胞培養液は10%(v/v)ウシ胎児血清と0.5%(v/v)アルブミン・脂肪酸フリーパウダーを加えたDMEM培地を用いた。脂肪酸の添加から48時間後にMTTアッセイにより生細胞数を測定した。
【0025】
(2)結果
図3にA549細胞およびHela細胞におけるMTTアッセイの結果を示す。両細胞ともに、上記HT1080細胞と同様の傾向が認められ、同じくラウリン酸とオレイン酸を組合せることで顕著な細胞死誘導効果があることを認めた。
【0026】
4.脂肪酸がアポトーシスに与える影響の評価
脂肪酸の細胞死誘導効果がアポトーシスの誘起によるものであることを確認するため、caspase-3の活性を測定・評価した。
(方法)
Jurkat細胞2x105 cells/200μLにラウリン酸を1 mM添加し、オレイン酸0.5 mM有無の
条件下で5時間培養した後、NucViewTM 488 Caspase-3 substrate(Biotium社)を用いてcaspase-3活性を測定した。なお、オレイン酸を加える場合には、ラウリン酸と同時に細胞培養液に添加した。比較対象として同量のDMSOを添加した群、および直鎖長鎖飽和脂肪酸であるパルミチン酸を1 mM添加した群を設け、同様の操作を行った。
【0027】
(結果)
Caspase-3活性の変化を図4に示す。DMSOと比して、パルミチン酸添加によりcaspase-3活性が8倍程度に上昇したが、オレイン酸を更に添加することでDMSOと同程度まで減少した。すなわち、パルミチン酸によりアポトーシスが促進されるが、オレイン酸によりこの効果のほぼすべてが抑制されることを認めた。一方、ラウリン酸においては、DMSOと比して5倍程度に上昇し、オレイン酸を更に添加することで11倍にまで上昇した。すなわち、ラウリン酸によりアポトーシスが促進され、オレイン酸はこれを更に促進することを認めた。
【0028】
上記の結果は、ラウリン酸とオレイン酸の組合せによる細胞死誘導効果は、アポトーシスの促進が起因の一つであり、これにより顕著な細胞死誘導効果が実現されることを示す。
【0029】
5.脂肪酸が細胞内活性酸素種(以降ROS)の産生に与える影響の評価
細胞内で過剰に産生されるROSはアポトーシスの起因の一つである。脂肪酸による細胞のアポトーシス誘導が、過剰なROS産生によるものであることを確認するため、細胞内ROSを検出・評価した。
【0030】
(方法)
Jurkat細胞2x105 cells/200μLにラウリン酸を1 mM添加し、オレイン酸0.5 mM有無の
条件下で4時間培養した後、2',7'-dichlorodihydrofluorescein diacetate, acetyl ester(以降DCFDA)(Invitrogen社)で処理したのち、フローサイトメーターにより蛍光強度を測定した。DCFDAは、細胞透過性を有するROSの蛍光指示物質である。なお、オレイン酸を加える場合には、ラウリン酸と同時に細胞培養液に添加した。比較対象として同量のDMSOを添加した群、および直鎖長鎖飽和脂肪酸であるパルミチン酸を0.5 mM添加した群を設け、同様の操作を行った。
【0031】
(結果)
ROS産生の変化を図5に示す。DMSOと比して、パルミチン酸添加によりROS産生が5倍程度に上昇したが、オレイン酸を更に添加することで3倍程度まで減少した。すなわち、パルミチン酸によりROS産生が促進されるが、オレイン酸によりこの効果は抑制されることを認めた。一方、ラウリン酸においては、DMSOと比して4倍程度に上昇し、オレイン酸を更に添加することで10倍にまで上昇した。すなわち、ラウリン酸によりROS産生が促進され、オレイン酸はこれを更に促進することを認めた。
【0032】
上記の結果は、ラウリン酸とオレイン酸の組合せによるアポトーシス促進効果は細胞内ROS産生の亢進が起因の一つであり、これにより顕著な細胞死誘導効果が実現されることを示す。
【0033】
6.まとめ
以上の通り、中鎖飽和脂肪酸と不飽和脂肪酸を組合せることで、種々の細胞において、これまでに知られていなかった顕著な細胞死誘導効果を実現できることが判明した。
【産業上の利用可能性】
【0034】
本発明の細胞死誘導効果を有する組成物は、種々の癌腫に対する抗がん剤や食品に使用される。
この発明は、上記発明の実施の形態及び実施例の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【0035】
前記実施形態では、まず、中鎖飽和脂肪酸またはオレイン酸のどちらか一方を含む培養液で培養し、その後に残りの一方を加えてもよい。この場合も略同様の効果が得られる。
本明細書の中で明示した論文、公開特許公報、及び特許公報などの内容は、その全ての内容を援用によって引用することとする。
【特許請求の範囲】
【請求項1】
中鎖飽和脂肪酸と、飽和脂肪酸と、を含む組成物。
【請求項2】
前記中鎖飽和脂肪酸が、炭素数が7〜13の直鎖または分岐鎖からなる脂肪酸群から少なくとも1つが選択される、請求項1に記載の組成物。
【請求項3】
前記不飽和脂肪酸が、不飽和度1以上である脂肪酸群から少なくとも1つが選択される、請求項1または2に記載の組成物。
【請求項4】
細胞死誘導効果を有し、請求項1ないし3に記載の組成物。
【請求項1】
中鎖飽和脂肪酸と、飽和脂肪酸と、を含む組成物。
【請求項2】
前記中鎖飽和脂肪酸が、炭素数が7〜13の直鎖または分岐鎖からなる脂肪酸群から少なくとも1つが選択される、請求項1に記載の組成物。
【請求項3】
前記不飽和脂肪酸が、不飽和度1以上である脂肪酸群から少なくとも1つが選択される、請求項1または2に記載の組成物。
【請求項4】
細胞死誘導効果を有し、請求項1ないし3に記載の組成物。
【図4】


【図5】


【図1】


【図2】


【図3】




【図5】


【図1】


【図2】


【図3】


【公開番号】特開2012−224737(P2012−224737A)
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願番号】特願2011−93212(P2011−93212)
【出願日】平成23年4月19日(2011.4.19)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願日】平成23年4月19日(2011.4.19)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
[ Back to top ]

