細胞群内の特定細胞に選択的に照準付けする方法及び装置
【課題】生きている細胞群内の特定の細胞に選択的に照準を定める方法及び装置を提供する。
【解決手段】目標細胞における反応を誘発するため、細胞群のうちの特定細胞を選択的に認識し、エネルギビームで選択した特定細胞を狙い打ちする方法であって、容器に保持した生物学的標本における細胞の画像を撮像する撮り込み装置450において、視界を画定する走査レンズ365と、前記視界を、容器内の生物学的標本における複数個の細胞フレームに分割するコンピュータシステムと、前記視界内の細胞フレームを照明する照明源305と、前記細胞フレームの画像を撮り込む画像撮り込みシステムと、および前記画像を参照して前記生物学的標本における細胞の組織学的または物理学的特性を決定するコマンドとを具えたことを特徴とする画像撮り込み装置。
【解決手段】目標細胞における反応を誘発するため、細胞群のうちの特定細胞を選択的に認識し、エネルギビームで選択した特定細胞を狙い打ちする方法であって、容器に保持した生物学的標本における細胞の画像を撮像する撮り込み装置450において、視界を画定する走査レンズ365と、前記視界を、容器内の生物学的標本における複数個の細胞フレームに分割するコンピュータシステムと、前記視界内の細胞フレームを照明する照明源305と、前記細胞フレームの画像を撮り込む画像撮り込みシステムと、および前記画像を参照して前記生物学的標本における細胞の組織学的または物理学的特性を決定するコマンドとを具えたことを特徴とする画像撮り込み装置。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の背景)
発明の分野 本発明は、生きている細胞群内の特定の細胞に選択的に照準を定める方法及び装置に関するものである。特に、本発明は、細胞群内の特定の細胞を選択的に認識し、個別にエネルギビームの照準を定めて照射して目標細胞の反応を誘発することを高速に行なう方法及び装置に関するものである。
【背景技術】
【0002】
関連技術の説明 細胞治療を使用することは急激に増えており、医療現場でも重要な治療形態となってきている。他の治療方法とは異なり、細胞治療は効果が長持ちし、また生きた細胞を使用することによって効果が永続することもよくある。造血幹細胞(HSC)(例えば、骨髄又は可動化した末梢血液)の移植は実際上保健が効く細胞治療の一つの実施例である。多くの他の細胞治療が開発されつつあり、癌、感染症のための免疫治療、軟骨欠損のための軟骨細胞治療、神経変性疾患のための神経細胞治療、極めて多くの症候のための幹細胞治療がある。これら治療の多くは十分な効力を実現するために好ましくない有害な細胞を除去する必要がある。
【0003】
遺伝子治療も細胞治療の成功に影響を及ぼす活発に発展している医療分野である。人のゲノムに関する理解に急激な進歩があったとしたら、患者に移植する前に多くの遺伝子が細胞への注入に利用できるであろう。しかし、関心のある特定の細胞に遺伝子を効率よく照準を定めて供給することは、この治療の発展における困難な障害となってきている。
【0004】
癌治療においては、化学治療及び/又は放射線治療を多量に施して人体における急激に分裂する癌細胞を選択的に壊死させることができることが知られている。しかし、不幸にも、人体における幾つかの他の細胞タイプも急激に分裂し、実際多くの抗癌治療のための投与限界毒性がHSC及び骨髄内の元祖細胞を殺してしまう。HSC移植は抗癌治療に続く造血システムを救済する治療として開発された。注入の際に、移植者のHSC及び元祖細胞を選択的に骨髄に戻して植えつける。このプロセスを、血液細胞を日毎にカウントすることにより臨床的にモニタする。血液カウントが容認できるレベルまで回復したとき(通常は20〜30日かかる)、患者の移植が完了したと判断し、退院させる。
【0005】
HSC移植は、骨髄内で行なうのが一般的であったが、可動化した末梢血(成長要因又は低量化学療法投与後に白血球除去血輸血によって得られる)が最近好まれて使用されるようになった。これは、即ち、患者から骨髄を約1リットルも採取する必要がないからである。更に、可動化された末梢血からのHSCはより迅速な移植(8〜15日)ができるようになり、患者のケアが軽く、また退院も早まることにつながる。HSC移植は多くの疾患における確立された治療方法となってきており、1997年には世界中で45,000以上もの症例が実施された)。
【0006】
HSC移植は、ドナー細胞(同種遺伝子)、又は高投与抗癌治療の前に採取及び低温保存した患者細胞(自己保存)のいずれかを使用して行われる。自己移植は多くの疾患の治療に幅広く使用され、例えば、肺がん、ホジキンス及び非ホジキンスリンパ腫、神経芽細胞腫、及び多発性骨髄腫に使用される。自己移植の数は同種移植よりも勝っており、約2:1の割合である。この比率は更に増加しており、これは主に、同種移植に関連する移植体対受容体疾患(GVHD)の合併症が起因している。自己移植における最も重要な問題の一つは、HSCとともに腫瘍細胞を患者に再導入してしまうことである。即ち、これら腫瘍細胞は元々の疾患を再発させるからである。
【0007】
腫瘍の成長につれて、腫瘍細胞は元の腫瘍箇所に留まる場合があり、また血流によって人体の他の部位に移動する場合がある。このプロセス、いわゆる腫瘍転移は、病状を極めて悪化させるサテライト腫瘍の形成及び成長を招く。これら転移腫瘍細胞が血液、他の組織、例えば、よくありうる骨髄中に存在すると、自己移植に大きな問題を生ずる。実際、患者に戻して抗癌治療を続けるよう採取したHSCを転移腫瘍細胞が汚染する可能性が極めて高い。
【0008】
自己骨髄内及び採血した可動化末梢血内に汚染源となる腫瘍細胞が存在することが多くの科学的研究で確認されている。最近の画期的な研究では、再注入した腫瘍細胞は確実に人に疾患再発を生ずることを明示している(非特許文献1:1994年Rill氏らの論文)。このことは、移植前に採取した細胞に遺伝子的マーキングを施すことによって検証されており、またこのマーカーは疾患が再発した患者の再生腫瘍細胞内で検出されたことで分かったものである。これらデータは他の研究者によっても確認されており(非特許文献2:1994年Deisseroth氏らの論文参照)、HSC移植における汚染源となる腫瘍細胞は自己移植を受ける患者にとっての現実的な驚異であることを開示している。
【0009】
その後の詳細な研究も、移植者に再注入された腫瘍細胞の実際の数が、激痛を伴うリンパ芽細胞白血病(非特許文献3:1997年Vervoordeldonk氏らの論文参照)、非ホジキンスリンパ腫(非特許文献4:1992年Sharp 氏らの論文参照)、及び肺がん(非特許文献5:1996年Brockstein氏らの論文;非特許文献6:1996年Fields氏らの論文;非特許文献7:1997年Shulze氏らの論文;非特許文献8:1998年Vannucchi 氏らの論文;非特許文献9:1997年Vredenburgh 氏らの論文参照)の再発の危険性に相関関係があることが開示されている。これら多くの研究のうち一つは、注入された腫瘍細胞の数は再発に至る経過時間に反比例することすら開示している(非特許文献9参照)。
【0010】
自己移植における腫瘍細胞汚染の既知の危険性ゆえに、採取したHSC群から汚染源となる腫瘍細胞を除去する多くの方法が提案された。すべての排除方法がよりどころにする基本原理は、患者の造血再構成に必要なHSCを保存しながら腫瘍細胞を除去するか、壊死させるか、することである。
【0011】
このような方法のうちの一つは、腫瘍細胞からHSCを分別する蛍光活性化細胞分別(FACS)を使用した(非特許文献10:1995年Tricot氏らの論文参照)。既知のように、流動血球計算によって、一度に細胞を分別し、物理的に細胞表面におけるマーカーと物理的特徴とに基づいて入り混ざった細胞から一種の細胞群を分別する。しかし、臨床用途でFACSを使用して大量の細胞群を分離するのは、処理が遅く、細胞選別率が極めて低く、98%以上の純度を達成しにくいため、有利ではない。
【0012】
流動血球計算検出器を使用する他の方法として、特許文献1(Shapiro 氏の米国特許第4,395,397号)に記載のものがある。この特許文献1(Shapiro 氏の特許)方法においては、ラベル付けした細胞を流動血球計算検出器内に配置し、検出器を通過し、電子システムによってラベルが付いていると認識された流動流れ内のラベル付き細胞を下流域のレーザビームを使用して殺す。この方法は多くの欠点がある。第1に、好ましくない細胞が検出器/レーザ領域を通過した後には、破壊に成功したかをチェックする方法がない点である。腫瘍が破壊から逃れた場合、患者に再導入される恐れがある。第2に、レーザビームの集束スポットの直径は液体流の断面より大きい。従って、好ましくない細胞領域におけるHSCの多くもレーザビームによって破壊される。更に、上述したように、流動血球計算技術によって得られる純度はそれほど良質ではなく、これは液体の速い流れ(1〜20m/秒)に乗って流動する異成分が入り混ざった細胞群のランダムかつ動的な性質によるものである。
【0013】
レーザ技術を利用した他の方法として、特許文献2(Schindler 氏らの米国特許第4,629,687号)に記載されているものがある。この方法は、可動表面上に固定した細胞を成長させ、次に可動表面にわたり小さいレーザビームスポットを走査して一度に一回細胞を照明し、情報を記録する。次に、同じレーザビームをより高い壊死レベルの出力に切り換え、照明ステップ中に有益細胞が記録されている領域を除いてすべての領域に対して可動表面をビームで掃射する。しかし、不幸にもこの方法も手間がかかり、表面に付着できる細胞にのみ有効である。
【0014】
更に他のレーザ技術を利用した方法として、特許文献3(Kratzer 氏の米国特許第5,035,693号)に記載されているものがある。この方法においては、細胞を移動ベルト上に配置し、小さいレーザビームスポットで表面を走査する。特定の細胞が照明レーザスポットに応答して放射を発生するとき、同一のレーザを即座に高い出力に切り換え、ほぼ同時に細胞を殺してからスキャナをこの細胞から適切にそらせる。しかし、このシステムも特許文献1(Shapiro 氏の特許)方法と同じ多くの欠点を有する。例えば、結像中にスキャナを連続的移動させ、また細胞を殺すため、システムは極めて動的であり、従って、安定性がなく、静的システムよりも正確さに欠ける欠点がある。更に、細胞はベルト上で移動して一方向に検出器を通過するため、この方法は可逆的ではない。従って、1個の腫瘍細胞が検出を免れたら患者に再導入される恐れがある。
【0015】
他の方法も小さいレーザビームスポットを表面上に動的に走査して細胞を照明する。例えば、特許文献4(Sawmura 氏らの米国特許第4,284,897号)は電流計制御偏向ミラーを使用して小さいレーザビームスポットを標準顕微鏡内で走査して蛍光細胞を照明することが記載されている。特許文献5(Dixon 氏らの米国特許第5,381,224号)には、Fシータ走査レンズを電流計制御偏向ミラーでラスタ走査するレーザビームスポットを使用し、顕微鏡標本を撮像することについて記載している。特許文献6及び7(Kain氏の米国特許第5,646,411号及び同第5,719,391号には、Fシータレンズにより電流計制御で小さいレーザビームスポットを走査することが記載されている。これら撮像方法のすべては、画像を撮るべき表面上にわたり移動する小さいポイントを動的に照明するものである。走査する表面は撮像中にも移動する場合がある。
【0016】
小さいレーザスポットを走査する同様の方法は細胞の撮像よりも他の目的に使用することが記載している。例えば、特許文献8(Overbeck氏の米国特許第4,532,402号)は、電流計制御を使用して小さいレーザビームスポットを半導体表面に移動させて集積回路を修復することについて記載している。同様に、特許文献9(Okada 氏らの米国特許第5,690,846号)は、Fシータ走査レンズによりミラーで小さいレーザスポットを移動させるレーザ処理について記載している。特許文献10(Murakame氏らの米国特許第5,296,963号)は、電流計制御偏向ミラーを使用して小さいレーザビームスポットを標準の反転した顕微鏡内に走査し、遺伝子物質を挿入するため細胞に孔を空けることについて記載している。
【0017】
更に、生物学的標本を走査する他の方法が、特許文献11(Price 氏の米国特許第5,932,872号)に記載されている。この方法は、複数個の検出器を使用して一定移動する表面から多数の焦点面における画像を同時に撮り込むものである。得られた画像を使用して、リアルタイムで最良合焦画像を選択し、標本の三次元立体画像を生成するのに使用する。
【先行技術文献】
【特許文献】
【0018】
【特許文献1】米国特許第4,395,397号明細書
【特許文献2】米国特許第4,629,687号明細書
【特許文献3】米国特許第5,035,693号明細書
【特許文献4】米国特許第4,284,897号明細書
【特許文献5】米国特許第5,381,224号明細書
【特許文献6】米国特許第5,646,411号明細書
【特許文献7】米国特許第5,719,391号明細書
【特許文献8】米国特許第4,532,402号明細書
【特許文献9】米国特許第5,690,846号明細書
【特許文献10】米国特許第5,296,963号明細書
【特許文献11】米国特許第5,932,872号明細書
【非特許文献】
【0019】
【非特許文献1】1994年Rill氏らの論文/Rill, D. R., Santana. V.M., Roberts, W. M., Nilson, T., Bowman, L. C., Krance, R. A., Heslop, H. E., Moen, R. C., Ihle, J. N., and Brenner, M. K.: Direct demonstration that autologous bone marrow transplantation for solid tumors can return a multiplicity of tumorigenic cells. Blood 84: 380-383, 1994
【非特許文献2】1994年Deisseroth氏らの論文/Deisseroth, A. B., Zu, Z., Claxton, D., Hanania, E. G., Fu, S., Ellerson, D., Goldberg, L., Thomas, M., Janicek, K., anderson, W. F., Hester, J., Korbling, M., Durett, A., Moen, R., Berenson, R., Heimfeld, S., Hamer, J., Calver, L.,Tibbits, P., Talpaz, M., Kantarjiam, H., Champlin, R., and Reading, C.: Genetic marking shows that Ph+ cells present in autologous transplants of chronic myelogenous leukemia (CML) cotribute to relapse after autologous bone marrow transplantation in CML. Blood 83: 3068-3076, 1994
【非特許文献3】1997年Vervoordeldonk氏らの論文/Vervoordeldonk, S. F., Merle, P. A., Behrendt, H., Steenbergen, E. J., van den Berg, H., van Wering, E. R., von dem Borne, A. E. G., van der Schoot, C. E., van Leeuwen, E. F., and Slaper-Cortenbach, I. C. M.: PCR-positivity in harvested bone marrow predicts relaps after transplantation with autologous purged bone marrow in children in second remission of precursor B-cell acute leukemia. Br. J. Haematol. 96: 395-402, 1997
【非特許文献4】1992年Sharp 氏らの論文参照/Sharp, C. G., Joshi, S. S., Armitage, J. O. Bierman, P., Coccia, P. F., Harrington, D. S., Kessinger, A., Crouse, D. A., Manns, S. L., and Weisenburger, D. D.: Significance marrow by a cultuer technique. Blood 79: 1074-1080, 1992
【非特許文献5】1996年Brockstein氏らの論文/Brockstein, B. E., Ross, A. A., Moss, T. J., Kahn, D. G., Hollingsworth, K., and Willaims, S. F.: Tumor cell contamination of bone marrow harvest products: Clinical consequences in a cohort of advanced-stage breast cancer patients undergoing high-dose chemotherapy. J.Hematotherapy 5: 617-624, 1996
【非特許文献6】1996年Fields氏らの論文/Fields, K. K., Elfenbein, G. J., Trudeau, W. L., Perkins, J. B., Janssen, W. E., and Moscinski, L. C.,: Clinical significance of bone marrow metastases as detected using the polymerase chain reaction in patients with breast cancer undergoing high-dose chemotherapy and autologous bone marrow transplantation. J. Clin. Oncol. 14: 1868-1876, 1996
【非特許文献7】1997年Shulze氏らの論文/Shulze, R., Schulze, M., Wischnik, A., Ehnle, S., Doukas, K., Behr, W., Ehret, W., and Schlimok, G.: Tumor cell contamination of peripheral blood stem cell transplants and bone marrow in high-risk breast cancer patients, Bone Marrow Transplant. 19: 1223-1228, 1997
【非特許文献8】1998年Vannucchi 氏らの論文/Vannucchi, A. M., Bosi, A., Glinz, S., Lombarkini, L., Longo, G., Mariani, M. P., and Rossi-Ferrini, P.,: Evaluation of breast tumour cell contamination on the bone marrow and leukapheresis collections by RT-PCR for cytokeratin-19 mRNA. Br.J.Haematol. 103: 610-617, 1998
【非特許文献9】1997年Vredenburgh 氏らの論文/Vredenburgh, J. J., Silva, O., Broadwater, G., Berry, D., DeSombre, K., Tyer, C., Petros, W. P., Peters, W. P., and Bast, J., R.C.,: The significance of tumor contamination in the bone marrow from high-risk primary breast cancer patients treated with high-dose chemotherapy and hematopoietic support. Biol. Blood Marrow Transplant. 3: 91-97, 1997
【非特許文献10】1995年Tricot氏らの論文/Tricot, G., Gazitt, Y., Jagannath, S., Vesole, D., Reading, C. L., Juttner, C. A., Hoffman, R., and Barlogie, B.: CD34+Thy+lin- peripheral blood stem cells (PBSC) effect timely trilineage engraftment in multiple myeloma (MM). Blood 86: 293a-0, 1995
【非特許文献11】1995年Gazitt氏らの論文/Gazitt, Y., Reading, C. C., Hoffman, R., Wickrema, A., Vesole, D. H., Jagannath, S., Condino, J., Lee, B., Barlogie, B., and Tricot, G.: Purified CD34+ lin-Thy+ stem cells do not contain clonal myeloma cells, Blood 86: 381-389, 1995
【非特許文献12】1991年Gribben 氏らの論文/Gribben, J. G., Freedman, A. S., Neuberg, D., Roy, D. C., Blake, K. W., Woo, S. D., Grossbard, M. L., Rabinowe, S. N., Coral, F., Freeman, G. J., Ritz, J., and Nadler, L. M.L.: Immunologic purging of marrow assessed by PCR before autologous bone marrow transplantation for B-cell lymphoma. N.E.J.Med. 325: 1525-1533, 1991
【非特許文献13】1997年Mapara氏らの論文/Mapara, M. Y., Koerner, I. J., Hildebrandt, M., Bargou, R., Krahl, D., Reinhardt, P., and Doerken, B.: Monitoring of tumor cell purging after highly efficient immunomagnetic selection of CD34 cells from leukapheresis products in brest cancer patients: Comparison of immunocytochemical tumor cell staining and reverse transcriptse-polymerase chain reaction. Blood 89: 337-344, 1997
【非特許文献14】1997年Paulus氏らの論文/Paulus, U., Dreger, P., Viehmann, K., von Neuhoff, N., and Schmitz, N.: Purging peripheral blood progenitor cell grafts from lymphoma cells: Quantitative comparison of immonomagnetic CD34+ selection system. Stem Cells 15: 297-304, 1997
【発明の概要】
【発明が解決しようとする課題】
【0020】
上述の多くの方法は、採取した細胞群の全体に対して腫瘍細胞の除去又は腫瘍細胞壊死を制御する上での基礎になっている。流動血球計算検出器においては、単一細胞を基礎として細胞を分別し、物理的にHSCから好ましくない腫瘍細胞を分離する。これら方法のそれぞれは、HSC移植における腫瘍細胞の数を減らすことが知られているが、すべての腫瘍細胞を検出して除去及び壊死させることができることを示しているものはない。実際、移植患者の大多数は、これら除去技術を適用した後にも検出可能な腫瘍細胞を含んでいる。多重ステップ除去処置後にも移植あたり約30〜30,000個の腫瘍細胞が残存する(非特許文献12:1995年Gazitt氏らの論文;非特許文献13:1991年Gribben 氏らの論文;非特許文献14:1997年Mapara氏らの論文;非特許文献15:1997年Paulus氏らの論文参照)。更に、これら方法のすべては、何らかのHSCロス又はダメージがあり、患者の生着を遅らせるHSC移植の成功に大きな打撃を与える。要約すると、既存の除去技術は不適切であり、HSC移植から検出可能なすべての腫瘍細胞を効果的に除去することができる新規な手法に対する大きな臨床的要望がある。本明細書に記載する本発明方法及び装置はこの要望を満たすものである。
【0021】
生物学的標本における薬剤化合物候補に対する高い処理率のスクリーニングも他の重要な分野である。典型的には、多数の候補化合物をマルチウェル(窪み)プレートのウェル(窪み)に配置した小さい細胞サンプルに並列的に適用し、各ウェルにおける変化を生物学的インジケータで検査する。多数の化合物があるため、スクリーニング速度は重要なファクタ(要因)である。このような研究は現在では細胞群全体からの信号を捕らえなければならないことによって、また顕微鏡で個別の細胞を面倒な人間の観察によって行なうため限界がある。前者の手法は、細胞の副細胞群に対する効果を観察する可能性、又は細胞の一部のみにおける効果を観察する可能性を排除し、後者の手法は、多くの候補化合物を適用するのに時間がかかり過ぎる。個別の細胞における候補化合物の効果を迅速に測定する装置及び方法は極めて需要がある。
【課題を解決するための手段】
【0022】
発明の開示
本発明は、目標細胞における反応を誘発するために、細胞群内の特定の細胞を選択的に認識し、個別にエネルギビームで照準を定めて照射する高速処理方法及び装置を提供する。本発明装置を使用することにより、細胞群におけるすべての検出可能な目標細胞を特別に認識及び照準を定め、目標としない細胞にはほとんど影響を及ぼすことがない。細胞は入り混ざった細胞群又は同種由来の細胞とすることができる。
【0023】
特定細胞は、幾つかの手法を使用して本明細書に記載した本発明によって認識する。一つの実施例としては非破壊ラベル付け方法があり、第1細胞群のすべての細胞を入り混ざった細胞群における第2細胞群をなす残りの細胞から区別する。この実施例においては、ラベルの付いた抗体を使用し、第1細胞群の各細胞に特別なマークを付け、第2細胞群の細胞にはマークを付けない。このようにしてラベルの付いた細胞は入り混ざった細胞群から認識する。微細エネルギビームを第1目標細胞に合焦し、所望の反応を生ぜしめる。この後、次の目標細胞を照射し、すべての目標細胞を照射するまでこの作業を繰り返す。
【0024】
他の実施例においては、第2細胞群の細胞に選択的に結合するが第1細胞群の細胞には結合しない抗体を使用して第1細胞群の細胞を認識する。第1細胞群の細胞はラベルがないことによって認識し、この後エネルギビームで個別に照準を定めて照射する。
【0025】
エネルギビームによって誘発される反応の性質はエネルギビームの性質に依存する。反応は致死的なもの又は非致死的なものとすることができる。エネルギビームで誘発される反応の例としては、壊死、寿命死、光学的削孔(周囲の媒体に存在する物質、例えば、遺伝子材料を侵入させるため)、細胞分解、細胞運動(レーザトウィーザ:laser tweezers)、細胞化合物のカッティング、感光物質の活性化、蛍光試薬の励起、フォトブリーチング、及び分子脱ケージ化(アンケージング)がある。
【0026】
本発明は、更に、生物学的標本内における個別の細胞の形態学的又は生理学的特徴を決定する装置を意図する。従って、本発明装置は、細胞群における非致死的反応を直接又は間接的に誘発し、この反応を測定する。このような非致死的な反応としては、光学的削孔、細胞運動(レーザトウィーザ)、細胞化合物のカッティング(レーザシザーズ)、感光物質の活性化、蛍光試薬の励起がある。このような非致死的反応は、細胞の内外におけるフォトブリーチング、フォトブリーチングリカバリ、分子脱ケージ化の技術によって照準される細胞の反応がある。このような装置の実施例は、生物学的標本の細胞フレームを照明する照明源と、細胞フレームの画像を撮り込む画像撮り込み装置と、画像を参照して生物学的標本内における第1個別細胞の位置を決定する第1制御手段と、少なくとも1個又はそれ以上の個別細胞における反応を誘発するに十分なエネルギを発射するエネルギ源と、形態学的又は生理学的特徴に関して第1個別細胞を調べるに十分なエネルギビームで第1個別細胞を通過させる第2制御手段と、前記調べる第1個別細胞の反応を測定する検出器と、を具えることを特徴とする。
【0027】
更に、本発明装置の他の実施例においては、 生物学的標本における細胞フレームを照明する照明源と、 細胞フレームの画像を撮り込む画像撮り込み装置と、 画像を参照して生物学的標本における第1目標細胞の位置を決定する第1制御手段と、 第1目標細胞の形態学的又は生理学的特徴の変化を生ぜしめるに十分なエネルギビームを第1目標細胞に通過させる第2制御手段と、 第1目標細胞の形態学的又は生理学的特徴における変化の反応を測定する検出器とを具えることを特徴とする。
【0028】
本発明の更に他の発明は、生物学的標本における細胞フレームを照明する照明源と、第1細胞フレームの画像を撮り込む画像撮り込み装置と、画像を参照して生物学的標本における個別の細胞の位置を決定する第1制御手段と、個別の細胞のうち少なくとも1個における反応を誘発するに十分なエネルギビームを発射するエネルギ源と、第1個別細胞における形態学的又は生理学的特徴の変化を生ずるのに十分なエネルギビームを第1個別細胞に通過させる第2制御手段と、第1個別細胞の形態学的又は生理学的特徴を測定するための検出器とを具えることを特徴とする。
【0029】
更に、本発明の他の発明は、多数のケージ化化合物を含む生物学的標本における個別の細胞の形態学的又は生理学的特徴を決定する装置において、
細胞フレームの画像を撮り込む画像撮り込み装置と、
ケージ化化合物のうちの少なくとも1個又はそれ以上の脱ケージ化に十分なエネルギビームをケージ化化合物の1個又はそれ以上に通過させる第1制御手段と、
1個又はそれ以上のケージ化化合物を解体するに十分なエネルギビームを発射するエネルギ源と、
ケージ化化合物の1個又はそれ以上が解体した化合物の反応に応じて形態学的又は生理学的特徴の変化の進行をモニタする第2制御手段と
を具えたことを特徴とする。
【0030】
更に、生物学的標本における個別の細胞の形態学的又は生理学的特徴を決定する本発明装置は、
生物学的標本の細胞フレームを照明する照明源と、
細胞フレームの画像を撮り込む画像撮り込み装置と、
細胞フレームにおける個別の細胞の形態学的又は生理学的特徴を決定する第1制御手段と
を具える。
【0031】
本発明装置は、外部からの刺激に対する細胞の反応を高い処理効率でスクリーニングするのに使用することができ、このような刺激に対する個別の細胞における反応の迅速位置決め及び測定を行なうことができる。このようにして、照明源及び/又はエネルギビームは、分子が細胞内又は細胞上にあろうとなかろうと、細胞の近傍の分子に照準を付けることができ、エネルギビームを分子に作用させて活性化し、また照明源は活性化した分子に対する細胞の反応を研究することができるようになる。
【0032】
多数の商業的に重要な研究及び臨床用途も本発明を適用することができ、このような実施例を以下に説明する。
【0033】
[詳細な説明]
目標細胞における反応を誘発するため、細胞群(母集団)のうちの特定細胞を選択的に認識し、エネルギビームで選択した特定細胞を狙い打ちする方法及び方法を説明する。細胞群は、入り混じった群又は元々均一な群とすることができる。本発明方法及び装置の任意の実施例における反応は致死的なもの、又は非致死的なものとすることができる。このような反応の例としては上述したようなもの、及び本明細書全体で述べるものがある。目標とする細胞は標本が入り混じった群である場合によく行われるようにラベルを付けることができる。他方で標本が均質である場合には、目標細胞は、細胞の反応を調べるため、光源又はエネルギビームによって検閲している又は光源又はエネルギビームが通過している個別の細胞とすることができる。例えば、このような反応としては、細胞の形態学的特徴又は物理学的特徴に関する反応がある。一般的に、この方法は、先ず、第1細胞群及び第2細胞群よりなる細胞混合群のうち第1細胞群の個別細胞を識別及び見出すためのマーカーとして機能するラベルを使用する。本明細書中、装置及び方法によって目標とされた細胞とは、混合細胞群の場合には選択的にラベル付けされた細胞であり、照射源又はエネルギビームによって検閲される又は通過される細胞を意味する。
【0034】
選択されたラベルは、第2細胞群から第1細胞群を認識及び区別するものとすることができる。例えば、フッ化クロムで直接的に又は関節的にタグ付けされた単クローン抗体を特定ラベルとして使用することができる。細胞表面に結合するラベルの他の例としては、非抗体蛋白質、レクチン、炭水化物、又は選択的な細胞結合能力を有する短ペプチドがある。細胞膜介在染料、例えば、PKH‐2及びPKH‐26を、細胞の有糸(核)分裂的履歴を示すのに有用な識別ラベルとして使用することもできる。多くの細胞膜浸透試薬も生きている細胞を他の細胞から選択した規準に基づいて識別するのに利用することができる。例えば、ファロイディン(phalloidin)は細胞膜全体を示し、テトラメチル・ロドアミン・メチルエステル(TMRM)はミトコンドリア状の膜浸透能力を示し、モノクロロビメイン(monochlorobimane)はグルタシオン(glutathione) 誘導ステージを示し、カルボキシルメチル・フルオレセイン(fluorescein) ジアセテート(CMFDA)はチオール(thiol) 活性を示し、カルボキシフルオレセインは細胞内pHを示し、フラ(fura)‐2は細胞内Ca2+レベルを示し、5,5′,6,6′‐テトラクロロ‐1,1′,3,3′‐テトラエチルベンジミダゾル・カルボシアニン・イオダイド(JC‐1)は膜電位を示す。細胞生存能力は蛍光性のSYTO13又はYO‐PRO試薬を使用することによって評価することができる。同様に、蛍光的にタグ付けした遺伝子プローブ(DNA又はRNA)を使用して、注目の遺伝子を有する又は注目の遺伝子を示す細胞のラベル付けに使用することができる。更に、細胞サイクル状態は、ホーシュスト(Hoechst) 33342染料を使用してブロモードオキシユリダイン(BrdU)と組合せて新たな合成DNAにラベル付けする既存のDNAにラベル付けして評価することができる。
【0035】
第1細胞群の細胞に特定のラベルを利用できない場合、本発明方法は第2細胞群の細胞のための特定ラベルを使用することによって反転的に行なうことができることに注意されたい。例えば、造血細胞群において、CD34又はACC‐133細胞マーカーを使用して造血原細胞のみにラベル付けし、混合細胞群における他の細胞にはラベル付けしないようにすることができる。この実施例においては、第1の細胞群はラベルがないことで認識でき、このことによりエネルギビーム照射の照準を付けることができる。
【0036】
第1細胞群の細胞を認識した後、エネルギビームを例えば、レーザからのビーム、コリメートした若しくは集束させた非レーザ光、RFエネルギ、加速粒子、集束させた超音波エネルギ、電子ビーム、又は他の放射ビームを使用して、目標とする照射量で照射し、第1細胞群の細胞の各々に所定の反応を誘発させ、第2細胞群の細胞にはほとんど影響しないようにすることができる。
【0037】
このような所定反応の一つとしてフォトブリーチングがある。フォトブリーチングにおいては、染料の形式のラベル、例えば、ロドアミン(rhodamine)123、GFP、フロレセイン・イソチオシアネート(FITC)、又はフィコエリトリン(phycoerythrin) を標本に添加してから本発明方法を開始する。細胞群が染料に反応する時間が経過した後、エネルギビームを使用して細胞群個別の細胞領域を漂白する。このようなフォトブリーチング検査は、細胞成分及びプロセスの運動性、補充性、機能等を調べるのに使用することができる。
【0038】
他の反応としては内部分子の脱ケージ化がある。このようなプロセスにおいて、標本を、本発明方法を開始する前にケージ化分子と組合せる。このようなケージ化分子は、L‐アスパラギン酸のベータ‐2,6‐ジニトロベンジル・エステル、又は8‐ヒドロキシピレン‐1,3,6‐トリス‐スルフォン酸の1‐(2‐ニトロフェニル)エチル・エステルがある。同様に、アルファ‐カルボキシル‐2‐ニトロベンジル(CNB)及び5‐カルボキシルメソキシ‐2‐ニトロベンジル(CMNB)を含むケージ化グループを、生物学的に活性分子、例えば、エーテル、チオエーテル、エステル、アミン、又は同様の機能グループにリンクさせることもできる。用語「内部分子の脱ケージ化」は、分子解放が細胞表面又は細胞内で生ずることを意味するものとする。このような脱ケージ化実験は、細胞膜の浸透性及び細胞信号伝達のような迅速な分子プロセスを調べる。
【0039】
他の反応としては、外部分子脱ケージ化がある。この反応は、内部分子ケージ化とほぼ同様のプロセスを使用する。しかし、外部分子脱ケージ化においては、脱ケージ化された分子は目標細胞内に取り付けたり、組み込んだりしない。その代わり、周囲の目標細胞のケージ化及び脱ケージ化分子への反応が本発明装置及び方法によって画像化される。
【図面の簡単な説明】
【0040】
【図1】細胞処置装置の一つの実施例におけるハウジング及びディスプレイの外観の斜視図である。
【図2】細胞処置装置の一つの実施例における外側ハウジングを取外し、内部の構成部材を示す斜視図である。
【図3】細胞処置装置の一つの実施例における光学的副組立体の設計のブロック図である。
【図4】細胞処置装置の一つの実施例による光学的副組立体の一つの実施例における斜視図である。
【図5】光学的副組立体の一つの実施例における走査レンズ及び可動ステージの構成を示す側面図である。
【図6】光学的副組立体の一つの実施例における底面側から見た斜視図である。
【図7】細胞処置装置の可動ステージの頂面側から見た斜視図である
【発明を実施するための形態】
【0041】
図1は、細胞処置装置10の一つの実施例を示す。細胞処置装置10は、装置の内部構成部材を収納するハウジング15を有する。ハウジングは、レーザに対する安全性連動装置を有し、ユーザーに対する安全性を確保し、更に、外部からの影響による干渉(例えば、外光、塵埃等)も制限する。ハウジング15の上方部分にはディスプレイユニットを配置し、処置中の細胞群を捕らえた画像を表示する。これら画像は、以下により詳細に説明するように、カメラで撮り込む。キーボード25及びマウス30を使用してデータを入力し、また装置10を制御する。アクセスドア35によって処置を行なっている細胞の標本容器を保持する可動ステージにアクセスすることができる。
【0042】
装置10の内部を図2に示す。図示のように、装置10には、装置の内部構成部材を保持する上側トレイ200と、下側トレイ210を設ける。上側トレイ200には1対の吸気フィルタ215A,Bを有し、装置10の内部に引き込む外気を濾過する。アクセスドアの下側には光学的副組立体(図示せず)を設ける。この光学的副組立体を上側トレイ200に取り付け、このことを図3乃至図6につき詳細に説明する。
【0043】
下側トレイ210には、装置10を動作させるソフトウェアプログラム、コマンド及び命令を記憶するコンピュータ225を設ける。更に、このコンピュータ225は、電気信号接続ラインによって処置装置に制御信号を供給し、レーザを操作して標本上に適正な光点を生じて細胞を処置できるようにする。
【0044】
図示のように、一連の電源230A,B,Cは、装置10内の種々の電気コンポーネントに給電する。更に、無停止電源235を組み込み、瞬間的な外部電源遮断があっても装置の機能を継続できるようにする。
【0045】
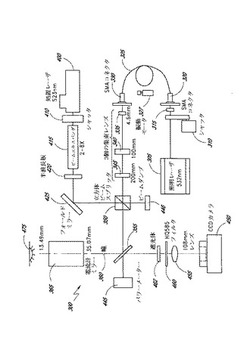
図3には、細胞処置装置10の一つの実施例における光学的副組立体300の一つの実施例のレイアウトを示す。図示のように、照明レーザ305により指向性のあるレーザ出力を発生し、このレーザ出力を使用して標本における目標とする細胞に付した特定ラベルを励起させる。この実施例においては、照明レーザは532nmの波長の光を発生する。照明レーザが光ビームを発生した後は、光はレーザ光のパルス長さを制御するシッャタ310を通過する。
【0046】
照明レーザ光がシッャタ310を通過した後、ボールレンズ315に入射し、SMA光ファイバコネクタ320に集束して進入する。照明レーザビームが光ファイバコネクタ320内に進入した後、光ファイバケーブル325によって出力部330に伝送される。照明ビームは光ファイバケーブル325を通過することにより、照明レーザ305は処置装置内の任意の位置に配置することができ、光学的構成部材の光路上に直接配置しなければならないという制限はない。ある実施例においては、光ファイバケーブル325を振動モータ327に連結し、より均一な照射スポットをスクランブル状態で発生させることができる。
【0047】
光が出力部330を通過した後、一連の集束レンズに指向させ、細胞の一つのフレーム、すなわち「1個のフレーム」を照射するための適正な直径にビームを集束する。本明細書中、細胞の一つのフレーム又は「1個の細胞フレーム」を、カメラで撮影した1フレーム画像内に写る生物学的標本の部分と定義する。このことを以下により詳細に説明する。
【0048】
従って、照明レーザビームは第1集束レンズ335を通過する。この実施例では、この第1集束レンズの焦点長さは4.6mmとする。光ビームは、次に焦点長さが100mmである第2集束レンズ340を通過する。最後に、焦点長さが200mmの第3集束レンズ345を通過する。特別な集束レンズを使用する実施例で本発明を説明したが、照明レーザビームを有利な直径に集束する他の同様のレンズ構成も同様に機能することは勿論である。
【0049】
従って、本発明は、特別な集束レンズ系を有する特定の実施例には限定されない。
【0050】
照明レーザビームが第3集束レンズ345を通過した後、照明レーザから発生する532nm波長の光を伝送する立方体形状のビームスプリッタ350に進入する。好適には、この立方体形状のビームスプリッタ350は一辺が25.5mmの立方体ビームスプリッタ(カナダ国、アービンのメレス‐グリオット社製)とする。しかし、他の寸法のビームスプリッタでも同様に機能することが予想される。更に、多数のプレート状ビームスプリッタ又は薄膜ビームスプリッタを立方体ビームスプリッタ350の代わりに使用しても目立った機能変化はない。
【0051】
照明レーザ光が立方体ビームスプリッタ350を通過した後、長波長透過ミラー355に達し、このミラーで532nmの照明レーザ光を電流計ミラー360のセットに反射し、この電流計ミラー360は照明レーザ光をコンピュータ制御の下に走査レンズ365(ニュージャージー州、ワートン、スペシャル・オプティクス社製)に指向させ、この走査レンズは照明レーザ光を標本(図示せず)に指向させる。電流計ミラーは、照明レーザ光が適正な細胞群(即ち、細胞のフレーム)に指向させて画像を形成する。この実施例で述べる用語「走査レンズ」は、屈折レンズも含まれる。本明細書中に使用する用語「走査レンズ」は図示の実施例に限定されることなく、1個又はそれ以上の屈折性及び/又は反射性光学的素子の組合せた1個又はそれ以上の回折素子を有するレンズ系をも含むことができる。当業者であれば、適正細胞群を照射するため、どのように「走査レンズ」系を設計すべきかは、分かるであろう。
【0052】
照明レーザからの光は、標本を照射するのに有用な波長のものとする。この実施例では、Nd:YAGによる532nm波長の連続した周波数倍増レーザ装置(ドイツ国、ネヴァルク、B&W TeK社製)からのエネルギを長波長通過ミラー(アリゾナ州、フェニックスのカスタム・サイエンティフィック社製)で反射させ、標本における蛍光タグを励起させる。ある一つの実施例において、蛍光タグをフィコエリトリン(phycoerythrin) とする。代案として、アレクサ(Alexa) 532(オレゴン州、ユージーン、モレキュラー・プローブ社製)を使用することができる。フィコエリトリン及びアレクサ532は、580nmの近傍にピークがあるスペクトルを発生し、標本から発生した蛍光は長波長通過ミラーを経てカメラに伝送する。カメラの前方にフィルタを使用して興味のある波長帯域にない光を遮蔽し、カメラに進入する背景光量を減少する。
【0053】
他の多くの装置もこのように使用して標本を照射することができ、以下のものに限定されるものではないが、例えば、フィルタの有無に関係なく、アークランプ(例えば、水銀、キセノン等)、発光ダイオード(LED)、他のタイプのレーザ等がある。この特別なレーザの利点は、高強度であり、比較的エネルギ効率がよく、コンパクトであり、発熱が少ない点である。更に、異なる励起及びスペクトル発生を生ずる他のフッ化クロムを、照射源、フィルタ、長及び/又は短波長通過ミラーを適切に選択してこのような装置に使用することもできる。例えば、アロフィコシアニン(APC)は633nm波長のHeNe照明レーザで励起することができ、フルオロイソシオシアネート(FITC)は488nmアルゴン照明レーザで励起することができる。当業者であれば、種々のコンポーネントよりなる他の光学的レイアウトで本発明による目的を達成することができであろう。
【0054】
照明レーザ305の他に、光学的処置レーザ400を設け、画像分析によって認識された後の目標細胞を照射する。勿論、ある実施例においては、細胞群内の目標細胞の壊死を誘発する処置の場合がある。図示のように、処置レーザ400はシッャタ410を通過する523nmのエネルギビームを出力する。レーザは523nmの波長のエネルギビームを出力する例を示したが、他の波長のエネルギを発生する他のエネルギ源も本発明の範囲内である。
【0055】
処置レーザエネルギビームがシッャタ410を通過した後、ビームエキスパンダ(ニュージャージー州、ワートン、スペシャル・オプティクス社製)に進入し、エネルギビームの直径を標本の平面において適正な寸法に調整する。ビームエキスパンダ415に続いて半波長板420を配置し、ビームの偏光を制御する。次いで処置レーザエネルギビームをミラー425で反射させ、立方体ビームスプリッタ350に入射させる。処置レーザエネルギビームは立方体ビームスプリッタ350で90゜反射し、照明レーザ光ビームの出射光路に整列する。このようにして、処置レーザエネルギビーム及び照明レーザ光ビームの双方が同一の光路に沿って立方体ビームスプリッタ350から出射する。立方体ビームスプリッタ350から処置レーザビームは長波長通過ミラー355で反射し、電流計ミラー360によって操作され、走査レンズ365に接触し、最終的に標本内の目標細胞に集束される。この実施例でも「走査レンズ」は、やはり屈折レンズとすることができる。上述したように、用語「走査レンズ」は、以下に限定されないが、例えば、1個又はそれ以上の屈性性又は反射性の光学的素子を単独で又は組合せて使用するレンズ系とすることができる。更に、「走査レンズ」は、1個又はそれ以上の屈折性及び/又は反射性素子と組合せて使用する1個又はそれ以上の回折素子を含むことができる。当業者であれば、標本内の目標細胞に集束させる「走査レンズ」系を設計する方法は知っているであろう。
【0056】
照明レーザ光ビームの僅かな部分は長波長通過ミラー355を通過して強度センサ445(カリフォルニア州、パロアルト、ジェンテック社製)に入射する。強度センサ445に入射するビームの一部を使用して照明レーザ305から発生する光の強度レベルを計算する。同様に、処置レーザエネルギビームの僅かな部分を立方体ビームスプリッタ350に通過させ、第2強度センサ446(カリフォルニア州、パロアルト、ジェンテック社製)に入射させる。強度センサ446に入射したビームの一部を使用して処置レーザ400から発生するエネルギ強度のレベルを計算する。これら強度センサは電気的にコンピュータシステムにリンクさせ、コンピュータシステムにおける命令/コマンドで強度測定値を採り込んで発生したエネルギ量を決定する。
【0057】
処置レーザからのエネルギビームは細胞における反応を生ずるのに有用な波長を有するものとする。例えば、パルス状の523nm波長のNd:YLF周波数倍増レーザを使用して目標細胞を含む局部的容積部分を加熱し、所定時間内で壊死を誘発するようにする。壊死メカニズムは、ニームズ(1996年Niemz の論文参照)によって検証されたように、細胞内で生ずる実際の温度に依存する。
【0058】
安定性、出射高反復率、保守不要期間が長い点で有利なのでNd:YLF周波数倍増固体レーザ(カリフォルニア州マウンテンビュー、スペクトラ‐フィジクス社製)を使用する。しかし、多くの細胞培養液及び細胞はこのグリーンの波長の光に対して比較的透過性を示し、従って、細胞の壊死させるのに極めて高いエネルギの流れを必要とする。必要なエネルギ量を大幅に減少する、従って、処置レーザのコスト及び寸法を減少するためには、目的に適合した染料を標本に添加し、標本内で処置レーザのエネルギ吸収を効率よく行なうようにする。図示の実施例では、無害の染料FD&Cレッド#40(アルラレッド)を使用し、処置レーザからの523nmエネルギを吸収するが、当業者であれば標本における効率のよいエネルギ吸収をもたらす他のレーザ/染料についての認識は持っているであろう。例えば、633nmHeNeレーザエネルギは、FD&Cグリーン#3(ファーストグリーンFCF)によって効率よく吸収され、488nmアルゴンレーザエネルギはFD&Cイエロー#5(サンセットイエローFCF)によって効率よく吸収され、1064nmNd:YAGレーザエネルギはフィルトロン(ミシシッピー州ゼーランド、ジェンテックス社製)赤外線吸収染料によって効率よく吸収される。エネルギ吸収染料を使用することによって目標細胞を壊死させるに必要なエネルギ量を減少することができる。即ち、処置レーザエネルギの多くがこのような染料の存在で吸収されるからである。
【0059】
染料を添加せずに細胞を熱で壊死させる他の方法としては紫外線レーザを使用する方法がある。355nm波長のNd:YAG周波数3倍増レーザからのエネルギは細胞内の核酸及び蛋白質によって吸収され、加熱及び壊死を生ずる。更に染料を添加せずに細胞を熱で壊死させる更に他の方法としては近赤外線レーザを使用する方法がある。2100nm波長のHo:YAGレーザ又は2940nm波長のEr:YAGレーザからのエネルギは、細胞内の水に吸収され、加熱と壊死を生ずる。
【0060】
この実施例は、エネルギビームで加熱することにより細胞を壊死させる処置を説明したが、当業者であれば、エネルギビームによって他の反応を細胞に誘発することができることは認識されるであろう。このような他の反応としては、ニームズ(1996年Niemz 論文参照)によって検証されたように、例えば、光学‐機械的崩壊、光学的解離、光学的切除、光学‐化学的反応がある。例えば、混合細胞内の感光物質(例えば、ヘムトポルフィリン誘導体、すず‐エチオプルプリン、ルテチウム・テキサフィリン)(1998年 Oleinick及びEvansの論文参照)は、照射によって目標細胞内で特別に活性化する。更に、細胞膜内に小さい移行孔を生じて遺伝子又は他の物質が侵入することができるようになる(1996年Palumbo 氏らの論文参照)。更に、蛋白質又は遺伝子物質のような細胞内又は細胞表面における特別な分子は、指向性のあるエネルギビームによって不活性化され得る(1999年Grate 氏及びWilson氏の論文;及び1988年Jay 氏の論文参照)。更に、光学的ブリーチングを使用して、細胞内運動、例えば、細胞膜内における蛋白質の拡散、細胞の有糸(核)分裂中の細胞内微小管の運動を測定することができる(1997年発行J.セル サイエンス110(9)及び1041頁におけるLadha 氏らの1997年の論文;1991年発行J.セル サイエンス100(第1章)205頁のCentonze氏及びBorisy氏の論文;1999年2月トレンズ・セル・ビオル(第2部)61〜65頁のWhite 氏及びStelzer 氏の論文;1999年8月Pharm Res 16巻(8号)1153〜1162頁のMeyvis氏らの論文参照)。更に、ケージ化化合物の光分解、又はマルチフォトンによる脱ケージ化を含む脱ケージ化を使用して一時的かつ空間的分析で生物学的活性生成物又は他の興味ある生成物の放出を制御することができる(1992年J.セル・バイオロジー119〜367頁のTheriot 氏及びMitchison 氏の論文;1994年PNAS91巻(14号)6629頁のDenk氏の論文参照)。特定の目標細胞に指向させた電磁放射を使用して目標細胞において反応を誘発するこれらメカニズムも本発明に組み込むことができる。
【0061】
照明レーザ305及び処置レーザ400の他に、本発明装置は、細胞群の画像(即ち、フレーム)を撮り込むカメラ450を有する。図3に示すように、カメラ450はレンズ455及びフィルタ460を経て合焦され、迷遊的背景画像を撮り込むことなく細胞の画像を正確に記録することができる。遮光体462をフィルタ460とミラー355との間に配置し、標本からの画像に関連しない角度からカメラに入射する光を排除する。フィルタ460は、所定の波長帯域内の光のみを通過させるよう選択する。この波長帯域としては、例えば、照明レーザ305によって励起される際に目標細胞から発生する光、並びにバックライト光源475からの光がある。
【0062】
バックライト光源475を標本の上方に配置し、標本の後から照明レーザ305で生ずる波長とは異なる波長で照明する。このLEDは、590nmの波長の光を発生し、長波長通過ミラーを透過してカメラに指向される。このバックライト照明は、フレーム内の蛍光目標がないときに細胞を結像するのに有用である。このバックライトを使用する例としては、フレーム内に無垢な非蛍光細胞のみが存在している場合でも光学系の適正な合焦を得るのに使用する。一つの実施例においては、このバックライトをアクセスドア35(図2参照)の下側に取り付ける。
【0063】
上述したように、カメラに復帰する光のみ標本内の興味ある波長の光である。他の光の波長は、フィルタ460を通過せず、カメラ450には記録されない。このことにより、興味ある細胞のみの画像を撮り込むためのより信頼性のあるメカニズムが得られる。当業者にとっては、単独のフィルタ460の代わりに、可動フィルタホイールを使用し、異なるフィルタを光路に出し入れすることができるようにすることもできる。このような実施例においては、異なる光の波長の画像も細胞処置中における異なる時刻に撮り込むことができ、従って、多数の細胞ラベルを使用することができる。
【0064】
この実施例においては、カメラは電荷結合デバイス(CCD)式とし、画像処理コンピュータシステムに伝送することができる。以下に説明するように、コンピュータシステムは、CCDカメラによって撮り込んだ画像を参照して標本における目標細胞の座標系を決定する。
【0065】
次に図4につき説明するが、この図4は光学的副組立体の実施例の斜視図である。図示のように、照明レーザ305は光ビームをシッャタ310及びボールレンズ315からSMA光ファイバコネクタ320に伝送する。光は光ファイバケーブル325及び出力部330を経て集束レンズ335,340,345に入射する。次に、光は立方体ビームスプリッタ350に入射し、長波長通過ミラー355に伝送される。長波長通過355から、光ビームはコンピュータ制御の電流計ミラー360に入射し、この電流計ミラー360で制御されて走査レンズ365から標本における細胞群の適正フレームに指向する。
【0066】
図4の斜視図に示すように、処置レーザ400はシッャタ410を経てビームエキスパンダ415にエネルギを伝送する。処置レーザ400からのエネルギはこのビームエキスパンダ415及び半波長板420を通過して転向ミラー425に入射してから立方体ビームスプリッタ350に入射し、このビームスプリッタ350で90゜反射し、長波長通過ミラー355に達し、このミラー355で反射してコンピュータ制御電流計ミラー360に達する。電流計ミラー360によって走査レンズ365に指向させられた後、レーザエネルギビームは細胞群内の適正位置に入射し、特定の目標細胞に反応を誘発する。
【0067】
処置すべき極めて大きい標本表面積に対応するため、本発明装置には、走査レンズに対して標本容器を機械的に移動させる可動ステージを設ける。このようにして、走査レンズの視界内における細胞群のうち特定の副細胞群(即ち、フィールド)を処置した後に、可動ステージを走査レンズ視界内の他の副細胞群に移動する。図5に示すようにコンピュータ制御の可動ステージ500は処置すべき標本容器(図示せず)を保持する。この可動ステージ500はコンピュータ制御のサーボモータによって2軸に沿って移動し、標本容器を機器の光学的構成部材に対して相対移動させることができる。特定経路に沿うステージ移動は装置の他の動作に協調して動作する。更に、特定の座標系をセーブすることができ、興味のある位置に可動ステージを復帰させるよう呼び戻すことができる。x方向及びy方向の移動に関するエンコーダによりステージ位置に関する閉ループフィードバック制御を行なう。
【0068】
フラットフィールド(F‐シータ)走査レンズ365を可動ステージの下方に取り付ける。走査レンズの視界は、走査レンズの上方に可動ステージ500によって位置決めされる標本の部分である。レンズ365をステップモータに取り付け、レンズ365を自動的に昇降させ(z軸に沿って)、系の合焦を行なう。
【0069】
図4乃至図6に示すように、走査レンズ365の下方に電流計制御偏向ミラー360を配置し、互いに直交する軸線に沿う電磁エネルギを転向する。偏向ミラーの背後に長波長通過ミラー355を配置し、545nmよりも短い波長の電磁エネルギを反射する。545nmより長い波長のエネルギは長波長通過ミラーを通過してフィルタ460、結合レンズ455を経てCCDカメラに入射し、カメラ450(図3及び図4参照)のCCDセンサ上に適正サイズの画像を生ずる。走査レンズ365及び結合レンズ455の組合せによって規定される大きさは、単独細胞を信頼性高く検出するとともに、カメラによって1フレームで見える領域を最大にするよう選択する。CCDカメラ(テキサス州オースチンのDVC社製)を図示の実施例に示すが、このカメラは当業者に既知である任意のタイプの検出器又は画像撮り込み機器とすることができる。本発明装置の光学的副組立体は防振プラットフォームに取り付け、図2及び図5に示すように動作中の安定性を得るようにする。
【0070】
図7には、可動ステージ500の頂面から見た図を示す。図示のように、標本容器を可動ステージ500に取り付ける。標本容器505は上側軸線ネストプレート510に載置し、このネストプレート510は可動ステージ500に対して前後方向に移動するよう設計する。ステップモータ(図示せず)を上側軸線ネストプレート510及びコンピュータシステムに連結し、コンピュータからのコマンドによって標本容器505を前後に移動させる。
【0071】
可動ステージ500をタイミングベルト515に連結し、可動ステージ500を1対の支持トラック525A,Bに沿って側方に移動させる。タイミングベルト515をプーリ(図示せず)に取り付け、このプーリはプーリカバー530の下方に収容する。プーリをステップモータ535に連結し、タイミングベルト515を駆動して可動ステージ500を側方に移動させる。ステップモータ535を電気的にコンピュータシステムに接続し、コンピュータシステムからのコマンドによって可動ステージ500の側方移動を生ずるようにする。行程リミットセンサ540をコンピュータシステムに接続し、可動ステージが所定側方距離を越えて移動した場合に警報を発生するようにする。
【0072】
1対の加速度計545A,Bをこのプラットフォームに組み込み、装置動作に干渉する過剰な衝突又は振動を記録するようにすると好適である。更に、2軸傾斜計550を可動ステージに組み込み、標本容器が水平であるようにし、従って、標本容器における重力に基づく運動が起こる可能性を減少するようにすると好適である。
【0073】
標本チャンバにはダクト付きのファンを設け、標本容器における結露を生じないようにし、またサーモカップルを設けて標本チャンバが容認できる温度範囲内にあるか否かを測定する。他のファンを設け、電子機器から発生する熱を追い出し、また適正なフィルタ215A,Bを吸気する。
【0074】
コンピュータシステム225は上述した種々の電子ハードウェアの動作及び同期を制御する。コンピュータシステムはハードウェアとのインターフェイスをとる任意の市販のコンピュータとすることができる。コンピュータシステムの一つの実施例としては、インテルペンティアム(登録商標)II,III,IV をベースにしてコンピュータ動作するマイクロソフトWindows(登録商標)NT(登録商標)オペレーションシステムとすることができる。ソフトウェアを使用し、種々の機器と通信し、また以下に説明するようにして動作を制御する。
【0075】
装置を先ず初期化するとき、コンピュータはハードディスクドライバからファイルをRAMにロードし、装置を適正に初期化する。多数の組み込みテストを自動的に行なって装置の適正動作を確認し、また較正ルーチンを行って装置を較正する。これらルーチンをうまく完了した際に、ユーザーはキーボード及びマウスから行なうべき手順に関する情報を入力することを促される。必要な情報が入力された後、ユーザーはアクセスドア35を開き、標本を可動ステージに装填することを促される。
【0076】
標本を可動ステージに載置してドアを閉めた後、コンピュータは信号をステージに送信し、ホームポジションに移動する。ファンは初期化されて標本を温めて結露曇りを晴らすようにする。この間に、標本内の細胞は底面に沈殿することができる。更に、この間に、装置は標本を適正に装填した確認のコマンドを発生して光学系の焦点範囲内に位置決めする。例えば、標本容器における特定のマーキングをコンピュータシステムによって位置決め及び合焦し、走査レンズを標本容器の底面に適正に合焦しておく。このようなマーキングは、容器、内容物、及び実行すべき手順を認識する機器にも使用する。所定時間の経過後に、コンピュータはファンを停止させ、処置中における過剰な振動を防止し、細胞処置を開始する。
【0077】
先ず、コンピュータは可動ステージを走査レンズ上に移動するよう命令し、処置すべき標本の第1領域(即ち、フィールド)を直接走査レンズの視界に位置決めする。電流計偏向ミラーに命令し、視界の中心フレームがカメラに結像されるよう移動する。以下に説明するように、走査レンズによって結像されるフィールドは複数個のフレームに分割する。各フレームはフレーム内の細胞がカメラによって有効に結像される適正サイズのものとする。
【0078】
次に、バックライト475を動作させて視界を照明し、走査レンズの合焦を行なうことができるようにする。走査レンズが標本に適正に合焦した後、コンピュータシステムは視界を複数個のフレームに分割し、各フレームをカメラによって個別に分析する。この方法によれば、装置は大きな視界内の複数個のフレームを機械的なステージを移動することなく処理することができる。電流計転向ミラーによって1個のフレームから次のフレームに、ステージを移動する機械的ステップに比べて極めて迅速に移動することができ、この方法は極めて迅速かつ効率的な装置をもたらす。
【0079】
標本が焦点にあるようにする他の手段を利用することもできる。例えば、レーザプロキシメータ(ミシシッピー州アウバーン、コーク社製)は、走査レンズと標本との間の距離を迅速に決定し、走査レンズの位置を調整することができる。チャンバプロキシメータも利用でき、同じ目的を達成する。当業者であれば、走査レンズの上方の焦点位置に標本を位置決めする他の手段を提案することができるであろう。
【0080】
好適な実施例においては、本明細書に記載した装置は、1分間当たり、生物学的標本の少なくとも1,2,3,4,5,6,7,又は14平方センチメートルを処置する。他の実施例においては、上述の装置は、1分間当たり、生物学的標本の少なくとも0.25,0.5,1,2,3,4,又は8百万個の細胞を処置する。更に他の実施例においては、装置は、1秒間当たり、50,100,150,200,250,300,350,400,又は800個の細胞の割合で目標細胞の反応を誘発できる。
【0081】
初期的には、視界の中心におけるフレームの画像をカメラに撮り込みコンピュータのメモリに記憶する。コンピュータにおける命令により、画像の寸法、数及び他の目的とする特徴を見ることによって標本の合焦状態を分析する。必要に応じて、コンピュータは走査レンズに取り付けたz軸モータに命令を与えて最良合焦状態を得るよう昇降させる。装置は、最良合焦状態が得られるまで数個のz位置での画像を繰り返し分析する。次に、電流計制御転向ミラーに命令してカメラによって個別に撮り込まれる4,9,12,18,24又はそれ以上の数の個別フレームに分割する。電流計偏向ミラーが視界における第1フレームに指向をとった後、照明レーザの前方のシッャタを開いてこの電流計偏向ミラー及び走査レンズを経て第1フレームを照明する。カメラはこの第1フレームの細胞における標本から蛍光発光の画像を撮り込む。画像を取得した後、照明レーザの前方のシッャタを閉じ、コンピュータ内のソフトウェアプログラム(イリノイ州グローブのエピックバッファロー社製)によって画像処理する。
【0082】
上述の強度センサ445は照明レーザによって発射される光のレベルを検出し、細胞のフレームを照明するに適したものであるかをコンピュータが計算できるようにする。適していない場合には、他の照明及び画像撮り込みシーケンスを行なうようにする。十分な標本照明を得るのに繰り返し失敗した場合、エラー条件であることになり、オペレータに通知する。
【0083】
照明光のシッャタ遮蔽により、標本の好ましくない加熱及び光学的ブリーチングを減少し、より反復可能な蛍光信号を生ずることができる。画像分析アルゴリズムを動作させ、撮り込む画像の特徴につきフレームにおけるすべての目標細胞のx‐y中心座標系を位置決めする。画像に目標が存在する場合、コンピュータは可動ステージ位置及び視界に対するすべての目標位置の二次元座標系を計算し、次に電流計制御偏向ミラーを位置決めし、第1フレームの第1目標細胞の位置に指向させる。視界内における単一フレームの細胞のみを撮り込み、このポイントにおける分析を行なう。このようにして、標本の副細胞群内の比較的少ない数の認識目標が存在する。更に、カメラはより少ない数の細胞群に指向するため、より大きいサイズを使用して各目標をCCDカメラの画素によって結像することができる。
【0084】
コンピュータシステムが電流計制御偏向ミラー位置決めして第1フレームの細胞内における第1目標細胞の位置に指向させた後、処置レーザを短い時間にわたり発射させ、第1目標細胞に適正な量のエネルギ照射を与える。上述の強度センサ446は処置レーザから発射するエネルギレベルを検出し、目標細胞に反応を誘発するに適正だったか否かをコンピュータが計算できるようにする。エネルギレベルが十分でなかった場合、処置レーザを再び同一目標に向かって発射する。繰り返しの照射で必要とされる量のエネルギを発生しない場合にはエラー条件としてオペレータに通知する。このようにして、目標照準ステップ、発射ステップ、感知ステップをコンピュータが繰り返し、撮り込むフレームのすべての目標が照射されるようにする。
【0085】
第1フレームにおける細胞のすべての目標が処置レーザによって照射された後、ミラーを第2フレームの細胞が視界に入るように位置決めし、フレーム照明及びカメラ結像ポイントで上述の処理を繰り返す。この処理は走査レンズの上方の視界内におけるすべてのフレームに対して継続して行なう。これらフレームのすべてを処理したとき、コンピュータは可動ステージに命令して標本の次の視界に移動し、バックライト照明ステップ及び自動合焦ステップを繰り返す処理を行なう。フレーム及び視界は適正なオーバーラップ状態にし、不慮に標本の消失領域がないようにする。標本を完全に処置した後、オペレータは標本を取り出す信号を入力し、即座に装置を次の標本処理を行なう準備をする。
【0086】
上述したところは目標を見出す蛍光画像分析について説明したが、非蛍光バックライトLED照明画像を使用して他のタイプの目標を、たとえラベルが付いていないものであっても見出すこともできる。
【0087】
順次のフレームの結像及び順次の目標照射を制御する電流計偏向ミラーを使用することの利点は大きいものである。電流計偏向ミラーの一つのブランドとしては、ケンブリッジ・テクノロジー社の型番6860がある(マサチューセッツ州ケンブリッジ)。この電流計偏向ミラーは数ミリ秒内で正確に再位置決めすることができ、大きな領域及び妥当な時間内でのできるだけ多くの目標の処理を行なうことができる。これに比べて、可動ステージは動作が比較的緩慢であり、従って、標本の特定領域を走査レンズの視界内に移動することのみに使用する。電流計制御ボードによって連続的に発生するエラー信号をコンピュータによってモニタし、ミラーを所定位置に位置決めし、画像を撮り込む前に安定状態にするか、又は閉ループで目標に向け発射する。
【0088】
本発明の明細書中、用語「標本」は広い意味を持つものとする。即ち、装置内に配置する生物学的サンプルの任意のタイプを包含する。標本は容器内に又は容器に関連して閉じ込め、細胞の無菌状態及び活状態を維持する。更に、標本は冷却装置に組み込み又は関連させ、本発明方法の動作中に外気温より高い又は低い温度に維持する。標本容器を使用する場合には、この標本容器は照明レーザ、バックライト照明、及び処置レーザと共存できるものとし、標本容器自体に大きなダメージを受けずに適切なエネルギを透過するものとすべきである。
【0089】
上述の実施例の多くの変更も可能であり、例えば、照明、結像、及び細胞照準に関して他の方法もあり得る。例えば、走査レンズに対する標本の移動は、標本をほぼ静止した状態にして走査レンズを移動することによって達成することができる。照明ビーム、画像、及びエネルギビームの偏向は、任意の制御可能反射装置又は回折装置によって達成することができ、例えば、プリズム、圧電傾動プラットフォーム、又は音響光学的偏向器がある。更に、装置は、標本の下方又は上方のいずれかから画像処理を行なうようにすることもできる。装置を可動走査レンズに対して合焦するため、照明ビーム及びエネルギビームはz軸に沿って異なる焦点面に指向させることができる。このようにして、異なる垂直方向高さに位置する標本部分は三次元的に装置によって結像及び画像処理することができる。各ステップのシーケンスはプロセスを変更することなく変化させることができる。例えば、標本のすべての目標座標系を位置決め及び記憶し、次に目標を復帰させ、一定時間内に一回又はそれ以上の回数にわたりエネルギを照射することができる。
【0090】
標本を最適に処置するため、標本をほぼ平坦な表面上に載置し、標本の大部分が焦点の狭い範囲内に存在させ、自動合焦ステップを繰り返す必要を減少するようにする。この表面における細胞の密度は、原理的に任意の値とすることができる。しかし、細胞密度は本発明の手順に必要な全表面積を減少するため、できるだけ高い密度とすべきである。
【0091】
以下に、異なる用途に上述の方法及び装置を使用する実施例を示す。
【0092】
実施例1:自己HSC移植
HSC自己移植が必要なB細胞由来転移腫瘍を有する患者を医師が認識したとする。治療の最初のステップとして、患者に標準のHSC採取処置をとらせ、侵されている腫瘍細胞の数が未知数である約1×1010個の造血細胞を採取する。採取した細胞をHSCのために、CD34表面抗原を有する細胞を選択する市販の免疫適合性コラム(カリフォルニア州アービン、ネクセル・セラピュティクス社のIsolex(登録商標)300)を使用して濃縮し、腫瘍細胞の数が未知数である約3×108 個の造血細胞群にする。この後に、入り混ざった細胞群を、フィコエリトリンに結合する抗B細胞抗体(CD20及びCD22に指向させる)に接触させる。ラベルを付けた抗体を特別にB細胞由来の腫瘍細胞に結合する。
【0093】
この入り混ざった細胞群を、ほぼ平坦表面上の無菌標本容器に収容し、1平方センチメートル当たり約500,000個の細胞の集合となるようにする。標本を上述の装置の可動ステージ上に配置し、すべての検出可能な腫瘍細胞を、フィコエリトリンを参照して識別し、治療(処置)レーザから致死量のエネルギを照射する。この装置の設計は、4時間にわたり臨床規模の移植標本の処理を行なうことができるものとする。細胞を標本容器から回収し、洗浄し、次に低温保存する。細胞を患者に再注入する前に、患者の体内における腫瘍細胞を破壊する化学治療を高い投与量で行なう。この処置に続いて、処理した細胞を37゜Cで解凍して患者に静脈注射で投与する。患者は元の癌の再発なしに回復する。
【0094】
実施例2:同種HSC移植
他の実施例としては、HSC同種移植における移植体対受容体疾患の大きな危険性及び困難性に打ち勝つことができる。患者は適当なドナーが見つかったときに同種移植のために選択される。上述の実施例で説明したように、選択したドナーから細胞を採取する。この場合、入り混ざった細胞を、フィコエリトリンのラベル付けをした抗CD3のT細胞抗体に接触させる。代案として、同種抗原が存在する場合に、活性T細胞マーカー(例えば、CD69)を使用して特定の同種反応T細胞のサブセットにラベル付けをする。細胞群を上述の装置によって処理し、患者に投与すべきT細胞の数を厳密に規定及び制御する。このタイプの制御は、多すぎるT細胞投与が移植体対受容体疾患の危険性を増大させるとともに、T細胞が少なすぎると移植欠陥の危険性及び既知の有益な移植体対白血病効果が喪失する危険性がある。本発明方法及び装置によれば、同種移植におけるT細胞の数を厳密に制御することができる。
【0095】
実施例3:組織工学
他の実施例においては、本発明装置を使用して組織工学の用途の接種物における冒されている細胞を除去するのに使用する。細胞汚染問題は組織工学を実施するに必要な初代細胞培養を生成する際に存在し、このことはランガー氏及びヴァカンティ氏によって説明されている(1999年のLnager氏及びVacanti 氏の論文参照)。特に、軟骨疾患の軟骨細胞治療は、軟骨生検から採取した細胞群における不純物によって妨げられる。従って、本発明を使用して接種物からこのタイプの細胞を特別に取り出す。
【0096】
例えば、軟骨置換を要する患者から軟骨生検を行なう。この標本を通常の条件の下で成長させる(1994年Brittberg 氏らの論文参照)。培養体をすべての汚染細胞例えば、繊維芽細胞のための特定ラベルで着色する。この入り混ざった細胞を上述の装置内に配置し、ラベル付けした汚染細胞を目標として処置レーザを照射し、ゆっくりと軟骨細胞を成長させ、培養体で十分発育させる。
【0097】
実施例4:幹細胞治療
更に、他の実施例としては、胚芽幹細胞を使用して広範囲の種々の病疾患を治療する。胚芽幹細胞は未分化であるため、心筋細胞及びニューロンのような移植に使用される多くのタイプの組織を生成するのに使用される。しかし、移植される未分化胚芽幹細胞は奇形種として知られているタイプの腫瘍を形成する細胞種が混じる傾向もある(1999年Pedersen氏の論文参照)。従って、胚芽幹細胞由来の組織を治療に使用することは、厳密な細胞の純化を必要とし、十分分化した細胞のみを確実に移植することができなければならない。本明細書に記載した装置を使用することにより、胚芽幹細胞由来の組織を患者に移植する前に、未分化幹細胞を排除する。
【0098】
実施例5:人体腫瘍細胞培養体の生成
他の実施例としては、腫瘍生検を癌患者から取り出し、人体腫瘍細胞の培養を開始する。しかし、多くの腫瘍タイプから初代人体腫瘍細胞培養を生体外で生成するのは、初代細胞群を汚染する恐れがあって複雑であり、この汚染は腫瘍細胞よりも生体外成長特性が優勢である。例えば、汚染する繊維芽細胞は、多くの癌細胞培養を育成するのに大きな障害となる。本明細書で説明した装置を使用し、特に、汚染する細胞にラベル付けし、破壊するとともに、生検腫瘍細胞を完全な状態のままにしておくことができる。従って、より活発な初代細胞が癌細胞の系列を襲いまた破壊することがない。
【0099】
実施例6:特定mRNA発現ライブラリの構築
異なる細胞群内の遺伝子の特別な発現パターンは多くの研究者にとって極めて興味深いものであり、また多くの研究は異なる細胞タイプの発現された遺伝子のライブラリを個別に構築するものであった。例えば、腫瘍細胞対正常細胞で発現する遺伝子を知ることは極めて大きな潜在的な価値を有する(1999年Cossman 氏らの論文参照)。このようなライブラリを構築するのに使用する増幅方法によって、少ない数の汚染細胞であっても、不正確な発現ライブラリを生ずる結果を招く(1999年Cossman 氏らの論文;1998年Schutze 及びLahr氏の論文参照)。この問題を解決する手法の一つとして、レーザ顕微解剖即ち、レーザ・キャプチャ・マイクロディセッション(LCM)を使用するものがあり、この手法は、単一の細胞を使用して増幅用に原初遺伝子物質を用意するものである(1998年Schutze 及びLahr氏の論文参照)。不幸にも、単一細胞の遺伝子発現は幾分確率論的であり、また分析時における個別細胞の特別な状態に左右される傾向がある(1999年Cossman 氏らの論文参照)。従って、mRNAを抽出する前に多くの数の細胞を正確に精製することにより極めて正確な発現ライブラリを構築できるようになり、このような正確な発現ライブラリは、単一細胞発現や汚染細胞による発現によって左右されることなく研究している細胞群を表現するものである。本明細書に記載の本発明方法及び装置を使用して細胞群を精製し、RNA抽出手順の実施中に汚染細胞がないようにすることができる。
【0100】
実施例7:特定細胞群の移入(Transfection)
多くの研究及び臨床遺伝子治療の用途は、存在している他の細胞に移入することなしには所望の細胞タイプの妥当な数の細胞に対する移入が不可能であることで阻害されている。本発明方法及び装置は、細胞の混合群内で細胞を選択的に狙いを付けて移入することができる。照準を付けたエネルギ源で細胞膜に又は細胞膜の近傍に光学機械的衝撃波を発生することによって、移行孔を形成し、この移行孔を経て遺伝子(又は他の)物質が細胞内に進入することができる。この遺伝子転移方法はオプトポレーション(optoporation)と称されている(1996年Palumbo 氏らの論文参照)。上述の本発明装置によれば、興味のある細胞のみに選択的にオプトポレーションを迅速かつ自動的に狙いを付けて行なうことができる。
【0101】
例えば、白血細胞は移入すべきDNAを含む溶液を有する標本容器内で配置する。幹細胞に対する特異性を有する蛍光ラベル付き抗体を媒質に添加し、幹細胞に結合させる。標本容器は細胞処置装置内に配置し、処置レーザを照明レーザ光の下で蛍光を発しているすべての細胞に照射する。この処置レーザは照準を付けた細胞にDNAを特定移入するのに有効である。
【0102】
実施例8:生物工学的用途における好ましいクローンの選択
細胞系を使用して価値ある生成物を創成する多くの生物工学的処理において、極めて効率よく生成物を創出するクローンを派生させることが望まれている。クローンのこの選択は手作業で行われることがよくあり、何らかの方法で隔離した多数のクローンを監視しながら手作業で行われることがよくある。本発明によれば、特定生成物を創出するための好ましいクローンの監視及び選択を迅速かつ自動的に行なうことができる。例えば、最大量の抗体を創出するハイブリドーマ細胞は、FC 領域に指向する蛍光ラベルによって認識できる。蛍光ラベルのない又は僅かしか蛍光ラベルが付けられていない細胞は処置レーザで狙い打ちして壊死させ、残ったものがうまい具合に抗体生成に使用するクローンとなる。
【0103】
実施例9:細胞反応の自動モニタ
特定刺激に反応する細胞を自動的にモニタすることは、高い処理効率が得られる薬物スクリーニングにおいて極めて有益である。窪み付きプレートの一つの窪みに収納される細胞群を刺激にさらし、細胞群全体からの蛍光信号を経時的に捕らえることがよくある。本明細書に記載した本発明方法及び装置を使用することにより、より詳細なモニタを単一細胞レベルで行なうことができる。例えば、細胞群にラベル付けし、興味ある細胞の副母集団の特性を認識する。このラベルは照明レーザによって励起し、これら細胞を認識できる。この後、処置レーザを第1ラベルによって識別した個々の細胞に照準を付けて照射し、第2ラベルを励起させ、各細胞の反応に関する情報を得る。細胞はほぼ表面上で静止しているため、各細胞は多数回の評価で、各細胞反応の運動に関する一時的な情報を得る。更に、大きな面積を有する走査レンズ及び電流計制御偏向ミラーを使用することによって、比較的多数の窪みを短時間で迅速にモニタすることができる。
【0104】
特別な実施例としては、上述の実施例2で示した同種反応する(アロリアクティブな:alloreactive)T細胞の場合を考慮する。同種抗原の場合、活性化したドナーT細胞はCD69によって認識することができる。処置レーザを使用してこれら細胞を照射壊死させる代わりに、処置レーザを使用してカルボキシフルオレセイン・ジアセテートの励起及び蛍光発光によって各活性化したT細胞の細胞内pHを調べることができる。照準を定めたレーザによって活性化した細胞のみを調べることができるとともに、大部分のスクリーニング方法で細胞群全体の反応を評価することができる。一連の窪みを並列的にモニタする場合、種々の試薬を個別の窪みに添加し、また特定の活性化したT細胞の各試薬に対する反応を経時的にモニタすることができる。このような装置は、移植体対受容体疾患における同種反応性T細胞の反応を改善する試薬のための高い処理効率が得られるスクリーニング方法をもたらす。この実施例によれば、当業者であれば、刺激に対する細胞反応を、第1ラベルで認識した興味ある細胞のみに焦点を当てて個別の細胞毎にモニタする他の大きな実施例も考え付くことができるであろう。
【0105】
実施例10:フォトブリーチング研究
蛍光体を付けた生物学的サンプルの特定領域のフォトブリーチング及び/又はフォトブリーチリカバリは、種々の生物学的プロセスを評価するのに使用する一般的な方法である。例えば、細胞懸濁液をロドアミン(rhodamine)123でラベル付けし、細胞内のミトコンドリアに蛍光のしみを付ける。本発明の照明レーザを使用することにより、1個又はそれ以上の細胞内のミトコンドリアをロドアミン123の蛍光によって可視化する。次に処置レーザを使用して合焦した光ビームを発生して1個又はそれ以上の細胞内の小さい領域におけるロドアミン123のフォトブリーチングを生ずる。フォトブリーチした領域は直後に黒ずむとともに、隣接領域には影響がない。一連の画像を、照明レーザを使用して撮影し、時系列的な一連の画像を生じ、ブリーチされないミトコンドリアの処置レーザでフォトブリーチされた領域への移動を記録する。この手法を使用して細胞内の多くの生物学的構造の動き、入れ替わり、補充を評価することができる。
【0106】
このようにして、培養したラットの神経突起において、ミトコンドリアのフォトブリーチリカバリを、各細胞内におけるミトコンドリアの移動プールの寸法を測定する(1995年Chute 氏らの論文参照)。これら細胞におけるフォトブリーチリカバリの速度は、細胞内カルシウム及びマグネシウム濃度、エネルギ状態、及び微小管の無欠性に依存する。神経組織に有害な物質例えば、タクソール(taxol)又はヴィンブラスチン(vinblaatine) はフォトブリーチングリカバリの速度に影響する。従って、神経組織に有害な物質の評価は、マルチウェル(窪み)付きプレートのウェル(窪み)内の種々の試薬にさらした統計学的に多数の神経突起内におけるミトコンドリアのフォトブリーチリカバリの測定に基づいて行なうことができる。このような用途では、本明細書に記載した本発明装置により、迅速かつ自動化した評価方法を提供し、多数の細胞における多くの物質の神経組織毒性を評価することができる。この実施例に基づいて、当業者であれば、生物学的標本から有用な情報を得るためにフォトブリーチングを誘発し、またフォトブリーチリカバリをモニタする他の実施例を考え付くことができるであろう。
【0107】
実施例11:脱ケージ化研究
ケージ化化合物を使用して生物学的プロセスを素早く研究することには、非活性状態にある生物学的関連物質の結合(即ち、ケージ化)があり、ケージ化物質を生物学的標本内に拡散させ(比較的ゆっくりとしたプロセスで)、次にレーザを使用して光分解反応を誘発し(比較的速いプロセスで)、その場においてミリ秒単位で物質を解放(即ち、脱ケージ化)する。次に、生物学的標本を短い時間にわたり顕微鏡観察し、生物学的プロセスにおける脱ケージ化されない物質の効果を決定する。おき重要な物質のケージとしては、以下のものがある即ち、ダイオキシジン(Dioxygen)、環式ADP‐リボース(cADPR)、ニコチン酸アデニン・ジニュークレオチド・フォスフェート(NAADP)、一酸化窒素(NO)、カルシウム、Lアスパラギン酸塩、及びアデノシン・トリフォスフェート(ATP)がある。走化性は、脱ケージ化化合物によって研究することができる生理学的特徴の一つの例である。
【0108】
脱ケージ化研究には、生物学的標本の生物学的標本にレーザ光を照射し、次いで時系列的に顕微鏡により標本を観察することが含まれる。本発明装置はこの研究における有用性ははっきりとしている。特別な例としては、L‐アスパラギン酸塩に指向するE.coli走化性の研究がある(1999年Jasuja氏らの論文参照)。アスパラギン酸のベータ‐2,6‐ジニトロベンジル・エステル、及び8‐ヒドロキシピレン‐1,3,6‐トリス‐スルフォン酸の1‐(2‐ニトロフェニル)エチル・エステルを、E.coliを含むウェル(窪み)付きプレートの窪みに添加する。処置レーザで照射する際に、Lアスパラギン酸塩及び発蛍光団の8‐ヒドロキシピレン‐1,3,6‐トリス‐スルフォン酸(ピラニン:pyranine)の局部的脱ケージ化が誘発される。L‐アスパラギン酸塩は、E.coliのための化学的誘引物質として作用し、その後の蛍光画像(照明レーザを使用する)において、ピラニン発蛍光団は、照射した局部領域で生じた脱ケージ化の度合を示すインジケータとして作用する。脱ケージ化現象における可視波長光、例えば、バックライトによって照明された近傍のE.coliの経時的画像を使用して、局部的に脱ケージ化されたL‐アスパラギン酸塩に対する微生物の化学走化性反応を測定する。本発明の特徴によって、それぞれ潜在的な抗微生物試薬を添加した多数のウェル(窪み)を迅速にスクリーニングして微生物の走化性反応を決定する。この実施例によれば、当業者であれば、処置レーザによって脱ケージ化を誘発し、次いで時系列的に顕微鏡観察し、多数のサンプルを自動的に有用な情報を得る他の実施例を考え付くことができるであろう。
【0109】
本発明の特徴を本明細書に例示した特別な実施例につき説明したが、本発明はこれに限定されるものではない。本発明は特許請求の範囲によってのみ限定される。
【0110】
以下に、引用文献を列挙する。




【技術分野】
【0001】
(発明の背景)
発明の分野 本発明は、生きている細胞群内の特定の細胞に選択的に照準を定める方法及び装置に関するものである。特に、本発明は、細胞群内の特定の細胞を選択的に認識し、個別にエネルギビームの照準を定めて照射して目標細胞の反応を誘発することを高速に行なう方法及び装置に関するものである。
【背景技術】
【0002】
関連技術の説明 細胞治療を使用することは急激に増えており、医療現場でも重要な治療形態となってきている。他の治療方法とは異なり、細胞治療は効果が長持ちし、また生きた細胞を使用することによって効果が永続することもよくある。造血幹細胞(HSC)(例えば、骨髄又は可動化した末梢血液)の移植は実際上保健が効く細胞治療の一つの実施例である。多くの他の細胞治療が開発されつつあり、癌、感染症のための免疫治療、軟骨欠損のための軟骨細胞治療、神経変性疾患のための神経細胞治療、極めて多くの症候のための幹細胞治療がある。これら治療の多くは十分な効力を実現するために好ましくない有害な細胞を除去する必要がある。
【0003】
遺伝子治療も細胞治療の成功に影響を及ぼす活発に発展している医療分野である。人のゲノムに関する理解に急激な進歩があったとしたら、患者に移植する前に多くの遺伝子が細胞への注入に利用できるであろう。しかし、関心のある特定の細胞に遺伝子を効率よく照準を定めて供給することは、この治療の発展における困難な障害となってきている。
【0004】
癌治療においては、化学治療及び/又は放射線治療を多量に施して人体における急激に分裂する癌細胞を選択的に壊死させることができることが知られている。しかし、不幸にも、人体における幾つかの他の細胞タイプも急激に分裂し、実際多くの抗癌治療のための投与限界毒性がHSC及び骨髄内の元祖細胞を殺してしまう。HSC移植は抗癌治療に続く造血システムを救済する治療として開発された。注入の際に、移植者のHSC及び元祖細胞を選択的に骨髄に戻して植えつける。このプロセスを、血液細胞を日毎にカウントすることにより臨床的にモニタする。血液カウントが容認できるレベルまで回復したとき(通常は20〜30日かかる)、患者の移植が完了したと判断し、退院させる。
【0005】
HSC移植は、骨髄内で行なうのが一般的であったが、可動化した末梢血(成長要因又は低量化学療法投与後に白血球除去血輸血によって得られる)が最近好まれて使用されるようになった。これは、即ち、患者から骨髄を約1リットルも採取する必要がないからである。更に、可動化された末梢血からのHSCはより迅速な移植(8〜15日)ができるようになり、患者のケアが軽く、また退院も早まることにつながる。HSC移植は多くの疾患における確立された治療方法となってきており、1997年には世界中で45,000以上もの症例が実施された)。
【0006】
HSC移植は、ドナー細胞(同種遺伝子)、又は高投与抗癌治療の前に採取及び低温保存した患者細胞(自己保存)のいずれかを使用して行われる。自己移植は多くの疾患の治療に幅広く使用され、例えば、肺がん、ホジキンス及び非ホジキンスリンパ腫、神経芽細胞腫、及び多発性骨髄腫に使用される。自己移植の数は同種移植よりも勝っており、約2:1の割合である。この比率は更に増加しており、これは主に、同種移植に関連する移植体対受容体疾患(GVHD)の合併症が起因している。自己移植における最も重要な問題の一つは、HSCとともに腫瘍細胞を患者に再導入してしまうことである。即ち、これら腫瘍細胞は元々の疾患を再発させるからである。
【0007】
腫瘍の成長につれて、腫瘍細胞は元の腫瘍箇所に留まる場合があり、また血流によって人体の他の部位に移動する場合がある。このプロセス、いわゆる腫瘍転移は、病状を極めて悪化させるサテライト腫瘍の形成及び成長を招く。これら転移腫瘍細胞が血液、他の組織、例えば、よくありうる骨髄中に存在すると、自己移植に大きな問題を生ずる。実際、患者に戻して抗癌治療を続けるよう採取したHSCを転移腫瘍細胞が汚染する可能性が極めて高い。
【0008】
自己骨髄内及び採血した可動化末梢血内に汚染源となる腫瘍細胞が存在することが多くの科学的研究で確認されている。最近の画期的な研究では、再注入した腫瘍細胞は確実に人に疾患再発を生ずることを明示している(非特許文献1:1994年Rill氏らの論文)。このことは、移植前に採取した細胞に遺伝子的マーキングを施すことによって検証されており、またこのマーカーは疾患が再発した患者の再生腫瘍細胞内で検出されたことで分かったものである。これらデータは他の研究者によっても確認されており(非特許文献2:1994年Deisseroth氏らの論文参照)、HSC移植における汚染源となる腫瘍細胞は自己移植を受ける患者にとっての現実的な驚異であることを開示している。
【0009】
その後の詳細な研究も、移植者に再注入された腫瘍細胞の実際の数が、激痛を伴うリンパ芽細胞白血病(非特許文献3:1997年Vervoordeldonk氏らの論文参照)、非ホジキンスリンパ腫(非特許文献4:1992年Sharp 氏らの論文参照)、及び肺がん(非特許文献5:1996年Brockstein氏らの論文;非特許文献6:1996年Fields氏らの論文;非特許文献7:1997年Shulze氏らの論文;非特許文献8:1998年Vannucchi 氏らの論文;非特許文献9:1997年Vredenburgh 氏らの論文参照)の再発の危険性に相関関係があることが開示されている。これら多くの研究のうち一つは、注入された腫瘍細胞の数は再発に至る経過時間に反比例することすら開示している(非特許文献9参照)。
【0010】
自己移植における腫瘍細胞汚染の既知の危険性ゆえに、採取したHSC群から汚染源となる腫瘍細胞を除去する多くの方法が提案された。すべての排除方法がよりどころにする基本原理は、患者の造血再構成に必要なHSCを保存しながら腫瘍細胞を除去するか、壊死させるか、することである。
【0011】
このような方法のうちの一つは、腫瘍細胞からHSCを分別する蛍光活性化細胞分別(FACS)を使用した(非特許文献10:1995年Tricot氏らの論文参照)。既知のように、流動血球計算によって、一度に細胞を分別し、物理的に細胞表面におけるマーカーと物理的特徴とに基づいて入り混ざった細胞から一種の細胞群を分別する。しかし、臨床用途でFACSを使用して大量の細胞群を分離するのは、処理が遅く、細胞選別率が極めて低く、98%以上の純度を達成しにくいため、有利ではない。
【0012】
流動血球計算検出器を使用する他の方法として、特許文献1(Shapiro 氏の米国特許第4,395,397号)に記載のものがある。この特許文献1(Shapiro 氏の特許)方法においては、ラベル付けした細胞を流動血球計算検出器内に配置し、検出器を通過し、電子システムによってラベルが付いていると認識された流動流れ内のラベル付き細胞を下流域のレーザビームを使用して殺す。この方法は多くの欠点がある。第1に、好ましくない細胞が検出器/レーザ領域を通過した後には、破壊に成功したかをチェックする方法がない点である。腫瘍が破壊から逃れた場合、患者に再導入される恐れがある。第2に、レーザビームの集束スポットの直径は液体流の断面より大きい。従って、好ましくない細胞領域におけるHSCの多くもレーザビームによって破壊される。更に、上述したように、流動血球計算技術によって得られる純度はそれほど良質ではなく、これは液体の速い流れ(1〜20m/秒)に乗って流動する異成分が入り混ざった細胞群のランダムかつ動的な性質によるものである。
【0013】
レーザ技術を利用した他の方法として、特許文献2(Schindler 氏らの米国特許第4,629,687号)に記載されているものがある。この方法は、可動表面上に固定した細胞を成長させ、次に可動表面にわたり小さいレーザビームスポットを走査して一度に一回細胞を照明し、情報を記録する。次に、同じレーザビームをより高い壊死レベルの出力に切り換え、照明ステップ中に有益細胞が記録されている領域を除いてすべての領域に対して可動表面をビームで掃射する。しかし、不幸にもこの方法も手間がかかり、表面に付着できる細胞にのみ有効である。
【0014】
更に他のレーザ技術を利用した方法として、特許文献3(Kratzer 氏の米国特許第5,035,693号)に記載されているものがある。この方法においては、細胞を移動ベルト上に配置し、小さいレーザビームスポットで表面を走査する。特定の細胞が照明レーザスポットに応答して放射を発生するとき、同一のレーザを即座に高い出力に切り換え、ほぼ同時に細胞を殺してからスキャナをこの細胞から適切にそらせる。しかし、このシステムも特許文献1(Shapiro 氏の特許)方法と同じ多くの欠点を有する。例えば、結像中にスキャナを連続的移動させ、また細胞を殺すため、システムは極めて動的であり、従って、安定性がなく、静的システムよりも正確さに欠ける欠点がある。更に、細胞はベルト上で移動して一方向に検出器を通過するため、この方法は可逆的ではない。従って、1個の腫瘍細胞が検出を免れたら患者に再導入される恐れがある。
【0015】
他の方法も小さいレーザビームスポットを表面上に動的に走査して細胞を照明する。例えば、特許文献4(Sawmura 氏らの米国特許第4,284,897号)は電流計制御偏向ミラーを使用して小さいレーザビームスポットを標準顕微鏡内で走査して蛍光細胞を照明することが記載されている。特許文献5(Dixon 氏らの米国特許第5,381,224号)には、Fシータ走査レンズを電流計制御偏向ミラーでラスタ走査するレーザビームスポットを使用し、顕微鏡標本を撮像することについて記載している。特許文献6及び7(Kain氏の米国特許第5,646,411号及び同第5,719,391号には、Fシータレンズにより電流計制御で小さいレーザビームスポットを走査することが記載されている。これら撮像方法のすべては、画像を撮るべき表面上にわたり移動する小さいポイントを動的に照明するものである。走査する表面は撮像中にも移動する場合がある。
【0016】
小さいレーザスポットを走査する同様の方法は細胞の撮像よりも他の目的に使用することが記載している。例えば、特許文献8(Overbeck氏の米国特許第4,532,402号)は、電流計制御を使用して小さいレーザビームスポットを半導体表面に移動させて集積回路を修復することについて記載している。同様に、特許文献9(Okada 氏らの米国特許第5,690,846号)は、Fシータ走査レンズによりミラーで小さいレーザスポットを移動させるレーザ処理について記載している。特許文献10(Murakame氏らの米国特許第5,296,963号)は、電流計制御偏向ミラーを使用して小さいレーザビームスポットを標準の反転した顕微鏡内に走査し、遺伝子物質を挿入するため細胞に孔を空けることについて記載している。
【0017】
更に、生物学的標本を走査する他の方法が、特許文献11(Price 氏の米国特許第5,932,872号)に記載されている。この方法は、複数個の検出器を使用して一定移動する表面から多数の焦点面における画像を同時に撮り込むものである。得られた画像を使用して、リアルタイムで最良合焦画像を選択し、標本の三次元立体画像を生成するのに使用する。
【先行技術文献】
【特許文献】
【0018】
【特許文献1】米国特許第4,395,397号明細書
【特許文献2】米国特許第4,629,687号明細書
【特許文献3】米国特許第5,035,693号明細書
【特許文献4】米国特許第4,284,897号明細書
【特許文献5】米国特許第5,381,224号明細書
【特許文献6】米国特許第5,646,411号明細書
【特許文献7】米国特許第5,719,391号明細書
【特許文献8】米国特許第4,532,402号明細書
【特許文献9】米国特許第5,690,846号明細書
【特許文献10】米国特許第5,296,963号明細書
【特許文献11】米国特許第5,932,872号明細書
【非特許文献】
【0019】
【非特許文献1】1994年Rill氏らの論文/Rill, D. R., Santana. V.M., Roberts, W. M., Nilson, T., Bowman, L. C., Krance, R. A., Heslop, H. E., Moen, R. C., Ihle, J. N., and Brenner, M. K.: Direct demonstration that autologous bone marrow transplantation for solid tumors can return a multiplicity of tumorigenic cells. Blood 84: 380-383, 1994
【非特許文献2】1994年Deisseroth氏らの論文/Deisseroth, A. B., Zu, Z., Claxton, D., Hanania, E. G., Fu, S., Ellerson, D., Goldberg, L., Thomas, M., Janicek, K., anderson, W. F., Hester, J., Korbling, M., Durett, A., Moen, R., Berenson, R., Heimfeld, S., Hamer, J., Calver, L.,Tibbits, P., Talpaz, M., Kantarjiam, H., Champlin, R., and Reading, C.: Genetic marking shows that Ph+ cells present in autologous transplants of chronic myelogenous leukemia (CML) cotribute to relapse after autologous bone marrow transplantation in CML. Blood 83: 3068-3076, 1994
【非特許文献3】1997年Vervoordeldonk氏らの論文/Vervoordeldonk, S. F., Merle, P. A., Behrendt, H., Steenbergen, E. J., van den Berg, H., van Wering, E. R., von dem Borne, A. E. G., van der Schoot, C. E., van Leeuwen, E. F., and Slaper-Cortenbach, I. C. M.: PCR-positivity in harvested bone marrow predicts relaps after transplantation with autologous purged bone marrow in children in second remission of precursor B-cell acute leukemia. Br. J. Haematol. 96: 395-402, 1997
【非特許文献4】1992年Sharp 氏らの論文参照/Sharp, C. G., Joshi, S. S., Armitage, J. O. Bierman, P., Coccia, P. F., Harrington, D. S., Kessinger, A., Crouse, D. A., Manns, S. L., and Weisenburger, D. D.: Significance marrow by a cultuer technique. Blood 79: 1074-1080, 1992
【非特許文献5】1996年Brockstein氏らの論文/Brockstein, B. E., Ross, A. A., Moss, T. J., Kahn, D. G., Hollingsworth, K., and Willaims, S. F.: Tumor cell contamination of bone marrow harvest products: Clinical consequences in a cohort of advanced-stage breast cancer patients undergoing high-dose chemotherapy. J.Hematotherapy 5: 617-624, 1996
【非特許文献6】1996年Fields氏らの論文/Fields, K. K., Elfenbein, G. J., Trudeau, W. L., Perkins, J. B., Janssen, W. E., and Moscinski, L. C.,: Clinical significance of bone marrow metastases as detected using the polymerase chain reaction in patients with breast cancer undergoing high-dose chemotherapy and autologous bone marrow transplantation. J. Clin. Oncol. 14: 1868-1876, 1996
【非特許文献7】1997年Shulze氏らの論文/Shulze, R., Schulze, M., Wischnik, A., Ehnle, S., Doukas, K., Behr, W., Ehret, W., and Schlimok, G.: Tumor cell contamination of peripheral blood stem cell transplants and bone marrow in high-risk breast cancer patients, Bone Marrow Transplant. 19: 1223-1228, 1997
【非特許文献8】1998年Vannucchi 氏らの論文/Vannucchi, A. M., Bosi, A., Glinz, S., Lombarkini, L., Longo, G., Mariani, M. P., and Rossi-Ferrini, P.,: Evaluation of breast tumour cell contamination on the bone marrow and leukapheresis collections by RT-PCR for cytokeratin-19 mRNA. Br.J.Haematol. 103: 610-617, 1998
【非特許文献9】1997年Vredenburgh 氏らの論文/Vredenburgh, J. J., Silva, O., Broadwater, G., Berry, D., DeSombre, K., Tyer, C., Petros, W. P., Peters, W. P., and Bast, J., R.C.,: The significance of tumor contamination in the bone marrow from high-risk primary breast cancer patients treated with high-dose chemotherapy and hematopoietic support. Biol. Blood Marrow Transplant. 3: 91-97, 1997
【非特許文献10】1995年Tricot氏らの論文/Tricot, G., Gazitt, Y., Jagannath, S., Vesole, D., Reading, C. L., Juttner, C. A., Hoffman, R., and Barlogie, B.: CD34+Thy+lin- peripheral blood stem cells (PBSC) effect timely trilineage engraftment in multiple myeloma (MM). Blood 86: 293a-0, 1995
【非特許文献11】1995年Gazitt氏らの論文/Gazitt, Y., Reading, C. C., Hoffman, R., Wickrema, A., Vesole, D. H., Jagannath, S., Condino, J., Lee, B., Barlogie, B., and Tricot, G.: Purified CD34+ lin-Thy+ stem cells do not contain clonal myeloma cells, Blood 86: 381-389, 1995
【非特許文献12】1991年Gribben 氏らの論文/Gribben, J. G., Freedman, A. S., Neuberg, D., Roy, D. C., Blake, K. W., Woo, S. D., Grossbard, M. L., Rabinowe, S. N., Coral, F., Freeman, G. J., Ritz, J., and Nadler, L. M.L.: Immunologic purging of marrow assessed by PCR before autologous bone marrow transplantation for B-cell lymphoma. N.E.J.Med. 325: 1525-1533, 1991
【非特許文献13】1997年Mapara氏らの論文/Mapara, M. Y., Koerner, I. J., Hildebrandt, M., Bargou, R., Krahl, D., Reinhardt, P., and Doerken, B.: Monitoring of tumor cell purging after highly efficient immunomagnetic selection of CD34 cells from leukapheresis products in brest cancer patients: Comparison of immunocytochemical tumor cell staining and reverse transcriptse-polymerase chain reaction. Blood 89: 337-344, 1997
【非特許文献14】1997年Paulus氏らの論文/Paulus, U., Dreger, P., Viehmann, K., von Neuhoff, N., and Schmitz, N.: Purging peripheral blood progenitor cell grafts from lymphoma cells: Quantitative comparison of immonomagnetic CD34+ selection system. Stem Cells 15: 297-304, 1997
【発明の概要】
【発明が解決しようとする課題】
【0020】
上述の多くの方法は、採取した細胞群の全体に対して腫瘍細胞の除去又は腫瘍細胞壊死を制御する上での基礎になっている。流動血球計算検出器においては、単一細胞を基礎として細胞を分別し、物理的にHSCから好ましくない腫瘍細胞を分離する。これら方法のそれぞれは、HSC移植における腫瘍細胞の数を減らすことが知られているが、すべての腫瘍細胞を検出して除去及び壊死させることができることを示しているものはない。実際、移植患者の大多数は、これら除去技術を適用した後にも検出可能な腫瘍細胞を含んでいる。多重ステップ除去処置後にも移植あたり約30〜30,000個の腫瘍細胞が残存する(非特許文献12:1995年Gazitt氏らの論文;非特許文献13:1991年Gribben 氏らの論文;非特許文献14:1997年Mapara氏らの論文;非特許文献15:1997年Paulus氏らの論文参照)。更に、これら方法のすべては、何らかのHSCロス又はダメージがあり、患者の生着を遅らせるHSC移植の成功に大きな打撃を与える。要約すると、既存の除去技術は不適切であり、HSC移植から検出可能なすべての腫瘍細胞を効果的に除去することができる新規な手法に対する大きな臨床的要望がある。本明細書に記載する本発明方法及び装置はこの要望を満たすものである。
【0021】
生物学的標本における薬剤化合物候補に対する高い処理率のスクリーニングも他の重要な分野である。典型的には、多数の候補化合物をマルチウェル(窪み)プレートのウェル(窪み)に配置した小さい細胞サンプルに並列的に適用し、各ウェルにおける変化を生物学的インジケータで検査する。多数の化合物があるため、スクリーニング速度は重要なファクタ(要因)である。このような研究は現在では細胞群全体からの信号を捕らえなければならないことによって、また顕微鏡で個別の細胞を面倒な人間の観察によって行なうため限界がある。前者の手法は、細胞の副細胞群に対する効果を観察する可能性、又は細胞の一部のみにおける効果を観察する可能性を排除し、後者の手法は、多くの候補化合物を適用するのに時間がかかり過ぎる。個別の細胞における候補化合物の効果を迅速に測定する装置及び方法は極めて需要がある。
【課題を解決するための手段】
【0022】
発明の開示
本発明は、目標細胞における反応を誘発するために、細胞群内の特定の細胞を選択的に認識し、個別にエネルギビームで照準を定めて照射する高速処理方法及び装置を提供する。本発明装置を使用することにより、細胞群におけるすべての検出可能な目標細胞を特別に認識及び照準を定め、目標としない細胞にはほとんど影響を及ぼすことがない。細胞は入り混ざった細胞群又は同種由来の細胞とすることができる。
【0023】
特定細胞は、幾つかの手法を使用して本明細書に記載した本発明によって認識する。一つの実施例としては非破壊ラベル付け方法があり、第1細胞群のすべての細胞を入り混ざった細胞群における第2細胞群をなす残りの細胞から区別する。この実施例においては、ラベルの付いた抗体を使用し、第1細胞群の各細胞に特別なマークを付け、第2細胞群の細胞にはマークを付けない。このようにしてラベルの付いた細胞は入り混ざった細胞群から認識する。微細エネルギビームを第1目標細胞に合焦し、所望の反応を生ぜしめる。この後、次の目標細胞を照射し、すべての目標細胞を照射するまでこの作業を繰り返す。
【0024】
他の実施例においては、第2細胞群の細胞に選択的に結合するが第1細胞群の細胞には結合しない抗体を使用して第1細胞群の細胞を認識する。第1細胞群の細胞はラベルがないことによって認識し、この後エネルギビームで個別に照準を定めて照射する。
【0025】
エネルギビームによって誘発される反応の性質はエネルギビームの性質に依存する。反応は致死的なもの又は非致死的なものとすることができる。エネルギビームで誘発される反応の例としては、壊死、寿命死、光学的削孔(周囲の媒体に存在する物質、例えば、遺伝子材料を侵入させるため)、細胞分解、細胞運動(レーザトウィーザ:laser tweezers)、細胞化合物のカッティング、感光物質の活性化、蛍光試薬の励起、フォトブリーチング、及び分子脱ケージ化(アンケージング)がある。
【0026】
本発明は、更に、生物学的標本内における個別の細胞の形態学的又は生理学的特徴を決定する装置を意図する。従って、本発明装置は、細胞群における非致死的反応を直接又は間接的に誘発し、この反応を測定する。このような非致死的な反応としては、光学的削孔、細胞運動(レーザトウィーザ)、細胞化合物のカッティング(レーザシザーズ)、感光物質の活性化、蛍光試薬の励起がある。このような非致死的反応は、細胞の内外におけるフォトブリーチング、フォトブリーチングリカバリ、分子脱ケージ化の技術によって照準される細胞の反応がある。このような装置の実施例は、生物学的標本の細胞フレームを照明する照明源と、細胞フレームの画像を撮り込む画像撮り込み装置と、画像を参照して生物学的標本内における第1個別細胞の位置を決定する第1制御手段と、少なくとも1個又はそれ以上の個別細胞における反応を誘発するに十分なエネルギを発射するエネルギ源と、形態学的又は生理学的特徴に関して第1個別細胞を調べるに十分なエネルギビームで第1個別細胞を通過させる第2制御手段と、前記調べる第1個別細胞の反応を測定する検出器と、を具えることを特徴とする。
【0027】
更に、本発明装置の他の実施例においては、 生物学的標本における細胞フレームを照明する照明源と、 細胞フレームの画像を撮り込む画像撮り込み装置と、 画像を参照して生物学的標本における第1目標細胞の位置を決定する第1制御手段と、 第1目標細胞の形態学的又は生理学的特徴の変化を生ぜしめるに十分なエネルギビームを第1目標細胞に通過させる第2制御手段と、 第1目標細胞の形態学的又は生理学的特徴における変化の反応を測定する検出器とを具えることを特徴とする。
【0028】
本発明の更に他の発明は、生物学的標本における細胞フレームを照明する照明源と、第1細胞フレームの画像を撮り込む画像撮り込み装置と、画像を参照して生物学的標本における個別の細胞の位置を決定する第1制御手段と、個別の細胞のうち少なくとも1個における反応を誘発するに十分なエネルギビームを発射するエネルギ源と、第1個別細胞における形態学的又は生理学的特徴の変化を生ずるのに十分なエネルギビームを第1個別細胞に通過させる第2制御手段と、第1個別細胞の形態学的又は生理学的特徴を測定するための検出器とを具えることを特徴とする。
【0029】
更に、本発明の他の発明は、多数のケージ化化合物を含む生物学的標本における個別の細胞の形態学的又は生理学的特徴を決定する装置において、
細胞フレームの画像を撮り込む画像撮り込み装置と、
ケージ化化合物のうちの少なくとも1個又はそれ以上の脱ケージ化に十分なエネルギビームをケージ化化合物の1個又はそれ以上に通過させる第1制御手段と、
1個又はそれ以上のケージ化化合物を解体するに十分なエネルギビームを発射するエネルギ源と、
ケージ化化合物の1個又はそれ以上が解体した化合物の反応に応じて形態学的又は生理学的特徴の変化の進行をモニタする第2制御手段と
を具えたことを特徴とする。
【0030】
更に、生物学的標本における個別の細胞の形態学的又は生理学的特徴を決定する本発明装置は、
生物学的標本の細胞フレームを照明する照明源と、
細胞フレームの画像を撮り込む画像撮り込み装置と、
細胞フレームにおける個別の細胞の形態学的又は生理学的特徴を決定する第1制御手段と
を具える。
【0031】
本発明装置は、外部からの刺激に対する細胞の反応を高い処理効率でスクリーニングするのに使用することができ、このような刺激に対する個別の細胞における反応の迅速位置決め及び測定を行なうことができる。このようにして、照明源及び/又はエネルギビームは、分子が細胞内又は細胞上にあろうとなかろうと、細胞の近傍の分子に照準を付けることができ、エネルギビームを分子に作用させて活性化し、また照明源は活性化した分子に対する細胞の反応を研究することができるようになる。
【0032】
多数の商業的に重要な研究及び臨床用途も本発明を適用することができ、このような実施例を以下に説明する。
【0033】
[詳細な説明]
目標細胞における反応を誘発するため、細胞群(母集団)のうちの特定細胞を選択的に認識し、エネルギビームで選択した特定細胞を狙い打ちする方法及び方法を説明する。細胞群は、入り混じった群又は元々均一な群とすることができる。本発明方法及び装置の任意の実施例における反応は致死的なもの、又は非致死的なものとすることができる。このような反応の例としては上述したようなもの、及び本明細書全体で述べるものがある。目標とする細胞は標本が入り混じった群である場合によく行われるようにラベルを付けることができる。他方で標本が均質である場合には、目標細胞は、細胞の反応を調べるため、光源又はエネルギビームによって検閲している又は光源又はエネルギビームが通過している個別の細胞とすることができる。例えば、このような反応としては、細胞の形態学的特徴又は物理学的特徴に関する反応がある。一般的に、この方法は、先ず、第1細胞群及び第2細胞群よりなる細胞混合群のうち第1細胞群の個別細胞を識別及び見出すためのマーカーとして機能するラベルを使用する。本明細書中、装置及び方法によって目標とされた細胞とは、混合細胞群の場合には選択的にラベル付けされた細胞であり、照射源又はエネルギビームによって検閲される又は通過される細胞を意味する。
【0034】
選択されたラベルは、第2細胞群から第1細胞群を認識及び区別するものとすることができる。例えば、フッ化クロムで直接的に又は関節的にタグ付けされた単クローン抗体を特定ラベルとして使用することができる。細胞表面に結合するラベルの他の例としては、非抗体蛋白質、レクチン、炭水化物、又は選択的な細胞結合能力を有する短ペプチドがある。細胞膜介在染料、例えば、PKH‐2及びPKH‐26を、細胞の有糸(核)分裂的履歴を示すのに有用な識別ラベルとして使用することもできる。多くの細胞膜浸透試薬も生きている細胞を他の細胞から選択した規準に基づいて識別するのに利用することができる。例えば、ファロイディン(phalloidin)は細胞膜全体を示し、テトラメチル・ロドアミン・メチルエステル(TMRM)はミトコンドリア状の膜浸透能力を示し、モノクロロビメイン(monochlorobimane)はグルタシオン(glutathione) 誘導ステージを示し、カルボキシルメチル・フルオレセイン(fluorescein) ジアセテート(CMFDA)はチオール(thiol) 活性を示し、カルボキシフルオレセインは細胞内pHを示し、フラ(fura)‐2は細胞内Ca2+レベルを示し、5,5′,6,6′‐テトラクロロ‐1,1′,3,3′‐テトラエチルベンジミダゾル・カルボシアニン・イオダイド(JC‐1)は膜電位を示す。細胞生存能力は蛍光性のSYTO13又はYO‐PRO試薬を使用することによって評価することができる。同様に、蛍光的にタグ付けした遺伝子プローブ(DNA又はRNA)を使用して、注目の遺伝子を有する又は注目の遺伝子を示す細胞のラベル付けに使用することができる。更に、細胞サイクル状態は、ホーシュスト(Hoechst) 33342染料を使用してブロモードオキシユリダイン(BrdU)と組合せて新たな合成DNAにラベル付けする既存のDNAにラベル付けして評価することができる。
【0035】
第1細胞群の細胞に特定のラベルを利用できない場合、本発明方法は第2細胞群の細胞のための特定ラベルを使用することによって反転的に行なうことができることに注意されたい。例えば、造血細胞群において、CD34又はACC‐133細胞マーカーを使用して造血原細胞のみにラベル付けし、混合細胞群における他の細胞にはラベル付けしないようにすることができる。この実施例においては、第1の細胞群はラベルがないことで認識でき、このことによりエネルギビーム照射の照準を付けることができる。
【0036】
第1細胞群の細胞を認識した後、エネルギビームを例えば、レーザからのビーム、コリメートした若しくは集束させた非レーザ光、RFエネルギ、加速粒子、集束させた超音波エネルギ、電子ビーム、又は他の放射ビームを使用して、目標とする照射量で照射し、第1細胞群の細胞の各々に所定の反応を誘発させ、第2細胞群の細胞にはほとんど影響しないようにすることができる。
【0037】
このような所定反応の一つとしてフォトブリーチングがある。フォトブリーチングにおいては、染料の形式のラベル、例えば、ロドアミン(rhodamine)123、GFP、フロレセイン・イソチオシアネート(FITC)、又はフィコエリトリン(phycoerythrin) を標本に添加してから本発明方法を開始する。細胞群が染料に反応する時間が経過した後、エネルギビームを使用して細胞群個別の細胞領域を漂白する。このようなフォトブリーチング検査は、細胞成分及びプロセスの運動性、補充性、機能等を調べるのに使用することができる。
【0038】
他の反応としては内部分子の脱ケージ化がある。このようなプロセスにおいて、標本を、本発明方法を開始する前にケージ化分子と組合せる。このようなケージ化分子は、L‐アスパラギン酸のベータ‐2,6‐ジニトロベンジル・エステル、又は8‐ヒドロキシピレン‐1,3,6‐トリス‐スルフォン酸の1‐(2‐ニトロフェニル)エチル・エステルがある。同様に、アルファ‐カルボキシル‐2‐ニトロベンジル(CNB)及び5‐カルボキシルメソキシ‐2‐ニトロベンジル(CMNB)を含むケージ化グループを、生物学的に活性分子、例えば、エーテル、チオエーテル、エステル、アミン、又は同様の機能グループにリンクさせることもできる。用語「内部分子の脱ケージ化」は、分子解放が細胞表面又は細胞内で生ずることを意味するものとする。このような脱ケージ化実験は、細胞膜の浸透性及び細胞信号伝達のような迅速な分子プロセスを調べる。
【0039】
他の反応としては、外部分子脱ケージ化がある。この反応は、内部分子ケージ化とほぼ同様のプロセスを使用する。しかし、外部分子脱ケージ化においては、脱ケージ化された分子は目標細胞内に取り付けたり、組み込んだりしない。その代わり、周囲の目標細胞のケージ化及び脱ケージ化分子への反応が本発明装置及び方法によって画像化される。
【図面の簡単な説明】
【0040】
【図1】細胞処置装置の一つの実施例におけるハウジング及びディスプレイの外観の斜視図である。
【図2】細胞処置装置の一つの実施例における外側ハウジングを取外し、内部の構成部材を示す斜視図である。
【図3】細胞処置装置の一つの実施例における光学的副組立体の設計のブロック図である。
【図4】細胞処置装置の一つの実施例による光学的副組立体の一つの実施例における斜視図である。
【図5】光学的副組立体の一つの実施例における走査レンズ及び可動ステージの構成を示す側面図である。
【図6】光学的副組立体の一つの実施例における底面側から見た斜視図である。
【図7】細胞処置装置の可動ステージの頂面側から見た斜視図である
【発明を実施するための形態】
【0041】
図1は、細胞処置装置10の一つの実施例を示す。細胞処置装置10は、装置の内部構成部材を収納するハウジング15を有する。ハウジングは、レーザに対する安全性連動装置を有し、ユーザーに対する安全性を確保し、更に、外部からの影響による干渉(例えば、外光、塵埃等)も制限する。ハウジング15の上方部分にはディスプレイユニットを配置し、処置中の細胞群を捕らえた画像を表示する。これら画像は、以下により詳細に説明するように、カメラで撮り込む。キーボード25及びマウス30を使用してデータを入力し、また装置10を制御する。アクセスドア35によって処置を行なっている細胞の標本容器を保持する可動ステージにアクセスすることができる。
【0042】
装置10の内部を図2に示す。図示のように、装置10には、装置の内部構成部材を保持する上側トレイ200と、下側トレイ210を設ける。上側トレイ200には1対の吸気フィルタ215A,Bを有し、装置10の内部に引き込む外気を濾過する。アクセスドアの下側には光学的副組立体(図示せず)を設ける。この光学的副組立体を上側トレイ200に取り付け、このことを図3乃至図6につき詳細に説明する。
【0043】
下側トレイ210には、装置10を動作させるソフトウェアプログラム、コマンド及び命令を記憶するコンピュータ225を設ける。更に、このコンピュータ225は、電気信号接続ラインによって処置装置に制御信号を供給し、レーザを操作して標本上に適正な光点を生じて細胞を処置できるようにする。
【0044】
図示のように、一連の電源230A,B,Cは、装置10内の種々の電気コンポーネントに給電する。更に、無停止電源235を組み込み、瞬間的な外部電源遮断があっても装置の機能を継続できるようにする。
【0045】
図3には、細胞処置装置10の一つの実施例における光学的副組立体300の一つの実施例のレイアウトを示す。図示のように、照明レーザ305により指向性のあるレーザ出力を発生し、このレーザ出力を使用して標本における目標とする細胞に付した特定ラベルを励起させる。この実施例においては、照明レーザは532nmの波長の光を発生する。照明レーザが光ビームを発生した後は、光はレーザ光のパルス長さを制御するシッャタ310を通過する。
【0046】
照明レーザ光がシッャタ310を通過した後、ボールレンズ315に入射し、SMA光ファイバコネクタ320に集束して進入する。照明レーザビームが光ファイバコネクタ320内に進入した後、光ファイバケーブル325によって出力部330に伝送される。照明ビームは光ファイバケーブル325を通過することにより、照明レーザ305は処置装置内の任意の位置に配置することができ、光学的構成部材の光路上に直接配置しなければならないという制限はない。ある実施例においては、光ファイバケーブル325を振動モータ327に連結し、より均一な照射スポットをスクランブル状態で発生させることができる。
【0047】
光が出力部330を通過した後、一連の集束レンズに指向させ、細胞の一つのフレーム、すなわち「1個のフレーム」を照射するための適正な直径にビームを集束する。本明細書中、細胞の一つのフレーム又は「1個の細胞フレーム」を、カメラで撮影した1フレーム画像内に写る生物学的標本の部分と定義する。このことを以下により詳細に説明する。
【0048】
従って、照明レーザビームは第1集束レンズ335を通過する。この実施例では、この第1集束レンズの焦点長さは4.6mmとする。光ビームは、次に焦点長さが100mmである第2集束レンズ340を通過する。最後に、焦点長さが200mmの第3集束レンズ345を通過する。特別な集束レンズを使用する実施例で本発明を説明したが、照明レーザビームを有利な直径に集束する他の同様のレンズ構成も同様に機能することは勿論である。
【0049】
従って、本発明は、特別な集束レンズ系を有する特定の実施例には限定されない。
【0050】
照明レーザビームが第3集束レンズ345を通過した後、照明レーザから発生する532nm波長の光を伝送する立方体形状のビームスプリッタ350に進入する。好適には、この立方体形状のビームスプリッタ350は一辺が25.5mmの立方体ビームスプリッタ(カナダ国、アービンのメレス‐グリオット社製)とする。しかし、他の寸法のビームスプリッタでも同様に機能することが予想される。更に、多数のプレート状ビームスプリッタ又は薄膜ビームスプリッタを立方体ビームスプリッタ350の代わりに使用しても目立った機能変化はない。
【0051】
照明レーザ光が立方体ビームスプリッタ350を通過した後、長波長透過ミラー355に達し、このミラーで532nmの照明レーザ光を電流計ミラー360のセットに反射し、この電流計ミラー360は照明レーザ光をコンピュータ制御の下に走査レンズ365(ニュージャージー州、ワートン、スペシャル・オプティクス社製)に指向させ、この走査レンズは照明レーザ光を標本(図示せず)に指向させる。電流計ミラーは、照明レーザ光が適正な細胞群(即ち、細胞のフレーム)に指向させて画像を形成する。この実施例で述べる用語「走査レンズ」は、屈折レンズも含まれる。本明細書中に使用する用語「走査レンズ」は図示の実施例に限定されることなく、1個又はそれ以上の屈折性及び/又は反射性光学的素子の組合せた1個又はそれ以上の回折素子を有するレンズ系をも含むことができる。当業者であれば、適正細胞群を照射するため、どのように「走査レンズ」系を設計すべきかは、分かるであろう。
【0052】
照明レーザからの光は、標本を照射するのに有用な波長のものとする。この実施例では、Nd:YAGによる532nm波長の連続した周波数倍増レーザ装置(ドイツ国、ネヴァルク、B&W TeK社製)からのエネルギを長波長通過ミラー(アリゾナ州、フェニックスのカスタム・サイエンティフィック社製)で反射させ、標本における蛍光タグを励起させる。ある一つの実施例において、蛍光タグをフィコエリトリン(phycoerythrin) とする。代案として、アレクサ(Alexa) 532(オレゴン州、ユージーン、モレキュラー・プローブ社製)を使用することができる。フィコエリトリン及びアレクサ532は、580nmの近傍にピークがあるスペクトルを発生し、標本から発生した蛍光は長波長通過ミラーを経てカメラに伝送する。カメラの前方にフィルタを使用して興味のある波長帯域にない光を遮蔽し、カメラに進入する背景光量を減少する。
【0053】
他の多くの装置もこのように使用して標本を照射することができ、以下のものに限定されるものではないが、例えば、フィルタの有無に関係なく、アークランプ(例えば、水銀、キセノン等)、発光ダイオード(LED)、他のタイプのレーザ等がある。この特別なレーザの利点は、高強度であり、比較的エネルギ効率がよく、コンパクトであり、発熱が少ない点である。更に、異なる励起及びスペクトル発生を生ずる他のフッ化クロムを、照射源、フィルタ、長及び/又は短波長通過ミラーを適切に選択してこのような装置に使用することもできる。例えば、アロフィコシアニン(APC)は633nm波長のHeNe照明レーザで励起することができ、フルオロイソシオシアネート(FITC)は488nmアルゴン照明レーザで励起することができる。当業者であれば、種々のコンポーネントよりなる他の光学的レイアウトで本発明による目的を達成することができであろう。
【0054】
照明レーザ305の他に、光学的処置レーザ400を設け、画像分析によって認識された後の目標細胞を照射する。勿論、ある実施例においては、細胞群内の目標細胞の壊死を誘発する処置の場合がある。図示のように、処置レーザ400はシッャタ410を通過する523nmのエネルギビームを出力する。レーザは523nmの波長のエネルギビームを出力する例を示したが、他の波長のエネルギを発生する他のエネルギ源も本発明の範囲内である。
【0055】
処置レーザエネルギビームがシッャタ410を通過した後、ビームエキスパンダ(ニュージャージー州、ワートン、スペシャル・オプティクス社製)に進入し、エネルギビームの直径を標本の平面において適正な寸法に調整する。ビームエキスパンダ415に続いて半波長板420を配置し、ビームの偏光を制御する。次いで処置レーザエネルギビームをミラー425で反射させ、立方体ビームスプリッタ350に入射させる。処置レーザエネルギビームは立方体ビームスプリッタ350で90゜反射し、照明レーザ光ビームの出射光路に整列する。このようにして、処置レーザエネルギビーム及び照明レーザ光ビームの双方が同一の光路に沿って立方体ビームスプリッタ350から出射する。立方体ビームスプリッタ350から処置レーザビームは長波長通過ミラー355で反射し、電流計ミラー360によって操作され、走査レンズ365に接触し、最終的に標本内の目標細胞に集束される。この実施例でも「走査レンズ」は、やはり屈折レンズとすることができる。上述したように、用語「走査レンズ」は、以下に限定されないが、例えば、1個又はそれ以上の屈性性又は反射性の光学的素子を単独で又は組合せて使用するレンズ系とすることができる。更に、「走査レンズ」は、1個又はそれ以上の屈折性及び/又は反射性素子と組合せて使用する1個又はそれ以上の回折素子を含むことができる。当業者であれば、標本内の目標細胞に集束させる「走査レンズ」系を設計する方法は知っているであろう。
【0056】
照明レーザ光ビームの僅かな部分は長波長通過ミラー355を通過して強度センサ445(カリフォルニア州、パロアルト、ジェンテック社製)に入射する。強度センサ445に入射するビームの一部を使用して照明レーザ305から発生する光の強度レベルを計算する。同様に、処置レーザエネルギビームの僅かな部分を立方体ビームスプリッタ350に通過させ、第2強度センサ446(カリフォルニア州、パロアルト、ジェンテック社製)に入射させる。強度センサ446に入射したビームの一部を使用して処置レーザ400から発生するエネルギ強度のレベルを計算する。これら強度センサは電気的にコンピュータシステムにリンクさせ、コンピュータシステムにおける命令/コマンドで強度測定値を採り込んで発生したエネルギ量を決定する。
【0057】
処置レーザからのエネルギビームは細胞における反応を生ずるのに有用な波長を有するものとする。例えば、パルス状の523nm波長のNd:YLF周波数倍増レーザを使用して目標細胞を含む局部的容積部分を加熱し、所定時間内で壊死を誘発するようにする。壊死メカニズムは、ニームズ(1996年Niemz の論文参照)によって検証されたように、細胞内で生ずる実際の温度に依存する。
【0058】
安定性、出射高反復率、保守不要期間が長い点で有利なのでNd:YLF周波数倍増固体レーザ(カリフォルニア州マウンテンビュー、スペクトラ‐フィジクス社製)を使用する。しかし、多くの細胞培養液及び細胞はこのグリーンの波長の光に対して比較的透過性を示し、従って、細胞の壊死させるのに極めて高いエネルギの流れを必要とする。必要なエネルギ量を大幅に減少する、従って、処置レーザのコスト及び寸法を減少するためには、目的に適合した染料を標本に添加し、標本内で処置レーザのエネルギ吸収を効率よく行なうようにする。図示の実施例では、無害の染料FD&Cレッド#40(アルラレッド)を使用し、処置レーザからの523nmエネルギを吸収するが、当業者であれば標本における効率のよいエネルギ吸収をもたらす他のレーザ/染料についての認識は持っているであろう。例えば、633nmHeNeレーザエネルギは、FD&Cグリーン#3(ファーストグリーンFCF)によって効率よく吸収され、488nmアルゴンレーザエネルギはFD&Cイエロー#5(サンセットイエローFCF)によって効率よく吸収され、1064nmNd:YAGレーザエネルギはフィルトロン(ミシシッピー州ゼーランド、ジェンテックス社製)赤外線吸収染料によって効率よく吸収される。エネルギ吸収染料を使用することによって目標細胞を壊死させるに必要なエネルギ量を減少することができる。即ち、処置レーザエネルギの多くがこのような染料の存在で吸収されるからである。
【0059】
染料を添加せずに細胞を熱で壊死させる他の方法としては紫外線レーザを使用する方法がある。355nm波長のNd:YAG周波数3倍増レーザからのエネルギは細胞内の核酸及び蛋白質によって吸収され、加熱及び壊死を生ずる。更に染料を添加せずに細胞を熱で壊死させる更に他の方法としては近赤外線レーザを使用する方法がある。2100nm波長のHo:YAGレーザ又は2940nm波長のEr:YAGレーザからのエネルギは、細胞内の水に吸収され、加熱と壊死を生ずる。
【0060】
この実施例は、エネルギビームで加熱することにより細胞を壊死させる処置を説明したが、当業者であれば、エネルギビームによって他の反応を細胞に誘発することができることは認識されるであろう。このような他の反応としては、ニームズ(1996年Niemz 論文参照)によって検証されたように、例えば、光学‐機械的崩壊、光学的解離、光学的切除、光学‐化学的反応がある。例えば、混合細胞内の感光物質(例えば、ヘムトポルフィリン誘導体、すず‐エチオプルプリン、ルテチウム・テキサフィリン)(1998年 Oleinick及びEvansの論文参照)は、照射によって目標細胞内で特別に活性化する。更に、細胞膜内に小さい移行孔を生じて遺伝子又は他の物質が侵入することができるようになる(1996年Palumbo 氏らの論文参照)。更に、蛋白質又は遺伝子物質のような細胞内又は細胞表面における特別な分子は、指向性のあるエネルギビームによって不活性化され得る(1999年Grate 氏及びWilson氏の論文;及び1988年Jay 氏の論文参照)。更に、光学的ブリーチングを使用して、細胞内運動、例えば、細胞膜内における蛋白質の拡散、細胞の有糸(核)分裂中の細胞内微小管の運動を測定することができる(1997年発行J.セル サイエンス110(9)及び1041頁におけるLadha 氏らの1997年の論文;1991年発行J.セル サイエンス100(第1章)205頁のCentonze氏及びBorisy氏の論文;1999年2月トレンズ・セル・ビオル(第2部)61〜65頁のWhite 氏及びStelzer 氏の論文;1999年8月Pharm Res 16巻(8号)1153〜1162頁のMeyvis氏らの論文参照)。更に、ケージ化化合物の光分解、又はマルチフォトンによる脱ケージ化を含む脱ケージ化を使用して一時的かつ空間的分析で生物学的活性生成物又は他の興味ある生成物の放出を制御することができる(1992年J.セル・バイオロジー119〜367頁のTheriot 氏及びMitchison 氏の論文;1994年PNAS91巻(14号)6629頁のDenk氏の論文参照)。特定の目標細胞に指向させた電磁放射を使用して目標細胞において反応を誘発するこれらメカニズムも本発明に組み込むことができる。
【0061】
照明レーザ305及び処置レーザ400の他に、本発明装置は、細胞群の画像(即ち、フレーム)を撮り込むカメラ450を有する。図3に示すように、カメラ450はレンズ455及びフィルタ460を経て合焦され、迷遊的背景画像を撮り込むことなく細胞の画像を正確に記録することができる。遮光体462をフィルタ460とミラー355との間に配置し、標本からの画像に関連しない角度からカメラに入射する光を排除する。フィルタ460は、所定の波長帯域内の光のみを通過させるよう選択する。この波長帯域としては、例えば、照明レーザ305によって励起される際に目標細胞から発生する光、並びにバックライト光源475からの光がある。
【0062】
バックライト光源475を標本の上方に配置し、標本の後から照明レーザ305で生ずる波長とは異なる波長で照明する。このLEDは、590nmの波長の光を発生し、長波長通過ミラーを透過してカメラに指向される。このバックライト照明は、フレーム内の蛍光目標がないときに細胞を結像するのに有用である。このバックライトを使用する例としては、フレーム内に無垢な非蛍光細胞のみが存在している場合でも光学系の適正な合焦を得るのに使用する。一つの実施例においては、このバックライトをアクセスドア35(図2参照)の下側に取り付ける。
【0063】
上述したように、カメラに復帰する光のみ標本内の興味ある波長の光である。他の光の波長は、フィルタ460を通過せず、カメラ450には記録されない。このことにより、興味ある細胞のみの画像を撮り込むためのより信頼性のあるメカニズムが得られる。当業者にとっては、単独のフィルタ460の代わりに、可動フィルタホイールを使用し、異なるフィルタを光路に出し入れすることができるようにすることもできる。このような実施例においては、異なる光の波長の画像も細胞処置中における異なる時刻に撮り込むことができ、従って、多数の細胞ラベルを使用することができる。
【0064】
この実施例においては、カメラは電荷結合デバイス(CCD)式とし、画像処理コンピュータシステムに伝送することができる。以下に説明するように、コンピュータシステムは、CCDカメラによって撮り込んだ画像を参照して標本における目標細胞の座標系を決定する。
【0065】
次に図4につき説明するが、この図4は光学的副組立体の実施例の斜視図である。図示のように、照明レーザ305は光ビームをシッャタ310及びボールレンズ315からSMA光ファイバコネクタ320に伝送する。光は光ファイバケーブル325及び出力部330を経て集束レンズ335,340,345に入射する。次に、光は立方体ビームスプリッタ350に入射し、長波長通過ミラー355に伝送される。長波長通過355から、光ビームはコンピュータ制御の電流計ミラー360に入射し、この電流計ミラー360で制御されて走査レンズ365から標本における細胞群の適正フレームに指向する。
【0066】
図4の斜視図に示すように、処置レーザ400はシッャタ410を経てビームエキスパンダ415にエネルギを伝送する。処置レーザ400からのエネルギはこのビームエキスパンダ415及び半波長板420を通過して転向ミラー425に入射してから立方体ビームスプリッタ350に入射し、このビームスプリッタ350で90゜反射し、長波長通過ミラー355に達し、このミラー355で反射してコンピュータ制御電流計ミラー360に達する。電流計ミラー360によって走査レンズ365に指向させられた後、レーザエネルギビームは細胞群内の適正位置に入射し、特定の目標細胞に反応を誘発する。
【0067】
処置すべき極めて大きい標本表面積に対応するため、本発明装置には、走査レンズに対して標本容器を機械的に移動させる可動ステージを設ける。このようにして、走査レンズの視界内における細胞群のうち特定の副細胞群(即ち、フィールド)を処置した後に、可動ステージを走査レンズ視界内の他の副細胞群に移動する。図5に示すようにコンピュータ制御の可動ステージ500は処置すべき標本容器(図示せず)を保持する。この可動ステージ500はコンピュータ制御のサーボモータによって2軸に沿って移動し、標本容器を機器の光学的構成部材に対して相対移動させることができる。特定経路に沿うステージ移動は装置の他の動作に協調して動作する。更に、特定の座標系をセーブすることができ、興味のある位置に可動ステージを復帰させるよう呼び戻すことができる。x方向及びy方向の移動に関するエンコーダによりステージ位置に関する閉ループフィードバック制御を行なう。
【0068】
フラットフィールド(F‐シータ)走査レンズ365を可動ステージの下方に取り付ける。走査レンズの視界は、走査レンズの上方に可動ステージ500によって位置決めされる標本の部分である。レンズ365をステップモータに取り付け、レンズ365を自動的に昇降させ(z軸に沿って)、系の合焦を行なう。
【0069】
図4乃至図6に示すように、走査レンズ365の下方に電流計制御偏向ミラー360を配置し、互いに直交する軸線に沿う電磁エネルギを転向する。偏向ミラーの背後に長波長通過ミラー355を配置し、545nmよりも短い波長の電磁エネルギを反射する。545nmより長い波長のエネルギは長波長通過ミラーを通過してフィルタ460、結合レンズ455を経てCCDカメラに入射し、カメラ450(図3及び図4参照)のCCDセンサ上に適正サイズの画像を生ずる。走査レンズ365及び結合レンズ455の組合せによって規定される大きさは、単独細胞を信頼性高く検出するとともに、カメラによって1フレームで見える領域を最大にするよう選択する。CCDカメラ(テキサス州オースチンのDVC社製)を図示の実施例に示すが、このカメラは当業者に既知である任意のタイプの検出器又は画像撮り込み機器とすることができる。本発明装置の光学的副組立体は防振プラットフォームに取り付け、図2及び図5に示すように動作中の安定性を得るようにする。
【0070】
図7には、可動ステージ500の頂面から見た図を示す。図示のように、標本容器を可動ステージ500に取り付ける。標本容器505は上側軸線ネストプレート510に載置し、このネストプレート510は可動ステージ500に対して前後方向に移動するよう設計する。ステップモータ(図示せず)を上側軸線ネストプレート510及びコンピュータシステムに連結し、コンピュータからのコマンドによって標本容器505を前後に移動させる。
【0071】
可動ステージ500をタイミングベルト515に連結し、可動ステージ500を1対の支持トラック525A,Bに沿って側方に移動させる。タイミングベルト515をプーリ(図示せず)に取り付け、このプーリはプーリカバー530の下方に収容する。プーリをステップモータ535に連結し、タイミングベルト515を駆動して可動ステージ500を側方に移動させる。ステップモータ535を電気的にコンピュータシステムに接続し、コンピュータシステムからのコマンドによって可動ステージ500の側方移動を生ずるようにする。行程リミットセンサ540をコンピュータシステムに接続し、可動ステージが所定側方距離を越えて移動した場合に警報を発生するようにする。
【0072】
1対の加速度計545A,Bをこのプラットフォームに組み込み、装置動作に干渉する過剰な衝突又は振動を記録するようにすると好適である。更に、2軸傾斜計550を可動ステージに組み込み、標本容器が水平であるようにし、従って、標本容器における重力に基づく運動が起こる可能性を減少するようにすると好適である。
【0073】
標本チャンバにはダクト付きのファンを設け、標本容器における結露を生じないようにし、またサーモカップルを設けて標本チャンバが容認できる温度範囲内にあるか否かを測定する。他のファンを設け、電子機器から発生する熱を追い出し、また適正なフィルタ215A,Bを吸気する。
【0074】
コンピュータシステム225は上述した種々の電子ハードウェアの動作及び同期を制御する。コンピュータシステムはハードウェアとのインターフェイスをとる任意の市販のコンピュータとすることができる。コンピュータシステムの一つの実施例としては、インテルペンティアム(登録商標)II,III,IV をベースにしてコンピュータ動作するマイクロソフトWindows(登録商標)NT(登録商標)オペレーションシステムとすることができる。ソフトウェアを使用し、種々の機器と通信し、また以下に説明するようにして動作を制御する。
【0075】
装置を先ず初期化するとき、コンピュータはハードディスクドライバからファイルをRAMにロードし、装置を適正に初期化する。多数の組み込みテストを自動的に行なって装置の適正動作を確認し、また較正ルーチンを行って装置を較正する。これらルーチンをうまく完了した際に、ユーザーはキーボード及びマウスから行なうべき手順に関する情報を入力することを促される。必要な情報が入力された後、ユーザーはアクセスドア35を開き、標本を可動ステージに装填することを促される。
【0076】
標本を可動ステージに載置してドアを閉めた後、コンピュータは信号をステージに送信し、ホームポジションに移動する。ファンは初期化されて標本を温めて結露曇りを晴らすようにする。この間に、標本内の細胞は底面に沈殿することができる。更に、この間に、装置は標本を適正に装填した確認のコマンドを発生して光学系の焦点範囲内に位置決めする。例えば、標本容器における特定のマーキングをコンピュータシステムによって位置決め及び合焦し、走査レンズを標本容器の底面に適正に合焦しておく。このようなマーキングは、容器、内容物、及び実行すべき手順を認識する機器にも使用する。所定時間の経過後に、コンピュータはファンを停止させ、処置中における過剰な振動を防止し、細胞処置を開始する。
【0077】
先ず、コンピュータは可動ステージを走査レンズ上に移動するよう命令し、処置すべき標本の第1領域(即ち、フィールド)を直接走査レンズの視界に位置決めする。電流計偏向ミラーに命令し、視界の中心フレームがカメラに結像されるよう移動する。以下に説明するように、走査レンズによって結像されるフィールドは複数個のフレームに分割する。各フレームはフレーム内の細胞がカメラによって有効に結像される適正サイズのものとする。
【0078】
次に、バックライト475を動作させて視界を照明し、走査レンズの合焦を行なうことができるようにする。走査レンズが標本に適正に合焦した後、コンピュータシステムは視界を複数個のフレームに分割し、各フレームをカメラによって個別に分析する。この方法によれば、装置は大きな視界内の複数個のフレームを機械的なステージを移動することなく処理することができる。電流計転向ミラーによって1個のフレームから次のフレームに、ステージを移動する機械的ステップに比べて極めて迅速に移動することができ、この方法は極めて迅速かつ効率的な装置をもたらす。
【0079】
標本が焦点にあるようにする他の手段を利用することもできる。例えば、レーザプロキシメータ(ミシシッピー州アウバーン、コーク社製)は、走査レンズと標本との間の距離を迅速に決定し、走査レンズの位置を調整することができる。チャンバプロキシメータも利用でき、同じ目的を達成する。当業者であれば、走査レンズの上方の焦点位置に標本を位置決めする他の手段を提案することができるであろう。
【0080】
好適な実施例においては、本明細書に記載した装置は、1分間当たり、生物学的標本の少なくとも1,2,3,4,5,6,7,又は14平方センチメートルを処置する。他の実施例においては、上述の装置は、1分間当たり、生物学的標本の少なくとも0.25,0.5,1,2,3,4,又は8百万個の細胞を処置する。更に他の実施例においては、装置は、1秒間当たり、50,100,150,200,250,300,350,400,又は800個の細胞の割合で目標細胞の反応を誘発できる。
【0081】
初期的には、視界の中心におけるフレームの画像をカメラに撮り込みコンピュータのメモリに記憶する。コンピュータにおける命令により、画像の寸法、数及び他の目的とする特徴を見ることによって標本の合焦状態を分析する。必要に応じて、コンピュータは走査レンズに取り付けたz軸モータに命令を与えて最良合焦状態を得るよう昇降させる。装置は、最良合焦状態が得られるまで数個のz位置での画像を繰り返し分析する。次に、電流計制御転向ミラーに命令してカメラによって個別に撮り込まれる4,9,12,18,24又はそれ以上の数の個別フレームに分割する。電流計偏向ミラーが視界における第1フレームに指向をとった後、照明レーザの前方のシッャタを開いてこの電流計偏向ミラー及び走査レンズを経て第1フレームを照明する。カメラはこの第1フレームの細胞における標本から蛍光発光の画像を撮り込む。画像を取得した後、照明レーザの前方のシッャタを閉じ、コンピュータ内のソフトウェアプログラム(イリノイ州グローブのエピックバッファロー社製)によって画像処理する。
【0082】
上述の強度センサ445は照明レーザによって発射される光のレベルを検出し、細胞のフレームを照明するに適したものであるかをコンピュータが計算できるようにする。適していない場合には、他の照明及び画像撮り込みシーケンスを行なうようにする。十分な標本照明を得るのに繰り返し失敗した場合、エラー条件であることになり、オペレータに通知する。
【0083】
照明光のシッャタ遮蔽により、標本の好ましくない加熱及び光学的ブリーチングを減少し、より反復可能な蛍光信号を生ずることができる。画像分析アルゴリズムを動作させ、撮り込む画像の特徴につきフレームにおけるすべての目標細胞のx‐y中心座標系を位置決めする。画像に目標が存在する場合、コンピュータは可動ステージ位置及び視界に対するすべての目標位置の二次元座標系を計算し、次に電流計制御偏向ミラーを位置決めし、第1フレームの第1目標細胞の位置に指向させる。視界内における単一フレームの細胞のみを撮り込み、このポイントにおける分析を行なう。このようにして、標本の副細胞群内の比較的少ない数の認識目標が存在する。更に、カメラはより少ない数の細胞群に指向するため、より大きいサイズを使用して各目標をCCDカメラの画素によって結像することができる。
【0084】
コンピュータシステムが電流計制御偏向ミラー位置決めして第1フレームの細胞内における第1目標細胞の位置に指向させた後、処置レーザを短い時間にわたり発射させ、第1目標細胞に適正な量のエネルギ照射を与える。上述の強度センサ446は処置レーザから発射するエネルギレベルを検出し、目標細胞に反応を誘発するに適正だったか否かをコンピュータが計算できるようにする。エネルギレベルが十分でなかった場合、処置レーザを再び同一目標に向かって発射する。繰り返しの照射で必要とされる量のエネルギを発生しない場合にはエラー条件としてオペレータに通知する。このようにして、目標照準ステップ、発射ステップ、感知ステップをコンピュータが繰り返し、撮り込むフレームのすべての目標が照射されるようにする。
【0085】
第1フレームにおける細胞のすべての目標が処置レーザによって照射された後、ミラーを第2フレームの細胞が視界に入るように位置決めし、フレーム照明及びカメラ結像ポイントで上述の処理を繰り返す。この処理は走査レンズの上方の視界内におけるすべてのフレームに対して継続して行なう。これらフレームのすべてを処理したとき、コンピュータは可動ステージに命令して標本の次の視界に移動し、バックライト照明ステップ及び自動合焦ステップを繰り返す処理を行なう。フレーム及び視界は適正なオーバーラップ状態にし、不慮に標本の消失領域がないようにする。標本を完全に処置した後、オペレータは標本を取り出す信号を入力し、即座に装置を次の標本処理を行なう準備をする。
【0086】
上述したところは目標を見出す蛍光画像分析について説明したが、非蛍光バックライトLED照明画像を使用して他のタイプの目標を、たとえラベルが付いていないものであっても見出すこともできる。
【0087】
順次のフレームの結像及び順次の目標照射を制御する電流計偏向ミラーを使用することの利点は大きいものである。電流計偏向ミラーの一つのブランドとしては、ケンブリッジ・テクノロジー社の型番6860がある(マサチューセッツ州ケンブリッジ)。この電流計偏向ミラーは数ミリ秒内で正確に再位置決めすることができ、大きな領域及び妥当な時間内でのできるだけ多くの目標の処理を行なうことができる。これに比べて、可動ステージは動作が比較的緩慢であり、従って、標本の特定領域を走査レンズの視界内に移動することのみに使用する。電流計制御ボードによって連続的に発生するエラー信号をコンピュータによってモニタし、ミラーを所定位置に位置決めし、画像を撮り込む前に安定状態にするか、又は閉ループで目標に向け発射する。
【0088】
本発明の明細書中、用語「標本」は広い意味を持つものとする。即ち、装置内に配置する生物学的サンプルの任意のタイプを包含する。標本は容器内に又は容器に関連して閉じ込め、細胞の無菌状態及び活状態を維持する。更に、標本は冷却装置に組み込み又は関連させ、本発明方法の動作中に外気温より高い又は低い温度に維持する。標本容器を使用する場合には、この標本容器は照明レーザ、バックライト照明、及び処置レーザと共存できるものとし、標本容器自体に大きなダメージを受けずに適切なエネルギを透過するものとすべきである。
【0089】
上述の実施例の多くの変更も可能であり、例えば、照明、結像、及び細胞照準に関して他の方法もあり得る。例えば、走査レンズに対する標本の移動は、標本をほぼ静止した状態にして走査レンズを移動することによって達成することができる。照明ビーム、画像、及びエネルギビームの偏向は、任意の制御可能反射装置又は回折装置によって達成することができ、例えば、プリズム、圧電傾動プラットフォーム、又は音響光学的偏向器がある。更に、装置は、標本の下方又は上方のいずれかから画像処理を行なうようにすることもできる。装置を可動走査レンズに対して合焦するため、照明ビーム及びエネルギビームはz軸に沿って異なる焦点面に指向させることができる。このようにして、異なる垂直方向高さに位置する標本部分は三次元的に装置によって結像及び画像処理することができる。各ステップのシーケンスはプロセスを変更することなく変化させることができる。例えば、標本のすべての目標座標系を位置決め及び記憶し、次に目標を復帰させ、一定時間内に一回又はそれ以上の回数にわたりエネルギを照射することができる。
【0090】
標本を最適に処置するため、標本をほぼ平坦な表面上に載置し、標本の大部分が焦点の狭い範囲内に存在させ、自動合焦ステップを繰り返す必要を減少するようにする。この表面における細胞の密度は、原理的に任意の値とすることができる。しかし、細胞密度は本発明の手順に必要な全表面積を減少するため、できるだけ高い密度とすべきである。
【0091】
以下に、異なる用途に上述の方法及び装置を使用する実施例を示す。
【0092】
実施例1:自己HSC移植
HSC自己移植が必要なB細胞由来転移腫瘍を有する患者を医師が認識したとする。治療の最初のステップとして、患者に標準のHSC採取処置をとらせ、侵されている腫瘍細胞の数が未知数である約1×1010個の造血細胞を採取する。採取した細胞をHSCのために、CD34表面抗原を有する細胞を選択する市販の免疫適合性コラム(カリフォルニア州アービン、ネクセル・セラピュティクス社のIsolex(登録商標)300)を使用して濃縮し、腫瘍細胞の数が未知数である約3×108 個の造血細胞群にする。この後に、入り混ざった細胞群を、フィコエリトリンに結合する抗B細胞抗体(CD20及びCD22に指向させる)に接触させる。ラベルを付けた抗体を特別にB細胞由来の腫瘍細胞に結合する。
【0093】
この入り混ざった細胞群を、ほぼ平坦表面上の無菌標本容器に収容し、1平方センチメートル当たり約500,000個の細胞の集合となるようにする。標本を上述の装置の可動ステージ上に配置し、すべての検出可能な腫瘍細胞を、フィコエリトリンを参照して識別し、治療(処置)レーザから致死量のエネルギを照射する。この装置の設計は、4時間にわたり臨床規模の移植標本の処理を行なうことができるものとする。細胞を標本容器から回収し、洗浄し、次に低温保存する。細胞を患者に再注入する前に、患者の体内における腫瘍細胞を破壊する化学治療を高い投与量で行なう。この処置に続いて、処理した細胞を37゜Cで解凍して患者に静脈注射で投与する。患者は元の癌の再発なしに回復する。
【0094】
実施例2:同種HSC移植
他の実施例としては、HSC同種移植における移植体対受容体疾患の大きな危険性及び困難性に打ち勝つことができる。患者は適当なドナーが見つかったときに同種移植のために選択される。上述の実施例で説明したように、選択したドナーから細胞を採取する。この場合、入り混ざった細胞を、フィコエリトリンのラベル付けをした抗CD3のT細胞抗体に接触させる。代案として、同種抗原が存在する場合に、活性T細胞マーカー(例えば、CD69)を使用して特定の同種反応T細胞のサブセットにラベル付けをする。細胞群を上述の装置によって処理し、患者に投与すべきT細胞の数を厳密に規定及び制御する。このタイプの制御は、多すぎるT細胞投与が移植体対受容体疾患の危険性を増大させるとともに、T細胞が少なすぎると移植欠陥の危険性及び既知の有益な移植体対白血病効果が喪失する危険性がある。本発明方法及び装置によれば、同種移植におけるT細胞の数を厳密に制御することができる。
【0095】
実施例3:組織工学
他の実施例においては、本発明装置を使用して組織工学の用途の接種物における冒されている細胞を除去するのに使用する。細胞汚染問題は組織工学を実施するに必要な初代細胞培養を生成する際に存在し、このことはランガー氏及びヴァカンティ氏によって説明されている(1999年のLnager氏及びVacanti 氏の論文参照)。特に、軟骨疾患の軟骨細胞治療は、軟骨生検から採取した細胞群における不純物によって妨げられる。従って、本発明を使用して接種物からこのタイプの細胞を特別に取り出す。
【0096】
例えば、軟骨置換を要する患者から軟骨生検を行なう。この標本を通常の条件の下で成長させる(1994年Brittberg 氏らの論文参照)。培養体をすべての汚染細胞例えば、繊維芽細胞のための特定ラベルで着色する。この入り混ざった細胞を上述の装置内に配置し、ラベル付けした汚染細胞を目標として処置レーザを照射し、ゆっくりと軟骨細胞を成長させ、培養体で十分発育させる。
【0097】
実施例4:幹細胞治療
更に、他の実施例としては、胚芽幹細胞を使用して広範囲の種々の病疾患を治療する。胚芽幹細胞は未分化であるため、心筋細胞及びニューロンのような移植に使用される多くのタイプの組織を生成するのに使用される。しかし、移植される未分化胚芽幹細胞は奇形種として知られているタイプの腫瘍を形成する細胞種が混じる傾向もある(1999年Pedersen氏の論文参照)。従って、胚芽幹細胞由来の組織を治療に使用することは、厳密な細胞の純化を必要とし、十分分化した細胞のみを確実に移植することができなければならない。本明細書に記載した装置を使用することにより、胚芽幹細胞由来の組織を患者に移植する前に、未分化幹細胞を排除する。
【0098】
実施例5:人体腫瘍細胞培養体の生成
他の実施例としては、腫瘍生検を癌患者から取り出し、人体腫瘍細胞の培養を開始する。しかし、多くの腫瘍タイプから初代人体腫瘍細胞培養を生体外で生成するのは、初代細胞群を汚染する恐れがあって複雑であり、この汚染は腫瘍細胞よりも生体外成長特性が優勢である。例えば、汚染する繊維芽細胞は、多くの癌細胞培養を育成するのに大きな障害となる。本明細書で説明した装置を使用し、特に、汚染する細胞にラベル付けし、破壊するとともに、生検腫瘍細胞を完全な状態のままにしておくことができる。従って、より活発な初代細胞が癌細胞の系列を襲いまた破壊することがない。
【0099】
実施例6:特定mRNA発現ライブラリの構築
異なる細胞群内の遺伝子の特別な発現パターンは多くの研究者にとって極めて興味深いものであり、また多くの研究は異なる細胞タイプの発現された遺伝子のライブラリを個別に構築するものであった。例えば、腫瘍細胞対正常細胞で発現する遺伝子を知ることは極めて大きな潜在的な価値を有する(1999年Cossman 氏らの論文参照)。このようなライブラリを構築するのに使用する増幅方法によって、少ない数の汚染細胞であっても、不正確な発現ライブラリを生ずる結果を招く(1999年Cossman 氏らの論文;1998年Schutze 及びLahr氏の論文参照)。この問題を解決する手法の一つとして、レーザ顕微解剖即ち、レーザ・キャプチャ・マイクロディセッション(LCM)を使用するものがあり、この手法は、単一の細胞を使用して増幅用に原初遺伝子物質を用意するものである(1998年Schutze 及びLahr氏の論文参照)。不幸にも、単一細胞の遺伝子発現は幾分確率論的であり、また分析時における個別細胞の特別な状態に左右される傾向がある(1999年Cossman 氏らの論文参照)。従って、mRNAを抽出する前に多くの数の細胞を正確に精製することにより極めて正確な発現ライブラリを構築できるようになり、このような正確な発現ライブラリは、単一細胞発現や汚染細胞による発現によって左右されることなく研究している細胞群を表現するものである。本明細書に記載の本発明方法及び装置を使用して細胞群を精製し、RNA抽出手順の実施中に汚染細胞がないようにすることができる。
【0100】
実施例7:特定細胞群の移入(Transfection)
多くの研究及び臨床遺伝子治療の用途は、存在している他の細胞に移入することなしには所望の細胞タイプの妥当な数の細胞に対する移入が不可能であることで阻害されている。本発明方法及び装置は、細胞の混合群内で細胞を選択的に狙いを付けて移入することができる。照準を付けたエネルギ源で細胞膜に又は細胞膜の近傍に光学機械的衝撃波を発生することによって、移行孔を形成し、この移行孔を経て遺伝子(又は他の)物質が細胞内に進入することができる。この遺伝子転移方法はオプトポレーション(optoporation)と称されている(1996年Palumbo 氏らの論文参照)。上述の本発明装置によれば、興味のある細胞のみに選択的にオプトポレーションを迅速かつ自動的に狙いを付けて行なうことができる。
【0101】
例えば、白血細胞は移入すべきDNAを含む溶液を有する標本容器内で配置する。幹細胞に対する特異性を有する蛍光ラベル付き抗体を媒質に添加し、幹細胞に結合させる。標本容器は細胞処置装置内に配置し、処置レーザを照明レーザ光の下で蛍光を発しているすべての細胞に照射する。この処置レーザは照準を付けた細胞にDNAを特定移入するのに有効である。
【0102】
実施例8:生物工学的用途における好ましいクローンの選択
細胞系を使用して価値ある生成物を創成する多くの生物工学的処理において、極めて効率よく生成物を創出するクローンを派生させることが望まれている。クローンのこの選択は手作業で行われることがよくあり、何らかの方法で隔離した多数のクローンを監視しながら手作業で行われることがよくある。本発明によれば、特定生成物を創出するための好ましいクローンの監視及び選択を迅速かつ自動的に行なうことができる。例えば、最大量の抗体を創出するハイブリドーマ細胞は、FC 領域に指向する蛍光ラベルによって認識できる。蛍光ラベルのない又は僅かしか蛍光ラベルが付けられていない細胞は処置レーザで狙い打ちして壊死させ、残ったものがうまい具合に抗体生成に使用するクローンとなる。
【0103】
実施例9:細胞反応の自動モニタ
特定刺激に反応する細胞を自動的にモニタすることは、高い処理効率が得られる薬物スクリーニングにおいて極めて有益である。窪み付きプレートの一つの窪みに収納される細胞群を刺激にさらし、細胞群全体からの蛍光信号を経時的に捕らえることがよくある。本明細書に記載した本発明方法及び装置を使用することにより、より詳細なモニタを単一細胞レベルで行なうことができる。例えば、細胞群にラベル付けし、興味ある細胞の副母集団の特性を認識する。このラベルは照明レーザによって励起し、これら細胞を認識できる。この後、処置レーザを第1ラベルによって識別した個々の細胞に照準を付けて照射し、第2ラベルを励起させ、各細胞の反応に関する情報を得る。細胞はほぼ表面上で静止しているため、各細胞は多数回の評価で、各細胞反応の運動に関する一時的な情報を得る。更に、大きな面積を有する走査レンズ及び電流計制御偏向ミラーを使用することによって、比較的多数の窪みを短時間で迅速にモニタすることができる。
【0104】
特別な実施例としては、上述の実施例2で示した同種反応する(アロリアクティブな:alloreactive)T細胞の場合を考慮する。同種抗原の場合、活性化したドナーT細胞はCD69によって認識することができる。処置レーザを使用してこれら細胞を照射壊死させる代わりに、処置レーザを使用してカルボキシフルオレセイン・ジアセテートの励起及び蛍光発光によって各活性化したT細胞の細胞内pHを調べることができる。照準を定めたレーザによって活性化した細胞のみを調べることができるとともに、大部分のスクリーニング方法で細胞群全体の反応を評価することができる。一連の窪みを並列的にモニタする場合、種々の試薬を個別の窪みに添加し、また特定の活性化したT細胞の各試薬に対する反応を経時的にモニタすることができる。このような装置は、移植体対受容体疾患における同種反応性T細胞の反応を改善する試薬のための高い処理効率が得られるスクリーニング方法をもたらす。この実施例によれば、当業者であれば、刺激に対する細胞反応を、第1ラベルで認識した興味ある細胞のみに焦点を当てて個別の細胞毎にモニタする他の大きな実施例も考え付くことができるであろう。
【0105】
実施例10:フォトブリーチング研究
蛍光体を付けた生物学的サンプルの特定領域のフォトブリーチング及び/又はフォトブリーチリカバリは、種々の生物学的プロセスを評価するのに使用する一般的な方法である。例えば、細胞懸濁液をロドアミン(rhodamine)123でラベル付けし、細胞内のミトコンドリアに蛍光のしみを付ける。本発明の照明レーザを使用することにより、1個又はそれ以上の細胞内のミトコンドリアをロドアミン123の蛍光によって可視化する。次に処置レーザを使用して合焦した光ビームを発生して1個又はそれ以上の細胞内の小さい領域におけるロドアミン123のフォトブリーチングを生ずる。フォトブリーチした領域は直後に黒ずむとともに、隣接領域には影響がない。一連の画像を、照明レーザを使用して撮影し、時系列的な一連の画像を生じ、ブリーチされないミトコンドリアの処置レーザでフォトブリーチされた領域への移動を記録する。この手法を使用して細胞内の多くの生物学的構造の動き、入れ替わり、補充を評価することができる。
【0106】
このようにして、培養したラットの神経突起において、ミトコンドリアのフォトブリーチリカバリを、各細胞内におけるミトコンドリアの移動プールの寸法を測定する(1995年Chute 氏らの論文参照)。これら細胞におけるフォトブリーチリカバリの速度は、細胞内カルシウム及びマグネシウム濃度、エネルギ状態、及び微小管の無欠性に依存する。神経組織に有害な物質例えば、タクソール(taxol)又はヴィンブラスチン(vinblaatine) はフォトブリーチングリカバリの速度に影響する。従って、神経組織に有害な物質の評価は、マルチウェル(窪み)付きプレートのウェル(窪み)内の種々の試薬にさらした統計学的に多数の神経突起内におけるミトコンドリアのフォトブリーチリカバリの測定に基づいて行なうことができる。このような用途では、本明細書に記載した本発明装置により、迅速かつ自動化した評価方法を提供し、多数の細胞における多くの物質の神経組織毒性を評価することができる。この実施例に基づいて、当業者であれば、生物学的標本から有用な情報を得るためにフォトブリーチングを誘発し、またフォトブリーチリカバリをモニタする他の実施例を考え付くことができるであろう。
【0107】
実施例11:脱ケージ化研究
ケージ化化合物を使用して生物学的プロセスを素早く研究することには、非活性状態にある生物学的関連物質の結合(即ち、ケージ化)があり、ケージ化物質を生物学的標本内に拡散させ(比較的ゆっくりとしたプロセスで)、次にレーザを使用して光分解反応を誘発し(比較的速いプロセスで)、その場においてミリ秒単位で物質を解放(即ち、脱ケージ化)する。次に、生物学的標本を短い時間にわたり顕微鏡観察し、生物学的プロセスにおける脱ケージ化されない物質の効果を決定する。おき重要な物質のケージとしては、以下のものがある即ち、ダイオキシジン(Dioxygen)、環式ADP‐リボース(cADPR)、ニコチン酸アデニン・ジニュークレオチド・フォスフェート(NAADP)、一酸化窒素(NO)、カルシウム、Lアスパラギン酸塩、及びアデノシン・トリフォスフェート(ATP)がある。走化性は、脱ケージ化化合物によって研究することができる生理学的特徴の一つの例である。
【0108】
脱ケージ化研究には、生物学的標本の生物学的標本にレーザ光を照射し、次いで時系列的に顕微鏡により標本を観察することが含まれる。本発明装置はこの研究における有用性ははっきりとしている。特別な例としては、L‐アスパラギン酸塩に指向するE.coli走化性の研究がある(1999年Jasuja氏らの論文参照)。アスパラギン酸のベータ‐2,6‐ジニトロベンジル・エステル、及び8‐ヒドロキシピレン‐1,3,6‐トリス‐スルフォン酸の1‐(2‐ニトロフェニル)エチル・エステルを、E.coliを含むウェル(窪み)付きプレートの窪みに添加する。処置レーザで照射する際に、Lアスパラギン酸塩及び発蛍光団の8‐ヒドロキシピレン‐1,3,6‐トリス‐スルフォン酸(ピラニン:pyranine)の局部的脱ケージ化が誘発される。L‐アスパラギン酸塩は、E.coliのための化学的誘引物質として作用し、その後の蛍光画像(照明レーザを使用する)において、ピラニン発蛍光団は、照射した局部領域で生じた脱ケージ化の度合を示すインジケータとして作用する。脱ケージ化現象における可視波長光、例えば、バックライトによって照明された近傍のE.coliの経時的画像を使用して、局部的に脱ケージ化されたL‐アスパラギン酸塩に対する微生物の化学走化性反応を測定する。本発明の特徴によって、それぞれ潜在的な抗微生物試薬を添加した多数のウェル(窪み)を迅速にスクリーニングして微生物の走化性反応を決定する。この実施例によれば、当業者であれば、処置レーザによって脱ケージ化を誘発し、次いで時系列的に顕微鏡観察し、多数のサンプルを自動的に有用な情報を得る他の実施例を考え付くことができるであろう。
【0109】
本発明の特徴を本明細書に例示した特別な実施例につき説明したが、本発明はこれに限定されるものではない。本発明は特許請求の範囲によってのみ限定される。
【0110】
以下に、引用文献を列挙する。




【特許請求の範囲】
【請求項1】
生物学的標本内の1個又はそれ以上の目標とする細胞の反応を選択的に誘発する選択的細胞反応誘発装置において、
前記生物学的標本内のセルのフレームを照明する照明源と、
前記セルフレームの画像を撮り込む画像撮り込み装置と、
前記画像内の1個又はそれ以上の目標細胞の位置を決定するための第1制御手段と、
前記セルフレーム内の1個又はそれ以上の目標細胞のうち少なくとも1個に反応を誘発するに十分なエネルギビームを発射させるエネルギ源と、
前記1個又はそれ以上の目標細胞の前記位置に前記エネルギビームを偏向させる第2制御手段と
を具えたことを特徴とする選択的反応誘発装置。
【請求項2】
前記1個又はそれ以上の目標細胞をラベルの存在又は不在によって認識する請求項1記載の装置。
【請求項3】
前記ラベルを細胞表面に設けた請求項2記載の装置。
【請求項4】
前記ラベルを抗体とした請求項3記載の装置。
【請求項5】
前記ラベルを細胞膜透過試薬とした請求項2記載の装置。
【請求項6】
照明源を拡散レーザ光とした請求項1記載の装置。
【請求項7】
前記照明源をアークランプとした請求項1記載の装置。
【請求項8】
前記照明源を発光ダイオードとした請求項1記載の装置。
【請求項9】
前記照明源を白熱ランプとした請求項1記載の装置。
【請求項10】
前記照明源を蛍光ランプとした請求項1記載の装置。
【請求項11】
前記照明源を前記生物学的標本の細胞の副母集団のみを照明するものとした請求項1記載の装置。
【請求項12】
前記1個又はそれ以上の目標細胞を腫瘍細胞とした請求項1記載の装置。
【請求項13】
前記1個又はそれ以上の目標細胞を繊維芽細胞とした請求項1記載の装置。
【請求項14】
前記1個又はそれ以上の目標細胞をT細胞とした請求項1記載の装置。
【請求項15】
前記1個又はそれ以上の目標細胞を奇形腫細胞とした請求項1記載の装置。
【請求項16】
前記1個又はそれ以上の目標細胞を非腫瘍細胞とした請求項1記載の装置。
【請求項17】
前記画像撮り込み装置をカメラとした請求項1記載の装置。
【請求項18】
前記カメラを電荷結合デバイスとした請求項1記載の装置。
【請求項19】
前記エネルギ源をレーザとした請求項1記載の装置。
【請求項20】
前記レーザから発射されるエネルギの波長をほぼ100ナノメートルと30マイクロメートルとの間の値とした請求項19記載の装置。
【請求項21】
前記第1制御手段は、前記生物学的標本のうちの前記1個又はそれ以上の細胞の二次元位置を決定する手段とした請求項1記載の装置。
【請求項22】
前記第1制御手段は、前記生物学的標本のうちの前記1個又はそれ以上の細胞の三次元位置を決定する手段とした請求項1記載の装置。
【請求項23】
更に、前記第2制御手段によって制御される1個又はそれ以上のエネルギビーム偏向装置を設けた請求項1記載の装置。
【請求項24】
前記エネルギビーム偏向装置は、前記エネルギビームを反射する1個又はそれ以上の反射素子を有するものとして構成した請求項23記載の装置。
【請求項25】
前記エネルギビーム偏向装置は、前記エネルギビームを屈折する1個又はそれ以上の屈折素子を有するものとして構成した請求項23記載の装置。
【請求項26】
前記エネルギビーム偏向装置は、前記エネルギビームを回折する1個又はそれ以上の回折素子を有するものとして構成した請求項23記載の装置。
【請求項27】
前記エネルギビーム偏向装置は、前記エネルギビームを屈折又は反射する1個又はそれ以上の素子と組合せて回折する1個又はそれ以上の素子を有するものとして構成した請求項23記載の装置。
【請求項28】
前記エネルギビーム偏向装置は、前記エネルギビームを反射する1個又はそれ以上の素子と組合せて屈折する1個又はそれ以上の素子を有するものとして構成した請求項23記載の装置。
【請求項29】
前記エネルギビーム偏向装置は、前記エネルギビームを反射する1個又はそれ以上の反射素子及び前記エネルギビームを回折する1個又はそれ以上の回折素子と組合せて屈折する1個又はそれ以上の屈折素子を有するものとして構成した請求項23記載の装置。
【請求項30】
前記エネルギビーム偏向装置は、電流計制御ミラーを有するものとして構成した請求項23記載の装置。
【請求項31】
前記エネルギビーム偏向装置は、圧電傾動プラットフォームを有するものとして構成した請求項23記載の装置。
【請求項32】
前記エネルギビーム偏向装置は、音響光学的転向器を有するものとして構成した請求項23記載の装置。
【請求項33】
前記第1制御手段はコンピュータ制御の下に実行するものとした請求項1記載の装置。
【請求項34】
前記第2制御手段はコンピュータ制御の下に実行するものとした請求項1記載の装置。
【請求項35】
前記装置は、1分間当たり生物学的標本面積のうち少なくとも1,2,3,4,5,6,7又は14平方センチメートルの面積を処理するものとした請求項1記載の装置。
【請求項36】
前記装置は、1分間当たり生物学的標本の細胞のうち少なくとも0.25,0.5,1,2,3,4,又は8百万個の細胞の画像を結像するものとした請求項1記載の装置。
【請求項37】
前記装置は、1秒間当たり少なくとも50,100,150,200,250,300,350,400、又は800個の目標細胞の反応を誘発することができるものとした請求項1記載の装置。
【請求項38】
前記1個又はそれ以上の目標細胞に誘発される反応を壊死とした請求項1記載の装置。
【請求項39】
前記反応を非致死的のものとした請求項1記載の装置。
【請求項40】
前記1個又はそれ以上の目標細胞に誘発される反応を感光剤の活性化とした請求項1記載の装置。
【請求項41】
前記1個又はそれ以上の目標細胞に誘発される反応を物質の侵入を可能にする光学的削孔とした請求項1記載の装置。
【請求項42】
前記物質を遺伝子材料としたとした請求項1記載の装置。
【請求項43】
前記1個又はそれ以上の目標細胞に誘発される反応を細胞成分の非活性化とした請求項1記載の装置。
【請求項44】
前記1個又はそれ以上の目標細胞に誘発される反応を前記1個又はそれ以上の目標細胞の制御される運動とした請求項1記載の装置。
【請求項45】
前記反応を前記1個又はそれ以上の目標細胞内における蛍光染料の励起とした請求項1記載の装置。
【請求項46】
前記1個又はそれ以上の目標細胞とエネルギ吸収染料を接触させる請求項1記載の装置。
【請求項47】
前記反応をフォトブリーチングリカバリとした請求項1記載の装置。
【請求項48】
前記反応を内部分子の脱ケージ化の効果とした請求項1記載の装置。
【請求項49】
前記画像撮り込み装置にリンクする自動合焦機構を制御する第3制御手段を設けた請求項1記載の装置。
【請求項50】
前記第3制御手段をコンピュータ制御の下に実行する請求項1記載の装置。
【請求項51】
生物学的標本内の1個又はそれ以上の目標とする細胞の反応を選択的に誘発する選択的細胞反応誘発装置において、
前記生物学的標本内の複数個の細胞フレームを含む視界に合焦する走査レンズと、
1個又はそれ以上の細胞フレームを照明する照明源と、
前記視界内の第1細胞フレームの画像を撮り込む画像撮り込み装置と、
前記第1細胞フレーム内の1個又はそれ以上の目標細胞の位置を決定する第1制御手段と、
前記1個又はそれ以上の目標細胞のうち少なくとも1個の反応を誘発するに十分なエネルギビームを発生するエネルギ源と、
前記第1細胞フレーム内の1個又はそれ以上の目標細胞の位置に前記エネルギビームを偏向する第2制御手段と
を具えたことを特徴とする装置。
【請求項52】
更に、
前記視界内の第2細胞フレームに向けて前記照明源の出力を指向させる指向手段と、
前記第2細胞フレームの画像を撮り込む画像撮り込み手段と、
前記第2細胞フレームの前記1個又はそれ以上の目標細胞の位置を決定する第3制御手段と、
前記第2細胞フレーム内の前記1個又はそれ以上の目標細胞の位置に前記エネルギビームを偏向する第4制御手段と
を設けた請求項51記載の装置。
【請求項53】
前記照明源を指向させる指向手段を1個又はそれ以上の反射素子とした請求項52記載の装置。
【請求項54】
前記照明源を指向させる指向手段を1個又はそれ以上の屈折素子とした請求項52記載の装置。
【請求項55】
更に、前記走査レンズに対して前記生物学的標本の位置を移動させる移動手段を設けた請求項51記載の装置。
【請求項56】
前記走査レンズは、1個又はそれ以上の屈折素子を有するものとして構成した請求項51記載の装置。
【請求項57】
前記走査レンズをF‐シータ設計の直径が少なくとも8,10,12,14,16,又は18mmのものとした請求項51記載の装置。
【請求項58】
前記走査レンズは、1個又はそれ以上の反射素子を有するものとして構成した請求項51記載の装置。
【請求項59】
前記走査レンズは、1個又はそれ以上の回折素子を有するものとして構成した請求項51記載の装置。
【請求項60】
前記走査レンズは、1個又はそれ以上の反射素子と組合せた1個又はそれ以上の屈折素子を有するものとした請求項51記載の装置。
【請求項61】
前記走査レンズは、1個又はそれ以上の屈折素子又は反射素子と組合せた1個又はそれ以上の回折素子を有するものとした請求項51記載の装置。
【請求項62】
前記走査レンズは、1個又はそれ以上の反射素子及び1個又はそれ以上の回折素子と組合せた1個又はそれ以上の屈折素子を有するものとした請求項51記載の装置。
【請求項63】
更に、前記走査レンズを合焦するプロキシメータを設けた請求項51記載の装置。
【請求項64】
前記プロキシメータをレーザプロキシメータとした請求項63記載の装置。
【請求項65】
前記反応は、細胞壊死、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項51記載の装置。
【請求項66】
前記反応を非致死的なものとした請求項51記載の装置。
【請求項67】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項66記載の装置。
【請求項68】
ラベル付きの細胞の第1細胞群と、ラベルなし細胞の第1細胞群との混合体のうち前記第1細胞群の細胞を認識する細胞認識装置において、 前記混合体における細胞フレームを照明する照明源と、 前記細胞フレームの画像を撮り込む画像撮り込み装置と、 前記画像を参照してラベル付き細胞の第1細胞群のうち少なくとも1個の細胞の位置を決定する第1制御手段とを具えたことを特徴とする認識装置。
【請求項69】
更に、前記ラベル付き細胞の第1細胞群における少なくとも1個の細胞の位置を記憶するメモリを設けた請求項68記載の装置。
【請求項70】
更に、前記ラベル付き細胞の第1細胞群における細胞の数を記憶するメモリを設けた請求項68記載の装置。
【請求項71】
更に、ラベル付きの細胞の第1細胞群における少なくとも1個の細胞に反応を誘発するに十分なエネルギビームを発射するエネルギ源を設けた請求項68記載の装置。
【請求項72】
生物学的標本における個別の細胞の形態学的又は生理学的特徴を決定する細胞特徴決定装置において、
前記生物学的標本における細胞フレームを照明する照明源と、
前記細胞フレームの画像を撮り込む画像撮り込み装置と、
前記画像を参照して前記生物学的標本における第1個別細胞の位置を決定する第1制御手段と、
前記1個又はそれ以上の個別細胞のうち少なくとも1個に反応を誘発するに十分なエネルギビームを発射するエネルギ源と、
前記第1個別細胞の形態学的又は生理学的特徴の存在を調べるに十分なエネルギビームを第1個別細胞に通過させる第2制御手段と、 前記通過調査に対する前記第1個別細胞の反応を測定する検出器と
を具えたことを特徴とする装置。
【請求項73】
前記第1個別細胞を第1ラベルの存在又は不在によって認識する請求項72記載の装置。
【請求項74】
前記第1ラベルを蛍光剤でタグ付けした抗体とした請求項73記載の装置。
【請求項75】
前記第1個別細胞を第2ラベルでラベル付けし、前記第1ラベルを照明源で活性化し、また第2ラベルを前記エネルギビームで活性化させる請求項73記載の装置。
【請求項76】
前記形態学的又は生理学的特徴をカルシウム量とした請求項72記載の装置。
【請求項77】
前記形態学的又は生理学的特徴を細胞サイクル状態とした請求項72記載の装置。
【請求項78】
前記形態学的又は生理学的特徴を細胞有糸分裂履歴とした請求項72記載の装置。
【請求項79】
前記形態学的又は生理学的特徴を生存可能性とした請求項72記載の装置。
【請求項80】
前記形態学的又は生理学的特徴を細胞膜無欠性とした請求項72記載の装置。
【請求項81】
前記形態学的又は生理学的特徴を細胞内pHとした請求項72記載の装置。
【請求項82】
前記形態学的又は生理学的特徴を膜内外電位差とした請求項72記載の装置。
【請求項83】
前記形態学的又は生理学的特徴をグルタチオン還元段階とした請求項72記載の装置。
【請求項84】
前記形態学的又は生理学的特徴をチオール活性とした請求項72記載の装置。
【請求項85】
前記形態学的又は生理学的特徴を遺伝子発現とした請求項72記載の装置。
【請求項86】
前記形態学的又は生理学的特徴をフォトブリーチングリカバリとした請求項72記載の装置。
【請求項87】
前記形態学的又は生理学的特徴を内部分子脱ケージ化に対する反応とした請求項72記載の装置。
【請求項88】
前記反応を非致死的のものとした請求項72記載の装置。
【請求項89】
生物学的標本内の1個又はそれ以上の目標細胞に反応を選択的に誘発する選択的細胞反応誘発装置において、
前記生物学的標本内の細胞フレームを照明する照明源と、
前記細胞フレームの画像を撮り込む画像撮り込み装置と、
前記画像内の1個又はそれ以上の細胞の位置を決定する第1制御手段と、
前記細胞フレーム内の前記1個又はそれ以上の目標細胞の少なくとも1個の反応を誘発するに十分なエネルギビームを発射するエネルギ源と、
前記エネルギ源によって発射されるエネルギ量を検出するセンサと
を具えたことを特徴とする装置。
【請求項90】
前記反応を、細胞壊死、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項89記載の装置。
【請求項91】
前記反応を非致死的なものとした請求項89記載の装置。
【請求項92】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項91記載の装置。
【請求項93】
生物学的標本内の1個又はそれ以上の目標細胞の反応を選択的に誘発する選択的細胞反応誘発方法において、
前記生物学的標本内の細胞フレームを照明し、
前記細胞フレームの画像を撮り込み、
前記画像内の前記1個又はそれ以上の目標細胞の位置を決定し、
前記1個又はそれ以上の目標細胞の位置にエネルギビームを偏向させることよりなり、このエネルギビームは前記1個又はそれ以上の目標細胞のうち少なくとも1個に反応を誘発するに十分なものとした
ことを特徴とする方法。
【請求項94】
前記1個又はそれ以上の目標細胞の位置を決定するステップは、前記1個又はそれ以上の目標細胞に付けられたラベルの有無によって決定するものとした請求項93記載の方法。
【請求項95】
前記細胞フレームの画像を撮り込むステップは、ラベル付き細胞の画像を撮り込むものとした請求項93記載の方法。
【請求項96】
前記細胞フレームを照明するステップは、励起レーザ光源で細胞フレームを照明するものとした請求項93記載の方法。
【請求項97】
前記反応を、細胞壊死、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項93記載の方法。
【請求項98】
前記反応を非致死的なものとした請求項93記載の方法。
【請求項99】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項98記載の方法。
【請求項100】
容器に保持した細胞群のうち個別の細胞における反応を迅速に誘発する反応迅速誘発方法において、
細胞群における第1視界内の第1細胞フレームを照明し、
前記第1視界内の前記第1細胞フレームの画像を撮り込み、
前記画像を参照して前記第1細胞フレーム内における第1個別細胞の位置を決定し、
前記第1個別細胞の位置にエネルギビームを偏向することよりなり、前記エネルギビームは前記第1個別細胞のうちの少なくとも1個に反応を誘発するに十分な量とした
ことを特徴とする方法。
【請求項101】
更に、
前記第1視界内の第2細胞フレームの画像を撮り込み、
前記画像を参照して前記第2細胞フレームの第2個別細胞の位置を決定し、
前記第2個別細胞の位置にエネルギビームを偏向し、前記エネルギビームは前記第2個別細胞のうちの少なくとも1個に反応を誘発するに十分な量とした
請求項100記載の方法。
【請求項102】
更に、
前記細胞群の第2視界内の第1細胞フレームを照明し、
前記第2視界内の第1細胞フレームの画像を撮り込み、
前記画像を参照して前記第2視界内における第1細胞フレームの第3個別細胞の位置を決定し、
前記第3個別細胞の位置にエネルギビームを偏向し、前記エネルギビームは前記第3個別細胞のうちの少なくとも1個に反応を誘発するに十分な量とした
請求項100記載の方法。
【請求項103】
前記第2視界内の前記第1細胞フレームを照明するステップは、前記容器を移動し、また前記第1細胞フレームを照明するものとした請求項102記載の方法。
【請求項104】
前記反応を、細胞壊死、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング及び内部分子脱ケージ化よりなるグループから選択したものとした請求項102記載の方法。
【請求項105】
前記反応を非致死的なものとした請求項102記載の方法。
【請求項106】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項105記載の方法。
【請求項107】
生物学的標本における1個又はそれ以上目標細胞に反応を選択的に誘発する選択的細胞反応誘発方法において、
前記生物学的標本における複数個の細胞フレームよりなる視界のうち一つの視界に対して走査レンズを合焦し、
前記視界内の1個又はそれ以上の細胞フレームを照明し、
前記視界における第1細胞フレームの画像を撮り込み、
前記第1細胞フレームにおける前記1個又はそれ以上の目標細胞の位置を決定し、
前記1個又はそれ以上の目標細胞のうち少なくとも1個に反応を誘発するに十分なエネルギビームを発射し、
前記第1細胞フレームにおける前記1個又はそれ以上の目標細胞の位置に前記エネルギビームを偏向させる
ことよりなることを特徴とする方法。
【請求項108】
前記反応を、細胞壊死、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング及び内部分子脱ケージ化よりなるグループから選択したものとした請求項107記載の方法。
【請求項109】
前記反応を非致死的なものとした請求項107記載の方法。
【請求項110】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項109記載の方法。
【請求項111】
前記第1細胞フレームの画像を撮り込むステップは、ラベル付き細胞の画像を撮り込むものとした請求項107記載の方法。
【請求項112】
1個又はそれ以上の細胞フレームを照明するステップは、励起レーザ光源で前記1個又はそれ以上の細胞フレームを照明するものとした請求項107記載の方法。
【請求項113】
細胞群における1個又はそれ以上の目標細胞に反応を誘発する細胞反応誘発方法において、
前記細胞群における細胞を照明し、
前記照明された細胞の画像を撮り込み、
前記画像を参照して1個又はそれ以上の目標細胞の位置を決定し、
前記1個又はそれ以上の目標細胞のうち少なくとも1個に反応を誘発するに十分なエネルギビームを発射し、
前記エネルギビームに含まれるエネルギ量を測定し、
前記1個又はそれ以上の目標細胞の位置に前記エネルギビームを偏向する
ことよりなることを特徴とする方法。
【請求項114】
前記エネルギビームを偏向させる前に前記エネルギビームに含まれるエネルギ量を測定する請求項113記載の方法。
【請求項115】
前記反応を、細胞壊死、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング及び内部分子脱ケージ化よりなるグループから選択したものとした請求項113記載の方法。
【請求項116】
前記反応を非致死的なものとした請求項113記載の方法。
【請求項117】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項116記載の方法。
【請求項118】
生物学的標本内の個別の形態学的又は生理学的特徴を決定する装置において、
前記生物学的標本内の細胞フレームを照明する照明源と、
前記細胞フレームの画像を撮り込む画像撮り込み装置と、
前記画像を参照して前記生物学的標本の個別細胞の位置を決定する第1制御手段と、
前記個別細胞のうちの少なくとも1個に反応を誘発するに十分なエネルギビームを発射するエネルギ源と、
前記第1個別細胞の形態学的又は生理学的特徴を変化させるに十分なエネルギビームで前記第1個別細胞を通過させる第2制御手段と、
前記第1個別細胞の形態学的又は生理学的特徴を測定する検出器と
を具えたことを特徴とする装置。
【請求項119】
前記反応を非致死的なものとした請求項118記載の装置。
【請求項120】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項119記載の装置。
【請求項121】
生物学的標本内における個別の細胞の形態学的又は生理学的特徴を決定する装置において、
ケージ化化合物を含む前記生物学的標本における細胞フレームを照明する照明源と、
前記細胞フレームの画像を撮り込む画像撮り込み装置と、
前記ケージ化化合物のうちの1個又はそれ以上の脱ケージ化するのに十分なエネルギビームを前記ケージ化化合物のうちの1個又はそれ以上に通過させる第1制御手段と、
前記ケージ化化合物のうちの1個又はそれ以上を脱ケージ化するに十分なビームを発射するエネルギ源と、
前記ケージ化化合物のうちの1個又はそれ以上の脱ケージ化された化合物に応答する前記形態学的又は生理学的特徴の変化の進行をモニタする第2制御手段と
を具えたことを特徴とする装置。
【請求項122】
生物学的標本における個別細胞の形態学的又は生理学的特徴を決定する装置において、
前記生物学的標本における細胞フレームを照明する照明源と、
前記細胞フレームの画像を撮り込む画像撮り込み装置と、
前記細胞フレームにおける前記個別細胞の形態学的又は生理学的特徴を決定する第1制御手段と、
を具えたことを特徴とする装置。
【請求項123】
前記形態学的又は生理学的特徴をカルシウム量とした請求項122記載の装置。
【請求項124】
前記形態学的又は生理学的特徴を細胞サイクル状態とした請求項122記載の装置。
【請求項125】
前記形態学的又は生理学的特徴を細胞有糸分裂履歴とした請求項122記載の装置。
【請求項126】
前記形態学的又は生理学的特徴を生存可能性とした請求項122記載の装置。
【請求項127】
前記形態学的又は生理学的特徴を細胞膜無欠性とした請求項122記載の装置。
【請求項128】
前記形態学的又は生理学的特徴を細胞内pHとした請求項122記載の装置。
【請求項129】
前記形態学的又は生理学的特徴を膜内外電位差とした請求項122記載の装置。
【請求項130】
前記形態学的又は生理学的特徴をグルタチオン還元段階とした請求項122記載の装置。
【請求項131】
前記形態学的又は生理学的特徴をチオール活性とした請求項122記載の装置。
【請求項132】
前記形態学的又は生理学的特徴を遺伝子発現とした請求項122記載の装置。
【請求項133】
前記形態学的又は生理学的特徴をフォトブリーチングリカバリとした請求項122記載の装置。
【請求項134】
前記形態学的又は生理学的特徴を内部分子脱ケージ化に対する反応とした請求項122記載の装置。
【請求項1】
生物学的標本内の1個又はそれ以上の目標とする細胞の反応を選択的に誘発する選択的細胞反応誘発装置において、
前記生物学的標本内のセルのフレームを照明する照明源と、
前記セルフレームの画像を撮り込む画像撮り込み装置と、
前記画像内の1個又はそれ以上の目標細胞の位置を決定するための第1制御手段と、
前記セルフレーム内の1個又はそれ以上の目標細胞のうち少なくとも1個に反応を誘発するに十分なエネルギビームを発射させるエネルギ源と、
前記1個又はそれ以上の目標細胞の前記位置に前記エネルギビームを偏向させる第2制御手段と
を具えたことを特徴とする選択的反応誘発装置。
【請求項2】
前記1個又はそれ以上の目標細胞をラベルの存在又は不在によって認識する請求項1記載の装置。
【請求項3】
前記ラベルを細胞表面に設けた請求項2記載の装置。
【請求項4】
前記ラベルを抗体とした請求項3記載の装置。
【請求項5】
前記ラベルを細胞膜透過試薬とした請求項2記載の装置。
【請求項6】
照明源を拡散レーザ光とした請求項1記載の装置。
【請求項7】
前記照明源をアークランプとした請求項1記載の装置。
【請求項8】
前記照明源を発光ダイオードとした請求項1記載の装置。
【請求項9】
前記照明源を白熱ランプとした請求項1記載の装置。
【請求項10】
前記照明源を蛍光ランプとした請求項1記載の装置。
【請求項11】
前記照明源を前記生物学的標本の細胞の副母集団のみを照明するものとした請求項1記載の装置。
【請求項12】
前記1個又はそれ以上の目標細胞を腫瘍細胞とした請求項1記載の装置。
【請求項13】
前記1個又はそれ以上の目標細胞を繊維芽細胞とした請求項1記載の装置。
【請求項14】
前記1個又はそれ以上の目標細胞をT細胞とした請求項1記載の装置。
【請求項15】
前記1個又はそれ以上の目標細胞を奇形腫細胞とした請求項1記載の装置。
【請求項16】
前記1個又はそれ以上の目標細胞を非腫瘍細胞とした請求項1記載の装置。
【請求項17】
前記画像撮り込み装置をカメラとした請求項1記載の装置。
【請求項18】
前記カメラを電荷結合デバイスとした請求項1記載の装置。
【請求項19】
前記エネルギ源をレーザとした請求項1記載の装置。
【請求項20】
前記レーザから発射されるエネルギの波長をほぼ100ナノメートルと30マイクロメートルとの間の値とした請求項19記載の装置。
【請求項21】
前記第1制御手段は、前記生物学的標本のうちの前記1個又はそれ以上の細胞の二次元位置を決定する手段とした請求項1記載の装置。
【請求項22】
前記第1制御手段は、前記生物学的標本のうちの前記1個又はそれ以上の細胞の三次元位置を決定する手段とした請求項1記載の装置。
【請求項23】
更に、前記第2制御手段によって制御される1個又はそれ以上のエネルギビーム偏向装置を設けた請求項1記載の装置。
【請求項24】
前記エネルギビーム偏向装置は、前記エネルギビームを反射する1個又はそれ以上の反射素子を有するものとして構成した請求項23記載の装置。
【請求項25】
前記エネルギビーム偏向装置は、前記エネルギビームを屈折する1個又はそれ以上の屈折素子を有するものとして構成した請求項23記載の装置。
【請求項26】
前記エネルギビーム偏向装置は、前記エネルギビームを回折する1個又はそれ以上の回折素子を有するものとして構成した請求項23記載の装置。
【請求項27】
前記エネルギビーム偏向装置は、前記エネルギビームを屈折又は反射する1個又はそれ以上の素子と組合せて回折する1個又はそれ以上の素子を有するものとして構成した請求項23記載の装置。
【請求項28】
前記エネルギビーム偏向装置は、前記エネルギビームを反射する1個又はそれ以上の素子と組合せて屈折する1個又はそれ以上の素子を有するものとして構成した請求項23記載の装置。
【請求項29】
前記エネルギビーム偏向装置は、前記エネルギビームを反射する1個又はそれ以上の反射素子及び前記エネルギビームを回折する1個又はそれ以上の回折素子と組合せて屈折する1個又はそれ以上の屈折素子を有するものとして構成した請求項23記載の装置。
【請求項30】
前記エネルギビーム偏向装置は、電流計制御ミラーを有するものとして構成した請求項23記載の装置。
【請求項31】
前記エネルギビーム偏向装置は、圧電傾動プラットフォームを有するものとして構成した請求項23記載の装置。
【請求項32】
前記エネルギビーム偏向装置は、音響光学的転向器を有するものとして構成した請求項23記載の装置。
【請求項33】
前記第1制御手段はコンピュータ制御の下に実行するものとした請求項1記載の装置。
【請求項34】
前記第2制御手段はコンピュータ制御の下に実行するものとした請求項1記載の装置。
【請求項35】
前記装置は、1分間当たり生物学的標本面積のうち少なくとも1,2,3,4,5,6,7又は14平方センチメートルの面積を処理するものとした請求項1記載の装置。
【請求項36】
前記装置は、1分間当たり生物学的標本の細胞のうち少なくとも0.25,0.5,1,2,3,4,又は8百万個の細胞の画像を結像するものとした請求項1記載の装置。
【請求項37】
前記装置は、1秒間当たり少なくとも50,100,150,200,250,300,350,400、又は800個の目標細胞の反応を誘発することができるものとした請求項1記載の装置。
【請求項38】
前記1個又はそれ以上の目標細胞に誘発される反応を壊死とした請求項1記載の装置。
【請求項39】
前記反応を非致死的のものとした請求項1記載の装置。
【請求項40】
前記1個又はそれ以上の目標細胞に誘発される反応を感光剤の活性化とした請求項1記載の装置。
【請求項41】
前記1個又はそれ以上の目標細胞に誘発される反応を物質の侵入を可能にする光学的削孔とした請求項1記載の装置。
【請求項42】
前記物質を遺伝子材料としたとした請求項1記載の装置。
【請求項43】
前記1個又はそれ以上の目標細胞に誘発される反応を細胞成分の非活性化とした請求項1記載の装置。
【請求項44】
前記1個又はそれ以上の目標細胞に誘発される反応を前記1個又はそれ以上の目標細胞の制御される運動とした請求項1記載の装置。
【請求項45】
前記反応を前記1個又はそれ以上の目標細胞内における蛍光染料の励起とした請求項1記載の装置。
【請求項46】
前記1個又はそれ以上の目標細胞とエネルギ吸収染料を接触させる請求項1記載の装置。
【請求項47】
前記反応をフォトブリーチングリカバリとした請求項1記載の装置。
【請求項48】
前記反応を内部分子の脱ケージ化の効果とした請求項1記載の装置。
【請求項49】
前記画像撮り込み装置にリンクする自動合焦機構を制御する第3制御手段を設けた請求項1記載の装置。
【請求項50】
前記第3制御手段をコンピュータ制御の下に実行する請求項1記載の装置。
【請求項51】
生物学的標本内の1個又はそれ以上の目標とする細胞の反応を選択的に誘発する選択的細胞反応誘発装置において、
前記生物学的標本内の複数個の細胞フレームを含む視界に合焦する走査レンズと、
1個又はそれ以上の細胞フレームを照明する照明源と、
前記視界内の第1細胞フレームの画像を撮り込む画像撮り込み装置と、
前記第1細胞フレーム内の1個又はそれ以上の目標細胞の位置を決定する第1制御手段と、
前記1個又はそれ以上の目標細胞のうち少なくとも1個の反応を誘発するに十分なエネルギビームを発生するエネルギ源と、
前記第1細胞フレーム内の1個又はそれ以上の目標細胞の位置に前記エネルギビームを偏向する第2制御手段と
を具えたことを特徴とする装置。
【請求項52】
更に、
前記視界内の第2細胞フレームに向けて前記照明源の出力を指向させる指向手段と、
前記第2細胞フレームの画像を撮り込む画像撮り込み手段と、
前記第2細胞フレームの前記1個又はそれ以上の目標細胞の位置を決定する第3制御手段と、
前記第2細胞フレーム内の前記1個又はそれ以上の目標細胞の位置に前記エネルギビームを偏向する第4制御手段と
を設けた請求項51記載の装置。
【請求項53】
前記照明源を指向させる指向手段を1個又はそれ以上の反射素子とした請求項52記載の装置。
【請求項54】
前記照明源を指向させる指向手段を1個又はそれ以上の屈折素子とした請求項52記載の装置。
【請求項55】
更に、前記走査レンズに対して前記生物学的標本の位置を移動させる移動手段を設けた請求項51記載の装置。
【請求項56】
前記走査レンズは、1個又はそれ以上の屈折素子を有するものとして構成した請求項51記載の装置。
【請求項57】
前記走査レンズをF‐シータ設計の直径が少なくとも8,10,12,14,16,又は18mmのものとした請求項51記載の装置。
【請求項58】
前記走査レンズは、1個又はそれ以上の反射素子を有するものとして構成した請求項51記載の装置。
【請求項59】
前記走査レンズは、1個又はそれ以上の回折素子を有するものとして構成した請求項51記載の装置。
【請求項60】
前記走査レンズは、1個又はそれ以上の反射素子と組合せた1個又はそれ以上の屈折素子を有するものとした請求項51記載の装置。
【請求項61】
前記走査レンズは、1個又はそれ以上の屈折素子又は反射素子と組合せた1個又はそれ以上の回折素子を有するものとした請求項51記載の装置。
【請求項62】
前記走査レンズは、1個又はそれ以上の反射素子及び1個又はそれ以上の回折素子と組合せた1個又はそれ以上の屈折素子を有するものとした請求項51記載の装置。
【請求項63】
更に、前記走査レンズを合焦するプロキシメータを設けた請求項51記載の装置。
【請求項64】
前記プロキシメータをレーザプロキシメータとした請求項63記載の装置。
【請求項65】
前記反応は、細胞壊死、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項51記載の装置。
【請求項66】
前記反応を非致死的なものとした請求項51記載の装置。
【請求項67】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項66記載の装置。
【請求項68】
ラベル付きの細胞の第1細胞群と、ラベルなし細胞の第1細胞群との混合体のうち前記第1細胞群の細胞を認識する細胞認識装置において、 前記混合体における細胞フレームを照明する照明源と、 前記細胞フレームの画像を撮り込む画像撮り込み装置と、 前記画像を参照してラベル付き細胞の第1細胞群のうち少なくとも1個の細胞の位置を決定する第1制御手段とを具えたことを特徴とする認識装置。
【請求項69】
更に、前記ラベル付き細胞の第1細胞群における少なくとも1個の細胞の位置を記憶するメモリを設けた請求項68記載の装置。
【請求項70】
更に、前記ラベル付き細胞の第1細胞群における細胞の数を記憶するメモリを設けた請求項68記載の装置。
【請求項71】
更に、ラベル付きの細胞の第1細胞群における少なくとも1個の細胞に反応を誘発するに十分なエネルギビームを発射するエネルギ源を設けた請求項68記載の装置。
【請求項72】
生物学的標本における個別の細胞の形態学的又は生理学的特徴を決定する細胞特徴決定装置において、
前記生物学的標本における細胞フレームを照明する照明源と、
前記細胞フレームの画像を撮り込む画像撮り込み装置と、
前記画像を参照して前記生物学的標本における第1個別細胞の位置を決定する第1制御手段と、
前記1個又はそれ以上の個別細胞のうち少なくとも1個に反応を誘発するに十分なエネルギビームを発射するエネルギ源と、
前記第1個別細胞の形態学的又は生理学的特徴の存在を調べるに十分なエネルギビームを第1個別細胞に通過させる第2制御手段と、 前記通過調査に対する前記第1個別細胞の反応を測定する検出器と
を具えたことを特徴とする装置。
【請求項73】
前記第1個別細胞を第1ラベルの存在又は不在によって認識する請求項72記載の装置。
【請求項74】
前記第1ラベルを蛍光剤でタグ付けした抗体とした請求項73記載の装置。
【請求項75】
前記第1個別細胞を第2ラベルでラベル付けし、前記第1ラベルを照明源で活性化し、また第2ラベルを前記エネルギビームで活性化させる請求項73記載の装置。
【請求項76】
前記形態学的又は生理学的特徴をカルシウム量とした請求項72記載の装置。
【請求項77】
前記形態学的又は生理学的特徴を細胞サイクル状態とした請求項72記載の装置。
【請求項78】
前記形態学的又は生理学的特徴を細胞有糸分裂履歴とした請求項72記載の装置。
【請求項79】
前記形態学的又は生理学的特徴を生存可能性とした請求項72記載の装置。
【請求項80】
前記形態学的又は生理学的特徴を細胞膜無欠性とした請求項72記載の装置。
【請求項81】
前記形態学的又は生理学的特徴を細胞内pHとした請求項72記載の装置。
【請求項82】
前記形態学的又は生理学的特徴を膜内外電位差とした請求項72記載の装置。
【請求項83】
前記形態学的又は生理学的特徴をグルタチオン還元段階とした請求項72記載の装置。
【請求項84】
前記形態学的又は生理学的特徴をチオール活性とした請求項72記載の装置。
【請求項85】
前記形態学的又は生理学的特徴を遺伝子発現とした請求項72記載の装置。
【請求項86】
前記形態学的又は生理学的特徴をフォトブリーチングリカバリとした請求項72記載の装置。
【請求項87】
前記形態学的又は生理学的特徴を内部分子脱ケージ化に対する反応とした請求項72記載の装置。
【請求項88】
前記反応を非致死的のものとした請求項72記載の装置。
【請求項89】
生物学的標本内の1個又はそれ以上の目標細胞に反応を選択的に誘発する選択的細胞反応誘発装置において、
前記生物学的標本内の細胞フレームを照明する照明源と、
前記細胞フレームの画像を撮り込む画像撮り込み装置と、
前記画像内の1個又はそれ以上の細胞の位置を決定する第1制御手段と、
前記細胞フレーム内の前記1個又はそれ以上の目標細胞の少なくとも1個の反応を誘発するに十分なエネルギビームを発射するエネルギ源と、
前記エネルギ源によって発射されるエネルギ量を検出するセンサと
を具えたことを特徴とする装置。
【請求項90】
前記反応を、細胞壊死、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項89記載の装置。
【請求項91】
前記反応を非致死的なものとした請求項89記載の装置。
【請求項92】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項91記載の装置。
【請求項93】
生物学的標本内の1個又はそれ以上の目標細胞の反応を選択的に誘発する選択的細胞反応誘発方法において、
前記生物学的標本内の細胞フレームを照明し、
前記細胞フレームの画像を撮り込み、
前記画像内の前記1個又はそれ以上の目標細胞の位置を決定し、
前記1個又はそれ以上の目標細胞の位置にエネルギビームを偏向させることよりなり、このエネルギビームは前記1個又はそれ以上の目標細胞のうち少なくとも1個に反応を誘発するに十分なものとした
ことを特徴とする方法。
【請求項94】
前記1個又はそれ以上の目標細胞の位置を決定するステップは、前記1個又はそれ以上の目標細胞に付けられたラベルの有無によって決定するものとした請求項93記載の方法。
【請求項95】
前記細胞フレームの画像を撮り込むステップは、ラベル付き細胞の画像を撮り込むものとした請求項93記載の方法。
【請求項96】
前記細胞フレームを照明するステップは、励起レーザ光源で細胞フレームを照明するものとした請求項93記載の方法。
【請求項97】
前記反応を、細胞壊死、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項93記載の方法。
【請求項98】
前記反応を非致死的なものとした請求項93記載の方法。
【請求項99】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項98記載の方法。
【請求項100】
容器に保持した細胞群のうち個別の細胞における反応を迅速に誘発する反応迅速誘発方法において、
細胞群における第1視界内の第1細胞フレームを照明し、
前記第1視界内の前記第1細胞フレームの画像を撮り込み、
前記画像を参照して前記第1細胞フレーム内における第1個別細胞の位置を決定し、
前記第1個別細胞の位置にエネルギビームを偏向することよりなり、前記エネルギビームは前記第1個別細胞のうちの少なくとも1個に反応を誘発するに十分な量とした
ことを特徴とする方法。
【請求項101】
更に、
前記第1視界内の第2細胞フレームの画像を撮り込み、
前記画像を参照して前記第2細胞フレームの第2個別細胞の位置を決定し、
前記第2個別細胞の位置にエネルギビームを偏向し、前記エネルギビームは前記第2個別細胞のうちの少なくとも1個に反応を誘発するに十分な量とした
請求項100記載の方法。
【請求項102】
更に、
前記細胞群の第2視界内の第1細胞フレームを照明し、
前記第2視界内の第1細胞フレームの画像を撮り込み、
前記画像を参照して前記第2視界内における第1細胞フレームの第3個別細胞の位置を決定し、
前記第3個別細胞の位置にエネルギビームを偏向し、前記エネルギビームは前記第3個別細胞のうちの少なくとも1個に反応を誘発するに十分な量とした
請求項100記載の方法。
【請求項103】
前記第2視界内の前記第1細胞フレームを照明するステップは、前記容器を移動し、また前記第1細胞フレームを照明するものとした請求項102記載の方法。
【請求項104】
前記反応を、細胞壊死、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング及び内部分子脱ケージ化よりなるグループから選択したものとした請求項102記載の方法。
【請求項105】
前記反応を非致死的なものとした請求項102記載の方法。
【請求項106】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項105記載の方法。
【請求項107】
生物学的標本における1個又はそれ以上目標細胞に反応を選択的に誘発する選択的細胞反応誘発方法において、
前記生物学的標本における複数個の細胞フレームよりなる視界のうち一つの視界に対して走査レンズを合焦し、
前記視界内の1個又はそれ以上の細胞フレームを照明し、
前記視界における第1細胞フレームの画像を撮り込み、
前記第1細胞フレームにおける前記1個又はそれ以上の目標細胞の位置を決定し、
前記1個又はそれ以上の目標細胞のうち少なくとも1個に反応を誘発するに十分なエネルギビームを発射し、
前記第1細胞フレームにおける前記1個又はそれ以上の目標細胞の位置に前記エネルギビームを偏向させる
ことよりなることを特徴とする方法。
【請求項108】
前記反応を、細胞壊死、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング及び内部分子脱ケージ化よりなるグループから選択したものとした請求項107記載の方法。
【請求項109】
前記反応を非致死的なものとした請求項107記載の方法。
【請求項110】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項109記載の方法。
【請求項111】
前記第1細胞フレームの画像を撮り込むステップは、ラベル付き細胞の画像を撮り込むものとした請求項107記載の方法。
【請求項112】
1個又はそれ以上の細胞フレームを照明するステップは、励起レーザ光源で前記1個又はそれ以上の細胞フレームを照明するものとした請求項107記載の方法。
【請求項113】
細胞群における1個又はそれ以上の目標細胞に反応を誘発する細胞反応誘発方法において、
前記細胞群における細胞を照明し、
前記照明された細胞の画像を撮り込み、
前記画像を参照して1個又はそれ以上の目標細胞の位置を決定し、
前記1個又はそれ以上の目標細胞のうち少なくとも1個に反応を誘発するに十分なエネルギビームを発射し、
前記エネルギビームに含まれるエネルギ量を測定し、
前記1個又はそれ以上の目標細胞の位置に前記エネルギビームを偏向する
ことよりなることを特徴とする方法。
【請求項114】
前記エネルギビームを偏向させる前に前記エネルギビームに含まれるエネルギ量を測定する請求項113記載の方法。
【請求項115】
前記反応を、細胞壊死、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング及び内部分子脱ケージ化よりなるグループから選択したものとした請求項113記載の方法。
【請求項116】
前記反応を非致死的なものとした請求項113記載の方法。
【請求項117】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項116記載の方法。
【請求項118】
生物学的標本内の個別の形態学的又は生理学的特徴を決定する装置において、
前記生物学的標本内の細胞フレームを照明する照明源と、
前記細胞フレームの画像を撮り込む画像撮り込み装置と、
前記画像を参照して前記生物学的標本の個別細胞の位置を決定する第1制御手段と、
前記個別細胞のうちの少なくとも1個に反応を誘発するに十分なエネルギビームを発射するエネルギ源と、
前記第1個別細胞の形態学的又は生理学的特徴を変化させるに十分なエネルギビームで前記第1個別細胞を通過させる第2制御手段と、
前記第1個別細胞の形態学的又は生理学的特徴を測定する検出器と
を具えたことを特徴とする装置。
【請求項119】
前記反応を非致死的なものとした請求項118記載の装置。
【請求項120】
前記反応は、光学的削孔、感光試薬の活性化、細胞成分の非活性化、制御運動、蛍光剤の励起、フォトブリーチング、及び内部分子脱ケージ化よりなるグループから選択したものとした請求項119記載の装置。
【請求項121】
生物学的標本内における個別の細胞の形態学的又は生理学的特徴を決定する装置において、
ケージ化化合物を含む前記生物学的標本における細胞フレームを照明する照明源と、
前記細胞フレームの画像を撮り込む画像撮り込み装置と、
前記ケージ化化合物のうちの1個又はそれ以上の脱ケージ化するのに十分なエネルギビームを前記ケージ化化合物のうちの1個又はそれ以上に通過させる第1制御手段と、
前記ケージ化化合物のうちの1個又はそれ以上を脱ケージ化するに十分なビームを発射するエネルギ源と、
前記ケージ化化合物のうちの1個又はそれ以上の脱ケージ化された化合物に応答する前記形態学的又は生理学的特徴の変化の進行をモニタする第2制御手段と
を具えたことを特徴とする装置。
【請求項122】
生物学的標本における個別細胞の形態学的又は生理学的特徴を決定する装置において、
前記生物学的標本における細胞フレームを照明する照明源と、
前記細胞フレームの画像を撮り込む画像撮り込み装置と、
前記細胞フレームにおける前記個別細胞の形態学的又は生理学的特徴を決定する第1制御手段と、
を具えたことを特徴とする装置。
【請求項123】
前記形態学的又は生理学的特徴をカルシウム量とした請求項122記載の装置。
【請求項124】
前記形態学的又は生理学的特徴を細胞サイクル状態とした請求項122記載の装置。
【請求項125】
前記形態学的又は生理学的特徴を細胞有糸分裂履歴とした請求項122記載の装置。
【請求項126】
前記形態学的又は生理学的特徴を生存可能性とした請求項122記載の装置。
【請求項127】
前記形態学的又は生理学的特徴を細胞膜無欠性とした請求項122記載の装置。
【請求項128】
前記形態学的又は生理学的特徴を細胞内pHとした請求項122記載の装置。
【請求項129】
前記形態学的又は生理学的特徴を膜内外電位差とした請求項122記載の装置。
【請求項130】
前記形態学的又は生理学的特徴をグルタチオン還元段階とした請求項122記載の装置。
【請求項131】
前記形態学的又は生理学的特徴をチオール活性とした請求項122記載の装置。
【請求項132】
前記形態学的又は生理学的特徴を遺伝子発現とした請求項122記載の装置。
【請求項133】
前記形態学的又は生理学的特徴をフォトブリーチングリカバリとした請求項122記載の装置。
【請求項134】
前記形態学的又は生理学的特徴を内部分子脱ケージ化に対する反応とした請求項122記載の装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−130341(P2012−130341A)
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−4470(P2012−4470)
【出願日】平成24年1月12日(2012.1.12)
【分割の表示】特願2001−542522(P2001−542522)の分割
【原出願日】平成12年11月30日(2000.11.30)
【出願人】(512009919)インテレクソン コーポレイション (1)
【Fターム(参考)】
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願番号】特願2012−4470(P2012−4470)
【出願日】平成24年1月12日(2012.1.12)
【分割の表示】特願2001−542522(P2001−542522)の分割
【原出願日】平成12年11月30日(2000.11.30)
【出願人】(512009919)インテレクソン コーポレイション (1)
【Fターム(参考)】
[ Back to top ]

