細胞表面糖鎖の製造方法および細胞表面糖鎖試料
【課題】細胞膜表面に存在する複合糖質から糖鎖を簡便に回収、精製する方法を提供する
【解決手段】細胞表面の複合糖質より糖鎖を回収、精製する方法であって、全細胞組織を破砕処理し、糖鎖遊離酵素により複合糖質から糖鎖を分離し、一級アミノ基を有する糖鎖精製用基材と接触させて糖鎖を捕捉し、当該基材ごと回収することを特徴とする細胞表面糖鎖の製造方法。
【解決手段】細胞表面の複合糖質より糖鎖を回収、精製する方法であって、全細胞組織を破砕処理し、糖鎖遊離酵素により複合糖質から糖鎖を分離し、一級アミノ基を有する糖鎖精製用基材と接触させて糖鎖を捕捉し、当該基材ごと回収することを特徴とする細胞表面糖鎖の製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞表面に存在する複合糖質の糖鎖試料の製造方法に関する。
【背景技術】
【0002】
糖鎖を有する生体高分子としては、細胞の安定化に寄与する植物細胞の細胞壁のプロテオグリカン、細胞の分化、増殖、接着、移動等に影響を与える糖脂質、及び細胞間相互作用や細胞認識に関与している糖タンパク質等が挙げられるが、これらの高分子の糖鎖が、互いに機能を代行、補助、増幅、調節、あるいは阻害しあいながら高度で精密な生体反応を制御する機構が次第に明らかにされつつある。さらに、このような糖鎖と細胞の分化増殖、細胞接着、免疫、及び細胞の癌化との関係が明確にされれば、この糖鎖工学と、医学、細胞工学、あるいは臓器工学とを密接に関連させて新たな展開を図ることが期待できる(非特許文献1)。
【0003】
特に細胞表面に存在する糖鎖は様々な生体反応の足場として重要な役割をしている事が明らかとなってきた。例えば、レセプターとの相互作用異常による疾病の発生、あるいはエイズウイルスやインフルエンザウイルスなどの感染、病原性大腸菌O157の毒素やコレラ毒素の細胞への侵入に関わるとされている。また、種々の癌細胞では特異的な糖鎖が細胞表面に現れるなど、細胞表面糖鎖は細胞に個性をあたえる重要な分子とされている。
【0004】
これらの解析のため、糖鎖構造解析の技術が開発されており、これらの技術は、複合糖質からの糖鎖切り出し、糖鎖の分離精製、糖鎖の標識化などの工程を組み合わせたものであるが、これらの工程はきわめて煩雑である。
【0005】
例えば細胞表面の糖鎖を解析する方法として、超遠心などの大型の装置を用いて細胞表面タンパク質を分画した後、結合している糖鎖を回収、解析する方法がある。しかしながらこの方法を用いた場合必ずしも表面に存在する糖タンパク質全てを回収できているとは言えなく、また高額な装置である超遠心機を必要とする。そのため特別な装置を必要とせず、また表面糖鎖を容易に網羅的に回収できる方法が求められている。
【0006】
糖鎖の分離精製には、たとえば、イオン交換樹脂、逆相クロマトグラフィ、活性炭、ゲル濾過クロマトグラフィなどの手法が用いられるが、これらの分離手段は糖を特異的に認識する方法ではないので、莢雑物(ペプチド、タンパク質など)の混入が避けられず、また糖鎖の構造によって回収率に差異が生じることが多い。さらに、クロマトグラフィで糖鎖を高精度に分離する場合には、糖鎖にピリジルアミノ化などの蛍光標識を施す必要があり、煩雑な操作が必要となる。蛍光標識した糖鎖を分析するには、標識後の反応液中より未反応の2−アミノピリジン等の夾雑物を除き、該標識化糖鎖を精製することが必要である。
【0007】
一般には、該標識化糖鎖と夾雑物の分子量の差を利用してゲルろ過を行い、夾雑物を除去する。しかしながら、この方法は器具を多く用いる点と、操作に多くの時間を要する点から、多数の試料を短時間に処理するのは困難である。また、簡易な方法として共沸により夾雑物を留去する方法も試みられているが、十分に夾雑物を除去するのは難しい。糖鎖構造と各種疾患の関係を調べるためには、統計的処理が可能な多数の検体の糖鎖構造を調べる必要がある。この場合、従来法のように煩雑な手法を用いると
膨大なコストと時間が必要になる。そこで、簡単な作業で糖鎖を分離精製する手段が求められていた。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2008−228640号公報
【非特許文献】
【0009】
【非特許文献1】糖鎖生物学入門 化学同人 2005年11月1日発行 第1版
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、細胞膜表面に存在する複合糖質から糖鎖を簡便に回収、精製する方法を提供することを目的とする。
【課題を解決するための手段】
【0011】
このような目的は、以下の(1)〜(6)に記載の本発明により達成される。
(1)細胞表面の複合糖質より糖鎖を回収、精製する方法であって、
全細胞組織を破砕処理し、
糖鎖遊離酵素により複合糖質から糖鎖を分離し、
一級アミノ基を有する糖鎖精製用基材と接触させて糖鎖を捕捉し、
当該基材ごと回収し、
ことを特徴とする細胞表面糖鎖の製造方法。
(2)前記細胞破砕処理が、回転数7,000〜9,000rpmの回転体により細胞を破砕する(1)記載の細胞表面糖鎖の製造方法。
(3)前記糖鎖遊離酵素が、エンド型グリコシダーゼである(1)記載の細胞表面糖鎖の製造方法。
(4)前記糖鎖精製用基材の一級アミノ基が、ヒドラジド基、またはオキシルアミノ基である(1)記載の細胞表面糖鎖の製造方法。
(5)(1)〜(4)で用いる細胞が、培養細胞である細胞表面糖鎖の製造方法。
(6)(1)〜(5)の製造方法で作成された細胞表面糖鎖試料。
【発明の効果】
【0012】
本発明は、細胞膜表面に存在する複合糖質から、糖鎖を簡便に回収、精製するする方法を提供することが可能となる。
【図面の簡単な説明】
【0013】
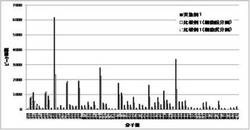
【図1】実施例1、比較例1のHeLa細胞の細胞表面糖鎖MALDI−TOF−MAS測定結果
【図2】実施例2、比較例2のHepG2細胞の細胞表面糖鎖MALDI−TOF−MAS測定結果
【図3】実施例3、比較例3のF9細胞の細胞表面糖鎖MALDI−TOF−MAS測定結果
【図4】実施例1、比較例1のHeLa細胞の細胞表面糖鎖HPLC測定結果
【図5】実施例2、比較例2のHepG2細胞の細胞表面糖鎖HPLC測定結果
【図6】実施例3、比較例3のF9細胞の細胞表面糖鎖HPLC測定結果
【発明を実施するための形態】
【0014】
以下、細胞表面糖鎖試料の製造方法の詳細について説明する。
【0015】
本発明における細胞表面の複合糖質とは、細胞の表面に存在する、糖または糖鎖を分子中に含む分子群であり、例えば、糖脂質、糖タンパク、グリコサミノグリカン等を示してい
る。
【0016】
本発明における細胞とは、生体組織由来の細胞であれば良く、好ましくはて生体外で培養された培養細胞であることが好ましい。培養細胞の場合、細胞増殖によって細胞数を確保することが可能である。また、必要に応じて細胞選別などを実施することもできる。
【0017】
細胞内に糖鎖複合体の多くは表面に存在する分子群である。そのため、本願発明では、細胞を破砕した後、各成分の分画を行うことなく、全体を用いて糖鎖の分離精製を行うことを特徴としている。
【0018】
これは、細胞内に存在するN結合型の糖鎖のほとんどが、細胞表面に存在していることから、あえて分画を行わないことで、工程と時間を短縮することにある。
さらに、膜画分のみを精製して使用する方法を採用しても、正確に細胞表面の膜分画のみを回収するすべはなく、細胞質内のオルガネラの膜分画も同時に回収することになってしまう。従って、全細胞を破砕して、各成分分画を行うことをせず用いても同じである。
【0019】
まず、本発明において使用する細胞を準備する。細胞の由来は特に限定するものではないが、細胞以外の夾雑物は十分に除去しておく必要がある。例えば、生体由来細胞であれば、細胞外マトリックスや、体液成分であり、培養細胞であれば、培養液成分である血清や、接着因子などの分子群である。
【0020】
本発明で使用する細胞は特に限定するものではなく、幹細胞、前駆細胞、成熟細胞、上皮細胞、組織細胞、および血液細胞等が対象となりうる。
【0021】
細胞の回収方法について述べる。培養細胞の場合、浮遊細胞は培養液ごと回収し、遠心分離により細胞ペレットとして回収することができる。接着細胞の場合は、培養容器から細胞をはぎ取り遠心分離処理により細胞ペレットとして回収できる。回収後の細胞は、緩衝液で2〜5回洗浄し、培養液成分を除去することが望ましい。培養液中には、血清や増殖因子など、回収した細胞に由来しない複合糖質が含まれているからである。
【0022】
洗浄に用いる緩衝液は、pH5.0〜11.0の緩衝液で、例えばリン酸緩衝液、トリス緩衝液、HEPES緩衝液を好適に用いることができる。
【0023】
本発明の細胞の破砕処理について述べる。
細胞の破砕処理は、回転物に細胞を接触させ、その剪断力により細胞をすりつぶすことにより細胞膜を破壊する。この方法についは、市販の細胞破砕装置を用いることで簡単に操作することができる。
また、細胞に超音波振動を与え、細胞膜を破壊し、細胞膜中に存在する糖ペプチドや糖脂質を分離することも可能であり、市販の超音波発生装置を用いることが好ましいが、特に限定するものではない。
【0024】
前記の破砕処理により細胞表面に存在する複合糖質が分離した状態で回収できる。この複合糖質から糖鎖を分離するためには、糖鎖遊離酵素を処方することにより達成できる。
【0025】
(糖鎖切り出し)
次に、得られた複合糖質において、タンパク質及び又は脂質に結合している糖鎖を切り出す働きを有する酵素を含有する溶液と接触させる。
本発明に用いる酵素は、エンド型グリコシダーゼであることが好ましい。エンド型グリコシダーゼとしては、ペプチド:N-グリカナーゼ、エンド-β-N-アセチルグルコサミニダーゼ、エンド-β-マンノシダーゼ、エンド-α-N-アセチルガラクトサミニダーゼ、エン
ド-β-キシロシダーゼ、エンド-β-ガラクトシダーゼ、エンド-β-グルクロニダーゼ、精巣性ヒアルロニダーゼ、エンド-β-N-アセチルヘキソサミニダーゼ、エンドグリコセラ
ミダーゼ等が挙げられる。
【0026】
糖鎖遊離酵素は、各酵素に適したバッファ、例えば50mMリン酸バッファ(pH7.5)に溶解し、細胞全体が浸る溶液量に調整するのが良い。また、酵素溶液の濃度は1 Unit/mL以上であることが望ましく、10 Unit/mL以上であるのがより望ましい。反応温度は酵
素が最も効率よく働く37℃が良い。反応時間は1時間以上16時間以内であるのが好ま
しく、5時間以上16時間以内であることがより好ましく、さらには10時間以上16時間
以内であることが好ましい。
【0027】
(糖鎖精製用基材)
当該糖鎖精製基材は、糖鎖を捕捉するための反応性の一級アミノ基をその表面に有する基材であり、該一級アミノとしてオキシルアミノ基またはヒドラジド基を有することが望ましい。これは、酵素やカップリング試薬などの非存在下においても糖鎖還元末端であるアルデヒド基と反応し結合可能であるから好適である。
【0028】
前記糖鎖精製用基材は、下記一般式〔1〕で表される構造が好ましい。
【化1】

(R1,R2は−O−,−S−,−NH−,−CO−,−CONH−が挿入されてもよい炭素数1〜20の炭化水素鎖,R3,R4,R5はH,CH3,または炭素数2〜5の炭化水素鎖を示す。m,nはモノマーユニット数を示す。)
【0029】
また、前記基材は、水溶液や有機溶媒に不溶性の基材であることがのぞましく、材質は特に限定するものではないが、ガラスや耐有機溶剤性に優れた樹脂、例えばシリコン、ポリスチレン、エチレン−無水マレイン酸共重合物、ポリメタクリル酸メチル等を選ぶことができる。
【0030】
前記基材は、下記一般式〔2〕の構造を有する架橋ポリマー構造を有するポリマーマトリックスで構成される粒子であることが好ましい。
【化2】

【0031】
前記糖鎖精製用基材の形態は、特に限定するものではないが、粒子またはプレート状の形態であることが好ましい。糖鎖ライブラリーを作製するためには、同時に多数の試料を処理する可能性があり、その際には、カラムに粒子を充填したものを使用する事で連続的な処理が可能である。また、マルチウェルプレートであれば同時に多検体を処理することが可能である。マルチウェルプレートとしては、6、12、24,48、96,384ウェルなどのマルチウェルプレートを適宜使用することが出来る。
【0032】
式〔2〕の基材以外では、粒子として無機物質を用いることができる。該基材としては、粒子状のものを用いることができ、例えばシリカ粒子、アルミナ粒子、ガラス粒子、金属粒子などが挙げられる。また、有機高分子物質としては、アガロース、セファロースに代表される多糖類ゲル、ビニル化合物の重合体であるポリマーを粒子状にしたものを使用することが出来る。
また、粒子としたときの形状は球であることが好ましく、平均粒径0.1μm以上500μm以下の粒子である。この場合の平均粒径は光学顕微鏡視野において観察される各粒子の直径を計測することにより求めたものである。このような範囲の粒径を有する基材の粒子は、遠心分離、 フィルターなどによる回収が容易であり、かつ、充分な表面積を有し
ているために糖鎖との反応効率も高いと考えられる。粒径が上記の範囲よりも大幅に大きい場合、表面積が小さくなるために糖鎖との反応効率が低くなることがある。また、粒径が上記の範囲よりも大幅に小さい場合、特にフィルターによる粒子の回収が難しくなることがある。さらに、粒子をカラムに充填して用いる場合、粒径が過小であると通液の際の圧力損失が大きくなってしまうことがある。
【0033】
(糖鎖捕捉)
前記糖鎖精製基材で末端還元糖鎖と一級アミノ基の結合反応の条件の一具体例は、pHが2〜7、反応温度が50〜100℃、好ましくは60〜90℃、より好ましくは70〜85℃、反応時間が15〜120分である。最も好ましい条件はpH3〜6、反応温度が80℃、反応時間が1時間である。
pHが3未満、または7を越える場合は、中間体であるイミン体の生成が遅くなるため、
捕捉効率が落ちる。反応温度は、50℃未満の場合、反応効率が著しく悪化する場合があり、糖鎖を十分に捕捉することができない。反応は、開放系で行って溶媒を完全に蒸発させることが好ましい。これは、溶媒が蒸発するにつれで溶液濃度が無限濃縮されることにより十分な反応をおこさせることが目的である。
また、90℃を超える場合は、糖鎖自身に悪影響を及ぼすと共に、基材がプラスチックの場合は種類によって変形、溶融を発生することがある。
反応時間が30分より短い場合は十分な結合反応が得られない場合があり、糖鎖を十分に捕捉することが出来ない。また90分を超えた反応は、更なる糖鎖の捕捉は見られず時間をかけただけの効果がない。
【0034】
(夾雑物の除去)
糖鎖を捕捉した状態の糖鎖精製基材は、夾雑物を取り除くために洗浄する必要がある。
ここで、洗浄液に用いられる溶液としては、メタノール、エタノールなどのアルコール類;水および水性緩衝液などが使用される。ここで、洗浄に水溶液が用いられる場合、この水溶液のpHは中性付近であることが好ましく、そのpHは4〜10、より好ましくは6〜8である。
前期糖鎖捕捉した基材は、洗浄により、精製原料中の糖鎖以外の夾雑物を簡単に除去することが可能で、糖鎖のみを基材ごと回収することができる。
洗浄方法としては、粒子の場合は、洗浄液に浸漬し、洗浄液の交換を繰り返すことで洗浄することができる。
【0035】
例えば、遠心チューブ内に粒子を入れ、洗浄液を加え、粒子を自然沈降、または、遠心分離により強制的に沈降させた後、上清を除去する操作を繰り返すことで洗浄することができる。前記洗浄操作は3〜6回行うことが好ましい。
プレートの場合は、各ウェル内に洗浄液を分注、吸引除去を繰り返すことで簡便に洗浄することができる。また、必要に応じてプレートを遠心可能な遠心分離機を用いても良い。
【0036】
また、チューブ状の容器であって、底面部に、液体透過可能で該粒子が不透過な孔径を有するフィルターを装着するフィルターチューブを用いることも可能である。該フィルターチューブに粒子を入れて使用することで、洗浄に要した洗浄液を、フィルターを介して除去することが可能となり、前記の遠心操作後の上清除去の工程が必要なくなり、作業性の向上を図ることができる。
また、6〜384穴のマルチウェルプレートの底部が前記フィルターを装着したものが各種市販されており、これらのプレートを用いることでハイスループット化することが可能である。特に96穴マルチウェルプレートは、溶液分注機器、吸引除去システム、およびプレートの搬送システム等が開発されており、ハイスループット化に最適である。
【0037】
本発明において、糖鎖を検出する祭に、更に糖鎖に結合した基材又は化合物(以下基材、化合物Aと称す)を別の化合物(以下化合物Bと称す)に置換する工程を有することが好ましい。置換する工程は、基材または化合物Aに対して置換化合物である化合物Bを過剰量加えることでなすことが好ましい。
【0038】
置換化合物である化合物Bは、アルデヒド基と特異的に反応する官能基を有している化合物であることが好ましく、アルデヒド基と特異的に反応する官能基以外に結合に関与する反応基を有していても良い。結合に関与する反応基としては、ビオチン、アミノ基、カルボキシル基、エステル基、チオール基、マレイミド基、共役ジエン、アルケン、アルキン、アジド基等が挙げられる。
【0039】
置換する工程において、過剰に加える化合物Bの量は、基材又は化合物Aが有する糖鎖と特異的に反応する官能基量に対して、好ましくは1.5倍量以上、より好ましくは3倍量
以上、さらに好ましくは5倍量以上であり、最も好ましくは10倍量以上である。置換す
るための反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。pH調整のためには、各種緩衝液を用いることができる。反応系の温度は,好ましくは4〜90℃,より好ましくは4〜70℃、さらに好ましくは30〜80℃であり,最も好ましくは40〜80℃である。
【0040】
化合物Bが、UV吸収性又は蛍光特性を持つ化合物で場合、糖鎖が標識化され、糖鎖の検出が容易となる。UV吸収又は蛍光特性を持つ化合物としては、芳香族化合物又は複素芳香族化合物であることが好ましい。
遊離糖鎖の検出には、質量分析機器、高速液体クロマトグラフィ等が使用できる。
【0041】
<一連の作業の流れの説明>
培養細胞の場合は、まず培養液を除去した後、細胞を洗浄液で2〜3回洗浄し、培養液の残滓を除去する。洗浄液は一般的には、緩衝液を用いる。
次に、細胞をセルスクレーパーで掻きだし細胞を回収する。通常は、トリプシン等の酵素処理により細胞を培養器からはがすが、本発明においても、トリプシン処理による細胞回収方法が好適に用いられる。
回収した細胞は、遠心管に入れ遠心操作により、細胞ペレットとして回収する。
前記細胞ペレットに、界面活性剤入りの緩衝液を加え、超音波発生装置にかけ、細胞を溶解させる。
通常はここで、密度勾配超遠心操作による、細胞オルガネラの分画操作があるが、本発明ではそれをせず、そのまま次のステップに進むことができる。
【0042】
細胞オルガネラ、膜成分、複合糖質のカクテルになっている溶液中に、糖鎖脱離酵素であるN−グルカナーゼを加え、反応させる。この操作により、複合糖質より糖鎖が末端アルデヒド化した状態で分離する。次に、第1級アミノ基を有する基材を加えることで、アルデヒド基との反応を促し、基材で糖鎖を補足することが可能となる。
次に基材を遠心操作などで回収、洗浄することで、糖鎖と基材のみを回収できる。
【0043】
このステップは、基材ごと回収した糖鎖を基材から遊離させると同時に標識する方法と、糖鎖を基材から遊離させた後に、標識する2つの方法がある。
【0044】
遊離操作の基本は、基材ごと回収した糖鎖を酸性溶媒中、加熱反応を行うことで糖鎖を基材から切り出すことができる。
具体的な方法を以下に示す。
【0045】
反応を行う溶媒は、酸と水が反応に必要であることから、酸と水と有機溶媒の混合溶媒が好ましい。酸と水と有機溶媒の混合溶媒の場合、水の含有率は好ましくは0.1%〜90%、より好ましくは0.1%〜80%、さらに好ましくは0.1%〜50%である。水の代わりに水性緩衝液を含有しても良い。混合前の緩衝液の濃度は好ましくは0.1mM〜1M、より好ましくは0.1mM〜500mM、さらに好ましくは1mM〜100mMである。反応溶液のpHは好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。使用する酸は例えば、酢酸、ギ酸、トリフルオロ酢酸、塩酸、クエン酸、リン酸、硫酸が好ましく、より好ましくは酢酸、ギ酸、トリフルオロ酢酸、リン酸、さらに好ましくは酢酸、トリフルオロ酢酸である。
【0046】
反応温度に関しては4〜90℃が好ましく、好ましくは25〜90℃で、さらに好ましくは50〜90℃である。反応時間は、5分間〜24時間、好ましくは10分間〜8時間、より好ましくは15分間〜120分間である。反応は、開放系で行って溶媒を完全に蒸発させることが好ましい。これは、溶媒が蒸発するにつれで溶液濃度が無限濃縮されること
により十分な反応をおこさせることが目的である。
【0047】
pH2の酸性から中性付近で、糖鎖切り出し反応を行うことができるため、従来の強酸
性処理、たとえば10%トリフルオロ酢酸処理による切出しのような強酸の存在下での切出し反応に比べて、シアル酸残基の脱離など糖鎖の加水分解などを引き起こすことを抑制することができるようになる。
【0048】
また、基材ごと回収した糖鎖を遊離させ、さらに、高速液体クロマトグラフィなどの方法で分画・分析をする場合には、糖鎖を蛍光標識する必要がある。糖鎖の遊離ならびに蛍光標識について以下に記載する。また、MALDI−TOF MSやESI−MSによる検出感度を向上させるために、糖鎖を化合物で標識する必要がある。
【0049】
この化合物で標識する方法としては、基材ごと回収した糖鎖を基材から遊離させた後に標識する方法と、糖鎖を基材から遊離させると同時に標識する、2つの方法がある。
【0050】
糖鎖を糖鎖捕捉基材から切り出して後に標識する方法としては、アミノ基を有する標識化合物を作用させて、還元アミノ化反応により糖鎖を前記標識化合物に結合させることができる。
【0051】
この方法は、連続的に行うことができるため、糖鎖の回収、精製から検出までの自動化が可能となる。
【0052】
まず、糖鎖捕捉基材から切り出す操作を行う。遊離操作の基本は、前記のように基材ごと回収した糖鎖を酸性溶媒中、加熱反応を行うことで糖鎖を基材から切り出すことである。用いる試薬や反応条件は前記の通りである。
【0053】
続いて、回収した糖鎖を、溶液中でアミノ基を含む還元アミノ化反応により標識化合部と結合させる。
【0054】
前記のアミノ基を含む化合物は、具体的には蛍光物質またはUV吸収基を有する化合物が、下記のアミノ基を含む物質からなる群から選ぶことが、好ましい。
8-Aminopyrene-1,3,6-trisulfonate, 8-Aminonaphthalene-1,3,6-trisulphonate, 7-Amino-1,3-naphtalenedisulfonic acid, 2-Amino9(10H)-acridone,5-Aminofluorescein,Dansylethylenediamie, 2-Aminopyridine, 7-Amino-4-methylcoumarine, 2-Aminobenzamide, 2-Aminobenzoic acid, 3-Aminobenzoic acid, 7-Amino-1-naphthol, 3-(Acethylamino)-6-aminoacridine, 2-Amino-6-cyanoethylpyridine,Ethyl p-aminobenzoate, p-Aminobenzonitrile, 及び7-aminonaphothalene-1,3-disulfonic acid
【0055】
(還元アミノ化反応による標識方法)
具体的には、2-Aminobenzamideによる標識の場合、基材から糖鎖を遊離後、反応容器に0.35 M 2-Aminobenzamid, 1 M sodium cyanoborohydride, 30% 酢酸水溶液を加え、60℃で数時間反応する事で達成される。
【0056】
一方、糖鎖を糖鎖捕捉基材から切り出すと同時に標識する方法としては、ヒドラジド基、またはアミノオキシ基を有する標識化合物を作用させて、ヒドラゾン−ヒドラゾンあるいはヒドラゾン−オキシム交換反応により糖鎖を固相基材から切り離しすると同時に前記標識化合物に結合させることで可能である。
【0057】
この方法は、連続的に行うことができるため、糖鎖の回収、精製から検出までの自動化が可能となる。
【0058】
ヒドラジド基を含む標識化合物の作製方法としては、上記糖鎖を遊離する工程において、ヒドラジド基を含有しており、蛍光物質またはUV吸収基を有する化合物を接触させ糖鎖を遊離させると同時に蛍光物質またはUV吸収物質で糖鎖を標識する方法がある。反応の溶媒、反応温度、時間の詳細は前記の通りであるが、アルデヒド基を含む化合物、例えば糖鎖に対して10等量以上の化合物を添加することで達成できる。
【0059】
前記ヒドラジド基を含む物質、具体的には蛍光物質またはUV吸収基を有する化合物が、下記のヒドラジド基を含む物質である群から選ぶことができる。
5-Dimethylaminonaphthalene-1-sulfonyl hydrazine (Dansylhydrazine); 2-hydrazinopyridine;9-fluorenylmethyl carbazate (Fmoc hydrazine);benzylhydrazine;4,4-difluoro-5,7-dimethyl-4-bora-3a,4a-diaza-s-indacene-3-propionoc acid, hydrazide;2-(6,8-difluoro-7-hydroxy-4-methylcoumarin)acetohydrazide;7-diethylaminocoumarin-3-carboxylic acid, hydrazide (DCCH);phenylhydrazine;1-Naphthaleneacethydrazide;2-hydrazinobenzoic acid;biotin hydrazide;phenylacetic hydrazide.
【0060】
アミノオキシ基を含む標識化合物としては、アミノオキシ基含有の蛍光物質またはUV吸収基を有する化合物を接触させ糖鎖を遊離させると同時に蛍光物質またはUV吸収基を有する化合物で糖鎖を標識する方法である。反応の溶媒、反応温度、時間の詳細は前記の通りであるが、アミノ基を含む化合物、例えば糖鎖に対して10等量以上の化合物を添加することで達成できる。
【0061】
上記アミノオキシ化合物が下記の化合物から選ばれる事が望ましい。
O-benzylhydroxylamine;O-phenylhydroxylamine; O-(2,3,4,5,6-pentafluorobenzyl)hydroxylamine; O-(4-nitrobenzyl)hydroxylamine; 2-aminooxypyridine; 2-aminooxymethylpyridine; 4-[(aminooxyacetyl)amino]benzoic acid methyl ester; 4-[(aminooxyacetyl)amino]benzoic acid ethyl ester; 4-[(aminooxyacetyl)amino]benzoic acid n-butyl ester.
【0062】
前記アミノオキシ基を有する化合物がアルギニン残基、トリプトファン残基、フェニルアラニン残基、チロシン残基、システイン残基およびこれら誘導体の少なくとも一つからなる部分を含む化合物であることが好ましく、下記(式3)で表される構造を有した化合物であることが好ましい。
【化3】

【0063】
また、この化合物Aとしては、前記化合物の他、2−アミノベンズアミドや2−アミノピリジンといったアミノ化合物を用いることができる。
なお、化合物Aとして、このようなアミノ化合物を用いた場合、以下のようにして糖鎖はラベル化される。
【0064】
すなわち、まず、純水と酢酸/アセトニトリル溶液を加えて加熱乾固させることで、捕捉された糖鎖を糖鎖捕捉基材から切り離して一旦遊離させる。その後、化合物含有液25を添加して、遊離した糖鎖と化合物Aとを反応させることで、糖鎖が化合物Aによりラベル化される。
【0065】
このラベル化の反応系のpHは、好ましくは2〜10、より好ましくは2〜9であり、さらに好ましくは3〜8である。
ラベル化時の温度は、好ましくは4〜100℃程度、より好ましくは20〜95℃程度、さらに好ましくは30〜90℃程度の温度範囲に保たれるように設定する。
また、反応時間は、かかる温度範囲に設定した場合、通常、0.1〜20時間程度、好ましくは、0.6〜12時間程度に設定される。
【0066】
かかる条件で、ラベル化を行うことで、糖鎖が確実に化合物Aによりラベル化される。
なお、化合物Aとしてアミノ化合物を用いた場合、化合物含有液25の乾燥を省略するようにしてもよい。
なお、本工程において、糖鎖のラベル化が必要ない場合には、糖鎖の化合物Aによる置換を省略することができる。
【0067】
(糖鎖試料保存方法)
前記の方法により得られた標識された糖鎖は溶液状態で試料として回収される。この溶液状の糖鎖試料は、目的に応じて、すぐに使用してもよいし、必要時まで保存しておいてよい。保存方法は、そのまま市販の蓋付きチューブなど、密閉容器に移し冷凍保存することが好ましい。さらに好ましくは凍結乾燥させてから冷凍保存する方法である。冷凍保存の温度は、−20℃以下が好ましく、より好ましくは−80℃以下である。
【実施例】
【0068】
以下、本発明を実施例に基づいて詳細に説明するが、本発明はこれに限定されるものではない。
【0069】
(実施例1)
HeLa細胞を、最小必須培地(MEM)に10%ウシ血清を加えた培地を入れた75cm2の培養フラスコ(住友ベークライト株式会社製)に5.0X103cells/cm2で播種し、5%CO2インキュベート内で6日間、37℃で培養した。培地を除去しPBS(−)5mLで2回洗浄後、PBS(−)5mLを加えスクレーパーで細胞をはがして15mL遠沈管に回収した。170G、5分で遠心をかけ上清を除去し、PBS(−)1mLに再懸濁させて1.5mLマイクロチューブに移し、再度170G、5分で遠心をかけ上清を除去してペレットを得た。このペレットに0.5vol%のTriton X−100(和光純薬工業株式会社、582−83991)水溶液25μLを加えて小型ホモジナイザー(ペレットペッスル、アズワン株式会社、2−4782−04)を用いて細胞を破砕し、ホモジナイザーに付着した溶液を超純水25μLで洗い流し全量を回収して5
0μLの細胞破砕液を調製した。
【0070】
(実施例2)
HepG2細胞を、ダルベッコ改変イーグル培地(DMEM、Low glucose)に10%ウシ胎児血清を加えた培地を入れた75cm2の培養フラスコ(住友ベークライト株式会社製)に2.0X104cells/cm2で播種し、5%CO2インキュベート内で6日間、37℃で培養した。細胞破砕溶液は実施例1と同様に調製した。
【0071】
(実施例3)
F9細胞を、ダルベッコ改変イーグル培地(DMEM、High glucose)に10%ウシ胎児血清を加えた培地を入れた、フィブロネクチンコート済みの75cm2培養フラスコ(住友ベークライト株式会社製)に3.3X104cells/cm2で播種し、5%CO2インキュベート内で4日間、37℃で培養した。細胞破砕溶液は実施例1と同様に調製した。
【0072】
(比較例1)
HeLa細胞を、MEMに10%ウシ血清を加えた培地を入れた75cm2の培養フラスコ(住友ベークライト株式会社製)に5.0X103cells/cm2で播種し、5%CO2インキュベート内で6日間、37℃で培養した。培地を除去しPBS(−)5mLで2回洗浄後、PBS(−)5mLを加えスクレーパーで細胞をはがして15mL遠沈管に回収した。4℃、1000G、5分で遠心をかけ上清を除去してペレットを得た。膜タンパク回収キット(ProteoExtract(R) Transmembrane Protein Extraction Kit (TM-PEK)、MERCK社製)を用いてこのペレットを氷上でプロトコル通りに処理し、細胞膜分画と細胞質分画を得た。
【0073】
(比較例2)
HepG2細胞を、ダルベッコ改変イーグル培地(DMEM、Low glucose)に10%ウシ胎児血清を加えた培地を入れた75cm2の培養フラスコ(住友ベークライト株式会社製)に2.0X104cells/cm2で播種し、5%CO2インキュベート内で6日間、37℃で培養した。細胞膜分画と細胞質分画は比較例1と同様に調製した。
【0074】
(比較例3)
F9細胞を、DMEM(High glucose)に10%ウシ胎児血清を加えた培地を入れた、フィブロネクチンコート済みの75cm2培養フラスコ(住友ベークライト株式会社製)に3.3×X103cells/cm2で播種し、5%CO2インキュベート内で4日間、37℃で培養した。細胞膜分画と細胞質分画は比較例1と同様に調製した。
【0075】
(評価)
糖鎖の切り出し
得られた細胞破砕溶液、細胞膜分画及び細胞質分画のタンパク濃度を測定し、必要に応じて限外ろ過などによる濃縮を行った。各溶液50μLに1M重炭酸アンモニウム(和光純薬工業株式会社、017−02875)水溶液5μLと120mMジチオスレイトール(シグマ社製、D9779)水溶液5μLを加え60℃で30分静置、123mMヨードアセトアミド(和光純薬工業株式会社、093−02152)水溶液10μL加え遮光下室温で1時間静置、トリプシン(シグマ社製、T−0303)を1mM塩酸に溶解させて40unit/μLに調製した溶液10μLを加え37℃、2時間静置を順に行った。その後、90℃、5分加熱してトリプシンを失活させて37℃以下に戻した後、PNGase F(ロシュアプライドサイエンス社製)を5unit加えて37℃で14時間静置した。
【0076】
糖鎖の精製(回収及び標識化)
糖鎖捕捉用の基材であるヒドラジド基を有するビーズ5mg(BlotGlyco(R))
、住友ベークライト株式会社製、BS−45603、式2の構造を有し、モノマー仕込み比がm:n=20:1のポリマー)が入ったディスポカラムに糖鎖切り出し処理後の溶液20μLおよび180μLの2%酢酸/アセトニトリル溶液を加え、80℃で1時間反応させた。反応は開放系で行い、溶媒が完全に蒸発しビーズが乾固した状態であることを目視で確認した。グアニジン溶液、水、1%トリエチルアミン溶液にてビーズを洗浄後、10%無水酢酸/メタノールを添加し、室温で30分間反応させ、未反応のヒドラジド基をキャ
ッピングした。
【0077】
このビーズを半分に分け、MALDI−TOF−MS用標識化を行うために半分のビーズを10mM塩酸水溶液、メタノール、DMSOにて洗浄した。500mMの1−メチル−3−p−トリルトリアゼン(MTT)(東京化成工業株式会社、M0641)/DMSO
を100μL加え、60℃で1時間反応させシアル酸残基のカルボン酸をメチルエステル化した。反応後、メタノール、水にてビーズを洗浄した。再遊離試薬溶液(BlotGl
ycoキット付属品、20mMに調製、化学構造は式3)20μLおよび2%酢酸/アセ
トニトリル溶液180μLを加え、80℃で1時間反応させた。反応は開放系で行い、溶
媒が完全に蒸発しビーズが乾固した状態であることを目視で確認した。
ビーズの入ったディスポカラムに超純水50μLを加えて糖鎖溶液50μLを回収し、アセトニトリルで20倍に希釈した後、シリカカラム (BlotGlycoキット付属品)
に添加してシリカゲルに標識糖鎖を吸着させた。アセトニトリルにてカラムを洗浄後、超純水50μLを加えて溶出し、標識糖鎖を回収した。
【0078】
また、HPLC用標識化を行うために残り半分のビーズをメタノール、水にて洗浄した。超純水20μLおよび2%酢酸/アセトニトリル溶液180μLを加え、70■Cで1.5時間反応させた。反応は開放系で行い、溶媒が完全に蒸発しビーズが乾固した状態であることを目視で確認した。
ビーズの入ったディスポカラムに、2−aminobenzamide(2−AB、和光純薬工業株式会社、574−92441)およびシアノ水素化ホウ素ナトリウム(シグマ社製、156159)の終濃度がそれぞれ0.35M、1Mになるように30%酢酸/DMSO混合溶媒に溶解させて調整した溶液50μLを添加し、60℃で2時間反応させた。
反応溶液50μLを回収し、アセトニトリルで20倍に希釈した後、シリカカラム (Bl
otGlycoキット付属品)に添加してシリカゲルに標識糖鎖を吸着させた。アセトニ
トリルおよびアセトニトリル/水混合溶媒(95:5)にてカラムを洗浄後、超純水50μLにて標識糖鎖を回収した。
【0079】
糖鎖の測定(MALDI−TOF−MS)
得られた糖鎖の分子量を、2,5-ジヒドロキシ安息香酸をマトリックスに用いてMALDI−TOF−MS(Autoflex III TOF/TOF、Bruker Daltonics)で測定した。縦軸にピーク面積、横軸に分子量をとってグラフ化した。
糖鎖の測定(HPLC)
得られた糖鎖を逆相HPLC(Nexera UHPLCシステム、株式会社島津製作所製)にて分析した。逆相HPLCの条件を表1に示す。
【表1】

【0080】
なお、表1のA液及びB液は、それぞれ移動相を構成する液体であり、これらA液とB液とを混合して移動相の極性を調整するようになっている。また、表1において、「B:a%(T1分)→B:b%(T2分)」という記載は、B溶液の濃度を、(T2−T1)分間で、a%からb%まで変化させたことを意味する。ただし、T1,T2,a,bはそれぞれ実数を表わす。また、表1において%は体積を基準とした百分率を表わす。
【産業上の利用可能性】
【0081】
本発明は、細胞膜表面に存在する複合糖質から、糖鎖を簡便に回収、精製するする方法を提供することが可能となる。
【技術分野】
【0001】
本発明は、細胞表面に存在する複合糖質の糖鎖試料の製造方法に関する。
【背景技術】
【0002】
糖鎖を有する生体高分子としては、細胞の安定化に寄与する植物細胞の細胞壁のプロテオグリカン、細胞の分化、増殖、接着、移動等に影響を与える糖脂質、及び細胞間相互作用や細胞認識に関与している糖タンパク質等が挙げられるが、これらの高分子の糖鎖が、互いに機能を代行、補助、増幅、調節、あるいは阻害しあいながら高度で精密な生体反応を制御する機構が次第に明らかにされつつある。さらに、このような糖鎖と細胞の分化増殖、細胞接着、免疫、及び細胞の癌化との関係が明確にされれば、この糖鎖工学と、医学、細胞工学、あるいは臓器工学とを密接に関連させて新たな展開を図ることが期待できる(非特許文献1)。
【0003】
特に細胞表面に存在する糖鎖は様々な生体反応の足場として重要な役割をしている事が明らかとなってきた。例えば、レセプターとの相互作用異常による疾病の発生、あるいはエイズウイルスやインフルエンザウイルスなどの感染、病原性大腸菌O157の毒素やコレラ毒素の細胞への侵入に関わるとされている。また、種々の癌細胞では特異的な糖鎖が細胞表面に現れるなど、細胞表面糖鎖は細胞に個性をあたえる重要な分子とされている。
【0004】
これらの解析のため、糖鎖構造解析の技術が開発されており、これらの技術は、複合糖質からの糖鎖切り出し、糖鎖の分離精製、糖鎖の標識化などの工程を組み合わせたものであるが、これらの工程はきわめて煩雑である。
【0005】
例えば細胞表面の糖鎖を解析する方法として、超遠心などの大型の装置を用いて細胞表面タンパク質を分画した後、結合している糖鎖を回収、解析する方法がある。しかしながらこの方法を用いた場合必ずしも表面に存在する糖タンパク質全てを回収できているとは言えなく、また高額な装置である超遠心機を必要とする。そのため特別な装置を必要とせず、また表面糖鎖を容易に網羅的に回収できる方法が求められている。
【0006】
糖鎖の分離精製には、たとえば、イオン交換樹脂、逆相クロマトグラフィ、活性炭、ゲル濾過クロマトグラフィなどの手法が用いられるが、これらの分離手段は糖を特異的に認識する方法ではないので、莢雑物(ペプチド、タンパク質など)の混入が避けられず、また糖鎖の構造によって回収率に差異が生じることが多い。さらに、クロマトグラフィで糖鎖を高精度に分離する場合には、糖鎖にピリジルアミノ化などの蛍光標識を施す必要があり、煩雑な操作が必要となる。蛍光標識した糖鎖を分析するには、標識後の反応液中より未反応の2−アミノピリジン等の夾雑物を除き、該標識化糖鎖を精製することが必要である。
【0007】
一般には、該標識化糖鎖と夾雑物の分子量の差を利用してゲルろ過を行い、夾雑物を除去する。しかしながら、この方法は器具を多く用いる点と、操作に多くの時間を要する点から、多数の試料を短時間に処理するのは困難である。また、簡易な方法として共沸により夾雑物を留去する方法も試みられているが、十分に夾雑物を除去するのは難しい。糖鎖構造と各種疾患の関係を調べるためには、統計的処理が可能な多数の検体の糖鎖構造を調べる必要がある。この場合、従来法のように煩雑な手法を用いると
膨大なコストと時間が必要になる。そこで、簡単な作業で糖鎖を分離精製する手段が求められていた。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2008−228640号公報
【非特許文献】
【0009】
【非特許文献1】糖鎖生物学入門 化学同人 2005年11月1日発行 第1版
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、細胞膜表面に存在する複合糖質から糖鎖を簡便に回収、精製する方法を提供することを目的とする。
【課題を解決するための手段】
【0011】
このような目的は、以下の(1)〜(6)に記載の本発明により達成される。
(1)細胞表面の複合糖質より糖鎖を回収、精製する方法であって、
全細胞組織を破砕処理し、
糖鎖遊離酵素により複合糖質から糖鎖を分離し、
一級アミノ基を有する糖鎖精製用基材と接触させて糖鎖を捕捉し、
当該基材ごと回収し、
ことを特徴とする細胞表面糖鎖の製造方法。
(2)前記細胞破砕処理が、回転数7,000〜9,000rpmの回転体により細胞を破砕する(1)記載の細胞表面糖鎖の製造方法。
(3)前記糖鎖遊離酵素が、エンド型グリコシダーゼである(1)記載の細胞表面糖鎖の製造方法。
(4)前記糖鎖精製用基材の一級アミノ基が、ヒドラジド基、またはオキシルアミノ基である(1)記載の細胞表面糖鎖の製造方法。
(5)(1)〜(4)で用いる細胞が、培養細胞である細胞表面糖鎖の製造方法。
(6)(1)〜(5)の製造方法で作成された細胞表面糖鎖試料。
【発明の効果】
【0012】
本発明は、細胞膜表面に存在する複合糖質から、糖鎖を簡便に回収、精製するする方法を提供することが可能となる。
【図面の簡単な説明】
【0013】
【図1】実施例1、比較例1のHeLa細胞の細胞表面糖鎖MALDI−TOF−MAS測定結果
【図2】実施例2、比較例2のHepG2細胞の細胞表面糖鎖MALDI−TOF−MAS測定結果
【図3】実施例3、比較例3のF9細胞の細胞表面糖鎖MALDI−TOF−MAS測定結果
【図4】実施例1、比較例1のHeLa細胞の細胞表面糖鎖HPLC測定結果
【図5】実施例2、比較例2のHepG2細胞の細胞表面糖鎖HPLC測定結果
【図6】実施例3、比較例3のF9細胞の細胞表面糖鎖HPLC測定結果
【発明を実施するための形態】
【0014】
以下、細胞表面糖鎖試料の製造方法の詳細について説明する。
【0015】
本発明における細胞表面の複合糖質とは、細胞の表面に存在する、糖または糖鎖を分子中に含む分子群であり、例えば、糖脂質、糖タンパク、グリコサミノグリカン等を示してい
る。
【0016】
本発明における細胞とは、生体組織由来の細胞であれば良く、好ましくはて生体外で培養された培養細胞であることが好ましい。培養細胞の場合、細胞増殖によって細胞数を確保することが可能である。また、必要に応じて細胞選別などを実施することもできる。
【0017】
細胞内に糖鎖複合体の多くは表面に存在する分子群である。そのため、本願発明では、細胞を破砕した後、各成分の分画を行うことなく、全体を用いて糖鎖の分離精製を行うことを特徴としている。
【0018】
これは、細胞内に存在するN結合型の糖鎖のほとんどが、細胞表面に存在していることから、あえて分画を行わないことで、工程と時間を短縮することにある。
さらに、膜画分のみを精製して使用する方法を採用しても、正確に細胞表面の膜分画のみを回収するすべはなく、細胞質内のオルガネラの膜分画も同時に回収することになってしまう。従って、全細胞を破砕して、各成分分画を行うことをせず用いても同じである。
【0019】
まず、本発明において使用する細胞を準備する。細胞の由来は特に限定するものではないが、細胞以外の夾雑物は十分に除去しておく必要がある。例えば、生体由来細胞であれば、細胞外マトリックスや、体液成分であり、培養細胞であれば、培養液成分である血清や、接着因子などの分子群である。
【0020】
本発明で使用する細胞は特に限定するものではなく、幹細胞、前駆細胞、成熟細胞、上皮細胞、組織細胞、および血液細胞等が対象となりうる。
【0021】
細胞の回収方法について述べる。培養細胞の場合、浮遊細胞は培養液ごと回収し、遠心分離により細胞ペレットとして回収することができる。接着細胞の場合は、培養容器から細胞をはぎ取り遠心分離処理により細胞ペレットとして回収できる。回収後の細胞は、緩衝液で2〜5回洗浄し、培養液成分を除去することが望ましい。培養液中には、血清や増殖因子など、回収した細胞に由来しない複合糖質が含まれているからである。
【0022】
洗浄に用いる緩衝液は、pH5.0〜11.0の緩衝液で、例えばリン酸緩衝液、トリス緩衝液、HEPES緩衝液を好適に用いることができる。
【0023】
本発明の細胞の破砕処理について述べる。
細胞の破砕処理は、回転物に細胞を接触させ、その剪断力により細胞をすりつぶすことにより細胞膜を破壊する。この方法についは、市販の細胞破砕装置を用いることで簡単に操作することができる。
また、細胞に超音波振動を与え、細胞膜を破壊し、細胞膜中に存在する糖ペプチドや糖脂質を分離することも可能であり、市販の超音波発生装置を用いることが好ましいが、特に限定するものではない。
【0024】
前記の破砕処理により細胞表面に存在する複合糖質が分離した状態で回収できる。この複合糖質から糖鎖を分離するためには、糖鎖遊離酵素を処方することにより達成できる。
【0025】
(糖鎖切り出し)
次に、得られた複合糖質において、タンパク質及び又は脂質に結合している糖鎖を切り出す働きを有する酵素を含有する溶液と接触させる。
本発明に用いる酵素は、エンド型グリコシダーゼであることが好ましい。エンド型グリコシダーゼとしては、ペプチド:N-グリカナーゼ、エンド-β-N-アセチルグルコサミニダーゼ、エンド-β-マンノシダーゼ、エンド-α-N-アセチルガラクトサミニダーゼ、エン
ド-β-キシロシダーゼ、エンド-β-ガラクトシダーゼ、エンド-β-グルクロニダーゼ、精巣性ヒアルロニダーゼ、エンド-β-N-アセチルヘキソサミニダーゼ、エンドグリコセラ
ミダーゼ等が挙げられる。
【0026】
糖鎖遊離酵素は、各酵素に適したバッファ、例えば50mMリン酸バッファ(pH7.5)に溶解し、細胞全体が浸る溶液量に調整するのが良い。また、酵素溶液の濃度は1 Unit/mL以上であることが望ましく、10 Unit/mL以上であるのがより望ましい。反応温度は酵
素が最も効率よく働く37℃が良い。反応時間は1時間以上16時間以内であるのが好ま
しく、5時間以上16時間以内であることがより好ましく、さらには10時間以上16時間
以内であることが好ましい。
【0027】
(糖鎖精製用基材)
当該糖鎖精製基材は、糖鎖を捕捉するための反応性の一級アミノ基をその表面に有する基材であり、該一級アミノとしてオキシルアミノ基またはヒドラジド基を有することが望ましい。これは、酵素やカップリング試薬などの非存在下においても糖鎖還元末端であるアルデヒド基と反応し結合可能であるから好適である。
【0028】
前記糖鎖精製用基材は、下記一般式〔1〕で表される構造が好ましい。
【化1】

(R1,R2は−O−,−S−,−NH−,−CO−,−CONH−が挿入されてもよい炭素数1〜20の炭化水素鎖,R3,R4,R5はH,CH3,または炭素数2〜5の炭化水素鎖を示す。m,nはモノマーユニット数を示す。)
【0029】
また、前記基材は、水溶液や有機溶媒に不溶性の基材であることがのぞましく、材質は特に限定するものではないが、ガラスや耐有機溶剤性に優れた樹脂、例えばシリコン、ポリスチレン、エチレン−無水マレイン酸共重合物、ポリメタクリル酸メチル等を選ぶことができる。
【0030】
前記基材は、下記一般式〔2〕の構造を有する架橋ポリマー構造を有するポリマーマトリックスで構成される粒子であることが好ましい。
【化2】

【0031】
前記糖鎖精製用基材の形態は、特に限定するものではないが、粒子またはプレート状の形態であることが好ましい。糖鎖ライブラリーを作製するためには、同時に多数の試料を処理する可能性があり、その際には、カラムに粒子を充填したものを使用する事で連続的な処理が可能である。また、マルチウェルプレートであれば同時に多検体を処理することが可能である。マルチウェルプレートとしては、6、12、24,48、96,384ウェルなどのマルチウェルプレートを適宜使用することが出来る。
【0032】
式〔2〕の基材以外では、粒子として無機物質を用いることができる。該基材としては、粒子状のものを用いることができ、例えばシリカ粒子、アルミナ粒子、ガラス粒子、金属粒子などが挙げられる。また、有機高分子物質としては、アガロース、セファロースに代表される多糖類ゲル、ビニル化合物の重合体であるポリマーを粒子状にしたものを使用することが出来る。
また、粒子としたときの形状は球であることが好ましく、平均粒径0.1μm以上500μm以下の粒子である。この場合の平均粒径は光学顕微鏡視野において観察される各粒子の直径を計測することにより求めたものである。このような範囲の粒径を有する基材の粒子は、遠心分離、 フィルターなどによる回収が容易であり、かつ、充分な表面積を有し
ているために糖鎖との反応効率も高いと考えられる。粒径が上記の範囲よりも大幅に大きい場合、表面積が小さくなるために糖鎖との反応効率が低くなることがある。また、粒径が上記の範囲よりも大幅に小さい場合、特にフィルターによる粒子の回収が難しくなることがある。さらに、粒子をカラムに充填して用いる場合、粒径が過小であると通液の際の圧力損失が大きくなってしまうことがある。
【0033】
(糖鎖捕捉)
前記糖鎖精製基材で末端還元糖鎖と一級アミノ基の結合反応の条件の一具体例は、pHが2〜7、反応温度が50〜100℃、好ましくは60〜90℃、より好ましくは70〜85℃、反応時間が15〜120分である。最も好ましい条件はpH3〜6、反応温度が80℃、反応時間が1時間である。
pHが3未満、または7を越える場合は、中間体であるイミン体の生成が遅くなるため、
捕捉効率が落ちる。反応温度は、50℃未満の場合、反応効率が著しく悪化する場合があり、糖鎖を十分に捕捉することができない。反応は、開放系で行って溶媒を完全に蒸発させることが好ましい。これは、溶媒が蒸発するにつれで溶液濃度が無限濃縮されることにより十分な反応をおこさせることが目的である。
また、90℃を超える場合は、糖鎖自身に悪影響を及ぼすと共に、基材がプラスチックの場合は種類によって変形、溶融を発生することがある。
反応時間が30分より短い場合は十分な結合反応が得られない場合があり、糖鎖を十分に捕捉することが出来ない。また90分を超えた反応は、更なる糖鎖の捕捉は見られず時間をかけただけの効果がない。
【0034】
(夾雑物の除去)
糖鎖を捕捉した状態の糖鎖精製基材は、夾雑物を取り除くために洗浄する必要がある。
ここで、洗浄液に用いられる溶液としては、メタノール、エタノールなどのアルコール類;水および水性緩衝液などが使用される。ここで、洗浄に水溶液が用いられる場合、この水溶液のpHは中性付近であることが好ましく、そのpHは4〜10、より好ましくは6〜8である。
前期糖鎖捕捉した基材は、洗浄により、精製原料中の糖鎖以外の夾雑物を簡単に除去することが可能で、糖鎖のみを基材ごと回収することができる。
洗浄方法としては、粒子の場合は、洗浄液に浸漬し、洗浄液の交換を繰り返すことで洗浄することができる。
【0035】
例えば、遠心チューブ内に粒子を入れ、洗浄液を加え、粒子を自然沈降、または、遠心分離により強制的に沈降させた後、上清を除去する操作を繰り返すことで洗浄することができる。前記洗浄操作は3〜6回行うことが好ましい。
プレートの場合は、各ウェル内に洗浄液を分注、吸引除去を繰り返すことで簡便に洗浄することができる。また、必要に応じてプレートを遠心可能な遠心分離機を用いても良い。
【0036】
また、チューブ状の容器であって、底面部に、液体透過可能で該粒子が不透過な孔径を有するフィルターを装着するフィルターチューブを用いることも可能である。該フィルターチューブに粒子を入れて使用することで、洗浄に要した洗浄液を、フィルターを介して除去することが可能となり、前記の遠心操作後の上清除去の工程が必要なくなり、作業性の向上を図ることができる。
また、6〜384穴のマルチウェルプレートの底部が前記フィルターを装着したものが各種市販されており、これらのプレートを用いることでハイスループット化することが可能である。特に96穴マルチウェルプレートは、溶液分注機器、吸引除去システム、およびプレートの搬送システム等が開発されており、ハイスループット化に最適である。
【0037】
本発明において、糖鎖を検出する祭に、更に糖鎖に結合した基材又は化合物(以下基材、化合物Aと称す)を別の化合物(以下化合物Bと称す)に置換する工程を有することが好ましい。置換する工程は、基材または化合物Aに対して置換化合物である化合物Bを過剰量加えることでなすことが好ましい。
【0038】
置換化合物である化合物Bは、アルデヒド基と特異的に反応する官能基を有している化合物であることが好ましく、アルデヒド基と特異的に反応する官能基以外に結合に関与する反応基を有していても良い。結合に関与する反応基としては、ビオチン、アミノ基、カルボキシル基、エステル基、チオール基、マレイミド基、共役ジエン、アルケン、アルキン、アジド基等が挙げられる。
【0039】
置換する工程において、過剰に加える化合物Bの量は、基材又は化合物Aが有する糖鎖と特異的に反応する官能基量に対して、好ましくは1.5倍量以上、より好ましくは3倍量
以上、さらに好ましくは5倍量以上であり、最も好ましくは10倍量以上である。置換す
るための反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。pH調整のためには、各種緩衝液を用いることができる。反応系の温度は,好ましくは4〜90℃,より好ましくは4〜70℃、さらに好ましくは30〜80℃であり,最も好ましくは40〜80℃である。
【0040】
化合物Bが、UV吸収性又は蛍光特性を持つ化合物で場合、糖鎖が標識化され、糖鎖の検出が容易となる。UV吸収又は蛍光特性を持つ化合物としては、芳香族化合物又は複素芳香族化合物であることが好ましい。
遊離糖鎖の検出には、質量分析機器、高速液体クロマトグラフィ等が使用できる。
【0041】
<一連の作業の流れの説明>
培養細胞の場合は、まず培養液を除去した後、細胞を洗浄液で2〜3回洗浄し、培養液の残滓を除去する。洗浄液は一般的には、緩衝液を用いる。
次に、細胞をセルスクレーパーで掻きだし細胞を回収する。通常は、トリプシン等の酵素処理により細胞を培養器からはがすが、本発明においても、トリプシン処理による細胞回収方法が好適に用いられる。
回収した細胞は、遠心管に入れ遠心操作により、細胞ペレットとして回収する。
前記細胞ペレットに、界面活性剤入りの緩衝液を加え、超音波発生装置にかけ、細胞を溶解させる。
通常はここで、密度勾配超遠心操作による、細胞オルガネラの分画操作があるが、本発明ではそれをせず、そのまま次のステップに進むことができる。
【0042】
細胞オルガネラ、膜成分、複合糖質のカクテルになっている溶液中に、糖鎖脱離酵素であるN−グルカナーゼを加え、反応させる。この操作により、複合糖質より糖鎖が末端アルデヒド化した状態で分離する。次に、第1級アミノ基を有する基材を加えることで、アルデヒド基との反応を促し、基材で糖鎖を補足することが可能となる。
次に基材を遠心操作などで回収、洗浄することで、糖鎖と基材のみを回収できる。
【0043】
このステップは、基材ごと回収した糖鎖を基材から遊離させると同時に標識する方法と、糖鎖を基材から遊離させた後に、標識する2つの方法がある。
【0044】
遊離操作の基本は、基材ごと回収した糖鎖を酸性溶媒中、加熱反応を行うことで糖鎖を基材から切り出すことができる。
具体的な方法を以下に示す。
【0045】
反応を行う溶媒は、酸と水が反応に必要であることから、酸と水と有機溶媒の混合溶媒が好ましい。酸と水と有機溶媒の混合溶媒の場合、水の含有率は好ましくは0.1%〜90%、より好ましくは0.1%〜80%、さらに好ましくは0.1%〜50%である。水の代わりに水性緩衝液を含有しても良い。混合前の緩衝液の濃度は好ましくは0.1mM〜1M、より好ましくは0.1mM〜500mM、さらに好ましくは1mM〜100mMである。反応溶液のpHは好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。使用する酸は例えば、酢酸、ギ酸、トリフルオロ酢酸、塩酸、クエン酸、リン酸、硫酸が好ましく、より好ましくは酢酸、ギ酸、トリフルオロ酢酸、リン酸、さらに好ましくは酢酸、トリフルオロ酢酸である。
【0046】
反応温度に関しては4〜90℃が好ましく、好ましくは25〜90℃で、さらに好ましくは50〜90℃である。反応時間は、5分間〜24時間、好ましくは10分間〜8時間、より好ましくは15分間〜120分間である。反応は、開放系で行って溶媒を完全に蒸発させることが好ましい。これは、溶媒が蒸発するにつれで溶液濃度が無限濃縮されること
により十分な反応をおこさせることが目的である。
【0047】
pH2の酸性から中性付近で、糖鎖切り出し反応を行うことができるため、従来の強酸
性処理、たとえば10%トリフルオロ酢酸処理による切出しのような強酸の存在下での切出し反応に比べて、シアル酸残基の脱離など糖鎖の加水分解などを引き起こすことを抑制することができるようになる。
【0048】
また、基材ごと回収した糖鎖を遊離させ、さらに、高速液体クロマトグラフィなどの方法で分画・分析をする場合には、糖鎖を蛍光標識する必要がある。糖鎖の遊離ならびに蛍光標識について以下に記載する。また、MALDI−TOF MSやESI−MSによる検出感度を向上させるために、糖鎖を化合物で標識する必要がある。
【0049】
この化合物で標識する方法としては、基材ごと回収した糖鎖を基材から遊離させた後に標識する方法と、糖鎖を基材から遊離させると同時に標識する、2つの方法がある。
【0050】
糖鎖を糖鎖捕捉基材から切り出して後に標識する方法としては、アミノ基を有する標識化合物を作用させて、還元アミノ化反応により糖鎖を前記標識化合物に結合させることができる。
【0051】
この方法は、連続的に行うことができるため、糖鎖の回収、精製から検出までの自動化が可能となる。
【0052】
まず、糖鎖捕捉基材から切り出す操作を行う。遊離操作の基本は、前記のように基材ごと回収した糖鎖を酸性溶媒中、加熱反応を行うことで糖鎖を基材から切り出すことである。用いる試薬や反応条件は前記の通りである。
【0053】
続いて、回収した糖鎖を、溶液中でアミノ基を含む還元アミノ化反応により標識化合部と結合させる。
【0054】
前記のアミノ基を含む化合物は、具体的には蛍光物質またはUV吸収基を有する化合物が、下記のアミノ基を含む物質からなる群から選ぶことが、好ましい。
8-Aminopyrene-1,3,6-trisulfonate, 8-Aminonaphthalene-1,3,6-trisulphonate, 7-Amino-1,3-naphtalenedisulfonic acid, 2-Amino9(10H)-acridone,5-Aminofluorescein,Dansylethylenediamie, 2-Aminopyridine, 7-Amino-4-methylcoumarine, 2-Aminobenzamide, 2-Aminobenzoic acid, 3-Aminobenzoic acid, 7-Amino-1-naphthol, 3-(Acethylamino)-6-aminoacridine, 2-Amino-6-cyanoethylpyridine,Ethyl p-aminobenzoate, p-Aminobenzonitrile, 及び7-aminonaphothalene-1,3-disulfonic acid
【0055】
(還元アミノ化反応による標識方法)
具体的には、2-Aminobenzamideによる標識の場合、基材から糖鎖を遊離後、反応容器に0.35 M 2-Aminobenzamid, 1 M sodium cyanoborohydride, 30% 酢酸水溶液を加え、60℃で数時間反応する事で達成される。
【0056】
一方、糖鎖を糖鎖捕捉基材から切り出すと同時に標識する方法としては、ヒドラジド基、またはアミノオキシ基を有する標識化合物を作用させて、ヒドラゾン−ヒドラゾンあるいはヒドラゾン−オキシム交換反応により糖鎖を固相基材から切り離しすると同時に前記標識化合物に結合させることで可能である。
【0057】
この方法は、連続的に行うことができるため、糖鎖の回収、精製から検出までの自動化が可能となる。
【0058】
ヒドラジド基を含む標識化合物の作製方法としては、上記糖鎖を遊離する工程において、ヒドラジド基を含有しており、蛍光物質またはUV吸収基を有する化合物を接触させ糖鎖を遊離させると同時に蛍光物質またはUV吸収物質で糖鎖を標識する方法がある。反応の溶媒、反応温度、時間の詳細は前記の通りであるが、アルデヒド基を含む化合物、例えば糖鎖に対して10等量以上の化合物を添加することで達成できる。
【0059】
前記ヒドラジド基を含む物質、具体的には蛍光物質またはUV吸収基を有する化合物が、下記のヒドラジド基を含む物質である群から選ぶことができる。
5-Dimethylaminonaphthalene-1-sulfonyl hydrazine (Dansylhydrazine); 2-hydrazinopyridine;9-fluorenylmethyl carbazate (Fmoc hydrazine);benzylhydrazine;4,4-difluoro-5,7-dimethyl-4-bora-3a,4a-diaza-s-indacene-3-propionoc acid, hydrazide;2-(6,8-difluoro-7-hydroxy-4-methylcoumarin)acetohydrazide;7-diethylaminocoumarin-3-carboxylic acid, hydrazide (DCCH);phenylhydrazine;1-Naphthaleneacethydrazide;2-hydrazinobenzoic acid;biotin hydrazide;phenylacetic hydrazide.
【0060】
アミノオキシ基を含む標識化合物としては、アミノオキシ基含有の蛍光物質またはUV吸収基を有する化合物を接触させ糖鎖を遊離させると同時に蛍光物質またはUV吸収基を有する化合物で糖鎖を標識する方法である。反応の溶媒、反応温度、時間の詳細は前記の通りであるが、アミノ基を含む化合物、例えば糖鎖に対して10等量以上の化合物を添加することで達成できる。
【0061】
上記アミノオキシ化合物が下記の化合物から選ばれる事が望ましい。
O-benzylhydroxylamine;O-phenylhydroxylamine; O-(2,3,4,5,6-pentafluorobenzyl)hydroxylamine; O-(4-nitrobenzyl)hydroxylamine; 2-aminooxypyridine; 2-aminooxymethylpyridine; 4-[(aminooxyacetyl)amino]benzoic acid methyl ester; 4-[(aminooxyacetyl)amino]benzoic acid ethyl ester; 4-[(aminooxyacetyl)amino]benzoic acid n-butyl ester.
【0062】
前記アミノオキシ基を有する化合物がアルギニン残基、トリプトファン残基、フェニルアラニン残基、チロシン残基、システイン残基およびこれら誘導体の少なくとも一つからなる部分を含む化合物であることが好ましく、下記(式3)で表される構造を有した化合物であることが好ましい。
【化3】

【0063】
また、この化合物Aとしては、前記化合物の他、2−アミノベンズアミドや2−アミノピリジンといったアミノ化合物を用いることができる。
なお、化合物Aとして、このようなアミノ化合物を用いた場合、以下のようにして糖鎖はラベル化される。
【0064】
すなわち、まず、純水と酢酸/アセトニトリル溶液を加えて加熱乾固させることで、捕捉された糖鎖を糖鎖捕捉基材から切り離して一旦遊離させる。その後、化合物含有液25を添加して、遊離した糖鎖と化合物Aとを反応させることで、糖鎖が化合物Aによりラベル化される。
【0065】
このラベル化の反応系のpHは、好ましくは2〜10、より好ましくは2〜9であり、さらに好ましくは3〜8である。
ラベル化時の温度は、好ましくは4〜100℃程度、より好ましくは20〜95℃程度、さらに好ましくは30〜90℃程度の温度範囲に保たれるように設定する。
また、反応時間は、かかる温度範囲に設定した場合、通常、0.1〜20時間程度、好ましくは、0.6〜12時間程度に設定される。
【0066】
かかる条件で、ラベル化を行うことで、糖鎖が確実に化合物Aによりラベル化される。
なお、化合物Aとしてアミノ化合物を用いた場合、化合物含有液25の乾燥を省略するようにしてもよい。
なお、本工程において、糖鎖のラベル化が必要ない場合には、糖鎖の化合物Aによる置換を省略することができる。
【0067】
(糖鎖試料保存方法)
前記の方法により得られた標識された糖鎖は溶液状態で試料として回収される。この溶液状の糖鎖試料は、目的に応じて、すぐに使用してもよいし、必要時まで保存しておいてよい。保存方法は、そのまま市販の蓋付きチューブなど、密閉容器に移し冷凍保存することが好ましい。さらに好ましくは凍結乾燥させてから冷凍保存する方法である。冷凍保存の温度は、−20℃以下が好ましく、より好ましくは−80℃以下である。
【実施例】
【0068】
以下、本発明を実施例に基づいて詳細に説明するが、本発明はこれに限定されるものではない。
【0069】
(実施例1)
HeLa細胞を、最小必須培地(MEM)に10%ウシ血清を加えた培地を入れた75cm2の培養フラスコ(住友ベークライト株式会社製)に5.0X103cells/cm2で播種し、5%CO2インキュベート内で6日間、37℃で培養した。培地を除去しPBS(−)5mLで2回洗浄後、PBS(−)5mLを加えスクレーパーで細胞をはがして15mL遠沈管に回収した。170G、5分で遠心をかけ上清を除去し、PBS(−)1mLに再懸濁させて1.5mLマイクロチューブに移し、再度170G、5分で遠心をかけ上清を除去してペレットを得た。このペレットに0.5vol%のTriton X−100(和光純薬工業株式会社、582−83991)水溶液25μLを加えて小型ホモジナイザー(ペレットペッスル、アズワン株式会社、2−4782−04)を用いて細胞を破砕し、ホモジナイザーに付着した溶液を超純水25μLで洗い流し全量を回収して5
0μLの細胞破砕液を調製した。
【0070】
(実施例2)
HepG2細胞を、ダルベッコ改変イーグル培地(DMEM、Low glucose)に10%ウシ胎児血清を加えた培地を入れた75cm2の培養フラスコ(住友ベークライト株式会社製)に2.0X104cells/cm2で播種し、5%CO2インキュベート内で6日間、37℃で培養した。細胞破砕溶液は実施例1と同様に調製した。
【0071】
(実施例3)
F9細胞を、ダルベッコ改変イーグル培地(DMEM、High glucose)に10%ウシ胎児血清を加えた培地を入れた、フィブロネクチンコート済みの75cm2培養フラスコ(住友ベークライト株式会社製)に3.3X104cells/cm2で播種し、5%CO2インキュベート内で4日間、37℃で培養した。細胞破砕溶液は実施例1と同様に調製した。
【0072】
(比較例1)
HeLa細胞を、MEMに10%ウシ血清を加えた培地を入れた75cm2の培養フラスコ(住友ベークライト株式会社製)に5.0X103cells/cm2で播種し、5%CO2インキュベート内で6日間、37℃で培養した。培地を除去しPBS(−)5mLで2回洗浄後、PBS(−)5mLを加えスクレーパーで細胞をはがして15mL遠沈管に回収した。4℃、1000G、5分で遠心をかけ上清を除去してペレットを得た。膜タンパク回収キット(ProteoExtract(R) Transmembrane Protein Extraction Kit (TM-PEK)、MERCK社製)を用いてこのペレットを氷上でプロトコル通りに処理し、細胞膜分画と細胞質分画を得た。
【0073】
(比較例2)
HepG2細胞を、ダルベッコ改変イーグル培地(DMEM、Low glucose)に10%ウシ胎児血清を加えた培地を入れた75cm2の培養フラスコ(住友ベークライト株式会社製)に2.0X104cells/cm2で播種し、5%CO2インキュベート内で6日間、37℃で培養した。細胞膜分画と細胞質分画は比較例1と同様に調製した。
【0074】
(比較例3)
F9細胞を、DMEM(High glucose)に10%ウシ胎児血清を加えた培地を入れた、フィブロネクチンコート済みの75cm2培養フラスコ(住友ベークライト株式会社製)に3.3×X103cells/cm2で播種し、5%CO2インキュベート内で4日間、37℃で培養した。細胞膜分画と細胞質分画は比較例1と同様に調製した。
【0075】
(評価)
糖鎖の切り出し
得られた細胞破砕溶液、細胞膜分画及び細胞質分画のタンパク濃度を測定し、必要に応じて限外ろ過などによる濃縮を行った。各溶液50μLに1M重炭酸アンモニウム(和光純薬工業株式会社、017−02875)水溶液5μLと120mMジチオスレイトール(シグマ社製、D9779)水溶液5μLを加え60℃で30分静置、123mMヨードアセトアミド(和光純薬工業株式会社、093−02152)水溶液10μL加え遮光下室温で1時間静置、トリプシン(シグマ社製、T−0303)を1mM塩酸に溶解させて40unit/μLに調製した溶液10μLを加え37℃、2時間静置を順に行った。その後、90℃、5分加熱してトリプシンを失活させて37℃以下に戻した後、PNGase F(ロシュアプライドサイエンス社製)を5unit加えて37℃で14時間静置した。
【0076】
糖鎖の精製(回収及び標識化)
糖鎖捕捉用の基材であるヒドラジド基を有するビーズ5mg(BlotGlyco(R))
、住友ベークライト株式会社製、BS−45603、式2の構造を有し、モノマー仕込み比がm:n=20:1のポリマー)が入ったディスポカラムに糖鎖切り出し処理後の溶液20μLおよび180μLの2%酢酸/アセトニトリル溶液を加え、80℃で1時間反応させた。反応は開放系で行い、溶媒が完全に蒸発しビーズが乾固した状態であることを目視で確認した。グアニジン溶液、水、1%トリエチルアミン溶液にてビーズを洗浄後、10%無水酢酸/メタノールを添加し、室温で30分間反応させ、未反応のヒドラジド基をキャ
ッピングした。
【0077】
このビーズを半分に分け、MALDI−TOF−MS用標識化を行うために半分のビーズを10mM塩酸水溶液、メタノール、DMSOにて洗浄した。500mMの1−メチル−3−p−トリルトリアゼン(MTT)(東京化成工業株式会社、M0641)/DMSO
を100μL加え、60℃で1時間反応させシアル酸残基のカルボン酸をメチルエステル化した。反応後、メタノール、水にてビーズを洗浄した。再遊離試薬溶液(BlotGl
ycoキット付属品、20mMに調製、化学構造は式3)20μLおよび2%酢酸/アセ
トニトリル溶液180μLを加え、80℃で1時間反応させた。反応は開放系で行い、溶
媒が完全に蒸発しビーズが乾固した状態であることを目視で確認した。
ビーズの入ったディスポカラムに超純水50μLを加えて糖鎖溶液50μLを回収し、アセトニトリルで20倍に希釈した後、シリカカラム (BlotGlycoキット付属品)
に添加してシリカゲルに標識糖鎖を吸着させた。アセトニトリルにてカラムを洗浄後、超純水50μLを加えて溶出し、標識糖鎖を回収した。
【0078】
また、HPLC用標識化を行うために残り半分のビーズをメタノール、水にて洗浄した。超純水20μLおよび2%酢酸/アセトニトリル溶液180μLを加え、70■Cで1.5時間反応させた。反応は開放系で行い、溶媒が完全に蒸発しビーズが乾固した状態であることを目視で確認した。
ビーズの入ったディスポカラムに、2−aminobenzamide(2−AB、和光純薬工業株式会社、574−92441)およびシアノ水素化ホウ素ナトリウム(シグマ社製、156159)の終濃度がそれぞれ0.35M、1Mになるように30%酢酸/DMSO混合溶媒に溶解させて調整した溶液50μLを添加し、60℃で2時間反応させた。
反応溶液50μLを回収し、アセトニトリルで20倍に希釈した後、シリカカラム (Bl
otGlycoキット付属品)に添加してシリカゲルに標識糖鎖を吸着させた。アセトニ
トリルおよびアセトニトリル/水混合溶媒(95:5)にてカラムを洗浄後、超純水50μLにて標識糖鎖を回収した。
【0079】
糖鎖の測定(MALDI−TOF−MS)
得られた糖鎖の分子量を、2,5-ジヒドロキシ安息香酸をマトリックスに用いてMALDI−TOF−MS(Autoflex III TOF/TOF、Bruker Daltonics)で測定した。縦軸にピーク面積、横軸に分子量をとってグラフ化した。
糖鎖の測定(HPLC)
得られた糖鎖を逆相HPLC(Nexera UHPLCシステム、株式会社島津製作所製)にて分析した。逆相HPLCの条件を表1に示す。
【表1】

【0080】
なお、表1のA液及びB液は、それぞれ移動相を構成する液体であり、これらA液とB液とを混合して移動相の極性を調整するようになっている。また、表1において、「B:a%(T1分)→B:b%(T2分)」という記載は、B溶液の濃度を、(T2−T1)分間で、a%からb%まで変化させたことを意味する。ただし、T1,T2,a,bはそれぞれ実数を表わす。また、表1において%は体積を基準とした百分率を表わす。
【産業上の利用可能性】
【0081】
本発明は、細胞膜表面に存在する複合糖質から、糖鎖を簡便に回収、精製するする方法を提供することが可能となる。
【特許請求の範囲】
【請求項1】
細胞表面の複合糖質より糖鎖を回収、精製する方法であって、
全細胞組織を破砕処理し、
糖鎖遊離酵素により複合糖質から糖鎖を分離し、
一級アミノ基を有する糖鎖精製用基材と接触させて糖鎖を捕捉し、
当該基材ごと回収する
ことを特徴とする細胞表面糖鎖の製造方法。
【請求項2】
前記細胞破砕処理が、回転数7,000〜9,000rpmの回転体により細胞を破砕する請求項1記載の細胞表面糖鎖の製造方法。
【請求項3】
前記糖鎖遊離酵素が、エンド型グリコシダーゼである請求項1記載の細胞表面糖鎖の製造方法。
【請求項4】
前記糖鎖精製用基材の一級アミノ基が、ヒドラジド基、またはオキシルアミノ基である請求項1記載の細胞表面糖鎖の製造方法。
【請求項5】
前記請求項1〜4で用いる細胞が、培養細胞である細胞表面糖鎖の製造方法。
【請求項6】
前記請求項1〜5の製造方法で作成された細胞表面糖鎖試料。
【請求項1】
細胞表面の複合糖質より糖鎖を回収、精製する方法であって、
全細胞組織を破砕処理し、
糖鎖遊離酵素により複合糖質から糖鎖を分離し、
一級アミノ基を有する糖鎖精製用基材と接触させて糖鎖を捕捉し、
当該基材ごと回収する
ことを特徴とする細胞表面糖鎖の製造方法。
【請求項2】
前記細胞破砕処理が、回転数7,000〜9,000rpmの回転体により細胞を破砕する請求項1記載の細胞表面糖鎖の製造方法。
【請求項3】
前記糖鎖遊離酵素が、エンド型グリコシダーゼである請求項1記載の細胞表面糖鎖の製造方法。
【請求項4】
前記糖鎖精製用基材の一級アミノ基が、ヒドラジド基、またはオキシルアミノ基である請求項1記載の細胞表面糖鎖の製造方法。
【請求項5】
前記請求項1〜4で用いる細胞が、培養細胞である細胞表面糖鎖の製造方法。
【請求項6】
前記請求項1〜5の製造方法で作成された細胞表面糖鎖試料。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−70682(P2013−70682A)
【公開日】平成25年4月22日(2013.4.22)
【国際特許分類】
【出願番号】特願2011−213610(P2011−213610)
【出願日】平成23年9月29日(2011.9.29)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
【公開日】平成25年4月22日(2013.4.22)
【国際特許分類】
【出願日】平成23年9月29日(2011.9.29)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
[ Back to top ]

