細胞解析装置及び細胞解析方法
【課題】極めて容易にしかも高精度でがんの悪性度解析を行う。
【解決手段】単離・細胞核染色された細胞を計測して、蛍光強度のヒストグラムを得るフローサイトメータ6と、前記ヒストグラムのデータから、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数を求め、この強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する判定手段を有するコンピュータ7とを具備する。
細胞核染色された細胞を計測する計測部と、
前記計測部の結果を用いて蛍光強度のヒストグラムを表示する表示部と、
前記ヒストグラムのデータから、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数を求め、この強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する判定手段と
を具備することを特徴とする
【解決手段】単離・細胞核染色された細胞を計測して、蛍光強度のヒストグラムを得るフローサイトメータ6と、前記ヒストグラムのデータから、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数を求め、この強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する判定手段を有するコンピュータ7とを具備する。
細胞核染色された細胞を計測する計測部と、
前記計測部の結果を用いて蛍光強度のヒストグラムを表示する表示部と、
前記ヒストグラムのデータから、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数を求め、この強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する判定手段と
を具備することを特徴とする
【発明の詳細な説明】
【技術分野】
【0001】
この発明は、細胞解析装置及び細胞解析方法に関するものである。
【背景技術】
【0002】
従来、病理標本作成の後に細胞検査士や病理医によって組織切片による病理診断が行われている。
【0003】
標本作成や細胞検査士や病理医による診断のためには熟練した技術が必要であり、更に、技術の差により診断結果に違いが生じる虞もある。また、組織摘出から診断を行うまでには、組織固定・切片作成・染色といった手技が必要であり、細胞検査士等を一定時間拘束する。このため、診断までの手技を自動化することが求められている。
【0004】
更に、手術中に摘出した組織が腫瘍か正常組織か判別することも腫瘍の部位や術式によって必要であり、細胞診断や凍結切片による迅速診断が行われているが、通常の病理診断と比較して、より高度な技術・診断精度が要求される。
【0005】
また、病理医にとっては術中一定時間拘束される摘出した固形組織のがん細胞迅速診断を、自動でより客観的に行う装置があれば、非常に有用であると考えられる。更に、腫瘍断端の組織の解析を行うことは、迅速病理診断では一断面でしか診断できなかったものが、組織中の細胞全体を解析出来ることにつながり、このような装置の開発及び提供が望まれている。
【0006】
そこで、従来においては、フローサイトメトリー法を用いて、フローセルを流れる測定試料から蛍光を検出して、測定対象細胞の大きさを反映した値と、測定対象細胞の核の大きさを反映した値とに基づいて測定対象細胞の異常を判定するようにした細胞分析装置が知られている(特許文献1参照)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2009−103687号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は上記のような病理診断の分野における現状に鑑みてなされたもので、その目的は、フローサイトメータによる測定結果を応用して、極めて容易にしかも高精度でがんの悪性度解析を行うことが可能な細胞解析装置及び細胞解析方法を提供することである。
【課題を解決するための手段】
【0009】
本発明に係る細胞解析装置は、細胞核染色された細胞を計測する計測部と、前記計測部の結果を用いて蛍光強度のヒストグラムを表示する表示部と、前記ヒストグラムのデータから、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数を求め、この強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する判定手段とを具備することを特徴とする。
【0010】
本発明に係る細胞解析装置では、判定手段は、強領域細胞数とヒストグラムより求めた細胞数との比に基づき判定を行うことを特徴とする。
【0011】
本発明に係る細胞解析装置では、前記ヒストグラムのデータから、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数を求め、前記判定手段を弱領域細胞数により補正することを特徴とする。
【0012】
本発明に係る細胞解析装置では、前記ヒストグラムのデータから、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数を求め、弱領域細胞数と強領域細胞数との比に基づき判定を行うことを特徴とする。
【0013】
本発明に係る細胞解析方法は、単離・細胞核染色された細胞を計測して、蛍光強度のヒストグラムを得るステップと、前記ヒストグラムのデータから、正常細胞のピークを検出するステップと、前記ピークよりも蛍光強度の強い領域に分布する強領域細胞数を求めるステップと、求めた強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する判定するステップとを具備することを特徴とする。
【0014】
本発明に係る細胞解析方法では、全細胞数と強領域細胞数との比に基づき判定を行うことを特徴とする。
【0015】
本発明に係る細胞解析方法では、前記ヒストグラムのデータから、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数を求め、弱領域細胞数と強領域細胞数との比に基づき判定を行うことを特徴とする。
【発明の効果】
【0016】
本発明によれば、蛍光強度のヒストグラムのデータから、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数を求め、この強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定するので、フローサイトメータにより得られた結果を用いて容易に、がんの悪性度を解析可能である。
【図面の簡単な説明】
【0017】
【図1】本発明に係る方法により解析を行う診断システムの概略構成図。
【図2】本発明に係る装置による解析の全段階に用いる細胞単離機器を示す側面図。
【図3】本発明に係る装置による解析の全段階に用いる細胞単離機器の要部断面図。
【図4】本発明に係る装置による解析の全段階に用いる細胞単離機器を示す組立斜視図。
【図5】本発明に係る装置による解析の全段階に用いる細胞単離機器の組織取り込みの過程を示す斜視図。
【図6】本発明に係る装置による解析の全段階に用いる細胞単離機器を用いた細胞浮遊液生成過程を示す工程図。
【図7】フローサイトメータによる蛍光強度のヒストグラムの一例を示す図。
【図8】本発明に係る細胞解析装置の実施形態による動作を説明するためのフローチャート。
【図9】本発明に係る細胞解析装置の実施形態において用いたスレッショルドを示す図。
【図10】病理診断によるがん悪性度解析結果をプロットした図。
【図11】図9について、平均値と標準偏差を求めて示した図。
【図12】図10についてスレッショルドの境界線と共に示した図。
【図13】病理診断の結果と、本発明に係る細胞解析装置の実施形態による解析結果の対比を示す図。
【発明を実施するための形態】
【0018】
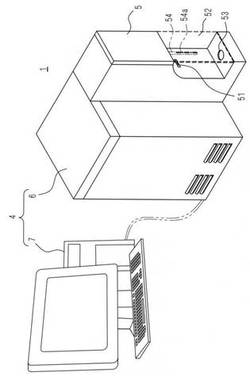
以下添付図面を参照して、本発明に係るがんの細胞解析装置及びその方法の実施例を説明する。各図において、同一の構成要素には同一の符号を付して重複する説明を省略する。細胞単離機器2と本発明の細胞解析装置の実施形態に係るがん悪性度解析装置4を用いて構成される診断システム1を図1に示す。悪性度解析装置4はフローサイトメータ6とコンピュータ7により構成される。言うまでもなく、それぞれ別の装置とせずにフローサイトメータ6にコンピュータ7の機能を持たせてもよい。図2に示すように、細胞単離機器2は、試薬を入れるための容器20に挿入された状態で自動細胞前処理装置5にセットされる。
【0019】
図3に示すように、細胞単離機器2は、透明あるいは半透明であって試薬と反応しない樹脂性の筒体21と底蓋部31を備える。筒体21は、上側部に厚肉帯部22を有し、厚肉帯部22における外径は、試薬が入れられる試験管などの容器20の内径とほぼ同一であり、容器20の口部内壁に接触した状態で挿入される。
【0020】
図3、図4に示すように、筒体21の厚肉帯部22の外壁には、筒体21の直径を挟んで対称な位置に摘片23、24が設けられている。摘片23と厚肉帯部22との間には、容器20における開口部の端部20aが入り込み挟持される挟持溝23aが形成されている。この挟持溝23aは、容器20と嵌合した細胞単離機器2の装着姿勢を確認するための嵌合部として機能する。
【0021】
摘片24は摘片23とは異なる形状を有しており、容器20に挿入された状態の細胞単離機器2は、例えば摘片24が自動細胞前処理装置5の固定孔51に挿入されてセットされる。固定孔51には、フォトインタラプタや近接スイッチなどのセンサが備えられている。センサは、摘片24が適切に挿入されたか否かを検出する信号を制御部へ送出し、制御部は不適切な場合にアラームを発生する。このため、摘片24と摘片23とによって、自動細胞前処理装置5に対する細胞単離機器2の誤セットを防止可能となっている。
【0022】
筒体21の下端部はやや細径のスリーブ端部25となっており、傾斜面によって切り取られた形状を有している。この筒体21におけるスリーブ端部25の傾斜面には、網26が張設されている。この網26は、例えば樹脂あるいは金属性であり、例えば40μメッシュ径の粗さを有し、スリーブ端部25の傾斜面にウエルダーなどにより張設される。
【0023】
摘片24が自動細胞前処理装置5の固定孔51にセットされたとき、網26の最低部分が手前側に位置し、図1に示される自動細胞前処理装置5のノズル54が下降した状態では、ノズル54の先端が網26の最低部分に近接することになる。ノズル54には、その先端から長手方向(図1の縦方向)にスリット54aが形成されており、後に説明するピッペッティングのときに、微細化された組織がノズル54に詰まってピッペッティングが妨げられる不具合を防止するようにノズルの先端に切込みが入った形で構成されている。
【0024】
スリーブ端部25の最下端部には組織取得手段であるスプーン27が突出して形成されている。スプーン27は、スリーブ端部25から真直ぐに下方へ延びる柄部27aと、柄部27aの先端からほぼ直角に筒体21における内径側へ折れ曲がった掻取部27bとを有し、掻取部27bの中央部27bbは凹状容器形状に形成され、組織を掻き取ると共に掻き取った組織を保持する場合に作業が容易な形状となっている。組織取得手段は、このような要件が満たされるものであれば、スプーン形状に限定されない。
【0025】
筒体21の厚肉帯部22における直下の外壁には、空気抜用の孔28が形成されており、液が底側から貯液されてゆく場合に、筒体21と容器20との間隙29に存在する空気が上記孔28を介して筒体21の上側開口部から抜ける。このため、適切なピペッティングの処理が確保される。
【0026】
底蓋部31は、筒状の本体部32と半球形殻体33とにより構成された有底管である。本体部32の開口端部34は、筒体21におけるスリーブ端部25の傾斜面に一致させた傾斜面となっている。開口端部34の内壁部35は、上記筒体21におけるスリーブ端部25が挿入される薄肉の内壁となっている。
【0027】
本体部32の上部側と下部側には、それぞれ内外を繋ぐ孔36、37が形成されている。孔36、37は、筒体21におけるスリーブ端部25が底蓋部31へ挿入された状態においても内外を繋ぎ、本体部32へ流入した液を筒体21と容器20との間隙29に流出させ、また、ピッペティングによる細胞浮遊液の吸引の場合には、筒体21と容器20との間隙29から液を呼び戻すように働くものである。
【0028】
更に、ピッペティングによって発生した気泡により組織の撹拌が妨げられることがある。その場合、孔36、37があることによって、気泡を孔36から抜くとともに孔37から液を呼び込むことができる。さらには網26が傾斜していることにより、孔36からの脱気が効率よく行うことができる。
【0029】
半球形殻体33の外壁には、容器20の壁に当接して姿勢を安定させる脚部38が設けられている。脚部38は、概ね三角形形状であり、容器20の底壁や内側壁に当接して、厚肉帯部22と協働し、容器20内において細胞単離機器2を揺動させることなく、安定した状態で保持する。脚部の形状は、三角形形状に限られることはなく、細胞単離機器2を安定した状態で保持可能であればどのような形状でも良い。
【0030】
以上の通りに構成された細胞単離機器2を用いて細胞浮遊液を得る場合には、容器20に細胞処理薬30を入れたものを用いる。この細胞処理薬30としては、例えば、10%Triton X-100/RO水、1%ヨウ素化プロピジウム/RO水、1%RNase/RO水を、1対10対2(体積)の割合で混合した溶液を、65μLずつ試験管に分注し、凍結乾燥機(KYOWA VAC RLE−52ES:共和真空技術製)を用い凍結乾燥させた試薬を用いることができる。この試薬については、本願の発明者らが既に出願済みの特願2009−244702号に詳細を譲る。勿論、試薬は凍結乾燥したものに限られるものではなく、また、液体の試薬の場合には、自動細胞前処理装置5から供給するようにしても良い。更に試薬にデキストリンを添加してもよい。
【0031】
解析対象である組織61を図5に示すようにシャーレ62に入れて、適量を筒体21のスプーン27によって掻き取り、スプーン27に載せた状態において底蓋部31を筒体21に結合する。次に、上記細胞処理薬30が入っている容器20に細胞単離機器2を挿入して嵌合する。このように、細胞単離機器2によって、ピンセットなど他の器具を用いずに、容易に組織を掻き取り、測定キットにセットすることができる。
【0032】
次に、図1に示した自動細胞前処理装置5の例えば上下にスライドする蓋52を開けて、固定孔51に細胞単離機器2の摘片24を挿入すると共に、容器20の底部を位置決孔53に挿入して、容器20が適切に支持されるようにセットする。
【0033】
この後、自動細胞前処理装置5の蓋52を閉めると、自動細胞前処理装置5は前処理の動作を図6に示すように行う。まず、自動細胞前処理装置5はノズル54を降下させて2mlの希釈液であるリン酸緩衝液を吐出する(S11)。次に、ノズル54を上昇させてノズル54から自動細胞前処理装置5の吸引吐出機構部に空気層を生成する(S12)。
【0034】
再び、ノズル54を下降させて試薬30とリン酸緩衝液と組織61が混合された細胞浮遊液55を出し入れするピペッティングを所要時間行う(S13)。この所要時間は、脳腫瘍組織の測定においては5分程度で十分な結果が得られた。次に、ノズル54を下降させた状態において試料としての細胞浮遊液55を吸引してフローサイトメータ6による測定をスタートさせる(S14)。吸引される細胞浮遊液は、網26を介してろ過されたものを得ることができる。
【0035】
自動細胞前処理装置5は、測定が終了すると、例えば警報音等により終了を報知するので、操作者は、自動細胞前処理装置5の蓋52を開けて細胞単離機器2がセットされた状態の容器20を取り出し、全てを医療廃棄物のダストボックス56へ廃棄する(S15)。
【0036】
自動細胞前処理装置5により吸引された細胞浮遊液は、悪性度解析装置4を構成するフローサイトメータ6に送られる。フローサイトメータ6は細胞浮遊液を用いて、単離・細胞核染色された細胞を計測して、イベント毎の蛍光信号のピーク値と積分値により図示しないスキャッタグラムを得る。このスキャッタグラムに適切なゲート処理を行い、シングル細胞と思われるイベントから蛍光強度積分値のヒストグラムを得る。このヒストグラムは、図示しないLCDなどの表示器に表示される。このように、フローサイトメータ6は、細胞核染色された細胞を計測する計測部及び上記計測部の結果を用いて蛍光強度のヒストグラムを表示する表示部として機能する。
【0037】
このヒストグラムは、図7に示すようである。P1は、G0/G1期細胞群によるピークであり、P2はDNA量が正常とは異なる腫瘍細胞を指すDNA Aneuploidyの細胞群によるピークであり、P3はG2/M期細胞群によるピークである。フローサイトメータ6により得られた蛍光強度のヒストグラムに係るデータはコンピュータ7へ送られる。
【0038】
コンピュータ7には、判定手段が備えられている。判定手段は、ヒストグラムのデータから、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数を求め、この強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する。
【0039】
フローサイトメータ6とコンピュータ7の判定手段によって構成される悪性度解析装置4による動作は、図8に示されるフローチャートによる示すことができる。蛍光強度のヒストグラムを作成する(S21)は、フローサイトメータ6によって行われる。
【0040】
次に、判定手段により、ヒストグラムのデータから正常細胞のピーク検出が行われる(S22)。即ち、図7に示したG0/G1期細胞群によるピークP1を求め、その終了点PFを確定する。具体的には、細胞数が所定数(例えば10)以下となるポイントをサーチする。
【0041】
次に、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数Sを求める(S23)。図7においては、PFよりも右側に示されている領域Rに分布する細胞数を求める。更に、蛍光強度のヒストグラムにおける全細胞数Aを求め(S24)、ここでは強領域細胞数Sと全細胞数Aの比(S/A)をスレッショルドTHと比較し、悪性度を得てコンピュータ7の表示器や図示しないプリンタから出力する(S25)。
【0042】
スレッショルドTHを図9に示す。これは、次のようにして得たものである。実際に病理診断を行い、正常とグレード(grade)2〜4に分けて強領域細胞数Sの比(S/A)をプロットすると図10のように分布が得られた。この結果について、正常とグレード(grade)2〜4とのそれぞれの平均値と標準偏差を求めると図11のように求まる。求められたそれぞれの平均値と標準偏差を用いて計算を行い、上記図9のスレッショルドTHを得たものである。
【0043】
図10に示されている病理診断の結果による分布に対し、スレッショルドTHの境界値K1(6.1%)、K2(20.6%)、K3(40%)を図示すると図12のようになる。病理診断の結果としてえられた正常(0)及びグレード(grade)2〜4について、本実施形態に係る細胞解析方法を実施して得られた結果を図の横方向に分解して示した表が図13(a)である。つまり、病理診断の結果が正常(0)である46ケースを、本実施形態では、正常(0)が36ケースとグレード2が10ケースであるとの解析結果になったことを示す。これにより、図13(b)の「True negative」に示すように、本実施形態では78%の確率で正常と判断し、図13(b)の「False positive」に示すように、22%の確率で悪性度ありと判定することが確かめられた。
【0044】
また、病理診断でグレード2〜4の109ケースについて、本実施形態では図13(b)の「False negative」に示すように、5%の確率で正常と判定し、図13(b)の「True positive」に示すようにグレード2〜4であると判定することが確かめられた。
【0045】
尚、上記の実施形態で用いたスレッショルドTHは、対象とする組織等により適宜変更し得るものである。また、上記では強領域細胞数Sと全細胞数Aの比(S/A)を用いて判定を行ったが、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数Wを求め、弱領域細胞数Wと強領域細胞数Sとの比に基づき重み付けをして判定を行うようにしても良い。この処理は、別言すれば判定手段の判定を弱領域細胞数により補正することを意味する。その他、全細胞数A、強領域細胞数S、弱領域細胞数Wを組み合わせて差分を得て、これを用いて悪性度を判定する等の様々の手法を採用することができる。
【0046】
ここでは、がんの悪性度の判定は、正常及びグレードの判定を説明したが、単にがん細胞の有無の判定に用いることができることは言うまでもない。
【符号の説明】
【0047】
2 細胞単離機器
4 悪性度解析装置
5 自動細胞前処理装置
6 フローサイトメータ
7 コンピュータ
20 容器
21 筒体
26 網
27 スプーン
38 脚部
【技術分野】
【0001】
この発明は、細胞解析装置及び細胞解析方法に関するものである。
【背景技術】
【0002】
従来、病理標本作成の後に細胞検査士や病理医によって組織切片による病理診断が行われている。
【0003】
標本作成や細胞検査士や病理医による診断のためには熟練した技術が必要であり、更に、技術の差により診断結果に違いが生じる虞もある。また、組織摘出から診断を行うまでには、組織固定・切片作成・染色といった手技が必要であり、細胞検査士等を一定時間拘束する。このため、診断までの手技を自動化することが求められている。
【0004】
更に、手術中に摘出した組織が腫瘍か正常組織か判別することも腫瘍の部位や術式によって必要であり、細胞診断や凍結切片による迅速診断が行われているが、通常の病理診断と比較して、より高度な技術・診断精度が要求される。
【0005】
また、病理医にとっては術中一定時間拘束される摘出した固形組織のがん細胞迅速診断を、自動でより客観的に行う装置があれば、非常に有用であると考えられる。更に、腫瘍断端の組織の解析を行うことは、迅速病理診断では一断面でしか診断できなかったものが、組織中の細胞全体を解析出来ることにつながり、このような装置の開発及び提供が望まれている。
【0006】
そこで、従来においては、フローサイトメトリー法を用いて、フローセルを流れる測定試料から蛍光を検出して、測定対象細胞の大きさを反映した値と、測定対象細胞の核の大きさを反映した値とに基づいて測定対象細胞の異常を判定するようにした細胞分析装置が知られている(特許文献1参照)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2009−103687号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は上記のような病理診断の分野における現状に鑑みてなされたもので、その目的は、フローサイトメータによる測定結果を応用して、極めて容易にしかも高精度でがんの悪性度解析を行うことが可能な細胞解析装置及び細胞解析方法を提供することである。
【課題を解決するための手段】
【0009】
本発明に係る細胞解析装置は、細胞核染色された細胞を計測する計測部と、前記計測部の結果を用いて蛍光強度のヒストグラムを表示する表示部と、前記ヒストグラムのデータから、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数を求め、この強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する判定手段とを具備することを特徴とする。
【0010】
本発明に係る細胞解析装置では、判定手段は、強領域細胞数とヒストグラムより求めた細胞数との比に基づき判定を行うことを特徴とする。
【0011】
本発明に係る細胞解析装置では、前記ヒストグラムのデータから、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数を求め、前記判定手段を弱領域細胞数により補正することを特徴とする。
【0012】
本発明に係る細胞解析装置では、前記ヒストグラムのデータから、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数を求め、弱領域細胞数と強領域細胞数との比に基づき判定を行うことを特徴とする。
【0013】
本発明に係る細胞解析方法は、単離・細胞核染色された細胞を計測して、蛍光強度のヒストグラムを得るステップと、前記ヒストグラムのデータから、正常細胞のピークを検出するステップと、前記ピークよりも蛍光強度の強い領域に分布する強領域細胞数を求めるステップと、求めた強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する判定するステップとを具備することを特徴とする。
【0014】
本発明に係る細胞解析方法では、全細胞数と強領域細胞数との比に基づき判定を行うことを特徴とする。
【0015】
本発明に係る細胞解析方法では、前記ヒストグラムのデータから、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数を求め、弱領域細胞数と強領域細胞数との比に基づき判定を行うことを特徴とする。
【発明の効果】
【0016】
本発明によれば、蛍光強度のヒストグラムのデータから、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数を求め、この強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定するので、フローサイトメータにより得られた結果を用いて容易に、がんの悪性度を解析可能である。
【図面の簡単な説明】
【0017】
【図1】本発明に係る方法により解析を行う診断システムの概略構成図。
【図2】本発明に係る装置による解析の全段階に用いる細胞単離機器を示す側面図。
【図3】本発明に係る装置による解析の全段階に用いる細胞単離機器の要部断面図。
【図4】本発明に係る装置による解析の全段階に用いる細胞単離機器を示す組立斜視図。
【図5】本発明に係る装置による解析の全段階に用いる細胞単離機器の組織取り込みの過程を示す斜視図。
【図6】本発明に係る装置による解析の全段階に用いる細胞単離機器を用いた細胞浮遊液生成過程を示す工程図。
【図7】フローサイトメータによる蛍光強度のヒストグラムの一例を示す図。
【図8】本発明に係る細胞解析装置の実施形態による動作を説明するためのフローチャート。
【図9】本発明に係る細胞解析装置の実施形態において用いたスレッショルドを示す図。
【図10】病理診断によるがん悪性度解析結果をプロットした図。
【図11】図9について、平均値と標準偏差を求めて示した図。
【図12】図10についてスレッショルドの境界線と共に示した図。
【図13】病理診断の結果と、本発明に係る細胞解析装置の実施形態による解析結果の対比を示す図。
【発明を実施するための形態】
【0018】
以下添付図面を参照して、本発明に係るがんの細胞解析装置及びその方法の実施例を説明する。各図において、同一の構成要素には同一の符号を付して重複する説明を省略する。細胞単離機器2と本発明の細胞解析装置の実施形態に係るがん悪性度解析装置4を用いて構成される診断システム1を図1に示す。悪性度解析装置4はフローサイトメータ6とコンピュータ7により構成される。言うまでもなく、それぞれ別の装置とせずにフローサイトメータ6にコンピュータ7の機能を持たせてもよい。図2に示すように、細胞単離機器2は、試薬を入れるための容器20に挿入された状態で自動細胞前処理装置5にセットされる。
【0019】
図3に示すように、細胞単離機器2は、透明あるいは半透明であって試薬と反応しない樹脂性の筒体21と底蓋部31を備える。筒体21は、上側部に厚肉帯部22を有し、厚肉帯部22における外径は、試薬が入れられる試験管などの容器20の内径とほぼ同一であり、容器20の口部内壁に接触した状態で挿入される。
【0020】
図3、図4に示すように、筒体21の厚肉帯部22の外壁には、筒体21の直径を挟んで対称な位置に摘片23、24が設けられている。摘片23と厚肉帯部22との間には、容器20における開口部の端部20aが入り込み挟持される挟持溝23aが形成されている。この挟持溝23aは、容器20と嵌合した細胞単離機器2の装着姿勢を確認するための嵌合部として機能する。
【0021】
摘片24は摘片23とは異なる形状を有しており、容器20に挿入された状態の細胞単離機器2は、例えば摘片24が自動細胞前処理装置5の固定孔51に挿入されてセットされる。固定孔51には、フォトインタラプタや近接スイッチなどのセンサが備えられている。センサは、摘片24が適切に挿入されたか否かを検出する信号を制御部へ送出し、制御部は不適切な場合にアラームを発生する。このため、摘片24と摘片23とによって、自動細胞前処理装置5に対する細胞単離機器2の誤セットを防止可能となっている。
【0022】
筒体21の下端部はやや細径のスリーブ端部25となっており、傾斜面によって切り取られた形状を有している。この筒体21におけるスリーブ端部25の傾斜面には、網26が張設されている。この網26は、例えば樹脂あるいは金属性であり、例えば40μメッシュ径の粗さを有し、スリーブ端部25の傾斜面にウエルダーなどにより張設される。
【0023】
摘片24が自動細胞前処理装置5の固定孔51にセットされたとき、網26の最低部分が手前側に位置し、図1に示される自動細胞前処理装置5のノズル54が下降した状態では、ノズル54の先端が網26の最低部分に近接することになる。ノズル54には、その先端から長手方向(図1の縦方向)にスリット54aが形成されており、後に説明するピッペッティングのときに、微細化された組織がノズル54に詰まってピッペッティングが妨げられる不具合を防止するようにノズルの先端に切込みが入った形で構成されている。
【0024】
スリーブ端部25の最下端部には組織取得手段であるスプーン27が突出して形成されている。スプーン27は、スリーブ端部25から真直ぐに下方へ延びる柄部27aと、柄部27aの先端からほぼ直角に筒体21における内径側へ折れ曲がった掻取部27bとを有し、掻取部27bの中央部27bbは凹状容器形状に形成され、組織を掻き取ると共に掻き取った組織を保持する場合に作業が容易な形状となっている。組織取得手段は、このような要件が満たされるものであれば、スプーン形状に限定されない。
【0025】
筒体21の厚肉帯部22における直下の外壁には、空気抜用の孔28が形成されており、液が底側から貯液されてゆく場合に、筒体21と容器20との間隙29に存在する空気が上記孔28を介して筒体21の上側開口部から抜ける。このため、適切なピペッティングの処理が確保される。
【0026】
底蓋部31は、筒状の本体部32と半球形殻体33とにより構成された有底管である。本体部32の開口端部34は、筒体21におけるスリーブ端部25の傾斜面に一致させた傾斜面となっている。開口端部34の内壁部35は、上記筒体21におけるスリーブ端部25が挿入される薄肉の内壁となっている。
【0027】
本体部32の上部側と下部側には、それぞれ内外を繋ぐ孔36、37が形成されている。孔36、37は、筒体21におけるスリーブ端部25が底蓋部31へ挿入された状態においても内外を繋ぎ、本体部32へ流入した液を筒体21と容器20との間隙29に流出させ、また、ピッペティングによる細胞浮遊液の吸引の場合には、筒体21と容器20との間隙29から液を呼び戻すように働くものである。
【0028】
更に、ピッペティングによって発生した気泡により組織の撹拌が妨げられることがある。その場合、孔36、37があることによって、気泡を孔36から抜くとともに孔37から液を呼び込むことができる。さらには網26が傾斜していることにより、孔36からの脱気が効率よく行うことができる。
【0029】
半球形殻体33の外壁には、容器20の壁に当接して姿勢を安定させる脚部38が設けられている。脚部38は、概ね三角形形状であり、容器20の底壁や内側壁に当接して、厚肉帯部22と協働し、容器20内において細胞単離機器2を揺動させることなく、安定した状態で保持する。脚部の形状は、三角形形状に限られることはなく、細胞単離機器2を安定した状態で保持可能であればどのような形状でも良い。
【0030】
以上の通りに構成された細胞単離機器2を用いて細胞浮遊液を得る場合には、容器20に細胞処理薬30を入れたものを用いる。この細胞処理薬30としては、例えば、10%Triton X-100/RO水、1%ヨウ素化プロピジウム/RO水、1%RNase/RO水を、1対10対2(体積)の割合で混合した溶液を、65μLずつ試験管に分注し、凍結乾燥機(KYOWA VAC RLE−52ES:共和真空技術製)を用い凍結乾燥させた試薬を用いることができる。この試薬については、本願の発明者らが既に出願済みの特願2009−244702号に詳細を譲る。勿論、試薬は凍結乾燥したものに限られるものではなく、また、液体の試薬の場合には、自動細胞前処理装置5から供給するようにしても良い。更に試薬にデキストリンを添加してもよい。
【0031】
解析対象である組織61を図5に示すようにシャーレ62に入れて、適量を筒体21のスプーン27によって掻き取り、スプーン27に載せた状態において底蓋部31を筒体21に結合する。次に、上記細胞処理薬30が入っている容器20に細胞単離機器2を挿入して嵌合する。このように、細胞単離機器2によって、ピンセットなど他の器具を用いずに、容易に組織を掻き取り、測定キットにセットすることができる。
【0032】
次に、図1に示した自動細胞前処理装置5の例えば上下にスライドする蓋52を開けて、固定孔51に細胞単離機器2の摘片24を挿入すると共に、容器20の底部を位置決孔53に挿入して、容器20が適切に支持されるようにセットする。
【0033】
この後、自動細胞前処理装置5の蓋52を閉めると、自動細胞前処理装置5は前処理の動作を図6に示すように行う。まず、自動細胞前処理装置5はノズル54を降下させて2mlの希釈液であるリン酸緩衝液を吐出する(S11)。次に、ノズル54を上昇させてノズル54から自動細胞前処理装置5の吸引吐出機構部に空気層を生成する(S12)。
【0034】
再び、ノズル54を下降させて試薬30とリン酸緩衝液と組織61が混合された細胞浮遊液55を出し入れするピペッティングを所要時間行う(S13)。この所要時間は、脳腫瘍組織の測定においては5分程度で十分な結果が得られた。次に、ノズル54を下降させた状態において試料としての細胞浮遊液55を吸引してフローサイトメータ6による測定をスタートさせる(S14)。吸引される細胞浮遊液は、網26を介してろ過されたものを得ることができる。
【0035】
自動細胞前処理装置5は、測定が終了すると、例えば警報音等により終了を報知するので、操作者は、自動細胞前処理装置5の蓋52を開けて細胞単離機器2がセットされた状態の容器20を取り出し、全てを医療廃棄物のダストボックス56へ廃棄する(S15)。
【0036】
自動細胞前処理装置5により吸引された細胞浮遊液は、悪性度解析装置4を構成するフローサイトメータ6に送られる。フローサイトメータ6は細胞浮遊液を用いて、単離・細胞核染色された細胞を計測して、イベント毎の蛍光信号のピーク値と積分値により図示しないスキャッタグラムを得る。このスキャッタグラムに適切なゲート処理を行い、シングル細胞と思われるイベントから蛍光強度積分値のヒストグラムを得る。このヒストグラムは、図示しないLCDなどの表示器に表示される。このように、フローサイトメータ6は、細胞核染色された細胞を計測する計測部及び上記計測部の結果を用いて蛍光強度のヒストグラムを表示する表示部として機能する。
【0037】
このヒストグラムは、図7に示すようである。P1は、G0/G1期細胞群によるピークであり、P2はDNA量が正常とは異なる腫瘍細胞を指すDNA Aneuploidyの細胞群によるピークであり、P3はG2/M期細胞群によるピークである。フローサイトメータ6により得られた蛍光強度のヒストグラムに係るデータはコンピュータ7へ送られる。
【0038】
コンピュータ7には、判定手段が備えられている。判定手段は、ヒストグラムのデータから、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数を求め、この強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する。
【0039】
フローサイトメータ6とコンピュータ7の判定手段によって構成される悪性度解析装置4による動作は、図8に示されるフローチャートによる示すことができる。蛍光強度のヒストグラムを作成する(S21)は、フローサイトメータ6によって行われる。
【0040】
次に、判定手段により、ヒストグラムのデータから正常細胞のピーク検出が行われる(S22)。即ち、図7に示したG0/G1期細胞群によるピークP1を求め、その終了点PFを確定する。具体的には、細胞数が所定数(例えば10)以下となるポイントをサーチする。
【0041】
次に、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数Sを求める(S23)。図7においては、PFよりも右側に示されている領域Rに分布する細胞数を求める。更に、蛍光強度のヒストグラムにおける全細胞数Aを求め(S24)、ここでは強領域細胞数Sと全細胞数Aの比(S/A)をスレッショルドTHと比較し、悪性度を得てコンピュータ7の表示器や図示しないプリンタから出力する(S25)。
【0042】
スレッショルドTHを図9に示す。これは、次のようにして得たものである。実際に病理診断を行い、正常とグレード(grade)2〜4に分けて強領域細胞数Sの比(S/A)をプロットすると図10のように分布が得られた。この結果について、正常とグレード(grade)2〜4とのそれぞれの平均値と標準偏差を求めると図11のように求まる。求められたそれぞれの平均値と標準偏差を用いて計算を行い、上記図9のスレッショルドTHを得たものである。
【0043】
図10に示されている病理診断の結果による分布に対し、スレッショルドTHの境界値K1(6.1%)、K2(20.6%)、K3(40%)を図示すると図12のようになる。病理診断の結果としてえられた正常(0)及びグレード(grade)2〜4について、本実施形態に係る細胞解析方法を実施して得られた結果を図の横方向に分解して示した表が図13(a)である。つまり、病理診断の結果が正常(0)である46ケースを、本実施形態では、正常(0)が36ケースとグレード2が10ケースであるとの解析結果になったことを示す。これにより、図13(b)の「True negative」に示すように、本実施形態では78%の確率で正常と判断し、図13(b)の「False positive」に示すように、22%の確率で悪性度ありと判定することが確かめられた。
【0044】
また、病理診断でグレード2〜4の109ケースについて、本実施形態では図13(b)の「False negative」に示すように、5%の確率で正常と判定し、図13(b)の「True positive」に示すようにグレード2〜4であると判定することが確かめられた。
【0045】
尚、上記の実施形態で用いたスレッショルドTHは、対象とする組織等により適宜変更し得るものである。また、上記では強領域細胞数Sと全細胞数Aの比(S/A)を用いて判定を行ったが、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数Wを求め、弱領域細胞数Wと強領域細胞数Sとの比に基づき重み付けをして判定を行うようにしても良い。この処理は、別言すれば判定手段の判定を弱領域細胞数により補正することを意味する。その他、全細胞数A、強領域細胞数S、弱領域細胞数Wを組み合わせて差分を得て、これを用いて悪性度を判定する等の様々の手法を採用することができる。
【0046】
ここでは、がんの悪性度の判定は、正常及びグレードの判定を説明したが、単にがん細胞の有無の判定に用いることができることは言うまでもない。
【符号の説明】
【0047】
2 細胞単離機器
4 悪性度解析装置
5 自動細胞前処理装置
6 フローサイトメータ
7 コンピュータ
20 容器
21 筒体
26 網
27 スプーン
38 脚部
【特許請求の範囲】
【請求項1】
細胞核染色された細胞を計測する計測部と、
前記計測部の結果を用いて蛍光強度のヒストグラムを表示する表示部と、
前記ヒストグラムのデータから、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数を求め、この強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する判定手段と
を具備することを特徴とする細胞解析装置。
【請求項2】
判定手段は、強領域細胞数とヒストグラムより求めた細胞数との比に基づき判定を行うことを特徴とする請求項1に記載の細胞解析装置。
【請求項3】
前記ヒストグラムのデータから、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数を求め、前記判定手段を弱領域細胞数により補正することを特徴とする請求項2に記載の細胞解析装置。
【請求項4】
前記ヒストグラムのデータから、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数を求め、弱領域細胞数と強領域細胞数との比に基づき判定を行うことを特徴とする請求項1に記載の細胞解析装置
【請求項5】
細胞核染色された細胞を計測して、蛍光強度のヒストグラムを得るステップと、
前記ヒストグラムのデータから、正常細胞のピークを検出するステップと、
前記ピークよりも蛍光強度の強い領域に分布する強領域細胞数を求めるステップと、
求めた強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する判定するステップと
を具備することを特徴とする細胞解析方法。
【請求項6】
全細胞数と強領域細胞数との比に基づき判定を行うことを特徴とする請求項5に記載の細胞解析方法。
【請求項7】
前記ヒストグラムのデータから、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数を求め、弱領域細胞数と強領域細胞数との比に基づき判定を行うことを特徴とする請求項5に記載の細胞解析方法。
【請求項1】
細胞核染色された細胞を計測する計測部と、
前記計測部の結果を用いて蛍光強度のヒストグラムを表示する表示部と、
前記ヒストグラムのデータから、正常細胞よりも蛍光強度の強い領域に分布する強領域細胞数を求め、この強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する判定手段と
を具備することを特徴とする細胞解析装置。
【請求項2】
判定手段は、強領域細胞数とヒストグラムより求めた細胞数との比に基づき判定を行うことを特徴とする請求項1に記載の細胞解析装置。
【請求項3】
前記ヒストグラムのデータから、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数を求め、前記判定手段を弱領域細胞数により補正することを特徴とする請求項2に記載の細胞解析装置。
【請求項4】
前記ヒストグラムのデータから、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数を求め、弱領域細胞数と強領域細胞数との比に基づき判定を行うことを特徴とする請求項1に記載の細胞解析装置
【請求項5】
細胞核染色された細胞を計測して、蛍光強度のヒストグラムを得るステップと、
前記ヒストグラムのデータから、正常細胞のピークを検出するステップと、
前記ピークよりも蛍光強度の強い領域に分布する強領域細胞数を求めるステップと、
求めた強領域細胞数と前記ヒストグラムに基づいてがんの悪性度を判定する判定するステップと
を具備することを特徴とする細胞解析方法。
【請求項6】
全細胞数と強領域細胞数との比に基づき判定を行うことを特徴とする請求項5に記載の細胞解析方法。
【請求項7】
前記ヒストグラムのデータから、正常細胞よりも蛍光強度の弱い領域に分布する弱領域細胞数を求め、弱領域細胞数と強領域細胞数との比に基づき判定を行うことを特徴とする請求項5に記載の細胞解析方法。
【図4】


【図8】


【図9】


【図11】


【図1】


【図2】


【図3】


【図5】


【図6】


【図7】


【図10】


【図12】


【図13】




【図8】


【図9】


【図11】


【図1】


【図2】


【図3】


【図5】


【図6】


【図7】


【図10】


【図12】


【図13】


【公開番号】特開2012−47594(P2012−47594A)
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願番号】特願2010−189920(P2010−189920)
【出願日】平成22年8月26日(2010.8.26)
【出願人】(000230962)日本光電工業株式会社 (179)
【Fターム(参考)】
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願日】平成22年8月26日(2010.8.26)
【出願人】(000230962)日本光電工業株式会社 (179)
【Fターム(参考)】
[ Back to top ]

