細胞評価装置、インキュベータ、細胞評価方法、細胞評価プログラムおよび細胞の培養方法
【課題】細胞を染色せずに、細胞の状態を推定する細胞評価装置を提供する。
【解決手段】第1の種類の細胞と第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、第1の種類の個別の細胞および細胞の集合体が占める領域と第2の種類の細胞が占める領域とを抽出する領域抽出部44と、領域抽出部44で抽出された第2の種類の細胞が占める領域に存在する第2の種類の細胞の形態的特徴を示す特徴量を算出する特徴量算出部45と、第2の種類の細胞が有する形態的特徴を示す特徴量と、第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する評価処理部48と、を備える。
【解決手段】第1の種類の細胞と第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、第1の種類の個別の細胞および細胞の集合体が占める領域と第2の種類の細胞が占める領域とを抽出する領域抽出部44と、領域抽出部44で抽出された第2の種類の細胞が占める領域に存在する第2の種類の細胞の形態的特徴を示す特徴量を算出する特徴量算出部45と、第2の種類の細胞が有する形態的特徴を示す特徴量と、第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する評価処理部48と、を備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞評価装置、インキュベータ、細胞評価方法、細胞評価プログラムおよび細胞の培養方法に関するものである。
【背景技術】
【0002】
一般的に、細胞の培養状態を評価する技術は、再生医療などの先端医療分野や医薬品のスクリーニングを含む幅広い分野での基盤技術となっている。例えば、再生医療分野では、インビトロで細胞を増殖、分化させるプロセスが存在する。そして、上記のプロセスでは、細胞の分化の成否、細胞の癌化や感染の有無を管理するために、細胞の培養状態を的確に評価することが不可欠である。一例として、マーカーとして転写因子を用いたがん細胞の評価方法が開示されている(特許文献1参照)。
【0003】
一方、ES(Embryonic Stem、胚性幹)細胞またはiPS(induced Pluripotent Stem、誘導多能性幹)細胞などの万能細胞は、理論上すべての組織に分化する分化多能性を保ちつつ、ほぼ無限に増殖させる事ができるため、医薬開発および再生医療への応用に注目が集まっている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2007−195533号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
iPS細胞を再生医療に応用する際には、状態が良いiPS細胞だけ抽出する必要があるため、培養しているiPS細胞の状態を評価することが必要となる。しかしながら、従来の技術では、iPS細胞を染色マーカーで染色せずに、iPS細胞の状態を評価できないという問題があった。
【0006】
そこで本発明は、上記問題に鑑みてなされたものであり、細胞を染色せずに、細胞の状態を推定する細胞評価装置、インキュベータ、細胞評価方法、細胞評価プログラムおよび細胞の培養方法を提供することを課題とする。
【課題を解決するための手段】
【0007】
上記問題を解決するために、本発明は、第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、前記第1の種類の個別の細胞および細胞の集合体が占める領域と前記第2の種類の細胞が占める領域とを抽出する領域抽出部と、前記領域抽出部で抽出された第2の種類の細胞が占める領域に存在する前記第2の種類の細胞の形態的特徴を示す特徴量を算出する第1の特徴量算出部と、前記第2の種類の細胞が有する形態的特徴を示す特徴量と、前記第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する評価処理部と、を備えることを特徴とする細胞評価装置である。
【0008】
また、本発明は、細胞を培養する培養容器を収納するとともに、所定の環境条件に内部を維持可能な恒温室と、前記恒温室内で前記培養容器に含まれる前記細胞の画像を撮像する撮像装置と、請求項1から請求項7のいずれか1項に記載の細胞評価装置と、を備えることを特徴とするインキュベータである。
【0009】
また、本発明は、第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、前記第1の種類の個別の細胞および細胞の集合体が占める領域と前記第2の種類の細胞が占める領域とを抽出する領域抽出手順と、前記領域抽出手順で抽出された第2の種類の細胞が占める領域に存在する前記第2の種類の細胞の形態的特徴を示す特徴量を算出する第1の特徴量算出手順と、前記第2の種類の細胞が有する形態的特徴を示す特徴量と、前記第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する評価処理手順と、を有することを特徴とする細胞評価方法である。
【0010】
また、本発明は、第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、前記第1の種類の個別の細胞および細胞の集合体が占める領域と前記第2の種類の細胞が占める領域とを抽出する第1のステップと、前記第1のステップで抽出された第2の種類の細胞が占める領域に存在する前記第2の種類の細胞の形態的特徴を示す特徴量を算出する第2のステップと、前記第2の種類の細胞が有する形態的特徴を示す特徴量と、前記第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する第3のステップと、をコンピュータに実行させるための細胞評価プログラムである。
【0011】
また、本発明は、第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞が撮像された画像から、前記第2の種類の細胞の形態的特徴を示す特徴量を抽出し、前記第2の種類の細胞の形態的特徴を示す特徴量に基づき、第1の種類の細胞の状態を推定し、前記第1の細胞の状態に基づき、前記第1の種類の細胞又は前記第2の種類の細胞の培養条件を変更することを特徴とする細胞の培養方法である。
【発明の効果】
【0012】
本発明によれば、細胞を染色せずに、細胞の状態を推定することができる。
【図面の簡単な説明】
【0013】
【図1】本発明の実施形態であるインキュベータの正面図である。
【図2】本発明の実施形態であるインキュベータの平面図である。
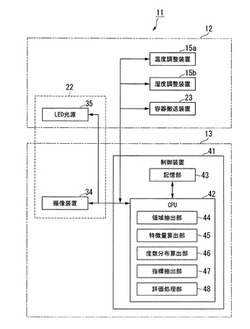
【図3】本発明の第1の実施例であるインキュベータのブロック構成図である。
【図4】iPS細胞と共培養されているフィーダー細胞とが撮像された画像から、iPS細胞のコロニーの領域とフィーダー細胞の領域とを抽出する処理を説明するための図である。
【図5】抽出されたiPS細胞のコロニーの領域と、フィーダー細胞の領域とを説明するための図である。
【図6】細胞の形態の各特徴量を説明するための図である。
【図7】ある特徴量についての計算モデルのパラメータを格納するテーブルを説明するための図である。
【図8】Artificial Neural Networkの概要を説明するための図である。
【図9】Fuzzy Neural Networkの概要を説明するための図である。
【図10】Fuzzy Neural Networkにおけるシグモイド関数を説明するための図である。
【図11】インキュベータにおける観察処理の一例を示すフローチャートである。
【図12】計算モデル用の教師値の算出を説明するためのフローチャートである。
【図13】計算モデルの構築を説明するためのフローチャートである。
【図14】計算モデルを用いたiPS細胞の分化度を推定するためのフローチャートである。
【図15】本発明の第2の実施例であるインキュベータのブロック構成図である。
【図16】画像別、コロニー+フィーダーモデルの決定木を説明するための図である。
【図17】画像別、コロニー・フィーダー別モデルの決定木を説明するための図である。
【図18】細胞別、コロニー・フィーダー別モデルの決定木を説明するための図である。
【図19】決定木算出用の教師値の算出を説明するためのフローチャートである。
【図20】決定木算出用の特徴量の算出を説明するためのフローチャートである。
【図21】画像別の決定木の算出を説明するためのフローチャートである。
【図22】細胞別の決定木算出を説明するためのフローチャートである。
【図23】図16に示す画像別、コロニー+フィーダーモデルを用いたiPS細胞の状態の推定を説明するためのフローチャートである。
【図24】図17に示す画像別、コロニー・フィーダー別モデルを用いたiPS細胞の状態の推定を説明するためのフローチャートである。
【図25】図18に示す細胞別、コロニー・フィーダー別モデルを用いたiPS細胞の状態の推定を説明するためのフローチャートである。
【図26】本発明の実施例2の細胞評価プログラムを用いた細胞の培養方法を説明するためのフローチャートである。
【発明を実施するための形態】
【0014】
以下、本発明を実施するための形態について、図面を参照して詳細に説明する。本発明の実施形態では、iPS細胞と、iPS細胞の周囲に存在しiPS細胞に栄養素などを供給する1種類のフィーダー細胞とが共に培養されている。
【0015】
<実施例1>
一般的に、ES細胞またはiPS細胞は、その分化能力が高いほどその品質が良いと考えられている。従って、本発明の実施例1では、iPS細胞の状態を推定するのに、全体の細胞に占める分化した細胞の割合(以下、分化度と称する)を指標とする。
図1は、本発明の実施形態であるインキュベータの正面図である。図2は、本発明の実施形態であるインキュベータの平面図である。
【0016】
恒温室15の前面には、大扉16、中扉17、小扉18が配置されている。大扉16
は、上部ケーシング12および下部ケーシング13の前面を覆っている。中扉17は、上
部ケーシング12の前面を覆っており、大扉16の開放時に恒温室15と外部との環境を
隔離する。小扉18は、細胞を培養する培養容器19を搬出入するための扉であって、中
扉17に取り付けられている。この小扉18から培養容器19を搬出入することで、恒温
室15の環境変化を抑制することが可能となる。なお、大扉16、中扉17、小扉18
は、パッキンP1,P2,P3によりそれぞれ気密性が維持されている。
【0017】
また、恒温室15には、ストッカー21、観察ユニット22、容器搬送装置23、搬送
台24が配置されている。ここで、搬送台24は、小扉18の手前に配置されており、培
養容器19を小扉18から搬出入する。
【0018】
ストッカー21は、上部ケーシング12の前面(図2の下側)からみて恒温室15の左
側に配置される。ストッカー21は複数の棚を有しており、ストッカー21の各々の棚に
は培養容器19を複数収納することができる。なお、各々の培養容器19には、培養の対
象となる細胞が培地とともに収容されている。
【0019】
ここで、観察ユニット22は、上部ケーシング12のベースプレート14の開口部に嵌
め込まれて配置される。観察ユニット22は、試料台31と、試料台31の上方に張り出
したスタンドアーム32と、位相差観察用の顕微光学系および撮像装置(34)を内蔵し
た本体部分33と、を有している。そして、試料台31およびスタンドアーム32は恒温室15に配置される一方で、本体部分33は下部ケーシング13内に収納される。
【0020】
観察ユニット22は、上部ケーシング12の前面からみて恒温室15の右側に配置され
る。この観察ユニット22は、培養容器19内の細胞のタイムラプス観察を実行すること
ができる。
【0021】
ここで、観察ユニット22は、上部ケーシング12のベースプレート14の開口部に嵌
め込まれて配置される。観察ユニット22は、試料台31と、試料台31の上方に張り出
したスタンドアーム32と、位相差観察用の顕微光学系および撮像装置(34)を内蔵し
た本体部分33と、を有している。そして、試料台31およびスタンドアーム32は恒温室15に配置される一方で、本体部分33は下部ケーシング13内に収納される。
【0022】
試料台31は透光性の材質で構成されており、その上に培養容器19を載置することが
できる。この試料台31は水平方向に移動可能に構成されており、上面に載置した培養容
器19の位置を調整できる。また、スタンドアーム32にはLED光源35が内蔵されて
いる。そして、撮像装置34は、スタンドアーム32によって試料台31の上側から透過
照明された培養容器19の細胞を、顕微鏡の光学系を介して撮像することで細胞の顕微鏡画像を取得する。
【0023】
容器搬送装置23は、上部ケーシング12の前面からみて恒温室15の中央に配置され
る。この容器搬送装置23は、ストッカー21、観察ユニット22の試料台31および搬
送台24との間で培養容器19の受け渡しを行う。
【0024】
図2に示すように、容器搬送装置23は、多関節アームを有する垂直ロボット34と、回転ステージ35と、ミニステージ36と、アーム部37とを有している。回転ステージ35は、垂直ロボット34の先端部に回転軸35aを介して水平方向に180°回転可能に取り付けられている。そのため、回転ステージ35は、ストッカー21、試料台31および搬送台24に対して、アーム部37をそれぞれ対向させることができる。
【0025】
また、ミニステージ36は、回転ステージ35に対して水平方向に摺動可能に取り付けられている。ミニステージ36には培養容器19を把持するアーム部37が取り付けられている。
【0026】
図3は、本発明の第1の実施例であるインキュベータのブロック構成図である。
第1の実施例のインキュベータ11は、上部ケーシング12と下部ケーシング13とを有している。インキュベータ11の組立状態において、上部ケーシング12は下部ケーシング13の上に載置される。なお、上部ケーシング12と下部ケーシング13との内部空間は、ベースプレート14によって上下に仕切られている。
【0027】
上部ケーシング12は、温度調整装置15aと、湿度調整装置15bと、容器搬送装置23と、LED光源35とを有している。
まず、上部ケーシング12の構成の概要を説明する。上部ケーシング12の内部には、
細胞の培養を行う恒温室15が形成されている。この恒温室15は温度調整装置15aお
よび湿度調整装置15bを有している。
【0028】
温度調整装置15aおよび湿度調整装置15bは、恒温室15内を細胞の培養に適した環境(例えば温度37℃、湿度90%)に維持する(なお、図1、図2での温度調整装置15a、湿度調整装置15bの図示は省略する)。
LED光源35は、培養容器19を照明する。
【0029】
次に、下部ケーシング13の構成の概要を説明する。下部ケーシング13の内部には、観察ユニット22の撮像装置34や、インキュベータ11の制御装置(細胞評価装置)41が収納されている。
撮像装置34は、上側から透過照明された培養容器19の細胞を、顕微鏡の光学系を介して撮像することで細胞の顕微鏡画像を取得する。撮像装置34は、その細胞の顕微鏡画像をCPU42へ供給する。
【0030】
制御装置(細胞評価装置)41は、温度調整装置15aと、湿度調整装置15bと、観察ユニット22と、
容器搬送装置23とそれぞれ接続されている。この制御装置41は、所定のプログラムに
従ってインキュベータ11の各部を統括的に制御する。
【0031】
一例として、制御装置41は、温度調整装置15aおよび湿度調整装置15bをそれぞ
れ制御して恒温室15内を所定の環境条件に維持する。また、制御装置41は、所定の観
察スケジュールに基づいて、観察ユニット22および容器搬送装置23を制御して、培養
容器19の観察シーケンスを自動的に実行する。さらに、制御装置41は、観察シーケン
スで取得した画像に基づいて、細胞の状態の評価を行う培養状態評価処理を実行する。
【0032】
制御装置41は、CPU42と、記憶部43と、を用いて構成されている。CPU42は、制御装置41の各種の演算処理を実行するプロセッサである。
記憶部43は、ハードディスクや、フラッシュメモリ等の不揮発性の記憶媒体などで構成される。この記憶部43は、ストッカー21に収納されている各培養容器19に関する管理データと、撮像装置で撮像された顕微鏡画像のデータとを保持する。さらに、記憶部43は、CPU42によって実行されるプログラムを保持する。
【0033】
なお、上記の管理データには、(a)個々の培養容器19を示すインデックスデータ、(b)ストッカー21での培養容器19の収納位置、(c)培養容器19の種類および形状(ウェルプレート、ディッシュ、フラスコなど)、(d)培養容器19で培養されている細胞の種類、(e)培養容器19の観察スケジュール、(f)タイムラプス観察時の撮像条件(対物レンズの倍率、容器内の観察地点等)、などが含まれている。また、ウェルプレートのように複数の小容器で同時に細胞を培養できる培養容器19については、各々の小容器ごとにそれぞれ管理データが生成される。
【0034】
また、記憶部43は、予め用意されたサンプルの顕微鏡画像のデータを保持する。また、予め用意されたモデル構築用の顕微鏡画像のデータと、画像の教師値(例えば、分化の度合い)を保持する。
【0035】
CPU42は、記憶部43に記憶されているプログラムを読み出して実行することにより、領域抽出部44と、特徴量算出部45と、度数分布算出部46と、指標抽出部47と、評価処理部48との各部の機能を実現する。
【0036】
図4は、iPS細胞と共培養されているフィーダー細胞とが撮像された画像から、iPS細胞のコロニーの領域とフィーダー細胞の領域とを抽出する処理を説明するための図である。
領域抽出部44は、予め用意されたサンプルの顕微鏡画像のデータを記憶部43から読み込む。そして、領域抽出部44は、上記のサンプルの顕微鏡画像のうちから、処理対象となる画像81を指定する。そして、領域抽出部44は、画像81をOpen−Closeフィルタをかけて、Open−Closeフィルタをかけた画像82を生成する。
【0037】
そして、領域抽出部44は、画像81から生成したOpen−Closeフィルタをかけた画像82を引き算した背景補正画像83を生成する。これによって、画像81のバックグラウンドの輝度を均一にすることができる。
【0038】
領域抽出部44は、背景補正画像83に対して、画像内に含まれる細胞を抽出する。例えば、位相差顕微鏡で細胞を撮像すると、細胞壁のように位相差の変化の大きな部位の周辺にはハロが現れる。そのため、領域抽出部44は、細胞壁に対応するハロを公知のエッジ抽出手法で抽出するとともに、輪郭追跡処理によってエッジで囲まれた閉空間を細胞と推定する。これにより上記の顕微鏡画像から個々の細胞を抽出することができる。
【0039】
そして、領域抽出部44は、背景補正画像83から、iPS細胞のコロニーの領域を抽出した画像84を生成する。また、領域抽出部44は、背景補正画像83から、フィーダー細胞の領域を抽出した画像85を生成する。
【0040】
図5は、抽出されたiPS細胞のコロニーの領域と、フィーダー細胞の領域とを説明するための図である。
領域抽出部44は、iPS細胞のコロニーの領域を抽出した画像84から、iPS細胞のコロニーの領域91を抜き出す。また、領域抽出部44は、フィーダー細胞の領域を抽出した画像85からフィーダー細胞の領域92を抜き出す。
領域抽出部44は、各観察時間におけるiPS細胞のコロニーの領域91の情報と、そのフィーダー細胞の領域92の情報とを、特徴量算出部45へ供給する。
【0041】
図6は、細胞の形態の各特徴量を説明するための図である。具体的に、細胞形態の特徴量は、例えば、以下の通りである。
「Total area」(図6の(a)参照)は、注目する細胞の面積を示す値である。例えば、細胞形態の特徴量算出部45は、注目する細胞の領域の画素数に基づいて「Total area」の値を求めることができる。
【0042】
「Hole area」(図6の(b)参照)は、注目する細胞内のHoleの面積を示す値である。ここで、Holeは、コントラストによって、細胞内における画像の明るさが閾値以上となる部分(位相差観察では白に近い状態となる箇所)を指す。例えば、細胞内小器官の染色されたリソソームなどがHoleとして検出される。
また、画像によっては、細胞核や、他の細胞小器官がHoleとして検出されうる。なお、細胞形態の特徴量算出部45は、細胞内における輝度値が閾値以上となる画素のまとまりをHoleとして検出し、このHoleの画素数に基づいて「Hole area」の値を求めればよい。
【0043】
「relative hole area」(図6の(c)参照)は、「Hole area」の値を「Total area」の値で除した値である(relative hole area=Hole area/Total area)。この「relative hole area」は、細胞の大きさにおける細胞内小器官の割合を示すパラメータであって、例えば細胞内小器官の肥大化や核の形の悪化などに応じてその値が変動する。
【0044】
「Perimeter」(図6の(d)参照)は、注目する細胞の外周の長さを示す値である。例えば、細胞形態の特徴量算出部45は、細胞を抽出するときの輪郭追跡処理により「Perimeter」の値を取得することができる。
【0045】
「Width」(図6の(e)参照)は、注目する細胞の画像横方向(X方向)での長さを示す値である。
「Height」(図6の(f)参照)は、注目する細胞の画像縦方向(Y方向)での長さを示す値である。
【0046】
「Length」(図6の(g)参照)は、注目する細胞を横切る線のうちの最大値(細胞の全長)を示す値である。
「Breadth」(図6の(h)参照)は、「Length」に直交する線のうちの最大値(細胞の横幅)を示す値である。
【0047】
「Fiber Length」(図6の(i)参照)は、注目する細胞を擬似的に線状と仮定した場合の長さを示す値である。細胞形態の特徴量算出部45は、下式(1)により「Fiber Length」の値を求める。
【0048】
【数1】

【0049】
但し、本明細書の式において「P」はPerimeterの値を示す。同様に「A」はTotal Areaの値を示す。
【0050】
「Fiber Breadth」(図6の(j)参照)は、注目する細胞を擬似的に線状と仮定した場合の幅(Fiber Lengthと直交する方向の長さ)を示す値である。細胞形態の特徴量算出部45は、下式(2)により「Fiber Breadth」の値を求める。
【0051】
【数2】

【0052】
「Shape Factor」(図6の(k)参照)は、注目する細胞の円形度(細胞の丸さ)を示す値である。細胞形態の特徴量算出部45は、下式(3)により「Shape Factor」の値を求める。
【0053】
【数3】

【0054】
「Elliptical form Factor」(図6の(l)参照)は、「Length」の値を「Breadth」の値で除した値(Elliptical form Factor=Length/Breadth)であって、注目する細胞の細長さの度合いを示すパラメータとなる。
【0055】
「Inner radius」(図6の(m)参照)は、注目する細胞の内接円の半径を示す値である。
「Outer radius」(図6の(n)参照)は、注目する細胞の外接円の半径を示す値である。
【0056】
「Mean radius」(図6の(o)参照)は、注目する細胞の輪郭を構成する全点とその重心点との平均距離を示す値である。
「Equivalent radius」(図6の(p)参照)は、注目する細胞と同面積の円の半径を示す値である。この「Equivalent radius」のパラメータは、注目する細胞を仮想的に円に近似した場合の大きさを示している。
【0057】
ここで、細胞形態の特徴量算出部45は、細胞に対応する画素数に誤差分を加味して上記の各特徴量を求めてもよい。このとき、細胞形態の特徴量算出部45は、顕微鏡画像の撮影条件(撮影倍率や顕微光学系の収差など)を考慮して特徴量を求めるようにしてもよい。なお、「Inner radius」、「Outer radius」、「Mean radius」、「Equivalent radius」を求めるときには、細胞形態の特徴量算出部45は、公知の重心演算の手法に基づいて各細胞の重心点を求め、この重心点を基準にして各パラメータを求めればよい。
【0058】
細胞形態の特徴量算出部45は、領域抽出部44から供給された各観察時間におけるiPS細胞のコロニーの領域91の情報と、フィーダー細胞の領域92の情報とを受け取る。
【0059】
細胞形態の特徴量算出部45は、各フィーダー細胞の領域92において、図6に例示するフィーダー細胞の形態的特徴量を算出する。
ここで、フィーダー細胞の形態的特徴量とは、以下の特徴量を含んでもよい。「フィーダー細胞そのものの凹凸に相当する輝度値」、「フィーダー細胞の中の輝度分布」等である。
【0060】
なお、細胞形態の特徴量算出部45は、更に、各iPS細胞のコロニーの領域91において、図6に例示するiPS細胞のコロニーの形態的特徴量を算出してもよい。
ここで、iPS細胞のコロニーの形態的特徴量は、「コロニーそのものの凹凸に相当する輝度値」、「コロニーの中の輝度分布」、「コロニーを1つの物体と考えた、コロニー集団の形の分布」の特徴量を含んでもよい。
【0061】
なお、細胞形態の特徴量算出部45は、iPS細胞のコロニーの形態的特徴量だけでなく、図6に例示する個々のiPS細胞の形態的特徴量を算出してもよい。ここで、iPS細胞の形態的特徴量は、「iPS細胞そのものの凹凸に相当する輝度値」、「iPS細胞の中の輝度分布」等の特徴量を含んでもよい。
【0062】
そして、算出した各観察時間における各フィーダー細胞の形態的特徴量と、各iPS細胞のコロニーの形態的特徴量と、個々のiPS細胞の形態的特徴量と、を記憶部43に記録する。
【0063】
度数分布算出部46は、記憶部43から各観察時間における各フィーダー細胞の形態的特徴量と、各iPS細胞のコロニーの形態的特徴量と、個々のiPS細胞の形態的特徴量と、を読み出す。また、度数分布算出部46は、記憶部43から観察画像の教師値を読み出す。
【0064】
度数分布算出部46は、各々の顕微鏡画像毎に算出された特徴量の種類毎に、それぞれ特徴量の度数分布を算出する。従って、度数分布算出部46は、1つの顕微鏡画像に対して、例えば57(=19[種類の特徴量]×3[種類の細胞])種類の特徴値の度数分布を求めることとなる。また、度数分布算出部46は、各々の度数分布において、特徴値の各区分に対応する細胞の数を頻度(%)として算出する。
【0065】
度数分布算出部46は、上記の度数分布における度数の区分を、特徴量の種類ごとの標準偏差を用いて正規化する。ここでは一例として、「Shape Factor」の度数分布での区分を決定する場合を説明する。
【0066】
まず、度数分布算出部46は、各々の顕微鏡画像から算出された全ての「Shape Factor」の値の標準偏差を算出する。次に、度数分布算出部46は、上記の標準偏差の値をFisherの式に代入して、「Shape Factor」の度数分布における度数の区分の基準値を求める。このとき、度数分布算出部46は、全ての「Shape Factor」の値の標準偏差(S)を4で除するとともに、小数点以下3桁目を四捨五入して上記の基準値とする。なお、一の実施形態での度数分布算出部46は、度数分布をヒストグラムとして図示する場合、20級数分の区間をモニタ等に描画させるものとする。
【0067】
一例として、「Shape Factor」の標準偏差Sが259のとき、259/4
=64.750から「64.75」が上記の基準値となる。そして、注目する画像の「S
hape Factor」の度数分布を求めるとき、度数分布算出部46は、「Shap
e Factor」の値に応じて0値から64.75刻みで設定された各クラスに細胞を
分類し、各クラスでの細胞の個数をカウントすればよい。
【0068】
このように、度数分布算出部46が、特徴量の種類毎に標準偏差で度数分布の区分を正
規化するため、異なる特徴値の間でも度数分布の傾向を大局的に近似させることができる。よって、一の実施例では、異なる特徴値間で細胞の培養状態と度数分布の変化との相関を求めることが比較的容易となる。
【0069】
度数分布算出部46は、全ての形態的特徴量をヒストグラムする。度数分布算出部46は、全てのヒストグラムを記憶部43に保存する。
【0070】
指標抽出部47は、全てのヒストグラムを記憶部43から読み出す。
指標抽出部47は、形態的特徴量ごとに、各経時のヒストグラムを、経時の全組み合わせ分比較して、経時間のヒストグラムの面積差の絶対値を算出する。
【0071】
図7は、ある特徴量についての計算モデルのパラメータを格納するテーブルを説明するための図である。テーブル100は、時刻1と、時刻2と、各特徴量f(j)(jは1からnまでの整数)の時刻1の特徴量のヒストグラムと、時刻2の特徴量のヒストグラムとの面積差ΔSf(j)と、教師値(例えば、分化の度合い)の差を用いて構成されている。
ここで、一例として、形態的特徴量の種類が同じで、撮影時間(0、24、48、72、96時間目)が異なる5つの度数分布を想定する。
【0072】
指標抽出部47は、上記全10通りの組み合わせに対して、以下の式(4)により、度数分布の面積差の絶対値(画像間での度数分布の差分の絶対値を積分したもの)を算出する。つまり、1セット分における1種類の特徴量に注目したとき、指標抽出部47は、その特徴値の度数分布につき、計10通りの面積差を算出する。
【0073】
【数4】

【0074】
但し、式(4)において、「Control」は初期状態の度数分布(8時間目)における1区間分の度数(細胞数)を示す。また、「Sample」は、比較対象の度数分布における1区間分の度数を示す。また、iは、度数分布の区間を示す変数である。
【0075】
指標抽出部47は、特徴量の種類ごとに上記演算を行うことで、すべての特徴量についてそれぞれ10通りの度数分布の変化量を取得できる。すなわち、1セット分の顕微鏡画像について、19種類×10通りで190の度数分布の組み合わせをとることができる。以後、上記の度数分布の組み合わせの1つを、指標と称する
指標抽出部47は、形態的特徴量毎に、上記テーブル100を、記憶部43に保存する。
【0076】
指標抽出部47は、190の指標のうちから、細胞の培養状態をよく反映する指標を多変量解析により1以上指定する。この指標の組合せの選択は、後述するファジーニューラルネットワークと同等の非線形モデル以外にも、細胞とその形態の複雑性に応じて線形モデルの利用も有効である。このような指標の組合せの選択と共に、指標抽出部47は、上記の指定された1以上の指標を用いて、顕微鏡画像から、iPS細胞の状態を推定する計算モデルを算出する。
【0077】
具体的には、各経時の形の指標19種類の平均値(入力値1)と、各経時の形の指標19種類の標準偏差(入力値2)と、各経時の形の指標19種類の分布の値そのもの(入力値3)と、各経時の形の指標19種類の分布の経時間の面積差(入力値4)との4つの入力値がある。4つの入力値に対し、各画像細胞の分化度(教師値)が関係付けられる。従って、指標抽出部47は、教師値を最も精度よく予測できる入力値の組み合わせを見つける。
【0078】
ここで、指標抽出部47は、ファジーニューラルネットワーク(Fuzzy Neural Network:FNN)解析によって上記の計算モデルを求める。
【0079】
FNNとは、人工ニューラルネットワーク(Artificial Neural Network:ANN)とファジィ推論とを組み合わせた方法である。このFNNでは、ファジイ推論の欠点であるメンバーシップ関数の決定を人間に頼るという部分を回避すべく、ANNをファジィ推論に組み込んでその自動決定を行う。学習機械のひとつであるANN(図10参照)は、生体の脳における神経回路網を数学的にモデル化したものであり、以下の特徴を持つ。
【0080】
図8は、Artificial Neural Networkの概要を説明するための図である。
ANNにおける学習は、目的の出力値(教師値)をもつ学習用のデータ(入力値:X)を用いて、バックプロパゲーション(Back propagation:BP)法により教師値と出力値(Y)との誤差が小さくなるように、ノード(図8において丸で示す)間をつなぐ回路における結合荷重を変え、その出力値が教師値に近づくようにモデルを構築する過程である。
【0081】
このBP法を用いれば、ANNは学習により自動的に知識を獲得することができる。そして、最終的に学習に用いていないデータを入力することにより、そのモデルの汎用性を評価できる。従来、メンバーシップ関数の決定は、人間の感覚に頼っていたが、上で述べたようなANNをファジイ推論に組み込むことで自動的なメンバーシップ関数の同定が可能になる。これがFNNである。
【0082】
図9は、Fuzzy Neural Networkの概要を説明するための図である。
FNNでは、ANNと同様に、BP法を用いることによりネットワークに与えられた入出力関係を、結合荷重を変化させることで自動的に同定しモデル化できる。FNNは、学習後のモデルを解析することでファジィ推論のように人間に理解しやすい言語的なルール(一例として図9の右下の吹き出しを参照)として知識を獲得できるという特徴をもっている。
【0083】
つまり、FNNは、その構造、特徴から、細胞の形態的特徴を表した数値のような変数の組み合わせにおける最適なファジィ推論の組み合わせを自動決定し、予測目標に関する推定と、予測に有効な指標の組み合わせを示すルールの生成を同時に行うことができる。
【0084】
FNNの構造は、「入力層」、シグモイド関数に含まれるパラメータWc、Wgを決定する「メンバーシップ関数部分(前件部)」、Wfを決定するとともに入力および出力の関係をルールとして取り出すことが可能な「ファジィルール部分(後件部)」、「出力層」の4層から成り立っている(図9参照)。
【0085】
図10は、Fuzzy Neural Networkにおけるシグモイド関数を説明するための図である。
FNNのモデル構造を決定する結合荷重にはWc、Wg、Wfがある。結合荷重Wcは、メンバーシップ関数に用いられるシグモイド関数の中心位置、Wgは中心位置での傾きを決定する(図10参照)。
【0086】
図9に戻り、モデル内では、入力値がファジィ関数により、人間の感覚的に近い柔軟性を持って表現される(一例として図9の左下の吹き出しを参照)。結合荷重Wfは各ファジイ領域の推定結果に対する寄与を表しており、Wfよりファジィルールを導くことができる。即ち、モデル内の構造はあとから解読でき、ルールとして書き起こすことができる(一例として図9中右下の吹き出しを参照)。
【0087】
FNN解析におけるファジィルールの作成には結合荷重のひとつであるWf値が用いられる。Wf値が正の値で大きいと、そのユニットは「予測に有効である」と判定されることに対する寄与が大きく、そのルールに当てはまった指標は「有効である」と判断される。Wf値が負の値で小さいと、そのユニットは「予測に有効でない」と判定されることに対する寄与が大きく、そのルールに当てはまった指標は「有効でない」と判断される。
【0088】
より具体的な例として、指標抽出部47は、以下の(A)から(H)の処理により、上記の計算モデルを求める。
【0089】
(A)指標抽出部47は、190の指標のうちから1つの指標を選択する。
(B)指標抽出部47は、(A)で選択された指標による度数分布の変化量を変数
とした計算式により、各々の顕微鏡画像のセットでの、iPS細胞の状態(予測値)を求める。
【0090】
仮に、1つの指標から、iPS細胞の状態を求める計算式を「Y=αX1」(但し、「Y」は、iPS細胞の計算値(例えば、iPS細胞の増加数を示す値)、「X1」は上記の選択された指標に対応する度数分布の変化量、「α」はX1に対応する係数値、をそれぞれ示す)とする。このとき、指標抽出部47は、αに任意の値を代入するとともに、X1に各セットにおける度数分布の変化量をそれぞれ代入する。これにより、各セットでのがん細胞の計算値(Y)が求められる。
【0091】
(C)指標抽出部47は、各々の顕微鏡画像のセットについて、(B)で求めた計
算値Yと、実際のiPS細胞の数(教師値)との誤差をそれぞれ求める。なお、上記の教師値は、読み込んだiPS細胞の数の情報に基づいて、指標抽出部47が求めるものとする。
そして、指標抽出部47は、各顕微鏡画像のセットでの計算値の誤差がより小さくなるように、教師付き学習により上記の計算式の係数αを修正する。
【0092】
(D)指標抽出部47は、上記の(B)および(C)の処理を繰り返し、上記(A)の指標について、計算値の平均誤差が最も小さくなる計算式のモデルを取得する。
(E)指標抽出部47は、190の各指標について、上記(A)から(D)の各処理を繰り返す。そして、指標抽出部47は、190の各指標における計算値の平均誤差を比較し、その平均誤差が最も低くなる指標を、評価情報の生成に用いる1番目の指標とする。
【0093】
(F)指標抽出部47は、上記(E)で求めた1番目の指標と組み合わせる2番目の指標を求める。このとき、指標抽出部47は、上記の1番目の指標と残りの189の指標とを1つずつペアにしてゆく。次に、指標抽出部47は、各々のペアにおいて、計算式でがん細胞の予測誤差を求める。
【0094】
仮に、2つの指標からがん細胞の数を求める計算式を「Y=αX1+βX2」(但し、「Y」はがん細胞の計算値、「X1」は1番目の指標に対応する度数分布の変化量、「α」はX1に対応する係数値、「X2」は、選択された指標に対応する度数分布の変化量、「β」はX2に対応する係数値、をそれぞれ示す)とする。
そして、指標抽出部47は、上記の(B)および(C)と同様の処理により、計算値の平均誤差が最も小さくなるように、上記の係数α、βの値を求める。
【0095】
その後、指標抽出部47は、各々のペアで求めた計算値の平均誤差を比較し、その平均誤差が最も低くなるペアを求める。そして、指標抽出部47は、平均誤差が最も低くなるペアの指標を、評価情報の生成に用いる1番目および2番目の指標とする。
【0096】
(G)指標抽出部47は、所定の終了条件を満たした段階で演算処理を終了する。例えば、指標抽出部47は、指標を増やす前後の各計算式による平均誤差を比較する。そして、指標抽出部47は、指標を増やした後の計算式による平均誤差が、指標を増やす前の計算式による平均誤差より高い場合(または両者の差が許容範囲に収まる場合)には、演算処理を終了する。
【0097】
(H)一方、上記(G)で終了条件を満たさない場合、指標抽出部47は、さらに指標の数を1つ増やして、上記(F)および(G)と同様の処理を繰り返す。これにより、上記の計算モデルを求めるときに、ステップワイズな変数選択によって指標の絞り込みが行われることとなる。
【0098】
指標抽出部47は、上記で求めた計算モデルの情報(計算式に用いる各指標を示す情報、計算式で各々の指標に対応する係数値の情報など)を記憶部43に記録する。
【0099】
なお、指標としては上記の指標に限られるものではなく、指標抽出部47は、0時間目、24時間目、48時間目、72時間目、96時間目、120時間目、148時間目、および168時間目の各々を基準として、1種類の特徴量に対して36(=9×8÷2)通りの指標をそれぞれ求め、19種類の特徴量に対して合計684(19種類×36通り)の指標を求めてもよい。
このような基準となる時刻が異なる指標を用いることにより、指標抽出部47は、より予測精度が高い計算モデルを構築することができる。
【0100】
評価処理部48は、記憶部43から対象画像の入力値1から入力値4と、計算モデルの情報を読み出す。
評価処理部48は、既に構築された計算モデルの計算式に用いる指標の値のみを入力値1から入力値4から選択する。
【0101】
例えば、評価処理部48は、対象画像において、「8時間目の細胞の長さの標準偏差」と「96時間目の細胞丸さのヒストグラムと12時間目の細胞丸さのヒストグラムの面積差」とを選択する。
評価処理部48は、上記選択した指標を計算モデルに入力し、推定した分化度を算出する。
【0102】
CPU42は、評価処理部48が推定したiPS細胞の状態に基づき、iPS細胞又はフィーダー細胞の培養条件(例えば温度、湿度等)を変更するよう制御する。例えば、CPU42は、温度調整装置15aに制御信号を供給し、恒温室15内の温度を上昇させるように制御する。また、CPU42は、湿度調整装置15bに制御信号を供給し、恒温室15内の湿度を下降させるように制御する。
【0103】
<iPS細胞の観察の例>
図11は、インキュベータにおける観察処理の一例を示すフローチャートである。この図11は、恒温室15内に搬入された培養容器19を、登録された観察スケジュールに従ってタイムラプス観察する動作例を示している。
【0104】
ステップS101において、CPU42は、記憶部43の管理データの観察スケジュールと現在日時とを比較して、培養容器19の観察開始時間が到来したか否かを判定する。観察開始時間となった場合(ステップS101 YES)、CPU42はS102に処理を移行させる。一方、培養容器19の観察時間ではない場合(ステップS101 NO)には、CPU42は次の観察スケジュールの時刻まで待機する。
【0105】
次に、ステップS102において、CPU42は、観察スケジュールに対応する培養容器19の搬送を容器搬送装置23に指示する。そして、容器搬送装置23は、指示された培養容器19をストッカー21から搬出して観察ユニット22の試料台31に載置する。なお、培養容器19が試料台31に載置された段階で、スタンドアーム32に内蔵されたバードビューカメラ(不図示)によって培養容器19の全体観察画像が撮像される。
【0106】
次に、ステップS103において、CPU42は、観察ユニット22に対して細胞の顕微鏡画像の撮像を指示する。観察ユニット22は、LED光源35を点灯させて培養容器19を照明するとともに、撮像装置34を駆動させて培養容器19内の細胞の顕微鏡画像を撮像する。
【0107】
このとき、撮像装置34は、記憶部43に記憶されている管理データに基づいて、ユーザの指定した撮像条件(対物レンズの倍率、容器内の観察地点)に基づいて顕微鏡画像を撮像する。例えば、培養容器19内の複数のポイントを観察する場合、観察ユニット22は、試料台31の駆動によって培養容器19の位置を逐次調整し、各々のポイントでそれぞれ顕微鏡画像を撮像する。なお、S103で取得された顕微鏡画像のデータは、制御装置41に読み込まれるとともに、CPU42の制御によって記憶部43に記録される。
【0108】
次に、ステップS104において、CPU42は、観察スケジュールの終了後に培養容器19の搬送を容器搬送装置23に指示する。そして、容器搬送装置23は、指示された培養容器19を観察ユニット22の試料台31からストッカー21の所定の収納位置に搬送する。その後、CPU42は、観察シーケンスを終了してS101に処理を戻す。以上で、本フローチャートの説明を終了する。
【0109】
<計算モデル用の教師値算出の例>
図12は、計算モデル用の教師値の算出を説明するためのフローチャートである。この計算モデルの生成処理では、画像の撮影時間および特徴値の種類がそれぞれ異なる複数の度数分布の組み合わせから、iPS細胞の状態の推定に用いる度数分布の組み合わせを、制御装置41が決定する。
【0110】
まず、ステップS201において、撮像装置34は、iPS細胞とiPS細胞の周囲に存在し、共に培養されているフィーダー細胞とが撮像された参照画像を継続的に取得し、記憶部43に保存する。
【0111】
次に、ステップS202において、一定期間培養後に、ユーザは、画像撮影した細胞を染色マーカー(例えば、分化度を示す染色マーカーであるSSEA−4、SSEA−1、およびnanog等)で染色する。
なお、CPU42が、一定期間培養後に、予め容器に入れられた染色マーカーを培養液に加えることに制御してもよい。これによって、画像撮影した細胞を染色マーカーで染色することができる。
【0112】
撮像装置34は、位相差観察用の顕微光学系で結像された染色されたiPS細胞を撮像する。なお、染色マーカーが蛍光物質で標識されている場合には、撮像装置34は、図示されていない蛍光観察用の顕微光学系で結像された染色されたiPS細胞を撮像する。そして、撮像装置34は、染色後の画像を記憶部43に保存する。
【0113】
次に、ステップS203において、CPU42は、記憶部43から染色後の画像を読み出す。CPU42は、iPS細胞毎に染色の有無を判定する。
次に、ステップS204において、CPU42は、画像の教師値(分化度)を算出する。例えば、染色細胞数が72個、全体のiPS細胞数が100個だとすると、画像の教師値(分化度)は染色細胞数/全体の細胞数=72(%)となる。
【0114】
次に、ステップS205において、ステップS201からステップS204の処理を全てのサンプルに対して所定の回数行っていない場合(ステップS201 NO)、上記工程を他のiPS細胞とフィーダー細胞とが共培養されたサンプルに対して、各々数十から数百枚行う。
【0115】
例えば、ユーザが、分化度20付近(サンプル30個)、分化度50付近(サンプル30個)、分化度80付近(サンプル30個)、分化度100付近(サンプル30個)のサンプルに対して、24時間おきに4日間画像を撮影する。
【0116】
上記継続培養画像は、4[条件]×30[サンプル]=120[枚]が、4日分存在するため、各120枚の画像に対して、0時間目、24時間目、48時間目、72時間目、96時間目の5点が存在する。また、それぞれの画像に対して、CPU42は、教師値(分化度)を算出し、記憶部43に保存する。
【0117】
次に、ステップS205において、ステップS201からステップS204の処理を全てのサンプルに対して所定の回数行った場合(ステップS201 YES)、本フローチャートは、終了する。
【0118】
図13は、計算モデルの構築を説明するためのフローチャートである。
まず、ステップS301において、CPU42は、予め用意されたサンプルの顕微鏡画像のデータを記憶部43から読み込む。なお、S301でのCPU42は、各画像に対応する細胞の総数およびiPS細胞の数を示す情報もこの時点で取得するものとする。
【0119】
次に、ステップS302において、CPU42は、上記のサンプルの顕微鏡画像のうちから、処理対象となる画像を指定する。ここで、S302でのCPU42は、予め用意されているサンプルの顕微鏡画像のすべてを処理対象として順次指定してゆくものとする。
【0120】
次に、ステップS303において、領域抽出部44は、処理対象の顕微鏡画像について、画像内に含まれるiPS細胞のコロニーの領域と、フィーダー細胞の領域とを抽出する。
【0121】
次に、ステップS304において、特徴量算出部45は、処理対象の顕微鏡画像中に含まれる各iPS細胞のコロニーと、各iPS細胞と、各フィーダー細胞との形態的特徴を示す特徴量を算出する。例えば、各経時120(=4[条件]×30[枚])枚の画像に対して、各経時における特徴量を算出する。
【0122】
次に、ステップS305において、特徴量算出部45は、算出した全ての特徴量を記憶部43に保存する。
次に、ステップS306において、全画像を全画像の特徴量を算出していない場合(ステップS306 NO)、ステップS302に戻る。全画像を全画像の特徴量を算出した場合(ステップS306 YES)、ステップS307に遷移する。
【0123】
次に、ステップS307において、度数分布算出部46は、各経時の特徴量の平均値と、各経時の特徴量の標準偏差と、各経時の特徴量の度数分布を算出する。換言すれば、度数分布算出部46は、各画像中のすべての細胞1つ1つの形態情報を収集し、これを集団としてヒストグラム化する。
【0124】
次に、ステップS308において、指標抽出部47は、特徴量毎に、経時間の特徴量の度数分布の面積の差を、経時の全組み合わせに対して算出する。
例えば、各120枚の画像に対して、0時間目、24時間目、48時間目、72時間目、96時間目の5点が存在するとする。そうすると、以下の10個の経時の組み合わせが存在する。その経時の組み合わせは、[時間目]−[時間目]の書式で表すと、24−0、48−0、72−0、96−0、48−24、72−24、96−24、72−48、96−48、96−72である。
【0125】
次に、ステップS309において、全ての特徴量で、経時間の特徴量の度数分布の面積の差を、経時の全組み合わせに対して算出していない場合(ステップS309 NO)、ステップS308に戻る。ステップS309において、全ての特徴量で、経時間の特徴量の度数分布の面積の差を、経時の全組み合わせに対して算出した場合(ステップS309 YES)、ステップS310に遷移する。
【0126】
次に、ステップS310において、指標抽出部47は、190の指標のうちから、iPS細胞の状態をよく反映する指標を多変量解析により1以上指定する。この指標の組合せの選択は、前述したファジーニューラルネットワークと同等の非線形モデル以外にも、細胞とその形態の複雑性に応じて線形モデルの利用も有効である。このような指標の組合せの選択と共に、指標抽出部47は、上記の指定された1以上の指標を用いて、顕微鏡画像からiPS細胞の状態を導出する計算モデルを求める。
【0127】
次に、ステップS311において、指標抽出部47は、計算モデルの情報(計算式に用いる各指標を示す情報、計算式で各々の指標に対応する係数値の情報など)を記憶部43に記録する。以上で、本フローチャートは終了する。
【0128】
<iPS細胞の状態推定処理の例>
図14は、計算モデルを用いたiPS細胞の分化度を推定するためのフローチャートである。
まず、ステップS401において、評価処理部48は、評価対象となる複数の顕微鏡画像(対象画像)のデータを記憶部43から読み込む。ここで、対象画像は、細胞群を培養した培養容器19をインキュベータ11によって同一視野を同一の撮影条件でタイムラプス観察して取得されたものとする。また、この場合のタイムラプス観察は、図13の例と条件を揃えるために、培養開始を初回として24時間おきに96時間目まで行うものとする。
【0129】
次に、ステップS402において、評価処理部48は、記憶部43の計算モデルの情報(図13のS311で記録されたもの)を読み込む。
次に、ステップS403において、特徴量算出部45、度数分布演算部46および評価処理部48は、上記の計算モデルの変数に対応する各指標について、それぞれ度数分布の変化量を求める。
【0130】
次に、ステップS304において、評価処理部48は、ステップS403で求めた各指標の度数分布の変化量を、S302で読み出した計算モデルに代入して演算を行う。そして、評価処理部48は、上記の演算結果に基づいて、評価対象の顕微鏡画像におけるiPS細胞の分化度を示す推定情報を生成する。その後、評価処理部48は、この推定情報を不図示のモニタ等に表示させる。以上で、本フローチャートは終了する。
【0131】
第1の実施例によれば、iPS細胞のコロニーの形態的特徴量と、iPS細胞の形態的特徴量と、フィーダー細胞の形態的特徴量とから、iPS細胞の状態を推定することができる。
【0132】
なお、第1の実施例では、iPS細胞のコロニーの形態的特徴量と、iPS細胞の形態的特徴量と、フィーダー細胞の形態的特徴量とから、iPS細胞の分化度を推定したがこれに限らない。
フィーダー細胞の形態的特徴量の度数分布の時間変化のみから、iPS細胞の分化度を推定してもよい。
また、フィーダー細胞の形態的特徴量の度数分布の時間変化と、個別のiPS細胞の形態的特徴量の度数分布の時間変化またはiPS細胞のコロニーの形態的特徴量の度数分布の時間変化とから、iPS細胞の分化度を推定してもよい。
【0133】
なお、第1の実施例では、iPS細胞の分化度を推定したがこれに限らず、iPS細胞の劣化度合い、iPS細胞の増殖度、iPS細胞の分化の方向性、iPS細胞の腫瘍化しやすさ等でもよい。
【0134】
<実施例2>
上記の実施例1は、連続値でiPS細胞の状態を評価したが、本実施例2ではレベルとして大まかにiPS細胞の状態を区分する。本実施例2の方法は、染色評価の信頼性や実施例1の推定精度によっては連続値評価が適していない場合に、特に有用である。以下、本発明の第2の実施例について、図面を参照して詳細に説明する。
【0135】
図15は、本発明の第2の実施例であるインキュベータのブロック構成図である。インキュベータ11aは、上部ケーシング12と、下部ケーシング13aとを用いて構成されている。下部ケーシング13aは、撮像装置34と制御装置41aとを用いて構成されている。制御装置(細胞評価装置)41aは、CPU42aと記憶部43aとを用いて構成されている。
CPU42aと記憶部43a以外は、図3のブロック構成図と同じであるので、CPU42aと記憶部43a以外は説明を省略する。
【0136】
記憶部43aは、ハードディスクや、フラッシュメモリ等の不揮発性の記憶媒体などで構成される。この記憶部43aは、不図示のストッカーに収納されている各培養容器(不図示)に関する管理データと、撮像装置で撮像された顕微鏡画像のデータとを保持する。
さらに、記憶部43aは、CPU42aによって実行されるプログラムと、指標抽出部47aで算出された判別モデルの情報とを保持する。
【0137】
CPU42aは、記憶部43aに記憶されているプログラムを読み出して実行することにより、領域抽出部44と、特徴量算出部45aと、度数分布算出部46と、指標抽出部47aと、評価処理部48aとの各部の機能を実現する。
【0138】
領域抽出部44と、度数分布算出部46との処理は、第1の実施例と同じなので、説明を省略する。
【0139】
特徴量算出部45aは、実施例1と同様に、領域抽出部44により画像から抽出した各画像のオブジェクトに対して、細胞の形態的特徴を示す特徴量をそれぞれ求める。一例として、特徴量算出部45aは、各細胞について19種類の特徴量をそれぞれ求める。
【0140】
特徴量算出部45aは、演算対象の教師画像について、19種類の特徴量の画像内平均値および画像内標準偏差をそれぞれ求める。そして、特徴量算出部45aは、上記の各特徴量の画像内平均値および画像内標準偏差をそれぞれ記憶部43aに記録する。
【0141】
これにより、細胞の継代数が同一であって観察時期(0、24、48、72、96時間目)がいずれも異なる5枚分の教師画像について、各観察時期においてそれぞれ38の特徴量(19種類×2通り(平均値、標準偏差))が求まることとなる。
【0142】
特徴量算出部45aは、以下の(A1)−(A3)の処理によって、継代数が共通する教師画像をグループ化し、グループ化した教師画像群のうちの2つの教師画像間で各特徴量の変化量を求める。
【0143】
(A1)特徴量算出部45aは、細胞の継代数が同一であって観察時期(0、24、48、72、96時間目)がいずれも異なる6枚分の教師画像をそれぞれグループ化する。特に限定するものではないが、グループ化する教師画像は、培養容器および撮像した位置(視野)が共通する5枚の顕微鏡画像であることが好ましい。
【0144】
(A2)特徴量算出部45aは、上記(A1)でグループ化した教師画像群において、撮像時点の異なる2つの教師画像を組み合わせる。ここで、1グループの教師画像は5枚であるので、2つの教師画像の組み合わせは10通りとなる。また、2つの教師画像の組み合わせは10通りであるため、1グループの教師画像群から求まる変化量は380種類(19の特徴量×2通り(平均値、標準偏差)×10通りの組み合わせ)となる。
【0145】
(A3)特徴量算出部45aは、上記(A2)の1つの組み合わせごとに、2つの教師画像間における各特徴量の画像内平均値の変化を示す19種類の変化量と、2つの教師画像間における各特徴量の画像内標準偏差の変化を示す19種類の変化量とをそれぞれ求める。
【0146】
続いて、指標抽出部47aの処理について、説明する。
指標抽出部47aは、度数分布算出部46で算出された形態的特徴量の度数分布の各経時の面積差を算出する。
【0147】
指標抽出部47aは、特徴量算出部45aで算出された形態的特徴量と、形態的特徴量の度数分布の面積差とに基づいて、異なる分化を示す細胞を、分化毎にクラス分けする判別モデルを構築する。本第2の実施例での指標抽出部47aは、判別モデルの1つの形態として、決定木解析(Decision tree analysis)を採用し、細胞の継代回数に応じて顕微鏡画像をクラス分けする決定木を構築する。
【0148】
<決定木の構築方法>
以下、指標抽出部47aが決定木を構築する方法について説明する。
指標抽出部47aは、決定木の根ノードにおいて、継代数の異なる細胞を分類するときに適用するパラメータの種類(指標の種類)とそのパラメータの値(指標の閾値)とを求める。なお、上記のパラメータの種類は、各観察時期(0、24、48、72、96時間目)の各特徴量(150種類)および特徴量の変化量(380種類)のうちから選択される。
【0149】
以下、上記の指標の種類および指標の閾値の求め方の一例を説明する。まず、指標抽出部47aは、上記の530(=150+380)種類のパラメータのうちから演算対象のパラメータを選択する。このとき、指標抽出部47aは、演算対象のパラメータに対応する教師画像群を予め抽出する。なお、抽出された教師画像群には、細胞の継代数の異なる教師画像が含まれる。
【0150】
次に、指標抽出部47aは、演算対象のパラメータに探索範囲(上限および下限)を設定するとともに、演算対象のパラメータの探索範囲を任意の刻みで複数に区切る。指標抽出部47aは、演算対象のパラメータの各刻み(パラメータの値)を閾値として、演算対象のパラメータに対応する教師画像群の細胞を2つの集合に分類する。これにより、演算対象のパラメータの各刻みにおいて、教師画像群の細胞の分類結果がそれぞれ得られる。
このとき、指標抽出部47aは、分類結果の各集合において、細胞の継代数に応じた細胞の数の分布をそれぞれ求めておく。
【0151】
指標抽出部47aは、上記の450種類の全パラメータでそれぞれ同様の処理を行い、各パラメータの個々の刻みにおける教師画像群の分類結果を取得する。そして、指標抽出部47aは、全ての分類結果のうちから、継代数の異なる細胞の分類に最も適したパラメータの種類(指標の種類)およびそのパラメータでの閾値(指標の閾値または指標の閾値)を決定する。
【0152】
一例として、指標抽出部47aは、パラメータの種類および閾値の組み合わせのうち、任意の継代数の細胞を一方の集合に完全に分離できるものを、指標の種類および指標の閾値に決定する。上記条件に該当する組み合わせが複数ある場合、指標抽出部47aは、1種類分の任意の継代数の細胞のみを一方の集合に分離できるものを優先して上記の指標の種類および指標の閾値を決定すればよい。
【0153】
また、上記条件に該当する組み合わせがない場合、指標抽出部47aは、以下の要領で指標の種類および指標の閾値を決定してもよい。例えば、指標抽出部47aは、2つの集合に同じ継代数の教師画像が含まれるが、一方の集合は1種類分の継代数の教師画像のみを抽出でき、かつ、一方の集合で抽出できる教師画像の数が最も多くなるものを優先して上記の指標の種類および指標の閾値を決定すればよい。
【0154】
指標抽出部47aは、次に指標の種類および指標の閾値を求める演算対象のノードを指定する。例えば、指標抽出部47aは、親ノードから左右に分岐する子ノードのうち左側のノードを指定する。なお、左側の子ノードよりも下層の全ノードで既に指標の種類および指標の閾値が求められている場合、指標抽出部47aは、親ノードから右側に分岐するノードを指定する。
【0155】
指標抽出部47aは、現在の演算対象のノードがそれ以上に分岐できないターミナルノードであるか否かを判定する。例えば、指標抽出部47aは、現在の演算対象のノードで1種類分の継代数の細胞が分離できている場合、ターミナルノードであると判定する。
【0156】
指標抽出部47aは、演算が完了したか否かを判定する。なお、指標抽出部47aは、ターミナルノードを除くすべてのノードで指標の種類および指標の閾値を求め終えた場合に演算が完了したものと判定する。
【0157】
指標抽出部47aは、現在の演算対象のノードにおいて、指標の種類および指標の閾値を求める。その後、指標抽出部47aは、演算対象のノードを変更する。その後、ループにより、各ノードでの指標の種類および指標の閾値が再帰的に求められる。
指標抽出部47aは、以上の処理で構築された判別モデルのデータを記憶装置43aに記録する。
【0158】
<指標の算出方法>
指標抽出部47aは、下記の2つの方法を用いて、iPS細胞の状態を区分するための指標を算出する。
1つ目の方法として、指標抽出部47aは、細胞の状態を染色等で評価し、「レベル」として大まかにいくつかに区分する。例えば、指標抽出部47aは、分化度小、分化度中、および分化度大に区分する。すなわち、指標抽出部47aは、順番や優劣が存在するものを、いくつかの「レベル」に区分する。
【0159】
2つ目の方法として、指標抽出部47aは、細胞の品質を染色等で評価し、「グループ」として大まかにいくつかに区分する。例えば、指標抽出部47aは、骨分化グループ、軟骨分化グループおよび脂肪分化グループに区分する。すなわち、指標抽出部47aは、各グループに順番や優劣はなく、並列的なグループであり、数字等で各グループをうまく言い表すことができないものを、いくつかの「グループ」に区分する。
【0160】
指標抽出部47aは、決定木法を用いて、下記の2種類のモデルを作る。
指標抽出部47aは、画像別モデルとして、画像毎の入力値と画像毎の教師値を用いて、データをグループ化する。指標抽出部47aは、各「レベル」または各「グループ」を区分し、細胞の分化の度合いのレベルを分類し、各分化の種類が分類する。
【0161】
指標抽出部47aは、細胞別モデルとして、細胞毎の入力値と細胞毎の教師値を用いて、データをグループ化する。指標抽出部47aは、画像中の細胞1つ1つに対して、各細胞のレベルやグループを区分する。これによって、1つ1つの細胞において、どんな形の指標の組み合わせならば、どんなレベルかグループに相当するかがわかる。
【0162】
指標抽出部47aは、上記各分類において、用意された「レベル」または「グループ」という多群をもっともよく別々に分離できる精度が高くなるように、各「レベル」または各「グループ」に対して指標の組み合わせと、その指標の閾値を選ぶ。
指標抽出部47aは、決定木の指標とその指標の閾値を記憶部43aに保存する。
【0163】
評価処理部48aは、記憶部43aからその決定木の指標とその指標の閾値を読み出す。評価処理部48aは、対象画像の特徴量からその指標の値を抽出する。評価処理部48aは、決定木のノードの指標ごとに、対象画像から抽出した指標の値と閾値とを比較する。これによって、評価処理部48aは、対象画像または対象iPS細胞を、「レベル」または「グループ」に分類する。評価処理部48aは、分類結果に基づいて、iPS細胞の状態の推定結果を算出する。
以下、指標抽出部47aと評価処理部48aとの具体的な処理例について説明する。
【0164】
<画像別、コロニー+フィーダーモデル>
図16は、画像別、コロニー+フィーダーモデルの決定木を説明するための図である。
図16の決定木は、分化のグループを分けた一例である。対象画像において、96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差が20以上であれば、グループ1(骨の分化グループ)に属する。
【0165】
対象画像において、96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差が20未満で、24時間のコロニーの丸さの平均値が30以上であれば、グループ2(軟骨の分化グループ)に属する。
対象画像において、96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差が20未満で、24時間のコロニーの丸さの平均値が30未満であれば、グループ3(脂肪の分化グループ)に属する。
【0166】
指標抽出部47aは、画像別モデルとして、iPS細胞のコロニーの特徴量とフィーダー細胞の特徴量を用いた決定木の指標の種類を算出する。
例えば、指標抽出部47aは、「96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差」と「24時間目のコロニーの丸さの平均値」という指標の種類を選択する。
【0167】
また、指標抽出部47aは、各指標の種類に対して、どの値以上または未満で判断するかという閾値(指標の閾値)を決定する。
例えば、指標抽出部47aは、指標「96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差」の種類に対して、指標の閾値20を決定し、指標の種類「24時間目のコロニーの丸さの平均値」に対して、指標の閾値30を決定する。
【0168】
<画像別、コロニー・フィーダーモデル>
図17は、画像別、コロニー・フィーダー別モデルの決定木を説明するための図である。
図17(a)は、画像別の、iPS細胞のコロニーの特徴量に基づく決定木(以下、コロニーモデル)を説明するための図である。図17(a)の決定木は、分化のグループを分けた一例である。対象画像において、24時間のコロニーの丸さの平均値が20以上であれば、グループ1(骨の分化グループ)に属する。
【0169】
対象画像において、24時間のコロニーの丸さの平均値が20未満で、96時間目と24時間目のコロニーの長さの変化量が100以上であれば、グループ2(軟骨の分化グループ)に属する。
一方、対象画像において、24時間のコロニーの丸さの平均値が20未満で、96時間目と24時間目のコロニーの長さの変化量が100未満であれば、グループ3(脂肪の分化グループ)に属する。
【0170】
図17(b)は、画像別の、フィーダー細胞の特徴量に基づく決定木(以下、フィーダーモデルと称する)を説明するための図である。図17(b)の決定木は、iPS細胞の劣化度合いのレベルを分けた一例である。対象画像において、48時間のフィーダー細胞の丸さの平均値が40以上であれば、グループ1(劣化度合い:大)に属する。
【0171】
対象画像において、48時間のフィーダー細胞の丸さの平均値が40未満で、96時間目と24時間目のフィーダー細胞の丸さのヒストグラムの面積差が50以上であれば、グループ2(劣化度合い:中)に属する。
一方、対象画像において、48時間のフィーダー細胞の丸さの平均値が40未満で、96時間目と24時間目のフィーダー細胞の丸さのヒストグラムの面積差が50未満であれば、グループ3(劣化度合い:小)に属する。
【0172】
指標抽出部47aは、画像別モデルとして、iPS細胞のコロニーの特徴量とフィーダー細胞の特徴量を用いた別々の決定木の指標を算出する。
例えば、指標抽出部47aは、コロニーモデルに対して、「24時間目のコロニーの丸さの平均値」と「96時間目と24時間目のコロニーの長さの変化量」という指標の種類を選択する。
また、指標抽出部47aは、フィーダーモデルに対して、「48時間目のフィーダー細胞の丸さの平均値」と「96時間目と24時間目のフィーダー細胞の丸さのヒストグラムの面積差」という指標の種類を選択する。
【0173】
また、指標抽出部47aは、各指標の種類に対して、指標の閾値を決定する。
例えば、指標抽出部47aは、指標の種類「24時間目のコロニーの丸さの平均値」に対して、指標の閾値20を決定し、指標の種類「96時間目と24時間目のコロニーの長さの変化量」に対して、指標の閾値100を決定する。
【0174】
また、指標抽出部47aは、指標の種類「48時間目のフィーダー細胞の丸さの平均値」に対して、指標の閾値40を決定し、指標の種類「96時間目と24時間目のフィーダー細胞の丸さのヒストグラムの面積差」に対して、指標の閾値50を決定する。
【0175】
評価処理部48aは、コロニーモデルでグループ1(分化グループ:骨)、フィーダーモデルでグループ3(劣化度合い:小)というような複合的な推定をする。
なお、評価処理部48aは、コロニーモデルでグループ1(分化グループ骨)、フィーダーモデルでグループ1(分化グループ骨)の両方でグループ名が一致した場合のみ、確かな予測とすることにしてもよい。
【0176】
<細胞別、コロニー・フィーダー別モデル>
図18は、細胞別、コロニー・フィーダー別モデルの決定木を説明するための図である。図18(a)は、細胞毎のコロニーモデルを説明するための図である。図18(a)の決定木は、分化のグループを分けた一例である。対象画像のあるiPS細胞のコロニーにおいて、24時間のコロニーの丸さの平均値が80以上で、96時間目と24時間目の96時間目と24時間目のコロニーの丸さのヒストグラムの面積差が20未満であれば、そのiPS細胞はグループ1(骨の分化グループ)に属する。
【0177】
対象画像のあるiPS細胞のコロニーにおいて、24時間のコロニーの丸さが80以上で、96時間目と24時間目のコロニーの丸さのヒストグラムの面積差が20以上であれば、そのiPS細胞はグループ2(軟骨の分化グループ)に属する。
一方、対象画像のあるiPS細胞のコロニーにおいて、24時間のコロニーの丸さが80未満であれば、そのiPS細胞はグループ3(脂肪の分化グループ)に属する。
【0178】
図18(b)は、細胞毎のフィーダーモデルを説明するための図である。図18(b)の決定木は、分化のグループを分けた一例である。対象画像において、状態を推定したいiPS細胞の周囲に存在するフィーダー細胞において、48時間のフィーダーの長さが20以上で、24時間目のフィーダーの輝度が30以上であれば、そのiPS細胞はレベル1(増殖能:高)に属する。
【0179】
対象画像において、状態を推定したいiPS細胞の周囲に存在するフィーダー細胞において、48時間のフィーダーの長さが20以上で、24時間目のフィーダーの輝度が30以上であれば、そのiPS細胞はレベル2(増殖能:中)に属する。
一方、対象画像において、状態を推定したいiPS細胞の周囲に存在するフィーダー細胞において、48時間のフィーダーの長さが20以上で、24時間目のフィーダーの輝度が30以上であれば、そのiPS細胞はレベル3(増殖能:小)に属する。
【0180】
指標抽出部47aは、個々の細胞レベルでiPS細胞の状態を推定するために、iPS細胞のコロニーの特徴量を用いた決定木と、フィーダー細胞の特徴量を用いた決定木とを作成する。
指標抽出部47aは、iPS細胞のコロニー1つ1つに対して、コロニーモデルの指標の組み合わせを検証して、コロニーに対する指標を算出する。
【0181】
また、指標抽出部47aは、フィーダー細胞1つ1つに対して、フィーダーモデルの指標の組み合わせを検証して、フィーダー細胞に対する指標を算出する。
また、指標抽出部47aは、各指標の種類に対して、指標の閾値を決定する。
【0182】
例えば、指標抽出部47aは、指標の種類「24時間目のコロニーの丸さ」に対して、指標の閾値80を決定し、指標の種類「96時間目と24時間目のコロニーの丸さのヒストグラムの面積差」に対して、指標の閾値20を決定する。
また、指標抽出部47aは、指標の種類「48時間目のフィーダー細胞の長さ」に対して、指標の閾値20を決定し、指標の種類「24時間目のフィーダー細胞の輝度」に対して、指標の閾値30を決定する。
【0183】
対象画像において、あるiPS細胞の状態を推定する際には、評価処理部48aは、2つのモデルの結果を総合して、iPS細胞の状態を推定する。
例えば、コロニーモデルにおいて、iPS細胞のコロニーの24時間目のコロニーの丸さ80以上、96時間目と24時間目のコロニーの丸さのヒストグラムの面積差が20未満であれば、評価処理部48aは、iPS細胞をグループ1に分類する。これによって、評価処理部48aは、そのiPS細胞が骨に分化する能力をもつと推定する。
【0184】
また、例えば、そのiPS細胞の周囲に存在するフィーダー細胞の形態的特徴量のうち、48時間目のフィーダー細胞の長さが20以上で、24時間目のフィーダー細胞の輝度が30以上であれば、評価処理部48aは、iPS細胞をレベル1に分類する。これによって、評価処理部48aは、iPS細胞の増殖能が高いと推定する。
そして、評価処理部48aは、iPS細胞を骨に分化する能力があり、増殖能が高いと複合的に推定する。
【0185】
CPU42aは、評価処理部48aが推定したiPS細胞の状態に基づき、iPS細胞又はフィーダー細胞の培養条件(例えば温度、湿度等)を変更するよう制御する。例えば、CPU42aは、温度調整装置15aに制御信号を供給し、恒温室15内の温度を上昇させるように制御する。また、CPU42aは、湿度調整装置15bに制御信号を供給し、恒温室15内の湿度を下降させるように制御する。
【0186】
図19は、決定木算出用の教師値の算出を説明するためのフローチャートである。
まず、ステップS501において、撮像装置34は、iPS細胞とiPS細胞の周囲に存在し、共に培養されているフィーダー細胞とが撮像された参照画像を継続的に取得し、記憶部43aに保存する。
【0187】
次に、ステップS502において、一定期間培養後に、ユーザは、画像撮影した細胞を染色マーカー(例えば、分化度を示す染色マーカーであるSSEA−4、SSEA−1、およびnanog等)で染色する。
なお、CPU42aが、一定期間培養後に、予め容器に入れられた染色マーカーを培養液に加えることに制御してもよい。これによって、画像撮影した細胞を染色マーカーで染色することができる。
【0188】
次に、ステップS503において、CPU42aは、染色画像から細胞毎に染色の有無を判定する。
次のステップS504とステップS505において、CPU42aは、評価の結果を「レベル」か「グループ」として評価し、下記の画像別教師値と細胞別教師値をつくる。なお、教師値は、染色結果だけでなく、熟練者による評価に基づいてもよい。
【0189】
<画像別教師値>
まず、ステップS504において、CPU42aは、画像ごとに、画像中に含まれる細胞と認識される画像中のオブジェクト1個1個に対して、染色の有無を判定する。染色の判定の際、CPU42aは、オブジェクトの輝度値が所定の閾値よりも大きい場合には、「染色有り」と判定する。一方、指標抽出部47aは、オブジェクトの輝度値が所定の閾値以下の場合には、「染色無し」と判定する。
【0190】
そして、CPU42aは、全体の細胞数に対する「染色有り」と判定された細胞数の割合を算出する。CPU42aは、その割合に基づいて、その画像毎に、「レベル」または「グループ」の分類名を決定する。例えば、CPU42aは、ある画像に対して、「分化グループ:骨」と分類名を決定する。
【0191】
<細胞別教師値>
次に、ステップS505において、CPU42aは、各サンプル(=複数の画像から構成されるある1つの実験条件下のデータ)中の細胞と認識される画像中のオブジェクト1個1個に対して、染色の有無や、熟練者の経験に基づき、その細胞毎に、「レベル」または「グループ」の呼び名をつける。ここで、「判断不能」「ゴミ」などというグループを作ってもよい。
【0192】
次に、ステップS506において、全ての条件で、ステップS501からステップS505の処理を所定の回数行っていない場合(ステップS506 NO)、ステップS501に戻る。一方、ステップS506において、全ての条件で、ステップS501からステップS505の処理を所定の回数行った場合(ステップS506 YES)、本フローチャートは終了する。
【0193】
図20は、決定木算出用の特徴量の算出を説明するためのフローチャートである。図20のフローチャートの処理は、ユーザからの指示に応じてCPU42aが実行する。
まず、ステップS601において、CPU42aは、予め用意されたサンプルの顕微鏡画像のデータを記憶部43aから読み込む。なお、S601でのCPU42aは、各画像に対応する細胞の総数およびiPS細胞の数を示す情報もこの時点で取得するものとする。
【0194】
次に、ステップS602において、CPU42aは、上記のサンプルの顕微鏡画像のうちから、処理対象となる画像を指定する。ここで、S602でのCPU42aは、予め用意されているサンプルの顕微鏡画像のすべてを処理対象として順次指定してゆくものとする。
【0195】
次に、ステップS603において、領域抽出部44は、処理対象の顕微鏡画像について、画像内に含まれるiPS細胞のコロニーの領域と、フィーダー細胞の領域とを抽出する。
【0196】
次に、ステップS604において、特徴量算出部45aは、実施例1と同様に、領域抽出部44により画像から抽出した各画像のオブジェクトに対して、細胞の形態的特徴を示す特徴量をそれぞれ求める。一例として、特徴量算出部45aは、各細胞について図6に示された19種類の特徴量をそれぞれ求める。
【0197】
次に、ステップS605において、特徴量算出部45aは、演算対象の教師画像について、19種類の特徴量の画像内平均値および画像内標準偏差をそれぞれ求める。そして、特徴量算出部45aは、上記の各特徴量の画像内平均値および画像内標準偏差をそれぞれ記憶部43aに記録する。
【0198】
次に、ステップS606において、特徴量算出部45aが、全画像の特徴量を算出していない場合(S606 NO)、ステップS602に戻る。一方、特徴量算出部45aが、全画像の特徴量を算出した場合(S606 YES)、本フローチャートは終了する。
【0199】
図21は、画像別の決定木の算出を説明するためのフローチャートである。予め、図20のフローチャートで、特徴量算出部45aが各経時の各形態的特徴量の平均値(入力値1)および各経時の各形態的特徴量の標準偏差(入力値2)を算出しているものとする。
まず、ステップS701において、度数分布算出部46は、各経時の各形態的特徴量の度数分布(入力値3)を算出する。
【0200】
次に、ステップS702において、指標抽出部47aは、形態的特徴量ごとに、特徴量の度数分布の面積の差(入力値4)を経時の全組み合わせで算出する。
次に、ステップS703において、指標抽出部47aが、全ての特徴量で、各経時間の特徴量の度数分布の面積の差を算出していない場合(S703 NO)、指標抽出部47aは、ステップS702に戻る。一方、指標抽出部47aが、全ての特徴量で、各経時間の特徴量の度数分布の面積の差を算出した場合(S703 NO)、ステップS704に遷移する。
【0201】
次に、ステップS704において、指標抽出部47aは、画像毎の上記4つの入力値と画像毎の教師値を用いてデータをグループ化して、決定木を構築する。ここで、教師値は、例えば、細胞の分化の度合いを示すレベルであえば、高、中または小であり、分化の種類を示すグループであれば、骨、軟骨または脂肪である。
これによって、各「レベル」または各「グループ」が区分される。例えば、細胞の分化の度合いを示すレベルが分類されたり、各分化の種類を示すグループが分類されたりする。
【0202】
次に、ステップS705において、指標抽出部47aは、決定木の構造と、グループ化したときの指標の種類と、指標の種類毎の指標の閾値とを記憶部43aに保存する。以上で、本フローチャートは終了する。
【0203】
図22は、細胞別の決定木算出を説明するためのフローチャートである。
まず、ステップS801において、指標抽出部47aは、特徴量算出部45aにより算出された各画像中の細胞と認識されるオブジェクト1個1個に対して形の指標を、実験条件毎に記憶部43aから読み出す。
【0204】
次に、ステップS802において、指標抽出部47aは、細胞毎の上記4つの入力値と細胞毎の教師値を用いてデータをグループ化して、決定木を構築する。これによって、対象画像中の細胞1つ1つに対して、各細胞のレベル」または「グループ」が区分される。従って、1つ1つの細胞において、形の指標の組み合わせから、その細胞の「レベル」または「グループ」を特定することができる。
【0205】
次に、ステップS803において、指標抽出部47aは、決定木の構造と、グループ化したときの指標の種類と、指標の種類毎の指標の閾値とを記憶部43aに保存する。以上で、本フローチャートは終了する。
【0206】
続いて、判別モデルである決定木を用いて、対象画像からiPS細胞の状態を推定する3つの方法について説明する。まず、フィーダー細胞の形態的特徴量とiPS細胞のコロニーの特徴量とから、対象画像中に含まれるiPS細胞集団の状態を推定する方法について説明する。
【0207】
図23は、図16に示す画像別、コロニー+フィーダーモデルを用いたiPS細胞の状態の推定を説明するためのフローチャートである。
まず、ステップS901において、撮像装置34は、iPS細胞とiPS細胞の周囲に存在し、共に培養されているフィーダー細胞とが撮像された参照画像を継続的に取得し、記憶部43aに保存する。
【0208】
次に、ステップS902において、特徴量算出部45aは、上記4つの入力値を算出する。
次に、ステップS903において、評価処理部48aは、記憶部43aから画像別、コロニー+フィーダーモデルで用いられる指標の種類およびその指標の閾値を読み出す。
【0209】
次に、ステップS904において、評価処理部48aは、特徴量算出部45aが算出した4つの入力値から、読み出した指標の種類に該当する値を読み出す。
そして、評価処理部48aは、その読み出した指標の種類に該当する値を、その指標の閾値と比較することによって、iPS細胞を所定のグループに分類する。これによって、評価処理部48aは、iPS細胞の状態を推定することができる。
【0210】
例えば、評価処理部48aは、上記入力値から「96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差」と「24時間目のコロニーの丸さ平均値」という指標の種類に該当する値をそれぞれ読み出す(図16参照)。
そして、評価処理部48aは、「96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差」に該当する値が、その指標の閾値(20)以上であれば、iPS細胞を「骨に分化する能力を持つ」というグループに分類する。
【0211】
これによって、iPS細胞の周囲に存在するフィーダー細胞集団の形態的特徴量の度数分布の時間変化から、iPS細胞の分化の種類を推定することができる。
【0212】
一方、評価処理部48aは、入力値のうち「96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差」に該当する値が、その指標の閾値(20)未満であり、入力値のうち「24時間目のコロニーの丸さの平均値」に該当する値が、その指標の閾値(30)以上であれば、iPS細胞を「軟骨に分化する能力を持つ」というグループに分類する。
【0213】
これによって、iPS細胞の周囲に存在するフィーダー細胞集団の形態的特徴量の度数分布の時間変化と、iPS細胞のコロニー集団の形態的特徴量とから、iPS細胞の分化の種類を推定することができる。以上で、本フローチャートは終了する。
【0214】
2番目に、フィーダー細胞の形態的特徴量とiPS細胞のコロニーの特徴量とから、対象画像中に含まれるiPS細胞集団の状態を推定する方法について説明する。
図24は、図17に示す画像別、コロニー・フィーダー別モデルを用いたiPS細胞の状態の推定を説明するためのフローチャートである。
【0215】
まず、ステップS1001からステップS1002までは、ステップS901からステップS902までと同じなので、説明を省略する。
次に、ステップS1003において、評価処理部48aは、記憶部43aから画像別、コロニー・フィーダー別モデルで用いられる指標の種類およびその指標の閾値を読み出す。
【0216】
次に、ステップS1004において、評価処理部48aは、特徴量算出部45aが算出した4つの入力値から、コロニーモデルの指標の種類に該当する値を読み出す。
そして、評価処理部48aは、その読み出した指標の種類に該当する値を、その指標の閾値と比較することによって、iPS細胞を所定のグループに分類する。
【0217】
例えば、評価処理部48aは、上記入力値から「24時間目のコロニーの丸さの平均値」と「96時間目と24時間目のコロニーの長さの変化量」という指標の種類に該当する値をそれぞれ読み出す(図17(a)参照)。
そして、評価処理部48aは、入力値のうち「24時間目のコロニーの丸さの平均値」に該当する値が、その指標の閾値(20)以上であれば、iPS細胞を「骨に分化する能力を持つ」というグループに分類する。
【0218】
これによって、iPS細胞のコロニー集団の形態的特徴量から、iPS細胞の分化の種類を推定することができる。
【0219】
次に、ステップS1005において、評価処理部48aは、特徴量算出部45aが算出した4つの入力値から、フィーダーモデルの指標の種類に該当する値を読み出す。
そして、評価処理部48aは、その読み出した指標の種類に該当する値を、その指標の閾値と比較することによって、iPS細胞を所定のレベルに分類する。
【0220】
例えば、評価処理部48aは、上記入力値から「48時間目のフィーダー細胞の丸さ平均値」と「96時間目と24時間目のフィーダー細胞の丸さのヒストグラムの面積差」という指標の種類に該当する値をそれぞれ読み出す(図17(b)参照)。
そして、評価処理部48aは、入力値のうち「48時間目のフィーダー細胞の丸さ平均値」に該当する値が、その指標の閾値(40)以上であれば、iPS細胞を「大きな劣化度合い」というレベルに分類する。
【0221】
これによって、フィーダー細胞集団の形態的特徴量から、iPS細胞の劣化度合いを推定することができる。
【0222】
次に、ステップS1006において、評価処理部48aは、分類したグループとレベルに基づいて、iPS細胞の状態を複合的に推定する。
例えば、評価処理部48aは、コロニーモデルでグループ1(分化グループ:骨)、フィーダーモデルでレベル1(劣化度合い:大)に分類されたことから、iPS細胞は骨に分化したが、劣化が激しいという複合的な推定をする。以上で、本フローチャートは、終了する。
【0223】
最後に、フィーダー細胞の形態的特徴量とiPS細胞のコロニーの特徴量とから、対象画像中に含まれるiPS細胞集団の状態を推定する方法について説明する。
図25は、図18に示す細胞別、コロニー・フィーダー別モデルを用いたiPS細胞の状態の推定を説明するためのフローチャートである。
【0224】
まず、ステップS1101からステップS1102までは、ステップS901からステップS902までと同じなので、説明を省略する。
次に、ステップS1103において、評価処理部48aは、記憶部43aから細胞別、コロニー・フィーダー別モデルで用いられる指標の種類およびその指標の閾値を読み出す。
【0225】
次に、ステップS1104において、評価処理部48aは、特徴量算出部45aが算出した4つの入力値から、コロニーモデルの指標の種類に該当する値を読み出す。
そして、評価処理部48aは、その読み出した指標の種類に該当する値を、その指標の閾値と比較することによって、iPS細胞を所定のグループに分類する。
【0226】
例えば、評価処理部48aは、上記入力値から「24時間目のコロニーの丸さ」と「96時間目と24時間目のコロニーの丸さのヒストグラムの面積差」という指標の種類に該当する値をそれぞれ読み出す(図18(a)参照)。
そして、評価処理部48aは、入力値のうち「24時間目のコロニーの丸さ」に該当する値が、その指標の閾値(80)未満であれば、iPS細胞を「脂肪に分化する能力をもつ」というグループに分類する。
【0227】
これによって、iPS細胞の1つのコロニーの形態的特徴量から、そのiPS細胞のコロニーに含まれるiPS細胞の分化の種類を推定することができる。
【0228】
次に、ステップS1105において、評価処理部48aは、特徴量算出部45aが算出した4つの入力値から、フィーダーモデルの指標の種類に該当する値を読み出す。
そして、評価処理部48aは、その読み出した指標の種類に該当する値を、その指標の閾値と比較することによって、iPS細胞を所定のレベルに分類する。
【0229】
例えば、評価処理部48aは、上記入力値から「48時間目のフィーダー細胞の長さ」と「24時間目のフィーダー細胞の輝度」という指標の種類に該当する値をそれぞれ読み出す(図18(b)参照)。
そして、評価処理部48aは、入力値のうち「48時間目のフィーダー細胞の長さ」に該当する値が、その指標の閾値(20)未満であれば、iPS細胞を「低い増殖能」というレベルに分類する。
【0230】
これによって、1つのフィーダー細胞の形態的特徴量から、その周囲に存在するiPS細胞の分化の種類を推定することができる。
【0231】
次に、ステップS1106において、評価処理部48aは、分類したグループとレベルに基づいて、iPS細胞の状態を複合的に推定する。
例えば、評価処理部48aは、コロニーモデルでグループ3(分化グループ:脂肪)、フィーダーモデルでレベル3(増殖能:低)に分類されたことから、そのiPS細胞は脂肪に分化する分化能を有するが、増殖能が低いという複合的な推定をする。以上で、本フローチャートは、終了する。
【0232】
以上、本発明の第2の実施例によれば、対象画像中に含まれるフィーダー細胞集団の形態的特徴量から、対象画像中に含まれるiPS細胞集団を、所定の「レベル」または所定の「グループ」に区分することができる。
さらに、対象画像中に含まれるフィーダー細胞集団の形態的特徴量と、対象画像中に含まれるiPS細胞集団の形態的特徴量とから、対象画像中に含まれるiPS細胞集団を、所定の「レベル」または所定の「グループ」に区分することができる。
【0233】
また、対象画像中に含まれる1つのフィーダー細胞の形態的特徴量から、対象画像中の1つのiPS細胞を、所定の「レベル」または所定の「グループ」に区分することができる。
さらに、対象画像中に含まれる1つのフィーダー細胞の形態的特徴量と、対象画像中に含まれる1つのiPS細胞の形態的特徴量とから、対象画像中の1つのiPS細胞を、所定の「レベル」または所定の「グループ」に区分することができる。
【0234】
なお、第2の実施例では、iPS細胞のコロニーの特徴量とフィーダー細胞の特徴量に対して、それぞれ別々の決定木を構築したが、これに限らず、両方の特徴量を用いた決定木を構築してもよい。
なお、第2の実施例では、iPS細胞の分化の方向性、iPS細胞の劣化度合い、またはiPS細胞の増殖度を推定したがこれに限らず、iPS細胞の分化度、iPS細胞の腫瘍化しやすさ等でもよい。
【0235】
<細胞の培養法の例>
図26は、本発明の実施例2の細胞評価プログラムを用いた細胞の培養方法を説明するためのフローチャートである。本フローチャートでは、インキュベータ11に増殖させたいiPS細胞を含んだシャーレが置かれた状況を想定することとする。
【0236】
まず、ステップS1201において、CPU42aは、予め決められた培養条件(例えば所定の温度、湿度等)で細胞を培養するよう温度調整装置15aと湿度調整装置15bとを制御する。所定期間経過後、ステップS1202において、CPU42aは、記憶部43aから読み出した本発明の実施形態の細胞評価プログラムを実行し、細胞の状態を評価する。次に、ステップS1203において、CPU42aは、細胞の状態の評価結果に基づき、培養を中止するか、培養条件を変更するか、または現在の培養条件で培養を続行するか判定する。
【0237】
次に、ステップS1204において、CPU42aが培養を中止すると判定した場合(ステップS1204 YES)、CPU42aは培養の中止を示す情報を不図示のモニタ等に表示させ、処理を終了する。
一方、CPU42aは培養を中止すると判定しなかった場合(ステップS1204 NO)、CPU42aはステップS1205の処理に進む。
【0238】
次に、ステップS1205において、CPU42aが培養条件を変更すると判定した場合(ステップS1205 YES)、CPU42aは、細胞の状態の評価結果と関係付けられた培養条件(例えば所定の温度、湿度等)に変更するよう温度調整装置15aと湿度調整装置15bとを制御する(ステップS1206)。CPU42aは、ステップS1202の処理に戻る。
一方、CPU42aが現在の培養条件で培養を続行すると判定した場合(ステップS1205 NO)、CPU42aはステップS1207の処理に進む。
【0239】
次に、ステップS1207において、CPU42aは、予め決められた時間の経過毎に、撮像装置34で撮像された画像から、iPS細胞に相当するオブジェクトを抽出し、オブジェクトの数すなわち細胞数を計数する。
【0240】
次に、ステップS1208において、計数された細胞数が所定の細胞数に到達していない場合(ステップS1208 NO)、計数された細胞数に応じた時間が経過した後、CPU42aはステップS1202の処理に戻る。
一方、計数された細胞数が所定の細胞数に到達した場合(ステップS1208 YES)、CPU42aはその細胞の培養が完了した旨を示す情報を、不図示のモニタ等に表 示させる。以上で、本フローチャートは、終了する。
【0241】
以上により、本発明の細胞の培養方法を用いれば、細胞の評価に基づいて動的に培養条件を変更することができるので、iPS細胞を容易に増殖させることができる。
なお、本発明の実施例2の細胞評価プログラムを用いて、細胞の培養条件を変更したが、これに限らず、本発明の実施例1の細胞評価プログラムを用いて、細胞の培養条件を変更してもよい。
【0242】
なお、本発明の実施形態では、iPS細胞について説明したがこれに限らず、ES細胞でも、他の細胞でもよい。
また、本発明の実施形態では、iPS細胞の状態を推定するために、他のiPS細胞の形態的特徴量を指標にしたが、これに限らず、ES細胞など近種の細胞の形態的特徴量を指標にしてもよい。
【0243】
なお、本発明の実施形態では、フィーダー細胞は1種類の細胞であるとして説明したが、これに限らず、フィーダー細胞は複数種類の細胞を用いて構成されてもよい。その際には、その複数種類のフィーダー細胞のうち、少なくとも1種類のフィーダー細胞の形態的特徴量を指標にすればよい。
また、本発明の実施形態では、iPS細胞とフィーダー細胞との2種類の細胞が共に培養されているとしたが、これに限らず、その他の種類の細胞が、iPS細胞とフィーダー細胞と共に培養されていてもよい。
【0244】
<実施形態の補足事項>
(1)上記の一の実施形態では、インキュベータ11またはインキュベータ11aがそれぞれ備える制御装置41または制御装置41aに情報処理装置を組み込んだ例を説明したが、本発明の情報処理装置は、インキュベータ11またはインキュベータ11aから顕微鏡画像を取得して解析を行う外部の独立したコンピュータで構成されていてもよい(この場合の図示は省略する)。
【0245】
(2)上記の実施形態では、領域抽出部44、特徴量算出部45または特徴量算出部45a、度数分布算出部46、指標抽出部47または指標抽出部47a、評価処理部48または評価処理部48aの各機能をプログラムでソフトウェア的に実現する例を説明したが、これらの処理をASICによってハードウエア的に実現しても勿論かまわない。
【0246】
(3)上記の一の実施形態では、評価情報の計算モデルとその指標を制御装置41または制御装置41aがFNNによって求める例を説明した。しかし、本発明の培養状態評価装置は、例えば、重回帰分析などの他の多変量解析によって、評価情報の計算モデルとその指標を求めるものでもよい。
【0247】
さらに、本発明の培養状態評価装置は、複数の計算モデルを組み合わせて、これらの計算モデルによる演算結果の多数決(あるいは重み付け平均)によって、最終的な評価情報を生成するようにしてもよい。この場合には、例えば、混在率の低いデータではMRAが強く、混在率の高いデータにはFNNが強いというように、一方の計算モデルでは精度の低い状況を他のモデルによってカバーすることができ、評価情報の精度をより高めることができる。
【0248】
(4)また、培養状態評価装置は、評価情報の計算モデルを求めるときに、最初に複数の指標を組み合わせでの計算結果を演算し、変数増減法により指標を増減させるようにしてもよい。また、データの精度が高ければ指標を全て用いても良い。
【0249】
(5)上記の一の実施形態では、2つの度数分布の差分の絶対値和を用いて、度数分布の変化量を求める例を説明したが、2つの度数分布の差分の二乗和から度数分布の変化量を求めてもよい。また、上記の一の実施形態で示した計算式はあくまで一例に過ぎず、例えば2次以上のn次方程式などであってもよい。
【0250】
(6)上記の実施形態や実施例に示した特徴値はあくまで一例にすぎず、評価対象の細胞の種類などに応じて他の特徴値のパラメータを採用することも勿論可能である。
【0251】
以上、本発明の実施形態について図面を参照して詳述したが、具体的な構成はこの実施形態に限られるものではなく、この発明の要旨を逸脱しない範囲の設計等も含まれる。
【符号の説明】
【0252】
11 インキュベータ
11a インキュベータ
15 恒温室
19 培養容器
22 観察ユニット
34 撮像装置
41 制御装置
41a 制御装置
42 CPU
42a CPU
43 記憶部
43a 記憶部
44 領域抽出部
45 特徴量算出部
45a 特徴量算出部
46 度数分布算出部
47 指標抽出部
47a 指標抽出部
48 評価処理部
48a 評価処理部
【技術分野】
【0001】
本発明は、細胞評価装置、インキュベータ、細胞評価方法、細胞評価プログラムおよび細胞の培養方法に関するものである。
【背景技術】
【0002】
一般的に、細胞の培養状態を評価する技術は、再生医療などの先端医療分野や医薬品のスクリーニングを含む幅広い分野での基盤技術となっている。例えば、再生医療分野では、インビトロで細胞を増殖、分化させるプロセスが存在する。そして、上記のプロセスでは、細胞の分化の成否、細胞の癌化や感染の有無を管理するために、細胞の培養状態を的確に評価することが不可欠である。一例として、マーカーとして転写因子を用いたがん細胞の評価方法が開示されている(特許文献1参照)。
【0003】
一方、ES(Embryonic Stem、胚性幹)細胞またはiPS(induced Pluripotent Stem、誘導多能性幹)細胞などの万能細胞は、理論上すべての組織に分化する分化多能性を保ちつつ、ほぼ無限に増殖させる事ができるため、医薬開発および再生医療への応用に注目が集まっている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2007−195533号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
iPS細胞を再生医療に応用する際には、状態が良いiPS細胞だけ抽出する必要があるため、培養しているiPS細胞の状態を評価することが必要となる。しかしながら、従来の技術では、iPS細胞を染色マーカーで染色せずに、iPS細胞の状態を評価できないという問題があった。
【0006】
そこで本発明は、上記問題に鑑みてなされたものであり、細胞を染色せずに、細胞の状態を推定する細胞評価装置、インキュベータ、細胞評価方法、細胞評価プログラムおよび細胞の培養方法を提供することを課題とする。
【課題を解決するための手段】
【0007】
上記問題を解決するために、本発明は、第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、前記第1の種類の個別の細胞および細胞の集合体が占める領域と前記第2の種類の細胞が占める領域とを抽出する領域抽出部と、前記領域抽出部で抽出された第2の種類の細胞が占める領域に存在する前記第2の種類の細胞の形態的特徴を示す特徴量を算出する第1の特徴量算出部と、前記第2の種類の細胞が有する形態的特徴を示す特徴量と、前記第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する評価処理部と、を備えることを特徴とする細胞評価装置である。
【0008】
また、本発明は、細胞を培養する培養容器を収納するとともに、所定の環境条件に内部を維持可能な恒温室と、前記恒温室内で前記培養容器に含まれる前記細胞の画像を撮像する撮像装置と、請求項1から請求項7のいずれか1項に記載の細胞評価装置と、を備えることを特徴とするインキュベータである。
【0009】
また、本発明は、第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、前記第1の種類の個別の細胞および細胞の集合体が占める領域と前記第2の種類の細胞が占める領域とを抽出する領域抽出手順と、前記領域抽出手順で抽出された第2の種類の細胞が占める領域に存在する前記第2の種類の細胞の形態的特徴を示す特徴量を算出する第1の特徴量算出手順と、前記第2の種類の細胞が有する形態的特徴を示す特徴量と、前記第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する評価処理手順と、を有することを特徴とする細胞評価方法である。
【0010】
また、本発明は、第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、前記第1の種類の個別の細胞および細胞の集合体が占める領域と前記第2の種類の細胞が占める領域とを抽出する第1のステップと、前記第1のステップで抽出された第2の種類の細胞が占める領域に存在する前記第2の種類の細胞の形態的特徴を示す特徴量を算出する第2のステップと、前記第2の種類の細胞が有する形態的特徴を示す特徴量と、前記第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する第3のステップと、をコンピュータに実行させるための細胞評価プログラムである。
【0011】
また、本発明は、第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞が撮像された画像から、前記第2の種類の細胞の形態的特徴を示す特徴量を抽出し、前記第2の種類の細胞の形態的特徴を示す特徴量に基づき、第1の種類の細胞の状態を推定し、前記第1の細胞の状態に基づき、前記第1の種類の細胞又は前記第2の種類の細胞の培養条件を変更することを特徴とする細胞の培養方法である。
【発明の効果】
【0012】
本発明によれば、細胞を染色せずに、細胞の状態を推定することができる。
【図面の簡単な説明】
【0013】
【図1】本発明の実施形態であるインキュベータの正面図である。
【図2】本発明の実施形態であるインキュベータの平面図である。
【図3】本発明の第1の実施例であるインキュベータのブロック構成図である。
【図4】iPS細胞と共培養されているフィーダー細胞とが撮像された画像から、iPS細胞のコロニーの領域とフィーダー細胞の領域とを抽出する処理を説明するための図である。
【図5】抽出されたiPS細胞のコロニーの領域と、フィーダー細胞の領域とを説明するための図である。
【図6】細胞の形態の各特徴量を説明するための図である。
【図7】ある特徴量についての計算モデルのパラメータを格納するテーブルを説明するための図である。
【図8】Artificial Neural Networkの概要を説明するための図である。
【図9】Fuzzy Neural Networkの概要を説明するための図である。
【図10】Fuzzy Neural Networkにおけるシグモイド関数を説明するための図である。
【図11】インキュベータにおける観察処理の一例を示すフローチャートである。
【図12】計算モデル用の教師値の算出を説明するためのフローチャートである。
【図13】計算モデルの構築を説明するためのフローチャートである。
【図14】計算モデルを用いたiPS細胞の分化度を推定するためのフローチャートである。
【図15】本発明の第2の実施例であるインキュベータのブロック構成図である。
【図16】画像別、コロニー+フィーダーモデルの決定木を説明するための図である。
【図17】画像別、コロニー・フィーダー別モデルの決定木を説明するための図である。
【図18】細胞別、コロニー・フィーダー別モデルの決定木を説明するための図である。
【図19】決定木算出用の教師値の算出を説明するためのフローチャートである。
【図20】決定木算出用の特徴量の算出を説明するためのフローチャートである。
【図21】画像別の決定木の算出を説明するためのフローチャートである。
【図22】細胞別の決定木算出を説明するためのフローチャートである。
【図23】図16に示す画像別、コロニー+フィーダーモデルを用いたiPS細胞の状態の推定を説明するためのフローチャートである。
【図24】図17に示す画像別、コロニー・フィーダー別モデルを用いたiPS細胞の状態の推定を説明するためのフローチャートである。
【図25】図18に示す細胞別、コロニー・フィーダー別モデルを用いたiPS細胞の状態の推定を説明するためのフローチャートである。
【図26】本発明の実施例2の細胞評価プログラムを用いた細胞の培養方法を説明するためのフローチャートである。
【発明を実施するための形態】
【0014】
以下、本発明を実施するための形態について、図面を参照して詳細に説明する。本発明の実施形態では、iPS細胞と、iPS細胞の周囲に存在しiPS細胞に栄養素などを供給する1種類のフィーダー細胞とが共に培養されている。
【0015】
<実施例1>
一般的に、ES細胞またはiPS細胞は、その分化能力が高いほどその品質が良いと考えられている。従って、本発明の実施例1では、iPS細胞の状態を推定するのに、全体の細胞に占める分化した細胞の割合(以下、分化度と称する)を指標とする。
図1は、本発明の実施形態であるインキュベータの正面図である。図2は、本発明の実施形態であるインキュベータの平面図である。
【0016】
恒温室15の前面には、大扉16、中扉17、小扉18が配置されている。大扉16
は、上部ケーシング12および下部ケーシング13の前面を覆っている。中扉17は、上
部ケーシング12の前面を覆っており、大扉16の開放時に恒温室15と外部との環境を
隔離する。小扉18は、細胞を培養する培養容器19を搬出入するための扉であって、中
扉17に取り付けられている。この小扉18から培養容器19を搬出入することで、恒温
室15の環境変化を抑制することが可能となる。なお、大扉16、中扉17、小扉18
は、パッキンP1,P2,P3によりそれぞれ気密性が維持されている。
【0017】
また、恒温室15には、ストッカー21、観察ユニット22、容器搬送装置23、搬送
台24が配置されている。ここで、搬送台24は、小扉18の手前に配置されており、培
養容器19を小扉18から搬出入する。
【0018】
ストッカー21は、上部ケーシング12の前面(図2の下側)からみて恒温室15の左
側に配置される。ストッカー21は複数の棚を有しており、ストッカー21の各々の棚に
は培養容器19を複数収納することができる。なお、各々の培養容器19には、培養の対
象となる細胞が培地とともに収容されている。
【0019】
ここで、観察ユニット22は、上部ケーシング12のベースプレート14の開口部に嵌
め込まれて配置される。観察ユニット22は、試料台31と、試料台31の上方に張り出
したスタンドアーム32と、位相差観察用の顕微光学系および撮像装置(34)を内蔵し
た本体部分33と、を有している。そして、試料台31およびスタンドアーム32は恒温室15に配置される一方で、本体部分33は下部ケーシング13内に収納される。
【0020】
観察ユニット22は、上部ケーシング12の前面からみて恒温室15の右側に配置され
る。この観察ユニット22は、培養容器19内の細胞のタイムラプス観察を実行すること
ができる。
【0021】
ここで、観察ユニット22は、上部ケーシング12のベースプレート14の開口部に嵌
め込まれて配置される。観察ユニット22は、試料台31と、試料台31の上方に張り出
したスタンドアーム32と、位相差観察用の顕微光学系および撮像装置(34)を内蔵し
た本体部分33と、を有している。そして、試料台31およびスタンドアーム32は恒温室15に配置される一方で、本体部分33は下部ケーシング13内に収納される。
【0022】
試料台31は透光性の材質で構成されており、その上に培養容器19を載置することが
できる。この試料台31は水平方向に移動可能に構成されており、上面に載置した培養容
器19の位置を調整できる。また、スタンドアーム32にはLED光源35が内蔵されて
いる。そして、撮像装置34は、スタンドアーム32によって試料台31の上側から透過
照明された培養容器19の細胞を、顕微鏡の光学系を介して撮像することで細胞の顕微鏡画像を取得する。
【0023】
容器搬送装置23は、上部ケーシング12の前面からみて恒温室15の中央に配置され
る。この容器搬送装置23は、ストッカー21、観察ユニット22の試料台31および搬
送台24との間で培養容器19の受け渡しを行う。
【0024】
図2に示すように、容器搬送装置23は、多関節アームを有する垂直ロボット34と、回転ステージ35と、ミニステージ36と、アーム部37とを有している。回転ステージ35は、垂直ロボット34の先端部に回転軸35aを介して水平方向に180°回転可能に取り付けられている。そのため、回転ステージ35は、ストッカー21、試料台31および搬送台24に対して、アーム部37をそれぞれ対向させることができる。
【0025】
また、ミニステージ36は、回転ステージ35に対して水平方向に摺動可能に取り付けられている。ミニステージ36には培養容器19を把持するアーム部37が取り付けられている。
【0026】
図3は、本発明の第1の実施例であるインキュベータのブロック構成図である。
第1の実施例のインキュベータ11は、上部ケーシング12と下部ケーシング13とを有している。インキュベータ11の組立状態において、上部ケーシング12は下部ケーシング13の上に載置される。なお、上部ケーシング12と下部ケーシング13との内部空間は、ベースプレート14によって上下に仕切られている。
【0027】
上部ケーシング12は、温度調整装置15aと、湿度調整装置15bと、容器搬送装置23と、LED光源35とを有している。
まず、上部ケーシング12の構成の概要を説明する。上部ケーシング12の内部には、
細胞の培養を行う恒温室15が形成されている。この恒温室15は温度調整装置15aお
よび湿度調整装置15bを有している。
【0028】
温度調整装置15aおよび湿度調整装置15bは、恒温室15内を細胞の培養に適した環境(例えば温度37℃、湿度90%)に維持する(なお、図1、図2での温度調整装置15a、湿度調整装置15bの図示は省略する)。
LED光源35は、培養容器19を照明する。
【0029】
次に、下部ケーシング13の構成の概要を説明する。下部ケーシング13の内部には、観察ユニット22の撮像装置34や、インキュベータ11の制御装置(細胞評価装置)41が収納されている。
撮像装置34は、上側から透過照明された培養容器19の細胞を、顕微鏡の光学系を介して撮像することで細胞の顕微鏡画像を取得する。撮像装置34は、その細胞の顕微鏡画像をCPU42へ供給する。
【0030】
制御装置(細胞評価装置)41は、温度調整装置15aと、湿度調整装置15bと、観察ユニット22と、
容器搬送装置23とそれぞれ接続されている。この制御装置41は、所定のプログラムに
従ってインキュベータ11の各部を統括的に制御する。
【0031】
一例として、制御装置41は、温度調整装置15aおよび湿度調整装置15bをそれぞ
れ制御して恒温室15内を所定の環境条件に維持する。また、制御装置41は、所定の観
察スケジュールに基づいて、観察ユニット22および容器搬送装置23を制御して、培養
容器19の観察シーケンスを自動的に実行する。さらに、制御装置41は、観察シーケン
スで取得した画像に基づいて、細胞の状態の評価を行う培養状態評価処理を実行する。
【0032】
制御装置41は、CPU42と、記憶部43と、を用いて構成されている。CPU42は、制御装置41の各種の演算処理を実行するプロセッサである。
記憶部43は、ハードディスクや、フラッシュメモリ等の不揮発性の記憶媒体などで構成される。この記憶部43は、ストッカー21に収納されている各培養容器19に関する管理データと、撮像装置で撮像された顕微鏡画像のデータとを保持する。さらに、記憶部43は、CPU42によって実行されるプログラムを保持する。
【0033】
なお、上記の管理データには、(a)個々の培養容器19を示すインデックスデータ、(b)ストッカー21での培養容器19の収納位置、(c)培養容器19の種類および形状(ウェルプレート、ディッシュ、フラスコなど)、(d)培養容器19で培養されている細胞の種類、(e)培養容器19の観察スケジュール、(f)タイムラプス観察時の撮像条件(対物レンズの倍率、容器内の観察地点等)、などが含まれている。また、ウェルプレートのように複数の小容器で同時に細胞を培養できる培養容器19については、各々の小容器ごとにそれぞれ管理データが生成される。
【0034】
また、記憶部43は、予め用意されたサンプルの顕微鏡画像のデータを保持する。また、予め用意されたモデル構築用の顕微鏡画像のデータと、画像の教師値(例えば、分化の度合い)を保持する。
【0035】
CPU42は、記憶部43に記憶されているプログラムを読み出して実行することにより、領域抽出部44と、特徴量算出部45と、度数分布算出部46と、指標抽出部47と、評価処理部48との各部の機能を実現する。
【0036】
図4は、iPS細胞と共培養されているフィーダー細胞とが撮像された画像から、iPS細胞のコロニーの領域とフィーダー細胞の領域とを抽出する処理を説明するための図である。
領域抽出部44は、予め用意されたサンプルの顕微鏡画像のデータを記憶部43から読み込む。そして、領域抽出部44は、上記のサンプルの顕微鏡画像のうちから、処理対象となる画像81を指定する。そして、領域抽出部44は、画像81をOpen−Closeフィルタをかけて、Open−Closeフィルタをかけた画像82を生成する。
【0037】
そして、領域抽出部44は、画像81から生成したOpen−Closeフィルタをかけた画像82を引き算した背景補正画像83を生成する。これによって、画像81のバックグラウンドの輝度を均一にすることができる。
【0038】
領域抽出部44は、背景補正画像83に対して、画像内に含まれる細胞を抽出する。例えば、位相差顕微鏡で細胞を撮像すると、細胞壁のように位相差の変化の大きな部位の周辺にはハロが現れる。そのため、領域抽出部44は、細胞壁に対応するハロを公知のエッジ抽出手法で抽出するとともに、輪郭追跡処理によってエッジで囲まれた閉空間を細胞と推定する。これにより上記の顕微鏡画像から個々の細胞を抽出することができる。
【0039】
そして、領域抽出部44は、背景補正画像83から、iPS細胞のコロニーの領域を抽出した画像84を生成する。また、領域抽出部44は、背景補正画像83から、フィーダー細胞の領域を抽出した画像85を生成する。
【0040】
図5は、抽出されたiPS細胞のコロニーの領域と、フィーダー細胞の領域とを説明するための図である。
領域抽出部44は、iPS細胞のコロニーの領域を抽出した画像84から、iPS細胞のコロニーの領域91を抜き出す。また、領域抽出部44は、フィーダー細胞の領域を抽出した画像85からフィーダー細胞の領域92を抜き出す。
領域抽出部44は、各観察時間におけるiPS細胞のコロニーの領域91の情報と、そのフィーダー細胞の領域92の情報とを、特徴量算出部45へ供給する。
【0041】
図6は、細胞の形態の各特徴量を説明するための図である。具体的に、細胞形態の特徴量は、例えば、以下の通りである。
「Total area」(図6の(a)参照)は、注目する細胞の面積を示す値である。例えば、細胞形態の特徴量算出部45は、注目する細胞の領域の画素数に基づいて「Total area」の値を求めることができる。
【0042】
「Hole area」(図6の(b)参照)は、注目する細胞内のHoleの面積を示す値である。ここで、Holeは、コントラストによって、細胞内における画像の明るさが閾値以上となる部分(位相差観察では白に近い状態となる箇所)を指す。例えば、細胞内小器官の染色されたリソソームなどがHoleとして検出される。
また、画像によっては、細胞核や、他の細胞小器官がHoleとして検出されうる。なお、細胞形態の特徴量算出部45は、細胞内における輝度値が閾値以上となる画素のまとまりをHoleとして検出し、このHoleの画素数に基づいて「Hole area」の値を求めればよい。
【0043】
「relative hole area」(図6の(c)参照)は、「Hole area」の値を「Total area」の値で除した値である(relative hole area=Hole area/Total area)。この「relative hole area」は、細胞の大きさにおける細胞内小器官の割合を示すパラメータであって、例えば細胞内小器官の肥大化や核の形の悪化などに応じてその値が変動する。
【0044】
「Perimeter」(図6の(d)参照)は、注目する細胞の外周の長さを示す値である。例えば、細胞形態の特徴量算出部45は、細胞を抽出するときの輪郭追跡処理により「Perimeter」の値を取得することができる。
【0045】
「Width」(図6の(e)参照)は、注目する細胞の画像横方向(X方向)での長さを示す値である。
「Height」(図6の(f)参照)は、注目する細胞の画像縦方向(Y方向)での長さを示す値である。
【0046】
「Length」(図6の(g)参照)は、注目する細胞を横切る線のうちの最大値(細胞の全長)を示す値である。
「Breadth」(図6の(h)参照)は、「Length」に直交する線のうちの最大値(細胞の横幅)を示す値である。
【0047】
「Fiber Length」(図6の(i)参照)は、注目する細胞を擬似的に線状と仮定した場合の長さを示す値である。細胞形態の特徴量算出部45は、下式(1)により「Fiber Length」の値を求める。
【0048】
【数1】

【0049】
但し、本明細書の式において「P」はPerimeterの値を示す。同様に「A」はTotal Areaの値を示す。
【0050】
「Fiber Breadth」(図6の(j)参照)は、注目する細胞を擬似的に線状と仮定した場合の幅(Fiber Lengthと直交する方向の長さ)を示す値である。細胞形態の特徴量算出部45は、下式(2)により「Fiber Breadth」の値を求める。
【0051】
【数2】

【0052】
「Shape Factor」(図6の(k)参照)は、注目する細胞の円形度(細胞の丸さ)を示す値である。細胞形態の特徴量算出部45は、下式(3)により「Shape Factor」の値を求める。
【0053】
【数3】

【0054】
「Elliptical form Factor」(図6の(l)参照)は、「Length」の値を「Breadth」の値で除した値(Elliptical form Factor=Length/Breadth)であって、注目する細胞の細長さの度合いを示すパラメータとなる。
【0055】
「Inner radius」(図6の(m)参照)は、注目する細胞の内接円の半径を示す値である。
「Outer radius」(図6の(n)参照)は、注目する細胞の外接円の半径を示す値である。
【0056】
「Mean radius」(図6の(o)参照)は、注目する細胞の輪郭を構成する全点とその重心点との平均距離を示す値である。
「Equivalent radius」(図6の(p)参照)は、注目する細胞と同面積の円の半径を示す値である。この「Equivalent radius」のパラメータは、注目する細胞を仮想的に円に近似した場合の大きさを示している。
【0057】
ここで、細胞形態の特徴量算出部45は、細胞に対応する画素数に誤差分を加味して上記の各特徴量を求めてもよい。このとき、細胞形態の特徴量算出部45は、顕微鏡画像の撮影条件(撮影倍率や顕微光学系の収差など)を考慮して特徴量を求めるようにしてもよい。なお、「Inner radius」、「Outer radius」、「Mean radius」、「Equivalent radius」を求めるときには、細胞形態の特徴量算出部45は、公知の重心演算の手法に基づいて各細胞の重心点を求め、この重心点を基準にして各パラメータを求めればよい。
【0058】
細胞形態の特徴量算出部45は、領域抽出部44から供給された各観察時間におけるiPS細胞のコロニーの領域91の情報と、フィーダー細胞の領域92の情報とを受け取る。
【0059】
細胞形態の特徴量算出部45は、各フィーダー細胞の領域92において、図6に例示するフィーダー細胞の形態的特徴量を算出する。
ここで、フィーダー細胞の形態的特徴量とは、以下の特徴量を含んでもよい。「フィーダー細胞そのものの凹凸に相当する輝度値」、「フィーダー細胞の中の輝度分布」等である。
【0060】
なお、細胞形態の特徴量算出部45は、更に、各iPS細胞のコロニーの領域91において、図6に例示するiPS細胞のコロニーの形態的特徴量を算出してもよい。
ここで、iPS細胞のコロニーの形態的特徴量は、「コロニーそのものの凹凸に相当する輝度値」、「コロニーの中の輝度分布」、「コロニーを1つの物体と考えた、コロニー集団の形の分布」の特徴量を含んでもよい。
【0061】
なお、細胞形態の特徴量算出部45は、iPS細胞のコロニーの形態的特徴量だけでなく、図6に例示する個々のiPS細胞の形態的特徴量を算出してもよい。ここで、iPS細胞の形態的特徴量は、「iPS細胞そのものの凹凸に相当する輝度値」、「iPS細胞の中の輝度分布」等の特徴量を含んでもよい。
【0062】
そして、算出した各観察時間における各フィーダー細胞の形態的特徴量と、各iPS細胞のコロニーの形態的特徴量と、個々のiPS細胞の形態的特徴量と、を記憶部43に記録する。
【0063】
度数分布算出部46は、記憶部43から各観察時間における各フィーダー細胞の形態的特徴量と、各iPS細胞のコロニーの形態的特徴量と、個々のiPS細胞の形態的特徴量と、を読み出す。また、度数分布算出部46は、記憶部43から観察画像の教師値を読み出す。
【0064】
度数分布算出部46は、各々の顕微鏡画像毎に算出された特徴量の種類毎に、それぞれ特徴量の度数分布を算出する。従って、度数分布算出部46は、1つの顕微鏡画像に対して、例えば57(=19[種類の特徴量]×3[種類の細胞])種類の特徴値の度数分布を求めることとなる。また、度数分布算出部46は、各々の度数分布において、特徴値の各区分に対応する細胞の数を頻度(%)として算出する。
【0065】
度数分布算出部46は、上記の度数分布における度数の区分を、特徴量の種類ごとの標準偏差を用いて正規化する。ここでは一例として、「Shape Factor」の度数分布での区分を決定する場合を説明する。
【0066】
まず、度数分布算出部46は、各々の顕微鏡画像から算出された全ての「Shape Factor」の値の標準偏差を算出する。次に、度数分布算出部46は、上記の標準偏差の値をFisherの式に代入して、「Shape Factor」の度数分布における度数の区分の基準値を求める。このとき、度数分布算出部46は、全ての「Shape Factor」の値の標準偏差(S)を4で除するとともに、小数点以下3桁目を四捨五入して上記の基準値とする。なお、一の実施形態での度数分布算出部46は、度数分布をヒストグラムとして図示する場合、20級数分の区間をモニタ等に描画させるものとする。
【0067】
一例として、「Shape Factor」の標準偏差Sが259のとき、259/4
=64.750から「64.75」が上記の基準値となる。そして、注目する画像の「S
hape Factor」の度数分布を求めるとき、度数分布算出部46は、「Shap
e Factor」の値に応じて0値から64.75刻みで設定された各クラスに細胞を
分類し、各クラスでの細胞の個数をカウントすればよい。
【0068】
このように、度数分布算出部46が、特徴量の種類毎に標準偏差で度数分布の区分を正
規化するため、異なる特徴値の間でも度数分布の傾向を大局的に近似させることができる。よって、一の実施例では、異なる特徴値間で細胞の培養状態と度数分布の変化との相関を求めることが比較的容易となる。
【0069】
度数分布算出部46は、全ての形態的特徴量をヒストグラムする。度数分布算出部46は、全てのヒストグラムを記憶部43に保存する。
【0070】
指標抽出部47は、全てのヒストグラムを記憶部43から読み出す。
指標抽出部47は、形態的特徴量ごとに、各経時のヒストグラムを、経時の全組み合わせ分比較して、経時間のヒストグラムの面積差の絶対値を算出する。
【0071】
図7は、ある特徴量についての計算モデルのパラメータを格納するテーブルを説明するための図である。テーブル100は、時刻1と、時刻2と、各特徴量f(j)(jは1からnまでの整数)の時刻1の特徴量のヒストグラムと、時刻2の特徴量のヒストグラムとの面積差ΔSf(j)と、教師値(例えば、分化の度合い)の差を用いて構成されている。
ここで、一例として、形態的特徴量の種類が同じで、撮影時間(0、24、48、72、96時間目)が異なる5つの度数分布を想定する。
【0072】
指標抽出部47は、上記全10通りの組み合わせに対して、以下の式(4)により、度数分布の面積差の絶対値(画像間での度数分布の差分の絶対値を積分したもの)を算出する。つまり、1セット分における1種類の特徴量に注目したとき、指標抽出部47は、その特徴値の度数分布につき、計10通りの面積差を算出する。
【0073】
【数4】

【0074】
但し、式(4)において、「Control」は初期状態の度数分布(8時間目)における1区間分の度数(細胞数)を示す。また、「Sample」は、比較対象の度数分布における1区間分の度数を示す。また、iは、度数分布の区間を示す変数である。
【0075】
指標抽出部47は、特徴量の種類ごとに上記演算を行うことで、すべての特徴量についてそれぞれ10通りの度数分布の変化量を取得できる。すなわち、1セット分の顕微鏡画像について、19種類×10通りで190の度数分布の組み合わせをとることができる。以後、上記の度数分布の組み合わせの1つを、指標と称する
指標抽出部47は、形態的特徴量毎に、上記テーブル100を、記憶部43に保存する。
【0076】
指標抽出部47は、190の指標のうちから、細胞の培養状態をよく反映する指標を多変量解析により1以上指定する。この指標の組合せの選択は、後述するファジーニューラルネットワークと同等の非線形モデル以外にも、細胞とその形態の複雑性に応じて線形モデルの利用も有効である。このような指標の組合せの選択と共に、指標抽出部47は、上記の指定された1以上の指標を用いて、顕微鏡画像から、iPS細胞の状態を推定する計算モデルを算出する。
【0077】
具体的には、各経時の形の指標19種類の平均値(入力値1)と、各経時の形の指標19種類の標準偏差(入力値2)と、各経時の形の指標19種類の分布の値そのもの(入力値3)と、各経時の形の指標19種類の分布の経時間の面積差(入力値4)との4つの入力値がある。4つの入力値に対し、各画像細胞の分化度(教師値)が関係付けられる。従って、指標抽出部47は、教師値を最も精度よく予測できる入力値の組み合わせを見つける。
【0078】
ここで、指標抽出部47は、ファジーニューラルネットワーク(Fuzzy Neural Network:FNN)解析によって上記の計算モデルを求める。
【0079】
FNNとは、人工ニューラルネットワーク(Artificial Neural Network:ANN)とファジィ推論とを組み合わせた方法である。このFNNでは、ファジイ推論の欠点であるメンバーシップ関数の決定を人間に頼るという部分を回避すべく、ANNをファジィ推論に組み込んでその自動決定を行う。学習機械のひとつであるANN(図10参照)は、生体の脳における神経回路網を数学的にモデル化したものであり、以下の特徴を持つ。
【0080】
図8は、Artificial Neural Networkの概要を説明するための図である。
ANNにおける学習は、目的の出力値(教師値)をもつ学習用のデータ(入力値:X)を用いて、バックプロパゲーション(Back propagation:BP)法により教師値と出力値(Y)との誤差が小さくなるように、ノード(図8において丸で示す)間をつなぐ回路における結合荷重を変え、その出力値が教師値に近づくようにモデルを構築する過程である。
【0081】
このBP法を用いれば、ANNは学習により自動的に知識を獲得することができる。そして、最終的に学習に用いていないデータを入力することにより、そのモデルの汎用性を評価できる。従来、メンバーシップ関数の決定は、人間の感覚に頼っていたが、上で述べたようなANNをファジイ推論に組み込むことで自動的なメンバーシップ関数の同定が可能になる。これがFNNである。
【0082】
図9は、Fuzzy Neural Networkの概要を説明するための図である。
FNNでは、ANNと同様に、BP法を用いることによりネットワークに与えられた入出力関係を、結合荷重を変化させることで自動的に同定しモデル化できる。FNNは、学習後のモデルを解析することでファジィ推論のように人間に理解しやすい言語的なルール(一例として図9の右下の吹き出しを参照)として知識を獲得できるという特徴をもっている。
【0083】
つまり、FNNは、その構造、特徴から、細胞の形態的特徴を表した数値のような変数の組み合わせにおける最適なファジィ推論の組み合わせを自動決定し、予測目標に関する推定と、予測に有効な指標の組み合わせを示すルールの生成を同時に行うことができる。
【0084】
FNNの構造は、「入力層」、シグモイド関数に含まれるパラメータWc、Wgを決定する「メンバーシップ関数部分(前件部)」、Wfを決定するとともに入力および出力の関係をルールとして取り出すことが可能な「ファジィルール部分(後件部)」、「出力層」の4層から成り立っている(図9参照)。
【0085】
図10は、Fuzzy Neural Networkにおけるシグモイド関数を説明するための図である。
FNNのモデル構造を決定する結合荷重にはWc、Wg、Wfがある。結合荷重Wcは、メンバーシップ関数に用いられるシグモイド関数の中心位置、Wgは中心位置での傾きを決定する(図10参照)。
【0086】
図9に戻り、モデル内では、入力値がファジィ関数により、人間の感覚的に近い柔軟性を持って表現される(一例として図9の左下の吹き出しを参照)。結合荷重Wfは各ファジイ領域の推定結果に対する寄与を表しており、Wfよりファジィルールを導くことができる。即ち、モデル内の構造はあとから解読でき、ルールとして書き起こすことができる(一例として図9中右下の吹き出しを参照)。
【0087】
FNN解析におけるファジィルールの作成には結合荷重のひとつであるWf値が用いられる。Wf値が正の値で大きいと、そのユニットは「予測に有効である」と判定されることに対する寄与が大きく、そのルールに当てはまった指標は「有効である」と判断される。Wf値が負の値で小さいと、そのユニットは「予測に有効でない」と判定されることに対する寄与が大きく、そのルールに当てはまった指標は「有効でない」と判断される。
【0088】
より具体的な例として、指標抽出部47は、以下の(A)から(H)の処理により、上記の計算モデルを求める。
【0089】
(A)指標抽出部47は、190の指標のうちから1つの指標を選択する。
(B)指標抽出部47は、(A)で選択された指標による度数分布の変化量を変数
とした計算式により、各々の顕微鏡画像のセットでの、iPS細胞の状態(予測値)を求める。
【0090】
仮に、1つの指標から、iPS細胞の状態を求める計算式を「Y=αX1」(但し、「Y」は、iPS細胞の計算値(例えば、iPS細胞の増加数を示す値)、「X1」は上記の選択された指標に対応する度数分布の変化量、「α」はX1に対応する係数値、をそれぞれ示す)とする。このとき、指標抽出部47は、αに任意の値を代入するとともに、X1に各セットにおける度数分布の変化量をそれぞれ代入する。これにより、各セットでのがん細胞の計算値(Y)が求められる。
【0091】
(C)指標抽出部47は、各々の顕微鏡画像のセットについて、(B)で求めた計
算値Yと、実際のiPS細胞の数(教師値)との誤差をそれぞれ求める。なお、上記の教師値は、読み込んだiPS細胞の数の情報に基づいて、指標抽出部47が求めるものとする。
そして、指標抽出部47は、各顕微鏡画像のセットでの計算値の誤差がより小さくなるように、教師付き学習により上記の計算式の係数αを修正する。
【0092】
(D)指標抽出部47は、上記の(B)および(C)の処理を繰り返し、上記(A)の指標について、計算値の平均誤差が最も小さくなる計算式のモデルを取得する。
(E)指標抽出部47は、190の各指標について、上記(A)から(D)の各処理を繰り返す。そして、指標抽出部47は、190の各指標における計算値の平均誤差を比較し、その平均誤差が最も低くなる指標を、評価情報の生成に用いる1番目の指標とする。
【0093】
(F)指標抽出部47は、上記(E)で求めた1番目の指標と組み合わせる2番目の指標を求める。このとき、指標抽出部47は、上記の1番目の指標と残りの189の指標とを1つずつペアにしてゆく。次に、指標抽出部47は、各々のペアにおいて、計算式でがん細胞の予測誤差を求める。
【0094】
仮に、2つの指標からがん細胞の数を求める計算式を「Y=αX1+βX2」(但し、「Y」はがん細胞の計算値、「X1」は1番目の指標に対応する度数分布の変化量、「α」はX1に対応する係数値、「X2」は、選択された指標に対応する度数分布の変化量、「β」はX2に対応する係数値、をそれぞれ示す)とする。
そして、指標抽出部47は、上記の(B)および(C)と同様の処理により、計算値の平均誤差が最も小さくなるように、上記の係数α、βの値を求める。
【0095】
その後、指標抽出部47は、各々のペアで求めた計算値の平均誤差を比較し、その平均誤差が最も低くなるペアを求める。そして、指標抽出部47は、平均誤差が最も低くなるペアの指標を、評価情報の生成に用いる1番目および2番目の指標とする。
【0096】
(G)指標抽出部47は、所定の終了条件を満たした段階で演算処理を終了する。例えば、指標抽出部47は、指標を増やす前後の各計算式による平均誤差を比較する。そして、指標抽出部47は、指標を増やした後の計算式による平均誤差が、指標を増やす前の計算式による平均誤差より高い場合(または両者の差が許容範囲に収まる場合)には、演算処理を終了する。
【0097】
(H)一方、上記(G)で終了条件を満たさない場合、指標抽出部47は、さらに指標の数を1つ増やして、上記(F)および(G)と同様の処理を繰り返す。これにより、上記の計算モデルを求めるときに、ステップワイズな変数選択によって指標の絞り込みが行われることとなる。
【0098】
指標抽出部47は、上記で求めた計算モデルの情報(計算式に用いる各指標を示す情報、計算式で各々の指標に対応する係数値の情報など)を記憶部43に記録する。
【0099】
なお、指標としては上記の指標に限られるものではなく、指標抽出部47は、0時間目、24時間目、48時間目、72時間目、96時間目、120時間目、148時間目、および168時間目の各々を基準として、1種類の特徴量に対して36(=9×8÷2)通りの指標をそれぞれ求め、19種類の特徴量に対して合計684(19種類×36通り)の指標を求めてもよい。
このような基準となる時刻が異なる指標を用いることにより、指標抽出部47は、より予測精度が高い計算モデルを構築することができる。
【0100】
評価処理部48は、記憶部43から対象画像の入力値1から入力値4と、計算モデルの情報を読み出す。
評価処理部48は、既に構築された計算モデルの計算式に用いる指標の値のみを入力値1から入力値4から選択する。
【0101】
例えば、評価処理部48は、対象画像において、「8時間目の細胞の長さの標準偏差」と「96時間目の細胞丸さのヒストグラムと12時間目の細胞丸さのヒストグラムの面積差」とを選択する。
評価処理部48は、上記選択した指標を計算モデルに入力し、推定した分化度を算出する。
【0102】
CPU42は、評価処理部48が推定したiPS細胞の状態に基づき、iPS細胞又はフィーダー細胞の培養条件(例えば温度、湿度等)を変更するよう制御する。例えば、CPU42は、温度調整装置15aに制御信号を供給し、恒温室15内の温度を上昇させるように制御する。また、CPU42は、湿度調整装置15bに制御信号を供給し、恒温室15内の湿度を下降させるように制御する。
【0103】
<iPS細胞の観察の例>
図11は、インキュベータにおける観察処理の一例を示すフローチャートである。この図11は、恒温室15内に搬入された培養容器19を、登録された観察スケジュールに従ってタイムラプス観察する動作例を示している。
【0104】
ステップS101において、CPU42は、記憶部43の管理データの観察スケジュールと現在日時とを比較して、培養容器19の観察開始時間が到来したか否かを判定する。観察開始時間となった場合(ステップS101 YES)、CPU42はS102に処理を移行させる。一方、培養容器19の観察時間ではない場合(ステップS101 NO)には、CPU42は次の観察スケジュールの時刻まで待機する。
【0105】
次に、ステップS102において、CPU42は、観察スケジュールに対応する培養容器19の搬送を容器搬送装置23に指示する。そして、容器搬送装置23は、指示された培養容器19をストッカー21から搬出して観察ユニット22の試料台31に載置する。なお、培養容器19が試料台31に載置された段階で、スタンドアーム32に内蔵されたバードビューカメラ(不図示)によって培養容器19の全体観察画像が撮像される。
【0106】
次に、ステップS103において、CPU42は、観察ユニット22に対して細胞の顕微鏡画像の撮像を指示する。観察ユニット22は、LED光源35を点灯させて培養容器19を照明するとともに、撮像装置34を駆動させて培養容器19内の細胞の顕微鏡画像を撮像する。
【0107】
このとき、撮像装置34は、記憶部43に記憶されている管理データに基づいて、ユーザの指定した撮像条件(対物レンズの倍率、容器内の観察地点)に基づいて顕微鏡画像を撮像する。例えば、培養容器19内の複数のポイントを観察する場合、観察ユニット22は、試料台31の駆動によって培養容器19の位置を逐次調整し、各々のポイントでそれぞれ顕微鏡画像を撮像する。なお、S103で取得された顕微鏡画像のデータは、制御装置41に読み込まれるとともに、CPU42の制御によって記憶部43に記録される。
【0108】
次に、ステップS104において、CPU42は、観察スケジュールの終了後に培養容器19の搬送を容器搬送装置23に指示する。そして、容器搬送装置23は、指示された培養容器19を観察ユニット22の試料台31からストッカー21の所定の収納位置に搬送する。その後、CPU42は、観察シーケンスを終了してS101に処理を戻す。以上で、本フローチャートの説明を終了する。
【0109】
<計算モデル用の教師値算出の例>
図12は、計算モデル用の教師値の算出を説明するためのフローチャートである。この計算モデルの生成処理では、画像の撮影時間および特徴値の種類がそれぞれ異なる複数の度数分布の組み合わせから、iPS細胞の状態の推定に用いる度数分布の組み合わせを、制御装置41が決定する。
【0110】
まず、ステップS201において、撮像装置34は、iPS細胞とiPS細胞の周囲に存在し、共に培養されているフィーダー細胞とが撮像された参照画像を継続的に取得し、記憶部43に保存する。
【0111】
次に、ステップS202において、一定期間培養後に、ユーザは、画像撮影した細胞を染色マーカー(例えば、分化度を示す染色マーカーであるSSEA−4、SSEA−1、およびnanog等)で染色する。
なお、CPU42が、一定期間培養後に、予め容器に入れられた染色マーカーを培養液に加えることに制御してもよい。これによって、画像撮影した細胞を染色マーカーで染色することができる。
【0112】
撮像装置34は、位相差観察用の顕微光学系で結像された染色されたiPS細胞を撮像する。なお、染色マーカーが蛍光物質で標識されている場合には、撮像装置34は、図示されていない蛍光観察用の顕微光学系で結像された染色されたiPS細胞を撮像する。そして、撮像装置34は、染色後の画像を記憶部43に保存する。
【0113】
次に、ステップS203において、CPU42は、記憶部43から染色後の画像を読み出す。CPU42は、iPS細胞毎に染色の有無を判定する。
次に、ステップS204において、CPU42は、画像の教師値(分化度)を算出する。例えば、染色細胞数が72個、全体のiPS細胞数が100個だとすると、画像の教師値(分化度)は染色細胞数/全体の細胞数=72(%)となる。
【0114】
次に、ステップS205において、ステップS201からステップS204の処理を全てのサンプルに対して所定の回数行っていない場合(ステップS201 NO)、上記工程を他のiPS細胞とフィーダー細胞とが共培養されたサンプルに対して、各々数十から数百枚行う。
【0115】
例えば、ユーザが、分化度20付近(サンプル30個)、分化度50付近(サンプル30個)、分化度80付近(サンプル30個)、分化度100付近(サンプル30個)のサンプルに対して、24時間おきに4日間画像を撮影する。
【0116】
上記継続培養画像は、4[条件]×30[サンプル]=120[枚]が、4日分存在するため、各120枚の画像に対して、0時間目、24時間目、48時間目、72時間目、96時間目の5点が存在する。また、それぞれの画像に対して、CPU42は、教師値(分化度)を算出し、記憶部43に保存する。
【0117】
次に、ステップS205において、ステップS201からステップS204の処理を全てのサンプルに対して所定の回数行った場合(ステップS201 YES)、本フローチャートは、終了する。
【0118】
図13は、計算モデルの構築を説明するためのフローチャートである。
まず、ステップS301において、CPU42は、予め用意されたサンプルの顕微鏡画像のデータを記憶部43から読み込む。なお、S301でのCPU42は、各画像に対応する細胞の総数およびiPS細胞の数を示す情報もこの時点で取得するものとする。
【0119】
次に、ステップS302において、CPU42は、上記のサンプルの顕微鏡画像のうちから、処理対象となる画像を指定する。ここで、S302でのCPU42は、予め用意されているサンプルの顕微鏡画像のすべてを処理対象として順次指定してゆくものとする。
【0120】
次に、ステップS303において、領域抽出部44は、処理対象の顕微鏡画像について、画像内に含まれるiPS細胞のコロニーの領域と、フィーダー細胞の領域とを抽出する。
【0121】
次に、ステップS304において、特徴量算出部45は、処理対象の顕微鏡画像中に含まれる各iPS細胞のコロニーと、各iPS細胞と、各フィーダー細胞との形態的特徴を示す特徴量を算出する。例えば、各経時120(=4[条件]×30[枚])枚の画像に対して、各経時における特徴量を算出する。
【0122】
次に、ステップS305において、特徴量算出部45は、算出した全ての特徴量を記憶部43に保存する。
次に、ステップS306において、全画像を全画像の特徴量を算出していない場合(ステップS306 NO)、ステップS302に戻る。全画像を全画像の特徴量を算出した場合(ステップS306 YES)、ステップS307に遷移する。
【0123】
次に、ステップS307において、度数分布算出部46は、各経時の特徴量の平均値と、各経時の特徴量の標準偏差と、各経時の特徴量の度数分布を算出する。換言すれば、度数分布算出部46は、各画像中のすべての細胞1つ1つの形態情報を収集し、これを集団としてヒストグラム化する。
【0124】
次に、ステップS308において、指標抽出部47は、特徴量毎に、経時間の特徴量の度数分布の面積の差を、経時の全組み合わせに対して算出する。
例えば、各120枚の画像に対して、0時間目、24時間目、48時間目、72時間目、96時間目の5点が存在するとする。そうすると、以下の10個の経時の組み合わせが存在する。その経時の組み合わせは、[時間目]−[時間目]の書式で表すと、24−0、48−0、72−0、96−0、48−24、72−24、96−24、72−48、96−48、96−72である。
【0125】
次に、ステップS309において、全ての特徴量で、経時間の特徴量の度数分布の面積の差を、経時の全組み合わせに対して算出していない場合(ステップS309 NO)、ステップS308に戻る。ステップS309において、全ての特徴量で、経時間の特徴量の度数分布の面積の差を、経時の全組み合わせに対して算出した場合(ステップS309 YES)、ステップS310に遷移する。
【0126】
次に、ステップS310において、指標抽出部47は、190の指標のうちから、iPS細胞の状態をよく反映する指標を多変量解析により1以上指定する。この指標の組合せの選択は、前述したファジーニューラルネットワークと同等の非線形モデル以外にも、細胞とその形態の複雑性に応じて線形モデルの利用も有効である。このような指標の組合せの選択と共に、指標抽出部47は、上記の指定された1以上の指標を用いて、顕微鏡画像からiPS細胞の状態を導出する計算モデルを求める。
【0127】
次に、ステップS311において、指標抽出部47は、計算モデルの情報(計算式に用いる各指標を示す情報、計算式で各々の指標に対応する係数値の情報など)を記憶部43に記録する。以上で、本フローチャートは終了する。
【0128】
<iPS細胞の状態推定処理の例>
図14は、計算モデルを用いたiPS細胞の分化度を推定するためのフローチャートである。
まず、ステップS401において、評価処理部48は、評価対象となる複数の顕微鏡画像(対象画像)のデータを記憶部43から読み込む。ここで、対象画像は、細胞群を培養した培養容器19をインキュベータ11によって同一視野を同一の撮影条件でタイムラプス観察して取得されたものとする。また、この場合のタイムラプス観察は、図13の例と条件を揃えるために、培養開始を初回として24時間おきに96時間目まで行うものとする。
【0129】
次に、ステップS402において、評価処理部48は、記憶部43の計算モデルの情報(図13のS311で記録されたもの)を読み込む。
次に、ステップS403において、特徴量算出部45、度数分布演算部46および評価処理部48は、上記の計算モデルの変数に対応する各指標について、それぞれ度数分布の変化量を求める。
【0130】
次に、ステップS304において、評価処理部48は、ステップS403で求めた各指標の度数分布の変化量を、S302で読み出した計算モデルに代入して演算を行う。そして、評価処理部48は、上記の演算結果に基づいて、評価対象の顕微鏡画像におけるiPS細胞の分化度を示す推定情報を生成する。その後、評価処理部48は、この推定情報を不図示のモニタ等に表示させる。以上で、本フローチャートは終了する。
【0131】
第1の実施例によれば、iPS細胞のコロニーの形態的特徴量と、iPS細胞の形態的特徴量と、フィーダー細胞の形態的特徴量とから、iPS細胞の状態を推定することができる。
【0132】
なお、第1の実施例では、iPS細胞のコロニーの形態的特徴量と、iPS細胞の形態的特徴量と、フィーダー細胞の形態的特徴量とから、iPS細胞の分化度を推定したがこれに限らない。
フィーダー細胞の形態的特徴量の度数分布の時間変化のみから、iPS細胞の分化度を推定してもよい。
また、フィーダー細胞の形態的特徴量の度数分布の時間変化と、個別のiPS細胞の形態的特徴量の度数分布の時間変化またはiPS細胞のコロニーの形態的特徴量の度数分布の時間変化とから、iPS細胞の分化度を推定してもよい。
【0133】
なお、第1の実施例では、iPS細胞の分化度を推定したがこれに限らず、iPS細胞の劣化度合い、iPS細胞の増殖度、iPS細胞の分化の方向性、iPS細胞の腫瘍化しやすさ等でもよい。
【0134】
<実施例2>
上記の実施例1は、連続値でiPS細胞の状態を評価したが、本実施例2ではレベルとして大まかにiPS細胞の状態を区分する。本実施例2の方法は、染色評価の信頼性や実施例1の推定精度によっては連続値評価が適していない場合に、特に有用である。以下、本発明の第2の実施例について、図面を参照して詳細に説明する。
【0135】
図15は、本発明の第2の実施例であるインキュベータのブロック構成図である。インキュベータ11aは、上部ケーシング12と、下部ケーシング13aとを用いて構成されている。下部ケーシング13aは、撮像装置34と制御装置41aとを用いて構成されている。制御装置(細胞評価装置)41aは、CPU42aと記憶部43aとを用いて構成されている。
CPU42aと記憶部43a以外は、図3のブロック構成図と同じであるので、CPU42aと記憶部43a以外は説明を省略する。
【0136】
記憶部43aは、ハードディスクや、フラッシュメモリ等の不揮発性の記憶媒体などで構成される。この記憶部43aは、不図示のストッカーに収納されている各培養容器(不図示)に関する管理データと、撮像装置で撮像された顕微鏡画像のデータとを保持する。
さらに、記憶部43aは、CPU42aによって実行されるプログラムと、指標抽出部47aで算出された判別モデルの情報とを保持する。
【0137】
CPU42aは、記憶部43aに記憶されているプログラムを読み出して実行することにより、領域抽出部44と、特徴量算出部45aと、度数分布算出部46と、指標抽出部47aと、評価処理部48aとの各部の機能を実現する。
【0138】
領域抽出部44と、度数分布算出部46との処理は、第1の実施例と同じなので、説明を省略する。
【0139】
特徴量算出部45aは、実施例1と同様に、領域抽出部44により画像から抽出した各画像のオブジェクトに対して、細胞の形態的特徴を示す特徴量をそれぞれ求める。一例として、特徴量算出部45aは、各細胞について19種類の特徴量をそれぞれ求める。
【0140】
特徴量算出部45aは、演算対象の教師画像について、19種類の特徴量の画像内平均値および画像内標準偏差をそれぞれ求める。そして、特徴量算出部45aは、上記の各特徴量の画像内平均値および画像内標準偏差をそれぞれ記憶部43aに記録する。
【0141】
これにより、細胞の継代数が同一であって観察時期(0、24、48、72、96時間目)がいずれも異なる5枚分の教師画像について、各観察時期においてそれぞれ38の特徴量(19種類×2通り(平均値、標準偏差))が求まることとなる。
【0142】
特徴量算出部45aは、以下の(A1)−(A3)の処理によって、継代数が共通する教師画像をグループ化し、グループ化した教師画像群のうちの2つの教師画像間で各特徴量の変化量を求める。
【0143】
(A1)特徴量算出部45aは、細胞の継代数が同一であって観察時期(0、24、48、72、96時間目)がいずれも異なる6枚分の教師画像をそれぞれグループ化する。特に限定するものではないが、グループ化する教師画像は、培養容器および撮像した位置(視野)が共通する5枚の顕微鏡画像であることが好ましい。
【0144】
(A2)特徴量算出部45aは、上記(A1)でグループ化した教師画像群において、撮像時点の異なる2つの教師画像を組み合わせる。ここで、1グループの教師画像は5枚であるので、2つの教師画像の組み合わせは10通りとなる。また、2つの教師画像の組み合わせは10通りであるため、1グループの教師画像群から求まる変化量は380種類(19の特徴量×2通り(平均値、標準偏差)×10通りの組み合わせ)となる。
【0145】
(A3)特徴量算出部45aは、上記(A2)の1つの組み合わせごとに、2つの教師画像間における各特徴量の画像内平均値の変化を示す19種類の変化量と、2つの教師画像間における各特徴量の画像内標準偏差の変化を示す19種類の変化量とをそれぞれ求める。
【0146】
続いて、指標抽出部47aの処理について、説明する。
指標抽出部47aは、度数分布算出部46で算出された形態的特徴量の度数分布の各経時の面積差を算出する。
【0147】
指標抽出部47aは、特徴量算出部45aで算出された形態的特徴量と、形態的特徴量の度数分布の面積差とに基づいて、異なる分化を示す細胞を、分化毎にクラス分けする判別モデルを構築する。本第2の実施例での指標抽出部47aは、判別モデルの1つの形態として、決定木解析(Decision tree analysis)を採用し、細胞の継代回数に応じて顕微鏡画像をクラス分けする決定木を構築する。
【0148】
<決定木の構築方法>
以下、指標抽出部47aが決定木を構築する方法について説明する。
指標抽出部47aは、決定木の根ノードにおいて、継代数の異なる細胞を分類するときに適用するパラメータの種類(指標の種類)とそのパラメータの値(指標の閾値)とを求める。なお、上記のパラメータの種類は、各観察時期(0、24、48、72、96時間目)の各特徴量(150種類)および特徴量の変化量(380種類)のうちから選択される。
【0149】
以下、上記の指標の種類および指標の閾値の求め方の一例を説明する。まず、指標抽出部47aは、上記の530(=150+380)種類のパラメータのうちから演算対象のパラメータを選択する。このとき、指標抽出部47aは、演算対象のパラメータに対応する教師画像群を予め抽出する。なお、抽出された教師画像群には、細胞の継代数の異なる教師画像が含まれる。
【0150】
次に、指標抽出部47aは、演算対象のパラメータに探索範囲(上限および下限)を設定するとともに、演算対象のパラメータの探索範囲を任意の刻みで複数に区切る。指標抽出部47aは、演算対象のパラメータの各刻み(パラメータの値)を閾値として、演算対象のパラメータに対応する教師画像群の細胞を2つの集合に分類する。これにより、演算対象のパラメータの各刻みにおいて、教師画像群の細胞の分類結果がそれぞれ得られる。
このとき、指標抽出部47aは、分類結果の各集合において、細胞の継代数に応じた細胞の数の分布をそれぞれ求めておく。
【0151】
指標抽出部47aは、上記の450種類の全パラメータでそれぞれ同様の処理を行い、各パラメータの個々の刻みにおける教師画像群の分類結果を取得する。そして、指標抽出部47aは、全ての分類結果のうちから、継代数の異なる細胞の分類に最も適したパラメータの種類(指標の種類)およびそのパラメータでの閾値(指標の閾値または指標の閾値)を決定する。
【0152】
一例として、指標抽出部47aは、パラメータの種類および閾値の組み合わせのうち、任意の継代数の細胞を一方の集合に完全に分離できるものを、指標の種類および指標の閾値に決定する。上記条件に該当する組み合わせが複数ある場合、指標抽出部47aは、1種類分の任意の継代数の細胞のみを一方の集合に分離できるものを優先して上記の指標の種類および指標の閾値を決定すればよい。
【0153】
また、上記条件に該当する組み合わせがない場合、指標抽出部47aは、以下の要領で指標の種類および指標の閾値を決定してもよい。例えば、指標抽出部47aは、2つの集合に同じ継代数の教師画像が含まれるが、一方の集合は1種類分の継代数の教師画像のみを抽出でき、かつ、一方の集合で抽出できる教師画像の数が最も多くなるものを優先して上記の指標の種類および指標の閾値を決定すればよい。
【0154】
指標抽出部47aは、次に指標の種類および指標の閾値を求める演算対象のノードを指定する。例えば、指標抽出部47aは、親ノードから左右に分岐する子ノードのうち左側のノードを指定する。なお、左側の子ノードよりも下層の全ノードで既に指標の種類および指標の閾値が求められている場合、指標抽出部47aは、親ノードから右側に分岐するノードを指定する。
【0155】
指標抽出部47aは、現在の演算対象のノードがそれ以上に分岐できないターミナルノードであるか否かを判定する。例えば、指標抽出部47aは、現在の演算対象のノードで1種類分の継代数の細胞が分離できている場合、ターミナルノードであると判定する。
【0156】
指標抽出部47aは、演算が完了したか否かを判定する。なお、指標抽出部47aは、ターミナルノードを除くすべてのノードで指標の種類および指標の閾値を求め終えた場合に演算が完了したものと判定する。
【0157】
指標抽出部47aは、現在の演算対象のノードにおいて、指標の種類および指標の閾値を求める。その後、指標抽出部47aは、演算対象のノードを変更する。その後、ループにより、各ノードでの指標の種類および指標の閾値が再帰的に求められる。
指標抽出部47aは、以上の処理で構築された判別モデルのデータを記憶装置43aに記録する。
【0158】
<指標の算出方法>
指標抽出部47aは、下記の2つの方法を用いて、iPS細胞の状態を区分するための指標を算出する。
1つ目の方法として、指標抽出部47aは、細胞の状態を染色等で評価し、「レベル」として大まかにいくつかに区分する。例えば、指標抽出部47aは、分化度小、分化度中、および分化度大に区分する。すなわち、指標抽出部47aは、順番や優劣が存在するものを、いくつかの「レベル」に区分する。
【0159】
2つ目の方法として、指標抽出部47aは、細胞の品質を染色等で評価し、「グループ」として大まかにいくつかに区分する。例えば、指標抽出部47aは、骨分化グループ、軟骨分化グループおよび脂肪分化グループに区分する。すなわち、指標抽出部47aは、各グループに順番や優劣はなく、並列的なグループであり、数字等で各グループをうまく言い表すことができないものを、いくつかの「グループ」に区分する。
【0160】
指標抽出部47aは、決定木法を用いて、下記の2種類のモデルを作る。
指標抽出部47aは、画像別モデルとして、画像毎の入力値と画像毎の教師値を用いて、データをグループ化する。指標抽出部47aは、各「レベル」または各「グループ」を区分し、細胞の分化の度合いのレベルを分類し、各分化の種類が分類する。
【0161】
指標抽出部47aは、細胞別モデルとして、細胞毎の入力値と細胞毎の教師値を用いて、データをグループ化する。指標抽出部47aは、画像中の細胞1つ1つに対して、各細胞のレベルやグループを区分する。これによって、1つ1つの細胞において、どんな形の指標の組み合わせならば、どんなレベルかグループに相当するかがわかる。
【0162】
指標抽出部47aは、上記各分類において、用意された「レベル」または「グループ」という多群をもっともよく別々に分離できる精度が高くなるように、各「レベル」または各「グループ」に対して指標の組み合わせと、その指標の閾値を選ぶ。
指標抽出部47aは、決定木の指標とその指標の閾値を記憶部43aに保存する。
【0163】
評価処理部48aは、記憶部43aからその決定木の指標とその指標の閾値を読み出す。評価処理部48aは、対象画像の特徴量からその指標の値を抽出する。評価処理部48aは、決定木のノードの指標ごとに、対象画像から抽出した指標の値と閾値とを比較する。これによって、評価処理部48aは、対象画像または対象iPS細胞を、「レベル」または「グループ」に分類する。評価処理部48aは、分類結果に基づいて、iPS細胞の状態の推定結果を算出する。
以下、指標抽出部47aと評価処理部48aとの具体的な処理例について説明する。
【0164】
<画像別、コロニー+フィーダーモデル>
図16は、画像別、コロニー+フィーダーモデルの決定木を説明するための図である。
図16の決定木は、分化のグループを分けた一例である。対象画像において、96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差が20以上であれば、グループ1(骨の分化グループ)に属する。
【0165】
対象画像において、96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差が20未満で、24時間のコロニーの丸さの平均値が30以上であれば、グループ2(軟骨の分化グループ)に属する。
対象画像において、96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差が20未満で、24時間のコロニーの丸さの平均値が30未満であれば、グループ3(脂肪の分化グループ)に属する。
【0166】
指標抽出部47aは、画像別モデルとして、iPS細胞のコロニーの特徴量とフィーダー細胞の特徴量を用いた決定木の指標の種類を算出する。
例えば、指標抽出部47aは、「96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差」と「24時間目のコロニーの丸さの平均値」という指標の種類を選択する。
【0167】
また、指標抽出部47aは、各指標の種類に対して、どの値以上または未満で判断するかという閾値(指標の閾値)を決定する。
例えば、指標抽出部47aは、指標「96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差」の種類に対して、指標の閾値20を決定し、指標の種類「24時間目のコロニーの丸さの平均値」に対して、指標の閾値30を決定する。
【0168】
<画像別、コロニー・フィーダーモデル>
図17は、画像別、コロニー・フィーダー別モデルの決定木を説明するための図である。
図17(a)は、画像別の、iPS細胞のコロニーの特徴量に基づく決定木(以下、コロニーモデル)を説明するための図である。図17(a)の決定木は、分化のグループを分けた一例である。対象画像において、24時間のコロニーの丸さの平均値が20以上であれば、グループ1(骨の分化グループ)に属する。
【0169】
対象画像において、24時間のコロニーの丸さの平均値が20未満で、96時間目と24時間目のコロニーの長さの変化量が100以上であれば、グループ2(軟骨の分化グループ)に属する。
一方、対象画像において、24時間のコロニーの丸さの平均値が20未満で、96時間目と24時間目のコロニーの長さの変化量が100未満であれば、グループ3(脂肪の分化グループ)に属する。
【0170】
図17(b)は、画像別の、フィーダー細胞の特徴量に基づく決定木(以下、フィーダーモデルと称する)を説明するための図である。図17(b)の決定木は、iPS細胞の劣化度合いのレベルを分けた一例である。対象画像において、48時間のフィーダー細胞の丸さの平均値が40以上であれば、グループ1(劣化度合い:大)に属する。
【0171】
対象画像において、48時間のフィーダー細胞の丸さの平均値が40未満で、96時間目と24時間目のフィーダー細胞の丸さのヒストグラムの面積差が50以上であれば、グループ2(劣化度合い:中)に属する。
一方、対象画像において、48時間のフィーダー細胞の丸さの平均値が40未満で、96時間目と24時間目のフィーダー細胞の丸さのヒストグラムの面積差が50未満であれば、グループ3(劣化度合い:小)に属する。
【0172】
指標抽出部47aは、画像別モデルとして、iPS細胞のコロニーの特徴量とフィーダー細胞の特徴量を用いた別々の決定木の指標を算出する。
例えば、指標抽出部47aは、コロニーモデルに対して、「24時間目のコロニーの丸さの平均値」と「96時間目と24時間目のコロニーの長さの変化量」という指標の種類を選択する。
また、指標抽出部47aは、フィーダーモデルに対して、「48時間目のフィーダー細胞の丸さの平均値」と「96時間目と24時間目のフィーダー細胞の丸さのヒストグラムの面積差」という指標の種類を選択する。
【0173】
また、指標抽出部47aは、各指標の種類に対して、指標の閾値を決定する。
例えば、指標抽出部47aは、指標の種類「24時間目のコロニーの丸さの平均値」に対して、指標の閾値20を決定し、指標の種類「96時間目と24時間目のコロニーの長さの変化量」に対して、指標の閾値100を決定する。
【0174】
また、指標抽出部47aは、指標の種類「48時間目のフィーダー細胞の丸さの平均値」に対して、指標の閾値40を決定し、指標の種類「96時間目と24時間目のフィーダー細胞の丸さのヒストグラムの面積差」に対して、指標の閾値50を決定する。
【0175】
評価処理部48aは、コロニーモデルでグループ1(分化グループ:骨)、フィーダーモデルでグループ3(劣化度合い:小)というような複合的な推定をする。
なお、評価処理部48aは、コロニーモデルでグループ1(分化グループ骨)、フィーダーモデルでグループ1(分化グループ骨)の両方でグループ名が一致した場合のみ、確かな予測とすることにしてもよい。
【0176】
<細胞別、コロニー・フィーダー別モデル>
図18は、細胞別、コロニー・フィーダー別モデルの決定木を説明するための図である。図18(a)は、細胞毎のコロニーモデルを説明するための図である。図18(a)の決定木は、分化のグループを分けた一例である。対象画像のあるiPS細胞のコロニーにおいて、24時間のコロニーの丸さの平均値が80以上で、96時間目と24時間目の96時間目と24時間目のコロニーの丸さのヒストグラムの面積差が20未満であれば、そのiPS細胞はグループ1(骨の分化グループ)に属する。
【0177】
対象画像のあるiPS細胞のコロニーにおいて、24時間のコロニーの丸さが80以上で、96時間目と24時間目のコロニーの丸さのヒストグラムの面積差が20以上であれば、そのiPS細胞はグループ2(軟骨の分化グループ)に属する。
一方、対象画像のあるiPS細胞のコロニーにおいて、24時間のコロニーの丸さが80未満であれば、そのiPS細胞はグループ3(脂肪の分化グループ)に属する。
【0178】
図18(b)は、細胞毎のフィーダーモデルを説明するための図である。図18(b)の決定木は、分化のグループを分けた一例である。対象画像において、状態を推定したいiPS細胞の周囲に存在するフィーダー細胞において、48時間のフィーダーの長さが20以上で、24時間目のフィーダーの輝度が30以上であれば、そのiPS細胞はレベル1(増殖能:高)に属する。
【0179】
対象画像において、状態を推定したいiPS細胞の周囲に存在するフィーダー細胞において、48時間のフィーダーの長さが20以上で、24時間目のフィーダーの輝度が30以上であれば、そのiPS細胞はレベル2(増殖能:中)に属する。
一方、対象画像において、状態を推定したいiPS細胞の周囲に存在するフィーダー細胞において、48時間のフィーダーの長さが20以上で、24時間目のフィーダーの輝度が30以上であれば、そのiPS細胞はレベル3(増殖能:小)に属する。
【0180】
指標抽出部47aは、個々の細胞レベルでiPS細胞の状態を推定するために、iPS細胞のコロニーの特徴量を用いた決定木と、フィーダー細胞の特徴量を用いた決定木とを作成する。
指標抽出部47aは、iPS細胞のコロニー1つ1つに対して、コロニーモデルの指標の組み合わせを検証して、コロニーに対する指標を算出する。
【0181】
また、指標抽出部47aは、フィーダー細胞1つ1つに対して、フィーダーモデルの指標の組み合わせを検証して、フィーダー細胞に対する指標を算出する。
また、指標抽出部47aは、各指標の種類に対して、指標の閾値を決定する。
【0182】
例えば、指標抽出部47aは、指標の種類「24時間目のコロニーの丸さ」に対して、指標の閾値80を決定し、指標の種類「96時間目と24時間目のコロニーの丸さのヒストグラムの面積差」に対して、指標の閾値20を決定する。
また、指標抽出部47aは、指標の種類「48時間目のフィーダー細胞の長さ」に対して、指標の閾値20を決定し、指標の種類「24時間目のフィーダー細胞の輝度」に対して、指標の閾値30を決定する。
【0183】
対象画像において、あるiPS細胞の状態を推定する際には、評価処理部48aは、2つのモデルの結果を総合して、iPS細胞の状態を推定する。
例えば、コロニーモデルにおいて、iPS細胞のコロニーの24時間目のコロニーの丸さ80以上、96時間目と24時間目のコロニーの丸さのヒストグラムの面積差が20未満であれば、評価処理部48aは、iPS細胞をグループ1に分類する。これによって、評価処理部48aは、そのiPS細胞が骨に分化する能力をもつと推定する。
【0184】
また、例えば、そのiPS細胞の周囲に存在するフィーダー細胞の形態的特徴量のうち、48時間目のフィーダー細胞の長さが20以上で、24時間目のフィーダー細胞の輝度が30以上であれば、評価処理部48aは、iPS細胞をレベル1に分類する。これによって、評価処理部48aは、iPS細胞の増殖能が高いと推定する。
そして、評価処理部48aは、iPS細胞を骨に分化する能力があり、増殖能が高いと複合的に推定する。
【0185】
CPU42aは、評価処理部48aが推定したiPS細胞の状態に基づき、iPS細胞又はフィーダー細胞の培養条件(例えば温度、湿度等)を変更するよう制御する。例えば、CPU42aは、温度調整装置15aに制御信号を供給し、恒温室15内の温度を上昇させるように制御する。また、CPU42aは、湿度調整装置15bに制御信号を供給し、恒温室15内の湿度を下降させるように制御する。
【0186】
図19は、決定木算出用の教師値の算出を説明するためのフローチャートである。
まず、ステップS501において、撮像装置34は、iPS細胞とiPS細胞の周囲に存在し、共に培養されているフィーダー細胞とが撮像された参照画像を継続的に取得し、記憶部43aに保存する。
【0187】
次に、ステップS502において、一定期間培養後に、ユーザは、画像撮影した細胞を染色マーカー(例えば、分化度を示す染色マーカーであるSSEA−4、SSEA−1、およびnanog等)で染色する。
なお、CPU42aが、一定期間培養後に、予め容器に入れられた染色マーカーを培養液に加えることに制御してもよい。これによって、画像撮影した細胞を染色マーカーで染色することができる。
【0188】
次に、ステップS503において、CPU42aは、染色画像から細胞毎に染色の有無を判定する。
次のステップS504とステップS505において、CPU42aは、評価の結果を「レベル」か「グループ」として評価し、下記の画像別教師値と細胞別教師値をつくる。なお、教師値は、染色結果だけでなく、熟練者による評価に基づいてもよい。
【0189】
<画像別教師値>
まず、ステップS504において、CPU42aは、画像ごとに、画像中に含まれる細胞と認識される画像中のオブジェクト1個1個に対して、染色の有無を判定する。染色の判定の際、CPU42aは、オブジェクトの輝度値が所定の閾値よりも大きい場合には、「染色有り」と判定する。一方、指標抽出部47aは、オブジェクトの輝度値が所定の閾値以下の場合には、「染色無し」と判定する。
【0190】
そして、CPU42aは、全体の細胞数に対する「染色有り」と判定された細胞数の割合を算出する。CPU42aは、その割合に基づいて、その画像毎に、「レベル」または「グループ」の分類名を決定する。例えば、CPU42aは、ある画像に対して、「分化グループ:骨」と分類名を決定する。
【0191】
<細胞別教師値>
次に、ステップS505において、CPU42aは、各サンプル(=複数の画像から構成されるある1つの実験条件下のデータ)中の細胞と認識される画像中のオブジェクト1個1個に対して、染色の有無や、熟練者の経験に基づき、その細胞毎に、「レベル」または「グループ」の呼び名をつける。ここで、「判断不能」「ゴミ」などというグループを作ってもよい。
【0192】
次に、ステップS506において、全ての条件で、ステップS501からステップS505の処理を所定の回数行っていない場合(ステップS506 NO)、ステップS501に戻る。一方、ステップS506において、全ての条件で、ステップS501からステップS505の処理を所定の回数行った場合(ステップS506 YES)、本フローチャートは終了する。
【0193】
図20は、決定木算出用の特徴量の算出を説明するためのフローチャートである。図20のフローチャートの処理は、ユーザからの指示に応じてCPU42aが実行する。
まず、ステップS601において、CPU42aは、予め用意されたサンプルの顕微鏡画像のデータを記憶部43aから読み込む。なお、S601でのCPU42aは、各画像に対応する細胞の総数およびiPS細胞の数を示す情報もこの時点で取得するものとする。
【0194】
次に、ステップS602において、CPU42aは、上記のサンプルの顕微鏡画像のうちから、処理対象となる画像を指定する。ここで、S602でのCPU42aは、予め用意されているサンプルの顕微鏡画像のすべてを処理対象として順次指定してゆくものとする。
【0195】
次に、ステップS603において、領域抽出部44は、処理対象の顕微鏡画像について、画像内に含まれるiPS細胞のコロニーの領域と、フィーダー細胞の領域とを抽出する。
【0196】
次に、ステップS604において、特徴量算出部45aは、実施例1と同様に、領域抽出部44により画像から抽出した各画像のオブジェクトに対して、細胞の形態的特徴を示す特徴量をそれぞれ求める。一例として、特徴量算出部45aは、各細胞について図6に示された19種類の特徴量をそれぞれ求める。
【0197】
次に、ステップS605において、特徴量算出部45aは、演算対象の教師画像について、19種類の特徴量の画像内平均値および画像内標準偏差をそれぞれ求める。そして、特徴量算出部45aは、上記の各特徴量の画像内平均値および画像内標準偏差をそれぞれ記憶部43aに記録する。
【0198】
次に、ステップS606において、特徴量算出部45aが、全画像の特徴量を算出していない場合(S606 NO)、ステップS602に戻る。一方、特徴量算出部45aが、全画像の特徴量を算出した場合(S606 YES)、本フローチャートは終了する。
【0199】
図21は、画像別の決定木の算出を説明するためのフローチャートである。予め、図20のフローチャートで、特徴量算出部45aが各経時の各形態的特徴量の平均値(入力値1)および各経時の各形態的特徴量の標準偏差(入力値2)を算出しているものとする。
まず、ステップS701において、度数分布算出部46は、各経時の各形態的特徴量の度数分布(入力値3)を算出する。
【0200】
次に、ステップS702において、指標抽出部47aは、形態的特徴量ごとに、特徴量の度数分布の面積の差(入力値4)を経時の全組み合わせで算出する。
次に、ステップS703において、指標抽出部47aが、全ての特徴量で、各経時間の特徴量の度数分布の面積の差を算出していない場合(S703 NO)、指標抽出部47aは、ステップS702に戻る。一方、指標抽出部47aが、全ての特徴量で、各経時間の特徴量の度数分布の面積の差を算出した場合(S703 NO)、ステップS704に遷移する。
【0201】
次に、ステップS704において、指標抽出部47aは、画像毎の上記4つの入力値と画像毎の教師値を用いてデータをグループ化して、決定木を構築する。ここで、教師値は、例えば、細胞の分化の度合いを示すレベルであえば、高、中または小であり、分化の種類を示すグループであれば、骨、軟骨または脂肪である。
これによって、各「レベル」または各「グループ」が区分される。例えば、細胞の分化の度合いを示すレベルが分類されたり、各分化の種類を示すグループが分類されたりする。
【0202】
次に、ステップS705において、指標抽出部47aは、決定木の構造と、グループ化したときの指標の種類と、指標の種類毎の指標の閾値とを記憶部43aに保存する。以上で、本フローチャートは終了する。
【0203】
図22は、細胞別の決定木算出を説明するためのフローチャートである。
まず、ステップS801において、指標抽出部47aは、特徴量算出部45aにより算出された各画像中の細胞と認識されるオブジェクト1個1個に対して形の指標を、実験条件毎に記憶部43aから読み出す。
【0204】
次に、ステップS802において、指標抽出部47aは、細胞毎の上記4つの入力値と細胞毎の教師値を用いてデータをグループ化して、決定木を構築する。これによって、対象画像中の細胞1つ1つに対して、各細胞のレベル」または「グループ」が区分される。従って、1つ1つの細胞において、形の指標の組み合わせから、その細胞の「レベル」または「グループ」を特定することができる。
【0205】
次に、ステップS803において、指標抽出部47aは、決定木の構造と、グループ化したときの指標の種類と、指標の種類毎の指標の閾値とを記憶部43aに保存する。以上で、本フローチャートは終了する。
【0206】
続いて、判別モデルである決定木を用いて、対象画像からiPS細胞の状態を推定する3つの方法について説明する。まず、フィーダー細胞の形態的特徴量とiPS細胞のコロニーの特徴量とから、対象画像中に含まれるiPS細胞集団の状態を推定する方法について説明する。
【0207】
図23は、図16に示す画像別、コロニー+フィーダーモデルを用いたiPS細胞の状態の推定を説明するためのフローチャートである。
まず、ステップS901において、撮像装置34は、iPS細胞とiPS細胞の周囲に存在し、共に培養されているフィーダー細胞とが撮像された参照画像を継続的に取得し、記憶部43aに保存する。
【0208】
次に、ステップS902において、特徴量算出部45aは、上記4つの入力値を算出する。
次に、ステップS903において、評価処理部48aは、記憶部43aから画像別、コロニー+フィーダーモデルで用いられる指標の種類およびその指標の閾値を読み出す。
【0209】
次に、ステップS904において、評価処理部48aは、特徴量算出部45aが算出した4つの入力値から、読み出した指標の種類に該当する値を読み出す。
そして、評価処理部48aは、その読み出した指標の種類に該当する値を、その指標の閾値と比較することによって、iPS細胞を所定のグループに分類する。これによって、評価処理部48aは、iPS細胞の状態を推定することができる。
【0210】
例えば、評価処理部48aは、上記入力値から「96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差」と「24時間目のコロニーの丸さ平均値」という指標の種類に該当する値をそれぞれ読み出す(図16参照)。
そして、評価処理部48aは、「96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差」に該当する値が、その指標の閾値(20)以上であれば、iPS細胞を「骨に分化する能力を持つ」というグループに分類する。
【0211】
これによって、iPS細胞の周囲に存在するフィーダー細胞集団の形態的特徴量の度数分布の時間変化から、iPS細胞の分化の種類を推定することができる。
【0212】
一方、評価処理部48aは、入力値のうち「96時間目と24時間目のフィーダー細胞のヒストグラム間の面積差」に該当する値が、その指標の閾値(20)未満であり、入力値のうち「24時間目のコロニーの丸さの平均値」に該当する値が、その指標の閾値(30)以上であれば、iPS細胞を「軟骨に分化する能力を持つ」というグループに分類する。
【0213】
これによって、iPS細胞の周囲に存在するフィーダー細胞集団の形態的特徴量の度数分布の時間変化と、iPS細胞のコロニー集団の形態的特徴量とから、iPS細胞の分化の種類を推定することができる。以上で、本フローチャートは終了する。
【0214】
2番目に、フィーダー細胞の形態的特徴量とiPS細胞のコロニーの特徴量とから、対象画像中に含まれるiPS細胞集団の状態を推定する方法について説明する。
図24は、図17に示す画像別、コロニー・フィーダー別モデルを用いたiPS細胞の状態の推定を説明するためのフローチャートである。
【0215】
まず、ステップS1001からステップS1002までは、ステップS901からステップS902までと同じなので、説明を省略する。
次に、ステップS1003において、評価処理部48aは、記憶部43aから画像別、コロニー・フィーダー別モデルで用いられる指標の種類およびその指標の閾値を読み出す。
【0216】
次に、ステップS1004において、評価処理部48aは、特徴量算出部45aが算出した4つの入力値から、コロニーモデルの指標の種類に該当する値を読み出す。
そして、評価処理部48aは、その読み出した指標の種類に該当する値を、その指標の閾値と比較することによって、iPS細胞を所定のグループに分類する。
【0217】
例えば、評価処理部48aは、上記入力値から「24時間目のコロニーの丸さの平均値」と「96時間目と24時間目のコロニーの長さの変化量」という指標の種類に該当する値をそれぞれ読み出す(図17(a)参照)。
そして、評価処理部48aは、入力値のうち「24時間目のコロニーの丸さの平均値」に該当する値が、その指標の閾値(20)以上であれば、iPS細胞を「骨に分化する能力を持つ」というグループに分類する。
【0218】
これによって、iPS細胞のコロニー集団の形態的特徴量から、iPS細胞の分化の種類を推定することができる。
【0219】
次に、ステップS1005において、評価処理部48aは、特徴量算出部45aが算出した4つの入力値から、フィーダーモデルの指標の種類に該当する値を読み出す。
そして、評価処理部48aは、その読み出した指標の種類に該当する値を、その指標の閾値と比較することによって、iPS細胞を所定のレベルに分類する。
【0220】
例えば、評価処理部48aは、上記入力値から「48時間目のフィーダー細胞の丸さ平均値」と「96時間目と24時間目のフィーダー細胞の丸さのヒストグラムの面積差」という指標の種類に該当する値をそれぞれ読み出す(図17(b)参照)。
そして、評価処理部48aは、入力値のうち「48時間目のフィーダー細胞の丸さ平均値」に該当する値が、その指標の閾値(40)以上であれば、iPS細胞を「大きな劣化度合い」というレベルに分類する。
【0221】
これによって、フィーダー細胞集団の形態的特徴量から、iPS細胞の劣化度合いを推定することができる。
【0222】
次に、ステップS1006において、評価処理部48aは、分類したグループとレベルに基づいて、iPS細胞の状態を複合的に推定する。
例えば、評価処理部48aは、コロニーモデルでグループ1(分化グループ:骨)、フィーダーモデルでレベル1(劣化度合い:大)に分類されたことから、iPS細胞は骨に分化したが、劣化が激しいという複合的な推定をする。以上で、本フローチャートは、終了する。
【0223】
最後に、フィーダー細胞の形態的特徴量とiPS細胞のコロニーの特徴量とから、対象画像中に含まれるiPS細胞集団の状態を推定する方法について説明する。
図25は、図18に示す細胞別、コロニー・フィーダー別モデルを用いたiPS細胞の状態の推定を説明するためのフローチャートである。
【0224】
まず、ステップS1101からステップS1102までは、ステップS901からステップS902までと同じなので、説明を省略する。
次に、ステップS1103において、評価処理部48aは、記憶部43aから細胞別、コロニー・フィーダー別モデルで用いられる指標の種類およびその指標の閾値を読み出す。
【0225】
次に、ステップS1104において、評価処理部48aは、特徴量算出部45aが算出した4つの入力値から、コロニーモデルの指標の種類に該当する値を読み出す。
そして、評価処理部48aは、その読み出した指標の種類に該当する値を、その指標の閾値と比較することによって、iPS細胞を所定のグループに分類する。
【0226】
例えば、評価処理部48aは、上記入力値から「24時間目のコロニーの丸さ」と「96時間目と24時間目のコロニーの丸さのヒストグラムの面積差」という指標の種類に該当する値をそれぞれ読み出す(図18(a)参照)。
そして、評価処理部48aは、入力値のうち「24時間目のコロニーの丸さ」に該当する値が、その指標の閾値(80)未満であれば、iPS細胞を「脂肪に分化する能力をもつ」というグループに分類する。
【0227】
これによって、iPS細胞の1つのコロニーの形態的特徴量から、そのiPS細胞のコロニーに含まれるiPS細胞の分化の種類を推定することができる。
【0228】
次に、ステップS1105において、評価処理部48aは、特徴量算出部45aが算出した4つの入力値から、フィーダーモデルの指標の種類に該当する値を読み出す。
そして、評価処理部48aは、その読み出した指標の種類に該当する値を、その指標の閾値と比較することによって、iPS細胞を所定のレベルに分類する。
【0229】
例えば、評価処理部48aは、上記入力値から「48時間目のフィーダー細胞の長さ」と「24時間目のフィーダー細胞の輝度」という指標の種類に該当する値をそれぞれ読み出す(図18(b)参照)。
そして、評価処理部48aは、入力値のうち「48時間目のフィーダー細胞の長さ」に該当する値が、その指標の閾値(20)未満であれば、iPS細胞を「低い増殖能」というレベルに分類する。
【0230】
これによって、1つのフィーダー細胞の形態的特徴量から、その周囲に存在するiPS細胞の分化の種類を推定することができる。
【0231】
次に、ステップS1106において、評価処理部48aは、分類したグループとレベルに基づいて、iPS細胞の状態を複合的に推定する。
例えば、評価処理部48aは、コロニーモデルでグループ3(分化グループ:脂肪)、フィーダーモデルでレベル3(増殖能:低)に分類されたことから、そのiPS細胞は脂肪に分化する分化能を有するが、増殖能が低いという複合的な推定をする。以上で、本フローチャートは、終了する。
【0232】
以上、本発明の第2の実施例によれば、対象画像中に含まれるフィーダー細胞集団の形態的特徴量から、対象画像中に含まれるiPS細胞集団を、所定の「レベル」または所定の「グループ」に区分することができる。
さらに、対象画像中に含まれるフィーダー細胞集団の形態的特徴量と、対象画像中に含まれるiPS細胞集団の形態的特徴量とから、対象画像中に含まれるiPS細胞集団を、所定の「レベル」または所定の「グループ」に区分することができる。
【0233】
また、対象画像中に含まれる1つのフィーダー細胞の形態的特徴量から、対象画像中の1つのiPS細胞を、所定の「レベル」または所定の「グループ」に区分することができる。
さらに、対象画像中に含まれる1つのフィーダー細胞の形態的特徴量と、対象画像中に含まれる1つのiPS細胞の形態的特徴量とから、対象画像中の1つのiPS細胞を、所定の「レベル」または所定の「グループ」に区分することができる。
【0234】
なお、第2の実施例では、iPS細胞のコロニーの特徴量とフィーダー細胞の特徴量に対して、それぞれ別々の決定木を構築したが、これに限らず、両方の特徴量を用いた決定木を構築してもよい。
なお、第2の実施例では、iPS細胞の分化の方向性、iPS細胞の劣化度合い、またはiPS細胞の増殖度を推定したがこれに限らず、iPS細胞の分化度、iPS細胞の腫瘍化しやすさ等でもよい。
【0235】
<細胞の培養法の例>
図26は、本発明の実施例2の細胞評価プログラムを用いた細胞の培養方法を説明するためのフローチャートである。本フローチャートでは、インキュベータ11に増殖させたいiPS細胞を含んだシャーレが置かれた状況を想定することとする。
【0236】
まず、ステップS1201において、CPU42aは、予め決められた培養条件(例えば所定の温度、湿度等)で細胞を培養するよう温度調整装置15aと湿度調整装置15bとを制御する。所定期間経過後、ステップS1202において、CPU42aは、記憶部43aから読み出した本発明の実施形態の細胞評価プログラムを実行し、細胞の状態を評価する。次に、ステップS1203において、CPU42aは、細胞の状態の評価結果に基づき、培養を中止するか、培養条件を変更するか、または現在の培養条件で培養を続行するか判定する。
【0237】
次に、ステップS1204において、CPU42aが培養を中止すると判定した場合(ステップS1204 YES)、CPU42aは培養の中止を示す情報を不図示のモニタ等に表示させ、処理を終了する。
一方、CPU42aは培養を中止すると判定しなかった場合(ステップS1204 NO)、CPU42aはステップS1205の処理に進む。
【0238】
次に、ステップS1205において、CPU42aが培養条件を変更すると判定した場合(ステップS1205 YES)、CPU42aは、細胞の状態の評価結果と関係付けられた培養条件(例えば所定の温度、湿度等)に変更するよう温度調整装置15aと湿度調整装置15bとを制御する(ステップS1206)。CPU42aは、ステップS1202の処理に戻る。
一方、CPU42aが現在の培養条件で培養を続行すると判定した場合(ステップS1205 NO)、CPU42aはステップS1207の処理に進む。
【0239】
次に、ステップS1207において、CPU42aは、予め決められた時間の経過毎に、撮像装置34で撮像された画像から、iPS細胞に相当するオブジェクトを抽出し、オブジェクトの数すなわち細胞数を計数する。
【0240】
次に、ステップS1208において、計数された細胞数が所定の細胞数に到達していない場合(ステップS1208 NO)、計数された細胞数に応じた時間が経過した後、CPU42aはステップS1202の処理に戻る。
一方、計数された細胞数が所定の細胞数に到達した場合(ステップS1208 YES)、CPU42aはその細胞の培養が完了した旨を示す情報を、不図示のモニタ等に表 示させる。以上で、本フローチャートは、終了する。
【0241】
以上により、本発明の細胞の培養方法を用いれば、細胞の評価に基づいて動的に培養条件を変更することができるので、iPS細胞を容易に増殖させることができる。
なお、本発明の実施例2の細胞評価プログラムを用いて、細胞の培養条件を変更したが、これに限らず、本発明の実施例1の細胞評価プログラムを用いて、細胞の培養条件を変更してもよい。
【0242】
なお、本発明の実施形態では、iPS細胞について説明したがこれに限らず、ES細胞でも、他の細胞でもよい。
また、本発明の実施形態では、iPS細胞の状態を推定するために、他のiPS細胞の形態的特徴量を指標にしたが、これに限らず、ES細胞など近種の細胞の形態的特徴量を指標にしてもよい。
【0243】
なお、本発明の実施形態では、フィーダー細胞は1種類の細胞であるとして説明したが、これに限らず、フィーダー細胞は複数種類の細胞を用いて構成されてもよい。その際には、その複数種類のフィーダー細胞のうち、少なくとも1種類のフィーダー細胞の形態的特徴量を指標にすればよい。
また、本発明の実施形態では、iPS細胞とフィーダー細胞との2種類の細胞が共に培養されているとしたが、これに限らず、その他の種類の細胞が、iPS細胞とフィーダー細胞と共に培養されていてもよい。
【0244】
<実施形態の補足事項>
(1)上記の一の実施形態では、インキュベータ11またはインキュベータ11aがそれぞれ備える制御装置41または制御装置41aに情報処理装置を組み込んだ例を説明したが、本発明の情報処理装置は、インキュベータ11またはインキュベータ11aから顕微鏡画像を取得して解析を行う外部の独立したコンピュータで構成されていてもよい(この場合の図示は省略する)。
【0245】
(2)上記の実施形態では、領域抽出部44、特徴量算出部45または特徴量算出部45a、度数分布算出部46、指標抽出部47または指標抽出部47a、評価処理部48または評価処理部48aの各機能をプログラムでソフトウェア的に実現する例を説明したが、これらの処理をASICによってハードウエア的に実現しても勿論かまわない。
【0246】
(3)上記の一の実施形態では、評価情報の計算モデルとその指標を制御装置41または制御装置41aがFNNによって求める例を説明した。しかし、本発明の培養状態評価装置は、例えば、重回帰分析などの他の多変量解析によって、評価情報の計算モデルとその指標を求めるものでもよい。
【0247】
さらに、本発明の培養状態評価装置は、複数の計算モデルを組み合わせて、これらの計算モデルによる演算結果の多数決(あるいは重み付け平均)によって、最終的な評価情報を生成するようにしてもよい。この場合には、例えば、混在率の低いデータではMRAが強く、混在率の高いデータにはFNNが強いというように、一方の計算モデルでは精度の低い状況を他のモデルによってカバーすることができ、評価情報の精度をより高めることができる。
【0248】
(4)また、培養状態評価装置は、評価情報の計算モデルを求めるときに、最初に複数の指標を組み合わせでの計算結果を演算し、変数増減法により指標を増減させるようにしてもよい。また、データの精度が高ければ指標を全て用いても良い。
【0249】
(5)上記の一の実施形態では、2つの度数分布の差分の絶対値和を用いて、度数分布の変化量を求める例を説明したが、2つの度数分布の差分の二乗和から度数分布の変化量を求めてもよい。また、上記の一の実施形態で示した計算式はあくまで一例に過ぎず、例えば2次以上のn次方程式などであってもよい。
【0250】
(6)上記の実施形態や実施例に示した特徴値はあくまで一例にすぎず、評価対象の細胞の種類などに応じて他の特徴値のパラメータを採用することも勿論可能である。
【0251】
以上、本発明の実施形態について図面を参照して詳述したが、具体的な構成はこの実施形態に限られるものではなく、この発明の要旨を逸脱しない範囲の設計等も含まれる。
【符号の説明】
【0252】
11 インキュベータ
11a インキュベータ
15 恒温室
19 培養容器
22 観察ユニット
34 撮像装置
41 制御装置
41a 制御装置
42 CPU
42a CPU
43 記憶部
43a 記憶部
44 領域抽出部
45 特徴量算出部
45a 特徴量算出部
46 度数分布算出部
47 指標抽出部
47a 指標抽出部
48 評価処理部
48a 評価処理部
【特許請求の範囲】
【請求項1】
第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、前記第1の種類の個別の細胞および細胞の集合体が占める領域と前記第2の種類の細胞が占める領域とを抽出する領域抽出部と、
前記領域抽出部で抽出された第2の種類の細胞が占める領域に存在する前記第2の種類の細胞の形態的特徴を示す特徴量を算出する第1の特徴量算出部と、
前記第2の種類の細胞が有する形態的特徴を示す特徴量と、前記第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する評価処理部と、
を備えることを特徴とする細胞評価装置。
【請求項2】
前記対象画像毎に前記第2の種類の細胞の特徴量の度数分布を算出する第1の度数分布算出部を更に備え、
前記評価処理部は、異なる時刻で取得された対象画像間における前記第1の度数分布算出部により算出された度数分布の変化を抽出し、前記抽出された変化に応じて、前記第1の種類の細胞の状態を評価することを特徴とする請求項1に記載の細胞評価装置。
【請求項3】
前記対象画像毎に前記第1の種類の細胞の特徴量の度数分布をそれぞれ算出する第2の度数分布算出部を更に備え、
前記評価処理部は、異なる時刻で取得された対象画像間における前記第1の度数分布算出部により算出された度数分布の変化と、前記対象画像間での前記第2の度数分布算出部により算出された度数分布の変化を抽出し、前記抽出された変化に基づいて、前記第1の種類の細胞の状態を評価することを特徴とする請求項2に記載の細胞評価装置。
【請求項4】
前記第1の種類の細胞と前記第2の種類の細胞と同種の細胞が共に培養されている状態が撮像された参照画像を記憶する記憶部と、
前記参照画像が撮像された時間の情報と、前記参照画像における第2の種類の細胞が有する形態的特徴を示す特徴量とに基づいて、前記第1の種類の細胞の品質を分類する指標を算出する第1の指標算出部と、
を更に備え、
前記評価処理部は、前記第1の指標算出部により算出された指標と、前記対象画像から抽出された前記第2の種類の細胞が有する形態的特徴を示す特徴量とを照合し、前記第1の種類の細胞の状態を評価することを特徴とする請求項1に記載の細胞評価装置。
【請求項5】
前記参照画像が撮像された時間の情報と、前記参照画像における第1の種類の細胞が有する形態的特徴を示す特徴量と、前記参照画像における第2の種類の細胞が有する形態的特徴を示す特徴量とに基づいて、前記第1の種類の細胞の品質を分類する指標を算出する第2の指標算出部と、
を更に備え、
前記評価処理部は、前記第1の指標算出部により算出された指標と前記第2の指標算出部により算出された指標と、前記対象画像から抽出された前記第1の種類の細胞が有する形態的特徴を示す特徴量とを照合し、前記第1の種類の細胞の状態を評価することを特徴とする請求項4に記載の細胞評価装置。
【請求項6】
前記第1の種類の細胞は、ES細胞またはiPS細胞であることを特徴とする請求項1から請求項5のいずれかに記載の細胞評価装置。
【請求項7】
前記第2の種類の細胞は、フィーダー細胞であることを特徴とする請求項1から請求項6のいずれかに記載の細胞評価装置。
【請求項8】
細胞を培養する培養容器を収納するとともに、所定の環境条件に内部を維持可能な恒温室と、
前記恒温室内で前記培養容器に含まれる前記細胞の画像を撮像する撮像装置と、
請求項1から請求項7のいずれか1項に記載の細胞評価装置と、
を備えることを特徴とするインキュベータ。
【請求項9】
第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、前記第1の種類の個別の細胞および細胞の集合体が占める領域と前記第2の種類の細胞が占める領域とを抽出する領域抽出手順と、
前記領域抽出手順で抽出された第2の種類の細胞が占める領域に存在する前記第2の種類の細胞の形態的特徴を示す特徴量を算出する第1の特徴量算出手順と、
前記第2の種類の細胞が有する形態的特徴を示す特徴量と、前記第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する評価処理手順と、
を有することを特徴とする細胞評価方法。
【請求項10】
第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、前記第1の種類の個別の細胞および細胞の集合体が占める領域と前記第2の種類の細胞が占める領域とを抽出する第1のステップと、
前記第1のステップで抽出された第2の種類の細胞が占める領域に存在する前記第2の種類の細胞の形態的特徴を示す特徴量を算出する第2のステップと、
前記第2の種類の細胞が有する形態的特徴を示す特徴量と、前記第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する第3のステップと、
をコンピュータに実行させるための細胞評価プログラム。
【請求項11】
第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞が撮像された画像から、前記第2の種類の細胞の形態的特徴を示す特徴量を抽出し、
前記第2の種類の細胞の形態的特徴を示す特徴量に基づき、第1の種類の細胞の状態を推定し、
前記第1の細胞の状態に基づき、前記第1の種類の細胞又は前記第2の種類の細胞の培養条件を変更することを特徴とする細胞の培養方法。
【請求項1】
第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、前記第1の種類の個別の細胞および細胞の集合体が占める領域と前記第2の種類の細胞が占める領域とを抽出する領域抽出部と、
前記領域抽出部で抽出された第2の種類の細胞が占める領域に存在する前記第2の種類の細胞の形態的特徴を示す特徴量を算出する第1の特徴量算出部と、
前記第2の種類の細胞が有する形態的特徴を示す特徴量と、前記第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する評価処理部と、
を備えることを特徴とする細胞評価装置。
【請求項2】
前記対象画像毎に前記第2の種類の細胞の特徴量の度数分布を算出する第1の度数分布算出部を更に備え、
前記評価処理部は、異なる時刻で取得された対象画像間における前記第1の度数分布算出部により算出された度数分布の変化を抽出し、前記抽出された変化に応じて、前記第1の種類の細胞の状態を評価することを特徴とする請求項1に記載の細胞評価装置。
【請求項3】
前記対象画像毎に前記第1の種類の細胞の特徴量の度数分布をそれぞれ算出する第2の度数分布算出部を更に備え、
前記評価処理部は、異なる時刻で取得された対象画像間における前記第1の度数分布算出部により算出された度数分布の変化と、前記対象画像間での前記第2の度数分布算出部により算出された度数分布の変化を抽出し、前記抽出された変化に基づいて、前記第1の種類の細胞の状態を評価することを特徴とする請求項2に記載の細胞評価装置。
【請求項4】
前記第1の種類の細胞と前記第2の種類の細胞と同種の細胞が共に培養されている状態が撮像された参照画像を記憶する記憶部と、
前記参照画像が撮像された時間の情報と、前記参照画像における第2の種類の細胞が有する形態的特徴を示す特徴量とに基づいて、前記第1の種類の細胞の品質を分類する指標を算出する第1の指標算出部と、
を更に備え、
前記評価処理部は、前記第1の指標算出部により算出された指標と、前記対象画像から抽出された前記第2の種類の細胞が有する形態的特徴を示す特徴量とを照合し、前記第1の種類の細胞の状態を評価することを特徴とする請求項1に記載の細胞評価装置。
【請求項5】
前記参照画像が撮像された時間の情報と、前記参照画像における第1の種類の細胞が有する形態的特徴を示す特徴量と、前記参照画像における第2の種類の細胞が有する形態的特徴を示す特徴量とに基づいて、前記第1の種類の細胞の品質を分類する指標を算出する第2の指標算出部と、
を更に備え、
前記評価処理部は、前記第1の指標算出部により算出された指標と前記第2の指標算出部により算出された指標と、前記対象画像から抽出された前記第1の種類の細胞が有する形態的特徴を示す特徴量とを照合し、前記第1の種類の細胞の状態を評価することを特徴とする請求項4に記載の細胞評価装置。
【請求項6】
前記第1の種類の細胞は、ES細胞またはiPS細胞であることを特徴とする請求項1から請求項5のいずれかに記載の細胞評価装置。
【請求項7】
前記第2の種類の細胞は、フィーダー細胞であることを特徴とする請求項1から請求項6のいずれかに記載の細胞評価装置。
【請求項8】
細胞を培養する培養容器を収納するとともに、所定の環境条件に内部を維持可能な恒温室と、
前記恒温室内で前記培養容器に含まれる前記細胞の画像を撮像する撮像装置と、
請求項1から請求項7のいずれか1項に記載の細胞評価装置と、
を備えることを特徴とするインキュベータ。
【請求項9】
第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、前記第1の種類の個別の細胞および細胞の集合体が占める領域と前記第2の種類の細胞が占める領域とを抽出する領域抽出手順と、
前記領域抽出手順で抽出された第2の種類の細胞が占める領域に存在する前記第2の種類の細胞の形態的特徴を示す特徴量を算出する第1の特徴量算出手順と、
前記第2の種類の細胞が有する形態的特徴を示す特徴量と、前記第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する評価処理手順と、
を有することを特徴とする細胞評価方法。
【請求項10】
第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞とが撮像された対象画像において、前記第1の種類の個別の細胞および細胞の集合体が占める領域と前記第2の種類の細胞が占める領域とを抽出する第1のステップと、
前記第1のステップで抽出された第2の種類の細胞が占める領域に存在する前記第2の種類の細胞の形態的特徴を示す特徴量を算出する第2のステップと、
前記第2の種類の細胞が有する形態的特徴を示す特徴量と、前記第1の種類の細胞の状態との対応関係に基づいて、第1の種類の細胞の状態を評価する第3のステップと、
をコンピュータに実行させるための細胞評価プログラム。
【請求項11】
第1の種類の細胞と前記第1の種類の細胞の周囲に存在し、共に培養されている第2の種類の細胞が撮像された画像から、前記第2の種類の細胞の形態的特徴を示す特徴量を抽出し、
前記第2の種類の細胞の形態的特徴を示す特徴量に基づき、第1の種類の細胞の状態を推定し、
前記第1の細胞の状態に基づき、前記第1の種類の細胞又は前記第2の種類の細胞の培養条件を変更することを特徴とする細胞の培養方法。
【図1】


【図2】


【図3】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図4】


【図5】




【図2】


【図3】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図4】


【図5】


【公開番号】特開2011−229409(P2011−229409A)
【公開日】平成23年11月17日(2011.11.17)
【国際特許分類】
【出願番号】特願2010−100162(P2010−100162)
【出願日】平成22年4月23日(2010.4.23)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【出願人】(000004112)株式会社ニコン (12,601)
【Fターム(参考)】
【公開日】平成23年11月17日(2011.11.17)
【国際特許分類】
【出願日】平成22年4月23日(2010.4.23)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【出願人】(000004112)株式会社ニコン (12,601)
【Fターム(参考)】
[ Back to top ]

