細胞質不和合性阻害による糸状菌類へのウイルス導入方法
【課題】 本発明は、特定の菌種や菌株の種類に制限されることなく、二核菌亜界に属する幅広い糸状菌類の菌種や菌株に容易に適用が可能である(極めて汎用性が高い)、菌類寄生ウイルスの導入方法を開発することを目的とする。
【解決手段】 ウイルス供与菌が保持している導入対象の菌類寄生ウイルスを、当該ウイルス供与菌と細胞質不和合性の関係にあるウイルス受容菌に導入するにあたり、;当該ウイルス供与菌とウイルス受容菌の両菌株を、亜鉛イオン存在下で共培養(好ましくは対峙培養)することによって、;‘人為的な菌糸融合’及び‘細胞質不和合性反応に伴う菌糸の細胞死阻害や遅延’を誘導し、当該菌糸融合を介して‘当該糸状菌類間でのウイルス移行’を行わせることを特徴とする、;糸状菌類への菌類寄生ウイルス導入方法、を提供する。
【解決手段】 ウイルス供与菌が保持している導入対象の菌類寄生ウイルスを、当該ウイルス供与菌と細胞質不和合性の関係にあるウイルス受容菌に導入するにあたり、;当該ウイルス供与菌とウイルス受容菌の両菌株を、亜鉛イオン存在下で共培養(好ましくは対峙培養)することによって、;‘人為的な菌糸融合’及び‘細胞質不和合性反応に伴う菌糸の細胞死阻害や遅延’を誘導し、当該菌糸融合を介して‘当該糸状菌類間でのウイルス移行’を行わせることを特徴とする、;糸状菌類への菌類寄生ウイルス導入方法、を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、糸状菌類に感染している菌類寄生ウイルスを、細胞質不和合の関係にある他の糸状菌類に導入する方法に関する。
【背景技術】
【0002】
植物病を引き起こす病原菌の多くは、二核菌亜界(子嚢菌類及び担子菌類からなる分類群)に属する糸状菌類が原因であることが知られている。
そこで、植物病原糸状菌に感染する菌類寄生ウイルス(マイコウイルス、菌類ウイルスともいう)を利用して、その宿主となる病原菌の病原力を低下させることによって植物病害を防除する生物防除法の開発が試みられている。
その先駆的研究として、果樹類の重要な病害である紋羽病(白紋羽病および紫紋羽病)を防除するために菌類寄生ウイルスを利用する研究開発が進められている(非特許文献1 参照)。
【0003】
しかし、菌類寄生ウイルスは、任意の植物病原糸状菌の菌株に導入できないという問題がこの生物防除法の開発を遅らせている。
その問題は、異なる菌体間における菌類寄生ウイルスの伝搬(移行)は、(1)体細胞的に和合な菌体間での菌糸融合によってのみ認められ、体細胞的に不和合な菌体間では認められないこと(細胞質不和合性)、(2)そして菌類寄生ウイルスは外部から直接に菌糸細胞に感染しないこと、に起因する(非特許文献2 参照)。
なお、自然界に生息している糸状菌類は、それぞれ細胞質和合に関する遺伝子型が異なっており、対峙培養を行うと細胞質不和合性反応に伴う細胞死が引き起こされてしまう。
【0004】
現行の菌類寄生ウイルスの人為的な導入方法としては、ベクターモノカリオンを用いた導入方法、すなわち、同じ菌種内の異なる菌株と菌糸融合を行う性質を有するベクターモノカリオン菌株を仲介することによって菌類寄生ウイルスを導入する方法(特許文献1参照)、が挙げられる。しかし、当該方法は、担子菌類にのみ限定される手法であり、さらにウイルスを導入できる菌株には制限があり、任意の菌株にウイルスを導入することができない方法である。(非特許文献3,4 参照)。
また、プロトプラストを用いた導入方法(ウイルス発現ベクターを用いた形質転換によるウイルス発現、試験管内転写産物の導入、電子銃による純化ウイルス粒子の導入、異なる菌体由来のプロトプラスト融合による導入などを含む)(非特許文献5 参照)を挙げることもできる。しかし、当該導入方法は、プロトプラスト化と再生系が確立している種類や菌株にしか用いることができず、また、プロトプラスト化やプロトプラストからの菌糸再生が得られにくい菌種や菌株には適用が困難な方法である。
【0005】
このように、従来の方法では、菌類寄生ウイルスを糸状菌類に人為的に導入する際に利用できる菌種や菌株に大幅な制限があり、任意の菌種や菌株に菌類寄生ウイルスを導入できる汎用性の高い方法の開発が望まれていた。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2002-065279号公報
【非特許文献】
【0007】
【非特許文献1】Matsumoto,N. (1998) Japan Agricultural Research Quarterly (JARQ), 32: p31-35.
【非特許文献2】Buck, K. W. (1998) Bridge, P., Couteaudier, Y. and Clarkson, J. (eds). p53-72. CAB International, Wallingford, Oxfordshire.
【非特許文献3】Suzaki, K. et al. (2003) Mycoscience, 44: p139-147.
【非特許文献4】Suzaki, K. et al. (2005) Journal of General Plant Pathology, 71: p161-168.
【非特許文献5】佐々木厚子(2009)果樹研究所研究報告,8:p1-14.
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明では、上記従来の課題を解決し、特定の菌種や菌株の種類に制限されることなく、二核菌亜界に属する幅広い糸状菌類の菌種や菌株に容易に適用が可能である(極めて汎用性が高い)、菌類寄生ウイルスの導入方法を開発することを目的とする。
【課題を解決するための手段】
【0009】
本発明者らは、二核菌亜界に属する糸状菌類どうしの細胞質不和合性反応に着目し、それを阻害する作用を有する物質の探索を行った。
その結果、‘亜鉛イオン’に、糸状菌どうしの細胞質不和合性を阻害する作用があり、本来は起こらないはずの菌糸融合(及び細胞質不和合性反応に伴う菌糸の細胞死の阻害や遅延)が起こることを見出した。
そして、当該菌糸融合を介することによって、これらの糸状菌類間でのウイルスの移行が起こることを見出した。
【0010】
本発明は、これらの知見に基づいてなされたものである。
即ち、〔請求項1〕に係る本発明は、下記(a)の糸状菌類に感染している導入対象の菌類寄生ウイルスを、下記(b)の糸状菌類に導入するにあたり、;下記(a)及び(b)の糸状菌類を、亜鉛イオン存在下で共培養することを特徴とする、;糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
(a):導入対象の菌類寄生ウイルスが感染している二核菌亜界に属する糸状菌類。
(b):前記(a)の糸状菌類に属するが細胞質不和合の関係にあり、導入対象の菌類寄生ウイルスが感染していない二核菌亜界に属する糸状菌類。
また、〔請求項2〕に係る本発明は、前記糸状菌類が、分子系統学的に子嚢菌類又は担子菌類に属するものである、請求項1に記載の糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
また、〔請求項3〕に係る本発明は、前記(b)の糸状菌類が、前記(a)の糸状菌類と同一菌種のものである、請求項1又は2に記載の糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
また、〔請求項4〕に係る本発明は、前記亜鉛イオンが、塩化亜鉛又は硫酸亜鉛に由来するものである、請求項1〜3のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
また、〔請求項5〕に係る本発明は、前記共培養が、0.4〜2.5mMの亜鉛イオン存在下で行うものである、請求項1〜4のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
また、〔請求項6〕に係る本発明は、前記糸状菌類が、植物病原菌であり、;前記寄生ウイルスが、前記植物病原菌によって引き起こされる植物に対する病原力を低下させるウイルスである、;請求項1〜5のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
また、〔請求項7〕に係る本発明は、前記糸状菌類が、白紋羽病菌又は紫紋羽病菌である、請求項1〜6のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
【発明の効果】
【0011】
本発明は、特定の菌種や菌株の種類に制限されることなく、二核菌亜界に属する糸状菌類(具体的には、担子菌類及び子嚢菌類)に、菌類寄生ウイルスを人為的に導入することを可能とする。
また、本発明は、人為的に誘発した菌糸融合を介してウイルスの導入を図る方法であるため、菌株間での細胞質不和合の関係やプロトプラスト化の確立等を考慮する必要が無く、極めて汎用性の高い方法である。
これにより本発明は、現行の方法が適さなかった糸状菌類の菌種または菌株への菌類寄生ウイルスの導入において有効な技術となることが期待される。
また、本発明は、室内の培養にて行うことが可能であるが、野外の土壌中や植物体上に生育する糸状菌に、直接ウイルス導入することも可能とする。
【0012】
また、本発明によって、植物病原糸状菌に対して、高い病原力低下効果を示す菌類寄生ウイルスを効率良く選抜することが可能となる。それによって、ウイルスが感染して病原力の低下した植物病原菌を容易に獲得することが可能となる。
特には、果樹の重要疾病である紋羽病の病原である紋羽病菌に対して、病原力を低下させる菌類寄生ウイルスが導入された紋羽病菌を得ることが可能となる。
【0013】
本発明では、農場等に発生した植物病原菌と同一菌株である病原性低下ウイルス感染菌株を用いることによって、糸状菌類が引き起こす植物疾病に対する生物防除が可能となる。
例えば、本発明により、病原力低下ウイルスが感染した特定の植物病原菌の菌株と、亜鉛イオンを含む適切な培地をキット化することが期待される。当該キットを用いることによって、農場や圃場で発生した植物病原菌に対して、これらを防除可能な病原性低下ウイルス感染菌株を、容易に作製できることが期待される。
また、本発明におけるウイルス導入を野外の土壌中や植物病斑上にて行うことによって、野外で発生した強病原力菌の病原力を直接低下させる生物防除が可能となる。
【図面の簡単な説明】
【0014】
【図1】菌界(Fungi)に属する代表的な分類群の系統関係を示す模式図である。
【図2】細胞質不和合性を有する糸状菌類間において、亜鉛イオン処理によるウイルス移行メカニズムの推定図である。
【図3】‘実施例1’において、ウイルス移行を行うための各工程の培養状態を示す図である。(A) 前培養における対峙培養。 (B) 各種物質含有培地における対峙培養。 (C) ハイグロマイシン含有培地での再培養。 各図において‘供与菌’は「ウイルス供与菌」を、‘受容菌’は「ウイルス受容菌」を示す。
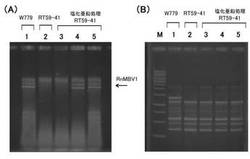
【図4】‘実施例1’において、ウイルス受容菌へのウイルス移行を検出した電気泳動図である。(A) ウイルスゲノムの存在を確認するための全核酸の電気泳動図。 (B) 菌株の多型パターンを示すPCR産物の電気泳動図。 各図においてレーン1はW779株(ウイルス供与菌)、;レーン2はRT59-41株(ウイルス受容菌)、;レーン3〜5は塩化亜鉛処理したRT59-41株、;からの核酸を示す。なお、レーンMは、DNA分子量サイズマーカー(1Kb DNA Ladder; Fermentas社)を示す。
【図5】‘実施例2’において、受容菌へのウイルス移行を検出した電気泳動図である。(A) ウイルスゲノムの存在を確認するための全核酸の電気泳動図。 (B) 菌株の多型パターンを示すPCR産物の電気泳動図。 各図においてレーン1はRT59-41株(ウイルス受容菌)、;レーン2はW780株(ウイルス供与菌)、;レーン3〜6は塩化亜鉛処理したRT59-41株、;からの核酸を示す。なお、レーンMは、DNA分子量サイズマーカー(1Kb DNA Ladder; Fermentas社)を示す。
【図6】‘実施例5’において、受容菌へのウイルス移行を検出した電気泳動図である。(A) ウイルスゲノムの存在を確認するための全核酸の電気泳動図。 (B) 菌株の多型パターンを示すPCR産物の電気泳動図。 各図においてレーン1はRT59-41株(ウイルス受容菌)、;レーン2はW779株(ウイルス供与菌)、;レーン3,4は硫酸亜鉛処理したRT59-41株、;からの核酸を示す。なお、レーンMは、DNA分子量サイズマーカー(1Kb DNA Ladder; Fermentas社)を示す。
【図7】‘実施例6’において、受容菌へのウイルス移行を検出した電気泳動図である。(A) ウイルスゲノムの存在を確認するための全核酸の電気泳動図。 (B) 菌株の多型パターンを示すPCR産物の電気泳動図。 各図においてレーン1はV18株(ウイルス受容菌)、;レーン2はV670株(ウイルス供与菌)、;レーン3〜5は塩化亜鉛処理したV18株、;からの核酸を示す。なお、レーンMは、DNA分子量サイズマーカー(1Kb DNA Ladder; Fermentas社)を示す。
【図8】‘実施例7’において、W779株とW370hti株の菌糸融合を示す顕微鏡写真像図である。
【図9】(A)‘実施例8’において、W779株とW97株の菌糸が接近した際の菌糸の行動頻度を示す図である。 (B)‘実施例8’において、W779株とW97株の菌糸融合を示す顕微鏡写真像図である。
【図10】(A)‘実施例9’において、V18株とV670株の菌糸が接近した際の菌糸の行動頻度を示す図である。 (B)‘実施例9’において、V18株とV670株の菌糸融合を示す顕微鏡写真像図である。
【発明を実施するための形態】
【0015】
本発明は、糸状菌類に感染している菌類寄生ウイルスを、細胞質不和合の関係にある他の糸状菌類に導入する方法に関する。
【0016】
〔糸状菌類について〕
本発明における「糸状菌類」とは、‘子嚢菌類’および‘担子菌類’に属する真核性の菌類を指し、生活環において管状の栄養体(菌糸)を形成する種類や菌種を指すものである。
子嚢菌類と担子菌類は、二核菌亜界(Dikarya)を構成する分類群であり、それぞれが系統的に単系統の群である。両者は、共通の糸状菌型の祖先菌類から分岐して多様化したものと認められる(図1 参照)。
なお、子嚢菌類と担子菌類の単系統性については、例えば、Berbee and Taylor 1992 Molecular Biology and Evolution 9:278-284(SSU rDNAによる解析)、;Liu et al. 2006 BMC Evolutionary Biology 6:74(RNA polymerase genesによる解析)、;Seif et al. 2005 Nucleic Acids Research 33:734-744(mitochondrial genome sequencingによる解析)、に詳細な報告がある。
【0017】
ここで、「子嚢菌類」(Ascomycota)とは、微小な子嚢を形成しその中に減数分裂によって胞子を作ることを特徴とする単系統の分類群である。子実体を形成するカビの仲間、キノコの一部が含まれる。
具体的には、チャワンタケ、アミガサタケ、トリュフ、セイヨウショウロ、アカパンカビ、白紋羽病菌、リンゴ腐らん病菌、イネいもち病菌、アオカビ、コウジカビ、ウドンコ病菌、天狗巣病菌、出芽酵母、などを挙げることができる。
また、「担子菌類」(Basidiomycota)は、担子器の外側に胞子が形成されることを特徴とする単系統の分類群である。植物病原菌である黒穂病菌やさび病菌等の仲間、肉眼で確認できる子実体を形成する仲間(大部分のキノコ)が含まれる。
具体的には、さび病菌、紫紋羽病菌、黒穂病菌、マツタケ、シイタケ、スッポンタケ、ホコリタケ、キクラゲ、Rhizoctonia属菌、担子菌酵母、などを挙げることができる。
【0018】
また、本発明のウイルス導入技術は、菌糸伸長及び菌糸融合を行う上記分類群の種類であって、寄生可能な菌類寄生ウイルスが存在するものであれば、如何なる(任意の)菌種や菌株の糸状菌類に対しても、適用が可能な技術である。
例えば、任意の糸状菌類に対して、自然界では感染しえない他の糸状菌類の寄生ウイルスを導入することも可能となる。
また、分類不明学上の位置が不明の不完全菌類(有性生殖が不明のもの)や、現在の分類体系上では子嚢菌類や担子菌類に属さないと考えられている種類であっても、分子系統学的に子嚢菌類又は担子菌類に属すると認められる種類であれば、本発明の技術が適用可能である。
具体的には、分子系統学的解析(例えば、SSU rDNA, EF1-1α, ミトコンドリアゲノム配列など、を用いた解析など)によって、(I) 既知の子嚢菌類又は担子菌類の構成種から形成される単系統群に含まれる種類、(II) 既知の子嚢菌類又は担子菌類の構成種から形成される単系統群とさらにクレード(単系統群)を形成する種類、を挙げることができる。
なお、子嚢菌類と担子菌類の両系統において、菌糸形成能を失った単細胞体制の種類(子嚢菌類における出芽酵母や分裂酵母、;担子菌類における担子菌酵母)が存在するが、生活環において糸状菌の態様を有する種類であれば、本発明の技術が適用可能である。
【0019】
本発明は、細胞質不和合の関係にある糸状菌類どうしにおいて、当該細胞質不和合性を阻害することにより、菌糸融合を介して物理的にウイルス導入を行う方法によるものである。
そのため、本発明における‘ウイルス供与菌’と‘ウイルス受容菌’とは、細胞質不和合性反応が起こる関係にあることが必要である。
具体的には、これら両者の糸状菌類どうしが、同一菌種に分類されているが他菌株(同一菌種他菌株)のものどうしを用いることが好適である。
また、他菌種に分類されているものどうしであっても、細胞質不和合性反応が起こる関係(例えば近縁種の一部)にあるものどうしであれば、適用することができる。
なお、同一菌種同一菌株のものどうしを用いた場合、細胞質不和合性反応そのものが起こらないため、本発明の方法を用いることなく、菌糸融合を介して菌糸全体(個体)にウイルス伝搬させることが可能となる。
【0020】
なお、ここで「ウイルス供与菌」とは、導入対象である菌類寄生ウイルスが感染している糸状菌類を指す。
また、「ウイルス受容菌」とは、当該導入対象である菌類寄生ウイルスが感染していない目的の糸状菌類を指す。なお、ウイルス受容菌においても、導入対象でない他のウイルスが感染していることが想定される。
【0021】
〔菌類寄生ウイルスについて〕
本発明において導入対象である「菌類寄生ウイルス」(マイコウイルス、菌類ウイルス)は、目的の糸状菌類(ウイルス受容菌)に寄生可能なものであればよい。
また、目的の糸状菌類(ウイルス受容菌)では従来見つかっていないウイルス、人為的な改変を伴ったウイルス等であっても、当該糸状菌類に寄生可能なものであれば、本発明の方法によって導入することが可能である。
なお、好ましくは、ゲノムサイズの小さいものである方が、導入効率の点で好適である。
【0022】
〔ウイルス導入方法〕
・前培養
本発明のウイルス導入方法においては、後記の亜鉛イオン処理を行う前に、亜鉛イオンを含まない培地において、ウイルス供与菌とウイルス受容菌の前培養を行うことが好適である。
具体的には、両菌株を同一培地において共培養(特に寒天培地上での対峙培養)を行い、両菌株の菌糸を含む状態のもの(特に菌叢どうしが交わる状態まで培養したもの)について、亜鉛イオン処理を行うことが好適である。
また、それぞれの菌株を単独で前培養を行い、その後で菌糸どうしを混合して亜鉛イオン処理に用いることもできる。
当該前培養に用いることができる培地としては、用いる糸状菌類が培養可能な培地であれば如何なる培地(液体培地と固体培地の両方が可能)でも用いることができる。
なお、後記の亜鉛イオン処理を、直接野外に生息するウイルス受容菌に対して行う場合には、ウイルス供与菌のみを前培養することになる。
【0023】
・亜鉛イオン処理
本発明における糸状菌類への菌類寄生ウイルス導入は、‘ウイルス供与菌’と‘ウイルス受容菌’とを、亜鉛イオン存在下において共培養を行うことを必須とする方法である。
当該共培養(亜鉛イオン処理)は、亜鉛イオンを含有する培地にて行うことが好適であるが、ウイルス受容菌が生育する野外の土壌や植物病斑などの植物体上に、‘亜鉛イオン’と‘ウイルス供与菌’を散布, 塗布, 又は添加等することによって、直接野外にて行うことも可能である。
【0024】
本発明において、亜鉛イオンは、‘細胞質不和合性反応’を阻害する物質として、特別な効果を有する物質である。
当該細胞質不和合反応が阻害されることによって、次いで‘人為的な菌糸融合’及び‘細胞質不和合性反応に伴う菌糸の細胞死阻害や遅延’が誘導される。
そして、最終的には、当該菌糸融合を介して、‘当該糸状菌類間でのウイルス移行’が起こり、対象の菌類寄生ウイルスを目的の糸状菌類へ導入することが可能となる(図2:亜鉛イオン処理によるウイルス移行メカニズムの推定図を参照)。
なお、ここで移行するものは、ウイルス粒子そのものであるが、感染の確認はウイルスゲノム(VC因子:dsRNA)の検出により行う。
【0025】
ここで、「亜鉛イオン存在下」としては、亜鉛イオン濃度に換算して、0.4mM以上、好ましくは0.5mM以上、さらには0.75mM以上、を挙げることができる。
なお、当該工程においては、亜鉛イオン濃度が高い程、ウイルス導入効率も向上するため、好適である。反対に、亜鉛イオン濃度が、当該所定値よりも低い場合、ウイルス導入効率は著しく低下するため好適でない。
なお、亜鉛イオンの上限値としては、糸状菌類の種類によって亜鉛イオン感受性が異なる(生育阻害が出る濃度が異なる)ため一概に決められない点があるが、例えば、亜鉛イオン濃度に換算して、2.5mM以下、好ましくは2.0mM以下、特には1.8mM以下、さらには1.5mM以下を挙げることができる。
また、亜鉛イオンの供給源として添加できる物質としては、具体的には、塩化亜鉛(ZnCl2)、硫酸亜鉛(ZnSO4)、を用いることが好適であるが、酸化亜鉛(ZnO)、硫化亜鉛(ZnS)、グルコン酸亜鉛、ステアリン酸亜鉛、酢酸亜鉛((CH3COOH)2Zn)、臭化亜鉛(ZnBr2)、炭酸亜鉛(ZnCO3)、クエン酸亜鉛(Zn3(C6H5O7)2)、ヨウ化亜鉛(ZnI2)などを用いることも可能である。
なお、当該亜鉛イオン処理(共培養)を「培地」にて行う場合、ウイルス供与菌とウイルス受容菌とが共に同時に培養可能な培地であれば、如何なる培地をも用いることができる。また、寒天培地などの固形培地の形態であることが望ましい。
【0026】
当該亜鉛イオン処理(共培養)の条件としては、ウイルス供与菌とウイルス受容菌が共に培養可能な条件であればよく、例えば、15〜35℃の好気的条件等で行うことが望ましい。
培養期間としては、5〜60日、好ましくは10〜30日(例えば白紋羽病菌の場合は約10〜30日、紫紋羽病菌の場合は約14〜30日)の共培養によって、ウイルス受容菌(目的の糸状菌類)に、対象ウイルスが導入された菌株を得ることが可能となる。
【0027】
また、当該亜鉛イオン処理(共培養)は、両菌株の菌糸が交ざり合って生育している状態であれば、行うことが可能である。
当該処理を培地にて行う場合、具体的には、両菌株を寒天培地上で対峙培養を行い、菌叢どうしが交わった状態のものについて行うことが好適である。
【0028】
当該亜鉛イオン処理後のウイルス受容菌には、ウイルス供与菌からのウイルス移行が起こった菌糸を含むものとなる。
従って、用途によっては、得られた培養菌叢の全部(もしくは受容菌側の菌叢のみを全部)を混合して、菌混合物の状態でそのままで用いることもできる。例えば、植物疾病の原因菌の防除に用いる際には、このような菌混合物の状態で用いた場合でも、生物防除効果を得ることができる。
【0029】
〔ウイルス導入後の処理〕
・亜鉛イオン処理後の工程
上記亜鉛イオン処理を野外ではなく「培地」にて行った場合、望ましくは、受容菌側の菌叢(対峙培養でない場合は後述の手段で受容菌と判別された菌叢や菌糸)の一部を、亜鉛イオンを含有しない培地に移植して、単離して用いることが好適である。
なお、再培養(単離)した菌叢がウイルス移行したものであるかの確認は、菌叢の全核酸を抽出して電気泳動を行って、ウイルスゲノムRNAの存在を確認することにより、確認することができる。なお、ウイルスゲノムRNAを標的としたRT-PCR法等によっても、検出することが可能である。
【0030】
再培養(単離)した菌叢がウイルス受容菌であるかの確認は、得られた菌叢とウイルス供与菌とウイルス受容菌のそれぞれと対峙培養を行い、どちらの菌かを判別することが可能である。
また、両菌株を判別可能なDNA多型解析を行うことでも、確認することが可能である。例えば、白紋羽病菌の場合は、配列番号1又は配列番号2に記載のプライマーを用いたUniversally Primed-PCR法により、多型解析を行うことが可能となる。
【0031】
前記共培養を行った後は、ウイルス受容菌のみを容易に選択するために、ウイルス供与菌が生育せずに、ウイルス受容菌のみが生育できるような条件で培養を行うことが望ましい。
なお、本発明では、ウイルス受容菌としては任意の菌に対して行うことが可能な実施態様であることが、様々な用途への応用の点で重要である。
(a) そこで、ウイルス供与菌側に生育困難性(例えば栄養要求性)の性質を持たせておき、当該ウイルス供与菌の生育が困難な培地(例えば栄養が欠失した培地)に植継いで、ウイルス受容菌を選択する方法などを挙げることができる。
(b) また、ウイルス受容菌側に予め選抜遺伝子(抗生物質耐性遺伝子、マーカー遺伝子等)を組み込んでおく態様で行うことも可能である。
これにより、共培養後にウイルス受容菌部分を選択培地に植継いで、ウイルス導入がされた受容菌のみを選択培養する方法が可能となる。また、発光や発色等が確認された菌糸のみを選択移植することも可能となる。
【0032】
上記のようにして選択したウイルス受容菌は、当該移植部分付近の菌糸の継代培養を2回以上(好ましくは3〜5回)繰り返すことで、ウイルス受容菌どうしの菌糸融合(体細胞和合)により、植継いだ菌糸全体に当該ウイルスの感染を促すことができる。
なお、前記(b)の方法で選抜遺伝子を組み込んだウイルス受容菌は、そのままでは野外に持ち出すことができない。
そこで、当該ウイルス受容菌(選抜遺伝子、ウイルス導入済み)を、選抜遺伝子を組み込む前の元の菌株と一緒に培養し、菌糸融合させることによって、ウイルスを感染させた元の菌株を野外散布等に用いることができる。
【0033】
〔本発明の応用態様〕
本発明によって、幅広い糸状菌類の菌種や菌株に対して容易に菌類寄生ウイルスを導入することが可能となる。また、自然界では感染しえない組合せの菌類寄生ウイルスを導入した菌株、人為的な改変を伴ったウイルスを導入した菌株、などの作出も可能となり、病原力の低下がより顕著な菌株の作出も可能となる。
【0034】
・植物防除法への応用
特に本発明は、植物病原菌に対して、当該病原力を低下(弱毒化)させる菌類寄生ウイルスを導入させて、「病原力が低下した植物病原菌を作出すること」に、有用性を発揮する技術である。
本発明の方法によって人為的に作出した病原力低下菌(弱毒菌)は、当該病原力低下菌の野生型植物病原菌(強毒菌)が引き起こす疾病に対して、ウイルス感染を利用した生物防除を行うことができる。
【0035】
(i) 具体的に本発明では、上記したウイルス導入方法によって作出した病原力低下菌(弱毒菌)を、果樹園や畑の土壌に散布して、野生型の病原菌(強毒菌)と接触(菌糸融合)させることによって、細胞質和合の野生型菌にウイルス伝搬(感染)がおこり、野生型を弱毒化させることが可能となる。
(ii) また本発明では、「野生型の病原菌(強毒菌)であるウイルス受容菌」が生育する野外の土壌又は植物体上に形成された病斑上に、「亜鉛イオン」と「病原力を低下(弱毒化)させる菌類寄生ウイルスが感染したウイルス供与菌」を散布等することによって、直接野外にてウイルス導入を行い、野外の病原菌の病原性を低下させることが可能となる。
【0036】
ここで、生物防除が可能な植物疾病としては、前記糸状菌類に属する植物病原菌が原因となるものであれば、如何なるものであっても応用が可能である。
例えば、紋羽病(紫紋羽病、白紋羽病)、胴枯病、腐らん病、青かび病、枝枯病、葉枯病、すす病、葉腐病、根腐病、萎凋病、立枯病、紋枯病、いもち病、灰色かび病、ならたけ病、材質腐朽病、などを挙げることができる。
なお、原因病原菌の人工培養系が確立していない疾病(例えば、さび病、うどんこ病など)については、現時点では本発明の応用は困難であるが、将来、これらの原因病原菌の人工培養系が確立した際には、応用が可能となることが期待される。
【0037】
・紋羽病の植物防除への応用
本発明では、特に、果樹、農作物、園芸植物全般に対して大きな被害を与える紋羽病への応用を挙げることができる。
紋羽病は、原因菌である紋羽病菌によって引き起こされる植物疾病の総称であり、原因菌として、白紋羽病菌(子嚢菌類)と紫紋羽病菌(担子菌類)が挙げられる。これらは疾病の外観は類似するが、分類的には全く異なる糸状菌類である。
‘白紋羽病菌’としては、Rosellinia属に属する100種類以上の種のうち、R.necatrix、R.compacta、を挙げることができる。
‘紫紋羽病菌’としては、Helicobasidium属に属する数種を挙げることができ、H.mompa、H.brebissonii、H.longisporum、などを挙げることができる。
【0038】
本発明の方法によって、白紋羽病の病原力を低下させる菌類寄生ウイルスとしては、Rosellinia necatrix megabirnavirus1(RnMBV1)、Rosellinia necatrix mycoreovirus3(RnMYRV3)、などを挙げることができる。
また、紫紋羽病の病原力を低減させる菌類寄生ウイルスとしては、Helicobasidium mompa endornavirus1(HmEV1)、Helicobasidium mompa endornavirus1-670(HmEV1-670)、Helicobasidium mompa mitovirus1-18(HmMV1-18)、Helicobasidium mompa totivirus1(HmTV1)などを挙げることができる。
なお、本発明の方法では、前記のように、任意の紋羽病菌に対して自然界では感染しえない他の紋羽病菌の寄生ウイルスの導入を行うことも可能となる。
【0039】
本発明の方法で作出した病原力が低下した紋羽病菌によって、紋羽病の生物防除が可能となる植物としては、果樹、農作物、園芸植物全般を挙げることができる。
特には、白紋羽病の場合では、リンゴ、ナシ、ブドウ、ビワ、イチジク、キウイフルーウ、モモ、ウメ、オウトウ、アンズ、スモモ、カキ、カンキツ、クリ、クワ、チャ、サクラ、カシ、ナラ、ポプラ、カエデ、ツバキ、ツツジ、バラ、キク、オモト、シャクヤク、など、;紫紋羽病の場合では、リンゴ、クワ、ウルシ、チャ、サクラ、ナラ、カエデ、ツバキ、ツツジ、ヒサカキ、ユリノキ、サツマイモ、アスパラガス、ニンジン、アルファルファ、など、;に対して、有効に用いることができる。
【実施例】
【0040】
以下、実施例を挙げて本発明を説明するが、本発明の範囲はこれらにより限定されるものではない。
【0041】
〔実施例1〕『細胞質不和合性を阻害する物質の探索』
細胞質不和合性によって菌糸融合が阻害されている白紋羽病菌の菌株どうしにおいて、細胞質不和合反応を阻害する物質の探索を行った。
【0042】
(1)前培養(W779株 vs. RT59-41株)
表2に示す白紋羽病菌(Rosellinia necatrix)のRnMBV1(Rosellinia necatrix megabirnavirus1)感染株である「W779株」(ウイルス供与菌)と、ウイルスフリー株である「RT59-41株」(ウイルス受容菌)を、1/10濃度オートミール寒天培地(オートミール粉末3g, シュクロース5g, 寒天末15g/1L)の上に並べた1cm角のセルロースメンブレン上に接種し、対峙培養を行った(図3A 参照)。培養は25℃で3〜4日間行い、互いの菌叢が交わる程度まで生育させた。
なお、これらの菌株どうしは細胞質不和合(MCG (Mycelial Compatibility Group)が異なる)の関係にある。
【0043】
(2)各種物質含有培地での対峙培養
次に、9cmシャーレに、前記1/10濃度オートミール培地に表1-A〜1-Dに示す各物質(87種類)をそれぞれ含有させた寒天培地を調製した。なお、各物質について、3,4段階の希釈系列(50〜100倍の濃度範囲)の培地を作成した。各物質の濃度は、過去に各種阻害反応(多くはシグナル伝達系の阻害)が文献に記載されている有効レベルや従来に用いられる濃度等、を参考にして決定した。
これらの培地の上に、前記対峙培養した菌叢をセルロースメンブレンごと移植した(図3B 参照。なお、図3Bにはそのうちの一部の各種試料含有培地を示した。)。なお、移植の際には、シャーレの隅に移植して菌叢の生育スペースを確保した。そして、25℃で2週間培養することで菌叢を成長させた。
【0044】
その後、W779株(ウイルス供与菌)になるべく接近しているRT59-41株(ウイルス受容菌)側の菌糸片を切り出し、ハイグロマイシンを含むPDA寒天培地(ハイグロマイシン濃度50μg/ml)の上に並べた1cm角メンブレン上に接種した。
そして、25℃で1週間の再培養(単離培養)を行い(図3C 参照)、ハイグロマイシン耐性を有さないW779株の生育を抑えて、RT59-41株のみを選択的に生育させた。
【0045】
【表1−A】

【0046】
【表1−B】

【0047】
【表1−C】

【0048】
【表1−D】

【0049】
(3)ウイルス移行の検出
上記再培養で生育した各試験区の菌叢(RT59-41株)について、細胞破壊機で細胞を破壊した後、常法により全核酸(菌株のゲノムDNA及びtotal RNA、ウイルスゲノムRNA)を抽出した。そして、得られた核酸を電気泳動することによって、ウイルス由来のゲノム二本鎖RNAの有無を判別した。
【0050】
その結果、上記87種類の試料のうち、「塩化亜鉛(亜鉛イオン)」を含有させた培地(試料60)を用いた場合でのみ、RT59-41株(ウイルス受容菌)側でのウイルスの存在が検出された。
詳しくは、1.5mM塩化亜鉛含有培地で32株中4株、0.75mM塩化亜鉛含有培地で12株中2株、において、ウイルスゲノムのRNA(VC因子)が検出された。
なお、図4A(全核酸の電気泳動像)は、レーン4,5の菌叢において、RT59-41株にウイルスゲノムRNAの存在が検出された例を示す図である。
【0051】
また、他の試料においては、Pronase Eを含有させた培地(試料8)で1例のみウイルスが検出されたが、再現性が確認できなかった。また、他の85種類の物質を含有させた培地では、RT59-41株(ウイルス受容菌)側でのウイルスの存在は全く検出できなかった。
【0052】
(4)ウイルス供与菌でないことの確認
上記得られた菌叢が、W779株(ウイルス供与菌:ハイグロマイシン非耐性)の混入でないことを確認するため、得られた菌叢の全核酸を鋳型としたUniversally Primed-PCR法により、菌株ゲノムDNAの多型解析を行った。
Universally Primed-PCR法は、配列番号1に記載のプライマー1種類のみをPCR反応液に添加して、菌叢のゲノムDNAを鋳型としたPCR(アニーリング温度55℃)を行うことによって行った。
なお、当該プライマーは、当該プライマー1種類のみを用いてPCRを行うことによって、白紋羽病菌のDNA多型解析を可能とするプライマーである。
【0053】
その結果、試験区60においてウイルスの存在が認められた菌叢の多型パターンは、RT59-41株のものと一致した。従って、当該菌叢は、W779株の混入ではなくRT59-41株であることが確認された。
なお、図4B(PCR産物の電気泳動像)は、ウイルスゲノムRNAの存在が検出されたレーン4,5の菌叢の多型パターンが、RT59-41株と一致したことを示す図である。
【0054】
(5)考察
以上のことから、塩化亜鉛を含む培地での対峙培養を行うことによって、W779株からRT59-41株へのウイルス移行が起こったことが示された。
また、当該ウイルス移行は、W779株とRT59-41株の間では本来は起こらない菌糸融合を介して行われたことが推測された。なお、当該実施例において特に重要な各項目を、表2に示す。
【0055】
【表2】

【0056】
〔実施例2〕『他の菌類ウイルスの移行試験(W780株 vs. RT59-41株)』
実施例1で示された糸状菌類間のウイルス移行現象が、菌類ウイルスRnMBV1を用いた場合の特異的な現象であるのかを検討した。
ウイルス供与菌として、前記W779株とは異なる菌類ウイルスであるRnPV(partitivirusに属する未同定種)の感染株である「W780株」(表3)を用いて、実施例1と同様にして、ウイルス受容菌(RT59-41株)へのウイルス移行処理を行った。W780株とRT59-41株は、細胞質不和合の関係にある菌株どうしである。
なお、ウイルス移行を誘導するため対峙培養には、前記1/10濃度オートミール培地に塩化亜鉛を0.75mM含有する培地を用いた。
全核酸を電気泳動した結果を図5Aに示す。また、Universally Primed-PCR法でのDNA多型解析の結果を図5Bに示す。
【0057】
その結果、W780株に感染している菌類ウイルス(RnPV)についても、塩化亜鉛を含む培地での対峙培養によって、RT59-41株に移行することが示された。
【0058】
【表3】

【0059】
〔実施例3〕『他の受容菌への移行試験(W780株 vs. RT56-2株)』
実施例1,2で示された糸状菌類間のウイルス移行現象が、ウイルス受容菌にRT59-41株を用いた場合の特異的な現象であるのかを検討した。
ウイルス受容菌として、前記RT59-41株とは異なるウイルスフリー株である「RT56-2株」(表4)を用いて、実施例2と同様にしてウイルス移行処理を行った。W780株とRT56-2株は、細胞質不和合の関係にある菌株どうしである。
なお、ウイルス移行を誘導するため対峙培養には、前記1/10濃度オートミール培地に塩化亜鉛を0.75mM含有する培地を用いた。
【0060】
その結果、ウイルス受容菌としてRT56-2株を用いた場合でも、塩化亜鉛を含む培地での対峙培養によって、W780株から菌類ウイルス(RnPV)が移行することが示された。
【0061】
【表4】

【0062】
〔実施例4〕『塩化亜鉛濃度の検討』
実施例1〜3で示された糸状菌類間のウイルス移行現象において、対峙培養に用いる培地の塩化亜鉛の「濃度」の検討を行った。
ウイルス移行を誘導するための対峙培養に用いる培地として、前記1/10濃度オートミール培地に表5に示す塩化亜鉛含有培地を用い、実施例1と同様にして、ウイルス受容菌(RT59-41株)へのウイルス移行処理を行った。また、ウイルス供与菌として、W779株、W780株の両方の場合を検討した。ウイルス移行頻度の結果を表5に示す。
【0063】
その結果、塩化亜鉛を0.5mM以上含有する培地で対峙培養を行うことで、RT59-41株(受容菌)へのウイルス移行が起こることが示された。また、0.75mM, 1.5mMと濃度が上がるにつれて、ウイルス移行率も上昇することが示された。
一方、塩化亜鉛濃度が0.25mM以下では、ウイルス移行が確認されなかった。
【0064】
なお、W780株に感染しているウイルス(RnPV: ゲノムサイズ0.29 kb)の方が、W779株に感染しているウイルス(RnMBV1:ゲノムサイズ8.9kb, 7.2kb)よりも、RT59-41株(ウイルス受容菌)に移行する頻度が大幅に高かった。
これは、感染しているウイルスゲノム(VC因子)の大きさが、菌糸融合を介したウイルス移行の効率に影響しているためと推測される(表3,4 参照)。
【0065】
【表5】

【0066】
〔実施例5〕『硫酸亜鉛処理によるウイルス移行評価』
実施例1〜4で示された糸状菌類間のウイルス移行現象が、塩化亜鉛を用いた場合の特異的な現象であるのかを検討した。
ウイルス移行を誘導するための対峙培養に用いる培地として、前記1/10濃度オートミール培地に「1mM 硫酸亜鉛」を含む培地を用い、実施例1と同様にして、ウイルス供与菌(W779株)からウイルス受容菌(RT59-41株)へのウイルス移行処理を行った。
全核酸を電気泳動した結果を図6Aに示す。また、Universally Primed-PCR法でのDNA多型解析の結果を図6Bに示す。また、ウイルス移行頻度の結果を表6に示す。
【0067】
その結果、硫酸亜鉛を含む培地を用いた場合でも、ウイルス供与菌の菌類ウイルスが、ウイルス受容菌に移行することが示された。
この結果から、実施例1〜4において確認された塩化亜鉛を用いたウイルス移行作用は、塩化物イオンによるものではなく、‘亜鉛イオン’によって誘起されることが示された。
【0068】
また、硫酸亜鉛を用いた場合のウイルス移行の頻度は、同様の濃度の塩化亜鉛を用いた場合と比べて、同程度の効率であることが示された。
【0069】
【表6】

【0070】
〔実施例6〕『紫紋羽病菌(担子菌類)におけるウイルス移行評価』
実施例1〜5で示された‘子嚢菌類’である白紋羽病菌に対するウイルス移行技術が、‘担子菌類’である紫紋羽病菌に対しても適用できるかを検討した。
表7に示す紫紋羽病菌(Helicobasidium mompa)のHmEV1-670の感染株である「V670株」(ウイルス供与菌)と「V18株」(ウイルス受容菌)について、実施例1と同様にしてウイルス移行処理を行った。V670株とV18株は、細胞質不和合の関係にある菌株どうしである。
なお、ウイルス移行を誘導するため対峙培養には、前記1/10濃度オートミール培地に塩化亜鉛を0.5mM含有する培地を用いた。
全核酸を電気泳動した結果を図7Aに示す。また、Universally Primed-PCR法でのDNA多型解析の結果を図7Bに示す。
【0071】
その結果、亜鉛イオンを含む培地での対峙培養によって、V670株が保持していた菌類寄生ウイルス(HmEV1-670)がV18株に移行することが示された。
この結果から、‘担子菌類’である紫紋羽病菌の菌株どうしにおいても、亜鉛イオン処理による菌類ウイルス移行技術が適用できることが示された。
【0072】
【表7】

【0073】
〔実施例7〕『白紋羽病菌(子嚢菌類)における菌糸融合の観察』
上記亜鉛イオン処理による糸状菌類間のウイルス移行現象が、白紋羽病菌(子嚢菌類)において具体的にどのように行われるのかを検討するため、菌糸融合を観察した。
表8に示す互いに細胞質不和合の関係にあるW779株とW370hti株(ハイグロマイシン耐性を付与する前のRT59-41株の親株)について、前記1/10濃度オートミール培地に塩化亜鉛を0.75mM含有する培地において対峙培養を行った。
前培養および対峙培養は、実施例1と同様にして行った。なお、観察された菌糸融合の顕微鏡写真像図を、図8に示す。
【0074】
その結果、菌叢が接触する付近の菌糸において、W779株とW370hti株の間で菌糸融合が起こることが観察された。
このことから、亜鉛イオン処理によって誘導される細胞質不和合の関係にある糸状菌類間のウイルス移行現象は、菌糸融合を介して行われていることが示唆された。
【0075】
【表8】

【0076】
〔実施例8〕『白紋羽病菌(子嚢菌類)における菌糸融合促進作用の観察』
実施例7で観察された菌糸融合について、さらに詳細を観察した。
表9に示す互いに細胞質不和合の関係にあるW779株とW97株について、前記1/10濃度オートミール培地に塩化亜鉛を0.75mM含有する培地において対峙培養を行った。前培養および対峙培養は、実施例1と同様にして行った。
なお、比較対照として、塩化亜鉛を含有しない前記1/10濃度オートミール培地と用いたことを除いては同様にして、これらの菌株の対峙培養を行った。
そして、互いの菌糸が接近した際に菌糸が示す行動について、以下の項目の観察頻度を計測した。結果を図9Aに示す。なお、観察された菌糸融合の顕微鏡写真像図を、図9Bに示す。
【0077】
・「菌糸が接近した際に示す行動」
Parallel: 互いの菌糸が平行に並ぶ。
Crossover: 互いの菌糸が回避し合う。
Approaching: 互いの菌糸が接近し合う。
Fusion: 互いの菌糸が融合する。
【0078】
その結果、亜鉛イオン処理によって、本来は菌糸融合が阻害されているW779株とW97株において、菌糸融合を促進する行動する頻度(Approaching、Fusion)が増加し、菌糸融合を阻害する行動(Crossover)が抑制されることが示された。
特に、W779株とW97株の間では本来は全く起こらない(0%である)菌糸融合が、有意に誘導されることが示された(図9AのFusionの項目参照)。
また、これらの菌糸どうしが接近した場合、本来は細胞質不和合による細胞死が引き起こされるが、亜鉛イオン処理によって、当該細胞死が阻害又は遅延されていることが推測された。
【0079】
【表9】

【0080】
〔実施例9〕『紫紋羽病菌の菌糸融合促進作用』
‘担子菌類’である紫紋羽病菌でのウイルス移行現象が、‘子嚢菌類’である白紋羽病菌と同様の機構(メカニズム)によって行われるのかを検討するため、亜鉛イオン処理における菌糸融合の詳細を観察した。
表10に示す互いに細胞質不和合の関係にあるV18株とV670株について、前記1/10濃度オートミール培地に塩化亜鉛を0.5mM含有する培地において対峙培養を行った。前培養および対峙培養は、実施例1と同様にして行った。
なお、比較対照として、塩化亜鉛を含有しない前記1/10濃度オートミール培地と用いたことを除いては同様にして、これらの菌株の対峙培養を行った。
そして、互いの菌糸が接近した際に菌糸が示す行動について、実施例8で示した項目の観察頻度を計測した。結果を図10Aに示す。なお、観察された菌糸融合の顕微鏡写真像図を、図10Bに示す。
【0081】
その結果、塩化亜鉛処理によって、本来は菌糸融合が阻害されているV18株とV670株において、菌糸融合を促進する行動する頻度(Approaching、Fusion)が増加し、菌糸融合を阻害する行動(Parallel、Crossover)が抑制されることが示された。
特に、菌糸が接近する頻度が大幅に増加し、菌糸融合の頻度も有意に増加することが示された(図10AのApproaching、Fusionの項目参照)。
また、これらの菌糸どうしが接近した場合に起こる細胞質不和合による細胞死についても、阻害又は遅延されていることが推測された。
なお、これらの結果は、実施例8における白紋羽病菌の観察結果と同様の傾向を示すものであった。
【0082】
【表10】

【0083】
〔ウイルス移行機構の考察〕
菌類において、子嚢菌類(カビ、キノコの一部、出芽酵母等を含むグループ)と、担子菌類(キノコの大部分、酵母の一種を含むグループ)とは、それぞれが単系統を形成する分類群であるが、両者は共通の糸状菌型の祖先菌類から分岐して多様化したものと推測されている(図1 参照)。
【0084】
また、上記実施例1〜9から、‘子嚢菌類’である白紋羽病菌と‘担子菌類’である紫紋羽病菌の両方において、細胞質不和合の関係にある菌株どうしでの菌糸融合が、亜鉛イオン処理により誘導されることが確認された。また、菌糸融合の際に観察される挙動は、両者で共通の傾向を有することが確認された。
そして、当該菌糸融合を介して、菌類ウイルス移行を人為的に誘起できることが示された。
これらのことから、亜鉛イオン処理によるウイルス移行の誘導現象は、‘子嚢菌類’と‘担子菌類’に属する菌類種(二核菌亜界)において、広く適用可能な技術であることが示唆された。
【産業上の利用可能性】
【0085】
本発明により、農業および園芸の幅広い分野において、植物疾病に対する有効な生物防除方法を開発する手段となることが期待される。特に、紋羽病の生物防除に対して応用されることが期待される。
また本発明は、植物病原菌に限らずに、キノコやカビ等の糸状菌類に対する極めて有用な菌類寄生ウイルスの導入技術となること、が期待される。
【技術分野】
【0001】
本発明は、糸状菌類に感染している菌類寄生ウイルスを、細胞質不和合の関係にある他の糸状菌類に導入する方法に関する。
【背景技術】
【0002】
植物病を引き起こす病原菌の多くは、二核菌亜界(子嚢菌類及び担子菌類からなる分類群)に属する糸状菌類が原因であることが知られている。
そこで、植物病原糸状菌に感染する菌類寄生ウイルス(マイコウイルス、菌類ウイルスともいう)を利用して、その宿主となる病原菌の病原力を低下させることによって植物病害を防除する生物防除法の開発が試みられている。
その先駆的研究として、果樹類の重要な病害である紋羽病(白紋羽病および紫紋羽病)を防除するために菌類寄生ウイルスを利用する研究開発が進められている(非特許文献1 参照)。
【0003】
しかし、菌類寄生ウイルスは、任意の植物病原糸状菌の菌株に導入できないという問題がこの生物防除法の開発を遅らせている。
その問題は、異なる菌体間における菌類寄生ウイルスの伝搬(移行)は、(1)体細胞的に和合な菌体間での菌糸融合によってのみ認められ、体細胞的に不和合な菌体間では認められないこと(細胞質不和合性)、(2)そして菌類寄生ウイルスは外部から直接に菌糸細胞に感染しないこと、に起因する(非特許文献2 参照)。
なお、自然界に生息している糸状菌類は、それぞれ細胞質和合に関する遺伝子型が異なっており、対峙培養を行うと細胞質不和合性反応に伴う細胞死が引き起こされてしまう。
【0004】
現行の菌類寄生ウイルスの人為的な導入方法としては、ベクターモノカリオンを用いた導入方法、すなわち、同じ菌種内の異なる菌株と菌糸融合を行う性質を有するベクターモノカリオン菌株を仲介することによって菌類寄生ウイルスを導入する方法(特許文献1参照)、が挙げられる。しかし、当該方法は、担子菌類にのみ限定される手法であり、さらにウイルスを導入できる菌株には制限があり、任意の菌株にウイルスを導入することができない方法である。(非特許文献3,4 参照)。
また、プロトプラストを用いた導入方法(ウイルス発現ベクターを用いた形質転換によるウイルス発現、試験管内転写産物の導入、電子銃による純化ウイルス粒子の導入、異なる菌体由来のプロトプラスト融合による導入などを含む)(非特許文献5 参照)を挙げることもできる。しかし、当該導入方法は、プロトプラスト化と再生系が確立している種類や菌株にしか用いることができず、また、プロトプラスト化やプロトプラストからの菌糸再生が得られにくい菌種や菌株には適用が困難な方法である。
【0005】
このように、従来の方法では、菌類寄生ウイルスを糸状菌類に人為的に導入する際に利用できる菌種や菌株に大幅な制限があり、任意の菌種や菌株に菌類寄生ウイルスを導入できる汎用性の高い方法の開発が望まれていた。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2002-065279号公報
【非特許文献】
【0007】
【非特許文献1】Matsumoto,N. (1998) Japan Agricultural Research Quarterly (JARQ), 32: p31-35.
【非特許文献2】Buck, K. W. (1998) Bridge, P., Couteaudier, Y. and Clarkson, J. (eds). p53-72. CAB International, Wallingford, Oxfordshire.
【非特許文献3】Suzaki, K. et al. (2003) Mycoscience, 44: p139-147.
【非特許文献4】Suzaki, K. et al. (2005) Journal of General Plant Pathology, 71: p161-168.
【非特許文献5】佐々木厚子(2009)果樹研究所研究報告,8:p1-14.
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明では、上記従来の課題を解決し、特定の菌種や菌株の種類に制限されることなく、二核菌亜界に属する幅広い糸状菌類の菌種や菌株に容易に適用が可能である(極めて汎用性が高い)、菌類寄生ウイルスの導入方法を開発することを目的とする。
【課題を解決するための手段】
【0009】
本発明者らは、二核菌亜界に属する糸状菌類どうしの細胞質不和合性反応に着目し、それを阻害する作用を有する物質の探索を行った。
その結果、‘亜鉛イオン’に、糸状菌どうしの細胞質不和合性を阻害する作用があり、本来は起こらないはずの菌糸融合(及び細胞質不和合性反応に伴う菌糸の細胞死の阻害や遅延)が起こることを見出した。
そして、当該菌糸融合を介することによって、これらの糸状菌類間でのウイルスの移行が起こることを見出した。
【0010】
本発明は、これらの知見に基づいてなされたものである。
即ち、〔請求項1〕に係る本発明は、下記(a)の糸状菌類に感染している導入対象の菌類寄生ウイルスを、下記(b)の糸状菌類に導入するにあたり、;下記(a)及び(b)の糸状菌類を、亜鉛イオン存在下で共培養することを特徴とする、;糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
(a):導入対象の菌類寄生ウイルスが感染している二核菌亜界に属する糸状菌類。
(b):前記(a)の糸状菌類に属するが細胞質不和合の関係にあり、導入対象の菌類寄生ウイルスが感染していない二核菌亜界に属する糸状菌類。
また、〔請求項2〕に係る本発明は、前記糸状菌類が、分子系統学的に子嚢菌類又は担子菌類に属するものである、請求項1に記載の糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
また、〔請求項3〕に係る本発明は、前記(b)の糸状菌類が、前記(a)の糸状菌類と同一菌種のものである、請求項1又は2に記載の糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
また、〔請求項4〕に係る本発明は、前記亜鉛イオンが、塩化亜鉛又は硫酸亜鉛に由来するものである、請求項1〜3のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
また、〔請求項5〕に係る本発明は、前記共培養が、0.4〜2.5mMの亜鉛イオン存在下で行うものである、請求項1〜4のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
また、〔請求項6〕に係る本発明は、前記糸状菌類が、植物病原菌であり、;前記寄生ウイルスが、前記植物病原菌によって引き起こされる植物に対する病原力を低下させるウイルスである、;請求項1〜5のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
また、〔請求項7〕に係る本発明は、前記糸状菌類が、白紋羽病菌又は紫紋羽病菌である、請求項1〜6のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法、に関するものである。
【発明の効果】
【0011】
本発明は、特定の菌種や菌株の種類に制限されることなく、二核菌亜界に属する糸状菌類(具体的には、担子菌類及び子嚢菌類)に、菌類寄生ウイルスを人為的に導入することを可能とする。
また、本発明は、人為的に誘発した菌糸融合を介してウイルスの導入を図る方法であるため、菌株間での細胞質不和合の関係やプロトプラスト化の確立等を考慮する必要が無く、極めて汎用性の高い方法である。
これにより本発明は、現行の方法が適さなかった糸状菌類の菌種または菌株への菌類寄生ウイルスの導入において有効な技術となることが期待される。
また、本発明は、室内の培養にて行うことが可能であるが、野外の土壌中や植物体上に生育する糸状菌に、直接ウイルス導入することも可能とする。
【0012】
また、本発明によって、植物病原糸状菌に対して、高い病原力低下効果を示す菌類寄生ウイルスを効率良く選抜することが可能となる。それによって、ウイルスが感染して病原力の低下した植物病原菌を容易に獲得することが可能となる。
特には、果樹の重要疾病である紋羽病の病原である紋羽病菌に対して、病原力を低下させる菌類寄生ウイルスが導入された紋羽病菌を得ることが可能となる。
【0013】
本発明では、農場等に発生した植物病原菌と同一菌株である病原性低下ウイルス感染菌株を用いることによって、糸状菌類が引き起こす植物疾病に対する生物防除が可能となる。
例えば、本発明により、病原力低下ウイルスが感染した特定の植物病原菌の菌株と、亜鉛イオンを含む適切な培地をキット化することが期待される。当該キットを用いることによって、農場や圃場で発生した植物病原菌に対して、これらを防除可能な病原性低下ウイルス感染菌株を、容易に作製できることが期待される。
また、本発明におけるウイルス導入を野外の土壌中や植物病斑上にて行うことによって、野外で発生した強病原力菌の病原力を直接低下させる生物防除が可能となる。
【図面の簡単な説明】
【0014】
【図1】菌界(Fungi)に属する代表的な分類群の系統関係を示す模式図である。
【図2】細胞質不和合性を有する糸状菌類間において、亜鉛イオン処理によるウイルス移行メカニズムの推定図である。
【図3】‘実施例1’において、ウイルス移行を行うための各工程の培養状態を示す図である。(A) 前培養における対峙培養。 (B) 各種物質含有培地における対峙培養。 (C) ハイグロマイシン含有培地での再培養。 各図において‘供与菌’は「ウイルス供与菌」を、‘受容菌’は「ウイルス受容菌」を示す。
【図4】‘実施例1’において、ウイルス受容菌へのウイルス移行を検出した電気泳動図である。(A) ウイルスゲノムの存在を確認するための全核酸の電気泳動図。 (B) 菌株の多型パターンを示すPCR産物の電気泳動図。 各図においてレーン1はW779株(ウイルス供与菌)、;レーン2はRT59-41株(ウイルス受容菌)、;レーン3〜5は塩化亜鉛処理したRT59-41株、;からの核酸を示す。なお、レーンMは、DNA分子量サイズマーカー(1Kb DNA Ladder; Fermentas社)を示す。
【図5】‘実施例2’において、受容菌へのウイルス移行を検出した電気泳動図である。(A) ウイルスゲノムの存在を確認するための全核酸の電気泳動図。 (B) 菌株の多型パターンを示すPCR産物の電気泳動図。 各図においてレーン1はRT59-41株(ウイルス受容菌)、;レーン2はW780株(ウイルス供与菌)、;レーン3〜6は塩化亜鉛処理したRT59-41株、;からの核酸を示す。なお、レーンMは、DNA分子量サイズマーカー(1Kb DNA Ladder; Fermentas社)を示す。
【図6】‘実施例5’において、受容菌へのウイルス移行を検出した電気泳動図である。(A) ウイルスゲノムの存在を確認するための全核酸の電気泳動図。 (B) 菌株の多型パターンを示すPCR産物の電気泳動図。 各図においてレーン1はRT59-41株(ウイルス受容菌)、;レーン2はW779株(ウイルス供与菌)、;レーン3,4は硫酸亜鉛処理したRT59-41株、;からの核酸を示す。なお、レーンMは、DNA分子量サイズマーカー(1Kb DNA Ladder; Fermentas社)を示す。
【図7】‘実施例6’において、受容菌へのウイルス移行を検出した電気泳動図である。(A) ウイルスゲノムの存在を確認するための全核酸の電気泳動図。 (B) 菌株の多型パターンを示すPCR産物の電気泳動図。 各図においてレーン1はV18株(ウイルス受容菌)、;レーン2はV670株(ウイルス供与菌)、;レーン3〜5は塩化亜鉛処理したV18株、;からの核酸を示す。なお、レーンMは、DNA分子量サイズマーカー(1Kb DNA Ladder; Fermentas社)を示す。
【図8】‘実施例7’において、W779株とW370hti株の菌糸融合を示す顕微鏡写真像図である。
【図9】(A)‘実施例8’において、W779株とW97株の菌糸が接近した際の菌糸の行動頻度を示す図である。 (B)‘実施例8’において、W779株とW97株の菌糸融合を示す顕微鏡写真像図である。
【図10】(A)‘実施例9’において、V18株とV670株の菌糸が接近した際の菌糸の行動頻度を示す図である。 (B)‘実施例9’において、V18株とV670株の菌糸融合を示す顕微鏡写真像図である。
【発明を実施するための形態】
【0015】
本発明は、糸状菌類に感染している菌類寄生ウイルスを、細胞質不和合の関係にある他の糸状菌類に導入する方法に関する。
【0016】
〔糸状菌類について〕
本発明における「糸状菌類」とは、‘子嚢菌類’および‘担子菌類’に属する真核性の菌類を指し、生活環において管状の栄養体(菌糸)を形成する種類や菌種を指すものである。
子嚢菌類と担子菌類は、二核菌亜界(Dikarya)を構成する分類群であり、それぞれが系統的に単系統の群である。両者は、共通の糸状菌型の祖先菌類から分岐して多様化したものと認められる(図1 参照)。
なお、子嚢菌類と担子菌類の単系統性については、例えば、Berbee and Taylor 1992 Molecular Biology and Evolution 9:278-284(SSU rDNAによる解析)、;Liu et al. 2006 BMC Evolutionary Biology 6:74(RNA polymerase genesによる解析)、;Seif et al. 2005 Nucleic Acids Research 33:734-744(mitochondrial genome sequencingによる解析)、に詳細な報告がある。
【0017】
ここで、「子嚢菌類」(Ascomycota)とは、微小な子嚢を形成しその中に減数分裂によって胞子を作ることを特徴とする単系統の分類群である。子実体を形成するカビの仲間、キノコの一部が含まれる。
具体的には、チャワンタケ、アミガサタケ、トリュフ、セイヨウショウロ、アカパンカビ、白紋羽病菌、リンゴ腐らん病菌、イネいもち病菌、アオカビ、コウジカビ、ウドンコ病菌、天狗巣病菌、出芽酵母、などを挙げることができる。
また、「担子菌類」(Basidiomycota)は、担子器の外側に胞子が形成されることを特徴とする単系統の分類群である。植物病原菌である黒穂病菌やさび病菌等の仲間、肉眼で確認できる子実体を形成する仲間(大部分のキノコ)が含まれる。
具体的には、さび病菌、紫紋羽病菌、黒穂病菌、マツタケ、シイタケ、スッポンタケ、ホコリタケ、キクラゲ、Rhizoctonia属菌、担子菌酵母、などを挙げることができる。
【0018】
また、本発明のウイルス導入技術は、菌糸伸長及び菌糸融合を行う上記分類群の種類であって、寄生可能な菌類寄生ウイルスが存在するものであれば、如何なる(任意の)菌種や菌株の糸状菌類に対しても、適用が可能な技術である。
例えば、任意の糸状菌類に対して、自然界では感染しえない他の糸状菌類の寄生ウイルスを導入することも可能となる。
また、分類不明学上の位置が不明の不完全菌類(有性生殖が不明のもの)や、現在の分類体系上では子嚢菌類や担子菌類に属さないと考えられている種類であっても、分子系統学的に子嚢菌類又は担子菌類に属すると認められる種類であれば、本発明の技術が適用可能である。
具体的には、分子系統学的解析(例えば、SSU rDNA, EF1-1α, ミトコンドリアゲノム配列など、を用いた解析など)によって、(I) 既知の子嚢菌類又は担子菌類の構成種から形成される単系統群に含まれる種類、(II) 既知の子嚢菌類又は担子菌類の構成種から形成される単系統群とさらにクレード(単系統群)を形成する種類、を挙げることができる。
なお、子嚢菌類と担子菌類の両系統において、菌糸形成能を失った単細胞体制の種類(子嚢菌類における出芽酵母や分裂酵母、;担子菌類における担子菌酵母)が存在するが、生活環において糸状菌の態様を有する種類であれば、本発明の技術が適用可能である。
【0019】
本発明は、細胞質不和合の関係にある糸状菌類どうしにおいて、当該細胞質不和合性を阻害することにより、菌糸融合を介して物理的にウイルス導入を行う方法によるものである。
そのため、本発明における‘ウイルス供与菌’と‘ウイルス受容菌’とは、細胞質不和合性反応が起こる関係にあることが必要である。
具体的には、これら両者の糸状菌類どうしが、同一菌種に分類されているが他菌株(同一菌種他菌株)のものどうしを用いることが好適である。
また、他菌種に分類されているものどうしであっても、細胞質不和合性反応が起こる関係(例えば近縁種の一部)にあるものどうしであれば、適用することができる。
なお、同一菌種同一菌株のものどうしを用いた場合、細胞質不和合性反応そのものが起こらないため、本発明の方法を用いることなく、菌糸融合を介して菌糸全体(個体)にウイルス伝搬させることが可能となる。
【0020】
なお、ここで「ウイルス供与菌」とは、導入対象である菌類寄生ウイルスが感染している糸状菌類を指す。
また、「ウイルス受容菌」とは、当該導入対象である菌類寄生ウイルスが感染していない目的の糸状菌類を指す。なお、ウイルス受容菌においても、導入対象でない他のウイルスが感染していることが想定される。
【0021】
〔菌類寄生ウイルスについて〕
本発明において導入対象である「菌類寄生ウイルス」(マイコウイルス、菌類ウイルス)は、目的の糸状菌類(ウイルス受容菌)に寄生可能なものであればよい。
また、目的の糸状菌類(ウイルス受容菌)では従来見つかっていないウイルス、人為的な改変を伴ったウイルス等であっても、当該糸状菌類に寄生可能なものであれば、本発明の方法によって導入することが可能である。
なお、好ましくは、ゲノムサイズの小さいものである方が、導入効率の点で好適である。
【0022】
〔ウイルス導入方法〕
・前培養
本発明のウイルス導入方法においては、後記の亜鉛イオン処理を行う前に、亜鉛イオンを含まない培地において、ウイルス供与菌とウイルス受容菌の前培養を行うことが好適である。
具体的には、両菌株を同一培地において共培養(特に寒天培地上での対峙培養)を行い、両菌株の菌糸を含む状態のもの(特に菌叢どうしが交わる状態まで培養したもの)について、亜鉛イオン処理を行うことが好適である。
また、それぞれの菌株を単独で前培養を行い、その後で菌糸どうしを混合して亜鉛イオン処理に用いることもできる。
当該前培養に用いることができる培地としては、用いる糸状菌類が培養可能な培地であれば如何なる培地(液体培地と固体培地の両方が可能)でも用いることができる。
なお、後記の亜鉛イオン処理を、直接野外に生息するウイルス受容菌に対して行う場合には、ウイルス供与菌のみを前培養することになる。
【0023】
・亜鉛イオン処理
本発明における糸状菌類への菌類寄生ウイルス導入は、‘ウイルス供与菌’と‘ウイルス受容菌’とを、亜鉛イオン存在下において共培養を行うことを必須とする方法である。
当該共培養(亜鉛イオン処理)は、亜鉛イオンを含有する培地にて行うことが好適であるが、ウイルス受容菌が生育する野外の土壌や植物病斑などの植物体上に、‘亜鉛イオン’と‘ウイルス供与菌’を散布, 塗布, 又は添加等することによって、直接野外にて行うことも可能である。
【0024】
本発明において、亜鉛イオンは、‘細胞質不和合性反応’を阻害する物質として、特別な効果を有する物質である。
当該細胞質不和合反応が阻害されることによって、次いで‘人為的な菌糸融合’及び‘細胞質不和合性反応に伴う菌糸の細胞死阻害や遅延’が誘導される。
そして、最終的には、当該菌糸融合を介して、‘当該糸状菌類間でのウイルス移行’が起こり、対象の菌類寄生ウイルスを目的の糸状菌類へ導入することが可能となる(図2:亜鉛イオン処理によるウイルス移行メカニズムの推定図を参照)。
なお、ここで移行するものは、ウイルス粒子そのものであるが、感染の確認はウイルスゲノム(VC因子:dsRNA)の検出により行う。
【0025】
ここで、「亜鉛イオン存在下」としては、亜鉛イオン濃度に換算して、0.4mM以上、好ましくは0.5mM以上、さらには0.75mM以上、を挙げることができる。
なお、当該工程においては、亜鉛イオン濃度が高い程、ウイルス導入効率も向上するため、好適である。反対に、亜鉛イオン濃度が、当該所定値よりも低い場合、ウイルス導入効率は著しく低下するため好適でない。
なお、亜鉛イオンの上限値としては、糸状菌類の種類によって亜鉛イオン感受性が異なる(生育阻害が出る濃度が異なる)ため一概に決められない点があるが、例えば、亜鉛イオン濃度に換算して、2.5mM以下、好ましくは2.0mM以下、特には1.8mM以下、さらには1.5mM以下を挙げることができる。
また、亜鉛イオンの供給源として添加できる物質としては、具体的には、塩化亜鉛(ZnCl2)、硫酸亜鉛(ZnSO4)、を用いることが好適であるが、酸化亜鉛(ZnO)、硫化亜鉛(ZnS)、グルコン酸亜鉛、ステアリン酸亜鉛、酢酸亜鉛((CH3COOH)2Zn)、臭化亜鉛(ZnBr2)、炭酸亜鉛(ZnCO3)、クエン酸亜鉛(Zn3(C6H5O7)2)、ヨウ化亜鉛(ZnI2)などを用いることも可能である。
なお、当該亜鉛イオン処理(共培養)を「培地」にて行う場合、ウイルス供与菌とウイルス受容菌とが共に同時に培養可能な培地であれば、如何なる培地をも用いることができる。また、寒天培地などの固形培地の形態であることが望ましい。
【0026】
当該亜鉛イオン処理(共培養)の条件としては、ウイルス供与菌とウイルス受容菌が共に培養可能な条件であればよく、例えば、15〜35℃の好気的条件等で行うことが望ましい。
培養期間としては、5〜60日、好ましくは10〜30日(例えば白紋羽病菌の場合は約10〜30日、紫紋羽病菌の場合は約14〜30日)の共培養によって、ウイルス受容菌(目的の糸状菌類)に、対象ウイルスが導入された菌株を得ることが可能となる。
【0027】
また、当該亜鉛イオン処理(共培養)は、両菌株の菌糸が交ざり合って生育している状態であれば、行うことが可能である。
当該処理を培地にて行う場合、具体的には、両菌株を寒天培地上で対峙培養を行い、菌叢どうしが交わった状態のものについて行うことが好適である。
【0028】
当該亜鉛イオン処理後のウイルス受容菌には、ウイルス供与菌からのウイルス移行が起こった菌糸を含むものとなる。
従って、用途によっては、得られた培養菌叢の全部(もしくは受容菌側の菌叢のみを全部)を混合して、菌混合物の状態でそのままで用いることもできる。例えば、植物疾病の原因菌の防除に用いる際には、このような菌混合物の状態で用いた場合でも、生物防除効果を得ることができる。
【0029】
〔ウイルス導入後の処理〕
・亜鉛イオン処理後の工程
上記亜鉛イオン処理を野外ではなく「培地」にて行った場合、望ましくは、受容菌側の菌叢(対峙培養でない場合は後述の手段で受容菌と判別された菌叢や菌糸)の一部を、亜鉛イオンを含有しない培地に移植して、単離して用いることが好適である。
なお、再培養(単離)した菌叢がウイルス移行したものであるかの確認は、菌叢の全核酸を抽出して電気泳動を行って、ウイルスゲノムRNAの存在を確認することにより、確認することができる。なお、ウイルスゲノムRNAを標的としたRT-PCR法等によっても、検出することが可能である。
【0030】
再培養(単離)した菌叢がウイルス受容菌であるかの確認は、得られた菌叢とウイルス供与菌とウイルス受容菌のそれぞれと対峙培養を行い、どちらの菌かを判別することが可能である。
また、両菌株を判別可能なDNA多型解析を行うことでも、確認することが可能である。例えば、白紋羽病菌の場合は、配列番号1又は配列番号2に記載のプライマーを用いたUniversally Primed-PCR法により、多型解析を行うことが可能となる。
【0031】
前記共培養を行った後は、ウイルス受容菌のみを容易に選択するために、ウイルス供与菌が生育せずに、ウイルス受容菌のみが生育できるような条件で培養を行うことが望ましい。
なお、本発明では、ウイルス受容菌としては任意の菌に対して行うことが可能な実施態様であることが、様々な用途への応用の点で重要である。
(a) そこで、ウイルス供与菌側に生育困難性(例えば栄養要求性)の性質を持たせておき、当該ウイルス供与菌の生育が困難な培地(例えば栄養が欠失した培地)に植継いで、ウイルス受容菌を選択する方法などを挙げることができる。
(b) また、ウイルス受容菌側に予め選抜遺伝子(抗生物質耐性遺伝子、マーカー遺伝子等)を組み込んでおく態様で行うことも可能である。
これにより、共培養後にウイルス受容菌部分を選択培地に植継いで、ウイルス導入がされた受容菌のみを選択培養する方法が可能となる。また、発光や発色等が確認された菌糸のみを選択移植することも可能となる。
【0032】
上記のようにして選択したウイルス受容菌は、当該移植部分付近の菌糸の継代培養を2回以上(好ましくは3〜5回)繰り返すことで、ウイルス受容菌どうしの菌糸融合(体細胞和合)により、植継いだ菌糸全体に当該ウイルスの感染を促すことができる。
なお、前記(b)の方法で選抜遺伝子を組み込んだウイルス受容菌は、そのままでは野外に持ち出すことができない。
そこで、当該ウイルス受容菌(選抜遺伝子、ウイルス導入済み)を、選抜遺伝子を組み込む前の元の菌株と一緒に培養し、菌糸融合させることによって、ウイルスを感染させた元の菌株を野外散布等に用いることができる。
【0033】
〔本発明の応用態様〕
本発明によって、幅広い糸状菌類の菌種や菌株に対して容易に菌類寄生ウイルスを導入することが可能となる。また、自然界では感染しえない組合せの菌類寄生ウイルスを導入した菌株、人為的な改変を伴ったウイルスを導入した菌株、などの作出も可能となり、病原力の低下がより顕著な菌株の作出も可能となる。
【0034】
・植物防除法への応用
特に本発明は、植物病原菌に対して、当該病原力を低下(弱毒化)させる菌類寄生ウイルスを導入させて、「病原力が低下した植物病原菌を作出すること」に、有用性を発揮する技術である。
本発明の方法によって人為的に作出した病原力低下菌(弱毒菌)は、当該病原力低下菌の野生型植物病原菌(強毒菌)が引き起こす疾病に対して、ウイルス感染を利用した生物防除を行うことができる。
【0035】
(i) 具体的に本発明では、上記したウイルス導入方法によって作出した病原力低下菌(弱毒菌)を、果樹園や畑の土壌に散布して、野生型の病原菌(強毒菌)と接触(菌糸融合)させることによって、細胞質和合の野生型菌にウイルス伝搬(感染)がおこり、野生型を弱毒化させることが可能となる。
(ii) また本発明では、「野生型の病原菌(強毒菌)であるウイルス受容菌」が生育する野外の土壌又は植物体上に形成された病斑上に、「亜鉛イオン」と「病原力を低下(弱毒化)させる菌類寄生ウイルスが感染したウイルス供与菌」を散布等することによって、直接野外にてウイルス導入を行い、野外の病原菌の病原性を低下させることが可能となる。
【0036】
ここで、生物防除が可能な植物疾病としては、前記糸状菌類に属する植物病原菌が原因となるものであれば、如何なるものであっても応用が可能である。
例えば、紋羽病(紫紋羽病、白紋羽病)、胴枯病、腐らん病、青かび病、枝枯病、葉枯病、すす病、葉腐病、根腐病、萎凋病、立枯病、紋枯病、いもち病、灰色かび病、ならたけ病、材質腐朽病、などを挙げることができる。
なお、原因病原菌の人工培養系が確立していない疾病(例えば、さび病、うどんこ病など)については、現時点では本発明の応用は困難であるが、将来、これらの原因病原菌の人工培養系が確立した際には、応用が可能となることが期待される。
【0037】
・紋羽病の植物防除への応用
本発明では、特に、果樹、農作物、園芸植物全般に対して大きな被害を与える紋羽病への応用を挙げることができる。
紋羽病は、原因菌である紋羽病菌によって引き起こされる植物疾病の総称であり、原因菌として、白紋羽病菌(子嚢菌類)と紫紋羽病菌(担子菌類)が挙げられる。これらは疾病の外観は類似するが、分類的には全く異なる糸状菌類である。
‘白紋羽病菌’としては、Rosellinia属に属する100種類以上の種のうち、R.necatrix、R.compacta、を挙げることができる。
‘紫紋羽病菌’としては、Helicobasidium属に属する数種を挙げることができ、H.mompa、H.brebissonii、H.longisporum、などを挙げることができる。
【0038】
本発明の方法によって、白紋羽病の病原力を低下させる菌類寄生ウイルスとしては、Rosellinia necatrix megabirnavirus1(RnMBV1)、Rosellinia necatrix mycoreovirus3(RnMYRV3)、などを挙げることができる。
また、紫紋羽病の病原力を低減させる菌類寄生ウイルスとしては、Helicobasidium mompa endornavirus1(HmEV1)、Helicobasidium mompa endornavirus1-670(HmEV1-670)、Helicobasidium mompa mitovirus1-18(HmMV1-18)、Helicobasidium mompa totivirus1(HmTV1)などを挙げることができる。
なお、本発明の方法では、前記のように、任意の紋羽病菌に対して自然界では感染しえない他の紋羽病菌の寄生ウイルスの導入を行うことも可能となる。
【0039】
本発明の方法で作出した病原力が低下した紋羽病菌によって、紋羽病の生物防除が可能となる植物としては、果樹、農作物、園芸植物全般を挙げることができる。
特には、白紋羽病の場合では、リンゴ、ナシ、ブドウ、ビワ、イチジク、キウイフルーウ、モモ、ウメ、オウトウ、アンズ、スモモ、カキ、カンキツ、クリ、クワ、チャ、サクラ、カシ、ナラ、ポプラ、カエデ、ツバキ、ツツジ、バラ、キク、オモト、シャクヤク、など、;紫紋羽病の場合では、リンゴ、クワ、ウルシ、チャ、サクラ、ナラ、カエデ、ツバキ、ツツジ、ヒサカキ、ユリノキ、サツマイモ、アスパラガス、ニンジン、アルファルファ、など、;に対して、有効に用いることができる。
【実施例】
【0040】
以下、実施例を挙げて本発明を説明するが、本発明の範囲はこれらにより限定されるものではない。
【0041】
〔実施例1〕『細胞質不和合性を阻害する物質の探索』
細胞質不和合性によって菌糸融合が阻害されている白紋羽病菌の菌株どうしにおいて、細胞質不和合反応を阻害する物質の探索を行った。
【0042】
(1)前培養(W779株 vs. RT59-41株)
表2に示す白紋羽病菌(Rosellinia necatrix)のRnMBV1(Rosellinia necatrix megabirnavirus1)感染株である「W779株」(ウイルス供与菌)と、ウイルスフリー株である「RT59-41株」(ウイルス受容菌)を、1/10濃度オートミール寒天培地(オートミール粉末3g, シュクロース5g, 寒天末15g/1L)の上に並べた1cm角のセルロースメンブレン上に接種し、対峙培養を行った(図3A 参照)。培養は25℃で3〜4日間行い、互いの菌叢が交わる程度まで生育させた。
なお、これらの菌株どうしは細胞質不和合(MCG (Mycelial Compatibility Group)が異なる)の関係にある。
【0043】
(2)各種物質含有培地での対峙培養
次に、9cmシャーレに、前記1/10濃度オートミール培地に表1-A〜1-Dに示す各物質(87種類)をそれぞれ含有させた寒天培地を調製した。なお、各物質について、3,4段階の希釈系列(50〜100倍の濃度範囲)の培地を作成した。各物質の濃度は、過去に各種阻害反応(多くはシグナル伝達系の阻害)が文献に記載されている有効レベルや従来に用いられる濃度等、を参考にして決定した。
これらの培地の上に、前記対峙培養した菌叢をセルロースメンブレンごと移植した(図3B 参照。なお、図3Bにはそのうちの一部の各種試料含有培地を示した。)。なお、移植の際には、シャーレの隅に移植して菌叢の生育スペースを確保した。そして、25℃で2週間培養することで菌叢を成長させた。
【0044】
その後、W779株(ウイルス供与菌)になるべく接近しているRT59-41株(ウイルス受容菌)側の菌糸片を切り出し、ハイグロマイシンを含むPDA寒天培地(ハイグロマイシン濃度50μg/ml)の上に並べた1cm角メンブレン上に接種した。
そして、25℃で1週間の再培養(単離培養)を行い(図3C 参照)、ハイグロマイシン耐性を有さないW779株の生育を抑えて、RT59-41株のみを選択的に生育させた。
【0045】
【表1−A】

【0046】
【表1−B】

【0047】
【表1−C】

【0048】
【表1−D】

【0049】
(3)ウイルス移行の検出
上記再培養で生育した各試験区の菌叢(RT59-41株)について、細胞破壊機で細胞を破壊した後、常法により全核酸(菌株のゲノムDNA及びtotal RNA、ウイルスゲノムRNA)を抽出した。そして、得られた核酸を電気泳動することによって、ウイルス由来のゲノム二本鎖RNAの有無を判別した。
【0050】
その結果、上記87種類の試料のうち、「塩化亜鉛(亜鉛イオン)」を含有させた培地(試料60)を用いた場合でのみ、RT59-41株(ウイルス受容菌)側でのウイルスの存在が検出された。
詳しくは、1.5mM塩化亜鉛含有培地で32株中4株、0.75mM塩化亜鉛含有培地で12株中2株、において、ウイルスゲノムのRNA(VC因子)が検出された。
なお、図4A(全核酸の電気泳動像)は、レーン4,5の菌叢において、RT59-41株にウイルスゲノムRNAの存在が検出された例を示す図である。
【0051】
また、他の試料においては、Pronase Eを含有させた培地(試料8)で1例のみウイルスが検出されたが、再現性が確認できなかった。また、他の85種類の物質を含有させた培地では、RT59-41株(ウイルス受容菌)側でのウイルスの存在は全く検出できなかった。
【0052】
(4)ウイルス供与菌でないことの確認
上記得られた菌叢が、W779株(ウイルス供与菌:ハイグロマイシン非耐性)の混入でないことを確認するため、得られた菌叢の全核酸を鋳型としたUniversally Primed-PCR法により、菌株ゲノムDNAの多型解析を行った。
Universally Primed-PCR法は、配列番号1に記載のプライマー1種類のみをPCR反応液に添加して、菌叢のゲノムDNAを鋳型としたPCR(アニーリング温度55℃)を行うことによって行った。
なお、当該プライマーは、当該プライマー1種類のみを用いてPCRを行うことによって、白紋羽病菌のDNA多型解析を可能とするプライマーである。
【0053】
その結果、試験区60においてウイルスの存在が認められた菌叢の多型パターンは、RT59-41株のものと一致した。従って、当該菌叢は、W779株の混入ではなくRT59-41株であることが確認された。
なお、図4B(PCR産物の電気泳動像)は、ウイルスゲノムRNAの存在が検出されたレーン4,5の菌叢の多型パターンが、RT59-41株と一致したことを示す図である。
【0054】
(5)考察
以上のことから、塩化亜鉛を含む培地での対峙培養を行うことによって、W779株からRT59-41株へのウイルス移行が起こったことが示された。
また、当該ウイルス移行は、W779株とRT59-41株の間では本来は起こらない菌糸融合を介して行われたことが推測された。なお、当該実施例において特に重要な各項目を、表2に示す。
【0055】
【表2】

【0056】
〔実施例2〕『他の菌類ウイルスの移行試験(W780株 vs. RT59-41株)』
実施例1で示された糸状菌類間のウイルス移行現象が、菌類ウイルスRnMBV1を用いた場合の特異的な現象であるのかを検討した。
ウイルス供与菌として、前記W779株とは異なる菌類ウイルスであるRnPV(partitivirusに属する未同定種)の感染株である「W780株」(表3)を用いて、実施例1と同様にして、ウイルス受容菌(RT59-41株)へのウイルス移行処理を行った。W780株とRT59-41株は、細胞質不和合の関係にある菌株どうしである。
なお、ウイルス移行を誘導するため対峙培養には、前記1/10濃度オートミール培地に塩化亜鉛を0.75mM含有する培地を用いた。
全核酸を電気泳動した結果を図5Aに示す。また、Universally Primed-PCR法でのDNA多型解析の結果を図5Bに示す。
【0057】
その結果、W780株に感染している菌類ウイルス(RnPV)についても、塩化亜鉛を含む培地での対峙培養によって、RT59-41株に移行することが示された。
【0058】
【表3】

【0059】
〔実施例3〕『他の受容菌への移行試験(W780株 vs. RT56-2株)』
実施例1,2で示された糸状菌類間のウイルス移行現象が、ウイルス受容菌にRT59-41株を用いた場合の特異的な現象であるのかを検討した。
ウイルス受容菌として、前記RT59-41株とは異なるウイルスフリー株である「RT56-2株」(表4)を用いて、実施例2と同様にしてウイルス移行処理を行った。W780株とRT56-2株は、細胞質不和合の関係にある菌株どうしである。
なお、ウイルス移行を誘導するため対峙培養には、前記1/10濃度オートミール培地に塩化亜鉛を0.75mM含有する培地を用いた。
【0060】
その結果、ウイルス受容菌としてRT56-2株を用いた場合でも、塩化亜鉛を含む培地での対峙培養によって、W780株から菌類ウイルス(RnPV)が移行することが示された。
【0061】
【表4】

【0062】
〔実施例4〕『塩化亜鉛濃度の検討』
実施例1〜3で示された糸状菌類間のウイルス移行現象において、対峙培養に用いる培地の塩化亜鉛の「濃度」の検討を行った。
ウイルス移行を誘導するための対峙培養に用いる培地として、前記1/10濃度オートミール培地に表5に示す塩化亜鉛含有培地を用い、実施例1と同様にして、ウイルス受容菌(RT59-41株)へのウイルス移行処理を行った。また、ウイルス供与菌として、W779株、W780株の両方の場合を検討した。ウイルス移行頻度の結果を表5に示す。
【0063】
その結果、塩化亜鉛を0.5mM以上含有する培地で対峙培養を行うことで、RT59-41株(受容菌)へのウイルス移行が起こることが示された。また、0.75mM, 1.5mMと濃度が上がるにつれて、ウイルス移行率も上昇することが示された。
一方、塩化亜鉛濃度が0.25mM以下では、ウイルス移行が確認されなかった。
【0064】
なお、W780株に感染しているウイルス(RnPV: ゲノムサイズ0.29 kb)の方が、W779株に感染しているウイルス(RnMBV1:ゲノムサイズ8.9kb, 7.2kb)よりも、RT59-41株(ウイルス受容菌)に移行する頻度が大幅に高かった。
これは、感染しているウイルスゲノム(VC因子)の大きさが、菌糸融合を介したウイルス移行の効率に影響しているためと推測される(表3,4 参照)。
【0065】
【表5】

【0066】
〔実施例5〕『硫酸亜鉛処理によるウイルス移行評価』
実施例1〜4で示された糸状菌類間のウイルス移行現象が、塩化亜鉛を用いた場合の特異的な現象であるのかを検討した。
ウイルス移行を誘導するための対峙培養に用いる培地として、前記1/10濃度オートミール培地に「1mM 硫酸亜鉛」を含む培地を用い、実施例1と同様にして、ウイルス供与菌(W779株)からウイルス受容菌(RT59-41株)へのウイルス移行処理を行った。
全核酸を電気泳動した結果を図6Aに示す。また、Universally Primed-PCR法でのDNA多型解析の結果を図6Bに示す。また、ウイルス移行頻度の結果を表6に示す。
【0067】
その結果、硫酸亜鉛を含む培地を用いた場合でも、ウイルス供与菌の菌類ウイルスが、ウイルス受容菌に移行することが示された。
この結果から、実施例1〜4において確認された塩化亜鉛を用いたウイルス移行作用は、塩化物イオンによるものではなく、‘亜鉛イオン’によって誘起されることが示された。
【0068】
また、硫酸亜鉛を用いた場合のウイルス移行の頻度は、同様の濃度の塩化亜鉛を用いた場合と比べて、同程度の効率であることが示された。
【0069】
【表6】

【0070】
〔実施例6〕『紫紋羽病菌(担子菌類)におけるウイルス移行評価』
実施例1〜5で示された‘子嚢菌類’である白紋羽病菌に対するウイルス移行技術が、‘担子菌類’である紫紋羽病菌に対しても適用できるかを検討した。
表7に示す紫紋羽病菌(Helicobasidium mompa)のHmEV1-670の感染株である「V670株」(ウイルス供与菌)と「V18株」(ウイルス受容菌)について、実施例1と同様にしてウイルス移行処理を行った。V670株とV18株は、細胞質不和合の関係にある菌株どうしである。
なお、ウイルス移行を誘導するため対峙培養には、前記1/10濃度オートミール培地に塩化亜鉛を0.5mM含有する培地を用いた。
全核酸を電気泳動した結果を図7Aに示す。また、Universally Primed-PCR法でのDNA多型解析の結果を図7Bに示す。
【0071】
その結果、亜鉛イオンを含む培地での対峙培養によって、V670株が保持していた菌類寄生ウイルス(HmEV1-670)がV18株に移行することが示された。
この結果から、‘担子菌類’である紫紋羽病菌の菌株どうしにおいても、亜鉛イオン処理による菌類ウイルス移行技術が適用できることが示された。
【0072】
【表7】

【0073】
〔実施例7〕『白紋羽病菌(子嚢菌類)における菌糸融合の観察』
上記亜鉛イオン処理による糸状菌類間のウイルス移行現象が、白紋羽病菌(子嚢菌類)において具体的にどのように行われるのかを検討するため、菌糸融合を観察した。
表8に示す互いに細胞質不和合の関係にあるW779株とW370hti株(ハイグロマイシン耐性を付与する前のRT59-41株の親株)について、前記1/10濃度オートミール培地に塩化亜鉛を0.75mM含有する培地において対峙培養を行った。
前培養および対峙培養は、実施例1と同様にして行った。なお、観察された菌糸融合の顕微鏡写真像図を、図8に示す。
【0074】
その結果、菌叢が接触する付近の菌糸において、W779株とW370hti株の間で菌糸融合が起こることが観察された。
このことから、亜鉛イオン処理によって誘導される細胞質不和合の関係にある糸状菌類間のウイルス移行現象は、菌糸融合を介して行われていることが示唆された。
【0075】
【表8】

【0076】
〔実施例8〕『白紋羽病菌(子嚢菌類)における菌糸融合促進作用の観察』
実施例7で観察された菌糸融合について、さらに詳細を観察した。
表9に示す互いに細胞質不和合の関係にあるW779株とW97株について、前記1/10濃度オートミール培地に塩化亜鉛を0.75mM含有する培地において対峙培養を行った。前培養および対峙培養は、実施例1と同様にして行った。
なお、比較対照として、塩化亜鉛を含有しない前記1/10濃度オートミール培地と用いたことを除いては同様にして、これらの菌株の対峙培養を行った。
そして、互いの菌糸が接近した際に菌糸が示す行動について、以下の項目の観察頻度を計測した。結果を図9Aに示す。なお、観察された菌糸融合の顕微鏡写真像図を、図9Bに示す。
【0077】
・「菌糸が接近した際に示す行動」
Parallel: 互いの菌糸が平行に並ぶ。
Crossover: 互いの菌糸が回避し合う。
Approaching: 互いの菌糸が接近し合う。
Fusion: 互いの菌糸が融合する。
【0078】
その結果、亜鉛イオン処理によって、本来は菌糸融合が阻害されているW779株とW97株において、菌糸融合を促進する行動する頻度(Approaching、Fusion)が増加し、菌糸融合を阻害する行動(Crossover)が抑制されることが示された。
特に、W779株とW97株の間では本来は全く起こらない(0%である)菌糸融合が、有意に誘導されることが示された(図9AのFusionの項目参照)。
また、これらの菌糸どうしが接近した場合、本来は細胞質不和合による細胞死が引き起こされるが、亜鉛イオン処理によって、当該細胞死が阻害又は遅延されていることが推測された。
【0079】
【表9】

【0080】
〔実施例9〕『紫紋羽病菌の菌糸融合促進作用』
‘担子菌類’である紫紋羽病菌でのウイルス移行現象が、‘子嚢菌類’である白紋羽病菌と同様の機構(メカニズム)によって行われるのかを検討するため、亜鉛イオン処理における菌糸融合の詳細を観察した。
表10に示す互いに細胞質不和合の関係にあるV18株とV670株について、前記1/10濃度オートミール培地に塩化亜鉛を0.5mM含有する培地において対峙培養を行った。前培養および対峙培養は、実施例1と同様にして行った。
なお、比較対照として、塩化亜鉛を含有しない前記1/10濃度オートミール培地と用いたことを除いては同様にして、これらの菌株の対峙培養を行った。
そして、互いの菌糸が接近した際に菌糸が示す行動について、実施例8で示した項目の観察頻度を計測した。結果を図10Aに示す。なお、観察された菌糸融合の顕微鏡写真像図を、図10Bに示す。
【0081】
その結果、塩化亜鉛処理によって、本来は菌糸融合が阻害されているV18株とV670株において、菌糸融合を促進する行動する頻度(Approaching、Fusion)が増加し、菌糸融合を阻害する行動(Parallel、Crossover)が抑制されることが示された。
特に、菌糸が接近する頻度が大幅に増加し、菌糸融合の頻度も有意に増加することが示された(図10AのApproaching、Fusionの項目参照)。
また、これらの菌糸どうしが接近した場合に起こる細胞質不和合による細胞死についても、阻害又は遅延されていることが推測された。
なお、これらの結果は、実施例8における白紋羽病菌の観察結果と同様の傾向を示すものであった。
【0082】
【表10】

【0083】
〔ウイルス移行機構の考察〕
菌類において、子嚢菌類(カビ、キノコの一部、出芽酵母等を含むグループ)と、担子菌類(キノコの大部分、酵母の一種を含むグループ)とは、それぞれが単系統を形成する分類群であるが、両者は共通の糸状菌型の祖先菌類から分岐して多様化したものと推測されている(図1 参照)。
【0084】
また、上記実施例1〜9から、‘子嚢菌類’である白紋羽病菌と‘担子菌類’である紫紋羽病菌の両方において、細胞質不和合の関係にある菌株どうしでの菌糸融合が、亜鉛イオン処理により誘導されることが確認された。また、菌糸融合の際に観察される挙動は、両者で共通の傾向を有することが確認された。
そして、当該菌糸融合を介して、菌類ウイルス移行を人為的に誘起できることが示された。
これらのことから、亜鉛イオン処理によるウイルス移行の誘導現象は、‘子嚢菌類’と‘担子菌類’に属する菌類種(二核菌亜界)において、広く適用可能な技術であることが示唆された。
【産業上の利用可能性】
【0085】
本発明により、農業および園芸の幅広い分野において、植物疾病に対する有効な生物防除方法を開発する手段となることが期待される。特に、紋羽病の生物防除に対して応用されることが期待される。
また本発明は、植物病原菌に限らずに、キノコやカビ等の糸状菌類に対する極めて有用な菌類寄生ウイルスの導入技術となること、が期待される。
【特許請求の範囲】
【請求項1】
下記(a)の糸状菌類に感染している導入対象の菌類寄生ウイルスを、下記(b)の糸状菌類に導入するにあたり、;下記(a)及び(b)の糸状菌類を、亜鉛イオン存在下で共培養することを特徴とする、;糸状菌類への菌類寄生ウイルス導入方法。
(a):導入対象の菌類寄生ウイルスが感染している二核菌亜界に属する糸状菌類。
(b):前記(a)の糸状菌類に属するが細胞質不和合の関係にあり、導入対象の菌類寄生ウイルスが感染していない二核菌亜界に属する糸状菌類。
【請求項2】
前記糸状菌類が、分子系統学的に子嚢菌類又は担子菌類に属するものである、請求項1に記載の糸状菌類への菌類寄生ウイルス導入方法。
【請求項3】
前記(b)の糸状菌類が、前記(a)の糸状菌類と同一菌種のものである、請求項1又は2に記載の糸状菌類への菌類寄生ウイルス導入方法。
【請求項4】
前記亜鉛イオンが、塩化亜鉛又は硫酸亜鉛に由来するものである、請求項1〜3のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法。
【請求項5】
前記共培養が、0.4〜2.5mMの亜鉛イオン存在下で行うものである、請求項1〜4のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法。
【請求項6】
前記糸状菌類が、植物病原菌であり、;前記寄生ウイルスが、前記植物病原菌によって引き起こされる植物に対する病原力を低下させるウイルスである、;請求項1〜5のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法。
【請求項7】
前記糸状菌類が、白紋羽病菌又は紫紋羽病菌である、請求項1〜6のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法。
【請求項1】
下記(a)の糸状菌類に感染している導入対象の菌類寄生ウイルスを、下記(b)の糸状菌類に導入するにあたり、;下記(a)及び(b)の糸状菌類を、亜鉛イオン存在下で共培養することを特徴とする、;糸状菌類への菌類寄生ウイルス導入方法。
(a):導入対象の菌類寄生ウイルスが感染している二核菌亜界に属する糸状菌類。
(b):前記(a)の糸状菌類に属するが細胞質不和合の関係にあり、導入対象の菌類寄生ウイルスが感染していない二核菌亜界に属する糸状菌類。
【請求項2】
前記糸状菌類が、分子系統学的に子嚢菌類又は担子菌類に属するものである、請求項1に記載の糸状菌類への菌類寄生ウイルス導入方法。
【請求項3】
前記(b)の糸状菌類が、前記(a)の糸状菌類と同一菌種のものである、請求項1又は2に記載の糸状菌類への菌類寄生ウイルス導入方法。
【請求項4】
前記亜鉛イオンが、塩化亜鉛又は硫酸亜鉛に由来するものである、請求項1〜3のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法。
【請求項5】
前記共培養が、0.4〜2.5mMの亜鉛イオン存在下で行うものである、請求項1〜4のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法。
【請求項6】
前記糸状菌類が、植物病原菌であり、;前記寄生ウイルスが、前記植物病原菌によって引き起こされる植物に対する病原力を低下させるウイルスである、;請求項1〜5のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法。
【請求項7】
前記糸状菌類が、白紋羽病菌又は紫紋羽病菌である、請求項1〜6のいずれかに記載の糸状菌類への菌類寄生ウイルス導入方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2012−110318(P2012−110318A)
【公開日】平成24年6月14日(2012.6.14)
【国際特許分類】
【出願番号】特願2011−181140(P2011−181140)
【出願日】平成23年8月23日(2011.8.23)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成23年度日本植物病理学会大会プログラム・講演要旨予稿集 平成23年3月11日発行 発行者 日本植物病理学会
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度、独立行政法人農業・食品産業技術総合研究機構 生物系特定産業技術研究支援センター、「イノベーション創出基礎的研究推進事業」委託事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(501203344)独立行政法人農業・食品産業技術総合研究機構 (827)
【Fターム(参考)】
【公開日】平成24年6月14日(2012.6.14)
【国際特許分類】
【出願日】平成23年8月23日(2011.8.23)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成23年度日本植物病理学会大会プログラム・講演要旨予稿集 平成23年3月11日発行 発行者 日本植物病理学会
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度、独立行政法人農業・食品産業技術総合研究機構 生物系特定産業技術研究支援センター、「イノベーション創出基礎的研究推進事業」委託事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(501203344)独立行政法人農業・食品産業技術総合研究機構 (827)
【Fターム(参考)】
[ Back to top ]

