細胞間接着剤
【課題】細胞間の接着力を高める剤を開発する。
【解決手段】リンゴ抽出物を有効成分とする細胞間接着剤。
【解決手段】リンゴ抽出物を有効成分とする細胞間接着剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞間の接着技術に関する。
【背景技術】
【0002】
本発明者は、アンチエイジングに関する研究開発を継続して行っている。老化の進んだ生体組織の細胞は細胞間の接着力が低下することが知られている。本発明者は、細胞間の接着力を高める剤の探究を行った。
特許文献1(特開2009−149548号公報)には、雪茶の抽出物を有効成分とするインテグリン産生促進剤が開示されている。特許文献2(特開平11−246428号公報)には、ヒバマタ、ローズマリー、キウイ、ブクリョウ、ゴボウ、ニンジン及びコウソウからなる群より選ばれる1以上の植物又はその抽出物を有効成分とするインテグリン産生促進剤が開示されている。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2009−149548号公報
【特許文献2】特開平11−246428号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明の目的は、細胞間の接着力を高める剤を開発することを目的とする。
【課題を解決するための手段】
【0005】
リンゴ抽出物に着目して、試験した結果細胞間接着能があることを知見して、本発明に至った。更に、研究を進めた結果、リンゴ抽出物には、インテグリンβ1及びインテグリンα2の産生を促進させることを知見した。
1.リンゴ抽出物を有効成分とする細胞間接着剤。
2.さらに、有効成分として、コラーゲンペプチド、マリアアザミ抽出物を含有することを特徴とする1.記載の細胞間接着剤。
3.細胞が老化したヒト皮膚線維芽細胞であることを特徴とする1.又は2.記載の細胞間接着剤。
4.リンゴ抽出物を有効成分とするインテグリン産生促進剤。
5.インテグリンがインテグリンα2及び/又はインテグリンβ1である4.記載の産生促進剤。
【発明の効果】
【0006】
本発明は、細胞間接着剤、インテグリンα2及び/又はインテグリンβ1産生促進剤を提供することができる。特に、リンゴ抽出物、コラーゲンペプチド及びマリアアザミ抽出物の3種類を含む組成物は、細胞間接着能が優れている。
【図面の簡単な説明】
【0007】
【図1】細胞間接着能試験結果を示すグラフ
【図2】真皮線維芽細胞のインテグリンα2の産生促進試験結果を示すグラフ
【図3】真皮線維芽細胞のインテグリンβ1の産生促進試験結果を示すグラフ
【図4】表皮細胞のインテグリンβ1の産生促進試験結果を示すグラフ
【図5】細胞間接着能試験結果を示すグラフ
【発明を実施するための形態】
【0008】
本発明は、リンゴ抽出物を有効成分とする細胞間接着剤、インテグリンα2及び/又はインテグリンβ1産生促進剤である。また、リンゴ抽出物、コラーゲンペプチド及びマリアアザミ抽出物の3種類を含む組成物は優れた細胞間接着剤である。
【0009】
本発明の細胞間接着剤は、皮膚細胞、特に皮膚線維芽細胞と細胞外マトリックスとの相互作用を活性化して結合力を増強させることができる。本発明のインテグリンα2及び/又はインテグリンβ1産生促進をはかることができ、皮膚のたるみや弾力を改善又は皮膚の免疫異常を改善することが期待できる。
【0010】
<リンゴ抽出物>
リンゴ抽出物には、ポリフェノール、有機酸、アミノ酸などを含むことが知られている。
リンゴ抽出物は、血管機能改善作用を高めることが可能なBNP調節剤として抽出物を有効成分として含有してなるBNP調節剤、血行促進剤(特開2007−008837号公報、特開2006−265220号公報)や飲料(特開2004−305087号公報)、化粧料配合剤(特開2001−187724号公報)、消臭剤成分(特開平11−319051号公報)、香料成分(特開平08−023939号公報)などに用いられることが知られている。
【0011】
リンゴ抽出物において、リンゴ(Malus pumila)の品種は、例えば、ふじ、国光、王林、紅玉、ジョナゴールド、デリシャス、さんさ、千秋などが挙げられ、特に制限されない。リンゴの抽出部位は、特に制限されず、例えば、果実、葉、幹、花などが挙げられ、好ましくは、果実である。前記果実は、例えば、未熟果(幼果)でも良く、完熟果でも良く、特に制限されない。リンゴ抽出物は、これらの部位を、単独で、または2種以上組み合わせて抽出しても良い。
【0012】
リンゴ抽出物を抽出する方法は、特に制限されず、従来公知の方法を採用できる。抽出方法の具体例としては、例えば、以下のようであっても良い。まず、リンゴの全果を、水洗後、グラインダーなどにより粉砕する。この粉砕物を、ペクチナーゼ処理に供し、遠心分離後、抽出溶媒により分配ろ過して、リンゴ抽出物を調製しても良い。前記ペクチナーゼ処理としては、特に制限されないが、例えば、20〜60℃の温度条件化で、ペクチナーゼを10〜50ppm添加して行っても良い。抽出溶媒としては、特に制限されないが、例えば、ヘキサン、クロロホルムなどの有機溶媒が挙げられる。
【0013】
本発明において、リンゴ抽出物は、例えば、市販のリンゴ抽出物を用いても良く、リンゴ果実から抽出して調製しても良く、特に制限されない。
本発明のコラーゲンゲル収縮剤中に含まれるリンゴ抽出物含量は、特に制限されないが、例えば、0.01〜99重量%、好ましくは、0.1〜50重量%である。
本発明のコラーゲンゲル収縮剤は、リンゴ由来のポリフェノールを含むリンゴ抽出物が好ましい。
【0014】
ポリフェノールの分画方法は、特に制限されず、従来公知の方法を採用できる。ポリフェノールは、例えば、リンゴ抽出物をカラムに通液後、カラムの吸着物を溶出し、この溶出画分を減圧留去濃縮して分画しても良い。また、さらに、この濃縮液に粉末助剤を添加し、凍結乾燥または噴霧乾燥して、ポリフェノール粉末を調製しても良い。
【0015】
本発明において、ポリフェノールは、例えば、市販のリンゴ由来のポリフェノール含有物を用いても良く、リンゴ果実から抽出および分画して調製しても良く、特に制限されない。本発明のコラーゲンゲル収縮剤中に含まれる前記ポリフェノール含量は、特に制限されないが、例えば、0.01〜99重量%、好ましくは、0.1〜50重量%である。
【0016】
<コラーゲンペプチド>
コラーゲンペプチドとしてコラーゲントリペプチドが適している。コラーゲントリペプチドは、平均分子量が400以下のものを含有するトリペプチドであり、通常一般のコラーゲンと称するものとは区別されるものである。さらに詳しくは、アミノ酸配列がGly−X−Y(X,Yはアミノ酸)であるペプタイドが好ましく、特に好ましくはアミノ酸配列がGly−Pro−Hypのものである。 本発明のコラーゲントリペプチドは、豚などの動物由来、魚由来いずれも使用可能である。
本発明のコラーゲントリペプチドは、主にコラーゲンを加水分解して製造することができる。コラーゲン加水分解物は、既に市販されているが、これらの酵素的に加水分解されたコラーゲンの多くは、分子量の分布範囲が二千から八万である。これらの加水分解物は水に対する分散性の向上を目的とするものである。
これに対して本発明のコラーゲン加水分解物は、特定の有効成分として分子量で約400以下のペプタイドを含むことを特徴とする。
添加量は、0.01%以上が好ましい。本試験系の試験ではコラーゲンゲルの収縮は80%程度が上限と想定されるので、コラーゲンゲルの収縮が70%程度以上は、添加濃度を増やしても増加効果は小さい。したがって、マイナスとなることは無いと言う意味では、上限は無いが、実質的には1.0%程度が上限となる。
【0017】
<マリアアザミ抽出物>
マリアアザミ抽出物は、キク科マリアアザミ(学名シリバム・マリアナムSilybum marianum Gaertn、別名オオアザミ、オオヒレアザミ、ミルクアザミ;CAS No.84604−20−6)から抽出される。マリアアザミ抽出物に含まれる主要成分にシリマリンがある。
シリマリン(Silymarin;CAS No.65666−07−1)は、マリアアザミ抽出物に含まれるフラボノリグナンの総称であり、分子式C25H22O10で表される、シリビン(Silybin;CAS No.22888−70−6)、シリジアニン(Silydianin;CAS No.29782−68−1)、シリクリスチン(Silychristin;CAS No.33889−69−9)、イソシリビン(Isosilybin;CAS No.72581−71−6)などを含有している組成物である(天然薬物事典、奥田拓男編、廣川書店、昭和61年3月3日 発行)。
またシリマリンは前記の通りフラボノリグナンの混合物であり、シリマリンとしての植物抽出物や植物中の含有量は、分光光度計による測定に基づいた方法(Wagner,H.,et al.,Arznein.Forsch,18,696,1968.)、薄層クロマトグラフィーによる方法(Wagner,H.,et al.,Arznein.Forsch,24,466,1974.)、高速液体クロマトグラフィーによる方法(Tittel,G.,et al.,J.Chromatogr.,135,499,1977.、Tittel,G.,et al.,J.Chromatogr.,153,227,1978.、Quercia,V.,et al.,Chromatography in Biochemistry,Medicine and Enviromental Research,Frigerio A.(Ed).,Elsevier Scientific Publishing Company,Amsterdam,1983,p1.)により測定可能である。これらの測定法の中でも、分光光度計による測定に基づいた方法の一つである2,4−ジニトロヒドラジン分析は、ドイツ薬局方(Silybum marianumの果実に関するモノグラフ)に報告されており、広く用いられている。また、シリマリン又はその構成成分であるシリビン、シリジアニン、シリクリスチン、イソシリビンをリン脂質複合体として配合することができる。リン脂質複合体はINDENA社が市販しているSILYMARIN PHYTOSOME(シリマリンのリン脂質複合体)、SILIPHOS(シリビンのリン脂質複合体)を使用することができる。
例えば、INDENA社製シリマリンは、ドイツ薬局方DABに収載された吸光度比法でシリビン換算で測定したシリビン、イソシリビン、シリクリスチン、シリジアニン含量が約65%以上、そのうちHPLC法で測定したシリビンとイソシリビンの合計は約30%以上である。
本発明に配合するマリアアザミ抽出物に含まれるシリマリン又はその構成成分であるシリビン、イソシリビン、シリジアニン、シリクリスチンの濃度は0.01重量%以上が好ましく、0.1重量%以上がさらに好ましい。0.01重量%未満では、I型コラーゲン産生促進作用、エラスチン産生促進作用が十分に発揮されない。濃度は高いほど好ましいが、2.0重量%以上では完全に溶解しにくい傾向がある。
【0018】
本発明の細胞間接着剤は、皮膚細胞、特に皮膚線維芽細胞と細胞外マトリックスとの相互作用を活性化して結合力を増強させることができる。本発明は、インテグリンα2及び/又はインテグリンβ1産生促進をはかることができ、皮膚のたるみや弾力を改善することが期待できる。
【0019】
線維芽細胞の由来組織は、特に制限されず、例えば、皮膚、肺、心臓などが挙げられ、好ましくは、皮膚である。線維芽細胞の由来種は、特に制限されず、例えば、ヒト、ブタ、ウシ、ウサギ、ラット、マウスなどがあげられ、好ましくは、ヒトである。
【0020】
剤型は任意であり、皮膚外用剤としては、例えば液剤、懸濁剤、乳剤、クリーム剤、軟膏剤、ゲル剤、リニメント剤、ローション剤又はパップ剤、ドリンク剤等の医薬又は医薬部外品が好ましく挙げられる。さらに、医薬品類、医薬部外品類、それらの飲用品、化粧品類に配合して用いることができる。特に、外皮に適用される医薬品,医薬部外品,化粧品組成物といった外用剤組成物に適用される。
具体的な使用形態としては、水性成分、油性成分、植物抽出物、動物抽出物、粉末、賦形剤、界面活性剤、油剤、アルコール、pH調整剤、防腐剤、酸化防止剤、増粘剤、甘味剤、色素、香料等を必要に応じて混合して適宜配合することにより外用剤組成物の化粧水、乳液、クリーム、パック、パウダー、スプレー、軟膏、分散液、洗浄料、および液体状、ペースト状、カプセル状、粉末状、錠剤等種々の剤型とすることが可能である。
【実施例1】
【0021】
[細胞間接着能試験]
りんご抽出物をin vitroで細胞に適用して細胞間接着能試験を行った。
材料
コラーゲンTypeIコーティング24ウェルプレート(IWAKI製)
りんご抽出物:ポマクティブHFV(ヴァルデヴィル社)
【0022】
1.試験方法
新生児由来ヒト皮膚線維芽細胞を5%FBS含有DMEM培地で継代培養し、播種後に細胞増殖を抑制したPDL(集団倍加数)が60に達した細胞をトリプシン処理で回収し、細胞懸濁液を調整した。
コラーゲンTypeIコーティング24ウェルプレートに5000cells/1wellの細胞密度で線維芽細胞を播種し、りんご抽出物であるポマクティブHFVを100、50、30、10μg/mlの濃度で添加した。
培養液はフェノールレッドフリーのDMEM培地(Sigma製)を用いた。
各群はn=4で評価した。
72時間5%CO2インキュベーター37℃で培養した。
(観察)この培養中、接着能の衰えた線維芽細胞はウェルプレートに接着せずに浮遊していた。
【0023】
培養終了後に培養液を吸引し、2.5%(v/v:希釈液はPBS(−))グルタルアルデヒドで室温10分間反応させて、ウェルプレートに接着した線維芽細胞の固定処理を行った。
固定終了後、グルタルアルデヒド溶液を吸引除去し、水道水をウェルプレートに流水させてプレート洗浄し、50℃10分間の乾燥処理を行った。
0.5%(w/v;溶媒は20%(v/v)メタノール水溶液)Crystal Violetで室温10分間染色反応した。反応後、Crystal Violet溶液を吸引除去し、水道水をウェルプレートに流水させてプレート洗浄し、50℃10分間の乾燥処理を行った。
(観察)この乾燥させた状態でCrystal Violetに染色した線維芽細胞を観察したところ、コントロール群の線維芽細胞はプレートの一部についてのみ接着していたが、ポマクティブHFV添加群はいずれもコントロール群より著しく接着した細胞が多かった。
【0024】
乾燥が終了したプレートに対し、100mMクエン酸(pH7.5、溶媒:50%メタノール水溶液)を室温30分間反応させてCrystal Violetの色素を抽出した。
色素溶液をそれぞれ回収し、96ウェルプレートにそれぞれ分注し、吸光度590nmについてマルチプレートリーダー(モレキュラーデバイス製)を用いて測定した。
得られた吸光度について、コントロール処理群を基準(1.00)として、ポマクティブHFVの各濃度添加群について比率を求め、多重比較検定試験としてDunnett test(**:p<0.01、*:p<0.05)を実施した。
【0025】
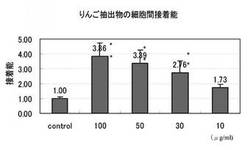
2.結果を表1及び図1に示す。
試験結果から、コントロール群における細胞接着率に対し、ポマクティブHFVを100、50、30μg/mlで濃度依存的に細胞のI型コラーゲンへの接着能が増した。
また、接着時の細胞を観察すると、100、50、30μg/mlりんごポリフェノール添加時に線維芽細胞の数割の形状が星型に変形していた。10μg/ml添加ではコントロール群とほぼ同じ細胞の形状であった。
【0026】
【表1】

【実施例2】
【0027】
[インテグリンα2鎖産生促進試験]
りんご抽出物を摂取及び皮膚に紫外線を照射しつつ飼育したヘアレスマウスを解剖してインテグリンα2鎖の産生促進状態を分析した。
材料
UVA波およびUVB波を照射したヘアレスマウス
りんご抽出物:ポマクティブHFV(ヴァルデヴィル社)
【0028】
1.ヘアレスマウスに対する紫外線照射及び飼育UVA波およびUVB波をヘアレスマウスに照射させてシワを形成させる試験系において被験物質であるそれぞれの食品原料を経口摂取させてシワの抑制および皮膚老化抑制効果について検討を行った。
導入時6週齢のヘアレスマウス(Hos:HR−1雌)を用いて以下の1)〜4)の条件・方法で試験を行った。
1)試験対象物の調製および投与
ヘアレスマウスの群分けは投与開始日に、一般状態が良好な動物を体重により、群間での差が無いように1群6匹に振り分けた。なお、各々の個体は1ゲージ/群で飼育とした。
マウス用飼料MF(オリエンタルバイオサービス製)に、それぞれ被験物質が均一に混ざるように混合処理を施し、混餌にて自由摂取させた。混餌は動物搬入直後から解剖18時間前まで実施した。投与群の一覧を表2に示す。
2)UV照射(表1;試験概要)
UV照射時は、動物を専用のケージに移し、1群ずつUVB20mJ/cm2およびUVA10J/cm2を照射した。照射は週三回の月曜、水曜、金曜で10週間実施した。
【0029】
【表2】

【0030】
3)試料の採取
各群、本飼育期間終了翌日より18時間絶食後、氷冷したAvertin(2,2,2−トリブロモエタノール)を0.5mg/kg体重腹腔内投与により麻酔を導入した。その後、皮膚背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位範囲で反射型レプリカ((有)アサヒバイオメッド製)を採取した。その後、開腹し解剖を行った。皮膚組織は10%中性ホルマリン浸潤、パラフィン包埋処理し、組織染色実験時に5μmの厚さでスライドガラスに貼付した。
【0031】
4)マウス皮膚組織中(真皮線維芽細胞)のインテグリンα2測定
インテグリンα2は免疫組織化学的手法を用いて測定した。
動物の解剖時に皮膚組織背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位の皮膚1cm2を切り取り、10%中性ホルマリン固定処理を室温18時間行い、及びパラフィン包埋して皮膚組織を保存した。5μm厚の切片を適宜作製し、脱パラフィン処理、親水化は公知の方法に基づいて実施した。
抗原賦活化は10mMクエン酸緩衝液(pH=6.0)中でマイクロウェーブ処理5分間の沸騰を実施した。室温まで冷却後、常温下0.3%過酸化水素含有メタノールで30分反応させて内因性ペルオキシダーゼを阻害した。水洗、10mMPBS(−)洗浄後、ヤギ血清50倍10mMPBS(−)希釈溶液の室温1時間反応でブロッキング反応、血清を落として1次抗体(Anti-mouse integrin α2(LSB製))を5μg/mlで4℃一晩反応させた。10mMPBS(−)で2回洗浄し、ビオチン化二次抗体(ビオチン化ヤギ免疫グロブリンM;DAKO製)を300倍希釈したものを30分間室温で抗体を反応させた。10mMPBS(−)で2回洗浄し、ABC試薬(ABC-HRP;Vectastain製)を30分間室温で反応させた。
発色試薬としてDAB(3,3-ジアミノベンジジンテトラヒドロクロライド:DAKO製)を用いて5分常温下で反応させた。水洗後、公知の方法に基づいて脱水、封入処理を行った。
顕微鏡下で皮膚組織の染色状況を観察し、MPコントローラーを用いて画像を取り込み、画像中の真皮乳頭層部分の100μm×100μmの範囲の染色箇所をImageJにて数値化した。
【0032】
2.結果を表3及び図2に示す。
コントロール食UV+群を基準として比率を求め、多重比較検定試験としてSteel Test(vs試験群2、**:p<0.01、*:p<0.05)を実施した。測定結果を表3及び図2に示す。
【0033】
【表3】

【0034】
UV照射の有無に着目すると、単純照射した試験群2を基準(産生量を1)とすると、非照射の試験群1では試験群2に対して2.81倍産生量が高かった。
これに対して、りんご抽出物(ポマクティブHFV)を混餌した試験群では、3.23〜3.92倍を示している。やや濃度依存的にインテグリンα2の産生が増加していることを示している。統計的に見ると、有意差は認められない結果であるので、インテグリンα2の量が増加していることは、りんご抽出物(ポマクティブHFV)が低濃度摂取であっても、限界的な作用効果を示すものと判断できる。そして、その産生促進作用は、UV非照射よりも強く表れるので、単にUV照射に対する補償作用以上に強いインテグリンα2の産生促進効果がりんご抽出物(ポマクティブHFV)には存在することが確認できる。
【実施例3】
【0035】
[インテグリンβ1鎖産生促進試験(真皮線維芽細胞)]
実施例2において試験に供したヘアレスマウスを解剖して得られた試料を分析してインテグリンβ1の産生状態を分析した。
【0036】
マウス皮膚組織中(真皮線維芽細胞)のインテグリンβ1産生促進
インテグリンβ1は免疫組織化学的手法を用いて測定した。
動物の解剖時に皮膚組織背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位の皮膚1cm2を切り取り、10%中性ホルマリン固定処理を室温18時間行い、及びパラフィン包埋して皮膚組織を保存した。
5μm厚の切片を適宜作製し、脱パラフィン処理、親水化は公知の方法に基づいて実施した。
抗原賦活化は10mMクエン酸緩衝液(pH=6.0)中でマイクロウェーブ処理5分間の沸騰を実施した。室温まで冷却後、常温下0.3%過酸化水素含有メタノールで30分反応させて内因性ペルオキシダーゼを阻害した。水洗、10mMPBS(−)洗浄後、ウサギ血清50倍10mMPBS(−)希釈溶液の室温1時間反応でブロッキング反応、血清を落として1次抗体(Anti-mouse Integrin β1 CD29 Antibody:R&D systems製)を5μg/mlで4℃一晩反応させた。
10mMPBS(−)で2回洗浄し、ビオチン化二次抗体(ビオチン化ウサギ免疫グロブリンM;DAKO製)を300倍希釈したものを30分間室温で抗体を反応させた。10mMPBS(−)で2回洗浄し、ABC試薬(ABC-HRP;Vectastain製)を30分間室温で反応させた。
発色試薬としてDAB(3,3-ジアミノベンジジンテトラヒドロクロライド:DAKO製)を用いて3分常温下で反応させた。水洗後、公知の方法に基づいて脱水、封入処理を行った。
顕微鏡下で皮膚組織の染色状況を観察し、MPコントローラーを用いて画像を取り込み、画像中の真皮乳頭層部分の100μm×100μmの範囲の染色箇所をImageJにて数値化した。
【0037】
結果を表4及び図3に示す。
コントロール食UV+群を基準として比率を求め、多重比較検定試験としてSteel Test(vs試験群2、**:p<0.01、*:p<0.05)を実施した。測定結果を表4及び図3に示す。
【0038】
【表4】

【0039】
UV照射の有無に着目すると、単純照射した試験群2を基準(産生量を1)とすると、非照射の試験群1では試験群2に対して2.50倍産生量が高かった。
これに対して、りんご抽出物(ポマクティブHFV)を混餌した試験群では、3.51〜5.48倍を示している。やや濃度依存的にインテグリンβ1の産生が増加していることを示している。統計的に見ると、有意差は認められない結果であるので、インテグリンβ1の量が増加していることは、りんご抽出物(ポマクティブHFV)が低濃度摂取であっても、限界的な作用効果を示すものと判断できる。そして、その産生促進作用は、UV非照射よりも強く表れるので、単にUV照射に対する補償作用以上に強いインテグリンβ1の産生促進効果がりんご抽出物(ポマクティブHFV)には存在することが確認できる。
【実施例4】
【0040】
[インテグリンβ1鎖産生促進試験(表皮細胞)]
実施例2において試験に供したヘアレスマウスを解剖して得られた試料を分析してインテグリンβ1の産生状態を分析した。
【0041】
マウス皮膚組織中(表皮細胞)のインテグリンβ1量
インテグリンβ1は免疫組織化学的手法を用いて測定した。
動物の解剖時に皮膚組織背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位の皮膚1cm2を切り取り、10%中性ホルマリン固定処理を室温18時間行い、及びパラフィン包埋して皮膚組織を保存した。
5μm厚の切片を適宜作製し、脱パラフィン処理、親水化は公知の方法に基づいて実施した。
抗原賦活化は10mMクエン酸緩衝液(pH=6.0)中でマイクロウェーブ処理5分間の沸騰を実施した。室温まで冷却後、常温下0.3%過酸化水素含有メタノールで30分反応させて内因性ペルオキシダーゼを阻害した。水洗、10mMPBS(−)洗浄後、ウサギ血清50倍10mMPBS(−)希釈溶液の室温1時間反応でブロッキング反応、血清を落として1次抗体(Anti-mouse Integrin β1 CD29 Antibody:R&D systems製)を5μg/mlで4℃一晩反応させた。
10mMPBS(−)で2回洗浄し、ビオチン化二次抗体(ビオチン化ウサギ免疫グロブリンM;DAKO製)を300倍希釈したものを30分間室温で抗体を反応させた。10mMPBS(−)で2回洗浄し、ABC試薬(ABC-HRP;Vectastain製)を30分間室温で反応させた。
発色試薬としてDAB(3,3-ジアミノベンジジンテトラヒドロクロライド:DAKO製)を用いて3分常温下で反応させた。水洗後、公知の方法に基づいて脱水、封入処理を行った。
顕微鏡下で皮膚組織の染色状況を観察し、MPコントローラーを用いて画像を取り込み、画像中の免疫組織染色したマウス皮膚組織の表皮基底細胞の1細胞および周縁15μm四方の染色箇所をImageJにて数値化した。
結果を表5及び図4に示す。
【0042】
【表5】

【0043】
UV照射の有無に着目すると、単純照射した試験群2を基準(産生量を1)とすると、非照射の試験群1では試験群2に対して1.10倍と僅かな差であり、両者に有意な差は認められなかった。
これに対して、りんご抽出物(ポマクティブHFV)を混餌した試験群では、1.40倍から2.20倍を示している。試験群3および試験群4においてそれぞれ、試験群2に対する統計的有意差が得られた。よって、りんご抽出物により表皮細胞においてもインテグリンβ1の産生促進効果が確認できる。
【実施例5】
【0044】
[材料]
・コラーゲンTypeIコーティング24ウェルプレート(IWAKI製)
・ダルベッコ改変イーグル培地(低グルコース)(Sigma製)
・ダルベッコ改変イーグル培地(高グルコース)(DMEM(液体)(商品名;Gib co))
【0045】
[ 評価検体 ]
(a)リンゴ抽出物:ポマクティブHFV(ユニテックフーズ製)⇒規格;全ポリフェ ノール量90%以上(UV法)
(b)コラーゲンペプチド:HACP-01(HTCコラーゲン、ゼライス製)⇒規格;トリ ペプチド15%以上
(c)マリアアザミ抽出物:シリマリンET/G(Indena S.p.A.製)⇒ 規格;シリビン・イソシリビン合計30%以上(HPLC法)、シリマリン含量 65%以上(DAB10[ドイツ薬物規格第10項]による)
【0046】
[ 試験方法および結果 ]
コラーゲンTypeIコーティングプレートへの線維芽細胞接着能
(1)新生児由来ヒト皮膚線維芽細胞を5%FBS含有DMEM培地(高グルコース)で継代培 養し、播種後に細胞増殖が抑制したPDL(集団倍加数)が60に達した細胞をト リプシン処理で回収し、細胞懸濁液を調整した。
(2)コラーゲンTypeIコーティング24ウェルプレートに5000cells/1wellの 細胞密度で線維芽細胞を播種し、次の試験群を設定した。
(試験群1):コントロール
(試験群2):りんご抽出物を10μg/ml
(試験群3)コラーゲンペプチド30μg/ml
(試験群4)マリアアザミ抽出物10μg/ml
(試験群5):リンゴ抽出物とコラーゲンペプチドの2者併用群
(試験群6)リンゴ抽出物とコラーゲンペプチドおよびシリマリン抽出物の3者併用群
【0047】
(3)培養液はフェノールレッドフリー、血清フリーのDMEM培地(低グルコース)を 用いた。各群はn=4で評価した。2時間5%CO2インキュベーター37℃で培 養した。
(4)この培養中、接着能の衰えた線維芽細胞はウェルプレートに接着せずに浮遊してい た。
(5)培養終了後に培養液を吸引し、2.5%(v/v:希釈液はPBS(−))グルタ ルアルデヒドで室温10分間反応させて、ウェルプレートに接着した線維芽細胞の 固定処理を行った。固定終了後、グルタルアルデヒド溶液を吸引除去し、水道水を ウェルプレートに流水させてプレート洗浄し、50℃10分間の乾燥処理を行っ た。
(6)0.5%(w/v;溶媒は20%(v/v)メタノール水溶液)Crystal Violetで室温10分間染色反応した。反応後、Crystal Viole t溶液を吸引除去し、水道水をウェルプレートに流水させてプレート洗浄し、 50℃10分間の乾燥処理を行った。
(7)乾燥が終了したウェルプレートに対し、100mMクエン酸(溶媒:50%メタ ノール水溶液)を室温30分間反応させてCrystal Violetの色素を 抽出した。色素溶液をそれぞれ回収し、96ウェルプレートにそれぞれ分注し、吸 光度590nmについてマルチプレートリーダー(モレキュラーデバイス製)を用 いて測定した。
(8)得られた吸光度について、コントロール処理群を基準(1.00)として、各サン プル添加群について比率を求めた。比率が1よりも大きくなるほど細胞とI型コ ラーゲンとの接着能が増す事を示している。
結果を表6、図5に示す。
【0048】
【表6】

【0049】
試験結果から、コントロール群である試験群1(100%の基準とする)に対して、試験群2で147%、試験群3で103%、試験群4では169%細胞接着が亢進している。
試験群5の2者併用は194%と、試験群2と試験群3の細胞接着率の総和よりも著しく細胞接着が亢進している。
さらに、試験群6の3者併用は302%となり、試験群2、試験群3および試験群4の総和よりも著しく細胞接着が亢進した。
したがって、3者併用の細胞接着能は、それぞれの単独及び2者併用に比べて、予想外に著しく亢進していることが分かる。
【技術分野】
【0001】
本発明は、細胞間の接着技術に関する。
【背景技術】
【0002】
本発明者は、アンチエイジングに関する研究開発を継続して行っている。老化の進んだ生体組織の細胞は細胞間の接着力が低下することが知られている。本発明者は、細胞間の接着力を高める剤の探究を行った。
特許文献1(特開2009−149548号公報)には、雪茶の抽出物を有効成分とするインテグリン産生促進剤が開示されている。特許文献2(特開平11−246428号公報)には、ヒバマタ、ローズマリー、キウイ、ブクリョウ、ゴボウ、ニンジン及びコウソウからなる群より選ばれる1以上の植物又はその抽出物を有効成分とするインテグリン産生促進剤が開示されている。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2009−149548号公報
【特許文献2】特開平11−246428号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明の目的は、細胞間の接着力を高める剤を開発することを目的とする。
【課題を解決するための手段】
【0005】
リンゴ抽出物に着目して、試験した結果細胞間接着能があることを知見して、本発明に至った。更に、研究を進めた結果、リンゴ抽出物には、インテグリンβ1及びインテグリンα2の産生を促進させることを知見した。
1.リンゴ抽出物を有効成分とする細胞間接着剤。
2.さらに、有効成分として、コラーゲンペプチド、マリアアザミ抽出物を含有することを特徴とする1.記載の細胞間接着剤。
3.細胞が老化したヒト皮膚線維芽細胞であることを特徴とする1.又は2.記載の細胞間接着剤。
4.リンゴ抽出物を有効成分とするインテグリン産生促進剤。
5.インテグリンがインテグリンα2及び/又はインテグリンβ1である4.記載の産生促進剤。
【発明の効果】
【0006】
本発明は、細胞間接着剤、インテグリンα2及び/又はインテグリンβ1産生促進剤を提供することができる。特に、リンゴ抽出物、コラーゲンペプチド及びマリアアザミ抽出物の3種類を含む組成物は、細胞間接着能が優れている。
【図面の簡単な説明】
【0007】
【図1】細胞間接着能試験結果を示すグラフ
【図2】真皮線維芽細胞のインテグリンα2の産生促進試験結果を示すグラフ
【図3】真皮線維芽細胞のインテグリンβ1の産生促進試験結果を示すグラフ
【図4】表皮細胞のインテグリンβ1の産生促進試験結果を示すグラフ
【図5】細胞間接着能試験結果を示すグラフ
【発明を実施するための形態】
【0008】
本発明は、リンゴ抽出物を有効成分とする細胞間接着剤、インテグリンα2及び/又はインテグリンβ1産生促進剤である。また、リンゴ抽出物、コラーゲンペプチド及びマリアアザミ抽出物の3種類を含む組成物は優れた細胞間接着剤である。
【0009】
本発明の細胞間接着剤は、皮膚細胞、特に皮膚線維芽細胞と細胞外マトリックスとの相互作用を活性化して結合力を増強させることができる。本発明のインテグリンα2及び/又はインテグリンβ1産生促進をはかることができ、皮膚のたるみや弾力を改善又は皮膚の免疫異常を改善することが期待できる。
【0010】
<リンゴ抽出物>
リンゴ抽出物には、ポリフェノール、有機酸、アミノ酸などを含むことが知られている。
リンゴ抽出物は、血管機能改善作用を高めることが可能なBNP調節剤として抽出物を有効成分として含有してなるBNP調節剤、血行促進剤(特開2007−008837号公報、特開2006−265220号公報)や飲料(特開2004−305087号公報)、化粧料配合剤(特開2001−187724号公報)、消臭剤成分(特開平11−319051号公報)、香料成分(特開平08−023939号公報)などに用いられることが知られている。
【0011】
リンゴ抽出物において、リンゴ(Malus pumila)の品種は、例えば、ふじ、国光、王林、紅玉、ジョナゴールド、デリシャス、さんさ、千秋などが挙げられ、特に制限されない。リンゴの抽出部位は、特に制限されず、例えば、果実、葉、幹、花などが挙げられ、好ましくは、果実である。前記果実は、例えば、未熟果(幼果)でも良く、完熟果でも良く、特に制限されない。リンゴ抽出物は、これらの部位を、単独で、または2種以上組み合わせて抽出しても良い。
【0012】
リンゴ抽出物を抽出する方法は、特に制限されず、従来公知の方法を採用できる。抽出方法の具体例としては、例えば、以下のようであっても良い。まず、リンゴの全果を、水洗後、グラインダーなどにより粉砕する。この粉砕物を、ペクチナーゼ処理に供し、遠心分離後、抽出溶媒により分配ろ過して、リンゴ抽出物を調製しても良い。前記ペクチナーゼ処理としては、特に制限されないが、例えば、20〜60℃の温度条件化で、ペクチナーゼを10〜50ppm添加して行っても良い。抽出溶媒としては、特に制限されないが、例えば、ヘキサン、クロロホルムなどの有機溶媒が挙げられる。
【0013】
本発明において、リンゴ抽出物は、例えば、市販のリンゴ抽出物を用いても良く、リンゴ果実から抽出して調製しても良く、特に制限されない。
本発明のコラーゲンゲル収縮剤中に含まれるリンゴ抽出物含量は、特に制限されないが、例えば、0.01〜99重量%、好ましくは、0.1〜50重量%である。
本発明のコラーゲンゲル収縮剤は、リンゴ由来のポリフェノールを含むリンゴ抽出物が好ましい。
【0014】
ポリフェノールの分画方法は、特に制限されず、従来公知の方法を採用できる。ポリフェノールは、例えば、リンゴ抽出物をカラムに通液後、カラムの吸着物を溶出し、この溶出画分を減圧留去濃縮して分画しても良い。また、さらに、この濃縮液に粉末助剤を添加し、凍結乾燥または噴霧乾燥して、ポリフェノール粉末を調製しても良い。
【0015】
本発明において、ポリフェノールは、例えば、市販のリンゴ由来のポリフェノール含有物を用いても良く、リンゴ果実から抽出および分画して調製しても良く、特に制限されない。本発明のコラーゲンゲル収縮剤中に含まれる前記ポリフェノール含量は、特に制限されないが、例えば、0.01〜99重量%、好ましくは、0.1〜50重量%である。
【0016】
<コラーゲンペプチド>
コラーゲンペプチドとしてコラーゲントリペプチドが適している。コラーゲントリペプチドは、平均分子量が400以下のものを含有するトリペプチドであり、通常一般のコラーゲンと称するものとは区別されるものである。さらに詳しくは、アミノ酸配列がGly−X−Y(X,Yはアミノ酸)であるペプタイドが好ましく、特に好ましくはアミノ酸配列がGly−Pro−Hypのものである。 本発明のコラーゲントリペプチドは、豚などの動物由来、魚由来いずれも使用可能である。
本発明のコラーゲントリペプチドは、主にコラーゲンを加水分解して製造することができる。コラーゲン加水分解物は、既に市販されているが、これらの酵素的に加水分解されたコラーゲンの多くは、分子量の分布範囲が二千から八万である。これらの加水分解物は水に対する分散性の向上を目的とするものである。
これに対して本発明のコラーゲン加水分解物は、特定の有効成分として分子量で約400以下のペプタイドを含むことを特徴とする。
添加量は、0.01%以上が好ましい。本試験系の試験ではコラーゲンゲルの収縮は80%程度が上限と想定されるので、コラーゲンゲルの収縮が70%程度以上は、添加濃度を増やしても増加効果は小さい。したがって、マイナスとなることは無いと言う意味では、上限は無いが、実質的には1.0%程度が上限となる。
【0017】
<マリアアザミ抽出物>
マリアアザミ抽出物は、キク科マリアアザミ(学名シリバム・マリアナムSilybum marianum Gaertn、別名オオアザミ、オオヒレアザミ、ミルクアザミ;CAS No.84604−20−6)から抽出される。マリアアザミ抽出物に含まれる主要成分にシリマリンがある。
シリマリン(Silymarin;CAS No.65666−07−1)は、マリアアザミ抽出物に含まれるフラボノリグナンの総称であり、分子式C25H22O10で表される、シリビン(Silybin;CAS No.22888−70−6)、シリジアニン(Silydianin;CAS No.29782−68−1)、シリクリスチン(Silychristin;CAS No.33889−69−9)、イソシリビン(Isosilybin;CAS No.72581−71−6)などを含有している組成物である(天然薬物事典、奥田拓男編、廣川書店、昭和61年3月3日 発行)。
またシリマリンは前記の通りフラボノリグナンの混合物であり、シリマリンとしての植物抽出物や植物中の含有量は、分光光度計による測定に基づいた方法(Wagner,H.,et al.,Arznein.Forsch,18,696,1968.)、薄層クロマトグラフィーによる方法(Wagner,H.,et al.,Arznein.Forsch,24,466,1974.)、高速液体クロマトグラフィーによる方法(Tittel,G.,et al.,J.Chromatogr.,135,499,1977.、Tittel,G.,et al.,J.Chromatogr.,153,227,1978.、Quercia,V.,et al.,Chromatography in Biochemistry,Medicine and Enviromental Research,Frigerio A.(Ed).,Elsevier Scientific Publishing Company,Amsterdam,1983,p1.)により測定可能である。これらの測定法の中でも、分光光度計による測定に基づいた方法の一つである2,4−ジニトロヒドラジン分析は、ドイツ薬局方(Silybum marianumの果実に関するモノグラフ)に報告されており、広く用いられている。また、シリマリン又はその構成成分であるシリビン、シリジアニン、シリクリスチン、イソシリビンをリン脂質複合体として配合することができる。リン脂質複合体はINDENA社が市販しているSILYMARIN PHYTOSOME(シリマリンのリン脂質複合体)、SILIPHOS(シリビンのリン脂質複合体)を使用することができる。
例えば、INDENA社製シリマリンは、ドイツ薬局方DABに収載された吸光度比法でシリビン換算で測定したシリビン、イソシリビン、シリクリスチン、シリジアニン含量が約65%以上、そのうちHPLC法で測定したシリビンとイソシリビンの合計は約30%以上である。
本発明に配合するマリアアザミ抽出物に含まれるシリマリン又はその構成成分であるシリビン、イソシリビン、シリジアニン、シリクリスチンの濃度は0.01重量%以上が好ましく、0.1重量%以上がさらに好ましい。0.01重量%未満では、I型コラーゲン産生促進作用、エラスチン産生促進作用が十分に発揮されない。濃度は高いほど好ましいが、2.0重量%以上では完全に溶解しにくい傾向がある。
【0018】
本発明の細胞間接着剤は、皮膚細胞、特に皮膚線維芽細胞と細胞外マトリックスとの相互作用を活性化して結合力を増強させることができる。本発明は、インテグリンα2及び/又はインテグリンβ1産生促進をはかることができ、皮膚のたるみや弾力を改善することが期待できる。
【0019】
線維芽細胞の由来組織は、特に制限されず、例えば、皮膚、肺、心臓などが挙げられ、好ましくは、皮膚である。線維芽細胞の由来種は、特に制限されず、例えば、ヒト、ブタ、ウシ、ウサギ、ラット、マウスなどがあげられ、好ましくは、ヒトである。
【0020】
剤型は任意であり、皮膚外用剤としては、例えば液剤、懸濁剤、乳剤、クリーム剤、軟膏剤、ゲル剤、リニメント剤、ローション剤又はパップ剤、ドリンク剤等の医薬又は医薬部外品が好ましく挙げられる。さらに、医薬品類、医薬部外品類、それらの飲用品、化粧品類に配合して用いることができる。特に、外皮に適用される医薬品,医薬部外品,化粧品組成物といった外用剤組成物に適用される。
具体的な使用形態としては、水性成分、油性成分、植物抽出物、動物抽出物、粉末、賦形剤、界面活性剤、油剤、アルコール、pH調整剤、防腐剤、酸化防止剤、増粘剤、甘味剤、色素、香料等を必要に応じて混合して適宜配合することにより外用剤組成物の化粧水、乳液、クリーム、パック、パウダー、スプレー、軟膏、分散液、洗浄料、および液体状、ペースト状、カプセル状、粉末状、錠剤等種々の剤型とすることが可能である。
【実施例1】
【0021】
[細胞間接着能試験]
りんご抽出物をin vitroで細胞に適用して細胞間接着能試験を行った。
材料
コラーゲンTypeIコーティング24ウェルプレート(IWAKI製)
りんご抽出物:ポマクティブHFV(ヴァルデヴィル社)
【0022】
1.試験方法
新生児由来ヒト皮膚線維芽細胞を5%FBS含有DMEM培地で継代培養し、播種後に細胞増殖を抑制したPDL(集団倍加数)が60に達した細胞をトリプシン処理で回収し、細胞懸濁液を調整した。
コラーゲンTypeIコーティング24ウェルプレートに5000cells/1wellの細胞密度で線維芽細胞を播種し、りんご抽出物であるポマクティブHFVを100、50、30、10μg/mlの濃度で添加した。
培養液はフェノールレッドフリーのDMEM培地(Sigma製)を用いた。
各群はn=4で評価した。
72時間5%CO2インキュベーター37℃で培養した。
(観察)この培養中、接着能の衰えた線維芽細胞はウェルプレートに接着せずに浮遊していた。
【0023】
培養終了後に培養液を吸引し、2.5%(v/v:希釈液はPBS(−))グルタルアルデヒドで室温10分間反応させて、ウェルプレートに接着した線維芽細胞の固定処理を行った。
固定終了後、グルタルアルデヒド溶液を吸引除去し、水道水をウェルプレートに流水させてプレート洗浄し、50℃10分間の乾燥処理を行った。
0.5%(w/v;溶媒は20%(v/v)メタノール水溶液)Crystal Violetで室温10分間染色反応した。反応後、Crystal Violet溶液を吸引除去し、水道水をウェルプレートに流水させてプレート洗浄し、50℃10分間の乾燥処理を行った。
(観察)この乾燥させた状態でCrystal Violetに染色した線維芽細胞を観察したところ、コントロール群の線維芽細胞はプレートの一部についてのみ接着していたが、ポマクティブHFV添加群はいずれもコントロール群より著しく接着した細胞が多かった。
【0024】
乾燥が終了したプレートに対し、100mMクエン酸(pH7.5、溶媒:50%メタノール水溶液)を室温30分間反応させてCrystal Violetの色素を抽出した。
色素溶液をそれぞれ回収し、96ウェルプレートにそれぞれ分注し、吸光度590nmについてマルチプレートリーダー(モレキュラーデバイス製)を用いて測定した。
得られた吸光度について、コントロール処理群を基準(1.00)として、ポマクティブHFVの各濃度添加群について比率を求め、多重比較検定試験としてDunnett test(**:p<0.01、*:p<0.05)を実施した。
【0025】
2.結果を表1及び図1に示す。
試験結果から、コントロール群における細胞接着率に対し、ポマクティブHFVを100、50、30μg/mlで濃度依存的に細胞のI型コラーゲンへの接着能が増した。
また、接着時の細胞を観察すると、100、50、30μg/mlりんごポリフェノール添加時に線維芽細胞の数割の形状が星型に変形していた。10μg/ml添加ではコントロール群とほぼ同じ細胞の形状であった。
【0026】
【表1】

【実施例2】
【0027】
[インテグリンα2鎖産生促進試験]
りんご抽出物を摂取及び皮膚に紫外線を照射しつつ飼育したヘアレスマウスを解剖してインテグリンα2鎖の産生促進状態を分析した。
材料
UVA波およびUVB波を照射したヘアレスマウス
りんご抽出物:ポマクティブHFV(ヴァルデヴィル社)
【0028】
1.ヘアレスマウスに対する紫外線照射及び飼育UVA波およびUVB波をヘアレスマウスに照射させてシワを形成させる試験系において被験物質であるそれぞれの食品原料を経口摂取させてシワの抑制および皮膚老化抑制効果について検討を行った。
導入時6週齢のヘアレスマウス(Hos:HR−1雌)を用いて以下の1)〜4)の条件・方法で試験を行った。
1)試験対象物の調製および投与
ヘアレスマウスの群分けは投与開始日に、一般状態が良好な動物を体重により、群間での差が無いように1群6匹に振り分けた。なお、各々の個体は1ゲージ/群で飼育とした。
マウス用飼料MF(オリエンタルバイオサービス製)に、それぞれ被験物質が均一に混ざるように混合処理を施し、混餌にて自由摂取させた。混餌は動物搬入直後から解剖18時間前まで実施した。投与群の一覧を表2に示す。
2)UV照射(表1;試験概要)
UV照射時は、動物を専用のケージに移し、1群ずつUVB20mJ/cm2およびUVA10J/cm2を照射した。照射は週三回の月曜、水曜、金曜で10週間実施した。
【0029】
【表2】

【0030】
3)試料の採取
各群、本飼育期間終了翌日より18時間絶食後、氷冷したAvertin(2,2,2−トリブロモエタノール)を0.5mg/kg体重腹腔内投与により麻酔を導入した。その後、皮膚背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位範囲で反射型レプリカ((有)アサヒバイオメッド製)を採取した。その後、開腹し解剖を行った。皮膚組織は10%中性ホルマリン浸潤、パラフィン包埋処理し、組織染色実験時に5μmの厚さでスライドガラスに貼付した。
【0031】
4)マウス皮膚組織中(真皮線維芽細胞)のインテグリンα2測定
インテグリンα2は免疫組織化学的手法を用いて測定した。
動物の解剖時に皮膚組織背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位の皮膚1cm2を切り取り、10%中性ホルマリン固定処理を室温18時間行い、及びパラフィン包埋して皮膚組織を保存した。5μm厚の切片を適宜作製し、脱パラフィン処理、親水化は公知の方法に基づいて実施した。
抗原賦活化は10mMクエン酸緩衝液(pH=6.0)中でマイクロウェーブ処理5分間の沸騰を実施した。室温まで冷却後、常温下0.3%過酸化水素含有メタノールで30分反応させて内因性ペルオキシダーゼを阻害した。水洗、10mMPBS(−)洗浄後、ヤギ血清50倍10mMPBS(−)希釈溶液の室温1時間反応でブロッキング反応、血清を落として1次抗体(Anti-mouse integrin α2(LSB製))を5μg/mlで4℃一晩反応させた。10mMPBS(−)で2回洗浄し、ビオチン化二次抗体(ビオチン化ヤギ免疫グロブリンM;DAKO製)を300倍希釈したものを30分間室温で抗体を反応させた。10mMPBS(−)で2回洗浄し、ABC試薬(ABC-HRP;Vectastain製)を30分間室温で反応させた。
発色試薬としてDAB(3,3-ジアミノベンジジンテトラヒドロクロライド:DAKO製)を用いて5分常温下で反応させた。水洗後、公知の方法に基づいて脱水、封入処理を行った。
顕微鏡下で皮膚組織の染色状況を観察し、MPコントローラーを用いて画像を取り込み、画像中の真皮乳頭層部分の100μm×100μmの範囲の染色箇所をImageJにて数値化した。
【0032】
2.結果を表3及び図2に示す。
コントロール食UV+群を基準として比率を求め、多重比較検定試験としてSteel Test(vs試験群2、**:p<0.01、*:p<0.05)を実施した。測定結果を表3及び図2に示す。
【0033】
【表3】

【0034】
UV照射の有無に着目すると、単純照射した試験群2を基準(産生量を1)とすると、非照射の試験群1では試験群2に対して2.81倍産生量が高かった。
これに対して、りんご抽出物(ポマクティブHFV)を混餌した試験群では、3.23〜3.92倍を示している。やや濃度依存的にインテグリンα2の産生が増加していることを示している。統計的に見ると、有意差は認められない結果であるので、インテグリンα2の量が増加していることは、りんご抽出物(ポマクティブHFV)が低濃度摂取であっても、限界的な作用効果を示すものと判断できる。そして、その産生促進作用は、UV非照射よりも強く表れるので、単にUV照射に対する補償作用以上に強いインテグリンα2の産生促進効果がりんご抽出物(ポマクティブHFV)には存在することが確認できる。
【実施例3】
【0035】
[インテグリンβ1鎖産生促進試験(真皮線維芽細胞)]
実施例2において試験に供したヘアレスマウスを解剖して得られた試料を分析してインテグリンβ1の産生状態を分析した。
【0036】
マウス皮膚組織中(真皮線維芽細胞)のインテグリンβ1産生促進
インテグリンβ1は免疫組織化学的手法を用いて測定した。
動物の解剖時に皮膚組織背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位の皮膚1cm2を切り取り、10%中性ホルマリン固定処理を室温18時間行い、及びパラフィン包埋して皮膚組織を保存した。
5μm厚の切片を適宜作製し、脱パラフィン処理、親水化は公知の方法に基づいて実施した。
抗原賦活化は10mMクエン酸緩衝液(pH=6.0)中でマイクロウェーブ処理5分間の沸騰を実施した。室温まで冷却後、常温下0.3%過酸化水素含有メタノールで30分反応させて内因性ペルオキシダーゼを阻害した。水洗、10mMPBS(−)洗浄後、ウサギ血清50倍10mMPBS(−)希釈溶液の室温1時間反応でブロッキング反応、血清を落として1次抗体(Anti-mouse Integrin β1 CD29 Antibody:R&D systems製)を5μg/mlで4℃一晩反応させた。
10mMPBS(−)で2回洗浄し、ビオチン化二次抗体(ビオチン化ウサギ免疫グロブリンM;DAKO製)を300倍希釈したものを30分間室温で抗体を反応させた。10mMPBS(−)で2回洗浄し、ABC試薬(ABC-HRP;Vectastain製)を30分間室温で反応させた。
発色試薬としてDAB(3,3-ジアミノベンジジンテトラヒドロクロライド:DAKO製)を用いて3分常温下で反応させた。水洗後、公知の方法に基づいて脱水、封入処理を行った。
顕微鏡下で皮膚組織の染色状況を観察し、MPコントローラーを用いて画像を取り込み、画像中の真皮乳頭層部分の100μm×100μmの範囲の染色箇所をImageJにて数値化した。
【0037】
結果を表4及び図3に示す。
コントロール食UV+群を基準として比率を求め、多重比較検定試験としてSteel Test(vs試験群2、**:p<0.01、*:p<0.05)を実施した。測定結果を表4及び図3に示す。
【0038】
【表4】

【0039】
UV照射の有無に着目すると、単純照射した試験群2を基準(産生量を1)とすると、非照射の試験群1では試験群2に対して2.50倍産生量が高かった。
これに対して、りんご抽出物(ポマクティブHFV)を混餌した試験群では、3.51〜5.48倍を示している。やや濃度依存的にインテグリンβ1の産生が増加していることを示している。統計的に見ると、有意差は認められない結果であるので、インテグリンβ1の量が増加していることは、りんご抽出物(ポマクティブHFV)が低濃度摂取であっても、限界的な作用効果を示すものと判断できる。そして、その産生促進作用は、UV非照射よりも強く表れるので、単にUV照射に対する補償作用以上に強いインテグリンβ1の産生促進効果がりんご抽出物(ポマクティブHFV)には存在することが確認できる。
【実施例4】
【0040】
[インテグリンβ1鎖産生促進試験(表皮細胞)]
実施例2において試験に供したヘアレスマウスを解剖して得られた試料を分析してインテグリンβ1の産生状態を分析した。
【0041】
マウス皮膚組織中(表皮細胞)のインテグリンβ1量
インテグリンβ1は免疫組織化学的手法を用いて測定した。
動物の解剖時に皮膚組織背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位の皮膚1cm2を切り取り、10%中性ホルマリン固定処理を室温18時間行い、及びパラフィン包埋して皮膚組織を保存した。
5μm厚の切片を適宜作製し、脱パラフィン処理、親水化は公知の方法に基づいて実施した。
抗原賦活化は10mMクエン酸緩衝液(pH=6.0)中でマイクロウェーブ処理5分間の沸騰を実施した。室温まで冷却後、常温下0.3%過酸化水素含有メタノールで30分反応させて内因性ペルオキシダーゼを阻害した。水洗、10mMPBS(−)洗浄後、ウサギ血清50倍10mMPBS(−)希釈溶液の室温1時間反応でブロッキング反応、血清を落として1次抗体(Anti-mouse Integrin β1 CD29 Antibody:R&D systems製)を5μg/mlで4℃一晩反応させた。
10mMPBS(−)で2回洗浄し、ビオチン化二次抗体(ビオチン化ウサギ免疫グロブリンM;DAKO製)を300倍希釈したものを30分間室温で抗体を反応させた。10mMPBS(−)で2回洗浄し、ABC試薬(ABC-HRP;Vectastain製)を30分間室温で反応させた。
発色試薬としてDAB(3,3-ジアミノベンジジンテトラヒドロクロライド:DAKO製)を用いて3分常温下で反応させた。水洗後、公知の方法に基づいて脱水、封入処理を行った。
顕微鏡下で皮膚組織の染色状況を観察し、MPコントローラーを用いて画像を取り込み、画像中の免疫組織染色したマウス皮膚組織の表皮基底細胞の1細胞および周縁15μm四方の染色箇所をImageJにて数値化した。
結果を表5及び図4に示す。
【0042】
【表5】

【0043】
UV照射の有無に着目すると、単純照射した試験群2を基準(産生量を1)とすると、非照射の試験群1では試験群2に対して1.10倍と僅かな差であり、両者に有意な差は認められなかった。
これに対して、りんご抽出物(ポマクティブHFV)を混餌した試験群では、1.40倍から2.20倍を示している。試験群3および試験群4においてそれぞれ、試験群2に対する統計的有意差が得られた。よって、りんご抽出物により表皮細胞においてもインテグリンβ1の産生促進効果が確認できる。
【実施例5】
【0044】
[材料]
・コラーゲンTypeIコーティング24ウェルプレート(IWAKI製)
・ダルベッコ改変イーグル培地(低グルコース)(Sigma製)
・ダルベッコ改変イーグル培地(高グルコース)(DMEM(液体)(商品名;Gib co))
【0045】
[ 評価検体 ]
(a)リンゴ抽出物:ポマクティブHFV(ユニテックフーズ製)⇒規格;全ポリフェ ノール量90%以上(UV法)
(b)コラーゲンペプチド:HACP-01(HTCコラーゲン、ゼライス製)⇒規格;トリ ペプチド15%以上
(c)マリアアザミ抽出物:シリマリンET/G(Indena S.p.A.製)⇒ 規格;シリビン・イソシリビン合計30%以上(HPLC法)、シリマリン含量 65%以上(DAB10[ドイツ薬物規格第10項]による)
【0046】
[ 試験方法および結果 ]
コラーゲンTypeIコーティングプレートへの線維芽細胞接着能
(1)新生児由来ヒト皮膚線維芽細胞を5%FBS含有DMEM培地(高グルコース)で継代培 養し、播種後に細胞増殖が抑制したPDL(集団倍加数)が60に達した細胞をト リプシン処理で回収し、細胞懸濁液を調整した。
(2)コラーゲンTypeIコーティング24ウェルプレートに5000cells/1wellの 細胞密度で線維芽細胞を播種し、次の試験群を設定した。
(試験群1):コントロール
(試験群2):りんご抽出物を10μg/ml
(試験群3)コラーゲンペプチド30μg/ml
(試験群4)マリアアザミ抽出物10μg/ml
(試験群5):リンゴ抽出物とコラーゲンペプチドの2者併用群
(試験群6)リンゴ抽出物とコラーゲンペプチドおよびシリマリン抽出物の3者併用群
【0047】
(3)培養液はフェノールレッドフリー、血清フリーのDMEM培地(低グルコース)を 用いた。各群はn=4で評価した。2時間5%CO2インキュベーター37℃で培 養した。
(4)この培養中、接着能の衰えた線維芽細胞はウェルプレートに接着せずに浮遊してい た。
(5)培養終了後に培養液を吸引し、2.5%(v/v:希釈液はPBS(−))グルタ ルアルデヒドで室温10分間反応させて、ウェルプレートに接着した線維芽細胞の 固定処理を行った。固定終了後、グルタルアルデヒド溶液を吸引除去し、水道水を ウェルプレートに流水させてプレート洗浄し、50℃10分間の乾燥処理を行っ た。
(6)0.5%(w/v;溶媒は20%(v/v)メタノール水溶液)Crystal Violetで室温10分間染色反応した。反応後、Crystal Viole t溶液を吸引除去し、水道水をウェルプレートに流水させてプレート洗浄し、 50℃10分間の乾燥処理を行った。
(7)乾燥が終了したウェルプレートに対し、100mMクエン酸(溶媒:50%メタ ノール水溶液)を室温30分間反応させてCrystal Violetの色素を 抽出した。色素溶液をそれぞれ回収し、96ウェルプレートにそれぞれ分注し、吸 光度590nmについてマルチプレートリーダー(モレキュラーデバイス製)を用 いて測定した。
(8)得られた吸光度について、コントロール処理群を基準(1.00)として、各サン プル添加群について比率を求めた。比率が1よりも大きくなるほど細胞とI型コ ラーゲンとの接着能が増す事を示している。
結果を表6、図5に示す。
【0048】
【表6】

【0049】
試験結果から、コントロール群である試験群1(100%の基準とする)に対して、試験群2で147%、試験群3で103%、試験群4では169%細胞接着が亢進している。
試験群5の2者併用は194%と、試験群2と試験群3の細胞接着率の総和よりも著しく細胞接着が亢進している。
さらに、試験群6の3者併用は302%となり、試験群2、試験群3および試験群4の総和よりも著しく細胞接着が亢進した。
したがって、3者併用の細胞接着能は、それぞれの単独及び2者併用に比べて、予想外に著しく亢進していることが分かる。
【特許請求の範囲】
【請求項1】
リンゴ抽出物を有効成分とする細胞間接着剤。
【請求項2】
さらに、有効成分として、コラーゲンペプチド、マリアアザミ抽出物を含有することを特徴とする請求項1記載の細胞間接着剤。
【請求項3】
細胞が老化したヒト皮膚線維芽細胞であることを特徴とする請求項1又は2記載の細胞間接着剤。
【請求項4】
リンゴ抽出物を有効成分とするインテグリン産生促進剤。
【請求項5】
インテグリンがインテグリンα2及び/又はインテグリンβ1である請求項4記載の産生促進剤。
【請求項1】
リンゴ抽出物を有効成分とする細胞間接着剤。
【請求項2】
さらに、有効成分として、コラーゲンペプチド、マリアアザミ抽出物を含有することを特徴とする請求項1記載の細胞間接着剤。
【請求項3】
細胞が老化したヒト皮膚線維芽細胞であることを特徴とする請求項1又は2記載の細胞間接着剤。
【請求項4】
リンゴ抽出物を有効成分とするインテグリン産生促進剤。
【請求項5】
インテグリンがインテグリンα2及び/又はインテグリンβ1である請求項4記載の産生促進剤。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−219454(P2011−219454A)
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願番号】特願2010−227762(P2010−227762)
【出願日】平成22年10月7日(2010.10.7)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願日】平成22年10月7日(2010.10.7)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
[ Back to top ]

