細菌の回収方法
【課題】試料中の細菌の効果的な回収、濃縮、精製方法の提供。
【解決手段】本発明による試料中の標的細菌の回収、濃縮、精製方法は、該標的細菌を認識する抗体を固相化した担体と、標的細菌を該担体に結合後に担体を洗浄する工程を含んでなるもの、である。
【解決手段】本発明による試料中の標的細菌の回収、濃縮、精製方法は、該標的細菌を認識する抗体を固相化した担体と、標的細菌を該担体に結合後に担体を洗浄する工程を含んでなるもの、である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗体を用いて各種試料中から細菌を回収する方法に関するものである。
【背景技術】
【0002】
細菌やウイルスによる感染症その他の病気の原因を確定診断するためには、その病気の原因となっている細菌やウイルスを検出し同定することが必要である。従来の細菌検査では、試料中の検査対象である病原菌の濃縮処理や精製処理を行わず検査に供しており、該試料を寒天培地に塗布して培養後、出現したコロニーを計数する培養検査が標準法として用いられていた。例えば、結核菌の場合は前記の様な処理を行っていない試料を用いた塗沫検査や培養検査が基本であった。また、食中毒菌の検査の場合も同様の培養法が標準的に用いられていた。
【0003】
また、臨床診断等の分野では、試料から核酸を抽出し、標的細菌およびウイルスの核酸を増幅し検出することにより、病気の確定診断が行われている。この場合、試料からの核酸の抽出が重要な操作となっている。核酸抽出には、フェノール/クロロホルム法、グアニジン法等が知られているが、試料中に核酸の抽出を阻害する夾雑物あるいは、核酸増幅反応を阻害する物質が存在することが知られている。
【発明の開示】
【発明が解決しようとする課題】
【0004】
これら従来法による細菌による病気の確定診断のための細菌検査においては、培養に時間がかかるという問題点があった。一般的な細菌検査では、増菌培養、選択培養といった培養を行い、一般生菌数の測定には2〜3日間、食中毒細菌等特定の細菌の検出には4〜5日間必要である。また例えば、結核菌の場合、菌の生育速度が遅く、検出、同定に4週間以上を必要としている。これらは試料中の細菌数が少なく、培養以外の現在の検出技術(例えば塗沫検査)では検出することが困難なことが原因である。
【0005】
また、臨床診断等の分野における遺伝子検査に用いられる試料としては、血液、尿、喀痰、膿、血液培養液、スワブ、コロニー等があげられる。これらの試料から従来の方法により核酸を抽出ことは可能であるが、試料中に核酸の抽出を阻害する夾雑物あるいは、核酸増幅反応を阻害する物質が存在することが知られている。それらは試料中からの核酸の抽出を困難にし、その後の工程である核酸増幅を阻害し、正確な細菌の検出、同定を困難なものにしている。
【0006】
また、従来の方法で試料中の標的細菌の濃縮を行おうとした場合、遠心分離による標的細菌の沈降やフィルターろ過が考えられるが、これらの技術では培養や核酸増幅の工程を阻害する試料中の夾雑物も同時に回収してしまうという問題点があった。
【0007】
そこで本発明の目的は、標的細菌を試料の中から特異的に回収し、検出可能な量まで濃縮する方法を提供することにある。また、その過程で、核酸の抽出および後の核酸増幅工程を阻害する物質を洗浄除去し、標的細菌を精製する方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは研究を重ねた結果、試料中の標的細菌を回収し、濃縮、精製する方法を見出した。本発明は、標的細菌の表面抗原を特異的に認識する抗体を有する担体と、標的細菌を含有すると思われる試料とを接触させ、抗原抗体反応により標的細菌を担体に結合させ、その後標的細菌以外の試料中の夾雑物を除去し、標的細菌を選択的に回収し濃縮する工程を含むことを特徴とする、標的細菌の回収方法である。以下、本発明を詳細に説明する。
【0009】
本発明において標的細菌に特異的に結合する抗体とは、標的細菌の細胞表層膜に存在する表面抗原を特異的に認識し結合する抗体を意味し、モノクローナル抗体であってもポリクローナル抗体であってもよい。また、標的細菌の細胞表層膜に存在する共通抗原を認識するものであっても、標的細菌の細胞表層膜に特異的に存在する抗原を認識するものであってもよい。標的細菌の細胞表層膜に存在する抗原は、グラム陰性菌の場合、細胞外膜に存在するリポ蛋白質、蛋白質、リポ多糖、あるいは鞭毛が挙げられ、グラム陽性菌の場合、細胞壁に存在する多糖、ペプチドグリカン、蛋白質、あるいは鞭毛が挙げられる。
【0010】
担体に結合する抗体量の下限界は、標的細菌検査における検出下限界よりも多くの標的細菌数を結合できる抗体量であればよく、望ましくは湿潤担体量1mlに対して0.5mg以上である。結合する抗体量の上限界は、固相に結合した抗体の上からさらに抗体が結合した場合は抗体と抗原の結合が阻害される場合があるので、望ましくは湿潤担体量1mlに対して10mg以下である。
【0011】
抗体を固相化する担体は、通常アフィニティークロマトグラフィーを作製するために用いられるゲル担体や蛋白質結合能を有する担体であればよく、例えばTOYOPEAL AF−Tresyl−650M(東ソー社製)やセファロース4B(アマシャムファルマシアバイオテク社製)およびポリスチレンビーズがあげられる。抗体の担体への結合は、化学的な共有結合による結合でも疎水性相互作用による物理的吸着によるものでもよい。また、ビオチンとストレプトアビジンを介して行われるようなリガンドによる親和性を利用したものでもよい。化学的な共有結合の方法は、アミノ基やカルボキシル基やチオール基等の官能基を介して行われる。例えば、担体のカルボキシル基をN−ヒドロキシスクシミドで活性エステル体とし抗体のアミノ基とアミド結合を形成させて結合させる。本発明で使用する担体の形状は限定されるものではなく、粒子状、多孔質フィルター状、ファイバー状、シート状であってもよい。担体が球状粒子である場合、粒子径は均一でなくてもよく直径は5μm〜500μm程度であればよい。しかし粒子径が小さい場合は試料と分離する場合に分離方法によっては分離が困難になる場合や時間がかかり過ぎるという問題点が生じる。また、粒子径が大きすぎる場合は単位体積あたりの担体表面積が小さくなり、標的細菌を結合する能力が低下する。そのため担体の粒子径は、直径40μm〜150μmが好ましい。
【0012】
本発明における標的細菌とは、例えば大腸菌、サルモネラ、肺炎桿菌、セラチア菌、腸炎ビブリオ、インフルエンザ桿菌等のグラム陰性菌、黄色ぶどう球菌、レンサ球菌、破傷風菌、ボツリヌス菌、炭疽菌等のグラム陽性菌があげられる。また、結核菌もあげられる。
【0013】
試料には、血液、尿、血液培養液等の試料溶液、喀痰、膿、コロニー、スワブ等の生体試料の試料懸濁液、あるいは食物試料のホモジェナイズ等の試料懸濁液があげられる。喀痰の場合は、NALC処理等の試料の粘性を落す前処理を行うとより好ましい結果が得られる。
【0014】
試料と抗体固相化担体との接触は、バッチ法あるいはカラム法のどちらでもよいが、試料中に不溶性の懸濁物が存在する場合はバッチ法が好ましい。接触させる時間は抗原抗体反応が完了する時間であれば制限はないが、臨床検査、診断時の操作性を考慮すると短時間であるほうが好ましい。
【0015】
標的細菌が結合した担体の洗浄は、通常使用される緩衝液で行えばよく、例えば、PBS、リン酸緩衝液、トリス緩衝液等があげられる。そのpHは5〜9付近であればよく、好ましくは6〜8であればよい。また、洗浄後の核酸の抽出の過程での核酸の分解を抑えるために1mMのEDTAを添加することが好ましい。
【0016】
試料中の標的細菌を結合した担体の、試料溶液、試料懸濁液、洗浄液からの分離方法は、バッチ法の場合は自然沈降、遠心分離、磁気分離等によって行えばよい。カラム法の場合は試料溶液、試料懸濁液、洗浄液をカラムに通過させることにより行うことができる。
【0017】
本発明により回収、濃縮、精製された標的細菌は、核酸増幅検査、免疫診断等に供される。核酸増幅検査は、PCR(Polymerase Chain Reaction)、LCR(Ligase Chain Reaction)、LAMP(Loop−mediated Isothermal Amplification of DNA)等のDNA増幅法、NASBA(Nucleic Acid Sequence Based Amplification)、TMA(Transcription−Mediated Amplification)あるいはTRC(Transcription Reverse Transcription Concerted Reaction、医学のあゆみ、Vol.206.No8、2003)等のRNA増幅法があげられる。これら核酸増幅検査のための核酸の抽出を行う場合、試料によっては核酸の抽出を阻害する夾雑物あるいは核酸増幅反応を阻害する物質が存在しているが、本発明により精製された標的細菌は、これらの夾雑物が洗浄除去されているため核酸の抽出を容易に行うことが可能である。また、標的細菌を担体に結合したまま行うことが可能である。核酸の抽出は、酵素や界面活性剤で細胞膜や細胞壁を破壊し、複合体の蛋白質を分解して核酸を遊離させた後、フェノール/クロロホルムを添加して遊離した核酸を抽出する、いわゆるフェノール/クロロホルム法(Molecular Cloning:A laboratory manual Appendix E3−E4(New York:Cold Spring Harbor Laboratory,1989年))、塩酸グアニジンまたはチオシアン酸グアニジンで処理して細胞膜や細胞壁を破壊し、核酸との複合体を形成している蛋白質を変性して核酸を遊離させた後、エタノール等を添加して遊離した核酸を抽出する、いわゆるグアニジン法(Molecular Cloning:A laboratory manual Appendix 7.23〜7.25(New York:Cold Spring Harbor Laboratory,1989年))、あるいは市販されている核酸抽出試薬を用いて行えばよい。
【発明の効果】
【0018】
本発明においては試料中の標的細菌が濃縮されているため、試料中の標的細菌が極微量であって通常の検出方法では検出不可能な場合においても検出することが可能である。
【実施例】
【0019】
以下に、発明を更に詳細に説明するために実施例を示すが、本発明はこれら実施例に限定されるものではない。
【0020】
実施例1 ストレプトアビジン固相化ゲルの作製
固相化用担体としてアフィニティー用ゲルであるTOYOPEAL AF−Tresyl−650M(東ソー社製)を用いた。1gのTOYOPEAL AF−Tresyl−650Mを超純水で膨潤し、4mlの1Mリン酸緩衝液pH7.5に懸濁した。該ゲル懸濁液にストレプトアビジン(プロザイム社製)を2mg添加し、4℃で16時間ゆるやかに攪拌した。反応後ゲル懸濁液を静置しゲルを沈降させた後上清を除去し、0.1Mトリス緩衝溶液pH8.0を4ml添加し、ゆるやかにゲルを再懸濁させた。この操作を3回行った後、室温で1時間ゆるやかに攪拌した。ゲル懸濁液を静置しゲルを沈降させた後上清を除去し、PBSを4ml添加し、ゆるやかにゲルを再懸濁させた。この操作を3回行った。
【0021】
実施例2 大腸菌認識抗体固相化ゲルの作製
実施例1に従って作製したストレプトアビジン固相化ゲルに、ビオチン標識大腸菌認識抗体(バイロスタット社製)2mgを添加し室温で30分ゆるやかに攪拌した。ゲル懸濁液を静置しゲルを沈降させた後上清を除去し、PBSを4ml添加しゆるやかにゲルを再懸濁させた。この操作を3回行った。
【0022】
実施例3 大腸菌認識抗体固相化ゲルによる大腸菌懸濁液からの大腸菌の回収
実施例2に従って作製した大腸菌認識抗体固相化ゲルを、体積比でゲル量対液量が2対1の割合になるようにPBSを加えゲルを懸濁した。
【0023】
MRSA(メシチリン耐性黄色ブドウ球菌)のPBP−2’をコードするmecA遺伝子(FEBS Lett. 221(1)、167−171,1987)を組み込んだpUC19により形質転換を行ったJM109を、100μg/mlのアンピシリンを添加したLB培地により37℃で一晩培養した。該培養液を、波長600nmにおける吸光度が0.5となるようにPBSで希釈し、さらにPBSを用いて1倍、102倍、104倍の希釈系列を作製し試料とした。該試料5mlに上記大腸菌認識抗体固相化ゲル懸濁液0.25mlをそれぞれ添加し、37℃で1時間ゆるやかに攪拌した。その後ゲルを回収し、0.5mlのPBSで5回洗浄した後QIA prep Spin Miniprep Kit(QIAGEN社製)でゲルから直接プラスミドを抽出した。
【0024】
該プラスミドを鋳型としプライマー(F−PBP−1:配列番号1に記載)とプライマー(F−PBP−2:配列番号2に記載)によるLA PCR(タカラバイオ社製)を用いたPCRを行うことによりmecA遺伝子を増幅した。PCR反応は、94℃で20秒、43℃で30秒、72℃で2分を1サイクルとして25サイクル行った。反応後の増幅断片を検出するため、反応液を1%アガロースゲルにて電気泳動を行いエチジウムブロマイドにより染色した。
【0025】
電気泳動の結果を図1に示した。検出されたバンドのうち標的大腸菌の濃度が最も薄い試料のレーンを矢印で示した。その結果、大腸菌102倍希釈した大腸菌溶液からmecA遺伝子を検出することができた。このことは、大腸菌認識抗体固相化ゲルを使用して、希釈した大腸菌溶液から大腸菌を回収することが可能であることを示す。
【0026】
実施例4 大腸菌認識抗体固相化ゲルによる喀痰中の大腸菌の濃縮精製
実施例2に従って作製した大腸菌認識抗体固相化ゲルを、体積比でゲル量対液量が2対1の割合になるようにPBSを加えゲルを懸濁した。
【0027】
筆者の咽頭より採取した喀痰3mlに0.5mlのPBSを添加し激しく攪拌した。該溶液を0.1Mリン酸ナトリウム緩衝液pH7.5で10倍に希釈し喀痰溶液とした。
【0028】
実施例3に示すmecA遺伝子を組み込んだpUC19により形質転換を行ったJM109を、100μg/mlのアンピシリンを添加したLB培地により37℃で一晩培養した。該培養液を上記喀痰溶液に、波長600nmにおける吸光度が0.5、0.5x10−1、0.5x10−2、0.5x10−3、となるように添加し試料とした。該試料1mlに上記大腸菌認識抗体固相化ゲル懸濁液0.1mlをそれぞれ添加し、37℃で1時間ゆるやかに攪拌した。その後ゲルを回収し、0.5mlの0.1Mリン酸ナトリウム緩衝液pH7.5で5回洗浄した後QIA prep Spin Miniprep Kit(QIAGEN社製)を用いてゲルから直接プラスミドを抽出した。
【0029】
該喀痰試料中の夾雑物は遠心操作では標的細菌と共に沈降してしまい遠心操作では除去できず、かつ抽出に用いる試料容量を増やすと夾雑物により核酸の抽出が阻害されるため、10μlを対照として用いた。上記試料それぞれ10μlからQIA prep Spin Miniprep Kit(QIAGEN社製)を用いてプラスミドを抽出した。
【0030】
該プラスミドを鋳型とし実施例3と同様にPCRを行うことによりmecA遺伝子を増幅した。反応後の増幅断片を検出するため、反応液を1%アガロースゲルにて電気泳動を行いエチジウムブロマイドにより染色した。
【0031】
標的大腸菌の検出は、該PCR増幅産物を検出することにより行った。
【0032】
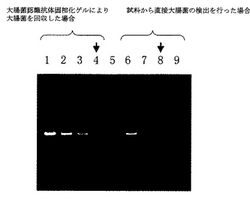
電気泳動の結果を図2に示した。大腸菌認識抗体固相化ゲルを使用して大腸菌を回収した場合と使用しなかった場合において、それぞれ検出されたバンドのうち標的大腸菌の濃度が最も薄い試料のレーンを矢印で示した。その結果、大腸菌認識抗体固相化ゲルにより大腸菌を回収した場合は103倍希釈した大腸菌溶液からmecA遺伝子を検出することができた。一方、試料から直接大腸菌の検出を行った場合は、102倍希釈した大腸菌溶液までしか検出できなかった。このことは、大腸菌認識抗体固相化ゲルを使用して、希釈した大腸菌溶液から標的大腸菌を濃縮し、遠心で除去することのできない遺伝子抽出を阻害する夾雑物を除去し大腸菌を精製することが可能であることを示す。
【図面の簡単な説明】
【0033】
【図1】図1に示す電気泳動図は大腸菌認識抗体固相化ゲルを用いて大腸菌懸濁液から標的大腸菌を検出した場合の検出下限界を見たものである。検出は大腸菌からプラスミドを抽出し、該プラスミドを鋳型としたPCR増幅産物のバンドを検出することにより行った。レーン1は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5で示される場合、レーン2は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5x10−1で示される場合、レーン3は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5x10−2で示される場合、レーン4はDNAマーカーをそれぞれ示す。
【図2】図2に示す電気泳動図は大腸菌認識抗体固相化ゲルを用いて喀痰試料から標的大腸菌を検出した場合の検出下限界を見たものである。検出は大腸菌からプラスミドを抽出し、該プラスミドを鋳型としたPCR増幅産物のバンドを検出することにより行った。レーン1から4は、大腸菌認識抗体固相化ゲルを用いた場合を示し、レーン6から9は用いなかった場合、レーン5はDNAマーカーをそれぞれ示す。また、レーン1、6は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5で示される場合、レーン2、7は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5x10−1で示される場合、レーン3、8は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5x10−2で示される場合、レーン4、9は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5x10−3で示される場合をそれぞれ示す。
【技術分野】
【0001】
本発明は、抗体を用いて各種試料中から細菌を回収する方法に関するものである。
【背景技術】
【0002】
細菌やウイルスによる感染症その他の病気の原因を確定診断するためには、その病気の原因となっている細菌やウイルスを検出し同定することが必要である。従来の細菌検査では、試料中の検査対象である病原菌の濃縮処理や精製処理を行わず検査に供しており、該試料を寒天培地に塗布して培養後、出現したコロニーを計数する培養検査が標準法として用いられていた。例えば、結核菌の場合は前記の様な処理を行っていない試料を用いた塗沫検査や培養検査が基本であった。また、食中毒菌の検査の場合も同様の培養法が標準的に用いられていた。
【0003】
また、臨床診断等の分野では、試料から核酸を抽出し、標的細菌およびウイルスの核酸を増幅し検出することにより、病気の確定診断が行われている。この場合、試料からの核酸の抽出が重要な操作となっている。核酸抽出には、フェノール/クロロホルム法、グアニジン法等が知られているが、試料中に核酸の抽出を阻害する夾雑物あるいは、核酸増幅反応を阻害する物質が存在することが知られている。
【発明の開示】
【発明が解決しようとする課題】
【0004】
これら従来法による細菌による病気の確定診断のための細菌検査においては、培養に時間がかかるという問題点があった。一般的な細菌検査では、増菌培養、選択培養といった培養を行い、一般生菌数の測定には2〜3日間、食中毒細菌等特定の細菌の検出には4〜5日間必要である。また例えば、結核菌の場合、菌の生育速度が遅く、検出、同定に4週間以上を必要としている。これらは試料中の細菌数が少なく、培養以外の現在の検出技術(例えば塗沫検査)では検出することが困難なことが原因である。
【0005】
また、臨床診断等の分野における遺伝子検査に用いられる試料としては、血液、尿、喀痰、膿、血液培養液、スワブ、コロニー等があげられる。これらの試料から従来の方法により核酸を抽出ことは可能であるが、試料中に核酸の抽出を阻害する夾雑物あるいは、核酸増幅反応を阻害する物質が存在することが知られている。それらは試料中からの核酸の抽出を困難にし、その後の工程である核酸増幅を阻害し、正確な細菌の検出、同定を困難なものにしている。
【0006】
また、従来の方法で試料中の標的細菌の濃縮を行おうとした場合、遠心分離による標的細菌の沈降やフィルターろ過が考えられるが、これらの技術では培養や核酸増幅の工程を阻害する試料中の夾雑物も同時に回収してしまうという問題点があった。
【0007】
そこで本発明の目的は、標的細菌を試料の中から特異的に回収し、検出可能な量まで濃縮する方法を提供することにある。また、その過程で、核酸の抽出および後の核酸増幅工程を阻害する物質を洗浄除去し、標的細菌を精製する方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは研究を重ねた結果、試料中の標的細菌を回収し、濃縮、精製する方法を見出した。本発明は、標的細菌の表面抗原を特異的に認識する抗体を有する担体と、標的細菌を含有すると思われる試料とを接触させ、抗原抗体反応により標的細菌を担体に結合させ、その後標的細菌以外の試料中の夾雑物を除去し、標的細菌を選択的に回収し濃縮する工程を含むことを特徴とする、標的細菌の回収方法である。以下、本発明を詳細に説明する。
【0009】
本発明において標的細菌に特異的に結合する抗体とは、標的細菌の細胞表層膜に存在する表面抗原を特異的に認識し結合する抗体を意味し、モノクローナル抗体であってもポリクローナル抗体であってもよい。また、標的細菌の細胞表層膜に存在する共通抗原を認識するものであっても、標的細菌の細胞表層膜に特異的に存在する抗原を認識するものであってもよい。標的細菌の細胞表層膜に存在する抗原は、グラム陰性菌の場合、細胞外膜に存在するリポ蛋白質、蛋白質、リポ多糖、あるいは鞭毛が挙げられ、グラム陽性菌の場合、細胞壁に存在する多糖、ペプチドグリカン、蛋白質、あるいは鞭毛が挙げられる。
【0010】
担体に結合する抗体量の下限界は、標的細菌検査における検出下限界よりも多くの標的細菌数を結合できる抗体量であればよく、望ましくは湿潤担体量1mlに対して0.5mg以上である。結合する抗体量の上限界は、固相に結合した抗体の上からさらに抗体が結合した場合は抗体と抗原の結合が阻害される場合があるので、望ましくは湿潤担体量1mlに対して10mg以下である。
【0011】
抗体を固相化する担体は、通常アフィニティークロマトグラフィーを作製するために用いられるゲル担体や蛋白質結合能を有する担体であればよく、例えばTOYOPEAL AF−Tresyl−650M(東ソー社製)やセファロース4B(アマシャムファルマシアバイオテク社製)およびポリスチレンビーズがあげられる。抗体の担体への結合は、化学的な共有結合による結合でも疎水性相互作用による物理的吸着によるものでもよい。また、ビオチンとストレプトアビジンを介して行われるようなリガンドによる親和性を利用したものでもよい。化学的な共有結合の方法は、アミノ基やカルボキシル基やチオール基等の官能基を介して行われる。例えば、担体のカルボキシル基をN−ヒドロキシスクシミドで活性エステル体とし抗体のアミノ基とアミド結合を形成させて結合させる。本発明で使用する担体の形状は限定されるものではなく、粒子状、多孔質フィルター状、ファイバー状、シート状であってもよい。担体が球状粒子である場合、粒子径は均一でなくてもよく直径は5μm〜500μm程度であればよい。しかし粒子径が小さい場合は試料と分離する場合に分離方法によっては分離が困難になる場合や時間がかかり過ぎるという問題点が生じる。また、粒子径が大きすぎる場合は単位体積あたりの担体表面積が小さくなり、標的細菌を結合する能力が低下する。そのため担体の粒子径は、直径40μm〜150μmが好ましい。
【0012】
本発明における標的細菌とは、例えば大腸菌、サルモネラ、肺炎桿菌、セラチア菌、腸炎ビブリオ、インフルエンザ桿菌等のグラム陰性菌、黄色ぶどう球菌、レンサ球菌、破傷風菌、ボツリヌス菌、炭疽菌等のグラム陽性菌があげられる。また、結核菌もあげられる。
【0013】
試料には、血液、尿、血液培養液等の試料溶液、喀痰、膿、コロニー、スワブ等の生体試料の試料懸濁液、あるいは食物試料のホモジェナイズ等の試料懸濁液があげられる。喀痰の場合は、NALC処理等の試料の粘性を落す前処理を行うとより好ましい結果が得られる。
【0014】
試料と抗体固相化担体との接触は、バッチ法あるいはカラム法のどちらでもよいが、試料中に不溶性の懸濁物が存在する場合はバッチ法が好ましい。接触させる時間は抗原抗体反応が完了する時間であれば制限はないが、臨床検査、診断時の操作性を考慮すると短時間であるほうが好ましい。
【0015】
標的細菌が結合した担体の洗浄は、通常使用される緩衝液で行えばよく、例えば、PBS、リン酸緩衝液、トリス緩衝液等があげられる。そのpHは5〜9付近であればよく、好ましくは6〜8であればよい。また、洗浄後の核酸の抽出の過程での核酸の分解を抑えるために1mMのEDTAを添加することが好ましい。
【0016】
試料中の標的細菌を結合した担体の、試料溶液、試料懸濁液、洗浄液からの分離方法は、バッチ法の場合は自然沈降、遠心分離、磁気分離等によって行えばよい。カラム法の場合は試料溶液、試料懸濁液、洗浄液をカラムに通過させることにより行うことができる。
【0017】
本発明により回収、濃縮、精製された標的細菌は、核酸増幅検査、免疫診断等に供される。核酸増幅検査は、PCR(Polymerase Chain Reaction)、LCR(Ligase Chain Reaction)、LAMP(Loop−mediated Isothermal Amplification of DNA)等のDNA増幅法、NASBA(Nucleic Acid Sequence Based Amplification)、TMA(Transcription−Mediated Amplification)あるいはTRC(Transcription Reverse Transcription Concerted Reaction、医学のあゆみ、Vol.206.No8、2003)等のRNA増幅法があげられる。これら核酸増幅検査のための核酸の抽出を行う場合、試料によっては核酸の抽出を阻害する夾雑物あるいは核酸増幅反応を阻害する物質が存在しているが、本発明により精製された標的細菌は、これらの夾雑物が洗浄除去されているため核酸の抽出を容易に行うことが可能である。また、標的細菌を担体に結合したまま行うことが可能である。核酸の抽出は、酵素や界面活性剤で細胞膜や細胞壁を破壊し、複合体の蛋白質を分解して核酸を遊離させた後、フェノール/クロロホルムを添加して遊離した核酸を抽出する、いわゆるフェノール/クロロホルム法(Molecular Cloning:A laboratory manual Appendix E3−E4(New York:Cold Spring Harbor Laboratory,1989年))、塩酸グアニジンまたはチオシアン酸グアニジンで処理して細胞膜や細胞壁を破壊し、核酸との複合体を形成している蛋白質を変性して核酸を遊離させた後、エタノール等を添加して遊離した核酸を抽出する、いわゆるグアニジン法(Molecular Cloning:A laboratory manual Appendix 7.23〜7.25(New York:Cold Spring Harbor Laboratory,1989年))、あるいは市販されている核酸抽出試薬を用いて行えばよい。
【発明の効果】
【0018】
本発明においては試料中の標的細菌が濃縮されているため、試料中の標的細菌が極微量であって通常の検出方法では検出不可能な場合においても検出することが可能である。
【実施例】
【0019】
以下に、発明を更に詳細に説明するために実施例を示すが、本発明はこれら実施例に限定されるものではない。
【0020】
実施例1 ストレプトアビジン固相化ゲルの作製
固相化用担体としてアフィニティー用ゲルであるTOYOPEAL AF−Tresyl−650M(東ソー社製)を用いた。1gのTOYOPEAL AF−Tresyl−650Mを超純水で膨潤し、4mlの1Mリン酸緩衝液pH7.5に懸濁した。該ゲル懸濁液にストレプトアビジン(プロザイム社製)を2mg添加し、4℃で16時間ゆるやかに攪拌した。反応後ゲル懸濁液を静置しゲルを沈降させた後上清を除去し、0.1Mトリス緩衝溶液pH8.0を4ml添加し、ゆるやかにゲルを再懸濁させた。この操作を3回行った後、室温で1時間ゆるやかに攪拌した。ゲル懸濁液を静置しゲルを沈降させた後上清を除去し、PBSを4ml添加し、ゆるやかにゲルを再懸濁させた。この操作を3回行った。
【0021】
実施例2 大腸菌認識抗体固相化ゲルの作製
実施例1に従って作製したストレプトアビジン固相化ゲルに、ビオチン標識大腸菌認識抗体(バイロスタット社製)2mgを添加し室温で30分ゆるやかに攪拌した。ゲル懸濁液を静置しゲルを沈降させた後上清を除去し、PBSを4ml添加しゆるやかにゲルを再懸濁させた。この操作を3回行った。
【0022】
実施例3 大腸菌認識抗体固相化ゲルによる大腸菌懸濁液からの大腸菌の回収
実施例2に従って作製した大腸菌認識抗体固相化ゲルを、体積比でゲル量対液量が2対1の割合になるようにPBSを加えゲルを懸濁した。
【0023】
MRSA(メシチリン耐性黄色ブドウ球菌)のPBP−2’をコードするmecA遺伝子(FEBS Lett. 221(1)、167−171,1987)を組み込んだpUC19により形質転換を行ったJM109を、100μg/mlのアンピシリンを添加したLB培地により37℃で一晩培養した。該培養液を、波長600nmにおける吸光度が0.5となるようにPBSで希釈し、さらにPBSを用いて1倍、102倍、104倍の希釈系列を作製し試料とした。該試料5mlに上記大腸菌認識抗体固相化ゲル懸濁液0.25mlをそれぞれ添加し、37℃で1時間ゆるやかに攪拌した。その後ゲルを回収し、0.5mlのPBSで5回洗浄した後QIA prep Spin Miniprep Kit(QIAGEN社製)でゲルから直接プラスミドを抽出した。
【0024】
該プラスミドを鋳型としプライマー(F−PBP−1:配列番号1に記載)とプライマー(F−PBP−2:配列番号2に記載)によるLA PCR(タカラバイオ社製)を用いたPCRを行うことによりmecA遺伝子を増幅した。PCR反応は、94℃で20秒、43℃で30秒、72℃で2分を1サイクルとして25サイクル行った。反応後の増幅断片を検出するため、反応液を1%アガロースゲルにて電気泳動を行いエチジウムブロマイドにより染色した。
【0025】
電気泳動の結果を図1に示した。検出されたバンドのうち標的大腸菌の濃度が最も薄い試料のレーンを矢印で示した。その結果、大腸菌102倍希釈した大腸菌溶液からmecA遺伝子を検出することができた。このことは、大腸菌認識抗体固相化ゲルを使用して、希釈した大腸菌溶液から大腸菌を回収することが可能であることを示す。
【0026】
実施例4 大腸菌認識抗体固相化ゲルによる喀痰中の大腸菌の濃縮精製
実施例2に従って作製した大腸菌認識抗体固相化ゲルを、体積比でゲル量対液量が2対1の割合になるようにPBSを加えゲルを懸濁した。
【0027】
筆者の咽頭より採取した喀痰3mlに0.5mlのPBSを添加し激しく攪拌した。該溶液を0.1Mリン酸ナトリウム緩衝液pH7.5で10倍に希釈し喀痰溶液とした。
【0028】
実施例3に示すmecA遺伝子を組み込んだpUC19により形質転換を行ったJM109を、100μg/mlのアンピシリンを添加したLB培地により37℃で一晩培養した。該培養液を上記喀痰溶液に、波長600nmにおける吸光度が0.5、0.5x10−1、0.5x10−2、0.5x10−3、となるように添加し試料とした。該試料1mlに上記大腸菌認識抗体固相化ゲル懸濁液0.1mlをそれぞれ添加し、37℃で1時間ゆるやかに攪拌した。その後ゲルを回収し、0.5mlの0.1Mリン酸ナトリウム緩衝液pH7.5で5回洗浄した後QIA prep Spin Miniprep Kit(QIAGEN社製)を用いてゲルから直接プラスミドを抽出した。
【0029】
該喀痰試料中の夾雑物は遠心操作では標的細菌と共に沈降してしまい遠心操作では除去できず、かつ抽出に用いる試料容量を増やすと夾雑物により核酸の抽出が阻害されるため、10μlを対照として用いた。上記試料それぞれ10μlからQIA prep Spin Miniprep Kit(QIAGEN社製)を用いてプラスミドを抽出した。
【0030】
該プラスミドを鋳型とし実施例3と同様にPCRを行うことによりmecA遺伝子を増幅した。反応後の増幅断片を検出するため、反応液を1%アガロースゲルにて電気泳動を行いエチジウムブロマイドにより染色した。
【0031】
標的大腸菌の検出は、該PCR増幅産物を検出することにより行った。
【0032】
電気泳動の結果を図2に示した。大腸菌認識抗体固相化ゲルを使用して大腸菌を回収した場合と使用しなかった場合において、それぞれ検出されたバンドのうち標的大腸菌の濃度が最も薄い試料のレーンを矢印で示した。その結果、大腸菌認識抗体固相化ゲルにより大腸菌を回収した場合は103倍希釈した大腸菌溶液からmecA遺伝子を検出することができた。一方、試料から直接大腸菌の検出を行った場合は、102倍希釈した大腸菌溶液までしか検出できなかった。このことは、大腸菌認識抗体固相化ゲルを使用して、希釈した大腸菌溶液から標的大腸菌を濃縮し、遠心で除去することのできない遺伝子抽出を阻害する夾雑物を除去し大腸菌を精製することが可能であることを示す。
【図面の簡単な説明】
【0033】
【図1】図1に示す電気泳動図は大腸菌認識抗体固相化ゲルを用いて大腸菌懸濁液から標的大腸菌を検出した場合の検出下限界を見たものである。検出は大腸菌からプラスミドを抽出し、該プラスミドを鋳型としたPCR増幅産物のバンドを検出することにより行った。レーン1は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5で示される場合、レーン2は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5x10−1で示される場合、レーン3は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5x10−2で示される場合、レーン4はDNAマーカーをそれぞれ示す。
【図2】図2に示す電気泳動図は大腸菌認識抗体固相化ゲルを用いて喀痰試料から標的大腸菌を検出した場合の検出下限界を見たものである。検出は大腸菌からプラスミドを抽出し、該プラスミドを鋳型としたPCR増幅産物のバンドを検出することにより行った。レーン1から4は、大腸菌認識抗体固相化ゲルを用いた場合を示し、レーン6から9は用いなかった場合、レーン5はDNAマーカーをそれぞれ示す。また、レーン1、6は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5で示される場合、レーン2、7は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5x10−1で示される場合、レーン3、8は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5x10−2で示される場合、レーン4、9は試料中の大腸菌濃度が波長600nmにおける吸光度が0.5x10−3で示される場合をそれぞれ示す。
【特許請求の範囲】
【請求項1】
標的細菌に特異的に結合する抗体を固相化した担体を試料中の標的細菌と接触させ、該抗体と標的細菌との抗原抗体反応による結合により標的細菌を担体に捕捉する工程を含んでなる、標的細菌の回収方法。
【請求項2】
標的細菌に特異的に結合する抗体を固相化した担体を試料中の標的細菌と接触させ、該抗体と標的細菌との抗原抗体反応による結合により標的細菌を担体に捕捉する工程、該標的細菌結合担体を洗浄することにより標的細菌を精製する工程、該標的細菌結合担体から核酸を抽出する工程からなる、標的細菌の核酸回収方法。
【請求項3】
標的細菌に特異的に結合する抗体を固相化した担体を試料中の標的細菌と接触させ、該抗体と標的細菌との抗原抗体反応による結合により標的細菌を担体に捕捉する工程、該標的細菌結合担体を洗浄することにより標的細菌を精製する工程、該標的細菌結合担体から核酸を抽出する工程、抽出した核酸を増幅、検出する工程からなる、標的細菌の検出方法。
【請求項4】
担体に固相化する標的細菌に特異的に結合する抗体量が、湿潤担体量1mlに対して0.5mg以上10mg以下である、請求項1乃至3に記載の方法。
【請求項5】
抗体を固相化する担体の粒子径が、5μm以上500μm以下である、請求項1乃至3に記載の方法。
【請求項1】
標的細菌に特異的に結合する抗体を固相化した担体を試料中の標的細菌と接触させ、該抗体と標的細菌との抗原抗体反応による結合により標的細菌を担体に捕捉する工程を含んでなる、標的細菌の回収方法。
【請求項2】
標的細菌に特異的に結合する抗体を固相化した担体を試料中の標的細菌と接触させ、該抗体と標的細菌との抗原抗体反応による結合により標的細菌を担体に捕捉する工程、該標的細菌結合担体を洗浄することにより標的細菌を精製する工程、該標的細菌結合担体から核酸を抽出する工程からなる、標的細菌の核酸回収方法。
【請求項3】
標的細菌に特異的に結合する抗体を固相化した担体を試料中の標的細菌と接触させ、該抗体と標的細菌との抗原抗体反応による結合により標的細菌を担体に捕捉する工程、該標的細菌結合担体を洗浄することにより標的細菌を精製する工程、該標的細菌結合担体から核酸を抽出する工程、抽出した核酸を増幅、検出する工程からなる、標的細菌の検出方法。
【請求項4】
担体に固相化する標的細菌に特異的に結合する抗体量が、湿潤担体量1mlに対して0.5mg以上10mg以下である、請求項1乃至3に記載の方法。
【請求項5】
抗体を固相化する担体の粒子径が、5μm以上500μm以下である、請求項1乃至3に記載の方法。
【図1】


【図2】




【図2】


【公開番号】特開2006−42743(P2006−42743A)
【公開日】平成18年2月16日(2006.2.16)
【国際特許分類】
【出願番号】特願2004−232108(P2004−232108)
【出願日】平成16年8月9日(2004.8.9)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成18年2月16日(2006.2.16)
【国際特許分類】
【出願日】平成16年8月9日(2004.8.9)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

