細菌を固定化する皮膚前処理剤
外科切開術前に皮膚をシールするため及び生存細菌を固定化するために、通常は、皮膚前処理剤の上側に皮膚シーラントが適用される。このシーラントは、通常、手術後も皮膚上に残される。この2段階の処理は、皮膚シーラントを適用する前に皮膚前処理剤を乾燥させる必要があるため、時間がかかるものであった。本発明は、皮膚上に存在する細菌の少なくとも95%を固定化することができ、かつ、シアノアクリレートを実質的に含まない皮膚前処理剤を提供する。本発明の皮膚前処理剤は、揮発性溶媒を含んでおり、ヨードフォア、ビグアニド、フェノール、第4級アミン、抗生物質、酸化物及び金属などの抗微生物化合物をさらに含み得る。本発明の皮膚前処理剤は、外科手術前に該皮膚前処理剤の上側に追加的な皮膚シーラントまたは切開ドレープなどを適用することなく使用することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は細菌を固定化する皮膚前処理剤に関する。
【背景技術】
【0002】
アメリカ合衆国の内外では、手術部位感染(surgical site infection:SSI)が患者の疾患及び死亡の重大な原因となっている。ヨーロッパでは年間3000万件の手術が行われており、そのうちの2%、すなわち60万人の患者に手術部位感染が発生している。アメリカ合衆国では、手術部位感染は、2番目に多い院内感染である。アメリカ合衆国では年間4000万件の手術が行われており、そのうちの80万〜200万件が手術部位感染に関連している。SSIは、入院期間を平均7.5日間長引かせるので、毎年、国に1億3千万〜8億4千5百万ドルの負担をかけている。手術部位感染の40〜60%は防止することができると推定されている。
【0003】
病院はSSIの発生に起因する多大な追加的コストを負担することとなり、心胸部手術に関連するSSIの場合、病院の負担が患者一人当たり25万ドル以上になるのも珍しいことではない。当然ながら、これらのコストは最終的には医療費に上乗せされ、社会が負担することとなる。このような社会的コストは、年間で10〜100億ドルになると推定されている。
【0004】
米国政府の新方針では、例えば、メディケア・メディケイド・サービスセンター(Centers for Medicare and Medicaid Services:CMS)の医療の質に基づく支払方式(Pay for Performance:P4P)プランのように、回避可能な院内感染に対して病院が責任を負うことを求めている。このプランの下では、患者が入院期間中に特定の病気に罹った場合、メディケアはもはや追加的な入院費用は支払わない。このやり方は、病院が、院内感染を防止するための予防措置を講じることを促進する。追加的な入院費用の支払いが行われない病気のリストには、いくつかの選択されたSSIが含まれる。P4Pのようなプランは、病院に、また州議会にも意識の高まりをもたらし、病院は新しい品質管理方法を実行するために積極的に行動するようになり、州議会は感染報告に取り掛かった。
【0005】
感染率を低減させるための標準的手法には、手指消毒、無菌操作、サージカルドレープの使用及び、滅菌野の形成/維持が含まれる。加えて、切開前に、切開前に切開部位の周囲皮膚の微生物含有量を減少させるための様々な追加的な方法が市場に導入されている。この目的のために、様々な抗微生物処理剤、とりわけ外科用皮膚前処理剤溶液が開発されている。例としては、アルコール、クロルヘキシジン、グルコン酸塩、またはヨードフォアを含む組成物が挙げられる。このような皮膚前処理剤溶液は、皮膚上に存在する微生物の数を大幅に低減させることができるが、皮膚上に存在する細菌を完全に根絶することは不可能であると長年考えられてきた。
【0006】
BETADINE(登録商標)(Purdue Pharma)やCHLORAPREP(登録商標)(Cardinal Healthcare)などの標準的な外科用皮膚前処理剤は、皮膚に塗布したときに抗微生物作用を発揮するが、塗布部位を完全に殺菌することはできない。また、このような標準的な外科用皮膚前処理剤は、細菌をどのレベルにおいても固定化することができない。その結果、生存細菌が、洗浄液、体液または手技操作によって切開部に移動することが可能となる。米国特許第5,916,882号(特許文献1)は、アルコール、ヨウ素及び、好適には水溶性ゲルを含むBETADINE(登録商標)に関連すると考えられている。
【0007】
DURAPREP(登録商標)(3M)または PREVAIL(登録商標)FX(Cardinal Healthcare)などの既存の膜形成前処理剤は、細菌固定化をほとんどあるいは全く提供しない(生存有機体の固定化は<90%)。また、前記膜の皮膚への付着強度は比較的弱く、手術部位の手技操作中に前記膜の望まないまたは予期せぬ剥離を引き起こし得る。米国特許第4,584,192号(特許文献2)は、DURAPREP(登録商標)に関連すると考えられており、ヨウ要素を含有する膜形成組成物が教示されており、かつ、酸性官能基モノマーを使用しないことが教示されている(段落5、55−58行目)。
【0008】
外科用膜形成組成物を提供するための他の試みも行われている。例えば、米国特許第5,547,662号(特許文献3)には、抗菌剤及び着色剤を含む膜形成皮膚前処理剤が開示されている。しかし、この特許文献は、細菌の固定化については議論していない。米国特許第6,139,856号(特許文献4)には、フッ化物ベースの膜が開示されており、抗菌剤含有化合物が含まれる。PCT国際公開第 WO 01/01994号(特許文献5)には、膜形成組成物用の水溶液が開示されている。
【0009】
手術前にヒトの皮膚を殺菌するのは不可能なので、手術部位の微生物汚染を制限するための他の方法を外科用前処理剤と併用できるように適合させることが行われてきた。そのような方法の1つは、皮膚上の細菌の固定化に基づいている。このような製品は、前処理段階で生存している微生物が皮膚から切開部へ移動する可能性を低減させる役割を果たす。このような製品の例には、3M社からIOBAN(登録商標)またはSTERIDRAPE(登録商標)の商品名で販売されている外科用切開ドレープが含まれる。切開ドレープは、手術前に、目的とする外科切開部位に適用される接着性フィルムの大きなシートである。適用後、外科医は、切開ドレープを介して皮膚を切開する。切開ドレープはその後、切開部を閉じるときまで適用した位置に留められ、創傷部を閉じるときに皮膚から部分的または完全に取り除かれる。
【0010】
理論上、このようなフィルム型の切開ドレープは、創傷部位の汚染を減少させ、それによりSSIの発生率を減少させるという利点を提供する。しかし、実際は、様々な研究が、前記切開ドレープの有効性が疑わしいことを示唆している。いくつかの研究は、切開ドレープを使用することにより創傷汚染を減少させることができるという利点を示している。しかし、他の研究は、切開ドレープには、創傷部の周囲への接着が失われ、それによりその後の手技に不具合が生じるなどのいくつかの短所があることを示唆している。従来の切開ドレープは、皮膚切開部の周縁部に対する接着に不具合が生じた場合、そのような不具合が生じない場合と比べて、SSI感染率が大幅に増加する。
【0011】
切開ドレープ及び皮膚シーラントは、外科用皮膚前処理剤の代替物としてではなく、外科用皮膚前処理剤と共に使用される補助的な製品と見なされている。そのため、医療従事者は、外科処置を開始する前に、2つの互いに異なる製品を手に持って前記2つの製品を患者に各々適用する必要があったため時間がかかった。病院、特に手術室(OR)では、空間と時間は両方とも非常に貴重なものである。1つの製品で皮膚上の細菌の殺菌及び固定化を1回のステップで行うことができれば、空間及び時間を節約することができる。したがって、細菌を固定化することができ、かつ殺菌作用を有する皮膚前処理剤またはシーラントが求められていることは明らかである。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】米国特許第5,916,882号明細書
【特許文献2】米国特許第4,584,192号明細書
【特許文献3】米国特許第5,547,662号明細書
【特許文献4】米国特許第6,139,856号明細書
【特許文献5】PCT国際公開第 WO 01/01994号公報
【特許文献6】米国特許第6,342,213号明細書
【発明の概要】
【課題を解決するための手段】
【0013】
上記課題を解決するために、本発明は、皮膚への良好な付着性を有し、かつ細菌を固定化することができる、アルコール可溶性及び水不溶性を有する膜形成組成物を提供する。本発明の膜形成皮膚前処理剤組成物は、単独で、すなわち手術前にその上側に適用される皮膚シーラントまたは切開ドレープを用いることなく使用することができる。
【0014】
本発明の組成物は、揮発性溶媒と、次の(a)〜(d)からなる群より選択される膜形成化合物とを含む。(a)アルキルアルコールのアクリル酸エステル、アルキルアルコールのメタクリル酸エステル及び、アクリル酸若しくはメタアクリル酸の繰り返し単位を含む化合物、(b)アルキルビニルエーテル及び無水マレイン酸エステル酸の酸エステルの繰り返し単位を含む化合物、(c)アルキルアルコールのメタクリル酸エステル及びビニルピリジンの繰り返し単位を含む化合物、及び(d)アルキルアクリルアミド及びアクリル酸若しくはメタアクリル酸の繰り返し単位並びに天然ゴム樹脂を含む化合物。本発明の組成物は、任意選択で、さらなる殺菌作用を提供する追加的な抗菌剤を含み得る。
【図面の簡単な説明】
【0015】
【図1】細菌の固定化数を示すグラフである。
【図2】細菌の固定化数を示すグラフである。
【図3】細菌の固定化数を示すグラフである。
【図4】細菌の固定化数を示すグラフである。
【図5】皮膚への付着強度を示すグラフである。
【発明を実施するための形態】
【0016】
本発明は、1回の塗布ステップで皮膚細菌叢(フローラ)を効果的に固定化しかつ随意的に殺滅することができる、皮膚に優しい膜形成組成物に関する。
【0017】
本発明の組成物は、急速乾燥及び、塗布ステップ中における随意的な抗微生物効果を確実にするために、揮発性溶媒(望ましくはアルコール)を含むこと、並びに、シアノアクリレートを含まないことが望ましい。皮膚上に形成された膜は、
・洗浄中または体液と接触したときに洗い流されないように耐水性を有し、
・外科処置の間中に行われる手技操作中に無傷状態を持続的に保つために、良好な皮膚付着性及び柔軟性を有し、かつ
・形成された膜の下側の皮膚上に存在する生存細菌の少なくとも90%、好ましくは99%を固定化することができる。
【0018】
本発明の組成物は、随意的に、さらなる殺菌効果を提供する追加的な抗微生物剤を含み得る。追加的な抗微生物剤の例には、ヨードフォア(PVP−I)、ビグアニド(CHG)、フェノール(PCMX)、第4級アミン(塩化ベンザルコニウム)、抗生物質、酸化物、金属(銀)が含まれる。本発明の膜形成組成物はまた、補助的なドレープまたは包帯の皮膚への結合性を向上させるための粘着性付与剤(天然ゴム、接着剤など)や、塗布された位置を示すための着色剤をさらに含み得る。適切なゴムには、マスチックゴム、ボスウェリン(boswellin)、ベンゾイン化合物、エレミゴムが含まれる。
【0019】
揮発性溶媒は、約20℃ないし約40℃(すなわち、室温付近またはそれ以上の温度)で揮発する化学薬品である。揮発性溶媒には、アルコール、エステル、塩素化炭化水素、エステル、クロロフルオロカーボンが含まれる。例示的な揮発性溶媒には、イソプロパノール、エタノール、酢酸エチル、トリクロロエタン、アセトンが含まれる。
【0020】
上記の基準に最も適合する候補を決定するための試験方法を開発した。その試験方法を下記に示す。
【0021】
固定化試験方法
【0022】
試薬
【0023】
クエン酸緩衝液
【0024】
クエン酸の0.1M水溶液を調製した(1000mL中に21.01gの無水試薬グレードのクエン酸{HOC(COOH)(CH2COOH)2}を溶解させた)。ろ過し、殺菌した後、4℃で保存した(有効保存期間3か月)。クエン酸ナトリウムの0.1M水溶液を調製した(1000mL中に29.41gのNa3C6H5O7・2H2Oを溶解させた(有効保存期間3か月)。CB:メスシリンダーで0.1Mのクエン酸16.0mLを計量した。メスシリンダーに34.0mLのクエン酸ナトリウムを加えた。蒸留水を加えて100mLにした。1M NaOH及び/または5M HClを用いて、pHを5.5±0.1に調節した。ろ過し、殺菌した後、2〜8℃で保存した(有効保存期間1か月)。
【0025】
リン酸緩衝皮膚溶離剤(Phosphate Buffered Skin Eluant:PBSE)
【0026】
1000mL中に、12.36gのNa2HPO4(無水試薬グレード)、1.80gのNaH2PO4・H2O(試薬グレード)及び85.00gのNaCl(試薬グレード)を溶解させ、リン酸緩衝生理食塩水の10倍の原液を調製した。ろ過し、殺菌した後、室温で1年を超えない期間で保存した。PBSE:850mLの蒸留水に100mLの10倍原液を加えた。PBSに、10.0mlのTRITON X-100、20.0mlのTween-80、1.00gのペプトン、及び16.66gのレシチンを加えた。継続的に撹拌しながら沸点まで加熱した後、加熱を止め、レシチンが完全に溶解するまで継続的に撹拌した。適切なサイズのボトルに分配した後、オートクレーブ法によって殺菌した。オートクレーブから取り出し、粗熱を取った。キャップを閉め、勢いよく振った。2〜8℃で保存した。使用前に室温に順応させた。1か月後に期限が切れる。
【0027】
注意:最終水溶液の最終濃度が0.1%(w/v)となるように、PBSEにチオ硫酸ナトリウムを加えるものとする。チオ硫酸ナトリウムの添加は、無菌法を用いて行うべきである。
【0028】
皮膚サンプル
【0029】
適切な代用皮膚から、5cm×5cmの皮膚サンプルを必要数切り出した。この実験では、代用皮膚としては、非無菌MEDISKIN(登録商標)II代用皮膚(Brennen Medical, LLC, St. Paul, MN, Catalog# I-188)を用いた。MEDISKIN(登録商標)II代用皮膚は−20℃で保存し、大気条件下で30〜60分間解凍した。試験されるコード当たり、最低2つの複製を用意した。カップスクラブ法に用いられる試料採取領域は、ステンレススチール製のカップスクラブリング及び外科用マーキングペンを用いて、各皮膚サンプル上に画定した。
【0030】
皮膚接種方法
【0031】
用意した接種材料(バシラス・ステアロサーモフィラス胞子、EM Science Catalog #1.11499.0001、pH5.5の殺菌したクエン酸塩緩衝剤中に〜107CFU/ml)の25μLのアリコートを各皮膚サンプルの中央に加え、殺菌したガラス棒を用いてサンプル採取領域全体に均一に広げた。その後、前記皮膚サンプルをペトリ皿に入れた。ペトリ皿の蓋は、前記皮膚サンプルが乾燥するまで開けておいた。
【0032】
皮膚処理
【0033】
試験する膜形成物質0.1または1.0mL(各用量は0.004または0.04ml/cm2である)をピペットで取って皮膚サンプルの中央に添加し、殺菌したガラス棒を用いてサンプルの全面に広げることにより、前記乾燥させた接種皮膚サンプルを処理した。前記皮膚サンプルをペトリ皿に入れた。ペトリ皿の蓋は、少なくとも30分間または前記皮膚サンプルが乾燥するまで(最大120分間)開けておいた。
【0034】
試験サンプルの回収
【0035】
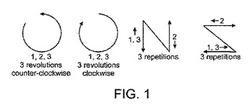
各サンプルについて、滅菌したカップスクラブリングを、サンプル採取領域の真上にしっかりと固定した。前記リングを固定した状態で、ピペットを使用して2mLのリン酸緩衝皮膚溶離剤(PBSE)を試験部位に添加した。殺菌したガラス棒を使用して、試験部位を優しくこすり、この動作を、反時計方向、時計方向、前後方向、左右方向に3回ずつ繰り返した。図1を参照されたい。
【0036】
殺菌したピペットを使用して、カップスクラブリングの内側から前記溶離剤を抽出し、殺菌した試験管へ移した。最初の回収プロセスの後、同一の試験部位にさらに2mLのPBSEを加え、殺菌したガラス棒を使用して優しくこすり、同一の収容用試験管に入れて混合させた。前記試験管には約4mLの前記溶離剤が収容された。
【0037】
試験管に収容した前記溶離剤をPBSEによって10倍に連続的に希釈した。各溶離剤サンプルから回収した生存胞子の総数を定量化するために、各希釈物をトリプシン大豆寒天(TSA)上に載置した(2組作製した)。
【0038】
培養及び観察
【0039】
全てのTSAプレートを50±2℃で48±4時間培養した。培養後、各プレートのコロニー形成単位(CFU)の総数を数え、記録した。各プレートのCFU総数から、LOG10CFU/サンプルを計算した。被験物質での処理を行った試験コードを、胞子を接種したが被験物質での処理を行わなかったサンプルと比較した。被験物質に起因するCFUの数の減少は、後述する「固定化」の欄で報告する。LOG10未処理数−LOG10処理数=LOG10膜形成ポリマーによる固定化数。例示的な材料及び比較材料の固定化数の結果を図2〜4に示す。各材料の組成は後述する。
【0040】
皮膚への付着強度の試験方法
【0041】
ASTM D5179-02「有機コーティングのプラスチック基材への付着を直接引張試験によって測定するための標準試験方法(Standard Test Method for Measuring Adhesion of Organic Coatings to Plastic Substrates by Direct Tensile Testing)」を修正した方法を用いて、膜の皮膚への付着強度を測定した。この方法は、ASTM F-2256やASTM F2458などの他のASTM試験方法よりも再現性が高い、皮膚への付着強度の測定方法であることが認められているので選択された。また、この方法は、カップスクラブ法と同じサイズ及びポリマー投与レベルのサンプルを利用するという利点を有しているので、付着強度と細菌固定化能力との直接的な比較が可能となる。全てのステップは、環境が調節された部屋(22〜24℃、相対湿度48〜52%)内で行った。代用皮膚(Brennen Medical, LLC(St. Paul, MN)社製のPorcine Test Material, Cat# I-188)を5cm×5cmの正方形に切断した。この皮膚サンプルを以下のステップに従って処理した。
・1つの皮膚サンプルを両面テープ片(幅5cm×長さ〜15cm、3M(登録商標)410B-7197-017)の中央に載置した。皮膚サンプルが両面テープ片に強固に結合されることを確実にするために、皮膚サンプルを載置する直前に、皮膚サンプルが載置される両面テープ片の中央にシアノアクリレート接着剤を0.1〜0.2ml塗布した。シアノアクリレート接着剤は、皮膚サンプルが配置される場所の全体に液滴として分布させた。
・各サンプルを、0.1mlのシアノアクリレート組成物または0.1mlの膜形成ポリマーで処理した。ガラス棒を使用して前記前処理剤を皮膚サンプルの表面全体に均等に広げ、最低15分間、最大40分間乾燥させた。外科用前処理剤溶液がシアノアクリレートの付着強度に与える影響を調べる場合は、シアノアクリレートを塗布する前に、0.1mlの前処理剤溶液を皮膚サンプルに塗布し、皮膚サンプル表面全体に広げた後、最低15分間乾燥させた。
・前処理剤を乾燥させた後、両面テープにおけるサンプルが結合されていない方の面を持って、皮膚サンプルを結合力試験機の載置台に載置した。
・各サンプルの試験を行う前に、結合力試験機のテスト運転を行った。テスト運転は、サンプル上に非粘着性紙を配置し、結合試験機を60psiで3秒間運転した。
・両面テープ(幅2.5cm×長さ〜5cm、3M(登録商標)410B-7197-017)の切片を、2.5cm×2.5cmの底面積を有するステンレス製スタッドの底部に載置した。テープ側を下にして前記スタッドを前記結合試験機に配置した。全てのサンプル面積は、スタッドと同じ寸法(2.5cm×2.5cm)にした。
・その後、試験を開始し、前記スタッド及びサンプルを、60psiで30秒間、互いに接触させた。これは、スタッド上の前記テープを、前記皮膚表面上の前記処理膜に良好に接着させるのに十分な時間である。
・30秒後、前記スタッド及びサンプルを互いに引き離し、両者を引き離すのに要する力(Kg重)を測定した。皮膚サンプルの表面から前記膜が除去されたかどうかを調べるために、及び、前記膜の皮膚への付着強度が正確に測定されたことを確実にするために、前記スタッドを視覚的に評価した。前記膜が前記サンプルから除去されてない場合、その試験は有意と見なさない。
【0042】
材料
【0043】
膜形成ポリマーは、International Specialty Products(ISP)社、National Starch社及びSigma-Aldrich社から入手した。Sigma-Aldrich社の製品は商品名では販売されていないので、製品番号を記載した。
【0044】
【表1】

【0045】
例示的な膜形成剤
【0046】
Dermacryl 79及びDermacryl C。Demacrylポリマーシリーズは、National Starch社から入手可能である。Dermacryl 79は、アルキルアクリルアミドと、アクリル酸若しくはメタアクリル酸との繰り返し単位(以下に示すA参照)を含むコポリマー化合物であり、白色粉体として提供される。Dermacryl Cは、アルキルアルコールのアクリル酸エステルと、アルキルアルコールのメタアクリル酸エステルと、アクリル酸若しくはメタアクリル酸との繰り返し単位(以下に示すB参照)を含むコポリマー化合物であり、水性エマルションとして提供される。前記両化合物は、耐久性及び耐水性を向上させ、かつ柔らかい自然な感触を提供することができる、持続性及び柔軟性を有する透明な膜を形成するようにデザインされている。前記両化合物は、マスカラまたは他のカラー化粧品並びに日焼け止め剤において防水助剤として商業的に使用されている。
【0047】
【化1】

【0048】
Gantrez ES-435。Gantrezポリマー群は、アルキルビニルエーテルと、マレイン酸エステルとを含むコポリマー化合物からなる。これらは、優れた持続性、髪型保持性及び耐湿性を有する、非粘性の丈夫な透明膜を形成するようにデザインされている。これらは、ヘアスプレーやゲルなどの髪型固定用製品として商業的に使用されている。Gantrezの個別のバージョンは、様々なアルキルエステル官能基及び分子量をカバーしている。この種々の種類のポリマーは、調製者に、膜の付着強度及び弾性を微調整するための様々なオプションを与える。細菌固定化については、ブチルエステルを含む場合に優れた性能を発揮することが分かった(Gantrez ES-435。化学式を以下に示す)。Gantrez ES-435は、アルキルビニルエーテルと無水マレイン酸の酸エステルとの繰り返し単位(アルキルエステル長さn=4)を含むコポリマー化合物である。Gantrezポリマーは、〜50%のポリマー含有率を有する粘性イソプロピルアルコール溶液としてIPS(International Specialty Products)社から供給されたものである。
【0049】
【化2】

【0050】
アクリレートコポリマー。様々なアクリレート系コポリマーを、この実験の一環として試験した。これらの材料は、優れた膜を形成し、かつ所望の溶解性を得るために容易に改変することができるので選択された。コポリマーをアクリレート系モノマーに加えることにより、付着性、弾性、耐水性の向上などの追加的な利点を得ることができる。ビニルビリジン−コ−ブチルメタアクリレートコポリマーが、他のアクリレートコポリマーと比べて、優れた細菌固定化を提供することが分かった。このコポリマーの化学構造を下記に示す。ポリ(ビニルビリジン−コ−ブチルメタアクリレート)、別名P(VP−BMA)は、アルキルアルコールのメタアクリル酸エステルとビニルビリジンとの繰り返し単位を含むコポリマー化合物である。
【0051】
【化3】

【0052】
マスチックゴム。マスチックゴムは天然ゴム樹脂の一例である。マスチックノキ(Pistacia lentiscus)(ピスタチオ種の常緑低木)から産生される。マスチックゴムは、地中海及び中東の国々において、少なくとも約3000年に渡って、様々な胃腸薬として使用されている。古代では、マスチックゴムは、消化不良または他の腸疾患に有効な薬理作用を有するため、非常に尊ばれていた。他の適切なゴムには、ボスウェリン(boswellin)、ベンゾイン化合物及びエレミゴムが含まれる。
【0053】
比較例としての皮膚前処理剤
【0054】
市販の皮膚前処理剤。比較例として試験するために、様々な市販の皮膚前処理剤を入手した。試験される前処理剤を下記の表1に列挙する。これらの前処理剤は、様々な有効な抗菌剤を含んでいる様々な組成物である。これらの前処理剤のうちの4つは、抗菌剤に加えて、非公表の膜形成剤を含んでいる。全ての前処理剤溶液をそれらの塗布器から取り出し(該当する場合は)、上述した試験方法を用いて試験した。これらの比較例は、既存の市販の皮膚前処理剤が最小限の細菌固定化しか提供しないことを示す。
【0055】
【表2】

【0056】
他の比較例としてのポリマー
【0057】
Gantrezポリマーシリーズ。Gantrez SP-215及びES- 335は、エチルビニルエーテル及びマレイン酸エステルである(化学構造式を下記に示す)。Gantrez SP-215は、アルキルビニルエーテルと無水マエイン酸の酸エステルとの繰り返し単位を含むコポリマー化合物である(アルキルエステル長さn=2)。Gantrez ES-335は、アルキルビニルエーテルと無水マエイン酸の酸エステルとの繰り返し単位を含むコポリマー化合物である(アルキルエステル長さn=3)。Gantrezポリマーは、〜50%のポリマー含有率を有する粘性アルコール溶液としてIPS(International Specialty Products)社から供給されたものである。これらは、優れた持続性、髪型保持性及び耐湿性を有する、非粘性の丈夫な透明膜を形成するようにデザインされている。これらは、ヘアスプレーやゲルなどの髪型固定用製品として商業的に使用されている。これらの比較例は、細菌固定化を達成するためには、マレイン酸エステルの選択が重要であることを示す。
【0058】
【化4】

【0059】
Stylezeポリマーシリーズ。Stylezeポリマーは、ビニルピロリドン、アクリル酸及び、アルキルアルコールのメタアクリル酸エステルの繰り返し単位を含むコポリマーである(化学構造式を下記に示す)。Stylezeポリマーは、IPS社から白色紛体として市販されている。Styleze 2000製品は、向上した耐湿性を提供し、髪への保持性を強化するために、髪型固定用製品としての役割を果たすことができるようにデザインされている。この比較例は、化粧品の分野の全ての髪型固定剤が、細菌固定化を提供しないことを示す。
【0060】
【化5】

【0061】
Antaronポリマーシリーズ。これらの材料は、ビニルピロリドンと長鎖オレフィンのコポリマーである。Anatron 220-Fは、アルキル置換されたビニルピロリドンの繰り返し単位を含むポリマー化合物である(化学構造式を下記に示す)。これらの溶液中での溶解特性及び粘性は、分子構造及び重量により調節することができる。Antaron V/WPグレードは、優れた膜形成剤であり、耐水性、耐久性及び防湿性を提供する。また、これらは、皮膚持続性が高い。この比較例は、全てのポリマー膜が、適切な細菌固定化を提供する耐水性及び/または耐久性を有する材料としてデザインされていないことを示す。
【0062】
【化6】

【0063】
Acrylateコポリマー。様々なアクリレート系コポリマーを、この実験の一環として試験した。これらの材料は、優れた膜を形成し、かつ所望の溶解性を得るために容易に改変することができるので選択された。コポリマーをアクリレート系モノマーに加えることにより、付着性、弾性、耐水性の向上などの追加的な利点を得ることができる。試験したポリマーのいくつかの例と、それらの化学構造式を下記に示す。これらの比較例は、全ての不水溶性アクリル系コポリマーが細菌固定化を提供しないことを実証するために選択された。ポリ(ブチルメタアクリレート−コ−メチルメタアクリレート)、別名P(BMA−MMA)は、2つの別個のアルキルアルコールのメタアクリル酸エステルを含むコポリマー化合物である。ポリ(ビニルアセテート−コ−ブチルマレート−コ−イソブルニルアクリレート)、別名P(VAc−BM−iBA)は、ビニルアセテートと、アルキルマレイン酸と、アルキルアルコールのアクリル酸エステルとの繰り返し単位を含むコポリマー化合物である。
【0064】
【化7】

【0065】
被験材料
【0066】
【表3】

【0067】
【表4】

【0068】
【表5】

【0069】
固定化の結果。比較を容易にするために、結果を表またはグラフ形式で示す。
【0070】
【表6】

【0071】
【表7】

【0072】
【表8】

【0073】
膜形成化合物は、本発明の皮膚前処理組成物の5〜50重量%、より好ましくは10〜30重量%の量で存在すべきであることが分かった。
【0074】
皮膚への付着強度の試験結果:ほとんどの材料は皮膚への付着性が適切であると考えられるので、実施例及び比較例の一部のみを試験した。結果を図5にグラフ形式で示す。
【0075】
結果から明らかに分かるように、実施例の材料は、比較例よりも優れた固定化特性を有する。
【0076】
従来の皮膚前処理剤、すなわち、それを通じて外科的切開術が行われる膜形成バリアとして使用するのに加えて、本発明のインジケータ及び硬化性皮膚前処理剤組成物は、創傷、打撲傷、擦り傷、やけど、にきび、水脹れ、かみ傷、刺し傷、爪、角質、穿刺、切り傷及び他の皮膚崩壊を、その後の汚染から保護するためにまたは事前感染領域の拡大による存在を示すために閉じる及び/または覆う絆創膏(または包帯)のように使用することもできる。したがって、本発明の皮膚前処理剤組成物の使用は、医療従事者に限定されるものではない。また、本発明の皮膚前処理剤組成物の塗布前における皮膚前処理剤の使用は必須ではない。
【0077】
創傷保護は、治癒過程を実施するために重要である。従来の絆創膏やガーゼ創傷包帯は、急性創傷または皮膚炎を治療/保護するために消費者に使用されてきた。このような絆創膏は、創傷治癒のための化学的処置はほとんど提供しないため、一般的に能動的に作用しない。このような絆創膏は、主に、創傷部に低レベルの圧力を加え、周囲環境に露出しないように創傷部を保護し、かつ創傷部から滲出する体液を吸収する役割を果たす。このような絆創膏は一般的に、創傷部に貼った後にユーザーから見える基層を含む。前記基層は一般的に、ポリマー材料(例えばフィルム)、不織布ウエブまたはそれらの組み合わせから作成されており、柔軟性及び/または通気性を高めるために何らかの方法で穿孔されている。前記基層は、多くの場合、絆創膏を創傷部に貼った後にユーザーから見える上面と、底面(皮膚接触面)とを有するフィルム要素を含む。絆創膏をユーザーに貼り付ける手段を提供するために、通常、前記基層の前記底面に皮膚に優しい接着剤が配されている。また、絆創膏/創傷包帯が非接着型である場合は、別個の接着テープを使用して創傷部に貼り付ける。前記基層の前記底面の中央には一般的に、前記創傷からの滲出液を吸収するための吸収パッドが配置されている。そして、前記吸収パッドと前記創傷部との間にバリアを設けるために、通常は、前記吸収パッドの表面(皮膚側面)に非粘性の穿孔膜層が設けられている。このことにより、創傷液は、創傷部に粘着することなく、前記穿孔膜層を通過することができる。一般的に、このような絆創膏の前記吸収パッドは薬剤成分を含んでいないが、比較的最近では、絆創膏メーカーは、創傷治癒を助長するために、抗生物質製剤を絆創膏の表面または内部に含めることを始めている。
【0078】
本発明の皮膚前処理剤は、この複雑な絆創膏構造を、乾燥すると柔軟性コーティングとなって創傷部を絆創膏と同じように保護することができる1回の液体処理に置き換えることができる。さらに、微生物阻害領域の形成や創傷治癒の促進などのさらなる利益を提供するために、本発明の組成物に抗生物質等の薬剤が有効量で混合される。本発明の皮膚前処理剤は、表在性の創傷、やけど、または擦り傷の表面を覆う効果的な厚さの膜コーティングを形成するために塗布される。治療される創傷が表在性であり皮層下まで延在していないため、創傷内に拡散または形成されるポリマー残基は、皮膚から自然に押し出される。一般的に、本発明の皮膚前処理剤は、創傷領域を覆い、十分な柔軟性及び組織に対する付着性を有し、かつ剥離及び亀裂がすぐに生じない付着性膜コーティングを提供する。前記コーティングは一般的に、約0.5mm以下の厚さを有する。
【0079】
このような厚さのシーラントコーティングは、従来の絆創膏と同じような方法で創傷部を保護する物理的バリア層を、表存性創傷上に形成する。具体的には、前記コーティングは、創傷部が濡れたときでも交換する必要がない略気密性の防水シールを、創傷部の周りに形成する。形成されたコーティングは細菌及び汚染物質が創傷部に進入するのを防止する。そのため、二次感染の可能性が減少する。一般的に、この付着性コーティングは、コーティングされた領域を動かすことを妨げない。また、この付着性コーティングは、創傷の早期治癒を促進することができる。さらに、従来の絆創膏とは異なり、このコーティングは適用した2〜3日後に皮膚から自然に剥がれ落ちるので、従来の絆創膏を皮膚から剥がすときのような不快感はない。なお、このポリマーコーティングを早期に除去したい場合は、アセトン等の溶剤を使用することにより除去することができる。このことについての詳細は米国特許第6,342,213号(特許文献6)を参照されたい。
【0080】
当業者に理解されるように、本発明の変更形態及び変形形態は当業者の能力の範囲内にあると考えられる。本発明者は、そのような変更形態及び変形形態が本発明の範囲に含まれることを意図している。また、本発明の範囲は、本明細書に開示されている特定の実施形態に限定されるものと解釈されるべきではなく、先述の開示を踏まえて添付の請求項にのみ従うものであると理解されたい。
【技術分野】
【0001】
本発明は細菌を固定化する皮膚前処理剤に関する。
【背景技術】
【0002】
アメリカ合衆国の内外では、手術部位感染(surgical site infection:SSI)が患者の疾患及び死亡の重大な原因となっている。ヨーロッパでは年間3000万件の手術が行われており、そのうちの2%、すなわち60万人の患者に手術部位感染が発生している。アメリカ合衆国では、手術部位感染は、2番目に多い院内感染である。アメリカ合衆国では年間4000万件の手術が行われており、そのうちの80万〜200万件が手術部位感染に関連している。SSIは、入院期間を平均7.5日間長引かせるので、毎年、国に1億3千万〜8億4千5百万ドルの負担をかけている。手術部位感染の40〜60%は防止することができると推定されている。
【0003】
病院はSSIの発生に起因する多大な追加的コストを負担することとなり、心胸部手術に関連するSSIの場合、病院の負担が患者一人当たり25万ドル以上になるのも珍しいことではない。当然ながら、これらのコストは最終的には医療費に上乗せされ、社会が負担することとなる。このような社会的コストは、年間で10〜100億ドルになると推定されている。
【0004】
米国政府の新方針では、例えば、メディケア・メディケイド・サービスセンター(Centers for Medicare and Medicaid Services:CMS)の医療の質に基づく支払方式(Pay for Performance:P4P)プランのように、回避可能な院内感染に対して病院が責任を負うことを求めている。このプランの下では、患者が入院期間中に特定の病気に罹った場合、メディケアはもはや追加的な入院費用は支払わない。このやり方は、病院が、院内感染を防止するための予防措置を講じることを促進する。追加的な入院費用の支払いが行われない病気のリストには、いくつかの選択されたSSIが含まれる。P4Pのようなプランは、病院に、また州議会にも意識の高まりをもたらし、病院は新しい品質管理方法を実行するために積極的に行動するようになり、州議会は感染報告に取り掛かった。
【0005】
感染率を低減させるための標準的手法には、手指消毒、無菌操作、サージカルドレープの使用及び、滅菌野の形成/維持が含まれる。加えて、切開前に、切開前に切開部位の周囲皮膚の微生物含有量を減少させるための様々な追加的な方法が市場に導入されている。この目的のために、様々な抗微生物処理剤、とりわけ外科用皮膚前処理剤溶液が開発されている。例としては、アルコール、クロルヘキシジン、グルコン酸塩、またはヨードフォアを含む組成物が挙げられる。このような皮膚前処理剤溶液は、皮膚上に存在する微生物の数を大幅に低減させることができるが、皮膚上に存在する細菌を完全に根絶することは不可能であると長年考えられてきた。
【0006】
BETADINE(登録商標)(Purdue Pharma)やCHLORAPREP(登録商標)(Cardinal Healthcare)などの標準的な外科用皮膚前処理剤は、皮膚に塗布したときに抗微生物作用を発揮するが、塗布部位を完全に殺菌することはできない。また、このような標準的な外科用皮膚前処理剤は、細菌をどのレベルにおいても固定化することができない。その結果、生存細菌が、洗浄液、体液または手技操作によって切開部に移動することが可能となる。米国特許第5,916,882号(特許文献1)は、アルコール、ヨウ素及び、好適には水溶性ゲルを含むBETADINE(登録商標)に関連すると考えられている。
【0007】
DURAPREP(登録商標)(3M)または PREVAIL(登録商標)FX(Cardinal Healthcare)などの既存の膜形成前処理剤は、細菌固定化をほとんどあるいは全く提供しない(生存有機体の固定化は<90%)。また、前記膜の皮膚への付着強度は比較的弱く、手術部位の手技操作中に前記膜の望まないまたは予期せぬ剥離を引き起こし得る。米国特許第4,584,192号(特許文献2)は、DURAPREP(登録商標)に関連すると考えられており、ヨウ要素を含有する膜形成組成物が教示されており、かつ、酸性官能基モノマーを使用しないことが教示されている(段落5、55−58行目)。
【0008】
外科用膜形成組成物を提供するための他の試みも行われている。例えば、米国特許第5,547,662号(特許文献3)には、抗菌剤及び着色剤を含む膜形成皮膚前処理剤が開示されている。しかし、この特許文献は、細菌の固定化については議論していない。米国特許第6,139,856号(特許文献4)には、フッ化物ベースの膜が開示されており、抗菌剤含有化合物が含まれる。PCT国際公開第 WO 01/01994号(特許文献5)には、膜形成組成物用の水溶液が開示されている。
【0009】
手術前にヒトの皮膚を殺菌するのは不可能なので、手術部位の微生物汚染を制限するための他の方法を外科用前処理剤と併用できるように適合させることが行われてきた。そのような方法の1つは、皮膚上の細菌の固定化に基づいている。このような製品は、前処理段階で生存している微生物が皮膚から切開部へ移動する可能性を低減させる役割を果たす。このような製品の例には、3M社からIOBAN(登録商標)またはSTERIDRAPE(登録商標)の商品名で販売されている外科用切開ドレープが含まれる。切開ドレープは、手術前に、目的とする外科切開部位に適用される接着性フィルムの大きなシートである。適用後、外科医は、切開ドレープを介して皮膚を切開する。切開ドレープはその後、切開部を閉じるときまで適用した位置に留められ、創傷部を閉じるときに皮膚から部分的または完全に取り除かれる。
【0010】
理論上、このようなフィルム型の切開ドレープは、創傷部位の汚染を減少させ、それによりSSIの発生率を減少させるという利点を提供する。しかし、実際は、様々な研究が、前記切開ドレープの有効性が疑わしいことを示唆している。いくつかの研究は、切開ドレープを使用することにより創傷汚染を減少させることができるという利点を示している。しかし、他の研究は、切開ドレープには、創傷部の周囲への接着が失われ、それによりその後の手技に不具合が生じるなどのいくつかの短所があることを示唆している。従来の切開ドレープは、皮膚切開部の周縁部に対する接着に不具合が生じた場合、そのような不具合が生じない場合と比べて、SSI感染率が大幅に増加する。
【0011】
切開ドレープ及び皮膚シーラントは、外科用皮膚前処理剤の代替物としてではなく、外科用皮膚前処理剤と共に使用される補助的な製品と見なされている。そのため、医療従事者は、外科処置を開始する前に、2つの互いに異なる製品を手に持って前記2つの製品を患者に各々適用する必要があったため時間がかかった。病院、特に手術室(OR)では、空間と時間は両方とも非常に貴重なものである。1つの製品で皮膚上の細菌の殺菌及び固定化を1回のステップで行うことができれば、空間及び時間を節約することができる。したがって、細菌を固定化することができ、かつ殺菌作用を有する皮膚前処理剤またはシーラントが求められていることは明らかである。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】米国特許第5,916,882号明細書
【特許文献2】米国特許第4,584,192号明細書
【特許文献3】米国特許第5,547,662号明細書
【特許文献4】米国特許第6,139,856号明細書
【特許文献5】PCT国際公開第 WO 01/01994号公報
【特許文献6】米国特許第6,342,213号明細書
【発明の概要】
【課題を解決するための手段】
【0013】
上記課題を解決するために、本発明は、皮膚への良好な付着性を有し、かつ細菌を固定化することができる、アルコール可溶性及び水不溶性を有する膜形成組成物を提供する。本発明の膜形成皮膚前処理剤組成物は、単独で、すなわち手術前にその上側に適用される皮膚シーラントまたは切開ドレープを用いることなく使用することができる。
【0014】
本発明の組成物は、揮発性溶媒と、次の(a)〜(d)からなる群より選択される膜形成化合物とを含む。(a)アルキルアルコールのアクリル酸エステル、アルキルアルコールのメタクリル酸エステル及び、アクリル酸若しくはメタアクリル酸の繰り返し単位を含む化合物、(b)アルキルビニルエーテル及び無水マレイン酸エステル酸の酸エステルの繰り返し単位を含む化合物、(c)アルキルアルコールのメタクリル酸エステル及びビニルピリジンの繰り返し単位を含む化合物、及び(d)アルキルアクリルアミド及びアクリル酸若しくはメタアクリル酸の繰り返し単位並びに天然ゴム樹脂を含む化合物。本発明の組成物は、任意選択で、さらなる殺菌作用を提供する追加的な抗菌剤を含み得る。
【図面の簡単な説明】
【0015】
【図1】細菌の固定化数を示すグラフである。
【図2】細菌の固定化数を示すグラフである。
【図3】細菌の固定化数を示すグラフである。
【図4】細菌の固定化数を示すグラフである。
【図5】皮膚への付着強度を示すグラフである。
【発明を実施するための形態】
【0016】
本発明は、1回の塗布ステップで皮膚細菌叢(フローラ)を効果的に固定化しかつ随意的に殺滅することができる、皮膚に優しい膜形成組成物に関する。
【0017】
本発明の組成物は、急速乾燥及び、塗布ステップ中における随意的な抗微生物効果を確実にするために、揮発性溶媒(望ましくはアルコール)を含むこと、並びに、シアノアクリレートを含まないことが望ましい。皮膚上に形成された膜は、
・洗浄中または体液と接触したときに洗い流されないように耐水性を有し、
・外科処置の間中に行われる手技操作中に無傷状態を持続的に保つために、良好な皮膚付着性及び柔軟性を有し、かつ
・形成された膜の下側の皮膚上に存在する生存細菌の少なくとも90%、好ましくは99%を固定化することができる。
【0018】
本発明の組成物は、随意的に、さらなる殺菌効果を提供する追加的な抗微生物剤を含み得る。追加的な抗微生物剤の例には、ヨードフォア(PVP−I)、ビグアニド(CHG)、フェノール(PCMX)、第4級アミン(塩化ベンザルコニウム)、抗生物質、酸化物、金属(銀)が含まれる。本発明の膜形成組成物はまた、補助的なドレープまたは包帯の皮膚への結合性を向上させるための粘着性付与剤(天然ゴム、接着剤など)や、塗布された位置を示すための着色剤をさらに含み得る。適切なゴムには、マスチックゴム、ボスウェリン(boswellin)、ベンゾイン化合物、エレミゴムが含まれる。
【0019】
揮発性溶媒は、約20℃ないし約40℃(すなわち、室温付近またはそれ以上の温度)で揮発する化学薬品である。揮発性溶媒には、アルコール、エステル、塩素化炭化水素、エステル、クロロフルオロカーボンが含まれる。例示的な揮発性溶媒には、イソプロパノール、エタノール、酢酸エチル、トリクロロエタン、アセトンが含まれる。
【0020】
上記の基準に最も適合する候補を決定するための試験方法を開発した。その試験方法を下記に示す。
【0021】
固定化試験方法
【0022】
試薬
【0023】
クエン酸緩衝液
【0024】
クエン酸の0.1M水溶液を調製した(1000mL中に21.01gの無水試薬グレードのクエン酸{HOC(COOH)(CH2COOH)2}を溶解させた)。ろ過し、殺菌した後、4℃で保存した(有効保存期間3か月)。クエン酸ナトリウムの0.1M水溶液を調製した(1000mL中に29.41gのNa3C6H5O7・2H2Oを溶解させた(有効保存期間3か月)。CB:メスシリンダーで0.1Mのクエン酸16.0mLを計量した。メスシリンダーに34.0mLのクエン酸ナトリウムを加えた。蒸留水を加えて100mLにした。1M NaOH及び/または5M HClを用いて、pHを5.5±0.1に調節した。ろ過し、殺菌した後、2〜8℃で保存した(有効保存期間1か月)。
【0025】
リン酸緩衝皮膚溶離剤(Phosphate Buffered Skin Eluant:PBSE)
【0026】
1000mL中に、12.36gのNa2HPO4(無水試薬グレード)、1.80gのNaH2PO4・H2O(試薬グレード)及び85.00gのNaCl(試薬グレード)を溶解させ、リン酸緩衝生理食塩水の10倍の原液を調製した。ろ過し、殺菌した後、室温で1年を超えない期間で保存した。PBSE:850mLの蒸留水に100mLの10倍原液を加えた。PBSに、10.0mlのTRITON X-100、20.0mlのTween-80、1.00gのペプトン、及び16.66gのレシチンを加えた。継続的に撹拌しながら沸点まで加熱した後、加熱を止め、レシチンが完全に溶解するまで継続的に撹拌した。適切なサイズのボトルに分配した後、オートクレーブ法によって殺菌した。オートクレーブから取り出し、粗熱を取った。キャップを閉め、勢いよく振った。2〜8℃で保存した。使用前に室温に順応させた。1か月後に期限が切れる。
【0027】
注意:最終水溶液の最終濃度が0.1%(w/v)となるように、PBSEにチオ硫酸ナトリウムを加えるものとする。チオ硫酸ナトリウムの添加は、無菌法を用いて行うべきである。
【0028】
皮膚サンプル
【0029】
適切な代用皮膚から、5cm×5cmの皮膚サンプルを必要数切り出した。この実験では、代用皮膚としては、非無菌MEDISKIN(登録商標)II代用皮膚(Brennen Medical, LLC, St. Paul, MN, Catalog# I-188)を用いた。MEDISKIN(登録商標)II代用皮膚は−20℃で保存し、大気条件下で30〜60分間解凍した。試験されるコード当たり、最低2つの複製を用意した。カップスクラブ法に用いられる試料採取領域は、ステンレススチール製のカップスクラブリング及び外科用マーキングペンを用いて、各皮膚サンプル上に画定した。
【0030】
皮膚接種方法
【0031】
用意した接種材料(バシラス・ステアロサーモフィラス胞子、EM Science Catalog #1.11499.0001、pH5.5の殺菌したクエン酸塩緩衝剤中に〜107CFU/ml)の25μLのアリコートを各皮膚サンプルの中央に加え、殺菌したガラス棒を用いてサンプル採取領域全体に均一に広げた。その後、前記皮膚サンプルをペトリ皿に入れた。ペトリ皿の蓋は、前記皮膚サンプルが乾燥するまで開けておいた。
【0032】
皮膚処理
【0033】
試験する膜形成物質0.1または1.0mL(各用量は0.004または0.04ml/cm2である)をピペットで取って皮膚サンプルの中央に添加し、殺菌したガラス棒を用いてサンプルの全面に広げることにより、前記乾燥させた接種皮膚サンプルを処理した。前記皮膚サンプルをペトリ皿に入れた。ペトリ皿の蓋は、少なくとも30分間または前記皮膚サンプルが乾燥するまで(最大120分間)開けておいた。
【0034】
試験サンプルの回収
【0035】
各サンプルについて、滅菌したカップスクラブリングを、サンプル採取領域の真上にしっかりと固定した。前記リングを固定した状態で、ピペットを使用して2mLのリン酸緩衝皮膚溶離剤(PBSE)を試験部位に添加した。殺菌したガラス棒を使用して、試験部位を優しくこすり、この動作を、反時計方向、時計方向、前後方向、左右方向に3回ずつ繰り返した。図1を参照されたい。
【0036】
殺菌したピペットを使用して、カップスクラブリングの内側から前記溶離剤を抽出し、殺菌した試験管へ移した。最初の回収プロセスの後、同一の試験部位にさらに2mLのPBSEを加え、殺菌したガラス棒を使用して優しくこすり、同一の収容用試験管に入れて混合させた。前記試験管には約4mLの前記溶離剤が収容された。
【0037】
試験管に収容した前記溶離剤をPBSEによって10倍に連続的に希釈した。各溶離剤サンプルから回収した生存胞子の総数を定量化するために、各希釈物をトリプシン大豆寒天(TSA)上に載置した(2組作製した)。
【0038】
培養及び観察
【0039】
全てのTSAプレートを50±2℃で48±4時間培養した。培養後、各プレートのコロニー形成単位(CFU)の総数を数え、記録した。各プレートのCFU総数から、LOG10CFU/サンプルを計算した。被験物質での処理を行った試験コードを、胞子を接種したが被験物質での処理を行わなかったサンプルと比較した。被験物質に起因するCFUの数の減少は、後述する「固定化」の欄で報告する。LOG10未処理数−LOG10処理数=LOG10膜形成ポリマーによる固定化数。例示的な材料及び比較材料の固定化数の結果を図2〜4に示す。各材料の組成は後述する。
【0040】
皮膚への付着強度の試験方法
【0041】
ASTM D5179-02「有機コーティングのプラスチック基材への付着を直接引張試験によって測定するための標準試験方法(Standard Test Method for Measuring Adhesion of Organic Coatings to Plastic Substrates by Direct Tensile Testing)」を修正した方法を用いて、膜の皮膚への付着強度を測定した。この方法は、ASTM F-2256やASTM F2458などの他のASTM試験方法よりも再現性が高い、皮膚への付着強度の測定方法であることが認められているので選択された。また、この方法は、カップスクラブ法と同じサイズ及びポリマー投与レベルのサンプルを利用するという利点を有しているので、付着強度と細菌固定化能力との直接的な比較が可能となる。全てのステップは、環境が調節された部屋(22〜24℃、相対湿度48〜52%)内で行った。代用皮膚(Brennen Medical, LLC(St. Paul, MN)社製のPorcine Test Material, Cat# I-188)を5cm×5cmの正方形に切断した。この皮膚サンプルを以下のステップに従って処理した。
・1つの皮膚サンプルを両面テープ片(幅5cm×長さ〜15cm、3M(登録商標)410B-7197-017)の中央に載置した。皮膚サンプルが両面テープ片に強固に結合されることを確実にするために、皮膚サンプルを載置する直前に、皮膚サンプルが載置される両面テープ片の中央にシアノアクリレート接着剤を0.1〜0.2ml塗布した。シアノアクリレート接着剤は、皮膚サンプルが配置される場所の全体に液滴として分布させた。
・各サンプルを、0.1mlのシアノアクリレート組成物または0.1mlの膜形成ポリマーで処理した。ガラス棒を使用して前記前処理剤を皮膚サンプルの表面全体に均等に広げ、最低15分間、最大40分間乾燥させた。外科用前処理剤溶液がシアノアクリレートの付着強度に与える影響を調べる場合は、シアノアクリレートを塗布する前に、0.1mlの前処理剤溶液を皮膚サンプルに塗布し、皮膚サンプル表面全体に広げた後、最低15分間乾燥させた。
・前処理剤を乾燥させた後、両面テープにおけるサンプルが結合されていない方の面を持って、皮膚サンプルを結合力試験機の載置台に載置した。
・各サンプルの試験を行う前に、結合力試験機のテスト運転を行った。テスト運転は、サンプル上に非粘着性紙を配置し、結合試験機を60psiで3秒間運転した。
・両面テープ(幅2.5cm×長さ〜5cm、3M(登録商標)410B-7197-017)の切片を、2.5cm×2.5cmの底面積を有するステンレス製スタッドの底部に載置した。テープ側を下にして前記スタッドを前記結合試験機に配置した。全てのサンプル面積は、スタッドと同じ寸法(2.5cm×2.5cm)にした。
・その後、試験を開始し、前記スタッド及びサンプルを、60psiで30秒間、互いに接触させた。これは、スタッド上の前記テープを、前記皮膚表面上の前記処理膜に良好に接着させるのに十分な時間である。
・30秒後、前記スタッド及びサンプルを互いに引き離し、両者を引き離すのに要する力(Kg重)を測定した。皮膚サンプルの表面から前記膜が除去されたかどうかを調べるために、及び、前記膜の皮膚への付着強度が正確に測定されたことを確実にするために、前記スタッドを視覚的に評価した。前記膜が前記サンプルから除去されてない場合、その試験は有意と見なさない。
【0042】
材料
【0043】
膜形成ポリマーは、International Specialty Products(ISP)社、National Starch社及びSigma-Aldrich社から入手した。Sigma-Aldrich社の製品は商品名では販売されていないので、製品番号を記載した。
【0044】
【表1】

【0045】
例示的な膜形成剤
【0046】
Dermacryl 79及びDermacryl C。Demacrylポリマーシリーズは、National Starch社から入手可能である。Dermacryl 79は、アルキルアクリルアミドと、アクリル酸若しくはメタアクリル酸との繰り返し単位(以下に示すA参照)を含むコポリマー化合物であり、白色粉体として提供される。Dermacryl Cは、アルキルアルコールのアクリル酸エステルと、アルキルアルコールのメタアクリル酸エステルと、アクリル酸若しくはメタアクリル酸との繰り返し単位(以下に示すB参照)を含むコポリマー化合物であり、水性エマルションとして提供される。前記両化合物は、耐久性及び耐水性を向上させ、かつ柔らかい自然な感触を提供することができる、持続性及び柔軟性を有する透明な膜を形成するようにデザインされている。前記両化合物は、マスカラまたは他のカラー化粧品並びに日焼け止め剤において防水助剤として商業的に使用されている。
【0047】
【化1】

【0048】
Gantrez ES-435。Gantrezポリマー群は、アルキルビニルエーテルと、マレイン酸エステルとを含むコポリマー化合物からなる。これらは、優れた持続性、髪型保持性及び耐湿性を有する、非粘性の丈夫な透明膜を形成するようにデザインされている。これらは、ヘアスプレーやゲルなどの髪型固定用製品として商業的に使用されている。Gantrezの個別のバージョンは、様々なアルキルエステル官能基及び分子量をカバーしている。この種々の種類のポリマーは、調製者に、膜の付着強度及び弾性を微調整するための様々なオプションを与える。細菌固定化については、ブチルエステルを含む場合に優れた性能を発揮することが分かった(Gantrez ES-435。化学式を以下に示す)。Gantrez ES-435は、アルキルビニルエーテルと無水マレイン酸の酸エステルとの繰り返し単位(アルキルエステル長さn=4)を含むコポリマー化合物である。Gantrezポリマーは、〜50%のポリマー含有率を有する粘性イソプロピルアルコール溶液としてIPS(International Specialty Products)社から供給されたものである。
【0049】
【化2】

【0050】
アクリレートコポリマー。様々なアクリレート系コポリマーを、この実験の一環として試験した。これらの材料は、優れた膜を形成し、かつ所望の溶解性を得るために容易に改変することができるので選択された。コポリマーをアクリレート系モノマーに加えることにより、付着性、弾性、耐水性の向上などの追加的な利点を得ることができる。ビニルビリジン−コ−ブチルメタアクリレートコポリマーが、他のアクリレートコポリマーと比べて、優れた細菌固定化を提供することが分かった。このコポリマーの化学構造を下記に示す。ポリ(ビニルビリジン−コ−ブチルメタアクリレート)、別名P(VP−BMA)は、アルキルアルコールのメタアクリル酸エステルとビニルビリジンとの繰り返し単位を含むコポリマー化合物である。
【0051】
【化3】

【0052】
マスチックゴム。マスチックゴムは天然ゴム樹脂の一例である。マスチックノキ(Pistacia lentiscus)(ピスタチオ種の常緑低木)から産生される。マスチックゴムは、地中海及び中東の国々において、少なくとも約3000年に渡って、様々な胃腸薬として使用されている。古代では、マスチックゴムは、消化不良または他の腸疾患に有効な薬理作用を有するため、非常に尊ばれていた。他の適切なゴムには、ボスウェリン(boswellin)、ベンゾイン化合物及びエレミゴムが含まれる。
【0053】
比較例としての皮膚前処理剤
【0054】
市販の皮膚前処理剤。比較例として試験するために、様々な市販の皮膚前処理剤を入手した。試験される前処理剤を下記の表1に列挙する。これらの前処理剤は、様々な有効な抗菌剤を含んでいる様々な組成物である。これらの前処理剤のうちの4つは、抗菌剤に加えて、非公表の膜形成剤を含んでいる。全ての前処理剤溶液をそれらの塗布器から取り出し(該当する場合は)、上述した試験方法を用いて試験した。これらの比較例は、既存の市販の皮膚前処理剤が最小限の細菌固定化しか提供しないことを示す。
【0055】
【表2】

【0056】
他の比較例としてのポリマー
【0057】
Gantrezポリマーシリーズ。Gantrez SP-215及びES- 335は、エチルビニルエーテル及びマレイン酸エステルである(化学構造式を下記に示す)。Gantrez SP-215は、アルキルビニルエーテルと無水マエイン酸の酸エステルとの繰り返し単位を含むコポリマー化合物である(アルキルエステル長さn=2)。Gantrez ES-335は、アルキルビニルエーテルと無水マエイン酸の酸エステルとの繰り返し単位を含むコポリマー化合物である(アルキルエステル長さn=3)。Gantrezポリマーは、〜50%のポリマー含有率を有する粘性アルコール溶液としてIPS(International Specialty Products)社から供給されたものである。これらは、優れた持続性、髪型保持性及び耐湿性を有する、非粘性の丈夫な透明膜を形成するようにデザインされている。これらは、ヘアスプレーやゲルなどの髪型固定用製品として商業的に使用されている。これらの比較例は、細菌固定化を達成するためには、マレイン酸エステルの選択が重要であることを示す。
【0058】
【化4】

【0059】
Stylezeポリマーシリーズ。Stylezeポリマーは、ビニルピロリドン、アクリル酸及び、アルキルアルコールのメタアクリル酸エステルの繰り返し単位を含むコポリマーである(化学構造式を下記に示す)。Stylezeポリマーは、IPS社から白色紛体として市販されている。Styleze 2000製品は、向上した耐湿性を提供し、髪への保持性を強化するために、髪型固定用製品としての役割を果たすことができるようにデザインされている。この比較例は、化粧品の分野の全ての髪型固定剤が、細菌固定化を提供しないことを示す。
【0060】
【化5】

【0061】
Antaronポリマーシリーズ。これらの材料は、ビニルピロリドンと長鎖オレフィンのコポリマーである。Anatron 220-Fは、アルキル置換されたビニルピロリドンの繰り返し単位を含むポリマー化合物である(化学構造式を下記に示す)。これらの溶液中での溶解特性及び粘性は、分子構造及び重量により調節することができる。Antaron V/WPグレードは、優れた膜形成剤であり、耐水性、耐久性及び防湿性を提供する。また、これらは、皮膚持続性が高い。この比較例は、全てのポリマー膜が、適切な細菌固定化を提供する耐水性及び/または耐久性を有する材料としてデザインされていないことを示す。
【0062】
【化6】

【0063】
Acrylateコポリマー。様々なアクリレート系コポリマーを、この実験の一環として試験した。これらの材料は、優れた膜を形成し、かつ所望の溶解性を得るために容易に改変することができるので選択された。コポリマーをアクリレート系モノマーに加えることにより、付着性、弾性、耐水性の向上などの追加的な利点を得ることができる。試験したポリマーのいくつかの例と、それらの化学構造式を下記に示す。これらの比較例は、全ての不水溶性アクリル系コポリマーが細菌固定化を提供しないことを実証するために選択された。ポリ(ブチルメタアクリレート−コ−メチルメタアクリレート)、別名P(BMA−MMA)は、2つの別個のアルキルアルコールのメタアクリル酸エステルを含むコポリマー化合物である。ポリ(ビニルアセテート−コ−ブチルマレート−コ−イソブルニルアクリレート)、別名P(VAc−BM−iBA)は、ビニルアセテートと、アルキルマレイン酸と、アルキルアルコールのアクリル酸エステルとの繰り返し単位を含むコポリマー化合物である。
【0064】
【化7】

【0065】
被験材料
【0066】
【表3】

【0067】
【表4】

【0068】
【表5】

【0069】
固定化の結果。比較を容易にするために、結果を表またはグラフ形式で示す。
【0070】
【表6】

【0071】
【表7】

【0072】
【表8】

【0073】
膜形成化合物は、本発明の皮膚前処理組成物の5〜50重量%、より好ましくは10〜30重量%の量で存在すべきであることが分かった。
【0074】
皮膚への付着強度の試験結果:ほとんどの材料は皮膚への付着性が適切であると考えられるので、実施例及び比較例の一部のみを試験した。結果を図5にグラフ形式で示す。
【0075】
結果から明らかに分かるように、実施例の材料は、比較例よりも優れた固定化特性を有する。
【0076】
従来の皮膚前処理剤、すなわち、それを通じて外科的切開術が行われる膜形成バリアとして使用するのに加えて、本発明のインジケータ及び硬化性皮膚前処理剤組成物は、創傷、打撲傷、擦り傷、やけど、にきび、水脹れ、かみ傷、刺し傷、爪、角質、穿刺、切り傷及び他の皮膚崩壊を、その後の汚染から保護するためにまたは事前感染領域の拡大による存在を示すために閉じる及び/または覆う絆創膏(または包帯)のように使用することもできる。したがって、本発明の皮膚前処理剤組成物の使用は、医療従事者に限定されるものではない。また、本発明の皮膚前処理剤組成物の塗布前における皮膚前処理剤の使用は必須ではない。
【0077】
創傷保護は、治癒過程を実施するために重要である。従来の絆創膏やガーゼ創傷包帯は、急性創傷または皮膚炎を治療/保護するために消費者に使用されてきた。このような絆創膏は、創傷治癒のための化学的処置はほとんど提供しないため、一般的に能動的に作用しない。このような絆創膏は、主に、創傷部に低レベルの圧力を加え、周囲環境に露出しないように創傷部を保護し、かつ創傷部から滲出する体液を吸収する役割を果たす。このような絆創膏は一般的に、創傷部に貼った後にユーザーから見える基層を含む。前記基層は一般的に、ポリマー材料(例えばフィルム)、不織布ウエブまたはそれらの組み合わせから作成されており、柔軟性及び/または通気性を高めるために何らかの方法で穿孔されている。前記基層は、多くの場合、絆創膏を創傷部に貼った後にユーザーから見える上面と、底面(皮膚接触面)とを有するフィルム要素を含む。絆創膏をユーザーに貼り付ける手段を提供するために、通常、前記基層の前記底面に皮膚に優しい接着剤が配されている。また、絆創膏/創傷包帯が非接着型である場合は、別個の接着テープを使用して創傷部に貼り付ける。前記基層の前記底面の中央には一般的に、前記創傷からの滲出液を吸収するための吸収パッドが配置されている。そして、前記吸収パッドと前記創傷部との間にバリアを設けるために、通常は、前記吸収パッドの表面(皮膚側面)に非粘性の穿孔膜層が設けられている。このことにより、創傷液は、創傷部に粘着することなく、前記穿孔膜層を通過することができる。一般的に、このような絆創膏の前記吸収パッドは薬剤成分を含んでいないが、比較的最近では、絆創膏メーカーは、創傷治癒を助長するために、抗生物質製剤を絆創膏の表面または内部に含めることを始めている。
【0078】
本発明の皮膚前処理剤は、この複雑な絆創膏構造を、乾燥すると柔軟性コーティングとなって創傷部を絆創膏と同じように保護することができる1回の液体処理に置き換えることができる。さらに、微生物阻害領域の形成や創傷治癒の促進などのさらなる利益を提供するために、本発明の組成物に抗生物質等の薬剤が有効量で混合される。本発明の皮膚前処理剤は、表在性の創傷、やけど、または擦り傷の表面を覆う効果的な厚さの膜コーティングを形成するために塗布される。治療される創傷が表在性であり皮層下まで延在していないため、創傷内に拡散または形成されるポリマー残基は、皮膚から自然に押し出される。一般的に、本発明の皮膚前処理剤は、創傷領域を覆い、十分な柔軟性及び組織に対する付着性を有し、かつ剥離及び亀裂がすぐに生じない付着性膜コーティングを提供する。前記コーティングは一般的に、約0.5mm以下の厚さを有する。
【0079】
このような厚さのシーラントコーティングは、従来の絆創膏と同じような方法で創傷部を保護する物理的バリア層を、表存性創傷上に形成する。具体的には、前記コーティングは、創傷部が濡れたときでも交換する必要がない略気密性の防水シールを、創傷部の周りに形成する。形成されたコーティングは細菌及び汚染物質が創傷部に進入するのを防止する。そのため、二次感染の可能性が減少する。一般的に、この付着性コーティングは、コーティングされた領域を動かすことを妨げない。また、この付着性コーティングは、創傷の早期治癒を促進することができる。さらに、従来の絆創膏とは異なり、このコーティングは適用した2〜3日後に皮膚から自然に剥がれ落ちるので、従来の絆創膏を皮膚から剥がすときのような不快感はない。なお、このポリマーコーティングを早期に除去したい場合は、アセトン等の溶剤を使用することにより除去することができる。このことについての詳細は米国特許第6,342,213号(特許文献6)を参照されたい。
【0080】
当業者に理解されるように、本発明の変更形態及び変形形態は当業者の能力の範囲内にあると考えられる。本発明者は、そのような変更形態及び変形形態が本発明の範囲に含まれることを意図している。また、本発明の範囲は、本明細書に開示されている特定の実施形態に限定されるものと解釈されるべきではなく、先述の開示を踏まえて添付の請求項にのみ従うものであると理解されたい。
【特許請求の範囲】
【請求項1】
外科用の皮膚前処理剤であって、
揮発性溶媒と、下記の(a)〜(d)からなる群より選択される膜形成化合物とを含むことを特徴とする皮膚前処理剤。
(a)アルキルアルコールのアクリル酸エステル、アルキルアルコールのメタクリル酸エステル及び、アクリル酸若しくはメタアクリル酸の繰り返し単位を含む化合物、
(b)アルキルビニルエーテル及び無水マレイン酸エステル酸の酸エステルの繰り返し単位を含む化合物、
(c)アルキルアルコールのメタクリル酸エステル及びビニルピリジンの繰り返し単位を含む化合物、及び
(d)アルキルアクリルアミド及びアクリル酸若しくはメタアクリル酸の繰り返し単位並びに天然ゴム樹脂を含む化合物。
【請求項2】
請求項1に記載の皮膚前処理剤であって、
前記揮発性溶媒が、エタノール、イソプロパノール、酢酸エチル及びアセトンからなる群より選択されることを特徴とする皮膚前処理剤。
【請求項3】
請求項1に記載の皮膚前処理剤であって、
ヨードフォア、ビグアニド、フェノール、第4級アミン、抗生物質、酸化物及び金属からなる群より選択される抗菌性化合物をさらに含むことを特徴とする皮膚前処理剤。
【請求項4】
請求項1に記載の皮膚前処理剤であって、
マスチックゴム、ボスウェリン、ベンゾイン化合物及びエレミゴムからなる群より選択されるゴムからなる粘着性付与剤をさらに含むことを特徴とする皮膚前処理剤。
【請求項5】
請求項1に記載の皮膚前処理剤であって、
当該皮膚前処理剤を皮膚に塗布し、乾燥させたときに、前記皮膚上に存在する細菌の少なくとも90%を固定化することを特徴とする皮膚前処理剤。
【請求項6】
請求項1に記載の皮膚前処理剤であって、
当該皮膚前処理剤を皮膚に塗布し、乾燥させたときに、前記皮膚上に存在する細菌の少なくとも95%を固定化することを特徴とする皮膚前処理剤。
【請求項7】
請求項1に記載の皮膚前処理剤であって、
当該皮膚前処理剤を皮膚に塗布し、乾燥させたときに、前記皮膚上に存在する細菌の少なくとも99%を固定化することを特徴とする皮膚前処理剤。
【請求項8】
請求項1に記載の皮膚前処理剤であって、
前記膜形成化合物を5〜50重量%の量で含有することを特徴とする皮膚前処理剤。
【請求項9】
請求項1に記載の皮膚前処理剤であって、
前記膜形成化合物を10〜30重量%の量で含有することを特徴とする皮膚前処理剤。
【請求項10】
請求項1に記載の皮膚前処理剤であって、
シアノアクリレートを実質的に含まないことを特徴とする皮膚前処理剤。
【請求項11】
請求項1に記載の皮膚前処理剤であって、
手術前に当該皮膚前処理剤の上側に皮膚シーラントまたは切開ドレープが適用されないことを特徴とする皮膚前処理剤。
【請求項12】
外科用の皮膚前処理剤であって、
揮発性溶媒と、
膜形成ポリマーとを含み、
当該皮膚前処理剤を皮膚に塗布し、乾燥させたときに、前記皮膚上に存在する細菌の少なくとも99%を固定化することを特徴とする皮膚前処理剤。
【請求項13】
請求項12に記載の皮膚前処理剤であって、
ヨードフォア、ビグアニド、フェノール、第4級アミン、抗生物質、酸化物及び金属からなる群より選択される抗菌性化合物をさらに含むことを特徴とする皮膚前処理剤。
【請求項1】
外科用の皮膚前処理剤であって、
揮発性溶媒と、下記の(a)〜(d)からなる群より選択される膜形成化合物とを含むことを特徴とする皮膚前処理剤。
(a)アルキルアルコールのアクリル酸エステル、アルキルアルコールのメタクリル酸エステル及び、アクリル酸若しくはメタアクリル酸の繰り返し単位を含む化合物、
(b)アルキルビニルエーテル及び無水マレイン酸エステル酸の酸エステルの繰り返し単位を含む化合物、
(c)アルキルアルコールのメタクリル酸エステル及びビニルピリジンの繰り返し単位を含む化合物、及び
(d)アルキルアクリルアミド及びアクリル酸若しくはメタアクリル酸の繰り返し単位並びに天然ゴム樹脂を含む化合物。
【請求項2】
請求項1に記載の皮膚前処理剤であって、
前記揮発性溶媒が、エタノール、イソプロパノール、酢酸エチル及びアセトンからなる群より選択されることを特徴とする皮膚前処理剤。
【請求項3】
請求項1に記載の皮膚前処理剤であって、
ヨードフォア、ビグアニド、フェノール、第4級アミン、抗生物質、酸化物及び金属からなる群より選択される抗菌性化合物をさらに含むことを特徴とする皮膚前処理剤。
【請求項4】
請求項1に記載の皮膚前処理剤であって、
マスチックゴム、ボスウェリン、ベンゾイン化合物及びエレミゴムからなる群より選択されるゴムからなる粘着性付与剤をさらに含むことを特徴とする皮膚前処理剤。
【請求項5】
請求項1に記載の皮膚前処理剤であって、
当該皮膚前処理剤を皮膚に塗布し、乾燥させたときに、前記皮膚上に存在する細菌の少なくとも90%を固定化することを特徴とする皮膚前処理剤。
【請求項6】
請求項1に記載の皮膚前処理剤であって、
当該皮膚前処理剤を皮膚に塗布し、乾燥させたときに、前記皮膚上に存在する細菌の少なくとも95%を固定化することを特徴とする皮膚前処理剤。
【請求項7】
請求項1に記載の皮膚前処理剤であって、
当該皮膚前処理剤を皮膚に塗布し、乾燥させたときに、前記皮膚上に存在する細菌の少なくとも99%を固定化することを特徴とする皮膚前処理剤。
【請求項8】
請求項1に記載の皮膚前処理剤であって、
前記膜形成化合物を5〜50重量%の量で含有することを特徴とする皮膚前処理剤。
【請求項9】
請求項1に記載の皮膚前処理剤であって、
前記膜形成化合物を10〜30重量%の量で含有することを特徴とする皮膚前処理剤。
【請求項10】
請求項1に記載の皮膚前処理剤であって、
シアノアクリレートを実質的に含まないことを特徴とする皮膚前処理剤。
【請求項11】
請求項1に記載の皮膚前処理剤であって、
手術前に当該皮膚前処理剤の上側に皮膚シーラントまたは切開ドレープが適用されないことを特徴とする皮膚前処理剤。
【請求項12】
外科用の皮膚前処理剤であって、
揮発性溶媒と、
膜形成ポリマーとを含み、
当該皮膚前処理剤を皮膚に塗布し、乾燥させたときに、前記皮膚上に存在する細菌の少なくとも99%を固定化することを特徴とする皮膚前処理剤。
【請求項13】
請求項12に記載の皮膚前処理剤であって、
ヨードフォア、ビグアニド、フェノール、第4級アミン、抗生物質、酸化物及び金属からなる群より選択される抗菌性化合物をさらに含むことを特徴とする皮膚前処理剤。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公表番号】特表2013−515048(P2013−515048A)
【公表日】平成25年5月2日(2013.5.2)
【国際特許分類】
【出願番号】特願2012−545480(P2012−545480)
【出願日】平成22年11月22日(2010.11.22)
【国際出願番号】PCT/IB2010/055330
【国際公開番号】WO2011/077281
【国際公開日】平成23年6月30日(2011.6.30)
【出願人】(504460441)キンバリー クラーク ワールドワイド インコーポレイテッド (396)
【Fターム(参考)】
【公表日】平成25年5月2日(2013.5.2)
【国際特許分類】
【出願日】平成22年11月22日(2010.11.22)
【国際出願番号】PCT/IB2010/055330
【国際公開番号】WO2011/077281
【国際公開日】平成23年6月30日(2011.6.30)
【出願人】(504460441)キンバリー クラーク ワールドワイド インコーポレイテッド (396)
【Fターム(参考)】
[ Back to top ]

