組成情報取得方法、組成情報取得装置及び飛行時間型二次イオン質量分析用試料台
【課題】 生体試料に固有の非特異吸着や、蛋白質の変成を軽減した、TOF−SIMS法を用いた蛋白質の検出法を提供する。
【解決手段】 TOF−SIMS法を用いて対象物を分析する方法において、対象物にイオン化促進物質(銀や金などの金属)を付与し、対象物の種類を判別できる親分子に相当する二次イオンを生成させる。これを用いて空間分解能の高い(〜1μm)二次元イメージ像を得ることで、混合蛋白質試料において、電気泳動法や薄層クロマトグラフィーなどの分離精製手法を用いることが出来る。
【解決手段】 TOF−SIMS法を用いて対象物を分析する方法において、対象物にイオン化促進物質(銀や金などの金属)を付与し、対象物の種類を判別できる親分子に相当する二次イオンを生成させる。これを用いて空間分解能の高い(〜1μm)二次元イメージ像を得ることで、混合蛋白質試料において、電気泳動法や薄層クロマトグラフィーなどの分離精製手法を用いることが出来る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、混合有機物、特に生体関連物質に対してその組成についての情報を、飛行時間型二次イオン質量分析法を用いて取得する方法、そのために用いる組成情報取得装置及び飛行時間型二次イオン質量分析用試料台に関する。
【背景技術】
【0002】
近年のゲノム解析の進展により、生体内に存在する遺伝子産物であるプロテインの解析の重要性が急速にクローズアップされてきている。
【0003】
従来から、プロテインの発現及び機能解析の重要性が指摘されており、その解析手法の開発が進められている。これらの手法は基本的に
(1)二次元電気泳動や高速液体クロマトグラフ(HPLC)による分離精製と、
(2)放射線分析、光学的分析、質量分析等の検出系
との組み合わせにより行われてきた。
【0004】
プロテイン解析技術の展開としては、その基盤ともいえるプロテオーム解析(細胞内プロテインの網羅的解析)によるデータベース構築と、そこで得られたデータベースに基づく診断デバイスや創薬(薬剤候補スクリーニング)デバイスに大別される。いずれの応用形態に対しても上記のような分析時間、スループット、感度、分解能及び柔軟性に問題のある従来方法とは異なった、小型化、高速化、自動化に適したデバイスが求められてきた。これらの要求を満たす手法としてプロテインを高密度に集積したいわゆるプロテインチップの開発が注目されている。
【0005】
プロテインチップは抗原抗体反応などを利用することにより発現している特定の蛋白質を捕捉し、それを蛍光検出法や表面プラズモン共鳴法、放射性同位体標識法、マトリックス支援レーザー脱離イオン化(MALDI)質量分析法などで検出する。また、蛋白質を対象とした他の質量分析法として電界放出を利用したものがある(特許文献1参照)。この方法は、金属電極上に前記蛋白質を、印加エネルギーに応じて分裂可能な開放基を介して、共有結合または配位結合させ、強電界を印加することで前記蛋白質を質量分析計へ導くというものである。
【0006】
このような検出法に対してプロテインチップが分離精製手法として用いられる理由のひとつに、これら検出法の空間分解能に対し、プロテインチップがちょうどよい広がりを持つことが挙げられる。
【0007】
例えばMALDI質量分析法や、その改良型であるSELDI質量分析法は、現在知られている中で最もソフトなイオン化法であり、分子量が大きく壊れ易いプロテイン(蛋白質ともいう。)をそのままイオン化し、親イオン若しくはそれに準じるイオンを検出できるという優れた特徴を有する。現在ではプロテインの質量を分析する際の標準的なイオン化法の一つとなっている。一方、これらの方法をプロテインチップの質量分析に応用する場合にはマトリクス物質の存在による制約から、蛋白質の二次元分布像(質量情報を用いたイメージング)の検出においてその空間分解能には限界がある。すなわち、励起源であるレーザー光自体は1〜2μm径程度に容易に集光できるが、分析対象のプロテインの周辺に存在するマトリクス物質が蒸発、イオン化するため、上記の方法でプロテインの二次元分布像を計測する場合の空間分解能は一般的には100μm程度となってしまう。また、集光させたレーザーを走査するには、レンズやミラーを複雑に動作させる必要がある。つまり、上記の方法でプロテインの二次元分布像を計測する場合、レーザー光を走査させることは難しく、被分析試料を載せた試料ステージを動かす方式に限られる。空間分解能の高いプロテインの二次元分布像を得ようとする場合、試料ステージを動かす方式は一般的には好ましくない可能性がある(機械的な可動部があることは信頼性の面で不利となる場合がある)。
【0008】
その他の従来の検出法も、対象物の二次元分布像を得ることは難しく、また、金属電極上に対象物を固定する必要があるなど、対象試料の形態に制限がある。
【0009】
このように検出法の空間分解能という側面からも、充分な空間分解能を持って分離精製が可能であるプロテインチップが注目されている。
【0010】
一方で、近年、蛋白質の質量分析法において、高感度な質量分析手段あるいは表面分析手段として、飛行時間型二次イオン質量分析法(Time of Flight Secondary Ion Mass Spectrometry、以下、TOF−SIMSと略す。)が使われるようになってきた。TOF−SIMSとは、固体試料の最表面にどのような原子または分子が存在するかを調べるための分析方法であり、以下のような特徴を持つ。すなわち、109atoms/cm2(最表面1原子層の1/105に相当する量)の極微量成分の検出能があること、有機物、無機物のどちらにも適用できること、表面に存在するすべての元素や化合物を測定できること、試料表面に存在する物質からの二次イオンのイメージングが可能なことである。
【0011】
以下、この方法の原理を簡単に説明する。
【0012】
高真空中で、高速のパルスイオンビーム(一次イオン)を固体試料表面に照射すると、スパッタリング現象によって表面の構成成分が真空中に放出される。このとき発生する正または負の電荷を帯びたイオン(二次イオン)を電場によって一方向に収束し、一定距離だけ離れた位置で検出する。一次イオンをパルス状に固体表面に照射すると、試料表面の組成に応じて様々な質量をもった二次イオンが発生するが、軽いイオンほど速く、反対に重いイオンほど遅い速度で飛行するため、二次イオンが発生してから検出されるまでの時間(飛行時間)を測定することで、発生した二次イオンの質量を分析することができる。一次イオンが照射されると固体試料表面の最も外側で発生した二次イオンのみが、真空中へ放出されるので、試料の最表面(深さ数オングストローム程度)の情報を得ることができる。TOF−SIMSでは一次イオン照射量が著しく少ないため、有機化合物は化学構造を保った状態でイオン化され、質量スペクトルから有機化合物の構造を知ることができる。ただし、ポリエチレンやポリエステルなどの人工高分子、プロテインなどの生体高分子などを通常の条件でTOF−SIMS分析した場合は、小さな分解フラグメントイオンとなってしまい、元の構造を知ることが一般的には難しい。また、固体試料が絶縁物の場合には、パルスで照射される一次イオンの間隙に電子線をパルスで照射することにより、固体表面に蓄積する正の電荷を中和できるため絶縁物を分析することも可能である。加えて、TOF−SIMSでは、一次イオンビームを走査することによって、試料表面のイオン像(マッピング)を測定することもできる。
【0013】
TOF−SIMSでプロテインを分析した例としては、特定のプロテインの一部分を15Nなどでアイソトープラベル化し、当該プロテインをC15N−のような二次イオンを用いてイメージング検出するもの(非特許文献1参照)、アミノ酸残基に対応するフラグメントイオン(二次イオン)の種類やその相対強度からプロテインの種類を推定するもの(非特許文献2参照)、さらには各種基板上に吸着させたプロテインについてのTOF−SIMS検出限界を調べたもの(非特許文献3参照)などが知られている。
【0014】
このTOF−SIMS法では、一次イオンを使用するため容易に収束かつ走査させることができるため、高空間分解能の二次イオン像(二次元分布像)を得ることができ、1μm程度の空間分解能を得ることも可能である。しかしながら、基板上の対象物に対し、通常の条件でTOF−SIMS測定を行うと、先に述べたように、生成する二次イオンは小さな分解フラグメントイオンがほとんどで、元の構造を知ることは一般的には難しい。そのため、複数の蛋白質が基板上に配置されたプロテインチップのような試料に対し、当該蛋白質の種類を判別できる高空間分解能の二次イオン像(二次元分布像)を得るには何らかの工夫が必要となる。ベル(A. M. Belu)らの方法は特定の蛋白質の一部分をアイソトープラベル化するもので、TOF−SIMSの持つ高空間分解能を十分生かせる方法である。しかしながら反面、特定の蛋白質を毎回、アイソトープラベル化するのは一般的ではない。また、マンタス(D. S. Mantus)らが示したアミノ酸残基に対応するフラグメントイオン(二次イオン)の種類やその相対強度からプロテインの種類を推定する方法は、アミノ酸の構成が似た蛋白質が混在する場合は判別が難しくなる。
【0015】
プロテインの分離、質量分析に関する上記以外の例としては次のようなものがある。高速液体クロマトグラフィーを用いたプロテインの分離において分離能を高めたものである(特許文献2参照)。しかしながら、この文献では分離したプロテインの質量分析による同定には至っていない。また、特許文献3では、特定のプロテインの検出方法と、この検出方法の一つとして質量分析による検出が開示されているが、一般的なプロテインやその混合物を対象としたものではない。
【0016】
また、生体から採取した試料の分析から健康状態を診断する方法として、例えば、血液のろ過、分離、分析方法を開示したもの(特許文献4参照)などがあるが、二次元的に展開したプロテイン質量情報(質量別の二次元分布状態)から健康状態を診断する方法はほとんど知られていない。
【0017】
このように、プロテインチップは蛋白質の検出において、該検出器で識別可能な空間領域で蛋白質を分離精製することで診断デバイスや創薬(薬剤候補スクリーニング)デバイスとしての利用が注目されている。
【0018】
しかしながら、プロテインチップは製造コストが高い上に、該チップに載せられる蛋白質の種類の制限から未知症状の診断について網羅的な調査が難しいことの他、蛋白質の非特異吸着の発生、固定時の蛋白質の変性などが問題となる場合がある。
【特許文献1】特表2001−521275号公報
【特許文献2】特許第3376955号公報
【特許文献3】特許第3035357号公報
【特許文献4】特開2001−258868号公報
【非特許文献1】A. M. Belu et al., Anal. Chem., 73, 143 (2001)
【非特許文献2】D. S. Mantus et al., Anal. Chem., 65, 1431 (1993)
【非特許文献3】M. S. Wagner el. Al., J. Biomater. Sci. Polymer Edn., 13, 407 (2002)
【発明の開示】
【発明が解決しようとする課題】
【0019】
従って、本発明は、生体試料に固有の非特異吸着や、蛋白質の変成を軽減した、TOF−SIMS法を用いた蛋白質の検出法を提供することを目的とする。
【課題を解決するための手段】
【0020】
本発明の組成情報取得方法は、
対象物の二次イオン質量スペクトルを、飛行時間型二次イオン質量分析法を用いて取得する方法であって、
前記対象物を分離する第一の工程と、
イオン化促進物質を前記対象物に付与する第二の工程と、
前記飛行時間型二次イオン質量分析法により前記対象物の二次イオン質量スペクトルを得る第三の工程と、
を有することを特徴とする。
【0021】
また、本発明の組成情報取得方法において、前記の分離された対象物を化学的手法によって分解する工程を前記第一の工程の後にさらに有することを特徴とする。本願において、「分離された対象物を化学的手法によって分解する」とは、制限酵素によるDNAの分解やプロテアーゼによる蛋白質の分解等を意味する。
【0022】
また、本発明の組成情報取得方法において、前記対象物を分離する第一の工程は、イオン化促進物質を含み前記対象物を分離できる機構を有する分離体を用い、電気泳動法又は薄層クロマトグラフィーにより前記対象物を分離する工程であることを特徴とする。
【0023】
また、本発明の組成情報取得方法において、前記の分離された対象物を化学的手法によって分解する工程を前記第一の工程の後にさらに有することを特徴とする。
【0024】
なお、前記対象物は、生体関連物質であることが好ましい。また、生体関連物質とは、DNA、RNAなどの核酸や蛋白質を含むが、分子量等に制約はない。また、前記生体関連物質は、核酸及び蛋白質並びにこれらを化学的手法によって分解した分解物からなる群から選択した物質であることが好ましい。さらに、本発明におけるイオン化促進物質とは、金属を含む物質(混合物であってもよい)が好ましく、特に、前記イオン化促進物質は、銀若しくは金又はこれらの混合物であることが好ましい。
【0025】
さらに、本発明の組成情報取得方法において、一次イオンビームの走査により、前記対象物の二次元分布状態の情報を取得することを特徴とする。
【0026】
一方、本発明の組成情報取得装置は、飛行時間型二次イオン質量分析装置を具備する組成情報取得装置であって、前記の分析装置における試料台は、イオン化促進物質を含み、対象物を分離する機構を有することを特徴とする。
【0027】
また、本発明の組成情報取得装置は、飛行時間型二次イオン質量分析装置を具備する組成情報取得装置であって、前記の分析装置における試料台は:イオン化促進物質を含み;且つ対象物を分離する機構と、分離された対象物を化学的手法によって分解する機構とを有する;ことを特徴とする。
【0028】
また、飛行時間型二次イオン質量分析を行う試料台において、イオン化促進物質を含み、対象物を分離する機構を有することを特徴とする。
【0029】
また、前記試料台は、イオン化促進物質を含む薄層クロマトグラフィー用プレートであることを特徴とする。
【0030】
さらに、前記試料台は、イオン化促進物質を含み、対象物を分離できる機能と分離された対象物を化学的手法によって分解する機能とを有することを特徴とする。
【0031】
さらに、本発明の健康状態に関する情報を得る方法は、請求項1乃至8のいずれか一項に記載の組成情報取得方法により健康状態に関する情報を得る方法において、前記対象物は、生体から採取した試料であることを特徴とする。
【0032】
また、本発明の健康状態に関する情報を得る方法において、前記試料を固定する試料台は、組成情報取得装置から取り外し可能であることを特徴とする。
【0033】
さらに、本発明の健康状態に関する情報を得る方法において、得られた二次イオン情報及び分離されたパターン情報に基づいて前記試料の成分を分析する工程を有するであることを特徴とする。また、前記の試料の成分を分析する工程は、予め用意された種々の健康状態に対応する二次イオン情報と分離されたパターン情報のライブラリーデータとを比較する行程であることを特徴とする。
【発明の効果】
【0034】
本発明の方法により、混合有機物からなる試料を各有機物に特徴的な位置に分離させ、それぞれの「質量情報」を用いてイメージング測定することで、前記混合有機物の二次元分布状態を高空間分解能(〜1μm)で可視化し、「質量情報」に加えて有機物の特定の手がかりとなる「位置情報」をも得ることが可能となる。これら二つの情報から、例えば血液など特定の生体試料について、検出される有機物と健康状態とを対応付けてデータベース化しておくことにより、健康状態に関する情報を得ることも可能となる。
【0035】
また試料を固定する試料台が組成情報取得装置から取り外し可能であるため、試料台が持ち運び可能であり、試料の固定を被験者の元で行うことができる。
【発明を実施するための最良の形態】
【0036】
以下に、本発明をより詳細に説明する。
【0037】
本発明は、第一に、従来空間的に高い分解能を持ちながら蛋白質の分析には適当な分析手段と言えなかったTOF−SIMS法において、イオン化を促進する試薬、例えば銀や金といった金属を試料と共存させることで蛋白質のイオン化を促進することができ、それによって該蛋白質の分析を行うことができるようになったことを利用している。第二に、TOF−SIMSによる空間的に高分解能な測定が可能になったことで、従来のようなプロテインチップによる分離精製ではなく、より製造コストに優れ、網羅的に蛋白質の分離を行える分離手法、例えば電気泳動法や薄層クロマトグラフィーを用いることが本発明の特徴である。なお、この手法による分離では複数の蛋白質成分が一部混在しながら連続的に分離されるため、従来の検出法(例えば、部分抽出、濃縮後の質量分析など)では充分にその組成を把握できなかった。
【0038】
本発明の組成情報取得方法は、
対象物の二次イオン質量スペクトルを、飛行時間型二次イオン質量分析法を用いて取得する方法であって、
前記対象物を分離する第一の工程と、
イオン化促進物質を前記対象物に付与する第二の工程と、
前記飛行時間型二次イオン質量分析法により前記対象物の二次イオン質量スペクトルを得る第三の工程と、
を有することを特徴とする。
【0039】
ここで、第一の行程は、電気泳動法または薄層クロマトグラフィーにより対象物を分離する行程であってもよい。また、第二の行程は、蒸着または化学的修飾によりイオン化促進物質を付与する行程であってもよい。このようにして得た組成物を、第三の行程を実行することにより、対象物に係る情報を取得する。
【0040】
図2は、本発明の工程を示す。図2において、201は、対象物を分離する工程、202は対象物にイオン化促進物を付与する工程、203は、飛行時間型二次イオン質量分析法により前記対象物の二次イオン質量スペクトルを得る工程を示す。また204は対象物を分解する工程を示し、当該工程は、飛行時間型二次イオン質量分析法を行う前に、必要に応じて対象物を所望の大きさに分解を行うことで、他の分析結果と総合的に判断することで分析精度を高めることができる。
【0041】
以下に上記各工程について詳細に説明する。始めに、対象物を分離する第一の工程について説明する。
【0042】
本発明における対象物を分離する手法としては、TOF−SIMSの二次元イメージングという特徴を活かすため、位置の広がりを伴って成分を分離(二次元方向に成分を分離)できる手法であることが必要となる。例えば、このような分離手法としては電気泳動法や薄層クロマトグラフィーなどが挙げられる。なお、TOF−SIMS測定時は高真空下に置く必要があるため、分離した試料・基板は充分に乾燥させる必要がある。この分離手法は複数を組み合わせてもよい。例えばC8(C8H17の固定されたプレート)とC18(C18H37の固定されたプレート)のように分離モードの異なるプレートで試料を分離することで、有機物の特定の手がかりとなる「位置情報」をより的確に得ることが出来る。
【0043】
次に、イオン化促進物質を共存させることで前記対象物のイオン化を促進する第二の工
程について説明する。
【0044】
本発明においては、イオン化を促進する物質(イオン化促進物質)を、必要に応じて増感物質と表現することがある。
【0045】
本発明の対象物のイオン化を促進する物質の付与方法は、
(1)基板上に対象物を配置した後に付与する、
(2)基板上に配置される対象物の特定の一種または複数種に対し、予め付与する、
(3)基板上に対象物が配置される前に、予め基板表面に付与する、
のいずれかである。具体的な付与方法としては蒸着、化学的修飾などが挙げられる。
【0046】
このうち、(1)の方式はあらゆる形態の対象物の解析に応用できる。即ち、汎用性が高い方式である。一方で、基板上に二次元的に分布している対象物に対しイオン化を促進する物質の付与を行う際は、この処理により対象物を拡散させないように注意する必要がある。化学的修飾などの処理で対象物の二次元分布状態が変化してしまっては、本発明の目的を達成できないからである。対象物の二次元分布状態が変化したかどうかは、例えば、化学的修飾を行う前後でのTOF−SIMS分析の結果との比較などから判断できる。
【0047】
次に(2)の方式は、予め特定の対象物の特定の部位に、対象物のイオン化を促進し、TOF−SIMS分析で感度が上昇する物質(増感物質)を結合させておくものであるが、この方式は特定の対象物の二次元分布状態を選択的にかつ高感度で検出できるという利点を有する。一方で、対象物ごとに予め化学的修飾処理などを行わなければならず、操作がやや煩雑になるという短所がある。なお、上記の増感物質の結合の方式としては共有結合、イオン結合、さらには増感物質として金属錯体を用いる場合の配位結合などが利用でき、特に制限はない。ただし、化学的修飾処理した蛋白質などの対象物を基板上に配置することになるので、該結合は安定であることが必要である。
【0048】
さらに(3)の方式は、対象物のイオン化を促進し、TOF−SIMS分析で感度が上昇する物質(増感物質)を予め基板表面に形成しておくものである。この方式では該増感物質の存在により新たな非特異吸着の問題が発生しないかどうかを十分調べておくことが重要である。この増感物質はTOF−SIMS分析で感度が上昇させるものであれば特に制限はなく、また対象物と直接結合しないものであってもよい(即ち、TOF−SIMS分析で二次イオンを発生させる過程で、該対象物のイオン化効率を高める効果があればよい)。さらに、この増感物質は基板の最表面に形成させることが好ましいが、非特異吸着を防止するため、該増感物質の上に単分子膜程度の別の物質を配置することも可能である。例えば、増感物質として金の蒸着膜を形成し、その上に11−hydroxy−1−undecanethiolの自己組織化単分子膜を形成する等の例を挙げることができる。
【0049】
本発明のイオン化促進物質(増感物質)について説明する。
【0050】
本発明者らの知見によれば、本発明のイオン化促進物質を対象物に作用させた場合に、対象物に一次イオンを照射した際に二次イオン化生成効率を向上させる作用については、以下のように考えている。
【0051】
対象物が生体から採取した試料である場合、生体組織中では、測定対象のタンパク質分子のペプチド鎖同士が絡み合い、TOF−SIMS法による測定の際、二次イオン種の生成効率を低下させる要因となっている。これに対して本発明においては、生体から採取した試料表面に、イオン化促進物質を含む溶液を作用させ、表面に存在するタンパク質分子に由来する二次イオン種の生成効率を向上させることができる。このイオン化促進物質は、一次イオンを照射する際、表面に存在するタンパク質分子に由来する二次イオン種の生成を促進・増加させる機能を示す物質である。
【0052】
具体的な作用方法の一例としては、イオン化促進物質を生体から採取した試料表面に存在するタンパク質分子に直接作用させるために、増感物質を含む溶液を試料表面に付与して、表面全体を被覆する状態で保持することが挙げられる。
【0053】
例えば、イオン化促進物質を含む溶液として、希薄な硝酸銀水溶液を用いると、該水溶液中で解離している銀イオンは、タンパク質分子を構成するペプチド鎖に作用して、銀イオンとタンパク質分子間に結合が生成し、二次イオン種の生成が促進される。このように本発明においては、イオン化促進物質自体、あるいは、イオン化促進物質の構成要素が、タンパク質分子を構成するペプチド鎖に作用して、ペプチド鎖と結合を生成することで、結果的に、タンパク質分子のペプチド鎖同士の絡み合いが解かれた状態となるものと考えられる。
【0054】
また、銀イオンはそれ自体がイオンとなりやすい物質であることから、この点からもタンパク質分子と結合することでタンパク質のイオン化を促進する効果を持つと考えられる。
【0055】
本発明において利用され得るイオン化促進物としては、例えば、前記硝酸銀の他、炭酸ナトリウムなどの塩、金や銀などの金属を含む物質(金属錯体など)や金属コロイドなどが挙げられる。また、イオン化促進物を含む溶液は、水溶液の形態が好ましい。
【0056】
本発明の化学的修飾とは、上記のように、TOF−SIMS分析で二次イオンを発生させる過程で、プロテインのイオン化効率を高める効果があり、該プロテインの二次元分布状態を変化させない処理であれば特に制限はないが、化学的修飾剤として金属を含む物質を用いることが好ましい。前記金属の種類としては、本発明者らが検討した限りでは銀または金、さらにはその両者を含む場合が特に好ましかったが、上記の効果を持つものであればこれ以外の金属であってもよい。
【0057】
化学的修飾の一手法として、基板上に配置された複数のプロテインに対し、銀鏡反応を利用して銀または銀イオンを該プロテインに付加させる方法を挙げることができる。銀鏡反応とは、アンモニア性硝酸銀水溶液に試料を加え、次いでジアンミン銀(I)イオンを還元し銀を析出させる反応である。銀はイオウとの親和性が高いことから、この反応はシステイン(Cysteine;Cys)を含むプロテインに対し特に有効である。また、基板上に二次元的に分布しているプロテインに対しこの反応を利用する場合は、同処理により該プロテインを拡散させないよう注意を払う必要がある。この反応に用いる試薬として、市販品(例えば、和光純薬製「銀染色IIキットワコー」など)を使用してもよい。また、硝酸銀水溶液を直接噴霧することによっても対象物のイオン化を促進する効果を得ることが出来る。
【0058】
しかしながら、化学的修飾の方法は上記に限られず、TOF−SIMS分析における対象物の二次イオン化効率を高める効果があり、該対象物の二次元分布状態を変化させない処理であればいかなる方法を用いてもよい。
【0059】
最後に、飛行時間型二次イオン質量分析法により、前記対象物の質量に関する情報(二次イオン質量スペクトル)を得る第三の工程について説明する。
【0060】
本発明の対象物の二次元分布状態の検出(イメージング)は、前記対象物を識別できる二次イオンを用いることを特徴としており、この二次イオンは質量/電荷比が500以上のイオンであることが好ましく、質量/電荷比が1000以上のイオンであることが特に好ましい。その理由は、蛋白のアミノ酸は典型的には質量数が100〜200であるため、重い二次イオンを検出できるほうが同定能力が高く、蛋白の同定に有用なデータとして、質量/電荷比が1000以上では5〜10のアミノ酸配列を知ることが出来、同定に有利であるからである。
【0061】
また、一次イオン種としては、イオン化効率、質量分解能等の観点からガリウムイオン、セシウムイオン、また、場合によっては金(Au)イオン等が、好適に用いられる。なお、Auイオンを用いると、極めて高感度の分析が可能となる点で好ましい。その際、Auイオンのみならず、金の多原子イオンである、Au2イオン、Au3イオンを用いることができ、この順で感度の上昇が図られる場合も多く、金の多原子イオンの利用は、さらに好ましい形態となる。
【0062】
さらに、一次イオンビームパルス周波数は、1kHz〜50kHzの範囲であることが望ましく、また、一次イオンビームエネルギーは、12keV〜25keVの範囲であること、さらには、一次イオンビームパルス幅は、0.5ns〜10nsの範囲であることが望ましい。
【0063】
また、本発明は、定量精度を向上させるために、高い質量分解能を保持し、比較的短時間で測定を完了させる必要があることから(一測定が数10秒から数10分のオーダー)、一次イオンビーム径は多少犠牲にして測定することが好ましい。具体的には、一次イオンビーム径をサブミクロンオーダーまで絞らずに、1μmから10μmの範囲に設定することが好ましい。その理由は、装置のスペック上、短時間で測定を終わらせることができるからである。
【0064】
このようにして得られる二次イオンの質量数に関する情報、および該二次イオンのイメージングにより得られる(対象物が分離された)パターン情報に基づいて試料の成分を分析することも可能となる。
【0065】
即ち、本発明における成分分析は対象物のイオン化を促進するための物質(イオン化促進物質)を用いて試料のイオン化を促進する第二の工程によって試料をより的確に特定できる情報を得ることを特徴とする。さらに、対象物を分離する第一の工程により、分離された各成分それぞれに特有な分離位置情報を更に特定のための情報として用いることにより、精度良く混合有機物試料の同定を行うことを特徴としている。例えば薄層クロマトグラフィーの場合、同一の分離条件においては各有機物試料がそれぞれ固有の位置に再現性良く分離される。これに、例えば銀原子を並存させてTOF−SIMS測定を行うことで、試料特定に有利な大きな質量/電荷比を持つ二次イオンを得ることが出来る。これらの情報を併せることで精度良く混合有機物試料の同定を行うことが出来る。特に、生体の特定の部位における蛋白質組成についてこれら二次イオンの質量数と分離位置についてのデータベースライブラリーを作製しておけば、健康状態の変化などに伴う組成変化を迅速に特定することが出来、健康状態の診断に用いることが出来る。
【0066】
次に図3を参照して本発明の試料台の断面図を示す。図3は、本発明の試料台の断面図を示す。図3において303は基板、302は分離体、301はイオン化促進物質である。
【0067】
イオン化促進物質301は分離体302の表面にのみ設けても良いが、分離体の内部に含まれていても良い。イオン化促進物質301を分離体302の表面に形成する方法としては、スパッタ、蒸着、CVD、電析等の方法を用いることが好ましい。
【0068】
前記対象物を分離する機能としての分離体302上にイオン化促進物質を設ける場合、その厚さとしては、厚すぎると、対象物の検出が困難になるため、当該厚さの上限としては好ましくは100nm以下、より好ましくは10nm以下、最適には5nm以下である。一方当該イオン化促進物質の厚さの下限としては、イオン化促進機能が発現され、目的とする対象物の分析が可能であれば特に制限はない。本発明者らの知見によれば、分離体上のイオン化促進物質の密度が1010atoms/cm2以上であれば本発明の分析を行うことができる。
【0069】
薄層クロマトグラフィーにより分離を行う場合は、対象物を分離する機能としての分離体302としては、所望の空隙を有するガラスの焼結体を基板303に固定したもの、同様にセルロースを基板303に固定したもの等を採用することが好ましい。
【0070】
また電気泳動法により分離を行う場合は、対象物を分離する機能としての分離体302としては、所望の空隙を有するゲル状物質、例えばポリアクリルアミドゲル、アガロースゲル等を採用することが好ましい。そして電気泳動法により試料から対象物を分離する場合は、前記ゲルに試料を滴下した後、所定の電界(例えば100V)を印加し、所定の時間電界を印加した状態を維持することによって対象物を分離することができる。
【0071】
次に図4を用いて本発明の試料台を用いた対象物の分離方法を説明する。図4において401はガラスキャピラリー、402は試料溶液、403はイオン化促進物質を有する試料台、404は対象物を分解する試薬(噴霧状態)、405は展開された試料スポットである。
【0072】
本発明において上記試料台とは、薄層クロマトグラフィー用プレート等のプレート自体、または当該プレート等を飛行時間型二次イオン質量分析装置に取り付けるためのホルダー等に固定したもの全体を示す。
【0073】
本発明の試料台はイオン化促進物質を含み、且つ対象物を分離できる機構または機能を有するものである。この試料台の具体例は、このような機能を有するものであれば、薄層クロマトグラフィー用プレートに限定されず、例えば、電気泳動法などがある。また必要に応じて分離された対象物を分解する工程を設けることができる。
【0074】
例えばイオン化促進物質である銀を蒸着した試料台(銀を蒸着した薄層クロマトグラフィー用プレート)403を調製し、これにガラスキャピラリー401を用いて試料溶液402を展開させることで試料溶液402から対象物を分離することができる。展開された試料スポット405に対象物を分解する試薬(噴霧状態)404を噴霧することで分離した対象物を分解することができる。
【0075】
上記対象物を分解する試薬(噴霧状態)404は必要に応じて噴霧手段を本発明の組成情報取得装置に設けることにより、一連の作業を効率的に行うことができる。
【0076】
以下に、実施例を挙げて、本発明をより具体的に説明する。以下に示す具体例は、本発明にかかる最良の実施形態の一例ではあるが、本発明はかかる具体的形態に限定されるものではない。
【実施例1】
【0077】
生体関連試料が分離された分析用試料プレートの作製(1)
薄層クロマトグラフィー用プレート(Merck製、RP−18、層厚0.2mm)を30mm×5mmに切断し、該プレートにスパッタ蒸着にてAg単一原子層を形成する。
【0078】
次に、合成ペプチドI(ペプチド配列:GGGGCGGGGG、C21H34N10O11S (平均分子量:634.61、同位体存在比が最も高い元素からなる分子の質量:634.21)シグマジェノシスジャパン社より購入)及び合成ペプチドII(ペプチド配列:GGGGCEGGGG、C24H38N10O13S (平均分子量:706.79、同位体存在比が最も高い元素からなる分子の質量:706.23)シグマジェノシスジャパン社より購入)の各々10μM混合水溶液を調製する。これをプレート中央部に10μl滴下し、これにガラスキャピラリー管により0.1vol%トリフルオロ酢酸入りアセトニトリル:蒸留水の1:1(容量比)溶液を浸透させることで展開させる。このような試料を複数枚作製する。
【実施例2】
【0079】
実施例1で作製される試料のTOF−SIMS分析
実施例1で作製される試料を風乾し、これをION TOF社製TOF−SIMS IV型装置を用いて分析する。測定条件を以下に要約する。
【0080】
一次イオン:25kV Ga+、0.6pA(パルス電流値)、ランダムスキャンモード
一次イオンのパルス周波数:2.5kHz(400μs/shot)
一次イオンパルス幅:約1ns
一次イオンビーム直径:約5μm
測定領域:マクロラスタ(30mm×5mm)
積算回数:256
このような条件で正および負の二次イオン質量スペクトルを測定すると、合成ペプチドIについては正の二次イオン質量スペクトルにおいて、その親分子にAgが付加し、さらに、炭素、酸素原子が一つずつ付加した質量に相当する二次イオンを検出することができる。また合成ペプチドIIについても同様に、正の二次イオン質量スペクトルにおいてその親分子にAgが付加し、さらに、炭素、酸素原子が一つずつ付加した質量に相当する二次イオンを検出することができる。
【0081】
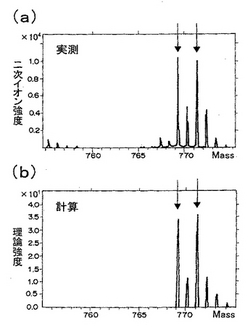
合成ペプチドIにおける、この領域のスペクトル拡大図を図1(a)に、同位体存在比を基に算出した理論スペクトルを図1(b)にそれぞれ示す。図1中、矢印を付けたピークは上記のイオン[(合成ペプチドI)+(Ag)+(CO)]+に相当するもので、矢印二本はそれぞれ二つのAgの同位体(質量数:107,109)に対応している。右側の矢印を付けたピークは109Agを含むもので、そのm/z値(771.2)は、[(合成ペプチドI)+(109Ag)+(CO)]+の理論値にほぼ一致する。合成ペプチドIIにおいても同様なスペクトルが得られる。これら合成ペプチドI及びIIの親イオンに準じるこれらの二次イオンを用いることで、該合成ペプチドI及びIIの二次元分布状態を反映した二次元イメージ像を得ることができる。
【0082】
これら合成ペプチドI及びIIはAg単一原子層が形成された薄層クロマトグラフ上で再現性良く分離される。
【0083】
なお、Ag単一原子層形成を行わない薄層クロマトグラフィー用プレートでは、上記の親イオンに準じる二次イオンピークは観測されない。また、親分子に相当する質量域においても二次イオンピークは観測されない。
【実施例3】
【0084】
生体関連試料が分離された分析用試料プレートの作製(2)
薄層クロマトグラフィー用プレート(Merck製、RP−18、層厚0.2mm)を30mm×5mmに切断し、試料分離用プレートとする。
【0085】
次に、実施例1と同様の合成ペプチドI及び合成ペプチドIIの各々10μM混合水溶液を調製する。これをプレート中央部に10μl滴下し、これにガラスキャピラリー管により0.1vol%トリフルオロ酢酸入りアセトニトリル:蒸留水の1:1(容量比)溶液を浸透させることで展開させる。これに10μM硝酸銀水溶液をプレート表面がやや湿る程度に噴霧を行う。例えば、1μL/cm2程度の量が好ましい。このような試料を複数枚作製する。
【実施例4】
【0086】
実施例3で作製される試料のTOF−SIMS分析
実施例3で作製される試料を風乾し、これをION TOF社製TOF−SIMS IV型装置を用いて分析する。測定条件は実施例2と同一とする。
【0087】
その結果、実施例2に示すものと同様のピークが観測される。また、これら合成ペプチドI及びIIの親イオンに準じるこれらの二次イオンを用いることで、該合成ペプチドI及びIIの二次元分布状態を反映した二次元イメージ像を得ることができる。
【0088】
これら合成ペプチドI及びIIは硝酸銀水溶液噴霧を行った後の薄層クロマトグラフ上で再現性良く分離される。
【0089】
なお、硝酸銀水溶液の噴霧を行わない薄層クロマトグラフィー用プレートでは、上記の親イオンに準じる二次イオンピークは観測されない。また、親分子に相当する質量域においても二次イオンピークは観測されない。
【実施例5】
【0090】
生体関連試料が分離された分析用試料プレートの作製(3)
薄層クロマトグラフィー用プレート(Merck製、RP−18、層厚0.2mm)を30mm×5mmに切断し、該プレートにスパッタ蒸着にてAg単一原子層を形成する。
【0091】
次に健常人の血液を2ml採取し、これに0.2vol%トリフルオロ酢酸入りアセトニトリル2mlを加える。これを乳鉢にて磨砕し、更に超音波処理を10分間行う。これを遠心分離(50,000G×60分間)にかけ、得られた上澄み液Iを分取する。なお、以上の操作は、全ての試料が4℃付近で保持されるように留意して行う。
【0092】
分取された上澄み液Iのうち1mlを凍結乾燥させ、これを20μlの蒸留水にて溶解させる。これを遠心分離(50,000G×60分間)にかけ、最終的に上澄み液10μlが得られる。これをプレート中央部に10μl滴下し、これにガラスキャピラリー管により0.1vol%トリフルオロ酢酸入りアセトニトリル:蒸留水の1:1(容量比)溶液を浸透させることで展開させる。このような試料を複数枚作製する(試料I)。
【0093】
比較用試料として同様に上澄み液Iのうち1mlを凍結乾燥させ、これにコレステロール(C27H46O;平均分子量:386.73、同位体存在比が最も高い元素からなる分子の質量:386.35)を200μg添加したものを20μlの蒸留水にて溶解させる。これを遠心分離(50,000G×60分間)にかけ、最終的に上澄み液10μlが得られる。これをプレート中央部に10μl滴下し、これにガラスキャピラリー管により0.1vol%トリフルオロ酢酸入りアセトニトリル:蒸留水の1:1(容量比)溶液を浸透させることで展開させる。このような試料を複数枚作製する(試料II)。
【実施例6】
【0094】
実施例5で作製される試料のTOF−SIMS分析
実施例5で作製される試料を風乾し、これをION TOF社製TOF−SIMS IV型装置を用いて分析する。測定条件は実施例2と同一とする。
【0095】
その結果、試料I及び試料IIについては正の二次イオン質量スペクトルにおいて、コレステロール分子の親分子にAgが付加した質量に相当する二次イオンを検出することができる。また、コレステロールの親イオンに準じるこの二次イオンを用いることで、該試料I及びIIにおけるコレステロールの二次元分布状態を反映した二次元イメージ像を得ることが出来る。両者のイメージ像は同一の位置に見られるが、その強度は試料IIの方が試料Iに比べて約3倍強い値を示す。
【実施例7】
【0096】
生体関連試料が分離された分析用試料プレートの作製(4)
薄層クロマトグラフィー用プレート(Merck製、RP−18、層厚0.2mm)を30mm×5mmに切断し、該プレートにスパッタ蒸着にてAg単一原子層を形成する。
【0097】
次に、実施例1と同様の合成ペプチドI及び合成ペプチドIIの各々20μM混合水溶液を調製する。これを100μl採取し、プロテアーゼとしてendoproteinase−Glu−C(セリンプロテアーゼ。タンパク質・ペプチドのE及びDのC端側を特異的に分解する。)の1.5μg/μl溶液(0.1Mリン酸ナトリウム緩衝液、pH:8.0)を100μl加え、37℃で18時間インキュベートする。処理した溶液をプレート中央部に10μl滴下し、これにガラスキャピラリー管により0.1vol%トリフルオロ酢酸入りアセトニトリル:蒸留水の1:1(容量比)溶液を浸透させることで展開させる。このような試料を複数枚作製する。
【実施例8】
【0098】
実施例7で作製される試料のTOF−SIMS分析
実施例7で作製される試料を風乾し、これをION TOF社製TOF−SIMS IV型装置を用いて分析する。測定条件は実施例2と同一とする。
【0099】
その結果、実施例2に示す合成ペプチドIと同様のピークが観測される。また、合成ペプチドIIに相当するピークは非常に弱い。一方で、GGGGC及びEGGGGにAgの付加した親イオンに準じるピークが確認される。これらの二次イオンを用いることで、該合成ペプチドI及びIIに由来する分解物の二次元分布状態を反映した二次元イメージ像を得ることができる。
【0100】
これら合成ペプチドI及びIIに由来する分解物はAg単一原子層形成を行った薄層クロマトグラフ上で再現性良く分離される。
【0101】
なお、Ag単一原子層形成を行わない薄層クロマトグラフィー用プレートでは、上記の親イオンに準じる二次イオンピークは観測されない。また、親分子に相当する質量域においても二次イオンピークは観測されない。
【実施例9】
【0102】
生体関連試料が分離された分析用試料プレートの作製(5)
薄層クロマトグラフィー用プレート(Merck製、RP−18、層厚0.2mm)を30mm×5mmに切断し、該プレートにスパッタ蒸着にてAg単一原子層を形成する。
【0103】
次に、実施例1と同様の合成ペプチドI及び合成ペプチドIIの各々10μM混合水溶液を調製する。これをプレート中央部に10μl滴下し、これにガラスキャピラリー管により0.1vol%トリフルオロ酢酸入りアセトニトリル:蒸留水の1:1(容量比)溶液を浸透させることで展開させる。これにプロテアーゼとしてendoproteinase−Glu−Cの1.5μg/μl溶液(0.1Mリン酸ナトリウム緩衝液、pH:8.0)をプレート表面がやや湿る程度、例えば、1μL/cm2程度の量が好ましい。に噴霧し、湿度100%、37℃で18時間インキュベートする。このような試料を複数枚作製する。
【実施例10】
【0104】
実施例9で作製される試料のTOF−SIMS分析
実施例9で作製される試料を風乾し、これをION TOF社製TOF−SIMS IV型装置を用いて分析する。測定条件は実施例2と同一とする。
【0105】
その結果、実施例2に示す合成ペプチドIと同様のピークが観測される。また、合成ペプチドIIに相当するピークは非常に弱い。一方で、GGGGC及びEGGGGにAgの付加した親イオンに準じるピークが実施例2において合成ペプチドIIに相当する位置に確認される。これらの二次イオンを用いることで、該合成ペプチドI及びIIに由来する分解物の二次元分布状態を反映した二次元イメージ像を得ることができる。
【0106】
これら合成ペプチドI及びIIに由来する分解物はAg単一原子層形成を行った薄層クロマトグラフ上で再現性良く分離される。
【0107】
なお、Ag単一原子層形成を行わない薄層クロマトグラフィー用プレートでは、上記の親イオンに準じる二次イオンピークは観測されない。また、親分子に相当する質量域においても二次イオンピークは観測されない。
【0108】
本発明は健康状態に関する情報を得る手法として利用することが期待され、その利用価値は極めて高い。
【図面の簡単な説明】
【0109】
【図1】実施例2における正の二次イオン質量スペクトルの部分拡大図を示し、(a)実測スペクトルであり、(b)同位体存在比を基に算出した理論スペクトルを示す。
【図2】本発明の工程を示す。
【図3】本発明の試料台の断面図を示す。
【図4】本発明の試料台の拡大図を示す。
【符号の説明】
【0110】
201 対象物を分離する工程
202 対象物にイオン化促進物を付与する工程
203 飛行時間型二次イオン質量分析法により前記対象物の二次イオン質量スペクトルを得る工程
204 対象物を分解する工程
301 イオン化促進物質
302 分離体
303 基板
401 ガラスキャピラリー
402 試料溶液
403 イオン化促進物質を有する試料台
404 対象物を分解する試薬(噴霧状態)
405 展開された試料スポット
【技術分野】
【0001】
本発明は、混合有機物、特に生体関連物質に対してその組成についての情報を、飛行時間型二次イオン質量分析法を用いて取得する方法、そのために用いる組成情報取得装置及び飛行時間型二次イオン質量分析用試料台に関する。
【背景技術】
【0002】
近年のゲノム解析の進展により、生体内に存在する遺伝子産物であるプロテインの解析の重要性が急速にクローズアップされてきている。
【0003】
従来から、プロテインの発現及び機能解析の重要性が指摘されており、その解析手法の開発が進められている。これらの手法は基本的に
(1)二次元電気泳動や高速液体クロマトグラフ(HPLC)による分離精製と、
(2)放射線分析、光学的分析、質量分析等の検出系
との組み合わせにより行われてきた。
【0004】
プロテイン解析技術の展開としては、その基盤ともいえるプロテオーム解析(細胞内プロテインの網羅的解析)によるデータベース構築と、そこで得られたデータベースに基づく診断デバイスや創薬(薬剤候補スクリーニング)デバイスに大別される。いずれの応用形態に対しても上記のような分析時間、スループット、感度、分解能及び柔軟性に問題のある従来方法とは異なった、小型化、高速化、自動化に適したデバイスが求められてきた。これらの要求を満たす手法としてプロテインを高密度に集積したいわゆるプロテインチップの開発が注目されている。
【0005】
プロテインチップは抗原抗体反応などを利用することにより発現している特定の蛋白質を捕捉し、それを蛍光検出法や表面プラズモン共鳴法、放射性同位体標識法、マトリックス支援レーザー脱離イオン化(MALDI)質量分析法などで検出する。また、蛋白質を対象とした他の質量分析法として電界放出を利用したものがある(特許文献1参照)。この方法は、金属電極上に前記蛋白質を、印加エネルギーに応じて分裂可能な開放基を介して、共有結合または配位結合させ、強電界を印加することで前記蛋白質を質量分析計へ導くというものである。
【0006】
このような検出法に対してプロテインチップが分離精製手法として用いられる理由のひとつに、これら検出法の空間分解能に対し、プロテインチップがちょうどよい広がりを持つことが挙げられる。
【0007】
例えばMALDI質量分析法や、その改良型であるSELDI質量分析法は、現在知られている中で最もソフトなイオン化法であり、分子量が大きく壊れ易いプロテイン(蛋白質ともいう。)をそのままイオン化し、親イオン若しくはそれに準じるイオンを検出できるという優れた特徴を有する。現在ではプロテインの質量を分析する際の標準的なイオン化法の一つとなっている。一方、これらの方法をプロテインチップの質量分析に応用する場合にはマトリクス物質の存在による制約から、蛋白質の二次元分布像(質量情報を用いたイメージング)の検出においてその空間分解能には限界がある。すなわち、励起源であるレーザー光自体は1〜2μm径程度に容易に集光できるが、分析対象のプロテインの周辺に存在するマトリクス物質が蒸発、イオン化するため、上記の方法でプロテインの二次元分布像を計測する場合の空間分解能は一般的には100μm程度となってしまう。また、集光させたレーザーを走査するには、レンズやミラーを複雑に動作させる必要がある。つまり、上記の方法でプロテインの二次元分布像を計測する場合、レーザー光を走査させることは難しく、被分析試料を載せた試料ステージを動かす方式に限られる。空間分解能の高いプロテインの二次元分布像を得ようとする場合、試料ステージを動かす方式は一般的には好ましくない可能性がある(機械的な可動部があることは信頼性の面で不利となる場合がある)。
【0008】
その他の従来の検出法も、対象物の二次元分布像を得ることは難しく、また、金属電極上に対象物を固定する必要があるなど、対象試料の形態に制限がある。
【0009】
このように検出法の空間分解能という側面からも、充分な空間分解能を持って分離精製が可能であるプロテインチップが注目されている。
【0010】
一方で、近年、蛋白質の質量分析法において、高感度な質量分析手段あるいは表面分析手段として、飛行時間型二次イオン質量分析法(Time of Flight Secondary Ion Mass Spectrometry、以下、TOF−SIMSと略す。)が使われるようになってきた。TOF−SIMSとは、固体試料の最表面にどのような原子または分子が存在するかを調べるための分析方法であり、以下のような特徴を持つ。すなわち、109atoms/cm2(最表面1原子層の1/105に相当する量)の極微量成分の検出能があること、有機物、無機物のどちらにも適用できること、表面に存在するすべての元素や化合物を測定できること、試料表面に存在する物質からの二次イオンのイメージングが可能なことである。
【0011】
以下、この方法の原理を簡単に説明する。
【0012】
高真空中で、高速のパルスイオンビーム(一次イオン)を固体試料表面に照射すると、スパッタリング現象によって表面の構成成分が真空中に放出される。このとき発生する正または負の電荷を帯びたイオン(二次イオン)を電場によって一方向に収束し、一定距離だけ離れた位置で検出する。一次イオンをパルス状に固体表面に照射すると、試料表面の組成に応じて様々な質量をもった二次イオンが発生するが、軽いイオンほど速く、反対に重いイオンほど遅い速度で飛行するため、二次イオンが発生してから検出されるまでの時間(飛行時間)を測定することで、発生した二次イオンの質量を分析することができる。一次イオンが照射されると固体試料表面の最も外側で発生した二次イオンのみが、真空中へ放出されるので、試料の最表面(深さ数オングストローム程度)の情報を得ることができる。TOF−SIMSでは一次イオン照射量が著しく少ないため、有機化合物は化学構造を保った状態でイオン化され、質量スペクトルから有機化合物の構造を知ることができる。ただし、ポリエチレンやポリエステルなどの人工高分子、プロテインなどの生体高分子などを通常の条件でTOF−SIMS分析した場合は、小さな分解フラグメントイオンとなってしまい、元の構造を知ることが一般的には難しい。また、固体試料が絶縁物の場合には、パルスで照射される一次イオンの間隙に電子線をパルスで照射することにより、固体表面に蓄積する正の電荷を中和できるため絶縁物を分析することも可能である。加えて、TOF−SIMSでは、一次イオンビームを走査することによって、試料表面のイオン像(マッピング)を測定することもできる。
【0013】
TOF−SIMSでプロテインを分析した例としては、特定のプロテインの一部分を15Nなどでアイソトープラベル化し、当該プロテインをC15N−のような二次イオンを用いてイメージング検出するもの(非特許文献1参照)、アミノ酸残基に対応するフラグメントイオン(二次イオン)の種類やその相対強度からプロテインの種類を推定するもの(非特許文献2参照)、さらには各種基板上に吸着させたプロテインについてのTOF−SIMS検出限界を調べたもの(非特許文献3参照)などが知られている。
【0014】
このTOF−SIMS法では、一次イオンを使用するため容易に収束かつ走査させることができるため、高空間分解能の二次イオン像(二次元分布像)を得ることができ、1μm程度の空間分解能を得ることも可能である。しかしながら、基板上の対象物に対し、通常の条件でTOF−SIMS測定を行うと、先に述べたように、生成する二次イオンは小さな分解フラグメントイオンがほとんどで、元の構造を知ることは一般的には難しい。そのため、複数の蛋白質が基板上に配置されたプロテインチップのような試料に対し、当該蛋白質の種類を判別できる高空間分解能の二次イオン像(二次元分布像)を得るには何らかの工夫が必要となる。ベル(A. M. Belu)らの方法は特定の蛋白質の一部分をアイソトープラベル化するもので、TOF−SIMSの持つ高空間分解能を十分生かせる方法である。しかしながら反面、特定の蛋白質を毎回、アイソトープラベル化するのは一般的ではない。また、マンタス(D. S. Mantus)らが示したアミノ酸残基に対応するフラグメントイオン(二次イオン)の種類やその相対強度からプロテインの種類を推定する方法は、アミノ酸の構成が似た蛋白質が混在する場合は判別が難しくなる。
【0015】
プロテインの分離、質量分析に関する上記以外の例としては次のようなものがある。高速液体クロマトグラフィーを用いたプロテインの分離において分離能を高めたものである(特許文献2参照)。しかしながら、この文献では分離したプロテインの質量分析による同定には至っていない。また、特許文献3では、特定のプロテインの検出方法と、この検出方法の一つとして質量分析による検出が開示されているが、一般的なプロテインやその混合物を対象としたものではない。
【0016】
また、生体から採取した試料の分析から健康状態を診断する方法として、例えば、血液のろ過、分離、分析方法を開示したもの(特許文献4参照)などがあるが、二次元的に展開したプロテイン質量情報(質量別の二次元分布状態)から健康状態を診断する方法はほとんど知られていない。
【0017】
このように、プロテインチップは蛋白質の検出において、該検出器で識別可能な空間領域で蛋白質を分離精製することで診断デバイスや創薬(薬剤候補スクリーニング)デバイスとしての利用が注目されている。
【0018】
しかしながら、プロテインチップは製造コストが高い上に、該チップに載せられる蛋白質の種類の制限から未知症状の診断について網羅的な調査が難しいことの他、蛋白質の非特異吸着の発生、固定時の蛋白質の変性などが問題となる場合がある。
【特許文献1】特表2001−521275号公報
【特許文献2】特許第3376955号公報
【特許文献3】特許第3035357号公報
【特許文献4】特開2001−258868号公報
【非特許文献1】A. M. Belu et al., Anal. Chem., 73, 143 (2001)
【非特許文献2】D. S. Mantus et al., Anal. Chem., 65, 1431 (1993)
【非特許文献3】M. S. Wagner el. Al., J. Biomater. Sci. Polymer Edn., 13, 407 (2002)
【発明の開示】
【発明が解決しようとする課題】
【0019】
従って、本発明は、生体試料に固有の非特異吸着や、蛋白質の変成を軽減した、TOF−SIMS法を用いた蛋白質の検出法を提供することを目的とする。
【課題を解決するための手段】
【0020】
本発明の組成情報取得方法は、
対象物の二次イオン質量スペクトルを、飛行時間型二次イオン質量分析法を用いて取得する方法であって、
前記対象物を分離する第一の工程と、
イオン化促進物質を前記対象物に付与する第二の工程と、
前記飛行時間型二次イオン質量分析法により前記対象物の二次イオン質量スペクトルを得る第三の工程と、
を有することを特徴とする。
【0021】
また、本発明の組成情報取得方法において、前記の分離された対象物を化学的手法によって分解する工程を前記第一の工程の後にさらに有することを特徴とする。本願において、「分離された対象物を化学的手法によって分解する」とは、制限酵素によるDNAの分解やプロテアーゼによる蛋白質の分解等を意味する。
【0022】
また、本発明の組成情報取得方法において、前記対象物を分離する第一の工程は、イオン化促進物質を含み前記対象物を分離できる機構を有する分離体を用い、電気泳動法又は薄層クロマトグラフィーにより前記対象物を分離する工程であることを特徴とする。
【0023】
また、本発明の組成情報取得方法において、前記の分離された対象物を化学的手法によって分解する工程を前記第一の工程の後にさらに有することを特徴とする。
【0024】
なお、前記対象物は、生体関連物質であることが好ましい。また、生体関連物質とは、DNA、RNAなどの核酸や蛋白質を含むが、分子量等に制約はない。また、前記生体関連物質は、核酸及び蛋白質並びにこれらを化学的手法によって分解した分解物からなる群から選択した物質であることが好ましい。さらに、本発明におけるイオン化促進物質とは、金属を含む物質(混合物であってもよい)が好ましく、特に、前記イオン化促進物質は、銀若しくは金又はこれらの混合物であることが好ましい。
【0025】
さらに、本発明の組成情報取得方法において、一次イオンビームの走査により、前記対象物の二次元分布状態の情報を取得することを特徴とする。
【0026】
一方、本発明の組成情報取得装置は、飛行時間型二次イオン質量分析装置を具備する組成情報取得装置であって、前記の分析装置における試料台は、イオン化促進物質を含み、対象物を分離する機構を有することを特徴とする。
【0027】
また、本発明の組成情報取得装置は、飛行時間型二次イオン質量分析装置を具備する組成情報取得装置であって、前記の分析装置における試料台は:イオン化促進物質を含み;且つ対象物を分離する機構と、分離された対象物を化学的手法によって分解する機構とを有する;ことを特徴とする。
【0028】
また、飛行時間型二次イオン質量分析を行う試料台において、イオン化促進物質を含み、対象物を分離する機構を有することを特徴とする。
【0029】
また、前記試料台は、イオン化促進物質を含む薄層クロマトグラフィー用プレートであることを特徴とする。
【0030】
さらに、前記試料台は、イオン化促進物質を含み、対象物を分離できる機能と分離された対象物を化学的手法によって分解する機能とを有することを特徴とする。
【0031】
さらに、本発明の健康状態に関する情報を得る方法は、請求項1乃至8のいずれか一項に記載の組成情報取得方法により健康状態に関する情報を得る方法において、前記対象物は、生体から採取した試料であることを特徴とする。
【0032】
また、本発明の健康状態に関する情報を得る方法において、前記試料を固定する試料台は、組成情報取得装置から取り外し可能であることを特徴とする。
【0033】
さらに、本発明の健康状態に関する情報を得る方法において、得られた二次イオン情報及び分離されたパターン情報に基づいて前記試料の成分を分析する工程を有するであることを特徴とする。また、前記の試料の成分を分析する工程は、予め用意された種々の健康状態に対応する二次イオン情報と分離されたパターン情報のライブラリーデータとを比較する行程であることを特徴とする。
【発明の効果】
【0034】
本発明の方法により、混合有機物からなる試料を各有機物に特徴的な位置に分離させ、それぞれの「質量情報」を用いてイメージング測定することで、前記混合有機物の二次元分布状態を高空間分解能(〜1μm)で可視化し、「質量情報」に加えて有機物の特定の手がかりとなる「位置情報」をも得ることが可能となる。これら二つの情報から、例えば血液など特定の生体試料について、検出される有機物と健康状態とを対応付けてデータベース化しておくことにより、健康状態に関する情報を得ることも可能となる。
【0035】
また試料を固定する試料台が組成情報取得装置から取り外し可能であるため、試料台が持ち運び可能であり、試料の固定を被験者の元で行うことができる。
【発明を実施するための最良の形態】
【0036】
以下に、本発明をより詳細に説明する。
【0037】
本発明は、第一に、従来空間的に高い分解能を持ちながら蛋白質の分析には適当な分析手段と言えなかったTOF−SIMS法において、イオン化を促進する試薬、例えば銀や金といった金属を試料と共存させることで蛋白質のイオン化を促進することができ、それによって該蛋白質の分析を行うことができるようになったことを利用している。第二に、TOF−SIMSによる空間的に高分解能な測定が可能になったことで、従来のようなプロテインチップによる分離精製ではなく、より製造コストに優れ、網羅的に蛋白質の分離を行える分離手法、例えば電気泳動法や薄層クロマトグラフィーを用いることが本発明の特徴である。なお、この手法による分離では複数の蛋白質成分が一部混在しながら連続的に分離されるため、従来の検出法(例えば、部分抽出、濃縮後の質量分析など)では充分にその組成を把握できなかった。
【0038】
本発明の組成情報取得方法は、
対象物の二次イオン質量スペクトルを、飛行時間型二次イオン質量分析法を用いて取得する方法であって、
前記対象物を分離する第一の工程と、
イオン化促進物質を前記対象物に付与する第二の工程と、
前記飛行時間型二次イオン質量分析法により前記対象物の二次イオン質量スペクトルを得る第三の工程と、
を有することを特徴とする。
【0039】
ここで、第一の行程は、電気泳動法または薄層クロマトグラフィーにより対象物を分離する行程であってもよい。また、第二の行程は、蒸着または化学的修飾によりイオン化促進物質を付与する行程であってもよい。このようにして得た組成物を、第三の行程を実行することにより、対象物に係る情報を取得する。
【0040】
図2は、本発明の工程を示す。図2において、201は、対象物を分離する工程、202は対象物にイオン化促進物を付与する工程、203は、飛行時間型二次イオン質量分析法により前記対象物の二次イオン質量スペクトルを得る工程を示す。また204は対象物を分解する工程を示し、当該工程は、飛行時間型二次イオン質量分析法を行う前に、必要に応じて対象物を所望の大きさに分解を行うことで、他の分析結果と総合的に判断することで分析精度を高めることができる。
【0041】
以下に上記各工程について詳細に説明する。始めに、対象物を分離する第一の工程について説明する。
【0042】
本発明における対象物を分離する手法としては、TOF−SIMSの二次元イメージングという特徴を活かすため、位置の広がりを伴って成分を分離(二次元方向に成分を分離)できる手法であることが必要となる。例えば、このような分離手法としては電気泳動法や薄層クロマトグラフィーなどが挙げられる。なお、TOF−SIMS測定時は高真空下に置く必要があるため、分離した試料・基板は充分に乾燥させる必要がある。この分離手法は複数を組み合わせてもよい。例えばC8(C8H17の固定されたプレート)とC18(C18H37の固定されたプレート)のように分離モードの異なるプレートで試料を分離することで、有機物の特定の手がかりとなる「位置情報」をより的確に得ることが出来る。
【0043】
次に、イオン化促進物質を共存させることで前記対象物のイオン化を促進する第二の工
程について説明する。
【0044】
本発明においては、イオン化を促進する物質(イオン化促進物質)を、必要に応じて増感物質と表現することがある。
【0045】
本発明の対象物のイオン化を促進する物質の付与方法は、
(1)基板上に対象物を配置した後に付与する、
(2)基板上に配置される対象物の特定の一種または複数種に対し、予め付与する、
(3)基板上に対象物が配置される前に、予め基板表面に付与する、
のいずれかである。具体的な付与方法としては蒸着、化学的修飾などが挙げられる。
【0046】
このうち、(1)の方式はあらゆる形態の対象物の解析に応用できる。即ち、汎用性が高い方式である。一方で、基板上に二次元的に分布している対象物に対しイオン化を促進する物質の付与を行う際は、この処理により対象物を拡散させないように注意する必要がある。化学的修飾などの処理で対象物の二次元分布状態が変化してしまっては、本発明の目的を達成できないからである。対象物の二次元分布状態が変化したかどうかは、例えば、化学的修飾を行う前後でのTOF−SIMS分析の結果との比較などから判断できる。
【0047】
次に(2)の方式は、予め特定の対象物の特定の部位に、対象物のイオン化を促進し、TOF−SIMS分析で感度が上昇する物質(増感物質)を結合させておくものであるが、この方式は特定の対象物の二次元分布状態を選択的にかつ高感度で検出できるという利点を有する。一方で、対象物ごとに予め化学的修飾処理などを行わなければならず、操作がやや煩雑になるという短所がある。なお、上記の増感物質の結合の方式としては共有結合、イオン結合、さらには増感物質として金属錯体を用いる場合の配位結合などが利用でき、特に制限はない。ただし、化学的修飾処理した蛋白質などの対象物を基板上に配置することになるので、該結合は安定であることが必要である。
【0048】
さらに(3)の方式は、対象物のイオン化を促進し、TOF−SIMS分析で感度が上昇する物質(増感物質)を予め基板表面に形成しておくものである。この方式では該増感物質の存在により新たな非特異吸着の問題が発生しないかどうかを十分調べておくことが重要である。この増感物質はTOF−SIMS分析で感度が上昇させるものであれば特に制限はなく、また対象物と直接結合しないものであってもよい(即ち、TOF−SIMS分析で二次イオンを発生させる過程で、該対象物のイオン化効率を高める効果があればよい)。さらに、この増感物質は基板の最表面に形成させることが好ましいが、非特異吸着を防止するため、該増感物質の上に単分子膜程度の別の物質を配置することも可能である。例えば、増感物質として金の蒸着膜を形成し、その上に11−hydroxy−1−undecanethiolの自己組織化単分子膜を形成する等の例を挙げることができる。
【0049】
本発明のイオン化促進物質(増感物質)について説明する。
【0050】
本発明者らの知見によれば、本発明のイオン化促進物質を対象物に作用させた場合に、対象物に一次イオンを照射した際に二次イオン化生成効率を向上させる作用については、以下のように考えている。
【0051】
対象物が生体から採取した試料である場合、生体組織中では、測定対象のタンパク質分子のペプチド鎖同士が絡み合い、TOF−SIMS法による測定の際、二次イオン種の生成効率を低下させる要因となっている。これに対して本発明においては、生体から採取した試料表面に、イオン化促進物質を含む溶液を作用させ、表面に存在するタンパク質分子に由来する二次イオン種の生成効率を向上させることができる。このイオン化促進物質は、一次イオンを照射する際、表面に存在するタンパク質分子に由来する二次イオン種の生成を促進・増加させる機能を示す物質である。
【0052】
具体的な作用方法の一例としては、イオン化促進物質を生体から採取した試料表面に存在するタンパク質分子に直接作用させるために、増感物質を含む溶液を試料表面に付与して、表面全体を被覆する状態で保持することが挙げられる。
【0053】
例えば、イオン化促進物質を含む溶液として、希薄な硝酸銀水溶液を用いると、該水溶液中で解離している銀イオンは、タンパク質分子を構成するペプチド鎖に作用して、銀イオンとタンパク質分子間に結合が生成し、二次イオン種の生成が促進される。このように本発明においては、イオン化促進物質自体、あるいは、イオン化促進物質の構成要素が、タンパク質分子を構成するペプチド鎖に作用して、ペプチド鎖と結合を生成することで、結果的に、タンパク質分子のペプチド鎖同士の絡み合いが解かれた状態となるものと考えられる。
【0054】
また、銀イオンはそれ自体がイオンとなりやすい物質であることから、この点からもタンパク質分子と結合することでタンパク質のイオン化を促進する効果を持つと考えられる。
【0055】
本発明において利用され得るイオン化促進物としては、例えば、前記硝酸銀の他、炭酸ナトリウムなどの塩、金や銀などの金属を含む物質(金属錯体など)や金属コロイドなどが挙げられる。また、イオン化促進物を含む溶液は、水溶液の形態が好ましい。
【0056】
本発明の化学的修飾とは、上記のように、TOF−SIMS分析で二次イオンを発生させる過程で、プロテインのイオン化効率を高める効果があり、該プロテインの二次元分布状態を変化させない処理であれば特に制限はないが、化学的修飾剤として金属を含む物質を用いることが好ましい。前記金属の種類としては、本発明者らが検討した限りでは銀または金、さらにはその両者を含む場合が特に好ましかったが、上記の効果を持つものであればこれ以外の金属であってもよい。
【0057】
化学的修飾の一手法として、基板上に配置された複数のプロテインに対し、銀鏡反応を利用して銀または銀イオンを該プロテインに付加させる方法を挙げることができる。銀鏡反応とは、アンモニア性硝酸銀水溶液に試料を加え、次いでジアンミン銀(I)イオンを還元し銀を析出させる反応である。銀はイオウとの親和性が高いことから、この反応はシステイン(Cysteine;Cys)を含むプロテインに対し特に有効である。また、基板上に二次元的に分布しているプロテインに対しこの反応を利用する場合は、同処理により該プロテインを拡散させないよう注意を払う必要がある。この反応に用いる試薬として、市販品(例えば、和光純薬製「銀染色IIキットワコー」など)を使用してもよい。また、硝酸銀水溶液を直接噴霧することによっても対象物のイオン化を促進する効果を得ることが出来る。
【0058】
しかしながら、化学的修飾の方法は上記に限られず、TOF−SIMS分析における対象物の二次イオン化効率を高める効果があり、該対象物の二次元分布状態を変化させない処理であればいかなる方法を用いてもよい。
【0059】
最後に、飛行時間型二次イオン質量分析法により、前記対象物の質量に関する情報(二次イオン質量スペクトル)を得る第三の工程について説明する。
【0060】
本発明の対象物の二次元分布状態の検出(イメージング)は、前記対象物を識別できる二次イオンを用いることを特徴としており、この二次イオンは質量/電荷比が500以上のイオンであることが好ましく、質量/電荷比が1000以上のイオンであることが特に好ましい。その理由は、蛋白のアミノ酸は典型的には質量数が100〜200であるため、重い二次イオンを検出できるほうが同定能力が高く、蛋白の同定に有用なデータとして、質量/電荷比が1000以上では5〜10のアミノ酸配列を知ることが出来、同定に有利であるからである。
【0061】
また、一次イオン種としては、イオン化効率、質量分解能等の観点からガリウムイオン、セシウムイオン、また、場合によっては金(Au)イオン等が、好適に用いられる。なお、Auイオンを用いると、極めて高感度の分析が可能となる点で好ましい。その際、Auイオンのみならず、金の多原子イオンである、Au2イオン、Au3イオンを用いることができ、この順で感度の上昇が図られる場合も多く、金の多原子イオンの利用は、さらに好ましい形態となる。
【0062】
さらに、一次イオンビームパルス周波数は、1kHz〜50kHzの範囲であることが望ましく、また、一次イオンビームエネルギーは、12keV〜25keVの範囲であること、さらには、一次イオンビームパルス幅は、0.5ns〜10nsの範囲であることが望ましい。
【0063】
また、本発明は、定量精度を向上させるために、高い質量分解能を保持し、比較的短時間で測定を完了させる必要があることから(一測定が数10秒から数10分のオーダー)、一次イオンビーム径は多少犠牲にして測定することが好ましい。具体的には、一次イオンビーム径をサブミクロンオーダーまで絞らずに、1μmから10μmの範囲に設定することが好ましい。その理由は、装置のスペック上、短時間で測定を終わらせることができるからである。
【0064】
このようにして得られる二次イオンの質量数に関する情報、および該二次イオンのイメージングにより得られる(対象物が分離された)パターン情報に基づいて試料の成分を分析することも可能となる。
【0065】
即ち、本発明における成分分析は対象物のイオン化を促進するための物質(イオン化促進物質)を用いて試料のイオン化を促進する第二の工程によって試料をより的確に特定できる情報を得ることを特徴とする。さらに、対象物を分離する第一の工程により、分離された各成分それぞれに特有な分離位置情報を更に特定のための情報として用いることにより、精度良く混合有機物試料の同定を行うことを特徴としている。例えば薄層クロマトグラフィーの場合、同一の分離条件においては各有機物試料がそれぞれ固有の位置に再現性良く分離される。これに、例えば銀原子を並存させてTOF−SIMS測定を行うことで、試料特定に有利な大きな質量/電荷比を持つ二次イオンを得ることが出来る。これらの情報を併せることで精度良く混合有機物試料の同定を行うことが出来る。特に、生体の特定の部位における蛋白質組成についてこれら二次イオンの質量数と分離位置についてのデータベースライブラリーを作製しておけば、健康状態の変化などに伴う組成変化を迅速に特定することが出来、健康状態の診断に用いることが出来る。
【0066】
次に図3を参照して本発明の試料台の断面図を示す。図3は、本発明の試料台の断面図を示す。図3において303は基板、302は分離体、301はイオン化促進物質である。
【0067】
イオン化促進物質301は分離体302の表面にのみ設けても良いが、分離体の内部に含まれていても良い。イオン化促進物質301を分離体302の表面に形成する方法としては、スパッタ、蒸着、CVD、電析等の方法を用いることが好ましい。
【0068】
前記対象物を分離する機能としての分離体302上にイオン化促進物質を設ける場合、その厚さとしては、厚すぎると、対象物の検出が困難になるため、当該厚さの上限としては好ましくは100nm以下、より好ましくは10nm以下、最適には5nm以下である。一方当該イオン化促進物質の厚さの下限としては、イオン化促進機能が発現され、目的とする対象物の分析が可能であれば特に制限はない。本発明者らの知見によれば、分離体上のイオン化促進物質の密度が1010atoms/cm2以上であれば本発明の分析を行うことができる。
【0069】
薄層クロマトグラフィーにより分離を行う場合は、対象物を分離する機能としての分離体302としては、所望の空隙を有するガラスの焼結体を基板303に固定したもの、同様にセルロースを基板303に固定したもの等を採用することが好ましい。
【0070】
また電気泳動法により分離を行う場合は、対象物を分離する機能としての分離体302としては、所望の空隙を有するゲル状物質、例えばポリアクリルアミドゲル、アガロースゲル等を採用することが好ましい。そして電気泳動法により試料から対象物を分離する場合は、前記ゲルに試料を滴下した後、所定の電界(例えば100V)を印加し、所定の時間電界を印加した状態を維持することによって対象物を分離することができる。
【0071】
次に図4を用いて本発明の試料台を用いた対象物の分離方法を説明する。図4において401はガラスキャピラリー、402は試料溶液、403はイオン化促進物質を有する試料台、404は対象物を分解する試薬(噴霧状態)、405は展開された試料スポットである。
【0072】
本発明において上記試料台とは、薄層クロマトグラフィー用プレート等のプレート自体、または当該プレート等を飛行時間型二次イオン質量分析装置に取り付けるためのホルダー等に固定したもの全体を示す。
【0073】
本発明の試料台はイオン化促進物質を含み、且つ対象物を分離できる機構または機能を有するものである。この試料台の具体例は、このような機能を有するものであれば、薄層クロマトグラフィー用プレートに限定されず、例えば、電気泳動法などがある。また必要に応じて分離された対象物を分解する工程を設けることができる。
【0074】
例えばイオン化促進物質である銀を蒸着した試料台(銀を蒸着した薄層クロマトグラフィー用プレート)403を調製し、これにガラスキャピラリー401を用いて試料溶液402を展開させることで試料溶液402から対象物を分離することができる。展開された試料スポット405に対象物を分解する試薬(噴霧状態)404を噴霧することで分離した対象物を分解することができる。
【0075】
上記対象物を分解する試薬(噴霧状態)404は必要に応じて噴霧手段を本発明の組成情報取得装置に設けることにより、一連の作業を効率的に行うことができる。
【0076】
以下に、実施例を挙げて、本発明をより具体的に説明する。以下に示す具体例は、本発明にかかる最良の実施形態の一例ではあるが、本発明はかかる具体的形態に限定されるものではない。
【実施例1】
【0077】
生体関連試料が分離された分析用試料プレートの作製(1)
薄層クロマトグラフィー用プレート(Merck製、RP−18、層厚0.2mm)を30mm×5mmに切断し、該プレートにスパッタ蒸着にてAg単一原子層を形成する。
【0078】
次に、合成ペプチドI(ペプチド配列:GGGGCGGGGG、C21H34N10O11S (平均分子量:634.61、同位体存在比が最も高い元素からなる分子の質量:634.21)シグマジェノシスジャパン社より購入)及び合成ペプチドII(ペプチド配列:GGGGCEGGGG、C24H38N10O13S (平均分子量:706.79、同位体存在比が最も高い元素からなる分子の質量:706.23)シグマジェノシスジャパン社より購入)の各々10μM混合水溶液を調製する。これをプレート中央部に10μl滴下し、これにガラスキャピラリー管により0.1vol%トリフルオロ酢酸入りアセトニトリル:蒸留水の1:1(容量比)溶液を浸透させることで展開させる。このような試料を複数枚作製する。
【実施例2】
【0079】
実施例1で作製される試料のTOF−SIMS分析
実施例1で作製される試料を風乾し、これをION TOF社製TOF−SIMS IV型装置を用いて分析する。測定条件を以下に要約する。
【0080】
一次イオン:25kV Ga+、0.6pA(パルス電流値)、ランダムスキャンモード
一次イオンのパルス周波数:2.5kHz(400μs/shot)
一次イオンパルス幅:約1ns
一次イオンビーム直径:約5μm
測定領域:マクロラスタ(30mm×5mm)
積算回数:256
このような条件で正および負の二次イオン質量スペクトルを測定すると、合成ペプチドIについては正の二次イオン質量スペクトルにおいて、その親分子にAgが付加し、さらに、炭素、酸素原子が一つずつ付加した質量に相当する二次イオンを検出することができる。また合成ペプチドIIについても同様に、正の二次イオン質量スペクトルにおいてその親分子にAgが付加し、さらに、炭素、酸素原子が一つずつ付加した質量に相当する二次イオンを検出することができる。
【0081】
合成ペプチドIにおける、この領域のスペクトル拡大図を図1(a)に、同位体存在比を基に算出した理論スペクトルを図1(b)にそれぞれ示す。図1中、矢印を付けたピークは上記のイオン[(合成ペプチドI)+(Ag)+(CO)]+に相当するもので、矢印二本はそれぞれ二つのAgの同位体(質量数:107,109)に対応している。右側の矢印を付けたピークは109Agを含むもので、そのm/z値(771.2)は、[(合成ペプチドI)+(109Ag)+(CO)]+の理論値にほぼ一致する。合成ペプチドIIにおいても同様なスペクトルが得られる。これら合成ペプチドI及びIIの親イオンに準じるこれらの二次イオンを用いることで、該合成ペプチドI及びIIの二次元分布状態を反映した二次元イメージ像を得ることができる。
【0082】
これら合成ペプチドI及びIIはAg単一原子層が形成された薄層クロマトグラフ上で再現性良く分離される。
【0083】
なお、Ag単一原子層形成を行わない薄層クロマトグラフィー用プレートでは、上記の親イオンに準じる二次イオンピークは観測されない。また、親分子に相当する質量域においても二次イオンピークは観測されない。
【実施例3】
【0084】
生体関連試料が分離された分析用試料プレートの作製(2)
薄層クロマトグラフィー用プレート(Merck製、RP−18、層厚0.2mm)を30mm×5mmに切断し、試料分離用プレートとする。
【0085】
次に、実施例1と同様の合成ペプチドI及び合成ペプチドIIの各々10μM混合水溶液を調製する。これをプレート中央部に10μl滴下し、これにガラスキャピラリー管により0.1vol%トリフルオロ酢酸入りアセトニトリル:蒸留水の1:1(容量比)溶液を浸透させることで展開させる。これに10μM硝酸銀水溶液をプレート表面がやや湿る程度に噴霧を行う。例えば、1μL/cm2程度の量が好ましい。このような試料を複数枚作製する。
【実施例4】
【0086】
実施例3で作製される試料のTOF−SIMS分析
実施例3で作製される試料を風乾し、これをION TOF社製TOF−SIMS IV型装置を用いて分析する。測定条件は実施例2と同一とする。
【0087】
その結果、実施例2に示すものと同様のピークが観測される。また、これら合成ペプチドI及びIIの親イオンに準じるこれらの二次イオンを用いることで、該合成ペプチドI及びIIの二次元分布状態を反映した二次元イメージ像を得ることができる。
【0088】
これら合成ペプチドI及びIIは硝酸銀水溶液噴霧を行った後の薄層クロマトグラフ上で再現性良く分離される。
【0089】
なお、硝酸銀水溶液の噴霧を行わない薄層クロマトグラフィー用プレートでは、上記の親イオンに準じる二次イオンピークは観測されない。また、親分子に相当する質量域においても二次イオンピークは観測されない。
【実施例5】
【0090】
生体関連試料が分離された分析用試料プレートの作製(3)
薄層クロマトグラフィー用プレート(Merck製、RP−18、層厚0.2mm)を30mm×5mmに切断し、該プレートにスパッタ蒸着にてAg単一原子層を形成する。
【0091】
次に健常人の血液を2ml採取し、これに0.2vol%トリフルオロ酢酸入りアセトニトリル2mlを加える。これを乳鉢にて磨砕し、更に超音波処理を10分間行う。これを遠心分離(50,000G×60分間)にかけ、得られた上澄み液Iを分取する。なお、以上の操作は、全ての試料が4℃付近で保持されるように留意して行う。
【0092】
分取された上澄み液Iのうち1mlを凍結乾燥させ、これを20μlの蒸留水にて溶解させる。これを遠心分離(50,000G×60分間)にかけ、最終的に上澄み液10μlが得られる。これをプレート中央部に10μl滴下し、これにガラスキャピラリー管により0.1vol%トリフルオロ酢酸入りアセトニトリル:蒸留水の1:1(容量比)溶液を浸透させることで展開させる。このような試料を複数枚作製する(試料I)。
【0093】
比較用試料として同様に上澄み液Iのうち1mlを凍結乾燥させ、これにコレステロール(C27H46O;平均分子量:386.73、同位体存在比が最も高い元素からなる分子の質量:386.35)を200μg添加したものを20μlの蒸留水にて溶解させる。これを遠心分離(50,000G×60分間)にかけ、最終的に上澄み液10μlが得られる。これをプレート中央部に10μl滴下し、これにガラスキャピラリー管により0.1vol%トリフルオロ酢酸入りアセトニトリル:蒸留水の1:1(容量比)溶液を浸透させることで展開させる。このような試料を複数枚作製する(試料II)。
【実施例6】
【0094】
実施例5で作製される試料のTOF−SIMS分析
実施例5で作製される試料を風乾し、これをION TOF社製TOF−SIMS IV型装置を用いて分析する。測定条件は実施例2と同一とする。
【0095】
その結果、試料I及び試料IIについては正の二次イオン質量スペクトルにおいて、コレステロール分子の親分子にAgが付加した質量に相当する二次イオンを検出することができる。また、コレステロールの親イオンに準じるこの二次イオンを用いることで、該試料I及びIIにおけるコレステロールの二次元分布状態を反映した二次元イメージ像を得ることが出来る。両者のイメージ像は同一の位置に見られるが、その強度は試料IIの方が試料Iに比べて約3倍強い値を示す。
【実施例7】
【0096】
生体関連試料が分離された分析用試料プレートの作製(4)
薄層クロマトグラフィー用プレート(Merck製、RP−18、層厚0.2mm)を30mm×5mmに切断し、該プレートにスパッタ蒸着にてAg単一原子層を形成する。
【0097】
次に、実施例1と同様の合成ペプチドI及び合成ペプチドIIの各々20μM混合水溶液を調製する。これを100μl採取し、プロテアーゼとしてendoproteinase−Glu−C(セリンプロテアーゼ。タンパク質・ペプチドのE及びDのC端側を特異的に分解する。)の1.5μg/μl溶液(0.1Mリン酸ナトリウム緩衝液、pH:8.0)を100μl加え、37℃で18時間インキュベートする。処理した溶液をプレート中央部に10μl滴下し、これにガラスキャピラリー管により0.1vol%トリフルオロ酢酸入りアセトニトリル:蒸留水の1:1(容量比)溶液を浸透させることで展開させる。このような試料を複数枚作製する。
【実施例8】
【0098】
実施例7で作製される試料のTOF−SIMS分析
実施例7で作製される試料を風乾し、これをION TOF社製TOF−SIMS IV型装置を用いて分析する。測定条件は実施例2と同一とする。
【0099】
その結果、実施例2に示す合成ペプチドIと同様のピークが観測される。また、合成ペプチドIIに相当するピークは非常に弱い。一方で、GGGGC及びEGGGGにAgの付加した親イオンに準じるピークが確認される。これらの二次イオンを用いることで、該合成ペプチドI及びIIに由来する分解物の二次元分布状態を反映した二次元イメージ像を得ることができる。
【0100】
これら合成ペプチドI及びIIに由来する分解物はAg単一原子層形成を行った薄層クロマトグラフ上で再現性良く分離される。
【0101】
なお、Ag単一原子層形成を行わない薄層クロマトグラフィー用プレートでは、上記の親イオンに準じる二次イオンピークは観測されない。また、親分子に相当する質量域においても二次イオンピークは観測されない。
【実施例9】
【0102】
生体関連試料が分離された分析用試料プレートの作製(5)
薄層クロマトグラフィー用プレート(Merck製、RP−18、層厚0.2mm)を30mm×5mmに切断し、該プレートにスパッタ蒸着にてAg単一原子層を形成する。
【0103】
次に、実施例1と同様の合成ペプチドI及び合成ペプチドIIの各々10μM混合水溶液を調製する。これをプレート中央部に10μl滴下し、これにガラスキャピラリー管により0.1vol%トリフルオロ酢酸入りアセトニトリル:蒸留水の1:1(容量比)溶液を浸透させることで展開させる。これにプロテアーゼとしてendoproteinase−Glu−Cの1.5μg/μl溶液(0.1Mリン酸ナトリウム緩衝液、pH:8.0)をプレート表面がやや湿る程度、例えば、1μL/cm2程度の量が好ましい。に噴霧し、湿度100%、37℃で18時間インキュベートする。このような試料を複数枚作製する。
【実施例10】
【0104】
実施例9で作製される試料のTOF−SIMS分析
実施例9で作製される試料を風乾し、これをION TOF社製TOF−SIMS IV型装置を用いて分析する。測定条件は実施例2と同一とする。
【0105】
その結果、実施例2に示す合成ペプチドIと同様のピークが観測される。また、合成ペプチドIIに相当するピークは非常に弱い。一方で、GGGGC及びEGGGGにAgの付加した親イオンに準じるピークが実施例2において合成ペプチドIIに相当する位置に確認される。これらの二次イオンを用いることで、該合成ペプチドI及びIIに由来する分解物の二次元分布状態を反映した二次元イメージ像を得ることができる。
【0106】
これら合成ペプチドI及びIIに由来する分解物はAg単一原子層形成を行った薄層クロマトグラフ上で再現性良く分離される。
【0107】
なお、Ag単一原子層形成を行わない薄層クロマトグラフィー用プレートでは、上記の親イオンに準じる二次イオンピークは観測されない。また、親分子に相当する質量域においても二次イオンピークは観測されない。
【0108】
本発明は健康状態に関する情報を得る手法として利用することが期待され、その利用価値は極めて高い。
【図面の簡単な説明】
【0109】
【図1】実施例2における正の二次イオン質量スペクトルの部分拡大図を示し、(a)実測スペクトルであり、(b)同位体存在比を基に算出した理論スペクトルを示す。
【図2】本発明の工程を示す。
【図3】本発明の試料台の断面図を示す。
【図4】本発明の試料台の拡大図を示す。
【符号の説明】
【0110】
201 対象物を分離する工程
202 対象物にイオン化促進物を付与する工程
203 飛行時間型二次イオン質量分析法により前記対象物の二次イオン質量スペクトルを得る工程
204 対象物を分解する工程
301 イオン化促進物質
302 分離体
303 基板
401 ガラスキャピラリー
402 試料溶液
403 イオン化促進物質を有する試料台
404 対象物を分解する試薬(噴霧状態)
405 展開された試料スポット
【特許請求の範囲】
【請求項1】
対象物の二次イオン質量スペクトルを、飛行時間型二次イオン質量分析法を用いて取得する方法であって、
前記対象物を分離する第一の工程と、
イオン化促進物質を前記対象物に付与する第二の工程と、
前記飛行時間型二次イオン質量分析法により前記対象物の二次イオン質量スペクトルを得る第三の工程と、
を有することを特徴とする前記対象物の組成情報取得方法。
【請求項2】
前記の分離された対象物を化学的手法によって分解する工程を前記第一の工程の後にさらに有することを特徴とする請求項1に記載の前記対象物の組成情報取得方法。
【請求項3】
前記対象物を分離する第一の工程は、イオン化促進物質を含み前記対象物を分離できる機構を有する分離体を用い、電気泳動法又は薄層クロマトグラフィーにより前記対象物を分離する工程であることを特徴とする請求項1に記載の前記対象物の組成情報取得方法。
【請求項4】
前記の分離された対象物を化学的手法によって分解する工程を前記第一の工程の後にさらに有することを特徴とする請求項3に記載の前記対象物の組成情報取得方法。
【請求項5】
前記対象物は、生体関連物質であることを特徴とする請求項1乃至4のいずれか一項に記載の前記対象物の組成情報取得方法。
【請求項6】
前記生体関連物質は、核酸及び蛋白質並びにこれらを化学的手法によって分解した分解物からなる群から選択した物質であることを特徴とする請求項5に記載の前記対象物の組成情報取得方法。
【請求項7】
前記イオン化促進物質は、銀若しくは金又はこれらの混合物であることを特徴とする請求項1乃至4のいずれか一項に記載の前記対象物の組成情報取得方法。
【請求項8】
一次イオンビームの走査により、前記対象物の二次元分布状態の情報を取得することを特徴とする請求項1乃至7のいずれか一項に記載の前記対象物の組成情報取得方法。
【請求項9】
飛行時間型二次イオン質量分析装置を具備する組成情報取得装置であって、前記の分析装置における試料台は、イオン化促進物質を含み、対象物を分離する機構を有することを特徴とする前記対象物の組成情報取得装置。
【請求項10】
飛行時間型二次イオン質量分析装置を具備する組成情報取得装置であって、
前記の分析装置における試料台は:
イオン化促進物質を含み;且つ
対象物を分離する機構と、分離された対象物を化学的手法によって分解する機構とを有する;
ことを特徴とする前記対象物の組成情報取得装置。
【請求項11】
飛行時間型二次イオン質量分析を行う試料台において、
イオン化促進物質を含み、対象物を分離する機構を有することを特徴とする飛行時間型二次イオン質量分析用試料台。
【請求項12】
前記試料台は、イオン化促進物質を含む薄層クロマトグラフィー用プレートであることを特徴とする請求項11に記載の飛行時間型二次イオン質量分析用試料台。
【請求項13】
前記試料台は、イオン化促進物質を含み、対象物を分離できる機能と分離された対象物を化学的手法によって分解する機能とを有することを特徴とする請求項11又は12に記載の飛行時間型二次イオン質量分析用試料台。
【請求項14】
請求項1乃至8のいずれか一項に記載の組成情報取得方法により健康状態に関する情報を得る方法において、前記対象物は、生体から採取した試料であることを特徴とする健康状態に関する情報を得る方法。
【請求項15】
前記試料を固定する試料台は、組成情報取得装置から取り外し可能であることを特徴とする請求項14に記載の健康状態に関する情報を得る方法。
【請求項16】
前記質量分析法の結果から得られた二次イオン情報及び分離されたパターン情報に基づいて前記試料の成分を分析する工程を有することを特徴とする請求項14又は15に記載の健康状態に関する情報を得る方法。
【請求項17】
前記の試料の成分を分析する工程は、予め用意された種々の健康状態に対応する二次イオン情報と分離されたパターン情報のライブラリーデータとを比較する行程であることを特徴とする請求項16に記載の健康状態に関する情報を得る方法。
【請求項1】
対象物の二次イオン質量スペクトルを、飛行時間型二次イオン質量分析法を用いて取得する方法であって、
前記対象物を分離する第一の工程と、
イオン化促進物質を前記対象物に付与する第二の工程と、
前記飛行時間型二次イオン質量分析法により前記対象物の二次イオン質量スペクトルを得る第三の工程と、
を有することを特徴とする前記対象物の組成情報取得方法。
【請求項2】
前記の分離された対象物を化学的手法によって分解する工程を前記第一の工程の後にさらに有することを特徴とする請求項1に記載の前記対象物の組成情報取得方法。
【請求項3】
前記対象物を分離する第一の工程は、イオン化促進物質を含み前記対象物を分離できる機構を有する分離体を用い、電気泳動法又は薄層クロマトグラフィーにより前記対象物を分離する工程であることを特徴とする請求項1に記載の前記対象物の組成情報取得方法。
【請求項4】
前記の分離された対象物を化学的手法によって分解する工程を前記第一の工程の後にさらに有することを特徴とする請求項3に記載の前記対象物の組成情報取得方法。
【請求項5】
前記対象物は、生体関連物質であることを特徴とする請求項1乃至4のいずれか一項に記載の前記対象物の組成情報取得方法。
【請求項6】
前記生体関連物質は、核酸及び蛋白質並びにこれらを化学的手法によって分解した分解物からなる群から選択した物質であることを特徴とする請求項5に記載の前記対象物の組成情報取得方法。
【請求項7】
前記イオン化促進物質は、銀若しくは金又はこれらの混合物であることを特徴とする請求項1乃至4のいずれか一項に記載の前記対象物の組成情報取得方法。
【請求項8】
一次イオンビームの走査により、前記対象物の二次元分布状態の情報を取得することを特徴とする請求項1乃至7のいずれか一項に記載の前記対象物の組成情報取得方法。
【請求項9】
飛行時間型二次イオン質量分析装置を具備する組成情報取得装置であって、前記の分析装置における試料台は、イオン化促進物質を含み、対象物を分離する機構を有することを特徴とする前記対象物の組成情報取得装置。
【請求項10】
飛行時間型二次イオン質量分析装置を具備する組成情報取得装置であって、
前記の分析装置における試料台は:
イオン化促進物質を含み;且つ
対象物を分離する機構と、分離された対象物を化学的手法によって分解する機構とを有する;
ことを特徴とする前記対象物の組成情報取得装置。
【請求項11】
飛行時間型二次イオン質量分析を行う試料台において、
イオン化促進物質を含み、対象物を分離する機構を有することを特徴とする飛行時間型二次イオン質量分析用試料台。
【請求項12】
前記試料台は、イオン化促進物質を含む薄層クロマトグラフィー用プレートであることを特徴とする請求項11に記載の飛行時間型二次イオン質量分析用試料台。
【請求項13】
前記試料台は、イオン化促進物質を含み、対象物を分離できる機能と分離された対象物を化学的手法によって分解する機能とを有することを特徴とする請求項11又は12に記載の飛行時間型二次イオン質量分析用試料台。
【請求項14】
請求項1乃至8のいずれか一項に記載の組成情報取得方法により健康状態に関する情報を得る方法において、前記対象物は、生体から採取した試料であることを特徴とする健康状態に関する情報を得る方法。
【請求項15】
前記試料を固定する試料台は、組成情報取得装置から取り外し可能であることを特徴とする請求項14に記載の健康状態に関する情報を得る方法。
【請求項16】
前記質量分析法の結果から得られた二次イオン情報及び分離されたパターン情報に基づいて前記試料の成分を分析する工程を有することを特徴とする請求項14又は15に記載の健康状態に関する情報を得る方法。
【請求項17】
前記の試料の成分を分析する工程は、予め用意された種々の健康状態に対応する二次イオン情報と分離されたパターン情報のライブラリーデータとを比較する行程であることを特徴とする請求項16に記載の健康状態に関する情報を得る方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2006−201149(P2006−201149A)
【公開日】平成18年8月3日(2006.8.3)
【国際特許分類】
【出願番号】特願2005−161498(P2005−161498)
【出願日】平成17年6月1日(2005.6.1)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
【公開日】平成18年8月3日(2006.8.3)
【国際特許分類】
【出願日】平成17年6月1日(2005.6.1)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
[ Back to top ]

