組換えFc受容体およびそれの製造方法
【課題】 抗体の免疫活性測定用試薬として有用なFcγRI細胞外領域を、活性型として発現させるためのポリヌクレオチド、およびそれを用いたFcγRIを簡便に製造する方法を提供すること。
【解決手段】 FcγRI細胞外領域をコードするポリヌクレオチドの5’末端側にペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドを付加したポリヌクレオチド、前記ポリヌクレオチドを含む発現プラスミド、および前記プラスミドで宿主を形質転換して得られる形質転換体を用いることで、可溶性かつ抗体結合活性を有したFcγRIを簡便に製造することができた。
【解決手段】 FcγRI細胞外領域をコードするポリヌクレオチドの5’末端側にペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドを付加したポリヌクレオチド、前記ポリヌクレオチドを含む発現プラスミド、および前記プラスミドで宿主を形質転換して得られる形質転換体を用いることで、可溶性かつ抗体結合活性を有したFcγRIを簡便に製造することができた。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒト抗体に対して高い親和性を有し、抗体の免疫活性測定用試薬として有用なFcレセプター、および遺伝子工学的手法を用いたFcレセプターの製造方法に関する。
【背景技術】
【0002】
Fcレセプター(Fc受容体)とは免疫グロブリン分子のFc領域に結合する一群のタンパク質分子である。個々の分子種は免疫グロブリンスーパーファミリーに属するFc認識ドメインを有し、単一種の、または同じサブタイプに属する免疫グロブリンを認識する。これによって個々の免疫応答においてどのアクセサリー細胞が動員されるかが決定される(非特許文献1)。
【0003】
Fcレセプターは、さらにサブタイプに分類することができ、免疫グロブリンG(以下IgGという)に対するレセプターとしてはFcγRI、FcγRIIa、FcγRIIb、FcγRIIIの存在が報告されている(非特許文献1)。中でも、FcγRIとIgGの結合親和性は高く、その平衡解離定数(KD)は10−8M以下である(非特許文献2)。FcγRIはIgGに対するレセプターであり、単球とマクロファージ上に構成的に発現し、好中球および好酸球上においては誘導的に発現する。FcγRIは、細胞外領域、細胞膜貫通領域、細胞質内領域に区分され、IgGとの結合は、IgG分子Fc領域とFcγRIの細胞外領域で起こり、その後細胞質へと結合のシグナルが伝達される。FcγRIはIgGとの結合に直接関わるα鎖と、γ鎖の2種類のサブユニットによって構成されており、γ鎖は細胞膜貫通領域と細胞外領域の境界にあるシステインを介した共有結合によりホモダイマーを形成している(非特許文献1)。
【0004】
Fcレセプターには免疫抑制的な生物学的特性があることから、近年では、自己免疫疾患、移植物の拒絶、悪性リンパ増殖などの領域において有効な医薬となる可能性が期待されている。また、Fcレセプターはヒトが持っている免疫機能の一つであることから、抗体のADCC(Anitibody−Dependent Cellular Cytotoxicity)活性(抗体依存性細胞障害活性)を測定するためのタンパク質としても注目を浴びている(特許文献1)。さらに、Fcレセプターの一つであるFcγRIが有する抗体への結合能は抗体の免疫活性測定用試薬や各種抗体精製用クロマトグラフィーゲルに用いる捕捉タンパク質として利用することができる(特許文献2)。
【0005】
このようにFcγRIの有する機能、およびさらなる生物学的機能を追求するために、FcγRI、その中でも特に抗体への結合能を有する細胞外領域を、遺伝子工学的手法を用いて効率よく発現させる試みがなされている。FcγRI細胞外領域を発現させる方法としては、哺乳動物細胞や昆虫細胞等を利用したものがある(非特許文献3)が、煩雑な作業と手間を要する。また、FcγRI細胞外領域を取扱いの容易な大腸菌で発現させた例もあるが、FcγRI細胞外領域は不活性型である封入体として発現するため、必ずしも効率的で有用な方法ではない(特許文献2および3)。さらに、従来、FcγRI細胞外領域を発現させる際は、FcγRI細胞外領域の一部分を欠いたポリペプチドで発現させたり、融合タンパク質の形態で発現させたり、グルタチオン−S−トランスフェラーゼやFLAG−tag等をN末端に付加して発現させていた。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2009−501913号公報
【特許文献2】特開2008−245580号公報
【特許文献3】特表2002−531086号公報
【非特許文献】
【0007】
【非特許文献1】J.V.Ravetch等,Annu.Rev.Immunol.,9,457,1991
【非特許文献2】J.M.Allen等,Science,243,378,1989
【非特許文献3】A.Paetz等,Biochem.Biophys.Res.comun.,338,1811,2005
【非特許文献4】“Plasmid transformation of Escherichia coli and other bacteria”,Method in Enzymology,204,63−113,1991,Academic Press
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、抗体の免疫活性測定用試薬として有用なFcγRI細胞外領域を、活性型として発現させるためのポリヌクレオチド、およびそれを用いたFcγRIを簡便に製造する方法を提供することにある。
【課題を解決するための手段】
【0009】
上記課題を鑑みてなされた本発明は、以下の発明を包含する。
【0010】
第一の発明は、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドの5’末端側に、ペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドを付加した、ポリヌクレオチドである。
【0011】
第二の発明は、ペリプラズムにタンパク質を分泌させるシグナルペプチドが配列番号13から16に示すいずれかのポリペプチドである、第一の発明に記載のポリヌクレオチドである。
【0012】
第三の発明は、配列番号3から12に示すいずれかのポリペプチドをコードする、ポリヌクレオチドである。
【0013】
第四の発明は、第一から第三のいずれかの発明に記載のポリヌクレオチドを含む、ヒト型FcレセプターFcγRIを発現させるためのプラスミドである。
【0014】
第五の発明は、第四の発明に記載のプラスミドで宿主を形質転換して得られる、ヒト型FcレセプターFcγRIを発現可能な形質転換体である。
【0015】
第六の発明は、第五の発明に記載の形質転換体を用いた、ヒト型FcレセプターFcγRIの製造方法である。
【0016】
以下、本発明について詳細に説明する。
【0017】
本発明においてヒト型FcレセプターFcγRI細胞外領域とは、ヒト型FcγRIのうち細胞外領域の全領域または概ね全領域のアミノ酸を含むポリペプチドのことをいう。
【0018】
ヒト型FcγRIは図1に示すように、N末端側から15残基のシグナルペプチド領域(図1のSS、配列番号2に記載のアミノ酸配列のうち−15番目から−1番目までの領域)、277残基からなる細胞外領域(図1のEC、配列番号2に記載のアミノ酸配列のうち1番目から277番目までの領域)、21残基の細胞膜貫通領域(図1のTM、配列番号2に記載のアミノ酸配列のうち278番目から298番目までの領域)、61残基の細胞内領域(図1のC、配列番号2に記載のアミノ酸配列のうち299番目から359番目までの領域)からなる。このうちIgG分子のFc領域と結合親和性を有するのは細胞外領域であり、前記領域でIgGを直接捕捉している。なお、本発明のヒト型FcレセプターFcγRI細胞外領域は、細胞外領域のN末端側にあるシグナルペプチド領域(具体的には配列番号2の−15番目から−1番目までの領域)の一部を含んでもよいし、細胞外領域のC末端側にある細胞膜貫通領域(具体的には配列番号2の278番目から298番目までの領域)の一部を含んでもよい。
【0019】
本発明において、ヒト型FcγRI細胞外領域の全領域のアミノ酸とは、具体的には、配列番号2で開示のヒト型FcγRIアミノ酸配列のうち1番目から277番目までの領域、すなわち277残基からなるヒト型FcγRI細胞外領域の全アミノ酸のことをいう。また、ヒト型FcγRI細胞外領域の概ね全領域のアミノ酸とは、具体的には、配列番号2の1番目から277番目までの領域(ヒト型FcγRI細胞外領域の全領域)のうち、抗体(IgG)結合親和性を失わない範囲で、N末端側および/またはC末端側の1から15アミノ酸を削除したものをいう。
【0020】
なお、本発明において、ヒト型FcγRI細胞外領域の全領域または概ね全領域のアミノ酸配列には、IgGへの捕捉機能を妨げない範囲でアミノ酸の置換および/または欠失および/または挿入があってもよい。
【0021】
本発明のポリヌクレオチドは、前述したヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドの5’末端側に、ペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドを付加していることを特徴としている。ペリプラズムにタンパク質を分泌させるシグナルペプチドは、ヒト型FcγRIを発現させる宿主により適宜選択すればよく、宿主が大腸菌の場合は大腸菌発現において汎用されているpelBシグナルペプチド(UniProt No.P0C1C1の1番目から22番目までの領域、配列番号13)、DsbAシグナルペプチド(UniProt No.P0AEG4の1から19番目までの領域、配列番号14)、MalEシグナルペプチド(UniProt No.P0AEX9の1番目から26番目までの領域、配列番号15)、TorTシグナルペプチド(UniProt No.P38683の1番目から18番目の領域、配列番号16)が例示できる。
【0022】
なお、本発明のポリヌクレオチドにおいて、ペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドは、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドの5’末端側に直接付加してもよいし、前記二つのポリヌクレオチドの間に、任意のリンカーペプチドをコードするポリヌクレオチド配列を、発現するヒト型FcγRIのIgGへの捕捉機能を妨げない範囲で挿入してもよい。さらに、本発明のポリヌクレオチドには、5’末端側および/または3’末端側に、発現したヒト型FcγRIの簡便な精製や定量を可能にするためのポリヒスチジンタグやc−mycタグといったタグペプチドをコードするポリヌクレオチドをさらに付加してもよい。
【0023】
本発明のポリヌクレオチドの一態様として、大腸菌発現において汎用されているpelBシグナルペプチド(MKYLLPTAAAGLLLLAAQPAMA、配列番号13)、およびヒト型FcレセプターFcγRI細胞外領域(配列番号2に記載のアミノ酸配列のうち1番目から274番目までの領域、または5番目から274番目までの領域)を含む、配列番号3から5に示すポリペプチドをコードするポリヌクレオチドがあげられる。
【0024】
本発明のポリヌクレオチドの別の態様として、DsbA(MKKIWLALAGLVLAFSASA、配列番号14)、MalE(MKIKTGARILALSALTTMMFSASALA、配列番号15)、TorT(MRVLLFLLLSLFMLPAFS、配列番号16)のいずれかより選択されるシグナルペプチド、およびヒト型FcレセプターFcγRI細胞外領域(配列番号2に記載のアミノ酸配列のうち1番目から274番目までの領域)を含む、配列番号6から12に示すポリペプチドをコードするポリヌクレオチドをあげることができる。
【0025】
なお、本発明におけるヒト型FcレセプターFcγRI細胞外領域、およびペリプラズムにタンパク質を分泌させるシグナルペプチドを含むポリペプチドから、本発明のポリヌクレオチドに変換する際、ヒト型FcγRIを発現させる宿主におけるコドンの使用頻度を考慮のうえ変換するのが好ましい。一例として宿主が大腸菌の場合は、アルギニン(Arg)ではAGA、AGG、CGG、CGA、イソロイシン(Ile)ではATA、ロイシン(Leu)ではCTA、グリシン(Gly)ではGGA、プロリン(Pro)ではCCCを例示することができる。コドンの使用頻度の解析は公的データベース(URL:http://www.kazusa.or.jp/codon/、アクセス日:2009年9月25日)を利用することによっても可能である。
【0026】
本発明のポリヌクレオチドの具体的態様として、配列番号3から12に示すアミノ酸配列からヌクレオチド配列に変換した配列番号17から26に示すポリヌクレオチドがあげられる。
【0027】
本発明のポリヌクレオチドを用いてヒト型FcγRIを製造するには、ヒト型FcγRIを発現させる宿主に適したプラスミドに本発明のポリヌクレオチドを挿入後、宿主を形質転換することで組換え体を作製し、前記組換え体を培養して製造すればよい。以下、製造方法について詳細に説明する。
【0028】
本発明のポリヌクレオチドの取得方法としては、
(1)目的とするタンパク質のアミノ酸配列からヌクレオチド配列に変換し、該ヌクレオチド配列を含むポリヌクレオチド全体を人工的に合成して取得する方法、
(2)ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドの領域(一例として、配列番号1に記載のヌクレオチド配列のうち58番目から888番目までの配列を含む領域)を、ヒト型FcγRIのcDNAなどからPCR法といったDNA増幅法を用いて調製し、その増幅産物を利用して目的とするタンパク質をコードするポリヌクレオチドを人工的に合成して取得する方法、
が例示できる。
【0029】
(1)の方法で取得する場合において、アミノ酸配列からヌクレオチド配列に変換する際は、前述したように、組換え対象宿主におけるコドンの使用頻度を考慮して変換するのが好ましい。
【0030】
また、(1)、(2)いずれの方法で本発明のポリヌクレオチドを取得する場合においても、前記ポリヌクレオチドと発現プラスミドとを連結させるための制限酵素認識配列、および/または発現したヒト型FcγRIの簡便な精製・定量を可能にするためのタグ配列を付加してもよい。付加する制限酵素認識配列は、前記ポリヌクレオチド配列を考慮のうえ適切な配列を選択すればよい。また付加するタグ配列は、ポリヒスチジンタグやc−mycタグといった遺伝子工学で多用されるオリゴアミノ酸をコードするヌクレオチド配列が使用できる。なお前記タグ配列は、前記ポリヌクレオチドの5’末端側に付加してもよいし、3’末端側に付加してもよい。
【0031】
本発明のヒト型FcγRIを発現させるためのプラスミドは、本発明のポリヌクレオチド、本発明のポリヌクレオチドを発現させるためのポリヌクレオチド、および宿主中で本発明のプラスミドを複製するための複製起点を有し、かつ、対象宿主を形質転換できるものであればよく、適宜選択し使用することができるが、通常は取扱いの容易な発現プラスミドを用いる。大腸菌を宿主として用いる場合、前記本発明のポリヌクレオチドを発現させるためのポリヌクレオチドとしては、lacプロモータ、trcプロモータ、T7プロモータ等が例示でき、中でも、転写活性の強いT7プロモータが好ましい。また、本発明のプラスミドにアンピシリンといった薬剤に対する耐性を宿主に付与するためのポリヌクレオチド(薬剤耐性遺伝子)をさらに含んでいると、本発明のプラスミドで宿主を形質転換する操作にあたり、本発明のプラスミドが導入された宿主と導入されなかった宿主との選別が容易に行なえるため好ましい。
【0032】
ヒト型FcγRIを、遺伝子工学的手法を用いて製造するために使用する宿主としては、大腸菌の場合、JM109株等K12系の株を用いるのが好ましく、BL21(DE3)株等T7プロモータが利用できる株がさらに好ましい。なお、前記宿主を変異処理することにより得られる変異株も、本発明の製造方法で用いる宿主として利用することもできる。変異処理は、ニトロソグアニジンやメタンスルホン酸エチルといった変異処理剤、紫外線、放射線等の当業者にとって周知の方法を用いて行なえばよい。
【0033】
宿主への本発明のプラスミドの導入および発現のための手順または方法は、下記に示す方法以外であってもよく、例えば非特許文献4に記載されている遺伝子工学の分野により慣用されている手法または方法に準じて実施してもよい。具体的にはヒートショック法、エレクトロポレーション法等をあげることができる。
【0034】
本発明のヒト型FcγRIの製造方法は、本発明のプラスミドで形質転換した宿主(形質転換体)を培養する工程を含む。上記方法は、具体的には、前記形質転換体を培養し、その培養物から、ヒト型FcγRIを回収することを含む。本発明のヒト型FcγRIの製造方法で用いる本発明の形質転換体は、対象宿主の培養に適した培地で培養すればよく、宿主が大腸菌の場合は、必要な栄養源を補ったLB(ルリア−ベルターニ)培地が好ましい培地の一例としてあげられる。好ましい実施態様においては、形質転換体の増殖を本発明のプラスミドの導入の有無により選択的に可能にするために、培地に本発明のプラスミドに挿入した薬剤耐性遺伝子に対応した薬剤を含んでいるのが好ましい。例えば、カナマイシン耐性遺伝子を発現可能な本発明のプラスミドが導入された宿主の増殖のために、培地にカナマイシンが添加される。なお、培地には、炭素、窒素および無機塩供給源の他に、適当な栄養源を加えてもよい。さらに、所望により、グルタチオン、システイン、シスタミン、チオグリコレート、ジチオスレイトールからなる群から選択される一種類以上の還元剤を含んでもよい。また、培地にはグリシン等の細胞から培養液へのタンパク質分泌を促す試薬を加えてもよい。具体的添加例として、宿主が大腸菌の場合、培地に対してグリシンを2%(w/v)以下で加えるのが好ましい。
【0035】
培養温度は宿主が大腸菌の場合、一般に10℃から40℃、好ましくは25℃から35℃、より好ましくは30℃前後であるが、発現させるヒト型FcγRIの特性により選択すればよい。培養培地のpHは宿主が大腸菌の場合、pH6.8からpH7.4、好ましくはpH7.0前後である。
【0036】
本発明のプラスミドに誘導性のプロモータが含まれる場合は、ヒト型FcγRIが良好に発現できるような条件下で誘導すればよい。誘導剤としてはIPTG(isopropyl−β−D−thiogalactopyranoside)が例示できる。宿主が大腸菌の場合、培養液の濁度(600nmにおける吸光度)を測定し、約0.5から1.0となったときに適当量のIPTGを添加後、引き続き培養することで、ヒト型FcγRIの発現を誘導することができる。IPTGの添加濃度は0.005から1.0mMの範囲から適宜選択すればよいが、0.01から0.5mM程度が好ましい。IPTG誘導に関する種々の条件は当該技術分野において周知の条件で行なえばよい。
【0037】
本発明の形質転換体培養液からヒト型FcγRIを回収するには、発現の形態によって適宜抽出方法を選択すればよい。培養上清に発現する場合は菌体を遠心分離操作によって分離し、得られる培養上清からヒト型FcγRIを抽出すればよい。一方、細胞内(原核生物のペリプラズムも含む)に発現する場合には、遠心分離操作により菌体を集めた後、酵素処理剤や界面活性剤等を添加することにより菌体を破砕して、ヒト型FcγRIを抽出すればよい。抽出タンパク質の中からヒト型FcγRIを分離・精製するには、当該技術分野において公知の方法を用いればよい。一例として、液体クロマトグラフィーを用いた分離・精製があげられる。液体クロマトグラフィーとしては、イオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、ゲルろ過クロマトグラフィー、アフィニティークロマトグラフィーなどがあげられる。これらのクロマトグラフィーを組み合わせて精製操作を行なうことによって、可溶性かつ抗体結合活性を有したヒト型FcγRIを高純度に調製することができる。
【発明の効果】
【0038】
本発明のポリヌクレオチドは、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドの5’末端側に、ペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドを付加していることを特徴としている。本発明のポリヌクレオチドを対象宿主に適切なプラスミドに挿入し、本発明のポリヌクレオチドを挿入したプラスミドで宿主を形質転換して得られる形質転換体を培養することで、ヒト型FcγRIを可溶性かつ抗体結合活性を有した状態で発現させることができる。特に宿主が大腸菌の場合、ペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドとして、配列番号13から16に示すいずれかのポリペプチドをコードするポリヌクレオチドを用いると、大腸菌でヒト型FcγRIを可溶性かつ抗体結合活性を有した状態で発現させることができるため、ヒト型FcγRIを簡便かつ大量に製造することができる。
【0039】
本発明の製造方法で得られたヒト型FcγRIはその細胞外領域を含んでいるため、ヒト型FcγRIが有する抗体(IgG)との結合活性は保持されている。したがって、本発明の製造方法で得られたヒト型FcγRIは、抗体の免疫活性測定用試薬、抗体精製用クロマトグラフィーゲルに用いる捕捉タンパク質、抗FcγRI抗体を作製するための免疫源等に用いることができる。
【図面の簡単な説明】
【0040】
【図1】ヒト型FcレセプターFcγRIの構造を示す図である。
【図2】発現プラスミドppelBL1FcRの構造を示す図である。
【図3】ppelBL1FcR形質転換体(実施例1、黒ひし形)およびpDsbA1FcR形質転換体(実施例4、白ひし形)のそれぞれで発現したヒト型FcγRIについて抗体結合活性を評価した図である。
【図4】ppelBFcR形質転換体(実施例2、黒ひし形)、ppelBL2FcR形質転換体(実施例3、黒四角)、pMalEFcR形質転換体(実施例7、白ひし形)およびpMalELFcR形質転換体(実施例8、白四角)のそれぞれで発現したヒト型FcγRIについて抗体結合活性を評価した図である。
【図5】pDsbA2FcR形質転換体(実施例5、白ひし形)、pDsbALFcR形質転換体(実施例6、白四角)、pTorTFcR形質転換体(実施例9、黒ひし形)、pTorTLFcR形質転換体(実施例10、黒四角)のそれぞれで発現したヒト型FcγRIについて抗体結合活性を評価した図である。
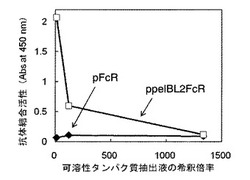
【図6】pFcR形質転換体(比較例1、黒ひし型)とppelBL2FcR形質転換体(実施例3、白四角)のそれぞれで発現したヒト型FcγRIについて抗体結合活性を評価した図である。
【図7】ppelBL1FcR形質転換体(実施例1)で発現したヒト型FcγRIについて抗体(IgG)サブクラスへの結合活性を評価した図である。
【図8】ウエスタンブロティング法によるHisタグ付きヒト型FcγRIの検出結果を示した図である。図中のレーンMが分子量マーカーを、レーン1がppelBL1FcR形質転換体(実施例1)からの粗精製タンパク質溶液を、レーン2がpDsbA1FcR形質転換体(実施例4)からの粗精製タンパク質溶液を、それぞれ示し、矢印はヒト型FcγRIに相当するバンドを示す。
【実施例】
【0041】
以下に実施例をあげて本発明を説明するが、本発明はこれにより限定されるものではない。
【0042】
実施例1 発現プラスミドppelBL1FcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドppelBL1FcRを調製した。
(1)特許文献2に記載の、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチド(コドンはヒト型から大腸菌型に変換している)を含むプラスミドpECFcRを鋳型として、配列番号27のオリゴヌクレオチド(5’−AGT[GGATCC]CACCAAGGCTGTGATTACGCTGCAACCACCGT−3’;角かっこ内は制限酵素BamHIサイト)と、配列番号28のオリゴヌクレオチド(5’−CC[AAGCTT]AATGATGATGATGATGATGGACCGGGGTCGGCAGTTGAAGACCCAG−3’;角かっこ内の塩基は制限酵素HindIIIサイト)をPCRプライマーとして下記のPCR条件1でPCRを行ない、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを作製した。なお、前記ポリヌクレオチドの3’末端には、配列番号28を用いてポリヒスチジンタグをコードするポリヌクレオチドを付加した。
【0043】
PCR条件1:
(試薬組成)
鋳型DNA
各0.4μM PCRプライマー
0.025U/μL PrimeSTAR HS DNA Polymeras
e(タカラバイオ社)
1×PrimeSTARバッファー(Mg2+Plus)(タカラバイオ社)
各200μM dNTP Mixture(タカラバイオ社)
(反応条件)
98℃で10秒、55℃で5秒、72℃で1分を1サイクルとするPCR反応を
30サイクル行なった。
(2)反応終了後、0.9%のアガロース電気泳動により、増幅産物のバンドが設計通りのサイズの位置にあることを確認後、前記増幅産物を抽出し(QIAquick Gel extraction kit:キアゲン社)、BamHIとHindIIIで制限酵素消化した。
(3)BamHIとHindIIIで消化したpET26b(+)プラスミド(Novagen社)にDNA Ligation Kit(Mighty Mix)(タカラバイオ社)を用いてライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(4)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地(10g/L tryptone、5g/L Yeast extract、5g/L NaCl)で培養した。培養菌体よりプラスミドDNAを抽出(QIAprep Spin Miniprep kit:キアゲン社)することで、発現プラスミドppelBL1FcRを得た。
【0044】
実施例2 発現プラスミドppelBFcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドppelBFcRを調製した。
(1)配列番号29のオリゴヌクレオチド(5’−TATA[CATATG]AAATACCTATTGCCTACGGCAGCCGCT−3’;角かっこ内の塩基は制限酵素NdeIサイト)、配列番号30のオリゴヌクレオチド(5’−ATTGTTATTACTCGCTGCCCAACCAGCGATGGCC−3’)、配列番号31のオリゴヌクレオチド(5’−GCAGCGAGTAATAACAATCCAGCGGCTGCCGTAGGCA−3’)、および配列番号32のオリゴヌクレオチド(5’−TTTGGTGGTATCTACTTGGGCCATCGCTGGT−3’)を下記のPCR条件2でPCRを行ない、各オリゴヌクレオチドを連結した。
【0045】
PCR条件2:
(試薬組成)
各2.5μMのオリゴヌクレオチド、または各等モルのポリヌクレオチド
0.025U/μL PrimeSTAR HS DNA Polymeras
e(タカラバイオ社)
1×PrimeSTARバッファー(Mg2+Plus)(タカラバイオ社)
各200μM dNTP Mixture(タカラバイオ社)
(反応条件)
98℃で10秒、55℃で5秒、72℃で1分を1サイクルとするPCR反応を
5サイクル行なった。
(2)鋳型として(1)の増幅産物、PCRプライマーとして配列番号29および32のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、pelBシグナルペプチドをコードするポリヌクレオチドを作製した。
(3)(2)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(4)鋳型として実施例1で調製したppelBL1FcR、PCRプライマーとして配列番号33のオリゴヌクレオチド(5’−CAAGTAGATACCACCAAAGCTGTGATTACGCTGCAACCACCGT−3’)および配列番号34のオリゴヌクレオチド(5’−TATGCTAGTTATTGCTCAG−3’)を用いた他は、前記PCR条件1でPCRを行ない、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを作製した。
(5)(4)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(6)(3)で得られたpelBシグナルペプチドをコードするポリヌクレオチド、および(5)で得られたヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを用い、前記PCR条件2でPCRを行ない、前記二つのポリヌクレオチドを連結した。
(7)鋳型として(6)のPCR産物、PCRプライマーとして配列番号29および34のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、pelBシグナルペプチドおよびヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを作製した。
(8)(7)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(9)(8)で精製した増幅産物を、NdeIとHindIIIで制限酵素消化した。
(10)NdeIとHindIIIで消化したpET26b(+)プラスミド(Novagen社)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(11)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドppelBFcRを得た。
【0046】
実施例3 発現プラスミドppelBL2FcRの調製
実施例2の(1)における各オリゴヌクレオチドの代わりに、配列番号29のオリゴヌクレオチド、配列番号30のオリゴヌクレオチド、配列番号31のオリゴヌクレオチド、および配列番号35のオリゴヌクレオチド(5’−TTGGTGGTATCTACTTGGCCACCCGTATTTGCGGCCATCGCTGG−3’)を用いた他は、実施例2と同様な方法で調製することで、ヒト型FcγRI発現プラスミドppelBL2FcRを得た。
【0047】
実施例4 発現プラスミドpDsbA1FcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドpDsbA1FcRを調製した。
(1)配列番号36のオリゴヌクレオチド(5’−CGC[TCTAGA]AATAATTTTGTTTAACTTTAAGAAGG−3’;角かっこ内の塩基は制限酵素XbaIサイト)、配列番号37のオリゴヌクレオチド(5’−TATACCATGAAAAAGATTTGGCTGGCGCTGGCTGG−3’)、配列番号38のオリゴヌクレオチド(5’−TAGTTTTAGCGTTTAGCGCATCGGCGCAAGTGGATC−3’)、配列番号39のオリゴヌクレオチド(5’−CTTGGTG[GGATCC]ACTTGCGCCGAT−3’;角かっこ内の塩基は制限酵素BamHIサイト)、配列番号40のオリゴヌクレオチド(5’−CTAAACGCTAAAACTAAACCAGCCAGCGCCAGCCA−3’)、および配列番号41のオリゴヌクレオチド(5’−CTTTTTCATGGTATATCTCCTTCTTAAAGTTAAACAA−3’)を前記PCR条件2でPCRを行ない、各オリゴヌクレオチドを連結した。
(2)鋳型として(1)の増幅産物、PCRプライマーとして配列番号36のオリゴヌクレオチドおよび39のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、DsbAシグナルペプチドをコードするポリヌクレオチドを作製した。
(3)(2)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(4)(3)で精製した増幅産物を、XbaIとBamHIで制限酵素消化した。
(5)XbaIとBamHIで消化したpET28a(+)プラスミド(Novagen社)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(6)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドpDsbAを調製した。
(7)実施例1で作製したヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドをBamHIとHindIIIで制限酵素消化後、BamHIとHindIIIで消化した発現プラスミドpDsbA((6)で調製)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(8)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドpDsbA1FcRを得た。
【0048】
実施例5 発現プラスミドpDsbA2FcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドpDsbA2FcRを調製した。
(1)鋳型として実施例4で調製したpDsbA1FcRを、PCRプライマーとして配列番号36のオリゴヌクレオチドと配列番号42のオリゴヌクレオチド(5’−TTTGGTGGTATCTACTTGCGCCGATGCGCTAAACGCTA−3’)を用いた他は、前記PCR条件1と同じ条件でPCRを行ない、DsbAシグナルペプチドをコードするポリヌクレオチドを作製した。
(2)(1)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(3)(2)で得られたDsbAシグナルペプチドをコードするポリヌクレオチドと、実施例2で作製したヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドとを、前記PCR条件2にてPCRを行なうことで連結した。
(4)鋳型として(3)の増幅産物、PCRプライマーとして配列番号36のオリゴヌクレオチドおよび配列番号34のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、DsbAシグナルペプチドとヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを作製した。
(5)(4)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(6)(5)で精製した増幅産物を、XbaIとHindIIIで制限酵素消化した。
(7)XbaIとHindIIIで消化したpET28a(+)プラスミド(Novagen社)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(8)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドpDsbA2FcRを得た。
【0049】
実施例6 発現プラスミドpDsbALFcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドpDsbALFcRを調製した。
(1)鋳型として実施例4で調製したpDsbA1FcRを、PCRプライマーとして配列番号36のオリゴヌクレオチドおよび配列番号40のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、DsbAシグナルペプチドをコードするポリヌクレオチドを作製した。
(2)(1)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(3)配列番号43のオリゴヌクレオチド(5’−TAGTTTTAGCGTTTAGCGCATCGGCGGCGCAGTATGAAGA−3’)と配列番号44のオリゴヌクレオチド(5’−TTTGGTGGTATCTACTTGATCTTCATACTGCGCCGC−3’)とを、前記PCR条件2と同じ条件でPCRを行なうことで連結した。
(4)鋳型として(2)および(3)の増幅産物、PCRプライマーとして配列番号36のオリゴヌクレオチドおよび配列番号44のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、DsbAシグナルペプチドおよびリンカーペプチドをコードするポリヌクレオチドを作製した。
(5)(4)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(6)(5)の増幅産物および実施例2で作製したヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドから、実施例5の(3)から(8)と同じ方法により、発現プラスミドpDsbALFcRを得た。
【0050】
実施例7 発現プラスミドpMalEFcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドpMalEFcRを調製した。
(1)配列番号45のオリゴヌクレオチド(5’−TATA[CATATG]AAAATAAAAACAGGTGCACGCATCC−3’;角かっこ内の塩基は制限酵素NdeIサイト)、配列番号46のオリゴヌクレオチド(5’−GCATTAACGACGATGATGTTTTCCGCCTCGGCTCTCGCC−3’)、配列番号47のオリゴヌクレオチド(5’−ATCGTCGTTAATGCGGATAATGCGAGGATGCGTGCACCTG−3’)、および配列番号48のオリゴヌクレオチド(5’−TTTGGTGGTATCTACTTGGGCGAGAGCCGAGGCGGAAA−3’)を前記PCR条件2でPCRを行ない、各オリゴヌクレオチドを連結した。
(2)鋳型として(1)の増幅産物、PCRプライマーとして配列番号45のオリゴヌクレオチドおよび配列番号48のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、MalEシグナルペプチドをコードするポリヌクレオチドを作製した。
(3)(2)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(4)(3)で精製した増幅産物と、実施例2に記載のヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドとを、上記PCR条件2でPCRを行なうことで連結した。
(5)鋳型として(4)の増幅産物を、PCRプライマーとして配列番号45のオリゴヌクレオチドおよび配列番号34のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ方法でPCRを行ない、MalEシグナルペプチドとヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを作製した。
(6)(5)の増幅産物0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(7)(6)で精製した増幅産物を、NdeIとHindIIIで制限酵素消化した。
(8)NdeIとHindIIIで消化したpET26b(+)プラスミド(Novagen社)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(9)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドpMalEFcRを得た。
【0051】
実施例8 発現プラスミドpMalELFcRの作製
実施例7の(1)における各オリゴヌクレオチドの代わりに、配列番号45のオリゴヌクレオチド、配列番号46のオリゴヌクレオチド、配列番号47のオリゴヌクレオチド、および配列番号49のオリゴヌクレオチド(5’−TGGTATCTACTTGACCTTCTTCGATTTTGGCGAGAGCCGAGGCG−3’)を用いた他は、実施例7と同様な方法で調製することで、発現プラスミドpMalELFcRを得た。
【0052】
実施例9 発現プラスミドpTorTFcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドpTorTFcRを調製した。
(1)配列番号50のオリゴヌクレオチド(5’−TATA[CATATG]CGCGTACTGCTATTTTTAC−3’;角かっこ内の塩基は制限酵素NdeIサイト)、配列番号51のオリゴヌクレオチド(5’−TTCTTTCCCTTTTCATGTTGCCGGCATTTTCG−3’)、配列番号52のオリゴヌクレオチド(5’−TGAAAAGGGAAAGAAGTAAAAATAGCAGTACG−3’)、および配列番号53のオリゴヌクレオチド(5’−TTTGGTGGTATCTACTTGCGAAAATGCCGGCAACA−3’)を前記PCR条件2でPCRを行ない、各オリゴヌクレオチドを連結した。
(2)鋳型として(1)の増幅産物、PCRプライマーとして配列番号50のオリゴヌクレオチドおよび配列番号53のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、TorTシグナルペプチドをコードするポリヌクレオチドを作製した。
(3)(2)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(4)(3)で精製した増幅産物と、実施例2に記載のヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドとを、上記PCR条件2でPCRを行なうことで連結した。
(5)鋳型として(4)の増幅産物を、PCRプライマーとして配列番号50のオリゴヌクレオチドおよび配列番号34のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ方法でPCRを行ない、TorTシグナルペプチドとヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを作製した。
(6)(5)の増幅産物0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(7)(6)で精製した増幅産物を、NdeIとHindIIIで制限酵素消化した。
(8)NdeIとHindIIIで消化したpET26b(+)プラスミド(Novagen社)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(9)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドpTorTFcRを得た。
【0053】
実施例10 発現プラスミドpTorTLFcRの調製
実施例9(1)における各オリゴヌクレオチドの代わりに、配列番号50のオリゴヌクレオチド、配列番号51のオリゴヌクレオチド、配列番号52のオリゴヌクレオチド、および配列番号54のオリゴヌクレオチド(5’−TGGTGGTATCTACTTGCAACAGGTTATCAGCCGAAAATGCCGGCA−3’)を用いた他は、実施例9と同様な方法で調製することで、ヒト型FcγRI発現プラスミドpTorTLFcRを得た。
【0054】
実施例11 各発現プラスミドのポリヌクレオチド配列確認
実施例1から10で調製した発現プラスミドのポリヌクレオチド配列をチェーンターミネータ法に基づくBig Dye Terminator Cycle Sequencing FS read Reaction kit(PEアプライドバイオシステム社)を用いてサイクルシークエンス反応に供し、全自動DNAシークエンサーABI Prism 3700 DNA analyzer(PEアプライドバイオシステム社)にて解析した。なお、配列番号55(5’−TAATACGACTCACTATAGGG−3’)と配列番号34に示すオリゴヌクレオチドをシークエンス用プライマーとして使用した。解析の結果、ヌクレオチド配列はそれぞれのプラスミドで設計通りであることが確認された。
【0055】
以下にそれぞれの発現プラスミドの概要を記す。
【0056】
発現プラスミドppelBL1FcR(実施例1)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号3に、それをコードするポリヌクレオチド配列を配列番号17に示す。また、ppelBL1FcRの構造を図2に示す。
【0057】
発現プラスミドppelBFcR(実施例2)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号4に、それをコードするポリヌクレオチド配列を配列番号18に示す。なお、ppelBL1FcRの構造は、ppelBL1FcR(図2)のうち制限酵素NdeIサイトと制限酵素HindIIIサイトの間が、配列番号18の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0058】
発現プラスミドppelBL2FcR(実施例3)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号5に、それをコードするポリヌクレオチド配列を配列番号19に示す。なお、ppelBL2FcRの構造は、ppelBL1FcR(図2)のうち制限酵素NdeIサイトと制限酵素HindIIIサイトの間が、配列番号19の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0059】
発現プラスミドpDsbA1FcR(実施例4)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号6に、それをコードするポリヌクレオチド配列を配列番号20に示す。なお、pDsbA1FcRの構造は、ppelBL1FcR(図2)のうち制限酵素XbaIサイトと制限酵素HindIIIサイトの間が、配列番号20の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0060】
発現プラスミドpDsbA2FcR(実施例5)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号7に、それをコードするポリヌクレオチド配列を配列番号21に示す。なお、pDsbA2FcRの構造は、ppelBL1FcR(図2)のうち制限酵素XbaIサイトと制限酵素HindIIIサイトの間が、配列番号21の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0061】
発現プラスミドpDsbALFcR(実施例6)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号8に、それをコードするポリヌクレオチド配列を配列番号22に示す。なお、pDsbALFcRの構造は、ppelBL1FcR(図2)のうち制限酵素XbaIサイトと制限酵素HindIIIサイトの間が、配列番号22の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0062】
発現プラスミドpMalEFcR(実施例7)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号9に、それをコードするポリヌクレオチド配列を配列番号23に示す。なお、pMalEFcRの構造は、ppelBL1FcR(図2)のうち制限酵素NdeIサイトと制限酵素HindIIIサイトの間が、配列番号23の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0063】
発現プラスミドpMalELFcR(実施例8)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号10に、それをコードするポリヌクレオチド配列を配列番号24に示す。なお、pMalELFcRの構造は、ppelBL1FcR(図2)のうち制限酵素NdeIサイトと制限酵素HindIIIサイトの間が、配列番号24の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0064】
発現プラスミドpTorTFcR(実施例9)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号11に、それをコードするポリヌクレオチド配列を配列番号25に示す。なお、pTorTFcRの構造は、ppelBL1FcR(図2)のうち制限酵素NdeIサイトと制限酵素HindIIIサイトの間が、配列番号25の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0065】
発現プラスミドpTorTLFcR(実施例10)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号12に、それをコードするポリヌクレオチド配列を配列番号26に示す。なお、pTorTLFcRの構造は、ppelBL1FcR(図2)のうち制限酵素NdeIサイトと制限酵素HindIIIサイトの間が、配列番号26の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0066】
実施例1から10で調製した発現プラスミドによって発現されるヒト型FcγRIのうち、N末端側アミノ酸配列の概要を表1および配列番号59から68に示す。なお、表1の「発現されるヒト型FcγRIのN末端アミノ酸配列」欄にある「−」は各領域の境界を示す。
【0067】
【表1】

実施例12 発現されたヒト型FcγRIの抗体結合活性確認(その1)
(1)ppelBL1FcRで大腸菌を形質転換して得られた組換え大腸菌(ppelBL1FcR形質転換体、実施例1)、およびpDsbA1FcRで大腸菌を形質転換して得られた組換え大腸菌(pDsbA1FcR形質転換体、実施例4)を、それぞれ50μg/mL カナマイシンを添加したLB液体培地に接種し、37℃で一晩振盪培養した。
(2)それぞれの培養液を、新たに50μg/mL カナマイシンを添加した2×YT液体培地(16g/L Triptone、10g/L Yeast extract、5g/L NaCl)に接種し37℃で振盪培養した。
(3)培養液の濁度(600nmにおける吸光度)の値が約0.5になったところで培養温度を20℃にして30分培養後、IPTGを0.1mMとなるように培養液に添加し、20℃で22時間振盪培養した。培養後の培養液の濁度(600nmにおける吸光度)の値は、ppelBL1FcR形質転換体が4.76、pDsbA1FcR形質転換体が6.54であった。
(4)それぞれの形質転換体からBugBuster protein extraction Kit(Novagen社)を用いて可溶性タンパク質抽出液を調製した。
(5)可溶性タンパク質抽出液中の可溶性ヒト型FcγRIの抗体結合活性を下記に示すELISA(Enzyme−Linked Immunosorbent Assay)法により評価した。
(5−1)抗体であるガンマグロブリン(化学及血清療法研究所)を、96穴マイクロプレートのウェルに濃度1μg/wellで固定し(4℃、18時間)、StartingBlock Blocking Buffers(PIERCE社)によりブロッキングした。
(5−2)調製した可溶性タンパク質抽出液を段階希釈し、ELISA反応に供した(30℃、2時間)。
(5−3)0.2%(w/v) Tween 20、150mM NaClを含むTris−HCl緩衝液(pH8.0)で洗浄後、Horseradish Peroxidase(HRP)抗His−Tag抗体試薬(BETHYL社)を添加し、30℃で2時間反応した。
(5−4)(5−3)の緩衝液で洗浄後、TMB Peroxidase Substrate(KPL社)を添加し、450nmの吸光度を測定した。
【0068】
結果を図3に示す。図中、X軸(横軸)はサンプルの希釈倍率を示し、Y軸(縦軸)は、450nmの吸光度(単位は任意)となり抗体結合活性を示す。図3に示す通り、ppelBL1FcR形質転換体およびpDsbA1FcR形質転換体から得られた可溶性タンパク質抽出液は、その濃度が高くなるほど(希釈倍率が小さいほど)吸光度の値が高くなった。すなわち、ppelBL1FcR形質転換体およびpDsbA1FcR形質転換体により発現したヒト型FcγRIが、可溶性かつ抗体結合活性を有していることがわかる。
【0069】
実施例13 発現されたヒト型FcγRIの抗体結合活性確認(その2)
(1)ppelBFcRで大腸菌を形質転換して得られた組換え大腸菌(ppelBFcR形質転換体、実施例2)、ppelBL2FcRで大腸菌を形質転換して得られた組換え大腸菌(ppelBL2FcR形質転換体、実施例3)、pMalEFcRで大腸菌を形質転換して得られた組換え大腸菌(pMalEFcR形質転換体、実施例7)、およびpMalELFcRで大腸菌を形質転換して得られた組換え大腸菌(pMalELFcR形質転換体、実施例8)を、それぞれ50μg/mL カナマイシンを添加したLB液体培地に接種し、37℃で一晩振盪培養した。
(2)それぞれの培養液を、新たに50μg/mL カナマイシンを添加したLB液体培地に接種し37℃で振盪培養した。
(3)培養液の濁度(600nmにおける吸光度)が約0.5になったところで培養温度を20℃にして30分培養後、IPTGを0.01mMとなるように培養液に添加し、20℃で22時間振盪培養した。培養後の培養液の濁度(600nmにおける吸光度)は、ppelBFcR形質転換体が5.21、ppelBL2FcR形質転換体が5.24、pMalEFcR形質転換体が4.82、pMalELFcR形質転換体が5.36であった。
(4)実施例12の(4)から(5)と同様な方法で、それぞれの形質転換体から可溶性タンパク質抽出液を調製し、可溶性タンパク質抽出液中の可溶性ヒト型FcγRIの抗体結合活性をELISA法により評価した。
【0070】
結果を図4に示す。図中、X軸(横軸)およびY軸(縦軸)は図3と同じである。図4に示した通り、いずれの形質転換体から得られた可溶性タンパク質抽出液であっても、その濃度が高くなるほど(希釈倍率が小さいほど)吸光度の値が高くなった。すなわち、ppelBFcR形質転換体、ppelBL2FcR形質転換体、pMalEFcR形質転換体およびpMalELFcR形質転換体でそれぞれ発現したヒト型FcγRIが、可溶性かつ抗体結合活性を有していることがわかる。
【0071】
実施例14 発現されたヒト型FcγRIの抗体結合活性確認(その3)
(1)pDsbA2FcRで大腸菌を形質転換して得られた組換え大腸菌(pDsbA2FcR形質転換体、実施例5)、pDsbALFcRで大腸菌を形質転換して得られた組換え大腸菌(pDsbALFcR形質転換体、実施例6)、pTorTFcRで大腸菌を形質転換して得られた組換え大腸菌(pTorTFcR形質転換体、実施例9)、およびpTorTLFcRで大腸菌を形質転換して得られた組換え大腸菌(pTorTLFcR形質転換体、実施例10)を、実施例13の(1)から(3)と同様な方法で発現誘導した。培養後の培養液の濁度(600nmにおける吸光度)は、pDsbA2FcR形質転換体が2.81、pDsbALFcR形質転換体が3.27、pTorTFcR形質転換体が3.35、pTorTLFcR形質転換体が3.57であった。
(2)実施例13の(4)から(5)と同様の方法で、それぞれの形質転換体から可溶性タンパク質抽出液を調製し、可溶性タンパク質抽出液中の可溶性ヒト型FcγRIの抗体結合活性をELISA法により評価した。
【0072】
結果を図5に示す。図中、X軸(横軸)およびY軸(縦軸)は図3と同じである。図5に示した通り、いずれの形質転換体から得られた可溶性タンパク質抽出液であっても、その濃度が高くなるほど(希釈倍率が小さいほど)吸光度の値が高くなった。すなわち、pDsbA2FcR形質転換体と、pDsbALFcR形質転換体、pTorTFcR形質転換体、pTorTLFcR形質転換体でそれぞれ発現したFcγRIが、可溶性かつ抗体結合活性を有していることがわかる。
【0073】
比較例1 発現プラスミドpFcRの調製
比較対象プラスミドとして、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドのみを挿入した、ヒト型FcγRI発現プラスミドpFcRを調製した。
(1)鋳型として実施例2に記載のヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを、PCRプライマーとして配列番号56のオリゴヌクレオチド(5’−TCAG[CCATGG]GACAAGTAGATACCACCAAAGCTGTGATTA−3’;角かっこ内の塩基は制限酵素NcoIサイト)および配列番号34のオリゴヌクレオチドを用いた他は、前記PCR条件1でPCRを行ない、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチド(5’末端側にNcoIサイトが存在)を作製した。
(2)(1)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(3)(2)で精製した増幅産物を、NcoIとHindIIIで制限酵素消化した。
(4)NcoIとHindIIIで消化したpET28a(+)プラスミド(Novagen社)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(5)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドpFcRを得た。
(6)(5)で得られたpFcRを、実施例11と同様の方法でヌクレオチド配列の確認を行なった。
【0074】
発現プラスミドpFcRによって発現されるヒト型FcγRIのアミノ酸配列を配列番号57に、それをコードするポリヌクレオチド配列を配列番号58に示す。なお、pFcRの構造は、pET28a(+)プラスミドの制限酵素NcoIサイトと制限酵素HindIIIサイトの間が、配列番号58の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。pFcRによって発現されるヒト型FcγRIのうち、N末端側アミノ酸配列の概要を表1および配列番号69に示す。
【0075】
比較例2 pFcR形質転換体で発現したヒト型FcγRIの抗体結合活性確認
(1)pFcRで大腸菌を形質転換して得られた組換え大腸菌(pFcR形質転換体、比較例1)、およびppelBL2FcR形質転換体(実施例3)を、それぞれ50μg/mL カナマイシンを添加したLB液体培地に接種し、37℃で一晩振盪培養した。
(2)それぞれの培養液を、新たに50μg/mL カナマイシンを添加したLB液体培地に接種し37℃で振盪培養した。
(3)培養液の濁度(600nmにおける吸光度)が約0.5になったところで培養温度を20℃にして30分培養後、IPTGを0.1mMとなるように培養液に添加し、20℃で22時間振盪培養した。培養後の培養液の濁度(600nmにおける吸光度)は、pFcR形質転換体が6.91、ppelBL2FcR形質転換体が2.87であった。
(4)実施例12の(4)から(5)と同様の方法で、それぞれの形質転換体から可溶性タンパク質抽出液を調製し、可溶性タンパク質抽出液中の可溶性ヒト型FcγRIの抗体結合活性をELISA法により評価した。
【0076】
結果を図6に示す。図中、X軸(横軸)およびY軸(縦軸)は図3と同じである。ppelBL2FcR形質転換体から得られた可溶性タンパク質抽出液は、図6および図4(実施例13)に示すように、その濃度が高くなるほど(希釈倍率が小さいほど)吸光度の値が高くなった。一方、pFcR形質転換体から得られた可溶性タンパク質抽出液は、その濃度を高くしても(希釈倍率が小さくしても)吸光度の値は高くならず、抗体結合活性は認められなかった。pFcRで発現するFcγRIの細胞外領域を含むポリペプチド(配列番号57)のN末端側には、従来技術(特許文献2および3)のようにシグナルペプチドが付加されていないため、大腸菌内で発現したヒト型FcγRIは不溶性の封入体となり、可溶性タンパク質として発現しなかった。よって、組換え大腸菌を用いて、可溶性かつ抗体結合活性を有するヒト型FcγRIを発現させるには、発現させるヒト型FcレセプターFcγRI細胞外領域のN末端側に大腸菌ペリプラズムにタンパク質を分泌させるシグナルペプチドを付加することが必要であることがわかる。
【0077】
以上より、本発明のヒト型FcγRIの製造方法は、従来の大腸菌発現系(特許文献2および3)と比較し、ヒト型FcγRIを可溶性かつ抗体結合活性を有した状態で発現可能な方法であり、当該タンパク質の生産に有用な方法といえる。
【0078】
実施例15 発現したタンパク質の抗体結合活性の確認(抗体スペクトラム)
ヒト型FcγRIでは抗体(IgG)のサブクラスIgG1からIgG4に対して結合活性が異なることが知られ、IgG1≧IgG3>IgG4>IgG2の順で結合活性を示すことが知られている(非特許文献3)。そこで、ELISA法を用いてppelBL1FcR形質転換体(実施例1)で発現したヒト型FcγRIの抗体サブクラスへの結合活性を評価した。ELISA法は、実施例12の(5−1)において96穴マイクロプレートのウェルにガンマグロブリンを添加する代わりに濃度0.1μg/wellのIgG1κ、IgG2κ、IgG3κまたはIgG4κを固定化した他は、実施例12の(5)と同様な方法で行なった。また、ELISAには調製した可溶性タンパク質抽出液を20倍希釈したものを供した。
【0079】
ppelBL1FcR形質転換体(実施例1)で発現したヒト型FcγRIについて、抗体サブクラスへの結合活性を評価した結果を図7に示した。図7に示すように、抗体サブクラスに対しIgG3≧IgG1>IgG4≧IgG2の順で結合活性を示した。このことから、ppelBL1FcR形質転換体で発現したヒト型FcγRIは、天然のヒト型FcγRIとほぼ同等のサブクラス選択性を有していることがわかる。
【0080】
実施例16 発現したヒト型FcγRIのウエスタンブロッティング検出
(1)ppelBL1FcR形質転換体(実施例1)およびpDsbA1FcR形質転換体(実施例4)を、それぞれ実施例12と同様な方法で誘導発現培養を行なった。
(2)それぞれの菌体から、実施例12と同様の方法で可溶性タンパク質抽出液を調製し、His・Bind Resin(Novagen社)を用いたクロマトグラフィーにより粗精製し、粗精製タンパク質溶液を得た。
(3)それぞれの粗精製タンパク質溶液中のHisタグが付いたヒト型FcγRIを特異的に検出するため下記に示すウエスタンブロッティングを行なった。
(3−1)それぞれの粗精製タンパク質溶液についてSDS−PAGEを行ない、PVDF(Polyvinylidene difluoride)膜に転写・固定化した。
(3−2)PVDF膜を0.2%(w/v) Tween 20、150mM NaClを含むTris−HCl緩衝液(pH8.0)からなる緩衝液で洗浄後、3%スキムミルクを含む同緩衝液でブロッキングを行ない、スキムミルクなしの同緩衝液で再度洗浄した。
(3−3)PVDF膜に対しHRP抗His−Tag抗体試薬(BETHYL社)で抗原抗体反応を行ない、これを(3−2)の緩衝液(スキムミルクなし)で洗浄後、ECL plus(GEヘルスケアバイオサイエンス社)を用い化学発光検出した。
【0081】
ppelBL1FcR形質転換体とpDsbA1FcR形質転換体、それぞれで発現するヒト型FcγRIは、GENETYX−WIN(version 3.1.0、ゼネティックス社)を使用して計算した結果、SDS−PAGEを行なうと両方とも30kDa付近にバンドが位置すると推測されたが、ウエスタンブロティングの結果、図8に示すように30kDa付近にppelBL1FcR形質転換体とpDsbA1FcR形質転換体、それぞれで発現したヒト型FcγRIが検出された。このことから、それぞれの形質転換体より得られた粗精製タンパク質溶液中に、ヒト型FcγRIが含まれていることが明らかとなった。
【技術分野】
【0001】
本発明は、ヒト抗体に対して高い親和性を有し、抗体の免疫活性測定用試薬として有用なFcレセプター、および遺伝子工学的手法を用いたFcレセプターの製造方法に関する。
【背景技術】
【0002】
Fcレセプター(Fc受容体)とは免疫グロブリン分子のFc領域に結合する一群のタンパク質分子である。個々の分子種は免疫グロブリンスーパーファミリーに属するFc認識ドメインを有し、単一種の、または同じサブタイプに属する免疫グロブリンを認識する。これによって個々の免疫応答においてどのアクセサリー細胞が動員されるかが決定される(非特許文献1)。
【0003】
Fcレセプターは、さらにサブタイプに分類することができ、免疫グロブリンG(以下IgGという)に対するレセプターとしてはFcγRI、FcγRIIa、FcγRIIb、FcγRIIIの存在が報告されている(非特許文献1)。中でも、FcγRIとIgGの結合親和性は高く、その平衡解離定数(KD)は10−8M以下である(非特許文献2)。FcγRIはIgGに対するレセプターであり、単球とマクロファージ上に構成的に発現し、好中球および好酸球上においては誘導的に発現する。FcγRIは、細胞外領域、細胞膜貫通領域、細胞質内領域に区分され、IgGとの結合は、IgG分子Fc領域とFcγRIの細胞外領域で起こり、その後細胞質へと結合のシグナルが伝達される。FcγRIはIgGとの結合に直接関わるα鎖と、γ鎖の2種類のサブユニットによって構成されており、γ鎖は細胞膜貫通領域と細胞外領域の境界にあるシステインを介した共有結合によりホモダイマーを形成している(非特許文献1)。
【0004】
Fcレセプターには免疫抑制的な生物学的特性があることから、近年では、自己免疫疾患、移植物の拒絶、悪性リンパ増殖などの領域において有効な医薬となる可能性が期待されている。また、Fcレセプターはヒトが持っている免疫機能の一つであることから、抗体のADCC(Anitibody−Dependent Cellular Cytotoxicity)活性(抗体依存性細胞障害活性)を測定するためのタンパク質としても注目を浴びている(特許文献1)。さらに、Fcレセプターの一つであるFcγRIが有する抗体への結合能は抗体の免疫活性測定用試薬や各種抗体精製用クロマトグラフィーゲルに用いる捕捉タンパク質として利用することができる(特許文献2)。
【0005】
このようにFcγRIの有する機能、およびさらなる生物学的機能を追求するために、FcγRI、その中でも特に抗体への結合能を有する細胞外領域を、遺伝子工学的手法を用いて効率よく発現させる試みがなされている。FcγRI細胞外領域を発現させる方法としては、哺乳動物細胞や昆虫細胞等を利用したものがある(非特許文献3)が、煩雑な作業と手間を要する。また、FcγRI細胞外領域を取扱いの容易な大腸菌で発現させた例もあるが、FcγRI細胞外領域は不活性型である封入体として発現するため、必ずしも効率的で有用な方法ではない(特許文献2および3)。さらに、従来、FcγRI細胞外領域を発現させる際は、FcγRI細胞外領域の一部分を欠いたポリペプチドで発現させたり、融合タンパク質の形態で発現させたり、グルタチオン−S−トランスフェラーゼやFLAG−tag等をN末端に付加して発現させていた。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2009−501913号公報
【特許文献2】特開2008−245580号公報
【特許文献3】特表2002−531086号公報
【非特許文献】
【0007】
【非特許文献1】J.V.Ravetch等,Annu.Rev.Immunol.,9,457,1991
【非特許文献2】J.M.Allen等,Science,243,378,1989
【非特許文献3】A.Paetz等,Biochem.Biophys.Res.comun.,338,1811,2005
【非特許文献4】“Plasmid transformation of Escherichia coli and other bacteria”,Method in Enzymology,204,63−113,1991,Academic Press
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、抗体の免疫活性測定用試薬として有用なFcγRI細胞外領域を、活性型として発現させるためのポリヌクレオチド、およびそれを用いたFcγRIを簡便に製造する方法を提供することにある。
【課題を解決するための手段】
【0009】
上記課題を鑑みてなされた本発明は、以下の発明を包含する。
【0010】
第一の発明は、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドの5’末端側に、ペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドを付加した、ポリヌクレオチドである。
【0011】
第二の発明は、ペリプラズムにタンパク質を分泌させるシグナルペプチドが配列番号13から16に示すいずれかのポリペプチドである、第一の発明に記載のポリヌクレオチドである。
【0012】
第三の発明は、配列番号3から12に示すいずれかのポリペプチドをコードする、ポリヌクレオチドである。
【0013】
第四の発明は、第一から第三のいずれかの発明に記載のポリヌクレオチドを含む、ヒト型FcレセプターFcγRIを発現させるためのプラスミドである。
【0014】
第五の発明は、第四の発明に記載のプラスミドで宿主を形質転換して得られる、ヒト型FcレセプターFcγRIを発現可能な形質転換体である。
【0015】
第六の発明は、第五の発明に記載の形質転換体を用いた、ヒト型FcレセプターFcγRIの製造方法である。
【0016】
以下、本発明について詳細に説明する。
【0017】
本発明においてヒト型FcレセプターFcγRI細胞外領域とは、ヒト型FcγRIのうち細胞外領域の全領域または概ね全領域のアミノ酸を含むポリペプチドのことをいう。
【0018】
ヒト型FcγRIは図1に示すように、N末端側から15残基のシグナルペプチド領域(図1のSS、配列番号2に記載のアミノ酸配列のうち−15番目から−1番目までの領域)、277残基からなる細胞外領域(図1のEC、配列番号2に記載のアミノ酸配列のうち1番目から277番目までの領域)、21残基の細胞膜貫通領域(図1のTM、配列番号2に記載のアミノ酸配列のうち278番目から298番目までの領域)、61残基の細胞内領域(図1のC、配列番号2に記載のアミノ酸配列のうち299番目から359番目までの領域)からなる。このうちIgG分子のFc領域と結合親和性を有するのは細胞外領域であり、前記領域でIgGを直接捕捉している。なお、本発明のヒト型FcレセプターFcγRI細胞外領域は、細胞外領域のN末端側にあるシグナルペプチド領域(具体的には配列番号2の−15番目から−1番目までの領域)の一部を含んでもよいし、細胞外領域のC末端側にある細胞膜貫通領域(具体的には配列番号2の278番目から298番目までの領域)の一部を含んでもよい。
【0019】
本発明において、ヒト型FcγRI細胞外領域の全領域のアミノ酸とは、具体的には、配列番号2で開示のヒト型FcγRIアミノ酸配列のうち1番目から277番目までの領域、すなわち277残基からなるヒト型FcγRI細胞外領域の全アミノ酸のことをいう。また、ヒト型FcγRI細胞外領域の概ね全領域のアミノ酸とは、具体的には、配列番号2の1番目から277番目までの領域(ヒト型FcγRI細胞外領域の全領域)のうち、抗体(IgG)結合親和性を失わない範囲で、N末端側および/またはC末端側の1から15アミノ酸を削除したものをいう。
【0020】
なお、本発明において、ヒト型FcγRI細胞外領域の全領域または概ね全領域のアミノ酸配列には、IgGへの捕捉機能を妨げない範囲でアミノ酸の置換および/または欠失および/または挿入があってもよい。
【0021】
本発明のポリヌクレオチドは、前述したヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドの5’末端側に、ペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドを付加していることを特徴としている。ペリプラズムにタンパク質を分泌させるシグナルペプチドは、ヒト型FcγRIを発現させる宿主により適宜選択すればよく、宿主が大腸菌の場合は大腸菌発現において汎用されているpelBシグナルペプチド(UniProt No.P0C1C1の1番目から22番目までの領域、配列番号13)、DsbAシグナルペプチド(UniProt No.P0AEG4の1から19番目までの領域、配列番号14)、MalEシグナルペプチド(UniProt No.P0AEX9の1番目から26番目までの領域、配列番号15)、TorTシグナルペプチド(UniProt No.P38683の1番目から18番目の領域、配列番号16)が例示できる。
【0022】
なお、本発明のポリヌクレオチドにおいて、ペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドは、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドの5’末端側に直接付加してもよいし、前記二つのポリヌクレオチドの間に、任意のリンカーペプチドをコードするポリヌクレオチド配列を、発現するヒト型FcγRIのIgGへの捕捉機能を妨げない範囲で挿入してもよい。さらに、本発明のポリヌクレオチドには、5’末端側および/または3’末端側に、発現したヒト型FcγRIの簡便な精製や定量を可能にするためのポリヒスチジンタグやc−mycタグといったタグペプチドをコードするポリヌクレオチドをさらに付加してもよい。
【0023】
本発明のポリヌクレオチドの一態様として、大腸菌発現において汎用されているpelBシグナルペプチド(MKYLLPTAAAGLLLLAAQPAMA、配列番号13)、およびヒト型FcレセプターFcγRI細胞外領域(配列番号2に記載のアミノ酸配列のうち1番目から274番目までの領域、または5番目から274番目までの領域)を含む、配列番号3から5に示すポリペプチドをコードするポリヌクレオチドがあげられる。
【0024】
本発明のポリヌクレオチドの別の態様として、DsbA(MKKIWLALAGLVLAFSASA、配列番号14)、MalE(MKIKTGARILALSALTTMMFSASALA、配列番号15)、TorT(MRVLLFLLLSLFMLPAFS、配列番号16)のいずれかより選択されるシグナルペプチド、およびヒト型FcレセプターFcγRI細胞外領域(配列番号2に記載のアミノ酸配列のうち1番目から274番目までの領域)を含む、配列番号6から12に示すポリペプチドをコードするポリヌクレオチドをあげることができる。
【0025】
なお、本発明におけるヒト型FcレセプターFcγRI細胞外領域、およびペリプラズムにタンパク質を分泌させるシグナルペプチドを含むポリペプチドから、本発明のポリヌクレオチドに変換する際、ヒト型FcγRIを発現させる宿主におけるコドンの使用頻度を考慮のうえ変換するのが好ましい。一例として宿主が大腸菌の場合は、アルギニン(Arg)ではAGA、AGG、CGG、CGA、イソロイシン(Ile)ではATA、ロイシン(Leu)ではCTA、グリシン(Gly)ではGGA、プロリン(Pro)ではCCCを例示することができる。コドンの使用頻度の解析は公的データベース(URL:http://www.kazusa.or.jp/codon/、アクセス日:2009年9月25日)を利用することによっても可能である。
【0026】
本発明のポリヌクレオチドの具体的態様として、配列番号3から12に示すアミノ酸配列からヌクレオチド配列に変換した配列番号17から26に示すポリヌクレオチドがあげられる。
【0027】
本発明のポリヌクレオチドを用いてヒト型FcγRIを製造するには、ヒト型FcγRIを発現させる宿主に適したプラスミドに本発明のポリヌクレオチドを挿入後、宿主を形質転換することで組換え体を作製し、前記組換え体を培養して製造すればよい。以下、製造方法について詳細に説明する。
【0028】
本発明のポリヌクレオチドの取得方法としては、
(1)目的とするタンパク質のアミノ酸配列からヌクレオチド配列に変換し、該ヌクレオチド配列を含むポリヌクレオチド全体を人工的に合成して取得する方法、
(2)ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドの領域(一例として、配列番号1に記載のヌクレオチド配列のうち58番目から888番目までの配列を含む領域)を、ヒト型FcγRIのcDNAなどからPCR法といったDNA増幅法を用いて調製し、その増幅産物を利用して目的とするタンパク質をコードするポリヌクレオチドを人工的に合成して取得する方法、
が例示できる。
【0029】
(1)の方法で取得する場合において、アミノ酸配列からヌクレオチド配列に変換する際は、前述したように、組換え対象宿主におけるコドンの使用頻度を考慮して変換するのが好ましい。
【0030】
また、(1)、(2)いずれの方法で本発明のポリヌクレオチドを取得する場合においても、前記ポリヌクレオチドと発現プラスミドとを連結させるための制限酵素認識配列、および/または発現したヒト型FcγRIの簡便な精製・定量を可能にするためのタグ配列を付加してもよい。付加する制限酵素認識配列は、前記ポリヌクレオチド配列を考慮のうえ適切な配列を選択すればよい。また付加するタグ配列は、ポリヒスチジンタグやc−mycタグといった遺伝子工学で多用されるオリゴアミノ酸をコードするヌクレオチド配列が使用できる。なお前記タグ配列は、前記ポリヌクレオチドの5’末端側に付加してもよいし、3’末端側に付加してもよい。
【0031】
本発明のヒト型FcγRIを発現させるためのプラスミドは、本発明のポリヌクレオチド、本発明のポリヌクレオチドを発現させるためのポリヌクレオチド、および宿主中で本発明のプラスミドを複製するための複製起点を有し、かつ、対象宿主を形質転換できるものであればよく、適宜選択し使用することができるが、通常は取扱いの容易な発現プラスミドを用いる。大腸菌を宿主として用いる場合、前記本発明のポリヌクレオチドを発現させるためのポリヌクレオチドとしては、lacプロモータ、trcプロモータ、T7プロモータ等が例示でき、中でも、転写活性の強いT7プロモータが好ましい。また、本発明のプラスミドにアンピシリンといった薬剤に対する耐性を宿主に付与するためのポリヌクレオチド(薬剤耐性遺伝子)をさらに含んでいると、本発明のプラスミドで宿主を形質転換する操作にあたり、本発明のプラスミドが導入された宿主と導入されなかった宿主との選別が容易に行なえるため好ましい。
【0032】
ヒト型FcγRIを、遺伝子工学的手法を用いて製造するために使用する宿主としては、大腸菌の場合、JM109株等K12系の株を用いるのが好ましく、BL21(DE3)株等T7プロモータが利用できる株がさらに好ましい。なお、前記宿主を変異処理することにより得られる変異株も、本発明の製造方法で用いる宿主として利用することもできる。変異処理は、ニトロソグアニジンやメタンスルホン酸エチルといった変異処理剤、紫外線、放射線等の当業者にとって周知の方法を用いて行なえばよい。
【0033】
宿主への本発明のプラスミドの導入および発現のための手順または方法は、下記に示す方法以外であってもよく、例えば非特許文献4に記載されている遺伝子工学の分野により慣用されている手法または方法に準じて実施してもよい。具体的にはヒートショック法、エレクトロポレーション法等をあげることができる。
【0034】
本発明のヒト型FcγRIの製造方法は、本発明のプラスミドで形質転換した宿主(形質転換体)を培養する工程を含む。上記方法は、具体的には、前記形質転換体を培養し、その培養物から、ヒト型FcγRIを回収することを含む。本発明のヒト型FcγRIの製造方法で用いる本発明の形質転換体は、対象宿主の培養に適した培地で培養すればよく、宿主が大腸菌の場合は、必要な栄養源を補ったLB(ルリア−ベルターニ)培地が好ましい培地の一例としてあげられる。好ましい実施態様においては、形質転換体の増殖を本発明のプラスミドの導入の有無により選択的に可能にするために、培地に本発明のプラスミドに挿入した薬剤耐性遺伝子に対応した薬剤を含んでいるのが好ましい。例えば、カナマイシン耐性遺伝子を発現可能な本発明のプラスミドが導入された宿主の増殖のために、培地にカナマイシンが添加される。なお、培地には、炭素、窒素および無機塩供給源の他に、適当な栄養源を加えてもよい。さらに、所望により、グルタチオン、システイン、シスタミン、チオグリコレート、ジチオスレイトールからなる群から選択される一種類以上の還元剤を含んでもよい。また、培地にはグリシン等の細胞から培養液へのタンパク質分泌を促す試薬を加えてもよい。具体的添加例として、宿主が大腸菌の場合、培地に対してグリシンを2%(w/v)以下で加えるのが好ましい。
【0035】
培養温度は宿主が大腸菌の場合、一般に10℃から40℃、好ましくは25℃から35℃、より好ましくは30℃前後であるが、発現させるヒト型FcγRIの特性により選択すればよい。培養培地のpHは宿主が大腸菌の場合、pH6.8からpH7.4、好ましくはpH7.0前後である。
【0036】
本発明のプラスミドに誘導性のプロモータが含まれる場合は、ヒト型FcγRIが良好に発現できるような条件下で誘導すればよい。誘導剤としてはIPTG(isopropyl−β−D−thiogalactopyranoside)が例示できる。宿主が大腸菌の場合、培養液の濁度(600nmにおける吸光度)を測定し、約0.5から1.0となったときに適当量のIPTGを添加後、引き続き培養することで、ヒト型FcγRIの発現を誘導することができる。IPTGの添加濃度は0.005から1.0mMの範囲から適宜選択すればよいが、0.01から0.5mM程度が好ましい。IPTG誘導に関する種々の条件は当該技術分野において周知の条件で行なえばよい。
【0037】
本発明の形質転換体培養液からヒト型FcγRIを回収するには、発現の形態によって適宜抽出方法を選択すればよい。培養上清に発現する場合は菌体を遠心分離操作によって分離し、得られる培養上清からヒト型FcγRIを抽出すればよい。一方、細胞内(原核生物のペリプラズムも含む)に発現する場合には、遠心分離操作により菌体を集めた後、酵素処理剤や界面活性剤等を添加することにより菌体を破砕して、ヒト型FcγRIを抽出すればよい。抽出タンパク質の中からヒト型FcγRIを分離・精製するには、当該技術分野において公知の方法を用いればよい。一例として、液体クロマトグラフィーを用いた分離・精製があげられる。液体クロマトグラフィーとしては、イオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、ゲルろ過クロマトグラフィー、アフィニティークロマトグラフィーなどがあげられる。これらのクロマトグラフィーを組み合わせて精製操作を行なうことによって、可溶性かつ抗体結合活性を有したヒト型FcγRIを高純度に調製することができる。
【発明の効果】
【0038】
本発明のポリヌクレオチドは、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドの5’末端側に、ペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドを付加していることを特徴としている。本発明のポリヌクレオチドを対象宿主に適切なプラスミドに挿入し、本発明のポリヌクレオチドを挿入したプラスミドで宿主を形質転換して得られる形質転換体を培養することで、ヒト型FcγRIを可溶性かつ抗体結合活性を有した状態で発現させることができる。特に宿主が大腸菌の場合、ペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドとして、配列番号13から16に示すいずれかのポリペプチドをコードするポリヌクレオチドを用いると、大腸菌でヒト型FcγRIを可溶性かつ抗体結合活性を有した状態で発現させることができるため、ヒト型FcγRIを簡便かつ大量に製造することができる。
【0039】
本発明の製造方法で得られたヒト型FcγRIはその細胞外領域を含んでいるため、ヒト型FcγRIが有する抗体(IgG)との結合活性は保持されている。したがって、本発明の製造方法で得られたヒト型FcγRIは、抗体の免疫活性測定用試薬、抗体精製用クロマトグラフィーゲルに用いる捕捉タンパク質、抗FcγRI抗体を作製するための免疫源等に用いることができる。
【図面の簡単な説明】
【0040】
【図1】ヒト型FcレセプターFcγRIの構造を示す図である。
【図2】発現プラスミドppelBL1FcRの構造を示す図である。
【図3】ppelBL1FcR形質転換体(実施例1、黒ひし形)およびpDsbA1FcR形質転換体(実施例4、白ひし形)のそれぞれで発現したヒト型FcγRIについて抗体結合活性を評価した図である。
【図4】ppelBFcR形質転換体(実施例2、黒ひし形)、ppelBL2FcR形質転換体(実施例3、黒四角)、pMalEFcR形質転換体(実施例7、白ひし形)およびpMalELFcR形質転換体(実施例8、白四角)のそれぞれで発現したヒト型FcγRIについて抗体結合活性を評価した図である。
【図5】pDsbA2FcR形質転換体(実施例5、白ひし形)、pDsbALFcR形質転換体(実施例6、白四角)、pTorTFcR形質転換体(実施例9、黒ひし形)、pTorTLFcR形質転換体(実施例10、黒四角)のそれぞれで発現したヒト型FcγRIについて抗体結合活性を評価した図である。
【図6】pFcR形質転換体(比較例1、黒ひし型)とppelBL2FcR形質転換体(実施例3、白四角)のそれぞれで発現したヒト型FcγRIについて抗体結合活性を評価した図である。
【図7】ppelBL1FcR形質転換体(実施例1)で発現したヒト型FcγRIについて抗体(IgG)サブクラスへの結合活性を評価した図である。
【図8】ウエスタンブロティング法によるHisタグ付きヒト型FcγRIの検出結果を示した図である。図中のレーンMが分子量マーカーを、レーン1がppelBL1FcR形質転換体(実施例1)からの粗精製タンパク質溶液を、レーン2がpDsbA1FcR形質転換体(実施例4)からの粗精製タンパク質溶液を、それぞれ示し、矢印はヒト型FcγRIに相当するバンドを示す。
【実施例】
【0041】
以下に実施例をあげて本発明を説明するが、本発明はこれにより限定されるものではない。
【0042】
実施例1 発現プラスミドppelBL1FcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドppelBL1FcRを調製した。
(1)特許文献2に記載の、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチド(コドンはヒト型から大腸菌型に変換している)を含むプラスミドpECFcRを鋳型として、配列番号27のオリゴヌクレオチド(5’−AGT[GGATCC]CACCAAGGCTGTGATTACGCTGCAACCACCGT−3’;角かっこ内は制限酵素BamHIサイト)と、配列番号28のオリゴヌクレオチド(5’−CC[AAGCTT]AATGATGATGATGATGATGGACCGGGGTCGGCAGTTGAAGACCCAG−3’;角かっこ内の塩基は制限酵素HindIIIサイト)をPCRプライマーとして下記のPCR条件1でPCRを行ない、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを作製した。なお、前記ポリヌクレオチドの3’末端には、配列番号28を用いてポリヒスチジンタグをコードするポリヌクレオチドを付加した。
【0043】
PCR条件1:
(試薬組成)
鋳型DNA
各0.4μM PCRプライマー
0.025U/μL PrimeSTAR HS DNA Polymeras
e(タカラバイオ社)
1×PrimeSTARバッファー(Mg2+Plus)(タカラバイオ社)
各200μM dNTP Mixture(タカラバイオ社)
(反応条件)
98℃で10秒、55℃で5秒、72℃で1分を1サイクルとするPCR反応を
30サイクル行なった。
(2)反応終了後、0.9%のアガロース電気泳動により、増幅産物のバンドが設計通りのサイズの位置にあることを確認後、前記増幅産物を抽出し(QIAquick Gel extraction kit:キアゲン社)、BamHIとHindIIIで制限酵素消化した。
(3)BamHIとHindIIIで消化したpET26b(+)プラスミド(Novagen社)にDNA Ligation Kit(Mighty Mix)(タカラバイオ社)を用いてライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(4)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地(10g/L tryptone、5g/L Yeast extract、5g/L NaCl)で培養した。培養菌体よりプラスミドDNAを抽出(QIAprep Spin Miniprep kit:キアゲン社)することで、発現プラスミドppelBL1FcRを得た。
【0044】
実施例2 発現プラスミドppelBFcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドppelBFcRを調製した。
(1)配列番号29のオリゴヌクレオチド(5’−TATA[CATATG]AAATACCTATTGCCTACGGCAGCCGCT−3’;角かっこ内の塩基は制限酵素NdeIサイト)、配列番号30のオリゴヌクレオチド(5’−ATTGTTATTACTCGCTGCCCAACCAGCGATGGCC−3’)、配列番号31のオリゴヌクレオチド(5’−GCAGCGAGTAATAACAATCCAGCGGCTGCCGTAGGCA−3’)、および配列番号32のオリゴヌクレオチド(5’−TTTGGTGGTATCTACTTGGGCCATCGCTGGT−3’)を下記のPCR条件2でPCRを行ない、各オリゴヌクレオチドを連結した。
【0045】
PCR条件2:
(試薬組成)
各2.5μMのオリゴヌクレオチド、または各等モルのポリヌクレオチド
0.025U/μL PrimeSTAR HS DNA Polymeras
e(タカラバイオ社)
1×PrimeSTARバッファー(Mg2+Plus)(タカラバイオ社)
各200μM dNTP Mixture(タカラバイオ社)
(反応条件)
98℃で10秒、55℃で5秒、72℃で1分を1サイクルとするPCR反応を
5サイクル行なった。
(2)鋳型として(1)の増幅産物、PCRプライマーとして配列番号29および32のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、pelBシグナルペプチドをコードするポリヌクレオチドを作製した。
(3)(2)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(4)鋳型として実施例1で調製したppelBL1FcR、PCRプライマーとして配列番号33のオリゴヌクレオチド(5’−CAAGTAGATACCACCAAAGCTGTGATTACGCTGCAACCACCGT−3’)および配列番号34のオリゴヌクレオチド(5’−TATGCTAGTTATTGCTCAG−3’)を用いた他は、前記PCR条件1でPCRを行ない、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを作製した。
(5)(4)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(6)(3)で得られたpelBシグナルペプチドをコードするポリヌクレオチド、および(5)で得られたヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを用い、前記PCR条件2でPCRを行ない、前記二つのポリヌクレオチドを連結した。
(7)鋳型として(6)のPCR産物、PCRプライマーとして配列番号29および34のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、pelBシグナルペプチドおよびヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを作製した。
(8)(7)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(9)(8)で精製した増幅産物を、NdeIとHindIIIで制限酵素消化した。
(10)NdeIとHindIIIで消化したpET26b(+)プラスミド(Novagen社)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(11)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドppelBFcRを得た。
【0046】
実施例3 発現プラスミドppelBL2FcRの調製
実施例2の(1)における各オリゴヌクレオチドの代わりに、配列番号29のオリゴヌクレオチド、配列番号30のオリゴヌクレオチド、配列番号31のオリゴヌクレオチド、および配列番号35のオリゴヌクレオチド(5’−TTGGTGGTATCTACTTGGCCACCCGTATTTGCGGCCATCGCTGG−3’)を用いた他は、実施例2と同様な方法で調製することで、ヒト型FcγRI発現プラスミドppelBL2FcRを得た。
【0047】
実施例4 発現プラスミドpDsbA1FcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドpDsbA1FcRを調製した。
(1)配列番号36のオリゴヌクレオチド(5’−CGC[TCTAGA]AATAATTTTGTTTAACTTTAAGAAGG−3’;角かっこ内の塩基は制限酵素XbaIサイト)、配列番号37のオリゴヌクレオチド(5’−TATACCATGAAAAAGATTTGGCTGGCGCTGGCTGG−3’)、配列番号38のオリゴヌクレオチド(5’−TAGTTTTAGCGTTTAGCGCATCGGCGCAAGTGGATC−3’)、配列番号39のオリゴヌクレオチド(5’−CTTGGTG[GGATCC]ACTTGCGCCGAT−3’;角かっこ内の塩基は制限酵素BamHIサイト)、配列番号40のオリゴヌクレオチド(5’−CTAAACGCTAAAACTAAACCAGCCAGCGCCAGCCA−3’)、および配列番号41のオリゴヌクレオチド(5’−CTTTTTCATGGTATATCTCCTTCTTAAAGTTAAACAA−3’)を前記PCR条件2でPCRを行ない、各オリゴヌクレオチドを連結した。
(2)鋳型として(1)の増幅産物、PCRプライマーとして配列番号36のオリゴヌクレオチドおよび39のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、DsbAシグナルペプチドをコードするポリヌクレオチドを作製した。
(3)(2)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(4)(3)で精製した増幅産物を、XbaIとBamHIで制限酵素消化した。
(5)XbaIとBamHIで消化したpET28a(+)プラスミド(Novagen社)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(6)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドpDsbAを調製した。
(7)実施例1で作製したヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドをBamHIとHindIIIで制限酵素消化後、BamHIとHindIIIで消化した発現プラスミドpDsbA((6)で調製)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(8)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドpDsbA1FcRを得た。
【0048】
実施例5 発現プラスミドpDsbA2FcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドpDsbA2FcRを調製した。
(1)鋳型として実施例4で調製したpDsbA1FcRを、PCRプライマーとして配列番号36のオリゴヌクレオチドと配列番号42のオリゴヌクレオチド(5’−TTTGGTGGTATCTACTTGCGCCGATGCGCTAAACGCTA−3’)を用いた他は、前記PCR条件1と同じ条件でPCRを行ない、DsbAシグナルペプチドをコードするポリヌクレオチドを作製した。
(2)(1)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(3)(2)で得られたDsbAシグナルペプチドをコードするポリヌクレオチドと、実施例2で作製したヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドとを、前記PCR条件2にてPCRを行なうことで連結した。
(4)鋳型として(3)の増幅産物、PCRプライマーとして配列番号36のオリゴヌクレオチドおよび配列番号34のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、DsbAシグナルペプチドとヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを作製した。
(5)(4)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(6)(5)で精製した増幅産物を、XbaIとHindIIIで制限酵素消化した。
(7)XbaIとHindIIIで消化したpET28a(+)プラスミド(Novagen社)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(8)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドpDsbA2FcRを得た。
【0049】
実施例6 発現プラスミドpDsbALFcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドpDsbALFcRを調製した。
(1)鋳型として実施例4で調製したpDsbA1FcRを、PCRプライマーとして配列番号36のオリゴヌクレオチドおよび配列番号40のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、DsbAシグナルペプチドをコードするポリヌクレオチドを作製した。
(2)(1)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(3)配列番号43のオリゴヌクレオチド(5’−TAGTTTTAGCGTTTAGCGCATCGGCGGCGCAGTATGAAGA−3’)と配列番号44のオリゴヌクレオチド(5’−TTTGGTGGTATCTACTTGATCTTCATACTGCGCCGC−3’)とを、前記PCR条件2と同じ条件でPCRを行なうことで連結した。
(4)鋳型として(2)および(3)の増幅産物、PCRプライマーとして配列番号36のオリゴヌクレオチドおよび配列番号44のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、DsbAシグナルペプチドおよびリンカーペプチドをコードするポリヌクレオチドを作製した。
(5)(4)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(6)(5)の増幅産物および実施例2で作製したヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドから、実施例5の(3)から(8)と同じ方法により、発現プラスミドpDsbALFcRを得た。
【0050】
実施例7 発現プラスミドpMalEFcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドpMalEFcRを調製した。
(1)配列番号45のオリゴヌクレオチド(5’−TATA[CATATG]AAAATAAAAACAGGTGCACGCATCC−3’;角かっこ内の塩基は制限酵素NdeIサイト)、配列番号46のオリゴヌクレオチド(5’−GCATTAACGACGATGATGTTTTCCGCCTCGGCTCTCGCC−3’)、配列番号47のオリゴヌクレオチド(5’−ATCGTCGTTAATGCGGATAATGCGAGGATGCGTGCACCTG−3’)、および配列番号48のオリゴヌクレオチド(5’−TTTGGTGGTATCTACTTGGGCGAGAGCCGAGGCGGAAA−3’)を前記PCR条件2でPCRを行ない、各オリゴヌクレオチドを連結した。
(2)鋳型として(1)の増幅産物、PCRプライマーとして配列番号45のオリゴヌクレオチドおよび配列番号48のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、MalEシグナルペプチドをコードするポリヌクレオチドを作製した。
(3)(2)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(4)(3)で精製した増幅産物と、実施例2に記載のヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドとを、上記PCR条件2でPCRを行なうことで連結した。
(5)鋳型として(4)の増幅産物を、PCRプライマーとして配列番号45のオリゴヌクレオチドおよび配列番号34のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ方法でPCRを行ない、MalEシグナルペプチドとヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを作製した。
(6)(5)の増幅産物0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(7)(6)で精製した増幅産物を、NdeIとHindIIIで制限酵素消化した。
(8)NdeIとHindIIIで消化したpET26b(+)プラスミド(Novagen社)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(9)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドpMalEFcRを得た。
【0051】
実施例8 発現プラスミドpMalELFcRの作製
実施例7の(1)における各オリゴヌクレオチドの代わりに、配列番号45のオリゴヌクレオチド、配列番号46のオリゴヌクレオチド、配列番号47のオリゴヌクレオチド、および配列番号49のオリゴヌクレオチド(5’−TGGTATCTACTTGACCTTCTTCGATTTTGGCGAGAGCCGAGGCG−3’)を用いた他は、実施例7と同様な方法で調製することで、発現プラスミドpMalELFcRを得た。
【0052】
実施例9 発現プラスミドpTorTFcRの調製
以下に示す方法により、ヒト型FcγRI発現プラスミドpTorTFcRを調製した。
(1)配列番号50のオリゴヌクレオチド(5’−TATA[CATATG]CGCGTACTGCTATTTTTAC−3’;角かっこ内の塩基は制限酵素NdeIサイト)、配列番号51のオリゴヌクレオチド(5’−TTCTTTCCCTTTTCATGTTGCCGGCATTTTCG−3’)、配列番号52のオリゴヌクレオチド(5’−TGAAAAGGGAAAGAAGTAAAAATAGCAGTACG−3’)、および配列番号53のオリゴヌクレオチド(5’−TTTGGTGGTATCTACTTGCGAAAATGCCGGCAACA−3’)を前記PCR条件2でPCRを行ない、各オリゴヌクレオチドを連結した。
(2)鋳型として(1)の増幅産物、PCRプライマーとして配列番号50のオリゴヌクレオチドおよび配列番号53のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ条件でPCRを行ない、TorTシグナルペプチドをコードするポリヌクレオチドを作製した。
(3)(2)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(4)(3)で精製した増幅産物と、実施例2に記載のヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドとを、上記PCR条件2でPCRを行なうことで連結した。
(5)鋳型として(4)の増幅産物を、PCRプライマーとして配列番号50のオリゴヌクレオチドおよび配列番号34のオリゴヌクレオチドを用いた他は、前記PCR条件1と同じ方法でPCRを行ない、TorTシグナルペプチドとヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを作製した。
(6)(5)の増幅産物0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(7)(6)で精製した増幅産物を、NdeIとHindIIIで制限酵素消化した。
(8)NdeIとHindIIIで消化したpET26b(+)プラスミド(Novagen社)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(9)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドpTorTFcRを得た。
【0053】
実施例10 発現プラスミドpTorTLFcRの調製
実施例9(1)における各オリゴヌクレオチドの代わりに、配列番号50のオリゴヌクレオチド、配列番号51のオリゴヌクレオチド、配列番号52のオリゴヌクレオチド、および配列番号54のオリゴヌクレオチド(5’−TGGTGGTATCTACTTGCAACAGGTTATCAGCCGAAAATGCCGGCA−3’)を用いた他は、実施例9と同様な方法で調製することで、ヒト型FcγRI発現プラスミドpTorTLFcRを得た。
【0054】
実施例11 各発現プラスミドのポリヌクレオチド配列確認
実施例1から10で調製した発現プラスミドのポリヌクレオチド配列をチェーンターミネータ法に基づくBig Dye Terminator Cycle Sequencing FS read Reaction kit(PEアプライドバイオシステム社)を用いてサイクルシークエンス反応に供し、全自動DNAシークエンサーABI Prism 3700 DNA analyzer(PEアプライドバイオシステム社)にて解析した。なお、配列番号55(5’−TAATACGACTCACTATAGGG−3’)と配列番号34に示すオリゴヌクレオチドをシークエンス用プライマーとして使用した。解析の結果、ヌクレオチド配列はそれぞれのプラスミドで設計通りであることが確認された。
【0055】
以下にそれぞれの発現プラスミドの概要を記す。
【0056】
発現プラスミドppelBL1FcR(実施例1)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号3に、それをコードするポリヌクレオチド配列を配列番号17に示す。また、ppelBL1FcRの構造を図2に示す。
【0057】
発現プラスミドppelBFcR(実施例2)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号4に、それをコードするポリヌクレオチド配列を配列番号18に示す。なお、ppelBL1FcRの構造は、ppelBL1FcR(図2)のうち制限酵素NdeIサイトと制限酵素HindIIIサイトの間が、配列番号18の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0058】
発現プラスミドppelBL2FcR(実施例3)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号5に、それをコードするポリヌクレオチド配列を配列番号19に示す。なお、ppelBL2FcRの構造は、ppelBL1FcR(図2)のうち制限酵素NdeIサイトと制限酵素HindIIIサイトの間が、配列番号19の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0059】
発現プラスミドpDsbA1FcR(実施例4)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号6に、それをコードするポリヌクレオチド配列を配列番号20に示す。なお、pDsbA1FcRの構造は、ppelBL1FcR(図2)のうち制限酵素XbaIサイトと制限酵素HindIIIサイトの間が、配列番号20の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0060】
発現プラスミドpDsbA2FcR(実施例5)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号7に、それをコードするポリヌクレオチド配列を配列番号21に示す。なお、pDsbA2FcRの構造は、ppelBL1FcR(図2)のうち制限酵素XbaIサイトと制限酵素HindIIIサイトの間が、配列番号21の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0061】
発現プラスミドpDsbALFcR(実施例6)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号8に、それをコードするポリヌクレオチド配列を配列番号22に示す。なお、pDsbALFcRの構造は、ppelBL1FcR(図2)のうち制限酵素XbaIサイトと制限酵素HindIIIサイトの間が、配列番号22の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0062】
発現プラスミドpMalEFcR(実施例7)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号9に、それをコードするポリヌクレオチド配列を配列番号23に示す。なお、pMalEFcRの構造は、ppelBL1FcR(図2)のうち制限酵素NdeIサイトと制限酵素HindIIIサイトの間が、配列番号23の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0063】
発現プラスミドpMalELFcR(実施例8)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号10に、それをコードするポリヌクレオチド配列を配列番号24に示す。なお、pMalELFcRの構造は、ppelBL1FcR(図2)のうち制限酵素NdeIサイトと制限酵素HindIIIサイトの間が、配列番号24の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0064】
発現プラスミドpTorTFcR(実施例9)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号11に、それをコードするポリヌクレオチド配列を配列番号25に示す。なお、pTorTFcRの構造は、ppelBL1FcR(図2)のうち制限酵素NdeIサイトと制限酵素HindIIIサイトの間が、配列番号25の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0065】
発現プラスミドpTorTLFcR(実施例10)によって発現されるヒト型FcγRIのアミノ酸配列を配列番号12に、それをコードするポリヌクレオチド配列を配列番号26に示す。なお、pTorTLFcRの構造は、ppelBL1FcR(図2)のうち制限酵素NdeIサイトと制限酵素HindIIIサイトの間が、配列番号26の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。
【0066】
実施例1から10で調製した発現プラスミドによって発現されるヒト型FcγRIのうち、N末端側アミノ酸配列の概要を表1および配列番号59から68に示す。なお、表1の「発現されるヒト型FcγRIのN末端アミノ酸配列」欄にある「−」は各領域の境界を示す。
【0067】
【表1】

実施例12 発現されたヒト型FcγRIの抗体結合活性確認(その1)
(1)ppelBL1FcRで大腸菌を形質転換して得られた組換え大腸菌(ppelBL1FcR形質転換体、実施例1)、およびpDsbA1FcRで大腸菌を形質転換して得られた組換え大腸菌(pDsbA1FcR形質転換体、実施例4)を、それぞれ50μg/mL カナマイシンを添加したLB液体培地に接種し、37℃で一晩振盪培養した。
(2)それぞれの培養液を、新たに50μg/mL カナマイシンを添加した2×YT液体培地(16g/L Triptone、10g/L Yeast extract、5g/L NaCl)に接種し37℃で振盪培養した。
(3)培養液の濁度(600nmにおける吸光度)の値が約0.5になったところで培養温度を20℃にして30分培養後、IPTGを0.1mMとなるように培養液に添加し、20℃で22時間振盪培養した。培養後の培養液の濁度(600nmにおける吸光度)の値は、ppelBL1FcR形質転換体が4.76、pDsbA1FcR形質転換体が6.54であった。
(4)それぞれの形質転換体からBugBuster protein extraction Kit(Novagen社)を用いて可溶性タンパク質抽出液を調製した。
(5)可溶性タンパク質抽出液中の可溶性ヒト型FcγRIの抗体結合活性を下記に示すELISA(Enzyme−Linked Immunosorbent Assay)法により評価した。
(5−1)抗体であるガンマグロブリン(化学及血清療法研究所)を、96穴マイクロプレートのウェルに濃度1μg/wellで固定し(4℃、18時間)、StartingBlock Blocking Buffers(PIERCE社)によりブロッキングした。
(5−2)調製した可溶性タンパク質抽出液を段階希釈し、ELISA反応に供した(30℃、2時間)。
(5−3)0.2%(w/v) Tween 20、150mM NaClを含むTris−HCl緩衝液(pH8.0)で洗浄後、Horseradish Peroxidase(HRP)抗His−Tag抗体試薬(BETHYL社)を添加し、30℃で2時間反応した。
(5−4)(5−3)の緩衝液で洗浄後、TMB Peroxidase Substrate(KPL社)を添加し、450nmの吸光度を測定した。
【0068】
結果を図3に示す。図中、X軸(横軸)はサンプルの希釈倍率を示し、Y軸(縦軸)は、450nmの吸光度(単位は任意)となり抗体結合活性を示す。図3に示す通り、ppelBL1FcR形質転換体およびpDsbA1FcR形質転換体から得られた可溶性タンパク質抽出液は、その濃度が高くなるほど(希釈倍率が小さいほど)吸光度の値が高くなった。すなわち、ppelBL1FcR形質転換体およびpDsbA1FcR形質転換体により発現したヒト型FcγRIが、可溶性かつ抗体結合活性を有していることがわかる。
【0069】
実施例13 発現されたヒト型FcγRIの抗体結合活性確認(その2)
(1)ppelBFcRで大腸菌を形質転換して得られた組換え大腸菌(ppelBFcR形質転換体、実施例2)、ppelBL2FcRで大腸菌を形質転換して得られた組換え大腸菌(ppelBL2FcR形質転換体、実施例3)、pMalEFcRで大腸菌を形質転換して得られた組換え大腸菌(pMalEFcR形質転換体、実施例7)、およびpMalELFcRで大腸菌を形質転換して得られた組換え大腸菌(pMalELFcR形質転換体、実施例8)を、それぞれ50μg/mL カナマイシンを添加したLB液体培地に接種し、37℃で一晩振盪培養した。
(2)それぞれの培養液を、新たに50μg/mL カナマイシンを添加したLB液体培地に接種し37℃で振盪培養した。
(3)培養液の濁度(600nmにおける吸光度)が約0.5になったところで培養温度を20℃にして30分培養後、IPTGを0.01mMとなるように培養液に添加し、20℃で22時間振盪培養した。培養後の培養液の濁度(600nmにおける吸光度)は、ppelBFcR形質転換体が5.21、ppelBL2FcR形質転換体が5.24、pMalEFcR形質転換体が4.82、pMalELFcR形質転換体が5.36であった。
(4)実施例12の(4)から(5)と同様な方法で、それぞれの形質転換体から可溶性タンパク質抽出液を調製し、可溶性タンパク質抽出液中の可溶性ヒト型FcγRIの抗体結合活性をELISA法により評価した。
【0070】
結果を図4に示す。図中、X軸(横軸)およびY軸(縦軸)は図3と同じである。図4に示した通り、いずれの形質転換体から得られた可溶性タンパク質抽出液であっても、その濃度が高くなるほど(希釈倍率が小さいほど)吸光度の値が高くなった。すなわち、ppelBFcR形質転換体、ppelBL2FcR形質転換体、pMalEFcR形質転換体およびpMalELFcR形質転換体でそれぞれ発現したヒト型FcγRIが、可溶性かつ抗体結合活性を有していることがわかる。
【0071】
実施例14 発現されたヒト型FcγRIの抗体結合活性確認(その3)
(1)pDsbA2FcRで大腸菌を形質転換して得られた組換え大腸菌(pDsbA2FcR形質転換体、実施例5)、pDsbALFcRで大腸菌を形質転換して得られた組換え大腸菌(pDsbALFcR形質転換体、実施例6)、pTorTFcRで大腸菌を形質転換して得られた組換え大腸菌(pTorTFcR形質転換体、実施例9)、およびpTorTLFcRで大腸菌を形質転換して得られた組換え大腸菌(pTorTLFcR形質転換体、実施例10)を、実施例13の(1)から(3)と同様な方法で発現誘導した。培養後の培養液の濁度(600nmにおける吸光度)は、pDsbA2FcR形質転換体が2.81、pDsbALFcR形質転換体が3.27、pTorTFcR形質転換体が3.35、pTorTLFcR形質転換体が3.57であった。
(2)実施例13の(4)から(5)と同様の方法で、それぞれの形質転換体から可溶性タンパク質抽出液を調製し、可溶性タンパク質抽出液中の可溶性ヒト型FcγRIの抗体結合活性をELISA法により評価した。
【0072】
結果を図5に示す。図中、X軸(横軸)およびY軸(縦軸)は図3と同じである。図5に示した通り、いずれの形質転換体から得られた可溶性タンパク質抽出液であっても、その濃度が高くなるほど(希釈倍率が小さいほど)吸光度の値が高くなった。すなわち、pDsbA2FcR形質転換体と、pDsbALFcR形質転換体、pTorTFcR形質転換体、pTorTLFcR形質転換体でそれぞれ発現したFcγRIが、可溶性かつ抗体結合活性を有していることがわかる。
【0073】
比較例1 発現プラスミドpFcRの調製
比較対象プラスミドとして、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドのみを挿入した、ヒト型FcγRI発現プラスミドpFcRを調製した。
(1)鋳型として実施例2に記載のヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドを、PCRプライマーとして配列番号56のオリゴヌクレオチド(5’−TCAG[CCATGG]GACAAGTAGATACCACCAAAGCTGTGATTA−3’;角かっこ内の塩基は制限酵素NcoIサイト)および配列番号34のオリゴヌクレオチドを用いた他は、前記PCR条件1でPCRを行ない、ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチド(5’末端側にNcoIサイトが存在)を作製した。
(2)(1)の増幅産物を0.9%のアガロース電気泳動にかけ、目的の増幅産物に相当するバンドを切り出し後、ゲルから抽出することで増幅産物を精製した。
(3)(2)で精製した増幅産物を、NcoIとHindIIIで制限酵素消化した。
(4)NcoIとHindIIIで消化したpET28a(+)プラスミド(Novagen社)にライゲーションし、ヒートショック法により大腸菌BL21(DE3)を形質転換した。
(5)得られた形質転換体を50μg/mL カナマイシンを添加したLB培地で培養し、菌体よりプラスミドDNAを抽出することで、発現プラスミドpFcRを得た。
(6)(5)で得られたpFcRを、実施例11と同様の方法でヌクレオチド配列の確認を行なった。
【0074】
発現プラスミドpFcRによって発現されるヒト型FcγRIのアミノ酸配列を配列番号57に、それをコードするポリヌクレオチド配列を配列番号58に示す。なお、pFcRの構造は、pET28a(+)プラスミドの制限酵素NcoIサイトと制限酵素HindIIIサイトの間が、配列番号58の同制限酵素サイト間のポリヌクレオチド配列と置き換わったものである。pFcRによって発現されるヒト型FcγRIのうち、N末端側アミノ酸配列の概要を表1および配列番号69に示す。
【0075】
比較例2 pFcR形質転換体で発現したヒト型FcγRIの抗体結合活性確認
(1)pFcRで大腸菌を形質転換して得られた組換え大腸菌(pFcR形質転換体、比較例1)、およびppelBL2FcR形質転換体(実施例3)を、それぞれ50μg/mL カナマイシンを添加したLB液体培地に接種し、37℃で一晩振盪培養した。
(2)それぞれの培養液を、新たに50μg/mL カナマイシンを添加したLB液体培地に接種し37℃で振盪培養した。
(3)培養液の濁度(600nmにおける吸光度)が約0.5になったところで培養温度を20℃にして30分培養後、IPTGを0.1mMとなるように培養液に添加し、20℃で22時間振盪培養した。培養後の培養液の濁度(600nmにおける吸光度)は、pFcR形質転換体が6.91、ppelBL2FcR形質転換体が2.87であった。
(4)実施例12の(4)から(5)と同様の方法で、それぞれの形質転換体から可溶性タンパク質抽出液を調製し、可溶性タンパク質抽出液中の可溶性ヒト型FcγRIの抗体結合活性をELISA法により評価した。
【0076】
結果を図6に示す。図中、X軸(横軸)およびY軸(縦軸)は図3と同じである。ppelBL2FcR形質転換体から得られた可溶性タンパク質抽出液は、図6および図4(実施例13)に示すように、その濃度が高くなるほど(希釈倍率が小さいほど)吸光度の値が高くなった。一方、pFcR形質転換体から得られた可溶性タンパク質抽出液は、その濃度を高くしても(希釈倍率が小さくしても)吸光度の値は高くならず、抗体結合活性は認められなかった。pFcRで発現するFcγRIの細胞外領域を含むポリペプチド(配列番号57)のN末端側には、従来技術(特許文献2および3)のようにシグナルペプチドが付加されていないため、大腸菌内で発現したヒト型FcγRIは不溶性の封入体となり、可溶性タンパク質として発現しなかった。よって、組換え大腸菌を用いて、可溶性かつ抗体結合活性を有するヒト型FcγRIを発現させるには、発現させるヒト型FcレセプターFcγRI細胞外領域のN末端側に大腸菌ペリプラズムにタンパク質を分泌させるシグナルペプチドを付加することが必要であることがわかる。
【0077】
以上より、本発明のヒト型FcγRIの製造方法は、従来の大腸菌発現系(特許文献2および3)と比較し、ヒト型FcγRIを可溶性かつ抗体結合活性を有した状態で発現可能な方法であり、当該タンパク質の生産に有用な方法といえる。
【0078】
実施例15 発現したタンパク質の抗体結合活性の確認(抗体スペクトラム)
ヒト型FcγRIでは抗体(IgG)のサブクラスIgG1からIgG4に対して結合活性が異なることが知られ、IgG1≧IgG3>IgG4>IgG2の順で結合活性を示すことが知られている(非特許文献3)。そこで、ELISA法を用いてppelBL1FcR形質転換体(実施例1)で発現したヒト型FcγRIの抗体サブクラスへの結合活性を評価した。ELISA法は、実施例12の(5−1)において96穴マイクロプレートのウェルにガンマグロブリンを添加する代わりに濃度0.1μg/wellのIgG1κ、IgG2κ、IgG3κまたはIgG4κを固定化した他は、実施例12の(5)と同様な方法で行なった。また、ELISAには調製した可溶性タンパク質抽出液を20倍希釈したものを供した。
【0079】
ppelBL1FcR形質転換体(実施例1)で発現したヒト型FcγRIについて、抗体サブクラスへの結合活性を評価した結果を図7に示した。図7に示すように、抗体サブクラスに対しIgG3≧IgG1>IgG4≧IgG2の順で結合活性を示した。このことから、ppelBL1FcR形質転換体で発現したヒト型FcγRIは、天然のヒト型FcγRIとほぼ同等のサブクラス選択性を有していることがわかる。
【0080】
実施例16 発現したヒト型FcγRIのウエスタンブロッティング検出
(1)ppelBL1FcR形質転換体(実施例1)およびpDsbA1FcR形質転換体(実施例4)を、それぞれ実施例12と同様な方法で誘導発現培養を行なった。
(2)それぞれの菌体から、実施例12と同様の方法で可溶性タンパク質抽出液を調製し、His・Bind Resin(Novagen社)を用いたクロマトグラフィーにより粗精製し、粗精製タンパク質溶液を得た。
(3)それぞれの粗精製タンパク質溶液中のHisタグが付いたヒト型FcγRIを特異的に検出するため下記に示すウエスタンブロッティングを行なった。
(3−1)それぞれの粗精製タンパク質溶液についてSDS−PAGEを行ない、PVDF(Polyvinylidene difluoride)膜に転写・固定化した。
(3−2)PVDF膜を0.2%(w/v) Tween 20、150mM NaClを含むTris−HCl緩衝液(pH8.0)からなる緩衝液で洗浄後、3%スキムミルクを含む同緩衝液でブロッキングを行ない、スキムミルクなしの同緩衝液で再度洗浄した。
(3−3)PVDF膜に対しHRP抗His−Tag抗体試薬(BETHYL社)で抗原抗体反応を行ない、これを(3−2)の緩衝液(スキムミルクなし)で洗浄後、ECL plus(GEヘルスケアバイオサイエンス社)を用い化学発光検出した。
【0081】
ppelBL1FcR形質転換体とpDsbA1FcR形質転換体、それぞれで発現するヒト型FcγRIは、GENETYX−WIN(version 3.1.0、ゼネティックス社)を使用して計算した結果、SDS−PAGEを行なうと両方とも30kDa付近にバンドが位置すると推測されたが、ウエスタンブロティングの結果、図8に示すように30kDa付近にppelBL1FcR形質転換体とpDsbA1FcR形質転換体、それぞれで発現したヒト型FcγRIが検出された。このことから、それぞれの形質転換体より得られた粗精製タンパク質溶液中に、ヒト型FcγRIが含まれていることが明らかとなった。
【特許請求の範囲】
【請求項1】
ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドの5’末端側に、ペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドを付加した、ポリヌクレオチド。
【請求項2】
ペリプラズムにタンパク質を分泌させるシグナルペプチドが配列番号13から16に示すいずれかのポリペプチドである、請求項1に記載のポリヌクレオチド。
【請求項3】
配列番号3から12に示すいずれかのポリペプチドをコードする、ポリヌクレオチド。
【請求項4】
請求項1から3のいずれかに記載のポリヌクレオチドを含む、ヒト型FcレセプターFcγRIを発現させるためのプラスミド。
【請求項5】
請求項4に記載のプラスミドで宿主を形質転換して得られる、ヒト型FcレセプターFcγRIを発現可能な形質転換体。
【請求項6】
請求項5に記載の形質転換体を用いた、ヒト型FcレセプターFcγRIの製造方法。
【請求項1】
ヒト型FcレセプターFcγRI細胞外領域をコードするポリヌクレオチドの5’末端側に、ペリプラズムにタンパク質を分泌させるシグナルペプチドをコードするポリヌクレオチドを付加した、ポリヌクレオチド。
【請求項2】
ペリプラズムにタンパク質を分泌させるシグナルペプチドが配列番号13から16に示すいずれかのポリペプチドである、請求項1に記載のポリヌクレオチド。
【請求項3】
配列番号3から12に示すいずれかのポリペプチドをコードする、ポリヌクレオチド。
【請求項4】
請求項1から3のいずれかに記載のポリヌクレオチドを含む、ヒト型FcレセプターFcγRIを発現させるためのプラスミド。
【請求項5】
請求項4に記載のプラスミドで宿主を形質転換して得られる、ヒト型FcレセプターFcγRIを発現可能な形質転換体。
【請求項6】
請求項5に記載の形質転換体を用いた、ヒト型FcレセプターFcγRIの製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2011−97898(P2011−97898A)
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願番号】特願2009−256180(P2009−256180)
【出願日】平成21年11月9日(2009.11.9)
【出願人】(000173762)公益財団法人相模中央化学研究所 (151)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願日】平成21年11月9日(2009.11.9)
【出願人】(000173762)公益財団法人相模中央化学研究所 (151)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

