組織からの幹細胞回収効率を上げるための細胞死抑制薬剤の利用
【課題】哺乳動物の遺体から幹細胞を採取する方法を提供する。
【解決手段】死後24時間以上経過した哺乳動物の遺体の移植細胞採取部位の体温が4℃〜37℃、特に4℃〜25℃である遺体の幹細胞、特に間葉系幹細胞、造血幹細胞、神経幹細胞、肝幹細胞、筋幹細胞および脂肪幹細胞からなる群から選ばれる少なくとも一種である幹細胞を含む組織を取り出し、該組織から幹細胞を分離し、該幹細胞をアポトーシス阻害剤、特にカスベースインヒビターで処理することを特徴とする幹細胞を調製する方法。
【解決手段】死後24時間以上経過した哺乳動物の遺体の移植細胞採取部位の体温が4℃〜37℃、特に4℃〜25℃である遺体の幹細胞、特に間葉系幹細胞、造血幹細胞、神経幹細胞、肝幹細胞、筋幹細胞および脂肪幹細胞からなる群から選ばれる少なくとも一種である幹細胞を含む組織を取り出し、該組織から幹細胞を分離し、該幹細胞をアポトーシス阻害剤、特にカスベースインヒビターで処理することを特徴とする幹細胞を調製する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒトの遺体から幹細胞を取り出す技術に関し、特に非冷凍保存条件下で24時間以上経過した遺体から幹細胞を調製する方法に関する。
【背景技術】
【0002】
幹細胞は、細胞移植治療や人工皮膚、人工臓器構築、あるいは疾患の治療のための有用な材料である。
【0003】
これまで組織から幹細胞を採取する場合には、組織切片を切り出してすぐ細胞抽出操作を行っていた。またそれが不可能な場合は出来るかぎり早く組織を氷冷するか、または凍結することが必要と考えられていた(非特許文献1〜3)。特に、幹細胞の採取対象が遺体の場合には、遺体全体を死後ただちに冷蔵するか、組織を切り出して凍結していた。このような処置を献体者の死後すみやかに行う事は、遺族感情や病院の体制からして実施困難である。従って、少数の実験的な試みを除き、遺体からの幹細胞の回収は行われていないのが実情である。
【非特許文献1】Palmer, T. D., Schwartz, P. H., Taupin, P., Kaspar, B., Stein, S. A., Gage, F. H. 2001. Progenitor cells from human brain after death. Nature 411: 42-43.
【非特許文献2】Dietrich, J., Noble, M., and Mayer-Proschel, M. 2002. Charactererization of A2B5+ glialprecursor cells from cryopreserved human fetal brain progenitor cells. Glia 40: 65-77.
【非特許文献3】Xu, Y., Kimura, K., Matsumoto, N., and Ide, C. 2003. Isolation of neural stem cells from the forebrain of deceased early postnatal and adult rats with protracted post-mortem intervals. J. Neurosci. Res. 74: 533-540.
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明は、ヒトの遺体から効率的に幹細胞を調製する技術を確立することを目的とし、特に、死後24時間以内に幹細胞が存在する部位において室温程度あるいはそれ以上の温度下に比較的長時間放置された遺体から幹細胞を調製する技術を提供することを目的とする。
【課題を解決するための手段】
【0005】
遺体は、死後24時間経過すると火葬が許可され、幹細胞の取得も許容される。
【0006】
従来、遺体からの幹細胞の取得のためには、死後直ちに遺体を冷却あるいは凍結することが必要と考えられていた。
【0007】
本発明者は、遺体からの死後24時間以上経過後の幹細胞の取得を試み、遺体の移植細胞採取部位の体温が4℃〜37℃の範囲であれば、死後24時間経過後であっても、アポトーシス阻害剤で幹細胞を処理することにより、十分な量の幹細胞が得られることを見出し、本発明を完成した。
【0008】
本発明は、以下の幹細胞の調製方法に関する。
1. 死後24時間以上経過した哺乳動物の遺体から幹細胞を含む組織を取り出し、該組織から幹細胞を分離し、該幹細胞をアポトーシス阻害剤で処理することを特徴とする幹細胞を調製する方法。
2. 死後24時間の遺体の被移植部位の体温が4℃〜37℃程度である、項1に記載の方法。
3. 死後24時間の遺体の移植細胞採取部位の平均体温が4℃〜25℃程度である、請求項1に記載の方法。
4. アポトーシス阻害剤がカスペースインヒビターであることを特徴とする、項1〜3のいずれかに記載の方法。
5. 幹細胞が、間葉系幹細胞、造血幹細胞、神経幹細胞、肝幹細胞、筋幹細胞および脂肪幹細胞からなる群から選ばれる少なくとも1種である、項1〜4のいずれかに記載の方法。
【発明の効果】
【0009】
ヒトの遺体の特に幹細胞を採取可能な部位は、死後24時間以上の期間、0℃あるいはそれ以下の温度に冷却されることは稀であり、通常室温あるいは4〜25℃程度の温度下におかれることが多く、遺体、特に被移植部位の温度は、死亡直後の36〜37℃前後の温度から徐々に下降し、24時間後には、4〜20℃程度に低下することが多い。このような遺体であっても、本発明によれば死後24時間経過後に幹細胞を取得することができる。
【発明を実施するための最良の形態】
【0010】
個体の死と細胞の死は必ずしも同期しない。遺体の細胞全てが心臓停止後ただちに死滅するわけではない。それどころか、ほとんどの細胞は血流停止後も生きている。循環が停止した体内で酸素が欠乏し体液の酸性度が上昇する過程で、組織の細胞は慚減的に死滅してゆく。細胞死は代謝が活発な細胞ほど早く起こり、代謝的に不活発な細胞は比較的長生きする。幹細胞は代謝的に不活発な細胞であるため、遺体の組織内でも長く生存している可能性がある。この場合の細胞死はアポトーシスと呼ばれる、一種の細胞自殺の過程を経る。すなわち、細胞に内在する酵素(カスペースの名前で知られる一群のタンパク質分解酵素群が主となる)が、積極的に自身の細胞の分解を行う。本発明は、こうしたアポトーシスに関わる酵素群を特異的阻害剤で抑制することによってアポトーシスの進行を阻害し、遺体もしくは生体から切り出した組織片から幹細胞を回収する効率を飛躍的に高めることができる。
【0011】
本発明において、遺体からの幹細胞を含む組織の取り出しは、死後(心臓死の後)24時間以上経過後、好ましくは死後48時間内に行われる。得られた幹細胞を含む組織から、常法に従い、幹細胞を分離し、得られた幹細胞をアポトーシス阻害剤で処理する。
【0012】
哺乳動物としては、ヒト、サル、ウシ、ウマ、ブタ、イヌ、マウス、ラット等が挙げられ、好ましくはヒトである。
【0013】
幹細胞を含む組織としては、骨髄(造血幹細胞、間葉系幹細胞)、脳(神経幹細胞)、脂肪組織(脂肪幹細胞)、肝臓(肝幹細胞)、筋肉(筋幹細胞)などが挙げられる。好ましい組織ないし臓器は、脳、骨髄、筋肉である。
【0014】
幹細胞としては、間葉系幹細胞、造血幹細胞、神経幹細胞、肝幹細胞、筋幹細胞、脂肪幹細胞などが挙げられる。好ましい幹細胞は、神経幹細胞、間葉系幹細胞、造血幹細胞、筋幹細胞、脂肪幹細胞である。
【0015】
アポトーシス阻害剤としては、カスペースインヒビター、p53インヒビター、Bcl2ファミリーなどが挙げられ、好ましいアポトーシス阻害剤はカスペースインヒビターである。
【0016】
カスペースインヒビターとしては、細胞膜透過合成ペプチドZ-VAD-FMK、Z-WEHD-FMK、Z-VDVAD-FMK、Z-DEVD-FMK、Z-YVAD-FMK、Z-VEID-FMK、Z-IETD-FMK、Z-LEHD-FMK、Z-AEVD-FMK、Z-LEED-FMKなどが挙げられるが、これらに限定されず、カスペースを阻害するものが広く包含される。
【0017】
カスペースインヒビターは常法に従い使用可能であるが、その使用濃度は、通常1〜10μM程度である。
【0018】
本発明で幹細胞を取得するための遺体は、霊安室(通常10〜20℃)、あるいは棺の中でドライアイスで冷却されることがあるが、その幹細胞を含む組織の温度は、このような条件下で4〜37℃程度の範囲内にある。遺体の体温は死亡直後が最も高く37℃程度であり、その後、徐々に低下して、死後24時間後には4〜20℃程度の温度になる。このような体温を有する遺体であれば、本発明の方法により十分な量の幹細胞を取得することができる。
【0019】
本発明の好ましい実施形態において、幹細胞を取得する組織の死後の平均温度は、4〜25℃、好ましくは4〜15℃である。該組織の死後の平均温度が、4〜25℃であれば、死後24時間〜48時間、好ましくは死後24時間〜44時間、より好ましくは死後24時間〜40時間、特に死後24時間〜36時間以内であれば、十分な量の幹細胞を得ることができる。
【0020】
例えば幹細胞として、神経幹細胞を採取した場合、該当神経幹細胞は、パーキンソン病、アルツハイマー病、多発性硬化症などの中枢神経変性疾患の治療に有用である。また、脳挫傷や脊椎損傷のような外傷性中枢神経損傷や、脳硬塞や脳溢血のような虚血性脳疾患により損傷した部位の治療にも有効である。
【0021】
また、間葉系幹細胞を採取した場合には、適切な分化刺激を与える事により、人工骨のコーティング、移植用軟骨組織の形成、人工腎臓の構成細胞の材料として用いる事ができる他、糖尿病の治療に用いる事ができる。造血幹細胞を採取した場合には、白血病治療のための骨髄移植代用細胞としての用途の他、これまで骨髄の提供者数が十分ではなかったため治療の機会を与えられなかった、血液感染症(AIDSやB型肝炎等)さらに自己免疫疾患(リューマチ、過敏性大腸炎、全身性エリテマトーデス等)の根本治療に使う事ができる。また、筋幹細胞や脂肪幹細胞などは、体の欠損部位の補修に用いることができる他、人工臓器あるいは人工皮膚の作製、心筋梗塞などの治療に有用である。また、幹細胞としてはいまだ同定されていないが、皮膚にも幹細胞様の細胞が存在する事が示唆されており、本発明の手法を用いる事により、遺体から人工皮膚作製用の細胞を採取する際に、その回収効率を大幅に引き上げることができる可能性がある。
【0022】
以上列記した移植医療用細胞としての用途の他に、ヒト由来の幹細胞は、人工環境下で分化刺激を加える事により各種の正常細胞に誘導分化させる事ができる。このようなヒト正常細胞を用いれば、各種医薬品の安全性評価をこれまでより簡単、安価かつ迅速に行う事ができるようになる。
【実施例】
【0023】
以下、本発明を実施例に基づきより詳細に説明するが、本発明がこれら実施例に限定されないことはいうまでもない。
実施例1
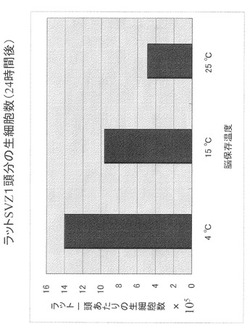
生後7日齢のSprague-Dawley系統ラット(P7ラット)を用いて実験を行った。安楽死させたラットより全脳を摘出して生理食塩水で洗い、脳保存液{MEM-HEPES、0.6% glucose、penicillin-streptomycin (100 U/ml)}に浸潤した。脳の保存温度は4℃、15℃、25℃に設定した。それぞれ、冷蔵、冬場の室温、真夏の室温を想定して決定した。保存時間は、日本アイバンクの指針に基づき、夏場の遺体からの角膜採取の限界である6時間より開始して、24時間、48時間と3点を取った。10 cmシャーレに生理食塩水を入れ、この中で保存しておいた脳から脳室壁下帯領域(SVZ)を切り出した。切り出したSVZを荒くほぐした後、トリプシン液{DMEM/F-12 medium containing x1 B27 supplement, 5 mM HEPES (pH 7.4), penicillin (100 U/ml), streptomycin (100 U/ml), plasmocin(25 ng/ml), 0.6% glucose, trypsin(1.3 mg/ml), hyaluronidase (0.7 mg/ml), DNase I (0.004%) and kynarenicacid (0.2 mg/ml)}中で37℃、10分間反応させた。反応後、等量のトリプシン阻害剤(大豆由来、0.7 mg/ml)を加えて反応を止めた。さらにピペッティングで単細胞まで分離した後、細胞を洗い、一頭分の脳室壁下帯領域あたり10 mlの神経幹細胞培地{DMEM/F-12 medium containing, x1 B27 supplement, 5 mM HEPES (pH 7.4), penicillin (100 U/ml), streptomycin (100 U/ml), plasmocin (25 ng/ml), 0.6% glucose and EGF (20 ng/ml)}に懸濁したのちに生細胞数をTrypan Blue染色法を用いて血球検査板で計測した。死後24時間後でも4℃、15℃、25℃に保存した脳に充分量の生細胞数が存在していることが分かった(図1)。
生細胞計測後の細胞懸濁液10 mlを6ウエルプレートに播種した。培養は37℃、5% 炭酸ガス、20%酸素で行った。培養開始10日後に生成した神経幹細胞/神経前駆細胞塊(ニューロスフェア)の個数を計測した。その結果、4℃保存の場合、死後24時間までは顕著な生成率の変化は無く、48時間後でも死後6時間後比27%のニューロスフェア生成効率を得た。これに対し、15℃保存の場合におけるニューロスフェア生成効率は、24時間後で9.4%、48時間後では2.7%に低下した。25℃保存では24時間後で2.1%であり、48時間後ではニューロスフェアの生成は見られなかった(図2A〜図2C)。 カスペース阻害剤添加実験は以下のように行った。カスペース阻害剤 {Caspase Inhibitors; Z-VAD-FMK (general caspaseinhibitor), Z-WEHD-FMK (caspase-1 inhibitor), Z-VDVAD-FMK (caspase-2 inhibitor), Z-DEVD-FMK (caspase-3 inhibitor), Z-YVAD-FMK (caspase-4 inhibitor), Z-VEID-FMK (caspase-6 inhibitor), Z-IETD-FMK (caspase-8 inhibitor), Z-LEHD-FMK (caspase-9 inhibitor), Z-AEVD-FMK (caspase-10 inhibitor), Z-LEED-FMK (caspase-13 inhibitor)} 以上はすべてR&D Systemsより購入した。カスペース阻害剤は 20% DMSO と0.8% BSAを含む生理食塩水で溶解させて2 mM溶液としたのち、これを1000倍希釈して最終濃度2μMで用いた。カスペース阻害剤は脳保存液にも神経幹細胞培地にも添加した。コントロール系には溶媒のみ加えた。15℃で24時間、脳を保存した後、SVZの細胞懸濁液を調製し、5日後に生成して来るニューロスフェアの数を計測した結果、Z-VDVAD-FMK、Z-DEVD-FMK、Z-YVAD-FMK、Z-IETD-FMKの添加によって顕著な効果が見られた(図3)。特に、caspase-8のInhibitorであるZ-IETD-FMKの添加によって、収量がコントロールの2.8倍に増加した。
【図面の簡単な説明】
【0024】
【図1】ラットSVZ1頭分の生細胞数(24時間後、4℃、15℃、25℃で脳を保存)を示す。
【図2A】ラットSVZ1頭分(6、24、48時間、4℃で脳を保存)より生成したニューロスフェア出現効率を示す。
【図2B】ラットSVZ1頭分(6、24、48時間、15℃で脳を保存)より生成したニューロスフェア出現効率を示す。
【図2C】ラットSVZ1頭分(6、24、48時間、25℃で脳を保存)より生成したニューロスフェア出現効率を示す。
【図3】カスペースンヒビター(2μM)添加によるラットSVZ一頭あたり(24時間15℃で脳を保存)のニューロスフェア出現効率の改善を示す。
【技術分野】
【0001】
本発明は、ヒトの遺体から幹細胞を取り出す技術に関し、特に非冷凍保存条件下で24時間以上経過した遺体から幹細胞を調製する方法に関する。
【背景技術】
【0002】
幹細胞は、細胞移植治療や人工皮膚、人工臓器構築、あるいは疾患の治療のための有用な材料である。
【0003】
これまで組織から幹細胞を採取する場合には、組織切片を切り出してすぐ細胞抽出操作を行っていた。またそれが不可能な場合は出来るかぎり早く組織を氷冷するか、または凍結することが必要と考えられていた(非特許文献1〜3)。特に、幹細胞の採取対象が遺体の場合には、遺体全体を死後ただちに冷蔵するか、組織を切り出して凍結していた。このような処置を献体者の死後すみやかに行う事は、遺族感情や病院の体制からして実施困難である。従って、少数の実験的な試みを除き、遺体からの幹細胞の回収は行われていないのが実情である。
【非特許文献1】Palmer, T. D., Schwartz, P. H., Taupin, P., Kaspar, B., Stein, S. A., Gage, F. H. 2001. Progenitor cells from human brain after death. Nature 411: 42-43.
【非特許文献2】Dietrich, J., Noble, M., and Mayer-Proschel, M. 2002. Charactererization of A2B5+ glialprecursor cells from cryopreserved human fetal brain progenitor cells. Glia 40: 65-77.
【非特許文献3】Xu, Y., Kimura, K., Matsumoto, N., and Ide, C. 2003. Isolation of neural stem cells from the forebrain of deceased early postnatal and adult rats with protracted post-mortem intervals. J. Neurosci. Res. 74: 533-540.
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明は、ヒトの遺体から効率的に幹細胞を調製する技術を確立することを目的とし、特に、死後24時間以内に幹細胞が存在する部位において室温程度あるいはそれ以上の温度下に比較的長時間放置された遺体から幹細胞を調製する技術を提供することを目的とする。
【課題を解決するための手段】
【0005】
遺体は、死後24時間経過すると火葬が許可され、幹細胞の取得も許容される。
【0006】
従来、遺体からの幹細胞の取得のためには、死後直ちに遺体を冷却あるいは凍結することが必要と考えられていた。
【0007】
本発明者は、遺体からの死後24時間以上経過後の幹細胞の取得を試み、遺体の移植細胞採取部位の体温が4℃〜37℃の範囲であれば、死後24時間経過後であっても、アポトーシス阻害剤で幹細胞を処理することにより、十分な量の幹細胞が得られることを見出し、本発明を完成した。
【0008】
本発明は、以下の幹細胞の調製方法に関する。
1. 死後24時間以上経過した哺乳動物の遺体から幹細胞を含む組織を取り出し、該組織から幹細胞を分離し、該幹細胞をアポトーシス阻害剤で処理することを特徴とする幹細胞を調製する方法。
2. 死後24時間の遺体の被移植部位の体温が4℃〜37℃程度である、項1に記載の方法。
3. 死後24時間の遺体の移植細胞採取部位の平均体温が4℃〜25℃程度である、請求項1に記載の方法。
4. アポトーシス阻害剤がカスペースインヒビターであることを特徴とする、項1〜3のいずれかに記載の方法。
5. 幹細胞が、間葉系幹細胞、造血幹細胞、神経幹細胞、肝幹細胞、筋幹細胞および脂肪幹細胞からなる群から選ばれる少なくとも1種である、項1〜4のいずれかに記載の方法。
【発明の効果】
【0009】
ヒトの遺体の特に幹細胞を採取可能な部位は、死後24時間以上の期間、0℃あるいはそれ以下の温度に冷却されることは稀であり、通常室温あるいは4〜25℃程度の温度下におかれることが多く、遺体、特に被移植部位の温度は、死亡直後の36〜37℃前後の温度から徐々に下降し、24時間後には、4〜20℃程度に低下することが多い。このような遺体であっても、本発明によれば死後24時間経過後に幹細胞を取得することができる。
【発明を実施するための最良の形態】
【0010】
個体の死と細胞の死は必ずしも同期しない。遺体の細胞全てが心臓停止後ただちに死滅するわけではない。それどころか、ほとんどの細胞は血流停止後も生きている。循環が停止した体内で酸素が欠乏し体液の酸性度が上昇する過程で、組織の細胞は慚減的に死滅してゆく。細胞死は代謝が活発な細胞ほど早く起こり、代謝的に不活発な細胞は比較的長生きする。幹細胞は代謝的に不活発な細胞であるため、遺体の組織内でも長く生存している可能性がある。この場合の細胞死はアポトーシスと呼ばれる、一種の細胞自殺の過程を経る。すなわち、細胞に内在する酵素(カスペースの名前で知られる一群のタンパク質分解酵素群が主となる)が、積極的に自身の細胞の分解を行う。本発明は、こうしたアポトーシスに関わる酵素群を特異的阻害剤で抑制することによってアポトーシスの進行を阻害し、遺体もしくは生体から切り出した組織片から幹細胞を回収する効率を飛躍的に高めることができる。
【0011】
本発明において、遺体からの幹細胞を含む組織の取り出しは、死後(心臓死の後)24時間以上経過後、好ましくは死後48時間内に行われる。得られた幹細胞を含む組織から、常法に従い、幹細胞を分離し、得られた幹細胞をアポトーシス阻害剤で処理する。
【0012】
哺乳動物としては、ヒト、サル、ウシ、ウマ、ブタ、イヌ、マウス、ラット等が挙げられ、好ましくはヒトである。
【0013】
幹細胞を含む組織としては、骨髄(造血幹細胞、間葉系幹細胞)、脳(神経幹細胞)、脂肪組織(脂肪幹細胞)、肝臓(肝幹細胞)、筋肉(筋幹細胞)などが挙げられる。好ましい組織ないし臓器は、脳、骨髄、筋肉である。
【0014】
幹細胞としては、間葉系幹細胞、造血幹細胞、神経幹細胞、肝幹細胞、筋幹細胞、脂肪幹細胞などが挙げられる。好ましい幹細胞は、神経幹細胞、間葉系幹細胞、造血幹細胞、筋幹細胞、脂肪幹細胞である。
【0015】
アポトーシス阻害剤としては、カスペースインヒビター、p53インヒビター、Bcl2ファミリーなどが挙げられ、好ましいアポトーシス阻害剤はカスペースインヒビターである。
【0016】
カスペースインヒビターとしては、細胞膜透過合成ペプチドZ-VAD-FMK、Z-WEHD-FMK、Z-VDVAD-FMK、Z-DEVD-FMK、Z-YVAD-FMK、Z-VEID-FMK、Z-IETD-FMK、Z-LEHD-FMK、Z-AEVD-FMK、Z-LEED-FMKなどが挙げられるが、これらに限定されず、カスペースを阻害するものが広く包含される。
【0017】
カスペースインヒビターは常法に従い使用可能であるが、その使用濃度は、通常1〜10μM程度である。
【0018】
本発明で幹細胞を取得するための遺体は、霊安室(通常10〜20℃)、あるいは棺の中でドライアイスで冷却されることがあるが、その幹細胞を含む組織の温度は、このような条件下で4〜37℃程度の範囲内にある。遺体の体温は死亡直後が最も高く37℃程度であり、その後、徐々に低下して、死後24時間後には4〜20℃程度の温度になる。このような体温を有する遺体であれば、本発明の方法により十分な量の幹細胞を取得することができる。
【0019】
本発明の好ましい実施形態において、幹細胞を取得する組織の死後の平均温度は、4〜25℃、好ましくは4〜15℃である。該組織の死後の平均温度が、4〜25℃であれば、死後24時間〜48時間、好ましくは死後24時間〜44時間、より好ましくは死後24時間〜40時間、特に死後24時間〜36時間以内であれば、十分な量の幹細胞を得ることができる。
【0020】
例えば幹細胞として、神経幹細胞を採取した場合、該当神経幹細胞は、パーキンソン病、アルツハイマー病、多発性硬化症などの中枢神経変性疾患の治療に有用である。また、脳挫傷や脊椎損傷のような外傷性中枢神経損傷や、脳硬塞や脳溢血のような虚血性脳疾患により損傷した部位の治療にも有効である。
【0021】
また、間葉系幹細胞を採取した場合には、適切な分化刺激を与える事により、人工骨のコーティング、移植用軟骨組織の形成、人工腎臓の構成細胞の材料として用いる事ができる他、糖尿病の治療に用いる事ができる。造血幹細胞を採取した場合には、白血病治療のための骨髄移植代用細胞としての用途の他、これまで骨髄の提供者数が十分ではなかったため治療の機会を与えられなかった、血液感染症(AIDSやB型肝炎等)さらに自己免疫疾患(リューマチ、過敏性大腸炎、全身性エリテマトーデス等)の根本治療に使う事ができる。また、筋幹細胞や脂肪幹細胞などは、体の欠損部位の補修に用いることができる他、人工臓器あるいは人工皮膚の作製、心筋梗塞などの治療に有用である。また、幹細胞としてはいまだ同定されていないが、皮膚にも幹細胞様の細胞が存在する事が示唆されており、本発明の手法を用いる事により、遺体から人工皮膚作製用の細胞を採取する際に、その回収効率を大幅に引き上げることができる可能性がある。
【0022】
以上列記した移植医療用細胞としての用途の他に、ヒト由来の幹細胞は、人工環境下で分化刺激を加える事により各種の正常細胞に誘導分化させる事ができる。このようなヒト正常細胞を用いれば、各種医薬品の安全性評価をこれまでより簡単、安価かつ迅速に行う事ができるようになる。
【実施例】
【0023】
以下、本発明を実施例に基づきより詳細に説明するが、本発明がこれら実施例に限定されないことはいうまでもない。
実施例1
生後7日齢のSprague-Dawley系統ラット(P7ラット)を用いて実験を行った。安楽死させたラットより全脳を摘出して生理食塩水で洗い、脳保存液{MEM-HEPES、0.6% glucose、penicillin-streptomycin (100 U/ml)}に浸潤した。脳の保存温度は4℃、15℃、25℃に設定した。それぞれ、冷蔵、冬場の室温、真夏の室温を想定して決定した。保存時間は、日本アイバンクの指針に基づき、夏場の遺体からの角膜採取の限界である6時間より開始して、24時間、48時間と3点を取った。10 cmシャーレに生理食塩水を入れ、この中で保存しておいた脳から脳室壁下帯領域(SVZ)を切り出した。切り出したSVZを荒くほぐした後、トリプシン液{DMEM/F-12 medium containing x1 B27 supplement, 5 mM HEPES (pH 7.4), penicillin (100 U/ml), streptomycin (100 U/ml), plasmocin(25 ng/ml), 0.6% glucose, trypsin(1.3 mg/ml), hyaluronidase (0.7 mg/ml), DNase I (0.004%) and kynarenicacid (0.2 mg/ml)}中で37℃、10分間反応させた。反応後、等量のトリプシン阻害剤(大豆由来、0.7 mg/ml)を加えて反応を止めた。さらにピペッティングで単細胞まで分離した後、細胞を洗い、一頭分の脳室壁下帯領域あたり10 mlの神経幹細胞培地{DMEM/F-12 medium containing, x1 B27 supplement, 5 mM HEPES (pH 7.4), penicillin (100 U/ml), streptomycin (100 U/ml), plasmocin (25 ng/ml), 0.6% glucose and EGF (20 ng/ml)}に懸濁したのちに生細胞数をTrypan Blue染色法を用いて血球検査板で計測した。死後24時間後でも4℃、15℃、25℃に保存した脳に充分量の生細胞数が存在していることが分かった(図1)。
生細胞計測後の細胞懸濁液10 mlを6ウエルプレートに播種した。培養は37℃、5% 炭酸ガス、20%酸素で行った。培養開始10日後に生成した神経幹細胞/神経前駆細胞塊(ニューロスフェア)の個数を計測した。その結果、4℃保存の場合、死後24時間までは顕著な生成率の変化は無く、48時間後でも死後6時間後比27%のニューロスフェア生成効率を得た。これに対し、15℃保存の場合におけるニューロスフェア生成効率は、24時間後で9.4%、48時間後では2.7%に低下した。25℃保存では24時間後で2.1%であり、48時間後ではニューロスフェアの生成は見られなかった(図2A〜図2C)。 カスペース阻害剤添加実験は以下のように行った。カスペース阻害剤 {Caspase Inhibitors; Z-VAD-FMK (general caspaseinhibitor), Z-WEHD-FMK (caspase-1 inhibitor), Z-VDVAD-FMK (caspase-2 inhibitor), Z-DEVD-FMK (caspase-3 inhibitor), Z-YVAD-FMK (caspase-4 inhibitor), Z-VEID-FMK (caspase-6 inhibitor), Z-IETD-FMK (caspase-8 inhibitor), Z-LEHD-FMK (caspase-9 inhibitor), Z-AEVD-FMK (caspase-10 inhibitor), Z-LEED-FMK (caspase-13 inhibitor)} 以上はすべてR&D Systemsより購入した。カスペース阻害剤は 20% DMSO と0.8% BSAを含む生理食塩水で溶解させて2 mM溶液としたのち、これを1000倍希釈して最終濃度2μMで用いた。カスペース阻害剤は脳保存液にも神経幹細胞培地にも添加した。コントロール系には溶媒のみ加えた。15℃で24時間、脳を保存した後、SVZの細胞懸濁液を調製し、5日後に生成して来るニューロスフェアの数を計測した結果、Z-VDVAD-FMK、Z-DEVD-FMK、Z-YVAD-FMK、Z-IETD-FMKの添加によって顕著な効果が見られた(図3)。特に、caspase-8のInhibitorであるZ-IETD-FMKの添加によって、収量がコントロールの2.8倍に増加した。
【図面の簡単な説明】
【0024】
【図1】ラットSVZ1頭分の生細胞数(24時間後、4℃、15℃、25℃で脳を保存)を示す。
【図2A】ラットSVZ1頭分(6、24、48時間、4℃で脳を保存)より生成したニューロスフェア出現効率を示す。
【図2B】ラットSVZ1頭分(6、24、48時間、15℃で脳を保存)より生成したニューロスフェア出現効率を示す。
【図2C】ラットSVZ1頭分(6、24、48時間、25℃で脳を保存)より生成したニューロスフェア出現効率を示す。
【図3】カスペースンヒビター(2μM)添加によるラットSVZ一頭あたり(24時間15℃で脳を保存)のニューロスフェア出現効率の改善を示す。
【特許請求の範囲】
【請求項1】
死後24時間以上経過した哺乳動物の遺体から幹細胞を含む組織を取り出し、該組織から幹細胞を分離し、該幹細胞をアポトーシス阻害剤で処理することを特徴とする幹細胞を調製する方法。
【請求項2】
死後24時間の遺体の移植細胞採取部位の体温が4℃〜37℃程度の範囲内である、請求項1に記載の方法。
【請求項3】
死後24時間の遺体の移植細胞採取部位の平均体温が4℃〜25℃程度である、請求項1に記載の方法。
【請求項4】
アポトーシス阻害剤がカスペースインヒビターであることを特徴とする、請求項1〜3のいずれかに記載の方法。
【請求項5】
幹細胞が、間葉系幹細胞、造血幹細胞、神経幹細胞、肝幹細胞、筋幹細胞および脂肪幹細胞からなる群から選ばれる少なくとも1種である、請求項1〜4のいずれかに記載の方法。
【請求項1】
死後24時間以上経過した哺乳動物の遺体から幹細胞を含む組織を取り出し、該組織から幹細胞を分離し、該幹細胞をアポトーシス阻害剤で処理することを特徴とする幹細胞を調製する方法。
【請求項2】
死後24時間の遺体の移植細胞採取部位の体温が4℃〜37℃程度の範囲内である、請求項1に記載の方法。
【請求項3】
死後24時間の遺体の移植細胞採取部位の平均体温が4℃〜25℃程度である、請求項1に記載の方法。
【請求項4】
アポトーシス阻害剤がカスペースインヒビターであることを特徴とする、請求項1〜3のいずれかに記載の方法。
【請求項5】
幹細胞が、間葉系幹細胞、造血幹細胞、神経幹細胞、肝幹細胞、筋幹細胞および脂肪幹細胞からなる群から選ばれる少なくとも1種である、請求項1〜4のいずれかに記載の方法。
【図1】


【図2A】


【図2B】


【図2C】


【図3】




【図2A】


【図2B】


【図2C】


【図3】


【公開番号】特開2007−166927(P2007−166927A)
【公開日】平成19年7月5日(2007.7.5)
【国際特許分類】
【出願番号】特願2005−365468(P2005−365468)
【出願日】平成17年12月19日(2005.12.19)
【出願人】(300061835)財団法人先端医療振興財団 (28)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成19年7月5日(2007.7.5)
【国際特許分類】
【出願日】平成17年12月19日(2005.12.19)
【出願人】(300061835)財団法人先端医療振興財団 (28)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

