組織の処理方法
組織を処理する方法が提供される。幾つかの実施形態では、その方法に、組織試料に高静水圧を加えることにより組織試料を脱細胞化する方法が含まれる。幾つかの実施形態では、その方法に、組織試料に高静水圧を加えることにより、組織試料を解凍する方法および/または試料中のバイオバーデンを減少させる方法が含まれる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、組織の処理方法に関するものである。本出願は、35U.S.C.§119に基づき、2009年8月18日に出願された米国仮特許出願第61/234,681号に対して優先権を主張する。
【背景技術】
【0002】
人間と動物の組織は、患者に使用する様々な組織製品を製造するために使用することができる。組織は、多くの場合、特定の細胞および/または非細胞成分を取り除くために、かつ/または組織に存在する病原体を破壊するために、処理される。また、処理または保管中、組織は冷凍および解凍されることもある。
【発明の概要】
【0003】
ある実施形態によれば、組織試料を脱細胞化する方法が提供され、その方法が、哺乳類の軟組織を有する組織試料を液体中に与えるステップと、軟組織に含まれるネイティブ組織細胞の実質的にすべてを破壊するのに十分な時間、少なくとも200MPaの圧力を上記液体に加えるステップとを備え、細胞の実質的にすべてを破壊するステップが、生理食塩水中で組織試料を洗浄することによりネイティブ組織細胞の少なくとも95%の除去が可能となるように、細胞の細胞膜を破壊するステップを含む。
【0004】
ある実施形態によれば、組織試料を解凍する方法が提供され、その方法が、少なくとも部分的に凍結した哺乳類組織を含む組織試料を液体中に与えるステップと、凍結した組織試料を解凍するのに十分な圧力を前記液体に加えるステップとを備える。
【0005】
ある実施形態によれば、組織試料を脱細胞化する方法が提供され、その方法が、哺乳類組織を含む組織試料を、液体を含むコンテナ内に与えるステップと、軟組織に含まれる細胞の実質的にすべてが破壊されるのに十分な時間、前記液体に圧力を加えるステップとを備え、細胞の実質的にすべてを破壊するステップが、生理食塩水中で組織試料を洗浄することによりネイティブ組織細胞の少なくとも95%の除去が可能となるように、細胞の細胞膜を破壊するステップを含み、組織試料の温度が30℃を超えないような速度で圧力が加えられる。
【0006】
ある実施形態によれば、組織試料におけるバイオバーデンを減少させる方法が提供され、その方法が、哺乳類の軟組織を含む組織試料を、液体を含むコンテナ内に与えるステップと、軟組織内の細菌濃度を少なくとも5log(対数)減少させるのに十分な時間、前記液体に圧力を加えるステップとを備え、圧力を加えている間、組織試料の温度が30℃を超えないものとなっている。
【図面の簡単な説明】
【0007】
【図1】図1は、水の状態図である。
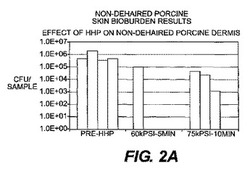
【図2】図2Aは、実験1で説明される、ブタの皮膚全体の試料に対するバイオバーデン試験の結果データである。図2Bは、実験1で説明される、ブタの真皮に対するバイオバーデン試験の結果データである。
【図3】図3は、実験2で説明される、ブタの真皮に対するバイオバーデン試験の結果データである。
【図4】図4は、実験1および2の試料についての温度対圧力プロファイル曲線である。
【発明を実施するための形態】
【0008】
ここで、本開示に係る例示的な実施形態を詳細に述べることとする。その実施例は、添付図面に示されている。同じ部分または同様の部分を指すものとして、同じ符号を可能な限り図面全体に亘って使用することとする。
【0009】
本出願においては、単数形の使用は、特に記載しない限りは、複数を含む。本出願では、“または”の使用は、特に記載がない限りは、“および/または”を意味する。また、用語“含んでいる(including)”の使用は、“含む(includes)”および“含まれる(included)”のようなその他の形式と同様に、制限的なものではない。本明細書に記載の任意の範囲は、両端点およびそれら端点間のすべての値を含むものとみなされる。
【0010】
本明細書に記載の“高静水圧”は、液体に含まれる対象物に加えられる圧力を指すものとみなされ、ここで、液体は、対象物に力を与えるために加圧されるものである。ある実施形態では、“高静水圧”が、200MPaよりも大きい、液体に加えられる圧力を含むことができる。
【0011】
本明細書に使用される“バイオバーデン(bioburden)”は、組織試料中の微生物の量を意味し、その微生物には、バクテリア、ウィルス、菌類、寄生生物、クラミジア、リケッチア、マイコプラズマおよび原生動物が含まれるが、それらに限定されるものではない。
【0012】
本明細書に使用される“組織製品(tissue products)”または“組織由来製品(tissue-derived products)”は、任意の方法で(例えば、それに限定される訳ではないが、組織から細胞を除去することにより、組織から特定の化学物質を除去することにより、あるいは組織を殺菌することにより)改変された、組織から生産される任意の製品を意味する。本明細書に使用される“組織試料”は、無傷の未処理の組織と、処理されて“組織製品”または“組織由来製品”をもたらす組織の両方を含む。
【0013】
本明細書中で使用されるセクションの見出しは、単なる編成目的のものであり、記載の主題を限定するものとして解釈されるべきものではない。特許、特許出願、記事、書籍または論文に限定される訳ではないが、それらを含む本出願で引用される文献のすべてまたは一部は、如何なる目的に対しても、その全体が引用により明確に援用されるものである。
【0014】
様々な人間および動物の組織は、患者の治療用の製品を生産するために使用することができる。例えば、様々な疾病および/または構造上の損傷(例えば、外傷、手術、萎縮および/または長期間の摩擦および変性)により損傷を受けた、あるいは失われた人間の組織の再生、修復、増強、補強および/または治療のための様々な組織製品が生産されている。そのような製品には、例えば、その他の物質および/または化学物質と組み合わせて、あるいは単独で使用することができる、組織マトリクスおよび/または組織由来タンパク質またはタンパク質含有物質(例えば、グリコサミノグリカン)が含まれる。
【0015】
ある実施形態では、それら製品は、完全にまたは部分的に脱細胞化されて、患者に使用される組織マトリクスまたは細胞外組織物質を与えることができる。例えば、皮膚、腸、骨、軟骨、神経組織(例えば、神経線維または硬膜)、腱、靭帯またはその他組織のような様々な組織は、完全にまたは部分的に脱細胞化されて、患者に有用な組織製品を生産することができる。ある場合には、それら脱細胞化された製品は、外因性細胞物質(例えば、幹細胞)を加えることなく使用することができる。ある場合には、それら脱細胞化された製品は、治療を促進するために、自己またはその他の源からの細胞で播種することができる。
【0016】
ある実施形態では、組織製品がしばしば患者の体または体内に移植されるため、そのような物質を殺菌するか、あるいは選択された使用において許されるレベルまで、製品に含まれる可能性のある細菌またはその他の病原体の量を少なくとも減らすことが望ましい。ある実施形態では、様々な組織、組織由来製品およびその他の移植可能な医療デバイスが、一般に、照射(例えば、ガンマ、電子ビームまたはX線)のようなプロセス、化学物質または熱による処理を使用して殺菌される。
【0017】
様々な医療または手術応用における使用のために、組織または組織製品は、用途に応じて、所望の生物学的特性を保有する必要がある。例えば、組織再生に使用される組織製品は、一般に、細胞の内部成長および/または再生を支援または誘導することができるようにすべきである。しかしながら、特定の組織処理技術は、ある細胞に損傷を与えるか、かつ/または特定の生物学的機能に望ましい組織の一部を除去する可能性がある。例えば、ある実施形態では、組織脱細胞化プロセスは、特定の細胞の再生または成長に望ましい様々な細胞シグナル分子または細胞外マトリクスタンパク質に損傷を与えるか、または除去する可能性のある、様々な酵素、洗浄剤および/または化学物質の使用を含むことができる。また、ある実施形態では、ガンマ線照射のような殺菌技術が、そのような製品の破壊および/または化学的変質を引き起こすことにより、組織製品を変化させることがある。
【0018】
本開示は、組織試料を処理する方法であって、そのような方法を使用して生産された組織製品のある所望の生物学的特性を維持する方法を提供する。幾つかの実施形態では、上記方法は、組織試料を脱細胞化する方法を含む。ある実施形態では、上記方法は、組織試料を解凍する方法を含む。幾つかの実施形態では、上記方法は、組織試料のバイオバーデンを低減する方法を含む。
【0019】
幾つかの実施形態では、組織試料を処理する方法が、組織への高静水圧の適用を含むことができる。ある実施形態では、組織試料を液体中に置くことにより、あるいは組織を液体中に与えることにより、高静水圧を組織試料に加えることができる。ある実施形態では、圧力を液体に加えることができ、それにより、組織試料に加えられる圧力を制御することができる。様々な実施形態では、組織試料を脱細胞化し、組織試料のバイオバーデンを低減し、かつ/または組織試料を解凍するために、組織試料に加えられる圧力、圧力が加えられる時間、および/または圧力の増加率および/または減少率を制御することができる。
【0020】
様々な実施形態では、様々な因子に基づいて、組織試料に加えられる圧力を選択することができる。幾つかの実施形態では、処理される組織試料のタイプに基づいて、圧力が選択される。幾つかの実施形態では、組織試料の所望の生物学的特性を維持しながら、組織試料の脱細胞化を行うことを可能とするように、圧力が選択される。幾つかの実施形態では、選択された温度よりも高く組織試料の温度を上げることなく組織を解凍することを可能にするように、かつ/または選択された時間内に解凍することを可能にするように、圧力が選択される。
【0021】
様々な実施形態では、様々な異なる組織試料タイプを処理するために、本開示の方法を使用することができる。例示的な哺乳類の組織試料には、骨、皮膚、腸、膀胱、腱、靭帯、筋肉、筋膜、神経組織、肝臓、心臓、肺、腎臓、軟骨および/またはその他の哺乳類の組織が含まれるが、それらに限定されるものではない。ある実施形態では、組織試料に、哺乳類の軟組織試料を含むことがある。例えば、ある実施形態では、組織試料に、哺乳類の真皮を含むことがある。ある実施形態では、周囲の表皮および/または皮下脂肪のようなその他の組織から真皮を分離することができる。ある実施形態では、組織試料に、小腸粘膜下組織を含むことがある。ある実施形態では、組織試料に、ヒトまたは非ヒトの源を含むことがある。例示的で適当な非ヒト組織源には、ブタ、ヒツジ、ヤギ、ウサギ、サルおよび/またはその他のヒト以外の哺乳動物が含まれる。
【0022】
ある実施形態に係る組織試料を処理するために、様々なタイプの高静水圧利用システムを使用することができる。ある実施形態では、高静水圧利用システムが、鋼またはその他の硬質材料から形成された硬質の容器またはコンテナを含むものとなる。ある実施形態では、処理される組織試料が、流体(例えば、水)とともに容器内に置かれる。ある実施形態では、流体を含む柔軟なコンテナ内に組織試料を詰めて、その柔軟なパッケージを、流体を含む容器内に置くようにしてもよい。ある実施形態では、容器に組織試料と流体を入れた後に、容器内の流体に圧力が加えられる。ある実施形態では、様々な方法で圧力を加えることができる。例えば、ある実施形態では、容器内の圧力を圧縮するために空気圧式のピストンを使用して圧力を加えることができ、あるいは容器内の圧力が所望のレベルに達するまで、ポンプが追加の流体を容器内に押し込むことができる。
【0023】
ある実施形態では、液体を含む柔軟なコンテナ内に組織試料が詰められて、そのコンテナに圧力が加えられる。幾つかの実施形態では、液体を含む硬質な加圧コンテナ内に組織試料が置かれて、その硬質なコンテナ内の液体に圧力が加えられる。幾つかの実施形態では、液体を含む柔軟なコンテナ内に組織試料が詰められるとともに、その柔軟なコンテナが、液体を含む硬質な加圧コンテナ内に置かれて、その硬質なコンテナ内の液体に圧力が加えられる。様々な実施形態では、例えば、ピストンを使用して流体を圧縮することにより、あるいは一定の容量を有するコンテナ内に追加流体をポンプで送り込むことにより、流体に圧力を加えることができる。ある実施形態では、組織試料が柔軟なコンテナに詰められるとき、一般に、柔軟なコンテナ内部の流体のみが組織試料に接触するように柔軟なコンテナが密封される。
【0024】
高静水圧の利用中に液体と接触するために、様々な液体を使用することができる。例えば、種々の水溶液を使用することができる。ある実施形態では、液体に塩類水溶液が含まれる。ある実施形態では、液体にリン酸緩衝生理食塩水のような食塩水が含まれる。
【0025】
幾つかの実施形態では、組織試料のネイティブ組織細胞(native tissue cells)の一部または実質的にすべてを破壊するために、組織試料を処理することができる。ある実施形態では、細胞に著しい損傷を与えることのない液体(例えば、PBS)により、高静水圧で処理された組織試料を洗浄した後、試料を分析して、ネイティブ組織細胞が、存在するとしたら、どれだけ多く残存しているのかを判定することにより、ネイティブ組織細胞の破壊が完了したかどうかの判定を行うことができる。例えば、幾つかの実施形態では、高静水圧処理により細胞を破壊した後に、生理食塩水で洗うだけで、細胞の残余物を除去することができ、また、洗浄された試料を評価して、細胞が除去されて細胞の破壊を示しているかどうかを判定することができる。試料を評価して細胞が破壊および除去されているかどうかを判定する適当な方法の幾つかは、良く知られており、それには、例えば、冷凍または固定された組織細胞の光学顕微鏡検査法が含まれるが、これに限定されるものではない。ある実施形態では、DNAが存在することを示す試薬を使用して、細胞または細胞残余物の存在を評価することができる。その試薬として、例えば、PICOGREEN(登録商標)DNA定量化キットを使用することができる。
【0026】
本明細書に使用される、細胞の実質的にすべての破壊とは、これまでの組織学(例えば、光学顕微鏡検査法)を使用して評価した場合に、高静水圧で処理されて食塩水で洗浄された組織試料のネイティブ組織細胞の少なくとも95%乃至100%(両端点およびそれら端点間のすべてのパーセンテージを含む)が存在していないことを意味するとして理解されたい。
【0027】
幾つかの実施形態では、組織試料中の細胞の一部または実質的すべてを除去するために、組織試料を高静水圧で処理することができ、残りの細胞を除去するために、組織試料をその他のプロセスでさらに処理することができる。例えば、様々な実施形態では、上述したように、組織から細胞を除去するために、様々な酵素、清浄剤および/またはその他の化学物質が使用されるが、そのような処理は、組織の細胞外マトリクスを変化させる可能性がある。したがって、酵素、清浄剤および/またはその他の化学物質による処理量を減少させるために、先ず、組織試料を高静水圧処理で処理して、細胞の一部または実質的にすべてを除去し、幾らかが組織試料に存在する場合には、細胞をさらに除去するために、組織試料を少なくとも1の追加的な脱細胞プロセスでさらに処理することができる。脱細胞を行う適当な試薬および方法には、例えば、Livesey等に発行された米国特許第5,336,616号に記載のものが含まれるが、それに限定されるものではない。
【0028】
幾つかの実施形態では、無細胞組織マトリクス(acellular tissue matrix)を生成するために、組織試料を処理することができる。幾つかの実施形態では、無細胞組織マトリクスに細胞外マトリックスが含まれる。例えば、様々な実施形態では、組織マトリクスに、様々な異なる哺乳類の軟組織から得たコラーゲンマトリクスが含まれる。ある実施形態では、組織マトリクスに、1またはそれ以上の追加的な細胞外マトリクスタンパク質および/または分子が含まれ、それには、種々のGAG、細胞シグナリング分子、または細胞結合、接着、成長、分化および/またはリモデリングのような様々な生物学的機能を生じさせるのに望ましいその他の化学物質が含まれるが、それらに限定されるものではない。
【0029】
幾つかの実施形態では、組織試料を脱細胞化する方法は、液体中に哺乳類の軟組織を含む組織試料を提供するステップと、軟組織に含まれるネイティブ組織細胞の実質的にすべてを破壊するのに十分な時間、液体に圧力を加えるステップとを備える。幾つかの実施形態では、軟組織に含まれるネイティブ組織細胞の実質的にすべてを破壊する最小圧力で圧力が加えられる。様々な実施形態では、その圧力が、少なくとも200MPa、少なくとも300MPa、少なくとも400MPaまたは少なくとも500MPaである。様々な実施形態では、その圧力が、300MPaと500MPaとの間に入る。様々な実施形態では、その圧力が、軟組織に含まれるネイティブ組織細胞の実質的にすべてを破壊するのに十分な時間、加えられる。様々な実施形態では、その圧力が、少なくとも30分から少なくとも60分間加えられる。ある実施形態では、液体に加えられる圧力が、少なくとも10分間で、少なくとも400MPaである。ある実施形態では、液体に加えられる圧力が、少なくとも30分間で、少なくとも400MPaである。ある実施形態では、液体に加えられる圧力が、少なくとも30分間で、少なくとも500MPaである。様々な実施形態では、後述するように、組織試料の過度の加熱を生じることなく、脱細胞化方法が実行される。
【0030】
様々な実施形態では、本開示の方法が、組織試料の著しい加熱を生じることなく、組織試料に対して高静水圧の利用を可能にする。様々な実施形態では、ある組織試料の加熱が、様々な組織細胞外マトリクスタンパク質に損傷を与えて、組織の修復、置換または再生に使用する場合に、組織試料の所望の生物学的機能を損なう可能性がある。このため、本明細書中のある実施形態は、組織細胞外マトリクスタンパク質に損傷を与え得る温度または時間、組織試料を加熱することなく、組織の脱細胞化、組織の解凍および/または組織バイオバーデンの低減を可能にする。ある実施形態では、組織試料が30℃より高い温度に達しないような速度および最大圧力で、高静水圧が加えられる。ある実施形態では、その温度が25℃を超えない。
【0031】
ある実施形態では、静水圧容器中の加圧が、容器に含まれる物質(すなわち、液体)の断熱圧縮を引き起こし、それが、圧縮された物質の温度の上昇を引き起こす。しかしながら、ある加圧容器は、その壁を介した熱伝導を可能とし、よってそのようなシステムは、真に断熱ではない。したがって、様々な実施形態では、圧力の増加量が、圧縮速度(すなわち、圧力の増加)および容器の壁への熱伝導または容器の壁からの熱伝導に関連する。また、様々な実施形態では、容器内の水の相変化も、容器内の温度に影響を与えることがある。したがって、幾つかの実施形態では、処理容器中の圧力の増加速度を制御することにより、高静水圧で処理される試料の温度を制御することができる。
【0032】
ある実施形態では、高静水圧の適用前および/または適用中に、組織試料、加圧容器に含まれる液体および/または加圧装置を冷却することができる。幾つかの実施形態では、加圧容器に含まれる液体に氷を入れることができ、かつ/または、加圧容器の壁を冷却することができる。
【0033】
様々な実施形態では、組織の損傷、破壊および/または微生物増殖を防止するために、多くの場合、処理、移送および/または保管中に組織試料を冷凍することが望ましい。様々な実施形態では、後の処理中または使用中に、組織試料が解凍される。しかしながら、組織試料の加熱による解凍は、組織細胞外マトリクス成分に損傷を与え、かつ/または微生物増殖を促進する可能性がある。さらに、ある実施形態では、相対的に低温条件下(例えば、冷蔵、または試料中の水の凝固点のすぐ上の条件下)での組織試料の解凍が、特に大きな組織試料の場合に、時間のかかることがある。
【0034】
ある実施形態では、組織試料を解凍する方法が、少なくとも部分的に凍結した哺乳類組織を含む組織試料を液体に入れるステップと、凍結した組織試料を解凍するのに十分な圧力を液体に加えるステップとを備える。幾つかの実施形態では、限られた時間内に、かつ/または組織試料の温度の限られた上昇のみで、解凍が生じる。
【0035】
図1は水の固液相の状態図を与える。図示のように、様々な氷相の融点は、高圧で低下する。したがって、ある実施形態では、氷を含む試料に高静水圧を加えることにより、組織試料を著しく加熱することなく、固体状態の水から液体への変化を引き起こすことができる。
【0036】
様々な実施形態では、組織試料が、部分的にまたは完全に固体の状態である水(すなわち、氷)を含むことができる。様々な実施形態では、組織試料の解凍が、試料中の固体状態の水の一部または実質的すべてを液体に変化させるステップを含む。幾つかの実施形態では、凍結した組織試料の解凍が、組織試料中の固体状態の水の50%より多くに、液体状態への相変態を生じさせるステップを備える。幾つかの実施形態では、凍結した組織の解凍が、組織試料中の固体状態の水の実質的にすべてに、液体状態への相変態を生じさせるステップを備える。様々な実施形態では、試料中の氷の50%乃至100%に、液体状態への相変態を生じさせる。
【0037】
様々な実施形態では、高静水圧処理の適用前後の試料中の固体状態の氷の量は、幾つかの方法で決定することができる。例えば、様々な実施形態では、試料中の氷の存在は、少ない試料を使用して示差走査熱量測定法(DSC)により決定することができる。様々な実施形態において、より多い試料に対しては、既知の温度で熱的に絶縁された液体中に試料を置いて、熱をシステムに供給することにより、氷を識別することができる。ある実施形態では、断熱系で試料を圧縮(加圧)することができ、圧縮中に、試料の温度または試料周囲の流体媒質の温度を測定することができる。氷の無い試料は、加圧速度に関連する一定の速度で断熱系においてその温度が上昇することが予想される。ある実施形態では、氷を含む試料の場合、氷の融点近傍の温度で試料の温度が横這い状態になる。幾つかの実施形態では、試料周囲の流体の温度が測定される場合、氷を含まない試料よりも、氷を含む試料の方が緩やかに流体の温度が上昇することとなる。試料温度の水平状態および/または温度上昇速度の減少は、存在する氷の量に依存することとなる。
【0038】
幾つかの実施形態では、高静水圧処理を受ける組織試料の温度が、上限値未満に維持される。幾つかの実施形態では、上限値が試料の初期温度に基づくものとなる。例えば、幾つかの実施形態では、組織試料の温度を10℃よりも大きく昇温させることなく、組織の解凍が行われる。幾つかの実施形態では、温度を30℃よりも高く上昇させることなく解凍が行われる。幾つかの実施形態では、温度を25℃よりも高く上昇させることなく解凍が行われる。ある実施形態では、組織試料の温度を約25℃乃至30℃よりも高く上昇させることなく解凍が行われる。
【0039】
幾つかの実施形態では、温度を上限値よりも高く上昇させることなく、所定時間内で解凍が行われる。例えば、幾つかの実施形態では、30分以内に解凍が生じる。ある実施形態では、60分以内に解凍が生じる。様々な実施形態では、約30分と約60分の間に解凍が生じる。
【0040】
様々な実施形態では、試料のバイオバーデンにおいて所定レベルの低下を得るために高静水圧処理が行われる。例えば、様々な実施形態では、試料中の細菌負荷において少なくとも5logの低下、6logの低下、7logの低下または8logの低下を生じさせるのに十分な圧力および時間を生じさせるのに十分な圧力および時間で高静水圧を加えることができる。幾つかの実施形態では、バイオバーデンを特定レベルに低下させるのに十分な圧力および時間で高静水圧を加えることができる。
【0041】
様々な実施形態では、組織試料から微生物を抽出して特定タイプの有機体を培養または定量化することにより、試料のバイオバーデンを測定することができる。試料から微生物を抽出する適当な方法は、減菌液で試料を洗浄するステップと、試料中の1または複数の特定の微生物の量を数値化するために、試料の洗浄に使用した液体の一部またはすべてを培養するステップとを含む。様々な実施形態では、定量化される微生物のタイプに基づいて、かつ/または組織に対する損傷を防止するように、洗浄流体を選択することができる。幾つかの実施形態では、温度を30℃よりも高く上昇させることなくバイオバーデンの低減が行われる。幾つかの実施形態では、温度を25℃よりも高く上昇させることなくバイオバーデンの低減が行われる。ある実施形態では、組織試料の温度を約25℃乃至30℃よりも高く上昇させることなくバイオバーデンの低減が行われる。
【0042】
幾つかの実施形態では、組織試料に高静水圧を加える前または後に、減菌プロセスを行うことができる。例えば、幾つかの実施形態では、高静水圧の利用により、組織試料のバイオバーデンが少なくとも部分的に低減されることとなり、試料中のバイオバーデンをさらに低減するために、組織の減菌プロセスが行われる。幾つかの実施形態では、その減菌プロセスを、組織試料をパッケージする直前または直後に行われる最終的な減菌プロセスとすることができる。本明細書に使用される“滅菌プロセス(sterilization process)”には、試料中のバイオバーデンを低減する任意のプロセスが含まれるが、試料を完全に無菌状態にする必要はない。
【0043】
ある例示的なプロセスには、ガンマ線照射プロセス、電子ビーム照射プロセス、超臨界二酸化炭素減菌プロセスおよび過酢酸処理プロセスが含まれるが、それらに限定されるものではない。様々な実施形態では、そのようなプロセスが、幾つかの組織成分にダメージを与えて、よって所望の生物学的特性を有する組織をもたらすことができ、減菌プロセスの時間または強度(例えば、照射量またはpH)を制限することが望ましい場合もある。このため、ある実施形態では、バイオバーデンを部分的に低減するために試料に高静水圧を加えることが、所望の減菌レベルを達成するために使用される後続の減菌プロセスの量を減少させることができる。適当な減菌プロセスには、例えば、Sun等に発行された米国特許出願公開公報第2006/0073592A1号、Kempに発行された米国特許第5,460,962号、Cook等に発行された米国特許出願公開公報第2008/0171092A1号に記載されたものが含まれるが、それらに限定されるものではない。
【0044】
実施例1:組織のバイオバーデンの低減
【0045】
ブタの皮膚を使用した。無傷の毛を有する皮膚全体として、組織を用意するとともに、表皮および皮下脂肪層から分離された真皮層(皮層)として、組織を用意した。真皮層は、真皮から真皮深部の薄層(1−2mm)および皮下脂肪を切除し、真皮から真皮上層および表皮の薄層(0.25−1mm)を切除することにより、分離した。毛は、真皮を分離する前に機械的に取り除いた。両試料タイプは、事前に冷凍し、分離した真皮組織中のバイオバーデンレベルを増加させるために、冷蔵状態下で解凍した後に数日間、組織すべて(皮膚全体および分離した真皮)を一緒に保存した。各ピースは、DENI(商標)MagicVac食品セーバーデバイスを使用して、個別にパッケージした。ブタ組織が加圧容器に曝されるのを防ぐために、各ピースを3つの真空密閉ポーチ内で密閉した。パッケージが試料とピッタリ合うように、密閉ポーチ内に最小量の流体とともに試料を詰めた。
【0046】
ElmHurst Research社(ニューヨーク州アルバニー)により製造された13リットルの加圧システムを実験に使用した。このシステムは、一定の容積を有していて、流体を容器内にポンプで送り込むことにより圧力を加えるものであった。容器のキャップから加圧チャンバ内に突出する熱電対を使用してバルク流体圧力を測定することにより、温度を測定した。
【0047】
皮膚全体および分離された真皮の両方の小さいピースを最初に試験し(操作1および2)、その後に、除毛してない大きいピースを同じ条件に曝した(操作3および4)。それら条件が表1に要約されている。圧力容器は、温度制御システムを備えておらず、このため、最高温度が、主に初期の温度および最大圧力に依存するものとなった。圧力上昇の速度は、350PSI/秒の単一速度であった。操作1および2の後に、高静水圧に曝された組織の小さなピースについて、分解(degradation)の明白な兆候を肉眼と感触で調べた。分解の明白な兆候は見受けられなかったため、組織の大きなピースを操作3および4で処理した。
【表1】

【0048】
曝した後、1週間未満、冷蔵条件(1−10℃)で組織試料を保存した。皮膚全体および分離した真皮の試料をバイオバーデン試験にかけた。試料をPBS溶液中で攪拌して試料から細菌を抽出し、PBS溶液を寒天培地上に載せて培養した。細菌コロニーの数を数えた。また、未処理の組織(分離された真皮および皮膚全体の両方)の対照試料も、高静水圧に曝す前に、同じバイオバーデン試験を行った。
【0049】
また、冷却後、分離された真皮の組織試料の残りも、DSCにかけた。DSCは、TA示差走査熱量計(TA Instruments社、デラウェア州ニューキャッスル)上の12−23mgの試料を使用して行った。
【0050】
図2Aおよび図2Bには、バイオバーデン試験の結果が示されている。データは、組織試料当たりのコロニー形成単位(CFU)としてLog10目盛で示されている。結果は、除毛していない組織について、少なくとも1乃至3Log10の低下、分離された真皮組織について、4乃至5Log10の低下を示している。結果は、高圧力および長時間の圧力保持時間の方が、低圧力および短時間よりも、バイオバーデン全体をより多く減少させたことを示している。
【0051】
試験された各圧力(60kPSIおよび75kPSI)において、分離された真皮組織と比較して、全体の皮膚組織において細菌の不活化の減少があった。したがって、皮膚移植については、高静水圧処理の前に組織試料を切り取って非真皮要素を取り除くことにより、バイオバーデンの低減の改善を与えることができる。
【0052】
この研究では、不活化データが、試験された短時間について優れた結果を示した。しかしながら、処理された試料についてのDSC特性は、同じ熱的組織損傷を示した。例えば、5分間65kPSIまたは10分間70kPSIの何れかに曝された試料は、高レベルの変性コラーゲンを示す、DSCに温度オンセット値(thermal onset values)を有していた。このため、処理温度を制御したときの、脱細胞化、解凍またはバイオバーデンの低減について、高静水圧の効果を評価するために、実験を行った。
【0053】
実施例2:プロセス温度の制御
【0054】
実施例1で説明したように、ブタの皮膚組織を得て、真皮組織を分離した。組織は、使用前に−80℃で保存した。その後、36時間未満、7℃に保持された対流インキュベータ内で試料を解凍した。試料のすべてを約7cm×7cmの正方形のピースに切断した。DENI(商標)MagicVacパッケージを使用して、組織の寸法にピッタリ合うように、パッケージを形成した。
【0055】
組織試料は、予め作成したパッケージ内に個別に置いた。その後、パッケージがほぼ満杯となるようにPBSを加えた(平均で少なくとも50mL)。PBSは、使用前に数時間攪拌しながら真空プルダウン(vacuum pull down)を使用して、パッケージ内に入れる前に、脱気した。攪拌子の周囲に気泡がもはや形成されなくなったときに、脱気が完了したと考えた。パッケージを絞ることにより、パッケージからなるべく多くの空気を除去し、パッケージの開口端を熱シーラーで密封した。
【0056】
高静水圧容器を冷やすために氷を使用した。3回の操作合計で約50ポンドの氷が必要であった。組織の上下両方に、加圧前に容器に氷を加えた。実施例2に記載の実験に対して、実施例1に記載の同じ加圧システムを使用した。
【0057】
実施例2の各操作条件が表2に要約されている。低温で容器シール漏れが生じる懸念があったため、氷を同じように使用しなかった。低温における容器の一体性に対する信頼が増加するに連れて、より多くの氷を使用した。したがって、各操作の開始温度が、より多くの氷が使用されたことにより、低くなった。
【表2】

【0058】
高静水圧を加えた後、24時間未満、冷蔵状態(1−10℃)下で組織を保存した。パッケージ化、処理およびバイオバーデン試験の間の時間、組織に与えるPBS溶液の影響を制御するために、未処理対照試料をPBS中で保持して、処理済みの試料とともに試験した。減菌状態下で高静水圧に曝した後に試料を切断した。これは、バイオバーデン結果に影響を与える可能性がある。実験1と同様に、細菌汚染を評価した。
【0059】
実施例1で述べたように、バイオバーデン試験を行った。バイオバーデン試験の結果は、図3に示されている。ここでは分離された真皮の組織のみを試験した。Y軸は、CFUを対数目盛りで表している。保持時間が長く、圧力が高くなるほど、バイオバーデン減少が改善された。例えば、操作1および3はともに保持時間10分で行われたが、操作3は、より高い圧力で行われ、その結果、バイオバーデン減少が改善された。また、操作1および2はともに50kPSIで行われたが、操作2はより長い時間行われ、その結果、操作1に比べて、バイオバーデン減少が改善された。
【0060】
図4は、この実施例の3回の操作と実施例1の4回の操作の期間中の圧力対温度のグラフによる記録である。この実施例では、試料の温度が約25℃を超えることはなかった。実施例1では、試料の温度が35℃を超え、より高圧では、40℃にもなることがあった。各曲線上部のフラットな領域は、おそらくは高圧力保持ステップ中の流体から容器壁への熱伝導あるいは流体への熱伝導による冷却の横這い状態である。高圧容器の鋼壁は、常温で開始して、多量の容器の鋼壁が、温度勾配に応じて大きなヒートシンクまたはソースを与えた。実施例2は、冷却の横這い状態を同様に有するが、それほど明白ではない。
【0061】
また、各試料について、TA示差走査熱量計を使用してDSC試験も行った。表3にDSCの結果が示されている。対照として、未処理真皮も示されている。実施例1とは対照的に、実施例2の試料は、コラーゲン変性を示す低温オンセット値を示さなかった。実施例2の操作1乃至3についての温度オンセット値は、約59−60℃であった。これは対照試料と同様である。このため、試料の温度を制御しながら高静水圧を加えることは、著しいコラーゲン変性を生じることなく、試料のバイオバーデンを減少させるのに効果的であった。
【表3】

【技術分野】
【0001】
本発明は、組織の処理方法に関するものである。本出願は、35U.S.C.§119に基づき、2009年8月18日に出願された米国仮特許出願第61/234,681号に対して優先権を主張する。
【背景技術】
【0002】
人間と動物の組織は、患者に使用する様々な組織製品を製造するために使用することができる。組織は、多くの場合、特定の細胞および/または非細胞成分を取り除くために、かつ/または組織に存在する病原体を破壊するために、処理される。また、処理または保管中、組織は冷凍および解凍されることもある。
【発明の概要】
【0003】
ある実施形態によれば、組織試料を脱細胞化する方法が提供され、その方法が、哺乳類の軟組織を有する組織試料を液体中に与えるステップと、軟組織に含まれるネイティブ組織細胞の実質的にすべてを破壊するのに十分な時間、少なくとも200MPaの圧力を上記液体に加えるステップとを備え、細胞の実質的にすべてを破壊するステップが、生理食塩水中で組織試料を洗浄することによりネイティブ組織細胞の少なくとも95%の除去が可能となるように、細胞の細胞膜を破壊するステップを含む。
【0004】
ある実施形態によれば、組織試料を解凍する方法が提供され、その方法が、少なくとも部分的に凍結した哺乳類組織を含む組織試料を液体中に与えるステップと、凍結した組織試料を解凍するのに十分な圧力を前記液体に加えるステップとを備える。
【0005】
ある実施形態によれば、組織試料を脱細胞化する方法が提供され、その方法が、哺乳類組織を含む組織試料を、液体を含むコンテナ内に与えるステップと、軟組織に含まれる細胞の実質的にすべてが破壊されるのに十分な時間、前記液体に圧力を加えるステップとを備え、細胞の実質的にすべてを破壊するステップが、生理食塩水中で組織試料を洗浄することによりネイティブ組織細胞の少なくとも95%の除去が可能となるように、細胞の細胞膜を破壊するステップを含み、組織試料の温度が30℃を超えないような速度で圧力が加えられる。
【0006】
ある実施形態によれば、組織試料におけるバイオバーデンを減少させる方法が提供され、その方法が、哺乳類の軟組織を含む組織試料を、液体を含むコンテナ内に与えるステップと、軟組織内の細菌濃度を少なくとも5log(対数)減少させるのに十分な時間、前記液体に圧力を加えるステップとを備え、圧力を加えている間、組織試料の温度が30℃を超えないものとなっている。
【図面の簡単な説明】
【0007】
【図1】図1は、水の状態図である。
【図2】図2Aは、実験1で説明される、ブタの皮膚全体の試料に対するバイオバーデン試験の結果データである。図2Bは、実験1で説明される、ブタの真皮に対するバイオバーデン試験の結果データである。
【図3】図3は、実験2で説明される、ブタの真皮に対するバイオバーデン試験の結果データである。
【図4】図4は、実験1および2の試料についての温度対圧力プロファイル曲線である。
【発明を実施するための形態】
【0008】
ここで、本開示に係る例示的な実施形態を詳細に述べることとする。その実施例は、添付図面に示されている。同じ部分または同様の部分を指すものとして、同じ符号を可能な限り図面全体に亘って使用することとする。
【0009】
本出願においては、単数形の使用は、特に記載しない限りは、複数を含む。本出願では、“または”の使用は、特に記載がない限りは、“および/または”を意味する。また、用語“含んでいる(including)”の使用は、“含む(includes)”および“含まれる(included)”のようなその他の形式と同様に、制限的なものではない。本明細書に記載の任意の範囲は、両端点およびそれら端点間のすべての値を含むものとみなされる。
【0010】
本明細書に記載の“高静水圧”は、液体に含まれる対象物に加えられる圧力を指すものとみなされ、ここで、液体は、対象物に力を与えるために加圧されるものである。ある実施形態では、“高静水圧”が、200MPaよりも大きい、液体に加えられる圧力を含むことができる。
【0011】
本明細書に使用される“バイオバーデン(bioburden)”は、組織試料中の微生物の量を意味し、その微生物には、バクテリア、ウィルス、菌類、寄生生物、クラミジア、リケッチア、マイコプラズマおよび原生動物が含まれるが、それらに限定されるものではない。
【0012】
本明細書に使用される“組織製品(tissue products)”または“組織由来製品(tissue-derived products)”は、任意の方法で(例えば、それに限定される訳ではないが、組織から細胞を除去することにより、組織から特定の化学物質を除去することにより、あるいは組織を殺菌することにより)改変された、組織から生産される任意の製品を意味する。本明細書に使用される“組織試料”は、無傷の未処理の組織と、処理されて“組織製品”または“組織由来製品”をもたらす組織の両方を含む。
【0013】
本明細書中で使用されるセクションの見出しは、単なる編成目的のものであり、記載の主題を限定するものとして解釈されるべきものではない。特許、特許出願、記事、書籍または論文に限定される訳ではないが、それらを含む本出願で引用される文献のすべてまたは一部は、如何なる目的に対しても、その全体が引用により明確に援用されるものである。
【0014】
様々な人間および動物の組織は、患者の治療用の製品を生産するために使用することができる。例えば、様々な疾病および/または構造上の損傷(例えば、外傷、手術、萎縮および/または長期間の摩擦および変性)により損傷を受けた、あるいは失われた人間の組織の再生、修復、増強、補強および/または治療のための様々な組織製品が生産されている。そのような製品には、例えば、その他の物質および/または化学物質と組み合わせて、あるいは単独で使用することができる、組織マトリクスおよび/または組織由来タンパク質またはタンパク質含有物質(例えば、グリコサミノグリカン)が含まれる。
【0015】
ある実施形態では、それら製品は、完全にまたは部分的に脱細胞化されて、患者に使用される組織マトリクスまたは細胞外組織物質を与えることができる。例えば、皮膚、腸、骨、軟骨、神経組織(例えば、神経線維または硬膜)、腱、靭帯またはその他組織のような様々な組織は、完全にまたは部分的に脱細胞化されて、患者に有用な組織製品を生産することができる。ある場合には、それら脱細胞化された製品は、外因性細胞物質(例えば、幹細胞)を加えることなく使用することができる。ある場合には、それら脱細胞化された製品は、治療を促進するために、自己またはその他の源からの細胞で播種することができる。
【0016】
ある実施形態では、組織製品がしばしば患者の体または体内に移植されるため、そのような物質を殺菌するか、あるいは選択された使用において許されるレベルまで、製品に含まれる可能性のある細菌またはその他の病原体の量を少なくとも減らすことが望ましい。ある実施形態では、様々な組織、組織由来製品およびその他の移植可能な医療デバイスが、一般に、照射(例えば、ガンマ、電子ビームまたはX線)のようなプロセス、化学物質または熱による処理を使用して殺菌される。
【0017】
様々な医療または手術応用における使用のために、組織または組織製品は、用途に応じて、所望の生物学的特性を保有する必要がある。例えば、組織再生に使用される組織製品は、一般に、細胞の内部成長および/または再生を支援または誘導することができるようにすべきである。しかしながら、特定の組織処理技術は、ある細胞に損傷を与えるか、かつ/または特定の生物学的機能に望ましい組織の一部を除去する可能性がある。例えば、ある実施形態では、組織脱細胞化プロセスは、特定の細胞の再生または成長に望ましい様々な細胞シグナル分子または細胞外マトリクスタンパク質に損傷を与えるか、または除去する可能性のある、様々な酵素、洗浄剤および/または化学物質の使用を含むことができる。また、ある実施形態では、ガンマ線照射のような殺菌技術が、そのような製品の破壊および/または化学的変質を引き起こすことにより、組織製品を変化させることがある。
【0018】
本開示は、組織試料を処理する方法であって、そのような方法を使用して生産された組織製品のある所望の生物学的特性を維持する方法を提供する。幾つかの実施形態では、上記方法は、組織試料を脱細胞化する方法を含む。ある実施形態では、上記方法は、組織試料を解凍する方法を含む。幾つかの実施形態では、上記方法は、組織試料のバイオバーデンを低減する方法を含む。
【0019】
幾つかの実施形態では、組織試料を処理する方法が、組織への高静水圧の適用を含むことができる。ある実施形態では、組織試料を液体中に置くことにより、あるいは組織を液体中に与えることにより、高静水圧を組織試料に加えることができる。ある実施形態では、圧力を液体に加えることができ、それにより、組織試料に加えられる圧力を制御することができる。様々な実施形態では、組織試料を脱細胞化し、組織試料のバイオバーデンを低減し、かつ/または組織試料を解凍するために、組織試料に加えられる圧力、圧力が加えられる時間、および/または圧力の増加率および/または減少率を制御することができる。
【0020】
様々な実施形態では、様々な因子に基づいて、組織試料に加えられる圧力を選択することができる。幾つかの実施形態では、処理される組織試料のタイプに基づいて、圧力が選択される。幾つかの実施形態では、組織試料の所望の生物学的特性を維持しながら、組織試料の脱細胞化を行うことを可能とするように、圧力が選択される。幾つかの実施形態では、選択された温度よりも高く組織試料の温度を上げることなく組織を解凍することを可能にするように、かつ/または選択された時間内に解凍することを可能にするように、圧力が選択される。
【0021】
様々な実施形態では、様々な異なる組織試料タイプを処理するために、本開示の方法を使用することができる。例示的な哺乳類の組織試料には、骨、皮膚、腸、膀胱、腱、靭帯、筋肉、筋膜、神経組織、肝臓、心臓、肺、腎臓、軟骨および/またはその他の哺乳類の組織が含まれるが、それらに限定されるものではない。ある実施形態では、組織試料に、哺乳類の軟組織試料を含むことがある。例えば、ある実施形態では、組織試料に、哺乳類の真皮を含むことがある。ある実施形態では、周囲の表皮および/または皮下脂肪のようなその他の組織から真皮を分離することができる。ある実施形態では、組織試料に、小腸粘膜下組織を含むことがある。ある実施形態では、組織試料に、ヒトまたは非ヒトの源を含むことがある。例示的で適当な非ヒト組織源には、ブタ、ヒツジ、ヤギ、ウサギ、サルおよび/またはその他のヒト以外の哺乳動物が含まれる。
【0022】
ある実施形態に係る組織試料を処理するために、様々なタイプの高静水圧利用システムを使用することができる。ある実施形態では、高静水圧利用システムが、鋼またはその他の硬質材料から形成された硬質の容器またはコンテナを含むものとなる。ある実施形態では、処理される組織試料が、流体(例えば、水)とともに容器内に置かれる。ある実施形態では、流体を含む柔軟なコンテナ内に組織試料を詰めて、その柔軟なパッケージを、流体を含む容器内に置くようにしてもよい。ある実施形態では、容器に組織試料と流体を入れた後に、容器内の流体に圧力が加えられる。ある実施形態では、様々な方法で圧力を加えることができる。例えば、ある実施形態では、容器内の圧力を圧縮するために空気圧式のピストンを使用して圧力を加えることができ、あるいは容器内の圧力が所望のレベルに達するまで、ポンプが追加の流体を容器内に押し込むことができる。
【0023】
ある実施形態では、液体を含む柔軟なコンテナ内に組織試料が詰められて、そのコンテナに圧力が加えられる。幾つかの実施形態では、液体を含む硬質な加圧コンテナ内に組織試料が置かれて、その硬質なコンテナ内の液体に圧力が加えられる。幾つかの実施形態では、液体を含む柔軟なコンテナ内に組織試料が詰められるとともに、その柔軟なコンテナが、液体を含む硬質な加圧コンテナ内に置かれて、その硬質なコンテナ内の液体に圧力が加えられる。様々な実施形態では、例えば、ピストンを使用して流体を圧縮することにより、あるいは一定の容量を有するコンテナ内に追加流体をポンプで送り込むことにより、流体に圧力を加えることができる。ある実施形態では、組織試料が柔軟なコンテナに詰められるとき、一般に、柔軟なコンテナ内部の流体のみが組織試料に接触するように柔軟なコンテナが密封される。
【0024】
高静水圧の利用中に液体と接触するために、様々な液体を使用することができる。例えば、種々の水溶液を使用することができる。ある実施形態では、液体に塩類水溶液が含まれる。ある実施形態では、液体にリン酸緩衝生理食塩水のような食塩水が含まれる。
【0025】
幾つかの実施形態では、組織試料のネイティブ組織細胞(native tissue cells)の一部または実質的にすべてを破壊するために、組織試料を処理することができる。ある実施形態では、細胞に著しい損傷を与えることのない液体(例えば、PBS)により、高静水圧で処理された組織試料を洗浄した後、試料を分析して、ネイティブ組織細胞が、存在するとしたら、どれだけ多く残存しているのかを判定することにより、ネイティブ組織細胞の破壊が完了したかどうかの判定を行うことができる。例えば、幾つかの実施形態では、高静水圧処理により細胞を破壊した後に、生理食塩水で洗うだけで、細胞の残余物を除去することができ、また、洗浄された試料を評価して、細胞が除去されて細胞の破壊を示しているかどうかを判定することができる。試料を評価して細胞が破壊および除去されているかどうかを判定する適当な方法の幾つかは、良く知られており、それには、例えば、冷凍または固定された組織細胞の光学顕微鏡検査法が含まれるが、これに限定されるものではない。ある実施形態では、DNAが存在することを示す試薬を使用して、細胞または細胞残余物の存在を評価することができる。その試薬として、例えば、PICOGREEN(登録商標)DNA定量化キットを使用することができる。
【0026】
本明細書に使用される、細胞の実質的にすべての破壊とは、これまでの組織学(例えば、光学顕微鏡検査法)を使用して評価した場合に、高静水圧で処理されて食塩水で洗浄された組織試料のネイティブ組織細胞の少なくとも95%乃至100%(両端点およびそれら端点間のすべてのパーセンテージを含む)が存在していないことを意味するとして理解されたい。
【0027】
幾つかの実施形態では、組織試料中の細胞の一部または実質的すべてを除去するために、組織試料を高静水圧で処理することができ、残りの細胞を除去するために、組織試料をその他のプロセスでさらに処理することができる。例えば、様々な実施形態では、上述したように、組織から細胞を除去するために、様々な酵素、清浄剤および/またはその他の化学物質が使用されるが、そのような処理は、組織の細胞外マトリクスを変化させる可能性がある。したがって、酵素、清浄剤および/またはその他の化学物質による処理量を減少させるために、先ず、組織試料を高静水圧処理で処理して、細胞の一部または実質的にすべてを除去し、幾らかが組織試料に存在する場合には、細胞をさらに除去するために、組織試料を少なくとも1の追加的な脱細胞プロセスでさらに処理することができる。脱細胞を行う適当な試薬および方法には、例えば、Livesey等に発行された米国特許第5,336,616号に記載のものが含まれるが、それに限定されるものではない。
【0028】
幾つかの実施形態では、無細胞組織マトリクス(acellular tissue matrix)を生成するために、組織試料を処理することができる。幾つかの実施形態では、無細胞組織マトリクスに細胞外マトリックスが含まれる。例えば、様々な実施形態では、組織マトリクスに、様々な異なる哺乳類の軟組織から得たコラーゲンマトリクスが含まれる。ある実施形態では、組織マトリクスに、1またはそれ以上の追加的な細胞外マトリクスタンパク質および/または分子が含まれ、それには、種々のGAG、細胞シグナリング分子、または細胞結合、接着、成長、分化および/またはリモデリングのような様々な生物学的機能を生じさせるのに望ましいその他の化学物質が含まれるが、それらに限定されるものではない。
【0029】
幾つかの実施形態では、組織試料を脱細胞化する方法は、液体中に哺乳類の軟組織を含む組織試料を提供するステップと、軟組織に含まれるネイティブ組織細胞の実質的にすべてを破壊するのに十分な時間、液体に圧力を加えるステップとを備える。幾つかの実施形態では、軟組織に含まれるネイティブ組織細胞の実質的にすべてを破壊する最小圧力で圧力が加えられる。様々な実施形態では、その圧力が、少なくとも200MPa、少なくとも300MPa、少なくとも400MPaまたは少なくとも500MPaである。様々な実施形態では、その圧力が、300MPaと500MPaとの間に入る。様々な実施形態では、その圧力が、軟組織に含まれるネイティブ組織細胞の実質的にすべてを破壊するのに十分な時間、加えられる。様々な実施形態では、その圧力が、少なくとも30分から少なくとも60分間加えられる。ある実施形態では、液体に加えられる圧力が、少なくとも10分間で、少なくとも400MPaである。ある実施形態では、液体に加えられる圧力が、少なくとも30分間で、少なくとも400MPaである。ある実施形態では、液体に加えられる圧力が、少なくとも30分間で、少なくとも500MPaである。様々な実施形態では、後述するように、組織試料の過度の加熱を生じることなく、脱細胞化方法が実行される。
【0030】
様々な実施形態では、本開示の方法が、組織試料の著しい加熱を生じることなく、組織試料に対して高静水圧の利用を可能にする。様々な実施形態では、ある組織試料の加熱が、様々な組織細胞外マトリクスタンパク質に損傷を与えて、組織の修復、置換または再生に使用する場合に、組織試料の所望の生物学的機能を損なう可能性がある。このため、本明細書中のある実施形態は、組織細胞外マトリクスタンパク質に損傷を与え得る温度または時間、組織試料を加熱することなく、組織の脱細胞化、組織の解凍および/または組織バイオバーデンの低減を可能にする。ある実施形態では、組織試料が30℃より高い温度に達しないような速度および最大圧力で、高静水圧が加えられる。ある実施形態では、その温度が25℃を超えない。
【0031】
ある実施形態では、静水圧容器中の加圧が、容器に含まれる物質(すなわち、液体)の断熱圧縮を引き起こし、それが、圧縮された物質の温度の上昇を引き起こす。しかしながら、ある加圧容器は、その壁を介した熱伝導を可能とし、よってそのようなシステムは、真に断熱ではない。したがって、様々な実施形態では、圧力の増加量が、圧縮速度(すなわち、圧力の増加)および容器の壁への熱伝導または容器の壁からの熱伝導に関連する。また、様々な実施形態では、容器内の水の相変化も、容器内の温度に影響を与えることがある。したがって、幾つかの実施形態では、処理容器中の圧力の増加速度を制御することにより、高静水圧で処理される試料の温度を制御することができる。
【0032】
ある実施形態では、高静水圧の適用前および/または適用中に、組織試料、加圧容器に含まれる液体および/または加圧装置を冷却することができる。幾つかの実施形態では、加圧容器に含まれる液体に氷を入れることができ、かつ/または、加圧容器の壁を冷却することができる。
【0033】
様々な実施形態では、組織の損傷、破壊および/または微生物増殖を防止するために、多くの場合、処理、移送および/または保管中に組織試料を冷凍することが望ましい。様々な実施形態では、後の処理中または使用中に、組織試料が解凍される。しかしながら、組織試料の加熱による解凍は、組織細胞外マトリクス成分に損傷を与え、かつ/または微生物増殖を促進する可能性がある。さらに、ある実施形態では、相対的に低温条件下(例えば、冷蔵、または試料中の水の凝固点のすぐ上の条件下)での組織試料の解凍が、特に大きな組織試料の場合に、時間のかかることがある。
【0034】
ある実施形態では、組織試料を解凍する方法が、少なくとも部分的に凍結した哺乳類組織を含む組織試料を液体に入れるステップと、凍結した組織試料を解凍するのに十分な圧力を液体に加えるステップとを備える。幾つかの実施形態では、限られた時間内に、かつ/または組織試料の温度の限られた上昇のみで、解凍が生じる。
【0035】
図1は水の固液相の状態図を与える。図示のように、様々な氷相の融点は、高圧で低下する。したがって、ある実施形態では、氷を含む試料に高静水圧を加えることにより、組織試料を著しく加熱することなく、固体状態の水から液体への変化を引き起こすことができる。
【0036】
様々な実施形態では、組織試料が、部分的にまたは完全に固体の状態である水(すなわち、氷)を含むことができる。様々な実施形態では、組織試料の解凍が、試料中の固体状態の水の一部または実質的すべてを液体に変化させるステップを含む。幾つかの実施形態では、凍結した組織試料の解凍が、組織試料中の固体状態の水の50%より多くに、液体状態への相変態を生じさせるステップを備える。幾つかの実施形態では、凍結した組織の解凍が、組織試料中の固体状態の水の実質的にすべてに、液体状態への相変態を生じさせるステップを備える。様々な実施形態では、試料中の氷の50%乃至100%に、液体状態への相変態を生じさせる。
【0037】
様々な実施形態では、高静水圧処理の適用前後の試料中の固体状態の氷の量は、幾つかの方法で決定することができる。例えば、様々な実施形態では、試料中の氷の存在は、少ない試料を使用して示差走査熱量測定法(DSC)により決定することができる。様々な実施形態において、より多い試料に対しては、既知の温度で熱的に絶縁された液体中に試料を置いて、熱をシステムに供給することにより、氷を識別することができる。ある実施形態では、断熱系で試料を圧縮(加圧)することができ、圧縮中に、試料の温度または試料周囲の流体媒質の温度を測定することができる。氷の無い試料は、加圧速度に関連する一定の速度で断熱系においてその温度が上昇することが予想される。ある実施形態では、氷を含む試料の場合、氷の融点近傍の温度で試料の温度が横這い状態になる。幾つかの実施形態では、試料周囲の流体の温度が測定される場合、氷を含まない試料よりも、氷を含む試料の方が緩やかに流体の温度が上昇することとなる。試料温度の水平状態および/または温度上昇速度の減少は、存在する氷の量に依存することとなる。
【0038】
幾つかの実施形態では、高静水圧処理を受ける組織試料の温度が、上限値未満に維持される。幾つかの実施形態では、上限値が試料の初期温度に基づくものとなる。例えば、幾つかの実施形態では、組織試料の温度を10℃よりも大きく昇温させることなく、組織の解凍が行われる。幾つかの実施形態では、温度を30℃よりも高く上昇させることなく解凍が行われる。幾つかの実施形態では、温度を25℃よりも高く上昇させることなく解凍が行われる。ある実施形態では、組織試料の温度を約25℃乃至30℃よりも高く上昇させることなく解凍が行われる。
【0039】
幾つかの実施形態では、温度を上限値よりも高く上昇させることなく、所定時間内で解凍が行われる。例えば、幾つかの実施形態では、30分以内に解凍が生じる。ある実施形態では、60分以内に解凍が生じる。様々な実施形態では、約30分と約60分の間に解凍が生じる。
【0040】
様々な実施形態では、試料のバイオバーデンにおいて所定レベルの低下を得るために高静水圧処理が行われる。例えば、様々な実施形態では、試料中の細菌負荷において少なくとも5logの低下、6logの低下、7logの低下または8logの低下を生じさせるのに十分な圧力および時間を生じさせるのに十分な圧力および時間で高静水圧を加えることができる。幾つかの実施形態では、バイオバーデンを特定レベルに低下させるのに十分な圧力および時間で高静水圧を加えることができる。
【0041】
様々な実施形態では、組織試料から微生物を抽出して特定タイプの有機体を培養または定量化することにより、試料のバイオバーデンを測定することができる。試料から微生物を抽出する適当な方法は、減菌液で試料を洗浄するステップと、試料中の1または複数の特定の微生物の量を数値化するために、試料の洗浄に使用した液体の一部またはすべてを培養するステップとを含む。様々な実施形態では、定量化される微生物のタイプに基づいて、かつ/または組織に対する損傷を防止するように、洗浄流体を選択することができる。幾つかの実施形態では、温度を30℃よりも高く上昇させることなくバイオバーデンの低減が行われる。幾つかの実施形態では、温度を25℃よりも高く上昇させることなくバイオバーデンの低減が行われる。ある実施形態では、組織試料の温度を約25℃乃至30℃よりも高く上昇させることなくバイオバーデンの低減が行われる。
【0042】
幾つかの実施形態では、組織試料に高静水圧を加える前または後に、減菌プロセスを行うことができる。例えば、幾つかの実施形態では、高静水圧の利用により、組織試料のバイオバーデンが少なくとも部分的に低減されることとなり、試料中のバイオバーデンをさらに低減するために、組織の減菌プロセスが行われる。幾つかの実施形態では、その減菌プロセスを、組織試料をパッケージする直前または直後に行われる最終的な減菌プロセスとすることができる。本明細書に使用される“滅菌プロセス(sterilization process)”には、試料中のバイオバーデンを低減する任意のプロセスが含まれるが、試料を完全に無菌状態にする必要はない。
【0043】
ある例示的なプロセスには、ガンマ線照射プロセス、電子ビーム照射プロセス、超臨界二酸化炭素減菌プロセスおよび過酢酸処理プロセスが含まれるが、それらに限定されるものではない。様々な実施形態では、そのようなプロセスが、幾つかの組織成分にダメージを与えて、よって所望の生物学的特性を有する組織をもたらすことができ、減菌プロセスの時間または強度(例えば、照射量またはpH)を制限することが望ましい場合もある。このため、ある実施形態では、バイオバーデンを部分的に低減するために試料に高静水圧を加えることが、所望の減菌レベルを達成するために使用される後続の減菌プロセスの量を減少させることができる。適当な減菌プロセスには、例えば、Sun等に発行された米国特許出願公開公報第2006/0073592A1号、Kempに発行された米国特許第5,460,962号、Cook等に発行された米国特許出願公開公報第2008/0171092A1号に記載されたものが含まれるが、それらに限定されるものではない。
【0044】
実施例1:組織のバイオバーデンの低減
【0045】
ブタの皮膚を使用した。無傷の毛を有する皮膚全体として、組織を用意するとともに、表皮および皮下脂肪層から分離された真皮層(皮層)として、組織を用意した。真皮層は、真皮から真皮深部の薄層(1−2mm)および皮下脂肪を切除し、真皮から真皮上層および表皮の薄層(0.25−1mm)を切除することにより、分離した。毛は、真皮を分離する前に機械的に取り除いた。両試料タイプは、事前に冷凍し、分離した真皮組織中のバイオバーデンレベルを増加させるために、冷蔵状態下で解凍した後に数日間、組織すべて(皮膚全体および分離した真皮)を一緒に保存した。各ピースは、DENI(商標)MagicVac食品セーバーデバイスを使用して、個別にパッケージした。ブタ組織が加圧容器に曝されるのを防ぐために、各ピースを3つの真空密閉ポーチ内で密閉した。パッケージが試料とピッタリ合うように、密閉ポーチ内に最小量の流体とともに試料を詰めた。
【0046】
ElmHurst Research社(ニューヨーク州アルバニー)により製造された13リットルの加圧システムを実験に使用した。このシステムは、一定の容積を有していて、流体を容器内にポンプで送り込むことにより圧力を加えるものであった。容器のキャップから加圧チャンバ内に突出する熱電対を使用してバルク流体圧力を測定することにより、温度を測定した。
【0047】
皮膚全体および分離された真皮の両方の小さいピースを最初に試験し(操作1および2)、その後に、除毛してない大きいピースを同じ条件に曝した(操作3および4)。それら条件が表1に要約されている。圧力容器は、温度制御システムを備えておらず、このため、最高温度が、主に初期の温度および最大圧力に依存するものとなった。圧力上昇の速度は、350PSI/秒の単一速度であった。操作1および2の後に、高静水圧に曝された組織の小さなピースについて、分解(degradation)の明白な兆候を肉眼と感触で調べた。分解の明白な兆候は見受けられなかったため、組織の大きなピースを操作3および4で処理した。
【表1】

【0048】
曝した後、1週間未満、冷蔵条件(1−10℃)で組織試料を保存した。皮膚全体および分離した真皮の試料をバイオバーデン試験にかけた。試料をPBS溶液中で攪拌して試料から細菌を抽出し、PBS溶液を寒天培地上に載せて培養した。細菌コロニーの数を数えた。また、未処理の組織(分離された真皮および皮膚全体の両方)の対照試料も、高静水圧に曝す前に、同じバイオバーデン試験を行った。
【0049】
また、冷却後、分離された真皮の組織試料の残りも、DSCにかけた。DSCは、TA示差走査熱量計(TA Instruments社、デラウェア州ニューキャッスル)上の12−23mgの試料を使用して行った。
【0050】
図2Aおよび図2Bには、バイオバーデン試験の結果が示されている。データは、組織試料当たりのコロニー形成単位(CFU)としてLog10目盛で示されている。結果は、除毛していない組織について、少なくとも1乃至3Log10の低下、分離された真皮組織について、4乃至5Log10の低下を示している。結果は、高圧力および長時間の圧力保持時間の方が、低圧力および短時間よりも、バイオバーデン全体をより多く減少させたことを示している。
【0051】
試験された各圧力(60kPSIおよび75kPSI)において、分離された真皮組織と比較して、全体の皮膚組織において細菌の不活化の減少があった。したがって、皮膚移植については、高静水圧処理の前に組織試料を切り取って非真皮要素を取り除くことにより、バイオバーデンの低減の改善を与えることができる。
【0052】
この研究では、不活化データが、試験された短時間について優れた結果を示した。しかしながら、処理された試料についてのDSC特性は、同じ熱的組織損傷を示した。例えば、5分間65kPSIまたは10分間70kPSIの何れかに曝された試料は、高レベルの変性コラーゲンを示す、DSCに温度オンセット値(thermal onset values)を有していた。このため、処理温度を制御したときの、脱細胞化、解凍またはバイオバーデンの低減について、高静水圧の効果を評価するために、実験を行った。
【0053】
実施例2:プロセス温度の制御
【0054】
実施例1で説明したように、ブタの皮膚組織を得て、真皮組織を分離した。組織は、使用前に−80℃で保存した。その後、36時間未満、7℃に保持された対流インキュベータ内で試料を解凍した。試料のすべてを約7cm×7cmの正方形のピースに切断した。DENI(商標)MagicVacパッケージを使用して、組織の寸法にピッタリ合うように、パッケージを形成した。
【0055】
組織試料は、予め作成したパッケージ内に個別に置いた。その後、パッケージがほぼ満杯となるようにPBSを加えた(平均で少なくとも50mL)。PBSは、使用前に数時間攪拌しながら真空プルダウン(vacuum pull down)を使用して、パッケージ内に入れる前に、脱気した。攪拌子の周囲に気泡がもはや形成されなくなったときに、脱気が完了したと考えた。パッケージを絞ることにより、パッケージからなるべく多くの空気を除去し、パッケージの開口端を熱シーラーで密封した。
【0056】
高静水圧容器を冷やすために氷を使用した。3回の操作合計で約50ポンドの氷が必要であった。組織の上下両方に、加圧前に容器に氷を加えた。実施例2に記載の実験に対して、実施例1に記載の同じ加圧システムを使用した。
【0057】
実施例2の各操作条件が表2に要約されている。低温で容器シール漏れが生じる懸念があったため、氷を同じように使用しなかった。低温における容器の一体性に対する信頼が増加するに連れて、より多くの氷を使用した。したがって、各操作の開始温度が、より多くの氷が使用されたことにより、低くなった。
【表2】

【0058】
高静水圧を加えた後、24時間未満、冷蔵状態(1−10℃)下で組織を保存した。パッケージ化、処理およびバイオバーデン試験の間の時間、組織に与えるPBS溶液の影響を制御するために、未処理対照試料をPBS中で保持して、処理済みの試料とともに試験した。減菌状態下で高静水圧に曝した後に試料を切断した。これは、バイオバーデン結果に影響を与える可能性がある。実験1と同様に、細菌汚染を評価した。
【0059】
実施例1で述べたように、バイオバーデン試験を行った。バイオバーデン試験の結果は、図3に示されている。ここでは分離された真皮の組織のみを試験した。Y軸は、CFUを対数目盛りで表している。保持時間が長く、圧力が高くなるほど、バイオバーデン減少が改善された。例えば、操作1および3はともに保持時間10分で行われたが、操作3は、より高い圧力で行われ、その結果、バイオバーデン減少が改善された。また、操作1および2はともに50kPSIで行われたが、操作2はより長い時間行われ、その結果、操作1に比べて、バイオバーデン減少が改善された。
【0060】
図4は、この実施例の3回の操作と実施例1の4回の操作の期間中の圧力対温度のグラフによる記録である。この実施例では、試料の温度が約25℃を超えることはなかった。実施例1では、試料の温度が35℃を超え、より高圧では、40℃にもなることがあった。各曲線上部のフラットな領域は、おそらくは高圧力保持ステップ中の流体から容器壁への熱伝導あるいは流体への熱伝導による冷却の横這い状態である。高圧容器の鋼壁は、常温で開始して、多量の容器の鋼壁が、温度勾配に応じて大きなヒートシンクまたはソースを与えた。実施例2は、冷却の横這い状態を同様に有するが、それほど明白ではない。
【0061】
また、各試料について、TA示差走査熱量計を使用してDSC試験も行った。表3にDSCの結果が示されている。対照として、未処理真皮も示されている。実施例1とは対照的に、実施例2の試料は、コラーゲン変性を示す低温オンセット値を示さなかった。実施例2の操作1乃至3についての温度オンセット値は、約59−60℃であった。これは対照試料と同様である。このため、試料の温度を制御しながら高静水圧を加えることは、著しいコラーゲン変性を生じることなく、試料のバイオバーデンを減少させるのに効果的であった。
【表3】

【特許請求の範囲】
【請求項1】
組織試料を脱細胞化する方法であって、
哺乳類組織を有する組織試料を液体中に与えるステップと、
軟組織に含まれるネイティブ組織細胞の実質的にすべてを破壊するのに十分な時間、少なくとも200MPaの圧力を上記液体に加えるステップとを備え、
細胞の実質的にすべてを破壊するステップが、生理食塩水中で組織試料を洗浄することによりネイティブ組織細胞の少なくとも95%の除去が可能となるように、細胞の細胞膜を破壊するステップを含むことを特徴とする方法。
【請求項2】
請求項1に記載の方法において、
前記液体に加えられる圧力が少なくとも約500MPaであることを特徴とする方法。
【請求項3】
請求項1に記載の方法において、
前記液体に加えられる圧力が、少なくとも30分間において、少なくとも300MPaであることを特徴とする方法。
【請求項4】
請求項1に記載の方法において、
前記液体に加えられる圧力が、少なくとも10分間において、少なくとも400MPaであることを特徴とする方法。
【請求項5】
請求項1に記載の方法において、
前記液体に加えられる圧力が、少なくとも30分間において、少なくとも400MPaであることを特徴とする方法。
【請求項6】
請求項1に記載の方法において、
前記液体が塩類水溶液を含むことを特徴とする方法。
【請求項7】
請求項6に記載の方法において、
前記液体がリン酸緩衝生理食塩水を含むことを特徴とする方法。
【請求項8】
請求項1に記載の方法において、
組織に対して減菌プロセスを行うステップをさらに備えることを特徴とする方法。
【請求項9】
請求項8に記載の方法において、
前記減菌プロセスが、ガンマ線照射プロセスを含むことを特徴とする方法。
【請求項10】
請求項8に記載の方法において、
前記減菌プロセスが、電子ビーム照射プロセスを含むことを特徴とする方法。
【請求項11】
請求項8に記載の方法において、
前記減菌プロセスが、超臨界二酸化炭素減菌プロセスを含むことを特徴とする方法。
【請求項12】
請求項8に記載の方法において、
前記減菌プロセスが、過酢酸処理プロセスを含むことを特徴とする方法。
【請求項13】
請求項1に記載の方法において、
前記哺乳類組織が軟組織を含むことを特徴とする方法。
【請求項14】
請求項13に記載の方法において、
前記哺乳類組織が皮膚を含むことを特徴とする方法。
【請求項15】
請求項13に記載の方法において、
前記哺乳類の軟組織がブタの真皮を含むことを特徴とする方法。
【請求項16】
請求項14に記載の方法において、
圧力を加える前に、皮膚から表皮層を除去するステップをさらに備えることを特徴とする方法。
【請求項17】
請求項1に記載の方法において、
前記哺乳類組織が腱または靱帯の少なくとも一方を含むことを特徴とする方法。
【請求項18】
請求項1に記載の方法において、
前記哺乳類組織が小腸粘膜下組織を含むことを特徴とする方法。
【請求項19】
請求項1に記載の方法において、
前記哺乳類の軟組織を洗浄して破壊された細胞を除去するステップと、
組織試料に対して少なくとも1の追加的な脱細胞化プロセスを行うステップとをさらに備えることを特徴とする方法。
【請求項20】
組織試料を解凍する方法であって、
少なくとも部分的に凍結した哺乳類組織を含む組織試料を液体中に与えるステップと、
凍結した組織試料を解凍するのに十分な圧力を前記液体に加えるステップとを備えることを特徴とする方法。
【請求項21】
請求項20に記載の方法において、
凍結した組織を解凍するステップが、
組織試料の固体状態の水の50%よりも多くを液体状態に相変態させるステップを備えることを特徴とする方法。
【請求項22】
請求項20に記載の方法において、
凍結した組織を解凍するステップが、
組織試料の固体状態の水の実質的にすべてを液体状態に相変態させるステップを備えることを特徴とする方法。
【請求項23】
請求項20に記載の方法において、
組織試料の温度を10℃よりも大きく昇温させることなく組織の解凍を行うことを特徴とする方法。
【請求項24】
請求項20に記載の方法において、
組織試料の温度を30℃よりも高い温度に上昇させることなく組織の解凍を行うことを特徴とする方法。
【請求項25】
請求項21に記載の方法において、
組織試料の温度を10℃よりも大きく昇温させることなく組織の解凍を行うことを特徴とする方法。
【請求項26】
請求項21に記載の方法において、
組織試料の温度を30℃よりも高い温度に上昇させることなく組織の解凍を行うことを特徴とする方法。
【請求項27】
請求項22に記載の方法において、
組織試料の温度を10℃よりも大きく昇温させることなく組織の解凍を行うことを特徴とする方法。
【請求項28】
請求項22に記載の方法において、
組織試料の温度を30℃よりも高い温度に上昇させることなく組織の解凍を行うことを特徴とする方法。
【請求項29】
請求項23乃至28の何れか一項に記載の方法において、
組織の解凍が30分未満で行われることを特徴とする方法。
【請求項30】
請求項23乃至28の何れか一項に記載の方法において、
組織の解凍が60分未満で行われることを特徴とする方法。
【請求項31】
請求項20に記載の方法において、
前記液体に加えられる圧力が少なくとも500MPaであることを特徴とする方法。
【請求項32】
請求項20に記載の方法において、
前記液体が塩類水溶液を含むことを特徴とする方法。
【請求項33】
請求項32に記載の方法において、
前記液体がリン酸緩衝生理食塩水を含むことを特徴とする方法。
【請求項34】
請求項20に記載の方法において、
組織に対して減菌プロセスを行うステップをさらに備えることを特徴とする方法。
【請求項35】
請求項34に記載の方法において、
前記減菌プロセスが、ガンマ線照射プロセスを含むことを特徴とする方法。
【請求項36】
請求項34に記載の方法において、
前記減菌プロセスが、電子ビーム照射プロセスを含むことを特徴とする方法。
【請求項37】
請求項34に記載の方法において、
前記減菌プロセスが、超臨界二酸化炭素減菌プロセスを含むことを特徴とする方法。
【請求項38】
請求項34に記載の方法において、
前記減菌プロセスが、過酢酸処理プロセスを含むことを特徴とする方法。
【請求項39】
請求項20に記載の方法において、
前記組織試料が軟組織を含むことを特徴とする方法。
【請求項40】
請求項36に記載の方法において、
前記軟組織が真皮を含むことを特徴とする方法。
【請求項41】
請求項37に記載の方法において、
前記軟組織がブタの真皮を含むことを特徴とする方法。
【請求項42】
請求項39に記載の方法において、
前記哺乳類組織が腱または靱帯の少なくとも一方を含むことを特徴とする方法。
【請求項43】
請求項39に記載の方法において、
前記哺乳類組織が小腸粘膜下組織を含むことを特徴とする方法。
【請求項44】
組織試料を脱細胞化する方法であって、
哺乳類組織を含む組織試料を、液体を含むコンテナ内に与えるステップと、
軟組織に含まれる細胞の実質的にすべてが破壊されるのに十分な時間、前記液体に圧力を加えるステップとを備え、
細胞の実質的にすべてを破壊するステップは、生理食塩水中で組織試料を洗浄することによりネイティブ組織細胞の少なくとも95%の除去が可能となるように、細胞の細胞膜を破壊するステップを含み、
組織試料の温度が30℃を超えないような速度で圧力が加えられることを特徴とする方法。
【請求項45】
請求項44に記載の方法において、
前記液体に加えられる圧力が少なくとも500MPaであることを特徴とする方法。
【請求項46】
請求項44に記載の方法において、
前記液体に加えられる圧力が、少なくとも30分間において、少なくとも300MPaであることを特徴とする方法。
【請求項47】
請求項44に記載の方法において、
前記液体に加えられる圧力が、少なくとも10分間において、少なくとも400MPaであることを特徴とする方法。
【請求項48】
請求項44に記載の方法において、
前記液体に加えられる圧力が、少なくとも40分間において、少なくとも400MPaであることを特徴とする方法。
【請求項49】
請求項44に記載の方法において、
前記液体が塩類水溶液を含むことを特徴とする方法。
【請求項50】
請求項49に記載の方法において、
前記液体がリン酸緩衝生理食塩水を含むことを特徴とする方法。
【請求項51】
請求項44に記載の方法において、
組織に対して減菌プロセスを行うステップをさらに備えることを特徴とする方法。
【請求項52】
請求項51に記載の方法において、
前記減菌プロセスが、ガンマ線照射プロセスを含むことを特徴とする方法。
【請求項53】
請求項51に記載の方法において、
前記減菌プロセスが、電子ビーム照射プロセスを含むことを特徴とする方法。
【請求項54】
請求項51に記載の方法において、
前記減菌プロセスが、超臨界二酸化炭素減菌プロセスを含むことを特徴とする方法。
【請求項55】
請求項51に記載の方法において、
前記減菌プロセスが、過酢酸処理プロセスを含むことを特徴とする方法。
【請求項56】
請求項44に記載の方法において、
前記哺乳類組織が皮膚を含むことを特徴とする方法。
【請求項57】
請求項56に記載の方法において、
前記哺乳類の軟組織がブタの真皮を含むことを特徴とする方法。
【請求項58】
請求項57に記載の方法において、
圧力を加える前に、皮膚から表皮層を除去するステップをさらに備えることを特徴とする方法。
【請求項59】
組織試料におけるバイオバーデンを減少させる方法であって、
哺乳類の軟組織を含む組織試料を、液体を含むコンテナ内に与えるステップと、
軟組織内の細菌濃度を少なくとも5log(対数)減少させるのに十分な時間、前記液体に圧力を加えるステップとを備え、
圧力を加えている間、組織試料の温度が30℃を超えないことを特徴とする方法。
【請求項60】
請求項59に記載の方法において、
前記液体に加えられる圧力が少なくとも500MPaであることを特徴とする方法。
【請求項61】
請求項59に記載の方法において、
前記液体に加えられる圧力が、少なくとも30分間において、少なくとも300MPaであることを特徴とする方法。
【請求項62】
請求項59に記載の方法において、
前記液体に加えられる圧力が、少なくとも10分間において、少なくとも400MPaであることを特徴とする方法。
【請求項63】
請求項59に記載の方法において、
前記液体に加えられる圧力が、少なくとも40分間において、少なくとも400MPaであることを特徴とする方法。
【請求項64】
請求項59に記載の方法において、
前記液体が塩類水溶液を含むことを特徴とする方法。
【請求項65】
請求項64に記載の方法において、
前記液体がリン酸緩衝生理食塩水を含むことを特徴とする方法。
【請求項66】
請求項59に記載の方法において、
組織に対して少なくとも1の追加的な減菌プロセスを行うステップをさらに備えることを特徴とする方法。
【請求項67】
請求項66に記載の方法において、
前記減菌プロセスが、ガンマ線照射プロセスを含むことを特徴とする方法。
【請求項68】
請求項66に記載の方法において、
前記減菌プロセスが、電子ビーム照射プロセスを含むことを特徴とする方法。
【請求項69】
請求項66に記載の方法において、
前記減菌プロセスが、超臨界二酸化炭素減菌プロセスを含むことを特徴とする方法。
【請求項70】
請求項66に記載の方法において、
前記減菌プロセスが、過酢酸処理プロセスを含むことを特徴とする方法。
【請求項71】
請求項59に記載の方法において、
前記哺乳類の軟組織が皮膚を含むことを特徴とする方法。
【請求項72】
請求項71に記載の方法において、
前記哺乳類の軟組織がブタの真皮を含むことを特徴とする方法。
【請求項73】
請求項71に記載の方法において、
圧力を加える前に、皮膚から表皮層を除去するステップをさらに備えることを特徴とする方法。
【請求項74】
請求項59に記載の方法において、
組織試料の温度が25℃を超えないことを特徴とする方法。
【請求項75】
請求項59に記載の方法において、
前記哺乳類の軟組織が真皮であることを特徴とする方法。
【請求項76】
請求項75に記載の方法において、
前記哺乳類の軟組織が無細胞の真皮であることを特徴とする方法。
【請求項77】
請求項59に記載の方法において、
前記哺乳類の軟組織が無細胞であることを特徴とする方法。
【請求項78】
組織試料におけるバイオバーデンを減少させる方法であって、
哺乳類の軟組織を含む組織試料を、液体を含むコンテナ内に与えるステップと、
少なくとも200MPaの圧力を前記液体に加えるステップとを備え、
圧力を加えている間、組織試料の温度が30℃を超えないことを特徴とする方法。
【請求項79】
請求項78に記載の方法において、
前記液体に加えられる圧力が少なくとも500MPaであることを特徴とする方法。
【請求項80】
請求項78に記載の方法において、
前記液体に加えられる圧力が、少なくとも30分間において、少なくとも300MPaであることを特徴とする方法。
【請求項81】
請求項78に記載の方法において、
前記液体に加えられる圧力が、少なくとも10分間において、少なくとも400MPaであることを特徴とする方法。
【請求項82】
請求項78に記載の方法において、
前記液体に加えられる圧力が、少なくとも40分間において、少なくとも400MPaであることを特徴とする方法。
【請求項83】
請求項78に記載の方法において、
前記液体が塩類水溶液を含むことを特徴とする方法。
【請求項84】
請求項83に記載の方法において、
前記液体がリン酸緩衝生理食塩水を含むことを特徴とする方法。
【請求項85】
請求項78に記載の方法において、
組織に対して少なくとも1の追加的な減菌プロセスを行うステップをさらに備えることを特徴とする方法。
【請求項86】
請求項85に記載の方法において、
前記減菌プロセスが、ガンマ線照射プロセスを含むことを特徴とする方法。
【請求項87】
請求項85に記載の方法において、
前記減菌プロセスが、電子ビーム照射プロセスを含むことを特徴とする方法。
【請求項88】
請求項85に記載の方法において、
前記減菌プロセスが、超臨界二酸化炭素減菌プロセスを含むことを特徴とする方法。
【請求項89】
請求項85に記載の方法において、
前記減菌プロセスが、過酢酸処理プロセスを含むことを特徴とする方法。
【請求項90】
請求項78に記載の方法において、
前記哺乳類の軟組織が皮膚を含むことを特徴とする方法。
【請求項91】
請求項90に記載の方法において、
前記哺乳類の軟組織がブタの真皮を含むことを特徴とする方法。
【請求項92】
請求項90に記載の方法において、
圧力を加える前に、皮膚から表皮層を除去するステップをさらに備えることを特徴とする方法。
【請求項93】
請求項78に記載の方法において、
組織試料の温度が25℃を超えないことを特徴とする方法。
【請求項94】
請求項78に記載の方法において、
前記哺乳類の軟組織が真皮であることを特徴とする方法。
【請求項95】
請求項94に記載の方法において、
前記哺乳類の軟組織が無細胞の真皮であることを特徴とする方法。
【請求項96】
請求項78に記載の方法において、
前記哺乳類の軟組織が無細胞であることを特徴とする方法。
【請求項97】
請求項78に記載の方法において、
前記哺乳類の軟組織中の細菌濃度を少なくとも5log(対数)減少させるのに十分な時間、前記液体に圧力が加えられることを特徴とする方法。
【請求項98】
組織製品であって、請求項1乃至97の何れか一項に記載の方法を使用して製造したことを特徴とする組織製品。
【請求項1】
組織試料を脱細胞化する方法であって、
哺乳類組織を有する組織試料を液体中に与えるステップと、
軟組織に含まれるネイティブ組織細胞の実質的にすべてを破壊するのに十分な時間、少なくとも200MPaの圧力を上記液体に加えるステップとを備え、
細胞の実質的にすべてを破壊するステップが、生理食塩水中で組織試料を洗浄することによりネイティブ組織細胞の少なくとも95%の除去が可能となるように、細胞の細胞膜を破壊するステップを含むことを特徴とする方法。
【請求項2】
請求項1に記載の方法において、
前記液体に加えられる圧力が少なくとも約500MPaであることを特徴とする方法。
【請求項3】
請求項1に記載の方法において、
前記液体に加えられる圧力が、少なくとも30分間において、少なくとも300MPaであることを特徴とする方法。
【請求項4】
請求項1に記載の方法において、
前記液体に加えられる圧力が、少なくとも10分間において、少なくとも400MPaであることを特徴とする方法。
【請求項5】
請求項1に記載の方法において、
前記液体に加えられる圧力が、少なくとも30分間において、少なくとも400MPaであることを特徴とする方法。
【請求項6】
請求項1に記載の方法において、
前記液体が塩類水溶液を含むことを特徴とする方法。
【請求項7】
請求項6に記載の方法において、
前記液体がリン酸緩衝生理食塩水を含むことを特徴とする方法。
【請求項8】
請求項1に記載の方法において、
組織に対して減菌プロセスを行うステップをさらに備えることを特徴とする方法。
【請求項9】
請求項8に記載の方法において、
前記減菌プロセスが、ガンマ線照射プロセスを含むことを特徴とする方法。
【請求項10】
請求項8に記載の方法において、
前記減菌プロセスが、電子ビーム照射プロセスを含むことを特徴とする方法。
【請求項11】
請求項8に記載の方法において、
前記減菌プロセスが、超臨界二酸化炭素減菌プロセスを含むことを特徴とする方法。
【請求項12】
請求項8に記載の方法において、
前記減菌プロセスが、過酢酸処理プロセスを含むことを特徴とする方法。
【請求項13】
請求項1に記載の方法において、
前記哺乳類組織が軟組織を含むことを特徴とする方法。
【請求項14】
請求項13に記載の方法において、
前記哺乳類組織が皮膚を含むことを特徴とする方法。
【請求項15】
請求項13に記載の方法において、
前記哺乳類の軟組織がブタの真皮を含むことを特徴とする方法。
【請求項16】
請求項14に記載の方法において、
圧力を加える前に、皮膚から表皮層を除去するステップをさらに備えることを特徴とする方法。
【請求項17】
請求項1に記載の方法において、
前記哺乳類組織が腱または靱帯の少なくとも一方を含むことを特徴とする方法。
【請求項18】
請求項1に記載の方法において、
前記哺乳類組織が小腸粘膜下組織を含むことを特徴とする方法。
【請求項19】
請求項1に記載の方法において、
前記哺乳類の軟組織を洗浄して破壊された細胞を除去するステップと、
組織試料に対して少なくとも1の追加的な脱細胞化プロセスを行うステップとをさらに備えることを特徴とする方法。
【請求項20】
組織試料を解凍する方法であって、
少なくとも部分的に凍結した哺乳類組織を含む組織試料を液体中に与えるステップと、
凍結した組織試料を解凍するのに十分な圧力を前記液体に加えるステップとを備えることを特徴とする方法。
【請求項21】
請求項20に記載の方法において、
凍結した組織を解凍するステップが、
組織試料の固体状態の水の50%よりも多くを液体状態に相変態させるステップを備えることを特徴とする方法。
【請求項22】
請求項20に記載の方法において、
凍結した組織を解凍するステップが、
組織試料の固体状態の水の実質的にすべてを液体状態に相変態させるステップを備えることを特徴とする方法。
【請求項23】
請求項20に記載の方法において、
組織試料の温度を10℃よりも大きく昇温させることなく組織の解凍を行うことを特徴とする方法。
【請求項24】
請求項20に記載の方法において、
組織試料の温度を30℃よりも高い温度に上昇させることなく組織の解凍を行うことを特徴とする方法。
【請求項25】
請求項21に記載の方法において、
組織試料の温度を10℃よりも大きく昇温させることなく組織の解凍を行うことを特徴とする方法。
【請求項26】
請求項21に記載の方法において、
組織試料の温度を30℃よりも高い温度に上昇させることなく組織の解凍を行うことを特徴とする方法。
【請求項27】
請求項22に記載の方法において、
組織試料の温度を10℃よりも大きく昇温させることなく組織の解凍を行うことを特徴とする方法。
【請求項28】
請求項22に記載の方法において、
組織試料の温度を30℃よりも高い温度に上昇させることなく組織の解凍を行うことを特徴とする方法。
【請求項29】
請求項23乃至28の何れか一項に記載の方法において、
組織の解凍が30分未満で行われることを特徴とする方法。
【請求項30】
請求項23乃至28の何れか一項に記載の方法において、
組織の解凍が60分未満で行われることを特徴とする方法。
【請求項31】
請求項20に記載の方法において、
前記液体に加えられる圧力が少なくとも500MPaであることを特徴とする方法。
【請求項32】
請求項20に記載の方法において、
前記液体が塩類水溶液を含むことを特徴とする方法。
【請求項33】
請求項32に記載の方法において、
前記液体がリン酸緩衝生理食塩水を含むことを特徴とする方法。
【請求項34】
請求項20に記載の方法において、
組織に対して減菌プロセスを行うステップをさらに備えることを特徴とする方法。
【請求項35】
請求項34に記載の方法において、
前記減菌プロセスが、ガンマ線照射プロセスを含むことを特徴とする方法。
【請求項36】
請求項34に記載の方法において、
前記減菌プロセスが、電子ビーム照射プロセスを含むことを特徴とする方法。
【請求項37】
請求項34に記載の方法において、
前記減菌プロセスが、超臨界二酸化炭素減菌プロセスを含むことを特徴とする方法。
【請求項38】
請求項34に記載の方法において、
前記減菌プロセスが、過酢酸処理プロセスを含むことを特徴とする方法。
【請求項39】
請求項20に記載の方法において、
前記組織試料が軟組織を含むことを特徴とする方法。
【請求項40】
請求項36に記載の方法において、
前記軟組織が真皮を含むことを特徴とする方法。
【請求項41】
請求項37に記載の方法において、
前記軟組織がブタの真皮を含むことを特徴とする方法。
【請求項42】
請求項39に記載の方法において、
前記哺乳類組織が腱または靱帯の少なくとも一方を含むことを特徴とする方法。
【請求項43】
請求項39に記載の方法において、
前記哺乳類組織が小腸粘膜下組織を含むことを特徴とする方法。
【請求項44】
組織試料を脱細胞化する方法であって、
哺乳類組織を含む組織試料を、液体を含むコンテナ内に与えるステップと、
軟組織に含まれる細胞の実質的にすべてが破壊されるのに十分な時間、前記液体に圧力を加えるステップとを備え、
細胞の実質的にすべてを破壊するステップは、生理食塩水中で組織試料を洗浄することによりネイティブ組織細胞の少なくとも95%の除去が可能となるように、細胞の細胞膜を破壊するステップを含み、
組織試料の温度が30℃を超えないような速度で圧力が加えられることを特徴とする方法。
【請求項45】
請求項44に記載の方法において、
前記液体に加えられる圧力が少なくとも500MPaであることを特徴とする方法。
【請求項46】
請求項44に記載の方法において、
前記液体に加えられる圧力が、少なくとも30分間において、少なくとも300MPaであることを特徴とする方法。
【請求項47】
請求項44に記載の方法において、
前記液体に加えられる圧力が、少なくとも10分間において、少なくとも400MPaであることを特徴とする方法。
【請求項48】
請求項44に記載の方法において、
前記液体に加えられる圧力が、少なくとも40分間において、少なくとも400MPaであることを特徴とする方法。
【請求項49】
請求項44に記載の方法において、
前記液体が塩類水溶液を含むことを特徴とする方法。
【請求項50】
請求項49に記載の方法において、
前記液体がリン酸緩衝生理食塩水を含むことを特徴とする方法。
【請求項51】
請求項44に記載の方法において、
組織に対して減菌プロセスを行うステップをさらに備えることを特徴とする方法。
【請求項52】
請求項51に記載の方法において、
前記減菌プロセスが、ガンマ線照射プロセスを含むことを特徴とする方法。
【請求項53】
請求項51に記載の方法において、
前記減菌プロセスが、電子ビーム照射プロセスを含むことを特徴とする方法。
【請求項54】
請求項51に記載の方法において、
前記減菌プロセスが、超臨界二酸化炭素減菌プロセスを含むことを特徴とする方法。
【請求項55】
請求項51に記載の方法において、
前記減菌プロセスが、過酢酸処理プロセスを含むことを特徴とする方法。
【請求項56】
請求項44に記載の方法において、
前記哺乳類組織が皮膚を含むことを特徴とする方法。
【請求項57】
請求項56に記載の方法において、
前記哺乳類の軟組織がブタの真皮を含むことを特徴とする方法。
【請求項58】
請求項57に記載の方法において、
圧力を加える前に、皮膚から表皮層を除去するステップをさらに備えることを特徴とする方法。
【請求項59】
組織試料におけるバイオバーデンを減少させる方法であって、
哺乳類の軟組織を含む組織試料を、液体を含むコンテナ内に与えるステップと、
軟組織内の細菌濃度を少なくとも5log(対数)減少させるのに十分な時間、前記液体に圧力を加えるステップとを備え、
圧力を加えている間、組織試料の温度が30℃を超えないことを特徴とする方法。
【請求項60】
請求項59に記載の方法において、
前記液体に加えられる圧力が少なくとも500MPaであることを特徴とする方法。
【請求項61】
請求項59に記載の方法において、
前記液体に加えられる圧力が、少なくとも30分間において、少なくとも300MPaであることを特徴とする方法。
【請求項62】
請求項59に記載の方法において、
前記液体に加えられる圧力が、少なくとも10分間において、少なくとも400MPaであることを特徴とする方法。
【請求項63】
請求項59に記載の方法において、
前記液体に加えられる圧力が、少なくとも40分間において、少なくとも400MPaであることを特徴とする方法。
【請求項64】
請求項59に記載の方法において、
前記液体が塩類水溶液を含むことを特徴とする方法。
【請求項65】
請求項64に記載の方法において、
前記液体がリン酸緩衝生理食塩水を含むことを特徴とする方法。
【請求項66】
請求項59に記載の方法において、
組織に対して少なくとも1の追加的な減菌プロセスを行うステップをさらに備えることを特徴とする方法。
【請求項67】
請求項66に記載の方法において、
前記減菌プロセスが、ガンマ線照射プロセスを含むことを特徴とする方法。
【請求項68】
請求項66に記載の方法において、
前記減菌プロセスが、電子ビーム照射プロセスを含むことを特徴とする方法。
【請求項69】
請求項66に記載の方法において、
前記減菌プロセスが、超臨界二酸化炭素減菌プロセスを含むことを特徴とする方法。
【請求項70】
請求項66に記載の方法において、
前記減菌プロセスが、過酢酸処理プロセスを含むことを特徴とする方法。
【請求項71】
請求項59に記載の方法において、
前記哺乳類の軟組織が皮膚を含むことを特徴とする方法。
【請求項72】
請求項71に記載の方法において、
前記哺乳類の軟組織がブタの真皮を含むことを特徴とする方法。
【請求項73】
請求項71に記載の方法において、
圧力を加える前に、皮膚から表皮層を除去するステップをさらに備えることを特徴とする方法。
【請求項74】
請求項59に記載の方法において、
組織試料の温度が25℃を超えないことを特徴とする方法。
【請求項75】
請求項59に記載の方法において、
前記哺乳類の軟組織が真皮であることを特徴とする方法。
【請求項76】
請求項75に記載の方法において、
前記哺乳類の軟組織が無細胞の真皮であることを特徴とする方法。
【請求項77】
請求項59に記載の方法において、
前記哺乳類の軟組織が無細胞であることを特徴とする方法。
【請求項78】
組織試料におけるバイオバーデンを減少させる方法であって、
哺乳類の軟組織を含む組織試料を、液体を含むコンテナ内に与えるステップと、
少なくとも200MPaの圧力を前記液体に加えるステップとを備え、
圧力を加えている間、組織試料の温度が30℃を超えないことを特徴とする方法。
【請求項79】
請求項78に記載の方法において、
前記液体に加えられる圧力が少なくとも500MPaであることを特徴とする方法。
【請求項80】
請求項78に記載の方法において、
前記液体に加えられる圧力が、少なくとも30分間において、少なくとも300MPaであることを特徴とする方法。
【請求項81】
請求項78に記載の方法において、
前記液体に加えられる圧力が、少なくとも10分間において、少なくとも400MPaであることを特徴とする方法。
【請求項82】
請求項78に記載の方法において、
前記液体に加えられる圧力が、少なくとも40分間において、少なくとも400MPaであることを特徴とする方法。
【請求項83】
請求項78に記載の方法において、
前記液体が塩類水溶液を含むことを特徴とする方法。
【請求項84】
請求項83に記載の方法において、
前記液体がリン酸緩衝生理食塩水を含むことを特徴とする方法。
【請求項85】
請求項78に記載の方法において、
組織に対して少なくとも1の追加的な減菌プロセスを行うステップをさらに備えることを特徴とする方法。
【請求項86】
請求項85に記載の方法において、
前記減菌プロセスが、ガンマ線照射プロセスを含むことを特徴とする方法。
【請求項87】
請求項85に記載の方法において、
前記減菌プロセスが、電子ビーム照射プロセスを含むことを特徴とする方法。
【請求項88】
請求項85に記載の方法において、
前記減菌プロセスが、超臨界二酸化炭素減菌プロセスを含むことを特徴とする方法。
【請求項89】
請求項85に記載の方法において、
前記減菌プロセスが、過酢酸処理プロセスを含むことを特徴とする方法。
【請求項90】
請求項78に記載の方法において、
前記哺乳類の軟組織が皮膚を含むことを特徴とする方法。
【請求項91】
請求項90に記載の方法において、
前記哺乳類の軟組織がブタの真皮を含むことを特徴とする方法。
【請求項92】
請求項90に記載の方法において、
圧力を加える前に、皮膚から表皮層を除去するステップをさらに備えることを特徴とする方法。
【請求項93】
請求項78に記載の方法において、
組織試料の温度が25℃を超えないことを特徴とする方法。
【請求項94】
請求項78に記載の方法において、
前記哺乳類の軟組織が真皮であることを特徴とする方法。
【請求項95】
請求項94に記載の方法において、
前記哺乳類の軟組織が無細胞の真皮であることを特徴とする方法。
【請求項96】
請求項78に記載の方法において、
前記哺乳類の軟組織が無細胞であることを特徴とする方法。
【請求項97】
請求項78に記載の方法において、
前記哺乳類の軟組織中の細菌濃度を少なくとも5log(対数)減少させるのに十分な時間、前記液体に圧力が加えられることを特徴とする方法。
【請求項98】
組織製品であって、請求項1乃至97の何れか一項に記載の方法を使用して製造したことを特徴とする組織製品。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2013−502275(P2013−502275A)
【公表日】平成25年1月24日(2013.1.24)
【国際特許分類】
【出願番号】特願2012−525634(P2012−525634)
【出願日】平成22年8月17日(2010.8.17)
【国際出願番号】PCT/US2010/045723
【国際公開番号】WO2011/022369
【国際公開日】平成23年2月24日(2011.2.24)
【出願人】(504154148)ライフセル コーポレーション (13)
【氏名又は名称原語表記】LifeCell Corporation
【Fターム(参考)】
【公表日】平成25年1月24日(2013.1.24)
【国際特許分類】
【出願日】平成22年8月17日(2010.8.17)
【国際出願番号】PCT/US2010/045723
【国際公開番号】WO2011/022369
【国際公開日】平成23年2月24日(2011.2.24)
【出願人】(504154148)ライフセル コーポレーション (13)
【氏名又は名称原語表記】LifeCell Corporation
【Fターム(参考)】
[ Back to top ]

