組織産生のための方法および手段ならびに得られる組織
本発明は、組織産生(再生、再建、補強および/または若返り)の分野に関する。より正確には、本発明は、特定の組織または細胞を再生するための、好ましくは、骨、脂肪、腱、筋肉、軟骨および骨髄間質のような間葉系組織、ならびに、血液学的な組織または細胞(RBC、WBC、血小板、リンパ球、血液学的幹細胞(HSC)、内皮前駆細胞(EPC)など)を再生するための方法に関連する。本発明はまた、損傷または疾患のある組織または細胞の再建、再生、若返りまたは補強を、本発明の方法によって得られる(再生された)組織または細胞を使用して哺乳動物対象において、好ましくはヒト患者において行うための方法に関連する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、組織産生(再生、再建、補強および/または若返り)の分野に関する。
【0002】
より正確には、本発明は、特定の組織または細胞を再生するための、好ましくは、骨、脂肪、腱、筋肉、軟骨および骨髄間質のような間葉系組織、ならびに、血液学的な組織または細胞(RBC、WBC、血小板、リンパ球、血液学的幹細胞(HSC)、内皮前駆細胞(EPC)など)を再生するための方法および手段(製造物およびデバイス)に関連する。
【0003】
本発明はまた、損傷または疾患のある組織または細胞の再建、再生、若返りまたは補強を、本発明の方法によって得られる(再生された)組織または細胞を使用して哺乳動物対象において、好ましくはヒト患者において行うための方法および手段(製造物およびデバイス)に関連する。
【背景技術】
【0004】
損傷または疾患のある組織、すなわち、骨を再建するための種々の技術が存在する。細胞媒介再生技術がそれらの1つである。
【0005】
間葉系幹細胞(MSC)またはHSCは、「間充織」として知られている骨髄間質において見出され、また、脂肪組織においてもまた見出される幹細胞に対応する。
【0006】
MSCおよびHSCは、適切な数の細胞を得るためにエクスビボ培養で拡大することができる。しかしながら、大量の骨髄の採取および長時間の培養が、十分な量の幹細胞を得るために要求される。幹細胞のインビトロ培養はその増殖能力を変化させ、また、その分化能を低下させる。これらの細胞は分化および増殖についての多能性を示し、また、適切なサイトカインおよび増殖因子、ならびに、EPCを含む血液学的細胞を使用して様々なタイプの細胞(例えば、筋肉、血管系、ニューロン組織、肝臓、骨芽細胞、軟骨細胞、筋芽細胞、ケラチノブラストおよび線維芽細胞など)に分化させることができる。
【0007】
これらのMSCを細胞媒介再生技術において使用することがこれまで長い間提案されている。
【0008】
さらには、老化は幹細胞の特性およびその分化能力を変化させることが知られている。
【0009】
実際、骨再生方法では、MSCが患者から取り出され、適切な骨増殖因子を使用してインビトロで増殖させられ、骨芽細胞に分化させられる。このように、骨組織が生じさせられ、その後、再建方法において患者への埋め込みのためにインプラントとして使用される。心臓発作後、患者は、大量の骨髄サンプルを集めるために局所麻酔され、その後、骨髄サンプルは、全量または一部が、すなわち、細胞分取後に再注入される。ガン治療では、幹細胞を単離し、刺激し、そして、場合により、患者へのその再注入の前に、エクスビボでトランスフェクションすることができる。白血病を処置するための移植のための補助剤として、多量の異種MSCがドナーの骨髄と一緒に注入される。
【0010】
組織再生および組織再建における血小板富化血漿(「PRP」と略記される)の潜在的使用のための研究が既に開始されている。
【0011】
PRPは間質幹細胞のインビトロ増殖を誘導する能力があることが立証されている(Lucarelli E.他、Biomaterials、24(2003)、3095頁〜3100頁)。
【0012】
近年の科学的研究はまた、骨再建においてMSCとともにグラフト材料として使用される血小板富化血漿(「PRP」と略記される)の有益な効果に関する最初の結果を与えている(Kitoh H.他、Clin.Oral Implants Res.、第15(5)巻(2004)、589頁〜597頁;Yamada Y他、J.Biomed.Mater.Res.、第68A(4)巻(2004)、747頁〜755頁)。
【0013】
それにもかかわらず、MSC−HSCを使用する組織再生の現在の方法、および、HSC細胞では、いくつかの欠点がもたらされる。具体的には、生じた骨組織に、適切な形状を与えることが、これらの方法および細胞に関して困難である。埋め込みに耐えるための十分な機械的強度を有する骨組織を得ることもまた困難である。その上、インビトロ培養では、骨組織を十分な量で得るために非常に時間がかかる。
【発明の概要】
【0014】
本発明は、(ヒト胚性でない)幹細胞(好ましくはMSCおよびEPC、場合により、HSCを除いて)を得ること、および/または、(ヒト胚性でない)幹細胞(好ましくはMSCおよびEPC、場合により、HSCを除いて)の増殖を誘導することのための、また、哺乳動物の組織または細胞の「産生」(再生、再建、補強および/または若返り)のための、先行技術の欠点を示さない改善された、また、代替となり得る方法および手段を提供する。
【0015】
好ましくは、MSCは、CD105、CD73、CD90からなる群から選択される1つ、2つまたは(好ましくは)3つの陽性マーカーを(その細胞表面に)発現し、かつ、CD45、CD34、CD14、CD19およびHLA−DRからなる群から選択される1つ、2つ、3つ、4つまたは(好ましくは)5つのマーカーの(その細胞表面における)発現を有しないとして定義される。
【0016】
代替として(または加えて)、MSCは、標準的な培養条件で維持されるとき、プラスチック接着性の細胞である。
【0017】
代替として(または加えて)、MSCは、骨芽細胞、脂肪細胞および/または軟骨細胞にインビトロで分化することができる。
【0018】
好ましくは、EPCは、CD133およびCD34の両方を(その細胞表面に)発現するとして定義され、好ましくは、CD31および/またはCD144をさらに発現し、しかし、場合により、CD45を発現しない。
【0019】
代替として(または加えて)、EPCは、コロニーをインビトロで形成するその能力によって定義され、この場合、好ましくは、コロニーは、より多くの細長い出芽細胞が周辺部に存在する丸い細胞の中央コアとして定義される。
【0020】
代替として(または加えて)、EPCは、VEGFの存在下でのマトリゲルアッセイにおいて置床されるときのその血管形成性によって定義される。
【0021】
好ましくは、HSCは、CD34マーカーおよびCD45マーカーを発現するとして定義される。
【0022】
本発明は、哺乳動物対象(ヒト患者を含む)における起こり得る移植片対宿主拒絶および宿主対移植片拒絶を軽減または回避し、同様にまた、哺乳動物対象(ヒト患者を含む)における、損傷組織または疾患組織の、組織または細胞の再生、再建または補強の後での感染の欠点を軽減または回避する方法および手段を提案する。
【0023】
本発明はさらに、高齢患者の場合には、あるいは、心臓発作または心臓障害に苦しむ人々の場合にはとりわけ有害である全身麻酔を何ら必要としないかもしれない、改善および簡略化された方法および手段を提案する。
【0024】
好都合なことに、本発明の製造物、方法および手段は、組織または細胞を再生するために使用される。
【0025】
具体的には、本発明は、(骨)再建のための満足できる構造的特徴および物理的特徴を有する新しい(骨)組織を得ることを可能にする方法および手段を提供する。これらの物理的特徴には、すなわち、形状、機械的強度および弾力性が含まれる。生物学的特徴には、すなわち、骨、皮膚、脂肪または筋肉のようないくつかの成熟組織における、増殖、委任および分化の高い可能性を有する未成熟な細胞の高い割合および濃度が含まれる。
【0026】
本発明はまた、MSCと、場合により、EPC(場合により、HSCを除いて)とを含む高濃度の未成熟な幹細胞を骨髄において誘導することによって、および/または、高濃度のEPC細胞を血液において誘導することによって幹細胞を動員する、心臓発作を処置するための方法および手段を提供する。
【0027】
実際、手術手技後のようなすべての炎症性状態、または、炎症性疾患もまた、本発明の方法および手段から利益を受けることができる。これは、炎症は、当然のことながら、幹細胞を動員するからであり、また、幹細胞における増大は、当然のことながら、必要性がある分化した細胞に変換され得るからである。
【0028】
本発明はまた、インビトロ培養時間を短くするか、または抑え、かつ、必要とされる集められた骨髄の量を少なくする簡便化された方法および手段を提供する。
【0029】
本発明は、幹細胞(好ましくはMSC−EPC、場合により、HSCを除いて)を得るための、また、場合により、(a)哺乳動物対象の組織または細胞の再生、再建、補強および/または若返りのための、好ましくは、(a)ヒト患者の組織または細胞の再生、再建、補強および/または若返りのための方法および手段に関連し、この場合、この方法は下記の工程を含む:
a)(液体)血液サンプルをこの哺乳動物対象から、好ましくはヒト患者から集める工程;
b)自己PRPをこの血液の血漿サンプルから調製する工程、ただし、PRPの血小板割合の濃縮が好ましくは、この哺乳動物対象の全血の約100%〜約1000%の間で、好ましくはこのヒト患者の全血の約100%〜約1000%の間で含まれ、より好ましくは、この哺乳動物対象の全血の約200%〜約500%の間で、好ましくはこのヒト患者の全血の約200%〜約500%の間で含まれる;
c)この自己PRPを、
・トロンビン(異種トロンビン、自己トロンビン、あるいは、組換え型のヒトトロンビンまたはウシトロンビン)、これには、(活性化型または非活性化型である)組換えトロンビン(FII)が含まれる;
・トロンビン、とりわけ、トロンボプラスチン(組織因子)、好ましくは組換えトロンボプラスチン(rTF)、より好ましくはヒト組織因子(hTF)、一層より好ましくは組換えヒト組織因子(rhTF)、より具体的には組換え可溶性ヒト組織因子(rshTF)を産生することができる化合物(凝固因子)、これは、場合により、リン脂質(PL)(例えば、ホスファチジルコリン、ホスファチジルセリンおよびホスファチジルエタノールアミンなど)の添加と組み合わせられる;
・CaCl2、
・(組換え)ヒト第VII因子またはヒト第VIIa因子(例えば、化合物NOVOSEVEN(登録商標)など)、
・(組換え)ヒト第X(a)因子、
・(組換え)組織因子または(組換え)第VII因子または(組換え)第VIIa因子、
・(組換え)組織因子および第Xa因子、
・(組換え)組織因子/第VIIa因子/第Xa因子、
・(組換え)第VIII因子、
・(組換え)第IX因子、あるいは
・上記化合物の組合せ
からなる群から選択される効果的な量の(活性な)哺乳動物化合物、好ましくは、(活性な)ヒト化合物により活性化して、その結果、濃縮された活性化自己血小板富化血漿を含有する第1の流体(溶液)を得る工程;
d)胚性でない(好ましくはMSC、EPC)幹細胞が多い目標注入領域(好ましくは胸骨または腸骨稜に由来する骨髄)または脂肪組織を同じ哺乳動物対象において、好ましくは同じヒト患者において選択する工程;
e)この第1の流体(溶液)を哺乳動物対象のこの目標注入領域に、好ましくはヒト患者のこの目標注入領域に注入して、その結果、(好ましくはMSC−EPC)幹細胞のインビボ増殖をこの哺乳動物対象において、好ましくはこのヒト患者において局所的に誘導する工程;
f)場合により、十分なインキュベーション時間の後で、同じ哺乳動物対象から、好ましくは同じヒト患者から、この目標注入領域からの、(MSC、EPC)細胞が多い骨髄(液)サンプル、または、この哺乳動物からの血液サンプル、または、この哺乳動物からの脂肪サンプルのどれかを集め、幹細胞をこのサンプルから回収する工程;
場合により、工程a)〜工程e)、または、工程a)〜工程f)を、規定された時間間隔で数回(好ましくは少なくとも2回、3回または4回)(好ましくは毎週)繰り返す工程;
g)場合により、第2の血液サンプルを集める工程;
h)場合により、第2の自己血小板富化血漿をこの第2の血液サンプルから調製する工程;
i)場合により、この自己血小板富化血漿を、工程c)において添加される上記の活性化合物の効果的な量の添加によって活性化して、その結果、濃縮された活性化自己血小板富化血漿を含有する第2の流体(溶液)をこの第2の血液サンプルから得る工程;
j)場合により、この第2の流体(溶液)と、幹細胞が多い、以前に集められた骨髄サンプルまたは血液サンプルまたは脂肪サンプルとを混合して、その結果、活性化された濃縮自己血小板富化血漿および幹細胞を含む組成物を得る工程;
k)場合により、分化補助剤をこれらの幹細胞に加えて、好ましくは(活性化された濃縮自己PRPおよび幹細胞を含む)組成物に加えて、その結果、(場合により、HSCを除いて、MSC、EPC)幹細胞の「事前に規定された」分化した組織細胞への分化を誘導し、場合により、所望される組織の再生を得る工程、ただし、これらの補助剤は、工程c)において使用される上記の活性化合物、ならびに/あるいは、細胞固定のための少なくとも1つのマトリックス、および、特定の細胞(例えば、骨芽細胞系細胞(骨細胞、骨芽細胞など)、筋肉細胞、内皮細胞、ニューロン細胞、肝細胞または線維芽細胞およびケラチノサイトなど)への幹細胞の分化を得る(誘導する)ための1つまたは複数の要素を含み、この場合、これらの要素は好ましくは、ビタミン(ビタミンC(L−アスコルビン酸)、ビタミンD3(1,25(OH)2D3ビタミン))、コルチゾン(またはコルチゾン誘導体、例えば、デキサメタゾン、ヒドロコルチゾン、プレドニゾロン、メチルプレドニゾロン、デキサメタゾン、トリアムシノロン、ベタメタゾンなど)、および、場合により、β−グリセロホスファート(これらの要素は好ましくは、これらの要素の遅い放出を可能にする、ポリDL−乳酸−co−グリコール酸(PLGA)、ポリグリコール酸および/またはポリ−L−乳酸(PLLA)、アルギン酸塩の足場(例えば、マイクロビーズなど)に存在する)、ならびに/あるいは、BMP2(これはMEDTRONICSから得られるかもしれない)、または、上皮増殖因子、または、神経増殖因子、または、当業者によって知られている任意の他のサイトカイン、増殖因子もしくは分化因子からなる群から選択される;および
l)場合により、活性化された濃縮自己血小板富化血漿およびMSCを含む組成物に、適切なゲル化剤(このゲル化剤は好ましくは、工程c)において添加される活性化合物の十分な量から得られる)を加えて、ゲルを得る工程;および
m)場合により、そのようにして得られたゲルを、哺乳動物対象の目標再建部位(例えば、自己採取骨、同種移植片、異種移植片またはコラーゲンリーフなど)の内部/表面に、好ましくはヒト患者の目標再建部位(例えば、自己採取骨、同種移植片、異種移植片またはコラーゲンリーフなど)の内部/表面に場合により適用することによって、得られたゲルをインプラントとして使用して、その結果、組織再建がこの再建部位において生じ得るようにする工程。
これらの工程a)〜工程m)を、十分な量の幹細胞を得るように、規定された時間間隔で数回(好ましくは少なくとも2回、3回または4回)(好ましくは毎週)繰り返すことができる。
【0030】
本発明はさらに、下記の工程を含む、活性化MSCが富化された(単核)細胞(MSC)集団を得るための方法に関連する:
・必要な場合には、骨髄幹細胞を、好ましくは本発明の方法によって、かつ/または、PRPおよび凝固因子の添加によって活性化する工程;
・活性化された骨髄のサンプルを得る工程;
・必要な場合には、このサンプルの幹細胞を富化する工程。
【0031】
好ましくは、活性化MSCが富化された(単核)細胞(MSC)集団を得るためのこの方法では、(インビトロで成長させられるときに)コロニー(CFU−F)を形成するこれらのMSCの能力が増大しており、より好ましくは少なくとも約30%(少なくとも約50%、なおさらにより好ましくは少なくとも約100%)増大している。
【0032】
好都合なことに、または、加えて、活性化MSCが富化された(単核)細胞(MSC)集団を得るためのこの方法では、少なくとも約13個のコロニー(より好ましくは少なくとも約15個のコロニー、なおさらにより好ましくは少なくとも約20個のコロニー)(CFU−F)が、この活性化骨髄に由来するサンプルから得られる1000000個の単核細胞のインビトロ培養のときに形成される。
【0033】
好都合なことに、または、加えて、活性化MSCが富化された(単核)細胞(MSC)集団を得るためのこの方法では、MSCの(インビトロ)培養のときに形成されるコロニー(CFU−F)の少なくとも約35%(より好ましくは少なくとも約40%、なおさらにより好ましくは少なくとも約50%)が骨原性マーカー(例えば、アルカリホスファターゼなど)を発現する。
【0034】
好ましくは、活性化MSCが富化された(単核)細胞(MSC)集団を得るためのこの方法では、幹細胞の富化が、骨髄サンプルの遠心分離(これにより、上清液、非MSC細胞および破片が富化されたペレット、ならびに、(活性化)MSC細胞が富化された中間画分がもたらされる)、および、この中間画分の回収によって行われる。
【0035】
本発明の別の局面が、活性化MSCの(増大した)集団を含む骨髄サンプルに関連し、この場合、好ましくは、(インビトロで成長させられるときに)コロニー(CFU−F)を形成するこの(活性化)MSCの能力が増大しており、より好ましくは少なくとも約30%(より好ましくは少なくとも約50%、なおさらにより好ましくは少なくとも約100%)増大している。
【0036】
好都合なことに(または加えて)、活性化MSCの(増大した)集団を含むこの骨髄サンプルにおいて、少なくとも約13個のコロニー(少なくとも約15個のコロニー、なおさらにより好ましくは少なくとも約20個のコロニー)(CFU−F)が、このサンプルから得られる1000000個の単核細胞のインビトロ培養(好ましくは、この活性化骨髄から得られる1000000個の単核細胞のインビトロ培養)のときに形成される。
【0037】
好都合なことに(または加えて)、活性化MSC集団が富化されたこの骨髄サンプルにおいて、MSCの培養によって形成されるコロニー(CFU−F)の少なくとも約35%(より好ましくは少なくとも約40%、なおさらにより好ましくは少なくとも約50%)が骨原性マーカー(例えば、アルカリホスファターゼなど)を発現する。
【0038】
場合により、活性化MSCが富化されたMSC集団を得るためのこの方法において、および/または、活性化MSCが富化されたこの骨髄サンプルにおいて、EPCの(相対的)含有量が増大せず、かつ/または、HSCの含有量が低下する。
【0039】
本発明の方法によって得られるMSC細胞は好都合なことに、哺乳動物対象に対して、好ましくはヒト患者に対して、好ましくは再生させるための部位の近く(またはその部位)に注入され、または、代替として、輸血によって注入される。
【0040】
本発明による方法は、損傷組織もしくは疾患組織の組織を再生するために、または、毒性化合物の影響を特徴づけるためのスクリーニング細胞として使用される特定の幹細胞を回収するために、あるいは、自己または異種であろうとも、将来の使用のために(バンクにおいて)保管するために使用することができる。
【0041】
本発明によれば、用語「組織再生」は、新しい組織を幹細胞から再生することを示し、用語「再建」または用語「補強」は、この得られた再生組織を、組織修復または組織成長刺激が必要とされる哺乳動物対象に、好ましくは、組織修復または組織成長刺激が必要とされるヒト患者に埋め込み、一体化させることを示す。組織修復または刺激が、患者の組織に影響を及ぼすか、または、患者の全体的な全身的健康状態に影響を及ぼす損傷、疾患または衰弱(加齢状態)のために要求されるかもしれない。組織再生が、ガン、心筋症、先天性心臓疾患、冠状動脈疾患、虚血、拡張期機能不全、心内膜炎、心筋梗塞、パーキンソン病、アルツハイマー病、ハンチントン病、テイ・サックス病、脊髄傷害、脳卒中、脳血管障害、再生不良性貧血、多発性硬化症、関節リウマチ、シェーグレン症候群、1型糖尿病、グレーヴズ病、エリテマトーデス、骨再建、骨萎縮、骨粗鬆症および骨補強、ならびに、場合により、アテローム性動脈硬化および心筋炎の場合には特に必要とされる。
【0042】
したがって、用語「再建部位」は、修復目的または補強目的のための組織再建が要求される哺乳動物体内組織の特定の部位を示す。
【0043】
本発明によれば、「血小板富化血漿(PRP)」は、血小板の濃度が、処置された哺乳動物対象(ヒト患者)のベースライン静脈カウント数に対して少なくとも約100%の割合で増大しており、好ましくは約200%〜1000%の間の割合で増大しており、かつ、(1マイクロリットル(μL)あたり)少なくとも600000個の血小板濃度、または、1μLあたり少なくとも800000個の血小板濃度、または、1μLあたり少なくとも1000000個の血小板の血小板濃度に達し、好ましくは、1μLあたり約800000個(または約1500000個の血小板)〜1μLあたり約6000000個(または約8000000個の血小板)の間の血小板濃度に達し、より好ましくは、1μLあたり約2000000個の血小板〜1μLあたり約5000000個の血小板の間の血小板濃度に達する流体(溶液)を意味する。PRPは、遠心分離デバイスを用いて、例えば、米国特許第6719901号、国際公開WO02/080991、米国特許第6855119号、国際公開WO03/106040、国際公開WO00/61256および国際公開WO2004/024198に記載される遠心分離デバイスなどを用いて、都合よく得られる。
【0044】
Graziani F他、Clinical oral implant research、第17巻、第2号、212頁〜219頁(2006)は、細胞増殖に対する種々のPRP濃度の影響を調べている。最大の効果が2.5倍の濃度で達成され、より高濃度では、細胞増殖における低下がもたらされたようである。細胞増殖に対するPRPの最も注目すべき影響が約72時間で特徴づけられた。このときの血小板濃度は、得ることができた最大濃度のおよそ半分であった。しかしながら、一部の細胞増殖については、PRPのより高い濃度が好まれ得るかもしれない。
【0045】
トロンビンは、好都合には、自己トロンビン、異種トロンビンまたは組換えトロンビンが可能であり、好ましくは組換えトロンビンが可能であり、例えば、ZYMOGENETICS社(www.zgi.com)によって製造される組換えトロンビンなどが可能である。
【0046】
好ましくは、約10単位〜約200単位の(組換え型、ウシ型または自己)トロンビンが、より好ましくは、約10単位〜約75単位の(組換え)トロンビンが、6ml〜20mlの抗凝固処理(不活性化)PRPに加えられる。
【0047】
したがって、PRPの非常に遅い凝固を誘導するために、(組換え型、ウシ型または自己)トロンビンが、約0.5単位/ml〜約33単位/mlで、好ましくは約0.5単位/ml〜約3.75単位/mlで、より好ましくは約1.5単位/ml〜約3.75単位/mlで抗凝固処理(不活性化)PRPに加えられる。
【0048】
代替では、PRPの遅い凝固を誘導するために、(組換え型、ウシ型または自己)トロンビンが、約0.5単位/ml〜約10単位/mlで、好ましくは約1.5単位/ml〜約10単位/mlで抗凝固処理(不活性化)PRPに加えられる。
【0049】
トロンビン単位は、1mlのシュウ酸塩添加血漿を37℃において30秒で凝固する物質である。
【0050】
哺乳動物の血液凝固に関与する他の凝固因子(第VII因子、第VIIa因子(Novonordiskから得られるNovoSeven(登録商標))、第VIII因子、第IX因子、第X因子、第Xa因子など)もまた使用することができ、あるいは、血液凝固に関与する(またはトロンビンを生じさせることができる)どのような化合物もまた使用することができる。しかしながら、トロンボプラスチン(ヒト組織因子:hTFまたはhTf)が好ましい。これは、トロンボプラスチンは安全であり、かつ、可溶性形態で提供することができ、また、トロンビンに反して、凝固カスケードが制御可能であり、かつ、血液凝固があまり急速に得られないからである。組成物に存在するかもしれない関連脂質および他の分子の例が欧州特許EP1239894に記載される。
【0051】
好ましくは、PRPおよび凝固因子(凝固因子はより好ましくは可溶性ヒト組織因子(shTf)である)が、患者への注入の前(直前)に混合される。
【0052】
好都合には、PRPおよび凝固因子(凝固因子はより好ましくは可溶性ヒト組織因子(shTf)である)が、(好ましくは、約20℃〜約37℃の間に含まれる温度で)混合され、これらは、(約20℃〜約37℃の間に含まれる温度で)好ましくは数分間、可溶性のままである。
【0053】
より好ましくは、PRPは、凝固因子(凝固因子はより好ましくはshTfである)と混合されたとき、非常にゆっくり凝固し、好ましくは、混合されたときには、1分間を越えて、より好ましくは、2分間を越えて、3分間を越えて、4分間を越えて、または、5分間を越えてさえ、液体(可溶性)のままである(または、液体(可溶性)のままであることができる)(この場合、温度は約20℃〜約37℃の間に含まれる)。
【0054】
一層より好ましくは、PRPは、凝固因子(凝固因子はより好ましくはshTfである)と混合されたとき、非常にゆっくり凝固し、好ましくは、哺乳動物対象(ヒト患者)に注入されたとき、30秒間を越えて、より好ましくは、1分間を越えて、2分間を越えて、3分間を越えて、4分間を越えて、または、5分間を越えてさえ、液体(可溶性)のままである(または、液体(可溶性)のままであることができる)。
【0055】
好ましくは、約600単位〜約120000単位の(活性化)第VIIa因子(約12μg〜約2400μg)が、より好ましくは、約600単位〜約60000単位の(活性化)第VIIa因子(約12μg〜約1200μg)が、なおさらにより好ましくは、約600単位〜約6000単位の(活性化)第VIIa因子(約12μg〜約120μg)が、6ml〜20mlの抗凝固処理(不活性化)PRPに加えられる。
【0056】
したがって、(PRPの遅い凝固を誘導するために)、(活性化)第VIIa因子が、約30単位/ml(0.6μg/ml)〜約20000単位/ml(400μg/ml)で、好ましくは約30単位/ml(0.6μg/ml)〜約10000単位/ml(200μg/ml)で、より好ましくは約30単位/ml(0.6μg/ml)〜約1000単位/ml(20μg/ml)で抗凝固処理(不活性化)PRPに加えられる。
【0057】
代替では、(PRPの非常に遅い凝固を誘導するために)、(活性化)第VIIa因子が、約30単位/ml(0.6μg/ml)〜約6000単位/ml(120μg/ml)で、好ましくは約30単位/ml(0.6μg/ml)〜約3000単位/ml(60μg/ml)で、より好ましくは約30単位/ml(0.6μg/ml)〜約300単位/ml(6μg/ml)で、なおさらにより好ましくは約100単位/ml(2μg/ml)〜約300単位/ml(6μg/ml)で抗凝固処理(不活性化)PRPに加えられる。
【0058】
種々のリン脂質(ホスファチジルコリン、ホスファチジルエタノールアミンおよび/またはホスファチジルセリン)の添加を伴うヒト組織因子(hTF)が、ヒトトロンボプラスチンによって意味される。このhTfは、(完全な)hTfの263個のアミノ酸から、243個のアミノ酸(組織因子の細胞質外テールおよび膜部分)のポリペプチドまたは単に(短縮された)(可溶性)組織因子である短縮型hTfから、219個または206個のアミノ酸(細胞質外テールのみ)のポリペプチドから、あるいは、それらの任意の変化体から作製することができる。
【0059】
好ましくは、100μg〜3000μgの可溶性組織因子が、より好ましくは、約300μg〜約900μgの可溶性組織因子が、約6ml〜約20mlの抗凝固処理(不活性化)PRPに加えられる。
【0060】
したがって、(非常に遅い凝固を誘導するために)、約2μg/ml〜約150μg/mlの可溶性組織因子が、好ましくは、約15μg/ml〜約150μg/mlの可溶性組織因子が、なおさらにより好ましくは、約15μg/ml〜約45μg/mlの可溶性組織因子が、抗凝固処理(不活性化)PRPに加えられる。
【0061】
代替では、(PRPの遅い凝固を誘導するために)、約15μg/ml〜約500μg/mlの可溶性組織因子が、好ましくは、約50μg/ml〜約150μg/mlの可溶性組織因子が、抗凝固処理(不活性化)PRPに加えられる。
【0062】
(非修飾)hTfの変化体は、非修飾分子の機能的活性(PRPの活性化)に影響を及ぼさない、1つまたは複数のアミノ酸の欠失、付加または置換を含むことができる。
【0063】
PRPの活性化はまた、凝固カスケードに関与する他の分子によって得ることができ、好ましくは、上記方法の工程c)において使用される活性化合物の1つによって得ることができる。
【0064】
これらの様々な活性化合物は、とりわけ、凝固因子は、1つまたは複数の混入物(とりわけ、細菌またはウイルス)の伝播を避けるために、1つまたは複数の不活性化工程に付すことができる。この不活性化工程は、溶媒/界面活性剤、乾熱、UVC不活性化などを加えることに基づくことができる。
【0065】
本発明の方法では、とりわけ、上記方法の工程k)において、マイクロビーズが、媒体層がアスコルビン酸を含有し、かつ、内層被覆がβ−グリセロホスファートを含む薬物送達システムとして使用される。
【0066】
これらのマイクロビーズの他の改変を、選択された部位へのその補充、および、所望される細胞(例えば、筋肉細胞、血管細胞、ニューロン細胞、肝細胞、骨芽細胞、線維芽細胞など)へのその委任、分化のためには特に、幹細胞の分化を改善するための本発明による方法において使用することができる。
【0067】
好ましい実施形態において、本発明による方法では、工程a)、工程b)および工程c)が行われず、工程d)および工程e)が下記のように変更される:
d)幹細胞が多い目標注入領域(好ましくは、哺乳動物の胸骨または腸骨稜)を哺乳動物対象において、好ましくはヒト患者の骨髄において選択すること、
e)十分な量の幹細胞活性化流体または工程c)で使用される活性化合物を哺乳動物対象(ヒト患者)のこの目標注入領域に注入して、その結果、自己PRPを加えることなく、(間葉系)幹細胞のインビボ増殖を直接、哺乳動物対象(好ましくはヒト患者)において局所的に誘導すること。
【0068】
本方法のこの好ましい実施形態の他の工程、すなわち、工程f)〜工程m)は、上記で記載される工程に対応し得る。
【0069】
別の好ましい実施形態において、工程f)〜工程m)が行われず、工程a)〜工程e)が、哺乳動物対象(ヒト患者)の身体において、とりわけ、幹細胞の濃度が低い高齢者(50歳を超える高齢者、好ましくは、約60歳の高齢者または65歳を超える高齢者)において、幹細胞の増殖を得るために使用される。幹細胞の刺激によるこの若返り工程が、組織または細胞の再生、再建、補強または若返りを改善するために、とりわけ、このヒト患者身体における損傷または疾患のある組織または細胞の再生、再建、補強または若返りを改善するために、好ましくは(ヒト)患者の身体に対する可能な外科手術の前に行われる。
【0070】
必要ならば、前記刺激を、工程a)〜工程c)を使用することなく、前記実施形態において記載されるように得ることができ、また、PRPの添加を伴うことなく、上記で提案されるように工程d)および工程e)を選択することによって得ることができる。
【0071】
本発明による方法では、十分なインキュベーション時間の後、当業者は、幹細胞が多い骨髄(液)サンプルを、好ましくは目標注入領域から集めることができ、または、(EPC、MSC)幹細胞が同様に多い血液サンプルを集めることができる。
【0072】
この回収工程(f)は、幹細胞のインビボ増殖がまた、哺乳動物対象の血液へのこれらの幹細胞の増殖を誘導しているという事実のために、血液サンプルに対して行うことができる。したがって、当業者によって広く知られている方法によって、例えば、古典的なプラスマフェレーシス透析法およびプラスマフェレーシス透析手段などによって、血液サンプルから直接、幹細胞を回収することが可能である。
【0073】
本発明は、(非凝固および/または可溶性)PRPおよび(十分な量の)凝固因子、または、それらを含む(医薬用)組成物を、医薬品として、好ましくはPRPおよび凝固因子の非凝固および/または可溶性の混合物の形態で提供する。
【0074】
好ましくは、PRPおよび凝固因子(凝固因子は好ましくはshTfである)が、患者への注入の前(直前)に混合される。
【0075】
より好ましくは、PRPは、凝固因子(凝固因子は好ましくはshTfである)と混合されたとき、非常にゆっくり凝固し、好ましくは、1分間を越えて、より好ましくは、2分間を越えて、3分間を越えて、4分間を越えて、または、5分間を越えてさえ、液体(非凝固および/または可溶性)のままである(または、液体(非凝固および/または可溶性)のままであることができる)。
【0076】
凝固因子の十分な量によって、(不活性化)PRPの(非常に)遅い凝固を可能にする量が意味される。
【0077】
より好ましくは、本発明は、PRPおよび凝固因子(血液凝固に関与する化合物)(の非凝固および/または可溶性の混合物)(ただし、凝固因子は、(好ましくは可溶性)トロンボプラスチン(または組織因子(TF))、第Xa因子、第VIIa因子またはそれらの混合物からなる群から選択される)、または、それらを含む(医薬用)組成物を医薬品として提供する。
【0078】
なおさらにより好ましくは、本発明は、PRPおよびこの凝固因子(血液凝固に関与する化合物)(の非凝固および/または可溶性の混合物)、または、それらを含む(医薬用)組成物を、哺乳動物対象の幹細胞プール、好ましくはヒト患者の幹細胞プール、好ましくはEPCおよび/またはMSCを、より好ましくはHSCプールを変化させることなく、または、止血を変化させることなく富化するための医薬品としての使用のために提供する。
【0079】
代替では、本発明は、凝固因子、好ましくは、(好ましくは可溶性)トロンボプラスチン(または組織因子(Tf))、第Xa因子、第VIIa因子またはそれらの混合物からなる群から選択される凝固因子(より好ましくは可溶性組織因子(sTF)、なおさらにより好ましくは可溶性ヒト組織因子(shTf))を、哺乳動物対象の幹細胞プール、好ましくはヒト患者の幹細胞プール、好ましくはEPCおよび/またはMSCを、より好ましくはHSCプールを変化させることなく、または、止血を変化させることなく富化するための医薬品としての使用のために提供する。
【0080】
本発明は、PRPおよび凝固因子(の非凝固および/または可溶性の混合物)(凝固因子は、好ましくは、(可溶性)トロンボプラスチン(hTf)、第Xa因子および第VIIa因子からなる群から選択され、より好ましくは可溶性hTfである)、または、それらを含む(医薬用)組成物を、医薬品としての使用のために、とりわけ、心臓血管(心臓関連または心臓性)疾患、好ましくは、(変性)心筋症、(先天性)心臓疾患、冠状動脈疾患、虚血、拡張期機能不全、アテローム性動脈硬化、心筋炎、心内膜炎および心筋梗塞からなる群から選択される心臓血管(心臓関連または心臓性)疾患の処置および/または防止のための医薬品としてのそれらの使用のために提供する。
【0081】
代替では、本発明は、凝固因子、好ましくは、(好ましくは可溶性)トロンボプラスチン(または組織因子(Tf))、第Xa因子、第VIIa因子またはそれらの混合物からなる群から選択される凝固因子(より好ましくは可溶性組織因子(sTf)、なおさらにより好ましくは可溶性ヒト組織因子(shTf))を、心臓血管(心臓関連または心臓性)疾患、好ましくは、(変性)心筋症、(先天性)心臓疾患、冠状動脈疾患、虚血、拡張期機能不全、アテローム性動脈硬化、心筋炎、心内膜炎および心筋梗塞からなる群から選択される心臓血管(心臓関連または心臓性)疾患の処置および/または防止のための医薬品としての使用のために提供する。
【0082】
本発明は、PRPおよび凝固因子(の非凝固および/または可溶性の混合物)(凝固因子は、好ましくは、(可溶性)トロンボプラスチン(hTf)、第Xa因子および第VIIa因子からなる群から選択され、より好ましくは可溶性hTfである)、または、それらを含む(医薬用)組成物を、神経学的疾患、好ましくは、パーキンソン病、アルツハイマー病、ハンチントン病、テイ・サックス病、脊髄傷害、脳卒中および脳血管障害および筋萎縮性側索硬化症(ALS)からなる群から選択される神経学的疾患の処置および/または防止のための医薬品としての使用のために提供する。
【0083】
代替では、本発明は、凝固因子、好ましくは、(好ましくは可溶性)トロンボプラスチン(または組織因子(Tf))、第Xa因子、第VIIa因子またはそれらの混合物からなる群から選択される凝固因子(より好ましくは可溶性組織因子(sTf)、なおさらにより好ましくは可溶性ヒト組織因子(shTf))を、(哺乳動物対象の)神経学的疾患、好ましくは、パーキンソン病、アルツハイマー病、ハンチントン病、テイ・サックス病、脊髄傷害、脳卒中および脳血管障害および筋萎縮性側索硬化症(ALS)からなる群から選択される(哺乳動物対象の)神経学的疾患の処置および/または防止のための医薬品としての使用のために提供する。
【0084】
本発明は、PRPおよび凝固因子(の非凝固および/または可溶性の混合物)(凝固因子は、好ましくは、(可溶性)トロンボプラスチン(hTf)、第Xa因子および第VIIa因子からなる群から選択され、より好ましくは可溶性hTfである)を、変性(自己免疫)疾患、好ましくは、再生不良性貧血、多発性硬化症、関節リウマチ、シェーグレン症候群、1型糖尿病、グレーヴズ病およびエリテマトーデスからなる群から選択される変性(自己免疫)疾患の処置および/または防止のための医薬品としての使用のために提供する。
【0085】
代替では、本発明は、(好ましくは可溶性)トロンボプラスチン(または組織因子(Tf))、第Xa因子、第VIIa因子またはそれらの混合物(より好ましくは可溶性組織因子(sTf)、なおさらにより好ましくは可溶性ヒト組織因子(shTf))を、変性(自己免疫)疾患、好ましくは、再生不良性貧血、多発性硬化症、関節リウマチ、シェーグレン症候群、1型糖尿病、グレーヴズ病およびエリテマトーデスからなる群から選択される変性(自己免疫)疾患の処置および/または防止のための医薬品としての使用のために提供する。
【0086】
本発明は、PRPおよび凝固因子(の非凝固および/または可溶性の混合物)(凝固因子は、好ましくは、(可溶性)トロンボプラスチン(hTf)、第Xa因子および第VIIa因子からなる群から選択され、より好ましくは可溶性hTfである)、または、それらを含む(医薬用)組成物を、ガン(白血病)および/または感染性疾患(AIDS)の処置のための医薬品としての使用のために提供する。
【0087】
代替では、本発明は、(好ましくは可溶性)トロンボプラスチン(または組織因子(Tf))、第Xa因子、第VIIa因子またはそれらの混合物(より好ましくは可溶性組織因子(sTf)、なおさらにより好ましくは可溶性ヒト組織因子(shTf))を、ガン(白血病)の処置のための医薬品としての使用のために提供する。
【0088】
本発明は、PRPおよび凝固因子(の非凝固および/または可溶性の混合物)(凝固因子は、好ましくは、(可溶性)トロンボプラスチン(hTf)、第Xa因子および第VIIa因子からなる群から選択され、より好ましくは可溶性hTfである)、または、それらを含む(医薬用)組成物を、骨変性関連疾患、好ましくは、骨萎縮、骨粗鬆症からなる群から選択される骨変性関連疾患の処置および/または防止のための医薬品としての使用のために、また、場合により、骨再建または骨補強のための医薬品としての使用のために提供する。
【0089】
代替では、本発明のPRPおよび凝固因子は、哺乳動物対象の腸骨稜、胸骨の中、および/または、脂肪組織に、好ましくはヒト患者の腸骨稜、胸骨の中、および/または、脂肪組織に、より好ましくは、前記ヒト患者の腸骨稜の骨髄に、(非凝固および/または可溶性の混合物の形態で)同時に(または別々に)注入される。
【0090】
好都合には、(非凝固および/または可溶性の混合物の形態での)約6ml〜約20mlのPRPにおける約2μg/ml〜約500μg/mlの(可溶性)hTfが、好ましくは対象または患者の腸骨稜、胸骨および/または脂肪組織に注入される本発明の医薬品において使用される。
【0091】
代替では、(非凝固および/または可溶性の混合物の形態での)約6ml〜約20mlのPRPにおける約5単位/ml〜約500単位/mlの第Xa因子が、好ましくは対象または患者の腸骨稜または胸骨および/または脂肪組織に注入される本発明の医薬品において使用される。
【0092】
代替では、(非凝固および/または可溶性の混合物の形態での)約6ml〜約20mlのPRPにおける約30単位/ml〜約20000単位/mlの第VIIa因子が、好ましくは対象または患者の腸骨稜または胸骨および/または脂肪組織に注入される本発明の医薬品において使用される。
【0093】
本発明の別の局面が、場合により、適切な医薬用のキャリアまたは希釈剤と、効果的な量のPRPと、下記からなる群から選択される、効果的な量の凝固因子とを含む(非凝固および/または可溶性の)医薬組成物であって、心臓血管疾患、神経学的疾患、自己免疫疾患、炎症、肝臓傷害および/または骨粗鬆症からなる群から選択される疾患の処置および/または防止のための(非凝固および/または可溶性の)医薬組成物である:
・トロンボプラスチン(組織因子)、好ましくは組換えトロンボプラスチン(rTf)、好ましくはヒト組織因子(hTf)、より好ましくは組換えヒト組織因子(rhTf)、より好ましくは組換え可溶性ヒト組織因子(rshTf)、これらは、より好ましくは、リン脂質(PL)、より具体的には、ホスファチジルコリン、ホスファチジルセリンおよびホスファチジルエタノールアミンの添加を伴う;または
・第VII(a)因子、
・第X(a)因子、
・組織因子−第VII(a)因子、
・組織因子−第VII(a)因子−第X(a)因子、
・第VIII(a)因子、
・第IX(a)因子、あるいは、上記化合物の組合せ(ただし、これらの因子は活性化型または非活性化型である)。
【0094】
好ましくは、本発明による(非凝固および/または可溶性の)医薬組成物は心臓病学において使用され、ただし、この場合、心臓血管(心臓関連または心臓性)疾患が、好ましくは、アテローム性動脈硬化、心筋症、先天性心臓疾患、心筋炎、冠状動脈疾患、心臓血管障害、拡張期機能不全、心内膜炎、虚血および心筋梗塞からなる群から選択される。
【0095】
好ましくは、本発明による(非凝固および/または可溶性の)医薬組成物は神経学において使用され、ただし、この場合、神経学的疾患が、好ましくは、パーキンソン病、アルツハイマー病、ハンチントン病、テイ・サックス病、脊髄傷害、脳卒中、脳血管障害、再生不良性貧血、筋萎縮性側索硬化症(ALS)および/または多発性硬化症からなる群から選択される。
【0096】
本発明の別の局面が、幹細胞のインビトロ増殖のための、(非凝固(可溶性))PRPおよび凝固因子(好ましくはhTf)の(混合物の)使用である。
【0097】
最後に、本発明の1つの局面が、本発明による方法の種々の実施形態を行うための様々な要素および手段を含む、構成要素のキットに関連し、とりわけ、下記のものを含むキットに関連する:
・自己PRPを集めるための遠心分離デバイス、および、場合により、自己トロンビンまたは異種トロンビンを哺乳動物の血漿から得るための手段;
・1つまたは複数の哺乳動物活性化合物(凝固因子)、好ましくは、1つまたは複数のヒト活性化合物(凝固因子)、あるいは、上記方法の工程c)において使用される前記1つまたは複数の化合物を含む1つまたは複数の流体(溶液)(ただし、これらは1つまたは複数のバイアルに存在するかもしれない);
・場合により、血液サンプルおよび/または骨髄サンプルおよび/または脂肪サンプルを哺乳動物対象から集めるための手段;および
・場合により、この自己PRPおよび/またはこの活性化合物を、MSCが多い目標注入領域において哺乳動物対象に再注入するための手段(シリンジ、ニードル、管類など)。
【0098】
好ましくは、これらの手段は、MSC活性化化合物(凝固因子)またはMSC活性化化合物(凝固因子)を含む流体と一緒での(自己)PRPの注入のために十分であり、これらの手段はまた、幹細胞が多いこの目標注入領域から、これらの幹細胞を含む骨髄液サンプルを集めるためにも十分である。
【0099】
好都合なことに、これらの手段はまた、遠心分離デバイスへの接続を得るために、また、得られた自己PRP(および、場合により、自己トロンビン)を集めるために、また、集められた血小板富化血漿液(および、場合により、自己トロンビン)を、(間葉系)幹細胞が多い目標部位(胸骨、腸骨稜または脂肪組織)において、同じ患者に(同時に)注入するために十分である。これらの手段はまた、この目標注入領域から、同じ哺乳動物に由来する骨髄液サンプルを集めるために使用され(ただし、この場合、この骨髄液サンプルは、インビトロ増殖の後で幹細胞が多くなっている)、また、場合により、これらの幹細胞を、好ましくは(場合により、本発明のキットの遠心分離デバイスによる)遠心分離によって、または、米国特許出願公開第2007/0276352号に記載される手段によってそれらの混入物から分離するために使用される。
【0100】
これらの手段はまた、(間葉系)幹細胞が多い血液サンプルを集めるための好適な要素、および、これらの幹細胞を当業者によって広く知られている手段によって血液サンプルから分離するための好適な要素、ならびに、場合により、これらの幹細胞を、好ましくは(場合により、本発明のキットの遠心分離デバイスによる)遠心分離によってそれらの混入物から分離するための好適な要素を含むことができる。
【0101】
好ましくは、これらの手段は、注入シリンジおよび採取用シリンジ、あるいは、骨髄もしくは血液への流体の注入、および/または、骨髄もしくは血液からの流体の採取のための専用デバイス、好ましくは、上記で記載される本発明によるデバイス、好都合には遠心分離デバイスに連結される上記で記載される本発明によるデバイス、好ましくは、国際公開WO03/106040、米国特許第6855119号、国際公開WO02/080991および米国特許第6719901号の各文書に記載されるような遠心分離デバイスを含む。
【0102】
本発明による、構成要素のキットにおいて、幹細胞活性化化合物は好都合には、急速な凝固を避けるために、PRPを含む注入シリンジとは別にされるバイアルまたはシリンジに、あるいは、骨髄への流体の注入および/または骨髄からの流体の採取のための専用デバイスに、好ましくは、上記で記載される本発明によるデバイスに存在する。幹細胞が多い目標注入領域におけるPRPおよび活性化化合物(凝固因子)の同時注入を可能にする二重注入シリンジ(すなわち、the Company Harvest(登録商標)USAによって販売されるSmarjet(商標)液体・噴霧送達システム、PRP・トロンビン製剤SMARTPREP(商標)(Harvest(登録商標)USA)の作製のために使用される他のシステム、自己血小板分離装置Magellan(商標)(Medtronic(登録商標))、Symphony(登録商標)血小板濃縮システム(Depuy)、Acromed(登録商標)デバイス(Johnson and Johnson(登録商標))、Angel(登録商標)(SORIN−DIDECO)、血液銀行において使用される3i血小板濃縮デバイスまたは他のデバイス)を使用することもまた可能である。
【0103】
本発明の、構成要素のキットはまた、緩衝剤および分化化合物、または、これらの化合物を含む流体などを含めて、注入のための種々の活性化合物または流体を有する異なるバイアルを含むことができる。
【0104】
本発明による注入シリンジまたはデバイスは哺乳動物対象の胸骨または腸骨稜における注入のために十分であり、好ましくはヒト患者の胸骨または腸骨稜における注入のために十分である。
【0105】
本発明の、構成要素のキットはまた、他の要素、例えば、好適な注入を可能にするための管類、ポンプ、バルブなどを、哺乳動物の身体からの十分な採取のために、また、本発明によるプロセスの自動化を可能にするために含むことができる。これらの要素は好都合には、当業者によって広く知られている好適な自己輸血手順によって手術部位から採取し、生物学的化合物を患者に再注入するための自己輸血システムにおいて一体化される。
【0106】
構成要素のこのキットはまた、好適なコンピューターおよび適切なソフトウエアによって実施および/または制御され得る本発明による連続する工程を行うための指示手段を含むことができる。
【図面の簡単な説明】
【0107】
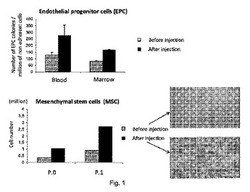
【図1】図1は、内皮前駆体細胞の数を、本発明の方法による注入の前または後において患者の血液または患者の骨髄に存在する106個の非接着性細胞について表す。
【0108】
【図2】図2は、処置前および処置後のEPCである。
【0109】
【図3】図3は、エクスビボ培養の有無に関して、本発明の方法による注入の前または後におけるMSCの数を表す。
【0110】
【図4】図4は、PRP+可溶性hTfの注入の前(0日目)、3日後および7日後に患者の血液または骨髄から得られる、コロニーを形成することができるEPCの数を表す。これは、処置による血液におけるEPCの動員を強調する。
【0111】
【図5】図5は、PRP注入後のMSCのインビトロ培養を表す。
【0112】
【図6】図6は、刺激域におけるコロニー形成単位−線維芽細胞(CFU−F)の増大を表す。
【0113】
【図7】図7は、注入部位(左側)または反対側部位(右側)において、PRP+可溶性hTfの注入の前(0日目)に得られるMSC、または、7日後に得られるMSCのインビトロ増加を表す。MSCの拡大特性が処置によって増大するが(左側の7日目および0日目を比較のこと)、反対側部位では減少する。
【0114】
【図8】図8は、PRP+可溶性hTfによる処置の前、3日後および7日後における血液細胞集団を表す。CD34およびCD133について陽性である細胞(幹細胞)が、処置の3日後および7日後ではるかにより多く存在する。これは骨髄からの動員を反映する。
【0115】
【図9】図9は、PRP+可溶性hTfによる処置の前および7日後に処置部位(左側)または反対側部位において得られる骨髄細胞集団を表す。CD34およびCD133のレベルが両方の部位において処置によって維持される。これは、幹細胞含有量を補充する骨髄の能力を強調する。CD31細胞が両方の部位においてはるかにより多く存在する。
【0116】
【図10】図10は、間葉系前駆体としてコロニーを形成することができる細胞(CFU−F)、および、前骨芽細胞マーカーと見なされるアルカリホスファターゼを発現する間葉系前駆体としてコロニーを形成することができる細胞(CFU−O)の相対数を表す。細胞を、処置前(G0)、PRP+可溶性hTfによる処理の3日後に処置部位(G3およびRG3)または反対側部位(D3およびRD3)において骨髄から採取した。細胞の一部はまた、間葉系細胞を富化するために処理された(RG3およびRD3)。
【0117】
【図11】図11は、カルシウムおよびアルカリホスファターゼの測定とともに、骨組織に向かう分化を表す。細胞を、処置前(G0)、PRP+可溶性hTfによる処置の3日後に処理部位(G3)または反対側部位(D3)において骨髄から採取し、示された時間、ペトリ皿で成長させた。
【0118】
【図12】図12は、図10の場合のように処理されたが、28日までの間成長させられた細胞のインシトゥーカルシウム標識化を表す。
【0119】
【図13】図13は、本発明に従って得られた幹細胞を(より大きな量で)使用する患者の顎の骨再建を表す。左側:処置後1週間、12cm3の異種骨で満たされるインプラントを示す;右側:54日の処置の後、インプラントを再び覆う、同種組織の再形成および新形成された骨組織を開示する。下段パネル:再建された顎が生組織から作製されること(血管形成)を立証する処置後90日での99Tcシンチグラフィー。
【発明を実施するための形態】
【0120】
本発明の方法では、ヒト患者が、移植片について、提供者として、また、宿主として、両方で使用される。
【0121】
本発明の方法の独創性は、増殖細胞工程が、その部位において、すなわち、インビボで行われ、先行技術による技術で行われるようなインビトロではもはや行われないことである。しかしながら、本発明に従って刺激される幹細胞は、(刺激されていない幹細胞と比較して)インビトロでの増大した成長を有する。ヒト患者によって産生される幹細胞の量は、生まれた直後のヒトでは極めて重要であるが、年とともに急激に減少することが知られている。
【0122】
したがって、幹細胞を患者から回収すること、とりわけ、高齢者の患者から回収することは、極めて困難である。
【0123】
したがって、本発明による方法および手段は、患者に対する限定された危険性により、大量の幹細胞をインビボで迅速に得るために、また、これらの得られた幹細胞を回収するために使用することができる。
【0124】
活性化された自己PRPの使用と組み合わされるこの技術的特徴は、本発明の方法および手段に、効率の点で先行技術を上回る実際の利点をもたらす。
【0125】
実際、移植片拒絶の危険性がこのように最小限に抑えられ、本方法の安全性が最大化される。これは、インビトロ操作が最小限に抑えられる(または、最小限に抑えられ得る)からである。
【0126】
加えて、本発明者らは、好都合なことに、白血球数が、本方法適用時、ならびに/または、PRPおよび凝固因子を本発明に従って使用した後、患者の血液においてほとんど変化しないことを認めた。
【0127】
しかしながら、数工程が、とりわけ、細胞の分化がインビトロで実現され得る。
【0128】
PRPおよび可溶性hTfが富化される細胞培地が、幹細胞の増殖をインビトロで誘導することにおいて、同様にまた、幹細胞を未分化状態で保つことにおいてより大きい効力を有することもまた明らかにされる。
【0129】
約20ml〜約200mlの血液サンプル、好ましくは、ヒト患者からの約60mlの血液が集められる。この採血サンプルから、(ヒト患者の全血における元の濃度の約100%〜約1000%またはそれ以上の間での)濃度の血小板を含む自己血小板富化血漿(自己PRP)の調製物(約6mlまたは約7ml〜約40mlのPRP、好ましくは約7ml〜約10mlのPRP)を最新技術(国際公開WO03106040、国際公開WO00/61256、国際公開WO2004/024198、米国特許第6855119号、国際公開WO02/080991および米国特許第6719901号)において記載されるMagellan(商標)Medtronic(登録商標)法および装置またはデバイスによって得ることが可能である。
【0130】
得られた自己血小板富化血漿が、濃縮された活性化自己PRPを含有する第1の溶液を形成するために、1マイクロリットルあたり、乾燥形態での凝固因子(約200単位〜約10000単位のトロンビン、または、約1mgの組換えヒト組織因子(トロンボプラスチン))に加えられる。
【0131】
血小板濃度が、血小板の生存性を約37℃で保証するように適合化される。
【0132】
代替では、トロンビンまたは組換え可溶性ヒト組織因子(トロンボプラスチン)を前記の自己血小板富化血漿に加える代わりに、自己PRPを、好ましくは、流体を骨髄腔に送達すること、および/または、流体を骨髄腔から抜き取ることのために好適な本発明の永続的な埋め込み可能な手段を使用して、同じヒト患者の腸骨稜、胸骨または脂肪組織に再注入することができる。
【0133】
凝固因子(またはCaCl2)が、注入直前のPRPのシリンジに加えられる。
【0134】
この溶液が、同じヒト患者の腸骨稜、胸骨または脂肪組織に再注入され、その結果、(間葉系前駆細胞および/または内皮前駆細胞の)インビボ増殖が、HSC幹細胞の増殖を好都合には誘導することなく、前記患者において局所的に誘導される。
【0135】
注入後の約3日、4日、5日、6日、7日、8日、9日、10日、11日、12日、13日、14日、15日、16日、17日、18日、19日、20日から、約21日までで、(間葉系)幹細胞が多い骨髄サンプルが、(同じ目標注入部位において)集められた。3日後および7日後に、10mlの血液サンプルおよび骨髄サンプルが、血液学的パラメーター(ヘマトクリット、ヘモグロビン、白血球)の最終的変化を推定するために集められた。3日後および7日後に、骨髄サンプルが、EPCおよびMSCを比較するために、また、末梢血における幹細胞の動員を立証するために、互いに向かい合わせで行われる2回の穿刺によって集められた。
【0136】
この採取工程が、例えば、整形外科的処置法または外科的処置法のために、提案されるのと同じ日に行われる。
【0137】
これらの採取工程は好ましくは、十分な幹細胞濃度を得るように、規定された時間間隔で数回(好ましくは毎週)繰り返される。
【0138】
血小板は、血小板由来増殖因子、トランスフォーミング増殖因子ベータ、血小板由来上皮増殖因子、血小板由来血管形成因子、インスリン様増殖因子1および血小板増殖因子4を含めて、数多くの分子を放出することが知られている。これらの分子は、局所的な間葉系細胞および内皮細胞に、遊走、分裂、ならびに、コラーゲン合成およびマトリックス合成の増大を行うためのシグナルを送る。
【0139】
さらに、以前に集められた骨髄サンプルが、活性化および濃縮された自己PRPおよびMSCを含む組成物を得るように、(好ましくは、約1mgの量の組換えヒト組織因子(トロンボプラスチン)、または、十分な量の上記凝固因子の1つに加えて)、血小板富化血漿と混合される。
【0140】
さらに、約80mg/mlの量のビタミンC(L−アスコルビン酸)、ビタミンD3(1,25(OH)2D3ビタミン)、および、約10−8Mの濃度のデキサメタゾンを、増殖、分化およびマトリックス産生を誘導するために、この濃縮物に加えることができる。デキサメタゾンは好ましくは、カプセル化された化合物の(遅延)放出を可能にする、PLGA(ポリDL−乳酸−co−グリコール酸)、PGA(vp8)(ポリグリコール酸)、PLLA(ポリ−L−乳酸)および/またはアルギン酸塩の足場(例えば、マイクロビーズなど)と一緒に調製される。他のポリマー化合物を、これらの好ましい化合物の効率的なカプセル化および放出を得るために使用することができる。
【0141】
骨形成を強化するための活性な化合物を含むそのような足場は、科学文献において既に記載された足場と類似している(Mariani M.他、Tissue Eng.、12(3)、547頁〜558頁(2006)、および、Inane B.他、Tissue Eng.、12(2)、257頁〜266頁(2006))。
【0142】
得られた組成物は、骨組織の再生のために直接に使用され得るペーストを形成するように、十分なゲル化剤(例えば、アルギン酸塩またはCaCl2溶液など)を同様に含むゲルと類似している(国際公開WO2004/024198を参照のこと)。これは、効率的な拡大および/または分化を得るために当業者によって適合化することができる。
【0143】
さらに、種々の段階で細胞によって発現されるいくつかの表現型マーカー(産生されるCD34、CD133、CD45、NGF−R、サイトカインなど)を、幹細胞の発現、および/または、未成熟な細胞(未成熟な骨前駆体細胞)、成熟した骨前駆体細胞、前骨芽細胞、成熟した骨芽細胞、骨細胞などへの幹細胞の分化を追跡するために使用することができる。
【0144】
他の化合物、例えば、転写調節因子(Cbfa−1、Msx−2、c−fos、fra−2、Dix−5など)、リンホカイン(IL−1)、増殖因子(TGF−β)、(EGF)などもまた、本発明の方法および組成物において使用することができる。
【0145】
骨髄においてCD34+およびCD31+である第1のタイプの幹細胞が得られた。図1および図2は、本発明の方法に関して、骨髄および末梢血においてEPCのインビボでの刺激を(PRPおよび組織因子の添加によって、例えば、20μg〜1000μgの可溶性組織因子(sTF)/6mlのPRP、好ましくは100μg〜700μgのsTF/6mlのPRP、より好ましくは334μgのsTF/6mlのPRPの添加によって)得ることが可能であることを示す。さらに、MSCはまた、初回培養の前後で、著しく、かつ、予想外に増幅される(図7)。

表1から、処置後7日目で、「娘細胞」含有量(例えば、WBCおよびCFU−Fなど)が骨髄の注入側では強く高められる。実際には、この影響は一層より大きい。実際、この定量では、注入の反対側でのCFU−F含有量およびCFU−C含有量の減少によって例示されるような、また、図3および図7において実証されるような血液への細胞の動員が計数されない。動員のこの最初の証拠は、健康な患者の場合でさえ、治療目的のための可能性を示す。そのうえ、他の「娘細胞」、すなわち、図1において明らかにされるようなEPCが血液において動員され、また、骨髄に驚くほど(より)多く存在したままであり(図2を参照のこと)、このことは、刺激(増加)、それに続く、分化および動員の複雑な速度論を反映している。
【0146】
その後、本発明者は、コロニーを形成する処置された細胞の能力を測定した。図3に示されるように、細胞が血液および骨髄から得られる。上記で示されるように、PRP+可溶性hTfを注入した3日後、EPCコロニーの数が2倍を超えて増大する。この影響が7日目までずっと持続する。しかしながら、骨髄では、EPCコロニーの数が7日目において低下した。これはそれらの動員を反映する。
【0147】
MSCを7日間のPRP+可溶性hTfの注入の後で骨髄から採取し、その後、ペトリ皿で成長させた(図5)。はるかにより多くのCFU−Fが、PRP+可溶性hTfの注入の後で骨髄から得られた。
【0148】
本発明者は、7日間の処置の前または後で骨髄から採取された単核細胞(MNC)を精製し、コロニーを形成するその能力が3倍増大していることを測定した(図6)。
【0149】
MSCを7日間のPRP+可溶性hTfの注入の前または後で骨髄から採取し、その後、成長させた(図7)。処置部位から採取された細胞は、より多く存在することのほかに、インビトロで成長する増大した能力を獲得していた。
【0150】
その後、本発明者は血液中の細胞(図8)および骨髄中の細胞(図9)の特徴づけを行った。血液において、CD34細胞およびCD133細胞が処置によって増大した。このことは、幹細胞の成長および動員に対する処置の正の影響を開示する。一方、それらの相対的存在量が骨髄において一定のままであった。このことは、幹細胞含有量を一定に保つ骨髄の能力を反映する。本発明者はさらに、処置後、CD31細胞が骨髄により多く存在することを認めた。この速度論は、細胞タイプおよび階層に関連づけられる:「母」のCD34+およびCD133+についてはより迅速であり(それらのレベルが7日目でベースラインにほぼ戻った)、「娘」のEPCおよびCFU−F幹細胞についてはより遅く(それらのレベルが注入側では7日目においてより大きい)、そして、分化したWBCについては一層より遅いかもしれない。
【0151】
異種移植片、同種移植片または自己移植片から得られる無機質型マトリックスもまた、骨再生組織を改善するためのゲル組成物において使用することができる。
【0152】
特定の組織への幹細胞の分化を得るために、特定の組織の再生を得るためのいくつかの特異的な増殖因子を使用することが可能である(皮膚組織を得るための上皮増殖因子(EGF)、骨または軟骨の形成を誘導するためのBMPファミリーの化合物、造血系分化を誘導するためのG−CSFまたはAMD300、その他)。
【0153】
ゲル組成物はまた、(骨芽細胞系細胞を得るために、)連続する増殖、分化、成熟化、および、場合により、鉱物化を伴う事象の複雑なカスケードを介して、幹細胞を拡大し、要求される組織細胞に分化させるために、他の要素を含むことができる。このゲル組成物はまた、(異栄養性無機質沈着物形成を誘導するための)β−グリセロホスファート、いくつかのより特異的なヒト増殖因子、または、カルシウム含有化合物(例えば、CaCl2、β−リン酸三カルシウム、骨粒子(変性骨由来または非変性骨由来)、アパタイト、アスピジン(aspidine)、硫酸カルシウム、炭酸カルシウム、ヒドロキシアパタイト、グルコノ乳酸カルシウム(calcium gluconolactate)、グルコン酸カルシウム、乳酸カルシウム、カルシウムグルトニアート(calcium glutoniate)およびそれらの混合物)を含む場合があり、そのような化合物の例が欧州特許EP1239894に記載される。
【0154】
本発明者は幹細胞を上記のように刺激し、その後、コロニーを形成するその増大した能力、アルカリホスファターゼを発現するその増大した能力、カルシウムを利用および固定するその増大した能力を測定した(図10〜図12)。
【0155】
その後、本発明者は、得られた細胞を使用して、自己インプラントを作製し、完全な骨を再構成した。
【0156】
図13に示されるように、本発明者はまた、骨髄へのPRPおよび可溶性hTfの注入によって幹細胞を活性化し、その後、幹細胞を活性化後3日目に得た後で、生組織を再構成することができた。3日間の活性化の後、内皮前駆体細胞の7倍の増大が血液において認められ、一方、骨髄では2倍の増大であった。このことは、処置後3日での幹細胞の増加および動員の両方を反映する。これらの幹細胞を、患者の損傷した顎に設置されるために適合化されたチタンの網状物に沈着させた。これらの活性化幹細胞は、99Tcシンチグラフィーによって示されるように、成長、分化、および、生組織の再構成(新しい血管の産生を含む)を行うことができた。
【0157】
その後、本発明者は、本発明に従って処置された13名の患者において、サイトカインの血中濃度における何らかの変化について探索した。かなりの増大が、PRPおよび凝固因子(shTf)を前記患者の腸骨稜の骨髄に注入した後の3日および7日で、FGF−2(約4倍)、VEGF(約2倍)、Rantes(約2倍)およびBDNF(+50パーセント)において認められた。
【0158】
その後、本発明者は、神経変性(神経学的)疾患に罹患している患者において、疾患を遅らせるか、または、それどころか、疾患を停止させるつもりで、PRPおよび凝固因子(shTf)の注入を試験した。本発明者は筋萎縮性側索硬化症(ALS)罹患患者を選択し、腸骨稜由来の骨髄におけるPRPおよび凝固因子(shTf)を左側に注入した。その後、4日後に、本発明者は、同じ注入を右側において再び行い、このプロトコルを1ヶ月間繰り返し、そして、患者を、そのような注入を行うことなく1ヶ月間回復させた。その後、この注入プロトコルを繰り返した。疾患の悪化における軽減が得られ、また、ある程度の改善さえ得られた。
【0159】
その後、本発明者はさらに、患者の骨髄の幹細胞を、PRPおよび凝固因子(shTf)を注入した3日後に回収し、その後、(MSC富化)幹細胞を、富化された幹細胞(MSC)を患者の心臓に再注入する前に5分間の2000g×分での遠心分離によって活性化骨髄から精製することによって心臓病学(心筋梗塞罹患患者)において本発明を評価した。全体的には、本発明者は、本発明の教示に従って処置された患者における改善を認めた。
【0160】
本発明者はさらに、適合し得る提供者の腸骨稜に由来する骨髄においてPRPおよび凝固因子(shTf)を注入することによって幹細胞の増殖および活性化を刺激した。その後、本発明者は、骨髄が放射線照射されている白血病罹患患者への再注入の前に、(活性化)骨髄サンプルをこの提供者から単離した。
【0161】
その後、本発明者は、感染性疾患(AIDS)において本発明を評価した。
【0162】
しかしながら、本発明の方法および/または医薬用製造物によって引き起こされる幹細胞および/またはサイトカインの増大を考えると、いくつかの他の疾患が当業者によって処置され得ることが明らかである(この場合、前記疾患は好ましくは、ガン、炎症、骨粗鬆症、肝臓傷害、自己免疫疾患および/または感染性疾患を含めて、心臓病学的疾患、神経学的疾患、変性疾患からなる群から選択される)。
【技術分野】
【0001】
本発明は、組織産生(再生、再建、補強および/または若返り)の分野に関する。
【0002】
より正確には、本発明は、特定の組織または細胞を再生するための、好ましくは、骨、脂肪、腱、筋肉、軟骨および骨髄間質のような間葉系組織、ならびに、血液学的な組織または細胞(RBC、WBC、血小板、リンパ球、血液学的幹細胞(HSC)、内皮前駆細胞(EPC)など)を再生するための方法および手段(製造物およびデバイス)に関連する。
【0003】
本発明はまた、損傷または疾患のある組織または細胞の再建、再生、若返りまたは補強を、本発明の方法によって得られる(再生された)組織または細胞を使用して哺乳動物対象において、好ましくはヒト患者において行うための方法および手段(製造物およびデバイス)に関連する。
【背景技術】
【0004】
損傷または疾患のある組織、すなわち、骨を再建するための種々の技術が存在する。細胞媒介再生技術がそれらの1つである。
【0005】
間葉系幹細胞(MSC)またはHSCは、「間充織」として知られている骨髄間質において見出され、また、脂肪組織においてもまた見出される幹細胞に対応する。
【0006】
MSCおよびHSCは、適切な数の細胞を得るためにエクスビボ培養で拡大することができる。しかしながら、大量の骨髄の採取および長時間の培養が、十分な量の幹細胞を得るために要求される。幹細胞のインビトロ培養はその増殖能力を変化させ、また、その分化能を低下させる。これらの細胞は分化および増殖についての多能性を示し、また、適切なサイトカインおよび増殖因子、ならびに、EPCを含む血液学的細胞を使用して様々なタイプの細胞(例えば、筋肉、血管系、ニューロン組織、肝臓、骨芽細胞、軟骨細胞、筋芽細胞、ケラチノブラストおよび線維芽細胞など)に分化させることができる。
【0007】
これらのMSCを細胞媒介再生技術において使用することがこれまで長い間提案されている。
【0008】
さらには、老化は幹細胞の特性およびその分化能力を変化させることが知られている。
【0009】
実際、骨再生方法では、MSCが患者から取り出され、適切な骨増殖因子を使用してインビトロで増殖させられ、骨芽細胞に分化させられる。このように、骨組織が生じさせられ、その後、再建方法において患者への埋め込みのためにインプラントとして使用される。心臓発作後、患者は、大量の骨髄サンプルを集めるために局所麻酔され、その後、骨髄サンプルは、全量または一部が、すなわち、細胞分取後に再注入される。ガン治療では、幹細胞を単離し、刺激し、そして、場合により、患者へのその再注入の前に、エクスビボでトランスフェクションすることができる。白血病を処置するための移植のための補助剤として、多量の異種MSCがドナーの骨髄と一緒に注入される。
【0010】
組織再生および組織再建における血小板富化血漿(「PRP」と略記される)の潜在的使用のための研究が既に開始されている。
【0011】
PRPは間質幹細胞のインビトロ増殖を誘導する能力があることが立証されている(Lucarelli E.他、Biomaterials、24(2003)、3095頁〜3100頁)。
【0012】
近年の科学的研究はまた、骨再建においてMSCとともにグラフト材料として使用される血小板富化血漿(「PRP」と略記される)の有益な効果に関する最初の結果を与えている(Kitoh H.他、Clin.Oral Implants Res.、第15(5)巻(2004)、589頁〜597頁;Yamada Y他、J.Biomed.Mater.Res.、第68A(4)巻(2004)、747頁〜755頁)。
【0013】
それにもかかわらず、MSC−HSCを使用する組織再生の現在の方法、および、HSC細胞では、いくつかの欠点がもたらされる。具体的には、生じた骨組織に、適切な形状を与えることが、これらの方法および細胞に関して困難である。埋め込みに耐えるための十分な機械的強度を有する骨組織を得ることもまた困難である。その上、インビトロ培養では、骨組織を十分な量で得るために非常に時間がかかる。
【発明の概要】
【0014】
本発明は、(ヒト胚性でない)幹細胞(好ましくはMSCおよびEPC、場合により、HSCを除いて)を得ること、および/または、(ヒト胚性でない)幹細胞(好ましくはMSCおよびEPC、場合により、HSCを除いて)の増殖を誘導することのための、また、哺乳動物の組織または細胞の「産生」(再生、再建、補強および/または若返り)のための、先行技術の欠点を示さない改善された、また、代替となり得る方法および手段を提供する。
【0015】
好ましくは、MSCは、CD105、CD73、CD90からなる群から選択される1つ、2つまたは(好ましくは)3つの陽性マーカーを(その細胞表面に)発現し、かつ、CD45、CD34、CD14、CD19およびHLA−DRからなる群から選択される1つ、2つ、3つ、4つまたは(好ましくは)5つのマーカーの(その細胞表面における)発現を有しないとして定義される。
【0016】
代替として(または加えて)、MSCは、標準的な培養条件で維持されるとき、プラスチック接着性の細胞である。
【0017】
代替として(または加えて)、MSCは、骨芽細胞、脂肪細胞および/または軟骨細胞にインビトロで分化することができる。
【0018】
好ましくは、EPCは、CD133およびCD34の両方を(その細胞表面に)発現するとして定義され、好ましくは、CD31および/またはCD144をさらに発現し、しかし、場合により、CD45を発現しない。
【0019】
代替として(または加えて)、EPCは、コロニーをインビトロで形成するその能力によって定義され、この場合、好ましくは、コロニーは、より多くの細長い出芽細胞が周辺部に存在する丸い細胞の中央コアとして定義される。
【0020】
代替として(または加えて)、EPCは、VEGFの存在下でのマトリゲルアッセイにおいて置床されるときのその血管形成性によって定義される。
【0021】
好ましくは、HSCは、CD34マーカーおよびCD45マーカーを発現するとして定義される。
【0022】
本発明は、哺乳動物対象(ヒト患者を含む)における起こり得る移植片対宿主拒絶および宿主対移植片拒絶を軽減または回避し、同様にまた、哺乳動物対象(ヒト患者を含む)における、損傷組織または疾患組織の、組織または細胞の再生、再建または補強の後での感染の欠点を軽減または回避する方法および手段を提案する。
【0023】
本発明はさらに、高齢患者の場合には、あるいは、心臓発作または心臓障害に苦しむ人々の場合にはとりわけ有害である全身麻酔を何ら必要としないかもしれない、改善および簡略化された方法および手段を提案する。
【0024】
好都合なことに、本発明の製造物、方法および手段は、組織または細胞を再生するために使用される。
【0025】
具体的には、本発明は、(骨)再建のための満足できる構造的特徴および物理的特徴を有する新しい(骨)組織を得ることを可能にする方法および手段を提供する。これらの物理的特徴には、すなわち、形状、機械的強度および弾力性が含まれる。生物学的特徴には、すなわち、骨、皮膚、脂肪または筋肉のようないくつかの成熟組織における、増殖、委任および分化の高い可能性を有する未成熟な細胞の高い割合および濃度が含まれる。
【0026】
本発明はまた、MSCと、場合により、EPC(場合により、HSCを除いて)とを含む高濃度の未成熟な幹細胞を骨髄において誘導することによって、および/または、高濃度のEPC細胞を血液において誘導することによって幹細胞を動員する、心臓発作を処置するための方法および手段を提供する。
【0027】
実際、手術手技後のようなすべての炎症性状態、または、炎症性疾患もまた、本発明の方法および手段から利益を受けることができる。これは、炎症は、当然のことながら、幹細胞を動員するからであり、また、幹細胞における増大は、当然のことながら、必要性がある分化した細胞に変換され得るからである。
【0028】
本発明はまた、インビトロ培養時間を短くするか、または抑え、かつ、必要とされる集められた骨髄の量を少なくする簡便化された方法および手段を提供する。
【0029】
本発明は、幹細胞(好ましくはMSC−EPC、場合により、HSCを除いて)を得るための、また、場合により、(a)哺乳動物対象の組織または細胞の再生、再建、補強および/または若返りのための、好ましくは、(a)ヒト患者の組織または細胞の再生、再建、補強および/または若返りのための方法および手段に関連し、この場合、この方法は下記の工程を含む:
a)(液体)血液サンプルをこの哺乳動物対象から、好ましくはヒト患者から集める工程;
b)自己PRPをこの血液の血漿サンプルから調製する工程、ただし、PRPの血小板割合の濃縮が好ましくは、この哺乳動物対象の全血の約100%〜約1000%の間で、好ましくはこのヒト患者の全血の約100%〜約1000%の間で含まれ、より好ましくは、この哺乳動物対象の全血の約200%〜約500%の間で、好ましくはこのヒト患者の全血の約200%〜約500%の間で含まれる;
c)この自己PRPを、
・トロンビン(異種トロンビン、自己トロンビン、あるいは、組換え型のヒトトロンビンまたはウシトロンビン)、これには、(活性化型または非活性化型である)組換えトロンビン(FII)が含まれる;
・トロンビン、とりわけ、トロンボプラスチン(組織因子)、好ましくは組換えトロンボプラスチン(rTF)、より好ましくはヒト組織因子(hTF)、一層より好ましくは組換えヒト組織因子(rhTF)、より具体的には組換え可溶性ヒト組織因子(rshTF)を産生することができる化合物(凝固因子)、これは、場合により、リン脂質(PL)(例えば、ホスファチジルコリン、ホスファチジルセリンおよびホスファチジルエタノールアミンなど)の添加と組み合わせられる;
・CaCl2、
・(組換え)ヒト第VII因子またはヒト第VIIa因子(例えば、化合物NOVOSEVEN(登録商標)など)、
・(組換え)ヒト第X(a)因子、
・(組換え)組織因子または(組換え)第VII因子または(組換え)第VIIa因子、
・(組換え)組織因子および第Xa因子、
・(組換え)組織因子/第VIIa因子/第Xa因子、
・(組換え)第VIII因子、
・(組換え)第IX因子、あるいは
・上記化合物の組合せ
からなる群から選択される効果的な量の(活性な)哺乳動物化合物、好ましくは、(活性な)ヒト化合物により活性化して、その結果、濃縮された活性化自己血小板富化血漿を含有する第1の流体(溶液)を得る工程;
d)胚性でない(好ましくはMSC、EPC)幹細胞が多い目標注入領域(好ましくは胸骨または腸骨稜に由来する骨髄)または脂肪組織を同じ哺乳動物対象において、好ましくは同じヒト患者において選択する工程;
e)この第1の流体(溶液)を哺乳動物対象のこの目標注入領域に、好ましくはヒト患者のこの目標注入領域に注入して、その結果、(好ましくはMSC−EPC)幹細胞のインビボ増殖をこの哺乳動物対象において、好ましくはこのヒト患者において局所的に誘導する工程;
f)場合により、十分なインキュベーション時間の後で、同じ哺乳動物対象から、好ましくは同じヒト患者から、この目標注入領域からの、(MSC、EPC)細胞が多い骨髄(液)サンプル、または、この哺乳動物からの血液サンプル、または、この哺乳動物からの脂肪サンプルのどれかを集め、幹細胞をこのサンプルから回収する工程;
場合により、工程a)〜工程e)、または、工程a)〜工程f)を、規定された時間間隔で数回(好ましくは少なくとも2回、3回または4回)(好ましくは毎週)繰り返す工程;
g)場合により、第2の血液サンプルを集める工程;
h)場合により、第2の自己血小板富化血漿をこの第2の血液サンプルから調製する工程;
i)場合により、この自己血小板富化血漿を、工程c)において添加される上記の活性化合物の効果的な量の添加によって活性化して、その結果、濃縮された活性化自己血小板富化血漿を含有する第2の流体(溶液)をこの第2の血液サンプルから得る工程;
j)場合により、この第2の流体(溶液)と、幹細胞が多い、以前に集められた骨髄サンプルまたは血液サンプルまたは脂肪サンプルとを混合して、その結果、活性化された濃縮自己血小板富化血漿および幹細胞を含む組成物を得る工程;
k)場合により、分化補助剤をこれらの幹細胞に加えて、好ましくは(活性化された濃縮自己PRPおよび幹細胞を含む)組成物に加えて、その結果、(場合により、HSCを除いて、MSC、EPC)幹細胞の「事前に規定された」分化した組織細胞への分化を誘導し、場合により、所望される組織の再生を得る工程、ただし、これらの補助剤は、工程c)において使用される上記の活性化合物、ならびに/あるいは、細胞固定のための少なくとも1つのマトリックス、および、特定の細胞(例えば、骨芽細胞系細胞(骨細胞、骨芽細胞など)、筋肉細胞、内皮細胞、ニューロン細胞、肝細胞または線維芽細胞およびケラチノサイトなど)への幹細胞の分化を得る(誘導する)ための1つまたは複数の要素を含み、この場合、これらの要素は好ましくは、ビタミン(ビタミンC(L−アスコルビン酸)、ビタミンD3(1,25(OH)2D3ビタミン))、コルチゾン(またはコルチゾン誘導体、例えば、デキサメタゾン、ヒドロコルチゾン、プレドニゾロン、メチルプレドニゾロン、デキサメタゾン、トリアムシノロン、ベタメタゾンなど)、および、場合により、β−グリセロホスファート(これらの要素は好ましくは、これらの要素の遅い放出を可能にする、ポリDL−乳酸−co−グリコール酸(PLGA)、ポリグリコール酸および/またはポリ−L−乳酸(PLLA)、アルギン酸塩の足場(例えば、マイクロビーズなど)に存在する)、ならびに/あるいは、BMP2(これはMEDTRONICSから得られるかもしれない)、または、上皮増殖因子、または、神経増殖因子、または、当業者によって知られている任意の他のサイトカイン、増殖因子もしくは分化因子からなる群から選択される;および
l)場合により、活性化された濃縮自己血小板富化血漿およびMSCを含む組成物に、適切なゲル化剤(このゲル化剤は好ましくは、工程c)において添加される活性化合物の十分な量から得られる)を加えて、ゲルを得る工程;および
m)場合により、そのようにして得られたゲルを、哺乳動物対象の目標再建部位(例えば、自己採取骨、同種移植片、異種移植片またはコラーゲンリーフなど)の内部/表面に、好ましくはヒト患者の目標再建部位(例えば、自己採取骨、同種移植片、異種移植片またはコラーゲンリーフなど)の内部/表面に場合により適用することによって、得られたゲルをインプラントとして使用して、その結果、組織再建がこの再建部位において生じ得るようにする工程。
これらの工程a)〜工程m)を、十分な量の幹細胞を得るように、規定された時間間隔で数回(好ましくは少なくとも2回、3回または4回)(好ましくは毎週)繰り返すことができる。
【0030】
本発明はさらに、下記の工程を含む、活性化MSCが富化された(単核)細胞(MSC)集団を得るための方法に関連する:
・必要な場合には、骨髄幹細胞を、好ましくは本発明の方法によって、かつ/または、PRPおよび凝固因子の添加によって活性化する工程;
・活性化された骨髄のサンプルを得る工程;
・必要な場合には、このサンプルの幹細胞を富化する工程。
【0031】
好ましくは、活性化MSCが富化された(単核)細胞(MSC)集団を得るためのこの方法では、(インビトロで成長させられるときに)コロニー(CFU−F)を形成するこれらのMSCの能力が増大しており、より好ましくは少なくとも約30%(少なくとも約50%、なおさらにより好ましくは少なくとも約100%)増大している。
【0032】
好都合なことに、または、加えて、活性化MSCが富化された(単核)細胞(MSC)集団を得るためのこの方法では、少なくとも約13個のコロニー(より好ましくは少なくとも約15個のコロニー、なおさらにより好ましくは少なくとも約20個のコロニー)(CFU−F)が、この活性化骨髄に由来するサンプルから得られる1000000個の単核細胞のインビトロ培養のときに形成される。
【0033】
好都合なことに、または、加えて、活性化MSCが富化された(単核)細胞(MSC)集団を得るためのこの方法では、MSCの(インビトロ)培養のときに形成されるコロニー(CFU−F)の少なくとも約35%(より好ましくは少なくとも約40%、なおさらにより好ましくは少なくとも約50%)が骨原性マーカー(例えば、アルカリホスファターゼなど)を発現する。
【0034】
好ましくは、活性化MSCが富化された(単核)細胞(MSC)集団を得るためのこの方法では、幹細胞の富化が、骨髄サンプルの遠心分離(これにより、上清液、非MSC細胞および破片が富化されたペレット、ならびに、(活性化)MSC細胞が富化された中間画分がもたらされる)、および、この中間画分の回収によって行われる。
【0035】
本発明の別の局面が、活性化MSCの(増大した)集団を含む骨髄サンプルに関連し、この場合、好ましくは、(インビトロで成長させられるときに)コロニー(CFU−F)を形成するこの(活性化)MSCの能力が増大しており、より好ましくは少なくとも約30%(より好ましくは少なくとも約50%、なおさらにより好ましくは少なくとも約100%)増大している。
【0036】
好都合なことに(または加えて)、活性化MSCの(増大した)集団を含むこの骨髄サンプルにおいて、少なくとも約13個のコロニー(少なくとも約15個のコロニー、なおさらにより好ましくは少なくとも約20個のコロニー)(CFU−F)が、このサンプルから得られる1000000個の単核細胞のインビトロ培養(好ましくは、この活性化骨髄から得られる1000000個の単核細胞のインビトロ培養)のときに形成される。
【0037】
好都合なことに(または加えて)、活性化MSC集団が富化されたこの骨髄サンプルにおいて、MSCの培養によって形成されるコロニー(CFU−F)の少なくとも約35%(より好ましくは少なくとも約40%、なおさらにより好ましくは少なくとも約50%)が骨原性マーカー(例えば、アルカリホスファターゼなど)を発現する。
【0038】
場合により、活性化MSCが富化されたMSC集団を得るためのこの方法において、および/または、活性化MSCが富化されたこの骨髄サンプルにおいて、EPCの(相対的)含有量が増大せず、かつ/または、HSCの含有量が低下する。
【0039】
本発明の方法によって得られるMSC細胞は好都合なことに、哺乳動物対象に対して、好ましくはヒト患者に対して、好ましくは再生させるための部位の近く(またはその部位)に注入され、または、代替として、輸血によって注入される。
【0040】
本発明による方法は、損傷組織もしくは疾患組織の組織を再生するために、または、毒性化合物の影響を特徴づけるためのスクリーニング細胞として使用される特定の幹細胞を回収するために、あるいは、自己または異種であろうとも、将来の使用のために(バンクにおいて)保管するために使用することができる。
【0041】
本発明によれば、用語「組織再生」は、新しい組織を幹細胞から再生することを示し、用語「再建」または用語「補強」は、この得られた再生組織を、組織修復または組織成長刺激が必要とされる哺乳動物対象に、好ましくは、組織修復または組織成長刺激が必要とされるヒト患者に埋め込み、一体化させることを示す。組織修復または刺激が、患者の組織に影響を及ぼすか、または、患者の全体的な全身的健康状態に影響を及ぼす損傷、疾患または衰弱(加齢状態)のために要求されるかもしれない。組織再生が、ガン、心筋症、先天性心臓疾患、冠状動脈疾患、虚血、拡張期機能不全、心内膜炎、心筋梗塞、パーキンソン病、アルツハイマー病、ハンチントン病、テイ・サックス病、脊髄傷害、脳卒中、脳血管障害、再生不良性貧血、多発性硬化症、関節リウマチ、シェーグレン症候群、1型糖尿病、グレーヴズ病、エリテマトーデス、骨再建、骨萎縮、骨粗鬆症および骨補強、ならびに、場合により、アテローム性動脈硬化および心筋炎の場合には特に必要とされる。
【0042】
したがって、用語「再建部位」は、修復目的または補強目的のための組織再建が要求される哺乳動物体内組織の特定の部位を示す。
【0043】
本発明によれば、「血小板富化血漿(PRP)」は、血小板の濃度が、処置された哺乳動物対象(ヒト患者)のベースライン静脈カウント数に対して少なくとも約100%の割合で増大しており、好ましくは約200%〜1000%の間の割合で増大しており、かつ、(1マイクロリットル(μL)あたり)少なくとも600000個の血小板濃度、または、1μLあたり少なくとも800000個の血小板濃度、または、1μLあたり少なくとも1000000個の血小板の血小板濃度に達し、好ましくは、1μLあたり約800000個(または約1500000個の血小板)〜1μLあたり約6000000個(または約8000000個の血小板)の間の血小板濃度に達し、より好ましくは、1μLあたり約2000000個の血小板〜1μLあたり約5000000個の血小板の間の血小板濃度に達する流体(溶液)を意味する。PRPは、遠心分離デバイスを用いて、例えば、米国特許第6719901号、国際公開WO02/080991、米国特許第6855119号、国際公開WO03/106040、国際公開WO00/61256および国際公開WO2004/024198に記載される遠心分離デバイスなどを用いて、都合よく得られる。
【0044】
Graziani F他、Clinical oral implant research、第17巻、第2号、212頁〜219頁(2006)は、細胞増殖に対する種々のPRP濃度の影響を調べている。最大の効果が2.5倍の濃度で達成され、より高濃度では、細胞増殖における低下がもたらされたようである。細胞増殖に対するPRPの最も注目すべき影響が約72時間で特徴づけられた。このときの血小板濃度は、得ることができた最大濃度のおよそ半分であった。しかしながら、一部の細胞増殖については、PRPのより高い濃度が好まれ得るかもしれない。
【0045】
トロンビンは、好都合には、自己トロンビン、異種トロンビンまたは組換えトロンビンが可能であり、好ましくは組換えトロンビンが可能であり、例えば、ZYMOGENETICS社(www.zgi.com)によって製造される組換えトロンビンなどが可能である。
【0046】
好ましくは、約10単位〜約200単位の(組換え型、ウシ型または自己)トロンビンが、より好ましくは、約10単位〜約75単位の(組換え)トロンビンが、6ml〜20mlの抗凝固処理(不活性化)PRPに加えられる。
【0047】
したがって、PRPの非常に遅い凝固を誘導するために、(組換え型、ウシ型または自己)トロンビンが、約0.5単位/ml〜約33単位/mlで、好ましくは約0.5単位/ml〜約3.75単位/mlで、より好ましくは約1.5単位/ml〜約3.75単位/mlで抗凝固処理(不活性化)PRPに加えられる。
【0048】
代替では、PRPの遅い凝固を誘導するために、(組換え型、ウシ型または自己)トロンビンが、約0.5単位/ml〜約10単位/mlで、好ましくは約1.5単位/ml〜約10単位/mlで抗凝固処理(不活性化)PRPに加えられる。
【0049】
トロンビン単位は、1mlのシュウ酸塩添加血漿を37℃において30秒で凝固する物質である。
【0050】
哺乳動物の血液凝固に関与する他の凝固因子(第VII因子、第VIIa因子(Novonordiskから得られるNovoSeven(登録商標))、第VIII因子、第IX因子、第X因子、第Xa因子など)もまた使用することができ、あるいは、血液凝固に関与する(またはトロンビンを生じさせることができる)どのような化合物もまた使用することができる。しかしながら、トロンボプラスチン(ヒト組織因子:hTFまたはhTf)が好ましい。これは、トロンボプラスチンは安全であり、かつ、可溶性形態で提供することができ、また、トロンビンに反して、凝固カスケードが制御可能であり、かつ、血液凝固があまり急速に得られないからである。組成物に存在するかもしれない関連脂質および他の分子の例が欧州特許EP1239894に記載される。
【0051】
好ましくは、PRPおよび凝固因子(凝固因子はより好ましくは可溶性ヒト組織因子(shTf)である)が、患者への注入の前(直前)に混合される。
【0052】
好都合には、PRPおよび凝固因子(凝固因子はより好ましくは可溶性ヒト組織因子(shTf)である)が、(好ましくは、約20℃〜約37℃の間に含まれる温度で)混合され、これらは、(約20℃〜約37℃の間に含まれる温度で)好ましくは数分間、可溶性のままである。
【0053】
より好ましくは、PRPは、凝固因子(凝固因子はより好ましくはshTfである)と混合されたとき、非常にゆっくり凝固し、好ましくは、混合されたときには、1分間を越えて、より好ましくは、2分間を越えて、3分間を越えて、4分間を越えて、または、5分間を越えてさえ、液体(可溶性)のままである(または、液体(可溶性)のままであることができる)(この場合、温度は約20℃〜約37℃の間に含まれる)。
【0054】
一層より好ましくは、PRPは、凝固因子(凝固因子はより好ましくはshTfである)と混合されたとき、非常にゆっくり凝固し、好ましくは、哺乳動物対象(ヒト患者)に注入されたとき、30秒間を越えて、より好ましくは、1分間を越えて、2分間を越えて、3分間を越えて、4分間を越えて、または、5分間を越えてさえ、液体(可溶性)のままである(または、液体(可溶性)のままであることができる)。
【0055】
好ましくは、約600単位〜約120000単位の(活性化)第VIIa因子(約12μg〜約2400μg)が、より好ましくは、約600単位〜約60000単位の(活性化)第VIIa因子(約12μg〜約1200μg)が、なおさらにより好ましくは、約600単位〜約6000単位の(活性化)第VIIa因子(約12μg〜約120μg)が、6ml〜20mlの抗凝固処理(不活性化)PRPに加えられる。
【0056】
したがって、(PRPの遅い凝固を誘導するために)、(活性化)第VIIa因子が、約30単位/ml(0.6μg/ml)〜約20000単位/ml(400μg/ml)で、好ましくは約30単位/ml(0.6μg/ml)〜約10000単位/ml(200μg/ml)で、より好ましくは約30単位/ml(0.6μg/ml)〜約1000単位/ml(20μg/ml)で抗凝固処理(不活性化)PRPに加えられる。
【0057】
代替では、(PRPの非常に遅い凝固を誘導するために)、(活性化)第VIIa因子が、約30単位/ml(0.6μg/ml)〜約6000単位/ml(120μg/ml)で、好ましくは約30単位/ml(0.6μg/ml)〜約3000単位/ml(60μg/ml)で、より好ましくは約30単位/ml(0.6μg/ml)〜約300単位/ml(6μg/ml)で、なおさらにより好ましくは約100単位/ml(2μg/ml)〜約300単位/ml(6μg/ml)で抗凝固処理(不活性化)PRPに加えられる。
【0058】
種々のリン脂質(ホスファチジルコリン、ホスファチジルエタノールアミンおよび/またはホスファチジルセリン)の添加を伴うヒト組織因子(hTF)が、ヒトトロンボプラスチンによって意味される。このhTfは、(完全な)hTfの263個のアミノ酸から、243個のアミノ酸(組織因子の細胞質外テールおよび膜部分)のポリペプチドまたは単に(短縮された)(可溶性)組織因子である短縮型hTfから、219個または206個のアミノ酸(細胞質外テールのみ)のポリペプチドから、あるいは、それらの任意の変化体から作製することができる。
【0059】
好ましくは、100μg〜3000μgの可溶性組織因子が、より好ましくは、約300μg〜約900μgの可溶性組織因子が、約6ml〜約20mlの抗凝固処理(不活性化)PRPに加えられる。
【0060】
したがって、(非常に遅い凝固を誘導するために)、約2μg/ml〜約150μg/mlの可溶性組織因子が、好ましくは、約15μg/ml〜約150μg/mlの可溶性組織因子が、なおさらにより好ましくは、約15μg/ml〜約45μg/mlの可溶性組織因子が、抗凝固処理(不活性化)PRPに加えられる。
【0061】
代替では、(PRPの遅い凝固を誘導するために)、約15μg/ml〜約500μg/mlの可溶性組織因子が、好ましくは、約50μg/ml〜約150μg/mlの可溶性組織因子が、抗凝固処理(不活性化)PRPに加えられる。
【0062】
(非修飾)hTfの変化体は、非修飾分子の機能的活性(PRPの活性化)に影響を及ぼさない、1つまたは複数のアミノ酸の欠失、付加または置換を含むことができる。
【0063】
PRPの活性化はまた、凝固カスケードに関与する他の分子によって得ることができ、好ましくは、上記方法の工程c)において使用される活性化合物の1つによって得ることができる。
【0064】
これらの様々な活性化合物は、とりわけ、凝固因子は、1つまたは複数の混入物(とりわけ、細菌またはウイルス)の伝播を避けるために、1つまたは複数の不活性化工程に付すことができる。この不活性化工程は、溶媒/界面活性剤、乾熱、UVC不活性化などを加えることに基づくことができる。
【0065】
本発明の方法では、とりわけ、上記方法の工程k)において、マイクロビーズが、媒体層がアスコルビン酸を含有し、かつ、内層被覆がβ−グリセロホスファートを含む薬物送達システムとして使用される。
【0066】
これらのマイクロビーズの他の改変を、選択された部位へのその補充、および、所望される細胞(例えば、筋肉細胞、血管細胞、ニューロン細胞、肝細胞、骨芽細胞、線維芽細胞など)へのその委任、分化のためには特に、幹細胞の分化を改善するための本発明による方法において使用することができる。
【0067】
好ましい実施形態において、本発明による方法では、工程a)、工程b)および工程c)が行われず、工程d)および工程e)が下記のように変更される:
d)幹細胞が多い目標注入領域(好ましくは、哺乳動物の胸骨または腸骨稜)を哺乳動物対象において、好ましくはヒト患者の骨髄において選択すること、
e)十分な量の幹細胞活性化流体または工程c)で使用される活性化合物を哺乳動物対象(ヒト患者)のこの目標注入領域に注入して、その結果、自己PRPを加えることなく、(間葉系)幹細胞のインビボ増殖を直接、哺乳動物対象(好ましくはヒト患者)において局所的に誘導すること。
【0068】
本方法のこの好ましい実施形態の他の工程、すなわち、工程f)〜工程m)は、上記で記載される工程に対応し得る。
【0069】
別の好ましい実施形態において、工程f)〜工程m)が行われず、工程a)〜工程e)が、哺乳動物対象(ヒト患者)の身体において、とりわけ、幹細胞の濃度が低い高齢者(50歳を超える高齢者、好ましくは、約60歳の高齢者または65歳を超える高齢者)において、幹細胞の増殖を得るために使用される。幹細胞の刺激によるこの若返り工程が、組織または細胞の再生、再建、補強または若返りを改善するために、とりわけ、このヒト患者身体における損傷または疾患のある組織または細胞の再生、再建、補強または若返りを改善するために、好ましくは(ヒト)患者の身体に対する可能な外科手術の前に行われる。
【0070】
必要ならば、前記刺激を、工程a)〜工程c)を使用することなく、前記実施形態において記載されるように得ることができ、また、PRPの添加を伴うことなく、上記で提案されるように工程d)および工程e)を選択することによって得ることができる。
【0071】
本発明による方法では、十分なインキュベーション時間の後、当業者は、幹細胞が多い骨髄(液)サンプルを、好ましくは目標注入領域から集めることができ、または、(EPC、MSC)幹細胞が同様に多い血液サンプルを集めることができる。
【0072】
この回収工程(f)は、幹細胞のインビボ増殖がまた、哺乳動物対象の血液へのこれらの幹細胞の増殖を誘導しているという事実のために、血液サンプルに対して行うことができる。したがって、当業者によって広く知られている方法によって、例えば、古典的なプラスマフェレーシス透析法およびプラスマフェレーシス透析手段などによって、血液サンプルから直接、幹細胞を回収することが可能である。
【0073】
本発明は、(非凝固および/または可溶性)PRPおよび(十分な量の)凝固因子、または、それらを含む(医薬用)組成物を、医薬品として、好ましくはPRPおよび凝固因子の非凝固および/または可溶性の混合物の形態で提供する。
【0074】
好ましくは、PRPおよび凝固因子(凝固因子は好ましくはshTfである)が、患者への注入の前(直前)に混合される。
【0075】
より好ましくは、PRPは、凝固因子(凝固因子は好ましくはshTfである)と混合されたとき、非常にゆっくり凝固し、好ましくは、1分間を越えて、より好ましくは、2分間を越えて、3分間を越えて、4分間を越えて、または、5分間を越えてさえ、液体(非凝固および/または可溶性)のままである(または、液体(非凝固および/または可溶性)のままであることができる)。
【0076】
凝固因子の十分な量によって、(不活性化)PRPの(非常に)遅い凝固を可能にする量が意味される。
【0077】
より好ましくは、本発明は、PRPおよび凝固因子(血液凝固に関与する化合物)(の非凝固および/または可溶性の混合物)(ただし、凝固因子は、(好ましくは可溶性)トロンボプラスチン(または組織因子(TF))、第Xa因子、第VIIa因子またはそれらの混合物からなる群から選択される)、または、それらを含む(医薬用)組成物を医薬品として提供する。
【0078】
なおさらにより好ましくは、本発明は、PRPおよびこの凝固因子(血液凝固に関与する化合物)(の非凝固および/または可溶性の混合物)、または、それらを含む(医薬用)組成物を、哺乳動物対象の幹細胞プール、好ましくはヒト患者の幹細胞プール、好ましくはEPCおよび/またはMSCを、より好ましくはHSCプールを変化させることなく、または、止血を変化させることなく富化するための医薬品としての使用のために提供する。
【0079】
代替では、本発明は、凝固因子、好ましくは、(好ましくは可溶性)トロンボプラスチン(または組織因子(Tf))、第Xa因子、第VIIa因子またはそれらの混合物からなる群から選択される凝固因子(より好ましくは可溶性組織因子(sTF)、なおさらにより好ましくは可溶性ヒト組織因子(shTf))を、哺乳動物対象の幹細胞プール、好ましくはヒト患者の幹細胞プール、好ましくはEPCおよび/またはMSCを、より好ましくはHSCプールを変化させることなく、または、止血を変化させることなく富化するための医薬品としての使用のために提供する。
【0080】
本発明は、PRPおよび凝固因子(の非凝固および/または可溶性の混合物)(凝固因子は、好ましくは、(可溶性)トロンボプラスチン(hTf)、第Xa因子および第VIIa因子からなる群から選択され、より好ましくは可溶性hTfである)、または、それらを含む(医薬用)組成物を、医薬品としての使用のために、とりわけ、心臓血管(心臓関連または心臓性)疾患、好ましくは、(変性)心筋症、(先天性)心臓疾患、冠状動脈疾患、虚血、拡張期機能不全、アテローム性動脈硬化、心筋炎、心内膜炎および心筋梗塞からなる群から選択される心臓血管(心臓関連または心臓性)疾患の処置および/または防止のための医薬品としてのそれらの使用のために提供する。
【0081】
代替では、本発明は、凝固因子、好ましくは、(好ましくは可溶性)トロンボプラスチン(または組織因子(Tf))、第Xa因子、第VIIa因子またはそれらの混合物からなる群から選択される凝固因子(より好ましくは可溶性組織因子(sTf)、なおさらにより好ましくは可溶性ヒト組織因子(shTf))を、心臓血管(心臓関連または心臓性)疾患、好ましくは、(変性)心筋症、(先天性)心臓疾患、冠状動脈疾患、虚血、拡張期機能不全、アテローム性動脈硬化、心筋炎、心内膜炎および心筋梗塞からなる群から選択される心臓血管(心臓関連または心臓性)疾患の処置および/または防止のための医薬品としての使用のために提供する。
【0082】
本発明は、PRPおよび凝固因子(の非凝固および/または可溶性の混合物)(凝固因子は、好ましくは、(可溶性)トロンボプラスチン(hTf)、第Xa因子および第VIIa因子からなる群から選択され、より好ましくは可溶性hTfである)、または、それらを含む(医薬用)組成物を、神経学的疾患、好ましくは、パーキンソン病、アルツハイマー病、ハンチントン病、テイ・サックス病、脊髄傷害、脳卒中および脳血管障害および筋萎縮性側索硬化症(ALS)からなる群から選択される神経学的疾患の処置および/または防止のための医薬品としての使用のために提供する。
【0083】
代替では、本発明は、凝固因子、好ましくは、(好ましくは可溶性)トロンボプラスチン(または組織因子(Tf))、第Xa因子、第VIIa因子またはそれらの混合物からなる群から選択される凝固因子(より好ましくは可溶性組織因子(sTf)、なおさらにより好ましくは可溶性ヒト組織因子(shTf))を、(哺乳動物対象の)神経学的疾患、好ましくは、パーキンソン病、アルツハイマー病、ハンチントン病、テイ・サックス病、脊髄傷害、脳卒中および脳血管障害および筋萎縮性側索硬化症(ALS)からなる群から選択される(哺乳動物対象の)神経学的疾患の処置および/または防止のための医薬品としての使用のために提供する。
【0084】
本発明は、PRPおよび凝固因子(の非凝固および/または可溶性の混合物)(凝固因子は、好ましくは、(可溶性)トロンボプラスチン(hTf)、第Xa因子および第VIIa因子からなる群から選択され、より好ましくは可溶性hTfである)を、変性(自己免疫)疾患、好ましくは、再生不良性貧血、多発性硬化症、関節リウマチ、シェーグレン症候群、1型糖尿病、グレーヴズ病およびエリテマトーデスからなる群から選択される変性(自己免疫)疾患の処置および/または防止のための医薬品としての使用のために提供する。
【0085】
代替では、本発明は、(好ましくは可溶性)トロンボプラスチン(または組織因子(Tf))、第Xa因子、第VIIa因子またはそれらの混合物(より好ましくは可溶性組織因子(sTf)、なおさらにより好ましくは可溶性ヒト組織因子(shTf))を、変性(自己免疫)疾患、好ましくは、再生不良性貧血、多発性硬化症、関節リウマチ、シェーグレン症候群、1型糖尿病、グレーヴズ病およびエリテマトーデスからなる群から選択される変性(自己免疫)疾患の処置および/または防止のための医薬品としての使用のために提供する。
【0086】
本発明は、PRPおよび凝固因子(の非凝固および/または可溶性の混合物)(凝固因子は、好ましくは、(可溶性)トロンボプラスチン(hTf)、第Xa因子および第VIIa因子からなる群から選択され、より好ましくは可溶性hTfである)、または、それらを含む(医薬用)組成物を、ガン(白血病)および/または感染性疾患(AIDS)の処置のための医薬品としての使用のために提供する。
【0087】
代替では、本発明は、(好ましくは可溶性)トロンボプラスチン(または組織因子(Tf))、第Xa因子、第VIIa因子またはそれらの混合物(より好ましくは可溶性組織因子(sTf)、なおさらにより好ましくは可溶性ヒト組織因子(shTf))を、ガン(白血病)の処置のための医薬品としての使用のために提供する。
【0088】
本発明は、PRPおよび凝固因子(の非凝固および/または可溶性の混合物)(凝固因子は、好ましくは、(可溶性)トロンボプラスチン(hTf)、第Xa因子および第VIIa因子からなる群から選択され、より好ましくは可溶性hTfである)、または、それらを含む(医薬用)組成物を、骨変性関連疾患、好ましくは、骨萎縮、骨粗鬆症からなる群から選択される骨変性関連疾患の処置および/または防止のための医薬品としての使用のために、また、場合により、骨再建または骨補強のための医薬品としての使用のために提供する。
【0089】
代替では、本発明のPRPおよび凝固因子は、哺乳動物対象の腸骨稜、胸骨の中、および/または、脂肪組織に、好ましくはヒト患者の腸骨稜、胸骨の中、および/または、脂肪組織に、より好ましくは、前記ヒト患者の腸骨稜の骨髄に、(非凝固および/または可溶性の混合物の形態で)同時に(または別々に)注入される。
【0090】
好都合には、(非凝固および/または可溶性の混合物の形態での)約6ml〜約20mlのPRPにおける約2μg/ml〜約500μg/mlの(可溶性)hTfが、好ましくは対象または患者の腸骨稜、胸骨および/または脂肪組織に注入される本発明の医薬品において使用される。
【0091】
代替では、(非凝固および/または可溶性の混合物の形態での)約6ml〜約20mlのPRPにおける約5単位/ml〜約500単位/mlの第Xa因子が、好ましくは対象または患者の腸骨稜または胸骨および/または脂肪組織に注入される本発明の医薬品において使用される。
【0092】
代替では、(非凝固および/または可溶性の混合物の形態での)約6ml〜約20mlのPRPにおける約30単位/ml〜約20000単位/mlの第VIIa因子が、好ましくは対象または患者の腸骨稜または胸骨および/または脂肪組織に注入される本発明の医薬品において使用される。
【0093】
本発明の別の局面が、場合により、適切な医薬用のキャリアまたは希釈剤と、効果的な量のPRPと、下記からなる群から選択される、効果的な量の凝固因子とを含む(非凝固および/または可溶性の)医薬組成物であって、心臓血管疾患、神経学的疾患、自己免疫疾患、炎症、肝臓傷害および/または骨粗鬆症からなる群から選択される疾患の処置および/または防止のための(非凝固および/または可溶性の)医薬組成物である:
・トロンボプラスチン(組織因子)、好ましくは組換えトロンボプラスチン(rTf)、好ましくはヒト組織因子(hTf)、より好ましくは組換えヒト組織因子(rhTf)、より好ましくは組換え可溶性ヒト組織因子(rshTf)、これらは、より好ましくは、リン脂質(PL)、より具体的には、ホスファチジルコリン、ホスファチジルセリンおよびホスファチジルエタノールアミンの添加を伴う;または
・第VII(a)因子、
・第X(a)因子、
・組織因子−第VII(a)因子、
・組織因子−第VII(a)因子−第X(a)因子、
・第VIII(a)因子、
・第IX(a)因子、あるいは、上記化合物の組合せ(ただし、これらの因子は活性化型または非活性化型である)。
【0094】
好ましくは、本発明による(非凝固および/または可溶性の)医薬組成物は心臓病学において使用され、ただし、この場合、心臓血管(心臓関連または心臓性)疾患が、好ましくは、アテローム性動脈硬化、心筋症、先天性心臓疾患、心筋炎、冠状動脈疾患、心臓血管障害、拡張期機能不全、心内膜炎、虚血および心筋梗塞からなる群から選択される。
【0095】
好ましくは、本発明による(非凝固および/または可溶性の)医薬組成物は神経学において使用され、ただし、この場合、神経学的疾患が、好ましくは、パーキンソン病、アルツハイマー病、ハンチントン病、テイ・サックス病、脊髄傷害、脳卒中、脳血管障害、再生不良性貧血、筋萎縮性側索硬化症(ALS)および/または多発性硬化症からなる群から選択される。
【0096】
本発明の別の局面が、幹細胞のインビトロ増殖のための、(非凝固(可溶性))PRPおよび凝固因子(好ましくはhTf)の(混合物の)使用である。
【0097】
最後に、本発明の1つの局面が、本発明による方法の種々の実施形態を行うための様々な要素および手段を含む、構成要素のキットに関連し、とりわけ、下記のものを含むキットに関連する:
・自己PRPを集めるための遠心分離デバイス、および、場合により、自己トロンビンまたは異種トロンビンを哺乳動物の血漿から得るための手段;
・1つまたは複数の哺乳動物活性化合物(凝固因子)、好ましくは、1つまたは複数のヒト活性化合物(凝固因子)、あるいは、上記方法の工程c)において使用される前記1つまたは複数の化合物を含む1つまたは複数の流体(溶液)(ただし、これらは1つまたは複数のバイアルに存在するかもしれない);
・場合により、血液サンプルおよび/または骨髄サンプルおよび/または脂肪サンプルを哺乳動物対象から集めるための手段;および
・場合により、この自己PRPおよび/またはこの活性化合物を、MSCが多い目標注入領域において哺乳動物対象に再注入するための手段(シリンジ、ニードル、管類など)。
【0098】
好ましくは、これらの手段は、MSC活性化化合物(凝固因子)またはMSC活性化化合物(凝固因子)を含む流体と一緒での(自己)PRPの注入のために十分であり、これらの手段はまた、幹細胞が多いこの目標注入領域から、これらの幹細胞を含む骨髄液サンプルを集めるためにも十分である。
【0099】
好都合なことに、これらの手段はまた、遠心分離デバイスへの接続を得るために、また、得られた自己PRP(および、場合により、自己トロンビン)を集めるために、また、集められた血小板富化血漿液(および、場合により、自己トロンビン)を、(間葉系)幹細胞が多い目標部位(胸骨、腸骨稜または脂肪組織)において、同じ患者に(同時に)注入するために十分である。これらの手段はまた、この目標注入領域から、同じ哺乳動物に由来する骨髄液サンプルを集めるために使用され(ただし、この場合、この骨髄液サンプルは、インビトロ増殖の後で幹細胞が多くなっている)、また、場合により、これらの幹細胞を、好ましくは(場合により、本発明のキットの遠心分離デバイスによる)遠心分離によって、または、米国特許出願公開第2007/0276352号に記載される手段によってそれらの混入物から分離するために使用される。
【0100】
これらの手段はまた、(間葉系)幹細胞が多い血液サンプルを集めるための好適な要素、および、これらの幹細胞を当業者によって広く知られている手段によって血液サンプルから分離するための好適な要素、ならびに、場合により、これらの幹細胞を、好ましくは(場合により、本発明のキットの遠心分離デバイスによる)遠心分離によってそれらの混入物から分離するための好適な要素を含むことができる。
【0101】
好ましくは、これらの手段は、注入シリンジおよび採取用シリンジ、あるいは、骨髄もしくは血液への流体の注入、および/または、骨髄もしくは血液からの流体の採取のための専用デバイス、好ましくは、上記で記載される本発明によるデバイス、好都合には遠心分離デバイスに連結される上記で記載される本発明によるデバイス、好ましくは、国際公開WO03/106040、米国特許第6855119号、国際公開WO02/080991および米国特許第6719901号の各文書に記載されるような遠心分離デバイスを含む。
【0102】
本発明による、構成要素のキットにおいて、幹細胞活性化化合物は好都合には、急速な凝固を避けるために、PRPを含む注入シリンジとは別にされるバイアルまたはシリンジに、あるいは、骨髄への流体の注入および/または骨髄からの流体の採取のための専用デバイスに、好ましくは、上記で記載される本発明によるデバイスに存在する。幹細胞が多い目標注入領域におけるPRPおよび活性化化合物(凝固因子)の同時注入を可能にする二重注入シリンジ(すなわち、the Company Harvest(登録商標)USAによって販売されるSmarjet(商標)液体・噴霧送達システム、PRP・トロンビン製剤SMARTPREP(商標)(Harvest(登録商標)USA)の作製のために使用される他のシステム、自己血小板分離装置Magellan(商標)(Medtronic(登録商標))、Symphony(登録商標)血小板濃縮システム(Depuy)、Acromed(登録商標)デバイス(Johnson and Johnson(登録商標))、Angel(登録商標)(SORIN−DIDECO)、血液銀行において使用される3i血小板濃縮デバイスまたは他のデバイス)を使用することもまた可能である。
【0103】
本発明の、構成要素のキットはまた、緩衝剤および分化化合物、または、これらの化合物を含む流体などを含めて、注入のための種々の活性化合物または流体を有する異なるバイアルを含むことができる。
【0104】
本発明による注入シリンジまたはデバイスは哺乳動物対象の胸骨または腸骨稜における注入のために十分であり、好ましくはヒト患者の胸骨または腸骨稜における注入のために十分である。
【0105】
本発明の、構成要素のキットはまた、他の要素、例えば、好適な注入を可能にするための管類、ポンプ、バルブなどを、哺乳動物の身体からの十分な採取のために、また、本発明によるプロセスの自動化を可能にするために含むことができる。これらの要素は好都合には、当業者によって広く知られている好適な自己輸血手順によって手術部位から採取し、生物学的化合物を患者に再注入するための自己輸血システムにおいて一体化される。
【0106】
構成要素のこのキットはまた、好適なコンピューターおよび適切なソフトウエアによって実施および/または制御され得る本発明による連続する工程を行うための指示手段を含むことができる。
【図面の簡単な説明】
【0107】
【図1】図1は、内皮前駆体細胞の数を、本発明の方法による注入の前または後において患者の血液または患者の骨髄に存在する106個の非接着性細胞について表す。
【0108】
【図2】図2は、処置前および処置後のEPCである。
【0109】
【図3】図3は、エクスビボ培養の有無に関して、本発明の方法による注入の前または後におけるMSCの数を表す。
【0110】
【図4】図4は、PRP+可溶性hTfの注入の前(0日目)、3日後および7日後に患者の血液または骨髄から得られる、コロニーを形成することができるEPCの数を表す。これは、処置による血液におけるEPCの動員を強調する。
【0111】
【図5】図5は、PRP注入後のMSCのインビトロ培養を表す。
【0112】
【図6】図6は、刺激域におけるコロニー形成単位−線維芽細胞(CFU−F)の増大を表す。
【0113】
【図7】図7は、注入部位(左側)または反対側部位(右側)において、PRP+可溶性hTfの注入の前(0日目)に得られるMSC、または、7日後に得られるMSCのインビトロ増加を表す。MSCの拡大特性が処置によって増大するが(左側の7日目および0日目を比較のこと)、反対側部位では減少する。
【0114】
【図8】図8は、PRP+可溶性hTfによる処置の前、3日後および7日後における血液細胞集団を表す。CD34およびCD133について陽性である細胞(幹細胞)が、処置の3日後および7日後ではるかにより多く存在する。これは骨髄からの動員を反映する。
【0115】
【図9】図9は、PRP+可溶性hTfによる処置の前および7日後に処置部位(左側)または反対側部位において得られる骨髄細胞集団を表す。CD34およびCD133のレベルが両方の部位において処置によって維持される。これは、幹細胞含有量を補充する骨髄の能力を強調する。CD31細胞が両方の部位においてはるかにより多く存在する。
【0116】
【図10】図10は、間葉系前駆体としてコロニーを形成することができる細胞(CFU−F)、および、前骨芽細胞マーカーと見なされるアルカリホスファターゼを発現する間葉系前駆体としてコロニーを形成することができる細胞(CFU−O)の相対数を表す。細胞を、処置前(G0)、PRP+可溶性hTfによる処理の3日後に処置部位(G3およびRG3)または反対側部位(D3およびRD3)において骨髄から採取した。細胞の一部はまた、間葉系細胞を富化するために処理された(RG3およびRD3)。
【0117】
【図11】図11は、カルシウムおよびアルカリホスファターゼの測定とともに、骨組織に向かう分化を表す。細胞を、処置前(G0)、PRP+可溶性hTfによる処置の3日後に処理部位(G3)または反対側部位(D3)において骨髄から採取し、示された時間、ペトリ皿で成長させた。
【0118】
【図12】図12は、図10の場合のように処理されたが、28日までの間成長させられた細胞のインシトゥーカルシウム標識化を表す。
【0119】
【図13】図13は、本発明に従って得られた幹細胞を(より大きな量で)使用する患者の顎の骨再建を表す。左側:処置後1週間、12cm3の異種骨で満たされるインプラントを示す;右側:54日の処置の後、インプラントを再び覆う、同種組織の再形成および新形成された骨組織を開示する。下段パネル:再建された顎が生組織から作製されること(血管形成)を立証する処置後90日での99Tcシンチグラフィー。
【発明を実施するための形態】
【0120】
本発明の方法では、ヒト患者が、移植片について、提供者として、また、宿主として、両方で使用される。
【0121】
本発明の方法の独創性は、増殖細胞工程が、その部位において、すなわち、インビボで行われ、先行技術による技術で行われるようなインビトロではもはや行われないことである。しかしながら、本発明に従って刺激される幹細胞は、(刺激されていない幹細胞と比較して)インビトロでの増大した成長を有する。ヒト患者によって産生される幹細胞の量は、生まれた直後のヒトでは極めて重要であるが、年とともに急激に減少することが知られている。
【0122】
したがって、幹細胞を患者から回収すること、とりわけ、高齢者の患者から回収することは、極めて困難である。
【0123】
したがって、本発明による方法および手段は、患者に対する限定された危険性により、大量の幹細胞をインビボで迅速に得るために、また、これらの得られた幹細胞を回収するために使用することができる。
【0124】
活性化された自己PRPの使用と組み合わされるこの技術的特徴は、本発明の方法および手段に、効率の点で先行技術を上回る実際の利点をもたらす。
【0125】
実際、移植片拒絶の危険性がこのように最小限に抑えられ、本方法の安全性が最大化される。これは、インビトロ操作が最小限に抑えられる(または、最小限に抑えられ得る)からである。
【0126】
加えて、本発明者らは、好都合なことに、白血球数が、本方法適用時、ならびに/または、PRPおよび凝固因子を本発明に従って使用した後、患者の血液においてほとんど変化しないことを認めた。
【0127】
しかしながら、数工程が、とりわけ、細胞の分化がインビトロで実現され得る。
【0128】
PRPおよび可溶性hTfが富化される細胞培地が、幹細胞の増殖をインビトロで誘導することにおいて、同様にまた、幹細胞を未分化状態で保つことにおいてより大きい効力を有することもまた明らかにされる。
【0129】
約20ml〜約200mlの血液サンプル、好ましくは、ヒト患者からの約60mlの血液が集められる。この採血サンプルから、(ヒト患者の全血における元の濃度の約100%〜約1000%またはそれ以上の間での)濃度の血小板を含む自己血小板富化血漿(自己PRP)の調製物(約6mlまたは約7ml〜約40mlのPRP、好ましくは約7ml〜約10mlのPRP)を最新技術(国際公開WO03106040、国際公開WO00/61256、国際公開WO2004/024198、米国特許第6855119号、国際公開WO02/080991および米国特許第6719901号)において記載されるMagellan(商標)Medtronic(登録商標)法および装置またはデバイスによって得ることが可能である。
【0130】
得られた自己血小板富化血漿が、濃縮された活性化自己PRPを含有する第1の溶液を形成するために、1マイクロリットルあたり、乾燥形態での凝固因子(約200単位〜約10000単位のトロンビン、または、約1mgの組換えヒト組織因子(トロンボプラスチン))に加えられる。
【0131】
血小板濃度が、血小板の生存性を約37℃で保証するように適合化される。
【0132】
代替では、トロンビンまたは組換え可溶性ヒト組織因子(トロンボプラスチン)を前記の自己血小板富化血漿に加える代わりに、自己PRPを、好ましくは、流体を骨髄腔に送達すること、および/または、流体を骨髄腔から抜き取ることのために好適な本発明の永続的な埋め込み可能な手段を使用して、同じヒト患者の腸骨稜、胸骨または脂肪組織に再注入することができる。
【0133】
凝固因子(またはCaCl2)が、注入直前のPRPのシリンジに加えられる。
【0134】
この溶液が、同じヒト患者の腸骨稜、胸骨または脂肪組織に再注入され、その結果、(間葉系前駆細胞および/または内皮前駆細胞の)インビボ増殖が、HSC幹細胞の増殖を好都合には誘導することなく、前記患者において局所的に誘導される。
【0135】
注入後の約3日、4日、5日、6日、7日、8日、9日、10日、11日、12日、13日、14日、15日、16日、17日、18日、19日、20日から、約21日までで、(間葉系)幹細胞が多い骨髄サンプルが、(同じ目標注入部位において)集められた。3日後および7日後に、10mlの血液サンプルおよび骨髄サンプルが、血液学的パラメーター(ヘマトクリット、ヘモグロビン、白血球)の最終的変化を推定するために集められた。3日後および7日後に、骨髄サンプルが、EPCおよびMSCを比較するために、また、末梢血における幹細胞の動員を立証するために、互いに向かい合わせで行われる2回の穿刺によって集められた。
【0136】
この採取工程が、例えば、整形外科的処置法または外科的処置法のために、提案されるのと同じ日に行われる。
【0137】
これらの採取工程は好ましくは、十分な幹細胞濃度を得るように、規定された時間間隔で数回(好ましくは毎週)繰り返される。
【0138】
血小板は、血小板由来増殖因子、トランスフォーミング増殖因子ベータ、血小板由来上皮増殖因子、血小板由来血管形成因子、インスリン様増殖因子1および血小板増殖因子4を含めて、数多くの分子を放出することが知られている。これらの分子は、局所的な間葉系細胞および内皮細胞に、遊走、分裂、ならびに、コラーゲン合成およびマトリックス合成の増大を行うためのシグナルを送る。
【0139】
さらに、以前に集められた骨髄サンプルが、活性化および濃縮された自己PRPおよびMSCを含む組成物を得るように、(好ましくは、約1mgの量の組換えヒト組織因子(トロンボプラスチン)、または、十分な量の上記凝固因子の1つに加えて)、血小板富化血漿と混合される。
【0140】
さらに、約80mg/mlの量のビタミンC(L−アスコルビン酸)、ビタミンD3(1,25(OH)2D3ビタミン)、および、約10−8Mの濃度のデキサメタゾンを、増殖、分化およびマトリックス産生を誘導するために、この濃縮物に加えることができる。デキサメタゾンは好ましくは、カプセル化された化合物の(遅延)放出を可能にする、PLGA(ポリDL−乳酸−co−グリコール酸)、PGA(vp8)(ポリグリコール酸)、PLLA(ポリ−L−乳酸)および/またはアルギン酸塩の足場(例えば、マイクロビーズなど)と一緒に調製される。他のポリマー化合物を、これらの好ましい化合物の効率的なカプセル化および放出を得るために使用することができる。
【0141】
骨形成を強化するための活性な化合物を含むそのような足場は、科学文献において既に記載された足場と類似している(Mariani M.他、Tissue Eng.、12(3)、547頁〜558頁(2006)、および、Inane B.他、Tissue Eng.、12(2)、257頁〜266頁(2006))。
【0142】
得られた組成物は、骨組織の再生のために直接に使用され得るペーストを形成するように、十分なゲル化剤(例えば、アルギン酸塩またはCaCl2溶液など)を同様に含むゲルと類似している(国際公開WO2004/024198を参照のこと)。これは、効率的な拡大および/または分化を得るために当業者によって適合化することができる。
【0143】
さらに、種々の段階で細胞によって発現されるいくつかの表現型マーカー(産生されるCD34、CD133、CD45、NGF−R、サイトカインなど)を、幹細胞の発現、および/または、未成熟な細胞(未成熟な骨前駆体細胞)、成熟した骨前駆体細胞、前骨芽細胞、成熟した骨芽細胞、骨細胞などへの幹細胞の分化を追跡するために使用することができる。
【0144】
他の化合物、例えば、転写調節因子(Cbfa−1、Msx−2、c−fos、fra−2、Dix−5など)、リンホカイン(IL−1)、増殖因子(TGF−β)、(EGF)などもまた、本発明の方法および組成物において使用することができる。
【0145】
骨髄においてCD34+およびCD31+である第1のタイプの幹細胞が得られた。図1および図2は、本発明の方法に関して、骨髄および末梢血においてEPCのインビボでの刺激を(PRPおよび組織因子の添加によって、例えば、20μg〜1000μgの可溶性組織因子(sTF)/6mlのPRP、好ましくは100μg〜700μgのsTF/6mlのPRP、より好ましくは334μgのsTF/6mlのPRPの添加によって)得ることが可能であることを示す。さらに、MSCはまた、初回培養の前後で、著しく、かつ、予想外に増幅される(図7)。

表1から、処置後7日目で、「娘細胞」含有量(例えば、WBCおよびCFU−Fなど)が骨髄の注入側では強く高められる。実際には、この影響は一層より大きい。実際、この定量では、注入の反対側でのCFU−F含有量およびCFU−C含有量の減少によって例示されるような、また、図3および図7において実証されるような血液への細胞の動員が計数されない。動員のこの最初の証拠は、健康な患者の場合でさえ、治療目的のための可能性を示す。そのうえ、他の「娘細胞」、すなわち、図1において明らかにされるようなEPCが血液において動員され、また、骨髄に驚くほど(より)多く存在したままであり(図2を参照のこと)、このことは、刺激(増加)、それに続く、分化および動員の複雑な速度論を反映している。
【0146】
その後、本発明者は、コロニーを形成する処置された細胞の能力を測定した。図3に示されるように、細胞が血液および骨髄から得られる。上記で示されるように、PRP+可溶性hTfを注入した3日後、EPCコロニーの数が2倍を超えて増大する。この影響が7日目までずっと持続する。しかしながら、骨髄では、EPCコロニーの数が7日目において低下した。これはそれらの動員を反映する。
【0147】
MSCを7日間のPRP+可溶性hTfの注入の後で骨髄から採取し、その後、ペトリ皿で成長させた(図5)。はるかにより多くのCFU−Fが、PRP+可溶性hTfの注入の後で骨髄から得られた。
【0148】
本発明者は、7日間の処置の前または後で骨髄から採取された単核細胞(MNC)を精製し、コロニーを形成するその能力が3倍増大していることを測定した(図6)。
【0149】
MSCを7日間のPRP+可溶性hTfの注入の前または後で骨髄から採取し、その後、成長させた(図7)。処置部位から採取された細胞は、より多く存在することのほかに、インビトロで成長する増大した能力を獲得していた。
【0150】
その後、本発明者は血液中の細胞(図8)および骨髄中の細胞(図9)の特徴づけを行った。血液において、CD34細胞およびCD133細胞が処置によって増大した。このことは、幹細胞の成長および動員に対する処置の正の影響を開示する。一方、それらの相対的存在量が骨髄において一定のままであった。このことは、幹細胞含有量を一定に保つ骨髄の能力を反映する。本発明者はさらに、処置後、CD31細胞が骨髄により多く存在することを認めた。この速度論は、細胞タイプおよび階層に関連づけられる:「母」のCD34+およびCD133+についてはより迅速であり(それらのレベルが7日目でベースラインにほぼ戻った)、「娘」のEPCおよびCFU−F幹細胞についてはより遅く(それらのレベルが注入側では7日目においてより大きい)、そして、分化したWBCについては一層より遅いかもしれない。
【0151】
異種移植片、同種移植片または自己移植片から得られる無機質型マトリックスもまた、骨再生組織を改善するためのゲル組成物において使用することができる。
【0152】
特定の組織への幹細胞の分化を得るために、特定の組織の再生を得るためのいくつかの特異的な増殖因子を使用することが可能である(皮膚組織を得るための上皮増殖因子(EGF)、骨または軟骨の形成を誘導するためのBMPファミリーの化合物、造血系分化を誘導するためのG−CSFまたはAMD300、その他)。
【0153】
ゲル組成物はまた、(骨芽細胞系細胞を得るために、)連続する増殖、分化、成熟化、および、場合により、鉱物化を伴う事象の複雑なカスケードを介して、幹細胞を拡大し、要求される組織細胞に分化させるために、他の要素を含むことができる。このゲル組成物はまた、(異栄養性無機質沈着物形成を誘導するための)β−グリセロホスファート、いくつかのより特異的なヒト増殖因子、または、カルシウム含有化合物(例えば、CaCl2、β−リン酸三カルシウム、骨粒子(変性骨由来または非変性骨由来)、アパタイト、アスピジン(aspidine)、硫酸カルシウム、炭酸カルシウム、ヒドロキシアパタイト、グルコノ乳酸カルシウム(calcium gluconolactate)、グルコン酸カルシウム、乳酸カルシウム、カルシウムグルトニアート(calcium glutoniate)およびそれらの混合物)を含む場合があり、そのような化合物の例が欧州特許EP1239894に記載される。
【0154】
本発明者は幹細胞を上記のように刺激し、その後、コロニーを形成するその増大した能力、アルカリホスファターゼを発現するその増大した能力、カルシウムを利用および固定するその増大した能力を測定した(図10〜図12)。
【0155】
その後、本発明者は、得られた細胞を使用して、自己インプラントを作製し、完全な骨を再構成した。
【0156】
図13に示されるように、本発明者はまた、骨髄へのPRPおよび可溶性hTfの注入によって幹細胞を活性化し、その後、幹細胞を活性化後3日目に得た後で、生組織を再構成することができた。3日間の活性化の後、内皮前駆体細胞の7倍の増大が血液において認められ、一方、骨髄では2倍の増大であった。このことは、処置後3日での幹細胞の増加および動員の両方を反映する。これらの幹細胞を、患者の損傷した顎に設置されるために適合化されたチタンの網状物に沈着させた。これらの活性化幹細胞は、99Tcシンチグラフィーによって示されるように、成長、分化、および、生組織の再構成(新しい血管の産生を含む)を行うことができた。
【0157】
その後、本発明者は、本発明に従って処置された13名の患者において、サイトカインの血中濃度における何らかの変化について探索した。かなりの増大が、PRPおよび凝固因子(shTf)を前記患者の腸骨稜の骨髄に注入した後の3日および7日で、FGF−2(約4倍)、VEGF(約2倍)、Rantes(約2倍)およびBDNF(+50パーセント)において認められた。
【0158】
その後、本発明者は、神経変性(神経学的)疾患に罹患している患者において、疾患を遅らせるか、または、それどころか、疾患を停止させるつもりで、PRPおよび凝固因子(shTf)の注入を試験した。本発明者は筋萎縮性側索硬化症(ALS)罹患患者を選択し、腸骨稜由来の骨髄におけるPRPおよび凝固因子(shTf)を左側に注入した。その後、4日後に、本発明者は、同じ注入を右側において再び行い、このプロトコルを1ヶ月間繰り返し、そして、患者を、そのような注入を行うことなく1ヶ月間回復させた。その後、この注入プロトコルを繰り返した。疾患の悪化における軽減が得られ、また、ある程度の改善さえ得られた。
【0159】
その後、本発明者はさらに、患者の骨髄の幹細胞を、PRPおよび凝固因子(shTf)を注入した3日後に回収し、その後、(MSC富化)幹細胞を、富化された幹細胞(MSC)を患者の心臓に再注入する前に5分間の2000g×分での遠心分離によって活性化骨髄から精製することによって心臓病学(心筋梗塞罹患患者)において本発明を評価した。全体的には、本発明者は、本発明の教示に従って処置された患者における改善を認めた。
【0160】
本発明者はさらに、適合し得る提供者の腸骨稜に由来する骨髄においてPRPおよび凝固因子(shTf)を注入することによって幹細胞の増殖および活性化を刺激した。その後、本発明者は、骨髄が放射線照射されている白血病罹患患者への再注入の前に、(活性化)骨髄サンプルをこの提供者から単離した。
【0161】
その後、本発明者は、感染性疾患(AIDS)において本発明を評価した。
【0162】
しかしながら、本発明の方法および/または医薬用製造物によって引き起こされる幹細胞および/またはサイトカインの増大を考えると、いくつかの他の疾患が当業者によって処置され得ることが明らかである(この場合、前記疾患は好ましくは、ガン、炎症、骨粗鬆症、肝臓傷害、自己免疫疾患および/または感染性疾患を含めて、心臓病学的疾患、神経学的疾患、変性疾患からなる群から選択される)。
【特許請求の範囲】
【請求項1】
医薬品としての血小板富化血漿(PRP)および凝固因子。
【請求項2】
非凝固性(可溶性)の混合物である、請求項1に記載の医薬品。
【請求項3】
幹細胞プール、好ましくは、哺乳動物対象の内皮前駆体細胞および/または間葉系幹細胞のプールを富化するための医薬品を製造するための、PRPおよび凝固因子の使用。
【請求項4】
心臓血管疾患の処置および/または防止のための医薬品を製造するための、PRPおよび凝固因子の使用。
【請求項5】
前記心臓血管疾患が、(変性)心筋症、(先天性)心臓疾患、冠状動脈疾患、虚血、拡張期機能不全、アテローム性動脈硬化、心筋炎、心内膜炎および/または心筋梗塞からなる群から選択される、請求項4に記載の使用。
【請求項6】
神経学的疾患の処置および/または防止のための医薬品を製造するための、PRPおよび凝固因子の使用。
【請求項7】
前記神経学的疾患が、パーキンソン病、アルツハイマー病、ハンチントン病、テイ・サックス病、脊髄傷害、脳卒中、脳血管障害および筋萎縮性側索硬化症(ALS)からなる群から選択される、請求項6に記載の使用。
【請求項8】
自己免疫疾患の処置および/または防止のための医薬品を製造するための、PRPおよび凝固因子の使用。
【請求項9】
前記自己免疫疾患が、再生不良性貧血、多発性硬化症、関節リウマチ、シェーグレン症候群、1型糖尿病、グレーヴズ病および/またはエリテマトーデスからなる群から選択される、請求項8に記載の使用。
【請求項10】
骨変性疾患の処置および/または防止のための医薬品を製造するための、PRPおよび凝固因子の使用。
【請求項11】
前記骨変性疾患が、骨萎縮、骨粗鬆症、骨再建および骨補強からなる群から選択される、請求項10に記載の使用。
【請求項12】
前記医薬品が可溶性混合物の形態である、請求項3〜11のいずれかに記載の使用。
【請求項13】
前記血小板富化血漿および前記凝固因子が哺乳動物対象の骨髄および/または脂肪組織に注入され、好ましくは、前記哺乳動物対象の腸骨稜または胸骨の骨髄に注入される、請求項3〜12のいずれかに記載の使用。
【請求項14】
前記哺乳動物対象がヒト患者である、請求項3〜13のいずれかに記載の使用。
【請求項15】
前記凝固因子が、(可溶性)トロンボプラスチン(hTfまたはヒト組織因子)、第Xa因子、第VIIa因子、第X因子、第VII因子またはそれらの混合物からなる群から選択される、請求項1または2に記載の医薬品。
【請求項16】
・自己PRPと、場合により、自己トロンビンとを哺乳動物対象(好ましくはヒト患者)の血漿から得るための遠心分離デバイス;
・1つまたは複数の哺乳動物(好ましくはヒト)活性化合物、あるいは、前記化合物を含む流体(ただし、これらはバイアルに存在するかもしれない);
・自己PRPと、MSC活性化化合物または前記化合物を含む流体とにおける注入手段;および
・場合により、血液サンプルまたは骨髄液サンプルからの幹細胞の採取手段
を含む、構成要素のキット。
【請求項17】
前記活性化合物が、
・効果的な量のトロンボプラスチン(組織因子またはTf)、好ましくは組換えトロンボプラスチン(組換え組織因子またはrTf)、好ましくはヒト組織因子(hTf)、より好ましくは組換えヒト組織因子(rhTf)、より好ましくは組換え可溶性ヒト組織因子(rshTf)、ただし、これらはより好ましくは、リン脂質(より具体的には、ホスファチジルコリン、ホスファチジルセリンおよびホスファチジルエタノールアミン)の添加を伴う;または
・効果的な量のヒト第VII因子、
・効果的な量のヒト第X因子、
・効果的な量の組織因子−第VIIa因子、
・効果的な量の組織第Xa因子、
・効果的な量の組織因子−第VIIa因子−第Xa因子、
・効果的な量の第VIII因子、
・効果的な量の第IX因子、あるいは
・上記因子の組合せ(ただし、前記因子は活性化型または非活性化型である)
からなる群から選択される、請求項16に記載の構成要素のキット。
【請求項18】
活性化MSCが富化された集団を含む骨髄サンプル。
【請求項19】
コロニーを形成する前記MSCの能力が増大している、請求項18に記載の骨髄サンプル。
【請求項20】
コロニーを形成する前記MSCの能力が少なくとも約30%増大し、かつ/または、少なくとも13個のコロニー(CFU−F)が、前記骨髄サンプルの1000000個の単核細胞を培養するときに得られる、請求項18または19に記載の骨髄サンプル。
【請求項21】
哺乳動物対象の幹細胞プールを富化するための医薬品として使用される凝固因子。
【請求項22】
心臓血管疾患の処置および/または防止のための医薬品として使用される凝固因子。
【請求項23】
哺乳動物対象の神経学的疾患の処置および/または防止のための医薬品として使用される凝固因子。
【請求項24】
自己免疫疾患の処置および/または防止のための医薬品として使用される凝固因子。
【請求項25】
ガンおよび/または感染性疾患の処置および/または防止のための医薬品として使用される凝固因子。
【請求項26】
前記凝固因子が、組織因子(Tf)、第Xa因子、第VIIa因子またはそれらの混合物からなる群から選択される、請求項21〜25のいずれかに記載される医薬品。
【請求項27】
前記凝固因子が可溶性ヒト組織因子である、請求項21〜25のいずれかに記載される医薬品。
【請求項28】
十分な量のPRPと、凝固因子(好ましくは、(可溶性)トロンボプラスチン(ヒト組織因子(hTf))、第Xa因子、第VIIa因子またはそれらの混合物からなる群から選択される凝固因子)とを使用する、ヒト胚性でない幹細胞のインビトロ培養のための方法。
【請求項29】
活性化された骨髄からサンプルを得る工程(1つまたは複数)を含む、活性化MSCが富化された細胞集団を得るための方法。
【請求項30】
前記骨髄が、PRPおよび凝固因子の添加によって(前もって)活性化される、請求項29に記載の方法。
【請求項31】
前記骨髄サンプルに存在する幹細胞を富化する工程をさらに含む、請求項29または30に記載の方法。
【請求項32】
幹細胞の前記富化が、前記骨髄サンプルの遠心分離および中間画分の回収によって行われる、請求項31に記載の方法。
【請求項33】
コロニーを形成する前記MSCの能力が増大している、請求項29〜32のいずれかに記載の方法。
【請求項34】
コロニーを形成する前記MSCの能力が少なくとも約30%増大し、かつ/または、少なくとも13個のコロニーが、活性化された骨髄から得られるサンプルの1000000個の単核細胞を培養するときに得られる、請求項32または33に記載の方法。
【請求項35】
非胚性ヒト幹細胞を得るための、そして、場合により、組織(好ましくはヒト患者の組織)または細胞を再生するための方法であって、下記の工程:
b)血液サンプルを哺乳動物対象から集める工程;
c)自己PRPを前記血漿から調製する工程;
d)前記自己PRPを、
・効果的な量のトロンビン、
・効果的な量のトロンボプラスチン、または
・効果的な量のCaCl2、
・効果的な量の第VII因子、
・効果的な量の第X因子、
・効果的な量の組織因子および第VIIa因子、
・効果的な量の第Xa因子、
・効果的な量の組織因子、第VIIa因子および第Xa因子、
・効果的な量の第VIII因子、
・効果的な量の第IX因子、あるいは
・上記因子の組合せ
からなる群から選択される哺乳動物活性要素、好ましくはヒト活性要素の添加によって活性化して、その結果、濃縮された活性化自己血小板富化血漿を含有する第1の流体を得る工程;
e)非胚性幹細胞が多い目標注入領域を同じ哺乳動物対象において選択する工程;
f)前記第1の流体を前記哺乳動物対象の前記目標注入領域に注入して、その結果、幹細胞のインビボ増殖を前記哺乳動物対象において局所的に誘導する工程;
g)場合により、十分なインキュベーション時間の後で、同じ哺乳動物対象から、細胞が多い血液サンプルおよび/または骨髄サンプルを集め、そして、得られた幹細胞を回収し、好ましくは非胚性ヒトCD34+CD31+幹細胞を回収し、場合により、
工程a)〜工程e)、または、工程a)〜工程f)を数回繰り返す工程;
h)場合により、第2の血液サンプルを集める工程;
i)場合により、第2の自己PRPを前記第2の血液サンプルから調製する工程;
j)場合により、前記自己PRPを、
・効果的な量のトロンビン、
・効果的な量のトロンボプラスチン、または
・効果的な量のCaCl2、
・効果的な量のヒト第VII因子、
・効果的な量のヒト第X因子、
・効果的な量の組織因子および第VIIa因子、
・効果的な量の組織因子および第Xa因子、
・効果的な量の組織因子、第VIIa因子および第Xa因子、
・効果的な量の第VIII因子、
・効果的な量の第IX因子、あるいは
・上記因子の組合せ
からなる群から選択される活性な要素によって活性化して、その結果、濃縮された活性化自己血小板富化血漿を含有する第2の流体を得る工程;
k)場合により、前記第2の流体と、以前に集められた前記血液サンプルまたは骨髄液サンプルとを混合して、その結果、活性化された濃縮されている自己PRPおよびMSCを含む組成物を得る工程;
l)場合により、細胞固定のための少なくとも1つのマトリックスと、好ましくは、ビタミン、コルチゾンもしくはコルチゾン誘導体(デキサメタゾン、ヒドロコルチゾン、プレドニゾロン、メチルプレドニゾロン、デキサメタゾン、トリアムシノロン、ベタメタゾン)および/またはβ−グリセロホスファートからなる群から選択される他の要素とを含む分化補助剤を前記幹細胞に、好ましくは、活性化された濃縮されている自己PRPおよびMSCを含む前記組成物に加えて、その結果、分化した(骨)組織細胞への前記幹細胞の分化を誘導し、そして、場合により、前記組織の再生を得る工程;および
m)場合により、活性化された濃縮されている自己PRPおよび幹細胞を含む前記組成物に、適切なゲル化剤を加えて、ゲル組成物を形成する工程;および
n)場合により、そのようにして得られた前記ゲル組成物を前記哺乳動物(好ましくはヒト患者)の目標組織再建部位の内部/表面に適用して、その結果、組織再建が前記再建部位において生じ得るようにする工程
を含む方法。
【請求項36】
インキュベーション時間が3日〜3ヶ月の間で含まれ、好ましくは15日〜1ヶ月の間で含まれ、より好ましくは3週間である、請求項35に記載の方法。
【請求項37】
前記PRPが、1マイクロリットルあたり600000個の血小板〜1マイクロリットルあたり8000000個の血小板の間で含まれる、血小板における濃度を与える、請求項35または36のいずれかに記載の方法。
【請求項38】
組織再建のための、場合により、請求項28〜37のいずれかに記載される方法によって得られるゲル組成物であって、十分な量のトロンボプラスチンと、ヒト胚性でない幹細胞と、少なくとも1つの適切なゲル化剤と、場合により、ビタミン、コルチゾン誘導体(デキサメタゾン)またはそれらの混合物からなる群から選択される補助剤とによる活性化された濃縮されている自己PRPを含むゲル組成物。
【請求項39】
哺乳動物対象由来のサイトカインの血中濃度を好ましくは少なくとも50%増大させるための方法であって、PRPおよび凝固因子を前記哺乳動物において注入する工程を含む方法。
【請求項40】
前記PRPおよび前記凝固因子が骨髄に注入され、好ましくは、哺乳動物対象の腸骨稜の骨髄に注入される、請求項39に記載の方法。
【請求項41】
前記サイトカインが、FGF−2、VEGF、RantesおよびBDNFからなる群から選択される2つまたは3つまたは4つの異なるサイトカインである、請求項39または40に記載の方法。
【請求項42】
FGF−2、VEGF、RantesおよびBDNFとは異なるサイトカインは影響を受けない、請求項39〜41のいずれかに記載の方法。
【請求項43】
前記サイトカインが、IGF−1、SDF−1アルファ、MIP−1アルファおよびPDGFまたはそれらの混合物からなる群から選択される、請求項42に記載の方法。
【請求項1】
医薬品としての血小板富化血漿(PRP)および凝固因子。
【請求項2】
非凝固性(可溶性)の混合物である、請求項1に記載の医薬品。
【請求項3】
幹細胞プール、好ましくは、哺乳動物対象の内皮前駆体細胞および/または間葉系幹細胞のプールを富化するための医薬品を製造するための、PRPおよび凝固因子の使用。
【請求項4】
心臓血管疾患の処置および/または防止のための医薬品を製造するための、PRPおよび凝固因子の使用。
【請求項5】
前記心臓血管疾患が、(変性)心筋症、(先天性)心臓疾患、冠状動脈疾患、虚血、拡張期機能不全、アテローム性動脈硬化、心筋炎、心内膜炎および/または心筋梗塞からなる群から選択される、請求項4に記載の使用。
【請求項6】
神経学的疾患の処置および/または防止のための医薬品を製造するための、PRPおよび凝固因子の使用。
【請求項7】
前記神経学的疾患が、パーキンソン病、アルツハイマー病、ハンチントン病、テイ・サックス病、脊髄傷害、脳卒中、脳血管障害および筋萎縮性側索硬化症(ALS)からなる群から選択される、請求項6に記載の使用。
【請求項8】
自己免疫疾患の処置および/または防止のための医薬品を製造するための、PRPおよび凝固因子の使用。
【請求項9】
前記自己免疫疾患が、再生不良性貧血、多発性硬化症、関節リウマチ、シェーグレン症候群、1型糖尿病、グレーヴズ病および/またはエリテマトーデスからなる群から選択される、請求項8に記載の使用。
【請求項10】
骨変性疾患の処置および/または防止のための医薬品を製造するための、PRPおよび凝固因子の使用。
【請求項11】
前記骨変性疾患が、骨萎縮、骨粗鬆症、骨再建および骨補強からなる群から選択される、請求項10に記載の使用。
【請求項12】
前記医薬品が可溶性混合物の形態である、請求項3〜11のいずれかに記載の使用。
【請求項13】
前記血小板富化血漿および前記凝固因子が哺乳動物対象の骨髄および/または脂肪組織に注入され、好ましくは、前記哺乳動物対象の腸骨稜または胸骨の骨髄に注入される、請求項3〜12のいずれかに記載の使用。
【請求項14】
前記哺乳動物対象がヒト患者である、請求項3〜13のいずれかに記載の使用。
【請求項15】
前記凝固因子が、(可溶性)トロンボプラスチン(hTfまたはヒト組織因子)、第Xa因子、第VIIa因子、第X因子、第VII因子またはそれらの混合物からなる群から選択される、請求項1または2に記載の医薬品。
【請求項16】
・自己PRPと、場合により、自己トロンビンとを哺乳動物対象(好ましくはヒト患者)の血漿から得るための遠心分離デバイス;
・1つまたは複数の哺乳動物(好ましくはヒト)活性化合物、あるいは、前記化合物を含む流体(ただし、これらはバイアルに存在するかもしれない);
・自己PRPと、MSC活性化化合物または前記化合物を含む流体とにおける注入手段;および
・場合により、血液サンプルまたは骨髄液サンプルからの幹細胞の採取手段
を含む、構成要素のキット。
【請求項17】
前記活性化合物が、
・効果的な量のトロンボプラスチン(組織因子またはTf)、好ましくは組換えトロンボプラスチン(組換え組織因子またはrTf)、好ましくはヒト組織因子(hTf)、より好ましくは組換えヒト組織因子(rhTf)、より好ましくは組換え可溶性ヒト組織因子(rshTf)、ただし、これらはより好ましくは、リン脂質(より具体的には、ホスファチジルコリン、ホスファチジルセリンおよびホスファチジルエタノールアミン)の添加を伴う;または
・効果的な量のヒト第VII因子、
・効果的な量のヒト第X因子、
・効果的な量の組織因子−第VIIa因子、
・効果的な量の組織第Xa因子、
・効果的な量の組織因子−第VIIa因子−第Xa因子、
・効果的な量の第VIII因子、
・効果的な量の第IX因子、あるいは
・上記因子の組合せ(ただし、前記因子は活性化型または非活性化型である)
からなる群から選択される、請求項16に記載の構成要素のキット。
【請求項18】
活性化MSCが富化された集団を含む骨髄サンプル。
【請求項19】
コロニーを形成する前記MSCの能力が増大している、請求項18に記載の骨髄サンプル。
【請求項20】
コロニーを形成する前記MSCの能力が少なくとも約30%増大し、かつ/または、少なくとも13個のコロニー(CFU−F)が、前記骨髄サンプルの1000000個の単核細胞を培養するときに得られる、請求項18または19に記載の骨髄サンプル。
【請求項21】
哺乳動物対象の幹細胞プールを富化するための医薬品として使用される凝固因子。
【請求項22】
心臓血管疾患の処置および/または防止のための医薬品として使用される凝固因子。
【請求項23】
哺乳動物対象の神経学的疾患の処置および/または防止のための医薬品として使用される凝固因子。
【請求項24】
自己免疫疾患の処置および/または防止のための医薬品として使用される凝固因子。
【請求項25】
ガンおよび/または感染性疾患の処置および/または防止のための医薬品として使用される凝固因子。
【請求項26】
前記凝固因子が、組織因子(Tf)、第Xa因子、第VIIa因子またはそれらの混合物からなる群から選択される、請求項21〜25のいずれかに記載される医薬品。
【請求項27】
前記凝固因子が可溶性ヒト組織因子である、請求項21〜25のいずれかに記載される医薬品。
【請求項28】
十分な量のPRPと、凝固因子(好ましくは、(可溶性)トロンボプラスチン(ヒト組織因子(hTf))、第Xa因子、第VIIa因子またはそれらの混合物からなる群から選択される凝固因子)とを使用する、ヒト胚性でない幹細胞のインビトロ培養のための方法。
【請求項29】
活性化された骨髄からサンプルを得る工程(1つまたは複数)を含む、活性化MSCが富化された細胞集団を得るための方法。
【請求項30】
前記骨髄が、PRPおよび凝固因子の添加によって(前もって)活性化される、請求項29に記載の方法。
【請求項31】
前記骨髄サンプルに存在する幹細胞を富化する工程をさらに含む、請求項29または30に記載の方法。
【請求項32】
幹細胞の前記富化が、前記骨髄サンプルの遠心分離および中間画分の回収によって行われる、請求項31に記載の方法。
【請求項33】
コロニーを形成する前記MSCの能力が増大している、請求項29〜32のいずれかに記載の方法。
【請求項34】
コロニーを形成する前記MSCの能力が少なくとも約30%増大し、かつ/または、少なくとも13個のコロニーが、活性化された骨髄から得られるサンプルの1000000個の単核細胞を培養するときに得られる、請求項32または33に記載の方法。
【請求項35】
非胚性ヒト幹細胞を得るための、そして、場合により、組織(好ましくはヒト患者の組織)または細胞を再生するための方法であって、下記の工程:
b)血液サンプルを哺乳動物対象から集める工程;
c)自己PRPを前記血漿から調製する工程;
d)前記自己PRPを、
・効果的な量のトロンビン、
・効果的な量のトロンボプラスチン、または
・効果的な量のCaCl2、
・効果的な量の第VII因子、
・効果的な量の第X因子、
・効果的な量の組織因子および第VIIa因子、
・効果的な量の第Xa因子、
・効果的な量の組織因子、第VIIa因子および第Xa因子、
・効果的な量の第VIII因子、
・効果的な量の第IX因子、あるいは
・上記因子の組合せ
からなる群から選択される哺乳動物活性要素、好ましくはヒト活性要素の添加によって活性化して、その結果、濃縮された活性化自己血小板富化血漿を含有する第1の流体を得る工程;
e)非胚性幹細胞が多い目標注入領域を同じ哺乳動物対象において選択する工程;
f)前記第1の流体を前記哺乳動物対象の前記目標注入領域に注入して、その結果、幹細胞のインビボ増殖を前記哺乳動物対象において局所的に誘導する工程;
g)場合により、十分なインキュベーション時間の後で、同じ哺乳動物対象から、細胞が多い血液サンプルおよび/または骨髄サンプルを集め、そして、得られた幹細胞を回収し、好ましくは非胚性ヒトCD34+CD31+幹細胞を回収し、場合により、
工程a)〜工程e)、または、工程a)〜工程f)を数回繰り返す工程;
h)場合により、第2の血液サンプルを集める工程;
i)場合により、第2の自己PRPを前記第2の血液サンプルから調製する工程;
j)場合により、前記自己PRPを、
・効果的な量のトロンビン、
・効果的な量のトロンボプラスチン、または
・効果的な量のCaCl2、
・効果的な量のヒト第VII因子、
・効果的な量のヒト第X因子、
・効果的な量の組織因子および第VIIa因子、
・効果的な量の組織因子および第Xa因子、
・効果的な量の組織因子、第VIIa因子および第Xa因子、
・効果的な量の第VIII因子、
・効果的な量の第IX因子、あるいは
・上記因子の組合せ
からなる群から選択される活性な要素によって活性化して、その結果、濃縮された活性化自己血小板富化血漿を含有する第2の流体を得る工程;
k)場合により、前記第2の流体と、以前に集められた前記血液サンプルまたは骨髄液サンプルとを混合して、その結果、活性化された濃縮されている自己PRPおよびMSCを含む組成物を得る工程;
l)場合により、細胞固定のための少なくとも1つのマトリックスと、好ましくは、ビタミン、コルチゾンもしくはコルチゾン誘導体(デキサメタゾン、ヒドロコルチゾン、プレドニゾロン、メチルプレドニゾロン、デキサメタゾン、トリアムシノロン、ベタメタゾン)および/またはβ−グリセロホスファートからなる群から選択される他の要素とを含む分化補助剤を前記幹細胞に、好ましくは、活性化された濃縮されている自己PRPおよびMSCを含む前記組成物に加えて、その結果、分化した(骨)組織細胞への前記幹細胞の分化を誘導し、そして、場合により、前記組織の再生を得る工程;および
m)場合により、活性化された濃縮されている自己PRPおよび幹細胞を含む前記組成物に、適切なゲル化剤を加えて、ゲル組成物を形成する工程;および
n)場合により、そのようにして得られた前記ゲル組成物を前記哺乳動物(好ましくはヒト患者)の目標組織再建部位の内部/表面に適用して、その結果、組織再建が前記再建部位において生じ得るようにする工程
を含む方法。
【請求項36】
インキュベーション時間が3日〜3ヶ月の間で含まれ、好ましくは15日〜1ヶ月の間で含まれ、より好ましくは3週間である、請求項35に記載の方法。
【請求項37】
前記PRPが、1マイクロリットルあたり600000個の血小板〜1マイクロリットルあたり8000000個の血小板の間で含まれる、血小板における濃度を与える、請求項35または36のいずれかに記載の方法。
【請求項38】
組織再建のための、場合により、請求項28〜37のいずれかに記載される方法によって得られるゲル組成物であって、十分な量のトロンボプラスチンと、ヒト胚性でない幹細胞と、少なくとも1つの適切なゲル化剤と、場合により、ビタミン、コルチゾン誘導体(デキサメタゾン)またはそれらの混合物からなる群から選択される補助剤とによる活性化された濃縮されている自己PRPを含むゲル組成物。
【請求項39】
哺乳動物対象由来のサイトカインの血中濃度を好ましくは少なくとも50%増大させるための方法であって、PRPおよび凝固因子を前記哺乳動物において注入する工程を含む方法。
【請求項40】
前記PRPおよび前記凝固因子が骨髄に注入され、好ましくは、哺乳動物対象の腸骨稜の骨髄に注入される、請求項39に記載の方法。
【請求項41】
前記サイトカインが、FGF−2、VEGF、RantesおよびBDNFからなる群から選択される2つまたは3つまたは4つの異なるサイトカインである、請求項39または40に記載の方法。
【請求項42】
FGF−2、VEGF、RantesおよびBDNFとは異なるサイトカインは影響を受けない、請求項39〜41のいずれかに記載の方法。
【請求項43】
前記サイトカインが、IGF−1、SDF−1アルファ、MIP−1アルファおよびPDGFまたはそれらの混合物からなる群から選択される、請求項42に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公表番号】特表2012−516877(P2012−516877A)
【公表日】平成24年7月26日(2012.7.26)
【国際特許分類】
【出願番号】特願2011−548696(P2011−548696)
【出願日】平成22年2月5日(2010.2.5)
【国際出願番号】PCT/EP2010/051442
【国際公開番号】WO2010/089379
【国際公開日】平成22年8月12日(2010.8.12)
【出願人】(511192023)
【Fターム(参考)】
【公表日】平成24年7月26日(2012.7.26)
【国際特許分類】
【出願日】平成22年2月5日(2010.2.5)
【国際出願番号】PCT/EP2010/051442
【国際公開番号】WO2010/089379
【国際公開日】平成22年8月12日(2010.8.12)
【出願人】(511192023)

【Fターム(参考)】
[ Back to top ]

