組織認識のための方法及びシステム
体組織を特性化する方法であって、この方法は、a)超音波を身体の組織内に透過させて、体組織を3℃未満だけ加熱するステップと、b)超音波透過中、超音波透過後、または両方で、1つ以上の位置で1回以上、組織の温度を測定するステップと、c)温度測定を利用して、超音波の吸収の差異、超音波透過後の組織の冷却速度の差異、または両方に基づいて体組織の少なくとも1つの特性を決定するステップとを含む。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願
本願は、2009年12月29日にともに出願された米国特許出願第12/648433号及び米国特許出願第12/648440号の一部継続出願(CIP)であり、その内容はその全体を参照として本明細書に組み込まれる。米国特許出願第12/648433号は、2009年6月1日に出願された米国仮特許出願第61/182781号、および2008年12月29日に出願された米国仮特許出願第61/193815号からの米国特許法第119条(e)項35の利益を主張した。米国特許出願第12/648440号は、2008年12月29日に出願された米国仮特許出願第61/193829号からの米国特許法第119条(e)項35の利益を主張した。
【0002】
本願は、代理人管理番号50493を有する、同日に出願された別のPCT出願に関連し、その内容は、参照として本明細書に組み込まれる。
【0003】
上記の出願の全ての内容は、参照として本書に完全に記載されているように組み込まれる。
【0004】
技術分野
本発明は、その一部の実施形態では、超音波への曝露中および/または曝露後にその熱応答によって体組織の少なくとも1つの特性を決定するシステムに関し、さらに詳しくは、そのような方法を用いて癌組織を正常な組織と区別するシステムに関するが、それに限定されない。
【背景技術】
【0005】
多数の医用撮像モダリティが、異なる種類の体組織を判別するために、特に癌および他の病変組織を位置特定するために使用されるが、これらのモダリティは各々、何らかの不利点を有する。超音波撮像は一部の種類の軟組織を充分に判別しない。X線は、特にコンピュータ断層撮影(CT)スキャンに使用される場合、一部の種類の軟組織を判別することができるが、X線画像の解像度および雑音レベルは多すぎる放射線の悪影響によって限定され、これは、通常のX線画像よりずっと高いX線量を必要とするCT画像に特に当てはまる。磁気共鳴断層撮影(MRI)は概して、軟組織を判別するには超音波より優れているが、MRI装置は一般的に大型かつ高価であり、かつしばしば患者を包囲し、他の手順を実時間で実行するためのアクセスに制限がある。CT装置、およびPETのような核医学撮像用の装置もまた大型かつ高価になる傾向がある。赤外線撮像は、周囲の領域とは温度が異なる身体表面上の領域を特定することができるが、体温制御メカニズムは温度を均一にする傾向があるので、病変組織を見つけるための実用性は限定される。
【0006】
生検も癌および他の疾患を識別するために使用されるが、生検は侵襲的であり、感染症のリスクを伴い、かつ患者にとってはしばしば不快である。さらに、前立腺生検で通常行なわれているように、疑われる病変組織の位置が分からずに生検を行なうと、病変組織を見逃して、偽陰性の結果が出ることがある。
【0007】
超音波は、医療では撮像および治療の両方に使用される。超音波医用撮像システムは一般的に、200から5000パルス/秒の間の短パルスの超音波を使用する。例えば米国食品医薬品局(FDA)による安全規則は一般的に、超音波撮像システムを、曝露される組織の温度を3℃超上昇させない比較的低い時間平均パワーに制限している。各パルス内のパワーは一般的に、適切な信号対雑音比をもたらすために、平均パワーよりずっと大きい。例えば、FDA規則は空間ピーク時間平均パワーを720mW/cm2に制限するが、空間ピークパルス平均パワーは190W/cm2もの高さにすることができる。本書で使用する場合、「空間ピーク時間平均パワー」および「空間ピークパルス平均パワー」は両方とも、2008年9月9日発行のFDA文書560「Information for Manufacturers Seeking Marketing Clearance of Diagnostic Ultrasound Systems and Transducers」に定義されている全体的最大軽減定格パワーを指す。
【0008】
超音波治療システムはより高いパワーを使用し、処置される組織の温度を一般的に3℃超上昇させる。一部の超音波治療システムは、組織を焼灼するために、小さい体積全体でずっと高い温度まで組織を加熱する。International Symposium on Therapeutic Ultrasound, Seattle 2002で発表されたRalf Seipらの「Real‐Time Detection of Multiple Lesions During High Intensity Focused Ultrasound(HIFU) Treatments」は、30ないし37ワットの全音響パワーを用いて組織を局所的に85℃超に加熱することによって病変を生成し、散乱超音波を用いて実時間で監視する超音波治療システムを記載している。
【0009】
Mastらの米国特許第7211044号明細書は、低強度超音波信号を最初に標的組織に集束させて、1℃未満の温度上昇を生じる治療用超音波システムを記載している。標的組織の温度上昇を撮像して、超音波信号が標的組織に正しく照準していることを確実にし、次いで高強度超音波を標的組織に集束させて、温熱治療を施すか、または組織を焼灼する。
【0010】
G.E.P.M.Van Venrooijの「Measurement of ultrasound velocity in human tissue」、Ultrasonics、October 1971、p.240〜242は、血液、脳脊髄液、および様々な種類の脳腫瘍における超音波の音速および音響インピーダンスに関するデータを掲載している。Ferride Severcan、Dana Dorohoi、およびDorina Creangaの「Ultrasound Propagation Through Biological Tissues」、Studia Universitatis Babes‐Bolyai、Physica、Special Issue、2001、p.169〜175は、様々な種類の体組織における様々な周波数および温度での超音波の音速、音響インピーダンス、および吸収係数を掲載し、かつ組織内の超音波伝搬を特徴付ける物理パラメータを用いて腫瘍または異物の存在に関する情報を得ることができることを示唆している。
【0011】
オンラインニュースレターBio‐Medicineは、2009年3月24日にwww.bio−medicine.org/medicine−technology−1/EDAP−Announces−Launch−of−Clinical−Study−Combining−HIFU−and−Chemotherapy−for−Localized−Aggressive−High−Risk−Prostate−Cancer−4−l/からダウンロードした2007年8月17日付けの記事で、前立腺癌の高強度集束超音波(HIFU)治療の世界的指導者、フランス国リヨンのEDAP TMS S.A.による臨床試験で、化学療法薬剤と併せて、治療用超音波を使用してステージT2cの前立腺癌を焼灼することを記載している。周囲組織における化学療法薬剤の有効性が超音波治療によって改善されるといわれる。動物実験で超音波治療と化学治療を組み合わせることの相乗効果は、Curielらの「HIFU and Chemotherapy Synergistic Inhibitory Effect on Dunning AT2 Tumour‐Bearing Rats」、4th International Symposium on Therapeutic Ultrasound、AIP Conference Proceedings、Volume 754、pp.191〜195(2005)によって報告されている。
【0012】
A.Bounaimらの「Sensitivity of the ultrasonic CARI technique for breast tumor detection using a FETD scheme」,Ultrasonics 42、919〜925(2004)は、「良性および悪性乳房病変の弁別を改善する臨床上の潜在力を実証した」といわれる、乳癌の超音波検出のためのCARI(臨床振幅/速度再構成撮像)技術のシミュレーションを記載している。該論文は、「CARIモダリティの臨床研究が、音速および音響の組織減衰が女性乳房の様々な組織を特徴付けるのに重要な定量パラメータであることを示した」と言及している。
【0013】
Bao‐wei Dongらの「In vivo measurements of frequency‐dependent attenuation in tumors of the liver」、Journal of Clinical Ultrasound、22、167〜174(1994)は、健康な被験者および様々な種類の良性および悪性肝臓腫瘍を持つ被験者の肝臓における超音波減衰の周波数依存度の測定を記載している。一部の種類の腫瘍は、減衰に対し健康な組織より高い周波数依存度を示したが、他の種類の腫瘍は、減衰に対し健康な組織より低い周波数依存度を示した。
【0014】
Xiao‐Zhou Liuらの「Ultrasonic characterization of porcine liver tissue at frequency between 25 to 55MHz」、World J Gastroenterol 2006 April 14;、12(14):2276〜2279は、硬変ブタ肝組織に見られる超音波の減衰が正常なブタ肝組織より大きいことを記載している。
【0015】
L.Landiniらは、Medical and Biological Engineering and Computing 24、243〜247(1986)で、「正常な胸部組織および病的な胸部組織における超音波の周波数依存減衰の測定について、・・・脂肪組織、線維脂肪実質、および線維症、ならびに増殖性線維症を伴う場合と伴わない場合の悪性腫瘍(それぞれ浸潤腺管癌スキルス型および髄様癌)を含め・・・報告している。減衰測定の結果は、減衰係数が、細胞の大きな優位性を持つ組織では低くなり(脂肪組織、髄様癌)、コラーゲン線維含有量と共に増大する(浸潤腺管癌スキルス型、線維症、線維脂肪)ことを示す。」
【0016】
2009年2月24日にwww.iaec.gov.il/docs/IAEC20.pdfからダウンロードしたB.Sfezらの「Electro‐Optical Ultrasound」、Israel Atomic Energy Commission Annual Report、2001、p.1〜23は、可視光または赤外光を組織内に伝達し、集束した超音波を使用して組織を走査する医用撮像方法を記載している。光は組織によって強く散乱されるが、超音波が集束する場所を通過する光の部分は、超音波周波数におけるその変調によって識別することができ、このようにして組織における光の吸収の3Dマップを再構成することができる。
【0017】
Victoria S.Hollisの「Non‐Invasive Monitoring of Brain Tissue Temperature by Near‐infrared Spectroscopy」、Ph.D.thesis、Dept.of Medical Physics and Bioengineering、University of London、Sept. 2002は、第4章で、近赤外分光法(NIRS)、マイクロ波放射測定法、磁気共鳴温度測定法、および超音波温度測定法を含め、脳温を非侵襲的に測定する様々な方法を検討している。
【0018】
超音波を用いて組織温度を非侵襲的に測定することは、2005年4月1〜3日の2005 Annual Meeting、 Society for Thermal Medicine、Bethesda,Marylandで発表された講演「An In Vivo System for the Determination of the Effect of Temperature on Backscattered Ultrasound Energy in Ultrasonic Images」においてW.L.Straube、J.Parry、E.Moros、J.Trobaugh、およびR.M.Arthurによって、かつ2007年5月16日の第32回UITC Alexandria,VAで発表された講演「Change in Ultrasonic Backscattered Energy for Temperature Imaging:Factors Affecting Temperature Accuracy and Spatial Resolution in 3‐D」においてR.M.Arthurらによっても述べられている。著者らは、温度に対する依存度が異なる超音波後方散乱係数を有する水溶性および脂肪性物質の小さい内包物を含む、肝臓組織のような不均質な組織からの超音波の後方散乱について考察している。彼らは、結果的に生じる後方散乱エネルギの空間的変動を用いて組織の温度を測定することを記載している。
【0019】
SeipおよびEbbiniの「Noninvasive Estimation of Tissue Temperature Response to Heating Fields Using Diagnostic Ultrasound」,IEEE Transactions on Biomedical Engineering、vol 42、pp.828〜839(1995)は、診断用超音波の後方散乱を利用して組織の温度変化を監視するための別の技術を記載している。該技術は、大部分の生体組織が半規則的散乱格子であるという観察結果に基づいている。これらの格子構造は、音速の温度依存性および格子構造の熱膨張を介して後方散乱超音波の高調波を発生させ、高調波の周波数偏移は温度に依存する。周波数偏移を推定するために自己回帰モデルベースの方法が使用される。
【0020】
超音波は、セラミックス、金属、およびプラスチックを含め種々の材料の非破壊検査に使用されてきた。材料内部のクラックおよび他の欠陥はバルク材より多く超音波を吸収し、かつ欠陥が材料の表面に発生させた、測定される温度上昇によって検出される。典型的には、超音波トランスデューサは100W/cm2を超えるパワー密度を生成し、数Hzから数百分の1Hzまでの範囲の周波数で変調される。そのようなシステムの例は、「Insight」ISSN 1354‐2575、2003、vol.45、#3、pp 178〜182(British Institute of Nondestructive Testing)におけるTh.Zweschperらの「Ultrasound excited thermography using frequency modulated elastic waves」、J.Rantalaらの「Lock‐in thermography with mechanical loss angle heating at ultrasonic frequencies」、Quantitative Infrared Thermography、Eurotherm Series 50、Edition ETS 1997、pp 389〜393、および2009年1月25日にwww.ndt.net/article/ecndt2006/papers〜l.htmからダウンロードした論文We.3.8.2であるA.Gleiterらの「Ultrasound‐Lockin‐Thermography for Advanced Depth Resolved Defect Selective Imaging」、European Conference on Non‐Destructive Testing 2006に記載されている。
【0021】
Littrupらの米国特許出願公開第2004/0030227号明細書は、医学的病理の少なくとも一部分を含む組織の体積によって散乱した第1組の音響放射を受信するステップと、その後、組織の体積の温度を変化させるステップとを含む、医学的病理を治療するための方法を記載している。該方法はまた、その後、組織の体積によって散乱した第2組の音響放射を受信するステップと、第1および第2組の受信した音響放射から医学的病理の部分を位置特定するステップとをも含む。医学的病理の一部分を位置特定するステップは、温度変化の結果生じる第1および第2組の受信した音響放射の差異から医学的病理を識別することを含む。一部の実施形態では、温度の変化は超音波加熱によって発生する。該方法はまた、医学的病理の部分を損傷するのに充分なエネルギを医学的病理の部分に照射することをも含む。Littrupらはまた、乳房組織をRFパワーで加熱すること、および腫瘍の加熱応答が良性組織より大きいことを頼りに、熱音響コンピュータ断層撮影法を用いて腫瘍を検出することをも記載している。
【0022】
Littrupらの優先権文書であったRatherらの米国特許第6728567号明細書は、超音波トランスデューサのアレイを使用し、超音波を様々な方向から体組織に透過させ、断層撮影法を用いて超音波吸収率、音速、および他のパラメータを体組織における三次元位置の関数として求めることを記載している。結果は、癌組織を健康な組織と区別するために使用される。
【0023】
Emelianovらの米国特許出願公開第2009/0105588号明細書は、レーザによる組織の加熱について記載しているが、超音波を利用して温度変化を測定し、脂肪および筋肉が異なる熱膨張係数および温度による異なる音速の変化率を有するという事実から、それが脂肪かそれとも筋肉かを決定する超音波加熱についても示している。
【0024】
Stecknerの米国特許出願公開第2008/0200795号明細書は、例えば0.3テスラでMR画像を作成しながら、MRI共鳴周波数の超音波を当てることを記載しており、そこでは共鳴周波数は利用可能な超音波周波数範囲に含まれる。超音波場における組織の動きは、MR画像のコントラストに影響する動きアーチファクトを生じる。超音波の吸収が大きいため、超音波が組織まで浸透しない位置では動きアーチファクトが低減されるので、異なる位置におけるMR画像のコントラストの差異は、異なる位置における超音波吸収率に関する情報を得るために使用することができる。
【0025】
Sanghviらの米国特許出願公開第2010/0092424号明細書は、細胞物質を放出させるために高強度の集束超音波を腫瘍に当て、かつ放出された物質を検査して、それがどのような種類の腫瘍であるかを決定することを記載している。
【0026】
Lanzaらの米国特許第7179449号明細書は、標的に結合される超音波造影剤を使用することを記載している。造影剤は温度に依存する超音波反射率を有する。温度を変化させることによって、造影剤による超音波の反射を体内の他の構造からの超音波の反射と区別することができる。
【0027】
Von Behrenらの米国特許第6824518号明細書は、時折起きる高出力パルスを正常な撮像パルスの間にインタリーブして画像品質を改善する超音波撮像トランスデューサを記載している。このトランスデューサを使用する間、組織の損傷を回避するために温度を監視する。
【0028】
Casscellsらの米国特許第5935075号明細書は、破裂する可能性の高い動脈のプラークを、そのようなプラークが生じる余分の熱によって検出する、任意選択的に超音波画像システムと結合されたカテーテル内、IR光ファイバシステム内で赤外線センサを使用することを記載している。該方法は、周囲の組織より冷温の異常組織または異物をも検出することができる。Casscellsらは、血管内の血流を測定するための赤外線センサ付きカテーテルを記載するそれ以前の米国特許第4986671号明細書を引用している。米国特許第4621929号明細書では、赤外線放射は光ファイバに沿って赤外線センサを加熱するように向けられ、その後のその冷却速度を用いて血流を測定する。
【0029】
Kaczkowskiらの米国特許出願公開第2007/0106157号明細書は、超音波を使用してまたは任意の他の熱源を使用して加熱された組織の温度を、後方散乱超音波を利用して、時間の関数としてマッピングすることを記載している。高密度の脈管構造の領域では異方性となり得る熱拡散率K、および位置の関数としての熱源Qを計算し、温熱治療を計画するためにそれらを使用する。温熱治療中、比吸収量の変化または介入経路減衰の変化のためQが変化したかどうかを調べるために、監視が実時間で行なわれ、変化した場合、補償するように加熱力を実時間で変化させることができる。灌流も非侵襲的に測定して、温熱治療を監視するときに考慮に入れることができる。これらの方法は、温熱治療のモデル化および監視のために、「一般的組織特性化技術として利用することもできる」。
【0030】
Rosembergらの米国特許第7367944号明細書は、温熱治療中に熱に対する生体応答を示すパラメータを監視することを記載し、かつ温熱治療中の熱輸送における灌流の役割を論じている。
【0031】
Fitzsimmonsらの米国特許出願公開第2008/0004528号明細書は、超音波を利用して、標的領域を撮像することによってそれを診断または特徴付けて、それが良性であるか悪性であるかを決定し、かつその大きさ、形状、粘度、および/または密度を決定することを記載している。
【0032】
Baumgardnerら(CoolTouch,Inc.)の欧州特許出願公開第1030611号明細書は、超音波を含めてエネルギ送達装置と共に使用されるフラッシングおよび/または冷却を利用する診断および治療の方法および技術を記載している。彼らは、温度を検知し、かつ制御のためにフィードバックループを使用することも記載している。これは、しわを除去するために、表皮を冷却しながら真皮をレーザで加熱するときに行なわれる。
【0033】
Lizziらの米国特許出願公開第2009/0287082号明細書は、超音波撮像を用いて、治療用超音波を当てる間、組織における加熱効果および永続的効果を監視することを記載している。
【発明の概要】
【0034】
本発明の一部の実施形態の態様は、診断用超音波に典型的に使用される比較的低いパワーレベルで超音波を使用して、エネルギ吸収および冷却特性によって体組織の少なくとも1つの特性を決定することに関する。
【0035】
したがって、本発明の例示的実施形態では、体組織を特性化する方法であって、
a)超音波を身体の組織内に透過させて、体組織を3℃未満だけ加熱するステップと、
b)超音波透過中、超音波透過後、または両方で、1つ以上の位置で1回以上、組織の温度を測定するステップと、
c)温度測定を利用して、超音波の吸収の差異、超音波透過後の組織の冷却速度の差異、または両方に基づいて体組織の少なくとも1つの特性を決定するステップと、
を含む方法を提供する。
【0036】
任意選択的に、超音波は、任意の1秒間の時間平均で720mW/cm2未満の空間ピーク・パワー・レベルで体組織に透過される。
【0037】
任意選択的に、体組織の少なくとも1つの特性を決定するステップは、癌組織を見つけ、それを正常な組織と区別することを含む。
【0038】
任意選択的に、該方法はまた、少なくとも1つの小線源治療用シードを癌組織の位置に対応する位置に配置するステップをも含む。
【0039】
任意選択的に、癌組織は、超音波による加熱速度が大きいことによって判別される。
【0040】
加えて、または代替的に、癌組織は、超音波の透過後の急速な冷却速度によって判別される。
【0041】
本発明の実施形態では、温度を測定するステップは、身体の外表面における放射赤外線分布を測定することを含む。
【0042】
任意選択的に、超音波を透過させるステップは、2つの異なる時間に、組織における異なる浸透深さを有する2つの異なる周波数で超音波を透過させることを含み、温度を測定するステップは、各々の周波数での加熱による放射赤外線分布を測定することを含み、体組織の少なくとも1つの特性を決定するステップは、組織内への深さに対する特性の依存度を決定することを含む。
【0043】
任意選択的に、組織は乳房組織であり、体組織の特性化は、乳癌の位置を特定することを含む。
【0044】
任意選択的に、温度測定を利用するステップは、画像処理ソフトウェアを用いて測定された赤外線分布を鮮明にすることを含む。
【0045】
本発明の実施形態では、該方法はまた、侵襲性プローブを組織に配置するステップをも含み、温度を測定するステップは、プローブの経路に沿って行なわれる。
【0046】
任意選択的に、侵襲性プローブは、生検針または小線源治療シードを植設するための針を備える。
【0047】
任意選択的に、該方法はまた、癌組織の位置に対応する異なる経路に沿って組織に生検針を配置するステップと、異なる経路に沿って生検針で生検試料を採取するステップとをも含む。
【0048】
任意選択的に、プローブは生検針を備え、温度を測定するステップは、針の内部に位置する可動温度センサによって行なわれ、かつ生検試料のための場所を空けるために、温度を測定した後、温度センサを針から取り出すことをも含む。
【0049】
任意選択的に、該方法はまた、温度を測定した後、前記温度測定から決定された癌組織の位置に応じて選択された位置で生検試料を針で採取するステップをも含む。
【0050】
任意選択的に、温度は、プローブが所定の位置にある間に、またはプローブを移動させながら順次、複数の位置で測定される。
【0051】
任意選択的に、組織は前立腺組織を含む。
【0052】
任意選択的に、組織の温度を測定するステップは、近赤外分光法、マイクロ波放射測定法、超音波温度測定法、磁気共鳴温度測定法、および電気インピーダンス断層撮影法のうちの1つ以上を使用することを含む。
【0053】
本発明の実施形態では、超音波を透過させるステップは、少なくとも0.1秒間連続して行なわれる。
【0054】
任意選択的に、単位面積あたりの入射超音波パワーは、組織の領域全体で2倍以内に均一であり、ここで領域は、超音波パワーの入射方向に対して垂直な少なくとも3cm×3cmの断面を有し、かつ超音波パワーの入射の方向に少なくとも1cmの距離に渡って延在する。
【0055】
さらに、本発明の例示的実施形態では、体組織を特性化するためのシステムであって、
a)任意の1秒間の時間平均で720mW/cm2以下の空間ピークパワーを透過させることに限定された、超音波を体組織内に透過させるための超音波透過システムと、
b)組織内への超音波の透過中および/または透過後に1つ以上の位置で体組織の温度を測定し、それによって組織を特性化するための情報を提供する温度測定システムと、
を備えたシステムを提供する。
【0056】
任意選択的に、温度測定システムは、身体の外表面の温度を測定するための赤外線カメラを備える。
【0057】
任意選択的に、該システムはまた、乳房を圧縮するための圧縮要素をも備え、赤外線カメラは、圧縮された乳房の表面全体の温度のマップを作成するために配置される。
【0058】
任意選択的に、超音波トランスミッタは、拡張領域にわたって圧縮された乳房に超音波を透過させるように配置される。
【0059】
任意選択的に、該システムはまた、生検針または小線源治療シードを植設するための針をも含み、温度測定システムは針に関連付けられた少なくとも1つの温度センサを備える。
【0060】
任意選択的に、少なくとも1つの温度センサは針に沿って配列された複数の温度センサを備える。
【0061】
追加的に、または代替的に、少なくとも1つの温度センサは、針の内部に位置する温度センサを備える。
【0062】
任意選択的に、温度マッピングシステムは1分未満の取得時間内に、0.5℃より高精度、1cmより高い空間分解能で温度を測定することができる。
【0063】
任意選択的に、システムはまた、温度測定を用いて体組織の少なくとも1つの特性を決定する制御装置をも含む。
【0064】
任意選択的に、制御装置は、体組織の特性を決定する際に、超音波透過および温度測定の相対的タイミングを考慮に入れる。
【0065】
別途定義されない限り、本明細書で使用されるすべての技術的用語および/または科学的用語は、本発明が属する技術分野の当業者によって一般に理解されるのと同じ意味を有する。本明細書に記載される方法および材料と類似または同等である方法および材料を本発明の実施または試験において使用することができるが、例示的な方法および/または材料が下記に記載される。矛盾する場合には、定義を含めて、本特許明細書が優先する。加えて、材料、方法および実施例は例示にすぎず、限定であることは意図されない。
【図面の簡単な説明】
【0066】
本明細書では本発明のいくつかの実施形態を単に例示し添付の図面を参照して説明する。特に詳細に図面を参照して、示されている詳細が例示として本発明の実施形態を例示考察することだけを目的としていることを強調するものである。この点について、図面について行う説明によって、本発明の実施形態を実施する方法は当業者には明らかになるであろう。
【0067】
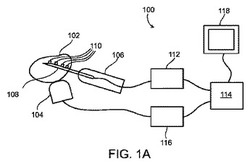
【図1A】本発明の例示的実施形態に係る、前立腺用の超音波生検または小線源治療システムの略図。
【0068】
【図1B】本発明の例示的実施形態に係る、図1Aに示した針の代わりに使用することのできる針の略図。
【0069】
【図2】図1Aのシステムを使用して前立腺の温度がその上で測定されるグリッドの略斜視図。
【0070】
【図3】本発明の例示的実施形態に係る、図1Aのシステムを使用する前立腺の生検手順の流れ図。
【0071】
【図4】本発明の例示的実施形態に係る、図1Aのシステムを使用する前立腺の小線源治療手順のフローチャート。
【0072】
【図5】本発明の例示的実施形態に係る、乳癌を検出するための超音波システムの略図。
【0073】
【図6】図5のシステムを使用して得られる乳房の温度の赤外線マップの略図。
【0074】
【図7】本発明の異なる例示的実施形態に係る、乳癌を検出するための超音波システムの略図。
【0075】
【図8】本発明の例示的実施形態に係る、生検手順中の生検針の時系列の略図。
【0076】
【図9】図8に示した生検針を使用する図8に示した生検手順のフローチャート。
【0077】
【図10】本発明の例示的実施形態に係る、針の壁を組み込んだ内蔵熱電対付きの生検針の略図。
【発明を実施するための形態】
【0078】
本発明は、その一部の実施形態では、超音波への曝露中および/または曝露後にその熱応答によって体組織の少なくとも1つの特性を決定するシステムに関し、さらに詳しくは、そのような方法を用いて癌組織を正常な組織と区別するシステムに関するが、それに限定されない。
【0079】
本発明の一部の実施形態の態様は、診断用超音波に対する米国FDAの限度である720mW/cm2以下の空間ピーク時間平均パワーレベルで組織内に超音波を透過させ、かつ超音波透過中および/または透過後に1つ以上の位置で組織の温度を測定することによって、体組織の少なくとも1つの特性を決定するためのシステムに関する。一部の種類の癌は例えば超音波を正常な組織より多く吸収し、より大きく加熱され、かつ血流の増加のため超音波の透過後に正常な組織より急速に冷却するので、任意選択的に、そのような方法は癌または他の疾病状態を正常な組織と区別するために使用される。他の種類の癌または他の病変組織は超音波の吸収が正常な組織より少なく、温度があまり上がらない。該方法はまた、所与の位置における組織の種類を決定するためにも使用することができる。
【0080】
任意選択的に、温度は、赤外線カメラまたはスキャナを用いて、身体の外側で測定される。これは、例えば乳癌を検出するのに、特に癌が表面に近づくように乳房を圧縮する場合に、特に有用である。任意選択的に、身体の表面の赤外線画像は、表面の下に存在する乳癌のようなある種の組織をよりよく検出しかつ位置特定するために、画像処理ソフトウェアを用いて鮮明化される。
【0081】
本発明の例示的実施形態では、組織の温度は、組織を貫通する侵襲性プローブ、例えば前立腺における生検針または小線源治療針で、プローブに沿って配列された温度センサのアレイ、または任意選択的にプローブを移動させながら異なる位置で順次温度を測定するプローブの端部付近の単一のセンサを用いて、内側で測定される。任意選択的に、温度測定は、生検試料を採取する位置を選択する際に、または小線源治療用シードを植設する位置を選択する際に使用される。
【0082】
任意選択的に、超音波は、組織の温度を3℃以下だけ上昇させる。任意選択的に、超音波は連続的に、あるいは中断なく少なくとも0.1秒間にわたって透過される。
【0083】
任意選択的に、超音波パワーは、検査される組織の領域の大部分で比較的均一に分布するので、加熱の差異は、ほとんどまたは略完全に不均一な加熱パワー分布に起因するのではなく、実質的に組織における吸収率の差異に起因する。例えば、入射超音波パワーは組織領域全体で2倍未満だけ、または30%未満、または20%未満、または10%未満だけ変動する。任意選択的に、パワーの入射に対して垂直な面内で、組織領域は断面が少なくとも3cm×3cm、または少なくとも5cm×5cm、または少なくとも10cm×10cmであり、かつパワーの入射方向に少なくとも1cm、または少なくとも2cm、または少なくとも5cm、または少なくとも10cmの距離にわたって延在する。
【0084】
本発明の少なくとも1つの実施形態を詳細に説明する前に、本発明は、その適用において、下記の説明に示される細部、または、実施例によって例示される細部に必ずしも限定されないことを理解しなければならない。本発明は他の実施形態が可能であり、あるいは、様々な方法で実施、または、実行される。
【0085】
生検システム
ここで図面を参照すると、図1Aは本発明の例示的実施形態に係る前立腺生検システム100を概略的に示す。システム100は、生検針108を生検対象器官内に前進させるときに生検銃106を誘導するために、超音波トランスデューサ104、例えば前立腺生検の場合には経直腸超音波トランスデューサを、あるいはそのようなトランスデューサのアレイを用いて、身体の器官、例えば前立腺102の超音波画像を実時間で作成する。任意選択的に、トランスデューサ104はまた、器官および身体の他の部分によって散乱した超音波をも受信して、超音波画像を提供する。代替的に、または追加的に、1つ以上の他の超音波トランスデューサが撮像用の受信器として働く。
【0086】
生検システムについてここでは前立腺に関連して記載するが、そのようなシステムは身体の他の部分にも使用することができる。システム100で、超音波トランスデューサ104は、たとえ撮像のために多くのパワーが必要でない場合でも、超音波パワーの一部の吸収のため、組織の温度が測定可能な程度に上昇するように、充分なパワーを前立腺102に透過させる。正常および病的な胸部および肝臓の組織における異なる超音波減衰率および減衰の周波数依存性を明らかにした前掲の論文によって示唆される通り、前立腺の悪性腫瘍は周囲の正常な組織とは異なる速度で熱を吸収して、正常な組織より急速に、またはより緩徐に昇温する傾向がある。
【0087】
トランスデューサ104は、例えば720mW/cm2よりわずかに低い、例えば700mW/cm2、または500mW/cm2、または400mW/cm2、または300mW/cm2、または200mW/cm2、または中間値、または200mW/cm2未満の空間ピーク時間平均パワーで超音波を透過させる。パワーは任意選択的に、例えば形状が少なくとも略方形で、6cm幅、または5cm幅、または4cm幅、または3cm幅、またはより大きいか、小さいか、中間値のトランスデューサヘッドの寸法全体にかなり均一に分布する。任意選択的に、トランスデューサは、前立腺の撮像または治療に使用される直腸超音波プローブ用の標準サイズである。発明者によるインビトロ検査は、1MHzの周波数で幅5cmの方形全体に均一に分布する700mW/cm2の超音波パワーを用いて、死組織を2分ないし4分で3℃ないし6℃だけ加熱することができることを明らかにした。このパワーレベルおよび周波数で生体組織における温度上昇は、身体の熱調節メカニズムのため、より低くなることが予想される。
【0088】
任意選択的に、超音波パワーは前立腺の大部分にわたって比較的均一に分布されるので、加熱の差異は、略完全に不均一な超音波パワー分布に起因するのではなく、実質的に組織の吸収率の差異によるものである。加えて、組織が前立腺の寸法に匹敵する距離にわたって入射超音波パワーの有意の部分を吸収し、かつ特定の悪性腫瘍が正常な組織より多くの超音波を吸収する場合には、これらの悪性腫瘍は、より大きい温度勾配を有することによって、正常な組織と区別することができる。周囲の組織より多くの超音波を吸収する腫瘍の「陰」に隠れている前立腺の部分は、より低温になる傾向があるので、これが起きることを予想することができる。逆に、悪性腫瘍が正常な組織より少ない超音波を吸収する種類であった場合には、近傍の正常な組織より低い温度勾配を持つことができる。
【0089】
1つ以上の温度センサ110、例えば熱電対が針108上に位置し、針108の経路に沿って前立腺の温度を測定する。本発明の一部の実施形態では、図1Aに示す通り、針108の長さに沿って配列された複数の温度センサ110は、針が前立腺に適切に配置されたときに、同時に温度を測定する。本発明の一部の実施形態では、例えば針108の先端に1つだけの温度センサが存在し、針を引き出しながら、針の経路に沿った様々な位置の温度が順次測定される。たとえ2つ以上の温度センサが存在する場合でも、任意選択的に1つ以上の中間位置の温度は、針が多少引き出されるときに測定される。針が引き出されるときに温度が測定される場合、温度センサがその周囲と平衡化しかつ温度を正確に測定することができるように、針は任意選択的に、充分にゆっくりと、あるいは特定の位置で充分に長く休止しながら引き出される。代替的に、針はより急速に引き出されるが、温度センサの有限平衡時間は、結果の解析に考慮される。温度センサの平衡時間は任意選択的に、インビトロで実験的に決定されるか、あるいは比熱および熱伝導率を含むモデルを用いて計算される。
【0090】
本発明の一部の実施形態では、少なくとも1つの温度センサは、任意選択的に熱電対の金属の1つとして針の壁を組み込み針に内蔵された熱電対を含む。本発明のこれらの実施形態の一部については、後で図10の説明でさらに詳述する。
【0091】
本発明の一部の実施形態では、1つ以上の温度センサが、生検針に位置する代わりにまたはそれに加えて、超音波トランスミッタにまたはそれに隣接して位置し、これらのセンサは、前立腺の外表面に隣接する1つ以上の位置で、例えば直腸壁で、温度を測定する。そのような温度センサは、特に、前立腺の表面付近に、直腸壁に隣接して位置する腫瘍に関する情報を提供することができる。
【0092】
任意選択的に、温度センサ110は、2分未満、または1分未満、または30秒未満、または10秒未満、または3秒未満、または1秒未満、または0.3秒未満、または0.1秒未満の取得時間で、1℃、または0.5℃、または0.2℃、または0.1℃、または0.05℃、または0.02℃の精度内に正確に温度を測定することができる。任意選択的に、各温度測定は、1センチメートル、または5mm、または2mm、または1mm以内に位置特定される。任意選択的に、測定は、少なくとも針の経路の方向に、またはそのような間隔で離間配置された針を用いることによって温度が測定される前立腺の体積内の全方向に、1cm未満、または5mm未満、または2mm未満の空間的間隔で行なわれる。
【0093】
データインタフェース112は温度センサ110からの信号を受信し、任意選択的に、温度データの何らかの予備処理を行ない、例えば信号をアナログからデジタル形に変換し、制御装置114、例えばパーソナルコンピュータ、または専用電子回路にデータを渡す。超音波トランスデューサ104は、任意選択的にパワーをトランスデューサに提供しかつ任意選択的に超音波撮像データの予備処理を行なうインタフェース116に接続される。代替的に、超音波撮像のためのパワーおよび予備処理は、異なるモジュールによって提供される。超音波撮像に関するデータは任意選択的に、ディスプレイ用の画像を生成するために制御装置114または異なる制御装置に渡される。画像は、生検を実行する医師を案内するために、モニタ118または別のディスプレイ装置に表示される。任意選択的に、モニタ118または別のディスプレイ装置は、下述するように、前立腺の温度マップを表示するためにも使用される。
【0094】
図1Bは、任意選択的に図1Aの針108の代わりに使用される設計の中空針120を概略的に示す。針120は、外側に取り付けられた1つ以上の温度センサ110を有する代わりに、またはそれに加えて、その内側に存在するかまたは針の壁に内蔵された1つ以上の温度センサ122を有し、かつ針の側部に沿って、かつ/またはその端部に配設された1つ以上の温度測定位置124を有する。任意選択的に、温度測定位置の1つ以上は開放窓であるか、あるいは赤外線を透過する閉鎖窓であり、温度センサは窓を介して体組織を観察し、かつ例えば赤外線によって組織の温度を測定し、あるいは温度センサは窓を介して直接体組織に接触し、その温度を直接測定する。窓は例えば針の直径の10%から30%の間、または30%から50%の間、または50%超、または針の直径の10%未満の幅を有する。任意選択的に、窓の縁部は、組織を損傷しないように、少なくとも針の外面では平滑である。任意選択的に、針に窓を有する代わりに、またはそれに加えて、針の温度測定位置の1つ以上が熱伝導率の高い中実な領域であり、針の周囲構造は任意選択的に、熱伝導率の低い材料から作られる。温度センサは、そこからの赤外線放射を測定することによって、または直接接触温度測定によって、これらの高熱伝導率領域の各々の温度を測定し、したがって針の外側の高熱伝導率領域と接触する体組織の温度の指標を提供する。本発明の一部の実施形態では、温度センサは、各温度測定位置に1つずつ、所定の位置に固定される。本発明の他の実施形態では、温度センサは移動可能であり、針から引き出すことができる。例えば、1つ以上の温度センサが、生検試料を採取するために使用される針のチャネル内に位置し、任意選択的に、生検試料を採取するために使用される窓を介して温度を検知し、生検試料のための場所を空けるために、生検試料を採取する前にチャネルから引き出される。温度センサが移動可能である場合には、任意選択的に針が挿入された後、任意選択的に1つの温度測定位置から次の温度測定位置に移動して、各位置で順次温度を測定する1つだけの温度センサが存在する。任意選択的に、温度センサが移動可能である場合、針が前立腺内に挿入されるまで、温度センサは針内に挿入されない。
【0095】
本発明の一部の実施形態では、針120は最初に前立腺内に、前立腺全体に、または前立腺中の距離のかなりの部分に、または生検対象の前立腺の部分、例えば癌が隠れている可能性が最も高いと考えられる部分を網羅するのに充分な深さまで挿入される。任意選択的に、針120は、典型的には5から12cmの長さの前立腺の最長寸法に沿って向けられるように、会陰内手順を用いて挿入される。この初期挿入時に生検試料は採取されないが、温度プロファイルは、針120を使用するための上記の方法のいずれかを用いて超音波加熱後に、針の長さに沿って測定される。任意選択的に、この温度プロファイルは、針が最後まで挿入された後で測定される。代替的に、温度プロファイルは、針が挿入されるにつれて、任意選択的に、正確な測定のための時間を見越して各位置で休止しながら、異なる位置で順次測定される。針は細いので、たとえそれが熱良導体から作られている場合でも、それが温度プロファイル自体に重大な影響を及ぼすとは考えられず、そのような影響は、針に比較的低い熱導体を使用することによって軽減することができる。前立腺の最長寸法に沿って針を挿入することにより、針が前立腺の短い寸法に沿って挿入された場合より多数の独立位置で温度プロファイルを測定することが可能になり、かつ、より少数の針挿入で前立腺の大部分を網羅する温度マップを作成することが可能になる。
【0096】
ひとたび温度プロファイルが分かると、温度プロファイルおよび任意選択的に他のデータにも基づいて、癌が位置する可能性が最も高い針の長さに沿った温度測定位置124に関して、決定を下すことができる。単数または複数の温度センサが任意選択的に針から引き出され、癌が位置する可能性が最も高いと決定された温度測定位置の1つ以上から生検試料が採取される。温度測定位置が開放窓である場合には、任意選択的に、その温度測定位置で窓を介して生検試料が採取される。本発明の一部の実施形態では、温度測定位置は良好な熱伝導率を持つ閉鎖領域であるが、それらを介して生検試料を採取するために、例えば開口を露出すべく針の内側または外側のシースを回転することによって開放することができる。本発明の例示的実施形態に従って、温度をどのように測定し、かつ生検試料を採取するかについてのさらなる詳細は、後で図8および9の説明で提供する。
【0097】
温度測定
先行技術および本発明の一部の実施形態では、癌と正常な組織を事前に区別することが一般的に不可能なので、前立腺生検は任意選択的に前立腺全体に分布する複数の位置から採取される。図2は前立腺102の表面における12の標的点202のアレイを示し、各標的点は小さい円で示される。各標的点202に対し、生検針は経路204に沿って標的点を通して挿入される。温度測定は、上述した方法の1つを使用して、図2に一連の黒い点として示す各経路204に沿った複数の位置の各々で行なわれる。温度が測定される点の全てが、任意選択的に前立腺102の体積の大部分を網羅するグリッドを構成する。図2では経路は互いに略平行であるように概略的に示されているが、経路が略平行である必要はない。一般的に、経路の位置および向きは、直腸生検プローブを介する前立腺への制限されたアクセスによって拘束される。
【0098】
図3は、生検システム100を使用するための流れ図300を示す。302で、超音波が前立腺に透過される。任意選択的に、透過された超音波は、先行技術の前立腺生検システムで行なわれているように、生検を誘導するために前立腺を撮像するために使用される超音波だけである。そのような超音波は通常、典型的に200から5000パルス/秒の間のパルスレートで、一連のパルスとして透過される。任意選択的に、この目的のために、既存の既製前立腺生検超音波システムは、一部の実施形態では、前立腺を充分に加熱して温度変化を測定するために、撮像用に通常必要とされるより高いパワーで使用される。代替的に、撮像用に使用される超音波パルスに加えて、前立腺を充分に加熱するために、超音波の追加成分が、任意選択的にパルス化されずに、またはずっと低いパルスレートで、例えば100パルス/秒未満、または50パルス/秒未満、20パルス/秒未満、または10パルス/秒未満でパルス化されて透過される。超音波の追加成分の各パルス、またはパルス化されない場合には透過全体が、少なくとも0.01秒、または少なくとも0.02秒、または少なくとも0.05秒、または少なくとも0.1秒、または少なくとも0.2秒持続する。追加成分がパルス化される場合、少なくとも1%、または少なくとも2%、または少なくとも5%、または少なくとも10%、または少なくとも20%のデューティサイクルを有する。
【0099】
追加加熱成分は、撮像に使用される超音波と同一の周波数または同一の周波数範囲を有することができるが、そうする必要はない。特に、より高い分解能の画像を得るために、高い周波数の超音波、例えば7ないし10MHzを撮像用に使用すると共に、均一かつ深部の加熱を得るため、かつ/または組織の種類に対する加熱速度の感応性を高めるために、低い周波数の超音波を加熱用に使用することが有利である。発明者はインビトロ試験を実施し、1MHzの超音波の吸収率が異なる組織間を、特にニワトリの肝臓とウシの肝臓とを、3MHzの超音波の吸収率よりよく区別することを示した。
【0100】
300kHzもしくは500kHzもの低い超音波の周波数、または300kHzから1MHzの間、もしくは1MHzから3MHzの間の周波数も加熱に使用することができる。本発明の一部の実施形態では、特に超音波が組織内の奥深くまで浸透する必要がない場合、例えば3MHzから5MHzの間、または5MHzから15MHzの間の高い周波数の超音波が加熱に使用される。高い周波数の超音波を使用すると、所与の加熱パワーで組織のキャビテーションを引き起こす可能性が低下するという潜在的利点を持つことができる。
【0101】
本発明の一部の実施形態では、生検を誘導するために、磁気共鳴断層撮影または電気インピーダンス撮像のような異なる撮像モダリティが使用され、超音波は前立腺を加熱して温度変化を測定するためにだけ使用される。本発明の一部の実施形態では、生検を誘導するために超音波撮像が使用される場合でも、生検を実施する前に最初に前立腺に透過される超音波は、前立腺を加熱するためにだけ使用され、かつ任意選択的にパルス化されず、あるいは撮像に使用される超音波よりずっと低いパルスレートでパルス化される。しかし、例えば撮像用に設計された市販の超音波システムによって加熱が行なわれる場合、加熱に使用される超音波は高速パルス化される。
【0102】
本発明の一部の実施形態では、超音波は当初、生検を誘導するために撮像用にのみ使用され、生検針が超音波撮像によって誘導されない場合には、超音波は当初全く透過されない。生検針が挿入され、かつ1つ以上の温度測定が行なわれて、加熱がほとんどまたは全く行なわれない状態でベースラインが提供された後でなければ、前立腺を加熱するために実質的な超音波パワーは透過されない。そのようなベースライン測定は、様々な位置における組織の絶対的および相対的加熱度のより正確な評価を可能にし、かつ超音波加熱とは無関係に存在する腫瘍と正常な組織との間の温度差、例えば異なる代謝率による差異または健康な組織および腫瘍における血液循環の差異を明らかにすることもできる。
【0103】
任意選択的に、超音波トランスデューサは、身体の様々な部分の診断用超音波に対して米国食品医薬品局によって課せられた限度である720mW/cm2以下、または430mW/cm2以下の単位面積あたりの全超音波パワー、ピーク空間時間平均パワーを前立腺に透過することに制限される。任意選択的に、ピーク空間時間平均パワーは94mW/cm2未満、または17mW/cm2未満である。任意選択的に、これらのパワー限度は、少なくとも10秒間、または少なくとも1秒間、または少なくとも0.1秒間のいずれかの時間平均に適用される。任意選択的に、ピーク空間パルス平均パワーは190W/cm2未満、または28W/cm2未満である。任意選択的に、超音波トランスデューサは、ハードウェアによって、例えばこのパワー限度に達するとトランスデューサを停止させる保護回路によって、これらのパワー限度、または中間的、またはより厳しいパワー限界の少なくとも1つを超えることが防止される。代替的に、または追加的に、例えば制御装置114内のソフトウェアが、パワー限度を超えることを防止する。本発明の一部の実施形態では、システムは物理的により高いパワーで実行することができるが、パワーを制限する制御ノブまたはユーザが制御装置114に入力することのできる入力パラメータが設けられ、例えばFDA要件を満たすために、これらのパワー限度の1つが選択されるか、あるいはユーザに推奨される。
【0104】
任意選択的に、前立腺に超音波が透過される結果、前立腺の温度上昇が1℃、2℃、3℃、または4℃を超えることはなく、あるいは前立腺が38℃、39℃、40℃、または41℃を超えることはない。
【0105】
任意選択的に、超音波による加熱と、血液循環ならびに周囲の組織への熱伝導および他の熱輸送による冷却とが均衡して、前立腺が熱平衡に達するように充分長い時間にわたって、超音波が前立腺を加熱するまで、生検は実行されない。例えば、加熱は1分超、または3分超、または5分超にわたって続行される。熱平衡に達するまで待つことの潜在的な利点は、生検中に測定された温度プロファイルが、生検の実行前に正確にどれだけ長く加熱が続けられたかに対し感応せず、かつ異なる生検針によって異なる時間に測定された温度を有意義に比較することができることである。代替的に、生検は、熱平衡に達する前に、または必ずしも熱平衡に達するまで待たずに実行され、温度測定を評価し、かつ異なる時間に行なわれた異なる生検針による測定を比較するときに、任意選択的に熱モデリングが使用される。
【0106】
304で、生検針が発射され、または他の方法で前立腺内に前進される。306で、針上の1つ以上の温度センサによって温度が記録される。任意選択的に、図1に対し記載した通り、針に沿って配設された複数の温度センサが存在し、針に沿って異なる位置で異なるセンサによって温度は同時に測定される。代替的にまたは追加的に、温度は、針が前立腺から引き出されるときに、または針が部分的に引き出された後で再挿入されるときに、針の経路に沿って異なる位置で、各温度センサによって、または単一の温度センサによって順次測定される。任意選択的に、正確な測定を行なうことができるように、針は充分に緩徐に移動し、かつ/または温度が測定されるたびに針の移動は休止される。任意選択的に、針が前立腺内に発射された後、針を配置する際の誘導のための超音波撮像がもはや不要になっても、測定中に、かつこの針による測定から次の針による測定までの間、熱平衡状態で温度が各位置で一定値を維持するように、超音波パワーは透過され続ける。代替的に、針が配置された後、超音波パワーは低減され、あるいは完全に停止され、異なる時間に採取された温度データを解析するときに、熱モデリングが任意選択的に使用される。
【0107】
本発明の一部の実施形態では、生検針を用いて温度を測定する代わりに、必ずしも中空ではなく、かつ必ずしも前立腺内に速射されない別の針が前立腺内に挿入され、温度を測定するために使用される。代替的にまたは追加的に、温度は、直腸壁に隣接して前立腺の外にあるセンサによって測定される。1つ以上の生検試料は後で、前立腺の温度がマッピングされた後に、採取される。任意選択的に、試料が採取されるときに、温度も生検針によって測定される。任意選択的に、温度データによって示される腫瘍の位置に応じて、生検試料は制限された数の経路からだけ採取される。
【0108】
任意選択的に、308で、温度は、超音波パワーを低減または停止した後で、針の経路に沿って1つ以上の位置で再び測定される。306と同様に、針の長さに沿って位置する複数の温度センサを使用することができ、あるいは任意選択的に針の端部に位置する単一の温度センサを使用することができ、温度は異なる位置で同時に、かつ/または針を引き出しながら順次、測定することができる。306で温度測定を行ないながら針が引き出される場合、任意選択的に、針は完全には引き出されず、先端が前立腺内に維持され、308で温度測定を再び実行するために、任意選択的に針は同じ経路に沿って前立腺内に押し戻される。超音波パワーを停止または低減した状態で第2組の温度測定を行なうことにより、前立腺における異なる位置の冷却速度の尺度がもたらされる。加熱速度と同様に、冷却速度もまた、例えば悪性腫瘍における血液循環の増加のため、癌組織と正常な組織との間で異なる。温度が数℃上昇した正常な組織の典型的な特性冷却時間は、数分である。任意選択的に、追加の測定が同じ針で1つ以上のしばらく後の時間に、例えば30秒後に、または1分後に、または2分後に、温度がさらに低下したときに、冷却速度に関する追加情報を提供するために行なわれる。その針による温度測定が全部完了したときに、針は完全に引き出され、生検試料は任意選択的に、前立腺生検の通常の手順に従って保存される。
【0109】
本発明の一部の実施形態では、特に、生検針を挿入する前に前立腺が著しく加熱されない実施形態では、308で温度を測定する前に超音波パワーを、停止または低減させる代わりに、作動または増大させることができる。306で行なわれた温度測定は次いで、実質的な加熱の前にベースライン温度をもたらし、かつ308の温度測定は、超音波の吸収による温度上昇の尺度をもたらす。任意選択的に、超音波パワーは次いで停止または低減され、1つ以上の追加的時間後に冷却速度を測定するために温度測定が行なわれる。
【0110】
本発明の一部の実施形態では、温度測定は最初に、第1周波数の超音波による前立腺の加熱中または加熱後に行なわれる。前立腺は次いで第2周波数の超音波により加熱され、第2組の温度測定が行なわれる。前立腺が第1周波数での加熱から完全に冷却する時間がない場合、第1加熱からの残熱が任意選択的に、第2組の温度測定の解析に考慮される。2つの異なる超音波周波数による加熱効果を測定することにより、例えば腫瘍を識別するための追加情報をもたらすことができる。
【0111】
310で、所望の生検試料が全部はまだ採取されていない場合、流れ図は302に戻り、超音波は任意選択的に、前立腺を加熱するように、かつ/または次の生検針のために超音波撮像の誘導をもたらすように透過される。本発明の一部の実施形態では、前立腺は、第1針で温度測定が行なわれる前に、しかし後続針の1つ以上を使用する直前ではなく、実質的に加熱され、これらの針により行なわれる温度測定は、以前の超音波吸収からの前立腺に残っている残熱に依存する。
【0112】
任意選択的に、データを解析してエネルギ吸収および冷却速度の両方のマップを提供するときに、異なる針に対して加熱以来の異なる経過時間が考慮される。任意選択的に、第1組の針は、加熱中または加熱のすぐ後に、前立腺の体積全体に広く分散して使用される。任意選択的に第1組とインタリーブされかつ前立腺の体積全体に同じく広く分散された第2組の針は、加熱後に、第1組の後かなりの熱輸送が行なわれるのに充分長い時間後に使用される。各組の針からの温度データを補間することにより、前立腺全体の温度マップを2つの異なる時間に計算することが可能になる。
【0113】
典型的に、生検針は、現行の慣習で前立腺生検中に、前立腺の体積の多くを網羅する約12の位置で使用される。本発明の一部の実施形態では、生検針は、任意選択的に前立腺の多くを網羅するように間隔を置いて12未満の位置で使用され、生検針は、下述するように温度データによって示された場合にのみ、追加位置で使用される。
【0114】
温度データの解析
所望の生検試料が全部採取されると、次いで312で、温度データが解析され、腫瘍の可能性がある位置を識別および/または推定するために使用される。そのような腫瘍は、図2に示すような三次元データグリッドに例えば温度の極大または極小として現われる。任意選択的に、異なる針の経路間の中心にある腫瘍の位置を推定するために、離散グリッド点の温度データは補間される。隣接する針の経路間の距離より小さい直径の腫瘍に対しても、かつ腫瘍全体が針の経路の間に位置する場合でも、熱は血液循環によって、かつ/または熱伝導によって腫瘍から、または腫瘍へ輸送され、あるいは他の方法で輸送されるので、各腫瘍の周りの領域は正常な組織の残部より高温または低温になるため、これを行なうことが可能である。
【0115】
任意選択的に、腫瘍を識別または位置特定する際に、超音波によって得られた他のデータが温度データと共に使用される。例えば、ドップラ超音波データを使用することができ、あるいは超音波撮像データを使用することができる。
【0116】
314で、すでに使用された針の経路の間に位置するように思われる1つ以上の腫瘍の生検試料を得るために、312で行なわれた温度データの解析に基づいて、追加の生検針を使用すべきか否かの決定が下される。そのような追加の生検針は、他の生検針で採取し損ねた腫瘍から組織試料をおそらく得ることに加えて、任意選択的にそれらの経路に沿って温度を測定するためにも使用され、かつそのような腫瘍の存在を確認または否定することができ、かつ腫瘍が存在する場合はそれらの位置をより正確に測定することができる。1つ以上の追加生検針を使用することが決定された場合には、それらの経路の位置および角度または向きが、既存の温度データに基づいて選択され、流れ図は302に戻る。追加の生検針によって測定された温度データは、腫瘍の位置のより正確な推定を導くことができ、次いでさらなる生検針を使用して、それらから試料を得ることができる。それ以上の生検針が使用されない場合、手順は316で終了する。
【0117】
任意選択的に、温度データは、生検試料を検査するときに、例えば試料の特定の部分の特別な精密検査を指示するため、かつ/または見つかった癌の発達のステージを特性化するための追加情報をもたらすために、病理医によって使用される。
【0118】
小線源治療システムおよび手順
図4は、放射性シードを前立腺の選択された位置に配置することによって、前立腺癌を治療するための小線源治療手順の流れ図400を示す。小線源治療手順は任意選択的に、図1に示すことのできる小線源治療システムを用いて、ただし生検針108を小線源治療針に置き換え、かつ生検銃106を、小線源治療針を保持かつ挿入するための適切な装置に置き換えて、実行される。超音波トランスデューサ104および温度センサ110を含めて、図1の他の要素は、生検システムの場合と同様に、小線源治療システムにも使用することができる。図2の針経路204、および温度測定が行なわれるグリッド点は、生検システムと同様に、小線源治療システムにも関係することができる。
【0119】
402で、超音波は前立腺内に透過される。図3の流れ図300の場合と同様に、超音波は任意選択的に、小線源治療シードの配置を誘導するために使用される撮像用超音波だけであり、あるいは特に前立腺を加熱して温度分布を測定するための成分を含むことができる。一般的に、図3に対して記載した超音波の透過のための種々の選択肢が図4にも当てはまる。
【0120】
404で、1つ以上の小線源治療シードを含む針が、前立腺の表面の計画挿入点で、例えば図2における点202の1つで、前立腺内に挿入される。任意選択的に、針挿入点は、前立腺の体積の多くを網羅するように、かつ比較的均等な間隔で配置されるように選択される。これは、前立腺腫瘍がどこに位置しているか一般的に不明であるので、前立腺内およびその付近の健康な組織を必要以上に害しないように試みながら、前立腺のどこにでもある腫瘍を破壊するために、小線源治療シードが前立腺の体積全体に比較的均等に配置されるように、前立腺の小線源治療で典型的に行なわれる。代替的に、腫瘍の位置は、図3に対して上述したように、例えば以前に行なわれた生検中に測定された温度データを用いて推定され、小線源治療針の挿入点は、腫瘍の予想位置の近くにだけ植設することができるように、あるいはより多くのシードまたは放射性の高いシードが腫瘍の予想位置の近くに集中して、腫瘍に前立腺の残部より高い放射線量をもたらすように、選択される。
【0121】
406で、温度は任意選択的に針の経路に沿って測定される。これは、例えば針に沿って配設された温度センサのアレイを、任意選択的に同時に使用して行なわれる。代替的に、温度は、針が挿入されていくときに、または引き出されていくときに、任意選択的に例えば針の先端付近に位置する単一の温度センサによって、針に沿った異なる位置で順次測定される。308に対して記載したように温度が低下していくときに温度を測定するための選択肢を含めて、図3に対して記載した温度を測定するための選択肢のいずれも使用することができる。小線源治療針は、生検針とは異なり、一般的に銃で前立腺内に発射されないので、温度は任意選択的に、針が最初に挿入されていくときに測定される。本発明の一部の実施形態では、温度は小線源治療針によって全く測定されず、例えば図3に対して記載した生検システムを使用して予め得られた温度プロファイルが、小線源治療針の経路に沿った温度プロファイルの近似値として使用される。
【0122】
408で、小線源治療針の経路に沿った位置が、温度測定から導出された腫瘍の位置に関する情報を用いて、放射性小線源治療シードを配置するために選択される。より多くの超音波パワーが健康な組織より悪性腫瘍によって吸収されることが予想されるので、例えば、シードは主に、針の経路に沿った位置で温度が極大を有する場所もしくは温度が通常より高い場所またはその付近のみに植設される。シードをこれらの位置に限定または集中させることは、シードがより均等に分布された場合より、シードが癌細胞を殺すのに効果的になり、かつ/または健康な組織に対する害が少なくなるという潜在的な利点を有する。
【0123】
任意選択的に、シードを配置するためにすでに通過した位置に針を戻すことが要求されても、シードを配置する前に、温度プロファイルが針の経路全体にわたって測定される。代替的に、局所温度のみ、または針がすでに測定した温度のみに依存するアルゴリズムに従ってシードの位置を決定して、シードは針が最初に挿入されるときに配置される。代替的に、シードを配置するための位置は、完全な温度プロファイルに基づいて決定されるが、小線源治療針がまだ通過していないか、あるいはまだ測定されていない経路の部分については、予め取得した温度測定が使用される。
【0124】
410で、計画された針挿入点が全部使用されたか否かが決定され、使用されていない場合、流れ図は402および404に戻り、小線源治療針が次の針挿入点に挿入される。任意選択的に、任意の針挿入点に対し、以前の針挿入点で小線源治療針から得られた温度データが408で、その挿入点に対し放射性シードを植設する場所を決定するときに使用される。
【0125】
全ての計画挿入点が使用されると、412で全ての挿入点からの温度データが解析され、任意選択的に、例えば図3に記載された生検手順から予め得られた温度データが、解析にも使用される。任意選択的に、図3に対して記載したように前立腺における悪性腫瘍の位置の推定を含むこの解析の結果を使用して、414で、小線源治療手順に追加の針挿入点を使用するか否かの決定が下される。例えば、温度データの解析が、2つの隣接する挿入点に対する小線源治療針の経路間の中心に腫瘍が存在することを示唆する場合、任意選択的に、1つ以上の放射性シードをその腫瘍の中心に近づけて配置するために、追加の挿入点が使用される。追加の挿入点が使用される場合、流れ図は新しい挿入点のために402および404に戻る。任意選択的に、1つ以上の追加シードを配置する前に腫瘍の中心をより正確に位置特定するために、追加の温度データが新しい挿入点の針の経路に沿って測定される。使用すべきそれ以上の追加挿入点が存在しない場合、小線源治療手順は416で終了する。
【0126】
乳房超音波システム
図5は、癌組織および健康な組織の超音波に対する異なる熱応答、および/またはそれらの異なる冷却速度を利用して、乳癌を検出および位置特定するためのシステム500を概略的に示す。多少異なる構成を持つ類似のシステム700を図7に示し、以下で説明する。システム500で、乳房502は、例えばプレート504および506の間に配置されることによって圧縮される。プレートを乳房の両側の表面に押し付けて乳房を偏平にするために、緊張要素508、例えば1つ以上のボルトが任意選択的に使用される。任意選択的に、プレート504および506、ならびに緊張装置508は、既存のマンモグラフィまたは乳房生検システム、または乳房温度の赤外線マッピングに使用されるシステムで乳房を保持しかつ偏平にするために使用される装置と同様に構成される。超音波トランスデューサ510は、プレート506の開口を介して、または直接プレート506を介して、超音波を乳房内に透過させ、乳房を加熱する。超音波トランスデューサ510は任意選択的に、乳房の体積のかなりの部分に超音波エネルギの比較的広幅で均一なビームを生成するように構成される。代替的にまたは追加的に、トランスデューサ510は、ビームが比較的狭幅である場合でも、超音波パワーを乳房でより均一に分布させるようにビームをスキャンする。超音波の周波数は、プレート506からプレート504に進む方向に超音波パワー密度が偏平にされた乳房全体でかなり均一になるように、任意選択的に充分に低く、例えば2MHz未満または1MHz未満であり、任意選択的に、500kHzまたは300kHzもの低さである。代替的に、特に乳房の非常に深い位置で癌を検出または位置特定することを希望しない場合に、任意選択的に最高5MHzまで、または最高15MHzさえまでの高い周波数が使用される。超音波トランスデューサの空間ピーク時間平均のパワー密度は、任意選択的に720mW/cm2未満に制限される。図3の説明で前立腺生検システムに対して上述したように、パワー密度の限度はハードウェアによって、ソフトウェアによって、ユーザによる制御パラメータの選択によって、またはこれらの任意の組合せによって課せられる。任意選択的に、前立腺生検に対して上述したパワーの限度のいずれかが、ここでも適用される。任意選択的に、超音波が乳房に透過された結果、乳房の温度上昇が1℃、2℃、3℃、または4℃を超えることはなく、あるいは乳房が38℃、39℃、40℃、または41℃を超えることはない。
【0127】
本発明の一部の実施形態では、超音波トランスデューサ510は、乳房が圧縮される前に、超音波を乳房内に透過させて、組織を加熱する。この場合、トランスデューサ510は超音波をプレート506に、またはプレート506の開口に透過させる必要はなく、任意選択的に、超音波トランスデューサは、プレートが接触していない領域で乳房に直接当接配置され、超音波パワーが加えられた後でだけ、乳房は例えばプレート504および506の間で圧縮される。これは、乳房が圧縮された場合に、圧縮されない場合とは乳房の超音波吸収特性が異なり、かつ非圧縮乳房組織が、例えば健康な組織と癌組織とをより良く区別することができるという潜在的利点を有する。圧縮された乳房でも温度を測定するのではなく、温度を測定する前に乳房を圧縮することは、異なる加熱特性または冷却特性を持つ乳房腫瘍のような、乳房内のより高い(またはより低い)温度の局所領域が表面に近くなり、検出および特性化が容易になるという潜在的利点を有する。組織を多少冷却させて異なる冷却速度を持つ領域を明らかにするために、乳房組織の加熱と温度測定との間に、熱的に有意の時間を経過させた場合、乳房の圧縮は、加熱の直後に、または冷却期間後に温度を測定する直前に、またはそれらの間の任意の時点で、開始することができる。
【0128】
赤外線カメラ512は、任意選択的に少なくとも部分的に赤外線を透過するかあるいは1つ以上の開口を有しそこを通してカメラが赤外線を検出することのできる表面504を介して、乳房の表面を撮像する。赤外線カメラ512は、体温より高い表面温度の小さい変化を測定するのに有用な波長、例えば3ミクロンから12ミクロンの間で作動する。任意選択的に、赤外線カメラ512は、体表面温度を測定するために使用される市販の赤外線カメラ、例えばFLIRブランド、B‐CAM Western‐Sモデル、またはその類似物である。任意選択的に、温度は、1センチメートル未満、または5mm未満、または2mm未満の空間分解能、1分未満、または30秒未満、または10秒未満、または3秒未満、または1秒未満、または0.3秒未満、または0.1秒未満の取得時間で、1℃、または0.5℃、または0.2℃、または0.1℃、または0.05℃の精度内で正確に測定される。腫瘍は、正常な乳房組織より多く超音波を吸収する傾向があるので、超音波による乳房の加熱中および加熱のすぐ後に、赤外線画像に局所的ホットスポットとして現われる。一部の種類の腫瘍は、それらが正常な乳房組織より少なく超音波を吸収する場合、局所的クールスポットとして現われる。腫瘍はまた、局所的血流が正常な組織より大きいため、超音波パワーが除去された後、他の乳房組織より早く熱が冷めることがある。
【0129】
任意選択的に、赤外線画像は、乳房の超音波加熱中および加熱後に、これらの効果の一方または両方によって腫瘍を検出するために、2回以上作成される。任意選択的に、ベースライン温度分布を提供するために、少なくとも1つの赤外線画像が乳房の加熱前にも作成される。そのような測定は、組織を加熱しなくても存在する健康な組織と病変組織との間の温度差を検出することができ、かつそのような温度差を組織の異なる超音波吸収率に関連する温度差と区別することができるという、潜在的な利点を有する。例えば癌組織における血液循環の増大は癌組織を周囲の正常な組織より低温にし、あるいは代謝作用の増大は癌組織を高温にする。これらの効果の両方、および異なる超音波吸収率による差異を測定することにより、病変組織と健康な組織をより確実に区別することが可能になる。超音波加熱中には乳房が圧縮されず、加熱後に赤外線画像が作成されるときにだけ圧縮される場合、任意選択的に、乳房は超音波加熱前に赤外線画像を作成するためにも圧縮され、それは、加熱前および加熱後に作成された画像を比較することが容易になるという潜在的利点を有する。
【0130】
任意選択的に、赤外線画像は、乳房における超音波の分布の不均一性を考慮に入れるように、例えばソフトウェアによって調整される。
【0131】
乳房502はプレート504および506ならびに緊張要素508によって比較的偏平にされるので、乳房の表面の二次元赤外線画像は、適度に高い分解能で腫瘍を明らかにすることができる。典型的には、腫瘍と乳房の表面との間の距離よりずっと小さい直径の腫瘍は、プレート504および506の間の距離を超えることのできない表面の下の腫瘍の深さに匹敵する直径の領域全体で、乳房の表面に局所的温度差を生じることが予想される。その距離が乳房の寸法と比較して比較的小さい場合には、腫瘍の位置を赤外線カメラによってかなりよく特定することができる。図6は、一定表面温度の等温線602を持つ赤外線画像600の実施例を示す。温度の局所ピーク604または温度の極小は、腫瘍の位置を示す。
【0132】
温度は任意選択的に、所与の波長または波長範囲における赤外線放射強度から、かつ/または赤外線スペクトルから、かつ/またはピーク放射赤外線波長から決定される。任意選択的に、温度は計算されず、これらのパラメータの1つ、またはそれらの組合せが温度の代用として、腫瘍の位置特定のために使用される。
【0133】
赤外線画像はまた、乳房の表面下の腫瘍の深さを推定するためにも使用することができる。高い周波数の超音波、例えば3MHz以上を使用する場合、超音波パワーはほとんどが、超音波トランスデューサ510に隣接する乳房の表面近くで吸収される。異なる超音波周波数を用いて作成された赤外線画像を比較することによって、腫瘍の深さを推定することができる。例えばプレート504および506を取り外し、それらの位置を交換し、かつそれらを乳房の周りに再配置することによって、超音波トランスデューサ510が乳房の異なる側に配置された赤外線画像を比較すると、腫瘍が乳房のどちら側により近いかによって、異常な領域の直径が2つの画像で異なるので、腫瘍の深さに関する情報を提供することもできる。さらに、超音波周波数が比較的高い場合には、超音波トランスデューサは、一方の画像で乳房の片側を主に加熱し、かつ他方の画像で乳房の反対側を主に加熱する。
【0134】
腫瘍の深さに関する情報を得るために、単数または複数の赤外線画像を使用するか否かにかかわらず、画像600のような赤外線画像は任意選択的に、乳房生検を誘導するために使用される。生検針は例えば乳房の領域604に挿入される。任意選択的に、図1に示した前立腺生検針による温度測定と同様に、生検針上の1つ以上の温度センサが、乳房の超音波加熱中または加熱後に、乳房の温度を深さの関数として測定するために使用される。乳房の深さの関数として温度プロファイルを知ることにより、腫瘍を三次元で正確に位置特定することが可能になり、次いで腫瘍の生検試料を採取することができる。赤外線カメラ、生検針、または両方からの温度データは任意選択的に、前立腺生検に対して上述したように、生検試料を検査するときに診断を下すのを助けるために、病理医によって使用される。
【0135】
図7は、癌組織および健康な組織の超音波に対する熱応答の差異および/またはそれらの異なる冷却速度も利用して、乳癌を検出しかつ位置特定するための代替的システム700を概略的に示す。システム700では、乳房はプレート間で偏平にされないが、ブラジャ704によって乳房に当接保持された1つ以上の可撓性曲面702によって包囲される。複数の超音波アクチュエータ706、例えば圧電アクチュエータが超音波を乳房内に透過させる。任意選択的に制御装置710、例えばコンピュータによって制御される超音波パワー源708が、アクチュエータ706に電力を供給する。任意選択的に、乳房への超音波パワーの比較的均一な分布をもたらすために、異なるアクチュエータの相対位相が例えば制御装置710によって設定される。任意選択的に、そのような制御は、アクチュエータ706を曲面702上に規則的な配列またはパターン状に配設させることによって、容易化される。任意選択的に、比較的密に配置された比較的多数のアクチュエータ、例えば10、20、50、または100のアクチュエータ、またはより少数、またはより多数、または中間数のアクチュエータが存在する。そのような配設は、大きすぎる局所的パワー密度を使用することなく、例えば720mW/cm2を超えることなく、比較的大きい平均超音波パワー密度を乳房内に透過させることを可能にする。任意選択的に、アクチュエータ706は、曲面702と、曲面702およびブラジャ704によって所定の位置に保持された乳房との間のゲルまたは液体によって、乳房組織に充分に結合される。
【0136】
超音波は、使用されるパワーレベルで乳房組織に測定可能な温度上昇を生じるのに充分長い時間、例えば1分間、2分間、3分間、もしくは5分間、またはより長い時間、より短い時間、もしくは中間的時間だけ乳房に透過される。次いで、乳房の表面上の位置の関数としての温度の測定が、例えば赤外線カメラ712を用いて行なわれる。赤外線カメラ712は、図5の赤外線カメラ512に対して上述した特徴のいずれかを持つことができる。任意選択的に温度測定が行なわれる前に、曲面702およびブラジャ704は開放されるか、あるいは乳房から取り外され、乳房の表面を直接観察することが可能になる。任意選択的に、温度測定は、乳房の異なる部分における、例えば健康な組織および癌組織における異なる加熱速度および/または冷却速度による温度の差異が、乳房内の熱輸送のため非常に大きく低下しないように、超音波の透過が停止した後、充分に短い時間内に、例えば1分、2分、または3分より短い時間内に行なわれる。任意選択的に、温度測定はまた、図5について上述した通り、ベースライン温度分布を提供するために、乳房組織を超音波で加熱する前にも行なわれる。
【0137】
カメラ712によって作成される1つ以上の赤外線画像は任意選択的に、システム500に対して上述した方法のいずれかを用いて、乳房の腫瘍を位置特定するために使用される。任意選択的に、1つ以上の画像がカメラ712によって制御装置710に、または異なるコンピュータに送られ、そこで画像は保存、処理、および/または解析される。
【0138】
任意選択的に、システム500もしくはシステム700のいずれか、または任意の同様のシステムを使用して、例えば画像を鮮明にすることによって画像を処理するために、ソフトウェアが使用される。鮮明化は例えば、焦点が外れた画像を処理するために使用される市販のソフトウェアを用いて行なうことができる。代替的に、どちらも分解能の損失を生じるが、一般的に画像に対し焦点ずれによるぼやけとは異なる効果を有する拡散によってぼやけた画像を復元するように特別に設計および/または最適化されたソフトウェアが使用される。そのような画像処理は、例えば腫瘍の位置が乳房の表面から遠すぎるため、そうしなければ見逃されることのある乳房腫瘍を検出するのに、または検出された腫瘍が乳房のどこに位置するかをより正確に決定するのに役立つことができる。検出された腫瘍が乳房の表面下にどれだけ離れて位置するかをより正確に推定するために、画像処理または画像解析を使用することもできる。任意選択的に、腫瘍が小さいかまたは点状であると想定することによって、1つ以上の乳房腫瘍を乳房内で位置特定するために、乳房の表面の赤外線画像に適用される画像処理ソフトウェアが使用される。
【0139】
乳房が偏平にされないシステム700のようなシステムは、乳房内の比較的深い位置にある腫瘍に対して、システム500のようなシステムより感受性が低いが、乳房腫瘍は往々にして表面に比較的近い位置にあるので、システム700は乳癌のスクリーニングを目的とする場合には依然として充分である。また、スクリーニングを目的とする場合、疑わしい腫瘍の位置を最初から正確に決定することは重要ではない。
【0140】
任意選択的に、システム500またはシステム700のいずれにおいても、カメラ512または712を用いて乳房の表面からの赤外線放射を測定することに加えて、またはその代わりに、異なる非侵襲性温度測定技術が使用される。任意選択的に、乳房組織の温度は、赤外線放射を用いて表面温度を測定し、かつ内部温度を推測するだけではなく、温度の直接ボリュメトリック測定を可能にする方法を用いてマッピングされる。これは、乳房の表面下の深さを含めて、腫瘍を三次元でより正確に位置特定することが可能になるという潜在的利点を有する。以下の非侵襲性ボリュメトリック温度測定技術の1つ以上を使用することができる。
1)近赤外分光法
2)マイクロ波放射測定法
3)異なる供給源からの加熱用超音波または診断用超音波を使用する超音波温度測定法
4)磁気共鳴温度測定法
5)電気インピーダンス断層撮影法
【0141】
これらの技術の内の最初の4つは、上で引用した参考文献に、特にHollisの博士論文、および超音波温度測定法の場合、StraubeらおよびArthurらの講演、ならびにSeipおよびEbbiniによる論文に記載されている。少なくとも比較的低い周波数、例えば100kHzより充分に低い周波数の電流および電圧では、体組織の比インピーダンスまたは抵抗率が局所的温度に依存するので、電気インピーダンス断層撮影法は温度をボリュメトリックに見つけるために使用することができる。電気インピーダンス断層撮影法は、測定される組織の種類の抵抗率の温度依存性を事前に較正した場合、温度を絶対的に測定するために使用することができ、あるいは抵抗率の温度依存性が事前に較正されない場合でも、温度の変化を検出しかつ異なる場所の温度変化を比較するために使用することができる。
【0142】
これらの非侵襲性ボリュメトリック温度測定技術のいずれも、上述の通り、侵襲性プローブによって行なわれる温度測定を補足するために、前立腺に使用されることを含め、身体の他の部分の腫瘍または異常組織を検出するためにも使用することができる。
【0143】
生検針および手順
図8は、本発明の例示的実施形態に従って、試料を採取する位置を選択するために温度測定を利用して、生検試料を採取するために生検針がどのように使用されるかを例証する時系列を概略的に示す。図9は生検手順のフローチャート900である。図8の左側にある時系列の最初の図は、フローチャートの902で組織内に、例えば前立腺組織内に最初に挿入されるときの生検針800を示す。針800は先鋭点802を有し、当初は閉位置にあり、任意選択的にカバー804内に引き戻され、先鋭点802だけがカバーの外側にある。切欠図は、針の側面にその長さに沿って配設された複数の窓806を持つ、カバー804内の針を示す。針が挿入されている間、窓を被覆しておくと、窓の鋭利な縁による組織の損傷が回避され、かつ生検試料を正確にどこから採取するかが決定されるまで、組織を針の内側の外に維持し続けるという潜在的な利点が得られる。任意選択的に、生検が行なわれる組織の全長をカバーするように、針は902で組織内の充分奥まで押し込まれる。例えば、それが前立腺生検に使用される場合、針は任意選択的に前立腺全体にまたは略全体に押し込まれる。
【0144】
時系列における次の図808に示すように、針が所定の位置に着くと、フローチャートの904でカバー804が引き戻され、窓806が周囲の組織に曝露される。温度センサ810、例えば熱電対が次いで任意選択的に針の内側に沿って押し込まれる。フローチャートの906で、温度センサ810は、各窓806で組織の温度測定を行なう。異なる種類の組織、例えば健康な組織と癌組織とをそれらの異なる加熱速度および/または冷却速度によって区別するために、温度測定は、超音波による組織の加熱後に行なわれる。任意選択的に、センサ810を針に沿って軸線方向に1つの窓806から別の窓に針に沿って軸線方向に動かしながら、温度測定は順次行なわれる。任意選択的に、一部の窓は異なる方位角位置にも位置し、センサ810は、1つの窓から次の窓に軸線方向のみならず、方位角方向にも移動する。代替的にまたは追加的に、温度センサ810は、針の異なる窓806を介して温度を同時に測定する複数のサブセンサを備える。全ての温度測定が同時に行なわれる場合、測定を行なうために温度センサ810を移動させる必要はなく、任意選択的に、針が最初に組織内に挿入されたときに、温度センサ810はすでに所定の位置に着いている。1つ以上のワイヤ812は任意選択的に、身体の外側に位置するデータリンクに温度データを伝達する。ひとたび温度測定が行なわれると、温度センサ810は任意選択的に針から引き出される。本発明の一部の実施形態では、温度センサは針内の所定の位置に永久的に維持される。しかし、温度センサを取り出すと、温度センサが生検試料の採取を妨げないという潜在的利点が得られる。
【0145】
フローチャートの908で、針に沿ったどの位置で生検試料を採取すべきかに関し、温度測定に基づいて決定が下される。任意選択的に、温度測定に基づいて、癌組織が見つかる可能性の高い位置が選択される。例えば、超音波加熱の結果、癌組織が健康な組織より高い温度を有することが予想される場合、かつ組織が針の経路に沿ってかなり均一な超音波のパワー密度に曝露された場合には、測定温度に局所的ピークが存在する窓806で、生検試料を採取することができる。癌組織が健康な組織より低い温度を有することが予想される場合には、測定温度に極小が存在する窓806で、生検試料を採取することができる。
【0146】
フローチャートの910で、時系列の図814に示す通り、生検キャリアロッド816が針の内側に沿って押し込まれる。キャリアロッド816は任意選択的にその側面を閉鎖され、窓806の1つであって生検試料が採取される窓820に隣接して位置する生検スリット822を除いて、中実領域818が窓806を組織から遮断する。生検スリットが窓820に隣接して配置されると、キャリアロッド816の内側はその位置の組織に露出される。任意選択的に、各々、生検スリットがキャリアロッドの端に対して異なる位置にある、異なるキャリアロッドが利用可能である。ひとたび生検試料を採取するための位置が選択されると、キャリアロッドが針内に進入できる限り奥まで押し込まれたときに、生検スリットが窓820に隣接して生検試料を採取するための正しい位置に配置されるように、キャリアロッドの1つが選択される。代替的に、生検スリットは常にキャリアロッドの端の近くに位置し、キャリアロッドは、生検スリットが選択された窓820に隣接して配置されるように、ちょうど足りる距離だけ針内に押し込まれる。任意選択的に、この場合、キャリアロッドは停止要素を含み、停止要素は、キャリアロッドを挿入する前に、キャリアロッドが針の奥まで押し込まれすぎないように調整される。
【0147】
フローチャートの912で、組織試料はキャリアロッド内に、または窓のすぐ内側に位置するキャリアロッドのポケット内に切り落とされる。これは例えば、時系列の図824に示すように、カバー804を針上で前方に押し進めることによって行なわれる。これが行なわれる前に、針によって押し退けられた組織の圧力のため、組織の一部は、窓820および生検スリット822を通してキャリアロッド816の内部に膨出する。カバー804は充分に鋭利な刃を有し、かつ/または針とカバーとの間に充分に密な嵌合が存在するので、カバー804を針上に押し被されるときに、キャリアロッド816の内部に膨出した組織の部分が、キャリアロッド内に切り落とされる。フローチャートの914で、キャリアロッドは生検試料と共に針から取り出される。任意選択的に、キャリアロッドが取り出されるときに、針およびカバーは組織内に残る。
【0148】
フローチャートの916で、任意選択的に、針に沿った異なる位置で別の生検材料を採取すべきか否かの決定が下される。この決定は任意選択的に、906で測定した針に沿った組織の温度プロファイルに基づく。例えば温度プロファイルが、例えば温度の2つの極大によって示される2つの別個の腫瘍の存在を示唆する場合には、それらの各々から生検試料を採取するように選択が行なわれる。どの位置に癌組織が存在する可能性が最も高いかを温度プロファイルから判断することが難しい場合、2つ以上の生検試料を採取するという選択を行なうこともある。任意選択的に、全ての生検試料を採取する場所に関する決定は、温度が測定された後、試料のいずれかが採取される前に行なわれる。
【0149】
別の試料を採取する場合には、カバーが任意選択的に、918で再び引き戻される。代替的に、カバーはキャリアロッドが取り出される前に引き戻される。しかし、キャリアロッドが取り外される間、カバーを閉じたままにしておくと、他の位置の組織が窓806のいずれかに流入してキャリアロッドを妨害し、かつ/または生検スリットを介してキャリアロッド内に流入することを防止することができる。ひとたびカバーが引き戻されると、910で新しいキャリアロッドが挿入され、最初の生検試料に対し上述したように、新しい生検試料を採取するように配置される。任意選択的に、新しいキャリアロッドが挿入し終わるまで、カバーは引き戻されない。
【0150】
全ての生検試料が採取されると、920で針およびカバーが組織から取り出される。
【0151】
図10は、例えば図8の生検針800の代替例として使用することのできる内蔵熱電対付き生検針1000を概略的に示す。針1000の壁1002は、熱電対で使用することのできる1つの金属、例えばアルメルから構成される。壁1002に沿って延びるが壁1002から電気的に絶縁された1つ以上のストリップ1004は、第1金属と共に熱電対に使用することのできる異なる金属、例えばクロメルから作られる。例えばストリップ1004は電気絶縁接着剤により壁1002に付着される。各ストリップ1004は、ストリップが壁1002と良好な電気接触状態にあり、かつ針1000に隣接する組織と良好な熱接触状態にある遠位端1006を有する。各ストリップの近位端には電気リード1008があり、かつ壁1002の近位端に電気的に接続された電気リード1010も存在する。リード1008およびリード1010は任意選択的に、一定の既知の温度に維持される。壁1002および各ストリップ1004は、そのストリップ用のリード1008とリード1010との間に、そのストリップの遠位端1006の温度に依存する電位差を持つ、熱電対を形成する。任意選択的に、針1000は複数のそのようなストリップを含み、各ストリップは針1000に沿った異なる位置に遠位端1006を持つ。リード1008およびリード1010の既知の固定温度に対する針1000の長さに沿った組織の温度プロファイルは、リード1010の電位に対する各リード1008の電位を測定することによって決定される。
【0152】
針800の一部の特徴、例えば任意選択的に針のストリップ1004とは異なる側にある窓806、カバー804、およびキャリアロッド816は、針1000に使用することができることに注目されたい。ストリップ1004は任意選択的に壁1002の内側または外側に沿った適位置に確実に接着され、かつ任意選択的に半径方向に細い。これは、ストリップ1004が、針の外側に沿った任意の要素、例えばカバーの摺動、または針の内側に沿った任意の要素、例えばキャリアロッドの摺動を妨害せず、あるいはそれによって損傷されないという潜在的利点を有する。
【0153】
本明細書中で使用される用語「約」は、±10%を示す。
【0154】
用語「含む/備える(comprises、comprising、includes、including)」、「有する(having)」、およびそれらの同根語は、「含むが、それらに限定されない(including but not limited to)」ことを意味する。この用語は、「からなる(consisting of)」および「から本質的になる(consisting essentially of)」を包含する。
【0155】
表現「から本質的になる」は、さらなる成分および/または工程が、特許請求される組成物または方法の基本的かつ新規な特徴を実質的に変化させない場合にだけ、組成物または方法がさらなる成分および/または工程を含み得ることを意味する。
【0156】
本明細書中で使用される場合、単数形態(「a」、「an」および「the」)は、文脈がそうでないことを明確に示さない限り、複数の参照物を包含する。例えば、用語「化合物(a compound)」または用語「少なくとも1つの化合物」は、その混合物を含めて、複数の化合物を包含し得る。
【0157】
用語「例示的」は、本明細書では「例(example,instance又はillustration)として作用する」ことを意味するために使用される。「例示的」として記載されたいかなる実施形態も必ずしも他の実施形態に対して好ましいもしくは有利なものとして解釈されたりかつ/または他の実施形態からの特徴の組み入れを除外するものではない。
【0158】
用語「任意選択的」は、本明細書では、「一部の実施形態に与えられるが、他の実施形態には与えられない」ことを意味するために使用される。本発明のいかなる特定の実施形態も対立しない限り複数の「任意選択的」な特徴を含むことができる。
【0159】
本開示を通して、本発明の様々な態様が範囲形式で提示され得る。範囲形式での記載は単に便宜上および簡潔化のためであり、本発明の範囲に対する柔軟性のない限定として解釈すべきでないことを理解しなければならない。従って、範囲の記載は、具体的に開示された可能なすべての部分範囲、ならびに、その範囲に含まれる個々の数値を有すると見なさなければならない。例えば、1〜6などの範囲の記載は、具体的に開示された部分範囲(例えば、1〜3、1〜4、1〜5、2〜4、2〜6、3〜6など)、ならびに、その範囲に含まれる個々の数値(例えば、1、2、3、4、5および6)を有すると見なさなければならない。このことは、範囲の広さにかかわらず、適用される。
【0160】
数値範囲が本明細書中で示される場合には常に、示された範囲に含まれる任意の言及された数字(分数または整数)を含むことが意味される。第1の示された数字および第2の示された数字「の範囲である/の間の範囲」という表現、および、第1の示された数字「から」第2の示された数「まで及ぶ/までの範囲」という表現は、交換可能に使用され、第1の示された数字と、第2の示された数字と、その間のすべての分数および整数とを含むことが意味される。
【0161】
本明細書中で使用される用語「方法(method)」は、所与の課題を達成するための様式、手段、技術および手順を示し、これには、化学、薬理学、生物学、生化学および医学の技術分野の実施者に知られているそのような様式、手段、技術および手順、または、知られている様式、手段、技術および手順から、化学、薬理学、生物学、生化学および医学の技術分野の実施者によって容易に開発されるそのような様式、手段、技術および手順が含まれるが、それらに限定されない。
【0162】
本明細書で使用される場合、用語「治療する/処置する」には、状態の進行を取り消すこと、実質的に阻害すること、遅くすること、または、逆向きにすること、状態の臨床的症状または審美的症状を実質的に改善すること、あるいは、状態の臨床的症状または審美的症状の出現を実質的に防止することが含まれる。
【0163】
明確にするため別個の実施形態の文脈で説明されている本発明の特定の特徴が、単一の実施形態に組み合わせて提供されることもできることは分かるであろう。逆に、簡潔にするため単一の実施形態で説明されている本発明の各種の特徴は別個にまたは適切なサブコンビネーションで、あるいは本発明の他の記載される実施形態において好適なように提供することもできる。種々の実施形態の文脈において記載される特定の特徴は、その実施形態がそれらの要素なしに動作不能である場合を除いては、それらの実施形態の不可欠な特徴であると見なされるべきではない。
【0164】
本明細書中上記に描かれるような、および、下記の請求項の節において特許請求されるような本発明の様々な実施形態および態様のそれぞれは、実験的裏付けが下記の実施例において見出される。
【実施例】
【0165】
次に下記の実施例が参照されるが、下記の実施例は、上記の説明と一緒に、本発明を非限定様式で例示する。
【0166】
異なる超音波加熱速度を使用して、それ以外では類似した種類の組織を区別することの実現可能性を実証するために、ニワトリの肝臓の小片をウシの肝臓の大片の表面に埋め込み、あるいはウシの肝臓の小片をニワトリの肝臓のより大片に埋め込んで、インビトロ試験を行なった。次いで試料全体を、1MHzまたは3MHzのいずれかで720mW/cm2より低い時間平均強度の超音波により、その温度が数℃上昇するように約1分から約6分の範囲の充分に長い時間、均一に加熱した。赤外線カメラを使用して、試料の表面を撮像し、2種類の肝臓の温度を測定した。全ての事例において、ウシの肝臓はニワトリの肝臓よりかなり速く加熱され、かつ2種類の肝臓が赤外線画像で容易に区別可能であることが明らかになった。
【0167】
表1は、行なわれた5つの試験のデータを示す。全ての試験において、治療用超音波機、Mettler Electronics Sonicator740を使用し、単一のトランスデューサを10%デューティサイクルで作動させた。トランスデューサを上向きにして機械をフィクスチャに配置し、超音波の均一な非集束ビームを発生するように設定した。試料をトランスデューサの頂部に配置した。FLIRブランド、B‐CAM Western‐Sモデル赤外線カメラを用いて、加熱前および加熱後の温度を測定した。初期温度は20℃から25℃の間であり、2種類の肝臓の間に検出できる差はなかった。試験2から5において、トランスデューサと試料との間の結合を改善するために、ゲルを使用した。試験1ではゲルを使用せず、その結果、結合は不充分であり、6分を超えるずっと長い加熱時間を使用した。この加熱時間は2種類の肝臓の間の実質的な伝導熱流束を可能にするのに充分な長さであり、その結果、2種類の肝臓における温度上昇は、試験1では、他の試験よりずっと近接していた。試験1および5ではニワトリの肝臓をウシの肝臓に埋め込み、試験2、3、および4では、ウシの肝臓をニワトリの肝臓に埋め込んだ。
【表1】

【0168】
結果は、3MHzの超音波の場合、1MHzの超音波より、加熱速度が高いことを示している。ニワトリの肝臓が周囲のウシの肝臓によって著しく伝導加熱された試験1を無視すると、データは1MHzの超音波が2種類の組織を3MHzの超音波よりよく区別することをかろうじて示唆している。臨床に使用する場合、3MHzの超音波ほど大きく吸収されないことによる1MHzの超音波の組織におけるより深い浸透も有利である。試験3、4、および5の比較は、温度測定の精度内で、2種類の肝臓の加熱速度が再現可能であり、予想通り、超音波パワーに比例することを示す。
【0169】
試験はニワトリの脚でも行なわれ、1MHz、700mW/cm2の平均パワーでトランスデューサを脚の裏から当てた。加熱後に撮影した赤外線画像は、腱組織による超音波吸収が周囲の筋肉組織より大きいことを示した。
【0170】
超音波加熱を使用してラットの壊死組織が正常な肝臓組織から区別されること、および画像処理がこの目的に有用であることを実証するために、インビボ試験を行なった。面積10cm2の超音波トランスデューサで1.4W/cm2の1MHz超音波を4分間肝臓に当てた。標準Photoshop画像鮮明化ソフトウェアを用いて処理した赤外線画像は、壊死組織の大部分が肝臓の表面から数ミリメートル下にあり、未処理赤外線画像では正常な組織とそれほど明瞭に区別されないにもかかわらず、超音波加熱後の壊死組織と正常な組織とを明瞭に区別する。処理後の赤外線画像では、壊死組織における超音波加熱速度が正常な組織より低いことを反映して、壊死組織は赤外線温度が28℃であったが、正常な肝臓組織は赤外線温度が29℃であった。
【0171】
本発明はその特定の実施態様によって説明してきたが、多くの別法、変更および変形があることは当業者には明らかであることは明白である。従って、本発明は、本願の請求項の精神と広い範囲の中に入るこのような別法、変更および変形すべてを包含するものである。
【0172】
本明細書で挙げた刊行物、特許および特許出願はすべて、個々の刊行物、特許および特許出願が各々あたかも具体的にかつ個々に引用提示されているのと同程度に、全体を本明細書に援用するものである。さらに、本願で引用または確認したことは本発明の先行技術として利用できるという自白とみなすべきではない。節の見出しが使用されている程度まで、それらは必ずしも限定であると解釈されるべきではない。
【技術分野】
【0001】
関連出願
本願は、2009年12月29日にともに出願された米国特許出願第12/648433号及び米国特許出願第12/648440号の一部継続出願(CIP)であり、その内容はその全体を参照として本明細書に組み込まれる。米国特許出願第12/648433号は、2009年6月1日に出願された米国仮特許出願第61/182781号、および2008年12月29日に出願された米国仮特許出願第61/193815号からの米国特許法第119条(e)項35の利益を主張した。米国特許出願第12/648440号は、2008年12月29日に出願された米国仮特許出願第61/193829号からの米国特許法第119条(e)項35の利益を主張した。
【0002】
本願は、代理人管理番号50493を有する、同日に出願された別のPCT出願に関連し、その内容は、参照として本明細書に組み込まれる。
【0003】
上記の出願の全ての内容は、参照として本書に完全に記載されているように組み込まれる。
【0004】
技術分野
本発明は、その一部の実施形態では、超音波への曝露中および/または曝露後にその熱応答によって体組織の少なくとも1つの特性を決定するシステムに関し、さらに詳しくは、そのような方法を用いて癌組織を正常な組織と区別するシステムに関するが、それに限定されない。
【背景技術】
【0005】
多数の医用撮像モダリティが、異なる種類の体組織を判別するために、特に癌および他の病変組織を位置特定するために使用されるが、これらのモダリティは各々、何らかの不利点を有する。超音波撮像は一部の種類の軟組織を充分に判別しない。X線は、特にコンピュータ断層撮影(CT)スキャンに使用される場合、一部の種類の軟組織を判別することができるが、X線画像の解像度および雑音レベルは多すぎる放射線の悪影響によって限定され、これは、通常のX線画像よりずっと高いX線量を必要とするCT画像に特に当てはまる。磁気共鳴断層撮影(MRI)は概して、軟組織を判別するには超音波より優れているが、MRI装置は一般的に大型かつ高価であり、かつしばしば患者を包囲し、他の手順を実時間で実行するためのアクセスに制限がある。CT装置、およびPETのような核医学撮像用の装置もまた大型かつ高価になる傾向がある。赤外線撮像は、周囲の領域とは温度が異なる身体表面上の領域を特定することができるが、体温制御メカニズムは温度を均一にする傾向があるので、病変組織を見つけるための実用性は限定される。
【0006】
生検も癌および他の疾患を識別するために使用されるが、生検は侵襲的であり、感染症のリスクを伴い、かつ患者にとってはしばしば不快である。さらに、前立腺生検で通常行なわれているように、疑われる病変組織の位置が分からずに生検を行なうと、病変組織を見逃して、偽陰性の結果が出ることがある。
【0007】
超音波は、医療では撮像および治療の両方に使用される。超音波医用撮像システムは一般的に、200から5000パルス/秒の間の短パルスの超音波を使用する。例えば米国食品医薬品局(FDA)による安全規則は一般的に、超音波撮像システムを、曝露される組織の温度を3℃超上昇させない比較的低い時間平均パワーに制限している。各パルス内のパワーは一般的に、適切な信号対雑音比をもたらすために、平均パワーよりずっと大きい。例えば、FDA規則は空間ピーク時間平均パワーを720mW/cm2に制限するが、空間ピークパルス平均パワーは190W/cm2もの高さにすることができる。本書で使用する場合、「空間ピーク時間平均パワー」および「空間ピークパルス平均パワー」は両方とも、2008年9月9日発行のFDA文書560「Information for Manufacturers Seeking Marketing Clearance of Diagnostic Ultrasound Systems and Transducers」に定義されている全体的最大軽減定格パワーを指す。
【0008】
超音波治療システムはより高いパワーを使用し、処置される組織の温度を一般的に3℃超上昇させる。一部の超音波治療システムは、組織を焼灼するために、小さい体積全体でずっと高い温度まで組織を加熱する。International Symposium on Therapeutic Ultrasound, Seattle 2002で発表されたRalf Seipらの「Real‐Time Detection of Multiple Lesions During High Intensity Focused Ultrasound(HIFU) Treatments」は、30ないし37ワットの全音響パワーを用いて組織を局所的に85℃超に加熱することによって病変を生成し、散乱超音波を用いて実時間で監視する超音波治療システムを記載している。
【0009】
Mastらの米国特許第7211044号明細書は、低強度超音波信号を最初に標的組織に集束させて、1℃未満の温度上昇を生じる治療用超音波システムを記載している。標的組織の温度上昇を撮像して、超音波信号が標的組織に正しく照準していることを確実にし、次いで高強度超音波を標的組織に集束させて、温熱治療を施すか、または組織を焼灼する。
【0010】
G.E.P.M.Van Venrooijの「Measurement of ultrasound velocity in human tissue」、Ultrasonics、October 1971、p.240〜242は、血液、脳脊髄液、および様々な種類の脳腫瘍における超音波の音速および音響インピーダンスに関するデータを掲載している。Ferride Severcan、Dana Dorohoi、およびDorina Creangaの「Ultrasound Propagation Through Biological Tissues」、Studia Universitatis Babes‐Bolyai、Physica、Special Issue、2001、p.169〜175は、様々な種類の体組織における様々な周波数および温度での超音波の音速、音響インピーダンス、および吸収係数を掲載し、かつ組織内の超音波伝搬を特徴付ける物理パラメータを用いて腫瘍または異物の存在に関する情報を得ることができることを示唆している。
【0011】
オンラインニュースレターBio‐Medicineは、2009年3月24日にwww.bio−medicine.org/medicine−technology−1/EDAP−Announces−Launch−of−Clinical−Study−Combining−HIFU−and−Chemotherapy−for−Localized−Aggressive−High−Risk−Prostate−Cancer−4−l/からダウンロードした2007年8月17日付けの記事で、前立腺癌の高強度集束超音波(HIFU)治療の世界的指導者、フランス国リヨンのEDAP TMS S.A.による臨床試験で、化学療法薬剤と併せて、治療用超音波を使用してステージT2cの前立腺癌を焼灼することを記載している。周囲組織における化学療法薬剤の有効性が超音波治療によって改善されるといわれる。動物実験で超音波治療と化学治療を組み合わせることの相乗効果は、Curielらの「HIFU and Chemotherapy Synergistic Inhibitory Effect on Dunning AT2 Tumour‐Bearing Rats」、4th International Symposium on Therapeutic Ultrasound、AIP Conference Proceedings、Volume 754、pp.191〜195(2005)によって報告されている。
【0012】
A.Bounaimらの「Sensitivity of the ultrasonic CARI technique for breast tumor detection using a FETD scheme」,Ultrasonics 42、919〜925(2004)は、「良性および悪性乳房病変の弁別を改善する臨床上の潜在力を実証した」といわれる、乳癌の超音波検出のためのCARI(臨床振幅/速度再構成撮像)技術のシミュレーションを記載している。該論文は、「CARIモダリティの臨床研究が、音速および音響の組織減衰が女性乳房の様々な組織を特徴付けるのに重要な定量パラメータであることを示した」と言及している。
【0013】
Bao‐wei Dongらの「In vivo measurements of frequency‐dependent attenuation in tumors of the liver」、Journal of Clinical Ultrasound、22、167〜174(1994)は、健康な被験者および様々な種類の良性および悪性肝臓腫瘍を持つ被験者の肝臓における超音波減衰の周波数依存度の測定を記載している。一部の種類の腫瘍は、減衰に対し健康な組織より高い周波数依存度を示したが、他の種類の腫瘍は、減衰に対し健康な組織より低い周波数依存度を示した。
【0014】
Xiao‐Zhou Liuらの「Ultrasonic characterization of porcine liver tissue at frequency between 25 to 55MHz」、World J Gastroenterol 2006 April 14;、12(14):2276〜2279は、硬変ブタ肝組織に見られる超音波の減衰が正常なブタ肝組織より大きいことを記載している。
【0015】
L.Landiniらは、Medical and Biological Engineering and Computing 24、243〜247(1986)で、「正常な胸部組織および病的な胸部組織における超音波の周波数依存減衰の測定について、・・・脂肪組織、線維脂肪実質、および線維症、ならびに増殖性線維症を伴う場合と伴わない場合の悪性腫瘍(それぞれ浸潤腺管癌スキルス型および髄様癌)を含め・・・報告している。減衰測定の結果は、減衰係数が、細胞の大きな優位性を持つ組織では低くなり(脂肪組織、髄様癌)、コラーゲン線維含有量と共に増大する(浸潤腺管癌スキルス型、線維症、線維脂肪)ことを示す。」
【0016】
2009年2月24日にwww.iaec.gov.il/docs/IAEC20.pdfからダウンロードしたB.Sfezらの「Electro‐Optical Ultrasound」、Israel Atomic Energy Commission Annual Report、2001、p.1〜23は、可視光または赤外光を組織内に伝達し、集束した超音波を使用して組織を走査する医用撮像方法を記載している。光は組織によって強く散乱されるが、超音波が集束する場所を通過する光の部分は、超音波周波数におけるその変調によって識別することができ、このようにして組織における光の吸収の3Dマップを再構成することができる。
【0017】
Victoria S.Hollisの「Non‐Invasive Monitoring of Brain Tissue Temperature by Near‐infrared Spectroscopy」、Ph.D.thesis、Dept.of Medical Physics and Bioengineering、University of London、Sept. 2002は、第4章で、近赤外分光法(NIRS)、マイクロ波放射測定法、磁気共鳴温度測定法、および超音波温度測定法を含め、脳温を非侵襲的に測定する様々な方法を検討している。
【0018】
超音波を用いて組織温度を非侵襲的に測定することは、2005年4月1〜3日の2005 Annual Meeting、 Society for Thermal Medicine、Bethesda,Marylandで発表された講演「An In Vivo System for the Determination of the Effect of Temperature on Backscattered Ultrasound Energy in Ultrasonic Images」においてW.L.Straube、J.Parry、E.Moros、J.Trobaugh、およびR.M.Arthurによって、かつ2007年5月16日の第32回UITC Alexandria,VAで発表された講演「Change in Ultrasonic Backscattered Energy for Temperature Imaging:Factors Affecting Temperature Accuracy and Spatial Resolution in 3‐D」においてR.M.Arthurらによっても述べられている。著者らは、温度に対する依存度が異なる超音波後方散乱係数を有する水溶性および脂肪性物質の小さい内包物を含む、肝臓組織のような不均質な組織からの超音波の後方散乱について考察している。彼らは、結果的に生じる後方散乱エネルギの空間的変動を用いて組織の温度を測定することを記載している。
【0019】
SeipおよびEbbiniの「Noninvasive Estimation of Tissue Temperature Response to Heating Fields Using Diagnostic Ultrasound」,IEEE Transactions on Biomedical Engineering、vol 42、pp.828〜839(1995)は、診断用超音波の後方散乱を利用して組織の温度変化を監視するための別の技術を記載している。該技術は、大部分の生体組織が半規則的散乱格子であるという観察結果に基づいている。これらの格子構造は、音速の温度依存性および格子構造の熱膨張を介して後方散乱超音波の高調波を発生させ、高調波の周波数偏移は温度に依存する。周波数偏移を推定するために自己回帰モデルベースの方法が使用される。
【0020】
超音波は、セラミックス、金属、およびプラスチックを含め種々の材料の非破壊検査に使用されてきた。材料内部のクラックおよび他の欠陥はバルク材より多く超音波を吸収し、かつ欠陥が材料の表面に発生させた、測定される温度上昇によって検出される。典型的には、超音波トランスデューサは100W/cm2を超えるパワー密度を生成し、数Hzから数百分の1Hzまでの範囲の周波数で変調される。そのようなシステムの例は、「Insight」ISSN 1354‐2575、2003、vol.45、#3、pp 178〜182(British Institute of Nondestructive Testing)におけるTh.Zweschperらの「Ultrasound excited thermography using frequency modulated elastic waves」、J.Rantalaらの「Lock‐in thermography with mechanical loss angle heating at ultrasonic frequencies」、Quantitative Infrared Thermography、Eurotherm Series 50、Edition ETS 1997、pp 389〜393、および2009年1月25日にwww.ndt.net/article/ecndt2006/papers〜l.htmからダウンロードした論文We.3.8.2であるA.Gleiterらの「Ultrasound‐Lockin‐Thermography for Advanced Depth Resolved Defect Selective Imaging」、European Conference on Non‐Destructive Testing 2006に記載されている。
【0021】
Littrupらの米国特許出願公開第2004/0030227号明細書は、医学的病理の少なくとも一部分を含む組織の体積によって散乱した第1組の音響放射を受信するステップと、その後、組織の体積の温度を変化させるステップとを含む、医学的病理を治療するための方法を記載している。該方法はまた、その後、組織の体積によって散乱した第2組の音響放射を受信するステップと、第1および第2組の受信した音響放射から医学的病理の部分を位置特定するステップとをも含む。医学的病理の一部分を位置特定するステップは、温度変化の結果生じる第1および第2組の受信した音響放射の差異から医学的病理を識別することを含む。一部の実施形態では、温度の変化は超音波加熱によって発生する。該方法はまた、医学的病理の部分を損傷するのに充分なエネルギを医学的病理の部分に照射することをも含む。Littrupらはまた、乳房組織をRFパワーで加熱すること、および腫瘍の加熱応答が良性組織より大きいことを頼りに、熱音響コンピュータ断層撮影法を用いて腫瘍を検出することをも記載している。
【0022】
Littrupらの優先権文書であったRatherらの米国特許第6728567号明細書は、超音波トランスデューサのアレイを使用し、超音波を様々な方向から体組織に透過させ、断層撮影法を用いて超音波吸収率、音速、および他のパラメータを体組織における三次元位置の関数として求めることを記載している。結果は、癌組織を健康な組織と区別するために使用される。
【0023】
Emelianovらの米国特許出願公開第2009/0105588号明細書は、レーザによる組織の加熱について記載しているが、超音波を利用して温度変化を測定し、脂肪および筋肉が異なる熱膨張係数および温度による異なる音速の変化率を有するという事実から、それが脂肪かそれとも筋肉かを決定する超音波加熱についても示している。
【0024】
Stecknerの米国特許出願公開第2008/0200795号明細書は、例えば0.3テスラでMR画像を作成しながら、MRI共鳴周波数の超音波を当てることを記載しており、そこでは共鳴周波数は利用可能な超音波周波数範囲に含まれる。超音波場における組織の動きは、MR画像のコントラストに影響する動きアーチファクトを生じる。超音波の吸収が大きいため、超音波が組織まで浸透しない位置では動きアーチファクトが低減されるので、異なる位置におけるMR画像のコントラストの差異は、異なる位置における超音波吸収率に関する情報を得るために使用することができる。
【0025】
Sanghviらの米国特許出願公開第2010/0092424号明細書は、細胞物質を放出させるために高強度の集束超音波を腫瘍に当て、かつ放出された物質を検査して、それがどのような種類の腫瘍であるかを決定することを記載している。
【0026】
Lanzaらの米国特許第7179449号明細書は、標的に結合される超音波造影剤を使用することを記載している。造影剤は温度に依存する超音波反射率を有する。温度を変化させることによって、造影剤による超音波の反射を体内の他の構造からの超音波の反射と区別することができる。
【0027】
Von Behrenらの米国特許第6824518号明細書は、時折起きる高出力パルスを正常な撮像パルスの間にインタリーブして画像品質を改善する超音波撮像トランスデューサを記載している。このトランスデューサを使用する間、組織の損傷を回避するために温度を監視する。
【0028】
Casscellsらの米国特許第5935075号明細書は、破裂する可能性の高い動脈のプラークを、そのようなプラークが生じる余分の熱によって検出する、任意選択的に超音波画像システムと結合されたカテーテル内、IR光ファイバシステム内で赤外線センサを使用することを記載している。該方法は、周囲の組織より冷温の異常組織または異物をも検出することができる。Casscellsらは、血管内の血流を測定するための赤外線センサ付きカテーテルを記載するそれ以前の米国特許第4986671号明細書を引用している。米国特許第4621929号明細書では、赤外線放射は光ファイバに沿って赤外線センサを加熱するように向けられ、その後のその冷却速度を用いて血流を測定する。
【0029】
Kaczkowskiらの米国特許出願公開第2007/0106157号明細書は、超音波を使用してまたは任意の他の熱源を使用して加熱された組織の温度を、後方散乱超音波を利用して、時間の関数としてマッピングすることを記載している。高密度の脈管構造の領域では異方性となり得る熱拡散率K、および位置の関数としての熱源Qを計算し、温熱治療を計画するためにそれらを使用する。温熱治療中、比吸収量の変化または介入経路減衰の変化のためQが変化したかどうかを調べるために、監視が実時間で行なわれ、変化した場合、補償するように加熱力を実時間で変化させることができる。灌流も非侵襲的に測定して、温熱治療を監視するときに考慮に入れることができる。これらの方法は、温熱治療のモデル化および監視のために、「一般的組織特性化技術として利用することもできる」。
【0030】
Rosembergらの米国特許第7367944号明細書は、温熱治療中に熱に対する生体応答を示すパラメータを監視することを記載し、かつ温熱治療中の熱輸送における灌流の役割を論じている。
【0031】
Fitzsimmonsらの米国特許出願公開第2008/0004528号明細書は、超音波を利用して、標的領域を撮像することによってそれを診断または特徴付けて、それが良性であるか悪性であるかを決定し、かつその大きさ、形状、粘度、および/または密度を決定することを記載している。
【0032】
Baumgardnerら(CoolTouch,Inc.)の欧州特許出願公開第1030611号明細書は、超音波を含めてエネルギ送達装置と共に使用されるフラッシングおよび/または冷却を利用する診断および治療の方法および技術を記載している。彼らは、温度を検知し、かつ制御のためにフィードバックループを使用することも記載している。これは、しわを除去するために、表皮を冷却しながら真皮をレーザで加熱するときに行なわれる。
【0033】
Lizziらの米国特許出願公開第2009/0287082号明細書は、超音波撮像を用いて、治療用超音波を当てる間、組織における加熱効果および永続的効果を監視することを記載している。
【発明の概要】
【0034】
本発明の一部の実施形態の態様は、診断用超音波に典型的に使用される比較的低いパワーレベルで超音波を使用して、エネルギ吸収および冷却特性によって体組織の少なくとも1つの特性を決定することに関する。
【0035】
したがって、本発明の例示的実施形態では、体組織を特性化する方法であって、
a)超音波を身体の組織内に透過させて、体組織を3℃未満だけ加熱するステップと、
b)超音波透過中、超音波透過後、または両方で、1つ以上の位置で1回以上、組織の温度を測定するステップと、
c)温度測定を利用して、超音波の吸収の差異、超音波透過後の組織の冷却速度の差異、または両方に基づいて体組織の少なくとも1つの特性を決定するステップと、
を含む方法を提供する。
【0036】
任意選択的に、超音波は、任意の1秒間の時間平均で720mW/cm2未満の空間ピーク・パワー・レベルで体組織に透過される。
【0037】
任意選択的に、体組織の少なくとも1つの特性を決定するステップは、癌組織を見つけ、それを正常な組織と区別することを含む。
【0038】
任意選択的に、該方法はまた、少なくとも1つの小線源治療用シードを癌組織の位置に対応する位置に配置するステップをも含む。
【0039】
任意選択的に、癌組織は、超音波による加熱速度が大きいことによって判別される。
【0040】
加えて、または代替的に、癌組織は、超音波の透過後の急速な冷却速度によって判別される。
【0041】
本発明の実施形態では、温度を測定するステップは、身体の外表面における放射赤外線分布を測定することを含む。
【0042】
任意選択的に、超音波を透過させるステップは、2つの異なる時間に、組織における異なる浸透深さを有する2つの異なる周波数で超音波を透過させることを含み、温度を測定するステップは、各々の周波数での加熱による放射赤外線分布を測定することを含み、体組織の少なくとも1つの特性を決定するステップは、組織内への深さに対する特性の依存度を決定することを含む。
【0043】
任意選択的に、組織は乳房組織であり、体組織の特性化は、乳癌の位置を特定することを含む。
【0044】
任意選択的に、温度測定を利用するステップは、画像処理ソフトウェアを用いて測定された赤外線分布を鮮明にすることを含む。
【0045】
本発明の実施形態では、該方法はまた、侵襲性プローブを組織に配置するステップをも含み、温度を測定するステップは、プローブの経路に沿って行なわれる。
【0046】
任意選択的に、侵襲性プローブは、生検針または小線源治療シードを植設するための針を備える。
【0047】
任意選択的に、該方法はまた、癌組織の位置に対応する異なる経路に沿って組織に生検針を配置するステップと、異なる経路に沿って生検針で生検試料を採取するステップとをも含む。
【0048】
任意選択的に、プローブは生検針を備え、温度を測定するステップは、針の内部に位置する可動温度センサによって行なわれ、かつ生検試料のための場所を空けるために、温度を測定した後、温度センサを針から取り出すことをも含む。
【0049】
任意選択的に、該方法はまた、温度を測定した後、前記温度測定から決定された癌組織の位置に応じて選択された位置で生検試料を針で採取するステップをも含む。
【0050】
任意選択的に、温度は、プローブが所定の位置にある間に、またはプローブを移動させながら順次、複数の位置で測定される。
【0051】
任意選択的に、組織は前立腺組織を含む。
【0052】
任意選択的に、組織の温度を測定するステップは、近赤外分光法、マイクロ波放射測定法、超音波温度測定法、磁気共鳴温度測定法、および電気インピーダンス断層撮影法のうちの1つ以上を使用することを含む。
【0053】
本発明の実施形態では、超音波を透過させるステップは、少なくとも0.1秒間連続して行なわれる。
【0054】
任意選択的に、単位面積あたりの入射超音波パワーは、組織の領域全体で2倍以内に均一であり、ここで領域は、超音波パワーの入射方向に対して垂直な少なくとも3cm×3cmの断面を有し、かつ超音波パワーの入射の方向に少なくとも1cmの距離に渡って延在する。
【0055】
さらに、本発明の例示的実施形態では、体組織を特性化するためのシステムであって、
a)任意の1秒間の時間平均で720mW/cm2以下の空間ピークパワーを透過させることに限定された、超音波を体組織内に透過させるための超音波透過システムと、
b)組織内への超音波の透過中および/または透過後に1つ以上の位置で体組織の温度を測定し、それによって組織を特性化するための情報を提供する温度測定システムと、
を備えたシステムを提供する。
【0056】
任意選択的に、温度測定システムは、身体の外表面の温度を測定するための赤外線カメラを備える。
【0057】
任意選択的に、該システムはまた、乳房を圧縮するための圧縮要素をも備え、赤外線カメラは、圧縮された乳房の表面全体の温度のマップを作成するために配置される。
【0058】
任意選択的に、超音波トランスミッタは、拡張領域にわたって圧縮された乳房に超音波を透過させるように配置される。
【0059】
任意選択的に、該システムはまた、生検針または小線源治療シードを植設するための針をも含み、温度測定システムは針に関連付けられた少なくとも1つの温度センサを備える。
【0060】
任意選択的に、少なくとも1つの温度センサは針に沿って配列された複数の温度センサを備える。
【0061】
追加的に、または代替的に、少なくとも1つの温度センサは、針の内部に位置する温度センサを備える。
【0062】
任意選択的に、温度マッピングシステムは1分未満の取得時間内に、0.5℃より高精度、1cmより高い空間分解能で温度を測定することができる。
【0063】
任意選択的に、システムはまた、温度測定を用いて体組織の少なくとも1つの特性を決定する制御装置をも含む。
【0064】
任意選択的に、制御装置は、体組織の特性を決定する際に、超音波透過および温度測定の相対的タイミングを考慮に入れる。
【0065】
別途定義されない限り、本明細書で使用されるすべての技術的用語および/または科学的用語は、本発明が属する技術分野の当業者によって一般に理解されるのと同じ意味を有する。本明細書に記載される方法および材料と類似または同等である方法および材料を本発明の実施または試験において使用することができるが、例示的な方法および/または材料が下記に記載される。矛盾する場合には、定義を含めて、本特許明細書が優先する。加えて、材料、方法および実施例は例示にすぎず、限定であることは意図されない。
【図面の簡単な説明】
【0066】
本明細書では本発明のいくつかの実施形態を単に例示し添付の図面を参照して説明する。特に詳細に図面を参照して、示されている詳細が例示として本発明の実施形態を例示考察することだけを目的としていることを強調するものである。この点について、図面について行う説明によって、本発明の実施形態を実施する方法は当業者には明らかになるであろう。
【0067】
【図1A】本発明の例示的実施形態に係る、前立腺用の超音波生検または小線源治療システムの略図。
【0068】
【図1B】本発明の例示的実施形態に係る、図1Aに示した針の代わりに使用することのできる針の略図。
【0069】
【図2】図1Aのシステムを使用して前立腺の温度がその上で測定されるグリッドの略斜視図。
【0070】
【図3】本発明の例示的実施形態に係る、図1Aのシステムを使用する前立腺の生検手順の流れ図。
【0071】
【図4】本発明の例示的実施形態に係る、図1Aのシステムを使用する前立腺の小線源治療手順のフローチャート。
【0072】
【図5】本発明の例示的実施形態に係る、乳癌を検出するための超音波システムの略図。
【0073】
【図6】図5のシステムを使用して得られる乳房の温度の赤外線マップの略図。
【0074】
【図7】本発明の異なる例示的実施形態に係る、乳癌を検出するための超音波システムの略図。
【0075】
【図8】本発明の例示的実施形態に係る、生検手順中の生検針の時系列の略図。
【0076】
【図9】図8に示した生検針を使用する図8に示した生検手順のフローチャート。
【0077】
【図10】本発明の例示的実施形態に係る、針の壁を組み込んだ内蔵熱電対付きの生検針の略図。
【発明を実施するための形態】
【0078】
本発明は、その一部の実施形態では、超音波への曝露中および/または曝露後にその熱応答によって体組織の少なくとも1つの特性を決定するシステムに関し、さらに詳しくは、そのような方法を用いて癌組織を正常な組織と区別するシステムに関するが、それに限定されない。
【0079】
本発明の一部の実施形態の態様は、診断用超音波に対する米国FDAの限度である720mW/cm2以下の空間ピーク時間平均パワーレベルで組織内に超音波を透過させ、かつ超音波透過中および/または透過後に1つ以上の位置で組織の温度を測定することによって、体組織の少なくとも1つの特性を決定するためのシステムに関する。一部の種類の癌は例えば超音波を正常な組織より多く吸収し、より大きく加熱され、かつ血流の増加のため超音波の透過後に正常な組織より急速に冷却するので、任意選択的に、そのような方法は癌または他の疾病状態を正常な組織と区別するために使用される。他の種類の癌または他の病変組織は超音波の吸収が正常な組織より少なく、温度があまり上がらない。該方法はまた、所与の位置における組織の種類を決定するためにも使用することができる。
【0080】
任意選択的に、温度は、赤外線カメラまたはスキャナを用いて、身体の外側で測定される。これは、例えば乳癌を検出するのに、特に癌が表面に近づくように乳房を圧縮する場合に、特に有用である。任意選択的に、身体の表面の赤外線画像は、表面の下に存在する乳癌のようなある種の組織をよりよく検出しかつ位置特定するために、画像処理ソフトウェアを用いて鮮明化される。
【0081】
本発明の例示的実施形態では、組織の温度は、組織を貫通する侵襲性プローブ、例えば前立腺における生検針または小線源治療針で、プローブに沿って配列された温度センサのアレイ、または任意選択的にプローブを移動させながら異なる位置で順次温度を測定するプローブの端部付近の単一のセンサを用いて、内側で測定される。任意選択的に、温度測定は、生検試料を採取する位置を選択する際に、または小線源治療用シードを植設する位置を選択する際に使用される。
【0082】
任意選択的に、超音波は、組織の温度を3℃以下だけ上昇させる。任意選択的に、超音波は連続的に、あるいは中断なく少なくとも0.1秒間にわたって透過される。
【0083】
任意選択的に、超音波パワーは、検査される組織の領域の大部分で比較的均一に分布するので、加熱の差異は、ほとんどまたは略完全に不均一な加熱パワー分布に起因するのではなく、実質的に組織における吸収率の差異に起因する。例えば、入射超音波パワーは組織領域全体で2倍未満だけ、または30%未満、または20%未満、または10%未満だけ変動する。任意選択的に、パワーの入射に対して垂直な面内で、組織領域は断面が少なくとも3cm×3cm、または少なくとも5cm×5cm、または少なくとも10cm×10cmであり、かつパワーの入射方向に少なくとも1cm、または少なくとも2cm、または少なくとも5cm、または少なくとも10cmの距離にわたって延在する。
【0084】
本発明の少なくとも1つの実施形態を詳細に説明する前に、本発明は、その適用において、下記の説明に示される細部、または、実施例によって例示される細部に必ずしも限定されないことを理解しなければならない。本発明は他の実施形態が可能であり、あるいは、様々な方法で実施、または、実行される。
【0085】
生検システム
ここで図面を参照すると、図1Aは本発明の例示的実施形態に係る前立腺生検システム100を概略的に示す。システム100は、生検針108を生検対象器官内に前進させるときに生検銃106を誘導するために、超音波トランスデューサ104、例えば前立腺生検の場合には経直腸超音波トランスデューサを、あるいはそのようなトランスデューサのアレイを用いて、身体の器官、例えば前立腺102の超音波画像を実時間で作成する。任意選択的に、トランスデューサ104はまた、器官および身体の他の部分によって散乱した超音波をも受信して、超音波画像を提供する。代替的に、または追加的に、1つ以上の他の超音波トランスデューサが撮像用の受信器として働く。
【0086】
生検システムについてここでは前立腺に関連して記載するが、そのようなシステムは身体の他の部分にも使用することができる。システム100で、超音波トランスデューサ104は、たとえ撮像のために多くのパワーが必要でない場合でも、超音波パワーの一部の吸収のため、組織の温度が測定可能な程度に上昇するように、充分なパワーを前立腺102に透過させる。正常および病的な胸部および肝臓の組織における異なる超音波減衰率および減衰の周波数依存性を明らかにした前掲の論文によって示唆される通り、前立腺の悪性腫瘍は周囲の正常な組織とは異なる速度で熱を吸収して、正常な組織より急速に、またはより緩徐に昇温する傾向がある。
【0087】
トランスデューサ104は、例えば720mW/cm2よりわずかに低い、例えば700mW/cm2、または500mW/cm2、または400mW/cm2、または300mW/cm2、または200mW/cm2、または中間値、または200mW/cm2未満の空間ピーク時間平均パワーで超音波を透過させる。パワーは任意選択的に、例えば形状が少なくとも略方形で、6cm幅、または5cm幅、または4cm幅、または3cm幅、またはより大きいか、小さいか、中間値のトランスデューサヘッドの寸法全体にかなり均一に分布する。任意選択的に、トランスデューサは、前立腺の撮像または治療に使用される直腸超音波プローブ用の標準サイズである。発明者によるインビトロ検査は、1MHzの周波数で幅5cmの方形全体に均一に分布する700mW/cm2の超音波パワーを用いて、死組織を2分ないし4分で3℃ないし6℃だけ加熱することができることを明らかにした。このパワーレベルおよび周波数で生体組織における温度上昇は、身体の熱調節メカニズムのため、より低くなることが予想される。
【0088】
任意選択的に、超音波パワーは前立腺の大部分にわたって比較的均一に分布されるので、加熱の差異は、略完全に不均一な超音波パワー分布に起因するのではなく、実質的に組織の吸収率の差異によるものである。加えて、組織が前立腺の寸法に匹敵する距離にわたって入射超音波パワーの有意の部分を吸収し、かつ特定の悪性腫瘍が正常な組織より多くの超音波を吸収する場合には、これらの悪性腫瘍は、より大きい温度勾配を有することによって、正常な組織と区別することができる。周囲の組織より多くの超音波を吸収する腫瘍の「陰」に隠れている前立腺の部分は、より低温になる傾向があるので、これが起きることを予想することができる。逆に、悪性腫瘍が正常な組織より少ない超音波を吸収する種類であった場合には、近傍の正常な組織より低い温度勾配を持つことができる。
【0089】
1つ以上の温度センサ110、例えば熱電対が針108上に位置し、針108の経路に沿って前立腺の温度を測定する。本発明の一部の実施形態では、図1Aに示す通り、針108の長さに沿って配列された複数の温度センサ110は、針が前立腺に適切に配置されたときに、同時に温度を測定する。本発明の一部の実施形態では、例えば針108の先端に1つだけの温度センサが存在し、針を引き出しながら、針の経路に沿った様々な位置の温度が順次測定される。たとえ2つ以上の温度センサが存在する場合でも、任意選択的に1つ以上の中間位置の温度は、針が多少引き出されるときに測定される。針が引き出されるときに温度が測定される場合、温度センサがその周囲と平衡化しかつ温度を正確に測定することができるように、針は任意選択的に、充分にゆっくりと、あるいは特定の位置で充分に長く休止しながら引き出される。代替的に、針はより急速に引き出されるが、温度センサの有限平衡時間は、結果の解析に考慮される。温度センサの平衡時間は任意選択的に、インビトロで実験的に決定されるか、あるいは比熱および熱伝導率を含むモデルを用いて計算される。
【0090】
本発明の一部の実施形態では、少なくとも1つの温度センサは、任意選択的に熱電対の金属の1つとして針の壁を組み込み針に内蔵された熱電対を含む。本発明のこれらの実施形態の一部については、後で図10の説明でさらに詳述する。
【0091】
本発明の一部の実施形態では、1つ以上の温度センサが、生検針に位置する代わりにまたはそれに加えて、超音波トランスミッタにまたはそれに隣接して位置し、これらのセンサは、前立腺の外表面に隣接する1つ以上の位置で、例えば直腸壁で、温度を測定する。そのような温度センサは、特に、前立腺の表面付近に、直腸壁に隣接して位置する腫瘍に関する情報を提供することができる。
【0092】
任意選択的に、温度センサ110は、2分未満、または1分未満、または30秒未満、または10秒未満、または3秒未満、または1秒未満、または0.3秒未満、または0.1秒未満の取得時間で、1℃、または0.5℃、または0.2℃、または0.1℃、または0.05℃、または0.02℃の精度内に正確に温度を測定することができる。任意選択的に、各温度測定は、1センチメートル、または5mm、または2mm、または1mm以内に位置特定される。任意選択的に、測定は、少なくとも針の経路の方向に、またはそのような間隔で離間配置された針を用いることによって温度が測定される前立腺の体積内の全方向に、1cm未満、または5mm未満、または2mm未満の空間的間隔で行なわれる。
【0093】
データインタフェース112は温度センサ110からの信号を受信し、任意選択的に、温度データの何らかの予備処理を行ない、例えば信号をアナログからデジタル形に変換し、制御装置114、例えばパーソナルコンピュータ、または専用電子回路にデータを渡す。超音波トランスデューサ104は、任意選択的にパワーをトランスデューサに提供しかつ任意選択的に超音波撮像データの予備処理を行なうインタフェース116に接続される。代替的に、超音波撮像のためのパワーおよび予備処理は、異なるモジュールによって提供される。超音波撮像に関するデータは任意選択的に、ディスプレイ用の画像を生成するために制御装置114または異なる制御装置に渡される。画像は、生検を実行する医師を案内するために、モニタ118または別のディスプレイ装置に表示される。任意選択的に、モニタ118または別のディスプレイ装置は、下述するように、前立腺の温度マップを表示するためにも使用される。
【0094】
図1Bは、任意選択的に図1Aの針108の代わりに使用される設計の中空針120を概略的に示す。針120は、外側に取り付けられた1つ以上の温度センサ110を有する代わりに、またはそれに加えて、その内側に存在するかまたは針の壁に内蔵された1つ以上の温度センサ122を有し、かつ針の側部に沿って、かつ/またはその端部に配設された1つ以上の温度測定位置124を有する。任意選択的に、温度測定位置の1つ以上は開放窓であるか、あるいは赤外線を透過する閉鎖窓であり、温度センサは窓を介して体組織を観察し、かつ例えば赤外線によって組織の温度を測定し、あるいは温度センサは窓を介して直接体組織に接触し、その温度を直接測定する。窓は例えば針の直径の10%から30%の間、または30%から50%の間、または50%超、または針の直径の10%未満の幅を有する。任意選択的に、窓の縁部は、組織を損傷しないように、少なくとも針の外面では平滑である。任意選択的に、針に窓を有する代わりに、またはそれに加えて、針の温度測定位置の1つ以上が熱伝導率の高い中実な領域であり、針の周囲構造は任意選択的に、熱伝導率の低い材料から作られる。温度センサは、そこからの赤外線放射を測定することによって、または直接接触温度測定によって、これらの高熱伝導率領域の各々の温度を測定し、したがって針の外側の高熱伝導率領域と接触する体組織の温度の指標を提供する。本発明の一部の実施形態では、温度センサは、各温度測定位置に1つずつ、所定の位置に固定される。本発明の他の実施形態では、温度センサは移動可能であり、針から引き出すことができる。例えば、1つ以上の温度センサが、生検試料を採取するために使用される針のチャネル内に位置し、任意選択的に、生検試料を採取するために使用される窓を介して温度を検知し、生検試料のための場所を空けるために、生検試料を採取する前にチャネルから引き出される。温度センサが移動可能である場合には、任意選択的に針が挿入された後、任意選択的に1つの温度測定位置から次の温度測定位置に移動して、各位置で順次温度を測定する1つだけの温度センサが存在する。任意選択的に、温度センサが移動可能である場合、針が前立腺内に挿入されるまで、温度センサは針内に挿入されない。
【0095】
本発明の一部の実施形態では、針120は最初に前立腺内に、前立腺全体に、または前立腺中の距離のかなりの部分に、または生検対象の前立腺の部分、例えば癌が隠れている可能性が最も高いと考えられる部分を網羅するのに充分な深さまで挿入される。任意選択的に、針120は、典型的には5から12cmの長さの前立腺の最長寸法に沿って向けられるように、会陰内手順を用いて挿入される。この初期挿入時に生検試料は採取されないが、温度プロファイルは、針120を使用するための上記の方法のいずれかを用いて超音波加熱後に、針の長さに沿って測定される。任意選択的に、この温度プロファイルは、針が最後まで挿入された後で測定される。代替的に、温度プロファイルは、針が挿入されるにつれて、任意選択的に、正確な測定のための時間を見越して各位置で休止しながら、異なる位置で順次測定される。針は細いので、たとえそれが熱良導体から作られている場合でも、それが温度プロファイル自体に重大な影響を及ぼすとは考えられず、そのような影響は、針に比較的低い熱導体を使用することによって軽減することができる。前立腺の最長寸法に沿って針を挿入することにより、針が前立腺の短い寸法に沿って挿入された場合より多数の独立位置で温度プロファイルを測定することが可能になり、かつ、より少数の針挿入で前立腺の大部分を網羅する温度マップを作成することが可能になる。
【0096】
ひとたび温度プロファイルが分かると、温度プロファイルおよび任意選択的に他のデータにも基づいて、癌が位置する可能性が最も高い針の長さに沿った温度測定位置124に関して、決定を下すことができる。単数または複数の温度センサが任意選択的に針から引き出され、癌が位置する可能性が最も高いと決定された温度測定位置の1つ以上から生検試料が採取される。温度測定位置が開放窓である場合には、任意選択的に、その温度測定位置で窓を介して生検試料が採取される。本発明の一部の実施形態では、温度測定位置は良好な熱伝導率を持つ閉鎖領域であるが、それらを介して生検試料を採取するために、例えば開口を露出すべく針の内側または外側のシースを回転することによって開放することができる。本発明の例示的実施形態に従って、温度をどのように測定し、かつ生検試料を採取するかについてのさらなる詳細は、後で図8および9の説明で提供する。
【0097】
温度測定
先行技術および本発明の一部の実施形態では、癌と正常な組織を事前に区別することが一般的に不可能なので、前立腺生検は任意選択的に前立腺全体に分布する複数の位置から採取される。図2は前立腺102の表面における12の標的点202のアレイを示し、各標的点は小さい円で示される。各標的点202に対し、生検針は経路204に沿って標的点を通して挿入される。温度測定は、上述した方法の1つを使用して、図2に一連の黒い点として示す各経路204に沿った複数の位置の各々で行なわれる。温度が測定される点の全てが、任意選択的に前立腺102の体積の大部分を網羅するグリッドを構成する。図2では経路は互いに略平行であるように概略的に示されているが、経路が略平行である必要はない。一般的に、経路の位置および向きは、直腸生検プローブを介する前立腺への制限されたアクセスによって拘束される。
【0098】
図3は、生検システム100を使用するための流れ図300を示す。302で、超音波が前立腺に透過される。任意選択的に、透過された超音波は、先行技術の前立腺生検システムで行なわれているように、生検を誘導するために前立腺を撮像するために使用される超音波だけである。そのような超音波は通常、典型的に200から5000パルス/秒の間のパルスレートで、一連のパルスとして透過される。任意選択的に、この目的のために、既存の既製前立腺生検超音波システムは、一部の実施形態では、前立腺を充分に加熱して温度変化を測定するために、撮像用に通常必要とされるより高いパワーで使用される。代替的に、撮像用に使用される超音波パルスに加えて、前立腺を充分に加熱するために、超音波の追加成分が、任意選択的にパルス化されずに、またはずっと低いパルスレートで、例えば100パルス/秒未満、または50パルス/秒未満、20パルス/秒未満、または10パルス/秒未満でパルス化されて透過される。超音波の追加成分の各パルス、またはパルス化されない場合には透過全体が、少なくとも0.01秒、または少なくとも0.02秒、または少なくとも0.05秒、または少なくとも0.1秒、または少なくとも0.2秒持続する。追加成分がパルス化される場合、少なくとも1%、または少なくとも2%、または少なくとも5%、または少なくとも10%、または少なくとも20%のデューティサイクルを有する。
【0099】
追加加熱成分は、撮像に使用される超音波と同一の周波数または同一の周波数範囲を有することができるが、そうする必要はない。特に、より高い分解能の画像を得るために、高い周波数の超音波、例えば7ないし10MHzを撮像用に使用すると共に、均一かつ深部の加熱を得るため、かつ/または組織の種類に対する加熱速度の感応性を高めるために、低い周波数の超音波を加熱用に使用することが有利である。発明者はインビトロ試験を実施し、1MHzの超音波の吸収率が異なる組織間を、特にニワトリの肝臓とウシの肝臓とを、3MHzの超音波の吸収率よりよく区別することを示した。
【0100】
300kHzもしくは500kHzもの低い超音波の周波数、または300kHzから1MHzの間、もしくは1MHzから3MHzの間の周波数も加熱に使用することができる。本発明の一部の実施形態では、特に超音波が組織内の奥深くまで浸透する必要がない場合、例えば3MHzから5MHzの間、または5MHzから15MHzの間の高い周波数の超音波が加熱に使用される。高い周波数の超音波を使用すると、所与の加熱パワーで組織のキャビテーションを引き起こす可能性が低下するという潜在的利点を持つことができる。
【0101】
本発明の一部の実施形態では、生検を誘導するために、磁気共鳴断層撮影または電気インピーダンス撮像のような異なる撮像モダリティが使用され、超音波は前立腺を加熱して温度変化を測定するためにだけ使用される。本発明の一部の実施形態では、生検を誘導するために超音波撮像が使用される場合でも、生検を実施する前に最初に前立腺に透過される超音波は、前立腺を加熱するためにだけ使用され、かつ任意選択的にパルス化されず、あるいは撮像に使用される超音波よりずっと低いパルスレートでパルス化される。しかし、例えば撮像用に設計された市販の超音波システムによって加熱が行なわれる場合、加熱に使用される超音波は高速パルス化される。
【0102】
本発明の一部の実施形態では、超音波は当初、生検を誘導するために撮像用にのみ使用され、生検針が超音波撮像によって誘導されない場合には、超音波は当初全く透過されない。生検針が挿入され、かつ1つ以上の温度測定が行なわれて、加熱がほとんどまたは全く行なわれない状態でベースラインが提供された後でなければ、前立腺を加熱するために実質的な超音波パワーは透過されない。そのようなベースライン測定は、様々な位置における組織の絶対的および相対的加熱度のより正確な評価を可能にし、かつ超音波加熱とは無関係に存在する腫瘍と正常な組織との間の温度差、例えば異なる代謝率による差異または健康な組織および腫瘍における血液循環の差異を明らかにすることもできる。
【0103】
任意選択的に、超音波トランスデューサは、身体の様々な部分の診断用超音波に対して米国食品医薬品局によって課せられた限度である720mW/cm2以下、または430mW/cm2以下の単位面積あたりの全超音波パワー、ピーク空間時間平均パワーを前立腺に透過することに制限される。任意選択的に、ピーク空間時間平均パワーは94mW/cm2未満、または17mW/cm2未満である。任意選択的に、これらのパワー限度は、少なくとも10秒間、または少なくとも1秒間、または少なくとも0.1秒間のいずれかの時間平均に適用される。任意選択的に、ピーク空間パルス平均パワーは190W/cm2未満、または28W/cm2未満である。任意選択的に、超音波トランスデューサは、ハードウェアによって、例えばこのパワー限度に達するとトランスデューサを停止させる保護回路によって、これらのパワー限度、または中間的、またはより厳しいパワー限界の少なくとも1つを超えることが防止される。代替的に、または追加的に、例えば制御装置114内のソフトウェアが、パワー限度を超えることを防止する。本発明の一部の実施形態では、システムは物理的により高いパワーで実行することができるが、パワーを制限する制御ノブまたはユーザが制御装置114に入力することのできる入力パラメータが設けられ、例えばFDA要件を満たすために、これらのパワー限度の1つが選択されるか、あるいはユーザに推奨される。
【0104】
任意選択的に、前立腺に超音波が透過される結果、前立腺の温度上昇が1℃、2℃、3℃、または4℃を超えることはなく、あるいは前立腺が38℃、39℃、40℃、または41℃を超えることはない。
【0105】
任意選択的に、超音波による加熱と、血液循環ならびに周囲の組織への熱伝導および他の熱輸送による冷却とが均衡して、前立腺が熱平衡に達するように充分長い時間にわたって、超音波が前立腺を加熱するまで、生検は実行されない。例えば、加熱は1分超、または3分超、または5分超にわたって続行される。熱平衡に達するまで待つことの潜在的な利点は、生検中に測定された温度プロファイルが、生検の実行前に正確にどれだけ長く加熱が続けられたかに対し感応せず、かつ異なる生検針によって異なる時間に測定された温度を有意義に比較することができることである。代替的に、生検は、熱平衡に達する前に、または必ずしも熱平衡に達するまで待たずに実行され、温度測定を評価し、かつ異なる時間に行なわれた異なる生検針による測定を比較するときに、任意選択的に熱モデリングが使用される。
【0106】
304で、生検針が発射され、または他の方法で前立腺内に前進される。306で、針上の1つ以上の温度センサによって温度が記録される。任意選択的に、図1に対し記載した通り、針に沿って配設された複数の温度センサが存在し、針に沿って異なる位置で異なるセンサによって温度は同時に測定される。代替的にまたは追加的に、温度は、針が前立腺から引き出されるときに、または針が部分的に引き出された後で再挿入されるときに、針の経路に沿って異なる位置で、各温度センサによって、または単一の温度センサによって順次測定される。任意選択的に、正確な測定を行なうことができるように、針は充分に緩徐に移動し、かつ/または温度が測定されるたびに針の移動は休止される。任意選択的に、針が前立腺内に発射された後、針を配置する際の誘導のための超音波撮像がもはや不要になっても、測定中に、かつこの針による測定から次の針による測定までの間、熱平衡状態で温度が各位置で一定値を維持するように、超音波パワーは透過され続ける。代替的に、針が配置された後、超音波パワーは低減され、あるいは完全に停止され、異なる時間に採取された温度データを解析するときに、熱モデリングが任意選択的に使用される。
【0107】
本発明の一部の実施形態では、生検針を用いて温度を測定する代わりに、必ずしも中空ではなく、かつ必ずしも前立腺内に速射されない別の針が前立腺内に挿入され、温度を測定するために使用される。代替的にまたは追加的に、温度は、直腸壁に隣接して前立腺の外にあるセンサによって測定される。1つ以上の生検試料は後で、前立腺の温度がマッピングされた後に、採取される。任意選択的に、試料が採取されるときに、温度も生検針によって測定される。任意選択的に、温度データによって示される腫瘍の位置に応じて、生検試料は制限された数の経路からだけ採取される。
【0108】
任意選択的に、308で、温度は、超音波パワーを低減または停止した後で、針の経路に沿って1つ以上の位置で再び測定される。306と同様に、針の長さに沿って位置する複数の温度センサを使用することができ、あるいは任意選択的に針の端部に位置する単一の温度センサを使用することができ、温度は異なる位置で同時に、かつ/または針を引き出しながら順次、測定することができる。306で温度測定を行ないながら針が引き出される場合、任意選択的に、針は完全には引き出されず、先端が前立腺内に維持され、308で温度測定を再び実行するために、任意選択的に針は同じ経路に沿って前立腺内に押し戻される。超音波パワーを停止または低減した状態で第2組の温度測定を行なうことにより、前立腺における異なる位置の冷却速度の尺度がもたらされる。加熱速度と同様に、冷却速度もまた、例えば悪性腫瘍における血液循環の増加のため、癌組織と正常な組織との間で異なる。温度が数℃上昇した正常な組織の典型的な特性冷却時間は、数分である。任意選択的に、追加の測定が同じ針で1つ以上のしばらく後の時間に、例えば30秒後に、または1分後に、または2分後に、温度がさらに低下したときに、冷却速度に関する追加情報を提供するために行なわれる。その針による温度測定が全部完了したときに、針は完全に引き出され、生検試料は任意選択的に、前立腺生検の通常の手順に従って保存される。
【0109】
本発明の一部の実施形態では、特に、生検針を挿入する前に前立腺が著しく加熱されない実施形態では、308で温度を測定する前に超音波パワーを、停止または低減させる代わりに、作動または増大させることができる。306で行なわれた温度測定は次いで、実質的な加熱の前にベースライン温度をもたらし、かつ308の温度測定は、超音波の吸収による温度上昇の尺度をもたらす。任意選択的に、超音波パワーは次いで停止または低減され、1つ以上の追加的時間後に冷却速度を測定するために温度測定が行なわれる。
【0110】
本発明の一部の実施形態では、温度測定は最初に、第1周波数の超音波による前立腺の加熱中または加熱後に行なわれる。前立腺は次いで第2周波数の超音波により加熱され、第2組の温度測定が行なわれる。前立腺が第1周波数での加熱から完全に冷却する時間がない場合、第1加熱からの残熱が任意選択的に、第2組の温度測定の解析に考慮される。2つの異なる超音波周波数による加熱効果を測定することにより、例えば腫瘍を識別するための追加情報をもたらすことができる。
【0111】
310で、所望の生検試料が全部はまだ採取されていない場合、流れ図は302に戻り、超音波は任意選択的に、前立腺を加熱するように、かつ/または次の生検針のために超音波撮像の誘導をもたらすように透過される。本発明の一部の実施形態では、前立腺は、第1針で温度測定が行なわれる前に、しかし後続針の1つ以上を使用する直前ではなく、実質的に加熱され、これらの針により行なわれる温度測定は、以前の超音波吸収からの前立腺に残っている残熱に依存する。
【0112】
任意選択的に、データを解析してエネルギ吸収および冷却速度の両方のマップを提供するときに、異なる針に対して加熱以来の異なる経過時間が考慮される。任意選択的に、第1組の針は、加熱中または加熱のすぐ後に、前立腺の体積全体に広く分散して使用される。任意選択的に第1組とインタリーブされかつ前立腺の体積全体に同じく広く分散された第2組の針は、加熱後に、第1組の後かなりの熱輸送が行なわれるのに充分長い時間後に使用される。各組の針からの温度データを補間することにより、前立腺全体の温度マップを2つの異なる時間に計算することが可能になる。
【0113】
典型的に、生検針は、現行の慣習で前立腺生検中に、前立腺の体積の多くを網羅する約12の位置で使用される。本発明の一部の実施形態では、生検針は、任意選択的に前立腺の多くを網羅するように間隔を置いて12未満の位置で使用され、生検針は、下述するように温度データによって示された場合にのみ、追加位置で使用される。
【0114】
温度データの解析
所望の生検試料が全部採取されると、次いで312で、温度データが解析され、腫瘍の可能性がある位置を識別および/または推定するために使用される。そのような腫瘍は、図2に示すような三次元データグリッドに例えば温度の極大または極小として現われる。任意選択的に、異なる針の経路間の中心にある腫瘍の位置を推定するために、離散グリッド点の温度データは補間される。隣接する針の経路間の距離より小さい直径の腫瘍に対しても、かつ腫瘍全体が針の経路の間に位置する場合でも、熱は血液循環によって、かつ/または熱伝導によって腫瘍から、または腫瘍へ輸送され、あるいは他の方法で輸送されるので、各腫瘍の周りの領域は正常な組織の残部より高温または低温になるため、これを行なうことが可能である。
【0115】
任意選択的に、腫瘍を識別または位置特定する際に、超音波によって得られた他のデータが温度データと共に使用される。例えば、ドップラ超音波データを使用することができ、あるいは超音波撮像データを使用することができる。
【0116】
314で、すでに使用された針の経路の間に位置するように思われる1つ以上の腫瘍の生検試料を得るために、312で行なわれた温度データの解析に基づいて、追加の生検針を使用すべきか否かの決定が下される。そのような追加の生検針は、他の生検針で採取し損ねた腫瘍から組織試料をおそらく得ることに加えて、任意選択的にそれらの経路に沿って温度を測定するためにも使用され、かつそのような腫瘍の存在を確認または否定することができ、かつ腫瘍が存在する場合はそれらの位置をより正確に測定することができる。1つ以上の追加生検針を使用することが決定された場合には、それらの経路の位置および角度または向きが、既存の温度データに基づいて選択され、流れ図は302に戻る。追加の生検針によって測定された温度データは、腫瘍の位置のより正確な推定を導くことができ、次いでさらなる生検針を使用して、それらから試料を得ることができる。それ以上の生検針が使用されない場合、手順は316で終了する。
【0117】
任意選択的に、温度データは、生検試料を検査するときに、例えば試料の特定の部分の特別な精密検査を指示するため、かつ/または見つかった癌の発達のステージを特性化するための追加情報をもたらすために、病理医によって使用される。
【0118】
小線源治療システムおよび手順
図4は、放射性シードを前立腺の選択された位置に配置することによって、前立腺癌を治療するための小線源治療手順の流れ図400を示す。小線源治療手順は任意選択的に、図1に示すことのできる小線源治療システムを用いて、ただし生検針108を小線源治療針に置き換え、かつ生検銃106を、小線源治療針を保持かつ挿入するための適切な装置に置き換えて、実行される。超音波トランスデューサ104および温度センサ110を含めて、図1の他の要素は、生検システムの場合と同様に、小線源治療システムにも使用することができる。図2の針経路204、および温度測定が行なわれるグリッド点は、生検システムと同様に、小線源治療システムにも関係することができる。
【0119】
402で、超音波は前立腺内に透過される。図3の流れ図300の場合と同様に、超音波は任意選択的に、小線源治療シードの配置を誘導するために使用される撮像用超音波だけであり、あるいは特に前立腺を加熱して温度分布を測定するための成分を含むことができる。一般的に、図3に対して記載した超音波の透過のための種々の選択肢が図4にも当てはまる。
【0120】
404で、1つ以上の小線源治療シードを含む針が、前立腺の表面の計画挿入点で、例えば図2における点202の1つで、前立腺内に挿入される。任意選択的に、針挿入点は、前立腺の体積の多くを網羅するように、かつ比較的均等な間隔で配置されるように選択される。これは、前立腺腫瘍がどこに位置しているか一般的に不明であるので、前立腺内およびその付近の健康な組織を必要以上に害しないように試みながら、前立腺のどこにでもある腫瘍を破壊するために、小線源治療シードが前立腺の体積全体に比較的均等に配置されるように、前立腺の小線源治療で典型的に行なわれる。代替的に、腫瘍の位置は、図3に対して上述したように、例えば以前に行なわれた生検中に測定された温度データを用いて推定され、小線源治療針の挿入点は、腫瘍の予想位置の近くにだけ植設することができるように、あるいはより多くのシードまたは放射性の高いシードが腫瘍の予想位置の近くに集中して、腫瘍に前立腺の残部より高い放射線量をもたらすように、選択される。
【0121】
406で、温度は任意選択的に針の経路に沿って測定される。これは、例えば針に沿って配設された温度センサのアレイを、任意選択的に同時に使用して行なわれる。代替的に、温度は、針が挿入されていくときに、または引き出されていくときに、任意選択的に例えば針の先端付近に位置する単一の温度センサによって、針に沿った異なる位置で順次測定される。308に対して記載したように温度が低下していくときに温度を測定するための選択肢を含めて、図3に対して記載した温度を測定するための選択肢のいずれも使用することができる。小線源治療針は、生検針とは異なり、一般的に銃で前立腺内に発射されないので、温度は任意選択的に、針が最初に挿入されていくときに測定される。本発明の一部の実施形態では、温度は小線源治療針によって全く測定されず、例えば図3に対して記載した生検システムを使用して予め得られた温度プロファイルが、小線源治療針の経路に沿った温度プロファイルの近似値として使用される。
【0122】
408で、小線源治療針の経路に沿った位置が、温度測定から導出された腫瘍の位置に関する情報を用いて、放射性小線源治療シードを配置するために選択される。より多くの超音波パワーが健康な組織より悪性腫瘍によって吸収されることが予想されるので、例えば、シードは主に、針の経路に沿った位置で温度が極大を有する場所もしくは温度が通常より高い場所またはその付近のみに植設される。シードをこれらの位置に限定または集中させることは、シードがより均等に分布された場合より、シードが癌細胞を殺すのに効果的になり、かつ/または健康な組織に対する害が少なくなるという潜在的な利点を有する。
【0123】
任意選択的に、シードを配置するためにすでに通過した位置に針を戻すことが要求されても、シードを配置する前に、温度プロファイルが針の経路全体にわたって測定される。代替的に、局所温度のみ、または針がすでに測定した温度のみに依存するアルゴリズムに従ってシードの位置を決定して、シードは針が最初に挿入されるときに配置される。代替的に、シードを配置するための位置は、完全な温度プロファイルに基づいて決定されるが、小線源治療針がまだ通過していないか、あるいはまだ測定されていない経路の部分については、予め取得した温度測定が使用される。
【0124】
410で、計画された針挿入点が全部使用されたか否かが決定され、使用されていない場合、流れ図は402および404に戻り、小線源治療針が次の針挿入点に挿入される。任意選択的に、任意の針挿入点に対し、以前の針挿入点で小線源治療針から得られた温度データが408で、その挿入点に対し放射性シードを植設する場所を決定するときに使用される。
【0125】
全ての計画挿入点が使用されると、412で全ての挿入点からの温度データが解析され、任意選択的に、例えば図3に記載された生検手順から予め得られた温度データが、解析にも使用される。任意選択的に、図3に対して記載したように前立腺における悪性腫瘍の位置の推定を含むこの解析の結果を使用して、414で、小線源治療手順に追加の針挿入点を使用するか否かの決定が下される。例えば、温度データの解析が、2つの隣接する挿入点に対する小線源治療針の経路間の中心に腫瘍が存在することを示唆する場合、任意選択的に、1つ以上の放射性シードをその腫瘍の中心に近づけて配置するために、追加の挿入点が使用される。追加の挿入点が使用される場合、流れ図は新しい挿入点のために402および404に戻る。任意選択的に、1つ以上の追加シードを配置する前に腫瘍の中心をより正確に位置特定するために、追加の温度データが新しい挿入点の針の経路に沿って測定される。使用すべきそれ以上の追加挿入点が存在しない場合、小線源治療手順は416で終了する。
【0126】
乳房超音波システム
図5は、癌組織および健康な組織の超音波に対する異なる熱応答、および/またはそれらの異なる冷却速度を利用して、乳癌を検出および位置特定するためのシステム500を概略的に示す。多少異なる構成を持つ類似のシステム700を図7に示し、以下で説明する。システム500で、乳房502は、例えばプレート504および506の間に配置されることによって圧縮される。プレートを乳房の両側の表面に押し付けて乳房を偏平にするために、緊張要素508、例えば1つ以上のボルトが任意選択的に使用される。任意選択的に、プレート504および506、ならびに緊張装置508は、既存のマンモグラフィまたは乳房生検システム、または乳房温度の赤外線マッピングに使用されるシステムで乳房を保持しかつ偏平にするために使用される装置と同様に構成される。超音波トランスデューサ510は、プレート506の開口を介して、または直接プレート506を介して、超音波を乳房内に透過させ、乳房を加熱する。超音波トランスデューサ510は任意選択的に、乳房の体積のかなりの部分に超音波エネルギの比較的広幅で均一なビームを生成するように構成される。代替的にまたは追加的に、トランスデューサ510は、ビームが比較的狭幅である場合でも、超音波パワーを乳房でより均一に分布させるようにビームをスキャンする。超音波の周波数は、プレート506からプレート504に進む方向に超音波パワー密度が偏平にされた乳房全体でかなり均一になるように、任意選択的に充分に低く、例えば2MHz未満または1MHz未満であり、任意選択的に、500kHzまたは300kHzもの低さである。代替的に、特に乳房の非常に深い位置で癌を検出または位置特定することを希望しない場合に、任意選択的に最高5MHzまで、または最高15MHzさえまでの高い周波数が使用される。超音波トランスデューサの空間ピーク時間平均のパワー密度は、任意選択的に720mW/cm2未満に制限される。図3の説明で前立腺生検システムに対して上述したように、パワー密度の限度はハードウェアによって、ソフトウェアによって、ユーザによる制御パラメータの選択によって、またはこれらの任意の組合せによって課せられる。任意選択的に、前立腺生検に対して上述したパワーの限度のいずれかが、ここでも適用される。任意選択的に、超音波が乳房に透過された結果、乳房の温度上昇が1℃、2℃、3℃、または4℃を超えることはなく、あるいは乳房が38℃、39℃、40℃、または41℃を超えることはない。
【0127】
本発明の一部の実施形態では、超音波トランスデューサ510は、乳房が圧縮される前に、超音波を乳房内に透過させて、組織を加熱する。この場合、トランスデューサ510は超音波をプレート506に、またはプレート506の開口に透過させる必要はなく、任意選択的に、超音波トランスデューサは、プレートが接触していない領域で乳房に直接当接配置され、超音波パワーが加えられた後でだけ、乳房は例えばプレート504および506の間で圧縮される。これは、乳房が圧縮された場合に、圧縮されない場合とは乳房の超音波吸収特性が異なり、かつ非圧縮乳房組織が、例えば健康な組織と癌組織とをより良く区別することができるという潜在的利点を有する。圧縮された乳房でも温度を測定するのではなく、温度を測定する前に乳房を圧縮することは、異なる加熱特性または冷却特性を持つ乳房腫瘍のような、乳房内のより高い(またはより低い)温度の局所領域が表面に近くなり、検出および特性化が容易になるという潜在的利点を有する。組織を多少冷却させて異なる冷却速度を持つ領域を明らかにするために、乳房組織の加熱と温度測定との間に、熱的に有意の時間を経過させた場合、乳房の圧縮は、加熱の直後に、または冷却期間後に温度を測定する直前に、またはそれらの間の任意の時点で、開始することができる。
【0128】
赤外線カメラ512は、任意選択的に少なくとも部分的に赤外線を透過するかあるいは1つ以上の開口を有しそこを通してカメラが赤外線を検出することのできる表面504を介して、乳房の表面を撮像する。赤外線カメラ512は、体温より高い表面温度の小さい変化を測定するのに有用な波長、例えば3ミクロンから12ミクロンの間で作動する。任意選択的に、赤外線カメラ512は、体表面温度を測定するために使用される市販の赤外線カメラ、例えばFLIRブランド、B‐CAM Western‐Sモデル、またはその類似物である。任意選択的に、温度は、1センチメートル未満、または5mm未満、または2mm未満の空間分解能、1分未満、または30秒未満、または10秒未満、または3秒未満、または1秒未満、または0.3秒未満、または0.1秒未満の取得時間で、1℃、または0.5℃、または0.2℃、または0.1℃、または0.05℃の精度内で正確に測定される。腫瘍は、正常な乳房組織より多く超音波を吸収する傾向があるので、超音波による乳房の加熱中および加熱のすぐ後に、赤外線画像に局所的ホットスポットとして現われる。一部の種類の腫瘍は、それらが正常な乳房組織より少なく超音波を吸収する場合、局所的クールスポットとして現われる。腫瘍はまた、局所的血流が正常な組織より大きいため、超音波パワーが除去された後、他の乳房組織より早く熱が冷めることがある。
【0129】
任意選択的に、赤外線画像は、乳房の超音波加熱中および加熱後に、これらの効果の一方または両方によって腫瘍を検出するために、2回以上作成される。任意選択的に、ベースライン温度分布を提供するために、少なくとも1つの赤外線画像が乳房の加熱前にも作成される。そのような測定は、組織を加熱しなくても存在する健康な組織と病変組織との間の温度差を検出することができ、かつそのような温度差を組織の異なる超音波吸収率に関連する温度差と区別することができるという、潜在的な利点を有する。例えば癌組織における血液循環の増大は癌組織を周囲の正常な組織より低温にし、あるいは代謝作用の増大は癌組織を高温にする。これらの効果の両方、および異なる超音波吸収率による差異を測定することにより、病変組織と健康な組織をより確実に区別することが可能になる。超音波加熱中には乳房が圧縮されず、加熱後に赤外線画像が作成されるときにだけ圧縮される場合、任意選択的に、乳房は超音波加熱前に赤外線画像を作成するためにも圧縮され、それは、加熱前および加熱後に作成された画像を比較することが容易になるという潜在的利点を有する。
【0130】
任意選択的に、赤外線画像は、乳房における超音波の分布の不均一性を考慮に入れるように、例えばソフトウェアによって調整される。
【0131】
乳房502はプレート504および506ならびに緊張要素508によって比較的偏平にされるので、乳房の表面の二次元赤外線画像は、適度に高い分解能で腫瘍を明らかにすることができる。典型的には、腫瘍と乳房の表面との間の距離よりずっと小さい直径の腫瘍は、プレート504および506の間の距離を超えることのできない表面の下の腫瘍の深さに匹敵する直径の領域全体で、乳房の表面に局所的温度差を生じることが予想される。その距離が乳房の寸法と比較して比較的小さい場合には、腫瘍の位置を赤外線カメラによってかなりよく特定することができる。図6は、一定表面温度の等温線602を持つ赤外線画像600の実施例を示す。温度の局所ピーク604または温度の極小は、腫瘍の位置を示す。
【0132】
温度は任意選択的に、所与の波長または波長範囲における赤外線放射強度から、かつ/または赤外線スペクトルから、かつ/またはピーク放射赤外線波長から決定される。任意選択的に、温度は計算されず、これらのパラメータの1つ、またはそれらの組合せが温度の代用として、腫瘍の位置特定のために使用される。
【0133】
赤外線画像はまた、乳房の表面下の腫瘍の深さを推定するためにも使用することができる。高い周波数の超音波、例えば3MHz以上を使用する場合、超音波パワーはほとんどが、超音波トランスデューサ510に隣接する乳房の表面近くで吸収される。異なる超音波周波数を用いて作成された赤外線画像を比較することによって、腫瘍の深さを推定することができる。例えばプレート504および506を取り外し、それらの位置を交換し、かつそれらを乳房の周りに再配置することによって、超音波トランスデューサ510が乳房の異なる側に配置された赤外線画像を比較すると、腫瘍が乳房のどちら側により近いかによって、異常な領域の直径が2つの画像で異なるので、腫瘍の深さに関する情報を提供することもできる。さらに、超音波周波数が比較的高い場合には、超音波トランスデューサは、一方の画像で乳房の片側を主に加熱し、かつ他方の画像で乳房の反対側を主に加熱する。
【0134】
腫瘍の深さに関する情報を得るために、単数または複数の赤外線画像を使用するか否かにかかわらず、画像600のような赤外線画像は任意選択的に、乳房生検を誘導するために使用される。生検針は例えば乳房の領域604に挿入される。任意選択的に、図1に示した前立腺生検針による温度測定と同様に、生検針上の1つ以上の温度センサが、乳房の超音波加熱中または加熱後に、乳房の温度を深さの関数として測定するために使用される。乳房の深さの関数として温度プロファイルを知ることにより、腫瘍を三次元で正確に位置特定することが可能になり、次いで腫瘍の生検試料を採取することができる。赤外線カメラ、生検針、または両方からの温度データは任意選択的に、前立腺生検に対して上述したように、生検試料を検査するときに診断を下すのを助けるために、病理医によって使用される。
【0135】
図7は、癌組織および健康な組織の超音波に対する熱応答の差異および/またはそれらの異なる冷却速度も利用して、乳癌を検出しかつ位置特定するための代替的システム700を概略的に示す。システム700では、乳房はプレート間で偏平にされないが、ブラジャ704によって乳房に当接保持された1つ以上の可撓性曲面702によって包囲される。複数の超音波アクチュエータ706、例えば圧電アクチュエータが超音波を乳房内に透過させる。任意選択的に制御装置710、例えばコンピュータによって制御される超音波パワー源708が、アクチュエータ706に電力を供給する。任意選択的に、乳房への超音波パワーの比較的均一な分布をもたらすために、異なるアクチュエータの相対位相が例えば制御装置710によって設定される。任意選択的に、そのような制御は、アクチュエータ706を曲面702上に規則的な配列またはパターン状に配設させることによって、容易化される。任意選択的に、比較的密に配置された比較的多数のアクチュエータ、例えば10、20、50、または100のアクチュエータ、またはより少数、またはより多数、または中間数のアクチュエータが存在する。そのような配設は、大きすぎる局所的パワー密度を使用することなく、例えば720mW/cm2を超えることなく、比較的大きい平均超音波パワー密度を乳房内に透過させることを可能にする。任意選択的に、アクチュエータ706は、曲面702と、曲面702およびブラジャ704によって所定の位置に保持された乳房との間のゲルまたは液体によって、乳房組織に充分に結合される。
【0136】
超音波は、使用されるパワーレベルで乳房組織に測定可能な温度上昇を生じるのに充分長い時間、例えば1分間、2分間、3分間、もしくは5分間、またはより長い時間、より短い時間、もしくは中間的時間だけ乳房に透過される。次いで、乳房の表面上の位置の関数としての温度の測定が、例えば赤外線カメラ712を用いて行なわれる。赤外線カメラ712は、図5の赤外線カメラ512に対して上述した特徴のいずれかを持つことができる。任意選択的に温度測定が行なわれる前に、曲面702およびブラジャ704は開放されるか、あるいは乳房から取り外され、乳房の表面を直接観察することが可能になる。任意選択的に、温度測定は、乳房の異なる部分における、例えば健康な組織および癌組織における異なる加熱速度および/または冷却速度による温度の差異が、乳房内の熱輸送のため非常に大きく低下しないように、超音波の透過が停止した後、充分に短い時間内に、例えば1分、2分、または3分より短い時間内に行なわれる。任意選択的に、温度測定はまた、図5について上述した通り、ベースライン温度分布を提供するために、乳房組織を超音波で加熱する前にも行なわれる。
【0137】
カメラ712によって作成される1つ以上の赤外線画像は任意選択的に、システム500に対して上述した方法のいずれかを用いて、乳房の腫瘍を位置特定するために使用される。任意選択的に、1つ以上の画像がカメラ712によって制御装置710に、または異なるコンピュータに送られ、そこで画像は保存、処理、および/または解析される。
【0138】
任意選択的に、システム500もしくはシステム700のいずれか、または任意の同様のシステムを使用して、例えば画像を鮮明にすることによって画像を処理するために、ソフトウェアが使用される。鮮明化は例えば、焦点が外れた画像を処理するために使用される市販のソフトウェアを用いて行なうことができる。代替的に、どちらも分解能の損失を生じるが、一般的に画像に対し焦点ずれによるぼやけとは異なる効果を有する拡散によってぼやけた画像を復元するように特別に設計および/または最適化されたソフトウェアが使用される。そのような画像処理は、例えば腫瘍の位置が乳房の表面から遠すぎるため、そうしなければ見逃されることのある乳房腫瘍を検出するのに、または検出された腫瘍が乳房のどこに位置するかをより正確に決定するのに役立つことができる。検出された腫瘍が乳房の表面下にどれだけ離れて位置するかをより正確に推定するために、画像処理または画像解析を使用することもできる。任意選択的に、腫瘍が小さいかまたは点状であると想定することによって、1つ以上の乳房腫瘍を乳房内で位置特定するために、乳房の表面の赤外線画像に適用される画像処理ソフトウェアが使用される。
【0139】
乳房が偏平にされないシステム700のようなシステムは、乳房内の比較的深い位置にある腫瘍に対して、システム500のようなシステムより感受性が低いが、乳房腫瘍は往々にして表面に比較的近い位置にあるので、システム700は乳癌のスクリーニングを目的とする場合には依然として充分である。また、スクリーニングを目的とする場合、疑わしい腫瘍の位置を最初から正確に決定することは重要ではない。
【0140】
任意選択的に、システム500またはシステム700のいずれにおいても、カメラ512または712を用いて乳房の表面からの赤外線放射を測定することに加えて、またはその代わりに、異なる非侵襲性温度測定技術が使用される。任意選択的に、乳房組織の温度は、赤外線放射を用いて表面温度を測定し、かつ内部温度を推測するだけではなく、温度の直接ボリュメトリック測定を可能にする方法を用いてマッピングされる。これは、乳房の表面下の深さを含めて、腫瘍を三次元でより正確に位置特定することが可能になるという潜在的利点を有する。以下の非侵襲性ボリュメトリック温度測定技術の1つ以上を使用することができる。
1)近赤外分光法
2)マイクロ波放射測定法
3)異なる供給源からの加熱用超音波または診断用超音波を使用する超音波温度測定法
4)磁気共鳴温度測定法
5)電気インピーダンス断層撮影法
【0141】
これらの技術の内の最初の4つは、上で引用した参考文献に、特にHollisの博士論文、および超音波温度測定法の場合、StraubeらおよびArthurらの講演、ならびにSeipおよびEbbiniによる論文に記載されている。少なくとも比較的低い周波数、例えば100kHzより充分に低い周波数の電流および電圧では、体組織の比インピーダンスまたは抵抗率が局所的温度に依存するので、電気インピーダンス断層撮影法は温度をボリュメトリックに見つけるために使用することができる。電気インピーダンス断層撮影法は、測定される組織の種類の抵抗率の温度依存性を事前に較正した場合、温度を絶対的に測定するために使用することができ、あるいは抵抗率の温度依存性が事前に較正されない場合でも、温度の変化を検出しかつ異なる場所の温度変化を比較するために使用することができる。
【0142】
これらの非侵襲性ボリュメトリック温度測定技術のいずれも、上述の通り、侵襲性プローブによって行なわれる温度測定を補足するために、前立腺に使用されることを含め、身体の他の部分の腫瘍または異常組織を検出するためにも使用することができる。
【0143】
生検針および手順
図8は、本発明の例示的実施形態に従って、試料を採取する位置を選択するために温度測定を利用して、生検試料を採取するために生検針がどのように使用されるかを例証する時系列を概略的に示す。図9は生検手順のフローチャート900である。図8の左側にある時系列の最初の図は、フローチャートの902で組織内に、例えば前立腺組織内に最初に挿入されるときの生検針800を示す。針800は先鋭点802を有し、当初は閉位置にあり、任意選択的にカバー804内に引き戻され、先鋭点802だけがカバーの外側にある。切欠図は、針の側面にその長さに沿って配設された複数の窓806を持つ、カバー804内の針を示す。針が挿入されている間、窓を被覆しておくと、窓の鋭利な縁による組織の損傷が回避され、かつ生検試料を正確にどこから採取するかが決定されるまで、組織を針の内側の外に維持し続けるという潜在的な利点が得られる。任意選択的に、生検が行なわれる組織の全長をカバーするように、針は902で組織内の充分奥まで押し込まれる。例えば、それが前立腺生検に使用される場合、針は任意選択的に前立腺全体にまたは略全体に押し込まれる。
【0144】
時系列における次の図808に示すように、針が所定の位置に着くと、フローチャートの904でカバー804が引き戻され、窓806が周囲の組織に曝露される。温度センサ810、例えば熱電対が次いで任意選択的に針の内側に沿って押し込まれる。フローチャートの906で、温度センサ810は、各窓806で組織の温度測定を行なう。異なる種類の組織、例えば健康な組織と癌組織とをそれらの異なる加熱速度および/または冷却速度によって区別するために、温度測定は、超音波による組織の加熱後に行なわれる。任意選択的に、センサ810を針に沿って軸線方向に1つの窓806から別の窓に針に沿って軸線方向に動かしながら、温度測定は順次行なわれる。任意選択的に、一部の窓は異なる方位角位置にも位置し、センサ810は、1つの窓から次の窓に軸線方向のみならず、方位角方向にも移動する。代替的にまたは追加的に、温度センサ810は、針の異なる窓806を介して温度を同時に測定する複数のサブセンサを備える。全ての温度測定が同時に行なわれる場合、測定を行なうために温度センサ810を移動させる必要はなく、任意選択的に、針が最初に組織内に挿入されたときに、温度センサ810はすでに所定の位置に着いている。1つ以上のワイヤ812は任意選択的に、身体の外側に位置するデータリンクに温度データを伝達する。ひとたび温度測定が行なわれると、温度センサ810は任意選択的に針から引き出される。本発明の一部の実施形態では、温度センサは針内の所定の位置に永久的に維持される。しかし、温度センサを取り出すと、温度センサが生検試料の採取を妨げないという潜在的利点が得られる。
【0145】
フローチャートの908で、針に沿ったどの位置で生検試料を採取すべきかに関し、温度測定に基づいて決定が下される。任意選択的に、温度測定に基づいて、癌組織が見つかる可能性の高い位置が選択される。例えば、超音波加熱の結果、癌組織が健康な組織より高い温度を有することが予想される場合、かつ組織が針の経路に沿ってかなり均一な超音波のパワー密度に曝露された場合には、測定温度に局所的ピークが存在する窓806で、生検試料を採取することができる。癌組織が健康な組織より低い温度を有することが予想される場合には、測定温度に極小が存在する窓806で、生検試料を採取することができる。
【0146】
フローチャートの910で、時系列の図814に示す通り、生検キャリアロッド816が針の内側に沿って押し込まれる。キャリアロッド816は任意選択的にその側面を閉鎖され、窓806の1つであって生検試料が採取される窓820に隣接して位置する生検スリット822を除いて、中実領域818が窓806を組織から遮断する。生検スリットが窓820に隣接して配置されると、キャリアロッド816の内側はその位置の組織に露出される。任意選択的に、各々、生検スリットがキャリアロッドの端に対して異なる位置にある、異なるキャリアロッドが利用可能である。ひとたび生検試料を採取するための位置が選択されると、キャリアロッドが針内に進入できる限り奥まで押し込まれたときに、生検スリットが窓820に隣接して生検試料を採取するための正しい位置に配置されるように、キャリアロッドの1つが選択される。代替的に、生検スリットは常にキャリアロッドの端の近くに位置し、キャリアロッドは、生検スリットが選択された窓820に隣接して配置されるように、ちょうど足りる距離だけ針内に押し込まれる。任意選択的に、この場合、キャリアロッドは停止要素を含み、停止要素は、キャリアロッドを挿入する前に、キャリアロッドが針の奥まで押し込まれすぎないように調整される。
【0147】
フローチャートの912で、組織試料はキャリアロッド内に、または窓のすぐ内側に位置するキャリアロッドのポケット内に切り落とされる。これは例えば、時系列の図824に示すように、カバー804を針上で前方に押し進めることによって行なわれる。これが行なわれる前に、針によって押し退けられた組織の圧力のため、組織の一部は、窓820および生検スリット822を通してキャリアロッド816の内部に膨出する。カバー804は充分に鋭利な刃を有し、かつ/または針とカバーとの間に充分に密な嵌合が存在するので、カバー804を針上に押し被されるときに、キャリアロッド816の内部に膨出した組織の部分が、キャリアロッド内に切り落とされる。フローチャートの914で、キャリアロッドは生検試料と共に針から取り出される。任意選択的に、キャリアロッドが取り出されるときに、針およびカバーは組織内に残る。
【0148】
フローチャートの916で、任意選択的に、針に沿った異なる位置で別の生検材料を採取すべきか否かの決定が下される。この決定は任意選択的に、906で測定した針に沿った組織の温度プロファイルに基づく。例えば温度プロファイルが、例えば温度の2つの極大によって示される2つの別個の腫瘍の存在を示唆する場合には、それらの各々から生検試料を採取するように選択が行なわれる。どの位置に癌組織が存在する可能性が最も高いかを温度プロファイルから判断することが難しい場合、2つ以上の生検試料を採取するという選択を行なうこともある。任意選択的に、全ての生検試料を採取する場所に関する決定は、温度が測定された後、試料のいずれかが採取される前に行なわれる。
【0149】
別の試料を採取する場合には、カバーが任意選択的に、918で再び引き戻される。代替的に、カバーはキャリアロッドが取り出される前に引き戻される。しかし、キャリアロッドが取り外される間、カバーを閉じたままにしておくと、他の位置の組織が窓806のいずれかに流入してキャリアロッドを妨害し、かつ/または生検スリットを介してキャリアロッド内に流入することを防止することができる。ひとたびカバーが引き戻されると、910で新しいキャリアロッドが挿入され、最初の生検試料に対し上述したように、新しい生検試料を採取するように配置される。任意選択的に、新しいキャリアロッドが挿入し終わるまで、カバーは引き戻されない。
【0150】
全ての生検試料が採取されると、920で針およびカバーが組織から取り出される。
【0151】
図10は、例えば図8の生検針800の代替例として使用することのできる内蔵熱電対付き生検針1000を概略的に示す。針1000の壁1002は、熱電対で使用することのできる1つの金属、例えばアルメルから構成される。壁1002に沿って延びるが壁1002から電気的に絶縁された1つ以上のストリップ1004は、第1金属と共に熱電対に使用することのできる異なる金属、例えばクロメルから作られる。例えばストリップ1004は電気絶縁接着剤により壁1002に付着される。各ストリップ1004は、ストリップが壁1002と良好な電気接触状態にあり、かつ針1000に隣接する組織と良好な熱接触状態にある遠位端1006を有する。各ストリップの近位端には電気リード1008があり、かつ壁1002の近位端に電気的に接続された電気リード1010も存在する。リード1008およびリード1010は任意選択的に、一定の既知の温度に維持される。壁1002および各ストリップ1004は、そのストリップ用のリード1008とリード1010との間に、そのストリップの遠位端1006の温度に依存する電位差を持つ、熱電対を形成する。任意選択的に、針1000は複数のそのようなストリップを含み、各ストリップは針1000に沿った異なる位置に遠位端1006を持つ。リード1008およびリード1010の既知の固定温度に対する針1000の長さに沿った組織の温度プロファイルは、リード1010の電位に対する各リード1008の電位を測定することによって決定される。
【0152】
針800の一部の特徴、例えば任意選択的に針のストリップ1004とは異なる側にある窓806、カバー804、およびキャリアロッド816は、針1000に使用することができることに注目されたい。ストリップ1004は任意選択的に壁1002の内側または外側に沿った適位置に確実に接着され、かつ任意選択的に半径方向に細い。これは、ストリップ1004が、針の外側に沿った任意の要素、例えばカバーの摺動、または針の内側に沿った任意の要素、例えばキャリアロッドの摺動を妨害せず、あるいはそれによって損傷されないという潜在的利点を有する。
【0153】
本明細書中で使用される用語「約」は、±10%を示す。
【0154】
用語「含む/備える(comprises、comprising、includes、including)」、「有する(having)」、およびそれらの同根語は、「含むが、それらに限定されない(including but not limited to)」ことを意味する。この用語は、「からなる(consisting of)」および「から本質的になる(consisting essentially of)」を包含する。
【0155】
表現「から本質的になる」は、さらなる成分および/または工程が、特許請求される組成物または方法の基本的かつ新規な特徴を実質的に変化させない場合にだけ、組成物または方法がさらなる成分および/または工程を含み得ることを意味する。
【0156】
本明細書中で使用される場合、単数形態(「a」、「an」および「the」)は、文脈がそうでないことを明確に示さない限り、複数の参照物を包含する。例えば、用語「化合物(a compound)」または用語「少なくとも1つの化合物」は、その混合物を含めて、複数の化合物を包含し得る。
【0157】
用語「例示的」は、本明細書では「例(example,instance又はillustration)として作用する」ことを意味するために使用される。「例示的」として記載されたいかなる実施形態も必ずしも他の実施形態に対して好ましいもしくは有利なものとして解釈されたりかつ/または他の実施形態からの特徴の組み入れを除外するものではない。
【0158】
用語「任意選択的」は、本明細書では、「一部の実施形態に与えられるが、他の実施形態には与えられない」ことを意味するために使用される。本発明のいかなる特定の実施形態も対立しない限り複数の「任意選択的」な特徴を含むことができる。
【0159】
本開示を通して、本発明の様々な態様が範囲形式で提示され得る。範囲形式での記載は単に便宜上および簡潔化のためであり、本発明の範囲に対する柔軟性のない限定として解釈すべきでないことを理解しなければならない。従って、範囲の記載は、具体的に開示された可能なすべての部分範囲、ならびに、その範囲に含まれる個々の数値を有すると見なさなければならない。例えば、1〜6などの範囲の記載は、具体的に開示された部分範囲(例えば、1〜3、1〜4、1〜5、2〜4、2〜6、3〜6など)、ならびに、その範囲に含まれる個々の数値(例えば、1、2、3、4、5および6)を有すると見なさなければならない。このことは、範囲の広さにかかわらず、適用される。
【0160】
数値範囲が本明細書中で示される場合には常に、示された範囲に含まれる任意の言及された数字(分数または整数)を含むことが意味される。第1の示された数字および第2の示された数字「の範囲である/の間の範囲」という表現、および、第1の示された数字「から」第2の示された数「まで及ぶ/までの範囲」という表現は、交換可能に使用され、第1の示された数字と、第2の示された数字と、その間のすべての分数および整数とを含むことが意味される。
【0161】
本明細書中で使用される用語「方法(method)」は、所与の課題を達成するための様式、手段、技術および手順を示し、これには、化学、薬理学、生物学、生化学および医学の技術分野の実施者に知られているそのような様式、手段、技術および手順、または、知られている様式、手段、技術および手順から、化学、薬理学、生物学、生化学および医学の技術分野の実施者によって容易に開発されるそのような様式、手段、技術および手順が含まれるが、それらに限定されない。
【0162】
本明細書で使用される場合、用語「治療する/処置する」には、状態の進行を取り消すこと、実質的に阻害すること、遅くすること、または、逆向きにすること、状態の臨床的症状または審美的症状を実質的に改善すること、あるいは、状態の臨床的症状または審美的症状の出現を実質的に防止することが含まれる。
【0163】
明確にするため別個の実施形態の文脈で説明されている本発明の特定の特徴が、単一の実施形態に組み合わせて提供されることもできることは分かるであろう。逆に、簡潔にするため単一の実施形態で説明されている本発明の各種の特徴は別個にまたは適切なサブコンビネーションで、あるいは本発明の他の記載される実施形態において好適なように提供することもできる。種々の実施形態の文脈において記載される特定の特徴は、その実施形態がそれらの要素なしに動作不能である場合を除いては、それらの実施形態の不可欠な特徴であると見なされるべきではない。
【0164】
本明細書中上記に描かれるような、および、下記の請求項の節において特許請求されるような本発明の様々な実施形態および態様のそれぞれは、実験的裏付けが下記の実施例において見出される。
【実施例】
【0165】
次に下記の実施例が参照されるが、下記の実施例は、上記の説明と一緒に、本発明を非限定様式で例示する。
【0166】
異なる超音波加熱速度を使用して、それ以外では類似した種類の組織を区別することの実現可能性を実証するために、ニワトリの肝臓の小片をウシの肝臓の大片の表面に埋め込み、あるいはウシの肝臓の小片をニワトリの肝臓のより大片に埋め込んで、インビトロ試験を行なった。次いで試料全体を、1MHzまたは3MHzのいずれかで720mW/cm2より低い時間平均強度の超音波により、その温度が数℃上昇するように約1分から約6分の範囲の充分に長い時間、均一に加熱した。赤外線カメラを使用して、試料の表面を撮像し、2種類の肝臓の温度を測定した。全ての事例において、ウシの肝臓はニワトリの肝臓よりかなり速く加熱され、かつ2種類の肝臓が赤外線画像で容易に区別可能であることが明らかになった。
【0167】
表1は、行なわれた5つの試験のデータを示す。全ての試験において、治療用超音波機、Mettler Electronics Sonicator740を使用し、単一のトランスデューサを10%デューティサイクルで作動させた。トランスデューサを上向きにして機械をフィクスチャに配置し、超音波の均一な非集束ビームを発生するように設定した。試料をトランスデューサの頂部に配置した。FLIRブランド、B‐CAM Western‐Sモデル赤外線カメラを用いて、加熱前および加熱後の温度を測定した。初期温度は20℃から25℃の間であり、2種類の肝臓の間に検出できる差はなかった。試験2から5において、トランスデューサと試料との間の結合を改善するために、ゲルを使用した。試験1ではゲルを使用せず、その結果、結合は不充分であり、6分を超えるずっと長い加熱時間を使用した。この加熱時間は2種類の肝臓の間の実質的な伝導熱流束を可能にするのに充分な長さであり、その結果、2種類の肝臓における温度上昇は、試験1では、他の試験よりずっと近接していた。試験1および5ではニワトリの肝臓をウシの肝臓に埋め込み、試験2、3、および4では、ウシの肝臓をニワトリの肝臓に埋め込んだ。
【表1】

【0168】
結果は、3MHzの超音波の場合、1MHzの超音波より、加熱速度が高いことを示している。ニワトリの肝臓が周囲のウシの肝臓によって著しく伝導加熱された試験1を無視すると、データは1MHzの超音波が2種類の組織を3MHzの超音波よりよく区別することをかろうじて示唆している。臨床に使用する場合、3MHzの超音波ほど大きく吸収されないことによる1MHzの超音波の組織におけるより深い浸透も有利である。試験3、4、および5の比較は、温度測定の精度内で、2種類の肝臓の加熱速度が再現可能であり、予想通り、超音波パワーに比例することを示す。
【0169】
試験はニワトリの脚でも行なわれ、1MHz、700mW/cm2の平均パワーでトランスデューサを脚の裏から当てた。加熱後に撮影した赤外線画像は、腱組織による超音波吸収が周囲の筋肉組織より大きいことを示した。
【0170】
超音波加熱を使用してラットの壊死組織が正常な肝臓組織から区別されること、および画像処理がこの目的に有用であることを実証するために、インビボ試験を行なった。面積10cm2の超音波トランスデューサで1.4W/cm2の1MHz超音波を4分間肝臓に当てた。標準Photoshop画像鮮明化ソフトウェアを用いて処理した赤外線画像は、壊死組織の大部分が肝臓の表面から数ミリメートル下にあり、未処理赤外線画像では正常な組織とそれほど明瞭に区別されないにもかかわらず、超音波加熱後の壊死組織と正常な組織とを明瞭に区別する。処理後の赤外線画像では、壊死組織における超音波加熱速度が正常な組織より低いことを反映して、壊死組織は赤外線温度が28℃であったが、正常な肝臓組織は赤外線温度が29℃であった。
【0171】
本発明はその特定の実施態様によって説明してきたが、多くの別法、変更および変形があることは当業者には明らかであることは明白である。従って、本発明は、本願の請求項の精神と広い範囲の中に入るこのような別法、変更および変形すべてを包含するものである。
【0172】
本明細書で挙げた刊行物、特許および特許出願はすべて、個々の刊行物、特許および特許出願が各々あたかも具体的にかつ個々に引用提示されているのと同程度に、全体を本明細書に援用するものである。さらに、本願で引用または確認したことは本発明の先行技術として利用できるという自白とみなすべきではない。節の見出しが使用されている程度まで、それらは必ずしも限定であると解釈されるべきではない。
【特許請求の範囲】
【請求項1】
体組織を特性化する方法であって、
a)超音波を身体の組織内に透過させて、体組織を3℃未満だけ加熱するステップと、
b)超音波透過中、超音波透過後、または両方で、1つ以上の位置で1回以上、組織の温度を測定するステップと、
c)温度測定を利用して、超音波の吸収の差異、超音波透過後の組織の冷却速度の差異、または両方に基づいて体組織の少なくとも1つの特性を決定するステップと、
を含む方法。
【請求項2】
超音波は、任意の1秒間の時間平均で720mW/cm2未満の空間ピーク・パワー・レベルで体組織に透過される、請求項1に記載の方法。
【請求項3】
体組織の少なくとも1つの特性を決定するステップは、癌組織を見つけ、それを正常な組織と区別することを含む、請求項1に記載の方法。
【請求項4】
少なくとも1つの小線源治療用シードを癌組織の位置に対応する位置に配置するステップをさらに含む、請求項3に記載の方法。
【請求項5】
癌組織は、超音波による加熱速度が大きいことによって判別される、請求項3に記載の方法。
【請求項6】
癌組織は、超音波の透過後の急速な冷却速度によって判別される、請求項3に記載の方法。
【請求項7】
温度を測定するステップは、身体の外表面における放射赤外線分布を測定することを含む、請求項1に記載の方法。
【請求項8】
超音波を透過させるステップは、2つの異なる時間に、組織における異なる浸透深さを有する2つの異なる周波数で超音波を透過させることを含み、温度を測定するステップは、各々の周波数での加熱による放射赤外線分布を測定することを含み、体組織の少なくとも1つの特性を決定するステップは、組織内への深さに対する特性の依存度を決定することを含む、請求項7に記載の方法。
【請求項9】
組織は乳房組織であり、体組織の特性化は、乳癌の位置を特定することを含む、請求項7に記載の方法。
【請求項10】
温度測定を利用するステップは、画像処理ソフトウェアを用いて測定された赤外線分布を鮮明にすることを含む、請求項7に記載の方法。
【請求項11】
侵襲性プローブを組織に配置するステップをさらに含み、温度を測定するステップは、プローブの経路に沿って行なわれる、請求項3に記載の方法。
【請求項12】
侵襲性プローブは、生検針または小線源治療シードを植設するための針を備える、請求項11に記載の方法。
【請求項13】
侵襲性プローブは生検針を備え、温度を測定するステップは、針の内部に位置する可動温度センサによって行なわれ、かつ生検試料のための場所を空けるために、温度を測定した後、温度センサを針から取り出すことをさらに含む、請求項12に記載の方法。
【請求項14】
温度を測定した後、前記温度測定から決定された癌組織の位置に応じて選択された位置で生検試料を針で採取するステップをさらに含む、請求項12に記載の方法。
【請求項15】
癌組織の位置に対応する異なる経路に沿って組織に生検針を配置するステップと、異なる経路に沿って生検針で生検試料を採取するステップとをさらに含む、請求項11に記載の方法。
【請求項16】
温度は、プローブが所定の位置にある間に、またはプローブを移動させながら順次、複数の位置で測定される、請求項11に記載の方法。
【請求項17】
組織は前立腺組織を含む、請求項11に記載の方法。
【請求項18】
組織の温度を測定するステップは、近赤外分光法、マイクロ波放射測定法、超音波温度測定法、磁気共鳴温度測定法、および電気インピーダンス断層撮影法のうちの1つ以上を使用することを含む、請求項1に記載の方法。
【請求項19】
超音波を透過させるステップは、少なくとも0.1秒間連続して行なわれる、請求項1に記載の方法。
【請求項20】
単位面積あたりの入射超音波パワーは、組織の領域全体で2倍以内に均一であり、ここで領域は、超音波パワーの入射方向に対して垂直な少なくとも3cm×3cmの断面を有し、かつ超音波パワーの入射の方向に少なくとも1cmの距離に渡って延在する、請求項1に記載の方法。
【請求項21】
体組織を特性化するためのシステムであって、
a)任意の1秒間の時間平均で720mW/cm2以下の空間ピークパワーを透過させることに限定された、超音波を体組織内に透過させるための超音波透過システムと、
b)組織内への超音波の透過中および/または透過後に1つ以上の位置で体組織の温度を測定し、それによって組織を特性化するための情報を提供する温度測定システムと、
を備えたシステム。
【請求項22】
温度測定システムは、身体の外表面の温度を測定するための赤外線カメラを備える、請求項21に記載のシステム。
【請求項23】
乳房を圧縮するための圧縮要素をさらに備え、赤外線カメラは、圧縮された乳房の表面全体の温度のマップを作成するために配置される、請求項22に記載のシステム。
【請求項24】
超音波トランスミッタは、拡張領域にわたって圧縮された乳房に超音波を透過させるように配置される、請求項23に記載のシステム。
【請求項25】
生検針または小線源治療シードを植設するための針をさらに含み、温度測定システムは針に関連付けられた少なくとも1つの温度センサを備える、請求項21に記載のシステム。
【請求項26】
少なくとも1つの温度センサは針に沿って配列された複数の温度センサを備える、請求項25に記載のシステム。
【請求項27】
少なくとも1つの温度センサは、針の内部に位置する温度センサを備える、請求項25に記載のシステム。
【請求項28】
温度測定システムは1分未満の取得時間内に、0.5℃より高精度、1cmより高い空間分解能で温度を測定することができる、請求項21に記載のシステム。
【請求項29】
温度測定を用いて体組織の少なくとも1つの特性を決定する制御装置をさらに含む、請求項21に記載のシステム。
【請求項30】
制御装置は、体組織の特性を決定する際に、超音波透過および温度測定の相対的タイミングを考慮に入れる、請求項29に記載のシステム。
【請求項1】
体組織を特性化する方法であって、
a)超音波を身体の組織内に透過させて、体組織を3℃未満だけ加熱するステップと、
b)超音波透過中、超音波透過後、または両方で、1つ以上の位置で1回以上、組織の温度を測定するステップと、
c)温度測定を利用して、超音波の吸収の差異、超音波透過後の組織の冷却速度の差異、または両方に基づいて体組織の少なくとも1つの特性を決定するステップと、
を含む方法。
【請求項2】
超音波は、任意の1秒間の時間平均で720mW/cm2未満の空間ピーク・パワー・レベルで体組織に透過される、請求項1に記載の方法。
【請求項3】
体組織の少なくとも1つの特性を決定するステップは、癌組織を見つけ、それを正常な組織と区別することを含む、請求項1に記載の方法。
【請求項4】
少なくとも1つの小線源治療用シードを癌組織の位置に対応する位置に配置するステップをさらに含む、請求項3に記載の方法。
【請求項5】
癌組織は、超音波による加熱速度が大きいことによって判別される、請求項3に記載の方法。
【請求項6】
癌組織は、超音波の透過後の急速な冷却速度によって判別される、請求項3に記載の方法。
【請求項7】
温度を測定するステップは、身体の外表面における放射赤外線分布を測定することを含む、請求項1に記載の方法。
【請求項8】
超音波を透過させるステップは、2つの異なる時間に、組織における異なる浸透深さを有する2つの異なる周波数で超音波を透過させることを含み、温度を測定するステップは、各々の周波数での加熱による放射赤外線分布を測定することを含み、体組織の少なくとも1つの特性を決定するステップは、組織内への深さに対する特性の依存度を決定することを含む、請求項7に記載の方法。
【請求項9】
組織は乳房組織であり、体組織の特性化は、乳癌の位置を特定することを含む、請求項7に記載の方法。
【請求項10】
温度測定を利用するステップは、画像処理ソフトウェアを用いて測定された赤外線分布を鮮明にすることを含む、請求項7に記載の方法。
【請求項11】
侵襲性プローブを組織に配置するステップをさらに含み、温度を測定するステップは、プローブの経路に沿って行なわれる、請求項3に記載の方法。
【請求項12】
侵襲性プローブは、生検針または小線源治療シードを植設するための針を備える、請求項11に記載の方法。
【請求項13】
侵襲性プローブは生検針を備え、温度を測定するステップは、針の内部に位置する可動温度センサによって行なわれ、かつ生検試料のための場所を空けるために、温度を測定した後、温度センサを針から取り出すことをさらに含む、請求項12に記載の方法。
【請求項14】
温度を測定した後、前記温度測定から決定された癌組織の位置に応じて選択された位置で生検試料を針で採取するステップをさらに含む、請求項12に記載の方法。
【請求項15】
癌組織の位置に対応する異なる経路に沿って組織に生検針を配置するステップと、異なる経路に沿って生検針で生検試料を採取するステップとをさらに含む、請求項11に記載の方法。
【請求項16】
温度は、プローブが所定の位置にある間に、またはプローブを移動させながら順次、複数の位置で測定される、請求項11に記載の方法。
【請求項17】
組織は前立腺組織を含む、請求項11に記載の方法。
【請求項18】
組織の温度を測定するステップは、近赤外分光法、マイクロ波放射測定法、超音波温度測定法、磁気共鳴温度測定法、および電気インピーダンス断層撮影法のうちの1つ以上を使用することを含む、請求項1に記載の方法。
【請求項19】
超音波を透過させるステップは、少なくとも0.1秒間連続して行なわれる、請求項1に記載の方法。
【請求項20】
単位面積あたりの入射超音波パワーは、組織の領域全体で2倍以内に均一であり、ここで領域は、超音波パワーの入射方向に対して垂直な少なくとも3cm×3cmの断面を有し、かつ超音波パワーの入射の方向に少なくとも1cmの距離に渡って延在する、請求項1に記載の方法。
【請求項21】
体組織を特性化するためのシステムであって、
a)任意の1秒間の時間平均で720mW/cm2以下の空間ピークパワーを透過させることに限定された、超音波を体組織内に透過させるための超音波透過システムと、
b)組織内への超音波の透過中および/または透過後に1つ以上の位置で体組織の温度を測定し、それによって組織を特性化するための情報を提供する温度測定システムと、
を備えたシステム。
【請求項22】
温度測定システムは、身体の外表面の温度を測定するための赤外線カメラを備える、請求項21に記載のシステム。
【請求項23】
乳房を圧縮するための圧縮要素をさらに備え、赤外線カメラは、圧縮された乳房の表面全体の温度のマップを作成するために配置される、請求項22に記載のシステム。
【請求項24】
超音波トランスミッタは、拡張領域にわたって圧縮された乳房に超音波を透過させるように配置される、請求項23に記載のシステム。
【請求項25】
生検針または小線源治療シードを植設するための針をさらに含み、温度測定システムは針に関連付けられた少なくとも1つの温度センサを備える、請求項21に記載のシステム。
【請求項26】
少なくとも1つの温度センサは針に沿って配列された複数の温度センサを備える、請求項25に記載のシステム。
【請求項27】
少なくとも1つの温度センサは、針の内部に位置する温度センサを備える、請求項25に記載のシステム。
【請求項28】
温度測定システムは1分未満の取得時間内に、0.5℃より高精度、1cmより高い空間分解能で温度を測定することができる、請求項21に記載のシステム。
【請求項29】
温度測定を用いて体組織の少なくとも1つの特性を決定する制御装置をさらに含む、請求項21に記載のシステム。
【請求項30】
制御装置は、体組織の特性を決定する際に、超音波透過および温度測定の相対的タイミングを考慮に入れる、請求項29に記載のシステム。
【図1A】


【図1B】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図1B】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公表番号】特表2013−515586(P2013−515586A)
【公表日】平成25年5月9日(2013.5.9)
【国際特許分類】
【出願番号】特願2012−546548(P2012−546548)
【出願日】平成22年12月29日(2010.12.29)
【国際出願番号】PCT/IB2010/056116
【国際公開番号】WO2011/080712
【国際公開日】平成23年7月7日(2011.7.7)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.PHOTOSHOP
【出願人】(512171331)ペルセウス−バイオメッド インコーポレイテッド (2)
【Fターム(参考)】
【公表日】平成25年5月9日(2013.5.9)
【国際特許分類】
【出願日】平成22年12月29日(2010.12.29)
【国際出願番号】PCT/IB2010/056116
【国際公開番号】WO2011/080712
【国際公開日】平成23年7月7日(2011.7.7)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.PHOTOSHOP
【出願人】(512171331)ペルセウス−バイオメッド インコーポレイテッド (2)
【Fターム(参考)】
[ Back to top ]

