経口デリバリーの改善方法
本発明は、治療薬の経口デリバリーを改善する方法であって、前記治療薬を、アンギオゲニンを含む担体タンパク質に結合させる段階を含む方法、アンギオゲニンと治療薬を含む融合タンパク質又はコンジュゲート及びそれらの医薬における使用を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は治療タンパク質又はペプチドの経口デリバリーを改善するための方法に関し、詳細には、経口投与された際に優れたバイオアベイラビリティーを有するタンパク質又はペプチドを設計する方法、並びに優れた経口バイオアベイラビリティーを有する治療タンパク質又はペプチドに関する。
【背景技術】
【0002】
治療薬の経口投与は、一般に治療中の患者から最適なコンプライアンスを得られ、投薬スケジュールをより柔軟にするだけでなく、注射投与に伴う危険、煩雑さ、出費が回避できるので望ましい。しかしながら、経口ルートが利用できるか否かは薬剤の能力、すなわち、
(a)口腔、食道又は腸の粘膜層から吸収される能力、
(b)消化管において酸と酵素分解に耐える能力及び
(c)上皮細胞層を通過して全身循環に入る能力
によって制限される。
【0003】
薬理学的ペプチドが全て実用的レベルで経口利用できるとは限らない。特に、インスリンや成長ホルモン、毛包刺激ホルモン、カルシトニン等のホルモンや、インターフェロンやインターロイキン等のサイトカインの経口利用性は、特別な製剤としない限り2%未満であることが知られている。このようなレベルでは、経口利用性は、時間的及び個体間で大きく変動することが多いため、薬理学的ペプチドの経口投与を非実用的、非経済的、または危険なものにしている。
【0004】
医療におけるペプチド類の重要性は増しているが、大部分のペプチドは注射により投与されざるを得ないという事実から、その使用は制限されている。経肺、経鼻、経皮等の全身投与の代替ルートが提案されてはいるものの、これまでに開発された剤はごく少数に限られ、耐容性の制約と、一回に送達可能な投与量の制約が問題となっている。
【0005】
これまでに医薬品のバイオアベイラビリティーを改善する種々の試みがなされてきた。これらには、サリチル酸誘導体や脂質−胆汁酸塩混合物、ミセル、グリセリド、アシルカルニチン等の透過性エンハンサーの添加が挙げられるが、多くの場合毒性の問題を引き起こすことが知られている。
【0006】
医薬がタンパク質又はペプチドである場合、経口バイオアベイラビリティーを改善する試みとしては、タンパク質又はペプチドにアプロチニンや大豆トリプシンインヒビター、アマスタチン等のプロテアーゼインヒビターを混合して投与された治療薬の分解を制限することが挙げられる。残念ながら、これらプロテアーゼインヒビターは選択的でなく、内因性のプロテアーゼが、プロテアーゼインヒビターの望ましくない影響によって抑制される。
【0007】
ペプチドの経口製剤を提供する他の試みとして、腸溶性コーティング等の保護コーティングの単独利用や、又は、例えば、親水性ポリエチレングリコール基と親油性アルキル基を有する両性オリゴマー又はポリマーとタンパク質又はペプチドとのカップリングによるペプチドの化学修飾と共に保護コーティングの利用が挙げられる。これらの技法での成功例はとても少ない。他のアプローチは、胃腸管の堅いジャンクションを緩ませる賦形剤を添加することであるが、このアプローチでは緩んだバリヤーがバクテリアを含む近隣の分子すべての進入を許容してしまうため、耐容性の問題が生じる。また、アルギン酸カルシウム被覆リポソーム製剤がペプチドの大腸デリバリーに使用されている。しかし現在までに、このようなアプローチは非常に限られたものしか適用されていない。
【0008】
治療ペプチド又はタンパク質を経口で生物学的に利用可能とする幾つかの試みは、ビタミンB12等の担体タンパク質又は担体ペプチドの使用に依存する。このようなシステムは、現在も研究されている。
【発明の概要】
【発明が解決しようとする課題】
【0009】
従って、薬剤、特にタンパク質又はペプチドの経口デリバリーを改善するための新しい方法であって、それらが腸内で影響を受けないで存在する方法、又は胃腸管を通じ、全身循環する方法が当業界で必要とされている。
【課題を解決するための手段】
【0010】
本発明の第一の態様は、治療薬の経口デリバリーを改善する方法であって、治療薬とアンギオゲニン含有担体タンパク質とを結合させる段階を含む方法を提供する。
【0011】
本出願人は、先の出願PCT/AU2009/000602において、アンギオゲニンを食餌に添加して、マウスに与えた際に効果を有し得ることから、アンギオゲニンの経口利用可能性を開示している。ミルク抽出物中のアンギオゲニンは、いかなる量においても毒性を示さないことも知られており、数日に一回の投与から連続投与まで、効果的に投与することができる。本発明者らは、それ自体では経口で生物学的に利用可能性がない(又は限定的な経口的バイオアベイラビリティーしか有さない)治療薬にアンギオゲニンを結合させることにより、当該治療薬に実質的な経口的バイオアベイラビリティーが付与されることを見出した。
【0012】
本発明の第二の態様は、治療薬を胃腸管内に、又は胃腸管を通って実質的に影響を受けずに輸送するための担体としてアンギオゲニン含有経口デリバリーシステムを提供する。
【0013】
本発明の第三の態様は、治療薬に結合したアンギオゲニン含有融合タンパク質又はコンジュゲートを提供する。
【0014】
本発明の第四の態様は、本発明の第三の態様の融合タンパク質又はコンジュゲートと医薬的に許容される担体を含む医薬組成物を提供する。
【0015】
一実施形態において、前記医薬組成物は、経口投与用医薬組成物である。
【0016】
本発明の第五の態様は、前記治療薬の経口的バイオアベイラビリティーを改善させるための、治療薬に結合するアンギオゲニンの使用を提供する。
【0017】
本発明の第六の態様は、通常、実質的に経口で生物学的に利用可能でない治療薬による治療を必要とする動物の病気の予防又は治療方法であって、前記動物に本発明の第三の態様の融合タンパク質若しくはコンジュゲート又は本発明の第四の態様の医薬組成物の有効量を経口投与する方法を提供する。
【0018】
本発明の第七の態様は、治療を必要とする患者に経口投与する治療薬を含む薬剤の製造におけるアンギオゲニンの使用を提供する。
【0019】
病態の進行及び/又は病態の進行に対する更なる治療薬の効果の診断及び/又はモニタリングに使用するための経口デリバリー剤としてアンギオゲニンが使用され得ることも意図される。
【0020】
一実施形態において、前記治療薬は、タンパク質又はペプチドである。
【0021】
本発明は、その更なる態様において、本発明の第三の態様の融合タンパク質又はコンジュゲートを含む食品、栄養補助食品又は飼料を提供する。
【発明の効果】
【0022】
観察される有益な効果に提案されるいかなるメカニズムにも拘束されることを望むものではないが、アンギオゲニンは、高度の折り畳み構造により、胃腸管に存在するプロテアーゼに耐性を有すると考えられる。アンギオゲニンは、特異な膜結合性と、粘膜層を通る胃腸管へのアンギオゲニンの輸送(及びアンギオゲニンが結合するいかなる物質の輸送)を向上させる親油性/親水性バランスとを有すると考えられる。このような特性によって、アンギオゲニン及びアンギオゲニンが結合するいかなる物質も、上皮細胞膜を通って輸送可能になると提唱されている。
【図面の簡単な説明】
【0023】
【図1】2時間にわたるペプシン消化(pH3.0、酵素基質比1:20)に対するネイティブbAngの消化耐性を示す。レーン1は分子量を示し、ペプシン消化に対するネイティブbAngのプロファイルと強度をレーン4〜12に示す。
【図2】制限サイトNdeI及びXhoIを用いてpET30Cベクターに構築されたαMSH.bAngのN末端ベクター構造体のマップを示す。
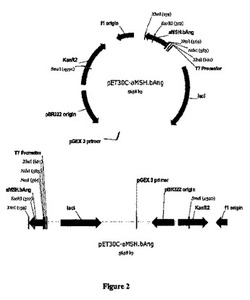
【図3】制限サイトNdeI及びXhoIを用いてpET30Cベクターに構築されたαAng.aMSHのC末端ベクター構造体のマップを示す。
【図4】制限サイトNdeI及びXhoIを用いてpET30Cベクターに構築されたαMSH.bAng及びbAng.aMSH構造体のプライマー配列を示す。
【図5】a.pET30Cベクター構造体からのα−MSH−bAngのDNA配列及びタンパク質配列、及びb.pET30Cベクター構造体からのbAng−α−MSHのDNA配列及びタンパク質配列を示す。
【図6】pET30Cベクター内の構造体からE.coliに発現された、精製αMSH.bAng.及びbAng−α−MSH融合タンパク質のSDSポリアクリルアミドゲルを示す。
【図7】C57Black/6Jマウスの血液(a.)及び組織(b.)中の放射性ラベルαMSH.bAng融合タンパク質の比率(経口強制給餌の総量に対するパーセンテージ)を示す。
【図8】C57Black/6Jマウスの血液(a.)及び組織(b.)中の放射性ラベルbAng.αMSH融合タンパク質の比率(経口強制給餌の総量に対するパーセンテージ)を示す。
【発明を実施するための形態】
【0024】
本発明者らは、アンギオゲニンが提供する疎水性基と親水性基のバランスによって、アンギオゲニンがアンギオゲニンと共に投与される治療薬を消化管内の酸と酵素分解から保護し、その治療薬を口腔、食道又は腸の粘膜層を通じて吸収させたり、任意的に上皮細胞層を超えて全身循環させて、治療薬が実質的に影響を受けないことを提唱する。「実質的に影響を受けない」とは、治療薬の治療活性が除かれないことを意味する。
【0025】
本明細書において「治療薬」とは、薬剤(例えば小分子薬剤(抗菌剤等))、医薬、検出可能なラベル、タンパク質(例えば、酵素)、タンパク質系化合物(例えば、タンパク質又はポリペプチド鎖を含むタンパク質複合体)及びポリペプチド(ペプチド)を含む。この治療薬は治療目的に限定されない。
【0026】
本明細書において「経口デリバリー」又は「経口投与」とは、胃腸管への投与及び送達のいずれをも意図しており、口咽頭腔への直接投与と口を介しての投与が含まれる。この場合、ペプチド又はポリペプチドの腸又は全身循環への実際の吸収は胃腸管(胃、小腸及び大腸を含む)で行われる。
本明細書において、「経口投与」とは舌下投与(レシピエントの舌下に適用する投与で、口咽頭腔を介する投与の一形態を表す)と口腔内投与(レシピエントの歯と頬の間の投与形態を表す)を含む。
【0027】
本明細書において、経口デリバリーと経口投与は相互に交換可能に使用することができる。
【0028】
本明細書においてバイオアベイラビリティーとは、治療薬の腸、血流又は全身循環における利用可能性を意味する。
【0029】
担体によってもたらされる輸送活性は、胃腸管の統合性に悪影響を及ぼさないことが好ましい。治療薬の輸送により、例えば、治療薬を個体の全身に循環させることが可能となる。
【0030】
「コンジュゲート」とは、担体と担体以外の治療薬との組み合わせを意味する。コンジュゲーションは、リンカーによるもの等化学的であってもよく、また、例えば遺伝子組み換え技術(融合タンパク質と、例えばレポーター分子(緑色蛍光タンパク質、β−ガラクトシダーゼ、Histag等))のように遺伝子的であってもよい。
【0031】
本発明のコンジュゲート及び医薬組成物は、他の化合物と共に、あるいは組み合わせて投与して組み合わせ効果や併用治療を提供することができる。本発明のコンジュゲートの活性が除かれない限り、医薬的活性剤の化学的適合性を有する組み合わせのいずれもが含まれると意図される。
【0032】
本発明のコンジュゲートが他の剤と共に併用治療において投与される場合、個体への投与は、逐次の同時のいずれも可能である。また、本発明に係る医薬組成物は、前述のような医薬的に許容される賦形剤と共に本発明の担体−剤のコンジュゲートと、当業界で知られている他の治療剤又は予防剤との組み合わせを含めることができる。
【0033】
経口デリバリー用治療薬は、いかなる疾病又は障害の治療にも使用することができる。
【0034】
「治療薬」又は「剤」は、疾病又は病態、傷害又は感染の症状の治療に使用される剤及び/又は医薬及び/又は薬剤を意味することが意図され、抗生物質、抗菌剤、抗がん剤及び血管新生阻害剤を含むが、これらに限定されない。
【0035】
「病態」とは、個体に対する、あるいは個体中の痛み、不快感、病気、疾病又は能力障害(精神的又は肉体的)を招く状況のいずれも意味すると意図される。
【0036】
アンギオゲニン担体を用いて、またはアンギオゲニンと結合され胃腸管に、あるいは胃腸管を通って送達することができるタンパク質又はタンパク質系治療薬の本発明における例としては、抗体、抗体フラグメン(Fvフラグメント、F(ab)2、F(ab)2’、Fab等の抗体結合フラグメント)、ペプチド系又はタンパク質系薬(ポジティブ薬理学的モジュレーター(アゴニスト)、薬理学的インヒビター(アンタゴニスト)等)等が挙げられるが、これらに限定されない。本発明におけるその他の剤の例としては、細胞毒(モノメチルオーリスタチンE(MMAE)、バクテリアエンドトキシン及びエクソトキシンからの毒素、ジフテリアトキシン、ボツニルムトキシン、テタヌストキシン、ペルシストキシン、スタフィロコッカスエンテロトキシン、毒ショック症候群トキシンTSST−1、アデニレートシクラーゼトキシン、シガトキシン、コレラエンテロトキシン、他)、血管新生阻害化合物(エンドスタチン、カテキン、栄養補助食品、ケモカインIP−10、マトリックスメタロプロテイナーゼ(MMPIs)インヒビター、アナステリン、ヴィロネクチン、アンチトロンビン、チロシンキナーゼインヒビター、VEGFインヒビター、受容体に対する抗体、ハーセプチン(Herceptin(登録商標))、アヴァスチン(Avastin(登録商標))、パニツムマブ、他)、IFN(α、β又はγ)、G−CSF、TPO、EPO、PtHR、アンギオゲニン等の抗菌剤、カテリシジン、GPCRペプチドリガンド、ヒト成長ホルモン、抗炎症ペプチド(BPI、リポコルチン含む)、サイトカイン(インターロイキン10、4及び13を含む)、腸ホルモン(セクレチン、ガストリン、コレシストキニン、VIP、GIP、モチリン、エンテログルカゴンを含む)、受容体活性化用合成ペプチド(ペプチドミメティックス)が挙げられる。
【0037】
腸の健康と免疫性のための治療薬は、腸管内腔(特に腸粘膜を通る)から腸への輸送に特に関連しており、必ずしも完全に腸上皮を通過して血流に到達しない。このような治療薬は、腸組織の機能の向上に用いることができる。これらには、アンギオゲニン、特に腸機能向上活性又は抗菌活性に最適化されたRNase5、RNase4、抗菌剤、抗炎症ペプチド(合成ペプチド、BPI、リポコルチン含む)、サイトカイン(インターロイキン10、4及び13を含む)、腸ホルモン(セクレチン、ガストリン、コレシストキニン、VIP、GIP、モチリン、エンテログルカゴンを含む)及び小児脂肪便症又は過敏性大腸症候群における免疫応答をブロックすると特徴づけられている剤のいずれもが含まれる。
【0038】
また、本発明によれば、前記剤は、抗がん剤等の小分子薬剤であってもよい。本発明において抗がん剤は、例えば本発明の担体に結合可能な基を有する薬剤を含むことができる。抗がん剤の例としては、パクリタキセル(タキソール)、ドセタキセル、ヴィンブラスチン、ヴィンクリスチン、エトポシド、ドキソルビシン、シクロホスファミド、タキソテレ、メルファラン、クロラムブシル及びこれらの組み合わせからなる群から選択される薬剤が挙げられるが、これらに限定されない。レプチンは肥満の治療に使用することができる。
【0039】
「小分子薬剤」とは、分子量1000g/mol以下を有する薬剤を意味すると意図される。
【0040】
本発明においては、一以上の担体結合サイトが利用可能又は存在する際、一以上の剤が本発明の担体に結合できることが理解されよう。従って、コンジュゲートは、一以上の剤を含むことができる。コンジュゲートは、それ自身が活性を有してもよい。すなわち、剤が担体に結合されていても剤が活性を有してもよい。更に本発明によれば、前記担体から化合物が放出されてもされなくてもよい。すなわち、通常、化合物は、胃腸管内に、又は胃腸管を超えて輸送された後に放出されてもよい。従って、この化合物は、コンジュゲート(又は担体)から放出され、その後活性を有してもよい。より詳細には、剤は、胃腸管内に、又は胃腸管を超えて輸送された後に担体から放出されてもよい。
【0041】
本発明の更なる態様は、動物(例えば患者)の治療方法であって、本発明のコンジュゲート及び/又医薬組成物を前記動物に投与することを含む方法に関する。
【0042】
[アンギオゲニン]
本発明で使用されるアンギオゲニンは、いかなる種からも得ることができるが、特にヒト、ウシ、ブタ、ウマ、鳥類、ヒツジ、ラット、ニワトリ、七面鳥又はマウスから得られるアンギオゲニンを含む。アンギオゲニンは、配列番号1(ヒト)、配列番号2(ウシ)、配列番号3(マウス)、配列番号4(ニワトリ)、配列番号5(ウサギ)、配列番号6(ブタ)、配列番号7(ウマ)、アンギオゲニンをコードする他の配列又は細胞培養において筋芽細胞の成長を誘起することが可能なこれらの機能的フラグンメントを含むことができる。
【0043】
【表1】

【0044】
【表2】

【0045】
前記アンギオゲニンは、公知のアンギオゲニンのアミノ酸配列に対して一以上の保存的なアミノ酸置換を含むことができる。保存的なアミノ酸置換の例として、Phe/Tyr、Ala/Val、Leu/IIe、Arg/His、Ser/Thr等が挙げられるが、これらに限定されない。アンギオゲニンは、公知のアンギオゲニンのアミノ酸配列に対して一以上のアミノ酸残基の挿入又は欠失(切断を含む)も含むことができる。さらに、前記アンギオゲニンは、一以上の自然多型性を含むことができる。前記アンギオゲニンは、完全に又は部分的に合成されたものでもよい。また、アンギオゲニンは、コンセンサス配列であってもよく、このコンセンサス配列は、例えば、二種以上からアンギオゲニンをコードする配列を比較し、標準的な方法によりそれらから誘導することによって得られる。最適化されたアンギオゲニン配列は、例えば、より高い活性、プロテアーゼ耐性等を与える変異を含む配列であってもよい。特に最適化されたアンギオゲニン配列においては、RNase活性が低減又は抑止されている。
【0046】
特殊なフラグメントと変異体は、触媒コア又は細胞結合サイトをコードする配列等のドメインを一以上含む。「触媒コア」とは、シグナルペプチドとN−末端及びC−末端可変領域を除くポリペプチドの内部領域を意味する。
【0047】
アンギオゲニンの異なる二領域は、血管新生活性のために必要である。これら領域は、His−13、Lys−41及びHis−115を含み、RNA及び最小限残基60〜68を含む非触媒細胞結合サイトを切断できる触媒サイトを含む。RNase活性と受容体結合能は必要ではあるが、血管新生活性のためには十分ではない。細胞内取込みと核転座も必要とされる。
【0048】
活性は、活性サイト及びその近傍のキーとなるアミノ酸を変更することにより増減することができ、Asp−116をHisに置換する高い活性がその一例である。機能的研究からArg−5及びArg−33も活性にとって重要であることがわかっている。
【0049】
RNaseのプロテアーゼ及び熱に対する安定性向上は、可能であるので、RNase5/アンギオゲニンの安定性とプロテアーゼ耐性は、改善可能である。これにより、コンジュゲート又は医薬組成物の送達の促進が可能となる。
【0050】
酵素的不活性の変異体は、内在化できるので、増殖する上皮細胞におけるアンギオゲニンの細胞取り込みは、ドメインに媒介され、RNase活性には依存しない。例えば、K41Q及びH13A変異体は、酵素的に不活性であるが、転座される。より容易に細胞に内在化され高活性な改善アンギオゲニンは、本発明の範囲に含まれ、このような変異体は、インヴィトロでの取り込みと培養中の上皮細胞及び筋細胞での活性試験によりテストすることができる。
【0051】
細胞輸送アンギオゲニンには、受容体結合と細胞内取込みが維持改善される必要がある。腸送達機能及び細胞送達機能が改善された変異体は、インヴィトロでのcaco−2腸上皮細胞系において試験され、スクリーニングされ得る。
【0052】
改善アンギオゲニンについては、より容易に細胞に内在化してより強力なものが望まれており、このような変異体は、インヴィトロの取り込みと培養中の上皮細胞及び筋細胞(マウス)での活性試験によりテストすることができる。
【0053】
本発明においては、いかなるアンギオゲニンも使用することができ、これには
マウス、ヒト、ウシ、ヒツジ等から得られるアンギオゲニンが含まれる。
【0054】
一般に、アンギオゲニンは、アミノ酸配列として少なくとも約70%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約98%以上の同一性を公知のアンギオゲニン配列に対して有することが好ましい。配列の類似性は、保存されたモチーフ等の大きな配列のサブセットである参照配列に基づいて計算される。配列分析用のアルゴリズムは、当業界で知られており、例えば、アルシュールらのJ.Mol.Biol.215:403〜10(1990)(デフォルトセッティングを用いた)に記載のBLASTがある。
【0055】
ストリンジェントなハイブリダイゼーション条件下において、公知のアンギオゲニンコード配列にハイブリダイズする核酸分子によってコードされるアンギオゲニン配列も好ましい。ストリンジェントなハイブリダイゼーション条件の一例は、50(C以上で0.1×SSC(15mM塩化ナトリウム/1.5mMクエン酸ナトリウム)である。ストリンジェントなハイブリダイゼーション条件の他の例は、溶液(50%ホルムアミド、1×SSC(150mM塩化ナトリウム/15mMクエン酸ナトリウム)、50mMリン酸ナトリウム(pH:7.6)、5×デンハール溶液、10%硫酸デキストラン及び20μg/ml変性・切断サケ精子DNA)中で42℃において一昼夜インキュベーションを行い、その後フィルターを約65℃で0.1×SSCで洗浄することである。例えば、高ストリンジェント条件は、65℃、約8時間(以上)の6×SSC(20×SSCが3.0M NaCl及び0.3Mクエン酸ナトリウムを含む)、1%ドデシル硫酸ナトリウム(SDS)における水溶液によるハイブリダイゼーション(例えば、ホルムアルデヒドを含まず)と、それに続く0.2×SSCと0.1%SDSの65℃における一回以上の洗浄を含む。例えば、中程度のストリンジェント条件は、65℃、約8時間(以上)の6×SSC、1%SDSにおける水溶液によるハイブリダイゼーション(例えば、ホルムアルデヒドを含まず)と、それに続く2×SSCと0.1%SDSの室温における一回以上の洗浄を含む。
【0056】
[治療薬]
本発明に使用される治療薬は、経口バイオアベイラビリティーを有さないか、または限定的なバイオアベイラビリティーしか有さない治療薬である。
【0057】
本治療薬は、胃腸管においては十分安定であり、腸粘膜の透過、又は血流への進入が困難であるのが好ましい。また、本治療タンパク質又はペプチドは、カプセル化、腸溶性コーティング等により胃腸管内で保護されている。理想的には、このような保護作用は、アンギオゲニン及び治療タンパク質又はペプチドが大腸に達するまで維持され、アンギオゲニンが腸粘膜を通って、任意的には腸上皮を超えて血流に放出されるよう、能動的又は受動的に治療薬を輸送できる。
【0058】
本明細書において「十分に安定な」とは、投与された剤が、胃腸管の30分間曝露された後に少なくとも20%残存することを意味する。
【0059】
一実施形態において、治療タンパク質又はペプチドは、20以下のアミノ酸のペプチドであり、本発明の経口デリバリーシステムを利用して投与された際、実質的な経口活性を提供できる。このような治療ペプチドの例としては、α-メラノサイト刺激ホルモン、バソプレシン、オキシトシン、エンケファリン、ソマトスタチン及びACV1を含むコノトキシン類が挙げられる。
【0060】
一実施形態において、本治療タンパク質又はペプチドは、21〜40のアミノ酸のペプチドであり、例えば、実施例に記載する副甲状腺ホルモン(PTH1−34)である。このような治療タンパク質又はペプチドの他の例としては、グルカゴン様ペプチド(GLP−1)、カルシトニン、PYY3−36、オキシントモジュリン、消化管抑制ペプチド(GIP)、エンドルフィン及びスーパーファミリーの関連するものが挙げられる。
【0061】
一実施形態において、本治療タンパク質又はペプチドは、41〜60のアミノ酸のペプチドである。このような治療ペプチドの例としては、インスリン及びインスリン様成長因子−1(IGF−I)が挙げられる。
【0062】
一実施形態において、本治療タンパク質又はペプチドは、61〜80のアミノ酸のペプチドである。
【0063】
一実施形態において、本治療タンパク質又はペプチドは、80より大きいアミノ酸のペプチドである。このような治療タンパク質又はペプチドの可能な例としては、成長ホルモン、インターロイキン及び他の大型成長因子が挙げられる。
【0064】
本発明の方法によって送達される鍵分子には、インターフェロンα、β、G−CSF、TPO、EPO、PtHR、抗菌剤様カテリシジン類、GPCRペプチドリガンド及びhGHや前述の受容体(ペプチドミメティックス)及び腸改善剤を活性化するように設計された合成ペプチドが挙げられる。
【0065】
[結合]
治療薬の経口バイオアベイラビリティーを改善するためにはアンギオゲニンに結合させる必要がある。この結合は共有結合でも非共有結合でもよい。当業者には、治療薬の機能とアンギオゲニンの胃腸管透過能力を維持する適切なリンカーは明白であろう。
【0066】
一実施形態においては、アンギオゲニンは、アンギオゲニンのN末端を介して治療薬に結合させる。他の実施形態においては、アンギオゲニンは、アンギオゲニンのC末端を介して治療薬に結合させる。治療薬がタンパク質又はペプチドであれば、アンギオゲニンにアンギオゲニンのN末端又はC末端を介して結合させる。
【0067】
アンギオゲニンと治療薬は、治療薬にバイオアクティビティを与えるいずれかの簡便な方法によって結合させることができる。アンギオゲニンは比較的大分子(100超のアミノ酸)であるので、組み換え法又はミルク又は血漿からの分離と、続く分離と酵素法による治療薬への結合によって合成することが好ましい。あるいは、全コンジュゲート又は融合タンパク質は組み換え法で合成することができる。当業者には適切な方法は良く知られているであろうし、ある状況において最も簡便な方法は容易に選択され得る。
【0068】
好ましい結合サイトは、治療薬の性質により変化するであろう。一特異的実施形態においては、コンジュゲートは、治療タンパク質又はペプチドのC末端に結合するアンギオゲニンのN末端を含むが、これは主にどの付加点がバイオアクティビティを保存するかに依存する。
【0069】
一実施形態においては、アンギオゲニンと治療薬は、ポリグリシン等のスペーサーを用いて分離される。スペーサーを使用すると立体障害と後続の治療薬活性低下を防止することができる。
【0070】
一旦治療薬が粘膜層に進入したか、または胃腸管を通って血流に存在した場合、アンギオゲニンの存在による治療薬のいかなる活性阻害も防止するために前記治療薬からアンギオゲニンが切断されるよう、前記スペーサー又はリンカーは、腸上皮に存在する酵素又はアンギオゲニンと治療薬の間のプロテアーゼに対する切断サイトを有することができる。
【0071】
融合タンパク質の末端の保護基等、タンパク質に化学修飾を付加すると、D−アミノ酸がC末端又はN末端に導入された、あるいは他のアミノ酸修飾がC末端及びN末端に導入された合成コンジュゲートにプロテアーゼ耐性が提供されるであろう。
【0072】
[コンジュゲート]
本明細書において定義されるコンジュゲートは、本明細書において定義される治療薬に任意の程度で結合された本明細書において定義されるアンギオゲニンを含む。アンギオゲニンは、同一であっても異なっていてもよい一以上の治療薬に結合させることができる。複数種の治療薬の結合には、ポリリシンリンカーを使用することができる。
【0073】
[医薬組成物]
本発明はその一態様において、病態の予防又は治療に有用な各種医薬組成物を提供する。本発明の一実施形態において、医薬組成物は、本発明の第三の態様の融合タンパク質又はコンジュゲート又はその類似体、誘導体又は塩を担体、賦形剤及び添加剤又は助剤を用いて対象への投与に適した剤形に調製される。
【0074】
通常使用される担体や助剤として、炭酸マグネシウム、二酸化チタン、ラクトース、マンニトール、その他糖類、タルク、ミルクプロテイン,ゼラチン、スターチ、ビタミン類、セルロース及びその誘導体、動植物油,ポリエチレングリコール及び溶媒(滅菌水、アルコール、グリセロール、多価アルコール等)が挙げられる。他の医薬的に許容される担体には無毒性賦形剤があり、これには塩類、保存料、バッファー等が含まれる。これら担体は、レミントンファーマシューティカルサイエンス20版、ウイリアムス&ウイルキンス(2000)及びブリティッシュナショナルフォーミュアリー43版(ブリティッシュメディカルアソシエーション及びロイヤルファーマシューティカルソサイエティオブグレートブリテン、2002;http://bnf.rhn.net)に記載されている。これらの記載を、本明細書の一部を構成するものとしてここに援用する。
【0075】
保存料としては、抗菌剤、酸化防止剤、キレート剤が挙げられる。本医薬組成物の種々の成分のpHと正確な濃度は、当業界の通常の方法に従って調整される。グッドマン及びギルマンの治療のための薬理学基礎(第7版、1985)を参照されたい。
【0076】
本医薬組成物は、投与単位として調製及び投与されることが好ましい。固体投与単位としては、錠剤、カプセル剤、座剤が挙げられる。対象を治療するに際し、化合物の活性、投与方法、病態の特徴と重度、対象の年齢と体重に応じて、異なる日用量で投与され得る。しかしながら、状況によっては日用量の増減が適切かもしれない。日用量の投与は、個々の投与量又は複数の少な目の投与単位の単回投与、及び小分けにした投与量を一定の間隔で多数回投与することによって行える。
【0077】
本発明の医薬組成物は、カプセル化又は腸溶性コーティングにより胃腸管においてその分解が低減されるという利点を享受することができる。
【0078】
本発明に係る医薬組成物は、その治療有効量を投与できる。もちろん、この使用のための有効量は、疾病の重度と対象の体重と全身状態に依存する。通常、インヴィトロにおける投薬量は、本医薬組成物のその場投与に有用な量についての良い目安とすることができる。また、細胞障害性の副作用を治療する効果的投薬量を決定するためには動物モデルを使用することができる。
【0079】
経口用製剤は硬ゼラチンカプセル剤とすることができ、カプセル内で有効成分は不活性な固体希釈剤と混合されている。固体希釈剤としては、炭酸カルシウム、リン酸カルシウム、カオリンが挙げられる。経口用製剤は、軟ゼラチンカプセル剤とすることで、カプセル内で有効成分は水又は油性媒体と混合されている。油性媒体としてはピーナツオイル、流動パラフィン、オリーブオイルが挙げられる。
【0080】
水性サスペンジョンも経口用には適しており、通常、有効物質を水性サスペンジョンの製造に適した賦形剤(例えば生理食塩水)との混和物として含有する。このような賦形剤としては、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロシプロピルメチルセルロース、アルギン酸ナトリウム、ポリビニルピロリドン、トラガカントゴム、アカシアゴム等の懸濁剤や分散剤又は湿潤剤が挙げられる。分散剤又は湿潤剤として、以下のものであってもよい。
(a)レシチン等の天然ホスファチド、
(b)アルキレンオキシドと脂肪酸との縮合物(例えば、ポリオキシエチレンステアレート)、
(c)エチレンオキシドと長鎖脂肪族アルコールとの縮合物(例えば、ヘプタデカエチレンオキセタノール)、
(d)エチレンオキシドと脂肪酸とヘキシトールから得られる部分エステルとの縮合物(例えば、ポリオキシエチレンソルビトールモノオレエート)又は
(e)エチレンオキシドと脂肪酸とヘキシトール無水物から得られる部分エステルとの縮合物(例えば、ポリオキシエチレンソルビタンモノオレエート)。
【0081】
本発明のコンジュゲートの投与濃度は、コンジュゲートの有効性に応じて大きく変化し、通常体重1kgあたり約1μg〜約5mgのオーダー(患者1日あたり約100μg〜約500mgのオーダー)である。担体材料と組み合わせて単回投与量を決めることが可能な有効成分量は、治療対象のホストと個々の投与方法のよって変化する。例えば、ヒトへの経口投与が意図される製剤は、約100μg〜500mgの活性化合物を適切且つ簡便な量の担体材料と共に含有することができる。担体材料の量は、組成物全体に対して約5%〜95%とすることができる。単位投与量形態は、通常約5mg〜500mgの有効成分を含む。
【0082】
しかしながら、どの患者についても具体的な投与濃度は、種々の因子に依存することが理解されよう。これら因子には、用いられる特定化合物の活性、年齢、体重、通常の健康状態、性別、食事、投与回数、投与経路、排せつレート、薬物の組み合わせ、治療中の特定の疾病の重度が含まれる。
【0083】
[食品及び栄養補助食品]
融合タンパク質又はコンジュゲートは、例えば、機能性食品又は動物用餌の食品組成物として投与することができる。このような食品は、どんな個体の摂取にも適している。本明細書において「個体」とは、ヒト及びヒト以外の個体を含む。ヒト以外の個体の例としては、動物、特に哺乳類(ウシ、ブタ、ヒツジ、ヤギ等の家畜)、家禽類、ペット及び愛玩動物(ウマ、ネコ、イヌ、モルモット、ラットマウス等)、水生動物(水産養殖用の魚類及び動物)等が挙げられる。
【0084】
「栄養補助食品」とは、疾患の予防及び治療を含む医学上の利益及び/又は健康上の利益を提供する食品又は食品の一部を意味する。
【0085】
栄養補助食品製品は、単離栄養分、食品サプリメント及び食餌から遺伝子工学改変食品、健康食品、ハーブ製品及びシリアル、スープ、飲料等の加工食品にまで及ぶ。「健康食品」とは、伝統的栄養素を上回る健康上の利益を提供し得る調製食品及び食品成分のいずれかを含む食品を意味する。
【0086】
対象とする栄養補助食品には、獣医用途又はヒト用途の食品が含まれ、これらはバーフード(シリアルバー、朝食バー、エネルギー補給バー、栄養補給バー等)、チューイングガム、ドリンク、強化ドリンク、ドリンクサプリメント(ドリンクに入れる粉末)、タブレット等を含む。
【0087】
本発明の食品又は栄養補助食品は、第三の態様の融合タンパク質又はコンジュゲートと少なくとも一種の食品用成分を含む。好ましい成分として、単糖類及び二糖類、炭水化物、タンパク質、アミノ酸、脂肪酸、脂質、安定化剤、保存料、香味料、着色料、甘味料、酸化防止剤、キレート化剤、担体、テクスチャラント、栄養素、pH調整剤、乳化剤、安定化剤、ミルクベース固形分、食物繊維等が挙げられるが、これらに限定されない。食品成分は天然原料から単離することもでき、合成で得ることもできる。すべての成分は、人が食べるのに適した食品用成分である。
【0088】
好ましい単糖類の例としては、ソルビトール、マンニトール、エリトロース、トレオース、リボース、アラビノース、キシロース、リブロース、グルコース、ガラクトース、マンノース、フルクトース、ソルボースが挙げられる。好ましい二糖類の例としては、スクロース、マルトース、ラクチトール、マルチトール、マルツロース、ラクトースが挙げられるが、これらに限定されない。
【0089】
好ましい炭水化物は、オリゴ糖類、多糖類及び/又は炭水化物誘導体である。本明細書において「オリゴ糖」とは、3〜9の単糖ユニットを有する消化可能な直鎖状分子であって、これらユニットは、グリコシド結合により共有結合されている。本明細書において「多糖」とは、9より大きい単糖ユニットを有する消化可能(すなわち、ヒト体内において代謝可能)な高分子であって、これらユニットは、グリコシド結合により共有結合されている。多糖類は、直鎖であっても分枝であってもよい。本発明においては、多価アルコール(例えば、グリセロール)等の炭水化物誘導体も複合炭水化物として使用できる。本明細書において炭水化物に関して「消化可能」とは、ヒト体内において生産される酵素により代謝可能である炭水化物を意味する。消化不可能な炭水化物である多糖類の例としては、セルロース、難消化性デンプン(未精製コーンスターチ)、退行性アミロース(高アミロースコーンスターチ)が挙げられる。炭水化物の例としては、ラフィノース、スタキオース、マルトトリオース、マルトテトラオース、グリコーゲン、アミロース、アミロペクチン、ポリデキストロース、マルトデキストリンが挙げられるが、これらに限定されない。
【0090】
好ましい脂肪としては、短鎖トリグリセライド(C2〜C4)及び長鎖トリグリセライド(C16〜C22)を含むトリグリセライドが挙げられるが、これらに限定されない。
【0091】
好ましいテクスチャラント(可溶性繊維とも称される)の例としては、ペクチン(高エステル、低エステル)、カラギーナン、アルギネート(アルギン酸、アルギン酸ナトリウム、アルギン酸カリウム、アルギン酸カルシウム等)、グアーガム、ローカストビーンガム、サイリウム、キサンタンガム、アラビアゴム、フラクトオリゴ糖、イヌリン、寒天及びこれら二種以上の機能的ブレンドが挙げられるが、これらに限定されない。
【0092】
好ましい乳化剤としては、プロピレングリコールモノステアレート(PGMS)、ナトリウムステアロイルラクチレート(SSL)、カルシウムステアロイルラクチレート(CSL)、モノグリセリド、ジグリセリド、モノジグリセリド、ポリグリセロールエステル、乳酸エステル、ポリソルベート、スクロースエステル等が挙げられるが、これらに限定されない。
【0093】
食物繊維は、多糖類、オリゴ糖類、リグニン及び関連する植物物質である。好ましい食物繊維としては、甜菜ファイバー、アップルファイバー、エンドウマメファイバー,小麦ファイバー、エンバクファイバー、大麦ファイバー、ライ麦ファイバー、米ファイバー、ジャガイモファイバー、トマトファイバー、他の植物の非デンプン多糖ファイバー及びこれらの組み合わせが挙げられるが、これらに限定されない。
【0094】
好ましい調味料としては、天然及び合成のフレーバーであって、「ブラウンフレーバー(コーヒー、ティー等)、乳製品フレーバー、フルーツフレーバー、バニラフレーバー、エッセンス剤、エキス剤、樹脂油剤、濃縮ジュース・ドリンク、フレーバー構成要素(δ−ラクトン、ケトン等)等、及びこれらフレーバーの組み合わせが挙げられる。植物由来のフレーバーの例としては、茶(好ましくは、ブラックティーや緑茶)、アロエベラ、ガラナ、チョウセンニンジン、いちょう、サンザシ、ハイビスカス、ローズヒップ、カモミール、ペパーミント、ウィキョウ、ショウガ、カンゾウ、蓮の実、シザンドラ、ノコギリヤシ、サルサパリラ、サフラワー、セイヨウオトギリソウ、ウコン、カルダモン、ナツメグ、ケイヒ、ジオスミン、シナモン、ジャスミン、サンザシ、キク、ヒシ、サトウキビ、レイシ、タケノコ、バニラ、コーヒー等が挙げられる。
【0095】
好ましい甘味料としては、アリテーム、デキストロース、フルクトース、ラクチロール、ポリデキストロース、キシリトール、キシロース、アスパルテーム、サッカリン、シクラメート、アセスルファームK、L−アスパルチル−L−フェニルアラニン低級アルキルエステル甘味料、L−アスパルチル−D−アラニンアミド、L−アスパルチル−D−セリンアミド、L−アスパルチル−ヒドロキシメチルアルカンアミド甘味料、L−アスパルチル−1−ヒドロキシエチルアルカンアミド甘味料等が挙げられるが、これらに限定されない。
【0096】
好ましい酸化防止剤としては、トコフェロール(天然、合成)、パルミチン酸アスコルビル、ガレート、ブチル化ヒドロキシアニソール(BHA)、ブチル化ヒドロキシトルエン(BHT)、tert−ブチルヒドロキノン(TBHQ)等が挙げられるが、これらに限定されない。
【0097】
好ましい栄養素としては、ビタミン類及びミネラル類が挙げられ、ナイアシン、チアミン、葉酸、パントテン酸、ビオチン、ビタミンA、ビタミンC、ビタミンB2、ビタミンB3、ビタミンB6、ビタミンB12、ビタミンD、ビタミンE、ビタミンK、鉄、亜鉛、銅、カルシウム、リン、ヨウ素、クロム、モリブデン、フッ化物等が含まれるが、これらに限定されない。
【0098】
好ましい着色料としては、FD&Cダイ(例えば、イエロー#5、ブルー#2、レッド#40)、FD&Cレークス、リボフラビン、β−カロテン、天然着色剤(フルーツエキス剤、野菜エキス剤及び/又は植物エキス剤(グレープ、クロフサスグリ、アロニア、ニンジン、ビート根、赤キャベツ、ハイビスカス等))が挙げられるが、これらに限定されない。
【0099】
保存料の例としては、ソルベート、ベンゾエート及びポリリン酸塩の各保存料が挙げられる。
【0100】
好ましい乳化剤としては、ジグリセリド、モノグリセリド、モノ及びジグリセリド酢酸エステル、モノ及びジグリセリドジアセチル酒石酸エステル、モノ及びジグリセリドクエン酸エステル、モノ及びジグリセリド乳酸エステル、脂肪酸、脂肪酸ポリグリセロールエステル、プロピレングリコール脂肪酸エステル、ソルビタンモノステアレート、ソルビタントリステアレート、ナトリウムステアロイルラクチレート、カルシウムステアロイルラクチレート等が挙げられるが、これらに限定されない。
【0101】
好ましいpH調整剤としては、有機及び無機の食用の酸が挙げられる。これらの酸は非解離の状態で存在させることができる他、それぞれの塩(例えばリン酸水素カリウム又はナトリウム、リン酸二水素カリウム又はナトリウム)として存在させることもできる。酸としては、食用の有機酸であって、クエン酸、リンゴ酸、フマル酸、アジピン酸、リン酸、グルコン酸、酒石酸、アスコルビン酸、酢酸、リン酸及びこれらの混合物が挙げられる。
【0102】
本発明の食品/栄養補助食品は、融合タンパク質又はコンジュゲートを約0.01重量%〜約50重量%含むことができる。例えば、約0.01重量%〜約0.1重量%、約0.1重量%〜約0.5重量%、約0.5重量%〜約1.0重量%、約1.0重量%〜約2.0重量%、約2.0重量%〜約5重量%、約5重量%〜約7重量%、約7重量%〜約10重量%、約10重量%〜約15重量%、約15重量%〜約20重量%、約20重量%〜約25重量%、約25重量%〜約30重量%、約30重量%〜約35重量%、約35重量%〜約40重量%、約40重量%〜約45重量%、約45重量%〜約50重量%である。
【0103】
前記食品が飲料である場合、その食品は、通常約50容量%以上の水を含む。例えば、約50容量%〜約60容量%、約60容量%〜約95容量%、約60容量%〜約70容量%、約70容量%〜約80容量%、約80容量%〜約90容量%、約90容量%〜約95容量%である。
【0104】
前記食品がバーである場合、その食品は、通常約15容量%以下の水を含む。例えば、約2容量%〜約5容量%、約5容量%〜約7容量%、約7容量%〜約10容量%、約10容量%〜約12容量%、約12容量%〜約15容量%である。
【0105】
いくつかの実施形態においては、食品/栄養補助食品は、本質的に乾燥状態にある。すなわち、約5%以下の水を含む。
【0106】
単糖類、二糖類及び複合炭水化物が存在する場合、それぞれ重量基準で通常約0.1%〜約15%含まれる。例えば、約0.1%〜約1%、約1%〜約5%、約5%〜約7%、約7%〜約10%、約10%〜約15%である。可溶性繊維、食物繊維及び乳化剤が存在する場合、それぞれ重量基準で通常約0.1%〜約15%含まれる。例えば、約0.1%〜約1%、約1%〜約5%、約5%〜約7%、約7%〜約10%、約10%〜約15%である。
【0107】
上述の他の成分が存在する場合、組成物に対し約0.001重量%〜約5重量%で存在する。
【0108】
[治療方法]
本発明の融合タンパク質、コンジュゲート、医薬品、食品、栄養補助食品、餌組成物は、治療薬を経口投与し、その治療薬によって治療可能な、いかなる病態の治療方法に使用することもできる。
【0109】
本明細書において「治療」とは、病態の予防又は病態の軽減を含むものと意図される。
【0110】
本発明により治療される病態は、前記治療薬によって治療される病態のいずれかである。
【0111】
以下の発明の説明及び特許請求の範囲において、文脈上で表現又は必然的含蓄が記載される必要がある場合を除き、「含む(comprise)」又はその変化したもの(comprises又はcomprising)は包括的な意味において使用される。すなわち、記述された特徴の存在を明示するが、本発明の種々の実施形態における更なる特徴の存在又は追加を排除しない。
【0112】
特に文脈にて明確に定められない限り、単数形「a」、「an」及び「the」は、複数形の言及も包含する。従って、例えば、「ペプチド」への言及は複数の該ペプチドを包含し、「アミノ酸」への言及は一以上のアミノ酸について言及する。
【0113】
数値範囲が記載される場合、この範囲は上限、下限及びその間の全ての数値を含むことは明らかに理解されよう。
【0114】
定義がなされていない限り、本明細書で使用されるすべての技術科学用語は、本発明が属する技術分野における通常の知識を有する者が一般に理解する意味と同じ意味を有する。本明細書に記載された内容と類似又は同様の材料及び方法のいずれもが本発明を実施又は試験するために使用又は利用できるが、好ましい材料及び方法を記載する。
【0115】
本明細書に記載の個々の材料及び方法は変更され得るので、本発明はこれらに限定されないことは明らかに理解されよう。本明細書で用いられる術語は個々の実施形態を記載する目的でのみ使用されており、添付のクレームのみによって限定される本発明の範囲を限定しないことも明らかに理解されよう。
【0116】
明示されない限り、本発明においては、通常の化学、タンパク質化学、分子生物学、酵素学の各技法を当業者の能力の範囲において利用される。このような技法は、当業者によく知られており、文献に詳細に説明されている。
【0117】
本発明を実施例と図面によって詳細に説明するが、これらは例示の目的のみであり、本発明を限定するものではない。
【実施例】
【0118】
[実施例1]組換えウシアンギオゲニンのプロテアーゼ耐性試験
ペプシン(ブタ胃粘膜タイプA;シグマ900−75−6)による消化に供するために、bAng(30μg)を調製した。消化を酵素/基質の比1:20で行い、実験を、温度とpHを一定条件(37℃、pH3)に制御して行った。サンプルは15分毎に取り出し、全消化時間を120分とした。各サンプルを素早く−80℃で急激に凍結して消化プロセスを停止した。ペプシン消化後、影響を受けなかったbAngのレベルをSDS PAGEで解析した。クマッシーブルーでゲルを染色し、オデッセイイメージングシステムV3.0でバンド密度を定量した。図1に本来のbAngのペプシン消化の様子を示す。図1に示すように、バンド密度の定量の結果、胃を模した条件における2時間の消化後、75%のbAngタンパク質が影響を受けない非分解タンパク質であった。
[実施例2]組み換え微生物を用いたアンギオゲニン融合タンパク質の生産
【0119】
N末端及びC末端αMSH.bAng構造体は、pET30Cベクターを用いて生成された。構造体を集積し、PCRで増幅し、制限サイトNdeI及びXhoIとαMSHを提供した(図2、3参照)。この生成物を、NdeI及びXhoIで消化後のpET30Cベクターの同じサイトにクローン化した。プライマー配列を示す(図4)。構造体の配列はDNAシ−ケンシングにより確認した(図5a、5b)。
【0120】
pET30C/bAng.α−MSH及びpET30C/α−MSH.bAngを保持する大腸菌BL21(DE3)pLysS株(E.coli strain BL21(DE3)pLysS)を用いて、rbAng融合タンパク質を発現させた。単離された封入体を6M塩酸グアニジン(GdnHCl)、100mM Tris/HCl(pH8)、1mM EDTA、100mM NaCl、10mM DTTを含む変性バッファーにタンパク質濃度約5mg/mlで溶解した。この変性溶液をゆっくりと希釈して、0.2mg/mlタンパク質、0.5mM DTT、0.3M GdnHClと100mM Tris/HCl(pH8)、1mM EDTA、0.3mM GSSG、1.5mM GSHの再生バッファーとした。続いてこの溶液を開放容器にて攪拌せずに4℃で72時間インキュベートした。再生終了後、溶液を限外濾過にて濃縮し、milliQウォーターに対して4℃で透析した。その後、ピアースストロングカチオン交換ミニスピンカラムに、製造指示に従ってロードした。rbAng融合タンパク質は、1M NaClで溶出させた。図6に精製組み換えタンパク質を示す。
[実施例3]放射性ラベルN末端及びC末端アンギオゲニン融合タンパク質は、マウスに経口強制給餌後15分以内に血流に吸収される。
【0121】
bAng.α−MSH及びαMSH.bAng.の両者合計200μgを実施例2に説明したプロトコールを用いて精製した。クロラミン−T・メタ重亜硫酸ナトリウム(CT/SMB)ヨウ素化によって、融合タンパク質各々(20μg)を1.0mCiの125Iでラベルした。遊離の、又は取り込まれなかった125Iは、PD10タンパク質カラムを用いたHPLCによってラベル化bAng.α−MSH及びαMSH.bAng.から分離した。125Iの取り込み率は、両タンパク質について79%で、これはマウスの経口強制給餌において合計790μCiのラベル化bAng.α−MSH及びαMSH.bAng.構造体が得られることに相当した。ラベル化bAng.α−MSH及びαMSH.bAng.は、個々の動物強制給餌する前にそれぞれ3.0mLに希釈した。
【0122】
実験には、C57Black/6Jマウス(雄性、30匹、8週齢)を用いた。マウスは午前11時00分に体重が測定され、強制給餌後のサンプリング(15、30、45、60、120、180分)に振り分けた(n=2又は3、各サンプリング時間にbAng.α−MSH及びαMSH.bAng.に対して)。各動物は強制給餌により適切な放射性ラベル溶液(200μL、53μCi相当)を投与し、15、30、45、60、120、180分に頸椎脱臼により殺した。
【0123】
血液は心臓穿刺により採取し、氷中に置いたヘパリン処置済チューブに入れ、−20℃で保存した。液体窒素で急激に凍結する前に脳を取り出し、重量を測定した。心臓、肝臓、腎臓、大腿四頭筋は、重量測定及びクランプして液体窒素中で急激に凍結する前に素早く切開して取り出した。切開後の組織は−80℃で保存した。
【0124】
各組織の放射能測定は、約40mgの組織を300μlの氷冷RIPAバッファー(50mM Tris−HCl(pH7.4)、150mM NaCl、1mM EDTA、1%NP−40、25%デオキシコール酸ナトリウム、1μg/ml Pics 1、1μg/ml Pics 2、2mM PMSF、1mM ピロリン酸ナトリウム、10mM NaF、1mM NaVO4)を含むエッペンドルフ管(2ml)に入れた。続いてハンドヘルドプロ200ホモジナイザー(プロサイエンティフィック社、オックスフォード、CT、米国)で約10秒間又は組織残留物の塊が見えなくなるまで組織をホモジナイズした。ホモジナイズ後、各サンプルを液体窒素で凍結保存し、分析に先立ち氷上で解凍した。解凍されると、サンプルを激しく5秒間ボルテックスして、4℃、3000gで30秒遠心した。その後、サンプルを100μlのデュプリケートで1分間ガンマカウンター(コブラII、オートガンマ、パッカードバイオサイエンス社)で測定した。
【0125】
ホモジナイズ後の各サンプルのタンパク質濃度をピアースBCAタンパク質アッセイ(サーモサイエンティフィック、ロックフォード、IL、米国)で分析した。サンプルは、RIPAバッファーで40倍に希釈して分析した。
【0126】
血液サンプルは、ヴォルテックスによる十分な混合に先立ちMQウォーターで30倍に希釈して分析した。サンプルを100μlのデュプリケートでチューブに添加し、上述のようにカウントを行った。
【0127】
図7a.に経口強制投与後15分以内にC57Black/6Jマウスの血液中に8%を超える摂取されたαMSH.bAng.が存在していたことを示す。このレベルは実験期間を通じて維持されていた。同様のbAng.αMSHの血液への取り込みが観察された(図8a.)。比較的低いレベルが肝臓において(摂取量全体の約0.6%)、また、腎臓において(摂取量全体の約0.2%)観察された(αMSH.bAng.については図7b.、bAng.αMSHについては図8b.)。大腿四頭筋、心臓及び脳への取り込みは、αMSH.bAng.及びbAng.αMSHについて、全て摂取量全体の0.1%以下であった。
【0128】
経口強制投与後15分以内の両融合タンパク質の8%以上の迅速な吸収と、このレベルの3時間を超える維持は、消化タンパク質にとって異常なことである。タンパク質消化後の遊離アミノ酸及び小分子のジ又はトリペプチドの胃腸管を通っての吸収は、消化吸収を反映するこの3時間のサンプリング期間内において、吸収のより緩やかな増加と明確な吸収ピーク(濃度)を示す。また、遊離アミノ酸は、皮膚、筋肉、腎臓、肝臓、脳の各組織を含む組織に導入されることによって迅速に取り除かれる。肝臓及び腎臓における低いパーセンテージのラベルの蓄積は、これらの組織における高い代謝活性と血液からの非特異的な取り込みのためであると思われる。骨格筋、心臓、脳への導入が無いことから、血液中のラベルの存在は、遊離アミノ酸に起因するのではなく、影響されなかったタンパク質に起因することが明らかに示される。
【0129】
マサネら(2001)は、ラットにおいて、強制給餌後最初の1時間における門脈の血流に吸収されるアミノ酸の80%が骨格筋、腎臓、脳、肝臓の各組織を含む組織内に封鎖されることを示した。マウスにおいては、加水分解を受けたタンパク質から得られるアミノ酸の90%以上が、強制給餌後最初6時間において腸を通って吸収され(オッセールら、1999)、循環から皮膚、肝臓、腎臓、脾臓、軟骨、骨格筋内に封鎖される。
【0130】
R.M.マサネ、I.ラフェカス及びX.レムサー(2001)、「Zucker−leanラットの強制給餌におけるタンパク質吸収」、「餌におけるタンパク質含有量の影響」、アーカイブズオブフィジオロジーアンドバイオケミストリー109:168〜174。
【0131】
S.オッセール、M.アダム、W.バベル及びJ.ザイフェルト(1999)、14C−ラベルゼラチン加水分解物の経口投与はマウス軟骨の放射能蓄積を誘導(C57/BL)。ジャーナルオブニュートリッション129:1891〜1895。
【技術分野】
【0001】
本発明は治療タンパク質又はペプチドの経口デリバリーを改善するための方法に関し、詳細には、経口投与された際に優れたバイオアベイラビリティーを有するタンパク質又はペプチドを設計する方法、並びに優れた経口バイオアベイラビリティーを有する治療タンパク質又はペプチドに関する。
【背景技術】
【0002】
治療薬の経口投与は、一般に治療中の患者から最適なコンプライアンスを得られ、投薬スケジュールをより柔軟にするだけでなく、注射投与に伴う危険、煩雑さ、出費が回避できるので望ましい。しかしながら、経口ルートが利用できるか否かは薬剤の能力、すなわち、
(a)口腔、食道又は腸の粘膜層から吸収される能力、
(b)消化管において酸と酵素分解に耐える能力及び
(c)上皮細胞層を通過して全身循環に入る能力
によって制限される。
【0003】
薬理学的ペプチドが全て実用的レベルで経口利用できるとは限らない。特に、インスリンや成長ホルモン、毛包刺激ホルモン、カルシトニン等のホルモンや、インターフェロンやインターロイキン等のサイトカインの経口利用性は、特別な製剤としない限り2%未満であることが知られている。このようなレベルでは、経口利用性は、時間的及び個体間で大きく変動することが多いため、薬理学的ペプチドの経口投与を非実用的、非経済的、または危険なものにしている。
【0004】
医療におけるペプチド類の重要性は増しているが、大部分のペプチドは注射により投与されざるを得ないという事実から、その使用は制限されている。経肺、経鼻、経皮等の全身投与の代替ルートが提案されてはいるものの、これまでに開発された剤はごく少数に限られ、耐容性の制約と、一回に送達可能な投与量の制約が問題となっている。
【0005】
これまでに医薬品のバイオアベイラビリティーを改善する種々の試みがなされてきた。これらには、サリチル酸誘導体や脂質−胆汁酸塩混合物、ミセル、グリセリド、アシルカルニチン等の透過性エンハンサーの添加が挙げられるが、多くの場合毒性の問題を引き起こすことが知られている。
【0006】
医薬がタンパク質又はペプチドである場合、経口バイオアベイラビリティーを改善する試みとしては、タンパク質又はペプチドにアプロチニンや大豆トリプシンインヒビター、アマスタチン等のプロテアーゼインヒビターを混合して投与された治療薬の分解を制限することが挙げられる。残念ながら、これらプロテアーゼインヒビターは選択的でなく、内因性のプロテアーゼが、プロテアーゼインヒビターの望ましくない影響によって抑制される。
【0007】
ペプチドの経口製剤を提供する他の試みとして、腸溶性コーティング等の保護コーティングの単独利用や、又は、例えば、親水性ポリエチレングリコール基と親油性アルキル基を有する両性オリゴマー又はポリマーとタンパク質又はペプチドとのカップリングによるペプチドの化学修飾と共に保護コーティングの利用が挙げられる。これらの技法での成功例はとても少ない。他のアプローチは、胃腸管の堅いジャンクションを緩ませる賦形剤を添加することであるが、このアプローチでは緩んだバリヤーがバクテリアを含む近隣の分子すべての進入を許容してしまうため、耐容性の問題が生じる。また、アルギン酸カルシウム被覆リポソーム製剤がペプチドの大腸デリバリーに使用されている。しかし現在までに、このようなアプローチは非常に限られたものしか適用されていない。
【0008】
治療ペプチド又はタンパク質を経口で生物学的に利用可能とする幾つかの試みは、ビタミンB12等の担体タンパク質又は担体ペプチドの使用に依存する。このようなシステムは、現在も研究されている。
【発明の概要】
【発明が解決しようとする課題】
【0009】
従って、薬剤、特にタンパク質又はペプチドの経口デリバリーを改善するための新しい方法であって、それらが腸内で影響を受けないで存在する方法、又は胃腸管を通じ、全身循環する方法が当業界で必要とされている。
【課題を解決するための手段】
【0010】
本発明の第一の態様は、治療薬の経口デリバリーを改善する方法であって、治療薬とアンギオゲニン含有担体タンパク質とを結合させる段階を含む方法を提供する。
【0011】
本出願人は、先の出願PCT/AU2009/000602において、アンギオゲニンを食餌に添加して、マウスに与えた際に効果を有し得ることから、アンギオゲニンの経口利用可能性を開示している。ミルク抽出物中のアンギオゲニンは、いかなる量においても毒性を示さないことも知られており、数日に一回の投与から連続投与まで、効果的に投与することができる。本発明者らは、それ自体では経口で生物学的に利用可能性がない(又は限定的な経口的バイオアベイラビリティーしか有さない)治療薬にアンギオゲニンを結合させることにより、当該治療薬に実質的な経口的バイオアベイラビリティーが付与されることを見出した。
【0012】
本発明の第二の態様は、治療薬を胃腸管内に、又は胃腸管を通って実質的に影響を受けずに輸送するための担体としてアンギオゲニン含有経口デリバリーシステムを提供する。
【0013】
本発明の第三の態様は、治療薬に結合したアンギオゲニン含有融合タンパク質又はコンジュゲートを提供する。
【0014】
本発明の第四の態様は、本発明の第三の態様の融合タンパク質又はコンジュゲートと医薬的に許容される担体を含む医薬組成物を提供する。
【0015】
一実施形態において、前記医薬組成物は、経口投与用医薬組成物である。
【0016】
本発明の第五の態様は、前記治療薬の経口的バイオアベイラビリティーを改善させるための、治療薬に結合するアンギオゲニンの使用を提供する。
【0017】
本発明の第六の態様は、通常、実質的に経口で生物学的に利用可能でない治療薬による治療を必要とする動物の病気の予防又は治療方法であって、前記動物に本発明の第三の態様の融合タンパク質若しくはコンジュゲート又は本発明の第四の態様の医薬組成物の有効量を経口投与する方法を提供する。
【0018】
本発明の第七の態様は、治療を必要とする患者に経口投与する治療薬を含む薬剤の製造におけるアンギオゲニンの使用を提供する。
【0019】
病態の進行及び/又は病態の進行に対する更なる治療薬の効果の診断及び/又はモニタリングに使用するための経口デリバリー剤としてアンギオゲニンが使用され得ることも意図される。
【0020】
一実施形態において、前記治療薬は、タンパク質又はペプチドである。
【0021】
本発明は、その更なる態様において、本発明の第三の態様の融合タンパク質又はコンジュゲートを含む食品、栄養補助食品又は飼料を提供する。
【発明の効果】
【0022】
観察される有益な効果に提案されるいかなるメカニズムにも拘束されることを望むものではないが、アンギオゲニンは、高度の折り畳み構造により、胃腸管に存在するプロテアーゼに耐性を有すると考えられる。アンギオゲニンは、特異な膜結合性と、粘膜層を通る胃腸管へのアンギオゲニンの輸送(及びアンギオゲニンが結合するいかなる物質の輸送)を向上させる親油性/親水性バランスとを有すると考えられる。このような特性によって、アンギオゲニン及びアンギオゲニンが結合するいかなる物質も、上皮細胞膜を通って輸送可能になると提唱されている。
【図面の簡単な説明】
【0023】
【図1】2時間にわたるペプシン消化(pH3.0、酵素基質比1:20)に対するネイティブbAngの消化耐性を示す。レーン1は分子量を示し、ペプシン消化に対するネイティブbAngのプロファイルと強度をレーン4〜12に示す。
【図2】制限サイトNdeI及びXhoIを用いてpET30Cベクターに構築されたαMSH.bAngのN末端ベクター構造体のマップを示す。
【図3】制限サイトNdeI及びXhoIを用いてpET30Cベクターに構築されたαAng.aMSHのC末端ベクター構造体のマップを示す。
【図4】制限サイトNdeI及びXhoIを用いてpET30Cベクターに構築されたαMSH.bAng及びbAng.aMSH構造体のプライマー配列を示す。
【図5】a.pET30Cベクター構造体からのα−MSH−bAngのDNA配列及びタンパク質配列、及びb.pET30Cベクター構造体からのbAng−α−MSHのDNA配列及びタンパク質配列を示す。
【図6】pET30Cベクター内の構造体からE.coliに発現された、精製αMSH.bAng.及びbAng−α−MSH融合タンパク質のSDSポリアクリルアミドゲルを示す。
【図7】C57Black/6Jマウスの血液(a.)及び組織(b.)中の放射性ラベルαMSH.bAng融合タンパク質の比率(経口強制給餌の総量に対するパーセンテージ)を示す。
【図8】C57Black/6Jマウスの血液(a.)及び組織(b.)中の放射性ラベルbAng.αMSH融合タンパク質の比率(経口強制給餌の総量に対するパーセンテージ)を示す。
【発明を実施するための形態】
【0024】
本発明者らは、アンギオゲニンが提供する疎水性基と親水性基のバランスによって、アンギオゲニンがアンギオゲニンと共に投与される治療薬を消化管内の酸と酵素分解から保護し、その治療薬を口腔、食道又は腸の粘膜層を通じて吸収させたり、任意的に上皮細胞層を超えて全身循環させて、治療薬が実質的に影響を受けないことを提唱する。「実質的に影響を受けない」とは、治療薬の治療活性が除かれないことを意味する。
【0025】
本明細書において「治療薬」とは、薬剤(例えば小分子薬剤(抗菌剤等))、医薬、検出可能なラベル、タンパク質(例えば、酵素)、タンパク質系化合物(例えば、タンパク質又はポリペプチド鎖を含むタンパク質複合体)及びポリペプチド(ペプチド)を含む。この治療薬は治療目的に限定されない。
【0026】
本明細書において「経口デリバリー」又は「経口投与」とは、胃腸管への投与及び送達のいずれをも意図しており、口咽頭腔への直接投与と口を介しての投与が含まれる。この場合、ペプチド又はポリペプチドの腸又は全身循環への実際の吸収は胃腸管(胃、小腸及び大腸を含む)で行われる。
本明細書において、「経口投与」とは舌下投与(レシピエントの舌下に適用する投与で、口咽頭腔を介する投与の一形態を表す)と口腔内投与(レシピエントの歯と頬の間の投与形態を表す)を含む。
【0027】
本明細書において、経口デリバリーと経口投与は相互に交換可能に使用することができる。
【0028】
本明細書においてバイオアベイラビリティーとは、治療薬の腸、血流又は全身循環における利用可能性を意味する。
【0029】
担体によってもたらされる輸送活性は、胃腸管の統合性に悪影響を及ぼさないことが好ましい。治療薬の輸送により、例えば、治療薬を個体の全身に循環させることが可能となる。
【0030】
「コンジュゲート」とは、担体と担体以外の治療薬との組み合わせを意味する。コンジュゲーションは、リンカーによるもの等化学的であってもよく、また、例えば遺伝子組み換え技術(融合タンパク質と、例えばレポーター分子(緑色蛍光タンパク質、β−ガラクトシダーゼ、Histag等))のように遺伝子的であってもよい。
【0031】
本発明のコンジュゲート及び医薬組成物は、他の化合物と共に、あるいは組み合わせて投与して組み合わせ効果や併用治療を提供することができる。本発明のコンジュゲートの活性が除かれない限り、医薬的活性剤の化学的適合性を有する組み合わせのいずれもが含まれると意図される。
【0032】
本発明のコンジュゲートが他の剤と共に併用治療において投与される場合、個体への投与は、逐次の同時のいずれも可能である。また、本発明に係る医薬組成物は、前述のような医薬的に許容される賦形剤と共に本発明の担体−剤のコンジュゲートと、当業界で知られている他の治療剤又は予防剤との組み合わせを含めることができる。
【0033】
経口デリバリー用治療薬は、いかなる疾病又は障害の治療にも使用することができる。
【0034】
「治療薬」又は「剤」は、疾病又は病態、傷害又は感染の症状の治療に使用される剤及び/又は医薬及び/又は薬剤を意味することが意図され、抗生物質、抗菌剤、抗がん剤及び血管新生阻害剤を含むが、これらに限定されない。
【0035】
「病態」とは、個体に対する、あるいは個体中の痛み、不快感、病気、疾病又は能力障害(精神的又は肉体的)を招く状況のいずれも意味すると意図される。
【0036】
アンギオゲニン担体を用いて、またはアンギオゲニンと結合され胃腸管に、あるいは胃腸管を通って送達することができるタンパク質又はタンパク質系治療薬の本発明における例としては、抗体、抗体フラグメン(Fvフラグメント、F(ab)2、F(ab)2’、Fab等の抗体結合フラグメント)、ペプチド系又はタンパク質系薬(ポジティブ薬理学的モジュレーター(アゴニスト)、薬理学的インヒビター(アンタゴニスト)等)等が挙げられるが、これらに限定されない。本発明におけるその他の剤の例としては、細胞毒(モノメチルオーリスタチンE(MMAE)、バクテリアエンドトキシン及びエクソトキシンからの毒素、ジフテリアトキシン、ボツニルムトキシン、テタヌストキシン、ペルシストキシン、スタフィロコッカスエンテロトキシン、毒ショック症候群トキシンTSST−1、アデニレートシクラーゼトキシン、シガトキシン、コレラエンテロトキシン、他)、血管新生阻害化合物(エンドスタチン、カテキン、栄養補助食品、ケモカインIP−10、マトリックスメタロプロテイナーゼ(MMPIs)インヒビター、アナステリン、ヴィロネクチン、アンチトロンビン、チロシンキナーゼインヒビター、VEGFインヒビター、受容体に対する抗体、ハーセプチン(Herceptin(登録商標))、アヴァスチン(Avastin(登録商標))、パニツムマブ、他)、IFN(α、β又はγ)、G−CSF、TPO、EPO、PtHR、アンギオゲニン等の抗菌剤、カテリシジン、GPCRペプチドリガンド、ヒト成長ホルモン、抗炎症ペプチド(BPI、リポコルチン含む)、サイトカイン(インターロイキン10、4及び13を含む)、腸ホルモン(セクレチン、ガストリン、コレシストキニン、VIP、GIP、モチリン、エンテログルカゴンを含む)、受容体活性化用合成ペプチド(ペプチドミメティックス)が挙げられる。
【0037】
腸の健康と免疫性のための治療薬は、腸管内腔(特に腸粘膜を通る)から腸への輸送に特に関連しており、必ずしも完全に腸上皮を通過して血流に到達しない。このような治療薬は、腸組織の機能の向上に用いることができる。これらには、アンギオゲニン、特に腸機能向上活性又は抗菌活性に最適化されたRNase5、RNase4、抗菌剤、抗炎症ペプチド(合成ペプチド、BPI、リポコルチン含む)、サイトカイン(インターロイキン10、4及び13を含む)、腸ホルモン(セクレチン、ガストリン、コレシストキニン、VIP、GIP、モチリン、エンテログルカゴンを含む)及び小児脂肪便症又は過敏性大腸症候群における免疫応答をブロックすると特徴づけられている剤のいずれもが含まれる。
【0038】
また、本発明によれば、前記剤は、抗がん剤等の小分子薬剤であってもよい。本発明において抗がん剤は、例えば本発明の担体に結合可能な基を有する薬剤を含むことができる。抗がん剤の例としては、パクリタキセル(タキソール)、ドセタキセル、ヴィンブラスチン、ヴィンクリスチン、エトポシド、ドキソルビシン、シクロホスファミド、タキソテレ、メルファラン、クロラムブシル及びこれらの組み合わせからなる群から選択される薬剤が挙げられるが、これらに限定されない。レプチンは肥満の治療に使用することができる。
【0039】
「小分子薬剤」とは、分子量1000g/mol以下を有する薬剤を意味すると意図される。
【0040】
本発明においては、一以上の担体結合サイトが利用可能又は存在する際、一以上の剤が本発明の担体に結合できることが理解されよう。従って、コンジュゲートは、一以上の剤を含むことができる。コンジュゲートは、それ自身が活性を有してもよい。すなわち、剤が担体に結合されていても剤が活性を有してもよい。更に本発明によれば、前記担体から化合物が放出されてもされなくてもよい。すなわち、通常、化合物は、胃腸管内に、又は胃腸管を超えて輸送された後に放出されてもよい。従って、この化合物は、コンジュゲート(又は担体)から放出され、その後活性を有してもよい。より詳細には、剤は、胃腸管内に、又は胃腸管を超えて輸送された後に担体から放出されてもよい。
【0041】
本発明の更なる態様は、動物(例えば患者)の治療方法であって、本発明のコンジュゲート及び/又医薬組成物を前記動物に投与することを含む方法に関する。
【0042】
[アンギオゲニン]
本発明で使用されるアンギオゲニンは、いかなる種からも得ることができるが、特にヒト、ウシ、ブタ、ウマ、鳥類、ヒツジ、ラット、ニワトリ、七面鳥又はマウスから得られるアンギオゲニンを含む。アンギオゲニンは、配列番号1(ヒト)、配列番号2(ウシ)、配列番号3(マウス)、配列番号4(ニワトリ)、配列番号5(ウサギ)、配列番号6(ブタ)、配列番号7(ウマ)、アンギオゲニンをコードする他の配列又は細胞培養において筋芽細胞の成長を誘起することが可能なこれらの機能的フラグンメントを含むことができる。
【0043】
【表1】

【0044】
【表2】

【0045】
前記アンギオゲニンは、公知のアンギオゲニンのアミノ酸配列に対して一以上の保存的なアミノ酸置換を含むことができる。保存的なアミノ酸置換の例として、Phe/Tyr、Ala/Val、Leu/IIe、Arg/His、Ser/Thr等が挙げられるが、これらに限定されない。アンギオゲニンは、公知のアンギオゲニンのアミノ酸配列に対して一以上のアミノ酸残基の挿入又は欠失(切断を含む)も含むことができる。さらに、前記アンギオゲニンは、一以上の自然多型性を含むことができる。前記アンギオゲニンは、完全に又は部分的に合成されたものでもよい。また、アンギオゲニンは、コンセンサス配列であってもよく、このコンセンサス配列は、例えば、二種以上からアンギオゲニンをコードする配列を比較し、標準的な方法によりそれらから誘導することによって得られる。最適化されたアンギオゲニン配列は、例えば、より高い活性、プロテアーゼ耐性等を与える変異を含む配列であってもよい。特に最適化されたアンギオゲニン配列においては、RNase活性が低減又は抑止されている。
【0046】
特殊なフラグメントと変異体は、触媒コア又は細胞結合サイトをコードする配列等のドメインを一以上含む。「触媒コア」とは、シグナルペプチドとN−末端及びC−末端可変領域を除くポリペプチドの内部領域を意味する。
【0047】
アンギオゲニンの異なる二領域は、血管新生活性のために必要である。これら領域は、His−13、Lys−41及びHis−115を含み、RNA及び最小限残基60〜68を含む非触媒細胞結合サイトを切断できる触媒サイトを含む。RNase活性と受容体結合能は必要ではあるが、血管新生活性のためには十分ではない。細胞内取込みと核転座も必要とされる。
【0048】
活性は、活性サイト及びその近傍のキーとなるアミノ酸を変更することにより増減することができ、Asp−116をHisに置換する高い活性がその一例である。機能的研究からArg−5及びArg−33も活性にとって重要であることがわかっている。
【0049】
RNaseのプロテアーゼ及び熱に対する安定性向上は、可能であるので、RNase5/アンギオゲニンの安定性とプロテアーゼ耐性は、改善可能である。これにより、コンジュゲート又は医薬組成物の送達の促進が可能となる。
【0050】
酵素的不活性の変異体は、内在化できるので、増殖する上皮細胞におけるアンギオゲニンの細胞取り込みは、ドメインに媒介され、RNase活性には依存しない。例えば、K41Q及びH13A変異体は、酵素的に不活性であるが、転座される。より容易に細胞に内在化され高活性な改善アンギオゲニンは、本発明の範囲に含まれ、このような変異体は、インヴィトロでの取り込みと培養中の上皮細胞及び筋細胞での活性試験によりテストすることができる。
【0051】
細胞輸送アンギオゲニンには、受容体結合と細胞内取込みが維持改善される必要がある。腸送達機能及び細胞送達機能が改善された変異体は、インヴィトロでのcaco−2腸上皮細胞系において試験され、スクリーニングされ得る。
【0052】
改善アンギオゲニンについては、より容易に細胞に内在化してより強力なものが望まれており、このような変異体は、インヴィトロの取り込みと培養中の上皮細胞及び筋細胞(マウス)での活性試験によりテストすることができる。
【0053】
本発明においては、いかなるアンギオゲニンも使用することができ、これには
マウス、ヒト、ウシ、ヒツジ等から得られるアンギオゲニンが含まれる。
【0054】
一般に、アンギオゲニンは、アミノ酸配列として少なくとも約70%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約98%以上の同一性を公知のアンギオゲニン配列に対して有することが好ましい。配列の類似性は、保存されたモチーフ等の大きな配列のサブセットである参照配列に基づいて計算される。配列分析用のアルゴリズムは、当業界で知られており、例えば、アルシュールらのJ.Mol.Biol.215:403〜10(1990)(デフォルトセッティングを用いた)に記載のBLASTがある。
【0055】
ストリンジェントなハイブリダイゼーション条件下において、公知のアンギオゲニンコード配列にハイブリダイズする核酸分子によってコードされるアンギオゲニン配列も好ましい。ストリンジェントなハイブリダイゼーション条件の一例は、50(C以上で0.1×SSC(15mM塩化ナトリウム/1.5mMクエン酸ナトリウム)である。ストリンジェントなハイブリダイゼーション条件の他の例は、溶液(50%ホルムアミド、1×SSC(150mM塩化ナトリウム/15mMクエン酸ナトリウム)、50mMリン酸ナトリウム(pH:7.6)、5×デンハール溶液、10%硫酸デキストラン及び20μg/ml変性・切断サケ精子DNA)中で42℃において一昼夜インキュベーションを行い、その後フィルターを約65℃で0.1×SSCで洗浄することである。例えば、高ストリンジェント条件は、65℃、約8時間(以上)の6×SSC(20×SSCが3.0M NaCl及び0.3Mクエン酸ナトリウムを含む)、1%ドデシル硫酸ナトリウム(SDS)における水溶液によるハイブリダイゼーション(例えば、ホルムアルデヒドを含まず)と、それに続く0.2×SSCと0.1%SDSの65℃における一回以上の洗浄を含む。例えば、中程度のストリンジェント条件は、65℃、約8時間(以上)の6×SSC、1%SDSにおける水溶液によるハイブリダイゼーション(例えば、ホルムアルデヒドを含まず)と、それに続く2×SSCと0.1%SDSの室温における一回以上の洗浄を含む。
【0056】
[治療薬]
本発明に使用される治療薬は、経口バイオアベイラビリティーを有さないか、または限定的なバイオアベイラビリティーしか有さない治療薬である。
【0057】
本治療薬は、胃腸管においては十分安定であり、腸粘膜の透過、又は血流への進入が困難であるのが好ましい。また、本治療タンパク質又はペプチドは、カプセル化、腸溶性コーティング等により胃腸管内で保護されている。理想的には、このような保護作用は、アンギオゲニン及び治療タンパク質又はペプチドが大腸に達するまで維持され、アンギオゲニンが腸粘膜を通って、任意的には腸上皮を超えて血流に放出されるよう、能動的又は受動的に治療薬を輸送できる。
【0058】
本明細書において「十分に安定な」とは、投与された剤が、胃腸管の30分間曝露された後に少なくとも20%残存することを意味する。
【0059】
一実施形態において、治療タンパク質又はペプチドは、20以下のアミノ酸のペプチドであり、本発明の経口デリバリーシステムを利用して投与された際、実質的な経口活性を提供できる。このような治療ペプチドの例としては、α-メラノサイト刺激ホルモン、バソプレシン、オキシトシン、エンケファリン、ソマトスタチン及びACV1を含むコノトキシン類が挙げられる。
【0060】
一実施形態において、本治療タンパク質又はペプチドは、21〜40のアミノ酸のペプチドであり、例えば、実施例に記載する副甲状腺ホルモン(PTH1−34)である。このような治療タンパク質又はペプチドの他の例としては、グルカゴン様ペプチド(GLP−1)、カルシトニン、PYY3−36、オキシントモジュリン、消化管抑制ペプチド(GIP)、エンドルフィン及びスーパーファミリーの関連するものが挙げられる。
【0061】
一実施形態において、本治療タンパク質又はペプチドは、41〜60のアミノ酸のペプチドである。このような治療ペプチドの例としては、インスリン及びインスリン様成長因子−1(IGF−I)が挙げられる。
【0062】
一実施形態において、本治療タンパク質又はペプチドは、61〜80のアミノ酸のペプチドである。
【0063】
一実施形態において、本治療タンパク質又はペプチドは、80より大きいアミノ酸のペプチドである。このような治療タンパク質又はペプチドの可能な例としては、成長ホルモン、インターロイキン及び他の大型成長因子が挙げられる。
【0064】
本発明の方法によって送達される鍵分子には、インターフェロンα、β、G−CSF、TPO、EPO、PtHR、抗菌剤様カテリシジン類、GPCRペプチドリガンド及びhGHや前述の受容体(ペプチドミメティックス)及び腸改善剤を活性化するように設計された合成ペプチドが挙げられる。
【0065】
[結合]
治療薬の経口バイオアベイラビリティーを改善するためにはアンギオゲニンに結合させる必要がある。この結合は共有結合でも非共有結合でもよい。当業者には、治療薬の機能とアンギオゲニンの胃腸管透過能力を維持する適切なリンカーは明白であろう。
【0066】
一実施形態においては、アンギオゲニンは、アンギオゲニンのN末端を介して治療薬に結合させる。他の実施形態においては、アンギオゲニンは、アンギオゲニンのC末端を介して治療薬に結合させる。治療薬がタンパク質又はペプチドであれば、アンギオゲニンにアンギオゲニンのN末端又はC末端を介して結合させる。
【0067】
アンギオゲニンと治療薬は、治療薬にバイオアクティビティを与えるいずれかの簡便な方法によって結合させることができる。アンギオゲニンは比較的大分子(100超のアミノ酸)であるので、組み換え法又はミルク又は血漿からの分離と、続く分離と酵素法による治療薬への結合によって合成することが好ましい。あるいは、全コンジュゲート又は融合タンパク質は組み換え法で合成することができる。当業者には適切な方法は良く知られているであろうし、ある状況において最も簡便な方法は容易に選択され得る。
【0068】
好ましい結合サイトは、治療薬の性質により変化するであろう。一特異的実施形態においては、コンジュゲートは、治療タンパク質又はペプチドのC末端に結合するアンギオゲニンのN末端を含むが、これは主にどの付加点がバイオアクティビティを保存するかに依存する。
【0069】
一実施形態においては、アンギオゲニンと治療薬は、ポリグリシン等のスペーサーを用いて分離される。スペーサーを使用すると立体障害と後続の治療薬活性低下を防止することができる。
【0070】
一旦治療薬が粘膜層に進入したか、または胃腸管を通って血流に存在した場合、アンギオゲニンの存在による治療薬のいかなる活性阻害も防止するために前記治療薬からアンギオゲニンが切断されるよう、前記スペーサー又はリンカーは、腸上皮に存在する酵素又はアンギオゲニンと治療薬の間のプロテアーゼに対する切断サイトを有することができる。
【0071】
融合タンパク質の末端の保護基等、タンパク質に化学修飾を付加すると、D−アミノ酸がC末端又はN末端に導入された、あるいは他のアミノ酸修飾がC末端及びN末端に導入された合成コンジュゲートにプロテアーゼ耐性が提供されるであろう。
【0072】
[コンジュゲート]
本明細書において定義されるコンジュゲートは、本明細書において定義される治療薬に任意の程度で結合された本明細書において定義されるアンギオゲニンを含む。アンギオゲニンは、同一であっても異なっていてもよい一以上の治療薬に結合させることができる。複数種の治療薬の結合には、ポリリシンリンカーを使用することができる。
【0073】
[医薬組成物]
本発明はその一態様において、病態の予防又は治療に有用な各種医薬組成物を提供する。本発明の一実施形態において、医薬組成物は、本発明の第三の態様の融合タンパク質又はコンジュゲート又はその類似体、誘導体又は塩を担体、賦形剤及び添加剤又は助剤を用いて対象への投与に適した剤形に調製される。
【0074】
通常使用される担体や助剤として、炭酸マグネシウム、二酸化チタン、ラクトース、マンニトール、その他糖類、タルク、ミルクプロテイン,ゼラチン、スターチ、ビタミン類、セルロース及びその誘導体、動植物油,ポリエチレングリコール及び溶媒(滅菌水、アルコール、グリセロール、多価アルコール等)が挙げられる。他の医薬的に許容される担体には無毒性賦形剤があり、これには塩類、保存料、バッファー等が含まれる。これら担体は、レミントンファーマシューティカルサイエンス20版、ウイリアムス&ウイルキンス(2000)及びブリティッシュナショナルフォーミュアリー43版(ブリティッシュメディカルアソシエーション及びロイヤルファーマシューティカルソサイエティオブグレートブリテン、2002;http://bnf.rhn.net)に記載されている。これらの記載を、本明細書の一部を構成するものとしてここに援用する。
【0075】
保存料としては、抗菌剤、酸化防止剤、キレート剤が挙げられる。本医薬組成物の種々の成分のpHと正確な濃度は、当業界の通常の方法に従って調整される。グッドマン及びギルマンの治療のための薬理学基礎(第7版、1985)を参照されたい。
【0076】
本医薬組成物は、投与単位として調製及び投与されることが好ましい。固体投与単位としては、錠剤、カプセル剤、座剤が挙げられる。対象を治療するに際し、化合物の活性、投与方法、病態の特徴と重度、対象の年齢と体重に応じて、異なる日用量で投与され得る。しかしながら、状況によっては日用量の増減が適切かもしれない。日用量の投与は、個々の投与量又は複数の少な目の投与単位の単回投与、及び小分けにした投与量を一定の間隔で多数回投与することによって行える。
【0077】
本発明の医薬組成物は、カプセル化又は腸溶性コーティングにより胃腸管においてその分解が低減されるという利点を享受することができる。
【0078】
本発明に係る医薬組成物は、その治療有効量を投与できる。もちろん、この使用のための有効量は、疾病の重度と対象の体重と全身状態に依存する。通常、インヴィトロにおける投薬量は、本医薬組成物のその場投与に有用な量についての良い目安とすることができる。また、細胞障害性の副作用を治療する効果的投薬量を決定するためには動物モデルを使用することができる。
【0079】
経口用製剤は硬ゼラチンカプセル剤とすることができ、カプセル内で有効成分は不活性な固体希釈剤と混合されている。固体希釈剤としては、炭酸カルシウム、リン酸カルシウム、カオリンが挙げられる。経口用製剤は、軟ゼラチンカプセル剤とすることで、カプセル内で有効成分は水又は油性媒体と混合されている。油性媒体としてはピーナツオイル、流動パラフィン、オリーブオイルが挙げられる。
【0080】
水性サスペンジョンも経口用には適しており、通常、有効物質を水性サスペンジョンの製造に適した賦形剤(例えば生理食塩水)との混和物として含有する。このような賦形剤としては、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロシプロピルメチルセルロース、アルギン酸ナトリウム、ポリビニルピロリドン、トラガカントゴム、アカシアゴム等の懸濁剤や分散剤又は湿潤剤が挙げられる。分散剤又は湿潤剤として、以下のものであってもよい。
(a)レシチン等の天然ホスファチド、
(b)アルキレンオキシドと脂肪酸との縮合物(例えば、ポリオキシエチレンステアレート)、
(c)エチレンオキシドと長鎖脂肪族アルコールとの縮合物(例えば、ヘプタデカエチレンオキセタノール)、
(d)エチレンオキシドと脂肪酸とヘキシトールから得られる部分エステルとの縮合物(例えば、ポリオキシエチレンソルビトールモノオレエート)又は
(e)エチレンオキシドと脂肪酸とヘキシトール無水物から得られる部分エステルとの縮合物(例えば、ポリオキシエチレンソルビタンモノオレエート)。
【0081】
本発明のコンジュゲートの投与濃度は、コンジュゲートの有効性に応じて大きく変化し、通常体重1kgあたり約1μg〜約5mgのオーダー(患者1日あたり約100μg〜約500mgのオーダー)である。担体材料と組み合わせて単回投与量を決めることが可能な有効成分量は、治療対象のホストと個々の投与方法のよって変化する。例えば、ヒトへの経口投与が意図される製剤は、約100μg〜500mgの活性化合物を適切且つ簡便な量の担体材料と共に含有することができる。担体材料の量は、組成物全体に対して約5%〜95%とすることができる。単位投与量形態は、通常約5mg〜500mgの有効成分を含む。
【0082】
しかしながら、どの患者についても具体的な投与濃度は、種々の因子に依存することが理解されよう。これら因子には、用いられる特定化合物の活性、年齢、体重、通常の健康状態、性別、食事、投与回数、投与経路、排せつレート、薬物の組み合わせ、治療中の特定の疾病の重度が含まれる。
【0083】
[食品及び栄養補助食品]
融合タンパク質又はコンジュゲートは、例えば、機能性食品又は動物用餌の食品組成物として投与することができる。このような食品は、どんな個体の摂取にも適している。本明細書において「個体」とは、ヒト及びヒト以外の個体を含む。ヒト以外の個体の例としては、動物、特に哺乳類(ウシ、ブタ、ヒツジ、ヤギ等の家畜)、家禽類、ペット及び愛玩動物(ウマ、ネコ、イヌ、モルモット、ラットマウス等)、水生動物(水産養殖用の魚類及び動物)等が挙げられる。
【0084】
「栄養補助食品」とは、疾患の予防及び治療を含む医学上の利益及び/又は健康上の利益を提供する食品又は食品の一部を意味する。
【0085】
栄養補助食品製品は、単離栄養分、食品サプリメント及び食餌から遺伝子工学改変食品、健康食品、ハーブ製品及びシリアル、スープ、飲料等の加工食品にまで及ぶ。「健康食品」とは、伝統的栄養素を上回る健康上の利益を提供し得る調製食品及び食品成分のいずれかを含む食品を意味する。
【0086】
対象とする栄養補助食品には、獣医用途又はヒト用途の食品が含まれ、これらはバーフード(シリアルバー、朝食バー、エネルギー補給バー、栄養補給バー等)、チューイングガム、ドリンク、強化ドリンク、ドリンクサプリメント(ドリンクに入れる粉末)、タブレット等を含む。
【0087】
本発明の食品又は栄養補助食品は、第三の態様の融合タンパク質又はコンジュゲートと少なくとも一種の食品用成分を含む。好ましい成分として、単糖類及び二糖類、炭水化物、タンパク質、アミノ酸、脂肪酸、脂質、安定化剤、保存料、香味料、着色料、甘味料、酸化防止剤、キレート化剤、担体、テクスチャラント、栄養素、pH調整剤、乳化剤、安定化剤、ミルクベース固形分、食物繊維等が挙げられるが、これらに限定されない。食品成分は天然原料から単離することもでき、合成で得ることもできる。すべての成分は、人が食べるのに適した食品用成分である。
【0088】
好ましい単糖類の例としては、ソルビトール、マンニトール、エリトロース、トレオース、リボース、アラビノース、キシロース、リブロース、グルコース、ガラクトース、マンノース、フルクトース、ソルボースが挙げられる。好ましい二糖類の例としては、スクロース、マルトース、ラクチトール、マルチトール、マルツロース、ラクトースが挙げられるが、これらに限定されない。
【0089】
好ましい炭水化物は、オリゴ糖類、多糖類及び/又は炭水化物誘導体である。本明細書において「オリゴ糖」とは、3〜9の単糖ユニットを有する消化可能な直鎖状分子であって、これらユニットは、グリコシド結合により共有結合されている。本明細書において「多糖」とは、9より大きい単糖ユニットを有する消化可能(すなわち、ヒト体内において代謝可能)な高分子であって、これらユニットは、グリコシド結合により共有結合されている。多糖類は、直鎖であっても分枝であってもよい。本発明においては、多価アルコール(例えば、グリセロール)等の炭水化物誘導体も複合炭水化物として使用できる。本明細書において炭水化物に関して「消化可能」とは、ヒト体内において生産される酵素により代謝可能である炭水化物を意味する。消化不可能な炭水化物である多糖類の例としては、セルロース、難消化性デンプン(未精製コーンスターチ)、退行性アミロース(高アミロースコーンスターチ)が挙げられる。炭水化物の例としては、ラフィノース、スタキオース、マルトトリオース、マルトテトラオース、グリコーゲン、アミロース、アミロペクチン、ポリデキストロース、マルトデキストリンが挙げられるが、これらに限定されない。
【0090】
好ましい脂肪としては、短鎖トリグリセライド(C2〜C4)及び長鎖トリグリセライド(C16〜C22)を含むトリグリセライドが挙げられるが、これらに限定されない。
【0091】
好ましいテクスチャラント(可溶性繊維とも称される)の例としては、ペクチン(高エステル、低エステル)、カラギーナン、アルギネート(アルギン酸、アルギン酸ナトリウム、アルギン酸カリウム、アルギン酸カルシウム等)、グアーガム、ローカストビーンガム、サイリウム、キサンタンガム、アラビアゴム、フラクトオリゴ糖、イヌリン、寒天及びこれら二種以上の機能的ブレンドが挙げられるが、これらに限定されない。
【0092】
好ましい乳化剤としては、プロピレングリコールモノステアレート(PGMS)、ナトリウムステアロイルラクチレート(SSL)、カルシウムステアロイルラクチレート(CSL)、モノグリセリド、ジグリセリド、モノジグリセリド、ポリグリセロールエステル、乳酸エステル、ポリソルベート、スクロースエステル等が挙げられるが、これらに限定されない。
【0093】
食物繊維は、多糖類、オリゴ糖類、リグニン及び関連する植物物質である。好ましい食物繊維としては、甜菜ファイバー、アップルファイバー、エンドウマメファイバー,小麦ファイバー、エンバクファイバー、大麦ファイバー、ライ麦ファイバー、米ファイバー、ジャガイモファイバー、トマトファイバー、他の植物の非デンプン多糖ファイバー及びこれらの組み合わせが挙げられるが、これらに限定されない。
【0094】
好ましい調味料としては、天然及び合成のフレーバーであって、「ブラウンフレーバー(コーヒー、ティー等)、乳製品フレーバー、フルーツフレーバー、バニラフレーバー、エッセンス剤、エキス剤、樹脂油剤、濃縮ジュース・ドリンク、フレーバー構成要素(δ−ラクトン、ケトン等)等、及びこれらフレーバーの組み合わせが挙げられる。植物由来のフレーバーの例としては、茶(好ましくは、ブラックティーや緑茶)、アロエベラ、ガラナ、チョウセンニンジン、いちょう、サンザシ、ハイビスカス、ローズヒップ、カモミール、ペパーミント、ウィキョウ、ショウガ、カンゾウ、蓮の実、シザンドラ、ノコギリヤシ、サルサパリラ、サフラワー、セイヨウオトギリソウ、ウコン、カルダモン、ナツメグ、ケイヒ、ジオスミン、シナモン、ジャスミン、サンザシ、キク、ヒシ、サトウキビ、レイシ、タケノコ、バニラ、コーヒー等が挙げられる。
【0095】
好ましい甘味料としては、アリテーム、デキストロース、フルクトース、ラクチロール、ポリデキストロース、キシリトール、キシロース、アスパルテーム、サッカリン、シクラメート、アセスルファームK、L−アスパルチル−L−フェニルアラニン低級アルキルエステル甘味料、L−アスパルチル−D−アラニンアミド、L−アスパルチル−D−セリンアミド、L−アスパルチル−ヒドロキシメチルアルカンアミド甘味料、L−アスパルチル−1−ヒドロキシエチルアルカンアミド甘味料等が挙げられるが、これらに限定されない。
【0096】
好ましい酸化防止剤としては、トコフェロール(天然、合成)、パルミチン酸アスコルビル、ガレート、ブチル化ヒドロキシアニソール(BHA)、ブチル化ヒドロキシトルエン(BHT)、tert−ブチルヒドロキノン(TBHQ)等が挙げられるが、これらに限定されない。
【0097】
好ましい栄養素としては、ビタミン類及びミネラル類が挙げられ、ナイアシン、チアミン、葉酸、パントテン酸、ビオチン、ビタミンA、ビタミンC、ビタミンB2、ビタミンB3、ビタミンB6、ビタミンB12、ビタミンD、ビタミンE、ビタミンK、鉄、亜鉛、銅、カルシウム、リン、ヨウ素、クロム、モリブデン、フッ化物等が含まれるが、これらに限定されない。
【0098】
好ましい着色料としては、FD&Cダイ(例えば、イエロー#5、ブルー#2、レッド#40)、FD&Cレークス、リボフラビン、β−カロテン、天然着色剤(フルーツエキス剤、野菜エキス剤及び/又は植物エキス剤(グレープ、クロフサスグリ、アロニア、ニンジン、ビート根、赤キャベツ、ハイビスカス等))が挙げられるが、これらに限定されない。
【0099】
保存料の例としては、ソルベート、ベンゾエート及びポリリン酸塩の各保存料が挙げられる。
【0100】
好ましい乳化剤としては、ジグリセリド、モノグリセリド、モノ及びジグリセリド酢酸エステル、モノ及びジグリセリドジアセチル酒石酸エステル、モノ及びジグリセリドクエン酸エステル、モノ及びジグリセリド乳酸エステル、脂肪酸、脂肪酸ポリグリセロールエステル、プロピレングリコール脂肪酸エステル、ソルビタンモノステアレート、ソルビタントリステアレート、ナトリウムステアロイルラクチレート、カルシウムステアロイルラクチレート等が挙げられるが、これらに限定されない。
【0101】
好ましいpH調整剤としては、有機及び無機の食用の酸が挙げられる。これらの酸は非解離の状態で存在させることができる他、それぞれの塩(例えばリン酸水素カリウム又はナトリウム、リン酸二水素カリウム又はナトリウム)として存在させることもできる。酸としては、食用の有機酸であって、クエン酸、リンゴ酸、フマル酸、アジピン酸、リン酸、グルコン酸、酒石酸、アスコルビン酸、酢酸、リン酸及びこれらの混合物が挙げられる。
【0102】
本発明の食品/栄養補助食品は、融合タンパク質又はコンジュゲートを約0.01重量%〜約50重量%含むことができる。例えば、約0.01重量%〜約0.1重量%、約0.1重量%〜約0.5重量%、約0.5重量%〜約1.0重量%、約1.0重量%〜約2.0重量%、約2.0重量%〜約5重量%、約5重量%〜約7重量%、約7重量%〜約10重量%、約10重量%〜約15重量%、約15重量%〜約20重量%、約20重量%〜約25重量%、約25重量%〜約30重量%、約30重量%〜約35重量%、約35重量%〜約40重量%、約40重量%〜約45重量%、約45重量%〜約50重量%である。
【0103】
前記食品が飲料である場合、その食品は、通常約50容量%以上の水を含む。例えば、約50容量%〜約60容量%、約60容量%〜約95容量%、約60容量%〜約70容量%、約70容量%〜約80容量%、約80容量%〜約90容量%、約90容量%〜約95容量%である。
【0104】
前記食品がバーである場合、その食品は、通常約15容量%以下の水を含む。例えば、約2容量%〜約5容量%、約5容量%〜約7容量%、約7容量%〜約10容量%、約10容量%〜約12容量%、約12容量%〜約15容量%である。
【0105】
いくつかの実施形態においては、食品/栄養補助食品は、本質的に乾燥状態にある。すなわち、約5%以下の水を含む。
【0106】
単糖類、二糖類及び複合炭水化物が存在する場合、それぞれ重量基準で通常約0.1%〜約15%含まれる。例えば、約0.1%〜約1%、約1%〜約5%、約5%〜約7%、約7%〜約10%、約10%〜約15%である。可溶性繊維、食物繊維及び乳化剤が存在する場合、それぞれ重量基準で通常約0.1%〜約15%含まれる。例えば、約0.1%〜約1%、約1%〜約5%、約5%〜約7%、約7%〜約10%、約10%〜約15%である。
【0107】
上述の他の成分が存在する場合、組成物に対し約0.001重量%〜約5重量%で存在する。
【0108】
[治療方法]
本発明の融合タンパク質、コンジュゲート、医薬品、食品、栄養補助食品、餌組成物は、治療薬を経口投与し、その治療薬によって治療可能な、いかなる病態の治療方法に使用することもできる。
【0109】
本明細書において「治療」とは、病態の予防又は病態の軽減を含むものと意図される。
【0110】
本発明により治療される病態は、前記治療薬によって治療される病態のいずれかである。
【0111】
以下の発明の説明及び特許請求の範囲において、文脈上で表現又は必然的含蓄が記載される必要がある場合を除き、「含む(comprise)」又はその変化したもの(comprises又はcomprising)は包括的な意味において使用される。すなわち、記述された特徴の存在を明示するが、本発明の種々の実施形態における更なる特徴の存在又は追加を排除しない。
【0112】
特に文脈にて明確に定められない限り、単数形「a」、「an」及び「the」は、複数形の言及も包含する。従って、例えば、「ペプチド」への言及は複数の該ペプチドを包含し、「アミノ酸」への言及は一以上のアミノ酸について言及する。
【0113】
数値範囲が記載される場合、この範囲は上限、下限及びその間の全ての数値を含むことは明らかに理解されよう。
【0114】
定義がなされていない限り、本明細書で使用されるすべての技術科学用語は、本発明が属する技術分野における通常の知識を有する者が一般に理解する意味と同じ意味を有する。本明細書に記載された内容と類似又は同様の材料及び方法のいずれもが本発明を実施又は試験するために使用又は利用できるが、好ましい材料及び方法を記載する。
【0115】
本明細書に記載の個々の材料及び方法は変更され得るので、本発明はこれらに限定されないことは明らかに理解されよう。本明細書で用いられる術語は個々の実施形態を記載する目的でのみ使用されており、添付のクレームのみによって限定される本発明の範囲を限定しないことも明らかに理解されよう。
【0116】
明示されない限り、本発明においては、通常の化学、タンパク質化学、分子生物学、酵素学の各技法を当業者の能力の範囲において利用される。このような技法は、当業者によく知られており、文献に詳細に説明されている。
【0117】
本発明を実施例と図面によって詳細に説明するが、これらは例示の目的のみであり、本発明を限定するものではない。
【実施例】
【0118】
[実施例1]組換えウシアンギオゲニンのプロテアーゼ耐性試験
ペプシン(ブタ胃粘膜タイプA;シグマ900−75−6)による消化に供するために、bAng(30μg)を調製した。消化を酵素/基質の比1:20で行い、実験を、温度とpHを一定条件(37℃、pH3)に制御して行った。サンプルは15分毎に取り出し、全消化時間を120分とした。各サンプルを素早く−80℃で急激に凍結して消化プロセスを停止した。ペプシン消化後、影響を受けなかったbAngのレベルをSDS PAGEで解析した。クマッシーブルーでゲルを染色し、オデッセイイメージングシステムV3.0でバンド密度を定量した。図1に本来のbAngのペプシン消化の様子を示す。図1に示すように、バンド密度の定量の結果、胃を模した条件における2時間の消化後、75%のbAngタンパク質が影響を受けない非分解タンパク質であった。
[実施例2]組み換え微生物を用いたアンギオゲニン融合タンパク質の生産
【0119】
N末端及びC末端αMSH.bAng構造体は、pET30Cベクターを用いて生成された。構造体を集積し、PCRで増幅し、制限サイトNdeI及びXhoIとαMSHを提供した(図2、3参照)。この生成物を、NdeI及びXhoIで消化後のpET30Cベクターの同じサイトにクローン化した。プライマー配列を示す(図4)。構造体の配列はDNAシ−ケンシングにより確認した(図5a、5b)。
【0120】
pET30C/bAng.α−MSH及びpET30C/α−MSH.bAngを保持する大腸菌BL21(DE3)pLysS株(E.coli strain BL21(DE3)pLysS)を用いて、rbAng融合タンパク質を発現させた。単離された封入体を6M塩酸グアニジン(GdnHCl)、100mM Tris/HCl(pH8)、1mM EDTA、100mM NaCl、10mM DTTを含む変性バッファーにタンパク質濃度約5mg/mlで溶解した。この変性溶液をゆっくりと希釈して、0.2mg/mlタンパク質、0.5mM DTT、0.3M GdnHClと100mM Tris/HCl(pH8)、1mM EDTA、0.3mM GSSG、1.5mM GSHの再生バッファーとした。続いてこの溶液を開放容器にて攪拌せずに4℃で72時間インキュベートした。再生終了後、溶液を限外濾過にて濃縮し、milliQウォーターに対して4℃で透析した。その後、ピアースストロングカチオン交換ミニスピンカラムに、製造指示に従ってロードした。rbAng融合タンパク質は、1M NaClで溶出させた。図6に精製組み換えタンパク質を示す。
[実施例3]放射性ラベルN末端及びC末端アンギオゲニン融合タンパク質は、マウスに経口強制給餌後15分以内に血流に吸収される。
【0121】
bAng.α−MSH及びαMSH.bAng.の両者合計200μgを実施例2に説明したプロトコールを用いて精製した。クロラミン−T・メタ重亜硫酸ナトリウム(CT/SMB)ヨウ素化によって、融合タンパク質各々(20μg)を1.0mCiの125Iでラベルした。遊離の、又は取り込まれなかった125Iは、PD10タンパク質カラムを用いたHPLCによってラベル化bAng.α−MSH及びαMSH.bAng.から分離した。125Iの取り込み率は、両タンパク質について79%で、これはマウスの経口強制給餌において合計790μCiのラベル化bAng.α−MSH及びαMSH.bAng.構造体が得られることに相当した。ラベル化bAng.α−MSH及びαMSH.bAng.は、個々の動物強制給餌する前にそれぞれ3.0mLに希釈した。
【0122】
実験には、C57Black/6Jマウス(雄性、30匹、8週齢)を用いた。マウスは午前11時00分に体重が測定され、強制給餌後のサンプリング(15、30、45、60、120、180分)に振り分けた(n=2又は3、各サンプリング時間にbAng.α−MSH及びαMSH.bAng.に対して)。各動物は強制給餌により適切な放射性ラベル溶液(200μL、53μCi相当)を投与し、15、30、45、60、120、180分に頸椎脱臼により殺した。
【0123】
血液は心臓穿刺により採取し、氷中に置いたヘパリン処置済チューブに入れ、−20℃で保存した。液体窒素で急激に凍結する前に脳を取り出し、重量を測定した。心臓、肝臓、腎臓、大腿四頭筋は、重量測定及びクランプして液体窒素中で急激に凍結する前に素早く切開して取り出した。切開後の組織は−80℃で保存した。
【0124】
各組織の放射能測定は、約40mgの組織を300μlの氷冷RIPAバッファー(50mM Tris−HCl(pH7.4)、150mM NaCl、1mM EDTA、1%NP−40、25%デオキシコール酸ナトリウム、1μg/ml Pics 1、1μg/ml Pics 2、2mM PMSF、1mM ピロリン酸ナトリウム、10mM NaF、1mM NaVO4)を含むエッペンドルフ管(2ml)に入れた。続いてハンドヘルドプロ200ホモジナイザー(プロサイエンティフィック社、オックスフォード、CT、米国)で約10秒間又は組織残留物の塊が見えなくなるまで組織をホモジナイズした。ホモジナイズ後、各サンプルを液体窒素で凍結保存し、分析に先立ち氷上で解凍した。解凍されると、サンプルを激しく5秒間ボルテックスして、4℃、3000gで30秒遠心した。その後、サンプルを100μlのデュプリケートで1分間ガンマカウンター(コブラII、オートガンマ、パッカードバイオサイエンス社)で測定した。
【0125】
ホモジナイズ後の各サンプルのタンパク質濃度をピアースBCAタンパク質アッセイ(サーモサイエンティフィック、ロックフォード、IL、米国)で分析した。サンプルは、RIPAバッファーで40倍に希釈して分析した。
【0126】
血液サンプルは、ヴォルテックスによる十分な混合に先立ちMQウォーターで30倍に希釈して分析した。サンプルを100μlのデュプリケートでチューブに添加し、上述のようにカウントを行った。
【0127】
図7a.に経口強制投与後15分以内にC57Black/6Jマウスの血液中に8%を超える摂取されたαMSH.bAng.が存在していたことを示す。このレベルは実験期間を通じて維持されていた。同様のbAng.αMSHの血液への取り込みが観察された(図8a.)。比較的低いレベルが肝臓において(摂取量全体の約0.6%)、また、腎臓において(摂取量全体の約0.2%)観察された(αMSH.bAng.については図7b.、bAng.αMSHについては図8b.)。大腿四頭筋、心臓及び脳への取り込みは、αMSH.bAng.及びbAng.αMSHについて、全て摂取量全体の0.1%以下であった。
【0128】
経口強制投与後15分以内の両融合タンパク質の8%以上の迅速な吸収と、このレベルの3時間を超える維持は、消化タンパク質にとって異常なことである。タンパク質消化後の遊離アミノ酸及び小分子のジ又はトリペプチドの胃腸管を通っての吸収は、消化吸収を反映するこの3時間のサンプリング期間内において、吸収のより緩やかな増加と明確な吸収ピーク(濃度)を示す。また、遊離アミノ酸は、皮膚、筋肉、腎臓、肝臓、脳の各組織を含む組織に導入されることによって迅速に取り除かれる。肝臓及び腎臓における低いパーセンテージのラベルの蓄積は、これらの組織における高い代謝活性と血液からの非特異的な取り込みのためであると思われる。骨格筋、心臓、脳への導入が無いことから、血液中のラベルの存在は、遊離アミノ酸に起因するのではなく、影響されなかったタンパク質に起因することが明らかに示される。
【0129】
マサネら(2001)は、ラットにおいて、強制給餌後最初の1時間における門脈の血流に吸収されるアミノ酸の80%が骨格筋、腎臓、脳、肝臓の各組織を含む組織内に封鎖されることを示した。マウスにおいては、加水分解を受けたタンパク質から得られるアミノ酸の90%以上が、強制給餌後最初6時間において腸を通って吸収され(オッセールら、1999)、循環から皮膚、肝臓、腎臓、脾臓、軟骨、骨格筋内に封鎖される。
【0130】
R.M.マサネ、I.ラフェカス及びX.レムサー(2001)、「Zucker−leanラットの強制給餌におけるタンパク質吸収」、「餌におけるタンパク質含有量の影響」、アーカイブズオブフィジオロジーアンドバイオケミストリー109:168〜174。
【0131】
S.オッセール、M.アダム、W.バベル及びJ.ザイフェルト(1999)、14C−ラベルゼラチン加水分解物の経口投与はマウス軟骨の放射能蓄積を誘導(C57/BL)。ジャーナルオブニュートリッション129:1891〜1895。
【特許請求の範囲】
【請求項1】
治療薬の経口デリバリーを改善する方法であって、前記治療薬を、アンギオゲニンを含む担体に結合させる段階を含む方法。
【請求項2】
治療薬を、胃腸管内に、又は胃腸管を通って輸送するための担体としてアンギオゲニンを含む経口デリバリーシステム。
【請求項3】
治療薬に結合したアンギオゲニンを含む融合タンパク質又はコンジュゲート。
【請求項4】
請求項3に記載の融合タンパク質又はコンジュゲートと医薬的に許容される担体を含む医薬組成物。
【請求項5】
経口投与用医薬組成物である、請求項4に記載の医薬組成物。
【請求項6】
治療薬に結合させて前記治療薬の経口的バイオアベイラビリティーを改善させるためのアンギオゲニンの使用。
【請求項7】
治療薬による治療を必要とする動物の病気の予防又は治療方法であって、前記動物に請求項3に記載の融合タンパク質又はコンジュゲート又は請求項4に記載の医薬組成物の有効量を経口投与する方法において、前記治療薬は通常実質的に経口的にバイオアベイラブルではない方法。
【請求項8】
前記治療薬は、タンパク質又はペプチドである、請求項3に記載のコンジュゲート。
【請求項9】
前記治療薬は、タンパク質又はペプチドである、請求項1に記載の方法。
【請求項10】
前記治療薬は、タンパク質又はペプチドである、請求項2に記載のデリバリーシステム。
【請求項11】
前記治療薬は、タンパク質又はペプチドである、請求項8に記載の医薬組成物。
【請求項12】
治療タンパク質又はペプチドは、20以下のアミノ酸を有する、請求項8に記載のコンジュゲート。
【請求項13】
治療タンパク質又はペプチドは、21〜40のアミノ酸を有する、請求項8に記載のコンジュゲート。
【請求項14】
治療タンパク質又はペプチドは、41〜60のアミノ酸を有する、請求項8に記載のコンジュゲート。
【請求項15】
治療タンパク質又はペプチドは、61〜80のアミノ酸を有する、請求項8に記載のコンジュゲート。
【請求項16】
治療タンパク質又はペプチドは、81以上のアミノ酸を有する、請求項8に記載のコンジュゲート。
【請求項17】
治療薬に結合した配列番号1、2、3、4、5、6又は7のアンギオゲニンを含む、請求項3に記載の融合タンパク質又はコンジュゲート。
【請求項18】
前記治療薬は、抗菌性ペプチドを含む、請求項17に記載のコンジュゲート。
【請求項19】
前記治療薬は、副甲状腺ホルモンを含む、請求項17に記載のコンジュゲート。
【請求項20】
前記治療薬は、インスリンを含む、請求項17に記載のコンジュゲート。
【請求項21】
前記治療薬は、インターフェロンα又はβ、G−CSF、TPO、EPO、PtHR、抗菌剤、アンギオゲニン、抗炎症剤、カテリシジン、GPCRペプチドリガンド、hGH又はレセプターを活性化するように設計された合成ペプチド(ペプチドミメティックス)を含む、請求項17に記載のコンジュゲート。
【請求項1】
治療薬の経口デリバリーを改善する方法であって、前記治療薬を、アンギオゲニンを含む担体に結合させる段階を含む方法。
【請求項2】
治療薬を、胃腸管内に、又は胃腸管を通って輸送するための担体としてアンギオゲニンを含む経口デリバリーシステム。
【請求項3】
治療薬に結合したアンギオゲニンを含む融合タンパク質又はコンジュゲート。
【請求項4】
請求項3に記載の融合タンパク質又はコンジュゲートと医薬的に許容される担体を含む医薬組成物。
【請求項5】
経口投与用医薬組成物である、請求項4に記載の医薬組成物。
【請求項6】
治療薬に結合させて前記治療薬の経口的バイオアベイラビリティーを改善させるためのアンギオゲニンの使用。
【請求項7】
治療薬による治療を必要とする動物の病気の予防又は治療方法であって、前記動物に請求項3に記載の融合タンパク質又はコンジュゲート又は請求項4に記載の医薬組成物の有効量を経口投与する方法において、前記治療薬は通常実質的に経口的にバイオアベイラブルではない方法。
【請求項8】
前記治療薬は、タンパク質又はペプチドである、請求項3に記載のコンジュゲート。
【請求項9】
前記治療薬は、タンパク質又はペプチドである、請求項1に記載の方法。
【請求項10】
前記治療薬は、タンパク質又はペプチドである、請求項2に記載のデリバリーシステム。
【請求項11】
前記治療薬は、タンパク質又はペプチドである、請求項8に記載の医薬組成物。
【請求項12】
治療タンパク質又はペプチドは、20以下のアミノ酸を有する、請求項8に記載のコンジュゲート。
【請求項13】
治療タンパク質又はペプチドは、21〜40のアミノ酸を有する、請求項8に記載のコンジュゲート。
【請求項14】
治療タンパク質又はペプチドは、41〜60のアミノ酸を有する、請求項8に記載のコンジュゲート。
【請求項15】
治療タンパク質又はペプチドは、61〜80のアミノ酸を有する、請求項8に記載のコンジュゲート。
【請求項16】
治療タンパク質又はペプチドは、81以上のアミノ酸を有する、請求項8に記載のコンジュゲート。
【請求項17】
治療薬に結合した配列番号1、2、3、4、5、6又は7のアンギオゲニンを含む、請求項3に記載の融合タンパク質又はコンジュゲート。
【請求項18】
前記治療薬は、抗菌性ペプチドを含む、請求項17に記載のコンジュゲート。
【請求項19】
前記治療薬は、副甲状腺ホルモンを含む、請求項17に記載のコンジュゲート。
【請求項20】
前記治療薬は、インスリンを含む、請求項17に記載のコンジュゲート。
【請求項21】
前記治療薬は、インターフェロンα又はβ、G−CSF、TPO、EPO、PtHR、抗菌剤、アンギオゲニン、抗炎症剤、カテリシジン、GPCRペプチドリガンド、hGH又はレセプターを活性化するように設計された合成ペプチド(ペプチドミメティックス)を含む、請求項17に記載のコンジュゲート。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2013−511542(P2013−511542A)
【公表日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願番号】特願2012−540067(P2012−540067)
【出願日】平成22年11月18日(2010.11.18)
【国際出願番号】PCT/US2010/057295
【国際公開番号】WO2011/063160
【国際公開日】平成23年5月26日(2011.5.26)
【出願人】(509127332)マリー ゴールバーン シーオー−オペレイティブ シーオー.リミテッド (6)
【氏名又は名称原語表記】MURRAY GOULBURN CO−OPERATIVE CO.LIMITED
【出願人】(509127343)アグリカルチャー ヴィクトリア サービス ピーティーワイ エルティーディー (6)
【氏名又は名称原語表記】AGRICULTURE VICTORIA SERVICES PTY LTD
【Fターム(参考)】
【公表日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願日】平成22年11月18日(2010.11.18)
【国際出願番号】PCT/US2010/057295
【国際公開番号】WO2011/063160
【国際公開日】平成23年5月26日(2011.5.26)
【出願人】(509127332)マリー ゴールバーン シーオー−オペレイティブ シーオー.リミテッド (6)
【氏名又は名称原語表記】MURRAY GOULBURN CO−OPERATIVE CO.LIMITED
【出願人】(509127343)アグリカルチャー ヴィクトリア サービス ピーティーワイ エルティーディー (6)
【氏名又は名称原語表記】AGRICULTURE VICTORIA SERVICES PTY LTD
【Fターム(参考)】
[ Back to top ]

