経口持続放出抗うつ薬製剤
医薬品形式のフェノキサチインに基づくMAO-Aインヒビターを開示する。それにより、MAO受容体は消化管での持続放出が可能である。特定のフェノキサチインに基づくMAO-Aインヒビターは、以下の式:

[式中、nは0、1または2であり; R1は分岐鎖または直鎖C1-5アルキルまたはC3-6シクロアルキルであり、これはヒドロキシル、または1個以上のハロゲンで場合により置換され; およびX1、X2、X3、X4、およびX5はすべて水素であるか、またはX1、X2、X3、X4、およびX5の1または2個がハロゲンであり、かつ残りが水素であり、ただしnが0または1であり、かつ各Xが水素である場合、R1はメチルではない]、のものを含む。医薬品形式、例えば錠剤またはカプセルとしての摂取後の活性成分の緩やかな放出を提供するために、種々の持続放出機構を利用することができる。形式には、持続放出錠剤、持続放出カプセル、持続放出ビーズを含むカプセルが含まれる。

[式中、nは0、1または2であり; R1は分岐鎖または直鎖C1-5アルキルまたはC3-6シクロアルキルであり、これはヒドロキシル、または1個以上のハロゲンで場合により置換され; およびX1、X2、X3、X4、およびX5はすべて水素であるか、またはX1、X2、X3、X4、およびX5の1または2個がハロゲンであり、かつ残りが水素であり、ただしnが0または1であり、かつ各Xが水素である場合、R1はメチルではない]、のものを含む。医薬品形式、例えば錠剤またはカプセルとしての摂取後の活性成分の緩やかな放出を提供するために、種々の持続放出機構を利用することができる。形式には、持続放出錠剤、持続放出カプセル、持続放出ビーズを含むカプセルが含まれる。
【発明の詳細な説明】
【技術分野】
【0001】
本明細書中では、経口持続放出医薬製剤、製品および関連の方法を提供する。特に、ここでは、3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを活性成分として含む経口持続放出医薬製剤、製品、および関連の方法を提供する。
【背景技術】
【0002】
高血圧クリーゼを生じさせることがある血圧の一時的上昇は、チラミンリッチ食物および飲料の摂取後にモノアミンオキシダーゼインヒビター(MAOI)物質、例えばフェネルジン、イソカルボキシアジド(isocarboxazide)、イプラニアジド(ipraniazid)、およびトラニルシプロミンで処置された患者で留意されている。褐色細胞腫を有する患者で観察されるものと類似の、この急性型の高血圧症は、医学文献で、「チーズ効果」または「チーズ反応」として言及されている。その理由は、いくつかの熟成チーズで高いチラミン含量が見出されるからである。この潜在的に危険な食物反応のせいで、それらが、大うつ病性障害、社交恐怖およびパニック発作の治療に非常に有効であっても、医師はMAOIを処方することに乗り気でない。
【発明の概要】
【発明が解決しようとする課題】
【0003】
したがって、危険な食物反応を誘発しないかまたは厳格な食事制限を必要としない好適なMAOIの必要性が依然として存在する。本明細書中で提供される製剤、製品および方法は、この必要性に対処し、かつ追加の利点を提供する。
【課題を解決するための手段】
【0004】
持続放出医薬品形式のフェノキサチインに基づくMAO-Aインヒビターを開示する。それにより、MAO受容体は胃での活性成分との結合から保護される。特定のフェノキサチインに基づくMAO-Aインヒビターは、以下の式:
【化1】

【0005】
式中、nは0、1または2であり; R1は分岐鎖または直鎖C1-5アルキルまたはC3-6シクロアルキルであり、これはヒドロキシル、または1個以上のハロゲンで場合により置換され; およびX1、X2、X3、X4、およびX5はすべて水素であるか、またはX1、X2、X3、X4、およびX5の1または2個がハロゲンであり、かつ残りが水素であり、ただしnが0または1であり、かつ各Xが水素である場合、R1はメチルではない、のものを含む。フェノキサチインに基づくMAO-Aインヒビターの例には、非限定的に、以下の式:
【化2】

【0006】
の3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシド(以後、「CX157」)、
以下の式:
【化3】

【0007】
の3-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシド(以後、「CX009」)、および
以下の式:
【化4】

【0008】
の3-(2,2,2-トリフルオロ-1-メチルエトキシ)フェノキサチイン10,10-ジオキシド(以後、「CX2614」)が含まれる。
【発明の効果】
【0009】
活性成分の放出の減少、および、それによる、該MAO-AインヒビターがMAO受容体を食事性チラミンとの結合からブロックする程度の減少のおかげで、そのような形式は危険な食物反応を誘発しないか、または厳格な食事制限を必要としない。
【0010】
一部の実施形態では、該製品形式は、錠剤またはカプセルまたは、環状ボディーに覆われているコアである。一部の実施形態では、該製品形式は、約40 ng/ml〜約80 ng/mlの範囲のフェノキサチインに基づくMAO-Aインヒビターの血漿レベルを達成するように製剤化される。一部の実施形態では、該製品形式は、3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを唯一の活性成分として含む。一部の実施形態では、該形式の3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドは約169〜175℃の融点を有することを特徴とする。一部の実施形態では、該形式の3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドは結晶形でありかつ、CuKα照射を使用して、2θ=11.0°でX線粉末回折ピークを有することを特徴とする。一部の実施形態では、該製品形式は、約50〜500ミリグラムの3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを含む錠剤である。
【0011】
また、3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを含み、かつ消化管での3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドの放出を遅延させるように構成される、経口医薬剤形を提供する。一部の実施形態では、該剤形形式は、錠剤、カプセル、または環状ボディーに覆われているコアである。
【図面の簡単な説明】
【0012】
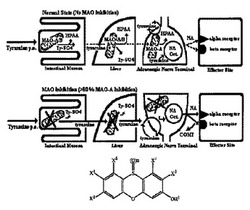
【図1】図1は、薬物未処置(unmedicated)被験体(上部)およびMAO-A阻害被験体(下部)での経口投与チラミンの生体内変換に関与する酵素障壁(enzymatic barriers)および酵素の図である。ヒトでは、MAO-AおよびMAO-Bの活性は以下の通りである: それぞれ、腸粘膜、90%および10 %: 肝臓、30%および70%: アドレナリン作動性神経末端、100%および0%。略語: HPAA=p-ヒドロキシフェニル酢酸; チラミン=遊離チラミン; Ty-SO4=硫酸チラミン; NA=ノルアドレナリン; Oct.=オクトパミン; COMT=カタコール-O-メチルトランスフェラーゼ(catachol-O-methyltransferase)。
【発明を実施するための形態】
【0013】
モノアミンオキシダーゼインヒビター(MAOI)物質は、チラミンリッチ食物および飲料の摂取後に危険な食物反応を引き起こしうる。この危険な副作用は、それらが、大うつ病性障害、社交恐怖およびパニック発作の治療に非常に有効であっても、MAOIの使用を最小にしている。モノアミンオキシダーゼA型の可逆的インヒビター(RIMA)は、モノアミンオキシダーゼを一時的かつ可逆的に阻害する精神医学的薬物および天然化合物のファミリーである。しかし、一部のRIMAの治療量は、依然として、チラミン昇圧効果を40-〜50-倍も増強しうる。結果として、RIMAもまた、治療的に使用されることはほとんどない。
【0014】
本明細書中で提供されるように、「概要」において上で定義される、フェノキサチインに基づくMAO-Aインヒビターと称される(本明細書中で「活性物(active)」または「活性成分」とも称される)、特定のクラスのRIMAの大きい安全要因は、即時放出製剤に関連するピーク曝露レベルを回避し、さらに、胃腸管および肝組織でMAO-Aに関して食事性チラミンと可逆的に競合する、抗うつ量の薬物を送達するように操作される、持続放出製剤によって達成することができる。そのような製剤はCX157の場合に特に有効である。その理由は、このRIMAがMAO-Bに関する阻害作用を欠いていて、ゆえにMAO-B経路によるチラミン不活性化を可能にするからである。ゆえに、MAO-AインヒビターとしてのCX157の特異的かつ可逆的特性は、経口チラミン昇圧効果に関する弱い増強効果に好都合なプロファイルを提供する。
【0015】
上記に基づいて、本明細書中では、種々の持続放出製剤および形式のフェノキサチインに基づくMAO-Aインヒビター、および特にCX157を提供する。例えば、フェノキサチインに基づくMAO-Aインヒビター、例えばCX157の臨床試験および市販の錠剤は、錠剤を持続放出可能にするように、コーティングするか、カプセル化するか、または他の様式で処理することができる。
【0016】
本明細書中で使用されるパーセンテージ、比、割合などのすべての表現は、特に指定されない限り、重量単位である。持続放出製品の割合の表現は、多数の成分が溶解または分散している水の除去後の乾燥形式の製品を表す。用語「糖」とは、還元糖以外の糖を表す。還元糖は、フェーリング(Fehling's) (またはベネディクト(Benedict's))またはトレンス(Tollens')試薬を還元する炭水化物である。すべての単糖は還元糖であり、スクロースを除くほとんどの二糖もそうである。一般的な結合または充填剤の1つはラクトースである。この賦形剤は、良好に圧縮するので錠剤に特に有用であり、希釈液でありかつ結合剤であり、かつ安価である。しかし、それは還元糖であり、該活性成分は、室温および促進安定条件(accelerated stability conditions)(熱)条件下でともに、ラクトースと相互作用する。したがって、該活性成分を含む製剤でラクトースおよび他の還元糖を回避することが重要である。以下で考察されるように、スクロースは特別な糖である。
【0017】
特定の持続放出製品では、活性物のコアを持続放出コーティングによって囲み、ペレットを形成させる。そしてペレットをゼラチンカプセル中に積載することができる。以下のように、種々の成分を加えてペレットを構築する方法とともに、ペレットの種々の成分および層を個別に考察する。
【0018】
A. 活性成分
持続放出医薬品の形式のフェノキサチインに基づくMAO-Aインヒビターを提供する。それによって、フェノキサチインに基づくMAO-Aインヒビターによる消化管でのMAO受容体の結合は減少する。本明細書中で提供される製剤で使用される特定の活性成分は、以下の式:
【化5】

【0019】
[式中、nは0、1または2であり; R1は分岐鎖または直鎖C1-5アルキルまたはC3-6シクロアルキルであり、これはヒドロキシル、または1個以上のハロゲンで場合により置換され; およびX1、X2、X3、X4、およびX5はすべて水素であるか、またはX1、X2、X3、X4、およびX5の1または2個がハロゲンであり、かつ残りが水素であり、ただしnが0または1であり、かつ各Xが水素である場合、R1はメチルではない]
を有するフェノキサチインに基づくMAO-Aインヒビターである。
【0020】
持続性放出医薬品の特定の活性成分は、以下の式:
【化6】

【0021】
の3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシド(本明細書中でCX157とも称される)を活性成分として含む。持続放出医薬品の別の特定のコアは、以下の式:
【化7】

【0022】
の3-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシド(本明細書中でCX009とも称される)を活性成分として含む。持続放出医薬品の別の特定のコアは、以下の式:
【化8】

【0023】
の3-(2,2,2-トリフルオロ-1-メチルエトキシ)フェノキサチイン10,10-ジオキシド(以後「CX2614」)を活性成分として含む。上記フェノキサチインに基づくMAO-Aインヒビターおよび他のフェノキサチインに基づくMAO-Aインヒビターの製造方法は当技術分野で公知であり、U.S. Pat. No. 6,110,961 (該文献は参照によりその全体がここに組み入れられる)で例証される。
【0024】
本明細書中では、また、1日1回または2回の投薬が可能であるように少ない賦形剤量しか有さない、該活性成分を含む経口組成物、例えば錠剤またはカプセルを提供し、好ましくは1または2個のそのような組成物を各投薬時に投与する。本明細書中で提供される持続放出製品は、活性成分の任意の物理的形式を利用することができる。活性な医薬成分がCX157である場合、該活性成分は「ハイメルト(high melt)」結晶形でありうる。
【0025】
CX157の「ハイメルト」結晶形は、U.S. Application No. 11/773,892 (該文献は参照によりその全体がここに組み入れられる)で教示され、ここに、上記出願の「フォームA」が、本明細書中で「ハイメルト」と称されるフォームである。簡潔に言えば、ハイメルトフォームは、約169〜176℃; 約170〜174℃、約171〜173℃、約171〜172℃、または約171℃の融点を有すると特徴付けられる。ハイメルトフォームは、約158〜163℃、典型的に約160〜162℃で融解する、3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン-10,10-ジオキシドの少なくとも1つの他のフォームと区別できる。ハイメルトフォームは、Karl Fischer法によって測定された場合に、約1% H2O未満、約1%〜0.001% H2O、約0.5%〜0.01% H2O、約0.05%〜0.01% H2O、または約0.02% H2Oを含むと特徴付けることもできる。さらに、ハイメルトフォームは、上記出願の図2(a)に実質的に同一の1480〜1440 cm-1の減衰全反射フーリエ変換赤外スペクトルを有するか、上記出願の図2(a)に実質的に同一の970〜800 cm-1の減衰全反射フーリエ変換赤外スペクトルを有するか、または上記出願の図2(a)に実質的に同一の減衰全反射フーリエ変換赤外スペクトルを有すると特徴付けることができる。ハイメルトフォームの減衰全反射フーリエ変換赤外スペクトルは、上記出願の図2(b)に実質的に同一のCX157の別のフォームの970〜800 cm-1および1480〜1440 cm-1の減衰全反射フーリエ変換赤外スペクトルと区別できる。ハイメルトフォームは、化合物と溶媒との比(w/v)が約1.6g:10 mLである場合に、酢酸中の10% (v/v)水である溶媒に約75〜85℃、約75〜80℃、約75〜78℃、または約75〜77℃で溶解するとさらに特徴付けることができる。
【0026】
ハイメルトフォームは、約4.0、4.4および/または8.0の面間隔(d spacings)での主要X線粉末回折ピークを有すると特徴付けることができる。ハイメルトフォームは、約10.3、7.3、および/または3.65の面間隔でのX線粉末回折ピークを実質的に欠くと特徴付けることができる。ハイメルトフォームは、CuKα照射を使用して、約2θ= 11.0°、20.1°、および/または22.2°での主要X線粉末回折ピークを有すると特徴付けることができる。ハイメルトフォームは、CuKα照射を使用して、約2θ=8.5°、12.0°、および/または24.6°でのX線粉末回折ピークを実質的に欠くと特徴付けることもできる。ハイメルトフォームは、上記出願の図1(a)に実質的に同一のX線粉末回折パターンを有すると特徴付けることもできる。ハイメルトフォームのX線粉末回折パターンは、CX157の別のフォームのX線粉末回折特性と区別でき、該CX157の別のフォームは、約10.3、7.3、および/または3.65の面間隔で、かつ、CuKα照射を使用して、約2θ= 11.0°、20.1°、および/または22.2°で主要ピークを有し、かつ上記出願の図1(b)に実質的に同一のX線粉末回折パターンを有する。
【0027】
B. 持続放出製剤
持続放出医薬製剤は種々の剤形、例えば錠剤およびビーズで構成することができ; 種々の充填剤および賦形剤、例えば遅延賦形剤(放出修飾因子とも称される)を含むことができ; 種々の方法で作製することができる。当業者は、本明細書中で提供される説明によって導かれる通常の実験法によって適切な構成を決定することができる。
【0028】
持続放出医薬製剤は充填剤を含むことができる。好適な充填剤の例には、非限定的に、METHOCEL(登録商標) メチルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルセルロース(HPC)、コーンスターチ、ポリビニルアルコール(PVA)、ポリビニルピロリドン(PVP)、架橋PVP、などが含まれる。
【0029】
持続放出医薬製剤は賦形剤を含むことができる。好適な賦形剤の例には、非限定的に、クエン酸アセチルトリエチル(ATEC)、クエン酸アセチルトリ-n-ブチル(ATBC)、アスパルテーム、ラクトース、アルギン酸化合物、炭酸カルシウム、カーボポール、カラゲナン、セルロース、酢酸フタル酸セルロース、クロスカルメロースナトリウム、クロスポビドン、デキストロース、セバシン酸ジブチル、エチルセルロース、フルクトース、ゲランガム、ベヘン酸グリセリル、グアールガム、ラクトース、乳酸ラウリル、低置換ヒドロキシプロピルセルロース(low-substituted hydroxypryopl cellulose) (L-HPC)、ステアリン酸マグネシウム、バクガデキストリン、マルトース、マンニトール、メチルセルロース、微結晶性セルロース、メタクリル酸化合物、カルボキシメチルセルロースナトリウム、ポリ酢酸フタル酸ビニル(PVAP)、ポビドン、シェラック、グリコール酸デンプンナトリウム、ソルビトール、デンプン、スクロース、トリアセチン、クエン酸トリエチル(triethylcitrate)、植物に基づく脂肪酸、キサンタンガム、キシリトール、などが含まれる。
【0030】
好ましい実施形態では、持続放出医薬製剤は活性成分メチルセルロースおよび微結晶性セルロースを含む。一部の実施形態では、製剤は、例えば、重量に基づいて、約30%、40%、または50%、〜約80%または90%の活性成分を含む。一部の実施形態では、製剤は、重量に基づいて、約0.1%、0.5%、1%、3%、5%、10%または20%の活性成分を含む。好ましくは、活性成分は、重量に基づいて、約55%、60%、65%、または70%のパーセンテージで存在する。他の好ましい実施形態では、製剤は約95%の活性成分を含む。
【0031】
活性成分は、少なくとも、または少なくとも約、10 mg、15 mg、20 mg、25 mg、30 mg、40 mg、50 mg、60 mg、70 mg、80 mg、90 mg、100 mg、125 mg、150 mg、175 mg、もしくは200 mg以上、または約それ以上で存在させることができる。活性成分は、25 mg、30 mg、40 mg、50 mg、60 mg、70 mg、80 mg、90 mg、100 mg、125 mg、150 mg、175 mg、200 mg、250 mg、300 mg、350 mg、400 mg、450 mg、500 mg、600 mg、700 mg、800 mg、900 mgもしくは1000 mgまで、または約それまで、それ未満、または約それ未満で存在させることができる。具体的な範囲には、約50 mg〜約500 mg、または約100 mg〜約200 mgが含まれる。
【0032】
持続放出活性成分医薬製剤中の成分のバランスは、例えば、修飾多糖、例えば、メチルセルロース(MC)および微結晶性セルロース(MCC)から選択することができる。一部の実施形態では、製剤は、重量に基づいて、約3%〜約99.9%の範囲の微結晶性セルロースを含む。特定の実施形態では、製剤は約3% MCCを含む。他の実施形態では、製剤は約5% MCCを含む。さらなる実施形態では、製剤は約10% MCCを含む。さらに他の実施形態では、製剤は約30% MCCを含む。さらなる実施形態では、製剤は約50% MCCを含む。
【0033】
一部の実施形態では、持続放出医薬製剤は約0%〜約40% MCを含む。特定の実施形態では、製剤は約3% MCを含む。他の実施形態では、製剤は約5% MCを含む。さらなる実施形態では、製剤は約10% MCを含む。さらに他の実施形態では、製剤は約30% MCを含む。さらなる実施形態では、製剤は約40% MCを含む。一部の実施形態では、製剤は約95%の活性成分を含み、残りの5%はMCとMCCとの間で分けられる。
【0034】
持続放出医薬製剤の溶解速度は、活性成分が血流への吸収にどれほど高速に利用可能になるかを決定し、したがって活性成分のバイオアベイラビリティをコントロールする。溶解速度は剤形のサイズおよび組成に依存する。一部の実施形態では、製剤の溶解速度は、製剤の追加の成分を変更することによって変化させることができる。崩壊剤、例えばデンプンまたはコーンスターチ、または架橋PVPを使用して、所望の場合に溶解度を増加させることができる。可溶化剤を使用して製剤の溶解度を増加させることもできる。一部の実施形態では、代替の結合剤、例えばヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルセルロース(HPC)、メチルセルロース(MC)、PVP、ガム、キサンチン、などを使用して溶解速度を増加させることができる。
【0035】
一部の実施形態では、製剤をより疎水性にする成分を加えることによって製剤の溶解速度を減少させることができる。例えば、ポリマー、例えばエチルセルロース、ろう、ステアリン酸マグネシウム、などを加えると溶解速度が減少する。
【0036】
一部の実施形態では、活性成分の血漿レベルをコントロールするように、持続放出医薬製剤の溶解速度を設計する。
【0037】
例えば、持続放出医薬製剤を、例えば、少なくとも、または少なくとも約、5 ng/ml、10 ng/ml、15 ng/ml、20 ng/ml、25 ng/ml、30 ng/ml、40 ng/ml、50 ng/ml、60 ng/ml、70 ng/ml、80 ng/ml、90 ng/ml、もしくは100 ng/ml以上、または約それ以上の活性成分の血漿レベルを達成するように製剤化することができる。持続放出医薬製剤を、例えば、25 ng/ml、30 ng/ml、40 ng/ml、50 ng/ml、60 ng/ml、70 ng/ml、80 ng/ml、90 ng/ml、100 ng/ml、125 ng/ml、150 ng/ml、175 ng/ml、200 ng/ml、250 ng/ml、300 ng/ml、350 ng/ml、400 ng/ml、450 ng/ml、もしくは500 ng/mlまで、または約それまで、それ未満、または約それ未満の活性成分の血漿レベルを達成するように製剤化することができる。具体的な範囲は、約10 ng/ml〜約150 ng/ml、約20 ng/ml〜約100 ng/ml、または約40 ng/ml〜約80 ng/mlである。そのような範囲は、チーズ効果を引き起こすのに、消化管および肝臓でのMAO阻害の十分な阻害を生じさせることなく、活性成分の治療レベルを達成するために好都合であることが想定される。
【0038】
一部の実施形態では、持続放出医薬製剤の溶解速度は、剤形中の活性成分の約25%が最初の1時間以内に溶解し、活性成分の約60%が最初の6時間以内に溶解し、活性成分の約80%が最初の9時間以内に溶解し、かつ実質的にすべての活性成分が最初の12時間以内に溶解するような溶解速度である。他の実施形態では、持続放出医薬製剤の溶解速度は、剤形中の活性成分の約35%が最初の1時間以内に溶解し、活性成分の約85%が最初の6時間以内に溶解し、かつ実質的にすべての活性成分が最初の9時間以内に溶解するような溶解速度である。さらに他の実施形態では、剤形中の持続放出医薬製剤の溶解速度は、ビーズ中の活性成分の約45%が最初の1時間以内に溶解し、かつ実質的にすべての活性成分が最初の6時間以内に溶解するような溶解速度である。
【0039】
製剤の溶解速度は、剤形をコーティングすることによって遅くすることもできる。コーティングの例には、持続放出ポリマーが含まれる。
【0040】
持続放出医薬製剤の溶解には、例えば、約2、4、6、または8時間〜約15、20、または25時間かかる。好ましくは、製剤は、約3、4、5、または6〜約8、9、または10時間の溶解速度を有する。
【0041】
別の実施形態は持続放出医薬製剤の製造方法を提供する。該方法は、活性成分を賦形剤および/または充填剤と混合して混合物を形成させるステップ、および混合物から好適な剤形(例えば、錠剤、ビーズ、など)を成形するステップを含む。一部の実施形態では、該製剤の製造方法は、剤形を成形する前に別の賦形剤および/または充填剤を混合物に加えるステップをさらに含む。充填剤および賦形剤は本明細書中に記載されるものである。一実施形態では、活性成分を充填剤および/または賦形剤と混合して、湿った混合物を形成させる。次いで、湿った混合物を粒子またはビーズに成形することができ、該粒子またはビーズを乾燥させることができる。次いで、乾燥生成物を錠剤化するか、または経口送達用のゼラチンカプセルに入れることができる。
【0042】
一実施形態では、持続放出医薬製剤はビーズの形式である。一部の実施形態では、ビーズは活性成分および充填剤を含む。他の実施形態では、ビーズは賦形剤をさらに含む。一部の実施形態では、充填剤および/または賦形剤はポリマー形式である。
【0043】
本明細書中で使用される「ビーズ」は、例えば、スフェア、ペレット、ミクロスフェア、粒子、微粒子、顆粒、などであってよい。ビーズは任意の所望の形状を有することができる。該形状は、例えば、球状、実質的に球状、棒状、円柱状、卵形、楕円形、粒状、などであってよい。所望であれば、ビーズのサイズおよび形状を改変して溶解速度を変化させることができる。ビーズをコーティングしてよく、コーティングしなくてもよい。他の成分の有無にかかわらず、ビーズを、経口送達用カプセル、錠剤、または任意の他の所望の固体経口剤形に成形することができる。
【0044】
一実施形態では、医薬製剤は、持続放出活性成分および充填剤を含むビーズを含む。一部の実施形態では、ビーズは賦形剤をさらに含む。一部の実施形態では、充填剤はポリマーである。一部の実施形態では、賦形剤はポリマーである。一部の実施形態では、充填剤は、メチルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルセルロース(HPC)、コーンスターチ、ポリビニルアルコール(PVA)、ポリビニルピロリドン(PVP)、および架橋PVPからなる群から選択される。一部の実施形態では、賦形剤は、クエン酸アセチルトリエチル(ATEC)、クエン酸アセチルトリ-n-ブチル(ATBC)、アスパルテーム、ラクトース、アルギン酸化合物、炭酸カルシウム、カーボポール、カラゲナン、セルロース、酢酸フタル酸セルロース、クロスカルメロースナトリウム、クロスポビドン、デキストロース、セバシン酸ジブチル、エチルセルロース、フルクトース、ゲランガム、ベヘン酸グリセリル、グアールガム、ラクトース、乳酸ラウリル、低置換ヒドロキシプロピルセルロース(L-HPC)、ステアリン酸マグネシウム、バクガデキストリン、マルトース、マンニトール、メチルセルロース、微結晶性セルロース、メタクリル酸化合物、カルボキシメチルセルロースナトリウム、ポリ酢酸フタル酸ビニル(polyvinyl acetate phathalate) (PVAP)、ポビドン、シェラック、グリコール酸デンプンナトリウム、ソルビトール、デンプン、スクロース、トリアセチン、クエン酸トリエチル、植物に基づく脂肪酸、キサンタンガム、およびキシリトールからなる群から選択される。一部の実施形態では、ビーズは、活性成分、メチルセルロースおよび微結晶性セルロースを含む。一部の実施形態では、ビーズは、重量に基づいて約0.1%〜約95%の活性成分を含む。一部の実施形態では、ビーズは、重量に基づいて約3%〜約99.9%の範囲の微結晶性セルロースを含む。一部の実施形態では、ビーズは、重量に基づいて約0%〜約40%のメチルセルロースを含む。
【0045】
改変は当業者に自明であるため、本発明は特許請求の範囲によってしか限定されないものとする。
【技術分野】
【0001】
本明細書中では、経口持続放出医薬製剤、製品および関連の方法を提供する。特に、ここでは、3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを活性成分として含む経口持続放出医薬製剤、製品、および関連の方法を提供する。
【背景技術】
【0002】
高血圧クリーゼを生じさせることがある血圧の一時的上昇は、チラミンリッチ食物および飲料の摂取後にモノアミンオキシダーゼインヒビター(MAOI)物質、例えばフェネルジン、イソカルボキシアジド(isocarboxazide)、イプラニアジド(ipraniazid)、およびトラニルシプロミンで処置された患者で留意されている。褐色細胞腫を有する患者で観察されるものと類似の、この急性型の高血圧症は、医学文献で、「チーズ効果」または「チーズ反応」として言及されている。その理由は、いくつかの熟成チーズで高いチラミン含量が見出されるからである。この潜在的に危険な食物反応のせいで、それらが、大うつ病性障害、社交恐怖およびパニック発作の治療に非常に有効であっても、医師はMAOIを処方することに乗り気でない。
【発明の概要】
【発明が解決しようとする課題】
【0003】
したがって、危険な食物反応を誘発しないかまたは厳格な食事制限を必要としない好適なMAOIの必要性が依然として存在する。本明細書中で提供される製剤、製品および方法は、この必要性に対処し、かつ追加の利点を提供する。
【課題を解決するための手段】
【0004】
持続放出医薬品形式のフェノキサチインに基づくMAO-Aインヒビターを開示する。それにより、MAO受容体は胃での活性成分との結合から保護される。特定のフェノキサチインに基づくMAO-Aインヒビターは、以下の式:
【化1】

【0005】
式中、nは0、1または2であり; R1は分岐鎖または直鎖C1-5アルキルまたはC3-6シクロアルキルであり、これはヒドロキシル、または1個以上のハロゲンで場合により置換され; およびX1、X2、X3、X4、およびX5はすべて水素であるか、またはX1、X2、X3、X4、およびX5の1または2個がハロゲンであり、かつ残りが水素であり、ただしnが0または1であり、かつ各Xが水素である場合、R1はメチルではない、のものを含む。フェノキサチインに基づくMAO-Aインヒビターの例には、非限定的に、以下の式:
【化2】

【0006】
の3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシド(以後、「CX157」)、
以下の式:
【化3】

【0007】
の3-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシド(以後、「CX009」)、および
以下の式:
【化4】

【0008】
の3-(2,2,2-トリフルオロ-1-メチルエトキシ)フェノキサチイン10,10-ジオキシド(以後、「CX2614」)が含まれる。
【発明の効果】
【0009】
活性成分の放出の減少、および、それによる、該MAO-AインヒビターがMAO受容体を食事性チラミンとの結合からブロックする程度の減少のおかげで、そのような形式は危険な食物反応を誘発しないか、または厳格な食事制限を必要としない。
【0010】
一部の実施形態では、該製品形式は、錠剤またはカプセルまたは、環状ボディーに覆われているコアである。一部の実施形態では、該製品形式は、約40 ng/ml〜約80 ng/mlの範囲のフェノキサチインに基づくMAO-Aインヒビターの血漿レベルを達成するように製剤化される。一部の実施形態では、該製品形式は、3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを唯一の活性成分として含む。一部の実施形態では、該形式の3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドは約169〜175℃の融点を有することを特徴とする。一部の実施形態では、該形式の3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドは結晶形でありかつ、CuKα照射を使用して、2θ=11.0°でX線粉末回折ピークを有することを特徴とする。一部の実施形態では、該製品形式は、約50〜500ミリグラムの3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを含む錠剤である。
【0011】
また、3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを含み、かつ消化管での3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドの放出を遅延させるように構成される、経口医薬剤形を提供する。一部の実施形態では、該剤形形式は、錠剤、カプセル、または環状ボディーに覆われているコアである。
【図面の簡単な説明】
【0012】
【図1】図1は、薬物未処置(unmedicated)被験体(上部)およびMAO-A阻害被験体(下部)での経口投与チラミンの生体内変換に関与する酵素障壁(enzymatic barriers)および酵素の図である。ヒトでは、MAO-AおよびMAO-Bの活性は以下の通りである: それぞれ、腸粘膜、90%および10 %: 肝臓、30%および70%: アドレナリン作動性神経末端、100%および0%。略語: HPAA=p-ヒドロキシフェニル酢酸; チラミン=遊離チラミン; Ty-SO4=硫酸チラミン; NA=ノルアドレナリン; Oct.=オクトパミン; COMT=カタコール-O-メチルトランスフェラーゼ(catachol-O-methyltransferase)。
【発明を実施するための形態】
【0013】
モノアミンオキシダーゼインヒビター(MAOI)物質は、チラミンリッチ食物および飲料の摂取後に危険な食物反応を引き起こしうる。この危険な副作用は、それらが、大うつ病性障害、社交恐怖およびパニック発作の治療に非常に有効であっても、MAOIの使用を最小にしている。モノアミンオキシダーゼA型の可逆的インヒビター(RIMA)は、モノアミンオキシダーゼを一時的かつ可逆的に阻害する精神医学的薬物および天然化合物のファミリーである。しかし、一部のRIMAの治療量は、依然として、チラミン昇圧効果を40-〜50-倍も増強しうる。結果として、RIMAもまた、治療的に使用されることはほとんどない。
【0014】
本明細書中で提供されるように、「概要」において上で定義される、フェノキサチインに基づくMAO-Aインヒビターと称される(本明細書中で「活性物(active)」または「活性成分」とも称される)、特定のクラスのRIMAの大きい安全要因は、即時放出製剤に関連するピーク曝露レベルを回避し、さらに、胃腸管および肝組織でMAO-Aに関して食事性チラミンと可逆的に競合する、抗うつ量の薬物を送達するように操作される、持続放出製剤によって達成することができる。そのような製剤はCX157の場合に特に有効である。その理由は、このRIMAがMAO-Bに関する阻害作用を欠いていて、ゆえにMAO-B経路によるチラミン不活性化を可能にするからである。ゆえに、MAO-AインヒビターとしてのCX157の特異的かつ可逆的特性は、経口チラミン昇圧効果に関する弱い増強効果に好都合なプロファイルを提供する。
【0015】
上記に基づいて、本明細書中では、種々の持続放出製剤および形式のフェノキサチインに基づくMAO-Aインヒビター、および特にCX157を提供する。例えば、フェノキサチインに基づくMAO-Aインヒビター、例えばCX157の臨床試験および市販の錠剤は、錠剤を持続放出可能にするように、コーティングするか、カプセル化するか、または他の様式で処理することができる。
【0016】
本明細書中で使用されるパーセンテージ、比、割合などのすべての表現は、特に指定されない限り、重量単位である。持続放出製品の割合の表現は、多数の成分が溶解または分散している水の除去後の乾燥形式の製品を表す。用語「糖」とは、還元糖以外の糖を表す。還元糖は、フェーリング(Fehling's) (またはベネディクト(Benedict's))またはトレンス(Tollens')試薬を還元する炭水化物である。すべての単糖は還元糖であり、スクロースを除くほとんどの二糖もそうである。一般的な結合または充填剤の1つはラクトースである。この賦形剤は、良好に圧縮するので錠剤に特に有用であり、希釈液でありかつ結合剤であり、かつ安価である。しかし、それは還元糖であり、該活性成分は、室温および促進安定条件(accelerated stability conditions)(熱)条件下でともに、ラクトースと相互作用する。したがって、該活性成分を含む製剤でラクトースおよび他の還元糖を回避することが重要である。以下で考察されるように、スクロースは特別な糖である。
【0017】
特定の持続放出製品では、活性物のコアを持続放出コーティングによって囲み、ペレットを形成させる。そしてペレットをゼラチンカプセル中に積載することができる。以下のように、種々の成分を加えてペレットを構築する方法とともに、ペレットの種々の成分および層を個別に考察する。
【0018】
A. 活性成分
持続放出医薬品の形式のフェノキサチインに基づくMAO-Aインヒビターを提供する。それによって、フェノキサチインに基づくMAO-Aインヒビターによる消化管でのMAO受容体の結合は減少する。本明細書中で提供される製剤で使用される特定の活性成分は、以下の式:
【化5】

【0019】
[式中、nは0、1または2であり; R1は分岐鎖または直鎖C1-5アルキルまたはC3-6シクロアルキルであり、これはヒドロキシル、または1個以上のハロゲンで場合により置換され; およびX1、X2、X3、X4、およびX5はすべて水素であるか、またはX1、X2、X3、X4、およびX5の1または2個がハロゲンであり、かつ残りが水素であり、ただしnが0または1であり、かつ各Xが水素である場合、R1はメチルではない]
を有するフェノキサチインに基づくMAO-Aインヒビターである。
【0020】
持続性放出医薬品の特定の活性成分は、以下の式:
【化6】

【0021】
の3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシド(本明細書中でCX157とも称される)を活性成分として含む。持続放出医薬品の別の特定のコアは、以下の式:
【化7】

【0022】
の3-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシド(本明細書中でCX009とも称される)を活性成分として含む。持続放出医薬品の別の特定のコアは、以下の式:
【化8】

【0023】
の3-(2,2,2-トリフルオロ-1-メチルエトキシ)フェノキサチイン10,10-ジオキシド(以後「CX2614」)を活性成分として含む。上記フェノキサチインに基づくMAO-Aインヒビターおよび他のフェノキサチインに基づくMAO-Aインヒビターの製造方法は当技術分野で公知であり、U.S. Pat. No. 6,110,961 (該文献は参照によりその全体がここに組み入れられる)で例証される。
【0024】
本明細書中では、また、1日1回または2回の投薬が可能であるように少ない賦形剤量しか有さない、該活性成分を含む経口組成物、例えば錠剤またはカプセルを提供し、好ましくは1または2個のそのような組成物を各投薬時に投与する。本明細書中で提供される持続放出製品は、活性成分の任意の物理的形式を利用することができる。活性な医薬成分がCX157である場合、該活性成分は「ハイメルト(high melt)」結晶形でありうる。
【0025】
CX157の「ハイメルト」結晶形は、U.S. Application No. 11/773,892 (該文献は参照によりその全体がここに組み入れられる)で教示され、ここに、上記出願の「フォームA」が、本明細書中で「ハイメルト」と称されるフォームである。簡潔に言えば、ハイメルトフォームは、約169〜176℃; 約170〜174℃、約171〜173℃、約171〜172℃、または約171℃の融点を有すると特徴付けられる。ハイメルトフォームは、約158〜163℃、典型的に約160〜162℃で融解する、3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン-10,10-ジオキシドの少なくとも1つの他のフォームと区別できる。ハイメルトフォームは、Karl Fischer法によって測定された場合に、約1% H2O未満、約1%〜0.001% H2O、約0.5%〜0.01% H2O、約0.05%〜0.01% H2O、または約0.02% H2Oを含むと特徴付けることもできる。さらに、ハイメルトフォームは、上記出願の図2(a)に実質的に同一の1480〜1440 cm-1の減衰全反射フーリエ変換赤外スペクトルを有するか、上記出願の図2(a)に実質的に同一の970〜800 cm-1の減衰全反射フーリエ変換赤外スペクトルを有するか、または上記出願の図2(a)に実質的に同一の減衰全反射フーリエ変換赤外スペクトルを有すると特徴付けることができる。ハイメルトフォームの減衰全反射フーリエ変換赤外スペクトルは、上記出願の図2(b)に実質的に同一のCX157の別のフォームの970〜800 cm-1および1480〜1440 cm-1の減衰全反射フーリエ変換赤外スペクトルと区別できる。ハイメルトフォームは、化合物と溶媒との比(w/v)が約1.6g:10 mLである場合に、酢酸中の10% (v/v)水である溶媒に約75〜85℃、約75〜80℃、約75〜78℃、または約75〜77℃で溶解するとさらに特徴付けることができる。
【0026】
ハイメルトフォームは、約4.0、4.4および/または8.0の面間隔(d spacings)での主要X線粉末回折ピークを有すると特徴付けることができる。ハイメルトフォームは、約10.3、7.3、および/または3.65の面間隔でのX線粉末回折ピークを実質的に欠くと特徴付けることができる。ハイメルトフォームは、CuKα照射を使用して、約2θ= 11.0°、20.1°、および/または22.2°での主要X線粉末回折ピークを有すると特徴付けることができる。ハイメルトフォームは、CuKα照射を使用して、約2θ=8.5°、12.0°、および/または24.6°でのX線粉末回折ピークを実質的に欠くと特徴付けることもできる。ハイメルトフォームは、上記出願の図1(a)に実質的に同一のX線粉末回折パターンを有すると特徴付けることもできる。ハイメルトフォームのX線粉末回折パターンは、CX157の別のフォームのX線粉末回折特性と区別でき、該CX157の別のフォームは、約10.3、7.3、および/または3.65の面間隔で、かつ、CuKα照射を使用して、約2θ= 11.0°、20.1°、および/または22.2°で主要ピークを有し、かつ上記出願の図1(b)に実質的に同一のX線粉末回折パターンを有する。
【0027】
B. 持続放出製剤
持続放出医薬製剤は種々の剤形、例えば錠剤およびビーズで構成することができ; 種々の充填剤および賦形剤、例えば遅延賦形剤(放出修飾因子とも称される)を含むことができ; 種々の方法で作製することができる。当業者は、本明細書中で提供される説明によって導かれる通常の実験法によって適切な構成を決定することができる。
【0028】
持続放出医薬製剤は充填剤を含むことができる。好適な充填剤の例には、非限定的に、METHOCEL(登録商標) メチルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルセルロース(HPC)、コーンスターチ、ポリビニルアルコール(PVA)、ポリビニルピロリドン(PVP)、架橋PVP、などが含まれる。
【0029】
持続放出医薬製剤は賦形剤を含むことができる。好適な賦形剤の例には、非限定的に、クエン酸アセチルトリエチル(ATEC)、クエン酸アセチルトリ-n-ブチル(ATBC)、アスパルテーム、ラクトース、アルギン酸化合物、炭酸カルシウム、カーボポール、カラゲナン、セルロース、酢酸フタル酸セルロース、クロスカルメロースナトリウム、クロスポビドン、デキストロース、セバシン酸ジブチル、エチルセルロース、フルクトース、ゲランガム、ベヘン酸グリセリル、グアールガム、ラクトース、乳酸ラウリル、低置換ヒドロキシプロピルセルロース(low-substituted hydroxypryopl cellulose) (L-HPC)、ステアリン酸マグネシウム、バクガデキストリン、マルトース、マンニトール、メチルセルロース、微結晶性セルロース、メタクリル酸化合物、カルボキシメチルセルロースナトリウム、ポリ酢酸フタル酸ビニル(PVAP)、ポビドン、シェラック、グリコール酸デンプンナトリウム、ソルビトール、デンプン、スクロース、トリアセチン、クエン酸トリエチル(triethylcitrate)、植物に基づく脂肪酸、キサンタンガム、キシリトール、などが含まれる。
【0030】
好ましい実施形態では、持続放出医薬製剤は活性成分メチルセルロースおよび微結晶性セルロースを含む。一部の実施形態では、製剤は、例えば、重量に基づいて、約30%、40%、または50%、〜約80%または90%の活性成分を含む。一部の実施形態では、製剤は、重量に基づいて、約0.1%、0.5%、1%、3%、5%、10%または20%の活性成分を含む。好ましくは、活性成分は、重量に基づいて、約55%、60%、65%、または70%のパーセンテージで存在する。他の好ましい実施形態では、製剤は約95%の活性成分を含む。
【0031】
活性成分は、少なくとも、または少なくとも約、10 mg、15 mg、20 mg、25 mg、30 mg、40 mg、50 mg、60 mg、70 mg、80 mg、90 mg、100 mg、125 mg、150 mg、175 mg、もしくは200 mg以上、または約それ以上で存在させることができる。活性成分は、25 mg、30 mg、40 mg、50 mg、60 mg、70 mg、80 mg、90 mg、100 mg、125 mg、150 mg、175 mg、200 mg、250 mg、300 mg、350 mg、400 mg、450 mg、500 mg、600 mg、700 mg、800 mg、900 mgもしくは1000 mgまで、または約それまで、それ未満、または約それ未満で存在させることができる。具体的な範囲には、約50 mg〜約500 mg、または約100 mg〜約200 mgが含まれる。
【0032】
持続放出活性成分医薬製剤中の成分のバランスは、例えば、修飾多糖、例えば、メチルセルロース(MC)および微結晶性セルロース(MCC)から選択することができる。一部の実施形態では、製剤は、重量に基づいて、約3%〜約99.9%の範囲の微結晶性セルロースを含む。特定の実施形態では、製剤は約3% MCCを含む。他の実施形態では、製剤は約5% MCCを含む。さらなる実施形態では、製剤は約10% MCCを含む。さらに他の実施形態では、製剤は約30% MCCを含む。さらなる実施形態では、製剤は約50% MCCを含む。
【0033】
一部の実施形態では、持続放出医薬製剤は約0%〜約40% MCを含む。特定の実施形態では、製剤は約3% MCを含む。他の実施形態では、製剤は約5% MCを含む。さらなる実施形態では、製剤は約10% MCを含む。さらに他の実施形態では、製剤は約30% MCを含む。さらなる実施形態では、製剤は約40% MCを含む。一部の実施形態では、製剤は約95%の活性成分を含み、残りの5%はMCとMCCとの間で分けられる。
【0034】
持続放出医薬製剤の溶解速度は、活性成分が血流への吸収にどれほど高速に利用可能になるかを決定し、したがって活性成分のバイオアベイラビリティをコントロールする。溶解速度は剤形のサイズおよび組成に依存する。一部の実施形態では、製剤の溶解速度は、製剤の追加の成分を変更することによって変化させることができる。崩壊剤、例えばデンプンまたはコーンスターチ、または架橋PVPを使用して、所望の場合に溶解度を増加させることができる。可溶化剤を使用して製剤の溶解度を増加させることもできる。一部の実施形態では、代替の結合剤、例えばヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルセルロース(HPC)、メチルセルロース(MC)、PVP、ガム、キサンチン、などを使用して溶解速度を増加させることができる。
【0035】
一部の実施形態では、製剤をより疎水性にする成分を加えることによって製剤の溶解速度を減少させることができる。例えば、ポリマー、例えばエチルセルロース、ろう、ステアリン酸マグネシウム、などを加えると溶解速度が減少する。
【0036】
一部の実施形態では、活性成分の血漿レベルをコントロールするように、持続放出医薬製剤の溶解速度を設計する。
【0037】
例えば、持続放出医薬製剤を、例えば、少なくとも、または少なくとも約、5 ng/ml、10 ng/ml、15 ng/ml、20 ng/ml、25 ng/ml、30 ng/ml、40 ng/ml、50 ng/ml、60 ng/ml、70 ng/ml、80 ng/ml、90 ng/ml、もしくは100 ng/ml以上、または約それ以上の活性成分の血漿レベルを達成するように製剤化することができる。持続放出医薬製剤を、例えば、25 ng/ml、30 ng/ml、40 ng/ml、50 ng/ml、60 ng/ml、70 ng/ml、80 ng/ml、90 ng/ml、100 ng/ml、125 ng/ml、150 ng/ml、175 ng/ml、200 ng/ml、250 ng/ml、300 ng/ml、350 ng/ml、400 ng/ml、450 ng/ml、もしくは500 ng/mlまで、または約それまで、それ未満、または約それ未満の活性成分の血漿レベルを達成するように製剤化することができる。具体的な範囲は、約10 ng/ml〜約150 ng/ml、約20 ng/ml〜約100 ng/ml、または約40 ng/ml〜約80 ng/mlである。そのような範囲は、チーズ効果を引き起こすのに、消化管および肝臓でのMAO阻害の十分な阻害を生じさせることなく、活性成分の治療レベルを達成するために好都合であることが想定される。
【0038】
一部の実施形態では、持続放出医薬製剤の溶解速度は、剤形中の活性成分の約25%が最初の1時間以内に溶解し、活性成分の約60%が最初の6時間以内に溶解し、活性成分の約80%が最初の9時間以内に溶解し、かつ実質的にすべての活性成分が最初の12時間以内に溶解するような溶解速度である。他の実施形態では、持続放出医薬製剤の溶解速度は、剤形中の活性成分の約35%が最初の1時間以内に溶解し、活性成分の約85%が最初の6時間以内に溶解し、かつ実質的にすべての活性成分が最初の9時間以内に溶解するような溶解速度である。さらに他の実施形態では、剤形中の持続放出医薬製剤の溶解速度は、ビーズ中の活性成分の約45%が最初の1時間以内に溶解し、かつ実質的にすべての活性成分が最初の6時間以内に溶解するような溶解速度である。
【0039】
製剤の溶解速度は、剤形をコーティングすることによって遅くすることもできる。コーティングの例には、持続放出ポリマーが含まれる。
【0040】
持続放出医薬製剤の溶解には、例えば、約2、4、6、または8時間〜約15、20、または25時間かかる。好ましくは、製剤は、約3、4、5、または6〜約8、9、または10時間の溶解速度を有する。
【0041】
別の実施形態は持続放出医薬製剤の製造方法を提供する。該方法は、活性成分を賦形剤および/または充填剤と混合して混合物を形成させるステップ、および混合物から好適な剤形(例えば、錠剤、ビーズ、など)を成形するステップを含む。一部の実施形態では、該製剤の製造方法は、剤形を成形する前に別の賦形剤および/または充填剤を混合物に加えるステップをさらに含む。充填剤および賦形剤は本明細書中に記載されるものである。一実施形態では、活性成分を充填剤および/または賦形剤と混合して、湿った混合物を形成させる。次いで、湿った混合物を粒子またはビーズに成形することができ、該粒子またはビーズを乾燥させることができる。次いで、乾燥生成物を錠剤化するか、または経口送達用のゼラチンカプセルに入れることができる。
【0042】
一実施形態では、持続放出医薬製剤はビーズの形式である。一部の実施形態では、ビーズは活性成分および充填剤を含む。他の実施形態では、ビーズは賦形剤をさらに含む。一部の実施形態では、充填剤および/または賦形剤はポリマー形式である。
【0043】
本明細書中で使用される「ビーズ」は、例えば、スフェア、ペレット、ミクロスフェア、粒子、微粒子、顆粒、などであってよい。ビーズは任意の所望の形状を有することができる。該形状は、例えば、球状、実質的に球状、棒状、円柱状、卵形、楕円形、粒状、などであってよい。所望であれば、ビーズのサイズおよび形状を改変して溶解速度を変化させることができる。ビーズをコーティングしてよく、コーティングしなくてもよい。他の成分の有無にかかわらず、ビーズを、経口送達用カプセル、錠剤、または任意の他の所望の固体経口剤形に成形することができる。
【0044】
一実施形態では、医薬製剤は、持続放出活性成分および充填剤を含むビーズを含む。一部の実施形態では、ビーズは賦形剤をさらに含む。一部の実施形態では、充填剤はポリマーである。一部の実施形態では、賦形剤はポリマーである。一部の実施形態では、充填剤は、メチルセルロース、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルセルロース(HPC)、コーンスターチ、ポリビニルアルコール(PVA)、ポリビニルピロリドン(PVP)、および架橋PVPからなる群から選択される。一部の実施形態では、賦形剤は、クエン酸アセチルトリエチル(ATEC)、クエン酸アセチルトリ-n-ブチル(ATBC)、アスパルテーム、ラクトース、アルギン酸化合物、炭酸カルシウム、カーボポール、カラゲナン、セルロース、酢酸フタル酸セルロース、クロスカルメロースナトリウム、クロスポビドン、デキストロース、セバシン酸ジブチル、エチルセルロース、フルクトース、ゲランガム、ベヘン酸グリセリル、グアールガム、ラクトース、乳酸ラウリル、低置換ヒドロキシプロピルセルロース(L-HPC)、ステアリン酸マグネシウム、バクガデキストリン、マルトース、マンニトール、メチルセルロース、微結晶性セルロース、メタクリル酸化合物、カルボキシメチルセルロースナトリウム、ポリ酢酸フタル酸ビニル(polyvinyl acetate phathalate) (PVAP)、ポビドン、シェラック、グリコール酸デンプンナトリウム、ソルビトール、デンプン、スクロース、トリアセチン、クエン酸トリエチル、植物に基づく脂肪酸、キサンタンガム、およびキシリトールからなる群から選択される。一部の実施形態では、ビーズは、活性成分、メチルセルロースおよび微結晶性セルロースを含む。一部の実施形態では、ビーズは、重量に基づいて約0.1%〜約95%の活性成分を含む。一部の実施形態では、ビーズは、重量に基づいて約3%〜約99.9%の範囲の微結晶性セルロースを含む。一部の実施形態では、ビーズは、重量に基づいて約0%〜約40%のメチルセルロースを含む。
【0045】
改変は当業者に自明であるため、本発明は特許請求の範囲によってしか限定されないものとする。
【特許請求の範囲】
【請求項1】
以下の式:
【化1】

[式中、nは0、1または2であり; R1は分岐鎖または直鎖C1-5アルキルまたはC3-6シクロアルキルであり、これはヒドロキシル、または1個以上のハロゲンで場合により置換され; およびX1、X2、X3、X4、およびX5はすべて水素であるか、またはX1、X2、X3、X4、およびX5の1または2個がハロゲンであり、かつ残りが水素であり、ただしnが0または1であり、かつ各Xが水素である場合、R1はメチルではない]
のフェノキサチインに基づくMAO-Aインヒビターを含む持続放出経口医薬品。
【請求項2】
フェノキサチインに基づくMAO-Aインヒビターが3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドである、請求項1に記載の持続放出製品。
【請求項3】
製品が錠剤である、請求項1または2に記載の持続放出製品。
【請求項4】
製品がカプセルである、請求項1〜3のいずれか1項に記載の持続放出製品。
【請求項5】
製品が、環状ボディーに覆われているコアである、請求項1〜4のいずれか1項に記載の持続放出製品。
【請求項6】
製品が、約40 ng/ml〜約80 ng/mlの範囲のフェノキサチインに基づくMAO-Aインヒビターの血漿レベルを達成するように製剤化される、請求項1〜5のいずれか1項に記載の持続放出製品。
【請求項7】
製品が、約10 ng/ml〜約150 ng/mlの範囲のフェノキサチインに基づくMAO-Aインヒビターの血漿レベルを達成するように製剤化される、請求項1〜6のいずれか1項に記載の持続放出製品。
【請求項8】
製品が3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを唯一の活性成分として含む、請求項1〜7のいずれか1項に記載の持続放出製品。
【請求項9】
3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドが約169〜175℃の融点を有すると特徴付けられる、請求項1〜8のいずれか1項に記載の持続放出製品。
【請求項10】
3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドが結晶形でありかつ、CuKα照射を使用して、2θ=11.0°でX線粉末回折ピークを有すると特徴付けられる、請求項1〜9のいずれか1項に記載の持続放出製品。
【請求項11】
製品が約50〜500ミリグラムの3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを含む錠剤である、請求項1〜10のいずれか1項に記載の持続放出製品。
【請求項12】
3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを含み、かつ消化管での3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドの放出を遅延させるように構成される、経口医薬剤形。
【請求項13】
錠剤、カプセル、または環状ボディーで覆われているコアである、請求項12に記載の経口医薬剤形。
【請求項14】
錠剤である、請求項13に記載の医薬剤形。
【請求項1】
以下の式:
【化1】

[式中、nは0、1または2であり; R1は分岐鎖または直鎖C1-5アルキルまたはC3-6シクロアルキルであり、これはヒドロキシル、または1個以上のハロゲンで場合により置換され; およびX1、X2、X3、X4、およびX5はすべて水素であるか、またはX1、X2、X3、X4、およびX5の1または2個がハロゲンであり、かつ残りが水素であり、ただしnが0または1であり、かつ各Xが水素である場合、R1はメチルではない]
のフェノキサチインに基づくMAO-Aインヒビターを含む持続放出経口医薬品。
【請求項2】
フェノキサチインに基づくMAO-Aインヒビターが3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドである、請求項1に記載の持続放出製品。
【請求項3】
製品が錠剤である、請求項1または2に記載の持続放出製品。
【請求項4】
製品がカプセルである、請求項1〜3のいずれか1項に記載の持続放出製品。
【請求項5】
製品が、環状ボディーに覆われているコアである、請求項1〜4のいずれか1項に記載の持続放出製品。
【請求項6】
製品が、約40 ng/ml〜約80 ng/mlの範囲のフェノキサチインに基づくMAO-Aインヒビターの血漿レベルを達成するように製剤化される、請求項1〜5のいずれか1項に記載の持続放出製品。
【請求項7】
製品が、約10 ng/ml〜約150 ng/mlの範囲のフェノキサチインに基づくMAO-Aインヒビターの血漿レベルを達成するように製剤化される、請求項1〜6のいずれか1項に記載の持続放出製品。
【請求項8】
製品が3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを唯一の活性成分として含む、請求項1〜7のいずれか1項に記載の持続放出製品。
【請求項9】
3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドが約169〜175℃の融点を有すると特徴付けられる、請求項1〜8のいずれか1項に記載の持続放出製品。
【請求項10】
3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドが結晶形でありかつ、CuKα照射を使用して、2θ=11.0°でX線粉末回折ピークを有すると特徴付けられる、請求項1〜9のいずれか1項に記載の持続放出製品。
【請求項11】
製品が約50〜500ミリグラムの3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを含む錠剤である、請求項1〜10のいずれか1項に記載の持続放出製品。
【請求項12】
3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドを含み、かつ消化管での3-フルオロ-7-(2,2,2-トリフルオロエトキシ)フェノキサチイン10,10-ジオキシドの放出を遅延させるように構成される、経口医薬剤形。
【請求項13】
錠剤、カプセル、または環状ボディーで覆われているコアである、請求項12に記載の経口医薬剤形。
【請求項14】
錠剤である、請求項13に記載の医薬剤形。
【図1】




【公表番号】特表2012−514649(P2012−514649A)
【公表日】平成24年6月28日(2012.6.28)
【国際特許分類】
【出願番号】特願2011−545449(P2011−545449)
【出願日】平成22年1月8日(2010.1.8)
【国際出願番号】PCT/US2010/020468
【国際公開番号】WO2010/080977
【国際公開日】平成22年7月15日(2010.7.15)
【出願人】(507034883)セネレックス バイオファーマ,インコーポレーテッド (2)
【Fターム(参考)】
【公表日】平成24年6月28日(2012.6.28)
【国際特許分類】
【出願日】平成22年1月8日(2010.1.8)
【国際出願番号】PCT/US2010/020468
【国際公開番号】WO2010/080977
【国際公開日】平成22年7月15日(2010.7.15)
【出願人】(507034883)セネレックス バイオファーマ,インコーポレーテッド (2)
【Fターム(参考)】
[ Back to top ]

