経皮吸収型製剤
【課題】鎮痛剤による副作用を軽減し、ケタミンの精神的副作用を回避しつつ、ケタミンの定常状態での血中濃度が、鎮痛剤の効果を相乗的に高める濃度で維持することを可能とする皮膚刺激性の少ない経皮吸収型製剤を提供。
【解決手段】支持体の片面に膏体層が設けられ、この膏体層が、ケタミン及び/又はその塩、カルボキシル基又はその塩を化学構造中に有し、アルコールに可溶性の高分子物質を1〜50重量%、アルミニウムせっけん及び/又はマグネシウムせっけんを1〜50重量%、グリセリンを必須成分とする多価アルコールを20〜90重量%含み、水溶液のpHが6.0以上である経皮吸収型製剤。
【解決手段】支持体の片面に膏体層が設けられ、この膏体層が、ケタミン及び/又はその塩、カルボキシル基又はその塩を化学構造中に有し、アルコールに可溶性の高分子物質を1〜50重量%、アルミニウムせっけん及び/又はマグネシウムせっけんを1〜50重量%、グリセリンを必須成分とする多価アルコールを20〜90重量%含み、水溶液のpHが6.0以上である経皮吸収型製剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ケタミンおよび/またはその塩を(以下、原則として「ケタミン」と総称する)含有し、ケタミンの精神的副作用を回避し、ケタミンの定常状態での血中濃度を、鎮痛剤の効果を相乗的に高める濃度で維持することができる皮膚刺激性の少ない経皮吸収型製剤に関するものである。
【背景技術】
【0002】
慢性疼痛は、長時間持続する難治性の疼痛であり、原因となった疾患が治癒した後も長期間持続する疼痛と、難知性慢性疾患により長期間持続する疼痛がある。慢性疼痛の一つとして、抹消神経、脊髄、脳といった様々な部位で、神経の疼痛伝達系に機能異常が起きて生じる神経因性疼痛がある。神経因性疼痛の主症状には、灼熱痛、アロディニア、痛覚過敏などがある。
【0003】
神経因性疼痛に関する病態生理学的機序が解明されてきている。その機序としては、神経系が過剰に興奮を起こすため、刺激があってもなくても、継続的な痛みを感じてしまうといったものである。この神経因性疼痛を含む慢性疼痛には、鎮痛補助薬として、抗けいれん薬や抗不整脈薬やNMDA受容体の非競合的拮抗薬などが、単独若しくは鎮痛剤と併用されて用いられている。
【0004】
特に、NMDA受容体の非競合的拮抗薬の一つであるケタミンは、神経系の興奮に寄与しているNMDA受容体に対して、拮抗作用を有するため鎮痛効果を示す。鎮痛剤としてのケタミンの有効血中濃度は、127ng/mL(非特許文献1)と報告されているが、この濃度は、ケタミンの精神的副作用を誘発する濃度でもあるため、この血中濃度になるようにケタミンを投与することは問題がある。しかしながら、非特許文献2には、ケタミンを注射によって投与し、ケタミンの血中濃度を<50ng/mL程度で用いることにより、鎮痛剤としての効果を維持しつつ、ケタミンによる精神的副作用を抑えられる可能性が示唆されている。但し、これらの文献には、鎮痛剤の効果を持続的に発現させるための具体的な製剤に関しては記載されていない。
【0005】
種々のタイプの慢性疼痛にかかった患者への麻薬性鎮痛剤の長期間の投与は、悪心、嘔吐、便秘、鎮痛剤に対する耐性及び/又は依存性などを含む多数の重大な副作用を発現させる。NMDA受容体の非競合的拮抗薬の一つであるケタミンは、モルヒネ等の麻薬性鎮痛剤の作用を増強することが報告されている(非特許文献3及び非特許文献4)。
【0006】
特許文献1、特許文献2、非特許文献5には、ケタミンを経皮投与することが記載されている。しかしながら、これらの文献には、麻薬性鎮痛剤との併用により、鎮痛補助薬としてケタミンの精神的副作用を誘発する濃度以下で、ケタミンの定常状態での血中濃度を維持することを可能にしたものではない。
【0007】
特許文献3には、ケタミンの血中濃度が10〜50ng/mLになるように持続注射を行い、鎮痛剤と併用した際の鎮痛効果について評価し、ケタミンを経皮的に投与するための製剤例について記載されている。しかしながら、これらの経皮吸収型製剤を用いた具体的な効果は記載されていないと共に、上記をこえる効果は期待し得ないものである。
【0008】
以上のように、鎮痛剤による副作用を軽減し、ケタミンの精神的副作用を回避ししつつ、ケタミンの定常状態での血中濃度が、鎮痛剤の効果を相乗的に高める濃度で維持することの可能な経皮吸収型製剤は、未だ十分に満足のいく製剤が開発されるに至っていないのが実状である。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特表平11−511466号公報
【特許文献2】特開平6−79002号公報
【特許文献3】特開2003−201254号公報
【非特許文献】
【0010】
【非特許文献1】慢性疼痛とケタミン ペインクリニック Vol.20 No.8
【非特許文献2】R.L.Schmidら(1999)、Pain 82:111−125
【非特許文献3】Suzuki Mら(1999、)Anesth Analg 89:98−103
【非特許文献4】Chia YYら(1998)、Anesth Analg 86:1245−1249
【非特許文献5】V.M.S.Azeuedoら(2000)、Anesth Analg 91:1479−1482
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明の目的は、鎮痛剤による副作用を軽減し、ケタミンの精神的副作用を回避ししつつ、ケタミンの定常状態での血中濃度が、鎮痛剤の効果を相乗的に高める濃度で維持することを可能とする皮膚刺激性の少ない経皮吸収型製剤を提供することにある。
【課題を解決するための手段】
【0012】
本発明は、支持体の片面に、(A)ケタミン及び/又はその塩、(B)カルボキシル基又はその塩を化学構造中に有し、アルコールに可溶性の高分子物質を1〜50重量%、(c)アルミニウムせっけん及び/又はマグネシウムせっけんを1〜50重量%、及び(D)多価アルコールを20〜90重量%含有し、且つ多価アルコールがグリセリンを必須成分として含有し、水溶液のpHが6.0以上である膏体層を有することを特徴とするケタミン含有経皮吸収型製剤である。
【発明の効果】
【0013】
本発明の経皮吸収型製剤は、ケタミンの定常状態での血中濃度が、ケタミンの精神的副作用を回避し、鎮痛剤の効果を相乗的に高める濃度で維持することを可能とし、皮膚刺激性が少なく、皮膚に長時間安定に貼付しうるという顕著な効果を示す。
【図面の簡単な説明】
【0014】
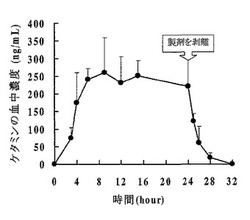
【図1】図1は本発明の経皮吸収型製剤のラット貼付試験の結果を示すグラフである。
【発明を実施するための形態】
【0015】
本発明の経皮吸収型製剤は、支持体の片面に設けた膏体層(粘着層)の構成に特徴を有する。膏体層を構成する必須の薬剤成分(A)はケタミンであり、ケタミンとしては、ケタミン及び/又はその化学的に許容される塩を含む。また含有量は、効果発現に必要とする経皮吸収速度が得られ、膏体層の貼付性を損なわなければ、特に限定されない。具体的には、膏体層中におけるケタミンの含有量は、少なすぎるとケタミンの経皮吸収速度を目的とする速度に維持することができず、目的とするケタミンの血中濃度を得ることができないことがある一方、多すぎるとケタミンの利用率が低下して非効率となって好ましくないので、1〜50重量%が好ましく、2〜30重量%がより好ましく、3〜20重量%が特に好ましい。
【0016】
本発明の膏体層の基材である粘着剤成分(B)は、その構造中にカルボキシル基及び/又はその塩を有しアルコールに可溶性の高分子物質であれば特に限定されず、例えばポリアクリル酸、ポリメタクリル酸、メチルビニルエーテル無水マレイン酸共重合体、イソブチレン無水マレイン酸共重合体、カルボキシメチルセルロースやそれらの塩等があげられる。また、従来公知の高分子物質、例えばポリビニルアルコールやポリビニルピロリドン、ポリエチレングリコール、ポリビニルアセトアミド等の構造中の一部に、カルボキシル基が導入された高分子物質を用いることもできる。更に、これらの高分子物質は構造中のカルボキシル基を一部エステル化やエーテル化したものも用いることができる。これらの高分子物質は単独でも、2種以上組み合わせて使用することもできる。これらの高分子物質の含量は、1〜50重量%が好ましく、5〜40重量%がより好ましく、10〜30重量%が特に好ましい。1重量%未満では凝集力が低下する傾向があり、保型性が保ち難く、貼付剤を皮膚から剥離した際に糊残りを生じることがある。また、50重量%を超えると凝集力が高くなる傾向が認められ、練合時や塗工時の作業性を低下させる傾向があるので好ましくない。
【0017】
これらの高分子化合物は固体物質であり、膏体を製造する際には、通常、グリセリンを必須成分とする多価アルコール等の他の成分と共に固体状の高分子化合物を揮発性有機溶剤に溶解した溶液をつくり、支持体上に塗布し、溶液を構成する揮発性成分の一部ないし全部を蒸発除去する方法で膏体層が形成される。その際の揮発性有機溶剤としてはエタノール等の1価の低級アルコールが好ましく用いられる。その意味で(B)成分として用いる高分子化合物はアルコール即ち1価アルコール及び/又は多価アルコールに可溶性の高分子化合物が用いられる。
【0018】
本発明の膏体層は、さらにアルミニウムせっけん及び/又はマグネシウムせっけんを含有する。これらの具体例としては、アルミニウムせっけんとしてステアリン酸アルミニウム、ベヘン酸アルミニウム、オクタン酸アルミニウム等が、マグネシウムせっけんとしてステアリン酸マグネシウム、ミリスチン酸マグネシウム、オレイン酸マグネシウム等があげられる。これらの金属せっけんは単独でも、2種類以上組み合わせても使用することができる。金属せっけんの含量は、1〜50重量%が好ましく、2〜30重量%がより好ましく、3〜15重量%が特に好ましい。1重量%未満では凝集力が低下する傾向があり、保型性が保ち難く、貼付剤を皮膚から剥離した際に糊残りや離しょう液を生じることがある。また、50重量%を超えると粘着力を低下させる傾向があるので好ましくない。
【0019】
本発明の膏体層は、さらに多価アルコールを含有する。多価アルコールの具体例としては、エチレングリコール、ジエチレングリコール、トリエチレングリコール、プロピレングリコール、1,3−ブチレングリコール、1,4−ブチレングリコール、グリセリン等や、重合度の低いポリエチレングリコールやポリプロピレングリコール等も挙げられ、中でもグリセリン、1,3−ブチレングリコール、プロピレングリコールが好ましく、グリセリン、1,3−ブチレングリコールが特に好ましい。本発明では多価アルコールの必須成分としてグリセリンを用いる。グリセリンを多価アルコールの総量に対して10重量%以上を配合することで、本発明の経皮吸収型製剤の皮膚刺激性を著しく軽減することができる。グリセリンは多価アルコールの総量を含めてもよいが、通常は80重量%以下が好ましい。
【0020】
本発明の膏体層は実質的に無水であることが望ましい。そのため膏体層の製造に供するグリセリンとしては、通常濃グリセリンと称されているグリセリン含量が98%以上のものが用いられる。
【0021】
本発明の膏体層は、前記したように、通常膏体を構成する各成分を1価の低級アルコールに溶解させ、その溶液を支持体に塗布して1価の低級アルコールの少なくとも一部を蒸発させて所望の粘着性をもつ膏体層とすることによって調整される。1価の低級アルコールの具体例としては、メチルアルコール(メタノール)、エチルアルコール(エタノール)、プロピルアルコール、イソプロピルアルコール、ブチルアルコール等が挙げられ、中でもエチルアルコール、イソプロピルアルコールが好ましく、エチルアルコールが特に好ましい。1価の低級アルコールはその実質上すべてを蒸発させることも可能だが、膏体中にその一部を残留させることが好ましい。1価の低級アルコール及びグリセリンを含む多価アルコールの総含量は、20〜90重量%が好ましく、30〜85重量%がより好ましく、40〜80重量%が特に好ましい。20重量%未満では、凝集力が高くなる傾向が認められ、練合時や塗工時の作業性を低下させる傾向があるので好ましくない。また、90重量%を超えると離しょう液を生じることがある。膏体中の1価の低級アルコールと多価アルコールの総量に対する1価の低級アルコールの量は50重量%以下であることが好ましい。
【0022】
本発明の膏体層は、その水溶液のpHが6.0以上であることを要する。このpHは6.5以上が好ましく、特に7.0以上が好ましい。膏体層がこのようなpH条件を満足するように、必要に応じてpH調整剤が用いられる。
【0023】
pH調整剤としては製剤技術の分野で使用し得るものであれば、特に限定はされない。その具体例としては、水酸化カリウム、水酸化カルシウム等の無機塩基、アンモニア、ジイソプロパノールアミン、トリイソプロパノールアミン、モノエタノールアミン、ジエタノールアミン、トリエタノールアミン、トリエチルアミン等有機塩基があげられる。これらの内、特にジイソプロパノールアミン及びトリイソプロパノールアミンが好ましい。本発明の経皮吸収型製剤において、膏体層のpHが6.0より低いと著しくケタミンの皮膚透過性が低下する傾向にある。尚、pHの上限は特に限定されないが、pHが高すぎると皮膚刺激の原因になるため、10.0以下にすることが好ましい。ここに記載したpH値は、膏体層の組成物を100〜500倍の質量の精製水に溶かした時の水溶液のpH値である。
【0024】
本発明の膏体層は、種々の任意成分を含有しうる。その一つは、経皮吸収促進剤である。経皮吸収促進剤としては、通常、経皮吸収型製剤に使用されるものであればよく、特に限定されないが、例えば高級アルコール類、高級脂肪酸、高級脂肪酸エステル類、尿素類、ピロリドン誘導体、有機酸、有機酸エステル類、テルペン類、精油、炭化水素、炭酸プロピレン、ベンジルアルコール、エイゾン(化学名:1−ドデシルアザシクロヘプタン−2−オン)、クロタミトン、シクロデキストリン、チオグリコール酸カルシウム等が挙げられ、これらの成分は単独あるいは二種以上を同時に用いることができる。これらの経皮吸収促進剤の内、ミリスチン酸イソプロピル、オレイルアルコールが好ましい。経皮吸収促進剤の含量は、0.01〜30重量%が好ましく、0.1〜10重量%がより好ましく、1〜10重量%が特に好ましい。0.01重量%未満では、経皮吸収促進作用が低下する傾向が認められ、30重量%を超えると、離しょう液が生じたり、皮膚への刺激性が増加する傾向にあるため好ましくない。これら経皮吸収促進剤を適宜配合することにより薬物の経皮への吸収促進、さらに薬効の持続作用等を与え、良好な経皮吸収型製剤を得ることができる。
【0025】
製剤のゲル化を促進させるために、必要に応じて有機酸を配合することもできる。ここで用いられる有機酸としては、特に限定されないが、通常外用製剤に添加剤として使用されるパルミチン酸、ステアリン酸、オレイン酸、リノール酸、リノレン酸等の脂肪酸や、酢酸、プロピオン酸、コハク酸、フマル酸、マレイン酸、リンゴ酸、シュウ酸、乳酸、グルタル酸、グルコン酸、クエン酸、酒石酸、安息香酸、フタル酸、サリチル酸等の他、これら有機酸の無水物やグルコノ−δ−ラクトン等がある。これらの内、特に乳酸が好ましい。
【0026】
上記の各成分のほか、従来の経皮吸収型製剤に慣用されている粘着付与剤、軟化剤、酸化防止剤、老化防止剤、充填剤等を配合することもできる。粘着付与剤としては、基剤との相溶性がよいものがよく、例えばポリテルペン樹脂、ロジンもしくはそのエステル、フェノール樹脂等があげられる。さらにパラヒドロキシ安息香酸メチル、パラヒドロキシ安息香酸エチル、パラヒドロキシ安息香酸プロピル、クロロブタノール、ベンジルアルコール等の保存剤の他、着香料等も添加することができる。更には各種の乳化剤、分散剤、湿潤剤、安定化剤、防腐剤および懸濁剤等を含有させることもできる。
【0027】
本発明の経皮吸収型製剤は、典型的には、支持体、上記した膏体層(粘着層)およびライナー層とを含む経皮吸収型製剤である。支持体としては、膏体層中の薬物の揮散や移行を防止するものであれば特に限定されないが、その具体例としては、酢酸セルロース、エチルセルロース、ポリエチレン、ポリウレタン、ポリエチレンテレフタレート(PET)、ナイロン等がある。またライナーは、経皮吸収型製剤を皮膚に適用するまで、膏体層を保護し、ケタミンが変質しないもので、かつ、容易に剥離できるものであれば特に限定されないが、その具体例としてはポリエチレンフィルム、ポリエチレンテレフタレートフィルムまたはポリプロピレンフィルムにシリコーン樹脂やフッ素樹脂等を塗布することによって剥離処理が施されたものなどが挙げられる。さらに、本発明の経皮吸収型製剤の厚みは、特に限定しないが、薄くなりすぎると必要量の薬物を含有することが出来なくなり、目的とする血中濃度を維持できない。逆に厚すぎると、のり残りが生じたり、端が衣服について剥がれ易くなるので、製剤の厚みは、20〜1500μmが好ましく、30μm〜1000μmが特に好ましい。
【0028】
次に実施例により本発明をさらに具体的に説明するが、本発明は、これらの実施例により限定されるものではない。さらに、下記の各処方に示す重量部は、乾燥及び加熱工程後に、最終的な薬物濃度より計算された経皮吸収型製剤中の配合量を示す。ただし、計算は揮発成分をエタノールのみとして行った。尚、乾燥前のエタノールの重量部を( )内に示した。
【実施例1】
【0029】
メチルビニルエーテル無水マレイン酸共重合体 7重量部
ポリアクリル酸部分中和物 7重量部
エタノール 8重量部( 90重量部)
グリセリン 25重量部
1,3−ブチレングリコール 25重量部
ステアリン酸アルニミウム 6重量部
ジイソプロパノールアミン 11重量部
乳酸 1重量部
ミリスチン酸イソプロピル 4重量部
塩酸ケタミン 6重量部
──────────────
100重量部(182重量部)
【0030】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にポリアクリル酸部分中和物、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、グリセリン、ジイソプロパノールアミン、乳酸及びミリスチン酸イソプロピルを加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したポリエチレンテレフタレートフィルム(以下PETフィルム)に塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、加熱してゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、8.123であった。
【実施例2】
【0031】
メチルビニルエーテル無水マレイン酸共重合体 7重量部
N−ビニルアセトアミド・
アクリル酸ナトリウム共重合樹脂 4重量部
エタノール 11重量部(160重量部)
グリセリン 26重量部
1,3−ブチレングリコール 26重量部
ステアリン酸アルニミウム 6重量部
ジイソプロパノールアミン 9重量部
乳酸 1重量部
ミリスチン酸イソプロピル 4重量部
塩酸ケタミン 6重量部
──────────────
100重量部(249重量部)
【0032】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にN−ビニルアセトアミド・アクリル酸ナトリウム共重合樹脂、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、グリセリン、ジイソプロパノールアミン、乳酸及びミリスチン酸イソプロピルを加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したPETフィルムに塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、ゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、8.004であった。
【実施例3】
【0033】
メチルビニルエーテル無水マレイン酸共重合体 7重量部
ポリアクリル酸部分中和物 7重量部
エタノール 14重量部( 90重量部)
グリセリン 24重量部
1,3−ブチレングリコール 24重量部
ステアリン酸アルニミウム 6重量部
ジイソプロパノールアミン 11重量部
乳酸 1重量部
塩酸ケタミン 6重量部
──────────────
100重量部(176重量部)
【0034】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にポリアクリル酸部分中和物、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、グリセリン、ジイソプロパノールアミン及び乳酸を加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したPETフィルムに塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、加熱してゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、7.974であった。
【実施例4】
【0035】
メチルビニルエーテル無水マレイン酸共重合体 7重量部
ポリアクリル酸部分中和物 7重量部
エタノール 12重量部( 90重量部)
グリセリン 26重量部
1,3−ブチレングリコール 26重量部
ステアリン酸アルニミウム 6重量部
ジイソプロパノールアミン 5重量部
乳酸 1重量部
ミリスチン酸イソプロピル 4重量部
塩酸ケタミン 6重量部
──────────────
100重量部(178重量部)
【0036】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にポリアクリル酸部分中和物、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、グリセリン、ジイソプロパノールアミン、乳酸及びミリスチン酸イソプロピルを加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したPETフィルムに塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、加熱してゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、6.806であった
【0037】
〔比較例1〕
メチルビニルエーテル無水マレイン酸共重合体 7重量部
ポリアクリル酸部分中和物 7重量部
エタノール 8重量部( 90重量部)
1,3−ブチレングリコール 50重量部
ステアリン酸アルニミウム 6重量部
ジイソプロパノールアミン 11重量部
乳酸 1重量部
ミリスチン酸イソプロピル 4重量部
塩酸ケタミン 6重量部
──────────────
100重量部(182重量部)
【0038】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にポリアクリル酸部分中和物、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、ジイソプロパノールアミン、乳酸及びミリスチン酸イソプロピルを加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したPETフィルムに塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、加熱してゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、8.174であった。
【0039】
〔比較例2〕
メチルビニルエーテル無水マレイン酸共重合体 7重量部
ポリアクリル酸部分中和物 7重量部
エタノール 11重量部( 90重量部)
グリセリン 29重量部
1,3−ブチレングリコール 29重量部
ステアリン酸アルニミウム 6重量部
乳酸 1重量部
ミリスチン酸イソプロピル 4重量部
塩酸ケタミン 6重量部
──────────────
100重量部(179重量部)
【0040】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にポリアクリル酸部分中和物、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、グリセリン、乳酸及びミリスチン酸イソプロピルを加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したPETフィルムに塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、加熱してゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、5.819であった。
【0041】
〔比較例3〕
メチルビニルエーテル無水マレイン酸共重合体 7重量部
ポリアクリル酸部分中和物 7重量部
エタノール 17重量部( 90重量部)
グリセリン 28重量部
1,3−ブチレングリコール 28重量部
ステアリン酸アルニミウム 6重量部
乳酸 1重量部
塩酸ケタミン 6重量部
──────────────
100重量部(173重量部)
【0042】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にポリアクリル酸部分中和物、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、グリセリン及び乳酸を加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したPETフィルムに塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、加熱してゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、5.717であった。
【0043】
試験例1
ウサギ皮膚刺激性試験
試験前日までにウサギの背部被毛を電気バリカンで毛刈し、試験当日に皮膚の状態が良好なことを確認した後、Draize法に準じて試験を行った。2.5cm×2.5cmの大きさに裁断した実施例1及び比較例1の経皮吸収型製剤を貼付し、貼付24時間後に剥離した。剥離1時間後を貼付24時間後として、24,48及び72時間後に紅斑と痂皮形成及び浮腫を指標とし、Draize法判定基準(表1)に従って、肉眼で皮膚状態を観察し点数をつけた。貼付24及び72時間後の評点を基に皮膚一次刺激性指数(Primary Irritation Index,P.I.I.)を算出した(式1)。P.I.I.値から、Draizeらの刺激性評価区分(表2)に従って刺激強度を評価した。
式1:P.I.I.値の算出
P.I.I.=(24時間後の健常部位の評点+
72時間後の健常部位の評点)÷2
【0044】
結果を表3に示した。表3より明らかなように、実施例1の経皮吸収型製剤は、比較例1に比較し、皮膚刺激の指標であるP.I.I.値が低く、また刺激性評価区分においても弱い刺激物であり、極めて安全性の高い貼付剤として有用性を十分に示すものである。
【0045】
【表1】

【0046】
【表2】

【0047】
【表3】

【0048】
試験例2
ラット皮膚透過試験
麻酔した8週齢のヘアレスラットの腹部皮膚を摘出し、真皮側の脂肪層を取り除いた。実施例1、2、3及び4、比較例2及び3で作製した経皮吸収型製剤から直径1cmの平面円形状の試験片(貼付面積:0.785cm2)を切り出し、皮膚に装着した後、速やかに37℃に保持された2−チャンバー拡散セルに装着した。レセプター側にpH7.2のリン酸緩衝液を適用し、所定時間ごとにレセプター液を一定量採取し、高速液体クロマトグラフによりケタミンの濃度を測定し、ケタミンの累積透過量を算出した。
【0049】
結果を表4に示した。実施例1、2、3及び4の経皮吸収型製剤は、比較例2及び3に比較し、ケタミンの高い透過性を示した。特に、実施例1と比較例2、実施例3と比較例3をそれぞれ比較するとpH調製剤を配合し、製剤のpHを高めることにより、ケタミンの皮膚透過性が著しく改善されることが示された。この結果から、製剤のpHが6以下になると、ケタミンの皮膚透過性が著しく低下するため、製剤のpHは6以上にすることが必要であり、本発明の有用性を裏づけるものである。さらに、実施例1と実施例3、比較例2と比較例3において、経皮吸収促進剤としてミリスチン酸イソプロピルを配合することにより、ケタミンの皮膚透過性が改善されることか確認できた。必要に応じて経皮吸収促進剤を配合することにより、ケタミンの皮膚透過性を改善することができるため、目的とするケタミンの有効血中濃度を得るために必要な製剤の適用面積を減らせることが可能である。
【0050】
【表4】

【0051】
試験例3
ラット貼付試験
実施例1で作製した経皮吸収型製剤から4cm×4cm(貼付面積:16cm2)の大きさに裁断した試験片を切り出し、麻酔した8週齢のヘアレスラットの腹部に貼付した。24時間貼付した後剥がした。所定時間ごとに血液を一定量採取し、高速液体クロマトグラフによりケタミンの濃度を測定して、ケタミンの血中濃度を算出した。
【0052】
結果を図1に示した。図1より明らかなように、実施例1の経皮吸収型製剤は、ラットに貼付後、速やかに血中濃度の上昇が起こり、24時間後まで一定の血中濃度を推移することが可能である製剤であることが示された。
【技術分野】
【0001】
本発明は、ケタミンおよび/またはその塩を(以下、原則として「ケタミン」と総称する)含有し、ケタミンの精神的副作用を回避し、ケタミンの定常状態での血中濃度を、鎮痛剤の効果を相乗的に高める濃度で維持することができる皮膚刺激性の少ない経皮吸収型製剤に関するものである。
【背景技術】
【0002】
慢性疼痛は、長時間持続する難治性の疼痛であり、原因となった疾患が治癒した後も長期間持続する疼痛と、難知性慢性疾患により長期間持続する疼痛がある。慢性疼痛の一つとして、抹消神経、脊髄、脳といった様々な部位で、神経の疼痛伝達系に機能異常が起きて生じる神経因性疼痛がある。神経因性疼痛の主症状には、灼熱痛、アロディニア、痛覚過敏などがある。
【0003】
神経因性疼痛に関する病態生理学的機序が解明されてきている。その機序としては、神経系が過剰に興奮を起こすため、刺激があってもなくても、継続的な痛みを感じてしまうといったものである。この神経因性疼痛を含む慢性疼痛には、鎮痛補助薬として、抗けいれん薬や抗不整脈薬やNMDA受容体の非競合的拮抗薬などが、単独若しくは鎮痛剤と併用されて用いられている。
【0004】
特に、NMDA受容体の非競合的拮抗薬の一つであるケタミンは、神経系の興奮に寄与しているNMDA受容体に対して、拮抗作用を有するため鎮痛効果を示す。鎮痛剤としてのケタミンの有効血中濃度は、127ng/mL(非特許文献1)と報告されているが、この濃度は、ケタミンの精神的副作用を誘発する濃度でもあるため、この血中濃度になるようにケタミンを投与することは問題がある。しかしながら、非特許文献2には、ケタミンを注射によって投与し、ケタミンの血中濃度を<50ng/mL程度で用いることにより、鎮痛剤としての効果を維持しつつ、ケタミンによる精神的副作用を抑えられる可能性が示唆されている。但し、これらの文献には、鎮痛剤の効果を持続的に発現させるための具体的な製剤に関しては記載されていない。
【0005】
種々のタイプの慢性疼痛にかかった患者への麻薬性鎮痛剤の長期間の投与は、悪心、嘔吐、便秘、鎮痛剤に対する耐性及び/又は依存性などを含む多数の重大な副作用を発現させる。NMDA受容体の非競合的拮抗薬の一つであるケタミンは、モルヒネ等の麻薬性鎮痛剤の作用を増強することが報告されている(非特許文献3及び非特許文献4)。
【0006】
特許文献1、特許文献2、非特許文献5には、ケタミンを経皮投与することが記載されている。しかしながら、これらの文献には、麻薬性鎮痛剤との併用により、鎮痛補助薬としてケタミンの精神的副作用を誘発する濃度以下で、ケタミンの定常状態での血中濃度を維持することを可能にしたものではない。
【0007】
特許文献3には、ケタミンの血中濃度が10〜50ng/mLになるように持続注射を行い、鎮痛剤と併用した際の鎮痛効果について評価し、ケタミンを経皮的に投与するための製剤例について記載されている。しかしながら、これらの経皮吸収型製剤を用いた具体的な効果は記載されていないと共に、上記をこえる効果は期待し得ないものである。
【0008】
以上のように、鎮痛剤による副作用を軽減し、ケタミンの精神的副作用を回避ししつつ、ケタミンの定常状態での血中濃度が、鎮痛剤の効果を相乗的に高める濃度で維持することの可能な経皮吸収型製剤は、未だ十分に満足のいく製剤が開発されるに至っていないのが実状である。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特表平11−511466号公報
【特許文献2】特開平6−79002号公報
【特許文献3】特開2003−201254号公報
【非特許文献】
【0010】
【非特許文献1】慢性疼痛とケタミン ペインクリニック Vol.20 No.8
【非特許文献2】R.L.Schmidら(1999)、Pain 82:111−125
【非特許文献3】Suzuki Mら(1999、)Anesth Analg 89:98−103
【非特許文献4】Chia YYら(1998)、Anesth Analg 86:1245−1249
【非特許文献5】V.M.S.Azeuedoら(2000)、Anesth Analg 91:1479−1482
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明の目的は、鎮痛剤による副作用を軽減し、ケタミンの精神的副作用を回避ししつつ、ケタミンの定常状態での血中濃度が、鎮痛剤の効果を相乗的に高める濃度で維持することを可能とする皮膚刺激性の少ない経皮吸収型製剤を提供することにある。
【課題を解決するための手段】
【0012】
本発明は、支持体の片面に、(A)ケタミン及び/又はその塩、(B)カルボキシル基又はその塩を化学構造中に有し、アルコールに可溶性の高分子物質を1〜50重量%、(c)アルミニウムせっけん及び/又はマグネシウムせっけんを1〜50重量%、及び(D)多価アルコールを20〜90重量%含有し、且つ多価アルコールがグリセリンを必須成分として含有し、水溶液のpHが6.0以上である膏体層を有することを特徴とするケタミン含有経皮吸収型製剤である。
【発明の効果】
【0013】
本発明の経皮吸収型製剤は、ケタミンの定常状態での血中濃度が、ケタミンの精神的副作用を回避し、鎮痛剤の効果を相乗的に高める濃度で維持することを可能とし、皮膚刺激性が少なく、皮膚に長時間安定に貼付しうるという顕著な効果を示す。
【図面の簡単な説明】
【0014】
【図1】図1は本発明の経皮吸収型製剤のラット貼付試験の結果を示すグラフである。
【発明を実施するための形態】
【0015】
本発明の経皮吸収型製剤は、支持体の片面に設けた膏体層(粘着層)の構成に特徴を有する。膏体層を構成する必須の薬剤成分(A)はケタミンであり、ケタミンとしては、ケタミン及び/又はその化学的に許容される塩を含む。また含有量は、効果発現に必要とする経皮吸収速度が得られ、膏体層の貼付性を損なわなければ、特に限定されない。具体的には、膏体層中におけるケタミンの含有量は、少なすぎるとケタミンの経皮吸収速度を目的とする速度に維持することができず、目的とするケタミンの血中濃度を得ることができないことがある一方、多すぎるとケタミンの利用率が低下して非効率となって好ましくないので、1〜50重量%が好ましく、2〜30重量%がより好ましく、3〜20重量%が特に好ましい。
【0016】
本発明の膏体層の基材である粘着剤成分(B)は、その構造中にカルボキシル基及び/又はその塩を有しアルコールに可溶性の高分子物質であれば特に限定されず、例えばポリアクリル酸、ポリメタクリル酸、メチルビニルエーテル無水マレイン酸共重合体、イソブチレン無水マレイン酸共重合体、カルボキシメチルセルロースやそれらの塩等があげられる。また、従来公知の高分子物質、例えばポリビニルアルコールやポリビニルピロリドン、ポリエチレングリコール、ポリビニルアセトアミド等の構造中の一部に、カルボキシル基が導入された高分子物質を用いることもできる。更に、これらの高分子物質は構造中のカルボキシル基を一部エステル化やエーテル化したものも用いることができる。これらの高分子物質は単独でも、2種以上組み合わせて使用することもできる。これらの高分子物質の含量は、1〜50重量%が好ましく、5〜40重量%がより好ましく、10〜30重量%が特に好ましい。1重量%未満では凝集力が低下する傾向があり、保型性が保ち難く、貼付剤を皮膚から剥離した際に糊残りを生じることがある。また、50重量%を超えると凝集力が高くなる傾向が認められ、練合時や塗工時の作業性を低下させる傾向があるので好ましくない。
【0017】
これらの高分子化合物は固体物質であり、膏体を製造する際には、通常、グリセリンを必須成分とする多価アルコール等の他の成分と共に固体状の高分子化合物を揮発性有機溶剤に溶解した溶液をつくり、支持体上に塗布し、溶液を構成する揮発性成分の一部ないし全部を蒸発除去する方法で膏体層が形成される。その際の揮発性有機溶剤としてはエタノール等の1価の低級アルコールが好ましく用いられる。その意味で(B)成分として用いる高分子化合物はアルコール即ち1価アルコール及び/又は多価アルコールに可溶性の高分子化合物が用いられる。
【0018】
本発明の膏体層は、さらにアルミニウムせっけん及び/又はマグネシウムせっけんを含有する。これらの具体例としては、アルミニウムせっけんとしてステアリン酸アルミニウム、ベヘン酸アルミニウム、オクタン酸アルミニウム等が、マグネシウムせっけんとしてステアリン酸マグネシウム、ミリスチン酸マグネシウム、オレイン酸マグネシウム等があげられる。これらの金属せっけんは単独でも、2種類以上組み合わせても使用することができる。金属せっけんの含量は、1〜50重量%が好ましく、2〜30重量%がより好ましく、3〜15重量%が特に好ましい。1重量%未満では凝集力が低下する傾向があり、保型性が保ち難く、貼付剤を皮膚から剥離した際に糊残りや離しょう液を生じることがある。また、50重量%を超えると粘着力を低下させる傾向があるので好ましくない。
【0019】
本発明の膏体層は、さらに多価アルコールを含有する。多価アルコールの具体例としては、エチレングリコール、ジエチレングリコール、トリエチレングリコール、プロピレングリコール、1,3−ブチレングリコール、1,4−ブチレングリコール、グリセリン等や、重合度の低いポリエチレングリコールやポリプロピレングリコール等も挙げられ、中でもグリセリン、1,3−ブチレングリコール、プロピレングリコールが好ましく、グリセリン、1,3−ブチレングリコールが特に好ましい。本発明では多価アルコールの必須成分としてグリセリンを用いる。グリセリンを多価アルコールの総量に対して10重量%以上を配合することで、本発明の経皮吸収型製剤の皮膚刺激性を著しく軽減することができる。グリセリンは多価アルコールの総量を含めてもよいが、通常は80重量%以下が好ましい。
【0020】
本発明の膏体層は実質的に無水であることが望ましい。そのため膏体層の製造に供するグリセリンとしては、通常濃グリセリンと称されているグリセリン含量が98%以上のものが用いられる。
【0021】
本発明の膏体層は、前記したように、通常膏体を構成する各成分を1価の低級アルコールに溶解させ、その溶液を支持体に塗布して1価の低級アルコールの少なくとも一部を蒸発させて所望の粘着性をもつ膏体層とすることによって調整される。1価の低級アルコールの具体例としては、メチルアルコール(メタノール)、エチルアルコール(エタノール)、プロピルアルコール、イソプロピルアルコール、ブチルアルコール等が挙げられ、中でもエチルアルコール、イソプロピルアルコールが好ましく、エチルアルコールが特に好ましい。1価の低級アルコールはその実質上すべてを蒸発させることも可能だが、膏体中にその一部を残留させることが好ましい。1価の低級アルコール及びグリセリンを含む多価アルコールの総含量は、20〜90重量%が好ましく、30〜85重量%がより好ましく、40〜80重量%が特に好ましい。20重量%未満では、凝集力が高くなる傾向が認められ、練合時や塗工時の作業性を低下させる傾向があるので好ましくない。また、90重量%を超えると離しょう液を生じることがある。膏体中の1価の低級アルコールと多価アルコールの総量に対する1価の低級アルコールの量は50重量%以下であることが好ましい。
【0022】
本発明の膏体層は、その水溶液のpHが6.0以上であることを要する。このpHは6.5以上が好ましく、特に7.0以上が好ましい。膏体層がこのようなpH条件を満足するように、必要に応じてpH調整剤が用いられる。
【0023】
pH調整剤としては製剤技術の分野で使用し得るものであれば、特に限定はされない。その具体例としては、水酸化カリウム、水酸化カルシウム等の無機塩基、アンモニア、ジイソプロパノールアミン、トリイソプロパノールアミン、モノエタノールアミン、ジエタノールアミン、トリエタノールアミン、トリエチルアミン等有機塩基があげられる。これらの内、特にジイソプロパノールアミン及びトリイソプロパノールアミンが好ましい。本発明の経皮吸収型製剤において、膏体層のpHが6.0より低いと著しくケタミンの皮膚透過性が低下する傾向にある。尚、pHの上限は特に限定されないが、pHが高すぎると皮膚刺激の原因になるため、10.0以下にすることが好ましい。ここに記載したpH値は、膏体層の組成物を100〜500倍の質量の精製水に溶かした時の水溶液のpH値である。
【0024】
本発明の膏体層は、種々の任意成分を含有しうる。その一つは、経皮吸収促進剤である。経皮吸収促進剤としては、通常、経皮吸収型製剤に使用されるものであればよく、特に限定されないが、例えば高級アルコール類、高級脂肪酸、高級脂肪酸エステル類、尿素類、ピロリドン誘導体、有機酸、有機酸エステル類、テルペン類、精油、炭化水素、炭酸プロピレン、ベンジルアルコール、エイゾン(化学名:1−ドデシルアザシクロヘプタン−2−オン)、クロタミトン、シクロデキストリン、チオグリコール酸カルシウム等が挙げられ、これらの成分は単独あるいは二種以上を同時に用いることができる。これらの経皮吸収促進剤の内、ミリスチン酸イソプロピル、オレイルアルコールが好ましい。経皮吸収促進剤の含量は、0.01〜30重量%が好ましく、0.1〜10重量%がより好ましく、1〜10重量%が特に好ましい。0.01重量%未満では、経皮吸収促進作用が低下する傾向が認められ、30重量%を超えると、離しょう液が生じたり、皮膚への刺激性が増加する傾向にあるため好ましくない。これら経皮吸収促進剤を適宜配合することにより薬物の経皮への吸収促進、さらに薬効の持続作用等を与え、良好な経皮吸収型製剤を得ることができる。
【0025】
製剤のゲル化を促進させるために、必要に応じて有機酸を配合することもできる。ここで用いられる有機酸としては、特に限定されないが、通常外用製剤に添加剤として使用されるパルミチン酸、ステアリン酸、オレイン酸、リノール酸、リノレン酸等の脂肪酸や、酢酸、プロピオン酸、コハク酸、フマル酸、マレイン酸、リンゴ酸、シュウ酸、乳酸、グルタル酸、グルコン酸、クエン酸、酒石酸、安息香酸、フタル酸、サリチル酸等の他、これら有機酸の無水物やグルコノ−δ−ラクトン等がある。これらの内、特に乳酸が好ましい。
【0026】
上記の各成分のほか、従来の経皮吸収型製剤に慣用されている粘着付与剤、軟化剤、酸化防止剤、老化防止剤、充填剤等を配合することもできる。粘着付与剤としては、基剤との相溶性がよいものがよく、例えばポリテルペン樹脂、ロジンもしくはそのエステル、フェノール樹脂等があげられる。さらにパラヒドロキシ安息香酸メチル、パラヒドロキシ安息香酸エチル、パラヒドロキシ安息香酸プロピル、クロロブタノール、ベンジルアルコール等の保存剤の他、着香料等も添加することができる。更には各種の乳化剤、分散剤、湿潤剤、安定化剤、防腐剤および懸濁剤等を含有させることもできる。
【0027】
本発明の経皮吸収型製剤は、典型的には、支持体、上記した膏体層(粘着層)およびライナー層とを含む経皮吸収型製剤である。支持体としては、膏体層中の薬物の揮散や移行を防止するものであれば特に限定されないが、その具体例としては、酢酸セルロース、エチルセルロース、ポリエチレン、ポリウレタン、ポリエチレンテレフタレート(PET)、ナイロン等がある。またライナーは、経皮吸収型製剤を皮膚に適用するまで、膏体層を保護し、ケタミンが変質しないもので、かつ、容易に剥離できるものであれば特に限定されないが、その具体例としてはポリエチレンフィルム、ポリエチレンテレフタレートフィルムまたはポリプロピレンフィルムにシリコーン樹脂やフッ素樹脂等を塗布することによって剥離処理が施されたものなどが挙げられる。さらに、本発明の経皮吸収型製剤の厚みは、特に限定しないが、薄くなりすぎると必要量の薬物を含有することが出来なくなり、目的とする血中濃度を維持できない。逆に厚すぎると、のり残りが生じたり、端が衣服について剥がれ易くなるので、製剤の厚みは、20〜1500μmが好ましく、30μm〜1000μmが特に好ましい。
【0028】
次に実施例により本発明をさらに具体的に説明するが、本発明は、これらの実施例により限定されるものではない。さらに、下記の各処方に示す重量部は、乾燥及び加熱工程後に、最終的な薬物濃度より計算された経皮吸収型製剤中の配合量を示す。ただし、計算は揮発成分をエタノールのみとして行った。尚、乾燥前のエタノールの重量部を( )内に示した。
【実施例1】
【0029】
メチルビニルエーテル無水マレイン酸共重合体 7重量部
ポリアクリル酸部分中和物 7重量部
エタノール 8重量部( 90重量部)
グリセリン 25重量部
1,3−ブチレングリコール 25重量部
ステアリン酸アルニミウム 6重量部
ジイソプロパノールアミン 11重量部
乳酸 1重量部
ミリスチン酸イソプロピル 4重量部
塩酸ケタミン 6重量部
──────────────
100重量部(182重量部)
【0030】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にポリアクリル酸部分中和物、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、グリセリン、ジイソプロパノールアミン、乳酸及びミリスチン酸イソプロピルを加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したポリエチレンテレフタレートフィルム(以下PETフィルム)に塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、加熱してゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、8.123であった。
【実施例2】
【0031】
メチルビニルエーテル無水マレイン酸共重合体 7重量部
N−ビニルアセトアミド・
アクリル酸ナトリウム共重合樹脂 4重量部
エタノール 11重量部(160重量部)
グリセリン 26重量部
1,3−ブチレングリコール 26重量部
ステアリン酸アルニミウム 6重量部
ジイソプロパノールアミン 9重量部
乳酸 1重量部
ミリスチン酸イソプロピル 4重量部
塩酸ケタミン 6重量部
──────────────
100重量部(249重量部)
【0032】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にN−ビニルアセトアミド・アクリル酸ナトリウム共重合樹脂、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、グリセリン、ジイソプロパノールアミン、乳酸及びミリスチン酸イソプロピルを加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したPETフィルムに塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、ゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、8.004であった。
【実施例3】
【0033】
メチルビニルエーテル無水マレイン酸共重合体 7重量部
ポリアクリル酸部分中和物 7重量部
エタノール 14重量部( 90重量部)
グリセリン 24重量部
1,3−ブチレングリコール 24重量部
ステアリン酸アルニミウム 6重量部
ジイソプロパノールアミン 11重量部
乳酸 1重量部
塩酸ケタミン 6重量部
──────────────
100重量部(176重量部)
【0034】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にポリアクリル酸部分中和物、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、グリセリン、ジイソプロパノールアミン及び乳酸を加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したPETフィルムに塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、加熱してゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、7.974であった。
【実施例4】
【0035】
メチルビニルエーテル無水マレイン酸共重合体 7重量部
ポリアクリル酸部分中和物 7重量部
エタノール 12重量部( 90重量部)
グリセリン 26重量部
1,3−ブチレングリコール 26重量部
ステアリン酸アルニミウム 6重量部
ジイソプロパノールアミン 5重量部
乳酸 1重量部
ミリスチン酸イソプロピル 4重量部
塩酸ケタミン 6重量部
──────────────
100重量部(178重量部)
【0036】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にポリアクリル酸部分中和物、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、グリセリン、ジイソプロパノールアミン、乳酸及びミリスチン酸イソプロピルを加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したPETフィルムに塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、加熱してゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、6.806であった
【0037】
〔比較例1〕
メチルビニルエーテル無水マレイン酸共重合体 7重量部
ポリアクリル酸部分中和物 7重量部
エタノール 8重量部( 90重量部)
1,3−ブチレングリコール 50重量部
ステアリン酸アルニミウム 6重量部
ジイソプロパノールアミン 11重量部
乳酸 1重量部
ミリスチン酸イソプロピル 4重量部
塩酸ケタミン 6重量部
──────────────
100重量部(182重量部)
【0038】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にポリアクリル酸部分中和物、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、ジイソプロパノールアミン、乳酸及びミリスチン酸イソプロピルを加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したPETフィルムに塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、加熱してゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、8.174であった。
【0039】
〔比較例2〕
メチルビニルエーテル無水マレイン酸共重合体 7重量部
ポリアクリル酸部分中和物 7重量部
エタノール 11重量部( 90重量部)
グリセリン 29重量部
1,3−ブチレングリコール 29重量部
ステアリン酸アルニミウム 6重量部
乳酸 1重量部
ミリスチン酸イソプロピル 4重量部
塩酸ケタミン 6重量部
──────────────
100重量部(179重量部)
【0040】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にポリアクリル酸部分中和物、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、グリセリン、乳酸及びミリスチン酸イソプロピルを加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したPETフィルムに塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、加熱してゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、5.819であった。
【0041】
〔比較例3〕
メチルビニルエーテル無水マレイン酸共重合体 7重量部
ポリアクリル酸部分中和物 7重量部
エタノール 17重量部( 90重量部)
グリセリン 28重量部
1,3−ブチレングリコール 28重量部
ステアリン酸アルニミウム 6重量部
乳酸 1重量部
塩酸ケタミン 6重量部
──────────────
100重量部(173重量部)
【0042】
メチルビニルエーテル無水マレイン酸共重合体及びエタノールを混合分散し、加熱溶解した液をAとする。別にポリアクリル酸部分中和物、ステアリン酸アルニミウム及び塩酸ケタミンを混合した粉末に、1,3−ブチレングリコール、グリセリン及び乳酸を加えて溶解混合した液をBとする。A及びBを混合し、脱泡した液を表面にシリコン処理を施したPETフィルムに塗工し乾燥させる。その後、PETフィルムに不織布を張り合わせた支持体で覆い、加熱してゲル化させたものを適当な大きさに裁断して、1cm2当り約4mgの塩酸ケタミンを含有する経皮吸収型製剤を得た。この製剤のpHを測定した時、5.717であった。
【0043】
試験例1
ウサギ皮膚刺激性試験
試験前日までにウサギの背部被毛を電気バリカンで毛刈し、試験当日に皮膚の状態が良好なことを確認した後、Draize法に準じて試験を行った。2.5cm×2.5cmの大きさに裁断した実施例1及び比較例1の経皮吸収型製剤を貼付し、貼付24時間後に剥離した。剥離1時間後を貼付24時間後として、24,48及び72時間後に紅斑と痂皮形成及び浮腫を指標とし、Draize法判定基準(表1)に従って、肉眼で皮膚状態を観察し点数をつけた。貼付24及び72時間後の評点を基に皮膚一次刺激性指数(Primary Irritation Index,P.I.I.)を算出した(式1)。P.I.I.値から、Draizeらの刺激性評価区分(表2)に従って刺激強度を評価した。
式1:P.I.I.値の算出
P.I.I.=(24時間後の健常部位の評点+
72時間後の健常部位の評点)÷2
【0044】
結果を表3に示した。表3より明らかなように、実施例1の経皮吸収型製剤は、比較例1に比較し、皮膚刺激の指標であるP.I.I.値が低く、また刺激性評価区分においても弱い刺激物であり、極めて安全性の高い貼付剤として有用性を十分に示すものである。
【0045】
【表1】

【0046】
【表2】

【0047】
【表3】

【0048】
試験例2
ラット皮膚透過試験
麻酔した8週齢のヘアレスラットの腹部皮膚を摘出し、真皮側の脂肪層を取り除いた。実施例1、2、3及び4、比較例2及び3で作製した経皮吸収型製剤から直径1cmの平面円形状の試験片(貼付面積:0.785cm2)を切り出し、皮膚に装着した後、速やかに37℃に保持された2−チャンバー拡散セルに装着した。レセプター側にpH7.2のリン酸緩衝液を適用し、所定時間ごとにレセプター液を一定量採取し、高速液体クロマトグラフによりケタミンの濃度を測定し、ケタミンの累積透過量を算出した。
【0049】
結果を表4に示した。実施例1、2、3及び4の経皮吸収型製剤は、比較例2及び3に比較し、ケタミンの高い透過性を示した。特に、実施例1と比較例2、実施例3と比較例3をそれぞれ比較するとpH調製剤を配合し、製剤のpHを高めることにより、ケタミンの皮膚透過性が著しく改善されることが示された。この結果から、製剤のpHが6以下になると、ケタミンの皮膚透過性が著しく低下するため、製剤のpHは6以上にすることが必要であり、本発明の有用性を裏づけるものである。さらに、実施例1と実施例3、比較例2と比較例3において、経皮吸収促進剤としてミリスチン酸イソプロピルを配合することにより、ケタミンの皮膚透過性が改善されることか確認できた。必要に応じて経皮吸収促進剤を配合することにより、ケタミンの皮膚透過性を改善することができるため、目的とするケタミンの有効血中濃度を得るために必要な製剤の適用面積を減らせることが可能である。
【0050】
【表4】

【0051】
試験例3
ラット貼付試験
実施例1で作製した経皮吸収型製剤から4cm×4cm(貼付面積:16cm2)の大きさに裁断した試験片を切り出し、麻酔した8週齢のヘアレスラットの腹部に貼付した。24時間貼付した後剥がした。所定時間ごとに血液を一定量採取し、高速液体クロマトグラフによりケタミンの濃度を測定して、ケタミンの血中濃度を算出した。
【0052】
結果を図1に示した。図1より明らかなように、実施例1の経皮吸収型製剤は、ラットに貼付後、速やかに血中濃度の上昇が起こり、24時間後まで一定の血中濃度を推移することが可能である製剤であることが示された。
【特許請求の範囲】
【請求項1】
ケタミン及び/又はその塩、カルボキシル基又はその塩を化学構造中に有し、アルコールに可溶性の高分子物質を1〜50重量%、アルミニウムせっけん及び/又はマグネシウムせっけんを1〜50重量%及び多価アルコールを20〜90重量%含有し、且つ多価アルコールがグリセリンを必須成分として含有し、水溶液のpHが6.0以上である膏層体を有することを特徴とする経皮吸収型製剤。
【請求項2】
1価の低級アルコールを多価アルコールより少量割合で含有する請求項1の経皮吸収型製剤。
【請求項1】
ケタミン及び/又はその塩、カルボキシル基又はその塩を化学構造中に有し、アルコールに可溶性の高分子物質を1〜50重量%、アルミニウムせっけん及び/又はマグネシウムせっけんを1〜50重量%及び多価アルコールを20〜90重量%含有し、且つ多価アルコールがグリセリンを必須成分として含有し、水溶液のpHが6.0以上である膏層体を有することを特徴とする経皮吸収型製剤。
【請求項2】
1価の低級アルコールを多価アルコールより少量割合で含有する請求項1の経皮吸収型製剤。
【図1】




【公開番号】特開2010−229045(P2010−229045A)
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願番号】特願2009−75679(P2009−75679)
【出願日】平成21年3月26日(2009.3.26)
【出願人】(390039468)三笠製薬株式会社 (7)
【Fターム(参考)】
【公開日】平成22年10月14日(2010.10.14)
【国際特許分類】
【出願日】平成21年3月26日(2009.3.26)
【出願人】(390039468)三笠製薬株式会社 (7)
【Fターム(参考)】
[ Back to top ]

