結合分子
【課題】親和性成熟を受ける機能性重鎖のみ抗体の多様なレパートリーの製造及びその使用、クラス特異的重鎖のみ抗体の多様なレパートリーの製造及びその使用並びに抗体重鎖の機能、好ましくは抗体重鎖の結合機能、定常領域のエフェクター活性及び任意選択的に追加のエフェクター機能を有する多価ポリペプチド複合体の製造及び使用、抗原の投与に応答してトランスジェニックマウス中に十分に機能性の重鎖のみ抗体を生成させる方法、特に、任意のクラス又は混合したクラスのヒトの抗原特異的で高アフィニティの重鎖のみ抗体の生成方法及び十分に機能性のVH抗原結合ドメインの単離と発現を提供する。
【解決手段】異種のVH重鎖遺伝子座を発現し、軽鎖を含む内因性抗体産生能力を低減されたトランスジェニック哺乳類を、抗原により免疫する、VH重鎖のみ抗体を製造する。
【解決手段】異種のVH重鎖遺伝子座を発現し、軽鎖を含む内因性抗体産生能力を低減されたトランスジェニック哺乳類を、抗原により免疫する、VH重鎖のみ抗体を製造する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、親和性成熟による機能性重鎖のみ抗体(functional heavy chain−only antibody)の多様なレパートリーの製造及びその使用に関する。また本発明はクラス特異的重鎖のみ抗体の多様なレパートリーの製造と使用、並びに抗体重鎖の機能、好ましくは抗体重鎖の結合機能、定常領域のエフェクター活性及び任意選択的に追加のエフェクター機能を有する多価ポリペプチド複合体の製造と使用に関する。
【0002】
本発明はまた、抗原の投与に応答して十分に機能性の重鎖のみ抗体をトランスジェニックマウス中で生成させる方法に関する。特に本発明は、任意のクラス又は混合したクラスのヒトの抗原に特異的で高親和性の重鎖のみ抗体を生成させ、十分に機能性のVH抗原結合ドメインを単離し発現させる方法に関する。
【0003】
本発明はまた、重鎖の機能、好ましくは重鎖のエフェクター活性及び他の結合機能とエフェクター機能を含む多価ポリペプチド複合体の生成に関する。
【0004】
本発明の方法を使用することによって生成した重鎖のみ抗体と他の多価結合複合体及びそれらの使用についても述べる。
【背景技術】
【0005】
モノクローナル抗体又はその異型は、21世紀に送り出される新薬の高い比率を占めるであろう。モノクローナル抗体療法は、リウマチ様関節炎やクローン病を治療するのに好ましい方法としてすでに容認されており、癌の治療に目覚しく進出している。また心臓血管疾患や感染症を治療するための抗体ベースの製品も開発中である。市販されている大部分のモノクローナル抗体の製品は、標的のリガンド(例えばTNFα)の単一の明確なエピトープを認識してこれと結合する。治療用のヒトモノクローナル抗体は、依然として、哺乳類の細胞を培養する方法で製造されている。二つの重鎖と二つの軽鎖からなる複合体(H2L2複合体)の会合と、それに続く翻訳後グリコシル化を行なう工程が、細菌系を使用することを妨げている。哺乳類細胞の培養によって抗体を製造するための製造コストと資本コストは高額なので、容認できる代替手段がないと抗体ベースの治療の可能性を制限してしまう恐れがある。各種のトランスジェニック生物は、十分な機能を有する抗体を発現できる。これらの生物としては植物、昆虫、鶏、ヤギ及びウシがあるが、市販の治療用製品を製造するのに今まで使われていない。
【0006】
機能性抗体のフラグメントは、大腸菌(E.coli)中で製造できるが、一般に、その製品は、ペグ化(pegylate)されないと、製造工程中、血清安定性が低い。
【0007】
二重特異性抗体の複合体は、同じ又は異なる抗原の二つの異なるエピトープに結合できる遺伝子工学的に処理されたIgベースの分子である。抗体を単独で又は他の結合因子と組み合わせて取り入れている二重特異性結合タンパク質は、獲得されたヒトの免疫機能が、治療効果、例えば病原体の排除(Van Spriel et al.,(1999)J.Infect.Diseases,179,661−669;Tacken et al.,(2004)J.Immunol.,172,4934−4940;米国特許第5,487,890号)、癌の治療(Glennie and van der Winkel ,(2003)Drug Discovery Today,8,503−5100)、及び免疫療法(Van Spriel et al.,(2000)Immunol.Today,21,391−397;Segal et al.,(2001)J.Immunol.Methods,248,1−6;Lyden et al.,(2001)Nat.Med.,7,1194−1201)を引き出す治療法の将来性を示している。
【0008】
二重特異性抗体の製品が二つ以上のH2L2複合体に基づいていると、製造上の問題が悪化する。例えば、重鎖と軽鎖の遺伝子の二つ以上の組合せが共発現すると、10種類もの組合わせが生じてそのうち一種類だけが所望のヘテロ二量体であることがある(Suresh et al.,(1986)Methods Enzymol.,121,210−228)。
【0009】
この問題を解決するため、重鎖エフェクターの機能を保持している二重特異性IgG全長(BsIgG)を哺乳類の細胞中で産生させる多くの方法が開発されている。BsIgGは、ヘテロ二量体が生成するのを避けるため遺伝子工学的に処理された「knob and hole」重鎖を必要とし、かつL鎖の誤対合を回避するため同じL鎖を利用する(Carter,(2001)J.Immunol.Methods,248,7−15)。化学的に架橋する代替法としては、各々異なる抗原を認識する抗体フラグメントから複合体を製造する方法(Ferguson et al.,(1995)Arthritis and Rheumatism,38,190−200)又は他の結合タンパク質、例えばコレクチン類を抗体フラグメントに架橋させる方法(Tacken et al.,(2004)J.Immunol.,172,4934−4940)が記述されている。
【0010】
一般に重鎖のエフェクター機能を欠いているダイアボディ(diabody)又はミニ抗体(BsAb)の開発によってもヘテロ二量体の重複が克服されている。これらの抗体は、VH結合部位とVL結合部位を持つ最小一本鎖抗体(scFv)を含み、その結合部位はその後折り畳まれてニ量体になり、その抗体の標的抗原各々に対して一価である二価の二重特異性抗体を生成する(Holliger et al.,(1993)PNAS,90,6444−6448;Muller et al.,(1998)FEBS Lett.,422,259−264)。場合によっては、CH1ドメインとL定常ドメインが、二重特異性ミニ抗体を生成するためのヘテロ二量体化ドメインとして使用されている(Muller et al.,(1998)FEBS Lett.,259−264)。BsAbを製造するため、大腸菌発現系に基づいた各種組換え法が開発されているが(Hudson,(1999)Curr.Opin.Immunol.,11,548−557)、臨床グレードの多価抗体物質の製造コストと製造規模が依然として臨床的開発に対して主な障害になっている(Segal et al.,(2001)J.Immunol.Methods,248,1−6)。
【0011】
最近、BsAbの概念が拡大されて、H鎖とL鎖のVHドメインとVLドメインが遺伝子工学的に処理されたscFv結合ドメインで置換されたジ−ダイアボディ(Di−diabody)すなわち四価の二重特異性抗体が含まれる。このような構造体は、遺伝子工学的に処理することは複雑であるが、ヘテロ二量体の重複無しで、培養中の哺乳類細胞中で会合できる(Lu et al.,(2003)J.Immunol.Methods,279,219−232)。
【0012】
免疫グロブリンの構造は当分野では周知である。大部分の天然免疫グロブリンは二つの重鎖と二つの軽鎖を含む。これらの重鎖は、各重鎖に沿ってそのほぼ中央に位置するヒンジドメインの間のジスルフィド結合によって互いに連結されている。軽鎖は、上記ヒンジドメインのN末端側の各重鎖と会合している。各軽鎖は通常、上記ヒンジドメインの近くのジスルフィド結合によって、それぞれの重鎖に結合している。
【0013】
Ig分子が正しく折りたたまれると、各鎖は、より線状のポリペプチド配列によって連結された多数の別個の球状ドメインになる。例えば、軽鎖は折りたたまれて可変ドメイン(VL)と定常ドメイン(CL)になる。重鎖は、軽鎖の可変ドメインに隣接する単一の可変ドメインVH、第一定常ドメイン、ヒンジドメイン及び二つ又は三つのさらなる定常ドメインを有する。重鎖の可変ドメイン(VH)と軽鎖の可変ドメイン(VL)は相互に作用して抗原結合領域(Fv)を生成する。一般に、VHとVLの両者は、抗原と結合するために必要であるが、重鎖の二量体とアミノ末端フラグメントは、軽鎖無しで活性を保持していることが分かっている(Jaton et al.,(1968)Biochemistry,7,4185−4195)。
【0014】
新しい分子生物学の技術の出現によって、重鎖のみ抗体(軽鎖が欠落している)が、ヒト及びネズミモデル系のB細胞増殖性障害(重鎖病)に存在することが確認された。重鎖病を分子レベルで分析した結果、ゲノムのレベルでの突然変異と欠失が重鎖CH1ドメインの不適切な発現を起こして、軽鎖と結合する性能が欠けている重鎖のみ抗体の発現を生じることが分かった(Hendershot et al.,(1987)J.Cell Biol.,104,761−767;Brandt et al.,(1984)Mol/Cell.Biol.,4,1270−1277参照)。
【0015】
ファージのライブラリーから誘導して単離されたヒトVHドメインに関する別の研究は、VHドメインの抗原特異的結合を証明したが、これらのVHドメインは溶解性が低いことが証明された。さらに、ファージのアレイにディスプレイされた特異的結合特性を有するヒトVHドメインを選択すると、遺伝子工学的に処理された抗体の基本構造を形成できることが示唆された(Ward et al.,(1989)Nature,341,544−546)。
【0016】
他の脊椎動物の種を使用した研究は、ラクダ類が、自然遺伝子突然変異の結果、CH1軽鎖結合領域が無いため軽鎖に結合できない機能性IgG2及びIgG3の重鎖のみ二量体を生成すること(Hamers−Casterman et al.,(1993)Nature,363,446−448)及びサメなどの種が、恐らく哺乳類のT細胞受容体又は免疫グロブリンの軽鎖に類縁の重鎖のみ様結合タンパク質ファミリーを生成すること(Stanfield et al.,(2004)Science,305,1770−1773)を示した。ラクダの重鎖のみ抗体の特性を決定する特徴は、ラクダVHドメインがヒトVHドメインと比べて溶解度が改善されていることである。ヒトVHは、遺伝子工学的に処理して溶解度の特性を改善できるであろうし(Davies and Riechmann(1996)Protein Eng.,9(6),531−537;Lutz and Muyldermans,(1999)J.Immunol.Methods,231,25−38参照)又は溶解度はインビボで自然選択で獲得されうる(Tanha et al.,(2001)J.Biol.Chem.,276,24774−24780参照)。しかし、VH結合ドメインがファージライブラリーから誘導されると、抗原に対する固有親和力は、例えばアフィニティーホットスポットランダマイゼーション(affinity hot spot randomisation)を含む親和力改善法を適用しても低マイクロモル〜高ナノモルの範囲内に留まっている(Yau et al.,(2005)J.Immunol.Methods,297,213−224)。
【0017】
また、ラクダのVH抗体は修飾されたCDR3ループが特徴である。このCDR3ループは、平均して、非ラクダ抗体に見られるものより長く、抗原の親和力と特異性の全体に対して大きく影響すると考えられる特徴であり、ラクダの重鎖のみ抗体の種にVLドメインが無いことを補償している(Desmyter et al.,(1996)Nat.Struct.Biol.,3,803−811;Riechmann and Muyldermans,(1999)J.Immunol.Methods,23,25−28)。
【0018】
ラクダの抗体に関する最近の構造研究は、抗体の多様性が、V(D)J組換え事象と体細胞変異によるインビボ成熟プロセスによりほとんど推進されることを示唆している(De Genst et al.,(2005)J.Biol.Chem.,280(14),14114−14121)。
【0019】
最近、トランスジェニック哺乳類で重鎖のみ抗体を製造する方法が開発された(WO02/085945及びWO02/085944参照)。任意の哺乳類(ヒトを含む)から誘導される任意のクラス(IgM、IgG、IgD、IgA又はIgE)の機能性重鎖のみ抗体は、抗原を投与することによってトランスジェニック哺乳類(好ましくはマウス)から製造できる。
【0020】
通常の免疫グロブリン重鎖の遺伝子座は、複数のV遺伝子のセグメント、多数のD遺伝子のセグメント及び多数のJ遺伝子のセグメントを含む。各V遺伝子セグメントは、VドメインのN末端からほとんどC末端までをコードしている。各VドメインのC末端は、一つのD遺伝子のセグメントと一つのJ遺伝子のセグメントでコードされている。VDJがB細胞中で再構成し、続いて親和性成熟して、VL結合ドメインとともに抗原を認識する部位すなわち抗原と結合する部位を形成する、VH結合ドメインを提供する。重鎖のCH1領域及び軽鎖のκ領域もしくはλ領域によって、重鎖と軽鎖が相互に作用し易くなる。
【0021】
重鎖のみ抗体を製造するため、生殖細胞系の重鎖遺伝子座は、予定される定常領域のいくらか又は全体をコードする遺伝子セグメントを含む。成熟過程で、再構成したVH結合ドメインは、CH2定常領域をコードするセグメント中にスプライスされて、CH1ドメインを欠いた重鎖をコードする再構成遺伝子を提供し、その結果免疫グロブリンの軽鎖と会合できなくなる。
【0022】
重鎖のみモノクローナル抗体は、標準のクローン化技術で脾臓のB細胞から又はファージディスプレイ法でB細胞のmRNAから回収できる(Ward et al.,(1989)Nature,341,544−546)。ラクダ又はトランスジェニック動物から誘導される重鎖のみ抗体は高い親和力を有する。通常のH2L2四量体の配列を分析した結果は、多様性が、主として、VDJの再構成及び体細胞の超変異の組合わせから生じることを示している(Xu and Davies,(2000)Immunity,13,37−45)。発現された重鎖のみmRNAの配列を分析した結果は、ラクダで産生されようと又はトランスジェニック動物で産生されようとも、上記観察結果を支持している(De Genst et al.,(2005)J.Biol.Chem.,280,14114−14121)。
【0023】
天然のラクダ及びヒトのVH領域の重要な共通の特徴は、各領域がモノマーとして結合し、VL領域との二量体化に依存せずに最適の溶解度と結合親和力が得られることである。これらの特徴は、特にブロッキング剤や組織浸透剤を製造するのに適していることはすでに知られている。
【0024】
ホモ二量体又はヘテロ二量体は、重鎖のみ抗体を酵素で切断することで又は合成法で製造することもできる(Jaton et al.,(1968)Biochemistry,7,4185−4195及び米国特許願公開第2003/0058074 A1号)。しかし、抗体のモノマー結合ドメインの利点は、やはり、多量体タンパク質を、試薬、治療剤及び診断剤として設計するときに有効に利用すべきである。
【0025】
ファージディスプレイ法で製造されるヒトVH又はラクダVHHは、体細胞の突然変異並びに通常の抗体結合部位のCDR3領域におけるDとJの領域組換えによって提供される追加の多様性(Xu and Davies,(2000)Immunity,13,37−45)によって改善される特性の利点を欠いている。ラクダのVHHはヒトのVHと比べて溶解度の利点を示しているが、ヒトにおいては抗原性なのでラクダを免疫することによって又はファージディスプレイ法によって製造しなければならない。
【0026】
VH結合ドメインを取り込むことは、特異性と結合力を失う可能性を伴ってVHドメインとVLドメインとから遺伝子工学的に製造しなければならないscFvを使用するより明らかに有利である。T細胞などの類縁遺伝子ファミリー又はサメ免疫グロブリンのファミリーから誘導されるVH結合ドメインも、二重又は多重の特異性結合分子を製造するためのscFvの代替物を提供する。他の天然産の結合タンパク質及びそのドメイン、例えば可溶性受容体のフラグメントも使用されてもよい。
【0027】
抗体のクラスはその生理学的機能が異なっている。例えば、IgGは成熟免疫応答に主要な役割を演じている。IgMは補体の結合と凝集に関与している。IgAは分泌物すなわち涙液、唾液、初乳、粘液におけるIgの主要クラスであるので、局所免疫で役割を演じている。多価結合複合体を遺伝子工学的に製造するときにクラス特異的な重鎖定常領域を含むことにより、必要な機能に応じて、インビボでエフェクター機能の治療利益を提供する。個々のエフェクター領域を遺伝子工学的に処理して、機能を付加したり又は削除できる(Van Dijk and van der Winkel,Curr.Opin.Chem.Biol.,(2001)Aug 5(4),368−374)。親和力の高いVH結合ドメインを含む重鎖のみ抗体を最適に製造し選択することは(その起源がヒト、ラクダ又はその外の起源であろうとも)、代替方法からインビボでの組換えと親和性成熟を促進しない無作為化ファージライブラリーからの選択による方法にまで利益を与えると思われる。
【0028】
したがって、IgAの定常ドメインの機能を含むと、病原体に対する粘膜の機能が改善され(Leher et al.,(1999)Exp.Eye.Res.,69,75−84)、一方IgG1の定常領域の機能が存在すると、インビボでの血清安定性が向上する。重鎖のCH2とCH3の定常ドメインが存在すると、天然の抗体類に見られるような安定な二量体化のための基盤を提供し、かつ翻訳後グリコシル化のための認識部位を提供する。CH2とCH3の存在は、二重特異性で多価の複合体が試薬及び診断剤として使用されるとき、二次抗体の認識をも可能にする。
【0029】
単離されて予め再構成されたラクダの重鎖のみ可変領域の配列は、ヒンジ領域とヒトIgG1エフェクタードメインの前に予めクローン化され、ベクター中に挿入され、COS細胞中で発現されて抗体を生成する。このインビトロの環境で発現された抗体は、ラクダ中のインビボでクラス(イソタイプ)のスイッチングと親和性成熟(超変異)のプロセスをすでに受けており、抗原に結合できる(Riechmann and Muyldermans,(1999)J.Immunol.Methods,231,25−38)。
【0030】
当分野では、重鎖のみ抗体の多様性とインビボでのB細胞応答性を最大にして、特に、多様な臨床、産業及び研究の用途で使用するために、最大の抗原結合能力を保持するクラス特異的ヒト重鎖のみ抗体及び機能性VH重鎖のみ結合ドメインの機能レパートリーを製造することが依然として要求されている。
【0031】
また、当分野では、抗体の重鎖の少なくとも一部、抗体重鎖単独、又はこれを生理学的に安定でエフェクター機能を有するエフェクター(軽)鎖と組み合わせて含む、可溶性の二価又は多価のポリペプチド結合複合体を製造することも依然として要求されている。
【発明の概要】
【0032】
本発明は、CH1ドメインをコードしていない重鎖定常領域を含み、そして発現されると、定義された単一又は複数のクラスの重鎖のみ抗体を産生できる異種のVH重鎖遺伝子座又はラクダVH(VHH)重鎖遺伝子座をトランスジェニック哺乳類内で発現させるステップを含む、トランスジェニック哺乳類内でVH重鎖のみ抗体又はラクダVH(VHH)重鎖のみ抗体を製造する方法を提供する。
【0033】
VH重鎖遺伝子座又はラクダVH(VHH)重鎖遺伝子座は、一つ以上のラクダV遺伝子セグメント又は非ラクダV遺伝子セグメントを含んでもよい。このV遺伝子セグメントは、改善された溶解度特性を示すように選択するか又は遺伝子工学的に処理されることが好ましい。そのV遺伝子セグメントはヒト由来であるのが好ましい。
【0034】
重鎖遺伝子座の重鎖定常領域は、Cα1及び/又はCα2、Cε、Cδ、Cγ及び/又はCμの重鎖定常領域遺伝子を含んでもよい。さらに、重鎖遺伝子座の重鎖定常領域は、以下の重鎖定常領域:Cα1、Cα2、Cε、Cδ、Cγ、Cμのうちの二つ以上を含んでもよい。
【0035】
好ましくは、VH重鎖遺伝子座は、少なくとも一つのヒトもしくはラクダのV遺伝子セグメント、少なくとも一つのDセグメント及び少なくとも一つのJセグメントを含む可変領域を含み、そのヒトもしくはラクダのV遺伝子セグメント、D遺伝子セグメント及びJ遺伝子セグメントは組み替えてVDJコーディング配列を形成させることができる。重鎖遺伝子座は、好ましくは20個以上のD遺伝子セグメント及び/又は5個以上のJ遺伝子セグメントを含む。好ましくは、D及びJの遺伝子セグメントは、脊椎動物、好ましくはヒトが起源のものである。CDR3ループは、任意の脊椎動物由来のD及びJの遺伝子セグメントを使って作られることができ、ヒトのD及びJ遺伝子セグメントが好ましい。
【0036】
VH重鎖遺伝子座は、J遺伝子セグメントを重鎖定常領域遺伝子と直接組換えることができる組換え配列(rss)を含んでもよい。
【0037】
異種重鎖遺伝子座の重鎖定常領域は、起源がヒト又は脊椎動物例えばラクダのものである。あるいは、その定常領域は、免疫グロブリン重鎖が起源でないものでもよい。
【0038】
好ましくは、本発明の方法によってほぼ正常のB細胞が成熟する。本発明は、本発明の方法で得られるか得ることができる重鎖のみ抗体もしくはそのフラグメント又は重鎖のみ抗体のクラスの混合物を提供する。この重鎖のみ抗体は、モノクローナル抗体又はそのフラグメント、例えばヒトもしくはラクダのVH結合ドメインなどでもよい。本発明のVH結合ドメインは、長く伸びたラクダ様CDR3ループを欠いていてもよく、あるいは長く伸びたラクダ様CDR3ループを含んでもよい。
【0039】
本発明は、本発明の異種重鎖遺伝子座を含むベクター及びこのようなベクターで形質転換された宿主細胞も提供する。
【0040】
また本発明は、本明細書に記載されている異種の重鎖遺伝子座を発現するトランスジェニック哺乳類も提供する。好ましくは、本発明のトランスジェニック哺乳類は、軽鎖を含む抗体を産生する能力が低い。
【0041】
本発明は、免疫療法用の薬剤を調製における本発明の重鎖のみ抗体又はそのフラグメントの使用も提供する。本発明の重鎖のみ抗体は、診断剤、試薬、抗体酵素又は阻害剤として使用することもできる。本発明はまた、本発明の重鎖のみ抗体もしくはそのフラグメント及び薬理学的に適正な担体を含む医薬組成物も提供する。
【0042】
本発明は、
(a)抗原を、本明細書に記載したようなトランスジェニック哺乳類に注射するステップと、
(b)目的とする抗原特異的の重鎖のみ抗体を発現する細胞又は組織を単離するステップと、
(c)ステップ(b)の細胞又は組織からハイブリドーマを産生するステップと、
(d)前記ハイブリドーマ由来の重鎖のみ抗体mRNAを、次に哺乳類、植物、昆虫、微生物、真菌又は代替の系などの異種発現系中に産生させるため、任意選択的にクローン化するステップと
を含む重鎖のみ抗体を産生させて選択する方法を提供する。
【0043】
次いで、VH結合ドメインを、ステップ(c)のクローン化mRNA由来の抗原特異的VHドメインを同定し単離することによって製造できる。
【0044】
また、本発明のVH結合ドメインは、
(a)抗原を本明細書に記載のトランスジェニック哺乳類に注射するステップと、
(b)目的とする抗原特異的重鎖のみ抗体を発現する細胞又は組織を単離するステップと、
(c)上記単離された細胞又は組織から得られたmRNAからVH遺伝子座をクローン化するステップと、
(d)ファージ又は類似のライブラリーを使ってコード化されたタンパク質をディスプレイするステップと、
(e)一種又は複数種の抗原特異的VHドメインを同定するステップと、
(f)上記一種もしくは複数種のVH結合ドメインだけを、又は融合タンパク質として細菌、酵母又は代替の発現系に発現させるステップと
によって製造することもできる。
【図面の簡単な説明】
【0045】
【図1】結合ドメイン(VH)、二量体化ドメイン(任意選択的にCH2、CH3及びCH4)並びにエフェクター部分(EM)を含むポリペプチド複合体を示す。結合ドメインとエフェクター部分は、二量体化ドメインのアミノ末端又はカルボキシ末端に配置できる。可撓性リンカー(<−)及びヒンジ
【数1】

領域を示す。
【図2】結合ドメインの異なる配置構成及び別の結合ドメインによるエフェクター部分の置換を示す。A.ホモ二量体が産生されるので好ましい選択肢である。産物を分離することは不要である。B.ホモ二量体とヘテロ二量体の混合物が産生される。産物を分離することが必要である。
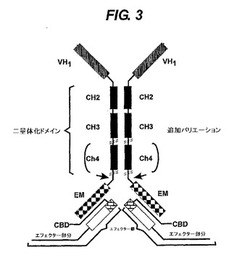
【図3】エフェクター鎖と会合する重鎖ポリペプチド複合体を示す。そのエフェククター鎖は、相補的結合ドメイン(CBD)とエフェクター部分(EM)を含む。CBDは重鎖のEMによって認識される。CBDは、エフェクター例えば酵素、毒素、キレート化剤、造影剤に又はこのエフェクターの一部に融合される。エフェクター鎖は、重鎖とは別個に合成できる。
【図4】J鎖で連結している二価の分泌IgAを示す。
【図5】J鎖で会合されている多価重鎖のみIgM様ポリペプチド複合体を示す。
【図6】IgG遺伝子座を発現するトランスジェニックマウスを生成させ、次いで抗原を投与して、重鎖のみ抗体とVHドメインの機能を発生させる方法を示す。
【図7】IgM遺伝子座を発現するトランスジェニックマウスを生成させ、次いで抗原を投与して、重鎖のみ抗体とVHドメインの機能を発生させる方法を示す。
【図8】IgA遺伝子座を発現するトランスジェニックマウスを生成させ、次いで抗原を投与して、重鎖のみ抗体とVHドメインの機能を発生させる方法を示す。
【図9】ヒトCγ2プライマーとVHH1及びVHH2のプライマーを組み合わせて使って、CH1を除くためにラクダのスプライス変異を有する定常領域を含む遺伝子座を持つマウスの骨髄cDNAから得たPCR産物の配列アラインメント。結果は、CH1が除かれていないことを示している。
【図10−13】VH/ラクダVH(VHH)構築物の構造。1−nはVH遺伝子又はDもしくはJのセグメントの数を表す。ヒト遺伝子座の通常の相補鎖は、51個のV遺伝子、25個の機能性Dセグメント(プラス2個の非機能性Dセグメント)及び6個のJセグメントである。Cμ(IgM用)又はCε(IgE用)の領域の場合、H領域は無く、CH3とM1の間に追加のCH4エキソンがある。その単一又は複数のVH遺伝子は変異していて、公有ドメインに、記載されているような可溶性を提供する。VH遺伝子、DとJのセグメント及びCエキソンはヒトのものが好ましいが、ラクダを含む他の任意の種由来のものでもよい。後者の場合、ラクダのVH(VHH)遺伝子は、天然で可溶性なので変異されない。
【図14】マウスの免疫のスケジュール及び大腸菌HSP70に対する重鎖のみIgG生成の抗体検定を示す。
【図15】トランスジェニックマウス由来の脾臓細胞に関するフローサイトメトリー分析と免疫組織化学試験の結果を示す。
【図16】DKTPで免疫されたトランスジェニックマウスのELISA分析の結果及び生成した抗体ライブラリーの配列分析の結果を示す。
【図17】免疫されたトランスジェニックマウスにみられる体細胞の変異とVDJの再構成の例を示す。
【図18】A5抗体を含有する応答プラスミドでトランスフェクトされたTet−on細胞系の免疫染色検定を行った結果を示す。
【図19】トランスジェニックマウス系の血清のウエスタンブロット分析の結果を示す。
【図20】IgMプラスIgG遺伝子座マウスが産生したヒト一本鎖IgMと混合したヒトIgMのサイズ分画を行なった結果を示す。
【図21】ヒトTNFαに対する一本鎖IgMとIgGの抗体のELISA分析の結果を示す。
【図22】HSP70と抗GAGに対する結合アフィニティを有するホモ二量体プラスミドを生成させる方法を示す。
【図23】ホモ二量体ポリペプチド複合体のCHO細胞内での機能的発現を示す。
【図24】ホモ二量体ポリペプチド複合体の抗GAGとHSP70に対する同時の機能的結合を示す。二価で二重特異性の抗体を図式的に示す。第二可変領域(gagに対するVHH2)を、他の特異性を含有する重鎖のみ抗体(HSP70に対するVHH1)のカルボキシ末端中にクローン化する。CH3とVHH2の間のヒンジ領域は、全てのシステインがプロリンで置換されたリンカー領域(矢印)で置換されている。ELISAプレートをGagでコートし、1%ミルク/1%BSA含有PBSでブロックし、まずダイアボディ培地(1:2希釈)でインキュベートし、次にBI21細胞溶解物(HSP70を含有)(1:2希釈)でインキュベートする。結合したタンパク質を試料緩衝剤=2−メルカプトエタノールで溶離し次いで8%ゲル上に泳動させる。Gag、ダイアボディ及びHSP70に対するポリ/モノクローナル抗体で染色する。抗Gag:ウサギポリクローナル/ブタ抗ウサギ−AP(青色)。抗HSP70:モノクローナル/ヤギ抗ヒトIgG−HRP(褐色)。ダイアボディ:ヤギ抗ヒトIgG−HRP(褐色)。レーン1:Gag/ダイアボディ/BI21細胞溶解物。レーン2:Gag/培養培地(ダイアボディの陰性対照)/BI21。レーン3:ミルク−BSA/ダイアボディ/BI21。レーン4:ミルク−BSA/培養培地/BI21。レーン5:Gag/ダイアボディ/ミルク−BSA。レーン6:Gag培養培地/ミルク−BSA。
【図25】IgAエフェクター機能を有するエフェクター鎖と任意選択的に会合しているホモ二量体のポリペプチド複合体を生成させる方法を示す。
【図26】IgAエフェクター機能を有するエフェクター鎖と任意選択的に会合しているホモ二量体のポリペプチド複合体を生成させる方法を示す。
【発明を実施するための形態】
【0046】
本発明者らは、従来技術の限界を克服し、トランスジェニック動物の特にマウスに、「マイクロ遺伝子座(micro loci)」を使って、形質細胞又はB細胞が分泌するクラス特異的重鎖のみ抗体又は異なるクラスの重鎖のみ抗体の混合物を産生させることができることを示したのである。次にこれらは、確立されたハイブリドーマの技術を使ってクラス特異的重鎖のみ抗体の信頼性の高い供給源を作製させるために使用するか、又は機能性ラクダVH(VHH)結合ドメイン、もしくはVH重鎖のみ結合ドメイン、好ましくはヒトが起源の可溶性VH重鎖のみ結合ドメインの原料として使用することができる(これらの結合ドメインはエフェクター機能は無いが結合機能は保持している)。
【0047】
本発明の方法で生成させることができる重鎖のみ抗体(ラクダ抗体を含む)は高い結合親和力を示すが、これは、一般に伸長したCDR3ループ無しのV、D及びJ遺伝子セグメントの再構成と体細胞変異で生じる。本質的に正常なB細胞の成熟は、単離された形質細胞中に存在する重鎖のみ抗体のレベルが高いとき(CH1ドメインが、組換え遺伝子座中に存在する全ての抗体クラスから除かれている場合)に観察される。B細胞の成熟及び会合された二量体(例えばIgG)又は多量体(例えばIgM)の分泌は、軽鎖遺伝子の存在又は発現とは無関係である。
【0048】
トランスジェニックマウス由来のハイブリドーマから単離された抗原特異的重鎖をコードする抗原特異的mRNAのヌクレオチド配列分析を行なった結果、重鎖抗体の多様性は、主としてVDJ組換えの機能であることが証明された。さらに、本発明者らは、抗体の多様性は、VHドメインの体細胞変異の関与が一層制限された形で重鎖のみ抗体の機能性抗原結合ドメインのCDR3領域で発生することを示した。本明細書に記載の方法を使って、機能性VHドメインを細菌系にクローン化し発現させて抗原と結合する特異性及び親和力を十分に保持したVH結合ドメインを生成させることができる。さらに、クラス特異的重鎖の二量体及び多量体は、培養中のハイブリドーマ細胞系に分泌させることができる。
【0049】
本発明はまた、トランスジェニックマウスを、抗原の投与に応答して好ましいクラスの重鎖のみ抗体、例えばIgMのみではなくてIgGのみ又は例えばIgA、IgG及びIgMの混合物を産生するようにプログラムすることができることも教示する。
【0050】
本発明者らは、CH1エキソンを欠いて、ヒトのD及びJセグメントによって二つのラマ(llama)VHH遺伝子に連結された最小のヒトIgG重鎖定常領域遺伝子座を発現するトランスジェニックマウスの生成についてすでに述べた(WO02/085945及びWO02/085944参照)。これらは、抗原を投与されると、機能性で親和力の高い抗原特異的IgG重鎖のみ抗体を産生する。重鎖のみ抗体のクラス混合物(IgMとIgG)の混合物は、重鎖定常領域を直列に並べて取り込む遺伝子構造を利用したインビボでのクラススイッチによって得られることができる(全ての定常領域遺伝子がCH1ドメインを欠いていてCH4ドメインが存在している場合)。
【0051】
本明細書で述べる改善は、ヒトのDとJのセグメントによって二つのラマVHH遺伝子に連結された同じIgG定常領域遺伝子座、及びCH1エキソンを欠いていて同じヒトDとJの遺伝子セグメントによって二つのラマVHH遺伝子に連結されたヒトIgM定常領域遺伝子座を組み込んだマウスも、高分子量の(多量体の)IgM重鎖のみ抗体及びIgG(二量体)重鎖のみ抗体を産生することである。驚くべきことには、本質的に正常なB細胞の成熟と抗体の産生は、トランスジェニック遺伝子座中に存在する各重鎖定常領域からのCH1配列の完全な欠失によっている。さらに、CH4エキソンは、存在していても除く必要は全く無い。
【0052】
したがって、例えば、同じヒトのDとJの遺伝子セグメントによって二つのラマV遺伝子セグメントに連結された機能性CH1エキソンを有するヒトIgM重鎖遺伝子座、及び同じヒトのDとJの遺伝子セグメントによって二つのラマV遺伝子セグメントに連結されたCH1エキソンを欠いたIgG定常重鎖領域遺伝子座を保持するトランスジェニック動物は、非常に低いレベルの重鎖のみ抗体を産生し、B細胞の成熟の証拠を示さない。
【0053】
CH4ドメインを含む他のエフェクタードメインは組み込まれても組み込まれなくてもよく、要求されるとおりに、生成する重鎖のみ抗体にエフェクターの特徴を導入するか、又は除くことができる。
【0054】
本発明者らは、抗体を産生する発現(すなわち、B細胞の成熟)がその構造中に存在するV遺伝子セグメントを利用することから起こり得ることを発見したのである。B細胞から誘導された抗体mRNAを単離して配列を決定することにより、DとJの遺伝子セグメントの組換えがCDR3の多様性を生み出すことを示している。生成したVHドメインの配列を比較すると、体細胞の突然変異が見られ、これは親和性成熟の事象が、前記組換えられたDとJの遺伝子セグメントと、発現されて生成した抗体mRNAのVHドメインにも起こったことを示している。
【0055】
好ましい構造は、可溶性を改善するために選択又は遺伝子工学的に処理され、組換えを行いCDR3を生成させるためDとJの鎖クラスターに連結されたV遺伝子セグメントを組み込む。好ましくは、そのVDJ配列は、各々CH1エキソンを欠いた好ましい単一又は複数の定常エフェクタードメインに対して直列に並べて連結される。
【0056】
本発明は、ヒトもしくはラクダのクラス特異的な重鎖のみ抗体又はヒトのVH結合ドメイン(好ましくは可溶性VH結合ドメイン)(単独又は好ましいエフェクタードメインに連結されたもの)の誘導と産生に限定されず、DとJの遺伝子セグメントに連結された、脊椎動物が起源の任意のV遺伝子セグメントのキメラ結合体(溶解度特性を改善するため任意選択的に遺伝子工学的に処理されている)の産生も含む。そのV遺伝子セグメントは、ヒトが起源であり、ラクダ由来のV遺伝子セグメントでないものが好ましい。生成したVHドメインは、そのDとJのセグメントがラクダ由来のものである場合を除いては、伸長したラクダ様CDR3ループを含有していなくてもよい。その結果、操作的にエフェクター定常領域に作動可能に連結されたCDR3の多様性と親和性成熟を示すVHドメインが得られる。親和性成熟は、好ましい親のトランスジェニック脊椎動物における機能的分泌と任意選択的な会合を確実にし、その後必要な場合に、選択可能なエフェクター機能も提供する。
【0057】
これらの観察結果は、改善され単純化されたクラス特異的重鎖のみ抗体の遺伝子工学的処理及び体細胞変異により親和性成熟を獲得した高親和力の可溶性VHドメインの誘導に対して重要な影響をもたらす。選択された重鎖定常領域エフェクター機能(CH1を欠いている)又はその混合物を取り込みにより、抗体の追加の遺伝子工学的処理を必要とすることなく、任意のクラスの重鎖のみ抗体又は任意の重鎖のみ抗体の混合物でも産生させることができる。VHドメインは、単独で細菌などの微生物系中で発現されるか、又は培養中のハイブリドーマ又はトランスフェクトされた細胞が分泌する、エフェクタードメインを取り込んだ機能性重鎖のみ抗体として発現されることができる。ヒトが起源の抗体とVH結合ドメインには、医薬、診断剤及び試薬として健康管理の分野に広範囲の用途があり、平行して農業、環境及び産業向けの用途がある。
【0058】
したがって、本発明は、第一の態様で、異種VH重鎖遺伝子座をトランスジェニック哺乳類内で発現させるステップを含むトランスジェニック哺乳類内でVH重鎖のみ抗体を産生させる方法を提供する。好ましくは、そのVH重鎖遺伝子座は、CH1ドメインをコードしない重鎖定常領域を含み、かつ発現されるとき完全な重鎖のみ抗体の多様なレパートリーを生成できる。
【0059】
本発明の第一態様は、ラクダVH重鎖遺伝子座をトランスジェニック哺乳類内で発現させるステップを含むトランスジェニック哺乳類内でラクダVH重鎖のみ抗体の製造方法であって、そのVH重鎖遺伝子座はCH1ドメインをコードしない重鎖定常領域を含み、そして発現されると、抗原の投与に応答してVDJが再構成されかつ親和性成熟する完全な重鎖のみ抗体の多様なレパートリーを生成できる方法も提供する。
【0060】
遺伝子工学的な処理が細胞表面の会合を妨げる分泌機構とそれに続くB細胞の成熟に対して影響しないとき、重鎖エフェクター分子は、遺伝子工学的に処理して機能ドメイン(例えばカルボキシ末端CH4ドメイン)を除かれてもよい。CH1エキソンだけ異種遺伝子座から除かれているか又はその遺伝子座中に存在しない。例えばグリコシル化を改善し又は機能を付加するため、遺伝子工学的に処理して遺伝子座に特徴を付け加えられてもよい。
【0061】
好ましくは、上記の異種遺伝子座は、発現されると、機能性のIgA、IgE、IgG、IgD又はIgMの分子又はそのイソタイプを生成できる。個々の抗体のクラス又は抗体クラスの混合物又はそのイソタイプも生成できる。
【0062】
したがって、異種の重鎖遺伝子座は、本質的に正常なB細胞の成熟とともに、必要な一種又は複数種の抗体クラスに応じて、重鎖のみ抗体の好ましいクラス又は混合物を生成するように設計される。ラクダのV、D及びJ遺伝子のセグメント並びにラクダのエフェクター領域を利用すると、ラクダの独特の特徴を有するラクダ抗体、例えば伸長したCDR3ループを生成する。無作為に選択された、又は溶解度を高めるために選択もしくは遺伝子工学的に処理されたV遺伝子セグメントを含むヒトのV、D及びJ遺伝子セグメントを使用すると、機能性のヒト重鎖のみ抗体を生成する。
【0063】
本発明で得られる抗体は、本質的に単一の又は知られたクラスの好ましくはヒトが起源の抗体である点で従来技術の抗体を超える利点を有する。これらの抗体は、VDJの組換え及びインビボでの親和性成熟の組合わせから得られる高い親和力を有する。抗体とそのフラグメントは、当業者に知られている十分に確立された方法を使って単離され、特性を決定され、そして製造できる。
【0064】
<異種重鎖遺伝子座>
本発明の文脈において、用語「異種」は、本明細書に記載されているように、ヌクレオチド配列又は遺伝子座が、それを配置された哺乳類にとって内在性ではないことを意味する。
【0065】
本発明の文脈において、用語「VH重鎖遺伝子座」は、操作して一つ以上の重鎖エフェクター領域(各々CH1ドメインを欠いている)に連結された、一つ以上のV遺伝子セグメント、一つ以上のD遺伝子セグメント、及び一つ以上のJ遺伝子セグメントを含むVHドメインをコードする最小マイクロ遺伝子座に関する。好ましくは、抗体のレパートリーが変化する主な原因は、V−D及びD−Jの結合によるDとJの遺伝子セグメントの選択で生成するCDR3領域である。
【0066】
本発明の利点は、再構成されたVH遺伝子配列に得られる抗体のレパートリーと多様性は、多数のDとJの遺伝子セグメントを使用することによって最大にすることができる点である。その後の体細胞変異は、最小の遺伝子座(マイクロ遺伝子座)を使用しながら、多数のV遺伝子セグメント又はVLとLC(軽鎖)免疫グロブリン遺伝子座を必要とせずに達成される。
【0067】
好ましくは、前記VH重鎖遺伝子座は、任意の脊椎動物種から誘導される2〜5個(2、3、4又は5個)のV遺伝子セグメントを含む。
【0068】
好ましくは、前記V遺伝子セグメントは、ヒトが起源であり、溶解度を改善するため任意選択的に選択されるか又は遺伝子工学的に処理される。
【0069】
VH重鎖遺伝子座は、好ましくは、2〜40個(2、3、4、5、6、7、8、9、10、12、14、16、18、20、30又は40個)以上のD遺伝子セグメントを含む。これらのD遺伝子セグメントは、任意の脊椎動物種から誘導できるが、最も好ましくは、そのD遺伝子セグメントはヒトのD遺伝子セグメント(通常、25個の機能性D遺伝子セグメント)である。
【0070】
VH重鎖遺伝子座は、好ましくは、2〜20個(2、3、4、5、6、7、8、9、10、12、14、16、18又は20個)以上のJ遺伝子セグメントを含む。これらのJ遺伝子セグメントは、任意の脊椎動物種から誘導できるが、最も好ましくは、そのJ遺伝子セグメントはヒトのJ遺伝子セグメント(通常、6個のJ遺伝子セグメント)である。
【0071】
VH重鎖遺伝子座は、好ましくは、2個以上のV遺伝子セグメント、25個の機能性ヒトD遺伝子セグメント及び6個のヒトJ遺伝子セグメントを含む。
【0072】
用語「V遺伝子セグメント」には、ラクダ及びヒトを含む脊椎動物から誘導される天然のV遺伝子セグメントが含まれており、これらセグメントは、溶解度などの特性を改善するため任意選択的に選択され、変異させ又は遺伝子工学的に処理されている。V遺伝子セグメントは、サメなどの他の種にも発見されており(Kokubu et al.,(1988)EMBO.J.,7,3413−3422参照)、又は、例えば免疫グロブリン軽鎖VLのレパートリーもしくはT細胞受容体VHのレパートリーになる場合、典型的な結合タンパク質の多様なVH様ファミリーを提供するようになる。
【0073】
VHドメインの溶解度を改善する好ましい方法は、単なる無作為ではなく合理的な手段を取り入れており、Davies and Reichmann,(1996)Protein Eng.,9(6),531−537及びRiechmann and Muyldermans,(1999)J.Immunol.Methods,231,25−38に例示されている。自然選択が、親和性成熟及びVDJの再構成に続いてVH遺伝子の好ましい変異を取り込むことによってインビボで起こることもある。
【0074】
V遺伝子セグメントは、本発明に従って、核酸が発現されたときVH重鎖のみ抗体を生成するために、D遺伝子セグメント、J遺伝子セグメント及び重鎖定常(エフェクター)領域(いくつかのエキソンを含んでもよいがCH1エキソンは除外されている)とで組換え可能でなければならない。
【0075】
本発明のV遺伝子セグメントは、その範囲内に、本発明にしたがって、D遺伝子セグメント、J遺伝子セグメント及び重鎖定常領域(一つ以上のエキソンを含むがCH1エキソンは含んでいない)で組換えて、本明細書で定義する重鎖のみ抗体を生成できるホモログ、誘導体又はタンパク質フラグメントをコードする任意の遺伝子配列も含む。
【0076】
したがって、VHコーディング配列は、天然の原料由来でも、又は当業者によく知られている方法を使って合成されてもよい。
【0077】
本発明の文脈において、用語「VHドメイン」は、先に定義したようにD遺伝子セグメント及びJ遺伝子セグメントで組換えられたときのV遺伝子セグメントの発現産物を意味する。好ましくは、本明細書で使用されるこのVHドメインは、溶解状態のままであり、そして溶解度を保持するために他の要因を必要とせずに生理的溶媒中で活性である。好ましくは、可溶性VHドメインの抗原への結合能は、VDJの組換え及び体細胞変異によって改善されている。ラクダ種に独特の伸長したCDR3ループの有無に対する依存性は全くない。このVHドメインは、モノマーとして抗原に結合でき、エフェクターの定常領域と結合すると、使用されるエフェクター分子(例えばIgG、IgA、IgMなど)の選択及び遺伝子工学的処理又は二量体化及び多量体化の別の機構によって、モノ特異性、二重特異性、多重特異性、二価又は多価の形態で産生されてもよい。可溶性の重鎖のみ抗体複合体の一部として発現されるときに、VLドメインと結合する可能性は、CH1エキソンを除くことによって排除される(Sitia et al.,(1990)Cell,60,781−790参照)。VHドメインを、多様なタンパク質ドメインとともに遺伝子工学的に処理して、標的治療や診断に使用する例えば毒素、酵素及び造影剤を有する融合タンパク質も産生させることもできる。
【0078】
本発明の文脈において、用語「D遺伝子セグメント」と「J遺伝子セグメント」には、D遺伝子セグメントとJ遺伝子セグメントの天然の配列が含まれる。好ましくは、D遺伝子セグメントとJ遺伝子セグメントは、V遺伝子セグメントの由来と同じ脊椎動物に由来する。例えば、V遺伝子セグメントがヒト由来で次いで可溶化又は遺伝子工学的に処理される場合は、D遺伝子セグメントとJ遺伝子セグメントもヒト由来である方が好ましい。あるいは、V遺伝子セグメントが例えばラクダ由来であり、D遺伝子セグメントとJ遺伝子セグメントがヒト由来でもよく、又はその逆でもよい。
【0079】
用語「D遺伝子セグメントとJ遺伝子セグメント」は、生成するセグメントが、本明細書に記載されているような重鎖抗体遺伝子座の保持する成分で組換えて本明細書に記載されているような重鎖のみ抗体を生成する限り、その範囲内に、その誘導体、ホモログ及びフラグメントを含む。D遺伝子セグメントとJ遺伝子セグメントは、天然の原料から誘導してもよく、又は当業者にはよく知られていて本明細書に記載されている方法を使って合成してもよい。V、D及びJの遺伝子セグメントは、組換えることができそして体細胞変異をする方が好ましい。
【0080】
V、D及びJの遺伝子セグメントは、単一の脊椎動物種から誘導することが好ましい。これはどの脊椎動物種でもよいがヒトが好ましい。
【0081】
さらに、本発明の異種重鎖遺伝子座は、インビボでエフェクター機能を提供する重鎖定常領域(例えばIgG、IgM、IgA、IgE、IgD又はそのイソタイプ)をコードするDNAの領域を含む。
【0082】
本発明は、本発明の方法で得られるか又は得ることができる抗原特異的の重鎖のみ抗体も提供する。
【0083】
<重鎖定常領域>
操作的に、重鎖定常領域は、天然又はB細胞内でV遺伝子セグメント、D遺伝子セグメント及びJ遺伝子セグメントで組換えできる遺伝子工学的に処理された遺伝子セグメントによってコードされている。好ましくは、その重鎖定常領域は、免疫グロブリンの遺伝子座由来である。
【0084】
本発明のこの態様によって、重鎖定常領域は各々、重鎖のみ抗体を生成できるように機能性CH1ドメイン無しで発現される少なくとも一つの重鎖定常領域を本質的に含む。各重鎖定常領域は、Cδ、Cγ1−4、Cμ、Cε及びCα1−2からなる群から選択される追加の重鎖定常領域のエキソンの一つ以上を、これら追加の重鎖定常領域の遺伝子が機能性CH1ドメインを発現しないという条件で含んでもよい。その重鎖定常領域の遺伝子セグメントは、必要な抗体クラスの好ましいクラス又は混合物によって選択される。任意選択的に、その異種重鎖遺伝子座はCμとCδを欠いている。
【0085】
例えば、クラスMのIg分子は、マクロファージの活性化及び補体の経路で重要な役割を演じていることが分かっている。IgMは、その結合部位が近接しているため、ウイルスを含む病原体に対して高い親和力を有する。しかし、IgMは、高速免疫検定法に使用することは難しいことが知られているが、一方クラスGのIgはこれらの検定法に容易に使用できる。このような用途に対しては、好ましい抗体のクラスとして、すなわちIgG又はIgMを選択することが有用である。
【0086】
CH1を欠いている異種重鎖Cγ遺伝子座の全て又は一部を発現すると、その異種IgG遺伝子座中に存在するIgG1、IgG2、IgG3及びIgG4のイソタイプによって、いくつかの又は全てのIgGイソタイプが任意選択的に産生される。あるいは、重鎖はCε遺伝子を含んでもよい。生成するIgE分子も治療に使用できる。
【0087】
あるいは、抗体の選択された混合物を得ることができる。例えば、IgAとIgMは、重鎖定常領域がCα遺伝子とCμ遺伝子を含むときに得ることができる。
【0088】
本発明の重鎖定常領域は、特に重鎖抗体を、ヒトを治療する用途に使用したいとき、ヒトが起源である方が好ましい。重鎖抗体を、診断又は獣医学的用途に使用したい場合、重鎖定常領域は、診断又は獣医学的治療をしたい標的の生物、脊椎動物又は哺乳類由来である方が好ましい。
【0089】
重鎖定常領域は、発現されたとき、機能性CH1ドメインを欠いている。そのCH1エキソン及び任意選択的にCμとCδの定常領域は、変異、欠失又は置換を行なってもよい。CH1エキソンは欠失している方が好ましい。例えば機能性CH1ドメインを含むIgMが存在するとB細胞の成熟を阻害し、B細胞の成熟が阻害された結果として、同じ遺伝子座中に重鎖のみIgG(CH1を欠いている)を産生発現することが制限される。
【0090】
本明細書で定義する「重鎖定常領域エキソン」(「CHエキソン」)は、天然の脊椎動物であるが特に哺乳類のCHエキソンの配列を含む。これはクラス特異的方式で変化する。例えば、IgGとIgAは、天然に、CH4ドメインを欠いている。用語「CHエキソン」は、そのCHエキソンが、重鎖定常領域の一成分であるとき、本明細書で定義したような機能性重鎖のみ抗体を生成できる限り、その範囲内に、その誘導体、ホモログ及びフラグメントも含む。
【0091】
CH4又は他の機能性ドメインは、存在しているとき、細胞内の分泌プロセス、B細胞の成熟又は生成した抗体ポリペプチドの結合活性を阻害しないならば、任意選択的に導入遺伝子中で遺伝子工学的に処理されたり又は欠失されてもよい。
【0092】
<哺乳類>
本発明の方法に使うトランスジェニック哺乳類はヒトではない。トランスジェニック哺乳類としては、ウサギ、モルモット、ラット又はマウスなどのげっ歯類が好ましい。マウスが特に好ましい。ヤギ、ヒツジ、ネコ、イヌ又は他の動物などの代替動物も利用できる。
【0093】
トランスジェニック動物は、確立された卵母細胞注射法及び確立されたときにはES細胞技術又はES細胞クローニング法を利用して生成させる方が好ましい。
【0094】
有利には、重鎖のみ抗体を本発明の方法によって発現させるとき、その哺乳類に内在している免疫グロブリンの重鎖遺伝子座及び任意選択的に軽鎖遺伝子座は、欠失させるか又は抑止する。
【0095】
抗体の起源とは異なる起原の脊椎動物種に抗体を投与すると、その投与された抗体に対する免疫応答が始まることが多いので、上記のような重鎖のみ抗体を生成させるこの方法は、ヒトの治療に使う抗体を生成させるのに特に有用であろう。
【0096】
したがって、別の態様で、本発明は、本発明の異種重鎖遺伝子座を発現するトランスジェニック哺乳類を提供する。
【0097】
そのトランスジェニック哺乳類は、軽鎖を含む抗体を産生する能力を低減するように遺伝子工学的に処理されてもよい。
【0098】
抗体産生細胞は、本発明のトランスジェニック動物に由来してもよく、例えば、本明細書に記載したような重鎖のみ抗体を産生するためのハイブリドーマを調製するのに使用できる。加えて、又は別の方法として、核酸配列は、本発明のトランスジェニック哺乳類から単離されてもよく、VHドメイン重鎖のみ鎖抗体又はその二重特異性/二機能複合体を、当業者に公知の組換えDNA法を使って製造するのに使用されてもよい。
【0099】
加えて、又は別の方法として、抗原特異的重鎖のみ抗体は、本発明のトランスジェニック動物を免疫することによって生成されてもよい。
【0100】
したがって、別の態様で、本発明は、本発明のトランスジェニック哺乳類を抗原で免疫することによって重鎖のみ抗体を製造する方法を提供する。
【0101】
本発明のこの態様の好ましい実施形態では、その哺乳類はマウスである。
【0102】
<重鎖のみ抗体及びそのフラグメント>
もう一つの態様で、本発明は、本発明の方法で得ることができる重鎖のみ抗体及びその機能性フラグメントと誘導体を提供する。VH結合ドメインを含むフラグメントは、本発明の重鎖のみ抗体すなわち軽鎖を欠いている抗体を、酵素又は臭化シアンで開裂することによって誘導できる(Jaton et al.,(1968)Biochemistry,7,4185−4195)。
【0103】
好ましい機能性フラグメントは、抗原特異的の重鎖のみ結合ドメイン、すなわち、単独のV、D及びJの遺伝子セグメント間の組換えと続く体細胞変異で生成するVH遺伝子座によって発現されるVH結合ドメインである。本発明のこの態様によって、VH遺伝子座は、例えば、上記免疫されたトランスジェニック動物の抗体産生細胞から単離したmRNAからクローン化できる。次に、クローン化された配列は、ファージ(Ward et al.,(1989)Nature,341,544−546)又は類似のディスプレイライブラリー、例えば酵母ベースの系(Boder and Wittrup,(1997)Nat.Biotechnol.,15,553−7)を使って提示され、抗原特異的VH結合ドメインが同定される。次に、抗原特異的重鎖結合ドメインは、大規模に量産可能な細菌、酵母又はそれに代わる発現系で、単独又は融合タンパク質として製造できる。またVH結合ドメインをコードする配列は、免疫されたトランスジェニックマウスから古典的な方法で誘導される、特性を決定されたハイブリドーマからクローン化することもできる。これらの配列は、異なるエフェクター機能を有する指定の抗体クラス(例えばIgE又はIgA)とその変異体を遺伝子工学的に処理することを含めて、VH結合ドメインとその誘導体の製造に使用されることができる。
【0104】
したがって、本発明はまた、
(a)目的とする抗原特異的重鎖のみ抗体(好ましくは、対象の可溶性の抗原特異的重鎖のみ抗体)を発現する細胞又は組織を単離するステップと、
(b)前記単離した細胞又は組織から誘導したmRNAからVH結合ドメインをコードする配列をクローン化するステップと、
(c)そのコードされたタンパク質を、ファージ又は類似のライブラリーを使ってディスプレイするステップと、
(d)抗原特異的VH結合ドメインを同定するステップと、
(e)そのVH結合ドメインを、単独で又は融合タンパク質として、細菌、酵母、哺乳類又は代替の発現系で発現させるステップと
を含むVH結合ドメインの製造方法を提供する。
【0105】
あるいは、VHドメイン含有フラグメントは、本発明の重鎖のみ抗体から、酵素による開裂法又は化学的開裂法を利用し、次いでその開裂産物からVHドメイン含有フラグメントを分離することによって製造できる。
【0106】
VH結合ドメインを、特性を決定されたハイブリドーマから単離する場合は、mRNA由来のクローン化VH結合ドメイン配列を、ファージなどのディスプレイ系を利用する追加の選択ステップに頼ることなく、発現ベクター中に直接クローン化できる。
【0107】
エフェクター領域を取り込んでいる、重鎖のみ抗体の産生系としては、大量飼育法に適した培養中の哺乳類の細胞(例えばCHO細胞)、植物(例えばトウモロコシ)、トランスジェニックヤギ、ウサギ、ウシ、ヒツジ、鶏及び昆虫の幼虫がある。ウイルス感染(例えば昆虫の幼虫や細胞系へのバキュロウイルスの感染)を含む他の産生系は、細胞培養法及び生殖細胞法の代わりの系である。その他の産生系も当業者にはよく知られている。重鎖のみIgA又はIgMの会合が必要な場合は、「J鎖」を共発現させることが有益である。ラクダの重鎖のみ抗体又はVH結合ドメインだけを産生させるのに適切な方法は当分野では周知である。例えば、ラクダのVH結合ドメインは細菌系で産生されており、ラクダの重鎖のみホモ二量体はハイブリドーマ及びトランスフェクトされた哺乳類細胞で産生されている(Reichmann and Muyldermans,(1999)J.Immunol.Methods,231,25−38参照)。
【0108】
ファージディスプレイ法を使って誘導された遺伝子工学的処理ヒトVH結合ドメインを発現させる方法も確立されている(Tanha et al.,(2001)J.Biol.Chem.,276,24774−24780及びこの文献に記載されている引用文献)。
【0109】
トランスジェニックハエ系由来の昆虫幼虫が、体腔液中に、哺乳類の細胞が産生する抗体と差異のない特性を有する機能性重鎖のみ抗体フラグメントを産生することが分かっている(PCT/GB2003/0003319)。本発明はまた、本発明のこの態様の方法によって得られる抗原特異的な単量体又は二量体のVH結合ドメインを提供する。
【0110】
本発明はまた、異種の重鎖遺伝子座、本発明の重鎖のみ抗体をコードする単離されたポリヌクレオチド及び異種の重鎖遺伝子座もしくはそのフラグメントを含むベクターからなるポリヌクレオチド配列、又は本発明の重鎖のみ抗体をコードする単離されたポリヌクレオチドを提供する。
【0111】
本発明はまた、本発明の異種重鎖遺伝子座もしくはそのフラグメント、又は重鎖のみ抗体もしくは抗体フラグメントをコードする単離されたポリヌクレオチドで形質転換された宿主細胞を提供する。
【0112】
第二の態様で、本発明は、エフェクター活性を提供するエフェクター部分を結合された本発明の抗原特異的VH結合ドメインを含むポリペプチド複合体を提供する。このエフェクター活性は、それに加えて重鎖定常領域により提供されてもよく、分子のアミノ末端又はカルボキシ末端に配置されてもよい。これらポリペプチド複合体は、エフェクター部分の追加のターゲッティング機能すなわちエフェクター機能と組み合わせて、抗原特異的VH結合ドメインが提供する生理機能を保持している。このようなポリペプチド複合体は、機能性モノマーの形態であるか、又はエフェクター部分の構造との相互作用によっては、二量体、四量体、五量体、多量体もしくは異なるVH結合ドメインを取り込んだ他の複合体の形態であり、その結果、多価又は多特異性を付与する。VH結合ドメインは、結合分子のアミノ末端又はカルボキシ末端に存在し得る(二量体の例の図1参照)。
【0113】
エフェクター部分が結合ドメインを含むとき、その結合ドメインは抗原特異的VH結合ドメインとは異なる特異性を有してもよい。この配列の利点は、そのポリペプチド複合体が異なる標的と容易に架橋できることである。例えば、二重特異性ポリペプチド複合体は、細胞−細胞間の相互作用と細胞−病原体間の相互作用を高めるのに利用できる。この実施形態では、本発明のポリペプチド複合体は、例えば病原体とマクロファージなどの2種類の細胞型を架橋するのに利用できる(Biburger et al.,(2005)J.Mol.Biol.,346,1299−1311参照)。このような二重特異性を設計する際には、VH結合ドメインを使用する方がscFV結合ドメインを使用するより好ましい。VH結合ドメインは、結合親和力が高いので、このようなポリペプチド複合体中に最小のベクター構造で、scFVの四量体の親分子に比例した特異性と親和力を保持するための設計上の考慮の必要も無しに組み込むことができる。二量体又は多量体のポリペプチド複合体を考えるとき、例えば、免疫グロブリン重鎖定常領域由来のCH2とCH3のドメインを含む二量体化ドメインが組み入れられる(図2参照)。
【0114】
用語「エフェクター部分」は、本明細書で使用する場合、細胞に対して所望の生物学的効果を仲介する任意の部分を含む。そのエフェクター部分は、好ましくは可溶性であり、そしてペプチド、ポリペプチドもしくはタンパク質でもよく、又は非ペプチド構造体でもよい。例えば、エフェクター部分は、酵素、ホルモン、サイトカイン、医薬、プロドラッグ、毒素特にタンパク質毒素、キレート化構造の放射性核種、結合ドメイン、二量体化ドメインもしくは相互作用ドメイン、造影剤、アルブミン又は阻害剤でもよい。
【0115】
アルブミンは、抗原特異的VH結合ドメインの安定性又は薬物動態学的及び/又は薬力学的特性を増大させるためにエフェクター部分として使用できる(Sung et al.,(2003)J.Interferon Cytokine Res.,23(1):25−36)。あるいは、エフェクター部分は、薬物動態学的特性を改善するため、ペグ化された構造(PEGylated)又は天然にグリコシル化された構造でもよい。
【0116】
エフェクター部分は、抗原特異的VH結合ドメインに結合されたペプチドでもよく、又は、例えばマレイミドリンカーのような化学的にリンクする構造体を使って、抗原特異的重鎖VHドメインに化学的に結合されてもよい。あるいは、本発明のプリペプチド複合体は、融合タンパク質として発現されてもよい。したがって、本発明は、異種の重鎖遺伝子座からなるポリヌクレオチド配列又は本発明の重鎖のみ抗体をコードする単離されたポリヌクレオチド(そのポリヌクレオチドはさらに読み取りフレーム中にエフェクター部分をコードする1個以上のエキソンを含む)も含む。このエキソンは、前記ポリヌクレオチドの5’末端又は3’末端に位置していてもよい。例えば、このポリヌクレオチドは、VHと結合ドメイン/エフェクター部分遺伝子セグメントをこの順序で、読み取りフレーム中に含んでもよい。遺伝子融合(genetic fusion)の場合、各種ドメインの結合は、融合タンパク質のアミノ酸配列をコードする組換えDNA構造体(同じ読取りフレームに配置された各種ドメインがコードされている)を使って達成されてもよい。このような構造体は、診断剤及び治療剤として有用である。診断剤として、そのエフェクタードメインは、蛍光タンパク質(例えばGFP)又は酵素(例えばβ−gal)でもよい。あるいは、エフェクタードメインは、基質に対する結合性を高めるためのタグ(例えばポリヒスチジン又はビオチン)、二次抗体に結合する部位を提供する抗原、又は蛍光マーカーが結合する部位として働くロイシンジッパーもしくは類似の結合モチーフでもよい。
【0117】
<ポリペプチド複合体>
本発明者らは、抗体重鎖の少なくとも一部分を、単独で又は相補的会合ドメインを含みかつ追加のエフェクター活性を有する別のエフェクター(軽)鎖と組み合わせて含む二価又は多価のポリペプチド複合体を産生できることを明らかにした。本発明のポリペプチド複合体は、エフェクター鎖に付随する追加エフェクター部分の機能と組み合わせた重鎖定常領域によって付与された生理学的機能を保持している(図3)。
【0118】
したがって、第三の態様では、ポリペプチド複合体は、一つ以上のエフェクター鎖(軽鎖)と組み合わせた重鎖を含む。本発明の第三の態様は一対の重鎖と一対のエフェクター鎖を含むポリペプチド複合体を提供し、
その一対の重鎖は互いに会合し、
一方のエフェクター鎖は一方の重鎖と会合し、他方のエフェクター鎖は他方の重鎖と会合し、
各重鎖は、結合ドメイン、好ましくは少なくともCH2、CH3及び任意選択的にCH4の定常領域ドメインを含む二量体化ドメイン並びにエフェクター鎖の相補的会合ドメインに結合できるエフェクター部分を含み、
そのエフェクター鎖は、エフェクター部分に連結された相補的会合ドメインを含み、そして
前記会合ドメインと相補的会合ドメインは非共有相互作用によって互いに会合している。
【0119】
好ましくは、上記重鎖のエフェクター部分は、エフェクター鎖のエフェクター部分とは異なっている。
【0120】
上記ポリペプチド複合体は、任意選択的に、CH3ドメイン(又は存在している場合はCH4ドメイン)のカルボキシル末端に、このドメインを会合ドメインに連結する可撓性ヒンジ様ドメインを含む。上記ポリペプチド複合体は、好ましくは、結合ドメインとCH2ドメインの間に、天然のヒンジドメイン又は遺伝子工学的に処理された可撓性ヒンジ様ドメインを含む。ヒンジ領域の存在により、生成したポリペプチド複合体内の結合ドメインとエフェクター部分の独立した機能を高められる。
【0121】
第一ポリペプチド重鎖のエフェクター部分は、任意選択的に、第二ポリペプチド重鎖のエフェクター部分の特異性とは異なる特異性を有する。本発明によれば、ポリペプチド複合体のエフェクター部分は結合ドメインで置換されてもよい。好ましくは、その結合ドメインは(本発明の第一態様で定義されたのと同じ)VHドメイン、又は細胞受容体結合ドメインを含む。生成する四価二量体の結合タンパク質(ポリペプチド複合体)は、異なるエフェクター部分を4個まで含むことができる。好ましくは、重鎖のアミノ末端のエフェクター部分は同一であり、そしてカルボキシ末端のエフェクター部分は同一であり(但し、アミノ末端のエフェクター部分とは異なる抗原又はエピトープを認識する)、単一のホモ二量体の会合を促進する。このような分子は、適正な重鎖の機能性ドメイン(例えばIgA又はIgM)を含むことによってエフェクター機能が提供されるので、病原体を捕獲するのに有利であることが分かるであろう。
【0122】
本発明の第三の態様の代表的ポリペプチド複合体は、細胞化学的ラベリング法、ターゲッティング法、又は治療に有用である。例えば、エフェクター分子が癌細胞の表面マーカーを標的とする抗原特異的VH結合ドメインを含みかつエフェクター部分がプロドラッグ変換酵素に対し特異的な結合ドメインを含むならば(エフェクター鎖)、その抗原特異的VH結合ドメインは、前記標的に結合して前記エフェクター部分をその標的の直近まで運び、その結果、前記エフェクター鎖と結合して、プロドラッグ(例えばCB1954を有するニトロレダクターゼ)の存在下、標的に対して生物学的効果を発揮できる。免疫グロブリン重鎖エフェクター機能を二量体化ドメインとして含むことも標的細胞を除くのに有用であろう。
【0123】
<エフェクター鎖>
エフェクター鎖は、相補結合ドメインとエフェクター部分を含み、重鎖のエフェクター部分を通じて重鎖と結びついて、会合されたポリペプチド結合複合体を形成する。そのエフェクター鎖の相補的会合ドメインは、エフェクター部分の不可欠な成分であってもよいし、又はエフェクター部分に融合もしくは化学的に結合されたタンパク質もしくは別のリガンドでもよい。前記会合されたポリペプチド結合複合体の重鎖は、標的に結合してエフェクター(軽)鎖部分を標的の直近まで運んで標的に生物学的効果を発揮できる。
【0124】
<エフェクター部分>
用語「エフェクター部分」は、本明細書で使用するときは、細胞に対して望ましい生物学的効果を仲介する任意の部分を含む。そのエフェクタードメインは、細胞例えばT細胞、ペプチド、ポリペプチドもしくはタンパク質でもよく、又は非ペプチド構造体でもよい。例えば、エフェクタードメインは、酵素、医薬、プロドラッグ、毒素特にタンパク質毒素、キレート化構造体の放射性核種又は結合ドメインでもよい。相補的会合ドメインと会合しているエフェクター部分は、所望の効果によって、自然状態で、細胞の、たんぱく質の、有機又は無機の部分でよい。
【0125】
用語「結合ドメイン」は、本発明の上記全ての態様について本明細書で使うときは、生理的溶媒中で活性である任意のポリペプチドドメインを含む。また、このような結合ドメインは、生理的条件下、標的に結合する性能を有していなければならない。
【0126】
このような結合ドメインは、細胞表面に対する結合又は接着を仲介できるドメインを含む。本発明のポリペプチド複合体に使用できる適切なドメインは、哺乳類、原核生物及びウイルスの細胞接着分子、サイトカイン、成長因子、受容体のアンタゴニストもしくはアゴニスト、リガンド、細胞表面の受容体、制御因子、構造タンパク質と構造ペプチド、血清タンパク質、分泌タンパク質、細胞膜会合タンパク質、ウイルス抗原、細菌抗原、原生動物抗原、寄生虫抗原、リポタンパク質、糖タンパク質、ホルモン、神経伝達物質、凝固因子、遺伝子工学的に処理された単一鎖Fvsなどである。その結合ドメインは、好ましくは脊椎動物のVHドメインであり、より好ましくはヒトVHドメインなどの哺乳類のVHドメインである。
【0127】
結合ドメインは、ラクダVH(VHH)ドメインを含んでもよく、又は非ラクダから得たVHドメインを含んでもよい。その結合ドメインは、好ましくはヒトVHドメインである。VH結合ドメインは、合成ファージライブラリーから誘導されたVHドメインではなく、トランスジェニック動物又は(上記の)ラクダから誘導したB細胞起源ものの方が好ましい。なぜなら、トランスジェニック動物又はラクダから誘導したB細胞起源のものが、インビボで抗原の投与に応答しVDJの再構成と体細胞変異によって生成するので親和力が高いためである。
【0128】
エフェクター部分が結合ドメインを含むとき、その結合ドメインは重鎖の結合ドメインと異なっている方が好ましい。この構成の利点は、ポリペプチド複合体が、異なる標的の架橋を促進できるか又は標的細胞(例えば病原体)の異なる抗原に結合できる点である。
【0129】
第一の重鎖の結合ドメインは、第二の重鎖の結合ドメインの特異性とは異なる特異性を有してもよい。この場合、ポリペプチド複合体は少なくとも二価であるので、異なる標的を架橋することができ、かつそのエフェクタードメインはその効果を両方の抗原に対して発揮できる。多価のポリペプチド複合体は、これら四価の重鎖を、さらに、異なる一種以上の特異性及び機能を有するエフェクタードメインを含むエフェクター鎖と会合させて作製できる。また、第一の重鎖のエフェクター部分は、第二の重鎖のエフェクター部分とは異なる特異性を有してもよく、その結果各々異なる機能を保持する二つ以上のエフェクター鎖を捕獲できる。
【0130】
<相補的会合ドメインはエフェクター部分に結合する>
重鎖がエフェクター鎖と会合しているとき、用語「エフェクター部分」と「相補的会合ドメイン」は、本明細書で使う場合、少なくとも一つの非共有結合を、互いに形成できる部分を含む。例えば、そのエフェクター部分と相補的会合ドメインは、免疫グロブリン重鎖のCH1ドメイン−免疫グロブリン軽鎖の定常領域間、ロイシンジッパー間、VCAM−VLA−4間、インテグリン−細胞外マトリックスタンパク質間、インテグリン−CD54もしくはCD102などの細胞表面分子間、ALCAM−SRCRドメイン間、scFv−抗原間又はVH結合ドメイン−抗原間などにみられるようなタンパク質−タンパク質相互作用を形成できるタンパク質、ペプチドフラグメント又は共通配列でもよい。
【0131】
<重鎖>
重鎖の二量体化ドメインが免疫グロブリン重鎖の定常領域を含むときは、その定常領域(CHエキソン)は、さらなる生理的機能をポリペプチド結合複合体に付与してもよい。特に、その免疫グロブリン重鎖の定常ドメインは、その抗体定常ドメインのクラス又はサブクラスに依存して、特に補体の結合、マクロファージの活性化及びFc受容体への結合を提供してもよい。
【0132】
先に考察したように、発現された重鎖のクラスは、インビボでのエフェクター機能に重要な役割を持っていることはよく報告されている。樹立細胞系は有用な生物学的ターゲッティング効果を有するポリペプチド複合体を産生するかもしれないが、その重鎖定常領域は、診断上又は治療上望ましくないクラスの場合があるかもしれず、又は有効量を分泌しないこともあり得る。したがって、本発明のポリペプチド複合体の重鎖定常ドメインは、特異的に変えたり又は部分的にもしくは完全に削除して、免疫グロブリン重鎖の成分を導入したり、又は除いてもよい。
【0133】
例えば、クラスMのIg分子が、マクロファージの活性化と補体の経路で重要な役割を演じていることは知られている。その結合部位の近接近により、IgMは、ウイルスを含む病原体に対して高い親和力を有する。しかしIgMは高速免疫検定法に使用することが難しいが、その一方でクラスGのIgはこの検定法に容易に使用できることも知られている。この用途では、重鎖のクラスをμからγのドメインに切り替えることが有効であろう。
【0134】
重鎖のCγ遺伝子座を単独で発現させると、IgG1、IgG2、IgG3及びIgG4のイソタイプを含むIgGを産生し、この内いくつかは補体も活性化する。IgG抗体類は、マクロファージ及び顆粒球に結合して活性化したり、また胎盤を通過することもできる。
【0135】
各種の抗体クラスの追加の用途はすでに考察されている。
【0136】
本発明のポリペプチド複合体の重鎖の定常領域は、先に定義したようなヒト、ウサギ、ラット又はマウスを起源とするものでよい。なかでも、ヒトを起源とするものが好ましい。
【0137】
本発明のポリペプチド複合体は、エフェクター機能を全く提供しない二量体化ドメインを利用することによって、リガンドがその受容体に結合するのを遮断するために単独で使用することができる。多種類の受容体を、多重特異性ポリペプチド複合体で遮断できる。
【0138】
本発明の第四の態様では、エフェクター分子が、別個のエフェクター分子と会合できるように二量体化ドメインを含んでもよい。この二量体化ドメインは、CH2、CH3又はCH4の抗体定常領域ドメイン及び/又はJ鎖のうち一つ以上を含んでもよい。本発明の本実施形態では、エフェクター分子の二量体又は多量体を産生するために二つ以上のエフェクター分子が会合してもよい。そのエフェクター分子は、同じでも(エフェクター分子のホモ二量体又はホモ多量体を産生できる)異なっていても(エフェクター分子のヘテロ二量体又はヘテロ多量体を産生できる)よい。好ましくは、エフェクター分子の二量体又は多量体は二価又は多価である。好ましくは、前記二つ以上のエフェクター分子の定常領域(すなわち二量体化ドメイン)は同じであるから生成物が異種になる可能性は低い。
【0139】
本発明の第四の態様によって、第一ポリペプチド重鎖と第二ポリペプチド重鎖からなる二量体を含むポリペプチド複合体であって、
各ポリペプチド重鎖が、結合ドメイン並びに任意選択的に少なくともCH2、CH3及び任意選択的にCH4の抗体定常領域のドメイン及び任意選択的にエフェクター部分を含む二量体化ドメインを含み、
好ましくは第一ポリペプチド重鎖の結合ドメインは、第二ポリペプチド重鎖の結合ドメインと同じ特異性を有し、そして
これら二つのポリペプチド重鎖の定常領域(二量体化ドメイン)は同一である
ポリペプチド複合体が提供される。
【0140】
好ましくは、上記第一鎖と第二鎖は同じエフェクター部分を有する。
【0141】
好ましくは、上記二量体化ドメインは、少なくともCH2、CH3及び任意選択的にCH4の抗体定常領域のドメインを含む。
【0142】
また、本発明の第四態様は、複数のポリペプチド重鎖二量体及び一つのJ鎖を含むポリペプチド複合体であって、
複数のポリペプチド重鎖二量体がJ鎖によって会合され、
各ポリペプチド重鎖が、結合ドメイン並びに同一のμ、ε、α又はγのCH2、CH3及び任意選択的にCH4のドメインを含み、そして
そのポリペプチド複合体中に、異なる特異性を有する少なくとも二つの結合ドメインが存在している
ポリペプチド複合体を提供する(図4と5参照)。
【0143】
上記本発明の第一態様で定義したように、各重鎖の定常領域は、好ましくは、重鎖のみ抗体を生成できるように機能性CH1ドメイン無しで発現される少なくとも一つの重鎖定常領域の遺伝子を含む。また、各重鎖定常領域は、Cδ、Cγ1−4、Cμ、Cε及びCα1−2からなる群から選択される一つ以上の追加の重鎖定常領域の遺伝子を、その追加の重鎖定常領域の遺伝子が機能性CH1ドメインを発現しないという条件で含んでもよい。その重鎖定常領域の遺伝子は、必要な抗体クラスの好ましいクラス又は混合物によって選択される。
【0144】
好ましくは、発現されるIgAとIgM中には、異なる特異性の結合ドメインが二つだけ存在している。
【0145】
一実施形態では、重鎖は各々CH4ドメインを含み、定常ドメインはαドメインであり、そしてポリペプチド複合体はJ鎖を含む。
【0146】
もう一つの実施形態では、重鎖は各々CH4ドメインを含み、定常ドメインはμドメインであり、そして抗体はJ鎖を含む。
【0147】
<ポリペプチド複合体の会合>
本発明のポリペプチド複合体のモジュールドメインの構成は、その複合体を、多種類の可能な順列で構築することを可能にする。ポリペプチド複合体のドメインの構造及びアミノ酸の配列におけるこのような変更は、配列をコードする対応DNAの適切な領域を適切に変異させるか又は部分的に合成し及び置換することによって達成されてもよい。置換ドメイン又は付加ドメインは、互換性がある組換えDNA配列から得られてもよい。例えば、重鎖は、結合ドメインとCH2ドメインのアミノ末端との間及びエフェクタードメインと重鎖のC末端(CH3又はCH4)との間の両方に、天然ヒンジ又は遺伝子工学的に処理された可撓性ポリペプチドドメインを含んでもよい。
【0148】
本発明のポリペプチド複合体の重鎖は、融合タンパク質として発現される。本発明のこの態様のポリペプチド複合体のエフェクター鎖は、融合タンパク質として発現されてもよく、又は化学的手段で会合されてもよく、又は自然状態の細胞であれば、血液もしくは組織から単離するかもしくはインビボで捕獲されもてよい(例えばアルブミン)。
【0149】
遺伝子融合の場合は、各種ドメインの連結は、融合タンパク質のアミノ酸配列をコードする組換えDNA構造体で、同じ読取り枠内に配置されている各種ドメインをコードするDNAを使うことで達成されてもよい。
【0150】
エフェクター部分は、融合タンパク質の一部として存在しているときは、相補的会合ドメインのアミノ末端又はカルボキシ末端に位置してもよい。
【0151】
あるいはエフェクター鎖のドメインは、融合タンパク質として合成するのではなく当分野で既知の通常のペプチド化学の方法で会合させてもよい。
【0152】
結合はペプチド結合又は化学結合を介してもよい。例えば、エフェクター部分は、相補的会合ドメインにペプチド結合されてもよいし、又は例えばマレイミドのリンカーなどの化学的連結構造体を使うことによって、相補的会合ドメインに化学的に結合されてもよい。
【0153】
そのエフェクター部分は重鎖のどの位置に配置してもよい。例えば、エフェクター部分は、重鎖のC末端に、又はポリペプチド複合体の結合ドメインとCH2ドメインもしくはヒンジドメインとの間に配置されてもよい。上記会合ドメインは、エフェクター機能及び二量体化ドメインを阻害することがあるので、CH2ドメインとCH3ドメインの間には配置しない方がよい。エフェクター部分は、その独立した結合/機能を高めるために、重鎖のアミノ末端又はカルボキシ末端に、ペプチドの可撓性リンカー又はヒンジ様領域によって連結する方が好ましい。
【0154】
<ポリヌクレオチド配列、ベクター及び宿主細胞>
本発明はまた、本発明のポリペプチド複合体のいずれか一つの重鎖をコードするポリヌクレオチド配列、上記ポリヌクテオチド配列を一つ以上含むベクター及び本発明のポリペプチド複合体の重鎖をコードするベクターで形質転換された宿主細胞を提供する。そのポリヌクレオチドは、好ましくは、発現された重鎖をホモ二量体として、宿主細胞が増殖している培地中に分泌させる配列を含む。その宿主細胞は、細菌及び酵母の細胞を含む任意の起源の細胞でもよいが、脊椎動物の宿主細胞が好ましく、哺乳類の宿主細胞が一層好ましい。
【0155】
同じ宿主細胞を、異なる標的に対する特異性を有する結合ドメインを含む重鎖をコードする第二ベクターでトランスフェクトすると、二つの構造体及びホモ二量体とヘテロ二量体の混合物の会合物が共発現される。ホモ二量体は同系の抗原に対して特異性を示し、ヘテロ二量体は両方の抗原に結合する。
【0156】
本発明はまた、本発明のポリペプチド複合体の少なくとも一つのエフェクター鎖をコードするベクターで形質転換された宿主細胞も提供する。その宿主細胞は、細菌及び酵母の細胞を含む任意の起源の細胞でよいが、脊椎動物の宿主細胞が好ましく、哺乳類の宿主細胞が一層好ましい。あるいは、エフェクター鎖は、当分野で知られている方法を使って合成されてもよい。
【0157】
本発明はまた、本発明のポリペプチド複合体の少なくとも一つの重鎖をコードするベクターで形質転換された宿主細胞を提供する。その宿主細胞は、細菌及び酵母の細胞を含む任意の起源の細胞でよいが、脊椎動物の宿主細胞が好ましく、哺乳類の宿主細胞が一層好ましい。あるいは、上記重鎖は、当分野で知られている方法を使って合成されてもよい。
【0158】
本発明はまた、本発明のポリペプチド複合体の少なくとも一つの重鎖及び少なくとも一つのエフェクター鎖をコードするベクターで形質転換された宿主細胞も提供する。その宿主細胞は、細菌及び酵母の細胞を含むどの起源の細胞でもよいが、脊椎動物の宿主細胞が好ましく、哺乳類の宿主細胞が一層好ましい。あるいは、これらの鎖は、当分野で知られている方法を使って、独立して合成され会合されてもよい。
【0159】
さらに、本発明は、本発明の少なくとも一つの重鎖のホモ二量体もしくはヘテロ二量体のポリペプチド複合体を発現するトランスジェニック生物を提供する。そのトランスジェニック生物は、ヒトではない脊椎動物もしくは哺乳類、植物又は昆虫でもよい。
【0160】
本発明はまた、本発明の第一態様のクラス特異的重鎖のみ抗体及びそのVHドメインを、本発明のトランスジェニック生物を抗原で免疫することによって産生する方法を提供する。
【0161】
本発明のこの態様の好ましい実施形態では、上記生物はマウスである。
【0162】
健康管理の用途で使う抗体及びポリペプチド複合体を産生するには、大量に生産する系が必要であり、その例は先に詳細に考察してある。このような系としては、大量に栽培もしくは飼育する方法に適した植物(例えばトウモロコシ)、トランスジェニックのウシ及びヒツジ、鶏及び昆虫の幼虫がある。細胞培養及び生殖細胞系列の方法に代わるものとしてウイルス感染(例えば昆虫の幼虫や細胞系へのバキュロウイルスの感染)を含む他の産生法も、当業者にはよく知られたものになるだろう。
【0163】
これらの方法及び当分野で知られている他の適切な方法は、本発明のポリペプチド結合複合体を製造するのに使用できる。ホモ二量体及び/又はヘテロ二量体の製造はこれらの方法を使って達成できる。
【0164】
<本発明の重鎖のみ抗体及びポリペプチド複合体の使用>
本発明の重鎖のみ抗体及びポリペプチド結合複合体には、多数の用途がある。
【0165】
例えば、本発明の重鎖のみ抗体及びポリペプチド複合体には、二重特異性及び多重特異性のポリペプチド複合体が含まれる。これらの複合体は、例えば、感染症の治療と予防に使う治療剤として特に有利である。
【0166】
本発明の重鎖のみ抗体及びポリペプチド結合複合体は、細胞化学的ラベリング法、ターゲッティング法、治療及び診断を実施するのに有用である。
【0167】
モノ抗体療法では、例えば、単一の結合部位の欠失をもたらす突然変異のために病原体の免疫回避が起こり、抗体の治療効果が消失するであろう。同じ病原体の異なる抗原を認識するヘテロ二量体のポリペプチド複合体を産生すればこの問題を克服できる。本発明のポリペプチド複合体中の異なる特異性を有する少なくとも二つの結合ドメインを、細胞−細胞の相互作用及び細胞/病原体の相互作用の両方を高めるために使用することもできる。
【0168】
本実施形態では、本発明のポリペプチド複合体は、例えば、病原体とマクロファージ又は腫瘍細胞とT細胞などの二つの細胞型の間をポリペプチド複合体で架橋するのに使用できる。あるいは、そのポリペプチド複合体は、重鎖定常領域だけで提供されているエフェクター機能によって、同じ病原体の二つ以上のエピトープを認識してもよい。
【0169】
あるいは、二重特異性ポリペプチド結合複合体はインビボで標的の細胞又は組織に対して使用されてもよく、次いで循環しているエフェクター分子又は造影剤を捕獲できる。例えば、二重特異性腫瘍ターゲッティング剤はプロドラッグ変換複合体を捕獲し次いでプロドラッグを反応剤に部分的に変換するために使用され得る。また、エフェクター剤と組み合わせた二重特異性結合複合体と多重特異性結合複合体は、結合ドメインを選択することによって一種以上の病原体に結合し、破壊するために使用されてもよい。あるいは、同じ病原体の異なる抗原を認識する二種以上の結合ドメインの存在は臨床面で有利であり、病原体内の突然変異が原因の病原体の免疫回避や医薬の余剰が起こる可能性を低める。
【0170】
本発明は、本発明の第一態様の重鎖のみ抗体又はそのフラグメント、本発明の第二態様のポリペプチド鎖とポリペプチド複合体、及び本発明の第三態様のエフェクター鎖とポリペプチド複合体を提供する。これらは全て、ヒトの医薬の用途に適しているので、本発明は、本発明の重鎖のみ抗体、ポリペプチド鎖、エフェクター鎖又はポリペプチド複合体を含む医薬組成物を提供する。本発明はまた、疾患の予防及び/又は治療に使う医薬を調製する際の、本発明の重鎖のみ抗体、ポリペプチド鎖、エフェクター鎖又はポリペプチド複合体の使用も提供する。重鎖とエフェクター鎖は、前記医薬の投与方法と作用によって、ともに又は別個に配合されてもよい。
【0171】
本発明の医薬組成物と医薬は、一般に、患者に投与する前に配合され得る。
【0172】
例えば、重鎖のみ抗体又はポリペプチド複合体は、特に凍結乾燥しなければならないとき、安定剤と混合してもよい。糖類(例えば、マンニトール、スクロース又はトレハロース)を添加すると、一般に、凍結乾燥中、安定性を付与し、好ましい安定剤はマンニトールである。ヒト血清アルブミン(好ましくは組換え体)も安定剤として添加できる。糖類の混合物、例えばスクロースとマンニトール、トレハロースとマンニトールなども使用できる。
【0173】
本発明の組成物には緩衝剤を添加してもよく、緩衝剤としては、例えば、トリス緩衝剤、ヒスチジン緩衝剤、グリシン緩衝剤又は好ましくはリン酸緩衝剤(例えば、リン酸二水素ナトリウムとリン酸水素二ナトリウムを含有する)がある。緩衝剤は、pHが7.2から7.8の間、特に約7.5になる量で添加することが好ましい。
【0174】
凍結乾燥した後、再構成するために注射用滅菌水が使用されてもよい。凍結乾燥された固形物を、ヒト血清アルブミン(好ましくは組換え体)を含む水性組成物で再構成することもできる。
【0175】
一般に、重鎖のみ抗体とポリペプチド複合体は、精製された形態で薬理学的に適正な担体とともに利用され得る。
【0176】
したがって、本発明は、本発明の医薬組成物を患者に投与することからなる患者の治療方法を提供する。患者は好ましくはヒトであり、小児(例えば幼児又は乳児)、10歳台のヒト又は成人でもよいが一般に成人であろう。
【0177】
本発明はまた、医薬として使用する本発明の重鎖のみ抗体、ポリペプチド鎖、エフェクター鎖又はポリペプチド複合体を提供する。
【0178】
本発明はまた、患者を治療するのに使う医薬を製造する際の本発明の重鎖のみ抗体、ポリペプチド鎖、エフェクター鎖又はポリペプチド複合体の使用も提供する。
【0179】
これらの使用、方法及び医薬は、好ましくは以下の疾患及び障害を治療するのに利用され、その疾患及び障害は、創傷の治癒;新生物、黒色腫、肺、結腸直腸、骨肉腫、直腸、卵巣、肉腫、頚管、食道、乳房、膵臓、膀胱、頭部と頚部などの充実性腫瘍を含む細胞増殖傷害;白血病、非ホジキンリンパ腫、白血球減少症、血小板減少症、血管新生障害、カポジ肉腫などの骨髄増殖性障害;アレルギー、炎症性腸疾患、関節炎、乾癬と気道炎症、喘息、免疫障害及び臓器移植拒絶を含む自己免疫/炎症障害;高血圧、水腫、狭心症、アテローム性じゅく状硬化症、血栓症、敗血症、ショック、再潅流障害及び虚血を含む心血管と脈管の障害;中枢神経系疾患、アルツハイマー病、脳損傷、筋萎縮性側索硬化症及び疼痛を含む神経障害;発達障害;糖尿病、骨粗鬆症と肥満症、AIDS及び腎臓病を含む代謝異常;ウイルス感染症、細菌感染症、真菌感染症及び寄生虫感染症を含む感染症;胎盤に関連する病的状態;並びに免疫療法を利用する他の病的状態である。
【0180】
さらなる態様では、本発明は、本発明の重鎖のみ抗体又はポリペプチド結合複合体の診断剤、予後治療剤又は治療用造影剤としての使用方法を提供する。さらに、本発明は、本発明の重鎖のホモもしくはヘテロの二量体だけ又はこれを本発明の一つ以上のエフェクター(軽)鎖と組み合わせた治療用造影剤、細胞化学の試薬又は診断剤としての使用方法を提供する。
【0181】
本発明は、本明細書に記載されている重鎖のみ抗体又はそのフラグメントの細胞内結合試薬又は抗体酵素としての使用方法を提供する。好ましい重鎖のみ抗体のフラグメントは、可溶性の抗原特異的VH結合ドメインである。
【0182】
本発明はまた、本発明の抗原特異的単鎖抗体又はVH結合ドメインの酵素阻害剤又は受容体封鎖剤としての使用方法を提供する。好ましい重鎖のみ抗体のフラグメントは、可溶性の抗原特異的VH結合ドメインである。
【0183】
本発明はまた、エフェクター分子に融合させたVHドメインの治療剤、造影剤、診断剤、アブザイム又は試薬としての使用方法を提供する。
【0184】
<一般技術>
本明細書で使用されている技術用語と科学用語は、特に定義しない限り、当業者(例えば細胞培養、分子遺伝学、核酸化学、ハイブリッド形成技術及び生化学の当業者)が共通して理解しているのと同じ意味を持っている。分子、遺伝子及び生化学の方法(一般に、Sambrook et al.,Molecular Cloning:A Laboratory Manual,2nd Ed.(1989)Cold Spring Harbor Laboratory Press,Cold Spring Harbor N.Y.及びAusubel et al.,Short Protocols in Molecular Biology(1999)4th Ed.,John Wiley & Sons,Inc.参照)並びに化学的方法の標準方法が使用される。さらに、標準の免疫学的方法として、Harlow & Lane,A Laboratory ManualCold Spring Harbor N.Y.がある。
【0185】
本発明の二価及び多価のポリペプチド複合体、単一重鎖抗体及びそのフラグメントの製造のために、任意の適切な組換えDNA技術が使用されてもよい。ポリペプチド複合体又は抗体の鎖各々をコードするDNA配列を含むプラスミドなどの典型的な発現ベクターが構築される。免疫グロブリンを酵素で及び化学的に細分して生成したフラグメントを分離する確立された適切な任意の方法が使用されてもよい。
【0186】
本発明はまた、トランスジェニックマウス内で重鎖のみ抗体を発現する構造体を含み、本発明のポリペプチド複合体を構築し発現するベクターを提供する。
【0187】
ポリペプチド鎖以外の鎖をコードするDNA配列を含有する単一ベクターが構築されてもよいことは高く評価されるであろう。例えば、二つの異なる重鎖をコードするDNA配列は、同じプラスミドの異なる位置に挿入されてもよい。
【0188】
あるいは、各ポリペプチド鎖をコードするDNA配列を、個々に一プラスミドに挿入して、各々特定のポリペプチド鎖をコードする多数の構築されたプラスミドを製造してもよい。配列を挿入するプラスミドは互換性のある方が好ましい。
【0189】
続いて、各プラスミドは、各宿主細胞がポリペプチド複合体中の各ポリペプチド鎖をコードするDNA配列を含有するように、宿主細胞を形質転換するのに使用される。
【0190】
細菌系内でクローン化するのに適切な発現ベクターとしては、Col E1、pcR1、pBR322、pACYC184及びRP4などのプラスミド、ファージDNA、又はこれらのいずれかの誘導体が使用されてもよい。
【0191】
酵母系内にクローン化するのに使用する適切な発現ベクターとしては、2micronプラスミドの複製起点に基づいたプラスミドが挙げられる。
【0192】
適正な哺乳類の遺伝子のプロモーター配列を含有する任意のプラスミドは、哺乳類系内でのクローン化に使用されてもよい。昆虫又はバキュロウイルスのプロモーター配列は、昆虫細胞の遺伝子を発現させるのに使用されてもよい。このようなベクターとしては、例えばpBR322、ウシ乳頭腫ウイルス、レトロウイルス類、DNAウイルス類及びワクシニアウイルス類由来のプラスミドがある。
【0193】
ポリペプチド複合体又は抗体を発現のために使用されてもよい適切な宿主細胞としては、細菌、酵母及び真核細胞例えば昆虫もしくは哺乳類の細胞系、トランスジェニック植物、昆虫、哺乳類及び他の無脊椎動物もしくは脊椎動物の発現系が挙げられる。
【0194】
<本発明のポリペプチド複合体及び単一重鎖抗体>
用語:本発明の「ポリペプチド複合体」、「単一重鎖抗体」及び「異種重鎖遺伝子座」は、例えば、類縁の細胞ホモログ、他の種由来のホモログ及びその変異体もしくは誘導体などの任意の供給源から得られる同族のポリペプチド及び核酸配列を含むことは当然明らかであろう。
【0195】
したがって、本発明は、本明細書に記載されている上記ポリペプチド複合体と抗体の変異体、ホモログ又は誘導体を含む。
【0196】
本発明の文脈では、同族配列は、少なくとも30個、好ましくは50、70、90又は100個のアミノ酸を超えるアミノ酸レベルで、少なくとも80、85、90、95、96、97、98、99、99.5、99.6、99.7、99.8、99.9%相同で好ましくは少なくとも98又は99%相同であるアミノ酸配列を含むと考えられる。相同性は類似性(すなわち類似の化学特性/機能を有するアミノ酸残基)によって検討することもできるが、本発明の文脈では、相同性は配列の同一性で表現する方が好ましい。
【0197】
本発明には、本発明のポリペプチド複合体と抗体を製造するのに使う構築された発現ベクター及び形質転換された宿主細胞も含まれる。
【0198】
個々の鎖は、同じ宿主細胞内で発現された後、活性型の完全なポリペプチド複合体又は重鎖のみ抗体を提供するために回収されてもよい。本発明の好ましい形態では、個々の重鎖は、宿主細胞によって処理されて、その細胞から有利に分泌される完全なポリペプチド複合体又は抗体を形成すると考えられる。好ましくは、エフェクター鎖は、宿主細胞又は合成手段によって別個に産生される。
【0199】
組換え抗体のポリペプチド複合体の調製法は、上記参照文献及び例えばEP−A−0 623 679;EP−A−0 368 684及びEP−A−0 436 597にも記載されている。
【0200】
<トランスジェニック生物の免疫>
さらなる態様で、本発明は、抗原を、本発明のトランスジェニック生物に投与することを含む本発明の抗体の製造方法を提供する。
【0201】
本発明のトランスジェニック生物から産生される抗体及びポリペプチド複合体としては、ポリクローナル抗体、モノクローナル抗体及びそのフラグメントが挙げられる。ポリクローナル抗体が必要なときは、トランスジェニック動物(例えばマウス、ウサギ、ヤギ、ウマなど)を、抗原で免疫し、免疫された動物から血清を集めて、公知の方法で処理されてもよい。ポリクローナル抗体を含有する血清が、他の抗原に対する抗体を含有するとき、対象のポリクローナル抗体は、当業者にはよく知られている免疫親和性クロマトグラフィー及びこれに類似の方法で精製できる。また、ポリクローナル抗血清を産生させ処理する技術も、当分野で知られている。
【0202】
<本発明のポリペプチド結合複合体及び抗体の使用方法>
本発明のポリペプチド複合体及び抗体とそのフラグメントは、インビボでの治療と予防の用途、インビトロとインビボで診断する際の用途、インビトロでの検定と試薬の用途などに利用されてもよい。
【0203】
本発明のポリペプチド複合体と抗体を治療と予防に用いる方法には、それらを、ヒトなどの受容哺乳類に投与するステップが含まれる。
【0204】
実質的に純粋なポリペプチド複合体及び抗体のそのフラグメントを少なくとも90〜95%の均質性で含有しているものが哺乳類に対して投与するのに好ましく、そして特に哺乳類がヒトの場合、医薬の用途には、98〜99%以上の均質性が最も好ましい。所望どおりに部分的に又は均質に精製されたならば、本明細書に記載のポリペプチド複合体と重鎖のみ抗体は、診断又は治療(体外の場合を含む)に使うか又は当業者に知られている方法を使って検定法を開発して実施するのに使用されてもよい。
【0205】
一般に本発明のポリペプチド複合体と抗体は、精製された形態で、薬理学的に適正な担体とともに利用される。典型的には、これら担体としては、水溶液もしくはアルコール/水溶液、乳濁液もしくは懸濁液があり、これらは生理食塩水及び/又は緩衝媒体を含んでもよい。非経口用の賦形剤としては、塩化ナトリウム溶液、リンゲルのデキストロース、デキストロースと塩化ナトリウム及び乳酸化リンゲル液がある。
【0206】
ポリペプチド複合体を懸濁液に保持することが必要な場合、生理的に許容できる適切なアジュバントを、カルボキシメチルセルロース、ポリビニルピロリドン、ゼラチン及びアルギネートなどの増粘剤から選択してもよい。
【0207】
静脈内用賦形剤としては、流体と栄養素の補充剤及び電解質の補充剤、例えばリンゲルのデキストロースに基づいたものが挙げられる。また、保存剤などの添加剤、例えば抗菌薬、抗酸化剤、キレート化剤及び不活性ガスが存在していてもよい(Mack(1982)Remington’s Pharmaceutical Sciences,16th Edition)。
【0208】
本発明のポリペプチド複合体及び抗体とそのフラグメントは、別個に投与される組成物として又は他の試薬とともに使用できる。これらは、各種の免疫治療用薬剤、例えばシクロスポリン、メトトレキサート、アドレアマイシン、シスプラチナム又はイムノトキシンを含んでもよい。あるいは、本発明のポリペプチド複合体は、酵素とともに使用して、プロドラッグをその活性部位で変換できる。
【0209】
医薬組成物は、本発明の選択された抗体とともに又は本発明の選択された抗体の組合せとともに、各種の細胞傷害性又は他の試薬の「カクテル」を含んでもよい。
【0210】
本発明の医薬組成物の投与経路は、当業者に公知のどの経路でもよい。特に制限を含まない免疫療法を含む治療法の場合、本発明のポリペプチド複合体又は抗体は、どの患者にも標準の方法で投与できる。その投与は、非経口、静脈内、筋肉内、腹腔内、経皮、経肺又はカテーテルを使って適切に行う直接注入を含む任意の適切な様式によって行なわれる。投与量と投与の頻度は、臨床医が考慮する患者の年齢、性別及び症状、他の医薬の同時投与、計器の示度などの他のパラメータに依存するであろう。
【0211】
本発明のポリペプチド複合体と抗体は、凍結乾燥して貯蔵し、使用する前に適切な担体で再構成することができる。既知の凍結乾燥法と再構成法を利用できる。凍結乾燥と再構成は、機能活性損失を起こし得るので、補償するため使用レベルを上方に調節しなければならないことがあるかもしれないことは当業者には当然明らかである。
【0212】
さらに本発明のポリペプチド複合体と抗体は、診断のために使用できる。例えば、本明細書に記載の抗体は、疾患状態中に特異的に発現されるか又はそのレベルが所与の疾患状態中に変化する抗原に対して生成又は発生されてもよい。
【0213】
診断又は追跡などの特定の目的のためには、ラベルを付加してもよい。適正なラベルとしては、限定されないが、放射能ラベル、NMRスピンラベル及び蛍光ラベルのいずれかがある。これらのラベルを検出する手段は、当業者にはよく知られている。
【0214】
本発明のポリペプチド複合体と抗体又はそのカクテルを含有する組成物は予防及び/又は治療のために投与できる。
【0215】
本発明のポリペプチド複合体又は抗体を一種以上含有する組成物は、予防と治療の段階で、哺乳類中の選択された標的細胞集団を変質させ、不活性化し、殺し又は除去することを促進するのに利用されてもよい。さらに、本明細書に記載されているポリペプチド複合体と抗体の選択されたレパートリーは、細胞の異種コレクション由来の標的細胞集団を殺し、減少させ又は有効に除去するために、体外又はインビトロで選択して使用されてもよい。
【実施例1】
【0216】
予備実験で、二つのラマVHHエキソンが、ヒト重鎖の多様性(diversity)(D)セグメントと連結(joining)(J)セグメントに連結され、さらにCμ、Cδ、Cγ2、Cγ3ヒト定常領域遺伝子とヒト重鎖免疫グロブリン3’LCRがそれに続く重鎖遺伝子座を発現するトランスジェニックマウスを準備した。前記ヒトのCγ2とCγ3の遺伝子は、G→Aのスプライス変異を含有していた。Frt部位が存在していると、Flpにより仲介される組換えによって、多コピー導入遺伝子アレイから単一コピートランスジェニックマウスを生成することができる。しかし、G→Aスプライス変異を有するトランスジェニック遺伝子座由来の配列は、異所スプライシングであるが不完全なCH1の除去を示した(図9)。
【0217】
<構造体>
この問題を克服するため、標準の方法を使って、ゲノムコスミドライブラリーをVH遺伝子を含有するクローンについてスクリーニングした。一つ(又は二つ以上)の異なる生殖細胞系VHを、その配列に基づいて無作為に選んだ(ヒトVHの場合は五つの属クラス)。親水性アミノ酸のコドンを、IMGTナンバリング法(Lefranc et al.(1999)によって、42、49、50及び52の位置に導入した。これらのVH遺伝子は、カスタムメイドのリンカーを使う直接クローン化法又は相同的組換え法などの標準法によってBACベクター中に組み入れられた。
【0218】
二つのクローンすなわち、ヒト重鎖のDとJのセグメント、Cμ(IgM)及びCδ(IgD)を含有するクローン 1065 N8並びにCγ3(IgG3)遺伝子を含有するクローン1115 N15を、ヒトゲノムPacライブラリー RPCI−11(BACPAC Recource Center,USA)から選択した。異なるヒトゲノムライブラリー(Incyte Genomics,CA,USA)由来のBac clone 11771を、Cγ2(IgG2)遺伝子及び免疫グロブリン重鎖LCRの原料として使用した(Mills et al.(1997)J.Exp.Med.,15;186(6):845−58)。
【0219】
標準法を使って、Cγ3とCγ2の遺伝子を、別個に、pFastBacベクター(Invitrogen)中にサブクローン化した。同様に、残りの任意のIg定常領域をこれらのBACからクローン化できる(IgA、IgE)。CH1エキソンの完全な欠失は、各定常領域のCH1エキソンの隣に位置する配列を使って、相同的組換え法(Imam et al.,(2001))によって達成した。Frt部位を、Cμスイッチ領域の前に任意選択的に導入し、標準的な手段で(例えばrosa−flpマウスと交配することにより)インビボにてflpリコンビナーゼで処理することによって、多コピー遺伝子座から単一コピー遺伝子座を生成させることができた(図10)。
【0220】
別個のVH遺伝子、DとJのセグメント及びCとLCRのエキソンを、通常の制限消化−連結法又は相同組換え法(又は両方を混合した方法)又は任意の他のクローン化法によって、一つのBAC中にクローン化した。次いでさらに別の構造体を作製することができた。
【0221】
<IgMのみ遺伝子座>
IgM構造体を得るため(図11)、ヒトのDとJの重鎖セグメント及びCμが続く一つ以上のVH遺伝子(好ましくは、可溶性を提供するため遺伝子工学的に処理されたヒトVH遺伝子又はラクダVHH遺伝子)をBAC中にクローン化した(本方法については上記を参照のこと)。この場合、Cμ領域だけが、最終のBAC中にクローン化された。
【0222】
<IgMプラスIgG遺伝子座(Cδは任意選択的)>
IgMプラスIgG構造体を得るため(図12)、ヒトのDとJの重鎖セグメント、Cμ(CH1エキソンは含有しないがCH4エキソンは含有する)、(任意選択的なCδ)及び修飾されたヒトCγ2とCγ3遺伝子と3’LCRが続く一つ以上のVH遺伝子(好ましくは、可溶性を提供するため遺伝子工学的に処理されたヒトVHセグメント又はラクダVHH遺伝子)をBAC中にクローン化した。IgGのみ遺伝子座を生成させるために、loxP部位を、標準クローン化ステップ(上記)によって導入し次いでそのBACを294 Cre大腸菌株中で成長させ(Buscholz et al.)、次いでcreにより仲介される組換え法によってIgGのみ遺伝子座を産生する細菌を得た。さらなる構築の詳細については先の説明を参照のこと。
【0223】
<IgMプラスIgG遺伝子座(Cδは任意選択的)>
IgMプラスIgG構造体を得るため(図13)、ヒトのDとJの重鎖セグメント、Cμ(CH1とCH4を含有する)、(任意選択的なCδ)及び修飾されたヒトCγ2とCγ3遺伝子と3’LCRが続く一つ以上のVH遺伝子(好ましくは、可溶性を提供するため遺伝子工学的に処理されたヒトVH遺伝子又はラクダVHH遺伝子)をBAC中にクローン化した。IgGのみ遺伝子座を生成させるために、loxP部位を、標準クローン化ステップ(上記)によって導入し次いでそのBACを294 Cre大腸菌株中で成長させ(Buscholz et al.)、次いでcreにより仲介される組換え法によってIgGのみ遺伝子座を産生する細菌を得た。
【0224】
<トランスジェニックマウス、飼育とゲノタイピング>
受精卵に対する標準マイクロインジェクション法又は胚幹細胞トランスフェクション法によって、前記最終BACを、トランスジェニックマウスに導入した。
【0225】
5’末端と3’末端の遺伝子座プローブを使って末端tailDNAをサザンブロット分析することによって(Southern 1975)、トランスジェニック遺伝子座を、完全性とコピー数についてチェックした。初代マウス(founder)は、μMT−/−バックグランドの系統中で繁殖させた。その遺伝子座の異なる領域各々についてプライマーを使って標準PCR分析することによって、ゲノタイピングを実施した。Cγ2とCγ3の両方から全CH1エキソンを除かれたトランスジェニックマウス(HLLラインを有するもの及びCμとCδの遺伝子を有しないもの)のBM cDNA由来のRT−PCR産物の配列を分析したところ、そのトランスジェニック遺伝子座は、VDJを組換えることができるのみならず、そのIgGの転写産物が、ラマやラクダのHCAbに見られる転写産物に似ていることを示した。
【0226】
<免疫組織化学>
脾臓をOCT化合物中に包埋した。クライオスタットによる5μmの凍結切片をアセトン中で固定し、すでに述べられているようにして(Leenen et al.1998)単一又は二重の標識を行った。モノクローナル抗体抗B220/RA3−6B2、モノクローナル抗体抗CD11c/N418(Steinman et al.1997)にはハイブリドーマ培養上澄み液が用いられた。ペルオキシダーゼを連結したヤギ抗ヒトIgG及びヤギ抗ヒトIgMをSigmaから入手した。第二ステップの試薬は、ペルオキシダーゼの標識をつけた、ヤギ抗ラットIg(DAKO,Glostrup,Denmark)もしくはヤギ抗ハムスターIg(Jackson ImmunoResearch Laboratories,West Grove,AL,USA)及びヤギ抗ラットIgアルカリホスファターゼ(Southern Biotechnology,Birmingam,AL,USA)であった。
【0227】
図15は、μMT−/−バックグランド中のμMT−/−、WTとHLL及びHLL−MDのトランスジェニックマウス由来の脾臓の5μm凍結切片を免疫組織化学分析した結果を示す。切片を、B細胞は抗B220(ブルー)で染色し、そして樹枝状細胞は抗CD11c/N418(褐色)で染色した。矢印はB細胞の小クラスターの位置を示す。
【0228】
<フローサイトメトリー分析>
単一細胞の懸濁液を、(Slieker et al.1993)、PBS中のリンパ系器官から調製した。約1×106個の細胞を抗体とともに、96ウェルプレート中のPBS/0.5%ウシ血清アルブミン(BSA)内で4℃にて30分間インキュベートした。細胞をPBS/0.5%BSA中で2回洗浄した。各試料について、FACScan analyzer(Becton Dickinson,Sunnyvale,CA)を使って、3×104個の細胞を計測した。FACSのデータは、CellQuest version 1.0 computer softwareを使って分析した。四色分析を、Becton Dickinson FACS Caliburで実施した。以下のmAb:FITC複合抗B220−RA3−6B2及びPE複合抗CD19をBD Pharmingen(San Diego,CA)から入手した。抗CD19及び抗B220で染色した脾臓細胞のFACSスキャンデータを図15の下部のパネルに示した。
【0229】
図15の左側に、HLL系−FlpeRトランスジェニック系を交配することによるインビボFlp組換えを提示してあり、これは組換え体の脾臓細胞に関するFACSスキャンデータを支持し、直接生成した元のHLL−MD系に見られるようなB細胞のレスキュー(rescue)を示している。右側には、Cag Creトランスジェニック系の飼育することによるインビボCre組換えと単一コピーの組換え体の脾臓細胞に関するFACSデータを示してある。
【0230】
<免疫付与とハイブリドーマの産生(図14)>
二つのラマVHHドメイン、ヒトのDとJの領域及びIgG2とIgG3の定常領域(CH1ドメインは含まない)からなる重鎖のみ抗体の遺伝子座を含有するトランスジェニックマウスを作製した。
【0231】
8週齢のマウスを、大腸菌熱ショックタンパク質70(hsp70)で免疫した。Specolアジュバント(IDDLO,Lelystadt,NL)を含有する抗原20μg又は5μgを、それぞれ、0日目、14日目、28日目、42日目に皮下注射し50日目に腹腔内注射した。0日目、14日目及び45日目に採血した。3回ブーストを行った後、Hsp70タンパク質で免疫したHLL−MD1マウス3匹のうち1匹に低力価の抗原特異的抗体が検出された(図14)。
【0232】
標準の脾臓細胞を黒色腫細胞系と融合させて、hsp70タンパク質に対するモノクローナル抗体をモノクローナルハイブリドーマ細胞系中に生成させた。その抗HSP70HCAbは、ヒトIgHD3−10セグメントに組換えられたD領域に最も近いラマVHHセグメント(VHH 2)(acc.num.X13972)及びヒトIgHJ4−02セグメント(acc.num.X86355)からなっている。頻度は高くないが、前記VHHは、生殖細胞系の配置構成と比べて図9Aに示すアミノ酸の変化を起こす突然変異を数回行なう。RT−PCR分析の結果もそのハイブリドーマ内に生産的IgH転写体を一つだけ示したが、これは他の転写体が全く生成しないことを示唆している。αHSP70 IgG2抗体は重鎖のみ二量体として分泌される(変性ゲル(二量体)及び非変性ゲル(モノマー)条件下のウエスタンブロット法、図14)。ClonalCellTM−HY kit(StemCell Technologies,UK)を生産者の指示に従って使用し、脾臓細胞を、56日目に、Sp2−O−Ag14黒色腫細胞(R.Haperen氏からの寄贈)と融合させた。
【0233】
二つのラマVHHドメイン、ヒトのDとJの領域、ヒトのIgM及びIgG2とIgG3の定常領域(全てCH1ドメインは含まない、図12)からなる重鎖のみ抗体の遺伝子座を含有するトランスジェニックマウスを、TNFαで免疫してHC−IgM抗体を得た。3匹のマウスのうち1匹が、標準ELISA検定法で陽性の血清を示した。標準的な黒色腫融合によって陽性のIgMハイブリドーマを得た(図16)。非還元条件下、Sepharose 6Bでゲル濾過した後、カラムの各画分を還元条件下のゲルに負荷し次いで抗ヒトIgM−HRPによって検出した(図20)。非還元条件下での分画は、HC−IgMが、ヒトの対照IgMと同じ大きさ(HC−IgMには欠けている軽鎖とCH1ドメインの分子量を差し引いた後)の多量体抗体として分泌されることを示した。各カラム画分の還元条件下でのゲル分画は、図20に示す予想モノマーを示した。
【0234】
<血清Ig ELISA>
15〜25週齢のマウスから血液を、EDTAをコートしたチューブに集めて、室温(RT)で15分間遠心し、次いでその上澄み液をPBSで1:5の比率で希釈した。96ウェルプレートを、5mg/ml濃度のヤギ抗ヒトIgG(YES Biotechnology)又はヤギ抗ヒトIgM(Sigma)で2時間コートし、PBSで洗浄し、ブロッキング溶液(1.5%BSA/1.5%粉乳/0.1%tween20/PBS)でRTにて1時間ブロックし、次にPBSで3回洗浄した。血清試料と標準液(ヒトIgG2又はヒトIgM(Sigma,Zwijndrecht,NL))の希釈シリーズを負荷して2〜4時間インキュベートし次いでプレートをPBSで6回洗浄した後、第二抗体(HRPに連結したヤギ抗ヒトIgG又はヤギ抗ヒトIgMを1:2000の比率で希釈したもの(Sigma,Zwijndrecht,NL))を添加した。希釈は全てブロッキング溶液で実施した。RTで1〜2時間インキュベートしてPBSで洗浄した後、POD基質(Roche)を添加した。
【0235】
IgG2ファージライブラリーから抗原特異的可溶性sdAbを検出するELISA試験の結果を図16に示す。可溶性sdAbを、抗原をコートしたプレートに対する第一抗体として使用し続いてマウス抗myc抗体及びHRP複合ヤギ抗マウス抗体を使った。PODを基質として使った。下部のパネルは、制限酵素Hinf Iによるクローンのフィンガープリンティングを示し、これはB.Pertusisに対するsdAbをコードする5個の異なるインサートを示している。
【0236】
<抗体ライブラリーの構築とスクリーニング>
Ultraspec RNA isolation system(Biotex Laboratories,Houston,Texas,USA)を使って、DKTPで免疫した単一コピーIgGのみマウスの脾臓から全RNAを単離した(図12 cre処理をした後)。oligo dTを使ってcDNAを作製した。vhl back SfiIプライマー(Dekker et al 2003)をhIgG2hingrevプライマー(5’−AATCTGGGCAGCGGCCGCCTCGACACAACATTTGCGCTC−3’)と組み合わせた特異的プライマーを使用してPCRによって、VHHのDJフラグメントをコードするDNAフラグメントを増幅した。その増幅されたVHHのDJフラグメント(約400 bp)を、Sfi I/Not Iで消化し、ゲルで精製し次いでSfi I/NotIで消化したファージミドベクターpHEN−1中にクローン化した。
【0237】
TG1エレクトロコンピテント細胞に形質転換して、ヒト単一ドメイン抗体を生産する抗体ライブラリーを得た。プラスティック(希釈されていないワクチンをコートしたイムノチューブ)に吸着させたワクチン抗原にパニングを行なって、2ラウンドの選択を実施した。制限分析と配列決定は標準の方法でおこなった。
【0238】
<重鎖のみ遺伝子座のRT−PCR>
HLL−MD遺伝子座が、多様な抗体レパートリーを産生する際に正常な遺伝子座として機能するかどうかを、パイエル板由来のcDNAに対してIgG2とIgG3の特異的プライマーを使って得たRT−PCR産物の配列を決定することによって試験した。図17は、免疫されていないマウス(左パネル)と免疫されたマウス(右パネル)由来のクローンの体細胞変異のいくつかの例を示す。これらのマウスは、IgGのみ遺伝子座、大腸菌hsp70、百日咳菌溶解物、破傷風トキソイドで免疫されたものであった。灰色の影付きの部分はERKCCVで始まるIgG2ヒンジ領域である。
【0239】
パイエル板のRT−PCRによる分析は、両VHを使うことを示したが、配列を決定された全ての抗体は、VH2を再構成していた。レパートリーの多様性の起源は、DとJのセグメントの選択及びV−DとD−Jの結合部によって形成されたCDR3領域である。ヒトJセグメントを使うことは、ヒトの再構成に見られるのと類似しており、JH4とJH6のセグメントが最も頻繁に使用される。
【0240】
この分析は、多様な抗体のレパートリーに寄与するために、両VH、異なるヒトDセグメント及び全てのヒトJセグメントを使われることを示した。再構成された各遺伝子を、その生殖細胞系のカウンターパートすなわちトランスジェニック構造体中の元のVHと比較することによって、IgG3をスイッチされたB細胞が存在し、体細胞の変異が起こっていることも分かった(図17参照)。したがって、ヒト重鎖のみIgG抗原受容体は、B細胞成熟に必要な信号を提供できる。
【0241】
<免疫染色>
図18は、A5抗体(Dekker et al.2003)を含有する応答プラスミドで追加的にトランスフェクトされたTet−on細胞系の一つを免疫染色した結果を示す。上のパネルは、ドキシサイクリンによって細胞質中に誘発され産生したA5抗体(赤色)及びDAPIによる細胞核の染色(青色)を示す。下のパネルは、核の中にrtTAを発現する細胞が、誘発(上のパネル)によってA5を産生する細胞であることを示す。下記配列を有するrtTAに対するヒトHCAbのうちの一種で染色を実施した(緑色)。FITC複合ヤギ抗ヒトIgGを第二ステップとして使用した。Dekker et al.2003にすでに記載されているようにして、A5を検出した。rTTA抗体は下記配列を有するIgG3であった。
【化1】

【0242】
このIgG3のヒンジは、アミノ酸198 ELKTPLから始まる。比較のため図17のIgG2ヒンジ領域を参照されたい。
【0243】
<ウエスタンブロット分析>
図19は、IgMプラスIgG遺伝子座(図10)を含有する異なるトランスジェニックマウス系の血清の、cre処理を行った後(すなわち、IgMが欠失しIgGのみ残留)のウエスタンブロットを示す。血清は、prot Gで精製し次いで還元条件下(図19の右のパネル)及び非還元条件下(図19の左のパネル)でゲル分画を行なった。対照は、バックグランドのKOマウス及び正常なヒトの血清の試料である。ヒト重鎖のみIgGが二量体であることを示す二つのゲルのサイズ間の差に留意されたい。
【0244】
図19に示した信号は、標準の方法によって抗ヒトIgG抗体で検出した。
【0245】
IgMプラスIgG遺伝子座マウスによって産生されるヒトIgMのサイズ分画
IgMプラスIgGマウス(図13)由来の血清を、対照のヒト血清の試料と混合した後、非還元条件下でゲル濾過することによって分画した。結果を図20に示す。カラムの複合体の分子量は、各レーンについて(各画分を示す)左から右に進むにつれて減少する。これら画分(各レーン)を、還元条件下にてゲル電気泳動法で分析した。
【0246】
ヒトTNFαで免疫された、IgMプラスIgG(図13)遺伝子座を含有するマウスから作製した多数のハイブリドーマのELISA分析を実施した。結果を図21に示す。図21の上部2列は抗ヒトIgGを分析した結果であり、次の2列は抗ヒトIgMを分析した結果である。血清試料(二つの矢印)は、このマウスがIgG抗TNFα抗体とIgM抗TNFα抗体の両者を産生したことを示している。単一矢印は、陽性IgMハイブリドーマを示す。それらのウェルは、市販のヒトTNFαでコートした。処理は全て標準法で行なった。
【実施例2】
【0247】
二重特異性二価抗体を、二つの重鎖のみモノ特異性抗体を結合させることによって生成させた。その第一抗体は、第一特異性とエフェクター機能(可変領域と定常領域それぞれの)をもたらす骨格を形成する。この第一抗体は、第二特異性を有する第二抗体と、新たに設計されたヒンジによって結合させる。このヒンジは、既存のIgG2のヒンジの配列と類似しているが、システインをプロリンで置換することによって変化させて、抗体二量体のシステインの架橋を防止し、かつプロリンで追加の可撓性を提供して、機能を阻害することがある第二抗体の立体束縛を防止した。
【0248】
最初の骨格抗体は、大腸菌HSP70タンパク質に対する抗体であった。このHSP70抗原を、先に述べたようにして(上記図14参照)、重鎖のみ抗体遺伝子座を含有するトランスジェニックマウスに注射した。標準のハイブリドーマ融合法によって、これらの動物からモノクローナル抗体を生成させた(上記事項参照)。次に、抗HSP抗体をコードするcDNAを、標準のRT−PCR組換えDNA法によってクローン化して、5’末端から3’末端まで(N末端からCOOH末端までのタンパク質の)、開始コドンATG、シグナルペプチドの配列、可変ドメインVHH1(Janssens et al参照)、組換えたDとJの領域及びCγ2の定常領域(CH1領域を欠いている)を含有するが、ストップコドンとポリA部位を含むプラスミドを得た(図22の左上部)。フォワードプライマーとリバースプライマーを使ってクローン化するため、抗HSP70抗体をコードするcDNAをPCRで増幅した。
【0249】
フォワードプライマーは、クローン化を行なうためのEcoRI部位(下線)、有効な翻訳開始配列(太文字)及び通常の開始コドン(灰色の影付き)を提供する
【化2】

であった。
【0250】
リバースプライマーは、HindIIIクローニング部位(下線)を提供し通常のストップコドンを保持する
【化3】

であった。
【0251】
したがって、増幅によって、EcoRI部位(下線)を含有するEcoRI/HindIIIフラグメントに、抗HSP抗体遺伝子の有効翻訳開始配列(太字)と通常の開始コドン(灰色の影付き)が導入される。
【0252】
リバース3’末端プライマーは、HindIIIクローニング部位(下線)を提供し通常のストップコドンを除く
【化4】

であった。これによって、プロモーター配列中にクローン化するためのEcoRI部位、及び発現プラスミドに対して5’末端を、かつ新たなヒンジ配列に対して3’末端をクローン化するためのHindIII部位を有するフラグメント(図22の頂部から2行目の左)を得た(下記参照)。最後に、そのフラグメントをEcoRI及びHindIIIで切断して、クローニングのための適正な単一標準末端を提供した。
【0253】
第二特異性をもたらす第二クローン化抗体は、ブタレトロウイルス(PERV)gag抗原に対するラマ抗体のVHHドメインを含んでいた(Dekker et al.,(2003)J.Virol.,77(22):12132−9,図22 頂部右)。抗gagは、以下のプライマーすなわちフォワードプライマー:
【化5】

及びリバースプライマー:
【化6】

を使って標準のPCR増幅法で増幅した。これは、5’末端を新しいヒンジを有するフレームにクローン化するためのXhoI部位(灰色の影付き)(下記参照)及び3’末端を発現プラスミド中にクローン化するためのEcoRI部位(下線)(図22右中央)を有する増幅フラグメント(図22頂部から2行目の右側)を提供する。最後に、そのフラグメントをEcoRIとXhoIで切断して、クローン化するための一本鎖末端を生成させた。
【0254】
これら二つの抗体の配列を、前記新しいヒンジによって組み合わせて一つのダイアボディにした。その新しいヒンジは、クローン化するための5’と3’のオーバーハング(overhang)(それぞれHindIIIとXhoIコンパティブル)を有する二本鎖オリゴヌクレオチドを形成する二つのオリゴヌクレオチドから作製した。このヒンジは、抗HSP70配列の末端及び抗gag配列の開始部分を有するフレーム内に位置するように設計した。ヒトIgG2ヒンジ中に通常存在しているスルフィド架橋が生成することは、システイン(灰色の影付き)をプロリン(下線)で置換することによって防止した。このプロリンは、ヒンジに追加の可撓性を付加して、第一抗体のCOOH末端にヒンジによって接続されることになる第二抗体ドメインを適正に機能させる。
【0255】
通常のIgGヒンジの配列(システインコドンは灰色の影付き、プロリンコドンは下線):
【化7】

及びその相補鎖は、
【化8】

及びその相補鎖:
【化9】

で置換した。またこれは、クローン化するためのHindIII部位(太字)とXhoI部位(イタリック体)とコンパティブルの二つの一本鎖末端を有するフラグメント(白囲み枠のヒンジ、図22の中央)を提供する。
【0256】
これら三つのフラグメント(抗HSP70 IgG2、ヒンジ及び抗gag)は、次いで鶏アクチンプロモーターとCMVエンハンサー配列を含有するブルースクリプト(bluescript)(Pbluescript11 sk+)発現プラスミド(図22の発現プラスミド)中に、標準の組換えDNA技術で連結した。このプラスミドが発現されると(下記参照)、図22の下部に示すダイアボディが生成する。
【0257】
ダイアボディ発現プラスミドを増殖させて、標準の方法(Superfect)によって、CHO細胞中に、プラスミドpGK−hygro(トランスフェクトされた細胞を選択させるため)とともに同時トランスフェクトされた(図23)。ハイグロマイシンを含有する培地で陽性のクローンを選択し、次いで抗ヒトIgG−HRP検出法を使ってCHO細胞が分泌したダイアボディを含有する増殖培地の抗gag ELISA標準分析(Dekker et al.,J.Virol.2003)を実施して、ダイアボディを発現した場合、陽性とした。抗aga活性を試験して陽性であれば、gagの特異性はそのダイアボディのバックエンド(COOH末端)にあるので、所与のクローンは恐らく間違いなく全ダイアボディを発現しているであろう。HSP70に関する次のELISA分析の結果も陽性であった。プラスミドから発現されたタンパク質が、110kDの二量体(図23の下部に示す)であったことを示すために、55kDのモノマー(非還元条件と還元条件でのウエスタンブロット、図23の右)と比較して、非還元条件下及び還元条件下にてELISA法で選択したこれらクローンのウエスタンブロットを実施した。したがって、ELISA分析結果とウエスタンブロットはともに、ダイアボディが、トランスフェクトされたCHO細胞によって二量体として発現されて培地中に分泌され(>70ng/ml)そしてその抗体はHSP70及びgagの抗原と結合できることを示している。しかし、その二量体のダイアボディ分子が前記抗原の両方に同時に結合できることは示していない。
【0258】
したがって、追跡実験を実施した。まず、gag抗原をプラスチック製ウェル(図24中央の第一ウェル)の底に固定した。次いで、クローン1のCHO細胞上澄み液を適用した後、ダイアボディ(図24の頂部)を第一抗原(gag)で捕獲した(図24中央の第二ウェル)。続いて、十分に洗浄し、次いで第二抗原(HSP70、図24中央の第三ウェル)を適用し続いて再び十分洗浄した。二重特異性抗体分子は、両抗原と同時に結合できたならば、第一抗原(gag)と結合し次いで第二抗原(HSP70)を捕獲することによってウェルの底に捕獲されているはずである。次いで全複合体をウェルから溶離したところ(図24中央の右側ウェル)、ダイアボディ体と両抗原が、ウエスタンブロット上に目視できるようになった(図24の下部)。
【0259】
分泌されたダイアボディを収集するために、CHOクローンを、同じ標準条件下で、抗体をハイブリドーマから集めるのに使用する培地(SIGMA ハイブリドーマ培地、血清無し)内で増殖させた。
【0260】
方法:Nunc−Immuno plate(Maxisorp)のウェルに、精製組換えgagタンパク質(PBS中12.5μg/ul)O/N 4Cをコートした。1%ミルク/1%BSA含有PBSで2時間ブロックした。PBS−ミルク−BSAで2倍に希釈したCHO−DBクローン1培地(又は対照)を、室温(RT)で3時間インキュベートした。PBS−ミルク−BSAで2倍に希釈した細菌B121の溶解物(HPS70タンパク質を含有する)を、RTで3時間インキュベートし次いで洗浄した。結合したタンパク質を、2−メルカプトエタノールを含有するレムリー(Laemmli)の試料緩衝液で溶離した。これら試料をウエスタンブロット法で分析した。したがって10%SDS−PAGEに泳動させ次いでニトロセルロース膜上にブロットした。そのブロットをPBS−ミルク−BSAで2時間ブロックし次いで第一抗体とともにインキュベートした。産生物を、眼に見える染色を実施できる酵素に結合された第二抗体を使う標準法で目視可能にした。使用した試薬は下記の通りである。
抗gag:ウサギポリクローナル(1:2000)2時間RT
抗ダイアボディ体:ヤギαヒトIgG−HRP(1:2500)2時間RT
抗HSP70:モノクローナルG20−380培地(1:2)2時間RT
二次抗体は、ヤギ抗ウサギーAP(1:2000)2時間RT及びHSP70モノクローナルに対するヤギ抗ヒトIgG−HRP(1:2500)2時間RTであった。
【0261】
タンパク質のバンドを目視可能にするために、アルカリホスファターゼ(AP)と反応する第一NBT/BCIP基質(紫色)及び西洋ワサビペルオキシダーゼ(HRP)と反応する第二DAB基質(褐色)を使用した。
【0262】
洗浄ステップは全て、PBS−0.05% Tween−20で実施した。
【0263】
一成分を除外するか又はダイアボディを産生しないCHO細胞由来の培地を添加することによって対照試験を実施した(図24)。すなわちダイアボディ無しの適用(トランスフェクトされていないCO細胞由来の培地)を欠いているのでgagのみを有するレーン2;ウェルの底にgagを欠いているので(ミルクタンパク質で置換されている)産生物が全く無いレーン3;gagとダイアボディを欠いているので産生物が全く無いレーン4;HSP70抗原を欠いているので(ミルク抗原で置換されている)ダイアボディとgagだけを有するレーン5;HSP70とダイアボディを欠いているのでgagだけを有するレーン6を利用して行なった。
【0264】
全3成分(ダイアボディ+両抗原)は、3成分全てを受け取ったレーン1のウェルにのみ存在していることは(図24の下部の図参照)、単一のダイアボディが両抗原に同時に結合することを示している。
【0265】
<二重特異性IgA又は多重特異性IgMの生成>
二重特異性IgAの生成は、IgGについて先に述べたのとほぼ同じであるが、Vhsol、D及びJに加えて、IgAを生成する定常領域Cαを使用する(図25)。
【0266】
IgMの生成はほとんど同じであるが、IgM分子は大きい多量体を形成することがあるので(J鎖があっても無くても)追加の可能性を提供する。したがって、上記分子に類似の分子に加えて(図26下部右、多量体化配列を除いた後)、異なる特異性を有するIgMを単に同時発現することによって多量体を生成させることもできる(図26下部左)。
【実施例3】
【0267】
PSCA(前立腺幹細胞抗原)に結合する結合ドメイン及びJunのロイシンジッパーモチーフと抗体ヒンジからなる会合ドメインを含む重鎖並びにFosのロイシンジッパーモチーフからなる相補的会合ドメイン、CH2ドメイン及びCH3ドメインを含む軽鎖を含むポリペプチド複合体をコードする発現ベクターを、Sambrook et al.(1989)Molecular Cloning−A Laboratory Manual,Cold Spring Harbor Laboratory Pressによって記載されているような分子生物学の技術を使って構築する。
【0268】
その発現ベクターを、次に、通常の技術によって、適切な宿主細胞に移行させて、そのベクターを最適に発現するトランスフェクトされた宿主細胞を作製する。前記トランスフェクトされたか又は形質転換された宿主細胞を、次に当業者に知られている任意の適切な方法を使って培養して本発明のポリペプチド複合体を産生させる。
【0269】
ポリペプチド複合体は、産生されたならば、クロスフロー濾過法、硫酸アンモニウム沈殿法及びアフィニティカラムクロマトグラフィ(例えば、プロテインA)を含む当分野の標準方法で精製する。
【0270】
次に当業者に知られている技術を使って、3,3’−ジインドリルメタン(DIM)からなる可溶性エフェクタードメインを、相補的会合ドメインに融合させる。
【実施例4】
【0271】
AFP(抗フェトプロテイン)に結合する可溶性VHH結合ドメイン並びにJunのロイシンジッパーモチーフ及び抗体ヒンジからなる会合ドメイン、CH2ドメイン及びCH3ドメインを含む本発明のポリペプチド複合体の重鎖をコードする発現ベクターを、Sambrook et alに記載されている分子生物学の技術を使って構築する。
【0272】
本発明のポリペプチド複合体の軽鎖をコードする第二発現ベクターも構築する。これは、Fosのロイシンジッパーモチーフからなる相補的会合ドメインを含む。
【0273】
次にこれら発現ベクターは、通常の技術によって適切な宿主細胞に移され、そのベクターを最適に発現する同時にトランスフェクトされた宿主細胞が産生される。次にこれらのトランスフェクトされたか又は形質転換された宿主細胞は、当業者に知られている任意の適切な技術を使って培養されて、本発明のポリペプチド複合体を産生する。
【0274】
ポリペプチド複合体は、産生されたならば、クロスフロー濾過法、硫酸アンモニウム沈殿法及びアフィニティカラムクロマトグラフィ(例えば、プロテインA)を含む当分野の標準方法で精製する。
【0275】
次に当業者に知られている技術を使って、3,3’−ジインドリルメタン(DIM)からなる可溶性エフェクタードメインを、相補的会合ドメインに融合させる。
【実施例5】
【0276】
<VCAMとVLA−4>
PSCA(前立腺幹細胞抗原)に結合する結合ドメイン及びVCAMと抗体ヒンジからなる会合ドメイン、CH2ドメイン及びCH3ドメインを含む重鎖;並びにリシンA毒素に融合したVLA−4からなる相補的会合ドメインを含む軽鎖を含むポリペプチド複合体をコードする発現ベクターを、Sambrook et alに記載されている分子生物学の技術を使って構築する。
【0277】
次にその発現ベクターは、通常の技術によって適切な宿主細胞に移され、そのベクターを最適に発現するトランスフェクトされた宿主細胞が産生される。次にそのトランスフェクトされたか又は形質転換された宿主細胞は、当業者に知られている任意の適切な技術を使って培養されて、本発明のポリペプチド複合体を産生する。
【0278】
ポリペプチド複合体は、産生されたならば、クロスフロー濾過法、硫酸アンモニウム沈殿法及びアフィニティカラムクロマトグラフィ(例えば、プロテインA)を含む当分野の標準方法で精製する。
【実施例6】
【0279】
PSCA(前立腺幹細胞抗原)に結合する結合ドメイン及びJunのロイシンジッパーモチーフと抗体ヒンジからなる会合ドメイン、CH2ドメイン及びCH3ドメインを含む重鎖;並びにFosのロイシンジッパーモチーフ及びプリンヌクレオシドホスホリラーゼ(PNP)をコードする可溶性エフェクタードメインからなる相補的会合ドメインを含む軽鎖を含むポリペプチド複合体をコードする発現ベクターを、Sambrook et alに記載されている分子生物学の技術を使って構築する。
【0280】
次にその発現ベクターは、通常の技術によって適切な宿主細胞に移され、そのベクターを最適に発現するトランスフェクトされた宿主細胞が産生される。次にそのトランスフェクトされたか又は形質転換された宿主細胞は、当業者に知られている任意の適切な技術を使って培養されて、本発明のポリペプチド複合体を産生する。
【0281】
ポリペプチド複合体は、産生されたならば、クロスフロー濾過法、硫酸アンモニウム沈殿法及びアフィニティカラムクロマトグラフィ(例えば、プロテインA)を含む当分野の標準方法で精製する。
【0282】
PNPは、フルダラビンを、PNP酵素を含む細胞を殺し次いでさらに拡散して周囲の未感染細胞を殺す毒性代謝産物の2−フルオロアデニンに変換する(局部バイスタンダー効果)。
【実施例7】
【0283】
糖タンパク質抗原gp120のV3−PND領域に結合する可溶性VHH結合ドメイン並びにJunのロイシンジッパーモチーフ及び抗体ヒンジからなる会合ドメイン、CH2ドメイン及びCH3ドメインを含む本発明のポリペプチド複合体の第一の重鎖をコードする発現ベクターを、Sambrook et alに記載されている分子生物学の技術を使って構築する。
【0284】
GP−41に結合する可溶性VHH結合ドメイン並びにJunのロイシンジッパーモチーフ及び抗体ヒンジ、CH2とCH3のドメインからなる会合ドメインを含む本発明のポリペプチド複合体の第二の重鎖をコードする第二発現ベクターも構築する。
【0285】
本発明のポリペプチド複合体の軽鎖をコードする第三発現ベクターも構築する。このベクターはFosのロイシンジッパーモチーフからなる相補的会合ドメインを含む。
【0286】
次にこれら発現ベクターは、通常の技術によって適切な宿主細胞に移され、そのベクターを最適に発現する同時にトランスフェクトされた宿主細胞が産生される。次にそのトランスフェクトされたか又は形質転換された宿主細胞は、当業者に知られている任意の適切な技術を使って培養されて、本発明のポリペプチド複合体を産生する。
【0287】
ポリペプチド複合体は、産生されたならば、クロスフロー濾過法、硫酸アンモニウム沈殿法及びアフィニティカラムクロマトグラフィ(例えば、プロテインA)を含む当分野の標準方法で精製する。
【0288】
次いでHIV−1 MN V3(PND)ペプチド免疫原からなる可溶性エフェクタードメインを、当業者に知られている技術を使って、前記相補的会合ドメインに融合させる。
【実施例8】
【0289】
糖タンパク質抗原のV3−PND領域に結合する可溶性VHH結合ドメインを含む本発明のポリペプチド複合体の第一の重鎖をコードする発現ベクターを、Sambrook et al.,(1989)Molecular Cloning−A Laboratory Manual,Cold Spring Harbor Laboratory Pressに記載されている分子生物学の技術を使って構築する。
【0290】
GP−41に結合する可溶性VHH結合ドメインを含む本発明のポリペプチド複合体の第二の重鎖をコードする第二発現ベクターも構築する。
【0291】
これら二つの重鎖は、これら二つの重鎖の定常領域が同一のμ、CH2、CH3及びCH4のドメインを含むことが特徴である。
【0292】
次にこれらの発現ベクターは、通常の方法でJ鎖を恒常的に発現する宿主細胞に移され、そのベクターを最適に発現する同時にトランスフェクトされた宿主細胞を産生する。次にそのトランスフェクトされたか又は形質転換された宿主細胞は、当業者に知られている任意の適切な技術を使って培養されて、本発明のポリペプチド複合体を産生する。
【0293】
ポリペプチド複合体は、産生されたならば、クロスフロー濾過法、硫酸アンモニウム沈殿法及びアフィニティカラムクロマトグラフィ(例えば、プロテインA)を含む当分野の標準方法で精製する。
【0294】
次いでHIV−1 MN V3(PND)ペプチド免疫原からなる可溶性エフェクタードメインを、当業者に知られている技術を使って、前記相補的会合ドメインに融合させる。
【0295】
本明細書に挙げた刊行物は全て参照により本明細書に組み込まれるものである。
【0296】
本発明の前記方法とシステムの各種変形と変化が本発明の範囲と精神から逸脱しないことは、当業者には明らかであろう。本発明は、特定の好ましい実施形態に関連させて説明してきたが、特許請求の範囲に記載されている本発明は、このような特定の実施形態に不当に限定されるべきでないと解すべきである。実際に、生化学、分子生物学及びバイオテクノロジー又は関連分野の当業者には明らかな、本発明を実施するため述べた方式の各種変形は、特許請求の範囲に含まれるものである。
【技術分野】
【0001】
本発明は、親和性成熟による機能性重鎖のみ抗体(functional heavy chain−only antibody)の多様なレパートリーの製造及びその使用に関する。また本発明はクラス特異的重鎖のみ抗体の多様なレパートリーの製造と使用、並びに抗体重鎖の機能、好ましくは抗体重鎖の結合機能、定常領域のエフェクター活性及び任意選択的に追加のエフェクター機能を有する多価ポリペプチド複合体の製造と使用に関する。
【0002】
本発明はまた、抗原の投与に応答して十分に機能性の重鎖のみ抗体をトランスジェニックマウス中で生成させる方法に関する。特に本発明は、任意のクラス又は混合したクラスのヒトの抗原に特異的で高親和性の重鎖のみ抗体を生成させ、十分に機能性のVH抗原結合ドメインを単離し発現させる方法に関する。
【0003】
本発明はまた、重鎖の機能、好ましくは重鎖のエフェクター活性及び他の結合機能とエフェクター機能を含む多価ポリペプチド複合体の生成に関する。
【0004】
本発明の方法を使用することによって生成した重鎖のみ抗体と他の多価結合複合体及びそれらの使用についても述べる。
【背景技術】
【0005】
モノクローナル抗体又はその異型は、21世紀に送り出される新薬の高い比率を占めるであろう。モノクローナル抗体療法は、リウマチ様関節炎やクローン病を治療するのに好ましい方法としてすでに容認されており、癌の治療に目覚しく進出している。また心臓血管疾患や感染症を治療するための抗体ベースの製品も開発中である。市販されている大部分のモノクローナル抗体の製品は、標的のリガンド(例えばTNFα)の単一の明確なエピトープを認識してこれと結合する。治療用のヒトモノクローナル抗体は、依然として、哺乳類の細胞を培養する方法で製造されている。二つの重鎖と二つの軽鎖からなる複合体(H2L2複合体)の会合と、それに続く翻訳後グリコシル化を行なう工程が、細菌系を使用することを妨げている。哺乳類細胞の培養によって抗体を製造するための製造コストと資本コストは高額なので、容認できる代替手段がないと抗体ベースの治療の可能性を制限してしまう恐れがある。各種のトランスジェニック生物は、十分な機能を有する抗体を発現できる。これらの生物としては植物、昆虫、鶏、ヤギ及びウシがあるが、市販の治療用製品を製造するのに今まで使われていない。
【0006】
機能性抗体のフラグメントは、大腸菌(E.coli)中で製造できるが、一般に、その製品は、ペグ化(pegylate)されないと、製造工程中、血清安定性が低い。
【0007】
二重特異性抗体の複合体は、同じ又は異なる抗原の二つの異なるエピトープに結合できる遺伝子工学的に処理されたIgベースの分子である。抗体を単独で又は他の結合因子と組み合わせて取り入れている二重特異性結合タンパク質は、獲得されたヒトの免疫機能が、治療効果、例えば病原体の排除(Van Spriel et al.,(1999)J.Infect.Diseases,179,661−669;Tacken et al.,(2004)J.Immunol.,172,4934−4940;米国特許第5,487,890号)、癌の治療(Glennie and van der Winkel ,(2003)Drug Discovery Today,8,503−5100)、及び免疫療法(Van Spriel et al.,(2000)Immunol.Today,21,391−397;Segal et al.,(2001)J.Immunol.Methods,248,1−6;Lyden et al.,(2001)Nat.Med.,7,1194−1201)を引き出す治療法の将来性を示している。
【0008】
二重特異性抗体の製品が二つ以上のH2L2複合体に基づいていると、製造上の問題が悪化する。例えば、重鎖と軽鎖の遺伝子の二つ以上の組合せが共発現すると、10種類もの組合わせが生じてそのうち一種類だけが所望のヘテロ二量体であることがある(Suresh et al.,(1986)Methods Enzymol.,121,210−228)。
【0009】
この問題を解決するため、重鎖エフェクターの機能を保持している二重特異性IgG全長(BsIgG)を哺乳類の細胞中で産生させる多くの方法が開発されている。BsIgGは、ヘテロ二量体が生成するのを避けるため遺伝子工学的に処理された「knob and hole」重鎖を必要とし、かつL鎖の誤対合を回避するため同じL鎖を利用する(Carter,(2001)J.Immunol.Methods,248,7−15)。化学的に架橋する代替法としては、各々異なる抗原を認識する抗体フラグメントから複合体を製造する方法(Ferguson et al.,(1995)Arthritis and Rheumatism,38,190−200)又は他の結合タンパク質、例えばコレクチン類を抗体フラグメントに架橋させる方法(Tacken et al.,(2004)J.Immunol.,172,4934−4940)が記述されている。
【0010】
一般に重鎖のエフェクター機能を欠いているダイアボディ(diabody)又はミニ抗体(BsAb)の開発によってもヘテロ二量体の重複が克服されている。これらの抗体は、VH結合部位とVL結合部位を持つ最小一本鎖抗体(scFv)を含み、その結合部位はその後折り畳まれてニ量体になり、その抗体の標的抗原各々に対して一価である二価の二重特異性抗体を生成する(Holliger et al.,(1993)PNAS,90,6444−6448;Muller et al.,(1998)FEBS Lett.,422,259−264)。場合によっては、CH1ドメインとL定常ドメインが、二重特異性ミニ抗体を生成するためのヘテロ二量体化ドメインとして使用されている(Muller et al.,(1998)FEBS Lett.,259−264)。BsAbを製造するため、大腸菌発現系に基づいた各種組換え法が開発されているが(Hudson,(1999)Curr.Opin.Immunol.,11,548−557)、臨床グレードの多価抗体物質の製造コストと製造規模が依然として臨床的開発に対して主な障害になっている(Segal et al.,(2001)J.Immunol.Methods,248,1−6)。
【0011】
最近、BsAbの概念が拡大されて、H鎖とL鎖のVHドメインとVLドメインが遺伝子工学的に処理されたscFv結合ドメインで置換されたジ−ダイアボディ(Di−diabody)すなわち四価の二重特異性抗体が含まれる。このような構造体は、遺伝子工学的に処理することは複雑であるが、ヘテロ二量体の重複無しで、培養中の哺乳類細胞中で会合できる(Lu et al.,(2003)J.Immunol.Methods,279,219−232)。
【0012】
免疫グロブリンの構造は当分野では周知である。大部分の天然免疫グロブリンは二つの重鎖と二つの軽鎖を含む。これらの重鎖は、各重鎖に沿ってそのほぼ中央に位置するヒンジドメインの間のジスルフィド結合によって互いに連結されている。軽鎖は、上記ヒンジドメインのN末端側の各重鎖と会合している。各軽鎖は通常、上記ヒンジドメインの近くのジスルフィド結合によって、それぞれの重鎖に結合している。
【0013】
Ig分子が正しく折りたたまれると、各鎖は、より線状のポリペプチド配列によって連結された多数の別個の球状ドメインになる。例えば、軽鎖は折りたたまれて可変ドメイン(VL)と定常ドメイン(CL)になる。重鎖は、軽鎖の可変ドメインに隣接する単一の可変ドメインVH、第一定常ドメイン、ヒンジドメイン及び二つ又は三つのさらなる定常ドメインを有する。重鎖の可変ドメイン(VH)と軽鎖の可変ドメイン(VL)は相互に作用して抗原結合領域(Fv)を生成する。一般に、VHとVLの両者は、抗原と結合するために必要であるが、重鎖の二量体とアミノ末端フラグメントは、軽鎖無しで活性を保持していることが分かっている(Jaton et al.,(1968)Biochemistry,7,4185−4195)。
【0014】
新しい分子生物学の技術の出現によって、重鎖のみ抗体(軽鎖が欠落している)が、ヒト及びネズミモデル系のB細胞増殖性障害(重鎖病)に存在することが確認された。重鎖病を分子レベルで分析した結果、ゲノムのレベルでの突然変異と欠失が重鎖CH1ドメインの不適切な発現を起こして、軽鎖と結合する性能が欠けている重鎖のみ抗体の発現を生じることが分かった(Hendershot et al.,(1987)J.Cell Biol.,104,761−767;Brandt et al.,(1984)Mol/Cell.Biol.,4,1270−1277参照)。
【0015】
ファージのライブラリーから誘導して単離されたヒトVHドメインに関する別の研究は、VHドメインの抗原特異的結合を証明したが、これらのVHドメインは溶解性が低いことが証明された。さらに、ファージのアレイにディスプレイされた特異的結合特性を有するヒトVHドメインを選択すると、遺伝子工学的に処理された抗体の基本構造を形成できることが示唆された(Ward et al.,(1989)Nature,341,544−546)。
【0016】
他の脊椎動物の種を使用した研究は、ラクダ類が、自然遺伝子突然変異の結果、CH1軽鎖結合領域が無いため軽鎖に結合できない機能性IgG2及びIgG3の重鎖のみ二量体を生成すること(Hamers−Casterman et al.,(1993)Nature,363,446−448)及びサメなどの種が、恐らく哺乳類のT細胞受容体又は免疫グロブリンの軽鎖に類縁の重鎖のみ様結合タンパク質ファミリーを生成すること(Stanfield et al.,(2004)Science,305,1770−1773)を示した。ラクダの重鎖のみ抗体の特性を決定する特徴は、ラクダVHドメインがヒトVHドメインと比べて溶解度が改善されていることである。ヒトVHは、遺伝子工学的に処理して溶解度の特性を改善できるであろうし(Davies and Riechmann(1996)Protein Eng.,9(6),531−537;Lutz and Muyldermans,(1999)J.Immunol.Methods,231,25−38参照)又は溶解度はインビボで自然選択で獲得されうる(Tanha et al.,(2001)J.Biol.Chem.,276,24774−24780参照)。しかし、VH結合ドメインがファージライブラリーから誘導されると、抗原に対する固有親和力は、例えばアフィニティーホットスポットランダマイゼーション(affinity hot spot randomisation)を含む親和力改善法を適用しても低マイクロモル〜高ナノモルの範囲内に留まっている(Yau et al.,(2005)J.Immunol.Methods,297,213−224)。
【0017】
また、ラクダのVH抗体は修飾されたCDR3ループが特徴である。このCDR3ループは、平均して、非ラクダ抗体に見られるものより長く、抗原の親和力と特異性の全体に対して大きく影響すると考えられる特徴であり、ラクダの重鎖のみ抗体の種にVLドメインが無いことを補償している(Desmyter et al.,(1996)Nat.Struct.Biol.,3,803−811;Riechmann and Muyldermans,(1999)J.Immunol.Methods,23,25−28)。
【0018】
ラクダの抗体に関する最近の構造研究は、抗体の多様性が、V(D)J組換え事象と体細胞変異によるインビボ成熟プロセスによりほとんど推進されることを示唆している(De Genst et al.,(2005)J.Biol.Chem.,280(14),14114−14121)。
【0019】
最近、トランスジェニック哺乳類で重鎖のみ抗体を製造する方法が開発された(WO02/085945及びWO02/085944参照)。任意の哺乳類(ヒトを含む)から誘導される任意のクラス(IgM、IgG、IgD、IgA又はIgE)の機能性重鎖のみ抗体は、抗原を投与することによってトランスジェニック哺乳類(好ましくはマウス)から製造できる。
【0020】
通常の免疫グロブリン重鎖の遺伝子座は、複数のV遺伝子のセグメント、多数のD遺伝子のセグメント及び多数のJ遺伝子のセグメントを含む。各V遺伝子セグメントは、VドメインのN末端からほとんどC末端までをコードしている。各VドメインのC末端は、一つのD遺伝子のセグメントと一つのJ遺伝子のセグメントでコードされている。VDJがB細胞中で再構成し、続いて親和性成熟して、VL結合ドメインとともに抗原を認識する部位すなわち抗原と結合する部位を形成する、VH結合ドメインを提供する。重鎖のCH1領域及び軽鎖のκ領域もしくはλ領域によって、重鎖と軽鎖が相互に作用し易くなる。
【0021】
重鎖のみ抗体を製造するため、生殖細胞系の重鎖遺伝子座は、予定される定常領域のいくらか又は全体をコードする遺伝子セグメントを含む。成熟過程で、再構成したVH結合ドメインは、CH2定常領域をコードするセグメント中にスプライスされて、CH1ドメインを欠いた重鎖をコードする再構成遺伝子を提供し、その結果免疫グロブリンの軽鎖と会合できなくなる。
【0022】
重鎖のみモノクローナル抗体は、標準のクローン化技術で脾臓のB細胞から又はファージディスプレイ法でB細胞のmRNAから回収できる(Ward et al.,(1989)Nature,341,544−546)。ラクダ又はトランスジェニック動物から誘導される重鎖のみ抗体は高い親和力を有する。通常のH2L2四量体の配列を分析した結果は、多様性が、主として、VDJの再構成及び体細胞の超変異の組合わせから生じることを示している(Xu and Davies,(2000)Immunity,13,37−45)。発現された重鎖のみmRNAの配列を分析した結果は、ラクダで産生されようと又はトランスジェニック動物で産生されようとも、上記観察結果を支持している(De Genst et al.,(2005)J.Biol.Chem.,280,14114−14121)。
【0023】
天然のラクダ及びヒトのVH領域の重要な共通の特徴は、各領域がモノマーとして結合し、VL領域との二量体化に依存せずに最適の溶解度と結合親和力が得られることである。これらの特徴は、特にブロッキング剤や組織浸透剤を製造するのに適していることはすでに知られている。
【0024】
ホモ二量体又はヘテロ二量体は、重鎖のみ抗体を酵素で切断することで又は合成法で製造することもできる(Jaton et al.,(1968)Biochemistry,7,4185−4195及び米国特許願公開第2003/0058074 A1号)。しかし、抗体のモノマー結合ドメインの利点は、やはり、多量体タンパク質を、試薬、治療剤及び診断剤として設計するときに有効に利用すべきである。
【0025】
ファージディスプレイ法で製造されるヒトVH又はラクダVHHは、体細胞の突然変異並びに通常の抗体結合部位のCDR3領域におけるDとJの領域組換えによって提供される追加の多様性(Xu and Davies,(2000)Immunity,13,37−45)によって改善される特性の利点を欠いている。ラクダのVHHはヒトのVHと比べて溶解度の利点を示しているが、ヒトにおいては抗原性なのでラクダを免疫することによって又はファージディスプレイ法によって製造しなければならない。
【0026】
VH結合ドメインを取り込むことは、特異性と結合力を失う可能性を伴ってVHドメインとVLドメインとから遺伝子工学的に製造しなければならないscFvを使用するより明らかに有利である。T細胞などの類縁遺伝子ファミリー又はサメ免疫グロブリンのファミリーから誘導されるVH結合ドメインも、二重又は多重の特異性結合分子を製造するためのscFvの代替物を提供する。他の天然産の結合タンパク質及びそのドメイン、例えば可溶性受容体のフラグメントも使用されてもよい。
【0027】
抗体のクラスはその生理学的機能が異なっている。例えば、IgGは成熟免疫応答に主要な役割を演じている。IgMは補体の結合と凝集に関与している。IgAは分泌物すなわち涙液、唾液、初乳、粘液におけるIgの主要クラスであるので、局所免疫で役割を演じている。多価結合複合体を遺伝子工学的に製造するときにクラス特異的な重鎖定常領域を含むことにより、必要な機能に応じて、インビボでエフェクター機能の治療利益を提供する。個々のエフェクター領域を遺伝子工学的に処理して、機能を付加したり又は削除できる(Van Dijk and van der Winkel,Curr.Opin.Chem.Biol.,(2001)Aug 5(4),368−374)。親和力の高いVH結合ドメインを含む重鎖のみ抗体を最適に製造し選択することは(その起源がヒト、ラクダ又はその外の起源であろうとも)、代替方法からインビボでの組換えと親和性成熟を促進しない無作為化ファージライブラリーからの選択による方法にまで利益を与えると思われる。
【0028】
したがって、IgAの定常ドメインの機能を含むと、病原体に対する粘膜の機能が改善され(Leher et al.,(1999)Exp.Eye.Res.,69,75−84)、一方IgG1の定常領域の機能が存在すると、インビボでの血清安定性が向上する。重鎖のCH2とCH3の定常ドメインが存在すると、天然の抗体類に見られるような安定な二量体化のための基盤を提供し、かつ翻訳後グリコシル化のための認識部位を提供する。CH2とCH3の存在は、二重特異性で多価の複合体が試薬及び診断剤として使用されるとき、二次抗体の認識をも可能にする。
【0029】
単離されて予め再構成されたラクダの重鎖のみ可変領域の配列は、ヒンジ領域とヒトIgG1エフェクタードメインの前に予めクローン化され、ベクター中に挿入され、COS細胞中で発現されて抗体を生成する。このインビトロの環境で発現された抗体は、ラクダ中のインビボでクラス(イソタイプ)のスイッチングと親和性成熟(超変異)のプロセスをすでに受けており、抗原に結合できる(Riechmann and Muyldermans,(1999)J.Immunol.Methods,231,25−38)。
【0030】
当分野では、重鎖のみ抗体の多様性とインビボでのB細胞応答性を最大にして、特に、多様な臨床、産業及び研究の用途で使用するために、最大の抗原結合能力を保持するクラス特異的ヒト重鎖のみ抗体及び機能性VH重鎖のみ結合ドメインの機能レパートリーを製造することが依然として要求されている。
【0031】
また、当分野では、抗体の重鎖の少なくとも一部、抗体重鎖単独、又はこれを生理学的に安定でエフェクター機能を有するエフェクター(軽)鎖と組み合わせて含む、可溶性の二価又は多価のポリペプチド結合複合体を製造することも依然として要求されている。
【発明の概要】
【0032】
本発明は、CH1ドメインをコードしていない重鎖定常領域を含み、そして発現されると、定義された単一又は複数のクラスの重鎖のみ抗体を産生できる異種のVH重鎖遺伝子座又はラクダVH(VHH)重鎖遺伝子座をトランスジェニック哺乳類内で発現させるステップを含む、トランスジェニック哺乳類内でVH重鎖のみ抗体又はラクダVH(VHH)重鎖のみ抗体を製造する方法を提供する。
【0033】
VH重鎖遺伝子座又はラクダVH(VHH)重鎖遺伝子座は、一つ以上のラクダV遺伝子セグメント又は非ラクダV遺伝子セグメントを含んでもよい。このV遺伝子セグメントは、改善された溶解度特性を示すように選択するか又は遺伝子工学的に処理されることが好ましい。そのV遺伝子セグメントはヒト由来であるのが好ましい。
【0034】
重鎖遺伝子座の重鎖定常領域は、Cα1及び/又はCα2、Cε、Cδ、Cγ及び/又はCμの重鎖定常領域遺伝子を含んでもよい。さらに、重鎖遺伝子座の重鎖定常領域は、以下の重鎖定常領域:Cα1、Cα2、Cε、Cδ、Cγ、Cμのうちの二つ以上を含んでもよい。
【0035】
好ましくは、VH重鎖遺伝子座は、少なくとも一つのヒトもしくはラクダのV遺伝子セグメント、少なくとも一つのDセグメント及び少なくとも一つのJセグメントを含む可変領域を含み、そのヒトもしくはラクダのV遺伝子セグメント、D遺伝子セグメント及びJ遺伝子セグメントは組み替えてVDJコーディング配列を形成させることができる。重鎖遺伝子座は、好ましくは20個以上のD遺伝子セグメント及び/又は5個以上のJ遺伝子セグメントを含む。好ましくは、D及びJの遺伝子セグメントは、脊椎動物、好ましくはヒトが起源のものである。CDR3ループは、任意の脊椎動物由来のD及びJの遺伝子セグメントを使って作られることができ、ヒトのD及びJ遺伝子セグメントが好ましい。
【0036】
VH重鎖遺伝子座は、J遺伝子セグメントを重鎖定常領域遺伝子と直接組換えることができる組換え配列(rss)を含んでもよい。
【0037】
異種重鎖遺伝子座の重鎖定常領域は、起源がヒト又は脊椎動物例えばラクダのものである。あるいは、その定常領域は、免疫グロブリン重鎖が起源でないものでもよい。
【0038】
好ましくは、本発明の方法によってほぼ正常のB細胞が成熟する。本発明は、本発明の方法で得られるか得ることができる重鎖のみ抗体もしくはそのフラグメント又は重鎖のみ抗体のクラスの混合物を提供する。この重鎖のみ抗体は、モノクローナル抗体又はそのフラグメント、例えばヒトもしくはラクダのVH結合ドメインなどでもよい。本発明のVH結合ドメインは、長く伸びたラクダ様CDR3ループを欠いていてもよく、あるいは長く伸びたラクダ様CDR3ループを含んでもよい。
【0039】
本発明は、本発明の異種重鎖遺伝子座を含むベクター及びこのようなベクターで形質転換された宿主細胞も提供する。
【0040】
また本発明は、本明細書に記載されている異種の重鎖遺伝子座を発現するトランスジェニック哺乳類も提供する。好ましくは、本発明のトランスジェニック哺乳類は、軽鎖を含む抗体を産生する能力が低い。
【0041】
本発明は、免疫療法用の薬剤を調製における本発明の重鎖のみ抗体又はそのフラグメントの使用も提供する。本発明の重鎖のみ抗体は、診断剤、試薬、抗体酵素又は阻害剤として使用することもできる。本発明はまた、本発明の重鎖のみ抗体もしくはそのフラグメント及び薬理学的に適正な担体を含む医薬組成物も提供する。
【0042】
本発明は、
(a)抗原を、本明細書に記載したようなトランスジェニック哺乳類に注射するステップと、
(b)目的とする抗原特異的の重鎖のみ抗体を発現する細胞又は組織を単離するステップと、
(c)ステップ(b)の細胞又は組織からハイブリドーマを産生するステップと、
(d)前記ハイブリドーマ由来の重鎖のみ抗体mRNAを、次に哺乳類、植物、昆虫、微生物、真菌又は代替の系などの異種発現系中に産生させるため、任意選択的にクローン化するステップと
を含む重鎖のみ抗体を産生させて選択する方法を提供する。
【0043】
次いで、VH結合ドメインを、ステップ(c)のクローン化mRNA由来の抗原特異的VHドメインを同定し単離することによって製造できる。
【0044】
また、本発明のVH結合ドメインは、
(a)抗原を本明細書に記載のトランスジェニック哺乳類に注射するステップと、
(b)目的とする抗原特異的重鎖のみ抗体を発現する細胞又は組織を単離するステップと、
(c)上記単離された細胞又は組織から得られたmRNAからVH遺伝子座をクローン化するステップと、
(d)ファージ又は類似のライブラリーを使ってコード化されたタンパク質をディスプレイするステップと、
(e)一種又は複数種の抗原特異的VHドメインを同定するステップと、
(f)上記一種もしくは複数種のVH結合ドメインだけを、又は融合タンパク質として細菌、酵母又は代替の発現系に発現させるステップと
によって製造することもできる。
【図面の簡単な説明】
【0045】
【図1】結合ドメイン(VH)、二量体化ドメイン(任意選択的にCH2、CH3及びCH4)並びにエフェクター部分(EM)を含むポリペプチド複合体を示す。結合ドメインとエフェクター部分は、二量体化ドメインのアミノ末端又はカルボキシ末端に配置できる。可撓性リンカー(<−)及びヒンジ
【数1】

領域を示す。
【図2】結合ドメインの異なる配置構成及び別の結合ドメインによるエフェクター部分の置換を示す。A.ホモ二量体が産生されるので好ましい選択肢である。産物を分離することは不要である。B.ホモ二量体とヘテロ二量体の混合物が産生される。産物を分離することが必要である。
【図3】エフェクター鎖と会合する重鎖ポリペプチド複合体を示す。そのエフェククター鎖は、相補的結合ドメイン(CBD)とエフェクター部分(EM)を含む。CBDは重鎖のEMによって認識される。CBDは、エフェクター例えば酵素、毒素、キレート化剤、造影剤に又はこのエフェクターの一部に融合される。エフェクター鎖は、重鎖とは別個に合成できる。
【図4】J鎖で連結している二価の分泌IgAを示す。
【図5】J鎖で会合されている多価重鎖のみIgM様ポリペプチド複合体を示す。
【図6】IgG遺伝子座を発現するトランスジェニックマウスを生成させ、次いで抗原を投与して、重鎖のみ抗体とVHドメインの機能を発生させる方法を示す。
【図7】IgM遺伝子座を発現するトランスジェニックマウスを生成させ、次いで抗原を投与して、重鎖のみ抗体とVHドメインの機能を発生させる方法を示す。
【図8】IgA遺伝子座を発現するトランスジェニックマウスを生成させ、次いで抗原を投与して、重鎖のみ抗体とVHドメインの機能を発生させる方法を示す。
【図9】ヒトCγ2プライマーとVHH1及びVHH2のプライマーを組み合わせて使って、CH1を除くためにラクダのスプライス変異を有する定常領域を含む遺伝子座を持つマウスの骨髄cDNAから得たPCR産物の配列アラインメント。結果は、CH1が除かれていないことを示している。
【図10−13】VH/ラクダVH(VHH)構築物の構造。1−nはVH遺伝子又はDもしくはJのセグメントの数を表す。ヒト遺伝子座の通常の相補鎖は、51個のV遺伝子、25個の機能性Dセグメント(プラス2個の非機能性Dセグメント)及び6個のJセグメントである。Cμ(IgM用)又はCε(IgE用)の領域の場合、H領域は無く、CH3とM1の間に追加のCH4エキソンがある。その単一又は複数のVH遺伝子は変異していて、公有ドメインに、記載されているような可溶性を提供する。VH遺伝子、DとJのセグメント及びCエキソンはヒトのものが好ましいが、ラクダを含む他の任意の種由来のものでもよい。後者の場合、ラクダのVH(VHH)遺伝子は、天然で可溶性なので変異されない。
【図14】マウスの免疫のスケジュール及び大腸菌HSP70に対する重鎖のみIgG生成の抗体検定を示す。
【図15】トランスジェニックマウス由来の脾臓細胞に関するフローサイトメトリー分析と免疫組織化学試験の結果を示す。
【図16】DKTPで免疫されたトランスジェニックマウスのELISA分析の結果及び生成した抗体ライブラリーの配列分析の結果を示す。
【図17】免疫されたトランスジェニックマウスにみられる体細胞の変異とVDJの再構成の例を示す。
【図18】A5抗体を含有する応答プラスミドでトランスフェクトされたTet−on細胞系の免疫染色検定を行った結果を示す。
【図19】トランスジェニックマウス系の血清のウエスタンブロット分析の結果を示す。
【図20】IgMプラスIgG遺伝子座マウスが産生したヒト一本鎖IgMと混合したヒトIgMのサイズ分画を行なった結果を示す。
【図21】ヒトTNFαに対する一本鎖IgMとIgGの抗体のELISA分析の結果を示す。
【図22】HSP70と抗GAGに対する結合アフィニティを有するホモ二量体プラスミドを生成させる方法を示す。
【図23】ホモ二量体ポリペプチド複合体のCHO細胞内での機能的発現を示す。
【図24】ホモ二量体ポリペプチド複合体の抗GAGとHSP70に対する同時の機能的結合を示す。二価で二重特異性の抗体を図式的に示す。第二可変領域(gagに対するVHH2)を、他の特異性を含有する重鎖のみ抗体(HSP70に対するVHH1)のカルボキシ末端中にクローン化する。CH3とVHH2の間のヒンジ領域は、全てのシステインがプロリンで置換されたリンカー領域(矢印)で置換されている。ELISAプレートをGagでコートし、1%ミルク/1%BSA含有PBSでブロックし、まずダイアボディ培地(1:2希釈)でインキュベートし、次にBI21細胞溶解物(HSP70を含有)(1:2希釈)でインキュベートする。結合したタンパク質を試料緩衝剤=2−メルカプトエタノールで溶離し次いで8%ゲル上に泳動させる。Gag、ダイアボディ及びHSP70に対するポリ/モノクローナル抗体で染色する。抗Gag:ウサギポリクローナル/ブタ抗ウサギ−AP(青色)。抗HSP70:モノクローナル/ヤギ抗ヒトIgG−HRP(褐色)。ダイアボディ:ヤギ抗ヒトIgG−HRP(褐色)。レーン1:Gag/ダイアボディ/BI21細胞溶解物。レーン2:Gag/培養培地(ダイアボディの陰性対照)/BI21。レーン3:ミルク−BSA/ダイアボディ/BI21。レーン4:ミルク−BSA/培養培地/BI21。レーン5:Gag/ダイアボディ/ミルク−BSA。レーン6:Gag培養培地/ミルク−BSA。
【図25】IgAエフェクター機能を有するエフェクター鎖と任意選択的に会合しているホモ二量体のポリペプチド複合体を生成させる方法を示す。
【図26】IgAエフェクター機能を有するエフェクター鎖と任意選択的に会合しているホモ二量体のポリペプチド複合体を生成させる方法を示す。
【発明を実施するための形態】
【0046】
本発明者らは、従来技術の限界を克服し、トランスジェニック動物の特にマウスに、「マイクロ遺伝子座(micro loci)」を使って、形質細胞又はB細胞が分泌するクラス特異的重鎖のみ抗体又は異なるクラスの重鎖のみ抗体の混合物を産生させることができることを示したのである。次にこれらは、確立されたハイブリドーマの技術を使ってクラス特異的重鎖のみ抗体の信頼性の高い供給源を作製させるために使用するか、又は機能性ラクダVH(VHH)結合ドメイン、もしくはVH重鎖のみ結合ドメイン、好ましくはヒトが起源の可溶性VH重鎖のみ結合ドメインの原料として使用することができる(これらの結合ドメインはエフェクター機能は無いが結合機能は保持している)。
【0047】
本発明の方法で生成させることができる重鎖のみ抗体(ラクダ抗体を含む)は高い結合親和力を示すが、これは、一般に伸長したCDR3ループ無しのV、D及びJ遺伝子セグメントの再構成と体細胞変異で生じる。本質的に正常なB細胞の成熟は、単離された形質細胞中に存在する重鎖のみ抗体のレベルが高いとき(CH1ドメインが、組換え遺伝子座中に存在する全ての抗体クラスから除かれている場合)に観察される。B細胞の成熟及び会合された二量体(例えばIgG)又は多量体(例えばIgM)の分泌は、軽鎖遺伝子の存在又は発現とは無関係である。
【0048】
トランスジェニックマウス由来のハイブリドーマから単離された抗原特異的重鎖をコードする抗原特異的mRNAのヌクレオチド配列分析を行なった結果、重鎖抗体の多様性は、主としてVDJ組換えの機能であることが証明された。さらに、本発明者らは、抗体の多様性は、VHドメインの体細胞変異の関与が一層制限された形で重鎖のみ抗体の機能性抗原結合ドメインのCDR3領域で発生することを示した。本明細書に記載の方法を使って、機能性VHドメインを細菌系にクローン化し発現させて抗原と結合する特異性及び親和力を十分に保持したVH結合ドメインを生成させることができる。さらに、クラス特異的重鎖の二量体及び多量体は、培養中のハイブリドーマ細胞系に分泌させることができる。
【0049】
本発明はまた、トランスジェニックマウスを、抗原の投与に応答して好ましいクラスの重鎖のみ抗体、例えばIgMのみではなくてIgGのみ又は例えばIgA、IgG及びIgMの混合物を産生するようにプログラムすることができることも教示する。
【0050】
本発明者らは、CH1エキソンを欠いて、ヒトのD及びJセグメントによって二つのラマ(llama)VHH遺伝子に連結された最小のヒトIgG重鎖定常領域遺伝子座を発現するトランスジェニックマウスの生成についてすでに述べた(WO02/085945及びWO02/085944参照)。これらは、抗原を投与されると、機能性で親和力の高い抗原特異的IgG重鎖のみ抗体を産生する。重鎖のみ抗体のクラス混合物(IgMとIgG)の混合物は、重鎖定常領域を直列に並べて取り込む遺伝子構造を利用したインビボでのクラススイッチによって得られることができる(全ての定常領域遺伝子がCH1ドメインを欠いていてCH4ドメインが存在している場合)。
【0051】
本明細書で述べる改善は、ヒトのDとJのセグメントによって二つのラマVHH遺伝子に連結された同じIgG定常領域遺伝子座、及びCH1エキソンを欠いていて同じヒトDとJの遺伝子セグメントによって二つのラマVHH遺伝子に連結されたヒトIgM定常領域遺伝子座を組み込んだマウスも、高分子量の(多量体の)IgM重鎖のみ抗体及びIgG(二量体)重鎖のみ抗体を産生することである。驚くべきことには、本質的に正常なB細胞の成熟と抗体の産生は、トランスジェニック遺伝子座中に存在する各重鎖定常領域からのCH1配列の完全な欠失によっている。さらに、CH4エキソンは、存在していても除く必要は全く無い。
【0052】
したがって、例えば、同じヒトのDとJの遺伝子セグメントによって二つのラマV遺伝子セグメントに連結された機能性CH1エキソンを有するヒトIgM重鎖遺伝子座、及び同じヒトのDとJの遺伝子セグメントによって二つのラマV遺伝子セグメントに連結されたCH1エキソンを欠いたIgG定常重鎖領域遺伝子座を保持するトランスジェニック動物は、非常に低いレベルの重鎖のみ抗体を産生し、B細胞の成熟の証拠を示さない。
【0053】
CH4ドメインを含む他のエフェクタードメインは組み込まれても組み込まれなくてもよく、要求されるとおりに、生成する重鎖のみ抗体にエフェクターの特徴を導入するか、又は除くことができる。
【0054】
本発明者らは、抗体を産生する発現(すなわち、B細胞の成熟)がその構造中に存在するV遺伝子セグメントを利用することから起こり得ることを発見したのである。B細胞から誘導された抗体mRNAを単離して配列を決定することにより、DとJの遺伝子セグメントの組換えがCDR3の多様性を生み出すことを示している。生成したVHドメインの配列を比較すると、体細胞の突然変異が見られ、これは親和性成熟の事象が、前記組換えられたDとJの遺伝子セグメントと、発現されて生成した抗体mRNAのVHドメインにも起こったことを示している。
【0055】
好ましい構造は、可溶性を改善するために選択又は遺伝子工学的に処理され、組換えを行いCDR3を生成させるためDとJの鎖クラスターに連結されたV遺伝子セグメントを組み込む。好ましくは、そのVDJ配列は、各々CH1エキソンを欠いた好ましい単一又は複数の定常エフェクタードメインに対して直列に並べて連結される。
【0056】
本発明は、ヒトもしくはラクダのクラス特異的な重鎖のみ抗体又はヒトのVH結合ドメイン(好ましくは可溶性VH結合ドメイン)(単独又は好ましいエフェクタードメインに連結されたもの)の誘導と産生に限定されず、DとJの遺伝子セグメントに連結された、脊椎動物が起源の任意のV遺伝子セグメントのキメラ結合体(溶解度特性を改善するため任意選択的に遺伝子工学的に処理されている)の産生も含む。そのV遺伝子セグメントは、ヒトが起源であり、ラクダ由来のV遺伝子セグメントでないものが好ましい。生成したVHドメインは、そのDとJのセグメントがラクダ由来のものである場合を除いては、伸長したラクダ様CDR3ループを含有していなくてもよい。その結果、操作的にエフェクター定常領域に作動可能に連結されたCDR3の多様性と親和性成熟を示すVHドメインが得られる。親和性成熟は、好ましい親のトランスジェニック脊椎動物における機能的分泌と任意選択的な会合を確実にし、その後必要な場合に、選択可能なエフェクター機能も提供する。
【0057】
これらの観察結果は、改善され単純化されたクラス特異的重鎖のみ抗体の遺伝子工学的処理及び体細胞変異により親和性成熟を獲得した高親和力の可溶性VHドメインの誘導に対して重要な影響をもたらす。選択された重鎖定常領域エフェクター機能(CH1を欠いている)又はその混合物を取り込みにより、抗体の追加の遺伝子工学的処理を必要とすることなく、任意のクラスの重鎖のみ抗体又は任意の重鎖のみ抗体の混合物でも産生させることができる。VHドメインは、単独で細菌などの微生物系中で発現されるか、又は培養中のハイブリドーマ又はトランスフェクトされた細胞が分泌する、エフェクタードメインを取り込んだ機能性重鎖のみ抗体として発現されることができる。ヒトが起源の抗体とVH結合ドメインには、医薬、診断剤及び試薬として健康管理の分野に広範囲の用途があり、平行して農業、環境及び産業向けの用途がある。
【0058】
したがって、本発明は、第一の態様で、異種VH重鎖遺伝子座をトランスジェニック哺乳類内で発現させるステップを含むトランスジェニック哺乳類内でVH重鎖のみ抗体を産生させる方法を提供する。好ましくは、そのVH重鎖遺伝子座は、CH1ドメインをコードしない重鎖定常領域を含み、かつ発現されるとき完全な重鎖のみ抗体の多様なレパートリーを生成できる。
【0059】
本発明の第一態様は、ラクダVH重鎖遺伝子座をトランスジェニック哺乳類内で発現させるステップを含むトランスジェニック哺乳類内でラクダVH重鎖のみ抗体の製造方法であって、そのVH重鎖遺伝子座はCH1ドメインをコードしない重鎖定常領域を含み、そして発現されると、抗原の投与に応答してVDJが再構成されかつ親和性成熟する完全な重鎖のみ抗体の多様なレパートリーを生成できる方法も提供する。
【0060】
遺伝子工学的な処理が細胞表面の会合を妨げる分泌機構とそれに続くB細胞の成熟に対して影響しないとき、重鎖エフェクター分子は、遺伝子工学的に処理して機能ドメイン(例えばカルボキシ末端CH4ドメイン)を除かれてもよい。CH1エキソンだけ異種遺伝子座から除かれているか又はその遺伝子座中に存在しない。例えばグリコシル化を改善し又は機能を付加するため、遺伝子工学的に処理して遺伝子座に特徴を付け加えられてもよい。
【0061】
好ましくは、上記の異種遺伝子座は、発現されると、機能性のIgA、IgE、IgG、IgD又はIgMの分子又はそのイソタイプを生成できる。個々の抗体のクラス又は抗体クラスの混合物又はそのイソタイプも生成できる。
【0062】
したがって、異種の重鎖遺伝子座は、本質的に正常なB細胞の成熟とともに、必要な一種又は複数種の抗体クラスに応じて、重鎖のみ抗体の好ましいクラス又は混合物を生成するように設計される。ラクダのV、D及びJ遺伝子のセグメント並びにラクダのエフェクター領域を利用すると、ラクダの独特の特徴を有するラクダ抗体、例えば伸長したCDR3ループを生成する。無作為に選択された、又は溶解度を高めるために選択もしくは遺伝子工学的に処理されたV遺伝子セグメントを含むヒトのV、D及びJ遺伝子セグメントを使用すると、機能性のヒト重鎖のみ抗体を生成する。
【0063】
本発明で得られる抗体は、本質的に単一の又は知られたクラスの好ましくはヒトが起源の抗体である点で従来技術の抗体を超える利点を有する。これらの抗体は、VDJの組換え及びインビボでの親和性成熟の組合わせから得られる高い親和力を有する。抗体とそのフラグメントは、当業者に知られている十分に確立された方法を使って単離され、特性を決定され、そして製造できる。
【0064】
<異種重鎖遺伝子座>
本発明の文脈において、用語「異種」は、本明細書に記載されているように、ヌクレオチド配列又は遺伝子座が、それを配置された哺乳類にとって内在性ではないことを意味する。
【0065】
本発明の文脈において、用語「VH重鎖遺伝子座」は、操作して一つ以上の重鎖エフェクター領域(各々CH1ドメインを欠いている)に連結された、一つ以上のV遺伝子セグメント、一つ以上のD遺伝子セグメント、及び一つ以上のJ遺伝子セグメントを含むVHドメインをコードする最小マイクロ遺伝子座に関する。好ましくは、抗体のレパートリーが変化する主な原因は、V−D及びD−Jの結合によるDとJの遺伝子セグメントの選択で生成するCDR3領域である。
【0066】
本発明の利点は、再構成されたVH遺伝子配列に得られる抗体のレパートリーと多様性は、多数のDとJの遺伝子セグメントを使用することによって最大にすることができる点である。その後の体細胞変異は、最小の遺伝子座(マイクロ遺伝子座)を使用しながら、多数のV遺伝子セグメント又はVLとLC(軽鎖)免疫グロブリン遺伝子座を必要とせずに達成される。
【0067】
好ましくは、前記VH重鎖遺伝子座は、任意の脊椎動物種から誘導される2〜5個(2、3、4又は5個)のV遺伝子セグメントを含む。
【0068】
好ましくは、前記V遺伝子セグメントは、ヒトが起源であり、溶解度を改善するため任意選択的に選択されるか又は遺伝子工学的に処理される。
【0069】
VH重鎖遺伝子座は、好ましくは、2〜40個(2、3、4、5、6、7、8、9、10、12、14、16、18、20、30又は40個)以上のD遺伝子セグメントを含む。これらのD遺伝子セグメントは、任意の脊椎動物種から誘導できるが、最も好ましくは、そのD遺伝子セグメントはヒトのD遺伝子セグメント(通常、25個の機能性D遺伝子セグメント)である。
【0070】
VH重鎖遺伝子座は、好ましくは、2〜20個(2、3、4、5、6、7、8、9、10、12、14、16、18又は20個)以上のJ遺伝子セグメントを含む。これらのJ遺伝子セグメントは、任意の脊椎動物種から誘導できるが、最も好ましくは、そのJ遺伝子セグメントはヒトのJ遺伝子セグメント(通常、6個のJ遺伝子セグメント)である。
【0071】
VH重鎖遺伝子座は、好ましくは、2個以上のV遺伝子セグメント、25個の機能性ヒトD遺伝子セグメント及び6個のヒトJ遺伝子セグメントを含む。
【0072】
用語「V遺伝子セグメント」には、ラクダ及びヒトを含む脊椎動物から誘導される天然のV遺伝子セグメントが含まれており、これらセグメントは、溶解度などの特性を改善するため任意選択的に選択され、変異させ又は遺伝子工学的に処理されている。V遺伝子セグメントは、サメなどの他の種にも発見されており(Kokubu et al.,(1988)EMBO.J.,7,3413−3422参照)、又は、例えば免疫グロブリン軽鎖VLのレパートリーもしくはT細胞受容体VHのレパートリーになる場合、典型的な結合タンパク質の多様なVH様ファミリーを提供するようになる。
【0073】
VHドメインの溶解度を改善する好ましい方法は、単なる無作為ではなく合理的な手段を取り入れており、Davies and Reichmann,(1996)Protein Eng.,9(6),531−537及びRiechmann and Muyldermans,(1999)J.Immunol.Methods,231,25−38に例示されている。自然選択が、親和性成熟及びVDJの再構成に続いてVH遺伝子の好ましい変異を取り込むことによってインビボで起こることもある。
【0074】
V遺伝子セグメントは、本発明に従って、核酸が発現されたときVH重鎖のみ抗体を生成するために、D遺伝子セグメント、J遺伝子セグメント及び重鎖定常(エフェクター)領域(いくつかのエキソンを含んでもよいがCH1エキソンは除外されている)とで組換え可能でなければならない。
【0075】
本発明のV遺伝子セグメントは、その範囲内に、本発明にしたがって、D遺伝子セグメント、J遺伝子セグメント及び重鎖定常領域(一つ以上のエキソンを含むがCH1エキソンは含んでいない)で組換えて、本明細書で定義する重鎖のみ抗体を生成できるホモログ、誘導体又はタンパク質フラグメントをコードする任意の遺伝子配列も含む。
【0076】
したがって、VHコーディング配列は、天然の原料由来でも、又は当業者によく知られている方法を使って合成されてもよい。
【0077】
本発明の文脈において、用語「VHドメイン」は、先に定義したようにD遺伝子セグメント及びJ遺伝子セグメントで組換えられたときのV遺伝子セグメントの発現産物を意味する。好ましくは、本明細書で使用されるこのVHドメインは、溶解状態のままであり、そして溶解度を保持するために他の要因を必要とせずに生理的溶媒中で活性である。好ましくは、可溶性VHドメインの抗原への結合能は、VDJの組換え及び体細胞変異によって改善されている。ラクダ種に独特の伸長したCDR3ループの有無に対する依存性は全くない。このVHドメインは、モノマーとして抗原に結合でき、エフェクターの定常領域と結合すると、使用されるエフェクター分子(例えばIgG、IgA、IgMなど)の選択及び遺伝子工学的処理又は二量体化及び多量体化の別の機構によって、モノ特異性、二重特異性、多重特異性、二価又は多価の形態で産生されてもよい。可溶性の重鎖のみ抗体複合体の一部として発現されるときに、VLドメインと結合する可能性は、CH1エキソンを除くことによって排除される(Sitia et al.,(1990)Cell,60,781−790参照)。VHドメインを、多様なタンパク質ドメインとともに遺伝子工学的に処理して、標的治療や診断に使用する例えば毒素、酵素及び造影剤を有する融合タンパク質も産生させることもできる。
【0078】
本発明の文脈において、用語「D遺伝子セグメント」と「J遺伝子セグメント」には、D遺伝子セグメントとJ遺伝子セグメントの天然の配列が含まれる。好ましくは、D遺伝子セグメントとJ遺伝子セグメントは、V遺伝子セグメントの由来と同じ脊椎動物に由来する。例えば、V遺伝子セグメントがヒト由来で次いで可溶化又は遺伝子工学的に処理される場合は、D遺伝子セグメントとJ遺伝子セグメントもヒト由来である方が好ましい。あるいは、V遺伝子セグメントが例えばラクダ由来であり、D遺伝子セグメントとJ遺伝子セグメントがヒト由来でもよく、又はその逆でもよい。
【0079】
用語「D遺伝子セグメントとJ遺伝子セグメント」は、生成するセグメントが、本明細書に記載されているような重鎖抗体遺伝子座の保持する成分で組換えて本明細書に記載されているような重鎖のみ抗体を生成する限り、その範囲内に、その誘導体、ホモログ及びフラグメントを含む。D遺伝子セグメントとJ遺伝子セグメントは、天然の原料から誘導してもよく、又は当業者にはよく知られていて本明細書に記載されている方法を使って合成してもよい。V、D及びJの遺伝子セグメントは、組換えることができそして体細胞変異をする方が好ましい。
【0080】
V、D及びJの遺伝子セグメントは、単一の脊椎動物種から誘導することが好ましい。これはどの脊椎動物種でもよいがヒトが好ましい。
【0081】
さらに、本発明の異種重鎖遺伝子座は、インビボでエフェクター機能を提供する重鎖定常領域(例えばIgG、IgM、IgA、IgE、IgD又はそのイソタイプ)をコードするDNAの領域を含む。
【0082】
本発明は、本発明の方法で得られるか又は得ることができる抗原特異的の重鎖のみ抗体も提供する。
【0083】
<重鎖定常領域>
操作的に、重鎖定常領域は、天然又はB細胞内でV遺伝子セグメント、D遺伝子セグメント及びJ遺伝子セグメントで組換えできる遺伝子工学的に処理された遺伝子セグメントによってコードされている。好ましくは、その重鎖定常領域は、免疫グロブリンの遺伝子座由来である。
【0084】
本発明のこの態様によって、重鎖定常領域は各々、重鎖のみ抗体を生成できるように機能性CH1ドメイン無しで発現される少なくとも一つの重鎖定常領域を本質的に含む。各重鎖定常領域は、Cδ、Cγ1−4、Cμ、Cε及びCα1−2からなる群から選択される追加の重鎖定常領域のエキソンの一つ以上を、これら追加の重鎖定常領域の遺伝子が機能性CH1ドメインを発現しないという条件で含んでもよい。その重鎖定常領域の遺伝子セグメントは、必要な抗体クラスの好ましいクラス又は混合物によって選択される。任意選択的に、その異種重鎖遺伝子座はCμとCδを欠いている。
【0085】
例えば、クラスMのIg分子は、マクロファージの活性化及び補体の経路で重要な役割を演じていることが分かっている。IgMは、その結合部位が近接しているため、ウイルスを含む病原体に対して高い親和力を有する。しかし、IgMは、高速免疫検定法に使用することは難しいことが知られているが、一方クラスGのIgはこれらの検定法に容易に使用できる。このような用途に対しては、好ましい抗体のクラスとして、すなわちIgG又はIgMを選択することが有用である。
【0086】
CH1を欠いている異種重鎖Cγ遺伝子座の全て又は一部を発現すると、その異種IgG遺伝子座中に存在するIgG1、IgG2、IgG3及びIgG4のイソタイプによって、いくつかの又は全てのIgGイソタイプが任意選択的に産生される。あるいは、重鎖はCε遺伝子を含んでもよい。生成するIgE分子も治療に使用できる。
【0087】
あるいは、抗体の選択された混合物を得ることができる。例えば、IgAとIgMは、重鎖定常領域がCα遺伝子とCμ遺伝子を含むときに得ることができる。
【0088】
本発明の重鎖定常領域は、特に重鎖抗体を、ヒトを治療する用途に使用したいとき、ヒトが起源である方が好ましい。重鎖抗体を、診断又は獣医学的用途に使用したい場合、重鎖定常領域は、診断又は獣医学的治療をしたい標的の生物、脊椎動物又は哺乳類由来である方が好ましい。
【0089】
重鎖定常領域は、発現されたとき、機能性CH1ドメインを欠いている。そのCH1エキソン及び任意選択的にCμとCδの定常領域は、変異、欠失又は置換を行なってもよい。CH1エキソンは欠失している方が好ましい。例えば機能性CH1ドメインを含むIgMが存在するとB細胞の成熟を阻害し、B細胞の成熟が阻害された結果として、同じ遺伝子座中に重鎖のみIgG(CH1を欠いている)を産生発現することが制限される。
【0090】
本明細書で定義する「重鎖定常領域エキソン」(「CHエキソン」)は、天然の脊椎動物であるが特に哺乳類のCHエキソンの配列を含む。これはクラス特異的方式で変化する。例えば、IgGとIgAは、天然に、CH4ドメインを欠いている。用語「CHエキソン」は、そのCHエキソンが、重鎖定常領域の一成分であるとき、本明細書で定義したような機能性重鎖のみ抗体を生成できる限り、その範囲内に、その誘導体、ホモログ及びフラグメントも含む。
【0091】
CH4又は他の機能性ドメインは、存在しているとき、細胞内の分泌プロセス、B細胞の成熟又は生成した抗体ポリペプチドの結合活性を阻害しないならば、任意選択的に導入遺伝子中で遺伝子工学的に処理されたり又は欠失されてもよい。
【0092】
<哺乳類>
本発明の方法に使うトランスジェニック哺乳類はヒトではない。トランスジェニック哺乳類としては、ウサギ、モルモット、ラット又はマウスなどのげっ歯類が好ましい。マウスが特に好ましい。ヤギ、ヒツジ、ネコ、イヌ又は他の動物などの代替動物も利用できる。
【0093】
トランスジェニック動物は、確立された卵母細胞注射法及び確立されたときにはES細胞技術又はES細胞クローニング法を利用して生成させる方が好ましい。
【0094】
有利には、重鎖のみ抗体を本発明の方法によって発現させるとき、その哺乳類に内在している免疫グロブリンの重鎖遺伝子座及び任意選択的に軽鎖遺伝子座は、欠失させるか又は抑止する。
【0095】
抗体の起源とは異なる起原の脊椎動物種に抗体を投与すると、その投与された抗体に対する免疫応答が始まることが多いので、上記のような重鎖のみ抗体を生成させるこの方法は、ヒトの治療に使う抗体を生成させるのに特に有用であろう。
【0096】
したがって、別の態様で、本発明は、本発明の異種重鎖遺伝子座を発現するトランスジェニック哺乳類を提供する。
【0097】
そのトランスジェニック哺乳類は、軽鎖を含む抗体を産生する能力を低減するように遺伝子工学的に処理されてもよい。
【0098】
抗体産生細胞は、本発明のトランスジェニック動物に由来してもよく、例えば、本明細書に記載したような重鎖のみ抗体を産生するためのハイブリドーマを調製するのに使用できる。加えて、又は別の方法として、核酸配列は、本発明のトランスジェニック哺乳類から単離されてもよく、VHドメイン重鎖のみ鎖抗体又はその二重特異性/二機能複合体を、当業者に公知の組換えDNA法を使って製造するのに使用されてもよい。
【0099】
加えて、又は別の方法として、抗原特異的重鎖のみ抗体は、本発明のトランスジェニック動物を免疫することによって生成されてもよい。
【0100】
したがって、別の態様で、本発明は、本発明のトランスジェニック哺乳類を抗原で免疫することによって重鎖のみ抗体を製造する方法を提供する。
【0101】
本発明のこの態様の好ましい実施形態では、その哺乳類はマウスである。
【0102】
<重鎖のみ抗体及びそのフラグメント>
もう一つの態様で、本発明は、本発明の方法で得ることができる重鎖のみ抗体及びその機能性フラグメントと誘導体を提供する。VH結合ドメインを含むフラグメントは、本発明の重鎖のみ抗体すなわち軽鎖を欠いている抗体を、酵素又は臭化シアンで開裂することによって誘導できる(Jaton et al.,(1968)Biochemistry,7,4185−4195)。
【0103】
好ましい機能性フラグメントは、抗原特異的の重鎖のみ結合ドメイン、すなわち、単独のV、D及びJの遺伝子セグメント間の組換えと続く体細胞変異で生成するVH遺伝子座によって発現されるVH結合ドメインである。本発明のこの態様によって、VH遺伝子座は、例えば、上記免疫されたトランスジェニック動物の抗体産生細胞から単離したmRNAからクローン化できる。次に、クローン化された配列は、ファージ(Ward et al.,(1989)Nature,341,544−546)又は類似のディスプレイライブラリー、例えば酵母ベースの系(Boder and Wittrup,(1997)Nat.Biotechnol.,15,553−7)を使って提示され、抗原特異的VH結合ドメインが同定される。次に、抗原特異的重鎖結合ドメインは、大規模に量産可能な細菌、酵母又はそれに代わる発現系で、単独又は融合タンパク質として製造できる。またVH結合ドメインをコードする配列は、免疫されたトランスジェニックマウスから古典的な方法で誘導される、特性を決定されたハイブリドーマからクローン化することもできる。これらの配列は、異なるエフェクター機能を有する指定の抗体クラス(例えばIgE又はIgA)とその変異体を遺伝子工学的に処理することを含めて、VH結合ドメインとその誘導体の製造に使用されることができる。
【0104】
したがって、本発明はまた、
(a)目的とする抗原特異的重鎖のみ抗体(好ましくは、対象の可溶性の抗原特異的重鎖のみ抗体)を発現する細胞又は組織を単離するステップと、
(b)前記単離した細胞又は組織から誘導したmRNAからVH結合ドメインをコードする配列をクローン化するステップと、
(c)そのコードされたタンパク質を、ファージ又は類似のライブラリーを使ってディスプレイするステップと、
(d)抗原特異的VH結合ドメインを同定するステップと、
(e)そのVH結合ドメインを、単独で又は融合タンパク質として、細菌、酵母、哺乳類又は代替の発現系で発現させるステップと
を含むVH結合ドメインの製造方法を提供する。
【0105】
あるいは、VHドメイン含有フラグメントは、本発明の重鎖のみ抗体から、酵素による開裂法又は化学的開裂法を利用し、次いでその開裂産物からVHドメイン含有フラグメントを分離することによって製造できる。
【0106】
VH結合ドメインを、特性を決定されたハイブリドーマから単離する場合は、mRNA由来のクローン化VH結合ドメイン配列を、ファージなどのディスプレイ系を利用する追加の選択ステップに頼ることなく、発現ベクター中に直接クローン化できる。
【0107】
エフェクター領域を取り込んでいる、重鎖のみ抗体の産生系としては、大量飼育法に適した培養中の哺乳類の細胞(例えばCHO細胞)、植物(例えばトウモロコシ)、トランスジェニックヤギ、ウサギ、ウシ、ヒツジ、鶏及び昆虫の幼虫がある。ウイルス感染(例えば昆虫の幼虫や細胞系へのバキュロウイルスの感染)を含む他の産生系は、細胞培養法及び生殖細胞法の代わりの系である。その他の産生系も当業者にはよく知られている。重鎖のみIgA又はIgMの会合が必要な場合は、「J鎖」を共発現させることが有益である。ラクダの重鎖のみ抗体又はVH結合ドメインだけを産生させるのに適切な方法は当分野では周知である。例えば、ラクダのVH結合ドメインは細菌系で産生されており、ラクダの重鎖のみホモ二量体はハイブリドーマ及びトランスフェクトされた哺乳類細胞で産生されている(Reichmann and Muyldermans,(1999)J.Immunol.Methods,231,25−38参照)。
【0108】
ファージディスプレイ法を使って誘導された遺伝子工学的処理ヒトVH結合ドメインを発現させる方法も確立されている(Tanha et al.,(2001)J.Biol.Chem.,276,24774−24780及びこの文献に記載されている引用文献)。
【0109】
トランスジェニックハエ系由来の昆虫幼虫が、体腔液中に、哺乳類の細胞が産生する抗体と差異のない特性を有する機能性重鎖のみ抗体フラグメントを産生することが分かっている(PCT/GB2003/0003319)。本発明はまた、本発明のこの態様の方法によって得られる抗原特異的な単量体又は二量体のVH結合ドメインを提供する。
【0110】
本発明はまた、異種の重鎖遺伝子座、本発明の重鎖のみ抗体をコードする単離されたポリヌクレオチド及び異種の重鎖遺伝子座もしくはそのフラグメントを含むベクターからなるポリヌクレオチド配列、又は本発明の重鎖のみ抗体をコードする単離されたポリヌクレオチドを提供する。
【0111】
本発明はまた、本発明の異種重鎖遺伝子座もしくはそのフラグメント、又は重鎖のみ抗体もしくは抗体フラグメントをコードする単離されたポリヌクレオチドで形質転換された宿主細胞を提供する。
【0112】
第二の態様で、本発明は、エフェクター活性を提供するエフェクター部分を結合された本発明の抗原特異的VH結合ドメインを含むポリペプチド複合体を提供する。このエフェクター活性は、それに加えて重鎖定常領域により提供されてもよく、分子のアミノ末端又はカルボキシ末端に配置されてもよい。これらポリペプチド複合体は、エフェクター部分の追加のターゲッティング機能すなわちエフェクター機能と組み合わせて、抗原特異的VH結合ドメインが提供する生理機能を保持している。このようなポリペプチド複合体は、機能性モノマーの形態であるか、又はエフェクター部分の構造との相互作用によっては、二量体、四量体、五量体、多量体もしくは異なるVH結合ドメインを取り込んだ他の複合体の形態であり、その結果、多価又は多特異性を付与する。VH結合ドメインは、結合分子のアミノ末端又はカルボキシ末端に存在し得る(二量体の例の図1参照)。
【0113】
エフェクター部分が結合ドメインを含むとき、その結合ドメインは抗原特異的VH結合ドメインとは異なる特異性を有してもよい。この配列の利点は、そのポリペプチド複合体が異なる標的と容易に架橋できることである。例えば、二重特異性ポリペプチド複合体は、細胞−細胞間の相互作用と細胞−病原体間の相互作用を高めるのに利用できる。この実施形態では、本発明のポリペプチド複合体は、例えば病原体とマクロファージなどの2種類の細胞型を架橋するのに利用できる(Biburger et al.,(2005)J.Mol.Biol.,346,1299−1311参照)。このような二重特異性を設計する際には、VH結合ドメインを使用する方がscFV結合ドメインを使用するより好ましい。VH結合ドメインは、結合親和力が高いので、このようなポリペプチド複合体中に最小のベクター構造で、scFVの四量体の親分子に比例した特異性と親和力を保持するための設計上の考慮の必要も無しに組み込むことができる。二量体又は多量体のポリペプチド複合体を考えるとき、例えば、免疫グロブリン重鎖定常領域由来のCH2とCH3のドメインを含む二量体化ドメインが組み入れられる(図2参照)。
【0114】
用語「エフェクター部分」は、本明細書で使用する場合、細胞に対して所望の生物学的効果を仲介する任意の部分を含む。そのエフェクター部分は、好ましくは可溶性であり、そしてペプチド、ポリペプチドもしくはタンパク質でもよく、又は非ペプチド構造体でもよい。例えば、エフェクター部分は、酵素、ホルモン、サイトカイン、医薬、プロドラッグ、毒素特にタンパク質毒素、キレート化構造の放射性核種、結合ドメイン、二量体化ドメインもしくは相互作用ドメイン、造影剤、アルブミン又は阻害剤でもよい。
【0115】
アルブミンは、抗原特異的VH結合ドメインの安定性又は薬物動態学的及び/又は薬力学的特性を増大させるためにエフェクター部分として使用できる(Sung et al.,(2003)J.Interferon Cytokine Res.,23(1):25−36)。あるいは、エフェクター部分は、薬物動態学的特性を改善するため、ペグ化された構造(PEGylated)又は天然にグリコシル化された構造でもよい。
【0116】
エフェクター部分は、抗原特異的VH結合ドメインに結合されたペプチドでもよく、又は、例えばマレイミドリンカーのような化学的にリンクする構造体を使って、抗原特異的重鎖VHドメインに化学的に結合されてもよい。あるいは、本発明のプリペプチド複合体は、融合タンパク質として発現されてもよい。したがって、本発明は、異種の重鎖遺伝子座からなるポリヌクレオチド配列又は本発明の重鎖のみ抗体をコードする単離されたポリヌクレオチド(そのポリヌクレオチドはさらに読み取りフレーム中にエフェクター部分をコードする1個以上のエキソンを含む)も含む。このエキソンは、前記ポリヌクレオチドの5’末端又は3’末端に位置していてもよい。例えば、このポリヌクレオチドは、VHと結合ドメイン/エフェクター部分遺伝子セグメントをこの順序で、読み取りフレーム中に含んでもよい。遺伝子融合(genetic fusion)の場合、各種ドメインの結合は、融合タンパク質のアミノ酸配列をコードする組換えDNA構造体(同じ読取りフレームに配置された各種ドメインがコードされている)を使って達成されてもよい。このような構造体は、診断剤及び治療剤として有用である。診断剤として、そのエフェクタードメインは、蛍光タンパク質(例えばGFP)又は酵素(例えばβ−gal)でもよい。あるいは、エフェクタードメインは、基質に対する結合性を高めるためのタグ(例えばポリヒスチジン又はビオチン)、二次抗体に結合する部位を提供する抗原、又は蛍光マーカーが結合する部位として働くロイシンジッパーもしくは類似の結合モチーフでもよい。
【0117】
<ポリペプチド複合体>
本発明者らは、抗体重鎖の少なくとも一部分を、単独で又は相補的会合ドメインを含みかつ追加のエフェクター活性を有する別のエフェクター(軽)鎖と組み合わせて含む二価又は多価のポリペプチド複合体を産生できることを明らかにした。本発明のポリペプチド複合体は、エフェクター鎖に付随する追加エフェクター部分の機能と組み合わせた重鎖定常領域によって付与された生理学的機能を保持している(図3)。
【0118】
したがって、第三の態様では、ポリペプチド複合体は、一つ以上のエフェクター鎖(軽鎖)と組み合わせた重鎖を含む。本発明の第三の態様は一対の重鎖と一対のエフェクター鎖を含むポリペプチド複合体を提供し、
その一対の重鎖は互いに会合し、
一方のエフェクター鎖は一方の重鎖と会合し、他方のエフェクター鎖は他方の重鎖と会合し、
各重鎖は、結合ドメイン、好ましくは少なくともCH2、CH3及び任意選択的にCH4の定常領域ドメインを含む二量体化ドメイン並びにエフェクター鎖の相補的会合ドメインに結合できるエフェクター部分を含み、
そのエフェクター鎖は、エフェクター部分に連結された相補的会合ドメインを含み、そして
前記会合ドメインと相補的会合ドメインは非共有相互作用によって互いに会合している。
【0119】
好ましくは、上記重鎖のエフェクター部分は、エフェクター鎖のエフェクター部分とは異なっている。
【0120】
上記ポリペプチド複合体は、任意選択的に、CH3ドメイン(又は存在している場合はCH4ドメイン)のカルボキシル末端に、このドメインを会合ドメインに連結する可撓性ヒンジ様ドメインを含む。上記ポリペプチド複合体は、好ましくは、結合ドメインとCH2ドメインの間に、天然のヒンジドメイン又は遺伝子工学的に処理された可撓性ヒンジ様ドメインを含む。ヒンジ領域の存在により、生成したポリペプチド複合体内の結合ドメインとエフェクター部分の独立した機能を高められる。
【0121】
第一ポリペプチド重鎖のエフェクター部分は、任意選択的に、第二ポリペプチド重鎖のエフェクター部分の特異性とは異なる特異性を有する。本発明によれば、ポリペプチド複合体のエフェクター部分は結合ドメインで置換されてもよい。好ましくは、その結合ドメインは(本発明の第一態様で定義されたのと同じ)VHドメイン、又は細胞受容体結合ドメインを含む。生成する四価二量体の結合タンパク質(ポリペプチド複合体)は、異なるエフェクター部分を4個まで含むことができる。好ましくは、重鎖のアミノ末端のエフェクター部分は同一であり、そしてカルボキシ末端のエフェクター部分は同一であり(但し、アミノ末端のエフェクター部分とは異なる抗原又はエピトープを認識する)、単一のホモ二量体の会合を促進する。このような分子は、適正な重鎖の機能性ドメイン(例えばIgA又はIgM)を含むことによってエフェクター機能が提供されるので、病原体を捕獲するのに有利であることが分かるであろう。
【0122】
本発明の第三の態様の代表的ポリペプチド複合体は、細胞化学的ラベリング法、ターゲッティング法、又は治療に有用である。例えば、エフェクター分子が癌細胞の表面マーカーを標的とする抗原特異的VH結合ドメインを含みかつエフェクター部分がプロドラッグ変換酵素に対し特異的な結合ドメインを含むならば(エフェクター鎖)、その抗原特異的VH結合ドメインは、前記標的に結合して前記エフェクター部分をその標的の直近まで運び、その結果、前記エフェクター鎖と結合して、プロドラッグ(例えばCB1954を有するニトロレダクターゼ)の存在下、標的に対して生物学的効果を発揮できる。免疫グロブリン重鎖エフェクター機能を二量体化ドメインとして含むことも標的細胞を除くのに有用であろう。
【0123】
<エフェクター鎖>
エフェクター鎖は、相補結合ドメインとエフェクター部分を含み、重鎖のエフェクター部分を通じて重鎖と結びついて、会合されたポリペプチド結合複合体を形成する。そのエフェクター鎖の相補的会合ドメインは、エフェクター部分の不可欠な成分であってもよいし、又はエフェクター部分に融合もしくは化学的に結合されたタンパク質もしくは別のリガンドでもよい。前記会合されたポリペプチド結合複合体の重鎖は、標的に結合してエフェクター(軽)鎖部分を標的の直近まで運んで標的に生物学的効果を発揮できる。
【0124】
<エフェクター部分>
用語「エフェクター部分」は、本明細書で使用するときは、細胞に対して望ましい生物学的効果を仲介する任意の部分を含む。そのエフェクタードメインは、細胞例えばT細胞、ペプチド、ポリペプチドもしくはタンパク質でもよく、又は非ペプチド構造体でもよい。例えば、エフェクタードメインは、酵素、医薬、プロドラッグ、毒素特にタンパク質毒素、キレート化構造体の放射性核種又は結合ドメインでもよい。相補的会合ドメインと会合しているエフェクター部分は、所望の効果によって、自然状態で、細胞の、たんぱく質の、有機又は無機の部分でよい。
【0125】
用語「結合ドメイン」は、本発明の上記全ての態様について本明細書で使うときは、生理的溶媒中で活性である任意のポリペプチドドメインを含む。また、このような結合ドメインは、生理的条件下、標的に結合する性能を有していなければならない。
【0126】
このような結合ドメインは、細胞表面に対する結合又は接着を仲介できるドメインを含む。本発明のポリペプチド複合体に使用できる適切なドメインは、哺乳類、原核生物及びウイルスの細胞接着分子、サイトカイン、成長因子、受容体のアンタゴニストもしくはアゴニスト、リガンド、細胞表面の受容体、制御因子、構造タンパク質と構造ペプチド、血清タンパク質、分泌タンパク質、細胞膜会合タンパク質、ウイルス抗原、細菌抗原、原生動物抗原、寄生虫抗原、リポタンパク質、糖タンパク質、ホルモン、神経伝達物質、凝固因子、遺伝子工学的に処理された単一鎖Fvsなどである。その結合ドメインは、好ましくは脊椎動物のVHドメインであり、より好ましくはヒトVHドメインなどの哺乳類のVHドメインである。
【0127】
結合ドメインは、ラクダVH(VHH)ドメインを含んでもよく、又は非ラクダから得たVHドメインを含んでもよい。その結合ドメインは、好ましくはヒトVHドメインである。VH結合ドメインは、合成ファージライブラリーから誘導されたVHドメインではなく、トランスジェニック動物又は(上記の)ラクダから誘導したB細胞起源ものの方が好ましい。なぜなら、トランスジェニック動物又はラクダから誘導したB細胞起源のものが、インビボで抗原の投与に応答しVDJの再構成と体細胞変異によって生成するので親和力が高いためである。
【0128】
エフェクター部分が結合ドメインを含むとき、その結合ドメインは重鎖の結合ドメインと異なっている方が好ましい。この構成の利点は、ポリペプチド複合体が、異なる標的の架橋を促進できるか又は標的細胞(例えば病原体)の異なる抗原に結合できる点である。
【0129】
第一の重鎖の結合ドメインは、第二の重鎖の結合ドメインの特異性とは異なる特異性を有してもよい。この場合、ポリペプチド複合体は少なくとも二価であるので、異なる標的を架橋することができ、かつそのエフェクタードメインはその効果を両方の抗原に対して発揮できる。多価のポリペプチド複合体は、これら四価の重鎖を、さらに、異なる一種以上の特異性及び機能を有するエフェクタードメインを含むエフェクター鎖と会合させて作製できる。また、第一の重鎖のエフェクター部分は、第二の重鎖のエフェクター部分とは異なる特異性を有してもよく、その結果各々異なる機能を保持する二つ以上のエフェクター鎖を捕獲できる。
【0130】
<相補的会合ドメインはエフェクター部分に結合する>
重鎖がエフェクター鎖と会合しているとき、用語「エフェクター部分」と「相補的会合ドメイン」は、本明細書で使う場合、少なくとも一つの非共有結合を、互いに形成できる部分を含む。例えば、そのエフェクター部分と相補的会合ドメインは、免疫グロブリン重鎖のCH1ドメイン−免疫グロブリン軽鎖の定常領域間、ロイシンジッパー間、VCAM−VLA−4間、インテグリン−細胞外マトリックスタンパク質間、インテグリン−CD54もしくはCD102などの細胞表面分子間、ALCAM−SRCRドメイン間、scFv−抗原間又はVH結合ドメイン−抗原間などにみられるようなタンパク質−タンパク質相互作用を形成できるタンパク質、ペプチドフラグメント又は共通配列でもよい。
【0131】
<重鎖>
重鎖の二量体化ドメインが免疫グロブリン重鎖の定常領域を含むときは、その定常領域(CHエキソン)は、さらなる生理的機能をポリペプチド結合複合体に付与してもよい。特に、その免疫グロブリン重鎖の定常ドメインは、その抗体定常ドメインのクラス又はサブクラスに依存して、特に補体の結合、マクロファージの活性化及びFc受容体への結合を提供してもよい。
【0132】
先に考察したように、発現された重鎖のクラスは、インビボでのエフェクター機能に重要な役割を持っていることはよく報告されている。樹立細胞系は有用な生物学的ターゲッティング効果を有するポリペプチド複合体を産生するかもしれないが、その重鎖定常領域は、診断上又は治療上望ましくないクラスの場合があるかもしれず、又は有効量を分泌しないこともあり得る。したがって、本発明のポリペプチド複合体の重鎖定常ドメインは、特異的に変えたり又は部分的にもしくは完全に削除して、免疫グロブリン重鎖の成分を導入したり、又は除いてもよい。
【0133】
例えば、クラスMのIg分子が、マクロファージの活性化と補体の経路で重要な役割を演じていることは知られている。その結合部位の近接近により、IgMは、ウイルスを含む病原体に対して高い親和力を有する。しかしIgMは高速免疫検定法に使用することが難しいが、その一方でクラスGのIgはこの検定法に容易に使用できることも知られている。この用途では、重鎖のクラスをμからγのドメインに切り替えることが有効であろう。
【0134】
重鎖のCγ遺伝子座を単独で発現させると、IgG1、IgG2、IgG3及びIgG4のイソタイプを含むIgGを産生し、この内いくつかは補体も活性化する。IgG抗体類は、マクロファージ及び顆粒球に結合して活性化したり、また胎盤を通過することもできる。
【0135】
各種の抗体クラスの追加の用途はすでに考察されている。
【0136】
本発明のポリペプチド複合体の重鎖の定常領域は、先に定義したようなヒト、ウサギ、ラット又はマウスを起源とするものでよい。なかでも、ヒトを起源とするものが好ましい。
【0137】
本発明のポリペプチド複合体は、エフェクター機能を全く提供しない二量体化ドメインを利用することによって、リガンドがその受容体に結合するのを遮断するために単独で使用することができる。多種類の受容体を、多重特異性ポリペプチド複合体で遮断できる。
【0138】
本発明の第四の態様では、エフェクター分子が、別個のエフェクター分子と会合できるように二量体化ドメインを含んでもよい。この二量体化ドメインは、CH2、CH3又はCH4の抗体定常領域ドメイン及び/又はJ鎖のうち一つ以上を含んでもよい。本発明の本実施形態では、エフェクター分子の二量体又は多量体を産生するために二つ以上のエフェクター分子が会合してもよい。そのエフェクター分子は、同じでも(エフェクター分子のホモ二量体又はホモ多量体を産生できる)異なっていても(エフェクター分子のヘテロ二量体又はヘテロ多量体を産生できる)よい。好ましくは、エフェクター分子の二量体又は多量体は二価又は多価である。好ましくは、前記二つ以上のエフェクター分子の定常領域(すなわち二量体化ドメイン)は同じであるから生成物が異種になる可能性は低い。
【0139】
本発明の第四の態様によって、第一ポリペプチド重鎖と第二ポリペプチド重鎖からなる二量体を含むポリペプチド複合体であって、
各ポリペプチド重鎖が、結合ドメイン並びに任意選択的に少なくともCH2、CH3及び任意選択的にCH4の抗体定常領域のドメイン及び任意選択的にエフェクター部分を含む二量体化ドメインを含み、
好ましくは第一ポリペプチド重鎖の結合ドメインは、第二ポリペプチド重鎖の結合ドメインと同じ特異性を有し、そして
これら二つのポリペプチド重鎖の定常領域(二量体化ドメイン)は同一である
ポリペプチド複合体が提供される。
【0140】
好ましくは、上記第一鎖と第二鎖は同じエフェクター部分を有する。
【0141】
好ましくは、上記二量体化ドメインは、少なくともCH2、CH3及び任意選択的にCH4の抗体定常領域のドメインを含む。
【0142】
また、本発明の第四態様は、複数のポリペプチド重鎖二量体及び一つのJ鎖を含むポリペプチド複合体であって、
複数のポリペプチド重鎖二量体がJ鎖によって会合され、
各ポリペプチド重鎖が、結合ドメイン並びに同一のμ、ε、α又はγのCH2、CH3及び任意選択的にCH4のドメインを含み、そして
そのポリペプチド複合体中に、異なる特異性を有する少なくとも二つの結合ドメインが存在している
ポリペプチド複合体を提供する(図4と5参照)。
【0143】
上記本発明の第一態様で定義したように、各重鎖の定常領域は、好ましくは、重鎖のみ抗体を生成できるように機能性CH1ドメイン無しで発現される少なくとも一つの重鎖定常領域の遺伝子を含む。また、各重鎖定常領域は、Cδ、Cγ1−4、Cμ、Cε及びCα1−2からなる群から選択される一つ以上の追加の重鎖定常領域の遺伝子を、その追加の重鎖定常領域の遺伝子が機能性CH1ドメインを発現しないという条件で含んでもよい。その重鎖定常領域の遺伝子は、必要な抗体クラスの好ましいクラス又は混合物によって選択される。
【0144】
好ましくは、発現されるIgAとIgM中には、異なる特異性の結合ドメインが二つだけ存在している。
【0145】
一実施形態では、重鎖は各々CH4ドメインを含み、定常ドメインはαドメインであり、そしてポリペプチド複合体はJ鎖を含む。
【0146】
もう一つの実施形態では、重鎖は各々CH4ドメインを含み、定常ドメインはμドメインであり、そして抗体はJ鎖を含む。
【0147】
<ポリペプチド複合体の会合>
本発明のポリペプチド複合体のモジュールドメインの構成は、その複合体を、多種類の可能な順列で構築することを可能にする。ポリペプチド複合体のドメインの構造及びアミノ酸の配列におけるこのような変更は、配列をコードする対応DNAの適切な領域を適切に変異させるか又は部分的に合成し及び置換することによって達成されてもよい。置換ドメイン又は付加ドメインは、互換性がある組換えDNA配列から得られてもよい。例えば、重鎖は、結合ドメインとCH2ドメインのアミノ末端との間及びエフェクタードメインと重鎖のC末端(CH3又はCH4)との間の両方に、天然ヒンジ又は遺伝子工学的に処理された可撓性ポリペプチドドメインを含んでもよい。
【0148】
本発明のポリペプチド複合体の重鎖は、融合タンパク質として発現される。本発明のこの態様のポリペプチド複合体のエフェクター鎖は、融合タンパク質として発現されてもよく、又は化学的手段で会合されてもよく、又は自然状態の細胞であれば、血液もしくは組織から単離するかもしくはインビボで捕獲されもてよい(例えばアルブミン)。
【0149】
遺伝子融合の場合は、各種ドメインの連結は、融合タンパク質のアミノ酸配列をコードする組換えDNA構造体で、同じ読取り枠内に配置されている各種ドメインをコードするDNAを使うことで達成されてもよい。
【0150】
エフェクター部分は、融合タンパク質の一部として存在しているときは、相補的会合ドメインのアミノ末端又はカルボキシ末端に位置してもよい。
【0151】
あるいはエフェクター鎖のドメインは、融合タンパク質として合成するのではなく当分野で既知の通常のペプチド化学の方法で会合させてもよい。
【0152】
結合はペプチド結合又は化学結合を介してもよい。例えば、エフェクター部分は、相補的会合ドメインにペプチド結合されてもよいし、又は例えばマレイミドのリンカーなどの化学的連結構造体を使うことによって、相補的会合ドメインに化学的に結合されてもよい。
【0153】
そのエフェクター部分は重鎖のどの位置に配置してもよい。例えば、エフェクター部分は、重鎖のC末端に、又はポリペプチド複合体の結合ドメインとCH2ドメインもしくはヒンジドメインとの間に配置されてもよい。上記会合ドメインは、エフェクター機能及び二量体化ドメインを阻害することがあるので、CH2ドメインとCH3ドメインの間には配置しない方がよい。エフェクター部分は、その独立した結合/機能を高めるために、重鎖のアミノ末端又はカルボキシ末端に、ペプチドの可撓性リンカー又はヒンジ様領域によって連結する方が好ましい。
【0154】
<ポリヌクレオチド配列、ベクター及び宿主細胞>
本発明はまた、本発明のポリペプチド複合体のいずれか一つの重鎖をコードするポリヌクレオチド配列、上記ポリヌクテオチド配列を一つ以上含むベクター及び本発明のポリペプチド複合体の重鎖をコードするベクターで形質転換された宿主細胞を提供する。そのポリヌクレオチドは、好ましくは、発現された重鎖をホモ二量体として、宿主細胞が増殖している培地中に分泌させる配列を含む。その宿主細胞は、細菌及び酵母の細胞を含む任意の起源の細胞でもよいが、脊椎動物の宿主細胞が好ましく、哺乳類の宿主細胞が一層好ましい。
【0155】
同じ宿主細胞を、異なる標的に対する特異性を有する結合ドメインを含む重鎖をコードする第二ベクターでトランスフェクトすると、二つの構造体及びホモ二量体とヘテロ二量体の混合物の会合物が共発現される。ホモ二量体は同系の抗原に対して特異性を示し、ヘテロ二量体は両方の抗原に結合する。
【0156】
本発明はまた、本発明のポリペプチド複合体の少なくとも一つのエフェクター鎖をコードするベクターで形質転換された宿主細胞も提供する。その宿主細胞は、細菌及び酵母の細胞を含む任意の起源の細胞でよいが、脊椎動物の宿主細胞が好ましく、哺乳類の宿主細胞が一層好ましい。あるいは、エフェクター鎖は、当分野で知られている方法を使って合成されてもよい。
【0157】
本発明はまた、本発明のポリペプチド複合体の少なくとも一つの重鎖をコードするベクターで形質転換された宿主細胞を提供する。その宿主細胞は、細菌及び酵母の細胞を含む任意の起源の細胞でよいが、脊椎動物の宿主細胞が好ましく、哺乳類の宿主細胞が一層好ましい。あるいは、上記重鎖は、当分野で知られている方法を使って合成されてもよい。
【0158】
本発明はまた、本発明のポリペプチド複合体の少なくとも一つの重鎖及び少なくとも一つのエフェクター鎖をコードするベクターで形質転換された宿主細胞も提供する。その宿主細胞は、細菌及び酵母の細胞を含むどの起源の細胞でもよいが、脊椎動物の宿主細胞が好ましく、哺乳類の宿主細胞が一層好ましい。あるいは、これらの鎖は、当分野で知られている方法を使って、独立して合成され会合されてもよい。
【0159】
さらに、本発明は、本発明の少なくとも一つの重鎖のホモ二量体もしくはヘテロ二量体のポリペプチド複合体を発現するトランスジェニック生物を提供する。そのトランスジェニック生物は、ヒトではない脊椎動物もしくは哺乳類、植物又は昆虫でもよい。
【0160】
本発明はまた、本発明の第一態様のクラス特異的重鎖のみ抗体及びそのVHドメインを、本発明のトランスジェニック生物を抗原で免疫することによって産生する方法を提供する。
【0161】
本発明のこの態様の好ましい実施形態では、上記生物はマウスである。
【0162】
健康管理の用途で使う抗体及びポリペプチド複合体を産生するには、大量に生産する系が必要であり、その例は先に詳細に考察してある。このような系としては、大量に栽培もしくは飼育する方法に適した植物(例えばトウモロコシ)、トランスジェニックのウシ及びヒツジ、鶏及び昆虫の幼虫がある。細胞培養及び生殖細胞系列の方法に代わるものとしてウイルス感染(例えば昆虫の幼虫や細胞系へのバキュロウイルスの感染)を含む他の産生法も、当業者にはよく知られたものになるだろう。
【0163】
これらの方法及び当分野で知られている他の適切な方法は、本発明のポリペプチド結合複合体を製造するのに使用できる。ホモ二量体及び/又はヘテロ二量体の製造はこれらの方法を使って達成できる。
【0164】
<本発明の重鎖のみ抗体及びポリペプチド複合体の使用>
本発明の重鎖のみ抗体及びポリペプチド結合複合体には、多数の用途がある。
【0165】
例えば、本発明の重鎖のみ抗体及びポリペプチド複合体には、二重特異性及び多重特異性のポリペプチド複合体が含まれる。これらの複合体は、例えば、感染症の治療と予防に使う治療剤として特に有利である。
【0166】
本発明の重鎖のみ抗体及びポリペプチド結合複合体は、細胞化学的ラベリング法、ターゲッティング法、治療及び診断を実施するのに有用である。
【0167】
モノ抗体療法では、例えば、単一の結合部位の欠失をもたらす突然変異のために病原体の免疫回避が起こり、抗体の治療効果が消失するであろう。同じ病原体の異なる抗原を認識するヘテロ二量体のポリペプチド複合体を産生すればこの問題を克服できる。本発明のポリペプチド複合体中の異なる特異性を有する少なくとも二つの結合ドメインを、細胞−細胞の相互作用及び細胞/病原体の相互作用の両方を高めるために使用することもできる。
【0168】
本実施形態では、本発明のポリペプチド複合体は、例えば、病原体とマクロファージ又は腫瘍細胞とT細胞などの二つの細胞型の間をポリペプチド複合体で架橋するのに使用できる。あるいは、そのポリペプチド複合体は、重鎖定常領域だけで提供されているエフェクター機能によって、同じ病原体の二つ以上のエピトープを認識してもよい。
【0169】
あるいは、二重特異性ポリペプチド結合複合体はインビボで標的の細胞又は組織に対して使用されてもよく、次いで循環しているエフェクター分子又は造影剤を捕獲できる。例えば、二重特異性腫瘍ターゲッティング剤はプロドラッグ変換複合体を捕獲し次いでプロドラッグを反応剤に部分的に変換するために使用され得る。また、エフェクター剤と組み合わせた二重特異性結合複合体と多重特異性結合複合体は、結合ドメインを選択することによって一種以上の病原体に結合し、破壊するために使用されてもよい。あるいは、同じ病原体の異なる抗原を認識する二種以上の結合ドメインの存在は臨床面で有利であり、病原体内の突然変異が原因の病原体の免疫回避や医薬の余剰が起こる可能性を低める。
【0170】
本発明は、本発明の第一態様の重鎖のみ抗体又はそのフラグメント、本発明の第二態様のポリペプチド鎖とポリペプチド複合体、及び本発明の第三態様のエフェクター鎖とポリペプチド複合体を提供する。これらは全て、ヒトの医薬の用途に適しているので、本発明は、本発明の重鎖のみ抗体、ポリペプチド鎖、エフェクター鎖又はポリペプチド複合体を含む医薬組成物を提供する。本発明はまた、疾患の予防及び/又は治療に使う医薬を調製する際の、本発明の重鎖のみ抗体、ポリペプチド鎖、エフェクター鎖又はポリペプチド複合体の使用も提供する。重鎖とエフェクター鎖は、前記医薬の投与方法と作用によって、ともに又は別個に配合されてもよい。
【0171】
本発明の医薬組成物と医薬は、一般に、患者に投与する前に配合され得る。
【0172】
例えば、重鎖のみ抗体又はポリペプチド複合体は、特に凍結乾燥しなければならないとき、安定剤と混合してもよい。糖類(例えば、マンニトール、スクロース又はトレハロース)を添加すると、一般に、凍結乾燥中、安定性を付与し、好ましい安定剤はマンニトールである。ヒト血清アルブミン(好ましくは組換え体)も安定剤として添加できる。糖類の混合物、例えばスクロースとマンニトール、トレハロースとマンニトールなども使用できる。
【0173】
本発明の組成物には緩衝剤を添加してもよく、緩衝剤としては、例えば、トリス緩衝剤、ヒスチジン緩衝剤、グリシン緩衝剤又は好ましくはリン酸緩衝剤(例えば、リン酸二水素ナトリウムとリン酸水素二ナトリウムを含有する)がある。緩衝剤は、pHが7.2から7.8の間、特に約7.5になる量で添加することが好ましい。
【0174】
凍結乾燥した後、再構成するために注射用滅菌水が使用されてもよい。凍結乾燥された固形物を、ヒト血清アルブミン(好ましくは組換え体)を含む水性組成物で再構成することもできる。
【0175】
一般に、重鎖のみ抗体とポリペプチド複合体は、精製された形態で薬理学的に適正な担体とともに利用され得る。
【0176】
したがって、本発明は、本発明の医薬組成物を患者に投与することからなる患者の治療方法を提供する。患者は好ましくはヒトであり、小児(例えば幼児又は乳児)、10歳台のヒト又は成人でもよいが一般に成人であろう。
【0177】
本発明はまた、医薬として使用する本発明の重鎖のみ抗体、ポリペプチド鎖、エフェクター鎖又はポリペプチド複合体を提供する。
【0178】
本発明はまた、患者を治療するのに使う医薬を製造する際の本発明の重鎖のみ抗体、ポリペプチド鎖、エフェクター鎖又はポリペプチド複合体の使用も提供する。
【0179】
これらの使用、方法及び医薬は、好ましくは以下の疾患及び障害を治療するのに利用され、その疾患及び障害は、創傷の治癒;新生物、黒色腫、肺、結腸直腸、骨肉腫、直腸、卵巣、肉腫、頚管、食道、乳房、膵臓、膀胱、頭部と頚部などの充実性腫瘍を含む細胞増殖傷害;白血病、非ホジキンリンパ腫、白血球減少症、血小板減少症、血管新生障害、カポジ肉腫などの骨髄増殖性障害;アレルギー、炎症性腸疾患、関節炎、乾癬と気道炎症、喘息、免疫障害及び臓器移植拒絶を含む自己免疫/炎症障害;高血圧、水腫、狭心症、アテローム性じゅく状硬化症、血栓症、敗血症、ショック、再潅流障害及び虚血を含む心血管と脈管の障害;中枢神経系疾患、アルツハイマー病、脳損傷、筋萎縮性側索硬化症及び疼痛を含む神経障害;発達障害;糖尿病、骨粗鬆症と肥満症、AIDS及び腎臓病を含む代謝異常;ウイルス感染症、細菌感染症、真菌感染症及び寄生虫感染症を含む感染症;胎盤に関連する病的状態;並びに免疫療法を利用する他の病的状態である。
【0180】
さらなる態様では、本発明は、本発明の重鎖のみ抗体又はポリペプチド結合複合体の診断剤、予後治療剤又は治療用造影剤としての使用方法を提供する。さらに、本発明は、本発明の重鎖のホモもしくはヘテロの二量体だけ又はこれを本発明の一つ以上のエフェクター(軽)鎖と組み合わせた治療用造影剤、細胞化学の試薬又は診断剤としての使用方法を提供する。
【0181】
本発明は、本明細書に記載されている重鎖のみ抗体又はそのフラグメントの細胞内結合試薬又は抗体酵素としての使用方法を提供する。好ましい重鎖のみ抗体のフラグメントは、可溶性の抗原特異的VH結合ドメインである。
【0182】
本発明はまた、本発明の抗原特異的単鎖抗体又はVH結合ドメインの酵素阻害剤又は受容体封鎖剤としての使用方法を提供する。好ましい重鎖のみ抗体のフラグメントは、可溶性の抗原特異的VH結合ドメインである。
【0183】
本発明はまた、エフェクター分子に融合させたVHドメインの治療剤、造影剤、診断剤、アブザイム又は試薬としての使用方法を提供する。
【0184】
<一般技術>
本明細書で使用されている技術用語と科学用語は、特に定義しない限り、当業者(例えば細胞培養、分子遺伝学、核酸化学、ハイブリッド形成技術及び生化学の当業者)が共通して理解しているのと同じ意味を持っている。分子、遺伝子及び生化学の方法(一般に、Sambrook et al.,Molecular Cloning:A Laboratory Manual,2nd Ed.(1989)Cold Spring Harbor Laboratory Press,Cold Spring Harbor N.Y.及びAusubel et al.,Short Protocols in Molecular Biology(1999)4th Ed.,John Wiley & Sons,Inc.参照)並びに化学的方法の標準方法が使用される。さらに、標準の免疫学的方法として、Harlow & Lane,A Laboratory ManualCold Spring Harbor N.Y.がある。
【0185】
本発明の二価及び多価のポリペプチド複合体、単一重鎖抗体及びそのフラグメントの製造のために、任意の適切な組換えDNA技術が使用されてもよい。ポリペプチド複合体又は抗体の鎖各々をコードするDNA配列を含むプラスミドなどの典型的な発現ベクターが構築される。免疫グロブリンを酵素で及び化学的に細分して生成したフラグメントを分離する確立された適切な任意の方法が使用されてもよい。
【0186】
本発明はまた、トランスジェニックマウス内で重鎖のみ抗体を発現する構造体を含み、本発明のポリペプチド複合体を構築し発現するベクターを提供する。
【0187】
ポリペプチド鎖以外の鎖をコードするDNA配列を含有する単一ベクターが構築されてもよいことは高く評価されるであろう。例えば、二つの異なる重鎖をコードするDNA配列は、同じプラスミドの異なる位置に挿入されてもよい。
【0188】
あるいは、各ポリペプチド鎖をコードするDNA配列を、個々に一プラスミドに挿入して、各々特定のポリペプチド鎖をコードする多数の構築されたプラスミドを製造してもよい。配列を挿入するプラスミドは互換性のある方が好ましい。
【0189】
続いて、各プラスミドは、各宿主細胞がポリペプチド複合体中の各ポリペプチド鎖をコードするDNA配列を含有するように、宿主細胞を形質転換するのに使用される。
【0190】
細菌系内でクローン化するのに適切な発現ベクターとしては、Col E1、pcR1、pBR322、pACYC184及びRP4などのプラスミド、ファージDNA、又はこれらのいずれかの誘導体が使用されてもよい。
【0191】
酵母系内にクローン化するのに使用する適切な発現ベクターとしては、2micronプラスミドの複製起点に基づいたプラスミドが挙げられる。
【0192】
適正な哺乳類の遺伝子のプロモーター配列を含有する任意のプラスミドは、哺乳類系内でのクローン化に使用されてもよい。昆虫又はバキュロウイルスのプロモーター配列は、昆虫細胞の遺伝子を発現させるのに使用されてもよい。このようなベクターとしては、例えばpBR322、ウシ乳頭腫ウイルス、レトロウイルス類、DNAウイルス類及びワクシニアウイルス類由来のプラスミドがある。
【0193】
ポリペプチド複合体又は抗体を発現のために使用されてもよい適切な宿主細胞としては、細菌、酵母及び真核細胞例えば昆虫もしくは哺乳類の細胞系、トランスジェニック植物、昆虫、哺乳類及び他の無脊椎動物もしくは脊椎動物の発現系が挙げられる。
【0194】
<本発明のポリペプチド複合体及び単一重鎖抗体>
用語:本発明の「ポリペプチド複合体」、「単一重鎖抗体」及び「異種重鎖遺伝子座」は、例えば、類縁の細胞ホモログ、他の種由来のホモログ及びその変異体もしくは誘導体などの任意の供給源から得られる同族のポリペプチド及び核酸配列を含むことは当然明らかであろう。
【0195】
したがって、本発明は、本明細書に記載されている上記ポリペプチド複合体と抗体の変異体、ホモログ又は誘導体を含む。
【0196】
本発明の文脈では、同族配列は、少なくとも30個、好ましくは50、70、90又は100個のアミノ酸を超えるアミノ酸レベルで、少なくとも80、85、90、95、96、97、98、99、99.5、99.6、99.7、99.8、99.9%相同で好ましくは少なくとも98又は99%相同であるアミノ酸配列を含むと考えられる。相同性は類似性(すなわち類似の化学特性/機能を有するアミノ酸残基)によって検討することもできるが、本発明の文脈では、相同性は配列の同一性で表現する方が好ましい。
【0197】
本発明には、本発明のポリペプチド複合体と抗体を製造するのに使う構築された発現ベクター及び形質転換された宿主細胞も含まれる。
【0198】
個々の鎖は、同じ宿主細胞内で発現された後、活性型の完全なポリペプチド複合体又は重鎖のみ抗体を提供するために回収されてもよい。本発明の好ましい形態では、個々の重鎖は、宿主細胞によって処理されて、その細胞から有利に分泌される完全なポリペプチド複合体又は抗体を形成すると考えられる。好ましくは、エフェクター鎖は、宿主細胞又は合成手段によって別個に産生される。
【0199】
組換え抗体のポリペプチド複合体の調製法は、上記参照文献及び例えばEP−A−0 623 679;EP−A−0 368 684及びEP−A−0 436 597にも記載されている。
【0200】
<トランスジェニック生物の免疫>
さらなる態様で、本発明は、抗原を、本発明のトランスジェニック生物に投与することを含む本発明の抗体の製造方法を提供する。
【0201】
本発明のトランスジェニック生物から産生される抗体及びポリペプチド複合体としては、ポリクローナル抗体、モノクローナル抗体及びそのフラグメントが挙げられる。ポリクローナル抗体が必要なときは、トランスジェニック動物(例えばマウス、ウサギ、ヤギ、ウマなど)を、抗原で免疫し、免疫された動物から血清を集めて、公知の方法で処理されてもよい。ポリクローナル抗体を含有する血清が、他の抗原に対する抗体を含有するとき、対象のポリクローナル抗体は、当業者にはよく知られている免疫親和性クロマトグラフィー及びこれに類似の方法で精製できる。また、ポリクローナル抗血清を産生させ処理する技術も、当分野で知られている。
【0202】
<本発明のポリペプチド結合複合体及び抗体の使用方法>
本発明のポリペプチド複合体及び抗体とそのフラグメントは、インビボでの治療と予防の用途、インビトロとインビボで診断する際の用途、インビトロでの検定と試薬の用途などに利用されてもよい。
【0203】
本発明のポリペプチド複合体と抗体を治療と予防に用いる方法には、それらを、ヒトなどの受容哺乳類に投与するステップが含まれる。
【0204】
実質的に純粋なポリペプチド複合体及び抗体のそのフラグメントを少なくとも90〜95%の均質性で含有しているものが哺乳類に対して投与するのに好ましく、そして特に哺乳類がヒトの場合、医薬の用途には、98〜99%以上の均質性が最も好ましい。所望どおりに部分的に又は均質に精製されたならば、本明細書に記載のポリペプチド複合体と重鎖のみ抗体は、診断又は治療(体外の場合を含む)に使うか又は当業者に知られている方法を使って検定法を開発して実施するのに使用されてもよい。
【0205】
一般に本発明のポリペプチド複合体と抗体は、精製された形態で、薬理学的に適正な担体とともに利用される。典型的には、これら担体としては、水溶液もしくはアルコール/水溶液、乳濁液もしくは懸濁液があり、これらは生理食塩水及び/又は緩衝媒体を含んでもよい。非経口用の賦形剤としては、塩化ナトリウム溶液、リンゲルのデキストロース、デキストロースと塩化ナトリウム及び乳酸化リンゲル液がある。
【0206】
ポリペプチド複合体を懸濁液に保持することが必要な場合、生理的に許容できる適切なアジュバントを、カルボキシメチルセルロース、ポリビニルピロリドン、ゼラチン及びアルギネートなどの増粘剤から選択してもよい。
【0207】
静脈内用賦形剤としては、流体と栄養素の補充剤及び電解質の補充剤、例えばリンゲルのデキストロースに基づいたものが挙げられる。また、保存剤などの添加剤、例えば抗菌薬、抗酸化剤、キレート化剤及び不活性ガスが存在していてもよい(Mack(1982)Remington’s Pharmaceutical Sciences,16th Edition)。
【0208】
本発明のポリペプチド複合体及び抗体とそのフラグメントは、別個に投与される組成物として又は他の試薬とともに使用できる。これらは、各種の免疫治療用薬剤、例えばシクロスポリン、メトトレキサート、アドレアマイシン、シスプラチナム又はイムノトキシンを含んでもよい。あるいは、本発明のポリペプチド複合体は、酵素とともに使用して、プロドラッグをその活性部位で変換できる。
【0209】
医薬組成物は、本発明の選択された抗体とともに又は本発明の選択された抗体の組合せとともに、各種の細胞傷害性又は他の試薬の「カクテル」を含んでもよい。
【0210】
本発明の医薬組成物の投与経路は、当業者に公知のどの経路でもよい。特に制限を含まない免疫療法を含む治療法の場合、本発明のポリペプチド複合体又は抗体は、どの患者にも標準の方法で投与できる。その投与は、非経口、静脈内、筋肉内、腹腔内、経皮、経肺又はカテーテルを使って適切に行う直接注入を含む任意の適切な様式によって行なわれる。投与量と投与の頻度は、臨床医が考慮する患者の年齢、性別及び症状、他の医薬の同時投与、計器の示度などの他のパラメータに依存するであろう。
【0211】
本発明のポリペプチド複合体と抗体は、凍結乾燥して貯蔵し、使用する前に適切な担体で再構成することができる。既知の凍結乾燥法と再構成法を利用できる。凍結乾燥と再構成は、機能活性損失を起こし得るので、補償するため使用レベルを上方に調節しなければならないことがあるかもしれないことは当業者には当然明らかである。
【0212】
さらに本発明のポリペプチド複合体と抗体は、診断のために使用できる。例えば、本明細書に記載の抗体は、疾患状態中に特異的に発現されるか又はそのレベルが所与の疾患状態中に変化する抗原に対して生成又は発生されてもよい。
【0213】
診断又は追跡などの特定の目的のためには、ラベルを付加してもよい。適正なラベルとしては、限定されないが、放射能ラベル、NMRスピンラベル及び蛍光ラベルのいずれかがある。これらのラベルを検出する手段は、当業者にはよく知られている。
【0214】
本発明のポリペプチド複合体と抗体又はそのカクテルを含有する組成物は予防及び/又は治療のために投与できる。
【0215】
本発明のポリペプチド複合体又は抗体を一種以上含有する組成物は、予防と治療の段階で、哺乳類中の選択された標的細胞集団を変質させ、不活性化し、殺し又は除去することを促進するのに利用されてもよい。さらに、本明細書に記載されているポリペプチド複合体と抗体の選択されたレパートリーは、細胞の異種コレクション由来の標的細胞集団を殺し、減少させ又は有効に除去するために、体外又はインビトロで選択して使用されてもよい。
【実施例1】
【0216】
予備実験で、二つのラマVHHエキソンが、ヒト重鎖の多様性(diversity)(D)セグメントと連結(joining)(J)セグメントに連結され、さらにCμ、Cδ、Cγ2、Cγ3ヒト定常領域遺伝子とヒト重鎖免疫グロブリン3’LCRがそれに続く重鎖遺伝子座を発現するトランスジェニックマウスを準備した。前記ヒトのCγ2とCγ3の遺伝子は、G→Aのスプライス変異を含有していた。Frt部位が存在していると、Flpにより仲介される組換えによって、多コピー導入遺伝子アレイから単一コピートランスジェニックマウスを生成することができる。しかし、G→Aスプライス変異を有するトランスジェニック遺伝子座由来の配列は、異所スプライシングであるが不完全なCH1の除去を示した(図9)。
【0217】
<構造体>
この問題を克服するため、標準の方法を使って、ゲノムコスミドライブラリーをVH遺伝子を含有するクローンについてスクリーニングした。一つ(又は二つ以上)の異なる生殖細胞系VHを、その配列に基づいて無作為に選んだ(ヒトVHの場合は五つの属クラス)。親水性アミノ酸のコドンを、IMGTナンバリング法(Lefranc et al.(1999)によって、42、49、50及び52の位置に導入した。これらのVH遺伝子は、カスタムメイドのリンカーを使う直接クローン化法又は相同的組換え法などの標準法によってBACベクター中に組み入れられた。
【0218】
二つのクローンすなわち、ヒト重鎖のDとJのセグメント、Cμ(IgM)及びCδ(IgD)を含有するクローン 1065 N8並びにCγ3(IgG3)遺伝子を含有するクローン1115 N15を、ヒトゲノムPacライブラリー RPCI−11(BACPAC Recource Center,USA)から選択した。異なるヒトゲノムライブラリー(Incyte Genomics,CA,USA)由来のBac clone 11771を、Cγ2(IgG2)遺伝子及び免疫グロブリン重鎖LCRの原料として使用した(Mills et al.(1997)J.Exp.Med.,15;186(6):845−58)。
【0219】
標準法を使って、Cγ3とCγ2の遺伝子を、別個に、pFastBacベクター(Invitrogen)中にサブクローン化した。同様に、残りの任意のIg定常領域をこれらのBACからクローン化できる(IgA、IgE)。CH1エキソンの完全な欠失は、各定常領域のCH1エキソンの隣に位置する配列を使って、相同的組換え法(Imam et al.,(2001))によって達成した。Frt部位を、Cμスイッチ領域の前に任意選択的に導入し、標準的な手段で(例えばrosa−flpマウスと交配することにより)インビボにてflpリコンビナーゼで処理することによって、多コピー遺伝子座から単一コピー遺伝子座を生成させることができた(図10)。
【0220】
別個のVH遺伝子、DとJのセグメント及びCとLCRのエキソンを、通常の制限消化−連結法又は相同組換え法(又は両方を混合した方法)又は任意の他のクローン化法によって、一つのBAC中にクローン化した。次いでさらに別の構造体を作製することができた。
【0221】
<IgMのみ遺伝子座>
IgM構造体を得るため(図11)、ヒトのDとJの重鎖セグメント及びCμが続く一つ以上のVH遺伝子(好ましくは、可溶性を提供するため遺伝子工学的に処理されたヒトVH遺伝子又はラクダVHH遺伝子)をBAC中にクローン化した(本方法については上記を参照のこと)。この場合、Cμ領域だけが、最終のBAC中にクローン化された。
【0222】
<IgMプラスIgG遺伝子座(Cδは任意選択的)>
IgMプラスIgG構造体を得るため(図12)、ヒトのDとJの重鎖セグメント、Cμ(CH1エキソンは含有しないがCH4エキソンは含有する)、(任意選択的なCδ)及び修飾されたヒトCγ2とCγ3遺伝子と3’LCRが続く一つ以上のVH遺伝子(好ましくは、可溶性を提供するため遺伝子工学的に処理されたヒトVHセグメント又はラクダVHH遺伝子)をBAC中にクローン化した。IgGのみ遺伝子座を生成させるために、loxP部位を、標準クローン化ステップ(上記)によって導入し次いでそのBACを294 Cre大腸菌株中で成長させ(Buscholz et al.)、次いでcreにより仲介される組換え法によってIgGのみ遺伝子座を産生する細菌を得た。さらなる構築の詳細については先の説明を参照のこと。
【0223】
<IgMプラスIgG遺伝子座(Cδは任意選択的)>
IgMプラスIgG構造体を得るため(図13)、ヒトのDとJの重鎖セグメント、Cμ(CH1とCH4を含有する)、(任意選択的なCδ)及び修飾されたヒトCγ2とCγ3遺伝子と3’LCRが続く一つ以上のVH遺伝子(好ましくは、可溶性を提供するため遺伝子工学的に処理されたヒトVH遺伝子又はラクダVHH遺伝子)をBAC中にクローン化した。IgGのみ遺伝子座を生成させるために、loxP部位を、標準クローン化ステップ(上記)によって導入し次いでそのBACを294 Cre大腸菌株中で成長させ(Buscholz et al.)、次いでcreにより仲介される組換え法によってIgGのみ遺伝子座を産生する細菌を得た。
【0224】
<トランスジェニックマウス、飼育とゲノタイピング>
受精卵に対する標準マイクロインジェクション法又は胚幹細胞トランスフェクション法によって、前記最終BACを、トランスジェニックマウスに導入した。
【0225】
5’末端と3’末端の遺伝子座プローブを使って末端tailDNAをサザンブロット分析することによって(Southern 1975)、トランスジェニック遺伝子座を、完全性とコピー数についてチェックした。初代マウス(founder)は、μMT−/−バックグランドの系統中で繁殖させた。その遺伝子座の異なる領域各々についてプライマーを使って標準PCR分析することによって、ゲノタイピングを実施した。Cγ2とCγ3の両方から全CH1エキソンを除かれたトランスジェニックマウス(HLLラインを有するもの及びCμとCδの遺伝子を有しないもの)のBM cDNA由来のRT−PCR産物の配列を分析したところ、そのトランスジェニック遺伝子座は、VDJを組換えることができるのみならず、そのIgGの転写産物が、ラマやラクダのHCAbに見られる転写産物に似ていることを示した。
【0226】
<免疫組織化学>
脾臓をOCT化合物中に包埋した。クライオスタットによる5μmの凍結切片をアセトン中で固定し、すでに述べられているようにして(Leenen et al.1998)単一又は二重の標識を行った。モノクローナル抗体抗B220/RA3−6B2、モノクローナル抗体抗CD11c/N418(Steinman et al.1997)にはハイブリドーマ培養上澄み液が用いられた。ペルオキシダーゼを連結したヤギ抗ヒトIgG及びヤギ抗ヒトIgMをSigmaから入手した。第二ステップの試薬は、ペルオキシダーゼの標識をつけた、ヤギ抗ラットIg(DAKO,Glostrup,Denmark)もしくはヤギ抗ハムスターIg(Jackson ImmunoResearch Laboratories,West Grove,AL,USA)及びヤギ抗ラットIgアルカリホスファターゼ(Southern Biotechnology,Birmingam,AL,USA)であった。
【0227】
図15は、μMT−/−バックグランド中のμMT−/−、WTとHLL及びHLL−MDのトランスジェニックマウス由来の脾臓の5μm凍結切片を免疫組織化学分析した結果を示す。切片を、B細胞は抗B220(ブルー)で染色し、そして樹枝状細胞は抗CD11c/N418(褐色)で染色した。矢印はB細胞の小クラスターの位置を示す。
【0228】
<フローサイトメトリー分析>
単一細胞の懸濁液を、(Slieker et al.1993)、PBS中のリンパ系器官から調製した。約1×106個の細胞を抗体とともに、96ウェルプレート中のPBS/0.5%ウシ血清アルブミン(BSA)内で4℃にて30分間インキュベートした。細胞をPBS/0.5%BSA中で2回洗浄した。各試料について、FACScan analyzer(Becton Dickinson,Sunnyvale,CA)を使って、3×104個の細胞を計測した。FACSのデータは、CellQuest version 1.0 computer softwareを使って分析した。四色分析を、Becton Dickinson FACS Caliburで実施した。以下のmAb:FITC複合抗B220−RA3−6B2及びPE複合抗CD19をBD Pharmingen(San Diego,CA)から入手した。抗CD19及び抗B220で染色した脾臓細胞のFACSスキャンデータを図15の下部のパネルに示した。
【0229】
図15の左側に、HLL系−FlpeRトランスジェニック系を交配することによるインビボFlp組換えを提示してあり、これは組換え体の脾臓細胞に関するFACSスキャンデータを支持し、直接生成した元のHLL−MD系に見られるようなB細胞のレスキュー(rescue)を示している。右側には、Cag Creトランスジェニック系の飼育することによるインビボCre組換えと単一コピーの組換え体の脾臓細胞に関するFACSデータを示してある。
【0230】
<免疫付与とハイブリドーマの産生(図14)>
二つのラマVHHドメイン、ヒトのDとJの領域及びIgG2とIgG3の定常領域(CH1ドメインは含まない)からなる重鎖のみ抗体の遺伝子座を含有するトランスジェニックマウスを作製した。
【0231】
8週齢のマウスを、大腸菌熱ショックタンパク質70(hsp70)で免疫した。Specolアジュバント(IDDLO,Lelystadt,NL)を含有する抗原20μg又は5μgを、それぞれ、0日目、14日目、28日目、42日目に皮下注射し50日目に腹腔内注射した。0日目、14日目及び45日目に採血した。3回ブーストを行った後、Hsp70タンパク質で免疫したHLL−MD1マウス3匹のうち1匹に低力価の抗原特異的抗体が検出された(図14)。
【0232】
標準の脾臓細胞を黒色腫細胞系と融合させて、hsp70タンパク質に対するモノクローナル抗体をモノクローナルハイブリドーマ細胞系中に生成させた。その抗HSP70HCAbは、ヒトIgHD3−10セグメントに組換えられたD領域に最も近いラマVHHセグメント(VHH 2)(acc.num.X13972)及びヒトIgHJ4−02セグメント(acc.num.X86355)からなっている。頻度は高くないが、前記VHHは、生殖細胞系の配置構成と比べて図9Aに示すアミノ酸の変化を起こす突然変異を数回行なう。RT−PCR分析の結果もそのハイブリドーマ内に生産的IgH転写体を一つだけ示したが、これは他の転写体が全く生成しないことを示唆している。αHSP70 IgG2抗体は重鎖のみ二量体として分泌される(変性ゲル(二量体)及び非変性ゲル(モノマー)条件下のウエスタンブロット法、図14)。ClonalCellTM−HY kit(StemCell Technologies,UK)を生産者の指示に従って使用し、脾臓細胞を、56日目に、Sp2−O−Ag14黒色腫細胞(R.Haperen氏からの寄贈)と融合させた。
【0233】
二つのラマVHHドメイン、ヒトのDとJの領域、ヒトのIgM及びIgG2とIgG3の定常領域(全てCH1ドメインは含まない、図12)からなる重鎖のみ抗体の遺伝子座を含有するトランスジェニックマウスを、TNFαで免疫してHC−IgM抗体を得た。3匹のマウスのうち1匹が、標準ELISA検定法で陽性の血清を示した。標準的な黒色腫融合によって陽性のIgMハイブリドーマを得た(図16)。非還元条件下、Sepharose 6Bでゲル濾過した後、カラムの各画分を還元条件下のゲルに負荷し次いで抗ヒトIgM−HRPによって検出した(図20)。非還元条件下での分画は、HC−IgMが、ヒトの対照IgMと同じ大きさ(HC−IgMには欠けている軽鎖とCH1ドメインの分子量を差し引いた後)の多量体抗体として分泌されることを示した。各カラム画分の還元条件下でのゲル分画は、図20に示す予想モノマーを示した。
【0234】
<血清Ig ELISA>
15〜25週齢のマウスから血液を、EDTAをコートしたチューブに集めて、室温(RT)で15分間遠心し、次いでその上澄み液をPBSで1:5の比率で希釈した。96ウェルプレートを、5mg/ml濃度のヤギ抗ヒトIgG(YES Biotechnology)又はヤギ抗ヒトIgM(Sigma)で2時間コートし、PBSで洗浄し、ブロッキング溶液(1.5%BSA/1.5%粉乳/0.1%tween20/PBS)でRTにて1時間ブロックし、次にPBSで3回洗浄した。血清試料と標準液(ヒトIgG2又はヒトIgM(Sigma,Zwijndrecht,NL))の希釈シリーズを負荷して2〜4時間インキュベートし次いでプレートをPBSで6回洗浄した後、第二抗体(HRPに連結したヤギ抗ヒトIgG又はヤギ抗ヒトIgMを1:2000の比率で希釈したもの(Sigma,Zwijndrecht,NL))を添加した。希釈は全てブロッキング溶液で実施した。RTで1〜2時間インキュベートしてPBSで洗浄した後、POD基質(Roche)を添加した。
【0235】
IgG2ファージライブラリーから抗原特異的可溶性sdAbを検出するELISA試験の結果を図16に示す。可溶性sdAbを、抗原をコートしたプレートに対する第一抗体として使用し続いてマウス抗myc抗体及びHRP複合ヤギ抗マウス抗体を使った。PODを基質として使った。下部のパネルは、制限酵素Hinf Iによるクローンのフィンガープリンティングを示し、これはB.Pertusisに対するsdAbをコードする5個の異なるインサートを示している。
【0236】
<抗体ライブラリーの構築とスクリーニング>
Ultraspec RNA isolation system(Biotex Laboratories,Houston,Texas,USA)を使って、DKTPで免疫した単一コピーIgGのみマウスの脾臓から全RNAを単離した(図12 cre処理をした後)。oligo dTを使ってcDNAを作製した。vhl back SfiIプライマー(Dekker et al 2003)をhIgG2hingrevプライマー(5’−AATCTGGGCAGCGGCCGCCTCGACACAACATTTGCGCTC−3’)と組み合わせた特異的プライマーを使用してPCRによって、VHHのDJフラグメントをコードするDNAフラグメントを増幅した。その増幅されたVHHのDJフラグメント(約400 bp)を、Sfi I/Not Iで消化し、ゲルで精製し次いでSfi I/NotIで消化したファージミドベクターpHEN−1中にクローン化した。
【0237】
TG1エレクトロコンピテント細胞に形質転換して、ヒト単一ドメイン抗体を生産する抗体ライブラリーを得た。プラスティック(希釈されていないワクチンをコートしたイムノチューブ)に吸着させたワクチン抗原にパニングを行なって、2ラウンドの選択を実施した。制限分析と配列決定は標準の方法でおこなった。
【0238】
<重鎖のみ遺伝子座のRT−PCR>
HLL−MD遺伝子座が、多様な抗体レパートリーを産生する際に正常な遺伝子座として機能するかどうかを、パイエル板由来のcDNAに対してIgG2とIgG3の特異的プライマーを使って得たRT−PCR産物の配列を決定することによって試験した。図17は、免疫されていないマウス(左パネル)と免疫されたマウス(右パネル)由来のクローンの体細胞変異のいくつかの例を示す。これらのマウスは、IgGのみ遺伝子座、大腸菌hsp70、百日咳菌溶解物、破傷風トキソイドで免疫されたものであった。灰色の影付きの部分はERKCCVで始まるIgG2ヒンジ領域である。
【0239】
パイエル板のRT−PCRによる分析は、両VHを使うことを示したが、配列を決定された全ての抗体は、VH2を再構成していた。レパートリーの多様性の起源は、DとJのセグメントの選択及びV−DとD−Jの結合部によって形成されたCDR3領域である。ヒトJセグメントを使うことは、ヒトの再構成に見られるのと類似しており、JH4とJH6のセグメントが最も頻繁に使用される。
【0240】
この分析は、多様な抗体のレパートリーに寄与するために、両VH、異なるヒトDセグメント及び全てのヒトJセグメントを使われることを示した。再構成された各遺伝子を、その生殖細胞系のカウンターパートすなわちトランスジェニック構造体中の元のVHと比較することによって、IgG3をスイッチされたB細胞が存在し、体細胞の変異が起こっていることも分かった(図17参照)。したがって、ヒト重鎖のみIgG抗原受容体は、B細胞成熟に必要な信号を提供できる。
【0241】
<免疫染色>
図18は、A5抗体(Dekker et al.2003)を含有する応答プラスミドで追加的にトランスフェクトされたTet−on細胞系の一つを免疫染色した結果を示す。上のパネルは、ドキシサイクリンによって細胞質中に誘発され産生したA5抗体(赤色)及びDAPIによる細胞核の染色(青色)を示す。下のパネルは、核の中にrtTAを発現する細胞が、誘発(上のパネル)によってA5を産生する細胞であることを示す。下記配列を有するrtTAに対するヒトHCAbのうちの一種で染色を実施した(緑色)。FITC複合ヤギ抗ヒトIgGを第二ステップとして使用した。Dekker et al.2003にすでに記載されているようにして、A5を検出した。rTTA抗体は下記配列を有するIgG3であった。
【化1】

【0242】
このIgG3のヒンジは、アミノ酸198 ELKTPLから始まる。比較のため図17のIgG2ヒンジ領域を参照されたい。
【0243】
<ウエスタンブロット分析>
図19は、IgMプラスIgG遺伝子座(図10)を含有する異なるトランスジェニックマウス系の血清の、cre処理を行った後(すなわち、IgMが欠失しIgGのみ残留)のウエスタンブロットを示す。血清は、prot Gで精製し次いで還元条件下(図19の右のパネル)及び非還元条件下(図19の左のパネル)でゲル分画を行なった。対照は、バックグランドのKOマウス及び正常なヒトの血清の試料である。ヒト重鎖のみIgGが二量体であることを示す二つのゲルのサイズ間の差に留意されたい。
【0244】
図19に示した信号は、標準の方法によって抗ヒトIgG抗体で検出した。
【0245】
IgMプラスIgG遺伝子座マウスによって産生されるヒトIgMのサイズ分画
IgMプラスIgGマウス(図13)由来の血清を、対照のヒト血清の試料と混合した後、非還元条件下でゲル濾過することによって分画した。結果を図20に示す。カラムの複合体の分子量は、各レーンについて(各画分を示す)左から右に進むにつれて減少する。これら画分(各レーン)を、還元条件下にてゲル電気泳動法で分析した。
【0246】
ヒトTNFαで免疫された、IgMプラスIgG(図13)遺伝子座を含有するマウスから作製した多数のハイブリドーマのELISA分析を実施した。結果を図21に示す。図21の上部2列は抗ヒトIgGを分析した結果であり、次の2列は抗ヒトIgMを分析した結果である。血清試料(二つの矢印)は、このマウスがIgG抗TNFα抗体とIgM抗TNFα抗体の両者を産生したことを示している。単一矢印は、陽性IgMハイブリドーマを示す。それらのウェルは、市販のヒトTNFαでコートした。処理は全て標準法で行なった。
【実施例2】
【0247】
二重特異性二価抗体を、二つの重鎖のみモノ特異性抗体を結合させることによって生成させた。その第一抗体は、第一特異性とエフェクター機能(可変領域と定常領域それぞれの)をもたらす骨格を形成する。この第一抗体は、第二特異性を有する第二抗体と、新たに設計されたヒンジによって結合させる。このヒンジは、既存のIgG2のヒンジの配列と類似しているが、システインをプロリンで置換することによって変化させて、抗体二量体のシステインの架橋を防止し、かつプロリンで追加の可撓性を提供して、機能を阻害することがある第二抗体の立体束縛を防止した。
【0248】
最初の骨格抗体は、大腸菌HSP70タンパク質に対する抗体であった。このHSP70抗原を、先に述べたようにして(上記図14参照)、重鎖のみ抗体遺伝子座を含有するトランスジェニックマウスに注射した。標準のハイブリドーマ融合法によって、これらの動物からモノクローナル抗体を生成させた(上記事項参照)。次に、抗HSP抗体をコードするcDNAを、標準のRT−PCR組換えDNA法によってクローン化して、5’末端から3’末端まで(N末端からCOOH末端までのタンパク質の)、開始コドンATG、シグナルペプチドの配列、可変ドメインVHH1(Janssens et al参照)、組換えたDとJの領域及びCγ2の定常領域(CH1領域を欠いている)を含有するが、ストップコドンとポリA部位を含むプラスミドを得た(図22の左上部)。フォワードプライマーとリバースプライマーを使ってクローン化するため、抗HSP70抗体をコードするcDNAをPCRで増幅した。
【0249】
フォワードプライマーは、クローン化を行なうためのEcoRI部位(下線)、有効な翻訳開始配列(太文字)及び通常の開始コドン(灰色の影付き)を提供する
【化2】

であった。
【0250】
リバースプライマーは、HindIIIクローニング部位(下線)を提供し通常のストップコドンを保持する
【化3】

であった。
【0251】
したがって、増幅によって、EcoRI部位(下線)を含有するEcoRI/HindIIIフラグメントに、抗HSP抗体遺伝子の有効翻訳開始配列(太字)と通常の開始コドン(灰色の影付き)が導入される。
【0252】
リバース3’末端プライマーは、HindIIIクローニング部位(下線)を提供し通常のストップコドンを除く
【化4】

であった。これによって、プロモーター配列中にクローン化するためのEcoRI部位、及び発現プラスミドに対して5’末端を、かつ新たなヒンジ配列に対して3’末端をクローン化するためのHindIII部位を有するフラグメント(図22の頂部から2行目の左)を得た(下記参照)。最後に、そのフラグメントをEcoRI及びHindIIIで切断して、クローニングのための適正な単一標準末端を提供した。
【0253】
第二特異性をもたらす第二クローン化抗体は、ブタレトロウイルス(PERV)gag抗原に対するラマ抗体のVHHドメインを含んでいた(Dekker et al.,(2003)J.Virol.,77(22):12132−9,図22 頂部右)。抗gagは、以下のプライマーすなわちフォワードプライマー:
【化5】

及びリバースプライマー:
【化6】

を使って標準のPCR増幅法で増幅した。これは、5’末端を新しいヒンジを有するフレームにクローン化するためのXhoI部位(灰色の影付き)(下記参照)及び3’末端を発現プラスミド中にクローン化するためのEcoRI部位(下線)(図22右中央)を有する増幅フラグメント(図22頂部から2行目の右側)を提供する。最後に、そのフラグメントをEcoRIとXhoIで切断して、クローン化するための一本鎖末端を生成させた。
【0254】
これら二つの抗体の配列を、前記新しいヒンジによって組み合わせて一つのダイアボディにした。その新しいヒンジは、クローン化するための5’と3’のオーバーハング(overhang)(それぞれHindIIIとXhoIコンパティブル)を有する二本鎖オリゴヌクレオチドを形成する二つのオリゴヌクレオチドから作製した。このヒンジは、抗HSP70配列の末端及び抗gag配列の開始部分を有するフレーム内に位置するように設計した。ヒトIgG2ヒンジ中に通常存在しているスルフィド架橋が生成することは、システイン(灰色の影付き)をプロリン(下線)で置換することによって防止した。このプロリンは、ヒンジに追加の可撓性を付加して、第一抗体のCOOH末端にヒンジによって接続されることになる第二抗体ドメインを適正に機能させる。
【0255】
通常のIgGヒンジの配列(システインコドンは灰色の影付き、プロリンコドンは下線):
【化7】

及びその相補鎖は、
【化8】

及びその相補鎖:
【化9】

で置換した。またこれは、クローン化するためのHindIII部位(太字)とXhoI部位(イタリック体)とコンパティブルの二つの一本鎖末端を有するフラグメント(白囲み枠のヒンジ、図22の中央)を提供する。
【0256】
これら三つのフラグメント(抗HSP70 IgG2、ヒンジ及び抗gag)は、次いで鶏アクチンプロモーターとCMVエンハンサー配列を含有するブルースクリプト(bluescript)(Pbluescript11 sk+)発現プラスミド(図22の発現プラスミド)中に、標準の組換えDNA技術で連結した。このプラスミドが発現されると(下記参照)、図22の下部に示すダイアボディが生成する。
【0257】
ダイアボディ発現プラスミドを増殖させて、標準の方法(Superfect)によって、CHO細胞中に、プラスミドpGK−hygro(トランスフェクトされた細胞を選択させるため)とともに同時トランスフェクトされた(図23)。ハイグロマイシンを含有する培地で陽性のクローンを選択し、次いで抗ヒトIgG−HRP検出法を使ってCHO細胞が分泌したダイアボディを含有する増殖培地の抗gag ELISA標準分析(Dekker et al.,J.Virol.2003)を実施して、ダイアボディを発現した場合、陽性とした。抗aga活性を試験して陽性であれば、gagの特異性はそのダイアボディのバックエンド(COOH末端)にあるので、所与のクローンは恐らく間違いなく全ダイアボディを発現しているであろう。HSP70に関する次のELISA分析の結果も陽性であった。プラスミドから発現されたタンパク質が、110kDの二量体(図23の下部に示す)であったことを示すために、55kDのモノマー(非還元条件と還元条件でのウエスタンブロット、図23の右)と比較して、非還元条件下及び還元条件下にてELISA法で選択したこれらクローンのウエスタンブロットを実施した。したがって、ELISA分析結果とウエスタンブロットはともに、ダイアボディが、トランスフェクトされたCHO細胞によって二量体として発現されて培地中に分泌され(>70ng/ml)そしてその抗体はHSP70及びgagの抗原と結合できることを示している。しかし、その二量体のダイアボディ分子が前記抗原の両方に同時に結合できることは示していない。
【0258】
したがって、追跡実験を実施した。まず、gag抗原をプラスチック製ウェル(図24中央の第一ウェル)の底に固定した。次いで、クローン1のCHO細胞上澄み液を適用した後、ダイアボディ(図24の頂部)を第一抗原(gag)で捕獲した(図24中央の第二ウェル)。続いて、十分に洗浄し、次いで第二抗原(HSP70、図24中央の第三ウェル)を適用し続いて再び十分洗浄した。二重特異性抗体分子は、両抗原と同時に結合できたならば、第一抗原(gag)と結合し次いで第二抗原(HSP70)を捕獲することによってウェルの底に捕獲されているはずである。次いで全複合体をウェルから溶離したところ(図24中央の右側ウェル)、ダイアボディ体と両抗原が、ウエスタンブロット上に目視できるようになった(図24の下部)。
【0259】
分泌されたダイアボディを収集するために、CHOクローンを、同じ標準条件下で、抗体をハイブリドーマから集めるのに使用する培地(SIGMA ハイブリドーマ培地、血清無し)内で増殖させた。
【0260】
方法:Nunc−Immuno plate(Maxisorp)のウェルに、精製組換えgagタンパク質(PBS中12.5μg/ul)O/N 4Cをコートした。1%ミルク/1%BSA含有PBSで2時間ブロックした。PBS−ミルク−BSAで2倍に希釈したCHO−DBクローン1培地(又は対照)を、室温(RT)で3時間インキュベートした。PBS−ミルク−BSAで2倍に希釈した細菌B121の溶解物(HPS70タンパク質を含有する)を、RTで3時間インキュベートし次いで洗浄した。結合したタンパク質を、2−メルカプトエタノールを含有するレムリー(Laemmli)の試料緩衝液で溶離した。これら試料をウエスタンブロット法で分析した。したがって10%SDS−PAGEに泳動させ次いでニトロセルロース膜上にブロットした。そのブロットをPBS−ミルク−BSAで2時間ブロックし次いで第一抗体とともにインキュベートした。産生物を、眼に見える染色を実施できる酵素に結合された第二抗体を使う標準法で目視可能にした。使用した試薬は下記の通りである。
抗gag:ウサギポリクローナル(1:2000)2時間RT
抗ダイアボディ体:ヤギαヒトIgG−HRP(1:2500)2時間RT
抗HSP70:モノクローナルG20−380培地(1:2)2時間RT
二次抗体は、ヤギ抗ウサギーAP(1:2000)2時間RT及びHSP70モノクローナルに対するヤギ抗ヒトIgG−HRP(1:2500)2時間RTであった。
【0261】
タンパク質のバンドを目視可能にするために、アルカリホスファターゼ(AP)と反応する第一NBT/BCIP基質(紫色)及び西洋ワサビペルオキシダーゼ(HRP)と反応する第二DAB基質(褐色)を使用した。
【0262】
洗浄ステップは全て、PBS−0.05% Tween−20で実施した。
【0263】
一成分を除外するか又はダイアボディを産生しないCHO細胞由来の培地を添加することによって対照試験を実施した(図24)。すなわちダイアボディ無しの適用(トランスフェクトされていないCO細胞由来の培地)を欠いているのでgagのみを有するレーン2;ウェルの底にgagを欠いているので(ミルクタンパク質で置換されている)産生物が全く無いレーン3;gagとダイアボディを欠いているので産生物が全く無いレーン4;HSP70抗原を欠いているので(ミルク抗原で置換されている)ダイアボディとgagだけを有するレーン5;HSP70とダイアボディを欠いているのでgagだけを有するレーン6を利用して行なった。
【0264】
全3成分(ダイアボディ+両抗原)は、3成分全てを受け取ったレーン1のウェルにのみ存在していることは(図24の下部の図参照)、単一のダイアボディが両抗原に同時に結合することを示している。
【0265】
<二重特異性IgA又は多重特異性IgMの生成>
二重特異性IgAの生成は、IgGについて先に述べたのとほぼ同じであるが、Vhsol、D及びJに加えて、IgAを生成する定常領域Cαを使用する(図25)。
【0266】
IgMの生成はほとんど同じであるが、IgM分子は大きい多量体を形成することがあるので(J鎖があっても無くても)追加の可能性を提供する。したがって、上記分子に類似の分子に加えて(図26下部右、多量体化配列を除いた後)、異なる特異性を有するIgMを単に同時発現することによって多量体を生成させることもできる(図26下部左)。
【実施例3】
【0267】
PSCA(前立腺幹細胞抗原)に結合する結合ドメイン及びJunのロイシンジッパーモチーフと抗体ヒンジからなる会合ドメインを含む重鎖並びにFosのロイシンジッパーモチーフからなる相補的会合ドメイン、CH2ドメイン及びCH3ドメインを含む軽鎖を含むポリペプチド複合体をコードする発現ベクターを、Sambrook et al.(1989)Molecular Cloning−A Laboratory Manual,Cold Spring Harbor Laboratory Pressによって記載されているような分子生物学の技術を使って構築する。
【0268】
その発現ベクターを、次に、通常の技術によって、適切な宿主細胞に移行させて、そのベクターを最適に発現するトランスフェクトされた宿主細胞を作製する。前記トランスフェクトされたか又は形質転換された宿主細胞を、次に当業者に知られている任意の適切な方法を使って培養して本発明のポリペプチド複合体を産生させる。
【0269】
ポリペプチド複合体は、産生されたならば、クロスフロー濾過法、硫酸アンモニウム沈殿法及びアフィニティカラムクロマトグラフィ(例えば、プロテインA)を含む当分野の標準方法で精製する。
【0270】
次に当業者に知られている技術を使って、3,3’−ジインドリルメタン(DIM)からなる可溶性エフェクタードメインを、相補的会合ドメインに融合させる。
【実施例4】
【0271】
AFP(抗フェトプロテイン)に結合する可溶性VHH結合ドメイン並びにJunのロイシンジッパーモチーフ及び抗体ヒンジからなる会合ドメイン、CH2ドメイン及びCH3ドメインを含む本発明のポリペプチド複合体の重鎖をコードする発現ベクターを、Sambrook et alに記載されている分子生物学の技術を使って構築する。
【0272】
本発明のポリペプチド複合体の軽鎖をコードする第二発現ベクターも構築する。これは、Fosのロイシンジッパーモチーフからなる相補的会合ドメインを含む。
【0273】
次にこれら発現ベクターは、通常の技術によって適切な宿主細胞に移され、そのベクターを最適に発現する同時にトランスフェクトされた宿主細胞が産生される。次にこれらのトランスフェクトされたか又は形質転換された宿主細胞は、当業者に知られている任意の適切な技術を使って培養されて、本発明のポリペプチド複合体を産生する。
【0274】
ポリペプチド複合体は、産生されたならば、クロスフロー濾過法、硫酸アンモニウム沈殿法及びアフィニティカラムクロマトグラフィ(例えば、プロテインA)を含む当分野の標準方法で精製する。
【0275】
次に当業者に知られている技術を使って、3,3’−ジインドリルメタン(DIM)からなる可溶性エフェクタードメインを、相補的会合ドメインに融合させる。
【実施例5】
【0276】
<VCAMとVLA−4>
PSCA(前立腺幹細胞抗原)に結合する結合ドメイン及びVCAMと抗体ヒンジからなる会合ドメイン、CH2ドメイン及びCH3ドメインを含む重鎖;並びにリシンA毒素に融合したVLA−4からなる相補的会合ドメインを含む軽鎖を含むポリペプチド複合体をコードする発現ベクターを、Sambrook et alに記載されている分子生物学の技術を使って構築する。
【0277】
次にその発現ベクターは、通常の技術によって適切な宿主細胞に移され、そのベクターを最適に発現するトランスフェクトされた宿主細胞が産生される。次にそのトランスフェクトされたか又は形質転換された宿主細胞は、当業者に知られている任意の適切な技術を使って培養されて、本発明のポリペプチド複合体を産生する。
【0278】
ポリペプチド複合体は、産生されたならば、クロスフロー濾過法、硫酸アンモニウム沈殿法及びアフィニティカラムクロマトグラフィ(例えば、プロテインA)を含む当分野の標準方法で精製する。
【実施例6】
【0279】
PSCA(前立腺幹細胞抗原)に結合する結合ドメイン及びJunのロイシンジッパーモチーフと抗体ヒンジからなる会合ドメイン、CH2ドメイン及びCH3ドメインを含む重鎖;並びにFosのロイシンジッパーモチーフ及びプリンヌクレオシドホスホリラーゼ(PNP)をコードする可溶性エフェクタードメインからなる相補的会合ドメインを含む軽鎖を含むポリペプチド複合体をコードする発現ベクターを、Sambrook et alに記載されている分子生物学の技術を使って構築する。
【0280】
次にその発現ベクターは、通常の技術によって適切な宿主細胞に移され、そのベクターを最適に発現するトランスフェクトされた宿主細胞が産生される。次にそのトランスフェクトされたか又は形質転換された宿主細胞は、当業者に知られている任意の適切な技術を使って培養されて、本発明のポリペプチド複合体を産生する。
【0281】
ポリペプチド複合体は、産生されたならば、クロスフロー濾過法、硫酸アンモニウム沈殿法及びアフィニティカラムクロマトグラフィ(例えば、プロテインA)を含む当分野の標準方法で精製する。
【0282】
PNPは、フルダラビンを、PNP酵素を含む細胞を殺し次いでさらに拡散して周囲の未感染細胞を殺す毒性代謝産物の2−フルオロアデニンに変換する(局部バイスタンダー効果)。
【実施例7】
【0283】
糖タンパク質抗原gp120のV3−PND領域に結合する可溶性VHH結合ドメイン並びにJunのロイシンジッパーモチーフ及び抗体ヒンジからなる会合ドメイン、CH2ドメイン及びCH3ドメインを含む本発明のポリペプチド複合体の第一の重鎖をコードする発現ベクターを、Sambrook et alに記載されている分子生物学の技術を使って構築する。
【0284】
GP−41に結合する可溶性VHH結合ドメイン並びにJunのロイシンジッパーモチーフ及び抗体ヒンジ、CH2とCH3のドメインからなる会合ドメインを含む本発明のポリペプチド複合体の第二の重鎖をコードする第二発現ベクターも構築する。
【0285】
本発明のポリペプチド複合体の軽鎖をコードする第三発現ベクターも構築する。このベクターはFosのロイシンジッパーモチーフからなる相補的会合ドメインを含む。
【0286】
次にこれら発現ベクターは、通常の技術によって適切な宿主細胞に移され、そのベクターを最適に発現する同時にトランスフェクトされた宿主細胞が産生される。次にそのトランスフェクトされたか又は形質転換された宿主細胞は、当業者に知られている任意の適切な技術を使って培養されて、本発明のポリペプチド複合体を産生する。
【0287】
ポリペプチド複合体は、産生されたならば、クロスフロー濾過法、硫酸アンモニウム沈殿法及びアフィニティカラムクロマトグラフィ(例えば、プロテインA)を含む当分野の標準方法で精製する。
【0288】
次いでHIV−1 MN V3(PND)ペプチド免疫原からなる可溶性エフェクタードメインを、当業者に知られている技術を使って、前記相補的会合ドメインに融合させる。
【実施例8】
【0289】
糖タンパク質抗原のV3−PND領域に結合する可溶性VHH結合ドメインを含む本発明のポリペプチド複合体の第一の重鎖をコードする発現ベクターを、Sambrook et al.,(1989)Molecular Cloning−A Laboratory Manual,Cold Spring Harbor Laboratory Pressに記載されている分子生物学の技術を使って構築する。
【0290】
GP−41に結合する可溶性VHH結合ドメインを含む本発明のポリペプチド複合体の第二の重鎖をコードする第二発現ベクターも構築する。
【0291】
これら二つの重鎖は、これら二つの重鎖の定常領域が同一のμ、CH2、CH3及びCH4のドメインを含むことが特徴である。
【0292】
次にこれらの発現ベクターは、通常の方法でJ鎖を恒常的に発現する宿主細胞に移され、そのベクターを最適に発現する同時にトランスフェクトされた宿主細胞を産生する。次にそのトランスフェクトされたか又は形質転換された宿主細胞は、当業者に知られている任意の適切な技術を使って培養されて、本発明のポリペプチド複合体を産生する。
【0293】
ポリペプチド複合体は、産生されたならば、クロスフロー濾過法、硫酸アンモニウム沈殿法及びアフィニティカラムクロマトグラフィ(例えば、プロテインA)を含む当分野の標準方法で精製する。
【0294】
次いでHIV−1 MN V3(PND)ペプチド免疫原からなる可溶性エフェクタードメインを、当業者に知られている技術を使って、前記相補的会合ドメインに融合させる。
【0295】
本明細書に挙げた刊行物は全て参照により本明細書に組み込まれるものである。
【0296】
本発明の前記方法とシステムの各種変形と変化が本発明の範囲と精神から逸脱しないことは、当業者には明らかであろう。本発明は、特定の好ましい実施形態に関連させて説明してきたが、特許請求の範囲に記載されている本発明は、このような特定の実施形態に不当に限定されるべきでないと解すべきである。実際に、生化学、分子生物学及びバイオテクノロジー又は関連分野の当業者には明らかな、本発明を実施するため述べた方式の各種変形は、特許請求の範囲に含まれるものである。
【特許請求の範囲】
【請求項1】
(a)異種のVH重鎖遺伝子座を発現するヒトを除くトランスジェニック哺乳類を提供するステップと、ここで、
(i)VH重鎖遺伝子座は、少なくとも一つのVH遺伝子セグメントと、少なくとも一つのD遺伝子セグメントと、少なくとも一つのJ遺伝子セグメントと、少なくとも一つの重鎖定常領域とを含む可変領域を含み、
(ii)各定常領域は機能性CH1ドメインをコードしておらず、
(iii)V遺伝子セグメント、D遺伝子セグメント及びJ遺伝子セグメントは、組み換えられてVDJコーディング配列を生成でき、
(iv)前記組み換えられたVH重鎖遺伝子座は、発現されると、機能性CH1ドメインを欠いた定常エフェクター領域と抗原特異的可溶性VHドメインとを含む可溶性の重鎖のみ抗体を生成でき、
(b)前記ヒトを除くトランスジェニック哺乳類を抗原により免疫するステップと
を含む、VH重鎖のみ抗体を製造する方法。
【請求項2】
前記ヒトを除くトランスジェニック哺乳類の免疫後、前記VH重鎖のみ抗体をコードする前記VH遺伝子座は体細胞変異によって親和性成熟を獲得する、請求項1に記載の方法。
【請求項3】
前記ヒトを除くトランスジェニック哺乳類は、軽鎖を含む内因性抗体を産生する能力を低減するように遺伝子工学的に処理されている、請求項1又は2に記載の方法。
【請求項4】
前記哺乳類に内在している免疫グロブリンの重鎖遺伝子座は、欠失又は抑止されている、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
請求項1〜4のいずれか一項に記載の方法であって、前記免疫は、トランスジェニック哺乳類に抗原を注射するステップを含み、さらに、前記方法は、
(c)目的とする抗原特異的重鎖のみ抗体を発現する細胞又は組織を単離するステップと、
(d)ステップ(c)の細胞又は組織からハイブリドーマを産生するステップと、
(e)前記ハイブリドーマ由来の重鎖のみ抗体mRNAをクローニングするステップと、
(f)前記重鎖のみ抗体を異種発現系中で産生するステップと
を含む方法。
【請求項6】
請求項1〜4のいずれか一項に記載のステップを含む抗原特異的可溶性VHドメインを製造する方法であって、前記免疫は、トランスジェニック哺乳類に抗原を注射するステップを含み、さらに、前記方法は、
(c)目的とする抗原特異的重鎖のみ抗体を発現する細胞又は組織を単離するステップと、
(d)ステップ(c)の細胞又は組織からハイブリドーマを産生するステップと、
(e)前記ハイブリドーマ由来の重鎖のみ抗体mRNAをクローニングするステップと、
(f)ステップ(e)のクローニングされたmRNAから抗原特異的可溶性VHドメインを単離同定するステップと、
(g)前記抗原特異的可溶性VHドメインを異種発現系中で産生するステップと
を含む方法。
【請求項7】
請求項1〜4のいずれか一項に記載のステップを含む抗原特異的可溶性VHドメインを製造する方法であって、前記免疫は、トランスジェニック哺乳類に抗原を注射するステップを含み、さらに、前記方法は、
(c)目的とする抗原特異的重鎖のみ抗体を発現する細胞又は組織を単離するステップと、
(d)前記単離された細胞又は組織由来のmRNAからVH遺伝子座をクローニングするステップと、
(e)ファージ又は類似のライブラリーを用いてコードされたタンパク質をディスプレイするステップと、
(f)抗原特異的可溶性VHドメインを同定するステップと、
(g)前記抗原特異的可溶性VHドメインを単独で、または融合体として発現させるステップと
を含む方法。
【請求項8】
前記VH重鎖遺伝子座は、哺乳類のV、D及びJ遺伝子セグメントを含む、請求項1〜7のいずれか一項に記載の方法。
【請求項9】
前記VH重鎖遺伝子座は、ヒトのV、D及びJ遺伝子セグメントを含む、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
各重鎖定常領域がヒト起源のものである請求項1〜9のいずれか一項に記載の方法。
【請求項11】
各重鎖定常領域がヒトでない脊椎動物起源のものである請求項1〜10のいずれか一項に記載の方法。
【請求項12】
前記VH重鎖遺伝子座は、複数のV遺伝子セグメントと、複数のD遺伝子セグメントと、複数のJ遺伝子セグメントとを含む請求項1〜11のいずれか一項に記載の方法。
【請求項13】
V遺伝子セグメントは、改善された溶解度を示すように選択、変異又は遺伝子工学的に処理されている請求項1〜12のいずれか一項に記載の方法。
【請求項14】
請求項1〜5又は8〜13のいずれか一項に記載の方法により得られる重鎖のみ抗体。
【請求項15】
請求項8〜13のいずれか一項に記載の方法により得られる抗原特異的可溶性VHドメイン。
【請求項16】
治療に使用するための、請求項14に記載の重鎖のみ抗体又は請求項15に記載の抗原特異的可溶性VHドメイン。
【請求項17】
請求項15に記載の一以上の抗原特異的可溶性VHドメインの、単独又は相補的会合ドメインを含みかつ追加のエフェクター活性を有する別のエフェクター鎖と組み合わせた、二価又は多価のポリペプチド複合体の産生のための使用。
【請求項1】
(a)異種のVH重鎖遺伝子座を発現するヒトを除くトランスジェニック哺乳類を提供するステップと、ここで、
(i)VH重鎖遺伝子座は、少なくとも一つのVH遺伝子セグメントと、少なくとも一つのD遺伝子セグメントと、少なくとも一つのJ遺伝子セグメントと、少なくとも一つの重鎖定常領域とを含む可変領域を含み、
(ii)各定常領域は機能性CH1ドメインをコードしておらず、
(iii)V遺伝子セグメント、D遺伝子セグメント及びJ遺伝子セグメントは、組み換えられてVDJコーディング配列を生成でき、
(iv)前記組み換えられたVH重鎖遺伝子座は、発現されると、機能性CH1ドメインを欠いた定常エフェクター領域と抗原特異的可溶性VHドメインとを含む可溶性の重鎖のみ抗体を生成でき、
(b)前記ヒトを除くトランスジェニック哺乳類を抗原により免疫するステップと
を含む、VH重鎖のみ抗体を製造する方法。
【請求項2】
前記ヒトを除くトランスジェニック哺乳類の免疫後、前記VH重鎖のみ抗体をコードする前記VH遺伝子座は体細胞変異によって親和性成熟を獲得する、請求項1に記載の方法。
【請求項3】
前記ヒトを除くトランスジェニック哺乳類は、軽鎖を含む内因性抗体を産生する能力を低減するように遺伝子工学的に処理されている、請求項1又は2に記載の方法。
【請求項4】
前記哺乳類に内在している免疫グロブリンの重鎖遺伝子座は、欠失又は抑止されている、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
請求項1〜4のいずれか一項に記載の方法であって、前記免疫は、トランスジェニック哺乳類に抗原を注射するステップを含み、さらに、前記方法は、
(c)目的とする抗原特異的重鎖のみ抗体を発現する細胞又は組織を単離するステップと、
(d)ステップ(c)の細胞又は組織からハイブリドーマを産生するステップと、
(e)前記ハイブリドーマ由来の重鎖のみ抗体mRNAをクローニングするステップと、
(f)前記重鎖のみ抗体を異種発現系中で産生するステップと
を含む方法。
【請求項6】
請求項1〜4のいずれか一項に記載のステップを含む抗原特異的可溶性VHドメインを製造する方法であって、前記免疫は、トランスジェニック哺乳類に抗原を注射するステップを含み、さらに、前記方法は、
(c)目的とする抗原特異的重鎖のみ抗体を発現する細胞又は組織を単離するステップと、
(d)ステップ(c)の細胞又は組織からハイブリドーマを産生するステップと、
(e)前記ハイブリドーマ由来の重鎖のみ抗体mRNAをクローニングするステップと、
(f)ステップ(e)のクローニングされたmRNAから抗原特異的可溶性VHドメインを単離同定するステップと、
(g)前記抗原特異的可溶性VHドメインを異種発現系中で産生するステップと
を含む方法。
【請求項7】
請求項1〜4のいずれか一項に記載のステップを含む抗原特異的可溶性VHドメインを製造する方法であって、前記免疫は、トランスジェニック哺乳類に抗原を注射するステップを含み、さらに、前記方法は、
(c)目的とする抗原特異的重鎖のみ抗体を発現する細胞又は組織を単離するステップと、
(d)前記単離された細胞又は組織由来のmRNAからVH遺伝子座をクローニングするステップと、
(e)ファージ又は類似のライブラリーを用いてコードされたタンパク質をディスプレイするステップと、
(f)抗原特異的可溶性VHドメインを同定するステップと、
(g)前記抗原特異的可溶性VHドメインを単独で、または融合体として発現させるステップと
を含む方法。
【請求項8】
前記VH重鎖遺伝子座は、哺乳類のV、D及びJ遺伝子セグメントを含む、請求項1〜7のいずれか一項に記載の方法。
【請求項9】
前記VH重鎖遺伝子座は、ヒトのV、D及びJ遺伝子セグメントを含む、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
各重鎖定常領域がヒト起源のものである請求項1〜9のいずれか一項に記載の方法。
【請求項11】
各重鎖定常領域がヒトでない脊椎動物起源のものである請求項1〜10のいずれか一項に記載の方法。
【請求項12】
前記VH重鎖遺伝子座は、複数のV遺伝子セグメントと、複数のD遺伝子セグメントと、複数のJ遺伝子セグメントとを含む請求項1〜11のいずれか一項に記載の方法。
【請求項13】
V遺伝子セグメントは、改善された溶解度を示すように選択、変異又は遺伝子工学的に処理されている請求項1〜12のいずれか一項に記載の方法。
【請求項14】
請求項1〜5又は8〜13のいずれか一項に記載の方法により得られる重鎖のみ抗体。
【請求項15】
請求項8〜13のいずれか一項に記載の方法により得られる抗原特異的可溶性VHドメイン。
【請求項16】
治療に使用するための、請求項14に記載の重鎖のみ抗体又は請求項15に記載の抗原特異的可溶性VHドメイン。
【請求項17】
請求項15に記載の一以上の抗原特異的可溶性VHドメインの、単独又は相補的会合ドメインを含みかつ追加のエフェクター活性を有する別のエフェクター鎖と組み合わせた、二価又は多価のポリペプチド複合体の産生のための使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【公開番号】特開2012−24087(P2012−24087A)
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願番号】特願2011−166562(P2011−166562)
【出願日】平成23年7月29日(2011.7.29)
【分割の表示】特願2007−522034(P2007−522034)の分割
【原出願日】平成17年7月22日(2005.7.22)
【出願人】(507021735)エラスムス・ユニヴァーシティ・メディカル・センター・ロッテルダム (6)
【出願人】(507021997)
【Fターム(参考)】
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願日】平成23年7月29日(2011.7.29)
【分割の表示】特願2007−522034(P2007−522034)の分割
【原出願日】平成17年7月22日(2005.7.22)
【出願人】(507021735)エラスムス・ユニヴァーシティ・メディカル・センター・ロッテルダム (6)
【出願人】(507021997)

【Fターム(参考)】
[ Back to top ]

