結晶化促進方法、結晶化解析方法、結晶の製造方法、結晶化装置の制御プログラム、記録媒体、及び結晶化装置
【課題】効率的に生体高分子を結晶化させる結晶化促進方法を提供する。
【解決手段】
タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶化促進方法である。結晶化装置は、生体高分子の結晶化溶液と、結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、透明導電体電極に挟持され、結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、散乱光検出部により検出された信号を分析する制御解析部とを備える。この上で、透明導電体電極により、結晶化溶液に対してほぼ一様な電場を印加する。次に、散乱光検出部により、結晶化溶液に光を照射して結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定する。そして、制御解析部により、前方小角散乱光又は後方小角散乱光の強度に基づいて、結晶化溶液の状態を分析する。
【解決手段】
タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶化促進方法である。結晶化装置は、生体高分子の結晶化溶液と、結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、透明導電体電極に挟持され、結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、散乱光検出部により検出された信号を分析する制御解析部とを備える。この上で、透明導電体電極により、結晶化溶液に対してほぼ一様な電場を印加する。次に、散乱光検出部により、結晶化溶液に光を照射して結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定する。そして、制御解析部により、前方小角散乱光又は後方小角散乱光の強度に基づいて、結晶化溶液の状態を分析する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、結晶化促進方法、結晶化解析方法、結晶の製造方法、結晶化装置の制御プログラム、記録媒体、及び結晶化装置に係り、特に生体高分子に内部電場印加を行い光散乱計測による結晶化状態の分析を行う技術に関する。
【背景技術】
【0002】
従来から、タンパク質に代表される生体高分子の機能を解明するために、結晶構造解析の技術が必要不可欠となっている。
生体高分子の結晶構造は、核磁気共鳴(NMR)測定、X線回折測定、また中性子線回折測定等を用いて解析される。
解析された結晶構造のデータを用いて、生体高分子の高次構造や機能の解析を行うことができる。
このような結晶構造の解析及び評価は、いかに良質の生体高分子の結晶を作製するかに大きく依存している。
【0003】
しかしながら、タンパク質結晶構造解析を行うにあたって、タンパク質の結晶化は主要な障害のままであった。
ここで、タンパク質の結晶作製は、通常、タンパク質の過飽和溶液に沈殿剤(結晶化剤)等を添加して行われる。
この際のタンパク質の結晶化条件は、タンパク質の溶液濃度、沈殿剤(結晶化剤)の種類や濃度、緩衝液の種類、pH値、溶液温度等の、物理的・化学的な結晶化要因を考慮する必要がある。
つまり、結晶化条件のスクリーニングは大変な努力を要する。
【0004】
ところが、溶液中におけるタンパク質の結晶成長速度は、一般的には大変遅い。
これは、X線又は中性子回折に適している単結晶を得るため、長い時間が要求されることを意味する。
従って、結晶化する条件下であっても、光学顕微鏡等で結晶生成が確認できるまでには、少なくとも数日から数週間が必要である。
また、タンパク質の種類や作製条件によっては、数ヶ月以上を要することもある。
さらに、困ったことに、結晶化条件がよく同定されているタンパク質に対してさえ、結晶化プロセスの詳細は、まだ明確になっていない。
【0005】
ここで、タンパク質結晶化は、過飽和になったタンパク質溶液に外部刺激を適用するいくつかの方法を使用して促進することができる。
この結晶化の促進方法として、磁場、超短パルス・レーザー、及び電場を加える外部刺激方法が知られている。電場印加法は、他の促進方法と比較すると、単純で廉価な装置を用いるため有利である。
典型的な電場印加法である外部電場印加法では、タンパク質結晶化を誘発するために、電気絶縁体を介して溶液に接している電極に高電圧(1〜10kV)をかける必要がある。このため、結晶化溶液セルの小型化が防げられるという問題があった。
対照的に、内部電場印加法は、例えば、実効値で1V以下の低電圧での印加を行うため、溶液での微弱電流が伴うという問題があるものの、結晶化溶液セルの大きさを最小化できる。
【0006】
従来の内部電場印加法の結晶化溶液セルとして、特許文献1を参照すると、内部電場を印加するタンパク質結晶化のための小さく透明な結晶化溶液セルが記載されている(以下、従来技術1とする。)。
この結晶化溶液セルでは、ガラス基板上のスズ含有のインジウム錫オキサイド(In2O3、ITO)薄膜を用いた透明導電体薄膜を透明導電体電極として使用しており、透明導電体電極を通して、タンパク質結晶成長についての観察が可能になった。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】国際公開第2010/100847号
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、従来技術1において、電場が結晶化を引き起こすプロセスは不明瞭なままであった。
したがって、この技術を使用した殆どの成功例は、試行錯誤の結果によっていた。
つまり、従来技術1の電場印加では、タンパク質の結晶化促進ができるものの、最適化条件等について探索するには、未だ多大な労力と時間を必要とするという問題があった。
【0009】
本発明は、このような状況に鑑みてなされたものであり、上述の課題を解消することを課題とする。
【課題を解決するための手段】
【0010】
本発明の結晶化促進方法は、タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶化促進方法であって、前記結晶化装置は、前記生体高分子の結晶化溶液と、前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、前記散乱光検出部により検出された信号を分析する制御解析部とを備え、前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析することを特徴とする。
本発明の結晶化促進方法は、前記制御解析部は、前記透明導電体電極に、低電圧を印加させ、前記結晶化溶液が生体高分子の凝集の遷移の状態になったことを検知して、前記低電圧の印加を停止させることを特徴とする。
本発明の結晶化促進方法は、前記前方小角散乱光又は前記後方小角散乱光の強度は、それぞれ散乱角度に対する前記前方小角散乱光の強度関数又は前記後方小角散乱光の強度関数であり、前記制御解析部は、散乱角度10°以下の前記前方小角散乱光又は前記後方小角散乱光の強度関数の変化により前記凝集の遷移の状態を検知することを特徴とする。
本発明の結晶化促進方法は、前記前方小角散乱光又は前記後方小角散乱光の強度は、それぞれ散乱角度に対する前記前方小角散乱光又は前記後方小角散乱光の強度関数から得られる、前記前方小角散乱光の強度の平均値又は前記後方小角散乱光の強度の平均値であることを特徴とする。
本発明の結晶化促進方法は、前記前方小角散乱光又は前記後方小角散乱光の時間的強度ゆらぎに基づいて、前記結晶化溶液における前記凝集の遷移の状態を分析することを特徴とする。
本発明の結晶化解析方法は、タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶化解析方法であって、前記結晶化装置は、前記生体高分子の結晶化溶液と、前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、前記散乱光検出部により検出された信号を分析する制御解析部とを備え、前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析し、前記結晶化溶液が生体高分子の凝集の遷移の状態を検知することを特徴とする。
本発明の結晶の製造方法は、タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶の製造方法であって、前記結晶化装置は、前記生体高分子の結晶化溶液と、前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、前記散乱光検出部により検出された信号を分析する制御解析部とを備え、前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析し、前記結晶化溶液が生体高分子の凝集の遷移の状態を検知して前記電場の印加を停止することを特徴とする。
本発明の結晶化装置の制御プログラムは、タンパク質を含む生体高分子の結晶化装置により、生体高分子の結晶化促進方法を実行させる結晶化装置の制御プログラムであって、前記結晶化装置は、前記生体高分子の結晶化溶液と、前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、前記散乱光検出部により検出された信号を分析する制御解析部とを備え、前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加させ、前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定させ、前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析させることを特徴とする。
本発明の記録媒体は、タンパク質を含む生体高分子を結晶化させるための結晶化装置により、生体高分子の結晶化促進方法を実行させる結晶化装置の制御プログラムを記録したコンピュータ読み取り可能な記録媒体であって、前記結晶化装置は、前記生体高分子の結晶化溶液と、前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、前記散乱光検出部により検出された信号を分析する制御解析部とを備え、前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加させ、前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定させ、前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析させることを特徴とする。
本発明の結晶化装置は、タンパク質を含む生体高分子の結晶化装置であって、前記結晶化装置は、前記生体高分子の結晶化溶液と、前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、前記散乱光検出部により検出された信号を分析する制御解析部とを備え、前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析することを特徴とする。
【発明の効果】
【0011】
本発明によれば、電場印加の状態下で結晶化溶液の光散乱を効率良く計測して最適に生体高分子を結晶化できる結晶化促進方法を提供することができる。
【図面の簡単な説明】
【0012】
【図1】本発明の実施の形態に係るタンパク質結晶化装置Xの制御構成と、入射光、透過光、前方小角散乱光、並びに後方小角散乱光との関係を示す図である。
【図2】本発明の実施の形態に係る測定試料部3の構成例を示す断面図である。
【図3】本発明の実施の形態に係る測定試料部3の構成例を示す正面図である。
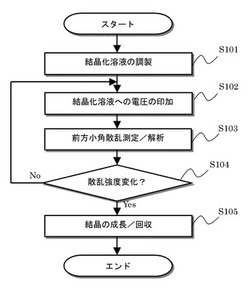
【図4】本発明の実施の形態に係るタンパク質結晶成長促進方法に係る処理のフローチャートである。
【図5】本発明の実施の形態の実施例に係るリゾチームの電圧印加/電圧印加無しにおける前方小角散乱の静的光散乱(SLS)分布を示すグラフである。
【図6】本発明の実施の形態の実施例に係るリゾチームの電圧印加から適宜の時間経過後の前方小角散乱光の測定を示すグラフである。
【図7】本発明の実施の形態の実施例に係る静的光散乱強度の平均値と経過時間の関係を示すグラフである。
【図8】本発明の実施の形態の実施例に係る電圧印加停止後のタンパク質結晶化の関係を示すグラフである。
【発明を実施するための形態】
【0013】
<実施の形態>
〔タンパク質結晶化装置Xの構成〕
まず、図1を参照して、本発明の実施の形態に係るタンパク質結晶化装置Xの構成について説明する。
本実施形態のタンパク質結晶化装置Xは、主な構成として、制御解析部1と、測定試料部3と、散乱光検出部5と、電源6とを備える。
タンパク質結晶化装置Xは、タンパク質結晶化溶液31を含む試料セルである測定試料部3の前方/後方小角散乱を測定するコンピュータ制御の前方小角散乱/後方小角散乱測定システムである。
図1においては、溶液セルの概略構成と前方/後方小角散乱光の測定の配置についても示した。図1の点線の矢印は光信号の流れを、実線の矢印は制御信号及び電気信号の流れの例を示している。
タンパク質結晶化装置Xは、測定試料部3に内部電場印加法で、電圧を印加する。この上で、例えば、2.5°から30°の間の角度において、0.05°の分解能で静的な前方小角散乱の正確な測定ができる。たとえば、約10分で2.5°から20°まで0.1°のステップで前方小角散乱が測定可能である。
【0014】
なお、本実施形態において、「前方小角光散乱」とは、測定対象となるタンパク質結晶化溶液へ入射する光の透過光に対する散乱角が10°程度以下、特に6°以下における溶液からの散乱光であることを示す。
また、同様に「後方小角光散乱」とは、測定対象の溶液へ入射する光の反射光に対する散乱角が10°程度以下、特に6°以下における溶液からの散乱光であることを示す。
【0015】
制御解析部1は、PC/AT互換機やMAC互換機等のPCやハンドヘルドデバイス等である。制御解析部1は、タンパク質結晶化溶液の散乱光に関する計測・収集したデータを分析し、例えば補助記憶装置であるハードディスク等に記憶する機能を備える。
制御解析部1は、電源6を制御して測定試料部3の結晶化溶液31に印加する電圧等を制御する。また、制御解析部1は、測定試料部3の2段回転ステージ等を制御する。また、制御解析部1は、タンパク質結晶化溶液31から散乱光検出部5により検出された静的光散乱、及び動的光散乱の計測、特に前方小角光散乱又は後方小角光散乱の計測に基づいて、溶液中におけるタンパク質結晶化の状態を分析する。この上で、制御解析部1は、タンパク質の結晶化が進行する状態になった場合には、電圧の印加を止めるように制御することが可能である。
なお、制御解析部1は、計測したデータをグラフとして表示部(ディスプレイ)やプリンタ(図示せず)に画像として表示する機能を備えている。
【0016】
測定試料部3は、測定対象のタンパク質結晶化溶液31を収容し、電圧を印加し、散乱光を計測するための容器(溶液セル)を含む部位である。
測定試料部3には、タンパク質結晶化溶液31からの散乱光、特に前方小角散乱光又は後方小角散乱光を測定するための適切な光学的配置が施されている。測定試料部3は、測定対象の溶液が微量で、高濃度であっても、溶液からの散乱光を効率良く放出させるように構成される。
測定試料部3には、更にこの溶液セルを支持する指示部材、及び溶液セルへ平行光を導くためのレンズやプリズム等の光学素子、入射光の角度を調整するステージ等を備えていてもよい。このため、測定試料部3は、例えば、θ回転ステージ上に固定される。この際、測定試料部3は、タンパク質結晶化溶液31へ、ビーム光が平行状態になるよう光学調整を行ったコリメートビーム光等を入射させ、溶液セルの透過光や反射光の影響を少なくし、タンパク質結晶化溶液からの前方小角散乱光又は後方小角散乱光、特に前方小角散乱光を効率よく放射させ測定できるように構成されている。
また、測定試料部3は、電源6からの交流電圧を内部印加で印加することができる。
測定試料部3の溶液セルの具体的な構造について後述する。
【0017】
散乱光検出部5は、タンパク質結晶化溶液から放射される散乱光を検出し、散乱光強度を測定するための光検出器である。
具体的には、散乱光検出部5は、タンパク質結晶化溶液による散乱光の検出に適した光検出器であり、各種の光センサを用いることができる。このため、散乱光検出部5は、θ回転ステージやスリット等の光学素子を含ませて、構成することができる。
タンパク質結晶化溶液の散乱光の時間的変化の測定(動的散乱光(DLS、Dynamic Light Scattering)測定とも呼ぶ)を行う場合には、散乱光検出部5の応答性を考慮し、適切な検出器を選択する。
応答性に優れた光検出器としては、pn接合間に真性半導体層を持ったPINフォトダイオード、アバランシェフォトダイオード、及びフォトマルチプライヤ(PMT)等が挙げられ、測定する散乱光のゆらぎ時間やゆらぎ周波数に応じて光検出器を選択する。
散乱光検出部5からの散乱光の信号が増幅されたアナログの出力電圧信号は、例えば、増幅された上で、アナログ/デジタル(A/D)変換器を介してデジタル信号に変換される。制御解析部1は、このデジタル信号を測定データとして取り込むことができる。
【0018】
なお、測定試料部3と散乱光検出部5とは、電動の回転ステージを用いて角度を調整するように構成可能である。この回転ステージとしては、例えば、2つの回転ステージの回転軸を一致させ、2段組に重ね合わせることによって一体化した、独立に回転移動できる2段回転ステージ(以下、θ−2θ回転ステージと呼ぶ。)を用いて入射光及び前方/後方小角散乱光の角度を調整するように構成できる。図1のタンパク質結晶化装置Xにおいて、制御解析部1が、入射角制御部の回転ステージにより入射光の角度を調整し、測定試料部3に導入する。そして、制御解析部1は、この溶液セル内のタンパク質結晶化溶液31からの散乱光の角度を回転ステージにより角度を調整し、散乱光検出部5に導入させ、前方小角散乱/後方小角散乱を測定する。
このようなタンパク質結晶化溶液の静的/動的散乱光の検出については、例えば、特願2010−281562又は文献(T.Wakamatsu,Applied Physics Letters,98,263701(2011)、参照)に記載の技術を用いて構成することができ、本明細書ではこれを引用するものとする。
【0019】
電源6は、多機能のファンクションジェネレータ等を用いた電源であり、測定試料部3に交流又は直流の電圧を印加する。
また、電源6は、測定試料部3に印加された電圧を、ストレージオシロスコープ等のように表示し、制御解析部1にてモニタリング可能である。
電源6は、測定試料部3の結晶化溶液セル内の導電性のタンパク質結晶化溶液31に、直流に換算した場合、1.2V以下の電圧で0.1μA以下の微弱電流が流れる。
【0020】
(本発明の実施の形態に係る測定試料部3の構成)
次に、図2の側断面図と図3の概正面図とを参照して、本発明の実施の形態に係る測定試料部3の溶液セルの構成の一例について説明する。
測定試料部3は、上述したように、光散乱計測のためにタンパク質結晶化溶液を収容するための溶液セルを含む部位である。この結晶化溶液セルの部位については、従来技術1の結晶化溶液セルと同様の構成を用いることができる。
具体的には、測定試料部3は、透明導電体薄膜の透明導電体電極34、35をそれぞれ形成した2つの平板状電極基板である透明基板32、33によって、電気絶縁部材として所定の厚さで平板状(面状)の絶縁スペーサーである電気絶縁部材39を挟む。そして、電気絶縁部材39内に、タンパク質結晶化溶液31を注入し保持する。測定試料部3は、このように、いわゆる「サンドイッチ型」電極構造にて製造することができる。つまり、電気絶縁部材39と透明基板32、33とは、タンパク質結晶化溶液31を保持する容器になる。
透明基板32、33に平板状の電極を用いることで、結晶化溶液中に、ほぼ一様な電場が形成される。これにより、溶液中の生体高分子全体に、効率よく電場を印加できるという効果が得られる。
また、透明基板32、33と透明導電体電極34、35とを用いることで、前方小角散乱光の測定と解析による電圧印加と結晶化の促進制御/解析が可能となる。
【0021】
タンパク質結晶化溶液31は、測定・分析対象のタンパク質結晶化溶液である。タンパク質結晶化溶液31は、タンパク質と、タンパク質を結晶化するための沈殿剤(結晶化剤)とを含む溶液、或いは、それらを含む各溶液の組み合わせ(混合)である。また、タンパク質結晶化溶液31には、pHを調整するために、タンパク質の結晶化に適した緩衝液(バッファー)を使用する。
また、タンパク質結晶化溶液31としては、バッチ法及び蒸気拡散法のいずれのタンパク質結晶化方法に係る試料溶液も用いることができる。
ここで、バッチ法とは、例えば、タンパク質と沈殿剤(結晶化剤)とを混合させたタンパク質結晶化溶液を測定試料部3内に封止して、タンパク質を結晶化させる方法である。また、蒸気拡散法とは、タンパク質含有溶液と沈殿剤(結晶化剤)含有溶液、及び緩衝液等の必要な各溶液を測定試料部3の中に離した状態で注入し封止して、タンパク質を結晶化させる方法である。
【0022】
透明基板32、33は、薄膜の透明導電体電極34、35を形成した平板状の透明な基板である。
透明基板32は、測定試料部3に入射光が入射する側の部材である。また、反対側の透明基板33は、測定試料部3から透過光が出射され、また散乱光が放射される側の部材である。同じ材料の透明部材で透明基板32、33を構成した場合には、測定試料部3において入射側と出射側の区別はなく、どちらから光を入射させてもよい。
透明基板32、33の材料としては、入射光側と散乱光放射側で、測定光領域で透過性に優れた光学材料が好ましい。これにより、前方小角散乱測定によって、電圧印加時のタンパク質凝集を測定できる。また、透明基板32、33を通して、実体顕微鏡などの光学顕微鏡やルーペ等により、結晶形成状態の光学的観察も可能である。
透明基板32、33は、薄い光学ガラス基板(厚さ約0.1〜0.5mm)を用いることが好適である。透明基板32、33として、例えば、2つの薄い光学ガラス板であるBK−7(18×32×0.15mm3)等を用いることができる。
なお、透明基板32、33としては、ガラス基板の他にも、耐熱性の樹脂(高分子、プラスチック)等であっても構わない。化学的に安定なプラスチック材料としては、ポリエチレンテレフタレート(PET)、ポリ塩化ビニリデン、及びポリエチレン等の重合高分子化合物が好ましい。
また、透明基板32、33は、所定の波長を透過しないようなフィルターやコーティング等を形成したり貼り付けたりすることもできる。また、偏光板等を形成することもでき、これにより位相差等により、結晶を観察しやすくなるという効果が得られる。
【0023】
透明導電体電極34、35は、透明基板32、33の上に形成された透明導電体の薄膜である。透明導電体電極34、35は、生体高分子の結晶化溶液へ電圧を印加するための電極として、端子36、37を介して電源6に電気的に接続される。これにより、電源6の電圧発生器から供給される所定の直流又は交流の電圧が、タンパク質結晶化溶液31に印加される。
透明導電体電極34、35は、透明導電体として、例えば、無機酸化物である、スズ含有の酸化インジウム(In2O3:Sn,ITO)、酸化亜鉛(ZnO)、酸化錫(SnO2)、酸化チタン(TiO2)等を用いることができる。たとえば、スズを添加した酸化インジウム(ITO)の薄膜を用いることが好適である。ITO膜の酸化物電極自体は、タンパク質結晶化において、結晶の核生成を起こすといった影響が無いため好適である。
透明導電体電極34、35としてITO膜を用いる場合、例えば、高周波マグネトロンスパッタリング法を用いることができる。この場合、厚さ10nm〜5μm程度のITO膜を用いることができる。膜厚が薄い方が光透過性で有利になるものの、結晶化溶液セルの耐久性等を考慮して最適な膜厚を選択することができる。たとえば、RF−DC結合形低圧マグネトロンスパッタ法を用いた場合、厚さ約100nm程度のITO膜電極を用いることが好適である。このような100nmのITO膜の場合、固有抵抗は、約5×10-4Ωcmで、光透過率は80%程度以上になる。
透明導電体電極34、35は、薄膜の電極を結晶化溶液に直接接触させる。平板の電極をこのように平行に対応して配置することで、印加電圧によってタンパク質結晶化溶液31内に、効率よく、均一な電場を印加することができる。
なお、透明導電体として、透明性のあるポリチオフェン系やポリピロール系などの導電性高分子も利用できる。
また、透明導電体電極34、35は、結晶形成の光学的観察が可能な程度の透過率があればよく、所定の波長を透過させなくてもよい。
【0024】
端子36、37は、透明導電体電極34、35から電源6に接続するための金属配線と端子を含む部位である。
この金属配線は、ITO膜製造後に、銀粒子ペースト等を使用して端子36、37に電気的に接続することができる。
【0025】
電気絶縁部材39は、透明導電体電極34、35の透明導電体電極に印加する電圧を絶縁するための電気絶縁スペーサー(以下、単に絶縁スペーサーと称す)である。
電気絶縁部材39の絶縁スペーサーは、結晶化溶液を保持するシール材でもある。すなわち、この電気絶縁部材39内に形成された溝孔等と、透明基板32、33の透明導電体電極34、35と絶縁スペーサーとで囲まれた空間が、タンパク質結晶化溶液31を収容する容器として機能する。
電気絶縁部材39の溝孔の大きさは、入射光のビームよりも大きくすることが好適である。これは、スペーサーから散乱光が生じると大きなノイズになるためである。
電気絶縁部材39として、例えばシリコンゴムや各種プラスチックを用いることができる。シリコンゴムを用いると、密着性が良好であり、数週間程度は結晶化溶液からの蒸発を防止できる。
【0026】
なお、測定試料部3へ前方小角散乱測定のため入射させる入射光としては、平行光、すなわちコリメート光が好ましい。これは、溶液からの散乱光の放射角強度分布を正確に測定するためである。
このため、狭いビームを生成する各種レーザーを用いることが好適である。たとえば、直径約0.7mm程度の狭いビームを生成するダイオード励起固体レーザー(λ=473nm、25mW)が好適である。
なお、入射光及び透過光の広がり角は、可能な限り低く抑えることが好ましい。
【0027】
〔タンパク質結晶成長促進方法〕
次に、本発明の実施の形態に係るタンパク質結晶成長促進方法について説明する。
本発明者らは、小角(θsが8°程度以下)の前方光散乱(FLS、forward light scattering)は、溶液が結晶化する際のタンパク質凝集に対して非常に敏感であることを発見した。本発明者らは、この前方小角散乱と電圧印加の制御とを組み合わせると、容易にタンパク質の結晶化促進の制御ができることを見いだし、鋭意実験と観察とを行い本発明を完成させた。
タンパク質の凝集は、タンパク質結晶化の核生成とその後の結晶成長にとって不可欠である。このため、前方小角散乱の測定は、タンパク質の結晶化を特徴づけることができる。
本発明者らは、内部電場印加によるタンパク質溶液の状態の推定に、この前方小角散乱の測定を用いることで、顕著にタンパク質結晶化させるタンパク質結晶化方法を完成させた。
すなわち、本実施形態に係るタンパク質結晶成長促進方法は、内部電場印加によるタンパク質溶液の状態の推定に、前方小角散乱の測定を用いる。これにより、顕著にタンパク質結晶化を促進させることができる。
以下で、図4を参照して、本実施形態のタンパク質結晶成長促進方法の処理の詳細について説明する。
【0028】
(ステップS101)
まず、結晶化溶液を調製する。
このステップでは、タンパク質結晶化溶液31に上述した結晶化させたい生体高分子、例えばタンパク質と、沈殿剤と、バッファーとを所定条件で調製する。この上で、透明導電体電極35に電気絶縁部材39を載せた状態で、タンパク質結晶化溶液31を注ぐ。
そして、測定試料部3にタンパク質結晶化溶液31を注入した後、蒸発を防止するために、例えばパラフィンオイル等でシールする。なお、液漏れ防止のために2枚の透明基板32、33と電気絶縁部材39との間をシリコングリースやフッ素グリース等でシールすることも好適である。
また、測定試料部3から溶液が漏れ出ないように、スペーサーと基板とを強く密着させ、適宜、留め金具等でクリップすることもできる。
なお、このタンパク質結晶化溶液31や各種バッファーの測定試料部3への導入について、制御解析部1が、タンパク質結晶化装置Xに備えられたマイクロパイプ等の輸液機構等を制御して実現するように構成できる。
【0029】
(ステップS102)
次に、本発明の実施の形態に係るタンパク質結晶化装置Xは、結晶化溶液への電圧の印加を行う。
具体的には、制御解析部1は、測定対象のタンパク質結晶化溶液31を含む測定試料部3に、電場印加により電源6から所定の交流/直流電圧を印加してタンパク質の結晶化を促進する。
この時間としては、少なくとも数時間程度、特に100分から180分間程度の電圧印加が好ましい。本実施形態では、低電圧を印加するため、電気分解は殆ど起こらず、微細結晶形成等の結晶化への悪影響が最低限に抑えられるという効果が得られる。
【0030】
(ステップS103)
次に、タンパク質結晶化装置Xは、前方小角散乱測定/解析を行う。
具体的には、レーザー等の入射光を入射したタンパク質結晶化溶液31の前方小角又は後方小角における散乱光を散乱光検出部5が測定し、制御解析部1に出力する。
制御解析部1は、この測定結果から、タンパク質結晶化溶液からの前方小角散乱光又は後方小角散乱光の放射角度の強度分布(SLS)、又はその時間的強度変化(DLS)を分析する。これにより、タンパク質結晶化溶液の状態を推定する。
ここでは、100分から180分間程度の時間で電場を印加した際に、凝集についての大きな変化が現われたか否かについて解析をする。この「凝集についての大きな変化」を、以下で、「凝集の遷移」の状態という。この「凝集の遷移」の状態では、顕微鏡等でも確認困難なタンパク質結晶化の核生成が起き、タンパク質結晶化溶液31の状態が変化していると考えられる。
この「凝集の遷移」の状態を検知するためには、前方小角の散乱角8°付近より小角、特に3°から6°付近の散乱角において、所定強度の散乱光が増加したことを検知する。この所定強度は、例えば、後述の実施例のように、リゾチームのような結晶化の性質がよく分かっているタンパク質の電圧印加と結晶化との関係から求めることができる。
【0031】
(ステップS104)
次に、制御解析部1は、散乱強度が変化して、タンパク質結晶化溶液31の状態が結晶化に向かっているか否か判定する。すなわち、「凝集の遷移」の状態になった場合、Yesと判定し、それ以外の場合はNoと判定する。
Yesの場合、制御解析部1は、処理をステップS105に進める。
Noの場合、制御解析部1は、処理をステップS102に戻す。
【0032】
(ステップS105)
この上で、タンパク質結晶化装置Xの制御解析部1は、タンパク質結晶化溶液31の状態が「凝集の遷移」の状態になった場合、電圧の印加を停止して、その旨を図示しない表示部の表示やブザー等で報知する。
この「凝集の遷移」の状態となった後は、下記の実施例で示すように、電場を印加しなくても結晶化が促進されるという効果が得られる。このため、電気分解等によるタンパク質結晶化溶液31の劣化を最小限に抑えた上で、測定試料部3の結晶化溶液セルを回収できる。また、結晶化を促進するための電圧の印加時間、及び電圧と沈殿剤の最適容量等との関係を最低限の手間で把握できる。
回収した測定試料部3の結晶化溶液セルを放置すると、タンパク質の結晶が成長する。成長した結晶のうち、X線や中性子線での解析に適した大きさで質の良い結晶を回収可能である。
以上で、本発明の実施の形態に係るタンパク質結晶成長促進方法の処理を終了する。
【0033】
以上のように構成することで、以下のような効果を得ることができる。
まず、本発明の実施の形態に係るタンパク質結晶化装置Xは、光学顕微鏡等でタンパク質の結晶形成確認を待たずに、電場印加下においてタンパク質の結晶化促進状態を分析できる。すなわち、稀少なタンパク質が溶解した数十μL以下の微量なタンパク質結晶化溶液31に対して、低電圧の印加状態下で、結晶形成の前段階状態にある「凝集の遷移」のような状態を評価することができる。
また、電場の印加によって観察された前方小角散乱の増加は、タンパク質結晶化のための必要条件である。実際に、回収した結晶化溶液セルでは大きな凝集体の形成が起こり、容易に観察することができる。また、この大きな凝集体の形成は、結晶核生成と結晶成長の基本の過程であることが確かである。
つまり、本発明の実施の形態に係るタンパク質結晶化促進方法では、準安定領域にあるタンパク質結晶化溶液31の低電圧印加と前方小角散乱を用いた観察とにより、従来は、多大な労力と時間を要した結晶化条件の探索が効率良く行える。
また、電場に誘発されたタンパク質凝集を前方小角散乱により検出することで、従来は不明であった電場印加によるタンパク質結晶化促進のメカニズムを解明することができる。つまり、電場によるタンパク質の結晶化における好適な解析方法を提供することができる。これにより、タンパク質の結晶化についての詳細を知ることができる。
また、本発明の実施の形態に係るタンパク質結晶化方法は、前方小角散乱を用いて、内部電場下のリゾチーム溶液のタンパク質の凝集が観察する。これにより、内部電場印加による「凝集の遷移」の存在を確認することができる。つまり、タンパク質溶液に100分以上の所定時間の低電圧をかけ、「凝集の遷移」の状態を確認すると、その後のタンパク質結晶化溶液31は凝集が著しく促進されることが期待できる。
これにより、必要十分な時間だけ電圧を印加することが可能になり、電気分解等の弊害を避けて、確実にタンパク質結晶化促進を行うことができる。
【0034】
なお、上述の実施の形態においては、生体高分子としてタンパク質の結晶化の例について説明したが、本発明はこれに限られず、各種生体高分子の分子配向化促進等について用いることができる。たとえば、生体高分子として、DNA、RNA等の核酸、糖質、脂質等について用いることができる。
また、PNA(Peptide Nucleic Acid)のような合成された生体高分子についても用いることができる。
【実施例】
【0035】
以下で、図面に基づいて本発明を実施例により更に順次説明するが、以下の具体例は本発明を限定するものではない。
【0036】
(生体高分子のタンパク質結晶化溶液31の調製)
本発明者らは、前方小角散乱を用いて、内部電場印加での凝集体の生成を示すために、タンパク質のニワトリ卵白リゾチームをモデル・タンパク質として使用した。ニワトリ卵白リゾチーム(HEWL:以下、単にリゾチームと呼ぶ。)は、結晶化の諸条件が良く調査されている。実際に、リゾチームは、結晶化の諸条件の関係性を図示した「相図」も作成されており(例えば、「W.Iwai,D.Yagi,T.Ishikawa,Y.Ohnishi,I.Tanaka,and N.Niimura,"Crystallization and evaluation of hen egg−white lysozyme crystals for protein pH titration in the crystalline state",Journal of Synchrotron Radiation,vol.15,pp.312−315(2008).」を参照)、分析対象として最適なタンパク質である。
本実施例においては、沈殿剤(結晶化剤)として、塩化ナトリウム(NaCl)を含む水溶液を用い、pH値を緩衝液(バッファー)である酢酸−酢酸ナトリウム緩衝液を用いて調製した。
具体的には、リゾチームは、再結晶によって6回精製されたものを、生化学工業株式会社から購入した。リゾチームはそれ以上の精製無しで使用された。また、リゾチーム溶液[CHEWL=90mg/mL(6.3mM)]と沈殿剤のNaCl[CNaCl=15%](w/v)(2.56M)とが50mM濃度の酢酸−酢酸Na緩衝溶液(pH4.6)を用いて、タンパク質結晶化溶液31として使用された。各実験においては、20℃で保存溶液から各タンパク質結晶化溶液31が別々に調製された。各溶液はフィルター(0.2μm孔径)を通し、20℃において所定比で混合され、調製された。タンパク質結晶化溶液31の導電率は約1〜5mS/cmだった。導電率は、マイクロリットル単位の微量溶液を測定できる簡易導電率計により測定された。
その後、それぞれのタンパク質結晶化溶液31(約18μL)は、透明基板の両方の導電性フィルムと接触して面するように、測定試料部3の絶縁スペーサーの円孔に注がれた。
前方小角散乱測定は、溶液を混合してから5分以内に始められた。
【0037】
(前方小角散乱の計測)
測定試料部3は、結晶化溶液セルへ電場を印加した状態で、電極を通してタンパク質溶液からの前方小角散乱の正確な測定ができるように、十分に薄く透明に構成した。
電気絶縁部材39として、円孔(直径約6mm)のあるシリコンゴム絶縁体シート(厚さ約1mm)が、2枚のITOを形成したプレートである透明基板32、33の間に挟まれた。
電場を印加する実験は、すべて正弦波で低周波、7.1V/cmの平均電場を与える20Hzの実効値0.71V(Vpp=2.0V)のAC電圧を使用した。
この印加電圧は必ずしも結晶化のための最適化された条件ではないが、結晶化促進に有効であると分かった。
泡の存在によって確認できる溶液の電気分解は、観察されなかった。なお、電気分解は、結晶化を妨害する溶存物質の迅速な濃度変異を誘発するため、好ましくない。
対照実験用に準備した測定試料部3(コントロール)は、電場を印加した測定試料部3と同条件で、電場を印加しないように調製された。
すべての実験で、NaClとリゾチーム溶液は、既知の結晶化状態図による準安定領域中になるよう使用された。
電場印加を行った前方小角散乱測定の実験は、すべて空調のある20℃プラスマイナス0.5℃の部屋で、上述のセット・アップにより行なわれた。
【0038】
(リゾチーム結晶化溶液の静的光散乱(SLS)分布)
図5を参照して、本発明の実施の形態に係るタンパク質結晶化装置Xによって測定された静的光散乱(SLS)分布についての実施例について説明する。
図5は、タンパク質結晶化溶液31としてリゾチーム結晶化溶液を用いた静的光散乱分布のグラフである。
縦軸は、散乱光強度として取得したIs値を、入射モニター光検出部(図示せず)による入射モニター光の強度I0で割って得られたものであり、すなわち、Is/I0である。横軸は、前方小角散乱角の角度θs(°)を示す。印加電圧ありのサンプルと、印加電圧の無いサンプルに対する静的光散乱(SLS)パターン(Is−θsカーブ)を示す。
【0039】
この分析におけるタンパク質結晶化溶液31として、リゾチーム濃度20mg/mL、沈殿剤(結晶化剤)NaCl濃度を3.0%(w/v)とし、溶液セルにリゾチーム結晶化溶液を封止したバッチ法の測定試料を用いた。
なお、ここで使用した結晶化溶液のリゾチーム及び結晶化剤の濃度条件は、相図によると、リゾチームの結晶作製に適する準安定条件の濃度領域に位置し、バッチ法では、核形成となる塵等や外部刺激(磁場、光、電場や音波等)によって結晶が形成・成長できる溶液状態である。
【0040】
この実施例では、同じ構造で寸法も同じ2つの溶液セルを用意し、同一濃度条件のタンパク質結晶化溶液をほぼ同時刻にリゾチーム結晶化溶液を封止した。
そして、所定の時間経過後に本発明の実施の形態に係るタンパク質結晶化装置Xを用いて、それぞれSLS分布を測定した。
一方の溶液セルにおいては、電圧発生器のファンクションジェネレータで発生させた周波数20Hz、実効値0.71V(最大電圧値1V)の正弦波交流電圧を透明導体膜の透明導体電極に約300分間印加した状態においてSLS分布を測定した。
もう一方の溶液セルでは、電圧を印加せずにそのまま静置し、約360分後にSLS分布を測定した。
【0041】
タンパク質結晶化溶液31を収容した溶液セルには、半径10mmのBK−7ガラス製の半円柱形プリズムの側面平面部に、ガラス材料と同じ屈折率の屈折率整合オイルで貼り付け、測定試料を装着した半円柱形プリズムをθ回転ステージ上に設置した。
これに、焦点距離130mmの円筒面平凸レンズ(シリンドリカルレンズ)と半円柱形プリズムとを用いて、球面部側面側からタンパク質結晶化溶液31へ、波長473nmの青色レーザ光を入射した。
この上で、タンパク質結晶化溶液からの散乱光を、透過光の方向(前方)からの散乱角度20°から3°までの前方小角散乱角の範囲で測定した。
【0042】
図5のリゾチーム結晶化溶液の散乱光強度の散乱角依存性によると、明らかに電圧印加したリゾチーム結晶化溶液の散乱光が、電圧印加せずにほぼ同一時間、静置した溶液の散乱光に比べて、その散乱光強度が著しく大きかった。
電圧印加無しの結晶化溶液でも、特に、散乱角8°付近より小角、特に3°から6°付近の散乱角において、ある程度の強度の散乱光が計測されているが、その強度は比較的弱かった。これに対し、電圧印加の結晶化溶液は、非常に大きな散乱光強度を示した。
このように低電圧(交流、実効値で1V未満)にもかかわらず、コントロールと比較した場合、散乱光強度は相当に高められた。SLS信号は、特に10°未満の前方小角で高くなっていた。
より大きなタンパク質凝集体は強度のSLSを誘発した。電場の無い溶液のSLSでは8°未満のθsで、散乱光強度が増加した。しかし、電場を印加した溶液に比べて、散乱光強度は低いままであった。SLSカーブにタンパク質凝集体の熱変動に起因する任意の小さな変異が現われた。これは、動的光散乱(DLS)と強度の関係があった。
つまり、前方小角散乱データにより、内部の電場が結晶化溶液のリゾチームの凝集を促進することに対する影響が明らかとなった。
【0043】
すなわち、電圧印加した場合、リゾチーム結晶化溶液中のリゾチームの凝集状態が大きく異なり、散乱光強度が顕著に増大していることから、リゾチームの凝集体形成や結晶核形成の促進等の結晶化が著しく進行していると判定できる。
したがって、この実施例により、タンパク質結晶化装置Xによって、タンパク質結晶化の状態分析に適した、前方小角散乱における散乱光の計測から、電場印加によるタンパク質結晶化の促進状態を高感度かつ高精度に測定できることがわかる。
なお、電圧印加したリゾチーム結晶化溶液の散乱光の曲線には、特に、散乱角10°付近よりも小角において、変動が計測されている。この変動は、散乱光測定の際の迷光、及び散乱光計測の際の電気的ノイズ等に因るものではなく、結晶化溶液からの散乱光自身の揺らぎ、すなわち、溶液中のリゾチーム凝集体や微結晶等の散乱体の熱的揺らぎが原因で生じたものであった。
【0044】
一方、電圧印加無しの状態で静置した溶液の散乱光曲線にも、このような小さな変動(ゆらぎ)が見られるが、電圧印加した溶液に比べそれらの変動も小さくなっている。このため、所定値を閾値として用いて、前方小角散乱の散乱強度からタンパク質の結晶化が促進されているか判定可能である。
検出部の光検出器として、高感度の光電子増倍管(PMT)を用いて散乱光を検出し、ストレージ型(波形記録型)のオシロスコープでその散乱光による増幅電圧信号を観測したところ、散乱光が、数十Hz程度以下の低周波領域において時間的に複雑に揺らいでいることが分かった。この現象は、動的光散乱(DLS)である。静的光散乱の強度が大きくなる、前方または後方の小角において、このようなDLSも増大し、結晶化溶液のDLSを感度良く測定でき、従って、タンパク質の凝集状態に関するより詳細な情報を得ることも可能である。
一方、結晶化溶液の散乱光強度が小さい、12°〜20°の比較的大きな散乱角では、散乱光の揺らぎは小さい。このため、この揺らぎを良好なSN比で測定するには、低ノイズの高性能増幅器等が必要であり、微小計測技術を必要とする。
【0045】
(電圧印加から適宜の時間経過後の前方小角散乱光の測定)
次に、図6を参照して、電圧印加から適宜の時間経過後の前方小角散乱光を測定した実施例について説明する。本実施例では、低電圧を印加して時間が経過した場合のイン・サイチュ(その場)前方小角散乱測定を行った。
すなわち、図6は、リゾチーム結晶化溶液に電圧を印加した状態において、本発明の実施の形態に係るタンパク質結晶化装置Xによって、電圧印加から適宜の時間経過後に、それぞれ測定されたSLS分布のグラフである。使用したリゾチーム結晶化溶液の濃度条件は、上述の実施例と同様に、リゾチーム濃度が20mg/mL、NaCl濃度が3.0%(w/v)であった。また、結晶化溶液に印加した電圧も同条件、すなわち、周波数20Hz、実効値0.71V(最大電圧値1V)の正弦波交流電圧であった。
結果として、SLS強度はリゾチーム溶液内に電圧を加えた時間に依存して増加した。大きな散乱角(例えば、θs=20°)では、初期のSLSカーブと比較すると、散乱強度の差異は小さかった。しかし、より小さな角度では、差異がより明白になった。270分後に、SLS強度及び変動の増加は顕著だった。これらから、タンパク質凝集体が内部の電場により大きくなっていたことが分かる。
より具体的に説明すると、リゾチーム結晶化溶液に電圧を印加して100分の経過時間では、未だ結晶化溶液の散乱光分布にはあまり変化が見られないが、180分の経過後には、結晶化溶液の散乱光強度が増大し、その後の経過時間270分及び320分では散乱光の増大が著しくなっている。また、特に、経過時間270分及び320分では、結晶化溶液からの散乱光自身の揺らぎも顕著に増大していることから、リゾチームの凝集体形成が進行している様子が判る。
結晶化溶液への電圧印加時間が100分間では、溶液の散乱光があまり変化していないことから、ある程度の電圧印加時間、例えば100分程度から180分程度以上の時間を経て、溶液中におけるリゾチームの状態の変化、例えば凝集体形成や微結晶形成の促進などの結晶化の進行が起こることが容易に推定できる。
【0046】
(静的光散乱強度の平均値と経過時間の関係)
次に、図7を参照して、上述の実施例におけるリゾチーム結晶化溶液の静的光散乱強度の平均値と経過時間の関係についての実施例について説明する。
図7は、リゾチーム濃度20mg/mL及び30mg/mL、NaCl濃度3.0%(w/v)のリゾチーム結晶化溶液に対し、上述の実施例と同様に電圧を印加した際の、SLS強度の時間依存性を示すグラフである。図7の横軸は、結晶化溶液に電圧を印加して経過した時間を示している。また、図7の縦軸は、静的光散乱強度の平均値を散乱光強度の値として示している。この静的光散乱強度の平均値は、上述の図6のようなリゾチーム結晶化溶液の静的光散乱分布(θs−Is)を基に、散乱角θsを波数ベクトルqに変換し、q−Isのデータにおいて、測定範囲のqに関して散乱光強度Isを平均した値である。この値は、各溶液試料の静的光散乱強度を相対的に簡単に比較できる指標となる。
図7に示すように、リゾチーム濃度20mg/mL及び30mg/mLとも、リゾチーム結晶化溶液に電圧印加し始めてからの経過時間に対し、経過時間100分程度までは、溶液の散乱光強度はほとんど変化しない。しかしながら、継続して電場を印加すると、タンパク質の凝集についての大きな変化、つまり「凝集の遷移」がt=100分付近で現われた。その後、散乱光強度は単調に増加した。30mg/mLのリゾチーム溶液は、20mg/mLのリゾチーム溶液より散乱光強度の上昇が早い。
このことから、電圧印加によるタンパク質凝集体形成の促進は、時間の経過のみでは進行しないことが分かる。つまり、結晶化溶液に電圧印加してすぐにタンパク質の凝集体形成が促進されるのではなく、むしろタンパク質の凝集体形成や結晶核形成には、ある程度の電圧印加の時間、例えば、100分間程度から150分間程度以上が必要であった。したがって、低電圧の内部電場印加によるタンパク質結晶化は、少なくとも100分程度以上の時間を要する。
【0047】
また、準安定域でリゾチーム溶液の濃度がより高いと、より大きな前方小角散乱を示し、結晶化の可能性がより高くなることも分かった。実際に電圧を印加した際、30mg/mLの溶液は、20mg/mLの溶液よりも早く視認できるリゾチーム結晶が現われた。リゾチーム濃度から、この差異は容易に理解できる。
本実施の形態に係るタンパク質結晶化装置Xでは、入力電力が非常に低いため、電圧印加によって誘発された溶液の温度増加が、タンパク質結晶化に影響を及ぼすことが殆どない程小さいことに注目すべきである。
【0048】
(電圧印加停止後のタンパク質結晶化)
最後に、図8を参照して、凝集を促進するのに十分な時間、電圧が印加されて止められた後の、タンパク質凝集プロセスについての実施例について説明する。
図8は、リゾチーム濃度が20mg/mL、NaCl濃度が3.0%(w/v)のタンパク質結晶化溶液31についての光散乱強度の典型的な変化の結果を示すグラフである。図8において、「0min」は、溶液に電圧を加える前に測定されたタンパク質結晶化溶液31のSLS強度を示す。また、「330min」は、330分間、上述の例と同様の電圧を印加した同一のタンパク質結晶化溶液31の散乱光強度である。また、「1,340min」は、340分後に電圧印加を停止した後、1,340分後に測定された同一のタンパク質結晶化溶液31の散乱光強度である。
図8の結果によれば、前方小角の散乱光強度は、タンパク質結晶化溶液に電場を加えると高められる。その後、印加した電場が切られても、この散乱光強度は増加し続ける。
これは、電圧印加によりタンパク質結晶化溶液が「凝集の遷移」の状態を経て、形成されたタンパク質凝集体が、電場無しで成長し続ける能力があることを示す。
逆に、印加電圧が「凝集の遷移」の状態になる前に止められた場合、SLSは印加電圧無しでは増加しなかった(図示せず)。
したがって、電場印加法では、電場が制限された時間のみ印加されても、タンパク質結晶の形成を促進する。
【0049】
以上のように、本実施例において、タンパク質結晶化装置Xを使用して、薄型で小型の低電圧駆動の結晶化溶液セルである測定試料部3を用いて、高精度のレーザ光散乱計測を行うことで、偶然に依らないタンパク質の結晶化促進が可能となった。
具体的に、測定試料部3のタンパク質結晶化溶液セルを使用して、ニワトリ卵白リゾチームの結晶化溶液に電場を印加した状態で、開発のタンパク質結晶化分析装置で測定したところ、電場印加が結晶化溶液に与える明確な効果が見られた。
ここで、測定試料部3の溶液セルは、薄型かつ小型であるため、微量の溶液を収容して、タンパク質結晶化溶液31からの散乱光の高精度計測を行うことができる。
すなわち、タンパク質結晶化装置Xを使用して、電場印加の状態下で結晶化溶液の光散乱を効率良く計測し、電場印加下で結晶化溶液状態を分析できる。よって、電場印加による結晶化促進の各種パラメータの最適化に資することができ、良質な結晶を容易に得ることが可能となる。
【産業上の利用可能性】
【0050】
本発明は、タンパク質結晶化溶液の結晶化を効率的に促進/分析する方法及び装置を提供するため、産業上利用することができる。
【符号の説明】
【0051】
1 制御解析部
3 測定試料部
5 散乱光検出部
6 電源
31 タンパク質結晶化溶液
32、33 透明基板
34、35 透明導電体電極
36、37 端子
39 電気絶縁部材
X タンパク質結晶化装置
【技術分野】
【0001】
本発明は、結晶化促進方法、結晶化解析方法、結晶の製造方法、結晶化装置の制御プログラム、記録媒体、及び結晶化装置に係り、特に生体高分子に内部電場印加を行い光散乱計測による結晶化状態の分析を行う技術に関する。
【背景技術】
【0002】
従来から、タンパク質に代表される生体高分子の機能を解明するために、結晶構造解析の技術が必要不可欠となっている。
生体高分子の結晶構造は、核磁気共鳴(NMR)測定、X線回折測定、また中性子線回折測定等を用いて解析される。
解析された結晶構造のデータを用いて、生体高分子の高次構造や機能の解析を行うことができる。
このような結晶構造の解析及び評価は、いかに良質の生体高分子の結晶を作製するかに大きく依存している。
【0003】
しかしながら、タンパク質結晶構造解析を行うにあたって、タンパク質の結晶化は主要な障害のままであった。
ここで、タンパク質の結晶作製は、通常、タンパク質の過飽和溶液に沈殿剤(結晶化剤)等を添加して行われる。
この際のタンパク質の結晶化条件は、タンパク質の溶液濃度、沈殿剤(結晶化剤)の種類や濃度、緩衝液の種類、pH値、溶液温度等の、物理的・化学的な結晶化要因を考慮する必要がある。
つまり、結晶化条件のスクリーニングは大変な努力を要する。
【0004】
ところが、溶液中におけるタンパク質の結晶成長速度は、一般的には大変遅い。
これは、X線又は中性子回折に適している単結晶を得るため、長い時間が要求されることを意味する。
従って、結晶化する条件下であっても、光学顕微鏡等で結晶生成が確認できるまでには、少なくとも数日から数週間が必要である。
また、タンパク質の種類や作製条件によっては、数ヶ月以上を要することもある。
さらに、困ったことに、結晶化条件がよく同定されているタンパク質に対してさえ、結晶化プロセスの詳細は、まだ明確になっていない。
【0005】
ここで、タンパク質結晶化は、過飽和になったタンパク質溶液に外部刺激を適用するいくつかの方法を使用して促進することができる。
この結晶化の促進方法として、磁場、超短パルス・レーザー、及び電場を加える外部刺激方法が知られている。電場印加法は、他の促進方法と比較すると、単純で廉価な装置を用いるため有利である。
典型的な電場印加法である外部電場印加法では、タンパク質結晶化を誘発するために、電気絶縁体を介して溶液に接している電極に高電圧(1〜10kV)をかける必要がある。このため、結晶化溶液セルの小型化が防げられるという問題があった。
対照的に、内部電場印加法は、例えば、実効値で1V以下の低電圧での印加を行うため、溶液での微弱電流が伴うという問題があるものの、結晶化溶液セルの大きさを最小化できる。
【0006】
従来の内部電場印加法の結晶化溶液セルとして、特許文献1を参照すると、内部電場を印加するタンパク質結晶化のための小さく透明な結晶化溶液セルが記載されている(以下、従来技術1とする。)。
この結晶化溶液セルでは、ガラス基板上のスズ含有のインジウム錫オキサイド(In2O3、ITO)薄膜を用いた透明導電体薄膜を透明導電体電極として使用しており、透明導電体電極を通して、タンパク質結晶成長についての観察が可能になった。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】国際公開第2010/100847号
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、従来技術1において、電場が結晶化を引き起こすプロセスは不明瞭なままであった。
したがって、この技術を使用した殆どの成功例は、試行錯誤の結果によっていた。
つまり、従来技術1の電場印加では、タンパク質の結晶化促進ができるものの、最適化条件等について探索するには、未だ多大な労力と時間を必要とするという問題があった。
【0009】
本発明は、このような状況に鑑みてなされたものであり、上述の課題を解消することを課題とする。
【課題を解決するための手段】
【0010】
本発明の結晶化促進方法は、タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶化促進方法であって、前記結晶化装置は、前記生体高分子の結晶化溶液と、前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、前記散乱光検出部により検出された信号を分析する制御解析部とを備え、前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析することを特徴とする。
本発明の結晶化促進方法は、前記制御解析部は、前記透明導電体電極に、低電圧を印加させ、前記結晶化溶液が生体高分子の凝集の遷移の状態になったことを検知して、前記低電圧の印加を停止させることを特徴とする。
本発明の結晶化促進方法は、前記前方小角散乱光又は前記後方小角散乱光の強度は、それぞれ散乱角度に対する前記前方小角散乱光の強度関数又は前記後方小角散乱光の強度関数であり、前記制御解析部は、散乱角度10°以下の前記前方小角散乱光又は前記後方小角散乱光の強度関数の変化により前記凝集の遷移の状態を検知することを特徴とする。
本発明の結晶化促進方法は、前記前方小角散乱光又は前記後方小角散乱光の強度は、それぞれ散乱角度に対する前記前方小角散乱光又は前記後方小角散乱光の強度関数から得られる、前記前方小角散乱光の強度の平均値又は前記後方小角散乱光の強度の平均値であることを特徴とする。
本発明の結晶化促進方法は、前記前方小角散乱光又は前記後方小角散乱光の時間的強度ゆらぎに基づいて、前記結晶化溶液における前記凝集の遷移の状態を分析することを特徴とする。
本発明の結晶化解析方法は、タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶化解析方法であって、前記結晶化装置は、前記生体高分子の結晶化溶液と、前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、前記散乱光検出部により検出された信号を分析する制御解析部とを備え、前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析し、前記結晶化溶液が生体高分子の凝集の遷移の状態を検知することを特徴とする。
本発明の結晶の製造方法は、タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶の製造方法であって、前記結晶化装置は、前記生体高分子の結晶化溶液と、前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、前記散乱光検出部により検出された信号を分析する制御解析部とを備え、前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析し、前記結晶化溶液が生体高分子の凝集の遷移の状態を検知して前記電場の印加を停止することを特徴とする。
本発明の結晶化装置の制御プログラムは、タンパク質を含む生体高分子の結晶化装置により、生体高分子の結晶化促進方法を実行させる結晶化装置の制御プログラムであって、前記結晶化装置は、前記生体高分子の結晶化溶液と、前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、前記散乱光検出部により検出された信号を分析する制御解析部とを備え、前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加させ、前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定させ、前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析させることを特徴とする。
本発明の記録媒体は、タンパク質を含む生体高分子を結晶化させるための結晶化装置により、生体高分子の結晶化促進方法を実行させる結晶化装置の制御プログラムを記録したコンピュータ読み取り可能な記録媒体であって、前記結晶化装置は、前記生体高分子の結晶化溶液と、前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、前記散乱光検出部により検出された信号を分析する制御解析部とを備え、前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加させ、前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定させ、前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析させることを特徴とする。
本発明の結晶化装置は、タンパク質を含む生体高分子の結晶化装置であって、前記結晶化装置は、前記生体高分子の結晶化溶液と、前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、前方小角散乱又は後方小角散乱を検出する散乱光検出部と、前記散乱光検出部により検出された信号を分析する制御解析部とを備え、前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析することを特徴とする。
【発明の効果】
【0011】
本発明によれば、電場印加の状態下で結晶化溶液の光散乱を効率良く計測して最適に生体高分子を結晶化できる結晶化促進方法を提供することができる。
【図面の簡単な説明】
【0012】
【図1】本発明の実施の形態に係るタンパク質結晶化装置Xの制御構成と、入射光、透過光、前方小角散乱光、並びに後方小角散乱光との関係を示す図である。
【図2】本発明の実施の形態に係る測定試料部3の構成例を示す断面図である。
【図3】本発明の実施の形態に係る測定試料部3の構成例を示す正面図である。
【図4】本発明の実施の形態に係るタンパク質結晶成長促進方法に係る処理のフローチャートである。
【図5】本発明の実施の形態の実施例に係るリゾチームの電圧印加/電圧印加無しにおける前方小角散乱の静的光散乱(SLS)分布を示すグラフである。
【図6】本発明の実施の形態の実施例に係るリゾチームの電圧印加から適宜の時間経過後の前方小角散乱光の測定を示すグラフである。
【図7】本発明の実施の形態の実施例に係る静的光散乱強度の平均値と経過時間の関係を示すグラフである。
【図8】本発明の実施の形態の実施例に係る電圧印加停止後のタンパク質結晶化の関係を示すグラフである。
【発明を実施するための形態】
【0013】
<実施の形態>
〔タンパク質結晶化装置Xの構成〕
まず、図1を参照して、本発明の実施の形態に係るタンパク質結晶化装置Xの構成について説明する。
本実施形態のタンパク質結晶化装置Xは、主な構成として、制御解析部1と、測定試料部3と、散乱光検出部5と、電源6とを備える。
タンパク質結晶化装置Xは、タンパク質結晶化溶液31を含む試料セルである測定試料部3の前方/後方小角散乱を測定するコンピュータ制御の前方小角散乱/後方小角散乱測定システムである。
図1においては、溶液セルの概略構成と前方/後方小角散乱光の測定の配置についても示した。図1の点線の矢印は光信号の流れを、実線の矢印は制御信号及び電気信号の流れの例を示している。
タンパク質結晶化装置Xは、測定試料部3に内部電場印加法で、電圧を印加する。この上で、例えば、2.5°から30°の間の角度において、0.05°の分解能で静的な前方小角散乱の正確な測定ができる。たとえば、約10分で2.5°から20°まで0.1°のステップで前方小角散乱が測定可能である。
【0014】
なお、本実施形態において、「前方小角光散乱」とは、測定対象となるタンパク質結晶化溶液へ入射する光の透過光に対する散乱角が10°程度以下、特に6°以下における溶液からの散乱光であることを示す。
また、同様に「後方小角光散乱」とは、測定対象の溶液へ入射する光の反射光に対する散乱角が10°程度以下、特に6°以下における溶液からの散乱光であることを示す。
【0015】
制御解析部1は、PC/AT互換機やMAC互換機等のPCやハンドヘルドデバイス等である。制御解析部1は、タンパク質結晶化溶液の散乱光に関する計測・収集したデータを分析し、例えば補助記憶装置であるハードディスク等に記憶する機能を備える。
制御解析部1は、電源6を制御して測定試料部3の結晶化溶液31に印加する電圧等を制御する。また、制御解析部1は、測定試料部3の2段回転ステージ等を制御する。また、制御解析部1は、タンパク質結晶化溶液31から散乱光検出部5により検出された静的光散乱、及び動的光散乱の計測、特に前方小角光散乱又は後方小角光散乱の計測に基づいて、溶液中におけるタンパク質結晶化の状態を分析する。この上で、制御解析部1は、タンパク質の結晶化が進行する状態になった場合には、電圧の印加を止めるように制御することが可能である。
なお、制御解析部1は、計測したデータをグラフとして表示部(ディスプレイ)やプリンタ(図示せず)に画像として表示する機能を備えている。
【0016】
測定試料部3は、測定対象のタンパク質結晶化溶液31を収容し、電圧を印加し、散乱光を計測するための容器(溶液セル)を含む部位である。
測定試料部3には、タンパク質結晶化溶液31からの散乱光、特に前方小角散乱光又は後方小角散乱光を測定するための適切な光学的配置が施されている。測定試料部3は、測定対象の溶液が微量で、高濃度であっても、溶液からの散乱光を効率良く放出させるように構成される。
測定試料部3には、更にこの溶液セルを支持する指示部材、及び溶液セルへ平行光を導くためのレンズやプリズム等の光学素子、入射光の角度を調整するステージ等を備えていてもよい。このため、測定試料部3は、例えば、θ回転ステージ上に固定される。この際、測定試料部3は、タンパク質結晶化溶液31へ、ビーム光が平行状態になるよう光学調整を行ったコリメートビーム光等を入射させ、溶液セルの透過光や反射光の影響を少なくし、タンパク質結晶化溶液からの前方小角散乱光又は後方小角散乱光、特に前方小角散乱光を効率よく放射させ測定できるように構成されている。
また、測定試料部3は、電源6からの交流電圧を内部印加で印加することができる。
測定試料部3の溶液セルの具体的な構造について後述する。
【0017】
散乱光検出部5は、タンパク質結晶化溶液から放射される散乱光を検出し、散乱光強度を測定するための光検出器である。
具体的には、散乱光検出部5は、タンパク質結晶化溶液による散乱光の検出に適した光検出器であり、各種の光センサを用いることができる。このため、散乱光検出部5は、θ回転ステージやスリット等の光学素子を含ませて、構成することができる。
タンパク質結晶化溶液の散乱光の時間的変化の測定(動的散乱光(DLS、Dynamic Light Scattering)測定とも呼ぶ)を行う場合には、散乱光検出部5の応答性を考慮し、適切な検出器を選択する。
応答性に優れた光検出器としては、pn接合間に真性半導体層を持ったPINフォトダイオード、アバランシェフォトダイオード、及びフォトマルチプライヤ(PMT)等が挙げられ、測定する散乱光のゆらぎ時間やゆらぎ周波数に応じて光検出器を選択する。
散乱光検出部5からの散乱光の信号が増幅されたアナログの出力電圧信号は、例えば、増幅された上で、アナログ/デジタル(A/D)変換器を介してデジタル信号に変換される。制御解析部1は、このデジタル信号を測定データとして取り込むことができる。
【0018】
なお、測定試料部3と散乱光検出部5とは、電動の回転ステージを用いて角度を調整するように構成可能である。この回転ステージとしては、例えば、2つの回転ステージの回転軸を一致させ、2段組に重ね合わせることによって一体化した、独立に回転移動できる2段回転ステージ(以下、θ−2θ回転ステージと呼ぶ。)を用いて入射光及び前方/後方小角散乱光の角度を調整するように構成できる。図1のタンパク質結晶化装置Xにおいて、制御解析部1が、入射角制御部の回転ステージにより入射光の角度を調整し、測定試料部3に導入する。そして、制御解析部1は、この溶液セル内のタンパク質結晶化溶液31からの散乱光の角度を回転ステージにより角度を調整し、散乱光検出部5に導入させ、前方小角散乱/後方小角散乱を測定する。
このようなタンパク質結晶化溶液の静的/動的散乱光の検出については、例えば、特願2010−281562又は文献(T.Wakamatsu,Applied Physics Letters,98,263701(2011)、参照)に記載の技術を用いて構成することができ、本明細書ではこれを引用するものとする。
【0019】
電源6は、多機能のファンクションジェネレータ等を用いた電源であり、測定試料部3に交流又は直流の電圧を印加する。
また、電源6は、測定試料部3に印加された電圧を、ストレージオシロスコープ等のように表示し、制御解析部1にてモニタリング可能である。
電源6は、測定試料部3の結晶化溶液セル内の導電性のタンパク質結晶化溶液31に、直流に換算した場合、1.2V以下の電圧で0.1μA以下の微弱電流が流れる。
【0020】
(本発明の実施の形態に係る測定試料部3の構成)
次に、図2の側断面図と図3の概正面図とを参照して、本発明の実施の形態に係る測定試料部3の溶液セルの構成の一例について説明する。
測定試料部3は、上述したように、光散乱計測のためにタンパク質結晶化溶液を収容するための溶液セルを含む部位である。この結晶化溶液セルの部位については、従来技術1の結晶化溶液セルと同様の構成を用いることができる。
具体的には、測定試料部3は、透明導電体薄膜の透明導電体電極34、35をそれぞれ形成した2つの平板状電極基板である透明基板32、33によって、電気絶縁部材として所定の厚さで平板状(面状)の絶縁スペーサーである電気絶縁部材39を挟む。そして、電気絶縁部材39内に、タンパク質結晶化溶液31を注入し保持する。測定試料部3は、このように、いわゆる「サンドイッチ型」電極構造にて製造することができる。つまり、電気絶縁部材39と透明基板32、33とは、タンパク質結晶化溶液31を保持する容器になる。
透明基板32、33に平板状の電極を用いることで、結晶化溶液中に、ほぼ一様な電場が形成される。これにより、溶液中の生体高分子全体に、効率よく電場を印加できるという効果が得られる。
また、透明基板32、33と透明導電体電極34、35とを用いることで、前方小角散乱光の測定と解析による電圧印加と結晶化の促進制御/解析が可能となる。
【0021】
タンパク質結晶化溶液31は、測定・分析対象のタンパク質結晶化溶液である。タンパク質結晶化溶液31は、タンパク質と、タンパク質を結晶化するための沈殿剤(結晶化剤)とを含む溶液、或いは、それらを含む各溶液の組み合わせ(混合)である。また、タンパク質結晶化溶液31には、pHを調整するために、タンパク質の結晶化に適した緩衝液(バッファー)を使用する。
また、タンパク質結晶化溶液31としては、バッチ法及び蒸気拡散法のいずれのタンパク質結晶化方法に係る試料溶液も用いることができる。
ここで、バッチ法とは、例えば、タンパク質と沈殿剤(結晶化剤)とを混合させたタンパク質結晶化溶液を測定試料部3内に封止して、タンパク質を結晶化させる方法である。また、蒸気拡散法とは、タンパク質含有溶液と沈殿剤(結晶化剤)含有溶液、及び緩衝液等の必要な各溶液を測定試料部3の中に離した状態で注入し封止して、タンパク質を結晶化させる方法である。
【0022】
透明基板32、33は、薄膜の透明導電体電極34、35を形成した平板状の透明な基板である。
透明基板32は、測定試料部3に入射光が入射する側の部材である。また、反対側の透明基板33は、測定試料部3から透過光が出射され、また散乱光が放射される側の部材である。同じ材料の透明部材で透明基板32、33を構成した場合には、測定試料部3において入射側と出射側の区別はなく、どちらから光を入射させてもよい。
透明基板32、33の材料としては、入射光側と散乱光放射側で、測定光領域で透過性に優れた光学材料が好ましい。これにより、前方小角散乱測定によって、電圧印加時のタンパク質凝集を測定できる。また、透明基板32、33を通して、実体顕微鏡などの光学顕微鏡やルーペ等により、結晶形成状態の光学的観察も可能である。
透明基板32、33は、薄い光学ガラス基板(厚さ約0.1〜0.5mm)を用いることが好適である。透明基板32、33として、例えば、2つの薄い光学ガラス板であるBK−7(18×32×0.15mm3)等を用いることができる。
なお、透明基板32、33としては、ガラス基板の他にも、耐熱性の樹脂(高分子、プラスチック)等であっても構わない。化学的に安定なプラスチック材料としては、ポリエチレンテレフタレート(PET)、ポリ塩化ビニリデン、及びポリエチレン等の重合高分子化合物が好ましい。
また、透明基板32、33は、所定の波長を透過しないようなフィルターやコーティング等を形成したり貼り付けたりすることもできる。また、偏光板等を形成することもでき、これにより位相差等により、結晶を観察しやすくなるという効果が得られる。
【0023】
透明導電体電極34、35は、透明基板32、33の上に形成された透明導電体の薄膜である。透明導電体電極34、35は、生体高分子の結晶化溶液へ電圧を印加するための電極として、端子36、37を介して電源6に電気的に接続される。これにより、電源6の電圧発生器から供給される所定の直流又は交流の電圧が、タンパク質結晶化溶液31に印加される。
透明導電体電極34、35は、透明導電体として、例えば、無機酸化物である、スズ含有の酸化インジウム(In2O3:Sn,ITO)、酸化亜鉛(ZnO)、酸化錫(SnO2)、酸化チタン(TiO2)等を用いることができる。たとえば、スズを添加した酸化インジウム(ITO)の薄膜を用いることが好適である。ITO膜の酸化物電極自体は、タンパク質結晶化において、結晶の核生成を起こすといった影響が無いため好適である。
透明導電体電極34、35としてITO膜を用いる場合、例えば、高周波マグネトロンスパッタリング法を用いることができる。この場合、厚さ10nm〜5μm程度のITO膜を用いることができる。膜厚が薄い方が光透過性で有利になるものの、結晶化溶液セルの耐久性等を考慮して最適な膜厚を選択することができる。たとえば、RF−DC結合形低圧マグネトロンスパッタ法を用いた場合、厚さ約100nm程度のITO膜電極を用いることが好適である。このような100nmのITO膜の場合、固有抵抗は、約5×10-4Ωcmで、光透過率は80%程度以上になる。
透明導電体電極34、35は、薄膜の電極を結晶化溶液に直接接触させる。平板の電極をこのように平行に対応して配置することで、印加電圧によってタンパク質結晶化溶液31内に、効率よく、均一な電場を印加することができる。
なお、透明導電体として、透明性のあるポリチオフェン系やポリピロール系などの導電性高分子も利用できる。
また、透明導電体電極34、35は、結晶形成の光学的観察が可能な程度の透過率があればよく、所定の波長を透過させなくてもよい。
【0024】
端子36、37は、透明導電体電極34、35から電源6に接続するための金属配線と端子を含む部位である。
この金属配線は、ITO膜製造後に、銀粒子ペースト等を使用して端子36、37に電気的に接続することができる。
【0025】
電気絶縁部材39は、透明導電体電極34、35の透明導電体電極に印加する電圧を絶縁するための電気絶縁スペーサー(以下、単に絶縁スペーサーと称す)である。
電気絶縁部材39の絶縁スペーサーは、結晶化溶液を保持するシール材でもある。すなわち、この電気絶縁部材39内に形成された溝孔等と、透明基板32、33の透明導電体電極34、35と絶縁スペーサーとで囲まれた空間が、タンパク質結晶化溶液31を収容する容器として機能する。
電気絶縁部材39の溝孔の大きさは、入射光のビームよりも大きくすることが好適である。これは、スペーサーから散乱光が生じると大きなノイズになるためである。
電気絶縁部材39として、例えばシリコンゴムや各種プラスチックを用いることができる。シリコンゴムを用いると、密着性が良好であり、数週間程度は結晶化溶液からの蒸発を防止できる。
【0026】
なお、測定試料部3へ前方小角散乱測定のため入射させる入射光としては、平行光、すなわちコリメート光が好ましい。これは、溶液からの散乱光の放射角強度分布を正確に測定するためである。
このため、狭いビームを生成する各種レーザーを用いることが好適である。たとえば、直径約0.7mm程度の狭いビームを生成するダイオード励起固体レーザー(λ=473nm、25mW)が好適である。
なお、入射光及び透過光の広がり角は、可能な限り低く抑えることが好ましい。
【0027】
〔タンパク質結晶成長促進方法〕
次に、本発明の実施の形態に係るタンパク質結晶成長促進方法について説明する。
本発明者らは、小角(θsが8°程度以下)の前方光散乱(FLS、forward light scattering)は、溶液が結晶化する際のタンパク質凝集に対して非常に敏感であることを発見した。本発明者らは、この前方小角散乱と電圧印加の制御とを組み合わせると、容易にタンパク質の結晶化促進の制御ができることを見いだし、鋭意実験と観察とを行い本発明を完成させた。
タンパク質の凝集は、タンパク質結晶化の核生成とその後の結晶成長にとって不可欠である。このため、前方小角散乱の測定は、タンパク質の結晶化を特徴づけることができる。
本発明者らは、内部電場印加によるタンパク質溶液の状態の推定に、この前方小角散乱の測定を用いることで、顕著にタンパク質結晶化させるタンパク質結晶化方法を完成させた。
すなわち、本実施形態に係るタンパク質結晶成長促進方法は、内部電場印加によるタンパク質溶液の状態の推定に、前方小角散乱の測定を用いる。これにより、顕著にタンパク質結晶化を促進させることができる。
以下で、図4を参照して、本実施形態のタンパク質結晶成長促進方法の処理の詳細について説明する。
【0028】
(ステップS101)
まず、結晶化溶液を調製する。
このステップでは、タンパク質結晶化溶液31に上述した結晶化させたい生体高分子、例えばタンパク質と、沈殿剤と、バッファーとを所定条件で調製する。この上で、透明導電体電極35に電気絶縁部材39を載せた状態で、タンパク質結晶化溶液31を注ぐ。
そして、測定試料部3にタンパク質結晶化溶液31を注入した後、蒸発を防止するために、例えばパラフィンオイル等でシールする。なお、液漏れ防止のために2枚の透明基板32、33と電気絶縁部材39との間をシリコングリースやフッ素グリース等でシールすることも好適である。
また、測定試料部3から溶液が漏れ出ないように、スペーサーと基板とを強く密着させ、適宜、留め金具等でクリップすることもできる。
なお、このタンパク質結晶化溶液31や各種バッファーの測定試料部3への導入について、制御解析部1が、タンパク質結晶化装置Xに備えられたマイクロパイプ等の輸液機構等を制御して実現するように構成できる。
【0029】
(ステップS102)
次に、本発明の実施の形態に係るタンパク質結晶化装置Xは、結晶化溶液への電圧の印加を行う。
具体的には、制御解析部1は、測定対象のタンパク質結晶化溶液31を含む測定試料部3に、電場印加により電源6から所定の交流/直流電圧を印加してタンパク質の結晶化を促進する。
この時間としては、少なくとも数時間程度、特に100分から180分間程度の電圧印加が好ましい。本実施形態では、低電圧を印加するため、電気分解は殆ど起こらず、微細結晶形成等の結晶化への悪影響が最低限に抑えられるという効果が得られる。
【0030】
(ステップS103)
次に、タンパク質結晶化装置Xは、前方小角散乱測定/解析を行う。
具体的には、レーザー等の入射光を入射したタンパク質結晶化溶液31の前方小角又は後方小角における散乱光を散乱光検出部5が測定し、制御解析部1に出力する。
制御解析部1は、この測定結果から、タンパク質結晶化溶液からの前方小角散乱光又は後方小角散乱光の放射角度の強度分布(SLS)、又はその時間的強度変化(DLS)を分析する。これにより、タンパク質結晶化溶液の状態を推定する。
ここでは、100分から180分間程度の時間で電場を印加した際に、凝集についての大きな変化が現われたか否かについて解析をする。この「凝集についての大きな変化」を、以下で、「凝集の遷移」の状態という。この「凝集の遷移」の状態では、顕微鏡等でも確認困難なタンパク質結晶化の核生成が起き、タンパク質結晶化溶液31の状態が変化していると考えられる。
この「凝集の遷移」の状態を検知するためには、前方小角の散乱角8°付近より小角、特に3°から6°付近の散乱角において、所定強度の散乱光が増加したことを検知する。この所定強度は、例えば、後述の実施例のように、リゾチームのような結晶化の性質がよく分かっているタンパク質の電圧印加と結晶化との関係から求めることができる。
【0031】
(ステップS104)
次に、制御解析部1は、散乱強度が変化して、タンパク質結晶化溶液31の状態が結晶化に向かっているか否か判定する。すなわち、「凝集の遷移」の状態になった場合、Yesと判定し、それ以外の場合はNoと判定する。
Yesの場合、制御解析部1は、処理をステップS105に進める。
Noの場合、制御解析部1は、処理をステップS102に戻す。
【0032】
(ステップS105)
この上で、タンパク質結晶化装置Xの制御解析部1は、タンパク質結晶化溶液31の状態が「凝集の遷移」の状態になった場合、電圧の印加を停止して、その旨を図示しない表示部の表示やブザー等で報知する。
この「凝集の遷移」の状態となった後は、下記の実施例で示すように、電場を印加しなくても結晶化が促進されるという効果が得られる。このため、電気分解等によるタンパク質結晶化溶液31の劣化を最小限に抑えた上で、測定試料部3の結晶化溶液セルを回収できる。また、結晶化を促進するための電圧の印加時間、及び電圧と沈殿剤の最適容量等との関係を最低限の手間で把握できる。
回収した測定試料部3の結晶化溶液セルを放置すると、タンパク質の結晶が成長する。成長した結晶のうち、X線や中性子線での解析に適した大きさで質の良い結晶を回収可能である。
以上で、本発明の実施の形態に係るタンパク質結晶成長促進方法の処理を終了する。
【0033】
以上のように構成することで、以下のような効果を得ることができる。
まず、本発明の実施の形態に係るタンパク質結晶化装置Xは、光学顕微鏡等でタンパク質の結晶形成確認を待たずに、電場印加下においてタンパク質の結晶化促進状態を分析できる。すなわち、稀少なタンパク質が溶解した数十μL以下の微量なタンパク質結晶化溶液31に対して、低電圧の印加状態下で、結晶形成の前段階状態にある「凝集の遷移」のような状態を評価することができる。
また、電場の印加によって観察された前方小角散乱の増加は、タンパク質結晶化のための必要条件である。実際に、回収した結晶化溶液セルでは大きな凝集体の形成が起こり、容易に観察することができる。また、この大きな凝集体の形成は、結晶核生成と結晶成長の基本の過程であることが確かである。
つまり、本発明の実施の形態に係るタンパク質結晶化促進方法では、準安定領域にあるタンパク質結晶化溶液31の低電圧印加と前方小角散乱を用いた観察とにより、従来は、多大な労力と時間を要した結晶化条件の探索が効率良く行える。
また、電場に誘発されたタンパク質凝集を前方小角散乱により検出することで、従来は不明であった電場印加によるタンパク質結晶化促進のメカニズムを解明することができる。つまり、電場によるタンパク質の結晶化における好適な解析方法を提供することができる。これにより、タンパク質の結晶化についての詳細を知ることができる。
また、本発明の実施の形態に係るタンパク質結晶化方法は、前方小角散乱を用いて、内部電場下のリゾチーム溶液のタンパク質の凝集が観察する。これにより、内部電場印加による「凝集の遷移」の存在を確認することができる。つまり、タンパク質溶液に100分以上の所定時間の低電圧をかけ、「凝集の遷移」の状態を確認すると、その後のタンパク質結晶化溶液31は凝集が著しく促進されることが期待できる。
これにより、必要十分な時間だけ電圧を印加することが可能になり、電気分解等の弊害を避けて、確実にタンパク質結晶化促進を行うことができる。
【0034】
なお、上述の実施の形態においては、生体高分子としてタンパク質の結晶化の例について説明したが、本発明はこれに限られず、各種生体高分子の分子配向化促進等について用いることができる。たとえば、生体高分子として、DNA、RNA等の核酸、糖質、脂質等について用いることができる。
また、PNA(Peptide Nucleic Acid)のような合成された生体高分子についても用いることができる。
【実施例】
【0035】
以下で、図面に基づいて本発明を実施例により更に順次説明するが、以下の具体例は本発明を限定するものではない。
【0036】
(生体高分子のタンパク質結晶化溶液31の調製)
本発明者らは、前方小角散乱を用いて、内部電場印加での凝集体の生成を示すために、タンパク質のニワトリ卵白リゾチームをモデル・タンパク質として使用した。ニワトリ卵白リゾチーム(HEWL:以下、単にリゾチームと呼ぶ。)は、結晶化の諸条件が良く調査されている。実際に、リゾチームは、結晶化の諸条件の関係性を図示した「相図」も作成されており(例えば、「W.Iwai,D.Yagi,T.Ishikawa,Y.Ohnishi,I.Tanaka,and N.Niimura,"Crystallization and evaluation of hen egg−white lysozyme crystals for protein pH titration in the crystalline state",Journal of Synchrotron Radiation,vol.15,pp.312−315(2008).」を参照)、分析対象として最適なタンパク質である。
本実施例においては、沈殿剤(結晶化剤)として、塩化ナトリウム(NaCl)を含む水溶液を用い、pH値を緩衝液(バッファー)である酢酸−酢酸ナトリウム緩衝液を用いて調製した。
具体的には、リゾチームは、再結晶によって6回精製されたものを、生化学工業株式会社から購入した。リゾチームはそれ以上の精製無しで使用された。また、リゾチーム溶液[CHEWL=90mg/mL(6.3mM)]と沈殿剤のNaCl[CNaCl=15%](w/v)(2.56M)とが50mM濃度の酢酸−酢酸Na緩衝溶液(pH4.6)を用いて、タンパク質結晶化溶液31として使用された。各実験においては、20℃で保存溶液から各タンパク質結晶化溶液31が別々に調製された。各溶液はフィルター(0.2μm孔径)を通し、20℃において所定比で混合され、調製された。タンパク質結晶化溶液31の導電率は約1〜5mS/cmだった。導電率は、マイクロリットル単位の微量溶液を測定できる簡易導電率計により測定された。
その後、それぞれのタンパク質結晶化溶液31(約18μL)は、透明基板の両方の導電性フィルムと接触して面するように、測定試料部3の絶縁スペーサーの円孔に注がれた。
前方小角散乱測定は、溶液を混合してから5分以内に始められた。
【0037】
(前方小角散乱の計測)
測定試料部3は、結晶化溶液セルへ電場を印加した状態で、電極を通してタンパク質溶液からの前方小角散乱の正確な測定ができるように、十分に薄く透明に構成した。
電気絶縁部材39として、円孔(直径約6mm)のあるシリコンゴム絶縁体シート(厚さ約1mm)が、2枚のITOを形成したプレートである透明基板32、33の間に挟まれた。
電場を印加する実験は、すべて正弦波で低周波、7.1V/cmの平均電場を与える20Hzの実効値0.71V(Vpp=2.0V)のAC電圧を使用した。
この印加電圧は必ずしも結晶化のための最適化された条件ではないが、結晶化促進に有効であると分かった。
泡の存在によって確認できる溶液の電気分解は、観察されなかった。なお、電気分解は、結晶化を妨害する溶存物質の迅速な濃度変異を誘発するため、好ましくない。
対照実験用に準備した測定試料部3(コントロール)は、電場を印加した測定試料部3と同条件で、電場を印加しないように調製された。
すべての実験で、NaClとリゾチーム溶液は、既知の結晶化状態図による準安定領域中になるよう使用された。
電場印加を行った前方小角散乱測定の実験は、すべて空調のある20℃プラスマイナス0.5℃の部屋で、上述のセット・アップにより行なわれた。
【0038】
(リゾチーム結晶化溶液の静的光散乱(SLS)分布)
図5を参照して、本発明の実施の形態に係るタンパク質結晶化装置Xによって測定された静的光散乱(SLS)分布についての実施例について説明する。
図5は、タンパク質結晶化溶液31としてリゾチーム結晶化溶液を用いた静的光散乱分布のグラフである。
縦軸は、散乱光強度として取得したIs値を、入射モニター光検出部(図示せず)による入射モニター光の強度I0で割って得られたものであり、すなわち、Is/I0である。横軸は、前方小角散乱角の角度θs(°)を示す。印加電圧ありのサンプルと、印加電圧の無いサンプルに対する静的光散乱(SLS)パターン(Is−θsカーブ)を示す。
【0039】
この分析におけるタンパク質結晶化溶液31として、リゾチーム濃度20mg/mL、沈殿剤(結晶化剤)NaCl濃度を3.0%(w/v)とし、溶液セルにリゾチーム結晶化溶液を封止したバッチ法の測定試料を用いた。
なお、ここで使用した結晶化溶液のリゾチーム及び結晶化剤の濃度条件は、相図によると、リゾチームの結晶作製に適する準安定条件の濃度領域に位置し、バッチ法では、核形成となる塵等や外部刺激(磁場、光、電場や音波等)によって結晶が形成・成長できる溶液状態である。
【0040】
この実施例では、同じ構造で寸法も同じ2つの溶液セルを用意し、同一濃度条件のタンパク質結晶化溶液をほぼ同時刻にリゾチーム結晶化溶液を封止した。
そして、所定の時間経過後に本発明の実施の形態に係るタンパク質結晶化装置Xを用いて、それぞれSLS分布を測定した。
一方の溶液セルにおいては、電圧発生器のファンクションジェネレータで発生させた周波数20Hz、実効値0.71V(最大電圧値1V)の正弦波交流電圧を透明導体膜の透明導体電極に約300分間印加した状態においてSLS分布を測定した。
もう一方の溶液セルでは、電圧を印加せずにそのまま静置し、約360分後にSLS分布を測定した。
【0041】
タンパク質結晶化溶液31を収容した溶液セルには、半径10mmのBK−7ガラス製の半円柱形プリズムの側面平面部に、ガラス材料と同じ屈折率の屈折率整合オイルで貼り付け、測定試料を装着した半円柱形プリズムをθ回転ステージ上に設置した。
これに、焦点距離130mmの円筒面平凸レンズ(シリンドリカルレンズ)と半円柱形プリズムとを用いて、球面部側面側からタンパク質結晶化溶液31へ、波長473nmの青色レーザ光を入射した。
この上で、タンパク質結晶化溶液からの散乱光を、透過光の方向(前方)からの散乱角度20°から3°までの前方小角散乱角の範囲で測定した。
【0042】
図5のリゾチーム結晶化溶液の散乱光強度の散乱角依存性によると、明らかに電圧印加したリゾチーム結晶化溶液の散乱光が、電圧印加せずにほぼ同一時間、静置した溶液の散乱光に比べて、その散乱光強度が著しく大きかった。
電圧印加無しの結晶化溶液でも、特に、散乱角8°付近より小角、特に3°から6°付近の散乱角において、ある程度の強度の散乱光が計測されているが、その強度は比較的弱かった。これに対し、電圧印加の結晶化溶液は、非常に大きな散乱光強度を示した。
このように低電圧(交流、実効値で1V未満)にもかかわらず、コントロールと比較した場合、散乱光強度は相当に高められた。SLS信号は、特に10°未満の前方小角で高くなっていた。
より大きなタンパク質凝集体は強度のSLSを誘発した。電場の無い溶液のSLSでは8°未満のθsで、散乱光強度が増加した。しかし、電場を印加した溶液に比べて、散乱光強度は低いままであった。SLSカーブにタンパク質凝集体の熱変動に起因する任意の小さな変異が現われた。これは、動的光散乱(DLS)と強度の関係があった。
つまり、前方小角散乱データにより、内部の電場が結晶化溶液のリゾチームの凝集を促進することに対する影響が明らかとなった。
【0043】
すなわち、電圧印加した場合、リゾチーム結晶化溶液中のリゾチームの凝集状態が大きく異なり、散乱光強度が顕著に増大していることから、リゾチームの凝集体形成や結晶核形成の促進等の結晶化が著しく進行していると判定できる。
したがって、この実施例により、タンパク質結晶化装置Xによって、タンパク質結晶化の状態分析に適した、前方小角散乱における散乱光の計測から、電場印加によるタンパク質結晶化の促進状態を高感度かつ高精度に測定できることがわかる。
なお、電圧印加したリゾチーム結晶化溶液の散乱光の曲線には、特に、散乱角10°付近よりも小角において、変動が計測されている。この変動は、散乱光測定の際の迷光、及び散乱光計測の際の電気的ノイズ等に因るものではなく、結晶化溶液からの散乱光自身の揺らぎ、すなわち、溶液中のリゾチーム凝集体や微結晶等の散乱体の熱的揺らぎが原因で生じたものであった。
【0044】
一方、電圧印加無しの状態で静置した溶液の散乱光曲線にも、このような小さな変動(ゆらぎ)が見られるが、電圧印加した溶液に比べそれらの変動も小さくなっている。このため、所定値を閾値として用いて、前方小角散乱の散乱強度からタンパク質の結晶化が促進されているか判定可能である。
検出部の光検出器として、高感度の光電子増倍管(PMT)を用いて散乱光を検出し、ストレージ型(波形記録型)のオシロスコープでその散乱光による増幅電圧信号を観測したところ、散乱光が、数十Hz程度以下の低周波領域において時間的に複雑に揺らいでいることが分かった。この現象は、動的光散乱(DLS)である。静的光散乱の強度が大きくなる、前方または後方の小角において、このようなDLSも増大し、結晶化溶液のDLSを感度良く測定でき、従って、タンパク質の凝集状態に関するより詳細な情報を得ることも可能である。
一方、結晶化溶液の散乱光強度が小さい、12°〜20°の比較的大きな散乱角では、散乱光の揺らぎは小さい。このため、この揺らぎを良好なSN比で測定するには、低ノイズの高性能増幅器等が必要であり、微小計測技術を必要とする。
【0045】
(電圧印加から適宜の時間経過後の前方小角散乱光の測定)
次に、図6を参照して、電圧印加から適宜の時間経過後の前方小角散乱光を測定した実施例について説明する。本実施例では、低電圧を印加して時間が経過した場合のイン・サイチュ(その場)前方小角散乱測定を行った。
すなわち、図6は、リゾチーム結晶化溶液に電圧を印加した状態において、本発明の実施の形態に係るタンパク質結晶化装置Xによって、電圧印加から適宜の時間経過後に、それぞれ測定されたSLS分布のグラフである。使用したリゾチーム結晶化溶液の濃度条件は、上述の実施例と同様に、リゾチーム濃度が20mg/mL、NaCl濃度が3.0%(w/v)であった。また、結晶化溶液に印加した電圧も同条件、すなわち、周波数20Hz、実効値0.71V(最大電圧値1V)の正弦波交流電圧であった。
結果として、SLS強度はリゾチーム溶液内に電圧を加えた時間に依存して増加した。大きな散乱角(例えば、θs=20°)では、初期のSLSカーブと比較すると、散乱強度の差異は小さかった。しかし、より小さな角度では、差異がより明白になった。270分後に、SLS強度及び変動の増加は顕著だった。これらから、タンパク質凝集体が内部の電場により大きくなっていたことが分かる。
より具体的に説明すると、リゾチーム結晶化溶液に電圧を印加して100分の経過時間では、未だ結晶化溶液の散乱光分布にはあまり変化が見られないが、180分の経過後には、結晶化溶液の散乱光強度が増大し、その後の経過時間270分及び320分では散乱光の増大が著しくなっている。また、特に、経過時間270分及び320分では、結晶化溶液からの散乱光自身の揺らぎも顕著に増大していることから、リゾチームの凝集体形成が進行している様子が判る。
結晶化溶液への電圧印加時間が100分間では、溶液の散乱光があまり変化していないことから、ある程度の電圧印加時間、例えば100分程度から180分程度以上の時間を経て、溶液中におけるリゾチームの状態の変化、例えば凝集体形成や微結晶形成の促進などの結晶化の進行が起こることが容易に推定できる。
【0046】
(静的光散乱強度の平均値と経過時間の関係)
次に、図7を参照して、上述の実施例におけるリゾチーム結晶化溶液の静的光散乱強度の平均値と経過時間の関係についての実施例について説明する。
図7は、リゾチーム濃度20mg/mL及び30mg/mL、NaCl濃度3.0%(w/v)のリゾチーム結晶化溶液に対し、上述の実施例と同様に電圧を印加した際の、SLS強度の時間依存性を示すグラフである。図7の横軸は、結晶化溶液に電圧を印加して経過した時間を示している。また、図7の縦軸は、静的光散乱強度の平均値を散乱光強度の値として示している。この静的光散乱強度の平均値は、上述の図6のようなリゾチーム結晶化溶液の静的光散乱分布(θs−Is)を基に、散乱角θsを波数ベクトルqに変換し、q−Isのデータにおいて、測定範囲のqに関して散乱光強度Isを平均した値である。この値は、各溶液試料の静的光散乱強度を相対的に簡単に比較できる指標となる。
図7に示すように、リゾチーム濃度20mg/mL及び30mg/mLとも、リゾチーム結晶化溶液に電圧印加し始めてからの経過時間に対し、経過時間100分程度までは、溶液の散乱光強度はほとんど変化しない。しかしながら、継続して電場を印加すると、タンパク質の凝集についての大きな変化、つまり「凝集の遷移」がt=100分付近で現われた。その後、散乱光強度は単調に増加した。30mg/mLのリゾチーム溶液は、20mg/mLのリゾチーム溶液より散乱光強度の上昇が早い。
このことから、電圧印加によるタンパク質凝集体形成の促進は、時間の経過のみでは進行しないことが分かる。つまり、結晶化溶液に電圧印加してすぐにタンパク質の凝集体形成が促進されるのではなく、むしろタンパク質の凝集体形成や結晶核形成には、ある程度の電圧印加の時間、例えば、100分間程度から150分間程度以上が必要であった。したがって、低電圧の内部電場印加によるタンパク質結晶化は、少なくとも100分程度以上の時間を要する。
【0047】
また、準安定域でリゾチーム溶液の濃度がより高いと、より大きな前方小角散乱を示し、結晶化の可能性がより高くなることも分かった。実際に電圧を印加した際、30mg/mLの溶液は、20mg/mLの溶液よりも早く視認できるリゾチーム結晶が現われた。リゾチーム濃度から、この差異は容易に理解できる。
本実施の形態に係るタンパク質結晶化装置Xでは、入力電力が非常に低いため、電圧印加によって誘発された溶液の温度増加が、タンパク質結晶化に影響を及ぼすことが殆どない程小さいことに注目すべきである。
【0048】
(電圧印加停止後のタンパク質結晶化)
最後に、図8を参照して、凝集を促進するのに十分な時間、電圧が印加されて止められた後の、タンパク質凝集プロセスについての実施例について説明する。
図8は、リゾチーム濃度が20mg/mL、NaCl濃度が3.0%(w/v)のタンパク質結晶化溶液31についての光散乱強度の典型的な変化の結果を示すグラフである。図8において、「0min」は、溶液に電圧を加える前に測定されたタンパク質結晶化溶液31のSLS強度を示す。また、「330min」は、330分間、上述の例と同様の電圧を印加した同一のタンパク質結晶化溶液31の散乱光強度である。また、「1,340min」は、340分後に電圧印加を停止した後、1,340分後に測定された同一のタンパク質結晶化溶液31の散乱光強度である。
図8の結果によれば、前方小角の散乱光強度は、タンパク質結晶化溶液に電場を加えると高められる。その後、印加した電場が切られても、この散乱光強度は増加し続ける。
これは、電圧印加によりタンパク質結晶化溶液が「凝集の遷移」の状態を経て、形成されたタンパク質凝集体が、電場無しで成長し続ける能力があることを示す。
逆に、印加電圧が「凝集の遷移」の状態になる前に止められた場合、SLSは印加電圧無しでは増加しなかった(図示せず)。
したがって、電場印加法では、電場が制限された時間のみ印加されても、タンパク質結晶の形成を促進する。
【0049】
以上のように、本実施例において、タンパク質結晶化装置Xを使用して、薄型で小型の低電圧駆動の結晶化溶液セルである測定試料部3を用いて、高精度のレーザ光散乱計測を行うことで、偶然に依らないタンパク質の結晶化促進が可能となった。
具体的に、測定試料部3のタンパク質結晶化溶液セルを使用して、ニワトリ卵白リゾチームの結晶化溶液に電場を印加した状態で、開発のタンパク質結晶化分析装置で測定したところ、電場印加が結晶化溶液に与える明確な効果が見られた。
ここで、測定試料部3の溶液セルは、薄型かつ小型であるため、微量の溶液を収容して、タンパク質結晶化溶液31からの散乱光の高精度計測を行うことができる。
すなわち、タンパク質結晶化装置Xを使用して、電場印加の状態下で結晶化溶液の光散乱を効率良く計測し、電場印加下で結晶化溶液状態を分析できる。よって、電場印加による結晶化促進の各種パラメータの最適化に資することができ、良質な結晶を容易に得ることが可能となる。
【産業上の利用可能性】
【0050】
本発明は、タンパク質結晶化溶液の結晶化を効率的に促進/分析する方法及び装置を提供するため、産業上利用することができる。
【符号の説明】
【0051】
1 制御解析部
3 測定試料部
5 散乱光検出部
6 電源
31 タンパク質結晶化溶液
32、33 透明基板
34、35 透明導電体電極
36、37 端子
39 電気絶縁部材
X タンパク質結晶化装置
【特許請求の範囲】
【請求項1】
タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶化促進方法であって、
前記結晶化装置は、
前記生体高分子の結晶化溶液と、
前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、
前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、
前方小角散乱又は後方小角散乱を検出する散乱光検出部と、
前記散乱光検出部により検出された信号を分析する制御解析部とを備え、
前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、
前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、
前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析する
ことを特徴とする生体高分子の結晶化促進方法。
【請求項2】
前記制御解析部は、
前記透明導電体電極に、低電圧を印加させ、
前記結晶化溶液が生体高分子の凝集の遷移の状態になったことを検知して、前記低電圧の印加を停止させる
ことを特徴とする請求項1に記載の生体高分子の結晶化促進方法。
【請求項3】
前記前方小角散乱光又は前記後方小角散乱光の強度は、それぞれ散乱角度に対する前記前方小角散乱光の強度関数又は前記後方小角散乱光の強度関数であり、
前記制御解析部は、散乱角度10°以下の前記前方小角散乱光又は前記後方小角散乱光の強度関数の変化により前記凝集の遷移の状態を検知する
ことを特徴とする請求項2に記載の生体高分子の結晶化促進方法。
【請求項4】
前記前方小角散乱光又は前記後方小角散乱光の強度は、それぞれ散乱角度に対する前記前方小角散乱光又は前記後方小角散乱光の強度関数から得られる、前記前方小角散乱光の強度の平均値又は前記後方小角散乱光の強度の平均値である
ことを特徴とする請求項3に記載の生体高分子の結晶化促進方法。
【請求項5】
前記前方小角散乱光又は前記後方小角散乱光の時間的強度ゆらぎに基づいて、前記結晶化溶液における前記凝集の遷移の状態を分析する
ことを特徴とする請求項3に記載の生体高分子の結晶化促進方法。
【請求項6】
タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶化解析方法であって、
前記結晶化装置は、
前記生体高分子の結晶化溶液と、
前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、
前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、
前方小角散乱又は後方小角散乱を検出する散乱光検出部と、
前記散乱光検出部により検出された信号を分析する制御解析部とを備え、
前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、
前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、
前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析し、前記結晶化溶液が生体高分子の凝集の遷移の状態を検知する
ことを特徴とする生体高分子の結晶化解析方法。
【請求項7】
タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶の製造方法であって、
前記結晶化装置は、
前記生体高分子の結晶化溶液と、
前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、
前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、 前方小角散乱又は後方小角散乱を検出する散乱光検出部と、
前記散乱光検出部により検出された信号を分析する制御解析部とを備え、
前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、
前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、
前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析し、前記結晶化溶液が生体高分子の凝集の遷移の状態を検知して前記電場の印加を停止する
ことを特徴とする生体高分子の結晶の製造方法。
【請求項8】
タンパク質を含む生体高分子の結晶化装置により、生体高分子の結晶化促進方法を実行させる結晶化装置の制御プログラムであって、
前記結晶化装置は、
前記生体高分子の結晶化溶液と、
前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、
前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、
前方小角散乱又は後方小角散乱を検出する散乱光検出部と、
前記散乱光検出部により検出された信号を分析する制御解析部とを備え、
前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加させ、
前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定させ、
前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析させる
ことを特徴とする生体高分子の結晶化装置の制御プログラム。
【請求項9】
タンパク質を含む生体高分子を結晶化させるための結晶化装置により、生体高分子の結晶化促進方法を実行させる結晶化装置の制御プログラムを記録したコンピュータ読み取り可能な記録媒体であって、
前記結晶化装置は、
前記生体高分子の結晶化溶液と、
前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、
前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、
前方小角散乱又は後方小角散乱を検出する散乱光検出部と、
前記散乱光検出部により検出された信号を分析する制御解析部とを備え、
前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加させ、
前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定させ、
前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析させる
ことを特徴とする記録媒体。
【請求項10】
タンパク質を含む生体高分子の結晶化装置であって、
前記結晶化装置は、
前記生体高分子の結晶化溶液と、
前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、
前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、
前方小角散乱又は後方小角散乱を検出する散乱光検出部と、
前記散乱光検出部により検出された信号を分析する制御解析部とを備え、
前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、
前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、
前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析する
ことを特徴とする生体高分子の結晶化装置。
【請求項1】
タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶化促進方法であって、
前記結晶化装置は、
前記生体高分子の結晶化溶液と、
前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、
前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、
前方小角散乱又は後方小角散乱を検出する散乱光検出部と、
前記散乱光検出部により検出された信号を分析する制御解析部とを備え、
前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、
前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、
前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析する
ことを特徴とする生体高分子の結晶化促進方法。
【請求項2】
前記制御解析部は、
前記透明導電体電極に、低電圧を印加させ、
前記結晶化溶液が生体高分子の凝集の遷移の状態になったことを検知して、前記低電圧の印加を停止させる
ことを特徴とする請求項1に記載の生体高分子の結晶化促進方法。
【請求項3】
前記前方小角散乱光又は前記後方小角散乱光の強度は、それぞれ散乱角度に対する前記前方小角散乱光の強度関数又は前記後方小角散乱光の強度関数であり、
前記制御解析部は、散乱角度10°以下の前記前方小角散乱光又は前記後方小角散乱光の強度関数の変化により前記凝集の遷移の状態を検知する
ことを特徴とする請求項2に記載の生体高分子の結晶化促進方法。
【請求項4】
前記前方小角散乱光又は前記後方小角散乱光の強度は、それぞれ散乱角度に対する前記前方小角散乱光又は前記後方小角散乱光の強度関数から得られる、前記前方小角散乱光の強度の平均値又は前記後方小角散乱光の強度の平均値である
ことを特徴とする請求項3に記載の生体高分子の結晶化促進方法。
【請求項5】
前記前方小角散乱光又は前記後方小角散乱光の時間的強度ゆらぎに基づいて、前記結晶化溶液における前記凝集の遷移の状態を分析する
ことを特徴とする請求項3に記載の生体高分子の結晶化促進方法。
【請求項6】
タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶化解析方法であって、
前記結晶化装置は、
前記生体高分子の結晶化溶液と、
前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、
前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、
前方小角散乱又は後方小角散乱を検出する散乱光検出部と、
前記散乱光検出部により検出された信号を分析する制御解析部とを備え、
前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、
前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、
前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析し、前記結晶化溶液が生体高分子の凝集の遷移の状態を検知する
ことを特徴とする生体高分子の結晶化解析方法。
【請求項7】
タンパク質を含む生体高分子の結晶化装置による生体高分子の結晶の製造方法であって、
前記結晶化装置は、
前記生体高分子の結晶化溶液と、
前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、
前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、 前方小角散乱又は後方小角散乱を検出する散乱光検出部と、
前記散乱光検出部により検出された信号を分析する制御解析部とを備え、
前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、
前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、
前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析し、前記結晶化溶液が生体高分子の凝集の遷移の状態を検知して前記電場の印加を停止する
ことを特徴とする生体高分子の結晶の製造方法。
【請求項8】
タンパク質を含む生体高分子の結晶化装置により、生体高分子の結晶化促進方法を実行させる結晶化装置の制御プログラムであって、
前記結晶化装置は、
前記生体高分子の結晶化溶液と、
前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、
前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、
前方小角散乱又は後方小角散乱を検出する散乱光検出部と、
前記散乱光検出部により検出された信号を分析する制御解析部とを備え、
前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加させ、
前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定させ、
前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析させる
ことを特徴とする生体高分子の結晶化装置の制御プログラム。
【請求項9】
タンパク質を含む生体高分子を結晶化させるための結晶化装置により、生体高分子の結晶化促進方法を実行させる結晶化装置の制御プログラムを記録したコンピュータ読み取り可能な記録媒体であって、
前記結晶化装置は、
前記生体高分子の結晶化溶液と、
前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、
前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、
前方小角散乱又は後方小角散乱を検出する散乱光検出部と、
前記散乱光検出部により検出された信号を分析する制御解析部とを備え、
前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加させ、
前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定させ、
前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析させる
ことを特徴とする記録媒体。
【請求項10】
タンパク質を含む生体高分子の結晶化装置であって、
前記結晶化装置は、
前記生体高分子の結晶化溶液と、
前記結晶化溶液に直接平行に接するように面状に形成された透明導電体電極と、
前記透明導電体電極に挟持され、前記結晶化溶液を保持するための電気絶縁部材と、
前方小角散乱又は後方小角散乱を検出する散乱光検出部と、
前記散乱光検出部により検出された信号を分析する制御解析部とを備え、
前記透明導電体電極により、前記結晶化溶液に対してほぼ一様な電場を印加し、
前記散乱光検出部により、前記結晶化溶液に光を照射して前記結晶化溶液からの前方小角散乱光又は後方小角散乱光を測定し、
前記制御解析部により、前記前方小角散乱光又は前記後方小角散乱光の強度に基づいて、前記結晶化溶液の状態を分析する
ことを特徴とする生体高分子の結晶化装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2013−53053(P2013−53053A)
【公開日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願番号】特願2011−194081(P2011−194081)
【出願日】平成23年9月6日(2011.9.6)
【出願人】(504237050)独立行政法人国立高等専門学校機構 (656)
【Fターム(参考)】
【公開日】平成25年3月21日(2013.3.21)
【国際特許分類】
【出願日】平成23年9月6日(2011.9.6)
【出願人】(504237050)独立行政法人国立高等専門学校機構 (656)
【Fターム(参考)】
[ Back to top ]

