結核菌群の薬剤感受性検査法及びキット
【課題】少量の培地を用いて簡便かつ迅速に行えるようにした安全性の高い結核菌の薬剤感受性検査法およびキットを提供する。
【解決手段】抗結核薬を含有する培地中で検体を培養し、得られた培養物を免疫学的測定に供することによって該培養物中の結核菌群特異的分泌タンパク質を結核菌マーカーとして検出する、結核菌の薬剤感受性検査法。多剤耐性結核菌を検出できるように、互いに異なる抗結核薬を含有する複数の培地中で検体を培養し、得られた培養物のそれぞれを免疫学的測定に供することが好ましい。抗結核薬は、イソニアジド(INH)、リファンピシン(RFP)、ストレプトマイシン(SM)、エタンブトール(EB)、カナマイシン(KM)等が使用できる。対照として、抗結核薬を含有しない培地中で検体を培養し、得られた培養物を免疫学的測定に供するとよい。免疫学的測定は、イムノクロマトグラフィー測定などのサンドイッチ式免疫測定が好ましい。
【解決手段】抗結核薬を含有する培地中で検体を培養し、得られた培養物を免疫学的測定に供することによって該培養物中の結核菌群特異的分泌タンパク質を結核菌マーカーとして検出する、結核菌の薬剤感受性検査法。多剤耐性結核菌を検出できるように、互いに異なる抗結核薬を含有する複数の培地中で検体を培養し、得られた培養物のそれぞれを免疫学的測定に供することが好ましい。抗結核薬は、イソニアジド(INH)、リファンピシン(RFP)、ストレプトマイシン(SM)、エタンブトール(EB)、カナマイシン(KM)等が使用できる。対照として、抗結核薬を含有しない培地中で検体を培養し、得られた培養物を免疫学的測定に供するとよい。免疫学的測定は、イムノクロマトグラフィー測定などのサンドイッチ式免疫測定が好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗結核薬含有培地中で検体を培養して得られた培養液中に分泌された結核菌群特異的分泌タンパク質を免疫学的測定により結核菌群マーカーとして検出することにより、少量の培地を用いて簡便かつ迅速に行えるようにした安全性の高い結核菌群の薬剤感受性検査法およびキットに関する。
【背景技術】
【0002】
現在、日本では年間数千人が、地球規模では年間数百万人が結核により死亡しているといわれている。結核の治療は、化学療法を中心とする内科的療法が基本であり、内科的療法では治療の目的を達成することが不可能な場合に外科療法を考慮する。内科的療法で使用する結核治療の薬剤としては、イソニアジド(INH)、リファンピシン(RFP)、ストレプトマイシン(SM)、エタンブトール(EB)等、多くの種類の薬剤が知られている。
【0003】
しかし、上記薬剤を患者に投与した場合、突然変異により、投与した薬剤に対する耐性を有する耐性菌が生じることが問題となっている。
近年、一次抗結核薬のINH及びRFPの両方に耐性を獲得した多剤耐性結核菌(multi-drug resistant tuberculosis, MDR-TB)が出現しており、更には二次抗結核薬に対する耐性をも獲得した超多剤耐性結核菌(extensively drug-resistant tuberculosis, XDR-TB)も出現している。
MDR-TB及びXDR-TBに対しては使用できる抗結核薬が限定されるため、迅速に感受性試験結果を得て、化学療法方針を決定する必要性がある。また、治療途中において薬剤耐性を獲得し、薬剤の治療効果が得られなくなる可能性もあり、薬剤効果をモニタリングしつつ、適切な化学療法方針を打ち出す必要性も生じている。
【0004】
我が国における抗酸菌群の薬剤感受性試験としては、標準法として1%小川培地を用いた固定濃度法が用いられている。ここでは、主なものを例にとると、リファンピシン(RFP)では40μg/ml、イソニアジド(INH)では0.2μg/ml又は1.0μg/mlの濃度の試験培地が使用される。
【0005】
薬剤感受性試験は菌の含まれる患者検体をそのまま感受性試験培地に接種する直接法と、分離培地に発育した菌を用いて検査する間接法に大別される。直接法はNALC-NaOH法で処理した患者検体を接種菌液として使用する。直接法は成績が早く得られること、本検査成績が検体中の耐性菌と感受性菌の構成状態を反映しているなどの利点があるが、接種菌量の調製が難しく、また、前処理剤の影響があるなどの問題を抱えている。一方、間接法は患者検体を分離培養して得られた菌から接種菌液を作製するため、直接法よりも精度の高い成績が得られる。いずれの方法においても、接種菌液を抗結核薬を含まないコントロール培地と抗結核薬を含む試験培地に接種し、培養後、両者の抗酸菌の発育程度を比較して抗結核薬に対する感受性が判定される。
【0006】
一般的に抗酸菌、特に結核菌は他の細菌に比較して生育が非常に遅い。そのため薬剤感受性が判明するまで通常1か月を要する。間接法では採取された患者検体からの分離培養に1〜2か月を要し、更に感受性試験での培養を実施するため、患者が結核症を疑われてから薬剤感受性が判明するまで3ヶ月以上を要することも希ではない。
【0007】
上記の方法以外の従来の方法としては、液体培地及び自動検出器を使用したBACTEC MGITTM 960結核菌薬剤感受性検査用システム(日本ベクトン・ディッキンソン株式会社)が挙げられる。このシステムは、培地内における菌の増殖による溶存酸素濃度の低下に伴い、センサーの蛍光強度が増加することを利用したものであり、この蛍光強度を自動的に測定することで菌の発育を検出するシステムである。この方法は従来法より迅速性に優れているが、非常に高価な専用機器及び試薬を必要とする。
また、マイクロプレートを利用した方法としてはブロスミックMTB-1(極東製薬製)が挙げられる。菌を接種後、密閉容器にて7日間のCO2培養を行い、菌の発育を確認することで薬剤感受性を判定する。
いずれの方法においても、判定にあたって菌の生育が必要とされるため、増殖の遅い結核菌では耐性の有無を判断するまでには数週間を要する。
【0008】
また、薬剤耐性遺伝子を検出する方法も開示されているが、迅速性は向上しているが、操作が煩雑であり、非常に高度な技術を要求されるため、臨床現場において使用するには不向きであり、未だ確立された遺伝子診断法はないのが現状である。
【0009】
【非特許文献1】青柳昭雄,川城丈夫,Medical Technology, vol. 26, No. 4, p.332-337(1998)
【非特許文献2】青木正和,複十字,No. 315, p.16-17(2007)
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明の目的は、少量の培地を用いて簡便かつ迅速に行えるようにした安全性の高い結核菌群の薬剤感受性検査法およびキットを提供することにある。
【課題を解決するための手段】
【0011】
本発明者は、抗結核薬に感受性を示す結核菌群の場合は、抗結核薬により菌体の増殖や分裂が抑制され、抗結核薬が殺菌的または静菌的に働き、菌体外に分泌されるタンパク質量が大幅に減少する一方、抗結核薬に耐性を示す結核菌株の場合は、少量の液体培地を用いた培養初期でも菌体外へタンパク質を分泌し、該分泌タンパク質は免疫学的測定によって高感度に検出できることを見出し、本発明を完成するに至った。
【0012】
すなわち、本発明の一局面によれば、抗結核薬を含有する培地中で検体を培養し、得られた培養物を免疫学的測定に供することによって該培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして検出することからなる、結核菌群の薬剤感受性検査法が提供される。
【0013】
この検査法における免疫学的測定としては、特に限定されるものではないが、サンドイッチ式免疫測定、とりわけELISA(Enzyme−linked immunosorbent assay)、イムノクロマトグラフィー測定などが好ましい。
【0014】
本発明の好ましい実施形態によれば、上記免疫学的測定は、結核菌群特異的分泌タンパク質に対する第一の抗体を予め所定位置に固定せしめて形成された捕捉部位を備える膜担体を用意し、該分泌タンパク質に対する第二の抗体と所定量の前記培養物との混合液を、前記捕捉部位に向けて前記膜担体にてクロマト展開せしめ、前記培養物中の該分泌タンパク質と前記第二の抗体との複合体を前記捕捉部位に捕捉させるイムノクロマトグラフィー測定によって行われる。
【0015】
また、本発明の検査法では、検体が多剤耐性結核菌又は超多剤耐性結核菌を含むかどうかを判定できるように、互いに異なる抗結核薬を含有する複数の培地中で検体を培養し、得られた培養物のそれぞれを免疫学的測定に供するようにすることが好ましい。
抗結核薬としては、例えば、イソニアジド(INH)、リファンピシン(RFP)、フルオロキノロン系抗菌薬、カナマイシン(KM)、アミカシン(AMK)、カブレオマイシン(CPM)、ストレプトマイシン(SM)、エタンブトール(EB)、エチオナミド、プロチオナミド(TH)、エンビオマイシン(EVM)、ピラジナミド(PZA)、パラアミノサリチル酸(PAS)及びサイクロセリン(CS)からなる群より選ばれた少なくとも1種を使用できる。このうち、検体が多剤耐性結核菌又は超多剤耐性結核菌を含むかどうかを判定できるように、抗結核薬として、少なくともイソニアジド(INH)及びリファンピシン(RFP)を用いることが好ましい。
好ましい実施形態によれば、本発明の検査法は、対照として、抗結核薬を含有しない培地中で検体を培養し、得られた培養物を免疫学的測定に供することによって該培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして検出する工程を包含する。
【0016】
また、本発明の他の局面によれば、抗結核薬を含有する培地が包入された培養容器と、該培地中で検体を培養することにより得られた培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして検出するための免疫学的測定装置とを少なくとも含んでなる、結核菌群の薬剤感受性検査用キットが提供される。
【0017】
このキットにおける免疫学的測定装置としては、特に限定されるものではないが、サンドイッチ式免疫測定装置、とりわけELISA装置(Enzyme−linked immunosorbent assay)、イムノクロマトグラフィー測定装置などが好ましい。
【0018】
本発明の好ましい実施形態によれば、上記免疫学的測定装置は、結核菌群特異的分泌タンパク質に対する第一の抗体と第二の抗体と膜担体とを少なくとも備え、前記第一の抗体は前記膜担体の所定位置に予め固定されて捕捉部位を形成し、前記第二の抗体は適当な標識物質で標識され、かつ、前記捕捉部位から離隔した位置で前記膜担体にてクロマト展開可能なように用意されてなるイムノクロマト法テストストリップを備えたイムノクロマトグラフィー測定装置である。
【0019】
また、本発明の検査用キットは、検体が多剤耐性結核菌又は超多剤耐性結核菌を含むかどうかを判定できるように、複数の培養容器を備え、それぞれの培養容器には、互いに異なる抗結核薬を含有する培地が包入されていることが好ましい。
抗結核薬としては、例えば、イソニアジド(INH)、リファンピシン(RFP)、フルオロキノロン系抗菌薬、カナマイシン(KM)、アミカシン(AMK)、カブレオマイシン(CPM)、ストレプトマイシン(SM)、エタンブトール(EB)、エチオナミド、プロチオナミド(TH)、エンビオマイシン(EVM)、ピラジナミド(PZA)、パラアミノサリチル酸(PAS)及びサイクロセリン(CS)からなる群より選ばれた少なくとも1種を使用できる。このうち、検体が多剤耐性結核菌又は超多剤耐性結核菌を含むかどうかを判定できるように、抗結核薬として、少なくともイソニアジド(INH)及びリファンピシン(RFP)を用いることが好ましい。
好ましい実施形態によれば、本発明のキットは、対照として、抗結核薬を含有しない培地が包入された培養容器を備えてなる。
【発明の効果】
【0020】
本発明によれば、抗結核薬含有培地中で検体を培養して得られた培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして免疫測定により検出することとしたので、高感度かつ特異的に薬剤耐性結核菌の検出が行える。また、結核菌群特異的分泌タンパク質は、生育の遅い結核菌にあっても培養初期から培養物中に分泌されるので、従来の方法よりも培養初期から薬剤耐性結核菌の検出を行うことができ、培養期間が短縮され、迅速に検査が行える。さらに、本発明は、菌体を実質的に増殖させること無く迅速に検査が行えることから、バイオハザードの面でも優れており、安全性の高い検査法である。特に、免疫測定をイムノクロマトグラフィー測定で行う場合は、特殊な機器及び熟練した技術を必要とすることなく、迅速かつ安全に検査が行える。
【発明を実施するための最良の形態】
【0021】
本発明では、免疫測定に先立ち、抗結核薬を含有する培地中に検体を接種し培養する。
検体としては、特に制限はないが、例えば、生体より採取された体液として、喀痰、胸水、気管支分泌液、胃液、血液、髄液、尿、便などが挙げられ、好ましくは喀痰が用いられる。また、呼吸器における検査を行った際に採取した気管支洗浄液、気管支又は肺より採取された組織片なども検体として使用できる。
【0022】
検体の培養は、常法により、液体培養または固体培養によって行うことができるが、培養物(すなわち培養液)をそのままイムノクロマトグラフィー測定などの免疫学的測定に適用できる点から、液体培養が好ましい。
【0023】
液体培養に使用する液体培地としては、上記検体を培養できるものであれば特に限定されず、例えば、結核菌検査指針に記載された培地を使用できる。具体例としては、Middlebrook 7H9培地、デュボス液体培地(ベクトン・デッキンソン社の商品)、MGIT(ベクトン・ディッキンソン社の商品)やBactAlert(ビオメリュー社の商品)などが挙げられる。
【0024】
固体培養に使用する固形培地としては、上記検体を培養できるものであれば特に限定されず、例えば、結核菌検査指針に記載された培地を使用できる。具体例としては、小川培地、試験管工藤PD固形斜面培地(協和薬品工業株式会社の商品)などが挙げられる。固体培養した培養物は、生理食塩水、リン酸緩衝液などの希釈液で希釈して免疫学的測定に供することができる。
【0025】
培養温度は、液体培養及び固体培養の何れの場合も、37℃前後であることが好ましい。培養時間は、結核菌群マーカーとして使用する結核菌群特異的分泌タンパク質を検出可能な量だけ分泌させるに十分な時間であればよく、通常、2〜10日である。
液体培養は、例えば、1ml〜10mlの培養容器に液体培地100μl〜5mlを包入し、上記培養期間だけ好気的に振とう培養することで行うことができる。
【0026】
抗結核薬としては、通常、多剤耐性結核菌又は超多剤耐性結核菌を検出できるものが使用される。多剤耐性結核菌とはイソニアジド(INH)とリファンピシン(RFP)の両剤を含む2薬剤以上に耐性を示す結核菌をいう。したがって、多剤耐性結核菌の検出のためには、培地に含有させる抗結核薬として、少なくともイソニアジド(INH)及びリファンピシン(RFP)の2種を使用することが必要である。また、2006年のWHOによる定義によると超多剤耐性結核菌とは、前記多剤耐性結核菌であって、さらに、フルオロキノロン系抗菌薬のいずれか1剤以上に耐性で、かつ注射可能な薬剤であるカナマイシン(KM)、アミカシン(AMK)、カブレオマイシン(CPM)の3剤中いずれか1剤以上に耐性の結核菌をいう。したがって、超多剤耐性結核菌の検出のためには、抗結核薬として、イソニアジド(INH)及びリファンピシン(RFP)に加えて、フルオロキノロン系抗菌薬(例えば、シプロフロキサシン(CPFX)、オフロキサシン(OFLX)、レボフロキサシン(LVFX))、カナマイシン(KM)、アミカシン(AMK)、カブレオマイシン(CPM)の4種を使用することが必要である。さらには、日本国内で抗結核薬として承認されているストレプトマイシン(SM)、エタンブトール(EB)、エチオナミドおよびプロチオナミド(TH)、エンビオマイシン(EVM)、ピラジナミド(PZA)、パラアミノサリチル酸(PAS)、サイクロセリン(CS)を使用することもできる。複数の抗結核薬は、通常、それぞれ別の培地中に含有させる。すなわち、本発明のキットでは、複数の培養容器が用意され、それぞれの培養容器に、異なる抗結核薬を含有する培地が包入されることが好ましい。
【0027】
本発明において検体の培養に用いる薬剤含有培地は、上記培地に上記抗結核薬を混合して調製することができるが、市販の薬剤含有培地をそのまま使用することもできる。かかる市販の薬剤含有培地としては、例えば、結核菌検査指針に記載されているものが挙げられ、具体例としては、結核菌用感受性一濃度培地(極東製薬工業の商品)、BACTEC MGIT 960 AST結核菌薬剤感受性検査用MGITシリーズ(ベクトン・ディッキンソンの商品)、ブロスミックMTB-1(極東製薬工業の商品)などが挙げられる。
【0028】
本発明において結核菌群マーカーとして使用する結核菌群特異的分泌タンパク質は、培養中に結核菌の菌体外に分泌されるタンパク質であれば特に制限はなく、従来公知の種々の分泌タンパクを使用できる。従来、結核菌は感染臓器内や培養中において菌体外へ種々のタンパク質を分泌していることが知られている。分泌タンパク質としてはMPB80, 70, 64をはじめ、ESAT-6やCFP-10などが知られており、ワクチンコンポーネントや抗体検査対象抗原として利用されている。これらの分泌タンパク質は増殖または生存している菌体中において盛んに合成され、菌体外へ分泌されている。これらのうち、培養早期に分泌され、かつ分泌量の多いものが好ましい。かかる観点から、MPB64は特に分泌量が多いことが知られているので、本発明において結核菌群マーカーとして好ましい。
【0029】
本発明においては、検体を薬剤含有培地で培養し、得られた培養物を免疫学的測定に供し、該培養物中に結核菌群マーカーとしての結核菌群特異的分泌タンパク質が検出されれば、薬剤耐性結核菌の存在が確認でき、検出されなければ薬剤耐性結核菌の存在は否定される。また、対照として検体を薬剤無添加の培地で培養し、得られた培養物を免疫学的測定に供し、該培養物中に前記タンパク質が検出されれば、結核菌の存在が確認できる。したがって、薬剤含有培地での培養と薬剤無添加の培地での培養を併用することにより、薬剤耐性結核菌の存否及び薬剤感受性結核菌の存否が判定できる。
上述のとおり、免疫学的測定は、特に限定されるものではないが、結核菌群特異的分泌タンパク質に対する第一の抗体と第二の抗体とを用いたサンドイッチ式免疫測定、とりわけELISA(Enzyme−linked immunosorbent assay)、イムノクロマトグラフィー測定などが好ましい。
【0030】
本発明において、第一の抗体と第二の抗体は、何れもポリクローナル抗体であってもモノクローナル抗体であってもよいが、反応特異性の点から、少なくとも一方はモノクローナル抗体であることが好ましい。
【0031】
ポリクローナル抗体は、結核菌やBCG菌の培養濾液をゲル濾過などの方法によって精製して得た精製蛋白、または、かかる蛋白をコードする遺伝子を大腸菌などの宿主で遺伝子工学的に発現させて抽出および精製して得た精製蛋白を抗原として常法に従って動物を免疫し、その血清から取得することができる。
【0032】
モノクローナル抗体は、例えば、上記と同様に得られた精製蛋白を抗原としてマウスのような動物を免疫したのち、この免疫された動物の脾臓細胞とミエローマ細胞とを細胞融合して得られた融合細胞をHAT含有培地でセレクトした後に増殖せしめ、増殖せしめた株を前記のようにして得られた精製蛋白を使用して、たとえば、酵素標識免疫法などにより選別することで、取得することができる。
【0033】
本発明の免疫学的測定として用いられるイムノクロマトグラフィー測定法は、公知のイムノクロマト法テストストリップの構成に準拠して容易に実施できる。
一般に、かかるイムノクロマト法テストストリップは、抗原の第一の抗原決定基にて抗体抗原反応可能な第一の抗体と、前記抗原の第二の抗原決定基にて抗体抗原反応可能で且つ標識された第二の抗体と、膜担体とを少なくとも備え、前記第一の抗体は前記膜担体の所定位置に予め固定されて捕捉部位を形成し、前記第二の抗体は前記捕捉部位から離隔した位置で前記膜担体にてクロマト展開可能なように用意されて構成される。第一の抗体および第二の抗体は、上述のように、それぞれポリクローナル抗体であってもモノクローナル抗体であっても良いが、少なくとも何れか一方がモノクローナル抗体であることが好ましい。MPB64は単量体蛋白なので、第一の抗体及び第二の抗体は「ヘテロ」の組み合わせで用いられ、すなわち、抗原上の位置および構造の何れもが異なる各抗原決定基をそれぞれ認識する第一の抗体及び第二の抗体が組み合わせて用いられる。
【0034】
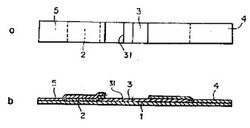
イムノクロマト法テストストリップの具体例としては、例えば、図1に示されるテストストリップが挙げられる。図1において、数字1は粘着シート、2は含浸部材、3は膜担体、31は捕捉部位、4は吸収用部材、5は試料添加用部材を示している。
図示の例では、膜担体3は、幅5mm、長さ36mmの細長い帯状のニトロセルロース製メンブレンフィルターで作成されている。
該膜担体3には、そのクロマト展開始点側の末端から7.5mmの位置に、第一の抗体が固定され、検体の捕捉部位31が形成される。
図示の例では、膜担体3は、ニトロセルロース製メンブレンフィルターを用いているが、被験試料に含まれる検体をクロマト展開可能で、かつ、上記捕捉部位31を形成する抗体を固定可能なものであれば、いかなるものであってもよく、他のセルロース類膜、ナイロン膜、ガラス繊維膜なども使用できる。
【0035】
含浸部材2は、前記第一の抗体が結合する第一の抗原決定基と異なる部位に位置する第二の抗原決定基にて前記抗原と抗体抗原反応する第二の抗体を含浸等の方法で配置せしめた部材からなる。当該第二の抗体は、適当な標識物質で予め標識される。
図示の例では、含浸部材2として、5mm×15mmの帯状のガラス繊維不織布を用いているが、これに限定されるものではなく、例えば、セルロース類布(濾紙、ニトロセルロース膜等)、ポリエチレン、ポリプロピレン等の多孔質プラスチック布類なども使用できる。
【0036】
第二の抗体の標識物質としては、使用可能なものであればいかなる物質であってもよく、呈色標識物質、酵素標識物質、放射線標識物質などが挙げられる。
このうち、捕捉部位31での色の変化を肉眼で観察することにより迅速かつ簡便に判定できる点から、呈色標識物質を用いることが好ましい。また、高感度化の観点からは、蛍光標識物質を用い、捕捉部位31の観察を蛍光イムノクロマトリーダーを用いて行えるようにすることが好ましい。
【0037】
呈色標識物質としては、金コロイド、白金コロイド、白金−金コロイド複合体等の金属コロイドの他、赤色および青色などのそれぞれの顔料で着色されたポリスチレンラテックスなどの合成ラテックスや、天然ゴムラテックスなどのラテックスが挙げられ、このうち、金コロイド、白金−金コロイド複合体などの金属コロイドが特に好ましい。
【0038】
蛍光標識物質としては、FITCやローダミンなどの直接標識物質のほか、蛍光化合物を包含した蛍光ラテックス、量子ドットのような化合物が挙げられ、このうち蛍光化合物を包含した蛍光ラテックスが好ましい。また、蛍光化合物の励起波長および蛍光波長は特に限定されないが、測定機器の設定の観点から、励起波長および測定波長が離れている、所謂ストークスシフトが大きい蛍光化合物を使用すること好ましい。
【0039】
当該含浸部材2は、標識された第二の抗体の懸濁液を前記ガラス繊維不織布等の部材に含浸せしめ、これを乾燥させることなどによって作製できる。
【0040】
図1に示されるように、膜担体3を粘着シート1の中程に貼着し、該膜担体3のクロマト展開の開始点側(すなわち図1の左側、以下「上流側」と記す、また、その逆の側、すなわち図1の右側を、以下「下流側」と記す)の末端の上に、含浸部材2の下流側末端を重ね合わせて連接するとともに、この含浸部材2の上流側部分を粘着シート1に貼着して本発明のイムノクロマト法テストストリップを作成できる。
さらに、必要に応じて、含浸部材2の上面に試料添加用部材5の下流側部分を載置するとともに、該試料添加用部材5の上流側部分を粘着シート1に貼着してもよく、また、膜担体3の下流側部分の上面に吸収用部材4の上流側部分を載置するとともに、該吸収用部材4の下流側部分を粘着シート1に貼着せしめることもできる。
【0041】
試料添加用部材5としては、例えば、多孔質ポリエチレンおよび多孔質ポリプロピレンなどのような多孔質合成樹脂のシートまたはフィルム、ならびに、濾紙および綿布などのようなセルロース製の紙または織布もしくは不織布を用いることができる。
吸収用部材4は、液体をすみやかに吸収、保持できる材質のものであればよく、綿布、濾紙、およびポリエチレン、ポリプロピレン等からなる多孔質プラスチック不織布等を挙げることができるが、特に濾紙が最適である。
【0042】
さらに、市販品の場合、図1のイムノクロマト法テストストリップは、試料添加用部材5と捕捉部位31の上方にそれぞれ被験試料注入部と判定部が開口された適当なプラスチック製ケース内に収容されて提供される。
【0043】
かくして、上記培養物を必要に応じて適当な展開溶媒と混合してクロマト展開可能な被験試料を得た後、当該被験試料を図1に示されるイムノクロマト法テストストリップの試料添加用部材5上に注入すると、該被験試料は、該試料添加用部材5を通過して含浸部材2において、標識された第二の抗体と混合する。
その際、該被験試料中にマーカー蛋白が存在すれば、抗原抗体反応によりマーカー蛋白と第二の抗体との複合体が形成される。
【0044】
この複合体は、膜担体3中をクロマト展開されて捕捉部位31に到達し、そこに固定された第一の抗体と抗原抗体反応して捕捉される。
このとき、標識物質として金コロイドなどの呈色標識物質が使用されていれば、当該呈色標識物質の集積により捕捉部位31が発色するので、直ちに、検体を定性的または定量的に測定することができる。標識物質として蛍光標識物質を使用した場合は、捕捉部位31に集積した蛍光物質の蛍光量を測定機器で読み取り、定量的に測定することができる。
なお、本発明では、第二の抗体又は第二の抗体を含有する前記含浸部材を膜担体上に配置せず、適当な容器に収納しておき、当該容器内で被験試料と第二の抗体を混合して膜担体に注入することにより膜担体にてクロマト展開可能なように、用意しておくこともできる。
【実施例】
【0045】
下記の実施例により本発明をさらに具体的に説明するが、本発明はこの実施例に限定されるものではない。
【0046】
参考例1(抗MPB64抗体を用いたイムノクロマトキットの作製)
(1)抗MPB64モノクローナル抗体の調製
特開平11-108931号公報記載の方法に準拠して、抗MPB64モノクローナル抗体(以下、単に「抗MPB64抗体」という)を得た。
【0047】
(2)白金−金コロイド粒子の調製
(1)使用するガラス器具の全てを王水で洗浄した。
(2)390mlの超純水をフラスコに入れて沸騰させ、この沸騰水に塩化金酸水溶液(水溶液1リットル当たり金として1g 、片山科学工業株式会社製)30mlを加え、その後、1重量% クエン酸ナトリウム水溶液60mlを加え、6分45秒後に、塩化白金酸水溶液(水溶液1リットル当たり白金として1g、和光純薬工業株式会社製) 30mlを加えた。塩化白金酸水溶液添加から5分後に1重量% クエン酸ナトリウム水溶液60mlを加え、4時間、還流を行い、白金−金コロイド懸濁液を得た。
【0048】
(3)白金−金コロイド標識抗MPB64抗体溶液の調製
上記(1)で得られた抗MPB64抗体を下記の手順でそれぞれ白金−金コロイド標識した。
抗MPB64抗体の蛋白換算重量1μg(以下、抗体の蛋白換算重量を示すとき、単に、その精製蛋白質の重量分析による重量数値で示す)と上記(2)の白金−金コロイド溶液1mlとを混合し、室温で2分間静置してこの抗体のことごとくを白金−金コロイド粒子表面に結合させた後、白金−金コロイド溶液における最終濃度が1%となるように10%ウシ血清アルブミン(以下、「BSA」と記す)水溶液を加え、この白金−金コロイド粒子の残余の表面をことごとくこのBSAでブロックして、白金−金コロイド標識抗MPB64抗体(以下、「白金−金コロイド標識抗体」と記す)溶液を調製した。この溶液を遠心分離(5600×G、30分間)して白金−金コロイド標識抗体を沈殿せしめ、上清液を除いて白金−金コロイド標識抗体を得た。この白金−金コロイド標識抗体を10%サッカロース・1%BSA・0.5%トリトン(Triton)-X100を含有する50mMトリス塩酸緩衝液(pH7.4)に懸濁して白金−金コロイド標識抗体溶液を得た。
【0049】
(4)MPB64測定用イムノクロマト法テストストリップの作成
図1に示されるイムノクロマト法テストストリップを下記の手順で作成した。
(4−1)抗MPB64抗体と白金−金コロイド標識抗体との複合体の捕捉部位
幅5mm、長さ36mmの細長い帯状のニトロセルロース膜をクロマトグラフ媒体のクロマト展開用膜担体3として用意した。
抗MPB64抗体1.0mg/mlが含有されてなる溶液0.5μLを、このクロマト展開用膜担体3におけるクロマト展開開始点側の末端から7.5mmの位置にライン状に塗布して、これを室温で乾燥し、MPB64タンパク質と白金−金コロイド標識抗体との複合体の捕捉部位31とした。なお、ここで使用した抗MPB64抗体は、特開平11-108931号公報に記載のように、上記(3)で使用した抗MPB64抗体とは、MPB64上の位置および構造の何れもが異なる抗原決定基を認識する抗体であった。
【0050】
(4−2)白金−金コロイド標識抗体含浸部材
5mm×15mmの帯状のガラス繊維不織布に、白金−金コロイド標識抗体溶液37.5μLを含浸せしめ、これを室温で乾燥させて白金−金コロイド標識抗体含浸部材2とした。
(4−3)イムノクロマト法テストストリップの作成
上記クロマト展開用膜担体3、上記標識抗体含浸部材2の他に、試料添加用部材5として綿布と、吸収用部材4として濾紙を用意した。そして、これらの部材を用いて、図1と同様のクロマト法テストストリップを作成した。
【0051】
参考例2(供試菌株M. bovis BCG Tokyo株の薬剤感受性試験)
Middlebrook 7H9ブロスBase(Difco社製) 4.7gをTween80 0.5gを含む蒸留水900mlに溶解させた。オートクレーブにて121℃、10分間高圧滅菌した。冷却後、ADC Enrichment(albumin-dextrose-catalase)100mlを無菌的に加え、Middlebrook 7H9液体培地を調製した。
M. bovis BCG Tokyo株(以下、BCG株と称する)を上記にて作製した液体培地に接種し、定法により培養を実施した。McFarland No.1相当の濁度が得られるまで培養を実施し、吸光度530nmにて、O.D. 0.1に調整し、薬剤感受性試験用接種菌液(濃度1mg/ml)を調製した。接種菌液を冷蒸留水にて希釈し、100倍希釈菌液及び1万倍希釈菌液を調製した。
結核菌用感受性一濃度培地(極東製薬工業製)に100倍希釈菌液及び1万倍希釈菌液をそれぞれ100μL接種した。対照として、小川培地からなるコントロール培地に100倍希釈菌液を100μL接種した。菌液を均等に培地全面に広げ、37℃にて培養した。
培養4週以内にて、コントロール培地上に菌の発育が十分に認められた時点で判定を実施した。菌の生育が確認され、コロニーを形成した場合を+、形成しなかった場合を−とした。100倍希釈菌液を接種した培地上に菌の発育が認められ、且つ1万倍希釈菌液を接種した培地上に菌の発育が認められない場合、薬剤に対し耐性(R)と判定した。一方、前記両方の培地に菌の発育が認められない場合、薬剤に対し感受性(S)と判定した。結果を表1に示す。表1の結果から、BCG株は試験に使用した抗結核薬全てに感受性であることが確認された。
【0052】
【表1】

【0053】
実施例1
(1)薬剤含有培地の調製
イソニアジド(INH)(Sigma Aldrich社製)10μgを蒸留水1mlに溶解させ、10μg/ml溶液を調製した。得られたINH溶液を、参考例2にて調製したMiddlebrook 7H9液体培地500μlに添加し、INHの最終濃度0.25μg/mlおよび1μg/mlの薬剤含有培地を調製した。
リファンピシン(RFP)(和光純薬社製)400μgを少量のメチルアルコールに溶解後、蒸留水1mlを加え溶解させ400μg/ml溶液を調製した。得られたRFP溶液を、参考例2にて調製したMiddlebrook 7H9液体培地500μlに添加し、RFPの最終濃度40μg/mlの薬剤含有培地を調製した。
硫酸ストレプトマイシン(SM)(和光純薬社製)100μgを蒸留水1mlに溶解させ100μg/ml溶液を調製した。得られたSM溶液を、参考例2にて調製したMiddlebrook 7H9液体培地500μlに添加し、SMの最終濃度5μg/ml 及び10μg/mlの薬剤含有培地を調製した。
塩酸エタンブトール(EB)(Sigma Aldrich社製)25μgを蒸留水1mlに溶解させ25μg/ml溶液を調製した。得られたEB溶液を、参考例2にて調製したMiddlebrook 7H9液体培地500μlに添加し、EBの最終濃度2.5μg/ml及び5μg/mlの薬剤含有培地を調製した。
カナマイシン(KM)硫酸塩(和光純薬社製)200μgを蒸留水1mlに溶解させ200μg/ml溶液を調製した。得られたKM溶液を、参考例2にて調製したMiddlebrook 7H9液体培地500μlに添加し、KMの最終濃度20μg/mlの薬剤含有培地を調製した。
【0054】
(2)培養及び免疫学的測定
参考例2に従い同じBCG株を液体培地にて培養し、得られた培養液を遠心分離し菌体(ペレット)を得た。本ペレットにTween80を含むリン酸緩衝生理食塩水(以下PBSと称する)を添加し洗浄した。遠心分離により上清を除き、Tween80を含むPBSに再懸濁しBCG株接種菌液(濃度1mg/ml)を調製した。本菌液を冷蒸留水にて希釈し、100倍希釈菌液を調製した。
上記(1)にて調製した薬剤含有培地に100倍希釈菌液を100μL接種した。対照として薬剤無添加のMiddlebrook 7H9液体培地(コントロール)に100倍希釈菌液を100μL接種した。2日間の培養の後、培養上清100μLを参考例1にて作製したイムノクロマト法テストストリップの試料添加用部材5にマイクロピペットで滴下してクロマト展開し、室温で15分放置後、上記捕捉部位31で捕捉されたMPB64タンパク質と白金−金コロイド標識抗体との複合体の捕捉量を肉眼で観察した。
捕捉量は、その量に比例して増減する黒色の呈色度合いを肉眼で、−(着色なし)、±(微弱な着色)、+(明確な着色)、++(顕著な着色)、+++(より顕著な着色)の5段階に区分して判定した。また同時にイムノクロマトリーダー(大塚電子製)により呈色強度(吸光度)を測定した。対照として培養0日目に採取した培養上清を用い、上記イムノクロマト法テストストリップを用いた試験を行った。その結果を表2及び図2に示した。
【0055】
【表2】

【0056】
表2の結果より、抗結核薬を含有する液体培地にて培養したBCG株の培養上清にはMPB64の分泌が抑制され、菌の生育が抑制されているか殺菌されていることが確認された。一方、薬剤無添加のコントロール培地にて培養したBCG株の場合、菌の生育が抑制されないため、培養上清へのMPB64の分泌が確認された。この結果は、参考例2のBCG株の薬剤感受性試験結果と一致した。本結果より、培養上清中のMPB64を測定することにより迅速に結核菌群の薬剤感受性を判定できることが示された。
【産業上の利用可能性】
【0057】
本発明は、薬剤耐性結核菌を簡便かつ迅速に検出することができるので、結核の適切な診断及び治療を行うために有用である。
【図面の簡単な説明】
【0058】
【図1】aはイムノクロマト法テストストリップの平面図、bはaで示されたイムノクロマト法テストストリップの縦断面図。
【図2】実施例1の結果を示すグラフである。
【符号の説明】
【0059】
1 粘着シート
2 含浸部材
3 膜担体
31 捕捉部位
4 吸収用部材
5 試料添加用部材
【技術分野】
【0001】
本発明は、抗結核薬含有培地中で検体を培養して得られた培養液中に分泌された結核菌群特異的分泌タンパク質を免疫学的測定により結核菌群マーカーとして検出することにより、少量の培地を用いて簡便かつ迅速に行えるようにした安全性の高い結核菌群の薬剤感受性検査法およびキットに関する。
【背景技術】
【0002】
現在、日本では年間数千人が、地球規模では年間数百万人が結核により死亡しているといわれている。結核の治療は、化学療法を中心とする内科的療法が基本であり、内科的療法では治療の目的を達成することが不可能な場合に外科療法を考慮する。内科的療法で使用する結核治療の薬剤としては、イソニアジド(INH)、リファンピシン(RFP)、ストレプトマイシン(SM)、エタンブトール(EB)等、多くの種類の薬剤が知られている。
【0003】
しかし、上記薬剤を患者に投与した場合、突然変異により、投与した薬剤に対する耐性を有する耐性菌が生じることが問題となっている。
近年、一次抗結核薬のINH及びRFPの両方に耐性を獲得した多剤耐性結核菌(multi-drug resistant tuberculosis, MDR-TB)が出現しており、更には二次抗結核薬に対する耐性をも獲得した超多剤耐性結核菌(extensively drug-resistant tuberculosis, XDR-TB)も出現している。
MDR-TB及びXDR-TBに対しては使用できる抗結核薬が限定されるため、迅速に感受性試験結果を得て、化学療法方針を決定する必要性がある。また、治療途中において薬剤耐性を獲得し、薬剤の治療効果が得られなくなる可能性もあり、薬剤効果をモニタリングしつつ、適切な化学療法方針を打ち出す必要性も生じている。
【0004】
我が国における抗酸菌群の薬剤感受性試験としては、標準法として1%小川培地を用いた固定濃度法が用いられている。ここでは、主なものを例にとると、リファンピシン(RFP)では40μg/ml、イソニアジド(INH)では0.2μg/ml又は1.0μg/mlの濃度の試験培地が使用される。
【0005】
薬剤感受性試験は菌の含まれる患者検体をそのまま感受性試験培地に接種する直接法と、分離培地に発育した菌を用いて検査する間接法に大別される。直接法はNALC-NaOH法で処理した患者検体を接種菌液として使用する。直接法は成績が早く得られること、本検査成績が検体中の耐性菌と感受性菌の構成状態を反映しているなどの利点があるが、接種菌量の調製が難しく、また、前処理剤の影響があるなどの問題を抱えている。一方、間接法は患者検体を分離培養して得られた菌から接種菌液を作製するため、直接法よりも精度の高い成績が得られる。いずれの方法においても、接種菌液を抗結核薬を含まないコントロール培地と抗結核薬を含む試験培地に接種し、培養後、両者の抗酸菌の発育程度を比較して抗結核薬に対する感受性が判定される。
【0006】
一般的に抗酸菌、特に結核菌は他の細菌に比較して生育が非常に遅い。そのため薬剤感受性が判明するまで通常1か月を要する。間接法では採取された患者検体からの分離培養に1〜2か月を要し、更に感受性試験での培養を実施するため、患者が結核症を疑われてから薬剤感受性が判明するまで3ヶ月以上を要することも希ではない。
【0007】
上記の方法以外の従来の方法としては、液体培地及び自動検出器を使用したBACTEC MGITTM 960結核菌薬剤感受性検査用システム(日本ベクトン・ディッキンソン株式会社)が挙げられる。このシステムは、培地内における菌の増殖による溶存酸素濃度の低下に伴い、センサーの蛍光強度が増加することを利用したものであり、この蛍光強度を自動的に測定することで菌の発育を検出するシステムである。この方法は従来法より迅速性に優れているが、非常に高価な専用機器及び試薬を必要とする。
また、マイクロプレートを利用した方法としてはブロスミックMTB-1(極東製薬製)が挙げられる。菌を接種後、密閉容器にて7日間のCO2培養を行い、菌の発育を確認することで薬剤感受性を判定する。
いずれの方法においても、判定にあたって菌の生育が必要とされるため、増殖の遅い結核菌では耐性の有無を判断するまでには数週間を要する。
【0008】
また、薬剤耐性遺伝子を検出する方法も開示されているが、迅速性は向上しているが、操作が煩雑であり、非常に高度な技術を要求されるため、臨床現場において使用するには不向きであり、未だ確立された遺伝子診断法はないのが現状である。
【0009】
【非特許文献1】青柳昭雄,川城丈夫,Medical Technology, vol. 26, No. 4, p.332-337(1998)
【非特許文献2】青木正和,複十字,No. 315, p.16-17(2007)
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明の目的は、少量の培地を用いて簡便かつ迅速に行えるようにした安全性の高い結核菌群の薬剤感受性検査法およびキットを提供することにある。
【課題を解決するための手段】
【0011】
本発明者は、抗結核薬に感受性を示す結核菌群の場合は、抗結核薬により菌体の増殖や分裂が抑制され、抗結核薬が殺菌的または静菌的に働き、菌体外に分泌されるタンパク質量が大幅に減少する一方、抗結核薬に耐性を示す結核菌株の場合は、少量の液体培地を用いた培養初期でも菌体外へタンパク質を分泌し、該分泌タンパク質は免疫学的測定によって高感度に検出できることを見出し、本発明を完成するに至った。
【0012】
すなわち、本発明の一局面によれば、抗結核薬を含有する培地中で検体を培養し、得られた培養物を免疫学的測定に供することによって該培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして検出することからなる、結核菌群の薬剤感受性検査法が提供される。
【0013】
この検査法における免疫学的測定としては、特に限定されるものではないが、サンドイッチ式免疫測定、とりわけELISA(Enzyme−linked immunosorbent assay)、イムノクロマトグラフィー測定などが好ましい。
【0014】
本発明の好ましい実施形態によれば、上記免疫学的測定は、結核菌群特異的分泌タンパク質に対する第一の抗体を予め所定位置に固定せしめて形成された捕捉部位を備える膜担体を用意し、該分泌タンパク質に対する第二の抗体と所定量の前記培養物との混合液を、前記捕捉部位に向けて前記膜担体にてクロマト展開せしめ、前記培養物中の該分泌タンパク質と前記第二の抗体との複合体を前記捕捉部位に捕捉させるイムノクロマトグラフィー測定によって行われる。
【0015】
また、本発明の検査法では、検体が多剤耐性結核菌又は超多剤耐性結核菌を含むかどうかを判定できるように、互いに異なる抗結核薬を含有する複数の培地中で検体を培養し、得られた培養物のそれぞれを免疫学的測定に供するようにすることが好ましい。
抗結核薬としては、例えば、イソニアジド(INH)、リファンピシン(RFP)、フルオロキノロン系抗菌薬、カナマイシン(KM)、アミカシン(AMK)、カブレオマイシン(CPM)、ストレプトマイシン(SM)、エタンブトール(EB)、エチオナミド、プロチオナミド(TH)、エンビオマイシン(EVM)、ピラジナミド(PZA)、パラアミノサリチル酸(PAS)及びサイクロセリン(CS)からなる群より選ばれた少なくとも1種を使用できる。このうち、検体が多剤耐性結核菌又は超多剤耐性結核菌を含むかどうかを判定できるように、抗結核薬として、少なくともイソニアジド(INH)及びリファンピシン(RFP)を用いることが好ましい。
好ましい実施形態によれば、本発明の検査法は、対照として、抗結核薬を含有しない培地中で検体を培養し、得られた培養物を免疫学的測定に供することによって該培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして検出する工程を包含する。
【0016】
また、本発明の他の局面によれば、抗結核薬を含有する培地が包入された培養容器と、該培地中で検体を培養することにより得られた培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして検出するための免疫学的測定装置とを少なくとも含んでなる、結核菌群の薬剤感受性検査用キットが提供される。
【0017】
このキットにおける免疫学的測定装置としては、特に限定されるものではないが、サンドイッチ式免疫測定装置、とりわけELISA装置(Enzyme−linked immunosorbent assay)、イムノクロマトグラフィー測定装置などが好ましい。
【0018】
本発明の好ましい実施形態によれば、上記免疫学的測定装置は、結核菌群特異的分泌タンパク質に対する第一の抗体と第二の抗体と膜担体とを少なくとも備え、前記第一の抗体は前記膜担体の所定位置に予め固定されて捕捉部位を形成し、前記第二の抗体は適当な標識物質で標識され、かつ、前記捕捉部位から離隔した位置で前記膜担体にてクロマト展開可能なように用意されてなるイムノクロマト法テストストリップを備えたイムノクロマトグラフィー測定装置である。
【0019】
また、本発明の検査用キットは、検体が多剤耐性結核菌又は超多剤耐性結核菌を含むかどうかを判定できるように、複数の培養容器を備え、それぞれの培養容器には、互いに異なる抗結核薬を含有する培地が包入されていることが好ましい。
抗結核薬としては、例えば、イソニアジド(INH)、リファンピシン(RFP)、フルオロキノロン系抗菌薬、カナマイシン(KM)、アミカシン(AMK)、カブレオマイシン(CPM)、ストレプトマイシン(SM)、エタンブトール(EB)、エチオナミド、プロチオナミド(TH)、エンビオマイシン(EVM)、ピラジナミド(PZA)、パラアミノサリチル酸(PAS)及びサイクロセリン(CS)からなる群より選ばれた少なくとも1種を使用できる。このうち、検体が多剤耐性結核菌又は超多剤耐性結核菌を含むかどうかを判定できるように、抗結核薬として、少なくともイソニアジド(INH)及びリファンピシン(RFP)を用いることが好ましい。
好ましい実施形態によれば、本発明のキットは、対照として、抗結核薬を含有しない培地が包入された培養容器を備えてなる。
【発明の効果】
【0020】
本発明によれば、抗結核薬含有培地中で検体を培養して得られた培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして免疫測定により検出することとしたので、高感度かつ特異的に薬剤耐性結核菌の検出が行える。また、結核菌群特異的分泌タンパク質は、生育の遅い結核菌にあっても培養初期から培養物中に分泌されるので、従来の方法よりも培養初期から薬剤耐性結核菌の検出を行うことができ、培養期間が短縮され、迅速に検査が行える。さらに、本発明は、菌体を実質的に増殖させること無く迅速に検査が行えることから、バイオハザードの面でも優れており、安全性の高い検査法である。特に、免疫測定をイムノクロマトグラフィー測定で行う場合は、特殊な機器及び熟練した技術を必要とすることなく、迅速かつ安全に検査が行える。
【発明を実施するための最良の形態】
【0021】
本発明では、免疫測定に先立ち、抗結核薬を含有する培地中に検体を接種し培養する。
検体としては、特に制限はないが、例えば、生体より採取された体液として、喀痰、胸水、気管支分泌液、胃液、血液、髄液、尿、便などが挙げられ、好ましくは喀痰が用いられる。また、呼吸器における検査を行った際に採取した気管支洗浄液、気管支又は肺より採取された組織片なども検体として使用できる。
【0022】
検体の培養は、常法により、液体培養または固体培養によって行うことができるが、培養物(すなわち培養液)をそのままイムノクロマトグラフィー測定などの免疫学的測定に適用できる点から、液体培養が好ましい。
【0023】
液体培養に使用する液体培地としては、上記検体を培養できるものであれば特に限定されず、例えば、結核菌検査指針に記載された培地を使用できる。具体例としては、Middlebrook 7H9培地、デュボス液体培地(ベクトン・デッキンソン社の商品)、MGIT(ベクトン・ディッキンソン社の商品)やBactAlert(ビオメリュー社の商品)などが挙げられる。
【0024】
固体培養に使用する固形培地としては、上記検体を培養できるものであれば特に限定されず、例えば、結核菌検査指針に記載された培地を使用できる。具体例としては、小川培地、試験管工藤PD固形斜面培地(協和薬品工業株式会社の商品)などが挙げられる。固体培養した培養物は、生理食塩水、リン酸緩衝液などの希釈液で希釈して免疫学的測定に供することができる。
【0025】
培養温度は、液体培養及び固体培養の何れの場合も、37℃前後であることが好ましい。培養時間は、結核菌群マーカーとして使用する結核菌群特異的分泌タンパク質を検出可能な量だけ分泌させるに十分な時間であればよく、通常、2〜10日である。
液体培養は、例えば、1ml〜10mlの培養容器に液体培地100μl〜5mlを包入し、上記培養期間だけ好気的に振とう培養することで行うことができる。
【0026】
抗結核薬としては、通常、多剤耐性結核菌又は超多剤耐性結核菌を検出できるものが使用される。多剤耐性結核菌とはイソニアジド(INH)とリファンピシン(RFP)の両剤を含む2薬剤以上に耐性を示す結核菌をいう。したがって、多剤耐性結核菌の検出のためには、培地に含有させる抗結核薬として、少なくともイソニアジド(INH)及びリファンピシン(RFP)の2種を使用することが必要である。また、2006年のWHOによる定義によると超多剤耐性結核菌とは、前記多剤耐性結核菌であって、さらに、フルオロキノロン系抗菌薬のいずれか1剤以上に耐性で、かつ注射可能な薬剤であるカナマイシン(KM)、アミカシン(AMK)、カブレオマイシン(CPM)の3剤中いずれか1剤以上に耐性の結核菌をいう。したがって、超多剤耐性結核菌の検出のためには、抗結核薬として、イソニアジド(INH)及びリファンピシン(RFP)に加えて、フルオロキノロン系抗菌薬(例えば、シプロフロキサシン(CPFX)、オフロキサシン(OFLX)、レボフロキサシン(LVFX))、カナマイシン(KM)、アミカシン(AMK)、カブレオマイシン(CPM)の4種を使用することが必要である。さらには、日本国内で抗結核薬として承認されているストレプトマイシン(SM)、エタンブトール(EB)、エチオナミドおよびプロチオナミド(TH)、エンビオマイシン(EVM)、ピラジナミド(PZA)、パラアミノサリチル酸(PAS)、サイクロセリン(CS)を使用することもできる。複数の抗結核薬は、通常、それぞれ別の培地中に含有させる。すなわち、本発明のキットでは、複数の培養容器が用意され、それぞれの培養容器に、異なる抗結核薬を含有する培地が包入されることが好ましい。
【0027】
本発明において検体の培養に用いる薬剤含有培地は、上記培地に上記抗結核薬を混合して調製することができるが、市販の薬剤含有培地をそのまま使用することもできる。かかる市販の薬剤含有培地としては、例えば、結核菌検査指針に記載されているものが挙げられ、具体例としては、結核菌用感受性一濃度培地(極東製薬工業の商品)、BACTEC MGIT 960 AST結核菌薬剤感受性検査用MGITシリーズ(ベクトン・ディッキンソンの商品)、ブロスミックMTB-1(極東製薬工業の商品)などが挙げられる。
【0028】
本発明において結核菌群マーカーとして使用する結核菌群特異的分泌タンパク質は、培養中に結核菌の菌体外に分泌されるタンパク質であれば特に制限はなく、従来公知の種々の分泌タンパクを使用できる。従来、結核菌は感染臓器内や培養中において菌体外へ種々のタンパク質を分泌していることが知られている。分泌タンパク質としてはMPB80, 70, 64をはじめ、ESAT-6やCFP-10などが知られており、ワクチンコンポーネントや抗体検査対象抗原として利用されている。これらの分泌タンパク質は増殖または生存している菌体中において盛んに合成され、菌体外へ分泌されている。これらのうち、培養早期に分泌され、かつ分泌量の多いものが好ましい。かかる観点から、MPB64は特に分泌量が多いことが知られているので、本発明において結核菌群マーカーとして好ましい。
【0029】
本発明においては、検体を薬剤含有培地で培養し、得られた培養物を免疫学的測定に供し、該培養物中に結核菌群マーカーとしての結核菌群特異的分泌タンパク質が検出されれば、薬剤耐性結核菌の存在が確認でき、検出されなければ薬剤耐性結核菌の存在は否定される。また、対照として検体を薬剤無添加の培地で培養し、得られた培養物を免疫学的測定に供し、該培養物中に前記タンパク質が検出されれば、結核菌の存在が確認できる。したがって、薬剤含有培地での培養と薬剤無添加の培地での培養を併用することにより、薬剤耐性結核菌の存否及び薬剤感受性結核菌の存否が判定できる。
上述のとおり、免疫学的測定は、特に限定されるものではないが、結核菌群特異的分泌タンパク質に対する第一の抗体と第二の抗体とを用いたサンドイッチ式免疫測定、とりわけELISA(Enzyme−linked immunosorbent assay)、イムノクロマトグラフィー測定などが好ましい。
【0030】
本発明において、第一の抗体と第二の抗体は、何れもポリクローナル抗体であってもモノクローナル抗体であってもよいが、反応特異性の点から、少なくとも一方はモノクローナル抗体であることが好ましい。
【0031】
ポリクローナル抗体は、結核菌やBCG菌の培養濾液をゲル濾過などの方法によって精製して得た精製蛋白、または、かかる蛋白をコードする遺伝子を大腸菌などの宿主で遺伝子工学的に発現させて抽出および精製して得た精製蛋白を抗原として常法に従って動物を免疫し、その血清から取得することができる。
【0032】
モノクローナル抗体は、例えば、上記と同様に得られた精製蛋白を抗原としてマウスのような動物を免疫したのち、この免疫された動物の脾臓細胞とミエローマ細胞とを細胞融合して得られた融合細胞をHAT含有培地でセレクトした後に増殖せしめ、増殖せしめた株を前記のようにして得られた精製蛋白を使用して、たとえば、酵素標識免疫法などにより選別することで、取得することができる。
【0033】
本発明の免疫学的測定として用いられるイムノクロマトグラフィー測定法は、公知のイムノクロマト法テストストリップの構成に準拠して容易に実施できる。
一般に、かかるイムノクロマト法テストストリップは、抗原の第一の抗原決定基にて抗体抗原反応可能な第一の抗体と、前記抗原の第二の抗原決定基にて抗体抗原反応可能で且つ標識された第二の抗体と、膜担体とを少なくとも備え、前記第一の抗体は前記膜担体の所定位置に予め固定されて捕捉部位を形成し、前記第二の抗体は前記捕捉部位から離隔した位置で前記膜担体にてクロマト展開可能なように用意されて構成される。第一の抗体および第二の抗体は、上述のように、それぞれポリクローナル抗体であってもモノクローナル抗体であっても良いが、少なくとも何れか一方がモノクローナル抗体であることが好ましい。MPB64は単量体蛋白なので、第一の抗体及び第二の抗体は「ヘテロ」の組み合わせで用いられ、すなわち、抗原上の位置および構造の何れもが異なる各抗原決定基をそれぞれ認識する第一の抗体及び第二の抗体が組み合わせて用いられる。
【0034】
イムノクロマト法テストストリップの具体例としては、例えば、図1に示されるテストストリップが挙げられる。図1において、数字1は粘着シート、2は含浸部材、3は膜担体、31は捕捉部位、4は吸収用部材、5は試料添加用部材を示している。
図示の例では、膜担体3は、幅5mm、長さ36mmの細長い帯状のニトロセルロース製メンブレンフィルターで作成されている。
該膜担体3には、そのクロマト展開始点側の末端から7.5mmの位置に、第一の抗体が固定され、検体の捕捉部位31が形成される。
図示の例では、膜担体3は、ニトロセルロース製メンブレンフィルターを用いているが、被験試料に含まれる検体をクロマト展開可能で、かつ、上記捕捉部位31を形成する抗体を固定可能なものであれば、いかなるものであってもよく、他のセルロース類膜、ナイロン膜、ガラス繊維膜なども使用できる。
【0035】
含浸部材2は、前記第一の抗体が結合する第一の抗原決定基と異なる部位に位置する第二の抗原決定基にて前記抗原と抗体抗原反応する第二の抗体を含浸等の方法で配置せしめた部材からなる。当該第二の抗体は、適当な標識物質で予め標識される。
図示の例では、含浸部材2として、5mm×15mmの帯状のガラス繊維不織布を用いているが、これに限定されるものではなく、例えば、セルロース類布(濾紙、ニトロセルロース膜等)、ポリエチレン、ポリプロピレン等の多孔質プラスチック布類なども使用できる。
【0036】
第二の抗体の標識物質としては、使用可能なものであればいかなる物質であってもよく、呈色標識物質、酵素標識物質、放射線標識物質などが挙げられる。
このうち、捕捉部位31での色の変化を肉眼で観察することにより迅速かつ簡便に判定できる点から、呈色標識物質を用いることが好ましい。また、高感度化の観点からは、蛍光標識物質を用い、捕捉部位31の観察を蛍光イムノクロマトリーダーを用いて行えるようにすることが好ましい。
【0037】
呈色標識物質としては、金コロイド、白金コロイド、白金−金コロイド複合体等の金属コロイドの他、赤色および青色などのそれぞれの顔料で着色されたポリスチレンラテックスなどの合成ラテックスや、天然ゴムラテックスなどのラテックスが挙げられ、このうち、金コロイド、白金−金コロイド複合体などの金属コロイドが特に好ましい。
【0038】
蛍光標識物質としては、FITCやローダミンなどの直接標識物質のほか、蛍光化合物を包含した蛍光ラテックス、量子ドットのような化合物が挙げられ、このうち蛍光化合物を包含した蛍光ラテックスが好ましい。また、蛍光化合物の励起波長および蛍光波長は特に限定されないが、測定機器の設定の観点から、励起波長および測定波長が離れている、所謂ストークスシフトが大きい蛍光化合物を使用すること好ましい。
【0039】
当該含浸部材2は、標識された第二の抗体の懸濁液を前記ガラス繊維不織布等の部材に含浸せしめ、これを乾燥させることなどによって作製できる。
【0040】
図1に示されるように、膜担体3を粘着シート1の中程に貼着し、該膜担体3のクロマト展開の開始点側(すなわち図1の左側、以下「上流側」と記す、また、その逆の側、すなわち図1の右側を、以下「下流側」と記す)の末端の上に、含浸部材2の下流側末端を重ね合わせて連接するとともに、この含浸部材2の上流側部分を粘着シート1に貼着して本発明のイムノクロマト法テストストリップを作成できる。
さらに、必要に応じて、含浸部材2の上面に試料添加用部材5の下流側部分を載置するとともに、該試料添加用部材5の上流側部分を粘着シート1に貼着してもよく、また、膜担体3の下流側部分の上面に吸収用部材4の上流側部分を載置するとともに、該吸収用部材4の下流側部分を粘着シート1に貼着せしめることもできる。
【0041】
試料添加用部材5としては、例えば、多孔質ポリエチレンおよび多孔質ポリプロピレンなどのような多孔質合成樹脂のシートまたはフィルム、ならびに、濾紙および綿布などのようなセルロース製の紙または織布もしくは不織布を用いることができる。
吸収用部材4は、液体をすみやかに吸収、保持できる材質のものであればよく、綿布、濾紙、およびポリエチレン、ポリプロピレン等からなる多孔質プラスチック不織布等を挙げることができるが、特に濾紙が最適である。
【0042】
さらに、市販品の場合、図1のイムノクロマト法テストストリップは、試料添加用部材5と捕捉部位31の上方にそれぞれ被験試料注入部と判定部が開口された適当なプラスチック製ケース内に収容されて提供される。
【0043】
かくして、上記培養物を必要に応じて適当な展開溶媒と混合してクロマト展開可能な被験試料を得た後、当該被験試料を図1に示されるイムノクロマト法テストストリップの試料添加用部材5上に注入すると、該被験試料は、該試料添加用部材5を通過して含浸部材2において、標識された第二の抗体と混合する。
その際、該被験試料中にマーカー蛋白が存在すれば、抗原抗体反応によりマーカー蛋白と第二の抗体との複合体が形成される。
【0044】
この複合体は、膜担体3中をクロマト展開されて捕捉部位31に到達し、そこに固定された第一の抗体と抗原抗体反応して捕捉される。
このとき、標識物質として金コロイドなどの呈色標識物質が使用されていれば、当該呈色標識物質の集積により捕捉部位31が発色するので、直ちに、検体を定性的または定量的に測定することができる。標識物質として蛍光標識物質を使用した場合は、捕捉部位31に集積した蛍光物質の蛍光量を測定機器で読み取り、定量的に測定することができる。
なお、本発明では、第二の抗体又は第二の抗体を含有する前記含浸部材を膜担体上に配置せず、適当な容器に収納しておき、当該容器内で被験試料と第二の抗体を混合して膜担体に注入することにより膜担体にてクロマト展開可能なように、用意しておくこともできる。
【実施例】
【0045】
下記の実施例により本発明をさらに具体的に説明するが、本発明はこの実施例に限定されるものではない。
【0046】
参考例1(抗MPB64抗体を用いたイムノクロマトキットの作製)
(1)抗MPB64モノクローナル抗体の調製
特開平11-108931号公報記載の方法に準拠して、抗MPB64モノクローナル抗体(以下、単に「抗MPB64抗体」という)を得た。
【0047】
(2)白金−金コロイド粒子の調製
(1)使用するガラス器具の全てを王水で洗浄した。
(2)390mlの超純水をフラスコに入れて沸騰させ、この沸騰水に塩化金酸水溶液(水溶液1リットル当たり金として1g 、片山科学工業株式会社製)30mlを加え、その後、1重量% クエン酸ナトリウム水溶液60mlを加え、6分45秒後に、塩化白金酸水溶液(水溶液1リットル当たり白金として1g、和光純薬工業株式会社製) 30mlを加えた。塩化白金酸水溶液添加から5分後に1重量% クエン酸ナトリウム水溶液60mlを加え、4時間、還流を行い、白金−金コロイド懸濁液を得た。
【0048】
(3)白金−金コロイド標識抗MPB64抗体溶液の調製
上記(1)で得られた抗MPB64抗体を下記の手順でそれぞれ白金−金コロイド標識した。
抗MPB64抗体の蛋白換算重量1μg(以下、抗体の蛋白換算重量を示すとき、単に、その精製蛋白質の重量分析による重量数値で示す)と上記(2)の白金−金コロイド溶液1mlとを混合し、室温で2分間静置してこの抗体のことごとくを白金−金コロイド粒子表面に結合させた後、白金−金コロイド溶液における最終濃度が1%となるように10%ウシ血清アルブミン(以下、「BSA」と記す)水溶液を加え、この白金−金コロイド粒子の残余の表面をことごとくこのBSAでブロックして、白金−金コロイド標識抗MPB64抗体(以下、「白金−金コロイド標識抗体」と記す)溶液を調製した。この溶液を遠心分離(5600×G、30分間)して白金−金コロイド標識抗体を沈殿せしめ、上清液を除いて白金−金コロイド標識抗体を得た。この白金−金コロイド標識抗体を10%サッカロース・1%BSA・0.5%トリトン(Triton)-X100を含有する50mMトリス塩酸緩衝液(pH7.4)に懸濁して白金−金コロイド標識抗体溶液を得た。
【0049】
(4)MPB64測定用イムノクロマト法テストストリップの作成
図1に示されるイムノクロマト法テストストリップを下記の手順で作成した。
(4−1)抗MPB64抗体と白金−金コロイド標識抗体との複合体の捕捉部位
幅5mm、長さ36mmの細長い帯状のニトロセルロース膜をクロマトグラフ媒体のクロマト展開用膜担体3として用意した。
抗MPB64抗体1.0mg/mlが含有されてなる溶液0.5μLを、このクロマト展開用膜担体3におけるクロマト展開開始点側の末端から7.5mmの位置にライン状に塗布して、これを室温で乾燥し、MPB64タンパク質と白金−金コロイド標識抗体との複合体の捕捉部位31とした。なお、ここで使用した抗MPB64抗体は、特開平11-108931号公報に記載のように、上記(3)で使用した抗MPB64抗体とは、MPB64上の位置および構造の何れもが異なる抗原決定基を認識する抗体であった。
【0050】
(4−2)白金−金コロイド標識抗体含浸部材
5mm×15mmの帯状のガラス繊維不織布に、白金−金コロイド標識抗体溶液37.5μLを含浸せしめ、これを室温で乾燥させて白金−金コロイド標識抗体含浸部材2とした。
(4−3)イムノクロマト法テストストリップの作成
上記クロマト展開用膜担体3、上記標識抗体含浸部材2の他に、試料添加用部材5として綿布と、吸収用部材4として濾紙を用意した。そして、これらの部材を用いて、図1と同様のクロマト法テストストリップを作成した。
【0051】
参考例2(供試菌株M. bovis BCG Tokyo株の薬剤感受性試験)
Middlebrook 7H9ブロスBase(Difco社製) 4.7gをTween80 0.5gを含む蒸留水900mlに溶解させた。オートクレーブにて121℃、10分間高圧滅菌した。冷却後、ADC Enrichment(albumin-dextrose-catalase)100mlを無菌的に加え、Middlebrook 7H9液体培地を調製した。
M. bovis BCG Tokyo株(以下、BCG株と称する)を上記にて作製した液体培地に接種し、定法により培養を実施した。McFarland No.1相当の濁度が得られるまで培養を実施し、吸光度530nmにて、O.D. 0.1に調整し、薬剤感受性試験用接種菌液(濃度1mg/ml)を調製した。接種菌液を冷蒸留水にて希釈し、100倍希釈菌液及び1万倍希釈菌液を調製した。
結核菌用感受性一濃度培地(極東製薬工業製)に100倍希釈菌液及び1万倍希釈菌液をそれぞれ100μL接種した。対照として、小川培地からなるコントロール培地に100倍希釈菌液を100μL接種した。菌液を均等に培地全面に広げ、37℃にて培養した。
培養4週以内にて、コントロール培地上に菌の発育が十分に認められた時点で判定を実施した。菌の生育が確認され、コロニーを形成した場合を+、形成しなかった場合を−とした。100倍希釈菌液を接種した培地上に菌の発育が認められ、且つ1万倍希釈菌液を接種した培地上に菌の発育が認められない場合、薬剤に対し耐性(R)と判定した。一方、前記両方の培地に菌の発育が認められない場合、薬剤に対し感受性(S)と判定した。結果を表1に示す。表1の結果から、BCG株は試験に使用した抗結核薬全てに感受性であることが確認された。
【0052】
【表1】

【0053】
実施例1
(1)薬剤含有培地の調製
イソニアジド(INH)(Sigma Aldrich社製)10μgを蒸留水1mlに溶解させ、10μg/ml溶液を調製した。得られたINH溶液を、参考例2にて調製したMiddlebrook 7H9液体培地500μlに添加し、INHの最終濃度0.25μg/mlおよび1μg/mlの薬剤含有培地を調製した。
リファンピシン(RFP)(和光純薬社製)400μgを少量のメチルアルコールに溶解後、蒸留水1mlを加え溶解させ400μg/ml溶液を調製した。得られたRFP溶液を、参考例2にて調製したMiddlebrook 7H9液体培地500μlに添加し、RFPの最終濃度40μg/mlの薬剤含有培地を調製した。
硫酸ストレプトマイシン(SM)(和光純薬社製)100μgを蒸留水1mlに溶解させ100μg/ml溶液を調製した。得られたSM溶液を、参考例2にて調製したMiddlebrook 7H9液体培地500μlに添加し、SMの最終濃度5μg/ml 及び10μg/mlの薬剤含有培地を調製した。
塩酸エタンブトール(EB)(Sigma Aldrich社製)25μgを蒸留水1mlに溶解させ25μg/ml溶液を調製した。得られたEB溶液を、参考例2にて調製したMiddlebrook 7H9液体培地500μlに添加し、EBの最終濃度2.5μg/ml及び5μg/mlの薬剤含有培地を調製した。
カナマイシン(KM)硫酸塩(和光純薬社製)200μgを蒸留水1mlに溶解させ200μg/ml溶液を調製した。得られたKM溶液を、参考例2にて調製したMiddlebrook 7H9液体培地500μlに添加し、KMの最終濃度20μg/mlの薬剤含有培地を調製した。
【0054】
(2)培養及び免疫学的測定
参考例2に従い同じBCG株を液体培地にて培養し、得られた培養液を遠心分離し菌体(ペレット)を得た。本ペレットにTween80を含むリン酸緩衝生理食塩水(以下PBSと称する)を添加し洗浄した。遠心分離により上清を除き、Tween80を含むPBSに再懸濁しBCG株接種菌液(濃度1mg/ml)を調製した。本菌液を冷蒸留水にて希釈し、100倍希釈菌液を調製した。
上記(1)にて調製した薬剤含有培地に100倍希釈菌液を100μL接種した。対照として薬剤無添加のMiddlebrook 7H9液体培地(コントロール)に100倍希釈菌液を100μL接種した。2日間の培養の後、培養上清100μLを参考例1にて作製したイムノクロマト法テストストリップの試料添加用部材5にマイクロピペットで滴下してクロマト展開し、室温で15分放置後、上記捕捉部位31で捕捉されたMPB64タンパク質と白金−金コロイド標識抗体との複合体の捕捉量を肉眼で観察した。
捕捉量は、その量に比例して増減する黒色の呈色度合いを肉眼で、−(着色なし)、±(微弱な着色)、+(明確な着色)、++(顕著な着色)、+++(より顕著な着色)の5段階に区分して判定した。また同時にイムノクロマトリーダー(大塚電子製)により呈色強度(吸光度)を測定した。対照として培養0日目に採取した培養上清を用い、上記イムノクロマト法テストストリップを用いた試験を行った。その結果を表2及び図2に示した。
【0055】
【表2】

【0056】
表2の結果より、抗結核薬を含有する液体培地にて培養したBCG株の培養上清にはMPB64の分泌が抑制され、菌の生育が抑制されているか殺菌されていることが確認された。一方、薬剤無添加のコントロール培地にて培養したBCG株の場合、菌の生育が抑制されないため、培養上清へのMPB64の分泌が確認された。この結果は、参考例2のBCG株の薬剤感受性試験結果と一致した。本結果より、培養上清中のMPB64を測定することにより迅速に結核菌群の薬剤感受性を判定できることが示された。
【産業上の利用可能性】
【0057】
本発明は、薬剤耐性結核菌を簡便かつ迅速に検出することができるので、結核の適切な診断及び治療を行うために有用である。
【図面の簡単な説明】
【0058】
【図1】aはイムノクロマト法テストストリップの平面図、bはaで示されたイムノクロマト法テストストリップの縦断面図。
【図2】実施例1の結果を示すグラフである。
【符号の説明】
【0059】
1 粘着シート
2 含浸部材
3 膜担体
31 捕捉部位
4 吸収用部材
5 試料添加用部材
【特許請求の範囲】
【請求項1】
抗結核薬を含有する培地中で検体を培養し、得られた培養物を免疫学的測定に供することによって該培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして検出することからなる、結核菌群の薬剤感受性検査法。
【請求項2】
互いに異なる抗結核薬を含有する複数の培地中で検体を培養し、得られた培養物のそれぞれを免疫学的測定に供する、請求項1に記載の薬剤感受性検査法。
【請求項3】
抗結核薬が、イソニアジド(INH)、リファンピシン(RFP)、フルオロキノロン系抗菌薬、カナマイシン(KM)、アミカシン(AMK)、カブレオマイシン(CPM)、ストレプトマイシン(SM)、エタンブトール(EB)、エチオナミド、プロチオナミド(TH)、エンビオマイシン(EVM)、ピラジナミド(PZA)、パラアミノサリチル酸(PAS)及びサイクロセリン(CS)からなる群より選ばれた少なくとも1種である、請求項2に記載の薬剤感受性検査法。
【請求項4】
抗結核薬が、少なくともイソニアジド(INH)及びリファンピシン(RFP)である、請求項3に記載の薬剤感受性検査法。
【請求項5】
対照として、抗結核薬を含有しない培地中で検体を培養し、得られた培養物を免疫学的測定に供することによって該培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして検出する、請求項1に記載の薬剤感受性検査法。
【請求項6】
免疫学的測定は、結核菌群特異的分泌タンパク質に対する第一の抗体と第二の抗体とを用いたサンドイッチ式免疫測定からなる、請求項1〜5の何れか1項に記載の薬剤感受性検査法。
【請求項7】
免疫学的測定は、結核菌群特異的分泌タンパク質に対する第一の抗体を予め所定位置に固定せしめて形成された捕捉部位を備える膜担体を用意し、該分泌タンパク質に対する第二の抗体と所定量の前記培養物との混合液を、前記捕捉部位に向けて前記膜担体にてクロマト展開せしめ、前記培養物中の該分泌タンパク質と前記第二の抗体との複合体を前記捕捉部位に捕捉させるイムノクロマトグラフィー測定である、請求項6に記載の薬剤感受性検査法。
【請求項8】
結核菌群特異的分泌タンパク質がMPB64である、請求項7に記載の薬剤感受性検査法。
【請求項9】
抗結核薬を含有する培地が包入された培養容器と、該培地中で検体を培養することにより得られた培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして検出するための免疫学的測定装置とを少なくとも含んでなる、結核菌群の薬剤感受性検査用キット。
【請求項10】
複数の培養容器を備え、それぞれの培養容器には、互いに異なる抗結核薬を含有する培地が包入されている、請求項9に記載の薬剤感受性検査用キット。
【請求項11】
抗結核薬が、イソニアジド(INH)、リファンピシン(RFP)、フルオロキノロン系抗菌薬、カナマイシン(KM)、アミカシン(AMK)、カブレオマイシン(CPM)、ストレプトマイシン(SM)、エタンブトール(EB)、エチオナミド、プロチオナミド(TH)、エンビオマイシン(EVM)、ピラジナミド(PZA)、パラアミノサリチル酸(PAS)及びサイクロセリン(CS)からなる群より選ばれた少なくとも1種である、請求項10に記載の薬剤感受性検査用キット。
【請求項12】
抗結核薬が、少なくともイソニアジド(INH)及びリファンピシン(RFP)である、請求項11に記載の薬剤感受性検査用キット。
【請求項13】
対照として、抗結核薬を含有しない培地が包入された培養容器を備えてなる、請求項9に記載の薬剤感受性検査用キット。
【請求項14】
免疫学的測定は、結核菌群特異的分泌タンパク質に対する第一の抗体と第二の抗体とを用いたサンドイッチ式免疫測定からなる、請求項9〜13の何れか1項に記載の薬剤感受性検査用キット。
【請求項15】
免疫学的測定装置は、結核菌群特異的分泌タンパク質に対する第一の抗体と第二の抗体と膜担体とを少なくとも備え、前記第一の抗体は前記膜担体の所定位置に予め固定されて捕捉部位を形成し、前記第二の抗体は適当な標識物質で標識され、かつ、前記捕捉部位から離隔した位置で前記膜担体にてクロマト展開可能なように用意されてなるイムノクロマト法テストストリップを備えたイムノクロマトグラフィー測定装置である、請求項14に記載の薬剤感受性検査用キット。
【請求項16】
結核菌群特異的分泌タンパク質がMPB64である、請求項15に記載の薬剤感受性検査用キット。
【請求項1】
抗結核薬を含有する培地中で検体を培養し、得られた培養物を免疫学的測定に供することによって該培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして検出することからなる、結核菌群の薬剤感受性検査法。
【請求項2】
互いに異なる抗結核薬を含有する複数の培地中で検体を培養し、得られた培養物のそれぞれを免疫学的測定に供する、請求項1に記載の薬剤感受性検査法。
【請求項3】
抗結核薬が、イソニアジド(INH)、リファンピシン(RFP)、フルオロキノロン系抗菌薬、カナマイシン(KM)、アミカシン(AMK)、カブレオマイシン(CPM)、ストレプトマイシン(SM)、エタンブトール(EB)、エチオナミド、プロチオナミド(TH)、エンビオマイシン(EVM)、ピラジナミド(PZA)、パラアミノサリチル酸(PAS)及びサイクロセリン(CS)からなる群より選ばれた少なくとも1種である、請求項2に記載の薬剤感受性検査法。
【請求項4】
抗結核薬が、少なくともイソニアジド(INH)及びリファンピシン(RFP)である、請求項3に記載の薬剤感受性検査法。
【請求項5】
対照として、抗結核薬を含有しない培地中で検体を培養し、得られた培養物を免疫学的測定に供することによって該培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして検出する、請求項1に記載の薬剤感受性検査法。
【請求項6】
免疫学的測定は、結核菌群特異的分泌タンパク質に対する第一の抗体と第二の抗体とを用いたサンドイッチ式免疫測定からなる、請求項1〜5の何れか1項に記載の薬剤感受性検査法。
【請求項7】
免疫学的測定は、結核菌群特異的分泌タンパク質に対する第一の抗体を予め所定位置に固定せしめて形成された捕捉部位を備える膜担体を用意し、該分泌タンパク質に対する第二の抗体と所定量の前記培養物との混合液を、前記捕捉部位に向けて前記膜担体にてクロマト展開せしめ、前記培養物中の該分泌タンパク質と前記第二の抗体との複合体を前記捕捉部位に捕捉させるイムノクロマトグラフィー測定である、請求項6に記載の薬剤感受性検査法。
【請求項8】
結核菌群特異的分泌タンパク質がMPB64である、請求項7に記載の薬剤感受性検査法。
【請求項9】
抗結核薬を含有する培地が包入された培養容器と、該培地中で検体を培養することにより得られた培養物中の結核菌群特異的分泌タンパク質を結核菌群マーカーとして検出するための免疫学的測定装置とを少なくとも含んでなる、結核菌群の薬剤感受性検査用キット。
【請求項10】
複数の培養容器を備え、それぞれの培養容器には、互いに異なる抗結核薬を含有する培地が包入されている、請求項9に記載の薬剤感受性検査用キット。
【請求項11】
抗結核薬が、イソニアジド(INH)、リファンピシン(RFP)、フルオロキノロン系抗菌薬、カナマイシン(KM)、アミカシン(AMK)、カブレオマイシン(CPM)、ストレプトマイシン(SM)、エタンブトール(EB)、エチオナミド、プロチオナミド(TH)、エンビオマイシン(EVM)、ピラジナミド(PZA)、パラアミノサリチル酸(PAS)及びサイクロセリン(CS)からなる群より選ばれた少なくとも1種である、請求項10に記載の薬剤感受性検査用キット。
【請求項12】
抗結核薬が、少なくともイソニアジド(INH)及びリファンピシン(RFP)である、請求項11に記載の薬剤感受性検査用キット。
【請求項13】
対照として、抗結核薬を含有しない培地が包入された培養容器を備えてなる、請求項9に記載の薬剤感受性検査用キット。
【請求項14】
免疫学的測定は、結核菌群特異的分泌タンパク質に対する第一の抗体と第二の抗体とを用いたサンドイッチ式免疫測定からなる、請求項9〜13の何れか1項に記載の薬剤感受性検査用キット。
【請求項15】
免疫学的測定装置は、結核菌群特異的分泌タンパク質に対する第一の抗体と第二の抗体と膜担体とを少なくとも備え、前記第一の抗体は前記膜担体の所定位置に予め固定されて捕捉部位を形成し、前記第二の抗体は適当な標識物質で標識され、かつ、前記捕捉部位から離隔した位置で前記膜担体にてクロマト展開可能なように用意されてなるイムノクロマト法テストストリップを備えたイムノクロマトグラフィー測定装置である、請求項14に記載の薬剤感受性検査用キット。
【請求項16】
結核菌群特異的分泌タンパク質がMPB64である、請求項15に記載の薬剤感受性検査用キット。
【図1】


【図2】




【図2】


【公開番号】特開2010−112844(P2010−112844A)
【公開日】平成22年5月20日(2010.5.20)
【国際特許分類】
【出願番号】特願2008−285898(P2008−285898)
【出願日】平成20年11月6日(2008.11.6)
【出願人】(508331659)有限会社環境しずおか (1)
【Fターム(参考)】
【公開日】平成22年5月20日(2010.5.20)
【国際特許分類】
【出願日】平成20年11月6日(2008.11.6)
【出願人】(508331659)有限会社環境しずおか (1)
【Fターム(参考)】
[ Back to top ]

