網膜幹細胞の分離方法および網膜幹細胞
【課題】 有用な治療法が今のところ存在しない網膜疾患に対して、実際に臨床応用できる可能性が非常に高い新しい治療法に応用できる網膜幹細胞、およびその分離取得手段を提供する。
【解決手段】 網膜幹細胞の分離を、哺乳動物の生体組織、又は血清代替物質の添加された培地で培養された哺乳動物の、生体組織の細胞の表面に発現している神経栄養因子の受容体であるp75+ 、trkA+ 、trkB+ 又はtrkC+ をマーカーとして、それらに対する抗体を用いて分離する。
【解決手段】 網膜幹細胞の分離を、哺乳動物の生体組織、又は血清代替物質の添加された培地で培養された哺乳動物の、生体組織の細胞の表面に発現している神経栄養因子の受容体であるp75+ 、trkA+ 、trkB+ 又はtrkC+ をマーカーとして、それらに対する抗体を用いて分離する。
【発明の詳細な説明】
【技術分野】
【0001】
この発明は、哺乳類の生体組織、特に、眼球組織、中でも虹彩組織の細胞を用いて、網膜を構成する細胞の基となる網膜幹細胞を効率的に分離する方法、および、その方法によって取得された網膜神経細胞に分化誘導し得る網膜幹細胞に関するもので、医療に関連する生化学工学技術の分野に属するものである。
【背景技術】
【0002】
脊椎動物、特に哺乳動物の組織において、傷害、疾患、加齢などによる組織や細胞に損傷が起こった場合、様々な作用が働き、組織や細胞の損傷を元の状態へ回復させようとする、いわゆる再生という現象が起こる。
この再生のプロセスにおいて、当該組織に存在する幹細胞が大きな役割を担っている。これら幹細胞は、必要に応じて様々な細胞や組織(臓器)に分化する多能性を有しているため、多能性組織幹細胞(以後、幹細胞と云う。)と呼ばれ、何らかの原因で損傷を受けた組織(臓器)にこの幹細胞を補うことで、組織(臓器)の回復・再生をさせることができるものである。
この幹細胞を用いた新しい医療技術を応用した再生医療は、今まで治療が不可能であった疾患に対する新しい治療法として期待されている。
【0003】
哺乳動物において、幹細胞の研究は、骨髄を始めとして様々な研究が進んでいる。
例えば、骨髄には、造血幹細胞と呼ばれる幹細胞が存在する。この幹細胞は、赤血球、顆粒球やリンパ球などの白血球、血小板など様々な機能の異なる細胞へ分化することが可能なものである。
一方、骨髄には、造血幹細胞とは別に骨髄間質細胞と呼ばれる非造血細胞(骨細胞、軟骨細胞、脂肪細胞など)へ分化することができる幹細胞も存在することが分かっている(非特許文献1)。
【0004】
また、近年の研究成果では、骨髄以外の様々な臓器や組織に、幹細胞が存在することが明らかにされている(非特許文献2,3,4,5)。
【0005】
このように、現在までに、様々な臓器や組織に存在する幹細胞を材料として、種々の細胞へ分化させる研究がなされ、網膜神経細胞へ分化させる研究も行われているが、神経系細胞、特に網膜神経細胞へ分化させ、かつ生理学的に機能する細胞を作成することは困難であった。
すなわち、第一に、網膜幹細胞を同定、分離するための細胞膜表面に発現している特異的なタンパク質が発見されていない。さらに、生理学的に機能する神経系細胞や網膜神経細胞へ分化誘導できる細胞は、限られた組織由来の細胞でないと難しいという問題が存在しているため、網膜細胞へ分化誘導するために細胞にウイルスベクターを用いて遺伝子を導入した報告や、非自己の細胞であるES細胞を用いるという研究報告はある。
しかしながら、これらは感染の問題、倫理上の問題が残され、実際の臨床応用には多くの問題点が残され、有効なものとは云えないものである。
【0006】
一方、上記目的のためには、必要とする幹細胞のみを選択的かつ効率的に分離する技術も必須の技術となる。
近年の報告によると、種々の組織に存在する幹細胞には、組織特異的なタンパクが合成されていることを明らかにし、このマーカータンパク質と云われている、細胞の膜表面に発現している組織特異的なタンパク質を利用することで幹細胞を同定、分離する技術が研究されている。
【0007】
既に報告されているマーカータンパク質として、骨髄には、「AC133」というマーカータンパク質をもつ細胞が存在している(非特許文献11)。
また、膵臓には、「c-Met」「c-Kit」「CD45」および「TER119」と云うマーカータンパク質を発現している細胞が存在し、このマーカータンパク質を利用した選択的細胞分離法に関する特許も公開されている(特許文献1)。
さらに、肝臓には、「Ttm2A」というマーカータンパク質が存在し、さらに、この「Ttm2A」をコードする「mRNA」を利用することで幹細胞の分離法についての発明も開示されている(特許文献2)。
【0008】
このように、様々な組織(臓器)によって、幹細胞のマーカータンパク質は異なっているため、全ての組織においての、組織特異的な幹細胞のマーカータンパク質の研究が再生医療研究の急務の課題となっている。
【0009】
さらに、最近の研究おいては、様々な組織の幹細胞から神経系細胞へ分化誘導する研究は種々報告されている。しかしながら、それらの方法では、神経系細胞への分化誘導できる成功率は非常に悪く、さらに、神経細胞に特異的なマーカータンパク質を発現する細胞は作成できるが、生理学(電気生理学)的に機能する細胞の作成までは殆どできていないのが現状である。
【非特許文献1】Pittenger M.F.,et al.,Science,1999,284,143−147
【非特許文献2】Goodell M.F.,et al.,Nat. Med.,1997,3,1337−1345
【非特許文献3】Zulewski H.,et al.,Diabetes,2001,50,521−533
【非特許文献4】Suzuki A.,et al.,Hepatology,2000,32,1230−1239
【非特許文献5】Zuk P.A.,et al.,Tissue Engineering,2001,7,211−228
【非特許文献6】Abe T.,et al.,日眼会誌,2002,106,778−803
【非特許文献7】Kurimoto Y.,et al.,Neuroscience letter,2001,306,57−60
【非特許文献8】Tropepe V.,et al.,Science,2000,287,2032−2036
【非特許文献9】Haruta M.,et al.,Nature Neuroscience,2001,4,1163−1164
【非特許文献10】Ikeda H.,et al.,Proceedings of the National Academy of Sciences of the United States of America,2005,102,11331−11336
【非特許文献11】Reyes M.,et al.,J.Clin.Invest.,2002,109,337−346
【特許文献1】WO2002/088335号
【特許文献2】特開2004−187679号
【発明の開示】
【発明が解決しようとする課題】
【0010】
この発明はかかる現状を鑑みた上で、上記のような従来技術における問題点を解決し、哺乳動物の生体組織、特に眼球組織から、網膜幹細胞を効率よく同定し、分離、培養および分化誘導できる方法を提供することである。
【0011】
すなわち、本発明者らはこのような背景から鋭意研究を行った結果、神経の生存や神経軸索の再生促進、神経系の発生や発達に関与する、ニュ−ロトロフィンと呼ばれる神経栄養因子(神経成長因子)のレセプターである「Low−affinity Nerve growth factor receptor p75(NGFRp75;以降、p75と記す。)」が、眼球組織に存在し、将来網膜幹細胞へ分化誘導できる幹細胞において発現していることを見出し、さらに、このp75をマーカータンパク質として用いることにより、網膜幹細胞を同定、分離することができ、しかも、その方法によれば、網膜幹細胞を効率的に回収することができることを見出し、従来技術が有する問題の存在しない網膜幹細胞の分離方法を確立したのである。
【0012】
また、発明者等はp75に加えて、神経栄養因子に分類される、すなわち、ニュ−ロトロフィンファミリーと呼ばれている、NGF、BDNF、NT−3、NT−4/5のレセプターであるTrk(TrkA+、TrkB+およびTrkC+)から選択されるマーカータンパク質を1種類以上組み合わせることで、より効率的に網膜幹細胞の同定、分離の効率を飛躍的に高められることを見出したのである。
【0013】
さらに、発明者等は、特定の培地を用いることにより、網膜幹細胞の分離前の生体組織、特に眼球組織の培養、分離後の培養、その際の網膜細胞への分化誘導効率培養および各種の網膜細胞への分化誘導効率を飛躍的に高められることをも見出して、この発明を完成したのである。
【課題を解決するための手段】
【0014】
すなわち、この発明の請求項1に記載の発明は、
細胞表面に発現している神経栄養因子の受容体であるp75+、trkA+、trkB+又はtrkC+をマーカーとして、哺乳動物の生体組織から網膜幹細胞を分離すること
を特徴とする網膜幹細胞の分離方法である。
【0015】
また、この発明の請求項2に記載の発明は、
請求項1に記載の網膜幹細胞の分離方法において、
前記分離が、
p75+、trkA+、trkB+又はtrkC+に対する抗体を用いて行われること
を特徴とするものである。
【0016】
また、この発明の請求項3に記載の発明は、
請求項1に記載の網膜幹細胞の分離方法において、
前記分離が、
p75+に対する抗体と、trkA+又はtrkB+もしくはtrkC+に対する抗体の1種以上とを組み合わせて用いて行われること
を特徴とするものである。
【0017】
また、この発明の請求項4に記載の発明は、
請求項1に記載の網膜幹細胞の分離方法において、
前記生体組織が、
血清または血清代替物質を加えた培地で培養した細胞であること
を特徴とするものである。
【0018】
また、この発明の請求項5に記載の発明は、
請求項1又は4に記載の網膜幹細胞の分離方法において、
前記生体組織が、
眼球組織由来の細胞であること
を特徴とするものである。
【0019】
また、この発明の請求項6に記載の発明は、
請求項1又は4に記載の網膜幹細胞の分離方法において、
前記生体組織が、
眼球の虹彩組織由来の細胞であること
を特徴とするものである。
【0020】
さらに、この発明の請求項7に記載の発明は、
哺乳動物の生体組織から分離された細胞で、かつ、種々の細胞への分化誘導が可能な多能性細胞であること
を特徴とする網膜幹細胞である。
【0021】
また、この発明の請求項8に記載の発明は、
請求項7に記載の網膜幹細胞において、
前記細胞が、
眼球組織由来の細胞であること
を特徴とするものである。
【0022】
また、この発明の請求項9に記載の発明は、
請求項7に記載の網膜幹細胞において、
前記細胞が、
眼球の虹彩組織由来の細胞であること
を特徴とするものである。
【0023】
また、この発明の請求項10に記載の発明は、
請求項7記載の網膜幹細胞において、
前記分化誘導が、
血清または血清代替物質と成長因子を加えた培地で培養することにより行われるものであること
を特徴とするものである。
【0024】
また、この発明の請求項11に記載の発明は、
請求項7記載の網膜幹細胞において、
前記分離が、
請求項1〜6に記載のいずれかの方法で行なわれたものであること
を特徴とするものである。
【発明の効果】
【0025】
この発明により、今まで困難であった哺乳動物の眼球組織に存在する網膜幹細胞を効率的に同定することが可能となった。さらに、従来の技術と比べて、高純度でより優れた網膜幹細胞を分離、回収することを可能とした。
また、この発明は、眼科再生医療の分野において、現在まで治療が困難であった疾患に対し、自己の細胞を用いた新しい治療法として応用できる可能性が非常に高いことから、社会に対して大きく貢献することができるものである。
【発明を実施するための最良の形態】
【0026】
以下、この発明にかかる網膜幹細胞の分離法等を、具体的かつ詳細な実施例に基づいて、詳細に説明するが、この発明はこれら実施例に何ら限定されるものではない。
【実施例】
【0027】
<成体マウス虹彩組織からの細胞採取>
DBA2/Crマウス(雄、4週齢)を安楽死させたのち、眼球を摘出した。
摘出した眼球をアルコールにて短時間消毒したのち、実体顕微鏡下にて眼球赤道部付近からマイクロスプリング尖刀を用いて切開し、虹彩組織のみを摘出した。
摘出した虹彩組織を酵素処理して個々の細胞に分散させたのち、Dulbecco’s
Modified Eagle MediumとF−12培地の1:1混合培養液(以降、基礎培地)を用いて洗浄した。
【0028】
<フローサイトメトリー(FACS)による細胞の単離解析>
神経幹細胞マーカーのNestin+ は、細胞質内タンパク質で、生きた細胞の状態ではFACSによる解析が不可能である。
そのため、細胞質内タンパク質の発現を解析するために、細胞を固定して細胞膜に穴を開けて、抗体が入るように固定する手段を採用し、神経幹細胞マーカーであるNestin+ 細胞が今回発見したマーカーを発現しているかを、以下のようにして調査した。
【0029】
各組織から調製した細胞を、1%パラフォルムアルデヒド固定液で15分固定した後、リン酸緩衝液(PBS)で洗浄した。
5%ウシ血清(FBS)と、細胞膜に穴を開けるための酵素であるサポニンを添加したハンクス液(Hank’s balanced salt solution)中で、抗p75ポリクローナル抗体(CHEMICON製)、抗Trk−A抗体(Santa Cruz Biotech製)、抗Trk−B抗体(Santa Cruz Biotech製)、抗Trk−C抗体(Santa Cruz Biotech製)、および抗Nestin抗体(Santa Cruz Biotech製)と30分間氷中で反応させた。
反応後、5%FBS、およびサポニンを添加したハンクス液にて3回洗浄し、続いてAlexa Fluor 488(インビトロジェン株式会社製)、又はPE−Cy5で標識した抗IgGモノクローナル抗体(Santa Cruz Biotech製)と30分間氷中にて反応させた。
最後に、5%FBSを含むハンクス液にて3回洗浄し、5%FBS添加ハンクス液中に細胞を懸濁した。
これら蛍光標識した細胞をセルソーターのFACS Vantage SE(ベックトン・ディッキンソン株式会社製)にて解析した。
ゲートの設定は、ネガティブコントロールを指標にした。
まず、前方散乱光(Foward Scatter)、側方散乱光(Side Scatter)により、残存する赤血球、細胞の残骸、細胞の凝集魂を除いた部分にゲート(R1)をかけた。
ついで、ゲート(R1)内のp75+ 、Trk−A+ 、Trk−B+ 、Trk−C+ 、およびNestin+細胞を解析した。
つぎに、染色の組み合わせによりNestin+ に加えてp75+ (以下、Nestin+ /p75+ と記す。)、同様にNestin+ /Trk−A+ 、Nestin+ /Trk−B+ 、およびNestin+ /Trk−C+ の組み合わせで細胞にゲート(R2)を設定し、それぞれのマーカータンパク質を合成している細胞を解析した。
【0030】
セルソーターにより、それぞれのマーカータンパク質、あるいはNestinとの共発現をしている細胞についての解析を行った。
【0031】
ゲート(R1)内のp75+ 、Trk−A+ 、Trk−B+ 、Trk−C+ 、およびNestin+ 細胞の発現割合を解析したところ、p75+ 細胞は全体の22.38%、Trk−A+ 細胞は全体の25.01%、Trk−B+ 細胞は全体の23.69%、Trk−C+ 細胞は全体の22.45%、およびNestin+ 細胞は全体の22.26%に発現していることが分かった。
【0032】
つぎに、Nestin+ /p75+ 、Nestin+ /Trk−A+ 、Nestin+/Trk−B+ 、およびNestin+ /Trk−C+ の発現割合を解析したところ、
Nestin+ /p75+ 細胞は全体の16.7%、
Nestin+ /Trk−A+ 細胞は全体の16.6%、
Nestin+ /Trk−B+ 細胞は全体の18.5%、および
Nestin+ /Trk−C+ 細胞は全体の15.5%
に発現していることが分かった。
この結果をさらに詳細に分析すると、Nestin+ の細胞は全てp75+細胞、Trk−A+ 細胞、Trk−B+ 細胞、あるいはTrk−C+ 細胞の分画に含まれていることが分かった。
【0033】
従来の方法では、神経幹細胞のみを生きた状態の細胞で分離することはできなかった。それは、神経幹細胞(神経前駆細胞)のマーカーであるNestinは細胞質内タンパク質であるため、生きた細胞の状態でセルソーターを用いて分離することが不可能であること、および効率的な神経幹細胞(神経前駆細胞)を分離することができる細胞膜タンパク質が分かっていなかったためである。
しかしながら、上記の結果から、神経幹細胞の表面に発現していることを見出したp75、Trk−A、Trk−B、あるいはTrk−Cを用いることで、初めて細胞膜タンパク質を用いて、神経幹細胞を、生きた細胞の状態で効率的にセルソーターを用いて分離することが以下の様に可能となった。
【0034】
<生きた状態の虹彩由来組織幹細胞の分離と解析>
上記結果から明らかなように、Nestin+ 細胞は、p75+ 細胞、Trk−A+ 細胞、Trk−B+ 細胞、あるいはTrk−C+ 細胞であることが分かった。
そこで、上記と同様の方法で成体マウス虹彩組織からの細胞を採取し、固定しないで、生きた状態のままの細胞を、p75、Trk−A、Trk−B、およびTrk−Cの抗体でそれぞれ標識して、セルソーターによる細胞分取を行った。
分取したp75+ 細胞、Trk−A+ 細胞、Trk−B+ 細胞、およびTrk−C+ 細胞を血清含有基礎培地で培養した。
なお、セルソーターによるソーティングを行う前の、様々な虹彩由来細胞が混在している状態の細胞を未処理細胞とした。
【0035】
p75+ 細胞、Trk−A+ 細胞、Trk−B+ 細胞、およびTrk−C+ 細胞と、未処理細胞を網膜細胞へ分化誘導するにあたって、まず、それぞれのマーカータンパク陽性の細胞を分取した後に接着培養させた細胞において、神経幹細胞(神経前駆細胞)のマーカーを発現する細胞の発現割合の確認評価を行った。
ついで、それぞれのマーカーでソーティングした細胞および未処理細胞を、血清含有基礎培地で3日間培養した後、神経幹細胞(神経前駆細胞)マーカーのNestin+ 細胞の割合についてフローサイトメトリー(FACS)を用いて測定した。
【0036】
FACSによるNestin+ 細胞の割合を測定したところ、
p75でソーティングした細胞では、Nestin+ 細胞は全体の95.4%、
Trk−Aでソーティングした細胞では、Nestin+ 細胞は全体の92.9%、
Trk−Bでソーティングした細胞では、Nestin+ 細胞は全体の90.3%、
Trk−Cでソーティングした細胞では、Nestin+ 細胞は全体の85.7%
に存在した。
一方、未処理細胞では4.3%であった。
【0037】
<虹彩由来組織幹細胞の状態を維持したまま増殖させた細胞の解析>
上記に記載した方法と同様にして、成体DBA2/Crマウスの虹彩組織から細胞を採取した。
つぎに、虹彩組織中に含まれる組織幹細胞の状態を維持させたまま増殖させるために、血清代替物質(ESGRO(CHEMICON)またはSynQ(Cell Culture Service))を加えた低血清の基礎培地に細胞を播種し、10日間培養した。
【0038】
10日間培養した細胞を酵素処理し、培養ディッシュから剥がし、個々の細胞に単離させた後、上記方法と同様に細胞を固定し、培養した細胞におけるp75、Trk−A、Trk−BおよびTrk−Cの発現量について、実施例1と同様に抗体を用いて細胞を標識し、フローサイトメトリー(FACS)を用いて測定した。
【0039】
Nestin+ /p75+ 、Nestin+ /Trk−A+ 、Nestin+ /Trk−B+ 、およびNestin+ /Trk−C+の発現割合を解析したところ、
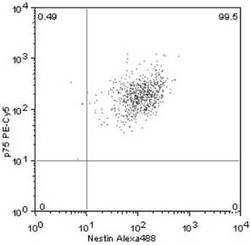
Nestin+ /p75+ 細胞は、全体の99.5%(図1)、
Nestin+ /Trk−A+ 細胞は、全体の97.6%(図2)、
Nestin+ /Trk−B+ 細胞は、全体の97.7%(図3)、および
Nestin+ /Trk−C+ 細胞は、全体の95.0%(図4)
に発現していることが分かった。
この結果から、虹彩由来細胞は本培養条件などで培養することによって、Nestin+ /p75+ 、Nestin+ /Trk−A+ 、Nestin+ /Trk−B+ 、およびNestin+ /Trk−C+ の発現割合を増加させることに成功した。
また、結果を詳細に分析すると、Nestin+ の細胞は全て、p75+ 、Trk−A+ 、Trk−B+ 、あるいはTrk−C+ であることが分かったため、これらの細胞表面マーカータンパクを用いて、細胞をソーティングすることで、Nestin+ の細胞を分取することができることが証明された。
【0040】
<虹彩組織由来Nestin+細胞の網膜細胞への分化誘導>
上記の方法に従って、虹彩由来細胞を培養した細胞を生きた状態のままで、p75、Trk−A、Trk−B、およびTrk−Cの抗体を用いて細胞を標識し、その陽性細胞をセルソーターでソーティングして、細胞を回収した。
回収した細胞は、上記実施例で明らかなようにNestin+ 細胞である。
網膜は、神経細胞の集まりであるため、このNestin+ 細胞は神経幹細胞(神経前駆細胞)であり、網膜幹細胞であるとも云える。
【0041】
回収した細胞を、神経細胞成長因子、およびTGF−β superfamilyや神経細胞成長因子などの成長因子を含む低血清分化誘導培地で培養し、網膜を構成する様々な細胞への分化誘導効率を評価した。
評価には、神経節細胞、ミューラーグリア細胞、水平細胞、双極細胞、視細胞の各細胞特異的マーカーを用いた。
なお、対象には、ソーティングしていない未処理細胞を用いた。
【0042】
分化誘導培地で14日間、培養した細胞を様々な網膜を構成する細胞に、特異的なタンパク質の抗体を用いて染色した。
免疫細胞染色に使用した抗体は、
神経節細胞のマーカータンパク質である、Brn−3bに対する抗体(Santa Cruz Biotech製)、
ミューラーグリア細胞のマーカータンパク質である、CRALBPに対する抗体(Abcam製)、
水平細胞のマーカータンパク質である、Calbindinに対する抗体(CHEMICON製)、
双極細胞のマーカータンパク質である、PKCに対する抗体(Sigma製)、
視細胞のマーカータンパク質である、Recoverinに対する抗体(CHEMICON製)
である。
【0043】
p75、Trk−A、Trk−B、およびTrk−Cによってソーティングした細胞では、いずれも網膜を構成する神経節細胞(図5)、ミューラーグリア細胞(図6)、水平細胞(図7)、双極細胞(図8)、および視細胞(図9)に分化誘導することができた。
一方、未処理細胞では、網膜の細胞へ分化させることはできなかった。
【0044】
<分化誘導した細胞の電気生理学的機能評価>
上記の方法で取得した、網膜細胞への分化誘導をした細胞について、神経の細胞として機能する細胞かどうかを、電気生理学的に評価した。
評価法としては、細胞の電気生理学的実験で一般的に用いられているホールセル・パッチクランプ法を実施した。
【0045】
網膜細胞に分化誘導させた、個々の細胞レベルにおける電気生理学的な機能評価を実施したところ、神経細胞に比較的特異的に観察される内向き電流(Naチャネル)が観察された(図10)。
【0046】
遺伝子組み換えを行い、マウスの体の、全ての細胞において、GFP(Green Fluorescent Protein:GFP)の蛍光を発するマウスを用いて、上記記載の方法で回収したp75+ 細胞、Trk−A+ 細胞、Trk−B+ 細胞、およびTrk−C+ 細胞を遺伝的に網膜視細胞に障害を持つrdマウスの網膜に移植し、移植前と移植40日後のマウス網膜電位(ERG)を測定した。
【0047】
移植する前のrdマウスの網膜電位は、A波も減衰していたが、特に、B波の振幅が小さい状態であった(図11−a)。
移植40日後のrdマウスの網膜電位は、特にB波の振幅が大きくなっており、網膜電位の回復が観察された(図11−b)。
【0048】
さらに、移植した網膜組織の切片標本を作成し、上記記載の網膜を構成する細胞に特異的なタンパク質の抗体を用いて染色したところ、移植した細胞(GFP:Greeen Fluorescence Proteinの蛍光を発する細胞)が様々な網膜の細胞層で分化し、種々の網膜細胞に分化していた(図12)。
【0049】
<ヒト虹彩組織細胞>
倫理委員会での承認を得た後、手術の過程で虹彩組織の一部を切除、破棄する疾患に罹患している方で、実験・研究の同意を得られた方から、通常破棄される虹彩組織を回収した。
得られたHuman由来の虹彩組織細胞を、未分化な状態を保ったままの状態で増殖させることのできる特殊な培養条件(自己血清、人工血清代替物質、Wnt経路のアンタゴニスト、b−FGFを含む基礎培地)で培養した。
培養したヒト虹彩由来細胞を、実施例3と同様にp75、Trk−A、Trk−B、Trk−Cのぞれぞれと、神経前駆細胞マーカーのNestin、および網膜神経細胞のマスター遺伝子であるPax6との共発現について調査した。
【0050】
培養した細胞を、FACSで解析したところ、
p75+ /Nestin+ 細胞の割合は、99.3%(図13)、
Trk−A+ /Nestin+ 細胞の割合は、95.1%(図14)、
Trk−B+ /Nestin+ 細胞の割合は、92.2%(図15)、
Trk−C+ /Nestin+ 細胞の割合は、90.2%(図16)
であった。
同様に、p75+ /Pax6+ 細胞の割合は、94.3%(図17)、
Trk−A+ /Pax6+ 細胞の割合は、93.9%(図18)、
Trk−B+ /Pax6+ 細胞の割合は、89.5%(図19)、
Trk−C+ /Pax6+ 細胞の割合は、80.2%(図20)
であった。
【0051】
これらの結果をから詳細に検証すると、例えば、
p75+ /Nestin+ 細胞の割合は99.3%であったが、
p75− /Nestin+ 細胞は0%で、
p75+ /Nestin− 細胞は0.67%
であったことから、ヒト虹彩由来細胞においても、p75+ 細胞は、Nestin+ 細胞であることが確認された。
【産業上の利用可能性】
【0052】
この発明の活用例として、臨床応用の可能性が非常に高い再生医療への応用が期待できる。
すなわち、この発明の新しい細胞表面マーカーを用いることにより、従来不可能であったセルソーターを用いた神経前駆細胞のみを、生きたままの状態で分離することができるようになった。
さらに、新しい細胞表面マーカーで分離した神経前駆細胞マーカー陽性の細胞を、シャーレの中で網膜細胞へ分化誘導できる培養条件で培養すると、網膜を構成する様々な細胞へ分化誘導できること、網膜神経細胞へ分化誘導した細胞は電気生理学的に機能する細胞であること、分離した神経前駆細胞マーカー陽性の細胞を網膜に障害のあるマウスに移植すると、必要な網膜細胞に分化し、神経ネットワークを構築できるため、電気生理学的な機能評価も回復することがわかった。
これらのマウスの実験結果と同様の結果が、ヒト虹彩由来細胞でもシャーレの中の実験では再現できることがわかった。
したがって、今まで治療方法がなかった網膜疾患に対して、実際に臨床応用ができる可能性が非常に高い新しい治療法への応用が期待できる。
【図面の簡単な説明】
【0053】
【図1】単離した培養細胞におけるNestin+ /p75+ 細胞の発現割合を示す図である。
【図2】単離した培養細胞におけるNestin+ /Trk−A+ 細胞の発現割合を示す図である。
【図3】単離した培養細胞におけるNestin+ /Trk−B+ 細胞の発現割合を示す図である。
【図4】単離した培養細胞におけるNestin+ /Trk−C+ 細胞の発現割合を示す図である。
【図5】分化誘導された網膜を構成する神経節細胞の図である。
【図6】分化誘導された網膜を構成するミューラーグリア細胞の図である。
【図7】分化誘導された網膜を構成する水平細胞の図である。
【図8】分化誘導された網膜を構成する双極細胞の図である。
【図9】分化誘導された網膜を構成する視細胞の図である。
【図10】分化誘導させた細胞のホールセル・パッチクランプ法による電気生理学的機能評価を示す図である。
【図11】網膜視細胞に障害を持つrdマウスの網膜に分離細胞を移植する前(a)と移植40日後(b)の網膜電位を示す図である。
【図12】移植細胞が様々な網膜の細胞層で分化(白色部分)していることを示す図である。
【図13】Human由来の虹彩組織から単離した培養細胞におけるp75+ /Nestin+ 細胞の発現割合を示す図である。
【図14】Human由来の虹彩組織から単離した培養細胞におけるTrk−A+ /Nestin+ 細胞の発現割合を示す図である。
【図15】Human由来の虹彩組織から単離した培養細胞におけるTrk−B+ /Nestin+ 細胞の発現割合を示す図である。
【図16】Human由来の虹彩組織から単離した培養細胞におけるTrk−C+ /Nestin+ 細胞の発現割合を示す図である。
【図17】Human由来の虹彩組織から単離した培養細胞におけるp75+ /Pax6+ 細胞の発現割合を示す図である。
【図18】Human由来の虹彩組織から単離した培養細胞におけるTrk−A+ /Pax6+ 細胞の発現割合を示す図である。
【図19】Human由来の虹彩組織から単離した培養細胞におけるTrk−B+ /Pax6+ 細胞の発現割合を示す図である。
【図20】Human由来の虹彩組織から単離した培養細胞におけるTrk−C+ /Pax6+ 細胞の発現割合を示す図である。
【技術分野】
【0001】
この発明は、哺乳類の生体組織、特に、眼球組織、中でも虹彩組織の細胞を用いて、網膜を構成する細胞の基となる網膜幹細胞を効率的に分離する方法、および、その方法によって取得された網膜神経細胞に分化誘導し得る網膜幹細胞に関するもので、医療に関連する生化学工学技術の分野に属するものである。
【背景技術】
【0002】
脊椎動物、特に哺乳動物の組織において、傷害、疾患、加齢などによる組織や細胞に損傷が起こった場合、様々な作用が働き、組織や細胞の損傷を元の状態へ回復させようとする、いわゆる再生という現象が起こる。
この再生のプロセスにおいて、当該組織に存在する幹細胞が大きな役割を担っている。これら幹細胞は、必要に応じて様々な細胞や組織(臓器)に分化する多能性を有しているため、多能性組織幹細胞(以後、幹細胞と云う。)と呼ばれ、何らかの原因で損傷を受けた組織(臓器)にこの幹細胞を補うことで、組織(臓器)の回復・再生をさせることができるものである。
この幹細胞を用いた新しい医療技術を応用した再生医療は、今まで治療が不可能であった疾患に対する新しい治療法として期待されている。
【0003】
哺乳動物において、幹細胞の研究は、骨髄を始めとして様々な研究が進んでいる。
例えば、骨髄には、造血幹細胞と呼ばれる幹細胞が存在する。この幹細胞は、赤血球、顆粒球やリンパ球などの白血球、血小板など様々な機能の異なる細胞へ分化することが可能なものである。
一方、骨髄には、造血幹細胞とは別に骨髄間質細胞と呼ばれる非造血細胞(骨細胞、軟骨細胞、脂肪細胞など)へ分化することができる幹細胞も存在することが分かっている(非特許文献1)。
【0004】
また、近年の研究成果では、骨髄以外の様々な臓器や組織に、幹細胞が存在することが明らかにされている(非特許文献2,3,4,5)。
【0005】
このように、現在までに、様々な臓器や組織に存在する幹細胞を材料として、種々の細胞へ分化させる研究がなされ、網膜神経細胞へ分化させる研究も行われているが、神経系細胞、特に網膜神経細胞へ分化させ、かつ生理学的に機能する細胞を作成することは困難であった。
すなわち、第一に、網膜幹細胞を同定、分離するための細胞膜表面に発現している特異的なタンパク質が発見されていない。さらに、生理学的に機能する神経系細胞や網膜神経細胞へ分化誘導できる細胞は、限られた組織由来の細胞でないと難しいという問題が存在しているため、網膜細胞へ分化誘導するために細胞にウイルスベクターを用いて遺伝子を導入した報告や、非自己の細胞であるES細胞を用いるという研究報告はある。
しかしながら、これらは感染の問題、倫理上の問題が残され、実際の臨床応用には多くの問題点が残され、有効なものとは云えないものである。
【0006】
一方、上記目的のためには、必要とする幹細胞のみを選択的かつ効率的に分離する技術も必須の技術となる。
近年の報告によると、種々の組織に存在する幹細胞には、組織特異的なタンパクが合成されていることを明らかにし、このマーカータンパク質と云われている、細胞の膜表面に発現している組織特異的なタンパク質を利用することで幹細胞を同定、分離する技術が研究されている。
【0007】
既に報告されているマーカータンパク質として、骨髄には、「AC133」というマーカータンパク質をもつ細胞が存在している(非特許文献11)。
また、膵臓には、「c-Met」「c-Kit」「CD45」および「TER119」と云うマーカータンパク質を発現している細胞が存在し、このマーカータンパク質を利用した選択的細胞分離法に関する特許も公開されている(特許文献1)。
さらに、肝臓には、「Ttm2A」というマーカータンパク質が存在し、さらに、この「Ttm2A」をコードする「mRNA」を利用することで幹細胞の分離法についての発明も開示されている(特許文献2)。
【0008】
このように、様々な組織(臓器)によって、幹細胞のマーカータンパク質は異なっているため、全ての組織においての、組織特異的な幹細胞のマーカータンパク質の研究が再生医療研究の急務の課題となっている。
【0009】
さらに、最近の研究おいては、様々な組織の幹細胞から神経系細胞へ分化誘導する研究は種々報告されている。しかしながら、それらの方法では、神経系細胞への分化誘導できる成功率は非常に悪く、さらに、神経細胞に特異的なマーカータンパク質を発現する細胞は作成できるが、生理学(電気生理学)的に機能する細胞の作成までは殆どできていないのが現状である。
【非特許文献1】Pittenger M.F.,et al.,Science,1999,284,143−147
【非特許文献2】Goodell M.F.,et al.,Nat. Med.,1997,3,1337−1345
【非特許文献3】Zulewski H.,et al.,Diabetes,2001,50,521−533
【非特許文献4】Suzuki A.,et al.,Hepatology,2000,32,1230−1239
【非特許文献5】Zuk P.A.,et al.,Tissue Engineering,2001,7,211−228
【非特許文献6】Abe T.,et al.,日眼会誌,2002,106,778−803
【非特許文献7】Kurimoto Y.,et al.,Neuroscience letter,2001,306,57−60
【非特許文献8】Tropepe V.,et al.,Science,2000,287,2032−2036
【非特許文献9】Haruta M.,et al.,Nature Neuroscience,2001,4,1163−1164
【非特許文献10】Ikeda H.,et al.,Proceedings of the National Academy of Sciences of the United States of America,2005,102,11331−11336
【非特許文献11】Reyes M.,et al.,J.Clin.Invest.,2002,109,337−346
【特許文献1】WO2002/088335号
【特許文献2】特開2004−187679号
【発明の開示】
【発明が解決しようとする課題】
【0010】
この発明はかかる現状を鑑みた上で、上記のような従来技術における問題点を解決し、哺乳動物の生体組織、特に眼球組織から、網膜幹細胞を効率よく同定し、分離、培養および分化誘導できる方法を提供することである。
【0011】
すなわち、本発明者らはこのような背景から鋭意研究を行った結果、神経の生存や神経軸索の再生促進、神経系の発生や発達に関与する、ニュ−ロトロフィンと呼ばれる神経栄養因子(神経成長因子)のレセプターである「Low−affinity Nerve growth factor receptor p75(NGFRp75;以降、p75と記す。)」が、眼球組織に存在し、将来網膜幹細胞へ分化誘導できる幹細胞において発現していることを見出し、さらに、このp75をマーカータンパク質として用いることにより、網膜幹細胞を同定、分離することができ、しかも、その方法によれば、網膜幹細胞を効率的に回収することができることを見出し、従来技術が有する問題の存在しない網膜幹細胞の分離方法を確立したのである。
【0012】
また、発明者等はp75に加えて、神経栄養因子に分類される、すなわち、ニュ−ロトロフィンファミリーと呼ばれている、NGF、BDNF、NT−3、NT−4/5のレセプターであるTrk(TrkA+、TrkB+およびTrkC+)から選択されるマーカータンパク質を1種類以上組み合わせることで、より効率的に網膜幹細胞の同定、分離の効率を飛躍的に高められることを見出したのである。
【0013】
さらに、発明者等は、特定の培地を用いることにより、網膜幹細胞の分離前の生体組織、特に眼球組織の培養、分離後の培養、その際の網膜細胞への分化誘導効率培養および各種の網膜細胞への分化誘導効率を飛躍的に高められることをも見出して、この発明を完成したのである。
【課題を解決するための手段】
【0014】
すなわち、この発明の請求項1に記載の発明は、
細胞表面に発現している神経栄養因子の受容体であるp75+、trkA+、trkB+又はtrkC+をマーカーとして、哺乳動物の生体組織から網膜幹細胞を分離すること
を特徴とする網膜幹細胞の分離方法である。
【0015】
また、この発明の請求項2に記載の発明は、
請求項1に記載の網膜幹細胞の分離方法において、
前記分離が、
p75+、trkA+、trkB+又はtrkC+に対する抗体を用いて行われること
を特徴とするものである。
【0016】
また、この発明の請求項3に記載の発明は、
請求項1に記載の網膜幹細胞の分離方法において、
前記分離が、
p75+に対する抗体と、trkA+又はtrkB+もしくはtrkC+に対する抗体の1種以上とを組み合わせて用いて行われること
を特徴とするものである。
【0017】
また、この発明の請求項4に記載の発明は、
請求項1に記載の網膜幹細胞の分離方法において、
前記生体組織が、
血清または血清代替物質を加えた培地で培養した細胞であること
を特徴とするものである。
【0018】
また、この発明の請求項5に記載の発明は、
請求項1又は4に記載の網膜幹細胞の分離方法において、
前記生体組織が、
眼球組織由来の細胞であること
を特徴とするものである。
【0019】
また、この発明の請求項6に記載の発明は、
請求項1又は4に記載の網膜幹細胞の分離方法において、
前記生体組織が、
眼球の虹彩組織由来の細胞であること
を特徴とするものである。
【0020】
さらに、この発明の請求項7に記載の発明は、
哺乳動物の生体組織から分離された細胞で、かつ、種々の細胞への分化誘導が可能な多能性細胞であること
を特徴とする網膜幹細胞である。
【0021】
また、この発明の請求項8に記載の発明は、
請求項7に記載の網膜幹細胞において、
前記細胞が、
眼球組織由来の細胞であること
を特徴とするものである。
【0022】
また、この発明の請求項9に記載の発明は、
請求項7に記載の網膜幹細胞において、
前記細胞が、
眼球の虹彩組織由来の細胞であること
を特徴とするものである。
【0023】
また、この発明の請求項10に記載の発明は、
請求項7記載の網膜幹細胞において、
前記分化誘導が、
血清または血清代替物質と成長因子を加えた培地で培養することにより行われるものであること
を特徴とするものである。
【0024】
また、この発明の請求項11に記載の発明は、
請求項7記載の網膜幹細胞において、
前記分離が、
請求項1〜6に記載のいずれかの方法で行なわれたものであること
を特徴とするものである。
【発明の効果】
【0025】
この発明により、今まで困難であった哺乳動物の眼球組織に存在する網膜幹細胞を効率的に同定することが可能となった。さらに、従来の技術と比べて、高純度でより優れた網膜幹細胞を分離、回収することを可能とした。
また、この発明は、眼科再生医療の分野において、現在まで治療が困難であった疾患に対し、自己の細胞を用いた新しい治療法として応用できる可能性が非常に高いことから、社会に対して大きく貢献することができるものである。
【発明を実施するための最良の形態】
【0026】
以下、この発明にかかる網膜幹細胞の分離法等を、具体的かつ詳細な実施例に基づいて、詳細に説明するが、この発明はこれら実施例に何ら限定されるものではない。
【実施例】
【0027】
<成体マウス虹彩組織からの細胞採取>
DBA2/Crマウス(雄、4週齢)を安楽死させたのち、眼球を摘出した。
摘出した眼球をアルコールにて短時間消毒したのち、実体顕微鏡下にて眼球赤道部付近からマイクロスプリング尖刀を用いて切開し、虹彩組織のみを摘出した。
摘出した虹彩組織を酵素処理して個々の細胞に分散させたのち、Dulbecco’s
Modified Eagle MediumとF−12培地の1:1混合培養液(以降、基礎培地)を用いて洗浄した。
【0028】
<フローサイトメトリー(FACS)による細胞の単離解析>
神経幹細胞マーカーのNestin+ は、細胞質内タンパク質で、生きた細胞の状態ではFACSによる解析が不可能である。
そのため、細胞質内タンパク質の発現を解析するために、細胞を固定して細胞膜に穴を開けて、抗体が入るように固定する手段を採用し、神経幹細胞マーカーであるNestin+ 細胞が今回発見したマーカーを発現しているかを、以下のようにして調査した。
【0029】
各組織から調製した細胞を、1%パラフォルムアルデヒド固定液で15分固定した後、リン酸緩衝液(PBS)で洗浄した。
5%ウシ血清(FBS)と、細胞膜に穴を開けるための酵素であるサポニンを添加したハンクス液(Hank’s balanced salt solution)中で、抗p75ポリクローナル抗体(CHEMICON製)、抗Trk−A抗体(Santa Cruz Biotech製)、抗Trk−B抗体(Santa Cruz Biotech製)、抗Trk−C抗体(Santa Cruz Biotech製)、および抗Nestin抗体(Santa Cruz Biotech製)と30分間氷中で反応させた。
反応後、5%FBS、およびサポニンを添加したハンクス液にて3回洗浄し、続いてAlexa Fluor 488(インビトロジェン株式会社製)、又はPE−Cy5で標識した抗IgGモノクローナル抗体(Santa Cruz Biotech製)と30分間氷中にて反応させた。
最後に、5%FBSを含むハンクス液にて3回洗浄し、5%FBS添加ハンクス液中に細胞を懸濁した。
これら蛍光標識した細胞をセルソーターのFACS Vantage SE(ベックトン・ディッキンソン株式会社製)にて解析した。
ゲートの設定は、ネガティブコントロールを指標にした。
まず、前方散乱光(Foward Scatter)、側方散乱光(Side Scatter)により、残存する赤血球、細胞の残骸、細胞の凝集魂を除いた部分にゲート(R1)をかけた。
ついで、ゲート(R1)内のp75+ 、Trk−A+ 、Trk−B+ 、Trk−C+ 、およびNestin+細胞を解析した。
つぎに、染色の組み合わせによりNestin+ に加えてp75+ (以下、Nestin+ /p75+ と記す。)、同様にNestin+ /Trk−A+ 、Nestin+ /Trk−B+ 、およびNestin+ /Trk−C+ の組み合わせで細胞にゲート(R2)を設定し、それぞれのマーカータンパク質を合成している細胞を解析した。
【0030】
セルソーターにより、それぞれのマーカータンパク質、あるいはNestinとの共発現をしている細胞についての解析を行った。
【0031】
ゲート(R1)内のp75+ 、Trk−A+ 、Trk−B+ 、Trk−C+ 、およびNestin+ 細胞の発現割合を解析したところ、p75+ 細胞は全体の22.38%、Trk−A+ 細胞は全体の25.01%、Trk−B+ 細胞は全体の23.69%、Trk−C+ 細胞は全体の22.45%、およびNestin+ 細胞は全体の22.26%に発現していることが分かった。
【0032】
つぎに、Nestin+ /p75+ 、Nestin+ /Trk−A+ 、Nestin+/Trk−B+ 、およびNestin+ /Trk−C+ の発現割合を解析したところ、
Nestin+ /p75+ 細胞は全体の16.7%、
Nestin+ /Trk−A+ 細胞は全体の16.6%、
Nestin+ /Trk−B+ 細胞は全体の18.5%、および
Nestin+ /Trk−C+ 細胞は全体の15.5%
に発現していることが分かった。
この結果をさらに詳細に分析すると、Nestin+ の細胞は全てp75+細胞、Trk−A+ 細胞、Trk−B+ 細胞、あるいはTrk−C+ 細胞の分画に含まれていることが分かった。
【0033】
従来の方法では、神経幹細胞のみを生きた状態の細胞で分離することはできなかった。それは、神経幹細胞(神経前駆細胞)のマーカーであるNestinは細胞質内タンパク質であるため、生きた細胞の状態でセルソーターを用いて分離することが不可能であること、および効率的な神経幹細胞(神経前駆細胞)を分離することができる細胞膜タンパク質が分かっていなかったためである。
しかしながら、上記の結果から、神経幹細胞の表面に発現していることを見出したp75、Trk−A、Trk−B、あるいはTrk−Cを用いることで、初めて細胞膜タンパク質を用いて、神経幹細胞を、生きた細胞の状態で効率的にセルソーターを用いて分離することが以下の様に可能となった。
【0034】
<生きた状態の虹彩由来組織幹細胞の分離と解析>
上記結果から明らかなように、Nestin+ 細胞は、p75+ 細胞、Trk−A+ 細胞、Trk−B+ 細胞、あるいはTrk−C+ 細胞であることが分かった。
そこで、上記と同様の方法で成体マウス虹彩組織からの細胞を採取し、固定しないで、生きた状態のままの細胞を、p75、Trk−A、Trk−B、およびTrk−Cの抗体でそれぞれ標識して、セルソーターによる細胞分取を行った。
分取したp75+ 細胞、Trk−A+ 細胞、Trk−B+ 細胞、およびTrk−C+ 細胞を血清含有基礎培地で培養した。
なお、セルソーターによるソーティングを行う前の、様々な虹彩由来細胞が混在している状態の細胞を未処理細胞とした。
【0035】
p75+ 細胞、Trk−A+ 細胞、Trk−B+ 細胞、およびTrk−C+ 細胞と、未処理細胞を網膜細胞へ分化誘導するにあたって、まず、それぞれのマーカータンパク陽性の細胞を分取した後に接着培養させた細胞において、神経幹細胞(神経前駆細胞)のマーカーを発現する細胞の発現割合の確認評価を行った。
ついで、それぞれのマーカーでソーティングした細胞および未処理細胞を、血清含有基礎培地で3日間培養した後、神経幹細胞(神経前駆細胞)マーカーのNestin+ 細胞の割合についてフローサイトメトリー(FACS)を用いて測定した。
【0036】
FACSによるNestin+ 細胞の割合を測定したところ、
p75でソーティングした細胞では、Nestin+ 細胞は全体の95.4%、
Trk−Aでソーティングした細胞では、Nestin+ 細胞は全体の92.9%、
Trk−Bでソーティングした細胞では、Nestin+ 細胞は全体の90.3%、
Trk−Cでソーティングした細胞では、Nestin+ 細胞は全体の85.7%
に存在した。
一方、未処理細胞では4.3%であった。
【0037】
<虹彩由来組織幹細胞の状態を維持したまま増殖させた細胞の解析>
上記に記載した方法と同様にして、成体DBA2/Crマウスの虹彩組織から細胞を採取した。
つぎに、虹彩組織中に含まれる組織幹細胞の状態を維持させたまま増殖させるために、血清代替物質(ESGRO(CHEMICON)またはSynQ(Cell Culture Service))を加えた低血清の基礎培地に細胞を播種し、10日間培養した。
【0038】
10日間培養した細胞を酵素処理し、培養ディッシュから剥がし、個々の細胞に単離させた後、上記方法と同様に細胞を固定し、培養した細胞におけるp75、Trk−A、Trk−BおよびTrk−Cの発現量について、実施例1と同様に抗体を用いて細胞を標識し、フローサイトメトリー(FACS)を用いて測定した。
【0039】
Nestin+ /p75+ 、Nestin+ /Trk−A+ 、Nestin+ /Trk−B+ 、およびNestin+ /Trk−C+の発現割合を解析したところ、
Nestin+ /p75+ 細胞は、全体の99.5%(図1)、
Nestin+ /Trk−A+ 細胞は、全体の97.6%(図2)、
Nestin+ /Trk−B+ 細胞は、全体の97.7%(図3)、および
Nestin+ /Trk−C+ 細胞は、全体の95.0%(図4)
に発現していることが分かった。
この結果から、虹彩由来細胞は本培養条件などで培養することによって、Nestin+ /p75+ 、Nestin+ /Trk−A+ 、Nestin+ /Trk−B+ 、およびNestin+ /Trk−C+ の発現割合を増加させることに成功した。
また、結果を詳細に分析すると、Nestin+ の細胞は全て、p75+ 、Trk−A+ 、Trk−B+ 、あるいはTrk−C+ であることが分かったため、これらの細胞表面マーカータンパクを用いて、細胞をソーティングすることで、Nestin+ の細胞を分取することができることが証明された。
【0040】
<虹彩組織由来Nestin+細胞の網膜細胞への分化誘導>
上記の方法に従って、虹彩由来細胞を培養した細胞を生きた状態のままで、p75、Trk−A、Trk−B、およびTrk−Cの抗体を用いて細胞を標識し、その陽性細胞をセルソーターでソーティングして、細胞を回収した。
回収した細胞は、上記実施例で明らかなようにNestin+ 細胞である。
網膜は、神経細胞の集まりであるため、このNestin+ 細胞は神経幹細胞(神経前駆細胞)であり、網膜幹細胞であるとも云える。
【0041】
回収した細胞を、神経細胞成長因子、およびTGF−β superfamilyや神経細胞成長因子などの成長因子を含む低血清分化誘導培地で培養し、網膜を構成する様々な細胞への分化誘導効率を評価した。
評価には、神経節細胞、ミューラーグリア細胞、水平細胞、双極細胞、視細胞の各細胞特異的マーカーを用いた。
なお、対象には、ソーティングしていない未処理細胞を用いた。
【0042】
分化誘導培地で14日間、培養した細胞を様々な網膜を構成する細胞に、特異的なタンパク質の抗体を用いて染色した。
免疫細胞染色に使用した抗体は、
神経節細胞のマーカータンパク質である、Brn−3bに対する抗体(Santa Cruz Biotech製)、
ミューラーグリア細胞のマーカータンパク質である、CRALBPに対する抗体(Abcam製)、
水平細胞のマーカータンパク質である、Calbindinに対する抗体(CHEMICON製)、
双極細胞のマーカータンパク質である、PKCに対する抗体(Sigma製)、
視細胞のマーカータンパク質である、Recoverinに対する抗体(CHEMICON製)
である。
【0043】
p75、Trk−A、Trk−B、およびTrk−Cによってソーティングした細胞では、いずれも網膜を構成する神経節細胞(図5)、ミューラーグリア細胞(図6)、水平細胞(図7)、双極細胞(図8)、および視細胞(図9)に分化誘導することができた。
一方、未処理細胞では、網膜の細胞へ分化させることはできなかった。
【0044】
<分化誘導した細胞の電気生理学的機能評価>
上記の方法で取得した、網膜細胞への分化誘導をした細胞について、神経の細胞として機能する細胞かどうかを、電気生理学的に評価した。
評価法としては、細胞の電気生理学的実験で一般的に用いられているホールセル・パッチクランプ法を実施した。
【0045】
網膜細胞に分化誘導させた、個々の細胞レベルにおける電気生理学的な機能評価を実施したところ、神経細胞に比較的特異的に観察される内向き電流(Naチャネル)が観察された(図10)。
【0046】
遺伝子組み換えを行い、マウスの体の、全ての細胞において、GFP(Green Fluorescent Protein:GFP)の蛍光を発するマウスを用いて、上記記載の方法で回収したp75+ 細胞、Trk−A+ 細胞、Trk−B+ 細胞、およびTrk−C+ 細胞を遺伝的に網膜視細胞に障害を持つrdマウスの網膜に移植し、移植前と移植40日後のマウス網膜電位(ERG)を測定した。
【0047】
移植する前のrdマウスの網膜電位は、A波も減衰していたが、特に、B波の振幅が小さい状態であった(図11−a)。
移植40日後のrdマウスの網膜電位は、特にB波の振幅が大きくなっており、網膜電位の回復が観察された(図11−b)。
【0048】
さらに、移植した網膜組織の切片標本を作成し、上記記載の網膜を構成する細胞に特異的なタンパク質の抗体を用いて染色したところ、移植した細胞(GFP:Greeen Fluorescence Proteinの蛍光を発する細胞)が様々な網膜の細胞層で分化し、種々の網膜細胞に分化していた(図12)。
【0049】
<ヒト虹彩組織細胞>
倫理委員会での承認を得た後、手術の過程で虹彩組織の一部を切除、破棄する疾患に罹患している方で、実験・研究の同意を得られた方から、通常破棄される虹彩組織を回収した。
得られたHuman由来の虹彩組織細胞を、未分化な状態を保ったままの状態で増殖させることのできる特殊な培養条件(自己血清、人工血清代替物質、Wnt経路のアンタゴニスト、b−FGFを含む基礎培地)で培養した。
培養したヒト虹彩由来細胞を、実施例3と同様にp75、Trk−A、Trk−B、Trk−Cのぞれぞれと、神経前駆細胞マーカーのNestin、および網膜神経細胞のマスター遺伝子であるPax6との共発現について調査した。
【0050】
培養した細胞を、FACSで解析したところ、
p75+ /Nestin+ 細胞の割合は、99.3%(図13)、
Trk−A+ /Nestin+ 細胞の割合は、95.1%(図14)、
Trk−B+ /Nestin+ 細胞の割合は、92.2%(図15)、
Trk−C+ /Nestin+ 細胞の割合は、90.2%(図16)
であった。
同様に、p75+ /Pax6+ 細胞の割合は、94.3%(図17)、
Trk−A+ /Pax6+ 細胞の割合は、93.9%(図18)、
Trk−B+ /Pax6+ 細胞の割合は、89.5%(図19)、
Trk−C+ /Pax6+ 細胞の割合は、80.2%(図20)
であった。
【0051】
これらの結果をから詳細に検証すると、例えば、
p75+ /Nestin+ 細胞の割合は99.3%であったが、
p75− /Nestin+ 細胞は0%で、
p75+ /Nestin− 細胞は0.67%
であったことから、ヒト虹彩由来細胞においても、p75+ 細胞は、Nestin+ 細胞であることが確認された。
【産業上の利用可能性】
【0052】
この発明の活用例として、臨床応用の可能性が非常に高い再生医療への応用が期待できる。
すなわち、この発明の新しい細胞表面マーカーを用いることにより、従来不可能であったセルソーターを用いた神経前駆細胞のみを、生きたままの状態で分離することができるようになった。
さらに、新しい細胞表面マーカーで分離した神経前駆細胞マーカー陽性の細胞を、シャーレの中で網膜細胞へ分化誘導できる培養条件で培養すると、網膜を構成する様々な細胞へ分化誘導できること、網膜神経細胞へ分化誘導した細胞は電気生理学的に機能する細胞であること、分離した神経前駆細胞マーカー陽性の細胞を網膜に障害のあるマウスに移植すると、必要な網膜細胞に分化し、神経ネットワークを構築できるため、電気生理学的な機能評価も回復することがわかった。
これらのマウスの実験結果と同様の結果が、ヒト虹彩由来細胞でもシャーレの中の実験では再現できることがわかった。
したがって、今まで治療方法がなかった網膜疾患に対して、実際に臨床応用ができる可能性が非常に高い新しい治療法への応用が期待できる。
【図面の簡単な説明】
【0053】
【図1】単離した培養細胞におけるNestin+ /p75+ 細胞の発現割合を示す図である。
【図2】単離した培養細胞におけるNestin+ /Trk−A+ 細胞の発現割合を示す図である。
【図3】単離した培養細胞におけるNestin+ /Trk−B+ 細胞の発現割合を示す図である。
【図4】単離した培養細胞におけるNestin+ /Trk−C+ 細胞の発現割合を示す図である。
【図5】分化誘導された網膜を構成する神経節細胞の図である。
【図6】分化誘導された網膜を構成するミューラーグリア細胞の図である。
【図7】分化誘導された網膜を構成する水平細胞の図である。
【図8】分化誘導された網膜を構成する双極細胞の図である。
【図9】分化誘導された網膜を構成する視細胞の図である。
【図10】分化誘導させた細胞のホールセル・パッチクランプ法による電気生理学的機能評価を示す図である。
【図11】網膜視細胞に障害を持つrdマウスの網膜に分離細胞を移植する前(a)と移植40日後(b)の網膜電位を示す図である。
【図12】移植細胞が様々な網膜の細胞層で分化(白色部分)していることを示す図である。
【図13】Human由来の虹彩組織から単離した培養細胞におけるp75+ /Nestin+ 細胞の発現割合を示す図である。
【図14】Human由来の虹彩組織から単離した培養細胞におけるTrk−A+ /Nestin+ 細胞の発現割合を示す図である。
【図15】Human由来の虹彩組織から単離した培養細胞におけるTrk−B+ /Nestin+ 細胞の発現割合を示す図である。
【図16】Human由来の虹彩組織から単離した培養細胞におけるTrk−C+ /Nestin+ 細胞の発現割合を示す図である。
【図17】Human由来の虹彩組織から単離した培養細胞におけるp75+ /Pax6+ 細胞の発現割合を示す図である。
【図18】Human由来の虹彩組織から単離した培養細胞におけるTrk−A+ /Pax6+ 細胞の発現割合を示す図である。
【図19】Human由来の虹彩組織から単離した培養細胞におけるTrk−B+ /Pax6+ 細胞の発現割合を示す図である。
【図20】Human由来の虹彩組織から単離した培養細胞におけるTrk−C+ /Pax6+ 細胞の発現割合を示す図である。
【特許請求の範囲】
【請求項1】
細胞表面に発現している神経栄養因子の受容体であるp75+、trkA+、trkB+又はtrkC+をマーカーとして、哺乳動物の生体組織から網膜幹細胞を分離すること
を特徴とする網膜幹細胞の分離方法。
【請求項2】
前記分離が、
p75+、trkA+、trkB+又はtrkC+に対する抗体を用いて行われること
を特徴とする請求項1に記載の網膜幹細胞の分離方法。
【請求項3】
前記分離が、
p75+に対する抗体と、trkA+又はtrkB+もしくはtrkC+に対する抗体の1種以上とを組み合わせて用いて行われること
を特徴とする請求項1に記載の網膜幹細胞の分離方法。
【請求項4】
前記生体組織が、
血清または血清代替物質を加えた培地で培養した細胞であること
を特徴とする請求項1に記載の網膜幹細胞の分離方法。
【請求項5】
前記生体組織が、
眼球組織由来の細胞であること
を特徴とする請求項1又は4に記載の網膜幹細胞の分離方法。
【請求項6】
前記生体組織が、
眼球の虹彩組織由来の細胞であること
を特徴とする請求項1又は4に記載の網膜幹細胞の分離方法。
【請求項7】
哺乳動物の生体組織から分離された細胞で、かつ、種々の細胞への分化誘導が可能な多能性細胞であること
を特徴とする網膜幹細胞。
【請求項8】
前記細胞が、
眼球組織由来の細胞であること
を特徴とする請求項7に記載の網膜幹細胞。
【請求項9】
前記細胞が、
眼球の虹彩組織由来の細胞であること
を特徴とする請求項7に記載の網膜幹細胞。
【請求項10】
前記分化誘導が、
血清または血清代替物質と成長因子を加えた培地で培養することにより行われるものであること
を特徴とする請求項7に記載の網膜幹細胞。
【請求項11】
前記分離が、
請求項1〜6に記載のいずれかの方法で行なわれたものであること
を特徴とする請求項7に記載の網膜幹細胞。
【請求項1】
細胞表面に発現している神経栄養因子の受容体であるp75+、trkA+、trkB+又はtrkC+をマーカーとして、哺乳動物の生体組織から網膜幹細胞を分離すること
を特徴とする網膜幹細胞の分離方法。
【請求項2】
前記分離が、
p75+、trkA+、trkB+又はtrkC+に対する抗体を用いて行われること
を特徴とする請求項1に記載の網膜幹細胞の分離方法。
【請求項3】
前記分離が、
p75+に対する抗体と、trkA+又はtrkB+もしくはtrkC+に対する抗体の1種以上とを組み合わせて用いて行われること
を特徴とする請求項1に記載の網膜幹細胞の分離方法。
【請求項4】
前記生体組織が、
血清または血清代替物質を加えた培地で培養した細胞であること
を特徴とする請求項1に記載の網膜幹細胞の分離方法。
【請求項5】
前記生体組織が、
眼球組織由来の細胞であること
を特徴とする請求項1又は4に記載の網膜幹細胞の分離方法。
【請求項6】
前記生体組織が、
眼球の虹彩組織由来の細胞であること
を特徴とする請求項1又は4に記載の網膜幹細胞の分離方法。
【請求項7】
哺乳動物の生体組織から分離された細胞で、かつ、種々の細胞への分化誘導が可能な多能性細胞であること
を特徴とする網膜幹細胞。
【請求項8】
前記細胞が、
眼球組織由来の細胞であること
を特徴とする請求項7に記載の網膜幹細胞。
【請求項9】
前記細胞が、
眼球の虹彩組織由来の細胞であること
を特徴とする請求項7に記載の網膜幹細胞。
【請求項10】
前記分化誘導が、
血清または血清代替物質と成長因子を加えた培地で培養することにより行われるものであること
を特徴とする請求項7に記載の網膜幹細胞。
【請求項11】
前記分離が、
請求項1〜6に記載のいずれかの方法で行なわれたものであること
を特徴とする請求項7に記載の網膜幹細胞。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【公開番号】特開2008−92891(P2008−92891A)
【公開日】平成20年4月24日(2008.4.24)
【国際特許分類】
【出願番号】特願2006−279917(P2006−279917)
【出願日】平成18年10月13日(2006.10.13)
【出願人】(505084309)有限会社 コーケン (2)
【Fターム(参考)】
【公開日】平成20年4月24日(2008.4.24)
【国際特許分類】
【出願日】平成18年10月13日(2006.10.13)
【出願人】(505084309)有限会社 コーケン (2)
【Fターム(参考)】
[ Back to top ]

