緑内障の治療のための血清アミロイドのRNAi阻害
【課題】SAAのmRNAを標的にし、それによってSAAのmRNAの発現を干渉する干渉RNAの提供。
【解決手段】SAAの発現を伴う緑内障における血清アミロイドA mRNAの発現を阻害するためのRNA干渉が提供される。対象の眼において血清アミロイドA mRNAの発現を弱める方法であって、19〜49ヌクレオチドの長さを有する干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を該対象の眼に投与する工程を包含し;該干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含む方法もまた提供される。
【解決手段】SAAの発現を伴う緑内障における血清アミロイドA mRNAの発現を阻害するためのRNA干渉が提供される。対象の眼において血清アミロイドA mRNAの発現を弱める方法であって、19〜49ヌクレオチドの長さを有する干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を該対象の眼に投与する工程を包含し;該干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含む方法もまた提供される。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の分野)
本発明は、緑内障、特に原発性開放隅角緑内障における血清アミロイドA(SAA)の発現を阻害する干渉RNA組成物の分野に関する。
【背景技術】
【0002】
(発明の背景)
緑内障は、特定の臨床徴候を共有する、視神経障害の混成群である。緑内障における視力の喪失は、視野、神経線維層の欠損、および視神経頭(ONH)の進行性吸角法における特徴的な変化により臨床的に診断される、神経網膜内の網膜神経節細胞の選択的な死が原因となっている。緑内障の発症における主要な危険因子の一つには、高眼圧(眼内圧(IOP)の上昇)の存在がある。適切な眼内圧は、眼の形状を維持し、眼房水を無血管組織の角膜や水晶体に流すことを可能にする圧力勾配をもたらすために必要となる。IOPは又、正常なIOPであると思われがちな症状を対象が有する、正常眼圧緑内障の原因に関与すると思われる。
【0003】
緑内障に関連するIOPの上昇は、前眼房の虹彩角膜角度に位置する小さな特殊組織である、小柱網(TM)内の眼房水の流出耐性の上昇によるものである、。TM細胞の緑内障の変化には、TM細胞の喪失、並びにタンパク質性プラーク様物質を含む細胞外破片の沈着および蓄積が含まれる。さらに、緑内障のONHにおいて発生する変化もある。緑内障の眼においては、ONHグリア細胞における形態および移動度の変化が見られる。IOPの上昇および一過性虚血発作の反応としては、ONH細胞外マトリックスの組成における変化、並びにグリア細胞および網膜神経節細胞の軸索形態の変化が見られる。
【0004】
原発性緑内障は、解剖学的または生理学的基礎をなす眼内の体液の流れに障害をもたらす。続発性緑内障は、眼または既存の疾患に対する障害または外傷の結果として発生する。慢性または単性緑内障としても知られる原発性開放隅角緑内障(POAG)は、全ての原発性緑内障の90%を占める。POAGは、小柱網の変性を特徴とし、眼からの体液の排出に対して異常に高い耐性をもたらす。このような耐性の変化が、IOPの上昇をもたらし、通常眼により生成される体液を上昇した耐性を超えて駆動させることが必要となる。
【0005】
現在の抗緑内障療法には、眼房水形成抑制剤またはブドウ膜強膜流出促進剤の使用によるIOPの低下、レーザー線維柱帯形成術、または排水を向上させるろ過手術である線維柱帯切除術が含まれる。薬学的な抗緑内障手法は、種々の好ましくない副作用を示す。例えば、ピロカルピン等の縮瞳薬は、視野のぼやけやその他のネガティブな視覚的副作用を引き起こす。又、炭酸脱水素抑制剤の全身投与は、吐き気、消化不良、疲労および代謝性アシドーシスを引き起こす。さらに、特定のβ−遮断薬は、肺組織中のβ−2受容体に対する効果に起因する重大な肺の副作用を伴うことが多くなっている。交感神経興奮薬は、頻脈、不整脈および高血圧を引き起こす。このようなネガティブな副作用は、対象の服薬率の低下や治療の終了をもたらす場合がある。
【0006】
さらに重要なことに、現在の抗緑内障療法は、小柱網の病理的損傷、視神経、並びに依然として改善が見られない網膜神経節細胞および軸索の喪失に直接対処するものではない。緑内障の重要度、および以前の治療方法の欠点を鑑みると、緑内障の進行の内在的な原因に対処する緑内障の治療方法の改善が望まれているように思われる。
【発明の概要】
【課題を解決するための手段】
【0007】
(発明の要旨)
本発明は、SAAのmRNAを標的にし、それによってSAAのmRNAの発現を干渉する干渉RNAを対象とする。本発明の干渉RNAは、SAA関連緑内障の治療に有用である。
【0008】
本発明の実施形態は、対象の眼において血清アミロイドA mRNAの発現を減衰させる方法を提供する。この方法は、19〜49ヌクレオチドの長さを有する二本鎖(ds)siRNAまたは一本鎖(ss)siRNAのような干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を対象の眼に投与することを包含する。
【0009】
二本鎖siRNAは、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および少なくともほぼ完全に連続した相補性の少なくとも19ヌクレオチドの領域を含む。さらに、アンチセンス配列は、SAA1、SAA2およびSAA4をそれぞれコード化するDNAのセンス配列である、配列番号1、配列番号2または配列番号3(GenBank受入番号NM_000331、BC020795およびNM_006512)に対応するmRNAの部分に生理学的条件下でハイブリダイズし、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する。このような組成物を投与することによって、対象の眼における血清アミロイドA mRNAの発現を減衰させる。
【0010】
干渉RNAが一本鎖である場合、干渉RNAは、配列番号1、配列番号2または配列番号3に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有するヌクレオチド配列を含む。
【0011】
本発明の一実施形態において、アンチセンスsiRNAは、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている。本発明の別の実施形態において、アンチセンス配列は、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている。本発明の更なる実施形態において、アンチセンス配列は、ヌクレオチド252、271、276、325または343から開始する配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている。本発明の尚更なる実施形態において、アンチセンス配列は、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている。
【0012】
本発明の更なる実施形態は、治療を必要とする対象における血清アミロイドA関連緑内障を治療する方法である。この方法は、19〜49ヌクレオチドの長さを有する干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を患者の眼に投与することを包含し、該干渉RNAは、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含む。アンチセンス配列は、生理学的条件下で、配列番号1、配列番号2または配列番号3に対応するmRNAの部分にハイブリダイズし、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する。それによって、血清アミロイドA関連緑内障が治療される。
例えば、本願発明は以下の項目を提供する。
(項目1)
対象の眼において血清アミロイドA mRNAの発現を弱める方法であって、
19〜49ヌクレオチドの長さを有する干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を該対象の眼に投与する工程を包含し;
該干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含み;
該アンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAの一部分に生理学的条件下でハイブリダイズし、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有し;
それによって、血清アミロイドA mRNAの発現が減衰される、方法。
(項目2)
前記対象が緑内障を有する、項目1に記載の方法。
(項目3)
前記対象が緑内障を発症する危険性がある、項目1に記載の方法。
(項目4)
前記アンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも21〜23ヌクレオチドの領域を有し、前記センス配列および該アンチセンス配列のそれぞれの3’末端に追加のTT配列を含む、項目1に記載の方法。
(項目5)
前記センスヌクレオチド配列および前記アンチセンスヌクレオチド配列が、ループヌクレオチド配列により結合されている、項目1に記載の方法。
(項目6)
前記組成物が局所、硝子体内または経強膜の経路を介して投与される、項目1に記載の方法。
(項目7)
前記アンチセンス配列が、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目1に記載の方法。
(項目8)
前記アンチセンス配列が、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目1に記載の方法。
(項目9)
前記アンチセンス配列が、ヌクレオチド252、271、276、325、343から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目1に記載の方法。
(項目10)
前記アンチセンス配列が、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目1に記載の方法。
(項目11)
前記アンチセンス配列が、
【化1】

を含む、項目1に記載の方法。
(項目12)
前記干渉RNAが、塩基部分、糖部分またはリン酸部分に修飾を含む、項目1に記載の方法。
(項目13)
さらに、19〜49ヌクレオチドの長さを有し、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に相補性の少なくとも19ヌクレオチドの領域を含む第二干渉RNAを、前記対象の眼に投与することを含み;
該第二干渉RNAのアンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAの第二部分に生理学的条件下でハイブリダイズし、該アンチセンス配列が、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAの第二のハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、項目1に記載の方法。
(項目14)
前記組成物が、それぞれ19〜49ヌクレオチドの長さを有する少なくとも4種の干渉RNAの混合物の有効量、および薬学的に許容可能な担体を含み、
各干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および4種の該干渉RNAのそれぞれの該センス配列とアンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含み;
該混合物のアンチセンス配列が、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAの一部分に生理学的条件下でハイブリダイズし、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、項目1に記載の方法。
(項目15)
対象の眼において血清アミロイドA mRNAの発現を減衰させる方法であって、
19〜49ヌクレオチドの長さを有する干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を該対象の眼に投与することを含み、
該干渉RNAが、配列番号1、配列番号2または配列番号3に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有するヌクレオチド配列を含み、
それによって、血清アミロイドA mRNAの発現が減衰される、方法。
(項目16)
前記組成物が局所、硝子体内または経強膜の経路を介して投与される、項目15に記載の方法。
(項目17)
前記干渉RNAが、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目15に記載の方法。
(項目18)
前記干渉RNAが、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目15に記載の方法。
(項目19)
前記干渉RNAが、ヌクレオチド252、271、276、325、343から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目15に記載の方法。
(項目20)
前記干渉RNAが、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目15に記載の方法。
(項目21)
さらに、19〜49ヌクレオチドの長さを有し、配列番号1、配列番号2または配列番号3に対応するmRNAの第二のハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する第二のヌクレオチド配列を含む第二の干渉RNAを、前記対象の眼に投与することを含む、項目15に記載の方法。
(項目22)
前記組成物が、それぞれ19〜49ヌクレオチドの長さを有する少なくとも4種の干渉RNAの混合物の有効量を含み、
該混合物が、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する第一、第二、第三および第四のヌクレオチド配列を含む、項目15に記載の方法。
(項目23)
治療を必要とする対象において血清アミロイドA関連緑内障を治療する方法であって、
19〜49ヌクレオチドの長さを有する干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を該対象の眼に投与することを含み、
該干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含み;
該アンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAの一部分に生理学的条件下でハイブリダイズし、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有し;
それによって、血清アミロイドA関連緑内障が治療される、方法。
(項目24)
前記組成物が局所、硝子体内または経強膜の経路を介して投与される、項目23に記載の方法。
(項目25)
前記干渉RNAが、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目23に記載の方法。
(項目26)
前記干渉RNAが、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目23に記載の方法。
(項目27)
前記干渉RNAが、ヌクレオチド252、271、276、325、343から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目23に記載の方法。
(項目28)
前記干渉RNAが、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目23に記載の方法。
(項目29)
さらに、19〜49ヌクレオチドの長さを有し、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含む第二干渉RNAを、前記対象の眼に投与することを含み;
該第二干渉RNAのアンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAの第二部分に生理学的条件下でハイブリダイズし、該アンチセンス配列が、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAの第二のハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、項目23に記載の方法。
(項目30)
前記組成物が、それぞれ19〜49ヌクレオチドの長さを有する少なくとも4種の干渉RNAの混合物の有効量、および薬学的に許容可能な担体を含み、
各干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および4種の該干渉RNAのそれぞれの該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含み;
該混合物のアンチセンス配列が、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAの部分に生理学的条件下でハイブリダイズし、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、項目23に記載の方法。
(項目31)
治療を必要とする対象において血清アミロイドA関連緑内障を治療する方法であって、
19〜49ヌクレオチドの長さを有する干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を該対象の眼に投与することを含み、
該干渉RNAが、配列番号1、配列番号2または配列番号3に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有するヌクレオチド配列を含み、
それによって、血清アミロイドA mRNAの発現が減衰される、方法。
(項目32)
前記組成物が局所、硝子体内または経強膜の経路を介して投与される、項目31に記載の方法。
(項目33)
前記干渉RNAが、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目31に記載の方法。
(項目34)
前記干渉RNAが、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目31に記載の方法。
(項目35)
前記干渉RNAが、ヌクレオチド252、271、276、325、343から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目31に記載の方法。
(項目36)
前記干渉RNAが、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目31に記載の方法。
(項目37)
さらに、19〜49ヌクレオチドの長さを有し、配列番号1、配列番号2または配列番号3に対応するmRNAの第二のハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する第二のヌクレオチド配列を含む第二の干渉RNAを、前記対象の眼に投与することを含む、項目31に記載の方法。
(項目38)
前記組成物が、それぞれ19〜49ヌクレオチドの長さを有する少なくとも4種の干渉RNAの混合物の有効量を含み、
該混合物が、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する第一、第二、第三および第四のヌクレオチド配列を含む、項目31に記載の方法。
(項目39)
対象の眼において血清アミロイドA mRNAの発現を減衰させるための医薬品の製造における、組成物の使用であって、
該組成物が、19〜49ヌクレオチドの長さを有する干渉RNAの有効量、および薬学的に許容可能な担体を含み、
該干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含み、
該アンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAの一部分に生理学的条件下でハイブリダイズし、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、使用。
(項目40)
前記アンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも21〜23ヌクレオチドの領域を有し、前記センス配列および該アンチセンス配列のそれぞれの3’末端に追加のTT配列を含む、項目39に記載の使用。
(項目41)
前記センスヌクレオチド配列および前記アンチセンスヌクレオチド配列が、ループヌクレオチド配列により結合されている、項目39に記載の使用。
(項目42)
前記組成物が、局所、硝子体内または経強膜の経路を介した投与のために調製されている、項目39に記載の使用。
(項目43)
前記アンチセンス配列が、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目39に記載の使用。
(項目44)
前記アンチセンス配列が、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目39に記載の使用。
(項目45)
前記アンチセンス配列が、ヌクレオチド252、271、276、325、343から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目39に記載の使用。
(項目46)
前記アンチセンス配列が、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目39に記載の使用。
(項目47)
前記アンチセンス配列が、
【化2】

を含む、項目39に記載の使用。
(項目48)
前記干渉RNAが、塩基部分、糖部分またはリン酸部分に修飾を含む、項目39に記載の使用。
(項目49)
前記組成物が、さらに、19〜49ヌクレオチドの長さを有し、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に相補性の少なくとも19ヌクレオチドの領域を含む第二干渉RNAを含み;
該第二干渉RNAのアンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAの第二部分に生理学的条件下でハイブリダイズし、該アンチセンス配列が、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAの第二のハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、項目39に記載の使用。
(項目50)
前記組成物が、それぞれ19〜49ヌクレオチドの長さを有する少なくとも4種の干渉RNAの混合物の有効量、および薬学的に許容可能な担体を含み、
各干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および4種の該干渉RNAのそれぞれの該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含み;
該混合物のアンチセンス配列が、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAの一部分に生理学的条件下でハイブリダイズし、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、項目39に記載の方法。
(項目51)
対象の眼において血清アミロイドA mRNAの発現を減衰させるための医薬品の製造における、組成物の使用であって、
該組成物が、19〜49ヌクレオチドの長さを有する干渉RNAの有効量、および薬学的に許容可能な担体を含み、
該干渉RNAが、配列番号1、配列番号2または配列番号3に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有するヌクレオチド配列を含む、使用。
(項目52)
前記組成物が、局所、硝子体内または経強膜の経路を介した投与のために調製されている、項目51に記載の使用。
(項目53)
前記干渉RNAが、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目51に記載の使用。
(項目54)
前記干渉RNAが、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目51に記載の使用。
(項目55)
前記干渉RNAが、ヌクレオチド252、271、276、325、343から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目51に記載の使用。
(項目56)
前記干渉RNAが、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目51に記載の使用。
(項目57)
前記組成物が、さらに、19〜49ヌクレオチドの長さを有し、配列番号1、配列番号2または配列番号3に対応するmRNAの第二のハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する第二ヌクレオチド配列を含む第二干渉RNAを含む、項目51に記載の使用。
(項目58)
前記組成物が、それぞれ19〜49ヌクレオチドの長さを有する少なくとも4種の干渉RNAの混合物の有効量を含み、
該混合物が、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する第一、第二、第三および第四のヌクレオチド配列を含む、項目51に記載の使用。
(項目59)
前記対象が血清アミロイドA関連緑内障を有する、項目39〜58のいずれか1項に記載の使用。
【図面の簡単な説明】
【0013】
【図1】図1は、SAA mRNAを標的にするSMARTPOOL(登録商標) siRNAでトランスフェクションされたNTM 765正常小柱網細胞における、siRNAの内因性SAA mRNAに対する効果を調べるための、SAA2 mRNA/18s rRNA比のQPCR解析結果を提供する。小柱網細胞は、Dharmafect#1試薬を使用して、3種の異なる濃度で24時間、100nMのsiRNAでトランスフェクションした。対照:対照;処理1:0.05μl/100μlウェルでの処理1;処理2:0.2μl/100μlウェルでの処理2;処理3:0.4μl/100μlウェルでの処理3。
【図2】図2は、SAA mRNAを標的にするSMARTPOOL(登録商標) siRNAでトランスフェクションされたGTM686正常小柱網細胞における、siRNAの内因性SAA mRNAに対する効果を調べるための、SAA2 mRNA/18s rRNA比のQPCR解析結果を提供する。小柱網細胞は、Dharmafect#1試薬を使用して、3種の異なる濃度で24時間、100nMのsiRNAでトランスフェクションした。対照:対照;処理1:0.05μl/100μlウェルでの処理1;処理2:0.2μl/100μlウェルでの処理2;処理3:0.4μl/100μlウェルでの処理3。*:一元配置分散分析(ANOVA)、次いでNewman−Keuls多重比較検定によると、対照および処理1の両方に対してp<0.05。
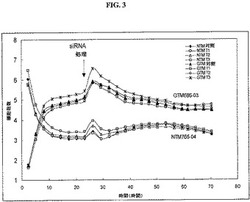
【図3】図3は、正常(NTM 765−04)および緑内障(GTM 686−03)小柱網細胞の増殖および形態に対するSAA siRNA処理の効果の、リアルタイム電子検出システム(RT−CESTM)による監視結果を提供する。細胞は、Dharmafect#1試薬を使用して、3種の異なる濃度で48時間、SAA mRNAを標的にするSMARTPOOL(登録商標) siRNA 100nMでトランスフェクションした。T1:0.05μl/100μlウェル;T2:0.2μl/100μlウェル;T3:0.4μl/100μlウェル。
【図4】図4は、siRNAで処理したNTM 765正常小柱網細胞の細胞可溶化物中の内因性SAAタンパク質レベルについてのELISAアッセイの結果を提供する。細胞は、Dharmafect#1試薬を使用して、3種の異なる濃度で48時間、SAA mRNAを標的にするSAA SMARTPOOL(登録商標) siRNA 100nMでトランスフェクションした。処理1:0.05μl/100μlウェルでの処理1;処理2:0.2μl/100μlウェルでの処理2;処理3:0.4μl/100μlウェルでの処理3。
【図5】図5は、siRNAで処理したGTM 686緑内障小柱網細胞の細胞可溶化物中の内因性SAAタンパク質レベルについてのELISAアッセイの結果を提供する。細胞は、Dharmafect#1試薬を使用して、3種の異なる濃度で48時間、SAA mRNAを標的にするSAA SMARTPOOL(登録商標) siRNA 100nMでトランスフェクションした。処理1:0.05μl/100μlウェルでの処理1;処理2:0.2μl/100μlウェルでの処理2;処理3:0.4μl/100μlウェルでの処理3。分散分析(ANOVA)、次いでBonferroni多重比較検定によると、対照に対して、*:p<0.05;**:p<0.01。
【発明を実施するための形態】
【0014】
(発明の詳細な説明)
「RNAi」と呼ばれるRNA干渉は、小型一本鎖または二本鎖RNA分子により生じる標的遺伝子の発現を減少させる方法である。干渉RNAには、二本鎖または一本鎖の何れかの小型干渉RNA(ds siRNAまたはss siRNA)、マイクロRNA(miRNA)、ショートヘアピンRNA(shRNA)等が含まれる。理論に束縛されるものではないが、RNA干渉は、dsRNA前駆体を長さ約20〜25ヌクレオチドの小型RNAに切断することによりインビボで起こると思われる。切断は、RNaseIII−RNAヘリカーゼ・ダイサーにより達成される。siRNAの「センス」鎖、即ち、標的mRNA配列と全く同じ配列を有する鎖を除去し、標的mRNAに相補的な「アンチセンス」鎖を残して、mRNAの発現を減少させる機能を果たす。siRNAのアンチセンス鎖は、RISC(RNA誘導サイレンシング複合体)として知られるタンパク質複合体をmRNAへ導くと、この複合体がRISCのArgonauteタンパク質によりmRNAを切断し、それによってこのmRNAによりタンパク質の産生を減少させると思われる。干渉RNAは触媒性であり、mRNAの発現の減少は、mRNAに対する干渉RNAの準化学量により達成することができる。mRNAの発現の減少は又、転写および翻訳機序を介して生じる場合もある。
【0015】
本発明は、眼疾患における血清アミロイドA(SAA)の発現を阻害する干渉RNAの使用に関する。本発明によると、外因によりもたらされるsiRNAが、眼構造のSAAのサイレンシングをもたらす。本発明者等は以前に、血清アミロイドA(SAA) mRNAおよびタンパク質の発現が、緑内障のTM組織および細胞において有意にアップレギュレートされることを示した(2003年12月17日に出願された係属中の米国特許出願USSN 60/530,430 “Use of Serum Amyloid A
Gene in Diagnosis and Treatment of Glaucoma and Identification of Anti−Glaucoma
Agents”)。本発明者等は、リアルタイム定量ポリメラーゼ連鎖反応(QPCR)により、Affymetrix遺伝子チップを使用して確認される異なるmRNAの発現を、並びにSAA ELISAアッセイにより、SAAタンパク質レベルの上昇を確認した(全体が参考として本明細書に組み入れられる、前述の係属中の米国特許出願)。
【0016】
本明細書で引用される核酸配列は、特に指示がない限り、5’から3’の方向に記述される。本明細書で使用される「核酸」という用語は、DNA(アデニン「A」、シトシン「C」、グアニン「G」、チミン「T」)またはRNA(アデニン「A」、シトシン「C」、グアニン「G」、ウラシル「U」)に存在するプリンまたはピリミジン塩基を含む、DNA若しくはRNAまたはその修飾形態の何れかを指す。本明細書に提示される干渉RNAは、「T」塩基がRNAに天然に生じないにもかかわらず、T塩基を、特に3’末端に含む場合がある。「核酸」は、「オリゴヌクレオチド」および「ポリヌクレオチド」という用語を包含し、一本鎖分子または二本鎖分子を指してもよい。二本鎖分子は、AとTの塩基、CとGの塩基、およびAとUの塩基のワトソン・クリック型塩基対合により形成される。二本鎖分子の鎖は、互いに部分的に、実質的にまたは完全に相補的である場合があり、二重鎖ハイブリッドを形成するが、その結合力は、塩基配列の相補性の性質および程度によって異なる。mRNA配列は、それをコード化するDNAのセンスまたはアンチセンス鎖配列を知ることによって、容易に判定される。例えば、配列番号1は、血清アミロイドA1 mRNAに対応するDNAのセンス鎖配列を提供する。例えば、配列番号1は、結合組織増殖因子のmRNAに対応するDNAのセンス鎖配列を提供する。mRNAの配列は、DNAのセンス鎖の配合と同一であるが、「T」塩基は「U」残基に置換されている。従って、血清アミロイドA1 mRNA配列は、配列番号1から既知であり、血清アミロイドA2 mRNA配列は、配列番号2から既知であり、血清アミロイドA4 mRNA配列は、配列番号3から既知である。
【0017】
血清アミロイドA mRNA:ヒト血清アミロイドAは、11番染色体の短腕に位置する遺伝子によってコード化される、異なった形で発現する多数のアポリポタンパク質を含む。SAAのイソフォームは4種類ある。全米バイオテクノロジー情報センター(ncbi.nlm.nih.gov)のGenBankデータベースには、血清アミロイドA1のメッセンジャーRNAの対応するDNAを、参照番号NM_000331としており、以下ではこれを配列番号1とする。血清アミロイドA1のコード配列は、ヌクレオチド225〜593である。
【0018】
SAA1:配列番号1
【0019】
【化3】

上述のSAA1 mRNA配列の等価物は、代替的なスプライス形態、対立形態、またはそれらの同族である。同族は、配列番号1と相同である別の哺乳類由来の血清アミロイドA1 mRNAである。配列番号1と関係するSAA1核酸配列は、GenBank受入番号NM_009117(マウス由来)、NM_199161(ヒト転写物変異体2)、BC007022.1、BG533276.1、BG567902.1、BQ691948.1、CD102084.1、M10906.1、M23698.1、X51439.1、X51441.1、X51442.1、X51443.1およびX56652.1の配列である。
【0020】
GenBankデータベースには、血清アミロイドA2のメッセンジャーRNAの対応するDNA配列を、参照番号NM_BC020795としており、以下ではこれを配列番号2とする。血清アミロイドA2のコード配列は、ヌクレオチド38〜406である。
【0021】
SAA2:配列番号2
【0022】
【化4】

上述のSAA2 mRNA配列の等価物は、代替的なスプライス形態、対立形態、またはそれらの同族である。同族は、配列番号2と相同である別の哺乳類由来の血清アミロイドA2 mRNAである。配列番号2と関係するSAA2核酸配列は、GenBank受入番号NM_030754(ヒト)、BC058008.1、J03474.1、L05921.1、M23699.1、M23700.1、M26152.1,X51440.1、X51444.1、X51445.1およびX56653.1の配列である。
【0023】
配列番号1および配列番号2のタンパク質生成物(SAA1およびSAA2)は、急性期反応物質として知られ、C反応性タンパク質と類似しており、それらは炎症性サイトカインによって劇的にアップレギュレートされる。SAA1およびSAA2タンパク質は、アミノ酸レベルで93.5%同一であり、遺伝子は、ヌクレオチドレベルで96.7%同一である。
【0024】
GenBankデータベースには、血清アミロイドA4のメッセンジャーRNAの対応するDNA配列を、参照番号NM_006512としており、以下ではこれを配列番号3とする。血清アミロイドA4のコード配列は、ヌクレオチド76〜468である。
【0025】
SAA4:配列番号3
【0026】
【化5】

SAA4は、低レベルで構成的に発現される遺伝子である。上述のSAA4 mRNA配列の等価物は、代替的なスプライス形態、対立形態、またはそれらの同族である。同族は、配列番号3と相同である別の哺乳類由来の血清アミロイドA4 mRNAである。配列番号3と関係するSAA核酸配列は、GenBank受入番号BC007026、M81349.1およびS48983.1である。
【0027】
mRNAの発現の減衰:本明細書で使用される「mRNAの発現の減少」という語句は、細胞内における標的遺伝子の完全なmRNA転写レベルを減少させる干渉RNAの量を投与し、それによって、スクランブル配列を有する対照RNAよりも、タンパク質へのmRNAの翻訳を減らすことを意味する。mRNAの発現の減少は、一般的にmRNAの「ノックダウン」と呼ばれている。50%〜100%を含むおよびそららの間の発現量のノックダウンが、本明細書の実施形態にで考慮される。しかし、このようなノックダウンレベルが本発明の目的において達成されることが必要なわけではない。又、2組の干渉RNAは、個別ではノックダウンにおける効果が弱い場合があるものの、一緒に投与すると、遥かに有効になる場合もある。一実施形態において、個々のds siRNAは、70%までのノックダウンに有効である。別の実施形態において、複数のds siRNAは、70%までのノックダウンに共に有効である。
【0028】
ノックダウンは、一般的に定量的ポリメラーゼ連鎖反応(QPCR)増幅法によりmRNAレベルを判定するか、またはウェスタン・ブロット若しくは酵素結合免疫測定法(ELISA)によりタンパク質レベルを判定することによって測定される。タンパク質レベルを分析することで、RNA誘導サイレンシング複合体(RISC)によるmRNA分解と、翻訳阻害の両方を評価することができる。ノックダウンを測定する更なる技法には、RNA溶液ハイブリダイゼーション、ヌクレアーゼ保護、ノーザンハイブリダイゼーション、逆転写、マイクロアレイによる遺伝子発現モニタリング、抗体結合、ラジオイムノアッセイ、および蛍光標識活性化細胞分析が含まれる。
【0029】
SAAの阻害は又、例えば眼内圧の改善、視野喪失の改善、または視神経頭の変化の改善のような緑内障の症状の改善を観察することによっても、ヒトまたは哺乳動物において推測される。
【0030】
本発明の実施形態の干渉RNAは触媒的に作用する。即ち、干渉RNAは、標的RNAを準化学量で阻害することができる。アンチセンス治療と比べると、治療効果をもたらすために必要となる干渉RNAが有意に少ない。
【0031】
二本鎖干渉RNA:本明細書で使用される二本鎖干渉RNA(siRNAとも呼ばれる)は、センスヌクレオチド配列およびアンチセンスヌクレオチド配列を有しており、該センスおよびアンチセンスヌクレオチド配列は、少なくともほぼ完全に連続した相補性の少なくとも19ヌクレオチドの領域を含む。干渉RNAの長さは、19〜49ヌクレオチドを含み、長さ19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48または49ヌクレオチドを含む場合がある。ds siRNAのアンチセンス配列は、生理学的条件下で、配列番号1、配列番号2または配列番号3の部分にハイブリダイズし、配列番号1、配列番号2または配列番号3それぞれのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する。
【0032】
siRNAのアンチセンス鎖は、細胞内でRISC複合体に結合し、アンチセンスRNAの配列と相補的な配列においてmRNAの配列と特異的に結合するようにこの結合した複合体を誘導し、それによってこの結合した複合体によるmRNAのその後の切断を可能にすることから、このアンチセンス鎖はsiRNAの活性誘導剤である。
【0033】
siRNAの標的配列を選択する技法は、ロックフェラー大学のウェブサイトより入手可能なTuschl,T.,et al.,”The siRNA User Guide”(2004年5月6日改訂)により、Ambionのウェブサイトに掲載されるTechnical Bulletin #506,”siRNA Design Guidelines,” Ambion Inc.により、G/C含有量の最小30%、最大55%の検索パラメータを使用するInvitrogenウェブサイトにより、およびDharmaconウェブサイトにより提示される。標的配列は、mRNAのコード領域または5’若しくは3’非翻訳領域に位置する場合がある。
【0034】
SAA1のDNA標的配列の実施形態は、配列番号1のヌクレオチド531〜549に存在する:
5’−TGGGGCAGGAGTGGCAAAG−3’ 配列番号4。
【0035】
配列番号4の対応するmRNA配列を標的にし、それぞれの鎖に3’UUオーバーハングを有する、本発明の二本鎖siRNAは、以下の通りである:
【0036】
【化6】

。
【0037】
3’オーバーハングは、複数の「U」残基、例えば、2、3、4、5および6個の間およびそれらを含む複数の「U」残基を有する場合がある。5’末端も又ヌクレオチドの5’オーバーハングを有する場合がある。配列番号4の対応するmRNA配列を標的にし、それぞれの鎖に3’TTオーバーハングを有する、本発明の二本鎖siRNAは、以下の通りである:
【0038】
【化7】

。
【0039】
二本鎖siRNAの鎖は、ヘアピンループにより結合されて、以下のように一本鎖siRNAを形成する場合がある:
【0040】
【化8】

。
【0041】
Nは、ヌクレオチドA、T、C、G、U、または当業者に既知の修飾形態である。ヌクレオチドNの数は、3〜23、または5〜15、または7〜13、または4〜9、または9〜11の間およびそれらを含む数であるか、或いはヌクレオチドNの数は9である。
【0042】
表1には、配列番号1、配列番号2および配列番号3のSAA DNA標的配列の例を一覧にする。これらから上述の方法により本発明のsiRNAが設計されている。
【0043】
【表1】

上の例で引用されているように、当業者は、配列番号1、配列番号2または配列番号3における配列部位を参照し、配列番号1、配列番号2または配列番号3のそれぞれと相補的またはほぼ相補的なヌクレオチドを追加または欠失することによって、表1に示す標的配列情報をもとに、表1に示す配列よりも長さが長いまたは短い干渉RNAを設計することができる。
【0044】
ds siRNAまたはss siRNAにより誘導される標的RNA切断反応は、極めて配列特異的である。一般的に、標的mRNAの部分と同一のセンスヌクレオチド配列と、mRNAセンス配列と全く相補的なアンチセンス部分とを含有するsiRNAは、SAA mRNAを阻害するsiRNAの実施形態である。しかし、siRNAのアンチセンス鎖と標的mRNAの間の100%配列相補性は、本発明を実施する上で必要ではない。従って、本発明は、遺伝子突然変異、系統多型現象、または進化的分岐に起因すると予測される配列変形を考慮する。例えば、標的配列に対する挿入、欠失または一点突然変異を有するsiRNA配列は、阻害に有効である。
【0045】
本発明の特定の実施形態において、アンチセンス配列は、CUUUGCCACUCCUGCCCCA(配列番号37)またはUCGGAAGUGAUUGGGGUCU(配列番号38)を含み、アンチセンス配列は、配列番号1に対応するmRNAの部分にハイブリダイズする。
【0046】
本発明の更なる実施形態において、アンチセンス配列は、UUUGUCUGAGCCGAUGUAA(配列番号39)、AACCAGGCCCGUGAGAAGC(配列番号40)、CUGAGCCGAUGUAAUUGGC(配列番号41)、CCCCCGAGCAUGGAAGUAU(配列番号42)、CUCUGGCAUUGCUGAUCAC(配列番号43)、GCCUGUGAGUCUCUGGAUA(配列番号44)、GCCACUCCUGCCCCAUUUA(配列番号45)、GCCAGCAGGUCGGAAGUGA(配列番号46)を含む、アンチセンス配列は、配列番号1に対応するmRNAの部分、または配列番号2に対応するmRNAの部分にハイブリダイズする。
【0047】
本発明の別の実施形態において、アンチセンス配列は、AGUCUCUGGAUAUUCUCUC(配列番号47)、UUUAUUGGCAGCCUGAUCG(配列番号48)、UUGCUGAUCACUUCUGCGG(配列番号49)、CUGGAUAUUCUCUCUGGCA(配列番号50)、UCUGCCACUCCUGCCCCAU(配列番号51)またはGCCACUCCUGCCCCAUUUA(配列番号69)を含み、アンチセンス配列は、配列番号2に対応するmRNAの部分にハイブリダイズする。
【0048】
前述の方法には、アンチセンス配列が、AACCCCUUGGAGAGCCUCC(配列番号52)、UGCCCAUGUCCCCAACCCC(配列番号53)、AUAGAGAUAUCUGUUUGAA(配列番号54)、CGAGCAUAGAGAUAUCUGU(配列番号55)、CUUUGGGCAGCAUCAUAGU(配列番号56)、AGACACCCCCAGGUCCUCU(配列番号57)、CCUGGAACGGCUGAUGAGU(配列番号58)、CCAAAUAAAUAGUAGUCUA(配列番号59)、UCCAAUACAGUGCUGCUGU(配列番号60)、CUCAGCUUUCUCGUUGGAC(配列番号61)、CCAUUCCUCAGCUUUCUCG(配列番号62)、CCGGCCCCAUUCCUCAGCU(配列番号63)、CUUUGCCACUCCGGCCCCA(配列番号64)、またはUCUGAAGCGGUCGGGGUCU(配列番号65)を含み、アンチセンス配列が、配列番号3に対応するmRNAの部分にハイブリダイズする実施形態が含まれる。
【0049】
siRNAのアンチセンス配列は、mRNAの標的配列と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドを有する。本明細書で使用される「ほぼ完全な」という表現は、標的mRNAの少なくとも一部分と、siRNAのアンチセンス配列が「実質的に相補的」であり、siRNAのセンス配列が「実質的に同一」であることを意味する。当業者に知られている「同一性」とは、配列間のヌクレオチドの順番をマッチングすることによって決定される、ヌクレオチド配列間の配列関係の程度を指す。一実施形態において、標的mRNA配列と80%の、および80%〜100%の相補性を有するアンチセンスRNAは、ほぼ完全に相補的であると考えられ、本発明で使用することができる。「完全な」連続した相補性は、隣接した塩基対の標準的なワトソン・クリック型塩基対合である。「少なくともほぼ完全な」連続した相補性には、本明細書で使用される「完全な」相補性が含まれる。同一性または相補性を判定するコンピュータ法は、ヌクレオチド配列の最高のマッチング程度を提供するように設計されており、例えば、BLASTPおよびBLASTN(Altschul,S.F.,et al.(1990) J.Mol.Biol.215:430−410)、並びにFASTAである。
【0050】
配列番号1、配列番号2または配列番号3に対応するmRNAの標的配列は、mRNAの5’または3’非翻訳領域、およびmRNAのコード領域にある場合がある。
【0051】
二本鎖干渉RNAの一方または両方の鎖は、1〜6個のヌクレオチドからなる3’オーバーハングを有する場合があり、これらのヌクレオチドは、リボヌクレオチド若しくはデオキシリボヌクレオチドまたはこれらの混合物である場合がある。このオーバーハングのヌクレオチドは塩基対ではない。本発明の一実施形態において、干渉ds RNAは、TTまたはUUの3’オーバーハングを含む。
【0052】
二本鎖siRNAのセンスおよびアンチセンス鎖は、上述の2本の一本鎖の二重形成において見られる場合もあれば、相補性の領域が塩基対であり、ヘアピンまたはループにより共有結合して一本鎖を形成する、単一分子である場合がある。ヘアピンは、ダイサーと呼ばれるタンパク質により細胞内で切断され、二つの個別の塩基対RNA分子の干渉RNAを形成すると考えられる。
【0053】
干渉RNAは、1個以上のヌクレオチドの追加、欠失、置換または修飾により天然に生じるRNAとは異なる場合がある。非ヌクレオチド物質は、5’末端、3’末端または内部の何れかで干渉RNAと結合する場合がある。そのような修飾は一般的に、干渉RNAのヌクレアーゼ耐性を向上させるため、細胞取り込みを改善するため、細胞標的化を増強するため、干渉RNAの追跡を助けるため、または安定性をさらに向上させるために設計される。例えば、干渉RNAは、オーバーハングの末端にプリンヌクレオチドを含む場合がある。例えば、ピロリジンリンカーによりコレステロールをds siRNA分子のセンス鎖の3’末端に結合することも、siRNAに安定性をもたらす。更なる修飾には、例えば、3’末端ビオチン分子、細胞侵入特性を有することが知られているペプチド、ナノ粒子、ペプチド模倣薬、蛍光染料、またはデンドリマーが含まれる。
【0054】
ヌクレオチドは、分子のその塩基部分、その糖部分、またはそのリン酸部分が修飾され、本発明の実施例において機能する場合がある。修飾には、例えば、アルキル、アルコキシ、アミノ、デアザ、ハロ、ヒドロキシル、チオール基、またはこれらの組み合わせによる置換が含まれる。ヌクレオチドは、より安定性のある類似体で置換される場合があり、例えば、Uを2’デオキシ−Tに置換したり、2’OHが、例えば、2’アミノ若しくは2’メチル基、2’メトキシエチル基、または2’−0,4’−Cメチレン架橋で置換されるような糖修飾を有する場合がある。ヌクレオチドのプリンまたはピリミジン類似体の例には、キサンチン、ヒポキサンチン、アザプリン、メチルチオアデニン、7−デアザ−アデノシン、並びにO−およびN−修飾ヌクレオチドが含まれる。ヌクレオチドのリン酸基は、リン酸基の1個以上の酸素を水素または硫黄で置換することによって修飾される場合がある(ホスホロチオエート)。修飾は、機能の改善、例えば、安定性若しくは透過率の改善、または局在化若しくは標的化に有用である。
【0055】
配列番号1の部分に相補的でないアンチセンスsiRNAの領域が存在する場合もある。非相補性領域は、相補性領域の3’末端、5’末端、またはその両末端に見られる場合がある。
【0056】
干渉RNAは、合成により生成され、例えば、インビトロ転写、siRNA発現ベクターまたはPCR発現カセットにより生成される場合がある。トランスフェクトされたsiRNAとして良好に機能する干渉RNAは、インビボで発現されたsiRNAとしても良好に機能する。
【0057】
干渉RNAは、保護されたリボヌクレオシドホスホロアミダイドおよび従来のDNA/RNAシンセサイザーを使用して化学的に合成され、例えば、Ambion Inc.(米国テキサス州オースチン)、Invitrogen(米国カリフォルニア州カールスバッド)、またはDharmacon(米国コロラド州ラファイエット)のような民間の供給業者から得る場合がある。干渉RNAは、例えば、溶媒または樹脂による抽出、沈殿、電気泳動、クロマトグラフィー、またはこれらの組み合わせにより精製される。或いは、干渉RNAは、試料の処理に起因する損失を回避するために、殆ど精製せずに使用される場合がある。
【0058】
干渉RNAは、当業者に既知のU6若しくはH1 RNA pol IIIプロモーター、サイトメガロウイルスプロモーター、またはSP6、T3若しくはT7プロモーターのような構成的または誘導的プロモーターを使用した、組み換えプラスミドからの発現により、対象に提供される場合がある。例えば、InvivoGen(米国カリフォルニア州サンディエゴ)製のpsiRNATMは、RNA pol IIIプロモーターによる細胞内のsiRNAの生成を可能にする。組み換えプラスミドから発現された干渉RNAは、標準的な技法によって単離される場合がある。
【0059】
干渉RNAの発現に使用するウイルスベクターは、例えば、上に記載したプラスミド用のプロモーターを使用して、アデノウイルス、アデノ関連ウイルス、ワクチニアウイルス、レトロウイルス(例えば、レンチウイルス、ラブドウイルス、マウス白血病ウイルス)、ヘルペスウイルス等から誘導される場合がある。ウイルスベクターの選択、ベクターによる干渉RNAの発現方法、およびウイルスベクターの送達方法は、当業者の技能の範囲内に含まれる。
【0060】
干渉RNAの発現は又、PCRによるヒトH1、ヒトU6またはマウスU6プロモーターを用いた発現カセットによるSILENCER EXPRESSTM(Ambion[米国テキサス州オースティン])(SEC)を使用することによってももたらされる。サイレンサー発現カセットは、ヘアピンsiRNAテンプレートをフランキングするプロモーターおよびターミネイター配列を含むPCR生成物である。細胞へトランスフェクションすると、ヘアピンsiRNAは、PCR生成物から発現され、特異的サイレンシングを誘導する。
【0061】
生理学的条件下でのハイブリダイゼーション:「ハイブリダイゼーション」とは、一本鎖核酸(DNAまたはRNA)が相補的またはほぼ相補的な塩基配列と相互作用して、ハイブリッドと呼ばれる水素結合複合体が一本鎖核酸により形成されるようにする技法を意味する。ハイブリダイゼーション反応は敏感で選択的であるため、対象となる特定の配列は低濃度で存在する試料中でも同定される。ハイブリダイゼーションの特異性(即ち、厳密性)は、例えば、インビトロでのプレハイブリダイゼーション溶液およびハイブリダイゼーション溶液における塩またはホルムアミドの濃度、並びにハイブリダイゼーション温度により制御され、当該技術においてもよく知られている。特に、厳密性は、塩の濃度を減衰させる、ホルムアミドの濃度を増大させる、またはハイブリダイゼーション温度を上昇させることによって増加する。
【0062】
例えば、厳密性の高い条件は、約50%のホルムアミドにおいて37℃〜42℃の温度で生じることができる。厳密性の低い条件は、約35%〜25%のホルムアミドにおいて30℃〜35℃で生じることができる。ハイブリダイゼーションの厳密性の条件の例は、Sambrook,J.,1989,Molecular Cloning: A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Yに示されている。厳密なハイブリダイゼーション条件の更なる例には、400mMのNaCl、40mMのPIPES、pH6.4、1mMのEDTA、50℃または70℃で12〜16時間保持後、洗浄;または1XSSC中70℃若しくは1XSSC中50℃、50%ホルムアミドでのハイブリダイゼーション後、0.3XSSC中70℃で洗浄;または4XSSC中70℃、若しくは4XSSC中50℃、50%ホルムアミドでのハイブリダイゼーション後、1XSSC中67℃で洗浄という条件が含まれる。ハイブリダイゼーションの温度は、ハイブリッドの融解温度(Tm)よりも約5〜10℃低い。ここでTmは、長さ19〜49塩基対のハイブリッドの場合、以下の計算式を使用して求められ:Tm℃=81.5+16.6(log10[Na+])+0.41(%G+C)−(600/N);式中、Nは、ハイブリッドにおける塩基の数であり、[Na+]は、ハイブリダイゼーション緩衝剤中のナトリウムイオンの濃度である。
【0063】
本発明の実施形態において、高厳密性条件下でインビトロにおいてSAA mRNAによりハイブリダイズする干渉RNAのアンチセンス鎖は、生理学的条件下でインビボにおいて特異的に結合する。高厳密性条件下で核酸とハイブリダイズしない関連する核酸の同定および単離は、厳密性の低い条件下で実施される。
【0064】
一本鎖干渉RNA:上述の通り、干渉RNAは、最終的に一本鎖として機能する。ss
siRNAは、二本鎖RNAよりも効能は低いものの、mRNAサイレンシングを行うことが見出されている。従って、本発明の実施形態は又、一本鎖siRNAが、生理学的条件下で、配列番号1、配列番号2または配列番号3の部分とハイブリダイズし、配列番号1、配列番号2または配列番号3のそれぞれのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、ss siRNAの投与も定める。ss siRNAは、上述のds siRNAの場合と同様に、19〜49ヌクレオチドの長さを有する。ss siRNAは、5’リン酸を有するか、またはin situ若しくはインビボにおいて5’位でリン酸化される。「5’リン酸化」という用語は、例えば、5’糖のC5ヒドロキシル(例えば、5’リボース若しくはデオキシリボース、またはそれらの類似体)にエステル結合を介して結合するリン酸基を有する、ポリヌクレオチドまたはオリゴヌクレオチドを記述するために使用される。ss siRNAは、一リン酸、二リン酸または三リン酸基を有する場合がある。
【0065】
ss siRNAは、ds siRNAの場合と同様に、化学的にまたはベクターを介して合成される。5’リン酸基がキナーゼによって添加される場合もあれば、5’リン酸がRNAのヌクレアーゼ切断の結果として得られる場合もある。送達はds siRNAの場合と同様である。一実施形態において、保護末端およびヌクレアーゼ耐性修飾を有するss siRNAは、サイレンシングのために投与される。ss siRNAは、保存のために乾燥させる場合もあれば、水溶液に溶解させる場合もある。この溶液は、アニーリングを阻害するためまたは安定化させるために、緩衝剤または塩を含有する場合がある。
【0066】
ヘアピン干渉RNA:ヘアピン干渉RNAは、一本鎖であり、1本の鎖の中にセンスとアンチセンスの両方の配列を含有する。DNAベクターによる発現のため、センスsiRNA配列に対応する少なくとも19ヌクレオチドの対応するDNAオリゴヌクレオチドは、短いスペーサーにより逆相補性アンチセンス配列と結合している。選択した発現ベクターに必要な場合は、3’末端Tおよびヌクレオチド形成制限部位を加える場合がある。得られたRNA転写物は、それ自体が折り畳んで、ステムループ構造を形成する。
【0067】
投与様式:干渉RNAは、眼周囲、結膜、テノン下、前房内、硝子体内、網膜下、眼球後部、または小管内注入のような眼組織注入により;カテーテルまたはその他の留置デバイス、例えば網膜ペレット、眼内インサート、坐剤、または多孔性、非多孔性若しくはゼラチン状物質を含むインプラントを使用した眼への直接適用により;局所点眼剤または軟膏により;盲嚢中の、または強膜に隣接(経強膜的)若しくは眼の中に移植した徐放デバイスにより、眼に直接送達する場合がある。前房内注入は、作用物質が小柱網に到達するように、角膜を通して前眼房内に達成される場合がある。小管内注入は、シュレム管に排出する静脈収集チャンネルの中に、またはシュレム管の中に送達する場合がある。
【0068】
対象:緑内障の治療を必要とするまたは緑内障を発症する危険性がある対象は、SAAの発現または活性に関連する緑内障、即ち、SAA関連緑内障を有する、またはその病態を有する危険性があるヒトまたはその他の哺乳動物である。このような疾患に関連する眼の構造には、例えば、網膜、脈絡膜、水晶体、角膜、小柱網、虹彩、視神経、視神経頭、強膜、眼房、ガラス体腔、毛様体が含まれる場合がある。
【0069】
製剤および投与量:医薬製剤は、本発明の干渉RNAまたはその塩を、水、緩衝剤、生理食塩水、グリシン、ヒアルロン酸、マンニトール等のような生理学的に許容可能な眼用担体と混合して、99重量%まで含有する。
【0070】
本発明の干渉RNAは、液剤、懸濁剤または乳剤として投与される。以下は、本発明に包含される可能性ある配合の例である。
【0071】
【表2】

一般的に、本発明の実施形態の干渉RNAの有効量は、眼部位におけるまたは該部位に隣接する、200pM〜100nM、または1nM〜50nM、または5nM〜約25nMの細胞間濃度を含む。局所組成物は、熟練した臨床医の日常的な裁量に従って、1日1〜4回眼の表面に送達される。製剤のpHは、pH4〜9またはpH4.5〜pH7.4である。
【0072】
正確なレジメは臨床医の裁量に委ねられているが、干渉RNAは、1日1〜4回それぞれの眼に1滴点眼するか、または臨床医の指示に従って投与される場合がある。製剤の有効量は、例えば、対象の年齢、人種および性別、または緑内障の重篤度のような要因により異なる場合がある。一実施形態において、干渉RNAは眼に局所送達され、治療用量で小柱網、網膜または視神経頭に到達し、それによってSAA関連疾患過程を改善する。
【0073】
許容可能な担体:眼に許容可能な担体は、多くても全くまたは殆ど眼に刺激を与えることがなく、必要に応じて適切な保存をもたらし、本発明の1つ以上の干渉RNAを同一投与で送達する担体を意味する。本発明の実施形態の干渉RNAの投与に許容可能な担体には、Mirus TransIT(登録商標)−TKO siRNA Tranfection Reagent(Mirus Corporation[米国ウィスコンシン州マディソン])、LIPOFECTIN(登録商標)、リポフェクタミン、OLIGOFECTAMINE(登録商標)(Invitrogen[米国カリフォルニア州サンディエゴ])、CELLFECTIN(登録商標)、DHARMAFECTTM(Dharmacon[米国イリノイ州シカゴ])またはポリリジンのようなポリカチオン、リポソーム、またはコレステロールのような脂肪溶解剤が含まれる。リポソームは、標準的な小胞形成脂質およびコレステロールのようなステロールから形成され、これには、例えば内皮細胞表面抗原に対する結合親和性を有するモノクローナル抗体のような標的分子が含まれる場合がある。さらに、リポソームはペグ化リポソームとなる場合がある。
【0074】
眼への送達では、干渉RNAは、眼科学的に許容可能な防腐剤、共溶媒、界面活性剤、粘度増強剤、浸透促進剤、緩衝剤、塩化ナトリウム、または水性で無菌の眼科用懸濁液若しくは溶液を形成する水と混合される場合がある。眼科用溶液製剤は、生理学的に許容可能な等張水性緩衝剤に抑制剤を溶解することによって調製される場合がある。さらに、眼科用溶液には、抑制剤の溶解を助ける眼科学的に許容可能な界面活性剤が含まれる場合がある。ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、メチルセルロース、ポリビニルピロリドン等のような粘度上昇剤を本発明の組成物に添加して、化合物の保持率を改善する場合もある。
【0075】
眼科用無菌軟膏製剤を調製するには、干渉RNAを、鉱油、液状ラノリンまたは白色ワセリンのような適切なビヒクル中の防腐剤と混合させる。眼科用無菌ゲル製剤は、他の眼科用製剤の技術で既知の方法に従って、例えばCARBOPOL(登録商標)−940(BE Goodrich[米国ノースカロライナ州シャーロット])等の組み合わせから調製した親水性基剤中に干渉RNAを懸濁することによって調製される場合がある。例えば、VISCOAT(登録商標)(Alcon Laboratories,Inc.[米国テキサス州フォートワース])は眼内注入に使用される場合がある。本発明の他の製剤は、干渉RNAが眼にあまり浸透しない場合に、cremephorおよびTWEEN(登録商標) 80(ポリオキシエチレンソルビタンモノラウレート、Sigma Aldrich[米国ミズーリ州セントルイス])のような浸透促進剤を含有する場合がある。
【0076】
キット:本発明の実施形態は、細胞におけるSAA mRNAの発現を減衰させる試薬を含むキットを提供する。キットは、干渉RNAに対応する二つの相補性一本鎖RNAをコード化するヌクレオチド配列にそれぞれ作動可能に結合する、T7プロモーター、T3プロモーターまたはSP6プロモーターのような二つの異なるプロモーターを有するDNAテンプレートを含有する。RNAは、DNAテンプレートから転写され、アニールされて、標的mRNAの発現を減衰させるのに有効な二本鎖RNAを形成する。キットは場合により、DNAテンプレートからDNA配列を増幅する増幅プライマー、およびRNAを合成するヌクレオチド三リン酸(即ち、ATP、GTP、CTPおよびUTP)を含有する。場合により、キットは、それぞれ、DNAテンプレートのプロモーターに結合することができ、且つプロモーターが作動可能に結合するヌクレオチド配列を転写することができる、二つのRNAポリメラーゼ、サイズ排除カラムのような、一本鎖RNAを精製する精製カラム、1つ以上の緩衝剤、例えば一本鎖RNAをアニーリングして二本鎖RNAを生じる緩衝剤、および二本鎖RNAを精製するRNAse AまたはRNAse Tを含有する。
【0077】
例えば、ヒト小柱網(TM)細胞内で内因性SAA発現のレベルをノックダウンするSAA干渉RNAの能力は、以下の通り実施する。GTM3またはHTM−3(Pang,I.H,et al.,1994.Curr.Eye Res.13:51−63を参照)と呼ばれる形質転換ヒトTM細胞系のトランスフェクションを、本明細書で引用されるSAA干渉RNA(100nM)およびLIPOFECTAMINETM 2000(Invitrogen[米国カリフォルニア州カールスバッド])の標準的なインビボ濃度を1:1(w/v)の比率で使用して達成する。スクランブルおよびラミンA/C siRNA(Dharmacon)を対照として使用する。
【0078】
QPCR TAQMAN(登録商標)フォワードおよびリバースプライマー、並びに標的部位を包含するプローブセットを、mRNA切断の程度を評価するために使用する。このようなプライマー/プローブセットは、例えば、ABI(Applied Biosystems[米国カリフォルニア州フォスターシティー])によって合成される場合がある。
【0079】
非特異的で標的を外す効果の機会を減らすために、SAA mRNAの発現を阻害する可能な限り低いsiRNA濃度を、siRNAについて判定する。SAA mRNAノックダウンは、適切なプライマー/プローブセットを使用するQPCR増幅により評価する。GTM3細胞におけるSAA siRNAの用量反応を、例えば、0、1、3、10、30および100nMの用量範囲のsiRNAにより24時間治療を行った後、GTM3細胞で観察する。データは、GraphPad Prism 4ソフトウェア(GraphPad Software,Inc.[米国カリフォルニア州サンディエゴ])を使用して、勾配変化、S字型用量反応アルゴリズム、および頂点拘束100%によりフィッティングする。試験を行った特定のsiRNAについてIC50を得る。
【0080】
実施例1
小柱網細胞におけるSAAをサイレンシングする干渉RNA
本研究では、正常なおよび緑内障のヒト小柱網(TM)細胞における内因性SAA発現のレベルをノックダウンするSAA干渉RNAの能力を試験する。
【0081】
正常(NTM765−04−OD,p5)および緑内障(GTM686−03−OS,p6)TM細胞系のトランスフェクションを、SMARTPOOL(登録商標) SAA干渉RNAプール(100nM)およびDHARMAFECT(登録商標) #1トランスフェクション試薬(Dharmacon Research Inc.[米国イリノイ州シカゴ])の標準的なインビボ濃度を使用して実施した。SMARTPOOL(登録商標) SAA干渉RNAは、配列番号11、配列番号18、配列番号19および配列番号20の配列識別子を有するSAA mRNA領域を標的にするように設計された、四つの相同的な二本鎖siRNAのプールを含み、三つの異なる濃度(処理1:0.05μl/100μlウェル;処理2:0.2μl/100μlウェル;処理3:0.4μl/100μlウェル)で24または48時間にわたり3回使用した。対照は処理しなかった。
【0082】
mRNAレベルに対する効果:SAA mRNAのQPCR解析では、RNAqueous−4TM PCR(Ambion[米国テキサス州オースティン])を使用して24時間処理した細胞から全RNAを抽出し、TaqMan(登録商標)逆転写試薬(PE Biosystems[米国カリフォルニア州フォスターシティー])を使用してcDNAを合成した。QPCRは、TaqMan(登録商標)ユニバーサルPCRマスターミックスおよび7700 SDS(PE Biosystems)を使用して3回実施した。マルチプレックスQPCRでは、リボソームRNA(18s rRNA、PE Biosystems)を標準化対照として使用した。QPCR解析は、2組のTaqMan(登録商標)プローブ/プライマーセット(PE Biosystems)を使用して実施し、第一のセット(P423)はSAA cDNA配列のコード領域を標的にし、第二のセット(P428)は非コード領域を標的にする。
【0083】
図1に示す通り、P423プライマーセットを使用した処理3の条件下でsiRNA処理したNTM765−04正常細胞には、18s rRNAと比べて約35%のSAA mRNAの阻害が認められた。図2に示す通り、P423プライマーセットを使用した処理3の条件下でsiRNA処理したGTM686−03緑内障細胞には、18s rRNAと比べて約41%のSAA mRNAの阻害が認められた。同様の結果はプライマーセットP428を使用しても得られた。
【0084】
SAAタンパク質レベルに対する効果:48時間処理した細胞から調製した細胞可溶化物中の内因性SAAタンパク質のレベルを、ELISAアッセイを使用して調べた。
【0085】
処理1、処理2および処理3のsiRNA処理したGTM686緑内障細胞全てでは、約66%のSAAタンパク質の減少が認められたが(図5)、NTM675細胞では認められなかった(図4)。内因性SAAタンパク質レベルは、何れの小柱網細胞系でも極めて低く、特にNTM765正常細胞で低かった。
【0086】
細胞増殖および形態に対する効果:TM細胞形態に対するSAA siRNAの効果を、リアルタイム電子検出システム(RT−CESTM、ACEA Biosciences,Inc.[米国カリフォルニア州サンディエゴ])により監視した。図3に示す通り、siRNA処理より、TM細胞の増殖または形態に対する毒性作用は認められなかった。
【0087】
本明細書に引用する参考文献は、これらが本明細書の記載内容の補足となる例示的な手順またはその他の詳細を示す限りにおいて、参考として明確に組み入れられる。
【0088】
本発明の開示内容に照らして、当業者は、本発明の趣旨および範囲から逸脱することなく、本明細書に開示される実施形態の明白な変更を行えることを理解する。本明細書に開示される全ての実施形態は、本発明の開示内容に照らして、過度の実験を行うことなく実行および実施することができる。本発明の全ての範囲は、本開示内容およびその同等の実施形態に記載されている。本明細書は、本発明が権利を受ける保護の全範囲を過度に狭めるものとして解釈されるべきではない。
【0089】
本明細書で使用される「a」および「an」という冠詞は、特に指示がない限り、「1つ」、「少なくとも1つ」または「1つ以上」の意味をとる。
【数1】

【数2】

【数3】

【数4】

【数5】

【数6】

【数7】

【数8】

【数9】

【数10】

【数11】

【数12】

【数13】

【数14】

【技術分野】
【0001】
(発明の分野)
本発明は、緑内障、特に原発性開放隅角緑内障における血清アミロイドA(SAA)の発現を阻害する干渉RNA組成物の分野に関する。
【背景技術】
【0002】
(発明の背景)
緑内障は、特定の臨床徴候を共有する、視神経障害の混成群である。緑内障における視力の喪失は、視野、神経線維層の欠損、および視神経頭(ONH)の進行性吸角法における特徴的な変化により臨床的に診断される、神経網膜内の網膜神経節細胞の選択的な死が原因となっている。緑内障の発症における主要な危険因子の一つには、高眼圧(眼内圧(IOP)の上昇)の存在がある。適切な眼内圧は、眼の形状を維持し、眼房水を無血管組織の角膜や水晶体に流すことを可能にする圧力勾配をもたらすために必要となる。IOPは又、正常なIOPであると思われがちな症状を対象が有する、正常眼圧緑内障の原因に関与すると思われる。
【0003】
緑内障に関連するIOPの上昇は、前眼房の虹彩角膜角度に位置する小さな特殊組織である、小柱網(TM)内の眼房水の流出耐性の上昇によるものである、。TM細胞の緑内障の変化には、TM細胞の喪失、並びにタンパク質性プラーク様物質を含む細胞外破片の沈着および蓄積が含まれる。さらに、緑内障のONHにおいて発生する変化もある。緑内障の眼においては、ONHグリア細胞における形態および移動度の変化が見られる。IOPの上昇および一過性虚血発作の反応としては、ONH細胞外マトリックスの組成における変化、並びにグリア細胞および網膜神経節細胞の軸索形態の変化が見られる。
【0004】
原発性緑内障は、解剖学的または生理学的基礎をなす眼内の体液の流れに障害をもたらす。続発性緑内障は、眼または既存の疾患に対する障害または外傷の結果として発生する。慢性または単性緑内障としても知られる原発性開放隅角緑内障(POAG)は、全ての原発性緑内障の90%を占める。POAGは、小柱網の変性を特徴とし、眼からの体液の排出に対して異常に高い耐性をもたらす。このような耐性の変化が、IOPの上昇をもたらし、通常眼により生成される体液を上昇した耐性を超えて駆動させることが必要となる。
【0005】
現在の抗緑内障療法には、眼房水形成抑制剤またはブドウ膜強膜流出促進剤の使用によるIOPの低下、レーザー線維柱帯形成術、または排水を向上させるろ過手術である線維柱帯切除術が含まれる。薬学的な抗緑内障手法は、種々の好ましくない副作用を示す。例えば、ピロカルピン等の縮瞳薬は、視野のぼやけやその他のネガティブな視覚的副作用を引き起こす。又、炭酸脱水素抑制剤の全身投与は、吐き気、消化不良、疲労および代謝性アシドーシスを引き起こす。さらに、特定のβ−遮断薬は、肺組織中のβ−2受容体に対する効果に起因する重大な肺の副作用を伴うことが多くなっている。交感神経興奮薬は、頻脈、不整脈および高血圧を引き起こす。このようなネガティブな副作用は、対象の服薬率の低下や治療の終了をもたらす場合がある。
【0006】
さらに重要なことに、現在の抗緑内障療法は、小柱網の病理的損傷、視神経、並びに依然として改善が見られない網膜神経節細胞および軸索の喪失に直接対処するものではない。緑内障の重要度、および以前の治療方法の欠点を鑑みると、緑内障の進行の内在的な原因に対処する緑内障の治療方法の改善が望まれているように思われる。
【発明の概要】
【課題を解決するための手段】
【0007】
(発明の要旨)
本発明は、SAAのmRNAを標的にし、それによってSAAのmRNAの発現を干渉する干渉RNAを対象とする。本発明の干渉RNAは、SAA関連緑内障の治療に有用である。
【0008】
本発明の実施形態は、対象の眼において血清アミロイドA mRNAの発現を減衰させる方法を提供する。この方法は、19〜49ヌクレオチドの長さを有する二本鎖(ds)siRNAまたは一本鎖(ss)siRNAのような干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を対象の眼に投与することを包含する。
【0009】
二本鎖siRNAは、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および少なくともほぼ完全に連続した相補性の少なくとも19ヌクレオチドの領域を含む。さらに、アンチセンス配列は、SAA1、SAA2およびSAA4をそれぞれコード化するDNAのセンス配列である、配列番号1、配列番号2または配列番号3(GenBank受入番号NM_000331、BC020795およびNM_006512)に対応するmRNAの部分に生理学的条件下でハイブリダイズし、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する。このような組成物を投与することによって、対象の眼における血清アミロイドA mRNAの発現を減衰させる。
【0010】
干渉RNAが一本鎖である場合、干渉RNAは、配列番号1、配列番号2または配列番号3に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有するヌクレオチド配列を含む。
【0011】
本発明の一実施形態において、アンチセンスsiRNAは、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている。本発明の別の実施形態において、アンチセンス配列は、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている。本発明の更なる実施形態において、アンチセンス配列は、ヌクレオチド252、271、276、325または343から開始する配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている。本発明の尚更なる実施形態において、アンチセンス配列は、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている。
【0012】
本発明の更なる実施形態は、治療を必要とする対象における血清アミロイドA関連緑内障を治療する方法である。この方法は、19〜49ヌクレオチドの長さを有する干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を患者の眼に投与することを包含し、該干渉RNAは、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含む。アンチセンス配列は、生理学的条件下で、配列番号1、配列番号2または配列番号3に対応するmRNAの部分にハイブリダイズし、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する。それによって、血清アミロイドA関連緑内障が治療される。
例えば、本願発明は以下の項目を提供する。
(項目1)
対象の眼において血清アミロイドA mRNAの発現を弱める方法であって、
19〜49ヌクレオチドの長さを有する干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を該対象の眼に投与する工程を包含し;
該干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含み;
該アンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAの一部分に生理学的条件下でハイブリダイズし、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有し;
それによって、血清アミロイドA mRNAの発現が減衰される、方法。
(項目2)
前記対象が緑内障を有する、項目1に記載の方法。
(項目3)
前記対象が緑内障を発症する危険性がある、項目1に記載の方法。
(項目4)
前記アンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも21〜23ヌクレオチドの領域を有し、前記センス配列および該アンチセンス配列のそれぞれの3’末端に追加のTT配列を含む、項目1に記載の方法。
(項目5)
前記センスヌクレオチド配列および前記アンチセンスヌクレオチド配列が、ループヌクレオチド配列により結合されている、項目1に記載の方法。
(項目6)
前記組成物が局所、硝子体内または経強膜の経路を介して投与される、項目1に記載の方法。
(項目7)
前記アンチセンス配列が、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目1に記載の方法。
(項目8)
前記アンチセンス配列が、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目1に記載の方法。
(項目9)
前記アンチセンス配列が、ヌクレオチド252、271、276、325、343から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目1に記載の方法。
(項目10)
前記アンチセンス配列が、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目1に記載の方法。
(項目11)
前記アンチセンス配列が、
【化1】

を含む、項目1に記載の方法。
(項目12)
前記干渉RNAが、塩基部分、糖部分またはリン酸部分に修飾を含む、項目1に記載の方法。
(項目13)
さらに、19〜49ヌクレオチドの長さを有し、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に相補性の少なくとも19ヌクレオチドの領域を含む第二干渉RNAを、前記対象の眼に投与することを含み;
該第二干渉RNAのアンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAの第二部分に生理学的条件下でハイブリダイズし、該アンチセンス配列が、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAの第二のハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、項目1に記載の方法。
(項目14)
前記組成物が、それぞれ19〜49ヌクレオチドの長さを有する少なくとも4種の干渉RNAの混合物の有効量、および薬学的に許容可能な担体を含み、
各干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および4種の該干渉RNAのそれぞれの該センス配列とアンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含み;
該混合物のアンチセンス配列が、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAの一部分に生理学的条件下でハイブリダイズし、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、項目1に記載の方法。
(項目15)
対象の眼において血清アミロイドA mRNAの発現を減衰させる方法であって、
19〜49ヌクレオチドの長さを有する干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を該対象の眼に投与することを含み、
該干渉RNAが、配列番号1、配列番号2または配列番号3に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有するヌクレオチド配列を含み、
それによって、血清アミロイドA mRNAの発現が減衰される、方法。
(項目16)
前記組成物が局所、硝子体内または経強膜の経路を介して投与される、項目15に記載の方法。
(項目17)
前記干渉RNAが、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目15に記載の方法。
(項目18)
前記干渉RNAが、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目15に記載の方法。
(項目19)
前記干渉RNAが、ヌクレオチド252、271、276、325、343から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目15に記載の方法。
(項目20)
前記干渉RNAが、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目15に記載の方法。
(項目21)
さらに、19〜49ヌクレオチドの長さを有し、配列番号1、配列番号2または配列番号3に対応するmRNAの第二のハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する第二のヌクレオチド配列を含む第二の干渉RNAを、前記対象の眼に投与することを含む、項目15に記載の方法。
(項目22)
前記組成物が、それぞれ19〜49ヌクレオチドの長さを有する少なくとも4種の干渉RNAの混合物の有効量を含み、
該混合物が、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する第一、第二、第三および第四のヌクレオチド配列を含む、項目15に記載の方法。
(項目23)
治療を必要とする対象において血清アミロイドA関連緑内障を治療する方法であって、
19〜49ヌクレオチドの長さを有する干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を該対象の眼に投与することを含み、
該干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含み;
該アンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAの一部分に生理学的条件下でハイブリダイズし、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有し;
それによって、血清アミロイドA関連緑内障が治療される、方法。
(項目24)
前記組成物が局所、硝子体内または経強膜の経路を介して投与される、項目23に記載の方法。
(項目25)
前記干渉RNAが、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目23に記載の方法。
(項目26)
前記干渉RNAが、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目23に記載の方法。
(項目27)
前記干渉RNAが、ヌクレオチド252、271、276、325、343から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目23に記載の方法。
(項目28)
前記干渉RNAが、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目23に記載の方法。
(項目29)
さらに、19〜49ヌクレオチドの長さを有し、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含む第二干渉RNAを、前記対象の眼に投与することを含み;
該第二干渉RNAのアンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAの第二部分に生理学的条件下でハイブリダイズし、該アンチセンス配列が、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAの第二のハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、項目23に記載の方法。
(項目30)
前記組成物が、それぞれ19〜49ヌクレオチドの長さを有する少なくとも4種の干渉RNAの混合物の有効量、および薬学的に許容可能な担体を含み、
各干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および4種の該干渉RNAのそれぞれの該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含み;
該混合物のアンチセンス配列が、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAの部分に生理学的条件下でハイブリダイズし、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、項目23に記載の方法。
(項目31)
治療を必要とする対象において血清アミロイドA関連緑内障を治療する方法であって、
19〜49ヌクレオチドの長さを有する干渉RNAの有効量および薬学的に許容可能な担体を含む組成物を該対象の眼に投与することを含み、
該干渉RNAが、配列番号1、配列番号2または配列番号3に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有するヌクレオチド配列を含み、
それによって、血清アミロイドA mRNAの発現が減衰される、方法。
(項目32)
前記組成物が局所、硝子体内または経強膜の経路を介して投与される、項目31に記載の方法。
(項目33)
前記干渉RNAが、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目31に記載の方法。
(項目34)
前記干渉RNAが、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目31に記載の方法。
(項目35)
前記干渉RNAが、ヌクレオチド252、271、276、325、343から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目31に記載の方法。
(項目36)
前記干渉RNAが、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目31に記載の方法。
(項目37)
さらに、19〜49ヌクレオチドの長さを有し、配列番号1、配列番号2または配列番号3に対応するmRNAの第二のハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する第二のヌクレオチド配列を含む第二の干渉RNAを、前記対象の眼に投与することを含む、項目31に記載の方法。
(項目38)
前記組成物が、それぞれ19〜49ヌクレオチドの長さを有する少なくとも4種の干渉RNAの混合物の有効量を含み、
該混合物が、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する第一、第二、第三および第四のヌクレオチド配列を含む、項目31に記載の方法。
(項目39)
対象の眼において血清アミロイドA mRNAの発現を減衰させるための医薬品の製造における、組成物の使用であって、
該組成物が、19〜49ヌクレオチドの長さを有する干渉RNAの有効量、および薬学的に許容可能な担体を含み、
該干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含み、
該アンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAの一部分に生理学的条件下でハイブリダイズし、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、使用。
(項目40)
前記アンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも21〜23ヌクレオチドの領域を有し、前記センス配列および該アンチセンス配列のそれぞれの3’末端に追加のTT配列を含む、項目39に記載の使用。
(項目41)
前記センスヌクレオチド配列および前記アンチセンスヌクレオチド配列が、ループヌクレオチド配列により結合されている、項目39に記載の使用。
(項目42)
前記組成物が、局所、硝子体内または経強膜の経路を介した投与のために調製されている、項目39に記載の使用。
(項目43)
前記アンチセンス配列が、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目39に記載の使用。
(項目44)
前記アンチセンス配列が、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目39に記載の使用。
(項目45)
前記アンチセンス配列が、ヌクレオチド252、271、276、325、343から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目39に記載の使用。
(項目46)
前記アンチセンス配列が、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目39に記載の使用。
(項目47)
前記アンチセンス配列が、
【化2】

を含む、項目39に記載の使用。
(項目48)
前記干渉RNAが、塩基部分、糖部分またはリン酸部分に修飾を含む、項目39に記載の使用。
(項目49)
前記組成物が、さらに、19〜49ヌクレオチドの長さを有し、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および該センス配列と該アンチセンス配列との間の少なくともほぼ完全に相補性の少なくとも19ヌクレオチドの領域を含む第二干渉RNAを含み;
該第二干渉RNAのアンチセンス配列が、配列番号1、配列番号2または配列番号3に対応するmRNAの第二部分に生理学的条件下でハイブリダイズし、該アンチセンス配列が、配列番号1、配列番号2または配列番号3のそれぞれに対応するmRNAの第二のハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、項目39に記載の使用。
(項目50)
前記組成物が、それぞれ19〜49ヌクレオチドの長さを有する少なくとも4種の干渉RNAの混合物の有効量、および薬学的に許容可能な担体を含み、
各干渉RNAが、センスヌクレオチド配列、アンチセンスヌクレオチド配列、および4種の該干渉RNAのそれぞれの該センス配列と該アンチセンス配列との間の少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を含み;
該混合物のアンチセンス配列が、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAの一部分に生理学的条件下でハイブリダイズし、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、項目39に記載の方法。
(項目51)
対象の眼において血清アミロイドA mRNAの発現を減衰させるための医薬品の製造における、組成物の使用であって、
該組成物が、19〜49ヌクレオチドの長さを有する干渉RNAの有効量、および薬学的に許容可能な担体を含み、
該干渉RNAが、配列番号1、配列番号2または配列番号3に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有するヌクレオチド配列を含む、使用。
(項目52)
前記組成物が、局所、硝子体内または経強膜の経路を介した投与のために調製されている、項目51に記載の使用。
(項目53)
前記干渉RNAが、ヌクレオチド230、357、362、380、447、470、527、531、548または557から始まる配列番号1に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目51に記載の使用。
(項目54)
前記干渉RNAが、ヌクレオチド43、170、175、193、260、283、339または370から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目51に記載の使用。
(項目55)
前記干渉RNAが、ヌクレオチド252、271、276、325、343から始まる配列番号2に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目51に記載の使用。
(項目56)
前記干渉RNAが、ヌクレオチド153、166、222、227、251、268、297、335、356、384、390、396、406または423から始まる配列番号3に対応するmRNAのヌクレオチド配列を標的にするように設計されている、項目51に記載の使用。
(項目57)
前記組成物が、さらに、19〜49ヌクレオチドの長さを有し、配列番号1、配列番号2または配列番号3に対応するmRNAの第二のハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する第二ヌクレオチド配列を含む第二干渉RNAを含む、項目51に記載の使用。
(項目58)
前記組成物が、それぞれ19〜49ヌクレオチドの長さを有する少なくとも4種の干渉RNAの混合物の有効量を含み、
該混合物が、それぞれヌクレオチド175、252、276および325から始まる配列番号2に対応するmRNAのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する第一、第二、第三および第四のヌクレオチド配列を含む、項目51に記載の使用。
(項目59)
前記対象が血清アミロイドA関連緑内障を有する、項目39〜58のいずれか1項に記載の使用。
【図面の簡単な説明】
【0013】
【図1】図1は、SAA mRNAを標的にするSMARTPOOL(登録商標) siRNAでトランスフェクションされたNTM 765正常小柱網細胞における、siRNAの内因性SAA mRNAに対する効果を調べるための、SAA2 mRNA/18s rRNA比のQPCR解析結果を提供する。小柱網細胞は、Dharmafect#1試薬を使用して、3種の異なる濃度で24時間、100nMのsiRNAでトランスフェクションした。対照:対照;処理1:0.05μl/100μlウェルでの処理1;処理2:0.2μl/100μlウェルでの処理2;処理3:0.4μl/100μlウェルでの処理3。
【図2】図2は、SAA mRNAを標的にするSMARTPOOL(登録商標) siRNAでトランスフェクションされたGTM686正常小柱網細胞における、siRNAの内因性SAA mRNAに対する効果を調べるための、SAA2 mRNA/18s rRNA比のQPCR解析結果を提供する。小柱網細胞は、Dharmafect#1試薬を使用して、3種の異なる濃度で24時間、100nMのsiRNAでトランスフェクションした。対照:対照;処理1:0.05μl/100μlウェルでの処理1;処理2:0.2μl/100μlウェルでの処理2;処理3:0.4μl/100μlウェルでの処理3。*:一元配置分散分析(ANOVA)、次いでNewman−Keuls多重比較検定によると、対照および処理1の両方に対してp<0.05。
【図3】図3は、正常(NTM 765−04)および緑内障(GTM 686−03)小柱網細胞の増殖および形態に対するSAA siRNA処理の効果の、リアルタイム電子検出システム(RT−CESTM)による監視結果を提供する。細胞は、Dharmafect#1試薬を使用して、3種の異なる濃度で48時間、SAA mRNAを標的にするSMARTPOOL(登録商標) siRNA 100nMでトランスフェクションした。T1:0.05μl/100μlウェル;T2:0.2μl/100μlウェル;T3:0.4μl/100μlウェル。
【図4】図4は、siRNAで処理したNTM 765正常小柱網細胞の細胞可溶化物中の内因性SAAタンパク質レベルについてのELISAアッセイの結果を提供する。細胞は、Dharmafect#1試薬を使用して、3種の異なる濃度で48時間、SAA mRNAを標的にするSAA SMARTPOOL(登録商標) siRNA 100nMでトランスフェクションした。処理1:0.05μl/100μlウェルでの処理1;処理2:0.2μl/100μlウェルでの処理2;処理3:0.4μl/100μlウェルでの処理3。
【図5】図5は、siRNAで処理したGTM 686緑内障小柱網細胞の細胞可溶化物中の内因性SAAタンパク質レベルについてのELISAアッセイの結果を提供する。細胞は、Dharmafect#1試薬を使用して、3種の異なる濃度で48時間、SAA mRNAを標的にするSAA SMARTPOOL(登録商標) siRNA 100nMでトランスフェクションした。処理1:0.05μl/100μlウェルでの処理1;処理2:0.2μl/100μlウェルでの処理2;処理3:0.4μl/100μlウェルでの処理3。分散分析(ANOVA)、次いでBonferroni多重比較検定によると、対照に対して、*:p<0.05;**:p<0.01。
【発明を実施するための形態】
【0014】
(発明の詳細な説明)
「RNAi」と呼ばれるRNA干渉は、小型一本鎖または二本鎖RNA分子により生じる標的遺伝子の発現を減少させる方法である。干渉RNAには、二本鎖または一本鎖の何れかの小型干渉RNA(ds siRNAまたはss siRNA)、マイクロRNA(miRNA)、ショートヘアピンRNA(shRNA)等が含まれる。理論に束縛されるものではないが、RNA干渉は、dsRNA前駆体を長さ約20〜25ヌクレオチドの小型RNAに切断することによりインビボで起こると思われる。切断は、RNaseIII−RNAヘリカーゼ・ダイサーにより達成される。siRNAの「センス」鎖、即ち、標的mRNA配列と全く同じ配列を有する鎖を除去し、標的mRNAに相補的な「アンチセンス」鎖を残して、mRNAの発現を減少させる機能を果たす。siRNAのアンチセンス鎖は、RISC(RNA誘導サイレンシング複合体)として知られるタンパク質複合体をmRNAへ導くと、この複合体がRISCのArgonauteタンパク質によりmRNAを切断し、それによってこのmRNAによりタンパク質の産生を減少させると思われる。干渉RNAは触媒性であり、mRNAの発現の減少は、mRNAに対する干渉RNAの準化学量により達成することができる。mRNAの発現の減少は又、転写および翻訳機序を介して生じる場合もある。
【0015】
本発明は、眼疾患における血清アミロイドA(SAA)の発現を阻害する干渉RNAの使用に関する。本発明によると、外因によりもたらされるsiRNAが、眼構造のSAAのサイレンシングをもたらす。本発明者等は以前に、血清アミロイドA(SAA) mRNAおよびタンパク質の発現が、緑内障のTM組織および細胞において有意にアップレギュレートされることを示した(2003年12月17日に出願された係属中の米国特許出願USSN 60/530,430 “Use of Serum Amyloid A
Gene in Diagnosis and Treatment of Glaucoma and Identification of Anti−Glaucoma
Agents”)。本発明者等は、リアルタイム定量ポリメラーゼ連鎖反応(QPCR)により、Affymetrix遺伝子チップを使用して確認される異なるmRNAの発現を、並びにSAA ELISAアッセイにより、SAAタンパク質レベルの上昇を確認した(全体が参考として本明細書に組み入れられる、前述の係属中の米国特許出願)。
【0016】
本明細書で引用される核酸配列は、特に指示がない限り、5’から3’の方向に記述される。本明細書で使用される「核酸」という用語は、DNA(アデニン「A」、シトシン「C」、グアニン「G」、チミン「T」)またはRNA(アデニン「A」、シトシン「C」、グアニン「G」、ウラシル「U」)に存在するプリンまたはピリミジン塩基を含む、DNA若しくはRNAまたはその修飾形態の何れかを指す。本明細書に提示される干渉RNAは、「T」塩基がRNAに天然に生じないにもかかわらず、T塩基を、特に3’末端に含む場合がある。「核酸」は、「オリゴヌクレオチド」および「ポリヌクレオチド」という用語を包含し、一本鎖分子または二本鎖分子を指してもよい。二本鎖分子は、AとTの塩基、CとGの塩基、およびAとUの塩基のワトソン・クリック型塩基対合により形成される。二本鎖分子の鎖は、互いに部分的に、実質的にまたは完全に相補的である場合があり、二重鎖ハイブリッドを形成するが、その結合力は、塩基配列の相補性の性質および程度によって異なる。mRNA配列は、それをコード化するDNAのセンスまたはアンチセンス鎖配列を知ることによって、容易に判定される。例えば、配列番号1は、血清アミロイドA1 mRNAに対応するDNAのセンス鎖配列を提供する。例えば、配列番号1は、結合組織増殖因子のmRNAに対応するDNAのセンス鎖配列を提供する。mRNAの配列は、DNAのセンス鎖の配合と同一であるが、「T」塩基は「U」残基に置換されている。従って、血清アミロイドA1 mRNA配列は、配列番号1から既知であり、血清アミロイドA2 mRNA配列は、配列番号2から既知であり、血清アミロイドA4 mRNA配列は、配列番号3から既知である。
【0017】
血清アミロイドA mRNA:ヒト血清アミロイドAは、11番染色体の短腕に位置する遺伝子によってコード化される、異なった形で発現する多数のアポリポタンパク質を含む。SAAのイソフォームは4種類ある。全米バイオテクノロジー情報センター(ncbi.nlm.nih.gov)のGenBankデータベースには、血清アミロイドA1のメッセンジャーRNAの対応するDNAを、参照番号NM_000331としており、以下ではこれを配列番号1とする。血清アミロイドA1のコード配列は、ヌクレオチド225〜593である。
【0018】
SAA1:配列番号1
【0019】
【化3】

上述のSAA1 mRNA配列の等価物は、代替的なスプライス形態、対立形態、またはそれらの同族である。同族は、配列番号1と相同である別の哺乳類由来の血清アミロイドA1 mRNAである。配列番号1と関係するSAA1核酸配列は、GenBank受入番号NM_009117(マウス由来)、NM_199161(ヒト転写物変異体2)、BC007022.1、BG533276.1、BG567902.1、BQ691948.1、CD102084.1、M10906.1、M23698.1、X51439.1、X51441.1、X51442.1、X51443.1およびX56652.1の配列である。
【0020】
GenBankデータベースには、血清アミロイドA2のメッセンジャーRNAの対応するDNA配列を、参照番号NM_BC020795としており、以下ではこれを配列番号2とする。血清アミロイドA2のコード配列は、ヌクレオチド38〜406である。
【0021】
SAA2:配列番号2
【0022】
【化4】

上述のSAA2 mRNA配列の等価物は、代替的なスプライス形態、対立形態、またはそれらの同族である。同族は、配列番号2と相同である別の哺乳類由来の血清アミロイドA2 mRNAである。配列番号2と関係するSAA2核酸配列は、GenBank受入番号NM_030754(ヒト)、BC058008.1、J03474.1、L05921.1、M23699.1、M23700.1、M26152.1,X51440.1、X51444.1、X51445.1およびX56653.1の配列である。
【0023】
配列番号1および配列番号2のタンパク質生成物(SAA1およびSAA2)は、急性期反応物質として知られ、C反応性タンパク質と類似しており、それらは炎症性サイトカインによって劇的にアップレギュレートされる。SAA1およびSAA2タンパク質は、アミノ酸レベルで93.5%同一であり、遺伝子は、ヌクレオチドレベルで96.7%同一である。
【0024】
GenBankデータベースには、血清アミロイドA4のメッセンジャーRNAの対応するDNA配列を、参照番号NM_006512としており、以下ではこれを配列番号3とする。血清アミロイドA4のコード配列は、ヌクレオチド76〜468である。
【0025】
SAA4:配列番号3
【0026】
【化5】

SAA4は、低レベルで構成的に発現される遺伝子である。上述のSAA4 mRNA配列の等価物は、代替的なスプライス形態、対立形態、またはそれらの同族である。同族は、配列番号3と相同である別の哺乳類由来の血清アミロイドA4 mRNAである。配列番号3と関係するSAA核酸配列は、GenBank受入番号BC007026、M81349.1およびS48983.1である。
【0027】
mRNAの発現の減衰:本明細書で使用される「mRNAの発現の減少」という語句は、細胞内における標的遺伝子の完全なmRNA転写レベルを減少させる干渉RNAの量を投与し、それによって、スクランブル配列を有する対照RNAよりも、タンパク質へのmRNAの翻訳を減らすことを意味する。mRNAの発現の減少は、一般的にmRNAの「ノックダウン」と呼ばれている。50%〜100%を含むおよびそららの間の発現量のノックダウンが、本明細書の実施形態にで考慮される。しかし、このようなノックダウンレベルが本発明の目的において達成されることが必要なわけではない。又、2組の干渉RNAは、個別ではノックダウンにおける効果が弱い場合があるものの、一緒に投与すると、遥かに有効になる場合もある。一実施形態において、個々のds siRNAは、70%までのノックダウンに有効である。別の実施形態において、複数のds siRNAは、70%までのノックダウンに共に有効である。
【0028】
ノックダウンは、一般的に定量的ポリメラーゼ連鎖反応(QPCR)増幅法によりmRNAレベルを判定するか、またはウェスタン・ブロット若しくは酵素結合免疫測定法(ELISA)によりタンパク質レベルを判定することによって測定される。タンパク質レベルを分析することで、RNA誘導サイレンシング複合体(RISC)によるmRNA分解と、翻訳阻害の両方を評価することができる。ノックダウンを測定する更なる技法には、RNA溶液ハイブリダイゼーション、ヌクレアーゼ保護、ノーザンハイブリダイゼーション、逆転写、マイクロアレイによる遺伝子発現モニタリング、抗体結合、ラジオイムノアッセイ、および蛍光標識活性化細胞分析が含まれる。
【0029】
SAAの阻害は又、例えば眼内圧の改善、視野喪失の改善、または視神経頭の変化の改善のような緑内障の症状の改善を観察することによっても、ヒトまたは哺乳動物において推測される。
【0030】
本発明の実施形態の干渉RNAは触媒的に作用する。即ち、干渉RNAは、標的RNAを準化学量で阻害することができる。アンチセンス治療と比べると、治療効果をもたらすために必要となる干渉RNAが有意に少ない。
【0031】
二本鎖干渉RNA:本明細書で使用される二本鎖干渉RNA(siRNAとも呼ばれる)は、センスヌクレオチド配列およびアンチセンスヌクレオチド配列を有しており、該センスおよびアンチセンスヌクレオチド配列は、少なくともほぼ完全に連続した相補性の少なくとも19ヌクレオチドの領域を含む。干渉RNAの長さは、19〜49ヌクレオチドを含み、長さ19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48または49ヌクレオチドを含む場合がある。ds siRNAのアンチセンス配列は、生理学的条件下で、配列番号1、配列番号2または配列番号3の部分にハイブリダイズし、配列番号1、配列番号2または配列番号3それぞれのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する。
【0032】
siRNAのアンチセンス鎖は、細胞内でRISC複合体に結合し、アンチセンスRNAの配列と相補的な配列においてmRNAの配列と特異的に結合するようにこの結合した複合体を誘導し、それによってこの結合した複合体によるmRNAのその後の切断を可能にすることから、このアンチセンス鎖はsiRNAの活性誘導剤である。
【0033】
siRNAの標的配列を選択する技法は、ロックフェラー大学のウェブサイトより入手可能なTuschl,T.,et al.,”The siRNA User Guide”(2004年5月6日改訂)により、Ambionのウェブサイトに掲載されるTechnical Bulletin #506,”siRNA Design Guidelines,” Ambion Inc.により、G/C含有量の最小30%、最大55%の検索パラメータを使用するInvitrogenウェブサイトにより、およびDharmaconウェブサイトにより提示される。標的配列は、mRNAのコード領域または5’若しくは3’非翻訳領域に位置する場合がある。
【0034】
SAA1のDNA標的配列の実施形態は、配列番号1のヌクレオチド531〜549に存在する:
5’−TGGGGCAGGAGTGGCAAAG−3’ 配列番号4。
【0035】
配列番号4の対応するmRNA配列を標的にし、それぞれの鎖に3’UUオーバーハングを有する、本発明の二本鎖siRNAは、以下の通りである:
【0036】
【化6】

。
【0037】
3’オーバーハングは、複数の「U」残基、例えば、2、3、4、5および6個の間およびそれらを含む複数の「U」残基を有する場合がある。5’末端も又ヌクレオチドの5’オーバーハングを有する場合がある。配列番号4の対応するmRNA配列を標的にし、それぞれの鎖に3’TTオーバーハングを有する、本発明の二本鎖siRNAは、以下の通りである:
【0038】
【化7】

。
【0039】
二本鎖siRNAの鎖は、ヘアピンループにより結合されて、以下のように一本鎖siRNAを形成する場合がある:
【0040】
【化8】

。
【0041】
Nは、ヌクレオチドA、T、C、G、U、または当業者に既知の修飾形態である。ヌクレオチドNの数は、3〜23、または5〜15、または7〜13、または4〜9、または9〜11の間およびそれらを含む数であるか、或いはヌクレオチドNの数は9である。
【0042】
表1には、配列番号1、配列番号2および配列番号3のSAA DNA標的配列の例を一覧にする。これらから上述の方法により本発明のsiRNAが設計されている。
【0043】
【表1】

上の例で引用されているように、当業者は、配列番号1、配列番号2または配列番号3における配列部位を参照し、配列番号1、配列番号2または配列番号3のそれぞれと相補的またはほぼ相補的なヌクレオチドを追加または欠失することによって、表1に示す標的配列情報をもとに、表1に示す配列よりも長さが長いまたは短い干渉RNAを設計することができる。
【0044】
ds siRNAまたはss siRNAにより誘導される標的RNA切断反応は、極めて配列特異的である。一般的に、標的mRNAの部分と同一のセンスヌクレオチド配列と、mRNAセンス配列と全く相補的なアンチセンス部分とを含有するsiRNAは、SAA mRNAを阻害するsiRNAの実施形態である。しかし、siRNAのアンチセンス鎖と標的mRNAの間の100%配列相補性は、本発明を実施する上で必要ではない。従って、本発明は、遺伝子突然変異、系統多型現象、または進化的分岐に起因すると予測される配列変形を考慮する。例えば、標的配列に対する挿入、欠失または一点突然変異を有するsiRNA配列は、阻害に有効である。
【0045】
本発明の特定の実施形態において、アンチセンス配列は、CUUUGCCACUCCUGCCCCA(配列番号37)またはUCGGAAGUGAUUGGGGUCU(配列番号38)を含み、アンチセンス配列は、配列番号1に対応するmRNAの部分にハイブリダイズする。
【0046】
本発明の更なる実施形態において、アンチセンス配列は、UUUGUCUGAGCCGAUGUAA(配列番号39)、AACCAGGCCCGUGAGAAGC(配列番号40)、CUGAGCCGAUGUAAUUGGC(配列番号41)、CCCCCGAGCAUGGAAGUAU(配列番号42)、CUCUGGCAUUGCUGAUCAC(配列番号43)、GCCUGUGAGUCUCUGGAUA(配列番号44)、GCCACUCCUGCCCCAUUUA(配列番号45)、GCCAGCAGGUCGGAAGUGA(配列番号46)を含む、アンチセンス配列は、配列番号1に対応するmRNAの部分、または配列番号2に対応するmRNAの部分にハイブリダイズする。
【0047】
本発明の別の実施形態において、アンチセンス配列は、AGUCUCUGGAUAUUCUCUC(配列番号47)、UUUAUUGGCAGCCUGAUCG(配列番号48)、UUGCUGAUCACUUCUGCGG(配列番号49)、CUGGAUAUUCUCUCUGGCA(配列番号50)、UCUGCCACUCCUGCCCCAU(配列番号51)またはGCCACUCCUGCCCCAUUUA(配列番号69)を含み、アンチセンス配列は、配列番号2に対応するmRNAの部分にハイブリダイズする。
【0048】
前述の方法には、アンチセンス配列が、AACCCCUUGGAGAGCCUCC(配列番号52)、UGCCCAUGUCCCCAACCCC(配列番号53)、AUAGAGAUAUCUGUUUGAA(配列番号54)、CGAGCAUAGAGAUAUCUGU(配列番号55)、CUUUGGGCAGCAUCAUAGU(配列番号56)、AGACACCCCCAGGUCCUCU(配列番号57)、CCUGGAACGGCUGAUGAGU(配列番号58)、CCAAAUAAAUAGUAGUCUA(配列番号59)、UCCAAUACAGUGCUGCUGU(配列番号60)、CUCAGCUUUCUCGUUGGAC(配列番号61)、CCAUUCCUCAGCUUUCUCG(配列番号62)、CCGGCCCCAUUCCUCAGCU(配列番号63)、CUUUGCCACUCCGGCCCCA(配列番号64)、またはUCUGAAGCGGUCGGGGUCU(配列番号65)を含み、アンチセンス配列が、配列番号3に対応するmRNAの部分にハイブリダイズする実施形態が含まれる。
【0049】
siRNAのアンチセンス配列は、mRNAの標的配列と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドを有する。本明細書で使用される「ほぼ完全な」という表現は、標的mRNAの少なくとも一部分と、siRNAのアンチセンス配列が「実質的に相補的」であり、siRNAのセンス配列が「実質的に同一」であることを意味する。当業者に知られている「同一性」とは、配列間のヌクレオチドの順番をマッチングすることによって決定される、ヌクレオチド配列間の配列関係の程度を指す。一実施形態において、標的mRNA配列と80%の、および80%〜100%の相補性を有するアンチセンスRNAは、ほぼ完全に相補的であると考えられ、本発明で使用することができる。「完全な」連続した相補性は、隣接した塩基対の標準的なワトソン・クリック型塩基対合である。「少なくともほぼ完全な」連続した相補性には、本明細書で使用される「完全な」相補性が含まれる。同一性または相補性を判定するコンピュータ法は、ヌクレオチド配列の最高のマッチング程度を提供するように設計されており、例えば、BLASTPおよびBLASTN(Altschul,S.F.,et al.(1990) J.Mol.Biol.215:430−410)、並びにFASTAである。
【0050】
配列番号1、配列番号2または配列番号3に対応するmRNAの標的配列は、mRNAの5’または3’非翻訳領域、およびmRNAのコード領域にある場合がある。
【0051】
二本鎖干渉RNAの一方または両方の鎖は、1〜6個のヌクレオチドからなる3’オーバーハングを有する場合があり、これらのヌクレオチドは、リボヌクレオチド若しくはデオキシリボヌクレオチドまたはこれらの混合物である場合がある。このオーバーハングのヌクレオチドは塩基対ではない。本発明の一実施形態において、干渉ds RNAは、TTまたはUUの3’オーバーハングを含む。
【0052】
二本鎖siRNAのセンスおよびアンチセンス鎖は、上述の2本の一本鎖の二重形成において見られる場合もあれば、相補性の領域が塩基対であり、ヘアピンまたはループにより共有結合して一本鎖を形成する、単一分子である場合がある。ヘアピンは、ダイサーと呼ばれるタンパク質により細胞内で切断され、二つの個別の塩基対RNA分子の干渉RNAを形成すると考えられる。
【0053】
干渉RNAは、1個以上のヌクレオチドの追加、欠失、置換または修飾により天然に生じるRNAとは異なる場合がある。非ヌクレオチド物質は、5’末端、3’末端または内部の何れかで干渉RNAと結合する場合がある。そのような修飾は一般的に、干渉RNAのヌクレアーゼ耐性を向上させるため、細胞取り込みを改善するため、細胞標的化を増強するため、干渉RNAの追跡を助けるため、または安定性をさらに向上させるために設計される。例えば、干渉RNAは、オーバーハングの末端にプリンヌクレオチドを含む場合がある。例えば、ピロリジンリンカーによりコレステロールをds siRNA分子のセンス鎖の3’末端に結合することも、siRNAに安定性をもたらす。更なる修飾には、例えば、3’末端ビオチン分子、細胞侵入特性を有することが知られているペプチド、ナノ粒子、ペプチド模倣薬、蛍光染料、またはデンドリマーが含まれる。
【0054】
ヌクレオチドは、分子のその塩基部分、その糖部分、またはそのリン酸部分が修飾され、本発明の実施例において機能する場合がある。修飾には、例えば、アルキル、アルコキシ、アミノ、デアザ、ハロ、ヒドロキシル、チオール基、またはこれらの組み合わせによる置換が含まれる。ヌクレオチドは、より安定性のある類似体で置換される場合があり、例えば、Uを2’デオキシ−Tに置換したり、2’OHが、例えば、2’アミノ若しくは2’メチル基、2’メトキシエチル基、または2’−0,4’−Cメチレン架橋で置換されるような糖修飾を有する場合がある。ヌクレオチドのプリンまたはピリミジン類似体の例には、キサンチン、ヒポキサンチン、アザプリン、メチルチオアデニン、7−デアザ−アデノシン、並びにO−およびN−修飾ヌクレオチドが含まれる。ヌクレオチドのリン酸基は、リン酸基の1個以上の酸素を水素または硫黄で置換することによって修飾される場合がある(ホスホロチオエート)。修飾は、機能の改善、例えば、安定性若しくは透過率の改善、または局在化若しくは標的化に有用である。
【0055】
配列番号1の部分に相補的でないアンチセンスsiRNAの領域が存在する場合もある。非相補性領域は、相補性領域の3’末端、5’末端、またはその両末端に見られる場合がある。
【0056】
干渉RNAは、合成により生成され、例えば、インビトロ転写、siRNA発現ベクターまたはPCR発現カセットにより生成される場合がある。トランスフェクトされたsiRNAとして良好に機能する干渉RNAは、インビボで発現されたsiRNAとしても良好に機能する。
【0057】
干渉RNAは、保護されたリボヌクレオシドホスホロアミダイドおよび従来のDNA/RNAシンセサイザーを使用して化学的に合成され、例えば、Ambion Inc.(米国テキサス州オースチン)、Invitrogen(米国カリフォルニア州カールスバッド)、またはDharmacon(米国コロラド州ラファイエット)のような民間の供給業者から得る場合がある。干渉RNAは、例えば、溶媒または樹脂による抽出、沈殿、電気泳動、クロマトグラフィー、またはこれらの組み合わせにより精製される。或いは、干渉RNAは、試料の処理に起因する損失を回避するために、殆ど精製せずに使用される場合がある。
【0058】
干渉RNAは、当業者に既知のU6若しくはH1 RNA pol IIIプロモーター、サイトメガロウイルスプロモーター、またはSP6、T3若しくはT7プロモーターのような構成的または誘導的プロモーターを使用した、組み換えプラスミドからの発現により、対象に提供される場合がある。例えば、InvivoGen(米国カリフォルニア州サンディエゴ)製のpsiRNATMは、RNA pol IIIプロモーターによる細胞内のsiRNAの生成を可能にする。組み換えプラスミドから発現された干渉RNAは、標準的な技法によって単離される場合がある。
【0059】
干渉RNAの発現に使用するウイルスベクターは、例えば、上に記載したプラスミド用のプロモーターを使用して、アデノウイルス、アデノ関連ウイルス、ワクチニアウイルス、レトロウイルス(例えば、レンチウイルス、ラブドウイルス、マウス白血病ウイルス)、ヘルペスウイルス等から誘導される場合がある。ウイルスベクターの選択、ベクターによる干渉RNAの発現方法、およびウイルスベクターの送達方法は、当業者の技能の範囲内に含まれる。
【0060】
干渉RNAの発現は又、PCRによるヒトH1、ヒトU6またはマウスU6プロモーターを用いた発現カセットによるSILENCER EXPRESSTM(Ambion[米国テキサス州オースティン])(SEC)を使用することによってももたらされる。サイレンサー発現カセットは、ヘアピンsiRNAテンプレートをフランキングするプロモーターおよびターミネイター配列を含むPCR生成物である。細胞へトランスフェクションすると、ヘアピンsiRNAは、PCR生成物から発現され、特異的サイレンシングを誘導する。
【0061】
生理学的条件下でのハイブリダイゼーション:「ハイブリダイゼーション」とは、一本鎖核酸(DNAまたはRNA)が相補的またはほぼ相補的な塩基配列と相互作用して、ハイブリッドと呼ばれる水素結合複合体が一本鎖核酸により形成されるようにする技法を意味する。ハイブリダイゼーション反応は敏感で選択的であるため、対象となる特定の配列は低濃度で存在する試料中でも同定される。ハイブリダイゼーションの特異性(即ち、厳密性)は、例えば、インビトロでのプレハイブリダイゼーション溶液およびハイブリダイゼーション溶液における塩またはホルムアミドの濃度、並びにハイブリダイゼーション温度により制御され、当該技術においてもよく知られている。特に、厳密性は、塩の濃度を減衰させる、ホルムアミドの濃度を増大させる、またはハイブリダイゼーション温度を上昇させることによって増加する。
【0062】
例えば、厳密性の高い条件は、約50%のホルムアミドにおいて37℃〜42℃の温度で生じることができる。厳密性の低い条件は、約35%〜25%のホルムアミドにおいて30℃〜35℃で生じることができる。ハイブリダイゼーションの厳密性の条件の例は、Sambrook,J.,1989,Molecular Cloning: A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Yに示されている。厳密なハイブリダイゼーション条件の更なる例には、400mMのNaCl、40mMのPIPES、pH6.4、1mMのEDTA、50℃または70℃で12〜16時間保持後、洗浄;または1XSSC中70℃若しくは1XSSC中50℃、50%ホルムアミドでのハイブリダイゼーション後、0.3XSSC中70℃で洗浄;または4XSSC中70℃、若しくは4XSSC中50℃、50%ホルムアミドでのハイブリダイゼーション後、1XSSC中67℃で洗浄という条件が含まれる。ハイブリダイゼーションの温度は、ハイブリッドの融解温度(Tm)よりも約5〜10℃低い。ここでTmは、長さ19〜49塩基対のハイブリッドの場合、以下の計算式を使用して求められ:Tm℃=81.5+16.6(log10[Na+])+0.41(%G+C)−(600/N);式中、Nは、ハイブリッドにおける塩基の数であり、[Na+]は、ハイブリダイゼーション緩衝剤中のナトリウムイオンの濃度である。
【0063】
本発明の実施形態において、高厳密性条件下でインビトロにおいてSAA mRNAによりハイブリダイズする干渉RNAのアンチセンス鎖は、生理学的条件下でインビボにおいて特異的に結合する。高厳密性条件下で核酸とハイブリダイズしない関連する核酸の同定および単離は、厳密性の低い条件下で実施される。
【0064】
一本鎖干渉RNA:上述の通り、干渉RNAは、最終的に一本鎖として機能する。ss
siRNAは、二本鎖RNAよりも効能は低いものの、mRNAサイレンシングを行うことが見出されている。従って、本発明の実施形態は又、一本鎖siRNAが、生理学的条件下で、配列番号1、配列番号2または配列番号3の部分とハイブリダイズし、配列番号1、配列番号2または配列番号3のそれぞれのハイブリダイズする部分と少なくともほぼ完全に連続して相補性の少なくとも19ヌクレオチドの領域を有する、ss siRNAの投与も定める。ss siRNAは、上述のds siRNAの場合と同様に、19〜49ヌクレオチドの長さを有する。ss siRNAは、5’リン酸を有するか、またはin situ若しくはインビボにおいて5’位でリン酸化される。「5’リン酸化」という用語は、例えば、5’糖のC5ヒドロキシル(例えば、5’リボース若しくはデオキシリボース、またはそれらの類似体)にエステル結合を介して結合するリン酸基を有する、ポリヌクレオチドまたはオリゴヌクレオチドを記述するために使用される。ss siRNAは、一リン酸、二リン酸または三リン酸基を有する場合がある。
【0065】
ss siRNAは、ds siRNAの場合と同様に、化学的にまたはベクターを介して合成される。5’リン酸基がキナーゼによって添加される場合もあれば、5’リン酸がRNAのヌクレアーゼ切断の結果として得られる場合もある。送達はds siRNAの場合と同様である。一実施形態において、保護末端およびヌクレアーゼ耐性修飾を有するss siRNAは、サイレンシングのために投与される。ss siRNAは、保存のために乾燥させる場合もあれば、水溶液に溶解させる場合もある。この溶液は、アニーリングを阻害するためまたは安定化させるために、緩衝剤または塩を含有する場合がある。
【0066】
ヘアピン干渉RNA:ヘアピン干渉RNAは、一本鎖であり、1本の鎖の中にセンスとアンチセンスの両方の配列を含有する。DNAベクターによる発現のため、センスsiRNA配列に対応する少なくとも19ヌクレオチドの対応するDNAオリゴヌクレオチドは、短いスペーサーにより逆相補性アンチセンス配列と結合している。選択した発現ベクターに必要な場合は、3’末端Tおよびヌクレオチド形成制限部位を加える場合がある。得られたRNA転写物は、それ自体が折り畳んで、ステムループ構造を形成する。
【0067】
投与様式:干渉RNAは、眼周囲、結膜、テノン下、前房内、硝子体内、網膜下、眼球後部、または小管内注入のような眼組織注入により;カテーテルまたはその他の留置デバイス、例えば網膜ペレット、眼内インサート、坐剤、または多孔性、非多孔性若しくはゼラチン状物質を含むインプラントを使用した眼への直接適用により;局所点眼剤または軟膏により;盲嚢中の、または強膜に隣接(経強膜的)若しくは眼の中に移植した徐放デバイスにより、眼に直接送達する場合がある。前房内注入は、作用物質が小柱網に到達するように、角膜を通して前眼房内に達成される場合がある。小管内注入は、シュレム管に排出する静脈収集チャンネルの中に、またはシュレム管の中に送達する場合がある。
【0068】
対象:緑内障の治療を必要とするまたは緑内障を発症する危険性がある対象は、SAAの発現または活性に関連する緑内障、即ち、SAA関連緑内障を有する、またはその病態を有する危険性があるヒトまたはその他の哺乳動物である。このような疾患に関連する眼の構造には、例えば、網膜、脈絡膜、水晶体、角膜、小柱網、虹彩、視神経、視神経頭、強膜、眼房、ガラス体腔、毛様体が含まれる場合がある。
【0069】
製剤および投与量:医薬製剤は、本発明の干渉RNAまたはその塩を、水、緩衝剤、生理食塩水、グリシン、ヒアルロン酸、マンニトール等のような生理学的に許容可能な眼用担体と混合して、99重量%まで含有する。
【0070】
本発明の干渉RNAは、液剤、懸濁剤または乳剤として投与される。以下は、本発明に包含される可能性ある配合の例である。
【0071】
【表2】

一般的に、本発明の実施形態の干渉RNAの有効量は、眼部位におけるまたは該部位に隣接する、200pM〜100nM、または1nM〜50nM、または5nM〜約25nMの細胞間濃度を含む。局所組成物は、熟練した臨床医の日常的な裁量に従って、1日1〜4回眼の表面に送達される。製剤のpHは、pH4〜9またはpH4.5〜pH7.4である。
【0072】
正確なレジメは臨床医の裁量に委ねられているが、干渉RNAは、1日1〜4回それぞれの眼に1滴点眼するか、または臨床医の指示に従って投与される場合がある。製剤の有効量は、例えば、対象の年齢、人種および性別、または緑内障の重篤度のような要因により異なる場合がある。一実施形態において、干渉RNAは眼に局所送達され、治療用量で小柱網、網膜または視神経頭に到達し、それによってSAA関連疾患過程を改善する。
【0073】
許容可能な担体:眼に許容可能な担体は、多くても全くまたは殆ど眼に刺激を与えることがなく、必要に応じて適切な保存をもたらし、本発明の1つ以上の干渉RNAを同一投与で送達する担体を意味する。本発明の実施形態の干渉RNAの投与に許容可能な担体には、Mirus TransIT(登録商標)−TKO siRNA Tranfection Reagent(Mirus Corporation[米国ウィスコンシン州マディソン])、LIPOFECTIN(登録商標)、リポフェクタミン、OLIGOFECTAMINE(登録商標)(Invitrogen[米国カリフォルニア州サンディエゴ])、CELLFECTIN(登録商標)、DHARMAFECTTM(Dharmacon[米国イリノイ州シカゴ])またはポリリジンのようなポリカチオン、リポソーム、またはコレステロールのような脂肪溶解剤が含まれる。リポソームは、標準的な小胞形成脂質およびコレステロールのようなステロールから形成され、これには、例えば内皮細胞表面抗原に対する結合親和性を有するモノクローナル抗体のような標的分子が含まれる場合がある。さらに、リポソームはペグ化リポソームとなる場合がある。
【0074】
眼への送達では、干渉RNAは、眼科学的に許容可能な防腐剤、共溶媒、界面活性剤、粘度増強剤、浸透促進剤、緩衝剤、塩化ナトリウム、または水性で無菌の眼科用懸濁液若しくは溶液を形成する水と混合される場合がある。眼科用溶液製剤は、生理学的に許容可能な等張水性緩衝剤に抑制剤を溶解することによって調製される場合がある。さらに、眼科用溶液には、抑制剤の溶解を助ける眼科学的に許容可能な界面活性剤が含まれる場合がある。ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、メチルセルロース、ポリビニルピロリドン等のような粘度上昇剤を本発明の組成物に添加して、化合物の保持率を改善する場合もある。
【0075】
眼科用無菌軟膏製剤を調製するには、干渉RNAを、鉱油、液状ラノリンまたは白色ワセリンのような適切なビヒクル中の防腐剤と混合させる。眼科用無菌ゲル製剤は、他の眼科用製剤の技術で既知の方法に従って、例えばCARBOPOL(登録商標)−940(BE Goodrich[米国ノースカロライナ州シャーロット])等の組み合わせから調製した親水性基剤中に干渉RNAを懸濁することによって調製される場合がある。例えば、VISCOAT(登録商標)(Alcon Laboratories,Inc.[米国テキサス州フォートワース])は眼内注入に使用される場合がある。本発明の他の製剤は、干渉RNAが眼にあまり浸透しない場合に、cremephorおよびTWEEN(登録商標) 80(ポリオキシエチレンソルビタンモノラウレート、Sigma Aldrich[米国ミズーリ州セントルイス])のような浸透促進剤を含有する場合がある。
【0076】
キット:本発明の実施形態は、細胞におけるSAA mRNAの発現を減衰させる試薬を含むキットを提供する。キットは、干渉RNAに対応する二つの相補性一本鎖RNAをコード化するヌクレオチド配列にそれぞれ作動可能に結合する、T7プロモーター、T3プロモーターまたはSP6プロモーターのような二つの異なるプロモーターを有するDNAテンプレートを含有する。RNAは、DNAテンプレートから転写され、アニールされて、標的mRNAの発現を減衰させるのに有効な二本鎖RNAを形成する。キットは場合により、DNAテンプレートからDNA配列を増幅する増幅プライマー、およびRNAを合成するヌクレオチド三リン酸(即ち、ATP、GTP、CTPおよびUTP)を含有する。場合により、キットは、それぞれ、DNAテンプレートのプロモーターに結合することができ、且つプロモーターが作動可能に結合するヌクレオチド配列を転写することができる、二つのRNAポリメラーゼ、サイズ排除カラムのような、一本鎖RNAを精製する精製カラム、1つ以上の緩衝剤、例えば一本鎖RNAをアニーリングして二本鎖RNAを生じる緩衝剤、および二本鎖RNAを精製するRNAse AまたはRNAse Tを含有する。
【0077】
例えば、ヒト小柱網(TM)細胞内で内因性SAA発現のレベルをノックダウンするSAA干渉RNAの能力は、以下の通り実施する。GTM3またはHTM−3(Pang,I.H,et al.,1994.Curr.Eye Res.13:51−63を参照)と呼ばれる形質転換ヒトTM細胞系のトランスフェクションを、本明細書で引用されるSAA干渉RNA(100nM)およびLIPOFECTAMINETM 2000(Invitrogen[米国カリフォルニア州カールスバッド])の標準的なインビボ濃度を1:1(w/v)の比率で使用して達成する。スクランブルおよびラミンA/C siRNA(Dharmacon)を対照として使用する。
【0078】
QPCR TAQMAN(登録商標)フォワードおよびリバースプライマー、並びに標的部位を包含するプローブセットを、mRNA切断の程度を評価するために使用する。このようなプライマー/プローブセットは、例えば、ABI(Applied Biosystems[米国カリフォルニア州フォスターシティー])によって合成される場合がある。
【0079】
非特異的で標的を外す効果の機会を減らすために、SAA mRNAの発現を阻害する可能な限り低いsiRNA濃度を、siRNAについて判定する。SAA mRNAノックダウンは、適切なプライマー/プローブセットを使用するQPCR増幅により評価する。GTM3細胞におけるSAA siRNAの用量反応を、例えば、0、1、3、10、30および100nMの用量範囲のsiRNAにより24時間治療を行った後、GTM3細胞で観察する。データは、GraphPad Prism 4ソフトウェア(GraphPad Software,Inc.[米国カリフォルニア州サンディエゴ])を使用して、勾配変化、S字型用量反応アルゴリズム、および頂点拘束100%によりフィッティングする。試験を行った特定のsiRNAについてIC50を得る。
【0080】
実施例1
小柱網細胞におけるSAAをサイレンシングする干渉RNA
本研究では、正常なおよび緑内障のヒト小柱網(TM)細胞における内因性SAA発現のレベルをノックダウンするSAA干渉RNAの能力を試験する。
【0081】
正常(NTM765−04−OD,p5)および緑内障(GTM686−03−OS,p6)TM細胞系のトランスフェクションを、SMARTPOOL(登録商標) SAA干渉RNAプール(100nM)およびDHARMAFECT(登録商標) #1トランスフェクション試薬(Dharmacon Research Inc.[米国イリノイ州シカゴ])の標準的なインビボ濃度を使用して実施した。SMARTPOOL(登録商標) SAA干渉RNAは、配列番号11、配列番号18、配列番号19および配列番号20の配列識別子を有するSAA mRNA領域を標的にするように設計された、四つの相同的な二本鎖siRNAのプールを含み、三つの異なる濃度(処理1:0.05μl/100μlウェル;処理2:0.2μl/100μlウェル;処理3:0.4μl/100μlウェル)で24または48時間にわたり3回使用した。対照は処理しなかった。
【0082】
mRNAレベルに対する効果:SAA mRNAのQPCR解析では、RNAqueous−4TM PCR(Ambion[米国テキサス州オースティン])を使用して24時間処理した細胞から全RNAを抽出し、TaqMan(登録商標)逆転写試薬(PE Biosystems[米国カリフォルニア州フォスターシティー])を使用してcDNAを合成した。QPCRは、TaqMan(登録商標)ユニバーサルPCRマスターミックスおよび7700 SDS(PE Biosystems)を使用して3回実施した。マルチプレックスQPCRでは、リボソームRNA(18s rRNA、PE Biosystems)を標準化対照として使用した。QPCR解析は、2組のTaqMan(登録商標)プローブ/プライマーセット(PE Biosystems)を使用して実施し、第一のセット(P423)はSAA cDNA配列のコード領域を標的にし、第二のセット(P428)は非コード領域を標的にする。
【0083】
図1に示す通り、P423プライマーセットを使用した処理3の条件下でsiRNA処理したNTM765−04正常細胞には、18s rRNAと比べて約35%のSAA mRNAの阻害が認められた。図2に示す通り、P423プライマーセットを使用した処理3の条件下でsiRNA処理したGTM686−03緑内障細胞には、18s rRNAと比べて約41%のSAA mRNAの阻害が認められた。同様の結果はプライマーセットP428を使用しても得られた。
【0084】
SAAタンパク質レベルに対する効果:48時間処理した細胞から調製した細胞可溶化物中の内因性SAAタンパク質のレベルを、ELISAアッセイを使用して調べた。
【0085】
処理1、処理2および処理3のsiRNA処理したGTM686緑内障細胞全てでは、約66%のSAAタンパク質の減少が認められたが(図5)、NTM675細胞では認められなかった(図4)。内因性SAAタンパク質レベルは、何れの小柱網細胞系でも極めて低く、特にNTM765正常細胞で低かった。
【0086】
細胞増殖および形態に対する効果:TM細胞形態に対するSAA siRNAの効果を、リアルタイム電子検出システム(RT−CESTM、ACEA Biosciences,Inc.[米国カリフォルニア州サンディエゴ])により監視した。図3に示す通り、siRNA処理より、TM細胞の増殖または形態に対する毒性作用は認められなかった。
【0087】
本明細書に引用する参考文献は、これらが本明細書の記載内容の補足となる例示的な手順またはその他の詳細を示す限りにおいて、参考として明確に組み入れられる。
【0088】
本発明の開示内容に照らして、当業者は、本発明の趣旨および範囲から逸脱することなく、本明細書に開示される実施形態の明白な変更を行えることを理解する。本明細書に開示される全ての実施形態は、本発明の開示内容に照らして、過度の実験を行うことなく実行および実施することができる。本発明の全ての範囲は、本開示内容およびその同等の実施形態に記載されている。本明細書は、本発明が権利を受ける保護の全範囲を過度に狭めるものとして解釈されるべきではない。
【0089】
本明細書で使用される「a」および「an」という冠詞は、特に指示がない限り、「1つ」、「少なくとも1つ」または「1つ以上」の意味をとる。
【数1】

【数2】

【数3】

【数4】

【数5】

【数6】

【数7】

【数8】

【数9】

【数10】

【数11】

【数12】

【数13】

【数14】

【特許請求の範囲】
【請求項1】
本願明細書に記載された発明。
【請求項1】
本願明細書に記載された発明。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−193209(P2012−193209A)
【公開日】平成24年10月11日(2012.10.11)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−157485(P2012−157485)
【出願日】平成24年7月13日(2012.7.13)
【分割の表示】特願2007−548440(P2007−548440)の分割
【原出願日】平成17年12月19日(2005.12.19)
【出願人】(399054697)アルコン,インコーポレイテッド (102)
【Fターム(参考)】
【公開日】平成24年10月11日(2012.10.11)
【国際特許分類】
【出願番号】特願2012−157485(P2012−157485)
【出願日】平成24年7月13日(2012.7.13)
【分割の表示】特願2007−548440(P2007−548440)の分割
【原出願日】平成17年12月19日(2005.12.19)
【出願人】(399054697)アルコン,インコーポレイテッド (102)
【Fターム(参考)】
[ Back to top ]

