線維性疾患のためのモデルとしての遺伝子導入動物
【課題】線維性疾患で発現を示すfra-2の広範な又は細胞タイプに特異的な異所性発現を有する遺伝子を導入したヒトではない動物、該動物を得るための方法及びそれらの使用を提供すること。
【解決手段】遺伝子導入ベクターを有する遺伝子導入齧歯動物の線維性疾患のモデルとしての使用であって、前記遺伝子導入ベクターが、(i)ゲノムfra−2遺伝子座、(ii)H2Kbプロモーター、及び(iii)FBJ−マウスサルコーマウイルスの長い末端反復(LTR)配列を有し、線維性疾患の表現型を示すfra−2の広範な又は細胞タイプに特異的な異所性発現を有することを特徴とする、使用。
【解決手段】遺伝子導入ベクターを有する遺伝子導入齧歯動物の線維性疾患のモデルとしての使用であって、前記遺伝子導入ベクターが、(i)ゲノムfra−2遺伝子座、(ii)H2Kbプロモーター、及び(iii)FBJ−マウスサルコーマウイルスの長い末端反復(LTR)配列を有し、線維性疾患の表現型を示すfra−2の広範な又は細胞タイプに特異的な異所性発現を有することを特徴とする、使用。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、肺性線維症及び皮膚の線維性疾患のような線維性疾患のための動物モデル、特にマウスモデルに関する。
【背景技術】
【0002】
肺性線維症は、世界中で五百万人に影響を及ぼす破壊的な疾患である。しかし、実際の人数は、起こり得る誤診のためにさらに著しく多いであろう。典型的には、患者は40歳代及び50歳代で、息切れ、慢性的な咳、疲労、食欲の喪失、及び急速な体重減少を含む症候群と共に肺性線維症を患う。診断後の平均生存期間は5年より短い(Giri, 2003)。肺性線維症は個別の実体として見えないが、通常は環境暴露に関連して患うか、又は症候群に伴うものとして患う。一般的な原因は、アスベスト、金属粉塵又は有機物質への暴露、サルコイドーシス(肉芽腫の形成を特徴とする疾患)、医薬品及び放射線への暴露である。肺性線維症はしばしば、リウマチ様関節炎及び強皮症などの結合組織病又は膠原病に関連する(Giri, 2003)。
病理学的には、該疾患は、肺の線維芽細胞病巣内の慢性炎症及びコラーゲン生成を特徴とする。線維芽細胞病巣の顕著な特徴である筋線維芽細胞は、形質転換成長因子β(TGF-β)の刺激による実質性線維芽細胞の局所的活性から生じると考えられ、歴史的には線維性障害におけるコラーゲン生成細胞であると考えられている(Selman and Pardo, 2003);さらに、CTGF(結合組織成長因子)は非常に重要な因子であると考えられており、分化及びコラーゲン遺伝子発現に必要である。しかし、最近の知見はこの基本的な考え方に疑問を呈しており、病理学的線維芽細胞の造血由来を提案している(Hashimoto et al., 2004)。
該疾患は、典型的には肺の瘢痕化及び線維性組織によって線が引かれる肺胞を進行させる。瘢痕が形成されると該組織は厚くなり、酸素を血流に運ぶ該組織の能力効率に不可逆的な損失を引き起こす(Gross and Hunninghake, 2001)。
【0003】
いくつかの成長因子は、肺性線維症の病原に関係している。これらの因子は、線維芽細胞分裂及び細胞外基質(ECM)生成を刺激するそれらの能力、並びに線維性肺疾患を有する患者又は動物の肺及び肺流体におけるそれらの存在によって特定される。これらの成長因子は、TGF-β、インスリン様成長因子(IGF)-I、血小板由来成長因子(PDGF)、線維芽細胞成長因子(FGF)群の要素及びケラチノサイト成長因子(KGF)を含む(Krein and Winston, 2002)。
現在、肺性線維症のための有効な処置又は治療はない。肺の瘢痕を治療するための薬理学的試薬は、依然として実験段階である。従来の理論はそれが自己免疫障害であろうことを前提としていたが、炎症を抑えるための処置は線維性進行を減少させる限定された成功のみを有する(Giri, 2003)。肺性線維症は非常に複雑な疾患であるため、診断後の患者の寿命予測は非常に変化する。
【0004】
肺性線維症が主に慢性炎症によって引き起こされるか否かは、依然として議論のある問題である(Gross and Hunninghake, 2001)。本来、実験的証拠は線維性肺疾患がそれらを発端とする炎症性障害であることを示唆した。例えば、肺性線維症は、肺の炎症性媒介腫瘍壊死因子α(TNF-α)の異所性発現を有するマウスで発生する(Miyazaki et al., 1995)。さらに、マウスの肺性線維症のブレオマイシンモデルでは、該線維症は、高濃度のTNF-αの生成を含む深刻な炎症によって進行される(Piguet et al., 1989)。重要なことは、TNF-α-欠乏又はTNF-α受容体-欠乏マウスが、ブレオマイシン誘発肺性線維症に対して抵抗する(Ortiz et al., 1998; Piguet et al., 1997)。これらの結果は、線維症は炎症性カスケードが回復不能な組織損傷が生じる前に妨害されると回避され得るという仮設を導いた。従って、この理論は、肺性線維症のコルチコステロイド及び細胞障害性療法のための最初の熱意を説明する。しかし今では、現在の抗炎症性療法がほとんど利益を与えないことが明らかである(Giri, 2003)。従って、一部の研究は、線維性肺障害が炎症性障害でないことを示すのを試みている。例えば、線維性肺疾患の発生は、一過性の炎症性応答のみを有する動物の肺に対するTGF-βのアデノウィルス導入によって誘発することができる。これらの新規洞察は、肺性線維症が慢性損傷よりもその後の損傷を治療する応答を伴う逐次的肺損傷から生じることを示唆している。従って、線維芽細胞複製及び基質沈着の修正に基づく治療計画が確立されている。しかし、コルヒチン治療(細胞内コラーゲン処理を妨害する)又はペニシラミン治療(コラーゲン架橋阻害剤)後の患者では、有益な臨床効果は全く見られなかった。線維成長を遮断する実験中の他の試薬は、ピルフェニドン、インターフェロンγ又はTGF-β情報伝達に対する抗体を含む(Giri, 2003)。
【発明の概要】
【0005】
従って、線維性疾患、例えば肺性線維症の研究、及び該障害の治療のための薬剤候補を試験するための有効且つ確実な動物モデルが必要である。
従って、本発明の目的は、線維性疾患、例えば強皮症様疾患に関連して発生する肺性線維症(全身性線維症)、又は他の線維性疾患のための動物モデルを提供することである。
本発明による問題の解決策は、転写調節因子AP-1に結合した分子機構に基づく。
転写調節因子AP-1は、Fos、Jun、及びCREB/ATF蛋白質群の一連の二量体生成物(Eferl and Wagner, 2003)、並びに他のbZip蛋白質によって生成される。さらに、Fos又はJunとNFκBのp65サブユニットとの間(Stein et al., 1993)、及びATF-2とp50-NFκBとの間(Du et al., 1993)に結合が観察された。組み合わせの結合は、3種のJun遺伝子(c-jun、junB、junD)、4種のFos遺伝子(c-fos、fosB、fra-1、fra-2)及び数種のCREB/ATF遺伝子(Eferl and Wagner, 2003)で引き出すことができる。全構造上の特徴における高度の相同性にも関わらず、Fos、Jun及びCREB群の種々の要素は著しい違いを示し、これらは個々の二量体のための遺伝子調節における特定の機能を示唆するDNA結合及び転写活性にわずかな違いを導く(Jochum et al., 2001)。AP-1群の要素は、細胞増殖並びに種々のタイプの分化の制御に関与し、神経機能及びストレス反応にも関与する。AP-1は、外部刺激を遺伝子発現の短期間及び長期間変化の両方に変換する主要因子の1種である(Jochum et al., 2001)。
【0006】
Jun及びFos蛋白質群の要素は共に、骨形成及び再生に必要である。条件付きcjun対立遺伝子の偏在する部分的欠乏は軸骨格の奇形を導き(Behrens et al., 2003)、最近になってJunBが骨細胞(骨形成細胞)増殖及び分化に必須であることが示された(Kenner et al., 2004)。大部分のFos蛋白質は、骨細胞及び破骨細胞(骨吸収細胞)の増殖及び分化に関与している。c-Fosを発現する遺伝子導入マウスは、骨細胞増殖の増加によって骨肉腫を発生する(Grigoriadis et al., 1993)。対照的に、c-Fosが欠如しているマウスは、破骨細胞系統における分化欠乏によって引き起こされる骨石化症を発生する(Grigoriadis et al., 1994; Wang et al., 1992)。この分化欠乏は、Fos及びFra-1が破骨細胞分化において重複する機能を有することを示唆するFos関連蛋白質Fra-1の発現によって救済することができる(Fleischmann et al., 2000)。条件付きマウスモデルにおけるFra-1の損失は、骨細胞の機能欠乏による骨量の減少を導く(Eferl et al., 2004)。一貫して、異所性Fra-1発現はおそらくは成熟した骨細胞への骨芽前駆細胞の促進された分化により骨硬化症を導く(Jochum et al., 2000)。同様の骨格表現型は、FosBの挿入変形であるΔFosBを発現する遺伝子導入マウスに記載されており、Fra-1及びΔFosBが骨細胞系統における共通の転写性標的遺伝子を調節することにより骨細胞分化が促進することを示唆した(Sabatakos et al., 2000)。しかし、骨形成におけるFra-2の必要性はそれ程明らかでない。軟骨細胞におけるFra-2の条件付き欠乏は骨量の減少を導くが(Karreth et al., 2004)、機能研究の増減は骨芽細胞又は破骨細胞で行われない。
【0007】
“異所性発現”は、そのような遺伝子が通常は発現しないか又は通常はより低い濃度で発現する組織での遺伝子発現の発生を表す。
本発明を導く実験では、Fra-2の遺伝子座が遺伝子導入マウス(fra-2tg)に広く過剰発現し、これは本来、骨芽細胞及び破骨細胞機能において増加したFra-2活性の結果を調査するためのものである。fra-2tgマウスのための遺伝子導入ベクターは、c-fostg及びfra1tgマウスと同様の方法で設計され(Grigoriadis et al., 1993; Jochum et al., 2000)、3種の遺伝子導入マウスモデルの有意義な比較を可能にする。
【0008】
前述のfra-2遺伝子導入マウスによる実験(Mc Henry et al., 1998)は、通常の眼における発生を乱すことを示し、驚くべきことに、本発明の実験ではfra-2の過剰発現がヒト肺性線維症に類似する表現型となることが見出された。驚くべきことに、fra-2遺伝子導入マウスは、主に肺に影響を及ぼす全身性線維症を発生して6ヶ月以内に死亡する。肺性線維症に加え、本発明の実験では、強皮性様表現型を導く数種の他の組織において線維症を患うことが示された。
従って、本発明は、線維性疾患の表現型で発現を示すfra-2の広範な又は細胞タイプに特異的な異所性発現を有するヒトではない遺伝子導入哺乳動物、特に齧歯動物を含む、線維性疾患のための動物モデルに関する。
【図面の簡単な説明】
【0009】
【図1】A)fra-2遺伝子導入ベクターの概略スキーム。H2kbプロモーターをfra-2発現に用いる。fra-2の後にIRES-EGFPレポーター遺伝子を用いて導入遺伝子活性を監視し、LTR配列をmRNA安定化のために含ませる。LoxP部位は、導入遺伝子のCre-リコンビナーゼ-媒介欠乏を可能にする。H2Kb:H2Kbプロモーター;E1-E4:fra-2のエキソン1-4;ポリA:ポリアデニル化信号;Hind III:サザンブロット分析に用いた限定部位。B)ゲノムにおける導入遺伝子のコピー数を決定するための3種の遺伝子導入系統(12、13、15)のサザンブロット分析。マウスの尾からのDNAをHind IIIで温浸させ、fra-2のエキソン2に対応する配列でプローブする。野生タイプ及び遺伝子導入バンドの位置を示す。定量化は、遺伝子導入系統12、13及び15のそれぞれに対して4回、60回及び2回の遺伝子導入コピーを明らかにした。C)遺伝子導入系統12、13及び15からの2種の組織(肝臓及び心臓)によるfra-2発現のためのRNase保護検定。Fra-2の発現は、系統12及び13の両組織で同程度まで増加する。導入遺伝子発現は遺伝子導入系統15では全く検出されない。GAPDHの発現は、ローディング・コントロールとして用いる。D)大人(6週間目)の遺伝子導入マウス(系統13)の異なる組織によるRNase保護検定。導入遺伝子は、脳、thy:胸腺、kid:腎臓、spl:脾臓、cal:頭頂部を除いて偏在して発現する。
【図2】A)fra-2tgマウスの早期致死率を示すKaplan Meierプロット。fra-2導入遺伝子の高い発現を有するマウス(系統12及び13)は成人期に病気になり、6週間目辺りで死に始めた。早期致死率は、導入遺伝子の発現を全く示さない系統15のマウスでは見られない。B)fra-2tgマウスの体重に対する増加した肺の比。肺の重さの増加が、系統12及び13の遺伝子導入マウスで観察される(ここでは系統12を示す)が、系統15では観察されない。肺の重さの大きな増加は、遺伝子導入マウスの致死率と一致する。病気は、体重の損失、毛の外見、マウスの弱さ及び息切れにより判断される。
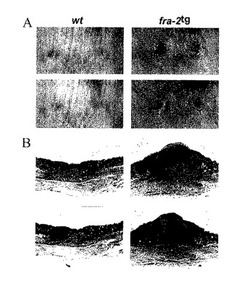
【図3】A)fra-2tg肺の全体的な形態。系統12及び13のマウスは、明らかな線維症を有する劇的に増加した肺を示す。B)fra-2tg肺のH&E-染色切片。系統12及び13のマウスは、間質性肺線維症(上部のパネル)及び血管の狭窄(下部のパネル)を示す。
【図4A】fra-2tgにおける強皮症様症候群の発生。コラーゲンのためのアニリンブルー染色(青色)は、fra-2tgマウスにおける線維性障害は肺に限定されないが、他の器官(肝臓、皮膚及び心臓が例として示されている)でも観察できることを明らかにした。
【図4B】fra-2tgマウスの肺におけるコラーゲン発現の同時PCR分析。線維性コラーゲンタイプI及びタイプIIIの発現は、病気のマウスの肺で増加した。
【図5A】fra-2tgマウスにおける肺性線維症は、血管及び炎症性細胞の血管周囲の移入で始まる。fra-2tg肺のH&E-染色は、肺性線維症における最初のイベントとしての炎症を説明する(上部のパネル)。炎症性細胞は、主にCD3-陽性T-細胞(黒色染色、矢じり)及び顆粒細胞などのエステラーゼ-陽性骨髄細胞(赤色染色、矢じり)からなる。
【図5B】炎症は、RNase保護検定によって説明されるfra-2tgマウスの肺におけるケモカイン及びサイトカインの蓄積を引き起こす。
【図6A】fra-2tg骨髄で再構築された野生タイプのマウスにおける全く深刻でない肺性線維症。致死量の放射線照射の後にfra-2tg骨髄で再構築された野生タイプのマウスの肺及び肝臓切片は、線維症が容易には移植され得ないことを実証する。
【図6B.C.D】B)野生タイプの骨髄で再構築された野生タイプのマウスからの骨髄細胞のFACSプロフィール。C)fra-2tg骨髄で再構築された野生タイプのマウスからの骨髄細胞のFACSプロフィール。ほとんど全ての骨髄細胞が導入遺伝子発現を反映するEGFPレポーター遺伝子を発現することに注意。D)器官/体重比は、全く深刻でない肺性線維症がfra-2tg骨髄で再構築された野生タイプのマウスで発生することを確証する。
【図7A】野生タイプの骨髄で再構築されたfra-2tgマウスにおける深刻な肺性線維症。致死量の放射線照射の後に野生タイプの骨髄で再構築されたfra-2tgマウスの肺及び肝臓切片は、野生タイプの骨髄の存在下で線維症が発症することを実証する。
【図7B.C.D】B)野生タイプの骨髄で再構築された野生タイプのマウスからの骨髄細胞のFACSプロフィール。C)野生タイプの骨髄で再構築されたfra-2tgマウスからの骨髄細胞のFACSプロフィール。ほとんど全ての遺伝子導入EGFP-陽性細胞が消失したことに注意。D)器官/体重比は、肺性線維症が野生タイプの骨髄で再構築されたfra-2tgマウスで発生したことを確証する。
【図8A.B】A)fra-2tgマウスの全層創傷後の遅れた創傷治癒。Fra-2遺伝子導入マウスは、背中の皮膚の全層創傷後に遅れた創傷閉鎖を示す(上部パネル:創傷後8日目、下部パネル:創傷後11日目)。B)コラーゲンからなる増加した量の肉芽組織が、fra-2遺伝子導入マウスの創傷で見える(創傷後11日目;上部パネル:H&E-染色;下部パネル:コラーゲンのための青色CAB-染色)。
【図8C】C)創傷治癒の定量化は、fra-2遺伝子導入マウスにおける遅れた創傷閉鎖が早ければ創傷後3日で始まることを説明する。
【図8D.E.F.G】D-G)創傷時及び創傷後3日目に採取された皮膚生検によるRNase保護検定。fra-2を除くAP-1要素(D)、基質メタロプロテイナーゼ(E)、TIMPs(E)、サイトカイン(F)、TGF-β群要素(F)及びケモカイン(G)の発現における違いは観察することができない。
【発明を実施するための形態】
【0010】
“線維性疾患”という用語は、例えば慢性炎症又は組織の修復及び再組織化により得る線維症を伴う疾患に関する。線維症は、腎臓、心臓、肺、肝臓、皮膚及び関節を含む器官又は組織の通常の成分としての線維性組織の形成とは反対に、修復性又は反応性方法としての器官又は組織における過剰な線維性結合組織の形成又は発生である。
好ましい実施態様では、線維性疾患は肺性疾患、特に肺性線維症である。
本発明の意味では、“肺性疾患”という用語は、肺(肺性)線維症及び突発性肺性疾患から選択される線維性成分を伴う肺性疾患、他の間質性肺炎(IP)、例えば巨細胞性間質性肺炎、非特異性IP、突発性組織化肺炎、膠原血管病関連IP、及び薬剤誘発IP、さらにサルコイドーシス、嚢胞性線維症、呼吸窮迫症候群、肉芽腫症、ケイ肺症、石綿症、肺を含む全身性強皮症、並びに線維症及び喘息又はCOPDにおける再構築を含む。
【0011】
さらなる実施態様では、線維性疾患は全身性線維症であり、これは、限定するわけではないが、さらに肺及び/又は皮膚、脾臓、心臓、腎臓及び/又は肝臓を含む数種の標的器官でそれ自体を表す強皮症様線維症である。
また、本発明の実験では、fra2tgマウスが、過剰な治癒に関連する皮膚の線維性障害を患うことが示された。皮膚のケロイド及び肥大性瘢痕は、該線維性皮膚障害の例である。
マウスの背中の皮膚の全層創傷治癒実験は、創縫合がfra-2tgマウスで遅れることを実証し、これは閉じている創傷における肉芽組織の過剰な生成によるものであり、過剰な瘢痕形成を導く。
従って、さらなる特徴では、本発明の動物モデルは線維性皮膚障害のためのモデルとしても有用である。
【0012】
“遺伝子導入齧歯動物”により、生殖細胞系に(すわなち、その細胞の大部分又は全てのゲノム配列に)安定に一体化される非内在性(すなわち、非相同性)核酸配列符号化Fra-2 DNAを有する齧歯動物(例えば、マウス、ラット、ハムスターなど)が意味される。あるいは、fra-2導入遺伝子は、fra-2の異所性発現を有するキメラマウスの産生のための胚幹細胞に導入することができる。
好ましい実施態様では、齧歯動物がマウスである。
異種Fra-2核酸は、例えば、標準プロトコルに従う宿主動物の胚又は胚幹細胞の遺伝子操作によってそのような動物の生殖細胞系に導入される。
以下では、fra-2遺伝子導入齧歯動物/マウスを“fra-2tg”齧歯動物/マウスと呼ぶ。
【0013】
明確にするために、“fra-2tgマウス”、又は“fra-2tg齧歯動物”という用語はそれぞれ、本発明の意味では、広範な又は細胞タイプに特異的な導入遺伝子発現を可能にするプロモーターの制御下で、fra-2ゲノム座又はfra-2 cDNAを有する遺伝子導入齧歯動物/マウスである。
“fra-2”(又は“Fra-2”)によって、関心のある表現型、すなわち線維性疾患、特に肺性線維症でそれ自体を示すような適切な濃度及び位置における好適なプロモーターの制御下で発現するときに起因する、任意の哺乳類種からのfra-2 DNA(又はFra-2蛋白質)を意味する。
選択されたfra-2 DNAは、選択された動物種(例えば、マウスがマウスfra-2 DNA導入遺伝子を有し、ラットがラットfra-2導入遺伝子を有する)の同種fra-2遺伝子と同一でよく、又は異なっていてもよく、例えば特にヒト疾患のためのモデル及びヒト疾患のための阻害剤をスクリーニング又は特徴付けるためのモデルとしての動物の使用を考慮して、ヒトfra-2でよい。
【0014】
fra-2/Fra-2 DNA/蛋白質配列は、例えば、ヒト(GenBank Accession No. X16706; Matsui et al., 1990)、マウス(GenBank Accession No. NM_008037; Foletta et al., 1994)又はラット(GenBank Accession No. NM_012954)からの文献で公知である。
本発明の実験では、成分H2-Kb(プロモーター)、IRES-EGFP(レポーター遺伝子)及びLTR(エンハンサー)を遺伝子導入構築に用いた;これらの成分は他の成分と置き換えることができるが、但し体内の濃度及び場所における導入遺伝子の発現は、それ自体を関心のある表現型で示すようなものである。導入遺伝子発現に好適な偏在性プロモーターの例は、ユビキチンCプロモーター、CMVプロモーター/エンハンサー、Pgk1プロモーター又はニワトリβ-アクチンプロモーターである(Schorpp et al., 1996)。導入遺伝子発現を監視するのに好適なレポーターシステムの例は、β-ガラクトシターゼ、EGFP、EYFP、ERFPである。fra-2の広範な発現を保証するための構築物に任意に存在してよい好適なエンハンサー成分の例は、FBJマウス骨肉腫ウィルスからの長い末端反復(LTR)である。
【0015】
本発明を導く実験では、以下の実験システムを用いた:第一に、ゲノムマウスλDNAライブラリー(マウス株129 Sv)を、fra-2の4種のエキソンに結合する標識オリゴヌクレオチドを有するマウスfra-2遺伝子のためにスクリーニングした。Fra-2全長遺伝子座を単離し、特徴付け、及び配列を決定した。該4種のエキソンの配列は、公表されているマウスFra-2 cDNA配列と完全に対応した(Foletta et al., 1994)。主要組織適合遺伝子複合体クラスI抗原H2-Kbのためのプロモーター(Grigoriadis et al., 1993)を、fra-2遺伝子座の前にクローン化し、偏在性導入遺伝子発現を可能にする。生体内における導入遺伝子活性を監視するために、IRES-EGFP(Zhu et al., 1999)配列を、fra-2遺伝子座の後にクローン化し、それに続いてFBJ-マウスサルコーマウィルスの長い末端反復(LTR)をクローン化して、fra-2 mRNAを安定化させ且つ間葉細胞における導入遺伝子発現を保証した(Grigoriadis et al., 1993)。さらに、loxPサイトを、エキソン2の前且つエキソン4の後に配置し、導入遺伝子発現の異なる導入遺伝子コピー数及び濃度により、導入遺伝子多量体のCre-媒介欠損及び数種の遺伝子導入系統の生成を可能にする。
【0016】
特にマウスのfra-2tg 齧歯動物は、例えばCre-loxP媒介遺伝子操作(例えばOrban et al., 1992; Sauer, 1993に記載)、受精した卵母細胞へのfra-2導入遺伝子の微量注入、受精した卵母細胞への細菌人工染色体(BACs)に基づく大量の導入遺伝子の注入(例えばChrast et al., 1999; Hong et al., 2001に記載)、レトロウィルス(Blesch, 2004)又は導入遺伝子を有する他のベクターによる8個の細胞分裂時期の胚の感染、例えばアデノウィルス(Lai et al., 2002)及びレンチウィルス媒介(Blesch, 2004)体細胞性遺伝子導入、導入遺伝子を有する構築物による胚幹(ES)細胞の移入又は感染(Wolf and Woodside, 2005)により、遺伝子導入動物を生成するための公知なプロトコルに基づく方法で得ることができる。
【0017】
さらなる特徴では、本発明は、肺性線維症のための動物モデルとしての、肺細胞、例えば気道上皮細胞、線維芽細胞、筋線維芽細胞及び造血性細胞のfra-2の異所性発現を有する齧歯動物、例えばマウスに関する。これらの特異的な細胞タイプにおける異所性発現を得るために、細胞タイプに特異的なプロモーターが遺伝子導入動物を生成するのに用いられ、例えば、気道上皮細胞のための界面活性蛋白質C(Boggaram, 2003)プロモーター、又はCD4プロモーター(Tanigaki et al., 2004)、CD19プロモーター(Rickert et al., 1997)、造血性細胞のためのLysMプロモーター(Clausen et al., 1999)又は線維芽細胞のためのプロ-α1(I)コラーゲンプロモーター(Rossert et al., 1995)である。これらの細胞タイプに加え、異所性発現が関心のある表現型に関連のある他の細胞に望ましくなり得る。上記細胞と類似して、fra-2発現は、細胞タイプに特異的なプロモーターを用いることにより、これらの細胞における導入遺伝子の配向性発現によって達成することができる。
【0018】
さらなる特徴では、本発明は、それらのゲノムにヒト又は齧歯動物fra-2 DNAが組み込まれた遺伝子導入齧歯動物細胞、特にマウス細胞に関する。fra-2遺伝子導入細胞は、偏在様式又は特に関心のある細胞タイプのいずれかでfra-2の異所性発現を有する齧歯動物から得ることができる。該細胞は、線維性疾患、特に肺性線維症の発生に寄与するそれらの能力に関して選択され、例えば、線維芽細胞又は筋線維芽細胞のような造血性細胞、肺性上皮細胞又は間葉細胞である。一方で線維芽細胞の過剰な成長及び他方で筋線維芽細胞の形成(線維芽細胞の形質転換から生じるか、又は造血性細胞から生じる)が肺性疾患の表現型に関連があるため、線維芽細胞及び筋線維芽細胞が特に関心が高い。
【0019】
関心のある細胞は公知の方法で単離及び培養することができ、例えば線維芽細胞、筋線維芽細胞、肺上皮細胞である(Dong et al., 1997; Phipps et al., 1989)。
あるいは関心のある細胞を遺伝子導入動物から単離するために、各主要な細胞又は細胞系をfra-2 DNAで移入することができる。
fra-2tgマウス及びそこから生じる細胞は、肺性疾患のような線維性疾患の治療のための薬剤を試験するのに有用である。
本発明の動物モデルは、治療計画、例えば薬理学的介入によって異常な瘢痕形成を回避するための化合物を試験するのにも用いることができる。特に、fra-2tgマウス又はfra-2tg細胞を、過剰な治癒における瘢痕形成の阻害剤をスクリーニングするための検定に用いることができる。本発明の実験は、Fra-2自体が、過剰な瘢痕形成を含む線維性障害の薬理学的介入のための標的であることを示した。従って、Fra-2阻害剤は、そのような疾患のための阻害剤として有用となり得る。
【0020】
本発明の動物モデルを用いてよいが、Fra-2活性に依存する線維形成性経路を担うプロ炎症性サイトカインの阻害剤を評価するのに限定されない。例えば、肺性上皮細胞の微細損傷を妨げ得る新規阻害剤、例えばアンギオテンシン転化酵素阻害剤又はカスパーゼ阻害剤を、本発明の動物モデルで試験することができる。また、患部の肺の線維性病巣におけるコラーゲンの蓄積又は一般的には線維形成性活性を妨害する特異的な阻害剤を試験することができる。
本発明のさらなる特徴では、遺伝子導入動物及びそこから生じる細胞系はまた、例えば、Fra-2活性に依存する未だ特定されていない線維形成性経路を阻害することにより、線維性疾患、特に肺性線維症の治療に有効な候補化合物を特定又は試験するのに用いることができる。
【0021】
従って、本発明は、さらに線維性疾患、例えば肺性線維症における化合物の治療効果を測定するための方法を提供する。該方法は、有効量の試験化合物をfra-2tg齧歯動物、特にマウスに投与することを含む。該方法は、試験化合物に対する遺伝子導入動物の応答(すなわち、疾患症候群の改善又は消失)を測定すること、及び遺伝子導入動物の応答と例えば野生タイプの動物又はあるいは遺伝子導入動物対照でよい対照動物の応答を比較することを含む。異所性fra-2発現から生じる表現型に効果を有し得る化合物はまた、例えばそのような化合物を特定するための細胞に基づく検定で、細胞に対してスクリーニングしてよい。fra-2を過剰発現する細胞を用いる検定では、該化合物が、線維芽細胞の過剰な成長及び/又は筋線維芽細胞への線維芽細胞の形質転換及び/又は細胞外基質形成におけるそれらの効果を試験することができる。
【0022】
特定の化合物の毒性及び治療効力は、細胞培養液又は実験動物における標準的な医薬品の手順によって測定することができ、例えばLD50(母集団の50%の致死量)及びED50(母集団の50%の治療上有効な用量)を測定する。毒性効果及び治療効果の間の用量比は治療指標であり、比LD50/ED50として表現することができる。大きな治療指標を示す化合物が好ましい。有毒な副作用を示す化合物を用いてよく、そのような化合物を患部組織の部位へ標的とする送達システムを設計し、非感染性細胞に対する潜在的損害を最小化し、それによって副作用を減少させるのに注意を払うべきである。例えば、短い血中濃度半減期を有する吸入化合物による局所的選択性を達成して、肺の線維症を治療する。
【0023】
細胞培養検定及び動物研究から得られたデータを、ヒトに使用するための用量範囲を処方するのに用いることができる。そのような化合物の用量は、好ましくは毒性をほとんど持たない又は毒性が全くないED50を含む濃度を循環する範囲内である。治療濃度域は、毒性効果を持たないより高いED値の使用を可能にし、そのようなED値は、例えばED90以下が好ましい。
用量は、用いた投与形態及び用いた投与経路に依存してこの範囲内で変化する。いかなる化合物でも、治療上有効量は、最初に細胞培養検定から評価することができる。用量は動物モデルで処方し、細胞培養液で測定してIC50以上(すわなち、症候群の半値阻害を達成する試験化合物の濃度)異常を含む循環血漿濃度範囲を達成してよい(作用薬では、IC50値以上の値(又は作用薬ではED50値)が好ましい)。
そのような情報を用いて、ヒトに有用な用量をより正確に決定することができる。血漿中濃度は公知の方法によって測定してよく、例えば高性能液体クロマトグラフィーによる。
【0024】
最後に、動物モデルはヒト線維性疾患、例えば肺性線維症の病因論を研究するのに有用である。肺性線維症の発生に原因のある細胞タイプを定義することが非常に重要である。
従来のブレオマイシン誘発肺性線維症モデルでは、この目的を妨害する骨髄移植研究などの実験が可能でなかった。さらに、fra-2tgマウスをRag2欠乏又はTNF-α受容体p55機能を損失したマウスなどの異なる遺伝的背景に繁殖させ、それぞれの肺性線維症に対する自己反応性T-細胞及びTNF-情報伝達の寄与を評価することができる。本発明の動物モデルで得ることのできる信頼のある細胞タイプ及び主要な情報伝達経路に関する知識は、肺性線維症の治療のために試験する薬剤の一般的な指導に中心的な影響を有する。
【0025】
実施例では、以下の材料及び方法を用いた:
fra-2tgマウスの生成
fra-2全長遺伝子座は、ゲノムλDNAライブラリーから単離し、配列を決定し、及びpBS IIベクターにクローン化する。主要な組織適合性の複雑な分類Iの抗原H2-Kbのためのプロモーター(Grigoriadis et al., 1993)を、fra-2遺伝子座の前にクローン化して、偏在的な導入遺伝子発現を可能にする。導入遺伝子活性を監視するために、IRES-EGFP(Zhu et al., 1999)配列を、FBJ-マウスサルコーマウィルスの長い末端反復(LTR)配列の後に続いているfra-2遺伝子座の後にクローン化する(Grigoriadis et al., 1993)。さらに、loxP部位を、エキソン2の前及びエキソン4の後ろに配置し、導入遺伝子多量体のCre-媒介欠乏、及び異なる導入遺伝子のコピー数を有する数種の遺伝子導入系統の生成、を可能にする。遺伝子導入構築物を、受精したC57Bl76卵母細胞の前核に注入し、3種の独立性遺伝子導入系統を確立する。
【0026】
サザンブロット及びRNase保護検定(RPA)
fra-2サザンブロットでは、10μgのテールDNAをHind IIIで温浸し、野生タイプのfra-2対立遺伝子のための12.5kbの断片、及び導入遺伝子のための7.5kbの断片を得る。バンドの欠乏では、fra-2のエキソン2に対応する0.6kbのKpnI断片をプローブとして用いる。RNase保護検定では、全肺RNAをTRIZOLプロトコル(Sigma)で単離する。RNase保護検定は、製造者のプロトコルに従うRiboQuantマルチ-プローブRNase保護検定システムmCK-2b及びmCK-5c(PharMingen)を用いて行う。
【0027】
組織学
組織は4℃で中性緩衝された4% PFAで終夜固定し、パラフィンに組み込む。5μmの切片を、ヘマトキシリン及びエオシン(H&E)又はクロマニリンブルーのいずれかで染色するか、又はさらに処理する。抗CD3のための免疫組織化学的染色(Santa Cruz)を、製造者の推奨に従い、MultiLink Dakoシステム(Dako E0453)による抗原検索(Dako S1699)の後に行う。
【0028】
骨髄再構築
6〜10ヶ月目の老いた雌のレシピエントマウスに致死量の放射線を照射し、20時間後に雄のドナーマウスからの骨髄で再構築する。骨髄をドナーマウスの大腿骨及び脛骨から流し、カウントし、及び5x106個の細胞をレシピエントの尾の静脈に注入する。組織学的検査のために屠殺した後に、レシピエントから骨髄及び脾臓細胞を定期的に採取し、再構築の効率をサザンブロット及びEGFP-蛍光のためのFACS分析によって評価する。
【0029】
実施例1
fra-2tgマウスの生成及びキャラクタリゼーション
ゲノムfra-2遺伝子座を、遺伝子導入ベクター上に広範な活性H2Kbプロモーターの前且つIRES-EGFPレポーター遺伝子の後に配置する(図1A)。FBJ-マウスサルコーマウィルスの長い末端反復(LTR)配列をfra-2 mRNAの安定化のため、且つ間葉細胞における導入遺伝子発現を保証するために含ませる。エキソン2の前及びエキソン4の後ろに配置されるさらなるloxP部位により、導入遺伝子マルチマーのCre-媒介欠失、並びに異なる導入遺伝子コピー数及び異なる導入遺伝子発現量を有する複数の遺伝子導入系統の生成、が可能となる。異なる導入遺伝子コピー数を有する3種の別個の遺伝子導入系統が生成されている(図1B)。系統12及び13は高濃度の導入遺伝子を発現し(図1C)、それぞれ4、60(4コピー、60コピー)の導入遺伝子コピーを有する。系統15は2(コピー)の導入遺伝子コピーのみを有し、いかなる顕在的導入遺伝子発現も示さない(図1C)。かなりの導入遺伝子発現が、脳を除く系統12及び13の全ての組織で観察することができる(図1D)。
【0030】
実施例2
fra-2tgマウスにおける肺性線維症発生
マウスが発生する主要な表現型を、肺組織上で強調されている全身性線維症である。肺性線維症は、fra-2tgマウスの大部分の早期致死性に関与している(図2A)。マウスは生後12ヶ月目辺りで病気になり、肺の重さ(図2B、3A)及び肺組織の線維症の劇的な増加による息切れに苦しむ。肺性線維症は、しばしば環境汚染物質に応じて又は症候群に関連して発生する。数種の組織のコラーゲン染色は、fra-2tgマウスにおける肺性線維症が数種の組織における全身性線維症を特徴とする強皮症様疾患に関連して発生することを説明している(図4A)。肺の線維形成性コラーゲンの生成増加は、即時のPCR分析で確認される。
【0031】
実施例3
炎症は肺性線維症における第一のイベントの一つである
10〜14週目の老いたマウスの肺を分析し、fra-2tgマウスにおける肺性線維症の始動イベントを特定する。この分析は、血管及び血管周囲領域における炎症が肺性線維症の第一のイベントの一つであることを説明している(図5A)。免疫組織化学的及び組織化学的染色は、肺を浸潤する主要な細胞集合を特定する。これらはCD3-陽性T-細胞及びエステラーゼ-陽性骨髄細胞である(図5A)。これらの細胞の存在は、ケモカイン及びサイトカインの増加した濃度と関連しており(図5B)、これが肺の線維形成性の変化に寄与し、またさらなる炎症性細胞を誘引し得る。
【0032】
実施例4
炎症及び肺性線維症は、気道上皮細胞の微細な損傷によって誘発される
肺性線維症は主に自己免疫疾患であるのか否か、又は免疫システムの多かれ少なかれ重要な寄与を伴う気道上皮の微細な損傷によって誘発されるのか否かは、依然として議論のある問題である。これらの疑問は、骨髄移植実験によって取り組まれる。一方で、該疾患は、fra-2tgマウスが肺損傷及び肺性線維症に関与する自己反応性免疫細胞を発生する場合はfra-2tg骨髄で移植可能であるべきである。他方で、該疾患はまた、気道上皮の微細な損傷が線維症の主要な引金である場合に、野生タイプの骨髄細胞で再構築されるfra-2tgマウスで発生すべきである。予備データは、肺性線維症がfra-2tg骨髄細胞で容易に移植できないことを示唆しており、主要な原因として自己免疫疾患を除外する(図6)。しかし、深刻な肺性線維症は、野生タイプの骨髄で再構築されたfra2tgマウスで発生しているように思われる(図7)。これらのデータは、おそらく肺胞上皮細胞のアポトーシスによって引き起こされる微細な損傷プロセスが肺性線維症の主要な原因であることを示唆している。
【0033】
実施例5
Fra-2tgマウスは、極度の瘢痕形成を示す。
Fra-2tgマウスは、背中の皮膚の全層皮膚生検パンチ創傷後に遅れた創傷閉鎖を示す(図8A,C)。コラーゲンからなる肉芽組織の増加量は、創傷後にfra-2tgマウスの創傷で現れる(図8B)。創傷時及び創傷後3日目に採取した皮膚生検によるRNase保護検定は、AP-1要素(fra-2を除く)、基質メタロプロテイナーゼ、TIMPs、サイトカイン、TGF-β群要素及びケモカインの発現に違いがないことを説明している(図8D-G)。これらのデータは、増加したFra-2活性が創傷閉鎖における遅れ及び過剰な瘢痕形成を導くことを説明している。これは、Fra-2活性の阻害剤を異所的に投与して損傷又は外科処置後の瘢痕形成を回避できることを示唆している。
【0034】



【技術分野】
【0001】
本発明は、肺性線維症及び皮膚の線維性疾患のような線維性疾患のための動物モデル、特にマウスモデルに関する。
【背景技術】
【0002】
肺性線維症は、世界中で五百万人に影響を及ぼす破壊的な疾患である。しかし、実際の人数は、起こり得る誤診のためにさらに著しく多いであろう。典型的には、患者は40歳代及び50歳代で、息切れ、慢性的な咳、疲労、食欲の喪失、及び急速な体重減少を含む症候群と共に肺性線維症を患う。診断後の平均生存期間は5年より短い(Giri, 2003)。肺性線維症は個別の実体として見えないが、通常は環境暴露に関連して患うか、又は症候群に伴うものとして患う。一般的な原因は、アスベスト、金属粉塵又は有機物質への暴露、サルコイドーシス(肉芽腫の形成を特徴とする疾患)、医薬品及び放射線への暴露である。肺性線維症はしばしば、リウマチ様関節炎及び強皮症などの結合組織病又は膠原病に関連する(Giri, 2003)。
病理学的には、該疾患は、肺の線維芽細胞病巣内の慢性炎症及びコラーゲン生成を特徴とする。線維芽細胞病巣の顕著な特徴である筋線維芽細胞は、形質転換成長因子β(TGF-β)の刺激による実質性線維芽細胞の局所的活性から生じると考えられ、歴史的には線維性障害におけるコラーゲン生成細胞であると考えられている(Selman and Pardo, 2003);さらに、CTGF(結合組織成長因子)は非常に重要な因子であると考えられており、分化及びコラーゲン遺伝子発現に必要である。しかし、最近の知見はこの基本的な考え方に疑問を呈しており、病理学的線維芽細胞の造血由来を提案している(Hashimoto et al., 2004)。
該疾患は、典型的には肺の瘢痕化及び線維性組織によって線が引かれる肺胞を進行させる。瘢痕が形成されると該組織は厚くなり、酸素を血流に運ぶ該組織の能力効率に不可逆的な損失を引き起こす(Gross and Hunninghake, 2001)。
【0003】
いくつかの成長因子は、肺性線維症の病原に関係している。これらの因子は、線維芽細胞分裂及び細胞外基質(ECM)生成を刺激するそれらの能力、並びに線維性肺疾患を有する患者又は動物の肺及び肺流体におけるそれらの存在によって特定される。これらの成長因子は、TGF-β、インスリン様成長因子(IGF)-I、血小板由来成長因子(PDGF)、線維芽細胞成長因子(FGF)群の要素及びケラチノサイト成長因子(KGF)を含む(Krein and Winston, 2002)。
現在、肺性線維症のための有効な処置又は治療はない。肺の瘢痕を治療するための薬理学的試薬は、依然として実験段階である。従来の理論はそれが自己免疫障害であろうことを前提としていたが、炎症を抑えるための処置は線維性進行を減少させる限定された成功のみを有する(Giri, 2003)。肺性線維症は非常に複雑な疾患であるため、診断後の患者の寿命予測は非常に変化する。
【0004】
肺性線維症が主に慢性炎症によって引き起こされるか否かは、依然として議論のある問題である(Gross and Hunninghake, 2001)。本来、実験的証拠は線維性肺疾患がそれらを発端とする炎症性障害であることを示唆した。例えば、肺性線維症は、肺の炎症性媒介腫瘍壊死因子α(TNF-α)の異所性発現を有するマウスで発生する(Miyazaki et al., 1995)。さらに、マウスの肺性線維症のブレオマイシンモデルでは、該線維症は、高濃度のTNF-αの生成を含む深刻な炎症によって進行される(Piguet et al., 1989)。重要なことは、TNF-α-欠乏又はTNF-α受容体-欠乏マウスが、ブレオマイシン誘発肺性線維症に対して抵抗する(Ortiz et al., 1998; Piguet et al., 1997)。これらの結果は、線維症は炎症性カスケードが回復不能な組織損傷が生じる前に妨害されると回避され得るという仮設を導いた。従って、この理論は、肺性線維症のコルチコステロイド及び細胞障害性療法のための最初の熱意を説明する。しかし今では、現在の抗炎症性療法がほとんど利益を与えないことが明らかである(Giri, 2003)。従って、一部の研究は、線維性肺障害が炎症性障害でないことを示すのを試みている。例えば、線維性肺疾患の発生は、一過性の炎症性応答のみを有する動物の肺に対するTGF-βのアデノウィルス導入によって誘発することができる。これらの新規洞察は、肺性線維症が慢性損傷よりもその後の損傷を治療する応答を伴う逐次的肺損傷から生じることを示唆している。従って、線維芽細胞複製及び基質沈着の修正に基づく治療計画が確立されている。しかし、コルヒチン治療(細胞内コラーゲン処理を妨害する)又はペニシラミン治療(コラーゲン架橋阻害剤)後の患者では、有益な臨床効果は全く見られなかった。線維成長を遮断する実験中の他の試薬は、ピルフェニドン、インターフェロンγ又はTGF-β情報伝達に対する抗体を含む(Giri, 2003)。
【発明の概要】
【0005】
従って、線維性疾患、例えば肺性線維症の研究、及び該障害の治療のための薬剤候補を試験するための有効且つ確実な動物モデルが必要である。
従って、本発明の目的は、線維性疾患、例えば強皮症様疾患に関連して発生する肺性線維症(全身性線維症)、又は他の線維性疾患のための動物モデルを提供することである。
本発明による問題の解決策は、転写調節因子AP-1に結合した分子機構に基づく。
転写調節因子AP-1は、Fos、Jun、及びCREB/ATF蛋白質群の一連の二量体生成物(Eferl and Wagner, 2003)、並びに他のbZip蛋白質によって生成される。さらに、Fos又はJunとNFκBのp65サブユニットとの間(Stein et al., 1993)、及びATF-2とp50-NFκBとの間(Du et al., 1993)に結合が観察された。組み合わせの結合は、3種のJun遺伝子(c-jun、junB、junD)、4種のFos遺伝子(c-fos、fosB、fra-1、fra-2)及び数種のCREB/ATF遺伝子(Eferl and Wagner, 2003)で引き出すことができる。全構造上の特徴における高度の相同性にも関わらず、Fos、Jun及びCREB群の種々の要素は著しい違いを示し、これらは個々の二量体のための遺伝子調節における特定の機能を示唆するDNA結合及び転写活性にわずかな違いを導く(Jochum et al., 2001)。AP-1群の要素は、細胞増殖並びに種々のタイプの分化の制御に関与し、神経機能及びストレス反応にも関与する。AP-1は、外部刺激を遺伝子発現の短期間及び長期間変化の両方に変換する主要因子の1種である(Jochum et al., 2001)。
【0006】
Jun及びFos蛋白質群の要素は共に、骨形成及び再生に必要である。条件付きcjun対立遺伝子の偏在する部分的欠乏は軸骨格の奇形を導き(Behrens et al., 2003)、最近になってJunBが骨細胞(骨形成細胞)増殖及び分化に必須であることが示された(Kenner et al., 2004)。大部分のFos蛋白質は、骨細胞及び破骨細胞(骨吸収細胞)の増殖及び分化に関与している。c-Fosを発現する遺伝子導入マウスは、骨細胞増殖の増加によって骨肉腫を発生する(Grigoriadis et al., 1993)。対照的に、c-Fosが欠如しているマウスは、破骨細胞系統における分化欠乏によって引き起こされる骨石化症を発生する(Grigoriadis et al., 1994; Wang et al., 1992)。この分化欠乏は、Fos及びFra-1が破骨細胞分化において重複する機能を有することを示唆するFos関連蛋白質Fra-1の発現によって救済することができる(Fleischmann et al., 2000)。条件付きマウスモデルにおけるFra-1の損失は、骨細胞の機能欠乏による骨量の減少を導く(Eferl et al., 2004)。一貫して、異所性Fra-1発現はおそらくは成熟した骨細胞への骨芽前駆細胞の促進された分化により骨硬化症を導く(Jochum et al., 2000)。同様の骨格表現型は、FosBの挿入変形であるΔFosBを発現する遺伝子導入マウスに記載されており、Fra-1及びΔFosBが骨細胞系統における共通の転写性標的遺伝子を調節することにより骨細胞分化が促進することを示唆した(Sabatakos et al., 2000)。しかし、骨形成におけるFra-2の必要性はそれ程明らかでない。軟骨細胞におけるFra-2の条件付き欠乏は骨量の減少を導くが(Karreth et al., 2004)、機能研究の増減は骨芽細胞又は破骨細胞で行われない。
【0007】
“異所性発現”は、そのような遺伝子が通常は発現しないか又は通常はより低い濃度で発現する組織での遺伝子発現の発生を表す。
本発明を導く実験では、Fra-2の遺伝子座が遺伝子導入マウス(fra-2tg)に広く過剰発現し、これは本来、骨芽細胞及び破骨細胞機能において増加したFra-2活性の結果を調査するためのものである。fra-2tgマウスのための遺伝子導入ベクターは、c-fostg及びfra1tgマウスと同様の方法で設計され(Grigoriadis et al., 1993; Jochum et al., 2000)、3種の遺伝子導入マウスモデルの有意義な比較を可能にする。
【0008】
前述のfra-2遺伝子導入マウスによる実験(Mc Henry et al., 1998)は、通常の眼における発生を乱すことを示し、驚くべきことに、本発明の実験ではfra-2の過剰発現がヒト肺性線維症に類似する表現型となることが見出された。驚くべきことに、fra-2遺伝子導入マウスは、主に肺に影響を及ぼす全身性線維症を発生して6ヶ月以内に死亡する。肺性線維症に加え、本発明の実験では、強皮性様表現型を導く数種の他の組織において線維症を患うことが示された。
従って、本発明は、線維性疾患の表現型で発現を示すfra-2の広範な又は細胞タイプに特異的な異所性発現を有するヒトではない遺伝子導入哺乳動物、特に齧歯動物を含む、線維性疾患のための動物モデルに関する。
【図面の簡単な説明】
【0009】
【図1】A)fra-2遺伝子導入ベクターの概略スキーム。H2kbプロモーターをfra-2発現に用いる。fra-2の後にIRES-EGFPレポーター遺伝子を用いて導入遺伝子活性を監視し、LTR配列をmRNA安定化のために含ませる。LoxP部位は、導入遺伝子のCre-リコンビナーゼ-媒介欠乏を可能にする。H2Kb:H2Kbプロモーター;E1-E4:fra-2のエキソン1-4;ポリA:ポリアデニル化信号;Hind III:サザンブロット分析に用いた限定部位。B)ゲノムにおける導入遺伝子のコピー数を決定するための3種の遺伝子導入系統(12、13、15)のサザンブロット分析。マウスの尾からのDNAをHind IIIで温浸させ、fra-2のエキソン2に対応する配列でプローブする。野生タイプ及び遺伝子導入バンドの位置を示す。定量化は、遺伝子導入系統12、13及び15のそれぞれに対して4回、60回及び2回の遺伝子導入コピーを明らかにした。C)遺伝子導入系統12、13及び15からの2種の組織(肝臓及び心臓)によるfra-2発現のためのRNase保護検定。Fra-2の発現は、系統12及び13の両組織で同程度まで増加する。導入遺伝子発現は遺伝子導入系統15では全く検出されない。GAPDHの発現は、ローディング・コントロールとして用いる。D)大人(6週間目)の遺伝子導入マウス(系統13)の異なる組織によるRNase保護検定。導入遺伝子は、脳、thy:胸腺、kid:腎臓、spl:脾臓、cal:頭頂部を除いて偏在して発現する。
【図2】A)fra-2tgマウスの早期致死率を示すKaplan Meierプロット。fra-2導入遺伝子の高い発現を有するマウス(系統12及び13)は成人期に病気になり、6週間目辺りで死に始めた。早期致死率は、導入遺伝子の発現を全く示さない系統15のマウスでは見られない。B)fra-2tgマウスの体重に対する増加した肺の比。肺の重さの増加が、系統12及び13の遺伝子導入マウスで観察される(ここでは系統12を示す)が、系統15では観察されない。肺の重さの大きな増加は、遺伝子導入マウスの致死率と一致する。病気は、体重の損失、毛の外見、マウスの弱さ及び息切れにより判断される。
【図3】A)fra-2tg肺の全体的な形態。系統12及び13のマウスは、明らかな線維症を有する劇的に増加した肺を示す。B)fra-2tg肺のH&E-染色切片。系統12及び13のマウスは、間質性肺線維症(上部のパネル)及び血管の狭窄(下部のパネル)を示す。
【図4A】fra-2tgにおける強皮症様症候群の発生。コラーゲンのためのアニリンブルー染色(青色)は、fra-2tgマウスにおける線維性障害は肺に限定されないが、他の器官(肝臓、皮膚及び心臓が例として示されている)でも観察できることを明らかにした。
【図4B】fra-2tgマウスの肺におけるコラーゲン発現の同時PCR分析。線維性コラーゲンタイプI及びタイプIIIの発現は、病気のマウスの肺で増加した。
【図5A】fra-2tgマウスにおける肺性線維症は、血管及び炎症性細胞の血管周囲の移入で始まる。fra-2tg肺のH&E-染色は、肺性線維症における最初のイベントとしての炎症を説明する(上部のパネル)。炎症性細胞は、主にCD3-陽性T-細胞(黒色染色、矢じり)及び顆粒細胞などのエステラーゼ-陽性骨髄細胞(赤色染色、矢じり)からなる。
【図5B】炎症は、RNase保護検定によって説明されるfra-2tgマウスの肺におけるケモカイン及びサイトカインの蓄積を引き起こす。
【図6A】fra-2tg骨髄で再構築された野生タイプのマウスにおける全く深刻でない肺性線維症。致死量の放射線照射の後にfra-2tg骨髄で再構築された野生タイプのマウスの肺及び肝臓切片は、線維症が容易には移植され得ないことを実証する。
【図6B.C.D】B)野生タイプの骨髄で再構築された野生タイプのマウスからの骨髄細胞のFACSプロフィール。C)fra-2tg骨髄で再構築された野生タイプのマウスからの骨髄細胞のFACSプロフィール。ほとんど全ての骨髄細胞が導入遺伝子発現を反映するEGFPレポーター遺伝子を発現することに注意。D)器官/体重比は、全く深刻でない肺性線維症がfra-2tg骨髄で再構築された野生タイプのマウスで発生することを確証する。
【図7A】野生タイプの骨髄で再構築されたfra-2tgマウスにおける深刻な肺性線維症。致死量の放射線照射の後に野生タイプの骨髄で再構築されたfra-2tgマウスの肺及び肝臓切片は、野生タイプの骨髄の存在下で線維症が発症することを実証する。
【図7B.C.D】B)野生タイプの骨髄で再構築された野生タイプのマウスからの骨髄細胞のFACSプロフィール。C)野生タイプの骨髄で再構築されたfra-2tgマウスからの骨髄細胞のFACSプロフィール。ほとんど全ての遺伝子導入EGFP-陽性細胞が消失したことに注意。D)器官/体重比は、肺性線維症が野生タイプの骨髄で再構築されたfra-2tgマウスで発生したことを確証する。
【図8A.B】A)fra-2tgマウスの全層創傷後の遅れた創傷治癒。Fra-2遺伝子導入マウスは、背中の皮膚の全層創傷後に遅れた創傷閉鎖を示す(上部パネル:創傷後8日目、下部パネル:創傷後11日目)。B)コラーゲンからなる増加した量の肉芽組織が、fra-2遺伝子導入マウスの創傷で見える(創傷後11日目;上部パネル:H&E-染色;下部パネル:コラーゲンのための青色CAB-染色)。
【図8C】C)創傷治癒の定量化は、fra-2遺伝子導入マウスにおける遅れた創傷閉鎖が早ければ創傷後3日で始まることを説明する。
【図8D.E.F.G】D-G)創傷時及び創傷後3日目に採取された皮膚生検によるRNase保護検定。fra-2を除くAP-1要素(D)、基質メタロプロテイナーゼ(E)、TIMPs(E)、サイトカイン(F)、TGF-β群要素(F)及びケモカイン(G)の発現における違いは観察することができない。
【発明を実施するための形態】
【0010】
“線維性疾患”という用語は、例えば慢性炎症又は組織の修復及び再組織化により得る線維症を伴う疾患に関する。線維症は、腎臓、心臓、肺、肝臓、皮膚及び関節を含む器官又は組織の通常の成分としての線維性組織の形成とは反対に、修復性又は反応性方法としての器官又は組織における過剰な線維性結合組織の形成又は発生である。
好ましい実施態様では、線維性疾患は肺性疾患、特に肺性線維症である。
本発明の意味では、“肺性疾患”という用語は、肺(肺性)線維症及び突発性肺性疾患から選択される線維性成分を伴う肺性疾患、他の間質性肺炎(IP)、例えば巨細胞性間質性肺炎、非特異性IP、突発性組織化肺炎、膠原血管病関連IP、及び薬剤誘発IP、さらにサルコイドーシス、嚢胞性線維症、呼吸窮迫症候群、肉芽腫症、ケイ肺症、石綿症、肺を含む全身性強皮症、並びに線維症及び喘息又はCOPDにおける再構築を含む。
【0011】
さらなる実施態様では、線維性疾患は全身性線維症であり、これは、限定するわけではないが、さらに肺及び/又は皮膚、脾臓、心臓、腎臓及び/又は肝臓を含む数種の標的器官でそれ自体を表す強皮症様線維症である。
また、本発明の実験では、fra2tgマウスが、過剰な治癒に関連する皮膚の線維性障害を患うことが示された。皮膚のケロイド及び肥大性瘢痕は、該線維性皮膚障害の例である。
マウスの背中の皮膚の全層創傷治癒実験は、創縫合がfra-2tgマウスで遅れることを実証し、これは閉じている創傷における肉芽組織の過剰な生成によるものであり、過剰な瘢痕形成を導く。
従って、さらなる特徴では、本発明の動物モデルは線維性皮膚障害のためのモデルとしても有用である。
【0012】
“遺伝子導入齧歯動物”により、生殖細胞系に(すわなち、その細胞の大部分又は全てのゲノム配列に)安定に一体化される非内在性(すなわち、非相同性)核酸配列符号化Fra-2 DNAを有する齧歯動物(例えば、マウス、ラット、ハムスターなど)が意味される。あるいは、fra-2導入遺伝子は、fra-2の異所性発現を有するキメラマウスの産生のための胚幹細胞に導入することができる。
好ましい実施態様では、齧歯動物がマウスである。
異種Fra-2核酸は、例えば、標準プロトコルに従う宿主動物の胚又は胚幹細胞の遺伝子操作によってそのような動物の生殖細胞系に導入される。
以下では、fra-2遺伝子導入齧歯動物/マウスを“fra-2tg”齧歯動物/マウスと呼ぶ。
【0013】
明確にするために、“fra-2tgマウス”、又は“fra-2tg齧歯動物”という用語はそれぞれ、本発明の意味では、広範な又は細胞タイプに特異的な導入遺伝子発現を可能にするプロモーターの制御下で、fra-2ゲノム座又はfra-2 cDNAを有する遺伝子導入齧歯動物/マウスである。
“fra-2”(又は“Fra-2”)によって、関心のある表現型、すなわち線維性疾患、特に肺性線維症でそれ自体を示すような適切な濃度及び位置における好適なプロモーターの制御下で発現するときに起因する、任意の哺乳類種からのfra-2 DNA(又はFra-2蛋白質)を意味する。
選択されたfra-2 DNAは、選択された動物種(例えば、マウスがマウスfra-2 DNA導入遺伝子を有し、ラットがラットfra-2導入遺伝子を有する)の同種fra-2遺伝子と同一でよく、又は異なっていてもよく、例えば特にヒト疾患のためのモデル及びヒト疾患のための阻害剤をスクリーニング又は特徴付けるためのモデルとしての動物の使用を考慮して、ヒトfra-2でよい。
【0014】
fra-2/Fra-2 DNA/蛋白質配列は、例えば、ヒト(GenBank Accession No. X16706; Matsui et al., 1990)、マウス(GenBank Accession No. NM_008037; Foletta et al., 1994)又はラット(GenBank Accession No. NM_012954)からの文献で公知である。
本発明の実験では、成分H2-Kb(プロモーター)、IRES-EGFP(レポーター遺伝子)及びLTR(エンハンサー)を遺伝子導入構築に用いた;これらの成分は他の成分と置き換えることができるが、但し体内の濃度及び場所における導入遺伝子の発現は、それ自体を関心のある表現型で示すようなものである。導入遺伝子発現に好適な偏在性プロモーターの例は、ユビキチンCプロモーター、CMVプロモーター/エンハンサー、Pgk1プロモーター又はニワトリβ-アクチンプロモーターである(Schorpp et al., 1996)。導入遺伝子発現を監視するのに好適なレポーターシステムの例は、β-ガラクトシターゼ、EGFP、EYFP、ERFPである。fra-2の広範な発現を保証するための構築物に任意に存在してよい好適なエンハンサー成分の例は、FBJマウス骨肉腫ウィルスからの長い末端反復(LTR)である。
【0015】
本発明を導く実験では、以下の実験システムを用いた:第一に、ゲノムマウスλDNAライブラリー(マウス株129 Sv)を、fra-2の4種のエキソンに結合する標識オリゴヌクレオチドを有するマウスfra-2遺伝子のためにスクリーニングした。Fra-2全長遺伝子座を単離し、特徴付け、及び配列を決定した。該4種のエキソンの配列は、公表されているマウスFra-2 cDNA配列と完全に対応した(Foletta et al., 1994)。主要組織適合遺伝子複合体クラスI抗原H2-Kbのためのプロモーター(Grigoriadis et al., 1993)を、fra-2遺伝子座の前にクローン化し、偏在性導入遺伝子発現を可能にする。生体内における導入遺伝子活性を監視するために、IRES-EGFP(Zhu et al., 1999)配列を、fra-2遺伝子座の後にクローン化し、それに続いてFBJ-マウスサルコーマウィルスの長い末端反復(LTR)をクローン化して、fra-2 mRNAを安定化させ且つ間葉細胞における導入遺伝子発現を保証した(Grigoriadis et al., 1993)。さらに、loxPサイトを、エキソン2の前且つエキソン4の後に配置し、導入遺伝子発現の異なる導入遺伝子コピー数及び濃度により、導入遺伝子多量体のCre-媒介欠損及び数種の遺伝子導入系統の生成を可能にする。
【0016】
特にマウスのfra-2tg 齧歯動物は、例えばCre-loxP媒介遺伝子操作(例えばOrban et al., 1992; Sauer, 1993に記載)、受精した卵母細胞へのfra-2導入遺伝子の微量注入、受精した卵母細胞への細菌人工染色体(BACs)に基づく大量の導入遺伝子の注入(例えばChrast et al., 1999; Hong et al., 2001に記載)、レトロウィルス(Blesch, 2004)又は導入遺伝子を有する他のベクターによる8個の細胞分裂時期の胚の感染、例えばアデノウィルス(Lai et al., 2002)及びレンチウィルス媒介(Blesch, 2004)体細胞性遺伝子導入、導入遺伝子を有する構築物による胚幹(ES)細胞の移入又は感染(Wolf and Woodside, 2005)により、遺伝子導入動物を生成するための公知なプロトコルに基づく方法で得ることができる。
【0017】
さらなる特徴では、本発明は、肺性線維症のための動物モデルとしての、肺細胞、例えば気道上皮細胞、線維芽細胞、筋線維芽細胞及び造血性細胞のfra-2の異所性発現を有する齧歯動物、例えばマウスに関する。これらの特異的な細胞タイプにおける異所性発現を得るために、細胞タイプに特異的なプロモーターが遺伝子導入動物を生成するのに用いられ、例えば、気道上皮細胞のための界面活性蛋白質C(Boggaram, 2003)プロモーター、又はCD4プロモーター(Tanigaki et al., 2004)、CD19プロモーター(Rickert et al., 1997)、造血性細胞のためのLysMプロモーター(Clausen et al., 1999)又は線維芽細胞のためのプロ-α1(I)コラーゲンプロモーター(Rossert et al., 1995)である。これらの細胞タイプに加え、異所性発現が関心のある表現型に関連のある他の細胞に望ましくなり得る。上記細胞と類似して、fra-2発現は、細胞タイプに特異的なプロモーターを用いることにより、これらの細胞における導入遺伝子の配向性発現によって達成することができる。
【0018】
さらなる特徴では、本発明は、それらのゲノムにヒト又は齧歯動物fra-2 DNAが組み込まれた遺伝子導入齧歯動物細胞、特にマウス細胞に関する。fra-2遺伝子導入細胞は、偏在様式又は特に関心のある細胞タイプのいずれかでfra-2の異所性発現を有する齧歯動物から得ることができる。該細胞は、線維性疾患、特に肺性線維症の発生に寄与するそれらの能力に関して選択され、例えば、線維芽細胞又は筋線維芽細胞のような造血性細胞、肺性上皮細胞又は間葉細胞である。一方で線維芽細胞の過剰な成長及び他方で筋線維芽細胞の形成(線維芽細胞の形質転換から生じるか、又は造血性細胞から生じる)が肺性疾患の表現型に関連があるため、線維芽細胞及び筋線維芽細胞が特に関心が高い。
【0019】
関心のある細胞は公知の方法で単離及び培養することができ、例えば線維芽細胞、筋線維芽細胞、肺上皮細胞である(Dong et al., 1997; Phipps et al., 1989)。
あるいは関心のある細胞を遺伝子導入動物から単離するために、各主要な細胞又は細胞系をfra-2 DNAで移入することができる。
fra-2tgマウス及びそこから生じる細胞は、肺性疾患のような線維性疾患の治療のための薬剤を試験するのに有用である。
本発明の動物モデルは、治療計画、例えば薬理学的介入によって異常な瘢痕形成を回避するための化合物を試験するのにも用いることができる。特に、fra-2tgマウス又はfra-2tg細胞を、過剰な治癒における瘢痕形成の阻害剤をスクリーニングするための検定に用いることができる。本発明の実験は、Fra-2自体が、過剰な瘢痕形成を含む線維性障害の薬理学的介入のための標的であることを示した。従って、Fra-2阻害剤は、そのような疾患のための阻害剤として有用となり得る。
【0020】
本発明の動物モデルを用いてよいが、Fra-2活性に依存する線維形成性経路を担うプロ炎症性サイトカインの阻害剤を評価するのに限定されない。例えば、肺性上皮細胞の微細損傷を妨げ得る新規阻害剤、例えばアンギオテンシン転化酵素阻害剤又はカスパーゼ阻害剤を、本発明の動物モデルで試験することができる。また、患部の肺の線維性病巣におけるコラーゲンの蓄積又は一般的には線維形成性活性を妨害する特異的な阻害剤を試験することができる。
本発明のさらなる特徴では、遺伝子導入動物及びそこから生じる細胞系はまた、例えば、Fra-2活性に依存する未だ特定されていない線維形成性経路を阻害することにより、線維性疾患、特に肺性線維症の治療に有効な候補化合物を特定又は試験するのに用いることができる。
【0021】
従って、本発明は、さらに線維性疾患、例えば肺性線維症における化合物の治療効果を測定するための方法を提供する。該方法は、有効量の試験化合物をfra-2tg齧歯動物、特にマウスに投与することを含む。該方法は、試験化合物に対する遺伝子導入動物の応答(すなわち、疾患症候群の改善又は消失)を測定すること、及び遺伝子導入動物の応答と例えば野生タイプの動物又はあるいは遺伝子導入動物対照でよい対照動物の応答を比較することを含む。異所性fra-2発現から生じる表現型に効果を有し得る化合物はまた、例えばそのような化合物を特定するための細胞に基づく検定で、細胞に対してスクリーニングしてよい。fra-2を過剰発現する細胞を用いる検定では、該化合物が、線維芽細胞の過剰な成長及び/又は筋線維芽細胞への線維芽細胞の形質転換及び/又は細胞外基質形成におけるそれらの効果を試験することができる。
【0022】
特定の化合物の毒性及び治療効力は、細胞培養液又は実験動物における標準的な医薬品の手順によって測定することができ、例えばLD50(母集団の50%の致死量)及びED50(母集団の50%の治療上有効な用量)を測定する。毒性効果及び治療効果の間の用量比は治療指標であり、比LD50/ED50として表現することができる。大きな治療指標を示す化合物が好ましい。有毒な副作用を示す化合物を用いてよく、そのような化合物を患部組織の部位へ標的とする送達システムを設計し、非感染性細胞に対する潜在的損害を最小化し、それによって副作用を減少させるのに注意を払うべきである。例えば、短い血中濃度半減期を有する吸入化合物による局所的選択性を達成して、肺の線維症を治療する。
【0023】
細胞培養検定及び動物研究から得られたデータを、ヒトに使用するための用量範囲を処方するのに用いることができる。そのような化合物の用量は、好ましくは毒性をほとんど持たない又は毒性が全くないED50を含む濃度を循環する範囲内である。治療濃度域は、毒性効果を持たないより高いED値の使用を可能にし、そのようなED値は、例えばED90以下が好ましい。
用量は、用いた投与形態及び用いた投与経路に依存してこの範囲内で変化する。いかなる化合物でも、治療上有効量は、最初に細胞培養検定から評価することができる。用量は動物モデルで処方し、細胞培養液で測定してIC50以上(すわなち、症候群の半値阻害を達成する試験化合物の濃度)異常を含む循環血漿濃度範囲を達成してよい(作用薬では、IC50値以上の値(又は作用薬ではED50値)が好ましい)。
そのような情報を用いて、ヒトに有用な用量をより正確に決定することができる。血漿中濃度は公知の方法によって測定してよく、例えば高性能液体クロマトグラフィーによる。
【0024】
最後に、動物モデルはヒト線維性疾患、例えば肺性線維症の病因論を研究するのに有用である。肺性線維症の発生に原因のある細胞タイプを定義することが非常に重要である。
従来のブレオマイシン誘発肺性線維症モデルでは、この目的を妨害する骨髄移植研究などの実験が可能でなかった。さらに、fra-2tgマウスをRag2欠乏又はTNF-α受容体p55機能を損失したマウスなどの異なる遺伝的背景に繁殖させ、それぞれの肺性線維症に対する自己反応性T-細胞及びTNF-情報伝達の寄与を評価することができる。本発明の動物モデルで得ることのできる信頼のある細胞タイプ及び主要な情報伝達経路に関する知識は、肺性線維症の治療のために試験する薬剤の一般的な指導に中心的な影響を有する。
【0025】
実施例では、以下の材料及び方法を用いた:
fra-2tgマウスの生成
fra-2全長遺伝子座は、ゲノムλDNAライブラリーから単離し、配列を決定し、及びpBS IIベクターにクローン化する。主要な組織適合性の複雑な分類Iの抗原H2-Kbのためのプロモーター(Grigoriadis et al., 1993)を、fra-2遺伝子座の前にクローン化して、偏在的な導入遺伝子発現を可能にする。導入遺伝子活性を監視するために、IRES-EGFP(Zhu et al., 1999)配列を、FBJ-マウスサルコーマウィルスの長い末端反復(LTR)配列の後に続いているfra-2遺伝子座の後にクローン化する(Grigoriadis et al., 1993)。さらに、loxP部位を、エキソン2の前及びエキソン4の後ろに配置し、導入遺伝子多量体のCre-媒介欠乏、及び異なる導入遺伝子のコピー数を有する数種の遺伝子導入系統の生成、を可能にする。遺伝子導入構築物を、受精したC57Bl76卵母細胞の前核に注入し、3種の独立性遺伝子導入系統を確立する。
【0026】
サザンブロット及びRNase保護検定(RPA)
fra-2サザンブロットでは、10μgのテールDNAをHind IIIで温浸し、野生タイプのfra-2対立遺伝子のための12.5kbの断片、及び導入遺伝子のための7.5kbの断片を得る。バンドの欠乏では、fra-2のエキソン2に対応する0.6kbのKpnI断片をプローブとして用いる。RNase保護検定では、全肺RNAをTRIZOLプロトコル(Sigma)で単離する。RNase保護検定は、製造者のプロトコルに従うRiboQuantマルチ-プローブRNase保護検定システムmCK-2b及びmCK-5c(PharMingen)を用いて行う。
【0027】
組織学
組織は4℃で中性緩衝された4% PFAで終夜固定し、パラフィンに組み込む。5μmの切片を、ヘマトキシリン及びエオシン(H&E)又はクロマニリンブルーのいずれかで染色するか、又はさらに処理する。抗CD3のための免疫組織化学的染色(Santa Cruz)を、製造者の推奨に従い、MultiLink Dakoシステム(Dako E0453)による抗原検索(Dako S1699)の後に行う。
【0028】
骨髄再構築
6〜10ヶ月目の老いた雌のレシピエントマウスに致死量の放射線を照射し、20時間後に雄のドナーマウスからの骨髄で再構築する。骨髄をドナーマウスの大腿骨及び脛骨から流し、カウントし、及び5x106個の細胞をレシピエントの尾の静脈に注入する。組織学的検査のために屠殺した後に、レシピエントから骨髄及び脾臓細胞を定期的に採取し、再構築の効率をサザンブロット及びEGFP-蛍光のためのFACS分析によって評価する。
【0029】
実施例1
fra-2tgマウスの生成及びキャラクタリゼーション
ゲノムfra-2遺伝子座を、遺伝子導入ベクター上に広範な活性H2Kbプロモーターの前且つIRES-EGFPレポーター遺伝子の後に配置する(図1A)。FBJ-マウスサルコーマウィルスの長い末端反復(LTR)配列をfra-2 mRNAの安定化のため、且つ間葉細胞における導入遺伝子発現を保証するために含ませる。エキソン2の前及びエキソン4の後ろに配置されるさらなるloxP部位により、導入遺伝子マルチマーのCre-媒介欠失、並びに異なる導入遺伝子コピー数及び異なる導入遺伝子発現量を有する複数の遺伝子導入系統の生成、が可能となる。異なる導入遺伝子コピー数を有する3種の別個の遺伝子導入系統が生成されている(図1B)。系統12及び13は高濃度の導入遺伝子を発現し(図1C)、それぞれ4、60(4コピー、60コピー)の導入遺伝子コピーを有する。系統15は2(コピー)の導入遺伝子コピーのみを有し、いかなる顕在的導入遺伝子発現も示さない(図1C)。かなりの導入遺伝子発現が、脳を除く系統12及び13の全ての組織で観察することができる(図1D)。
【0030】
実施例2
fra-2tgマウスにおける肺性線維症発生
マウスが発生する主要な表現型を、肺組織上で強調されている全身性線維症である。肺性線維症は、fra-2tgマウスの大部分の早期致死性に関与している(図2A)。マウスは生後12ヶ月目辺りで病気になり、肺の重さ(図2B、3A)及び肺組織の線維症の劇的な増加による息切れに苦しむ。肺性線維症は、しばしば環境汚染物質に応じて又は症候群に関連して発生する。数種の組織のコラーゲン染色は、fra-2tgマウスにおける肺性線維症が数種の組織における全身性線維症を特徴とする強皮症様疾患に関連して発生することを説明している(図4A)。肺の線維形成性コラーゲンの生成増加は、即時のPCR分析で確認される。
【0031】
実施例3
炎症は肺性線維症における第一のイベントの一つである
10〜14週目の老いたマウスの肺を分析し、fra-2tgマウスにおける肺性線維症の始動イベントを特定する。この分析は、血管及び血管周囲領域における炎症が肺性線維症の第一のイベントの一つであることを説明している(図5A)。免疫組織化学的及び組織化学的染色は、肺を浸潤する主要な細胞集合を特定する。これらはCD3-陽性T-細胞及びエステラーゼ-陽性骨髄細胞である(図5A)。これらの細胞の存在は、ケモカイン及びサイトカインの増加した濃度と関連しており(図5B)、これが肺の線維形成性の変化に寄与し、またさらなる炎症性細胞を誘引し得る。
【0032】
実施例4
炎症及び肺性線維症は、気道上皮細胞の微細な損傷によって誘発される
肺性線維症は主に自己免疫疾患であるのか否か、又は免疫システムの多かれ少なかれ重要な寄与を伴う気道上皮の微細な損傷によって誘発されるのか否かは、依然として議論のある問題である。これらの疑問は、骨髄移植実験によって取り組まれる。一方で、該疾患は、fra-2tgマウスが肺損傷及び肺性線維症に関与する自己反応性免疫細胞を発生する場合はfra-2tg骨髄で移植可能であるべきである。他方で、該疾患はまた、気道上皮の微細な損傷が線維症の主要な引金である場合に、野生タイプの骨髄細胞で再構築されるfra-2tgマウスで発生すべきである。予備データは、肺性線維症がfra-2tg骨髄細胞で容易に移植できないことを示唆しており、主要な原因として自己免疫疾患を除外する(図6)。しかし、深刻な肺性線維症は、野生タイプの骨髄で再構築されたfra2tgマウスで発生しているように思われる(図7)。これらのデータは、おそらく肺胞上皮細胞のアポトーシスによって引き起こされる微細な損傷プロセスが肺性線維症の主要な原因であることを示唆している。
【0033】
実施例5
Fra-2tgマウスは、極度の瘢痕形成を示す。
Fra-2tgマウスは、背中の皮膚の全層皮膚生検パンチ創傷後に遅れた創傷閉鎖を示す(図8A,C)。コラーゲンからなる肉芽組織の増加量は、創傷後にfra-2tgマウスの創傷で現れる(図8B)。創傷時及び創傷後3日目に採取した皮膚生検によるRNase保護検定は、AP-1要素(fra-2を除く)、基質メタロプロテイナーゼ、TIMPs、サイトカイン、TGF-β群要素及びケモカインの発現に違いがないことを説明している(図8D-G)。これらのデータは、増加したFra-2活性が創傷閉鎖における遅れ及び過剰な瘢痕形成を導くことを説明している。これは、Fra-2活性の阻害剤を異所的に投与して損傷又は外科処置後の瘢痕形成を回避できることを示唆している。
【0034】



【特許請求の範囲】
【請求項1】
線維性疾患の表現型で発現を示すfra-2の広範な又は細胞タイプに特異的な異所性発現を有する遺伝子を導入したヒトではない哺乳動物を含む、線維性疾患のためのヒトではない動物モデル。
【請求項2】
前記哺乳動物が齧歯動物である、請求項1記載のモデル。
【請求項3】
前記齧歯動物がマウスである、請求項2記載のモデル。
【請求項4】
ヒト線維性疾患のための、請求項1記載のモデル。
【請求項5】
強皮症様全身性線維症のための、請求項1記載のモデル。
【請求項6】
肺性線維症のための、請求項1記載のモデル。
【請求項7】
前記遺伝子導入哺乳動物が、肺細胞にfra-2を異所的に発現する、請求項6記載のモデル。
【請求項8】
線維性皮膚障害のための、請求項1記載のモデル。
【請求項9】
前記線維性皮膚障害が過剰な瘢痕形成である、請求項8記載のモデル。
【請求項10】
線維性疾患のためのモデルとしての遺伝子を導入したヒトではない哺乳動物を得るための方法であって、fra-2 DNAの広範な又は細胞タイプの異所的発現を可能にするプロモーターの制御下でfra-2 DNAを含有する遺伝子構築物が、ヒトではない宿主動物に導入される、方法。
【請求項11】
請求項1記載のモデルを試験化合物と接触させ、前記試験化合物に対する遺伝子導入哺乳動物の応答を測定し、及び遺伝子導入哺乳動物の応答を対照動物の応答と比較することを含む、線維性疾患における試験化合物の効果を測定する方法。
【請求項12】
線維性疾患が、強皮症様全身性線維症である、請求項11記載の方法。
【請求項13】
線維性疾患が、肺性線維症である、請求項11記載の方法。
【請求項14】
線維性疾患が、線維性皮膚障害である、請求項11記載の方法。
【請求項15】
線維性皮膚障害が、過剰な瘢痕形成である、請求項14記載の方法。
【請求項16】
fra-2を過剰発現する試験細胞を試験化合物と接触させ、前記試験細胞における前記試験化合物の効果を測定し、及び前記効果を対照細胞における前記試験化合物の効果と比較することを含む、線維性疾患における試験化合物の効果を測定する方法。
【請求項17】
前記細胞を、fra-2の前記異所性発現を有する前記遺伝子を導入したヒトではない哺乳動物から得る、請求項16記載の方法。
【請求項18】
線維性疾患が、強皮症様全身性線維症である、請求項16記載の方法。
【請求項19】
線維性疾患が、肺性線維症である、請求項16記載の方法。
【請求項20】
線維性疾患が、線維性皮膚障害である、請求項16記載の方法。
【請求項21】
線維性皮膚障害が、過剰な瘢痕形成である、請求項16記載の方法。
【請求項22】
前記細胞が、造血性細胞である、請求項16記載の方法。
【請求項23】
前記細胞が、肺の上皮細胞である、請求項16記載の方法。
【請求項24】
前記細胞が、間葉細胞である、請求項16記載の方法。
【請求項25】
間葉細胞が、線維芽細胞又は筋線維芽細胞である、請求項24記載の方法。
【請求項1】
線維性疾患の表現型で発現を示すfra-2の広範な又は細胞タイプに特異的な異所性発現を有する遺伝子を導入したヒトではない哺乳動物を含む、線維性疾患のためのヒトではない動物モデル。
【請求項2】
前記哺乳動物が齧歯動物である、請求項1記載のモデル。
【請求項3】
前記齧歯動物がマウスである、請求項2記載のモデル。
【請求項4】
ヒト線維性疾患のための、請求項1記載のモデル。
【請求項5】
強皮症様全身性線維症のための、請求項1記載のモデル。
【請求項6】
肺性線維症のための、請求項1記載のモデル。
【請求項7】
前記遺伝子導入哺乳動物が、肺細胞にfra-2を異所的に発現する、請求項6記載のモデル。
【請求項8】
線維性皮膚障害のための、請求項1記載のモデル。
【請求項9】
前記線維性皮膚障害が過剰な瘢痕形成である、請求項8記載のモデル。
【請求項10】
線維性疾患のためのモデルとしての遺伝子を導入したヒトではない哺乳動物を得るための方法であって、fra-2 DNAの広範な又は細胞タイプの異所的発現を可能にするプロモーターの制御下でfra-2 DNAを含有する遺伝子構築物が、ヒトではない宿主動物に導入される、方法。
【請求項11】
請求項1記載のモデルを試験化合物と接触させ、前記試験化合物に対する遺伝子導入哺乳動物の応答を測定し、及び遺伝子導入哺乳動物の応答を対照動物の応答と比較することを含む、線維性疾患における試験化合物の効果を測定する方法。
【請求項12】
線維性疾患が、強皮症様全身性線維症である、請求項11記載の方法。
【請求項13】
線維性疾患が、肺性線維症である、請求項11記載の方法。
【請求項14】
線維性疾患が、線維性皮膚障害である、請求項11記載の方法。
【請求項15】
線維性皮膚障害が、過剰な瘢痕形成である、請求項14記載の方法。
【請求項16】
fra-2を過剰発現する試験細胞を試験化合物と接触させ、前記試験細胞における前記試験化合物の効果を測定し、及び前記効果を対照細胞における前記試験化合物の効果と比較することを含む、線維性疾患における試験化合物の効果を測定する方法。
【請求項17】
前記細胞を、fra-2の前記異所性発現を有する前記遺伝子を導入したヒトではない哺乳動物から得る、請求項16記載の方法。
【請求項18】
線維性疾患が、強皮症様全身性線維症である、請求項16記載の方法。
【請求項19】
線維性疾患が、肺性線維症である、請求項16記載の方法。
【請求項20】
線維性疾患が、線維性皮膚障害である、請求項16記載の方法。
【請求項21】
線維性皮膚障害が、過剰な瘢痕形成である、請求項16記載の方法。
【請求項22】
前記細胞が、造血性細胞である、請求項16記載の方法。
【請求項23】
前記細胞が、肺の上皮細胞である、請求項16記載の方法。
【請求項24】
前記細胞が、間葉細胞である、請求項16記載の方法。
【請求項25】
間葉細胞が、線維芽細胞又は筋線維芽細胞である、請求項24記載の方法。
【図1】


【図2】


【図3】


【図4A】


【図4B】


【図5A】


【図5B】


【図6A】


【図6B.C.D】


【図7A】


【図7B.C.D】


【図8A.B】


【図8C】


【図8D.E.F.G】




【図2】


【図3】


【図4A】


【図4B】


【図5A】


【図5B】


【図6A】


【図6B.C.D】


【図7A】


【図7B.C.D】


【図8A.B】


【図8C】


【図8D.E.F.G】


【公開番号】特開2012−143248(P2012−143248A)
【公開日】平成24年8月2日(2012.8.2)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−96064(P2012−96064)
【出願日】平成24年4月3日(2012.4.3)
【分割の表示】特願2007−556601(P2007−556601)の分割
【原出願日】平成18年2月22日(2006.2.22)
【出願人】(503385923)ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング (976)
【Fターム(参考)】
【公開日】平成24年8月2日(2012.8.2)
【国際特許分類】
【出願番号】特願2012−96064(P2012−96064)
【出願日】平成24年4月3日(2012.4.3)
【分割の表示】特願2007−556601(P2007−556601)の分割
【原出願日】平成18年2月22日(2006.2.22)
【出願人】(503385923)ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング (976)
【Fターム(参考)】
[ Back to top ]

