線維症を処置するための方法およびPI−3キナーゼインヒビターの組成物
本明細書には、PI−3キナーゼインヒビターの方法および組成物、並びに哺乳動物におけるPI−3キナーゼ活性を阻害する際のそれらの使用および患者における線維化症状の処置が記載される。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、2009年4月9日に出願の米国仮特許出願第61/167,905号及び2009年8月21日に出願の米国仮特許出願第61/235,740号の利益を主張するものであり、これら全ては、全体において引用することにより本明細書に組み込まれる。
【背景技術】
【0002】
組織修復過程の間の過剰な結合組織の沈着は線維症を引き起こす。幾つかの例において、異常な及び/又は過剰な線維結合組織が、例えば、傷害、疾患又は感染のために失われた組織の上に広がる又はその組織に取って代わるとき、線維症は発症する。
【発明の概要】
【課題を解決するための手段】
【0003】
本明細書には、ウォルトマンニン又はウォルトマンニンアナログをそれを必要とする個体に投与する工程を含む、結合線維組織増殖症候群を処置する方法が提供される。本明細書にはまた、PI−3キナーゼ(PI3K)インヒビターをそれを必要とする個体に投与する工程を含む、肺線維症を処置する方法が記載される。本明細書にはさらに、ウォルトマンニン又はウォルトマンニンアナログをそれを必要とする個体に投与する工程を含む、肺線維症を処置する方法が記載される。幾つかの例において、線維症は、器官における異常な線維結合組織の進行に関係する。幾つかの例において、線維症は、影響を受けた器官において瘢痕化を引き起こし、それにより、深部器官で機能的及び/又は構造的な構成(architecture)を妨害する。幾つかの例において、線維症は、臓器移植及び/又は臓器同種移植片の手術後に、器官において生じる。幾つかの例において、PI−3キナーゼの活性は、本明細書に記載されるように、結合線維組織増殖症候群の発症及び/又は進行に関係する。
【0004】
従って、本明細書には、PI−3キナーゼの活性を低減又は部分的に低減する方法が記載され、それによって、線維症を逆戻りさせる(reversing)又は線維症の進行を遅らせる又は(例えば、臓器移植後の)線維症の確立(establishment)を予防する。幾つかの実施形態において、本明細書に記載されるウォルトマンニンアナログは、PI−3キナーゼインヒビターである。幾つかの実施形態において、本明細書に記載されるPI−3キナーゼインヒビターは、可逆的なPI−3キナーゼインヒビターである。他の実施形態において、本明細書に記載されるPI−3キナーゼインヒビターは、不可逆的なPI−3キナーゼインヒビターである。
【0005】
本明細書には、幾つかの実施形態において、PI−3キナーゼインヒビターをそれを必要とする個体に投与する工程を含む、軽度又は中程度又は重度の肺線維症を処置する方法が提供される。
【0006】
幾つかの実施形態において、PI−3キナーゼインヒビターは、PI−3キナーゼアルファ、PI−3キナーゼベータ、PI−3キナーゼデルタ又はPI−3キナーゼガンマ、又はそれらの組み合わせを選択的に阻害する。幾つかの実施形態において、PI−3キナーゼインヒビターは、PI−3キナーゼアルファ又はPI−3キナーゼベータ又はそれらの組み合わせを選択的に阻害する。
【0007】
幾つかの実施形態において、PI−3キナーゼインヒビターは、PI−3キナーゼの可逆的インヒビターである。幾つかの実施形態において、PI−3キナーゼインヒビターは、PI−3キナーゼの不可逆的インヒビターである。
【0008】
幾つかの実施形態において、肺線維症は特発性肺線維症である。幾つかの実施形態において、肺線維症は、石綿症、嚢胞性線維症、感染症(例えば、肺炎)、環境アレルゲン(例えば、炭塵、石綿、たばこの煙、ディーゼル排気、オゾン、産業排気からの微粒子)への接触、肺移植、自己免疫性疾患(例えば、強皮症)に関係する、又は肺線維症は、薬物誘発性の肺線維症である。
【0009】
上述される方法の幾つかの実施形態において、PI−3キナーゼインヒビターの投与は、肺線維症の進行を低減又は逆戻り又は減少させる。上述される方法の幾つかの実施形態において、PI−3キナーゼインヒビターの投与は、進行性の体重損失を防ぐ。上述される方法の幾つかの実施形態において、PI−3キナーゼインヒビターの投与は、肺力学におけるTGF−アルファ−依存の変化の進行を遅らせる。幾つかの実施形態において、PI−3キナーゼインヒビターの投与は、肺線維症の確立を防ぐ。幾つかの実施形態において、PI−3キナーゼインヒビターは、予防的に(例えば、肺移植前に)投与される。幾つかの実施形態において、PI−3キナーゼインヒビターは、治療上(例えば、軽度の又は中程度又は重度の肺線維症の発症後に)投与される。
【0010】
方法の幾つかの実施形態において、1以上のPI−3キナーゼインヒビターは、経口投与される。方法の幾つかの実施形態において、1以上のPI−3キナーゼインヒビターは、吸入可能な製剤として投与される。
【0011】
本明細書にはまた、治療上有効な量のウォルトマンニンアナログをそれを必要とする個体に投与する工程を含む、結合線維組織増殖症候群を患っていると診断された又はその疑いのある個体における、結合線維組織増殖症候群を処置する方法が提供される。
【0012】
幾つかの実施形態において、ウォルトマンニンアナログは以下の式の化合物である:
【0013】
【化1】

【0014】
式中、
−−−は任意の結合であり;
nは1−6であり;
Yはヘテロ原子であり;
R1及びR2は、不飽和のアルキル、非直鎖のアルキル、環式のアルキル、及び置換のアルキルから独立して選択される、又はR1及びR2は、それらに付いている原子と共にヘテロシクロアルキル基を形成し;
R3は、存在しないか、H、又はC1−C6の置換又は非置換のアルキルであり;
R4は、(C=O)R5、(C=O)OR5、(S=O)R5、(SO2)R5、(PO3)R5、(C=O)NR5R6であり;
R5は、置換又は非置換のC1−C6アルキルであり;及び
R6は、置換又は非置換のC1−C6アルキルである。
【0015】
幾つかの実施形態において、式IA又は式IBの化合物は、以下から選択される:
【0016】
【化2】

【0017】
式中、Yはヘテロ原子であり、R1及びR2は、不飽和のアルキル、非直鎖のアルキル、環式のアルキル、及び置換のアルキルから独立して選択される。
【0018】
幾つかの実施形態において、Yは、窒素及び硫黄から選択されるヘテロ原子である。幾つかの実施形態において、R1及びR2は、不飽和のアルキルである。幾つかの実施形態において、ウォルトマンニンアナログは、PI−3キナーゼインヒビターである。幾つかの実施形態において、PI−3キナーゼインヒビターはPX−866である。幾つかの実施形態において、PI−3キナーゼインヒビターはPX−867である。
【0019】
幾つかの実施形態において、結合線維組織増殖症候群は、軽度、中程度、又は重度の肺線維症、嚢胞性線維症、眼線維症(例えば、緑内障ろ過手術後の瘢痕化)、心内膜心筋線維症、縦隔線維症、骨髄線維症、骨線維症、線維化性結腸疾患、後腹膜線維症、間質性肺炎、肺内の進行性塊状線維症、ケロイド、強皮症、肥大性瘢痕、腎臓線維症、腸線維症、肝臓線維症、線維化性の胆汁うっ滞性肝炎、腎原性全身性線維症、臓器移植に関係する線維症、結合線維組織増殖症候群、又はアナフィラキシーショックの線維症である。
【0020】
幾つかの実施形態において、結合線維組織増殖症候群は、軽度、中程度、又は重度の特発性肺線維症である。幾つかの実施形態において、結合線維組織増殖症候群は、石綿症、嚢胞性線維症、感染、環境アレルゲンへの接触、肺移植、自己免疫性疾患に関係する肺線維症である、又は結合線維組織増殖症候群は、薬物誘発性の肺線維症である。幾つかの実施形態において、結合線維組織増殖症候群は、臓器移植と関係する。
【0021】
本明細書に記載される方法、化合物、及び組成物の他の目的、特徴及び利点は、以下の詳細な説明から明白となる。しかしながら、詳細な説明と具体的な実施例は、具体的な実施形態を示しているが、例示目的としてのみ与えられることを理解されたい。本明細書に言及される全ての引用は、特許、特許出願、及び公報を含み、言及される目的のための引用により本明細書に組み込まれる。
【図面の簡単な説明】
【0022】
本発明の新しい特徴は、添付の特許請求の範囲内に特に明記される。本発明の特徴及び利点のより良い理解は、本発明の原理が利用される、実例となる実施形態を明記する以下の詳細な説明、及び以下の添付図面への言及によって得られる:
【0023】
【図1A】図1Aは、本開示に従った典型的なウォルトマンニンアナログ及び代謝物質の構造式を示す。
【図1B】図1Bは、本開示に従った典型的なウォルトマンニンアナログ及び代謝物質の構造式を示す。
【図2A】図2は、PX−866が、TGFα誘発性のAktのリン酸化(P−Akt)を阻害することを示す。CCSP−rtTA/otet−TGFαトランスジェニックマウスにおける、P−Aktレベルのウエスタンブロット解析は、Dox処置された単一の導入遺伝子(CCSP/−)のコントロールと比較して、Dox誘発性のTGFα発現の1日後に5倍を超えて増加した。CCSP−rtTA/otet−TGFαマウスのPX−866での前処置は、代表的なイムノブロッティング(A)及びデンシトメトリー解析(B)によって実証されるように、増加したAktのリン酸化を妨げた。値は、各群において、平均±SE、n=6である。CCSP/−コントロール及びPX−866−処置マウスと比較して、*P<0.05である。
【図2B】図2は、PX−866が、TGFα誘発性のAktのリン酸化(P−Akt)を阻害することを示す。CCSP−rtTA/otet−TGFαトランスジェニックマウスにおける、P−Aktレベルのウエスタンブロット解析は、Dox処置された単一の導入遺伝子(CCSP/−)のコントロールと比較して、Dox誘発性のTGFα発現の1日後に5倍を超えて増加した。CCSP−rtTA/otet−TGFαマウスのPX−866での前処置は、代表的なイムノブロッティング(A)及びデンシトメトリー解析(B)によって実証されるように、増加したAktのリン酸化を妨げた。値は、各群において、平均±SE、n=6である。CCSP/−コントロール及びPX−866−処置マウスと比較して、*P<0.05である。
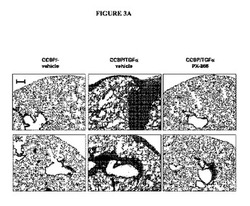
【図3A】図3Aは、PX−866が、肺線維症の確立を防ぐことを示す。4週間のDoxに続いて、コントロールの及びCCSP−rtTA/otet−TGFαトランスジェニックマウスからの肺の切片を、トリクロムで染色した(A)。TGFα誘発の開始にPX−866を投与された、CCSP−rtTA/otet−TGFαトランスジェニックマウスは、ビヒクル処置のCCSP−rtTA/otet−TGFαマウスと比較して、線維症の著しい減衰を示した。顕微鏡写真は2匹の別々の動物からのものであり、各群における5〜7匹のマウスからの肺を表している。顕微鏡写真は全て、同じ倍率で撮られ、目盛は200μmである。肺のコラーゲン含有量は、方法(Methods)に記載されるように、トランスジェニックマウスの肺から測定された。TGFα誘発の時に毎日投与されたPX−866は、肺コラーゲンの増加を防いだ(B)。値は、平均±SEである。CCSP/−コントロール及びPX−866−処置マウスと比較して、*p<0.05である。ビヒクルで処置されたCCSP−rtTA/otet−TGFαマウスと比較して、+p<0.05である。
【図3B】図3Aは、PX−866が、肺線維症の確立を防ぐことを示す。4週間のDoxに続いて、コントロールの及びCCSP−rtTA/otet−TGFαトランスジェニックマウスからの肺の切片を、トリクロムで染色した(A)。TGFα誘発の開始にPX−866を投与された、CCSP−rtTA/otet−TGFαトランスジェニックマウスは、ビヒクル処置のCCSP−rtTA/otet−TGFαマウスと比較して、線維症の著しい減衰を示した。顕微鏡写真は2匹の別々の動物からのものであり、各群における5〜7匹のマウスからの肺を表している。顕微鏡写真は全て、同じ倍率で撮られ、目盛は200μmである。肺のコラーゲン含有量は、方法(Methods)に記載されるように、トランスジェニックマウスの肺から測定された。TGFα誘発の時に毎日投与されたPX−866は、肺コラーゲンの増加を防いだ(B)。値は、平均±SEである。CCSP/−コントロール及びPX−866−処置マウスと比較して、*p<0.05である。ビヒクルで処置されたCCSP−rtTA/otet−TGFαマウスと比較して、+p<0.05である。
【図4】図4は、PX−866が、肺機能におけるTGFα依存の変化を防ぐことを示す。肺力学は、方法に記載されるように測定された。PX−866は、TGFα誘発の時に毎日投与され、4週間のDoxを受けている、ビヒクル処置されたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較して、気道抵抗、気道及び組織のエラスタンスの増加、及びコンプライアンスの減少を防いだ。CCSP/−コントロール及びPX−866−処置マウスと比較して、*p<0.05である。データは、各群において6〜10匹のマウスから導き出された。
【図5】図5は、PX−866が、進行性の体重損失を防ぐことを示す。確立された線維症において、PI3Kの阻害の有効性を評価するために、CCSP−rtTA/otet−TGFαトランスジェニックマウスは、4週間のDoxの後にPX−866で処置され、更に4週間Doxを与え続ける(remaining on Dox)。治療プロトコルは、パネルにおいて概略的に表わされる(A)。コントロールには、ビヒクルで処置され、更に4週間Doxを与え続ける、CCSP/−及びCCSP−rtTA/otet−TGFαマウスが含まれた。マウスについては、処置中に毎週体重を量った。8週間のTGFαのDox誘発性の発現は、ビヒクル処置マウスにおける進行性の体重損失を引き起こし(赤のライン)、一方で、TGFα誘発の4週間後にPX−866で処置されたマウスは、体重に変化はなかった(緑のライン)が、重さはCCSP/−コントロール(青のライン)、及び4週間のDoxを受け、その後、Doxを取り除かれ(Taken off Dox)、4週間のビヒクルで処置されたCCSP−rtTA/otet−TGFαマウスの下のままであった(金のライン)(B)。CCSP/−コントロールマウス、及びDoxを与え続けた及び取り除いた(on and off Dox)CCSP−rtTA/otet−TGFαトランスジェニックマウスと比較すると、*p<0.05であり;PX−866−処置のCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較すると、#p<0.05である。データは1群当たり10匹のマウスから導き出された。
【図6A】図6は、PX−866が、肺線維症の進行を低下させることを示す。TGFα誘発の開始の4週間後にPX−866を投与されたCCSP−rtTA/otet−TGFαトランスジェニックマウス、及びDoxを取り除かれたCCSP−rtTA/otet−TGFαトランスジェニックマウスの両方は、ビヒクル処置のCCSP−rtTA/otet−TGFαマウスと比較して、線維症の減衰を示した(図6A)。顕微鏡写真は、外膜領域(上部)及び肺胞領域(底部)を有する胸膜面に焦点を合わせた2匹の別々の動物からのものである。顕微鏡写真は全て、同じ倍率で撮られ、各群における6匹のマウスからの肺を表している。PX−866−処置マウスにおける肺コラーゲンは、4週間後にDoxを取り除かれたマウスと比較して、変化はなかった(図6B)が、CCSP/−コントロールマウスと比較すると高いままであった。*p<0.05、CCSP/−コントロールマウス、及びDoxを与え続けた及び取り除いたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較すると、*p<0.05であり;ビヒクル処置されたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較すると、#p<0.05である。データは、1群当たり10匹のマウスから導き出された。
【図6B】図6は、PX−866が、肺線維症の進行を低下させることを示す。TGFα誘発の開始の4週間後にPX−866を投与されたCCSP−rtTA/otet−TGFαトランスジェニックマウス、及びDoxを取り除かれたCCSP−rtTA/otet−TGFαトランスジェニックマウスの両方は、ビヒクル処置のCCSP−rtTA/otet−TGFαマウスと比較して、線維症の減衰を示した(図6A)。顕微鏡写真は、外膜領域(上部)及び肺胞領域(底部)を有する胸膜面に焦点を合わせた2匹の別々の動物からのものである。顕微鏡写真は全て、同じ倍率で撮られ、各群における6匹のマウスからの肺を表している。PX−866−処置マウスにおける肺コラーゲンは、4週間後にDoxを取り除かれたマウスと比較して、変化はなかった(図6B)が、CCSP/−コントロールマウスと比較すると高いままであった。*p<0.05、CCSP/−コントロールマウス、及びDoxを与え続けた及び取り除いたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較すると、*p<0.05であり;ビヒクル処置されたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較すると、#p<0.05である。データは、1群当たり10匹のマウスから導き出された。
【図7】図7は、PX−866が、肺力学においてTGFα依存の変化の進行を遅らせることを示す。Doxでの処置の4週間後にPX−866を投与された、CCSP−rtTA/otet−TGFαトランスジェニックマウスは、8週間のDoxを受けている、ビヒクル処置されたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較して、気道抵抗、及び気道及び組織のエラスタンスの増加を減少させ、コンプライアンスの減少を抑えることを示した。PX−866マウスにおける肺力学は、コントロールの及び4週間DoxのないCCSP−rtTA/otet−TGFαマウスと比較して、著しく変更された。CCSP/−コントロールマウス、及びDoxを与え続けた及び取り除いたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較して、*p<0.05であり;PX−866−処置されたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較して、#p<0.05である。データは、1群当たり10匹のマウスから導き出された。
【発明を実施するための形態】
【0024】
本明細書には、PI−3キナーゼインヒビターを含む、化合物、医薬組成物及び薬剤(例えば、本明細書に記載される、式IA、IB、IIA、IIB、又は任意の他のPI−3キナーゼインヒビターの化合物)、及びPI−3キナーゼ活性に関係する疾患又は疾病を処置又は予防するための化合物などを使用する方法が記載される。本明細書にはまた、幾つかの実施形態において、PI−3キナーゼ活性を阻害又は部分的に阻害する化合物(例えば、本明細書に記載される、式IA、IB、IIA、IIB又は任意の他のPI−3キナーゼインヒビターの化合物)、及びPI−3キナーゼ活性に関係する結合線維組織増殖症候群の症状を逆戻りさせる又は緩和するための化合物及び組成物などを使用する方法が記載される。本明細書にはまた、ウォルトマンニンアナログ、及び結合線維組織増殖症候群の処置のためのウォルトマンニンアナログを含む、医薬組成物及び薬剤が提供される。
【0025】
幾つかの例において、線維症は、フィブロネクチンを発現する筋線維芽細胞及び/又は線維芽細胞の増殖に関係する。幾つかの例において、影響を受けた器官におけるフィブロネクチンを発現する筋線維芽細胞及び/又は線維芽細胞の生存は、線維症の進行の決定因子である。幾つかの例において、フィブロネクチン媒介の付着は、PI−3キナーゼのシグナル伝達経路を活性化し、線維症の発症及び/又は進行の一因である。幾つかの例において、器官構造における変更されたフィブロネクチンの発現及び/又は分解は、線維症の病理学的兆候に関係する。
【0026】
幾つかの例において、ゲフィチニブ又はエルロチニブなどのEGFRチロシンキナーゼインヒビターで処置される肺癌の患者は、薬物誘発性の間質性肺疾患を発症する。幾つかの実施形態において、本明細書に記載されるPI−3キナーゼインヒビターは、間質性肺疾患などの薬物誘発性の結合線維組織増殖症候群を発症する患者の処置(例えば、線維症の低減又は逆戻り)を可能にする。幾つかの実施形態において、本明細書に記載される処置の方法は、現在の処置の方法(例えば、免疫抑制剤、EFGRチロシンキナーゼインヒビターでの処置)では効果のない結合線維組織増殖症候群の処置を可能にする。
【0027】
PI−3キナーゼは、ホスファチジルイノシトールのイノシトール環の3位の水酸基をリン酸化することが可能な、関係する酵素のファミリーである。それらは、細胞成長、増殖、分化、運動性、生存及び細胞内移動を含む、細胞機能の種々のリストに関連付けられる。これらの機能の多くは、プロテインキナーゼB(Akt)を活性化するためのPI−3キナーゼの能力に関連する。PI−3キナーゼのp110δアイソフォームの遺伝子の及び薬理学的な不活性化は、この酵素がT細胞、B細胞、肥満細胞及び好中球の機能にとって重要であることを明らかにした。幾つかの例において、PI−3キナーゼは、炎症反応の開始及び/又は維持を含む免疫系の反応において役割を果たす。幾つかの例において、PI−3キナーゼのシグナル伝達経路の阻害は細胞外マトリックスの沈着を阻害し、線維形成促進(profibrogenic)の因子の発現を減らす。線維形成促進の因子は、限定されないが、結合組織成長因子(CTGF)、線維芽細胞成長因子(FGF)、トランスフォーミング成長因子アルファ(TGF−α)、トランスフォーミング成長因子ベータ(TGF−β)などを含む。
【0028】
幾つかの例において、PI3K−Aktは、EGFR誘発性の腫瘍形成過程を媒介する、主要な下流シグナル伝達経路であり、TGFα誘発性の線維症の症状(例えば、肺線維症)を媒介する。幾つかの例において、活発な線維形成の間の肝細胞におけるPI−3キナーゼのシグナル伝達の阻害は、細胞外マトリックスの沈着を阻害し、線維形成促進の因子の発現を減らすため、肝線維症の進行を逆戻り又は低減させる。Son et al.Hepatology.2009,50,1512−23を参照。幾つかの例において、α8β1は、線維症及び臓器傷害の他のモデルにおいて筋線維芽細胞上でアップレギュレートされる。幾つかの例において、α8β1を発現する筋線維芽細胞の生存は、PI−3キナーゼによって媒介される。幾つかの例において、PI−3キナーゼの阻害は、臓器傷害に関係する持続性の線維症を低減又は逆戻りさせる。Farias et al.Biochemical and Biophysical Research Communications,329,2005,Pages 305−311を参照。
【0029】
従って、(例えば、本明細書に記載される、式IA、IB、IIA、IIB又は任意の他のPI−3キナーゼインヒビターの化合物の投与を介した)PI−3キナーゼ活性の阻害は、それを必要とする個体において線維症の進行を逆戻りさせる、低減させる、又は遅らせる。加えて、(例えば、本明細書に記載される、式IA、IB、IIA、IIB又は任意の他のPI−3キナーゼインヒビターの化合物及び/又はウォルトマンニンアナログの投与を介した)PI−3キナーゼ阻害は、線維症が宣告され、進行した後、確立された線維症を緩和及び/又は処置する。幾つかの実施形態において、(例えば、本明細書に記載される、式IA、IB、IIA、IIB又は任意の他のPI−3キナーゼインヒビターの化合物及び/又はウォルトマンニンアナログの投与を介した)PI−3キナーゼ活性の阻害は、結合線維組織増殖症候群にかかりやすい個体(例えば嚢胞性線維症の家族歴を有する個体)において線維症の発症を遅らせる。幾つかの実施形態において、(例えば、本明細書に記載される、式IA、IB、IIA、IIB又は任意の他のPI−3キナーゼインヒビターの化合物及び/又はウォルトマンニンアナログの投与を介した)PI−3キナーゼ活性の阻害は、(例えば、臓器移植後の)線維症の発病を減少させる又は予防する。
【0030】
従って、本明細書には、それを必要とする個体においてPI−3キナーゼの活性を低減又は部分的に低減する方法が記載され、それによって、線維症を逆戻りさせる、又は線維症の進行を遅らせる。幾つかの実施形態において、方法は、PI−3キナーゼインヒビター(例えば、本明細書に記載される、式IA、IB、IIA、IIB又は任意の他のPI−3キナーゼインヒビターの化合物及び/又はウォルトマンニンアナログ)を、それを必要とする個体に投与する工程を含む。幾つかの実施形態において、本明細書に記載されるPI−3キナーゼインヒビターは、可逆的なPI−3キナーゼインヒビターである。他の実施形態において、本明細書に記載されるPI−3キナーゼインヒビターは、不可逆的なPI−3キナーゼインヒビターである。幾つかの実施形態において、本明細書に記載されるPI−3キナーゼインヒビターは、PI−3キナーゼデルタ又はPI−3キナーゼガンマへの阻害活性と比較して、より効力のあるPI−3キナーゼアルファ又はPI−3キナーゼベータのインヒビターである。
【0031】
特定の定義
本明細書及び添付の請求項において使用されるように、単数形「a」、「an」及び「the」は、文脈がはっきりと特に指示していない限り、複数の指示対象を含むことも留意されたい。従って、例えば、「細胞」への言及は、当業者に周知の1以上の細胞及びその同等物などへの言及である。他に定義されない限り、本明細書で使用される全ての専門及び科学用語は、当業者によって一般に理解されるものと同じ意味を有する。本明細書に記載されるこれらのものと類似又は同等の任意の方法及び物質は、本明細書に記載される実施形態の実施又は試験において使用され得るが、特定の好ましい方法、装置、及び物質がこれより記載される。
【0032】
本明細書で使用されるように、用語「約(about)」は、使用されている数の数値の±10%を意味する。それ故、約50%は、45%〜55%の範囲内を意味する。「随意の(Optional)」又は「随意に(Optionally)」は、続いて記載される構造、事象又は状況が生じないかもしれないこと、及びその記載が、事象が生じる及び生じない例を含むことを意味すると受け取られ得る。
【0033】
治療薬と共に使用されるときの「投与すること」は、直接、標的組織の中又は上に投与するように、治療薬を全身に又は局所に投与すること、又は治療薬が標的である組織に確実に効果を与えるように患者に治療薬を投与することを意味する。従って、本明細書に使用されるように、用語「投与すること(Administering)」は、ウォルトマンニンアナログ又はその代謝物質と共に使用されるとき、限定されないが、ウォルトマンニンアナログ又はその代謝物質を標的組織の中又は上に提供すること;例えば、治療薬が標的組織又は細胞に行き渡るような静脈注射によって、ウォルトマンニンアナログ又はその代謝物質を、患者の全身に提供することを含む。組成物を「投与すること」は、注入、局所投与、及び経口投与で、又は他の方法単独で又は他の周知の手法と組み合わせて達成され得る。
【0034】
本明細書で使用されるように,用語「治療薬(therapeutic)」は、患者の望まれない疾病又は疾患を処置、除去、緩和、予防又は改善するために利用される薬剤を意味する。幾つかの実施形態において、治療薬は、本明細書に記載される線維症の症状の処置及び/又は緩和、又は症状の逆戻りに向けられる。幾つかの実施形態において、本明細書に記載される治療薬は、肺線維症の処置及び/又は肺線維症の症状の緩和又は逆戻りに向けられる。
【0035】
用語「動物(animal)」は本明細書に使用されるように、限定されないが、ヒト、及び野生動物、家畜などのヒト以外の脊椎動物を含む。用語「患者(patient)」及び「被験体(subject)」及び「個体(individual)」は、置換え可能で、本開示の化合物で処置され得る任意の生存生物を意味すると受け取られ得る。そのため、用語「患者」および「被験体」は、限定されないが、任意のヒト以外の哺乳動物、任意の霊長類又はヒトを含む。
【0036】
用語「阻害すること(inhibiting)」は、症状の発症を防ぐ、症状を緩和する、又は疾患、疾病又は障害を除去するための、本開示の化合物の投与を含む。
【0037】
「薬学的に許容可能な」により、担体、希釈剤、又は賦形剤は、製剤の他の成分と適合性がなければならず、そのレシピエントに有害であってはならないことが意味される。
【0038】
用語「医薬組成物(pharmaceutical composition)」は、少なくとも1つの活性成分を含む組成物を意味するものとし、それによって、組成物は、哺乳動物(例えば、限定されないが、ヒト)において、特定の、効果的な結果のための検査に適用可能である。当業者は、活性成分が技術者のニーズに基づく所望の効果的な結果を有しているかどうかを決定するのに適切な技術を理解及び認識するであろう。
【0039】
本明細書に使用されるような「治療上有効な量」、又は「有効な量」は、研究者、獣医、医師又は他の臨床医によって求められている組織、器官系、動物、個体又はヒトにおける生物学的反応又は薬への反応を引き出す活性化合物又は医薬品の量を指し、1以上の以下のことを含む:(1)疾患を予防すること;例えば、疾患、疾病又は障害にかかりやすいが、疾患の病状又は総体症状をまだ経験又は示していない個体において、疾患、疾病又は障害を予防すること、(2)疾患を阻害すること;例えば、疾患、疾病又は障害の病状又は総体症状を経験している又は示している個体において、疾患、疾病又は障害を阻害すること(即ち、病状又は総体症状の更なる進行を抑えること)、及び(3)疾患を緩和すること;例えば、疾患、疾病又は障害の病状又は総体症状を経験している又は示している個体において、疾患、疾病又は障害を緩和すること(即ち、病状又は総体症状を逆戻りさせること)。そのため、本開示の組成物の「治療上有効な量」又は「有効な量」の限定しない例は、細胞の活性化、移動、又は増殖を阻害する、又は癌を効果的に処置する又は癌の症状を緩和するために使用され得る。
【0040】
用語「線維症(fibrosis)」、「結合線維組織増殖症候群(fibrosing syndrome)」、又は「線維症の症状(fibrotic condition)」は、置換え可能に使用される。本明細書に使用されるように、用語「線維症」又は「結合線維組織増殖症候群」又は「線維症の症状」は、急性又は慢性の炎症及び/又は傷害に引き続き起こり、炎症又は傷害の部位での細胞及び/又はコラーゲンの異常蓄積に関係し、限定されないが、心臓、腎臓、関節、肺、又は皮膚などの個体の器官又は組織の線維症を含む症状を指す。用語「線維症」または「結合線維組織増殖症候群」又は「線維症の症状」は、肺線維症、特発性肺線維症、特発性間質性肺炎を含む間質性肺疾患、眼線維症(例えば、加齢黄斑変性症に関係する瘢痕化、又は緑内障ろ過手術後の瘢痕化)、嚢胞性線維症、心内膜心筋線維症、縦隔線維症、骨髄線維症、骨線維症、線維化性結腸疾患、後腹膜線維症、間質性肺炎、肺における進行性塊状線維症(石炭労働者じん肺症の合併症)、ケロイド、強皮症、肥大性瘢痕、腎臓線維症(例えば、尿細管間質性線維症)、(例えば、クローン病、炎症性大腸疾患に関係する)腸線維症、肝臓線維症、線維化性の胆汁うっ滞性肝炎、腎原性全身性線維症、結合線維組織増殖症候群、アナフィラキシーショックの線維症などを含む。幾つかの実施形態において、本明細書に記載される任意の線維症又は結合線維組織増殖症候群は、原因が不明である(特発性)。幾つかの実施形態において、本明細書に記載される任意の線維症又は結合線組織増殖症候群は、嚢胞性線維症に関係する。幾つかの実施形態において、本明細書に記載される任意の結合線維組織増殖症候群は、自己免疫性疾患、炎症、癌などに関係する。幾つかの実施形態において、本明細書に記載される任意の結合線維組織増殖症候群は、感染症(例えば、肺炎、結核、鳥インフルエンザなど)に関係する。幾つかの実施形態において、本明細書に記載される任意の線維症又は結合線維組織増殖症候群は、臓器移植(例えば、肺移植、肝移植、腎移植)に関係する。幾つかの実施形態において、本明細書に記載される任意の線維症又は結合線維組織増殖症候群は、限定されないが、石綿、炭塵、たばこの煙、ディーゼル排気、オゾン、大気微粒子などを含む、アレルゲン及び/又は環境汚染物質への接触に関係する。幾つかの実施形態において、本明細書に記載される任意の線維症又は結合線維組織増殖症候群は薬物誘発性の線維症である。
【0041】
本発明の方法は、内科治療及び/又は予防的治療の両方を適切なものとして含む。治療上の及び/又は予防的な効果を得るために投与される化合物の特定の投与量は、例えば、投与される化合物、投与経路、及び処置されている疾病を含む事例を取り巻く、特定の状況によって、もちろん、決定されるであろう。化合物は、広い投与量範囲にわたって有効であり、例えば、1日当たりの投与量は、通常、0.001から100mg/kgまでの範囲内、より一般的には、0.01から1mg/kgまでの範囲内にある。しかしながら、投与される有効な量が、処置される疾病、投与される化合物の選択、及び投与の選択される経路を含む、関連する状況に照らして、医師によって決定されることが理解されるであろう。本明細書に記載される化合物の治療上有効な量は、典型的に、生理学的に容認可能な賦形剤の組成物において投与されるとき、組織において有効な全身濃度又は局所濃度を達成するのに十分であるような量である。
【0042】
本明細書に使用されるような用語「処置(treat)」、「処置される(treated)」、又は「処置すること(treating)」は、治療処置及び予防的な対策又は予防策の両方を指し、その目的は、望まれない生理学的な疾病、傷害又は疾患を予防する又は遅らせる(減少させる)、又は有益な又は所望の臨床結果を得ることである。本明細書に記載される目的のために、有益な又は所望の臨床結果は、限定されないが、症状の軽減;疾病、傷害又は疾患の範囲の減少;疾病、傷害又は疾患の状態の安定化(即ち、悪化させない);疾病、傷害又は疾患の発症の遅延又は進行の停滞;疾病、傷害又は疾患の緩和;及び検知可能又は検知不可能であろうと、疾病、傷害又は疾患の(部分的又は全体的な)緩解、又は向上又は改善を含む。処置は、過剰レベルの副作用のない、臨床的に有意な反応を引き出すことを含む。処置はまた、処置を受けない場合に予想される生存と比較して、生存を延長することを含む。
【0043】
用語、「ウォルトマンニンアナログ(wortmannin analog)」又は「ウォルトマンニンのアナログ(analog of wortmannin)」は、ウォルトマンニンにおいて、1以上の原子、官能基、又は下部構造が異なる原子、官能基、又は下部構造に置き換えられた一方で、ウォルトマンニンの機能活性を保持又は改善する、及び/又はPK特性を改善する、及び/又はウォルトマンニンの毒性を低減する、任意の化合物を指す。
【0044】
「アルキル」基は、脂肪族炭化水素基を指す。「アルキル」基は、置換及び非置換のアルキル基を含む。アルキル基への言及は、「飽和のアルキル」及び/又は「不飽和のアルキル」を含む。アルキル基は、飽和又は不飽和であろうと、分枝の基、直鎖の基、又は環式の基を含む。ほんの一例として、アルキルは、メチル、エチル、プロピル、イソ−プロピル、n−ブチル、イソ−ブチル、sec−ブチル、t−ブチル、ペンチル、イソ−ペンチル、ネオ−ペンチル、及びヘキシルを含む。幾つかの実施形態において、アルキル基は、決して限定されないが、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、第三ブチル、ペンチル、ヘキシル、エテニル、プロペニル、ブテニル、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルなどを含む。「低級アルキル」は、C1−C6アルキルである。「ヘテロアルキル」基は、アルキル基の炭素の任意の1つを、(例えば、CH2基をNH基又はO基に)付けた適切な数の水素原子を有するヘテロ原子と置換する。
【0045】
用語「シクロアルキル(cycloalkyl)」又は「環式のアルキル(cyclic alkyl)」は、単環式又は多環式の非芳香族のラジカルを指し、環を形成する各々の原子(即ち骨格原子)は、炭素原子である。「シクロアルキル」基は、置換及び非置換のシクロアルキル基を含む。様々な実施形態において、シクロアルキルは、飽和、又は部分的に不飽和である。幾つかの実施形態において、シクロアルキルは、芳香環と融合する。幾つかの実施形態において、シクロアルキルは、ヘテロアリール環と融合する。シクロアルキル基は、3乃至10の環原子を有する基を含む。シクロアルキル基の用例は、限定されないが、以下の部分などを含む:
【0046】
【化3】

【0047】
単環式のシクロアルキルは、限定されないが、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、及びシクロオクチルを含む。二環式のシクロアルキルは、限定されないが、テトラヒドロナフチル、インダニル、テトラヒドロペンタレンなどを含む。多環式のシクロアルキルは、アダマンタン、ノルボルナンなどを含む。用語、シクロアルキルは、「不飽和の非芳香性のカルボサイクリル」又は「非芳香性の不飽和のカルボサイクリル」を含み、両方とも、本明細書に定義されるように、非芳香性のカルボサイクリルを指し、少なくとも1つの炭素炭素二重結合又は1つの炭素炭素三重結合を含む。
【0048】
「ヘテロアリサイクリック」基又は「ヘテロシクロ」基又は「ヘテロシクロアルキル」基は、シクロアルキル基を指し、少なくとも1つの骨格環原子は、窒素、酸素及び硫黄から選択されるヘテロ原子である。「ヘテロシクロアルキル」基は、置換及び非置換のヘテロシクロアルキル基を含む。様々な実施形態において、ラジカルは、アリール又はヘテロアリールと融合する。非芳香族ヘテロ環としても言及される、ヘテロシクロ基の用例は以下のものなどを含む:
【0049】
【化4】

【0050】
用語「ヘテロアリサイクリック」はまた、炭水化物の環状体を全て含み、炭水化物は、限定されないが、単糖類、二糖類、及びオリゴ糖類を含む。
【0051】
ウォルトマンニンアナログ
ウォルトマンニンは、菌類ペニシリウムのウォルトマンニンの培養液から分離された天然の化合物である。ウォルトマンニンは、キナーゼ上の特定のリジン、パイ(pi)10a アイソフォームの触媒部位のATP結合ポケットのLys802又はパイ105アイソフォームのLys883との共有結合相互作用を介して、PI−3−キナーゼを不可逆的に阻害する。p110α、p110β、p110δ、及びp110γなどのPI−3キナーゼのほとんどのアイソフォームは、例えば、ウォルトマンニンによって等しく阻害される。しかしながら、ウォルトマンニンは肝臓及び血液の毒性を示し、生物学的に不安定な分子である。中性pHで、37℃又は0°Cのいずれかで水溶液として保存されたサンプルは、フラン環の加水分解の開放によって分解されやすい。フラン環の親電子性は、ウォルトマンニンの阻害活性の中心であることが示されてきた。PI−3−キナーゼの不可逆阻害は、ウォルトマンニンの位置C(20)でのフラン環上のキナーゼの活発なリジンのアタック(attack)に続くエナミンの形成によって生じる。従って、ウォルトマンニンの分解は、PI−3キナーゼ上のその阻害活性を妨げる。
【0052】
幾つかの実施形態において、本明細書に記載されるウォルトマンニンのアナログ及び代謝物質は、改善された生物学的安定性及び低減された全身毒性を示す。幾つかの実施形態において、本明細書に記載されるウォルトマンニンのアナログ及び代謝物質は、PI−3キナーゼインヒビターである。従って、本明細書に記載されるウォルトマンニンアナログの方法及び組成物は、例えば、肺線維症を含む線維症の症状を処置する、改善された方法を可能にする。
【0053】
幾つかの実施形態において、本明細書に記載される処置の方法に適しているウォルトマンニンアナログは、以下の式IA又はIBの化合物を含む:
【0054】
【化5】

【0055】
式中、
−−−は任意の結合であり;
nは1−6であり;
Yはヘテロ原子であり;
R1及びR2は、不飽和のアルキル、非直鎖のアルキル、環式のアルキル、及び置換のアルキルから独立して選択される、又はR1及びR2は、それらに付いている原子と共にヘテロシクロアルキル基を形成し;
R3は、存在しないか、H、又はC1−C6の置換又は非置換のアルキルであり;
R4は、(C=O)R5、(C=O)OR5、(S=O)R5、(SO2)R5、(PO3)R5、(C=O)NR5R6であり;
R5は、置換又は非置換のC1−C6アルキルであり;及び
R6は、置換又は非置換のC1−C6アルキルである。
【0056】
幾つかの実施形態において、本明細書に記載される処置の方法に適しているウォルトマンニンアナログは、以下の式の化合物を含む:
【0057】
【化6】

【0058】
式中、Yはヘテロ原子であり、R1及びR2は、不飽和のアルキル、非直鎖のアルキル、環式のアルキル、及び置換のアルキルから独立して選択される。
【0059】
幾つかの実施形態において、本明細書に記載される結合線維組織増殖症候群の処置に適しているウォルトマンニンアナログは、限定されないが、PX−866、PX−867、PX−868、PX−870、PX−871、PX−880、PX−881、PX−882、PX−889、PX−890、DJM2−170、DJM2−171、DJM2−177、DJM2−181及びそれらの組み合わせから選択された、化合物及び/又はその代謝物質を含む。幾つかの実施形態において、本明細書に記載される線維性障害の処置に適しているウォルトマンニンアナログは、英国公報第2302021号に記載される化合物を含み、その化合物は、引用によって本明細書に組み込まれる。
【0060】
図1は、結合線維組織増殖症候群の処置に有用な、典型的なウォルトマンニンアナログ及びその代謝物質の式を示す。
【0061】
PI−3キナーゼインヒビター
幾つかの実施形態において、本明細書に記載される結合線維組織増殖症候群(例えば、肺線維症)の処置に適しているPI−3キナーゼインヒビターは、限定されないが、ウォルトマンニンアナログ、ウォルトマンニン代謝物質、NVP−BEZ235、PI−130、LY294002及びオールトランス型レチノイン酸(ATRA)を含む。
【0062】
幾つかの実施形態において、本明細書に記載される結合線維組織増殖症候群の処置に適しているPI−3キナーゼインヒビターは、本明細書に記載のような式IA、IB、IIA及びIIBの化合物を含む。
【0063】
幾つかの実施形態において、結合線維組織増殖症候群(例えば、肺線維症)の処置に適しているPI−3キナーゼインヒビターは、限定されないが、米国特許出願公開第2005/0032727号、2007/0203098号、2007/0259876号、2008/0188423号、2009/0042773号、2007/0021447号、2008/0039459号、2008/0300239号、2009/0018131号、2009/0023742号、2009/0029998号、2009/0048252号、2009/0170848号、2009/0215818号、2009/0306074号、2009/0048252号、2008/0300239号、2009/0018131号、2009/0023742号、2009/0048252号、2009/0170848号、2009/0215818号、2009/0306074号に記載されるPI−3キナーゼインヒビターを含み、それらに記載されるPI−3キナーゼインヒビター化合物は、引用によって本明細書に組み込まれる。
【0064】
結合線維組織増殖症候群及び処置の方法
肺線維症
本明細書には、1以上のPI−3キナーゼインヒビターをそれを必要とする個体に投与する工程を含む、間質性肺疾患を処置する方法が提供される。幾つかの実施形態において、間質性肺疾患は、肺線維症である。幾つかの実施形態において、間質性肺疾患は、特発性肺線維症である。
【0065】
肺線維症は、多くの小児及び成人の肺疾患における罹患率及び死亡率の一因である。肺線維症を引き起こす臨床疾患は、不均一であり、線維症は、急性呼吸窮迫症候群におけるような急性肺傷害に続き、嚢胞性線維症(CF)におけるような慢性炎症性疾患から発症する可能性がある、又は特発性肺線維症(IPF)におけるように、原因不明に発症する可能性がある。肺線維症の病理的特徴は、基礎疾患プロセスによって変わり得るが、多くの共通する特徴が存在し、それは間充織細胞の増殖、細胞外マトリックスの拡張及び肺実質のリモデリングを含む。本明細書で使用されるように、肺線維症は、特発性肺線維症、びまん性間質性肺線維症、間質性肺臓炎、肺における進行性塊状線維症(石炭労働者じん肺症の合併症)などを含む。また、本明細書に記載される実施形態の範囲内で検討されるのは、嚢胞性線維症などの基礎疾患、又は強皮症などの自己免疫性疾患から生じる肺線維症である。本明細書で使用されるように、肺線維症は、限定されないが、石綿(即ち、石綿肺に関連する肺線維症)、炭塵、たばこの煙、ディーゼル排気、オゾンなどの大気汚染物質、産業排気からの微粒子などを含む、環境アレルゲン又は汚染物質への接触から生じる肺線維症を含む。本明細書で使用されるように、肺線維症は、肺炎などの感染又は任意の他の感染に関係する肺線維症を含む。肺線維症はまた、薬物誘発性の肺線維症(例えば、ブレオマイシンなどの薬物の投与から副作用として生じる線維症)を含む。
【0066】
従って、本明細書で提供される方法及び組成物は、本明細書に記載される任意の間質性肺障害及び/又は肺性の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。幾つかの実施形態において、間質性肺疾患及び/又は肺性の結合線維組織増殖症候群は、肺における筋線維芽細胞の増殖に関係する。幾つかの実施形態において、それを必要とする個体への1以上のPI−3キナーゼインヒビター(例えば、本明細書に記載される式IA、IAB、IIA又はIIBの化合物又は任意の他のPI−3キナーゼインヒビター)の投与は、肺における筋線維芽細胞の増殖を阻害、又は部分的に阻害し、それによって、本明細書に記載される任意の間質性肺疾患及び/又は肺性の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0067】
EGFR(HER1)は、HER2/neu、HER3及びHER4も含む受容体チロシンキナーゼのタンパク質ファミリーに属する。6つのEGFRリガンド(TGFα、EGF、HB−EGF、アンフィレグリン、ベータセルリン及びヘレグリン)は、肺に又は肺細胞内に局在している。活性化リガンドによって、EGFRファミリーメンバーは、異なる生物学的能力で様々なホモダイマー又はヘテロダイマーを形成する。EGFRの活性化は、種々の細胞機能を制御し、それらの多くは、細胞成長、増殖、分化、移動、アポトーシスからの保護及び形質転換を含む線維形成に関係する。肺上皮においてTGFαを特異的に発現する、ドキシサイクリン(Dox)制御可能なトランスジェニックマウスは、炎症とは無関係である、進行性及び広範囲な、脈管外膜の線維症、気管支周囲の線維症、間質性及び胸膜線維症を示す。これらのマウスの肺におけるTGFαの発現後に観察される遺伝子発現特性は、ヒトにおける肺性の線維症の疾患において見受けられる特性に類似している。
【0068】
幾つかの例において、EGFR活性の下流のシグナル伝達経路は、TGFα誘発性の肺線維症を媒介する。細胞外ドメインへのリガンドの結合の後に、受容体のホモダイマー及びヘテロダイマーが形成され、細胞質ドメインにおいて特異残基上の内因性のチロシンキナーゼ活性による、自己リン酸化又はリン酸基転移につながる。リン酸化チロシン残基は、RAS/RAF/キナーマイトジェン活性化プロテインキナーゼ(MAPK)カスケード、JAK/STAT経路、ホスホリパーゼCγ経路及びホスファチジルイノシトール3’−キナーゼ(PI3K)/Akt(プロテインキナーゼB)シグナル伝達経路を含む、多数の下流のエフェクター経路を活性化するシグナル伝達分子のためのドッキング部位になる。PI3Kは、受容体チロシンキナーゼ、Gタンパク質共役受容体又はサイトカイン受容体の活性化に反応して、ホスファチジルイノシトール(3,4,5)−三リン酸塩(PIP3)を形成するための、ホスファチジルイノシトール(4,5)−重リン酸塩(PIP2)のリン酸化を触媒するシグナル伝達酵素である。PIP3は、次々にAktを活性化し、成長、増殖、移動、生存及びコラーゲン遺伝子の発現を含む線維成長に関係する多くの細胞プロセスに関係している。腫瘍抑制因子ホスファターゼ及びテンシンホモログ(PTEN)は、PIP3をPIP2に脱リン酸化するPI3K−Akt経路のマイナス成長調節物質(negative growth regulator)である。PTENの薬理学的インヒビターで処置された、PTENハプロ不全のマウス及び野生型マウスの両方は、肺線維症の病因における対立しないPI3K−Akt活性のためのインビボの役割を支持する、ブレオマイシン誘発性の肺傷害に続く、増大したコラーゲン沈着及び筋線維芽細胞の分化を示す。
【0069】
幾つかの実施形態において、1以上のPI−3キナーゼインヒビターのそれを必要とする個体への投与は、肺細胞においてEGFRの活性を減少又は抑制する。幾つかの実施形態において、1以上のPI−3キナーゼインヒビターのそれを必要とする個体への投与は、TGF−αのEGFRへの結合を減少又は妨害し、それによって、PI−3キナーゼの下流の活性を阻害又は部分的に阻害する。
【0070】
PBK−AktがEGFR誘発性の腫瘍形成過程を媒介する主要な下流のシグナル伝達経路であるため、PBK−AktはTGFα誘発性の肺線維症を媒介し得る。PX−866は、抗腫瘍物質として現在、高度な前臨床開発中であるPI3Kの新しいインヒビターである。制御可能なトランスジェニックマウスにおいてTGFα誘発の時にPX−866を投与することによる、肺線維症の開始および伝播におけるPBKの役割は、図2乃至7及び実施例1乃至2において本明細書に記載される。
【0071】
幾つかの例において、PI3K以外の追加の下流のシグナル伝達経路は、活性化されたままであり、肺線維症の維持への一因であり続ける。EGFRなどのチロシンキナーゼ受容体は、細胞の成長及び増殖を制御するPI3K及び他の経路を活性化する。幾つかの実施形態において、肺線維症の維持における追加のシグナル伝達経路の活性の、標的とされた治療介入は、肺線維症の併用療法を可能にする。
【0072】
実施例1乃至2及び図2乃至7は、PI3KインヒビターPX−866での処置が、トランスジェニックマウスにおいてEGFR媒介の肺線維症及び関係する肺力学の変化を妨げることを示す。増加したEGFRリガンド及びEGFRの活性化は、線維性肺疾患を患う患者の幾つかの研究において確認されてきた。増加したTGFαは、IPFを患った患者の肺洗浄液において検知され、免疫組織化学は、TGFα及びEGFRの増加をタイプIIの上皮細胞、線維芽細胞及びIPFサンプルの脈管内皮に限局した。増加したEGFR及びEGFRリガンドもまた、嚢胞性線維症、気管支肺異形成及び喘息を患う患者の再構築された組織において確認された。幾つかの例において、EGFR標的の治療は、肺線維症のブレオマイシン、ナフタリン、石綿肺及びオバルブミンのモデルを含む、多くの動物モデルにおいて線維症を阻止する。従って、本明細書に記載される実施形態の範囲内で検討もされるのは、肺線維症の処置のためのEGFR標的の治療薬及びPI−3キナーゼモジュレーターを投与する工程を含む、併用療法である。
【0073】
幾つかの例において、EGFRシグナル伝達は間質性肺疾患を媒介し、急性肺傷害の間にサーファクタントタンパク質の発現を維持する。特定の場合において、EGFRの阻害は、サーファクタントタンパク質の発現を減少させることにより肺傷害を悪化させる。同時に、これらの発見は、肺のリモデリングに特有である経路を定義するという目標を持って線維症を媒介する、EGFRの下流のシグナル伝達経路の更なる分析を支持する。本開示は、PI3K−Aktが、肺線維症を媒介するEGFR活性の下流の主要なエフェクター経路であることを示す。
【0074】
PI3K経路は、肺線維症の媒介に関係する。ヒト及びマウスの線維芽細胞の両方における研究は、PI3K活性が、増加した増殖、コラーゲン合成及び筋線維芽細胞の分化と共に減少したアポトーシスにつながることを示す。IPFを患う患者から分離された線維芽細胞は、PI3K−Aktの異常活性化に関係する減少したPTEN発現及び活性、及び増加した増殖を示す。制御可能なTGFβ1トランスジェニックモデルにおける肺線維症は、マウスがAktインヒビターで処置されたとき、著しく減衰した。
【0075】
TGFαトランスジェニックモデルにおける線維症は、TGFα活性と無関係に発症し、これは、PI3K/Akt経路が、多数の線維症促進の刺激が間葉の増殖及びマトリックスの沈着の細胞反応を引き出すために集中する、潜在的な合流点を表わし得ることを示唆する。血小板由来成長因子(PDGF)ファミリーは、肺線維症の炎症性のモデルにおいて関係する別の線維症促進のサイトカインファミリーである。PDGFは、EGFRのように、受容体チロシンキナーゼである2つの受容体を介して作用する。EGFR及びTGFβ1のように、PDGF受容体はPI3Kを活性化する。集合的に、これらのデータは、PI3Kを、多数の線維形成のサイトカインが集中する共通経路として更に支持する。
【0076】
上皮細胞及び間充織細胞の両方は、TGFαに反応して増殖するが、両方の細胞タイプにおけるPI3K活性が、線維症につながるかどうかは不明瞭である。Pten遺伝子が肺上皮から暫定的に消失されたトランスジェニックマウスは、気管支内腔及び細気管支腔へ突き出た線維血管性コアを伴う、乳頭が並んだ(lining papillae)富細胞性の上皮細胞によって特徴付けられた際立った上皮過形成に関係する、増加した上皮のPI3K−Akt活性を示した。しかしながら、TGFαマウスと異なり、過形成は進行性ではなく、実質線維化は発症せず、これが、線維芽細胞のPI3K活性がPI3K/Akt媒介の線維症の媒介において重要であることを示唆した。
【0077】
最近のデータは、ヒトの線維性肺疾患におけるPI3K−Aktの活性を支持する。IPF患者からの肺生検の免疫組織学的分析は、線維芽細胞の病巣における増加したリン酸化のAktを示す。ヒトの線維症の疾患における異常なPI3Kシグナル伝達の証拠と結び付けられた、TGFα及びTGFβトランスジェニックモデルにおけるPI3K阻害は、PI3K−Akt経路を薬理学的に標的とすることを支持する。
【0078】
幾つかの実施形態において、本明細書には、被験体に治療上有効な量のウォルトマンニンアナログ又はウォルトマンニン代謝物質を投与する工程を含む、被験体の肺線維症を処置する方法が提供される。
【0079】
幾つかの実施形態において、本明細書には、肺線維症の治療のための、PI−3キナーゼインヒビター(例えば、本明細書に記載される、式IA、IB、IIA又はIIBの化合物、又は任意の他のPI−3キナーゼインヒビター)を使用するための方法が提供され、ここでの肺線維症は、軽度又は中程度である。幾つかの実施形態において、本明細書には、肺線維症の治療のためのPI−3キナーゼインヒビター(例えば、本明細書に記載される、式IA、IB、IIA又はIIBの化合物、又は任意の他のPI−3キナーゼインヒビター)を使用するための方法が提供され、ここでの肺線維症は、宣告され進行しているものである。幾つかの実施形態において、PI−3キナーゼインヒビター(例えば、本明細書に記載される、式IA、IB、IIA又はIIBの化合物、又は任意の他のPI−3キナーゼインヒビター)は、肺線維症の進行を減少させる。幾つかの実施形態において、PI−3キナーゼインヒビター(例えば、本明細書に記載される、式IA、IB、IIA又はIIBの化合物、又は任意の他のPI−3キナーゼインヒビター)は、肺力学においてTGF−α依存の変化の進行を遅らせる。幾つかの実施形態において、PI−3キナーゼインヒビター(例えば、本明細書に記載される、式IA、IB、IIA又はIIBの化合物、又は任意の他のPI−3キナーゼインヒビター)は、進行性の体重損失を防ぐ。
【0080】
幾つかの実施形態において、本明細書には、式IA、IB、IIA又はIIBの化合物の代謝物質を投与する工程を含む、肺線維症を処置する方法が提供される。一例として、特定の代謝物質が図1に示される。そのような実施形態の幾つかにおいて、そのような代謝物質は、ウォルトマンニンのインヒビターの活性に類似した又はそれより良いPI−3キナーゼに対する阻害活性を示す。
【0081】
眼線維症
本明細書には、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼのインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)をそれを必要とする個体に投与する工程を含む、眼線維症(眼の任意の領域における線維症及び/又は瘢痕化)の処置の方法が提供される。幾つかの例において、眼の恒常性が、例えば、感染又は炎症又は代謝性疾患によって妨害されるとき、線維症はグリア細胞及び/又は線維芽細胞によって媒介される。幾つかの例において、角膜の線維症(例えば、ヘルペス性角膜炎)は、感染(例えばウイルス感染)の後に生じる。幾つかの例において、糖尿病に関係する網膜の低酸素症は、線維症及びそれに続く牽引性網膜剥離(進行性の糖尿病性網膜症の合併症)につながる。幾つかの例において、新生血管の加齢黄斑変性(ARMD)に関係する網膜下の大量出血は、網膜下の線維症を引き起こす。幾つかの例において、線維芽細胞及び線維芽細胞様細胞(例えば、眼内のグリア細胞)の増殖は、細胞外マトリックスの変異につながり、それが瘢痕形成及び/又は視力喪失につながる。幾つかの例において、結膜の退化は、結果的に角膜表面での線維症につながる。幾つかの例において、眼線維症は、角膜移植の後に生じる。幾つかの例において、未熟児網膜症(ROP)は、未熟児の眼内の線維症に関係する。幾つかの例において、瘢痕化は、緑内障ろ過手術の後に生じる。
【0082】
幾つかの例において、眼線維症は、血管新生促進のVEGF及び線維症促進のCTGFのレベル間のバランスの変化の結果である。幾つかの実施形態において、1以上のPI−3キナーゼインヒビターのそれを必要とする個体への投与は、CTGFを阻害又は部分的に阻害する。幾つかの実施形態において、CTGFの阻害又は部分的な阻害は、眼線維症の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。従って、本明細書で提供される方法及び組成物は、本明細書に記載される任意の眼の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0083】
幾つかの実施形態において、眼の結合線維組織増殖症候群は、線維芽細胞又は線維芽細胞様細胞の増殖に関係する。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、線維芽細胞の増殖を阻害又は部分的に阻害し、それによって、本明細書に記載される任意の眼の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、緑内障ろ過手術後の瘢痕化の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、ARMDに関係する網膜内の瘢痕化の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0084】
胃腸管における結合線維組織増殖症候群
本明細書には、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼのインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)をそれを必要とする個体に投与する工程を含む、胃腸(GI)管における結合線維組織増殖症候群の処置の方法が提供される。GI管における結合線維組織増殖症候群は、限定されないが、線維化性結腸疾患、(例えば、クローン病、炎症性大腸疾患に関係する)腸線維症、肝臓線維症、線維化性の胆汁うっ滞性肝炎などを含む。そのような実施形態の幾つかにおいて、GI管の結合線維組織増殖症候群は嚢胞性線維症(例えば、線維化性結腸疾患)に関係する。幾つかの例において、活性化された線維芽細胞は、肝臓線維症の間の線維性の細胞外マトリックスの蓄積の一因である。
【0085】
幾つかの実施形態において、GI管の結合線維組織増殖症候群は、線維芽細胞の増殖に関係する。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、線維芽細胞の増殖を阻害又は部分的に阻害し、それによって、本明細書に記載される任意のGI管の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0086】
腎臓系における結合線維組織増殖症候群
本明細書には、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼのインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)をそれを必要とする個体に投与する工程を含む、腎臓係における結合線維組織増殖症候群の処置の方法が提供される。腎臓係における結合線維組織増殖症候群は、限定されないが、慢性腎疾患、後腹膜線維症、糖尿病腎症、慢性の糸球体硬化症、尿細管間質性線維症などを含む。
【0087】
幾つかの実施形態において、腎臓の結合線維組織増殖症候群は、線維芽細胞の増殖及び/又は活性化に関係する。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、線維芽細胞の増殖を阻害又は部分的に阻害し、それによって、本明細書に記載される任意の腎臓の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0088】
皮膚の結合線維組織増殖症候群
本明細書には、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼのインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)をそれを必要とする個体に投与する工程を含む、皮膚の結合線維組織増殖症候群の処置の方法が提供される。皮膚の結合線維組織増殖症候群は、限定されないが、ケロイド、強皮症、肥大性瘢痕、腎原性全身性線維症などを含む。幾つかの例において、ケロイドは、皮膚傷害の治癒の後に発症する緻密線維組織の異常増殖の結果である。幾つかの例において、肥大性瘢痕は、熱傷害及び/又は深い真皮を含む他の傷害の後に見られる。腎原性全身性線維症(NSF)は、皮膚において顕著な及び目に見える影響を有する全身性障害である。幾つかの例において、NSFと診断された患者は、軽度に隆起したプラーク、丘疹又は集密的な丘疹;及び/又は増加した数の線維芽細胞を示す生検、真皮において見られる正常なパターンのコラーゲン線維束の変化、及び増加したムチンの皮膚沈着を伴う、広範囲の硬化した皮膚を生じる。
【0089】
幾つかの実施形態において、皮膚の結合線維組織増殖症候群は、任意の皮層における線維芽細胞の増殖及び/又は活性化に関係する。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、線維芽細胞の増殖を阻害又は部分的に阻害し、それによって、本明細書に記載される任意の皮膚の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0090】
臓器移植に関係する結合線維組織増殖症候群
幾つかの実施形態において、結合線維組織増殖症候群は、移植肝(例えば、線維化性の胆汁うっ滞性肝炎、肝臓線維症、腎線維症など)などの(同種移植片及び/又は異種移植片を含む)臓器移植に関係する。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、移植臓器又はその近くにおける線維症の発生を減少させる又は妨げる。
【0091】
他の結合線維組織増殖症候群
本明細書には、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼのインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)をそれを必要とする個体に投与する工程を含む、特定の他の結合線維組織増殖症候群の処置の方法が提供される。そのような結合線維組織増殖症候群は、限定されないが、嚢胞性線維症、心内膜心筋線維症、縦隔線維症、骨髄線維症、骨線維症、結合線維組織増殖症候群、アナフィラキシーショックの線維症などを含む。
【0092】
実施例3乃至12は、上述される特定の結合線維組織増殖症候群の処置のための特定のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター)の使用を記載する。
【0093】
幾つかの実施形態において、上述される任意の結合線維組織増殖症候群は、線維芽細胞の増殖及び/又は活性化に関係する。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター)のそれを必要とする個体への投与は、線維芽細胞の増殖を阻害又は部分的に阻害し、それによって、本明細書に記載される任意の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0094】
1つの実施形態において、本明細書には、以下の構造を有する治療上有効な量のPX−866を被験体に投与する工程を含む、被験体において上述される任意の結合線維組織増殖症候群(例えば、肺線維症)を処置する方法が提供される:
【0095】
【化7】

【0096】
1つの実施形態において、本明細書には、以下の構造を有する治療上有効な量のPX−867を被験体に投与する工程を含む、被験体において上述される任意の結合線維組織増殖症候群(例えば、肺線維症)を処置する方法が提供される:
【0097】
【化8】

【0098】
特定の更なる実施形態は、限定されないが、PX−868、PX−870、PX−871、PX−880、PX−881、PX−882、PX−889、PX−890、DJM2−170、DJM2−171、DJM2−177、DJM2−181及びそれらの組み合わせから選択される、治療上有効な量のウォルトマンニンアナログ及び代謝物質を、それを必要とする個体に投与する工程を含む、結合線維組織増殖症候群(例えば、肺線維症)を処置する方法を提供する。
【0099】
併用療法
幾つかの実施形態において、本明細書には、結合線維組織増殖症候群(例えば、肺線維症)を処置するための第2の治療薬と組み合わせた、PI−3キナーゼインヒビター(例えば、本明細書に記載される式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター)を使用するための方法が提供される。
【0100】
幾つかの実施形態において、本明細書には、結合線維組織増殖症候群(例えば、肺線維症)を処置するための第2の治療薬と組み合わせた、ウォルトマンニンアナログ又は代謝物質を使用するための方法が提供される。
【0101】
第2の治療薬の例は、限定されないが、例えば、コルチコステロイド(例えば、プレドニゾン、デキサメタゾン、トリアムシノロン又は任意の他のコルチコステロイド)、ガンマインターフェロン、血清アミロイドP、シクロホスファミド、アザチオプリン、メトトレキサート、ペニシラミン、シクロスポリンなどの免疫抑制剤を含む。他の第2の治療薬は、コルヒチン、ミコフェノール酸モフェチル、ピルフェニドンなどを含む。幾つかの実施形態において、第2の治療薬は、タンパク質の治療薬(例えば、抗体)である。
【0102】
ラパマイシンの哺乳類標的(mTOR)は、高度に保存された細胞内のセリン/トレオニンキナーゼ及びPI3K経路における主要な下流の構成成分である。ケラチン研究は、PI3K−Akt−mTOR経路が、肺内でのEGFR活性によって誘発された線維化反応を媒介することを示す。従って、幾つかの実施形態において、本明細書に記載される線維症の処置の方法は、本明細書に記載される確立された肺線維症及び/又は他の線維症の症状の予防、進行の遅延、逆戻り及び/又は部分的な逆戻りのためにPI−3キナーゼインヒビターと組み合わせた、小分子のEGFRチロシンキナーゼインヒビター(例えばゲフィチニブ、エルロチニブなど)を投与する工程を含む。幾つかの実施形態において、本明細書に記載される線維症の処置の方法は、本明細書に記載される確立された肺線維症及び/又は他の線維症の症状の予防、進行の遅延、逆戻り及び/又は部分的な逆戻りのために、限定されないが、ラパマイシン、テムシロリムス、デフォロリムス、エベロリムス、BEZ235などを含む、小分子のmTorインヒビターを投与する工程を含む。
【0103】
医薬組成物/製剤
幾つかの実施形態において、本明細書に記載される化合物は、医薬組成物に製剤される。具体的な実施形態において、医薬組成物は、活性化合物を薬学的に使用可能な調剤に処理することを促進する賦形剤及び助剤を含む、1以上の生理学的に許容可能な担体を用いて、従来の方法で製剤される。適切な製剤は、選択される投与経路に依存する。任意の薬学的に許容可能な技術、担体、及び賦形剤は、本明細書に記載される医薬組成物を製剤するのに適したものとして使用される:Remington:The Science and Practice of Pharmacy,Nineteenth Ed(Easton,Pa.:Mack Publishing Company,1995);Hoover,John E.,Remington’s Pharmaceutical Sciences,Mack Publishing Co.,Easton,Pennsylvania 1975;Liberman,H.A.and Lachman,L.,Eds.,Pharmaceutical Dosage Forms,Marcel Decker,New York,N.Y.,1980;及び、Pharmaceutical Dosage Forms and Drug Delivery Systems,Seventh Ed.(Lippincott Williams & Wilkins1999)。
【0104】
本明細書には、式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログ、及び薬学的に許容可能な希釈剤、賦形剤、又は担体を含む医薬組成物が提供される。特定の実施形態において、本明細書に記載される化合物は、併用療法におけるように、式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログが、他の活性成分と混合される医薬組成物として投与される。本明細書に包含されるのは、下記の併用療法の節及び本開示の至る所に記述される活性分子の全ての組み合わせである。具体的な実施形態において、医薬組成物は、1以上の式IA、IB、IIA又はIIBの化合物を含む。
【0105】
医薬組成物は、本明細書で使用されるように、式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログと、担体、安定剤、希釈剤、分散剤、懸濁化剤、増粘剤、及び/又は賦形剤などの他の化学成分との混合物を指す。特定の実施形態において、医薬組成物は、有機体への化合物の投与を促進する。幾つかの実施形態において、本明細書に提供される処置又は使用の方法を実行することで、治療上有効な量の式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログが、処置される疾患又は疾病を有する哺乳動物に医薬組成物として投与される。特定の実施形態において、哺乳動物は、ヒトである。特定の実施形態において、治療上有効な量は、被験体の疾患の重症度、年齢及び相対的な健康状態、使用される化合物の効力及び他の要因によって変化する。本明細書に記載される化合物は、単独で、又は混合物の成分としての1以上の治療薬と組み合わせて使用される。
【0106】
そのような組成物において、薬理学的に活性な化合物は、「活性成分」として知られている。組成物を作る際に、活性成分は、通常、担体と混合される、又は担体によって薄められる、又はカプセル、サシェ(sachet)、紙又は他の容器の形態であり得る担体内に封入されるであろう。担体が希釈剤として機能するとき、それは、ビヒクル、活性成分の媒体の賦形剤として働く、固形、半固形、又は液状の物質であり得る。従って、組成物は、タブレット、丸剤、散剤、トローチ、サシェ、カシェ剤、エリキシル剤、乳剤、エマルション、シロップ、懸濁剤、軟及び硬ゼラチンカプセル、無菌注射剤、及び無菌包装された散剤の形態であることが可能である。
【0107】
適切な担体、賦形剤及び希釈剤の幾つかの例は、ラクトース、デキストロース、蔗糖、ソルビトール、マンニトール、デンプン、アラビアゴム、リン酸カルシウムアルギン酸塩、ケイ酸カルシウム、微結晶性セルロース、ポリビニルピロリドン、セルロース、トラガカント、ゼラチン、シロップ、メチルセルロース、メチル−及びプロピルヒドロキシベンゾアート、タルク、ステアリン酸マグネシウム、水、及び鉱油を含む。組成物は、平滑剤、湿潤剤、乳化及び懸濁化剤、保存剤、甘味剤又は香味剤を更に含むことができる。組成物は、当業者に周知の手順を使用することによって、患者への投与の後の活性成分の即時、持続、遅延の放出を提供するように製剤され得る。
【0108】
投与の適切な経路は、限定されないが、経口投与、静脈内投与、直腸投与、エアロゾール投与、非経口投与、経眼投与、経肺投与、経粘膜投与、経皮投与、膣内投与、経耳投与、経鼻投与、及び局所投与を含む。加えて、ほんの一例ではあるが、非経口送達は、くも膜下注射、直接的な脳室内注射、腹腔内注射、リンパ内注射、及び鼻腔内注射だけでなく、筋肉内注射、皮下注射、静脈内注射、髄内注射も含む。
【0109】
特定の実施形態において、本明細書に記載される化合物は、しばしばデポ製剤又は持続放出性製剤として、例えば、器官への直接的な化合物の注射を介して、全身的な様式よりもむしろ局所的な様式で投与される。
【0110】
線維症(例えば、肺線維症)の処置のための活性化合物の阻害量の局所送達は、線維症の部位又はその近くに化合物を投与する様々な技術により得る。局所送達の技術の例は、限定されないが、利用可能な技術の例示となるように意図される。例は、局所送達のカテーテル、部位特異的な担体、移植、直接注射、又は直接適用を含む。カテーテルによる局所送達は、線維症の部位への直接的な治療薬の投与を可能にする。
【0111】
移植による局所送達とは、線維症の臓器(例えば、肺)への治療薬を含むマトリックスの外科的な配置を指す。移植されたマトリックスは、拡散、化学反応、又は溶媒の活性化体によって治療薬を放出する。
【0112】
別の実施例は、ポリマーの腔内シーリングによる治療薬の送達である。この技術は、内腔の内面にポリマーインプラントを適用するためにカテーテルを使用する。生分解性のポリマーインプラントに組み込まれた治療薬は、それにより、手術部位に放出される。それは、PCT WO 90/01969(Schindler,Aug.23,1989)に記載される。
【0113】
インプラントによる局所送達のさらなる例は、部位への小胞または粒子状物質の直接注入による。これらの粒子状物質は、タンパク質、脂質、炭水化物または合成高分子など物質からできているかもしれない。これらの粒子状物質は、コーティングとして微小粒子の全体にわたって、または微小粒子一面に取り込まれた治療薬を有する。粒子状物質を取り込む送達システムは、Lange,Science 249:1527−1533 (1990)and Mathiowitz et al,J.App.Poly.Sci.,26:809(1981)に記載されている。
【0114】
部位特異的担体による局所送達は、薬物を標的線維症の臓器(例えば、肺)に向ける担体に治療薬を付着させることを記載する。この送達技術の例は、タンパク質リガンドまたはモノクローナル抗体など担体の使用を含む。
【0115】
いくつかの実施形態において、長期間作用型製剤は、移植(例えば皮下、又は筋肉内に)又は筋肉内注射により投与される。更に、他の実施形態において、薬物は標的とする薬物送達システムにおいて、例えば、臓器特異的抗体(organ−specific antibody)に覆われたリポソームにおいて送達される。このような実施形態において、リポソームは臓器に対し標的とされ、臓器により選択的に取り込まれる。また他の実施形態において、本明細書に記載の化合物は、急速放出製剤の形態、拡張放出製剤の形態、または中間的放出製剤の形態で提供される。また他の実施形態において、本明細書に記載の化合物は局所的に投与される。
【0116】
1つの実施形態において、式IA、IB、IIAまたはIIBの1つ以上の化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログが、水溶液中で製剤される。特定の実施形態において、その水溶液は、ほんの一例であるが、ハンクス溶液、リンガー溶液または生理的食塩水の緩衝液のような生理的に適合する緩衝液から選択される。他の実施形態において、式IA、IB、IIAまたはIIBの1つ以上の化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログが、経粘膜投与のために製剤される。特定の実施形態において、粘膜用製剤は、浸透すべきバリアにとって適切である浸透剤を含む。本明細書に記載の化合物が、他の非経口投与のために処方されるさらに他の実施形態において、適切な処方は、水溶性または非水溶性の溶液を含む。特定の実施形態において、そのような溶液は、生理学的に適合する緩衝液および/または賦形剤を含む。
【0117】
別の実施形態において、本明細書に記載の化合物は、経口投与のために製剤される。式IA、IB、IIA若しくはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログを含む本明細書に記載されている化合物は、活性化合物を、例えば薬学的に許容可能な担体または賦形剤と組み合わせることにより製剤される。様々な実施形態において、本明細書に記載の化合物は、ほんの一例であるが、錠剤、粉剤、丸薬、糖衣錠、カプセル剤、液剤、ゲル剤、シロップ剤、エリキシル剤、スラリー剤、懸濁剤などを含む、経口の投与形態で製剤される。
【0118】
経口投与については、化合物は、担体および賦形剤と混合されたり、タブレットにかたどられたり、ゼラチンカプセルに封入されたりし得る。
【0119】
特定の実施形態において、経口使用の医薬調製物は、一もしくはそれより多い固体の賦形剤を、本明細書に記載されている一もしくはそれより多い化合物と混合することによって得られ、必要に応じて、錠剤または糖衣錠コア(dragee cores)を得るために、得られた混合物を任意に粉砕し、適切な助剤を添加した後に顆粒の混合物を処理することで得られる。適切な賦形剤は、特に、ラクトース、ショ糖、マンニトールまたはソルビトールを含む糖などのフィラー;例えば、トウモロコシデンプン、小麦でん粉、米でん粉、じゃが芋でん粉、ゼラチン、トラガカントゴム、メチルセルロース、微結晶性セルロース、ヒドロキシプロピルメチルセルロース、ナトリウムカルボキシメチルセルロースなどのセルロース調製物:またはポリビニルピロリドン(PVPまたはポビドン)あるいはリン酸カルシウムなどの他のもの、である。具体的な実施形態において、崩壊剤が任意に加えられる。崩壊剤は、ほんの一例ではあるが、架橋クロスカルメロースナトリウム、ポリビニルピロリドン、寒天、またはアルギン酸もしくはアルギン酸ナトリウムなどのその塩を含む。
【0120】
1つの実施形態において、糖衣錠コアや錠剤などの剤形は、一もしくはそれより多い適切なコーティングを提供する。具体的な実施形態において、濃縮糖液は、剤形をコーティングするために使用される。糖液は、ほんの一例ではあるが、アラビアゴム、タルク、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコール、および/または二酸化チタン、ラッカー溶液、および適切な有機溶媒、または混合溶媒などのさらなる成分を任意に含む。染料および/または色素はまた、同定目的のためコーティングへ任意に加えられる。更に、染料および/または色素は、活性な化合物の投与量の異なる組み合わせを特徴づけるため任意に利用される。
【0121】
特定の実施形態において、本明細書に記載されている少なくとも一つの治療上有効な量の化合物は、他の経口剤形態で製剤される。経口剤形態は、ゼラチン製の柔らかい密封されたカプセル剤のみでなく、ゼラチン製の押し出しカプセル剤、およびグリセロールやソルビトールなどの可塑剤を含む。具体的な実施態様において、押し出しカプセル剤は、一もしくはそれより多いフィラーと混合された活性成分を含む。フィラーは、ほんの一例ではあるが、ラクトース、でん粉などの結合剤、および/またはタルクもしくはステアリン酸マグネシウムなどの潤滑剤、および任意に安定剤を含む。他の実施形態において、軟カプセル剤は適切な液体中で溶解または懸濁された一もしくはそれより多い活性な化合物を含む。適切な液体は、ほんの一例ではあるが、一もしくはそれより多い脂肪油、流動パラフィン、または液体ポリエチレングリコールを含む。更に、安定剤(stabilizer)が任意に加えられる。
【0122】
他の実施形態において、本明細書に記載されている治療上有効な量の少なくとも一つの化合物は、口腔投与または舌下投与のために製剤される。口腔投与または舌下投与に適した製剤は、ほんの一例ではあるが、錠剤、ロゼンジ剤、またはゲル剤を含む。
【0123】
更に他の実施態様において、本明細書に記載されている化合物は、ボーラス注入または持続注入に適した製剤を含む、非経口注入のために処方される。式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、代替的に、10%の水性のグルコース溶液、等張の食塩水、滅菌水などのような液体に溶かされ、静注で、または注入によって投与され得る。
【0124】
具体的な実施形態において、注入用製剤は、単位剤形で(例えばアンプルで)、または複数回用量容器で提供される。保存剤が、注入製剤へ任意に加えられる。更なる他の実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、油性ビヒクルまたは水性ビヒクル中の、無菌の懸濁剤、溶剤、またはエマルションとして、非経口注入に適した形態で製剤される。非経口注入製剤は、懸濁剤、安定剤、および/または分散剤などの処方剤(formulatory agent)を任意に含む。具体的な実施形態において、非経口投与のための医薬製剤は、水溶性形態の活性な化合物の水溶液を含む。更なる実施形態において、活性な化合物の懸濁剤は、適切な油性注入懸濁剤として調製される。本明細書に記載されている医薬組成物で使用される適切な親油性溶媒またはビヒクルは、ほんの一例ではあるが、ごま油などの脂肪油、またはオレイン酸エチルもしくはトリグリセリドなどの合成脂肪酸エステル、またはリポソームを含む。特定の具体的な実施形態において、水性注入懸濁剤は、カルボキシメチルセルロースナトリウム、ソルビトール、またはデキストランのような懸濁剤の粘度を増加させる物質を含む。懸濁剤は、高濃縮溶液の調製を可能にするため、化合物の溶解度を増加させる適切な安定剤または薬剤を任意に含む。代替的に、他の実施形態において、活性成分は、使用前に適切なビヒクル、例えば発熱物質を含まない滅菌水と共に構成するための粉末形態である。
【0125】
1つの態様において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、本明細書に記載されているような、または当該技術分野で既知の非経口注射のための溶液として調製され、自動注入器により投与される。米国特許第4,031,893号、 第5,358,489号;第5,540,664号;第5,665,071号、第5,695,472号およびWO/2005/087297(その各々はそのような開示のために参照によって本明細書に組み込まれる)に開示されたもののような自動注入器が知られている。一般に、自動注入器はすべて、注入されるための式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログを含む多くの溶液を含む。一般に、自動注入器は溶液の保持のためリザーバを含み、それは、薬物を送達するための注射針と同様、自動的に注射針を配置し、患者に注射針を挿入し、そして患者に薬物を送達するためのメカニズムとも流体で連絡している。典型的な注射器は、溶液の1mLにつき、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログのおよそ0.5mgから10mgの濃度で、溶液の約0.3mLを与える。各注射器は、化合物の1回用量のみ送達することができる。
【0126】
さらに他の実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、局所的に投与される。本明細書に記載されている化合物は、溶液、懸濁剤、ローション剤、ゲル剤、ペースト剤、薬用スティック、バーム、クリーム、または軟膏のような様々な局所投与が可能な組成物へと製剤される。そのような医薬組成物は、可溶化剤、安定剤、等張増強剤、緩衝剤、および保存剤を任意に含む。
【0127】
さらに他の実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、経皮投与のために製剤される。具体的な実施形態において、経皮製剤は、経皮送達装置および経皮送達パッチを利用し、そして、ポリマーまたは粘着剤で溶解および/または分散した親油性エマルションまたは緩衝水溶液になることが可能である。様々な実施形態において、このようなパッチは、治療剤の連続送達、パルス送達、またはオンデマンド送達用に構築される。さらなる実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの経皮的な送達は、イオン導入パッチなどによって達成される。特定の実施形態において、経皮パッチは、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの制御された送達を提供する。具体的な実施形態において、吸収速度は、律速膜(rate−controlling membrane)を使用することで、または化合物をポリマーマトリックスもしくはゲルの中に補足することで低減される。代替的な実施形態において、吸収促進剤は吸収性を高めるために使用される。吸収促進剤または担体は、皮膚を介する通過を補助する、薬学的に許容可能な吸収性溶媒を含む。例えば、1つの実施形態において、経皮装置は、支持部材、任意に担体と共に、化合物を含むリザーバ、任意に、制御された所定の速度で長時間にわたって宿主の皮膚に化合物を送達するための律速用バリア、および皮膚に装置を固定する手段を含む包帯の形態である。
【0128】
本明細書に記載の経皮製剤は当該技術分野で記載された様々な装置を用いて投与される。例えば、そのような装置は、限定されないが、米国特許第3,598,122号、第3,598,123号、第3,710,795号、第3,731,683号、米国特許第3,742,951号、第3,814,097号、第3,921,636号、第3,972,995号、第3,993,072号、第3,993,073号、第3,996,934号、第4,031,894号、第4,060,084号、第4,069,307号、第4,077,407号、第4,201,211号、第4,230,105号、第4,292,299号、第4,292,303号、第5,336,168号、第5,665,378号、第5,837,280号、第5,869,090号、第6,923,983号、第6,929,801号、及び第6,946,144号を含む。
【0129】
本明細書に記載の経皮剤形は、当該技術分野では通常である、特定の薬学的に許容可能な賦形剤を組み込むことがある。1つの実施形態において、本明細書に記載されている経皮的な製剤は少なくとも3つのコンポーネント:(1)式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの製剤;(2)浸透促進剤;および(3)水性アジュバント、を含む。加えて、経皮製剤は、これらに限定されないが、例えば、ゲル化剤、クリーム、及び軟膏基剤などの付加的な化合物をさらに含み得る。幾つかの実施形態において、経皮製剤は、吸収を促進し、皮膚から取り除かれることを防ぐために、裏地、又は不織布裏地さらに含む。他の実施形態において、本明細書に記載の経皮製剤は肌への拡散を促進するために飽和状態又は過飽和状態を維持する。
【0130】
他の実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、吸入による投与のために製剤される。吸入投与に適した様々な形態は、エアロゾル、ミスト、または粉末を含むが、これら限定されない。式IA、IB、IIAまたはIIBまたは本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの医薬組成物は、適切な推進剤(例えば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素、または他の適切なガス)を使用して、加圧包装またはネブライザーからエアロゾルスプレー形態で都合よく送達される。具体的な実施形態において、加圧されたエアロゾルの用量単位は、計量された量を送達するために、バルブを提供することによって決定される。特定の実施形態において、吸入器または注入器で使用するための、ほんの一例ではあるが、ゼラチンなどから成るカプセル剤および薬包は、化合物と、ラクトースまたはでん粉などの適切な粉末基剤の粉末混合を含んで製剤される。
【0131】
経鼻投与の剤形は従来技術で周知であり、例えば、米国特許第4,476,116号、第5,116,817号、第6,391,452号に記載され、その各々は参照によって特に組み込まれる。式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログを含む剤形は、これらの技術及び当該技術分野で周知の他の技術に従って調製されるが、このような剤形は、ベンジルアルコール又は他の好適な保存料、フルオロカーボン、及び/又は従来技術で公知の可溶化剤又は分散剤を用いて生理食塩水中の溶液として調製される。例えば、Ansel,H.C.et al.,Pharmaceutical Dosage Forms And Drug Delivery Systems,Sixth Ed.(1995)を参照されたい。好ましくは、これらの組成物及び剤形を、適切で毒性のない、薬学的に許容可能な成分を用いて調製される。これらの成分は、REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY, 21st edition, 2005(当該分野における標準的なリファレンスである)などのソースにおいて見出される。適切な担体の選択は、所望の鼻腔剤形(例えば、溶液、分散液、軟骨剤、又はゲル剤)の正確な性質に大きく依存している。鼻腔剤形は、一般的に、活性成分に加えて、大量の水を含有する。pH調節剤、乳化剤、又は分散剤、保存料、界面活性剤、ゲル化剤、又は緩衝剤、及び他の安定剤及び可溶化剤などの少量の他の成分も同様に存在することもある。好ましくは、鼻腔剤形は、鼻からの分泌物と等張であるべきである。
【0132】
吸入による投与に関して、本明細書に記載の化合物は、エアロゾル、噴霧、又は粉末としての形態で有り得る。本明細書に記載の医薬組成物は、好適な噴射剤(例えば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素、又は他の好適な気体)を用いて、加圧包装又は噴霧器から送り出されるエアロゾルの噴霧という形状で効果的に送達される。加圧型エアロゾルの場合、用量単位は計測された量を送達するためのバルブを提供することによって決定されてもよい。インヘラー又は吸入器を用いるための、ほんの一例ではあるが、ゼラチンのカプセル剤及び薬包は、本明細書に記載の化合物と、ラクトース又はスターチのような粉末基材の粉末混合を含んで製剤され得る。
【0133】
更なる他の実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、ポリビニルピロリドン、PEGなどの合成ポリマーだけでなく、ココアバターまたは他のグリセリドなどの従来の坐薬用基剤を含む、浣腸剤、直腸用ゲル剤、直腸用気泡剤、直腸用エアロゾル、坐薬、ゼリー状坐薬、または保持用浣腸剤などの直腸用組成物に製剤される。組成物の坐薬形態において、これらに限定されないが、例えば脂肪酸グリセリドの混合物などの低融点ワックスは、任意にココアバターと組み合わされて最初に溶解する。
【0134】
特定の実施形態において、医薬組成物は、賦形剤および補助剤を含む一もしくはそれより多い生理的に許容可能な担体を用いる任意の従来の様式で製剤され、これらの賦形剤および補助剤は、薬学的に使用できる調製物へと活性化合物を処理するのを容易にする。適切な製剤は、選択される投与経路に依存する。薬学的に許容可能なあらゆる技術、担体、および賦形剤は、適切に、当技術分野で理解されているように任意に使用される。式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログを含む医薬組成物は、従来の様式、ほんの一例として、従来の混合、溶解、造粒、ドラジェー製法、微粒子化、乳化、カプセル化、封入、又は圧縮プロセスなどの手段によって、製造可能である。
【0135】
医薬組成物は、少なくとも1つの薬学的に許容可能な担体、希釈剤または賦形剤、および、有効成分として少なくとも1つの式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログを含む。活性成分は、遊離酸形態もしくは遊離塩基形態、または薬学的に許容可能な塩の形態である。更に、本明細書に記載されている方法および医薬組成物は、同じタイプの活性を備えるこれら化合物の活性代謝物質だけでなく、N−酸化物、結晶型(多形体としても知られている)の使用を含む。本明細書に記載されている化合物の全ての互変異性体は、本明細書提示の化合物の範囲内に含まれる。更に、本明細書に記載されている化合物は、水やエタノールなどの薬学的に許容可能な溶媒を有する溶媒和形態のみでなく、非溶媒和形態も含む。本明細書に提示の化合物の溶媒和形態は、また、本明細書で開示されるとみなされる。更に、医薬組成物は、保存剤、安定剤、湿潤剤、もしくは乳化剤、溶解促進剤、浸透圧を調整する塩、緩衝剤、および/または他の治療上有効な物質などの、他の医薬品または治療剤、担体、アジュバントを任意に含む。
【0136】
本明細書に記載されている化合物を含む組成物の調製方法は、固体、半固体、または液体を形成するために、化合物を一もしくはそれより多い不活性な薬学的に許容可能な賦形剤または担体と共に処方する工程を含む。固形組成物は、粉剤、錠剤、分散性顆粒、カプセル剤、カシェ剤、および坐薬を含むが、これらに限定されない。液体組成物は、本明細書に開示される、化合物を溶解した溶液、化合物を含むエマルション、または化合物を含むリポソーム、ミセル、またはナノ粒子を含む溶液を含む。半固形組成物は、ゲル剤、懸濁剤、およびクリームを含むが、これらに限定されない。本明細書に記載されている医薬組成物の形態は、液体溶液または懸濁液、使用前に液体に溶解もしくは懸濁することに適した固形形態、またはエマルションを含む。これらの組成物はまた、湿潤剤または乳化剤、pH緩衝剤などの微量の非毒性補助物質を任意に含む。
【0137】
幾つかの実施形態において、少なくとも1つの式IA、IB、IIAまたはIIBの化合物又は本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログを含む医薬組成物は、薬物が溶液中、懸濁液中、またはその両方に存在する液体の形態を実例としてとる。一般的に組成物が溶液または懸濁液として投与されると、薬剤の第一の部分は溶液中に存在し、薬剤の第二の部分は液体マトリックス中の懸濁液中に粒子形態で存在する。いくつかの実施形態において、液体組成物はゲル製剤を含む。他の実施形態において、液体組成物は水性である。
【0138】
特定の実施形態において、医薬品の水溶性懸濁液は、懸濁剤として一もしくはそれより多いポリマーを含む。ポリマーは、セルロースポリマー、例えばヒドロキシプロピルメチルセルロースなどの水溶性ポリマー、および架橋カルボキシル含有ポリマーなどの非水溶性ポリマーを含む。本明細書に記載されている特定の医薬組成物は、例えばカルボキシメチルセルロース、カルボマー(アクリル酸ポリマー)、ポリ(メチルメタクリレート)、ポリアクリルアミド、ポリカルボフィル、アクリル酸/アクリル酸ブチルコポリマー、アルギン酸ナトリウム、およびデキストランから選択される粘膜付着性ポリマーを含む。
【0139】
医薬組成物はまた、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの溶解性を助けるために可溶化剤を任意に含む。「可溶化剤」という用語は、一般的に、薬剤のミセル溶液または真性溶液をもたらす薬剤を含む。特定の許容可能な非イオン性界面活性剤、例えばポリソルベート80は可溶化剤として役立ち、眼科用として許容可能なグリコール、ポリグリコール、例えばポリエチレングリコール400、およびグリコールエーテルも役立ち得る。
【0140】
更に、医薬組成物は、1つ以上のpH調整剤または酢酸、ホウ酸、クエン酸、乳酸、リン酸および塩酸のような酸;水酸化ナトリウム、リン酸ナトリウム、ホウ酸ナトリウム、クエン酸ナトリウム、酢酸ナトリウム、乳酸ナトリウムおよびトリスヒドロキシメチルアミノメタンのような塩基;およびシトラート/デキストロース、重炭酸ナトリウムおよび塩化アンモニウムのような緩衝液を含む緩衝剤を随意に含む。このような酸、塩基、および緩衝液は、組成物のpHを許容可能な範囲で維持するのに必要とされる量で含まれる。
【0141】
更に、医薬組成物は、組成物の重量モル浸透圧濃度を許容可能な範囲にするために必要な量で一もしくはそれより多い塩を任意に含む。このような塩は、ナトリウムカチオン、カリウムカチオン、またはアンモニウムカチオン及び塩化物アニオン、クエン酸アニオン、アスコルビン酸アニオン、ホウ酸アニオン、リン酸アニオン、重炭酸アニオン、硫酸アニオン、チオ硫酸アニオン又は亜硫酸水素アニオンを有するものを含み、適切な塩は、塩化ナトリウム、塩化カリウム、チオ硫酸ナトリウム、亜硫酸水素ナトリウム及び硫酸アンモニウムを含む。
【0142】
他の医薬組成物は、微生物の活性を抑制する一もしくはそれより多い保存剤を任意に含む。
適切な保存剤は、メルフェン(merfen)とチオマーサルなど水銀を含有している物質;安定した二酸化塩素;塩化ベンザルコニウム、セチルトリメチルアンモニウム臭化物及びセチルピリジニウム塩化物等の四級アンモニウム化合物を含む。更なる他の医薬組成物は、物理的安定性を増幅するため、または他の目的のために、一もしくはそれより多い界面活性剤を含む。適切な界面活性剤は、ポリオキシエチレン脂肪酸グリセリド及び例えばポリオキシエチレン(60)水素化ヒマシ油等の植物油、及び、例えば、オクトキシノール10、オクトキシノール40等のポリオキシエチレンアルキルエーテルとアルキルフェニルエーテルを含む。
【0143】
更なる他の医薬組成物は、必要な化学安定性を増幅させる一もしくはそれより多い抗酸化剤を含み得る。適切な抗酸化剤は、ほんの一例ではあるが、アスコルビン酸および二亜硫酸ナトリウムを含む。
【0144】
特定の実施形態において、医薬品の水性懸濁液組成物は、単回用量用の再密閉できない容器に包装される。あるいは、複数回用量用の再密閉できる容器が使用され、この場合は、組成物中に保存剤を含むことが一般的である。
【0145】
代替の実施形態において、疎水性医薬化合物用の他の送達システムが利用される。リポソームおよびエマルションは、本明細書での送達用ビヒクルまたは担体の例である。特定の実施形態において、N−メチルピロリドンなどの有機溶媒も利用される。更なる実施形態において、本明細書に記載されている化合物は、治療薬剤を含む固形疎水性ポリマーの半透性マトリックスなどの徐放システムを用いて送達される。様々な徐放物質が本明細書で役立つ。いくつかの実施形態において、徐放カプセル剤は、数時間から24時間までの間、化合物を放出する。治療試薬の化学的性質と生物学的安定性に依存して、タンパク質安定化のための追加方策が利用され得る。
【0146】
特定の実施形態において、本明細書に記載されている製剤は、一もしくはそれより多い抗酸化剤、金属キレート剤、チオール含有化合物、および/または他の一般的な安定剤を含む。これら安定剤の例としては、限定されるものではないが、(a)約0.5%〜約2%w/vのグリセロール、(b)約0.1%〜約1%w/vのメチオニン、(c)約0.1%〜約2%w/vのモノチオグリセロール、(d)約1mM〜約10mMのEDTA、(e)約0.01%〜約2%w/vのアスコルビン酸、(f)0.003%〜約0.02%w/vのポリソルベート80、(g)0.001%〜約0.05%w/vのポリソルベート20、(h)アルギニン、(i)ヘパリン、(j)硫酸デキストラン、(k)シクロデキストリン、(l)ペントサンポリサルフェートおよび他のヘパリノイド、(m)マグネシウムと亜鉛などの2価カチオン;又は(n)それらの組み合わせが挙げられる。
【0147】
投与方法および処置レジメン
1つの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、線維症の症状の処置のための薬物の製剤に使用される。加えて、そのような処置を必要とする被験体における本明細書に記載されているあらゆる疾患や疾病を処置するための方法は、先述の被験体に治療上有効な量の、少なくとも一つの式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログ、またはその薬学的に許容可能な塩、薬学的に活性な代謝物質、薬学的に許容可能なプロドラッグ、もしくは薬学的に許容可能な溶媒和物を含む、医薬組成物の投与を含む。
【0148】
特定の実施形態において、本明細書に記載されている化合物を含む組成物は、予防的および/または治療的処置のために投与される。特定の治療上の適用では、組成物は、既に疾患や疾病で苦しむ患者に、その疾患または疾病の症状を治し、または少なくとも部分的に阻止するのに十分な量で投与される。このような使用に有効な量は、疾患または疾病の重症度および経過、以前の治療、患者の健康状態、体重、および薬物への反応性、ならびに処置を行う医師の判断に左右される。治療上有効な量は、投与量増加臨床試験などを含むが、これらに限定されない方法により任意に定められる。
【0149】
予防上の適用において、本明細書に記載の化合物を含有する組成物は、特定の疾患、障害、又は疾病の影響を受け易く、またはその危険に曝されている患者に投与される。このような量は、「予防に有効な量または用量」と定義される。このような使用において、正確な量は、患者の健康状態、体重などにも左右される。患者に使用されると、この使用に有効な量は、疾患、障害、または疾病の重症度および経過、以前の治療、患者の健康状態および薬物への反応性、ならびに処置を行う医師の判断に左右される。
【0150】
患者の疾病が改善されない特定の実施形態において、患者の疾患または疾病の症状を改善、あるいは、そうでなければ、制御または制限するために、医師の裁量により化合物の投与は、慢性的に、つまり、患者の生存時間全体を含む長時間の間投与される。
【0151】
患者の疾状が改善される特定の実施形態において、投与される薬の投与量は、一時的に減少するか、一定時間の間一時的に停止させられることもある(即ち、「休薬期間」)。具体的な実施形態において、休薬期間の長さは、2日から1年までの間であり、ほんの一例ではあるが、2日、3日、4日、5日、6日、7日、10日、12日、15日、20日、28日、35日、50日、70日、100日、120日、150日、180日、200日、250日、280日、300日、320日、350日、および365日を含む。休薬期間中の投与量の減少は、10%から100%の間であり、ほんの一例ではあるが、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、および100%である。
【0152】
一旦患者の状態の改善が生じると、必要ならば維持量が投与される。続いて、具体的な実施形態において、投与量もしくは投与頻度、またはその両方が、その症状の機能として、改善された疾患、障害、または疾病が持続する量まで減らされる。しかし、特定の実施形態において、任意の症状の再発により、患者は断続的な処置を長期的に必要とする。
【0153】
このような量に相当する所与の薬剤の量は、特定の化合物、処置を必要とする被験体または宿主の疾患状態およびその重症度、アイデンティティ(例えば体重、性別)などの要因次第で変わるが、それにもかかわらず、例えば投与される特定の薬剤、投与経路、処置される疾病、および処置される被験体または宿主を含む症例を取り巻く特定の環境に応じて定めることができる。しかし一般的に、成人の処置に利用される投与量は、典型的に1日当たり0.02〜5000mg、好ましくは1日当たり1〜1500mgの範囲内にある。1つの実施形態において、所望の投与量は単回投与で、または同時に(もしくは短時間で)投与されるか、または適切な間隔、例えば一日に2回、3回、4回、またはそれ以上の下位投与量として投与される分割用量で、都合よく提供される。
【0154】
幾つかの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、慢性的に投与される。幾つかの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、断続的に投与される(例えば、化合物が投与されないか、低減された量で投与される期間を含む休薬期間)。幾つかの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、(a)式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの毎日の投与を含む、第1の期間;その後に続く(b)投与される、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの毎日の量の用量減少を含む第2の期間、を含むサイクルで投与される。幾つかの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、第2の期間に投与されない。幾つかの実施形態において、投与量のみでなく第1と第2の期間の持続期間は、本明細書に記載されているか、当該技術分野で既知の方法を使用して決定される。いくつかの場合において、休薬期間または用量減少期間は、活性剤の薬力学的特性に依存して適切である。
【0155】
特定の実施形態において、本明細書に記載されている医薬組成物は、正確な投与量の単回投与に適した単位剤形である。単位剤形において、製剤は、一以上の化合物の適量を含有する単位用量に分割される。具体的な実施形態において、単位用量は、製剤の分離量を含有するパッケージ形態である。制限のない例は、包装された錠剤やカプセル剤、およびバイアルまたはアンプルの中にある粉剤である。水性懸濁組成物は、単回用量用の再密閉できない容器の中に任意に包装される。代わりに、複数回用量用の再密閉できる容器は、組成物内に保存剤を含むのが一般的な場合に使用される。ほんの一例ではあるが、いくつかの実施形態において、非経口注入用の製剤は、単位剤形か、または、添加保存剤を備えた複数回用量容器に入れて提供され、この単位剤形は、アンプルを含むが、これに限定されない。
【0156】
1つの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログに適切な毎日の量は、体重当たり約0.001から約100mg/kgまである。1つの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログに適切な毎日の量は、体重当たり約0.01から約10mg/kgまである。いくつかの実施形態において、限定されないがヒトを含む大型哺乳動物における一日当たりの指示用量は、約0.5mgから約1000mgまでの範囲であり、限定されないが1日最大4回までの分割用量で適宜投与される。1つの実施形態において、一日当たりの用量は、拡張放出形態で投与される。特定の実施形態において、経口投与に適切な単位剤形は約1〜500mgの活性成分を含む。他の実施形態において、剤形における活性の1日の用量または量は、本明細書が示す範囲よりも低くまたは高く、個々の処置レジメンに関する多くの変数に基づく。様々な実施形態において、一日における単位ごとの投与量は、使用される化合物の活性、処置される疾患または疾病、投与の形態、個々の被験体の必要条件、処置される疾患または疾病の重症度、および医師の判断などを含むが、これらに限定されない多くの変数に依存して変更される。
【0157】
このような処置レジメンの毒性および治療効果は、LD50(個体群の50%致死量)およびED50(個体群の50%における治療上有効な用量)の決定などを含むが、これらに限定されない細胞培養物または実験動物における標準の薬学的手順により定められる。毒性と治療効果との間の用量比は、治療指数であり、LD50とED50との間の比率として表わされる。特定の実施形態において、細胞培養アッセイと動物実験から得たデータは、ヒトを含む哺乳動物に使用する治療上有効な1日の用量範囲および/または治療上有効な単位投与量での処方の際に用いられる。いくつかの実施形態において、本明細書に記載されている化合物の1日の投与量は、最小限の毒性を持つED50を含む血中濃度の範囲内にある。特定の実施形態において、1日の投与量および/または単回投与量は、利用される剤形および使用される投与経路次第で、この範囲内で変動する。
【0158】
使用される方法と材料を示す本発明と実施形態は、以下の制限しない実施例への言及によってさらに理解されるだろう。
【実施例】
【0159】
<実施例1>
トランスジェニックマウスおよびPX−866の投与:
2.3kbのラット・クラーラ細胞分泌タンパク質(CCSP)(別名、secretoglobin、family1A、member1(Scgblal)遺伝子プロモーター)の制御の下で逆テトラサイクリン反応性トランス活性化因子(reverse tetracycline-responsive transactivator)(rtTA)を発現するCCSP−rtTA活性化体マウスを、最小CMVプロモーターを加えたテトラサイクリンオペロンの7つのコピーの制御の下でのヒトTGFα((TetO)7−cmv TGFα) cDNAを含んでいる条件付きドキシサイクリン(Dox)調節トランスジェニックマウス(conditional doxycycline (Dox) regulated transgenic mice containing the human TGFα cDNA under the control of seven copies of the tetracycline operon ((TetO)7-cmv TGFα) plus a minimal CMV promoter)と交配させた。シングルトランスジェニック(CCSP−rtTA+/−)マウスとバイトランスジェニックCCSP−rtTA+/−/(TetO)7−cmv TGFα+/−マウスを、同腹仔内でホモ接合CCSP−rtTA+/+マウスをヘミ接合(TetO)?−cmv TGFα+/−マウスに交配させることによって、作製した。全てのマウスは、FVB/NJ近交系に由来する。マウスを、ウイルスフリーの容器内で養った。動物プロトコルはすべて、シンシナティチルドレンズ・ホスピタル研究財団(the Cincinnati Children's Hospital Research Foundation)の動物実験委員会(Institutional Animal Use and Care Committe)によって検討され承認された。TGFα発現を誘発するために、Dox(Sigma、St.Louis、MO)を、0.5mg/mlの最終濃度で飲料水、および食物(62.5mg/kg)に入れて投与した。水は、1週に3回交換した。当該技術分野で公知のように、マウスの遺伝子型を同定した(genotyped)。
【0160】
PI3KインヒビターPX−866(ProIX Pharmaceuticals、Tucson、Arizona)を、5%のEtOH中へ懸濁し、5mg/mlの保存溶液を作った。投与の3時間前に、食物と水をケージから取り除いた。その後、マウスに麻酔(Isoflurane;Abbott Labs、Chicago、IL)をかけ、無菌のビヒクルまたは薬物(3mg/kg)を、20ゲージの給餌カテーテル(Harvard Apparatus、Holliston、MA)を使用して胃管栄養によって投与した。マウスを、一日おきに4週までの間、ビヒクルまたはPX−866で処置した。マウスを、Dox、ビヒクルまたはPX−866処置の1日後または4週後に、ペントバルビタールナトリウム(65mg/ml)安楽死用溶液(Fort Dodge Animal Health、Fort Dodge、IA)で死なせた。
【0161】
ウェスタンブロット:
ウエスタンブロット解析を、以前記載したように肺ホモジェネート上で行った。ブロットをtotal and phosphorylated Aktに対する抗体(Ser 473およびThr 308、Cell Signaling Technology)と共に培養し、Phosphorlmager software Imagequant 5.2(Molecular Dynamics、Sunnyvale、CA)の上で容量積分関数(volume Integration function)を使用して定量した。
【0162】
肺組織学、免疫染色、および総肺コラーゲン:
肺を以前記載したように膨張固定した(inflation fixed)。切片(5wm)を、以前記載したように、三重染色のため、polysineスライドに載せた。総肺コラーゲンを、以前記載したように、合計の可溶性コラーゲンを定量することによって測定した(Sircol Collagen Assay、Biocolor、Ireland)。
【0163】
肺力学:
肺力学を、マウスに関してコンピューター化Flexi Vent system(SCIREQ、Montreal、Canada)で評価した。マウスに、ケタミンとキシラジンで麻酔をかけ、気管切開術を行い、その後、450呼吸/分の速度およびSCIREQシステム(これによって、動肺コンプライアンス解析ができる)によってコンピューター化された2cm H2Oの陽性呼気終圧(PEEP)で、8ml/kgの換気量で換気した。換気モードを、強制振動シグナル(forced oscillatory signal)(0.5−19.6Hz)に変更し、呼吸インピーダンスを測定した。組織エラスタンスを、各インピーダンス周波数範囲にモデルを適合させることにより、2cm H2OのPEEPでマウスに対して得た。このシステムにより、較正手順によって、装置と気管内チューブのインピーダンスを除外した。
【0164】
PX−866はAktのTGFαに誘発されるリン酸化を阻害する:
CCSP−rtTA/otet−TGFαマウスを、TGFαの発現を誘発するために、1日のDoxで処理した。ウエスタンブロット解析によって測定されるように、Ser
473に対するリン酸化Akt(P−Akt)レベルは、Dox処理コントロールマウスと比較して、5倍以上に増加した。Thr 308に対するP−Aktは、続くTGFα発現を変化させなかった(データは示さず)。CCSP−rtTA/otet−TGFαマウスにおけるPX−866処置は、P−AktにおけるTGFα−誘発の増加を阻害した(図2Aおよび2B)。
【0165】
統計:
マウス群(CCSP/−ビヒクル、CCSP/TGFαビヒクル、CCSP/TGFα PX−866)に対して、誤差(means)(+/− SEM)を計算し各変数に対してプロットした。式量濃度のために、プロットおよびシャピロ−ウィルク検定を使用して、データを評価した。式量濃度推定が得られなかった場合、グループ間の差異に関して試験するために、対数変換した値を、一元配置分散分析において使用した。対数変換が式量濃度を改善しなかった場合、ノンパラメトリックの一元配置分散分析を使用した。シミュレーションに基づく、ステップダウンの多重比較補正をすべての対の比較(pair-wise comparison)に使用した。ノンパラメトリックの一元配置分散分析に対しては、ボンフェローニ−ホルム多重比較補正を使用した。
【0166】
4つの異なる群のマウスの重量を、基線で測定し、次の8週の間、週一回、等しく間隔を置いたインターバルで測定した。Group*Timeの誤差における差異を計算するために、繰り返された測定の解析を、要素としてGroup*Timeと基線を用いて行った。別々のToepliz分散/共分散構造(separate Toepliz variance/covariance structure)が各グループに使用された。(プライオリに)選択されたGroup*Timeの誤差の差異を計算し、多重比較に対してシミュレーションベースの補正を使用して試験した。
【0167】
<実施例2>
PX−866はTGFα−誘発肺線維症を阻害する:
CCSP−rtTA/otet−TGFαマウスを、TGFα発現を誘発するためにDoxで処理し、同時に、4週間、PX−866(一日おきに4mg/kg)またはビヒクルのいずれかで処置した。TGFαの誘発は、広範囲な胸膜、血管周囲および気管支周囲の線維形成を引き起こした(図3A)。総肺コラーゲンレベルは、Dox処理コントロールマウスと比較して、CCSP−rtTA/otet−TGFαマウスにおいて2倍を超えた。PX−866処置マウスは、Dox処理コントロールマウスと比較して、組織学および総肺コラーゲンによって評価されるように、肺線維形成に何の違いも示さなかった(図3Aおよび3B)。Dox処理コントロールマウスと比較して、CCSP−rtTA/otet−TGFαマウスにおいて、肺コンプライアンスは30%以上減少し、気道抵抗、エラスタンスおよび組織エラスタンスは、2倍を超えて増加した。PX−866で処置されたマウスは、Dox処理コントロールマウスと比較して、肺力学に何の違いも示さなかった(図4)。
【0168】
PX−866は、確立しているTGFα誘発肺線維症の進行を防ぐ。
PX−866が確立している線維症の進行に影響を及ぼしているか否かを測定ために、Dox処理の後4週間、CCSP−rtTA/otet−TGFαマウスに、PX−866を投与し、さらに4週の間、Doxを与え続けた(remain on Dox)(合計8週)。コントロールは、ビヒクルで処置され、さらに4週の間、Doxを与え続けたCCSP/−およびCCSP−rtTA/otet−TGFαマウスを含んだ。第3組のコントロールは、4週間のDoxを受け、その後Doxを取り除き、そしてビヒクルで4週間処置したCCSP−rtTA/otet−TGFαマウスを含んだ(図5A)。マウスにおける線維形成を逆戻りさせることに関するPX−866の有効性を比較するために、EGFR活性化が失われる場合、マウスに対する継続的なEGFR活性化と共に、オン・オフDox群を加えた。ビヒクルで処置されたCCSP−rtTA/otet−TGFαマウスの体重は、Doxの8週間後に、基線から26%を超えて減少した(図5B)。5週の初めに投与したPX−866は、ビヒクルに処置されたCCSP−rtTA/otet−TGFαマウスと比較して、さらなる体重減少を防いだが、体重は、CCSP/−コントロールマウスまたはオフDoxのCSP−rtTA/otet−TGFαマウスより少ないままであった。8週間Doxおよびビヒクルにより処置したCCSP−rtTA/otet−TGFαマウスは、線維症が間質へ進行し肺胞の構造を目立たなくし、顕著な胸膜肥厚を示した(図6A)。さらに、大小の血管および気道において、血管周囲および気管支周囲の線維形成が進行した。PX−866処置CCSP−rtTA/otet−TGFαマウスは、ビヒクル処置マウスと比較して、低減した血管周囲および気管支周囲の線維形成のみでなく低減した胸膜線維症も示した。オフDoxのCCSP−rtTA/otet−TGFαマウスも、ほとんど線維形成が小さな気道および血管で見られない、同様の低減された胸膜および外膜の線維症を示した。総肺コラーゲンレベルは、Doxの8週後に、Dox処理CCSP/−コントロールマウスと比較して、CCSP−rtTA/otet−TGFαマウスにおいて4倍高かった(図6B)。PX−866処置CCSP−rtTA/otet−TGFαマウスとオフDoxのマウスの両方は、ビヒクル処置マウスと比較して、低減した肺コラーゲンレベルを示したが、レベルは、CCSP/−コントロールマウスと比較して、顕著に上昇したままであった。PX−866処置CCSP−rtTA/otet−TGFαマウスの肺力学は、ビヒクル処置マウスと比較して、顕著に改善されたが、また、コントロールおよび4週間オフDoxのCCSP−rtTA/otet−TGFαマウスと比較して、顕著に変化したままであった(図7)。
【0169】
肺線維症の個体の臨床治療をよりよく反映するために、PI3Kシグナル伝達の役割を、確立されたTGFα誘発線維症の維持に対して測定した。Dox中へPX−866で4週間処置したマウス(mice treated with PX-966 4 weeks into Dox)は、ビヒクル処置されたマウスと比較して、体重の標準化、肺組織学上の低減された線維症および改善された肺力学を示した。しかしながら、CCSP/−コントロールマウスと比較して、体重、肺組織学およびコラーゲンならびに肺力学はすべて変化したままであり、これは、線維症表現型の不完全な逆戻りを示す。線維症のプロセスは処置から4週間で完全に解かれるとは予想されないので、マウスにおいてDoxを取り除くことによってTGFα過剰発現が消失したエンドポイントを比較した。線維症のエンドポイントは、PX−866とオフDoxの群の間で類似するならば、PI3K阻害は肺線維症を逆戻りさせるのに有効だろう。現在の研究は、PX−866マウスは、オフDoxのマウスと比較して、総肺コラーゲンおよび組織学によって測定された同程度の線維症を示し、一方、PX−866−処置マウスにおいて、体重および肺力学を含む線維症の生理学測定は変化したままであった。線維症を逆戻りさせる際のPI3Kの抑制をさらに評価するために、PX−866処置マウスを、4週間のみDoxを与えたマウス(mice after only 4 weeks of Dox)と比較した。4週のDox群における線維症のエンドポイント(図3および4)は、マウスが処置を始める場合、肺線維症の新しい出発点を表わす。PI3Kの阻害が線維症を逆戻りさせるならば、線維症エンドポイントは、4週のDoxマウスと比較して改善することが予期される。PX−866処置マウスは、4週のDoxマウスと比較して、肺組織学およびコラーゲンで測定された同程度の線維症を示し、一方、肺力学は、PX−866処置マウスにおいて顕著に変化したままであった。まとめると、逆戻り研究は、PI3Kの阻害は、線維症が確立した後、肺線維症進行を妨げるが、生理学的変質を減少させることを示す。PX−866−処置マウス中の毎週の体重の値は、処置の最後の2週間の間上昇する傾向があり、これは、PX−866処置マウスにおける線維症の遅延性の回復および分解(resolution)を示唆する。
【0170】
<実施例3>
ブレオマイシンはマウス肺線維症モデルを誘発した:
薬物誘発肺線維症のマウスモデルを本研究の中で使用する。Walters et al. in Current Protocols in Pharmacology, posted online March 2008からのプロトコルを適用する。ブレオマイシンを、肺に直接的にか、または全身的にかのいずれかで送達し、マウスにおいて肺線維症のモデルを作製する。PX−866またはPX−867を含む製剤を、治療的にまたは予防的に投与する。Sircol Soluble Collagen Assay(Biocolor,Ltd.;Accurate Chemical and Scientificから入手可能)を使用して、肺コラーゲン含有量を測定する。肺におけるコラーゲン含有量の減少は、このモデルにおける治療効果を示す。
【0171】
<実施例4>
腸線維症に関する動物モデル
Gastroenterology 2003、125、1750−61に記載されている慢性の腸線維症ネズミモデルを、本研究の中で使用する。慢性炎症を、トリニトロベンゼンスルホン酸(TNBS)の毎週の注射によって確立する。線維症は、典型的にはTNBS注射剤の停止の後2−4週の間続く。PX−866を含む製剤を、治療的または予防的に投与する。
【0172】
結腸の線維症を組織学によって測定する。合計のコラーゲンレベルを、Kivirikko et al.,(Anal Biochem、1967、19:249−55)によって記載されたようにヒドロキシプロリンの定量化によって試験する。コントロールおよびTNBSで処置した結腸間充織細胞を、形態学と表現型によって特徴付ける。形質転換増殖因子ベータ−1(TGF−β−1)の結腸での発現を、半定量的なポリメラーゼ連鎖反応によって測定する。コラーゲンレベルとTGF−β−1の発現の減少は、このモデルにおける腸の線維症への治療効果を示す。
【0173】
<実施例5>
ウサギの創傷治癒および過形成性瘢痕モデル
麻酔の後に、耳の創傷を10匹のヤングアダルトのメスのニュージーランドウサギに作る(各耳の上に4つの創傷、1匹の動物当たり合計8つの創傷)。創傷を、7mmの生検パンチを使用して作成し、その創傷は、軟骨を露出するように作られる。解剖顕微鏡を使用して、各傷の表皮、真皮および軟骨膜の完全除去を確実にする。過形成性瘢痕モデルとして、増加した創傷を結果として生じるのは、軟骨膜の層の除去および続いてのその欠陥の表皮再形成における遅延である。各創傷は独立して直り、別々のサンプルと考えられる。
【0174】
創傷治癒の初期相および後期相を研究するために、2つの処置群を調べる。早期処置群(n=15ウサギ、120の創傷)を、負傷の後0日、1日、2日、3日、4日、5日、6日および7日に、局所製剤の重量で0.05―1.5%として製剤された試験化合物(溶液、クリーム、軟膏またはゲル)、または局所ビヒクル製剤を使用するプラセボのいずれかで処置し、負傷後28日目に採取する。後期の処置群(n=15ウサギ、120の創傷)を、負傷の後7日、8日、9日、10日、11日、12日、13日および14日に、局所製剤の重量で0.05―1.5%として製剤された試験化合物(溶液、クリーム、軟膏またはゲル)、または局所ビヒクル製剤を使用するプラセボのいずれかで処置し、負傷後28日目に採取する。各群中の創傷の半分を活性な化合物で処置し、半分をプラセボで処置する。各創傷を滅菌包帯(Tegaderm;3M)で覆い、各処置の後および肉眼的検査(gross examination)において創傷が再度上皮で覆われたように見えるまで必要とされる時、包帯を毎日替える。感染、乾燥またはネクローシスの証拠があるとき、創傷は解析から除外される。
【0175】
各研究の終わりに、創傷を、周囲の傷ついていない組織の5mmのマージンと共に採取する。瘢痕を二分し、各創傷の半分は、4%の中性緩衝ホルムアルデヒドで固定し、脱水し、パラフィンに埋め込み、4μmの断片にカットし、Masson’s trichromeまたはsirrus redで染色する。各創傷の他方の半分を、液体窒素で急速冷凍し、RNA抽出のために保存する。
【0176】
組織学解析
【0177】
光学顕微鏡を使用して、各組織断片を調べ、創傷治癒の程度および瘢痕肥大を、盲検で、等級をつけられたレンズレクチルで測定する。創傷治癒パラメーター:適切な測定は、肉芽組織内殖の用量および高さ、創傷の上皮化並びに創傷閉鎖である。各パラメーターを2度評価し、結果を平均する。
【0178】
瘢痕肥大パラメーター:
瘢痕の増大インデックスを、Lu et al(J.Am.Coll.Surg.,2005、201、p391−397)によって記載されるように測定する。値を、盲検で2度測定し、結果を平均する。
【0179】
<実施例6>
腎臓線維症の動物モデル
マウスを全身麻酔によって鎮静させ、切開を背中の右側に作る。右の近位の尿管を晒し、二重結紮する。偽手術されたマウスは尿管を晒すが、結紮しない。その後、間質の再造形を調べる。間質の腎臓線維症は、典型的には手術の約15日後に確立される。マウスのふさがれた腎臓は、線維芽細胞の増殖および炎症性の単核細胞の流入を伴う拡大した尿細管によって線維症の変更を示し、一方、偽手術されたマウスにおいて、正常な構造が保たれた。
【0180】
式IA、IB、IIAまたはIIBの化合物の経口製剤は、治療的または予防的に投与される。組織形態計測的なコンパートメントを、フルカラーの3CCDカメラおよびZeiss−KontronからのKS−400画像分析ソフトウェアを装備したZeiss顕微鏡を使用して記録する。組織も、平滑筋アルファアクチンの間質の発現に関して観察される。間質のコラーゲンの蓄積を、免疫ペルオキシダーゼ、およびSerius red染色によって測定する。線維症の逆戻りまたは低減は、PX−866の経口量の治療上の有効性を示す。
【0181】
<実施例7>
緑内障ろ過手術後の瘢痕化のための動物モデル
すべての実験は、雌のチンチラ雑種ウサギ(ChBB:CH)、3〜6月齢、および1.5〜2.5kgの重量で行う。動物を実験前に1週間馴化(acclimatized)させる。
【0182】
手術は、ケタミンおよびキシラジンの筋肉注射による全身麻酔並びにオキシブプロカイン点眼での局所麻酔のもと右眼において行う。Grisanti et al. Investigative Ophthalmology and Visual Science, 2005;46:191−196に記載されているように、周辺虹彩切除術を行う。手術の後の3日連続して、各動物に、PX−866またはPX−867を含む点滴剤を1日1回投与する。
【0183】
処置された眼の一般的な外観を評価し、局所毒性および眼不耐性を評価し、および眼内圧を測定するために、臨床検査を行う。線維症の組織の堆積に起因する結膜の透明性の喪失および肥厚化を、臨床的に試験し、創傷治癒を測定する。瘢痕化の抑制が半透明の結膜を維持すると予期される。
【0184】
すべてのウサギを、術後14日目に死なせ、処置した眼を組織学検査のために摘出する。標本の組織学的解析は、虹彩切除術の場所によって示されるような強膜切開部位の中心で行う。
【0185】
全面的な痕跡を与えるために組織をヘマトキシリンおよびエオジンで染色し、コラーゲンの細胞間マトリックス(ECM)堆積を測定するためにマソンの技術で染色する。ECM堆積の減少は治療効果を示す。
【0186】
<実施例8>
医薬組成物
【0187】
実施例8a:非経口組成物
【0188】
注射による投与に適切な非経口医薬組成物を調製するために、本明細書に記載の化合物の水溶性の塩100mgを滅菌水中に溶解させ、その後、0.9%の滅菌食塩水10mLと混合する。混合物を、注射による投与に適した投与量単位の形態に組み込む。
【0189】
実施例8b:経口組成物
【0190】
経口送達用の医薬組成物を調製するために、本明細書に記載の化合物100mgをスターチ750mgと混合する。混合物を、経口投与に適する、例えば硬ゼラチンカプセルのような経口投与量単位に組み込む。
【0191】
実施例8c:舌下(硬ロゼンジ)組成物
【0192】
硬ロゼンジなどの、口腔送達用の医薬組成物を調製するために、本明細書に記載の化合物100mgを、1.6mLのライト・コーンシロップ、2.4mLの蒸留水、及び、0.42mLのミント抽出物と混ざった、420mgの粉末状砂糖と混合する。混合物を軽く混ぜ、型に流し込むことで、口腔投与に適したドロップ剤を形成する。
【0193】
実施例8d:吸入用組成物
【0194】
吸入送達用の医薬組成物を調製するために、本明細書に記載の化合物20mgを、50mgの無水クエン酸、及び、100mLの0.9%塩化ナトリウム溶液と混合する。混合物を吸入投与に好適な吸入送達用ユニット(例えば、噴霧器)に取り込む。
【0195】
実施例8e:直腸ゲル組成物
【0196】
直腸送達用の医薬組成物を調製するために、本明細書に記載の化合物100mgを、2.5gのメチルセルロース(1500mPa)、100mgのメチルパラペン(methylparapen)、5gのグリセリン及び100mLの精製水と混合する。その後、結果として生じたゲル混合物を、直腸投与に適切な直腸送達用ユニット(例えば、注射器)に取り込む。
【0197】
実施例8f:局所ゲル組成物
【0198】
医薬的局所ゲル組成物を調製するために、本明細書に記載の化合物100mgを、1.75gのヒドロキシプロピルセルロース、10mLのプロピレングリコール、10mLのミリスチン酸イソプロピル、及び、100mLの精製アルコールUSPと混合する。その後、結果として生じたゲル混合物を、局所投与に適切な容器(チューブなど)に取り込む。
【0199】
実施例8g:点眼溶液組成物
【0200】
医薬的点眼溶液組成物を調製するために、本明細書に記載の化合物100mgを、100mLの精製水中で0.9gのNaClと混合し、0.2ミクロンのフィルタを用いてろ過する。その後、結果として生じた等張液を、点眼投与に適切な点眼用の送達ユニット(点眼薬容器等)に取り込む。
【0201】
<実施例9>
摘出されたケロイドの再発の処置および予防に対するPI−3キナーゼインヒビター化合物の影響を評価する臨床試験。術後7日に始める処置
耳垂上のケロイド瘢痕の切除に続いて局所的に投与された化合物の安全性および有効性を評価するための試験研究における、2重盲検の、無作為化した、プラセボ対照。各患者は、両側性のケロイド瘢痕切除を受け、患者がそれぞれ自分自身のコントロールとして働くように、片方の耳垂を化合物で処置し、一方、もう片方の耳垂をプラセボで処置する。
【0202】
18〜65歳の10〜12の被験体が、研究に参加する。全ての被験体は、切開後、その結果が各耳垂上の単一の傷の長さ2cmもあるように、外科的切除に適している両側性のケロイド瘢痕を有しているべきである。創傷は、耳垂の皮膚、脂肪および線維組織に制限される。
【0203】
被験体は、研究前に12週以内に、照射、冷凍外科、コルチコステロイドまたは他の薬物によるケロイド処置を経験していてはならない。被験体は、出血性疾患の病歴を有さず、進行中の乾癬若しくは湿疹、又は悪性皮膚腫瘍を経験していてはならず、またそれらを有していてはならない。子を妊娠している可能性のある女性の被験体は文書による陰性尿妊娠テストを受けるべきであり、研究期間の間、避妊の医学的に証明された形態を実行しなくてはならない。書面のインフォームドコンセントを、各被験体から得る。
【0204】
外科ケロイド切除および処置プロトコル
【0205】
10〜12の患者が、両側性のケロイド切除を受ける。各患者は、創傷を閉じた(wound closure)7日後に、各直線センチメートルの片方の耳垂創縁に(to each linear centimeter of one ear lobe wound margin)、臨床的に許容可能で安全な局所用の製剤(溶液、クリーム、軟膏またはゲル)中0.05から1.5%の間の適切な濃度に処方されたPI−3キナーゼインヒビターの化合物の経皮投与を受け、その後、4週間の間、24時間ごとに繰り返して受ける。もう片方の耳垂は、創傷を閉じた後すぐに、各直線センチメートルの片方の耳垂創縁に投与されるプレセボ(処置群において使用されるのと同一であるが、活性な医薬成分を欠いている、臨床的に許容可能で安全な局所用の製剤)で局所的に処置され、その後、4週間の間、24時間ごとに繰り返して処置される。主要な評価は、視覚的なアナログスケールを用いた、手術後4週から6月の時間にわたるレイパネル(lay panel)による写真の評価に基づく。
【0206】
主要な評価項目は、52週の時間枠の間、ケロイド指標で試験化合物について予備的な安全性の実績を獲得することである。副次的評価項目は、(i)ケロイド再発(時間枠52週間)および(ii)医師のグローバル評価と被験体の評価(時間枠52週間)である。
【0207】
<実施例10>
肺線維症の処置に対するPI−3キナーゼインヒビターの化合物の影響を評価する第I相試験
この研究は、以前の処置に失敗したことのある特発性肺線維症の患者について、PI−3キナーゼインヒビターの投与の安全性を評価する。
【0208】
研究タイプ:介入
【0209】
研究設計:処置、無作為化されていない、非盲検の、管理されない、単一グループの割付、安全性/有効性の研究
【0210】
各患者に、式IA、IB、IIAまたはIIBの化合物の1日2回の用量(a twice daily dose)を投与する。
【0211】
適格性:35歳〜80歳;研究に資格を有する両方の性;健康なボランティア:受け入れず(Not accepted)。
【0212】
包含基準:特発性肺線維症の診断;下記の少なくとも1つによって定義された、6か月の処置(アザチオプリンまたはシクロホスファミドとの/なしでの、ステロイド)にもかかわらず疾患が進行していること:増加した症状:少なくとも10%の呼気肺活量の減少、少なくとも20%の一酸化炭素に対する拡散能力の低下、CXRまたは高分解能CT走査における増加した浸潤、スクリーニング前少なくとも30日間は、<15mgのプレドニゾンを取ること。
【0213】
除外基準:かなりの環境曝露、コラーゲン道管病の診断、活性感染の証拠、臨床的に顕著な心臓病、心筋梗塞、6か月内の大動脈冠動脈バイパス術または血管形成術、不安定狭心症、6か月以内の入院が必要とされるうっ血性心不全、制御されていない不整脈、不十分にしか制御されていないあるいは重篤な糖尿病、妊娠または授乳中、別の実験プロトコルへの現在の登録。
【0214】
生理学基準:FEV1/FVC<0.60
【0215】
研究所基準:総ビリルビン>1.5×正常の上限、ASTまたはALT>3×正常の上限、アルカリフォスファターゼ>3×正常の上限、白血球数<2,500/mm3、ヘマトクリット<30%、血小板<100,000/mm3、プロトロンビン時間INR>1.5。
【0216】
この研究に対する主要なエンドポイントは、安全性である。
【0217】
副次的なエンドポイント:肺機能、運動能力および生活の質の変化。
【0218】
<実施例11>
肝臓線維症の処置に対するPI−3キナーゼインヒビターの化合物の影響を評価する臨床試験
本研究の目的は、肝臓線維症の発生率が、C型肝炎肝硬変のための肝移植の後の患者で低減されるか否かにある。本研究は、感染が戻っても線維症の発生率が低減されるか遅れるかどうかも評価する。
【0219】
研究タイプ:介入
【0220】
研究設計:C型肝炎肝硬変のための移植12か月後に肝臓線維症の進行を比較する、無作為化された、非盲検の研究。各患者に、PX−866またはPX−867の1日3回の用量(a thrice daily dose)を投与する。
【0221】
適格性:18歳〜75歳;両方の性。
【0222】
包含基準:移植の理由はC型肝炎肝硬変による末期の肝臓病である;生体ドナーから第1の肝移植を受けた患者;HCV+、HIV+またはHBV+ドナーからの肝臓のレシピエント;予め決められたサイズを超える肝臓癌のために移植された者;少なくとも6か月の間禁欲的でなかった、共存するアルコール性疾患を患う患者。
【0223】
主要な評価項目:線維症の割合(ステージ2またはその上[Ishak−Knodell FS>2])
【0224】
副次的評価項目:死または移植片機能喪失の結合したエンドポイントまたはFS>2の割合;平均線維症スコア、少なくとも1つのステージの線維症の増加がある患者のパーセンテージ;線維化胆汁うっ滞性肝炎の発生率。
【0225】
<実施例12>
腎臓線維症の治療に対するPI−3キナーゼインヒビター化合物の影響を評価する臨床試験
PX−866で処置した腎臓同種移植レシピエントにおける、6か月でのプロトコル生検における、間質性線維症および動脈硬化症の発生および程度、並びに糸球体の容量を測定すること。
【0226】
研究タイプ:介入
【0227】
研究設計:無作為化された、非盲検の、並行割付(parallel assignment)、アクティブコントロール(active control)。各患者は、PX−866またはPX−867の1日3回の用量(a thirice daily dose)を投与される。
【0228】
適格性:年齢>18歳。
【0229】
包含基準:生体ドナーからの腎臓同種移植のために、少なくとも1つのHLAのミスマッチが必要である;書面のインフォームド・コンセント(地方条例により遵守する)。
【0230】
除外基準:拒絶反応のため移植の失敗の病歴を有する、2回目または3回目の腎臓同種移植のレシピエント;ハプロタイプ同一の生体ドナーまたは心臓の鼓動がないドナーからの腎臓同種移植のレシピエント。
【0231】
主要な評価項目:本研究の主要なエンドポイントは、6か月でのプロトコル生検の皮質の断片的な間質性線維症の容量である。
【0232】
副次的評価項目:1年での患者の生存および移植片の生存;6か月および12か月での
血清中クレアチニンおよび推定されたクレアチニン・クリアランス;6か月でのプロトコル生検における脈管内膜のエリアおよび動脈壁の厚さおよび糸球体の容量;最初の年の間の急性拒絶エピソードの発生;処置不成功の発生。
【0233】
本発明は参照と共にその特定の好ましい実施形態のために相当詳細に記載されたが、他のバージョンが可能である。それ故、添付の請求項の精神および範囲は、本明細書に含まれる記載および好ましいバージョンに限定的であるべきでない。
【技術分野】
【0001】
本出願は、2009年4月9日に出願の米国仮特許出願第61/167,905号及び2009年8月21日に出願の米国仮特許出願第61/235,740号の利益を主張するものであり、これら全ては、全体において引用することにより本明細書に組み込まれる。
【背景技術】
【0002】
組織修復過程の間の過剰な結合組織の沈着は線維症を引き起こす。幾つかの例において、異常な及び/又は過剰な線維結合組織が、例えば、傷害、疾患又は感染のために失われた組織の上に広がる又はその組織に取って代わるとき、線維症は発症する。
【発明の概要】
【課題を解決するための手段】
【0003】
本明細書には、ウォルトマンニン又はウォルトマンニンアナログをそれを必要とする個体に投与する工程を含む、結合線維組織増殖症候群を処置する方法が提供される。本明細書にはまた、PI−3キナーゼ(PI3K)インヒビターをそれを必要とする個体に投与する工程を含む、肺線維症を処置する方法が記載される。本明細書にはさらに、ウォルトマンニン又はウォルトマンニンアナログをそれを必要とする個体に投与する工程を含む、肺線維症を処置する方法が記載される。幾つかの例において、線維症は、器官における異常な線維結合組織の進行に関係する。幾つかの例において、線維症は、影響を受けた器官において瘢痕化を引き起こし、それにより、深部器官で機能的及び/又は構造的な構成(architecture)を妨害する。幾つかの例において、線維症は、臓器移植及び/又は臓器同種移植片の手術後に、器官において生じる。幾つかの例において、PI−3キナーゼの活性は、本明細書に記載されるように、結合線維組織増殖症候群の発症及び/又は進行に関係する。
【0004】
従って、本明細書には、PI−3キナーゼの活性を低減又は部分的に低減する方法が記載され、それによって、線維症を逆戻りさせる(reversing)又は線維症の進行を遅らせる又は(例えば、臓器移植後の)線維症の確立(establishment)を予防する。幾つかの実施形態において、本明細書に記載されるウォルトマンニンアナログは、PI−3キナーゼインヒビターである。幾つかの実施形態において、本明細書に記載されるPI−3キナーゼインヒビターは、可逆的なPI−3キナーゼインヒビターである。他の実施形態において、本明細書に記載されるPI−3キナーゼインヒビターは、不可逆的なPI−3キナーゼインヒビターである。
【0005】
本明細書には、幾つかの実施形態において、PI−3キナーゼインヒビターをそれを必要とする個体に投与する工程を含む、軽度又は中程度又は重度の肺線維症を処置する方法が提供される。
【0006】
幾つかの実施形態において、PI−3キナーゼインヒビターは、PI−3キナーゼアルファ、PI−3キナーゼベータ、PI−3キナーゼデルタ又はPI−3キナーゼガンマ、又はそれらの組み合わせを選択的に阻害する。幾つかの実施形態において、PI−3キナーゼインヒビターは、PI−3キナーゼアルファ又はPI−3キナーゼベータ又はそれらの組み合わせを選択的に阻害する。
【0007】
幾つかの実施形態において、PI−3キナーゼインヒビターは、PI−3キナーゼの可逆的インヒビターである。幾つかの実施形態において、PI−3キナーゼインヒビターは、PI−3キナーゼの不可逆的インヒビターである。
【0008】
幾つかの実施形態において、肺線維症は特発性肺線維症である。幾つかの実施形態において、肺線維症は、石綿症、嚢胞性線維症、感染症(例えば、肺炎)、環境アレルゲン(例えば、炭塵、石綿、たばこの煙、ディーゼル排気、オゾン、産業排気からの微粒子)への接触、肺移植、自己免疫性疾患(例えば、強皮症)に関係する、又は肺線維症は、薬物誘発性の肺線維症である。
【0009】
上述される方法の幾つかの実施形態において、PI−3キナーゼインヒビターの投与は、肺線維症の進行を低減又は逆戻り又は減少させる。上述される方法の幾つかの実施形態において、PI−3キナーゼインヒビターの投与は、進行性の体重損失を防ぐ。上述される方法の幾つかの実施形態において、PI−3キナーゼインヒビターの投与は、肺力学におけるTGF−アルファ−依存の変化の進行を遅らせる。幾つかの実施形態において、PI−3キナーゼインヒビターの投与は、肺線維症の確立を防ぐ。幾つかの実施形態において、PI−3キナーゼインヒビターは、予防的に(例えば、肺移植前に)投与される。幾つかの実施形態において、PI−3キナーゼインヒビターは、治療上(例えば、軽度の又は中程度又は重度の肺線維症の発症後に)投与される。
【0010】
方法の幾つかの実施形態において、1以上のPI−3キナーゼインヒビターは、経口投与される。方法の幾つかの実施形態において、1以上のPI−3キナーゼインヒビターは、吸入可能な製剤として投与される。
【0011】
本明細書にはまた、治療上有効な量のウォルトマンニンアナログをそれを必要とする個体に投与する工程を含む、結合線維組織増殖症候群を患っていると診断された又はその疑いのある個体における、結合線維組織増殖症候群を処置する方法が提供される。
【0012】
幾つかの実施形態において、ウォルトマンニンアナログは以下の式の化合物である:
【0013】
【化1】

【0014】
式中、
−−−は任意の結合であり;
nは1−6であり;
Yはヘテロ原子であり;
R1及びR2は、不飽和のアルキル、非直鎖のアルキル、環式のアルキル、及び置換のアルキルから独立して選択される、又はR1及びR2は、それらに付いている原子と共にヘテロシクロアルキル基を形成し;
R3は、存在しないか、H、又はC1−C6の置換又は非置換のアルキルであり;
R4は、(C=O)R5、(C=O)OR5、(S=O)R5、(SO2)R5、(PO3)R5、(C=O)NR5R6であり;
R5は、置換又は非置換のC1−C6アルキルであり;及び
R6は、置換又は非置換のC1−C6アルキルである。
【0015】
幾つかの実施形態において、式IA又は式IBの化合物は、以下から選択される:
【0016】
【化2】

【0017】
式中、Yはヘテロ原子であり、R1及びR2は、不飽和のアルキル、非直鎖のアルキル、環式のアルキル、及び置換のアルキルから独立して選択される。
【0018】
幾つかの実施形態において、Yは、窒素及び硫黄から選択されるヘテロ原子である。幾つかの実施形態において、R1及びR2は、不飽和のアルキルである。幾つかの実施形態において、ウォルトマンニンアナログは、PI−3キナーゼインヒビターである。幾つかの実施形態において、PI−3キナーゼインヒビターはPX−866である。幾つかの実施形態において、PI−3キナーゼインヒビターはPX−867である。
【0019】
幾つかの実施形態において、結合線維組織増殖症候群は、軽度、中程度、又は重度の肺線維症、嚢胞性線維症、眼線維症(例えば、緑内障ろ過手術後の瘢痕化)、心内膜心筋線維症、縦隔線維症、骨髄線維症、骨線維症、線維化性結腸疾患、後腹膜線維症、間質性肺炎、肺内の進行性塊状線維症、ケロイド、強皮症、肥大性瘢痕、腎臓線維症、腸線維症、肝臓線維症、線維化性の胆汁うっ滞性肝炎、腎原性全身性線維症、臓器移植に関係する線維症、結合線維組織増殖症候群、又はアナフィラキシーショックの線維症である。
【0020】
幾つかの実施形態において、結合線維組織増殖症候群は、軽度、中程度、又は重度の特発性肺線維症である。幾つかの実施形態において、結合線維組織増殖症候群は、石綿症、嚢胞性線維症、感染、環境アレルゲンへの接触、肺移植、自己免疫性疾患に関係する肺線維症である、又は結合線維組織増殖症候群は、薬物誘発性の肺線維症である。幾つかの実施形態において、結合線維組織増殖症候群は、臓器移植と関係する。
【0021】
本明細書に記載される方法、化合物、及び組成物の他の目的、特徴及び利点は、以下の詳細な説明から明白となる。しかしながら、詳細な説明と具体的な実施例は、具体的な実施形態を示しているが、例示目的としてのみ与えられることを理解されたい。本明細書に言及される全ての引用は、特許、特許出願、及び公報を含み、言及される目的のための引用により本明細書に組み込まれる。
【図面の簡単な説明】
【0022】
本発明の新しい特徴は、添付の特許請求の範囲内に特に明記される。本発明の特徴及び利点のより良い理解は、本発明の原理が利用される、実例となる実施形態を明記する以下の詳細な説明、及び以下の添付図面への言及によって得られる:
【0023】
【図1A】図1Aは、本開示に従った典型的なウォルトマンニンアナログ及び代謝物質の構造式を示す。
【図1B】図1Bは、本開示に従った典型的なウォルトマンニンアナログ及び代謝物質の構造式を示す。
【図2A】図2は、PX−866が、TGFα誘発性のAktのリン酸化(P−Akt)を阻害することを示す。CCSP−rtTA/otet−TGFαトランスジェニックマウスにおける、P−Aktレベルのウエスタンブロット解析は、Dox処置された単一の導入遺伝子(CCSP/−)のコントロールと比較して、Dox誘発性のTGFα発現の1日後に5倍を超えて増加した。CCSP−rtTA/otet−TGFαマウスのPX−866での前処置は、代表的なイムノブロッティング(A)及びデンシトメトリー解析(B)によって実証されるように、増加したAktのリン酸化を妨げた。値は、各群において、平均±SE、n=6である。CCSP/−コントロール及びPX−866−処置マウスと比較して、*P<0.05である。
【図2B】図2は、PX−866が、TGFα誘発性のAktのリン酸化(P−Akt)を阻害することを示す。CCSP−rtTA/otet−TGFαトランスジェニックマウスにおける、P−Aktレベルのウエスタンブロット解析は、Dox処置された単一の導入遺伝子(CCSP/−)のコントロールと比較して、Dox誘発性のTGFα発現の1日後に5倍を超えて増加した。CCSP−rtTA/otet−TGFαマウスのPX−866での前処置は、代表的なイムノブロッティング(A)及びデンシトメトリー解析(B)によって実証されるように、増加したAktのリン酸化を妨げた。値は、各群において、平均±SE、n=6である。CCSP/−コントロール及びPX−866−処置マウスと比較して、*P<0.05である。
【図3A】図3Aは、PX−866が、肺線維症の確立を防ぐことを示す。4週間のDoxに続いて、コントロールの及びCCSP−rtTA/otet−TGFαトランスジェニックマウスからの肺の切片を、トリクロムで染色した(A)。TGFα誘発の開始にPX−866を投与された、CCSP−rtTA/otet−TGFαトランスジェニックマウスは、ビヒクル処置のCCSP−rtTA/otet−TGFαマウスと比較して、線維症の著しい減衰を示した。顕微鏡写真は2匹の別々の動物からのものであり、各群における5〜7匹のマウスからの肺を表している。顕微鏡写真は全て、同じ倍率で撮られ、目盛は200μmである。肺のコラーゲン含有量は、方法(Methods)に記載されるように、トランスジェニックマウスの肺から測定された。TGFα誘発の時に毎日投与されたPX−866は、肺コラーゲンの増加を防いだ(B)。値は、平均±SEである。CCSP/−コントロール及びPX−866−処置マウスと比較して、*p<0.05である。ビヒクルで処置されたCCSP−rtTA/otet−TGFαマウスと比較して、+p<0.05である。
【図3B】図3Aは、PX−866が、肺線維症の確立を防ぐことを示す。4週間のDoxに続いて、コントロールの及びCCSP−rtTA/otet−TGFαトランスジェニックマウスからの肺の切片を、トリクロムで染色した(A)。TGFα誘発の開始にPX−866を投与された、CCSP−rtTA/otet−TGFαトランスジェニックマウスは、ビヒクル処置のCCSP−rtTA/otet−TGFαマウスと比較して、線維症の著しい減衰を示した。顕微鏡写真は2匹の別々の動物からのものであり、各群における5〜7匹のマウスからの肺を表している。顕微鏡写真は全て、同じ倍率で撮られ、目盛は200μmである。肺のコラーゲン含有量は、方法(Methods)に記載されるように、トランスジェニックマウスの肺から測定された。TGFα誘発の時に毎日投与されたPX−866は、肺コラーゲンの増加を防いだ(B)。値は、平均±SEである。CCSP/−コントロール及びPX−866−処置マウスと比較して、*p<0.05である。ビヒクルで処置されたCCSP−rtTA/otet−TGFαマウスと比較して、+p<0.05である。
【図4】図4は、PX−866が、肺機能におけるTGFα依存の変化を防ぐことを示す。肺力学は、方法に記載されるように測定された。PX−866は、TGFα誘発の時に毎日投与され、4週間のDoxを受けている、ビヒクル処置されたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較して、気道抵抗、気道及び組織のエラスタンスの増加、及びコンプライアンスの減少を防いだ。CCSP/−コントロール及びPX−866−処置マウスと比較して、*p<0.05である。データは、各群において6〜10匹のマウスから導き出された。
【図5】図5は、PX−866が、進行性の体重損失を防ぐことを示す。確立された線維症において、PI3Kの阻害の有効性を評価するために、CCSP−rtTA/otet−TGFαトランスジェニックマウスは、4週間のDoxの後にPX−866で処置され、更に4週間Doxを与え続ける(remaining on Dox)。治療プロトコルは、パネルにおいて概略的に表わされる(A)。コントロールには、ビヒクルで処置され、更に4週間Doxを与え続ける、CCSP/−及びCCSP−rtTA/otet−TGFαマウスが含まれた。マウスについては、処置中に毎週体重を量った。8週間のTGFαのDox誘発性の発現は、ビヒクル処置マウスにおける進行性の体重損失を引き起こし(赤のライン)、一方で、TGFα誘発の4週間後にPX−866で処置されたマウスは、体重に変化はなかった(緑のライン)が、重さはCCSP/−コントロール(青のライン)、及び4週間のDoxを受け、その後、Doxを取り除かれ(Taken off Dox)、4週間のビヒクルで処置されたCCSP−rtTA/otet−TGFαマウスの下のままであった(金のライン)(B)。CCSP/−コントロールマウス、及びDoxを与え続けた及び取り除いた(on and off Dox)CCSP−rtTA/otet−TGFαトランスジェニックマウスと比較すると、*p<0.05であり;PX−866−処置のCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較すると、#p<0.05である。データは1群当たり10匹のマウスから導き出された。
【図6A】図6は、PX−866が、肺線維症の進行を低下させることを示す。TGFα誘発の開始の4週間後にPX−866を投与されたCCSP−rtTA/otet−TGFαトランスジェニックマウス、及びDoxを取り除かれたCCSP−rtTA/otet−TGFαトランスジェニックマウスの両方は、ビヒクル処置のCCSP−rtTA/otet−TGFαマウスと比較して、線維症の減衰を示した(図6A)。顕微鏡写真は、外膜領域(上部)及び肺胞領域(底部)を有する胸膜面に焦点を合わせた2匹の別々の動物からのものである。顕微鏡写真は全て、同じ倍率で撮られ、各群における6匹のマウスからの肺を表している。PX−866−処置マウスにおける肺コラーゲンは、4週間後にDoxを取り除かれたマウスと比較して、変化はなかった(図6B)が、CCSP/−コントロールマウスと比較すると高いままであった。*p<0.05、CCSP/−コントロールマウス、及びDoxを与え続けた及び取り除いたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較すると、*p<0.05であり;ビヒクル処置されたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較すると、#p<0.05である。データは、1群当たり10匹のマウスから導き出された。
【図6B】図6は、PX−866が、肺線維症の進行を低下させることを示す。TGFα誘発の開始の4週間後にPX−866を投与されたCCSP−rtTA/otet−TGFαトランスジェニックマウス、及びDoxを取り除かれたCCSP−rtTA/otet−TGFαトランスジェニックマウスの両方は、ビヒクル処置のCCSP−rtTA/otet−TGFαマウスと比較して、線維症の減衰を示した(図6A)。顕微鏡写真は、外膜領域(上部)及び肺胞領域(底部)を有する胸膜面に焦点を合わせた2匹の別々の動物からのものである。顕微鏡写真は全て、同じ倍率で撮られ、各群における6匹のマウスからの肺を表している。PX−866−処置マウスにおける肺コラーゲンは、4週間後にDoxを取り除かれたマウスと比較して、変化はなかった(図6B)が、CCSP/−コントロールマウスと比較すると高いままであった。*p<0.05、CCSP/−コントロールマウス、及びDoxを与え続けた及び取り除いたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較すると、*p<0.05であり;ビヒクル処置されたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較すると、#p<0.05である。データは、1群当たり10匹のマウスから導き出された。
【図7】図7は、PX−866が、肺力学においてTGFα依存の変化の進行を遅らせることを示す。Doxでの処置の4週間後にPX−866を投与された、CCSP−rtTA/otet−TGFαトランスジェニックマウスは、8週間のDoxを受けている、ビヒクル処置されたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較して、気道抵抗、及び気道及び組織のエラスタンスの増加を減少させ、コンプライアンスの減少を抑えることを示した。PX−866マウスにおける肺力学は、コントロールの及び4週間DoxのないCCSP−rtTA/otet−TGFαマウスと比較して、著しく変更された。CCSP/−コントロールマウス、及びDoxを与え続けた及び取り除いたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較して、*p<0.05であり;PX−866−処置されたCCSP−rtTA/otet−TGFαトランスジェニックマウスと比較して、#p<0.05である。データは、1群当たり10匹のマウスから導き出された。
【発明を実施するための形態】
【0024】
本明細書には、PI−3キナーゼインヒビターを含む、化合物、医薬組成物及び薬剤(例えば、本明細書に記載される、式IA、IB、IIA、IIB、又は任意の他のPI−3キナーゼインヒビターの化合物)、及びPI−3キナーゼ活性に関係する疾患又は疾病を処置又は予防するための化合物などを使用する方法が記載される。本明細書にはまた、幾つかの実施形態において、PI−3キナーゼ活性を阻害又は部分的に阻害する化合物(例えば、本明細書に記載される、式IA、IB、IIA、IIB又は任意の他のPI−3キナーゼインヒビターの化合物)、及びPI−3キナーゼ活性に関係する結合線維組織増殖症候群の症状を逆戻りさせる又は緩和するための化合物及び組成物などを使用する方法が記載される。本明細書にはまた、ウォルトマンニンアナログ、及び結合線維組織増殖症候群の処置のためのウォルトマンニンアナログを含む、医薬組成物及び薬剤が提供される。
【0025】
幾つかの例において、線維症は、フィブロネクチンを発現する筋線維芽細胞及び/又は線維芽細胞の増殖に関係する。幾つかの例において、影響を受けた器官におけるフィブロネクチンを発現する筋線維芽細胞及び/又は線維芽細胞の生存は、線維症の進行の決定因子である。幾つかの例において、フィブロネクチン媒介の付着は、PI−3キナーゼのシグナル伝達経路を活性化し、線維症の発症及び/又は進行の一因である。幾つかの例において、器官構造における変更されたフィブロネクチンの発現及び/又は分解は、線維症の病理学的兆候に関係する。
【0026】
幾つかの例において、ゲフィチニブ又はエルロチニブなどのEGFRチロシンキナーゼインヒビターで処置される肺癌の患者は、薬物誘発性の間質性肺疾患を発症する。幾つかの実施形態において、本明細書に記載されるPI−3キナーゼインヒビターは、間質性肺疾患などの薬物誘発性の結合線維組織増殖症候群を発症する患者の処置(例えば、線維症の低減又は逆戻り)を可能にする。幾つかの実施形態において、本明細書に記載される処置の方法は、現在の処置の方法(例えば、免疫抑制剤、EFGRチロシンキナーゼインヒビターでの処置)では効果のない結合線維組織増殖症候群の処置を可能にする。
【0027】
PI−3キナーゼは、ホスファチジルイノシトールのイノシトール環の3位の水酸基をリン酸化することが可能な、関係する酵素のファミリーである。それらは、細胞成長、増殖、分化、運動性、生存及び細胞内移動を含む、細胞機能の種々のリストに関連付けられる。これらの機能の多くは、プロテインキナーゼB(Akt)を活性化するためのPI−3キナーゼの能力に関連する。PI−3キナーゼのp110δアイソフォームの遺伝子の及び薬理学的な不活性化は、この酵素がT細胞、B細胞、肥満細胞及び好中球の機能にとって重要であることを明らかにした。幾つかの例において、PI−3キナーゼは、炎症反応の開始及び/又は維持を含む免疫系の反応において役割を果たす。幾つかの例において、PI−3キナーゼのシグナル伝達経路の阻害は細胞外マトリックスの沈着を阻害し、線維形成促進(profibrogenic)の因子の発現を減らす。線維形成促進の因子は、限定されないが、結合組織成長因子(CTGF)、線維芽細胞成長因子(FGF)、トランスフォーミング成長因子アルファ(TGF−α)、トランスフォーミング成長因子ベータ(TGF−β)などを含む。
【0028】
幾つかの例において、PI3K−Aktは、EGFR誘発性の腫瘍形成過程を媒介する、主要な下流シグナル伝達経路であり、TGFα誘発性の線維症の症状(例えば、肺線維症)を媒介する。幾つかの例において、活発な線維形成の間の肝細胞におけるPI−3キナーゼのシグナル伝達の阻害は、細胞外マトリックスの沈着を阻害し、線維形成促進の因子の発現を減らすため、肝線維症の進行を逆戻り又は低減させる。Son et al.Hepatology.2009,50,1512−23を参照。幾つかの例において、α8β1は、線維症及び臓器傷害の他のモデルにおいて筋線維芽細胞上でアップレギュレートされる。幾つかの例において、α8β1を発現する筋線維芽細胞の生存は、PI−3キナーゼによって媒介される。幾つかの例において、PI−3キナーゼの阻害は、臓器傷害に関係する持続性の線維症を低減又は逆戻りさせる。Farias et al.Biochemical and Biophysical Research Communications,329,2005,Pages 305−311を参照。
【0029】
従って、(例えば、本明細書に記載される、式IA、IB、IIA、IIB又は任意の他のPI−3キナーゼインヒビターの化合物の投与を介した)PI−3キナーゼ活性の阻害は、それを必要とする個体において線維症の進行を逆戻りさせる、低減させる、又は遅らせる。加えて、(例えば、本明細書に記載される、式IA、IB、IIA、IIB又は任意の他のPI−3キナーゼインヒビターの化合物及び/又はウォルトマンニンアナログの投与を介した)PI−3キナーゼ阻害は、線維症が宣告され、進行した後、確立された線維症を緩和及び/又は処置する。幾つかの実施形態において、(例えば、本明細書に記載される、式IA、IB、IIA、IIB又は任意の他のPI−3キナーゼインヒビターの化合物及び/又はウォルトマンニンアナログの投与を介した)PI−3キナーゼ活性の阻害は、結合線維組織増殖症候群にかかりやすい個体(例えば嚢胞性線維症の家族歴を有する個体)において線維症の発症を遅らせる。幾つかの実施形態において、(例えば、本明細書に記載される、式IA、IB、IIA、IIB又は任意の他のPI−3キナーゼインヒビターの化合物及び/又はウォルトマンニンアナログの投与を介した)PI−3キナーゼ活性の阻害は、(例えば、臓器移植後の)線維症の発病を減少させる又は予防する。
【0030】
従って、本明細書には、それを必要とする個体においてPI−3キナーゼの活性を低減又は部分的に低減する方法が記載され、それによって、線維症を逆戻りさせる、又は線維症の進行を遅らせる。幾つかの実施形態において、方法は、PI−3キナーゼインヒビター(例えば、本明細書に記載される、式IA、IB、IIA、IIB又は任意の他のPI−3キナーゼインヒビターの化合物及び/又はウォルトマンニンアナログ)を、それを必要とする個体に投与する工程を含む。幾つかの実施形態において、本明細書に記載されるPI−3キナーゼインヒビターは、可逆的なPI−3キナーゼインヒビターである。他の実施形態において、本明細書に記載されるPI−3キナーゼインヒビターは、不可逆的なPI−3キナーゼインヒビターである。幾つかの実施形態において、本明細書に記載されるPI−3キナーゼインヒビターは、PI−3キナーゼデルタ又はPI−3キナーゼガンマへの阻害活性と比較して、より効力のあるPI−3キナーゼアルファ又はPI−3キナーゼベータのインヒビターである。
【0031】
特定の定義
本明細書及び添付の請求項において使用されるように、単数形「a」、「an」及び「the」は、文脈がはっきりと特に指示していない限り、複数の指示対象を含むことも留意されたい。従って、例えば、「細胞」への言及は、当業者に周知の1以上の細胞及びその同等物などへの言及である。他に定義されない限り、本明細書で使用される全ての専門及び科学用語は、当業者によって一般に理解されるものと同じ意味を有する。本明細書に記載されるこれらのものと類似又は同等の任意の方法及び物質は、本明細書に記載される実施形態の実施又は試験において使用され得るが、特定の好ましい方法、装置、及び物質がこれより記載される。
【0032】
本明細書で使用されるように、用語「約(about)」は、使用されている数の数値の±10%を意味する。それ故、約50%は、45%〜55%の範囲内を意味する。「随意の(Optional)」又は「随意に(Optionally)」は、続いて記載される構造、事象又は状況が生じないかもしれないこと、及びその記載が、事象が生じる及び生じない例を含むことを意味すると受け取られ得る。
【0033】
治療薬と共に使用されるときの「投与すること」は、直接、標的組織の中又は上に投与するように、治療薬を全身に又は局所に投与すること、又は治療薬が標的である組織に確実に効果を与えるように患者に治療薬を投与することを意味する。従って、本明細書に使用されるように、用語「投与すること(Administering)」は、ウォルトマンニンアナログ又はその代謝物質と共に使用されるとき、限定されないが、ウォルトマンニンアナログ又はその代謝物質を標的組織の中又は上に提供すること;例えば、治療薬が標的組織又は細胞に行き渡るような静脈注射によって、ウォルトマンニンアナログ又はその代謝物質を、患者の全身に提供することを含む。組成物を「投与すること」は、注入、局所投与、及び経口投与で、又は他の方法単独で又は他の周知の手法と組み合わせて達成され得る。
【0034】
本明細書で使用されるように,用語「治療薬(therapeutic)」は、患者の望まれない疾病又は疾患を処置、除去、緩和、予防又は改善するために利用される薬剤を意味する。幾つかの実施形態において、治療薬は、本明細書に記載される線維症の症状の処置及び/又は緩和、又は症状の逆戻りに向けられる。幾つかの実施形態において、本明細書に記載される治療薬は、肺線維症の処置及び/又は肺線維症の症状の緩和又は逆戻りに向けられる。
【0035】
用語「動物(animal)」は本明細書に使用されるように、限定されないが、ヒト、及び野生動物、家畜などのヒト以外の脊椎動物を含む。用語「患者(patient)」及び「被験体(subject)」及び「個体(individual)」は、置換え可能で、本開示の化合物で処置され得る任意の生存生物を意味すると受け取られ得る。そのため、用語「患者」および「被験体」は、限定されないが、任意のヒト以外の哺乳動物、任意の霊長類又はヒトを含む。
【0036】
用語「阻害すること(inhibiting)」は、症状の発症を防ぐ、症状を緩和する、又は疾患、疾病又は障害を除去するための、本開示の化合物の投与を含む。
【0037】
「薬学的に許容可能な」により、担体、希釈剤、又は賦形剤は、製剤の他の成分と適合性がなければならず、そのレシピエントに有害であってはならないことが意味される。
【0038】
用語「医薬組成物(pharmaceutical composition)」は、少なくとも1つの活性成分を含む組成物を意味するものとし、それによって、組成物は、哺乳動物(例えば、限定されないが、ヒト)において、特定の、効果的な結果のための検査に適用可能である。当業者は、活性成分が技術者のニーズに基づく所望の効果的な結果を有しているかどうかを決定するのに適切な技術を理解及び認識するであろう。
【0039】
本明細書に使用されるような「治療上有効な量」、又は「有効な量」は、研究者、獣医、医師又は他の臨床医によって求められている組織、器官系、動物、個体又はヒトにおける生物学的反応又は薬への反応を引き出す活性化合物又は医薬品の量を指し、1以上の以下のことを含む:(1)疾患を予防すること;例えば、疾患、疾病又は障害にかかりやすいが、疾患の病状又は総体症状をまだ経験又は示していない個体において、疾患、疾病又は障害を予防すること、(2)疾患を阻害すること;例えば、疾患、疾病又は障害の病状又は総体症状を経験している又は示している個体において、疾患、疾病又は障害を阻害すること(即ち、病状又は総体症状の更なる進行を抑えること)、及び(3)疾患を緩和すること;例えば、疾患、疾病又は障害の病状又は総体症状を経験している又は示している個体において、疾患、疾病又は障害を緩和すること(即ち、病状又は総体症状を逆戻りさせること)。そのため、本開示の組成物の「治療上有効な量」又は「有効な量」の限定しない例は、細胞の活性化、移動、又は増殖を阻害する、又は癌を効果的に処置する又は癌の症状を緩和するために使用され得る。
【0040】
用語「線維症(fibrosis)」、「結合線維組織増殖症候群(fibrosing syndrome)」、又は「線維症の症状(fibrotic condition)」は、置換え可能に使用される。本明細書に使用されるように、用語「線維症」又は「結合線維組織増殖症候群」又は「線維症の症状」は、急性又は慢性の炎症及び/又は傷害に引き続き起こり、炎症又は傷害の部位での細胞及び/又はコラーゲンの異常蓄積に関係し、限定されないが、心臓、腎臓、関節、肺、又は皮膚などの個体の器官又は組織の線維症を含む症状を指す。用語「線維症」または「結合線維組織増殖症候群」又は「線維症の症状」は、肺線維症、特発性肺線維症、特発性間質性肺炎を含む間質性肺疾患、眼線維症(例えば、加齢黄斑変性症に関係する瘢痕化、又は緑内障ろ過手術後の瘢痕化)、嚢胞性線維症、心内膜心筋線維症、縦隔線維症、骨髄線維症、骨線維症、線維化性結腸疾患、後腹膜線維症、間質性肺炎、肺における進行性塊状線維症(石炭労働者じん肺症の合併症)、ケロイド、強皮症、肥大性瘢痕、腎臓線維症(例えば、尿細管間質性線維症)、(例えば、クローン病、炎症性大腸疾患に関係する)腸線維症、肝臓線維症、線維化性の胆汁うっ滞性肝炎、腎原性全身性線維症、結合線維組織増殖症候群、アナフィラキシーショックの線維症などを含む。幾つかの実施形態において、本明細書に記載される任意の線維症又は結合線維組織増殖症候群は、原因が不明である(特発性)。幾つかの実施形態において、本明細書に記載される任意の線維症又は結合線組織増殖症候群は、嚢胞性線維症に関係する。幾つかの実施形態において、本明細書に記載される任意の結合線維組織増殖症候群は、自己免疫性疾患、炎症、癌などに関係する。幾つかの実施形態において、本明細書に記載される任意の結合線維組織増殖症候群は、感染症(例えば、肺炎、結核、鳥インフルエンザなど)に関係する。幾つかの実施形態において、本明細書に記載される任意の線維症又は結合線維組織増殖症候群は、臓器移植(例えば、肺移植、肝移植、腎移植)に関係する。幾つかの実施形態において、本明細書に記載される任意の線維症又は結合線維組織増殖症候群は、限定されないが、石綿、炭塵、たばこの煙、ディーゼル排気、オゾン、大気微粒子などを含む、アレルゲン及び/又は環境汚染物質への接触に関係する。幾つかの実施形態において、本明細書に記載される任意の線維症又は結合線維組織増殖症候群は薬物誘発性の線維症である。
【0041】
本発明の方法は、内科治療及び/又は予防的治療の両方を適切なものとして含む。治療上の及び/又は予防的な効果を得るために投与される化合物の特定の投与量は、例えば、投与される化合物、投与経路、及び処置されている疾病を含む事例を取り巻く、特定の状況によって、もちろん、決定されるであろう。化合物は、広い投与量範囲にわたって有効であり、例えば、1日当たりの投与量は、通常、0.001から100mg/kgまでの範囲内、より一般的には、0.01から1mg/kgまでの範囲内にある。しかしながら、投与される有効な量が、処置される疾病、投与される化合物の選択、及び投与の選択される経路を含む、関連する状況に照らして、医師によって決定されることが理解されるであろう。本明細書に記載される化合物の治療上有効な量は、典型的に、生理学的に容認可能な賦形剤の組成物において投与されるとき、組織において有効な全身濃度又は局所濃度を達成するのに十分であるような量である。
【0042】
本明細書に使用されるような用語「処置(treat)」、「処置される(treated)」、又は「処置すること(treating)」は、治療処置及び予防的な対策又は予防策の両方を指し、その目的は、望まれない生理学的な疾病、傷害又は疾患を予防する又は遅らせる(減少させる)、又は有益な又は所望の臨床結果を得ることである。本明細書に記載される目的のために、有益な又は所望の臨床結果は、限定されないが、症状の軽減;疾病、傷害又は疾患の範囲の減少;疾病、傷害又は疾患の状態の安定化(即ち、悪化させない);疾病、傷害又は疾患の発症の遅延又は進行の停滞;疾病、傷害又は疾患の緩和;及び検知可能又は検知不可能であろうと、疾病、傷害又は疾患の(部分的又は全体的な)緩解、又は向上又は改善を含む。処置は、過剰レベルの副作用のない、臨床的に有意な反応を引き出すことを含む。処置はまた、処置を受けない場合に予想される生存と比較して、生存を延長することを含む。
【0043】
用語、「ウォルトマンニンアナログ(wortmannin analog)」又は「ウォルトマンニンのアナログ(analog of wortmannin)」は、ウォルトマンニンにおいて、1以上の原子、官能基、又は下部構造が異なる原子、官能基、又は下部構造に置き換えられた一方で、ウォルトマンニンの機能活性を保持又は改善する、及び/又はPK特性を改善する、及び/又はウォルトマンニンの毒性を低減する、任意の化合物を指す。
【0044】
「アルキル」基は、脂肪族炭化水素基を指す。「アルキル」基は、置換及び非置換のアルキル基を含む。アルキル基への言及は、「飽和のアルキル」及び/又は「不飽和のアルキル」を含む。アルキル基は、飽和又は不飽和であろうと、分枝の基、直鎖の基、又は環式の基を含む。ほんの一例として、アルキルは、メチル、エチル、プロピル、イソ−プロピル、n−ブチル、イソ−ブチル、sec−ブチル、t−ブチル、ペンチル、イソ−ペンチル、ネオ−ペンチル、及びヘキシルを含む。幾つかの実施形態において、アルキル基は、決して限定されないが、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、第三ブチル、ペンチル、ヘキシル、エテニル、プロペニル、ブテニル、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルなどを含む。「低級アルキル」は、C1−C6アルキルである。「ヘテロアルキル」基は、アルキル基の炭素の任意の1つを、(例えば、CH2基をNH基又はO基に)付けた適切な数の水素原子を有するヘテロ原子と置換する。
【0045】
用語「シクロアルキル(cycloalkyl)」又は「環式のアルキル(cyclic alkyl)」は、単環式又は多環式の非芳香族のラジカルを指し、環を形成する各々の原子(即ち骨格原子)は、炭素原子である。「シクロアルキル」基は、置換及び非置換のシクロアルキル基を含む。様々な実施形態において、シクロアルキルは、飽和、又は部分的に不飽和である。幾つかの実施形態において、シクロアルキルは、芳香環と融合する。幾つかの実施形態において、シクロアルキルは、ヘテロアリール環と融合する。シクロアルキル基は、3乃至10の環原子を有する基を含む。シクロアルキル基の用例は、限定されないが、以下の部分などを含む:
【0046】
【化3】

【0047】
単環式のシクロアルキルは、限定されないが、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、及びシクロオクチルを含む。二環式のシクロアルキルは、限定されないが、テトラヒドロナフチル、インダニル、テトラヒドロペンタレンなどを含む。多環式のシクロアルキルは、アダマンタン、ノルボルナンなどを含む。用語、シクロアルキルは、「不飽和の非芳香性のカルボサイクリル」又は「非芳香性の不飽和のカルボサイクリル」を含み、両方とも、本明細書に定義されるように、非芳香性のカルボサイクリルを指し、少なくとも1つの炭素炭素二重結合又は1つの炭素炭素三重結合を含む。
【0048】
「ヘテロアリサイクリック」基又は「ヘテロシクロ」基又は「ヘテロシクロアルキル」基は、シクロアルキル基を指し、少なくとも1つの骨格環原子は、窒素、酸素及び硫黄から選択されるヘテロ原子である。「ヘテロシクロアルキル」基は、置換及び非置換のヘテロシクロアルキル基を含む。様々な実施形態において、ラジカルは、アリール又はヘテロアリールと融合する。非芳香族ヘテロ環としても言及される、ヘテロシクロ基の用例は以下のものなどを含む:
【0049】
【化4】

【0050】
用語「ヘテロアリサイクリック」はまた、炭水化物の環状体を全て含み、炭水化物は、限定されないが、単糖類、二糖類、及びオリゴ糖類を含む。
【0051】
ウォルトマンニンアナログ
ウォルトマンニンは、菌類ペニシリウムのウォルトマンニンの培養液から分離された天然の化合物である。ウォルトマンニンは、キナーゼ上の特定のリジン、パイ(pi)10a アイソフォームの触媒部位のATP結合ポケットのLys802又はパイ105アイソフォームのLys883との共有結合相互作用を介して、PI−3−キナーゼを不可逆的に阻害する。p110α、p110β、p110δ、及びp110γなどのPI−3キナーゼのほとんどのアイソフォームは、例えば、ウォルトマンニンによって等しく阻害される。しかしながら、ウォルトマンニンは肝臓及び血液の毒性を示し、生物学的に不安定な分子である。中性pHで、37℃又は0°Cのいずれかで水溶液として保存されたサンプルは、フラン環の加水分解の開放によって分解されやすい。フラン環の親電子性は、ウォルトマンニンの阻害活性の中心であることが示されてきた。PI−3−キナーゼの不可逆阻害は、ウォルトマンニンの位置C(20)でのフラン環上のキナーゼの活発なリジンのアタック(attack)に続くエナミンの形成によって生じる。従って、ウォルトマンニンの分解は、PI−3キナーゼ上のその阻害活性を妨げる。
【0052】
幾つかの実施形態において、本明細書に記載されるウォルトマンニンのアナログ及び代謝物質は、改善された生物学的安定性及び低減された全身毒性を示す。幾つかの実施形態において、本明細書に記載されるウォルトマンニンのアナログ及び代謝物質は、PI−3キナーゼインヒビターである。従って、本明細書に記載されるウォルトマンニンアナログの方法及び組成物は、例えば、肺線維症を含む線維症の症状を処置する、改善された方法を可能にする。
【0053】
幾つかの実施形態において、本明細書に記載される処置の方法に適しているウォルトマンニンアナログは、以下の式IA又はIBの化合物を含む:
【0054】
【化5】

【0055】
式中、
−−−は任意の結合であり;
nは1−6であり;
Yはヘテロ原子であり;
R1及びR2は、不飽和のアルキル、非直鎖のアルキル、環式のアルキル、及び置換のアルキルから独立して選択される、又はR1及びR2は、それらに付いている原子と共にヘテロシクロアルキル基を形成し;
R3は、存在しないか、H、又はC1−C6の置換又は非置換のアルキルであり;
R4は、(C=O)R5、(C=O)OR5、(S=O)R5、(SO2)R5、(PO3)R5、(C=O)NR5R6であり;
R5は、置換又は非置換のC1−C6アルキルであり;及び
R6は、置換又は非置換のC1−C6アルキルである。
【0056】
幾つかの実施形態において、本明細書に記載される処置の方法に適しているウォルトマンニンアナログは、以下の式の化合物を含む:
【0057】
【化6】

【0058】
式中、Yはヘテロ原子であり、R1及びR2は、不飽和のアルキル、非直鎖のアルキル、環式のアルキル、及び置換のアルキルから独立して選択される。
【0059】
幾つかの実施形態において、本明細書に記載される結合線維組織増殖症候群の処置に適しているウォルトマンニンアナログは、限定されないが、PX−866、PX−867、PX−868、PX−870、PX−871、PX−880、PX−881、PX−882、PX−889、PX−890、DJM2−170、DJM2−171、DJM2−177、DJM2−181及びそれらの組み合わせから選択された、化合物及び/又はその代謝物質を含む。幾つかの実施形態において、本明細書に記載される線維性障害の処置に適しているウォルトマンニンアナログは、英国公報第2302021号に記載される化合物を含み、その化合物は、引用によって本明細書に組み込まれる。
【0060】
図1は、結合線維組織増殖症候群の処置に有用な、典型的なウォルトマンニンアナログ及びその代謝物質の式を示す。
【0061】
PI−3キナーゼインヒビター
幾つかの実施形態において、本明細書に記載される結合線維組織増殖症候群(例えば、肺線維症)の処置に適しているPI−3キナーゼインヒビターは、限定されないが、ウォルトマンニンアナログ、ウォルトマンニン代謝物質、NVP−BEZ235、PI−130、LY294002及びオールトランス型レチノイン酸(ATRA)を含む。
【0062】
幾つかの実施形態において、本明細書に記載される結合線維組織増殖症候群の処置に適しているPI−3キナーゼインヒビターは、本明細書に記載のような式IA、IB、IIA及びIIBの化合物を含む。
【0063】
幾つかの実施形態において、結合線維組織増殖症候群(例えば、肺線維症)の処置に適しているPI−3キナーゼインヒビターは、限定されないが、米国特許出願公開第2005/0032727号、2007/0203098号、2007/0259876号、2008/0188423号、2009/0042773号、2007/0021447号、2008/0039459号、2008/0300239号、2009/0018131号、2009/0023742号、2009/0029998号、2009/0048252号、2009/0170848号、2009/0215818号、2009/0306074号、2009/0048252号、2008/0300239号、2009/0018131号、2009/0023742号、2009/0048252号、2009/0170848号、2009/0215818号、2009/0306074号に記載されるPI−3キナーゼインヒビターを含み、それらに記載されるPI−3キナーゼインヒビター化合物は、引用によって本明細書に組み込まれる。
【0064】
結合線維組織増殖症候群及び処置の方法
肺線維症
本明細書には、1以上のPI−3キナーゼインヒビターをそれを必要とする個体に投与する工程を含む、間質性肺疾患を処置する方法が提供される。幾つかの実施形態において、間質性肺疾患は、肺線維症である。幾つかの実施形態において、間質性肺疾患は、特発性肺線維症である。
【0065】
肺線維症は、多くの小児及び成人の肺疾患における罹患率及び死亡率の一因である。肺線維症を引き起こす臨床疾患は、不均一であり、線維症は、急性呼吸窮迫症候群におけるような急性肺傷害に続き、嚢胞性線維症(CF)におけるような慢性炎症性疾患から発症する可能性がある、又は特発性肺線維症(IPF)におけるように、原因不明に発症する可能性がある。肺線維症の病理的特徴は、基礎疾患プロセスによって変わり得るが、多くの共通する特徴が存在し、それは間充織細胞の増殖、細胞外マトリックスの拡張及び肺実質のリモデリングを含む。本明細書で使用されるように、肺線維症は、特発性肺線維症、びまん性間質性肺線維症、間質性肺臓炎、肺における進行性塊状線維症(石炭労働者じん肺症の合併症)などを含む。また、本明細書に記載される実施形態の範囲内で検討されるのは、嚢胞性線維症などの基礎疾患、又は強皮症などの自己免疫性疾患から生じる肺線維症である。本明細書で使用されるように、肺線維症は、限定されないが、石綿(即ち、石綿肺に関連する肺線維症)、炭塵、たばこの煙、ディーゼル排気、オゾンなどの大気汚染物質、産業排気からの微粒子などを含む、環境アレルゲン又は汚染物質への接触から生じる肺線維症を含む。本明細書で使用されるように、肺線維症は、肺炎などの感染又は任意の他の感染に関係する肺線維症を含む。肺線維症はまた、薬物誘発性の肺線維症(例えば、ブレオマイシンなどの薬物の投与から副作用として生じる線維症)を含む。
【0066】
従って、本明細書で提供される方法及び組成物は、本明細書に記載される任意の間質性肺障害及び/又は肺性の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。幾つかの実施形態において、間質性肺疾患及び/又は肺性の結合線維組織増殖症候群は、肺における筋線維芽細胞の増殖に関係する。幾つかの実施形態において、それを必要とする個体への1以上のPI−3キナーゼインヒビター(例えば、本明細書に記載される式IA、IAB、IIA又はIIBの化合物又は任意の他のPI−3キナーゼインヒビター)の投与は、肺における筋線維芽細胞の増殖を阻害、又は部分的に阻害し、それによって、本明細書に記載される任意の間質性肺疾患及び/又は肺性の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0067】
EGFR(HER1)は、HER2/neu、HER3及びHER4も含む受容体チロシンキナーゼのタンパク質ファミリーに属する。6つのEGFRリガンド(TGFα、EGF、HB−EGF、アンフィレグリン、ベータセルリン及びヘレグリン)は、肺に又は肺細胞内に局在している。活性化リガンドによって、EGFRファミリーメンバーは、異なる生物学的能力で様々なホモダイマー又はヘテロダイマーを形成する。EGFRの活性化は、種々の細胞機能を制御し、それらの多くは、細胞成長、増殖、分化、移動、アポトーシスからの保護及び形質転換を含む線維形成に関係する。肺上皮においてTGFαを特異的に発現する、ドキシサイクリン(Dox)制御可能なトランスジェニックマウスは、炎症とは無関係である、進行性及び広範囲な、脈管外膜の線維症、気管支周囲の線維症、間質性及び胸膜線維症を示す。これらのマウスの肺におけるTGFαの発現後に観察される遺伝子発現特性は、ヒトにおける肺性の線維症の疾患において見受けられる特性に類似している。
【0068】
幾つかの例において、EGFR活性の下流のシグナル伝達経路は、TGFα誘発性の肺線維症を媒介する。細胞外ドメインへのリガンドの結合の後に、受容体のホモダイマー及びヘテロダイマーが形成され、細胞質ドメインにおいて特異残基上の内因性のチロシンキナーゼ活性による、自己リン酸化又はリン酸基転移につながる。リン酸化チロシン残基は、RAS/RAF/キナーマイトジェン活性化プロテインキナーゼ(MAPK)カスケード、JAK/STAT経路、ホスホリパーゼCγ経路及びホスファチジルイノシトール3’−キナーゼ(PI3K)/Akt(プロテインキナーゼB)シグナル伝達経路を含む、多数の下流のエフェクター経路を活性化するシグナル伝達分子のためのドッキング部位になる。PI3Kは、受容体チロシンキナーゼ、Gタンパク質共役受容体又はサイトカイン受容体の活性化に反応して、ホスファチジルイノシトール(3,4,5)−三リン酸塩(PIP3)を形成するための、ホスファチジルイノシトール(4,5)−重リン酸塩(PIP2)のリン酸化を触媒するシグナル伝達酵素である。PIP3は、次々にAktを活性化し、成長、増殖、移動、生存及びコラーゲン遺伝子の発現を含む線維成長に関係する多くの細胞プロセスに関係している。腫瘍抑制因子ホスファターゼ及びテンシンホモログ(PTEN)は、PIP3をPIP2に脱リン酸化するPI3K−Akt経路のマイナス成長調節物質(negative growth regulator)である。PTENの薬理学的インヒビターで処置された、PTENハプロ不全のマウス及び野生型マウスの両方は、肺線維症の病因における対立しないPI3K−Akt活性のためのインビボの役割を支持する、ブレオマイシン誘発性の肺傷害に続く、増大したコラーゲン沈着及び筋線維芽細胞の分化を示す。
【0069】
幾つかの実施形態において、1以上のPI−3キナーゼインヒビターのそれを必要とする個体への投与は、肺細胞においてEGFRの活性を減少又は抑制する。幾つかの実施形態において、1以上のPI−3キナーゼインヒビターのそれを必要とする個体への投与は、TGF−αのEGFRへの結合を減少又は妨害し、それによって、PI−3キナーゼの下流の活性を阻害又は部分的に阻害する。
【0070】
PBK−AktがEGFR誘発性の腫瘍形成過程を媒介する主要な下流のシグナル伝達経路であるため、PBK−AktはTGFα誘発性の肺線維症を媒介し得る。PX−866は、抗腫瘍物質として現在、高度な前臨床開発中であるPI3Kの新しいインヒビターである。制御可能なトランスジェニックマウスにおいてTGFα誘発の時にPX−866を投与することによる、肺線維症の開始および伝播におけるPBKの役割は、図2乃至7及び実施例1乃至2において本明細書に記載される。
【0071】
幾つかの例において、PI3K以外の追加の下流のシグナル伝達経路は、活性化されたままであり、肺線維症の維持への一因であり続ける。EGFRなどのチロシンキナーゼ受容体は、細胞の成長及び増殖を制御するPI3K及び他の経路を活性化する。幾つかの実施形態において、肺線維症の維持における追加のシグナル伝達経路の活性の、標的とされた治療介入は、肺線維症の併用療法を可能にする。
【0072】
実施例1乃至2及び図2乃至7は、PI3KインヒビターPX−866での処置が、トランスジェニックマウスにおいてEGFR媒介の肺線維症及び関係する肺力学の変化を妨げることを示す。増加したEGFRリガンド及びEGFRの活性化は、線維性肺疾患を患う患者の幾つかの研究において確認されてきた。増加したTGFαは、IPFを患った患者の肺洗浄液において検知され、免疫組織化学は、TGFα及びEGFRの増加をタイプIIの上皮細胞、線維芽細胞及びIPFサンプルの脈管内皮に限局した。増加したEGFR及びEGFRリガンドもまた、嚢胞性線維症、気管支肺異形成及び喘息を患う患者の再構築された組織において確認された。幾つかの例において、EGFR標的の治療は、肺線維症のブレオマイシン、ナフタリン、石綿肺及びオバルブミンのモデルを含む、多くの動物モデルにおいて線維症を阻止する。従って、本明細書に記載される実施形態の範囲内で検討もされるのは、肺線維症の処置のためのEGFR標的の治療薬及びPI−3キナーゼモジュレーターを投与する工程を含む、併用療法である。
【0073】
幾つかの例において、EGFRシグナル伝達は間質性肺疾患を媒介し、急性肺傷害の間にサーファクタントタンパク質の発現を維持する。特定の場合において、EGFRの阻害は、サーファクタントタンパク質の発現を減少させることにより肺傷害を悪化させる。同時に、これらの発見は、肺のリモデリングに特有である経路を定義するという目標を持って線維症を媒介する、EGFRの下流のシグナル伝達経路の更なる分析を支持する。本開示は、PI3K−Aktが、肺線維症を媒介するEGFR活性の下流の主要なエフェクター経路であることを示す。
【0074】
PI3K経路は、肺線維症の媒介に関係する。ヒト及びマウスの線維芽細胞の両方における研究は、PI3K活性が、増加した増殖、コラーゲン合成及び筋線維芽細胞の分化と共に減少したアポトーシスにつながることを示す。IPFを患う患者から分離された線維芽細胞は、PI3K−Aktの異常活性化に関係する減少したPTEN発現及び活性、及び増加した増殖を示す。制御可能なTGFβ1トランスジェニックモデルにおける肺線維症は、マウスがAktインヒビターで処置されたとき、著しく減衰した。
【0075】
TGFαトランスジェニックモデルにおける線維症は、TGFα活性と無関係に発症し、これは、PI3K/Akt経路が、多数の線維症促進の刺激が間葉の増殖及びマトリックスの沈着の細胞反応を引き出すために集中する、潜在的な合流点を表わし得ることを示唆する。血小板由来成長因子(PDGF)ファミリーは、肺線維症の炎症性のモデルにおいて関係する別の線維症促進のサイトカインファミリーである。PDGFは、EGFRのように、受容体チロシンキナーゼである2つの受容体を介して作用する。EGFR及びTGFβ1のように、PDGF受容体はPI3Kを活性化する。集合的に、これらのデータは、PI3Kを、多数の線維形成のサイトカインが集中する共通経路として更に支持する。
【0076】
上皮細胞及び間充織細胞の両方は、TGFαに反応して増殖するが、両方の細胞タイプにおけるPI3K活性が、線維症につながるかどうかは不明瞭である。Pten遺伝子が肺上皮から暫定的に消失されたトランスジェニックマウスは、気管支内腔及び細気管支腔へ突き出た線維血管性コアを伴う、乳頭が並んだ(lining papillae)富細胞性の上皮細胞によって特徴付けられた際立った上皮過形成に関係する、増加した上皮のPI3K−Akt活性を示した。しかしながら、TGFαマウスと異なり、過形成は進行性ではなく、実質線維化は発症せず、これが、線維芽細胞のPI3K活性がPI3K/Akt媒介の線維症の媒介において重要であることを示唆した。
【0077】
最近のデータは、ヒトの線維性肺疾患におけるPI3K−Aktの活性を支持する。IPF患者からの肺生検の免疫組織学的分析は、線維芽細胞の病巣における増加したリン酸化のAktを示す。ヒトの線維症の疾患における異常なPI3Kシグナル伝達の証拠と結び付けられた、TGFα及びTGFβトランスジェニックモデルにおけるPI3K阻害は、PI3K−Akt経路を薬理学的に標的とすることを支持する。
【0078】
幾つかの実施形態において、本明細書には、被験体に治療上有効な量のウォルトマンニンアナログ又はウォルトマンニン代謝物質を投与する工程を含む、被験体の肺線維症を処置する方法が提供される。
【0079】
幾つかの実施形態において、本明細書には、肺線維症の治療のための、PI−3キナーゼインヒビター(例えば、本明細書に記載される、式IA、IB、IIA又はIIBの化合物、又は任意の他のPI−3キナーゼインヒビター)を使用するための方法が提供され、ここでの肺線維症は、軽度又は中程度である。幾つかの実施形態において、本明細書には、肺線維症の治療のためのPI−3キナーゼインヒビター(例えば、本明細書に記載される、式IA、IB、IIA又はIIBの化合物、又は任意の他のPI−3キナーゼインヒビター)を使用するための方法が提供され、ここでの肺線維症は、宣告され進行しているものである。幾つかの実施形態において、PI−3キナーゼインヒビター(例えば、本明細書に記載される、式IA、IB、IIA又はIIBの化合物、又は任意の他のPI−3キナーゼインヒビター)は、肺線維症の進行を減少させる。幾つかの実施形態において、PI−3キナーゼインヒビター(例えば、本明細書に記載される、式IA、IB、IIA又はIIBの化合物、又は任意の他のPI−3キナーゼインヒビター)は、肺力学においてTGF−α依存の変化の進行を遅らせる。幾つかの実施形態において、PI−3キナーゼインヒビター(例えば、本明細書に記載される、式IA、IB、IIA又はIIBの化合物、又は任意の他のPI−3キナーゼインヒビター)は、進行性の体重損失を防ぐ。
【0080】
幾つかの実施形態において、本明細書には、式IA、IB、IIA又はIIBの化合物の代謝物質を投与する工程を含む、肺線維症を処置する方法が提供される。一例として、特定の代謝物質が図1に示される。そのような実施形態の幾つかにおいて、そのような代謝物質は、ウォルトマンニンのインヒビターの活性に類似した又はそれより良いPI−3キナーゼに対する阻害活性を示す。
【0081】
眼線維症
本明細書には、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼのインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)をそれを必要とする個体に投与する工程を含む、眼線維症(眼の任意の領域における線維症及び/又は瘢痕化)の処置の方法が提供される。幾つかの例において、眼の恒常性が、例えば、感染又は炎症又は代謝性疾患によって妨害されるとき、線維症はグリア細胞及び/又は線維芽細胞によって媒介される。幾つかの例において、角膜の線維症(例えば、ヘルペス性角膜炎)は、感染(例えばウイルス感染)の後に生じる。幾つかの例において、糖尿病に関係する網膜の低酸素症は、線維症及びそれに続く牽引性網膜剥離(進行性の糖尿病性網膜症の合併症)につながる。幾つかの例において、新生血管の加齢黄斑変性(ARMD)に関係する網膜下の大量出血は、網膜下の線維症を引き起こす。幾つかの例において、線維芽細胞及び線維芽細胞様細胞(例えば、眼内のグリア細胞)の増殖は、細胞外マトリックスの変異につながり、それが瘢痕形成及び/又は視力喪失につながる。幾つかの例において、結膜の退化は、結果的に角膜表面での線維症につながる。幾つかの例において、眼線維症は、角膜移植の後に生じる。幾つかの例において、未熟児網膜症(ROP)は、未熟児の眼内の線維症に関係する。幾つかの例において、瘢痕化は、緑内障ろ過手術の後に生じる。
【0082】
幾つかの例において、眼線維症は、血管新生促進のVEGF及び線維症促進のCTGFのレベル間のバランスの変化の結果である。幾つかの実施形態において、1以上のPI−3キナーゼインヒビターのそれを必要とする個体への投与は、CTGFを阻害又は部分的に阻害する。幾つかの実施形態において、CTGFの阻害又は部分的な阻害は、眼線維症の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。従って、本明細書で提供される方法及び組成物は、本明細書に記載される任意の眼の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0083】
幾つかの実施形態において、眼の結合線維組織増殖症候群は、線維芽細胞又は線維芽細胞様細胞の増殖に関係する。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、線維芽細胞の増殖を阻害又は部分的に阻害し、それによって、本明細書に記載される任意の眼の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、緑内障ろ過手術後の瘢痕化の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、ARMDに関係する網膜内の瘢痕化の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0084】
胃腸管における結合線維組織増殖症候群
本明細書には、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼのインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)をそれを必要とする個体に投与する工程を含む、胃腸(GI)管における結合線維組織増殖症候群の処置の方法が提供される。GI管における結合線維組織増殖症候群は、限定されないが、線維化性結腸疾患、(例えば、クローン病、炎症性大腸疾患に関係する)腸線維症、肝臓線維症、線維化性の胆汁うっ滞性肝炎などを含む。そのような実施形態の幾つかにおいて、GI管の結合線維組織増殖症候群は嚢胞性線維症(例えば、線維化性結腸疾患)に関係する。幾つかの例において、活性化された線維芽細胞は、肝臓線維症の間の線維性の細胞外マトリックスの蓄積の一因である。
【0085】
幾つかの実施形態において、GI管の結合線維組織増殖症候群は、線維芽細胞の増殖に関係する。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、線維芽細胞の増殖を阻害又は部分的に阻害し、それによって、本明細書に記載される任意のGI管の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0086】
腎臓系における結合線維組織増殖症候群
本明細書には、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼのインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)をそれを必要とする個体に投与する工程を含む、腎臓係における結合線維組織増殖症候群の処置の方法が提供される。腎臓係における結合線維組織増殖症候群は、限定されないが、慢性腎疾患、後腹膜線維症、糖尿病腎症、慢性の糸球体硬化症、尿細管間質性線維症などを含む。
【0087】
幾つかの実施形態において、腎臓の結合線維組織増殖症候群は、線維芽細胞の増殖及び/又は活性化に関係する。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、線維芽細胞の増殖を阻害又は部分的に阻害し、それによって、本明細書に記載される任意の腎臓の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0088】
皮膚の結合線維組織増殖症候群
本明細書には、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼのインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)をそれを必要とする個体に投与する工程を含む、皮膚の結合線維組織増殖症候群の処置の方法が提供される。皮膚の結合線維組織増殖症候群は、限定されないが、ケロイド、強皮症、肥大性瘢痕、腎原性全身性線維症などを含む。幾つかの例において、ケロイドは、皮膚傷害の治癒の後に発症する緻密線維組織の異常増殖の結果である。幾つかの例において、肥大性瘢痕は、熱傷害及び/又は深い真皮を含む他の傷害の後に見られる。腎原性全身性線維症(NSF)は、皮膚において顕著な及び目に見える影響を有する全身性障害である。幾つかの例において、NSFと診断された患者は、軽度に隆起したプラーク、丘疹又は集密的な丘疹;及び/又は増加した数の線維芽細胞を示す生検、真皮において見られる正常なパターンのコラーゲン線維束の変化、及び増加したムチンの皮膚沈着を伴う、広範囲の硬化した皮膚を生じる。
【0089】
幾つかの実施形態において、皮膚の結合線維組織増殖症候群は、任意の皮層における線維芽細胞の増殖及び/又は活性化に関係する。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、線維芽細胞の増殖を阻害又は部分的に阻害し、それによって、本明細書に記載される任意の皮膚の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0090】
臓器移植に関係する結合線維組織増殖症候群
幾つかの実施形態において、結合線維組織増殖症候群は、移植肝(例えば、線維化性の胆汁うっ滞性肝炎、肝臓線維症、腎線維症など)などの(同種移植片及び/又は異種移植片を含む)臓器移植に関係する。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)のそれを必要とする個体への投与は、移植臓器又はその近くにおける線維症の発生を減少させる又は妨げる。
【0091】
他の結合線維組織増殖症候群
本明細書には、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼのインヒビター(例えば、式IA、IB、IIA又はIIBの化合物)をそれを必要とする個体に投与する工程を含む、特定の他の結合線維組織増殖症候群の処置の方法が提供される。そのような結合線維組織増殖症候群は、限定されないが、嚢胞性線維症、心内膜心筋線維症、縦隔線維症、骨髄線維症、骨線維症、結合線維組織増殖症候群、アナフィラキシーショックの線維症などを含む。
【0092】
実施例3乃至12は、上述される特定の結合線維組織増殖症候群の処置のための特定のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター)の使用を記載する。
【0093】
幾つかの実施形態において、上述される任意の結合線維組織増殖症候群は、線維芽細胞の増殖及び/又は活性化に関係する。幾つかの実施形態において、1以上のウォルトマンニンアナログ及び/又はPI−3キナーゼインヒビター(例えば、式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター)のそれを必要とする個体への投与は、線維芽細胞の増殖を阻害又は部分的に阻害し、それによって、本明細書に記載される任意の結合線維組織増殖症候群の進行及び/又は発症を減らし、逆戻りさせ、又は遅らせる。
【0094】
1つの実施形態において、本明細書には、以下の構造を有する治療上有効な量のPX−866を被験体に投与する工程を含む、被験体において上述される任意の結合線維組織増殖症候群(例えば、肺線維症)を処置する方法が提供される:
【0095】
【化7】

【0096】
1つの実施形態において、本明細書には、以下の構造を有する治療上有効な量のPX−867を被験体に投与する工程を含む、被験体において上述される任意の結合線維組織増殖症候群(例えば、肺線維症)を処置する方法が提供される:
【0097】
【化8】

【0098】
特定の更なる実施形態は、限定されないが、PX−868、PX−870、PX−871、PX−880、PX−881、PX−882、PX−889、PX−890、DJM2−170、DJM2−171、DJM2−177、DJM2−181及びそれらの組み合わせから選択される、治療上有効な量のウォルトマンニンアナログ及び代謝物質を、それを必要とする個体に投与する工程を含む、結合線維組織増殖症候群(例えば、肺線維症)を処置する方法を提供する。
【0099】
併用療法
幾つかの実施形態において、本明細書には、結合線維組織増殖症候群(例えば、肺線維症)を処置するための第2の治療薬と組み合わせた、PI−3キナーゼインヒビター(例えば、本明細書に記載される式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター)を使用するための方法が提供される。
【0100】
幾つかの実施形態において、本明細書には、結合線維組織増殖症候群(例えば、肺線維症)を処置するための第2の治療薬と組み合わせた、ウォルトマンニンアナログ又は代謝物質を使用するための方法が提供される。
【0101】
第2の治療薬の例は、限定されないが、例えば、コルチコステロイド(例えば、プレドニゾン、デキサメタゾン、トリアムシノロン又は任意の他のコルチコステロイド)、ガンマインターフェロン、血清アミロイドP、シクロホスファミド、アザチオプリン、メトトレキサート、ペニシラミン、シクロスポリンなどの免疫抑制剤を含む。他の第2の治療薬は、コルヒチン、ミコフェノール酸モフェチル、ピルフェニドンなどを含む。幾つかの実施形態において、第2の治療薬は、タンパク質の治療薬(例えば、抗体)である。
【0102】
ラパマイシンの哺乳類標的(mTOR)は、高度に保存された細胞内のセリン/トレオニンキナーゼ及びPI3K経路における主要な下流の構成成分である。ケラチン研究は、PI3K−Akt−mTOR経路が、肺内でのEGFR活性によって誘発された線維化反応を媒介することを示す。従って、幾つかの実施形態において、本明細書に記載される線維症の処置の方法は、本明細書に記載される確立された肺線維症及び/又は他の線維症の症状の予防、進行の遅延、逆戻り及び/又は部分的な逆戻りのためにPI−3キナーゼインヒビターと組み合わせた、小分子のEGFRチロシンキナーゼインヒビター(例えばゲフィチニブ、エルロチニブなど)を投与する工程を含む。幾つかの実施形態において、本明細書に記載される線維症の処置の方法は、本明細書に記載される確立された肺線維症及び/又は他の線維症の症状の予防、進行の遅延、逆戻り及び/又は部分的な逆戻りのために、限定されないが、ラパマイシン、テムシロリムス、デフォロリムス、エベロリムス、BEZ235などを含む、小分子のmTorインヒビターを投与する工程を含む。
【0103】
医薬組成物/製剤
幾つかの実施形態において、本明細書に記載される化合物は、医薬組成物に製剤される。具体的な実施形態において、医薬組成物は、活性化合物を薬学的に使用可能な調剤に処理することを促進する賦形剤及び助剤を含む、1以上の生理学的に許容可能な担体を用いて、従来の方法で製剤される。適切な製剤は、選択される投与経路に依存する。任意の薬学的に許容可能な技術、担体、及び賦形剤は、本明細書に記載される医薬組成物を製剤するのに適したものとして使用される:Remington:The Science and Practice of Pharmacy,Nineteenth Ed(Easton,Pa.:Mack Publishing Company,1995);Hoover,John E.,Remington’s Pharmaceutical Sciences,Mack Publishing Co.,Easton,Pennsylvania 1975;Liberman,H.A.and Lachman,L.,Eds.,Pharmaceutical Dosage Forms,Marcel Decker,New York,N.Y.,1980;及び、Pharmaceutical Dosage Forms and Drug Delivery Systems,Seventh Ed.(Lippincott Williams & Wilkins1999)。
【0104】
本明細書には、式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログ、及び薬学的に許容可能な希釈剤、賦形剤、又は担体を含む医薬組成物が提供される。特定の実施形態において、本明細書に記載される化合物は、併用療法におけるように、式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログが、他の活性成分と混合される医薬組成物として投与される。本明細書に包含されるのは、下記の併用療法の節及び本開示の至る所に記述される活性分子の全ての組み合わせである。具体的な実施形態において、医薬組成物は、1以上の式IA、IB、IIA又はIIBの化合物を含む。
【0105】
医薬組成物は、本明細書で使用されるように、式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログと、担体、安定剤、希釈剤、分散剤、懸濁化剤、増粘剤、及び/又は賦形剤などの他の化学成分との混合物を指す。特定の実施形態において、医薬組成物は、有機体への化合物の投与を促進する。幾つかの実施形態において、本明細書に提供される処置又は使用の方法を実行することで、治療上有効な量の式IA、IB、IIA又はIIBの化合物、又は本明細書に記載される任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログが、処置される疾患又は疾病を有する哺乳動物に医薬組成物として投与される。特定の実施形態において、哺乳動物は、ヒトである。特定の実施形態において、治療上有効な量は、被験体の疾患の重症度、年齢及び相対的な健康状態、使用される化合物の効力及び他の要因によって変化する。本明細書に記載される化合物は、単独で、又は混合物の成分としての1以上の治療薬と組み合わせて使用される。
【0106】
そのような組成物において、薬理学的に活性な化合物は、「活性成分」として知られている。組成物を作る際に、活性成分は、通常、担体と混合される、又は担体によって薄められる、又はカプセル、サシェ(sachet)、紙又は他の容器の形態であり得る担体内に封入されるであろう。担体が希釈剤として機能するとき、それは、ビヒクル、活性成分の媒体の賦形剤として働く、固形、半固形、又は液状の物質であり得る。従って、組成物は、タブレット、丸剤、散剤、トローチ、サシェ、カシェ剤、エリキシル剤、乳剤、エマルション、シロップ、懸濁剤、軟及び硬ゼラチンカプセル、無菌注射剤、及び無菌包装された散剤の形態であることが可能である。
【0107】
適切な担体、賦形剤及び希釈剤の幾つかの例は、ラクトース、デキストロース、蔗糖、ソルビトール、マンニトール、デンプン、アラビアゴム、リン酸カルシウムアルギン酸塩、ケイ酸カルシウム、微結晶性セルロース、ポリビニルピロリドン、セルロース、トラガカント、ゼラチン、シロップ、メチルセルロース、メチル−及びプロピルヒドロキシベンゾアート、タルク、ステアリン酸マグネシウム、水、及び鉱油を含む。組成物は、平滑剤、湿潤剤、乳化及び懸濁化剤、保存剤、甘味剤又は香味剤を更に含むことができる。組成物は、当業者に周知の手順を使用することによって、患者への投与の後の活性成分の即時、持続、遅延の放出を提供するように製剤され得る。
【0108】
投与の適切な経路は、限定されないが、経口投与、静脈内投与、直腸投与、エアロゾール投与、非経口投与、経眼投与、経肺投与、経粘膜投与、経皮投与、膣内投与、経耳投与、経鼻投与、及び局所投与を含む。加えて、ほんの一例ではあるが、非経口送達は、くも膜下注射、直接的な脳室内注射、腹腔内注射、リンパ内注射、及び鼻腔内注射だけでなく、筋肉内注射、皮下注射、静脈内注射、髄内注射も含む。
【0109】
特定の実施形態において、本明細書に記載される化合物は、しばしばデポ製剤又は持続放出性製剤として、例えば、器官への直接的な化合物の注射を介して、全身的な様式よりもむしろ局所的な様式で投与される。
【0110】
線維症(例えば、肺線維症)の処置のための活性化合物の阻害量の局所送達は、線維症の部位又はその近くに化合物を投与する様々な技術により得る。局所送達の技術の例は、限定されないが、利用可能な技術の例示となるように意図される。例は、局所送達のカテーテル、部位特異的な担体、移植、直接注射、又は直接適用を含む。カテーテルによる局所送達は、線維症の部位への直接的な治療薬の投与を可能にする。
【0111】
移植による局所送達とは、線維症の臓器(例えば、肺)への治療薬を含むマトリックスの外科的な配置を指す。移植されたマトリックスは、拡散、化学反応、又は溶媒の活性化体によって治療薬を放出する。
【0112】
別の実施例は、ポリマーの腔内シーリングによる治療薬の送達である。この技術は、内腔の内面にポリマーインプラントを適用するためにカテーテルを使用する。生分解性のポリマーインプラントに組み込まれた治療薬は、それにより、手術部位に放出される。それは、PCT WO 90/01969(Schindler,Aug.23,1989)に記載される。
【0113】
インプラントによる局所送達のさらなる例は、部位への小胞または粒子状物質の直接注入による。これらの粒子状物質は、タンパク質、脂質、炭水化物または合成高分子など物質からできているかもしれない。これらの粒子状物質は、コーティングとして微小粒子の全体にわたって、または微小粒子一面に取り込まれた治療薬を有する。粒子状物質を取り込む送達システムは、Lange,Science 249:1527−1533 (1990)and Mathiowitz et al,J.App.Poly.Sci.,26:809(1981)に記載されている。
【0114】
部位特異的担体による局所送達は、薬物を標的線維症の臓器(例えば、肺)に向ける担体に治療薬を付着させることを記載する。この送達技術の例は、タンパク質リガンドまたはモノクローナル抗体など担体の使用を含む。
【0115】
いくつかの実施形態において、長期間作用型製剤は、移植(例えば皮下、又は筋肉内に)又は筋肉内注射により投与される。更に、他の実施形態において、薬物は標的とする薬物送達システムにおいて、例えば、臓器特異的抗体(organ−specific antibody)に覆われたリポソームにおいて送達される。このような実施形態において、リポソームは臓器に対し標的とされ、臓器により選択的に取り込まれる。また他の実施形態において、本明細書に記載の化合物は、急速放出製剤の形態、拡張放出製剤の形態、または中間的放出製剤の形態で提供される。また他の実施形態において、本明細書に記載の化合物は局所的に投与される。
【0116】
1つの実施形態において、式IA、IB、IIAまたはIIBの1つ以上の化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログが、水溶液中で製剤される。特定の実施形態において、その水溶液は、ほんの一例であるが、ハンクス溶液、リンガー溶液または生理的食塩水の緩衝液のような生理的に適合する緩衝液から選択される。他の実施形態において、式IA、IB、IIAまたはIIBの1つ以上の化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログが、経粘膜投与のために製剤される。特定の実施形態において、粘膜用製剤は、浸透すべきバリアにとって適切である浸透剤を含む。本明細書に記載の化合物が、他の非経口投与のために処方されるさらに他の実施形態において、適切な処方は、水溶性または非水溶性の溶液を含む。特定の実施形態において、そのような溶液は、生理学的に適合する緩衝液および/または賦形剤を含む。
【0117】
別の実施形態において、本明細書に記載の化合物は、経口投与のために製剤される。式IA、IB、IIA若しくはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログを含む本明細書に記載されている化合物は、活性化合物を、例えば薬学的に許容可能な担体または賦形剤と組み合わせることにより製剤される。様々な実施形態において、本明細書に記載の化合物は、ほんの一例であるが、錠剤、粉剤、丸薬、糖衣錠、カプセル剤、液剤、ゲル剤、シロップ剤、エリキシル剤、スラリー剤、懸濁剤などを含む、経口の投与形態で製剤される。
【0118】
経口投与については、化合物は、担体および賦形剤と混合されたり、タブレットにかたどられたり、ゼラチンカプセルに封入されたりし得る。
【0119】
特定の実施形態において、経口使用の医薬調製物は、一もしくはそれより多い固体の賦形剤を、本明細書に記載されている一もしくはそれより多い化合物と混合することによって得られ、必要に応じて、錠剤または糖衣錠コア(dragee cores)を得るために、得られた混合物を任意に粉砕し、適切な助剤を添加した後に顆粒の混合物を処理することで得られる。適切な賦形剤は、特に、ラクトース、ショ糖、マンニトールまたはソルビトールを含む糖などのフィラー;例えば、トウモロコシデンプン、小麦でん粉、米でん粉、じゃが芋でん粉、ゼラチン、トラガカントゴム、メチルセルロース、微結晶性セルロース、ヒドロキシプロピルメチルセルロース、ナトリウムカルボキシメチルセルロースなどのセルロース調製物:またはポリビニルピロリドン(PVPまたはポビドン)あるいはリン酸カルシウムなどの他のもの、である。具体的な実施形態において、崩壊剤が任意に加えられる。崩壊剤は、ほんの一例ではあるが、架橋クロスカルメロースナトリウム、ポリビニルピロリドン、寒天、またはアルギン酸もしくはアルギン酸ナトリウムなどのその塩を含む。
【0120】
1つの実施形態において、糖衣錠コアや錠剤などの剤形は、一もしくはそれより多い適切なコーティングを提供する。具体的な実施形態において、濃縮糖液は、剤形をコーティングするために使用される。糖液は、ほんの一例ではあるが、アラビアゴム、タルク、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコール、および/または二酸化チタン、ラッカー溶液、および適切な有機溶媒、または混合溶媒などのさらなる成分を任意に含む。染料および/または色素はまた、同定目的のためコーティングへ任意に加えられる。更に、染料および/または色素は、活性な化合物の投与量の異なる組み合わせを特徴づけるため任意に利用される。
【0121】
特定の実施形態において、本明細書に記載されている少なくとも一つの治療上有効な量の化合物は、他の経口剤形態で製剤される。経口剤形態は、ゼラチン製の柔らかい密封されたカプセル剤のみでなく、ゼラチン製の押し出しカプセル剤、およびグリセロールやソルビトールなどの可塑剤を含む。具体的な実施態様において、押し出しカプセル剤は、一もしくはそれより多いフィラーと混合された活性成分を含む。フィラーは、ほんの一例ではあるが、ラクトース、でん粉などの結合剤、および/またはタルクもしくはステアリン酸マグネシウムなどの潤滑剤、および任意に安定剤を含む。他の実施形態において、軟カプセル剤は適切な液体中で溶解または懸濁された一もしくはそれより多い活性な化合物を含む。適切な液体は、ほんの一例ではあるが、一もしくはそれより多い脂肪油、流動パラフィン、または液体ポリエチレングリコールを含む。更に、安定剤(stabilizer)が任意に加えられる。
【0122】
他の実施形態において、本明細書に記載されている治療上有効な量の少なくとも一つの化合物は、口腔投与または舌下投与のために製剤される。口腔投与または舌下投与に適した製剤は、ほんの一例ではあるが、錠剤、ロゼンジ剤、またはゲル剤を含む。
【0123】
更に他の実施態様において、本明細書に記載されている化合物は、ボーラス注入または持続注入に適した製剤を含む、非経口注入のために処方される。式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、代替的に、10%の水性のグルコース溶液、等張の食塩水、滅菌水などのような液体に溶かされ、静注で、または注入によって投与され得る。
【0124】
具体的な実施形態において、注入用製剤は、単位剤形で(例えばアンプルで)、または複数回用量容器で提供される。保存剤が、注入製剤へ任意に加えられる。更なる他の実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、油性ビヒクルまたは水性ビヒクル中の、無菌の懸濁剤、溶剤、またはエマルションとして、非経口注入に適した形態で製剤される。非経口注入製剤は、懸濁剤、安定剤、および/または分散剤などの処方剤(formulatory agent)を任意に含む。具体的な実施形態において、非経口投与のための医薬製剤は、水溶性形態の活性な化合物の水溶液を含む。更なる実施形態において、活性な化合物の懸濁剤は、適切な油性注入懸濁剤として調製される。本明細書に記載されている医薬組成物で使用される適切な親油性溶媒またはビヒクルは、ほんの一例ではあるが、ごま油などの脂肪油、またはオレイン酸エチルもしくはトリグリセリドなどの合成脂肪酸エステル、またはリポソームを含む。特定の具体的な実施形態において、水性注入懸濁剤は、カルボキシメチルセルロースナトリウム、ソルビトール、またはデキストランのような懸濁剤の粘度を増加させる物質を含む。懸濁剤は、高濃縮溶液の調製を可能にするため、化合物の溶解度を増加させる適切な安定剤または薬剤を任意に含む。代替的に、他の実施形態において、活性成分は、使用前に適切なビヒクル、例えば発熱物質を含まない滅菌水と共に構成するための粉末形態である。
【0125】
1つの態様において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、本明細書に記載されているような、または当該技術分野で既知の非経口注射のための溶液として調製され、自動注入器により投与される。米国特許第4,031,893号、 第5,358,489号;第5,540,664号;第5,665,071号、第5,695,472号およびWO/2005/087297(その各々はそのような開示のために参照によって本明細書に組み込まれる)に開示されたもののような自動注入器が知られている。一般に、自動注入器はすべて、注入されるための式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログを含む多くの溶液を含む。一般に、自動注入器は溶液の保持のためリザーバを含み、それは、薬物を送達するための注射針と同様、自動的に注射針を配置し、患者に注射針を挿入し、そして患者に薬物を送達するためのメカニズムとも流体で連絡している。典型的な注射器は、溶液の1mLにつき、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログのおよそ0.5mgから10mgの濃度で、溶液の約0.3mLを与える。各注射器は、化合物の1回用量のみ送達することができる。
【0126】
さらに他の実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、局所的に投与される。本明細書に記載されている化合物は、溶液、懸濁剤、ローション剤、ゲル剤、ペースト剤、薬用スティック、バーム、クリーム、または軟膏のような様々な局所投与が可能な組成物へと製剤される。そのような医薬組成物は、可溶化剤、安定剤、等張増強剤、緩衝剤、および保存剤を任意に含む。
【0127】
さらに他の実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、経皮投与のために製剤される。具体的な実施形態において、経皮製剤は、経皮送達装置および経皮送達パッチを利用し、そして、ポリマーまたは粘着剤で溶解および/または分散した親油性エマルションまたは緩衝水溶液になることが可能である。様々な実施形態において、このようなパッチは、治療剤の連続送達、パルス送達、またはオンデマンド送達用に構築される。さらなる実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの経皮的な送達は、イオン導入パッチなどによって達成される。特定の実施形態において、経皮パッチは、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの制御された送達を提供する。具体的な実施形態において、吸収速度は、律速膜(rate−controlling membrane)を使用することで、または化合物をポリマーマトリックスもしくはゲルの中に補足することで低減される。代替的な実施形態において、吸収促進剤は吸収性を高めるために使用される。吸収促進剤または担体は、皮膚を介する通過を補助する、薬学的に許容可能な吸収性溶媒を含む。例えば、1つの実施形態において、経皮装置は、支持部材、任意に担体と共に、化合物を含むリザーバ、任意に、制御された所定の速度で長時間にわたって宿主の皮膚に化合物を送達するための律速用バリア、および皮膚に装置を固定する手段を含む包帯の形態である。
【0128】
本明細書に記載の経皮製剤は当該技術分野で記載された様々な装置を用いて投与される。例えば、そのような装置は、限定されないが、米国特許第3,598,122号、第3,598,123号、第3,710,795号、第3,731,683号、米国特許第3,742,951号、第3,814,097号、第3,921,636号、第3,972,995号、第3,993,072号、第3,993,073号、第3,996,934号、第4,031,894号、第4,060,084号、第4,069,307号、第4,077,407号、第4,201,211号、第4,230,105号、第4,292,299号、第4,292,303号、第5,336,168号、第5,665,378号、第5,837,280号、第5,869,090号、第6,923,983号、第6,929,801号、及び第6,946,144号を含む。
【0129】
本明細書に記載の経皮剤形は、当該技術分野では通常である、特定の薬学的に許容可能な賦形剤を組み込むことがある。1つの実施形態において、本明細書に記載されている経皮的な製剤は少なくとも3つのコンポーネント:(1)式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの製剤;(2)浸透促進剤;および(3)水性アジュバント、を含む。加えて、経皮製剤は、これらに限定されないが、例えば、ゲル化剤、クリーム、及び軟膏基剤などの付加的な化合物をさらに含み得る。幾つかの実施形態において、経皮製剤は、吸収を促進し、皮膚から取り除かれることを防ぐために、裏地、又は不織布裏地さらに含む。他の実施形態において、本明細書に記載の経皮製剤は肌への拡散を促進するために飽和状態又は過飽和状態を維持する。
【0130】
他の実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、吸入による投与のために製剤される。吸入投与に適した様々な形態は、エアロゾル、ミスト、または粉末を含むが、これら限定されない。式IA、IB、IIAまたはIIBまたは本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの医薬組成物は、適切な推進剤(例えば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素、または他の適切なガス)を使用して、加圧包装またはネブライザーからエアロゾルスプレー形態で都合よく送達される。具体的な実施形態において、加圧されたエアロゾルの用量単位は、計量された量を送達するために、バルブを提供することによって決定される。特定の実施形態において、吸入器または注入器で使用するための、ほんの一例ではあるが、ゼラチンなどから成るカプセル剤および薬包は、化合物と、ラクトースまたはでん粉などの適切な粉末基剤の粉末混合を含んで製剤される。
【0131】
経鼻投与の剤形は従来技術で周知であり、例えば、米国特許第4,476,116号、第5,116,817号、第6,391,452号に記載され、その各々は参照によって特に組み込まれる。式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログを含む剤形は、これらの技術及び当該技術分野で周知の他の技術に従って調製されるが、このような剤形は、ベンジルアルコール又は他の好適な保存料、フルオロカーボン、及び/又は従来技術で公知の可溶化剤又は分散剤を用いて生理食塩水中の溶液として調製される。例えば、Ansel,H.C.et al.,Pharmaceutical Dosage Forms And Drug Delivery Systems,Sixth Ed.(1995)を参照されたい。好ましくは、これらの組成物及び剤形を、適切で毒性のない、薬学的に許容可能な成分を用いて調製される。これらの成分は、REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY, 21st edition, 2005(当該分野における標準的なリファレンスである)などのソースにおいて見出される。適切な担体の選択は、所望の鼻腔剤形(例えば、溶液、分散液、軟骨剤、又はゲル剤)の正確な性質に大きく依存している。鼻腔剤形は、一般的に、活性成分に加えて、大量の水を含有する。pH調節剤、乳化剤、又は分散剤、保存料、界面活性剤、ゲル化剤、又は緩衝剤、及び他の安定剤及び可溶化剤などの少量の他の成分も同様に存在することもある。好ましくは、鼻腔剤形は、鼻からの分泌物と等張であるべきである。
【0132】
吸入による投与に関して、本明細書に記載の化合物は、エアロゾル、噴霧、又は粉末としての形態で有り得る。本明細書に記載の医薬組成物は、好適な噴射剤(例えば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素、又は他の好適な気体)を用いて、加圧包装又は噴霧器から送り出されるエアロゾルの噴霧という形状で効果的に送達される。加圧型エアロゾルの場合、用量単位は計測された量を送達するためのバルブを提供することによって決定されてもよい。インヘラー又は吸入器を用いるための、ほんの一例ではあるが、ゼラチンのカプセル剤及び薬包は、本明細書に記載の化合物と、ラクトース又はスターチのような粉末基材の粉末混合を含んで製剤され得る。
【0133】
更なる他の実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、ポリビニルピロリドン、PEGなどの合成ポリマーだけでなく、ココアバターまたは他のグリセリドなどの従来の坐薬用基剤を含む、浣腸剤、直腸用ゲル剤、直腸用気泡剤、直腸用エアロゾル、坐薬、ゼリー状坐薬、または保持用浣腸剤などの直腸用組成物に製剤される。組成物の坐薬形態において、これらに限定されないが、例えば脂肪酸グリセリドの混合物などの低融点ワックスは、任意にココアバターと組み合わされて最初に溶解する。
【0134】
特定の実施形態において、医薬組成物は、賦形剤および補助剤を含む一もしくはそれより多い生理的に許容可能な担体を用いる任意の従来の様式で製剤され、これらの賦形剤および補助剤は、薬学的に使用できる調製物へと活性化合物を処理するのを容易にする。適切な製剤は、選択される投与経路に依存する。薬学的に許容可能なあらゆる技術、担体、および賦形剤は、適切に、当技術分野で理解されているように任意に使用される。式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログを含む医薬組成物は、従来の様式、ほんの一例として、従来の混合、溶解、造粒、ドラジェー製法、微粒子化、乳化、カプセル化、封入、又は圧縮プロセスなどの手段によって、製造可能である。
【0135】
医薬組成物は、少なくとも1つの薬学的に許容可能な担体、希釈剤または賦形剤、および、有効成分として少なくとも1つの式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログを含む。活性成分は、遊離酸形態もしくは遊離塩基形態、または薬学的に許容可能な塩の形態である。更に、本明細書に記載されている方法および医薬組成物は、同じタイプの活性を備えるこれら化合物の活性代謝物質だけでなく、N−酸化物、結晶型(多形体としても知られている)の使用を含む。本明細書に記載されている化合物の全ての互変異性体は、本明細書提示の化合物の範囲内に含まれる。更に、本明細書に記載されている化合物は、水やエタノールなどの薬学的に許容可能な溶媒を有する溶媒和形態のみでなく、非溶媒和形態も含む。本明細書に提示の化合物の溶媒和形態は、また、本明細書で開示されるとみなされる。更に、医薬組成物は、保存剤、安定剤、湿潤剤、もしくは乳化剤、溶解促進剤、浸透圧を調整する塩、緩衝剤、および/または他の治療上有効な物質などの、他の医薬品または治療剤、担体、アジュバントを任意に含む。
【0136】
本明細書に記載されている化合物を含む組成物の調製方法は、固体、半固体、または液体を形成するために、化合物を一もしくはそれより多い不活性な薬学的に許容可能な賦形剤または担体と共に処方する工程を含む。固形組成物は、粉剤、錠剤、分散性顆粒、カプセル剤、カシェ剤、および坐薬を含むが、これらに限定されない。液体組成物は、本明細書に開示される、化合物を溶解した溶液、化合物を含むエマルション、または化合物を含むリポソーム、ミセル、またはナノ粒子を含む溶液を含む。半固形組成物は、ゲル剤、懸濁剤、およびクリームを含むが、これらに限定されない。本明細書に記載されている医薬組成物の形態は、液体溶液または懸濁液、使用前に液体に溶解もしくは懸濁することに適した固形形態、またはエマルションを含む。これらの組成物はまた、湿潤剤または乳化剤、pH緩衝剤などの微量の非毒性補助物質を任意に含む。
【0137】
幾つかの実施形態において、少なくとも1つの式IA、IB、IIAまたはIIBの化合物又は本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログを含む医薬組成物は、薬物が溶液中、懸濁液中、またはその両方に存在する液体の形態を実例としてとる。一般的に組成物が溶液または懸濁液として投与されると、薬剤の第一の部分は溶液中に存在し、薬剤の第二の部分は液体マトリックス中の懸濁液中に粒子形態で存在する。いくつかの実施形態において、液体組成物はゲル製剤を含む。他の実施形態において、液体組成物は水性である。
【0138】
特定の実施形態において、医薬品の水溶性懸濁液は、懸濁剤として一もしくはそれより多いポリマーを含む。ポリマーは、セルロースポリマー、例えばヒドロキシプロピルメチルセルロースなどの水溶性ポリマー、および架橋カルボキシル含有ポリマーなどの非水溶性ポリマーを含む。本明細書に記載されている特定の医薬組成物は、例えばカルボキシメチルセルロース、カルボマー(アクリル酸ポリマー)、ポリ(メチルメタクリレート)、ポリアクリルアミド、ポリカルボフィル、アクリル酸/アクリル酸ブチルコポリマー、アルギン酸ナトリウム、およびデキストランから選択される粘膜付着性ポリマーを含む。
【0139】
医薬組成物はまた、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの溶解性を助けるために可溶化剤を任意に含む。「可溶化剤」という用語は、一般的に、薬剤のミセル溶液または真性溶液をもたらす薬剤を含む。特定の許容可能な非イオン性界面活性剤、例えばポリソルベート80は可溶化剤として役立ち、眼科用として許容可能なグリコール、ポリグリコール、例えばポリエチレングリコール400、およびグリコールエーテルも役立ち得る。
【0140】
更に、医薬組成物は、1つ以上のpH調整剤または酢酸、ホウ酸、クエン酸、乳酸、リン酸および塩酸のような酸;水酸化ナトリウム、リン酸ナトリウム、ホウ酸ナトリウム、クエン酸ナトリウム、酢酸ナトリウム、乳酸ナトリウムおよびトリスヒドロキシメチルアミノメタンのような塩基;およびシトラート/デキストロース、重炭酸ナトリウムおよび塩化アンモニウムのような緩衝液を含む緩衝剤を随意に含む。このような酸、塩基、および緩衝液は、組成物のpHを許容可能な範囲で維持するのに必要とされる量で含まれる。
【0141】
更に、医薬組成物は、組成物の重量モル浸透圧濃度を許容可能な範囲にするために必要な量で一もしくはそれより多い塩を任意に含む。このような塩は、ナトリウムカチオン、カリウムカチオン、またはアンモニウムカチオン及び塩化物アニオン、クエン酸アニオン、アスコルビン酸アニオン、ホウ酸アニオン、リン酸アニオン、重炭酸アニオン、硫酸アニオン、チオ硫酸アニオン又は亜硫酸水素アニオンを有するものを含み、適切な塩は、塩化ナトリウム、塩化カリウム、チオ硫酸ナトリウム、亜硫酸水素ナトリウム及び硫酸アンモニウムを含む。
【0142】
他の医薬組成物は、微生物の活性を抑制する一もしくはそれより多い保存剤を任意に含む。
適切な保存剤は、メルフェン(merfen)とチオマーサルなど水銀を含有している物質;安定した二酸化塩素;塩化ベンザルコニウム、セチルトリメチルアンモニウム臭化物及びセチルピリジニウム塩化物等の四級アンモニウム化合物を含む。更なる他の医薬組成物は、物理的安定性を増幅するため、または他の目的のために、一もしくはそれより多い界面活性剤を含む。適切な界面活性剤は、ポリオキシエチレン脂肪酸グリセリド及び例えばポリオキシエチレン(60)水素化ヒマシ油等の植物油、及び、例えば、オクトキシノール10、オクトキシノール40等のポリオキシエチレンアルキルエーテルとアルキルフェニルエーテルを含む。
【0143】
更なる他の医薬組成物は、必要な化学安定性を増幅させる一もしくはそれより多い抗酸化剤を含み得る。適切な抗酸化剤は、ほんの一例ではあるが、アスコルビン酸および二亜硫酸ナトリウムを含む。
【0144】
特定の実施形態において、医薬品の水性懸濁液組成物は、単回用量用の再密閉できない容器に包装される。あるいは、複数回用量用の再密閉できる容器が使用され、この場合は、組成物中に保存剤を含むことが一般的である。
【0145】
代替の実施形態において、疎水性医薬化合物用の他の送達システムが利用される。リポソームおよびエマルションは、本明細書での送達用ビヒクルまたは担体の例である。特定の実施形態において、N−メチルピロリドンなどの有機溶媒も利用される。更なる実施形態において、本明細書に記載されている化合物は、治療薬剤を含む固形疎水性ポリマーの半透性マトリックスなどの徐放システムを用いて送達される。様々な徐放物質が本明細書で役立つ。いくつかの実施形態において、徐放カプセル剤は、数時間から24時間までの間、化合物を放出する。治療試薬の化学的性質と生物学的安定性に依存して、タンパク質安定化のための追加方策が利用され得る。
【0146】
特定の実施形態において、本明細書に記載されている製剤は、一もしくはそれより多い抗酸化剤、金属キレート剤、チオール含有化合物、および/または他の一般的な安定剤を含む。これら安定剤の例としては、限定されるものではないが、(a)約0.5%〜約2%w/vのグリセロール、(b)約0.1%〜約1%w/vのメチオニン、(c)約0.1%〜約2%w/vのモノチオグリセロール、(d)約1mM〜約10mMのEDTA、(e)約0.01%〜約2%w/vのアスコルビン酸、(f)0.003%〜約0.02%w/vのポリソルベート80、(g)0.001%〜約0.05%w/vのポリソルベート20、(h)アルギニン、(i)ヘパリン、(j)硫酸デキストラン、(k)シクロデキストリン、(l)ペントサンポリサルフェートおよび他のヘパリノイド、(m)マグネシウムと亜鉛などの2価カチオン;又は(n)それらの組み合わせが挙げられる。
【0147】
投与方法および処置レジメン
1つの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、線維症の症状の処置のための薬物の製剤に使用される。加えて、そのような処置を必要とする被験体における本明細書に記載されているあらゆる疾患や疾病を処置するための方法は、先述の被験体に治療上有効な量の、少なくとも一つの式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログ、またはその薬学的に許容可能な塩、薬学的に活性な代謝物質、薬学的に許容可能なプロドラッグ、もしくは薬学的に許容可能な溶媒和物を含む、医薬組成物の投与を含む。
【0148】
特定の実施形態において、本明細書に記載されている化合物を含む組成物は、予防的および/または治療的処置のために投与される。特定の治療上の適用では、組成物は、既に疾患や疾病で苦しむ患者に、その疾患または疾病の症状を治し、または少なくとも部分的に阻止するのに十分な量で投与される。このような使用に有効な量は、疾患または疾病の重症度および経過、以前の治療、患者の健康状態、体重、および薬物への反応性、ならびに処置を行う医師の判断に左右される。治療上有効な量は、投与量増加臨床試験などを含むが、これらに限定されない方法により任意に定められる。
【0149】
予防上の適用において、本明細書に記載の化合物を含有する組成物は、特定の疾患、障害、又は疾病の影響を受け易く、またはその危険に曝されている患者に投与される。このような量は、「予防に有効な量または用量」と定義される。このような使用において、正確な量は、患者の健康状態、体重などにも左右される。患者に使用されると、この使用に有効な量は、疾患、障害、または疾病の重症度および経過、以前の治療、患者の健康状態および薬物への反応性、ならびに処置を行う医師の判断に左右される。
【0150】
患者の疾病が改善されない特定の実施形態において、患者の疾患または疾病の症状を改善、あるいは、そうでなければ、制御または制限するために、医師の裁量により化合物の投与は、慢性的に、つまり、患者の生存時間全体を含む長時間の間投与される。
【0151】
患者の疾状が改善される特定の実施形態において、投与される薬の投与量は、一時的に減少するか、一定時間の間一時的に停止させられることもある(即ち、「休薬期間」)。具体的な実施形態において、休薬期間の長さは、2日から1年までの間であり、ほんの一例ではあるが、2日、3日、4日、5日、6日、7日、10日、12日、15日、20日、28日、35日、50日、70日、100日、120日、150日、180日、200日、250日、280日、300日、320日、350日、および365日を含む。休薬期間中の投与量の減少は、10%から100%の間であり、ほんの一例ではあるが、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、および100%である。
【0152】
一旦患者の状態の改善が生じると、必要ならば維持量が投与される。続いて、具体的な実施形態において、投与量もしくは投与頻度、またはその両方が、その症状の機能として、改善された疾患、障害、または疾病が持続する量まで減らされる。しかし、特定の実施形態において、任意の症状の再発により、患者は断続的な処置を長期的に必要とする。
【0153】
このような量に相当する所与の薬剤の量は、特定の化合物、処置を必要とする被験体または宿主の疾患状態およびその重症度、アイデンティティ(例えば体重、性別)などの要因次第で変わるが、それにもかかわらず、例えば投与される特定の薬剤、投与経路、処置される疾病、および処置される被験体または宿主を含む症例を取り巻く特定の環境に応じて定めることができる。しかし一般的に、成人の処置に利用される投与量は、典型的に1日当たり0.02〜5000mg、好ましくは1日当たり1〜1500mgの範囲内にある。1つの実施形態において、所望の投与量は単回投与で、または同時に(もしくは短時間で)投与されるか、または適切な間隔、例えば一日に2回、3回、4回、またはそれ以上の下位投与量として投与される分割用量で、都合よく提供される。
【0154】
幾つかの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、慢性的に投与される。幾つかの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、断続的に投与される(例えば、化合物が投与されないか、低減された量で投与される期間を含む休薬期間)。幾つかの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、(a)式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの毎日の投与を含む、第1の期間;その後に続く(b)投与される、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログの毎日の量の用量減少を含む第2の期間、を含むサイクルで投与される。幾つかの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログは、第2の期間に投与されない。幾つかの実施形態において、投与量のみでなく第1と第2の期間の持続期間は、本明細書に記載されているか、当該技術分野で既知の方法を使用して決定される。いくつかの場合において、休薬期間または用量減少期間は、活性剤の薬力学的特性に依存して適切である。
【0155】
特定の実施形態において、本明細書に記載されている医薬組成物は、正確な投与量の単回投与に適した単位剤形である。単位剤形において、製剤は、一以上の化合物の適量を含有する単位用量に分割される。具体的な実施形態において、単位用量は、製剤の分離量を含有するパッケージ形態である。制限のない例は、包装された錠剤やカプセル剤、およびバイアルまたはアンプルの中にある粉剤である。水性懸濁組成物は、単回用量用の再密閉できない容器の中に任意に包装される。代わりに、複数回用量用の再密閉できる容器は、組成物内に保存剤を含むのが一般的な場合に使用される。ほんの一例ではあるが、いくつかの実施形態において、非経口注入用の製剤は、単位剤形か、または、添加保存剤を備えた複数回用量容器に入れて提供され、この単位剤形は、アンプルを含むが、これに限定されない。
【0156】
1つの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログに適切な毎日の量は、体重当たり約0.001から約100mg/kgまである。1つの実施形態において、式IA、IB、IIAまたはIIBの化合物または本明細書に記載されている任意の他のPI−3キナーゼインヒビター及び/又はウォルトマンニンアナログに適切な毎日の量は、体重当たり約0.01から約10mg/kgまである。いくつかの実施形態において、限定されないがヒトを含む大型哺乳動物における一日当たりの指示用量は、約0.5mgから約1000mgまでの範囲であり、限定されないが1日最大4回までの分割用量で適宜投与される。1つの実施形態において、一日当たりの用量は、拡張放出形態で投与される。特定の実施形態において、経口投与に適切な単位剤形は約1〜500mgの活性成分を含む。他の実施形態において、剤形における活性の1日の用量または量は、本明細書が示す範囲よりも低くまたは高く、個々の処置レジメンに関する多くの変数に基づく。様々な実施形態において、一日における単位ごとの投与量は、使用される化合物の活性、処置される疾患または疾病、投与の形態、個々の被験体の必要条件、処置される疾患または疾病の重症度、および医師の判断などを含むが、これらに限定されない多くの変数に依存して変更される。
【0157】
このような処置レジメンの毒性および治療効果は、LD50(個体群の50%致死量)およびED50(個体群の50%における治療上有効な用量)の決定などを含むが、これらに限定されない細胞培養物または実験動物における標準の薬学的手順により定められる。毒性と治療効果との間の用量比は、治療指数であり、LD50とED50との間の比率として表わされる。特定の実施形態において、細胞培養アッセイと動物実験から得たデータは、ヒトを含む哺乳動物に使用する治療上有効な1日の用量範囲および/または治療上有効な単位投与量での処方の際に用いられる。いくつかの実施形態において、本明細書に記載されている化合物の1日の投与量は、最小限の毒性を持つED50を含む血中濃度の範囲内にある。特定の実施形態において、1日の投与量および/または単回投与量は、利用される剤形および使用される投与経路次第で、この範囲内で変動する。
【0158】
使用される方法と材料を示す本発明と実施形態は、以下の制限しない実施例への言及によってさらに理解されるだろう。
【実施例】
【0159】
<実施例1>
トランスジェニックマウスおよびPX−866の投与:
2.3kbのラット・クラーラ細胞分泌タンパク質(CCSP)(別名、secretoglobin、family1A、member1(Scgblal)遺伝子プロモーター)の制御の下で逆テトラサイクリン反応性トランス活性化因子(reverse tetracycline-responsive transactivator)(rtTA)を発現するCCSP−rtTA活性化体マウスを、最小CMVプロモーターを加えたテトラサイクリンオペロンの7つのコピーの制御の下でのヒトTGFα((TetO)7−cmv TGFα) cDNAを含んでいる条件付きドキシサイクリン(Dox)調節トランスジェニックマウス(conditional doxycycline (Dox) regulated transgenic mice containing the human TGFα cDNA under the control of seven copies of the tetracycline operon ((TetO)7-cmv TGFα) plus a minimal CMV promoter)と交配させた。シングルトランスジェニック(CCSP−rtTA+/−)マウスとバイトランスジェニックCCSP−rtTA+/−/(TetO)7−cmv TGFα+/−マウスを、同腹仔内でホモ接合CCSP−rtTA+/+マウスをヘミ接合(TetO)?−cmv TGFα+/−マウスに交配させることによって、作製した。全てのマウスは、FVB/NJ近交系に由来する。マウスを、ウイルスフリーの容器内で養った。動物プロトコルはすべて、シンシナティチルドレンズ・ホスピタル研究財団(the Cincinnati Children's Hospital Research Foundation)の動物実験委員会(Institutional Animal Use and Care Committe)によって検討され承認された。TGFα発現を誘発するために、Dox(Sigma、St.Louis、MO)を、0.5mg/mlの最終濃度で飲料水、および食物(62.5mg/kg)に入れて投与した。水は、1週に3回交換した。当該技術分野で公知のように、マウスの遺伝子型を同定した(genotyped)。
【0160】
PI3KインヒビターPX−866(ProIX Pharmaceuticals、Tucson、Arizona)を、5%のEtOH中へ懸濁し、5mg/mlの保存溶液を作った。投与の3時間前に、食物と水をケージから取り除いた。その後、マウスに麻酔(Isoflurane;Abbott Labs、Chicago、IL)をかけ、無菌のビヒクルまたは薬物(3mg/kg)を、20ゲージの給餌カテーテル(Harvard Apparatus、Holliston、MA)を使用して胃管栄養によって投与した。マウスを、一日おきに4週までの間、ビヒクルまたはPX−866で処置した。マウスを、Dox、ビヒクルまたはPX−866処置の1日後または4週後に、ペントバルビタールナトリウム(65mg/ml)安楽死用溶液(Fort Dodge Animal Health、Fort Dodge、IA)で死なせた。
【0161】
ウェスタンブロット:
ウエスタンブロット解析を、以前記載したように肺ホモジェネート上で行った。ブロットをtotal and phosphorylated Aktに対する抗体(Ser 473およびThr 308、Cell Signaling Technology)と共に培養し、Phosphorlmager software Imagequant 5.2(Molecular Dynamics、Sunnyvale、CA)の上で容量積分関数(volume Integration function)を使用して定量した。
【0162】
肺組織学、免疫染色、および総肺コラーゲン:
肺を以前記載したように膨張固定した(inflation fixed)。切片(5wm)を、以前記載したように、三重染色のため、polysineスライドに載せた。総肺コラーゲンを、以前記載したように、合計の可溶性コラーゲンを定量することによって測定した(Sircol Collagen Assay、Biocolor、Ireland)。
【0163】
肺力学:
肺力学を、マウスに関してコンピューター化Flexi Vent system(SCIREQ、Montreal、Canada)で評価した。マウスに、ケタミンとキシラジンで麻酔をかけ、気管切開術を行い、その後、450呼吸/分の速度およびSCIREQシステム(これによって、動肺コンプライアンス解析ができる)によってコンピューター化された2cm H2Oの陽性呼気終圧(PEEP)で、8ml/kgの換気量で換気した。換気モードを、強制振動シグナル(forced oscillatory signal)(0.5−19.6Hz)に変更し、呼吸インピーダンスを測定した。組織エラスタンスを、各インピーダンス周波数範囲にモデルを適合させることにより、2cm H2OのPEEPでマウスに対して得た。このシステムにより、較正手順によって、装置と気管内チューブのインピーダンスを除外した。
【0164】
PX−866はAktのTGFαに誘発されるリン酸化を阻害する:
CCSP−rtTA/otet−TGFαマウスを、TGFαの発現を誘発するために、1日のDoxで処理した。ウエスタンブロット解析によって測定されるように、Ser
473に対するリン酸化Akt(P−Akt)レベルは、Dox処理コントロールマウスと比較して、5倍以上に増加した。Thr 308に対するP−Aktは、続くTGFα発現を変化させなかった(データは示さず)。CCSP−rtTA/otet−TGFαマウスにおけるPX−866処置は、P−AktにおけるTGFα−誘発の増加を阻害した(図2Aおよび2B)。
【0165】
統計:
マウス群(CCSP/−ビヒクル、CCSP/TGFαビヒクル、CCSP/TGFα PX−866)に対して、誤差(means)(+/− SEM)を計算し各変数に対してプロットした。式量濃度のために、プロットおよびシャピロ−ウィルク検定を使用して、データを評価した。式量濃度推定が得られなかった場合、グループ間の差異に関して試験するために、対数変換した値を、一元配置分散分析において使用した。対数変換が式量濃度を改善しなかった場合、ノンパラメトリックの一元配置分散分析を使用した。シミュレーションに基づく、ステップダウンの多重比較補正をすべての対の比較(pair-wise comparison)に使用した。ノンパラメトリックの一元配置分散分析に対しては、ボンフェローニ−ホルム多重比較補正を使用した。
【0166】
4つの異なる群のマウスの重量を、基線で測定し、次の8週の間、週一回、等しく間隔を置いたインターバルで測定した。Group*Timeの誤差における差異を計算するために、繰り返された測定の解析を、要素としてGroup*Timeと基線を用いて行った。別々のToepliz分散/共分散構造(separate Toepliz variance/covariance structure)が各グループに使用された。(プライオリに)選択されたGroup*Timeの誤差の差異を計算し、多重比較に対してシミュレーションベースの補正を使用して試験した。
【0167】
<実施例2>
PX−866はTGFα−誘発肺線維症を阻害する:
CCSP−rtTA/otet−TGFαマウスを、TGFα発現を誘発するためにDoxで処理し、同時に、4週間、PX−866(一日おきに4mg/kg)またはビヒクルのいずれかで処置した。TGFαの誘発は、広範囲な胸膜、血管周囲および気管支周囲の線維形成を引き起こした(図3A)。総肺コラーゲンレベルは、Dox処理コントロールマウスと比較して、CCSP−rtTA/otet−TGFαマウスにおいて2倍を超えた。PX−866処置マウスは、Dox処理コントロールマウスと比較して、組織学および総肺コラーゲンによって評価されるように、肺線維形成に何の違いも示さなかった(図3Aおよび3B)。Dox処理コントロールマウスと比較して、CCSP−rtTA/otet−TGFαマウスにおいて、肺コンプライアンスは30%以上減少し、気道抵抗、エラスタンスおよび組織エラスタンスは、2倍を超えて増加した。PX−866で処置されたマウスは、Dox処理コントロールマウスと比較して、肺力学に何の違いも示さなかった(図4)。
【0168】
PX−866は、確立しているTGFα誘発肺線維症の進行を防ぐ。
PX−866が確立している線維症の進行に影響を及ぼしているか否かを測定ために、Dox処理の後4週間、CCSP−rtTA/otet−TGFαマウスに、PX−866を投与し、さらに4週の間、Doxを与え続けた(remain on Dox)(合計8週)。コントロールは、ビヒクルで処置され、さらに4週の間、Doxを与え続けたCCSP/−およびCCSP−rtTA/otet−TGFαマウスを含んだ。第3組のコントロールは、4週間のDoxを受け、その後Doxを取り除き、そしてビヒクルで4週間処置したCCSP−rtTA/otet−TGFαマウスを含んだ(図5A)。マウスにおける線維形成を逆戻りさせることに関するPX−866の有効性を比較するために、EGFR活性化が失われる場合、マウスに対する継続的なEGFR活性化と共に、オン・オフDox群を加えた。ビヒクルで処置されたCCSP−rtTA/otet−TGFαマウスの体重は、Doxの8週間後に、基線から26%を超えて減少した(図5B)。5週の初めに投与したPX−866は、ビヒクルに処置されたCCSP−rtTA/otet−TGFαマウスと比較して、さらなる体重減少を防いだが、体重は、CCSP/−コントロールマウスまたはオフDoxのCSP−rtTA/otet−TGFαマウスより少ないままであった。8週間Doxおよびビヒクルにより処置したCCSP−rtTA/otet−TGFαマウスは、線維症が間質へ進行し肺胞の構造を目立たなくし、顕著な胸膜肥厚を示した(図6A)。さらに、大小の血管および気道において、血管周囲および気管支周囲の線維形成が進行した。PX−866処置CCSP−rtTA/otet−TGFαマウスは、ビヒクル処置マウスと比較して、低減した血管周囲および気管支周囲の線維形成のみでなく低減した胸膜線維症も示した。オフDoxのCCSP−rtTA/otet−TGFαマウスも、ほとんど線維形成が小さな気道および血管で見られない、同様の低減された胸膜および外膜の線維症を示した。総肺コラーゲンレベルは、Doxの8週後に、Dox処理CCSP/−コントロールマウスと比較して、CCSP−rtTA/otet−TGFαマウスにおいて4倍高かった(図6B)。PX−866処置CCSP−rtTA/otet−TGFαマウスとオフDoxのマウスの両方は、ビヒクル処置マウスと比較して、低減した肺コラーゲンレベルを示したが、レベルは、CCSP/−コントロールマウスと比較して、顕著に上昇したままであった。PX−866処置CCSP−rtTA/otet−TGFαマウスの肺力学は、ビヒクル処置マウスと比較して、顕著に改善されたが、また、コントロールおよび4週間オフDoxのCCSP−rtTA/otet−TGFαマウスと比較して、顕著に変化したままであった(図7)。
【0169】
肺線維症の個体の臨床治療をよりよく反映するために、PI3Kシグナル伝達の役割を、確立されたTGFα誘発線維症の維持に対して測定した。Dox中へPX−866で4週間処置したマウス(mice treated with PX-966 4 weeks into Dox)は、ビヒクル処置されたマウスと比較して、体重の標準化、肺組織学上の低減された線維症および改善された肺力学を示した。しかしながら、CCSP/−コントロールマウスと比較して、体重、肺組織学およびコラーゲンならびに肺力学はすべて変化したままであり、これは、線維症表現型の不完全な逆戻りを示す。線維症のプロセスは処置から4週間で完全に解かれるとは予想されないので、マウスにおいてDoxを取り除くことによってTGFα過剰発現が消失したエンドポイントを比較した。線維症のエンドポイントは、PX−866とオフDoxの群の間で類似するならば、PI3K阻害は肺線維症を逆戻りさせるのに有効だろう。現在の研究は、PX−866マウスは、オフDoxのマウスと比較して、総肺コラーゲンおよび組織学によって測定された同程度の線維症を示し、一方、PX−866−処置マウスにおいて、体重および肺力学を含む線維症の生理学測定は変化したままであった。線維症を逆戻りさせる際のPI3Kの抑制をさらに評価するために、PX−866処置マウスを、4週間のみDoxを与えたマウス(mice after only 4 weeks of Dox)と比較した。4週のDox群における線維症のエンドポイント(図3および4)は、マウスが処置を始める場合、肺線維症の新しい出発点を表わす。PI3Kの阻害が線維症を逆戻りさせるならば、線維症エンドポイントは、4週のDoxマウスと比較して改善することが予期される。PX−866処置マウスは、4週のDoxマウスと比較して、肺組織学およびコラーゲンで測定された同程度の線維症を示し、一方、肺力学は、PX−866処置マウスにおいて顕著に変化したままであった。まとめると、逆戻り研究は、PI3Kの阻害は、線維症が確立した後、肺線維症進行を妨げるが、生理学的変質を減少させることを示す。PX−866−処置マウス中の毎週の体重の値は、処置の最後の2週間の間上昇する傾向があり、これは、PX−866処置マウスにおける線維症の遅延性の回復および分解(resolution)を示唆する。
【0170】
<実施例3>
ブレオマイシンはマウス肺線維症モデルを誘発した:
薬物誘発肺線維症のマウスモデルを本研究の中で使用する。Walters et al. in Current Protocols in Pharmacology, posted online March 2008からのプロトコルを適用する。ブレオマイシンを、肺に直接的にか、または全身的にかのいずれかで送達し、マウスにおいて肺線維症のモデルを作製する。PX−866またはPX−867を含む製剤を、治療的にまたは予防的に投与する。Sircol Soluble Collagen Assay(Biocolor,Ltd.;Accurate Chemical and Scientificから入手可能)を使用して、肺コラーゲン含有量を測定する。肺におけるコラーゲン含有量の減少は、このモデルにおける治療効果を示す。
【0171】
<実施例4>
腸線維症に関する動物モデル
Gastroenterology 2003、125、1750−61に記載されている慢性の腸線維症ネズミモデルを、本研究の中で使用する。慢性炎症を、トリニトロベンゼンスルホン酸(TNBS)の毎週の注射によって確立する。線維症は、典型的にはTNBS注射剤の停止の後2−4週の間続く。PX−866を含む製剤を、治療的または予防的に投与する。
【0172】
結腸の線維症を組織学によって測定する。合計のコラーゲンレベルを、Kivirikko et al.,(Anal Biochem、1967、19:249−55)によって記載されたようにヒドロキシプロリンの定量化によって試験する。コントロールおよびTNBSで処置した結腸間充織細胞を、形態学と表現型によって特徴付ける。形質転換増殖因子ベータ−1(TGF−β−1)の結腸での発現を、半定量的なポリメラーゼ連鎖反応によって測定する。コラーゲンレベルとTGF−β−1の発現の減少は、このモデルにおける腸の線維症への治療効果を示す。
【0173】
<実施例5>
ウサギの創傷治癒および過形成性瘢痕モデル
麻酔の後に、耳の創傷を10匹のヤングアダルトのメスのニュージーランドウサギに作る(各耳の上に4つの創傷、1匹の動物当たり合計8つの創傷)。創傷を、7mmの生検パンチを使用して作成し、その創傷は、軟骨を露出するように作られる。解剖顕微鏡を使用して、各傷の表皮、真皮および軟骨膜の完全除去を確実にする。過形成性瘢痕モデルとして、増加した創傷を結果として生じるのは、軟骨膜の層の除去および続いてのその欠陥の表皮再形成における遅延である。各創傷は独立して直り、別々のサンプルと考えられる。
【0174】
創傷治癒の初期相および後期相を研究するために、2つの処置群を調べる。早期処置群(n=15ウサギ、120の創傷)を、負傷の後0日、1日、2日、3日、4日、5日、6日および7日に、局所製剤の重量で0.05―1.5%として製剤された試験化合物(溶液、クリーム、軟膏またはゲル)、または局所ビヒクル製剤を使用するプラセボのいずれかで処置し、負傷後28日目に採取する。後期の処置群(n=15ウサギ、120の創傷)を、負傷の後7日、8日、9日、10日、11日、12日、13日および14日に、局所製剤の重量で0.05―1.5%として製剤された試験化合物(溶液、クリーム、軟膏またはゲル)、または局所ビヒクル製剤を使用するプラセボのいずれかで処置し、負傷後28日目に採取する。各群中の創傷の半分を活性な化合物で処置し、半分をプラセボで処置する。各創傷を滅菌包帯(Tegaderm;3M)で覆い、各処置の後および肉眼的検査(gross examination)において創傷が再度上皮で覆われたように見えるまで必要とされる時、包帯を毎日替える。感染、乾燥またはネクローシスの証拠があるとき、創傷は解析から除外される。
【0175】
各研究の終わりに、創傷を、周囲の傷ついていない組織の5mmのマージンと共に採取する。瘢痕を二分し、各創傷の半分は、4%の中性緩衝ホルムアルデヒドで固定し、脱水し、パラフィンに埋め込み、4μmの断片にカットし、Masson’s trichromeまたはsirrus redで染色する。各創傷の他方の半分を、液体窒素で急速冷凍し、RNA抽出のために保存する。
【0176】
組織学解析
【0177】
光学顕微鏡を使用して、各組織断片を調べ、創傷治癒の程度および瘢痕肥大を、盲検で、等級をつけられたレンズレクチルで測定する。創傷治癒パラメーター:適切な測定は、肉芽組織内殖の用量および高さ、創傷の上皮化並びに創傷閉鎖である。各パラメーターを2度評価し、結果を平均する。
【0178】
瘢痕肥大パラメーター:
瘢痕の増大インデックスを、Lu et al(J.Am.Coll.Surg.,2005、201、p391−397)によって記載されるように測定する。値を、盲検で2度測定し、結果を平均する。
【0179】
<実施例6>
腎臓線維症の動物モデル
マウスを全身麻酔によって鎮静させ、切開を背中の右側に作る。右の近位の尿管を晒し、二重結紮する。偽手術されたマウスは尿管を晒すが、結紮しない。その後、間質の再造形を調べる。間質の腎臓線維症は、典型的には手術の約15日後に確立される。マウスのふさがれた腎臓は、線維芽細胞の増殖および炎症性の単核細胞の流入を伴う拡大した尿細管によって線維症の変更を示し、一方、偽手術されたマウスにおいて、正常な構造が保たれた。
【0180】
式IA、IB、IIAまたはIIBの化合物の経口製剤は、治療的または予防的に投与される。組織形態計測的なコンパートメントを、フルカラーの3CCDカメラおよびZeiss−KontronからのKS−400画像分析ソフトウェアを装備したZeiss顕微鏡を使用して記録する。組織も、平滑筋アルファアクチンの間質の発現に関して観察される。間質のコラーゲンの蓄積を、免疫ペルオキシダーゼ、およびSerius red染色によって測定する。線維症の逆戻りまたは低減は、PX−866の経口量の治療上の有効性を示す。
【0181】
<実施例7>
緑内障ろ過手術後の瘢痕化のための動物モデル
すべての実験は、雌のチンチラ雑種ウサギ(ChBB:CH)、3〜6月齢、および1.5〜2.5kgの重量で行う。動物を実験前に1週間馴化(acclimatized)させる。
【0182】
手術は、ケタミンおよびキシラジンの筋肉注射による全身麻酔並びにオキシブプロカイン点眼での局所麻酔のもと右眼において行う。Grisanti et al. Investigative Ophthalmology and Visual Science, 2005;46:191−196に記載されているように、周辺虹彩切除術を行う。手術の後の3日連続して、各動物に、PX−866またはPX−867を含む点滴剤を1日1回投与する。
【0183】
処置された眼の一般的な外観を評価し、局所毒性および眼不耐性を評価し、および眼内圧を測定するために、臨床検査を行う。線維症の組織の堆積に起因する結膜の透明性の喪失および肥厚化を、臨床的に試験し、創傷治癒を測定する。瘢痕化の抑制が半透明の結膜を維持すると予期される。
【0184】
すべてのウサギを、術後14日目に死なせ、処置した眼を組織学検査のために摘出する。標本の組織学的解析は、虹彩切除術の場所によって示されるような強膜切開部位の中心で行う。
【0185】
全面的な痕跡を与えるために組織をヘマトキシリンおよびエオジンで染色し、コラーゲンの細胞間マトリックス(ECM)堆積を測定するためにマソンの技術で染色する。ECM堆積の減少は治療効果を示す。
【0186】
<実施例8>
医薬組成物
【0187】
実施例8a:非経口組成物
【0188】
注射による投与に適切な非経口医薬組成物を調製するために、本明細書に記載の化合物の水溶性の塩100mgを滅菌水中に溶解させ、その後、0.9%の滅菌食塩水10mLと混合する。混合物を、注射による投与に適した投与量単位の形態に組み込む。
【0189】
実施例8b:経口組成物
【0190】
経口送達用の医薬組成物を調製するために、本明細書に記載の化合物100mgをスターチ750mgと混合する。混合物を、経口投与に適する、例えば硬ゼラチンカプセルのような経口投与量単位に組み込む。
【0191】
実施例8c:舌下(硬ロゼンジ)組成物
【0192】
硬ロゼンジなどの、口腔送達用の医薬組成物を調製するために、本明細書に記載の化合物100mgを、1.6mLのライト・コーンシロップ、2.4mLの蒸留水、及び、0.42mLのミント抽出物と混ざった、420mgの粉末状砂糖と混合する。混合物を軽く混ぜ、型に流し込むことで、口腔投与に適したドロップ剤を形成する。
【0193】
実施例8d:吸入用組成物
【0194】
吸入送達用の医薬組成物を調製するために、本明細書に記載の化合物20mgを、50mgの無水クエン酸、及び、100mLの0.9%塩化ナトリウム溶液と混合する。混合物を吸入投与に好適な吸入送達用ユニット(例えば、噴霧器)に取り込む。
【0195】
実施例8e:直腸ゲル組成物
【0196】
直腸送達用の医薬組成物を調製するために、本明細書に記載の化合物100mgを、2.5gのメチルセルロース(1500mPa)、100mgのメチルパラペン(methylparapen)、5gのグリセリン及び100mLの精製水と混合する。その後、結果として生じたゲル混合物を、直腸投与に適切な直腸送達用ユニット(例えば、注射器)に取り込む。
【0197】
実施例8f:局所ゲル組成物
【0198】
医薬的局所ゲル組成物を調製するために、本明細書に記載の化合物100mgを、1.75gのヒドロキシプロピルセルロース、10mLのプロピレングリコール、10mLのミリスチン酸イソプロピル、及び、100mLの精製アルコールUSPと混合する。その後、結果として生じたゲル混合物を、局所投与に適切な容器(チューブなど)に取り込む。
【0199】
実施例8g:点眼溶液組成物
【0200】
医薬的点眼溶液組成物を調製するために、本明細書に記載の化合物100mgを、100mLの精製水中で0.9gのNaClと混合し、0.2ミクロンのフィルタを用いてろ過する。その後、結果として生じた等張液を、点眼投与に適切な点眼用の送達ユニット(点眼薬容器等)に取り込む。
【0201】
<実施例9>
摘出されたケロイドの再発の処置および予防に対するPI−3キナーゼインヒビター化合物の影響を評価する臨床試験。術後7日に始める処置
耳垂上のケロイド瘢痕の切除に続いて局所的に投与された化合物の安全性および有効性を評価するための試験研究における、2重盲検の、無作為化した、プラセボ対照。各患者は、両側性のケロイド瘢痕切除を受け、患者がそれぞれ自分自身のコントロールとして働くように、片方の耳垂を化合物で処置し、一方、もう片方の耳垂をプラセボで処置する。
【0202】
18〜65歳の10〜12の被験体が、研究に参加する。全ての被験体は、切開後、その結果が各耳垂上の単一の傷の長さ2cmもあるように、外科的切除に適している両側性のケロイド瘢痕を有しているべきである。創傷は、耳垂の皮膚、脂肪および線維組織に制限される。
【0203】
被験体は、研究前に12週以内に、照射、冷凍外科、コルチコステロイドまたは他の薬物によるケロイド処置を経験していてはならない。被験体は、出血性疾患の病歴を有さず、進行中の乾癬若しくは湿疹、又は悪性皮膚腫瘍を経験していてはならず、またそれらを有していてはならない。子を妊娠している可能性のある女性の被験体は文書による陰性尿妊娠テストを受けるべきであり、研究期間の間、避妊の医学的に証明された形態を実行しなくてはならない。書面のインフォームドコンセントを、各被験体から得る。
【0204】
外科ケロイド切除および処置プロトコル
【0205】
10〜12の患者が、両側性のケロイド切除を受ける。各患者は、創傷を閉じた(wound closure)7日後に、各直線センチメートルの片方の耳垂創縁に(to each linear centimeter of one ear lobe wound margin)、臨床的に許容可能で安全な局所用の製剤(溶液、クリーム、軟膏またはゲル)中0.05から1.5%の間の適切な濃度に処方されたPI−3キナーゼインヒビターの化合物の経皮投与を受け、その後、4週間の間、24時間ごとに繰り返して受ける。もう片方の耳垂は、創傷を閉じた後すぐに、各直線センチメートルの片方の耳垂創縁に投与されるプレセボ(処置群において使用されるのと同一であるが、活性な医薬成分を欠いている、臨床的に許容可能で安全な局所用の製剤)で局所的に処置され、その後、4週間の間、24時間ごとに繰り返して処置される。主要な評価は、視覚的なアナログスケールを用いた、手術後4週から6月の時間にわたるレイパネル(lay panel)による写真の評価に基づく。
【0206】
主要な評価項目は、52週の時間枠の間、ケロイド指標で試験化合物について予備的な安全性の実績を獲得することである。副次的評価項目は、(i)ケロイド再発(時間枠52週間)および(ii)医師のグローバル評価と被験体の評価(時間枠52週間)である。
【0207】
<実施例10>
肺線維症の処置に対するPI−3キナーゼインヒビターの化合物の影響を評価する第I相試験
この研究は、以前の処置に失敗したことのある特発性肺線維症の患者について、PI−3キナーゼインヒビターの投与の安全性を評価する。
【0208】
研究タイプ:介入
【0209】
研究設計:処置、無作為化されていない、非盲検の、管理されない、単一グループの割付、安全性/有効性の研究
【0210】
各患者に、式IA、IB、IIAまたはIIBの化合物の1日2回の用量(a twice daily dose)を投与する。
【0211】
適格性:35歳〜80歳;研究に資格を有する両方の性;健康なボランティア:受け入れず(Not accepted)。
【0212】
包含基準:特発性肺線維症の診断;下記の少なくとも1つによって定義された、6か月の処置(アザチオプリンまたはシクロホスファミドとの/なしでの、ステロイド)にもかかわらず疾患が進行していること:増加した症状:少なくとも10%の呼気肺活量の減少、少なくとも20%の一酸化炭素に対する拡散能力の低下、CXRまたは高分解能CT走査における増加した浸潤、スクリーニング前少なくとも30日間は、<15mgのプレドニゾンを取ること。
【0213】
除外基準:かなりの環境曝露、コラーゲン道管病の診断、活性感染の証拠、臨床的に顕著な心臓病、心筋梗塞、6か月内の大動脈冠動脈バイパス術または血管形成術、不安定狭心症、6か月以内の入院が必要とされるうっ血性心不全、制御されていない不整脈、不十分にしか制御されていないあるいは重篤な糖尿病、妊娠または授乳中、別の実験プロトコルへの現在の登録。
【0214】
生理学基準:FEV1/FVC<0.60
【0215】
研究所基準:総ビリルビン>1.5×正常の上限、ASTまたはALT>3×正常の上限、アルカリフォスファターゼ>3×正常の上限、白血球数<2,500/mm3、ヘマトクリット<30%、血小板<100,000/mm3、プロトロンビン時間INR>1.5。
【0216】
この研究に対する主要なエンドポイントは、安全性である。
【0217】
副次的なエンドポイント:肺機能、運動能力および生活の質の変化。
【0218】
<実施例11>
肝臓線維症の処置に対するPI−3キナーゼインヒビターの化合物の影響を評価する臨床試験
本研究の目的は、肝臓線維症の発生率が、C型肝炎肝硬変のための肝移植の後の患者で低減されるか否かにある。本研究は、感染が戻っても線維症の発生率が低減されるか遅れるかどうかも評価する。
【0219】
研究タイプ:介入
【0220】
研究設計:C型肝炎肝硬変のための移植12か月後に肝臓線維症の進行を比較する、無作為化された、非盲検の研究。各患者に、PX−866またはPX−867の1日3回の用量(a thrice daily dose)を投与する。
【0221】
適格性:18歳〜75歳;両方の性。
【0222】
包含基準:移植の理由はC型肝炎肝硬変による末期の肝臓病である;生体ドナーから第1の肝移植を受けた患者;HCV+、HIV+またはHBV+ドナーからの肝臓のレシピエント;予め決められたサイズを超える肝臓癌のために移植された者;少なくとも6か月の間禁欲的でなかった、共存するアルコール性疾患を患う患者。
【0223】
主要な評価項目:線維症の割合(ステージ2またはその上[Ishak−Knodell FS>2])
【0224】
副次的評価項目:死または移植片機能喪失の結合したエンドポイントまたはFS>2の割合;平均線維症スコア、少なくとも1つのステージの線維症の増加がある患者のパーセンテージ;線維化胆汁うっ滞性肝炎の発生率。
【0225】
<実施例12>
腎臓線維症の治療に対するPI−3キナーゼインヒビター化合物の影響を評価する臨床試験
PX−866で処置した腎臓同種移植レシピエントにおける、6か月でのプロトコル生検における、間質性線維症および動脈硬化症の発生および程度、並びに糸球体の容量を測定すること。
【0226】
研究タイプ:介入
【0227】
研究設計:無作為化された、非盲検の、並行割付(parallel assignment)、アクティブコントロール(active control)。各患者は、PX−866またはPX−867の1日3回の用量(a thirice daily dose)を投与される。
【0228】
適格性:年齢>18歳。
【0229】
包含基準:生体ドナーからの腎臓同種移植のために、少なくとも1つのHLAのミスマッチが必要である;書面のインフォームド・コンセント(地方条例により遵守する)。
【0230】
除外基準:拒絶反応のため移植の失敗の病歴を有する、2回目または3回目の腎臓同種移植のレシピエント;ハプロタイプ同一の生体ドナーまたは心臓の鼓動がないドナーからの腎臓同種移植のレシピエント。
【0231】
主要な評価項目:本研究の主要なエンドポイントは、6か月でのプロトコル生検の皮質の断片的な間質性線維症の容量である。
【0232】
副次的評価項目:1年での患者の生存および移植片の生存;6か月および12か月での
血清中クレアチニンおよび推定されたクレアチニン・クリアランス;6か月でのプロトコル生検における脈管内膜のエリアおよび動脈壁の厚さおよび糸球体の容量;最初の年の間の急性拒絶エピソードの発生;処置不成功の発生。
【0233】
本発明は参照と共にその特定の好ましい実施形態のために相当詳細に記載されたが、他のバージョンが可能である。それ故、添付の請求項の精神および範囲は、本明細書に含まれる記載および好ましいバージョンに限定的であるべきでない。
【特許請求の範囲】
【請求項1】
必要とする個体にPI−3キナーゼインヒビターを投与する工程を含む、軽度又は中程度又は重度の肺線維症を処置する方法。
【請求項2】
前記PI−3キナーゼインヒビターが、PI−3キナーゼアルファ、PI−3キナーゼベータ、PI−3キナーゼデルタ若しくはPI−3キナーゼガンマ、またはそれらの組み合わせを選択的に阻害することを特徴とする請求項1に記載の方法。
【請求項3】
前記PI−3キナーゼインヒビターが、PI−3キナーゼアルファ若しくはPI−3キナーゼベータ、またはそれらの組み合わせを選択的に阻害することを特徴とする請求項1に記載の方法。
【請求項4】
前記PI−3キナーゼインヒビターが、PI−3キナーゼの可逆的阻害剤であることを特徴とする請求項1に記載の方法。
【請求項5】
前記PI−3キナーゼインヒビターが、PI−3キナーゼの不可逆阻害剤であることを特徴とする請求項1に記載の方法。
【請求項6】
前記肺線維症が、特発性肺線維症であることを特徴とする請求項1に記載の方法。
【請求項7】
前記肺線維症が、石綿肺、嚢胞性線維症、感染、環境アレルゲンへの接触、肺移植、自己免疫性疾患に関係しているか、または前記肺線維症が、薬剤性の肺線維症であることを特徴とする請求項1に記載の方法。
【請求項8】
前記PI−3キナーゼインヒビターが、肺線維症の進行を低減、または逆戻り、または減少させることを特徴とする請求項1に記載の方法。
【請求項9】
前記PI−3キナーゼインヒビターが、進行性の体重喪失を防ぐことを特徴とする請求項1に記載の方法。
【請求項10】
前記PI−3キナーゼインヒビターが、肺力学におけるTGFアルファに依存する変化の進行を減少させることを特徴とする請求項1に記載の方法。
【請求項11】
前記PI−3キナーゼインヒビターが、肺線維症の確立を防ぐことを特徴とする請求項1に記載の方法。
【請求項12】
前記PI−3キナーゼインヒビターが経口投与されることを特徴とする請求項1に記載の方法。
【請求項13】
前記PI−3キナーゼインヒビターが吸入可能な製剤として投与されることを特徴とする請求項1に記載の方法。
【請求項14】
治療上有効な量のウォルトマンニンまたはウォルトマンニンアナログを、それを必要とする個体に投与する工程を含む、線維化症状を伴うまたは線維化症状を有している疑いのあると診断された個体における線維化症状を処置する方法。
【請求項15】
前記ウォルトマンニンアナログが、以下の式:
【化1】

式中、
−−−は、任意の結合であり;
nは1−6であり;
Yはヘテロ原子であり;
R1及びR2は、不飽和のアルキル、非直鎖のアルキル、環式のアルキル、及び置換のアルキルから独立して選択され、又はR1及びR2は、それらが付いている原子と共にヘテロシクロアルキル基を形成し;
R3は、存在しないか、H、又はC1−C6の置換又は非置換のアルキルであり;
R4は、(C=O)R5、(C=O)OR5、(S=O)R5、(SO2)R5、(PO3)R5、(C=O)NR5R6であり;
R5は、置換又は非置換のC1−C6アルキルであり;及び
R6は、置換又は非置換のC1−C6アルキルである、
の化合物であることを特徴とする請求項14に記載の方法。
【請求項16】
式IAまたは式IBの前記化合物が、以下:
【化2】

式中、Yはヘテロ原子であり、並びにR1及びR2は、不飽和のアルキル、非直鎖のアルキル、環式のアルキル、及び置換のアルキルから独立して選択される、
から選択されることを特徴とする請求項14に記載の方法。
【請求項17】
Yが窒素および硫黄から選択されるヘテロ原子であることを特徴とする請求項16に記載の方法。
【請求項18】
前記R1およびR2が不飽和のアルキルであることを特徴とする請求項16に記載の方法。
【請求項19】
前記ウォルトマンニンアナログがPI−3キナーゼインヒビターであることを特徴とする請求項14に記載の方法。
【請求項20】
前記PI−3キナーゼインヒビターがPX−866であることを特徴とする請求項19に記載の方法。
【請求項21】
前記PI−3キナーゼインヒビターがPX−867であることを特徴とする請求項19に記載の方法。
【請求項22】
前記線維化症状が、軽度、中程度、又は重度の、肺線維症、嚢胞性線維症、眼線維症、心内膜心筋線維症、縦隔線維症、骨髄線維症、骨線維症、線維化性結腸疾患、後腹膜線維症、間質性肺炎、肺内の進行性塊状線維症、ケロイド、強皮症、瘢痕肥大、腎臓線維症、腸線維症、肝臓線維症、線維化性の胆汁うっ滞性肝炎、腎原性全身性線維症、臓器移植に関係する線維症、結合線維組織増殖症候群、又はアナフィラキシーショック線維症であることを特徴とする請求項14に記載の方法。
【請求項23】
前記線維化症状が、軽度、中程度、又は重度の特発性肺線維症であることを特徴とする請求項14に記載の方法。
【請求項24】
前記線維化症状が、石綿肺、嚢胞性線維症、感染、環境アレルゲンへの接触、自己免疫性疾患に関連した肺線維症、又は薬剤性の肺線維症であることを特徴とする請求項14に記載の方法。
【請求項25】
前記線維化症状が、臓器移植に関連することを特徴とする請求項14に記載の方法。
【請求項1】
必要とする個体にPI−3キナーゼインヒビターを投与する工程を含む、軽度又は中程度又は重度の肺線維症を処置する方法。
【請求項2】
前記PI−3キナーゼインヒビターが、PI−3キナーゼアルファ、PI−3キナーゼベータ、PI−3キナーゼデルタ若しくはPI−3キナーゼガンマ、またはそれらの組み合わせを選択的に阻害することを特徴とする請求項1に記載の方法。
【請求項3】
前記PI−3キナーゼインヒビターが、PI−3キナーゼアルファ若しくはPI−3キナーゼベータ、またはそれらの組み合わせを選択的に阻害することを特徴とする請求項1に記載の方法。
【請求項4】
前記PI−3キナーゼインヒビターが、PI−3キナーゼの可逆的阻害剤であることを特徴とする請求項1に記載の方法。
【請求項5】
前記PI−3キナーゼインヒビターが、PI−3キナーゼの不可逆阻害剤であることを特徴とする請求項1に記載の方法。
【請求項6】
前記肺線維症が、特発性肺線維症であることを特徴とする請求項1に記載の方法。
【請求項7】
前記肺線維症が、石綿肺、嚢胞性線維症、感染、環境アレルゲンへの接触、肺移植、自己免疫性疾患に関係しているか、または前記肺線維症が、薬剤性の肺線維症であることを特徴とする請求項1に記載の方法。
【請求項8】
前記PI−3キナーゼインヒビターが、肺線維症の進行を低減、または逆戻り、または減少させることを特徴とする請求項1に記載の方法。
【請求項9】
前記PI−3キナーゼインヒビターが、進行性の体重喪失を防ぐことを特徴とする請求項1に記載の方法。
【請求項10】
前記PI−3キナーゼインヒビターが、肺力学におけるTGFアルファに依存する変化の進行を減少させることを特徴とする請求項1に記載の方法。
【請求項11】
前記PI−3キナーゼインヒビターが、肺線維症の確立を防ぐことを特徴とする請求項1に記載の方法。
【請求項12】
前記PI−3キナーゼインヒビターが経口投与されることを特徴とする請求項1に記載の方法。
【請求項13】
前記PI−3キナーゼインヒビターが吸入可能な製剤として投与されることを特徴とする請求項1に記載の方法。
【請求項14】
治療上有効な量のウォルトマンニンまたはウォルトマンニンアナログを、それを必要とする個体に投与する工程を含む、線維化症状を伴うまたは線維化症状を有している疑いのあると診断された個体における線維化症状を処置する方法。
【請求項15】
前記ウォルトマンニンアナログが、以下の式:
【化1】

式中、
−−−は、任意の結合であり;
nは1−6であり;
Yはヘテロ原子であり;
R1及びR2は、不飽和のアルキル、非直鎖のアルキル、環式のアルキル、及び置換のアルキルから独立して選択され、又はR1及びR2は、それらが付いている原子と共にヘテロシクロアルキル基を形成し;
R3は、存在しないか、H、又はC1−C6の置換又は非置換のアルキルであり;
R4は、(C=O)R5、(C=O)OR5、(S=O)R5、(SO2)R5、(PO3)R5、(C=O)NR5R6であり;
R5は、置換又は非置換のC1−C6アルキルであり;及び
R6は、置換又は非置換のC1−C6アルキルである、
の化合物であることを特徴とする請求項14に記載の方法。
【請求項16】
式IAまたは式IBの前記化合物が、以下:
【化2】

式中、Yはヘテロ原子であり、並びにR1及びR2は、不飽和のアルキル、非直鎖のアルキル、環式のアルキル、及び置換のアルキルから独立して選択される、
から選択されることを特徴とする請求項14に記載の方法。
【請求項17】
Yが窒素および硫黄から選択されるヘテロ原子であることを特徴とする請求項16に記載の方法。
【請求項18】
前記R1およびR2が不飽和のアルキルであることを特徴とする請求項16に記載の方法。
【請求項19】
前記ウォルトマンニンアナログがPI−3キナーゼインヒビターであることを特徴とする請求項14に記載の方法。
【請求項20】
前記PI−3キナーゼインヒビターがPX−866であることを特徴とする請求項19に記載の方法。
【請求項21】
前記PI−3キナーゼインヒビターがPX−867であることを特徴とする請求項19に記載の方法。
【請求項22】
前記線維化症状が、軽度、中程度、又は重度の、肺線維症、嚢胞性線維症、眼線維症、心内膜心筋線維症、縦隔線維症、骨髄線維症、骨線維症、線維化性結腸疾患、後腹膜線維症、間質性肺炎、肺内の進行性塊状線維症、ケロイド、強皮症、瘢痕肥大、腎臓線維症、腸線維症、肝臓線維症、線維化性の胆汁うっ滞性肝炎、腎原性全身性線維症、臓器移植に関係する線維症、結合線維組織増殖症候群、又はアナフィラキシーショック線維症であることを特徴とする請求項14に記載の方法。
【請求項23】
前記線維化症状が、軽度、中程度、又は重度の特発性肺線維症であることを特徴とする請求項14に記載の方法。
【請求項24】
前記線維化症状が、石綿肺、嚢胞性線維症、感染、環境アレルゲンへの接触、自己免疫性疾患に関連した肺線維症、又は薬剤性の肺線維症であることを特徴とする請求項14に記載の方法。
【請求項25】
前記線維化症状が、臓器移植に関連することを特徴とする請求項14に記載の方法。
【図1A】


【図1B】


【図2A】


【図2B】


【図3A】


【図3B】


【図4】


【図5】


【図6A】


【図6B】


【図7】




【図1B】


【図2A】


【図2B】


【図3A】


【図3B】


【図4】


【図5】


【図6A】


【図6B】


【図7】


【公表番号】特表2012−523429(P2012−523429A)
【公表日】平成24年10月4日(2012.10.4)
【国際特許分類】
【出願番号】特願2012−504871(P2012−504871)
【出願日】平成22年4月8日(2010.4.8)
【国際出願番号】PCT/US2010/030420
【国際公開番号】WO2010/118250
【国際公開日】平成22年10月14日(2010.10.14)
【出願人】(511232628)オンコシレオン,インコーポレイテッド (1)
【Fターム(参考)】
【公表日】平成24年10月4日(2012.10.4)
【国際特許分類】
【出願日】平成22年4月8日(2010.4.8)
【国際出願番号】PCT/US2010/030420
【国際公開番号】WO2010/118250
【国際公開日】平成22年10月14日(2010.10.14)
【出願人】(511232628)オンコシレオン,インコーポレイテッド (1)
【Fターム(参考)】
[ Back to top ]

