縮合環化合物及びそれを含む有機発光素子
【課題】縮合環化合物及びそれを含む有機発光素子を提供する。
【解決手段】下記化学式(1)で表示される縮合環化合物及びそれを含む有機発光素子である:

前記化学式(1)で、R1ないしR11、R21ないしR25は、水素、アルキル基等であり、L1及びL2はアリーレン基等であり、a及びbは整数である。
【解決手段】下記化学式(1)で表示される縮合環化合物及びそれを含む有機発光素子である:

前記化学式(1)で、R1ないしR11、R21ないしR25は、水素、アルキル基等であり、L1及びL2はアリーレン基等であり、a及びbは整数である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、縮合環化合物及びそれを含む有機発光素子に関する。
【背景技術】
【0002】
有機発光素子(organic light emitting diode)は、自発光型素子であって、視野角が広くてコントラストにすぐれるだけではなく、応答時間が速く、輝度、駆動電圧及び応答速度の特性がすぐれ、かつ多色化が可能であるという長所を有している。一般的な有機発光素子は、基板上部にアノードが形成されており、このアノード上部に、正孔輸送層、発光層、電子輸送層及びカソードが順次に形成されている構造を有することができる。ここで、正孔輸送層、発光層及び電子輸送層は、有機化合物からなる有機薄膜である。
【0003】
前述のような構造を有する有機発光素子の駆動原理は、次の通りである。
前記アノード及びカソード間に電圧を印加すれば、アノードから注入された正孔は、正孔輸送層を経由して発光層に移動し、カソードから注入された電子は、電子輸送層を経由して発光層に移動する。前記正孔及び電子のようなキャリアは、発光層領域で再結合して励起子(exiton)を生成する。この励起子が励起状態から基底状態に変わりつつ光が生成される。
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、新規構造を有する縮合環化合物及びそれを含む有機発光素子を提供するものである。
【課題を解決するための手段】
【0005】
本発明の一側面によれば、下記化学式(1)で表示される縮合環化合物が提供される:
【化1】

前記化学式(1)で、R1ないしR11は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C60アルキル基、置換または非置換のC2−C60アルケニル基、置換または非置換のC2−C60アルキニル基、置換または非置換のC1−C60アルコキシ基、置換または非置換のC3−C60シクロアルキル基、置換または非置換のC5−C60アリール基、置換または非置換のC5−C60アリールオキシ基、置換または非置換のC5−C60アリールチオ基、置換または非置換のC2−C60ヘテロアリール基、−N(R21)(R22)、または−Si(R23)(R24)(R25)であり、L1及びL2は互いに独立に、置換または非置換のC5−C60アリーレン基、あるいは置換または非置換のC2−C60ヘテロアリーレン基であり、a及びbは互いに独立に、0ないし5の整数であり、R21ないしR25は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C60アルキル基、置換または非置換のC2−C60アルケニル基、置換または非置換のC2−C60アルキニル基、置換または非置換のC1−C60アルコキシ基、置換または非置換のC3−C60シクロアルキル基、置換または非置換のC5−C60アリール基、置換または非置換のC5−C60アリールオキシ基、置換または非置換のC5−C60アリールチオ基、あるいは置換または非置換のC2−C60ヘテロアリール基である。
本発明の他の側面によれば、第1電極と、前記第1電極に対向した第2電極と、前記第1電極と前記第2電極との間に介在された第1層と、を含み、前記第1層が、前記縮合環化合物を1種以上含む有機発光素子が提供される。
【発明の効果】
【0006】
本発明による有機発光素子は、低駆動電圧、高輝度、高効率及び長寿命を有することができる。
【図面の簡単な説明】
【0007】
【図1】一具現例による有機発光素子の構造を概略的に示した図面である。
【発明を実施するための形態】
【0008】
本発明の一具現例による縮合環化合物は、下記化学式(1)で表示される:
【化2】

前記化学式(1)で、R1ないしR11は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C60アルキル基、置換または非置換のC2−C60アルケニル基、置換または非置換のC2−C60アルキニル基、置換または非置換のC1−C60アルコキシ基、置換または非置換のC3−C60シクロアルキル基、置換または非置換のC5−C60アリール基、置換または非置換のC5−C60アリールオキシ基、置換または非置換のC5−C60アリールチオ基、置換または非置換のC2−C60ヘテロアリール基、−N(R21)(R22)、または−Si(R23)(R24)(R25)でありうる。
【0009】
例えば、化学式(1)で、前記R1ないしR11は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基、ペントキシ基、置換または非置換のフェニル基、置換または非置換のペンタレニル基(pentalenyl)、置換または非置換のインデニル基(indenyl)、置換または非置換のナフチル基(naphthyl)、置換または非置換のアズレニル基(azulenyl)、置換または非置換のヘプタレニル基(heptalenyl)、置換または非置換のインダセニル基(indacenyl)、置換または非置換のアセナフチル基(acenaphthyl)、置換または非置換のフルオレニル基(fluorenyl)、置換または非置換のフェナレニル基(phenalenyl)、置換または非置換のフェナントレニル基(phenanthrenyl)、置換または非置換のアントリル基(anthryl)、置換または非置換のフルオランテニル基(fluoranthenyl)、置換または非置換のトリフェニレニル基(triphenylenyl)、置換または非置換のピレニル基(pyrenyl)、置換または非置換のクリセニル基(chrysenyl)、置換または非置換のナフタセニル基(naphthacenyl)、置換または非置換のピセニル基(picenyl)、置換または非置換のペリレニル基(perylenyl)、置換または非置換のペンタセニル基(pentacenyl)、置換または非置換のヘキサセニル基(hexacenyl)、置換または非置換のピロリル基(pyrrolyl)、置換または非置換のピラゾリル基(pyrazolyl)、置換または非置換のイミダゾリル基(imidazolyl)、置換または非置換のイミダゾリニル基(imidazolinyl)、置換または非置換のイミダゾピリジニル基(imidazopyridinyl)、置換または非置換のイミダゾピリミジニル(imidazopyrimidinyl)、置換または非置換のピリジニル基(pyridinyl)、置換または非置換のピラジニル基(pyrazinyl)、置換または非置換のピリミジニル基(pyrimidinyl)、置換または非置換のインドリル基(indolyl)、置換または非置換のプリニル基(purinyl)、置換または非置換のキノリニル基(quinolinyl)、置換または非置換のフタラジニル基(phthalazinyl)、置換または非置換のインドリジニル基(indolizinyl)、置換または非置換のナフチリジニル基(naphthyridinyl)、置換または非置換のキナゾリニル基(quinazolinyl)、置換または非置換のシンノリニル基(cinnolinyl)、置換または非置換のインダゾリル基(indazolyl)、置換または非置換のカルバゾリル基(carbazolyl)、置換または非置換のフェナジニル基(phenazinyl)、置換または非置換のフェナントリジニル基(phenanthridinyl)、置換または非置換のピラニル基(pyranyl)、置換または非置換のクロメニル基(chromenyl)、置換または非置換のフラニル基、置換または非置換のベンゾフラニル基(benzofuranyl)、置換または非置換のチオフェニル基(thiophenyl)、置換または非置換のベンゾチオフェニル基(benzothiophenyl)、置換または非置換のイソチアゾリル基(isothiazolyl)、置換または非置換のベンゾイミダゾリル基(benzoimidazolyl)、置換または非置換のイソキサゾリル基(isoxazolyl)、置換または非置換のジベンゾチオフェニル基(dibenzothiophenyl)、置換または非置換のジベンゾフラニル基(dibenzofuranyl)、置換または非置換のトリアジニル基(triazinyl)、置換または非置換のオキサジアゾリル基(oxadiazolyl)、または−N(R21)(R22)であるが、これらに限定されるものではない。
【0010】
例えば、前記化学式(1)で、前記R1ないしR11は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C10アルキル基、置換または非置換のC2−C10アルケニル基、置換または非置換のC2−C10アルキニル基、置換または非置換のC1−C10アルコキシ基、及び下記化学式2Aないし2Qで表される基のうち一つであるが、これらに限定されるものではない。
【化3】

【化4】

前記化学式2Aないし2Qで、Y1ないしY6は互いに独立に、=N−または=C(Z11)−であり、T1及びT2は互いに独立に、−S−、−O−、−N(Z12)−または−C(Z13)(Z14)−であってもよい。
【0011】
一方、前記化学式2Aないし2Qで、Z1ないしZ4、及びZ11ないしZ14は互いに独立に、水素;重水素;ハロゲン原子;ヒドロキシル基;シアノ基;ニトロ基;カルボン酸基;C1−C60アルキル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC1−C60アルキル基;C2−C60アルケニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC2−C60アルケニル基;C2−C60アルキニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC2−C60アルキニル基;C1−C60アルコキシ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC1−C60アルコキシ基;C3−C60シクロアルキル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC3−C60シクロアルキル基;C5−C60アリール基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリール基;C5−C60アリールオキシ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリールオキシ基;C5−C60アリールチオ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリールチオ基;C2−C60ヘテロアリール基;または重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC2−C60ヘテロアリール基であってもよい。
【0012】
例えば、前記Z1ないしZ4、及びZ11ないしZ14は互いに独立に、水素;重水素;ハロゲン原子;ヒドロキシル基;シアノ基;メチル基;エチル基;プロピル基;ブチル基;ペンチル基;エテニル基;プロペニル基;ブテニル基;ペンテニル基;アセチル基;メトキシ基;エトキシ基;プロポキシ基;ブトキシ基;ペントキシ基;フェニル基;ナフチル基;フルオレニル基;フェナントレニル基;アントリル基;ピレニル基;クリセニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基及びペントキシ基のうち一つ以上で置換された、フェニル基、ナフチル基、フルオレニル基、フェナントレニル基、アントリル基、ピレニル基及びクリセニル基;カルバゾリル基;イミダゾリル基;イミダゾリニル基;イミダゾピリジニル基;イミダゾピリミジニル基;ピリジニル基;ピリミジニル基;トリアジニル基;キノリニル基;及び重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基及びペントキシ基のうち一つ以上で置換された、カルバゾリル基、イミダゾリル基、イミダゾリニル基、イミダゾピリジニル基、イミダゾピリミジニル基、ピリジニル基、ピリミジニル基、トリアジニル基及びキノリニル基;のうち一つであるが、これらに限定されるものではない。
【0013】
前記化学式2Aないし2Qで、pは、1ないし9の整数であり、qは、1ないし7の整数であり、rは、1ないし3の整数であり、sは1、ないし4の整数であるが、これらに限定されるものではない。
【0014】
pが2以上である場合、2以上のZ1は、互いに同一であったり異なりもし、qが2以上である場合、2以上のZ2は、互いに同一であったり異なりもし、rが2以上である場合、2以上のZ3は、互いに同一であったり異なりもし、sが2以上である場合、2以上のZ4は、互いに同一であったり異なりもする。
【0015】
例えば、前記R1ないしR11は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C10アルキル基、C1−C10アルコキシ基及び下記化学式3Aないし3Tで表される基のうち一つであるが、これらに限定されるものではない。
【化5】

【化6】

前記化学式3Aないし3Tで、Y1ないしY6、T1及びT2についての詳細な説明は、前述のところを参照する。前記化学式3Aないし3Tで、Z1a、Z1b、Z1c、Z1d、Z2、Z2a、Z2b、Z2c、Z3、Z3a、Z3b、Z11、Z12、Z13及びZ14についての詳細な説明は、前記Z1についての説明を参照する。
【0016】
前記化学式(1)で、L1及びL2は互いに独立に、置換または非置換のC5−C60アリーレン基、あるいは置換または非置換のC2−C60ヘテロアリーレン基であってもよい。
例えば、前記L1及びL2は互いに独立に、置換または非置換のフェニレン基、置換または非置換のペンタレニレン基、置換または非置換のインデニレン基、置換または非置換のナフチレン基、置換または非置換のアズレニレン基、置換または非置換のヘプタレニレン基、置換または非置換のインダセニレン基、置換または非置換のアセナフチレン基、置換または非置換のフルオレニレン基、置換または非置換のフェナレニレン基、置換または非置換のフェナントレニレン基、置換または非置換のアントリレン基、置換または非置換のフルオランテニレン基、置換または非置換のトリフェニレニレン基、置換または非置換のピレニレン基、置換または非置換のクリセニレン基、置換または非置換のナフタセニレン基、置換または非置換のピセニレン基、置換または非置換のペリレニレン基、置換または非置換のペンタセニレン基、置換または非置換のヘキサセニレン基、置換または非置換のピロリレン基、置換または非置換のピラゾリレン基、置換または非置換のイミダゾリレン基、置換または非置換のイミダゾリニレン基、置換または非置換のイミダゾピリジニレン基、置換または非置換のイミダゾピリミジニレン基、置換または非置換のピリジニレン基、置換または非置換のピラジニレン基、置換または非置換のピリミジニレン基、置換または非置換のインドリレン基、置換または非置換のプリニレン基、置換または非置換のキノリニレン基、置換または非置換のプタラジニレン基、置換または非置換のインドリジニレン基、置換または非置換のナフチリジニレン基、置換または非置換のキナゾリニレン基、置換または非置換のシンノリニレン基、置換または非置換のインダゾリレン基、置換または非置換のカルバゾリレン基、置換または非置換のフェナジニレン基、置換または非置換のフェナントリジニレン基、置換または非置換のピラニレン基、置換または非置換のクロメニレン基、置換または非置換のフラニル基、置換または非置換のベンゾフラニレン基、置換または非置換のチオフェニレン基、置換または非置換のベンゾチオフェニレン基、置換または非置換のイソチアゾリレン基、置換または非置換のベンゾイミダゾリレン基、置換または非置換のイソキサゾリレン基、置換または非置換のジベンゾチオフェニレン基、置換または非置換のジベンゾフラニレン基、置換または非置換のトリアジニレン基、あるいは置換または非置換のオキサジアゾリレン基であってもよいが、これらに限定されるものではない。
【0017】
例えば、前記L1及びL2は、下記化学式4Aないし4Oのうちいずれかで表される基の一つであってもよい。
【化7】

【化8】

前記化学式4Aないし4Oで、Y11ないしY16は互いに独立に、=N−または=C(Z31)−であり、T11は−S−、−O−、−N(Z32)−または−C(Z33)(Z34)−であってもよい。
【0018】
Z21ないしZ23、及びZ31ないしZ34についての詳細な説明は、前記Z1についての説明を参照する。
前記tは、1ないし8の整数であり、uは、1ないし5の整数であってもよい。
tが2以上である場合、2以上のZ21は、互いに同一であったり異なりもし、uが2以上である場合、2以上のZ22は、互いに同一であったり異なりもする。
前記化学式(1)で、a及びbは、0ないし5の整数である。例えば、前記a及びbは、0、1または2であってもよい。
前記aまたはbが0である場合、R4またはR5は、ピレンの炭素と直接連結される。aが2以上である場合、2以上のL1は、互いに同一であったり異なりもし、bが2以上である場合、2以上のL2は、互いに同一であったり異なりもする。
【0019】
前記化学式(1)は、下記化学式1Aまたは1Bで表示されてもよいが、これらに限定されるものではない。
【化9】

前記化学式1A及び1Bで、R1ないしR5、L1、L2、a及びbは、前述のとおりである。
【0020】
例えば、前記1A及び1Bで、R1ないしR3は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基、ペントキシ基、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のフルオレニル基、置換または非置換のフェナントレニル基、置換または非置換のアントリル基、置換または非置換のピレニル基、置換または非置換のクリセニル基、置換または非置換のピロリル基、置換または非置換のピラゾリル基、置換または非置換のイミダゾリル基、置換または非置換のイミダゾリニル基、置換または非置換のイミダゾピリジニル基、置換または非置換のイミダゾピリミジニル基、置換または非置換のピリジニル基、置換または非置換のピリミジニル基、置換または非置換のキノリニル基、置換または非置換のフラニル基、置換または非置換のベンゾフラニル基、置換または非置換のチオフェニル基、置換または非置換のベンゾチオフェニル基、置換または非置換のジベンゾチオフェニル基、置換または非置換のジベンゾフラニル基、置換または非置換のトリアジニル基、あるいは置換または非置換のオキサジアゾリル基であり、R4及びR5は、前記化学式2Aないし2Qに示される基のうちいずれか一つ(例えば、化学式3Aないし3Tに示される基のうちいずれか一つ)であり、L1及びL2は、前記化学式4Aないし4Oに示される基のうちいずれか一つであり、a及びbは、互いに独立に、0、1または2であるが、これらに限定されるものではない。
【0021】
前記化学式(1)は、ピレンとピリジンとが融合される(fused)ことにより、パイ共役システム(π−conjugation system)を有することにより、非発光性減衰(non-radiative decay)を低減させることができる。このような化学式(1)の化合物を採用した有機発光素子は、優秀な内部発光量子収率を有することができるが、前記有機発光素子の発光効率が向上しうる。
【0022】
前記化学式(1)で表示される化合物は、下記化合物1ないし46及び化合物101ないし157のうちいずれか一つであるが、これらに限定されるものではない。
【化10】

【化11】

【化12】

【化13】

【化14】

【0023】
本明細書で、非置換のC1−C60アルキル基(またはC1−C60アルキル基)の具体的な例としては、メチル、エチル、プロピル、イソブチル、sec−ブチル、ペンチル、iso−アミル、ヘキシルなどを挙げることができ、置換されたC1−C60アルキル基は、前記非置換のC1−C60アルキル基のうち一つ以上の水素原子が、重水素、ハロゲン原子、ヒドロキシル基、ニトロ基、シアノ基、アミノ基、アミジノ基、ヒドラジン、ヒドラゾン、カルボン酸基やその塩、スルホン酸基やその塩、リン酸やその塩、C1−C60アルキル基、C2−C60アルケニル基、C2−C60アルキニル基、C6−C60アリール基、C2−C60ヘテロアリール基、−N(Q1)(Q2)、または−Si(Q3)(Q4)(Q5)(ここで、Q1ないしQ5は、互いに独立に、水素、C1−C60アルキル基、C2−C60アルケニル基、C2−C60アルキニル基、C5−C60アリール基、またはC2−C60ヘテロアリール基である)で置換されたものである。
【0024】
本明細書で、非置換のC1−C60アルコキシ基(またはC1−C60アルコキシ基)は、−OA(ただしAは、前述のような非置換のC1−C60アルキル基である)の化学式を有し、その具体的な例としては、メトキシ、エトキシ、イソプロピルオキシなどがあり、それらアルコキシ基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C60アルキル基の場合と同様な置換基で置換可能である。
【0025】
本明細書で、非置換のC2−C60アルケニル基(またはC2−C60アルケニル基)は、前記非置換のC2−C60アルキル基の中間や末端に一つ以上の炭素二重結合を含有しているものを意味する。例としては、エテニル、プロペニル、ブテニルなどがある。それら非置換のC2−C60アルケニル基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C60アルキル基の場合と同様な置換基で置換可能である。
【0026】
本明細書で、非置換のC2−C60アルキニル基(またはC2−C60アルキニル基)は、前記定義されたようなC2−C60アルキル基の中間や末端に一つ以上の炭素三重結合を含有しているものを意味する。例としては、エチニル(ethynyl)、プロピニル(propynyl)などがある。それらアルキニル基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C60アルキル基の場合と同様な置換基で置換可能である。
【0027】
本明細書で、非置換のC5−C60アリール基は、一つ以上の芳香族環を含むC5−C60芳香族炭素環系を有する一価(monovalent)基を意味し、非置換のC5−C60アリーレン基は、一つ以上の芳香族環を含むC5−C60芳香族炭素環系を有する二価(divalent)基を意味する。前記アリール基及びアリーレン基が2以上の環を含む場合、2以上の環は、互いに融合されてもよい。前記アリール基及びアリーレン基のうち一つ以上の水素原子は、前述の置換されたC1−C60アルキル基の場合と同様な置換基で置換可能である。
【0028】
前記置換または非置換のC5−C60アリール基の例としては、フェニル基、C1−C10アルキルフェニル基(例えば、エチルフェニル基)、C1−C10アルキルビフェニル基(例えば、エチルビフェニル基)、ハロフェニル基(例えば、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基)、ジシアノフェニル基、トリフルオロメトキシフェニル基、o−,m−及びp−トリル基、o−,m−及びp−クメニル基、メシチル基、フェノキシフェニル基、(α,α−ジメチルベンゼン)フェニル基、(N,N’−ジメチル)アミノフェニル基、(N,N’−ジフェニル)アミノフェニル基、ペンタレニル基、インデニル基、ナフチル基、ハロナフチル基(例えば、フルオロナフチル基)、C1−C10アルキルナフチル基(例えば、メチルナフチル基)、C1−C10アルコキシナフチル基(例えば、メトキシナフチル基)、アントラセニル基、アズレニル基、ヘプタレニル基、アセナフチレニル基、フェナレニル基、フルオレニル基、アントラキノリル基、メチルアントリル基、フェナントリル基、トリフェニレニル基、ピレニル基、クリセニル基、エチル−クリセニル基、ピセニル基、ペリレニル基、クロロペリレニル基、ペンタフェニル基、ペンタセニル基、テトラフェニレニル基、ヘキサフェニル基、ヘキサセニル基、ルビセニル基、コロネリル基、トリナフチレニル基、ヘプタフェニル基、ヘプタセニル基、ピラントレニル基、オバレニル基などを挙げることができる。前記置換または非置換のC5−C60アリーレン基の例は、前記置換または非置換のC5−C60アリール基の例を参照して容易に認識されるであろう。
【0029】
本明細書で、非置換のC2−C60ヘテロアリール基は、N、O、PまたはSのうちから選択された1個以上のヘテロ原子を含み、残りの環原子がCである一つ以上の芳香族環からなる系を有する一価基を意味し、非置換のC2−C60ヘテロアリーレン基は、N、O、PまたはSのうちから選択された1個以上のヘテロ原子を含み、残りの環原子がCである一つ以上の芳香族環からなる系を有する二価基を意味する。ここで、前記ヘテロアリール基及びヘテロアリーレン基が2以上の環を含む場合、2以上の環は、互いに融合されてもよい。前記ヘテロアリール基及びヘテロアリーレン基のうち一つ以上の水素原子は、前述のC1−C60アルキル基の場合と同様な置換基で置換可能である。
【0030】
前記非置換のC2−C60ヘテロアリール基の例としては、ピラゾリル基、イミダゾリル基、オキサゾリル基、チアゾリル基、トリアゾリル基、テトラゾリル基、オキサジアゾリル基、ピリジニル基、ピリダジニル基、ピリミジニル基、トリアジニル基、カルバゾリル基、インドリル基、キノリニル基、イソキノリニル基、ベンゾイミダゾリル基、イミダゾピリジニル基、イミダゾピリミジニル基などを挙げることができる。前記非置換のC2−C60ヘテロアリーレン基の例は、前記置換または非置換のC2−C60アリーレン基の例を参照して容易に認識されるであろう。
【0031】
前記置換または非置換のC5−C60アリールオキシ基は、−OA2(ここでA2は、前記置換または非置換のC5−C60アリール基である)を指し、前記置換または非置換のC5−C60アリールチオ基は、−OA3(ここでA3は、前記置換または非置換のC5−C60アリール基である)を指す。
【0032】
前記化学式(1)で表される縮合環化合物は、公知の有機合成方法を利用して合成されてもよい。前記縮合環化合物の合成方法は、後述する実施例を参照して当業者に容易に認識されるであろう。
【0033】
前記化学式(1)で表される縮合環化合物は、有機発光素子に使われてもよい。従って、第1電極、前記第1電極に対向した第2電極、及び前記第1電極と前記第2電極との間に介在された第1層と、を含み、前記第1層が、前述のような化学式(1)で表示された縮合環化合物を含む有機発光素子が提供される。
【0034】
前記縮合環化合物は、単一物質または互いに異なる物質の混合物の形態で、前記第1層に含まれてもよい。すなわち、前記第1層は、1種以上の前記縮合環化合物を含むことができる。例えば、後述する実施例1の有機発光素子は、前記縮合環化合物として、化合物14(発光層に含まれ、蛍光ホストとしての役割を行う)だけを単一物質形態として含む。一方、後述する実施例7の有機発光素子は、前記縮合環化合物として、化合物14(発光層に含まれ、蛍光ホストとしての役割を行う)、及び化合物20(発光層に含まれて蛍光ドーパントとしての役割を行う)の混合物を含む。本明細書で、「前記第1層は、前記縮合環化合物は、単一物質または互いに異なる物質の混合物の形態で含む(または、前記第1層は、1種以上の前記縮合環化合物を含む)」という表現は、前述のところを参照し、当業者であるならば、容易に理解可能であろう。
【0035】
前記第1層は、正孔注入層、正孔輸送層、正孔注入機能及び正孔輸送機能を同時に有する機能層、電子阻止層、発光層、正孔阻止層、電子輸送層、電子注入層、並びに電子輸送機能及び電子注入機能を同時に有する機能層のうち少なくとも1層を含むことができる。
本明細書で、「第1層」は、有機発光素子のうち、第1電極と第2電極との間に介在された単一または複数の層を指す用語である。
【0036】
例えば、前記第1層は、発光層を含み、前記発光層に、前記縮合環化合物が含まれてもよい。前記発光層に含まれた縮合環化合物は、ホスト(リン光ホストまたは蛍光ホスト)またはドーパント(リン光ドーパントまたは蛍光ドーパント)の役割を行うことができる。例えば、前記発光層に含まれた縮合環化合物は、蛍光ホストの役割を行ったり(後述する実施例1など参照)、蛍光ドーパントの役割を行うことができる(後述する実施例3など参照)。
【0037】
前記発光層は、2種の互いに異なる縮合環化合物を含み、前記2種の互いに異なる縮合環化合物のうち一つは、ホスト(リン光ホストまたは蛍光ホスト)の役割を行い、他の一つは、ドーパント(リン光ドーパントまたは蛍光ドーパント)の役割を行うことができる。例えば、前記発光層は、2種の互いに異なる縮合環化合物を含み、前記2種の互いに異なる縮合環化合物のうち一つは、蛍光ホストの役割を行い、他の一つは、蛍光ドーパントの役割を行うことができる(後述する実施例7など参照)。
【0038】
前記第1層は、前述のような発光層以外に、電子輸送層をさらに含むことができる。このとき、前記電子輸送層は、前記発光層に含まれた縮合環化合物とは、同一であるか異なる前記縮合環化合物を含むことができる(後述する実施例8参照)。
【0039】
一方、前記第1層は、発光層を含み、前記発光層は、アントラセン系化合物、スチリル系化合物及びアリールアミノ系化合物のうち一つ以上を含むことができる。
前記発光層は、赤色、緑色または青色の発光層であってもよい。例えば、前記発光層は、青色発光層であってもよい。このとき、前記縮合環化合物は、青色ホスト及び/または青色ドーパントとして使われ、高効率、高輝度、高色純度及び長寿命を有する有機発光素子を提供することができる。
【0040】
また、前記第1層は、電子輸送層を含み、前記電子輸送層に、前記縮合環化合物が含まれてもよい(後述する実施例5など参照)。ここで、前記電子輸送層は、前記縮合環化合物以外に、金属含有化合物をさらに含むことができる。
【0041】
また、前記第1層は、前記正孔注入層、前記正孔輸送層、並びに前記正孔注入機能及び正孔輸送機能を同時に有する機能層のうち少なくとも1層を含み、前記正孔注入層、前記正孔輸送層、並びに前記正孔注入機能及び正孔輸送機能を同時に有する機能層のうち少なくとも1層は、通常の正孔注入物質、正孔輸送物質、及び正孔注入及び輸送の機能を同時に行う物質以外に、電荷生成物質をさらに含むことができる。
【0042】
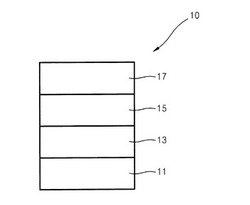
図1は、本発明の一具現例による有機発光素子10の断面図を概略的に図示したものである。以下、図1を参照しつつ、本発明の一具現例による有機発光素子の構造及び製造方法について説明すれば、次の通りである。
有機発光素子10は、基板11、第1電極13第1層15及び第2電極17を順に具備する。
【0043】
前記基板11としては、一般的な有機発光素子で使われる基板を使用することができるが、機械的強度、熱的安定性、透明性、表面平滑性、取扱容易性及び防水性にすぐれるガラス基板または透明プラスチック基板を使用することができる。
【0044】
前記第1電極13は、基板上部に、第1電極用物質を蒸着法またはスパッタリング法などを利用して提供することによって形成されてもよい。前記第1電極13がアノードである場合、正孔注入が容易になるように、第1電極用物質は、大きい仕事関数を有する物質のうちから選択されてもよい。前記第1電極13は、反射型電極または透過型電極であってもよい。第1電極用物質としては、透明であって伝導性にすぐれる酸化インジウムスズ(ITO)、酸化インジウム亜鉛(IZO)、酸化スズ(SnO2)、酸化亜鉛(ZnO)などを利用することができる。または、マグネシウム(Mg)、アルミニウム(Al)、アルミニウム−リチウム(Al−Li)、カルシウム(Ca)、マグネシウム−インジウム(Mg−In)、マグネシウム−銀(Mg−Ag)などを利用すれば、前記第1電極13を反射型電極として形成することもできる。
【0045】
前記第1電極13の上部には、第1層15が備わっている。
前記第1層15は、正孔注入層、正孔輸送層、発光層、正孔阻止層、電子輸送層及び電子注入層を含むことができる。
【0046】
正孔注入層(HIL)は、前記第1電極13上部に、真空蒸着法、スピンコーティング法、キャスト法、LB(Langmuir-Blodgett)法のような多様な方法を利用して形成されてもよい。
真空蒸着法によって正孔注入層を形成する場合、その蒸着条件は、正孔注入層の材料として使用する化合物、目的とする正孔注入層の構造及び熱的特性などによって異なるが、例えば、蒸着温度約100ないし約500℃、真空度約10−8ないし約10−3torr、蒸着速度約0.01ないし約100Å/secの範囲で選択されてもよいが、これに限定されるものではない。
【0047】
スピンコーティング法によって正孔注入層を形成する場合、そのコーティング条件は、正孔注入層の材料として使用する化合物、目的とする正孔注入層の構造及び熱的特性によって異なるが、約2,000rpmないし約5,000rpmのコーティング速度、コーティング後の溶媒除去のための熱処理温度は、約80℃ないし200℃の温度範囲で選択されてもよいが、これらに限定されるものではない。
【0048】
正孔注入物質としては、前記化学式(1)で表示される縮合環化合物及び/または公知の正孔注入物質を使用できるが、公知の正孔注入物質としては、例えば、N,N’−ジフェニル−N,N’−ビス−[4−(フェニル−m−トリル−アミノ)−フェニル]−ビフェニル−4,4’−ジアミン(DNTPD)、銅フタロシアニンなどのフタロシアニン化合物、4,4’,4”−トリス(3−メチルフェニルフェニルアミノ)トリフェニルアミン(m−MTDATA)、N,N’−ジ(1−ナフチル)−N,N’−ジフェニルベンジジン(NPB)、4,4’,4”−トリス{N,Nジフェニルアミノ}トリフェニルアミン(TDATA)、4,4’−ビス[N−(ナフチル)−N−フェニル−アミノ]ビフェニル(2−TNATA)、ポリアニリン/ドデシルベンゼンスルホン酸(Pani/DBSA)、ポリ(3,4−エチレンジオキシチオフェン)/ポリ(4−スチレンスルホネート)(PEDOT/PSS)、ポリアニリン/カンファースルホン酸(Pani/CSA)、またはポリアニリン/ポリ(4−スチレンスルホネート)(PANI/PSS)などを使用できるが、これらに限定されるもののではない。
【化15】

【0049】
前記正孔注入層の厚みは、約100Åないし約10,000Å、例えば、約100Åないし約1,000Åであってもよい。前記正孔注入層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、満足すべき正孔注入特性を得ることができる。
【0050】
次に、前記正孔注入層の上部に、真空蒸着法、スピンコーティング法、キャスト法、LB法のような多様な方法を利用して、正孔輸送層(HTL)を形成することができる。真空蒸着法及びスピンコーティング法によって正孔輸送層を形成する場合、その蒸着条件及びコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択されてもよい。
【0051】
正孔輸送物質としては、前述のような化学式(1)の縮合環化合物及び/または公知の正孔輸送物質を使用することができる。公知の正孔輸送材料としては、例えば、N−フェニルカルバゾール,ポリビニルカルバゾールなどのカルバゾール誘導体、N,N’−ビス(3−メチルフェニル)−N,N’−ジフェニル−[1,1−ビフェニル]−4,4’−ジアミン(TPD)、4,4’,4”−トリス(N−カルバゾリル)トリフェニルアミン(TCTA)、N,N’−ジ(1−ナフチル)−N,N’−ジフェニルベンジジン(NPB)などを挙げることができるが、これらに限定されるものではない。
【化16】

【0052】
前記正孔輸送層の厚みは、約50Åないし約1,000Å、例えば、約100Åないし約800Åであってもよい。前記正孔輸送層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、満足すべき正孔輸送特性を得ることができる。
【0053】
または、正孔注入層と正孔輸送層との代わりに、正孔注入機能と正孔輸送機能とを同時に有する機能層を形成することができる。前記正孔注入機能及び正孔輸送機能を同時に有する機能層物質は、公知の材料のうちから選択されてもよい。
【0054】
前記正孔注入層、正孔輸送層、並びに正孔注入機能及び正孔輸送機能を同時に有する機能層のうち少なくとも1層は、前述のような化学式(1)の縮合環化合物、公知の正孔注入物質、公知の正孔輸送物質、及び/または正孔注入機能及び正孔輸送機能を同時に有する物質以外に、膜の導電性などを向上させるために、電荷生成物質をさらに含むことができる。
【0055】
前記電荷生成物質は、例えば、p−ドーパントであってもよい。前記p−ドーパントの非制限的な例としては、テトラシアノキノンジメタン(TCNQ)、及び2,3,5,6−テトラフルオロ−テトラシアノ−1,4−ベンゾキノンジメタン(F4TCNQ)のようなキノン誘導体;タングステン酸化物及びモリブデン酸化物のような金属酸化物;下記化合物200のようなシアノ基含有化合物;などを挙げることができるが、これらに限定されるものではない。
【化17】

【0056】
前記正孔注入層、前記正孔輸送層、または前記正孔注入機能及び正孔輸送機能を同時に有する機能層が、前記電荷生成物質をさらに含む場合、前記電荷生成物質は、前記層中に均一に(homogeneous)分散されたり、または不均一に分布されていてもよい。
【0057】
前記正孔輸送層、または正孔注入機能及び正孔輸送機能を同時に有する機能層の上部に、真空蒸着法、スピンコーティング法、キャスト法、LB法のような方法を利用して、発光層(EML)を形成することができる。真空蒸着法及びスピンコーティング法によって発光層を形成する場合、その蒸着条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択されてもよい。
【0058】
前記発光層物質としては、前記化学式(1)の縮合環化合物及び/または公知の発光材料(ホスト及びドーパントをいずれも含む)のうち1種以上の物質を使用することができる。
公知のホストの例としては、トリス(8−キノリノラト)アルミニウム(Alq3)、4,4’−N,N’−ジカルバゾール−ビフェニル(CBP)、ポリ(n−ビニルカルバゾール)(PVK)、9,10−ジ(ナフタレン−2−イル)アントラセン(ADN)、TCTA、1,3,5−トリス(N−フェニルベンズイミダゾール−2−イル)ベンゼン(TPBI)、3−tert−ブチル−9,10−ジ(ナフト−2−イル)アントラセン(TBADN)、E3、ジスチリルアリーレン(DSA)などを使用することができるが、これらに限定されるものではない。
【化18】

【0059】
前記ドーパントは、蛍光ドーパント及びリン光ドーパントのうち少なくとも一つであってもよい。前記リン光ドーパントは、Ir、Pt、Os、Re、Ti、Zr、Hf、またはそれらのうち2以上の組み合わせを含む有機金属錯体であってもよいが、これらに限定されるものではない。
【0060】
一方、公知の赤色ドーパントとして、PtOEP、Ir(piq)3、Btp2Ir(acac)などを利用することができるが、これらに限定されるものではない。
【化19】

【0061】
また、公知の緑色ドーパントとしては、Ir(ppy)3(ppy=フェニルピリジン)、Ir(ppy)2(acac)、Ir(mpyp)3、10−(2−ベンゾチアゾリル)−2,3,6,7−テトラヒドロ−1,1,7,7−テトラメチル−1H,5H,11H−(1)ベンゾピロピラノ(6,7−8−i,j)キノリジン−11−オン(C545T)などを利用することができるが、これらに限定されるものではない。
【化20】

【0062】
一方、公知の青色ドーパントとしては、F2Irpic、(F2ppy)2Ir(tmd)、Ir(dfppz)3、ter−フルオレン、4,4’−ビス(4−ジフェニルアミノスチリル)ビフェニル(DPAVBi)、2,5,8,11−テトラ−tert−ブチルペリレン(TBPe)、1,4−ビス−(2,2−ジフェニルビニル)ビフェニル(DPVBi)などを利用することができるが、これらに限定されるものではない。
【化21】

【0063】
前記発光層がホスト及びドーパントを含む場合、ドーパントの含有量は、一般的に、ホスト約100重量部を基準として、約0.01ないし約15重量部の範囲で選択されてもよいが、これに限定されるものではない。
【0064】
前記発光層の厚みは、約100Åないし約1,000Å、例えば、約200Åないし約600Åであってもよい。前記発光層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な発光特性を示すことができる。
【0065】
発光層に、リン光ドーパントを共に使用する場合には、三重項励起子または正孔が電子輸送層に拡散する現象を防止するために、前記正孔輸送層と発光層との間に、真空蒸着法、スピンコーティング法、キャスト法、LB法のような方法を利用して、正孔阻止層(HBL)を形成することができる。真空蒸着法及びスピンコーティング法によって正孔阻止層を形成する場合、その条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択される。公知の正孔阻止材料も使用されてもよいが、その例としては、オキサジアゾール誘導体やトリアゾール誘導体やフェナントロリン誘導体などを挙げることができる。
【0066】
前記正孔阻止層の厚みは、約50Åないし約1,000Å、例えば、約100Åないし約300Åであってもよい。前記正孔阻止層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な正孔阻止特性を得ることができる。
【0067】
次に、電子輸送層(ETL)を、真空蒸着法、またはスピンコーティング法、キャスト法などの多様な方法を利用して形成する。真空蒸着法及びスピンコーティング法によって電子輸送層を形成する場合、その条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択されてもよい。前記電子輸送層材料としては、前記化学式(1)の縮合環化合物、または電子注入電極(カソード)から注入された電子を安定して輸送する機能を行うものであって、公知の電子輸送物質を利用することができる。公知の電子輸送物質の例としては、キノリン誘導体、特にAlq3、1,2,4−トリアゾール誘導体(TAZ)、ビス(2−メチル−8−キノリノラト)−(p−フェニルフェノラート)−アルミニウム(BAlq)、ベリリウムビス(ベンゾキノリン−10−オレート)(Bebq2)のような公知の材料を使用することができるが、これらに限定されるものではない。
【化22】

【0068】
前記電子輸送層の厚みは、約100Åないし約1,000Å、例えば、約150Åないし約500Åであってもよい。前記電子輸送層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、満足すべき電子輸送特性を得ることができる。
または前記電子輸送層は、電子輸送性有機化合物及び金属含有物質を含むことができる。前記電子輸送性有機化合物の非制限的な例としては、9,10−ジ(ナフタレン−2−イル)アントラセン(AND)、及び下記化合物201及び202のようなアントラセン系化合物などを挙げることができるが、これらに限定されるものではない。
【化23】

【0069】
前記金属含有物質はLi錯体を含むことができる。前記Li錯体の非制限的な例としては、リチウムキノレート(LiQ)または下記化合物203などを挙げることができる。
【化24】

【0070】
また電子輸送層の上部に、負極から電子の注入を容易にする機能を有する物質である電子注入層(EIL)が積層されてもよいが、これは特別に材料を制限するものではない。
前記電子注入層形成材料としては、LiF、NaCl、CsF、Li2O、BaOのような電子注入層形成材料として、公知の任意の物質を利用することができる。前記電子注入層の蒸着条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択されてもよい。
【0071】
前記電子注入層の厚みは、約1Åないし約100Å、約3Åないし約90Åであってもよい。前記電子注入層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、満足すべき電子注入特性を得ることができる。
【0072】
かような第1層15の上部には、第2電極17が備わっている。前記第2電極は、電子注入電極であるカソードであるが、このとき、前記第2電極形成用の金属としては、小さい仕事関数を有する金属、合金、電気伝導性化合物及びそれらの混合物を使用することができる。具体的な例としては、リチウム(Li)、マグネシウム(Mg)、アルミニウム(Al)、アルミニウム−リチウム(Al−Li)、カルシウム(Ca)、マグネシウム−インジウム(Mg−In)、マグネシウム−銀(Mg−Ag)などを薄膜に形成し、透過型電極を得ることができる。一方、前面発光素子を得るために、ITO、IZOを利用した透過型電極を形成できるなど、多様な変形が可能である。
【0073】
以下、合成例及び実施例を挙げ、本発明の一具現例による有機発光素子について、さらに具体的に説明するが、本発明が、下記の合成例及び実施例に限定されるものではない。
[実施例]
合成例1:化合物14の合成
下記反応式によって化合物14を合成した。
【化25】

中間体1−aの合成
1−アミノ−6−ブロモピレン10g(33.8mmol)、70%硫酸水溶液10gをニトロベンゼン8gに入れて混合し、110℃に上げた後、酸化剤であるグリセロール10gを滴加した後、110℃で10時間撹拌した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体1−a 7.1g(収率71%)を収得した。生成された化合物をLC−MS(liquid chromatography-mass spectroscopy)を介して確認した。
C19H10Br1N1:M+:331.00
中間体1−bの合成
中間体1−a 5g(15mmol)、ビス(ピナコラート)ジボロン(bis(pinacolato)diboron)4.6g(18mmol)、KOAc(酢酸カリウム)4.42g(45mmol)、[1,1’−ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(II)(Pd(dppf)Cl2)0.04g(0.06mmol)を、脱ガス(degassed)N,N‐ジメチルホルムアミド(DMF)100mLと混合させ、10時間撹拌した。そこから収得した混合物を、水100mLとジクロロメタン100mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて得られた残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体1−b 5.18g(収率91%)を収得した。生成された化合物をLC−MSを介して確認した。
C25H22B1N1O2:M+379.17
化合物14の合成
中間体1−b 2g(5.2mmol)、中間体1−c 1.9g(6.2mmol)、テトラキス(トリフェニルホスフィン)パラジウム(O)(Pd(PPh3)4)0.18g(0.16mmol)に、2M NaOH水溶液20mLとTHF 20mLとを混合し、80℃で10時間還流した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、1.8g(収率73%)の化合物14を収得した。生成された化合物をLC−MSとNMR(nuclear magnetic resonance)とを介して確認した。
C37H23N1:M+482.19
1H NMR(CDCl3,400MHz)δ(ppm)9.07(d,1H)8.90(m,1H)8.36(d,1H)8.29(s,1H)8.26−8.23(m,1H)8.20(d,1H)8.14(d,1H)8.01(d,1H)7.96(d,1H)7.85(m,2H)7.72−7.69(m,5H)7.49−7.39(m,7H)
【0074】
合成例2:化合物20の合成
下記反応式によって、化合物20を合成した:
【化26】

合成例1に記載されたところによって合成された中間体1−a 2g(6.0mmol)、中間体2−a 10.15g(60.0mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(O)(Pd2(dba)3)0.16g(0.18mmol)、(2,4,6−トリ−tert−ブチルフェニル)ホスフィン0.05g(0.18mmol)、ナトリウムt−ブトキシド0.7g(7.2mmol)を、トルエン100mLに入れ、100℃で10時間還流した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出して収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、化合物20 1.19g(収率47%)を得た。生成された化合物をLC−MSとNMRとを介して確認した。
C31H20N2:M+420.16
1H NMR(CDCl3,400MHz)δ(ppm)8.91(m,1H)8.69(d,1H)8.27−8.24(m,2H)8.08(d,1H)8.03(d,1H)7.91−7.02(m,14H)
【0075】
合成例3:化合物22の合成
下記反応式によって化合物22を合成した:
【化27】

中間体1−b 2g(5.2mmol)、中間体3−a 2.23g(6.2mmol)、Pd(PPh3)4 0.18g(0.16mmol)を、2M NaOH水溶液20mLとTHF 20mLとに入れて80℃で10時間還流した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出して収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、化合物22 1.7g(収率62%)を得た。生成された化合物をLC−MSとNMRとを介して確認した。
C33H23N2:M+532.18
1H NMR(CDCl3,400MHz)δ(ppm)9.07(d,1H)8.91(m,1H)8.63(d,1H)8.49(s,1H)8.47−8.44(m,1H)8.36(d,1H)8.23(d,2H)8.19(d,1H)7.84−7.81(m,2H)7.75−7.71(m,1H)7.44−7.23(m,8H)6.99(m,2H)
【0076】
合成例4:化合物30の合成
下記反応式によって化合物30を合成した:
【化28】

中間体1−b 2g(5.2mmol)、中間体4−a 2.0g(6.2mmol)、Pd(PPh3)4 0.18g(0.16mmol)を、2M NaOH水溶液20mLとTHF 20mLとに入れて80℃で10時間還流した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出して収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発して収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、化合物30 1.98g(収率77%)を得た。生成された化合物をLC−MSとNMRとを介して確認した。
C37H22N2:M+494.18
1H NMR(CDCl3,400MHz)δ(ppm)9.07(d,1H)8.91−8.90(m,1H)8.42(d,1H)8.29(s,1H)8.26−8.23(m,1H)8.17(d,1H)8.12−8.10(m,2H)8.04−8.00(m,2H)7.89(d,1H)7.61−7.57(m,2H)7.45−7.25(m,9H)
【0077】
合成例5:化合物31の合成
下記反応式によって化合物31を合成した:
【化29】

中間体1−b 2g(5.2mmol)、中間体5−a 2.02g(6.2mmol)、Pd(PPh3)4 0.18g(0.16mmol)を、2M NaOH水溶液20mLとTHF 20mLに入れて80℃で10時間還流した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出して収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発して得られた残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、化合物31 2.1g(収率81%)を得た。生成された化合物をLC−MSとNMRとを介して確認した。
C36H23N3:M+498.19
1H NMR(CDCl3,400MHz)δ(ppm)9.07(d,1H)8.91(m,1H)8.46(m,4H)8.42(d,1H)8.29(s,1H)8.25(m,1H)8.16(d,1H)8.04−8.00(m,2H)7.89(d,1H)7.52−7.49(m,2H)7.45−7.41(m,1H)7.25−7.21(m,2H)7.11(m,4H)
【0078】
合成例6:化合物43の合成
下記反応式によって化合物43を合成した:
【化30】

中間体1−b 2g(5.2mmol)、中間体6−a 2.16g(6.2mmol)、Pd(PPh3)4 0.18g(0.16mmol)を、2M NaOH水溶液20mLとTHF 20mLに入れて80℃で10時間還流した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出して収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発して得られた残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、化合物43 1.84g(収率68%)を得た。生成された化合物は、LC−MSとNMRとを介して確認した。
C38H23N3:M+521.19
1H NMR(CDCl3,400MHz)δ(ppm)9.07(d,1H)8.90(m,1H)8.42(d,1H)8.29(s,1H)8.26−8.22(m,1H)8.20−8.18(m,2H)8.11(d,1H)8.03(m,2H)7.89(d,1H)7.81−7.78(m,3H)7.66−7.64(m,1H)7.58−7.56(m,2H)7.45−7.20(m,6H)
【0079】
実施例1
コーニング(Corning)15Ω/cm2(1,200Å)ITOガラス基板を50mmx50mmx0.7mmサイズに切り、イソプロピルアルコールと純水とを利用し、それぞれ5分間超音波洗浄した後、30分間紫外線を照射してオゾンに露出させて洗浄し、真空蒸着装置にこのガラス基板を設けた。
前記ガラス基板のITO電極(アノード)上部に、4,4’−ビス[N−(ナフチル)−N−フェニル−アミノ]ビフェニル(2−TNATA)を蒸着し、600Å厚の正孔注入層を形成した後、前記正孔注入層の上部に、4,4’−ビス[N−(1−ナフチル)−N−フェニルアミノ]ビフェニル(NPB)を蒸着し、300Å厚の正孔輸送層を形成した。
次に、前記正孔輸送層の上部に、化合物14及び1,4−ビス−(2,2−ジフェニルビニル)ビフェニル(DPVBi)を、重量比98:2で共蒸着し、300Å厚の発光層を形成した。
この後、前記発光層の上部にAlq3を蒸着し、300Å厚の電子輸送層を形成し、前記電子輸送層の上部にLiFを蒸着し、10Å厚の電子注入層を形成し、前記電子注入層の上部にAlを蒸着し、3,000Å厚の第2電極(カソード)を形成することによって、有機発光素子を製造した。
【0080】
実施例2
発光層の形成時に、前記化合物14の代わりに、化合物30を利用したという点を除いては、実施例1と同じ方法を利用して、有機発光素子を製作した。
【0081】
実施例3
発光層の形成時に、前記化合物14の代わりに、9,10−ジ(ナフタレン−2−イル)アントラセン(ADN)を使用し、DPVBiの代わりに、化合物20を利用したという点を除いては、実施例1と同じ方法を利用して、有機発光素子を製作した。
【0082】
実施例4
発光層の形成時に、前記化合物20の代わりに、化合物22を利用したという点を除いては、実施例3と同じ方法を利用して、有機発光素子を製作した。
【0083】
実施例5
発光層の形成時に、前記化合物14の代わりにADNを使用し、電子輸送層の形成時に、Alq3の代わりに、化合物31を利用したという点を除いては、実施例1と同じ方法を利用して、有機発光素子を製作した。
【0084】
実施例6
電子輸送層の形成時に、前記化合物31の代わりに、化合物43を利用したという点を除いては、実施例5と同じ方法を利用して、有機発光素子を製作した。
【0085】
実施例7
発光層の形成時に、DPVBiの代わりに、化合物20を利用したという点を除いては、実施例1と同じ方法を利用して、有機発光素子を製作した。
【0086】
実施例8
発光層の形成時に、化合物14の代わりに化合物30を利用し、DPVBiの代わりに化合物33を利用し、電子輸送層の形成時に、Alq3の代わりに、化合物31を利用したという点を除いては、実施例1と同じ方法を利用して、有機発光素子を製作した。
【0087】
比較例1
発光層の形成時に、前記化合物14の代わりに、公知の青色蛍光ホストであるANDを利用したことを除いては、実施例1と同じ方法を利用して、有機発光素子を製作した。
【0088】
評価1
実施例1ないし8と、比較例1との有機発光素子の駆動電圧、電流密度、輝度、発光色、効率及び半減寿命(@100mA/cm2)を、PR650 Spectroscan Source Measurement Unit.(PhotoResearch社製)を利用して評価した。その結果は、下記表1の通りである。
【表1】

前記表1によれば、実施例1ないし8の有機発光素子は、比較例1の有機発光素子に比べて、低駆動電圧、高輝度、高効率及び長寿命を有するということを確認することができる。
【0089】
合成例11:化合物101の合成
【化31】

中間体I−1の合成
1−ニトロピレン4.94g(20.0mmol)をジクロロメタン100mlに溶かした後、0℃でブロム(Br2)2.50ml(20.0mmol)を徐々に滴加した。そこから収得した混合物を常温で12時間撹拌した後、水60mLとチオ硫酸ナトリウム20%水溶液30mlとを添加し、ジクロロメタン80mLで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、ジクロロメタン/ヘキサン溶液で再結晶させ、中間体I−1 4.04g(収率62%)を得た。生成された化合物は、HR−MSで確認した。
C16H8BrNO2計算値:324.9738;実測値:324.9740
中間体I−2の合成
中間体I−1 4.04g(12.4mmol)をエタノール50mlに溶かした後、Fe 2.80g(50mmol)、0.1M HCl10mLを添加した。そこから収得した混合物を95℃で3時間撹拌した。反応液を常温に冷やした後、水100mLとジエチルエーテル100mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて得られた残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体I−2 2.75g(収率75%)を得た。生成された化合物は、HR−MSを介して確認した。
C16H10BrN計算値:294.9997;実測値295.0012
中間体I−3の合成
中間体I−2 2.75g(9.30mmol)と1,3−プロパンジオール353mg(4.65mmol)とを、メシチレン(mesitylene)10mlに溶かした後、空気中で、IrCl3・H2O 70mg(0.19mmol)、2,2’−ビス(ジフェニルホスフィノ)−1,1’−ビナフチル(BINAP)186mg(0.28mmol)及びNa2CO3 34mg(0.30mmol)の混合物を追加した。そこから収得した混合物を169℃で15時間撹拌した後、常温に冷やした後、溶媒を真空下で除去して収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体I−3 2.84g(収率92%)を得た。生成された化合物は、HR−MSで確認した。
C19H10BrN計算値:330.9997;実測値:331.0002
【化32】

中間体I−4の合成
4−ブロモトリフェニルアミン3.24g(10.0mmol)、ビス(ピナコラート)ジボロン2.54g(10.0mmol)、[1,1’−ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(II)(PdCl2(dppf)2)0.36g(0.5mmol)及びKOAc 2.94g(30.0mmol)を、ジメチルスルホキシド(DMSO)40mlに溶かした後、80℃で6時間撹拌した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体I−4 2.57g(収率89%)を得た。生成された化合物は、HR−MSを介して確認した。
C24H26BNO2計算値:371.2057;実測値371.2051
化合物101の合成
中間体I−3 1.66g(5.0mmol)、中間体I−4 1.86g(5.0mmol)、Pd(PPh3)4 0.29g(0.25mmol)及びK2CO3 2.07g(15.0mmol)を、テトラヒドロフラン(THF)/H2O(2/1)混合溶液30mlに溶かした後、70℃で5時間撹拌した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、化合物101 1.86g(収率75%)を得た。生成された化合物は、HR−MSとNMRとを介して確認した。
C37H24N2計算値:496.1939;実測値[M+1]497.1922
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.70−8.67(m,1H)、8.29−8.22(m,3H)、8.17−8.14(m,2H)、8.03(d,1H)、7.68(d,1H)、7.53−7.48(m,2H)、7.45−7.42(m,1H)、7.08−7.04(m,4H)、6.98−6.93(m,2H)、6.67−6.63(m,2H)、6.17−6.13(m,4H)
【0090】
合成例12:化合物104の合成
【化33】

中間体I−5の合成
1−ブロモ−2−メチルベンゼン3.42g(20.0mmol)、o−トルイジン(o−toluidine)2.79g(30.0mmol)、Pd2(dba)3 0.37g(0.4mmol)、トリ−tert−ブチルホスフィン(P(t−Bu)3)0.08g(0.4mmol)及びKOtBu 2.88g(30.0mmol)を、トルエン60mlに溶かした後、85℃で4時間撹拌した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体I−5 3.47g(収率88%)を得た。生成された化合物は、HR−MSを介して確認した。
C14H15N計算値:197.2204;実測値197.2253
中間体I−6の合成
中間体I−5 1.97g(10.0mmol)、4−ブロモヨードベンゼン2.83g(10.0mmol)、Pd2(dba)3 0.18g(0.2mmol)、P(t−Bu) 30.04g(0.4mmol)及びKOtBu 1.44g(15.0mmol)を、トルエン40mlに溶かした後、85℃で4時間撹拌した。そこから収得した混合物を常温に冷やした後、水30mLとジエチルエーテル30mLで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体I−6 3.14g(収率89%)を得た。生成された化合物は、HR−MSを介して確認した。
C20H18BrN計算値:351.0623;実測値351.0653
中間体I−7の合成
4−ブロモトリフェニルアミンの代わりに、N−(4−ブロモフェニル)−2−メチル−N−o−トリルベンゼンアミンを使用したという点を除いては、前記中間体I−4と同じ方法を利用し、中間体I−7を合成した。生成された化合物は、HR−MSを介して確認した。
C26H30BNO2計算値:399.2370;実測値399.2381
化合物104の合成
中間体I−4の代わりに、中間体I−7を使用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物104 2.15g(収率75%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C39H28N2計算値:524.2252;実測値[M+1]525.2056
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(dd,1H)、8.69−8.67(d,1H)、8.29(s,1H)、8.27−8.23(m,2H)、8.17−8.14(m,2H)、8.04−8.02(d,1H)、7.69−7.67(d,1H)、7.49−7.41(m,3H)、7.06−7.03(m,2H)、6.98−6.89(m,4H)、6.83−6.78(m,2H)、6.63−6.60(m,2H)、1.82(s,6H)
【0091】
合成例13:化合物110の合成
【化34】

中間体I−8の合成
1−ブロモ−2−メチルベンゼンの代わりに、1−ブロモ−2,3,4−トリフルオロベンゼンを使用し、o−トルイジンの代わりに、アニリンを使用したという点を除いては、前記中間体I−5と同じ方法を利用し、中間体I−8 5.2g(65%)を合成した。生成された化合物は、HR−MSを介して確認した。
C12H8F3N計算値:223.0609;実測値223.0901
中間体I−9の合成
中間体I−5の代わりに、中間体I−8を使用したという点を除いては、前記中間体I−6の合成方法と同じ方法を利用し、中間体I−9 7.1g(81%)を合成した。生成された化合物は、HR−MSを介して確認した。
C18H11BrF3N計算値:377.0027;実測値377.0023
中間体I−10の合成
4−ブロモトリフェニルアミンの代わりに、中間体I−9を使用したという点を除いては、前記中間体I−4と同じ方法を利用し、中間体I−10 6.00g(75%)を合成した。生成された化合物は、HR−MSを介して確認した。
C24H23BF3NO2計算値:425.1774;実測値425.1769
化合物110の合成
中間体I−4の代わりに、中間体I−10を使用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物110 1.23g(63%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C37H21F3N2計算値:550.1657;実測値[M+1]551.5897
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.69−8.67(d,1H)、8.29(s,1H)、8.26−8.22(m,2H)、8.17−8.14(m,2H)、8.04−8.02(d,1H)、7.69−7.67(d,1H)、7.54−7.50(m,2H)、7.45−7.41(m,1H)、7.10−7.05(m,2H)、6.81−6.70(m,2H)、6.66−6.56(m,3H)、6.37−6.34(m,2H)、
【0092】
合成例14:化合物120の合成
【化35】

中間体I−11の合成
1,3−ジブロモ−5−ニトロベンゼン5.62g(20.0mmol)、フェニルボロン酸1.22g(10.0mmol)、PdPPh3 0.58g(0.5mmol)及びK2CO3 4.14g(30.0mmol)を、THF/H2O(2/1)40mlに溶かして80℃で5時間撹拌した後、常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体I−11 3.57g(収率65%)を得た。生成された化合物は、HR−MSを介して確認した。
C18H13NO2計算値:275.0948;実測値275.9732
中間体I−12の合成
中間体I−1の代わりに、中間体I−11を利用したという点を除いては、前記中間体I−2の合成方法と同じ方法を利用し、中間体I−12 2.64g(83%)を合成した。生成された化合物は、HR−MSを介して確認した。
C18H15N計算値:245.1204;実測値:245.5256
中間体I−13の合成
1−ブロモ−2−メチルベンゼンの代わりに、4−ブロモベンゼンを使用し、o−トルイジンの代わりに、中間体I−12を使用したという点を除いては、前記中間体I−5の合成方法と同じ方法を利用し、中間体I−13 2.38g(69%)を合成した。生成された化合物は、HR−MSを介して確認した。
C24H19N計算値:321.1517;実測値:321.6245
中間体I−14の合成
中間体I−5の代わりに、中間体1−13を使用したという点を除いては、前記中間体I−6の合成方法と同じ方法を利用し、中間体I−14 2.51g(71%)を合成した。生成された化合物をHR−MSを介して確認した。
C30H22BrN計算値:476.0936;実測値:476.4158
中間体I−15の合成
4−ブロモトリフェニルアミンの代わりに、中間体I−14を使用したという点を除いては、前記中間体I−1の合成方法と同じ方法を利用し、中間体I−15 2.29g(83%)を合成した。生成された化合物は、HR−MSを介して確認した。
C36H34BNO2計算値:523.2683;実測値523.5641
化合物120の合成
中間体I−14の代わりに、中間体I−15を使用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物120 1.65g(69%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C49H32N2計算値:648.2565;実測値[M+1]649.3520
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.69−8.67(d,1H)、8.39(s,1H)、8.27−8.22(d,2H)、8.17−8.14(m,2H)、8.04−8.02(d,1H)、7.69−7.64(m,5H)、7.54−7.50(m,3H)、7.46−7.40(m,7H)、7.10−7.05(m,2H)、6.93−6.89(m,2H)、6.87−6.86(d,2H)、6.68−6.63(m,1H)、6.29−6.26(m,2H)
【0093】
合成例15:化合物123の合成
【化36】

中間体I−16の合成
1−ブロモ−2,3,4−トリフルオロベンゼンの代わりに、2−ブロモピリジンを使用し、アニリンの代わりに、2−アミノピリジンを使用したという点を除いては、前記中間体I−8、I−9及びI−10の合成方法と同じ方法を利用し、中間体I−16 2.3g(51%)を合成した。生成された化合物は、HR−MSを介して確認した。
C22H24BN3O2計算値:373.1962;実測値373.1956
化合物123の合成
中間体I−4の代わりに、中間体I−16を利用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物123 1.34g(73%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C35H22N4計算値:498.1844;実測値[M+1]499.1925
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.69−8.67(d,1H)、8.29(s,1H)、8.27−8.21(m,4H)、8.17−8.13(m,2H)、8.04−8.02(s,1H)、7.73−7.67(m,3H)、7.55−7.51(m,2H)、7.45−7.42(dd,1H)、7.37−7.35(m,2H)、6.92−6.88(m,2H)、6.80−6.76(m,2H)
【0094】
合成例16:化合物133の合成
【化37】

中間体I−17の合成
1,3−ジブロモ−5−ニトロベンゼンの代わりに、1,3−ジブロモ−5−フルオロ−6−ニトロベンゼンを使用したという点を除いては、前記中間体I−11,1−12、I−13、1−14及びI−15の合成方法と同じ方法を利用して、中間体I−17 2.61g(45%)を合成した。生成された化合物は、HR−MSを介して確認した。
C38H33BFNO2計算値:541.2588;実測値541.3512
化合物133の合成
中間体I−4の代わりに、中間体I−17を利用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物133 1.78g(66%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C49H31FN2計算値:666.2471;実測値[M+1]667.3125
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.69−8.67(d,1H)、8.29(s,1H)、8.27−8.23(m,2H)、8.17−8.13(m,2H)、8.04−8.02(d,1H)、7.72−7.60(m,6H)、7.55−7.47(m,7H)、7.44−7.40(m,2H)、7.13−7.10(d,1H)、7.08−7.03(m,2H)、7.00−6.96(m,2H)、6.63−6.60(m,1H)、6.15−6.12(m,2H)
【0095】
合成例17:化合物139の合成
【化38】

中間体I−18の合成
1−ブロモ−2−メチルベンゼンの代わりにブロモベンゼンを使用し、o−トルイジンの代わりに、アニリンを使用したという点を除いては、前記中間体I−5の合成方法と同じ方法を利用し、ジフェニルアミンを合成した。次に、中間体I−5の代わりに、ジフェニルアミンを使用し、4−ブロモヨードベンゼンの代わりに、2−ブロモ−7−ヨード−9,9−ジメチル−9H−フルオレンを利用したという点を除いては、前記中間体I−6の合成方法と同じ方法を利用し、7−ブロモ−9,9−ジメチル−N,N−ジフェニル−9H−フルオレン−2−アミンを合成した。この後、中間体I−6の代わりに、7−ブロモ−9,9−ジメチル−N,N−ジフェニル−9H−フルオレン−2−アミンを利用したという点を除いては、前記中間体I−7の合成方法と同じ方法を利用し、中間体I−18 2.59g(46%)を合成した。生成された化合物は、HR−MSを介して確認した。
C33H34BNO2計算値:487.2683;実測値:487.3541
化合物139の合成
中間体I−4の代わりに、中間体I−18を利用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物139 1.99g(82%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C46H32N2計算値:612.2565;実測値[M+1]613.3546
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.70−8.67(m,1H)、8.29(s,1H)、8.26−8.22(m,2H)、8.16−8.14(m,1H)、7.99−7.92(dd,2H)、7.80−7.76(m,2H)、7.68−7.66(m,2H)、7.54−7.52(d,2H)、7.50−7.48(d,1H)、7.45−7.41(m,1H)、7.08−7.04(m,4H)、6.67−6.63(m,3H)、6.40−6.38(m,1H)、6.16−6.13(m,3H)、1.82(s,6H)
【0096】
合成例18:化合物149の合成
中間体I−4の代わりに、フェニルボロン酸を利用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物149 1.28g(74%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C25H15N計算値:329.1204;実測値[M+1]330.2132
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(dd,1H)、8.69−8.67(d,1H)、8.29(s,1H)、8.26−8.23(m,2H)、8.16−8.14(d,1H)、8.06−8.02(m,3H)、7.99−7.97(d,1H)、7.68−7.66(d,1H)、7.51−7.48(m,2H)、7.45−7.38(m,2H)
【0097】
合成例19:化合物154の合成
【化39】

中間体I−19の合成
1−ブロモ−2−メチルベンゼンの代わりに、2−ブロモフルオレンを使用し、o−トルイジンの代わりに、アニリンを使用したという点を除いては、前記中間体I−5の合成方法と同じ方法を利用し、中間体I−19 4.56g(72%)を合成した。生成された化合物をHR−MSを介して確認した。
C21H18N計算値:284.1439;実測値:284.1398
化合物154の合成
中間体I−4の代わりに、中間体I−19を利用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物154 1.05g(53%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C40H28N2計算値:536.2252;実測値[M+1]537.2412
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.61−8.59(d,1H)、8.27−8.23(m,2H)、8.17−8.08(dd,2H)、7.96−7.93(d,1H)、7.78−7.72(m,2H)、7.51−7.48(d,1H)、7.44−7.41(m,2H)、7.35−7.30(m,1H)、7.14−7.11(m,2H)、7.06−7.01(m,2H)、6.65−6.61(m,2H)、6.41−6.40(d,1H)、6.17−6.13(m,2H)、1.62(s,6H)
【0098】
合成例20:化合物157の合成
【化40】

中間体I−20の合成
1,3−ジブロモ−5−ニトロベンゼンの代わりに、2−ブロモ−7−ヨード−9,9−ジメチル−9H−フルオレンを使用し、フェニルボロン酸の代わりに、2−ナフチルボロン酸を使用したという点を除いては、前記中間体I−11の合成方法と同じ方法を利用し、中間体I−20 3.56g(85%)を合成した。生成された化合物をHR−MSを介して確認した。
C25H19Br計算値:398.0670;実測値:398.0750
中間体I−21の合成
1−ブロモ−2−メチルベンゼンの代わりに中間体I−20を使用し、o−トルイジンの代わりに、2−アミノフルオレンを使用したという点を除いては、前記中間体I−5の合成方法と同じ方法を利用し、中間体I−21 3.81g(81%)を合成した。生成された化合物をHR−MSを介して確認した。
C40H32N計算値:527.2613;実測値:527.3145
化合物157の合成
中間体I−4の代わりに、中間体I−21を利用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物157 1.71g(72%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C59H42N2計算値:778.3348;実測値[M+1]779.4982
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.61−8.59(d,1H)、8.27−8.23(m,2H)、8.18−8.08(dd,2H)、8.04(s,1H)、7.99−7.97(d,1H)、7.94−7.84(m,3H)、7.78−7.74(m,2H)、7.72−7.41(m,10H)、7.36−7.30(m,1H)、7.14−7.08(m,2H)、6.70−6.66(m,2H)、6.45−6.42(m,2H)、1.64−1.62(d,12H)
【0099】
実施例11
コーニング(Corning)15Ω/cm2(1,200Å)ITOガラス基板を50mmx50mmx0.7mmサイズに切り、イソプロピルアルコールと純水とを利用し、それぞれ5分間超音波洗浄した後、30分間紫外線を照射し、オゾンに露出させて洗浄し、真空蒸着装置にこのガラス基板を設けた。
前記ガラス基板のITO電極(アノード)上部に、2−TNATAを蒸着し、600Å厚の正孔注入層を形成した後、前記正孔注入層の上部に、4,4’−ビス[N−(1−ナフチル)−N−フェニルアミノ]ビフェニル(NPB)を蒸着し、300Å厚の正孔輸送層を形成した。
次に、前記正孔輸送層の上部に、9,10−ジ(ナフタレン−2−イル)アントラセン(ADN)及び化合物101を、重量比98:2で共蒸着し、300Å厚の発光層を形成した。
この後、前記発光層の上部にAlq3を蒸着し、300Å厚の電子輸送層を形成し、前記電子輸送層の上部にLiFを蒸着し、10Å厚の電子注入層を形成し、前記電子注入層の上部にAlを蒸着し、3,000Å厚の第2電極(カソード)を形成することによって、有機発光素子を製造した。
【0100】
実施例12
発光層の形成時に、前記化合物101の代わりに、化合物104を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0101】
実施例13
発光層の形成時に、前記化合物101の代わりに、化合物110を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0102】
実施例14
発光層の形成時に、前記化合物101の代わりに、化合物120を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0103】
実施例15
発光層の形成時に、前記化合物101の代わりに、化合物123を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0104】
実施例16
発光層の形成時に、前記化合物101の代わりに、化合物133を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0105】
実施例17
発光層の形成時に、前記化合物101の代わりに、化合物139を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0106】
実施例18
発光層の形成時に、前記化合物101の代わりに、化合物149を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0107】
実施例19
発光層の形成時に、前記化合物101の代わりに、化合物154を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0108】
実施例20
発光層の形成時に、前記化合物101の代わりに、化合物157を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0109】
比較例2
発光層の形成時に、前記化合物101の代わりに、DPVBiを利用したことを除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0110】
評価2
評価1と同じ方法を利用し、実施例11ないし20と比較例2との有機発光素子の駆動電圧、電流密度、輝度、発光色、効率及び半減寿命(@100mA/cm2)をPR650 Spectroscan Source Measurement Unit.(PhotoResearch社製)を評価し、その結果を下記表2に示した。
【表2】

前記表2によれば、実施例11ないし20の有機発光素子は、比較例2の有機発光素子に比べて、低駆動電圧、高輝度、高効率及び長寿命を有するということを確認することができる。
【符号の説明】
【0111】
10 有機発光素子
11 基板
13 第1電極
15 第1層
17 第2電極
【技術分野】
【0001】
本発明は、縮合環化合物及びそれを含む有機発光素子に関する。
【背景技術】
【0002】
有機発光素子(organic light emitting diode)は、自発光型素子であって、視野角が広くてコントラストにすぐれるだけではなく、応答時間が速く、輝度、駆動電圧及び応答速度の特性がすぐれ、かつ多色化が可能であるという長所を有している。一般的な有機発光素子は、基板上部にアノードが形成されており、このアノード上部に、正孔輸送層、発光層、電子輸送層及びカソードが順次に形成されている構造を有することができる。ここで、正孔輸送層、発光層及び電子輸送層は、有機化合物からなる有機薄膜である。
【0003】
前述のような構造を有する有機発光素子の駆動原理は、次の通りである。
前記アノード及びカソード間に電圧を印加すれば、アノードから注入された正孔は、正孔輸送層を経由して発光層に移動し、カソードから注入された電子は、電子輸送層を経由して発光層に移動する。前記正孔及び電子のようなキャリアは、発光層領域で再結合して励起子(exiton)を生成する。この励起子が励起状態から基底状態に変わりつつ光が生成される。
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、新規構造を有する縮合環化合物及びそれを含む有機発光素子を提供するものである。
【課題を解決するための手段】
【0005】
本発明の一側面によれば、下記化学式(1)で表示される縮合環化合物が提供される:
【化1】

前記化学式(1)で、R1ないしR11は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C60アルキル基、置換または非置換のC2−C60アルケニル基、置換または非置換のC2−C60アルキニル基、置換または非置換のC1−C60アルコキシ基、置換または非置換のC3−C60シクロアルキル基、置換または非置換のC5−C60アリール基、置換または非置換のC5−C60アリールオキシ基、置換または非置換のC5−C60アリールチオ基、置換または非置換のC2−C60ヘテロアリール基、−N(R21)(R22)、または−Si(R23)(R24)(R25)であり、L1及びL2は互いに独立に、置換または非置換のC5−C60アリーレン基、あるいは置換または非置換のC2−C60ヘテロアリーレン基であり、a及びbは互いに独立に、0ないし5の整数であり、R21ないしR25は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C60アルキル基、置換または非置換のC2−C60アルケニル基、置換または非置換のC2−C60アルキニル基、置換または非置換のC1−C60アルコキシ基、置換または非置換のC3−C60シクロアルキル基、置換または非置換のC5−C60アリール基、置換または非置換のC5−C60アリールオキシ基、置換または非置換のC5−C60アリールチオ基、あるいは置換または非置換のC2−C60ヘテロアリール基である。
本発明の他の側面によれば、第1電極と、前記第1電極に対向した第2電極と、前記第1電極と前記第2電極との間に介在された第1層と、を含み、前記第1層が、前記縮合環化合物を1種以上含む有機発光素子が提供される。
【発明の効果】
【0006】
本発明による有機発光素子は、低駆動電圧、高輝度、高効率及び長寿命を有することができる。
【図面の簡単な説明】
【0007】
【図1】一具現例による有機発光素子の構造を概略的に示した図面である。
【発明を実施するための形態】
【0008】
本発明の一具現例による縮合環化合物は、下記化学式(1)で表示される:
【化2】

前記化学式(1)で、R1ないしR11は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C60アルキル基、置換または非置換のC2−C60アルケニル基、置換または非置換のC2−C60アルキニル基、置換または非置換のC1−C60アルコキシ基、置換または非置換のC3−C60シクロアルキル基、置換または非置換のC5−C60アリール基、置換または非置換のC5−C60アリールオキシ基、置換または非置換のC5−C60アリールチオ基、置換または非置換のC2−C60ヘテロアリール基、−N(R21)(R22)、または−Si(R23)(R24)(R25)でありうる。
【0009】
例えば、化学式(1)で、前記R1ないしR11は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基、ペントキシ基、置換または非置換のフェニル基、置換または非置換のペンタレニル基(pentalenyl)、置換または非置換のインデニル基(indenyl)、置換または非置換のナフチル基(naphthyl)、置換または非置換のアズレニル基(azulenyl)、置換または非置換のヘプタレニル基(heptalenyl)、置換または非置換のインダセニル基(indacenyl)、置換または非置換のアセナフチル基(acenaphthyl)、置換または非置換のフルオレニル基(fluorenyl)、置換または非置換のフェナレニル基(phenalenyl)、置換または非置換のフェナントレニル基(phenanthrenyl)、置換または非置換のアントリル基(anthryl)、置換または非置換のフルオランテニル基(fluoranthenyl)、置換または非置換のトリフェニレニル基(triphenylenyl)、置換または非置換のピレニル基(pyrenyl)、置換または非置換のクリセニル基(chrysenyl)、置換または非置換のナフタセニル基(naphthacenyl)、置換または非置換のピセニル基(picenyl)、置換または非置換のペリレニル基(perylenyl)、置換または非置換のペンタセニル基(pentacenyl)、置換または非置換のヘキサセニル基(hexacenyl)、置換または非置換のピロリル基(pyrrolyl)、置換または非置換のピラゾリル基(pyrazolyl)、置換または非置換のイミダゾリル基(imidazolyl)、置換または非置換のイミダゾリニル基(imidazolinyl)、置換または非置換のイミダゾピリジニル基(imidazopyridinyl)、置換または非置換のイミダゾピリミジニル(imidazopyrimidinyl)、置換または非置換のピリジニル基(pyridinyl)、置換または非置換のピラジニル基(pyrazinyl)、置換または非置換のピリミジニル基(pyrimidinyl)、置換または非置換のインドリル基(indolyl)、置換または非置換のプリニル基(purinyl)、置換または非置換のキノリニル基(quinolinyl)、置換または非置換のフタラジニル基(phthalazinyl)、置換または非置換のインドリジニル基(indolizinyl)、置換または非置換のナフチリジニル基(naphthyridinyl)、置換または非置換のキナゾリニル基(quinazolinyl)、置換または非置換のシンノリニル基(cinnolinyl)、置換または非置換のインダゾリル基(indazolyl)、置換または非置換のカルバゾリル基(carbazolyl)、置換または非置換のフェナジニル基(phenazinyl)、置換または非置換のフェナントリジニル基(phenanthridinyl)、置換または非置換のピラニル基(pyranyl)、置換または非置換のクロメニル基(chromenyl)、置換または非置換のフラニル基、置換または非置換のベンゾフラニル基(benzofuranyl)、置換または非置換のチオフェニル基(thiophenyl)、置換または非置換のベンゾチオフェニル基(benzothiophenyl)、置換または非置換のイソチアゾリル基(isothiazolyl)、置換または非置換のベンゾイミダゾリル基(benzoimidazolyl)、置換または非置換のイソキサゾリル基(isoxazolyl)、置換または非置換のジベンゾチオフェニル基(dibenzothiophenyl)、置換または非置換のジベンゾフラニル基(dibenzofuranyl)、置換または非置換のトリアジニル基(triazinyl)、置換または非置換のオキサジアゾリル基(oxadiazolyl)、または−N(R21)(R22)であるが、これらに限定されるものではない。
【0010】
例えば、前記化学式(1)で、前記R1ないしR11は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C10アルキル基、置換または非置換のC2−C10アルケニル基、置換または非置換のC2−C10アルキニル基、置換または非置換のC1−C10アルコキシ基、及び下記化学式2Aないし2Qで表される基のうち一つであるが、これらに限定されるものではない。
【化3】

【化4】

前記化学式2Aないし2Qで、Y1ないしY6は互いに独立に、=N−または=C(Z11)−であり、T1及びT2は互いに独立に、−S−、−O−、−N(Z12)−または−C(Z13)(Z14)−であってもよい。
【0011】
一方、前記化学式2Aないし2Qで、Z1ないしZ4、及びZ11ないしZ14は互いに独立に、水素;重水素;ハロゲン原子;ヒドロキシル基;シアノ基;ニトロ基;カルボン酸基;C1−C60アルキル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC1−C60アルキル基;C2−C60アルケニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC2−C60アルケニル基;C2−C60アルキニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC2−C60アルキニル基;C1−C60アルコキシ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC1−C60アルコキシ基;C3−C60シクロアルキル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC3−C60シクロアルキル基;C5−C60アリール基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリール基;C5−C60アリールオキシ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリールオキシ基;C5−C60アリールチオ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリールチオ基;C2−C60ヘテロアリール基;または重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC2−C60ヘテロアリール基であってもよい。
【0012】
例えば、前記Z1ないしZ4、及びZ11ないしZ14は互いに独立に、水素;重水素;ハロゲン原子;ヒドロキシル基;シアノ基;メチル基;エチル基;プロピル基;ブチル基;ペンチル基;エテニル基;プロペニル基;ブテニル基;ペンテニル基;アセチル基;メトキシ基;エトキシ基;プロポキシ基;ブトキシ基;ペントキシ基;フェニル基;ナフチル基;フルオレニル基;フェナントレニル基;アントリル基;ピレニル基;クリセニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基及びペントキシ基のうち一つ以上で置換された、フェニル基、ナフチル基、フルオレニル基、フェナントレニル基、アントリル基、ピレニル基及びクリセニル基;カルバゾリル基;イミダゾリル基;イミダゾリニル基;イミダゾピリジニル基;イミダゾピリミジニル基;ピリジニル基;ピリミジニル基;トリアジニル基;キノリニル基;及び重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基及びペントキシ基のうち一つ以上で置換された、カルバゾリル基、イミダゾリル基、イミダゾリニル基、イミダゾピリジニル基、イミダゾピリミジニル基、ピリジニル基、ピリミジニル基、トリアジニル基及びキノリニル基;のうち一つであるが、これらに限定されるものではない。
【0013】
前記化学式2Aないし2Qで、pは、1ないし9の整数であり、qは、1ないし7の整数であり、rは、1ないし3の整数であり、sは1、ないし4の整数であるが、これらに限定されるものではない。
【0014】
pが2以上である場合、2以上のZ1は、互いに同一であったり異なりもし、qが2以上である場合、2以上のZ2は、互いに同一であったり異なりもし、rが2以上である場合、2以上のZ3は、互いに同一であったり異なりもし、sが2以上である場合、2以上のZ4は、互いに同一であったり異なりもする。
【0015】
例えば、前記R1ないしR11は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C10アルキル基、C1−C10アルコキシ基及び下記化学式3Aないし3Tで表される基のうち一つであるが、これらに限定されるものではない。
【化5】

【化6】

前記化学式3Aないし3Tで、Y1ないしY6、T1及びT2についての詳細な説明は、前述のところを参照する。前記化学式3Aないし3Tで、Z1a、Z1b、Z1c、Z1d、Z2、Z2a、Z2b、Z2c、Z3、Z3a、Z3b、Z11、Z12、Z13及びZ14についての詳細な説明は、前記Z1についての説明を参照する。
【0016】
前記化学式(1)で、L1及びL2は互いに独立に、置換または非置換のC5−C60アリーレン基、あるいは置換または非置換のC2−C60ヘテロアリーレン基であってもよい。
例えば、前記L1及びL2は互いに独立に、置換または非置換のフェニレン基、置換または非置換のペンタレニレン基、置換または非置換のインデニレン基、置換または非置換のナフチレン基、置換または非置換のアズレニレン基、置換または非置換のヘプタレニレン基、置換または非置換のインダセニレン基、置換または非置換のアセナフチレン基、置換または非置換のフルオレニレン基、置換または非置換のフェナレニレン基、置換または非置換のフェナントレニレン基、置換または非置換のアントリレン基、置換または非置換のフルオランテニレン基、置換または非置換のトリフェニレニレン基、置換または非置換のピレニレン基、置換または非置換のクリセニレン基、置換または非置換のナフタセニレン基、置換または非置換のピセニレン基、置換または非置換のペリレニレン基、置換または非置換のペンタセニレン基、置換または非置換のヘキサセニレン基、置換または非置換のピロリレン基、置換または非置換のピラゾリレン基、置換または非置換のイミダゾリレン基、置換または非置換のイミダゾリニレン基、置換または非置換のイミダゾピリジニレン基、置換または非置換のイミダゾピリミジニレン基、置換または非置換のピリジニレン基、置換または非置換のピラジニレン基、置換または非置換のピリミジニレン基、置換または非置換のインドリレン基、置換または非置換のプリニレン基、置換または非置換のキノリニレン基、置換または非置換のプタラジニレン基、置換または非置換のインドリジニレン基、置換または非置換のナフチリジニレン基、置換または非置換のキナゾリニレン基、置換または非置換のシンノリニレン基、置換または非置換のインダゾリレン基、置換または非置換のカルバゾリレン基、置換または非置換のフェナジニレン基、置換または非置換のフェナントリジニレン基、置換または非置換のピラニレン基、置換または非置換のクロメニレン基、置換または非置換のフラニル基、置換または非置換のベンゾフラニレン基、置換または非置換のチオフェニレン基、置換または非置換のベンゾチオフェニレン基、置換または非置換のイソチアゾリレン基、置換または非置換のベンゾイミダゾリレン基、置換または非置換のイソキサゾリレン基、置換または非置換のジベンゾチオフェニレン基、置換または非置換のジベンゾフラニレン基、置換または非置換のトリアジニレン基、あるいは置換または非置換のオキサジアゾリレン基であってもよいが、これらに限定されるものではない。
【0017】
例えば、前記L1及びL2は、下記化学式4Aないし4Oのうちいずれかで表される基の一つであってもよい。
【化7】

【化8】

前記化学式4Aないし4Oで、Y11ないしY16は互いに独立に、=N−または=C(Z31)−であり、T11は−S−、−O−、−N(Z32)−または−C(Z33)(Z34)−であってもよい。
【0018】
Z21ないしZ23、及びZ31ないしZ34についての詳細な説明は、前記Z1についての説明を参照する。
前記tは、1ないし8の整数であり、uは、1ないし5の整数であってもよい。
tが2以上である場合、2以上のZ21は、互いに同一であったり異なりもし、uが2以上である場合、2以上のZ22は、互いに同一であったり異なりもする。
前記化学式(1)で、a及びbは、0ないし5の整数である。例えば、前記a及びbは、0、1または2であってもよい。
前記aまたはbが0である場合、R4またはR5は、ピレンの炭素と直接連結される。aが2以上である場合、2以上のL1は、互いに同一であったり異なりもし、bが2以上である場合、2以上のL2は、互いに同一であったり異なりもする。
【0019】
前記化学式(1)は、下記化学式1Aまたは1Bで表示されてもよいが、これらに限定されるものではない。
【化9】

前記化学式1A及び1Bで、R1ないしR5、L1、L2、a及びbは、前述のとおりである。
【0020】
例えば、前記1A及び1Bで、R1ないしR3は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基、ペントキシ基、置換または非置換のフェニル基、置換または非置換のナフチル基、置換または非置換のフルオレニル基、置換または非置換のフェナントレニル基、置換または非置換のアントリル基、置換または非置換のピレニル基、置換または非置換のクリセニル基、置換または非置換のピロリル基、置換または非置換のピラゾリル基、置換または非置換のイミダゾリル基、置換または非置換のイミダゾリニル基、置換または非置換のイミダゾピリジニル基、置換または非置換のイミダゾピリミジニル基、置換または非置換のピリジニル基、置換または非置換のピリミジニル基、置換または非置換のキノリニル基、置換または非置換のフラニル基、置換または非置換のベンゾフラニル基、置換または非置換のチオフェニル基、置換または非置換のベンゾチオフェニル基、置換または非置換のジベンゾチオフェニル基、置換または非置換のジベンゾフラニル基、置換または非置換のトリアジニル基、あるいは置換または非置換のオキサジアゾリル基であり、R4及びR5は、前記化学式2Aないし2Qに示される基のうちいずれか一つ(例えば、化学式3Aないし3Tに示される基のうちいずれか一つ)であり、L1及びL2は、前記化学式4Aないし4Oに示される基のうちいずれか一つであり、a及びbは、互いに独立に、0、1または2であるが、これらに限定されるものではない。
【0021】
前記化学式(1)は、ピレンとピリジンとが融合される(fused)ことにより、パイ共役システム(π−conjugation system)を有することにより、非発光性減衰(non-radiative decay)を低減させることができる。このような化学式(1)の化合物を採用した有機発光素子は、優秀な内部発光量子収率を有することができるが、前記有機発光素子の発光効率が向上しうる。
【0022】
前記化学式(1)で表示される化合物は、下記化合物1ないし46及び化合物101ないし157のうちいずれか一つであるが、これらに限定されるものではない。
【化10】

【化11】

【化12】

【化13】

【化14】

【0023】
本明細書で、非置換のC1−C60アルキル基(またはC1−C60アルキル基)の具体的な例としては、メチル、エチル、プロピル、イソブチル、sec−ブチル、ペンチル、iso−アミル、ヘキシルなどを挙げることができ、置換されたC1−C60アルキル基は、前記非置換のC1−C60アルキル基のうち一つ以上の水素原子が、重水素、ハロゲン原子、ヒドロキシル基、ニトロ基、シアノ基、アミノ基、アミジノ基、ヒドラジン、ヒドラゾン、カルボン酸基やその塩、スルホン酸基やその塩、リン酸やその塩、C1−C60アルキル基、C2−C60アルケニル基、C2−C60アルキニル基、C6−C60アリール基、C2−C60ヘテロアリール基、−N(Q1)(Q2)、または−Si(Q3)(Q4)(Q5)(ここで、Q1ないしQ5は、互いに独立に、水素、C1−C60アルキル基、C2−C60アルケニル基、C2−C60アルキニル基、C5−C60アリール基、またはC2−C60ヘテロアリール基である)で置換されたものである。
【0024】
本明細書で、非置換のC1−C60アルコキシ基(またはC1−C60アルコキシ基)は、−OA(ただしAは、前述のような非置換のC1−C60アルキル基である)の化学式を有し、その具体的な例としては、メトキシ、エトキシ、イソプロピルオキシなどがあり、それらアルコキシ基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C60アルキル基の場合と同様な置換基で置換可能である。
【0025】
本明細書で、非置換のC2−C60アルケニル基(またはC2−C60アルケニル基)は、前記非置換のC2−C60アルキル基の中間や末端に一つ以上の炭素二重結合を含有しているものを意味する。例としては、エテニル、プロペニル、ブテニルなどがある。それら非置換のC2−C60アルケニル基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C60アルキル基の場合と同様な置換基で置換可能である。
【0026】
本明細書で、非置換のC2−C60アルキニル基(またはC2−C60アルキニル基)は、前記定義されたようなC2−C60アルキル基の中間や末端に一つ以上の炭素三重結合を含有しているものを意味する。例としては、エチニル(ethynyl)、プロピニル(propynyl)などがある。それらアルキニル基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C60アルキル基の場合と同様な置換基で置換可能である。
【0027】
本明細書で、非置換のC5−C60アリール基は、一つ以上の芳香族環を含むC5−C60芳香族炭素環系を有する一価(monovalent)基を意味し、非置換のC5−C60アリーレン基は、一つ以上の芳香族環を含むC5−C60芳香族炭素環系を有する二価(divalent)基を意味する。前記アリール基及びアリーレン基が2以上の環を含む場合、2以上の環は、互いに融合されてもよい。前記アリール基及びアリーレン基のうち一つ以上の水素原子は、前述の置換されたC1−C60アルキル基の場合と同様な置換基で置換可能である。
【0028】
前記置換または非置換のC5−C60アリール基の例としては、フェニル基、C1−C10アルキルフェニル基(例えば、エチルフェニル基)、C1−C10アルキルビフェニル基(例えば、エチルビフェニル基)、ハロフェニル基(例えば、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基)、ジシアノフェニル基、トリフルオロメトキシフェニル基、o−,m−及びp−トリル基、o−,m−及びp−クメニル基、メシチル基、フェノキシフェニル基、(α,α−ジメチルベンゼン)フェニル基、(N,N’−ジメチル)アミノフェニル基、(N,N’−ジフェニル)アミノフェニル基、ペンタレニル基、インデニル基、ナフチル基、ハロナフチル基(例えば、フルオロナフチル基)、C1−C10アルキルナフチル基(例えば、メチルナフチル基)、C1−C10アルコキシナフチル基(例えば、メトキシナフチル基)、アントラセニル基、アズレニル基、ヘプタレニル基、アセナフチレニル基、フェナレニル基、フルオレニル基、アントラキノリル基、メチルアントリル基、フェナントリル基、トリフェニレニル基、ピレニル基、クリセニル基、エチル−クリセニル基、ピセニル基、ペリレニル基、クロロペリレニル基、ペンタフェニル基、ペンタセニル基、テトラフェニレニル基、ヘキサフェニル基、ヘキサセニル基、ルビセニル基、コロネリル基、トリナフチレニル基、ヘプタフェニル基、ヘプタセニル基、ピラントレニル基、オバレニル基などを挙げることができる。前記置換または非置換のC5−C60アリーレン基の例は、前記置換または非置換のC5−C60アリール基の例を参照して容易に認識されるであろう。
【0029】
本明細書で、非置換のC2−C60ヘテロアリール基は、N、O、PまたはSのうちから選択された1個以上のヘテロ原子を含み、残りの環原子がCである一つ以上の芳香族環からなる系を有する一価基を意味し、非置換のC2−C60ヘテロアリーレン基は、N、O、PまたはSのうちから選択された1個以上のヘテロ原子を含み、残りの環原子がCである一つ以上の芳香族環からなる系を有する二価基を意味する。ここで、前記ヘテロアリール基及びヘテロアリーレン基が2以上の環を含む場合、2以上の環は、互いに融合されてもよい。前記ヘテロアリール基及びヘテロアリーレン基のうち一つ以上の水素原子は、前述のC1−C60アルキル基の場合と同様な置換基で置換可能である。
【0030】
前記非置換のC2−C60ヘテロアリール基の例としては、ピラゾリル基、イミダゾリル基、オキサゾリル基、チアゾリル基、トリアゾリル基、テトラゾリル基、オキサジアゾリル基、ピリジニル基、ピリダジニル基、ピリミジニル基、トリアジニル基、カルバゾリル基、インドリル基、キノリニル基、イソキノリニル基、ベンゾイミダゾリル基、イミダゾピリジニル基、イミダゾピリミジニル基などを挙げることができる。前記非置換のC2−C60ヘテロアリーレン基の例は、前記置換または非置換のC2−C60アリーレン基の例を参照して容易に認識されるであろう。
【0031】
前記置換または非置換のC5−C60アリールオキシ基は、−OA2(ここでA2は、前記置換または非置換のC5−C60アリール基である)を指し、前記置換または非置換のC5−C60アリールチオ基は、−OA3(ここでA3は、前記置換または非置換のC5−C60アリール基である)を指す。
【0032】
前記化学式(1)で表される縮合環化合物は、公知の有機合成方法を利用して合成されてもよい。前記縮合環化合物の合成方法は、後述する実施例を参照して当業者に容易に認識されるであろう。
【0033】
前記化学式(1)で表される縮合環化合物は、有機発光素子に使われてもよい。従って、第1電極、前記第1電極に対向した第2電極、及び前記第1電極と前記第2電極との間に介在された第1層と、を含み、前記第1層が、前述のような化学式(1)で表示された縮合環化合物を含む有機発光素子が提供される。
【0034】
前記縮合環化合物は、単一物質または互いに異なる物質の混合物の形態で、前記第1層に含まれてもよい。すなわち、前記第1層は、1種以上の前記縮合環化合物を含むことができる。例えば、後述する実施例1の有機発光素子は、前記縮合環化合物として、化合物14(発光層に含まれ、蛍光ホストとしての役割を行う)だけを単一物質形態として含む。一方、後述する実施例7の有機発光素子は、前記縮合環化合物として、化合物14(発光層に含まれ、蛍光ホストとしての役割を行う)、及び化合物20(発光層に含まれて蛍光ドーパントとしての役割を行う)の混合物を含む。本明細書で、「前記第1層は、前記縮合環化合物は、単一物質または互いに異なる物質の混合物の形態で含む(または、前記第1層は、1種以上の前記縮合環化合物を含む)」という表現は、前述のところを参照し、当業者であるならば、容易に理解可能であろう。
【0035】
前記第1層は、正孔注入層、正孔輸送層、正孔注入機能及び正孔輸送機能を同時に有する機能層、電子阻止層、発光層、正孔阻止層、電子輸送層、電子注入層、並びに電子輸送機能及び電子注入機能を同時に有する機能層のうち少なくとも1層を含むことができる。
本明細書で、「第1層」は、有機発光素子のうち、第1電極と第2電極との間に介在された単一または複数の層を指す用語である。
【0036】
例えば、前記第1層は、発光層を含み、前記発光層に、前記縮合環化合物が含まれてもよい。前記発光層に含まれた縮合環化合物は、ホスト(リン光ホストまたは蛍光ホスト)またはドーパント(リン光ドーパントまたは蛍光ドーパント)の役割を行うことができる。例えば、前記発光層に含まれた縮合環化合物は、蛍光ホストの役割を行ったり(後述する実施例1など参照)、蛍光ドーパントの役割を行うことができる(後述する実施例3など参照)。
【0037】
前記発光層は、2種の互いに異なる縮合環化合物を含み、前記2種の互いに異なる縮合環化合物のうち一つは、ホスト(リン光ホストまたは蛍光ホスト)の役割を行い、他の一つは、ドーパント(リン光ドーパントまたは蛍光ドーパント)の役割を行うことができる。例えば、前記発光層は、2種の互いに異なる縮合環化合物を含み、前記2種の互いに異なる縮合環化合物のうち一つは、蛍光ホストの役割を行い、他の一つは、蛍光ドーパントの役割を行うことができる(後述する実施例7など参照)。
【0038】
前記第1層は、前述のような発光層以外に、電子輸送層をさらに含むことができる。このとき、前記電子輸送層は、前記発光層に含まれた縮合環化合物とは、同一であるか異なる前記縮合環化合物を含むことができる(後述する実施例8参照)。
【0039】
一方、前記第1層は、発光層を含み、前記発光層は、アントラセン系化合物、スチリル系化合物及びアリールアミノ系化合物のうち一つ以上を含むことができる。
前記発光層は、赤色、緑色または青色の発光層であってもよい。例えば、前記発光層は、青色発光層であってもよい。このとき、前記縮合環化合物は、青色ホスト及び/または青色ドーパントとして使われ、高効率、高輝度、高色純度及び長寿命を有する有機発光素子を提供することができる。
【0040】
また、前記第1層は、電子輸送層を含み、前記電子輸送層に、前記縮合環化合物が含まれてもよい(後述する実施例5など参照)。ここで、前記電子輸送層は、前記縮合環化合物以外に、金属含有化合物をさらに含むことができる。
【0041】
また、前記第1層は、前記正孔注入層、前記正孔輸送層、並びに前記正孔注入機能及び正孔輸送機能を同時に有する機能層のうち少なくとも1層を含み、前記正孔注入層、前記正孔輸送層、並びに前記正孔注入機能及び正孔輸送機能を同時に有する機能層のうち少なくとも1層は、通常の正孔注入物質、正孔輸送物質、及び正孔注入及び輸送の機能を同時に行う物質以外に、電荷生成物質をさらに含むことができる。
【0042】
図1は、本発明の一具現例による有機発光素子10の断面図を概略的に図示したものである。以下、図1を参照しつつ、本発明の一具現例による有機発光素子の構造及び製造方法について説明すれば、次の通りである。
有機発光素子10は、基板11、第1電極13第1層15及び第2電極17を順に具備する。
【0043】
前記基板11としては、一般的な有機発光素子で使われる基板を使用することができるが、機械的強度、熱的安定性、透明性、表面平滑性、取扱容易性及び防水性にすぐれるガラス基板または透明プラスチック基板を使用することができる。
【0044】
前記第1電極13は、基板上部に、第1電極用物質を蒸着法またはスパッタリング法などを利用して提供することによって形成されてもよい。前記第1電極13がアノードである場合、正孔注入が容易になるように、第1電極用物質は、大きい仕事関数を有する物質のうちから選択されてもよい。前記第1電極13は、反射型電極または透過型電極であってもよい。第1電極用物質としては、透明であって伝導性にすぐれる酸化インジウムスズ(ITO)、酸化インジウム亜鉛(IZO)、酸化スズ(SnO2)、酸化亜鉛(ZnO)などを利用することができる。または、マグネシウム(Mg)、アルミニウム(Al)、アルミニウム−リチウム(Al−Li)、カルシウム(Ca)、マグネシウム−インジウム(Mg−In)、マグネシウム−銀(Mg−Ag)などを利用すれば、前記第1電極13を反射型電極として形成することもできる。
【0045】
前記第1電極13の上部には、第1層15が備わっている。
前記第1層15は、正孔注入層、正孔輸送層、発光層、正孔阻止層、電子輸送層及び電子注入層を含むことができる。
【0046】
正孔注入層(HIL)は、前記第1電極13上部に、真空蒸着法、スピンコーティング法、キャスト法、LB(Langmuir-Blodgett)法のような多様な方法を利用して形成されてもよい。
真空蒸着法によって正孔注入層を形成する場合、その蒸着条件は、正孔注入層の材料として使用する化合物、目的とする正孔注入層の構造及び熱的特性などによって異なるが、例えば、蒸着温度約100ないし約500℃、真空度約10−8ないし約10−3torr、蒸着速度約0.01ないし約100Å/secの範囲で選択されてもよいが、これに限定されるものではない。
【0047】
スピンコーティング法によって正孔注入層を形成する場合、そのコーティング条件は、正孔注入層の材料として使用する化合物、目的とする正孔注入層の構造及び熱的特性によって異なるが、約2,000rpmないし約5,000rpmのコーティング速度、コーティング後の溶媒除去のための熱処理温度は、約80℃ないし200℃の温度範囲で選択されてもよいが、これらに限定されるものではない。
【0048】
正孔注入物質としては、前記化学式(1)で表示される縮合環化合物及び/または公知の正孔注入物質を使用できるが、公知の正孔注入物質としては、例えば、N,N’−ジフェニル−N,N’−ビス−[4−(フェニル−m−トリル−アミノ)−フェニル]−ビフェニル−4,4’−ジアミン(DNTPD)、銅フタロシアニンなどのフタロシアニン化合物、4,4’,4”−トリス(3−メチルフェニルフェニルアミノ)トリフェニルアミン(m−MTDATA)、N,N’−ジ(1−ナフチル)−N,N’−ジフェニルベンジジン(NPB)、4,4’,4”−トリス{N,Nジフェニルアミノ}トリフェニルアミン(TDATA)、4,4’−ビス[N−(ナフチル)−N−フェニル−アミノ]ビフェニル(2−TNATA)、ポリアニリン/ドデシルベンゼンスルホン酸(Pani/DBSA)、ポリ(3,4−エチレンジオキシチオフェン)/ポリ(4−スチレンスルホネート)(PEDOT/PSS)、ポリアニリン/カンファースルホン酸(Pani/CSA)、またはポリアニリン/ポリ(4−スチレンスルホネート)(PANI/PSS)などを使用できるが、これらに限定されるもののではない。
【化15】

【0049】
前記正孔注入層の厚みは、約100Åないし約10,000Å、例えば、約100Åないし約1,000Åであってもよい。前記正孔注入層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、満足すべき正孔注入特性を得ることができる。
【0050】
次に、前記正孔注入層の上部に、真空蒸着法、スピンコーティング法、キャスト法、LB法のような多様な方法を利用して、正孔輸送層(HTL)を形成することができる。真空蒸着法及びスピンコーティング法によって正孔輸送層を形成する場合、その蒸着条件及びコーティング条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択されてもよい。
【0051】
正孔輸送物質としては、前述のような化学式(1)の縮合環化合物及び/または公知の正孔輸送物質を使用することができる。公知の正孔輸送材料としては、例えば、N−フェニルカルバゾール,ポリビニルカルバゾールなどのカルバゾール誘導体、N,N’−ビス(3−メチルフェニル)−N,N’−ジフェニル−[1,1−ビフェニル]−4,4’−ジアミン(TPD)、4,4’,4”−トリス(N−カルバゾリル)トリフェニルアミン(TCTA)、N,N’−ジ(1−ナフチル)−N,N’−ジフェニルベンジジン(NPB)などを挙げることができるが、これらに限定されるものではない。
【化16】

【0052】
前記正孔輸送層の厚みは、約50Åないし約1,000Å、例えば、約100Åないし約800Åであってもよい。前記正孔輸送層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、満足すべき正孔輸送特性を得ることができる。
【0053】
または、正孔注入層と正孔輸送層との代わりに、正孔注入機能と正孔輸送機能とを同時に有する機能層を形成することができる。前記正孔注入機能及び正孔輸送機能を同時に有する機能層物質は、公知の材料のうちから選択されてもよい。
【0054】
前記正孔注入層、正孔輸送層、並びに正孔注入機能及び正孔輸送機能を同時に有する機能層のうち少なくとも1層は、前述のような化学式(1)の縮合環化合物、公知の正孔注入物質、公知の正孔輸送物質、及び/または正孔注入機能及び正孔輸送機能を同時に有する物質以外に、膜の導電性などを向上させるために、電荷生成物質をさらに含むことができる。
【0055】
前記電荷生成物質は、例えば、p−ドーパントであってもよい。前記p−ドーパントの非制限的な例としては、テトラシアノキノンジメタン(TCNQ)、及び2,3,5,6−テトラフルオロ−テトラシアノ−1,4−ベンゾキノンジメタン(F4TCNQ)のようなキノン誘導体;タングステン酸化物及びモリブデン酸化物のような金属酸化物;下記化合物200のようなシアノ基含有化合物;などを挙げることができるが、これらに限定されるものではない。
【化17】

【0056】
前記正孔注入層、前記正孔輸送層、または前記正孔注入機能及び正孔輸送機能を同時に有する機能層が、前記電荷生成物質をさらに含む場合、前記電荷生成物質は、前記層中に均一に(homogeneous)分散されたり、または不均一に分布されていてもよい。
【0057】
前記正孔輸送層、または正孔注入機能及び正孔輸送機能を同時に有する機能層の上部に、真空蒸着法、スピンコーティング法、キャスト法、LB法のような方法を利用して、発光層(EML)を形成することができる。真空蒸着法及びスピンコーティング法によって発光層を形成する場合、その蒸着条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択されてもよい。
【0058】
前記発光層物質としては、前記化学式(1)の縮合環化合物及び/または公知の発光材料(ホスト及びドーパントをいずれも含む)のうち1種以上の物質を使用することができる。
公知のホストの例としては、トリス(8−キノリノラト)アルミニウム(Alq3)、4,4’−N,N’−ジカルバゾール−ビフェニル(CBP)、ポリ(n−ビニルカルバゾール)(PVK)、9,10−ジ(ナフタレン−2−イル)アントラセン(ADN)、TCTA、1,3,5−トリス(N−フェニルベンズイミダゾール−2−イル)ベンゼン(TPBI)、3−tert−ブチル−9,10−ジ(ナフト−2−イル)アントラセン(TBADN)、E3、ジスチリルアリーレン(DSA)などを使用することができるが、これらに限定されるものではない。
【化18】

【0059】
前記ドーパントは、蛍光ドーパント及びリン光ドーパントのうち少なくとも一つであってもよい。前記リン光ドーパントは、Ir、Pt、Os、Re、Ti、Zr、Hf、またはそれらのうち2以上の組み合わせを含む有機金属錯体であってもよいが、これらに限定されるものではない。
【0060】
一方、公知の赤色ドーパントとして、PtOEP、Ir(piq)3、Btp2Ir(acac)などを利用することができるが、これらに限定されるものではない。
【化19】

【0061】
また、公知の緑色ドーパントとしては、Ir(ppy)3(ppy=フェニルピリジン)、Ir(ppy)2(acac)、Ir(mpyp)3、10−(2−ベンゾチアゾリル)−2,3,6,7−テトラヒドロ−1,1,7,7−テトラメチル−1H,5H,11H−(1)ベンゾピロピラノ(6,7−8−i,j)キノリジン−11−オン(C545T)などを利用することができるが、これらに限定されるものではない。
【化20】

【0062】
一方、公知の青色ドーパントとしては、F2Irpic、(F2ppy)2Ir(tmd)、Ir(dfppz)3、ter−フルオレン、4,4’−ビス(4−ジフェニルアミノスチリル)ビフェニル(DPAVBi)、2,5,8,11−テトラ−tert−ブチルペリレン(TBPe)、1,4−ビス−(2,2−ジフェニルビニル)ビフェニル(DPVBi)などを利用することができるが、これらに限定されるものではない。
【化21】

【0063】
前記発光層がホスト及びドーパントを含む場合、ドーパントの含有量は、一般的に、ホスト約100重量部を基準として、約0.01ないし約15重量部の範囲で選択されてもよいが、これに限定されるものではない。
【0064】
前記発光層の厚みは、約100Åないし約1,000Å、例えば、約200Åないし約600Åであってもよい。前記発光層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な発光特性を示すことができる。
【0065】
発光層に、リン光ドーパントを共に使用する場合には、三重項励起子または正孔が電子輸送層に拡散する現象を防止するために、前記正孔輸送層と発光層との間に、真空蒸着法、スピンコーティング法、キャスト法、LB法のような方法を利用して、正孔阻止層(HBL)を形成することができる。真空蒸着法及びスピンコーティング法によって正孔阻止層を形成する場合、その条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択される。公知の正孔阻止材料も使用されてもよいが、その例としては、オキサジアゾール誘導体やトリアゾール誘導体やフェナントロリン誘導体などを挙げることができる。
【0066】
前記正孔阻止層の厚みは、約50Åないし約1,000Å、例えば、約100Åないし約300Åであってもよい。前記正孔阻止層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な正孔阻止特性を得ることができる。
【0067】
次に、電子輸送層(ETL)を、真空蒸着法、またはスピンコーティング法、キャスト法などの多様な方法を利用して形成する。真空蒸着法及びスピンコーティング法によって電子輸送層を形成する場合、その条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択されてもよい。前記電子輸送層材料としては、前記化学式(1)の縮合環化合物、または電子注入電極(カソード)から注入された電子を安定して輸送する機能を行うものであって、公知の電子輸送物質を利用することができる。公知の電子輸送物質の例としては、キノリン誘導体、特にAlq3、1,2,4−トリアゾール誘導体(TAZ)、ビス(2−メチル−8−キノリノラト)−(p−フェニルフェノラート)−アルミニウム(BAlq)、ベリリウムビス(ベンゾキノリン−10−オレート)(Bebq2)のような公知の材料を使用することができるが、これらに限定されるものではない。
【化22】

【0068】
前記電子輸送層の厚みは、約100Åないし約1,000Å、例えば、約150Åないし約500Åであってもよい。前記電子輸送層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、満足すべき電子輸送特性を得ることができる。
または前記電子輸送層は、電子輸送性有機化合物及び金属含有物質を含むことができる。前記電子輸送性有機化合物の非制限的な例としては、9,10−ジ(ナフタレン−2−イル)アントラセン(AND)、及び下記化合物201及び202のようなアントラセン系化合物などを挙げることができるが、これらに限定されるものではない。
【化23】

【0069】
前記金属含有物質はLi錯体を含むことができる。前記Li錯体の非制限的な例としては、リチウムキノレート(LiQ)または下記化合物203などを挙げることができる。
【化24】

【0070】
また電子輸送層の上部に、負極から電子の注入を容易にする機能を有する物質である電子注入層(EIL)が積層されてもよいが、これは特別に材料を制限するものではない。
前記電子注入層形成材料としては、LiF、NaCl、CsF、Li2O、BaOのような電子注入層形成材料として、公知の任意の物質を利用することができる。前記電子注入層の蒸着条件は、使用する化合物によって異なるが、一般的に、正孔注入層の形成とほぼ同じ条件範囲のうちから選択されてもよい。
【0071】
前記電子注入層の厚みは、約1Åないし約100Å、約3Åないし約90Åであってもよい。前記電子注入層の厚みが前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、満足すべき電子注入特性を得ることができる。
【0072】
かような第1層15の上部には、第2電極17が備わっている。前記第2電極は、電子注入電極であるカソードであるが、このとき、前記第2電極形成用の金属としては、小さい仕事関数を有する金属、合金、電気伝導性化合物及びそれらの混合物を使用することができる。具体的な例としては、リチウム(Li)、マグネシウム(Mg)、アルミニウム(Al)、アルミニウム−リチウム(Al−Li)、カルシウム(Ca)、マグネシウム−インジウム(Mg−In)、マグネシウム−銀(Mg−Ag)などを薄膜に形成し、透過型電極を得ることができる。一方、前面発光素子を得るために、ITO、IZOを利用した透過型電極を形成できるなど、多様な変形が可能である。
【0073】
以下、合成例及び実施例を挙げ、本発明の一具現例による有機発光素子について、さらに具体的に説明するが、本発明が、下記の合成例及び実施例に限定されるものではない。
[実施例]
合成例1:化合物14の合成
下記反応式によって化合物14を合成した。
【化25】

中間体1−aの合成
1−アミノ−6−ブロモピレン10g(33.8mmol)、70%硫酸水溶液10gをニトロベンゼン8gに入れて混合し、110℃に上げた後、酸化剤であるグリセロール10gを滴加した後、110℃で10時間撹拌した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体1−a 7.1g(収率71%)を収得した。生成された化合物をLC−MS(liquid chromatography-mass spectroscopy)を介して確認した。
C19H10Br1N1:M+:331.00
中間体1−bの合成
中間体1−a 5g(15mmol)、ビス(ピナコラート)ジボロン(bis(pinacolato)diboron)4.6g(18mmol)、KOAc(酢酸カリウム)4.42g(45mmol)、[1,1’−ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(II)(Pd(dppf)Cl2)0.04g(0.06mmol)を、脱ガス(degassed)N,N‐ジメチルホルムアミド(DMF)100mLと混合させ、10時間撹拌した。そこから収得した混合物を、水100mLとジクロロメタン100mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて得られた残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体1−b 5.18g(収率91%)を収得した。生成された化合物をLC−MSを介して確認した。
C25H22B1N1O2:M+379.17
化合物14の合成
中間体1−b 2g(5.2mmol)、中間体1−c 1.9g(6.2mmol)、テトラキス(トリフェニルホスフィン)パラジウム(O)(Pd(PPh3)4)0.18g(0.16mmol)に、2M NaOH水溶液20mLとTHF 20mLとを混合し、80℃で10時間還流した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、1.8g(収率73%)の化合物14を収得した。生成された化合物をLC−MSとNMR(nuclear magnetic resonance)とを介して確認した。
C37H23N1:M+482.19
1H NMR(CDCl3,400MHz)δ(ppm)9.07(d,1H)8.90(m,1H)8.36(d,1H)8.29(s,1H)8.26−8.23(m,1H)8.20(d,1H)8.14(d,1H)8.01(d,1H)7.96(d,1H)7.85(m,2H)7.72−7.69(m,5H)7.49−7.39(m,7H)
【0074】
合成例2:化合物20の合成
下記反応式によって、化合物20を合成した:
【化26】

合成例1に記載されたところによって合成された中間体1−a 2g(6.0mmol)、中間体2−a 10.15g(60.0mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(O)(Pd2(dba)3)0.16g(0.18mmol)、(2,4,6−トリ−tert−ブチルフェニル)ホスフィン0.05g(0.18mmol)、ナトリウムt−ブトキシド0.7g(7.2mmol)を、トルエン100mLに入れ、100℃で10時間還流した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出して収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、化合物20 1.19g(収率47%)を得た。生成された化合物をLC−MSとNMRとを介して確認した。
C31H20N2:M+420.16
1H NMR(CDCl3,400MHz)δ(ppm)8.91(m,1H)8.69(d,1H)8.27−8.24(m,2H)8.08(d,1H)8.03(d,1H)7.91−7.02(m,14H)
【0075】
合成例3:化合物22の合成
下記反応式によって化合物22を合成した:
【化27】

中間体1−b 2g(5.2mmol)、中間体3−a 2.23g(6.2mmol)、Pd(PPh3)4 0.18g(0.16mmol)を、2M NaOH水溶液20mLとTHF 20mLとに入れて80℃で10時間還流した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出して収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、化合物22 1.7g(収率62%)を得た。生成された化合物をLC−MSとNMRとを介して確認した。
C33H23N2:M+532.18
1H NMR(CDCl3,400MHz)δ(ppm)9.07(d,1H)8.91(m,1H)8.63(d,1H)8.49(s,1H)8.47−8.44(m,1H)8.36(d,1H)8.23(d,2H)8.19(d,1H)7.84−7.81(m,2H)7.75−7.71(m,1H)7.44−7.23(m,8H)6.99(m,2H)
【0076】
合成例4:化合物30の合成
下記反応式によって化合物30を合成した:
【化28】

中間体1−b 2g(5.2mmol)、中間体4−a 2.0g(6.2mmol)、Pd(PPh3)4 0.18g(0.16mmol)を、2M NaOH水溶液20mLとTHF 20mLとに入れて80℃で10時間還流した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出して収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発して収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、化合物30 1.98g(収率77%)を得た。生成された化合物をLC−MSとNMRとを介して確認した。
C37H22N2:M+494.18
1H NMR(CDCl3,400MHz)δ(ppm)9.07(d,1H)8.91−8.90(m,1H)8.42(d,1H)8.29(s,1H)8.26−8.23(m,1H)8.17(d,1H)8.12−8.10(m,2H)8.04−8.00(m,2H)7.89(d,1H)7.61−7.57(m,2H)7.45−7.25(m,9H)
【0077】
合成例5:化合物31の合成
下記反応式によって化合物31を合成した:
【化29】

中間体1−b 2g(5.2mmol)、中間体5−a 2.02g(6.2mmol)、Pd(PPh3)4 0.18g(0.16mmol)を、2M NaOH水溶液20mLとTHF 20mLに入れて80℃で10時間還流した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出して収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発して得られた残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、化合物31 2.1g(収率81%)を得た。生成された化合物をLC−MSとNMRとを介して確認した。
C36H23N3:M+498.19
1H NMR(CDCl3,400MHz)δ(ppm)9.07(d,1H)8.91(m,1H)8.46(m,4H)8.42(d,1H)8.29(s,1H)8.25(m,1H)8.16(d,1H)8.04−8.00(m,2H)7.89(d,1H)7.52−7.49(m,2H)7.45−7.41(m,1H)7.25−7.21(m,2H)7.11(m,4H)
【0078】
合成例6:化合物43の合成
下記反応式によって化合物43を合成した:
【化30】

中間体1−b 2g(5.2mmol)、中間体6−a 2.16g(6.2mmol)、Pd(PPh3)4 0.18g(0.16mmol)を、2M NaOH水溶液20mLとTHF 20mLに入れて80℃で10時間還流した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出して収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発して得られた残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、化合物43 1.84g(収率68%)を得た。生成された化合物は、LC−MSとNMRとを介して確認した。
C38H23N3:M+521.19
1H NMR(CDCl3,400MHz)δ(ppm)9.07(d,1H)8.90(m,1H)8.42(d,1H)8.29(s,1H)8.26−8.22(m,1H)8.20−8.18(m,2H)8.11(d,1H)8.03(m,2H)7.89(d,1H)7.81−7.78(m,3H)7.66−7.64(m,1H)7.58−7.56(m,2H)7.45−7.20(m,6H)
【0079】
実施例1
コーニング(Corning)15Ω/cm2(1,200Å)ITOガラス基板を50mmx50mmx0.7mmサイズに切り、イソプロピルアルコールと純水とを利用し、それぞれ5分間超音波洗浄した後、30分間紫外線を照射してオゾンに露出させて洗浄し、真空蒸着装置にこのガラス基板を設けた。
前記ガラス基板のITO電極(アノード)上部に、4,4’−ビス[N−(ナフチル)−N−フェニル−アミノ]ビフェニル(2−TNATA)を蒸着し、600Å厚の正孔注入層を形成した後、前記正孔注入層の上部に、4,4’−ビス[N−(1−ナフチル)−N−フェニルアミノ]ビフェニル(NPB)を蒸着し、300Å厚の正孔輸送層を形成した。
次に、前記正孔輸送層の上部に、化合物14及び1,4−ビス−(2,2−ジフェニルビニル)ビフェニル(DPVBi)を、重量比98:2で共蒸着し、300Å厚の発光層を形成した。
この後、前記発光層の上部にAlq3を蒸着し、300Å厚の電子輸送層を形成し、前記電子輸送層の上部にLiFを蒸着し、10Å厚の電子注入層を形成し、前記電子注入層の上部にAlを蒸着し、3,000Å厚の第2電極(カソード)を形成することによって、有機発光素子を製造した。
【0080】
実施例2
発光層の形成時に、前記化合物14の代わりに、化合物30を利用したという点を除いては、実施例1と同じ方法を利用して、有機発光素子を製作した。
【0081】
実施例3
発光層の形成時に、前記化合物14の代わりに、9,10−ジ(ナフタレン−2−イル)アントラセン(ADN)を使用し、DPVBiの代わりに、化合物20を利用したという点を除いては、実施例1と同じ方法を利用して、有機発光素子を製作した。
【0082】
実施例4
発光層の形成時に、前記化合物20の代わりに、化合物22を利用したという点を除いては、実施例3と同じ方法を利用して、有機発光素子を製作した。
【0083】
実施例5
発光層の形成時に、前記化合物14の代わりにADNを使用し、電子輸送層の形成時に、Alq3の代わりに、化合物31を利用したという点を除いては、実施例1と同じ方法を利用して、有機発光素子を製作した。
【0084】
実施例6
電子輸送層の形成時に、前記化合物31の代わりに、化合物43を利用したという点を除いては、実施例5と同じ方法を利用して、有機発光素子を製作した。
【0085】
実施例7
発光層の形成時に、DPVBiの代わりに、化合物20を利用したという点を除いては、実施例1と同じ方法を利用して、有機発光素子を製作した。
【0086】
実施例8
発光層の形成時に、化合物14の代わりに化合物30を利用し、DPVBiの代わりに化合物33を利用し、電子輸送層の形成時に、Alq3の代わりに、化合物31を利用したという点を除いては、実施例1と同じ方法を利用して、有機発光素子を製作した。
【0087】
比較例1
発光層の形成時に、前記化合物14の代わりに、公知の青色蛍光ホストであるANDを利用したことを除いては、実施例1と同じ方法を利用して、有機発光素子を製作した。
【0088】
評価1
実施例1ないし8と、比較例1との有機発光素子の駆動電圧、電流密度、輝度、発光色、効率及び半減寿命(@100mA/cm2)を、PR650 Spectroscan Source Measurement Unit.(PhotoResearch社製)を利用して評価した。その結果は、下記表1の通りである。
【表1】

前記表1によれば、実施例1ないし8の有機発光素子は、比較例1の有機発光素子に比べて、低駆動電圧、高輝度、高効率及び長寿命を有するということを確認することができる。
【0089】
合成例11:化合物101の合成
【化31】

中間体I−1の合成
1−ニトロピレン4.94g(20.0mmol)をジクロロメタン100mlに溶かした後、0℃でブロム(Br2)2.50ml(20.0mmol)を徐々に滴加した。そこから収得した混合物を常温で12時間撹拌した後、水60mLとチオ硫酸ナトリウム20%水溶液30mlとを添加し、ジクロロメタン80mLで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、ジクロロメタン/ヘキサン溶液で再結晶させ、中間体I−1 4.04g(収率62%)を得た。生成された化合物は、HR−MSで確認した。
C16H8BrNO2計算値:324.9738;実測値:324.9740
中間体I−2の合成
中間体I−1 4.04g(12.4mmol)をエタノール50mlに溶かした後、Fe 2.80g(50mmol)、0.1M HCl10mLを添加した。そこから収得した混合物を95℃で3時間撹拌した。反応液を常温に冷やした後、水100mLとジエチルエーテル100mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて得られた残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体I−2 2.75g(収率75%)を得た。生成された化合物は、HR−MSを介して確認した。
C16H10BrN計算値:294.9997;実測値295.0012
中間体I−3の合成
中間体I−2 2.75g(9.30mmol)と1,3−プロパンジオール353mg(4.65mmol)とを、メシチレン(mesitylene)10mlに溶かした後、空気中で、IrCl3・H2O 70mg(0.19mmol)、2,2’−ビス(ジフェニルホスフィノ)−1,1’−ビナフチル(BINAP)186mg(0.28mmol)及びNa2CO3 34mg(0.30mmol)の混合物を追加した。そこから収得した混合物を169℃で15時間撹拌した後、常温に冷やした後、溶媒を真空下で除去して収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体I−3 2.84g(収率92%)を得た。生成された化合物は、HR−MSで確認した。
C19H10BrN計算値:330.9997;実測値:331.0002
【化32】

中間体I−4の合成
4−ブロモトリフェニルアミン3.24g(10.0mmol)、ビス(ピナコラート)ジボロン2.54g(10.0mmol)、[1,1’−ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(II)(PdCl2(dppf)2)0.36g(0.5mmol)及びKOAc 2.94g(30.0mmol)を、ジメチルスルホキシド(DMSO)40mlに溶かした後、80℃で6時間撹拌した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体I−4 2.57g(収率89%)を得た。生成された化合物は、HR−MSを介して確認した。
C24H26BNO2計算値:371.2057;実測値371.2051
化合物101の合成
中間体I−3 1.66g(5.0mmol)、中間体I−4 1.86g(5.0mmol)、Pd(PPh3)4 0.29g(0.25mmol)及びK2CO3 2.07g(15.0mmol)を、テトラヒドロフラン(THF)/H2O(2/1)混合溶液30mlに溶かした後、70℃で5時間撹拌した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、化合物101 1.86g(収率75%)を得た。生成された化合物は、HR−MSとNMRとを介して確認した。
C37H24N2計算値:496.1939;実測値[M+1]497.1922
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.70−8.67(m,1H)、8.29−8.22(m,3H)、8.17−8.14(m,2H)、8.03(d,1H)、7.68(d,1H)、7.53−7.48(m,2H)、7.45−7.42(m,1H)、7.08−7.04(m,4H)、6.98−6.93(m,2H)、6.67−6.63(m,2H)、6.17−6.13(m,4H)
【0090】
合成例12:化合物104の合成
【化33】

中間体I−5の合成
1−ブロモ−2−メチルベンゼン3.42g(20.0mmol)、o−トルイジン(o−toluidine)2.79g(30.0mmol)、Pd2(dba)3 0.37g(0.4mmol)、トリ−tert−ブチルホスフィン(P(t−Bu)3)0.08g(0.4mmol)及びKOtBu 2.88g(30.0mmol)を、トルエン60mlに溶かした後、85℃で4時間撹拌した。そこから収得した混合物を常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体I−5 3.47g(収率88%)を得た。生成された化合物は、HR−MSを介して確認した。
C14H15N計算値:197.2204;実測値197.2253
中間体I−6の合成
中間体I−5 1.97g(10.0mmol)、4−ブロモヨードベンゼン2.83g(10.0mmol)、Pd2(dba)3 0.18g(0.2mmol)、P(t−Bu) 30.04g(0.4mmol)及びKOtBu 1.44g(15.0mmol)を、トルエン40mlに溶かした後、85℃で4時間撹拌した。そこから収得した混合物を常温に冷やした後、水30mLとジエチルエーテル30mLで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体I−6 3.14g(収率89%)を得た。生成された化合物は、HR−MSを介して確認した。
C20H18BrN計算値:351.0623;実測値351.0653
中間体I−7の合成
4−ブロモトリフェニルアミンの代わりに、N−(4−ブロモフェニル)−2−メチル−N−o−トリルベンゼンアミンを使用したという点を除いては、前記中間体I−4と同じ方法を利用し、中間体I−7を合成した。生成された化合物は、HR−MSを介して確認した。
C26H30BNO2計算値:399.2370;実測値399.2381
化合物104の合成
中間体I−4の代わりに、中間体I−7を使用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物104 2.15g(収率75%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C39H28N2計算値:524.2252;実測値[M+1]525.2056
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(dd,1H)、8.69−8.67(d,1H)、8.29(s,1H)、8.27−8.23(m,2H)、8.17−8.14(m,2H)、8.04−8.02(d,1H)、7.69−7.67(d,1H)、7.49−7.41(m,3H)、7.06−7.03(m,2H)、6.98−6.89(m,4H)、6.83−6.78(m,2H)、6.63−6.60(m,2H)、1.82(s,6H)
【0091】
合成例13:化合物110の合成
【化34】

中間体I−8の合成
1−ブロモ−2−メチルベンゼンの代わりに、1−ブロモ−2,3,4−トリフルオロベンゼンを使用し、o−トルイジンの代わりに、アニリンを使用したという点を除いては、前記中間体I−5と同じ方法を利用し、中間体I−8 5.2g(65%)を合成した。生成された化合物は、HR−MSを介して確認した。
C12H8F3N計算値:223.0609;実測値223.0901
中間体I−9の合成
中間体I−5の代わりに、中間体I−8を使用したという点を除いては、前記中間体I−6の合成方法と同じ方法を利用し、中間体I−9 7.1g(81%)を合成した。生成された化合物は、HR−MSを介して確認した。
C18H11BrF3N計算値:377.0027;実測値377.0023
中間体I−10の合成
4−ブロモトリフェニルアミンの代わりに、中間体I−9を使用したという点を除いては、前記中間体I−4と同じ方法を利用し、中間体I−10 6.00g(75%)を合成した。生成された化合物は、HR−MSを介して確認した。
C24H23BF3NO2計算値:425.1774;実測値425.1769
化合物110の合成
中間体I−4の代わりに、中間体I−10を使用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物110 1.23g(63%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C37H21F3N2計算値:550.1657;実測値[M+1]551.5897
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.69−8.67(d,1H)、8.29(s,1H)、8.26−8.22(m,2H)、8.17−8.14(m,2H)、8.04−8.02(d,1H)、7.69−7.67(d,1H)、7.54−7.50(m,2H)、7.45−7.41(m,1H)、7.10−7.05(m,2H)、6.81−6.70(m,2H)、6.66−6.56(m,3H)、6.37−6.34(m,2H)、
【0092】
合成例14:化合物120の合成
【化35】

中間体I−11の合成
1,3−ジブロモ−5−ニトロベンゼン5.62g(20.0mmol)、フェニルボロン酸1.22g(10.0mmol)、PdPPh3 0.58g(0.5mmol)及びK2CO3 4.14g(30.0mmol)を、THF/H2O(2/1)40mlに溶かして80℃で5時間撹拌した後、常温に冷やした後、水50mLとジエチルエーテル50mLとで3回抽出した。そこから収得した有機層を硫酸マグネシウムで乾燥させ、溶媒を蒸発させて収得した残留物を、シリカゲル・カラムクロマトグラフィで分離精製し、中間体I−11 3.57g(収率65%)を得た。生成された化合物は、HR−MSを介して確認した。
C18H13NO2計算値:275.0948;実測値275.9732
中間体I−12の合成
中間体I−1の代わりに、中間体I−11を利用したという点を除いては、前記中間体I−2の合成方法と同じ方法を利用し、中間体I−12 2.64g(83%)を合成した。生成された化合物は、HR−MSを介して確認した。
C18H15N計算値:245.1204;実測値:245.5256
中間体I−13の合成
1−ブロモ−2−メチルベンゼンの代わりに、4−ブロモベンゼンを使用し、o−トルイジンの代わりに、中間体I−12を使用したという点を除いては、前記中間体I−5の合成方法と同じ方法を利用し、中間体I−13 2.38g(69%)を合成した。生成された化合物は、HR−MSを介して確認した。
C24H19N計算値:321.1517;実測値:321.6245
中間体I−14の合成
中間体I−5の代わりに、中間体1−13を使用したという点を除いては、前記中間体I−6の合成方法と同じ方法を利用し、中間体I−14 2.51g(71%)を合成した。生成された化合物をHR−MSを介して確認した。
C30H22BrN計算値:476.0936;実測値:476.4158
中間体I−15の合成
4−ブロモトリフェニルアミンの代わりに、中間体I−14を使用したという点を除いては、前記中間体I−1の合成方法と同じ方法を利用し、中間体I−15 2.29g(83%)を合成した。生成された化合物は、HR−MSを介して確認した。
C36H34BNO2計算値:523.2683;実測値523.5641
化合物120の合成
中間体I−14の代わりに、中間体I−15を使用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物120 1.65g(69%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C49H32N2計算値:648.2565;実測値[M+1]649.3520
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.69−8.67(d,1H)、8.39(s,1H)、8.27−8.22(d,2H)、8.17−8.14(m,2H)、8.04−8.02(d,1H)、7.69−7.64(m,5H)、7.54−7.50(m,3H)、7.46−7.40(m,7H)、7.10−7.05(m,2H)、6.93−6.89(m,2H)、6.87−6.86(d,2H)、6.68−6.63(m,1H)、6.29−6.26(m,2H)
【0093】
合成例15:化合物123の合成
【化36】

中間体I−16の合成
1−ブロモ−2,3,4−トリフルオロベンゼンの代わりに、2−ブロモピリジンを使用し、アニリンの代わりに、2−アミノピリジンを使用したという点を除いては、前記中間体I−8、I−9及びI−10の合成方法と同じ方法を利用し、中間体I−16 2.3g(51%)を合成した。生成された化合物は、HR−MSを介して確認した。
C22H24BN3O2計算値:373.1962;実測値373.1956
化合物123の合成
中間体I−4の代わりに、中間体I−16を利用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物123 1.34g(73%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C35H22N4計算値:498.1844;実測値[M+1]499.1925
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.69−8.67(d,1H)、8.29(s,1H)、8.27−8.21(m,4H)、8.17−8.13(m,2H)、8.04−8.02(s,1H)、7.73−7.67(m,3H)、7.55−7.51(m,2H)、7.45−7.42(dd,1H)、7.37−7.35(m,2H)、6.92−6.88(m,2H)、6.80−6.76(m,2H)
【0094】
合成例16:化合物133の合成
【化37】

中間体I−17の合成
1,3−ジブロモ−5−ニトロベンゼンの代わりに、1,3−ジブロモ−5−フルオロ−6−ニトロベンゼンを使用したという点を除いては、前記中間体I−11,1−12、I−13、1−14及びI−15の合成方法と同じ方法を利用して、中間体I−17 2.61g(45%)を合成した。生成された化合物は、HR−MSを介して確認した。
C38H33BFNO2計算値:541.2588;実測値541.3512
化合物133の合成
中間体I−4の代わりに、中間体I−17を利用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物133 1.78g(66%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C49H31FN2計算値:666.2471;実測値[M+1]667.3125
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.69−8.67(d,1H)、8.29(s,1H)、8.27−8.23(m,2H)、8.17−8.13(m,2H)、8.04−8.02(d,1H)、7.72−7.60(m,6H)、7.55−7.47(m,7H)、7.44−7.40(m,2H)、7.13−7.10(d,1H)、7.08−7.03(m,2H)、7.00−6.96(m,2H)、6.63−6.60(m,1H)、6.15−6.12(m,2H)
【0095】
合成例17:化合物139の合成
【化38】

中間体I−18の合成
1−ブロモ−2−メチルベンゼンの代わりにブロモベンゼンを使用し、o−トルイジンの代わりに、アニリンを使用したという点を除いては、前記中間体I−5の合成方法と同じ方法を利用し、ジフェニルアミンを合成した。次に、中間体I−5の代わりに、ジフェニルアミンを使用し、4−ブロモヨードベンゼンの代わりに、2−ブロモ−7−ヨード−9,9−ジメチル−9H−フルオレンを利用したという点を除いては、前記中間体I−6の合成方法と同じ方法を利用し、7−ブロモ−9,9−ジメチル−N,N−ジフェニル−9H−フルオレン−2−アミンを合成した。この後、中間体I−6の代わりに、7−ブロモ−9,9−ジメチル−N,N−ジフェニル−9H−フルオレン−2−アミンを利用したという点を除いては、前記中間体I−7の合成方法と同じ方法を利用し、中間体I−18 2.59g(46%)を合成した。生成された化合物は、HR−MSを介して確認した。
C33H34BNO2計算値:487.2683;実測値:487.3541
化合物139の合成
中間体I−4の代わりに、中間体I−18を利用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物139 1.99g(82%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C46H32N2計算値:612.2565;実測値[M+1]613.3546
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.70−8.67(m,1H)、8.29(s,1H)、8.26−8.22(m,2H)、8.16−8.14(m,1H)、7.99−7.92(dd,2H)、7.80−7.76(m,2H)、7.68−7.66(m,2H)、7.54−7.52(d,2H)、7.50−7.48(d,1H)、7.45−7.41(m,1H)、7.08−7.04(m,4H)、6.67−6.63(m,3H)、6.40−6.38(m,1H)、6.16−6.13(m,3H)、1.82(s,6H)
【0096】
合成例18:化合物149の合成
中間体I−4の代わりに、フェニルボロン酸を利用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物149 1.28g(74%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C25H15N計算値:329.1204;実測値[M+1]330.2132
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(dd,1H)、8.69−8.67(d,1H)、8.29(s,1H)、8.26−8.23(m,2H)、8.16−8.14(d,1H)、8.06−8.02(m,3H)、7.99−7.97(d,1H)、7.68−7.66(d,1H)、7.51−7.48(m,2H)、7.45−7.38(m,2H)
【0097】
合成例19:化合物154の合成
【化39】

中間体I−19の合成
1−ブロモ−2−メチルベンゼンの代わりに、2−ブロモフルオレンを使用し、o−トルイジンの代わりに、アニリンを使用したという点を除いては、前記中間体I−5の合成方法と同じ方法を利用し、中間体I−19 4.56g(72%)を合成した。生成された化合物をHR−MSを介して確認した。
C21H18N計算値:284.1439;実測値:284.1398
化合物154の合成
中間体I−4の代わりに、中間体I−19を利用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物154 1.05g(53%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C40H28N2計算値:536.2252;実測値[M+1]537.2412
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.61−8.59(d,1H)、8.27−8.23(m,2H)、8.17−8.08(dd,2H)、7.96−7.93(d,1H)、7.78−7.72(m,2H)、7.51−7.48(d,1H)、7.44−7.41(m,2H)、7.35−7.30(m,1H)、7.14−7.11(m,2H)、7.06−7.01(m,2H)、6.65−6.61(m,2H)、6.41−6.40(d,1H)、6.17−6.13(m,2H)、1.62(s,6H)
【0098】
合成例20:化合物157の合成
【化40】

中間体I−20の合成
1,3−ジブロモ−5−ニトロベンゼンの代わりに、2−ブロモ−7−ヨード−9,9−ジメチル−9H−フルオレンを使用し、フェニルボロン酸の代わりに、2−ナフチルボロン酸を使用したという点を除いては、前記中間体I−11の合成方法と同じ方法を利用し、中間体I−20 3.56g(85%)を合成した。生成された化合物をHR−MSを介して確認した。
C25H19Br計算値:398.0670;実測値:398.0750
中間体I−21の合成
1−ブロモ−2−メチルベンゼンの代わりに中間体I−20を使用し、o−トルイジンの代わりに、2−アミノフルオレンを使用したという点を除いては、前記中間体I−5の合成方法と同じ方法を利用し、中間体I−21 3.81g(81%)を合成した。生成された化合物をHR−MSを介して確認した。
C40H32N計算値:527.2613;実測値:527.3145
化合物157の合成
中間体I−4の代わりに、中間体I−21を利用したという点を除いては、化合物101の合成方法と同じ方法を利用し、化合物157 1.71g(72%)を合成した。生成された化合物をHR−MS及びNMRを介して確認した。
C59H42N2計算値:778.3348;実測値[M+1]779.4982
1H NMR(CDCl3,400MHz)δ(ppm)8.92−8.90(m,1H)、8.61−8.59(d,1H)、8.27−8.23(m,2H)、8.18−8.08(dd,2H)、8.04(s,1H)、7.99−7.97(d,1H)、7.94−7.84(m,3H)、7.78−7.74(m,2H)、7.72−7.41(m,10H)、7.36−7.30(m,1H)、7.14−7.08(m,2H)、6.70−6.66(m,2H)、6.45−6.42(m,2H)、1.64−1.62(d,12H)
【0099】
実施例11
コーニング(Corning)15Ω/cm2(1,200Å)ITOガラス基板を50mmx50mmx0.7mmサイズに切り、イソプロピルアルコールと純水とを利用し、それぞれ5分間超音波洗浄した後、30分間紫外線を照射し、オゾンに露出させて洗浄し、真空蒸着装置にこのガラス基板を設けた。
前記ガラス基板のITO電極(アノード)上部に、2−TNATAを蒸着し、600Å厚の正孔注入層を形成した後、前記正孔注入層の上部に、4,4’−ビス[N−(1−ナフチル)−N−フェニルアミノ]ビフェニル(NPB)を蒸着し、300Å厚の正孔輸送層を形成した。
次に、前記正孔輸送層の上部に、9,10−ジ(ナフタレン−2−イル)アントラセン(ADN)及び化合物101を、重量比98:2で共蒸着し、300Å厚の発光層を形成した。
この後、前記発光層の上部にAlq3を蒸着し、300Å厚の電子輸送層を形成し、前記電子輸送層の上部にLiFを蒸着し、10Å厚の電子注入層を形成し、前記電子注入層の上部にAlを蒸着し、3,000Å厚の第2電極(カソード)を形成することによって、有機発光素子を製造した。
【0100】
実施例12
発光層の形成時に、前記化合物101の代わりに、化合物104を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0101】
実施例13
発光層の形成時に、前記化合物101の代わりに、化合物110を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0102】
実施例14
発光層の形成時に、前記化合物101の代わりに、化合物120を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0103】
実施例15
発光層の形成時に、前記化合物101の代わりに、化合物123を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0104】
実施例16
発光層の形成時に、前記化合物101の代わりに、化合物133を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0105】
実施例17
発光層の形成時に、前記化合物101の代わりに、化合物139を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0106】
実施例18
発光層の形成時に、前記化合物101の代わりに、化合物149を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0107】
実施例19
発光層の形成時に、前記化合物101の代わりに、化合物154を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0108】
実施例20
発光層の形成時に、前記化合物101の代わりに、化合物157を利用したという点を除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0109】
比較例2
発光層の形成時に、前記化合物101の代わりに、DPVBiを利用したことを除いては、実施例11と同じ方法を利用して、有機発光素子を製作した。
【0110】
評価2
評価1と同じ方法を利用し、実施例11ないし20と比較例2との有機発光素子の駆動電圧、電流密度、輝度、発光色、効率及び半減寿命(@100mA/cm2)をPR650 Spectroscan Source Measurement Unit.(PhotoResearch社製)を評価し、その結果を下記表2に示した。
【表2】

前記表2によれば、実施例11ないし20の有機発光素子は、比較例2の有機発光素子に比べて、低駆動電圧、高輝度、高効率及び長寿命を有するということを確認することができる。
【符号の説明】
【0111】
10 有機発光素子
11 基板
13 第1電極
15 第1層
17 第2電極
【特許請求の範囲】
【請求項1】
下記化学式(1)で表示される縮合環化合物:
【化1】

前記化学式(1)で、
R1ないしR11は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C60アルキル基、置換または非置換のC2−C60アルケニル基、置換または非置換のC2−C60アルキニル基、置換または非置換のC1−C60アルコキシ基、置換または非置換のC3−C60シクロアルキル基、置換または非置換のC5−C60アリール基、置換または非置換のC5−C60アリールオキシ基、置換または非置換のC5−C60アリールチオ基、置換または非置換のC2−C60ヘテロアリール基、−N(R21)(R22)、または−Si(R23)(R24)(R25)であり、
L1及びL2は互いに独立に、置換または非置換のC5−C60アリーレン基、あるいは置換または非置換のC2−C60ヘテロアリーレン基であり、
a及びbは、互いに独立に、0ないし5の整数であり、
R21ないしR25は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C60アルキル基、置換または非置換のC2−C60アルケニル基、置換または非置換のC2−C60アルキニル基、置換または非置換のC1−C60アルコキシ基、置換または非置換のC3−C60シクロアルキル基、置換または非置換のC5−C60アリール基、置換または非置換のC5−C60アリールオキシ基、置換または非置換のC5−C60アリールチオ基、あるいは置換または非置換のC2−C60ヘテロアリール基である。
【請求項2】
前記R1ないしR11が互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基、ペントキシ基、置換または非置換のフェニル基、置換または非置換のペンタレニル基、置換または非置換のインデニル基、置換または非置換のナフチル基、置換または非置換のアズレニル基、置換または非置換のヘプタレニル基、置換または非置換のインダセニル基、置換または非置換のアセナフチル基、置換または非置換のフルオレニル基、置換または非置換のフェナレニル基、置換または非置換のフェナントレニル基、置換または非置換のアントリル基、置換または非置換のフルオランテニル基、置換または非置換のトリフェニレニル基、置換または非置換のピレニル基、置換または非置換のクリセニル基、置換または非置換のナフタセニル基、置換または非置換のピセニル基、置換または非置換のペリレニル基、置換または非置換のペンタセニル基、置換または非置換のヘキサセニル基、置換または非置換のピロリル基、置換または非置換のピラゾリル基、置換または非置換のイミダゾリル基、置換または非置換のイミダゾリニル基、置換または非置換のイミダゾピリジニル基、置換または非置換のイミダゾピリミジニル基、置換または非置換のピリジニル基、置換または非置換のピラジニル基、置換または非置換のピリミジニル基、置換または非置換のインドリル基、置換または非置換のプリニル基、置換または非置換のキノリニル基、置換または非置換のフタラジニル基、置換または非置換のインドリジニル基、置換または非置換のナフチリジニル基、置換または非置換のキナゾリニル基、置換または非置換のシンノリニル基、置換または非置換のインダゾリル基、置換または非置換のカルバゾリル基、置換または非置換のフェナジニル基、置換または非置換のフェナントリジニル基、置換または非置換のピラニル基、置換または非置換のクロメニル基、置換または非置換のフラニル基、置換または非置換のベンゾフラニル基、置換または非置換のチオフェニル基、置換または非置換のベンゾチオフェニル基、置換または非置換のイソチアゾリル基、置換または非置換のベンゾイミダゾリル基、置換または非置換のイソキサゾリル基、置換または非置換のジベンゾチオフェニル基、置換または非置換のジベンゾフラニル基、置換または非置換のトリアジニル基、置換または非置換のオキサジアゾリル基、または−N(R21)(R22)であることを特徴とする請求項1に記載の縮合環化合物。
【請求項3】
前記R1ないしR11が互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C10アルキル基、置換または非置換のC2−C10アルケニル基、置換または非置換のC2−C10アルキニル基、置換または非置換のC1−C10アルコキシ基、及び下記化学式2Aないし2Qで表される基のうち一つであることを特徴とする請求項1又は2に記載の縮合環化合物:
【化2】

【化3】

前記化学式2Aないし2Qで、
Y1ないしY6は互いに独立に、=N−または=C(Z11)−であり、
T1及びT2は互いに独立に、−S−、−O−、−N(Z12)−または−C(Z13)(Z14)−であり、
Z1ないしZ4、及びZ11ないしZ14は互いに独立に、水素;重水素;ハロゲン原子;ヒドロキシル基;シアノ基;ニトロ基;カルボン酸基;C1−C60アルキル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC1−C60アルキル基;C2−C60アルケニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC2−C60アルケニル基;C2−C60アルキニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC2−C60アルキニル基;C1−C60アルコキシ基;重水素、ハロゲン元素、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC1−C60アルコキシ基;C3−C60シクロアルキル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC3−C60シクロアルキル基;C5−C60アリール基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリール基;C5−C60アリールオキシ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリールオキシ基;C5−C60アリールチオ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリールチオ基;C2−C60ヘテロアリール基;または重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC2−C60ヘテロアリール基であり、
pは、1ないし9の整数であり、
qは、1ないし7の整数であり、
rは、1ないし3の整数であり、
sは1、ないし4の整数である。
【請求項4】
Z1ないしZ4、及びZ11ないしZ14は互いに独立に、水素;重水素;ハロゲン原子;ヒドロキシル基;シアノ基;メチル基;エチル基;プロピル基;ブチル基;ペンチル基;エテニル基;プロペニル基;ブテニル基;ペンテニル基;アセチル基;メトキシ基;エトキシ基;プロポキシ基;ブトキシ基;ペントキシ基;フェニル基;ナフチル基;フルオレニル基;フェナントレニル基;アントリル基;ピレニル基;クリセニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基及びペントキシ基のうち一つ以上で置換された、フェニル基、ナフチル基、フルオレニル基、フェナントレニル基、アントリル基、ピレニル基及びクリセニル基;カルバゾリル基;イミダゾリル基;イミダゾリニル基;イミダゾピリジニル基;イミダゾピリミジニル基;ピリジニル基;ピリミジニル基;トリアジニル基;キノリニル基;及び重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基及びペントキシ基のうち一つ以上で置換された、カルバゾリル基、イミダゾリル基、イミダゾリニル基、イミダゾピリジニル基、イミダゾピリミジニル基、ピリジニル基、ピリミジニル基、トリアジニル基及びキノリニル基;のうち一つであることを特徴とする請求項3に記載の縮合環化合物。
【請求項5】
R1ないしR11が互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C10アルキル基、C1−C10アルコキシ基及び下記化学式3Aないし3Tで表される基のうちの一つであることを特徴とする請求項1〜4のいずれか1項に記載の縮合環化合物:
【化4】

【化5】

前記化学式3Aないし3Tで、
Y1ないしY6は互いに独立に、=N−または=C(Z11)−であり、
T1及びT2は互いに独立に、−S−、−O−、−N(Z12)−または−C(Z13)(Z14)−であり、
Z1a、Z1b、Z1c、Z1d、Z2、Z2a、Z2b、Z2c、Z3、Z3a、Z3b、Z11、Z12、Z13及びZ14は互いに独立に、水素;重水素;ハロゲン原子;ヒドロキシル基;シアノ基;メチル基;エチル基;プロピル基;ブチル基;ペンチル基;エテニル基;プロペニル基;ブテニル基;ペンテニル基;アセチル基;メトキシ基;エトキシ基;プロポキシ基;ブトキシ基;ペントキシ基;フェニル基;ナフチル基;フルオレニル基;フェナントレニル基;アントリル基;ピレニル基;クリセニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基及びペントキシ基のうち一つ以上で置換された、フェニル基、ナフチル基、フルオレニル基、フェナントレニル基、アントリル基、ピレニル基及びクリセニル基;カルバゾリル基;イミダゾリル基;イミダゾリニル基;イミダゾピリジニル基;イミダゾピリミジニル基;ピリジニル基;ピリミジニル基;トリアジニル基;キノリニル基;及び重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基及びペントキシ基のうち一つ以上で置換された、カルバゾリル基、イミダゾリル基、イミダゾリニル基、イミダゾピリジニル基、イミダゾピリミジニル基、ピリジニル基、ピリミジニル基、トリアジニル基及びキノリニル基;のうち一つである。
【請求項6】
前記a及びbが互いに独立に、0、1または2であることを特徴とする請求項1〜5のいずれか1項に記載の縮合環化合物。
【請求項7】
前記L1及びL2が互いに独立に、置換または非置換のフェニレン基、置換または非置換のペンタレニレン基、置換または非置換のインデニレン基、置換または非置換のナフチレン基、置換または非置換のアズレニレン基、置換または非置換のヘプタレニレン基、置換または非置換のインダセニレン基、置換または非置換のアセナフチレン基、置換または非置換のフルオレニレン基、置換または非置換のフェナレニレン基、置換または非置換のフェナントレニレン基、置換または非置換のアントリレン基、置換または非置換のフルオランテニレン基、置換または非置換のトリフェニレニレン基、置換または非置換のピレニレン基、置換または非置換のクリセニレン基、置換または非置換のナフタセニレン基、置換または非置換のピセニレン基、置換または非置換のペリレニレン基、置換または非置換のペンタセニレン基、置換または非置換のヘキサセニレン基、置換または非置換のピロリレン基、置換または非置換のピラゾリレン基、置換または非置換のイミダゾリレン基、置換または非置換のイミダゾリニレン基、置換または非置換のイミダゾピリジニレン基、置換または非置換のイミダゾピリミジニレン基、置換または非置換のピリジニレン基、置換または非置換のピラジニレン基、置換または非置換のピリミジニレン基、置換または非置換のインドリレン基、置換または非置換のプリニレン基、置換または非置換のキノリニレン基、置換または非置換のフタラジニレン基、置換または非置換のインドリジニレン基、置換または非置換のナフチリジニレン基、置換または非置換のキナゾリニレン基、置換または非置換のシンノリニレン基、置換または非置換のインダゾリレン基、置換または非置換のカルバゾリレン基、置換または非置換のフェナジニレン基、置換または非置換のフェナントリジニレン基、置換または非置換のピラニレン基、置換または非置換のクロメニレン基、置換または非置換のフラニル基、置換または非置換のベンゾフラニレン基、置換または非置換のチオフェニレン基、置換または非置換のベンゾチオフェニレン基、置換または非置換のイソチアゾリレン基、置換または非置換のベンゾイミダゾリレン基、置換または非置換のイソキサゾリレン基、置換または非置換のジベンゾチオフェニレン基、置換または非置換のジベンゾフラニレン基、置換または非置換のトリアジニレン基、あるいは置換または非置換のオキサジアゾリレン基であることを特徴とする請求項1〜6のいずれか1項に記載の縮合環化合物。
【請求項8】
前記L1及びL2が下記化学式4Aないし4Oのうちいずれか一つであることを特徴とする請求項1〜6のいずれか1項に記載の縮合環化合物:
【化6】

【化7】

前記化学式4Aないし4Oで、
Y11ないしY16は互いに独立に、=N−または=C(Z31)−であり、
T11は−S−、−O−、−N(Z32)−または−C(Z33)(Z34)−であり、
Z21ないしZ23、及びZ31ないしZ34は互いに独立に、水素;重水素;ハロゲン原子;ヒドロキシル基;シアノ基;ニトロ基;カルボン酸基;C1−C60アルキル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC1−C60アルキル基;C2−C60アルケニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC2−C60アルケニル基;C2−C60アルキニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC2−C60アルキニル基;C1−C60アルコキシ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC1−C60アルコキシ基;C3−C60シクロアルキル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC3−C60シクロアルキル基;C5−C60アリール基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリール基;C5−C60アリールオキシ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリールオキシ基;C5−C60アリールチオ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリールチオ基;C2−C60ヘテロアリール基;または重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC2−C60ヘテロアリール基であり、
tは、1ないし8の整数であり、
uは、1ないし5の整数である。
【請求項9】
下記化学式1Aまたは1Bで表示されることを特徴とする請求項1に記載の縮合環化合物:
【化8】

前記化学式1A及び1Bで、R1ないしR5、L1、L2、a及びbは、請求項1に記載のとおりである。
【請求項10】
下記化合物14,20,22,30,31,43,101,104,110,120,123,133,139,149,154または157であることを特徴とする請求項1に記載の縮合環化合物。
【化9】

【請求項11】
第1電極と、前記第1電極に対向した第2電極と、前記第1電極と前記第2電極との間に介在された第1層と、を含み、
前記第1層が請求項1〜10のうち、いずれか1項に記載の縮合環化合物を1種以上含む有機発光素子。
【請求項12】
前記第1層が、正孔注入層、正孔輸送層、正孔注入機能及び正孔輸送機能を同時に有する機能層、電子阻止層、発光層、正孔阻止層、電子輸送層、電子注入層、並びに電子輸送機能及び電子注入機能を同時に有する機能層のうち少なくとも1層を含むことを特徴とする請求項11に記載の有機発光素子。
【請求項13】
前記第1層が発光層を含み、前記発光層に、前記縮合環化合物が含まれていることを特徴とする請求項12に記載の有機発光素子。
【請求項14】
前記発光層に含まれた前記縮合環化合物が、ホストまたはドーパントの役割を行うことを特徴とする請求項13に記載の有機発光素子。
【請求項15】
前記発光層に、2種の互いに異なる前記縮合環化合物が含まれており、2種の互いに異なる縮合環化合物のうち一つは、ホストの役割を行い、他の一つは、ドーパントの役割を行うことを特徴とする請求項13に記載の有機発光素子。
【請求項16】
前記第1層が、電子輸送層を含み、前記電子輸送層に、前記縮合環化合物が含まれていることを特徴とする請求項12に記載の有機発光素子。
【請求項17】
前記電子輸送層が、金属含有化合物をさらに含むことを特徴とする請求項16に記載の有機発光素子。
【請求項18】
前記第1層が電子輸送層をさらに含み、前記電子輸送層は、前記発光層に含まれた縮合環化合物と異なる縮合環化合物を含むことを特徴とする請求項13に記載の有機発光素子。
【請求項19】
前記第1層が電子輸送層をさらに含み、前記電子輸送層は、前記発光層に含まれた縮合環化合物と異なる縮合環化合物を含むことを特徴とする請求項15に記載の有機発光素子。
【請求項20】
前記第1層が、前記正孔注入層、前記正孔輸送層、並びに前記正孔注入機能及び正孔輸送機能を同時に有する機能層のうち少なくとも1層を含み、前記正孔注入層、前記正孔輸送層、並びに前記正孔注入機能及び正孔輸送機能を同時に有する機能層のうち少なくとも1層が電荷生成物質をさらに含むことを特徴とする請求項12に記載の有機発光素子。
【請求項1】
下記化学式(1)で表示される縮合環化合物:
【化1】

前記化学式(1)で、
R1ないしR11は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C60アルキル基、置換または非置換のC2−C60アルケニル基、置換または非置換のC2−C60アルキニル基、置換または非置換のC1−C60アルコキシ基、置換または非置換のC3−C60シクロアルキル基、置換または非置換のC5−C60アリール基、置換または非置換のC5−C60アリールオキシ基、置換または非置換のC5−C60アリールチオ基、置換または非置換のC2−C60ヘテロアリール基、−N(R21)(R22)、または−Si(R23)(R24)(R25)であり、
L1及びL2は互いに独立に、置換または非置換のC5−C60アリーレン基、あるいは置換または非置換のC2−C60ヘテロアリーレン基であり、
a及びbは、互いに独立に、0ないし5の整数であり、
R21ないしR25は互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C60アルキル基、置換または非置換のC2−C60アルケニル基、置換または非置換のC2−C60アルキニル基、置換または非置換のC1−C60アルコキシ基、置換または非置換のC3−C60シクロアルキル基、置換または非置換のC5−C60アリール基、置換または非置換のC5−C60アリールオキシ基、置換または非置換のC5−C60アリールチオ基、あるいは置換または非置換のC2−C60ヘテロアリール基である。
【請求項2】
前記R1ないしR11が互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基、ペントキシ基、置換または非置換のフェニル基、置換または非置換のペンタレニル基、置換または非置換のインデニル基、置換または非置換のナフチル基、置換または非置換のアズレニル基、置換または非置換のヘプタレニル基、置換または非置換のインダセニル基、置換または非置換のアセナフチル基、置換または非置換のフルオレニル基、置換または非置換のフェナレニル基、置換または非置換のフェナントレニル基、置換または非置換のアントリル基、置換または非置換のフルオランテニル基、置換または非置換のトリフェニレニル基、置換または非置換のピレニル基、置換または非置換のクリセニル基、置換または非置換のナフタセニル基、置換または非置換のピセニル基、置換または非置換のペリレニル基、置換または非置換のペンタセニル基、置換または非置換のヘキサセニル基、置換または非置換のピロリル基、置換または非置換のピラゾリル基、置換または非置換のイミダゾリル基、置換または非置換のイミダゾリニル基、置換または非置換のイミダゾピリジニル基、置換または非置換のイミダゾピリミジニル基、置換または非置換のピリジニル基、置換または非置換のピラジニル基、置換または非置換のピリミジニル基、置換または非置換のインドリル基、置換または非置換のプリニル基、置換または非置換のキノリニル基、置換または非置換のフタラジニル基、置換または非置換のインドリジニル基、置換または非置換のナフチリジニル基、置換または非置換のキナゾリニル基、置換または非置換のシンノリニル基、置換または非置換のインダゾリル基、置換または非置換のカルバゾリル基、置換または非置換のフェナジニル基、置換または非置換のフェナントリジニル基、置換または非置換のピラニル基、置換または非置換のクロメニル基、置換または非置換のフラニル基、置換または非置換のベンゾフラニル基、置換または非置換のチオフェニル基、置換または非置換のベンゾチオフェニル基、置換または非置換のイソチアゾリル基、置換または非置換のベンゾイミダゾリル基、置換または非置換のイソキサゾリル基、置換または非置換のジベンゾチオフェニル基、置換または非置換のジベンゾフラニル基、置換または非置換のトリアジニル基、置換または非置換のオキサジアゾリル基、または−N(R21)(R22)であることを特徴とする請求項1に記載の縮合環化合物。
【請求項3】
前記R1ないしR11が互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、置換または非置換のC1−C10アルキル基、置換または非置換のC2−C10アルケニル基、置換または非置換のC2−C10アルキニル基、置換または非置換のC1−C10アルコキシ基、及び下記化学式2Aないし2Qで表される基のうち一つであることを特徴とする請求項1又は2に記載の縮合環化合物:
【化2】

【化3】

前記化学式2Aないし2Qで、
Y1ないしY6は互いに独立に、=N−または=C(Z11)−であり、
T1及びT2は互いに独立に、−S−、−O−、−N(Z12)−または−C(Z13)(Z14)−であり、
Z1ないしZ4、及びZ11ないしZ14は互いに独立に、水素;重水素;ハロゲン原子;ヒドロキシル基;シアノ基;ニトロ基;カルボン酸基;C1−C60アルキル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC1−C60アルキル基;C2−C60アルケニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC2−C60アルケニル基;C2−C60アルキニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC2−C60アルキニル基;C1−C60アルコキシ基;重水素、ハロゲン元素、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC1−C60アルコキシ基;C3−C60シクロアルキル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC3−C60シクロアルキル基;C5−C60アリール基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリール基;C5−C60アリールオキシ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリールオキシ基;C5−C60アリールチオ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリールチオ基;C2−C60ヘテロアリール基;または重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC2−C60ヘテロアリール基であり、
pは、1ないし9の整数であり、
qは、1ないし7の整数であり、
rは、1ないし3の整数であり、
sは1、ないし4の整数である。
【請求項4】
Z1ないしZ4、及びZ11ないしZ14は互いに独立に、水素;重水素;ハロゲン原子;ヒドロキシル基;シアノ基;メチル基;エチル基;プロピル基;ブチル基;ペンチル基;エテニル基;プロペニル基;ブテニル基;ペンテニル基;アセチル基;メトキシ基;エトキシ基;プロポキシ基;ブトキシ基;ペントキシ基;フェニル基;ナフチル基;フルオレニル基;フェナントレニル基;アントリル基;ピレニル基;クリセニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基及びペントキシ基のうち一つ以上で置換された、フェニル基、ナフチル基、フルオレニル基、フェナントレニル基、アントリル基、ピレニル基及びクリセニル基;カルバゾリル基;イミダゾリル基;イミダゾリニル基;イミダゾピリジニル基;イミダゾピリミジニル基;ピリジニル基;ピリミジニル基;トリアジニル基;キノリニル基;及び重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基及びペントキシ基のうち一つ以上で置換された、カルバゾリル基、イミダゾリル基、イミダゾリニル基、イミダゾピリジニル基、イミダゾピリミジニル基、ピリジニル基、ピリミジニル基、トリアジニル基及びキノリニル基;のうち一つであることを特徴とする請求項3に記載の縮合環化合物。
【請求項5】
R1ないしR11が互いに独立に、水素、重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C10アルキル基、C1−C10アルコキシ基及び下記化学式3Aないし3Tで表される基のうちの一つであることを特徴とする請求項1〜4のいずれか1項に記載の縮合環化合物:
【化4】

【化5】

前記化学式3Aないし3Tで、
Y1ないしY6は互いに独立に、=N−または=C(Z11)−であり、
T1及びT2は互いに独立に、−S−、−O−、−N(Z12)−または−C(Z13)(Z14)−であり、
Z1a、Z1b、Z1c、Z1d、Z2、Z2a、Z2b、Z2c、Z3、Z3a、Z3b、Z11、Z12、Z13及びZ14は互いに独立に、水素;重水素;ハロゲン原子;ヒドロキシル基;シアノ基;メチル基;エチル基;プロピル基;ブチル基;ペンチル基;エテニル基;プロペニル基;ブテニル基;ペンテニル基;アセチル基;メトキシ基;エトキシ基;プロポキシ基;ブトキシ基;ペントキシ基;フェニル基;ナフチル基;フルオレニル基;フェナントレニル基;アントリル基;ピレニル基;クリセニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基及びペントキシ基のうち一つ以上で置換された、フェニル基、ナフチル基、フルオレニル基、フェナントレニル基、アントリル基、ピレニル基及びクリセニル基;カルバゾリル基;イミダゾリル基;イミダゾリニル基;イミダゾピリジニル基;イミダゾピリミジニル基;ピリジニル基;ピリミジニル基;トリアジニル基;キノリニル基;及び重水素、ハロゲン原子、ヒドロキシル基、シアノ基、メチル基、エチル基、プロピル基、ブチル基、ペンチル基、エテニル基、プロペニル基、ブテニル基、ペンテニル基、アセチル基、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基及びペントキシ基のうち一つ以上で置換された、カルバゾリル基、イミダゾリル基、イミダゾリニル基、イミダゾピリジニル基、イミダゾピリミジニル基、ピリジニル基、ピリミジニル基、トリアジニル基及びキノリニル基;のうち一つである。
【請求項6】
前記a及びbが互いに独立に、0、1または2であることを特徴とする請求項1〜5のいずれか1項に記載の縮合環化合物。
【請求項7】
前記L1及びL2が互いに独立に、置換または非置換のフェニレン基、置換または非置換のペンタレニレン基、置換または非置換のインデニレン基、置換または非置換のナフチレン基、置換または非置換のアズレニレン基、置換または非置換のヘプタレニレン基、置換または非置換のインダセニレン基、置換または非置換のアセナフチレン基、置換または非置換のフルオレニレン基、置換または非置換のフェナレニレン基、置換または非置換のフェナントレニレン基、置換または非置換のアントリレン基、置換または非置換のフルオランテニレン基、置換または非置換のトリフェニレニレン基、置換または非置換のピレニレン基、置換または非置換のクリセニレン基、置換または非置換のナフタセニレン基、置換または非置換のピセニレン基、置換または非置換のペリレニレン基、置換または非置換のペンタセニレン基、置換または非置換のヘキサセニレン基、置換または非置換のピロリレン基、置換または非置換のピラゾリレン基、置換または非置換のイミダゾリレン基、置換または非置換のイミダゾリニレン基、置換または非置換のイミダゾピリジニレン基、置換または非置換のイミダゾピリミジニレン基、置換または非置換のピリジニレン基、置換または非置換のピラジニレン基、置換または非置換のピリミジニレン基、置換または非置換のインドリレン基、置換または非置換のプリニレン基、置換または非置換のキノリニレン基、置換または非置換のフタラジニレン基、置換または非置換のインドリジニレン基、置換または非置換のナフチリジニレン基、置換または非置換のキナゾリニレン基、置換または非置換のシンノリニレン基、置換または非置換のインダゾリレン基、置換または非置換のカルバゾリレン基、置換または非置換のフェナジニレン基、置換または非置換のフェナントリジニレン基、置換または非置換のピラニレン基、置換または非置換のクロメニレン基、置換または非置換のフラニル基、置換または非置換のベンゾフラニレン基、置換または非置換のチオフェニレン基、置換または非置換のベンゾチオフェニレン基、置換または非置換のイソチアゾリレン基、置換または非置換のベンゾイミダゾリレン基、置換または非置換のイソキサゾリレン基、置換または非置換のジベンゾチオフェニレン基、置換または非置換のジベンゾフラニレン基、置換または非置換のトリアジニレン基、あるいは置換または非置換のオキサジアゾリレン基であることを特徴とする請求項1〜6のいずれか1項に記載の縮合環化合物。
【請求項8】
前記L1及びL2が下記化学式4Aないし4Oのうちいずれか一つであることを特徴とする請求項1〜6のいずれか1項に記載の縮合環化合物:
【化6】

【化7】

前記化学式4Aないし4Oで、
Y11ないしY16は互いに独立に、=N−または=C(Z31)−であり、
T11は−S−、−O−、−N(Z32)−または−C(Z33)(Z34)−であり、
Z21ないしZ23、及びZ31ないしZ34は互いに独立に、水素;重水素;ハロゲン原子;ヒドロキシル基;シアノ基;ニトロ基;カルボン酸基;C1−C60アルキル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC1−C60アルキル基;C2−C60アルケニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC2−C60アルケニル基;C2−C60アルキニル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC2−C60アルキニル基;C1−C60アルコキシ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC1−C60アルコキシ基;C3−C60シクロアルキル基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基及びカルボン酸基のうち一つ以上で置換されたC3−C60シクロアルキル基;C5−C60アリール基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリール基;C5−C60アリールオキシ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリールオキシ基;C5−C60アリールチオ基;重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC5−C60アリールチオ基;C2−C60ヘテロアリール基;または重水素、ハロゲン原子、ヒドロキシル基、シアノ基、ニトロ基、カルボン酸基、C1−C60アルキル基及びC1−C60アルコキシ基のうち一つ以上で置換されたC2−C60ヘテロアリール基であり、
tは、1ないし8の整数であり、
uは、1ないし5の整数である。
【請求項9】
下記化学式1Aまたは1Bで表示されることを特徴とする請求項1に記載の縮合環化合物:
【化8】

前記化学式1A及び1Bで、R1ないしR5、L1、L2、a及びbは、請求項1に記載のとおりである。
【請求項10】
下記化合物14,20,22,30,31,43,101,104,110,120,123,133,139,149,154または157であることを特徴とする請求項1に記載の縮合環化合物。
【化9】

【請求項11】
第1電極と、前記第1電極に対向した第2電極と、前記第1電極と前記第2電極との間に介在された第1層と、を含み、
前記第1層が請求項1〜10のうち、いずれか1項に記載の縮合環化合物を1種以上含む有機発光素子。
【請求項12】
前記第1層が、正孔注入層、正孔輸送層、正孔注入機能及び正孔輸送機能を同時に有する機能層、電子阻止層、発光層、正孔阻止層、電子輸送層、電子注入層、並びに電子輸送機能及び電子注入機能を同時に有する機能層のうち少なくとも1層を含むことを特徴とする請求項11に記載の有機発光素子。
【請求項13】
前記第1層が発光層を含み、前記発光層に、前記縮合環化合物が含まれていることを特徴とする請求項12に記載の有機発光素子。
【請求項14】
前記発光層に含まれた前記縮合環化合物が、ホストまたはドーパントの役割を行うことを特徴とする請求項13に記載の有機発光素子。
【請求項15】
前記発光層に、2種の互いに異なる前記縮合環化合物が含まれており、2種の互いに異なる縮合環化合物のうち一つは、ホストの役割を行い、他の一つは、ドーパントの役割を行うことを特徴とする請求項13に記載の有機発光素子。
【請求項16】
前記第1層が、電子輸送層を含み、前記電子輸送層に、前記縮合環化合物が含まれていることを特徴とする請求項12に記載の有機発光素子。
【請求項17】
前記電子輸送層が、金属含有化合物をさらに含むことを特徴とする請求項16に記載の有機発光素子。
【請求項18】
前記第1層が電子輸送層をさらに含み、前記電子輸送層は、前記発光層に含まれた縮合環化合物と異なる縮合環化合物を含むことを特徴とする請求項13に記載の有機発光素子。
【請求項19】
前記第1層が電子輸送層をさらに含み、前記電子輸送層は、前記発光層に含まれた縮合環化合物と異なる縮合環化合物を含むことを特徴とする請求項15に記載の有機発光素子。
【請求項20】
前記第1層が、前記正孔注入層、前記正孔輸送層、並びに前記正孔注入機能及び正孔輸送機能を同時に有する機能層のうち少なくとも1層を含み、前記正孔注入層、前記正孔輸送層、並びに前記正孔注入機能及び正孔輸送機能を同時に有する機能層のうち少なくとも1層が電荷生成物質をさらに含むことを特徴とする請求項12に記載の有機発光素子。
【図1】




【公開番号】特開2013−1707(P2013−1707A)
【公開日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願番号】特願2012−106809(P2012−106809)
【出願日】平成24年5月8日(2012.5.8)
【出願人】(512187343)三星ディスプレイ株式會社 (73)
【氏名又は名称原語表記】Samsung Display Co.,Ltd.
【住所又は居所原語表記】95,Samsung 2 Ro,Giheung−Gu,Yongin−City,Gyeonggi−Do,Korea
【Fターム(参考)】
【公開日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願日】平成24年5月8日(2012.5.8)
【出願人】(512187343)三星ディスプレイ株式會社 (73)
【氏名又は名称原語表記】Samsung Display Co.,Ltd.
【住所又は居所原語表記】95,Samsung 2 Ro,Giheung−Gu,Yongin−City,Gyeonggi−Do,Korea
【Fターム(参考)】
[ Back to top ]

