繊維状タンパク質を生産する工程と繊維状タンパク質を用いた治療方法
球状タンパク質構造を繊維状タンパク質構造に変える方法。上記方法は、球状タンパク質を供給する工程と、上記球状タンパク質を含む溶液を調製する工程と、上記球状タンパク質を含む上記溶液に界面活性剤を加える工程と、上記溶液を少なくとも70 kDaの孔径を有する分子サイジングカラムに注ぐ工程と、界面活性剤を含む溶液で溶出させる工程とを含む。アンフォールディングしたタンパク質構造を繊維状タンパク質構造に変える方法。上記方法は、球状タンパク質を供給する工程と、上記球状タンパク質を含む溶液を調製する工程と、球状タンパク質をアンフォールディングさせる目的で尿素を上記溶液に加える工程と、上記溶液を分子サイジングカラムに注ぐ工程と、界面活性剤を含む溶液で溶出させる工程とを含む。癌治療の方法であって、タンパク質を供給する工程と、上記タンパク質を繊維構造に変える工程と、治療上有効な量の繊維構造タンパク質を必要とする患者に投与する工程とを含む。ワクチンアジュバント又は抗原アジュバントを製造する方法であって、タンパク質を供給する工程と、上記タンパク質を繊維構造に変える工程とを含む。
【発明の詳細な説明】
【技術分野】
【0001】
本願は、2008年4月11日に出願した米国特許出願12/082,634号、米国仮特許出願61/036,432号、2008年5月30日に出願した英国特許出願809919.4号及び2008年3月13日に出願した米国仮特許出願61/036,432号について優先権を主張し、それぞれの内容を参照によって、ここに組み込まれる。
【0002】
本開示で、アンフォールディングしたネイティブタンパク質から繊維構造へフォールディングする方法と、細胞アポトーシスを誘導する目的で及びワクチンアジュバントとして繊維構造タンパク質を利用する方法を開示する。
【背景技術】
【0003】
これまでの研究で、幾つかのタンパク質は、糖化(Bouma, et al. J Bio Chem 278(43):41810-41819: 2003)、高温度でのインキュベーション(Sagis, et al. Langmuir 20(3):924-927: 2004)又は超音波処理(Stathopulos, et al. Protein Sci 13(11):3017-3027: 2004)の後に、繊維構造を形成することが明らかになっている。しかし、これらの方法は、しばしば高濃度のタンパク質、激しい振盪、繊維化の種による補助を必要とし、そして一般的に長い時間かかり、外気温で1月近くインキュベートする。加えて、凝集体を形成し沈殿させない限り、そのような方法では、非繊維状タンパク質から繊維状タンパク質を単離することができない。
【0004】
球状タンパク質構造から繊維状タンパク質構造に変える方法を開示する。上記方法は、球状タンパク質を供給する工程と、上記球状タンパク質を含む溶液を調整する工程と、上記球状タンパク質を含む上記溶液に界面活性剤を加える工程と、少なくとも約70 kDaの孔径を有する分子サイジングカラムに上記溶液を注ぐ工程とを有する。1つの態様において、上記方法は界面活性剤を含む溶液で繊維状タンパク質を溶出させる工程を有する。
【0005】
本開示における他の態様において、癌治療に関する方法を開示する。上記方法は、タンパク質を供給する工程と、上記タンパク質を繊維構造に変える工程と、治療上有効な量の上記繊維構造タンパク質を必要とする患者に投与する工程とを有する。
【0006】
アジュバントを製造する方法を開示する。上記方法は、タンパク質を供給する工程と、上記タンパク質を繊維構造に変える工程とを有する。
【0007】
本開示において、上述した特徴及び目的は、添付図面とともに次の説明を参照することで更に明らかになるだろう。そこでは、同一の参照符号は同一の要素を表す。
【図面の簡単な説明】
【0008】
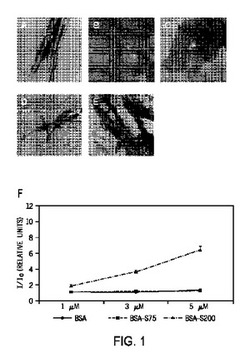
【図1a−e】図1a-eは、様々なタンパク質のTEMイメージである。
【図1f】図1fは、種々の濃度のBSA-S200に関する、チオフラビンT(ThT)の蛍光レベルを示すグラフである。
【図2a】図2aは、BSA-ZwitのTEMイメージである。
【図2b】図2bは、BSA-HW55SのTEMイメージである。
【図3a】図3aは、種々の濃度の様々なタンパク質に関する細胞毒性を示す棒グラフである。
【図3b】図3bは、様々な濃度の抗α5β1抗体で処理した後の、Aktに対するBSA-S200の効果を示すウエスタンブロットである。
【図3c】図3cは、種々の濃度のBSA-S200及び抗α5β1抗体に関する細胞毒性を示す棒グラフである。
【図4】図4は、様々なタンパク質のRGDモチーフ及び分子量に関する細胞毒性を示す棒グラフのコレクションである。
【図5a−b】図5a-bは、様々なタンパク質でインキュベートしたBHK-21細胞の顕微鏡イメージである。
【図5c】図5cは、カスパーゼ-3活性を示すグラフである。
【図6a】図6aは、様々な濃度のBSA-S200に関する細胞毒性を示すグラフである。
【図6b】図6bは、インテグリンα5β1タンパク質とBSA-S200及びネイティブBSAとの結合を示す免疫ブロットである。
【図7a−d】図7a-dは、F-BSA及び抗インテグリンα5β1抗体で処理したBHK-21細胞のウエスタンブロットである。
【図8】図8は、種々の濃度の様々なタンパク質に関するThTの蛍光レベルを示すグラフである。
【図9】図9は、Superdex-75カラムから溶出する、種々の濃度の様々なタンパク質調製物に関する細胞毒性を示すグラフである。
【図10a−e】図10a-eは、様々なタンパク質の構造を示すTEMイメージである。
【図10f−g】図10f-gは、種々の濃度のBSA-S200及びFN-S200に関するThTの蛍光レベルを示すグラフである。
【図11a】図11aは、抗TLR2抗体及び抗FMDV抗体とRAW 264.7細胞由来の溶解物との結合を示す免疫ブロットである。
【図11b−g】図11b-gは、免疫蛍光で染色している、BSA及びBSA-S200のイメージである。
【図12a−d】図12a-dは、様々なタンパク質で処理した細胞のNFκBレポータールシフェラーゼレベルを示すグラフである。
【図13a−c】図13a-cは、種々の濃度の様々なタンパク質でインキュベートしたRAW 264.7細胞のIL-6及びIL-8発現を示すグラフである。
【発明を実施するための形態】
【0009】
本開示は、繊維状タンパク質を生産する工程と繊維状タンパク質を用いた治療方法に関する。この工程は、操作の容易性、生産物の均一性、及びスケールアップの実現可能性を有する点で有利である。更に、タンパク質の繊維化は、この工程によると、繊維化の種で補助することなく誘導が可能である。わずかなタンパク質量であっても、この工程を適用できるであろう。ここで用いる“タンパク質”は、1以上のタンパク質、タンパク質断片、ポリペプチド又はペプチドを含む。タンパク質は、合成のタンパク質と天然のタンパク質の両方を含む。
【0010】
本開示に従い、球状タンパク質構造を繊維状タンパク質構造に変える方法が開示される。上記方法は、配列に関係なく、単純且つ迅速な方法で、ネイティブタンパク質を繊維形状に変える目的で用いることができる。上記方法は、球状タンパク質を供給する工程と、上記タンパク質を少なくとも70 kDaの孔径を有する分子サイジングカラムに注ぐ工程と、界面活性剤を含む溶液で上記タンパク質を溶出する工程とを有する。
【0011】
例示的な実施形態において、上記方法は球状タンパク質を供給する工程と、上記球状タンパク質を含む溶液を調整する工程と、上記球状タンパク質を含む上記溶液に界面活性剤を加える工程と、上記溶液を少なくとも70 kDaの孔径を有する分子サイジングカラムに注ぐ工程とを有する。
【0012】
例示的な実施形態において、上記方法は、球状タンパク質を供給する工程と、上記球状タンパク質を含む溶液を調整する工程と、上記球状タンパク質を含む上記溶液に界面活性剤を加える工程と、上記溶液を少なくとも約70 kDaの孔径を有する分子サイジングカラムに低濃度の界面活性剤の存在下で注ぐ工程とを有する。
【0013】
本開示における他の態様で、アンフォールディングしたタンパク質構造を繊維状タンパク質構造に変える方法が開示される。上記方法は、アンフォールディングしたタンパク質を供給する工程と、上記タンパク質を尿素の存在下で分子サイジングカラムに注ぐ工程とを有する。例示的な実施形態において、上記方法は、アンフォールディングしたタンパク質を8 Mの尿素の存在下で供給する工程と、上記タンパク質を70 kDa未満の孔径を有する分子サイジングカラムに界面活性剤の存在下で注ぐ工程とを有する。タンパク質をアンフォールディングさせるために加える尿素は、必ずしも8Mに限定されない。他のモル比であってもアンフォールディングするだろうし、アンフォールディングする程度はアンフォールディングさせるタンパク質による。
【0014】
球状タンパク質は、スフェロタンパク質(spheroprotein)とも知られており、2つある主なタンパク質の三次構造クラスの内の1つである。球状タンパク質は、一般的に可溶性であり、水中で球状の分子を形成する。これは、二次構造モチーフ(α-ヘリックス、β-シート、及びループ構造)が混ざり合う複雑な二次構造をとる。もう1つの主なタンパク質の三次構造クラスは、繊維状タンパク質、又は線維状(fibrous)タンパク質である。繊維状タンパク質は、一般的には不溶性であり、細長い形状をとる。これらは、単純な二次構造をとり、多くの場合、ただ1つの種類の二次構造モチーフに基づいている。
【0015】
例示的な実施形態において、上記球状タンパク質は、アルブミン、フィブロネクチン、口蹄疫ウイルスの組換カプシドタンパク質VP1(rVP1)、口蹄疫ウイルスの組換カプシドタンパク質VP2(rVP2)、口蹄疫ウイルスの組換カプシドタンパク質VP3(rVP3)、又はVP1、VP2、VP3及びVP4の前駆体タンパク質P1である。上記タンパク質は、VP1、VP2、VP3、及び/又はVP4からの複数の部分(例:VP2とVP4の両方の部分を含むVP42)を含むキメラタンパク質であってもよい。他の球状タンパク質を用いてもよく、それには天然に生じるタンパク質と合成オリゴペプチドの両方が含まれる。球状タンパク質は、一般的に溶液の形として溶けている。例示的な実施形態において、球状タンパク質はPBSに溶けている。
【0016】
サーファクタントは、ここでは界面活性剤とも言われ、水の表面張力をより低くし、有機化合物の溶解度を上げる物質である。界面活性剤は、カチオン性、アニオン性、及び両性界面活性剤を含むイオン性のものや、非イオン性のものであってもよい。界面活性剤は、タンパク質中の非共有結合を破壊し、その結果、タンパク質を変性させ、本来の形状又はコンフォメーションを失わせる役割を担う。例示的な実施形態において、用いた界面活性剤は、ドデシル硫酸ナトリウム(SDS)であって、Sigmaから入手した。他の例示的な実施形態において、用いた界面活性剤は、Zwittergent 3-14であって、Calbiochemから入手した。
【0017】
アミロイドは、線維状であるクロス-βタンパク質の凝集体である。多くのタンパク質は、繊維状の形態、原繊維構造、クロス-β回折パターン、β-構造の増加、コンゴーレッド結合、及びThT結合を含む特徴を有するアミロイド様の繊維に変えることが可能である。例示的な実施形態において、球状タンパク質をアミロイド様の繊維形状に変え、変えたタンパク質は、そのアミロイド様の特性によって同定することが可能になる。
【0018】
球状タンパク質構造を繊維状タンパク質構造に変え、それらを分離する工程において、クロマトグラフィを用いてもよい。一般的に、クロマトグラフィは、カラムを用いることで成し遂げられるが、他の方法(例:薄層クロマトグラフィの使用)を用いることも可能である。クロマトグラフィの技術には、サイズ排除、アフィニティ、及びイオン交換が含まれる。バッチ式での繊維状タンパク質の生産も可能ではあるが、カラムを用いる工程は、迅速で、安定であり、効率的且つ連続的に球状タンパク質を繊維形状に変えることが可能である。この工程のスケールアップも、カラムの使用で可能である。
【0019】
例示的な実施形態において、少なくとも約70 kDaのビーズ孔径を有するサイズ排除クロマトグラフィを用いた。用いるビーズ孔径は、球状タンパク質の様々な特徴(例えば、球状タンパク質のサイズ)に基づいて変更してもよい。孔径により、タンパク質がビーズマトリクスに入ることでき、これにより機械的な力が引き起こされ、この力がタンパク質のアンフォールディング/フォールディングに寄与し、繊維集合(fibrillogenic ensemble)を高める。例示的な実施形態において、用いる分子サイジングカラムはSuperdex 200である。他の例示的な実施形態において、用いる分子サイジングカラムはHW55Sである。
【0020】
カラムクロマトグラフィのために、カラムを溶出させる目的で低濃度の界面活性剤を含む緩衝液を用いてもよい。幾つかの態様においては、分子サイジングカラムは、25 mM Tris-HCL、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % SDSを含む緩衝液で溶出させる。他の例示的な実施形態において、分子サイジングカラムは、25 mM Tris-HCL、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % Zwittergent 3-14を含む緩衝液で溶出させる。溶出液は分画して回収してもよく、その後、繊維状タンパク質を含む画分を一緒にしてプールしてもよい。プールした画分は、更にフィルターを通して繊維状タンパク質を精製し、分離(例:PBSで透析しSDSを除去)してもよい。
【0021】
本開示における他の態様においては、癌治療の方法を開示する。上記方法は、タンパク質を供給する工程と、上記タンパク質を繊維構造に変える工程と、治療上有効な量の上記繊維構造のタンパク質を必要とする患者に投与する工程とを有する。タンパク質を繊維形状に変更することで、標的細胞に対する細胞毒性を高める。
【0022】
例示的な実施形態において、癌は、腎臓癌、乳癌、肺癌、前立腺癌、肝臓癌、又は卵巣癌である。癌治療に用いるタンパク質は、アルブミン、フィブロネクチン、rVP1、rVP2、rVP3、P1、又はキメラタンパク質(VP1、VP2、VP3、及び/又はVP4からの複数の部分を有するもの)である。例示的な実施形態において、繊維状タンパク質は、Aktシグナル経路を調節することで、癌細胞アポトーシスの誘導に関与する。ある例では、繊維状タンパク質は、Aktの非活性化を引き起こすインテグリンα5β1又はαvβ3を調節する。他の例では、繊維状のアルブミンはインテグリンに結合し、主にインテグリン/FAK/Akt/GSK-3β/カスパーゼ-3経路を介して細胞アポトーシスを引き起こす。
【0023】
例示的な実施形態によれば、上記タンパク質を、組成物の一部として投与してもよい。組成物は、粉末、クリーム、ゲル、軟膏(salves)、軟膏(ointments)、溶液、タブレット、カプセル、スプレー、及びパッチを含む様々な形態であってもよい。組成物を患者に送達させる目的で、媒体及び担体を用いてもよい。そのような担体には、可溶化剤、希釈剤、及び分散媒が含まれる。これらの担体は、生体適合性があり、薬剤として許容可能であり、そして繊維状タンパク質の治療特性を変えない。賦形剤、アジュバント及び他の成分も、組成物に含まれていてもよい。
【0024】
組成物の投与は、身体における種々の部位に対してさまざまな方法を通じて行ってもよく、その方法には静脈、皮内、皮下、経口(例:吸入)、経皮(即ち、局所)、経粘膜的、腹腔内、腫瘍内、及び直腸投与が含まれる。
【0025】
「治療上有効な量」という表現は、任意の治療に対して適用できる合理的な利益/リスク比で、ある所望の効果を生み出す量のことをいう。上記有効量は、治療中の疾患若しくは状態、投与している特定の対象構成物、患者の大きさ、又は疾患若しくは状態の重症度のようなファクターによって変えてもよい。当業者は、実験的に特定の化合物の有効量を過度の実験をすることなく決めることができる。
【0026】
癌治療のためのタンパク質は、疾患の重症度や癌細胞に対する所望の細胞毒性に基づいて選択してもよい。例示的な実施形態において、癌細胞に対する細胞毒性をより強くする目的で、RGDモチーフを有するタンパク質及び/又はより大きな分子量が選択される。
【0027】
本開示の他の態様において、ワクチンを製造する方法を開示する。上記方法は、タンパク質を供給する工程と、上記タンパク質を繊維構造に変える工程とを有する。この繊維構造のタンパク質を、特定疾患に対するワクチンとして患者に投与してもよい。
【0028】
本開示の他の態様において、ワクチン又は免疫学的アジュバントを製造する方法を開示する。上記方法は、タンパク質を供給する工程と、上記タンパク質を繊維構造に変える工程とを有する。アジュバントは、それ自身が特定の抗原性をもたないが、免疫系を刺激し、ワクチンへの応答を高めることができる。例示的な実施形態において、上記タンパク質はトール様受容体2(TLR2)を通じて先天性免疫応答を活性化させる。繊維状タンパク質は、TLR2を活性化しサイトカインの産生を誘導する一方で、上記タンパク質が天然の状態では活性化させない。
【0029】
他の実施形態において、抗原を繊維形状に変えて、抗原性とアジュバント効果の両方を持たせ、免疫応答を高める追加のアジュバントを必要としないワクチンを抗原から作製してもよい。
【実施例】
【0030】
本開示における更なる完全な理解は、以下の具体的な実施例及び図を参照することにより得られる。実施例及び図は、単に説明の目的で記述しているだけであって、なんら開示範囲を制限するものではない。形式上の変更や対応する言葉への置換は、周囲の状況から都合の良いものを意味又は表現し得ることを意図している。特定の用語が、ここでは採用されているが、そのような用語は、記述的な意義を意図するものであって、なんらその意義を制限する意図はない。上述した開示内容の変形形態及び変更形態は、その精神と範囲を逸脱することがなければ、行うことが可能であり、そして更に、付随の請求項によって示されている場合においてのみ制限が課せられるべきである。
【0031】
実施例1
材料及び方法
材料
phospho-Ser473 Aktに対する抗体は、Cell Signaling Technology, Incから入手した。Zwittergent 3-14は、Calbiochemから入手した。フィブロネクチン(FN)、抗アクチン抗体、抗インテグリンα5β1ポリクロナール抗体(機能阻害抗体)、西洋わさびペルオキシダーゼ結合抗マウスIgG二次抗体、西洋わさびペルオキシダーゼ結合抗ラビットIgG二次抗体及びMTTアッセイキットは、Chemicon International, Incから購入した。BSAは、Bio Basic Incから購入した。チオフラビンT(ThT)とドデシル硫酸ナトリウム(SDS)は、Sigmaから購入した。
【0032】
組換VP1及びVP3の発現と精製
VP1及びVP3は、口蹄疫ウイルス(FMDV)におけるカプシドタンパク質の構成要素である。組換VP1タンパク質は、大腸菌で発現させた後、精製し、リフォールディングした。これらの手順は、既に述べられている手順に従った(Yang, et al. Journal of Gene Medicine 7:708-717: 2005)。VP3遺伝子を、PCRにより、プラスミドpIBSY1-P1から5’-CCGGGATCCAAGCTTGGGATTTTCCCCGTGGCA-3’と5’-CCGCTCGAGTTGGGTTCGGGCGTCGAC-3’をプライマーとして増幅し、N末端にBamHIサイトをC末端にXhoIサイトをそれぞれ導入した。制限酵素で消化した後、増幅した遺伝子を、pET24a(+)(Novagene, WI)のBamHIサイトとXhoIサイトの間に結合し、DH5αコンピテント細胞に形質転換した。同定された陽性クローンは、シーケンスによって検証されたものであり、これを用いて大腸菌BL21(DE3)コンピテント細胞に形質転換した。組換VP3タンパク質は、大腸菌で発現させた後、精製し、リフォールディングした。これらの手順は、既に述べられている手順に従った(Yang, et al. Journal of Gene Medicine 7:708-717: 2005)。
【0033】
繊維状タンパク質の調製
20 mg BSA(Bio Basic Inc.)を10 ml PBSに溶解し、SDS(10 %; w/v)を、最終濃度が1 %になるまで加えた。水溶液用のソニケーターで5分間超音波処理をした後、続いてSDS含有タンパク質溶液をSuperdex-200カラム(2.6 cm × 100 cm, Amersham Biosciences)に注いだ。Superdex-200カラムは、事前に、25 mM Tris-HCl、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % SDSを含む緩衝液で平衡化しておいた。BSAを含む画分をプールした。プールした画分を、PBSで透析し、SDSを除いた。フィブロネクチン(Fibronection)繊維状タンパク質もまた同様のプロトコールを用いることで調製した。
【0034】
透過型電子顕微鏡(TEM)
透過型電子顕微鏡(TEM)により繊維状タンパク質を分析する目的で、1 mg/mlのタンパク質を200-メッシュの炭素被覆銅グリッドに加えた。余分なサンプルを除き、グリッドを風乾した。タンパク質を有するグリッドを、1 %(W/V)リンタングステン酸で1分間ネガティブ染色した。透過型電子顕微鏡の写真は、Hitachi H-7000電子顕微鏡を用いて20,000-150,000× の拡大率、75 kVで観察した。
【0035】
チオフラビンT(ThT)蛍光
チオフラビンT(ThT)は、アミロイド様特性のマーカーの1種である。蛍光を測定する目的で、濃度を上げたタンパク質(1 μM、3 μM、及び5 μM)を、20 μMのThTと共にインキュベートした。室温で1時間のインキュベーションの後、Wallac VICTOR2 1420マルチラベルカウンター(Perkin Elmer life science)を用いて、同じものを3回独立して蛍光を測定した。励起波長と発光波長は、それぞれ355nm、535nmである。緩衝液からのThT背景信号を、対応する測定値から差し引いた。
【0036】
細胞株及び処理
BHK-21細胞(ハムスターの腎臓由来)とT47D細胞株(ヒト乳管癌)を、10 % ウシ胎児血清 (FBS)、2 mM L-グルタミン、100 units/ml ペニシリン、及び100 μg/ml ストレプトマイシンを補充したダルベッコ変法イーグル培地(DMEM)において37℃で維持した。細胞を単層培養で一晩培養した。細胞を2度PBSで洗浄し、FBSを除いたDMEM中において、望ましい時間細胞をタンパク質で処理した。いくつかの細胞を、望ましい時点で0.2 mlのリシスバッファー(Pierce)で溶解し、20-μlのサンプルで、ウエスタンブロッティングによりAktのリン酸化を分析した。
【0037】
細胞生存率分析
細胞生存率を、MMT比色分析により測定した。対数増殖期の細胞(BHK-21細胞は1×104; T47D細胞株は1.25×104)を、10 % FBSを含むDMEM入りの96-ウェルのプレートに蒔き、24時間の生育の後、FBSを除いたDMEM中において、8時間37℃で、上記細胞を一連の濃度の繊維状タンパク質で処理した。処理後、MTT溶液を各ウェル(0.5 mg/ml)に加え、4時間インキュベートした。生存細胞の数は、ホルマザンの生産に直接比例するため、イソプロパノールでの可溶化後に、ELISAプレートリーダーを用いて560 nmで分光光度的に測定可能である。
【0038】
SDS-PAGE及び免疫ブロット分析
Hoefer垂直ゲル装置(Amersham Biosciences)を用いた10 % SDS-PAGEゲルで、サンプルを分離し、続いて電気泳動的にフッ化ポリビニリデン膜(Pall Corporation)へ転写した。上記膜を、5 % スキムミルク粉末を含むPBST中にて1時間ブロッキングし、ブロッキング緩衝液中にて一次抗体(5-10 μg/ml)と共にインキュベートした。上記膜をPBST中で洗浄し、続いて西洋わさびペルオキシダーゼ結合二次抗体(Chemicon)と共にインキュベートした。抗体は、化学発光(SuperSignal West Pico, Pierce)をBiomax MLフィルム(Eastman Kodak)に感光させることで検出した。
【0039】
図
図1 Superdex-200クロマトグラフィは、Superdex-75クロマトグラフィと違い、繊維状タンパク質の形成を促進させる。
TEMイメージから、(A)は繊維構造のBSA-S200が示されるが、(B)は球状構造のBSA-S75が示される。コントロールのBSAも球状構造(C)を示す。VP1-S200(D)とVP3-S200(E)の2つの組換タンパク質は、大腸菌で発現され、Superdex 200カラムでリフォールディングされたものであって、TEMアッセイにおいて繊維構造を示す。Fは、濃度を上げたBSA-S200を20μMのアミロイド特異的な色素ThTと共にしたインキュベーションが、BSA及びBSA-S75と比較して、ThTの蛍光レベルを増加させた結果である。値は3回測定したものである。表示するデータは平均値 ± S.D. (n=3)である。
【0040】
図2 界面活性剤又はビーズマトリクスに関係なくアミロイド様繊維を形成する。
TEMイメージから、繊維構造のBSA-Zwit(A)とBSA-HW55S(B)が示される。
【0041】
図3 繊維状タンパク質によって誘導される細胞死は、Aktシグナル経路を経由する。
BHK-21細胞を、無血清培地における様々な濃度のBSA、BSA-S75、BSA-S200、BSA-Zwit、又はBSA-HW55Sで8時間処理した。処理後、細胞生存率をMTTアッセイにより測定した。表示するデータは、平均値 ± S.D. (n=3) (A)である。BHK-21細胞を、30分間、抗α5β1抗体で前処理し又は前処理せずに、3 μMのBSA-S200で、望ましい時間処理した。処理後、抗phospho-Akt(p-Akt)を一次抗体としたウエスタンブロッティングにより、細胞溶解物を分析した(B)。Cは、T47D細胞株を、30分間、抗α5β1抗体で前処理し又は前処理せずに、無血清培地における様々な濃度のBSA-S200で、8時間処理したものである。処理後、細胞生存率をMTTアッセイで測定した。表示するデータは、平均値 ± S.D. (n=3)である。
【0042】
図4 BHK-21細胞に対する細胞毒性に関する、繊維状タンパク質のRGDモチーフ及び分子量の効果
(A)は、BHK-21細胞を、0.5 μMのVP1-S200、VP3-S200、BSA-S200、FN-S200、又はFNで8時間無血清培地中にて処理したものである。処理後、細胞生存率をMTTアッセイにより測定した。表示するデータは、平均値 ± S.D. (n=3)である。(B)は、BHK-21細胞を、濃度を上げたVP3-S200で8時間無血清培地中にて処理したものである。処理後、細胞生存率を、MTTアッセイにより測定した。表示するデータは、平均値 ± S.D. (n=3)である
【0043】
結果
アミロイド様繊維の形成に対するカラムのビーズ孔径及びビーズマトリクスの効果
ウシ血清アルブミン(BSA)は、球状タンパク質である。SDSを、BSA溶液に加え、Superdex -200カラム(600 KDaまでの孔径を有する)に注ぎ、25 mM Tris-HCl、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % SDSを含む緩衝液で溶出させた。Superdex-200カラムから得られたBSAタンパク質(BSA-S200)は、透過型電子顕微鏡(TEM)による分析で示される通り、繊維構造を表し(図1A)、アミロイド特異的な色素チオフラビンT(ThT)の蛍光が、用量依存的に強まった(図1F)。繊維の形成に対するカラムビーズの孔径の効果を調べる目的で、より小さい孔径(わずか3-70 kDaのMW範囲のもの)のSuperdex-75カラムを今回の実験で用いた(表1)。TEM分析から、Superdex 75から溶出したBSA(BSA-S75)は、BSAのように、球状構造を示し(図1B及びC)、アミロイド特異的な色素ThTの蛍光を高めない(図1F)ことが明らかとなった。大腸菌で発現させ、尿素で抽出し、アフィニティーカラムで精製した組換VP1(rVP1)と組換VP3(rVP3)も、上述の通り、界面活性剤と共にクロマトグラフィを行い、Superdex-S200カラムを通してリフォールディングを行った。TEMデータから、VP1-S200(図1D)とVP3-S200(図1E)も、繊維構造を示すことが明らかになった。繊維状タンパク質の形成に対するカラムのビーズマトリクスの効果が示された。HW55Sビーズは、Superdex-200と同様のビーズ特性(700 KDaまでの孔径を有する)を有するが、異なるマトリクス複合材料(表1)として、比較のために用いた。HW55Sクロマトグラフィから溶出したBSA(BSA-HW55S)は、TEMによる観察で繊維構造が示された(図2B)。これらのデータは、70 kDaを超える孔径を有するSuperdex-200(S200)やHW55Sのような分子サイジングカラムが、アミロイド様の繊維状タンパク質の形成を促進させることを示している。
【0044】
【表1】

【0045】
アミロイド様繊維の形成に対する界面活性剤の効果
Zwittergent 3-14は、幅広いpH範囲に対応する両性イオンの性質を保持する界面活性剤であり、陰イオン又は陽イオン化合物のいずれにも不可逆的な結合をしないと推定されている。ここで、Superdex-200クロマトグラフィにおける繊維状BSAの形成に対するZwittergent 3-14の効果を調べた。Zwittergent 3-14をBSA溶液(1 % Zwittergent 3-14)に加え、25 mM Tris-HCl、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % Zwittergent 3-14を含む緩衝液による溶出で、Superdex-200カラムを通過することによって及び/又は通過中に、BSAをリフォールディングさせた。Zwittergent 3-14を含むSuperdex-200カラムから得られたBSAタンパク質(BSA-Zwit)は、TEM下で繊維構造を示した(図2A)。これらのデータは、界面活性剤(例:SDS及びZwittergent 3-14)とビーズの孔径が繊維状タンパク質の形成にとって重要であることを示している。
【0046】
Aktの不活性化により細胞死を誘導する繊維状タンパク質
rVP1には、BHK-21細胞と様々な癌細胞株に対して細胞毒性があることは以前から明らかにされている。我々の方法で誘導した繊維状タンパク質が細胞に対する細胞毒性を有するか否かを試験する目的で、BHK-21細胞を無血清培地における様々な濃度のBSA-S200、BSA-Zwit、又はBSA-HW55Sで処理した。BSA-S200、BSA-Zwit、及びBSA-HW55Sの全てが、用量依存的に細胞死を引き起こすことが明らかになった(図3A)。BSA-Zwitが、全ての試験の中で最も強い細胞毒性を示した。0.5 μMの濃度の時、ほぼ100 %の細胞毒性を誘導した一方で、BSA-S 200は、35 %の細胞毒性を誘導し、BSA-HW55Sは、10 %の細胞毒性を誘導した。BSA-Zwit、BSA-S200及びBSA-HW55SのIC50は、それぞれ0.2、0.75 μMと10 μM超えであった。コントロールとして、2つの球状タンパク質である、ネイティブBSAとBSA-S75を用いた。そして、細胞に対する細胞毒性をほとんど又は全く誘導しないことが明らかとなった(図3A)。繊維状タンパク質により誘導される細胞死が、Aktシグナル経路を介するか否かを明らかにする目的で、BHK-21細胞を、30分間、抗α5β1抗体で前処理し又は前処理せずに、3 μMのBSA-S200で、望ましい時間処理した。データから、BSA-S200は、rVP1-S200とrVP3-S200のように、時間依存的にAktを不活性化することが明らかになった。加えて、Aktに対するBSA-S200の阻害効果が、濃度を上げた抗α5β1抗体による前処理によって明らかになった(図3B)。
【0047】
更に、繊維状タンパク質によって誘導される細胞死に対する抗α5β1抗体の効果を試験した。濃度を上げた抗α5β1抗体を用いて30分間、T47D細胞株(乳癌株)を前処理し、次にBSA-S200と共に細胞を無血清培地において8時間インキュベートした。細胞生存率の結果から、抗α5β1抗体を用いた、T47D細胞株の前処理が、BSA-S200の細胞毒性効果を弱毒化することが示された(図3C)。これらのデータは、Aktシグナル経路を調節することで癌細胞に対する細胞毒性を繊維状タンパク質が有することを示している。
【0048】
細胞に対する細胞毒性に関する、繊維状タンパク質のRGDモチーフ及び分子量の効果
RGDモチーフは、インテグリンのリガンドである。繊維状タンパク質が、インテグリン/Aktシグナル経路を調節することを通じて細胞死を誘導することが明らかにされている。フィブロネクチンは、RGDモチーフを有し且つ分子量が450 kDのタンパク質であって、SDS存在下でSuperdex200から溶出された時は、繊維構造であることも示された(FN-S200)(データは示さない)。BHK-21細胞に対する4つの繊維状タンパク質(即ち、rVP1-S200、FN-S200、rVP3-S200及びBSA-S200)の細胞毒性を比較した(図4A)。RGDモチーフを有する繊維状タンパク質(例:rVP1-S200及びFN-S200)には、RGDモチーフをもたないもの(例:BSA-S200及びrVP3-S200)よりも細胞毒性があることが明らかとなった。加えて、より分子量が高い繊維状タンパク質には、より分子量が低いものよりも細胞毒性を有していた。FN-S200(MW= 450 kD)は、VP1-S200(MW= 26 kD)よりも細胞毒性を有することが示された(図4A)。BSA-S200(MW= 66 kD)は、VP3-S200(MW= 26 kD)よりも細胞毒性を有することが示された(図4A)。VP3-S200は、図4Aの通り、0.5 μMの濃度においては、ほとんど細胞毒性を示さないが、より濃度が高いVP3-S200では、用量依存的に細胞毒性を誘導した(図4B)。以上より、RGDモチーフを有する繊維状タンパク質と、よりMWの高い繊維状タンパク質は、RGDモチーフをもたないものや、より分子量が低いものよりも細胞に対する細胞毒性を有する。
【0049】
抗癌剤としての繊維状タンパク質rVP1のインビトロ及びインビボにおける研究
組換VP1(rVP1)は、ドキソルビシンやタクソールよりも、インビトロにおける癌細胞の生育阻害に効果的である。インビトロにおけるrVP1の細胞毒性の効果は、MTT試薬を用いて評価した。rVP1のIC50値は、ドキソルビシンのIC50値よりも、4つの異なる肺癌、及び卵巣癌細胞株(A549、H146、H23、H23/0.3、及びSK-OV-3細胞)と正常な肺線維細胞株(WI-38)において低かった。より高い阻害効果が、ドキソルビシンやタクソールで処理した細胞との比較において、rVP1で処理したSK-OV-3細胞に対しても観察された。BNL細胞に対するrVP1のIC50値は、AML 12細胞(正常のマウス肝細胞株)よりも低いことから、rVP1は、マウスHCC細胞に対する細胞毒性が正常の肝細胞よりも強いことが示された。
【0050】
rVP1処理が腫瘍の生育を阻害し、HCCを有するマウスの生存を伸ばした。
BNL細胞を、BALB/cマウスの皮下に注射し、250 mm3の腫瘍容積が、腫瘍を注射してからおよそ2週間で検出された。4つのグループに分けたマウスに、週3回、3週間、rVP1(25 mg/kg、75 mg/kg、又は100 mg/kg)又はPBSを腫瘍内に注射した。rVP1で処理したマウスは、未処理のマウスよりも腫瘍容積が小さく、rVP1の投与量がより高いと、より強い効果を示した。コントロールのグループと処理したグループとの間における腫瘍容積の差には、統計的に有意な差があった(25 mg/kg、P < 0.05; 75 mg/kg 及び100 mg/kg、P < 0.001)。
【0051】
2グループに分けたマウスだけを用いた他の類似実験においても、rVP1(75 mg/kg)で処理したマウスの腫瘍容積は、PBSを投与しているコントロールマウスよりも小さかった。rVP1又はPBSで処理したマウスの生存期間の中央値は、それぞれ11.5週と13.5週であった。2グループ間の生存期間の差は、log-rank検定より計算され、その結果には統計的に有意な差があった。
【0052】
rVP1処理が、ヒト卵巣腫瘍を有するヌードマウスの生存率を上げる。
rVP1処理を、2ステージ腹腔内注射によって実施した。ヒト卵巣腫瘍を有するヌードマウスは、最初の注射を4時間受けた。この最初の注射は、SK-OV-3細胞をip注射で腹水に導入した後に行った。そして、異なる投与量のrVP1(15、50、150 mg/kg)を、48時間ごとに10回注射した。処理を10日間一時的に中断した後、再開し、rVP1注射を48時間ごとに5回繰り返した。rVP1注射(15と50 mg/k/g)を受けているマウスは、コントロールマウスと比較して生存率がより高かった。
【0053】
考察
アミロイド繊維の調製に用いられる通常の方法は、37℃でしばらくの間熟成させる方法である。多くの場合、数日から数週間の熟成期間を必要とする。複数の報告から、繊維形成はSDSによって促進させることが可能であるが、いまだ37℃一晩の激しい撹拌、室温で2日間のインキュベーション、又は繊維化の種の補助を必要としていることが明らかにされている。更に、これら全ての方法は、バッチ式の生産に属する。
【0054】
本研究において、カラムの使用が、改良した工程であって、繊維状タンパク質の形成を界面活性剤(SDS又はZwittergent 3-14)の存在下で、繊維化の種を使用せずに促進させる工程である(図1A、D、及びE; 図2A及びB)。また、このカラム工程を用いることで、迅速で、安定であり、効率的且つ連続的に、球状タンパク質を繊維形状へ変えられる。加えて、この工程はスケールアップもまた容易である。これまでの研究から、様々な構造を有する多くのタンパク質は、疾患に関するものと疾患に関係ないものの両方に関するタンパク質を含むものであって、アミロイドを形成し得ることが明らかにされている。様々なタンパク質から、種々の配列と構造に対してこのカラムクロマトグラフィ工程を適用することができ、そして繊維状タンパク質(例:BSA-S200、rVP1-S200、rVP3-S200及びFN-S200)に変え得ることが明らかになった(図1A、D、及びE)。カラムにより誘導される繊維形成の至適条件を明らかにする目的で、この工程において、繊維形成に影響を与える可能性のある幾つかのファクターに関して研究を行った。
【0055】
研究結果より、ビーズの孔径はカラムにより誘導される繊維形成にとって重要な役割を担っていることが示された。Superdex-200カラムは、Superdex-75カラムよりも大きいビーズの孔径を有する(表1)。Superdex 75カラムが繊維形成を促進できない(図1B)ことを説明すると以下のようになる。それは、ビーズの孔径が制限されていることで、タンパク質がビーズマトリクスに入ることを制限され、その結果、機械的な力の欠如が引き起こされているためである。この力が、タンパク質のアンフォールディング/フォールディングを引き起こし、繊維集合を高めることに寄与している。以上より、機械的な力と界面活性剤が、カラムにより誘導される繊維形成に関与していることが明らかになった。
【0056】
インテグリンは、膜内在性レセプターのファミリーであって、細胞接着分子として機能する。各インテグリンは、α-及びβ-サブユニットの非共有結合性会合によって形成するヘテロ二量体である。哺乳類種において、インテグリンファミリーは、24個の異なるヘテロ二量体から構成されており、それぞれの組織分布は明確に異なっている。インテグリンは、様々なプロセスに寄与しており、それには細胞と細胞外マトリクスとの間の結合や、細胞増殖、細胞形態、細胞遊走、及びアポトーシスを含む様々なプロセスを調節するシグナル伝達経路の誘導が含まれる。
【0057】
これまでの研究で、アミロイド繊維は神経細胞に対して細胞毒性を示すことが明らかになっている。これまでの研究で、α2β1及びαVβ1インテグリンシグナル経路がアミロイド-βにより誘導される神経毒性を媒介することも実証された。本研究で、繊維状タンパク質がインテグリンα5β1を調節することで癌の細胞死を誘導することが明らかにされた(図3B及び3C)。インテグリンのシグナル伝達は、Akt経路を活性化することができる。
【0058】
アミロイドは、その由来に関係なく、神経細胞に対して細胞毒性を示す。アミロイドにより誘導される細胞毒性のメカニズムは、アミロイドを形成するペプチドと脂質膜との相互作用に関係しているであろう。しかし、癌細胞に対する繊維状タンパク質の細胞毒性効果は、これまで報告されていない。我々は、SDSの補助を受けて、カラムにより誘導された繊維状タンパク質が、ヒトの癌細胞株に対して細胞毒性を示すことを明らかにした(図3C)。BSA-S200では、T47D細胞株において、濃度が2 μMのとき細胞生存率が70 %減少する結果となった(図3C)。
【0059】
最後に、RGDモチーフを有する繊維状タンパク質の細胞毒性効果を、RGDモチーフをもたない繊維状タンパク質と比較した。RGDモチーフは、インテグリンのリガンドであって、多くの機能(例:細胞遊走、細胞接着、細胞増殖)を調節する。これらの結果から、RGDモチーフを有する繊維状タンパク質は、RGDモチーフをもたない繊維状タンパク質と比較して、細胞に対する細胞毒性をより有することが示された(図4A)。繊維状タンパク質の分子量が、繊維状タンパク質により誘導される細胞毒性に関与することも明らかになった(図4A)。
【0060】
実施例2
材料と方法
材料
phospho-Try576/577 FAK、phospho-Ser473 Akt、及びphospho-Ser9 GSK-3βに対する抗体は、Cell Signaling Technology(Beverly, MA, USA)から購入した。phospho-Tyr397 FAKに対する抗体は、Biosource(Camirillo, CA, USA)から入手した。Zwittergent 3-14は、Calbiochem(San Diego, CA, USA)から購入した。インテグリンα5β1タンパク質、抗β-アクチン抗体、抗インテグリンα5抗体、抗インテグリンα5β抗体(機能阻害抗体)、西洋わさびペルオキシダーゼ結合抗マウスIgG二次抗体、西洋わさびペルオキシダーゼ結合抗ラビットIgG二次抗体、及びMTTアッセイキットは、Chemicon(Temecula, CA, USA)から購入した。抗BSA抗体は、Molecular Probes(Eugene, OR, USA)から入手した。BSAは、Bio Basic Inc.(Canada)から購入した。Aβ25-35は、Sigma(St. Louis, MO, USA)から購入し、滅菌した二重蒸留水に溶かし、37℃で3日間、使用前に熟成させた。チオフラビンT(ThT)、ドデシル硫酸ナトリウム(SDS)、4,6’-ジアミジノ-2-フェニルインドールジラクテート(DAPI)、及び他の化学薬品は、特に断りがなければ、Sigma(St. Louis, MO, USA)から入手した。Superdex-200、Superdex-75ビーズは、Amersham Biosciences(Uppsala, Sweden)から入手し、HW55Sゲル濾過ビーズは、TOSOH Corporation(Shiba, Tokyo, Japan)から入手した。
【0061】
繊維状BSA(F-BSA)の調製
20ミリグラムのBSA(Bio Basic Inc.)を、1 % SDS(w/v)含有の10 mlのPBSに溶かした。BSAの溶液を5分間超音波処理し、次にSuperdex-200、又はHWS55カラム(2.6 cm × 100 cm)に注いだ。上記カラムは、予め緩衝液(25 mM Tris-HCl、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % SDS)で平衡化しておいた。BSAを含む画分をプールした。プールした画分を、PBSで透析し、SDSを除いた。
【0062】
透過型電子顕微鏡(TEM)
透過型電子顕微鏡(TEM)により繊維状タンパク質を分析する目的で、1 mg/mlのタンパク質を200-メッシュの炭素被覆銅グリッドに加えた。余分なサンプルを除き、グリッドを風乾した。タンパク質を有するグリッドを、1 %(W/V)リンタングステン酸で1分間ネガティブ染色した。透過型電子顕微鏡の写真は、Hitachi H-7000 電子顕微鏡を用いて20,000-150,000× の拡大率、75 kVで観察した。
【0063】
チオフラビンT(ThT)の蛍光
蛍光を測定する目的で、濃度を上げたタンパク質(10 μM、20 μM、及び40 μM)を、20 μMのThTと共にインキュベートした。室温で1時間のインキュベーションの後、Wallac VICTOR2 1420マルチラベルカウンター(Perkin Elmer life science)を用いて、同じものを3回独立して蛍光を測定した。励起波長と発光波長は、それぞれ430nm、486nmである。緩衝液からのThT背景信号を、対応する測定値から差し引いた。
【0064】
細胞株及び処理
BHK-21細胞(ハムスターの腎臓由来; ATCC CRL-1632)とT47D細胞(ヒト乳管癌; ATCC HTB-133)を、10 % ウシ胎児血清(FBS)、2 mM L-グルタミン、100 units/ml ペニシリン、及び100 μg/ml ストレプトマイシンを補充したダルベッコ変法イーグル培地(DMEM)において37℃で維持した。簡潔に記述すると、処理する24時間前に、細胞を蒔いた。細胞を2度PBSで洗浄し、タンパク質と共に無血清DMEMにおいて、望ましい時間インキュベートした。望ましい時点において、0.2 mlのリシスバッファー(Pierce)で細胞を溶解し、30 μgの細胞溶解物で、ウエスタンブロッティングによりFAK、Akt、及びGSK-3βのリン酸化を分析した。
【0065】
細胞生存率分析
細胞生存率を、MTT比色分析により測定した。対数増殖期の細胞(BHK-21細胞は1×104; T47D細胞は1.25×104)を、10 % FBSを含むDMEM入りの96-ウェルのプレートに蒔き、24時間インキュベートした。一連の濃度のタンパク質での細胞処理を、無血清DMEM中において、8時間37℃で実施した。処理後、MTT溶液を各ウェル(0.5 mg/ml)に加え、4時間インキュベートした。生存細胞の数は、ホルマザンの生産に直接比例するため、イソプロパノールでの可溶化後に、ELISAプレートリーダーを用いて560 nmで分光光度的に測定可能である。
【0066】
SDS-PAGE及び免疫ブロット分析
Hoefer垂直ゲル装置(Amersham Biosciences)を用いた10 % SDS-PAGEゲルで、細胞溶解物を分離し、続いて電気泳動的にフッ化ポリビニリデン膜(Pall Corporation)へ転写した。上記膜を、5 % スキムミルク粉末を含むTBST緩衝液(5 mM Tris-HCl、pH 7.4、136 mM NaCl、0.1 % Tween-20)中にて1時間ブロッキングし、ブロッキング緩衝液中にて一次抗体(5-10 μg/ml)と共にインキュベートした。上記膜をTBST中で洗浄し、続いて西洋わさびペルオキシダーゼ結合二次抗体(Chemicon)と共にインキュベートした。抗体は、化学発光(SuperSignal West Pico, Pierce)をBiomax MLフィルム(Eastman Kodak)に感光させることで検出した。
【0067】
免疫沈降アッセイ
当量(20 μl)のプロテインA/Gビーズ(Santa Cruz Biotechnology)を、抗インテグリンα5β1抗体を介して、一方はインテグリンα5β1タンパク質で予めコーティングをし、他方はコーティングをしなかった。得られたビーズを、球状BSA(G-BSA)又は繊維状BSA(F-BSA)のいずれかと共に、一晩4℃にてインキュベートした。インキュベートの後、免疫複合体をPBSで3回洗浄し、抗インテグリンα5抗体及び抗BSA抗体を用いた免疫ブロットティングによって明らかにした。
【0068】
カスパーゼ-3活性アッセイ
カスパーゼ-3活性は、製造業者の取扱説明書に従い、蛍光基質z-DEVD-AMC(Upstate Biotechnology)の開裂により測定した。簡潔に記述すると、細胞を回収し、PBSで2回洗浄し、タンパク質分解酵素阻害剤の混合物(Sigma)を補充したリシスバッファー(Pierce)で溶解した。溶解物を、12,000 × gで15分間、4℃にて遠心分離をし、上清のタンパク質濃度を、Bio-Radタンパク質アッセイを用いて測定した。50 μg量の細胞溶解物を、72 μMのz-DEVD-AMCと共に室温で、15分間、同じものを3つ独立してインキュベートした。z-DEVD-AMCの開裂を、蛍光プレートリーダーを用いて、380 nmで励起した後に460 nmの発光を測定することで測定した。
【0069】
図
図5 繊維状BSAのアポトーシス効果
(A)は、BHK-21細胞を、1 μMのG-BSA(BSA)又はF-BSA(BSA-S200)と共に3時間インキュベートしたものである。細胞を蛍光顕微鏡で観察し、これらの核をDAPI(全てのパネルの倍率は、×400である)で染色した。(B)は、BHK-21細胞を40 μMのAβ25-35と共に3時間インキュベートしたものである。細胞を蛍光顕微鏡で観察し、これらの核をDAPI(全てのパネルの倍率は、×400である)で染色したものである。(C)は、BHK-21細胞を0.8 μMのG-BSA又はF-BSAと共に15時間、無血清培地で培養し、そしてカスパーゼ-3活性分析を行ったものである。カスパーゼ-3活性を、材料と方法で説明した蛍光基質によって測定した。表示するデータは、実験回数が3回の平均値 ± SDである。
【0070】
図6 繊維状BSA(F-BSA)とインテグリンα5β1との間の相互作用
(A)は、T47D細胞株を、30分間、抗インテグリンα5β1抗体で前処理し又は前処理せずに、無血清培地において様々な濃度のF-BSA(BSA-S200)と共に、8時間処理したものである。処理後、細胞生存率を、MTTアッセイにより測定した。表示するデータは、平均値 ± S.D. (n=3)である。(B)は、インテグリンα5β1タンパク質を、抗インテグリンα5β1抗体を介してプロテインA/Gビーズに結合し、F-BSA(BSA-S200)又はネイティブBSA(G-BSA)と共に一晩培養したものである。免疫複合体をSDS-PAGEで分離し、抗インテグリンα5抗体と抗BSA抗体で免疫ブロット(IB)した。
【0071】
図7 繊維状BSA(F-BSA)は、インテグリン/FAK/Akt経路により細胞毒性を誘導する。
(A)は、BHK-21細胞を、3 μMのF-BSAと共に無血清培地で、望ましい時間処理し、細胞溶解物を抗phospho-FAK(Tyr 576/577)又は抗phospho-FAK(Tyr 397)を一次抗体として用いて、ウエスタンブロッティングにより分析したものである。(B)は、BHK-21細胞を、30分間、抗インテグリンα5β1抗体で前処理し又は前処理せずに、3 μMのF-BSAと共に無血清培地で、望ましい時間処理したものである。処理後、細胞溶解物を、一次抗体である抗phospho-Akt(p-Akt)と抗phospho-GSK-3β(p-GSK-3β)を用いてウエスタンブロッティングにより分析した。β-アクチンは、標準化を目的とする内部標準としての役割を果たしている。(C)は、BHK-21細胞を、濃度を上げたネイティブBSAと共に無血清培地で1時間処理し、細胞溶解物を、一次抗体である抗phospho-Akt(p-Akt)を用いてウエスタンブロッティングにより分析したものである。(D)は、BHK-21細胞を、無血清培地で1時間、抗インテグリンα5β1抗体で前処理し又は前処理せずに、細胞溶解物を、一次抗体である抗phospho-Akt(p-Akt)を用いてウエスタンブロッティングにより分析したものである。
【0072】
結果
繊維状BSAは、BHK-21細胞においてアポトーシスを誘導した。
F-BSAにより誘導される細胞毒性が、細胞アポトーシスと関連しているか否かを実験する目的で、DAPI染色と、カスパーゼ-3活性を測定した。実験結果から、繊維状BSAは、BSA及びアミロイド(図5B)と比較して、核の凝縮を誘導(図5A)し、カスパーゼ3活性を上昇させる(図5C)ことが明らかとなった。以上より、これらの結果から、F-BSAは細胞のアポトーシスを誘導することが示された。
【0073】
繊維状BSAは、インテグリン/FAK/Akt/GSK-3β経路を介してアポトーシスを誘導した。
BHK-21細胞に加えて、F-BSAは、図6Aに図示するように、癌細胞(例:T47D細胞(乳癌株))に対する細胞毒性を示した。F-BSAのアポトーシス効果が、様々なプロセス(例:細胞増殖、細胞形態、細胞遊走、及びアポトーシス)を調節するとして知られているインテグリンを経由しているか否か実験する目的で、T47D細胞を、濃度を上げた抗α5β1抗体で30分間、前処理し、F-BSA(例えば、BSA-S200)と共に8時間、無血清培地中でインキュベートした。細胞生存率の結果から、抗α5β1抗体で前処理したT47D細胞は、F-BSAの細胞毒性効果を減少させることが示された(図6A)。F-BSAとインテグリンとの相互作用を、免疫沈降法によって更に検証した。コントロールビーズ又はインテグリンα5β1タンパク質結合ビーズとBSA又はF-BSAとのインキュベーションから、F-BSAはインテグリンα5β1と結合し、BSAとは結合しないことが明らかとなった(図6B)。
【0074】
インテグリンシグナル経路のカスケードに関する分子(例:接着斑キナーゼ(FAK)、Akt及びGSK-3β)が、F-BSAによって影響を受けるか否かを調べた。結果から、F-BSAはFAKの397番目のチロシン(Tyr 397)を時間依存的に脱リン酸化するが、FAKの576/577番目(Tyr 576/577)は、時間依存的には脱リン酸化しない(図7A)ことが明らかとなった。ウエスタンブロットからも、F-BSAはAktとGSK-3βを、時間依存的に脱リン酸化すること(図7B)が明らかになった。AktとGSK-3βのリン酸化に関するF-BSAの効果は、濃度を上げた抗α5β1抗体で細胞を前処理することで逆転した(図7B)。相対的に、ネイティブBSAと抗α5β1抗体は、Aktのリン酸化に効果がなかった(図7C及び7D)。これらの結果から、F-BSAはインテグリン/FAK/Akt/GSK-3β/カスパーゼ-3経路を介してアポトーシスを誘導することが示された。
【0075】
考察
ネイティブBSAは、インテグリンのリガンドではないが(図6B)、F-BSAはインテグリンα5β1に結合することで、細胞アポトーシスを引き起こす(図5と6)。F-BSAは、インテグリンα5β1に結合することで、細胞アポトーシスを媒介するが、これは、FAK(Tyr 397)、Akt及びGSK-3βの脱リン酸化を引き起こすことで起こる。本研究で生産されるF-BSAは、Aβによる誘導とは異なるメカニズムを介してインテグリンシグナル経路を不活性化しているように見える。
【0076】
BSAは、RGD(インテグリンの唯一の結合モチーフ)を有していないため、インテグリンに対する繊維状BSAの結合メカニズムが、配列にRGDを有する分子とまったく同じであるとは思えない。注目すべきは、たとえ、あるRGDをもつペプチドが細胞毒性を示しても、他のもの(例:フィブロネクチン)が細胞毒性を示さないこともある(Fornaro, et al. Journal of Biological Chemistry 278(50): 50402-504011: 2003)。
【0077】
実施例3
Superdex-75は、8Mの尿素存在下で、アンフォールディングしたBSAの繊維形成を誘導することが明らかとなった。組換VP1は、約8Mの尿素存在下でSuperdex-75により繊維形成が誘導されることも明らかとなった。このことは、ThTレベルの高まり(図8)と細胞毒性(図9)を通じて証明された。8Mの尿素を用いることに、制限はなく、他のモル比であっても、同程度またはそれよりも低い程度でアンフォールディングが促進されるであろう。
【0078】
実施例4
材料と方法
材料
TLR2に対する抗体は、Abcamから入手した。抗TLR2モノクローナル抗体(アンタゴニスト抗体)は、eBioscienceから購入した。コントロールIgG、フィブロネクチン(FN)、及び西洋わさびペルオキシダーゼ結合抗ラビットIgG二次抗体は、Chemiconから購入した。ウシ血清アルブミン(BSA)は、Bio Basic Incから購入した。抗BSA抗体は、Invitrogenから購入した。チオフラビンT(ThT)及びドデシル硫酸ナトリウム(SDS)は、Sigmaから購入した。
【0079】
大腸菌におけるVP3の発現
VP3は、口蹄疫ウイルス(FMDV)のカプシドタンパク質の構成要素である。VP3遺伝子を、PCRにより、プラスミドpIBSY1-P1(Yang, et al. The Journal of Gene Medicine 7:708-717: 2005)から5’-CCGGGATCCAAGCTTGGGATTTTCCCCGTGGCA-3’と5’-CCGCTCGAGTTGGGTTCGGGCGTCGAC-3’をプライマーとして増幅し、BamHIサイトをN末端に、XhoIサイトをC末端にそれぞれ導入した。組換VP3(大腸菌由来)の精製及びアッセイを容易にする目的で、T7タグ及びHisタグを、VP3遺伝子のN末端とC末端にそれぞれ付加した。制限酵素消化の後、増幅した遺伝子を、pET24a(+)(Novagene, WI)のBamHIとXhoIサイトの間に結合し、DH5αコンピテント細胞に形質転換した。同定された陽性クローンは、シーケンスにより検証された。プラスミドpVP3は、陽性クローンの1つから単離されてものであって、これを用いて大腸菌BL21(DE3)コンピテント細胞に形質転換した。組換VP3(rVP3)を、Wang, et al. Vaccine 21:3721-3729: 2003.に記載されている手順に従い、大腸菌で発現させた後に精製した。
【0080】
カラムクロマトグラフィによる繊維状タンパク質の調製
BSA-S200及びFN-S200を調製する目的で、タンパク質(2 mg/ml)を溶かした10 ml PBSを調整し、次に、SDS(10 %; w/v)を加え、最終濃度を1 %とした。5分間の超音波処理の後、SDSを含むタンパク質溶液を、Superdex-200カラム(2.6 cm × 100 cm, Amersham Biosciences)又はSuperdex-75カラムに注いだ。上記カラムは、予め緩衝液(25 mM Tris-HCl、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % SDSを含有)で平衡化しておいた。タンパク質を含む画分をプールした。プールした画分を、SDSを除く目的でリン酸緩衝食塩水(PBS)にて4.5時間(3回; 1.5時間/1回)透析した。
【0081】
透過型電子顕微鏡(TEM)
透過型電子顕微鏡(TEM)により、カラムクロマトグラフィを通す工程を行ったタンパク質又は行わなかったタンパク質を分析する目的で、等量のタンパク質を200-メッシュの炭素被覆銅グリッドに加えた。余分なサンプルを除き、グリッドを風乾した。タンパク質を有するグリッドを、1 %(W/V)リンタングステン酸で1分間ネガティブ染色した。透過型電子顕微鏡の写真を、Hitachi H-7000電子顕微鏡を用いて20,000-150,000× の拡大率、75 kVで記録した。
【0082】
チオフラビンT(ThT)蛍光
蛍光を測定する目的で、濃度を上げたタンパク質を、20 μMのThTと共にインキュベートした。室温で1時間のインキュベーションの後、Wallac VICTOR2 1420マルチラベルカウンター(Perkin Elmer life science)を用いて、同じものを3回独立して蛍光を測定した。励起波長と発光波長は、それぞれ355nm、535nmである。緩衝液からのThT背景信号を、対応する測定値から差し引いた。
【0083】
細胞株
マウスのマクロファージ細胞株RAW 264.7とヒト胎児腎臓細胞株(HEK 293T)を、37℃で10 % ウシ胎児血清(FBS)、2 mM L-グルタミン、100 units/ml ペニシリン、及び100 μg/ml ストレプトマイシンを補充したダルベッコ変法イーグル培地(DMEM)において、湿気のある5 % CO2の環境下に維持した。
【0084】
SDS-PAGE及び免疫ブロット分析
Hoefer垂直ゲル装置(Amersham Biosciences)を用いた10 %又は12 % SDS-PAGEゲルで、サンプルを分離し、続いて電気泳動的にフッ化ポリビニリデン膜(Pall Corporation)へ転写した。上記膜を、5 % スキムミルク粉末を含むPBST中にて1時間ブロッキングし、ブロッキング緩衝液中にて一次抗体(5-10 μg/ml)と共にインキュベートした。上記膜をPBST中で洗浄し、続いて西洋わさびペルオキシダーゼ結合二次抗体(Chemicon)と共にインキュベートした。抗体は、化学発光(SuperSignal West Pico, Pierce)をBiomax MLフィルム(Eastman Kodak)に感光させることで検出した。
【0085】
免疫沈降アッセイ
タンパク質分解酵素阻害剤の混合物(Sigma-Aldrich)を補充した、冷却したリシスバッファー(Pierce)で、RAW 264.7細胞を溶解した。等量のプロテインA/Gビーズを、一方はrVP3-S200で予めコーティングし、他方はコーティングしなかった。ビーズを、RAW 264.7細胞溶解物と共に一晩、4℃でインキュベートした。得られたビーズを、遠心分離で回収し、冷却したリシスバッファーで3回洗浄した。免疫複合体由来のタンパク質を、SDSサンプルバッファー中で加熱することにより溶出させ、SDS-PAGEで分析し、特異的な抗体で免疫ブロットした。
【0086】
免疫蛍光及び共焦点顕微鏡
RAW 264.7細胞のサブコンフルエントな単層は、24-ウェルの組織培養皿中で、12-mmのガラス製カバースリップ上で生育させたものであって、この単層を1時間、4℃、ウシ胎児血清(FBS)を除いたダルベッコ変法イーグル培地(DMEM)中で、BSA又はBSA-S200と共に処理した。処理後、単層をPBSで洗浄し、4 % パラホルムアルデヒドで固定した。固定後、パラホルムアルデヒドを除き、単層を一次抗体で1時間、室温でインキュベートした。二重標識を行うときは、細胞を、2つの抗体と共にインキュベートした。希釈した一次抗体は、以下の通り、抗TLR2(1/100)と抗BSA(1/200)である。PBSTで3回洗浄した後、細胞を、蛍光物質を結合した適切な二次抗体であるヤギ抗ラビットIgG(1/500; Alexa Fluor 488; Molecular Probes)又はヤギ抗マウスIgG(1/500; Alexa Fluor 555; Molecular Probes)と共に30分、室温でインキュベートした。このインキュベーションに続き、カバースリップをPBSTで3回洗浄し、マウントし、そしてLSM 510 META共焦点顕微鏡で調べた。
【0087】
ルシフェラーゼレポーター遺伝子アッセイ
ヒトTLR2を、一時的にヒト胎児腎臓(HEK293T)細胞で発現させ、サンプルに対するこれらの反応性についてアッセイした。HEK293T細胞に、ヒトTLR2遺伝子を有するpRK-FLAG-TLR2又はpcDNA3.1(コントロールとしての空ベクター)とNF-kB結合配列により制御されるルシフェラーゼレポーター遺伝子を含むpNFkB-Lucをトランスフェクトした。ルシフェラーゼ遺伝子は、NF-kBが結合配列に結合した時のみ発現する。トランスフェクション効率を標準化する目的で、上記細胞に、pcDNA3.1-β-galをコトランスフェクトした。プラスミドは、Lipofectamine2000(Invitrogen)を用いるトランスフェクションによりHEK293T細胞へ導入した。簡潔に記述すると、HEK293T細胞を、96-ウェルプレートにおいて1ウェルあたりの細胞濃度を2.5 X 104として、10 % 熱失活ウシ胎児血清(FBS)、100 units/ml ペニシリン及び100 μg/ml ストレプトマイシン塩を補充した0.1 ml ダルベッコ変法イーグル培地(DMEM)中で37℃一晩培養した。培地を、トランスフェクションの直前にOpti-MEMI(Invitrogen)へ置換した。トランスフェクション混合物は、25 μlのOPTI-MEMI培地で0.3 μlのLipofectamine2000を希釈し、0.1 μgのプラスミドDNA(0.01 μg/ウェル pRK-FLAG-hTLR又はpcDNA3.1(空ベクター)、0.07 μg/ウェル p5xNFkB-lucレポータープラスミド(Stratagene)及び0.02 μg/ウェル pcDNA3.1-βgal)入りの25 μlのOPTI-MEMIを、20分間の室温におけるインキュベーションの後に、希釈したものに加えることで調整した。DNA-Lipofectamine2000混合物を、細胞に添加し、静かに振盪することで混ぜた。37℃、5 % CO2の下で24時間のインキュベートした後、細胞をサンプルで刺激した。陽性コントロールとして、細胞をTLR2のリガンドであるPam3CSK4(InvivoGen)で刺激した。6時間後、細胞を溶解し、製造業者の取扱説明書に従いルシフェラーゼアッセイシステム(Promega)を用いてルシフェラーゼ活性をアッセイした。細胞を100 μlのPBSで2回洗浄し、100 μlのパッシブ(passive)リシスバッファー(Promega)に溶解した。20 μlの細胞溶解物を用いてルシフェラーゼ活性を測定した。各サンプルのルシフェラーゼ活性を、β-ガラクトシダーゼ活性で標準化した。実験データは、刺激をしていない、空ベクターをトランスフェクトしたコントロール細胞を基準とする倍数で増加を表した。
【0088】
ELISAによるサイトカインの定量化
一過性にトランスフェクトしたTLR2発現HEK293T細胞とマウスマクロファージ細胞株であるRAW264.7とを、それぞれ6又は24時間、TLR2-特異的リガンド又は繊維状タンパク質で刺激した。細胞培養上清を回収し、サイトカイン特異的ELISA(IL-6、IL-8及びTNF-α ELISAは、Biosource Internationalからのもの)で分析した。この分析は、製造業者のプロトコールに従って行った。
【0089】
図
図10 Superdex-200クロマトグラフィは、繊維状タンパク質の形成を促進する。
superdex200クロマトグラフィから調製されたBSA-S200、rVP3-S200、及びFN-S200の繊維構造を示すTEMイメージである(B、C、及びE)。コントロールである天然型BSA及びFNは、TEMイメージでは球状構造を示す(A及びD)。F及びGは、20μMのアミロイド特異的な色素ThTと共にBSA-S200又はFN-S200をインキュベーションすると、天然型のBSA又はFNと比較して、ThTの蛍光を高めることを示している。値は、3回独立して測定したものである。表示するデータは、n=3の時の平均値 ± SDである。
【0090】
図11 繊維状タンパク質は、TLR2と相互作用する。
(A)は、RAW 264.7細胞由来の溶解物を、rVP3-S200を固定したプロテインA/Gビーズ又はプロテインA/Gビーズ単独で一晩インキュベートし、プロテインA/Gビーズ-結合タンパク質をSDS-PAGEにより分離し、抗TLR2抗体又は抗FMDV抗体で免疫ブロットしたものを示している。BSA又はBSA-S200を、RAW 264.7単層に0.3 μMの濃度で、1時間4℃で吸着させた。材料及び方法に記述するIF染色で、細胞を処理した。BSA又はBSA-S200を、抗BSA抗体で染色し、Alexa Fluor 488(緑)で可視化し(B及びE)、そしてTLR2は、抗TLR2抗体で染色し、Alexa Fluor 555(赤)で可視化した(C及びF)。重ね合わせたイメージ(G)中の矢印は、いくつかの共局在する領域を示している。
【0091】
図12 TLR2を通る繊維状タンパク質シグナル
HEK293/TLR2細胞について、(A)は0.3 μMのrVP1で染色したものであって、(B)は0.2 μMのBSA、BSA-S200、FN、又はFN-S200で染色したものである。6時間後、細胞を溶解し、NFκBレポーターであるルシフェラーゼレベルを測定した。(C)は、HEK293/TLR2細胞を、pam3csk4(0.5 μg/ml)又は濃度を上げたSDSで刺激したものを示す。6時間後、細胞を溶解し、NFκBレポーターであるルシフェラーゼレベルを測定した。(D)は、HEK293/TLR2細胞を、10 μg/mlの中和抗TLR2抗体又はコントロールIgGで1時間、前処理したものを示す。細胞を、pam3csk4(0.5 μg/ml)、BSA-S200(0.2 μM)、FN-S200、又はrVP3-S200(0.2 μM)と共にインキュベートした。6時間後、細胞を溶解し、NFκBレポーターであるルシフェラーゼレベルを測定した。値は、3回独立して測定したものである。表示するデータは、n=3の時の平均値 ± SDである。
【0092】
図13 繊維状タンパク質により誘導されるサイトカインの産生は、TLR2を介する。
(A)は、RAW 264.7細胞を、種々の濃度のBSA又はBSA-S200でインキュベートしたものを示す。24時間後、培地中のIL-6をELISAで分析した。(B)は、HEK293/TLR2細胞を10 μg/mlの中和抗TLR2抗体又はコントロールIgGで1時間、前処理したものを示す。細胞を、pam3csk4(0.5 μg/ml)、BSA-200(0.2 μM)、FN-S200(0.2 μM)、又はrVP3-S200(0.2 μM)と共にインキュベートした。6時間後、培地中のIL-8をELISAで分析した。(C)は、RAW 264.7細胞を10 μg/mlの中和抗TLR2抗体又はコントロールIgGで1時間、前処理したものを示す。細胞を、BSA-200(0.2 μM)又はFN-S200(0.2 μM)と共にインキュベートした。24時間後、培地中のIL-6をELISAで分析した。値は、3回独立して測定したものである。表示するデータは、n=3の時の平均値 ± SDである。
【0093】
結果
Superdex-20カラムを通過した後のタンパク質は、アミロイド様の繊維特性を示す。
Superdex-200カラムを通過した後のタンパク質に関する構造上の特徴を決定する目的で、透過型電子顕微鏡(TEM)及びチオフラビンT(ThT)アッセイを用いた。TEM分析から、BSA-S200、rVP3-S200、及びFN-S200は、繊維構造(図10B、10C、及び10E)を示すことが明らかにされた。反対に、天然型のBSA及びFNは、球体構造(図10A及び10D)を示した。次に、アミロイド様繊維の蛍光発光を、特異的色素ThTとタンパク質とをインキュベートすることで試験した。データから、BSA-S200及びFN-S200は、ThTの蛍光発光を、用量依存的に強くすることが示された(図10F及び10G)。
【0094】
繊維状タンパク質は、TLR2と相互作用する。
RAW 264.7細胞におけるrVP3-S200とTLR2の結合を分析する目的で、免疫沈降プロトコールを用いて、RAW細胞溶解物にrVP3-S200でコートしたビーズ又はコントロールビーズをさらした。RAW細胞溶解物と、rVP3-S200が結合しているビーズ又はrVP3-S200が結合していないコントロールビーズとのインキュベーションから、rVP3-S200はTLR2に結合することが明らかになった(図11A)。BSA-S200がTLR2と共局在するか否を更に調べる目的で、共焦点免疫蛍光顕微鏡を行った。BSA又はBSA-S200を、4℃、1時間でRAW 264.7細胞に加え、そしてTLR2に対応するBSA又はBSA-S200の局在を共焦点顕微鏡により測定した。結果から、BSA-S200はTLR2と共局在し、BSAとは共局在しないことが示された(図11B-G)。
【0095】
繊維状タンパク質はTLR2を活性化する。
TLR2が過剰発現しているヒトの細胞を、rVP1-S200(0.3 μM)、BSA-S200(0.2 μM)又はFN-S200(0.2 μM)で刺激すると、NFκBの活性化に大きな影響を与えることになる一方、球形のBSA及びFNは、そのようなことを示さなかった(図12A及び12B)。TLR2の特異性を更に調べる目的で、TLR2が発現しているHEK293T細胞を、抗TLR2抗体で1時間、前処理し、細胞をpam3csk4(0.5 μg/ml)、BSA-S200(0.2 μM)、FN-S200(0.2 μM)、又はrVP3-S200(0.2 μM)で刺激した。pam3csk4は、TLR2のリガンドとして知られており、陽性コントロールとしての役割を果たす。6時間のインキュベーションの後、細胞を溶解し、NFκBの活性化を測定した。抗TLR2での前処理は、NFκB活性を著しく減少させる一方で、アイソタイプ抗体をコントロールとして前処理しても、そのようなことを示さなかった(図12D)。SDSを繊維状タンパク質の調製で使用したため、TLR2の活性化におけるSDSの効果も実験した。データから、濃度を上げたSDSは、TLR2の活性化に効果がないことが明らかになった(図12C)。注目すべきことは、SDSで処理し、Superdex-75カラムから溶出したBSA(BSA-S75)もTLR2の活性化効果を示したが、BSA-S200よりもその程度は低かった。
【0096】
繊維状タンパク質により誘導されるサイトカインの放出
RAW 264.7細胞を、種々の濃度のBSA又はBSA-S200でインキュベートした。24時間後、培地中のIL-6をELISAで分析した。BSA-S200は、IL-6の産生を、用量依存的に誘導するが、BSAはそのようなことを示さなかった(図13A)。サイトカインの産生とTLR2の関係を評価する目的で、TLR2阻害抗体を更なる実験で用いた。TLR2を発現しているHEK293T細胞(図13B)及びRAW 264.7細胞(図13C)の両方を抗TLR2抗又はコントロールIgGで1時間、前処理し、続いてpam3csk4(0.5 μg/ml)、BSA-S200(0.2 μM)、FN-S200(0.2 μM)、又はrVP3-S200(0.2 μM)で細胞を刺激し、IL-8及びIL-6の産生を測定した。BSA-S200、FN-S200、及びrVP3-S200の存在が、TLR2を発現しているHEK293T又はRAW 264.7細胞から産生されたIL-8及びIL-6のレベルの増加を引き起こした。他方で、抗TLR2抗体による前処理では、サイトカインの産生を著しく減少させたが、コントロールIgGではそのようなことを示さなかった(図13B及び13C)。
【0097】
考察
免疫沈降及び免疫蛍光の実験から、繊維状タンパク質はTLR2と結合することが明らかになった(図11)。TLR2は、トール様受容体のメンバーであって、微生物に共通して保存されている分子パターンに対する細胞応答を媒介する。TLR2は、様々なリガンドを認識し(Miyake. Seminars in Immunology 19:3-10: 2007; Kaisho, et al. Biochimica et Biophysica Acta 1589:1-13: 2002)、マクロファージのサイトカイン産生を促進させる(Tsuji, et al. Infection and Immunity 68:6883-6890: 2000; Basu, et al. The Journal of Biological Chemistry 279:7370-7377: 2004)。この研究で、カラムにより誘導される繊維状タンパク質は、RAW 264.7細胞におけるIL-6の産生を用量依存的に誘導することが明らかとなった(図13A)。RAW 264.7(図13C)又はTLR2を発現しているHEK293T細胞(図12C及び13B)を抗TLR2抗体で前処理すると、繊維状タンパク質により誘導されるサイトカインの産生は減少した。これらのデータから、カラムにより誘導される繊維状タンパク質は、TLR2のアゴニストを表し、免疫細胞からのサイトカイン放出を誘導することが示される。
【0098】
複数の研究から、アジュバント受容体としてのトール様受容体が実証されてきている(Hawkins, et al. The Journal of Pharmacology and Experimental Therapeutics 300:655-661: 2002)。フロイントアジュバントは、マウスの肝臓でTLR2発現を誘導する(Lim. International Immunopharmacology 3:115-118: 2003)。TLR2は、そのリガンドであるリポタンパク質のアジュバント活性を媒介する(Ishii, et al. Journal of clinical Immunology 27:363-371: 2007)。TLR2及びTLR4は、BCG-CWS(効果的な免疫アジュバントであるマイコバクテリウムの構成成分)の免疫応答にも関与している(Tsuji, et al. Infection and Immunity 68:6883-6890: 2000)。この研究は、TLR2の活性化を通じてサイトカインの産生を誘導する繊維状タンパク質の知見に関する。抗原を繊維形状に変えることは、抗原の抗原性を高める。従って、アジュバントの添加を必要としない。
【0099】
これらTLRの中で、TLR2が様々なリガンドを認識する。例えば、グラム陽性の細胞壁(Yoshimura, et al. J Immunol 163:1-5: 1999)、非定型のリポ多糖(LPS)(Bainbridge, et al. Cellular Microbiology 8:120-129: 2006; Reife, et al. Cellular Microbiology 8:857-868: 2006; Jotwani, et al. European Journal of Immunology 33:2980-2986: 2003)、ポリン(Massari, et al. J Immunol 176:2373-2380: 2006; Singleton, et al. J Immunol 174:3545-3550: 2005)、ペプチドグリカン(PGN)(Tsuji, et al. Infection and Immunity 68:6883-6890: 2000; Uehori, et al. Infection and Immunity 71: 4238-4249: 2003)、リポアラビノマンナン(Underhill, et al. Proc Nat Acad Sci 96:14459-14463: 1999; Means, et al. J Immunol 163:3920-3927: 1999; Tapping, et al. Journal of Endotoxin Research 9:264-268: 2003)、フェノール可溶性モジュリン(Hajjar, et al. J Immunol 166:15-19: 2001)、ビリオン(Compton, et al. Journal of Virology 77:4588-4596: 2003)、グライコイノシトールリン脂質(Campos, et al. J Immunol 167:416-423: 2001)、糖脂質(Opitz, et al. The Journal of Biological Chemistry 276:22041-22047: 2001)、リピドA(Onier, et al. International Journal of Cancer 81:755-760: 1999; Onier, et al. Clinical & Experimental Metastasis 17:299-306: 1999)、グライコリポタンパク質(Lopez, et al. J Immunol 170:2409-2416: 2003)、リポタンパク質/リポペプチド(Ozinsky, et al. Proc Nat Acad Sci 97:13766-13771: 2000; Hirschfeld, et al. J Immunol 163:2382-2386: 1999)、ザイモサン(Underhill, et al. Nature 401:811-815: 1999)、熱ショックタンパク質(HSPs)(Ohashi, et al. J Immunol 164:558-561: 2000; Asea, et al. The Journal of Biological Chemistry 277:15028-15034: 2002)細胞外マトリクス(ECM)構成成分(バイグリカン又はヒアルロン酸)(Schaefer, et al. The Journal of Clinical Investigation 115:2223-2233: 2005; Jiang, et al. Nature Medicine 11:1173-1179: 2005)、高移動度群ボックス1(HMGB1)(Park, et al. The Journal of Biological Chemistry 279:7370-7377: 2004)、細菌タンパク質又はウイルスタンパク質(Basu, et al. The Journal of Biological Chemistry 282:1039-1050: 2007)、リポホスホグリカン(LPG)(Becker, et al. Molecular and Biochemical Parasitology 130:65-74: 2003)、マクロファージ活性化リポペプチド-2(MALP-2)(Takeuchi, et al. International Immunology 13:933-940: 2001; Schneider, et al. Gut 53:355-361: 2004)、熱滅菌された細菌又は酵母(Flo, et al. J Immunol 164:2064-2069: 2000; Netea, et al. J Immunol 172:3712-3718: 2004; Taylor, et al. The Journal of allergy and Clinical Immunology 117:1148-1154: 2004)、外膜タンパク質A(Jeannin, et al Nature Immunology 1:502-509: 2000)、可溶性因子(Wyllie, et al. J Immunol 165:7125-7132: 2000; Henneke, et al. J Immunol 167:7069-7076: 2001)、及びリポタイコ酸(LTA)(Schwandner, et al. The Journal of Biological Chemistry 274:17406-17409: 1999; Han, et al. Infection and Immunity 71:5541-5548: 2003; Schroder, et al. The Journal of Biological Chemistry 278:15587-15594: 2003)がある。複数の研究から、TLR2により認識されるリガンドの多様性は、その他のTLRである、TLR1又はTLR6とヘテロ二量体を形成することによるものであることも示される(Bauer, et al. Proc Nat Acad Sci 98:9237-9242: 2001; Sugawara, et al. Microbiology and Immunology 47:327-336: 2003; Takeuchi, et al. Gene 231:59-65: 1999)。TLR1/TLR2のヘテロ二量体は、トリアシル化リポタンパク質を認識する一方で、TLR2/TLR6はジアシル化リポタンパク質を認識することが示されている(Takeuchi, et al. J Immunol 169:10-14: 2002)。
【0100】
方法及び試薬は、最も実用的で好ましい実施形態であると今現在考えられるものについて記述している一方で、本開示は、開示されている典型的な実施形態に必ずしも限定するものではないことが理解され、実施形態の修正や適応は、当業者であれば想到するであろうことは明らかである。請求項の精神と範囲内に含まれる様々な修正や同様の手順をカバーすることを意図するものであり、その範囲は、そのようなすべての修正や同様の仕組みを包含するような最も広い解釈と一致する範囲である。本開示は、次の請求項の全ての実施形態を含んでいる。
【図1A】

【図1B】

【図1C】

【図1D】

【図1E】

【図1F】

【図2A】

【図2B】

【図3A】

【図3B】

【図3C】

【図4A】

【図4B】

【図5A】

【図5B】

【図5C】

【図6A】

【図6B】

【図7A】

【図7B】

【図7C】

【図7D】

【技術分野】
【0001】
本願は、2008年4月11日に出願した米国特許出願12/082,634号、米国仮特許出願61/036,432号、2008年5月30日に出願した英国特許出願809919.4号及び2008年3月13日に出願した米国仮特許出願61/036,432号について優先権を主張し、それぞれの内容を参照によって、ここに組み込まれる。
【0002】
本開示で、アンフォールディングしたネイティブタンパク質から繊維構造へフォールディングする方法と、細胞アポトーシスを誘導する目的で及びワクチンアジュバントとして繊維構造タンパク質を利用する方法を開示する。
【背景技術】
【0003】
これまでの研究で、幾つかのタンパク質は、糖化(Bouma, et al. J Bio Chem 278(43):41810-41819: 2003)、高温度でのインキュベーション(Sagis, et al. Langmuir 20(3):924-927: 2004)又は超音波処理(Stathopulos, et al. Protein Sci 13(11):3017-3027: 2004)の後に、繊維構造を形成することが明らかになっている。しかし、これらの方法は、しばしば高濃度のタンパク質、激しい振盪、繊維化の種による補助を必要とし、そして一般的に長い時間かかり、外気温で1月近くインキュベートする。加えて、凝集体を形成し沈殿させない限り、そのような方法では、非繊維状タンパク質から繊維状タンパク質を単離することができない。
【0004】
球状タンパク質構造から繊維状タンパク質構造に変える方法を開示する。上記方法は、球状タンパク質を供給する工程と、上記球状タンパク質を含む溶液を調整する工程と、上記球状タンパク質を含む上記溶液に界面活性剤を加える工程と、少なくとも約70 kDaの孔径を有する分子サイジングカラムに上記溶液を注ぐ工程とを有する。1つの態様において、上記方法は界面活性剤を含む溶液で繊維状タンパク質を溶出させる工程を有する。
【0005】
本開示における他の態様において、癌治療に関する方法を開示する。上記方法は、タンパク質を供給する工程と、上記タンパク質を繊維構造に変える工程と、治療上有効な量の上記繊維構造タンパク質を必要とする患者に投与する工程とを有する。
【0006】
アジュバントを製造する方法を開示する。上記方法は、タンパク質を供給する工程と、上記タンパク質を繊維構造に変える工程とを有する。
【0007】
本開示において、上述した特徴及び目的は、添付図面とともに次の説明を参照することで更に明らかになるだろう。そこでは、同一の参照符号は同一の要素を表す。
【図面の簡単な説明】
【0008】
【図1a−e】図1a-eは、様々なタンパク質のTEMイメージである。
【図1f】図1fは、種々の濃度のBSA-S200に関する、チオフラビンT(ThT)の蛍光レベルを示すグラフである。
【図2a】図2aは、BSA-ZwitのTEMイメージである。
【図2b】図2bは、BSA-HW55SのTEMイメージである。
【図3a】図3aは、種々の濃度の様々なタンパク質に関する細胞毒性を示す棒グラフである。
【図3b】図3bは、様々な濃度の抗α5β1抗体で処理した後の、Aktに対するBSA-S200の効果を示すウエスタンブロットである。
【図3c】図3cは、種々の濃度のBSA-S200及び抗α5β1抗体に関する細胞毒性を示す棒グラフである。
【図4】図4は、様々なタンパク質のRGDモチーフ及び分子量に関する細胞毒性を示す棒グラフのコレクションである。
【図5a−b】図5a-bは、様々なタンパク質でインキュベートしたBHK-21細胞の顕微鏡イメージである。
【図5c】図5cは、カスパーゼ-3活性を示すグラフである。
【図6a】図6aは、様々な濃度のBSA-S200に関する細胞毒性を示すグラフである。
【図6b】図6bは、インテグリンα5β1タンパク質とBSA-S200及びネイティブBSAとの結合を示す免疫ブロットである。
【図7a−d】図7a-dは、F-BSA及び抗インテグリンα5β1抗体で処理したBHK-21細胞のウエスタンブロットである。
【図8】図8は、種々の濃度の様々なタンパク質に関するThTの蛍光レベルを示すグラフである。
【図9】図9は、Superdex-75カラムから溶出する、種々の濃度の様々なタンパク質調製物に関する細胞毒性を示すグラフである。
【図10a−e】図10a-eは、様々なタンパク質の構造を示すTEMイメージである。
【図10f−g】図10f-gは、種々の濃度のBSA-S200及びFN-S200に関するThTの蛍光レベルを示すグラフである。
【図11a】図11aは、抗TLR2抗体及び抗FMDV抗体とRAW 264.7細胞由来の溶解物との結合を示す免疫ブロットである。
【図11b−g】図11b-gは、免疫蛍光で染色している、BSA及びBSA-S200のイメージである。
【図12a−d】図12a-dは、様々なタンパク質で処理した細胞のNFκBレポータールシフェラーゼレベルを示すグラフである。
【図13a−c】図13a-cは、種々の濃度の様々なタンパク質でインキュベートしたRAW 264.7細胞のIL-6及びIL-8発現を示すグラフである。
【発明を実施するための形態】
【0009】
本開示は、繊維状タンパク質を生産する工程と繊維状タンパク質を用いた治療方法に関する。この工程は、操作の容易性、生産物の均一性、及びスケールアップの実現可能性を有する点で有利である。更に、タンパク質の繊維化は、この工程によると、繊維化の種で補助することなく誘導が可能である。わずかなタンパク質量であっても、この工程を適用できるであろう。ここで用いる“タンパク質”は、1以上のタンパク質、タンパク質断片、ポリペプチド又はペプチドを含む。タンパク質は、合成のタンパク質と天然のタンパク質の両方を含む。
【0010】
本開示に従い、球状タンパク質構造を繊維状タンパク質構造に変える方法が開示される。上記方法は、配列に関係なく、単純且つ迅速な方法で、ネイティブタンパク質を繊維形状に変える目的で用いることができる。上記方法は、球状タンパク質を供給する工程と、上記タンパク質を少なくとも70 kDaの孔径を有する分子サイジングカラムに注ぐ工程と、界面活性剤を含む溶液で上記タンパク質を溶出する工程とを有する。
【0011】
例示的な実施形態において、上記方法は球状タンパク質を供給する工程と、上記球状タンパク質を含む溶液を調整する工程と、上記球状タンパク質を含む上記溶液に界面活性剤を加える工程と、上記溶液を少なくとも70 kDaの孔径を有する分子サイジングカラムに注ぐ工程とを有する。
【0012】
例示的な実施形態において、上記方法は、球状タンパク質を供給する工程と、上記球状タンパク質を含む溶液を調整する工程と、上記球状タンパク質を含む上記溶液に界面活性剤を加える工程と、上記溶液を少なくとも約70 kDaの孔径を有する分子サイジングカラムに低濃度の界面活性剤の存在下で注ぐ工程とを有する。
【0013】
本開示における他の態様で、アンフォールディングしたタンパク質構造を繊維状タンパク質構造に変える方法が開示される。上記方法は、アンフォールディングしたタンパク質を供給する工程と、上記タンパク質を尿素の存在下で分子サイジングカラムに注ぐ工程とを有する。例示的な実施形態において、上記方法は、アンフォールディングしたタンパク質を8 Mの尿素の存在下で供給する工程と、上記タンパク質を70 kDa未満の孔径を有する分子サイジングカラムに界面活性剤の存在下で注ぐ工程とを有する。タンパク質をアンフォールディングさせるために加える尿素は、必ずしも8Mに限定されない。他のモル比であってもアンフォールディングするだろうし、アンフォールディングする程度はアンフォールディングさせるタンパク質による。
【0014】
球状タンパク質は、スフェロタンパク質(spheroprotein)とも知られており、2つある主なタンパク質の三次構造クラスの内の1つである。球状タンパク質は、一般的に可溶性であり、水中で球状の分子を形成する。これは、二次構造モチーフ(α-ヘリックス、β-シート、及びループ構造)が混ざり合う複雑な二次構造をとる。もう1つの主なタンパク質の三次構造クラスは、繊維状タンパク質、又は線維状(fibrous)タンパク質である。繊維状タンパク質は、一般的には不溶性であり、細長い形状をとる。これらは、単純な二次構造をとり、多くの場合、ただ1つの種類の二次構造モチーフに基づいている。
【0015】
例示的な実施形態において、上記球状タンパク質は、アルブミン、フィブロネクチン、口蹄疫ウイルスの組換カプシドタンパク質VP1(rVP1)、口蹄疫ウイルスの組換カプシドタンパク質VP2(rVP2)、口蹄疫ウイルスの組換カプシドタンパク質VP3(rVP3)、又はVP1、VP2、VP3及びVP4の前駆体タンパク質P1である。上記タンパク質は、VP1、VP2、VP3、及び/又はVP4からの複数の部分(例:VP2とVP4の両方の部分を含むVP42)を含むキメラタンパク質であってもよい。他の球状タンパク質を用いてもよく、それには天然に生じるタンパク質と合成オリゴペプチドの両方が含まれる。球状タンパク質は、一般的に溶液の形として溶けている。例示的な実施形態において、球状タンパク質はPBSに溶けている。
【0016】
サーファクタントは、ここでは界面活性剤とも言われ、水の表面張力をより低くし、有機化合物の溶解度を上げる物質である。界面活性剤は、カチオン性、アニオン性、及び両性界面活性剤を含むイオン性のものや、非イオン性のものであってもよい。界面活性剤は、タンパク質中の非共有結合を破壊し、その結果、タンパク質を変性させ、本来の形状又はコンフォメーションを失わせる役割を担う。例示的な実施形態において、用いた界面活性剤は、ドデシル硫酸ナトリウム(SDS)であって、Sigmaから入手した。他の例示的な実施形態において、用いた界面活性剤は、Zwittergent 3-14であって、Calbiochemから入手した。
【0017】
アミロイドは、線維状であるクロス-βタンパク質の凝集体である。多くのタンパク質は、繊維状の形態、原繊維構造、クロス-β回折パターン、β-構造の増加、コンゴーレッド結合、及びThT結合を含む特徴を有するアミロイド様の繊維に変えることが可能である。例示的な実施形態において、球状タンパク質をアミロイド様の繊維形状に変え、変えたタンパク質は、そのアミロイド様の特性によって同定することが可能になる。
【0018】
球状タンパク質構造を繊維状タンパク質構造に変え、それらを分離する工程において、クロマトグラフィを用いてもよい。一般的に、クロマトグラフィは、カラムを用いることで成し遂げられるが、他の方法(例:薄層クロマトグラフィの使用)を用いることも可能である。クロマトグラフィの技術には、サイズ排除、アフィニティ、及びイオン交換が含まれる。バッチ式での繊維状タンパク質の生産も可能ではあるが、カラムを用いる工程は、迅速で、安定であり、効率的且つ連続的に球状タンパク質を繊維形状に変えることが可能である。この工程のスケールアップも、カラムの使用で可能である。
【0019】
例示的な実施形態において、少なくとも約70 kDaのビーズ孔径を有するサイズ排除クロマトグラフィを用いた。用いるビーズ孔径は、球状タンパク質の様々な特徴(例えば、球状タンパク質のサイズ)に基づいて変更してもよい。孔径により、タンパク質がビーズマトリクスに入ることでき、これにより機械的な力が引き起こされ、この力がタンパク質のアンフォールディング/フォールディングに寄与し、繊維集合(fibrillogenic ensemble)を高める。例示的な実施形態において、用いる分子サイジングカラムはSuperdex 200である。他の例示的な実施形態において、用いる分子サイジングカラムはHW55Sである。
【0020】
カラムクロマトグラフィのために、カラムを溶出させる目的で低濃度の界面活性剤を含む緩衝液を用いてもよい。幾つかの態様においては、分子サイジングカラムは、25 mM Tris-HCL、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % SDSを含む緩衝液で溶出させる。他の例示的な実施形態において、分子サイジングカラムは、25 mM Tris-HCL、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % Zwittergent 3-14を含む緩衝液で溶出させる。溶出液は分画して回収してもよく、その後、繊維状タンパク質を含む画分を一緒にしてプールしてもよい。プールした画分は、更にフィルターを通して繊維状タンパク質を精製し、分離(例:PBSで透析しSDSを除去)してもよい。
【0021】
本開示における他の態様においては、癌治療の方法を開示する。上記方法は、タンパク質を供給する工程と、上記タンパク質を繊維構造に変える工程と、治療上有効な量の上記繊維構造のタンパク質を必要とする患者に投与する工程とを有する。タンパク質を繊維形状に変更することで、標的細胞に対する細胞毒性を高める。
【0022】
例示的な実施形態において、癌は、腎臓癌、乳癌、肺癌、前立腺癌、肝臓癌、又は卵巣癌である。癌治療に用いるタンパク質は、アルブミン、フィブロネクチン、rVP1、rVP2、rVP3、P1、又はキメラタンパク質(VP1、VP2、VP3、及び/又はVP4からの複数の部分を有するもの)である。例示的な実施形態において、繊維状タンパク質は、Aktシグナル経路を調節することで、癌細胞アポトーシスの誘導に関与する。ある例では、繊維状タンパク質は、Aktの非活性化を引き起こすインテグリンα5β1又はαvβ3を調節する。他の例では、繊維状のアルブミンはインテグリンに結合し、主にインテグリン/FAK/Akt/GSK-3β/カスパーゼ-3経路を介して細胞アポトーシスを引き起こす。
【0023】
例示的な実施形態によれば、上記タンパク質を、組成物の一部として投与してもよい。組成物は、粉末、クリーム、ゲル、軟膏(salves)、軟膏(ointments)、溶液、タブレット、カプセル、スプレー、及びパッチを含む様々な形態であってもよい。組成物を患者に送達させる目的で、媒体及び担体を用いてもよい。そのような担体には、可溶化剤、希釈剤、及び分散媒が含まれる。これらの担体は、生体適合性があり、薬剤として許容可能であり、そして繊維状タンパク質の治療特性を変えない。賦形剤、アジュバント及び他の成分も、組成物に含まれていてもよい。
【0024】
組成物の投与は、身体における種々の部位に対してさまざまな方法を通じて行ってもよく、その方法には静脈、皮内、皮下、経口(例:吸入)、経皮(即ち、局所)、経粘膜的、腹腔内、腫瘍内、及び直腸投与が含まれる。
【0025】
「治療上有効な量」という表現は、任意の治療に対して適用できる合理的な利益/リスク比で、ある所望の効果を生み出す量のことをいう。上記有効量は、治療中の疾患若しくは状態、投与している特定の対象構成物、患者の大きさ、又は疾患若しくは状態の重症度のようなファクターによって変えてもよい。当業者は、実験的に特定の化合物の有効量を過度の実験をすることなく決めることができる。
【0026】
癌治療のためのタンパク質は、疾患の重症度や癌細胞に対する所望の細胞毒性に基づいて選択してもよい。例示的な実施形態において、癌細胞に対する細胞毒性をより強くする目的で、RGDモチーフを有するタンパク質及び/又はより大きな分子量が選択される。
【0027】
本開示の他の態様において、ワクチンを製造する方法を開示する。上記方法は、タンパク質を供給する工程と、上記タンパク質を繊維構造に変える工程とを有する。この繊維構造のタンパク質を、特定疾患に対するワクチンとして患者に投与してもよい。
【0028】
本開示の他の態様において、ワクチン又は免疫学的アジュバントを製造する方法を開示する。上記方法は、タンパク質を供給する工程と、上記タンパク質を繊維構造に変える工程とを有する。アジュバントは、それ自身が特定の抗原性をもたないが、免疫系を刺激し、ワクチンへの応答を高めることができる。例示的な実施形態において、上記タンパク質はトール様受容体2(TLR2)を通じて先天性免疫応答を活性化させる。繊維状タンパク質は、TLR2を活性化しサイトカインの産生を誘導する一方で、上記タンパク質が天然の状態では活性化させない。
【0029】
他の実施形態において、抗原を繊維形状に変えて、抗原性とアジュバント効果の両方を持たせ、免疫応答を高める追加のアジュバントを必要としないワクチンを抗原から作製してもよい。
【実施例】
【0030】
本開示における更なる完全な理解は、以下の具体的な実施例及び図を参照することにより得られる。実施例及び図は、単に説明の目的で記述しているだけであって、なんら開示範囲を制限するものではない。形式上の変更や対応する言葉への置換は、周囲の状況から都合の良いものを意味又は表現し得ることを意図している。特定の用語が、ここでは採用されているが、そのような用語は、記述的な意義を意図するものであって、なんらその意義を制限する意図はない。上述した開示内容の変形形態及び変更形態は、その精神と範囲を逸脱することがなければ、行うことが可能であり、そして更に、付随の請求項によって示されている場合においてのみ制限が課せられるべきである。
【0031】
実施例1
材料及び方法
材料
phospho-Ser473 Aktに対する抗体は、Cell Signaling Technology, Incから入手した。Zwittergent 3-14は、Calbiochemから入手した。フィブロネクチン(FN)、抗アクチン抗体、抗インテグリンα5β1ポリクロナール抗体(機能阻害抗体)、西洋わさびペルオキシダーゼ結合抗マウスIgG二次抗体、西洋わさびペルオキシダーゼ結合抗ラビットIgG二次抗体及びMTTアッセイキットは、Chemicon International, Incから購入した。BSAは、Bio Basic Incから購入した。チオフラビンT(ThT)とドデシル硫酸ナトリウム(SDS)は、Sigmaから購入した。
【0032】
組換VP1及びVP3の発現と精製
VP1及びVP3は、口蹄疫ウイルス(FMDV)におけるカプシドタンパク質の構成要素である。組換VP1タンパク質は、大腸菌で発現させた後、精製し、リフォールディングした。これらの手順は、既に述べられている手順に従った(Yang, et al. Journal of Gene Medicine 7:708-717: 2005)。VP3遺伝子を、PCRにより、プラスミドpIBSY1-P1から5’-CCGGGATCCAAGCTTGGGATTTTCCCCGTGGCA-3’と5’-CCGCTCGAGTTGGGTTCGGGCGTCGAC-3’をプライマーとして増幅し、N末端にBamHIサイトをC末端にXhoIサイトをそれぞれ導入した。制限酵素で消化した後、増幅した遺伝子を、pET24a(+)(Novagene, WI)のBamHIサイトとXhoIサイトの間に結合し、DH5αコンピテント細胞に形質転換した。同定された陽性クローンは、シーケンスによって検証されたものであり、これを用いて大腸菌BL21(DE3)コンピテント細胞に形質転換した。組換VP3タンパク質は、大腸菌で発現させた後、精製し、リフォールディングした。これらの手順は、既に述べられている手順に従った(Yang, et al. Journal of Gene Medicine 7:708-717: 2005)。
【0033】
繊維状タンパク質の調製
20 mg BSA(Bio Basic Inc.)を10 ml PBSに溶解し、SDS(10 %; w/v)を、最終濃度が1 %になるまで加えた。水溶液用のソニケーターで5分間超音波処理をした後、続いてSDS含有タンパク質溶液をSuperdex-200カラム(2.6 cm × 100 cm, Amersham Biosciences)に注いだ。Superdex-200カラムは、事前に、25 mM Tris-HCl、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % SDSを含む緩衝液で平衡化しておいた。BSAを含む画分をプールした。プールした画分を、PBSで透析し、SDSを除いた。フィブロネクチン(Fibronection)繊維状タンパク質もまた同様のプロトコールを用いることで調製した。
【0034】
透過型電子顕微鏡(TEM)
透過型電子顕微鏡(TEM)により繊維状タンパク質を分析する目的で、1 mg/mlのタンパク質を200-メッシュの炭素被覆銅グリッドに加えた。余分なサンプルを除き、グリッドを風乾した。タンパク質を有するグリッドを、1 %(W/V)リンタングステン酸で1分間ネガティブ染色した。透過型電子顕微鏡の写真は、Hitachi H-7000電子顕微鏡を用いて20,000-150,000× の拡大率、75 kVで観察した。
【0035】
チオフラビンT(ThT)蛍光
チオフラビンT(ThT)は、アミロイド様特性のマーカーの1種である。蛍光を測定する目的で、濃度を上げたタンパク質(1 μM、3 μM、及び5 μM)を、20 μMのThTと共にインキュベートした。室温で1時間のインキュベーションの後、Wallac VICTOR2 1420マルチラベルカウンター(Perkin Elmer life science)を用いて、同じものを3回独立して蛍光を測定した。励起波長と発光波長は、それぞれ355nm、535nmである。緩衝液からのThT背景信号を、対応する測定値から差し引いた。
【0036】
細胞株及び処理
BHK-21細胞(ハムスターの腎臓由来)とT47D細胞株(ヒト乳管癌)を、10 % ウシ胎児血清 (FBS)、2 mM L-グルタミン、100 units/ml ペニシリン、及び100 μg/ml ストレプトマイシンを補充したダルベッコ変法イーグル培地(DMEM)において37℃で維持した。細胞を単層培養で一晩培養した。細胞を2度PBSで洗浄し、FBSを除いたDMEM中において、望ましい時間細胞をタンパク質で処理した。いくつかの細胞を、望ましい時点で0.2 mlのリシスバッファー(Pierce)で溶解し、20-μlのサンプルで、ウエスタンブロッティングによりAktのリン酸化を分析した。
【0037】
細胞生存率分析
細胞生存率を、MMT比色分析により測定した。対数増殖期の細胞(BHK-21細胞は1×104; T47D細胞株は1.25×104)を、10 % FBSを含むDMEM入りの96-ウェルのプレートに蒔き、24時間の生育の後、FBSを除いたDMEM中において、8時間37℃で、上記細胞を一連の濃度の繊維状タンパク質で処理した。処理後、MTT溶液を各ウェル(0.5 mg/ml)に加え、4時間インキュベートした。生存細胞の数は、ホルマザンの生産に直接比例するため、イソプロパノールでの可溶化後に、ELISAプレートリーダーを用いて560 nmで分光光度的に測定可能である。
【0038】
SDS-PAGE及び免疫ブロット分析
Hoefer垂直ゲル装置(Amersham Biosciences)を用いた10 % SDS-PAGEゲルで、サンプルを分離し、続いて電気泳動的にフッ化ポリビニリデン膜(Pall Corporation)へ転写した。上記膜を、5 % スキムミルク粉末を含むPBST中にて1時間ブロッキングし、ブロッキング緩衝液中にて一次抗体(5-10 μg/ml)と共にインキュベートした。上記膜をPBST中で洗浄し、続いて西洋わさびペルオキシダーゼ結合二次抗体(Chemicon)と共にインキュベートした。抗体は、化学発光(SuperSignal West Pico, Pierce)をBiomax MLフィルム(Eastman Kodak)に感光させることで検出した。
【0039】
図
図1 Superdex-200クロマトグラフィは、Superdex-75クロマトグラフィと違い、繊維状タンパク質の形成を促進させる。
TEMイメージから、(A)は繊維構造のBSA-S200が示されるが、(B)は球状構造のBSA-S75が示される。コントロールのBSAも球状構造(C)を示す。VP1-S200(D)とVP3-S200(E)の2つの組換タンパク質は、大腸菌で発現され、Superdex 200カラムでリフォールディングされたものであって、TEMアッセイにおいて繊維構造を示す。Fは、濃度を上げたBSA-S200を20μMのアミロイド特異的な色素ThTと共にしたインキュベーションが、BSA及びBSA-S75と比較して、ThTの蛍光レベルを増加させた結果である。値は3回測定したものである。表示するデータは平均値 ± S.D. (n=3)である。
【0040】
図2 界面活性剤又はビーズマトリクスに関係なくアミロイド様繊維を形成する。
TEMイメージから、繊維構造のBSA-Zwit(A)とBSA-HW55S(B)が示される。
【0041】
図3 繊維状タンパク質によって誘導される細胞死は、Aktシグナル経路を経由する。
BHK-21細胞を、無血清培地における様々な濃度のBSA、BSA-S75、BSA-S200、BSA-Zwit、又はBSA-HW55Sで8時間処理した。処理後、細胞生存率をMTTアッセイにより測定した。表示するデータは、平均値 ± S.D. (n=3) (A)である。BHK-21細胞を、30分間、抗α5β1抗体で前処理し又は前処理せずに、3 μMのBSA-S200で、望ましい時間処理した。処理後、抗phospho-Akt(p-Akt)を一次抗体としたウエスタンブロッティングにより、細胞溶解物を分析した(B)。Cは、T47D細胞株を、30分間、抗α5β1抗体で前処理し又は前処理せずに、無血清培地における様々な濃度のBSA-S200で、8時間処理したものである。処理後、細胞生存率をMTTアッセイで測定した。表示するデータは、平均値 ± S.D. (n=3)である。
【0042】
図4 BHK-21細胞に対する細胞毒性に関する、繊維状タンパク質のRGDモチーフ及び分子量の効果
(A)は、BHK-21細胞を、0.5 μMのVP1-S200、VP3-S200、BSA-S200、FN-S200、又はFNで8時間無血清培地中にて処理したものである。処理後、細胞生存率をMTTアッセイにより測定した。表示するデータは、平均値 ± S.D. (n=3)である。(B)は、BHK-21細胞を、濃度を上げたVP3-S200で8時間無血清培地中にて処理したものである。処理後、細胞生存率を、MTTアッセイにより測定した。表示するデータは、平均値 ± S.D. (n=3)である
【0043】
結果
アミロイド様繊維の形成に対するカラムのビーズ孔径及びビーズマトリクスの効果
ウシ血清アルブミン(BSA)は、球状タンパク質である。SDSを、BSA溶液に加え、Superdex -200カラム(600 KDaまでの孔径を有する)に注ぎ、25 mM Tris-HCl、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % SDSを含む緩衝液で溶出させた。Superdex-200カラムから得られたBSAタンパク質(BSA-S200)は、透過型電子顕微鏡(TEM)による分析で示される通り、繊維構造を表し(図1A)、アミロイド特異的な色素チオフラビンT(ThT)の蛍光が、用量依存的に強まった(図1F)。繊維の形成に対するカラムビーズの孔径の効果を調べる目的で、より小さい孔径(わずか3-70 kDaのMW範囲のもの)のSuperdex-75カラムを今回の実験で用いた(表1)。TEM分析から、Superdex 75から溶出したBSA(BSA-S75)は、BSAのように、球状構造を示し(図1B及びC)、アミロイド特異的な色素ThTの蛍光を高めない(図1F)ことが明らかとなった。大腸菌で発現させ、尿素で抽出し、アフィニティーカラムで精製した組換VP1(rVP1)と組換VP3(rVP3)も、上述の通り、界面活性剤と共にクロマトグラフィを行い、Superdex-S200カラムを通してリフォールディングを行った。TEMデータから、VP1-S200(図1D)とVP3-S200(図1E)も、繊維構造を示すことが明らかになった。繊維状タンパク質の形成に対するカラムのビーズマトリクスの効果が示された。HW55Sビーズは、Superdex-200と同様のビーズ特性(700 KDaまでの孔径を有する)を有するが、異なるマトリクス複合材料(表1)として、比較のために用いた。HW55Sクロマトグラフィから溶出したBSA(BSA-HW55S)は、TEMによる観察で繊維構造が示された(図2B)。これらのデータは、70 kDaを超える孔径を有するSuperdex-200(S200)やHW55Sのような分子サイジングカラムが、アミロイド様の繊維状タンパク質の形成を促進させることを示している。
【0044】
【表1】

【0045】
アミロイド様繊維の形成に対する界面活性剤の効果
Zwittergent 3-14は、幅広いpH範囲に対応する両性イオンの性質を保持する界面活性剤であり、陰イオン又は陽イオン化合物のいずれにも不可逆的な結合をしないと推定されている。ここで、Superdex-200クロマトグラフィにおける繊維状BSAの形成に対するZwittergent 3-14の効果を調べた。Zwittergent 3-14をBSA溶液(1 % Zwittergent 3-14)に加え、25 mM Tris-HCl、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % Zwittergent 3-14を含む緩衝液による溶出で、Superdex-200カラムを通過することによって及び/又は通過中に、BSAをリフォールディングさせた。Zwittergent 3-14を含むSuperdex-200カラムから得られたBSAタンパク質(BSA-Zwit)は、TEM下で繊維構造を示した(図2A)。これらのデータは、界面活性剤(例:SDS及びZwittergent 3-14)とビーズの孔径が繊維状タンパク質の形成にとって重要であることを示している。
【0046】
Aktの不活性化により細胞死を誘導する繊維状タンパク質
rVP1には、BHK-21細胞と様々な癌細胞株に対して細胞毒性があることは以前から明らかにされている。我々の方法で誘導した繊維状タンパク質が細胞に対する細胞毒性を有するか否かを試験する目的で、BHK-21細胞を無血清培地における様々な濃度のBSA-S200、BSA-Zwit、又はBSA-HW55Sで処理した。BSA-S200、BSA-Zwit、及びBSA-HW55Sの全てが、用量依存的に細胞死を引き起こすことが明らかになった(図3A)。BSA-Zwitが、全ての試験の中で最も強い細胞毒性を示した。0.5 μMの濃度の時、ほぼ100 %の細胞毒性を誘導した一方で、BSA-S 200は、35 %の細胞毒性を誘導し、BSA-HW55Sは、10 %の細胞毒性を誘導した。BSA-Zwit、BSA-S200及びBSA-HW55SのIC50は、それぞれ0.2、0.75 μMと10 μM超えであった。コントロールとして、2つの球状タンパク質である、ネイティブBSAとBSA-S75を用いた。そして、細胞に対する細胞毒性をほとんど又は全く誘導しないことが明らかとなった(図3A)。繊維状タンパク質により誘導される細胞死が、Aktシグナル経路を介するか否かを明らかにする目的で、BHK-21細胞を、30分間、抗α5β1抗体で前処理し又は前処理せずに、3 μMのBSA-S200で、望ましい時間処理した。データから、BSA-S200は、rVP1-S200とrVP3-S200のように、時間依存的にAktを不活性化することが明らかになった。加えて、Aktに対するBSA-S200の阻害効果が、濃度を上げた抗α5β1抗体による前処理によって明らかになった(図3B)。
【0047】
更に、繊維状タンパク質によって誘導される細胞死に対する抗α5β1抗体の効果を試験した。濃度を上げた抗α5β1抗体を用いて30分間、T47D細胞株(乳癌株)を前処理し、次にBSA-S200と共に細胞を無血清培地において8時間インキュベートした。細胞生存率の結果から、抗α5β1抗体を用いた、T47D細胞株の前処理が、BSA-S200の細胞毒性効果を弱毒化することが示された(図3C)。これらのデータは、Aktシグナル経路を調節することで癌細胞に対する細胞毒性を繊維状タンパク質が有することを示している。
【0048】
細胞に対する細胞毒性に関する、繊維状タンパク質のRGDモチーフ及び分子量の効果
RGDモチーフは、インテグリンのリガンドである。繊維状タンパク質が、インテグリン/Aktシグナル経路を調節することを通じて細胞死を誘導することが明らかにされている。フィブロネクチンは、RGDモチーフを有し且つ分子量が450 kDのタンパク質であって、SDS存在下でSuperdex200から溶出された時は、繊維構造であることも示された(FN-S200)(データは示さない)。BHK-21細胞に対する4つの繊維状タンパク質(即ち、rVP1-S200、FN-S200、rVP3-S200及びBSA-S200)の細胞毒性を比較した(図4A)。RGDモチーフを有する繊維状タンパク質(例:rVP1-S200及びFN-S200)には、RGDモチーフをもたないもの(例:BSA-S200及びrVP3-S200)よりも細胞毒性があることが明らかとなった。加えて、より分子量が高い繊維状タンパク質には、より分子量が低いものよりも細胞毒性を有していた。FN-S200(MW= 450 kD)は、VP1-S200(MW= 26 kD)よりも細胞毒性を有することが示された(図4A)。BSA-S200(MW= 66 kD)は、VP3-S200(MW= 26 kD)よりも細胞毒性を有することが示された(図4A)。VP3-S200は、図4Aの通り、0.5 μMの濃度においては、ほとんど細胞毒性を示さないが、より濃度が高いVP3-S200では、用量依存的に細胞毒性を誘導した(図4B)。以上より、RGDモチーフを有する繊維状タンパク質と、よりMWの高い繊維状タンパク質は、RGDモチーフをもたないものや、より分子量が低いものよりも細胞に対する細胞毒性を有する。
【0049】
抗癌剤としての繊維状タンパク質rVP1のインビトロ及びインビボにおける研究
組換VP1(rVP1)は、ドキソルビシンやタクソールよりも、インビトロにおける癌細胞の生育阻害に効果的である。インビトロにおけるrVP1の細胞毒性の効果は、MTT試薬を用いて評価した。rVP1のIC50値は、ドキソルビシンのIC50値よりも、4つの異なる肺癌、及び卵巣癌細胞株(A549、H146、H23、H23/0.3、及びSK-OV-3細胞)と正常な肺線維細胞株(WI-38)において低かった。より高い阻害効果が、ドキソルビシンやタクソールで処理した細胞との比較において、rVP1で処理したSK-OV-3細胞に対しても観察された。BNL細胞に対するrVP1のIC50値は、AML 12細胞(正常のマウス肝細胞株)よりも低いことから、rVP1は、マウスHCC細胞に対する細胞毒性が正常の肝細胞よりも強いことが示された。
【0050】
rVP1処理が腫瘍の生育を阻害し、HCCを有するマウスの生存を伸ばした。
BNL細胞を、BALB/cマウスの皮下に注射し、250 mm3の腫瘍容積が、腫瘍を注射してからおよそ2週間で検出された。4つのグループに分けたマウスに、週3回、3週間、rVP1(25 mg/kg、75 mg/kg、又は100 mg/kg)又はPBSを腫瘍内に注射した。rVP1で処理したマウスは、未処理のマウスよりも腫瘍容積が小さく、rVP1の投与量がより高いと、より強い効果を示した。コントロールのグループと処理したグループとの間における腫瘍容積の差には、統計的に有意な差があった(25 mg/kg、P < 0.05; 75 mg/kg 及び100 mg/kg、P < 0.001)。
【0051】
2グループに分けたマウスだけを用いた他の類似実験においても、rVP1(75 mg/kg)で処理したマウスの腫瘍容積は、PBSを投与しているコントロールマウスよりも小さかった。rVP1又はPBSで処理したマウスの生存期間の中央値は、それぞれ11.5週と13.5週であった。2グループ間の生存期間の差は、log-rank検定より計算され、その結果には統計的に有意な差があった。
【0052】
rVP1処理が、ヒト卵巣腫瘍を有するヌードマウスの生存率を上げる。
rVP1処理を、2ステージ腹腔内注射によって実施した。ヒト卵巣腫瘍を有するヌードマウスは、最初の注射を4時間受けた。この最初の注射は、SK-OV-3細胞をip注射で腹水に導入した後に行った。そして、異なる投与量のrVP1(15、50、150 mg/kg)を、48時間ごとに10回注射した。処理を10日間一時的に中断した後、再開し、rVP1注射を48時間ごとに5回繰り返した。rVP1注射(15と50 mg/k/g)を受けているマウスは、コントロールマウスと比較して生存率がより高かった。
【0053】
考察
アミロイド繊維の調製に用いられる通常の方法は、37℃でしばらくの間熟成させる方法である。多くの場合、数日から数週間の熟成期間を必要とする。複数の報告から、繊維形成はSDSによって促進させることが可能であるが、いまだ37℃一晩の激しい撹拌、室温で2日間のインキュベーション、又は繊維化の種の補助を必要としていることが明らかにされている。更に、これら全ての方法は、バッチ式の生産に属する。
【0054】
本研究において、カラムの使用が、改良した工程であって、繊維状タンパク質の形成を界面活性剤(SDS又はZwittergent 3-14)の存在下で、繊維化の種を使用せずに促進させる工程である(図1A、D、及びE; 図2A及びB)。また、このカラム工程を用いることで、迅速で、安定であり、効率的且つ連続的に、球状タンパク質を繊維形状へ変えられる。加えて、この工程はスケールアップもまた容易である。これまでの研究から、様々な構造を有する多くのタンパク質は、疾患に関するものと疾患に関係ないものの両方に関するタンパク質を含むものであって、アミロイドを形成し得ることが明らかにされている。様々なタンパク質から、種々の配列と構造に対してこのカラムクロマトグラフィ工程を適用することができ、そして繊維状タンパク質(例:BSA-S200、rVP1-S200、rVP3-S200及びFN-S200)に変え得ることが明らかになった(図1A、D、及びE)。カラムにより誘導される繊維形成の至適条件を明らかにする目的で、この工程において、繊維形成に影響を与える可能性のある幾つかのファクターに関して研究を行った。
【0055】
研究結果より、ビーズの孔径はカラムにより誘導される繊維形成にとって重要な役割を担っていることが示された。Superdex-200カラムは、Superdex-75カラムよりも大きいビーズの孔径を有する(表1)。Superdex 75カラムが繊維形成を促進できない(図1B)ことを説明すると以下のようになる。それは、ビーズの孔径が制限されていることで、タンパク質がビーズマトリクスに入ることを制限され、その結果、機械的な力の欠如が引き起こされているためである。この力が、タンパク質のアンフォールディング/フォールディングを引き起こし、繊維集合を高めることに寄与している。以上より、機械的な力と界面活性剤が、カラムにより誘導される繊維形成に関与していることが明らかになった。
【0056】
インテグリンは、膜内在性レセプターのファミリーであって、細胞接着分子として機能する。各インテグリンは、α-及びβ-サブユニットの非共有結合性会合によって形成するヘテロ二量体である。哺乳類種において、インテグリンファミリーは、24個の異なるヘテロ二量体から構成されており、それぞれの組織分布は明確に異なっている。インテグリンは、様々なプロセスに寄与しており、それには細胞と細胞外マトリクスとの間の結合や、細胞増殖、細胞形態、細胞遊走、及びアポトーシスを含む様々なプロセスを調節するシグナル伝達経路の誘導が含まれる。
【0057】
これまでの研究で、アミロイド繊維は神経細胞に対して細胞毒性を示すことが明らかになっている。これまでの研究で、α2β1及びαVβ1インテグリンシグナル経路がアミロイド-βにより誘導される神経毒性を媒介することも実証された。本研究で、繊維状タンパク質がインテグリンα5β1を調節することで癌の細胞死を誘導することが明らかにされた(図3B及び3C)。インテグリンのシグナル伝達は、Akt経路を活性化することができる。
【0058】
アミロイドは、その由来に関係なく、神経細胞に対して細胞毒性を示す。アミロイドにより誘導される細胞毒性のメカニズムは、アミロイドを形成するペプチドと脂質膜との相互作用に関係しているであろう。しかし、癌細胞に対する繊維状タンパク質の細胞毒性効果は、これまで報告されていない。我々は、SDSの補助を受けて、カラムにより誘導された繊維状タンパク質が、ヒトの癌細胞株に対して細胞毒性を示すことを明らかにした(図3C)。BSA-S200では、T47D細胞株において、濃度が2 μMのとき細胞生存率が70 %減少する結果となった(図3C)。
【0059】
最後に、RGDモチーフを有する繊維状タンパク質の細胞毒性効果を、RGDモチーフをもたない繊維状タンパク質と比較した。RGDモチーフは、インテグリンのリガンドであって、多くの機能(例:細胞遊走、細胞接着、細胞増殖)を調節する。これらの結果から、RGDモチーフを有する繊維状タンパク質は、RGDモチーフをもたない繊維状タンパク質と比較して、細胞に対する細胞毒性をより有することが示された(図4A)。繊維状タンパク質の分子量が、繊維状タンパク質により誘導される細胞毒性に関与することも明らかになった(図4A)。
【0060】
実施例2
材料と方法
材料
phospho-Try576/577 FAK、phospho-Ser473 Akt、及びphospho-Ser9 GSK-3βに対する抗体は、Cell Signaling Technology(Beverly, MA, USA)から購入した。phospho-Tyr397 FAKに対する抗体は、Biosource(Camirillo, CA, USA)から入手した。Zwittergent 3-14は、Calbiochem(San Diego, CA, USA)から購入した。インテグリンα5β1タンパク質、抗β-アクチン抗体、抗インテグリンα5抗体、抗インテグリンα5β抗体(機能阻害抗体)、西洋わさびペルオキシダーゼ結合抗マウスIgG二次抗体、西洋わさびペルオキシダーゼ結合抗ラビットIgG二次抗体、及びMTTアッセイキットは、Chemicon(Temecula, CA, USA)から購入した。抗BSA抗体は、Molecular Probes(Eugene, OR, USA)から入手した。BSAは、Bio Basic Inc.(Canada)から購入した。Aβ25-35は、Sigma(St. Louis, MO, USA)から購入し、滅菌した二重蒸留水に溶かし、37℃で3日間、使用前に熟成させた。チオフラビンT(ThT)、ドデシル硫酸ナトリウム(SDS)、4,6’-ジアミジノ-2-フェニルインドールジラクテート(DAPI)、及び他の化学薬品は、特に断りがなければ、Sigma(St. Louis, MO, USA)から入手した。Superdex-200、Superdex-75ビーズは、Amersham Biosciences(Uppsala, Sweden)から入手し、HW55Sゲル濾過ビーズは、TOSOH Corporation(Shiba, Tokyo, Japan)から入手した。
【0061】
繊維状BSA(F-BSA)の調製
20ミリグラムのBSA(Bio Basic Inc.)を、1 % SDS(w/v)含有の10 mlのPBSに溶かした。BSAの溶液を5分間超音波処理し、次にSuperdex-200、又はHWS55カラム(2.6 cm × 100 cm)に注いだ。上記カラムは、予め緩衝液(25 mM Tris-HCl、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % SDS)で平衡化しておいた。BSAを含む画分をプールした。プールした画分を、PBSで透析し、SDSを除いた。
【0062】
透過型電子顕微鏡(TEM)
透過型電子顕微鏡(TEM)により繊維状タンパク質を分析する目的で、1 mg/mlのタンパク質を200-メッシュの炭素被覆銅グリッドに加えた。余分なサンプルを除き、グリッドを風乾した。タンパク質を有するグリッドを、1 %(W/V)リンタングステン酸で1分間ネガティブ染色した。透過型電子顕微鏡の写真は、Hitachi H-7000 電子顕微鏡を用いて20,000-150,000× の拡大率、75 kVで観察した。
【0063】
チオフラビンT(ThT)の蛍光
蛍光を測定する目的で、濃度を上げたタンパク質(10 μM、20 μM、及び40 μM)を、20 μMのThTと共にインキュベートした。室温で1時間のインキュベーションの後、Wallac VICTOR2 1420マルチラベルカウンター(Perkin Elmer life science)を用いて、同じものを3回独立して蛍光を測定した。励起波長と発光波長は、それぞれ430nm、486nmである。緩衝液からのThT背景信号を、対応する測定値から差し引いた。
【0064】
細胞株及び処理
BHK-21細胞(ハムスターの腎臓由来; ATCC CRL-1632)とT47D細胞(ヒト乳管癌; ATCC HTB-133)を、10 % ウシ胎児血清(FBS)、2 mM L-グルタミン、100 units/ml ペニシリン、及び100 μg/ml ストレプトマイシンを補充したダルベッコ変法イーグル培地(DMEM)において37℃で維持した。簡潔に記述すると、処理する24時間前に、細胞を蒔いた。細胞を2度PBSで洗浄し、タンパク質と共に無血清DMEMにおいて、望ましい時間インキュベートした。望ましい時点において、0.2 mlのリシスバッファー(Pierce)で細胞を溶解し、30 μgの細胞溶解物で、ウエスタンブロッティングによりFAK、Akt、及びGSK-3βのリン酸化を分析した。
【0065】
細胞生存率分析
細胞生存率を、MTT比色分析により測定した。対数増殖期の細胞(BHK-21細胞は1×104; T47D細胞は1.25×104)を、10 % FBSを含むDMEM入りの96-ウェルのプレートに蒔き、24時間インキュベートした。一連の濃度のタンパク質での細胞処理を、無血清DMEM中において、8時間37℃で実施した。処理後、MTT溶液を各ウェル(0.5 mg/ml)に加え、4時間インキュベートした。生存細胞の数は、ホルマザンの生産に直接比例するため、イソプロパノールでの可溶化後に、ELISAプレートリーダーを用いて560 nmで分光光度的に測定可能である。
【0066】
SDS-PAGE及び免疫ブロット分析
Hoefer垂直ゲル装置(Amersham Biosciences)を用いた10 % SDS-PAGEゲルで、細胞溶解物を分離し、続いて電気泳動的にフッ化ポリビニリデン膜(Pall Corporation)へ転写した。上記膜を、5 % スキムミルク粉末を含むTBST緩衝液(5 mM Tris-HCl、pH 7.4、136 mM NaCl、0.1 % Tween-20)中にて1時間ブロッキングし、ブロッキング緩衝液中にて一次抗体(5-10 μg/ml)と共にインキュベートした。上記膜をTBST中で洗浄し、続いて西洋わさびペルオキシダーゼ結合二次抗体(Chemicon)と共にインキュベートした。抗体は、化学発光(SuperSignal West Pico, Pierce)をBiomax MLフィルム(Eastman Kodak)に感光させることで検出した。
【0067】
免疫沈降アッセイ
当量(20 μl)のプロテインA/Gビーズ(Santa Cruz Biotechnology)を、抗インテグリンα5β1抗体を介して、一方はインテグリンα5β1タンパク質で予めコーティングをし、他方はコーティングをしなかった。得られたビーズを、球状BSA(G-BSA)又は繊維状BSA(F-BSA)のいずれかと共に、一晩4℃にてインキュベートした。インキュベートの後、免疫複合体をPBSで3回洗浄し、抗インテグリンα5抗体及び抗BSA抗体を用いた免疫ブロットティングによって明らかにした。
【0068】
カスパーゼ-3活性アッセイ
カスパーゼ-3活性は、製造業者の取扱説明書に従い、蛍光基質z-DEVD-AMC(Upstate Biotechnology)の開裂により測定した。簡潔に記述すると、細胞を回収し、PBSで2回洗浄し、タンパク質分解酵素阻害剤の混合物(Sigma)を補充したリシスバッファー(Pierce)で溶解した。溶解物を、12,000 × gで15分間、4℃にて遠心分離をし、上清のタンパク質濃度を、Bio-Radタンパク質アッセイを用いて測定した。50 μg量の細胞溶解物を、72 μMのz-DEVD-AMCと共に室温で、15分間、同じものを3つ独立してインキュベートした。z-DEVD-AMCの開裂を、蛍光プレートリーダーを用いて、380 nmで励起した後に460 nmの発光を測定することで測定した。
【0069】
図
図5 繊維状BSAのアポトーシス効果
(A)は、BHK-21細胞を、1 μMのG-BSA(BSA)又はF-BSA(BSA-S200)と共に3時間インキュベートしたものである。細胞を蛍光顕微鏡で観察し、これらの核をDAPI(全てのパネルの倍率は、×400である)で染色した。(B)は、BHK-21細胞を40 μMのAβ25-35と共に3時間インキュベートしたものである。細胞を蛍光顕微鏡で観察し、これらの核をDAPI(全てのパネルの倍率は、×400である)で染色したものである。(C)は、BHK-21細胞を0.8 μMのG-BSA又はF-BSAと共に15時間、無血清培地で培養し、そしてカスパーゼ-3活性分析を行ったものである。カスパーゼ-3活性を、材料と方法で説明した蛍光基質によって測定した。表示するデータは、実験回数が3回の平均値 ± SDである。
【0070】
図6 繊維状BSA(F-BSA)とインテグリンα5β1との間の相互作用
(A)は、T47D細胞株を、30分間、抗インテグリンα5β1抗体で前処理し又は前処理せずに、無血清培地において様々な濃度のF-BSA(BSA-S200)と共に、8時間処理したものである。処理後、細胞生存率を、MTTアッセイにより測定した。表示するデータは、平均値 ± S.D. (n=3)である。(B)は、インテグリンα5β1タンパク質を、抗インテグリンα5β1抗体を介してプロテインA/Gビーズに結合し、F-BSA(BSA-S200)又はネイティブBSA(G-BSA)と共に一晩培養したものである。免疫複合体をSDS-PAGEで分離し、抗インテグリンα5抗体と抗BSA抗体で免疫ブロット(IB)した。
【0071】
図7 繊維状BSA(F-BSA)は、インテグリン/FAK/Akt経路により細胞毒性を誘導する。
(A)は、BHK-21細胞を、3 μMのF-BSAと共に無血清培地で、望ましい時間処理し、細胞溶解物を抗phospho-FAK(Tyr 576/577)又は抗phospho-FAK(Tyr 397)を一次抗体として用いて、ウエスタンブロッティングにより分析したものである。(B)は、BHK-21細胞を、30分間、抗インテグリンα5β1抗体で前処理し又は前処理せずに、3 μMのF-BSAと共に無血清培地で、望ましい時間処理したものである。処理後、細胞溶解物を、一次抗体である抗phospho-Akt(p-Akt)と抗phospho-GSK-3β(p-GSK-3β)を用いてウエスタンブロッティングにより分析した。β-アクチンは、標準化を目的とする内部標準としての役割を果たしている。(C)は、BHK-21細胞を、濃度を上げたネイティブBSAと共に無血清培地で1時間処理し、細胞溶解物を、一次抗体である抗phospho-Akt(p-Akt)を用いてウエスタンブロッティングにより分析したものである。(D)は、BHK-21細胞を、無血清培地で1時間、抗インテグリンα5β1抗体で前処理し又は前処理せずに、細胞溶解物を、一次抗体である抗phospho-Akt(p-Akt)を用いてウエスタンブロッティングにより分析したものである。
【0072】
結果
繊維状BSAは、BHK-21細胞においてアポトーシスを誘導した。
F-BSAにより誘導される細胞毒性が、細胞アポトーシスと関連しているか否かを実験する目的で、DAPI染色と、カスパーゼ-3活性を測定した。実験結果から、繊維状BSAは、BSA及びアミロイド(図5B)と比較して、核の凝縮を誘導(図5A)し、カスパーゼ3活性を上昇させる(図5C)ことが明らかとなった。以上より、これらの結果から、F-BSAは細胞のアポトーシスを誘導することが示された。
【0073】
繊維状BSAは、インテグリン/FAK/Akt/GSK-3β経路を介してアポトーシスを誘導した。
BHK-21細胞に加えて、F-BSAは、図6Aに図示するように、癌細胞(例:T47D細胞(乳癌株))に対する細胞毒性を示した。F-BSAのアポトーシス効果が、様々なプロセス(例:細胞増殖、細胞形態、細胞遊走、及びアポトーシス)を調節するとして知られているインテグリンを経由しているか否か実験する目的で、T47D細胞を、濃度を上げた抗α5β1抗体で30分間、前処理し、F-BSA(例えば、BSA-S200)と共に8時間、無血清培地中でインキュベートした。細胞生存率の結果から、抗α5β1抗体で前処理したT47D細胞は、F-BSAの細胞毒性効果を減少させることが示された(図6A)。F-BSAとインテグリンとの相互作用を、免疫沈降法によって更に検証した。コントロールビーズ又はインテグリンα5β1タンパク質結合ビーズとBSA又はF-BSAとのインキュベーションから、F-BSAはインテグリンα5β1と結合し、BSAとは結合しないことが明らかとなった(図6B)。
【0074】
インテグリンシグナル経路のカスケードに関する分子(例:接着斑キナーゼ(FAK)、Akt及びGSK-3β)が、F-BSAによって影響を受けるか否かを調べた。結果から、F-BSAはFAKの397番目のチロシン(Tyr 397)を時間依存的に脱リン酸化するが、FAKの576/577番目(Tyr 576/577)は、時間依存的には脱リン酸化しない(図7A)ことが明らかとなった。ウエスタンブロットからも、F-BSAはAktとGSK-3βを、時間依存的に脱リン酸化すること(図7B)が明らかになった。AktとGSK-3βのリン酸化に関するF-BSAの効果は、濃度を上げた抗α5β1抗体で細胞を前処理することで逆転した(図7B)。相対的に、ネイティブBSAと抗α5β1抗体は、Aktのリン酸化に効果がなかった(図7C及び7D)。これらの結果から、F-BSAはインテグリン/FAK/Akt/GSK-3β/カスパーゼ-3経路を介してアポトーシスを誘導することが示された。
【0075】
考察
ネイティブBSAは、インテグリンのリガンドではないが(図6B)、F-BSAはインテグリンα5β1に結合することで、細胞アポトーシスを引き起こす(図5と6)。F-BSAは、インテグリンα5β1に結合することで、細胞アポトーシスを媒介するが、これは、FAK(Tyr 397)、Akt及びGSK-3βの脱リン酸化を引き起こすことで起こる。本研究で生産されるF-BSAは、Aβによる誘導とは異なるメカニズムを介してインテグリンシグナル経路を不活性化しているように見える。
【0076】
BSAは、RGD(インテグリンの唯一の結合モチーフ)を有していないため、インテグリンに対する繊維状BSAの結合メカニズムが、配列にRGDを有する分子とまったく同じであるとは思えない。注目すべきは、たとえ、あるRGDをもつペプチドが細胞毒性を示しても、他のもの(例:フィブロネクチン)が細胞毒性を示さないこともある(Fornaro, et al. Journal of Biological Chemistry 278(50): 50402-504011: 2003)。
【0077】
実施例3
Superdex-75は、8Mの尿素存在下で、アンフォールディングしたBSAの繊維形成を誘導することが明らかとなった。組換VP1は、約8Mの尿素存在下でSuperdex-75により繊維形成が誘導されることも明らかとなった。このことは、ThTレベルの高まり(図8)と細胞毒性(図9)を通じて証明された。8Mの尿素を用いることに、制限はなく、他のモル比であっても、同程度またはそれよりも低い程度でアンフォールディングが促進されるであろう。
【0078】
実施例4
材料と方法
材料
TLR2に対する抗体は、Abcamから入手した。抗TLR2モノクローナル抗体(アンタゴニスト抗体)は、eBioscienceから購入した。コントロールIgG、フィブロネクチン(FN)、及び西洋わさびペルオキシダーゼ結合抗ラビットIgG二次抗体は、Chemiconから購入した。ウシ血清アルブミン(BSA)は、Bio Basic Incから購入した。抗BSA抗体は、Invitrogenから購入した。チオフラビンT(ThT)及びドデシル硫酸ナトリウム(SDS)は、Sigmaから購入した。
【0079】
大腸菌におけるVP3の発現
VP3は、口蹄疫ウイルス(FMDV)のカプシドタンパク質の構成要素である。VP3遺伝子を、PCRにより、プラスミドpIBSY1-P1(Yang, et al. The Journal of Gene Medicine 7:708-717: 2005)から5’-CCGGGATCCAAGCTTGGGATTTTCCCCGTGGCA-3’と5’-CCGCTCGAGTTGGGTTCGGGCGTCGAC-3’をプライマーとして増幅し、BamHIサイトをN末端に、XhoIサイトをC末端にそれぞれ導入した。組換VP3(大腸菌由来)の精製及びアッセイを容易にする目的で、T7タグ及びHisタグを、VP3遺伝子のN末端とC末端にそれぞれ付加した。制限酵素消化の後、増幅した遺伝子を、pET24a(+)(Novagene, WI)のBamHIとXhoIサイトの間に結合し、DH5αコンピテント細胞に形質転換した。同定された陽性クローンは、シーケンスにより検証された。プラスミドpVP3は、陽性クローンの1つから単離されてものであって、これを用いて大腸菌BL21(DE3)コンピテント細胞に形質転換した。組換VP3(rVP3)を、Wang, et al. Vaccine 21:3721-3729: 2003.に記載されている手順に従い、大腸菌で発現させた後に精製した。
【0080】
カラムクロマトグラフィによる繊維状タンパク質の調製
BSA-S200及びFN-S200を調製する目的で、タンパク質(2 mg/ml)を溶かした10 ml PBSを調整し、次に、SDS(10 %; w/v)を加え、最終濃度を1 %とした。5分間の超音波処理の後、SDSを含むタンパク質溶液を、Superdex-200カラム(2.6 cm × 100 cm, Amersham Biosciences)又はSuperdex-75カラムに注いだ。上記カラムは、予め緩衝液(25 mM Tris-HCl、pH 8.0、1 mM EDTA、0.1 M NaCl、及び0.05 % SDSを含有)で平衡化しておいた。タンパク質を含む画分をプールした。プールした画分を、SDSを除く目的でリン酸緩衝食塩水(PBS)にて4.5時間(3回; 1.5時間/1回)透析した。
【0081】
透過型電子顕微鏡(TEM)
透過型電子顕微鏡(TEM)により、カラムクロマトグラフィを通す工程を行ったタンパク質又は行わなかったタンパク質を分析する目的で、等量のタンパク質を200-メッシュの炭素被覆銅グリッドに加えた。余分なサンプルを除き、グリッドを風乾した。タンパク質を有するグリッドを、1 %(W/V)リンタングステン酸で1分間ネガティブ染色した。透過型電子顕微鏡の写真を、Hitachi H-7000電子顕微鏡を用いて20,000-150,000× の拡大率、75 kVで記録した。
【0082】
チオフラビンT(ThT)蛍光
蛍光を測定する目的で、濃度を上げたタンパク質を、20 μMのThTと共にインキュベートした。室温で1時間のインキュベーションの後、Wallac VICTOR2 1420マルチラベルカウンター(Perkin Elmer life science)を用いて、同じものを3回独立して蛍光を測定した。励起波長と発光波長は、それぞれ355nm、535nmである。緩衝液からのThT背景信号を、対応する測定値から差し引いた。
【0083】
細胞株
マウスのマクロファージ細胞株RAW 264.7とヒト胎児腎臓細胞株(HEK 293T)を、37℃で10 % ウシ胎児血清(FBS)、2 mM L-グルタミン、100 units/ml ペニシリン、及び100 μg/ml ストレプトマイシンを補充したダルベッコ変法イーグル培地(DMEM)において、湿気のある5 % CO2の環境下に維持した。
【0084】
SDS-PAGE及び免疫ブロット分析
Hoefer垂直ゲル装置(Amersham Biosciences)を用いた10 %又は12 % SDS-PAGEゲルで、サンプルを分離し、続いて電気泳動的にフッ化ポリビニリデン膜(Pall Corporation)へ転写した。上記膜を、5 % スキムミルク粉末を含むPBST中にて1時間ブロッキングし、ブロッキング緩衝液中にて一次抗体(5-10 μg/ml)と共にインキュベートした。上記膜をPBST中で洗浄し、続いて西洋わさびペルオキシダーゼ結合二次抗体(Chemicon)と共にインキュベートした。抗体は、化学発光(SuperSignal West Pico, Pierce)をBiomax MLフィルム(Eastman Kodak)に感光させることで検出した。
【0085】
免疫沈降アッセイ
タンパク質分解酵素阻害剤の混合物(Sigma-Aldrich)を補充した、冷却したリシスバッファー(Pierce)で、RAW 264.7細胞を溶解した。等量のプロテインA/Gビーズを、一方はrVP3-S200で予めコーティングし、他方はコーティングしなかった。ビーズを、RAW 264.7細胞溶解物と共に一晩、4℃でインキュベートした。得られたビーズを、遠心分離で回収し、冷却したリシスバッファーで3回洗浄した。免疫複合体由来のタンパク質を、SDSサンプルバッファー中で加熱することにより溶出させ、SDS-PAGEで分析し、特異的な抗体で免疫ブロットした。
【0086】
免疫蛍光及び共焦点顕微鏡
RAW 264.7細胞のサブコンフルエントな単層は、24-ウェルの組織培養皿中で、12-mmのガラス製カバースリップ上で生育させたものであって、この単層を1時間、4℃、ウシ胎児血清(FBS)を除いたダルベッコ変法イーグル培地(DMEM)中で、BSA又はBSA-S200と共に処理した。処理後、単層をPBSで洗浄し、4 % パラホルムアルデヒドで固定した。固定後、パラホルムアルデヒドを除き、単層を一次抗体で1時間、室温でインキュベートした。二重標識を行うときは、細胞を、2つの抗体と共にインキュベートした。希釈した一次抗体は、以下の通り、抗TLR2(1/100)と抗BSA(1/200)である。PBSTで3回洗浄した後、細胞を、蛍光物質を結合した適切な二次抗体であるヤギ抗ラビットIgG(1/500; Alexa Fluor 488; Molecular Probes)又はヤギ抗マウスIgG(1/500; Alexa Fluor 555; Molecular Probes)と共に30分、室温でインキュベートした。このインキュベーションに続き、カバースリップをPBSTで3回洗浄し、マウントし、そしてLSM 510 META共焦点顕微鏡で調べた。
【0087】
ルシフェラーゼレポーター遺伝子アッセイ
ヒトTLR2を、一時的にヒト胎児腎臓(HEK293T)細胞で発現させ、サンプルに対するこれらの反応性についてアッセイした。HEK293T細胞に、ヒトTLR2遺伝子を有するpRK-FLAG-TLR2又はpcDNA3.1(コントロールとしての空ベクター)とNF-kB結合配列により制御されるルシフェラーゼレポーター遺伝子を含むpNFkB-Lucをトランスフェクトした。ルシフェラーゼ遺伝子は、NF-kBが結合配列に結合した時のみ発現する。トランスフェクション効率を標準化する目的で、上記細胞に、pcDNA3.1-β-galをコトランスフェクトした。プラスミドは、Lipofectamine2000(Invitrogen)を用いるトランスフェクションによりHEK293T細胞へ導入した。簡潔に記述すると、HEK293T細胞を、96-ウェルプレートにおいて1ウェルあたりの細胞濃度を2.5 X 104として、10 % 熱失活ウシ胎児血清(FBS)、100 units/ml ペニシリン及び100 μg/ml ストレプトマイシン塩を補充した0.1 ml ダルベッコ変法イーグル培地(DMEM)中で37℃一晩培養した。培地を、トランスフェクションの直前にOpti-MEMI(Invitrogen)へ置換した。トランスフェクション混合物は、25 μlのOPTI-MEMI培地で0.3 μlのLipofectamine2000を希釈し、0.1 μgのプラスミドDNA(0.01 μg/ウェル pRK-FLAG-hTLR又はpcDNA3.1(空ベクター)、0.07 μg/ウェル p5xNFkB-lucレポータープラスミド(Stratagene)及び0.02 μg/ウェル pcDNA3.1-βgal)入りの25 μlのOPTI-MEMIを、20分間の室温におけるインキュベーションの後に、希釈したものに加えることで調整した。DNA-Lipofectamine2000混合物を、細胞に添加し、静かに振盪することで混ぜた。37℃、5 % CO2の下で24時間のインキュベートした後、細胞をサンプルで刺激した。陽性コントロールとして、細胞をTLR2のリガンドであるPam3CSK4(InvivoGen)で刺激した。6時間後、細胞を溶解し、製造業者の取扱説明書に従いルシフェラーゼアッセイシステム(Promega)を用いてルシフェラーゼ活性をアッセイした。細胞を100 μlのPBSで2回洗浄し、100 μlのパッシブ(passive)リシスバッファー(Promega)に溶解した。20 μlの細胞溶解物を用いてルシフェラーゼ活性を測定した。各サンプルのルシフェラーゼ活性を、β-ガラクトシダーゼ活性で標準化した。実験データは、刺激をしていない、空ベクターをトランスフェクトしたコントロール細胞を基準とする倍数で増加を表した。
【0088】
ELISAによるサイトカインの定量化
一過性にトランスフェクトしたTLR2発現HEK293T細胞とマウスマクロファージ細胞株であるRAW264.7とを、それぞれ6又は24時間、TLR2-特異的リガンド又は繊維状タンパク質で刺激した。細胞培養上清を回収し、サイトカイン特異的ELISA(IL-6、IL-8及びTNF-α ELISAは、Biosource Internationalからのもの)で分析した。この分析は、製造業者のプロトコールに従って行った。
【0089】
図
図10 Superdex-200クロマトグラフィは、繊維状タンパク質の形成を促進する。
superdex200クロマトグラフィから調製されたBSA-S200、rVP3-S200、及びFN-S200の繊維構造を示すTEMイメージである(B、C、及びE)。コントロールである天然型BSA及びFNは、TEMイメージでは球状構造を示す(A及びD)。F及びGは、20μMのアミロイド特異的な色素ThTと共にBSA-S200又はFN-S200をインキュベーションすると、天然型のBSA又はFNと比較して、ThTの蛍光を高めることを示している。値は、3回独立して測定したものである。表示するデータは、n=3の時の平均値 ± SDである。
【0090】
図11 繊維状タンパク質は、TLR2と相互作用する。
(A)は、RAW 264.7細胞由来の溶解物を、rVP3-S200を固定したプロテインA/Gビーズ又はプロテインA/Gビーズ単独で一晩インキュベートし、プロテインA/Gビーズ-結合タンパク質をSDS-PAGEにより分離し、抗TLR2抗体又は抗FMDV抗体で免疫ブロットしたものを示している。BSA又はBSA-S200を、RAW 264.7単層に0.3 μMの濃度で、1時間4℃で吸着させた。材料及び方法に記述するIF染色で、細胞を処理した。BSA又はBSA-S200を、抗BSA抗体で染色し、Alexa Fluor 488(緑)で可視化し(B及びE)、そしてTLR2は、抗TLR2抗体で染色し、Alexa Fluor 555(赤)で可視化した(C及びF)。重ね合わせたイメージ(G)中の矢印は、いくつかの共局在する領域を示している。
【0091】
図12 TLR2を通る繊維状タンパク質シグナル
HEK293/TLR2細胞について、(A)は0.3 μMのrVP1で染色したものであって、(B)は0.2 μMのBSA、BSA-S200、FN、又はFN-S200で染色したものである。6時間後、細胞を溶解し、NFκBレポーターであるルシフェラーゼレベルを測定した。(C)は、HEK293/TLR2細胞を、pam3csk4(0.5 μg/ml)又は濃度を上げたSDSで刺激したものを示す。6時間後、細胞を溶解し、NFκBレポーターであるルシフェラーゼレベルを測定した。(D)は、HEK293/TLR2細胞を、10 μg/mlの中和抗TLR2抗体又はコントロールIgGで1時間、前処理したものを示す。細胞を、pam3csk4(0.5 μg/ml)、BSA-S200(0.2 μM)、FN-S200、又はrVP3-S200(0.2 μM)と共にインキュベートした。6時間後、細胞を溶解し、NFκBレポーターであるルシフェラーゼレベルを測定した。値は、3回独立して測定したものである。表示するデータは、n=3の時の平均値 ± SDである。
【0092】
図13 繊維状タンパク質により誘導されるサイトカインの産生は、TLR2を介する。
(A)は、RAW 264.7細胞を、種々の濃度のBSA又はBSA-S200でインキュベートしたものを示す。24時間後、培地中のIL-6をELISAで分析した。(B)は、HEK293/TLR2細胞を10 μg/mlの中和抗TLR2抗体又はコントロールIgGで1時間、前処理したものを示す。細胞を、pam3csk4(0.5 μg/ml)、BSA-200(0.2 μM)、FN-S200(0.2 μM)、又はrVP3-S200(0.2 μM)と共にインキュベートした。6時間後、培地中のIL-8をELISAで分析した。(C)は、RAW 264.7細胞を10 μg/mlの中和抗TLR2抗体又はコントロールIgGで1時間、前処理したものを示す。細胞を、BSA-200(0.2 μM)又はFN-S200(0.2 μM)と共にインキュベートした。24時間後、培地中のIL-6をELISAで分析した。値は、3回独立して測定したものである。表示するデータは、n=3の時の平均値 ± SDである。
【0093】
結果
Superdex-20カラムを通過した後のタンパク質は、アミロイド様の繊維特性を示す。
Superdex-200カラムを通過した後のタンパク質に関する構造上の特徴を決定する目的で、透過型電子顕微鏡(TEM)及びチオフラビンT(ThT)アッセイを用いた。TEM分析から、BSA-S200、rVP3-S200、及びFN-S200は、繊維構造(図10B、10C、及び10E)を示すことが明らかにされた。反対に、天然型のBSA及びFNは、球体構造(図10A及び10D)を示した。次に、アミロイド様繊維の蛍光発光を、特異的色素ThTとタンパク質とをインキュベートすることで試験した。データから、BSA-S200及びFN-S200は、ThTの蛍光発光を、用量依存的に強くすることが示された(図10F及び10G)。
【0094】
繊維状タンパク質は、TLR2と相互作用する。
RAW 264.7細胞におけるrVP3-S200とTLR2の結合を分析する目的で、免疫沈降プロトコールを用いて、RAW細胞溶解物にrVP3-S200でコートしたビーズ又はコントロールビーズをさらした。RAW細胞溶解物と、rVP3-S200が結合しているビーズ又はrVP3-S200が結合していないコントロールビーズとのインキュベーションから、rVP3-S200はTLR2に結合することが明らかになった(図11A)。BSA-S200がTLR2と共局在するか否を更に調べる目的で、共焦点免疫蛍光顕微鏡を行った。BSA又はBSA-S200を、4℃、1時間でRAW 264.7細胞に加え、そしてTLR2に対応するBSA又はBSA-S200の局在を共焦点顕微鏡により測定した。結果から、BSA-S200はTLR2と共局在し、BSAとは共局在しないことが示された(図11B-G)。
【0095】
繊維状タンパク質はTLR2を活性化する。
TLR2が過剰発現しているヒトの細胞を、rVP1-S200(0.3 μM)、BSA-S200(0.2 μM)又はFN-S200(0.2 μM)で刺激すると、NFκBの活性化に大きな影響を与えることになる一方、球形のBSA及びFNは、そのようなことを示さなかった(図12A及び12B)。TLR2の特異性を更に調べる目的で、TLR2が発現しているHEK293T細胞を、抗TLR2抗体で1時間、前処理し、細胞をpam3csk4(0.5 μg/ml)、BSA-S200(0.2 μM)、FN-S200(0.2 μM)、又はrVP3-S200(0.2 μM)で刺激した。pam3csk4は、TLR2のリガンドとして知られており、陽性コントロールとしての役割を果たす。6時間のインキュベーションの後、細胞を溶解し、NFκBの活性化を測定した。抗TLR2での前処理は、NFκB活性を著しく減少させる一方で、アイソタイプ抗体をコントロールとして前処理しても、そのようなことを示さなかった(図12D)。SDSを繊維状タンパク質の調製で使用したため、TLR2の活性化におけるSDSの効果も実験した。データから、濃度を上げたSDSは、TLR2の活性化に効果がないことが明らかになった(図12C)。注目すべきことは、SDSで処理し、Superdex-75カラムから溶出したBSA(BSA-S75)もTLR2の活性化効果を示したが、BSA-S200よりもその程度は低かった。
【0096】
繊維状タンパク質により誘導されるサイトカインの放出
RAW 264.7細胞を、種々の濃度のBSA又はBSA-S200でインキュベートした。24時間後、培地中のIL-6をELISAで分析した。BSA-S200は、IL-6の産生を、用量依存的に誘導するが、BSAはそのようなことを示さなかった(図13A)。サイトカインの産生とTLR2の関係を評価する目的で、TLR2阻害抗体を更なる実験で用いた。TLR2を発現しているHEK293T細胞(図13B)及びRAW 264.7細胞(図13C)の両方を抗TLR2抗又はコントロールIgGで1時間、前処理し、続いてpam3csk4(0.5 μg/ml)、BSA-S200(0.2 μM)、FN-S200(0.2 μM)、又はrVP3-S200(0.2 μM)で細胞を刺激し、IL-8及びIL-6の産生を測定した。BSA-S200、FN-S200、及びrVP3-S200の存在が、TLR2を発現しているHEK293T又はRAW 264.7細胞から産生されたIL-8及びIL-6のレベルの増加を引き起こした。他方で、抗TLR2抗体による前処理では、サイトカインの産生を著しく減少させたが、コントロールIgGではそのようなことを示さなかった(図13B及び13C)。
【0097】
考察
免疫沈降及び免疫蛍光の実験から、繊維状タンパク質はTLR2と結合することが明らかになった(図11)。TLR2は、トール様受容体のメンバーであって、微生物に共通して保存されている分子パターンに対する細胞応答を媒介する。TLR2は、様々なリガンドを認識し(Miyake. Seminars in Immunology 19:3-10: 2007; Kaisho, et al. Biochimica et Biophysica Acta 1589:1-13: 2002)、マクロファージのサイトカイン産生を促進させる(Tsuji, et al. Infection and Immunity 68:6883-6890: 2000; Basu, et al. The Journal of Biological Chemistry 279:7370-7377: 2004)。この研究で、カラムにより誘導される繊維状タンパク質は、RAW 264.7細胞におけるIL-6の産生を用量依存的に誘導することが明らかとなった(図13A)。RAW 264.7(図13C)又はTLR2を発現しているHEK293T細胞(図12C及び13B)を抗TLR2抗体で前処理すると、繊維状タンパク質により誘導されるサイトカインの産生は減少した。これらのデータから、カラムにより誘導される繊維状タンパク質は、TLR2のアゴニストを表し、免疫細胞からのサイトカイン放出を誘導することが示される。
【0098】
複数の研究から、アジュバント受容体としてのトール様受容体が実証されてきている(Hawkins, et al. The Journal of Pharmacology and Experimental Therapeutics 300:655-661: 2002)。フロイントアジュバントは、マウスの肝臓でTLR2発現を誘導する(Lim. International Immunopharmacology 3:115-118: 2003)。TLR2は、そのリガンドであるリポタンパク質のアジュバント活性を媒介する(Ishii, et al. Journal of clinical Immunology 27:363-371: 2007)。TLR2及びTLR4は、BCG-CWS(効果的な免疫アジュバントであるマイコバクテリウムの構成成分)の免疫応答にも関与している(Tsuji, et al. Infection and Immunity 68:6883-6890: 2000)。この研究は、TLR2の活性化を通じてサイトカインの産生を誘導する繊維状タンパク質の知見に関する。抗原を繊維形状に変えることは、抗原の抗原性を高める。従って、アジュバントの添加を必要としない。
【0099】
これらTLRの中で、TLR2が様々なリガンドを認識する。例えば、グラム陽性の細胞壁(Yoshimura, et al. J Immunol 163:1-5: 1999)、非定型のリポ多糖(LPS)(Bainbridge, et al. Cellular Microbiology 8:120-129: 2006; Reife, et al. Cellular Microbiology 8:857-868: 2006; Jotwani, et al. European Journal of Immunology 33:2980-2986: 2003)、ポリン(Massari, et al. J Immunol 176:2373-2380: 2006; Singleton, et al. J Immunol 174:3545-3550: 2005)、ペプチドグリカン(PGN)(Tsuji, et al. Infection and Immunity 68:6883-6890: 2000; Uehori, et al. Infection and Immunity 71: 4238-4249: 2003)、リポアラビノマンナン(Underhill, et al. Proc Nat Acad Sci 96:14459-14463: 1999; Means, et al. J Immunol 163:3920-3927: 1999; Tapping, et al. Journal of Endotoxin Research 9:264-268: 2003)、フェノール可溶性モジュリン(Hajjar, et al. J Immunol 166:15-19: 2001)、ビリオン(Compton, et al. Journal of Virology 77:4588-4596: 2003)、グライコイノシトールリン脂質(Campos, et al. J Immunol 167:416-423: 2001)、糖脂質(Opitz, et al. The Journal of Biological Chemistry 276:22041-22047: 2001)、リピドA(Onier, et al. International Journal of Cancer 81:755-760: 1999; Onier, et al. Clinical & Experimental Metastasis 17:299-306: 1999)、グライコリポタンパク質(Lopez, et al. J Immunol 170:2409-2416: 2003)、リポタンパク質/リポペプチド(Ozinsky, et al. Proc Nat Acad Sci 97:13766-13771: 2000; Hirschfeld, et al. J Immunol 163:2382-2386: 1999)、ザイモサン(Underhill, et al. Nature 401:811-815: 1999)、熱ショックタンパク質(HSPs)(Ohashi, et al. J Immunol 164:558-561: 2000; Asea, et al. The Journal of Biological Chemistry 277:15028-15034: 2002)細胞外マトリクス(ECM)構成成分(バイグリカン又はヒアルロン酸)(Schaefer, et al. The Journal of Clinical Investigation 115:2223-2233: 2005; Jiang, et al. Nature Medicine 11:1173-1179: 2005)、高移動度群ボックス1(HMGB1)(Park, et al. The Journal of Biological Chemistry 279:7370-7377: 2004)、細菌タンパク質又はウイルスタンパク質(Basu, et al. The Journal of Biological Chemistry 282:1039-1050: 2007)、リポホスホグリカン(LPG)(Becker, et al. Molecular and Biochemical Parasitology 130:65-74: 2003)、マクロファージ活性化リポペプチド-2(MALP-2)(Takeuchi, et al. International Immunology 13:933-940: 2001; Schneider, et al. Gut 53:355-361: 2004)、熱滅菌された細菌又は酵母(Flo, et al. J Immunol 164:2064-2069: 2000; Netea, et al. J Immunol 172:3712-3718: 2004; Taylor, et al. The Journal of allergy and Clinical Immunology 117:1148-1154: 2004)、外膜タンパク質A(Jeannin, et al Nature Immunology 1:502-509: 2000)、可溶性因子(Wyllie, et al. J Immunol 165:7125-7132: 2000; Henneke, et al. J Immunol 167:7069-7076: 2001)、及びリポタイコ酸(LTA)(Schwandner, et al. The Journal of Biological Chemistry 274:17406-17409: 1999; Han, et al. Infection and Immunity 71:5541-5548: 2003; Schroder, et al. The Journal of Biological Chemistry 278:15587-15594: 2003)がある。複数の研究から、TLR2により認識されるリガンドの多様性は、その他のTLRである、TLR1又はTLR6とヘテロ二量体を形成することによるものであることも示される(Bauer, et al. Proc Nat Acad Sci 98:9237-9242: 2001; Sugawara, et al. Microbiology and Immunology 47:327-336: 2003; Takeuchi, et al. Gene 231:59-65: 1999)。TLR1/TLR2のヘテロ二量体は、トリアシル化リポタンパク質を認識する一方で、TLR2/TLR6はジアシル化リポタンパク質を認識することが示されている(Takeuchi, et al. J Immunol 169:10-14: 2002)。
【0100】
方法及び試薬は、最も実用的で好ましい実施形態であると今現在考えられるものについて記述している一方で、本開示は、開示されている典型的な実施形態に必ずしも限定するものではないことが理解され、実施形態の修正や適応は、当業者であれば想到するであろうことは明らかである。請求項の精神と範囲内に含まれる様々な修正や同様の手順をカバーすることを意図するものであり、その範囲は、そのようなすべての修正や同様の仕組みを包含するような最も広い解釈と一致する範囲である。本開示は、次の請求項の全ての実施形態を含んでいる。
【図1A】

【図1B】

【図1C】

【図1D】

【図1E】

【図1F】

【図2A】

【図2B】

【図3A】

【図3B】

【図3C】

【図4A】

【図4B】

【図5A】

【図5B】

【図5C】

【図6A】

【図6B】

【図7A】

【図7B】

【図7C】

【図7D】

【特許請求の範囲】
【請求項1】
球状タンパク質構造を繊維状タンパク質構造に変える方法であって、前記方法は、
球状タンパク質を供給する工程と、
前記球状タンパク質を含む溶液を調整する工程と、
前記溶液を少なくとも約70 kDaの孔径を有する分子サイジングカラムに注ぐ工程と、前記カラムから前記タンパク質を離脱させる工程とを有する方法
【請求項2】
前記繊維状タンパク質は、界面活性剤を含む溶液で前記カラムを溶出することで前記カラムから得られるものである、請求項1記載の方法
【請求項3】
前記分子サイジングカラムは、Superdex 200、Superdex 75及びHW55Sの内の1つである、請求項1記載の方法
【請求項4】
前記溶液を分子サイジングカラムに注ぐ前に、前記球状タンパク質を含む前記溶液に界面活性剤を加えることを更に含む、請求項1記載の方法
【請求項5】
前記界面活性剤は、SDS 及びZwittergent 3-14の内の1つである、請求項4記載の方法
【請求項6】
前記球状タンパク質が、アルブミン、フィブロネクチン、口蹄疫ウイルスの組換カプシドタンパク質VP1(rVP1)、口蹄疫ウイルスの組換カプシドタンパク質VP2(rVP2)、口蹄疫ウイルスの組換カプシドタンパク質VP3(rVP3)、VP1、VP2、VP3、及びVP4の前駆体タンパク質P1、並びにVP1、VP2、VP3、及びVP4からなる群より選択される少なくとも2つのタンパク質の部分を含むキメラタンパク質の内の1つである、請求項1記載の方法
【請求項7】
アンフォールディングしたタンパク質構造を繊維状タンパク質構造に変える方法であって、前記方法は、
タンパク質を含む溶液を供給する工程と、
約8Mの尿素を加えることで前記タンパク質をアンフォールディングさせる工程と、
前記溶液を70 kDa未満の孔径を有する分子サイジングカラムに注ぐ工程と、
前記タンパク質を繊維形状にリフォールディングすることを補助する流体手段を注ぐ工程とを有する方法
【請求項8】
前記流体手段が、低濃度の界面活性剤を含む緩衝液である、請求項7記載の方法
【請求項9】
前記分子サイジングカラムが、Superdex-75である、請求項7記載の方法
【請求項10】
前記アンフォールディングしたタンパク質が、アルブミン又は口蹄疫ウイルスの組換カプシドタンパク質VP1の内の1つである、請求項7記載の方法
【請求項11】
癌治療の方法であって、前記方法は、
タンパク質を供給する工程と、
前記タンパク質を繊維構造に変える工程と、
治療上有効な量の前記繊維構造タンパク質を必要とする患者に投与する工程とを有する方法
【請求項12】
前記タンパク質を繊維構造に変える工程が、前記タンパク質を含む溶液を調製する工程と前記溶液を少なくとも70 kDaの孔径を有する分子サイジングカラムに注ぐ工程を含む、請求項11記載の方法
【請求項13】
前記方法は、前記繊維状タンパク質を得る目的で、少なくとも低濃度の界面活性剤で前記カラムを溶出させる工程を更に含む、請求項12記載の方法
【請求項14】
前記繊維構造タンパク質が、Aktシグナル経路を調節することで細胞死を誘導する、請求項13記載の方法
【請求項15】
前記癌が、腎臓癌、乳癌、前立腺癌、肝臓癌、肺癌、及び卵巣癌の内の1つである、請求項13記載の方法
【請求項16】
前記タンパク質が、アルブミン、フィブロネクチン、口蹄疫ウイルスの組換カプシドタンパク質VP1(rVP1)、口蹄疫ウイルスの組換カプシドタンパク質VP2(rVP2)、口蹄疫ウイルスの組換カプシドタンパク質VP3(rVP3)、VP1、VP2、VP3、及びVP4の前駆体タンパク質P1、並びにVP1、VP2、VP3、及びVP4からなる群より選択される少なくとも2つのタンパク質の部分を含むキメラタンパク質の内の1つである、請求項13記載の方法
【請求項17】
ワクチンアジュバントを製造する方法であって、前記方法は、
タンパク質を供給する工程と、
前記タンパク質を繊維構造に変える工程とを有する方法
【請求項18】
前記タンパク質を繊維構造に変える工程が、前記タンパク質を含む溶液を調製する工程と、前記タンパク質を繊維構造に変える目的で前記溶液を少なくとも約70 kDaの孔径を有する分子サイジングカラムに注ぐ工程とを含む、請求項17記載の方法
【請求項19】
前記繊維構造タンパク質が、TLR-2を活性化する、請求項17記載の方法
【請求項20】
前記繊維構造タンパク質が、TLR-2-関連サイトカインの産生を誘導する、請求項17記載の方法
【請求項21】
前記サイトカインが、IL-6及びIL-8の内の1つである、請求項17記載の方法
【請求項22】
前記ワクチンアジュバントが、繊維構造に変えられた抗原である、請求項17記載の方法
【請求項23】
抗原アジュバントを製造する方法であって、前記方法は、
抗原を供給する工程と、
前記抗原を繊維構造に変える工程とを有する方法
【請求項24】
前記抗原を繊維構造に変える工程が、前記抗原を含む溶液を調製する工程と、前記抗原を少なくとも約70 kDaの孔径を有する分子サイジングカラムに注ぐ工程と、少なくとも界面活性剤を含む溶液で溶出させる工程とを含み、これにより前記カラムを通過する前記抗原が、繊維構造にリフォールディングする、請求項23記載の方法
【請求項25】
前記繊維構造タンパク質が、TLR-2-関連サイトカインの産生を活性化させる、請求項23記載の方法
【請求項26】
前記繊維構造タンパク質が、サイトカインの産生を誘導する、請求項23記載の方法
【請求項27】
前記サイトカインが、IL-6及びIL-8の内の1つである、請求項23記載の方法
【請求項1】
球状タンパク質構造を繊維状タンパク質構造に変える方法であって、前記方法は、
球状タンパク質を供給する工程と、
前記球状タンパク質を含む溶液を調整する工程と、
前記溶液を少なくとも約70 kDaの孔径を有する分子サイジングカラムに注ぐ工程と、前記カラムから前記タンパク質を離脱させる工程とを有する方法
【請求項2】
前記繊維状タンパク質は、界面活性剤を含む溶液で前記カラムを溶出することで前記カラムから得られるものである、請求項1記載の方法
【請求項3】
前記分子サイジングカラムは、Superdex 200、Superdex 75及びHW55Sの内の1つである、請求項1記載の方法
【請求項4】
前記溶液を分子サイジングカラムに注ぐ前に、前記球状タンパク質を含む前記溶液に界面活性剤を加えることを更に含む、請求項1記載の方法
【請求項5】
前記界面活性剤は、SDS 及びZwittergent 3-14の内の1つである、請求項4記載の方法
【請求項6】
前記球状タンパク質が、アルブミン、フィブロネクチン、口蹄疫ウイルスの組換カプシドタンパク質VP1(rVP1)、口蹄疫ウイルスの組換カプシドタンパク質VP2(rVP2)、口蹄疫ウイルスの組換カプシドタンパク質VP3(rVP3)、VP1、VP2、VP3、及びVP4の前駆体タンパク質P1、並びにVP1、VP2、VP3、及びVP4からなる群より選択される少なくとも2つのタンパク質の部分を含むキメラタンパク質の内の1つである、請求項1記載の方法
【請求項7】
アンフォールディングしたタンパク質構造を繊維状タンパク質構造に変える方法であって、前記方法は、
タンパク質を含む溶液を供給する工程と、
約8Mの尿素を加えることで前記タンパク質をアンフォールディングさせる工程と、
前記溶液を70 kDa未満の孔径を有する分子サイジングカラムに注ぐ工程と、
前記タンパク質を繊維形状にリフォールディングすることを補助する流体手段を注ぐ工程とを有する方法
【請求項8】
前記流体手段が、低濃度の界面活性剤を含む緩衝液である、請求項7記載の方法
【請求項9】
前記分子サイジングカラムが、Superdex-75である、請求項7記載の方法
【請求項10】
前記アンフォールディングしたタンパク質が、アルブミン又は口蹄疫ウイルスの組換カプシドタンパク質VP1の内の1つである、請求項7記載の方法
【請求項11】
癌治療の方法であって、前記方法は、
タンパク質を供給する工程と、
前記タンパク質を繊維構造に変える工程と、
治療上有効な量の前記繊維構造タンパク質を必要とする患者に投与する工程とを有する方法
【請求項12】
前記タンパク質を繊維構造に変える工程が、前記タンパク質を含む溶液を調製する工程と前記溶液を少なくとも70 kDaの孔径を有する分子サイジングカラムに注ぐ工程を含む、請求項11記載の方法
【請求項13】
前記方法は、前記繊維状タンパク質を得る目的で、少なくとも低濃度の界面活性剤で前記カラムを溶出させる工程を更に含む、請求項12記載の方法
【請求項14】
前記繊維構造タンパク質が、Aktシグナル経路を調節することで細胞死を誘導する、請求項13記載の方法
【請求項15】
前記癌が、腎臓癌、乳癌、前立腺癌、肝臓癌、肺癌、及び卵巣癌の内の1つである、請求項13記載の方法
【請求項16】
前記タンパク質が、アルブミン、フィブロネクチン、口蹄疫ウイルスの組換カプシドタンパク質VP1(rVP1)、口蹄疫ウイルスの組換カプシドタンパク質VP2(rVP2)、口蹄疫ウイルスの組換カプシドタンパク質VP3(rVP3)、VP1、VP2、VP3、及びVP4の前駆体タンパク質P1、並びにVP1、VP2、VP3、及びVP4からなる群より選択される少なくとも2つのタンパク質の部分を含むキメラタンパク質の内の1つである、請求項13記載の方法
【請求項17】
ワクチンアジュバントを製造する方法であって、前記方法は、
タンパク質を供給する工程と、
前記タンパク質を繊維構造に変える工程とを有する方法
【請求項18】
前記タンパク質を繊維構造に変える工程が、前記タンパク質を含む溶液を調製する工程と、前記タンパク質を繊維構造に変える目的で前記溶液を少なくとも約70 kDaの孔径を有する分子サイジングカラムに注ぐ工程とを含む、請求項17記載の方法
【請求項19】
前記繊維構造タンパク質が、TLR-2を活性化する、請求項17記載の方法
【請求項20】
前記繊維構造タンパク質が、TLR-2-関連サイトカインの産生を誘導する、請求項17記載の方法
【請求項21】
前記サイトカインが、IL-6及びIL-8の内の1つである、請求項17記載の方法
【請求項22】
前記ワクチンアジュバントが、繊維構造に変えられた抗原である、請求項17記載の方法
【請求項23】
抗原アジュバントを製造する方法であって、前記方法は、
抗原を供給する工程と、
前記抗原を繊維構造に変える工程とを有する方法
【請求項24】
前記抗原を繊維構造に変える工程が、前記抗原を含む溶液を調製する工程と、前記抗原を少なくとも約70 kDaの孔径を有する分子サイジングカラムに注ぐ工程と、少なくとも界面活性剤を含む溶液で溶出させる工程とを含み、これにより前記カラムを通過する前記抗原が、繊維構造にリフォールディングする、請求項23記載の方法
【請求項25】
前記繊維構造タンパク質が、TLR-2-関連サイトカインの産生を活性化させる、請求項23記載の方法
【請求項26】
前記繊維構造タンパク質が、サイトカインの産生を誘導する、請求項23記載の方法
【請求項27】
前記サイトカインが、IL-6及びIL-8の内の1つである、請求項23記載の方法
【図8】


【図9】


【図10A】


【図10B】


【図10C】


【図10D】


【図10E】


【図10F】


【図10G】


【図11A】


【図11B】


【図11C】


【図11D】


【図11E】


【図11F】


【図11G】


【図12A】


【図12B】


【図12C】


【図12D】


【図13A】


【図13B】


【図13C】




【図9】


【図10A】


【図10B】


【図10C】


【図10D】


【図10E】


【図10F】


【図10G】


【図11A】


【図11B】


【図11C】


【図11D】


【図11E】


【図11F】


【図11G】


【図12A】


【図12B】


【図12C】


【図12D】


【図13A】


【図13B】


【図13C】


【公表番号】特表2011−523623(P2011−523623A)
【公表日】平成23年8月18日(2011.8.18)
【国際特許分類】
【出願番号】特願2010−550909(P2010−550909)
【出願日】平成21年3月13日(2009.3.13)
【国際出願番号】PCT/US2009/037196
【国際公開番号】WO2009/114831
【国際公開日】平成21年9月17日(2009.9.17)
【出願人】(596118493)アカデミア シニカ (33)
【氏名又は名称原語表記】ACADEMIA SINICA
【住所又は居所原語表記】128 Sec 2,Academia Road,Nankang,Taipei 11529 TW
【Fターム(参考)】
【公表日】平成23年8月18日(2011.8.18)
【国際特許分類】
【出願日】平成21年3月13日(2009.3.13)
【国際出願番号】PCT/US2009/037196
【国際公開番号】WO2009/114831
【国際公開日】平成21年9月17日(2009.9.17)
【出願人】(596118493)アカデミア シニカ (33)
【氏名又は名称原語表記】ACADEMIA SINICA
【住所又は居所原語表記】128 Sec 2,Academia Road,Nankang,Taipei 11529 TW
【Fターム(参考)】
[ Back to top ]

