繊維製品の皮膚刺激性判定法
【課題】形状を有する物質、例えば繊維製品やテープ材等といった皮膚に直に接触して又は皮膚を被覆する態様で用いられるものの皮膚への刺激性を判定する方法であって、パッチテストに代替し得る方法の提供。
【解決手段】(1)皮膚モデルの表皮面上に繊維製品のサンプル片をおく工程、(2)この状態で皮膚モデルを培養する工程を有する皮膚刺激性判定法。皮膚モデルとしてより好ましいものとしては本出願人によって既に開示された培養皮膚を挙げることができる。かかる皮膚モデルは、少なくとも架橋度が異なる二種の生体親和性高分子からなるスポンジを組織培養用基材とし、一方の架橋度の高い基材上に繊維芽細胞を播種し培養した後、かかる基材上に他方の架橋度の低い基材を重ぬ、その上に角化細胞を播種し培養することによって得ることができる。
【解決手段】(1)皮膚モデルの表皮面上に繊維製品のサンプル片をおく工程、(2)この状態で皮膚モデルを培養する工程を有する皮膚刺激性判定法。皮膚モデルとしてより好ましいものとしては本出願人によって既に開示された培養皮膚を挙げることができる。かかる皮膚モデルは、少なくとも架橋度が異なる二種の生体親和性高分子からなるスポンジを組織培養用基材とし、一方の架橋度の高い基材上に繊維芽細胞を播種し培養した後、かかる基材上に他方の架橋度の低い基材を重ぬ、その上に角化細胞を播種し培養することによって得ることができる。
【発明の詳細な説明】
【0001】
【発明の属する技術分野】本発明は、形状を有する物質、例えば繊維製品やテープ材等といった、皮膚に直に接触して又は皮膚を被覆する態様で用いられるものの皮膚への刺激性を、培養皮膚モデルを用いて判定・評価する方法に関する。
【0002】
【従来の技術】従来、衣類等の繊維製品や絆創膏等に用いられるテープ材などの皮膚への刺激性を評価する方法としては、パッチテストが一般的である。例えば、そのテストのひとつである河合法(スンプ法)は、被験物である繊維製品をヒトの上腕内側部に直接貼付し、ガーゼ、紙絆創膏で押さえて24時間作用させ、その後、スンプ板と呼ばれる器具を用いて皮表レプリカを作製して、それを顕微鏡観察することにより皮膚刺激性を評価するものである〔河合法(顕微鏡観察による貼付試験判定法)、1988年4月、日本産業皮膚衛生協会発行〕。
【0003】このようなパッチテストはヒトの皮膚反応を直接観察できる点で優れているが、一方で、欠点もある。例えば、パッチテストの標準法では健康な成人男女20人に対する試験法が要求されるが〔河合法(顕微鏡観察による貼付試験判定法)、1988年4月、日本産業皮膚衛生協会発行〕、それだけの人数を確保し、更に20名もの被験者を24時間の間拘束するのは容易なことではない。結果として、非常に高価な試験にならざるを得ず、研究段階にある多種多様の被験物にはほとんど試みられないのが現状である。さらに、万一その被験物が激烈な刺激性を有していた場合の危険性も指摘されている。
【0004】一方、化粧品や洗浄剤等に含まれる化学物質(例えば、界面活性剤等)の皮膚刺激性を評価する方法として、培養細胞を用いた試験法が提案されている〔「細胞培養技術を使った動物実験代替法」、遺伝、1993年6月号(47巻6号)、第14〜20頁〕。これらの方法は、化学物質を培養細胞に作用させて細胞増殖率の阻害作用等を判定するものであり、動物を用いる刺激性判定法に代替し得、安価で簡便な方法である。
【0005】しかし、培養細胞に、直接繊維製品等の一定形状を有する被験物を作用させることは困難であり、また、角質層によるバリア機能等をもたない培養細胞の場合、どこまで皮膚の機能を代用できるか疑問視されている。
【0006】
【発明が解決しようとする課題】本発明は、上述するような実情に鑑みてなされたものであり、その目的とするところは、衣類、特に肌に直接接触する肌着等の繊維製品の皮膚刺激性を評価する方法であって、動物またはヒトの実際の皮膚を用いた皮膚刺激性試験に代替し得る、in vitroな皮膚刺激性判定法を提供するところにある。
【0007】
【課題を解決するための手段】本発明者らは、皮膚に直接接触した態様で用いられる例えば衣類等の繊維製品の、皮膚に対する刺激性を、動物やヒトを用いないで簡便に判定できる方法を開発すべく研究を重ねていたところ、ヒト皮膚に類似した構造を有する皮膚モデルを用いることにより、上記目的が達成できることを見いだした。具体的には、皮膚モデルとして皮膚細胞をそれぞれ含む表皮様組織及び真皮様組織よりなる二層構造を有する培養皮膚を用いることにより、繊維製品のサンプル片を被験物としてそのまま適用でき、繊維製品の物理的な皮膚刺激性が評価できること、更に驚くことに、当該方法により布地の微細な表面形状(構造)に起因する皮膚刺激性までもが判定できることを見いだした。
【0008】本発明は、かかる知見に基づいて開発されたものであり、すなわち、下記に示す皮膚刺激性判定法である。
【0009】項1.(1)皮膚モデルの表皮面上に繊維製品のサンプル片をおく工程、(2)この状態で皮膚モデルを培養する工程を有する、皮膚刺激性判定法。
【0010】項2.(1)及び(2)の工程に続いて、(2)で得られる皮膚モデルの細胞生存率又は細胞毒性を評価する工程を有する、項1記載の皮膚刺激性判定法。
【0011】項3.繊維製品が衣類である項1又は2記載の皮膚刺激性判定法。
【0012】項4.皮膚モデルが、皮膚細胞を含む表皮様組織及び真皮様組織よりなる二層構造よりなる培養皮膚であることを特徴とする項1乃至3のいずれかに記載の皮膚刺激性判定法。
【0013】項5.皮膚モデルが、少なくとも架橋度が異なる二種のスポンジ状生体親和性高分子を基材とし、一方の高架橋度の基材上に繊維芽細胞を播種し培養した後、かかる基材上に他方の低架橋度の基材を重ね、その上に角化細胞を播種し培養して得られる培養皮膚である、項1乃至4のいずれかに記載の皮膚刺激性判定法。
【0014】本発明の方法は、皮膚刺激性の判定に表皮様組織と真皮様組織とを有する皮膚相当物(皮膚モデル)を用いるものである。このため、一定形状(固体形状)を有する繊維製品のサンプル片を被験物として該皮膚モデルの表皮面上におくことにより、実際に繊維製品が皮膚に接触しているのと同様な状態を、試験環境として設定することができる。かくして、本発明の方法は、衣類等の繊維製品の皮膚刺激性評価に際して、従来の動物やヒトの皮膚に対して直接行われていたパッチテストに代替し得るものであり、化学的要因に基づく刺激(例えば、繊維素材に起因する刺激性、繊維製品に含まれる界面活性剤、柔軟剤、抗菌剤、蛍光増白剤等の化学物質)のみならず物理的要因に基づく刺激(例えば、繊維表面構造(形状)に起因する刺激性)をも包括して、繊維製品等の皮膚に対する刺激性を総合的に評価することができるものである。
【0015】
【発明の実施の形態】本発明の方法において皮膚刺激性の判定に用いられる皮膚モデルは、表皮様組織及び真皮様組織よりなる二層構造よりなるものであればよく、このように形態学的に皮膚に類似するものであれば特に制限されない。好ましくはヒトの皮膚に類似するものである。なお、表皮様組織には角化細胞等の皮膚細胞、また真皮様細胞には繊維芽細胞等の皮膚細胞が含まれていることが好ましい。更に表皮様組織の表面が空気中に露出して、実際のヒト皮膚同様に乾燥していることが好ましい。
【0016】かかる皮膚モデルとしては、例えば、米国特許第4485096号に記載される培養皮膚;Slivka,S.R.,L.Landeen,Zimber,M.,G.K.Naughton and R.L.Bartel,J. Invest. Dermatol.96: 544A (1991)に記載される培養皮膚;日形会誌、10:165〜180 (1990)に記載される培養皮膚を挙げることができる。
【0017】より好ましい皮膚モデルとしては、本出願人によって既に開示された特開平8−89239号公報記載の培養皮膚を挙げることができる。すなわち本発明は、本願出願人の培養皮膚(特開平8−89239号)の新たな用途を提供するものでもある。
【0018】かかる皮膚モデルは、少なくとも架橋度が異なる二種の生体親和性高分子からなるスポンジを組織培養用基材とし、一方の架橋度の高い基材上に繊維芽細胞を播種し培養した後、かかる基材上に他方の架橋度の低い基材を重ね、その上に角化細胞を播種し培養することによって得ることができる。
【0019】ここで用いられる生体親和性高分子としては、I,II,III,IV型コラーゲン、ゼラチン、アルギン酸ナトリウム、フィブロネクチン、ラミニン、ヒアルロン酸、キチン、キトサン、EHSマウス腫瘍可溶化抽出物等が例示できる。好ましくはI,II,III,IV型コラーゲンである。かかる生体親和高分子は常法に従ってスポンジ状に調製される(例えば特開平5−43734号、特開昭55−082621号、特開昭64−11141号、特開昭64−4629号公報等を参照)。
【0020】かかる生体親和性高分子に架橋を導入する方法も特に制限されず、例えば熱脱水架橋法;架橋剤としてアルデヒド類(例えばグルタルアルデヒド、ホルムアルデヒド等)、ジイソシアナート類(例えばヘキサメチレンジイソシアナート、トリレンジイソシアナート等)、エポキシ類(エチレングリコールジグリシジルエーテル等)又はカルボジイミド塩酸塩等を用いる化学架橋法等が採用される。
【0021】なお、二種のスポンジは、架橋度といった化学的性質の他に空孔径といった物理的性質を異にするものであってもよい。好ましくは繊維芽細胞を播種する高架橋基材の空孔径は、角化細胞を播種する低架橋基材の高架橋基材の空孔径よりも大きいことが望ましい。
【0022】具体的には、皮膚モデルとして用いられるヒト培養皮膚は、次のようにして調製される:まず一方のスポンジの孔径を50μm以上、好ましくは80〜95μm、厚みを1〜5mmになるように調製し、かかるスポンジに例えば化学架橋法により高度の架橋を導入する。これにヒト真皮繊維芽細胞を播種し培養する。そうすると、繊維芽細胞はスポンジの孔内に落ち込んでその孔内で三次元的に増殖する。しかし、スポンジには高度の架橋が導入されているため、スポンジ自身の分解消失は起こらない。かかるスポンジの上に、熱脱水架橋法等により低度の架橋が導入された他方のスポンジ(孔径30μm以下、好ましくは5〜20μm、厚み1〜2mm)を重ね、ヒト表皮角化細胞を播種し培養する。かかる角化細胞はスポンジの孔内に落ち込むことなくスポンジ表面で増殖する。後者の低架橋スポンジとして、例えば105℃、24時間の条件で熱脱水架橋したものを用いた場合、DME+5%血清培地で5日程度培養することにより、角化細胞の増殖とともにその足場になっていたスポンジが分解消失する。これにより実際の皮膚には存在しない構造物が消失する。更に、培養の際に培養液量を調整して表皮表面が液層と気層の界面の上に来るようにすることにより、ヒト皮膚と同様に乾燥した表皮面を得ることができる(気液界面培養)。斯くして、真皮繊維芽細胞及びコラーゲン等の細胞間物質からなる真皮様組織、並びに表皮角化細胞からなる表皮様組織から構成される、ヒトの皮膚構造を再現した培養皮膚が得られる。
【0023】本発明の判定法が対象とする被験物としては、形状を有する物質、例えば繊維製品やテープ材等といった、皮膚に直に接触して又は皮膚を被覆する態様で用いられるものを挙げることができる。具体的には、衣類、オムツ(紙オムツを含む)、生理用品、絆創膏、貼付剤、寝具類、絨毯、カーペット等が挙げられるが、好ましくは衣類等の繊維製品であり、より好ましくは肌に直接触れる肌着等の繊維製品である。
【0024】なお、これらの繊維製品等は、抗菌処理、柔軟剤処理、洗浄処理、染色処理、蛍光増白剤等で処理されていてもよく、本発明の方法によればかかる処理剤による刺激性と繊維表面の物理的な刺激とを総合して包括的に判定することができる。
【0025】本発明の方法は、基本的に(1)前述する皮膚モデルの表皮面上に繊維製品のサンプル片をおく工程、及び(2)この状態で皮膚モデルを培養する工程を有するものである。
【0026】(1)の工程において、被験物たる繊維製品のサンプル片は表皮面上にそのまま直に載せても、また少量の水分や油分を介して載せても良い。水分等を介することにより、被験物を表皮面に密着させることができる。ここで水分としては、例えば蒸留水等の水や、ダルベッコリン酸緩衝液等のバッファー、培養皮膚の培養に用いる培養液(例えば、血清培地を含んでいてもよいMEM(minimum essential medium)やDMEM(ダルベッコ改変イーグル培地(Dulbecco's ModifiedEagle Medium))を用いることができ、また油分としてはオリーブ油、パラフィン等のヒト皮脂に近い成分を用いることができる。
【0027】被験物を表皮面上に載せた皮膚モデルは、一定時間培養されるが、かかる培養液としては、通常MEM、DMEM等のように一般的に用いられる培養液に、1〜10重量%程度のウシ胎児血清を添加したものが好適に用いられる。好ましくは、5%ウシ胎児血清を添加したDMEM培地を挙げることができる。また、培養の条件は特に制限されず、培養液の種類や被験物の種類に応じて適宜選択することができ、例えば、培養温度は20〜37℃、好ましくは35〜37℃を例示することができる。また、培養時間も、培養液の種類や被験物の種類によって異なり一概に規定できないが、数分から100時間を越える範囲から適宜選択することができる(例えば1〜72時間、例えば24〜48時間等)。また、培養は通常の気相下で行うこともできるが、炭酸ガスインキュベーター中、5%程度の炭酸ガス濃度中で実施することが好ましい。
【0028】更に皮膚モデルの作製時と同様に刺激性判定時の培養に際しても、皮膚モデルの表皮表面は気液の界面より上に、好ましくはわずか上に気層に表出していることが好ましく、このような状態に維持されるように培養液量を調整することが好ましい。
【0029】繊維製品の皮膚刺激性は、前述する(1)及び(2)の工程を経て得られる皮膚モデルの細胞生存率又は細胞毒性の点から評価することができる。
【0030】細胞生存率の測定には、例えば、テトラゾリウム色素やニュートラルレッド等の生体色素を用いたアッセイ:MTT法及びNR法を挙げることができる。これらはそれぞれ Mossmann等の方法(Journal of Immunological Methods 65:55-63(1983))、及び Borenfreund等の方法(J.Tissue Cult.Meth.,9(1):7-9 (1984))に準じて行うことができる。細胞毒性は、(2)の工程での培養で、培養皮膚から培地中に放出される乳酸デヒドロゲナーゼ(LDH)〔Korzeniewskiの方法:J.Immunol Methods, 64, 313 (1983)〕やN−アセチルグルコサミニダーゼ(NAGS)の量、プロスタグランジンE2等の前炎症媒介物質の産生放出量〔Macloufらの方法:Prostandin and Lipid Melabolism in Radiation Injury,355-364(1987)〕、インターロイキン−1α、インターロイキン−8等の放出量〔Immunoassay:A practical guide ed Chan and Perlstein, 1987, Academic Press.〕等を測定することにより評価することができる。
【0031】
【実施例】以下、本発明の内容を以下の実施例及び試験例等を用いて具体的に説明する。ただし、これらの実施例及び試験例等は本発明の一態様にすぎず、本発明はこれらの例に何ら限定されるものではない。
【0032】参考例1 皮膚モデル(培養皮膚)の作製(1)高架橋スポンジの作製3mg/mlに希釈したTypeIコラーゲン溶液50gにクロロホルム0.5gを添加し、ホモジナイザーを用いて6000rpmで1分間ホモジナイズしたものをステンレス製枠に流し込み、−40℃で凍結し、これを真空減圧下(0.01mmHg)、30℃で24時間凍結乾燥した。更に、真空減圧下(0.01mmHg)、105℃で24時間熱脱水架橋を加えた後、0.2%グルタルアルデヒド溶液に24時間浸漬することにより化学架橋を導入した。これを再び凍結乾燥して孔径90μm、厚さ3mmの高架橋コラーゲンスポンジを得た。
【0033】(2)低架橋スポンジの作製0.3%水溶液(pH3)のTypeIコラーゲンをエタノールで希釈し、0.285%コラーゲン含有10%エタノール水溶液とした。更にこの溶液を直径9cmのシャーレに10g流し込み、−135℃で凍結し、0.01mmHg、乾燥温度40℃、乾燥時間24時間の条件で凍結乾燥を行い、更に真空減圧下(0.01mmHg)、105℃で24時間熱脱水架橋して、孔径30μm、厚さ1mmの低架橋コラーゲンスポンジを得た。
【0034】(3)細胞の播種及び培養24ウェル培養プレートの底面に、(1)で作製した高架橋コラーゲンスポンジを敷き詰め、クラボウ(株)から購入したヒト繊維芽細胞をMEM+10%血清培地に懸濁し、このスポンジ上に5.0×105cells/cm2の濃度で播種し、細胞が完全に装着するまで37℃、5%CO2で一晩培養した。次にこのスポンジ上に(2)で作製した低架橋コラーゲンスポンジを重ね、クラボウ(株)から購入したヒト角化細胞をKGM培地に懸濁し、この低架橋コラーゲンスポンジ上に5.0×105cells/cm2の濃度で播種し、細胞が完全に装着するまで37℃、5%CO2で一晩培養した。次に、かかる培養基材を24ウェル培養プレートから取り出し、6ウェル培養プレートに移した後、培地をDME+5%血清培地に変更した。ヒト角化細胞が空気中に出るように培養液の量を調整しながら5日間培養を続けた後、所望の皮膚モデル(培養皮膚)を得た。
【0035】なお、上記の「高架橋スポンジ」、「低架橋スポンジ」とは、それぞれ高度に架橋したコラーゲンスポンジ、低度に架橋したコラーゲンスポンジのことを意味し、表皮層には低架橋コラーゲンスポンジを用い、真皮層には高架橋コラーゲンスポンジを用いた。
【0036】かかる方法で得られた培養皮膚を、表皮面の直径12mmの円筒形にくりぬき、下記の実施例で皮膚モデルとして用いた。
【0037】実施例1 皮膚刺激判定−1本発明の方法を用いて、測定対象物として、未処理の肌着(A)と柔軟剤処理した肌着(B)とを用いて、それらの皮膚への刺激性を比較判定した。
【0038】なお、肌着はグンゼ(株)製の通常の綿100%ニット生地を用いたものであり、柔軟剤(日華化学(製))を含有するものを用いた。
【0039】(1)DEM+5%血清培地(250μl)の入った培養プレート(24ウェルプレート)に、上記参考例で作製した皮膚モデルを、表皮層を上向きにして表皮表面が気液の界面よりわずか上に表出するようにして置いた。
【0040】(2)肌着(A)及び肌着(B)をそれぞれ直径7mmの円状に打ち抜いてサンプル片を調製し、それぞれを被験物(A)及び(B)とした。これに20μlのダルベッコリン酸バッファー(PBS)を染み込ませて、それぞれモデル皮膚の表皮面の中央においた。なお、ネガティブコントロールとして、上記被験物の代わりに、直径7mmの円状のろ紙を用いて同様に試験した。
【0041】(3)この状態で、37℃、5%CO2の条件で、6時間、12時間、24時間及び48時間の各時間、皮膚モデルを培養した。
【0042】(4)所定培養時間後、表皮面上の被験物を取り除き、MTT(3-[4,5-ジメチルチアゾール-2-イル]-2,5-ジフェニルテトラゾリウムブロミド)を用いて、皮膚モデルの生細胞を染色した。
【0043】(5)次いで皮膚モデルの中央をポンチで直径5mmに打ち抜き、還元された色素を抽出して、細胞生存率(毒性率)を算出した。具体的には、抽出された還元色素の吸光度(570nm)を測定し、ネガティブコントロールについて得られた吸光度を100%として、それに対する吸光度の比から細胞生存率(%)を求めた。結果を表1に示す。
【0044】
【表1】

【0045】その結果、柔軟剤処理肌着は、未処理肌着に比して、短時間で生存細胞数の低下が生じた。これは本発明の方法が、繊維製品の刺激性を、それに含まれる化学物質に基づいて有意に識別し、判定できることを示すものである。
【0046】実施例2 皮膚刺激判定−2被験物として、チクチク感のあるウール製布地及び肌触りのよいベンベルク製布地を用いて、その皮膚への刺激性を比較判定した。
【0047】またここでは、検出された細胞毒性が物理的な刺激性に由来するものであるかどうかを確認するために、比較として布地の抽出液についても同様に刺激試験を行った。
【0048】(1)DEM+5%血清培地(250μl)の入った培養プレート(24ウェルプレート)に、上記参考例で作製した皮膚モデルを、表皮層を上向きにして表皮表面が気液の界面よりわずか上に表出するようにして置いた。
【0049】(2)ウール(A)及びベンベルク(B)をそれぞれ直径7mmの円形に打ち抜きサンプル片を調製し、これを被験物(A)及び(B)とした。
【0050】(3)また、更に前述する目的のために、双方の布地からバッファーを用いて抽出された抽出液についても同様に皮膚刺激試験を行った。具体的には、上記のそのまま被験物を用いた方法と試験条件を合わせるために、打ち抜いた各布地(被験物)の重さを計量し、それに20μlを加えた場合と同じ比率となるように、PBSバッファーを加え、37℃で72時間抽出を行った。抽出液はフィルター滅菌(0.45μメッシュ)してから試験に用いた。
【0051】(4)試験は、まず被験物(A)及び(B)に20μlのPBSバッファーを染み込ませて、皮膚モデルの表皮面の中央においた。また各抽出液については直径7mmに打ち抜いたろ紙に20μl染み込ませて同様に皮膚モデルの表皮面の中央においた。
【0052】下記に被験物を列記する。なお、ネガティブコントロールとして、被験物の代わりに、直径7mmのろ紙を用い、またコントロールとして皮膚モデルそのものを用いた。
【0053】
A:ウール /バッファーB:ベンベルク/バッファーC:ろ紙 /ウール抽出液D:ろ紙 /ベンベルク抽出液E:ろ紙 /バッファー (ネガティブコントロール)
F:無作用 (コントロール)
(3)この状態で、37℃、5%CO2の条件で、6時間、12時間、24時間及び48時間の各時間、皮膚モデルを培養した。
【0054】(4)MTTを用いて、培養皮膚の生細胞を染色した。
【0055】(5)次いで皮膚モデルの中央をポンチで直径5mmに打ち抜き、還元された色素を抽出して、細胞生存率(毒性率)を算出した。具体的には、抽出された還元色素の吸光度(570nm)を測定し、コントロールについて得られた吸光度を100%として、それに対する吸光度の比から細胞生存率(%)を求めた。結果を表2に示す。
【0056】
【表2】

【0057】この結果からわかるように、ウール製布地を直接作用させた場合、24時間までは殆どの細胞が生存しているが、48時間以降急速に細胞死が起こった。それに対して、同時に行ったウール製布地からの抽出液を作用させた場合には殆どの細胞は生き残っていた。一方、ベンベルク製布地については直接、抽出液ともに細胞死は少なかった。これは本発明の方法によれば、繊維製品(布地)の表面形状に由来する物理的刺激をも判定できることを示すものである。
【0058】
【発明の効果】本発明によれば、衣類等の繊維製品や絆創膏等に用いられるテープ材といった皮膚に直に接触し又は皮膚を覆う形状物の皮膚刺激性を判定する方法を提供することができる。かかる方法は、従来動物やヒトの皮膚に直接適用されていたパッチテストに代替し得るものであるが、パッチテストに比して、(1)安価である、(2)作用法や検出法の選択自由度が高い、(3)万一被験物が激烈な刺激性を有していても安全である、等の有利な効果を有している。更に本発明の方法によれば、多量の被験物の皮膚刺激性を同時に判定することも可能であるので、被験物の刺激性の有無のスクリーニングが可能となる。また、本発明の方法は、従来の細胞培養法に比して(イ)直接的に被験物を適用して評価できる、(ロ)角質バリア等皮膚機能を加味した判定ができる、等の有利な効果を有するものである。さらに、本発明の方法によれば、被験対象物として皮膚と同等な構造を有するモデルを使用するものであるので、皮膚刺激の作用機序の解明にも寄与することができる。
【図面の簡単な説明】
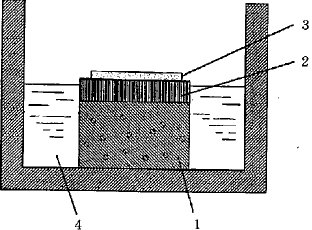
【図1】培地の入った培養プレートに皮膚モデルをその表皮層表面が気液界面より上に表出するように配置し、その上に被験物を載せた状態を示す断片図である。
【符号の説明】
1.真皮層
2.表皮層
3.被験物(繊維製品のサンプル片)
4.培地
【0001】
【発明の属する技術分野】本発明は、形状を有する物質、例えば繊維製品やテープ材等といった、皮膚に直に接触して又は皮膚を被覆する態様で用いられるものの皮膚への刺激性を、培養皮膚モデルを用いて判定・評価する方法に関する。
【0002】
【従来の技術】従来、衣類等の繊維製品や絆創膏等に用いられるテープ材などの皮膚への刺激性を評価する方法としては、パッチテストが一般的である。例えば、そのテストのひとつである河合法(スンプ法)は、被験物である繊維製品をヒトの上腕内側部に直接貼付し、ガーゼ、紙絆創膏で押さえて24時間作用させ、その後、スンプ板と呼ばれる器具を用いて皮表レプリカを作製して、それを顕微鏡観察することにより皮膚刺激性を評価するものである〔河合法(顕微鏡観察による貼付試験判定法)、1988年4月、日本産業皮膚衛生協会発行〕。
【0003】このようなパッチテストはヒトの皮膚反応を直接観察できる点で優れているが、一方で、欠点もある。例えば、パッチテストの標準法では健康な成人男女20人に対する試験法が要求されるが〔河合法(顕微鏡観察による貼付試験判定法)、1988年4月、日本産業皮膚衛生協会発行〕、それだけの人数を確保し、更に20名もの被験者を24時間の間拘束するのは容易なことではない。結果として、非常に高価な試験にならざるを得ず、研究段階にある多種多様の被験物にはほとんど試みられないのが現状である。さらに、万一その被験物が激烈な刺激性を有していた場合の危険性も指摘されている。
【0004】一方、化粧品や洗浄剤等に含まれる化学物質(例えば、界面活性剤等)の皮膚刺激性を評価する方法として、培養細胞を用いた試験法が提案されている〔「細胞培養技術を使った動物実験代替法」、遺伝、1993年6月号(47巻6号)、第14〜20頁〕。これらの方法は、化学物質を培養細胞に作用させて細胞増殖率の阻害作用等を判定するものであり、動物を用いる刺激性判定法に代替し得、安価で簡便な方法である。
【0005】しかし、培養細胞に、直接繊維製品等の一定形状を有する被験物を作用させることは困難であり、また、角質層によるバリア機能等をもたない培養細胞の場合、どこまで皮膚の機能を代用できるか疑問視されている。
【0006】
【発明が解決しようとする課題】本発明は、上述するような実情に鑑みてなされたものであり、その目的とするところは、衣類、特に肌に直接接触する肌着等の繊維製品の皮膚刺激性を評価する方法であって、動物またはヒトの実際の皮膚を用いた皮膚刺激性試験に代替し得る、in vitroな皮膚刺激性判定法を提供するところにある。
【0007】
【課題を解決するための手段】本発明者らは、皮膚に直接接触した態様で用いられる例えば衣類等の繊維製品の、皮膚に対する刺激性を、動物やヒトを用いないで簡便に判定できる方法を開発すべく研究を重ねていたところ、ヒト皮膚に類似した構造を有する皮膚モデルを用いることにより、上記目的が達成できることを見いだした。具体的には、皮膚モデルとして皮膚細胞をそれぞれ含む表皮様組織及び真皮様組織よりなる二層構造を有する培養皮膚を用いることにより、繊維製品のサンプル片を被験物としてそのまま適用でき、繊維製品の物理的な皮膚刺激性が評価できること、更に驚くことに、当該方法により布地の微細な表面形状(構造)に起因する皮膚刺激性までもが判定できることを見いだした。
【0008】本発明は、かかる知見に基づいて開発されたものであり、すなわち、下記に示す皮膚刺激性判定法である。
【0009】項1.(1)皮膚モデルの表皮面上に繊維製品のサンプル片をおく工程、(2)この状態で皮膚モデルを培養する工程を有する、皮膚刺激性判定法。
【0010】項2.(1)及び(2)の工程に続いて、(2)で得られる皮膚モデルの細胞生存率又は細胞毒性を評価する工程を有する、項1記載の皮膚刺激性判定法。
【0011】項3.繊維製品が衣類である項1又は2記載の皮膚刺激性判定法。
【0012】項4.皮膚モデルが、皮膚細胞を含む表皮様組織及び真皮様組織よりなる二層構造よりなる培養皮膚であることを特徴とする項1乃至3のいずれかに記載の皮膚刺激性判定法。
【0013】項5.皮膚モデルが、少なくとも架橋度が異なる二種のスポンジ状生体親和性高分子を基材とし、一方の高架橋度の基材上に繊維芽細胞を播種し培養した後、かかる基材上に他方の低架橋度の基材を重ね、その上に角化細胞を播種し培養して得られる培養皮膚である、項1乃至4のいずれかに記載の皮膚刺激性判定法。
【0014】本発明の方法は、皮膚刺激性の判定に表皮様組織と真皮様組織とを有する皮膚相当物(皮膚モデル)を用いるものである。このため、一定形状(固体形状)を有する繊維製品のサンプル片を被験物として該皮膚モデルの表皮面上におくことにより、実際に繊維製品が皮膚に接触しているのと同様な状態を、試験環境として設定することができる。かくして、本発明の方法は、衣類等の繊維製品の皮膚刺激性評価に際して、従来の動物やヒトの皮膚に対して直接行われていたパッチテストに代替し得るものであり、化学的要因に基づく刺激(例えば、繊維素材に起因する刺激性、繊維製品に含まれる界面活性剤、柔軟剤、抗菌剤、蛍光増白剤等の化学物質)のみならず物理的要因に基づく刺激(例えば、繊維表面構造(形状)に起因する刺激性)をも包括して、繊維製品等の皮膚に対する刺激性を総合的に評価することができるものである。
【0015】
【発明の実施の形態】本発明の方法において皮膚刺激性の判定に用いられる皮膚モデルは、表皮様組織及び真皮様組織よりなる二層構造よりなるものであればよく、このように形態学的に皮膚に類似するものであれば特に制限されない。好ましくはヒトの皮膚に類似するものである。なお、表皮様組織には角化細胞等の皮膚細胞、また真皮様細胞には繊維芽細胞等の皮膚細胞が含まれていることが好ましい。更に表皮様組織の表面が空気中に露出して、実際のヒト皮膚同様に乾燥していることが好ましい。
【0016】かかる皮膚モデルとしては、例えば、米国特許第4485096号に記載される培養皮膚;Slivka,S.R.,L.Landeen,Zimber,M.,G.K.Naughton and R.L.Bartel,J. Invest. Dermatol.96: 544A (1991)に記載される培養皮膚;日形会誌、10:165〜180 (1990)に記載される培養皮膚を挙げることができる。
【0017】より好ましい皮膚モデルとしては、本出願人によって既に開示された特開平8−89239号公報記載の培養皮膚を挙げることができる。すなわち本発明は、本願出願人の培養皮膚(特開平8−89239号)の新たな用途を提供するものでもある。
【0018】かかる皮膚モデルは、少なくとも架橋度が異なる二種の生体親和性高分子からなるスポンジを組織培養用基材とし、一方の架橋度の高い基材上に繊維芽細胞を播種し培養した後、かかる基材上に他方の架橋度の低い基材を重ね、その上に角化細胞を播種し培養することによって得ることができる。
【0019】ここで用いられる生体親和性高分子としては、I,II,III,IV型コラーゲン、ゼラチン、アルギン酸ナトリウム、フィブロネクチン、ラミニン、ヒアルロン酸、キチン、キトサン、EHSマウス腫瘍可溶化抽出物等が例示できる。好ましくはI,II,III,IV型コラーゲンである。かかる生体親和高分子は常法に従ってスポンジ状に調製される(例えば特開平5−43734号、特開昭55−082621号、特開昭64−11141号、特開昭64−4629号公報等を参照)。
【0020】かかる生体親和性高分子に架橋を導入する方法も特に制限されず、例えば熱脱水架橋法;架橋剤としてアルデヒド類(例えばグルタルアルデヒド、ホルムアルデヒド等)、ジイソシアナート類(例えばヘキサメチレンジイソシアナート、トリレンジイソシアナート等)、エポキシ類(エチレングリコールジグリシジルエーテル等)又はカルボジイミド塩酸塩等を用いる化学架橋法等が採用される。
【0021】なお、二種のスポンジは、架橋度といった化学的性質の他に空孔径といった物理的性質を異にするものであってもよい。好ましくは繊維芽細胞を播種する高架橋基材の空孔径は、角化細胞を播種する低架橋基材の高架橋基材の空孔径よりも大きいことが望ましい。
【0022】具体的には、皮膚モデルとして用いられるヒト培養皮膚は、次のようにして調製される:まず一方のスポンジの孔径を50μm以上、好ましくは80〜95μm、厚みを1〜5mmになるように調製し、かかるスポンジに例えば化学架橋法により高度の架橋を導入する。これにヒト真皮繊維芽細胞を播種し培養する。そうすると、繊維芽細胞はスポンジの孔内に落ち込んでその孔内で三次元的に増殖する。しかし、スポンジには高度の架橋が導入されているため、スポンジ自身の分解消失は起こらない。かかるスポンジの上に、熱脱水架橋法等により低度の架橋が導入された他方のスポンジ(孔径30μm以下、好ましくは5〜20μm、厚み1〜2mm)を重ね、ヒト表皮角化細胞を播種し培養する。かかる角化細胞はスポンジの孔内に落ち込むことなくスポンジ表面で増殖する。後者の低架橋スポンジとして、例えば105℃、24時間の条件で熱脱水架橋したものを用いた場合、DME+5%血清培地で5日程度培養することにより、角化細胞の増殖とともにその足場になっていたスポンジが分解消失する。これにより実際の皮膚には存在しない構造物が消失する。更に、培養の際に培養液量を調整して表皮表面が液層と気層の界面の上に来るようにすることにより、ヒト皮膚と同様に乾燥した表皮面を得ることができる(気液界面培養)。斯くして、真皮繊維芽細胞及びコラーゲン等の細胞間物質からなる真皮様組織、並びに表皮角化細胞からなる表皮様組織から構成される、ヒトの皮膚構造を再現した培養皮膚が得られる。
【0023】本発明の判定法が対象とする被験物としては、形状を有する物質、例えば繊維製品やテープ材等といった、皮膚に直に接触して又は皮膚を被覆する態様で用いられるものを挙げることができる。具体的には、衣類、オムツ(紙オムツを含む)、生理用品、絆創膏、貼付剤、寝具類、絨毯、カーペット等が挙げられるが、好ましくは衣類等の繊維製品であり、より好ましくは肌に直接触れる肌着等の繊維製品である。
【0024】なお、これらの繊維製品等は、抗菌処理、柔軟剤処理、洗浄処理、染色処理、蛍光増白剤等で処理されていてもよく、本発明の方法によればかかる処理剤による刺激性と繊維表面の物理的な刺激とを総合して包括的に判定することができる。
【0025】本発明の方法は、基本的に(1)前述する皮膚モデルの表皮面上に繊維製品のサンプル片をおく工程、及び(2)この状態で皮膚モデルを培養する工程を有するものである。
【0026】(1)の工程において、被験物たる繊維製品のサンプル片は表皮面上にそのまま直に載せても、また少量の水分や油分を介して載せても良い。水分等を介することにより、被験物を表皮面に密着させることができる。ここで水分としては、例えば蒸留水等の水や、ダルベッコリン酸緩衝液等のバッファー、培養皮膚の培養に用いる培養液(例えば、血清培地を含んでいてもよいMEM(minimum essential medium)やDMEM(ダルベッコ改変イーグル培地(Dulbecco's ModifiedEagle Medium))を用いることができ、また油分としてはオリーブ油、パラフィン等のヒト皮脂に近い成分を用いることができる。
【0027】被験物を表皮面上に載せた皮膚モデルは、一定時間培養されるが、かかる培養液としては、通常MEM、DMEM等のように一般的に用いられる培養液に、1〜10重量%程度のウシ胎児血清を添加したものが好適に用いられる。好ましくは、5%ウシ胎児血清を添加したDMEM培地を挙げることができる。また、培養の条件は特に制限されず、培養液の種類や被験物の種類に応じて適宜選択することができ、例えば、培養温度は20〜37℃、好ましくは35〜37℃を例示することができる。また、培養時間も、培養液の種類や被験物の種類によって異なり一概に規定できないが、数分から100時間を越える範囲から適宜選択することができる(例えば1〜72時間、例えば24〜48時間等)。また、培養は通常の気相下で行うこともできるが、炭酸ガスインキュベーター中、5%程度の炭酸ガス濃度中で実施することが好ましい。
【0028】更に皮膚モデルの作製時と同様に刺激性判定時の培養に際しても、皮膚モデルの表皮表面は気液の界面より上に、好ましくはわずか上に気層に表出していることが好ましく、このような状態に維持されるように培養液量を調整することが好ましい。
【0029】繊維製品の皮膚刺激性は、前述する(1)及び(2)の工程を経て得られる皮膚モデルの細胞生存率又は細胞毒性の点から評価することができる。
【0030】細胞生存率の測定には、例えば、テトラゾリウム色素やニュートラルレッド等の生体色素を用いたアッセイ:MTT法及びNR法を挙げることができる。これらはそれぞれ Mossmann等の方法(Journal of Immunological Methods 65:55-63(1983))、及び Borenfreund等の方法(J.Tissue Cult.Meth.,9(1):7-9 (1984))に準じて行うことができる。細胞毒性は、(2)の工程での培養で、培養皮膚から培地中に放出される乳酸デヒドロゲナーゼ(LDH)〔Korzeniewskiの方法:J.Immunol Methods, 64, 313 (1983)〕やN−アセチルグルコサミニダーゼ(NAGS)の量、プロスタグランジンE2等の前炎症媒介物質の産生放出量〔Macloufらの方法:Prostandin and Lipid Melabolism in Radiation Injury,355-364(1987)〕、インターロイキン−1α、インターロイキン−8等の放出量〔Immunoassay:A practical guide ed Chan and Perlstein, 1987, Academic Press.〕等を測定することにより評価することができる。
【0031】
【実施例】以下、本発明の内容を以下の実施例及び試験例等を用いて具体的に説明する。ただし、これらの実施例及び試験例等は本発明の一態様にすぎず、本発明はこれらの例に何ら限定されるものではない。
【0032】参考例1 皮膚モデル(培養皮膚)の作製(1)高架橋スポンジの作製3mg/mlに希釈したTypeIコラーゲン溶液50gにクロロホルム0.5gを添加し、ホモジナイザーを用いて6000rpmで1分間ホモジナイズしたものをステンレス製枠に流し込み、−40℃で凍結し、これを真空減圧下(0.01mmHg)、30℃で24時間凍結乾燥した。更に、真空減圧下(0.01mmHg)、105℃で24時間熱脱水架橋を加えた後、0.2%グルタルアルデヒド溶液に24時間浸漬することにより化学架橋を導入した。これを再び凍結乾燥して孔径90μm、厚さ3mmの高架橋コラーゲンスポンジを得た。
【0033】(2)低架橋スポンジの作製0.3%水溶液(pH3)のTypeIコラーゲンをエタノールで希釈し、0.285%コラーゲン含有10%エタノール水溶液とした。更にこの溶液を直径9cmのシャーレに10g流し込み、−135℃で凍結し、0.01mmHg、乾燥温度40℃、乾燥時間24時間の条件で凍結乾燥を行い、更に真空減圧下(0.01mmHg)、105℃で24時間熱脱水架橋して、孔径30μm、厚さ1mmの低架橋コラーゲンスポンジを得た。
【0034】(3)細胞の播種及び培養24ウェル培養プレートの底面に、(1)で作製した高架橋コラーゲンスポンジを敷き詰め、クラボウ(株)から購入したヒト繊維芽細胞をMEM+10%血清培地に懸濁し、このスポンジ上に5.0×105cells/cm2の濃度で播種し、細胞が完全に装着するまで37℃、5%CO2で一晩培養した。次にこのスポンジ上に(2)で作製した低架橋コラーゲンスポンジを重ね、クラボウ(株)から購入したヒト角化細胞をKGM培地に懸濁し、この低架橋コラーゲンスポンジ上に5.0×105cells/cm2の濃度で播種し、細胞が完全に装着するまで37℃、5%CO2で一晩培養した。次に、かかる培養基材を24ウェル培養プレートから取り出し、6ウェル培養プレートに移した後、培地をDME+5%血清培地に変更した。ヒト角化細胞が空気中に出るように培養液の量を調整しながら5日間培養を続けた後、所望の皮膚モデル(培養皮膚)を得た。
【0035】なお、上記の「高架橋スポンジ」、「低架橋スポンジ」とは、それぞれ高度に架橋したコラーゲンスポンジ、低度に架橋したコラーゲンスポンジのことを意味し、表皮層には低架橋コラーゲンスポンジを用い、真皮層には高架橋コラーゲンスポンジを用いた。
【0036】かかる方法で得られた培養皮膚を、表皮面の直径12mmの円筒形にくりぬき、下記の実施例で皮膚モデルとして用いた。
【0037】実施例1 皮膚刺激判定−1本発明の方法を用いて、測定対象物として、未処理の肌着(A)と柔軟剤処理した肌着(B)とを用いて、それらの皮膚への刺激性を比較判定した。
【0038】なお、肌着はグンゼ(株)製の通常の綿100%ニット生地を用いたものであり、柔軟剤(日華化学(製))を含有するものを用いた。
【0039】(1)DEM+5%血清培地(250μl)の入った培養プレート(24ウェルプレート)に、上記参考例で作製した皮膚モデルを、表皮層を上向きにして表皮表面が気液の界面よりわずか上に表出するようにして置いた。
【0040】(2)肌着(A)及び肌着(B)をそれぞれ直径7mmの円状に打ち抜いてサンプル片を調製し、それぞれを被験物(A)及び(B)とした。これに20μlのダルベッコリン酸バッファー(PBS)を染み込ませて、それぞれモデル皮膚の表皮面の中央においた。なお、ネガティブコントロールとして、上記被験物の代わりに、直径7mmの円状のろ紙を用いて同様に試験した。
【0041】(3)この状態で、37℃、5%CO2の条件で、6時間、12時間、24時間及び48時間の各時間、皮膚モデルを培養した。
【0042】(4)所定培養時間後、表皮面上の被験物を取り除き、MTT(3-[4,5-ジメチルチアゾール-2-イル]-2,5-ジフェニルテトラゾリウムブロミド)を用いて、皮膚モデルの生細胞を染色した。
【0043】(5)次いで皮膚モデルの中央をポンチで直径5mmに打ち抜き、還元された色素を抽出して、細胞生存率(毒性率)を算出した。具体的には、抽出された還元色素の吸光度(570nm)を測定し、ネガティブコントロールについて得られた吸光度を100%として、それに対する吸光度の比から細胞生存率(%)を求めた。結果を表1に示す。
【0044】
【表1】

【0045】その結果、柔軟剤処理肌着は、未処理肌着に比して、短時間で生存細胞数の低下が生じた。これは本発明の方法が、繊維製品の刺激性を、それに含まれる化学物質に基づいて有意に識別し、判定できることを示すものである。
【0046】実施例2 皮膚刺激判定−2被験物として、チクチク感のあるウール製布地及び肌触りのよいベンベルク製布地を用いて、その皮膚への刺激性を比較判定した。
【0047】またここでは、検出された細胞毒性が物理的な刺激性に由来するものであるかどうかを確認するために、比較として布地の抽出液についても同様に刺激試験を行った。
【0048】(1)DEM+5%血清培地(250μl)の入った培養プレート(24ウェルプレート)に、上記参考例で作製した皮膚モデルを、表皮層を上向きにして表皮表面が気液の界面よりわずか上に表出するようにして置いた。
【0049】(2)ウール(A)及びベンベルク(B)をそれぞれ直径7mmの円形に打ち抜きサンプル片を調製し、これを被験物(A)及び(B)とした。
【0050】(3)また、更に前述する目的のために、双方の布地からバッファーを用いて抽出された抽出液についても同様に皮膚刺激試験を行った。具体的には、上記のそのまま被験物を用いた方法と試験条件を合わせるために、打ち抜いた各布地(被験物)の重さを計量し、それに20μlを加えた場合と同じ比率となるように、PBSバッファーを加え、37℃で72時間抽出を行った。抽出液はフィルター滅菌(0.45μメッシュ)してから試験に用いた。
【0051】(4)試験は、まず被験物(A)及び(B)に20μlのPBSバッファーを染み込ませて、皮膚モデルの表皮面の中央においた。また各抽出液については直径7mmに打ち抜いたろ紙に20μl染み込ませて同様に皮膚モデルの表皮面の中央においた。
【0052】下記に被験物を列記する。なお、ネガティブコントロールとして、被験物の代わりに、直径7mmのろ紙を用い、またコントロールとして皮膚モデルそのものを用いた。
【0053】
A:ウール /バッファーB:ベンベルク/バッファーC:ろ紙 /ウール抽出液D:ろ紙 /ベンベルク抽出液E:ろ紙 /バッファー (ネガティブコントロール)
F:無作用 (コントロール)
(3)この状態で、37℃、5%CO2の条件で、6時間、12時間、24時間及び48時間の各時間、皮膚モデルを培養した。
【0054】(4)MTTを用いて、培養皮膚の生細胞を染色した。
【0055】(5)次いで皮膚モデルの中央をポンチで直径5mmに打ち抜き、還元された色素を抽出して、細胞生存率(毒性率)を算出した。具体的には、抽出された還元色素の吸光度(570nm)を測定し、コントロールについて得られた吸光度を100%として、それに対する吸光度の比から細胞生存率(%)を求めた。結果を表2に示す。
【0056】
【表2】

【0057】この結果からわかるように、ウール製布地を直接作用させた場合、24時間までは殆どの細胞が生存しているが、48時間以降急速に細胞死が起こった。それに対して、同時に行ったウール製布地からの抽出液を作用させた場合には殆どの細胞は生き残っていた。一方、ベンベルク製布地については直接、抽出液ともに細胞死は少なかった。これは本発明の方法によれば、繊維製品(布地)の表面形状に由来する物理的刺激をも判定できることを示すものである。
【0058】
【発明の効果】本発明によれば、衣類等の繊維製品や絆創膏等に用いられるテープ材といった皮膚に直に接触し又は皮膚を覆う形状物の皮膚刺激性を判定する方法を提供することができる。かかる方法は、従来動物やヒトの皮膚に直接適用されていたパッチテストに代替し得るものであるが、パッチテストに比して、(1)安価である、(2)作用法や検出法の選択自由度が高い、(3)万一被験物が激烈な刺激性を有していても安全である、等の有利な効果を有している。更に本発明の方法によれば、多量の被験物の皮膚刺激性を同時に判定することも可能であるので、被験物の刺激性の有無のスクリーニングが可能となる。また、本発明の方法は、従来の細胞培養法に比して(イ)直接的に被験物を適用して評価できる、(ロ)角質バリア等皮膚機能を加味した判定ができる、等の有利な効果を有するものである。さらに、本発明の方法によれば、被験対象物として皮膚と同等な構造を有するモデルを使用するものであるので、皮膚刺激の作用機序の解明にも寄与することができる。
【図面の簡単な説明】
【図1】培地の入った培養プレートに皮膚モデルをその表皮層表面が気液界面より上に表出するように配置し、その上に被験物を載せた状態を示す断片図である。
【符号の説明】
1.真皮層
2.表皮層
3.被験物(繊維製品のサンプル片)
4.培地
【特許請求の範囲】
【請求項1】(1)皮膚モデルの表皮面上に繊維製品のサンプル片をおく工程、(2)この状態で皮膚モデルを培養する工程を有する、皮膚刺激性判定法。
【請求項2】(1)及び(2)の工程に続いて、(2)で得られる皮膚モデルの細胞生存率又は細胞毒性を評価する工程を有する、請求項1記載の皮膚刺激性判定法。
【請求項3】繊維製品が衣類である請求項1又は2記載の皮膚刺激性判定法。
【請求項4】皮膚モデルが、皮膚細胞を含む表皮様組織及び真皮様組織の二層構造よりなる培養皮膚であることを特徴とする請求項1乃至3のいずれかに記載の皮膚刺激性判定法。
【請求項5】皮膚モデルが、少なくとも架橋度が異なる二種のスポンジ状生体親和性高分子を基材とし、一方の高架橋度の基材上に繊維芽細胞を播種し培養した後、かかる基材上に他方の低架橋度の基材を重ね、その上に角化細胞を播種し培養して得られる培養皮膚である、請求項1乃至4のいずれかに記載の皮膚刺激性判定法。
【請求項1】(1)皮膚モデルの表皮面上に繊維製品のサンプル片をおく工程、(2)この状態で皮膚モデルを培養する工程を有する、皮膚刺激性判定法。
【請求項2】(1)及び(2)の工程に続いて、(2)で得られる皮膚モデルの細胞生存率又は細胞毒性を評価する工程を有する、請求項1記載の皮膚刺激性判定法。
【請求項3】繊維製品が衣類である請求項1又は2記載の皮膚刺激性判定法。
【請求項4】皮膚モデルが、皮膚細胞を含む表皮様組織及び真皮様組織の二層構造よりなる培養皮膚であることを特徴とする請求項1乃至3のいずれかに記載の皮膚刺激性判定法。
【請求項5】皮膚モデルが、少なくとも架橋度が異なる二種のスポンジ状生体親和性高分子を基材とし、一方の高架橋度の基材上に繊維芽細胞を播種し培養した後、かかる基材上に他方の低架橋度の基材を重ね、その上に角化細胞を播種し培養して得られる培養皮膚である、請求項1乃至4のいずれかに記載の皮膚刺激性判定法。
【図1】




【公開番号】特開2000−93193(P2000−93193A)
【公開日】平成12年4月4日(2000.4.4)
【国際特許分類】
【出願番号】特願平10−269106
【出願日】平成10年9月24日(1998.9.24)
【出願人】(000001339)グンゼ株式会社 (919)
【Fターム(参考)】
【公開日】平成12年4月4日(2000.4.4)
【国際特許分類】
【出願日】平成10年9月24日(1998.9.24)
【出願人】(000001339)グンゼ株式会社 (919)
【Fターム(参考)】
[ Back to top ]

