置換および非置換アダマンチルアミドの新規化合物
【課題】11 β−hsd−1阻害剤であり、糖尿病、肥満、緑内障、骨粗鬆症、認知障害、免疫障害、うつ病、高血圧、および代謝性疾患の治療に有用な化合物の提供。
【解決手段】
本発明は、式(I)の化合物または薬学的に許容できるそれらの塩を提供する。また、本発明は、式(I)の化合物を含む医薬組成物および11−β−hsd−1の変調によって仲介される状態を治療する方法であって、有効量の式(I)の化合物を哺乳類に投与することを含む方法を提供する。

【解決手段】
本発明は、式(I)の化合物または薬学的に許容できるそれらの塩を提供する。また、本発明は、式(I)の化合物を含む医薬組成物および11−β−hsd−1の変調によって仲介される状態を治療する方法であって、有効量の式(I)の化合物を哺乳類に投与することを含む方法を提供する。

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規化合物、その化合物を含む医薬組成物、ならびに医学におけるおよびヒト11−β−ヒドロキシステロイドデヒドロゲナーゼ1型酵素(11−β−hsd−1)に作用する医薬品を調製するためのその化合物の使用に関する。
【背景技術】
【0002】
グルココルチコイドが糖尿病において中心的役割を果たすことは、半世紀以上にわたって知られてきた。例えば、糖尿病動物からの下垂体または副腎腺を摘出すると、糖尿病の最も重篤な症状を緩和し、血液中のグルコースの濃度を低下させる(Long,C.D.およびF.D.W.Leukins(1936)J.Exp.Med.63:465〜490;Houssay,B.A.(1942)Endocrinology 30:884〜892)。さらに、グルココルチコイドが、肝臓に対するグルカゴンの作用を可能にすることもよく知られている。
【0003】
局所的なグルココルチコイド作用および肝臓でのグルコース産生の重要なレギュレーターとしての11−β−hsd−1の役割は、十分に立証されている(例えば、Jamieson他(2000)J.Endocrinol.165:p.685〜692)。非特異的11−β−hsd−1阻害剤カルベノキソロンを投与した健常人志願者において肝臓のインスリン感受性が改善された(Walker,B.R.、他(1995)J.Clin.Endocrinol.Metab.80:3155〜3159)。さらに、予想機序は、マウスおよびラットによる様々な実験により確立されている。これらの研究は、肝臓でのグルコース産生における2つの重要な酵素、すなわちグルコース新生における律速酵素であるホスホエノールピルビン酸カルボキシキナーゼ(PEPCK)、ならびにグルコース新生およびグリコーゲン分解の最終共通ステップを触媒するグルコース−6−ホスファターゼ(G6Pase)のmRNAレベルおよび活性が低下することを示した。最後に、血糖値および肝臓でのグルコース産生は、11−β−hsd−1遺伝子がノックアウトされたマウスにおいて低下した。また、このモデルからのデータは、PEPCKおよびG6Paseの基礎レベルがグルココルチコイドと関係なく調節されるため、11−β−hsd−1の阻害が、予測されたように、低血糖を引き起こさないことを裏付けている(Kotelevtsev,Y.、他、(1997)Proc.Natl.Acad.Sci.USA 94:14924〜14929)。
【0004】
腹部肥満は、グルコース不耐性、高インスリン血症、高トリグリセリド血症、およびいわゆるメタボリック症候群の他の要素(例えば、血圧の上昇、HDLレベルの減少およびVLDLレベルの増加)と密接に関係している(MontagueおよびO′Rahilly、Diabetes 49:883〜888、2000)。肥満は、メタボリック症候群ならびに2型糖尿病の大部分(>80%)における重要な要素であり、大網脂肪は、中心的な重要性をもっているように見える。前脂肪細胞(間質細胞)における酵素の阻害は、脂肪細胞への分化速度を減少させることが分かっている。このことは、大網脂肪蓄積拡大の減少(おそらく低下)、すなわち、中心性肥満の減少をもたらすと予想される(Bujalska,I.J.、Kumar,S.、およびStewart,P.M.(1997)Lancet 349:1210〜1213)。
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明の化合物は、11 β−hsd−1阻害剤であり、したがって、糖尿病、肥満、緑内障、骨粗鬆症、認知障害、免疫障害、うつ病、高血圧、および代謝性疾患の治療に有用であると考えられる。
【課題を解決するための手段】
【0006】
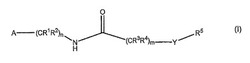
本発明は、式(I)の化合物、または薬学的に許容できるその塩もしくは溶媒和物に関し、
【0007】
【化1】

式中、
各R1、R2、R3、およびR4は、Hおよび(C1〜C6)アルキルから独立して選択され、
Yは、O、S、およびNR6からなる群から選択され、
各R5およびR6は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR7R8)t(C3〜C10)シクロアルキル、−(CR7R8)t(C6〜C10)アリール、および−(CR7R8)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、
あるいは、Yが、NR6である場合、R5およびR6は、それらが結合している窒素原子と一緒になって、(4〜11)員ヘテロシクリルを形成していてもよく、(4〜11)員ヘテロシクリルは、1〜5個のR9基により置換されていてもよく、
各R7およびR8は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
Aは、アダマンチルであり、
nおよびmは、0、1、2、および3からなる群から独立して選択され、
kは、1または2であり、
jは、0、1、および2からなる群から選択され、
t、u、p、qおよびvは、各々、0、1、2、3、4、および5からなる群から独立して選択され、
A、R1、R2、R3、R4、R5、R6、R7、およびR8の任意の炭素原子は、1〜5個のR9基により置換されていてもよく、
R5またはR6が(4〜11)員ヘテロシクリルであるR5またはR6の任意の窒素原子は、各々、1〜5個のR9基により置換されていてもよく、
各R9基は、ハロ、シアノ、ニトロ、−CF3、−CHF2、−CH2F、トリフルオロメトキシ、アジド、ヒドロキシ、(C1〜C6)アルコキシ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR10R11)t(C3〜C10)シクロアルキル、−(CR12R13)t(C6〜C10)アリール、−O−R12、−(C=O)−R12、−(C=O)−O−R12、−O−(C=O)−R12、−O−(R12)−O−(R13)、−NR12(C=O)−R13、−(C=O)−NR12R13、−NR12R13、−NR12OR13、−S(O)kNR12R13、−S(O)j(C1〜C6)アルキル、−O−SO2−R14、−NR14−S(O)k−R15、−(CR14R15)v(C6〜C10)アリール、−(CR14R15)v(4〜11)員ヘテロシクリル、−(CR14R15)q(C=O)(CR14R15)v(C6〜C10)アリール、−(CR14R15)q(C=O)(CR14R15)v(4〜11)員ヘテロシクリル、−(CR14R15)vO(CR14R15)q(C6〜C10)アリール、−(CR14R15)vO(CR14R15)q(4〜11)員ヘテロシクリル、−(CR14R15)qS(O)j(CR14R15)v(C6〜C10)アリール、および−(CR14R15)qS(O)j(CR14R15)v(4〜11)員ヘテロシクリルからなる群から独立して選択され、
上記R9基の任意の(4〜11)員ヘテロシクリルの任意の1または2個の炭素原子は、オキソ(=O)で置換されていてもよく、
上記R9基の任意の(C1〜C6)アルキル、任意の(C6〜C10)アリールおよび任意の(4〜11)員ヘテロシクリルの任意の炭素原子は、ハロ、シアノ、ニトロ、−CF3、−CFH2、−CF2H、トリフルオロメトキシ、アジド、−OR16、−(C=O)−R16、−(C=O)−O−R16、−O−(C=O)−R16、−NR16(C=O)−R17、−(C=O)−NR16R17、−NR16R17、−NR16OR17、−S(O)kNR12R13、−S(O)j(C1〜C6)アルキル、−O−SO2−R14、−NR14−S(O)k−R15、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR17R18)u(C6〜C10)アリール、および−(CR17R18)u(4〜11)員ヘテロシクリルから独立して選択される1〜5個の置換基で置換されていてもよく、
各R10、R11、R12、R13、R14、R15、R16、R17、およびR18基は、H、(C1〜C6)アルキル、−(CR19R20)t(C3〜C10)シクロアルキル、−(CR19R20)p(C6〜C10)アリール、および−(CR19R20)p(4〜11)員ヘテロシクリルからなる群から独立して選択され、
前記各R10、R11、R12、R13、R14、R15、R16、R17、およびR18基の(4〜11)員ヘテロシクリルの任意の1または2個の炭素原子は、オキソ(=O)で置換されていてもよく、
上記R10、R11、R12、R13、R14、R15、R16、R17、およびR18基の(C1〜C6)アルキル、任意の(C6〜C10)アリールおよび任意の(4〜11)員ヘテロシクリルの任意の炭素原子は、ハロ、シアノ、ニトロ、−NR21R22、−CF3、−CHF2、−CH2F、トリフルオロメトキシ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、ヒドロキシ、および(C1〜C6)アルコキシからなる群から独立して選択される1〜5個の置換基で置換されていてもよく、
各R19、R20、R21、およびR22基は、Hおよび(C1〜C6)アルキルからなる群から独立して選択され、
ハロ、−SOもしくは−SO2基またはN、OもしくはS原子と結合していない−CH3(メチル)、−CH2(メチレン)、または−CH(メチン)基を含む上記置換基のいずれも、ヒドロキシ、ハロ、(C1〜C6)アルキル、(C1〜C6)アルコキシ、アミノ、−NH(C1〜C6)(アルキル)および−N(C1〜C6)(アルキル)(C1〜C6)アルキルからなる群から独立して選択される置換基を前記基上に有していてよい。
【0008】
Yが、Oである化合物式(I)による本発明のある実施形態。
【0009】
Yが、NR6である化合物式(I)による本発明の別の実施形態。
【0010】
R5およびR6が、それらが結合している窒素と一緒になって、(4〜11)員ヘテロシクリルを形成している化合物式(I)による本発明のさらに別の実施形態。
【0011】
R5およびR6が、それらが結合している窒素と一緒になって、(4〜11)員ヘテロシクリルを形成しているこの実施形態の特定の態様において、(4〜11)員ヘテロシクリルは、下式からなる群から選択される。
【0012】
【化2】

【0013】
R5およびR6が、それらが結合している窒素と一緒になって、(4〜11)員ヘテロシクリルを形成している式(I)による化合物のさらに別の実施形態において、(4〜11)員ヘテロシクリルは、ピロリジニル、インドリル、イソキノリニル、ピペラジニル、およびピペリジニルからなる群から選択される。
【0014】
式(I)の化合物による本発明のある実施形態は、下式、または薬学的に許容できるそれらの塩からなる群から選択される。
【0015】
【化3−1】

【0016】
【化3−2】

【0017】
【化3−3】

【0018】
式(I)の化合物による本発明のある実施形態は、下式、または薬学的に許容できるそれらの塩からなる群から選択される。
【0019】
【化4】

【0020】
本発明のある実施形態において、有効量の式(I)による化合物、または薬学的に許容できるその塩もしくは溶媒和物、および薬学的に許容できる担体を含む医薬組成物。
【0021】
本発明のさらに別の実施形態において、11−β−hsd−1酵素の変調によって仲介される状態を治療する方法であって、有効量の式(I)による化合物、または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【0022】
本発明のさらに別の実施形態において、糖尿病、メタボリック症候群、インスリン抵抗症候群、肥満、緑内障、高脂血症、高血糖症、高インスリン血症、骨粗鬆症、結核、アテローム性動脈硬化症、認知症、うつ病、ウイルス疾患、炎症性障害、または肝臓が標的器官である疾患を治療する方法であって、有効量の式(I)による化合物、または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【0023】
本発明の別の実施形態において、11−β−hsd−1酵素の変調によって仲介される状態を治療する方法であって、緑内障を治療するための治療剤と組み合わせて、有効量の式(I)による化合物または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【0024】
さらに別の実施形態において、状態を治療する方法であって、緑内障を治療するためのプロスタノイド受容体作用薬(前記作用薬は、ラタノプロストである)と組み合わせて、有効量の式(I)による化合物または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【0025】
本発明のさらに別の実施形態において、状態を治療する方法であって、緑内障を治療するための知られている治療剤(前記薬剤は、炭酸脱水酵素阻害剤である)と組み合わせて、有効量の式(I)による化合物または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【0026】
本発明のある実施形態において、状態を治療する方法であって、知られている治療剤(前記治療剤は、PPAR作用薬である)と組み合わせて、有効量の式(I)による化合物を哺乳類に投与することを含む方法。
【0027】
本発明のある実施形態において、式(III)の化合物を調製する方法であって
【0028】
【化5】

[式中、
R7およびR8は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、あるいは
R7およびR8は、それらが結合している窒素と一緒になって、縮合または非縮合であってもよい(4〜11)員複素環を形成していてもよく、
tは、0、1、2、3、4、および5からなる群から選択され、
各R9およびR10は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
Aは、非置換であるか、あるいはハロ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルである]、
式(II)の化合物を
【0029】
【化6】

[式中、
Xは、脱離基であり、
Aは、上記のように定義されている]、
塩基の存在下、溶媒中で、アミンで処理して、式(III)の化合物を製造するステップ(a)と、式(Ia)の化合物を
【0030】
【化7】

[式中、
Aは、上記のように定義されている]、
塩基の存在下、溶媒中で、ハロゲン化アシルで処理して、式(II)の化合物を製造するステップ(b)とを含む方法。
【0031】
さらに別の実施形態において、ステップ(a)におけるXが、Cl、Br、およびメタンスルホネートからなる群から選択される方法。
【0032】
さらに別の実施形態において、ステップ(a)におけるアミンが、R7R8NHである方法。
【0033】
別の実施形態において、ステップ(a)における塩基が、K2CO3、NaHCO3、および(C2H5)3Nからなる群から選択される方法。
【0034】
さらに別の実施形態において、ステップ(a)が、約20℃から溶媒の沸点の温度範囲で進行する方法。
【0035】
さらに別の実施形態において、ステップ(b)における溶媒が、CH2Cl2またはアセトニトリルである方法。
【0036】
さらに別の実施形態において、ステップ(b)における塩基が、(C2H5)3NまたはNaHCO3である方法。
【0037】
さらに別の実施形態において、ステップ(b)が、約−15℃から約50℃の温度範囲で進行する方法。
【0038】
本発明のある実施形態において、式(IIa)の化合物を調製する方法であって
【0039】
【化8】

[式中、
Aは、非置換であるか、あるいはハロ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルであり、
各R9およびR10は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
tは、0、1、2、3、4、および5からなる群から選択される]、
式(V)の化合物を
【0040】
【化9】

[式中、
Aは、上記のように定義されている]、
ニートのSOCl2または溶媒中のSOCl2で処理して、式(IIa)の化合物を生成するステップ(c)と、
式(IV)の化合物を
【0041】
【化10】

[式中、
Aは、上記のように定義されており、
PGは、保護基である]、
溶媒中、保護基除去剤で処理して、式(V)の化合物を生成するステップ(d)と、
式(Ia)の化合物を
【0042】
【化11】

【0043】
【化12】

[式中、
Aは、上記のように定義されている]、
酸とカップリングさせて、式(IV)の化合物を生成するステップ(e)とを含む方法。
【0044】
さらに別の実施形態において、ステップ(c)における溶媒が、CCl4である方法。
【0045】
さらに別の実施形態において、ステップ(c)が、20℃〜100℃の温度にて行われる方法。
【0046】
別の実施形態において、ステップ(d)におけるPGが、(C6〜C12)アリールである方法。
【0047】
さらに別の実施形態において、PGが、フェニルである方法。
【0048】
さらに別の実施形態において、ステップ(d)における保護基除去剤が、(CH3)3Silである方法。
【0049】
さらに別の実施形態において、ステップ(d)における溶媒が、CHCl3である方法。
【0050】
さらに別の実施形態において、ステップ(d)が、20℃から溶媒の沸点の温度にて行われる方法。
【0051】
さらに別の実施形態において、ステップ(e)における酸が、ベンジルオキシ酢酸である方法。
【0052】
本発明のある実施形態において、式(III)の化合物を調製する方法であって
【0053】
【化13】

[式中、
R7およびR8は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、あるいは
R7およびR8は、それらが結合している窒素と一緒になって、縮合または非縮合であってもよい(4〜11)員複素環を形成していてもよく、
各R9およびR10は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
Aは、非置換であるか、あるいはハロ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルであり、
tは、0、1、2、3、4、および5からなる群から選択される]、
式(Ia)の化合物を、
【0054】
【化14】

式(VI)の化合物で
【0055】
【化15】

[式中、
R3は、(C1〜C6)アルキルであり、
R7およびR8は、上記で定義されている]、
適当な溶媒中、試薬の存在下で処理して、式(III)の化合物を生成するステップ(f)と、
式(VII)の化合物を
【0056】
【化16】

[式中、
R3は、上記で定義されており、
Xは、脱離基である]、
塩基の存在下で適当な溶媒中、アミンで処理して、式(VI)の化合物を生成するステップ(g)とを含む方法。
【0057】
さらに別の実施形態において、ステップ(f)においてR3が、メチルまたはエチルである方法。
【0058】
さらに別の実施形態において、ステップ(f)におけるXが、Cl、Brおよびメタンスルホネートからなる群から選択される方法。
【0059】
さらに別の実施形態において、ステップ(f)が、試薬Al(CH3)2Clを用いて行われる方法。
【0060】
さらに別の実施形態において、ステップ(f)が、溶媒CH2Cl2を用いて行われる方法。
【0061】
さらに別の実施形態において、ステップ(f)が、0℃から約20℃の温度にて行われる方法。
【0062】
さらに別の実施形態において、ステップ(g)におけるアミンが、R7R8NHである方法。
【0063】
さらに別の実施形態において、ステップ(g)における溶媒が、CH2Cl2またはDMFである方法。
【0064】
さらに別の実施形態において、ステップ(g)における塩基が、NaHCO3またはトリエチルアミンである方法。
【0065】
定義
本発明のために、本明細書において記載され特許請求の範囲に記載されているように、以下の用語は、以下の通り定義される。
【0066】
本明細書で使用する用語「含む(comprising)」および「含む(including)」は、それらのオープンな非限定的意味で使用される。
【0067】
本明細書で使用する用語「アルキル」には、他に指示がない限り、直鎖または分岐鎖部分を有する飽和一価炭化水素基が含まれる。
【0068】
本明細書で使用する用語「アルケニル」には、他に指示がない限り、アルキルが、上記で定義した通りである少なくとも1個の炭素−炭素二重結合を有するアルキル部分が含まれ、前記アルケニル部分のEおよびZ異性体が含まれる。
【0069】
本明細書で使用する用語「アルキニル」には、他に指示がない限り、アルキルが、上記で定義した通りである少なくとも1個の炭素−炭素三重結合を有するアルキル部分が含まれる。
【0070】
本明細書で使用する用語「アルコキシ」には、他に指示がない限り、アルキルが、上記で定義した通りであるO−アルキル基が含まれる。
【0071】
本明細書で使用する用語「OMs」は、他に指示がない限り、メタンスルホネートを意味するよう意図されている。
【0072】
本明細書で使用する用語「Me」は、他に指示がない限り、メチルを意味するよう意図されている。
【0073】
本明細書で使用する用語「Et」は、他に指示がない限り、エチルを意味するよう意図されている。
【0074】
本明細書で使用する用語「Et3N」は、他に指示がない限り、トリエチルアミンを意味するよう意図されている。
【0075】
本明細書で使用する用語「EtOAc」は、他に指示がない限り、酢酸エチルである。
【0076】
本明細書で使用する用語「AlMe2Cl」は、他に指示がない限り、塩化ジメチルアルミニウムを意味するよう意図されている。
【0077】
本明細書で使用する用語「Ac」は、他に指示がない限り、アセチルを意味するよう意図されている。
【0078】
本明細書で使用する用語「NT」は、他に指示がない限り、未試験を意味するよう意図されている。
【0079】
本明細書で使用する用語「TFA」は、他に指示がない限り、トリフルオロ酢酸を意味するよう意図されている。
【0080】
本明細書で使用する用語TEAは、他に指示がない限り、トリエタノールアミンを意味するよう意図されている。
【0081】
本明細書で使用する用語G6Pは、他に指示がない限り、グルコース−6−リン酸を意味するよう意図されている。
【0082】
本明細書で使用する用語NADPHは、他に指示がない限り、還元型のニコチンアミドアデニンジヌクレオチドリン酸を意味するよう意図されている。
【0083】
慣習により、本明細書における一部の構造式において、炭素原子およびそれらの結合水素原子は明示されず、例えば、
【0084】
【化17】

は、メチル基を表し、
【0085】
【化18】

は、エチル基を表し、
【0086】
【化19】

は、シクロペンチル基を表すなどである。
【0087】
本明細書で使用する用語「アミノ」には、−NH2基、およびN原子上の任意の置換体が含まれるよう意図されている。
【0088】
本明細書で使用する用語「ハロゲン」および「ハロ」は、塩素、フッ素、臭素またはヨウ素を表す。
【0089】
本明細書で使用する用語「トリフルオロメチル」は、−CF3基を表すことを意図している。
【0090】
本明細書で使用する用語「トリフルオロメトキシ」は、−OCF3基を表すことを意図している。
【0091】
本明細書で使用する用語「シアノ」は、−CN基を表すことを意図している。
【0092】
用語「置換されている」は、指定した基または部分が、1つまたは複数の置換基を有することを意味する。用語「置換されていない」は、指定した基が、置換基を有していないことを意味する。用語「置換されていてもよい」は、指定した基が、置換されていないか、あるいは1つまたは複数の置換基で置換されていることを意味する。
【0093】
本明細書で使用する用語「ニートの」は、溶媒が存在しないことを表すことを意図している。
【0094】
−(CR7R8)tまたは−(CR14R15)vなどの用語は、例えば、R7、R8、R14およびR15が、1を超えるtまたはvの各反復によって変化することがある場合に使用される。例えば、tまたはvが2である場合、用語−(CR7R8)vまたは−(CR14R15)tは、−CH2CH2−、または−CH(CH3)C(CH2CH3)(CH2CH2CH3)−、またはR7、R8、R14およびR15の定義の範囲内にある任意の数の類似部分に等しいことがある。
【0095】
本明細書で使用する用語Kiは、酵素阻害定数の値を意味するよう意図されている。
【0096】
本明細書で使用する用語IC50は、50%酵素阻害に必要とされる濃度を意味するよう意図されている。
【0097】
本明細書で使用する用語「min」は、他に指示がない限り、分を意味するよう意図されている。
【0098】
本明細書で使用する用語「m/z」は、他に指示がない限り、質量/電荷比を意味するよう意図されている。
【0099】
本明細書で使用する用語「DMF」は、他に指示がない限り、N,N−ジメチルホルムアミドを意味するよう意図されている。
【0100】
本明細書で使用する用語「DMSO」は、他に指示がない限り、ジメチルスルホキシドを意味するよう意図されている。
【0101】
本明細書で使用する語句「1つまたは複数の薬学的に許容できる塩」には、他に指示がない限り、式(1)の化合物中に存在する酸性基または塩基性基の塩が含まれる。塩基性の性質である式(I)の化合物は、様々な無機酸および有機酸と多種多様な塩を形成することができる。そのような式(1)の塩基性化合物の薬学的に許容できる酸付加塩を調製するのに使用することができる酸は、無毒性の酸付加塩、すなわち酢酸塩、ベンゼンスルホン酸塩、安息香酸塩、重炭酸塩、重硫酸塩、重酒石酸塩、ホウ酸塩、臭化物、カルシウムエデト酸塩、カンシル酸塩、炭酸塩、塩化物、クラブラン酸塩、クエン酸塩、二塩酸塩、エデト酸塩、エジシル酸塩、エストレート、エシレート、エチルコハク酸塩、フマル酸塩、グルセプテート、グルコン酸塩、グルタミン酸塩、グリコリルアルサニル酸塩、ヘキシルレゾルシネート(hexylresorcinate)、ヒドラバミン(hydrabamine)、臭化水素酸塩、塩酸塩、ヨウ化物、イソチオネート(isothionate)、乳酸塩、ラクトビオン酸塩、ラウリン酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、メチル硫酸塩、粘液酸塩、ナプシル酸塩、硝酸塩、オレイン酸塩、シュウ酸塩、パモ酸塩(エンボン酸塩)、パルミチン酸塩、パントテン酸塩、リン酸塩/二リン酸塩、ポリガラクツロン酸塩、サリチル酸塩、ステアリン酸塩、塩基性酢酸塩、コハク酸塩、タンニン酸塩、酒石酸塩、テオクル酸塩、トシル酸塩、トリエチオドード(triethiodode)、および吉草酸塩などの薬理学的に許容できる陰イオンを含む塩を形成する酸である。
【0102】
本明細書で使用する用語「肝臓が標的器官である疾患」は、他に指示がない限り、糖尿病、肝炎、肝癌、肝線維症、およびマラリアを意味する。
【0103】
本明細書で使用する用語「メタボリック症候群」は、他に指示がない限り、乾癬、糖尿病、創傷治癒、炎症、神経変性疾患、ガラクトース血症、メープルシロップ尿症、フェニルケトン尿症、高サルコシン血症、チミンウラシル尿症、スルフィヌリア(sulfinuria)、イソ吉草酸血症、サッカロピン尿症、4−ヒドロキシ酪酸尿症、グルコース−6−リン酸脱水素酵素欠損症、およびピルビン酸脱水素酵素欠損症を意味する。
【0104】
本明細書で使用する用語「治療すること」は、他に指示がない限り、そのような用語があてはまる障害もしくは状態、またはそのような障害もしくは状態の1つまたは複数の症状の進行を逆転、緩和、阻害すること、またはそれらを予防することを意味する。本明細書で使用する用語「治療」は、他に指示がない限り、「治療すること」が直ぐ前で定義されているように、治療する行為を指す。
【0105】
本明細書で使用する用語「変調する」または「変調すること」は、ステロイド/甲状腺スーパーファミリーのあるメンバーのモジュレーターが、直接的に(リガンドとして受容体と結合することにより)または間接的に(リガンドの前駆体または前駆体からのリガンドの産生を促進するインデューサーとして)ホルモン発現コントロール下で維持される1つまたは複数の遺伝子の発現を誘発する、またはそのようなコントロール下で維持される1つまたは複数の遺伝子の発現を抑制する能力を指す。
【0106】
本明細書で使用する用語「肥満」または「肥満の」は、一般的に、彼または彼女の年齢、性別および身長に対する平均体重を少なくとも約20〜30%上回っている個人を指す。技術的に、「肥満の」は、男性の場合、ボディーマス指数が27.8kg/m2を超えている個人と、女性の場合、ボディーマス指数が27.3kg/m2を超えている個人と定義されている。当業者には当然のことながら、本発明は、上記の基準に含まれる個人に限定されるものではない。実際、本発明の方法は、これらの伝統的基準から外れている個人、例えば、肥満になる傾向のある個人によっても有利に実施することができる。
【0107】
本明細書で使用する用語「炎症性障害」は、関節リウマチ、強直性脊椎炎、乾癬性関節炎、乾癬、軟骨石灰化、痛風、炎症性腸疾患、潰瘍性大腸炎、クローン病、線維筋痛、および悪液質などの障害を指す。
【0108】
本明細書で使用する語句「有効量」は、研究者、獣医師、医師または他の人により求められている組織、システム、動物、またはヒトの生物学的または医学的応答を誘発するはずの薬物または薬剤の量を指す。
【0109】
本明細書で使用する「血糖値を低下させるのに有効な量」は、望ましい効果を得るのに十分な高い循環濃度を提供するのに十分な化合物のレベルを指す。そのような濃度は、通常、約10nMから2μMまでの範囲に入り、約100nMから500nMまでの範囲の濃度が好ましい。前述のように、上記に記載したような式(I)の定義に含まれる様々な化合物の活性は、かなり変化することがあり、個々の対象は、症状の重症度に幅広い変化を示すことがあるため、治療に対する対象の応答を判断し、それによって用量を変えることは、開業医に委ねられている。
【0110】
本明細書で使用する用語「インスリン抵抗性」は、全身または骨格筋組織、心筋組織、脂肪組織または肝組織などの個々の組織におけるインスリンの作用に対する感受性の低下を指す。インスリン抵抗性は、糖尿病の有無にかかわらず多くの個人で生じる。
【0111】
本明細書で使用する語句「インスリン抵抗症候群」は、インスリン抵抗性、高インスリン血症、インスリン非依存性糖尿病(NIDDM)、動脈性高血圧、中心性(内臓型)肥満、および異常脂質血症が含まれる徴候の群を指す。
【0112】
本明細書で使用する用語「シクロアルキル」は、他に指示がない限り、合計3〜10個の炭素原子、好ましくは5〜8個の環炭素原子を含む本明細書で参照される非芳香族、飽和または部分飽和、単環式または縮合、スピロもしくは非縮合二環式もしくは三環式炭化水素を指す。例示的シクロアルキルには、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチルなどの3〜10個の炭素原子を有する単環式環、およびアダマンチルが含まれる。シクロアルキルの説明に役立つ例は、以下から誘導されるが、これらに限定されるものではない。
【0113】
【化20】

【0114】
本明細書で使用する用語「アリール」には、他に指示がない限り、フェニルまたはナフチルなどの、1個の水素の除去により芳香族炭化水素から誘導される有機基が含まれる。
【0115】
本明細書で使用する用語「(3〜7)員ヘテロシクリル」、「(6〜10)員ヘテロシクリル」、または「(4〜11)員ヘテロシクリル」には、他に指示がない限り、O、SおよびNから各々選択される1〜4個のヘテロ原子を含む芳香族および非芳香族複素環基が含まれ、各複素環基は、その環系内にそれぞれ3〜7個、6〜10個、または4〜11個の原子を有するが、ただし、前記基の環は、2つの隣接するOまたはS原子を含むことはない。非芳香族複素環基には、それらの環系内に3個のみの原子を有する基が含まれるが、芳香族複素環基は、それらの環系内に少なくとも5個の原子を有していなければならない。複素環基には、ベンゾ縮合環系が含まれる。3員複素環基の一例は、アジリジンであり、4員複素環基の一例は、アゼチジニル(アゼチジンから誘導される)である。5員複素環基の一例は、チアゾリルであり、7員環の一例は、アゼピニルであり、10員複素環基の一例は、キノリニルである。非芳香族複素環基の例は、ピロリジニル、テトラヒドロフラニル、ジヒドロフラニル、テトラヒドロチエニル、テトラヒドロピラニル、ジヒドロピラニル、テトラヒドロチオピラニル、ピペリジノ、モルホリノ、チオモルホリノ、チオキサニル、ピペラジニル、アゼチジニル、オキセタニル、チエタニル、ホモピペリジニル、オキセパニル、チエパニル、オキサゼピニル、ジアゼピニル、チアゼピニル、1,2,3,6−テトラヒドロピリジニル、2−ピロリニル、3−ピロリニル、インドリニル、2H−ピラニル、4H−ピラニル、ジオキサニル、1,3−ジオキソラニル、ピラゾリニル、ジチアニル、ジチオラニル、ジヒドロピラニル、ジヒドロチエニル、ジヒドロフラニル、ピラゾリジニル、イミダゾリニル、イミダゾリジニル、3−アザビシクロ[3.1.0]ヘキサニル、3−アザビシクロ[4.1.0]ヘプタニル、3H−インドリルおよびキノリジニルである。芳香族複素環基の例は、ピリジニル、イミダゾリル、ピリミジニル、ピラゾリル、トリアゾリル、ピラジニル、テトラゾリル、フリル、チエニル、イソオキサゾリル、チアゾリル、オキサゾリル、イソチアゾリル、ピロリル、キノリニル、イソキノリニル、インドリル、ベンゾイミダゾリル、ベンゾフラニル、シンノリニル、インダゾリル、インドリジニル、フタラジニル、ピリダジニル、トリアジニル、イソインドリル、プテリジニル、プリニル、オキサジアゾリル、チアジアゾリル、フラザニル、ベンゾフラザニル、ベンゾチオフェニル、ベンゾチアゾリル、ベンゾオキサゾリル、キナゾリニル、キノキサリニル、ナフチリジニル、およびフロピリジニルである。上記に列挙された基から誘導されるように、上記の基は、可能な場合には、C結合またはN結合であってもよい。例えば、ピロールから誘導される基は、ピロール−1−イル(N結合)またはピロール−3−イル(C結合)であってもよい。さらに、イミダゾールから誘導される基は、イミダゾール−1−イル(N結合)またはイミダゾール−3−イル(C結合)であってもよい。4〜7員複素環は、1個の環につき1つまたは2つのオキソにより任意の1つまたは複数の環炭素、イオウ、または窒素原子上で置換されていてもよい。2個の環炭素原子がオキソ部分で置換されている複素環基の一例は、1,1−ジオキソ−チオモルホリニルである。他の4〜7員複素環の説明に役立つ例は、以下から誘導されるが、これらに限定されるものではない。
【0116】
【化21】

【0117】
他に指示がない限り、用語「オキソ」は、=Oを指す。
【0118】
「溶媒和物」は、そのような化合物の生物学的有効性を保持している指定した化合物の薬学的に許容できる溶媒和形態を意味するよう意図されている。溶媒和物の例には、水、イソプロパノール、エタノール、メタノール、DMSO(ジメチルスルホキシド)酢酸エチル、酢酸、またはエタノールアミンと組み合わせた本発明の化合物が含まれる。
【0119】
本発明の化合物は、不斉炭素原子を有することがある。本発明の化合物の炭素−炭素結合は、本明細書において、以下の実線
【0120】
【化22】

以下の実線のくさび形、
【0121】
【化23】

または以下の破線のくさび形を用いて描かれることがある。
【0122】
【化24】

不斉炭素原子との結合を描くための実線の使用は、その炭素原子におけるすべての可能な立体異性体が含まれることを示すことを意図している。不斉炭素原子との結合を描くための実線のくさび形かまたは破線のくさび形の使用は、示されている立体異性体のみが含まれることを意図していることを示すことを意図している。本発明の化合物は、2つ以上の不斉炭素原子を含む可能性がある。それらの化合物では、不斉炭素原子との結合を描くための実線の使用は、すべての可能な立体異性体が含まれることを意図していることを示すことを意図している。本発明の化合物における1つまたは複数の不斉炭素原子との結合を描くための実線の使用、および同じ化合物における他の不斉炭素原子との結合を描くための実線のくさび形かまたは破線のくさび形の使用は、ジアステレオマーの混合物が存在することを示すことを意図している。
【0123】
本発明の個々の立体異性化合物の溶液は、平面偏光を回転させることがある。本発明の化合物の名前における「(+)」かまたは「(−)」記号の使用は、当業者に知られている技法を用いて測定すると、特定の立体異性体の溶液が、平面偏光を(+)または(−)方向に回転させることを示している。
【0124】
ジアステレオ異性体混合物は、当業者に知られている方法により、例えば、クロマトグラフィーまたは分別結晶により、それらの物理的化学的相違に基づいてそれらの個々のジアステレオマーに分離することができる。鏡像異性体は、適切な光学活性な化合物(例えば、アルコール)との反応により鏡像異性体混合物をジアステレオ異性体混合物に変換し、ジアステレオマーを分離し、個々のジアステレオマーを対応する純粋な鏡像異性体に変換する(例えば、加水分解する)ことにより分離することができる。ジアステレオ異性体混合物および純粋な鏡像異性体を含むそのようなすべての異性体は、本発明の一部と見なされる。
【0125】
あるいは、本発明の個々の立体異性化合物は、不斉合成により、鏡像異性的に濃縮された形態で調製することができる。不斉合成は、市販されているか当業者に知られている方法を用いて容易に調製される不斉出発材料の使用、合成の完了時に除去することができる不斉助剤の使用、または酵素的方法を用いる中間化合物の分割などの当業者に知られている技法を用いて行うことができる。そのような方法の選択は、出発材料の入手可能性、方法の相対的効率、およびそのような方法が特定の官能基を含む本発明の化合物に有用であるか否かが含まれるがこれらに限定されない要素によって異なるはずである。そのような選択は、当業者の知識の範囲内にある。
【0126】
本発明の化合物が不斉炭素原子を含む場合、派生する塩、プロドラッグおよび溶媒和物は、単一立体異性体、ラセミ化合物、および/または鏡像異性体および/またはジアステレオマーの混合物として存在することがある。そのようなすべての単一立体異性体、ラセミ化合物、およびそれらの混合物は、本発明の範囲内にあるよう意図されている。
【0127】
当業者には当然のことながら、光学的に純粋な化合物は、鏡像異性的に純粋である化合物である。本明細書で使用する用語「光学的に純粋な」は、少なくとも十分な活性を備える化合物を意味するよう意図されている。本発明の望ましい薬理学的に純粋な化合物を有する化合物を得るための光学的に純粋な量の単一鏡像異性体は、単一異性体を少なくとも90%含む(80%鏡像異性体過剰率)ことが好ましく、少なくとも95%である(90%e.e.)ことがより好ましく、少なくとも97.5%である(95%e.e.)ことがより好ましく、少なくとも99%である(98%e.e.)ことが最も好ましい。
【0128】
本発明の方法で使用される誘導体が塩基である場合、望ましい塩は、塩化水素酸;臭化水素酸;硫酸;硝酸;リン酸などの無機酸による、または酢酸;マレイン酸;コハク酸;マンデル酸;フマル酸;マロン酸;ピルビン酸;シュウ酸;グリコール酸;サリチル酸などの有機酸;グルクロン酸もしくはガラクツロン酸などのピラノシジル(pyranosidyl)酸;クエン酸もしくは酒石酸などのα−ヒドロキシ酸;アスパラギン酸もしくはグルタミン酸などのアミノ酸;安息香酸もしくは桂皮酸などの芳香族酸;p−トルエンスルホン酸もしくはエタンスルホン酸などのスルホン酸などによる遊離塩基の処理を含む当技術分野で知られている任意の適当な方法により調製することができる。
【0129】
本発明の方法において使用される誘導体が酸である場合、望ましい塩は、アミン(一級、二級、または三級);アルカリ金属水酸化物またはアルカリ土類金属水酸化物などによる遊離酸の処理を含む当技術分野で知られている任意の適当な方法により調製することができる。適当な塩の説明に役立つ例には、グリシンおよびアルギニンなどのアミノ酸;アンモニア;一級、二級、および三級アミン;ならびにピペリジン、モルホリン、およびピペラジンなどの環状アミンから誘導される有機塩;ならびにナトリウム、カルシウム、カリウム、マグネシウム、マンガン、鉄、銅、亜鉛、アルミニウム、およびリチウムから誘導される無機塩が含まれる。
【0130】
固体である誘導体、プロドラッグ、塩、または溶媒和物の場合、当業者には当然のことながら、本発明の方法において使用される誘導体、プロドラッグ、塩、および溶媒和物は、様々な多形体または結晶形で存在することがあり、それらのすべては、本発明および指定した式の範囲内に含まれるよう意図されている。さらに、本発明の方法において使用される誘導体、塩、プロドラッグおよび溶媒和物は、互変異性体として存在することがあり、それらのすべては、本発明の広範にわたる範囲に含まれるよう意図されている。
【0131】
塩基性の性質である本発明の化合物は、様々な無機酸および有機酸と多種多様な異なる塩を形成することができる。そのような塩は、動物への投与について薬学的に許容できなければならないが、実際には、初めに本発明の化合物を反応混合物から薬学的に許容できない塩として単離し、次いで、アルカリ試薬による処理によって後者をもとの遊離塩基化合物へ単に変換し、続いて後者の遊離塩基を薬学的に許容できる酸付加塩に変換することが望ましいことが多い。本発明の塩基化合物の酸付加塩は、水性溶媒媒質またはメタノールもしくはエタノールなどの適当な有機溶媒中で実質的に当量の選択された鉱酸または有機酸で塩基化合物を処理することによって容易に調製される。溶媒の注意深い蒸発により、望ましい固体の塩が容易に得られる。また、望ましい酸塩は、溶液に適切な鉱酸または有機酸を加えることにより、有機溶媒中の遊離塩基の溶液から析出させることができる。
【0132】
酸性の性質である本発明のこれらの化合物は、様々な薬理学的に許容できる陽イオンと塩基塩を形成することができる。そのような塩の例には、アルカリ金属塩またはアルカリ土類金属塩、特に、ナトリウム塩およびカリウム塩が含まれる。これらの塩はすべて、従来の技法によって調製される。本発明の薬学的に許容できる塩基塩を調製するための試薬として使用される化学塩基は、本発明の酸性化合物と無毒性塩基塩を形成する化学塩基である。そのような無毒性塩基塩には、ナトリウム、カリウム、カルシウムおよびマグネシウムなどの薬理学的に許容できる陽イオンから誘導される塩基塩が含まれる。これらの塩は、望ましい薬理学的に許容できる陽イオンを含有する水溶液で対応する酸性化合物を処理し、次いで、好ましくは減圧下で、得られる溶液を蒸発乾固することによって容易に調製することができる。あるいは、酸性化合物の低級アルカノール溶液と望ましいアルカリ金属アルコキシドを混ぜ合わせ、次いで、前と同様に得られる溶液を蒸発乾固することによっても調製することができる。どちらの場合にも、反応の完全性および望ましい最終生成物の最高収率を保証するために、化学量論的量の試薬が用いられることが好ましい。
【0133】
式(I)の特定の化合物は、不斉中心を有するため、様々な鏡像異性体で存在することがある。式(I)の化合物のすべての光学異性体および立体異性体、ならびにそれらの混合物は、本発明の範囲内にあると見なされる。式(I)の化合物に関して、本発明には、ラセミ化合物、1つまたは複数の鏡像異性体、1つまたは複数のジアステレオマー体、またはそれらの混合物の使用が含まれる。式(I)の化合物は、互変異性体として存在することもある。本発明は、そのような互変異性体すべておよびそれらの混合物の使用に関する。
【0134】
本発明の化合物内に含まれる特定の官能基は、生物学的等価性の基、すなわち、親基に対して類似した空間的および電子的要件を有するが、異なるか改善された物理化学的または他の特性を示す基と置き換えることができる。適当な例は、当業者によく知られており、Patini他、Chem.Rev、1996、96、3147〜3176およびそこで引用されている参考文献に記載されている部分が含まれるが、これらに限定されるものではない。
【0135】
本発明には、天然に通常見いだされる原子量または質量数と異なる原子量または質量数を有する原子によって1つまたは複数の原子が置き換えられているという事実を別にすれば式(I)に列挙された化合物と同一である同位体標識化合物も含まれる。本発明の化合物に組み入れることができる同位体の例には、それぞれ2H、3H、13C、14C、15N、18O、17O、31P、32P、35S、18F、および36Clなどの水素、炭素、窒素、酸素、リン、フッ素および塩素の同位体が含まれる。上述の同位体および/または他の原子の他の同位体を含有する本発明の化合物および薬学的に許容できる前記化合物の塩または溶媒和物は、本発明の範囲内にある。本発明の特定の同位体標識化合物、例えば3Hおよび14Cなどの放射性同位体が組み入れられている化合物は、薬物および/または基質の組織分布アッセイに有用である。トリチウム化、すなわち3Hおよび炭素14、すなわち14C、同位体は、それらを調製する容易さおよび検出性から特に好ましい。さらに、重水素、すなわち2Hなどのより重い同位体による置換は、より大きな代謝安定性、例えばin vivoにおける半減期の増加または必要用量の減少による特定の治療上の利点を与えることができ、ある環境では好ましいことがある。本発明の式(I)の同位体標識化合物は、一般的に、以下のスキームおよび/または実施例において開示されている手順を行い、非同位体標識試薬の代わりに容易に入手可能な同位体標識試薬を置換することによって調製することができる。
【0136】
本発明の他の態様、利点、および特徴は、以下の詳細な説明から明らかになるはずである。
【発明を実施するための最良の形態】
【0137】
以下の反応スキームは、本発明の化合物の調製を説明している。他に指示がない限り、反応スキームおよび続く考察におけるR1〜R22は、上記で定義した通りである。
【0138】
【化25】

【0139】
上記のスキーム1を参照すると、式IIIの化合物は、ほぼ室温から溶媒の沸点、典型的には約20℃から約100℃の適当な温度にて、塩基(例えば、K2CO3、NaHCO3、トリエチルアミン)の存在下、適当な溶媒(例えば、ジクロロメタンまたはDMF)中で、基Xが、Cl、Br、OMsなどの脱離基である式IIの化合物を、R7およびR8が、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR7R8)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、R7およびR8が、縮合または非縮合であってもよい(4〜11)員複素環を形成することができ、各R9およびR10が、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択されるアミン、R7R8NHと反応させることにより調製することができる。式IIの化合物は、−15℃〜50℃の適当な温度にてNaHCO3またはトリエチルアミンなどの塩基の存在下、CH2Cl2およびアセトニトリルなどの適当な溶媒中で、式Iaの化合物を、XがClまたはBrであるXCH2COClと反応させることにより調製することができる。当業者に対して市販されている式Iaの化合物は、Aが、非置換であるか、あるいはハロ、(C1〜C6)アルキル、−CF3、−CNおよびフェニルなどからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルであるアミンである。
【0140】
【化26】

【0141】
スキーム2を参照すると、式IIaの化合物は、室温から100℃の適当な温度にて、式Vの化合物をニートのSOCl2またはCCl4などの適当な溶媒中のSOCl2と反応させることにより、スキーム2に図示されているように調製することもできる。式Vの化合物は、室温から溶媒の沸点、典型的には約20℃から約100℃の適当な温度にて、PGがフェニルなどの適当な保護基である式IVの化合物を、CHCl3などの適当な溶媒中の(CH)3Silと反応させることにより調製することができる。式IVの化合物は、当業者に知られている方法により、当業者に対して市販されており、Aが、非置換であるか、あるいはハロ、(C1〜C6)アルキル、−CF3、−CNおよびフェニルなどからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルであるアミンである式Iaの化合物を、ベンジルオキシ酢酸などの適当な酸とカップリングさせることにより調製することができる。
【0142】
【化27】

【0143】
スキーム3を参照すると、式IIIの化合物は、0℃から室温の適当な温度にて、CH2Cl2などの適当な溶媒中、Al(CH3)2Clなどの試薬の存在下で式VIの化合物を式Iaの化合物と反応させることにより調製することもできる。式VIの化合物は、0℃〜100℃の適当な温度にて、NaHCO3またはトリエチルアミンなどの塩基の存在下、CH2Cl2またはDMFなどの適当な溶媒中、基Xが、Cl、Br、OMsなどの脱離基である式VIIの化合物を、R7およびR8が、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR7R8)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、R7およびR8が、縮合または非縮合であってもよい(4〜11)員複素環を形成することができ、各R9およびR10が、Hおよび(C1〜C6)アルキルからなる群から独立して選択される式R7R8NHのアミンと反応させることにより調製することができる。R3は、(C1〜C6)アルキルであり、メチルまたはエチルであることが適当である。
【0144】
すべての出発材料、試薬、および溶媒は、市販されており、特に指定のない限り、当業者に知られている。これらの化学的操作は、当業者に知られており、(a)T.W.GreeneおよびP.G.M.Wuts、「Protective Groups in Organic Synthesis」、第2版、John Wiley and Sons、New York、1991に概説されている方法による保護基の除去;(b)一級もしくは二級アミン、チオールまたはアルコールによる、それぞれ二級もしくは三級アミン、チオエーテルまたはエーテルを生成するための脱離基(ハロゲン化物、メシレート、トシレートなど)の置換;(c)対応する尿素、アミド、カルバメートまたはスルホンアミドを提供するためのイソシアネート、酸塩化物(または、他の活性化カルボン酸誘導体)、クロロギ酸アルキル/アリールまたは塩化スルホニルによる一級および二級アミンの処理;(d)アルデヒドを用いる一級または二級アミンの還元アミノ化が含まれる。
【0145】
本発明の化合物は、不斉炭素原子を有することがある。ジアステレオ異性体混合物は、当業者に知られている方法により、例えば、クロマトグラフィーまたは分別結晶により、それらの物理的化学的相違に基づいてそれらの個々のジアステレオマーに分離することができる。鏡像異性体は、適切な光学活性な化合物(例えば、アルコール)との反応により鏡像異性体混合物をジアステレオ異性体混合物に変換し、ジアステレオマーを分離し、個々のジアステレオマーを対応する純粋な鏡像異性体に変換する(例えば、加水分解する)ことにより分離することができる。ジアステレオ異性体混合物および純粋な鏡像異性体を含むそのようなすべての異性体は、本発明の一部と見なされる。
【0146】
塩基性の性質である式(I)の化合物は、様々な無機酸および有機酸と多種多様な異なる塩を形成することができる。そのような塩は、動物への投与について薬学的に許容できなければならないが、実際には、初めに式(I)の化合物を反応混合物から薬学的に許容できない塩として単離し、次いで、後者をアルカリ試薬による処理によってもとの遊離塩基化合物へ単に変換し、続いて後者の遊離塩基を薬学的に許容できる酸付加塩に変換することが望ましいことが多い。本発明の塩基化合物の酸付加塩は、水性溶媒媒質またはメタノールもしくはエタノールなどの適当な有機溶媒中で実質的に当量の選択された鉱酸または有機酸で塩基化合物を処理することによって容易に調製される。溶媒の注意深い蒸発により、望ましい固体の塩が容易に得られる。また、望ましい酸塩は、溶液に適切な鉱酸または有機酸を加えることにより、有機溶媒中の遊離塩基の溶液から析出させることができる。
【0147】
酸性の性質である式(I)のそれら化合物は、様々な薬理学的に許容できる陽イオンと塩基塩を形成することができる。そのような塩の例には、アルカリ金属塩またはアルカリ土類金属塩、特に、ナトリウム塩およびカリウム塩が含まれる。これらの塩はすべて、従来の技法によって調製される。本発明の薬学的に許容できる塩基塩を調製するための試薬として使用される化学塩基は、式(I)の酸性化合物と無毒性塩基塩を形成する化学塩基である。そのような無毒性塩基塩には、ナトリウム、カリウム、カルシウムおよびマグネシウムなどの薬理学的に許容できる陽イオンから誘導される塩基塩が含まれる。これらの塩は、望ましい薬理学的に許容できる陽イオンを含有する水溶液で対応する酸性化合物を処理し、次いで、好ましくは減圧下で、得られる溶液を蒸発乾固することによって容易に調製することができる。あるいは、酸性化合物の低級アルカノール溶液と望ましいアルカリ金属アルコキシドを混ぜ合わせ、次いで、前と同じように、得られる溶液を蒸発乾固することによっても調製することができる。どちらの場合にも、反応の完全性および望ましい最終生成物の最高収率を保証するために、化学量論的量の試薬が用いられることが好ましい。
【0148】
本発明の化合物は、11−β−hsd−1のモジュレーターであってもよい。本発明の化合物は、11−β−hsd−1によって仲介されるプロセスを変調することができ、そのようなプロセスは、本明細書に記載されている11−β−hsd−1阻害剤に応答する受容体または受容体の組合せによって仲介される生物学的、生理学的、内分泌学的、および他の身体プロセス(例えば、糖尿病、高脂血症、肥満、耐糖能異常、高血圧、脂肪肝、糖尿病合併症(例えば、網膜症、腎症、神経症、白内障および冠動脈疾患など)、動脈硬化症、妊娠糖尿病、多嚢胞性卵巣症候群、心血管疾患(例えば、虚血性心不全など)、アテローム性動脈硬化症または虚血性心不全により引き起こされる細胞損傷(例えば、脳卒中などにより引き起こされる脳損傷)、痛風、炎症性疾患(例えば、関節骨炎、疼痛、発熱、関節リウマチ、炎症性腸炎、座瘡、日焼け、乾癬、湿疹、アレルギー疾患、喘息、胃腸潰瘍、悪液質、自己免疫疾患、膵炎など)、癌、骨粗鬆症および白内障)を指す。そのようなプロセスの変調は、in vitroまたはin vivoで達成することができる。in vivo変調は、例えば、ヒト、げっ歯類、ヒツジ、ブタ、ウシなどの広範囲な対象において行うことができる。
【0149】
本発明による化合物は、11−β−hsd−1酵素の変調を必要とするいくつかの適応症において使用することができる。したがって、本発明による化合物は、認知症(WO97/07789を参照)、骨粗鬆症(Canalis E、Mechanisms of glucocorticoid action in bone:implications to glucocorticoid−induced osteoporosis、Journal of Clinical Endocrinology and Metabolism、1996、81、3441〜3447を参照)に対して使用することができ、免疫系の障害に関して(Franchimont、他「Inhibition of Th1 immune response by glucocorticoids:dexamethasone selectively inhibits IL−12−induced Stat 4 phosphorylation in T lymphocytes」、The Journal of Immunology 2000、Feb 15、vol.164(4)、1768〜74ページを参照)、および上記に列挙した適応症にも使用することができる。
【0150】
成熟脂肪細胞における11−β−hsd−1の阻害は、独立した心血管系危険因子であるプラスミノーゲン活性化因子阻害剤1(PAI−1)の分泌を軽減すると予想される(Halleux,C.M.、他(1999)J.Clin.Endocrinol.Metab.84:4097〜4105)。さらに、グルココルチコイド「活性」と心血管系危険因子の間には明確な相関があり、グルココルチコイド作用の低下が有益であることを示唆している(Walker,B.R.、他(1998)Hypertension 31:891〜895:Fraser,R.、他(1999)Hypertension 33:1364〜1368)。
【0151】
副腎摘出は、絶食の効果を弱め、食物摂取と視床下部神経ペプチドY発現の双方を増加させる。このことは、食物摂取を促進する際のグルココルチコイドの役割を裏付けており、脳における11−β−hsd−1の阻害が満腹感を高め、その結果、食物摂取を低下させることを示唆している(Woods,S.C.他(1998)Science、280:1378〜1383)。
【0152】
摘出マウス膵臓β細胞における11−β−hsd−1の阻害は、グルコース刺激性インスリン分泌を改善する(Davani,B.他(2000)J.Biol.Chem.Nov.10、2000;275(45):34841〜4)。グルココルチコイドは、in vivoで膵臓インスリン放出を減少させることがすでに知られていた(Billaudel,B.およびB.C.J.Sutter(1979)Horm.Metab.Res.11:555〜560)。したがって、11−β−hsd−1の阻害は、肝臓および脂肪に対する効果に加えて、糖尿病治療にとっての他の有益な効果をもたらすと予想される。
【0153】
ストレスおよびグルココルチコイドは、認知機能に影響を与える(de Quervain,D.J.−F.、B.Roozendaal、およびJ.L.McGaugh(1998)Nature 394:787〜790)。酵素11−β−hsd−1は、脳におけるグルココルチコイド作用のレベルを制御するため、神経毒性の一因となる(Rajan,V.、C.R.W.Edwards、およびJ.R.Secki,J.(1996)Neuroscience 16:65〜70;Secki,J.R.、Front.(2000)Neuroendocrinol.18:49〜99)。未発表の結果は、非特異的11−β−hsd−1阻害剤で治療したラットにおける有意な記憶改善を示している。脳におけるグルココルチコイドの上記および知られている効果に基づき、脳において11−β−hsd−1を阻害することが、不安の軽減をもたらすことも示唆されている(Tronche,F.他(1999)Nature Genetics 23:99〜103)。したがって、まとめると、ヒト脳における11−β−hsd−1の阻害は、コルチゾンのコルチゾールへの再活性化を妨げ、認知障害、うつ病、および食欲増加を含むニューロン生存およびニューロン機能の他の態様に対する有害なグルココルチコイド仲介性効果を防ぐであろうという仮説がある。
【0154】
グルココルチコイドは、免疫系を抑制するという一般的な認識がある。しかし、実際に、免疫系とHPA(視床下部−下垂体−副腎)軸との間には動的相互作用がある(Rook,G.A.W.(1999)Baillier’s Clin.Endocrinol.Metab.13:576〜581)。細胞性応答と体液性応答のバランスは、グルココルチコイドにより変調される。ストレスの状態におけるなどの高いグルココルチコイド活性は、体液性応答と関係している。したがって、酵素11−β−hsd−1の阻害は、細胞をベースにした反応へと応答を移行する手段として示唆されてきた。
【0155】
最近のデータは、グルココルチコイド標的受容体および11−β−hsd−1酵素のレベルが、緑内障に対する感受性を決定していることを示唆している(Stokes,J.他(2000)Invest.Ophthalmol.41:1629〜1638)。さらに、最近、11−β−hsd−1の阻害が、眼内圧を下げるための新規なアプローチとして提示された(Walker E.A.他、the Endocrine society meeting Jun.12〜15、1999、San DiegoにおけるポスターP3−698)。11−β−hsd−1の非特異的阻害剤であるカルベノキソロンの摂取は、正常な対象において眼内圧を20%低下させることが分かった。眼において、11−β−hsd−1の発現は、角膜上皮の基底細胞および角膜の非色素上皮(房水産生の部位)、毛様体筋ならびに虹彩の括約筋および散大筋に限定される。対照的に、別個のアイソザイム11β−ヒドロキシステロイドデヒドロゲナーゼ2型は、非色素毛様体上皮および角膜内皮において高度に発現される。どの酵素も、排出部位である小柱網には見いだされない。したがって、11−β−hsd−1は、排出よりむしろ房水産生での役割を有することが示唆されるが、グルココルチコイドもしくは鉱質コルチコイド受容体、または両方の活性化を妨害することによるのかどうかは今のところ不明である。
【0156】
グルココルチコイドは、骨格の発育および機能において不可欠な役割を有するが、過剰では有害である(Kim,C.H.、S.L.Cheng、およびG.S.Kim(1999)J.Endocrinol.162:371〜379)。骨結節形成に対する負の作用は、非特異的阻害剤カルベノキソロンによってブロックされ、グルココルチコイド作用における11−β−hsd−1の重要な役割が示唆された(Bellows,C.G.、A.Ciaccia、およびJ.N.M.Heersche、(1998)Bone 23:119〜125)。他のデータは、破骨細胞において十分に高いレベルの活性グルココルチコイドを提供し、骨吸収を増加させる際の11−β−hsd−1の役割を示唆している(Cooper,M.S.他(2000)Bone 27:375〜381)。まとめると、これらの様々なデータは、11−β−hsd−1の阻害が、並行して働く2つ以上の機構により骨粗鬆症に対して有益な効果を有することを示唆している。
【0157】
胆汁酸は、11β−ヒドロキシステロイドデヒドロゲナーゼ2型を阻害する。このことは、尿代謝産物の比を研究することによって示されるように、コルチゾンよりもコルチゾールに偏った全体的身体バランスのシフトをもたらす(Quattropani C、Vogt B、Odematt A、Dick B、Frey B M、Frey F J.2001、J Clin Invest.Nov;108(9):1299〜305。「Reduced activity of 11beta−hydroxysteroid dehydrogenase in patients with cholestasis」)。選択的阻害剤により肝臓における11−β−hsd−1の活性を低下させることは、この不均衡を逆転させ、胆管閉塞を除去する外科治療を待ちながら、高血圧などの症状に強く対抗すると予想される。
【0158】
本発明の化合物は、糖尿病性血管症、アテローム性動脈硬化症、糖尿病性腎症、糖尿病性神経障害、ならびに網膜症、白内障形成および緑内障などの糖尿病性の眼の合併症などのNIDDMの主要な後期合併症、ならびに異常脂肪血症、グルココルチコイド誘発性インスリン抵抗性、異常脂肪血症、多嚢胞性卵巣症候群、肥満、高血糖症、高脂血症、高コレステロール血症、高トリグリセリド血症、高インスリン血症、および高血圧を含むNIDDMと関係がある多くの他の状態を含むグルコース利用の障害およびインスリン抵抗性に伴う他の代謝性障害の治療にも有用である。これらの状態の簡単な定義は、任意の医学辞典、例えば、Stedman’s Medical Dictionary(第10版)で入手可能である。
【0159】
アッセイ
すべてのアッセイは、IN/USシステム社製β−Ramモデル3ラジオHPLC検出器付きの96ウェルプレートオートサンプラーと一緒にAgilent 1100 HPLC(高速液体クロマトグラフ)を用いて行った。11β−hsd−1アッセイは、300マイクロリットルの総容積でCornig(登録商標)96ウェルプレート上で行った。このアッセイにおいて使用される緩衝条件は、以下の通りである。100ミリモルTEA、200ミリモルNaCl、0.02%n−ドデシルβ−D−マルトシド(NDM)、5%グリセロール、5ミリモルβ−ME、pH8.0。アッセイのための反応混合物には、500ミリモルNADPH、約6ナノモル11β−hsd−1(強力な可逆的阻害剤による活性部位滴定に基づく)、1%DMSO(阻害剤)、2ミリモルG6P、1U/ミリリットルG6Pデヒドロゲナーゼ、および6ミリモルMgCl2が含まれる。G6P、G6PデヒドロゲナーゼおよびMgCl2は、11β−hsd−1活性を増幅するための再生システムとしての役割を果たす。NADPHおよび11β−hsd−1を、再生システムの添加および3H−コルチゾンによる開始に先立って、25℃にて阻害剤の存在下で30分間、緩衝液中でインキュベートした。
【0160】
初期反応速度は、試料60マイクロリットルをDMSO60マイクロリットルと混ぜることによって0〜60分の様々な時点で反応を停止することにより測定した。次いで、これらの試料を、1.25ミリリットル/分にてメタノール対水34:66の定組成法を実行しながら、Phenomenex of Torrance、CAから市販されているJupiter C18、150×4.6ミリメートル、5ミクロン、300Angstrom Phenomenex(登録商標)カラムに試料15マイクロリットルを注入することにより逆相液体クロマトグラフィーにより分析した。β−Ramモデル3は、3:1の液体シンチレーションカクテル対溶出液比でポンプ注送し、続いて、3Hシグナルを、観察されるピークの面積により測定する。3H−コルチゾンは、約7分で出るが、11β−hsd−1反応の3H−コルチゾール生成物は、約9分で出る。次いで、3H−コルチゾールの面積を時間に対してプロットし、線速度を決定し、次いで、この速度を、阻害濃度に対してプロットし、KiおよびIC50を決定することができる。
【0161】
[1,2−3H]−コルチゾンは、St.Louis、MissouriのAmerican Radiolabeled Chemicals Inc.から市販されている。NADPH、(G6P)、およびグルコース−6−リン酸デヒドロゲナーゼは、Sigma、Ronkonkoma、NY United Statesから市販されている。
【0162】
11−β−hsd−1酵素に対する本発明の化合物のKi値は、通常、約10ナノモルと約10マイクロモルの間にある。試験された本発明の化合物はすべて、上記のSPAアッセイの少なくとも1つにおいて1マイクロモル未満、好ましくは100ナノモル未満のKiを有している。化合物の特定の好ましい群は、様々な11−β−hsdに対して差次的選択性を有する。好ましい化合物の1つの群は、11β−hsd−2よりも11β−hsd−1に対して選択的活性を有する。化合物の別の好ましい群は、11β−hsd−1よりも11β hsd−2に対して選択的活性を有する。
【0163】
医薬組成物/製剤、用量および投与方法
特定の量の活性化合物で様々な医薬組成物を調製する方法は、当業者に知られているか、明らかなはずである。さらに、当業者は、製剤および投与技法に精通している。そのようなトピックスは、例えば、Goodman and Gilman’s The Pharmaceutical Basis of Therapeutics、最新版、Pergamon Press;およびRemington’s Phamaceutical Sciences、最新版、Mack Publishing,Co.、Eaton、Paにおいて考察されるであろう。これらの技法は、本明細書に記載されている方法および組成物の適切な態様および実施形態において用いることができる。以下の例は、例示的目的のためのみに提供され、本発明の制限としての役割を果たすことにはなっていない。
【0164】
式(I)の化合物は、11−β−hsd−1仲介性疾患の治療における使用に適している局所、経口および非経口医薬製剤として提供することができる。
【0165】
本発明の化合物は、錠剤またはカプセル剤として、油性または水性懸濁剤、ロゼンジ剤、トローチ剤、散剤、顆粒剤、乳剤、シロップ剤またはエリキシル剤として経口的に投与することができる。
【0166】
経口使用のための組成物には、薬学的に洗練されかつ味の良い調製物を製造するために風味付けし、甘くし、着色し、保存するための1つまたは複数の試剤が含まれていてよい。錠剤は、そのような錠剤の製造を助けるものとして薬学的に許容できる賦形剤を含有することができる。当技術分野において慣習的であるように、これらの錠剤を、モノステアリン酸グリセリルまたはジステアリン酸グリセリルなどの薬学的に許容できる腸溶コーティングでコーティングし、胃腸管における分解および吸収を遅らせ、より長時間にわたって持続的作用を提供することができる。
【0167】
経口使用のための製剤は、活性成分が、不活性な固体希釈剤、例えば、炭酸カルシウム、リン酸カルシウムまたはカオリンと混合されている硬質ゼラチンカプセル剤の形態であってもよい。それらは、活性成分が、水またはピーナッツ油、流動パラフィンもしくはオリーブ油などの油性媒質と混合されている軟質ゼラチンカプセル剤の形態であってもよい。
【0168】
水性懸濁剤は、通常、水性懸濁液の製造に適している賦形剤との混合物として活性成分を含有する。そのような賦形剤は、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシプロピルメチルセルロース、アルギン酸ナトリウム、ポリビニルピロリドン、トラガカントガムおよびアカシアガムなどの懸濁化剤;レシチンなどの天然に存在するホスファチド、エチレンオキシドと長鎖脂肪酸の縮合生成物、例えば、ステアリン酸ポリオキシエチレン、ヘプタデカエチレンオキシセタノールなどのエチレンオキシドと長鎖脂肪族アルコールの縮合生成物、モノオレイン酸ポリオキシエチレンソルビトールなどのエチレンオキシドと脂肪酸およびヘキシトールから誘導される部分エステルの縮合生成物またはモノオレイン酸ポリオキシエチレンソルビタンなどの脂肪酸ヘキシトール無水物であってもよい分散剤または湿潤剤であってもよい。
【0169】
医薬組成物は、無菌の注射用水性または油性懸濁液の形態であってもよい。この懸濁液は、上記で記載された適当な分散または湿潤剤および懸濁化剤を用い、知られている方法に従って製剤化することができる。無菌の注射用調製物は、無毒性の非経口的に許容できる希釈剤または溶媒中の懸濁液として、例えば、1,3−ブタンジオール溶液として製剤化することもできる。用いることができる許容できるビヒクルおよび溶媒には、水、リンゲル液および等張性塩化ナトリウム溶液がある。このために、合成モノまたはジグリセリドを含む任意の刺激のない固定油を用いることができる。さらに、オレイン酸などの脂肪酸は、注射剤の調製に使用される。
【0170】
式(I)の化合物は、薬物の直腸投与のための坐剤の形態でも投与することができる。これらの組成物は、薬物を、約25℃では固体であるが直腸温度では液体であるため、直腸内で融解して薬物を放出する適当な刺激性のない賦形剤と混合することにより調製することができる。そのような材料には、カカオ脂および他のグリセリドが含まれる。
【0171】
局所使用の場合、本発明の化合物を含有する調製物、例えば、クリーム剤、軟膏剤、ゼリー液剤、または懸濁剤が用いられる。
【0172】
式(I)の化合物は、小さな単層ベシクル、大きな単層ベシクルおよび多層ベシクルなどのリポソーム送達システムの形態でも投与することができる。リポソームは、コレステロール、ステアリルアミンまたはホスファチジルコリンなどの様々なリン脂質から作成することができる。
【0173】
本発明の化合物の用量レベルは、ほぼ約0.5mg/kg体重から約100mg/kg体重程度である。好ましい用量は、約30mg/kg体重から約100mg/kg体重である。しかし、当然のことながら、任意の特定の患者についての具体的な投与量レベルは、投与されている特定の化合物の活性、年齢、体重、全体的な健康状態、性別、食事、投与時間、投与経路、排泄速度、薬物組合せおよび治療を受けている特定の疾患の重症度を含む多くの要素によって異なるはずである。本発明化合物の治療活性を増強するため、スルホニル尿素、例えば、トルブタミドなどの他の経口的に活性な抗糖尿病化合物と同時に投与することができる。
【実施例】
【0174】
以下に提供される実施例、一般手順、および調製は、本発明の化合物およびそのような化合物を調製する方法をさらに説明し例示するものである。当然のことながら、本発明の範囲は、以下の実施例および調製の範囲によって決して制限されるものではない。以下の実施例において、単一のキラル中心のある分子は、他に指示のない限り、ラセミ混合物として存在する。2つ以上のキラル中心のある分子は、他に指示のない限り、ジアステレオマーのラセミ混合物として存在する。単一の鏡像異性体/ジアステレオマーは、当業者に知られている方法により得ることができる。
【0175】
本発明による様々な化合物の具体的実施例は、以下の実施例に示されているように有利に調製することができる。以下の実施例の構造は、以下の、プロトン磁気共鳴分光法(NMR)、赤外分光法(IR)、微量元素分析、大気圧化学イオン化質量分析法(APCI−MS)、薄層クロマトグラフィー(TLC)、融点(MP)、沸点(BP)、および高速液体クロマトグラフィー(HPLC)のうちの1つまたは複数によって確認した。
【0176】
以下の調製および実施例においてHPLCクロマトグラフィーに言及する場合、使用される一般条件は、他に指示のない限り、以下の通りである。使用されるカラムは、Alltech Platinum EPS 100 Angstrom 1.5ミクロンC18カラム;33ミリメートル×7ミリメートルである。試料は、Hewlett Packard−1100システム上で分析する。5.5分にわたり水(0.1%トリフルオロ酢酸)中の5%アセトニトリル〜水(0.1%トリフルオロ酢酸)中の95%アセトニトリルを流すグラジエント溶媒法を使用する。次いで、システムは、1.5分間の水(0.1%トリフルオロ酢酸)中の95%アセトニトリルによる洗浄サイクルに進む。この時間の流速は、一定の1.5ミリリットル/分である。
【0177】
化合物の構造は、元素分析かNMRのどちらかによって確認し、表題化合物中の特徴的なプロトンに割り当てられたピークを必要に応じて示す。1H NMRシフト(δH)は、内部参照標準から低磁場に百万分率(ppm)で示す。
【0178】
次に、以下の実施例を参照して本発明について記載する。これらの実施例は、本発明の範囲を限定していると見なされるべきではなく、例示的に役目を果たすに過ぎないものとする。
【0179】
方法A
(実施例1)
N−1−アダマンチル−2−[4−(2−メトキシフェノキシ)ピペリジン−1−イル]アセトアミド
【0180】
【化28】

オーブン乾燥してN2冷却した二口丸底フラスコに、1−アダマンタミン(437ミリグラム)および無水CH2Cl2(12ミリリットル)を加えた。この溶液に、窒素下で0℃にて、ヘキサン中のAl(CH3)2Clの1モル溶液(2.9ミリリットル)を少量ずつ加えた。濁った反応混合物を0℃にて30分間および室温にて1.7時間攪拌した後、無水CH2Cl2中の[4−(2−メトキシフェノキシ)ピペリジン−1−イル]酢酸エチル(170ミリグラム)の溶液をゆっくりと加えた。室温にて43時間攪拌した後、反応混合物を0℃まで冷却し、水(10ミリリットル)を滴下してクエンチし、CH2Cl2(9ミリリットル)で希釈した。層を分離し、水層をCH2Cl2(4×10ミリリットル)で抽出した。合わせた有機層をMgSO4で乾燥した。溶媒を真空中で除去し、残渣を、逆相Kromasil(登録商標)C18、水中の0.05%TFAおよびアセトニトリルを用いて精製すると、保持時間が14.8分のTFA塩として表題生成物(6.9ミリグラム)が得られた。APCIMS:m/z399.3(M+1)。
【0181】
(実施例2)
2−(4−アセチル−1,4−ジアゼパン−1−イル)−N−1−アダマンチルアセトアミド
【0182】
【化29】

表題化合物は、代わりに1−アダマンタミン(792ミリグラム)および(4−アセチル−1,4−ジアゼパン−1−イル)酢酸エチル(410ミリグラム)を用いて実施例1と同じように調製すると、保持時間が10.8分のTFA塩として表題生成物(14.7ミリグラム)が得られた。APCIMS:m/z334.3(M+1)。
【0183】
(実施例3)
N−(1−アダマンチルメチル)−2−[4−(2−メトキシフェノキシ)ピペリジン−1−イル]アセトアミド
【0184】
【化30】

表題化合物は、代わりに1−アダマンタンメチルアミン(498ミリグラム)および[4−(2−メトキシフェノキシ)ピペリジン−1−イル]酢酸エチル(177ミリグラム)を用いて実施例1と同じように調製すると、保持時間が15.5分のTFA塩として表題生成物(57ミリグラム)が得られた。APCIMS:m/z413.3(M+1)。
【0185】
(実施例4)
N1−1−アダマンチル−N2−シクロヘキシル−N2−エチルグリシンアミド
【0186】
【化31】

表題化合物は、代わりに1−アダマンタンアミン(711ミリグラム)およびN−シクロヘキシル−N−エチルグリシン酸エチル(500ミリグラム)を用いて実施例1と同じように調製すると、保持時間が14.6分のTFA塩として表題生成物(43ミリグラム)が得られた。APCIMS:m/z319.3(M+1)。
【0187】
調製4a N−シクロヘキシル−N−エチルグリシン酸エチル
【0188】
【化32】

ブロモ酢酸エチル(608ミリグラム)、N−エチルシクロヘキシルアミン(507ミリグラム)、K2CO3(2.57g)、水(10ミリリットル)を室温にて混ぜ合わせた。60℃にて20時間攪拌した後、反応混合物を室温まで冷却し、水(10.0ミリリットル)で希釈し、CH2Cl2(4× 100ミリリットルの総容積まで)で抽出した。合わせた有機層をK2CO3で乾燥した。溶媒を真空中で除去すると、表題生成物(720ミリグラム)が得られた。APCIMS:m/z214.4(M+1)。
【0189】
(実施例5)
N1−(1−アダマンチルメチル)−N2−(3,3,5−トリメチルシクロヘキシル)グリシンアミド
【0190】
【化33】

表題化合物は、代わりに1−アダマンタンメチルアミン(260ミリグラム)およびN−(3,3,5−トリメチルシクロヘキシル)グリシン酸エチル(178ミリグラム)を用いて実施例1と同じように調製すると、保持時間が16.9分のTFA塩として表題生成物(160ミリグラム)が得られた。APCIMS:m/z347.3(M+1)。1H NMR(400MHz,CHLOROFORM−D)δ ppm 0.53(1H,q,J=11.96Hz)0.72〜0.79(1H,m)0.84〜0.89(6H,m)0.90〜0.94(3H,m)1.27〜1.37(3H,m)1.43〜1.51(6H,m)1.53〜1.64(5H,m)1.65〜1.75(3H,m)1.85〜1.94(1H,m)1.94〜2.02(3H,m)2.54(1H,tt,J=11.62,3.79Hz)2.94(2H,qd,J=13.31,6.57Hz)3.25〜3.30(2H,m)7.53(1H,s)。
【0191】
(実施例6)
N1−1−アダマンチル−N2−(3,3,5−トリメチルシクロヘキシル)グリシンアミド
【0192】
【化34】

表題化合物は、代わりに1−アダマンタンアミン(620ミリグラム)およびN−(3,3,5−トリメチルシクロヘキシル)グリシン酸エチル(307ミリグラム)を用いて実施例1と同じように調製すると、保持時間が16分のTFA塩として表題生成物(45ミリグラム)が得られた。APCIMS:m/z333.3(M+1)。
【0193】
(実施例7)
N1−2−アダマンチル−N2−(3,3,5−トリメチルシクロヘキシル)グリシンアミド
【0194】
【化35】

表題化合物は、代わりに2−アダマンタンアミンHCl(414ミリグラム)およびN−(3,3,5−トリメチルシクロヘキシル)グリシン酸エチル(100ミリグラム)を用いて実施例1と同じように調製すると、保持時間が16分のTFA塩として表題生成物(37ミリグラム)が得られた。APCIMS:m/z333.3(M+1)。1H NMR(400MHz,MeOD)δ ppm 0.84〜0.90(2H,m)0.95〜1.05(11H,m)1.18(1H,t,J=12.38Hz)1.44(2H,dt,J=13.39,1.77Hz)1.65〜2.07(15H,m)3.80〜3.89(2H,m)4.03(1H,s)。
【0195】
(実施例8)
N−2−アダマンチル−2−[4−(2−メトキシフェノキシ)ピペリジン−1−イル]アセトアミド
【0196】
【化36】

表題化合物は、代わりに2−アダマンチルアミンHCl(400ミリグラム)、およびN−1−アダマンチル−2−[4−(2−メトキシフェノキシ)ピペリジン−1−イル]アセトアミドを用いて実施例1と同じように調製すると、保持時間が14.7分のTFA塩として表題生成物(68.5ミリグラム)が得られた。APCIMS:m/z399.3(M+1)および遊離塩基として(13.8ミリグラム)。1H NMR(400MHz,MeOD)δ ppm 1.68(2H,d,J=12.38Hz)1.75〜1.87(14H,m)1.91〜2.00(2H,m)2.34〜2.44(2H,m)2.74〜2.84(2H,m)3.00(2H,s)3.26(1H,dt,J=3.28,1.64Hz)3.77(3H,s)3.96(1H,s)4.22〜4.31(1H,m)6.82(1H,td,J=7.33,2.02Hz)6.87〜6.94(3H,m)。
【0197】
(実施例9)
N1−2−アダマンチル−N2−シクロヘキシル−N2−メチルグリシンアミド
【0198】
【化37】

表題化合物は、代わりにN−シクロヘキシル−N−メチルグリシン酸エチル(300ミリグラム)および2−アダマンタミンHCl(860ミリグラム)用いて実施例1と同じように調製すると、保持時間が13.2分のTFA塩として表題生成物(360.7ミリグラム)が得られた。APCIMS:m/z305.5(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.16〜1.27(1H,m)1.35〜1.52(3H,m)1.63〜1.74(3H,m)1.80(2H,s)1.83〜1.99(14H,m)2.07〜2.13(1H,m)2.84(3H,s)3.23(1H,tt,J=11.91,3.38Hz)3.77〜3.87(1H,m)4.02〜4.12(2H,m)8.24(1H,s)。
【0199】
調製9a N−シクロヘキシル−N−メチルグリシン酸エチル
【0200】
【化38】

表題化合物は、代わりにブロモ酢酸エチル(503ミリグラム)、N−メチルシクロヘキシルアミン(386ミリグラム)、K2CO3(2.06g)、水(8ミリリットル)を用いて実施例4aと同じように油(488ミリグラム)として調製した。APCIMS:m/z214.4(M+1)。
【0201】
(実施例10)
N1−2−アダマンチル−N2−シクロヘキシル−N2−エチルグリシンアミド
【0202】
【化39】

表題化合物は、代わりにN−シクロヘキシル−N−エチルグリシン酸エチル(303ミリグラム)、および2−アダマンタミンHCl(799ミリグラム)を用いて実施例1と同じように調製すると、保持時間が13.9分のTFA塩として表題生成物(310.1ミリグラム)が得られた。APCIMS:m/z319.5(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.26〜1.34(3H,m)1.36〜1.47(4H,m)1.63〜1.74(3H,m)1.80〜1.99(16H,m)2.04〜2.13(1H,m)3.24〜3.29(3H,m)3.79(1H,d,J=16.17Hz)4.01〜4.12(2H,m)8.25(1H,s)。
【0203】
(実施例11)
N−2−アダマンチル−2−(1,3−ジヒドロ−2H−イソインドール−2−イル)アセトアミド
【0204】
【化40】

表題化合物は、代わりに1,3−ジヒドロ−2H−イソインドール−2−イル酢酸エチル(352ミリグラム)および2−アダマンタミンHCl(982ミリグラム)を用いて実施例1と同じように調製すると、保持時間が13.23分のTFA塩として表題生成物(303.2ミリグラム)が得られた。APCIMS:m/z311.5(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.49(2H,d,J=12.63Hz)1.58〜1.77(14H,m)3.10〜3.20(1H,m)3.83〜3.91(5H,m)6.99〜7.08(4H,m)。
【0205】
調製11a 1,3−ジヒドロ−2H−イソインドール−2−イル酢酸エチル
【0206】
【化41】

【0207】
方法B
(実施例12)
N−1−アダマンチル−2−(ベンジルオキシ)アセトアミド
【0208】
【化42】

塩化(ベンジルオキシ)アセチル(406ミリグラム)が入ったバイアルに、1−アダマンタンアミン(983ミリグラム)と、続いて無水DMF(2ミリリットル)を加えた。マイクロ波中、80℃にて50分間加熱した後、反応混合物を水(10ミリリットル)でクエンチし、CH2Cl2(4×10ミリリットル)で抽出した。合わせた有機層をMgSO4で乾燥した。溶媒を真空中で除去し、残渣を、逆相Kromasil C18、水中の0.05%TFAおよびアセトニトリルを用いて精製すると、保持時間が20.5分のTFA塩として表題生成物(22ミリグラム)が得られた。APCIMS:m/z300.1(M+1) Ki:NT。
【0209】
方法C
(実施例13)
N−(1−アダマンチルメチル)−2−(4,5,7,8−テトラヒドロ−6H−イソオキサゾロ[3,4−d]アゼピン−6−イル)アセトアミド
【0210】
【化43】

N−(1−アダマンチルメチル)−2−クロロアセトアミド(58.6ミリグラム)、5,6,7,8−テトラヒドロ−4H−イソオキサゾロ[3,4−d]アゼピン(25.3ミリグラム)、K2CO3(75.1ミリグラム)およびCH2Cl2(3)を室温にて混ぜ合わせた。反応フラスコを黄色の栓で蓋をして40℃にて19時間攪拌した後、反応混合物を停止させ、室温まで冷却し、水(4ミリリットル)でクエンチした。層を分離し、水層をEtOAc(3×5ミリリットル)で抽出した。合わせた有機層をK2CO3で乾燥した。溶媒を真空中で除去し、残渣を、逆相Kromasil C18、水中の0.05%TFAおよびアセトニトリルを用いて精製すると、保持時間が12.9のTFA塩として表題生成物(16.2ミリグラム)が得られた。APCIMS:m/z344.3(M+1) Ki:NT。
【0211】
(実施例14)
4−{[2−(1−アダマンチルアミノ)−2−オキソエチル]アミノ}ピペリジン−1−カルボン酸エチル
【0212】
【化44】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)、4−アミノ−1−ピペリジンカルボン酸エチル(191ミリグラム)、K2CO3(450ミリグラム)およびCH2Cl2(10ミリリットル)を用いて実施例12と同じように、保持時間が12.5のTFA塩(170ミリグラム)として調製した。APCIMS:m/z364.3(M+1)。
【0213】
調製14a N−1−アダマンチル−2−クロロアセトアミド
【0214】
【化45】

表題化合物は、代わりに塩化メチレン(150ミリリットル)中の1−アダマンタンアミン(8.8g)を用い、続く窒素下で0℃におけるK2CO3(21.98g)により実施例1と同じように調製した。0℃にて20分間および室温にて17.5時間攪拌した後、塩化メチレン(50ミリリットル)を加えた。室温にて5時間攪拌した後、反応混合物を水(150ミリリットル)で希釈し、塩化メチレン(2×70ミリリットル)で抽出した。水層を水(50ミリリットル)で希釈し、塩化メチレン(3×70ミリリットル)で抽出した。合わせた有機層をK2CO3で乾燥した。溶媒を真空中で除去すると、白色の固体として望ましい生成物(11g)が得られた。
【0215】
(実施例15)
N−1−アダマンチル−2−[4−(1,3−ベンゾジオキソール−5−イルメチル)ピペラジン−1−イル]アセトアミド
【0216】
【化46】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(202ミリグラム)、1−(1,3−ベンゾジオキソール−5−イルメチル)ピペラジン(232ミリグラム)、K2CO3(373ミリグラム)およびCH2Cl2(3ミリリットル)を用いて実施例12と同じように、保持時間が12.7のTFA塩(192.4ミリグラム)として調製した。APCIMS:m/z412.3(M+1)。
【0217】
(実施例16)
4−({2−[(1−アダマンチルメチル)アミノ]−2−オキソエチル}アミノ)ピペリジン−1−カルボン酸エチル
【0218】
【化47】

表題化合物は、代わりにN−(1−アダマンチルメチル)−2−クロロアセトアミド(100ミリグラム)、1−ピペラジンカルボン酸エチル(75ミリグラム)、K2CO3(172ミリグラム)およびCH2Cl2(2ミリリットル)を用いて実施例12と同じように、保持時間が13.5のTFA塩(18.7ミリグラム)として調製した。APCIMS:m/z378.3(M+1)。
【0219】
調製16a N−(1−アダマンチルメチル)−2−クロロアセトアミド
【0220】
【化48】

無水塩化メチレン(6ミリリットル)中の塩化クロロアセチル(350ミリグラム)が入ったフラスコに、窒素下で0℃にて塩化メチレン中の1−アダマタンメチルアミン(500ミリグラム)の溶液と、続いてK2CO3を加えた。0℃にて20分間および室温にて16時間攪拌した後、反応混合物を水(5ミリリットル)で希釈し、塩化メチレン(10ミリリットル×4)で抽出した。合わせた有機層をMgSO4で乾燥した。溶媒を真空中で除去すると、液体として望ましい生成物(痕跡の1−アダマタンメチルアミンが混入した800ミリグラム)が得られた。
【0221】
(実施例17)
N−(1−アダマンチルメチル)−2−[4−(1,3−ベンゾジオキソール−5−イルメチル)ピペラジン−1−イル]アセトアミド
【0222】
【化49】

表題化合物は、代わりにN−(1−アダマンチルメチル)−2−クロロアセトアミド(100ミリグラム)、1−(1,3−ベンゾジオキソール−5−イルメチル)ピペラジン(101ミリグラム)、K2CO3(170ミリグラム)およびCH2Cl2(3ミリリットル)を用いて実施例12と同じように、保持時間が13.8のTFA塩(28ミリグラム)として調製した。APCIMS:m/z426.3(M+1)。
【0223】
(実施例18)
2−(4−アセチル−1,4−ジアゼパン−1−イル)−N−(1−アダマンチルメチル)アセトアミド
【0224】
【化50】

表題化合物は、代わりにN−(1−アダマンチルメチル)−2−クロロアセトアミド(172ミリグラム)、N−アセチルホモピペラジン(156ミリグラム)、K2CO3(352ミリグラム)およびCH2Cl2(6ミリリットル)を用いて実施例12と同じように、保持時間が11.8のTFA塩(64ミリグラム)として調製した。APCIMS:m/z348.3(M+1)。
【0225】
方法D
(実施例19)
N−(1−アダマンチル)−2−[4−(ヒドロキシメチル)ピペリジン−1−イル]アセトアミド
【0226】
【化51】

N−(1−アダマンチル)−2−クロロアセトアミド(190ミリグラム)、4−ピペリジンメタノール(92ミリグラム)、K2CO3(219ミリグラム)およびDMSO(2ミリリットル)を室温にて混ぜ合わせた。40℃にて15時間攪拌した後、反応混合物を停止させ、室温まで冷却し、濾過し、残渣を、逆相Kromasil C18、水中の0.05%TFAおよびアセトニトリルを用いて精製すると、保持時間が10.8分のTFA塩として表題生成物(182.3ミリグラム)が得られた。APCIMS:m/z307.3(M+1)。Ki:NT。
【0227】
(実施例20)
N1−1−アダマンチル−N2−(ピリジン−2−イルメチル)グリシンアミド
【0228】
【化52】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(136ミリグラム)および2−(アミノメチル)ピリジン(81ミリグラム)を用いて実施例19と同じように調製すると、保持時間が12分のTFA塩として表題化合物(92.4ミリグラム)が得られた。APCIMS:m/z300.2(M+1)。
【0229】
(実施例21)
N−1−アダマンチル−2−(4−ピリジン−2−イルピペラジン−1−イル)アセトアミド
【0230】
【化53】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(136ミリグラム)および1−(2−ピリジル)ピペラジン(123ミリグラム)を用いて実施例19と同じように調製すると、保持時間が10.1分のTFA塩として表題化合物(116.4ミリグラム)が得られた。APCIMS:m/z355.3(M+1)。
【0231】
(実施例22)
N−2−アダマンチル−2−[3−(2−クロロフェノキシ)ピペリジン−1−イル]アセトアミド
【0232】
【化54】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(152ミリグラム)、4−(2−トリフルオロメチルフェノキシ)ピペリジンHCl(142ミリグラム)を用いて実施例19と同じように調製すると、保持時間が15.9分のTFA塩として表題化合物(107.6ミリグラム)が得られた。APCIMS:m/z403.2(M+1)。
【0233】
調製22a N−2−アダマンチル−2−クロロアセトアミド
【0234】
【化55】

表題化合物は、代わりに塩化クロロアセチル(1.4g)、無水塩化メチレン(60ミリリットル)、2−アダマンチルアミン(1.865g)、K2CO3(5.09g)を用いて調製14aと同じように調製し、白色の固体(2.33g)を製造した。
【0235】
(実施例23)
N−2−アダマンチル−2−(4−シアノ−4−フェニルピペリジン−1−イル)アセトアミド
【0236】
【化56】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(98.6ミリグラム)および4−シアノ−4−フェニルピペリジンHCl(104ミリグラム)を用いて実施例19と同じように調製すると、保持時間が14.5分のTFA塩として表題化合物(59.8ミリグラム)が得られた。APCIMS:m/z378.5(M+1)。
【0237】
(実施例24)
N−2−アダマンチル−2−ピペリジン−1−イルアセトアミド
【0238】
【化57】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(101.6ミリグラム)およびピペリジン(52ミリグラム)を用いて実施例19と同じように調製すると、保持時間が11.6分のTFA塩として表題化合物(83.3ミリグラム)が得られた。APCIMS:m/z277.4(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.49〜1.58(1H,m)1.64(2H,d,J=12.88Hz)1.78〜2.00(17H,m)3.02(2H,t,J=11.49Hz)3.53(2H,d,J=11.62Hz)3.93(2H,s)4.03(1H,s)8.16(1H,s)。
【0239】
(実施例25)
N−2−アダマンチル−2−[4−(ピリジン−2−イルメチル)ピペリジン−1−イル]アセトアミド
【0240】
【化58】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(152ミリグラム)および2−ピペリジン−4−イルメチルピリジン2HCl(182ミリグラム)を用いて実施例19と同じように調製すると、保持時間が9.8分のTFA塩として表題化合物(151.2ミリグラム)が得られた。APCIMS:m/z368.5(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.60〜1.92(19H,m)2.17(1H,s)3.06(3H,d,J=6.32Hz)3.59(2H,s)3.94〜4.07(3H,m)7.84〜7.94(2H,m)8.47(1H,td,J=7.89,1.64Hz)8.76(1H,d,J=5.05Hz)。
【0241】
(実施例26)
1−[2−(2−アダマンチルアミノ)−2−オキソエチル]ピペリジン−4−カルボン酸メチル
【0242】
【化59】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(108ミリグラム)およびイソニペコチン酸メチル(102ミリグラム)を用いて実施例19と同じように調製すると、保持時間が12.1分のTFA塩として表題化合物(92.6ミリグラム)が得られた。APCIMS:m/z335.3(M+1)。
【0243】
(実施例27)
N−2−アダマンチル−2−(4−ヒドロキシ−4−フェニルピペリジン−1−イル)アセトアミド
【0244】
【化60】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(110ミリグラム)および4−ヒドロキシ−4−フェニルピペリジン(103.4ミリグラム)を用いて実施例19と同じように調製すると、保持時間が13.4分のTFA塩として表題化合物(105.8ミリグラム)が得られた。APCIMS:m/z369.5(M+1)。
【0245】
(実施例28)
N−2−アダマンチル−2−[4−(1H−ピラゾール−5−イル)ピペリジン−1−イル]アセトアミド
【0246】
【化61】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(99ミリグラム)および4−(1H−ピラゾール−5−イル)ピペリジン(73ミリグラム)を用いて実施例19と同じように調製すると、保持時間が11.3分のTFA塩として表題化合物(77.3ミリグラム)が得られた。APCIMS:m/z343.3(M+1)。
【0247】
(実施例29)
N−[(5R,7S)−3−フェニル−1−アダマンチル]−2−[4−(1H−ピラゾール−4−イル)ピペリジン−1−イル]アセトアミド
【0248】
【化62】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(170ミリグラム)および4−(1H−ピラゾール−5−イル)ピペリジン(84ミリグラム)を用いて実施例19と同じように調製すると、保持時間が14.3分のTFA塩として表題化合物(20.3ミリグラム)が得られた。APCIMS:m/z419.6(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.75(2H,s)1.89(4H,d,J=1.77Hz)2.01〜2.12(6H,m)2.16〜2.22(4H,m)2.27(3H,s)2.94〜3.04(1H,m)3.11〜3.21(2H,m)3.60〜3.69(2H,m)3.83(2H,s)6.21(1H,s)7.10〜7.17(1H,m)7.25〜7.36(4H,m)7.57(1H,d,J=2.27Hz)7.95(1H,s)。
【0249】
調製29a (3−フェニル−1−アダマンチル)カルバミン酸ベンジル
【0250】
【化63】

3−フェニルアダマンタン−1−カルボン酸(649ミリグラム)の入ったフラスコに、室温にてアジ化ジフェニルホスホリル(772ミリグラム)、トルエン(6ミリリットル)、Et3N(0.4ミリリットル)を加えた。70℃にて約1.2時間攪拌した後、ベンジルアルコール(0.28ミリリットル)を反応混合物に加えた。70℃にて19.4時間攪拌した後、反応混合物を室温まで冷却し、溶媒を減圧下で除去した。得られた残渣を、EtOAc(10ミリリットル)および水(5ミリリットル)で希釈した。層を分離した。水層をEtOAc(2×10ミリリットル)で抽出した。合わせた有機層をMgSO4で乾燥し、減圧下で濃縮すると、望ましい生成物(700ミリグラム)が得られた。
【0251】
調製29b (3−フェニル−1−アダマンチル)アミン
【0252】
【化64】

EtOAc(3ミリリットル)中の(3−フェニル−1−アダマンチル)カルバミン酸ベンジル(320ミリグラム)の溶液に、10%Pd/C(330ミリグラム)および酢酸を加えた。室温にて一夜水素化した後、反応混合物をEtOAcで希釈し、濾過した。溶媒を減圧下で除去すると、室温にて固化する油が得られ、望ましい生成物(177ミリグラム)が得られた。APCIMS:m/z227.2(M+1)。
【0253】
調製29c 2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド
【0254】
【化65】

表題化合物は、代わりに塩化クロロアセチル(97.4ミリグラム)、無水塩化メチレン(3.5ミリリットル)、(3−フェニル−1−アダマンチル)アミン(177ミリグラム)、K2CO3(324ミリグラム)を用いて調製14aと同じように調製し、重量は160ミリグラムであった。
【0255】
(実施例30)
N−[(5R,7S)−3−フェニル−1−アダマンチル]−2−[4−(ピリジン−2−イルメチル)ピペリジン−1−イル]アセトアミド
【0256】
【化66】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(147.9ミリグラム)および2−ピペリジン−4−イルメチルピリジン2HCl(138.2ミリグラム)を用いて実施例19と同じように調製すると、保持時間が12.5分のTFA塩として表題化合物(26.8ミリグラム)が得られた。APCIMS:m/z444.3(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.64〜1.75(4H,m)1.84〜1.94(7H,m)2.01〜2.28(8H,m)3.01(4H,d,J=5.81Hz)3.55(2H,s)3.79(2H,s)7.12〜7.35(5H,m)7.77〜7.85(2H,m)7.95(1H,m)8.37(1H,td,J=7.89,1.64Hz)8.70(1H,d,J=5.05Hz)。
【0257】
(実施例31)
2−(4−シアノ−4−フェニルピペリジン−1−イル)−N−[(5R,7S)−3−フェニル−1−アダマンチル]アセトアミド
【0258】
【化67】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(150ミリグラム)、4−シアノ−4−フェニルピペリジンHCl(122ミリグラム)を用いて実施例19と同じように調製すると、保持時間が17.2分のTFA塩として表題化合物(24.5ミリグラム)が得られた。APCIMS:m/z454.6(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.76(2H,s)1.86〜1.95(4H,m)2.03〜2.15(5H,m)2.20(2H,s)2.28(2H,s)2.48(2H,s)2.50(2H,d,J=2.53Hz)3.42〜3.53(2H,m)3.72〜3.84(2H,m)3.99(2H,s)7.15(1H,t,J=7.20Hz)7.25〜7.32(2H,m)7.33〜7.38(2H,m)7.39〜7.45(1H,m)7.45〜7.51(2H,m)7.54〜7.59(2H,m)。
【0259】
(実施例32)
1−(2−オキソ−2−{[(5R,7S)−3−フェニル−1−アダマンチル]アミノ}エチル)ピペリジン−4−カルボン酸メチル
【0260】
【化68】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(150ミリグラム)およびイソニペコチン酸メチル(78ミリグラム)を用いて実施例19と同じように調製すると、TFA塩をMP−CO3で処理した後に遊離塩基として表題化合物が得られ、保持時間は15.2分で重量は11.3ミリグラムであった。APCIMS:m/z411.6(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.63〜1.74(4H,m)1.81〜1.90(6H,m)1.96〜2.06(4H,m)2.11(2H,s)2.13〜2.24(5H,m)2.26〜2.35(1H,m)2.75〜2.82(2H,m)2.85(2H,s)3.57〜3.64(3H,m)7.07〜7.13(1H,m)7.21〜7.27(2H,m)7.29〜7.34(2H,m)。
【0261】
(実施例33)
2−(ヘキサヒドロピロロ[1,2−a]ピラジン−2(1H)−イル)−N−[(5R,7S)−3−フェニル−1−アダマンチル]アセトアミド
【0262】
【化69】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(156ミリグラム)およびオクタヒドロピロロ[1,2−a]ピラジン(69ミリグラム)を用いて実施例19と同じように調製すると、保持時間が13.6分のTFA塩として表題化合物(22ミリグラム)が得られた。APCIMS:m/z419.6(M+1)。
【0263】
(実施例34)
2−(3,4−ジヒドロイソキノリン−2(1H)−イル)−N−[(5R,7S)−3−フェニル−1−アダマンチル]アセトアミド
【0264】
【化70】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(156ミリグラム)および1,2,3,4−テトラヒドロイソキノリン(270ミリグラム)を用いて実施例19と同じように調製すると、保持時間が16.6分のTFA塩として表題化合物(20.9ミリグラム)が得られた。APCIMS:m/z401.6(M+1)。
【0265】
(実施例35)
2−[(3S,8aS)−3−メチルヘキサヒドロピロロ[1,2−a]ピラジン−2(1H)−イル]−N−[(5R,7S)−3−フェニル−1−アダマンチル]アセトアミド
【0266】
【化71】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(155ミリグラム)および3−メチルオクタヒドロピロロ[1,2−a]ピラジン(88ミリグラム)を用いて実施例19と同じように調製すると、保持時間が14.7分のTFA塩として表題化合物(15.5ミリグラム)が得られた。APCIMS:m/z408.6(M+1)。
【0267】
(実施例36)
N−2−アダマンチル−2−(3,4−ジヒドロイソキノリン−2(1H)−イル)アセトアミド
【0268】
【化72】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(150ミリグラム)および1,2,3,4−テトラヒドロイソキノリン(175.6ミリグラム)を用いて実施例19と同じように調製すると、保持時間が13.6分のTFA塩として表題化合物(131.2ミリグラム)が得られた。APCIMS:m/z325.5(M+1)。
【0269】
(実施例37)
2−(4−ヒドロキシピペリジン−1−イル)−N−[(5R,7S)−3−フェニル−1−アダマンチル]アセトアミド
【0270】
【化73】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(157ミリグラム)および4−ヒドロキシピペリジン(50.3ミリグラム)を用いて実施例19と同じように調製すると、保持時間が13.6分のTFA塩として表題化合物(10.6ミリグラム)が得られた。APCIMS:m/z367.5(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.46〜1.57(2H,m)1.71(2H,m)1.78〜1.89(6H,m)1.96〜2.06(4H,m)2.11(2H,s)2.18〜2.27(4H,m)2.67〜2.77(2H,m)2.85(2H,s)3.26(2H,dt,J=3.28,1.64Hz)3.51〜3.61(1H,m,J=8.91,8.91,4.42,4.04Hz)7.06〜7.13(1H,m)7.21〜7.27(2H,m)7.28〜7.34(2H,m)。
【0271】
(実施例38)
N1−2−アダマンチル−N2−ベンジル−N2−メチルグリシンアミド
【0272】
【化74】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(102.8ミリグラム)およびN−ベンジルメチルアミン(88ミリグラム)を用いて実施例19と同じように調製すると、保持時間が13.7分のTFA塩として表題化合物(42.2ミリグラム)が得られた。APCIMS:m/z313.5(M+1)。
【0273】
(実施例39)
N−2−アダマンチル−2−{4−[2−(トリフルオロメチル)フェノキシ]ピペリジン−1−イル}アセトアミド
【0274】
【化75】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(104ミリグラム)、4−(2−トリフルオロメチルフェノキシ)ピペリジン.HCl(142ミリグラム)、K2CO3(315ミリグラム)およびDMSO(2ミリリットル)を用いて実施例19と同じように、保持時間が16.5分のTFA塩(107.6ミリグラム)として調製した。APCIMS:m/z437.5(M+1)。
【0275】
(実施例40)
N−[(5R,7S)−3−(4−フルオロフェニル)−1−アダマンチル]−2−(4−ヒドロキシピペリジン−1−イル)アセトアミド
【0276】
【化76】

表題化合物は、代わりに2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド(100ミリグラム)および4−ヒドロキシピペリジン(95ミリグラム)を用いて実施例19と同じように調製すると、TFA塩として表題化合物が得られ、保持時間は13.9分で重量は40ミリグラムであった。APCIMS:m/z387.5(M+1)。
【0277】
調製40a [3−(4−フルオロフェニル)−1−アダマンチル]アミン
【0278】
【化77】

表題化合物は、代わりに用いて実施例35cと同じように調製した。
【0279】
調製40b 2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド
【0280】
【化78】

表題化合物は、代わりに塩化クロロアセチル(0.25ミリリットル)、無水塩化メチレン(20ミリリットル)、[3−(4−フルオロフェニル)−1−アダマンチル]アミン(684ミリグラム)、K2CO3(1150ミリグラム)を用いて調製14aと同じように調製し、重量は600ミリグラムであった。APCIMS:m/z322.1(M+1)。
【0281】
(実施例41)
1−(2−{[(5R,7S)−3−(4−フルオロフェニル)−1−アダマンチル]アミノ}−2−オキソエチル)ピペリジン−4−カルボン酸メチル
【0282】
【化79】

表題化合物は、代わりに2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド(100ミリグラム)およびイソニペコチン酸メチル(133.5ミリグラム)を用いて実施例19と同じように調製すると、TFA塩として表題化合物が得られ、保持時間は15.24分で重量は4.5ミリグラムであった。APCIMS:m/z429.5(M+1)。
【0283】
(実施例42)
N−[(5R,7S)−3−(4−フルオロフェニル)−1−アダマンチル]−2−ピペリジン−1−イルアセトアミド
【0284】
【化80】

表題化合物は、代わりに2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド(100ミリグラム)およびピペリジン(66.8ミリグラム)を用いて実施例19と同じように調製すると、TFA塩として表題化合物が得られ、保持時間は15.2分で重量は34.5ミリグラムであった。APCIMS:m/z371.5(M+1)。
【0285】
(実施例43)
N−[(5R,7S)−3−(4−フルオロフェニル)−1−アダマンチル]−2−(3−メチル−5,6−ジヒドロ[1,2,4]トリアゾロ[4,3−a]ピラジン−7(8H)−イル)アセトアミド
【0286】
【化81】

表題化合物は、代わりに2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド(100ミリグラム)および3−メチル−5,6,7,8−テトラヒドロ[1,2,4]トリアゾロ[4,3−a]ピラジン(90ミリグラム)を用いて実施例19と同じように調製すると、TFA塩として表題化合物が得られ、保持時間は14.5分で重量は89.7ミリグラムであった。APCIMS:m/z424.5(M+1)。
【0287】
(実施例44)
2−(3,4−テトラヒドロイソキノリン−2(1H)−イル)−N−[(5R,7S)−3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド
【0288】
【化82】

表題化合物は、代わりに2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド(100ミリグラム)および1,2,3,4−テトラヒドロイソキノリン(130ミリグラム)を用いて実施例19と同じように調製すると、TFA塩として表題化合物が得られ、保持時間は16.8分で重量は17.8ミリグラムであった。APCIMS:m/z419.5(M+1)。
【0289】
(実施例45)
N−[(5R,7S)−3−(4−フルオロフェニル)−1−アダマンチル]−2−(4−ピリジン−2−イルピペラジン−1−イル)アセトアミド
【0290】
【化83】

表題化合物は、代わりに2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド(100ミリグラム)および1−2ピリジル−ピペラジン(75ミリグラム)を用いて実施例19と同じように調製すると、TFA塩として表題化合物が得られ、保持時間は13.1分で重量は17.5ミリグラムであった。APCIMS:m/z449.2(M+1)。
【0291】
(実施例46)
N−2−アダマンチル−2−[4−(ピリジン−2−イルメチル)ピペラジン−1−イル]アセトアミド
【0292】
【化84】

N−2−アダマンチル−2−クロロアセトアミド(152ミリグラム)、2−ピリジルメチルピペラジン(128ミリグラム)、K2CO3(454ミリグラム)およびDMSO(2ミリリットル)を混ぜ合わせた。40℃にて24時間攪拌した後、反応混合物を停止させ、室温まで冷却し、濾過すると、室温にて析出する残渣が得られ、白色固体として望ましい生成物(68.9ミリグラム)が得られた。APCIMS:m/z358.3(M+1)。
【0293】
方法E
(実施例47)
N−1−アダマンチル−2−[4−(2−アミノエチル)ピペラジン−1−イル]アセトアミド
【0294】
【化85】

N−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)およびN−(2−アミノエチル)ピペラジン(147ミリグラム)、K2CO3(300ミリグラム)およびDMSO(3ミリリットル)を室温にて混ぜ合わせた。反応フラスコに黄色の栓で蓋をした。40℃にて20時間攪拌した後、反応混合物を停止させ、室温まで冷却し、メタノール(1ミリリットル)で希釈し、濾過した。溶媒を減圧下で除去し、残渣を、逆相Kromasil C18、水中の0.05%TFAおよびアセトニトリルを用いて精製すると、保持時間が9.3分のTFA塩として表題生成物(182.3ミリグラム)が得られた。APCIMS:m/z321.3(M+1)。Ki:NT。
【0295】
(実施例48)
4−[2−(1−アダマンチルアミノ)−2−オキソエチル]ピペラジン−1−カルボン酸エチル
【0296】
【化86】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)および1−エトキシカルボニルピペラジン(190ミリグラム)を用いて実施例47と同じように調製し、MP−CO3を用い、保持時間が12.1分の遊離塩基として表題化合物(145ミリグラム)を得た。APCIMS:m/z350.2(M+1)。
【0297】
(実施例49)
N−1−アダマンチル−2−ピペリジン−1−イルアセトアミド
【0298】
【化87】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)およびピペリジン(96ミリグラム)、K2CO3(300ミリグラム)を用いて実施例47と同じように調製すると、保持時間が11.7分のTFA塩として表題化合物(77.7ミリグラム)が得られた。APCIMS:m/z277.2(M+1)。
【0299】
(実施例50)
N−1−アダマンチル−2−[4−(2−オキソ−2−ピロリジン−1−イルエチル)ピペラジン−1−イル]アセトアミド
【0300】
【化88】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)およびN−(2−(1−ピペラジノ)アセチル−ピロリジン(217ミリグラム)を用いて実施例47と同じように調製すると、保持時間が11.1分のTFA塩として表題化合物(176ミリグラム)が得られた。APCIMS:m/z389.3(M+1)。
【0301】
(実施例51)
N−1−アダマンチル−2−(1,3−ジヒドロ−2H−イソインドール−2−イル)アセトアミド
【0302】
【化89】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)およびイソインドリン(131ミリグラム)を用いて実施例47と同じように調製すると、保持時間が13.1分のTFA塩として表題化合物(210.7ミリグラム)が得られた。APCIMS:m/z311.2(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.19〜1.30(1H,m)1.68(6H,s)2.00(8H,s)3.25〜3.27(3H,m)3.97(4H,s)7.13〜7.19(4H,m)。
【0303】
(実施例52)
N−1−アダマンチル−2−(4−ベンジルピペラジン−1−イル)アセトアミド
【0304】
【化90】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)および1−ベンジルピペラジン(207ミリグラム)を用いて実施例47と同じように調製すると、保持時間が12.9分で重量が32.8ミリグラムの表題化合物が得られた。APCIMS:m/z368.3(M+1)。
【0305】
(実施例53)
N−1−アダマンチル−2−(2,6−ジメチルモルホリン−4−イル)アセトアミド
【0306】
【化91】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)および2,6−ジメチルモルホリン(131ミリグラム)を用いて実施例47と同じように調製すると、保持時間が11.9分のTFA塩として表題化合物(172ミリグラム)が得られた。APCIMS:m/z307.2(M+1)。
【0307】
(実施例54)
N−1−アダマンチル−2−(3,4−ジヒドロイソキノリン−2(1H)−イル)アセトアミド
【0308】
【化92】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)および1,2,3,4−テトラヒドロイソキノリン(147ミリグラム)、K2CO3(300ミリグラム)およびDMSO(2ミリリットル)を用いて実施例47と同じように調製すると、MP−CO3による遊離塩基後の重量は121ミリグラムであった。TFA塩は、13.5分の保持時間を有していた。APCIMS:m/z325.2(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.62〜1.71(6H,m)1.95〜2.04(10H,m)2.75(2H,t,J=5.94Hz)2.87(2H,t,J=5.81Hz)3.03(2H,s)3.65(2H,s)6.95〜7.00(1H,m)7.03〜7.10(3H,m)。
【0309】
(実施例55)
N−1−アダマンチル−2−(4−ヒドロキシピペリジン−1−イル)アセトアミド
【0310】
【化93】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(251ミリグラム)および4−ヒドロキシピペリジン(217ミリグラム)を用いて実施例47と同じように調製すると、MP−CO3による遊離塩基後に白色の固体として表題化合物が得られた。TFA塩は、10.6分の保持時間を有していた。APCIMS:m/z293.2(M+1)。
【0311】
(実施例56)
N1−1−アダマンチル−N2−[2−(ジメチルアミノ)エチル]グリシンアミド
【0312】
【化94】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(260ミリグラム)およびN,N−ジメチルエチレンジアミン(96ミリグラム)を用いて実施例47と同じように調製すると、保持時間が9.1分のTFA塩として表題化合物(85.4ミリグラム)が得られた。APCIMS:m/z280.4(M+1)。
【0313】
(実施例57)
N1−1−アダマンチル−N2−シクロヘキシル−N2−メチルグリシンアミド
【0314】
【化95】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(251.6ミリグラム)およびN−メチルシクロヘキシルアミン(136.3ミリグラム)、K2CO3(305.2ミリグラム)を用いて実施例47と同じように調製すると、保持時間が13.7分のTFA塩として表題生成物(209.5ミリグラム)が得られた。APCIMS:m/z305.5(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.15〜1.26(1H,m)1.37〜1.47(4H,m)1.68〜1.76(7H,m)1.88〜1.99(3H,s)1.99〜2.09(11H,m)2.81(3H,s)3.20(1H,tt,J=11.75,3.41Hz)3.62(1H,d,J=15.41Hz)3.92(1H,d,J=15.66Hz)。
【0315】
(実施例58)
1−[2−(1−アダマンチルアミノ)−2−オキソエチル]ピペリジン−4−カルボキサミド
【0316】
【化96】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(125ミリグラム)およびイソニペコチンアミド(71ミリグラム)、K2CO3(152ミリグラム)およびDMSO(2ミリリットル)を用いて実施例47と同じように調製すると、MP−CO3による遊離塩基後の重量は61.1ミリグラムであった。TFA塩は、10.4分の保持時間を有していた。APCIMS:m/z320.2(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.70〜1.82(12H,m)1.99〜2.09(10H,m)2.15〜2.26(3H,m)2.84〜2.93(4H,m)。
【0317】
(実施例59)
N−2−アダマンチル−2−(4−ピリジン−2−イルピペラジン−1−イル)アセトアミド
【0318】
【化97】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(101ミリグラム)および1−(2−ピリジル)−ピペラジン(100ミリグラム)を用いて実施例47と同じように調製すると、保持時間が10分のTFA塩として表題化合物(126.1ミリグラム)が得られた。APCIMS:m/z355.3(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.42(2H,d,J=12.38Hz)1.57〜1.77(15H,m)3.07(1H,dt,J=3.28,1.64Hz)3.71〜3.85(8H,m)6.80(1H,t,J=6.57Hz)7.07(1H,d,J=9.09Hz)7.75(1H,ddd,J=8.97,7.20,1.77Hz)7.89(1H,dd,J=5.81,1.01Hz)。
【0319】
方法F
(実施例60)
1−(2−オキソ−2−{[(5R,7S)−3−フェニル−1−アダマンチル]アミノ}エチル)ピペリジン−4−カルボキサミド
【0320】
【化98】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(136ミリグラム)、4−ピペリジンカルボキサミド(58ミリグラム)、K2CO3(191ミリグラム)およびDMSO(3ミリリットル)を用いて調製14aと同じように、保持時間が13.3分のTFA塩(22.7ミリグラム)として調製した。APCIMS:m/z396.5(M+1)。
【0321】
(実施例61)
[3−(4−フルオロフェニル)−1−アダマンチル]カルバミン酸ベンジル
【0322】
【化99】

表題化合物は、調製29aと同じように調製した。
【0323】
構造、物理的データ、生物学的データ、および関連方法を表1においてさらに後述する。
【0324】
本発明を具体的および好ましい実施形態を参照することにより説明してきたが、当業者には当然のことながら、本発明の常用の実験および実施を通して変形形態および修正形態を実施することができる。したがって、本発明は、上記の説明によって限定されることはなく、添付の特許請求の範囲およびそれらの等価物によって定義されるよう意図されている。
【0325】
【表1−1】

【0326】
【表1−2】

【0327】
【表1−3】

【0328】
【表1−4】

【0329】
【表1−5】

【0330】
【表1−6】

【0331】
【表1−7】

【0332】
【表1−8】

【0333】
【表1−9】

【0334】
【表1−10】

【0335】
【表1−11】

【0336】
【表1−12】

【0337】
【表1−13】

【技術分野】
【0001】
本発明は、新規化合物、その化合物を含む医薬組成物、ならびに医学におけるおよびヒト11−β−ヒドロキシステロイドデヒドロゲナーゼ1型酵素(11−β−hsd−1)に作用する医薬品を調製するためのその化合物の使用に関する。
【背景技術】
【0002】
グルココルチコイドが糖尿病において中心的役割を果たすことは、半世紀以上にわたって知られてきた。例えば、糖尿病動物からの下垂体または副腎腺を摘出すると、糖尿病の最も重篤な症状を緩和し、血液中のグルコースの濃度を低下させる(Long,C.D.およびF.D.W.Leukins(1936)J.Exp.Med.63:465〜490;Houssay,B.A.(1942)Endocrinology 30:884〜892)。さらに、グルココルチコイドが、肝臓に対するグルカゴンの作用を可能にすることもよく知られている。
【0003】
局所的なグルココルチコイド作用および肝臓でのグルコース産生の重要なレギュレーターとしての11−β−hsd−1の役割は、十分に立証されている(例えば、Jamieson他(2000)J.Endocrinol.165:p.685〜692)。非特異的11−β−hsd−1阻害剤カルベノキソロンを投与した健常人志願者において肝臓のインスリン感受性が改善された(Walker,B.R.、他(1995)J.Clin.Endocrinol.Metab.80:3155〜3159)。さらに、予想機序は、マウスおよびラットによる様々な実験により確立されている。これらの研究は、肝臓でのグルコース産生における2つの重要な酵素、すなわちグルコース新生における律速酵素であるホスホエノールピルビン酸カルボキシキナーゼ(PEPCK)、ならびにグルコース新生およびグリコーゲン分解の最終共通ステップを触媒するグルコース−6−ホスファターゼ(G6Pase)のmRNAレベルおよび活性が低下することを示した。最後に、血糖値および肝臓でのグルコース産生は、11−β−hsd−1遺伝子がノックアウトされたマウスにおいて低下した。また、このモデルからのデータは、PEPCKおよびG6Paseの基礎レベルがグルココルチコイドと関係なく調節されるため、11−β−hsd−1の阻害が、予測されたように、低血糖を引き起こさないことを裏付けている(Kotelevtsev,Y.、他、(1997)Proc.Natl.Acad.Sci.USA 94:14924〜14929)。
【0004】
腹部肥満は、グルコース不耐性、高インスリン血症、高トリグリセリド血症、およびいわゆるメタボリック症候群の他の要素(例えば、血圧の上昇、HDLレベルの減少およびVLDLレベルの増加)と密接に関係している(MontagueおよびO′Rahilly、Diabetes 49:883〜888、2000)。肥満は、メタボリック症候群ならびに2型糖尿病の大部分(>80%)における重要な要素であり、大網脂肪は、中心的な重要性をもっているように見える。前脂肪細胞(間質細胞)における酵素の阻害は、脂肪細胞への分化速度を減少させることが分かっている。このことは、大網脂肪蓄積拡大の減少(おそらく低下)、すなわち、中心性肥満の減少をもたらすと予想される(Bujalska,I.J.、Kumar,S.、およびStewart,P.M.(1997)Lancet 349:1210〜1213)。
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明の化合物は、11 β−hsd−1阻害剤であり、したがって、糖尿病、肥満、緑内障、骨粗鬆症、認知障害、免疫障害、うつ病、高血圧、および代謝性疾患の治療に有用であると考えられる。
【課題を解決するための手段】
【0006】
本発明は、式(I)の化合物、または薬学的に許容できるその塩もしくは溶媒和物に関し、
【0007】
【化1】

式中、
各R1、R2、R3、およびR4は、Hおよび(C1〜C6)アルキルから独立して選択され、
Yは、O、S、およびNR6からなる群から選択され、
各R5およびR6は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR7R8)t(C3〜C10)シクロアルキル、−(CR7R8)t(C6〜C10)アリール、および−(CR7R8)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、
あるいは、Yが、NR6である場合、R5およびR6は、それらが結合している窒素原子と一緒になって、(4〜11)員ヘテロシクリルを形成していてもよく、(4〜11)員ヘテロシクリルは、1〜5個のR9基により置換されていてもよく、
各R7およびR8は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
Aは、アダマンチルであり、
nおよびmは、0、1、2、および3からなる群から独立して選択され、
kは、1または2であり、
jは、0、1、および2からなる群から選択され、
t、u、p、qおよびvは、各々、0、1、2、3、4、および5からなる群から独立して選択され、
A、R1、R2、R3、R4、R5、R6、R7、およびR8の任意の炭素原子は、1〜5個のR9基により置換されていてもよく、
R5またはR6が(4〜11)員ヘテロシクリルであるR5またはR6の任意の窒素原子は、各々、1〜5個のR9基により置換されていてもよく、
各R9基は、ハロ、シアノ、ニトロ、−CF3、−CHF2、−CH2F、トリフルオロメトキシ、アジド、ヒドロキシ、(C1〜C6)アルコキシ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR10R11)t(C3〜C10)シクロアルキル、−(CR12R13)t(C6〜C10)アリール、−O−R12、−(C=O)−R12、−(C=O)−O−R12、−O−(C=O)−R12、−O−(R12)−O−(R13)、−NR12(C=O)−R13、−(C=O)−NR12R13、−NR12R13、−NR12OR13、−S(O)kNR12R13、−S(O)j(C1〜C6)アルキル、−O−SO2−R14、−NR14−S(O)k−R15、−(CR14R15)v(C6〜C10)アリール、−(CR14R15)v(4〜11)員ヘテロシクリル、−(CR14R15)q(C=O)(CR14R15)v(C6〜C10)アリール、−(CR14R15)q(C=O)(CR14R15)v(4〜11)員ヘテロシクリル、−(CR14R15)vO(CR14R15)q(C6〜C10)アリール、−(CR14R15)vO(CR14R15)q(4〜11)員ヘテロシクリル、−(CR14R15)qS(O)j(CR14R15)v(C6〜C10)アリール、および−(CR14R15)qS(O)j(CR14R15)v(4〜11)員ヘテロシクリルからなる群から独立して選択され、
上記R9基の任意の(4〜11)員ヘテロシクリルの任意の1または2個の炭素原子は、オキソ(=O)で置換されていてもよく、
上記R9基の任意の(C1〜C6)アルキル、任意の(C6〜C10)アリールおよび任意の(4〜11)員ヘテロシクリルの任意の炭素原子は、ハロ、シアノ、ニトロ、−CF3、−CFH2、−CF2H、トリフルオロメトキシ、アジド、−OR16、−(C=O)−R16、−(C=O)−O−R16、−O−(C=O)−R16、−NR16(C=O)−R17、−(C=O)−NR16R17、−NR16R17、−NR16OR17、−S(O)kNR12R13、−S(O)j(C1〜C6)アルキル、−O−SO2−R14、−NR14−S(O)k−R15、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR17R18)u(C6〜C10)アリール、および−(CR17R18)u(4〜11)員ヘテロシクリルから独立して選択される1〜5個の置換基で置換されていてもよく、
各R10、R11、R12、R13、R14、R15、R16、R17、およびR18基は、H、(C1〜C6)アルキル、−(CR19R20)t(C3〜C10)シクロアルキル、−(CR19R20)p(C6〜C10)アリール、および−(CR19R20)p(4〜11)員ヘテロシクリルからなる群から独立して選択され、
前記各R10、R11、R12、R13、R14、R15、R16、R17、およびR18基の(4〜11)員ヘテロシクリルの任意の1または2個の炭素原子は、オキソ(=O)で置換されていてもよく、
上記R10、R11、R12、R13、R14、R15、R16、R17、およびR18基の(C1〜C6)アルキル、任意の(C6〜C10)アリールおよび任意の(4〜11)員ヘテロシクリルの任意の炭素原子は、ハロ、シアノ、ニトロ、−NR21R22、−CF3、−CHF2、−CH2F、トリフルオロメトキシ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、ヒドロキシ、および(C1〜C6)アルコキシからなる群から独立して選択される1〜5個の置換基で置換されていてもよく、
各R19、R20、R21、およびR22基は、Hおよび(C1〜C6)アルキルからなる群から独立して選択され、
ハロ、−SOもしくは−SO2基またはN、OもしくはS原子と結合していない−CH3(メチル)、−CH2(メチレン)、または−CH(メチン)基を含む上記置換基のいずれも、ヒドロキシ、ハロ、(C1〜C6)アルキル、(C1〜C6)アルコキシ、アミノ、−NH(C1〜C6)(アルキル)および−N(C1〜C6)(アルキル)(C1〜C6)アルキルからなる群から独立して選択される置換基を前記基上に有していてよい。
【0008】
Yが、Oである化合物式(I)による本発明のある実施形態。
【0009】
Yが、NR6である化合物式(I)による本発明の別の実施形態。
【0010】
R5およびR6が、それらが結合している窒素と一緒になって、(4〜11)員ヘテロシクリルを形成している化合物式(I)による本発明のさらに別の実施形態。
【0011】
R5およびR6が、それらが結合している窒素と一緒になって、(4〜11)員ヘテロシクリルを形成しているこの実施形態の特定の態様において、(4〜11)員ヘテロシクリルは、下式からなる群から選択される。
【0012】
【化2】

【0013】
R5およびR6が、それらが結合している窒素と一緒になって、(4〜11)員ヘテロシクリルを形成している式(I)による化合物のさらに別の実施形態において、(4〜11)員ヘテロシクリルは、ピロリジニル、インドリル、イソキノリニル、ピペラジニル、およびピペリジニルからなる群から選択される。
【0014】
式(I)の化合物による本発明のある実施形態は、下式、または薬学的に許容できるそれらの塩からなる群から選択される。
【0015】
【化3−1】

【0016】
【化3−2】

【0017】
【化3−3】

【0018】
式(I)の化合物による本発明のある実施形態は、下式、または薬学的に許容できるそれらの塩からなる群から選択される。
【0019】
【化4】

【0020】
本発明のある実施形態において、有効量の式(I)による化合物、または薬学的に許容できるその塩もしくは溶媒和物、および薬学的に許容できる担体を含む医薬組成物。
【0021】
本発明のさらに別の実施形態において、11−β−hsd−1酵素の変調によって仲介される状態を治療する方法であって、有効量の式(I)による化合物、または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【0022】
本発明のさらに別の実施形態において、糖尿病、メタボリック症候群、インスリン抵抗症候群、肥満、緑内障、高脂血症、高血糖症、高インスリン血症、骨粗鬆症、結核、アテローム性動脈硬化症、認知症、うつ病、ウイルス疾患、炎症性障害、または肝臓が標的器官である疾患を治療する方法であって、有効量の式(I)による化合物、または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【0023】
本発明の別の実施形態において、11−β−hsd−1酵素の変調によって仲介される状態を治療する方法であって、緑内障を治療するための治療剤と組み合わせて、有効量の式(I)による化合物または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【0024】
さらに別の実施形態において、状態を治療する方法であって、緑内障を治療するためのプロスタノイド受容体作用薬(前記作用薬は、ラタノプロストである)と組み合わせて、有効量の式(I)による化合物または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【0025】
本発明のさらに別の実施形態において、状態を治療する方法であって、緑内障を治療するための知られている治療剤(前記薬剤は、炭酸脱水酵素阻害剤である)と組み合わせて、有効量の式(I)による化合物または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【0026】
本発明のある実施形態において、状態を治療する方法であって、知られている治療剤(前記治療剤は、PPAR作用薬である)と組み合わせて、有効量の式(I)による化合物を哺乳類に投与することを含む方法。
【0027】
本発明のある実施形態において、式(III)の化合物を調製する方法であって
【0028】
【化5】

[式中、
R7およびR8は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、あるいは
R7およびR8は、それらが結合している窒素と一緒になって、縮合または非縮合であってもよい(4〜11)員複素環を形成していてもよく、
tは、0、1、2、3、4、および5からなる群から選択され、
各R9およびR10は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
Aは、非置換であるか、あるいはハロ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルである]、
式(II)の化合物を
【0029】
【化6】

[式中、
Xは、脱離基であり、
Aは、上記のように定義されている]、
塩基の存在下、溶媒中で、アミンで処理して、式(III)の化合物を製造するステップ(a)と、式(Ia)の化合物を
【0030】
【化7】

[式中、
Aは、上記のように定義されている]、
塩基の存在下、溶媒中で、ハロゲン化アシルで処理して、式(II)の化合物を製造するステップ(b)とを含む方法。
【0031】
さらに別の実施形態において、ステップ(a)におけるXが、Cl、Br、およびメタンスルホネートからなる群から選択される方法。
【0032】
さらに別の実施形態において、ステップ(a)におけるアミンが、R7R8NHである方法。
【0033】
別の実施形態において、ステップ(a)における塩基が、K2CO3、NaHCO3、および(C2H5)3Nからなる群から選択される方法。
【0034】
さらに別の実施形態において、ステップ(a)が、約20℃から溶媒の沸点の温度範囲で進行する方法。
【0035】
さらに別の実施形態において、ステップ(b)における溶媒が、CH2Cl2またはアセトニトリルである方法。
【0036】
さらに別の実施形態において、ステップ(b)における塩基が、(C2H5)3NまたはNaHCO3である方法。
【0037】
さらに別の実施形態において、ステップ(b)が、約−15℃から約50℃の温度範囲で進行する方法。
【0038】
本発明のある実施形態において、式(IIa)の化合物を調製する方法であって
【0039】
【化8】

[式中、
Aは、非置換であるか、あるいはハロ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルであり、
各R9およびR10は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
tは、0、1、2、3、4、および5からなる群から選択される]、
式(V)の化合物を
【0040】
【化9】

[式中、
Aは、上記のように定義されている]、
ニートのSOCl2または溶媒中のSOCl2で処理して、式(IIa)の化合物を生成するステップ(c)と、
式(IV)の化合物を
【0041】
【化10】

[式中、
Aは、上記のように定義されており、
PGは、保護基である]、
溶媒中、保護基除去剤で処理して、式(V)の化合物を生成するステップ(d)と、
式(Ia)の化合物を
【0042】
【化11】

【0043】
【化12】

[式中、
Aは、上記のように定義されている]、
酸とカップリングさせて、式(IV)の化合物を生成するステップ(e)とを含む方法。
【0044】
さらに別の実施形態において、ステップ(c)における溶媒が、CCl4である方法。
【0045】
さらに別の実施形態において、ステップ(c)が、20℃〜100℃の温度にて行われる方法。
【0046】
別の実施形態において、ステップ(d)におけるPGが、(C6〜C12)アリールである方法。
【0047】
さらに別の実施形態において、PGが、フェニルである方法。
【0048】
さらに別の実施形態において、ステップ(d)における保護基除去剤が、(CH3)3Silである方法。
【0049】
さらに別の実施形態において、ステップ(d)における溶媒が、CHCl3である方法。
【0050】
さらに別の実施形態において、ステップ(d)が、20℃から溶媒の沸点の温度にて行われる方法。
【0051】
さらに別の実施形態において、ステップ(e)における酸が、ベンジルオキシ酢酸である方法。
【0052】
本発明のある実施形態において、式(III)の化合物を調製する方法であって
【0053】
【化13】

[式中、
R7およびR8は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、あるいは
R7およびR8は、それらが結合している窒素と一緒になって、縮合または非縮合であってもよい(4〜11)員複素環を形成していてもよく、
各R9およびR10は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
Aは、非置換であるか、あるいはハロ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルであり、
tは、0、1、2、3、4、および5からなる群から選択される]、
式(Ia)の化合物を、
【0054】
【化14】

式(VI)の化合物で
【0055】
【化15】

[式中、
R3は、(C1〜C6)アルキルであり、
R7およびR8は、上記で定義されている]、
適当な溶媒中、試薬の存在下で処理して、式(III)の化合物を生成するステップ(f)と、
式(VII)の化合物を
【0056】
【化16】

[式中、
R3は、上記で定義されており、
Xは、脱離基である]、
塩基の存在下で適当な溶媒中、アミンで処理して、式(VI)の化合物を生成するステップ(g)とを含む方法。
【0057】
さらに別の実施形態において、ステップ(f)においてR3が、メチルまたはエチルである方法。
【0058】
さらに別の実施形態において、ステップ(f)におけるXが、Cl、Brおよびメタンスルホネートからなる群から選択される方法。
【0059】
さらに別の実施形態において、ステップ(f)が、試薬Al(CH3)2Clを用いて行われる方法。
【0060】
さらに別の実施形態において、ステップ(f)が、溶媒CH2Cl2を用いて行われる方法。
【0061】
さらに別の実施形態において、ステップ(f)が、0℃から約20℃の温度にて行われる方法。
【0062】
さらに別の実施形態において、ステップ(g)におけるアミンが、R7R8NHである方法。
【0063】
さらに別の実施形態において、ステップ(g)における溶媒が、CH2Cl2またはDMFである方法。
【0064】
さらに別の実施形態において、ステップ(g)における塩基が、NaHCO3またはトリエチルアミンである方法。
【0065】
定義
本発明のために、本明細書において記載され特許請求の範囲に記載されているように、以下の用語は、以下の通り定義される。
【0066】
本明細書で使用する用語「含む(comprising)」および「含む(including)」は、それらのオープンな非限定的意味で使用される。
【0067】
本明細書で使用する用語「アルキル」には、他に指示がない限り、直鎖または分岐鎖部分を有する飽和一価炭化水素基が含まれる。
【0068】
本明細書で使用する用語「アルケニル」には、他に指示がない限り、アルキルが、上記で定義した通りである少なくとも1個の炭素−炭素二重結合を有するアルキル部分が含まれ、前記アルケニル部分のEおよびZ異性体が含まれる。
【0069】
本明細書で使用する用語「アルキニル」には、他に指示がない限り、アルキルが、上記で定義した通りである少なくとも1個の炭素−炭素三重結合を有するアルキル部分が含まれる。
【0070】
本明細書で使用する用語「アルコキシ」には、他に指示がない限り、アルキルが、上記で定義した通りであるO−アルキル基が含まれる。
【0071】
本明細書で使用する用語「OMs」は、他に指示がない限り、メタンスルホネートを意味するよう意図されている。
【0072】
本明細書で使用する用語「Me」は、他に指示がない限り、メチルを意味するよう意図されている。
【0073】
本明細書で使用する用語「Et」は、他に指示がない限り、エチルを意味するよう意図されている。
【0074】
本明細書で使用する用語「Et3N」は、他に指示がない限り、トリエチルアミンを意味するよう意図されている。
【0075】
本明細書で使用する用語「EtOAc」は、他に指示がない限り、酢酸エチルである。
【0076】
本明細書で使用する用語「AlMe2Cl」は、他に指示がない限り、塩化ジメチルアルミニウムを意味するよう意図されている。
【0077】
本明細書で使用する用語「Ac」は、他に指示がない限り、アセチルを意味するよう意図されている。
【0078】
本明細書で使用する用語「NT」は、他に指示がない限り、未試験を意味するよう意図されている。
【0079】
本明細書で使用する用語「TFA」は、他に指示がない限り、トリフルオロ酢酸を意味するよう意図されている。
【0080】
本明細書で使用する用語TEAは、他に指示がない限り、トリエタノールアミンを意味するよう意図されている。
【0081】
本明細書で使用する用語G6Pは、他に指示がない限り、グルコース−6−リン酸を意味するよう意図されている。
【0082】
本明細書で使用する用語NADPHは、他に指示がない限り、還元型のニコチンアミドアデニンジヌクレオチドリン酸を意味するよう意図されている。
【0083】
慣習により、本明細書における一部の構造式において、炭素原子およびそれらの結合水素原子は明示されず、例えば、
【0084】
【化17】

は、メチル基を表し、
【0085】
【化18】

は、エチル基を表し、
【0086】
【化19】

は、シクロペンチル基を表すなどである。
【0087】
本明細書で使用する用語「アミノ」には、−NH2基、およびN原子上の任意の置換体が含まれるよう意図されている。
【0088】
本明細書で使用する用語「ハロゲン」および「ハロ」は、塩素、フッ素、臭素またはヨウ素を表す。
【0089】
本明細書で使用する用語「トリフルオロメチル」は、−CF3基を表すことを意図している。
【0090】
本明細書で使用する用語「トリフルオロメトキシ」は、−OCF3基を表すことを意図している。
【0091】
本明細書で使用する用語「シアノ」は、−CN基を表すことを意図している。
【0092】
用語「置換されている」は、指定した基または部分が、1つまたは複数の置換基を有することを意味する。用語「置換されていない」は、指定した基が、置換基を有していないことを意味する。用語「置換されていてもよい」は、指定した基が、置換されていないか、あるいは1つまたは複数の置換基で置換されていることを意味する。
【0093】
本明細書で使用する用語「ニートの」は、溶媒が存在しないことを表すことを意図している。
【0094】
−(CR7R8)tまたは−(CR14R15)vなどの用語は、例えば、R7、R8、R14およびR15が、1を超えるtまたはvの各反復によって変化することがある場合に使用される。例えば、tまたはvが2である場合、用語−(CR7R8)vまたは−(CR14R15)tは、−CH2CH2−、または−CH(CH3)C(CH2CH3)(CH2CH2CH3)−、またはR7、R8、R14およびR15の定義の範囲内にある任意の数の類似部分に等しいことがある。
【0095】
本明細書で使用する用語Kiは、酵素阻害定数の値を意味するよう意図されている。
【0096】
本明細書で使用する用語IC50は、50%酵素阻害に必要とされる濃度を意味するよう意図されている。
【0097】
本明細書で使用する用語「min」は、他に指示がない限り、分を意味するよう意図されている。
【0098】
本明細書で使用する用語「m/z」は、他に指示がない限り、質量/電荷比を意味するよう意図されている。
【0099】
本明細書で使用する用語「DMF」は、他に指示がない限り、N,N−ジメチルホルムアミドを意味するよう意図されている。
【0100】
本明細書で使用する用語「DMSO」は、他に指示がない限り、ジメチルスルホキシドを意味するよう意図されている。
【0101】
本明細書で使用する語句「1つまたは複数の薬学的に許容できる塩」には、他に指示がない限り、式(1)の化合物中に存在する酸性基または塩基性基の塩が含まれる。塩基性の性質である式(I)の化合物は、様々な無機酸および有機酸と多種多様な塩を形成することができる。そのような式(1)の塩基性化合物の薬学的に許容できる酸付加塩を調製するのに使用することができる酸は、無毒性の酸付加塩、すなわち酢酸塩、ベンゼンスルホン酸塩、安息香酸塩、重炭酸塩、重硫酸塩、重酒石酸塩、ホウ酸塩、臭化物、カルシウムエデト酸塩、カンシル酸塩、炭酸塩、塩化物、クラブラン酸塩、クエン酸塩、二塩酸塩、エデト酸塩、エジシル酸塩、エストレート、エシレート、エチルコハク酸塩、フマル酸塩、グルセプテート、グルコン酸塩、グルタミン酸塩、グリコリルアルサニル酸塩、ヘキシルレゾルシネート(hexylresorcinate)、ヒドラバミン(hydrabamine)、臭化水素酸塩、塩酸塩、ヨウ化物、イソチオネート(isothionate)、乳酸塩、ラクトビオン酸塩、ラウリン酸塩、リンゴ酸塩、マレイン酸塩、マンデル酸塩、メシル酸塩、メチル硫酸塩、粘液酸塩、ナプシル酸塩、硝酸塩、オレイン酸塩、シュウ酸塩、パモ酸塩(エンボン酸塩)、パルミチン酸塩、パントテン酸塩、リン酸塩/二リン酸塩、ポリガラクツロン酸塩、サリチル酸塩、ステアリン酸塩、塩基性酢酸塩、コハク酸塩、タンニン酸塩、酒石酸塩、テオクル酸塩、トシル酸塩、トリエチオドード(triethiodode)、および吉草酸塩などの薬理学的に許容できる陰イオンを含む塩を形成する酸である。
【0102】
本明細書で使用する用語「肝臓が標的器官である疾患」は、他に指示がない限り、糖尿病、肝炎、肝癌、肝線維症、およびマラリアを意味する。
【0103】
本明細書で使用する用語「メタボリック症候群」は、他に指示がない限り、乾癬、糖尿病、創傷治癒、炎症、神経変性疾患、ガラクトース血症、メープルシロップ尿症、フェニルケトン尿症、高サルコシン血症、チミンウラシル尿症、スルフィヌリア(sulfinuria)、イソ吉草酸血症、サッカロピン尿症、4−ヒドロキシ酪酸尿症、グルコース−6−リン酸脱水素酵素欠損症、およびピルビン酸脱水素酵素欠損症を意味する。
【0104】
本明細書で使用する用語「治療すること」は、他に指示がない限り、そのような用語があてはまる障害もしくは状態、またはそのような障害もしくは状態の1つまたは複数の症状の進行を逆転、緩和、阻害すること、またはそれらを予防することを意味する。本明細書で使用する用語「治療」は、他に指示がない限り、「治療すること」が直ぐ前で定義されているように、治療する行為を指す。
【0105】
本明細書で使用する用語「変調する」または「変調すること」は、ステロイド/甲状腺スーパーファミリーのあるメンバーのモジュレーターが、直接的に(リガンドとして受容体と結合することにより)または間接的に(リガンドの前駆体または前駆体からのリガンドの産生を促進するインデューサーとして)ホルモン発現コントロール下で維持される1つまたは複数の遺伝子の発現を誘発する、またはそのようなコントロール下で維持される1つまたは複数の遺伝子の発現を抑制する能力を指す。
【0106】
本明細書で使用する用語「肥満」または「肥満の」は、一般的に、彼または彼女の年齢、性別および身長に対する平均体重を少なくとも約20〜30%上回っている個人を指す。技術的に、「肥満の」は、男性の場合、ボディーマス指数が27.8kg/m2を超えている個人と、女性の場合、ボディーマス指数が27.3kg/m2を超えている個人と定義されている。当業者には当然のことながら、本発明は、上記の基準に含まれる個人に限定されるものではない。実際、本発明の方法は、これらの伝統的基準から外れている個人、例えば、肥満になる傾向のある個人によっても有利に実施することができる。
【0107】
本明細書で使用する用語「炎症性障害」は、関節リウマチ、強直性脊椎炎、乾癬性関節炎、乾癬、軟骨石灰化、痛風、炎症性腸疾患、潰瘍性大腸炎、クローン病、線維筋痛、および悪液質などの障害を指す。
【0108】
本明細書で使用する語句「有効量」は、研究者、獣医師、医師または他の人により求められている組織、システム、動物、またはヒトの生物学的または医学的応答を誘発するはずの薬物または薬剤の量を指す。
【0109】
本明細書で使用する「血糖値を低下させるのに有効な量」は、望ましい効果を得るのに十分な高い循環濃度を提供するのに十分な化合物のレベルを指す。そのような濃度は、通常、約10nMから2μMまでの範囲に入り、約100nMから500nMまでの範囲の濃度が好ましい。前述のように、上記に記載したような式(I)の定義に含まれる様々な化合物の活性は、かなり変化することがあり、個々の対象は、症状の重症度に幅広い変化を示すことがあるため、治療に対する対象の応答を判断し、それによって用量を変えることは、開業医に委ねられている。
【0110】
本明細書で使用する用語「インスリン抵抗性」は、全身または骨格筋組織、心筋組織、脂肪組織または肝組織などの個々の組織におけるインスリンの作用に対する感受性の低下を指す。インスリン抵抗性は、糖尿病の有無にかかわらず多くの個人で生じる。
【0111】
本明細書で使用する語句「インスリン抵抗症候群」は、インスリン抵抗性、高インスリン血症、インスリン非依存性糖尿病(NIDDM)、動脈性高血圧、中心性(内臓型)肥満、および異常脂質血症が含まれる徴候の群を指す。
【0112】
本明細書で使用する用語「シクロアルキル」は、他に指示がない限り、合計3〜10個の炭素原子、好ましくは5〜8個の環炭素原子を含む本明細書で参照される非芳香族、飽和または部分飽和、単環式または縮合、スピロもしくは非縮合二環式もしくは三環式炭化水素を指す。例示的シクロアルキルには、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチルなどの3〜10個の炭素原子を有する単環式環、およびアダマンチルが含まれる。シクロアルキルの説明に役立つ例は、以下から誘導されるが、これらに限定されるものではない。
【0113】
【化20】

【0114】
本明細書で使用する用語「アリール」には、他に指示がない限り、フェニルまたはナフチルなどの、1個の水素の除去により芳香族炭化水素から誘導される有機基が含まれる。
【0115】
本明細書で使用する用語「(3〜7)員ヘテロシクリル」、「(6〜10)員ヘテロシクリル」、または「(4〜11)員ヘテロシクリル」には、他に指示がない限り、O、SおよびNから各々選択される1〜4個のヘテロ原子を含む芳香族および非芳香族複素環基が含まれ、各複素環基は、その環系内にそれぞれ3〜7個、6〜10個、または4〜11個の原子を有するが、ただし、前記基の環は、2つの隣接するOまたはS原子を含むことはない。非芳香族複素環基には、それらの環系内に3個のみの原子を有する基が含まれるが、芳香族複素環基は、それらの環系内に少なくとも5個の原子を有していなければならない。複素環基には、ベンゾ縮合環系が含まれる。3員複素環基の一例は、アジリジンであり、4員複素環基の一例は、アゼチジニル(アゼチジンから誘導される)である。5員複素環基の一例は、チアゾリルであり、7員環の一例は、アゼピニルであり、10員複素環基の一例は、キノリニルである。非芳香族複素環基の例は、ピロリジニル、テトラヒドロフラニル、ジヒドロフラニル、テトラヒドロチエニル、テトラヒドロピラニル、ジヒドロピラニル、テトラヒドロチオピラニル、ピペリジノ、モルホリノ、チオモルホリノ、チオキサニル、ピペラジニル、アゼチジニル、オキセタニル、チエタニル、ホモピペリジニル、オキセパニル、チエパニル、オキサゼピニル、ジアゼピニル、チアゼピニル、1,2,3,6−テトラヒドロピリジニル、2−ピロリニル、3−ピロリニル、インドリニル、2H−ピラニル、4H−ピラニル、ジオキサニル、1,3−ジオキソラニル、ピラゾリニル、ジチアニル、ジチオラニル、ジヒドロピラニル、ジヒドロチエニル、ジヒドロフラニル、ピラゾリジニル、イミダゾリニル、イミダゾリジニル、3−アザビシクロ[3.1.0]ヘキサニル、3−アザビシクロ[4.1.0]ヘプタニル、3H−インドリルおよびキノリジニルである。芳香族複素環基の例は、ピリジニル、イミダゾリル、ピリミジニル、ピラゾリル、トリアゾリル、ピラジニル、テトラゾリル、フリル、チエニル、イソオキサゾリル、チアゾリル、オキサゾリル、イソチアゾリル、ピロリル、キノリニル、イソキノリニル、インドリル、ベンゾイミダゾリル、ベンゾフラニル、シンノリニル、インダゾリル、インドリジニル、フタラジニル、ピリダジニル、トリアジニル、イソインドリル、プテリジニル、プリニル、オキサジアゾリル、チアジアゾリル、フラザニル、ベンゾフラザニル、ベンゾチオフェニル、ベンゾチアゾリル、ベンゾオキサゾリル、キナゾリニル、キノキサリニル、ナフチリジニル、およびフロピリジニルである。上記に列挙された基から誘導されるように、上記の基は、可能な場合には、C結合またはN結合であってもよい。例えば、ピロールから誘導される基は、ピロール−1−イル(N結合)またはピロール−3−イル(C結合)であってもよい。さらに、イミダゾールから誘導される基は、イミダゾール−1−イル(N結合)またはイミダゾール−3−イル(C結合)であってもよい。4〜7員複素環は、1個の環につき1つまたは2つのオキソにより任意の1つまたは複数の環炭素、イオウ、または窒素原子上で置換されていてもよい。2個の環炭素原子がオキソ部分で置換されている複素環基の一例は、1,1−ジオキソ−チオモルホリニルである。他の4〜7員複素環の説明に役立つ例は、以下から誘導されるが、これらに限定されるものではない。
【0116】
【化21】

【0117】
他に指示がない限り、用語「オキソ」は、=Oを指す。
【0118】
「溶媒和物」は、そのような化合物の生物学的有効性を保持している指定した化合物の薬学的に許容できる溶媒和形態を意味するよう意図されている。溶媒和物の例には、水、イソプロパノール、エタノール、メタノール、DMSO(ジメチルスルホキシド)酢酸エチル、酢酸、またはエタノールアミンと組み合わせた本発明の化合物が含まれる。
【0119】
本発明の化合物は、不斉炭素原子を有することがある。本発明の化合物の炭素−炭素結合は、本明細書において、以下の実線
【0120】
【化22】

以下の実線のくさび形、
【0121】
【化23】

または以下の破線のくさび形を用いて描かれることがある。
【0122】
【化24】

不斉炭素原子との結合を描くための実線の使用は、その炭素原子におけるすべての可能な立体異性体が含まれることを示すことを意図している。不斉炭素原子との結合を描くための実線のくさび形かまたは破線のくさび形の使用は、示されている立体異性体のみが含まれることを意図していることを示すことを意図している。本発明の化合物は、2つ以上の不斉炭素原子を含む可能性がある。それらの化合物では、不斉炭素原子との結合を描くための実線の使用は、すべての可能な立体異性体が含まれることを意図していることを示すことを意図している。本発明の化合物における1つまたは複数の不斉炭素原子との結合を描くための実線の使用、および同じ化合物における他の不斉炭素原子との結合を描くための実線のくさび形かまたは破線のくさび形の使用は、ジアステレオマーの混合物が存在することを示すことを意図している。
【0123】
本発明の個々の立体異性化合物の溶液は、平面偏光を回転させることがある。本発明の化合物の名前における「(+)」かまたは「(−)」記号の使用は、当業者に知られている技法を用いて測定すると、特定の立体異性体の溶液が、平面偏光を(+)または(−)方向に回転させることを示している。
【0124】
ジアステレオ異性体混合物は、当業者に知られている方法により、例えば、クロマトグラフィーまたは分別結晶により、それらの物理的化学的相違に基づいてそれらの個々のジアステレオマーに分離することができる。鏡像異性体は、適切な光学活性な化合物(例えば、アルコール)との反応により鏡像異性体混合物をジアステレオ異性体混合物に変換し、ジアステレオマーを分離し、個々のジアステレオマーを対応する純粋な鏡像異性体に変換する(例えば、加水分解する)ことにより分離することができる。ジアステレオ異性体混合物および純粋な鏡像異性体を含むそのようなすべての異性体は、本発明の一部と見なされる。
【0125】
あるいは、本発明の個々の立体異性化合物は、不斉合成により、鏡像異性的に濃縮された形態で調製することができる。不斉合成は、市販されているか当業者に知られている方法を用いて容易に調製される不斉出発材料の使用、合成の完了時に除去することができる不斉助剤の使用、または酵素的方法を用いる中間化合物の分割などの当業者に知られている技法を用いて行うことができる。そのような方法の選択は、出発材料の入手可能性、方法の相対的効率、およびそのような方法が特定の官能基を含む本発明の化合物に有用であるか否かが含まれるがこれらに限定されない要素によって異なるはずである。そのような選択は、当業者の知識の範囲内にある。
【0126】
本発明の化合物が不斉炭素原子を含む場合、派生する塩、プロドラッグおよび溶媒和物は、単一立体異性体、ラセミ化合物、および/または鏡像異性体および/またはジアステレオマーの混合物として存在することがある。そのようなすべての単一立体異性体、ラセミ化合物、およびそれらの混合物は、本発明の範囲内にあるよう意図されている。
【0127】
当業者には当然のことながら、光学的に純粋な化合物は、鏡像異性的に純粋である化合物である。本明細書で使用する用語「光学的に純粋な」は、少なくとも十分な活性を備える化合物を意味するよう意図されている。本発明の望ましい薬理学的に純粋な化合物を有する化合物を得るための光学的に純粋な量の単一鏡像異性体は、単一異性体を少なくとも90%含む(80%鏡像異性体過剰率)ことが好ましく、少なくとも95%である(90%e.e.)ことがより好ましく、少なくとも97.5%である(95%e.e.)ことがより好ましく、少なくとも99%である(98%e.e.)ことが最も好ましい。
【0128】
本発明の方法で使用される誘導体が塩基である場合、望ましい塩は、塩化水素酸;臭化水素酸;硫酸;硝酸;リン酸などの無機酸による、または酢酸;マレイン酸;コハク酸;マンデル酸;フマル酸;マロン酸;ピルビン酸;シュウ酸;グリコール酸;サリチル酸などの有機酸;グルクロン酸もしくはガラクツロン酸などのピラノシジル(pyranosidyl)酸;クエン酸もしくは酒石酸などのα−ヒドロキシ酸;アスパラギン酸もしくはグルタミン酸などのアミノ酸;安息香酸もしくは桂皮酸などの芳香族酸;p−トルエンスルホン酸もしくはエタンスルホン酸などのスルホン酸などによる遊離塩基の処理を含む当技術分野で知られている任意の適当な方法により調製することができる。
【0129】
本発明の方法において使用される誘導体が酸である場合、望ましい塩は、アミン(一級、二級、または三級);アルカリ金属水酸化物またはアルカリ土類金属水酸化物などによる遊離酸の処理を含む当技術分野で知られている任意の適当な方法により調製することができる。適当な塩の説明に役立つ例には、グリシンおよびアルギニンなどのアミノ酸;アンモニア;一級、二級、および三級アミン;ならびにピペリジン、モルホリン、およびピペラジンなどの環状アミンから誘導される有機塩;ならびにナトリウム、カルシウム、カリウム、マグネシウム、マンガン、鉄、銅、亜鉛、アルミニウム、およびリチウムから誘導される無機塩が含まれる。
【0130】
固体である誘導体、プロドラッグ、塩、または溶媒和物の場合、当業者には当然のことながら、本発明の方法において使用される誘導体、プロドラッグ、塩、および溶媒和物は、様々な多形体または結晶形で存在することがあり、それらのすべては、本発明および指定した式の範囲内に含まれるよう意図されている。さらに、本発明の方法において使用される誘導体、塩、プロドラッグおよび溶媒和物は、互変異性体として存在することがあり、それらのすべては、本発明の広範にわたる範囲に含まれるよう意図されている。
【0131】
塩基性の性質である本発明の化合物は、様々な無機酸および有機酸と多種多様な異なる塩を形成することができる。そのような塩は、動物への投与について薬学的に許容できなければならないが、実際には、初めに本発明の化合物を反応混合物から薬学的に許容できない塩として単離し、次いで、アルカリ試薬による処理によって後者をもとの遊離塩基化合物へ単に変換し、続いて後者の遊離塩基を薬学的に許容できる酸付加塩に変換することが望ましいことが多い。本発明の塩基化合物の酸付加塩は、水性溶媒媒質またはメタノールもしくはエタノールなどの適当な有機溶媒中で実質的に当量の選択された鉱酸または有機酸で塩基化合物を処理することによって容易に調製される。溶媒の注意深い蒸発により、望ましい固体の塩が容易に得られる。また、望ましい酸塩は、溶液に適切な鉱酸または有機酸を加えることにより、有機溶媒中の遊離塩基の溶液から析出させることができる。
【0132】
酸性の性質である本発明のこれらの化合物は、様々な薬理学的に許容できる陽イオンと塩基塩を形成することができる。そのような塩の例には、アルカリ金属塩またはアルカリ土類金属塩、特に、ナトリウム塩およびカリウム塩が含まれる。これらの塩はすべて、従来の技法によって調製される。本発明の薬学的に許容できる塩基塩を調製するための試薬として使用される化学塩基は、本発明の酸性化合物と無毒性塩基塩を形成する化学塩基である。そのような無毒性塩基塩には、ナトリウム、カリウム、カルシウムおよびマグネシウムなどの薬理学的に許容できる陽イオンから誘導される塩基塩が含まれる。これらの塩は、望ましい薬理学的に許容できる陽イオンを含有する水溶液で対応する酸性化合物を処理し、次いで、好ましくは減圧下で、得られる溶液を蒸発乾固することによって容易に調製することができる。あるいは、酸性化合物の低級アルカノール溶液と望ましいアルカリ金属アルコキシドを混ぜ合わせ、次いで、前と同様に得られる溶液を蒸発乾固することによっても調製することができる。どちらの場合にも、反応の完全性および望ましい最終生成物の最高収率を保証するために、化学量論的量の試薬が用いられることが好ましい。
【0133】
式(I)の特定の化合物は、不斉中心を有するため、様々な鏡像異性体で存在することがある。式(I)の化合物のすべての光学異性体および立体異性体、ならびにそれらの混合物は、本発明の範囲内にあると見なされる。式(I)の化合物に関して、本発明には、ラセミ化合物、1つまたは複数の鏡像異性体、1つまたは複数のジアステレオマー体、またはそれらの混合物の使用が含まれる。式(I)の化合物は、互変異性体として存在することもある。本発明は、そのような互変異性体すべておよびそれらの混合物の使用に関する。
【0134】
本発明の化合物内に含まれる特定の官能基は、生物学的等価性の基、すなわち、親基に対して類似した空間的および電子的要件を有するが、異なるか改善された物理化学的または他の特性を示す基と置き換えることができる。適当な例は、当業者によく知られており、Patini他、Chem.Rev、1996、96、3147〜3176およびそこで引用されている参考文献に記載されている部分が含まれるが、これらに限定されるものではない。
【0135】
本発明には、天然に通常見いだされる原子量または質量数と異なる原子量または質量数を有する原子によって1つまたは複数の原子が置き換えられているという事実を別にすれば式(I)に列挙された化合物と同一である同位体標識化合物も含まれる。本発明の化合物に組み入れることができる同位体の例には、それぞれ2H、3H、13C、14C、15N、18O、17O、31P、32P、35S、18F、および36Clなどの水素、炭素、窒素、酸素、リン、フッ素および塩素の同位体が含まれる。上述の同位体および/または他の原子の他の同位体を含有する本発明の化合物および薬学的に許容できる前記化合物の塩または溶媒和物は、本発明の範囲内にある。本発明の特定の同位体標識化合物、例えば3Hおよび14Cなどの放射性同位体が組み入れられている化合物は、薬物および/または基質の組織分布アッセイに有用である。トリチウム化、すなわち3Hおよび炭素14、すなわち14C、同位体は、それらを調製する容易さおよび検出性から特に好ましい。さらに、重水素、すなわち2Hなどのより重い同位体による置換は、より大きな代謝安定性、例えばin vivoにおける半減期の増加または必要用量の減少による特定の治療上の利点を与えることができ、ある環境では好ましいことがある。本発明の式(I)の同位体標識化合物は、一般的に、以下のスキームおよび/または実施例において開示されている手順を行い、非同位体標識試薬の代わりに容易に入手可能な同位体標識試薬を置換することによって調製することができる。
【0136】
本発明の他の態様、利点、および特徴は、以下の詳細な説明から明らかになるはずである。
【発明を実施するための最良の形態】
【0137】
以下の反応スキームは、本発明の化合物の調製を説明している。他に指示がない限り、反応スキームおよび続く考察におけるR1〜R22は、上記で定義した通りである。
【0138】
【化25】

【0139】
上記のスキーム1を参照すると、式IIIの化合物は、ほぼ室温から溶媒の沸点、典型的には約20℃から約100℃の適当な温度にて、塩基(例えば、K2CO3、NaHCO3、トリエチルアミン)の存在下、適当な溶媒(例えば、ジクロロメタンまたはDMF)中で、基Xが、Cl、Br、OMsなどの脱離基である式IIの化合物を、R7およびR8が、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR7R8)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、R7およびR8が、縮合または非縮合であってもよい(4〜11)員複素環を形成することができ、各R9およびR10が、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択されるアミン、R7R8NHと反応させることにより調製することができる。式IIの化合物は、−15℃〜50℃の適当な温度にてNaHCO3またはトリエチルアミンなどの塩基の存在下、CH2Cl2およびアセトニトリルなどの適当な溶媒中で、式Iaの化合物を、XがClまたはBrであるXCH2COClと反応させることにより調製することができる。当業者に対して市販されている式Iaの化合物は、Aが、非置換であるか、あるいはハロ、(C1〜C6)アルキル、−CF3、−CNおよびフェニルなどからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルであるアミンである。
【0140】
【化26】

【0141】
スキーム2を参照すると、式IIaの化合物は、室温から100℃の適当な温度にて、式Vの化合物をニートのSOCl2またはCCl4などの適当な溶媒中のSOCl2と反応させることにより、スキーム2に図示されているように調製することもできる。式Vの化合物は、室温から溶媒の沸点、典型的には約20℃から約100℃の適当な温度にて、PGがフェニルなどの適当な保護基である式IVの化合物を、CHCl3などの適当な溶媒中の(CH)3Silと反応させることにより調製することができる。式IVの化合物は、当業者に知られている方法により、当業者に対して市販されており、Aが、非置換であるか、あるいはハロ、(C1〜C6)アルキル、−CF3、−CNおよびフェニルなどからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルであるアミンである式Iaの化合物を、ベンジルオキシ酢酸などの適当な酸とカップリングさせることにより調製することができる。
【0142】
【化27】

【0143】
スキーム3を参照すると、式IIIの化合物は、0℃から室温の適当な温度にて、CH2Cl2などの適当な溶媒中、Al(CH3)2Clなどの試薬の存在下で式VIの化合物を式Iaの化合物と反応させることにより調製することもできる。式VIの化合物は、0℃〜100℃の適当な温度にて、NaHCO3またはトリエチルアミンなどの塩基の存在下、CH2Cl2またはDMFなどの適当な溶媒中、基Xが、Cl、Br、OMsなどの脱離基である式VIIの化合物を、R7およびR8が、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR7R8)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、R7およびR8が、縮合または非縮合であってもよい(4〜11)員複素環を形成することができ、各R9およびR10が、Hおよび(C1〜C6)アルキルからなる群から独立して選択される式R7R8NHのアミンと反応させることにより調製することができる。R3は、(C1〜C6)アルキルであり、メチルまたはエチルであることが適当である。
【0144】
すべての出発材料、試薬、および溶媒は、市販されており、特に指定のない限り、当業者に知られている。これらの化学的操作は、当業者に知られており、(a)T.W.GreeneおよびP.G.M.Wuts、「Protective Groups in Organic Synthesis」、第2版、John Wiley and Sons、New York、1991に概説されている方法による保護基の除去;(b)一級もしくは二級アミン、チオールまたはアルコールによる、それぞれ二級もしくは三級アミン、チオエーテルまたはエーテルを生成するための脱離基(ハロゲン化物、メシレート、トシレートなど)の置換;(c)対応する尿素、アミド、カルバメートまたはスルホンアミドを提供するためのイソシアネート、酸塩化物(または、他の活性化カルボン酸誘導体)、クロロギ酸アルキル/アリールまたは塩化スルホニルによる一級および二級アミンの処理;(d)アルデヒドを用いる一級または二級アミンの還元アミノ化が含まれる。
【0145】
本発明の化合物は、不斉炭素原子を有することがある。ジアステレオ異性体混合物は、当業者に知られている方法により、例えば、クロマトグラフィーまたは分別結晶により、それらの物理的化学的相違に基づいてそれらの個々のジアステレオマーに分離することができる。鏡像異性体は、適切な光学活性な化合物(例えば、アルコール)との反応により鏡像異性体混合物をジアステレオ異性体混合物に変換し、ジアステレオマーを分離し、個々のジアステレオマーを対応する純粋な鏡像異性体に変換する(例えば、加水分解する)ことにより分離することができる。ジアステレオ異性体混合物および純粋な鏡像異性体を含むそのようなすべての異性体は、本発明の一部と見なされる。
【0146】
塩基性の性質である式(I)の化合物は、様々な無機酸および有機酸と多種多様な異なる塩を形成することができる。そのような塩は、動物への投与について薬学的に許容できなければならないが、実際には、初めに式(I)の化合物を反応混合物から薬学的に許容できない塩として単離し、次いで、後者をアルカリ試薬による処理によってもとの遊離塩基化合物へ単に変換し、続いて後者の遊離塩基を薬学的に許容できる酸付加塩に変換することが望ましいことが多い。本発明の塩基化合物の酸付加塩は、水性溶媒媒質またはメタノールもしくはエタノールなどの適当な有機溶媒中で実質的に当量の選択された鉱酸または有機酸で塩基化合物を処理することによって容易に調製される。溶媒の注意深い蒸発により、望ましい固体の塩が容易に得られる。また、望ましい酸塩は、溶液に適切な鉱酸または有機酸を加えることにより、有機溶媒中の遊離塩基の溶液から析出させることができる。
【0147】
酸性の性質である式(I)のそれら化合物は、様々な薬理学的に許容できる陽イオンと塩基塩を形成することができる。そのような塩の例には、アルカリ金属塩またはアルカリ土類金属塩、特に、ナトリウム塩およびカリウム塩が含まれる。これらの塩はすべて、従来の技法によって調製される。本発明の薬学的に許容できる塩基塩を調製するための試薬として使用される化学塩基は、式(I)の酸性化合物と無毒性塩基塩を形成する化学塩基である。そのような無毒性塩基塩には、ナトリウム、カリウム、カルシウムおよびマグネシウムなどの薬理学的に許容できる陽イオンから誘導される塩基塩が含まれる。これらの塩は、望ましい薬理学的に許容できる陽イオンを含有する水溶液で対応する酸性化合物を処理し、次いで、好ましくは減圧下で、得られる溶液を蒸発乾固することによって容易に調製することができる。あるいは、酸性化合物の低級アルカノール溶液と望ましいアルカリ金属アルコキシドを混ぜ合わせ、次いで、前と同じように、得られる溶液を蒸発乾固することによっても調製することができる。どちらの場合にも、反応の完全性および望ましい最終生成物の最高収率を保証するために、化学量論的量の試薬が用いられることが好ましい。
【0148】
本発明の化合物は、11−β−hsd−1のモジュレーターであってもよい。本発明の化合物は、11−β−hsd−1によって仲介されるプロセスを変調することができ、そのようなプロセスは、本明細書に記載されている11−β−hsd−1阻害剤に応答する受容体または受容体の組合せによって仲介される生物学的、生理学的、内分泌学的、および他の身体プロセス(例えば、糖尿病、高脂血症、肥満、耐糖能異常、高血圧、脂肪肝、糖尿病合併症(例えば、網膜症、腎症、神経症、白内障および冠動脈疾患など)、動脈硬化症、妊娠糖尿病、多嚢胞性卵巣症候群、心血管疾患(例えば、虚血性心不全など)、アテローム性動脈硬化症または虚血性心不全により引き起こされる細胞損傷(例えば、脳卒中などにより引き起こされる脳損傷)、痛風、炎症性疾患(例えば、関節骨炎、疼痛、発熱、関節リウマチ、炎症性腸炎、座瘡、日焼け、乾癬、湿疹、アレルギー疾患、喘息、胃腸潰瘍、悪液質、自己免疫疾患、膵炎など)、癌、骨粗鬆症および白内障)を指す。そのようなプロセスの変調は、in vitroまたはin vivoで達成することができる。in vivo変調は、例えば、ヒト、げっ歯類、ヒツジ、ブタ、ウシなどの広範囲な対象において行うことができる。
【0149】
本発明による化合物は、11−β−hsd−1酵素の変調を必要とするいくつかの適応症において使用することができる。したがって、本発明による化合物は、認知症(WO97/07789を参照)、骨粗鬆症(Canalis E、Mechanisms of glucocorticoid action in bone:implications to glucocorticoid−induced osteoporosis、Journal of Clinical Endocrinology and Metabolism、1996、81、3441〜3447を参照)に対して使用することができ、免疫系の障害に関して(Franchimont、他「Inhibition of Th1 immune response by glucocorticoids:dexamethasone selectively inhibits IL−12−induced Stat 4 phosphorylation in T lymphocytes」、The Journal of Immunology 2000、Feb 15、vol.164(4)、1768〜74ページを参照)、および上記に列挙した適応症にも使用することができる。
【0150】
成熟脂肪細胞における11−β−hsd−1の阻害は、独立した心血管系危険因子であるプラスミノーゲン活性化因子阻害剤1(PAI−1)の分泌を軽減すると予想される(Halleux,C.M.、他(1999)J.Clin.Endocrinol.Metab.84:4097〜4105)。さらに、グルココルチコイド「活性」と心血管系危険因子の間には明確な相関があり、グルココルチコイド作用の低下が有益であることを示唆している(Walker,B.R.、他(1998)Hypertension 31:891〜895:Fraser,R.、他(1999)Hypertension 33:1364〜1368)。
【0151】
副腎摘出は、絶食の効果を弱め、食物摂取と視床下部神経ペプチドY発現の双方を増加させる。このことは、食物摂取を促進する際のグルココルチコイドの役割を裏付けており、脳における11−β−hsd−1の阻害が満腹感を高め、その結果、食物摂取を低下させることを示唆している(Woods,S.C.他(1998)Science、280:1378〜1383)。
【0152】
摘出マウス膵臓β細胞における11−β−hsd−1の阻害は、グルコース刺激性インスリン分泌を改善する(Davani,B.他(2000)J.Biol.Chem.Nov.10、2000;275(45):34841〜4)。グルココルチコイドは、in vivoで膵臓インスリン放出を減少させることがすでに知られていた(Billaudel,B.およびB.C.J.Sutter(1979)Horm.Metab.Res.11:555〜560)。したがって、11−β−hsd−1の阻害は、肝臓および脂肪に対する効果に加えて、糖尿病治療にとっての他の有益な効果をもたらすと予想される。
【0153】
ストレスおよびグルココルチコイドは、認知機能に影響を与える(de Quervain,D.J.−F.、B.Roozendaal、およびJ.L.McGaugh(1998)Nature 394:787〜790)。酵素11−β−hsd−1は、脳におけるグルココルチコイド作用のレベルを制御するため、神経毒性の一因となる(Rajan,V.、C.R.W.Edwards、およびJ.R.Secki,J.(1996)Neuroscience 16:65〜70;Secki,J.R.、Front.(2000)Neuroendocrinol.18:49〜99)。未発表の結果は、非特異的11−β−hsd−1阻害剤で治療したラットにおける有意な記憶改善を示している。脳におけるグルココルチコイドの上記および知られている効果に基づき、脳において11−β−hsd−1を阻害することが、不安の軽減をもたらすことも示唆されている(Tronche,F.他(1999)Nature Genetics 23:99〜103)。したがって、まとめると、ヒト脳における11−β−hsd−1の阻害は、コルチゾンのコルチゾールへの再活性化を妨げ、認知障害、うつ病、および食欲増加を含むニューロン生存およびニューロン機能の他の態様に対する有害なグルココルチコイド仲介性効果を防ぐであろうという仮説がある。
【0154】
グルココルチコイドは、免疫系を抑制するという一般的な認識がある。しかし、実際に、免疫系とHPA(視床下部−下垂体−副腎)軸との間には動的相互作用がある(Rook,G.A.W.(1999)Baillier’s Clin.Endocrinol.Metab.13:576〜581)。細胞性応答と体液性応答のバランスは、グルココルチコイドにより変調される。ストレスの状態におけるなどの高いグルココルチコイド活性は、体液性応答と関係している。したがって、酵素11−β−hsd−1の阻害は、細胞をベースにした反応へと応答を移行する手段として示唆されてきた。
【0155】
最近のデータは、グルココルチコイド標的受容体および11−β−hsd−1酵素のレベルが、緑内障に対する感受性を決定していることを示唆している(Stokes,J.他(2000)Invest.Ophthalmol.41:1629〜1638)。さらに、最近、11−β−hsd−1の阻害が、眼内圧を下げるための新規なアプローチとして提示された(Walker E.A.他、the Endocrine society meeting Jun.12〜15、1999、San DiegoにおけるポスターP3−698)。11−β−hsd−1の非特異的阻害剤であるカルベノキソロンの摂取は、正常な対象において眼内圧を20%低下させることが分かった。眼において、11−β−hsd−1の発現は、角膜上皮の基底細胞および角膜の非色素上皮(房水産生の部位)、毛様体筋ならびに虹彩の括約筋および散大筋に限定される。対照的に、別個のアイソザイム11β−ヒドロキシステロイドデヒドロゲナーゼ2型は、非色素毛様体上皮および角膜内皮において高度に発現される。どの酵素も、排出部位である小柱網には見いだされない。したがって、11−β−hsd−1は、排出よりむしろ房水産生での役割を有することが示唆されるが、グルココルチコイドもしくは鉱質コルチコイド受容体、または両方の活性化を妨害することによるのかどうかは今のところ不明である。
【0156】
グルココルチコイドは、骨格の発育および機能において不可欠な役割を有するが、過剰では有害である(Kim,C.H.、S.L.Cheng、およびG.S.Kim(1999)J.Endocrinol.162:371〜379)。骨結節形成に対する負の作用は、非特異的阻害剤カルベノキソロンによってブロックされ、グルココルチコイド作用における11−β−hsd−1の重要な役割が示唆された(Bellows,C.G.、A.Ciaccia、およびJ.N.M.Heersche、(1998)Bone 23:119〜125)。他のデータは、破骨細胞において十分に高いレベルの活性グルココルチコイドを提供し、骨吸収を増加させる際の11−β−hsd−1の役割を示唆している(Cooper,M.S.他(2000)Bone 27:375〜381)。まとめると、これらの様々なデータは、11−β−hsd−1の阻害が、並行して働く2つ以上の機構により骨粗鬆症に対して有益な効果を有することを示唆している。
【0157】
胆汁酸は、11β−ヒドロキシステロイドデヒドロゲナーゼ2型を阻害する。このことは、尿代謝産物の比を研究することによって示されるように、コルチゾンよりもコルチゾールに偏った全体的身体バランスのシフトをもたらす(Quattropani C、Vogt B、Odematt A、Dick B、Frey B M、Frey F J.2001、J Clin Invest.Nov;108(9):1299〜305。「Reduced activity of 11beta−hydroxysteroid dehydrogenase in patients with cholestasis」)。選択的阻害剤により肝臓における11−β−hsd−1の活性を低下させることは、この不均衡を逆転させ、胆管閉塞を除去する外科治療を待ちながら、高血圧などの症状に強く対抗すると予想される。
【0158】
本発明の化合物は、糖尿病性血管症、アテローム性動脈硬化症、糖尿病性腎症、糖尿病性神経障害、ならびに網膜症、白内障形成および緑内障などの糖尿病性の眼の合併症などのNIDDMの主要な後期合併症、ならびに異常脂肪血症、グルココルチコイド誘発性インスリン抵抗性、異常脂肪血症、多嚢胞性卵巣症候群、肥満、高血糖症、高脂血症、高コレステロール血症、高トリグリセリド血症、高インスリン血症、および高血圧を含むNIDDMと関係がある多くの他の状態を含むグルコース利用の障害およびインスリン抵抗性に伴う他の代謝性障害の治療にも有用である。これらの状態の簡単な定義は、任意の医学辞典、例えば、Stedman’s Medical Dictionary(第10版)で入手可能である。
【0159】
アッセイ
すべてのアッセイは、IN/USシステム社製β−Ramモデル3ラジオHPLC検出器付きの96ウェルプレートオートサンプラーと一緒にAgilent 1100 HPLC(高速液体クロマトグラフ)を用いて行った。11β−hsd−1アッセイは、300マイクロリットルの総容積でCornig(登録商標)96ウェルプレート上で行った。このアッセイにおいて使用される緩衝条件は、以下の通りである。100ミリモルTEA、200ミリモルNaCl、0.02%n−ドデシルβ−D−マルトシド(NDM)、5%グリセロール、5ミリモルβ−ME、pH8.0。アッセイのための反応混合物には、500ミリモルNADPH、約6ナノモル11β−hsd−1(強力な可逆的阻害剤による活性部位滴定に基づく)、1%DMSO(阻害剤)、2ミリモルG6P、1U/ミリリットルG6Pデヒドロゲナーゼ、および6ミリモルMgCl2が含まれる。G6P、G6PデヒドロゲナーゼおよびMgCl2は、11β−hsd−1活性を増幅するための再生システムとしての役割を果たす。NADPHおよび11β−hsd−1を、再生システムの添加および3H−コルチゾンによる開始に先立って、25℃にて阻害剤の存在下で30分間、緩衝液中でインキュベートした。
【0160】
初期反応速度は、試料60マイクロリットルをDMSO60マイクロリットルと混ぜることによって0〜60分の様々な時点で反応を停止することにより測定した。次いで、これらの試料を、1.25ミリリットル/分にてメタノール対水34:66の定組成法を実行しながら、Phenomenex of Torrance、CAから市販されているJupiter C18、150×4.6ミリメートル、5ミクロン、300Angstrom Phenomenex(登録商標)カラムに試料15マイクロリットルを注入することにより逆相液体クロマトグラフィーにより分析した。β−Ramモデル3は、3:1の液体シンチレーションカクテル対溶出液比でポンプ注送し、続いて、3Hシグナルを、観察されるピークの面積により測定する。3H−コルチゾンは、約7分で出るが、11β−hsd−1反応の3H−コルチゾール生成物は、約9分で出る。次いで、3H−コルチゾールの面積を時間に対してプロットし、線速度を決定し、次いで、この速度を、阻害濃度に対してプロットし、KiおよびIC50を決定することができる。
【0161】
[1,2−3H]−コルチゾンは、St.Louis、MissouriのAmerican Radiolabeled Chemicals Inc.から市販されている。NADPH、(G6P)、およびグルコース−6−リン酸デヒドロゲナーゼは、Sigma、Ronkonkoma、NY United Statesから市販されている。
【0162】
11−β−hsd−1酵素に対する本発明の化合物のKi値は、通常、約10ナノモルと約10マイクロモルの間にある。試験された本発明の化合物はすべて、上記のSPAアッセイの少なくとも1つにおいて1マイクロモル未満、好ましくは100ナノモル未満のKiを有している。化合物の特定の好ましい群は、様々な11−β−hsdに対して差次的選択性を有する。好ましい化合物の1つの群は、11β−hsd−2よりも11β−hsd−1に対して選択的活性を有する。化合物の別の好ましい群は、11β−hsd−1よりも11β hsd−2に対して選択的活性を有する。
【0163】
医薬組成物/製剤、用量および投与方法
特定の量の活性化合物で様々な医薬組成物を調製する方法は、当業者に知られているか、明らかなはずである。さらに、当業者は、製剤および投与技法に精通している。そのようなトピックスは、例えば、Goodman and Gilman’s The Pharmaceutical Basis of Therapeutics、最新版、Pergamon Press;およびRemington’s Phamaceutical Sciences、最新版、Mack Publishing,Co.、Eaton、Paにおいて考察されるであろう。これらの技法は、本明細書に記載されている方法および組成物の適切な態様および実施形態において用いることができる。以下の例は、例示的目的のためのみに提供され、本発明の制限としての役割を果たすことにはなっていない。
【0164】
式(I)の化合物は、11−β−hsd−1仲介性疾患の治療における使用に適している局所、経口および非経口医薬製剤として提供することができる。
【0165】
本発明の化合物は、錠剤またはカプセル剤として、油性または水性懸濁剤、ロゼンジ剤、トローチ剤、散剤、顆粒剤、乳剤、シロップ剤またはエリキシル剤として経口的に投与することができる。
【0166】
経口使用のための組成物には、薬学的に洗練されかつ味の良い調製物を製造するために風味付けし、甘くし、着色し、保存するための1つまたは複数の試剤が含まれていてよい。錠剤は、そのような錠剤の製造を助けるものとして薬学的に許容できる賦形剤を含有することができる。当技術分野において慣習的であるように、これらの錠剤を、モノステアリン酸グリセリルまたはジステアリン酸グリセリルなどの薬学的に許容できる腸溶コーティングでコーティングし、胃腸管における分解および吸収を遅らせ、より長時間にわたって持続的作用を提供することができる。
【0167】
経口使用のための製剤は、活性成分が、不活性な固体希釈剤、例えば、炭酸カルシウム、リン酸カルシウムまたはカオリンと混合されている硬質ゼラチンカプセル剤の形態であってもよい。それらは、活性成分が、水またはピーナッツ油、流動パラフィンもしくはオリーブ油などの油性媒質と混合されている軟質ゼラチンカプセル剤の形態であってもよい。
【0168】
水性懸濁剤は、通常、水性懸濁液の製造に適している賦形剤との混合物として活性成分を含有する。そのような賦形剤は、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシプロピルメチルセルロース、アルギン酸ナトリウム、ポリビニルピロリドン、トラガカントガムおよびアカシアガムなどの懸濁化剤;レシチンなどの天然に存在するホスファチド、エチレンオキシドと長鎖脂肪酸の縮合生成物、例えば、ステアリン酸ポリオキシエチレン、ヘプタデカエチレンオキシセタノールなどのエチレンオキシドと長鎖脂肪族アルコールの縮合生成物、モノオレイン酸ポリオキシエチレンソルビトールなどのエチレンオキシドと脂肪酸およびヘキシトールから誘導される部分エステルの縮合生成物またはモノオレイン酸ポリオキシエチレンソルビタンなどの脂肪酸ヘキシトール無水物であってもよい分散剤または湿潤剤であってもよい。
【0169】
医薬組成物は、無菌の注射用水性または油性懸濁液の形態であってもよい。この懸濁液は、上記で記載された適当な分散または湿潤剤および懸濁化剤を用い、知られている方法に従って製剤化することができる。無菌の注射用調製物は、無毒性の非経口的に許容できる希釈剤または溶媒中の懸濁液として、例えば、1,3−ブタンジオール溶液として製剤化することもできる。用いることができる許容できるビヒクルおよび溶媒には、水、リンゲル液および等張性塩化ナトリウム溶液がある。このために、合成モノまたはジグリセリドを含む任意の刺激のない固定油を用いることができる。さらに、オレイン酸などの脂肪酸は、注射剤の調製に使用される。
【0170】
式(I)の化合物は、薬物の直腸投与のための坐剤の形態でも投与することができる。これらの組成物は、薬物を、約25℃では固体であるが直腸温度では液体であるため、直腸内で融解して薬物を放出する適当な刺激性のない賦形剤と混合することにより調製することができる。そのような材料には、カカオ脂および他のグリセリドが含まれる。
【0171】
局所使用の場合、本発明の化合物を含有する調製物、例えば、クリーム剤、軟膏剤、ゼリー液剤、または懸濁剤が用いられる。
【0172】
式(I)の化合物は、小さな単層ベシクル、大きな単層ベシクルおよび多層ベシクルなどのリポソーム送達システムの形態でも投与することができる。リポソームは、コレステロール、ステアリルアミンまたはホスファチジルコリンなどの様々なリン脂質から作成することができる。
【0173】
本発明の化合物の用量レベルは、ほぼ約0.5mg/kg体重から約100mg/kg体重程度である。好ましい用量は、約30mg/kg体重から約100mg/kg体重である。しかし、当然のことながら、任意の特定の患者についての具体的な投与量レベルは、投与されている特定の化合物の活性、年齢、体重、全体的な健康状態、性別、食事、投与時間、投与経路、排泄速度、薬物組合せおよび治療を受けている特定の疾患の重症度を含む多くの要素によって異なるはずである。本発明化合物の治療活性を増強するため、スルホニル尿素、例えば、トルブタミドなどの他の経口的に活性な抗糖尿病化合物と同時に投与することができる。
【実施例】
【0174】
以下に提供される実施例、一般手順、および調製は、本発明の化合物およびそのような化合物を調製する方法をさらに説明し例示するものである。当然のことながら、本発明の範囲は、以下の実施例および調製の範囲によって決して制限されるものではない。以下の実施例において、単一のキラル中心のある分子は、他に指示のない限り、ラセミ混合物として存在する。2つ以上のキラル中心のある分子は、他に指示のない限り、ジアステレオマーのラセミ混合物として存在する。単一の鏡像異性体/ジアステレオマーは、当業者に知られている方法により得ることができる。
【0175】
本発明による様々な化合物の具体的実施例は、以下の実施例に示されているように有利に調製することができる。以下の実施例の構造は、以下の、プロトン磁気共鳴分光法(NMR)、赤外分光法(IR)、微量元素分析、大気圧化学イオン化質量分析法(APCI−MS)、薄層クロマトグラフィー(TLC)、融点(MP)、沸点(BP)、および高速液体クロマトグラフィー(HPLC)のうちの1つまたは複数によって確認した。
【0176】
以下の調製および実施例においてHPLCクロマトグラフィーに言及する場合、使用される一般条件は、他に指示のない限り、以下の通りである。使用されるカラムは、Alltech Platinum EPS 100 Angstrom 1.5ミクロンC18カラム;33ミリメートル×7ミリメートルである。試料は、Hewlett Packard−1100システム上で分析する。5.5分にわたり水(0.1%トリフルオロ酢酸)中の5%アセトニトリル〜水(0.1%トリフルオロ酢酸)中の95%アセトニトリルを流すグラジエント溶媒法を使用する。次いで、システムは、1.5分間の水(0.1%トリフルオロ酢酸)中の95%アセトニトリルによる洗浄サイクルに進む。この時間の流速は、一定の1.5ミリリットル/分である。
【0177】
化合物の構造は、元素分析かNMRのどちらかによって確認し、表題化合物中の特徴的なプロトンに割り当てられたピークを必要に応じて示す。1H NMRシフト(δH)は、内部参照標準から低磁場に百万分率(ppm)で示す。
【0178】
次に、以下の実施例を参照して本発明について記載する。これらの実施例は、本発明の範囲を限定していると見なされるべきではなく、例示的に役目を果たすに過ぎないものとする。
【0179】
方法A
(実施例1)
N−1−アダマンチル−2−[4−(2−メトキシフェノキシ)ピペリジン−1−イル]アセトアミド
【0180】
【化28】

オーブン乾燥してN2冷却した二口丸底フラスコに、1−アダマンタミン(437ミリグラム)および無水CH2Cl2(12ミリリットル)を加えた。この溶液に、窒素下で0℃にて、ヘキサン中のAl(CH3)2Clの1モル溶液(2.9ミリリットル)を少量ずつ加えた。濁った反応混合物を0℃にて30分間および室温にて1.7時間攪拌した後、無水CH2Cl2中の[4−(2−メトキシフェノキシ)ピペリジン−1−イル]酢酸エチル(170ミリグラム)の溶液をゆっくりと加えた。室温にて43時間攪拌した後、反応混合物を0℃まで冷却し、水(10ミリリットル)を滴下してクエンチし、CH2Cl2(9ミリリットル)で希釈した。層を分離し、水層をCH2Cl2(4×10ミリリットル)で抽出した。合わせた有機層をMgSO4で乾燥した。溶媒を真空中で除去し、残渣を、逆相Kromasil(登録商標)C18、水中の0.05%TFAおよびアセトニトリルを用いて精製すると、保持時間が14.8分のTFA塩として表題生成物(6.9ミリグラム)が得られた。APCIMS:m/z399.3(M+1)。
【0181】
(実施例2)
2−(4−アセチル−1,4−ジアゼパン−1−イル)−N−1−アダマンチルアセトアミド
【0182】
【化29】

表題化合物は、代わりに1−アダマンタミン(792ミリグラム)および(4−アセチル−1,4−ジアゼパン−1−イル)酢酸エチル(410ミリグラム)を用いて実施例1と同じように調製すると、保持時間が10.8分のTFA塩として表題生成物(14.7ミリグラム)が得られた。APCIMS:m/z334.3(M+1)。
【0183】
(実施例3)
N−(1−アダマンチルメチル)−2−[4−(2−メトキシフェノキシ)ピペリジン−1−イル]アセトアミド
【0184】
【化30】

表題化合物は、代わりに1−アダマンタンメチルアミン(498ミリグラム)および[4−(2−メトキシフェノキシ)ピペリジン−1−イル]酢酸エチル(177ミリグラム)を用いて実施例1と同じように調製すると、保持時間が15.5分のTFA塩として表題生成物(57ミリグラム)が得られた。APCIMS:m/z413.3(M+1)。
【0185】
(実施例4)
N1−1−アダマンチル−N2−シクロヘキシル−N2−エチルグリシンアミド
【0186】
【化31】

表題化合物は、代わりに1−アダマンタンアミン(711ミリグラム)およびN−シクロヘキシル−N−エチルグリシン酸エチル(500ミリグラム)を用いて実施例1と同じように調製すると、保持時間が14.6分のTFA塩として表題生成物(43ミリグラム)が得られた。APCIMS:m/z319.3(M+1)。
【0187】
調製4a N−シクロヘキシル−N−エチルグリシン酸エチル
【0188】
【化32】

ブロモ酢酸エチル(608ミリグラム)、N−エチルシクロヘキシルアミン(507ミリグラム)、K2CO3(2.57g)、水(10ミリリットル)を室温にて混ぜ合わせた。60℃にて20時間攪拌した後、反応混合物を室温まで冷却し、水(10.0ミリリットル)で希釈し、CH2Cl2(4× 100ミリリットルの総容積まで)で抽出した。合わせた有機層をK2CO3で乾燥した。溶媒を真空中で除去すると、表題生成物(720ミリグラム)が得られた。APCIMS:m/z214.4(M+1)。
【0189】
(実施例5)
N1−(1−アダマンチルメチル)−N2−(3,3,5−トリメチルシクロヘキシル)グリシンアミド
【0190】
【化33】

表題化合物は、代わりに1−アダマンタンメチルアミン(260ミリグラム)およびN−(3,3,5−トリメチルシクロヘキシル)グリシン酸エチル(178ミリグラム)を用いて実施例1と同じように調製すると、保持時間が16.9分のTFA塩として表題生成物(160ミリグラム)が得られた。APCIMS:m/z347.3(M+1)。1H NMR(400MHz,CHLOROFORM−D)δ ppm 0.53(1H,q,J=11.96Hz)0.72〜0.79(1H,m)0.84〜0.89(6H,m)0.90〜0.94(3H,m)1.27〜1.37(3H,m)1.43〜1.51(6H,m)1.53〜1.64(5H,m)1.65〜1.75(3H,m)1.85〜1.94(1H,m)1.94〜2.02(3H,m)2.54(1H,tt,J=11.62,3.79Hz)2.94(2H,qd,J=13.31,6.57Hz)3.25〜3.30(2H,m)7.53(1H,s)。
【0191】
(実施例6)
N1−1−アダマンチル−N2−(3,3,5−トリメチルシクロヘキシル)グリシンアミド
【0192】
【化34】

表題化合物は、代わりに1−アダマンタンアミン(620ミリグラム)およびN−(3,3,5−トリメチルシクロヘキシル)グリシン酸エチル(307ミリグラム)を用いて実施例1と同じように調製すると、保持時間が16分のTFA塩として表題生成物(45ミリグラム)が得られた。APCIMS:m/z333.3(M+1)。
【0193】
(実施例7)
N1−2−アダマンチル−N2−(3,3,5−トリメチルシクロヘキシル)グリシンアミド
【0194】
【化35】

表題化合物は、代わりに2−アダマンタンアミンHCl(414ミリグラム)およびN−(3,3,5−トリメチルシクロヘキシル)グリシン酸エチル(100ミリグラム)を用いて実施例1と同じように調製すると、保持時間が16分のTFA塩として表題生成物(37ミリグラム)が得られた。APCIMS:m/z333.3(M+1)。1H NMR(400MHz,MeOD)δ ppm 0.84〜0.90(2H,m)0.95〜1.05(11H,m)1.18(1H,t,J=12.38Hz)1.44(2H,dt,J=13.39,1.77Hz)1.65〜2.07(15H,m)3.80〜3.89(2H,m)4.03(1H,s)。
【0195】
(実施例8)
N−2−アダマンチル−2−[4−(2−メトキシフェノキシ)ピペリジン−1−イル]アセトアミド
【0196】
【化36】

表題化合物は、代わりに2−アダマンチルアミンHCl(400ミリグラム)、およびN−1−アダマンチル−2−[4−(2−メトキシフェノキシ)ピペリジン−1−イル]アセトアミドを用いて実施例1と同じように調製すると、保持時間が14.7分のTFA塩として表題生成物(68.5ミリグラム)が得られた。APCIMS:m/z399.3(M+1)および遊離塩基として(13.8ミリグラム)。1H NMR(400MHz,MeOD)δ ppm 1.68(2H,d,J=12.38Hz)1.75〜1.87(14H,m)1.91〜2.00(2H,m)2.34〜2.44(2H,m)2.74〜2.84(2H,m)3.00(2H,s)3.26(1H,dt,J=3.28,1.64Hz)3.77(3H,s)3.96(1H,s)4.22〜4.31(1H,m)6.82(1H,td,J=7.33,2.02Hz)6.87〜6.94(3H,m)。
【0197】
(実施例9)
N1−2−アダマンチル−N2−シクロヘキシル−N2−メチルグリシンアミド
【0198】
【化37】

表題化合物は、代わりにN−シクロヘキシル−N−メチルグリシン酸エチル(300ミリグラム)および2−アダマンタミンHCl(860ミリグラム)用いて実施例1と同じように調製すると、保持時間が13.2分のTFA塩として表題生成物(360.7ミリグラム)が得られた。APCIMS:m/z305.5(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.16〜1.27(1H,m)1.35〜1.52(3H,m)1.63〜1.74(3H,m)1.80(2H,s)1.83〜1.99(14H,m)2.07〜2.13(1H,m)2.84(3H,s)3.23(1H,tt,J=11.91,3.38Hz)3.77〜3.87(1H,m)4.02〜4.12(2H,m)8.24(1H,s)。
【0199】
調製9a N−シクロヘキシル−N−メチルグリシン酸エチル
【0200】
【化38】

表題化合物は、代わりにブロモ酢酸エチル(503ミリグラム)、N−メチルシクロヘキシルアミン(386ミリグラム)、K2CO3(2.06g)、水(8ミリリットル)を用いて実施例4aと同じように油(488ミリグラム)として調製した。APCIMS:m/z214.4(M+1)。
【0201】
(実施例10)
N1−2−アダマンチル−N2−シクロヘキシル−N2−エチルグリシンアミド
【0202】
【化39】

表題化合物は、代わりにN−シクロヘキシル−N−エチルグリシン酸エチル(303ミリグラム)、および2−アダマンタミンHCl(799ミリグラム)を用いて実施例1と同じように調製すると、保持時間が13.9分のTFA塩として表題生成物(310.1ミリグラム)が得られた。APCIMS:m/z319.5(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.26〜1.34(3H,m)1.36〜1.47(4H,m)1.63〜1.74(3H,m)1.80〜1.99(16H,m)2.04〜2.13(1H,m)3.24〜3.29(3H,m)3.79(1H,d,J=16.17Hz)4.01〜4.12(2H,m)8.25(1H,s)。
【0203】
(実施例11)
N−2−アダマンチル−2−(1,3−ジヒドロ−2H−イソインドール−2−イル)アセトアミド
【0204】
【化40】

表題化合物は、代わりに1,3−ジヒドロ−2H−イソインドール−2−イル酢酸エチル(352ミリグラム)および2−アダマンタミンHCl(982ミリグラム)を用いて実施例1と同じように調製すると、保持時間が13.23分のTFA塩として表題生成物(303.2ミリグラム)が得られた。APCIMS:m/z311.5(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.49(2H,d,J=12.63Hz)1.58〜1.77(14H,m)3.10〜3.20(1H,m)3.83〜3.91(5H,m)6.99〜7.08(4H,m)。
【0205】
調製11a 1,3−ジヒドロ−2H−イソインドール−2−イル酢酸エチル
【0206】
【化41】

【0207】
方法B
(実施例12)
N−1−アダマンチル−2−(ベンジルオキシ)アセトアミド
【0208】
【化42】

塩化(ベンジルオキシ)アセチル(406ミリグラム)が入ったバイアルに、1−アダマンタンアミン(983ミリグラム)と、続いて無水DMF(2ミリリットル)を加えた。マイクロ波中、80℃にて50分間加熱した後、反応混合物を水(10ミリリットル)でクエンチし、CH2Cl2(4×10ミリリットル)で抽出した。合わせた有機層をMgSO4で乾燥した。溶媒を真空中で除去し、残渣を、逆相Kromasil C18、水中の0.05%TFAおよびアセトニトリルを用いて精製すると、保持時間が20.5分のTFA塩として表題生成物(22ミリグラム)が得られた。APCIMS:m/z300.1(M+1) Ki:NT。
【0209】
方法C
(実施例13)
N−(1−アダマンチルメチル)−2−(4,5,7,8−テトラヒドロ−6H−イソオキサゾロ[3,4−d]アゼピン−6−イル)アセトアミド
【0210】
【化43】

N−(1−アダマンチルメチル)−2−クロロアセトアミド(58.6ミリグラム)、5,6,7,8−テトラヒドロ−4H−イソオキサゾロ[3,4−d]アゼピン(25.3ミリグラム)、K2CO3(75.1ミリグラム)およびCH2Cl2(3)を室温にて混ぜ合わせた。反応フラスコを黄色の栓で蓋をして40℃にて19時間攪拌した後、反応混合物を停止させ、室温まで冷却し、水(4ミリリットル)でクエンチした。層を分離し、水層をEtOAc(3×5ミリリットル)で抽出した。合わせた有機層をK2CO3で乾燥した。溶媒を真空中で除去し、残渣を、逆相Kromasil C18、水中の0.05%TFAおよびアセトニトリルを用いて精製すると、保持時間が12.9のTFA塩として表題生成物(16.2ミリグラム)が得られた。APCIMS:m/z344.3(M+1) Ki:NT。
【0211】
(実施例14)
4−{[2−(1−アダマンチルアミノ)−2−オキソエチル]アミノ}ピペリジン−1−カルボン酸エチル
【0212】
【化44】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)、4−アミノ−1−ピペリジンカルボン酸エチル(191ミリグラム)、K2CO3(450ミリグラム)およびCH2Cl2(10ミリリットル)を用いて実施例12と同じように、保持時間が12.5のTFA塩(170ミリグラム)として調製した。APCIMS:m/z364.3(M+1)。
【0213】
調製14a N−1−アダマンチル−2−クロロアセトアミド
【0214】
【化45】

表題化合物は、代わりに塩化メチレン(150ミリリットル)中の1−アダマンタンアミン(8.8g)を用い、続く窒素下で0℃におけるK2CO3(21.98g)により実施例1と同じように調製した。0℃にて20分間および室温にて17.5時間攪拌した後、塩化メチレン(50ミリリットル)を加えた。室温にて5時間攪拌した後、反応混合物を水(150ミリリットル)で希釈し、塩化メチレン(2×70ミリリットル)で抽出した。水層を水(50ミリリットル)で希釈し、塩化メチレン(3×70ミリリットル)で抽出した。合わせた有機層をK2CO3で乾燥した。溶媒を真空中で除去すると、白色の固体として望ましい生成物(11g)が得られた。
【0215】
(実施例15)
N−1−アダマンチル−2−[4−(1,3−ベンゾジオキソール−5−イルメチル)ピペラジン−1−イル]アセトアミド
【0216】
【化46】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(202ミリグラム)、1−(1,3−ベンゾジオキソール−5−イルメチル)ピペラジン(232ミリグラム)、K2CO3(373ミリグラム)およびCH2Cl2(3ミリリットル)を用いて実施例12と同じように、保持時間が12.7のTFA塩(192.4ミリグラム)として調製した。APCIMS:m/z412.3(M+1)。
【0217】
(実施例16)
4−({2−[(1−アダマンチルメチル)アミノ]−2−オキソエチル}アミノ)ピペリジン−1−カルボン酸エチル
【0218】
【化47】

表題化合物は、代わりにN−(1−アダマンチルメチル)−2−クロロアセトアミド(100ミリグラム)、1−ピペラジンカルボン酸エチル(75ミリグラム)、K2CO3(172ミリグラム)およびCH2Cl2(2ミリリットル)を用いて実施例12と同じように、保持時間が13.5のTFA塩(18.7ミリグラム)として調製した。APCIMS:m/z378.3(M+1)。
【0219】
調製16a N−(1−アダマンチルメチル)−2−クロロアセトアミド
【0220】
【化48】

無水塩化メチレン(6ミリリットル)中の塩化クロロアセチル(350ミリグラム)が入ったフラスコに、窒素下で0℃にて塩化メチレン中の1−アダマタンメチルアミン(500ミリグラム)の溶液と、続いてK2CO3を加えた。0℃にて20分間および室温にて16時間攪拌した後、反応混合物を水(5ミリリットル)で希釈し、塩化メチレン(10ミリリットル×4)で抽出した。合わせた有機層をMgSO4で乾燥した。溶媒を真空中で除去すると、液体として望ましい生成物(痕跡の1−アダマタンメチルアミンが混入した800ミリグラム)が得られた。
【0221】
(実施例17)
N−(1−アダマンチルメチル)−2−[4−(1,3−ベンゾジオキソール−5−イルメチル)ピペラジン−1−イル]アセトアミド
【0222】
【化49】

表題化合物は、代わりにN−(1−アダマンチルメチル)−2−クロロアセトアミド(100ミリグラム)、1−(1,3−ベンゾジオキソール−5−イルメチル)ピペラジン(101ミリグラム)、K2CO3(170ミリグラム)およびCH2Cl2(3ミリリットル)を用いて実施例12と同じように、保持時間が13.8のTFA塩(28ミリグラム)として調製した。APCIMS:m/z426.3(M+1)。
【0223】
(実施例18)
2−(4−アセチル−1,4−ジアゼパン−1−イル)−N−(1−アダマンチルメチル)アセトアミド
【0224】
【化50】

表題化合物は、代わりにN−(1−アダマンチルメチル)−2−クロロアセトアミド(172ミリグラム)、N−アセチルホモピペラジン(156ミリグラム)、K2CO3(352ミリグラム)およびCH2Cl2(6ミリリットル)を用いて実施例12と同じように、保持時間が11.8のTFA塩(64ミリグラム)として調製した。APCIMS:m/z348.3(M+1)。
【0225】
方法D
(実施例19)
N−(1−アダマンチル)−2−[4−(ヒドロキシメチル)ピペリジン−1−イル]アセトアミド
【0226】
【化51】

N−(1−アダマンチル)−2−クロロアセトアミド(190ミリグラム)、4−ピペリジンメタノール(92ミリグラム)、K2CO3(219ミリグラム)およびDMSO(2ミリリットル)を室温にて混ぜ合わせた。40℃にて15時間攪拌した後、反応混合物を停止させ、室温まで冷却し、濾過し、残渣を、逆相Kromasil C18、水中の0.05%TFAおよびアセトニトリルを用いて精製すると、保持時間が10.8分のTFA塩として表題生成物(182.3ミリグラム)が得られた。APCIMS:m/z307.3(M+1)。Ki:NT。
【0227】
(実施例20)
N1−1−アダマンチル−N2−(ピリジン−2−イルメチル)グリシンアミド
【0228】
【化52】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(136ミリグラム)および2−(アミノメチル)ピリジン(81ミリグラム)を用いて実施例19と同じように調製すると、保持時間が12分のTFA塩として表題化合物(92.4ミリグラム)が得られた。APCIMS:m/z300.2(M+1)。
【0229】
(実施例21)
N−1−アダマンチル−2−(4−ピリジン−2−イルピペラジン−1−イル)アセトアミド
【0230】
【化53】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(136ミリグラム)および1−(2−ピリジル)ピペラジン(123ミリグラム)を用いて実施例19と同じように調製すると、保持時間が10.1分のTFA塩として表題化合物(116.4ミリグラム)が得られた。APCIMS:m/z355.3(M+1)。
【0231】
(実施例22)
N−2−アダマンチル−2−[3−(2−クロロフェノキシ)ピペリジン−1−イル]アセトアミド
【0232】
【化54】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(152ミリグラム)、4−(2−トリフルオロメチルフェノキシ)ピペリジンHCl(142ミリグラム)を用いて実施例19と同じように調製すると、保持時間が15.9分のTFA塩として表題化合物(107.6ミリグラム)が得られた。APCIMS:m/z403.2(M+1)。
【0233】
調製22a N−2−アダマンチル−2−クロロアセトアミド
【0234】
【化55】

表題化合物は、代わりに塩化クロロアセチル(1.4g)、無水塩化メチレン(60ミリリットル)、2−アダマンチルアミン(1.865g)、K2CO3(5.09g)を用いて調製14aと同じように調製し、白色の固体(2.33g)を製造した。
【0235】
(実施例23)
N−2−アダマンチル−2−(4−シアノ−4−フェニルピペリジン−1−イル)アセトアミド
【0236】
【化56】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(98.6ミリグラム)および4−シアノ−4−フェニルピペリジンHCl(104ミリグラム)を用いて実施例19と同じように調製すると、保持時間が14.5分のTFA塩として表題化合物(59.8ミリグラム)が得られた。APCIMS:m/z378.5(M+1)。
【0237】
(実施例24)
N−2−アダマンチル−2−ピペリジン−1−イルアセトアミド
【0238】
【化57】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(101.6ミリグラム)およびピペリジン(52ミリグラム)を用いて実施例19と同じように調製すると、保持時間が11.6分のTFA塩として表題化合物(83.3ミリグラム)が得られた。APCIMS:m/z277.4(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.49〜1.58(1H,m)1.64(2H,d,J=12.88Hz)1.78〜2.00(17H,m)3.02(2H,t,J=11.49Hz)3.53(2H,d,J=11.62Hz)3.93(2H,s)4.03(1H,s)8.16(1H,s)。
【0239】
(実施例25)
N−2−アダマンチル−2−[4−(ピリジン−2−イルメチル)ピペリジン−1−イル]アセトアミド
【0240】
【化58】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(152ミリグラム)および2−ピペリジン−4−イルメチルピリジン2HCl(182ミリグラム)を用いて実施例19と同じように調製すると、保持時間が9.8分のTFA塩として表題化合物(151.2ミリグラム)が得られた。APCIMS:m/z368.5(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.60〜1.92(19H,m)2.17(1H,s)3.06(3H,d,J=6.32Hz)3.59(2H,s)3.94〜4.07(3H,m)7.84〜7.94(2H,m)8.47(1H,td,J=7.89,1.64Hz)8.76(1H,d,J=5.05Hz)。
【0241】
(実施例26)
1−[2−(2−アダマンチルアミノ)−2−オキソエチル]ピペリジン−4−カルボン酸メチル
【0242】
【化59】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(108ミリグラム)およびイソニペコチン酸メチル(102ミリグラム)を用いて実施例19と同じように調製すると、保持時間が12.1分のTFA塩として表題化合物(92.6ミリグラム)が得られた。APCIMS:m/z335.3(M+1)。
【0243】
(実施例27)
N−2−アダマンチル−2−(4−ヒドロキシ−4−フェニルピペリジン−1−イル)アセトアミド
【0244】
【化60】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(110ミリグラム)および4−ヒドロキシ−4−フェニルピペリジン(103.4ミリグラム)を用いて実施例19と同じように調製すると、保持時間が13.4分のTFA塩として表題化合物(105.8ミリグラム)が得られた。APCIMS:m/z369.5(M+1)。
【0245】
(実施例28)
N−2−アダマンチル−2−[4−(1H−ピラゾール−5−イル)ピペリジン−1−イル]アセトアミド
【0246】
【化61】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(99ミリグラム)および4−(1H−ピラゾール−5−イル)ピペリジン(73ミリグラム)を用いて実施例19と同じように調製すると、保持時間が11.3分のTFA塩として表題化合物(77.3ミリグラム)が得られた。APCIMS:m/z343.3(M+1)。
【0247】
(実施例29)
N−[(5R,7S)−3−フェニル−1−アダマンチル]−2−[4−(1H−ピラゾール−4−イル)ピペリジン−1−イル]アセトアミド
【0248】
【化62】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(170ミリグラム)および4−(1H−ピラゾール−5−イル)ピペリジン(84ミリグラム)を用いて実施例19と同じように調製すると、保持時間が14.3分のTFA塩として表題化合物(20.3ミリグラム)が得られた。APCIMS:m/z419.6(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.75(2H,s)1.89(4H,d,J=1.77Hz)2.01〜2.12(6H,m)2.16〜2.22(4H,m)2.27(3H,s)2.94〜3.04(1H,m)3.11〜3.21(2H,m)3.60〜3.69(2H,m)3.83(2H,s)6.21(1H,s)7.10〜7.17(1H,m)7.25〜7.36(4H,m)7.57(1H,d,J=2.27Hz)7.95(1H,s)。
【0249】
調製29a (3−フェニル−1−アダマンチル)カルバミン酸ベンジル
【0250】
【化63】

3−フェニルアダマンタン−1−カルボン酸(649ミリグラム)の入ったフラスコに、室温にてアジ化ジフェニルホスホリル(772ミリグラム)、トルエン(6ミリリットル)、Et3N(0.4ミリリットル)を加えた。70℃にて約1.2時間攪拌した後、ベンジルアルコール(0.28ミリリットル)を反応混合物に加えた。70℃にて19.4時間攪拌した後、反応混合物を室温まで冷却し、溶媒を減圧下で除去した。得られた残渣を、EtOAc(10ミリリットル)および水(5ミリリットル)で希釈した。層を分離した。水層をEtOAc(2×10ミリリットル)で抽出した。合わせた有機層をMgSO4で乾燥し、減圧下で濃縮すると、望ましい生成物(700ミリグラム)が得られた。
【0251】
調製29b (3−フェニル−1−アダマンチル)アミン
【0252】
【化64】

EtOAc(3ミリリットル)中の(3−フェニル−1−アダマンチル)カルバミン酸ベンジル(320ミリグラム)の溶液に、10%Pd/C(330ミリグラム)および酢酸を加えた。室温にて一夜水素化した後、反応混合物をEtOAcで希釈し、濾過した。溶媒を減圧下で除去すると、室温にて固化する油が得られ、望ましい生成物(177ミリグラム)が得られた。APCIMS:m/z227.2(M+1)。
【0253】
調製29c 2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド
【0254】
【化65】

表題化合物は、代わりに塩化クロロアセチル(97.4ミリグラム)、無水塩化メチレン(3.5ミリリットル)、(3−フェニル−1−アダマンチル)アミン(177ミリグラム)、K2CO3(324ミリグラム)を用いて調製14aと同じように調製し、重量は160ミリグラムであった。
【0255】
(実施例30)
N−[(5R,7S)−3−フェニル−1−アダマンチル]−2−[4−(ピリジン−2−イルメチル)ピペリジン−1−イル]アセトアミド
【0256】
【化66】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(147.9ミリグラム)および2−ピペリジン−4−イルメチルピリジン2HCl(138.2ミリグラム)を用いて実施例19と同じように調製すると、保持時間が12.5分のTFA塩として表題化合物(26.8ミリグラム)が得られた。APCIMS:m/z444.3(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.64〜1.75(4H,m)1.84〜1.94(7H,m)2.01〜2.28(8H,m)3.01(4H,d,J=5.81Hz)3.55(2H,s)3.79(2H,s)7.12〜7.35(5H,m)7.77〜7.85(2H,m)7.95(1H,m)8.37(1H,td,J=7.89,1.64Hz)8.70(1H,d,J=5.05Hz)。
【0257】
(実施例31)
2−(4−シアノ−4−フェニルピペリジン−1−イル)−N−[(5R,7S)−3−フェニル−1−アダマンチル]アセトアミド
【0258】
【化67】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(150ミリグラム)、4−シアノ−4−フェニルピペリジンHCl(122ミリグラム)を用いて実施例19と同じように調製すると、保持時間が17.2分のTFA塩として表題化合物(24.5ミリグラム)が得られた。APCIMS:m/z454.6(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.76(2H,s)1.86〜1.95(4H,m)2.03〜2.15(5H,m)2.20(2H,s)2.28(2H,s)2.48(2H,s)2.50(2H,d,J=2.53Hz)3.42〜3.53(2H,m)3.72〜3.84(2H,m)3.99(2H,s)7.15(1H,t,J=7.20Hz)7.25〜7.32(2H,m)7.33〜7.38(2H,m)7.39〜7.45(1H,m)7.45〜7.51(2H,m)7.54〜7.59(2H,m)。
【0259】
(実施例32)
1−(2−オキソ−2−{[(5R,7S)−3−フェニル−1−アダマンチル]アミノ}エチル)ピペリジン−4−カルボン酸メチル
【0260】
【化68】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(150ミリグラム)およびイソニペコチン酸メチル(78ミリグラム)を用いて実施例19と同じように調製すると、TFA塩をMP−CO3で処理した後に遊離塩基として表題化合物が得られ、保持時間は15.2分で重量は11.3ミリグラムであった。APCIMS:m/z411.6(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.63〜1.74(4H,m)1.81〜1.90(6H,m)1.96〜2.06(4H,m)2.11(2H,s)2.13〜2.24(5H,m)2.26〜2.35(1H,m)2.75〜2.82(2H,m)2.85(2H,s)3.57〜3.64(3H,m)7.07〜7.13(1H,m)7.21〜7.27(2H,m)7.29〜7.34(2H,m)。
【0261】
(実施例33)
2−(ヘキサヒドロピロロ[1,2−a]ピラジン−2(1H)−イル)−N−[(5R,7S)−3−フェニル−1−アダマンチル]アセトアミド
【0262】
【化69】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(156ミリグラム)およびオクタヒドロピロロ[1,2−a]ピラジン(69ミリグラム)を用いて実施例19と同じように調製すると、保持時間が13.6分のTFA塩として表題化合物(22ミリグラム)が得られた。APCIMS:m/z419.6(M+1)。
【0263】
(実施例34)
2−(3,4−ジヒドロイソキノリン−2(1H)−イル)−N−[(5R,7S)−3−フェニル−1−アダマンチル]アセトアミド
【0264】
【化70】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(156ミリグラム)および1,2,3,4−テトラヒドロイソキノリン(270ミリグラム)を用いて実施例19と同じように調製すると、保持時間が16.6分のTFA塩として表題化合物(20.9ミリグラム)が得られた。APCIMS:m/z401.6(M+1)。
【0265】
(実施例35)
2−[(3S,8aS)−3−メチルヘキサヒドロピロロ[1,2−a]ピラジン−2(1H)−イル]−N−[(5R,7S)−3−フェニル−1−アダマンチル]アセトアミド
【0266】
【化71】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(155ミリグラム)および3−メチルオクタヒドロピロロ[1,2−a]ピラジン(88ミリグラム)を用いて実施例19と同じように調製すると、保持時間が14.7分のTFA塩として表題化合物(15.5ミリグラム)が得られた。APCIMS:m/z408.6(M+1)。
【0267】
(実施例36)
N−2−アダマンチル−2−(3,4−ジヒドロイソキノリン−2(1H)−イル)アセトアミド
【0268】
【化72】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(150ミリグラム)および1,2,3,4−テトラヒドロイソキノリン(175.6ミリグラム)を用いて実施例19と同じように調製すると、保持時間が13.6分のTFA塩として表題化合物(131.2ミリグラム)が得られた。APCIMS:m/z325.5(M+1)。
【0269】
(実施例37)
2−(4−ヒドロキシピペリジン−1−イル)−N−[(5R,7S)−3−フェニル−1−アダマンチル]アセトアミド
【0270】
【化73】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(157ミリグラム)および4−ヒドロキシピペリジン(50.3ミリグラム)を用いて実施例19と同じように調製すると、保持時間が13.6分のTFA塩として表題化合物(10.6ミリグラム)が得られた。APCIMS:m/z367.5(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.46〜1.57(2H,m)1.71(2H,m)1.78〜1.89(6H,m)1.96〜2.06(4H,m)2.11(2H,s)2.18〜2.27(4H,m)2.67〜2.77(2H,m)2.85(2H,s)3.26(2H,dt,J=3.28,1.64Hz)3.51〜3.61(1H,m,J=8.91,8.91,4.42,4.04Hz)7.06〜7.13(1H,m)7.21〜7.27(2H,m)7.28〜7.34(2H,m)。
【0271】
(実施例38)
N1−2−アダマンチル−N2−ベンジル−N2−メチルグリシンアミド
【0272】
【化74】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(102.8ミリグラム)およびN−ベンジルメチルアミン(88ミリグラム)を用いて実施例19と同じように調製すると、保持時間が13.7分のTFA塩として表題化合物(42.2ミリグラム)が得られた。APCIMS:m/z313.5(M+1)。
【0273】
(実施例39)
N−2−アダマンチル−2−{4−[2−(トリフルオロメチル)フェノキシ]ピペリジン−1−イル}アセトアミド
【0274】
【化75】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(104ミリグラム)、4−(2−トリフルオロメチルフェノキシ)ピペリジン.HCl(142ミリグラム)、K2CO3(315ミリグラム)およびDMSO(2ミリリットル)を用いて実施例19と同じように、保持時間が16.5分のTFA塩(107.6ミリグラム)として調製した。APCIMS:m/z437.5(M+1)。
【0275】
(実施例40)
N−[(5R,7S)−3−(4−フルオロフェニル)−1−アダマンチル]−2−(4−ヒドロキシピペリジン−1−イル)アセトアミド
【0276】
【化76】

表題化合物は、代わりに2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド(100ミリグラム)および4−ヒドロキシピペリジン(95ミリグラム)を用いて実施例19と同じように調製すると、TFA塩として表題化合物が得られ、保持時間は13.9分で重量は40ミリグラムであった。APCIMS:m/z387.5(M+1)。
【0277】
調製40a [3−(4−フルオロフェニル)−1−アダマンチル]アミン
【0278】
【化77】

表題化合物は、代わりに用いて実施例35cと同じように調製した。
【0279】
調製40b 2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド
【0280】
【化78】

表題化合物は、代わりに塩化クロロアセチル(0.25ミリリットル)、無水塩化メチレン(20ミリリットル)、[3−(4−フルオロフェニル)−1−アダマンチル]アミン(684ミリグラム)、K2CO3(1150ミリグラム)を用いて調製14aと同じように調製し、重量は600ミリグラムであった。APCIMS:m/z322.1(M+1)。
【0281】
(実施例41)
1−(2−{[(5R,7S)−3−(4−フルオロフェニル)−1−アダマンチル]アミノ}−2−オキソエチル)ピペリジン−4−カルボン酸メチル
【0282】
【化79】

表題化合物は、代わりに2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド(100ミリグラム)およびイソニペコチン酸メチル(133.5ミリグラム)を用いて実施例19と同じように調製すると、TFA塩として表題化合物が得られ、保持時間は15.24分で重量は4.5ミリグラムであった。APCIMS:m/z429.5(M+1)。
【0283】
(実施例42)
N−[(5R,7S)−3−(4−フルオロフェニル)−1−アダマンチル]−2−ピペリジン−1−イルアセトアミド
【0284】
【化80】

表題化合物は、代わりに2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド(100ミリグラム)およびピペリジン(66.8ミリグラム)を用いて実施例19と同じように調製すると、TFA塩として表題化合物が得られ、保持時間は15.2分で重量は34.5ミリグラムであった。APCIMS:m/z371.5(M+1)。
【0285】
(実施例43)
N−[(5R,7S)−3−(4−フルオロフェニル)−1−アダマンチル]−2−(3−メチル−5,6−ジヒドロ[1,2,4]トリアゾロ[4,3−a]ピラジン−7(8H)−イル)アセトアミド
【0286】
【化81】

表題化合物は、代わりに2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド(100ミリグラム)および3−メチル−5,6,7,8−テトラヒドロ[1,2,4]トリアゾロ[4,3−a]ピラジン(90ミリグラム)を用いて実施例19と同じように調製すると、TFA塩として表題化合物が得られ、保持時間は14.5分で重量は89.7ミリグラムであった。APCIMS:m/z424.5(M+1)。
【0287】
(実施例44)
2−(3,4−テトラヒドロイソキノリン−2(1H)−イル)−N−[(5R,7S)−3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド
【0288】
【化82】

表題化合物は、代わりに2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド(100ミリグラム)および1,2,3,4−テトラヒドロイソキノリン(130ミリグラム)を用いて実施例19と同じように調製すると、TFA塩として表題化合物が得られ、保持時間は16.8分で重量は17.8ミリグラムであった。APCIMS:m/z419.5(M+1)。
【0289】
(実施例45)
N−[(5R,7S)−3−(4−フルオロフェニル)−1−アダマンチル]−2−(4−ピリジン−2−イルピペラジン−1−イル)アセトアミド
【0290】
【化83】

表題化合物は、代わりに2−クロロ−N−[3−(4−フルオロフェニル)−1−アダマンチル]アセトアミド(100ミリグラム)および1−2ピリジル−ピペラジン(75ミリグラム)を用いて実施例19と同じように調製すると、TFA塩として表題化合物が得られ、保持時間は13.1分で重量は17.5ミリグラムであった。APCIMS:m/z449.2(M+1)。
【0291】
(実施例46)
N−2−アダマンチル−2−[4−(ピリジン−2−イルメチル)ピペラジン−1−イル]アセトアミド
【0292】
【化84】

N−2−アダマンチル−2−クロロアセトアミド(152ミリグラム)、2−ピリジルメチルピペラジン(128ミリグラム)、K2CO3(454ミリグラム)およびDMSO(2ミリリットル)を混ぜ合わせた。40℃にて24時間攪拌した後、反応混合物を停止させ、室温まで冷却し、濾過すると、室温にて析出する残渣が得られ、白色固体として望ましい生成物(68.9ミリグラム)が得られた。APCIMS:m/z358.3(M+1)。
【0293】
方法E
(実施例47)
N−1−アダマンチル−2−[4−(2−アミノエチル)ピペラジン−1−イル]アセトアミド
【0294】
【化85】

N−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)およびN−(2−アミノエチル)ピペラジン(147ミリグラム)、K2CO3(300ミリグラム)およびDMSO(3ミリリットル)を室温にて混ぜ合わせた。反応フラスコに黄色の栓で蓋をした。40℃にて20時間攪拌した後、反応混合物を停止させ、室温まで冷却し、メタノール(1ミリリットル)で希釈し、濾過した。溶媒を減圧下で除去し、残渣を、逆相Kromasil C18、水中の0.05%TFAおよびアセトニトリルを用いて精製すると、保持時間が9.3分のTFA塩として表題生成物(182.3ミリグラム)が得られた。APCIMS:m/z321.3(M+1)。Ki:NT。
【0295】
(実施例48)
4−[2−(1−アダマンチルアミノ)−2−オキソエチル]ピペラジン−1−カルボン酸エチル
【0296】
【化86】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)および1−エトキシカルボニルピペラジン(190ミリグラム)を用いて実施例47と同じように調製し、MP−CO3を用い、保持時間が12.1分の遊離塩基として表題化合物(145ミリグラム)を得た。APCIMS:m/z350.2(M+1)。
【0297】
(実施例49)
N−1−アダマンチル−2−ピペリジン−1−イルアセトアミド
【0298】
【化87】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)およびピペリジン(96ミリグラム)、K2CO3(300ミリグラム)を用いて実施例47と同じように調製すると、保持時間が11.7分のTFA塩として表題化合物(77.7ミリグラム)が得られた。APCIMS:m/z277.2(M+1)。
【0299】
(実施例50)
N−1−アダマンチル−2−[4−(2−オキソ−2−ピロリジン−1−イルエチル)ピペラジン−1−イル]アセトアミド
【0300】
【化88】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)およびN−(2−(1−ピペラジノ)アセチル−ピロリジン(217ミリグラム)を用いて実施例47と同じように調製すると、保持時間が11.1分のTFA塩として表題化合物(176ミリグラム)が得られた。APCIMS:m/z389.3(M+1)。
【0301】
(実施例51)
N−1−アダマンチル−2−(1,3−ジヒドロ−2H−イソインドール−2−イル)アセトアミド
【0302】
【化89】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)およびイソインドリン(131ミリグラム)を用いて実施例47と同じように調製すると、保持時間が13.1分のTFA塩として表題化合物(210.7ミリグラム)が得られた。APCIMS:m/z311.2(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.19〜1.30(1H,m)1.68(6H,s)2.00(8H,s)3.25〜3.27(3H,m)3.97(4H,s)7.13〜7.19(4H,m)。
【0303】
(実施例52)
N−1−アダマンチル−2−(4−ベンジルピペラジン−1−イル)アセトアミド
【0304】
【化90】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)および1−ベンジルピペラジン(207ミリグラム)を用いて実施例47と同じように調製すると、保持時間が12.9分で重量が32.8ミリグラムの表題化合物が得られた。APCIMS:m/z368.3(M+1)。
【0305】
(実施例53)
N−1−アダマンチル−2−(2,6−ジメチルモルホリン−4−イル)アセトアミド
【0306】
【化91】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)および2,6−ジメチルモルホリン(131ミリグラム)を用いて実施例47と同じように調製すると、保持時間が11.9分のTFA塩として表題化合物(172ミリグラム)が得られた。APCIMS:m/z307.2(M+1)。
【0307】
(実施例54)
N−1−アダマンチル−2−(3,4−ジヒドロイソキノリン−2(1H)−イル)アセトアミド
【0308】
【化92】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(250ミリグラム)および1,2,3,4−テトラヒドロイソキノリン(147ミリグラム)、K2CO3(300ミリグラム)およびDMSO(2ミリリットル)を用いて実施例47と同じように調製すると、MP−CO3による遊離塩基後の重量は121ミリグラムであった。TFA塩は、13.5分の保持時間を有していた。APCIMS:m/z325.2(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.62〜1.71(6H,m)1.95〜2.04(10H,m)2.75(2H,t,J=5.94Hz)2.87(2H,t,J=5.81Hz)3.03(2H,s)3.65(2H,s)6.95〜7.00(1H,m)7.03〜7.10(3H,m)。
【0309】
(実施例55)
N−1−アダマンチル−2−(4−ヒドロキシピペリジン−1−イル)アセトアミド
【0310】
【化93】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(251ミリグラム)および4−ヒドロキシピペリジン(217ミリグラム)を用いて実施例47と同じように調製すると、MP−CO3による遊離塩基後に白色の固体として表題化合物が得られた。TFA塩は、10.6分の保持時間を有していた。APCIMS:m/z293.2(M+1)。
【0311】
(実施例56)
N1−1−アダマンチル−N2−[2−(ジメチルアミノ)エチル]グリシンアミド
【0312】
【化94】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(260ミリグラム)およびN,N−ジメチルエチレンジアミン(96ミリグラム)を用いて実施例47と同じように調製すると、保持時間が9.1分のTFA塩として表題化合物(85.4ミリグラム)が得られた。APCIMS:m/z280.4(M+1)。
【0313】
(実施例57)
N1−1−アダマンチル−N2−シクロヘキシル−N2−メチルグリシンアミド
【0314】
【化95】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(251.6ミリグラム)およびN−メチルシクロヘキシルアミン(136.3ミリグラム)、K2CO3(305.2ミリグラム)を用いて実施例47と同じように調製すると、保持時間が13.7分のTFA塩として表題生成物(209.5ミリグラム)が得られた。APCIMS:m/z305.5(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.15〜1.26(1H,m)1.37〜1.47(4H,m)1.68〜1.76(7H,m)1.88〜1.99(3H,s)1.99〜2.09(11H,m)2.81(3H,s)3.20(1H,tt,J=11.75,3.41Hz)3.62(1H,d,J=15.41Hz)3.92(1H,d,J=15.66Hz)。
【0315】
(実施例58)
1−[2−(1−アダマンチルアミノ)−2−オキソエチル]ピペリジン−4−カルボキサミド
【0316】
【化96】

表題化合物は、代わりにN−1−アダマンチル−2−クロロアセトアミド(125ミリグラム)およびイソニペコチンアミド(71ミリグラム)、K2CO3(152ミリグラム)およびDMSO(2ミリリットル)を用いて実施例47と同じように調製すると、MP−CO3による遊離塩基後の重量は61.1ミリグラムであった。TFA塩は、10.4分の保持時間を有していた。APCIMS:m/z320.2(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.70〜1.82(12H,m)1.99〜2.09(10H,m)2.15〜2.26(3H,m)2.84〜2.93(4H,m)。
【0317】
(実施例59)
N−2−アダマンチル−2−(4−ピリジン−2−イルピペラジン−1−イル)アセトアミド
【0318】
【化97】

表題化合物は、代わりにN−2−アダマンチル−2−クロロアセトアミド(101ミリグラム)および1−(2−ピリジル)−ピペラジン(100ミリグラム)を用いて実施例47と同じように調製すると、保持時間が10分のTFA塩として表題化合物(126.1ミリグラム)が得られた。APCIMS:m/z355.3(M+1)。1H NMR(400MHz,MeOD)δ ppm 1.42(2H,d,J=12.38Hz)1.57〜1.77(15H,m)3.07(1H,dt,J=3.28,1.64Hz)3.71〜3.85(8H,m)6.80(1H,t,J=6.57Hz)7.07(1H,d,J=9.09Hz)7.75(1H,ddd,J=8.97,7.20,1.77Hz)7.89(1H,dd,J=5.81,1.01Hz)。
【0319】
方法F
(実施例60)
1−(2−オキソ−2−{[(5R,7S)−3−フェニル−1−アダマンチル]アミノ}エチル)ピペリジン−4−カルボキサミド
【0320】
【化98】

表題化合物は、代わりに2−クロロ−N−(3−フェニル−1−アダマンチル)アセトアミド(136ミリグラム)、4−ピペリジンカルボキサミド(58ミリグラム)、K2CO3(191ミリグラム)およびDMSO(3ミリリットル)を用いて調製14aと同じように、保持時間が13.3分のTFA塩(22.7ミリグラム)として調製した。APCIMS:m/z396.5(M+1)。
【0321】
(実施例61)
[3−(4−フルオロフェニル)−1−アダマンチル]カルバミン酸ベンジル
【0322】
【化99】

表題化合物は、調製29aと同じように調製した。
【0323】
構造、物理的データ、生物学的データ、および関連方法を表1においてさらに後述する。
【0324】
本発明を具体的および好ましい実施形態を参照することにより説明してきたが、当業者には当然のことながら、本発明の常用の実験および実施を通して変形形態および修正形態を実施することができる。したがって、本発明は、上記の説明によって限定されることはなく、添付の特許請求の範囲およびそれらの等価物によって定義されるよう意図されている。
【0325】
【表1−1】

【0326】
【表1−2】

【0327】
【表1−3】

【0328】
【表1−4】

【0329】
【表1−5】

【0330】
【表1−6】

【0331】
【表1−7】

【0332】
【表1−8】

【0333】
【表1−9】

【0334】
【表1−10】

【0335】
【表1−11】

【0336】
【表1−12】

【0337】
【表1−13】

【特許請求の範囲】
【請求項1】
式(I)の化合物、または薬学的に許容できるその塩もしくは溶媒和物
【化1】

[式中、
各R1、R2、R3、およびR4は、Hおよび(C1〜C6)アルキルから独立して選択され、
Yは、O、S、およびNR6からなる群から選択され、
各R5およびR6は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR7R8)t(C3〜C10)シクロアルキル、−(CR7R8)t(C6〜C10)アリール、および−(CR7R8)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、
あるいは、Yが、NR6である場合、R5およびR6は、それらが結合している窒素原子と一緒になって、(4〜11)員ヘテロシクリルを形成していてもよく、(4〜11)員ヘテロシクリルは、1〜5個のR9基により置換されていてもよく、
各R7およびR8は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
Aは、アダマンチルであり、
nおよびmは、0、1、2、および3からなる群から独立して選択され、
kは、1または2であり、
jは、0、1、および2からなる群から選択され、
t、u、p、qおよびvは、各々、0、1、2、3、4および5からなる群から独立して選択され、
A、R1、R2、R3、R4、R5、R6、R7、およびR8の任意の炭素原子は、1〜5個のR9基により置換されていてもよく、
R5またはR6が(4〜11)員ヘテロシクリルであるR5またはR6の任意の窒素原子は、各々、1〜5個のR9基により置換されていてもよく、
各R9基は、ハロ、シアノ、ニトロ、−CF3、−CHF2、−CH2F、トリフルオロメトキシ、アジド、ヒドロキシ、(C1〜C6)アルコキシ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR10R11)t(C3〜C10)シクロアルキル、−(CR12R13)t(C6〜C10)アリール、−O−R12、(C=O)−R12、−(C=O)−O−R12、−O−(C=O)−R12、−O−(R12)−O−(R13)、−NR12(C=O)−R13、−(C=O)−NR12R13、−NR12R13、−NR12OR13、−S(O)kNR12R13、−S(O)j(C1〜C6)アルキル、−O−SO2−R14、−NR14−S(O)k−R15、−(CR14R15)v(C6〜C10)アリール、−(CR14R15)v(4〜11)員ヘテロシクリル、−(CR14R15)q(C=O)(CR14R15)v(C6〜C10)アリール、−(CR14R15)q(C=O)(CR14R15)v(4〜11)員ヘテロシクリル、−(CR14R15)vO(CR14R15)q(C6〜C10)アリール、−(CR14R15)vO(CR14R15)q(4〜11)員ヘテロシクリル、−(CR14R15)qS(O)j(CR14R15)v(C6〜C10)アリール、および−(CR14R15)qS(O)j(CR14R15)v(4〜11)員ヘテロシクリルからなる群から独立して選択され、
上記R9基の任意の(4〜11)員ヘテロシクリルの任意の1または2個の炭素原子は、オキソ(=O)で置換されていてもよく、
上記R9基の任意の(C1〜C6)アルキル、任意の(C6〜C10)アリールおよび任意の(4〜11)員ヘテロシクリルの任意の炭素原子は、ハロ、シアノ、ニトロ、−CF3、−CFH2、−CF2H、トリフルオロメトキシ、アジド、−OR16、−(C=O)−R16、−(C=O)−O−R16、−O−(C=O)−R16、−NR16(C=O)−R17、(C=O)−NR16R17、−NR16R17、−NR16OR17、−S(O)kNR12R13、−S(O)j(C1〜C6)アルキル、−O−SO2−R14、−NR14−S(O)k−R15、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、(CR17R18)u(C6〜C10)アリール、および(CR17R18)u(4〜11)員ヘテロシクリルから独立して選択される1〜5個の置換基で置換されていてもよく、
各R10、R11、R12、R13、R14、R15、R16、R17、およびR18基は、H、(C1〜C6)アルキル、−(CR19R20)t(C3〜C10)シクロアルキル、−(CR19R20)p(C6〜C10)アリール、および−(CR19R20)p(4〜11)員ヘテロシクリルからなる群から独立して選択され、
前記各R10、R11、R12、R13、R14、R15、R16、R17、およびR18基の(4〜11)員ヘテロシクリルの任意の1または2個の炭素原子は、オキソ(=O)で置換されていてもよく、
上記R10、R11、R12、R13、R14、R15、R16、R17、およびR18基の任意の(C1〜C6)アルキル、任意の(C6〜C10)アリールおよび任意の(4〜11)員ヘテロシクリルの任意の炭素原子は、ハロ、シアノ、ニトロ、−NR21R22、−CF3、−CHF2、−CH2F、トリフルオロメトキシ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、ヒドロキシ、および(C1〜C6)アルコキシからなる群から独立して選択される1〜5個の置換基で置換されていてもよく、
各R19、R20、R21、およびR22基は、Hおよび(C1〜C6)アルキルからなる群から独立して選択され、
ハロ、−SOもしくは−SO2基またはN、OもしくはS原子と結合していない−CH3(メチル)、−CH2(メチレン)、または−CH(メチン)基を含む上記置換基のいずれも、ヒドロキシ、ハロ、(C1〜C6)アルキル、(C1〜C6)アルコキシ、アミノ、−NH(C1〜C6)(アルキル)および−N(C1〜C6)(アルキル)(C1〜C6)アルキルからなる群から独立して選択される置換基を前記基上に有していてよい]。
【請求項2】
Yが、Oである請求項1に記載の化合物。
【請求項3】
Yが、NR6である請求項1に記載の化合物。
【請求項4】
R5およびR6が、それらが結合している窒素と一緒になって、(4〜11)員ヘテロシクリルを形成している請求項3に記載の化合物。
【請求項5】
(4〜11)員ヘテロシクリルが、ピロリジニル、インドリル、イソキノリニル、ピペラジニル、およびピペリジニルからなる群から選択される請求項4に記載の化合物。
【請求項6】
下式からなる群から選択される化合物、または薬学的に許容できるそれらの塩。
【化2−1】

【化2−2】

【化2−3】

【請求項7】
下式からなる群から選択される化合物、または薬学的に許容できるそれらの塩。
【化3−1】

【化3−2】

【請求項8】
有効量の請求項1に記載の化合物、または薬学的に許容できるその塩もしくは溶媒和物、および薬学的に許容できる担体を含む医薬組成物。
【請求項9】
11−β−hsd−1酵素の変調によって仲介される状態を治療する方法であって、有効量の請求項1に記載の化合物、または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【請求項10】
糖尿病、メタボリック症候群、インスリン抵抗症候群、肥満、緑内障、高脂血症、高血糖症、高インスリン血症、骨粗鬆症、結核、アテローム性動脈硬化症、認知症、うつ病、ウイルス疾患、炎症性障害、または肝臓が標的器官である疾患を治療する方法であって、有効量の請求項1に記載の化合物、または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【請求項11】
11−β−hsd−1酵素の変調によって仲介される状態を治療する方法であって、緑内障を治療するための治療剤と組み合わせて、有効量の請求項1に記載の化合物または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【請求項12】
請求項11に記載の状態を治療する方法であって、緑内障を治療するためのプロスタノイド受容体作用薬(前記作用薬は、ラタノプロストである)と組み合わせて、有効量の請求項1に記載の化合物または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【請求項13】
請求項11に記載の状態を治療する方法であって、緑内障を治療するための知られている治療剤(前記薬剤は、炭酸脱水酵素阻害剤である)と組み合わせて、有効量の請求項1に記載の化合物または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【請求項14】
請求項11に記載の状態を治療する方法であって、知られている治療剤(前記治療剤は、糖尿病を治療するためのPPAR作用薬である)と組み合わせて、有効量の請求項1に記載の化合物を哺乳類に投与することを含む方法。
【請求項15】
式(III)の化合物を調製する方法であって
【化4】

[式中、
R7およびR8は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、あるいは
R7およびR8は、それらが結合している窒素と一緒になって、縮合または非縮合であってもよい(4〜11)員複素環を形成していてもよく、
tは、0、1、2、3、4、および5からなる群から選択され、
各R9およびR10は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
Aは、非置換であるか、あるいはハロ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルである]、
式(II)の化合物を
【化5】

[式中、
Xは、脱離基であり、
Aは、上記のように定義されている]、
塩基の存在下、溶媒中で、アミンで処理して、式(III)の化合物を製造するステップ(a)と、式(Ia)の化合物を
【化6】

[式中、
Aは、上記のように定義されている]、
塩基の存在下、溶媒中で、ハロゲン化アシルで処理して、式(II)の化合物を製造するステップ(b)とを含む方法。
【請求項16】
ステップ(a)におけるXが、Cl、Br、およびメタンスルホネートからなる群から選択される請求項15に記載の方法。
【請求項17】
ステップ(a)におけるアミンが、R7R8NHである請求項15に記載の方法。
【請求項18】
ステップ(a)における塩基が、K2CO3、NaHCO3、および(C2H5)3Nからなる群から選択される請求項15に記載の方法。
【請求項19】
ステップ(a)が、約20℃から溶媒の沸点の温度範囲で進行する請求項15に記載の方法。
【請求項20】
ステップ(b)における溶媒が、CH2Cl2またはアセトニトリルである請求項15に記載の方法。
【請求項21】
ステップ(b)における塩基が、(C2H5)3NまたはNaHCO3である請求項15に記載の方法。
【請求項22】
ステップ(b)が、約−15℃から約50℃の温度範囲で進行する請求項15に記載の方法。
【請求項23】
式(IIa)の化合物を調製する方法であって
【化7】

[式中、
Aは、非置換であるか、あるいはハロ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、(CR9R10)t(C3〜C10)シクロアルキル、(CR9R10)t(C6〜C10)アリール、および(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルであり、
各R9およびR10は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
tは、0、1、2、3、4、および5からなる群から選択される]、
式(V)の化合物を
【化8】

[式中、
Aは、上記のように定義されている]、
ニートのSOCl2または溶媒中のSOCl2で処理して、式(IIa)の化合物を生成するステップ(c)と、
式(IV)の化合物を
【化9】

[式中、
Aは、上記のように定義されており、
PGは、保護基である]、
溶媒中、保護基除去剤で処理して、式(V)の化合物を生成するステップ(d)と、
式(Ia)の化合物を
【化10】

【化11】

[式中、
Aは、上記のように定義されている]、
酸とカップリングさせて、式(IV)の化合物を生成するステップ(e)とを含む方法。
【請求項24】
ステップ(c)における溶媒が、CCl4である請求項23に記載の方法。
【請求項25】
ステップ(c)が、20℃〜100℃の温度にて行われる請求項23に記載の方法。
【請求項26】
ステップ(d)におけるPGが、(C6〜C12)アリールである請求項23に記載の方法。
【請求項27】
アリールが、フェニルである請求項26に記載の方法。
【請求項28】
ステップ(d)における保護基除去剤が、(CH3)3Silである請求項23に記載の方法。
【請求項29】
ステップ(d)における溶媒が、CHCl3である請求項23に記載の方法。
【請求項30】
ステップ(d)が、20℃から溶媒の沸点の温度にて行われる請求項23に記載の方法。
【請求項31】
ステップ(e)における酸が、ベンジルオキシ酢酸である請求項23に記載の方法。
【請求項32】
式(III)の化合物を調製する方法であって
【化12】

[式中、
R7およびR8は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、あるいは
R7およびR8は、それらが結合している窒素と一緒になって、縮合または非縮合であってもよい(4〜11)員複素環を形成していてもよく、
各R9およびR10は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
Aは、非置換であるか、あるいはハロ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルであり、
tは、0、1、2、3、4、および5からなる群から選択される]、
式(Ia)の化合物を、
【化13】

式(VI)の化合物で
【化14】

[式中、
R3は、(C1〜C6)アルキルであり、
R7およびR8は、上記で定義されている]、
適当な溶媒中、試薬の存在下で処理して、式(III)の化合物を生成するステップ(f)と、
式(VII)の化合物を
【化15】

[式中、
R3は、上記で定義されており、
Xが、脱離基である]、
塩基の存在下で適当な溶媒中、アミンで処理して、式(VI)の化合物を生成するステップ(g)とを含む方法。
【請求項33】
ステップ(f)R3が、メチルまたはエチルである請求項32に記載の方法。
【請求項34】
ステップ(f)におけるXが、Cl、Brおよびメタンスルホネートからなる群から選択される請求項32に記載の方法。
【請求項35】
ステップ(f)が、試薬Al(CH3)2Clを用いて行われる請求項32に記載の方法。
【請求項36】
ステップ(f)が、溶媒CH2Cl2を用いて行われる請求項32に記載の方法。
【請求項37】
ステップ(f)が、0℃から約20℃の温度にて行われる請求項32に記載の方法。
【請求項38】
ステップ(g)におけるアミンが、R7R8NHである請求項32に記載の方法。
【請求項39】
ステップ(g)における溶媒が、CH2Cl2またはDMFである請求項32に記載の方法。
【請求項40】
ステップ(g)における塩基が、NaHCO3またはトリエチルアミンである請求項32に記載の方法。
【請求項1】
式(I)の化合物、または薬学的に許容できるその塩もしくは溶媒和物
【化1】

[式中、
各R1、R2、R3、およびR4は、Hおよび(C1〜C6)アルキルから独立して選択され、
Yは、O、S、およびNR6からなる群から選択され、
各R5およびR6は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR7R8)t(C3〜C10)シクロアルキル、−(CR7R8)t(C6〜C10)アリール、および−(CR7R8)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、
あるいは、Yが、NR6である場合、R5およびR6は、それらが結合している窒素原子と一緒になって、(4〜11)員ヘテロシクリルを形成していてもよく、(4〜11)員ヘテロシクリルは、1〜5個のR9基により置換されていてもよく、
各R7およびR8は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
Aは、アダマンチルであり、
nおよびmは、0、1、2、および3からなる群から独立して選択され、
kは、1または2であり、
jは、0、1、および2からなる群から選択され、
t、u、p、qおよびvは、各々、0、1、2、3、4および5からなる群から独立して選択され、
A、R1、R2、R3、R4、R5、R6、R7、およびR8の任意の炭素原子は、1〜5個のR9基により置換されていてもよく、
R5またはR6が(4〜11)員ヘテロシクリルであるR5またはR6の任意の窒素原子は、各々、1〜5個のR9基により置換されていてもよく、
各R9基は、ハロ、シアノ、ニトロ、−CF3、−CHF2、−CH2F、トリフルオロメトキシ、アジド、ヒドロキシ、(C1〜C6)アルコキシ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR10R11)t(C3〜C10)シクロアルキル、−(CR12R13)t(C6〜C10)アリール、−O−R12、(C=O)−R12、−(C=O)−O−R12、−O−(C=O)−R12、−O−(R12)−O−(R13)、−NR12(C=O)−R13、−(C=O)−NR12R13、−NR12R13、−NR12OR13、−S(O)kNR12R13、−S(O)j(C1〜C6)アルキル、−O−SO2−R14、−NR14−S(O)k−R15、−(CR14R15)v(C6〜C10)アリール、−(CR14R15)v(4〜11)員ヘテロシクリル、−(CR14R15)q(C=O)(CR14R15)v(C6〜C10)アリール、−(CR14R15)q(C=O)(CR14R15)v(4〜11)員ヘテロシクリル、−(CR14R15)vO(CR14R15)q(C6〜C10)アリール、−(CR14R15)vO(CR14R15)q(4〜11)員ヘテロシクリル、−(CR14R15)qS(O)j(CR14R15)v(C6〜C10)アリール、および−(CR14R15)qS(O)j(CR14R15)v(4〜11)員ヘテロシクリルからなる群から独立して選択され、
上記R9基の任意の(4〜11)員ヘテロシクリルの任意の1または2個の炭素原子は、オキソ(=O)で置換されていてもよく、
上記R9基の任意の(C1〜C6)アルキル、任意の(C6〜C10)アリールおよび任意の(4〜11)員ヘテロシクリルの任意の炭素原子は、ハロ、シアノ、ニトロ、−CF3、−CFH2、−CF2H、トリフルオロメトキシ、アジド、−OR16、−(C=O)−R16、−(C=O)−O−R16、−O−(C=O)−R16、−NR16(C=O)−R17、(C=O)−NR16R17、−NR16R17、−NR16OR17、−S(O)kNR12R13、−S(O)j(C1〜C6)アルキル、−O−SO2−R14、−NR14−S(O)k−R15、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、(CR17R18)u(C6〜C10)アリール、および(CR17R18)u(4〜11)員ヘテロシクリルから独立して選択される1〜5個の置換基で置換されていてもよく、
各R10、R11、R12、R13、R14、R15、R16、R17、およびR18基は、H、(C1〜C6)アルキル、−(CR19R20)t(C3〜C10)シクロアルキル、−(CR19R20)p(C6〜C10)アリール、および−(CR19R20)p(4〜11)員ヘテロシクリルからなる群から独立して選択され、
前記各R10、R11、R12、R13、R14、R15、R16、R17、およびR18基の(4〜11)員ヘテロシクリルの任意の1または2個の炭素原子は、オキソ(=O)で置換されていてもよく、
上記R10、R11、R12、R13、R14、R15、R16、R17、およびR18基の任意の(C1〜C6)アルキル、任意の(C6〜C10)アリールおよび任意の(4〜11)員ヘテロシクリルの任意の炭素原子は、ハロ、シアノ、ニトロ、−NR21R22、−CF3、−CHF2、−CH2F、トリフルオロメトキシ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、ヒドロキシ、および(C1〜C6)アルコキシからなる群から独立して選択される1〜5個の置換基で置換されていてもよく、
各R19、R20、R21、およびR22基は、Hおよび(C1〜C6)アルキルからなる群から独立して選択され、
ハロ、−SOもしくは−SO2基またはN、OもしくはS原子と結合していない−CH3(メチル)、−CH2(メチレン)、または−CH(メチン)基を含む上記置換基のいずれも、ヒドロキシ、ハロ、(C1〜C6)アルキル、(C1〜C6)アルコキシ、アミノ、−NH(C1〜C6)(アルキル)および−N(C1〜C6)(アルキル)(C1〜C6)アルキルからなる群から独立して選択される置換基を前記基上に有していてよい]。
【請求項2】
Yが、Oである請求項1に記載の化合物。
【請求項3】
Yが、NR6である請求項1に記載の化合物。
【請求項4】
R5およびR6が、それらが結合している窒素と一緒になって、(4〜11)員ヘテロシクリルを形成している請求項3に記載の化合物。
【請求項5】
(4〜11)員ヘテロシクリルが、ピロリジニル、インドリル、イソキノリニル、ピペラジニル、およびピペリジニルからなる群から選択される請求項4に記載の化合物。
【請求項6】
下式からなる群から選択される化合物、または薬学的に許容できるそれらの塩。
【化2−1】

【化2−2】

【化2−3】

【請求項7】
下式からなる群から選択される化合物、または薬学的に許容できるそれらの塩。
【化3−1】

【化3−2】

【請求項8】
有効量の請求項1に記載の化合物、または薬学的に許容できるその塩もしくは溶媒和物、および薬学的に許容できる担体を含む医薬組成物。
【請求項9】
11−β−hsd−1酵素の変調によって仲介される状態を治療する方法であって、有効量の請求項1に記載の化合物、または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【請求項10】
糖尿病、メタボリック症候群、インスリン抵抗症候群、肥満、緑内障、高脂血症、高血糖症、高インスリン血症、骨粗鬆症、結核、アテローム性動脈硬化症、認知症、うつ病、ウイルス疾患、炎症性障害、または肝臓が標的器官である疾患を治療する方法であって、有効量の請求項1に記載の化合物、または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【請求項11】
11−β−hsd−1酵素の変調によって仲介される状態を治療する方法であって、緑内障を治療するための治療剤と組み合わせて、有効量の請求項1に記載の化合物または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【請求項12】
請求項11に記載の状態を治療する方法であって、緑内障を治療するためのプロスタノイド受容体作用薬(前記作用薬は、ラタノプロストである)と組み合わせて、有効量の請求項1に記載の化合物または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【請求項13】
請求項11に記載の状態を治療する方法であって、緑内障を治療するための知られている治療剤(前記薬剤は、炭酸脱水酵素阻害剤である)と組み合わせて、有効量の請求項1に記載の化合物または薬学的に許容できるその塩もしくは溶媒和物を哺乳類に投与することを含む方法。
【請求項14】
請求項11に記載の状態を治療する方法であって、知られている治療剤(前記治療剤は、糖尿病を治療するためのPPAR作用薬である)と組み合わせて、有効量の請求項1に記載の化合物を哺乳類に投与することを含む方法。
【請求項15】
式(III)の化合物を調製する方法であって
【化4】

[式中、
R7およびR8は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、あるいは
R7およびR8は、それらが結合している窒素と一緒になって、縮合または非縮合であってもよい(4〜11)員複素環を形成していてもよく、
tは、0、1、2、3、4、および5からなる群から選択され、
各R9およびR10は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
Aは、非置換であるか、あるいはハロ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルである]、
式(II)の化合物を
【化5】

[式中、
Xは、脱離基であり、
Aは、上記のように定義されている]、
塩基の存在下、溶媒中で、アミンで処理して、式(III)の化合物を製造するステップ(a)と、式(Ia)の化合物を
【化6】

[式中、
Aは、上記のように定義されている]、
塩基の存在下、溶媒中で、ハロゲン化アシルで処理して、式(II)の化合物を製造するステップ(b)とを含む方法。
【請求項16】
ステップ(a)におけるXが、Cl、Br、およびメタンスルホネートからなる群から選択される請求項15に記載の方法。
【請求項17】
ステップ(a)におけるアミンが、R7R8NHである請求項15に記載の方法。
【請求項18】
ステップ(a)における塩基が、K2CO3、NaHCO3、および(C2H5)3Nからなる群から選択される請求項15に記載の方法。
【請求項19】
ステップ(a)が、約20℃から溶媒の沸点の温度範囲で進行する請求項15に記載の方法。
【請求項20】
ステップ(b)における溶媒が、CH2Cl2またはアセトニトリルである請求項15に記載の方法。
【請求項21】
ステップ(b)における塩基が、(C2H5)3NまたはNaHCO3である請求項15に記載の方法。
【請求項22】
ステップ(b)が、約−15℃から約50℃の温度範囲で進行する請求項15に記載の方法。
【請求項23】
式(IIa)の化合物を調製する方法であって
【化7】

[式中、
Aは、非置換であるか、あるいはハロ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、(CR9R10)t(C3〜C10)シクロアルキル、(CR9R10)t(C6〜C10)アリール、および(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルであり、
各R9およびR10は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
tは、0、1、2、3、4、および5からなる群から選択される]、
式(V)の化合物を
【化8】

[式中、
Aは、上記のように定義されている]、
ニートのSOCl2または溶媒中のSOCl2で処理して、式(IIa)の化合物を生成するステップ(c)と、
式(IV)の化合物を
【化9】

[式中、
Aは、上記のように定義されており、
PGは、保護基である]、
溶媒中、保護基除去剤で処理して、式(V)の化合物を生成するステップ(d)と、
式(Ia)の化合物を
【化10】

【化11】

[式中、
Aは、上記のように定義されている]、
酸とカップリングさせて、式(IV)の化合物を生成するステップ(e)とを含む方法。
【請求項24】
ステップ(c)における溶媒が、CCl4である請求項23に記載の方法。
【請求項25】
ステップ(c)が、20℃〜100℃の温度にて行われる請求項23に記載の方法。
【請求項26】
ステップ(d)におけるPGが、(C6〜C12)アリールである請求項23に記載の方法。
【請求項27】
アリールが、フェニルである請求項26に記載の方法。
【請求項28】
ステップ(d)における保護基除去剤が、(CH3)3Silである請求項23に記載の方法。
【請求項29】
ステップ(d)における溶媒が、CHCl3である請求項23に記載の方法。
【請求項30】
ステップ(d)が、20℃から溶媒の沸点の温度にて行われる請求項23に記載の方法。
【請求項31】
ステップ(e)における酸が、ベンジルオキシ酢酸である請求項23に記載の方法。
【請求項32】
式(III)の化合物を調製する方法であって
【化12】

[式中、
R7およびR8は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択されるか、あるいは
R7およびR8は、それらが結合している窒素と一緒になって、縮合または非縮合であってもよい(4〜11)員複素環を形成していてもよく、
各R9およびR10は、H、(C1〜C6)アルキル、(C2〜C6)アルケニル、および(C2〜C6)アルキニルからなる群から独立して選択され、
Aは、非置換であるか、あるいはハロ、(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、−(CR9R10)t(C3〜C10)シクロアルキル、−(CR9R10)t(C6〜C10)アリール、および−(CR9R10)t(4〜11)員ヘテロシクリルからなる群から独立して選択される1〜5個の置換基で置換されているアダマンチルであり、
tは、0、1、2、3、4、および5からなる群から選択される]、
式(Ia)の化合物を、
【化13】

式(VI)の化合物で
【化14】

[式中、
R3は、(C1〜C6)アルキルであり、
R7およびR8は、上記で定義されている]、
適当な溶媒中、試薬の存在下で処理して、式(III)の化合物を生成するステップ(f)と、
式(VII)の化合物を
【化15】

[式中、
R3は、上記で定義されており、
Xが、脱離基である]、
塩基の存在下で適当な溶媒中、アミンで処理して、式(VI)の化合物を生成するステップ(g)とを含む方法。
【請求項33】
ステップ(f)R3が、メチルまたはエチルである請求項32に記載の方法。
【請求項34】
ステップ(f)におけるXが、Cl、Brおよびメタンスルホネートからなる群から選択される請求項32に記載の方法。
【請求項35】
ステップ(f)が、試薬Al(CH3)2Clを用いて行われる請求項32に記載の方法。
【請求項36】
ステップ(f)が、溶媒CH2Cl2を用いて行われる請求項32に記載の方法。
【請求項37】
ステップ(f)が、0℃から約20℃の温度にて行われる請求項32に記載の方法。
【請求項38】
ステップ(g)におけるアミンが、R7R8NHである請求項32に記載の方法。
【請求項39】
ステップ(g)における溶媒が、CH2Cl2またはDMFである請求項32に記載の方法。
【請求項40】
ステップ(g)における塩基が、NaHCO3またはトリエチルアミンである請求項32に記載の方法。
【公表番号】特表2008−518903(P2008−518903A)
【公表日】平成20年6月5日(2008.6.5)
【国際特許分類】
【出願番号】特願2007−538540(P2007−538540)
【出願日】平成17年10月20日(2005.10.20)
【国際出願番号】PCT/IB2005/003311
【国際公開番号】WO2006/048750
【国際公開日】平成18年5月11日(2006.5.11)
【出願人】(593141953)ファイザー・インク (302)
【Fターム(参考)】
【公表日】平成20年6月5日(2008.6.5)
【国際特許分類】
【出願日】平成17年10月20日(2005.10.20)
【国際出願番号】PCT/IB2005/003311
【国際公開番号】WO2006/048750
【国際公開日】平成18年5月11日(2006.5.11)
【出願人】(593141953)ファイザー・インク (302)
【Fターム(参考)】
[ Back to top ]

