羊水由来細胞
【課題】現在の臨床的要請に応えるために、最終的な内胚葉、あるいは膵臓ホルモン産生細胞の個体群、あるいは消化管ホルモン産生細胞、あるいはβ細胞系列への分化能を維持しながら増殖できる羊水由来細胞およびその採取方法を提供する。
【解決手段】この発明は、β細胞系列に分化可能な羊水由来細胞の増殖可能な個体群に関するものである。また、この発明は、上記羊水由来細胞を分離し、かつ増殖する方法、並びに糖尿病治療に上記羊水由来細胞を利用するための方法および上記羊水由来細胞を利用した組成物に関するものである。
【解決手段】この発明は、β細胞系列に分化可能な羊水由来細胞の増殖可能な個体群に関するものである。また、この発明は、上記羊水由来細胞を分離し、かつ増殖する方法、並びに糖尿病治療に上記羊水由来細胞を利用するための方法および上記羊水由来細胞を利用した組成物に関するものである。
【発明の詳細な説明】
【開示の内容】
【0001】
〔関連出願〕
この出願は、米国出願データ:2005年5月27日付けの仮出願No60/685,607号および2006年3月27日付けの仮出願No60/743,821号に関連するものである。
【0002】
〔発明の分野〕
この発明は、β細胞系列に分化することができ、個体群が増殖可能な羊水由来細胞に関するものである。また、この発明は、上記羊水由来細胞を分離し、かつ増殖させるための方法ばかりでなく、糖尿病治療において、上記羊水由来細胞を利用する方法および上記羊水由来細胞を利用した組成物を提供するものである。
【0003】
〔発明の背景〕
器官機能の低下は、先天的な欠陥、外傷、あるいは疾患に起因することがある。器官機能の低下を引き起こす疾患の一例は、真性糖尿病、すなわち糖尿病である。ほとんどの糖尿病の場合は、2つの臨床型に分類される。1型は、若年型糖尿病またはインスリン依存性真性糖尿病(IDDM)としても知られており、2型は成人発症性糖尿病としても知られている。各型は、予後、治療および発症原因が異なっている。両型は、患者の血糖値の調節不能によって特徴付けられる。その結果、糖分が細胞に入ることができず、代謝要求量を満たすことができないので、血糖値は高い値に上昇する。血糖を適切に代謝することができないということは、最初に、例えば高血糖症、過度の空腹感、口渇感、多尿症および糖尿がみられ、その後に、ニューロパシー、巨大血管疾患および微小血管疾患へ段階的に拡大してゆく、初期症状および末期症状が複合化した一連の総体的症状を引き起こすことを示すものである。
【0004】
1型糖尿病の一般的な治療方法には、典型的には、注射器あるいはポンプのいずれかで注入することによる外因性インスリン投与が含まれる。この方法は、血糖値を完全に正常化せず、しばしば低血糖症の発症リスク増加に関連している。低血糖症のリスクが増加する場合は、より有効な血糖調節を実現することができる。仮に膵臓の機能が臓器移植あるいは細胞(移植)治療によって回復あるいは活性化できる場合には、より有効な血糖調節を実現することができる。
【0005】
現在、糖尿病を治療するために用いられる多くの臓器移植治療が存在する。このような治療方法の1つには、分離した膵島を糖尿病患者へ移植する方法がある。ヒト膵島移植を行う上で、越えるべき大きなハードルの1つは、多くの糖尿病患者を治療するのに十分な数の膵島がないことである。膵島の不足に対する1つの実現可能な解決策は、交代細胞源からの膵島の生成である。
【0006】
成人体組織由来の前駆細胞が膵臓β細胞フェノタイプに分化することができるとの記録がある。例えば、国際出願WO2004/087885A2、ヘス(Hess)らによる文献(ネイチャーバイオテクノロジー2003年、第21巻第763頁〜第770頁)およびイアナス(Ianus)らによる文献(「臨床研究誌(J. Clin. Invest.)」2003年、第111巻第843頁〜第850頁)を参照されたい。これらの文献は、試験管内で、膵臓β細胞の特性を有する細胞に分化するか、あるいは生体内で機能低下した膵臓を再生するのに役立つ栄養因子を分泌する成人骨髄細胞由来の細胞の能力を報告している。
【0007】
膵臓細胞に分化できる他の前駆細胞源の中には、げっ歯類肝臓由来の楕円形幹細胞(国際出願WO03/033697)および分娩後胎盤(米国出願公開2004/0161419A1)が含まれる。
【0008】
β細胞を含む膵島の内分泌細胞は、アポトーシスおよび新しい膵島細胞(新生)の増殖の過程によって、常に入れ替わっている。そういうものであるから、膵臓は、膵臓ホルモン産生細胞に分化できる前駆細胞源であると考えられる。膵臓から分離され、かつ膵臓前駆細胞の潜在的な供給源として、形態学的に明瞭な3つの組織型である、膵島濃縮画分、脈管濃縮画分および腺房細胞濃縮画分が存在している。
【0009】
膵臓組織粗抽出物からの前駆細胞あるいは部分的に分化した細胞の分離は、細胞表面マーカーに対して生成された抗体を用いて実現可能である。例えば、米国出願公開2004/0241761は、ErbB2、ErbB3、ErbB4、Msx−2、PDX−1を発現したマウス細胞およびインスリンの分離を開示している。
【0010】
ゲルシェンゴーン(Gershengorn)らによる文献(サイエンス2004年、第306巻第2261頁〜第2264頁)は、膵島様の細胞凝集体を構成できた増殖細胞の生成方法を教示している。これらの増殖細胞は、分離されたヒト膵島の試験管内培養液から出現した粘着細胞の不均質な個体群に由来したものである。分離された膵島は、当初、組織培養プレート上に植えられ、10%血清を含有する培地内で培養されている。線維芽細胞様の細胞については、培養された膵島から出て移動し、かつ単一膜を形成する点が観察された。これらの細胞は、ネスチン(Nestin)、平滑筋アクチンおよびビメンチンを発現させるものである。
【0011】
また、膵臓前駆細胞は、シーバーグ(Seaberg)らによる文献(ネイチャーバイオテクノロジー2004年、第22巻第1115頁〜第1124頁)によって開示されているように、単一細胞に切り離された膵島および脈管組織の培養液から生成してもよい。シーバーグ(Seaberg)らによって開示されたマウス前駆細胞は、増殖中にネスチン(Nestin)を発現させるものである。
【0012】
米国出願公開2003/0082155は、幹細胞の機能および分子特性を有するヒト膵臓の膵島由来の細胞個体群を分離し、かつ同定する方法を開示している。特に、これらの分離細胞は、ネスチン(Nestin)染色陽性、ネスチン(Nestin)形質発現性、GLP−1R染色陽性、GLP−1R形質発現性、ABCG2染色陽性、ABCG2形質発現性、Oct3/4染色陽性、Oct3/4形質発現性、ラトロフィリン(latrophilin)(2型)染色陽性、ラトロフィリン(latrophilin)(2型)形質発現性、Hes−1染色陽性、Hes−1形質発現性、インテグリンサブユニットα6およびβ1染色陽性、インテグリンサブユニットα6およびβ1形質発現性、c−kit染色陽性、c−kit形質発現性、MDR−1染色陽性、MDR−1形質発現性、SST−R,2,3,4染色陽性、SST−R,2,3,4形質発現性、SUR−1染色陽性、SUR−1形質発現性、Kir6.2染色陽性、Kir6.2形質発現性、CD34染色陰性、CD45染色陰性、CD133染色陰性、MHCクラスI染色陰性、MHCクラスII染色陰性、サイトケラチン−19染色陰性、培養液中での長期増殖、培養液中での擬似膵島への分化能によって特徴付けされている。
【0013】
米国特許第5,834,308号、米国特許第6,001,647号および米国特許第6,703,017号に開示されているように、他の取り組みでは、NODマウス由来の膵島培養液の粗サンプルは、1年以上にわたって、増殖培養液中で保持され、かつインスリンを分泌できる膵島様の個体群に分化する能力を実証するように見える上皮様の培養物を作り出すのに使用可能である。
【0014】
膵島様の構造体は、ボナー・ワイア(Bonner−Weir)らによる文献(「自然科学アカデミー会報(Proc Nat Acad Sci)」2000年、第97巻第7999頁〜第8004頁)および米国特許第6,815,203B1に開示されているように、脈管組織を濃縮したヒト膵臓消化物画分から生成されてもよい。これらの文献に開示された膵島様の塊は、サイトケラチン−19染色が陽性となり、インスリンとの免疫活性を示している。
【0015】
国際出願2004/011621は、ヒト膵臓の脈管画分からインスリン陰性粘着細胞を生成する方法を開示している。
【0016】
国際出願03/102134は、ヒト膵臓消化物の腺房画分からサイトケラチン−19陽性の上皮細胞を生成する方法を開示している。この生成された上皮細胞は、誘導培地の存在下で、限定的に増殖し、かつインスリン産生細胞に分化することができる。
【0017】
米国出願公開2004/015805A1は、ヒト膵臓幹細胞サブセットが細胞表面マーカーCD56(NCAMとしても知られている)へのリガンドを用いて分離可能であると報告している。これらの細胞は、インスリン産生細胞およびインスリン産生凝集体に分化することができる。
【0018】
胎仔組織あるいは胚組織由来の前駆細胞が膵臓ホルモン産生細胞に分化する可能性があることが記録されている。例えば、ヒト胎仔あるいは胚由来の細胞がβ細胞系列に分化する可能性を報告する米国特許第6,436,704号、国際出願03/062405、国際出願WO02/092756および欧州特許出願0363125A2を参照されたい。
【0019】
ヒト胚性幹細胞(hES)は、受精卵の胚発達初期において胚盤胞の内細胞塊に由来するものである。胚盤胞は、胚が子宮壁内に着床する前の段階、胚の着床前期である。トンプソン(Thompson)およびその同僚によって記述された条件(トンプソン(Thompson)らによる文献(「自然科学アカデミー会報」1995年、第92巻第7844頁〜第7848頁);トンプソン(Thompson)らによる文献(「サイエンス」1998年、第282巻第1145頁〜第1147頁);マーシャル(Marshall)らによる文献(「分子生物学体系(Methods Mol. Biol.)」2001年、第158巻第11頁〜第18頁))に従って、不活性化された支持細胞層上で培養された場合には、胚盤胞の細胞内層は、試験管内で、未分化状態で無限に増殖可能である。正常に増殖したヒト胚性幹細胞(hES)は、多能性すなわち三胚葉である外胚葉(Ec)、中胚葉(Me)および内胚葉(En)に分化する能力を維持しながら、倍加する無限の可能性を有している。多能性のヒト胚性幹細胞(hES)として増殖した場合には、その細胞は倍数性の核型を維持し、老化現象に陥らない。
【0020】
ヒト胚性幹細胞(hES)は、特異的な転写因子OCT−4、NANOG、SOX−2、FGF−4およびREX−1を発現させることに加えて、細胞表面抗原の別の群であるSSEA−3、SSEA−4、TRA−2−54(アルカリ性脱リン酸酵素)、TRA−1−60およびTRA−1−81を呈するものである(ヘンダーソン(Henderson)らによる文献(幹細胞(Stem Cells)2002年、第20巻第329頁〜第337頁)、ドレーパー(Draper)らによる文献(「解剖学会誌(J. Anat.)」2002年、第200巻第249頁〜第258頁)、ミツイ(Mitsui)らによる文献(「細胞(Cell)」2003年、第113巻第631頁〜第642頁)、チェンバース(Chambers)らによる文献(「細胞」2003年、第113巻第643頁〜第655頁))。
【0021】
しかしながら、上記文献から、ヒト胚細胞が、多能性を拡大し維持するための支持細胞層、あるいは、例えばマトリゲル(MATRIGEL:登録商標)等の複合細胞外基質に調整培地を加えた組み合わせを、しばしば必要とする点について留意することは重要である。しかし、これらの条件は、細胞数を容易に拡大すること、および糖尿病を治療するための決定的な細胞(移植)治療を可能にするものではない。
【0022】
研究者は、非胚性の幹細胞(“成人幹細胞”)が、胚性幹細胞のように多くの異なる組織型に分化することができないことから、胚性幹細胞がまだ成人幹細胞の使用に比べて優位に立っていることを見出している。しかしながら、細胞が“胚盤胞”期における胚に由来していることは、胚性幹細胞の分離を妨げる壁の1つである。ヒト胚性幹細胞の研究は、感情的に告発された政治的および倫理的な議論によって妨げられており、成果を上げるのに、おそらく何年もかかりそうである。
【0023】
さらに、ヒト胚性幹細胞(hES)は、免疫疾患を有する動物、すなわち分娩後の状況で、組織中に注入された場合には、腫瘍化するのに対して、成人幹細胞では腫瘍化しないことが見出された。ヒト胚性幹細胞(hES)の腫瘍化の性状については、頻繁に取り扱われることはないが、この組織は、将来、細胞置換治療に使用される重責を担う可能性がある。ヒト胚性幹細胞(hES)およびこれらの腫瘍化特性を巡る政治的、道徳的および倫理的な論争ばかりでなく、遺伝的に正常なゲノムを維持しながら、培養液中で未分化の成人幹細胞を増殖させる場合に認識された困難性は、ヒト細胞置換治療の開発にとって大きな障壁である。
【0024】
多能性すなわち組織幹細胞は、絨毛膜絨毛および羊水から分離されている。多くの羊膜細胞および胎盤細胞は、共通の起源、すなわち胚自体、卵黄嚢、絨毛膜絨毛の間葉細胞核、絨毛膜および羊膜の元となる柔実胚の内細胞塊を共有している(クレン(Crane)およびチュン(Cheung)による文献(「分娩前診断(Prenatal Diagnosis)」1988年、第8巻第119頁〜第129頁))。三胚葉のすべてに由来する胚細胞および胎児細胞は、長期間、羊水中で確認されている(ミルンスキー(Milunsky)による文献(米国ニューヨーク州のプレナム出版社(Plenum Press)1979年発行、第75頁〜第84頁の「胎仔の遺伝的疾患(Genetic Disorder of the Fetus)」)、ホーン(Hoehn)およびサルク(Salk)による文献(「細胞生物学(Methods in Cell Biology)」1982年、第26巻第11頁〜第34頁)、ゴスデン(Gosden)による文献(「英国医学報告(British Medical Bulletin)」1983年、第39巻第348頁〜第354頁)、プルサ(Prusa)らによる文献(「ヒト再生(Human Reproduction)」2003年、第18巻第1489頁〜第1493頁))。したがって、羊水は、胚性様および胎仔様の幹細胞に、最小限侵襲的に到達する機会を与えるものである。
【0025】
羊水由来細胞は、胎仔の染色体疾患を検出するのに日常的に用いられている。羊水は、典型的には、第2妊娠3半期(妊娠期間の16週目〜22週目)中にサンプルが採取される。先行技術では、特異的な形態学的細胞:“線維芽細胞性(F)”細胞、“羊水(AF)”由来細胞および“上皮性(E)”細胞を有する3つの部分個体群の存在を明らかに実証している。“線維芽細胞性(F)”細胞および“羊水(AF)”由来細胞は急速に増殖するのに対して、“上皮性(E)”細胞は非常に遅い増殖曲線を示し、低いクローン効率を有している。
【0026】
例えば、特許協力条約(PCT)による国際出願WO2003/042405は、絨毛膜絨毛、羊水および胎盤からのc−Kit染色陽性幹細胞の分離を開示している(細胞1、表1参照)。
【0027】
他の例では、米国出願公開2005/0054093は、羊水からの幹細胞の分離を開示している。これらの幹細胞は、発生段階特異性胚抗原―3(SSEA−3)、発生段階特異性胚抗原―4(SSEA−4)、TRA1−60、TRA1−81、TRA 2−54、Oct−4、HLAクラスI、CD13、CD44、CD49bおよびCD105(細胞2、表1参照)を発現させるものである。
【0028】
他の例では、胎仔細胞は、羊水から分離されている(アンカー(Anker)らによる文献(「血液(Blood)」2003年、第102巻第1548頁〜第1549頁))。この文献に開示された細胞は、次のマーカー:CD44、CD73、CD90、CD105、CD106、およびHLA−A,B&Cの形質発現性に関して陽性である。これらの細胞は、次のマーカー:c−Kit(CD117)、CD11、CD31、CD34、CD45およびHLA−Dの形質発現性に関して陰性である(細胞3、表1参照)。
【0029】
また、羊水から分離された間葉幹細胞の個体群は、ツアイ(Tsai)らによる文献(「ヒト再生(Human Reproduction)」2004年、第19巻第1450頁〜第1456頁)に報告されている。この文献に開示された細胞は、次のマーカー:CD29、CD44、CD73、CD90およびHLA−A,B&Cの形質発現性に関して陽性である。また、これらの細胞は、胚性転写因子OCT−4の形質発現性に関して陽性である。上記細胞は、次のマーカー:c−Kit(CD117)、CD34およびHLA−Dの形質発現性に関して陰性である(細胞4、表1参照)。
【0030】
近年の刊行物および特許文献は、線維芽細胞性の羊水あるいは上皮部分個体群内に、ヒト胚細胞のいくつかの特性として、表面マーカーSSEA−3およびSSEA−4の形質発現性、転写因子OCT−4の形質発現性、高い増殖能、および多数の細胞型への分化能などを呈する細胞個体群が存在することを示唆しているが、ESマーカーSSEA−4の形質発現性を維持しながら、初期段階の内胚葉性マーカーの重要な形質発現性として、HNF−1β、HNF−3β、SOX−17およびGATA−6などを呈する細胞の部分個体群の存在を示す先行文献はない。
【0031】
HNF−1β、HNF−3β(FOXa2としても知られている)、SOX−17およびGATA−6に共通する形質発現性は、原腸形成中に、内胚葉の決定的な形成方法を規定する重要なステップとしてみなされている。したがって、上記マーカーの形質発現性は、羊水由来細胞から、膵臓β細胞の個体群、あるいは膵臓ホルモン産生細胞の個体群、あるいは消化管ホルモン産生細胞を生成する上で、重要となる可能性がある。
【0032】
したがって、現在の臨床的要請に応えるために、最終的な内胚葉、あるいは膵臓ホルモン産生細胞の個体群、あるいは消化管ホルモン産生細胞、あるいはβ細胞系列への分化能を維持しながら増殖できる羊水由来細胞系列を樹立するための培養条件を開発するという重要な要請が解決されなければならない。
【0033】
〔発明の概要〕
1つの実施の形態では、この発明は、哺乳類の羊水由来細胞を分離する方法を提供するものである。この発明によれば、羊水由来細胞は、妊娠期間の約14週目〜約23週目までの羊水サンプルから採取される。これに代えて、羊水由来細胞は、妊娠期間の約23週目〜約40週目までの羊水サンプルから採取される。
【0034】
1つの実施の形態では、培養液は、低酸素条件(酸素濃度:3%)下で、少なくとも5日間〜10日間、静かに放置される。これに代えて、培養液は、正常酸素条件(酸素濃度:約20%)下で、少なくとも5日間〜10日間、静かに放置される。
【0035】
他の実施の形態では、羊水由来細胞は、妊娠期間の第2妊娠3半期中の羊水サンプルから採取される。これに代えて、羊水由来細胞は、妊娠期間の第3妊娠3半期中の羊水サンプルから採取される。
【0036】
1つの実施の形態では、培養された羊水由来細胞は、単一細胞として分離され、クローン増殖される。
【0037】
この発明による方法に従って分離された羊水由来細胞は、例えば、羊水由来細胞によって発現する蛋白質マーカーを特異的に認識し、羊水由来細胞を同定し、かつ選択し、これにより実質的に精製された羊水由来細胞の個体群を得ることができる試薬(抗体等)と接触させてもよい。ここで、認識された蛋白質マーカーは少なくとも50%の細胞個体群中で発現する。
【0038】
1つの実施の形態では、結果として得られた羊水由来細胞の個体群は、次のマーカー:HNF−1β、HNF−3β、SOX−17あるいはGATA−6のうち、少なくとも1つのマーカーに関して実質的に陽性である。羊水由来細胞の個体群は、次のマーカー:CD117、Oct−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である。この羊水由来細胞の個体群は、HNF−1β、HNF−3β、SOX−17あるいはGATA−6を発現させる能力を喪失することなく、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0039】
1つの実施の形態では、羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、HNF−1β、HNF−3β、SOX−17あるいはGATA−6を発現させる能力を喪失することなく、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0040】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞の個体群は、次のマーカー:SOX−17、CD117、OCT−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である。羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、50回を超える回数の自己複製を繰り返して増殖することができる。
【0041】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞の個体群は、サイトケラチンと、次のマーカー:SOX−17、CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーとに関して実質的に陰性である。羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0042】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞の個体群は、SOX−17に関して実質的に陰性である。羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0043】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞の個体群は、次のマーカー:サイトケラチンと、SOX−17とに関して実質的に陰性である。羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0044】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞の個体群は、SOX−17に関して実質的に陰性である。さらに、羊水由来細胞の個体群は、次のマーカー:CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である。羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0045】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞の個体群は、次のマーカー:サイトケラチンおよびSOX−17に関して実質的に陰性である。さらに、羊水由来細胞の個体群は、次のマーカー:CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である。羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0046】
他の実施の形態では、この発明は、次のマーカー:CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である、分離精製された羊水由来細胞の個体群を提供するものである。
【0047】
他の実施の形態では、この発明は、次のマーカー:SOX−17、CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である、分離精製された羊水由来細胞の個体群を提供するものである。
【0048】
他の実施の形態では、この発明は、SOX−17に関して実質的に陰性である、分離精製された羊水由来細胞の個体群を提供するものである。
【0049】
他の実施の形態では、この発明は、SOX−17に関して実質的に陰性であり、かつ次のマーカー:CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である、分離精製された羊水由来細胞の個体群を提供するものである。
【0050】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞は、Musashi−1およびHes−1のうち、少なくとも1つを発現させてもよい。
【0051】
この発明によって分離され、かつ増殖された羊水由来細胞を、適切な試験管内あるいは生体内で、誘導してβ細胞系列の細胞に分化することができる。したがって、この発明によって選択され、かつ増殖された羊水由来細胞並びに羊水由来細胞に由来する分化細胞は、1型および2型の糖尿病を治療するのに有用である。
【0052】
この発明によって分離され、かつ増殖された羊水由来細胞を、適切な試験管内あるいは生体内で、消化管ホルモン産生細胞に誘導することができる。1つの実施の形態では、この発明によって分離され、かつ増殖された羊水由来細胞は、適切な試験管内あるいは生体内で、消化管ホルモン産生細胞に誘導することができると共に、糖反応法でインスリンを発現させてもよい。
【0053】
〔発明の詳細な説明〕
開示内容を明確にするため、およびこの発明を限定しないものとして、この発明の詳細な記述は、この発明の一定の特徴、実施の形態あるいは用途を記述するか、あるいは図示する次のサブセクションに分けられている。
【0054】
この発明は、高い増殖能を有し、かつ胚様の特性を呈する羊水由来細胞の個体群を分離するための方法に関するものである。同様の細胞は、絨毛膜絨毛内にも存在する可能性がある。この明細書に開示された発明の実施の形態の一部では、羊水由来細胞の、形態学的に明瞭な3つの個体群: “線維芽細胞性(F)”細胞、“上皮性(E)”細胞および“羊水(AF)”由来細胞を記述している。
【0055】
〔定義〕
“β細胞系列”とは、転写因子PDX−1と、次の転写因子:NGN−3、Nkx2.2、Nkx6.1、ニューロD、Isl−1、HNF−3β、MAFA、Pax4およびPax6のうち、少なくとも1つの転写因子とに対する形質発現が陽性である細胞を意味する。この技術分野における当業者にとっては、上記β細胞系列の細胞特性は、周知であり、上記β細胞系列の他の特性の確認を続行する。上記転写因子は、内分泌細胞の同定に関する従来技術において十分に確立されている(「ネイチャー遺伝学概要(Nature Reviews Genetics)」2002年、第3巻第524頁〜第632頁)。
【0056】
“膵島様の構造体”とは、この発明の方法を実施することによって導き出され、膵島の外観を有する細胞の三次元塊を意味する。膵島様の構造体内の細胞は、少なくとも上記PDX−1遺伝子と、グルカゴン、ソマトスタチンあるいはインスリンから選択された1つのホルモンとを発現させるものである。
【0057】
用語“低酸素性”とは、20%を下回る酸素濃度を意味し、好ましくは10%を下回る酸素濃度を意味し、より好ましくは5%を下回るが、1%を上回る酸素濃度を意味する。
【0058】
用語“正常酸素性”とは、約20%の大気酸素濃度を意味する。
【0059】
用語“実質的に陽性”とは、ある特定のマーカー(膜受容体、細胞質蛋白質または核蛋白質あるいは転写因子等)の形質発現性に関して細胞の個体群に関連して使用された場合に、上記マーカーが、細胞個体群の総数の少なくとも約50%、あるいは少なくとも約60%、あるいは少なくとも約70%に存在する、あるいは発現することを意味する。
【0060】
用語“実質的に陰性”とは、ある特定のマーカー(膜受容体、細胞質蛋白質または核蛋白質あるいは転写因子等)の形質発現性に関して細胞の個体群に関連して使用された場合に、上記マーカーが、細胞個体群の総数の少なくとも約70%、あるいは少なくとも約80%、あるいは少なくとも約90%に存在しない、あるいは発現しないことを意味する。
【0061】
この明細書で用いられている“幹細胞”とは、生体内あるいは生体外のいずれにおいても高度に増殖することができ、かつ他の細胞型に分化することができる未分化細胞を意味する。
【0062】
“前駆細胞”とは、分化によって幹細胞から導き出され、かつより成熟細胞型にさらに分化することができる細胞を意味する。前駆細胞は、典型的には、幹細胞と比較して、より制限的な増殖能を有している。
【0063】
“増殖可能な個体群”とは、細胞培養系内で少なくとも50回またはそれ以上の細胞分裂を経て、増殖される分離細胞の個体群の能力を意味する。
【0064】
“未分化細胞”とは、羊水から分離された細胞に関連して使用された場合に、PDX−1またはインスリンの形質発現性に関して実質的に陰性である羊水由来細胞の個体群を意味する。
【0065】
“分化細胞”とは、羊水から分離された細胞に関連して使用された場合に、PDX−1またはインスリンの形質発現性に関して実質的に陽性である羊水由来細胞の個体群を意味する。
【0066】
この明細書で用いられている“マーカー”は、対象細胞内で分化的に発現する核酸あるいはポリペプチド分子である。この文脈において、分化的な発現とは、陽性マーカーに関してはマーカー濃度の増加を意味し、陰性マーカーに関してはマーカー濃度の低下を意味する。マーカーとしての核酸あるいはポリペプチドの検出可能レベルは、対象外の細胞と比較して、対象細胞内で、十分に高いか、あるいは低いものであり、これにより、この技術分野において公知である種々の方法のすべてを用いて、対象細胞が同定され、かつ他の細胞との間で、識別可能である。
【0067】
“c−Kit”および“CD117”とは、共に、遺伝子保存機関(GenBank)寄託番号X06182に開示された配列を有するか、あるいは自然に出現する変異型配列を有する細胞表面受容体としてのチロシンキナーゼを意味する。
【0068】
また、“CD9”とは、“運動性関連蛋白質−1(MRP−1)”を意味し、細胞接着、運動性、増殖能および分化能に関係した膜貫通糖蛋白質である。
【0069】
また、“CD10”とは、“急性リンパ性白血病の共通抗原(CALLA)”を意味する。CD10は、中性の金属結合型蛋白質分解酵素活性(metalloendopeptidase)を有する細胞表面酵素であり、リンパ芽球性リンパ腫、バーキット型リンパ腫、および小胞性胚中心リンパ腫内で、および慢性骨髄性白血病患者内で発現する。また、CD10は、平均的な初期リンパ様前駆細胞、成人骨髄内の未成熟B細胞およびリンパ系組織内の胚中心B細胞表面上で発現する。また、CD10は、胸部筋上皮細胞、毛細胆管、線維芽細胞、腎臓の刷子縁および消化管上皮細胞上に存在している。
【0070】
また、“CD44”とは、“ヘルメス抗原”を意味し、ヒアルロナン用の主要な細胞表面受容体である。このCD44は、主に、肝細胞、上皮細胞の一部および心筋等の組織/細胞を除き、ほとんどの細胞型で発現する。
【0071】
また、“CD49f”とは、“a6インテグリン”および“VLA−6”を意味し、ラミニンを結合するインテグリンサブユニットβ1に関係している。CD49fは、主に、上皮細胞、栄養芽細胞、血小板および単核白血球上で、発現する。
【0072】
また、“CD73”とは、“外側−5´−ヌクレオチダーゼ”を意味し、CD73は、主に、B細胞およびT細胞のサブセット、骨髄間質細胞、種々の上皮細胞、線維芽細胞および内皮細胞上で、発現する。
【0073】
また、“CD90”とは、“Thy−1”を意味し、CD90は、主に、造血幹細胞、結合組織細胞および種々の線維芽細胞および間質細胞上で、発現する。
【0074】
“SSEA−1”(発生段階特異性胚抗原―1)は、マウス奇形幹細胞(EC)、マウスおよびヒトの胚芽細胞(EG)およびマウス胚性幹細胞(ES)の表面上に存在する糖脂質表面抗原である。
【0075】
“SSEA−3”(発生段階特異性胚抗原―3)は、ヒト奇形幹細胞(EC)、ヒト胚芽細胞(EG)およびヒト胚性幹細胞(ES)の表面上に存在する糖脂質表面抗原である。
【0076】
“SSEA−4”(発生段階特異性胚抗原―4)は、ヒト奇形幹細胞(EC)、ヒト胚芽細胞(EG)およびヒト胚性幹細胞(ES)の表面上に存在する糖脂質表面抗原である。
【0077】
“TRA1−60”は、ヒト奇形幹細胞(EC)、ヒト胚芽細胞(EG)およびヒト胚性幹細胞(ES)の表面上で発現するケラチン硫酸塩関連抗原である。
【0078】
“TRA1−81”は、ヒト奇形幹細胞(EC)、ヒト胚芽細胞(EG)およびヒト胚性幹細胞(ES)の表面上で発現するケラチン硫酸塩関連抗原である。
【0079】
“TRA2−49”は、ヒト奇形幹細胞(EC)およびヒト胚性幹細胞(ES)の表面上で発現するアルカリ性脱リン酸酵素のアイソザイムである。
【0080】
“Oct−4”は、POUドメイン転写因子の要素であり、多能性の幹細胞の証しとして広く見なされている。OCT−4と多能性の幹細胞との関係は、未分化状態の多能性の幹細胞への厳しく制限された形質発現によって示されている。体細胞系列への分化時に、OCT−4の形質発現は、急速に消滅する。
【0081】
また、“EPCAM”とは、上皮起源細胞および上皮由来腫瘍細胞上で広く発現する“上皮細胞粘着分子”を意味する。
【0082】
“Rex−1”は、発達段階で調節された酸性ジンクフィンガー遺伝子(Zfp−42)である。Rex−1のメッセージレベルは、胚性幹細胞内で高く、分化への誘導時に低下する。幹細胞に特異的なメッセージについて予想されるように、Rex−1 mRNA(伝令リボ核酸)は、胞胚の内細胞塊(ICM)、胞胚の栄養芽細胞の極内に存在し、後に、卵筒(栄養芽細胞由来組織)の栄養膜錐状体および胚体外外胚葉内に存在するが、その発生量は、上記内細胞塊(ICM)からの直接的な系統である胚の外胚葉内で非常に減少する。
【0083】
“HNF−1α”、“HNF−1β”および“HNF−3β”は、転写因子の肝核因子ファミリーに属しており、上記ファミリーは、高度に保護されたDNA(デオキシリボ核酸)結合ドメインおよび2つの短いカルボキシル末端ドメインによって特徴付けされる。
【0084】
“GATA−4”および“GATA−6”は、GATA転写因子ファミリーの要素である。この転写因子ファミリーは、TGFβシグナルによって誘導されるものであり、初期段階の内胚葉マーカー、Sox17αおよびHNF−1βと、初期段階以降のマーカーHNF−3βの維持に寄与するものである。
【0085】
“SOX−17”は、胚形成中における内胚葉の形成に関係する転写因子である。
【0086】
“細胞培養用基本合成培地”とは、細胞培養のための無血清合成培地あるいは血清を化学的に含有させた合成培地を意味する。このような培地には、ダルベッコ調製イーグル培地(Dulbecco's Modified Eagle's Medium)(DMEM)、α調製最小必須培地(αMMEM)、基本必須培地(BME)、CMRL−1066培地、RPMI1640培地、M199培地、ハムF10栄養培地(Ham's F10 nutrient medium)、ノックアウト(KNOCKOUT:商標)ダルベッコ調製イーグル培地(DMEM)、ダルベッコ改良型調製イーグル培地、MCDB−151、MCDB−153、MCDB−201およびMCDB−302(米国ミズーリ州のシグマ社製)等のMCDB系培地、およびダルベッコ調製イーグル培地(DMEM)/F12培地が含まれるが、これらに限定されるものではない。上記培地および上記以外の有用な培地は、例えば、米国ニューヨーク州グランドアイランドのギブコ社(GIBCO)から入手可能である。多くの培地は、アカデミック出版社により発行され、ウイリアム・ビー・ジャコビー(William B.Jakoby)およびアイラ・エイチ・パスタン(Ira H.Pastan)共編の “細胞培養(Cell Culture)”第LVII巻第62頁〜第72頁の「酵素学の方法編(Methods in Enzymology)」において評価されている。
【0087】
“ヘアリー/エンハンサ分割因子−1(hairy/enhancer of split-1)”としても知られている“Hes−1”は、細胞死の決定に影響を及ぼす可能性がある転写因子である。
【0088】
“Musashi−1”は、種を越えて高度に保護されたリボ核酸(RNA)結合蛋白質のサブファミリーの要素である。Musashi−1の形質発現は、発達している中央神経系内の増殖性細胞中に高濃度に濃縮されており、腸管細胞内の幹細胞マーカーとされてもよい。
【0089】
“薬剤担体”とは、哺乳類の細胞移植用の担体としての役割を果たすことができる、生分解性あるいは非生分解性にして、多孔性あるいは非多孔性の基質を意味する。
【0090】
この明細書で用いられているように“移植”には、人間の患者等の哺乳類内に細胞あるいは細胞の個体群あるいは組織を導入するステップが含まれる。また、“移植”には、薬剤担体に細胞あるいは組織を組み入れるステップと、人間の患者等の哺乳類内に上記担体を移植するステップを含めてもよい。
【0091】
〔羊水由来細胞の分離〕
この発明の1つの態様では、羊水由来細胞は、複数段階の方法によって分離され、その方法は、
−羊水を分離するステップ、
−上記羊水を遠心分離した後に、上清を除去するステップ、
−増殖培地中に細胞沈殿物を再懸濁させるステップ、
−低酸素環境下で、上記組織および細胞を培養するステップ、
−培地を変更することなく、上記培養物を約5日間〜10日間、静かに放置するステップ、
−クローニングリングを用いて、形態学的に明瞭なコロニーを分離するステップ、
−分離されたコロニーを増殖培地中で培養するステップ、
−連続希釈してクローン化し、増殖コロニーの元となる単一細胞を同定するステップ、および
−上記クローンを増殖培地中で培養するステップを本質的に含むものである。
【0092】
他の実施の形態では、羊水由来細胞は、複数段階の方法によって分離され、その方法は、
−羊水を分離するステップ、
−上記羊水を遠心分離した後に、上清を除去するステップ、
−増殖培地中に細胞沈殿物を再懸濁させるステップ、
−正常酸素環境下で、上記組織および細胞を培養するステップ、
−培地を変更することなく、上記培養物を約5日間〜10日間、静かに放置するステップ、
−クローニングリングを用いて、形態学的に明瞭なコロニーを分離するステップ、
−分離されたコロニーを増殖培地中で培養するステップ、
−連続希釈してクローン化し、増殖コロニーの元となる単一細胞を同定するステップ、および
−上記クローンを増殖培地中で培養するステップを本質的に含むものである。
【0093】
培養プレートは、例えば、フィブロネクチン、ビトロネクチン、ラミニン、コラーゲン、ゼラチン、トロンボスポンジン、胎盤抽出物、マトリゲル(MATRIGEL:登録商標)、テネイシン、ヒト血清あるいはこれらの組み合わせ等の試薬で、予め被覆されてもよい。
【0094】
所望ならば、羊水を、例えば、羊水細胞で発現した蛋白質マーカーを特異的に認識し、羊水由来細胞を同定しかつ選択し、これにより実質的に精製された羊水由来細胞の個体群を得ることができる、試薬(抗体等)へさらしてもよい。
【0095】
羊水由来細胞は、アムニオマックス(AMNIOMAX:商品名)完全培地(インビトロゲン(Invitrogen)社製)中で培養されてもよい。これに代えて、上記羊水由来細胞は、チャン(Chang)B/C培地(アーバインサイエンティフィック(Irvine Scientific)社製)中で培養されてもよい。これに代えて、上記羊水由来細胞は、インスリン・トランスフェリン・セレニウム−X(ITS−X、米国カリフォルニア州のインビトロゲン社製)、2%のウシ胎仔血清(FBS)、1%のペニシリン/ストレプトマイシン(P/S)+25ng/mLの塩基性線維芽細胞増殖因子(bFGF)を補給した低糖DMEM培地中で、培養されてもよい。これに代えて、上記羊水由来細胞は、20%のノックアウト(KNOCKOUT:商標)血清置換体(米国カリフォルニア州のインビトロゲン社製)、10ng/mLの塩基性線維芽細胞増殖因子(bFGF)を補給したディー・エム・ノックアウト(DM−KNOCKOUT:商標)培地(米国カリフォルニア州のインビトロゲン社製)中で、培養されてもよい。これに代えて、上記羊水由来細胞は、2%に規定されたウシ胎仔血清(FBS)、2mMのL−グルタミン、ITS(インスリン・トランスフェリン・セレニウム)、55μMの2−メルカプトエタノール、10ng/mLの上皮増殖因子(EGF)、4ng/mLの塩基性線維芽細胞増殖因子(bFGF)および4ng/mLのデキサメタソンを補給したウイリアムズ(Williams)培地E中で、培養されてもよい。これに代えて、上記羊水由来細胞は、配合比率1:1のDMEM−LG/MCDB201培地に、2%のウシ胎仔血清(FBS)、ITS−X(インスリン・トランスフェリン・セレニウム−X)、55μMのβme(メルカプトエタノール)、100μMのアスコルビン酸2−リン酸塩、4ng/mLの塩基性線維芽細胞増殖因子(bFGF)、10ng/mLの上皮増殖因子(EGF)および4ng/mLのデキサメタゾンを補給した培地中で、培養されてもよい。これに代えて、上記羊水由来細胞は、20%のウシ胎仔血清(FBS)を補給した低糖DMEM培地中で、培養されてもよい。これに代えて、上記羊水由来細胞は、5%のウシ胎仔血清(FBS)を補給した低糖DMEM培地中で、培養されてもよい。上記羊水由来細胞は、2%に規定されたウシ胎仔血清(FBS)、ITS−X(インスリン・トランスフェリン・セレニウム−X)、1nMのデキサメタソン、100mMのアスコルビン酸2−リン酸塩、10ng/mLの上皮増殖因子(EGF)、10ng/mLのPDGF―bbおよび100mMの2−メルカプトエタノールを補給した、配合比率1:1の低糖DMEM/MCDB201培地中で、培養されてもよい。上記培地には、塩基性線維芽細胞増殖因子(bFGF)を、約5ng/mL〜約100ng/mLの濃度範囲で補給されてもよい。これに代えて、上記羊水由来細胞は、1mMのL−グルタミン、1%の非必須アミノ酸および0.1mMの2−メルカプトエタノールを補給した20%のノックアウト(KNOCKOUT:商標)血清置換体+80%のノックアウト(KNOCKOUT:商標)DMEM中で、培養されてもよい。上記培地は、4ng/mLの塩基性線維芽細胞増殖因子(bFGF)を補給したヒトあるいはマウスの胚性線維芽細胞、ヒト骨髄由来間質細胞、あるいはヒト胎盤由来細胞上で、一晩中、調整されてもよい。これに代えて、上記羊水由来細胞は、20%に規定されたウシ胎仔血清(FBS)および0.1mMの2−メルカプトエタノールを補給した高糖DMEM中で、培養されてもよい。表2は、この発明の羊水由来細胞を培養するのに使用される種々の培地組成を示している。
【0096】
増殖培地での培養中に、上記羊水由来細胞は、低酸素条件あるいは正常酸素条件下で、培養されてもよい。低酸素条件下では、酸素濃度は、20%を下回るか、あるいは10%を下回るか、あるいは5%を下回るが、1%を上回る。
【0097】
好ましくは、上記培養は、培地を変更することなく、約5日間〜14日間、静かに増殖培地中で維持されるべきであり、この時点で、上記羊水由来細胞は典型的には、使用されている培養基質に粘着している。この点で、細胞は継代培養されてもよい。
【0098】
継代培養は、この技術分野における当業者にとって周知のいかなる酵素溶液で実現可能である。この発明の使用に適した酵素溶液の一例は、トリプルエクスプレス(TrypLE−EXPRESS:商標)(米国カリフォルニア州のインビトロゲン社製)である。
【0099】
さらに、羊水由来細胞は、この発明の細胞の増殖を刺激する1つまたはそれ以上の試薬を含有する合成の増殖培地中で培養することによって増殖させてもよい。上記因子としては、例えば、ニコチン酸アミド、TGF−β1、TGF−β2およびTGF−β3を含むTGF−βファミリーのメンバー、骨形態形成蛋白質(BMP−2、BMP−4、BMP−6、BMP−7、BMP−11、BMP−12およびBMP−13)、血清アルブミン、線維芽細胞増殖因子ファミリー、血小板由来増殖因子AAおよび血小板由来増殖因子BB、血小板多血漿、インスリン増殖因子(IGF−I、IGF−II)、増殖分化因子(GDF−5、GDF−6、GDF−8、GDF−10、GDF−11)、グルカゴン様ペプチドI(GLP−I)およびグルカゴン様ペプチドII(GLP−II)、GLP−I擬似体(mimetobody)、GLP−II擬似体、エキセンジン(Exendin)−4、レチノイン酸、副甲状腺ホルモン、インスリン、プロゲステロン、テストステロン、エストロゲン、アプロチニン、ヒドロコルチゾン、エタノールアミン、βメルカプトエタノール、上皮増殖因子(EGF)、ガストリンIおよびガストリンII、トリエチレンペンタミン等の銅キレート剤、TGF−α、フォルスコリン(forskolin)、酪酸ナトリウム塩、アクチビン、ベータセルリン、ノギン(noggin)、神経増殖因子、結節(nodal)、インスリン・トランスフェリン・セレニウム(ITS)、肝細胞増殖因子(HGF)、ケラチノサイト増殖因子(KGF)、ウシ脳下垂体抽出物、小島新生関連蛋白質(INGAP)、プロテアゾーム阻害剤、ノッチ経路阻害剤、ソニックヘッジホッグ阻害剤、GSK−3β阻害剤、あるいはこれらの組み合わせを含めてもよい。これに代えて、上記羊水由来細胞は、調整培地中で培養することによって増殖させてもよい。“調整培地”とは、細胞の個体群が細胞培養用基本合成培地中で増殖し、上記培地に可溶性因子を付与するものである。このような用途の一例では、上記細胞が生成する可溶性因子を残したまま、上記細胞が上記培地から除去される。この培地は、その後、異なる細胞の個体群を育成するのに使用される。
【0100】
ある特定の実施の形態では、上記羊水由来細胞は、標準組織培養プレート上で培養される。これに代えて、培養プレートは、例えば、マトリゲル(MATRIGEL:登録商標)、増殖因子を減少させたマトリゲル(MATRIGEL:登録商標)、ラミニン、コラーゲン、ゼラチン、テネイシン、フィブロネクチン、ビトロネクチン、トロンボスポンジン、胎盤抽出物、ヒト血清等の細胞外基質蛋白質あるいはこれらの組み合わせで、被覆されてもよい。
【0101】
〔分離された羊水由来細胞の特性〕
培養され、あるいは分離された細胞中で蛋白質マーカーおよび核酸マーカーの形質発現を読み取る方法は、この技術分野において通例である。この方法には、逆転写酵素・重合酵素の計量的連鎖反応(RT−PCR)、ノーザンブロット法、切片上ハイブリッド形成法(例えば、「分子生物学における最新プロトコル(Current Protocols in Molecular Biology)」(オスベル(Ausubel)らにより編集された補遺2001年)参照)、および材料切片の免疫組織化学的検定法のような免疫検定法、ウェスタンブロット法、無傷細胞中に到達しやすいマーカーを用いた流動細胞計測分析法(FACS)(例えば、米国ニューヨーク州のコールドスプリングハーバー研究所出版社から1998年に発行された研究便覧:ハーロー(Harlow)およびレーン(Lane)による“抗体の使用(Using Antibodies)”参照)が含まれる。
【0102】
表3〜5には、ある特定の蛋白質マーカーを検出するのに有用な抗体の例が示されている。表3〜5に示された抗体によって認識される同一のマーカーに向けて誘導される他の抗体も利用可能であるか、あるいは容易に開発できる点が留意されるべきである。上記のような他の抗体も、この発明に従って分離された細胞中のマーカーの形質発現を読み取るために使用可能である。
【0103】
この技術分野における当業者にとっては、β細胞系列の細胞特性は周知であり、上記β細胞系列の他の特性の確認を続行する。これらの特性は、この発明に従って分離された羊水由来細胞が分化して上記β細胞系列の細胞特性を獲得したことを確認するのに使用可能である。β細胞系列の特異的な特性は、例えば、PDX−1(膵臓および十二指腸ホメオボックス遺伝子−1)、NGN−3(ニューロゲニン−3)、Hlxb9、Nkx6、Isl1、Pax6、ニューロ(Neuro)D、Hnfla、Hnf−6、Hnf3β、Mafa、およびその他等、1つまたはそれ以上の転写因子の形質発現を含むものである。これらの転写因子は、内分泌細胞の同定に関する技術分野において十分に確立されている。例えば、エドルンド(Edlund)による文献(「ネイチャー遺伝学概要(Nature Reviews Genetics)」2002年、第3巻第524頁〜第632頁)を参照されたい。
【0104】
この技術分野における当業者にとっては、腸管細胞系列の細胞特性は周知であり、この系列の他の特性の確認を続行する。これらの特性は、この発明に従って分離された分化羊水由来細胞あるいは未分化羊水由来細胞が腸管細胞系列の特徴的特性の一部を有することを確認するのに使用可能である。腸管細胞系列の特性は、例えば、HES−1(ヘアリー/エンハンサ分割因子−1)、NGN−3(ニューロゲニン−3)、Pax6、ニューロ(Neuro)D、Math−1、Musashi−1、およびその他等、1つまたはそれ以上の転写因子の形質発現を含むものである。さらに、消化管細胞は、セクレチン、コレシストキニン、GLP−1、ニューロテンシン、胃抑制ペプチド(GIP)、セロトニン、ソマトスタチン、ガストリン、およびその他等のような、ホルモン類を発現させるものである。これらの転写因子および消化管ホルモンは、腸管細胞の同定に関する従来技術において十分に確立されている。例えば、ショーノフ(Schonhoff)による文献(「内分泌学(Endocrinology)」2004年、第145巻第2639頁〜第2644頁)。
【0105】
この発明の発明者らは、高度の増殖性を有し、胚細胞様の特性を呈し、次のマーカー:HNF−1β、HNF−3β、SOX−17あるいはGATA−6のうち、少なくとも1つのマーカーを発現させる羊水由来細胞の個体群を同定し、かつ分離している。特に、この発明に従って分離された羊水由来細胞は、次の蛋白質マーカー:CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーを実質的に欠くことによって、とりわけ特徴付けられる。上記特性を有する羊水由来細胞の個体群とは、この明細書においてAF−I(アメリカン・タイプ・カルチャー・コレクション(ATCC)寄託番号PTA−6975)を意味する。
【0106】
上述した増殖条件下では、この発明に従って分離された羊水由来細胞は、次のマーカー:HNF−1β、HNF−3β、SOX−17あるいはGATA−6のうち、少なくとも1つのマーカーを発現させる能力を維持しながら、50回を超える回数の細胞集団倍加数を繰り返して増殖することができる。
【0107】
また、この発明の発明者らは、高度の増殖性を有し、胚細胞様の特性を呈するが、次のマーカー:HNF−3β、SOX−17、GATA−4、CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーを発現させない羊水由来細胞の個体群を同定し、かつ分離している。特に、この発明に従って分離された羊水由来細胞は、次の蛋白質マーカー:CD117、OCT−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーを実質的に欠くことによって、とりわけ特徴付けられる。上記特性を有する羊水由来細胞の個体群とは、この明細書においてAF−IIを意味する。
【0108】
また、この発明の発明者らは、高度の増殖性を有し、胚細胞様の特性を呈するが、次のすべてのマーカー:HNF−3β、SOX−17、GATA−4、CD117、Oct−4、あるいはTra2−54を発現させない羊水由来細胞の個体群を同定し、かつ分離している。特に、この発明に従って分離された羊水由来細胞は、次の蛋白質マーカー:CD117、OCT−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーを実質的に欠くことによって、とりわけ特徴付けられる。上記特性を有する羊水由来細胞の個体群とは、この明細書においてAF−IIを意味する。
【0109】
また、この発明の発明者らは、高度の増殖性を有し、胚細胞様の特性を呈するが、サイトケラチンと、次のマーカー:HNF−3β、SOX−17、GATA−4、CD117、OCT−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーとを発現させない羊水由来細胞の個体群を同定し、かつ分離している。特に、この発明に従って分離された羊水由来細胞は、次の蛋白質マーカー:CD117、OCT−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーを実質的に欠くことによって、とりわけ特徴付けられる。上記特性を有する羊水由来細胞の個体群とは、この明細書においてAF−IIIを意味する。
【0110】
また、この発明の発明者らは、高度の増殖性を有し、胚細胞様の特性を呈するが、次のすべてのマーカー:サイトケラチン、HNF−3β、SOX−17、GATA−4、CD117、OCT−4、あるいはTRA−2−54を発現させない羊水由来細胞の個体群を同定し、かつ分離している。特に、この発明に従って分離された羊水由来細胞は、次の蛋白質マーカー:CD117、OCT−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーを実質的に欠くことによって、とりわけ特徴付けられる。上記特性を有する羊水由来細胞の個体群とは、この明細書においてAF−IIIを意味する。
【0111】
図9には、AF−I細胞、AF−II細胞およびAF−III細胞の形質発現プロファイルの概要が示されている。
【0112】
この発明の羊水由来細胞は、最終的な内胚葉あるいは膵臓β細胞系列の特性を有する細胞への分化能、あるいは消化管ホルモン産生細胞への分化能を維持しながら、50回を超える回数の細胞集団倍加数を繰り返して増殖することができる。
【0113】
〔羊水由来細胞の分化〕
1つの態様では、この発明は、この発明の増殖された羊水由来細胞を、β細胞系列の特性を有するマーカーを支持する細胞へ分化させることができる組成物を提供するものである。
【0114】
他の態様では、この発明は、この発明の増殖された羊水由来細胞を、最終的な内胚葉の特性を有するマーカーを支持する細胞へ分化させることができる組成物を提供するものである。
【0115】
他の態様では、この発明は、この発明の増殖された羊水由来細胞を、消化管ホルモン産生細胞の特性を有するマーカーを支持する細胞へ分化させることができる組成物を提供するものである。
【0116】
羊水由来細胞の増殖を支持する1つまたはそれ以上の成分が補給された場合における基本合成培地とは、1つまたはそれ以上の増殖因子が分化誘導量で補給された“誘導培地”を意味する。この発明によれば、誘導培地は20%以下の血清を含有している。1つの実施の形態では、ウシ胎児血清が使用されてもよい。これに代えて、ウシ胎仔血清(FBS)は、すべの哺乳類由来の血清、あるいはアルブミン、ウシアルブミンあるいは、β細胞系列への羊水由来細胞の分化を許容するか、あるいは分化能を高める他の物質と差し替えてもよい。これに代えて、誘導培地は、調整培地であってもよい。
【0117】
上記誘導培地に使用されるのに適切な因子としては、例えば、ニコチン酸アミド、TGF−β1、TGF−β2およびTGF−β3を含むTGFβファミリーのメンバー、骨形態形成蛋白質(BMP−2、BMP−4、BMP−6、BMP−7、BMP−11、BMP−12およびBMP−13)、血清アルブミン、線維芽細胞増殖因子ファミリー、血小板由来増殖因子−AAおよび血小板由来増殖因子−BB、血小板多血漿、インスリン様増殖因子(IGF−I、IGF−II)、増殖分化因子(GDF−5、GDF−6、GDF−8、GDF−10、GDF−11)、グルカゴン様ペプチドI(GLP−I)およびグルカゴン様ペプチドII(GLP−II)、GLP−1擬似体、GLP−2擬似体、エキセンジン(Exendin)−4、レチノイン酸、副甲状腺ホルモン、インスリン、プロゲステロン、アプロチニン、ヒドロコルチゾン、エタノールアミン、βメルカプトエタノール、上皮増殖因子(EGF)、ガストリンIおよびガストリンII、トリエチレンペンタミン等の銅キレート剤、TGF−α、フォルスコリン(forskolin)、酪酸ナトリウム塩、アクチビン、ベータセルリン、インスリン・トランスフェリン・セレニウム(ITS)、ノギン(noggin)、神経突起増殖因子、結節(nodal)、バルプロ酸(valporic acid)、トリコスタチン(trichostatin)A、酪酸ナトリウム、肝細胞増殖因子(HGF)、スフィンゴシン−1、Wnt−1、Wnt−3、Wnt−3a、Wnt−07aおよびWnt−8等のWnt蛋白質、ケラチノサイト増殖因子(KGF)、ディコフ(Dickkopf)蛋白質ファミリー、ウシ脳下垂体抽出物、小島新生関連蛋白質(INGAP)、インディアンヘッジホッグ阻害剤、ソニックヘッジホッグ阻害剤、プロテアゾーム阻害剤、ノッチ経路阻害剤、ソニックヘッジホッグ阻害剤、あるいはこれらの組み合わせを含めてもよい。
【0118】
この発明の1つの態様では、増殖因子と、塩基性線維芽細胞増殖因子(bFGF)、アクチビンA、FGF−5、N2およびB27(米国カリフォルニア州のギブコ(Gibco)社製)、例えば、ソニックヘッジホッグシグナルを阻害するシクロパミン(cyclopamine;米国カリフォルニア州のイー・エムー・ディー(EMD)社製)等のステロイドアルカロイド、および例えばMG−132(米国カリフォルニア州のイー・エムー・ディー(EMD)社製)等のプロテアゾーム阻害剤を含む化学物質との組み合わせは、β細胞系列への羊水由来細胞の分化を支持するために、基本合成培地に補給される。1つの態様では、上記羊水由来細胞は、10μMのMG−132を含有するDMEM(低糖、5.5mM)から構成された誘導培地中で、1日〜2日間、培養され、その後に、1XB27(米国カリフォルニア州のギブコ(Gibco)社製)および1XN2(米国カリフォルニア州のギブコ(Gibco)社製)を補給した誘導培地中で、さらに3日〜7日間、培養され、その後に、シクロパミン(10μM;米国カリフォルニア州のイー・エムー・ディー(EMD)社製)、塩基性線維芽細胞増殖因子(20ng/mL;bFGF;米国ミネソタ州のアール・エンド・ディー(R&D)システム製)、アクチビンA(20nM;米国ミネソタ州のアール・エンド・ディー(R&D)システム製)あるいはFGF−5(20ng/mL;米国ミネソタ州のアール・エンド・ディー(R&D)システム製)を補給した誘導培地中で、さらに5日間、培養される。
【0119】
この発明の他の態様では、この発明の羊水由来細胞は、胎仔の原発性発育不全の腸管および膵臓の培養物から分離された調整培地で、それぞれ腸管細胞系列あるいは膵臓細胞系列への更なる分化能を誘導するために、処理可能である。また、上記羊水由来細胞は、PANC−1、CAPAN−1、BxPC−3、HPAF−II等の膵臓細胞系列、HepG2等の肝臓細胞系列、および例えばFHs74およびHS738等の腸管細胞系列由来の調整培地で分化するように誘導されてもよい。これに代えて、この発明の羊水由来細胞は、内胚葉系列への分化を誘導されたヒトあるいはマウスの胚性幹細胞から分離された調整培地で、処理可能である。これらの細胞系列は、ATCC(アメリカン・タイプ・カルチャー・コレクション;米国バージニア州)から入手可能である。
【0120】
増殖因子の組み合わせおよび濃度、培養期間および他の培養条件は、この技術分野における当業者によって例えば、β細胞系列の細胞特性へ分化した細胞の割合をモニターすることによって、効率的な分化を達成するように最適化可能である。1つまたはそれ以上の増殖因子は、約1週間〜約4週間の期間中にわたって、この発明の羊水由来細胞がβ細胞系列のマーカーを支持する細胞に分化するのを誘導するのに十分な量で添加されてもよい。
【0121】
〔この発明の羊水由来細胞の治療用途〕
1つの態様では、この発明は、1型糖尿病患者あるいは同型糖尿病を発症するリスクを負う者を治療する方法を提供するものである。この方法は、羊水由来細胞を分離し培養するステップと、分離された細胞の個体群を増殖するステップと、上記培養細胞を試験管内でβ細胞系列に分化させるステップと、上記分化細胞を直接あるいは薬剤担体内に含めた形態で、患者内に移植するステップを含むものである。適切な場合には、患者は、移植細胞の生存および機能に役立つ薬剤すなわち生理活性因子で、さらに治療可能である。上記薬剤としては、例えば、インスリン、TGFβ1、TGFβ2およびTGFβ3を含むTGFβファミリーのメンバー、骨形態形成蛋白質(BMP−2、BMP−3、BMP−4、BMP−5、BMP−6、BMP−7、BMP−11、BMP−12およびBMP−13)、線維芽細胞増殖因子−1および線維芽細胞増殖因子−2、血小板由来増殖因子AAおよび血小板由来増殖因子BB、血小板多血漿、インスリン様増殖因子(IGF−I、IGF−II)、増殖分化因子(GDF−5、GDF−6、GDF−8、GDF−10、GDF−15)、血管内皮細胞由来増殖因子(VEGF)、プレイオトロフィン(pleiotrophin)、エンドセリン、およびその他を含めてもよい。他の薬剤配合物には、例えば、ニコチンアミド、グルカゴン様ペプチドI(GLP−I)、グルカゴン様ペプチドII(GLP−II)、GLP−I擬似体、GLP−II擬似体、エキセンジン(Exendin)−4、レチノイン酸、副甲状腺ホルモン、例えば米国出願公開2004/0209901および米国出願公開2004/0132729に開示された化合物等のMAPK阻害剤を含めることができる。
【0122】
さらに他の態様では、この発明は、2型糖尿病患者あるいは同型糖尿病を発症するリスクを負う者を治療する方法を提供するものである。この方法は、この発明による羊水由来細胞を分離し培養するステップと、分離された細胞の個体群を増殖するステップと、上記培養細胞を試験管内でβ細胞系列に分化させるステップと、上記分化細胞を直接あるいは薬剤担体内に含めた形態で、患者内に移植するステップを含むものである。
【0123】
さらに他の実施の形態では、この発明の羊水由来細胞は、DMSO(ジメチルスルホキシド)またはグリセロールを含有する市販の培地を用いて、凍結保存されてもよい。凍結保存された細胞は、必要とされるまで、液体窒素保存容器の気相中に保存されてもよい。
【0124】
さらに他の実施の形態では、この発明の羊水由来細胞は、この羊水由来細胞の生存力を高めるか、あるいは上記羊水由来細胞の膵臓β細胞系列への分化を誘導するために、同種あるいは異種の動物の成熟膵島を移植されてもよい。
【0125】
治療中の患者に対して供給される細胞の供給源であって、当該細胞が分離される羊水は、自己由来であってもよい。これに代えて、供給源は、同種由来あるいは異種由来であってもよい。また、患者に投与されるべき細胞は、増殖能および/または分化能を高めるか、あるいは免疫的拒絶反応のリスクを防止するか、あるいは低減するように、遺伝子的に変性されてもよい。これに代えて、この発明に従って得られた羊水由来細胞は、この発明に従って調製された分化細胞を移植する前に、被移植者の免疫反応を調節するのに使用可能である。例えば、米国特許第6,328,960号および米国特許第6,281,012号を参照されたい。
【0126】
この発明の羊水由来細胞は、被移植者への移植前に、インスリン産生細胞に分化されてもよい。特定の実施の形態では、この発明の羊水由来細胞は、被移植者への移植前に、β細胞に完全に分化される。これに代えて、この発明の羊水由来細胞は、未分化状態あるいは部分的分化状態で、被移植者へ移植されてもよい。更なる分化は、被移植者の体内で生じる可能性がある。
【0127】
この発明の羊水由来細胞は、遺伝子的に変性されてもよい。例えば、上記羊水由来細胞は、例えばPDX−1あるいはインスリン等のβ細胞系列の細胞特性を有するマーカーを過剰に発現させるように改良されてもよい。上記羊水由来細胞は、いかなる適切な対象遺伝子を過剰に発現させるように改良されてもよい。さらに、上記羊水由来細胞は、MATH−1等の腸管細胞の特性を有するマーカーを過剰に発現させるように改良されてもよい。これに代えて、この発明の羊水由来細胞は、胃抑制ペプチド(GIP)発現細胞の個体群に分化し、さらに、この個体群が糖感受性のインスリン産生細胞の個体群となるように、胃抑制ペプチド(GIP)プロモータの支配下でインスリン遺伝子で変性してもよい。この発明の羊水由来細胞を遺伝的に変性するのに有用な技術は、例えば、細胞生物学の標準的な教科書および検討書中で検索可能である。分子遺伝学および遺伝子工学における方法は、例えば、「分子クローニング」:研究マニュアル第2版(サムブルック(Sambrook)らによる。1989年);「オリゴヌクレオチド合成」(エム・ジェイ・ガイト(M.J.Gait)編。1984年);「動物細胞培養」(アール・アイ・フレッシュネイ(R.I.Freshney)編。1987年);「酵素学の方法シリーズ」(アカデミック出版社);「哺乳類細胞の遺伝子転写ベクター」(アイ・エム・ミラー(I.M.Miller)およびエム・ピー・カロス(M.P.Calos)編。1987年);「分子生物学の最新プロトコルおよび分子生物学の簡略プロトコル」第3版(エフ・エム・オスベル(F.M.Ausubel)ら編集。1987年および1995年);および「DNA組換え方法II」(アール・ウー(R.Wu)編。アカデミック出版社。1995年)に記述されている。
【0128】
対象遺伝子をコード化する核酸分子は、宿主の羊水由来細胞のゲノム中に安定に組み込まれてもよく、あるいは上記核酸分子は、ベクターあるいはプラスミド等の染色体外分子として存在してもよい。このような染色体外分子は、自己複製されてもよい。この明細書で用いられている用語“形質移入”とは、宿主の羊水由来細胞中に異種の核酸を導入するプロセスを意味する。
【0129】
未分化状態あるいは他の状態の細胞は、分散された細胞として、あるいは肝門脈中に注入可能な塊となった細胞として使用されてもよい。これに代えて、上記細胞は、生体適合性で生分解性の重合支持体、多孔性で非生分解性の装置、あるいは宿主の免疫反応から保護するようにカプセル内に配されてもよい。上記細胞は、被移植者の体内の適切な部位に移植されてもよい。移植部位としては、例えば、肝臓、生来の膵臓、腎臓被膜下腔、網(腹膜の襞)、腹膜、漿膜下腔、腸管、胃あるいは皮下嚢を含むものである。
【0130】
移植細胞の更なる分化能、生存力あるいは活性を高めるためには、増殖因子、抗酸化剤あるいは抗炎症剤等の付加的な因子は、細胞の注入前に、注入と同時に、あるいは注入後に、投与可能である。ある特定の実施の形態では、増殖因子は、生体体に注入された細胞を分化させるのに用いられる。上記因子を、内在性の細胞によって分泌可能であり、元の位置に注入された羊水由来細胞にさらすことができる。移植された羊水由来細胞を、この技術分野において公知の増殖因子であって、内在性の増殖因子と、注入された外来性の増殖因子とのいかなる組み合わせによって分化するように誘導可能である。
【0131】
移植に使用される細胞の投与量は、患者の容態および上記治療に対する感受性を含む多くのファクターに依存しており、この技術分野における当業者によって決定可能である。
【0132】
1つの態様では、この発明は、糖尿病患者あるいは糖尿病を発症するリスクを負う者を治療する方法を提供するものである。この方法は、この発明による羊水由来細胞を分離し培養するステップと、分離された細胞の個体群を増殖するステップと、上記培養羊水由来細胞を試験管内でβ細胞系列に分化させるステップと、上記分化細胞を三次元支持体に組み入れるステップを含むものである。この分化細胞は、患者への移植前に、試験管内の上記支持体上で維持可能である。これに代えて、上記分化細胞を含有する上記支持体は、試験管内で、付加的な培養をすることなく、直接、患者の体内に移植可能である。この支持体は、任意に、移植細胞の生存および機能に役立つ少なくとも1つの薬剤に組み入れることができる。
【0133】
この発明の目的に適した使用に供される支持体材料としては、組織修復に有用な組織テンプレート、導管、バリアおよびレザバーを含むものである。特に、発泡体、スポンジ、ゲル、ヒドロゲル、織物、および不織布構造の形態を有する材料であって、生物学的組織を再構築あるいは再生するばかりでなく、組織の成長を誘導する走化性因子を送出するのに試験管内および生体内で使用されてきた合成材料および天然材料は、この発明の方法の実施に使用するのに適している。例えば、米国特許第5,770,417号、米国特許第6,022,743号、米国特許第5,567,612号、米国特許第5,759,830号、米国特許第6,626,950号、米国特許第6,534,084号、米国特許第6,306,424号、米国特許第6,365,149号、米国特許第6,599,323号、米国特許第6,656,488号および国特許第6,333,029号に開示された材料を参照されたい。この発明において使用に適したポリマー材料の例は、米国出願公開2004/0062753および米国特許第4,557,264号に開示されている。
【0134】
薬剤を組み入れた支持体を形成するために、薬剤は、上記支持体を形成する前に、ポリマー溶液と混合可能である。これに代えて、薬剤は、好ましくは薬剤担体の存在下で、形成された支持体上に被覆されてもよい。薬剤は、液体、微細に分割された固体、あるいは他のいかなる適切な物理的形態を呈してもよい。これに代えて、支持体には、薬剤の放出速度を変更する賦形剤が添加されてもよい。他の実施の形態では、支持体には、例えば、米国特許第6,509,369号に開示された物質等の抗炎症剤である、少なくとも1種の薬剤配合物が組み入れられている。
【0135】
1つの実施の形態では、支持体には、例えば、米国特許第6,793,945号に開示された物質等の抗アポトーシス剤である、少なくとも1種の薬剤配合物が組み入れられている。
【0136】
他の実施の形態では、支持体には、例えば、米国特許第6,331,298号に開示された物質等の線維形成阻害剤である、少なくとも1種の薬剤配合物が組み入れられている。
【0137】
他の実施の形態では、支持体には、例えば、米国出願公開2004/0220393および米国出願公開2004/0209901に開示された物質等、血管形成能を高めることができる、少なくとも1種の薬剤配合物が組み入れられている。
【0138】
さらに他の実施の形態では、支持体には、例えば、米国出願公開2004/0171623に開示された物質等の免疫抑制剤である、少なくとも1種の薬剤配合物が組み入れられている。
【0139】
他の実施の形態では、支持体には、例えば、TGFβ1、TGFβ2およびTGFβ3を含むTGFβファミリーのメンバー、骨形態形成蛋白質(BMP−2、BMP−3、BMP−4、BMP−5、BMP−6、BMP−7、BMP−11、BMP−12およびBMP−13)、線維芽細胞増殖因子−1および線維芽細胞増殖因子−2、血小板由来増殖因子AAおよび血小板由来増殖因子BB、血小板多血漿、インスリン様増殖因子(IGF−I、IGF−II)、増殖分化因子(GDF−5、GDF−6、GDF−8、GDF−10、GDF−15)、血管内皮細胞由来増殖因子(VEGF)、プレイオトロフィン(pleiotrophin)、エンドセリン、およびその他の物質等の増殖因子である、少なくとも1種の薬剤配合物が組み入れられている。他の薬剤配合物には、例えば、ニコチンアミド、低酸素誘導因子1−α、グルカゴン様ペプチドI(GLP−I)、グルカゴン様ペプチドII(GLP−II)、GLP−I擬似体、GLP−II擬似体、エキセンジン(Exendin)−4、結節(nodal)、ノギン(noggin)、NGF、レチノイン酸、副甲状腺ホルモン、テネイシン−C、トロポエラスチン、トロビン由来ペプチド、カテリチジン(cathelicidin)、ディフェンシン、ラミニン、フィブロネクチンおよびビトロネクチン等、粘着性細胞外基質蛋白質の細胞結合ドメインおよびヘパリン結合ドメインを含む生物学的ペプチド、例えば米国出願公開2004/0209901および米国出願公開2004/0132729に開示された化合物等のMAPK阻害剤を含めることができる。
【0140】
この発明の羊水由来細胞の骨格への組み入れは、骨格上に細胞を単純に付着させることによって、実現可能である。細胞は、単純な拡散によって骨格内に導入可能である(ジェイ・ペディアール(J.Pediatr)による「外科学」1988年、第23(1、パート2)巻第3頁〜第9頁)。細胞播種の効率を高める他のいくつかの取り組みが開発されている。例えば、ポリグリコール酸骨格上に軟骨細胞を播種するのに、撹拌フラスコが使用されている(最新バイオテクノロジー1998年、第14(2)巻第193頁〜第202頁)。細胞を播種するための他の取り組みとしては、播種細胞への負荷を最小にし、かつ播種効率を高める効果を与える遠心分離の利用がある。例えば、ヤン(Yang)らは、遠心分離的細胞固定化方法(CCI)と呼ばれる細胞播種法を開発した(生医学材料研究誌(J.Biomed.Mater.Res.)2001年、第55(3)巻第379頁〜第386頁)。
【0141】
さらに、この発明は、次の実施例によって示されるが、これら実施例によって限定されるものではない。
【0142】
〔実施例1:ヒト羊水由来細胞系列の樹立〕
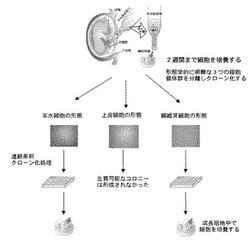
この発明の羊水由来細胞を分離するのに使用される羊水を、通常、妊娠期間の16週〜22週で実行される、胎仔の核型分析用の羊水穿刺法により得られたサンプルから採取した。図1には、上記羊水由来細胞を分離するのに使用される、複数の段階を踏む方法が概略的に示されている。上記羊水を7分間、重力の400倍の遠心力で遠心分離し、上清を除去した。この結果として得られた細胞沈殿物を、この発明に使用される上記羊水サンプル用の表3〜5に表示された増殖培地中に再懸濁させた。上記細胞を、コラーゲンIV型(100mmプレート当たりの1mg)、あるいはコラーゲンI型(1cm2当たりの1μg)、ビトロネクチン(1mL当たりの10μg)あるいはフィブロネクチン(1mL当たりの10μg)のいずれかを被覆したプレート上で培養した。羊水サンプルから得られた細胞は、大きなバラツキ(1サンプル当たりの細胞数:8,000〜300,000個)を有しており、一部のサンプルには、かなりの数の血球が混入していた。上記培養物を、低酸素条件(酸素濃度:3%)下で、少なくとも5日間〜10日間、静かに放置した。平行して、培養物を正常酸素条件下で、上記同様の条件で培養した。次に、上記培養物を上記増殖培地と同一の培地に添加し、70%〜80%の培養飽和密度(confluency)に達するまで培養した。この段階の細胞を“P0”と呼ぶものとする。培養物の一部では、細胞コロニーをクローニングリングで分離し、異なる培養プレートで継代培養した。形態学的に明瞭なコロニーは、線維芽細胞(F)、羊水細胞(AF)および上皮細胞(E)の特性を有する形態で存在していた(図2)。“トリプルエクスプレスTrypLE−EXPRESS(商標)”(インビトロゲン社製)を用いて、上記P0から細胞を放出させ、この細胞を、種々の濃度(1cm2当たりの細胞数:50〜10,000個)で、フィブロネクチン、ビトロネクチンあるいはコラーゲンIV型を被覆したフラスコ/皿/プレートに播種した。連続希釈クローン化処理に、上記P0細胞の一部を使用した。最速で増殖する細胞の細胞集団倍加時間は、継代初期で、約24時間であった。種々の培地条件(表2)下で培養された増殖細胞を、細胞表面マーカー(表3〜5)で分析した。細胞は、典型的には培養飽和密度70%まで分裂し、1cm2当たりの細胞数100〜10,000個で、再度、播種した。細胞増殖の種々の段階で、リボ核酸(RNA)を採集し、胚性および胚葉マーカー(表9)で分析した。
【0143】
この発明の羊水由来細胞は、種々の妊娠期間で存在していた。表10は、妊娠期間の17週〜41週で採取した羊水サンプル中に、羊水細胞(AF)、線維芽細胞(F)および上皮細胞(E)の形態の存否を示している。
【0144】
また、この発明の羊水由来細胞を、満期分娩時(妊娠期間の約40週)に得られた羊水から採取した。羊水サンプルを38週〜40週の分娩時に採取し、上記プロトコルに従って培養した。結果として得られた粘着細胞の固体群は、妊娠期間の16週〜22週で分離された細胞の特性に非常に類似する特性を呈した。
【0145】
〔実施例2:この発明の羊水由来細胞のクローン増殖〕
実施例1で記述された方法で、羊水細胞(AF)様の形態を有する細胞を、クローニングリングを用いてP0培養物から得た。表面受容体、細胞骨格蛋白質および転写因子について異なる発現性を示す3つの明瞭な細胞固体群を同定した。簡略化のために、上記固体群を、AF−I細胞、AF−II細胞およびAF−III細胞と呼ぶ。次の実施例では、AF−I細胞、AF−II細胞およびAF−III細胞の各個体群の差異を明確にする。
【0146】
〔実施例3:蛍光標示式細胞分取器(FACS)による分析〕
トリプルエクスプレス(TRYPLE(商標)−express)発現溶液(米国カリフォルニア州のギブコ(Gibco)社製)で5分間、培養することによって培養プレートから接着細胞を取り出した。この取り出された細胞を、10%のウシ胎仔血清(FBS)添加ダルベッコ調製イーグル培地(DMEM)中に再度、懸濁させ、かつ遠心分離後に、洗浄および、リン酸緩衝食塩水(PBS)中に2%のウシ血清アルブミン(BSA)および0.05%のアジ化ナトリウム(米国ミズーリ州のシグマ(Sigma)社製)を含有させた染色緩衝液中への再度の懸濁によって、上記細胞を回収した。適切な場合には、0.1%のγ―グロブリン(米国ミズーリ州のシグマ(Sigma)社製)溶液を15分間用いて、上記細胞のFc(免疫グロブリン結晶化可能断片)受容体を阻害した。アリコート(細胞数:約105個)を、表3に示されているように、フィコエリトリン(Phycoerythirin)(PE)あるいはアロフィコシアニン(APC)のいずれかを接合したモノクローナール抗体(細胞数106個当たりの抗体量5μL)あるいは未接合型の一次抗体と共に培養した。対照区には、アイソタイプが適切に適合した抗体、非染色細胞、および接合型の二次抗体のみが染色された細胞を含めた。すべての抗体との細胞培養を、4℃、30分間、実行したのち、上記細胞を染色緩衝液で洗浄した。未接合型の一次抗体で染色した細胞サンプルについては、接合型のフィコエリスリン(PE)あるいはアロフィコシアニン(APC)標識二次抗体と共に、さらに4℃、30分間、培養した。使用した二次抗体の記載に関しては表4を参照されたい。洗浄された細胞を顆粒化し、染色緩衝液中に再度、懸濁させ、蛍光標示式細胞分取器アレイ(FACSArray:ビー・ディー・バイオサイエンス(BD Biosciences)社製)で、少なくとも10,000件の事象を収集することによって、細胞表面分子を同定した。
【0147】
細胞内染色については、まず、4%のパラホルムアルデヒドで、10分間、細胞を固定した後、染色緩衝液で2回洗浄し、細胞を遠心分離し、リン酸緩衝食塩水(PBS)中に0.5%のトリトン(Triton)X(シグマ(Sigma)社製)を含有させた透過処理用緩衝液中に、室温(RT)で、5分間、上記細胞を再度、懸濁させた。浸透化させた細胞を、水洗用緩衝液で2回洗浄し、遠心分離し、上記染色緩衝液中に再度、懸濁させ、適切な接合型の抗体(細胞数106個当たりの抗体量5μL)と共に、4℃、30分間、培養した。未接合型の一次抗体で染色した細胞サンプルについては、接合型のフィコエリスリン(PE)あるいはアロフィコシアニン(APC)標識二次抗体(表4)と共に、さらに4℃、30分間、培養した。洗浄された細胞を顆粒化し、染色緩衝液中に再度、懸濁させ、蛍光標示式細胞分取器アレイ(FACSArray:ビー・ディー・バイオサイエンス(BD Biosciences)社製)で、少なくとも10,000件の事象を収集することによって、内部蛋白質を同定した。表6および表7には、検査した細胞表面マーカーおよび細胞内部マーカーの発現レベルが記載されている。蛍光標示式細胞分取器(FACS)による分析では、羊水細胞(AF−I、AF−IIおよびAF−III)、線維芽細胞(F)および上皮細胞(E)を識別する特性を有するマーカーを同定することができた(図3〜図5)。表8には、満期分娩時(38週〜40週)の羊水から分離したAF−I細胞の細胞表面発現プロファイルが示されている。細胞表面受容体の発現レベルは、16週〜22週の羊水から分離したAF−I細胞に非常に類似している。
【0148】
〔実施例4:未分化細胞の免疫染色〕
実施例1によって培養した細胞(1cm2当たりの細胞数:10,000個)を、ガラス製の底部を有する35mm径マイクロウェル皿(米国マサチューセッツ州のマテック(Matek)社製)の種々の増殖培地上に播種した。培養3日後に、4%のパラホルムアルデヒドで、10分間、上記細胞を固定した後、リン酸緩衝液(PBS)で2回洗浄し、さらに、0.5%のトリトン(Triton)X(シグマ(Sigma)社製)を含有させた透過処理用緩衝液を5分間、室温(RT)で添加し、リン酸緩衝液(PBS)で、さらに3回洗浄した。固定され、透過処理された細胞を、1%のウシ血清アルブミン(BSA)あるいは二次抗体が生成される種(ヤギ、ロバあるいはウサギ)から得られた4%の血清のいずれかで、阻害した。対照区サンプルには、一次抗体を省いた反応生成物、あるいは一次抗体をこの一次抗体に対応する免疫グロブリンに、上記一次抗体と同一の濃度で、置き換えた反応生成物を含めた。染色されたサンプルを、染色された核を計数するためにジアミジノ−2−フェニルインドール、ニ塩化水素化物(DAPI)を含有するプロロング(PROLONG:登録商標)抗退色性試薬(米国カリフォルニア州のインビトロゲン社製)で洗浄した。ニコン共焦エクリプスC−1型反転顕微鏡(日本国のニコン社製)および10倍〜60倍の対物レンズで、細胞画像を得た(図6〜図8)。
【0149】
〔実施例5:未分化細胞の重合酵素連鎖反応(PCR)分析〕
増殖培地中で培養した細胞からリボ核酸(RNA)を抽出した。ヒト膵臓、肝臓、脳、消化管(アンビオン(Ambion)社製)、NTERA細胞(ヒト胚性癌腫細胞系列;ATCC(アメリカン・タイプ・カルチャー・コレクション))、HEK293細胞(ATCC;アメリカン・タイプ・カルチャー・コレクション)、およびヒト気道上皮細胞(ケンブレックス(Cambrex)社製)由来の全リボ核酸(RNA)を、陽性対照区として用いた。骨髄由来間葉細胞(米国メリーランド州のケンブレックス(Cambrex)社製)を、膵臓発達過程に含まれる鍵遺伝子の発現性に関して陰性となる対照区として用いた。
【0150】
[リボ核酸(RNA)の抽出、精製、および相補デオキシリボ核酸(cDNA)の合成]
リボ核酸(RNA)サンプルを、エタノール含有高塩緩衝液の存在下で、シリカゲル膜(米国カリフォルニア州のキアゲン(Qiagen)社製のルナシー(Rneasy)ミニキット)との結合によって精製すると同時に、異物を洗浄除去した。カラムに結合した状態のリボ核酸(RNA)サンプルを、デオキシリボヌクレアーゼI(DNase I)(キアゲン(Qiagen)社製)で15分間、処理することによって、さらに精製した。その後に、高純度のリボ核酸(RNA)を水中に溶出させた。収量および純度を、分光光度計のA260(260nm吸収セル)およびA280(280nm吸収セル)の測定値によって推定した。相補デオキシリボ核酸(cDNA)の複製を、エイ・ビー・アイ(米国カリフォルニア州のエイ・ビー・アイ(ABI)社製)高容量相補デオキシリボ核酸(cDNA)アーカイブキット(ABI high capacity cDNA archive kit)で、精製リボ核酸(RNA)から作製した。
【0151】
〔リアルタイムの重合酵素連鎖反応(PCR)による増幅および定量分析〕
他に述べない限り、すべての試薬をアプライド・バイオシステムズ(Applied Biosystems)社から入手した。エイ・ビー・アイ・プリズム(ABI PRISM:登録商標)品番7000配列検出システムで、リアルタイムの重合酵素連鎖反応(PCR)を実行した。全反応液量を20μLとして20ngの逆転写型リボ核酸(RNA)と共に、タクマン(TAQMAN:登録商標)ユニバーサル・ピー・シー・アール・マスター・ミックス(UNIVERSAL PCR MASTER MIX:登録商標)(米国カリフォルニア州のエイ・ビー・アイ(ABI)社製)を用いた。ピペット操作ミスを訂正するために、各相補デオキシリボ核酸(cDNA)サンプルについて控えをとって実行した。反応開始剤およびタクマン(TAQMAN:登録商標)のFAM標識プローブを200nMの濃度で使用した。アプライド・バイオシステムズ(Applied Biosystems)の予備培養型18Sリボソームリボ核酸(RNA)あるいはヒト・グリセルアルデヒド−3−リン酸・デヒドロゲナーゼ(GAPDH)内在性対照キットで、各標的遺伝子の発現レベルを標準化した。反応開始剤およびプローブについては、エイ・ビー・アイ・プリズム・プライマー・エクスプレス(ABI PRISM PRIMER EXPRESS:商品名)ソフトウエアで設計するか、あるいはエイ・ビー・アイ(ABI)社製の予備培養型遺伝子分析キットを用いた。各遺伝子に関して、エクソンと境界部分との距離(spanning)となるように、反応開始剤あるいはプローブのいずれか一方を設計した。この設計は、反応開始剤/プローブが、存在するいかなるゲノム・デオキシリボ核酸(DNA)に結合する可能性を無くした。反応開始剤とプローブとのセットとしては、次の組み合わせ:Nkx2.2(Hs00159616)、Pdx−1(Hs00426216)、Nkx6.1(Hs00232355)、Ngn3(Hs00360700)、Pax4(Hs00173014)、Pax6(Hs00240871)、インスリン(Hs00355773)、Glu2(Hs00165775)、グルカゴン(Hs00174967)、Isl−1(Hs00158126)、ソマトスタチン(Hs00174949)、FoxA2(HNF3β)(Hs00232764)、HlxB9(Hs00232128)、GATA−4(Hs00171403)、HNF1β(Hs00172123)、Musashi同族体−1(Msi−1)(Hs00159291)、Hes−1(Hs00172878)、ニューロテンシン(NTS)(Hs00175048)、コレシストキニン(Hs00174937)、AFP(Hs00173490)、セクレチン(Hs00360814)、GIP(Hs00175030)、GFAP(Hs00157674)、MAP2(Hs00159041)、Olig2(Hs0037782)、Oct−4(CGACCATCTGCCGCTTTGAG(配列識別番号1))およびOct−4(CCCCCTGTCCCCCA TTCCTA(配列識別番号2));Rex−1(CAGATCCTAAACAGCTCGCAGAAT(配列識別番号3))およびRex−1(GCGTACGCAAATTAAACTCCAGA(配列識別番号4));Sox−17(TGGCGCAGCAGATACCA(配列識別番号5))、Sox−17(AGCGCCTTCCACGACTTG(配列識別番号6))、Sox−17(CCAGCATCTTGCTCAACTCGGCG(配列識別番号7))、ABCG−2(GTTTATCCGTGGTGTGTCTGG(配列識別番号8))およびABCG−2(CTGAGCTATAGAGGCCTGGG(配列識別番号9))、Sox2(ATGCACCGCTACGACGTGA(配列識別番号10))およびSox2(CTTTTGCACCCCTCCCATTT(配列識別番号11))として記載されている。残りの反応開始剤を、PRIMERSプログラムソフトウエア(米国カリフォルニア州のエイ・ビー・アイ(ABI)社製)で設計し、表9中に記載した。上記サンプルについて、当初50℃で2分間、95℃で10分間処理した後に、95℃で15秒間の変性ステップと、60℃で1分間の焼鈍/伸張ステップを40回、繰り返した。ジーンアンプ(GENEAMP:登録商標)品番7000配列検出システムソフトウエアで、データ分析を実行した。各反応開始剤/プローブセットに関して、蛍光強度が指数増幅領域の中間にある特異値に到達した周期数として、Ct値を求めた。形質発現の相対レベルを、比較Ct法で算出した。簡単に言えば、各相補デオキシリボ核酸(cDNA)サンプルについては、内在性対照区のCt値を、対象遺伝子のCt値から差し引いて、ΔCt値(ΔCt)を得た。100%の効率で増幅すると仮定して、対象遺伝子の標準量を2-ΔCtとして算出した。最終データを較正サンプルの相対値として示した。上記比較Ct法は、仮に対象区および内在性対照区の増幅効率が略等しい場合にのみ、有効とされている。したがって、反応開始剤/プローブのセット毎に、連続的に希釈した相補デオキシリボ核酸(cDNA)サンプルを増幅し、上記ΔCt値を確認することによって、予備実証実験を実行した。上記ΔCt値は、仮に増幅効率が等しい場合には、希釈範囲を超えて一定となるはずである(表9)。
【0152】
〔実施例6:細胞集団倍加時間〕
実施例1により分離し、かつ増殖した継代数6の羊水細胞(AF−I型)を、24ウェル組織培養プレート(米国マサチューセッツ州のコーニング社製)における培地番号11の増殖培地に1ウェル当たり細胞数10,000個で播種した。トリプルエクスプレス(TRYPLE(商標)−EXPRESS)発現溶液(米国カリフォルニア州のインビトロゲン(Invtrogen)社製)で、上記プレートの3つのウェルから細胞を除去し、グアバ(Guava)PCA−96細胞分析システムおよびビアカウント(VIACOUNT:登録商標)試薬(米国カリフォルニア州のグアバ(Guava)社製)で、細胞を計数した。図10は、低酸素条件(酸素濃度:3%)下で、培養した継代数6の細胞の増殖曲線を示している。対数グラフの直線部分で、上記細胞の細胞集団倍加時間を推定した。継代数6の細胞の細胞集団倍加時間は31時間であった。
【0153】
上記3つの細胞個体群(線維芽細胞、羊水細胞および上皮細胞形態)の増殖能を、長期間培養で比較した。図11は、5番培地中で培養したAF−I細胞、AF−II細胞、AF−III細胞、F細胞およびE細胞の増殖能を示している。F(“線維芽細胞性”羊水由来)細胞および羊水(AF)細胞が50回を超える回数の細胞集団倍加を繰り返して増殖することができ、かつ細胞(移植)治療用の供給源であることを示していることは明らかである。
【0154】
[実施例7:AF−I細胞のテロメア長]
末端TAGGGテロメア長検定法(米国インディアナ州のロッシュ社製)を用い、その製造者の指示に従って、限定された回数で行う連続希釈処理によって、単一細胞から分離したAF−I細胞系列のテロメア長を継代数12(1継代当たり細胞集団倍加:約50回)で分析した。10%のウシ胎仔血清(FBS)添加DMEM−LG培地で培養した細胞およびアムニオマックス(Amniomax(商標);ギブコ(Gibco)社製)培地で培養した細胞について、テロメア長を分析した(図12参照)。胚性癌腫細胞系列(NTERA細胞)由来のデオキシリボ核酸(DNA)を陽性の対照区とした。
【0155】
〔実施例8:核型分析〕
複数のドナーから分離した継代数8〜10(1継代当たり細胞集団倍加:約30回)のAF細胞の核型を、Gバンド染色検定法によって確認した。5つの核型が調製し、細胞遺伝学的分析では、上記細胞が常染色体を有し、形式上、染色体数46を有していることが示された。また、分析された全細胞は、胎仔起源を裏付けるX染色体およびY染色体を含有していた。図13は、妊娠期間の16週〜22週のドナーから採取した羊水から分離された羊水由来細胞(AF−I細胞、AF−II細胞およびAF−III細胞)の核型を示している。
【0156】
〔実施例9:満期分娩時の羊水由来のAF細胞の増殖能〕
図14は、満期分娩時(約38週まで)の羊水由来であって5番培地で培養したAF−I細胞形態の増殖能を示している。この増殖能は、16週〜22週で採取した羊水から分離したAF−I細胞の増殖能に非常に類似している。
【0157】
〔実施例10:線維芽細胞、上皮細胞および羊水細胞の形態に関するマイクロアレイ分析〕
ルナシー(RNeasy)ミニキット(キアゲン(Qiagen)社製)で、継代数9〜11の線維芽細胞性羊水由来細胞(F細胞)、上皮性羊水由来細胞(E細胞)、羊水由来羊水細胞(AF−I細胞系列、AF−II細胞系列およびAF−III細胞系列)および満期分娩時の羊水(AF term)から全リボ核酸(RNA)を分離した。コードリンク(Codelink(商標))システム(米国ニュージャージー州のアメルシャム・バイオサイエンス(Amersham Biosciences)社ジー・イー・ヘルスケア(GE Healthcare)部門製)に従って、サンプル調製、ハイブリダイゼーションおよび画像分析を実行した。コードリンク(Codelink(商標))ヒト・ホール・ゲノム・アレイ(Codelink Human Whole Genome arrays)を用いた。このアレイは、標的遺伝子の転写部分の端から端までのエクソンを保存するように設計された約5500030の部分プローブから構成されている。チップは45000までの非反復単一遺伝子識別番号(unique Unigene IDs)を含むものである。標準化および対数変換に続けて、オムニビズ(OmniViz:登録商標)ソフトウエア(米国マサチューセッツ州のマテック(Matek)社製)およびジーンシフター(GENESIFTER:米国ワシントン州のビズエックスラボズ(VizXLabs)社製)で、データ分析を実行した。標準化サンプルの歪みに伴う変換の分散安定化を対数変換型アレイデータセットに適用した。ピアソン相関係数で、各細胞系列内および異種細胞系列間での変動を比較した。分析されたすべてのサンプルに関しては、細胞系列内の相関係数は、細胞系列間の相関係数と比較して高くなった。図15には、細胞系列間の相関係数に伴う異種細胞型間の遺伝子発現プロファイルの変動が示されている。変動分析およびP値を0.05以下に調整(ベンジャミニ(Benjamini)およびホックベルグ(Hochberg)補正)したF検定で、遺伝子発現における細胞型間の顕著な差異を求めた。表11〜表17は、種々の細胞型間で、少なくとも5倍の分化的な発現性を呈する遺伝子を示している。
【0158】
[実施例11:腸管様細胞への細胞分化]
AF−I細胞系列で継代数14のAFCA007クローンAを、1cm2当たりの細胞数10,000個で、アムニオマックス(AMNIOMAX(商標))完全培地中で培養した。培養飽和密度時に、上記細胞を、アムニオマックス(AMNIOMAX:商品名)完全培地中に1日当たり10μMのレチノイン酸(RA)を投与して、2週間、さらに処理した。リボ核酸(RNA)を14日目に採集し、消化管ホルモン(セクレチン、ニューロテンシン、胃抑制ペプチド(GIP)、コレシストキニン、ソマトスタチンおよびガストリン)の形質発現を、実施例4に説明されているようなリアルタイムの重合酵素連鎖反応(PCR)で推定した。ΔΔC1法で相対的な発現レベルを推定するのに腸管リボ核酸(RNA)(Ambion)を用いた。表18は、処理済みサンプルおよび未処理サンプルにおける消化管ホルモンのC1値および相対的発現レベルを示している。表18に示されているように、レチノイン酸(RA)の添加は消化管ホルモンの発現を高めた。
【0159】
〔実施例12:複数の内分泌細胞系列への細胞分化〕
継代数8のAFCA007クローンA(AF−I細胞系列)由来の細胞を、1%増殖因子低減型マトリゲル(MATRIGEL:登録商標)基質(米国カリフォルニア州のベクトン・ディキンソン社製)を含むコラーゲン型I(ベクトン・ディキンソン社製)中に包理し、6ウェル・トランスウェル・インサート中に1ウェル当たり細胞数5×105個で播種した。継代数6のヒト大動脈内皮細胞(米国メリーランド州のケンブレックス(Cambrex)社製)をウェル底部に播種した。細胞を、5%のウシ胎仔血清(FBS)と、シクロパミン、塩基性線維芽細胞増殖因子(bFGF)、上皮増殖因子(EGF)、骨形態形成蛋白質(BMP)−4〜7、アクチビンA、エキセンジン−4、線維芽細胞増殖因子(FGF)−4、全トランス型レチノイン酸およびγ−セクレターゼ阻害剤を含む増殖因子を補給したDMEM地で14日間、培養した。培養物を1日おきに、供給した。全トランス型レチノイン酸によって処理した細胞は、α−胎仔性蛋白質(AFP)の反応性の向上を示した。アクチビンA、骨形態形成蛋白質(BMP)−4あるいはγ−セクレターゼ阻害剤L−685,458で処理した細胞は、HNF−3β発現反応性を向上させた。50ng/mLという高濃度の骨形態形成蛋白質(BMP)で処理した細胞は、転写因子GATA−4発現反応性を向上させた。50ng/mLの線維芽細胞増殖因子(FGF)−4で処理した細胞は、転写因子PDX−1発現反応性を向上させた(表19)。
【0160】
継代数6のAFCA004(E細胞形態)の細胞系列由来の細胞を、6ウェル培養プレートの各ウェルに5×105個で播種し、集密的PANC−1細胞(ATCC(アメリカン・タイプ・カルチャー・コレクション;米国バージニア州))を他の増殖因子と組み合わせて調整した培地で処理した。基本的な線維芽細胞増殖因子(FGF)、上皮増殖因子(EGF)および塩基性線維芽細胞増殖因子(bFGF)と上皮増殖因子(EGF)との組み合わせは、未処理細胞に対するHNF−3βの発現を100倍まで高めた。基本的な線維芽細胞増殖因子(FGF)、上皮増殖因子(EGF)および骨形態形成蛋白質(BMP)も、14日間の処理後に、ソマトスタチンの発現を活性化した(図16のパネルaおよびパネルb)。
【0161】
同時に得られた知見として、上記結果は、AF細胞を複数の異なる増殖因子で処理することによって、AF細胞が膵臓細胞系列、肝臓細胞系列あるいは消化管細胞系列に分化することができることを示唆している。
【0162】
〔実施例13:ノッチ経路阻害による内胚葉マーカーの発現調節〕
継代数8のAFCA007(AF−I細胞系列)由来の細胞を、ある濃度範囲のノッチ経路阻害剤L−685,458(米国ミズーリ州のシグマ(Sigma)社製)で、3日間〜5日間、処理した。L−685,458の細胞毒性を、MTS検定法(米国ウィスコンシン州のプロメガ(Promega)社製)で細胞の生存力を測定することによって確認した。上記処理後に、Hes−1形質発現性を分析するために、リアルタイムの重合酵素連鎖反応(PCR)検定法を実行した。我々発明者らは、L−685,458がHes−1形質発現性に対する投与量依存型の阻害効果を示したことを確認した(図17のパネルa)。なお、Hes−1は、ノッチ経路の下流側の直接的な標的である。MTS検定法で確認されたように、細胞の生存力に対する効果は、5日間、10μMまでのL−685,458の次の処理では、観察されなかった(図17のパネルb)。
【0163】
〔実施例14:AF−I細胞およびAF−II細胞のサイトカイン抗体アレイ分析〕
継代数10のAFCA007A(AF−I細胞系列)およびAFCA015C(AF−II細胞系列)を、集密度約70%まで増殖させた後、哺乳類細胞溶解キット(米国ミズーリ州のシグマ・アルドリッチ(Sigma−Aldrich)社製)で、細胞溶解物を収集した。米国ジョージア州のレイバイオテック(RayBiotech)社(http://www/raybiotech.com/)から提供されたサイトカイン・アレイ・パネルで、サイトカイン・アレイ分析を完了した。表20は、バックグラウンドを差し引いたデータの標準化後のサイトカイン、サイトカインおよび増殖因子の発現性を示している。各パネルについては、陽性および陰性の対照区も含まれている。上記パネルは、1つの細胞型当たり2つの異なるサンプルについて実施したものである。
【0164】
この明細書全体で引用された文献は、この明細書において参照することによって、その文献全体がこの明細書に組み込まれる。この発明の種々の態様が実施例および好適な実施の形態を参照して示されているが、この発明の範囲が、特許法の精神の下に適切に議論される特許請求の範囲によって規定されるが、先の記述によっては限定されないものと正当に評価されるはずである。
【表1】

【表2】

【表3】

【表4】

【表5】

【表6】

【表7】

【表8】

【表9】

【表10】

【表11−1】

【表11−2】

【表11−3】

【表11−4】

【表11−5】

【表11−6】

【表11−7】

【表11−8】

【表11−9】

【表11−10】

【表11−11】

【表11−12】

【表11−13】

【表11−14】

【表11−15】

【表11−16】

【表11−17】

【表11−18】

【表11−19】

【表11−20】

【表11−21】

【表11−22】

【表12−1】

【表12−2】

【表12−3】

【表12−4】

【表12−5】

【表12−6】

【表12−7】

【表12−8】

【表12−9】

【表12−10】

【表12−11】

【表12−12】

【表12−13】

【表12−14】

【表12−15】

【表12−16】

【表12−17】

【表12−18】

【表12−19】

【表12−20】

【表12−21】

【表12−22】

【表12−23】

【表12−24】

【表12−25】

【表13−1】

【表13−2】

【表13−3】

【表13−4】

【表13−5】

【表13−6】

【表13−7】

【表14−1】

【表14−2】

【表14−3】

【表14−4】

【表15−1】

【表15−2】

【表15−3】

【表15−4】

【表15−5】

【表15−6】

【表15−7】

【表15−8】

【表15−9】

【表15−10】

【表15−11】

【表15−12】

【表15−13】

【表15−14】

【表15−15】

【表15−16】

【表16−1】

【表16−2】

【表16−3】

【表16−4】

【表16−5】

【表16−6】

【表16−7】

【表16−8】

【表16−9】

【表16−10】

【表16−11】

【表16−12】

【表16−13】

【表16−14】

【表16−15】

【表16−16】

【表16−17】

【表16−18】

【表16−19】

【表17−1】

【表17−2】

【表17−3】

【表17−4】

【表17−5】

【表17−6】

【表17−7】

【表17−8】

【表17−9】

【表17−10】

【表17−11】

【表18】

【表19】

【表20−1】

【表20−2】

【表20−3】

【表20−4】

【表21−1】

【表21−2】

【表21−3】

【表21−4】

【表21−5】

【0165】
〔実施の態様〕
以下、この発明の実施の態様を説明する。
(1)実質的に精製された羊水由来細胞の個体群。
(2)実施態様1記載の羊水由来細胞の個体群において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、羊水由来細胞の個体群。
(3)実施態様2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、羊水由来細胞の個体群。
(4)実施態様2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、羊水由来細胞の個体群。
(5)実施態様2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、羊水由来細胞の個体群。
(6)実施態様2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性である、羊水由来細胞の個体群。
(7)実施態様6記載の羊水由来細胞の個体群において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、羊水由来細胞の個体群。
(8)実施態様6記載の羊水由来細胞の個体群において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、羊水由来細胞の個体群。
(9)実施態様1記載の羊水由来細胞の個体群において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、羊水由来細胞の個体群。
(10)実施態様1記載の羊水由来細胞の個体群において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、羊水由来細胞の個体群。
(11)実施態様10記載の羊水由来細胞の個体群において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、羊水由来細胞の個体群。
(12)実施態様10記載の羊水由来細胞の個体群において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、羊水由来細胞の個体群。
(13)実施態様10記載の羊水由来細胞の個体群において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、羊水由来細胞の個体群。
(14)実施態様1記載の羊水由来膵臓細胞の個体群において、
試験管内で増殖可能である、羊水由来膵臓細胞の個体群。
(15)実施態様1記載の羊水由来細胞の個体群において、
低酸素条件下の試験管内で増殖可能である、羊水由来細胞の個体群。
(16)実施態様1記載の羊水由来細胞の個体群において、
β細胞系列の特性を示す細胞に分化可能である、羊水由来細胞の個体群。
(17)実施態様1記載の羊水由来細胞の個体群において、
消化管ホルモン産生細胞に分化可能である、羊水由来細胞の個体群。
(18)羊水から細胞の個体群を採取する方法において、
a.羊水を分離するステップと、
b.前記羊水から前記細胞を分離するステップと、
c.培地中に前記細胞を配置するステップと、
d.培養容器中に前記細胞を播種するステップと、
e.少なくとも5日間、前記培地中で前記細胞を増殖させ、これにより羊水由来細胞の個体群を採取するステップと、
を含む、方法。
(19)実施態様18記載の方法において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、方法。
(20)実施態様19記載の方法において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、方法。
(21)実施態様19記載の方法において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、方法。
(22)実施態様19記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(23)実施態様19記載の方法において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性である、方法。
(24)実施態様23記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
(25)実施態様23記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(26)実施態様18記載の方法において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
(27)実施態様18記載の方法において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、方法。
(28)実施態様27記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
(29)実施態様27記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(30)実施態様27記載の方法において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
(31)実施態様18記載の方法において、
前記個体群の細胞は、試験管内で増殖可能である、方法。
(32)実施態様18記載の方法において、
前記個体群の細胞は、低酸素条件下の試験管内で増殖可能である、方法。
(33)実施態様18記載の方法において、
前記個体群の細胞は、β細胞系列の特性を示す細胞に分化可能である、方法。
(34)実施態様18記載の方法において、前記個体群の細胞は、消化管ホルモン産生細胞に分化可能である、方法。
(35)羊水から細胞の個体群を採取する方法において、
a.羊水を分離するステップと、
b.前記羊水から前記細胞を分離するステップと、
c.SSEA−4、SSEA−3、TRA1−60およびTRA1−81からなる群より選択された少なくとも1つのマーカーを発現させる細胞を選択するステップと、
d.培地中に前記細胞を配置するステップと、
e.培養容器中に前記細胞を播種するステップと、
f.少なくとも5日間、前記培地中で前記細胞を増殖させ、これにより羊水由来細胞の個体群を採取するステップと、
を含む、方法。
(36)実施態様35記載の方法において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、方法。
(37)実施態様36記載の方法において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、方法。
(38)実施態様36記載の方法において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、方法。
(39)実施態様36記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(40)実施態様36記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性である、方法。
(41)実施態様40記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
(42)実施態様40記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(43)実施態様35記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
(44)実施態様40記載の方法において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、方法。
(45)実施態様44記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
(46)実施態様44記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(47)実施態様44記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
(48)実施態様35記載の方法において、
前記個体群の細胞は、試験管内で増殖可能である、方法。
(49)実施態様35記載の方法において、
前記個体群の細胞は、低酸素条件下の試験管内で増殖可能である、方法。
(50)実施態様35記載の方法において、
前記個体群の細胞は、β細胞系列の特性を示す細胞に分化可能である、方法。
(51)実施態様35記載の方法において、
前記個体群の細胞は、消化管ホルモン産生細胞に分化可能である、方法。
(52)糖尿病患者あるいは糖尿病発症のリスクを負う者を治療するための方法において、
a.ドナーから採取した羊水由来細胞の個体群を分離するステップと、
b.前記患者に前記羊水由来細胞を移すステップを含む、方法。
(53)実施態様52記載の方法において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、方法。
(54)実施態様53記載の方法において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、方法。
(55)実施態様53記載の方法において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、方法。
(56)実施態様53記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(57)実施態様53記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性である、方法。
(58)実施態様57記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
(59)実施態様57記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(60)実施態様52記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
(61)実施態様57記載の方法において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、方法。
(62)実施態様61記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
(63)実施態様61記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(64)実施態様61記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
(65)実施態様52記載の方法において、
前記個体群の細胞は、前記患者に移すステップの前に、膵臓ホルモン産生細胞に分化される、方法。
(66)実施態様52記載の方法において、
前記個体群の細胞は、前記患者に移すステップの後に、膵臓ホルモン産生細胞に分化される、方法。
(67)実施態様52記載の方法において、
前記個体群の細胞は、試験管内で増殖可能である、方法。
(68)実施態様52記載の方法において、
前記個体群の細胞は、低酸素条件下の試験管内で増殖可能である、方法。
(69)実施態様52記載の方法において、
前記個体群の細胞は、β細胞系列の特性を示す細胞に分化可能である、方法。
(70)実施態様52記載の方法において、
前記個体群の細胞は、消化管ホルモン産生細胞に分化可能である、方法。
【図面の簡単な説明】
【0166】
【図1】この発明の羊水由来細胞を分離するのに用いられる分離ステップおよび培養ステップを示している。
【図2】継代数ゼロの羊水サンプルから分離された細胞の3つの特徴的な形態を示すもので、a)は羊水細胞の形態、b)は上皮細胞の形態、およびc)は線維芽細胞の形態である。
【図3】羊水由来のAF−I細胞上の細胞表面マーカーの発現を示している。これらのマーカーはパネルa〜n上に示されている。
【図4】羊水由来のF細胞上の細胞表面マーカーの発現を示している。これらのマーカーはパネルa〜l上に示されている。
【図5】羊水由来のE細胞上の細胞表面マーカーの発現を示している。これらのマーカーはパネルa〜m上に示されている。
【図6】羊水サンプル由来のF細胞の免疫蛍光像を示している。F細胞は、a)ビメンチン、b)発生段階特異性胚抗原(SSEA)−4、およびc)βIIIチューブリンに関して染色陽性を示した。
【図7】羊水サンプル由来のE細胞の免疫蛍光像を示している。E細胞は、a)ビメンチンおよびネスチン、b)発生段階特異性胚抗原(SSEA)−4、c)βIIIチューブリン、g)全サイトケラチン、h)平滑筋アクチン、およびi)サイトケラチン−19に関して染色陽性を示した。
【図8】羊水サンプル由来のAF−I細胞の免疫蛍光像を示している。AF−I細胞は、a)ビメンチンおよびネスチン、b)βIIIチューブリン、c)サイトケラチン−19およびHes−1、d)全サイトケラチン、e)発生段階特異性胚抗原(SSEA)−4、f)SOX−17およびZO−1、g)GATA−6、h)HNF−1β、およびi)平滑筋アクチンおよびHES−2に関して染色陽性を示した。
【図9】この発明のAF−I細胞、AF−II細胞およびAF−III細胞の発現プロファイルを示している。
【図10】初期継代のAF−I培養細胞の個体群の増殖曲線を示している。
【図11】異なるドナー由来のAF細胞、F細胞あるいはE細胞の増殖能を示している。図中記号◆は、妊娠期間の14週〜23週の第1ドナーの羊水から採取した、AF−I細胞形態を有する羊水由来細胞の細胞数を示している。5番培地(表II)で、細胞を培養した。図中記号▲は、妊娠期間の14週〜23週の第2ドナーの羊水から採取した、AF−I細胞形態を有する羊水由来細胞の細胞数を示している。5番培地(表II)で、細胞を培養した。図中記号■は、妊娠期間の14週〜23週の第3ドナーの羊水から採取した、F細胞形態を有する羊水由来細胞の細胞数を示している。15番培地(表II)で、細胞を培養した。図中記号*は、妊娠期間の14週〜23週の第4ドナーの羊水から採取した、F細胞形態を有する羊水由来細胞の細胞数を示している。16番培地(表II)で、細胞を培養した。図中記号●は、妊娠期間の14週〜23週のドナーの羊水から採取した、E細胞形態を有する羊水由来細胞の細胞数を示している。5番培地(表II)で、細胞を培養した。図中記号+は、妊娠期間の14週〜23週の第2ドナーの羊水から採取した、AF−II細胞形態を有する羊水由来細胞の細胞数を示している。5番培地(表II)で、細胞を培養した。図中記号△は、妊娠期間の14週〜23週の第2ドナーの羊水から採取した、AF−III細胞形態を有する羊水由来細胞の細胞数を示している。5番培地(表II)で、細胞を培養した。
【図12】アムニオマックス(AMNIOMAX:商品名)完全培地あるいは10%のウシ胎仔血清(FBS)添加DM−LG培地のいずれかにおいて、中程度の継代数(1継代当たり細胞集団倍加数:約40回)で培養されたAF−I細胞系列のテロメア長を示している。区分1は分子量の階段状分布であり、区分2は、テロメア長が高い位置にある対照区であり、区分3は、テロメア長が低い位置にある対照区であり、区分4は、ドナーから採取された羊水由来細胞であって、10%のウシ胎仔血清(FBS)添加DMEM−LG培地において、継代数12で培養された羊水由来細胞であり、区分5は、区分4と同一のドナーから採取された羊水由来細胞であって、5番培地において、継代数12で培養された羊水由来細胞であり、区分6は、陽性の対照区としての胚性癌腫細胞系列(NTERA細胞)である。
【図13】継代数7回〜9回(1継代当たり細胞集団倍加数:約30〜35回)で培養されたa)AF−I細胞、b)AF−II細胞およびc)AF−III細胞の核型を示している。
【図14】満期分娩時(約38週)における1つのドナーからの単一の羊水由来細胞の増殖能を示している。5番培地(表II)で、細胞を培養した。
【図15】異種の羊水由来細胞型間の形質発現プロファイルを分散プロットで示している。各プロットのピアソン相関係数も示されている。
【図16】羊水由来細胞内での形質発現における増殖因子の効果を示している。羊水由来細胞を単一のドナーから採取し、PANC−1細胞の培養液から採取した調整培地で12日間、培養した。表示された増殖因子を調整培地に補給した。リアルタイムのポリメラーゼ連鎖反応法(PCR)によって、HNF−3βおよびソマトスタチンの発現レベルを確認した。較正物質としてヒト膵臓由来の全リボ核酸(RNA)を含めた。パネルaは、HNF−3β発現の変化を示している。パネルbは、ソマトスタチン発現の変化を示している。
【図17】羊水(AF)細胞の形態を有する羊水由来培養細胞上でのL−685,458の効果を示している。パネルaは、表示された濃度のL−685,458で処理された羊水(AF)培養細胞内で、ヒトHes−1のRNA形質発現の相対的な差異を示している。パネルbは、L−685,458処理後に、上記培養細胞の生存力に対するL−685,458の効果を示している。細胞を、表示濃度で3日間、処理した。細胞毒性に対応する生存力の変化を、細胞の生存力の低下が490nmの波長での吸光度の減少に対応するMTS検定法で検出した。
【開示の内容】
【0001】
〔関連出願〕
この出願は、米国出願データ:2005年5月27日付けの仮出願No60/685,607号および2006年3月27日付けの仮出願No60/743,821号に関連するものである。
【0002】
〔発明の分野〕
この発明は、β細胞系列に分化することができ、個体群が増殖可能な羊水由来細胞に関するものである。また、この発明は、上記羊水由来細胞を分離し、かつ増殖させるための方法ばかりでなく、糖尿病治療において、上記羊水由来細胞を利用する方法および上記羊水由来細胞を利用した組成物を提供するものである。
【0003】
〔発明の背景〕
器官機能の低下は、先天的な欠陥、外傷、あるいは疾患に起因することがある。器官機能の低下を引き起こす疾患の一例は、真性糖尿病、すなわち糖尿病である。ほとんどの糖尿病の場合は、2つの臨床型に分類される。1型は、若年型糖尿病またはインスリン依存性真性糖尿病(IDDM)としても知られており、2型は成人発症性糖尿病としても知られている。各型は、予後、治療および発症原因が異なっている。両型は、患者の血糖値の調節不能によって特徴付けられる。その結果、糖分が細胞に入ることができず、代謝要求量を満たすことができないので、血糖値は高い値に上昇する。血糖を適切に代謝することができないということは、最初に、例えば高血糖症、過度の空腹感、口渇感、多尿症および糖尿がみられ、その後に、ニューロパシー、巨大血管疾患および微小血管疾患へ段階的に拡大してゆく、初期症状および末期症状が複合化した一連の総体的症状を引き起こすことを示すものである。
【0004】
1型糖尿病の一般的な治療方法には、典型的には、注射器あるいはポンプのいずれかで注入することによる外因性インスリン投与が含まれる。この方法は、血糖値を完全に正常化せず、しばしば低血糖症の発症リスク増加に関連している。低血糖症のリスクが増加する場合は、より有効な血糖調節を実現することができる。仮に膵臓の機能が臓器移植あるいは細胞(移植)治療によって回復あるいは活性化できる場合には、より有効な血糖調節を実現することができる。
【0005】
現在、糖尿病を治療するために用いられる多くの臓器移植治療が存在する。このような治療方法の1つには、分離した膵島を糖尿病患者へ移植する方法がある。ヒト膵島移植を行う上で、越えるべき大きなハードルの1つは、多くの糖尿病患者を治療するのに十分な数の膵島がないことである。膵島の不足に対する1つの実現可能な解決策は、交代細胞源からの膵島の生成である。
【0006】
成人体組織由来の前駆細胞が膵臓β細胞フェノタイプに分化することができるとの記録がある。例えば、国際出願WO2004/087885A2、ヘス(Hess)らによる文献(ネイチャーバイオテクノロジー2003年、第21巻第763頁〜第770頁)およびイアナス(Ianus)らによる文献(「臨床研究誌(J. Clin. Invest.)」2003年、第111巻第843頁〜第850頁)を参照されたい。これらの文献は、試験管内で、膵臓β細胞の特性を有する細胞に分化するか、あるいは生体内で機能低下した膵臓を再生するのに役立つ栄養因子を分泌する成人骨髄細胞由来の細胞の能力を報告している。
【0007】
膵臓細胞に分化できる他の前駆細胞源の中には、げっ歯類肝臓由来の楕円形幹細胞(国際出願WO03/033697)および分娩後胎盤(米国出願公開2004/0161419A1)が含まれる。
【0008】
β細胞を含む膵島の内分泌細胞は、アポトーシスおよび新しい膵島細胞(新生)の増殖の過程によって、常に入れ替わっている。そういうものであるから、膵臓は、膵臓ホルモン産生細胞に分化できる前駆細胞源であると考えられる。膵臓から分離され、かつ膵臓前駆細胞の潜在的な供給源として、形態学的に明瞭な3つの組織型である、膵島濃縮画分、脈管濃縮画分および腺房細胞濃縮画分が存在している。
【0009】
膵臓組織粗抽出物からの前駆細胞あるいは部分的に分化した細胞の分離は、細胞表面マーカーに対して生成された抗体を用いて実現可能である。例えば、米国出願公開2004/0241761は、ErbB2、ErbB3、ErbB4、Msx−2、PDX−1を発現したマウス細胞およびインスリンの分離を開示している。
【0010】
ゲルシェンゴーン(Gershengorn)らによる文献(サイエンス2004年、第306巻第2261頁〜第2264頁)は、膵島様の細胞凝集体を構成できた増殖細胞の生成方法を教示している。これらの増殖細胞は、分離されたヒト膵島の試験管内培養液から出現した粘着細胞の不均質な個体群に由来したものである。分離された膵島は、当初、組織培養プレート上に植えられ、10%血清を含有する培地内で培養されている。線維芽細胞様の細胞については、培養された膵島から出て移動し、かつ単一膜を形成する点が観察された。これらの細胞は、ネスチン(Nestin)、平滑筋アクチンおよびビメンチンを発現させるものである。
【0011】
また、膵臓前駆細胞は、シーバーグ(Seaberg)らによる文献(ネイチャーバイオテクノロジー2004年、第22巻第1115頁〜第1124頁)によって開示されているように、単一細胞に切り離された膵島および脈管組織の培養液から生成してもよい。シーバーグ(Seaberg)らによって開示されたマウス前駆細胞は、増殖中にネスチン(Nestin)を発現させるものである。
【0012】
米国出願公開2003/0082155は、幹細胞の機能および分子特性を有するヒト膵臓の膵島由来の細胞個体群を分離し、かつ同定する方法を開示している。特に、これらの分離細胞は、ネスチン(Nestin)染色陽性、ネスチン(Nestin)形質発現性、GLP−1R染色陽性、GLP−1R形質発現性、ABCG2染色陽性、ABCG2形質発現性、Oct3/4染色陽性、Oct3/4形質発現性、ラトロフィリン(latrophilin)(2型)染色陽性、ラトロフィリン(latrophilin)(2型)形質発現性、Hes−1染色陽性、Hes−1形質発現性、インテグリンサブユニットα6およびβ1染色陽性、インテグリンサブユニットα6およびβ1形質発現性、c−kit染色陽性、c−kit形質発現性、MDR−1染色陽性、MDR−1形質発現性、SST−R,2,3,4染色陽性、SST−R,2,3,4形質発現性、SUR−1染色陽性、SUR−1形質発現性、Kir6.2染色陽性、Kir6.2形質発現性、CD34染色陰性、CD45染色陰性、CD133染色陰性、MHCクラスI染色陰性、MHCクラスII染色陰性、サイトケラチン−19染色陰性、培養液中での長期増殖、培養液中での擬似膵島への分化能によって特徴付けされている。
【0013】
米国特許第5,834,308号、米国特許第6,001,647号および米国特許第6,703,017号に開示されているように、他の取り組みでは、NODマウス由来の膵島培養液の粗サンプルは、1年以上にわたって、増殖培養液中で保持され、かつインスリンを分泌できる膵島様の個体群に分化する能力を実証するように見える上皮様の培養物を作り出すのに使用可能である。
【0014】
膵島様の構造体は、ボナー・ワイア(Bonner−Weir)らによる文献(「自然科学アカデミー会報(Proc Nat Acad Sci)」2000年、第97巻第7999頁〜第8004頁)および米国特許第6,815,203B1に開示されているように、脈管組織を濃縮したヒト膵臓消化物画分から生成されてもよい。これらの文献に開示された膵島様の塊は、サイトケラチン−19染色が陽性となり、インスリンとの免疫活性を示している。
【0015】
国際出願2004/011621は、ヒト膵臓の脈管画分からインスリン陰性粘着細胞を生成する方法を開示している。
【0016】
国際出願03/102134は、ヒト膵臓消化物の腺房画分からサイトケラチン−19陽性の上皮細胞を生成する方法を開示している。この生成された上皮細胞は、誘導培地の存在下で、限定的に増殖し、かつインスリン産生細胞に分化することができる。
【0017】
米国出願公開2004/015805A1は、ヒト膵臓幹細胞サブセットが細胞表面マーカーCD56(NCAMとしても知られている)へのリガンドを用いて分離可能であると報告している。これらの細胞は、インスリン産生細胞およびインスリン産生凝集体に分化することができる。
【0018】
胎仔組織あるいは胚組織由来の前駆細胞が膵臓ホルモン産生細胞に分化する可能性があることが記録されている。例えば、ヒト胎仔あるいは胚由来の細胞がβ細胞系列に分化する可能性を報告する米国特許第6,436,704号、国際出願03/062405、国際出願WO02/092756および欧州特許出願0363125A2を参照されたい。
【0019】
ヒト胚性幹細胞(hES)は、受精卵の胚発達初期において胚盤胞の内細胞塊に由来するものである。胚盤胞は、胚が子宮壁内に着床する前の段階、胚の着床前期である。トンプソン(Thompson)およびその同僚によって記述された条件(トンプソン(Thompson)らによる文献(「自然科学アカデミー会報」1995年、第92巻第7844頁〜第7848頁);トンプソン(Thompson)らによる文献(「サイエンス」1998年、第282巻第1145頁〜第1147頁);マーシャル(Marshall)らによる文献(「分子生物学体系(Methods Mol. Biol.)」2001年、第158巻第11頁〜第18頁))に従って、不活性化された支持細胞層上で培養された場合には、胚盤胞の細胞内層は、試験管内で、未分化状態で無限に増殖可能である。正常に増殖したヒト胚性幹細胞(hES)は、多能性すなわち三胚葉である外胚葉(Ec)、中胚葉(Me)および内胚葉(En)に分化する能力を維持しながら、倍加する無限の可能性を有している。多能性のヒト胚性幹細胞(hES)として増殖した場合には、その細胞は倍数性の核型を維持し、老化現象に陥らない。
【0020】
ヒト胚性幹細胞(hES)は、特異的な転写因子OCT−4、NANOG、SOX−2、FGF−4およびREX−1を発現させることに加えて、細胞表面抗原の別の群であるSSEA−3、SSEA−4、TRA−2−54(アルカリ性脱リン酸酵素)、TRA−1−60およびTRA−1−81を呈するものである(ヘンダーソン(Henderson)らによる文献(幹細胞(Stem Cells)2002年、第20巻第329頁〜第337頁)、ドレーパー(Draper)らによる文献(「解剖学会誌(J. Anat.)」2002年、第200巻第249頁〜第258頁)、ミツイ(Mitsui)らによる文献(「細胞(Cell)」2003年、第113巻第631頁〜第642頁)、チェンバース(Chambers)らによる文献(「細胞」2003年、第113巻第643頁〜第655頁))。
【0021】
しかしながら、上記文献から、ヒト胚細胞が、多能性を拡大し維持するための支持細胞層、あるいは、例えばマトリゲル(MATRIGEL:登録商標)等の複合細胞外基質に調整培地を加えた組み合わせを、しばしば必要とする点について留意することは重要である。しかし、これらの条件は、細胞数を容易に拡大すること、および糖尿病を治療するための決定的な細胞(移植)治療を可能にするものではない。
【0022】
研究者は、非胚性の幹細胞(“成人幹細胞”)が、胚性幹細胞のように多くの異なる組織型に分化することができないことから、胚性幹細胞がまだ成人幹細胞の使用に比べて優位に立っていることを見出している。しかしながら、細胞が“胚盤胞”期における胚に由来していることは、胚性幹細胞の分離を妨げる壁の1つである。ヒト胚性幹細胞の研究は、感情的に告発された政治的および倫理的な議論によって妨げられており、成果を上げるのに、おそらく何年もかかりそうである。
【0023】
さらに、ヒト胚性幹細胞(hES)は、免疫疾患を有する動物、すなわち分娩後の状況で、組織中に注入された場合には、腫瘍化するのに対して、成人幹細胞では腫瘍化しないことが見出された。ヒト胚性幹細胞(hES)の腫瘍化の性状については、頻繁に取り扱われることはないが、この組織は、将来、細胞置換治療に使用される重責を担う可能性がある。ヒト胚性幹細胞(hES)およびこれらの腫瘍化特性を巡る政治的、道徳的および倫理的な論争ばかりでなく、遺伝的に正常なゲノムを維持しながら、培養液中で未分化の成人幹細胞を増殖させる場合に認識された困難性は、ヒト細胞置換治療の開発にとって大きな障壁である。
【0024】
多能性すなわち組織幹細胞は、絨毛膜絨毛および羊水から分離されている。多くの羊膜細胞および胎盤細胞は、共通の起源、すなわち胚自体、卵黄嚢、絨毛膜絨毛の間葉細胞核、絨毛膜および羊膜の元となる柔実胚の内細胞塊を共有している(クレン(Crane)およびチュン(Cheung)による文献(「分娩前診断(Prenatal Diagnosis)」1988年、第8巻第119頁〜第129頁))。三胚葉のすべてに由来する胚細胞および胎児細胞は、長期間、羊水中で確認されている(ミルンスキー(Milunsky)による文献(米国ニューヨーク州のプレナム出版社(Plenum Press)1979年発行、第75頁〜第84頁の「胎仔の遺伝的疾患(Genetic Disorder of the Fetus)」)、ホーン(Hoehn)およびサルク(Salk)による文献(「細胞生物学(Methods in Cell Biology)」1982年、第26巻第11頁〜第34頁)、ゴスデン(Gosden)による文献(「英国医学報告(British Medical Bulletin)」1983年、第39巻第348頁〜第354頁)、プルサ(Prusa)らによる文献(「ヒト再生(Human Reproduction)」2003年、第18巻第1489頁〜第1493頁))。したがって、羊水は、胚性様および胎仔様の幹細胞に、最小限侵襲的に到達する機会を与えるものである。
【0025】
羊水由来細胞は、胎仔の染色体疾患を検出するのに日常的に用いられている。羊水は、典型的には、第2妊娠3半期(妊娠期間の16週目〜22週目)中にサンプルが採取される。先行技術では、特異的な形態学的細胞:“線維芽細胞性(F)”細胞、“羊水(AF)”由来細胞および“上皮性(E)”細胞を有する3つの部分個体群の存在を明らかに実証している。“線維芽細胞性(F)”細胞および“羊水(AF)”由来細胞は急速に増殖するのに対して、“上皮性(E)”細胞は非常に遅い増殖曲線を示し、低いクローン効率を有している。
【0026】
例えば、特許協力条約(PCT)による国際出願WO2003/042405は、絨毛膜絨毛、羊水および胎盤からのc−Kit染色陽性幹細胞の分離を開示している(細胞1、表1参照)。
【0027】
他の例では、米国出願公開2005/0054093は、羊水からの幹細胞の分離を開示している。これらの幹細胞は、発生段階特異性胚抗原―3(SSEA−3)、発生段階特異性胚抗原―4(SSEA−4)、TRA1−60、TRA1−81、TRA 2−54、Oct−4、HLAクラスI、CD13、CD44、CD49bおよびCD105(細胞2、表1参照)を発現させるものである。
【0028】
他の例では、胎仔細胞は、羊水から分離されている(アンカー(Anker)らによる文献(「血液(Blood)」2003年、第102巻第1548頁〜第1549頁))。この文献に開示された細胞は、次のマーカー:CD44、CD73、CD90、CD105、CD106、およびHLA−A,B&Cの形質発現性に関して陽性である。これらの細胞は、次のマーカー:c−Kit(CD117)、CD11、CD31、CD34、CD45およびHLA−Dの形質発現性に関して陰性である(細胞3、表1参照)。
【0029】
また、羊水から分離された間葉幹細胞の個体群は、ツアイ(Tsai)らによる文献(「ヒト再生(Human Reproduction)」2004年、第19巻第1450頁〜第1456頁)に報告されている。この文献に開示された細胞は、次のマーカー:CD29、CD44、CD73、CD90およびHLA−A,B&Cの形質発現性に関して陽性である。また、これらの細胞は、胚性転写因子OCT−4の形質発現性に関して陽性である。上記細胞は、次のマーカー:c−Kit(CD117)、CD34およびHLA−Dの形質発現性に関して陰性である(細胞4、表1参照)。
【0030】
近年の刊行物および特許文献は、線維芽細胞性の羊水あるいは上皮部分個体群内に、ヒト胚細胞のいくつかの特性として、表面マーカーSSEA−3およびSSEA−4の形質発現性、転写因子OCT−4の形質発現性、高い増殖能、および多数の細胞型への分化能などを呈する細胞個体群が存在することを示唆しているが、ESマーカーSSEA−4の形質発現性を維持しながら、初期段階の内胚葉性マーカーの重要な形質発現性として、HNF−1β、HNF−3β、SOX−17およびGATA−6などを呈する細胞の部分個体群の存在を示す先行文献はない。
【0031】
HNF−1β、HNF−3β(FOXa2としても知られている)、SOX−17およびGATA−6に共通する形質発現性は、原腸形成中に、内胚葉の決定的な形成方法を規定する重要なステップとしてみなされている。したがって、上記マーカーの形質発現性は、羊水由来細胞から、膵臓β細胞の個体群、あるいは膵臓ホルモン産生細胞の個体群、あるいは消化管ホルモン産生細胞を生成する上で、重要となる可能性がある。
【0032】
したがって、現在の臨床的要請に応えるために、最終的な内胚葉、あるいは膵臓ホルモン産生細胞の個体群、あるいは消化管ホルモン産生細胞、あるいはβ細胞系列への分化能を維持しながら増殖できる羊水由来細胞系列を樹立するための培養条件を開発するという重要な要請が解決されなければならない。
【0033】
〔発明の概要〕
1つの実施の形態では、この発明は、哺乳類の羊水由来細胞を分離する方法を提供するものである。この発明によれば、羊水由来細胞は、妊娠期間の約14週目〜約23週目までの羊水サンプルから採取される。これに代えて、羊水由来細胞は、妊娠期間の約23週目〜約40週目までの羊水サンプルから採取される。
【0034】
1つの実施の形態では、培養液は、低酸素条件(酸素濃度:3%)下で、少なくとも5日間〜10日間、静かに放置される。これに代えて、培養液は、正常酸素条件(酸素濃度:約20%)下で、少なくとも5日間〜10日間、静かに放置される。
【0035】
他の実施の形態では、羊水由来細胞は、妊娠期間の第2妊娠3半期中の羊水サンプルから採取される。これに代えて、羊水由来細胞は、妊娠期間の第3妊娠3半期中の羊水サンプルから採取される。
【0036】
1つの実施の形態では、培養された羊水由来細胞は、単一細胞として分離され、クローン増殖される。
【0037】
この発明による方法に従って分離された羊水由来細胞は、例えば、羊水由来細胞によって発現する蛋白質マーカーを特異的に認識し、羊水由来細胞を同定し、かつ選択し、これにより実質的に精製された羊水由来細胞の個体群を得ることができる試薬(抗体等)と接触させてもよい。ここで、認識された蛋白質マーカーは少なくとも50%の細胞個体群中で発現する。
【0038】
1つの実施の形態では、結果として得られた羊水由来細胞の個体群は、次のマーカー:HNF−1β、HNF−3β、SOX−17あるいはGATA−6のうち、少なくとも1つのマーカーに関して実質的に陽性である。羊水由来細胞の個体群は、次のマーカー:CD117、Oct−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である。この羊水由来細胞の個体群は、HNF−1β、HNF−3β、SOX−17あるいはGATA−6を発現させる能力を喪失することなく、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0039】
1つの実施の形態では、羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、HNF−1β、HNF−3β、SOX−17あるいはGATA−6を発現させる能力を喪失することなく、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0040】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞の個体群は、次のマーカー:SOX−17、CD117、OCT−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である。羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、50回を超える回数の自己複製を繰り返して増殖することができる。
【0041】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞の個体群は、サイトケラチンと、次のマーカー:SOX−17、CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーとに関して実質的に陰性である。羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0042】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞の個体群は、SOX−17に関して実質的に陰性である。羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0043】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞の個体群は、次のマーカー:サイトケラチンと、SOX−17とに関して実質的に陰性である。羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0044】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞の個体群は、SOX−17に関して実質的に陰性である。さらに、羊水由来細胞の個体群は、次のマーカー:CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である。羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0045】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞の個体群は、次のマーカー:サイトケラチンおよびSOX−17に関して実質的に陰性である。さらに、羊水由来細胞の個体群は、次のマーカー:CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である。羊水由来細胞の個体群は、次のマーカー:SSEA−4およびCD44に関して実質的に陽性である。この羊水由来細胞の個体群は、50回を超える回数の細胞集団倍加を繰り返して増殖することができる。
【0046】
他の実施の形態では、この発明は、次のマーカー:CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である、分離精製された羊水由来細胞の個体群を提供するものである。
【0047】
他の実施の形態では、この発明は、次のマーカー:SOX−17、CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である、分離精製された羊水由来細胞の個体群を提供するものである。
【0048】
他の実施の形態では、この発明は、SOX−17に関して実質的に陰性である、分離精製された羊水由来細胞の個体群を提供するものである。
【0049】
他の実施の形態では、この発明は、SOX−17に関して実質的に陰性であり、かつ次のマーカー:CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーに関して実質的に陰性である、分離精製された羊水由来細胞の個体群を提供するものである。
【0050】
1つの実施の形態では、この発明による方法に従って分離された羊水由来細胞は、Musashi−1およびHes−1のうち、少なくとも1つを発現させてもよい。
【0051】
この発明によって分離され、かつ増殖された羊水由来細胞を、適切な試験管内あるいは生体内で、誘導してβ細胞系列の細胞に分化することができる。したがって、この発明によって選択され、かつ増殖された羊水由来細胞並びに羊水由来細胞に由来する分化細胞は、1型および2型の糖尿病を治療するのに有用である。
【0052】
この発明によって分離され、かつ増殖された羊水由来細胞を、適切な試験管内あるいは生体内で、消化管ホルモン産生細胞に誘導することができる。1つの実施の形態では、この発明によって分離され、かつ増殖された羊水由来細胞は、適切な試験管内あるいは生体内で、消化管ホルモン産生細胞に誘導することができると共に、糖反応法でインスリンを発現させてもよい。
【0053】
〔発明の詳細な説明〕
開示内容を明確にするため、およびこの発明を限定しないものとして、この発明の詳細な記述は、この発明の一定の特徴、実施の形態あるいは用途を記述するか、あるいは図示する次のサブセクションに分けられている。
【0054】
この発明は、高い増殖能を有し、かつ胚様の特性を呈する羊水由来細胞の個体群を分離するための方法に関するものである。同様の細胞は、絨毛膜絨毛内にも存在する可能性がある。この明細書に開示された発明の実施の形態の一部では、羊水由来細胞の、形態学的に明瞭な3つの個体群: “線維芽細胞性(F)”細胞、“上皮性(E)”細胞および“羊水(AF)”由来細胞を記述している。
【0055】
〔定義〕
“β細胞系列”とは、転写因子PDX−1と、次の転写因子:NGN−3、Nkx2.2、Nkx6.1、ニューロD、Isl−1、HNF−3β、MAFA、Pax4およびPax6のうち、少なくとも1つの転写因子とに対する形質発現が陽性である細胞を意味する。この技術分野における当業者にとっては、上記β細胞系列の細胞特性は、周知であり、上記β細胞系列の他の特性の確認を続行する。上記転写因子は、内分泌細胞の同定に関する従来技術において十分に確立されている(「ネイチャー遺伝学概要(Nature Reviews Genetics)」2002年、第3巻第524頁〜第632頁)。
【0056】
“膵島様の構造体”とは、この発明の方法を実施することによって導き出され、膵島の外観を有する細胞の三次元塊を意味する。膵島様の構造体内の細胞は、少なくとも上記PDX−1遺伝子と、グルカゴン、ソマトスタチンあるいはインスリンから選択された1つのホルモンとを発現させるものである。
【0057】
用語“低酸素性”とは、20%を下回る酸素濃度を意味し、好ましくは10%を下回る酸素濃度を意味し、より好ましくは5%を下回るが、1%を上回る酸素濃度を意味する。
【0058】
用語“正常酸素性”とは、約20%の大気酸素濃度を意味する。
【0059】
用語“実質的に陽性”とは、ある特定のマーカー(膜受容体、細胞質蛋白質または核蛋白質あるいは転写因子等)の形質発現性に関して細胞の個体群に関連して使用された場合に、上記マーカーが、細胞個体群の総数の少なくとも約50%、あるいは少なくとも約60%、あるいは少なくとも約70%に存在する、あるいは発現することを意味する。
【0060】
用語“実質的に陰性”とは、ある特定のマーカー(膜受容体、細胞質蛋白質または核蛋白質あるいは転写因子等)の形質発現性に関して細胞の個体群に関連して使用された場合に、上記マーカーが、細胞個体群の総数の少なくとも約70%、あるいは少なくとも約80%、あるいは少なくとも約90%に存在しない、あるいは発現しないことを意味する。
【0061】
この明細書で用いられている“幹細胞”とは、生体内あるいは生体外のいずれにおいても高度に増殖することができ、かつ他の細胞型に分化することができる未分化細胞を意味する。
【0062】
“前駆細胞”とは、分化によって幹細胞から導き出され、かつより成熟細胞型にさらに分化することができる細胞を意味する。前駆細胞は、典型的には、幹細胞と比較して、より制限的な増殖能を有している。
【0063】
“増殖可能な個体群”とは、細胞培養系内で少なくとも50回またはそれ以上の細胞分裂を経て、増殖される分離細胞の個体群の能力を意味する。
【0064】
“未分化細胞”とは、羊水から分離された細胞に関連して使用された場合に、PDX−1またはインスリンの形質発現性に関して実質的に陰性である羊水由来細胞の個体群を意味する。
【0065】
“分化細胞”とは、羊水から分離された細胞に関連して使用された場合に、PDX−1またはインスリンの形質発現性に関して実質的に陽性である羊水由来細胞の個体群を意味する。
【0066】
この明細書で用いられている“マーカー”は、対象細胞内で分化的に発現する核酸あるいはポリペプチド分子である。この文脈において、分化的な発現とは、陽性マーカーに関してはマーカー濃度の増加を意味し、陰性マーカーに関してはマーカー濃度の低下を意味する。マーカーとしての核酸あるいはポリペプチドの検出可能レベルは、対象外の細胞と比較して、対象細胞内で、十分に高いか、あるいは低いものであり、これにより、この技術分野において公知である種々の方法のすべてを用いて、対象細胞が同定され、かつ他の細胞との間で、識別可能である。
【0067】
“c−Kit”および“CD117”とは、共に、遺伝子保存機関(GenBank)寄託番号X06182に開示された配列を有するか、あるいは自然に出現する変異型配列を有する細胞表面受容体としてのチロシンキナーゼを意味する。
【0068】
また、“CD9”とは、“運動性関連蛋白質−1(MRP−1)”を意味し、細胞接着、運動性、増殖能および分化能に関係した膜貫通糖蛋白質である。
【0069】
また、“CD10”とは、“急性リンパ性白血病の共通抗原(CALLA)”を意味する。CD10は、中性の金属結合型蛋白質分解酵素活性(metalloendopeptidase)を有する細胞表面酵素であり、リンパ芽球性リンパ腫、バーキット型リンパ腫、および小胞性胚中心リンパ腫内で、および慢性骨髄性白血病患者内で発現する。また、CD10は、平均的な初期リンパ様前駆細胞、成人骨髄内の未成熟B細胞およびリンパ系組織内の胚中心B細胞表面上で発現する。また、CD10は、胸部筋上皮細胞、毛細胆管、線維芽細胞、腎臓の刷子縁および消化管上皮細胞上に存在している。
【0070】
また、“CD44”とは、“ヘルメス抗原”を意味し、ヒアルロナン用の主要な細胞表面受容体である。このCD44は、主に、肝細胞、上皮細胞の一部および心筋等の組織/細胞を除き、ほとんどの細胞型で発現する。
【0071】
また、“CD49f”とは、“a6インテグリン”および“VLA−6”を意味し、ラミニンを結合するインテグリンサブユニットβ1に関係している。CD49fは、主に、上皮細胞、栄養芽細胞、血小板および単核白血球上で、発現する。
【0072】
また、“CD73”とは、“外側−5´−ヌクレオチダーゼ”を意味し、CD73は、主に、B細胞およびT細胞のサブセット、骨髄間質細胞、種々の上皮細胞、線維芽細胞および内皮細胞上で、発現する。
【0073】
また、“CD90”とは、“Thy−1”を意味し、CD90は、主に、造血幹細胞、結合組織細胞および種々の線維芽細胞および間質細胞上で、発現する。
【0074】
“SSEA−1”(発生段階特異性胚抗原―1)は、マウス奇形幹細胞(EC)、マウスおよびヒトの胚芽細胞(EG)およびマウス胚性幹細胞(ES)の表面上に存在する糖脂質表面抗原である。
【0075】
“SSEA−3”(発生段階特異性胚抗原―3)は、ヒト奇形幹細胞(EC)、ヒト胚芽細胞(EG)およびヒト胚性幹細胞(ES)の表面上に存在する糖脂質表面抗原である。
【0076】
“SSEA−4”(発生段階特異性胚抗原―4)は、ヒト奇形幹細胞(EC)、ヒト胚芽細胞(EG)およびヒト胚性幹細胞(ES)の表面上に存在する糖脂質表面抗原である。
【0077】
“TRA1−60”は、ヒト奇形幹細胞(EC)、ヒト胚芽細胞(EG)およびヒト胚性幹細胞(ES)の表面上で発現するケラチン硫酸塩関連抗原である。
【0078】
“TRA1−81”は、ヒト奇形幹細胞(EC)、ヒト胚芽細胞(EG)およびヒト胚性幹細胞(ES)の表面上で発現するケラチン硫酸塩関連抗原である。
【0079】
“TRA2−49”は、ヒト奇形幹細胞(EC)およびヒト胚性幹細胞(ES)の表面上で発現するアルカリ性脱リン酸酵素のアイソザイムである。
【0080】
“Oct−4”は、POUドメイン転写因子の要素であり、多能性の幹細胞の証しとして広く見なされている。OCT−4と多能性の幹細胞との関係は、未分化状態の多能性の幹細胞への厳しく制限された形質発現によって示されている。体細胞系列への分化時に、OCT−4の形質発現は、急速に消滅する。
【0081】
また、“EPCAM”とは、上皮起源細胞および上皮由来腫瘍細胞上で広く発現する“上皮細胞粘着分子”を意味する。
【0082】
“Rex−1”は、発達段階で調節された酸性ジンクフィンガー遺伝子(Zfp−42)である。Rex−1のメッセージレベルは、胚性幹細胞内で高く、分化への誘導時に低下する。幹細胞に特異的なメッセージについて予想されるように、Rex−1 mRNA(伝令リボ核酸)は、胞胚の内細胞塊(ICM)、胞胚の栄養芽細胞の極内に存在し、後に、卵筒(栄養芽細胞由来組織)の栄養膜錐状体および胚体外外胚葉内に存在するが、その発生量は、上記内細胞塊(ICM)からの直接的な系統である胚の外胚葉内で非常に減少する。
【0083】
“HNF−1α”、“HNF−1β”および“HNF−3β”は、転写因子の肝核因子ファミリーに属しており、上記ファミリーは、高度に保護されたDNA(デオキシリボ核酸)結合ドメインおよび2つの短いカルボキシル末端ドメインによって特徴付けされる。
【0084】
“GATA−4”および“GATA−6”は、GATA転写因子ファミリーの要素である。この転写因子ファミリーは、TGFβシグナルによって誘導されるものであり、初期段階の内胚葉マーカー、Sox17αおよびHNF−1βと、初期段階以降のマーカーHNF−3βの維持に寄与するものである。
【0085】
“SOX−17”は、胚形成中における内胚葉の形成に関係する転写因子である。
【0086】
“細胞培養用基本合成培地”とは、細胞培養のための無血清合成培地あるいは血清を化学的に含有させた合成培地を意味する。このような培地には、ダルベッコ調製イーグル培地(Dulbecco's Modified Eagle's Medium)(DMEM)、α調製最小必須培地(αMMEM)、基本必須培地(BME)、CMRL−1066培地、RPMI1640培地、M199培地、ハムF10栄養培地(Ham's F10 nutrient medium)、ノックアウト(KNOCKOUT:商標)ダルベッコ調製イーグル培地(DMEM)、ダルベッコ改良型調製イーグル培地、MCDB−151、MCDB−153、MCDB−201およびMCDB−302(米国ミズーリ州のシグマ社製)等のMCDB系培地、およびダルベッコ調製イーグル培地(DMEM)/F12培地が含まれるが、これらに限定されるものではない。上記培地および上記以外の有用な培地は、例えば、米国ニューヨーク州グランドアイランドのギブコ社(GIBCO)から入手可能である。多くの培地は、アカデミック出版社により発行され、ウイリアム・ビー・ジャコビー(William B.Jakoby)およびアイラ・エイチ・パスタン(Ira H.Pastan)共編の “細胞培養(Cell Culture)”第LVII巻第62頁〜第72頁の「酵素学の方法編(Methods in Enzymology)」において評価されている。
【0087】
“ヘアリー/エンハンサ分割因子−1(hairy/enhancer of split-1)”としても知られている“Hes−1”は、細胞死の決定に影響を及ぼす可能性がある転写因子である。
【0088】
“Musashi−1”は、種を越えて高度に保護されたリボ核酸(RNA)結合蛋白質のサブファミリーの要素である。Musashi−1の形質発現は、発達している中央神経系内の増殖性細胞中に高濃度に濃縮されており、腸管細胞内の幹細胞マーカーとされてもよい。
【0089】
“薬剤担体”とは、哺乳類の細胞移植用の担体としての役割を果たすことができる、生分解性あるいは非生分解性にして、多孔性あるいは非多孔性の基質を意味する。
【0090】
この明細書で用いられているように“移植”には、人間の患者等の哺乳類内に細胞あるいは細胞の個体群あるいは組織を導入するステップが含まれる。また、“移植”には、薬剤担体に細胞あるいは組織を組み入れるステップと、人間の患者等の哺乳類内に上記担体を移植するステップを含めてもよい。
【0091】
〔羊水由来細胞の分離〕
この発明の1つの態様では、羊水由来細胞は、複数段階の方法によって分離され、その方法は、
−羊水を分離するステップ、
−上記羊水を遠心分離した後に、上清を除去するステップ、
−増殖培地中に細胞沈殿物を再懸濁させるステップ、
−低酸素環境下で、上記組織および細胞を培養するステップ、
−培地を変更することなく、上記培養物を約5日間〜10日間、静かに放置するステップ、
−クローニングリングを用いて、形態学的に明瞭なコロニーを分離するステップ、
−分離されたコロニーを増殖培地中で培養するステップ、
−連続希釈してクローン化し、増殖コロニーの元となる単一細胞を同定するステップ、および
−上記クローンを増殖培地中で培養するステップを本質的に含むものである。
【0092】
他の実施の形態では、羊水由来細胞は、複数段階の方法によって分離され、その方法は、
−羊水を分離するステップ、
−上記羊水を遠心分離した後に、上清を除去するステップ、
−増殖培地中に細胞沈殿物を再懸濁させるステップ、
−正常酸素環境下で、上記組織および細胞を培養するステップ、
−培地を変更することなく、上記培養物を約5日間〜10日間、静かに放置するステップ、
−クローニングリングを用いて、形態学的に明瞭なコロニーを分離するステップ、
−分離されたコロニーを増殖培地中で培養するステップ、
−連続希釈してクローン化し、増殖コロニーの元となる単一細胞を同定するステップ、および
−上記クローンを増殖培地中で培養するステップを本質的に含むものである。
【0093】
培養プレートは、例えば、フィブロネクチン、ビトロネクチン、ラミニン、コラーゲン、ゼラチン、トロンボスポンジン、胎盤抽出物、マトリゲル(MATRIGEL:登録商標)、テネイシン、ヒト血清あるいはこれらの組み合わせ等の試薬で、予め被覆されてもよい。
【0094】
所望ならば、羊水を、例えば、羊水細胞で発現した蛋白質マーカーを特異的に認識し、羊水由来細胞を同定しかつ選択し、これにより実質的に精製された羊水由来細胞の個体群を得ることができる、試薬(抗体等)へさらしてもよい。
【0095】
羊水由来細胞は、アムニオマックス(AMNIOMAX:商品名)完全培地(インビトロゲン(Invitrogen)社製)中で培養されてもよい。これに代えて、上記羊水由来細胞は、チャン(Chang)B/C培地(アーバインサイエンティフィック(Irvine Scientific)社製)中で培養されてもよい。これに代えて、上記羊水由来細胞は、インスリン・トランスフェリン・セレニウム−X(ITS−X、米国カリフォルニア州のインビトロゲン社製)、2%のウシ胎仔血清(FBS)、1%のペニシリン/ストレプトマイシン(P/S)+25ng/mLの塩基性線維芽細胞増殖因子(bFGF)を補給した低糖DMEM培地中で、培養されてもよい。これに代えて、上記羊水由来細胞は、20%のノックアウト(KNOCKOUT:商標)血清置換体(米国カリフォルニア州のインビトロゲン社製)、10ng/mLの塩基性線維芽細胞増殖因子(bFGF)を補給したディー・エム・ノックアウト(DM−KNOCKOUT:商標)培地(米国カリフォルニア州のインビトロゲン社製)中で、培養されてもよい。これに代えて、上記羊水由来細胞は、2%に規定されたウシ胎仔血清(FBS)、2mMのL−グルタミン、ITS(インスリン・トランスフェリン・セレニウム)、55μMの2−メルカプトエタノール、10ng/mLの上皮増殖因子(EGF)、4ng/mLの塩基性線維芽細胞増殖因子(bFGF)および4ng/mLのデキサメタソンを補給したウイリアムズ(Williams)培地E中で、培養されてもよい。これに代えて、上記羊水由来細胞は、配合比率1:1のDMEM−LG/MCDB201培地に、2%のウシ胎仔血清(FBS)、ITS−X(インスリン・トランスフェリン・セレニウム−X)、55μMのβme(メルカプトエタノール)、100μMのアスコルビン酸2−リン酸塩、4ng/mLの塩基性線維芽細胞増殖因子(bFGF)、10ng/mLの上皮増殖因子(EGF)および4ng/mLのデキサメタゾンを補給した培地中で、培養されてもよい。これに代えて、上記羊水由来細胞は、20%のウシ胎仔血清(FBS)を補給した低糖DMEM培地中で、培養されてもよい。これに代えて、上記羊水由来細胞は、5%のウシ胎仔血清(FBS)を補給した低糖DMEM培地中で、培養されてもよい。上記羊水由来細胞は、2%に規定されたウシ胎仔血清(FBS)、ITS−X(インスリン・トランスフェリン・セレニウム−X)、1nMのデキサメタソン、100mMのアスコルビン酸2−リン酸塩、10ng/mLの上皮増殖因子(EGF)、10ng/mLのPDGF―bbおよび100mMの2−メルカプトエタノールを補給した、配合比率1:1の低糖DMEM/MCDB201培地中で、培養されてもよい。上記培地には、塩基性線維芽細胞増殖因子(bFGF)を、約5ng/mL〜約100ng/mLの濃度範囲で補給されてもよい。これに代えて、上記羊水由来細胞は、1mMのL−グルタミン、1%の非必須アミノ酸および0.1mMの2−メルカプトエタノールを補給した20%のノックアウト(KNOCKOUT:商標)血清置換体+80%のノックアウト(KNOCKOUT:商標)DMEM中で、培養されてもよい。上記培地は、4ng/mLの塩基性線維芽細胞増殖因子(bFGF)を補給したヒトあるいはマウスの胚性線維芽細胞、ヒト骨髄由来間質細胞、あるいはヒト胎盤由来細胞上で、一晩中、調整されてもよい。これに代えて、上記羊水由来細胞は、20%に規定されたウシ胎仔血清(FBS)および0.1mMの2−メルカプトエタノールを補給した高糖DMEM中で、培養されてもよい。表2は、この発明の羊水由来細胞を培養するのに使用される種々の培地組成を示している。
【0096】
増殖培地での培養中に、上記羊水由来細胞は、低酸素条件あるいは正常酸素条件下で、培養されてもよい。低酸素条件下では、酸素濃度は、20%を下回るか、あるいは10%を下回るか、あるいは5%を下回るが、1%を上回る。
【0097】
好ましくは、上記培養は、培地を変更することなく、約5日間〜14日間、静かに増殖培地中で維持されるべきであり、この時点で、上記羊水由来細胞は典型的には、使用されている培養基質に粘着している。この点で、細胞は継代培養されてもよい。
【0098】
継代培養は、この技術分野における当業者にとって周知のいかなる酵素溶液で実現可能である。この発明の使用に適した酵素溶液の一例は、トリプルエクスプレス(TrypLE−EXPRESS:商標)(米国カリフォルニア州のインビトロゲン社製)である。
【0099】
さらに、羊水由来細胞は、この発明の細胞の増殖を刺激する1つまたはそれ以上の試薬を含有する合成の増殖培地中で培養することによって増殖させてもよい。上記因子としては、例えば、ニコチン酸アミド、TGF−β1、TGF−β2およびTGF−β3を含むTGF−βファミリーのメンバー、骨形態形成蛋白質(BMP−2、BMP−4、BMP−6、BMP−7、BMP−11、BMP−12およびBMP−13)、血清アルブミン、線維芽細胞増殖因子ファミリー、血小板由来増殖因子AAおよび血小板由来増殖因子BB、血小板多血漿、インスリン増殖因子(IGF−I、IGF−II)、増殖分化因子(GDF−5、GDF−6、GDF−8、GDF−10、GDF−11)、グルカゴン様ペプチドI(GLP−I)およびグルカゴン様ペプチドII(GLP−II)、GLP−I擬似体(mimetobody)、GLP−II擬似体、エキセンジン(Exendin)−4、レチノイン酸、副甲状腺ホルモン、インスリン、プロゲステロン、テストステロン、エストロゲン、アプロチニン、ヒドロコルチゾン、エタノールアミン、βメルカプトエタノール、上皮増殖因子(EGF)、ガストリンIおよびガストリンII、トリエチレンペンタミン等の銅キレート剤、TGF−α、フォルスコリン(forskolin)、酪酸ナトリウム塩、アクチビン、ベータセルリン、ノギン(noggin)、神経増殖因子、結節(nodal)、インスリン・トランスフェリン・セレニウム(ITS)、肝細胞増殖因子(HGF)、ケラチノサイト増殖因子(KGF)、ウシ脳下垂体抽出物、小島新生関連蛋白質(INGAP)、プロテアゾーム阻害剤、ノッチ経路阻害剤、ソニックヘッジホッグ阻害剤、GSK−3β阻害剤、あるいはこれらの組み合わせを含めてもよい。これに代えて、上記羊水由来細胞は、調整培地中で培養することによって増殖させてもよい。“調整培地”とは、細胞の個体群が細胞培養用基本合成培地中で増殖し、上記培地に可溶性因子を付与するものである。このような用途の一例では、上記細胞が生成する可溶性因子を残したまま、上記細胞が上記培地から除去される。この培地は、その後、異なる細胞の個体群を育成するのに使用される。
【0100】
ある特定の実施の形態では、上記羊水由来細胞は、標準組織培養プレート上で培養される。これに代えて、培養プレートは、例えば、マトリゲル(MATRIGEL:登録商標)、増殖因子を減少させたマトリゲル(MATRIGEL:登録商標)、ラミニン、コラーゲン、ゼラチン、テネイシン、フィブロネクチン、ビトロネクチン、トロンボスポンジン、胎盤抽出物、ヒト血清等の細胞外基質蛋白質あるいはこれらの組み合わせで、被覆されてもよい。
【0101】
〔分離された羊水由来細胞の特性〕
培養され、あるいは分離された細胞中で蛋白質マーカーおよび核酸マーカーの形質発現を読み取る方法は、この技術分野において通例である。この方法には、逆転写酵素・重合酵素の計量的連鎖反応(RT−PCR)、ノーザンブロット法、切片上ハイブリッド形成法(例えば、「分子生物学における最新プロトコル(Current Protocols in Molecular Biology)」(オスベル(Ausubel)らにより編集された補遺2001年)参照)、および材料切片の免疫組織化学的検定法のような免疫検定法、ウェスタンブロット法、無傷細胞中に到達しやすいマーカーを用いた流動細胞計測分析法(FACS)(例えば、米国ニューヨーク州のコールドスプリングハーバー研究所出版社から1998年に発行された研究便覧:ハーロー(Harlow)およびレーン(Lane)による“抗体の使用(Using Antibodies)”参照)が含まれる。
【0102】
表3〜5には、ある特定の蛋白質マーカーを検出するのに有用な抗体の例が示されている。表3〜5に示された抗体によって認識される同一のマーカーに向けて誘導される他の抗体も利用可能であるか、あるいは容易に開発できる点が留意されるべきである。上記のような他の抗体も、この発明に従って分離された細胞中のマーカーの形質発現を読み取るために使用可能である。
【0103】
この技術分野における当業者にとっては、β細胞系列の細胞特性は周知であり、上記β細胞系列の他の特性の確認を続行する。これらの特性は、この発明に従って分離された羊水由来細胞が分化して上記β細胞系列の細胞特性を獲得したことを確認するのに使用可能である。β細胞系列の特異的な特性は、例えば、PDX−1(膵臓および十二指腸ホメオボックス遺伝子−1)、NGN−3(ニューロゲニン−3)、Hlxb9、Nkx6、Isl1、Pax6、ニューロ(Neuro)D、Hnfla、Hnf−6、Hnf3β、Mafa、およびその他等、1つまたはそれ以上の転写因子の形質発現を含むものである。これらの転写因子は、内分泌細胞の同定に関する技術分野において十分に確立されている。例えば、エドルンド(Edlund)による文献(「ネイチャー遺伝学概要(Nature Reviews Genetics)」2002年、第3巻第524頁〜第632頁)を参照されたい。
【0104】
この技術分野における当業者にとっては、腸管細胞系列の細胞特性は周知であり、この系列の他の特性の確認を続行する。これらの特性は、この発明に従って分離された分化羊水由来細胞あるいは未分化羊水由来細胞が腸管細胞系列の特徴的特性の一部を有することを確認するのに使用可能である。腸管細胞系列の特性は、例えば、HES−1(ヘアリー/エンハンサ分割因子−1)、NGN−3(ニューロゲニン−3)、Pax6、ニューロ(Neuro)D、Math−1、Musashi−1、およびその他等、1つまたはそれ以上の転写因子の形質発現を含むものである。さらに、消化管細胞は、セクレチン、コレシストキニン、GLP−1、ニューロテンシン、胃抑制ペプチド(GIP)、セロトニン、ソマトスタチン、ガストリン、およびその他等のような、ホルモン類を発現させるものである。これらの転写因子および消化管ホルモンは、腸管細胞の同定に関する従来技術において十分に確立されている。例えば、ショーノフ(Schonhoff)による文献(「内分泌学(Endocrinology)」2004年、第145巻第2639頁〜第2644頁)。
【0105】
この発明の発明者らは、高度の増殖性を有し、胚細胞様の特性を呈し、次のマーカー:HNF−1β、HNF−3β、SOX−17あるいはGATA−6のうち、少なくとも1つのマーカーを発現させる羊水由来細胞の個体群を同定し、かつ分離している。特に、この発明に従って分離された羊水由来細胞は、次の蛋白質マーカー:CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーを実質的に欠くことによって、とりわけ特徴付けられる。上記特性を有する羊水由来細胞の個体群とは、この明細書においてAF−I(アメリカン・タイプ・カルチャー・コレクション(ATCC)寄託番号PTA−6975)を意味する。
【0106】
上述した増殖条件下では、この発明に従って分離された羊水由来細胞は、次のマーカー:HNF−1β、HNF−3β、SOX−17あるいはGATA−6のうち、少なくとも1つのマーカーを発現させる能力を維持しながら、50回を超える回数の細胞集団倍加数を繰り返して増殖することができる。
【0107】
また、この発明の発明者らは、高度の増殖性を有し、胚細胞様の特性を呈するが、次のマーカー:HNF−3β、SOX−17、GATA−4、CD117、Oct−4、あるいはTra2−54のうち、少なくとも1つのマーカーを発現させない羊水由来細胞の個体群を同定し、かつ分離している。特に、この発明に従って分離された羊水由来細胞は、次の蛋白質マーカー:CD117、OCT−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーを実質的に欠くことによって、とりわけ特徴付けられる。上記特性を有する羊水由来細胞の個体群とは、この明細書においてAF−IIを意味する。
【0108】
また、この発明の発明者らは、高度の増殖性を有し、胚細胞様の特性を呈するが、次のすべてのマーカー:HNF−3β、SOX−17、GATA−4、CD117、Oct−4、あるいはTra2−54を発現させない羊水由来細胞の個体群を同定し、かつ分離している。特に、この発明に従って分離された羊水由来細胞は、次の蛋白質マーカー:CD117、OCT−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーを実質的に欠くことによって、とりわけ特徴付けられる。上記特性を有する羊水由来細胞の個体群とは、この明細書においてAF−IIを意味する。
【0109】
また、この発明の発明者らは、高度の増殖性を有し、胚細胞様の特性を呈するが、サイトケラチンと、次のマーカー:HNF−3β、SOX−17、GATA−4、CD117、OCT−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーとを発現させない羊水由来細胞の個体群を同定し、かつ分離している。特に、この発明に従って分離された羊水由来細胞は、次の蛋白質マーカー:CD117、OCT−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーを実質的に欠くことによって、とりわけ特徴付けられる。上記特性を有する羊水由来細胞の個体群とは、この明細書においてAF−IIIを意味する。
【0110】
また、この発明の発明者らは、高度の増殖性を有し、胚細胞様の特性を呈するが、次のすべてのマーカー:サイトケラチン、HNF−3β、SOX−17、GATA−4、CD117、OCT−4、あるいはTRA−2−54を発現させない羊水由来細胞の個体群を同定し、かつ分離している。特に、この発明に従って分離された羊水由来細胞は、次の蛋白質マーカー:CD117、OCT−4、あるいはTRA−2−54のうち、少なくとも1つのマーカーを実質的に欠くことによって、とりわけ特徴付けられる。上記特性を有する羊水由来細胞の個体群とは、この明細書においてAF−IIIを意味する。
【0111】
図9には、AF−I細胞、AF−II細胞およびAF−III細胞の形質発現プロファイルの概要が示されている。
【0112】
この発明の羊水由来細胞は、最終的な内胚葉あるいは膵臓β細胞系列の特性を有する細胞への分化能、あるいは消化管ホルモン産生細胞への分化能を維持しながら、50回を超える回数の細胞集団倍加数を繰り返して増殖することができる。
【0113】
〔羊水由来細胞の分化〕
1つの態様では、この発明は、この発明の増殖された羊水由来細胞を、β細胞系列の特性を有するマーカーを支持する細胞へ分化させることができる組成物を提供するものである。
【0114】
他の態様では、この発明は、この発明の増殖された羊水由来細胞を、最終的な内胚葉の特性を有するマーカーを支持する細胞へ分化させることができる組成物を提供するものである。
【0115】
他の態様では、この発明は、この発明の増殖された羊水由来細胞を、消化管ホルモン産生細胞の特性を有するマーカーを支持する細胞へ分化させることができる組成物を提供するものである。
【0116】
羊水由来細胞の増殖を支持する1つまたはそれ以上の成分が補給された場合における基本合成培地とは、1つまたはそれ以上の増殖因子が分化誘導量で補給された“誘導培地”を意味する。この発明によれば、誘導培地は20%以下の血清を含有している。1つの実施の形態では、ウシ胎児血清が使用されてもよい。これに代えて、ウシ胎仔血清(FBS)は、すべの哺乳類由来の血清、あるいはアルブミン、ウシアルブミンあるいは、β細胞系列への羊水由来細胞の分化を許容するか、あるいは分化能を高める他の物質と差し替えてもよい。これに代えて、誘導培地は、調整培地であってもよい。
【0117】
上記誘導培地に使用されるのに適切な因子としては、例えば、ニコチン酸アミド、TGF−β1、TGF−β2およびTGF−β3を含むTGFβファミリーのメンバー、骨形態形成蛋白質(BMP−2、BMP−4、BMP−6、BMP−7、BMP−11、BMP−12およびBMP−13)、血清アルブミン、線維芽細胞増殖因子ファミリー、血小板由来増殖因子−AAおよび血小板由来増殖因子−BB、血小板多血漿、インスリン様増殖因子(IGF−I、IGF−II)、増殖分化因子(GDF−5、GDF−6、GDF−8、GDF−10、GDF−11)、グルカゴン様ペプチドI(GLP−I)およびグルカゴン様ペプチドII(GLP−II)、GLP−1擬似体、GLP−2擬似体、エキセンジン(Exendin)−4、レチノイン酸、副甲状腺ホルモン、インスリン、プロゲステロン、アプロチニン、ヒドロコルチゾン、エタノールアミン、βメルカプトエタノール、上皮増殖因子(EGF)、ガストリンIおよびガストリンII、トリエチレンペンタミン等の銅キレート剤、TGF−α、フォルスコリン(forskolin)、酪酸ナトリウム塩、アクチビン、ベータセルリン、インスリン・トランスフェリン・セレニウム(ITS)、ノギン(noggin)、神経突起増殖因子、結節(nodal)、バルプロ酸(valporic acid)、トリコスタチン(trichostatin)A、酪酸ナトリウム、肝細胞増殖因子(HGF)、スフィンゴシン−1、Wnt−1、Wnt−3、Wnt−3a、Wnt−07aおよびWnt−8等のWnt蛋白質、ケラチノサイト増殖因子(KGF)、ディコフ(Dickkopf)蛋白質ファミリー、ウシ脳下垂体抽出物、小島新生関連蛋白質(INGAP)、インディアンヘッジホッグ阻害剤、ソニックヘッジホッグ阻害剤、プロテアゾーム阻害剤、ノッチ経路阻害剤、ソニックヘッジホッグ阻害剤、あるいはこれらの組み合わせを含めてもよい。
【0118】
この発明の1つの態様では、増殖因子と、塩基性線維芽細胞増殖因子(bFGF)、アクチビンA、FGF−5、N2およびB27(米国カリフォルニア州のギブコ(Gibco)社製)、例えば、ソニックヘッジホッグシグナルを阻害するシクロパミン(cyclopamine;米国カリフォルニア州のイー・エムー・ディー(EMD)社製)等のステロイドアルカロイド、および例えばMG−132(米国カリフォルニア州のイー・エムー・ディー(EMD)社製)等のプロテアゾーム阻害剤を含む化学物質との組み合わせは、β細胞系列への羊水由来細胞の分化を支持するために、基本合成培地に補給される。1つの態様では、上記羊水由来細胞は、10μMのMG−132を含有するDMEM(低糖、5.5mM)から構成された誘導培地中で、1日〜2日間、培養され、その後に、1XB27(米国カリフォルニア州のギブコ(Gibco)社製)および1XN2(米国カリフォルニア州のギブコ(Gibco)社製)を補給した誘導培地中で、さらに3日〜7日間、培養され、その後に、シクロパミン(10μM;米国カリフォルニア州のイー・エムー・ディー(EMD)社製)、塩基性線維芽細胞増殖因子(20ng/mL;bFGF;米国ミネソタ州のアール・エンド・ディー(R&D)システム製)、アクチビンA(20nM;米国ミネソタ州のアール・エンド・ディー(R&D)システム製)あるいはFGF−5(20ng/mL;米国ミネソタ州のアール・エンド・ディー(R&D)システム製)を補給した誘導培地中で、さらに5日間、培養される。
【0119】
この発明の他の態様では、この発明の羊水由来細胞は、胎仔の原発性発育不全の腸管および膵臓の培養物から分離された調整培地で、それぞれ腸管細胞系列あるいは膵臓細胞系列への更なる分化能を誘導するために、処理可能である。また、上記羊水由来細胞は、PANC−1、CAPAN−1、BxPC−3、HPAF−II等の膵臓細胞系列、HepG2等の肝臓細胞系列、および例えばFHs74およびHS738等の腸管細胞系列由来の調整培地で分化するように誘導されてもよい。これに代えて、この発明の羊水由来細胞は、内胚葉系列への分化を誘導されたヒトあるいはマウスの胚性幹細胞から分離された調整培地で、処理可能である。これらの細胞系列は、ATCC(アメリカン・タイプ・カルチャー・コレクション;米国バージニア州)から入手可能である。
【0120】
増殖因子の組み合わせおよび濃度、培養期間および他の培養条件は、この技術分野における当業者によって例えば、β細胞系列の細胞特性へ分化した細胞の割合をモニターすることによって、効率的な分化を達成するように最適化可能である。1つまたはそれ以上の増殖因子は、約1週間〜約4週間の期間中にわたって、この発明の羊水由来細胞がβ細胞系列のマーカーを支持する細胞に分化するのを誘導するのに十分な量で添加されてもよい。
【0121】
〔この発明の羊水由来細胞の治療用途〕
1つの態様では、この発明は、1型糖尿病患者あるいは同型糖尿病を発症するリスクを負う者を治療する方法を提供するものである。この方法は、羊水由来細胞を分離し培養するステップと、分離された細胞の個体群を増殖するステップと、上記培養細胞を試験管内でβ細胞系列に分化させるステップと、上記分化細胞を直接あるいは薬剤担体内に含めた形態で、患者内に移植するステップを含むものである。適切な場合には、患者は、移植細胞の生存および機能に役立つ薬剤すなわち生理活性因子で、さらに治療可能である。上記薬剤としては、例えば、インスリン、TGFβ1、TGFβ2およびTGFβ3を含むTGFβファミリーのメンバー、骨形態形成蛋白質(BMP−2、BMP−3、BMP−4、BMP−5、BMP−6、BMP−7、BMP−11、BMP−12およびBMP−13)、線維芽細胞増殖因子−1および線維芽細胞増殖因子−2、血小板由来増殖因子AAおよび血小板由来増殖因子BB、血小板多血漿、インスリン様増殖因子(IGF−I、IGF−II)、増殖分化因子(GDF−5、GDF−6、GDF−8、GDF−10、GDF−15)、血管内皮細胞由来増殖因子(VEGF)、プレイオトロフィン(pleiotrophin)、エンドセリン、およびその他を含めてもよい。他の薬剤配合物には、例えば、ニコチンアミド、グルカゴン様ペプチドI(GLP−I)、グルカゴン様ペプチドII(GLP−II)、GLP−I擬似体、GLP−II擬似体、エキセンジン(Exendin)−4、レチノイン酸、副甲状腺ホルモン、例えば米国出願公開2004/0209901および米国出願公開2004/0132729に開示された化合物等のMAPK阻害剤を含めることができる。
【0122】
さらに他の態様では、この発明は、2型糖尿病患者あるいは同型糖尿病を発症するリスクを負う者を治療する方法を提供するものである。この方法は、この発明による羊水由来細胞を分離し培養するステップと、分離された細胞の個体群を増殖するステップと、上記培養細胞を試験管内でβ細胞系列に分化させるステップと、上記分化細胞を直接あるいは薬剤担体内に含めた形態で、患者内に移植するステップを含むものである。
【0123】
さらに他の実施の形態では、この発明の羊水由来細胞は、DMSO(ジメチルスルホキシド)またはグリセロールを含有する市販の培地を用いて、凍結保存されてもよい。凍結保存された細胞は、必要とされるまで、液体窒素保存容器の気相中に保存されてもよい。
【0124】
さらに他の実施の形態では、この発明の羊水由来細胞は、この羊水由来細胞の生存力を高めるか、あるいは上記羊水由来細胞の膵臓β細胞系列への分化を誘導するために、同種あるいは異種の動物の成熟膵島を移植されてもよい。
【0125】
治療中の患者に対して供給される細胞の供給源であって、当該細胞が分離される羊水は、自己由来であってもよい。これに代えて、供給源は、同種由来あるいは異種由来であってもよい。また、患者に投与されるべき細胞は、増殖能および/または分化能を高めるか、あるいは免疫的拒絶反応のリスクを防止するか、あるいは低減するように、遺伝子的に変性されてもよい。これに代えて、この発明に従って得られた羊水由来細胞は、この発明に従って調製された分化細胞を移植する前に、被移植者の免疫反応を調節するのに使用可能である。例えば、米国特許第6,328,960号および米国特許第6,281,012号を参照されたい。
【0126】
この発明の羊水由来細胞は、被移植者への移植前に、インスリン産生細胞に分化されてもよい。特定の実施の形態では、この発明の羊水由来細胞は、被移植者への移植前に、β細胞に完全に分化される。これに代えて、この発明の羊水由来細胞は、未分化状態あるいは部分的分化状態で、被移植者へ移植されてもよい。更なる分化は、被移植者の体内で生じる可能性がある。
【0127】
この発明の羊水由来細胞は、遺伝子的に変性されてもよい。例えば、上記羊水由来細胞は、例えばPDX−1あるいはインスリン等のβ細胞系列の細胞特性を有するマーカーを過剰に発現させるように改良されてもよい。上記羊水由来細胞は、いかなる適切な対象遺伝子を過剰に発現させるように改良されてもよい。さらに、上記羊水由来細胞は、MATH−1等の腸管細胞の特性を有するマーカーを過剰に発現させるように改良されてもよい。これに代えて、この発明の羊水由来細胞は、胃抑制ペプチド(GIP)発現細胞の個体群に分化し、さらに、この個体群が糖感受性のインスリン産生細胞の個体群となるように、胃抑制ペプチド(GIP)プロモータの支配下でインスリン遺伝子で変性してもよい。この発明の羊水由来細胞を遺伝的に変性するのに有用な技術は、例えば、細胞生物学の標準的な教科書および検討書中で検索可能である。分子遺伝学および遺伝子工学における方法は、例えば、「分子クローニング」:研究マニュアル第2版(サムブルック(Sambrook)らによる。1989年);「オリゴヌクレオチド合成」(エム・ジェイ・ガイト(M.J.Gait)編。1984年);「動物細胞培養」(アール・アイ・フレッシュネイ(R.I.Freshney)編。1987年);「酵素学の方法シリーズ」(アカデミック出版社);「哺乳類細胞の遺伝子転写ベクター」(アイ・エム・ミラー(I.M.Miller)およびエム・ピー・カロス(M.P.Calos)編。1987年);「分子生物学の最新プロトコルおよび分子生物学の簡略プロトコル」第3版(エフ・エム・オスベル(F.M.Ausubel)ら編集。1987年および1995年);および「DNA組換え方法II」(アール・ウー(R.Wu)編。アカデミック出版社。1995年)に記述されている。
【0128】
対象遺伝子をコード化する核酸分子は、宿主の羊水由来細胞のゲノム中に安定に組み込まれてもよく、あるいは上記核酸分子は、ベクターあるいはプラスミド等の染色体外分子として存在してもよい。このような染色体外分子は、自己複製されてもよい。この明細書で用いられている用語“形質移入”とは、宿主の羊水由来細胞中に異種の核酸を導入するプロセスを意味する。
【0129】
未分化状態あるいは他の状態の細胞は、分散された細胞として、あるいは肝門脈中に注入可能な塊となった細胞として使用されてもよい。これに代えて、上記細胞は、生体適合性で生分解性の重合支持体、多孔性で非生分解性の装置、あるいは宿主の免疫反応から保護するようにカプセル内に配されてもよい。上記細胞は、被移植者の体内の適切な部位に移植されてもよい。移植部位としては、例えば、肝臓、生来の膵臓、腎臓被膜下腔、網(腹膜の襞)、腹膜、漿膜下腔、腸管、胃あるいは皮下嚢を含むものである。
【0130】
移植細胞の更なる分化能、生存力あるいは活性を高めるためには、増殖因子、抗酸化剤あるいは抗炎症剤等の付加的な因子は、細胞の注入前に、注入と同時に、あるいは注入後に、投与可能である。ある特定の実施の形態では、増殖因子は、生体体に注入された細胞を分化させるのに用いられる。上記因子を、内在性の細胞によって分泌可能であり、元の位置に注入された羊水由来細胞にさらすことができる。移植された羊水由来細胞を、この技術分野において公知の増殖因子であって、内在性の増殖因子と、注入された外来性の増殖因子とのいかなる組み合わせによって分化するように誘導可能である。
【0131】
移植に使用される細胞の投与量は、患者の容態および上記治療に対する感受性を含む多くのファクターに依存しており、この技術分野における当業者によって決定可能である。
【0132】
1つの態様では、この発明は、糖尿病患者あるいは糖尿病を発症するリスクを負う者を治療する方法を提供するものである。この方法は、この発明による羊水由来細胞を分離し培養するステップと、分離された細胞の個体群を増殖するステップと、上記培養羊水由来細胞を試験管内でβ細胞系列に分化させるステップと、上記分化細胞を三次元支持体に組み入れるステップを含むものである。この分化細胞は、患者への移植前に、試験管内の上記支持体上で維持可能である。これに代えて、上記分化細胞を含有する上記支持体は、試験管内で、付加的な培養をすることなく、直接、患者の体内に移植可能である。この支持体は、任意に、移植細胞の生存および機能に役立つ少なくとも1つの薬剤に組み入れることができる。
【0133】
この発明の目的に適した使用に供される支持体材料としては、組織修復に有用な組織テンプレート、導管、バリアおよびレザバーを含むものである。特に、発泡体、スポンジ、ゲル、ヒドロゲル、織物、および不織布構造の形態を有する材料であって、生物学的組織を再構築あるいは再生するばかりでなく、組織の成長を誘導する走化性因子を送出するのに試験管内および生体内で使用されてきた合成材料および天然材料は、この発明の方法の実施に使用するのに適している。例えば、米国特許第5,770,417号、米国特許第6,022,743号、米国特許第5,567,612号、米国特許第5,759,830号、米国特許第6,626,950号、米国特許第6,534,084号、米国特許第6,306,424号、米国特許第6,365,149号、米国特許第6,599,323号、米国特許第6,656,488号および国特許第6,333,029号に開示された材料を参照されたい。この発明において使用に適したポリマー材料の例は、米国出願公開2004/0062753および米国特許第4,557,264号に開示されている。
【0134】
薬剤を組み入れた支持体を形成するために、薬剤は、上記支持体を形成する前に、ポリマー溶液と混合可能である。これに代えて、薬剤は、好ましくは薬剤担体の存在下で、形成された支持体上に被覆されてもよい。薬剤は、液体、微細に分割された固体、あるいは他のいかなる適切な物理的形態を呈してもよい。これに代えて、支持体には、薬剤の放出速度を変更する賦形剤が添加されてもよい。他の実施の形態では、支持体には、例えば、米国特許第6,509,369号に開示された物質等の抗炎症剤である、少なくとも1種の薬剤配合物が組み入れられている。
【0135】
1つの実施の形態では、支持体には、例えば、米国特許第6,793,945号に開示された物質等の抗アポトーシス剤である、少なくとも1種の薬剤配合物が組み入れられている。
【0136】
他の実施の形態では、支持体には、例えば、米国特許第6,331,298号に開示された物質等の線維形成阻害剤である、少なくとも1種の薬剤配合物が組み入れられている。
【0137】
他の実施の形態では、支持体には、例えば、米国出願公開2004/0220393および米国出願公開2004/0209901に開示された物質等、血管形成能を高めることができる、少なくとも1種の薬剤配合物が組み入れられている。
【0138】
さらに他の実施の形態では、支持体には、例えば、米国出願公開2004/0171623に開示された物質等の免疫抑制剤である、少なくとも1種の薬剤配合物が組み入れられている。
【0139】
他の実施の形態では、支持体には、例えば、TGFβ1、TGFβ2およびTGFβ3を含むTGFβファミリーのメンバー、骨形態形成蛋白質(BMP−2、BMP−3、BMP−4、BMP−5、BMP−6、BMP−7、BMP−11、BMP−12およびBMP−13)、線維芽細胞増殖因子−1および線維芽細胞増殖因子−2、血小板由来増殖因子AAおよび血小板由来増殖因子BB、血小板多血漿、インスリン様増殖因子(IGF−I、IGF−II)、増殖分化因子(GDF−5、GDF−6、GDF−8、GDF−10、GDF−15)、血管内皮細胞由来増殖因子(VEGF)、プレイオトロフィン(pleiotrophin)、エンドセリン、およびその他の物質等の増殖因子である、少なくとも1種の薬剤配合物が組み入れられている。他の薬剤配合物には、例えば、ニコチンアミド、低酸素誘導因子1−α、グルカゴン様ペプチドI(GLP−I)、グルカゴン様ペプチドII(GLP−II)、GLP−I擬似体、GLP−II擬似体、エキセンジン(Exendin)−4、結節(nodal)、ノギン(noggin)、NGF、レチノイン酸、副甲状腺ホルモン、テネイシン−C、トロポエラスチン、トロビン由来ペプチド、カテリチジン(cathelicidin)、ディフェンシン、ラミニン、フィブロネクチンおよびビトロネクチン等、粘着性細胞外基質蛋白質の細胞結合ドメインおよびヘパリン結合ドメインを含む生物学的ペプチド、例えば米国出願公開2004/0209901および米国出願公開2004/0132729に開示された化合物等のMAPK阻害剤を含めることができる。
【0140】
この発明の羊水由来細胞の骨格への組み入れは、骨格上に細胞を単純に付着させることによって、実現可能である。細胞は、単純な拡散によって骨格内に導入可能である(ジェイ・ペディアール(J.Pediatr)による「外科学」1988年、第23(1、パート2)巻第3頁〜第9頁)。細胞播種の効率を高める他のいくつかの取り組みが開発されている。例えば、ポリグリコール酸骨格上に軟骨細胞を播種するのに、撹拌フラスコが使用されている(最新バイオテクノロジー1998年、第14(2)巻第193頁〜第202頁)。細胞を播種するための他の取り組みとしては、播種細胞への負荷を最小にし、かつ播種効率を高める効果を与える遠心分離の利用がある。例えば、ヤン(Yang)らは、遠心分離的細胞固定化方法(CCI)と呼ばれる細胞播種法を開発した(生医学材料研究誌(J.Biomed.Mater.Res.)2001年、第55(3)巻第379頁〜第386頁)。
【0141】
さらに、この発明は、次の実施例によって示されるが、これら実施例によって限定されるものではない。
【0142】
〔実施例1:ヒト羊水由来細胞系列の樹立〕
この発明の羊水由来細胞を分離するのに使用される羊水を、通常、妊娠期間の16週〜22週で実行される、胎仔の核型分析用の羊水穿刺法により得られたサンプルから採取した。図1には、上記羊水由来細胞を分離するのに使用される、複数の段階を踏む方法が概略的に示されている。上記羊水を7分間、重力の400倍の遠心力で遠心分離し、上清を除去した。この結果として得られた細胞沈殿物を、この発明に使用される上記羊水サンプル用の表3〜5に表示された増殖培地中に再懸濁させた。上記細胞を、コラーゲンIV型(100mmプレート当たりの1mg)、あるいはコラーゲンI型(1cm2当たりの1μg)、ビトロネクチン(1mL当たりの10μg)あるいはフィブロネクチン(1mL当たりの10μg)のいずれかを被覆したプレート上で培養した。羊水サンプルから得られた細胞は、大きなバラツキ(1サンプル当たりの細胞数:8,000〜300,000個)を有しており、一部のサンプルには、かなりの数の血球が混入していた。上記培養物を、低酸素条件(酸素濃度:3%)下で、少なくとも5日間〜10日間、静かに放置した。平行して、培養物を正常酸素条件下で、上記同様の条件で培養した。次に、上記培養物を上記増殖培地と同一の培地に添加し、70%〜80%の培養飽和密度(confluency)に達するまで培養した。この段階の細胞を“P0”と呼ぶものとする。培養物の一部では、細胞コロニーをクローニングリングで分離し、異なる培養プレートで継代培養した。形態学的に明瞭なコロニーは、線維芽細胞(F)、羊水細胞(AF)および上皮細胞(E)の特性を有する形態で存在していた(図2)。“トリプルエクスプレスTrypLE−EXPRESS(商標)”(インビトロゲン社製)を用いて、上記P0から細胞を放出させ、この細胞を、種々の濃度(1cm2当たりの細胞数:50〜10,000個)で、フィブロネクチン、ビトロネクチンあるいはコラーゲンIV型を被覆したフラスコ/皿/プレートに播種した。連続希釈クローン化処理に、上記P0細胞の一部を使用した。最速で増殖する細胞の細胞集団倍加時間は、継代初期で、約24時間であった。種々の培地条件(表2)下で培養された増殖細胞を、細胞表面マーカー(表3〜5)で分析した。細胞は、典型的には培養飽和密度70%まで分裂し、1cm2当たりの細胞数100〜10,000個で、再度、播種した。細胞増殖の種々の段階で、リボ核酸(RNA)を採集し、胚性および胚葉マーカー(表9)で分析した。
【0143】
この発明の羊水由来細胞は、種々の妊娠期間で存在していた。表10は、妊娠期間の17週〜41週で採取した羊水サンプル中に、羊水細胞(AF)、線維芽細胞(F)および上皮細胞(E)の形態の存否を示している。
【0144】
また、この発明の羊水由来細胞を、満期分娩時(妊娠期間の約40週)に得られた羊水から採取した。羊水サンプルを38週〜40週の分娩時に採取し、上記プロトコルに従って培養した。結果として得られた粘着細胞の固体群は、妊娠期間の16週〜22週で分離された細胞の特性に非常に類似する特性を呈した。
【0145】
〔実施例2:この発明の羊水由来細胞のクローン増殖〕
実施例1で記述された方法で、羊水細胞(AF)様の形態を有する細胞を、クローニングリングを用いてP0培養物から得た。表面受容体、細胞骨格蛋白質および転写因子について異なる発現性を示す3つの明瞭な細胞固体群を同定した。簡略化のために、上記固体群を、AF−I細胞、AF−II細胞およびAF−III細胞と呼ぶ。次の実施例では、AF−I細胞、AF−II細胞およびAF−III細胞の各個体群の差異を明確にする。
【0146】
〔実施例3:蛍光標示式細胞分取器(FACS)による分析〕
トリプルエクスプレス(TRYPLE(商標)−express)発現溶液(米国カリフォルニア州のギブコ(Gibco)社製)で5分間、培養することによって培養プレートから接着細胞を取り出した。この取り出された細胞を、10%のウシ胎仔血清(FBS)添加ダルベッコ調製イーグル培地(DMEM)中に再度、懸濁させ、かつ遠心分離後に、洗浄および、リン酸緩衝食塩水(PBS)中に2%のウシ血清アルブミン(BSA)および0.05%のアジ化ナトリウム(米国ミズーリ州のシグマ(Sigma)社製)を含有させた染色緩衝液中への再度の懸濁によって、上記細胞を回収した。適切な場合には、0.1%のγ―グロブリン(米国ミズーリ州のシグマ(Sigma)社製)溶液を15分間用いて、上記細胞のFc(免疫グロブリン結晶化可能断片)受容体を阻害した。アリコート(細胞数:約105個)を、表3に示されているように、フィコエリトリン(Phycoerythirin)(PE)あるいはアロフィコシアニン(APC)のいずれかを接合したモノクローナール抗体(細胞数106個当たりの抗体量5μL)あるいは未接合型の一次抗体と共に培養した。対照区には、アイソタイプが適切に適合した抗体、非染色細胞、および接合型の二次抗体のみが染色された細胞を含めた。すべての抗体との細胞培養を、4℃、30分間、実行したのち、上記細胞を染色緩衝液で洗浄した。未接合型の一次抗体で染色した細胞サンプルについては、接合型のフィコエリスリン(PE)あるいはアロフィコシアニン(APC)標識二次抗体と共に、さらに4℃、30分間、培養した。使用した二次抗体の記載に関しては表4を参照されたい。洗浄された細胞を顆粒化し、染色緩衝液中に再度、懸濁させ、蛍光標示式細胞分取器アレイ(FACSArray:ビー・ディー・バイオサイエンス(BD Biosciences)社製)で、少なくとも10,000件の事象を収集することによって、細胞表面分子を同定した。
【0147】
細胞内染色については、まず、4%のパラホルムアルデヒドで、10分間、細胞を固定した後、染色緩衝液で2回洗浄し、細胞を遠心分離し、リン酸緩衝食塩水(PBS)中に0.5%のトリトン(Triton)X(シグマ(Sigma)社製)を含有させた透過処理用緩衝液中に、室温(RT)で、5分間、上記細胞を再度、懸濁させた。浸透化させた細胞を、水洗用緩衝液で2回洗浄し、遠心分離し、上記染色緩衝液中に再度、懸濁させ、適切な接合型の抗体(細胞数106個当たりの抗体量5μL)と共に、4℃、30分間、培養した。未接合型の一次抗体で染色した細胞サンプルについては、接合型のフィコエリスリン(PE)あるいはアロフィコシアニン(APC)標識二次抗体(表4)と共に、さらに4℃、30分間、培養した。洗浄された細胞を顆粒化し、染色緩衝液中に再度、懸濁させ、蛍光標示式細胞分取器アレイ(FACSArray:ビー・ディー・バイオサイエンス(BD Biosciences)社製)で、少なくとも10,000件の事象を収集することによって、内部蛋白質を同定した。表6および表7には、検査した細胞表面マーカーおよび細胞内部マーカーの発現レベルが記載されている。蛍光標示式細胞分取器(FACS)による分析では、羊水細胞(AF−I、AF−IIおよびAF−III)、線維芽細胞(F)および上皮細胞(E)を識別する特性を有するマーカーを同定することができた(図3〜図5)。表8には、満期分娩時(38週〜40週)の羊水から分離したAF−I細胞の細胞表面発現プロファイルが示されている。細胞表面受容体の発現レベルは、16週〜22週の羊水から分離したAF−I細胞に非常に類似している。
【0148】
〔実施例4:未分化細胞の免疫染色〕
実施例1によって培養した細胞(1cm2当たりの細胞数:10,000個)を、ガラス製の底部を有する35mm径マイクロウェル皿(米国マサチューセッツ州のマテック(Matek)社製)の種々の増殖培地上に播種した。培養3日後に、4%のパラホルムアルデヒドで、10分間、上記細胞を固定した後、リン酸緩衝液(PBS)で2回洗浄し、さらに、0.5%のトリトン(Triton)X(シグマ(Sigma)社製)を含有させた透過処理用緩衝液を5分間、室温(RT)で添加し、リン酸緩衝液(PBS)で、さらに3回洗浄した。固定され、透過処理された細胞を、1%のウシ血清アルブミン(BSA)あるいは二次抗体が生成される種(ヤギ、ロバあるいはウサギ)から得られた4%の血清のいずれかで、阻害した。対照区サンプルには、一次抗体を省いた反応生成物、あるいは一次抗体をこの一次抗体に対応する免疫グロブリンに、上記一次抗体と同一の濃度で、置き換えた反応生成物を含めた。染色されたサンプルを、染色された核を計数するためにジアミジノ−2−フェニルインドール、ニ塩化水素化物(DAPI)を含有するプロロング(PROLONG:登録商標)抗退色性試薬(米国カリフォルニア州のインビトロゲン社製)で洗浄した。ニコン共焦エクリプスC−1型反転顕微鏡(日本国のニコン社製)および10倍〜60倍の対物レンズで、細胞画像を得た(図6〜図8)。
【0149】
〔実施例5:未分化細胞の重合酵素連鎖反応(PCR)分析〕
増殖培地中で培養した細胞からリボ核酸(RNA)を抽出した。ヒト膵臓、肝臓、脳、消化管(アンビオン(Ambion)社製)、NTERA細胞(ヒト胚性癌腫細胞系列;ATCC(アメリカン・タイプ・カルチャー・コレクション))、HEK293細胞(ATCC;アメリカン・タイプ・カルチャー・コレクション)、およびヒト気道上皮細胞(ケンブレックス(Cambrex)社製)由来の全リボ核酸(RNA)を、陽性対照区として用いた。骨髄由来間葉細胞(米国メリーランド州のケンブレックス(Cambrex)社製)を、膵臓発達過程に含まれる鍵遺伝子の発現性に関して陰性となる対照区として用いた。
【0150】
[リボ核酸(RNA)の抽出、精製、および相補デオキシリボ核酸(cDNA)の合成]
リボ核酸(RNA)サンプルを、エタノール含有高塩緩衝液の存在下で、シリカゲル膜(米国カリフォルニア州のキアゲン(Qiagen)社製のルナシー(Rneasy)ミニキット)との結合によって精製すると同時に、異物を洗浄除去した。カラムに結合した状態のリボ核酸(RNA)サンプルを、デオキシリボヌクレアーゼI(DNase I)(キアゲン(Qiagen)社製)で15分間、処理することによって、さらに精製した。その後に、高純度のリボ核酸(RNA)を水中に溶出させた。収量および純度を、分光光度計のA260(260nm吸収セル)およびA280(280nm吸収セル)の測定値によって推定した。相補デオキシリボ核酸(cDNA)の複製を、エイ・ビー・アイ(米国カリフォルニア州のエイ・ビー・アイ(ABI)社製)高容量相補デオキシリボ核酸(cDNA)アーカイブキット(ABI high capacity cDNA archive kit)で、精製リボ核酸(RNA)から作製した。
【0151】
〔リアルタイムの重合酵素連鎖反応(PCR)による増幅および定量分析〕
他に述べない限り、すべての試薬をアプライド・バイオシステムズ(Applied Biosystems)社から入手した。エイ・ビー・アイ・プリズム(ABI PRISM:登録商標)品番7000配列検出システムで、リアルタイムの重合酵素連鎖反応(PCR)を実行した。全反応液量を20μLとして20ngの逆転写型リボ核酸(RNA)と共に、タクマン(TAQMAN:登録商標)ユニバーサル・ピー・シー・アール・マスター・ミックス(UNIVERSAL PCR MASTER MIX:登録商標)(米国カリフォルニア州のエイ・ビー・アイ(ABI)社製)を用いた。ピペット操作ミスを訂正するために、各相補デオキシリボ核酸(cDNA)サンプルについて控えをとって実行した。反応開始剤およびタクマン(TAQMAN:登録商標)のFAM標識プローブを200nMの濃度で使用した。アプライド・バイオシステムズ(Applied Biosystems)の予備培養型18Sリボソームリボ核酸(RNA)あるいはヒト・グリセルアルデヒド−3−リン酸・デヒドロゲナーゼ(GAPDH)内在性対照キットで、各標的遺伝子の発現レベルを標準化した。反応開始剤およびプローブについては、エイ・ビー・アイ・プリズム・プライマー・エクスプレス(ABI PRISM PRIMER EXPRESS:商品名)ソフトウエアで設計するか、あるいはエイ・ビー・アイ(ABI)社製の予備培養型遺伝子分析キットを用いた。各遺伝子に関して、エクソンと境界部分との距離(spanning)となるように、反応開始剤あるいはプローブのいずれか一方を設計した。この設計は、反応開始剤/プローブが、存在するいかなるゲノム・デオキシリボ核酸(DNA)に結合する可能性を無くした。反応開始剤とプローブとのセットとしては、次の組み合わせ:Nkx2.2(Hs00159616)、Pdx−1(Hs00426216)、Nkx6.1(Hs00232355)、Ngn3(Hs00360700)、Pax4(Hs00173014)、Pax6(Hs00240871)、インスリン(Hs00355773)、Glu2(Hs00165775)、グルカゴン(Hs00174967)、Isl−1(Hs00158126)、ソマトスタチン(Hs00174949)、FoxA2(HNF3β)(Hs00232764)、HlxB9(Hs00232128)、GATA−4(Hs00171403)、HNF1β(Hs00172123)、Musashi同族体−1(Msi−1)(Hs00159291)、Hes−1(Hs00172878)、ニューロテンシン(NTS)(Hs00175048)、コレシストキニン(Hs00174937)、AFP(Hs00173490)、セクレチン(Hs00360814)、GIP(Hs00175030)、GFAP(Hs00157674)、MAP2(Hs00159041)、Olig2(Hs0037782)、Oct−4(CGACCATCTGCCGCTTTGAG(配列識別番号1))およびOct−4(CCCCCTGTCCCCCA TTCCTA(配列識別番号2));Rex−1(CAGATCCTAAACAGCTCGCAGAAT(配列識別番号3))およびRex−1(GCGTACGCAAATTAAACTCCAGA(配列識別番号4));Sox−17(TGGCGCAGCAGATACCA(配列識別番号5))、Sox−17(AGCGCCTTCCACGACTTG(配列識別番号6))、Sox−17(CCAGCATCTTGCTCAACTCGGCG(配列識別番号7))、ABCG−2(GTTTATCCGTGGTGTGTCTGG(配列識別番号8))およびABCG−2(CTGAGCTATAGAGGCCTGGG(配列識別番号9))、Sox2(ATGCACCGCTACGACGTGA(配列識別番号10))およびSox2(CTTTTGCACCCCTCCCATTT(配列識別番号11))として記載されている。残りの反応開始剤を、PRIMERSプログラムソフトウエア(米国カリフォルニア州のエイ・ビー・アイ(ABI)社製)で設計し、表9中に記載した。上記サンプルについて、当初50℃で2分間、95℃で10分間処理した後に、95℃で15秒間の変性ステップと、60℃で1分間の焼鈍/伸張ステップを40回、繰り返した。ジーンアンプ(GENEAMP:登録商標)品番7000配列検出システムソフトウエアで、データ分析を実行した。各反応開始剤/プローブセットに関して、蛍光強度が指数増幅領域の中間にある特異値に到達した周期数として、Ct値を求めた。形質発現の相対レベルを、比較Ct法で算出した。簡単に言えば、各相補デオキシリボ核酸(cDNA)サンプルについては、内在性対照区のCt値を、対象遺伝子のCt値から差し引いて、ΔCt値(ΔCt)を得た。100%の効率で増幅すると仮定して、対象遺伝子の標準量を2-ΔCtとして算出した。最終データを較正サンプルの相対値として示した。上記比較Ct法は、仮に対象区および内在性対照区の増幅効率が略等しい場合にのみ、有効とされている。したがって、反応開始剤/プローブのセット毎に、連続的に希釈した相補デオキシリボ核酸(cDNA)サンプルを増幅し、上記ΔCt値を確認することによって、予備実証実験を実行した。上記ΔCt値は、仮に増幅効率が等しい場合には、希釈範囲を超えて一定となるはずである(表9)。
【0152】
〔実施例6:細胞集団倍加時間〕
実施例1により分離し、かつ増殖した継代数6の羊水細胞(AF−I型)を、24ウェル組織培養プレート(米国マサチューセッツ州のコーニング社製)における培地番号11の増殖培地に1ウェル当たり細胞数10,000個で播種した。トリプルエクスプレス(TRYPLE(商標)−EXPRESS)発現溶液(米国カリフォルニア州のインビトロゲン(Invtrogen)社製)で、上記プレートの3つのウェルから細胞を除去し、グアバ(Guava)PCA−96細胞分析システムおよびビアカウント(VIACOUNT:登録商標)試薬(米国カリフォルニア州のグアバ(Guava)社製)で、細胞を計数した。図10は、低酸素条件(酸素濃度:3%)下で、培養した継代数6の細胞の増殖曲線を示している。対数グラフの直線部分で、上記細胞の細胞集団倍加時間を推定した。継代数6の細胞の細胞集団倍加時間は31時間であった。
【0153】
上記3つの細胞個体群(線維芽細胞、羊水細胞および上皮細胞形態)の増殖能を、長期間培養で比較した。図11は、5番培地中で培養したAF−I細胞、AF−II細胞、AF−III細胞、F細胞およびE細胞の増殖能を示している。F(“線維芽細胞性”羊水由来)細胞および羊水(AF)細胞が50回を超える回数の細胞集団倍加を繰り返して増殖することができ、かつ細胞(移植)治療用の供給源であることを示していることは明らかである。
【0154】
[実施例7:AF−I細胞のテロメア長]
末端TAGGGテロメア長検定法(米国インディアナ州のロッシュ社製)を用い、その製造者の指示に従って、限定された回数で行う連続希釈処理によって、単一細胞から分離したAF−I細胞系列のテロメア長を継代数12(1継代当たり細胞集団倍加:約50回)で分析した。10%のウシ胎仔血清(FBS)添加DMEM−LG培地で培養した細胞およびアムニオマックス(Amniomax(商標);ギブコ(Gibco)社製)培地で培養した細胞について、テロメア長を分析した(図12参照)。胚性癌腫細胞系列(NTERA細胞)由来のデオキシリボ核酸(DNA)を陽性の対照区とした。
【0155】
〔実施例8:核型分析〕
複数のドナーから分離した継代数8〜10(1継代当たり細胞集団倍加:約30回)のAF細胞の核型を、Gバンド染色検定法によって確認した。5つの核型が調製し、細胞遺伝学的分析では、上記細胞が常染色体を有し、形式上、染色体数46を有していることが示された。また、分析された全細胞は、胎仔起源を裏付けるX染色体およびY染色体を含有していた。図13は、妊娠期間の16週〜22週のドナーから採取した羊水から分離された羊水由来細胞(AF−I細胞、AF−II細胞およびAF−III細胞)の核型を示している。
【0156】
〔実施例9:満期分娩時の羊水由来のAF細胞の増殖能〕
図14は、満期分娩時(約38週まで)の羊水由来であって5番培地で培養したAF−I細胞形態の増殖能を示している。この増殖能は、16週〜22週で採取した羊水から分離したAF−I細胞の増殖能に非常に類似している。
【0157】
〔実施例10:線維芽細胞、上皮細胞および羊水細胞の形態に関するマイクロアレイ分析〕
ルナシー(RNeasy)ミニキット(キアゲン(Qiagen)社製)で、継代数9〜11の線維芽細胞性羊水由来細胞(F細胞)、上皮性羊水由来細胞(E細胞)、羊水由来羊水細胞(AF−I細胞系列、AF−II細胞系列およびAF−III細胞系列)および満期分娩時の羊水(AF term)から全リボ核酸(RNA)を分離した。コードリンク(Codelink(商標))システム(米国ニュージャージー州のアメルシャム・バイオサイエンス(Amersham Biosciences)社ジー・イー・ヘルスケア(GE Healthcare)部門製)に従って、サンプル調製、ハイブリダイゼーションおよび画像分析を実行した。コードリンク(Codelink(商標))ヒト・ホール・ゲノム・アレイ(Codelink Human Whole Genome arrays)を用いた。このアレイは、標的遺伝子の転写部分の端から端までのエクソンを保存するように設計された約5500030の部分プローブから構成されている。チップは45000までの非反復単一遺伝子識別番号(unique Unigene IDs)を含むものである。標準化および対数変換に続けて、オムニビズ(OmniViz:登録商標)ソフトウエア(米国マサチューセッツ州のマテック(Matek)社製)およびジーンシフター(GENESIFTER:米国ワシントン州のビズエックスラボズ(VizXLabs)社製)で、データ分析を実行した。標準化サンプルの歪みに伴う変換の分散安定化を対数変換型アレイデータセットに適用した。ピアソン相関係数で、各細胞系列内および異種細胞系列間での変動を比較した。分析されたすべてのサンプルに関しては、細胞系列内の相関係数は、細胞系列間の相関係数と比較して高くなった。図15には、細胞系列間の相関係数に伴う異種細胞型間の遺伝子発現プロファイルの変動が示されている。変動分析およびP値を0.05以下に調整(ベンジャミニ(Benjamini)およびホックベルグ(Hochberg)補正)したF検定で、遺伝子発現における細胞型間の顕著な差異を求めた。表11〜表17は、種々の細胞型間で、少なくとも5倍の分化的な発現性を呈する遺伝子を示している。
【0158】
[実施例11:腸管様細胞への細胞分化]
AF−I細胞系列で継代数14のAFCA007クローンAを、1cm2当たりの細胞数10,000個で、アムニオマックス(AMNIOMAX(商標))完全培地中で培養した。培養飽和密度時に、上記細胞を、アムニオマックス(AMNIOMAX:商品名)完全培地中に1日当たり10μMのレチノイン酸(RA)を投与して、2週間、さらに処理した。リボ核酸(RNA)を14日目に採集し、消化管ホルモン(セクレチン、ニューロテンシン、胃抑制ペプチド(GIP)、コレシストキニン、ソマトスタチンおよびガストリン)の形質発現を、実施例4に説明されているようなリアルタイムの重合酵素連鎖反応(PCR)で推定した。ΔΔC1法で相対的な発現レベルを推定するのに腸管リボ核酸(RNA)(Ambion)を用いた。表18は、処理済みサンプルおよび未処理サンプルにおける消化管ホルモンのC1値および相対的発現レベルを示している。表18に示されているように、レチノイン酸(RA)の添加は消化管ホルモンの発現を高めた。
【0159】
〔実施例12:複数の内分泌細胞系列への細胞分化〕
継代数8のAFCA007クローンA(AF−I細胞系列)由来の細胞を、1%増殖因子低減型マトリゲル(MATRIGEL:登録商標)基質(米国カリフォルニア州のベクトン・ディキンソン社製)を含むコラーゲン型I(ベクトン・ディキンソン社製)中に包理し、6ウェル・トランスウェル・インサート中に1ウェル当たり細胞数5×105個で播種した。継代数6のヒト大動脈内皮細胞(米国メリーランド州のケンブレックス(Cambrex)社製)をウェル底部に播種した。細胞を、5%のウシ胎仔血清(FBS)と、シクロパミン、塩基性線維芽細胞増殖因子(bFGF)、上皮増殖因子(EGF)、骨形態形成蛋白質(BMP)−4〜7、アクチビンA、エキセンジン−4、線維芽細胞増殖因子(FGF)−4、全トランス型レチノイン酸およびγ−セクレターゼ阻害剤を含む増殖因子を補給したDMEM地で14日間、培養した。培養物を1日おきに、供給した。全トランス型レチノイン酸によって処理した細胞は、α−胎仔性蛋白質(AFP)の反応性の向上を示した。アクチビンA、骨形態形成蛋白質(BMP)−4あるいはγ−セクレターゼ阻害剤L−685,458で処理した細胞は、HNF−3β発現反応性を向上させた。50ng/mLという高濃度の骨形態形成蛋白質(BMP)で処理した細胞は、転写因子GATA−4発現反応性を向上させた。50ng/mLの線維芽細胞増殖因子(FGF)−4で処理した細胞は、転写因子PDX−1発現反応性を向上させた(表19)。
【0160】
継代数6のAFCA004(E細胞形態)の細胞系列由来の細胞を、6ウェル培養プレートの各ウェルに5×105個で播種し、集密的PANC−1細胞(ATCC(アメリカン・タイプ・カルチャー・コレクション;米国バージニア州))を他の増殖因子と組み合わせて調整した培地で処理した。基本的な線維芽細胞増殖因子(FGF)、上皮増殖因子(EGF)および塩基性線維芽細胞増殖因子(bFGF)と上皮増殖因子(EGF)との組み合わせは、未処理細胞に対するHNF−3βの発現を100倍まで高めた。基本的な線維芽細胞増殖因子(FGF)、上皮増殖因子(EGF)および骨形態形成蛋白質(BMP)も、14日間の処理後に、ソマトスタチンの発現を活性化した(図16のパネルaおよびパネルb)。
【0161】
同時に得られた知見として、上記結果は、AF細胞を複数の異なる増殖因子で処理することによって、AF細胞が膵臓細胞系列、肝臓細胞系列あるいは消化管細胞系列に分化することができることを示唆している。
【0162】
〔実施例13:ノッチ経路阻害による内胚葉マーカーの発現調節〕
継代数8のAFCA007(AF−I細胞系列)由来の細胞を、ある濃度範囲のノッチ経路阻害剤L−685,458(米国ミズーリ州のシグマ(Sigma)社製)で、3日間〜5日間、処理した。L−685,458の細胞毒性を、MTS検定法(米国ウィスコンシン州のプロメガ(Promega)社製)で細胞の生存力を測定することによって確認した。上記処理後に、Hes−1形質発現性を分析するために、リアルタイムの重合酵素連鎖反応(PCR)検定法を実行した。我々発明者らは、L−685,458がHes−1形質発現性に対する投与量依存型の阻害効果を示したことを確認した(図17のパネルa)。なお、Hes−1は、ノッチ経路の下流側の直接的な標的である。MTS検定法で確認されたように、細胞の生存力に対する効果は、5日間、10μMまでのL−685,458の次の処理では、観察されなかった(図17のパネルb)。
【0163】
〔実施例14:AF−I細胞およびAF−II細胞のサイトカイン抗体アレイ分析〕
継代数10のAFCA007A(AF−I細胞系列)およびAFCA015C(AF−II細胞系列)を、集密度約70%まで増殖させた後、哺乳類細胞溶解キット(米国ミズーリ州のシグマ・アルドリッチ(Sigma−Aldrich)社製)で、細胞溶解物を収集した。米国ジョージア州のレイバイオテック(RayBiotech)社(http://www/raybiotech.com/)から提供されたサイトカイン・アレイ・パネルで、サイトカイン・アレイ分析を完了した。表20は、バックグラウンドを差し引いたデータの標準化後のサイトカイン、サイトカインおよび増殖因子の発現性を示している。各パネルについては、陽性および陰性の対照区も含まれている。上記パネルは、1つの細胞型当たり2つの異なるサンプルについて実施したものである。
【0164】
この明細書全体で引用された文献は、この明細書において参照することによって、その文献全体がこの明細書に組み込まれる。この発明の種々の態様が実施例および好適な実施の形態を参照して示されているが、この発明の範囲が、特許法の精神の下に適切に議論される特許請求の範囲によって規定されるが、先の記述によっては限定されないものと正当に評価されるはずである。
【表1】

【表2】

【表3】

【表4】

【表5】

【表6】

【表7】

【表8】

【表9】

【表10】

【表11−1】

【表11−2】

【表11−3】

【表11−4】

【表11−5】

【表11−6】

【表11−7】

【表11−8】

【表11−9】

【表11−10】

【表11−11】

【表11−12】

【表11−13】

【表11−14】

【表11−15】

【表11−16】

【表11−17】

【表11−18】

【表11−19】

【表11−20】

【表11−21】

【表11−22】

【表12−1】

【表12−2】

【表12−3】

【表12−4】

【表12−5】

【表12−6】

【表12−7】

【表12−8】

【表12−9】

【表12−10】

【表12−11】

【表12−12】

【表12−13】

【表12−14】

【表12−15】

【表12−16】

【表12−17】

【表12−18】

【表12−19】

【表12−20】

【表12−21】

【表12−22】

【表12−23】

【表12−24】

【表12−25】

【表13−1】

【表13−2】

【表13−3】

【表13−4】

【表13−5】

【表13−6】

【表13−7】

【表14−1】

【表14−2】

【表14−3】

【表14−4】

【表15−1】

【表15−2】

【表15−3】

【表15−4】

【表15−5】

【表15−6】

【表15−7】

【表15−8】

【表15−9】

【表15−10】

【表15−11】

【表15−12】

【表15−13】

【表15−14】

【表15−15】

【表15−16】

【表16−1】

【表16−2】

【表16−3】

【表16−4】

【表16−5】

【表16−6】

【表16−7】

【表16−8】

【表16−9】

【表16−10】

【表16−11】

【表16−12】

【表16−13】

【表16−14】

【表16−15】

【表16−16】

【表16−17】

【表16−18】

【表16−19】

【表17−1】

【表17−2】

【表17−3】

【表17−4】

【表17−5】

【表17−6】

【表17−7】

【表17−8】

【表17−9】

【表17−10】

【表17−11】

【表18】

【表19】

【表20−1】

【表20−2】

【表20−3】

【表20−4】

【表21−1】

【表21−2】

【表21−3】

【表21−4】

【表21−5】

【0165】
〔実施の態様〕
以下、この発明の実施の態様を説明する。
(1)実質的に精製された羊水由来細胞の個体群。
(2)実施態様1記載の羊水由来細胞の個体群において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、羊水由来細胞の個体群。
(3)実施態様2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、羊水由来細胞の個体群。
(4)実施態様2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、羊水由来細胞の個体群。
(5)実施態様2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、羊水由来細胞の個体群。
(6)実施態様2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性である、羊水由来細胞の個体群。
(7)実施態様6記載の羊水由来細胞の個体群において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、羊水由来細胞の個体群。
(8)実施態様6記載の羊水由来細胞の個体群において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、羊水由来細胞の個体群。
(9)実施態様1記載の羊水由来細胞の個体群において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、羊水由来細胞の個体群。
(10)実施態様1記載の羊水由来細胞の個体群において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、羊水由来細胞の個体群。
(11)実施態様10記載の羊水由来細胞の個体群において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、羊水由来細胞の個体群。
(12)実施態様10記載の羊水由来細胞の個体群において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、羊水由来細胞の個体群。
(13)実施態様10記載の羊水由来細胞の個体群において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、羊水由来細胞の個体群。
(14)実施態様1記載の羊水由来膵臓細胞の個体群において、
試験管内で増殖可能である、羊水由来膵臓細胞の個体群。
(15)実施態様1記載の羊水由来細胞の個体群において、
低酸素条件下の試験管内で増殖可能である、羊水由来細胞の個体群。
(16)実施態様1記載の羊水由来細胞の個体群において、
β細胞系列の特性を示す細胞に分化可能である、羊水由来細胞の個体群。
(17)実施態様1記載の羊水由来細胞の個体群において、
消化管ホルモン産生細胞に分化可能である、羊水由来細胞の個体群。
(18)羊水から細胞の個体群を採取する方法において、
a.羊水を分離するステップと、
b.前記羊水から前記細胞を分離するステップと、
c.培地中に前記細胞を配置するステップと、
d.培養容器中に前記細胞を播種するステップと、
e.少なくとも5日間、前記培地中で前記細胞を増殖させ、これにより羊水由来細胞の個体群を採取するステップと、
を含む、方法。
(19)実施態様18記載の方法において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、方法。
(20)実施態様19記載の方法において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、方法。
(21)実施態様19記載の方法において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、方法。
(22)実施態様19記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(23)実施態様19記載の方法において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性である、方法。
(24)実施態様23記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
(25)実施態様23記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(26)実施態様18記載の方法において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
(27)実施態様18記載の方法において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、方法。
(28)実施態様27記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
(29)実施態様27記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(30)実施態様27記載の方法において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
(31)実施態様18記載の方法において、
前記個体群の細胞は、試験管内で増殖可能である、方法。
(32)実施態様18記載の方法において、
前記個体群の細胞は、低酸素条件下の試験管内で増殖可能である、方法。
(33)実施態様18記載の方法において、
前記個体群の細胞は、β細胞系列の特性を示す細胞に分化可能である、方法。
(34)実施態様18記載の方法において、前記個体群の細胞は、消化管ホルモン産生細胞に分化可能である、方法。
(35)羊水から細胞の個体群を採取する方法において、
a.羊水を分離するステップと、
b.前記羊水から前記細胞を分離するステップと、
c.SSEA−4、SSEA−3、TRA1−60およびTRA1−81からなる群より選択された少なくとも1つのマーカーを発現させる細胞を選択するステップと、
d.培地中に前記細胞を配置するステップと、
e.培養容器中に前記細胞を播種するステップと、
f.少なくとも5日間、前記培地中で前記細胞を増殖させ、これにより羊水由来細胞の個体群を採取するステップと、
を含む、方法。
(36)実施態様35記載の方法において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、方法。
(37)実施態様36記載の方法において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、方法。
(38)実施態様36記載の方法において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、方法。
(39)実施態様36記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(40)実施態様36記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性である、方法。
(41)実施態様40記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
(42)実施態様40記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(43)実施態様35記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
(44)実施態様40記載の方法において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、方法。
(45)実施態様44記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
(46)実施態様44記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(47)実施態様44記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
(48)実施態様35記載の方法において、
前記個体群の細胞は、試験管内で増殖可能である、方法。
(49)実施態様35記載の方法において、
前記個体群の細胞は、低酸素条件下の試験管内で増殖可能である、方法。
(50)実施態様35記載の方法において、
前記個体群の細胞は、β細胞系列の特性を示す細胞に分化可能である、方法。
(51)実施態様35記載の方法において、
前記個体群の細胞は、消化管ホルモン産生細胞に分化可能である、方法。
(52)糖尿病患者あるいは糖尿病発症のリスクを負う者を治療するための方法において、
a.ドナーから採取した羊水由来細胞の個体群を分離するステップと、
b.前記患者に前記羊水由来細胞を移すステップを含む、方法。
(53)実施態様52記載の方法において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、方法。
(54)実施態様53記載の方法において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、方法。
(55)実施態様53記載の方法において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、方法。
(56)実施態様53記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(57)実施態様53記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性である、方法。
(58)実施態様57記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
(59)実施態様57記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(60)実施態様52記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
(61)実施態様57記載の方法において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、方法。
(62)実施態様61記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
(63)実施態様61記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
(64)実施態様61記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
(65)実施態様52記載の方法において、
前記個体群の細胞は、前記患者に移すステップの前に、膵臓ホルモン産生細胞に分化される、方法。
(66)実施態様52記載の方法において、
前記個体群の細胞は、前記患者に移すステップの後に、膵臓ホルモン産生細胞に分化される、方法。
(67)実施態様52記載の方法において、
前記個体群の細胞は、試験管内で増殖可能である、方法。
(68)実施態様52記載の方法において、
前記個体群の細胞は、低酸素条件下の試験管内で増殖可能である、方法。
(69)実施態様52記載の方法において、
前記個体群の細胞は、β細胞系列の特性を示す細胞に分化可能である、方法。
(70)実施態様52記載の方法において、
前記個体群の細胞は、消化管ホルモン産生細胞に分化可能である、方法。
【図面の簡単な説明】
【0166】
【図1】この発明の羊水由来細胞を分離するのに用いられる分離ステップおよび培養ステップを示している。
【図2】継代数ゼロの羊水サンプルから分離された細胞の3つの特徴的な形態を示すもので、a)は羊水細胞の形態、b)は上皮細胞の形態、およびc)は線維芽細胞の形態である。
【図3】羊水由来のAF−I細胞上の細胞表面マーカーの発現を示している。これらのマーカーはパネルa〜n上に示されている。
【図4】羊水由来のF細胞上の細胞表面マーカーの発現を示している。これらのマーカーはパネルa〜l上に示されている。
【図5】羊水由来のE細胞上の細胞表面マーカーの発現を示している。これらのマーカーはパネルa〜m上に示されている。
【図6】羊水サンプル由来のF細胞の免疫蛍光像を示している。F細胞は、a)ビメンチン、b)発生段階特異性胚抗原(SSEA)−4、およびc)βIIIチューブリンに関して染色陽性を示した。
【図7】羊水サンプル由来のE細胞の免疫蛍光像を示している。E細胞は、a)ビメンチンおよびネスチン、b)発生段階特異性胚抗原(SSEA)−4、c)βIIIチューブリン、g)全サイトケラチン、h)平滑筋アクチン、およびi)サイトケラチン−19に関して染色陽性を示した。
【図8】羊水サンプル由来のAF−I細胞の免疫蛍光像を示している。AF−I細胞は、a)ビメンチンおよびネスチン、b)βIIIチューブリン、c)サイトケラチン−19およびHes−1、d)全サイトケラチン、e)発生段階特異性胚抗原(SSEA)−4、f)SOX−17およびZO−1、g)GATA−6、h)HNF−1β、およびi)平滑筋アクチンおよびHES−2に関して染色陽性を示した。
【図9】この発明のAF−I細胞、AF−II細胞およびAF−III細胞の発現プロファイルを示している。
【図10】初期継代のAF−I培養細胞の個体群の増殖曲線を示している。
【図11】異なるドナー由来のAF細胞、F細胞あるいはE細胞の増殖能を示している。図中記号◆は、妊娠期間の14週〜23週の第1ドナーの羊水から採取した、AF−I細胞形態を有する羊水由来細胞の細胞数を示している。5番培地(表II)で、細胞を培養した。図中記号▲は、妊娠期間の14週〜23週の第2ドナーの羊水から採取した、AF−I細胞形態を有する羊水由来細胞の細胞数を示している。5番培地(表II)で、細胞を培養した。図中記号■は、妊娠期間の14週〜23週の第3ドナーの羊水から採取した、F細胞形態を有する羊水由来細胞の細胞数を示している。15番培地(表II)で、細胞を培養した。図中記号*は、妊娠期間の14週〜23週の第4ドナーの羊水から採取した、F細胞形態を有する羊水由来細胞の細胞数を示している。16番培地(表II)で、細胞を培養した。図中記号●は、妊娠期間の14週〜23週のドナーの羊水から採取した、E細胞形態を有する羊水由来細胞の細胞数を示している。5番培地(表II)で、細胞を培養した。図中記号+は、妊娠期間の14週〜23週の第2ドナーの羊水から採取した、AF−II細胞形態を有する羊水由来細胞の細胞数を示している。5番培地(表II)で、細胞を培養した。図中記号△は、妊娠期間の14週〜23週の第2ドナーの羊水から採取した、AF−III細胞形態を有する羊水由来細胞の細胞数を示している。5番培地(表II)で、細胞を培養した。
【図12】アムニオマックス(AMNIOMAX:商品名)完全培地あるいは10%のウシ胎仔血清(FBS)添加DM−LG培地のいずれかにおいて、中程度の継代数(1継代当たり細胞集団倍加数:約40回)で培養されたAF−I細胞系列のテロメア長を示している。区分1は分子量の階段状分布であり、区分2は、テロメア長が高い位置にある対照区であり、区分3は、テロメア長が低い位置にある対照区であり、区分4は、ドナーから採取された羊水由来細胞であって、10%のウシ胎仔血清(FBS)添加DMEM−LG培地において、継代数12で培養された羊水由来細胞であり、区分5は、区分4と同一のドナーから採取された羊水由来細胞であって、5番培地において、継代数12で培養された羊水由来細胞であり、区分6は、陽性の対照区としての胚性癌腫細胞系列(NTERA細胞)である。
【図13】継代数7回〜9回(1継代当たり細胞集団倍加数:約30〜35回)で培養されたa)AF−I細胞、b)AF−II細胞およびc)AF−III細胞の核型を示している。
【図14】満期分娩時(約38週)における1つのドナーからの単一の羊水由来細胞の増殖能を示している。5番培地(表II)で、細胞を培養した。
【図15】異種の羊水由来細胞型間の形質発現プロファイルを分散プロットで示している。各プロットのピアソン相関係数も示されている。
【図16】羊水由来細胞内での形質発現における増殖因子の効果を示している。羊水由来細胞を単一のドナーから採取し、PANC−1細胞の培養液から採取した調整培地で12日間、培養した。表示された増殖因子を調整培地に補給した。リアルタイムのポリメラーゼ連鎖反応法(PCR)によって、HNF−3βおよびソマトスタチンの発現レベルを確認した。較正物質としてヒト膵臓由来の全リボ核酸(RNA)を含めた。パネルaは、HNF−3β発現の変化を示している。パネルbは、ソマトスタチン発現の変化を示している。
【図17】羊水(AF)細胞の形態を有する羊水由来培養細胞上でのL−685,458の効果を示している。パネルaは、表示された濃度のL−685,458で処理された羊水(AF)培養細胞内で、ヒトHes−1のRNA形質発現の相対的な差異を示している。パネルbは、L−685,458処理後に、上記培養細胞の生存力に対するL−685,458の効果を示している。細胞を、表示濃度で3日間、処理した。細胞毒性に対応する生存力の変化を、細胞の生存力の低下が490nmの波長での吸光度の減少に対応するMTS検定法で検出した。
【特許請求の範囲】
【請求項1】
実質的に精製された羊水由来細胞の個体群。
【請求項2】
請求項1記載の羊水由来細胞の個体群において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、羊水由来細胞の個体群。
【請求項3】
請求項2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、羊水由来細胞の個体群。
【請求項4】
請求項2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、羊水由来細胞の個体群。
【請求項5】
請求項2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、羊水由来細胞の個体群。
【請求項6】
請求項2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性である、羊水由来細胞の個体群。
【請求項7】
請求項6記載の羊水由来細胞の個体群において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、羊水由来細胞の個体群。
【請求項8】
請求項6記載の羊水由来細胞の個体群において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、羊水由来細胞の個体群。
【請求項9】
請求項1記載の羊水由来細胞の個体群において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、羊水由来細胞の個体群。
【請求項10】
請求項1記載の羊水由来細胞の個体群において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、羊水由来細胞の個体群。
【請求項11】
請求項10記載の羊水由来細胞の個体群において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、羊水由来細胞の個体群。
【請求項12】
請求項10記載の羊水由来細胞の個体群において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、羊水由来細胞の個体群。
【請求項13】
請求項10記載の羊水由来細胞の個体群において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、羊水由来細胞の個体群。
【請求項14】
請求項1記載の羊水由来膵臓細胞の個体群において、
試験管内で増殖可能である、羊水由来膵臓細胞の個体群。
【請求項15】
請求項1記載の羊水由来細胞の個体群において、
低酸素条件下の試験管内で増殖可能である、羊水由来細胞の個体群。
【請求項16】
請求項1記載の羊水由来細胞の個体群において、
β細胞系列の特性を示す細胞に分化可能である、羊水由来細胞の個体群。
【請求項17】
請求項1記載の羊水由来細胞の個体群において、
消化管ホルモン産生細胞に分化可能である、羊水由来細胞の個体群。
【請求項18】
羊水から細胞の個体群を採取する方法において、
a.羊水を分離するステップと、
b.前記羊水から前記細胞を分離するステップと、
c.培地中に前記細胞を配置するステップと、
d.培養容器中に前記細胞を播種するステップと、
e.少なくとも5日間、前記培地中で前記細胞を増殖させ、これにより羊水由来細胞の個体群を採取するステップと、
を含む、方法。
【請求項19】
請求項18記載の方法において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、方法。
【請求項20】
請求項19記載の方法において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、方法。
【請求項21】
請求項19記載の方法において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、方法。
【請求項22】
請求項19記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
【請求項23】
請求項19記載の方法において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性である、方法。
【請求項24】
請求項23記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
【請求項25】
請求項23記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
【請求項26】
請求項18記載の方法において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
【請求項27】
請求項18記載の方法において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、方法。
【請求項28】
請求項27記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
【請求項29】
請求項27記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
【請求項30】
請求項27記載の方法において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
【請求項31】
請求項18記載の方法において、
前記個体群の細胞は、試験管内で増殖可能である、方法。
【請求項32】
請求項18記載の方法において、
前記個体群の細胞は、低酸素条件下の試験管内で増殖可能である、方法。
【請求項33】
請求項18記載の方法において、
前記個体群の細胞は、β細胞系列の特性を示す細胞に分化可能である、方法。
【請求項34】
請求項18記載の方法において、
前記個体群の細胞は、消化管ホルモン産生細胞に分化可能である、方法。
【請求項35】
羊水から細胞の個体群を採取する方法において、
a.羊水を分離するステップと、
b.前記羊水から前記細胞を分離するステップと、
c.SSEA−4、SSEA−3、TRA1−60およびTRA1−81からなる群より選択された少なくとも1つのマーカーを発現させる細胞を選択するステップと、
d.培地中に前記細胞を配置するステップと、
e.培養容器中に前記細胞を播種するステップと、
f.少なくとも5日間、前記培地中で前記細胞を増殖させ、これにより羊水由来細胞の個体群を採取するステップと、
を含む、方法。
【請求項36】
請求項35記載の方法において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、方法。
【請求項37】
請求項36記載の方法において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、方法。
【請求項38】
請求項36記載の方法において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、方法。
【請求項39】
請求項36記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
【請求項40】
請求項36記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性である、方法。
【請求項41】
請求項40記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
【請求項42】
請求項40記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
【請求項43】
請求項35記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
【請求項44】
請求項40記載の方法において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、方法。
【請求項45】
請求項44記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
【請求項46】
請求項44記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
【請求項47】
請求項44記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
【請求項48】
請求項35記載の方法において、
前記個体群の細胞は、試験管内で増殖可能である、方法。
【請求項49】
請求項35記載の方法において、
前記個体群の細胞は、低酸素条件下の試験管内で増殖可能である、方法。
【請求項50】
請求項35記載の方法において、
前記個体群の細胞は、β細胞系列の特性を示す細胞に分化可能である、方法。
【請求項51】
請求項35記載の方法において、
前記個体群の細胞は、消化管ホルモン産生細胞に分化可能である、方法。
【請求項52】
糖尿病患者あるいは糖尿病発症のリスクを負う者を治療するための方法において、
a.ドナーから採取した羊水由来細胞の個体群を分離するステップと、
b.前記患者に前記羊水由来細胞を移すステップを含む、方法。
【請求項1】
実質的に精製された羊水由来細胞の個体群。
【請求項2】
請求項1記載の羊水由来細胞の個体群において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、羊水由来細胞の個体群。
【請求項3】
請求項2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、羊水由来細胞の個体群。
【請求項4】
請求項2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、羊水由来細胞の個体群。
【請求項5】
請求項2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、羊水由来細胞の個体群。
【請求項6】
請求項2記載の羊水由来細胞の個体群において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性である、羊水由来細胞の個体群。
【請求項7】
請求項6記載の羊水由来細胞の個体群において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、羊水由来細胞の個体群。
【請求項8】
請求項6記載の羊水由来細胞の個体群において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、羊水由来細胞の個体群。
【請求項9】
請求項1記載の羊水由来細胞の個体群において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、羊水由来細胞の個体群。
【請求項10】
請求項1記載の羊水由来細胞の個体群において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、羊水由来細胞の個体群。
【請求項11】
請求項10記載の羊水由来細胞の個体群において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、羊水由来細胞の個体群。
【請求項12】
請求項10記載の羊水由来細胞の個体群において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、羊水由来細胞の個体群。
【請求項13】
請求項10記載の羊水由来細胞の個体群において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、羊水由来細胞の個体群。
【請求項14】
請求項1記載の羊水由来膵臓細胞の個体群において、
試験管内で増殖可能である、羊水由来膵臓細胞の個体群。
【請求項15】
請求項1記載の羊水由来細胞の個体群において、
低酸素条件下の試験管内で増殖可能である、羊水由来細胞の個体群。
【請求項16】
請求項1記載の羊水由来細胞の個体群において、
β細胞系列の特性を示す細胞に分化可能である、羊水由来細胞の個体群。
【請求項17】
請求項1記載の羊水由来細胞の個体群において、
消化管ホルモン産生細胞に分化可能である、羊水由来細胞の個体群。
【請求項18】
羊水から細胞の個体群を採取する方法において、
a.羊水を分離するステップと、
b.前記羊水から前記細胞を分離するステップと、
c.培地中に前記細胞を配置するステップと、
d.培養容器中に前記細胞を播種するステップと、
e.少なくとも5日間、前記培地中で前記細胞を増殖させ、これにより羊水由来細胞の個体群を採取するステップと、
を含む、方法。
【請求項19】
請求項18記載の方法において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、方法。
【請求項20】
請求項19記載の方法において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、方法。
【請求項21】
請求項19記載の方法において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、方法。
【請求項22】
請求項19記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
【請求項23】
請求項19記載の方法において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性である、方法。
【請求項24】
請求項23記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
【請求項25】
請求項23記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
【請求項26】
請求項18記載の方法において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
【請求項27】
請求項18記載の方法において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、方法。
【請求項28】
請求項27記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
【請求項29】
請求項27記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
【請求項30】
請求項27記載の方法において、
前記個体群の細胞は、蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
【請求項31】
請求項18記載の方法において、
前記個体群の細胞は、試験管内で増殖可能である、方法。
【請求項32】
請求項18記載の方法において、
前記個体群の細胞は、低酸素条件下の試験管内で増殖可能である、方法。
【請求項33】
請求項18記載の方法において、
前記個体群の細胞は、β細胞系列の特性を示す細胞に分化可能である、方法。
【請求項34】
請求項18記載の方法において、
前記個体群の細胞は、消化管ホルモン産生細胞に分化可能である、方法。
【請求項35】
羊水から細胞の個体群を採取する方法において、
a.羊水を分離するステップと、
b.前記羊水から前記細胞を分離するステップと、
c.SSEA−4、SSEA−3、TRA1−60およびTRA1−81からなる群より選択された少なくとも1つのマーカーを発現させる細胞を選択するステップと、
d.培地中に前記細胞を配置するステップと、
e.培養容器中に前記細胞を播種するステップと、
f.少なくとも5日間、前記培地中で前記細胞を増殖させ、これにより羊水由来細胞の個体群を採取するステップと、
を含む、方法。
【請求項36】
請求項35記載の方法において、
前記個体群の細胞は、CD117、Oct−4、およびTra2−54からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陰性である、方法。
【請求項37】
請求項36記載の方法において、
前記個体群の細胞は、HNF−1β、GATA−6およびSox−17からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して実質的に陽性である、方法。
【請求項38】
請求項36記載の方法において、
前記個体群の細胞は、HNF−3β、Hes−1、GATA−4およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させるものでもある、方法。
【請求項39】
請求項36記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、AXL、bFGF、EGF受容体、Fas/TNFRSF6、GRO、GRO−α、ICAM−1、IL−1α、IL−3、IL−6、IL−8、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
【請求項40】
請求項36記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性である、方法。
【請求項41】
請求項40記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
【請求項42】
請求項40記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
【請求項43】
請求項35記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
【請求項44】
請求項40記載の方法において、
前記個体群の細胞は、CD117、Oct−4、Sox−17およびTra2−54の発現に対して実質的に陰性である、方法。
【請求項45】
請求項44記載の方法において、
前記個体群の細胞は、サイトケラチン蛋白質の発現に対して実質的に陰性である、方法。
【請求項46】
請求項44記載の方法において、
前記個体群の細胞は、肝臓活性化蛋白質、PDGF受容体β、bFGF、EGF受容体、GRO、GRO−α、ICAM−1、IL−3、IL−6、MIF、オステオプロテゲリン、TIMP−2およびTRAIL R3からなる群より選択された少なくとも1つの蛋白質マーカーの発現に対して陽性である、方法。
【請求項47】
請求項44記載の方法において、
前記個体群の細胞は、前記蛋白質マーカーSox−17の発現に対して実質的に陰性であり、かつHes−1およびMusashi−1からなる群より選択された少なくとも1つの遺伝子を発現させる、方法。
【請求項48】
請求項35記載の方法において、
前記個体群の細胞は、試験管内で増殖可能である、方法。
【請求項49】
請求項35記載の方法において、
前記個体群の細胞は、低酸素条件下の試験管内で増殖可能である、方法。
【請求項50】
請求項35記載の方法において、
前記個体群の細胞は、β細胞系列の特性を示す細胞に分化可能である、方法。
【請求項51】
請求項35記載の方法において、
前記個体群の細胞は、消化管ホルモン産生細胞に分化可能である、方法。
【請求項52】
糖尿病患者あるいは糖尿病発症のリスクを負う者を治療するための方法において、
a.ドナーから採取した羊水由来細胞の個体群を分離するステップと、
b.前記患者に前記羊水由来細胞を移すステップを含む、方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公開番号】特開2006−325594(P2006−325594A)
【公開日】平成18年12月7日(2006.12.7)
【国際特許分類】
【外国語出願】
【出願番号】特願2006−147101(P2006−147101)
【出願日】平成18年5月26日(2006.5.26)
【出願人】(596159500)ライフスキャン・インコーポレイテッド (100)
【氏名又は名称原語表記】Lifescan,Inc.
【住所又は居所原語表記】1000 Gibraltar Drive,Milpitas,California 95035,United States of America
【Fターム(参考)】
【公開日】平成18年12月7日(2006.12.7)
【国際特許分類】
【出願番号】特願2006−147101(P2006−147101)
【出願日】平成18年5月26日(2006.5.26)
【出願人】(596159500)ライフスキャン・インコーポレイテッド (100)
【氏名又は名称原語表記】Lifescan,Inc.
【住所又は居所原語表記】1000 Gibraltar Drive,Milpitas,California 95035,United States of America
【Fターム(参考)】
[ Back to top ]

