羊膜内感染の検出
本発明は、羊膜内感染の非侵襲性診断ために使用され得る、バイオマーカー及びバイオマーカーの群又は組み合わせの特定、及びそのようなバイオマーカーを用いた診断アッセイに関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、妊婦における羊膜内感染(IAI)のリスクの診断及び/又は評価のための試験に関する。本発明は、妊娠雌哺乳動物対象における羊膜内感染の診断のためのバイオマーカーの使用に関する、試験、診断アルゴリズム、バイオマーカー、材料、方法及び器具ならびに、このような診断のための診断テストシステム及び本明細書中で記載のような様々なその他の実施態様を提供することにさらに関する。
【背景技術】
【0002】
早産は、生後1ヶ月以内の大きな死亡原因であり、全乳児死亡の3分の1に対する寄与原因である。羊膜内感染(IAI)は、妊娠37週未満の特発性早産の大きな原因の1つである。早産に関与する他の状態としては、早期陣痛、早期破水、子癇前症、胎盤早期剥離、前置胎盤、胎児成長遅延、羊水過多又は羊水量異常、胎児奇形、子宮内出血、糖尿病、薬物乱用及びストレスが挙げられる。早期陣痛及び早産の管理には、必要に応じて、子宮収縮抑制薬及び胎児肺の成熟のためのコルチコステロイドによる治療が含まれ得る。陰性培養結果が出るまでB群レンサ球菌に適応するために狭域抗生物質が処方され得る。
【0003】
IAIは、特発性早期陣痛及び早産の最も重要な原因の1つである。IAIは羊膜腔の微生物侵入であり、全早期陣痛例の10−15%で起こる。(Newton ER.Clin Obstet Gynecol 1993;36(4):795−808;Watts DHら、Obstet Gynecol 1992;79:351−7;Romero Rら、Am J Obstet Gynecol 1993;169:805−16;Hillier SLら、Obstet Gynecol 1993;81:941−8)。膜が完全であるか又は完全ではない状態のIAIを説明するために使用されるその他の用語としては、羊水感染、羊膜炎及び臨床的絨毛羊膜炎が挙げられる。早期陣痛の原因としてのIAIの関与に加え、IAIはまた、特に早期新生児において、新生児有病率及び死亡率の上昇にも関連する。一般に、IAIを発症している母親から生まれた低出生体重児では周産期死亡率が3倍から4倍上昇することが知られている。呼吸窮迫症候群、脳室内出血及び新生児敗血症も増加する。(Morales,W.J.Obstetrics及びGynecology 70:183,1987)。IAIは新生児の脳室周囲白質軟化症及び脳性麻痺に独立して関連付けられており;大脳白質損傷及び脳性麻痺のリスクは、IAIの場合では9倍高い。(Bejar,R.ら、Am.J.Obstet.Gynecol.159:357、1988;Grether,J.K.及びNelson,K.B.JAMA 278:207、1997)。
【0004】
IAI例の大多数、80%から90%は、早期陣痛を除いては亜臨床的(無症状)である。現在、特発性早期陣痛の管理には、観察、子宮収縮抑制薬による治療及び羊水穿刺及び培養による可能性確認が含まれる。培養不能な微生物が存在し、栄養素選好的な微生物の単離が困難であり、抗生物質での治療歴があることにより、羊水培養のみでは、真のIAI有病率を過小評価することになる(Romero、R.ら、Am.J.Obstet.Gynecol.161:817、1989)。本発明の陽性IAI試験は、臨床家にとって利用可能な現在の診断及び治療計画に対する有用な補助的手段を提供するであろう。IAIの正確な診断は、IAIにおいて使用禁忌である子宮収縮抑制薬療法を差し控え、母親に対する出産場所及び、超早産児であり、IAIの過剰な結果として状態が悪い可能性がある乳児に対する必要なケアレベルを予想しながら、的を絞った抗生物質により母親を適切に治療するために重要である。
【0005】
本発明の陰性IAI試験は、早期陣痛の病因が感染以外のものであり得ることの再確認を提供する。30種類の他の徴候及び/又は症状の所見と合わせて、陰性試験により、医師が早期陣痛を処置することが可能になる。
【0006】
発症機序及びリスク因子:羊膜内感染は、下部生殖管微生物による上行性感染の結果として起こると考えられる。IAI有病率は、妊娠期間と強く反比例する。(Watts DHら、Obstet Gynecol 1992;79:351−7)。下部生殖管に対する常在細菌は、羊膜が完全であり、IAIの臨床兆候がない早期陣痛の全女性のうち10−20%(Romero Rら、Ann NY Acad Sci 1991;622:355−75)及び妊娠23−24週間で妊娠終了となった早期陣痛女性の最大67%(Watts DHら、Obstet Gynecol 1992;79:351−7)の羊水から回収される。さらに、これらの所見は、組織学的絨毛羊膜炎が20から24週で妊娠終了となった例の60−90%で見られているという事実により支持される。これらの所見は、IAIが特発性早期陣痛、特に妊娠初期における特発性早期陣痛の重要な原因であるという仮説の裏づけとなる。
【0007】
診断:IAIの早期診断により、適時に治療及び介入を行うことが可能となり得る。しかし、正確な診断を行うという点で複数の課題がある。臨床的見地から、IAIの臨床兆候及び症状は感染経過の後期に起こり、ごく一般的であり非特異的なので、早期診断は困難である。IAIを診断するために一般に使用される臨床基準には、母体発熱(≧37.8℃)を伴う早期陣痛があり、次のうち2以上:母体白血球増加(≧15,000/mm3)、母体又は胎児の頻脈、子宮圧痛又は羊水の悪臭、があることが含まれる。(Gibbs RSら、Am J Obstet Gynecol 1980;136(6):709−13)。Wattsらによる早期陣痛発来妊婦の研究では、羊水培養が陽性である場合と陽性ではない場合で、母体最高体温の平均、WBC数及び型別に違いはない。亜臨床的IAIはIAIに関して言及するために使用される用語であり、この場合、羊水培養が陽性であるおよそ88%の症例で徴候及び症状は僅かであるか又は現れていない。(Watts DHら、Obstet Gynecol 1992;79:351−7)。亜臨床的IAIの概念は、非ヒト霊長類モデルを用いたGravettらの知見によりさらに裏付けられる。これらの研究者らは、実験的IAIをB群レンサ球菌により誘発した後、実験的感染から28から40時間後に起こる感染誘発性早期陣痛の発来時に発熱及び白血球増加が現れるのは50%のみであることを明らかにした。(Gravett MGら、Am J Obstet Gynecol 1994;171(6):1660−7)。
【0008】
臨床的特徴が一貫しないため、IAIの診断を支援するために他の補助的臨床検査が利用されている。これらには、母体のC反応性タンパク質の測定、白血球又はグラム染色での細菌に関する羊水の直接検査、羊水培養、羊水グルコース濃度の測定、羊水白血球エステラーゼの検出、ガス−液体クロマトグラフィーによる細菌性有機酸の検出、様々な羊水サイトカイン(例えば、インターロイキン2、4、6、顆粒球コロニー−刺激因子及び腫瘍壊死因子−α)、マトリクスメタロプロテイナーゼ−9、ラクトフェリンの測定及び超音波検査による胎児活動性の評価(生物物理学的プロファイル)が含まれる。サイトカイン又は他の生化学的因子の測定は費用が嵩み、一般に臨床上利用可能ではなく、主として研究用ツールである。さらに、これらの試験の検査効率は、羊水グラム染色及び培養、羊水グルコース濃度及び羊水白血球エステラーゼの検出などのより簡単に利用可能な古典的試験よりも一貫して優れている訳ではない。これらの試験効率は既に幅広く考察されている。(Ohlsson,A.及びWang,E.:An analysis of antenatal tests to detect infection at preterm rupture of the membranes.American Journal of Obstetrics and Gynecology 162:809,1990)。全て、妥当な感度、特異性及び予測性を有するにもかかわらず、IAIの診断において臨床的特徴から切り離して単独で使用するのに十分な感度又は特異性を有するものはない。
【0009】
従って、IAIの早期及び正確な診断を可能にする新しいアプローチが強く求められている。
【発明の概要】
【0010】
本発明は、妊婦における羊膜内感染(IAI)のリスクの診断及び/又は評価のための試験に関する。本発明は、さらに、羊膜内感染(IAI)の非侵襲性診断のために使用することができるバイオマーカー及びバイオマーカーの群又は組み合わせの特定及び検出ならびに、妊婦における羊膜内感染(IAI)のリスクを診断及び/又は評価するための3種類のタンパク質バイオマーカーの独自の組み合わせの使用に基づく非侵襲性試験を含む、このようなバイオマーカーを使用した診断アッセイに関する。本発明は、全般的に、羊膜内感染の研究室開発テスト(laboratory developed test)及びインビトロ診断機器を作製するために使用される材料及び過程ならびにIAIの診断において臨床的有用性を有するバイオマーカーに関する。特に、本発明は、妊婦から得た頸管膣分泌液(CVF)などの生体試料を分析することによりIAIのリスクを診断するか又は評価するためのインビトロ診断機器を作製するための材料及び過程に関する。特に、本発明は、特に診断アルゴリズムと組み合わせて使用する場合に高精度で非侵襲性の頸管膣スワブに基づく免疫診断テストを用いてIAIの存在を予想することができる、バイオマーカーに関する。診断アルゴリズムと組み合わせて使用する場合、この独自のマーカーの組み合わせにより、高精度で非侵襲性の頸管膣スワブに基づく免疫診断テストを用いてIAIの存在を予想することが可能になる。
【0011】
ある実施態様において、本発明は、妊娠雌哺乳動物対象においてIAIの有無を判定するために、測定し、使用することができるバイオマーカーの新規パネルを提供する。
【0012】
ある態様において、本発明は、(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のレベルに対して、妊娠雌哺乳動物対象から得られた頸管膣分泌液の試料中で該2以上のタンパク質のレベルを測定することと;(b)該レベルが、該正常頸管膣分泌液中のレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中のレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む、妊娠雌哺乳動物対象における羊膜内感染の診断のための方法を提供する。ある実施態様において、対象はヒト患者である。ある種の実施態様において、本発明の方法は、これらのタンパク質の、少なくとも3、少なくとも4、少なくとも5、少なくとも6、少なくとも7、少なくとも8、少なくとも9種類又は全ての存在量を測定することを含む。
【0013】
ある態様において、本発明は、(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の対応するレベルに対して、妊娠雌哺乳動物対象から得られた頸管膣分泌液の試料中で該2以上のタンパク質のレベルを測定することと、(b)該試料中の該2以上のタンパク質のそれぞれの該レベルのそれぞれが、正常頸管膣分泌液中の該タンパク質のそれぞれの対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む、妊娠雌哺乳動物対象における羊膜内感染の診断のための方法を提供する。ある実施態様において、対象はヒト患者である。ある種の実施態様において、本発明の方法は、これらのタンパク質の、少なくとも3、少なくとも4、少なくとも5、少なくとも6、少なくとも7、少なくとも8、少なくとも9種類又は全ての存在量を測定することを含む。
【0014】
ある実施態様において、測定されるバイオマーカーとしては、増殖調節癌遺伝子α(GRO−a)及びマクロファージ炎症性タンパク質1β(MIP1b)が挙げられる。別の実施態様において、測定されるバイオマーカーとしては、増殖調節癌遺伝子α(GRO−a)及びα−1−酸性糖タンパク質(A1AG)が挙げられる。さらに別の実施態様において、測定されるバイオマーカーとしては、α−1−酸性糖タンパク質(A1AG)及びマクロファージ炎症性タンパク質1β(MIP1b)が挙げられる。これらの実施態様において、測定されるさらなるバイオマーカーとしては、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び/又は組織メタロプロテイナーゼ阻害物質−1(TIMP−1)を挙げることができる。さらなる実施態様において、測定されるバイオマーカーとしては、IGF−結合タンパク質−1(IGFBP−1)を挙げることができる。
【0015】
ある種の実施態様において、測定されるバイオマーカーとしては、組織メタロプロテイナーゼ阻害物質−1(TIMP−1)及び増殖調節癌遺伝子α(GRO−a)が挙げられる。ある種の実施態様において、測定されるバイオマーカーとしては、組織メタロプロテイナーゼ阻害物質−1(TIMP1)及びマクロファージ炎症性タンパク質1β(MIP1b)が挙げられる。ある種の実施態様において、測定されるバイオマーカーとしては、組織メタロプロテイナーゼ阻害物質−1(TIMP−1)及びα−1−酸性糖タンパク質(A1AG)が挙げられる。これらの実施態様において、測定されるさらなるバイオマーカーとしては、インターロイキン−6(IL−6)を挙げることができる。
【0016】
ある種の実施態様において、測定されるバイオマーカーとしては、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びマクロファージ炎症性タンパク質1β(MIP1b)が挙げられる。ある種の実施態様において、測定されるバイオマーカーとしては、インターロイキン−6(IL−6)、α−1−酸性糖タンパク質(A1AG)、リポ多糖結合タンパク質(LBP)、増殖調節癌遺伝子α(GRO−a)及びα−胎児性タンパク質(AFP)が挙げられる。
【0017】
ある実施態様において、本発明の方法は、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のレベルを測定することと、2以上の該試験タンパク質が、該頸管膣分泌液中で正常頸管膣分泌液に対する統計学的有意差を示す場合、該対象を羊膜内感染と診断することと、を含む。
【0018】
ある実施態様において、本発明の方法は、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のそれぞれのレベルを測定することと、該被験タンパク質の2以上のそれぞれのレベルが、該頸管膣分泌液試料中で、正常頸管膣分泌液中の対応するタンパク質レベルに対して統計学的有意差を示す場合、該対象を羊膜内感染と診断することと、を含む。
【0019】
ある種の実施態様において、本発明の方法は、前記被験タンパク質の全てのレベルが、該頸管膣分泌液試料において、正常頸管膣分泌液中の該タンパク質の対応するレベルに対して統計学的有意差を示す場合、対象を羊膜内感染と診断することを含む。全ての実施態様において、本明細書中で特定されるタンパク質のレベルは、免疫アッセイにより測定され得る。ある種の実施態様において、本明細書中で特定されるタンパク質のレベルは、タンパク質アレイを用いて測定され得る。ある種の実施態様において、本明細書中で特定されるタンパク質のレベルは、免疫クロマトグラフィー試験装置を用いて測定され得る。免疫クロマトグラフィー試験装置を用いたある種の実施態様において、本明細書中で特定されるタンパク質のレベルは、1以上のクロマトグラフィー試験ストリップを含む免疫クロマトグラフィー試験装置を用いて測定され得る。免疫クロマトグラフィー試験装置を用いたある種の実施態様において、免疫クロマトグラフィー試験装置はラテラルフロー装置である。
【0020】
ある種の実施態様において、本発明は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出ための2以上のクロマトグラフィーストリップを含む免疫クロマトグラフィー試験装置を提供する。ある実施態様において、免疫クロマトグラフィー試験装置は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質に対する抗体を含む試験ストリップを含む。ある実施態様において、免疫クロマトグラフィー試験装置はラテラルフロー装置である。
【0021】
ある種の実施態様において、本発明は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、IGF結合タンパク質−1(IGFBP−1)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される3以上のタンパク質を検出するための3以上のクロマトグラフィーストリップを含む免疫クロマトグラフィー試験装置を提供する。ある実施態様において、免疫クロマトグラフィー試験装置は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、IGF結合タンパク質−1(IGFBP−1)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される3以上のタンパク質に対する抗体を含む試験ストリップを含む。ある実施態様において、免疫クロマトグラフィー試験装置はラテラルフロー装置である。
【0022】
別の態様において、本発明は、(a)妊娠雌哺乳動物対象から頸管膣分泌液の試料を得ることと、(b)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のそれぞれの対応するレベルに対して、該2以上のタンパク質のレベルを決定することと;該2以上のタンパク質のそれぞれの該レベルが、該正常頸管膣分泌液における該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む、妊娠雌哺乳動物対象における羊膜内感染の診断のための方法を提供する。
【0023】
別の態様において、本発明は、
(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のレベルに対して、対象から得られた頸管膣分泌液の試料中で該2以上のタンパク質のレベルを測定することと、
(b)該レベルが、該正常頸管膣分泌液中のレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中のレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む、羊膜内感染を示す徴候及び症状を調べるための方法を提供する。ある種の実施態様において、徴候及び症状としては、母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体及び/又は胎児の頻脈、子宮圧痛及び/又は羊水の悪臭が挙げられるが、これらに限定されない。
【0024】
別の態様において、本発明は、
(a)正常頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の対応するレベルに対して又は羊膜内感染を示すことが分かっている頸管膣分泌液中の該2以上のタンパク質の対応するレベルに対して、対象から得られた頸管膣分泌液の試料中で該2以上のタンパク質のレベルを測定することと、
(b)該試料中の該2以上のタンパク質の該レベルのそれぞれが、該正常頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む、羊膜内感染を示す徴候及び症状を調べるための方法を提供する。ある種の実施態様において、徴候及び症状としては、母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体及び/又は胎児の頻脈、子宮圧痛及び/又は羊水の悪臭が挙げられるが、これらに限定されない。
【0025】
ある態様において、本発明は、
(a)妊娠雌哺乳動物対象から得られる頸管膣分泌液の試料において、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)のレベルを試験することと;
(b)該試料中のAFP、IL−6及びIGFBP−1の該レベルのそれぞれが、正常頸管膣分泌液中のAFP、IL−6及びIGFBP−1の対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている頸管膣分泌液中のAFP、IL−6及びIGFBP−1のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む、妊娠雌哺乳動物対象における羊膜内感染の診断のための方法に関する。
【0026】
ある実施態様において、対象はヒト患者である。
【0027】
別の実施態様において、タンパク質のレベルを測定するために構成される装置を用いて検査が実施される。
【0028】
さらに別の実施態様において、適切なプロセッサにより実行されるソフトウェアプログラムを用いることによって検査が行われる。
【0029】
さらなる実施態様において、このプログラムは、有形の物理媒体に格納されるソフトウェアに統合される。
【0030】
またさらなる実施態様において、この有形の物理媒体は、フラッシュドライブ、CD−ROM、フロッピーディスク、ハードドライブ、DVD及びプロセッサに伴うメモリからなる群から選択される。
【0031】
異なる実施態様において、本方法は、上記の検査又は診断の結果を記録するレポートを準備する段階をさらに含み、このレポートは、紙、フラッシュドライブ、CD−ROM、フロッピーディスク、ハードドライブ、DVD又はプロセッサに伴うメモリなどの有形の物理媒体に記録又は格納され得る。
【0032】
別の実施態様において、本方法は、患者又はその担当医などの関係者に上記の診断の結果を伝達する段階をさらに含む。様々な実施態様において、伝達は、書面で、eメールにより又は電話により行われる。
【0033】
さらに別の実施態様において、タンパク質レベルは免疫アッセイにより測定される。
【0034】
さらなる実施態様において、タンパク質レベルは、ラテラルフロー装置を使用し得る免疫クロマトグラフィー試験により測定される。
【0035】
またさらなる実施態様において、タンパク質レベルは、質量分析によって又はタンパク質アレイを使用することによって測定される。
【0036】
別の態様において、本発明は、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)検出のための抗体及び試薬を含む免疫アッセイキットに関する。
【0037】
また別の態様において、本発明は、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)の検出のための1以上のクロマトグラフィーストリップを含む免疫クロマトグラフィー試験装置に関する。
【0038】
ある実施態様において、免疫クロマトグラフィー試験装置において、試験ストリップは、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)に対する抗体を含む。
【0039】
別の実施態様において、本免疫クロマトグラフィー試験装置はラテラルフロー装置である。
【0040】
さらなる態様において、本発明は、
(a)前記対象から得られる頸管膣分泌液の試料中で、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)のレベルを試験することと;
(b)該レベルが、正常頸管膣分泌液中のレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている頸管膣分泌液中のレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む試験の結果及び/又は試験に基づく診断を含むレポートに関する。
【0041】
さらなる態様において、本発明は、
(a)前記対象から得られる頸管膣分泌液の試料中で、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)のレベルを試験することと;
(b)AFP、IL−6及びIGFBP−1の該レベルのそれぞれが、正常頸管膣分泌液中のAFP、IL−6及びIGFBP−1の対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている頸管膣分泌液中のAFP、IL−6及びIGFBP−1の対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、
を含む、試験の結果及び/又は試験に基づく診断を含むレポートに関する。
【0042】
またさらなる態様において、本発明は、
(a)前記対象から得られる頸管膣分泌液の試料中で、α−胎児性タンパク質、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)のレベルを試験することと;
(b)該レベルが正常頸管膣分泌液中のレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている頸管膣分泌液中のレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、
を含む、試験の結果及び/又は試験に基づく診断を格納する有形の物理媒体に関する。
【0043】
ある種の実施態様において、前記のタンパク質のレベルを測定するように構成される装置を用いて測定が実行される。別の実施態様において、適切なプロセッサにより実行されるソフトウェアプログラムを使用することによって測定が行われる。ある種の実施態様において、有形の物理媒体に格納されるソフトウェアにプログラムが組み入れられる。ある種の他の実施態様において、有形の物理媒体は、CD−ROM、フロッピーディスク、ハードドライブ、DVD及びプロセッサに伴うメモリからなる群から選択される。
【0044】
ある種の実施態様において、本発明の方法は、検査又は診断の結果を記録するレポートを準備する段階をさらに含む。ある実施態様において、このレポートは、有形の物理媒体に記録又は格納される。具体的な実施態様において、有形の物理媒体は紙である。別の実施態様において、有形の物理媒体は、CD−ROM、フロッピーディスク、ハードドライブ、DVD及びプロセッサに伴うメモリからなる群から選択される。
【0045】
ある種の他の実施態様において、本発明の方法は、関係者に上記の診断の結果を伝達する段階をさらに含む。ある実施態様において、関係者とは患者又はその担当医である。別の実施態様において、伝達は、書面で、eメールによって又は電話によって行われる。
【0046】
別の態様において、本発明は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための抗体及び試薬を含む免疫アッセイキットを提供する。ある実施態様において、本免疫アッセイキットは、本明細書中で特定される全タンパク質の検出のための、抗体及び試薬を含む。
【0047】
別の態様において、本発明は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、IGF結合タンパク質−1(IGFBP−1)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための抗体及び試薬を含む免疫アッセイキットを提供する。ある実施態様において、本免疫アッセイキットは、本明細書中で特定される全タンパク質の検出のための、抗体及び試薬を含む。
【0048】
また別の態様において、本発明は、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための抗体及び試薬を含む免疫アッセイキットを提供する。
【0049】
さらに別の態様において、本発明は、(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のレベルに対して、前記対象から得られる頸管膣分泌液の試料中で該レベルを測定することと、(b)該レベルが、該正常頸管膣分泌液中のレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中のレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む試験の結果及び/又は試験に基づく診断を含むレポートを提供する。
【0050】
別の態様において、本発明は、(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のレベルに対して、前記対象から得られる頸管膣分泌液の試料中で該レベルを測定することと;(b)該レベルが、該正常頸管膣分泌液中のレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中のレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む試験の結果及び/又は試験に基づく診断を格納する有形の物理媒体を提供する。
【図面の簡単な説明】
【0051】
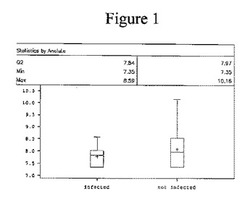
【図1】IAI感染(n=14)対非感染患者(n=95)における、GROαの自然対数値(アッセイ1)を示す箱ひげ図を示す。
【図2】IAI感染(n=14)対非感染患者(n=95)におけるMIP1bの自然対数値を示す箱ひげ図を示す。
【図3】IAI感染(n=14)対非感染患者(n=95)における、MCP−1の自然対数値を示す箱ひげ図を示す。
【図4】IAI感染(n=14)対非感染患者(n=95)における、B2MGの自然対数値を示す箱ひげ図を示す。
【図5】IAI感染(n=14)対非感染患者(n=95)における、TIMP−1の自然対数値を示す箱ひげ図を示す。
【図6】IAI感染(n=14)対非感染患者(n=95)における、A1AGの自然対数値を示す箱ひげ図を示す。
【図7】IAI感染(n=14)対非感染患者(n=95)における、IL−6の自然対数値を示す箱ひげ図を示す。
【図8】IAI感染(n=14)対非感染患者(n=95)における、LBPの自然対数値を示す。
【図9】IAI感染(n=14)対非感染患者(n=95)における、AFPの自然対数値を示す箱ひげ図を示す。
【図10】IAI感染(n=14)対非感染患者(n=95)における、VCAM−1の自然対数値を示す箱ひげ図を示す。
【図11】IAI対非IAIの予測に対する3マーカーモデルのAUROCを示す。感度は86%であり、特異性は85%である。
【図12】IAI対非IAIの予測に対する5マーカーモデルのAUROCを示す。感度はx%であり、特異性はy%である。
【図13】0又は1の複合(composite)IAI状態に対するバイオマーカーZスコアレベルを示す。
【図14】AUROCが0.86である、感度対1−特異性としてプロットされる、図13で示されるデータを示す。感度は82%であり、特異性は85%であり、PPVは33%及びNPVは98%であった。
【図15】CVF状態及びAF感染状態による、出産までの時間を示すカプラン−マイヤーグラフを示す。
【図16】0又は1の複合IAI状態に対するバイオマーカーZスコアレベルを示す。
【図17】AUROCが0.88である、感度対1−特異性としてプロットされる、図16で示されるデータを示す。感度は82%であり、特異性は89%であり、PPVは41%及びNPVは98%であった。
【発明を実施するための形態】
【0052】
定義
本発明は、特定の実施態様に限定されず、当然ではあるが変化し得ることを理解されたい。また、本明細書中で使用される用語は、ただ特定の実施態様を説明することを目的とするものであり、限定するものではないことも理解されたい。本願および添付の特許請求の範囲で使用される場合、「a」、「an」及び「the」という単数及び単数形の語は、例えば、場合によっては、別段の断りがない限り、複数の指示対象を含む。従って、例えば、「プローブ」への言及は、場合によっては複数のプローブ分子を含み;同様に、内容によっては、「核酸」という用語の使用は、場合によっては、実際問題として、多くの複製のその核酸分子を含む。遺伝子又はタンパク質に対する文字表記は、内容に応じて、遺伝子形態及び/又はタンパク質形態を指し得る。当業者は、本明細書中の配列、既知の配列及び遺伝コードに言及することによって、関連生体分子の核酸及びアミノ酸形態を完全に説明し得る。
【0053】
別段の断りがない限り、本明細書中で使用される技術及び科学用語は、本発明が属する技術分野の通常の技術者により一般に理解されるものと同じ意味を有する。Singletonら、Dictionary of Microbiology and Molecular Biology 第2版、J.Wiley & Sons(New York、N.Y.1994)は、当業者に対して本願で使用される用語の多くに対する指針を与える。
【0054】
「対応する」及び「対応すること」という用語及び文法的な同等物は、類似物又は類似物質を指すために本明細書中で使用され;例えば、タンパク質の2つの混合物に言及する場合、第一の混合物中のタンパク質Aは、第二の混合物中のタンパク質Aに対応するか又は第二の混合物中のタンパク質Aの対応するタンパク質であり;第一の混合物中のタンパク質Bは、第二の混合物中のタンパク質Bに対応するか又は第二の混合物中のタンパク質Bの対応するタンパク質である。
【0055】
「プロテオーム」という用語は、ある時間での生体試料中のタンパク質の大部分を叙述するために本明細書中で使用される。プロテオームの概念はゲノムとは基本的に異なる。ゲノムが実際上静的である一方で、プロテオームは内部及び外部事象に反応して継続的に変化する。
【0056】
「プロテオミックプロファイル」という用語は、ある時間における、生体試料中、例えば体液中の複数のタンパク質の発現パターンの表現に言及するために使用される。プロテオミックプロファイルは例えば質量スペクトルとして表すことができるが、タンパク質の何れかの物理化学的又は生化学的特性に基づく他の表現法も含まれる。従って、プロテオミックプロファイルは、例えば、二次元ゲル電気泳動により、例えば2−D PAGEにより調べた場合の、タンパク質の電気泳動的特性の差に基づき得、例えば二次元電気泳動ゲルにおける複数のスポットとして表され得る。差次的発現プロファイルは、具体的に特定されるタンパク質が存在しなくても重要な診断値を有し得る。例えばタンパク質マイクロアレイを用いて複数のスポット又はタンパク質を免疫ブロッティングすることによって、1個のタンパク質スポットを検出することができる。プロテオミックプロファイルは、一般に、数ピークから、50以上のピークに相当する複合プロファイルに至る範囲であり得る情報を表すか又はこのような情報を含有する。従って、例えば、プロテオミックプロファイルは、少なくとも2又は少なくとも5又は少なくとも10又は少なくとも15又は少なくとも20又は少なくとも25又は少なくとも30又は少なくとも35又は少なくとも40又は少なくとも45又は少なくとも50又は少なくとも60又は少なくとも65又は少なくとも70又は少なくとも75又は少なくとも80又は少なくとも85又は少なくとも85又は少なくとも90又は少なくとも95又は少なくとも100又は少なくとも125又は少なくとも150又は少なくとも175又は少なくとも200種類のタンパク質を含有し得るか又はこれらを表し得る。
【0057】
「病的状態」という用語は、最も広義で使用され、対象の健康を危うくする全ての変化及び現象に及ぶ。病的な母体の状態としては、羊膜内感染、例えば子癇前症などの胎児又は母体起源の状態ならびに早期陣痛及び早産が挙げられるが、これらに限定されない。病的な胎児の状態としては、ダウン症などの染色体異常(異数性)及び在胎期間及び胎児の成熟の全ての異常が挙げられるが、これらに限定されない。
【0058】
「病的[母体又は胎児の]状態の状況」という用語は、最も広い意味で本明細書中で使用され、病的状態の、欠如、存在、程度、段階、性質、進行又は軽減を指す。
【0059】
「独自の発現特性」という用語は、対応する正常生体試料(同じタイプの採取源、例えば体液から得られる。)のプロテオミックプロファイルとは統計学的に有意に異なる生体試料(例えば参照試料)のプロテオミックプロファイル内の独自の特性又はモチーフを説明するために使用される。
【0060】
「羊膜内感染(IAI)」、「羊水感染」、「羊膜炎」及び「臨床的絨毛羊膜炎」というう用語は交換可能に使用され、妊娠中の羊水及び子宮内の内容物の細菌性を含むがそれらに限定されない、急性感染を指す。
【0061】
(1)病的状態の進行の少なくともある程度の抑制、(2)病的状態の予防、(3)病的状態に関与する1以上の症状の少なくともある程度の緩和;(4)治療後の生存期間延長;及び/又は(5)治療後のある時点での死亡率低下を含むがこれらに限定されない、患者に対する利益を示す何らかの評価項目を使用して、「患者反応」を評価することができる。
【0062】
「治療」という用語は、治療処置及び予防又は防止対策の両方を指し、標的とする病的状態又は障害を予防するか又はその進行を鈍化させる(軽減する)ことを目的とする。治療を必要とする者としては、障害が既にある者ならびに障害を有しやすい者又は障害を予防すべき者が挙げられる。
【0063】
「先天性奇形」は、非遺伝的であるが出生時に存在する異常である。
【0064】
何らかの特定のタンパク質の指定には、本明細書中で使用される場合、他の種における(全ての天然変異体を含む)天然配列ホモログに加えて、全ての断片、前駆体及び天然の変異体、例えば、あるいはスプライシングを受けている及び対立遺伝子の変異体及びアイソフォーム、ならびに指定のタンパク質の可溶性形態が含まれる。従って、例えば、マクロファージ炎症性タンパク質1β(Swiss−Prot Acc.No.P13236)の存在量を試験することに言及する場合、この記述は、具体的に、Swiss−Prot Acc.No.13236という名目で記載されるタンパク質の、何らかの断片、前駆体又は天然の変異体ならびに、対象が非ヒトである場合、その非ヒトホモログ及びその天然の変異体を試験することを含む。
【0065】
詳細な説明
本発明は、母親又は胎児の体液のプロテオミックプロファイルに基づく、母体及び胎児の状態の早期の信頼性が高く非侵襲性の検査に対する方法及び手段に関する。特に、本発明は、IAI患者及び対照対象の試料中で差別的に存在するタンパク質マーカーの発見及びIAIの有無を判定するための方法及びキットにおけるこの発見の適用に基づく。これらのタンパク質マーカーは、IAI患者からの試料中で、IAIではない患者由来の試料中のレベルとは異なるレベルで見出される。従って、対照と比較した、試験試料中で見出される2以上のマーカーの量又は試験試料中の2以上のマーカーの有無から、患者のIAIの状況に関する有用な情報が提供される。
【0066】
本発明は、母親又は胎児の体液のプロテオミックプロファイルに基づく、母体及び胎児の状態の早期の信頼性が高く非侵襲性の検査のための方法及び手段にも関する。特に本発明は、妊婦又は胎児から得た体液、例えば頸管膣分泌液(CVF)中の、α−胎児性タンパク質(α−胎児性タンパク質)、インターロイキン−6(IL−6)及びインスリン増殖因子結合タンパク質−1(IGFBP−1)を測定することによる、IAIに対する早期の信頼性が高い検出のための診断及び予後診断試験を提供する。
【0067】
本発明はさらに、対象の徴候及び症状、例えば母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体又は胎児の頻脈、子宮圧痛又は羊水の悪臭を診断アルゴリズムに組み込むことがIAIの有無の判定に有用である、という発見に基づく。
【0068】
本発明は、例えば次の教科書(その内容は参照により本明細書によって明確に組み込まれる。):Proteome Research:New Frontiers in Functional Genomics(Principles and Practice),M.R.Wilkinsら編、Springer Verlag,1007;2−D Proteome Analysis Protocols,Andrew L Link,editor,Humana Press,1999;Proteome Research:Two−Dimensional Gel Electrophoresis and Identification Methods(Principles and Practice),T.Rabilloud editor,Springer Verlag,2000;Proteome Research:Mass Spectrometry(Principles and Practice),P.James editor,Springer Verlag,2001;Introduction to Proteomics,D.C.Liebler editor,Humana Press,2002;Proteomics in Practice:A Laboratory Manual of Proteome Analysis,R.Westermeierら編、John Wiley & Sons,2002に記載のような当技術分野で周知のプロテオミクス技術を利用する。
【0069】
当業者にとって当然のことながら、本発明の実施に際して、本明細書中に記載のものと同様又は同等である多くの方法及び材料を使用し得る。実際に、本発明は、記載の方法及び材料に何ら限定されない。
【0070】
1.体液で発現されるタンパク質及びポリペプチドの同定
本発明に従い、当技術分野で公知の様々な方法を使用して、体液のプロテオミクス分析を行うことができる。体液としては、例えば、頸管膣分泌液(CVF)、臍帯血、新生児血清、脳脊髄液(CSF)、羊水、血清、血漿、尿、脳脊髄液、母乳、粘液、唾液及び汗が挙げられる。
【0071】
主として、疾患において上方制御又は下方制御される検出タンパク質を検出するために、正常体液(正常試料)及び試験体液(試験試料)など、様々な起源由来の試料のタンパク質パターン(プロテオームマップ)を比較する。次いで、例えば免疫アッセイ、ペプチド−質量フィンガープリント法及び/又は質量分析及び配列決定法を用いて、これらのタンパク質を同定及び詳細に特性評価するために切り出すことができるか又は、関心のある疾患の診断のためにもしくは疾患の有無を確認するために、正常及び/又は疾患−特異的なプロテオームマップを直接使用することができる。
【0072】
比較分析において、タンパク質の相対レベル又は存在量を正確に表し、正確な結果を得るために、正常及び試験試料を完全に同じように処理することが重要である。総タンパク質の必要量は、使用する分析技術に依存し、当業者により容易に決定することができる。生体試料中に存在するタンパク質は、一般にそれらのpI及び分子量に従い、二次元ゲル電気泳動(2−DE)により分離される。等電点(一次元ゲル電気泳動)を用いて、タンパク質を最初にそれらの電荷によって分離する。この段階は、例えば、市販の固定化pH勾配(IPG)ストリップを用いて行うことができる。第二次元は通常のSDS−PAGE分析であり、ここでは等電点で分離済みのIPGストリップを試料として使用する。2−DE分離後、クーマシーブルー又は銀染色などの従来からの色素を用いてタンパク質を可視化し、公知の技術及び例えばBio−Rad 10GS800密度計及びPDQUESTソフトウェア(両者とも市販されている。)などの機器を用いて画像化することができる。
【0073】
次に、個々のスポットをゲルから切り出し、脱色して、トリプシン消化する。質量分析(MS)によってペプチド混合物を分析することができる。あるいは、例えばキャピラリー高圧液体クロマトグラフィー(HPLC)によりペプチドを分離することができ、個々に又はプール中の何れかでMSにより分析することができる。
【0074】
質量分析器は、イオン源、質量分析器、イオン検出器及びデータ収集ユニットから構成される。まず、イオン源においてペプチドをイオン化する。次いで、質量分析器においてそれらの質量電荷比に従い、イオン化ペプチドを分離し、分離イオンを検出する。質量分析は、特にマトリックス支援レーザー脱離イオン化/飛行時間型質量分析(MALDI−TOF)及びエレクトロスプレーイオン化(ESI)法の発明以来、タンパク質分析において広く使用されている。例えば、MALDI−TOF及び三重又は四重極型−TOF又はESIと組み合わせたイオントラップ質量分析計を含め、質量分析器にはいくつかの種類がある。このようにして、例えば、Q−Tof−2質量分析器は、全質量スペクトル範囲にわたりイオンを同時検出できる直交飛行時間分析装置を使用する。さらなる詳細については、例えばChemusevichら、J.Mass Spectrom.36:849−865(2001)を参照のこと。必要に応じて、質量分析又はエドマン分解のある種の改変法など、当技術分野で公知の技術によって、ペプチド断片及びそれらが由来するタンパク質全長のアミノ酸配列を調べることができる。
【0075】
2.羊膜内感染及び関連合併症の早期検出
羊膜内感染(IAI)は、妊娠中の羊水及び子宮内の内容物の急性細菌感染である。前向き研究から、全出産の4%から10%でIAIが発症することが示されている(Newton,E.R.,Prihoda,T.J.及びGibbs,R.S.:Logistic regression analysis of risk factors for intra−amniotic infection.Obstet.Gynecol.73:571,1989;Soper,D.E.,Mayhall,C.G.及びDalton,H.P.:Risk factors for intraamniotic infection:a prospective epidemicologic study.American Journal of Obstetrics and Gynecology 161:562,1989;及びLopez−Zeno,J.A.,Peaceman,A.M.,Adashek,J.A.及びSocol,M.L.:A controlled trial of a program for the active management of labor.N.Engl.J.Med.326:450,1992)。IAIを説明するために使用される他の用語としては、羊水感染、羊膜炎及び臨床的絨毛羊膜炎が挙げられる。羊膜内感染は、母体発熱、子宮圧痛、白血球増加及び胎児の頻脈によって臨床的に診断され、組織学的絨毛羊膜炎とは区別されるべきである。羊膜内感染は母体及び新生児死亡例の重要な原因である。羊膜内感染は周産期における発熱発症例の10−40%を占め、早期新生児敗血症及び肺炎例の20−40%に関与する(Newton,E.R.:Chorioamnionitis and intraamniotic infection.Clin.Obstet.Gynecol.36:795、1993)。母体の菌血症はIAI患者の2−6%で発症し、分娩後の感染死亡率が上昇する。IAI患者では機能障害分娩及び帝王切開出産のリスクも上昇する。Duffらは、分娩中に羊膜内感染を発症した患者のうち、75%で機能障害分娩が起こり、34%が帝王切開出産となったことを報告した(Duff,P.,Sanders,R.及びGibbs,R.S.:The course of labor in term pregnancies with chorioamnionitis.American Journal of Obstetrics and Gynecology 147:391、1983)。羊膜内感染はまた、特に早期新生児において、新生児有病率及び死亡率の上昇にも関与する。一般に、IAIである母親から出生した低出生体重児では、周産期死亡率が3倍から4倍上昇する(Gibbs,R.S.,Castillo,M.A.及びRodgers,P.J.:Management of Acute Chorioamnionitis.American Journal of Obstetrics and Gynecology 136:709,1980;Gilstrap,L.C.,III,Leveno,K.J.,Cox,S.M.,Burris,J.S.,Mashburn,M.及びRosenfeld,C.R.:Intrapartum treatment of acute chorioamnionitis: impact on neonatal sepsis.Am.J.Obstet.Gynecol.159:579,1988)。呼吸窮迫症候群、脳室内出血及び新生児敗血症も増加する(Morales,W.J.:The effect of chorioamnionitis on the developmental outcome of preterm infants at one year.Obstetrics and Gynecology 70:183、1987)。最近、IAIは新生児の脳室周囲白質軟化症及び脳性麻痺とも関連付けられており;大脳白質損傷及び脳性麻痺のリスクは、羊膜内感染の場合では9倍高い(Bejar,R.,Wozniak,P.,Allard,M.,Benirschke,K.,Vaucher,Y.,Coen,R.,Berry,C.、Schragg,P.,Villegas,I.及びResnik,R.:Antenatal origin of neurologic damage in newborn infants.I.Preterm infants.Am.J.Obstet.Gynecol.159:357,1988;Grether,J.K.及びNelson,K.B.:Maternal infection and cerebral palsy in infants of normal birth weight.JAMA 278:207,1997)。最後に、亜臨床的IAIは、胎膜が完全である早期陣痛において少なくとも10%の女性で認められており、このことから、IAIが、未熟児の重要かつおそらくは予防可能な原因であることが示唆される(Romero,R.,Avila,C.,Brekus,C.A.及びMorotti,R.:The role of systemic and intrauterine infection in preterm parturition.Annuals of the New York Academy of Sciences 622:355,1991)。Newtonによる文献レビューにおいて、臨床的IAIの発症率は、妊娠27週未満で41%、妊娠27−37週で15%及び妊娠38週以上では2%であることが明らかになった(Newtonら、上出)。胎膜が完全であり羊膜内感染の臨床兆候がなく早期陣痛が起こった全女性の10−20%の羊水から(Romeroら、上出)、及び23−24週で妊娠終了となった早期陣痛女性の最大67%で、下部生殖管に対する常在細菌も回収された(Watts、D.H.,Krohn,M.A.、Hillier,S.L.及びEschenbach,D.A.:The association of occult amniotic fluid infection with gestational age and neonatal outcome among women in preterm labor.Obstet Gynecol 79:351,1992)。これらの患者のうち殆どが迅速にに出産に至り、多くにおいて臨床的に明白なIAIが発現する。これらの知見から、最初に亜臨床的子宮内感染の上行が早期陣痛に先行し、超早産の重要な原因となり得るという仮説が支持される。
【0076】
早産は、妊娠満37週になる前の出生として定義される。米国における早産の発生率は、全生児出生の10−11%であり、早期陣痛の積極的治療にもかかわらず増加している。全体に、未熟児及びその事象は、先天性奇形によるものではない周産期死亡の80%に関与し、国家のヘルスケア予算に対して毎年およそ50億ドルの負担を課している。早産に対するリスク因子としては、非白人種、若年層、社会経済的地位の低さ、母体の体重が55kgを下回ること、未経産、妊娠第1三半期の出血、多胎妊娠が挙げられる(Meis P J,Michielutte R,Peters TJら、Factors associated with preterm birth in Cardiff,Wales:II.Indicated and spontaneous preterm birth.Am J Obstet Gynecol 173:597−602,1995)。
【0077】
残念ながら、自然早産に対するリスクがある患者の予測は、全般的に期待を裏切るものであった(Creasy RK,Iams JD.Preterm labor and delivery.In Maternal−Fetal Medicine,Creasy RK,Resnik R(編).W.B.Saunders Company,Philadelphia,Pa.第4版,1999.498−531ページ)。早産リスクが最大である集団を特定し、それにより早期介入を行って利益を得られる可能性があるという以前の試みには、リスク採点指標、子宮頸管の胎児フィブロネクチンの生化学的検出、子宮頸管長の超音波測定及び家庭での子宮活動の監視が含まれていた。これらのプログラムは、費用が嵩み、かつ、どの患者が早期介入又は予防から利益を得ることができるかを正確に予測することが不可能であることが障壁となっている。全て、陽性適中率がおよそ30%と不良であり、殆どの患者が、満期分娩時に「リスクあり」と判定される。子宮収縮を抑制するための薬物治療を含む介入は有効ではあるが、早期陣痛を早期に高い信頼性で診断することに依存する。従って、早産が関与する多大な費用及び新生児死亡率及び有病率を低下させるためには、早産リスクが最大である患者を特定するための早期の信頼性が高いマーカーが必要である。
【0078】
3.体液中のバイオマーカーを用いた羊膜内感染の早期検出及び診断
A)本発明は、例えば、頸管膣分泌液(CVF)、羊水、血清、血漿、尿、脳脊髄液、母乳、粘液又は唾液などの体液のプロテオミック分析による、羊膜内感染の診断のための、早期の信頼性が高い非侵襲性の方法を提供する。ある実施態様において、本発明は、免疫アッセイ又は免疫アッセイパネルによる羊膜内感染の診断のための早期の信頼性が高い非侵襲性の方法を提供する。ある実施態様において、本発明は、CVFのプロテオミック分析による羊膜内感染の診断のための早期の信頼性が高い非侵襲性の方法を提供する。
【0079】
非限定例として、本発明は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される1以上のタンパク質の1つのレベル又は量を、妊婦対象から得られた母体頸管膣分泌液試料において試験することを含む、妊婦対象における羊膜内感染の診断のための方法を提供する。羊膜内感染の診断は、IAIがない対照検体に対する、IAI陽性と判定される患者検体中の上述のタンパク質のレベル、量又は存在量の統計学的有意差に基づき得る。ある種の実施態様において、対象の徴候及び症状を診断アルゴリズムに組み込むことによって、羊膜内感染の診断が促進され得る。例えば、母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体及び/又は胎児の頻脈、子宮圧痛及び/又は羊水の悪臭を含むがこれらに限定されない、徴候及び症状の組み込みが、本診断アルゴリズムに含まれ得る。
表1:IAIに対するバイオマーカー

【0080】
上述のように、本発明の内容において、「プロテオミックプロファイル」という用語は、ある時間における、生体試料、例えば体液中の複数のタンパク質の発現パターンの表現に言及するために使用される。プロテオミックプロファイルは、例えば免疫アッセイ結果のパネルとして表すことができるが、タンパク質の何れかの物理化学的又は生化学的特性に基づく他の表現法も含まれる。体液のプロテオームに存在するタンパク質の全て又は一部を同定し、配列決定することは可能であるが、これは、本発明に従い作成されるプロテオミックプロファイルの診断用途に必要ではない。特定の疾患の診断は、正常プロテオミックプロファイルと、診断しようとする疾患又は病的状態が存在する場合の、同じ状況下で得られる同じ体液のプロテオミックプロファイルとの間の特徴的な差異(独自の発現特性)に基づき得る。独自の発現特性は、同じタイプの採取源から得られる対応する正常生体試料のプロテオミックプロファイルとは統計学的に有意に異なる、試験生体試料又は参照生体試料のプロテオミックプロファイル内の何らかの独自の特性又はモチーフであり得る。哺乳動物対象から得られる試験試料のプロテオミックプロファイルを病的な母体又は胎児状態の独自の発現特性の特徴を含む参照試料のプロテオミックプロファイルと比較した際に、参照試料と共通する独自の発現特性を有する場合、哺乳動物対象はこのような病的状態であると診断される。
【0081】
診断しようとする対象から得られる体液のプロテオミックプロファイルを、同じように得られ、処理された同じ種類の正常体液のプロテオミックプロファイルと比較することによって、特定の病的な母体/胎児の状態を診断することができる。試験試料のプロテオミックプロファイルが正常試料のプロテオミックプロファイルと基本的に同じである場合、対象は、対象となる病的な母体/胎児の状態がないとみなされる。正常試料のプロテオミックプロファイルに対して、試験試料のプロテオミックプロファイルが独自の発現特性を示す場合、対象は問題となっている母体/胎児の状態があると診断される。
【0082】
あるいは又はさらに、試験試料のプロテオミックプロファイルを、問題となっている病的な母体/胎児状態があると独立して診断された対象の体液から得られた参照試料のプロテオミックプロファイルと比較し得る。この場合、試験試料のプロテオミックプロファイルが、独自の発現特性を示す少なくとも1つの特性又は特性の組み合わせを参照試料のプロテオミックプロファイルと共有する場合、対象は、病的状態があると診断される。
【0083】
本発明の方法において、正常生体試料のプロテオミックプロファイルは、重要な診断の役割を果たす。上で考察されるように、試験試料のプロテオミックプロファイルが正常生体試料のプロテオミックプロファイルと基本的に同じである場合、患者は、特定しようとする病的な母体/胎児状態がないと診断される。副作用を起こす可能性があり得るか又は患者、胎児もしくは新生児を危険にさらし得る、不必要な治療又は介入を患者に対して行わなくてもよくなるため、この「陰性」診断は非常に意味がある。差が統計学的に有意であるか否かを判定するためにデータを解析する。
【0084】
下記の実施例で詳述する結果は、頸管膣分泌液(CVF)の正常プロテオミックプロファイルとは統計学的に有意に異なる羊膜内感染(IAI)のプロテオミックプロファイルの特徴を与える。さらに、本実施例は、IAIの発現マーカー及び独自の発現特性の特徴を与える。
【0085】
本発明の非侵襲性の診断方法を行うために特に有利な体液は、頸管膣分泌液(CVF)である。CVFは、水、電解質、低分子量有機化合物(グルコース、アミノ酸及び脂質)、細胞(白血球、リンパ球及び上皮細胞)及び子宮頸部により主に合成される多数のタンパク質及びタンパク質分解酵素からなる複合体液である。(Blandauら、The Biology of the Cervix.University of Chicago Press:Chicago,1973;p xi,450p)。CVFはまた、ムチン、デフェンシン、補体因子、免疫グロブリン、ラクトフェリン及びコレクチンを含む膣細胞からの分泌物も含有する(Blandauら、上出)。CVFは、膣、頸管及び子宮領域を含め、女性生殖管全体を流れ、円滑化する。CVFは、外来病原体に対する防御の最前線を形成し、生殖能力を示すものであり、授精、妊娠及び陣痛を促進する(Blandauら、上出;Bigelow,J.L.ら、Hum Reprod 2004,19,(4),889−92)。CVFはまた、ラクトバチルス・クリスパータス(Lactobacilli crispatus)及びラクトバチルス・バギナリス(Lactobacilli vaginalis)などの微生物叢も含有する。この微生物叢からの分泌液はCVFのpHを低下させ、これによりその抗病原体活性が促進される(Blandauら、上出)。膣の微生物叢における何らかの不均衡又は外部微生物叢の侵入の結果、細菌性膣症となる。細菌性膣症に反応して、頸管及び膣内上皮によるIL−1a、IL−1f3、IL−10、IL−8及びTNF−ctなどのいくつかのサイトカインのCVFへの分泌が変化する。(Mattsby−Baltzer,Iら、Acta Obstet Gynecol Scand 1998,77,(7),701−6;Eschenbach,D.A.ら、J Clin Microbiol 1989,27,(2)、251−6)。細菌性膣症の阻止不良は子宮頸癌(Mikamo,Hら、J Infect Chemother 1999,5,(2),82−85)、骨盤内炎症性疾患(Ness,R.B.ら、Am J Epidemiol 2005,162,(6),585−90.)、子宮内膜炎(Haggerty,C.L.ら、Clin Infect Dis 2004,39,(7),990−5;Morris,M.ら、Bjog 2001,108,(5)、439−50)及び卵管性不妊(Morrisら、上出)と正の相関が認められている。妊婦における細菌性膣症は、早期陣痛及び早産のリスク上昇と相関が認められている(Gravett,M.G.ら、Jama 1986,256,(14),1899−903)。
【0086】
CVFに存在するサイトカイン及び他の防御分子はまた、膣におけるHIVなどの性感染性免疫不全ウイルス及び単純ヘルペスウイルス(HSV)の感染、複製及び増殖においても重要な役割を果たす(Poli,G.ら、AIDS Res Hum Retroviruses 1992,8,(2),191−7;Zara,F.ら、Sex Transm Infect 2004,80,(2),108−12;John,M.ら、J Infect Dis 2005,192,(10),1731−40)。CVFの陽イオン性ポリペプチド断片の分析により、抗HIV活性に関与する20種類のポリペプチドが同定されている(Venkataraman,N.ら、J Immunol 2005,175,(11)、7560−7)。以前の研究においても、HIVビリオンを捕捉する際の、従って感染を防御する際の、CVFについての役割が特定されている(Maher,D.ら、Proc Natl Acad Sci USA 2005,102,(32),11504−9;Quinones−Mateu,M.Eら、Aids 2003,17,(16),F39−48)。最近の研究から、CVF中の一部の免疫応答分子と、早産に至る亜臨床的前期破水(PROM)の発生率との間の相関が検出されている(Helmig,B.R.ら、J Matern Fetal Neonatal Med 2002,12,(4),237−46;Ogino,M.ら、J Obstet Gynaecol Res 2005,31,(5),421−6)。妊娠中、CVFは、絨毛−脱落膜接触面の破壊又は同時分泌の何れかによる、子宮由来の羊水(AF)を含有し得る。このCVFへのAFの「漏出」は、女性において早産を予測するために使用されてきた胎児フィブロネクチンの存在についての現在の非侵襲性診断に対する基礎となっている(Swamy,G.K.ら、J Reprod Med 2005,50,(11),851−6)。
【0087】
CVFは、その回収方法が、AFの回収方法、即ち羊水穿刺に比べて非常に侵襲性の小さいものであるため、妊婦において母体及び胎児の健康状態を監視するための重要な診断部位の候補である。本明細書中で特定されるバイオマーカー及びバイオマーカー群又はそれらの組み合わせは、妊婦対象における羊膜内感染の信頼性の高い検出における有益な診断ツールを提供する。
【0088】
プロテオミックプロファイルを比較するための統計学的方法は当技術分野で周知である。例えば、免疫アッセイによって、一連のバイオマーカーに対するタンパク質発現レベルを定量することができる。適切なアルゴリズムを用いて、試験試料のプロテオミックプロファイル(パターン)を参照又は正常試料のプロテオミックプロファイル(パターン)と照合することによって、2種類のプロファイルの特徴的な発現特性又は実質的な同一性の有無を判定することができる。プロテオミックパターンを分析するための統計学的方法は、例えば、Petricoin IIIら、The Lancet 359:572−77(2002).;Issaqら、Biochem Biophys Commun 292:587−92(2002);Ballら、Bioinformatics 18:395−404(2002);及びLiら、Clinical Chemistry Journal,48:1296−1304(2002)において開示されている。
【0089】
(B)本発明は、例えば、頸管膣分泌液(CVF)、羊水、血清、血漿、尿、脳脊髄液、母乳、粘液又は唾液などの体液のプロテオミック分析による、羊膜内感染の診断のための早期の信頼性が高い非侵襲性の方法を提供する。ある実施態様において、本発明は、免疫アッセイによる、羊膜内感染の診断のための早期の信頼性が高い非侵襲性の方法を提供する。ある実施態様において、本発明は、CVFのプロテオミック分析による、羊膜内感染の診断のための早期の信頼性が高い非侵襲性の方法を提供する。
【0090】
非限定例として、本発明は、妊婦対象から得られる母体の頸管膣分泌液試料中で、少なくともα−胎児性タンパク質、IL−6及びIGFBP1の存在量を試験することを含む、妊婦対象における羊膜内感染の診断のための方法を提供する。羊膜内感染の診断は、IAIを有さない対照検体に対する、IAI陽性と判定されている患者検体中のこれらのタンパク質の存在量の統計学的有意差に基づく。
【0091】
上述のとおり、本発明の内容において、「プロテオミックプロファイル」という用語は、ある時間における、生体試料中、例えば体液中の複数のタンパク質の発現パターンの表現に言及するために使用される。プロテオミックプロファイルは例えば質量スペクトルとして表すことができるが、タンパク質の何れかの物理化学的又は生化学的特性に基づく他の表現法も含まれる。体液のプロテオームに存在するタンパク質の全て又は一部を同定し、配列決定することは可能であるが、これは、本発明に従い作成されるプロテオミックプロファイルの診断用途に必要ではない。特定の疾患の診断は、診断しようとする疾患又は病的状態が存在する場合、正常プロテオミックプロファイルと、同じ状況下で得られる同じ体液のプロテオミックプロファイルとの間の特徴的な差異(独自の発現特性)に基づき得る。独自の発現特性は、同じタイプの採取源から得られる対応する正常生体試料のプロテオミックプロファイルとは統計学的に有意に異なる試験生体試料又は参照生体試料のプロテオミックプロファイル内の何らかの独自の特性又はモチーフであり得る。例えば、プロテオミックプロファイルが質量スペクトル形態で与えられる場合、独自の発現特性とは、一般に、対応する正常試料の質量スペクトルとは質的又は量的に異なるピーク又はピークの組み合わせである。従って、質量スペクトルにおける新しいピーク又は新しいピークの組み合わせの出現又は質量スペクトルにおける、既存のピークもしくは既存のピークの組み合わせの大きさもしくは形の何らかの統計学的に有意な変化又は既存のピークの消失は、独自の発現特性とみなすことができる。哺乳動物対象から得られる試験試料のプロテオミックプロファイルを、病的な母体又は胎児の状態の独自の発現特性の特徴を含む参照試料のプロテオミックプロファイルと比較する際、哺乳動物対象が参照試料と同じ独自の発現特性を有する場合、その哺乳動物対象は、このような病的状態を有すると診断される。
【0092】
診断しようとする対象から得られる体液のプロテオミックプロファイルを、同じように得られ、処理された同じ種類の正常体液のプロテオミックプロファイルと比較することによって、特定の病的な母体/胎児の状態を診断することができる。試験試料のプロテオミックプロファイルが正常試料のプロテオミックプロファイルと基本的に同じである場合、その対象は対象となる病的な母体/胎児の状態がないとみなされる。正常試料のプロテオミックプロファイルに対して、試験試料のプロテオミックプロファイルが独自の発現特性を示す場合、その対象は、問題となる母体/胎児の状態があると診断される。
【0093】
あるいは又はさらに、試験試料のプロテオミックプロファイルを、問題となる病的な母体/胎児の状態があると独立して診断された対象の体液から得られた参照試料のプロテオミックプロファイルと比較し得る。この場合、試験試料のプロテオミックプロファイルが、参照試料のプロテオミックプロファイルと、独自の発現特性を表す少なくとも1つの特性又は特性の組み合わせを共有する場合、対象は病的状態があると診断される。
【0094】
本発明の方法において、正常生体試料のプロテオミックプロファイルは重要な診断的役割を果たす。上記で考察されるように、試験試料のプロテオミックプロファイルが、正常生体試料のプロテオミックプロファイルと基本的に同じである場合、患者は特定しようとする病的な母体/胎児の状態がないと診断される。副作用を起こす可能性があり得るか又は患者、胎児もしくは新生児を危険にさらし得る、不必要な治療又は介入を患者に対して行わなくてもよくなるため、この「陰性」診断は非常に意味がある。差が統計学的に有意であるか否かを判定するためにデータを解析する。
【0095】
従来のタンパク質分離法を用いて、基本的に同じ発現レベルで正常及び病的なプロテオームの両方で見出されるタンパク質(アルブミン及び免疫グロブリンなどの共通するタンパク質)を分析前に除去することによって、本発明の診断方法の感度を向上させることができる。独自の発現特性の一部ではないこのような共通タンパク質を除去すると、感度及び診断精度が向上する。あるいは又はさらに、診断判定を行うために、一般に、機械用のスペクトル選択アルゴリズムを用いて、結果のコンピュータ解析中、共通するタンパク質の発現特性を排除することができる(又はシグナルを除去することができる。)。
【0096】
下記実施例で詳述する結果は、頸管膣分泌液(CVF)の正常プロテオミックプロファイルとは統計学的に有意に異なる羊膜内感染(IAI)のプロテオミックプロファイルの特徴を与える。さらに、本実施例は、IAIの発現マーカー及び独自の発現特性の特徴を与える。
【0097】
本発明の非侵襲性の診断方法を行うために特に有利な体液は頸管膣分泌液(CVF)である。CVFは、水、電解質、低分子量有機化合物(グルコース、アミノ酸及び脂質)、細胞(白血球、リンパ球及び上皮細胞)及び子宮頸部により主に合成される多数のタンパク質及びタンパク質分解酵素からなる複合体液である(Blandauら、The Biology of the cervix.University of Chicago Press:Chicago,1973;p xi,450p)。CVFはまた、ムチン、デフェンシン、補体因子、免疫グロブリン、ラクトフェリン及びコレクチンを含む膣細胞からの分泌物も含有する(Blandauら、上出)。CVFは、膣、頸管及び子宮領域を含め、女性生殖管全体を流れ、円滑化する。CVFは、外来病原体に対する防御の最前線を形成し、生殖能力を示すものであり、授精、妊娠及び陣痛を促進する(Blandauら、上出;Bigelow,J.L.ら、Hum Reprod 2004,19,(4),889−92)。CVFはまた、ラクトバチルス・クリスパータス(Lactobacilli crispatus)及びラクトバチルス・バギナリス(Lactobacilli vaginalis)などの微生物叢も含有する。この微生物叢からの分泌液はCVFのpHを低下させ、これによりその抗病原体活性が促進される(Blandauら、上出)。膣の微生物叢における何らかの不均衡又は外部微生物叢の侵入の結果、細菌性膣症となる。細菌性膣症に反応して、頸管及び膣内上皮によるIL−1α、IL−1β、IL−10、IL−6及びTNF−αなどのいくつかのサイトカインのCVFへの分泌が変化する(Mattsby−Baltzer,Iら、Acta Obstet Gynecol Scand 1998,77,(7),701−6;Eschenbach,D.A.ら、J Clin Microbiol 1989,27,(2)、251−6)。細菌性膣症の阻止不良は子宮頸癌(Mikamo,Hら、J Infect Chemother 1999,5,(2),82−85)、骨盤内炎症性疾患(Ness,R.B.ら、Am J Epidemiol 2005,162,(6),585−90.)、子宮内膜炎(Haggerty,C.L.ら、Clin Infect Dis 2004,39,(7),990−5;Morris,M.ら,Bjog 2001,108,(5),439−50)及び卵管性不妊(Morrisら、上出)と正の相関が認められている。妊婦における細菌性膣症は、早期陣痛及び早産のリスク上昇と相関が認められている(Gravett,M.G.ら、Jama 1986,256,(14)、1899−903)。
【0098】
CVFに存在するサイトカイン及び他の防御分子はまた、膣におけるHIVなどの性感染性免疫不全ウイルス及び単純ヘルペスウイルス(HSV)の感染、複製及び増殖においても重要な役割を果たす(Poli,G.ら、AIDS Res Hum Retroviruses 1992,8,(2),191−7;Zara,F.ら、Sex Transm Infect 2004,80,(2),108−12;John,M.ら、J Infect Dis 2005,192,(10),1731−40)。CVFの陽イオン性ポリペプチド断片の分析により、抗HIV活性に関与する20種類のポリペプチドが同定された(Venkataraman,N.ら、J Immunol 2005,175,(11),7560−7)。以前の研究においても、HIVビリオンを捕捉する際の、従って感染を防御する際の、CVFについての役割が特定された(Maher,D.ら、Proc Natl Acad Sci USA 2005,102,(32)、11504−9;Quinones−Mateu,M.Eら、Aids 2003、17,(16),F39−48)。最近の研究から、CVF中の一部の免疫応答分子と早産に至る亜臨床的前期破水(PROM)の発生率との間に相関が検出された(Helmig,B.R.ら、J Matern Fetal Neonatal Med 2002,12,(4),237−46;Ogino,M.ら、J Obstet Gynaecol Res 2005,31,(5),421−6)。妊娠中、CVFは、絨毛−脱落膜接触面の破壊又は同時分泌の何れかによる、子宮由来の羊水(AF)を含有し得る。このCVFへのAFの「漏出」は、女性において早産を予測するために使用されてきた胎児フィブロネクチンの存在についての現在の非侵襲性診断に対する基礎となっている(Swamy,G.K.ら、J Reprod Med 2005,50,(11),851−6)。
【0099】
CVFは、その回収方法が、AFの回収方法、即ち羊水穿刺に比べて非常に侵襲性の小さいものであるため、妊婦において母体及び胎児の健康状態を監視するための重要な診断部位の候補である。本明細書中で特定されるバイオマーカーの組み合わせは、妊婦対象における羊膜内感染の信頼性の高い検出における有益な診断ツールを提供する。
【0100】
プロテオミックプロファイルを比較するための統計学的方法は当技術分野で周知である。例えば、質量スペクトルの場合、プロテオミックプロファイルは、スペクトルの水平軸に沿った、キーとなる質量/電荷(M/Z)位置でのピーク振幅値により定義される。従って、特徴的なプロテオミックプロファイルは、例えば、あるM/Z値でのスペクトル振幅の組み合わせにより形成されるパターンを特徴とし得る。適切なアルゴリズムを用いて、試験試料のプロテオミックプロファイル(パターン)を参照又は正常試料のプロテオミックプロファイル(パターン)と照合することによって、2種類のプロファイルの特徴的な発現特性又は実質的な同一性の有無を判定することができる。プロテオミックパターンを分析するための統計学的方法は、例えば、Petricoin IIIら、The Lancet 359:572−77(2002).;Issaqら、Biochem Biophys Commun 292:587−92(2002);Ballら、Bioinformatics 18:395−404(2002);及びLiら、Clinical Chemistry Journal,48:1296−1304(2002)において開示されている。
【0101】
4.タンパク質アレイ
上記で考察される診断及びスクリーニングアッセイは両者ともタンパク質アレイを用いて行うことができる。近年、タンパク質アレイは、タンパク質を検出し、それらの発現レベルを監視し、タンパク質相互作用及び機能を調べるための強力な手段として幅広く認識されている。自動化手段を用いて、多くの判定を同時に行うことができる場合、これらによりハイスループットタンパク質分析が可能となる。DNAアレイに対して元来開発されたマイクロアレイ又はチップ方式において、大量のデータを生成させながら最小限の材料を用いてこのような判定を行うことができる。
【0102】
2Dゲル電気泳動及び質量分析によるプロテオーム分析は非常に有効であるものの、必要とされる高い感度が常に得られるわけではなく、このため、少量発現される多くのタンパク質を見逃す可能性がある。タンパク質マイクロアレイにより、それらが高効率であることに加えて、感度が高くなる。
【0103】
タンパク質アレイは、当技術分野で周知の様々な共有及び非共有結合化学を用いて、ガラス、シリコン、プラスチックマイクロウェル、ニトロセルロース、PVDF膜及びマイクロビーズなどの固体表面上にタンパク質を固定化することによって形成される。固体支持体は、カップリング手順の前後で化学的に安定であり、良好なスポット形態を可能にし、非特異的結合を最小とすべきものであり、検出システムにおいてバックグラウンドに寄与してはならず、様々な検出システムと適合性がなければならない。
【0104】
一般に、タンパク質マイクロアレイは、DNAアレイの読み取りのために一般に使用されるものと同じ検出方法を使用する。同様に、DNAマイクロアレイを読み取るために使用されるものと同じ機器がタンパク質アレイに適用可能である。
【0105】
従って、捕捉アレイ(例えば抗体アレイ)は、正常及び病的な体液などの2種類の異なる採取源からの蛍光標識タンパク質を用いてプローブすることができる。この場合、読み取りは、標的タンパク質の発現レベルの変化の反映としての、蛍光シグナルの変化に基づく。代替的な読み取り法としては、蛍光共鳴エネルギー移動、表面プラズモン共鳴、ローリングサークルDNA増幅、共鳴光散乱、酵素反応及び原子間力顕微鏡法が挙げられるが、これらに限定されない。
【0106】
さらなる詳細については、例えば、Zhou H,ら、Trends Biotechnol.19:S34−9(2001);Zhuら、Current Opin.Chem.Biol.5:40−45−(2001);Wilson及びNock,Angew Chem Int Ed Engl 42:494−500(2003);及びSchweitzer及びKingsmore,Curr Opin Biotechnol 13:14−9(2002)を参照のこと。生体分子アレイは、2002年6月18日発行の米国特許第6,406,921号(この開示全体が、参照により本明細書によって明確に組み込まれる。)でも開示されている。
【0107】
5.免疫アッセイ
本発明の診断アッセイは、当技術分野で周知の様々な免疫アッセイ方式の形態で行うこともできる。本発明のある実施態様には、個体から体液、例えば頸管膣分泌液を得て;本明細書中に記載の免疫アッセイシステムを用いて体液中の本明細書中に記載の1以上のタンパク質の量を測定し;この体液中の本明細書中に記載の1以上のタンパク質の量を、羊膜内感染状態がない健康な個体における本明細書中に記載の1以上のタンパク質の参照レベルと比較する段階を含み、本明細書中に記載の1以上のタンパク質量の、参照レベルを上回る上昇から、個体が羊膜内感染に罹患していることが示される、個体における羊膜内感染を診断するための方法が含まれる。
【0108】
ある実施態様において、1段階アッセイ(試料+検出抗体の同時温置)が有用である。別の実施態様において、2段階アッセイ(試料及び検出抗体の順次温置)が有用である。2段階アッセイは、他のタンパク質分子が検出抗体への結合に競合し得る場合に好ましい。均一系免疫アッセイにおいて、抗原と抗体との間の免疫学的反応及び検出の両方を均一系反応で行うことができる。不均一系免疫アッセイには少なくとも1つの分離段階が含まれ、これにより未反応試薬と反応性生物を区別することが可能になる。
【0109】
免疫測定、「二部位」又は「サンドイッチ」免疫アッセイと呼ばれる免疫アッセイの実施態様において、検体において異なるエピトープに結合する2つの抗体と検体が結合するか又はこの2つの抗体間でサンドイッチされる。このような免疫アッセイの代表例としては、酵素免疫アッセイ又は酵素免疫測定アッセイ(EIA又はELISA)、免疫放射定量アッセイ(IRMA)、蛍光免疫アッセイ、ラテラルフローアッセイ、拡散免疫アッセイ、免疫沈降アッセイ及び磁気分離アッセイ(MSA)が挙げられる。このようなある1つのアッセイにおいて、「捕捉」抗体と呼ばれる第一の抗体を、タンパク質カップリング又はタンパク質結合面、コロイド金属粒子、酸化鉄粒子又はポリマー性ビーズなどの固体支持体に結合させる。ポリマー性ビーズの一例はラテックス粒子である。このような実施態様において、当技術分野で公知の手順を用いて、捕捉抗体を固体支持体に結合させるか又は捕捉抗体で個体支持体を被覆する。あるいは、固体支持体に結合されているか又は固体支持体を被覆するさらなる抗体により認識されるリガンドと捕捉抗体がカップリングされる。リガンドを介したさらなる抗体への捕捉抗体の結合は、固体支持体上に間接的に捕捉抗体を固定化する。このようなリガンドの例はフルオレセインである。
【0110】
当技術分野で公知の手順を用いて、「検出」抗体と称される第二の抗体を、標識とカップリングさせるか又は複合化させる。この目的に適切な標識の例としては、化学発光剤、発色剤、エネルギー移動剤、酵素、酵素反応の基質、蛍光剤及び放射性同位体が挙げられる。ある実施態様において、標識には、第二の抗体とカップリングさせるビオチンなどの第一のタンパク質及び酵素とカップリングさせるストレプトアビジンなどの第二のタンパク質が含まれる。第二のタンパク質は第一のタンパク質に結合する。基質が提供された際に酵素が検出可能なシグナルを生成させ、測定されるシグナル量が、検体に結合される第二の抗体の量に対応することになる。酵素の例としては、アルカリホスファターゼ、アミラーゼ、ルシフェラーゼ、カタラーゼ、β−ガラクトシダーゼ、グルコースオキシダーゼ、グルコース−6−リン酸デヒドロゲナーゼ、ヘキソキナーゼ、ホースラディッシュペルオキシダーゼ、ラクタマーゼ、ウレアーゼ及びリンゴ酸デヒドロゲナーゼが挙げられるが、これらに限定されない。適切な基質としては、TMB(3,3’,5,5’−テトラメチルベンジジン、OPD(o−フェニレンジアミン)及びABTS(2,2’−アジノ−ビス(3−エチルベンズチアゾリン−6−スルホン酸)が挙げられるが、これらに限定されない。
【0111】
「サンドイッチ」方式において、アッセイされている抗原は2種類の異なる抗体の間で保持される。この方法において、固体表面を最初に固相抗体で被覆する。次に、抗原(即ち診断タンパク質)を含有する試験試料又は被測定抗原を含有する組成物を添加し、抗原を被結合抗体と反応させる。未結合の抗原を全て洗い流す。次に、既知の量の酵素標識抗体を被結合抗体と反応させる。反応後、過剰な未結合の酵素連結抗体を全て洗い流す。次に、本アッセイで使用される酵素に対する基質を添加し、基質と酵素との間の反応により色の変化が生じる。視覚的な色の変化量が、特異的な酵素と複合化した被結合抗体の直接測定法であり、それ故に被験試料中に存在する抗原の測定法である。
【0112】
競合アッセイとしてELISAを使用することもできる。競合アッセイ方式において、測定しようとする抗原を含有する試験検体を正確な量の酵素−標識抗原と混合し、固体表面に連結されている抗−抗原抗体への結合に対して両者が競合する。酵素に対する基質を添加する前に、過剰な遊離酵素−標識抗原を洗い流す。酵素−基質相互作用により生じた色の強度量が、被験試料中の抗原量の尺度である。均一系免疫アッセイとしては、例えば酵素増幅免疫アッセイ技術(EMIT)が挙げられ、これには一般に、測定しようとする化合物を含む生体試料、測定しようとする化合物の酵素標識化分子、測定しようとする化合物に結合する特異的抗体及び特異的酵素発色基質が含まれる。典型的なEMITにおいて、過剰な特異的抗体を生体試料に添加する。生体試料が検出しようとするタンパク質を含有する場合、このようなタンパク質は抗体に結合する。次に、測定した量の対応する酵素−標識タンパク質を混合物に添加する。試料中のタンパク質分子に占有されていない抗体結合部位は、添加した酵素−標識タンパク質分子に占有される。結果として、遊離型の酵素−標識タンパク質のみが基質上で作用し得るので、酵素活性が低下する。無色から有色型に変換される基質の量から、混合物中に残存する遊離型酵素の量を決定する。試料中の検出しようとするタンパク質が高濃度であるほど、吸収読み取り値が高くなる。試料中のタンパク質が少ないほど、酵素活性が低くなり、結果として吸収読み取り値が低くなる。Ag−酵素複合体がAb−結合である場合、酵素標識の不活性化によって、EMITは、他の免疫アッセイ法で必要とされるような未結合化合物からの結合化合物の分離を行うことなく試験を行うことができる独自の系となる。
【0113】
本明細書中に記載のシステム及び方法の様々な実施態様において有用な抗体には、市販の抗体及び抗体断片ならびに指定の標的タンパク質上の適切なエピトープに結合するように作製された何らかの新規抗体が含まれる。全ての実施態様において、本発明に従い使用しようとする抗体は、頸管膣分泌液中に存在する本明細書中に記載のバイオマーカーの1以上の特異的なアイソフォームに結合しなければならない。本明細書中で例示される様々な実施態様で使用される抗体は、モノクローナル又はポリクローナルの性質を有するものである。他の抗体及び抗体断片、例えば、組み換え抗体、キメラ抗体、ヒト化抗体、Fab又はFv断片ならびにスクリーニングファージディスプレイライブラリにより選択される断片などの抗体断片なども、本明細書中に記載の組成物及び方法において有用である。
【0114】
現在、モノクローナルならびにポリクローナル抗体の調製のための方法は十分に確立されている(Harlow E.ら、1988.Antibodies.New York:Cold Spring Harbour Laboratory)。ある実施態様において、組み換えヒトLBP、その合成断片又は、ヒト血清から精製され得るようなLBPに対して抗体を生成させる。標準的な免疫付与及び採血手段を用いてマウス、ラット、ウサギ、ヤギ、ヒツジ、ロバ及びウマを含むが限定されない様々な種においてポリクローナル抗体を生成させる。高力価の動物血液を、硫酸アンモニウムでの沈殿などの通常の選択的塩析手段によって分画化し、標準的な方法に従い、プロテイン−A−セファロース及びレプチン−セファロースカラム上での連続的アフィニティークロマトグラフィーによって、特異的な免疫グロブリン画分を分離する。次に、特異性及び関連分子との交差反応性の欠如について、精製したポリクローナルならびにモノクローナル抗体の特徴を調べる。このような特性評価は、抗体結合に対する、未標識の潜在的な交差反応物レベルが高い競合において、タンパク質、例えば、放射性同位体又はビオチンなどのトレーサーで標識されるLBPを用いて、標準的な方法によって行われる。いくつかの実施態様において、特異性が非常に高い抗体画分を得るために又はポリクローナルプールから親和性がより高い抗体画分を選択するために、さらなる精製が必要とされる。モノクローナル抗体の場合、特に組み換え分子又はペプチド抗原を免疫付与のために使用する場合は、免疫原だけではなく天然循環分子に対して良好な結合特性及び特異性を持つ抗体の選択に注意が必要である。還元条件及び非還元条件下での、十分に確立されたドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動(SDS−PAGE)及びウエスタン免疫ブロット方法など、他の標準的な方法によって、交差反応性実験をさらに評価する。高速液体クロマトグラフィー(HPLC)により分画化された血清試料中で検出されるタンパク質の免疫学的反応性の評価は、検出されたタンパク質の分子量プロファイルを大まかに明らかにするためにも使用される(Gravett MGら、JAMA 2004;292:462−469;Khosravi MJら、Clin Biochem 1995;28:407−414)。
【0115】
モノクローナル抗体は、Kohler及びMilsteinの最初の技術(Kohler G.,Milstein C.Nature 256:495,1975)に基づく、十分に確立された標準的実験室手段((Laboratory Techniques in Biochemistry and Molecular Biology,編:R.H.Burdon及びP.H.van Kinppenberg;Elsevier Publishers Biomedical Division,1985中の)P.Tijssenによる「Practice and Theory of Enzyme Immunoassays」)に従い調製される。この技術は、免疫付与した動物から脾臓細胞を取り出し、骨髄腫細胞との融合又はエプスタイン−バーウイルス形質転換により抗体産生細胞を不死化し、次いで望ましい抗体を発現するクローンについてスクリーニングすることによって行われるが、当技術分野で公知の他の技術も使用される。抗体は、特異的なDNAでの免疫付与を含むが限定されない、当業者にとって公知の他のアプローチによっても作製される。
【0116】
本明細書中に記載の免疫アッセイでの使用の場合、標準的な抗体精製スキームを用いて抗体を精製する。様々な実施態様において、モノクローナル及びポリクローナルの両抗体とも、プロテイン−Aカラム上でのアフィニティークロマトグラフィーによって精製される。あるいは、標準的な方法を用いて、固定化抗原タンパク質を含有するゲルカラム上でのアフィニティークロマトグラフィーによって抗体が精製される。
【0117】
本明細書中に記載のシステム及び方法における使用に適切な抗体の選択に対する別の留意事項は、捕捉抗体及び検出抗体が、あるタンパク質分子に同時に結合できることである。MIP1bを含むある実施態様において、例えば捕捉抗体の抗MIP1b結合部位は検出抗体が結合するエピトープとは異なり、従って捕捉及び検出抗体に同時に結合し、特定のバイオマーカーを検出することが可能になる。エピトープの重複が顕著であり、その結果結合反応が不良となる場合、捕捉又は検出抗体としてバイオマーカーに対する異なる抗体を選択することは当業者の技術の範囲内である。いくつかの実施態様において、タンパク質表面上で抗体結合部位は完全に利用可能ではなく、例えばこのタンパク質は1以上の他のタンパク質との複合体で試料中に主に存在し、捕捉又は検出抗体への結合のために接近しにくい。このような環境においては、部分的なタンパク質変性又は緩衝液変異など、当技術分野で公知の技術を使用して抗体結合部位を露出させる。
【0118】
当技術分野で公知のように、必要な分析的及び/又は固相分離の必要条件に応じて、標準的な非共有又は共有結合法を用いて、捕捉抗体を様々な固相支持体とカップリングさせるか又は連結させる。固体支持体は、試験管、ビーズ、微小粒子、ろ紙、膜、ガラスフィルター、磁性粒子、ガラスもしくはシリコンチップ又は他の材料の形態及び当業者にとって公知のアプローチである。微小粒子、特に抗体で直接被覆されている磁気化粒子(磁性粒子−捕捉抗体)又は普遍的な結合剤(例えば、アビジン又は抗種抗体)で標識されている粒子の使用は、アッセイ温置時間を大幅に短くするために有用である。当技術分野で公知の他の代替アプローチとともにこれらによって、必要な感度を制限することなく数分以内にアッセイを完了できるようになる。磁気化粒子の使用又は同様のアプローチの使用により、広く利用可能な免疫分析装置において技術を便利に自動化することができる。
【0119】
タンパク質断片の検出のために使用される検出抗体は、レポーター分子と直接カップリングされるか又は二次検出系により間接的に検出される。後者は、標識された抗種抗体により認識される抗体及び他の形態の免疫学的又は非免疫学的架橋及びシグナル増幅検出系(例えばビオチン−ストレプトアビジン技術)を含む、当技術分野で公知のいくつかの異なる原理に基づく。アッセイ感度及び低レベルの再現性及び性能を顕著に向上させるために、シグナル増幅アプローチが使用される。直接又は間接的抗体カップリングに使用される標識は、何らかの検出可能なレポーター分子である。適切な標識の例は、フルオロフォア、発光標識、金属錯体及び放射性標識ならびに酵素などの他の適切な試薬により検出され得る部分又は発光性基質との酵素などの直接的もしくは間接的標識の様々な組み合わせなど、免疫学的及び非免疫学的検出系の分野で広く使用されるものである。
【0120】
本発明の方法の様々な実施態様において、何らかの試料及び抗体の体積及び温置時間を変更することは当技術分野の者の技術の範囲内である。これらの方法及び系には、従来の免疫アッセイで使用される一般的な改法及び当業者にとって公知の何らかの変更が含まれる。様々な実施態様において、アッセイデザインは、特定のアッセイ適用及びスピード、感度、精度及び利便性に対する必要性に応じて、均一系又は不均一系である。
【0121】
上述の免疫アッセイに加えて、他の免疫アッセイ(例えば、オクタロニープレート又はウエスタンブロットは、タンパク質ゲル又はフィルター上のタンパク質スポット上で行われ得る。)が当技術分野で公知であり、診断としての利用法が見出され得る。
【0122】
本発明の別の態様は免疫アッセイキットに関する。ある実施態様において、免疫アッセイキットは、本明細書中に記載のタンパク質の2以上の検出用の抗体及び試薬を含む。ある態様において、本発明は、捕捉抗体及び検出抗体を含むサンドイッチ免疫アッセイキットを含む。捕捉抗体及び検出抗体はモノクローナル又はポリクローナルであり得る。別の態様において、本発明は、免疫フロークロマトグラフィーを用いた免疫クロマトグラフィーストリップ(ICS)試験などのラテラルフロー装置を含む診断キットを含む。ラテラルフロー装置は、全般的に米国特許第4、943,522号;同第4,861,711号;同第4,857,453号;同第4,855,240号;同第4,775,636号;同第4,703,017号;同第4,361、537号;同第4,235,601号;同第4,168,146号;同第4,094,647号(これらのそれぞれの内容全体が、参照により組み込まれる。)に記載されるとおり、ラテラルフローアッセイ技術を利用する。また別の態様において、本免疫アッセイキットは、例えば、別個の容器中で、(a)新生児敗血症などの特定の母体/胎児の状態の診断で使用されるポリペプチドに対して結合特異性を有するモノクローナル抗体;(b)及び抗抗体免疫グロブリンを含み得る。この免疫アッセイキットは、本明細書中で提供される様々な方法の実施に対して使用され得る。モノクローナル抗体及び抗抗体免疫グロブリンは、約0.001mgから約100グラムの量、より好ましくは約0.01mgから約1グラムの量で提供され得る。抗抗体免疫グロブリンは、ポリクローナル免疫グロブリン、プロテインA又はプロテインG又はそれらの機能的断片であり得、これらは、当技術分野で公知の方法により使用前に標識され得る。本診断キットは、試験におけるバックグラウンド干渉を低下させるために必要な物質、シグナルを増強させるための物質、関心のある臨床転帰の予測値を生成するためのマーカー値を組み合わせて内挿するためのソフトウェア及びアルゴリズム、試験を行うための装置、較正曲線及びチャート、標準曲線及びチャートなどをさらに含み得る。本試験キットは、何らかの適切な方式で、一般には試験を行うための印刷された説明シートとともに1つの容器中に全ての要素が入っている状態で包装され得る。
【0123】
6.診断及び治療法
本発明の診断方法は、乳児及び/又は母親の生存に非常に重要であることが多い迅速な治療決断を行うための、開業医にとって有益なツールである。従って、例えば妊婦が早期陣痛の症状を示す場合、羊膜内感染があるか否かを判定するために診断テストを実施することが重要である。本明細書中の迅速かつ非侵襲性の診断テストにより、羊膜内感染の存在が確認される場合、医師は、早産児生存の可能性を向上させ、母体の健康に対するリスクを抑えるために緊急措置をとる必要がある。現在のところ利用可能な羊膜内感染に対する非侵襲性試験はない。
【0124】
羊膜内感染に対する試験が陰性である場合、早産が依然として予想されるものであるか否かという疑問が残る。現在、単一マーカーの胎児フィブロネクチン(fFN)試験がこの目的に使用されることがある。妊娠患者のCVF中にfFNがないことは、少なくともさらに2週間妊娠が継続するであろうという優れた指標である。しかしfFNの存在に基づき(陽性試験)、早産が起こりそうであるか否かを信頼性高く予想することはできない。本発明の複数マーカーによる診断テストは、陰性及び陽性試験結果の場合の両方において早産の可能性の信頼性のある予測因子を提供する。
【0125】
あるいは、患者が早産の症状を示し、診断テスト(本明細書中の試験又は臨床診療で使用される何らかの他の試験の何れか)を使用して早産の可能性を評価する場合、羊膜内感染の有無に関する情報を提供し、医師がよりよい治療決定を行い得るようにするためのフォローアップとして羊膜内感染に対する試験を行うことができる。
【0126】
本明細書中で特定されるタンパク質の発現レベルの測定又は取得後、アッセイ結果、知見、診断、予測及び/又は治療法の推奨は通常、記録され、例えば、技術者、医師及び/又は患者に伝達される。ある種の実施態様において、コンピュータを使用してこのような情報を関係者、例えば患者及び/又は担当医などに伝達する。いくつかの実施態様において、本アッセイを行うか又はアッセイ結果もしくは診断が伝達される国又は管轄とは異なる国又は管轄においてアッセイ結果が分析される。
【0127】
好ましい実施態様において、試験対象中での本明細書中の1以上のバイオマーカーの発現レベルに基づく診断、予測及び/又は治療法の推奨を、アッセイが完了し、診断及び/又は予測を出した後できるだけ迅速に対象に伝達する。ある種の実施態様において、診断、予測及び/又は治療法の推奨はさらに、対象が示す徴候及び症状に基づく。ある実施態様において、IAIを示す徴候及び症状としては、母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体又は胎児の頻脈、子宮圧痛又は羊水の悪臭が挙げられるが、これらに限定されない。IAIを示すその他の徴候及び症状は当技術分野で公知である。本明細書中に記載の方法において特定され定量される1以上のバイオマーカーが、1以上のパネルに含有され得る。パネルを含むバイオマーカーの数としては、1種類のバイオマーカー、2種類のバイオマーカー、3種類のバイオマーカー、4種類のバイオマーカー、5種類のバイオマーカー、6種類のバイオマーカー、7種類のバイオマーカー、8種類のバイオマーカー、9種類のバイオマーカー、10種類のバイオマーカー、11種類のバイオマーカー、12種類のバイオマーカー、13種類のバイオマーカー、14種類のバイオマーカー、15種類のバイオマーカー、16種類のバイオマーカー、17種類のバイオマーカー、18種類のバイオマーカー、19種類のバイオマーカー、20種類のバイオマーカーなどが挙げられ得る。
【0128】
好ましい実施態様において、本発明は、頸管膣分泌液(CVF)中のα−胎児性タンパク質、インターロイキン−6(IL−6)及びインスリン増殖因子結合タンパク質−1(IGFBP−1)濃度を測定する免疫クロマトグラフィー試験である羊膜内感染試験(ProteoGenix羊膜内感染試験(PG−IAI))に関する。本試験は、特発性早期陣痛が起こり、膜が完全であり、22週0日から36週6日の間に試料採取された妊婦においてIAIのリスクを評価する際に補助的なものとして特に有用であり、IAIが疑われる者に対する患者管理を優先するために使用することができる。
【0129】
特定の実施態様において、本試験はラテラルフローカートリッジに格納され、ラテラルフローリーダーを用いてPG−IAIバイオマーカーシグナル強度が測定される。スワブ回収キットを用いて非侵襲性のCVFスワブを使用してCVFを回収する。
【0130】
ラテラルフロー装置に対する試験性能を見積もるために、ELISAプラットフォームを用いた現在の臨床的/分析的研究からのデータを使用した。最良モデルは2種類のCVFバイオマーカー、すなわちα−胎児性タンパク質及びIL−6の質量濃度を使用した。さらなるCVFバイオマーカーであるIGFBP1は、この2種類のバイオマーカーによるリスク評価に対するゲートキーパーとなると認識されている。IGFBP1はそれ自身においてIAIに対する診断とはなり得ないが、これによりIAI偽陽性患者の結果の29%が排除され、診断テストの特異性が大きく向上する。
【0131】
結果及び/又は関連情報は対象の担当医師により対象に伝達され得る。あるいは、結果は、書面のレポートを提供することなどにより書面で、eメール又は電話などの電子的伝達形態を含む何らかの伝達手段によって、試験対象に直接伝達され得る。eメール伝達の場合など、コンピュータの使用によって伝達が促進され得る。ある種の実施態様において、遠隔通信における熟練技術者がよく精通しているであろうコンピュータハードウェア及びソフトウェアの組み合わせを使用して、診断テストの結果及び/又は試験から導かれる結論及び/又は試験に基づく治療法の推奨を含有する通信物を作成し、対象に自動的に送達し得る。医療向けの伝達システムの一例は米国特許第6,283,761号に記載されているが、本発明は、この特定の伝達システムを使用する方法に限定されない。本発明の方法のある種の実施態様において、試料のアッセイ、疾患の診断及びアッセイ結果又は診断の伝達を含む方法段階の全て又は一部が多様な(例えば外来)管轄で行われ得る。
【0132】
診断を促進するために、本発明の本明細書中で与えられる1以上のバイオマーカーの参照及び/又は対象バイオマーカープロファイル又は発現レベルを、限定されないが、とりわけVCRで読むことのできるもののようなアナログテープ、CD−ROM、DVD−ROM、USBフラッシュメディア、例えばフラッシュドライブなどの、電子的に又は機械読み取り可能な媒体に含有される表示装置上に表示することができる。このような機械読み取り可能な媒体はまた、臨床的パラメータ及び古典的な検査リスク因子の測定などのさらなる試験結果も含有し得るが、これらに限定されない。あるいは又はさらに、機械読み取り可能な媒体はまた、病歴及び何らかの関連家族歴などの対象情報も含み得る。
【0133】
微生物学及び治療:IAIは、真正細菌、マイコプラズマ種及び真菌を含む多菌性感染であることが多い。IAIにおける羊水からの培養又は16S rDNA PCRにより最も高頻度に回収される微生物には、ガードネレラ・バジナリス(Gardnerella vaginalis)、バクテロイデス・ビビウス(Bacteroides bivius)、フゾバクテリウム・ヌクレアーツム(Fusobacterium nucleatum)、ペプトストロプトコッカス属(Peptostroptococcus sp.)、プロボテラ・ビブス(Provotella bivus)、その他のグラム陰性嫌気性菌、カンジダならびに生殖器マイコプラズマ、マイコプラズマ・ホミニス(Mycoplasma hominis)及びウレアプラズマ・ウレアリチカム(Ureaplasma urealyticum)が含まれていた(DiGiulio DBら、PLoS ONE 3(8):e3056;Han,Yiping W.ら、J.Clin.Microbiol.2009 47:38−47)。標的となる抗生物質療法は、診断確定後すぐに分娩期に開始すべきである。
【0134】
本願で引用される特許及び参考文献は全てそれらの全体において参照により本明細書によって組み込まれる。
【実施例】
【0135】
次の実施例は、単なる説明目的のために与えらるものであり、本発明の範囲を何ら限定するものではない。当業者は、本発明の範囲内で変更することができる様々なパラメータを認めるであろう。
【実施例1】
【0136】
免疫アッセイを用いた羊膜内感染の頸管膣分泌液バイオマーカーの同定
早期陣痛が現れている患者から、個々の患者検体を回収した。対応する羊水検体を使用して、羊水培養(好気性、嫌気性及びマイコプラズマ種)及び羊水16SリボソームDNAの有無に基づき、羊膜内感染(IAI)を呈する者又は非IAIである者として患者を分類した。
【0137】
頸管膣分泌液スワブ回収。ポリエステルスワブ(Puritan、Guilford、ME)で頸管口を拭うことによって頸管膣分泌液を回収し、次いでこれを約1mLの検体回収緩衝液の入った容器に入れた。輸送のために検体を−70℃で凍結させ、次いで凍結融解し、270xgで15分間遠心し、長期保存のために再分注した。
【0138】
GROα:CVF検体の希釈。下記のQuantikine Human CXCL1/GROct免疫アッセイキットでの検査前に、アッセイ緩衝液(2.67mM KCl、1.47mM KH2PO4、137.93mM NaCl、8.06mM Na2HPO4−7H2O、0.15%BSA、0.05%v/v Tween−20、0.075%v/v ProClin 950、pH7.3+0.3)中で頸管膣分泌液(CVF)検体を1:50に希釈した。
【0139】
CVF検体中のGROαの検出。希釈後、製造者の説明書に対して一部変更を加え、試料として検体をR&D SystemsのQuantikine Human CXCL1/GROct免疫アッセイキット(カタログ番号DGR00)に供した。簡潔に述べると、試薬、対照及び試料を室温(RT)にした。GROct標準物質を5mLアッセイ緩衝液中で再構成し、1000pg/mL溶液を得た。この溶液を穏やかに撹拌しながら室温にて15分間温置した。温置後、750μLの1000pg/mL溶液を750μLのアッセイ緩衝液に加えて希釈し、500pg/mLの溶液を得た。この過程をさらに4回繰り返し、250pg/mL、125pg/mL、62.5pg/mL及び31.25pg/mLの溶液を得た。50μLのアッセイ希釈液RD1Uを各ウェルに添加した。200μLの標準物質を3つ組で適切なウェルに添加した。200μLの対照及び試料を2つ組で適切なウェルに添加した。これらのウェルを接着ストリップで覆い、RTで2時間温置した。接着ストリップを取り外し、BioTek ELx50プレート洗浄器を用いて、ウェルを400μLの1x洗浄緩衝液で3回洗浄し、各洗浄と洗浄の間に1分間温置した。ウェルを上下逆にしてペーパータオル上に叩きつけることによって残存液を全て除去した。200μLのGROct複合物を各ウェルに添加した。ウェルを接着ストリップで覆い、2−8℃で2時間温置した。この接着ストリップを取り外し、前と同じようにウェルを洗浄した。前と同じように残存液を全て除去した。200μLの基質溶液を各ウェルに添加した。これらのウェルをアルミホイルで覆い、RTで20分間温置した。50μLの停止溶液を各ウェルに添加した。BioTek Synergy2プレートリーダー及びBioTek Gen5ソフトウェアを用いて、450nm及び540nmでプレートの読み取りを行った。
【0140】
CVF検体中のGROαの定量。Gen5ソフトウェアを用いて、標準曲線を作成するために4パラメータ非線形回帰分析を行った。次いでこの標準曲線を使用して、免疫アッセイキットでのCVF検体の測定においてGROαの濃度を計算した。CVF検体中のGROαの最終濃度を計算するため、最初の検体希釈を考慮に入れるために、計算した濃度に50を乗じた。31.25pg/mLの標準物質のΔOD(OD450−OD540)読み取り値よりもΔOD読み取り値が低かった検体は何れも濃度を31.25pg/mLとし、これに50を乗じた。次いで、下記のとおり、統計学的方法を用いてデータを解析した。図1は、IAI感染(n=14)対非感染患者(n=95)における、GROα(アッセイ1)の自然対数値を示す箱ひげ図を示す。
【0141】
CVF検体の希釈。下記のQuantikineヒトIL−6免疫アッセイキットでの検査前に、標準物質希釈液RD6F中で頸管膣分泌液(CVF)検体を1:100に希釈した。
【0142】
CVF検体中のIL−6の検出。希釈後、製造者の説明書に対して一部変更を加え、試料として検体をR&D SystemsのQuantikineヒトIL−6免疫アッセイキット(カタログ番号D6050)に供した。簡潔に述べると、試薬、対照及び試料を室温(RT)にした。IL−6標準物質を5mLの標準物質希釈液RD6Fで再構成し、300pg/mLの溶液を得た。この溶液を穏やかに撹拌しながら室温にて15分間温置した。温置後、333μLの300pg/mL溶液を667μLの標準物質希釈液RD6Fに加えて希釈し、100pg/mLの溶液を得た。500μLの100pg/mL溶液を500μLの標準物質希釈液RD6Fに加えて希釈し、50pg/mLの溶液を得た。2倍希釈をさらに4回繰り返し、25pg/mL、12.5pg/mL、6.25pg/mL及び3.12pg/mLの溶液を得た。100μLのアッセイ希釈液RD1Wを各ウェルに添加した。100μLの標準物質を3つ組で適切なウェルに添加した。100μLの対照及び試料を2つ組で適切なウェルに添加した。これらのウェルを接着ストリップで覆い、RTで2時間温置した。接着ストリップを取り外し、BioTek ELx50プレート洗浄器を用いて、ウェルを400μLの1x洗浄緩衝液で4回洗浄した。ウェルを上下逆にしてペーパータオル上に叩きつけることによって残存液を全て除去した。200μLのIL−6複合物を各ウェルに添加した。これらのウェルを接着ストリップで覆い、RTで2時間温置した。接着ストリップを取り外し、前と同じようにウェルを洗浄した。前と同じように残存液を全て除去した。200μLの基質溶液を各ウェルに添加した。これらのウェルをアルミホイルで覆い、RTで20分間温置した。50μLの停止溶液を各ウェルに添加した。BioTek Synergy2プレートリーダー及びBioTek Gen5ソフトウェアを用いて450nm及び540nmでプレートの読み取りを行った。
【0143】
CVF検体中のIL−6定量。Gen5ソフトウェアを用いて、標準曲線を作成するために4パラメータ非線形回帰分析を行った。次いでこの標準曲線を使用して、免疫アッセイキットでのCVF検体の測定においてIL−6の濃度を計算した。CVF検体中のIL−6の最終濃度を計算するため、最初の検体希釈を考慮にいれるために、計算した濃度に100を乗じた。3.12pg/mLの標準物質のΔOD(OD450−OD540)読み取り値よりもΔOD読み取り値が低かった検体は何れも濃度を3.12pg/mLとし、これに100を乗じた。ΔOD読み取り値が300pg/mLの標準物質のΔOD読み取り値よりも高かった検体は全て、より高い希釈率で希釈し、そのキットで再び測定した。次いで、下記のとおり統計学的方法を用いてデータを解析した。図7は、IAI感染(n=14)対非感染患者(n=95)における、IL−6の自然対数値を示す箱ひげ図を示す。
【0144】
LBP:CVF検体の希釈。下記のヒトLBP ELISAキットにおける検査前に、アッセイ緩衝液(2.67mM KCl、1.47mM KH2PO4、137.93mM NaCl、8.06mM Na2HPO4−7H2O、0.15%BSA、0.05%v/v Tween−20、0.075%v/v ProClin950、pH7.3+0.3)中で頸管膣分泌液(CVF)検体を1:50に希釈した。
【0145】
CVF検体中のLBPの検出。希釈後、製造者の説明書に対して一部変更を加え、試料として検体をCell SciencesのヒトLBP ELISAキット(カタログ番号CKH113)に供した。簡潔に述べると、試薬、対照及び試料を室温(RT)に。ヒトLBP標準物質を30μL蒸留水で再構成した。次に、再構成したヒトLBP標準物質を1570μLアッセイ緩衝液に加えて希釈し、50ng/mLの溶液を得た。350μLの50ng/mL溶液を350μLのアッセイ緩衝液に加えて希釈し、25ng/mLの溶液を得た。2倍希釈をさらに4回繰り返し、12.5ng/mL、6.25ng/mL、3.125ng/mL及び1.56ng/mLの溶液を得た。100μLの標準物質を3つ組で適切なウェルに添加した。100μLの対照及び試料を2つ組で適切なウェルに添加した。これらのウェルを接着ストリップで覆い、振盪しながらRTで1時間温置した。接着ストリップを取り外し、BioTek ELx50プレート洗浄器を用いて、300μLの洗浄緩衝液でウェルを3回洗浄した。ウェルを上下逆にしてペーパータオル上に叩きつけることによって残存液を全て除去した。100μLの検出抗体を各ウェルに添加した。これらのウェルを接着ストリップで覆い、振盪しながらRTで1時間温置した。接着ストリップを取り外し、前と同じようにウェルを洗浄した。前と同じように残存液を全て除去した。100μLの基質溶液を各ウェルに添加した。これらのウェルをアルミホイルで覆い、RTで12−15分間温置した。100μLの停止溶液を各ウェルに添加した。BioTek Synergy2プレートリーダー及びBioTek Gen5ソフトウェアを用いて450nm及び620nmでプレートの読み取りを行った。図8は、IAI感染(n=14)対非感染患者(n=95)における、LBPの自然対数値を示す。
【0146】
CVF検体中のLBPの定量。Gen5ソフトウェアを用いて、標準曲線を作成するために4パラメータ非線形回帰分析を行った。次いでこの標準曲線を使用して、免疫アッセイキットでのCVF検体の測定においてLBPの濃度を計算した。CVF検体中のLBPの最終濃度を計算するため、最初の検体希釈を考慮にいれるために、計算した濃度に50を乗じた。1.56ng/mLの標準物質のΔOD(OD450−OD620)読み取り値よりもΔOD読み取り値が低かった検体は何れも濃度を1.56ng/mLとし、これに50を乗じた。ΔOD読み取り値が50ng/mLの標準物質のΔOD読み取り値よりも高い検体は全て、より高い希釈率で希釈し、そのキットで再び測定した。次いで、下記のとおり統計学的方法を用いてデータを解析した。
【0147】
A1AG:CVF検体の希釈。下記のヒトオロソムコイド(α−1−酸性糖タンパク質)ELISA定量キットでの検査前に、頸管膣分泌液(CVF)検体を1%ミルク入りのPBS中で20 1:200に希釈した。
【0148】
CVF検体中のA1AGの検出。希釈後、製造者の説明書に対して一部変更を加え、試料として検体をGenWayのヒトオロソムコイド(α−1−酸性糖タンパク質)ELISA定量キット(カタログ番号40−288−22927F)に供した。簡潔に述べると、試薬、対照及び試料を室温(RT)にした。被覆緩衝液(0.05M炭酸−重炭酸塩、pH9.4)中で被覆抗体を5μg/mLに希釈した。MaxiSorp面を有するImmuno LockWells(Nunc、カタログ番号446469)にこの5μg/mL被覆溶液100μLを添加した。これらのウェルをRTで1時間温置し、次いでBioTek ELx50プレート洗浄器を用いて、300μLの洗浄溶液(50mM Tris−HCl、0.14M NaCl、0.05%Tween 20)で3回洗浄した。ウェルを上下逆にしてペーパータオル上に叩きつけることによって残存液を全て除去した。200μLの1%ミルク入りPBSを各ウェルに添加し、ウェルをRTで1時間温置した。次いでウェルを前と同じように洗浄し、前と同じように残存液を全て除去した。1%ミルク入りPBS中で標準物質を250ng/mLに希釈した。次に、400μLの250ng/mL溶液を400μLの1%ミルク入りPBSに加えて希釈し、125ng/mLの溶液を得た。2倍希釈をさらに5回繰り返し、62.5ng/mL、31.25ng/mL、15.625ng/mL、7.8125ng/mL及び3.90625ng/mLの溶液を得た。100μLの標準物質を3つ組で適切なウェルに添加した。100μLの対照及び試料を2つ組で適切なウェルに添加した。これらのウェルを接着ストリップで覆い、RTで1時間温置した。接着ストリップを取り外し、BioTek ELx50プレート洗浄器を用いて300μLの洗浄溶液でウェルを5回洗浄した。前と同じように残存液を全て除去した。1%ミルク入りPBS中でHRP複合物を480ng/mLになるように希釈した。次に、100μLの希釈HRP複合物を各ウェルに添加した。これらのウェルを接着ストリップで覆い、RTで1時間温置した。接着ストリップを取り外し、前と同じようにウェルを洗浄した。
【0149】
前と同じように残存液を全て除去した。100μLの1−Step Ultra TMB ELISA(Thermo Scientific、カタログ番号34028)を各ウェルに添加した。これらのウェルをアルミホイルで覆い、RTで2.75分間温置した。TMB基質に対する停止試薬100μL(Sigma、カタログ番号S5814−100mL)を各ウェルに添加した。BioTek Synergy2プレートリーダー及びBioTek Gen5ソフトウェアを用いてプレートを450nmで読み取った。図6は、IAI感染(n=14)対非感染患者(n=95)における、A1AGの自然対数値を示す箱ひげ図を示す。
【0150】
CVF検体中のA1AGの定量。Gen5ソフトウェアを用いて、標準曲線を作成するために4パラメータ非線形回帰分析を行った。次いでこの標準曲線を使用して、免疫アッセイキットでのCVF検体の測定においてA1AGの濃度を計算した。CVF検体中のA1AGの最終濃度を計算するため、最初の検体希釈を考慮にいれるために、計算した濃度に200を乗じた。3.90625ng/mLの標準物質のOD450読み取り値よりもOD450読み取り値が低かった検体は全て、濃度を3.90625ng/mLとし、これに200を乗じた。
【0151】
250ng/mLの標準的物質のOD450読み取り値よりもOD450読み取り値が高い検体は全て、より高い希釈率で希釈し、そのキットで再び測定した。次いで、下記のとおり統計学的方法を用いてデータを解析した。
【0152】
CVF検体中のMIP−1β、AFP、B2MG、MCP−1、TIMP−1及びVCAM−1の検出及び定量
多重免疫アッセイ技術(Luminex xMAP)を用いてCVF検体中のMIP−1β、AFP、B2MG、MCP−1、TIMP−1及びVCAM−1の濃度を測定するために、外部検査実験室(Rules Based Medicine)と契約を結んだ。次に、下記のとおり、統計学的方法を用いて、この検査実験室により提供されたデータを解析した。図2は、IAI感染(n=14)対非感染患者(n=95)における、MIP 1bの自然対数値を示す箱ひげ図を示す。図3は、IAI感染(n=14)対非感染患者(n=95)における、MCP−1の自然対数値を示す箱ひげ図を示す。図4は、IAI感染(n=14)対非感染患者(n=95)における、B2MGの自然対数値を示す箱ひげ図を示す。図5は、IAI感染(n=14)対非感染患者(n=95)における、TIMP−1の自然対数値を示す箱ひげ図を示す。IAI感染(n=14)対非感染患者(n=95)における、AFPの自然対数値を示す箱ひげ図は図9で示す。IAI感染(n=14)対非感染患者(n=95)における、VCAM−1の自然対数値を示す箱ひげ図を図10で示す。
【0153】
データの統計学的解析。次のように個々のバイオマーカー比較を行った:複合参照定義を介して判定された感染状態対象対非感染状態の対象を群分けした。外れ値の影響を低下させるために自然対数変換データを用いて、群間比較を行うための一元配置ANOVAを行った。次にWilcoxinの順位付けに基づく(rank−based)検定を行って群間で比較した。最後に、判別能力を評価するために受信者動作特性(ROC)曲線を作成した。
【0154】
ロジスティック回帰を用いてバイオマーカーをモデルに組み合わせた。Wilcoxin検定においてp<0.20であったマーカーを、多重マーカーモデルにおいて検討した。モデルベースのROC曲線を作成し、多重マーカーモデルに対して個々のマーカーについての性能を比較するために使用した。ROC曲線下面積を最大にし、80%感度及び特異性の最低限受容可能な基準に曲線が確実に合致するようにすることが目的であった。有望なモデルに基づき、リスクスコアを算出した。リスクスコアにおける閾値は多重マーカーモデルの感度/特異性を最大化するものを選択した。
【0155】
10種類のバイオマーカーに対する個々の受信者動作特性曲線下の面積を表2で示す(「AUROC」の列)。図11及び12で示されるIAI対非IAIの判別のためのロジスティック回帰モデルを確立するために、他のバイオマーカーと組み合わせてこれらのマーカーを使用した。このモデルにおける各マーカーに対するパラメータを下記表3で示す。多重マーカーモデルにおいて行ったバイオマーカーの様々な組み合わせは、ある程度、個々のモデル性能を上回る。
表2.羊膜内感染の予測に関連する個々のバイオマーカーに対するAUROC及びp−値

表3.最尤推定値の解析

【実施例2】
【0156】
羊膜内感染に対するリスクを有するものとして患者を分類するために個々のバイオマーカー濃度に対するカットオフを使用することができるか否かを評価するために、CVFバイオマーカーに対する開発セットデータ(development set data)を解析した。個々のCVFバイオマーカー濃度は、質量単位として直接表すか又はこれらの質量単位の正規化値として表す。個々のバイオマーカーに対して及びバイオマーカーの組み合わせに対して、定量値を解析した。カットオフアプローチにより、ラテラルフロー装置としてCVF IAI試験を形式化することができる。ラテラルフロー方式において、ラテラルフローリーダーにおけるバンド強度を測定することによって、バイオマーカーレベルが定量的にスコア化される。
【0157】
xMAP(商標)技術に基づく個別解析用(single−analyte)ELISA及び多重液体ビーズアレイの組み合わせを使用して、IAIのバイオマーカーを特定した。ProteoGenix IAI Specimen Banking Trialにおいて、IAI有病率が15%であるヒト頸管膣分泌液検体のコホート(N=112)を集めた。羊膜内感染状態を定めるために、好気性、嫌気性及びマイコプラズマ培養によって、ならびに自社の16S rDNA PCR試験を用いて、これらの対象からの羊水を試験した。ロジスティック回帰分析、ならびに主成分分析を用いて、非IAI患者とIAI患者を判別することが可能な上位8種類のCVFバイオマーカーを選択するために、CVFにおけるELISA及びxMAP(商標)免疫アッセイデータを解析した。これらの8種類のバイオマーカーから、本発明に従い、最後の3種類を選択した。
【0158】
ラテラルフロー読み取りを模擬再現するために、ELISA実験からのデータを使用した。IAIに対するリスクを評価するための補助手段としてCVF IAI試験を使用することが目的なので、カットオフは感度を最大化するように選択した。IAIの診断を確認するために、羊水グルコース、グラム染色又は培養などの他の一般に利用可能な試験を使用し得る。このカットオフアプローチにより、PG−IAI試験の結果を感染に対する高リスク又は低リスクなど二元的な結果として報告することが可能になる。
【0159】
現時点での最良モデルでは、僅か2種類のバイオマーカー、すなわちα−胎児性タンパク質及びIL−6の質量濃度を使用する。検出可能なアルブミンが存在しないか(6/298)又は溶血が大きい(11/292)患者検体をデータセットから排除した。培養又は16S rDNAの複合参照標準物質に基づくと、このデータセットにおいて23例の感染例及び258例の非感染例があった。
【0160】
結果を図13及び14で示す。バイオマーカー濃度を対数変換し、Zスコアを計算した。このELISAデータセットにおいて1.0のZスコア合計カットオフを使用した。この2種類のバイオマーカーのZスコアの合計を定め、順位付けしてカットオフを定めた。感度は82%、特異性は85%、PPVは33%及びNPVは98%であった。AUROCは0.86であった。
【0161】
前記2種類のバイオマーカーリスク因子パネルに対するゲートキーパーとなる、さらなるCVFバイオマーカー、インスリン増殖因子結合タンパク質−1(IGFBP−1)を特定した。IGFBP−1バイオマーカーはIAIに対する診断用ではないが、(複合参照標準に基づき)多くのIAI偽陽性結果を排除し、PG−IAIリスク因子試験の特異性を顕著に向上させる。
【0162】
IGFBP−1は、胎膜の破裂を検出するための頸管膣分泌液中のバイオマーカーとして使用されている(AmnioSure Test;Medix Biochemica actim(商標)Prom Test)。IGFBP−1の濃度は、羊水中では頸管膣分泌液よりも1000から10,000倍高い。ProteoGenixコホートにおいて、早期破水(PROM)がないことは、羊歯状結晶試験(Fern)、ニトラジン、液体貯留(pooling)及び/又はAmnioSure検査が陰性であることにより確認した。下記のカプラン−マイヤーグラフで示されるように、CVF IGFBP1の濃度が3μg/mLより高い値であることは、非IAIの早産と一致する。結果を図15で示す。
【0163】
検出可能なアルブミン(6/298)がなく、溶血が大きいか(11/292)又はIGFBP1濃度が3μg/mLより高い(15/281)患者検体をデータセットから排除した。培養及び/又は16S rDNAの複合参照標準に基づくと、このデータセットにおいて、23例の感染例及び243例の非感染例があった。この2種類の診断バイオマーカー濃度を対数変換し、Zスコアを計算した。1.0のZスコア合計カットオフを使用した。この2種類のバイオマーカーのZスコアの合計を定め、順位付けしてカットオフを定めた。感度は82%、特異性は89%、PPVは41%及びNPVは98%であった。AUROCは0.86から0.89に上昇した。38例の偽陽性患者検体のうち11例(29%)が排除され、その結果、特異性が85%から89%に上昇し、PPVが33%から41%に上昇した。N=266の患者コホートにおいて、17%が高リスクスコアを有した。結果を図16及び17に示す。
【0164】
前述の発明を明確にし、理解可能にするためにある程度詳細に説明してきたが、本発明の真の範囲から逸脱することなく形態及び詳細の様々な変更が行われ得ることは、本開示を読むことから当業者にとって明らかとなろう。例えば、上記の技術及び機器を様々な組み合わせで使用することができる。本願で引用する、全ての刊行物、特許、特許願書及び/又はその他の書類は、各々の刊行物、特許、特許願書及び/又はその他の書類が、全目的のために参照により組み込まれるものであることが個々に示されるかのように、同じ程度、全目的のために参照により組み込まれる
【技術分野】
【0001】
本発明は、妊婦における羊膜内感染(IAI)のリスクの診断及び/又は評価のための試験に関する。本発明は、妊娠雌哺乳動物対象における羊膜内感染の診断のためのバイオマーカーの使用に関する、試験、診断アルゴリズム、バイオマーカー、材料、方法及び器具ならびに、このような診断のための診断テストシステム及び本明細書中で記載のような様々なその他の実施態様を提供することにさらに関する。
【背景技術】
【0002】
早産は、生後1ヶ月以内の大きな死亡原因であり、全乳児死亡の3分の1に対する寄与原因である。羊膜内感染(IAI)は、妊娠37週未満の特発性早産の大きな原因の1つである。早産に関与する他の状態としては、早期陣痛、早期破水、子癇前症、胎盤早期剥離、前置胎盤、胎児成長遅延、羊水過多又は羊水量異常、胎児奇形、子宮内出血、糖尿病、薬物乱用及びストレスが挙げられる。早期陣痛及び早産の管理には、必要に応じて、子宮収縮抑制薬及び胎児肺の成熟のためのコルチコステロイドによる治療が含まれ得る。陰性培養結果が出るまでB群レンサ球菌に適応するために狭域抗生物質が処方され得る。
【0003】
IAIは、特発性早期陣痛及び早産の最も重要な原因の1つである。IAIは羊膜腔の微生物侵入であり、全早期陣痛例の10−15%で起こる。(Newton ER.Clin Obstet Gynecol 1993;36(4):795−808;Watts DHら、Obstet Gynecol 1992;79:351−7;Romero Rら、Am J Obstet Gynecol 1993;169:805−16;Hillier SLら、Obstet Gynecol 1993;81:941−8)。膜が完全であるか又は完全ではない状態のIAIを説明するために使用されるその他の用語としては、羊水感染、羊膜炎及び臨床的絨毛羊膜炎が挙げられる。早期陣痛の原因としてのIAIの関与に加え、IAIはまた、特に早期新生児において、新生児有病率及び死亡率の上昇にも関連する。一般に、IAIを発症している母親から生まれた低出生体重児では周産期死亡率が3倍から4倍上昇することが知られている。呼吸窮迫症候群、脳室内出血及び新生児敗血症も増加する。(Morales,W.J.Obstetrics及びGynecology 70:183,1987)。IAIは新生児の脳室周囲白質軟化症及び脳性麻痺に独立して関連付けられており;大脳白質損傷及び脳性麻痺のリスクは、IAIの場合では9倍高い。(Bejar,R.ら、Am.J.Obstet.Gynecol.159:357、1988;Grether,J.K.及びNelson,K.B.JAMA 278:207、1997)。
【0004】
IAI例の大多数、80%から90%は、早期陣痛を除いては亜臨床的(無症状)である。現在、特発性早期陣痛の管理には、観察、子宮収縮抑制薬による治療及び羊水穿刺及び培養による可能性確認が含まれる。培養不能な微生物が存在し、栄養素選好的な微生物の単離が困難であり、抗生物質での治療歴があることにより、羊水培養のみでは、真のIAI有病率を過小評価することになる(Romero、R.ら、Am.J.Obstet.Gynecol.161:817、1989)。本発明の陽性IAI試験は、臨床家にとって利用可能な現在の診断及び治療計画に対する有用な補助的手段を提供するであろう。IAIの正確な診断は、IAIにおいて使用禁忌である子宮収縮抑制薬療法を差し控え、母親に対する出産場所及び、超早産児であり、IAIの過剰な結果として状態が悪い可能性がある乳児に対する必要なケアレベルを予想しながら、的を絞った抗生物質により母親を適切に治療するために重要である。
【0005】
本発明の陰性IAI試験は、早期陣痛の病因が感染以外のものであり得ることの再確認を提供する。30種類の他の徴候及び/又は症状の所見と合わせて、陰性試験により、医師が早期陣痛を処置することが可能になる。
【0006】
発症機序及びリスク因子:羊膜内感染は、下部生殖管微生物による上行性感染の結果として起こると考えられる。IAI有病率は、妊娠期間と強く反比例する。(Watts DHら、Obstet Gynecol 1992;79:351−7)。下部生殖管に対する常在細菌は、羊膜が完全であり、IAIの臨床兆候がない早期陣痛の全女性のうち10−20%(Romero Rら、Ann NY Acad Sci 1991;622:355−75)及び妊娠23−24週間で妊娠終了となった早期陣痛女性の最大67%(Watts DHら、Obstet Gynecol 1992;79:351−7)の羊水から回収される。さらに、これらの所見は、組織学的絨毛羊膜炎が20から24週で妊娠終了となった例の60−90%で見られているという事実により支持される。これらの所見は、IAIが特発性早期陣痛、特に妊娠初期における特発性早期陣痛の重要な原因であるという仮説の裏づけとなる。
【0007】
診断:IAIの早期診断により、適時に治療及び介入を行うことが可能となり得る。しかし、正確な診断を行うという点で複数の課題がある。臨床的見地から、IAIの臨床兆候及び症状は感染経過の後期に起こり、ごく一般的であり非特異的なので、早期診断は困難である。IAIを診断するために一般に使用される臨床基準には、母体発熱(≧37.8℃)を伴う早期陣痛があり、次のうち2以上:母体白血球増加(≧15,000/mm3)、母体又は胎児の頻脈、子宮圧痛又は羊水の悪臭、があることが含まれる。(Gibbs RSら、Am J Obstet Gynecol 1980;136(6):709−13)。Wattsらによる早期陣痛発来妊婦の研究では、羊水培養が陽性である場合と陽性ではない場合で、母体最高体温の平均、WBC数及び型別に違いはない。亜臨床的IAIはIAIに関して言及するために使用される用語であり、この場合、羊水培養が陽性であるおよそ88%の症例で徴候及び症状は僅かであるか又は現れていない。(Watts DHら、Obstet Gynecol 1992;79:351−7)。亜臨床的IAIの概念は、非ヒト霊長類モデルを用いたGravettらの知見によりさらに裏付けられる。これらの研究者らは、実験的IAIをB群レンサ球菌により誘発した後、実験的感染から28から40時間後に起こる感染誘発性早期陣痛の発来時に発熱及び白血球増加が現れるのは50%のみであることを明らかにした。(Gravett MGら、Am J Obstet Gynecol 1994;171(6):1660−7)。
【0008】
臨床的特徴が一貫しないため、IAIの診断を支援するために他の補助的臨床検査が利用されている。これらには、母体のC反応性タンパク質の測定、白血球又はグラム染色での細菌に関する羊水の直接検査、羊水培養、羊水グルコース濃度の測定、羊水白血球エステラーゼの検出、ガス−液体クロマトグラフィーによる細菌性有機酸の検出、様々な羊水サイトカイン(例えば、インターロイキン2、4、6、顆粒球コロニー−刺激因子及び腫瘍壊死因子−α)、マトリクスメタロプロテイナーゼ−9、ラクトフェリンの測定及び超音波検査による胎児活動性の評価(生物物理学的プロファイル)が含まれる。サイトカイン又は他の生化学的因子の測定は費用が嵩み、一般に臨床上利用可能ではなく、主として研究用ツールである。さらに、これらの試験の検査効率は、羊水グラム染色及び培養、羊水グルコース濃度及び羊水白血球エステラーゼの検出などのより簡単に利用可能な古典的試験よりも一貫して優れている訳ではない。これらの試験効率は既に幅広く考察されている。(Ohlsson,A.及びWang,E.:An analysis of antenatal tests to detect infection at preterm rupture of the membranes.American Journal of Obstetrics and Gynecology 162:809,1990)。全て、妥当な感度、特異性及び予測性を有するにもかかわらず、IAIの診断において臨床的特徴から切り離して単独で使用するのに十分な感度又は特異性を有するものはない。
【0009】
従って、IAIの早期及び正確な診断を可能にする新しいアプローチが強く求められている。
【発明の概要】
【0010】
本発明は、妊婦における羊膜内感染(IAI)のリスクの診断及び/又は評価のための試験に関する。本発明は、さらに、羊膜内感染(IAI)の非侵襲性診断のために使用することができるバイオマーカー及びバイオマーカーの群又は組み合わせの特定及び検出ならびに、妊婦における羊膜内感染(IAI)のリスクを診断及び/又は評価するための3種類のタンパク質バイオマーカーの独自の組み合わせの使用に基づく非侵襲性試験を含む、このようなバイオマーカーを使用した診断アッセイに関する。本発明は、全般的に、羊膜内感染の研究室開発テスト(laboratory developed test)及びインビトロ診断機器を作製するために使用される材料及び過程ならびにIAIの診断において臨床的有用性を有するバイオマーカーに関する。特に、本発明は、妊婦から得た頸管膣分泌液(CVF)などの生体試料を分析することによりIAIのリスクを診断するか又は評価するためのインビトロ診断機器を作製するための材料及び過程に関する。特に、本発明は、特に診断アルゴリズムと組み合わせて使用する場合に高精度で非侵襲性の頸管膣スワブに基づく免疫診断テストを用いてIAIの存在を予想することができる、バイオマーカーに関する。診断アルゴリズムと組み合わせて使用する場合、この独自のマーカーの組み合わせにより、高精度で非侵襲性の頸管膣スワブに基づく免疫診断テストを用いてIAIの存在を予想することが可能になる。
【0011】
ある実施態様において、本発明は、妊娠雌哺乳動物対象においてIAIの有無を判定するために、測定し、使用することができるバイオマーカーの新規パネルを提供する。
【0012】
ある態様において、本発明は、(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のレベルに対して、妊娠雌哺乳動物対象から得られた頸管膣分泌液の試料中で該2以上のタンパク質のレベルを測定することと;(b)該レベルが、該正常頸管膣分泌液中のレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中のレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む、妊娠雌哺乳動物対象における羊膜内感染の診断のための方法を提供する。ある実施態様において、対象はヒト患者である。ある種の実施態様において、本発明の方法は、これらのタンパク質の、少なくとも3、少なくとも4、少なくとも5、少なくとも6、少なくとも7、少なくとも8、少なくとも9種類又は全ての存在量を測定することを含む。
【0013】
ある態様において、本発明は、(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の対応するレベルに対して、妊娠雌哺乳動物対象から得られた頸管膣分泌液の試料中で該2以上のタンパク質のレベルを測定することと、(b)該試料中の該2以上のタンパク質のそれぞれの該レベルのそれぞれが、正常頸管膣分泌液中の該タンパク質のそれぞれの対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む、妊娠雌哺乳動物対象における羊膜内感染の診断のための方法を提供する。ある実施態様において、対象はヒト患者である。ある種の実施態様において、本発明の方法は、これらのタンパク質の、少なくとも3、少なくとも4、少なくとも5、少なくとも6、少なくとも7、少なくとも8、少なくとも9種類又は全ての存在量を測定することを含む。
【0014】
ある実施態様において、測定されるバイオマーカーとしては、増殖調節癌遺伝子α(GRO−a)及びマクロファージ炎症性タンパク質1β(MIP1b)が挙げられる。別の実施態様において、測定されるバイオマーカーとしては、増殖調節癌遺伝子α(GRO−a)及びα−1−酸性糖タンパク質(A1AG)が挙げられる。さらに別の実施態様において、測定されるバイオマーカーとしては、α−1−酸性糖タンパク質(A1AG)及びマクロファージ炎症性タンパク質1β(MIP1b)が挙げられる。これらの実施態様において、測定されるさらなるバイオマーカーとしては、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び/又は組織メタロプロテイナーゼ阻害物質−1(TIMP−1)を挙げることができる。さらなる実施態様において、測定されるバイオマーカーとしては、IGF−結合タンパク質−1(IGFBP−1)を挙げることができる。
【0015】
ある種の実施態様において、測定されるバイオマーカーとしては、組織メタロプロテイナーゼ阻害物質−1(TIMP−1)及び増殖調節癌遺伝子α(GRO−a)が挙げられる。ある種の実施態様において、測定されるバイオマーカーとしては、組織メタロプロテイナーゼ阻害物質−1(TIMP1)及びマクロファージ炎症性タンパク質1β(MIP1b)が挙げられる。ある種の実施態様において、測定されるバイオマーカーとしては、組織メタロプロテイナーゼ阻害物質−1(TIMP−1)及びα−1−酸性糖タンパク質(A1AG)が挙げられる。これらの実施態様において、測定されるさらなるバイオマーカーとしては、インターロイキン−6(IL−6)を挙げることができる。
【0016】
ある種の実施態様において、測定されるバイオマーカーとしては、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びマクロファージ炎症性タンパク質1β(MIP1b)が挙げられる。ある種の実施態様において、測定されるバイオマーカーとしては、インターロイキン−6(IL−6)、α−1−酸性糖タンパク質(A1AG)、リポ多糖結合タンパク質(LBP)、増殖調節癌遺伝子α(GRO−a)及びα−胎児性タンパク質(AFP)が挙げられる。
【0017】
ある実施態様において、本発明の方法は、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のレベルを測定することと、2以上の該試験タンパク質が、該頸管膣分泌液中で正常頸管膣分泌液に対する統計学的有意差を示す場合、該対象を羊膜内感染と診断することと、を含む。
【0018】
ある実施態様において、本発明の方法は、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のそれぞれのレベルを測定することと、該被験タンパク質の2以上のそれぞれのレベルが、該頸管膣分泌液試料中で、正常頸管膣分泌液中の対応するタンパク質レベルに対して統計学的有意差を示す場合、該対象を羊膜内感染と診断することと、を含む。
【0019】
ある種の実施態様において、本発明の方法は、前記被験タンパク質の全てのレベルが、該頸管膣分泌液試料において、正常頸管膣分泌液中の該タンパク質の対応するレベルに対して統計学的有意差を示す場合、対象を羊膜内感染と診断することを含む。全ての実施態様において、本明細書中で特定されるタンパク質のレベルは、免疫アッセイにより測定され得る。ある種の実施態様において、本明細書中で特定されるタンパク質のレベルは、タンパク質アレイを用いて測定され得る。ある種の実施態様において、本明細書中で特定されるタンパク質のレベルは、免疫クロマトグラフィー試験装置を用いて測定され得る。免疫クロマトグラフィー試験装置を用いたある種の実施態様において、本明細書中で特定されるタンパク質のレベルは、1以上のクロマトグラフィー試験ストリップを含む免疫クロマトグラフィー試験装置を用いて測定され得る。免疫クロマトグラフィー試験装置を用いたある種の実施態様において、免疫クロマトグラフィー試験装置はラテラルフロー装置である。
【0020】
ある種の実施態様において、本発明は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出ための2以上のクロマトグラフィーストリップを含む免疫クロマトグラフィー試験装置を提供する。ある実施態様において、免疫クロマトグラフィー試験装置は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質に対する抗体を含む試験ストリップを含む。ある実施態様において、免疫クロマトグラフィー試験装置はラテラルフロー装置である。
【0021】
ある種の実施態様において、本発明は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、IGF結合タンパク質−1(IGFBP−1)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される3以上のタンパク質を検出するための3以上のクロマトグラフィーストリップを含む免疫クロマトグラフィー試験装置を提供する。ある実施態様において、免疫クロマトグラフィー試験装置は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、IGF結合タンパク質−1(IGFBP−1)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される3以上のタンパク質に対する抗体を含む試験ストリップを含む。ある実施態様において、免疫クロマトグラフィー試験装置はラテラルフロー装置である。
【0022】
別の態様において、本発明は、(a)妊娠雌哺乳動物対象から頸管膣分泌液の試料を得ることと、(b)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のそれぞれの対応するレベルに対して、該2以上のタンパク質のレベルを決定することと;該2以上のタンパク質のそれぞれの該レベルが、該正常頸管膣分泌液における該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む、妊娠雌哺乳動物対象における羊膜内感染の診断のための方法を提供する。
【0023】
別の態様において、本発明は、
(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のレベルに対して、対象から得られた頸管膣分泌液の試料中で該2以上のタンパク質のレベルを測定することと、
(b)該レベルが、該正常頸管膣分泌液中のレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中のレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む、羊膜内感染を示す徴候及び症状を調べるための方法を提供する。ある種の実施態様において、徴候及び症状としては、母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体及び/又は胎児の頻脈、子宮圧痛及び/又は羊水の悪臭が挙げられるが、これらに限定されない。
【0024】
別の態様において、本発明は、
(a)正常頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の対応するレベルに対して又は羊膜内感染を示すことが分かっている頸管膣分泌液中の該2以上のタンパク質の対応するレベルに対して、対象から得られた頸管膣分泌液の試料中で該2以上のタンパク質のレベルを測定することと、
(b)該試料中の該2以上のタンパク質の該レベルのそれぞれが、該正常頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む、羊膜内感染を示す徴候及び症状を調べるための方法を提供する。ある種の実施態様において、徴候及び症状としては、母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体及び/又は胎児の頻脈、子宮圧痛及び/又は羊水の悪臭が挙げられるが、これらに限定されない。
【0025】
ある態様において、本発明は、
(a)妊娠雌哺乳動物対象から得られる頸管膣分泌液の試料において、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)のレベルを試験することと;
(b)該試料中のAFP、IL−6及びIGFBP−1の該レベルのそれぞれが、正常頸管膣分泌液中のAFP、IL−6及びIGFBP−1の対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている頸管膣分泌液中のAFP、IL−6及びIGFBP−1のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む、妊娠雌哺乳動物対象における羊膜内感染の診断のための方法に関する。
【0026】
ある実施態様において、対象はヒト患者である。
【0027】
別の実施態様において、タンパク質のレベルを測定するために構成される装置を用いて検査が実施される。
【0028】
さらに別の実施態様において、適切なプロセッサにより実行されるソフトウェアプログラムを用いることによって検査が行われる。
【0029】
さらなる実施態様において、このプログラムは、有形の物理媒体に格納されるソフトウェアに統合される。
【0030】
またさらなる実施態様において、この有形の物理媒体は、フラッシュドライブ、CD−ROM、フロッピーディスク、ハードドライブ、DVD及びプロセッサに伴うメモリからなる群から選択される。
【0031】
異なる実施態様において、本方法は、上記の検査又は診断の結果を記録するレポートを準備する段階をさらに含み、このレポートは、紙、フラッシュドライブ、CD−ROM、フロッピーディスク、ハードドライブ、DVD又はプロセッサに伴うメモリなどの有形の物理媒体に記録又は格納され得る。
【0032】
別の実施態様において、本方法は、患者又はその担当医などの関係者に上記の診断の結果を伝達する段階をさらに含む。様々な実施態様において、伝達は、書面で、eメールにより又は電話により行われる。
【0033】
さらに別の実施態様において、タンパク質レベルは免疫アッセイにより測定される。
【0034】
さらなる実施態様において、タンパク質レベルは、ラテラルフロー装置を使用し得る免疫クロマトグラフィー試験により測定される。
【0035】
またさらなる実施態様において、タンパク質レベルは、質量分析によって又はタンパク質アレイを使用することによって測定される。
【0036】
別の態様において、本発明は、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)検出のための抗体及び試薬を含む免疫アッセイキットに関する。
【0037】
また別の態様において、本発明は、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)の検出のための1以上のクロマトグラフィーストリップを含む免疫クロマトグラフィー試験装置に関する。
【0038】
ある実施態様において、免疫クロマトグラフィー試験装置において、試験ストリップは、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)に対する抗体を含む。
【0039】
別の実施態様において、本免疫クロマトグラフィー試験装置はラテラルフロー装置である。
【0040】
さらなる態様において、本発明は、
(a)前記対象から得られる頸管膣分泌液の試料中で、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)のレベルを試験することと;
(b)該レベルが、正常頸管膣分泌液中のレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている頸管膣分泌液中のレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む試験の結果及び/又は試験に基づく診断を含むレポートに関する。
【0041】
さらなる態様において、本発明は、
(a)前記対象から得られる頸管膣分泌液の試料中で、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)のレベルを試験することと;
(b)AFP、IL−6及びIGFBP−1の該レベルのそれぞれが、正常頸管膣分泌液中のAFP、IL−6及びIGFBP−1の対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている頸管膣分泌液中のAFP、IL−6及びIGFBP−1の対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、
を含む、試験の結果及び/又は試験に基づく診断を含むレポートに関する。
【0042】
またさらなる態様において、本発明は、
(a)前記対象から得られる頸管膣分泌液の試料中で、α−胎児性タンパク質、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)のレベルを試験することと;
(b)該レベルが正常頸管膣分泌液中のレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている頸管膣分泌液中のレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、
を含む、試験の結果及び/又は試験に基づく診断を格納する有形の物理媒体に関する。
【0043】
ある種の実施態様において、前記のタンパク質のレベルを測定するように構成される装置を用いて測定が実行される。別の実施態様において、適切なプロセッサにより実行されるソフトウェアプログラムを使用することによって測定が行われる。ある種の実施態様において、有形の物理媒体に格納されるソフトウェアにプログラムが組み入れられる。ある種の他の実施態様において、有形の物理媒体は、CD−ROM、フロッピーディスク、ハードドライブ、DVD及びプロセッサに伴うメモリからなる群から選択される。
【0044】
ある種の実施態様において、本発明の方法は、検査又は診断の結果を記録するレポートを準備する段階をさらに含む。ある実施態様において、このレポートは、有形の物理媒体に記録又は格納される。具体的な実施態様において、有形の物理媒体は紙である。別の実施態様において、有形の物理媒体は、CD−ROM、フロッピーディスク、ハードドライブ、DVD及びプロセッサに伴うメモリからなる群から選択される。
【0045】
ある種の他の実施態様において、本発明の方法は、関係者に上記の診断の結果を伝達する段階をさらに含む。ある実施態様において、関係者とは患者又はその担当医である。別の実施態様において、伝達は、書面で、eメールによって又は電話によって行われる。
【0046】
別の態様において、本発明は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための抗体及び試薬を含む免疫アッセイキットを提供する。ある実施態様において、本免疫アッセイキットは、本明細書中で特定される全タンパク質の検出のための、抗体及び試薬を含む。
【0047】
別の態様において、本発明は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、IGF結合タンパク質−1(IGFBP−1)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための抗体及び試薬を含む免疫アッセイキットを提供する。ある実施態様において、本免疫アッセイキットは、本明細書中で特定される全タンパク質の検出のための、抗体及び試薬を含む。
【0048】
また別の態様において、本発明は、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための抗体及び試薬を含む免疫アッセイキットを提供する。
【0049】
さらに別の態様において、本発明は、(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のレベルに対して、前記対象から得られる頸管膣分泌液の試料中で該レベルを測定することと、(b)該レベルが、該正常頸管膣分泌液中のレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中のレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む試験の結果及び/又は試験に基づく診断を含むレポートを提供する。
【0050】
別の態様において、本発明は、(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のレベルに対して、前記対象から得られる頸管膣分泌液の試料中で該レベルを測定することと;(b)該レベルが、該正常頸管膣分泌液中のレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中のレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、を含む試験の結果及び/又は試験に基づく診断を格納する有形の物理媒体を提供する。
【図面の簡単な説明】
【0051】
【図1】IAI感染(n=14)対非感染患者(n=95)における、GROαの自然対数値(アッセイ1)を示す箱ひげ図を示す。
【図2】IAI感染(n=14)対非感染患者(n=95)におけるMIP1bの自然対数値を示す箱ひげ図を示す。
【図3】IAI感染(n=14)対非感染患者(n=95)における、MCP−1の自然対数値を示す箱ひげ図を示す。
【図4】IAI感染(n=14)対非感染患者(n=95)における、B2MGの自然対数値を示す箱ひげ図を示す。
【図5】IAI感染(n=14)対非感染患者(n=95)における、TIMP−1の自然対数値を示す箱ひげ図を示す。
【図6】IAI感染(n=14)対非感染患者(n=95)における、A1AGの自然対数値を示す箱ひげ図を示す。
【図7】IAI感染(n=14)対非感染患者(n=95)における、IL−6の自然対数値を示す箱ひげ図を示す。
【図8】IAI感染(n=14)対非感染患者(n=95)における、LBPの自然対数値を示す。
【図9】IAI感染(n=14)対非感染患者(n=95)における、AFPの自然対数値を示す箱ひげ図を示す。
【図10】IAI感染(n=14)対非感染患者(n=95)における、VCAM−1の自然対数値を示す箱ひげ図を示す。
【図11】IAI対非IAIの予測に対する3マーカーモデルのAUROCを示す。感度は86%であり、特異性は85%である。
【図12】IAI対非IAIの予測に対する5マーカーモデルのAUROCを示す。感度はx%であり、特異性はy%である。
【図13】0又は1の複合(composite)IAI状態に対するバイオマーカーZスコアレベルを示す。
【図14】AUROCが0.86である、感度対1−特異性としてプロットされる、図13で示されるデータを示す。感度は82%であり、特異性は85%であり、PPVは33%及びNPVは98%であった。
【図15】CVF状態及びAF感染状態による、出産までの時間を示すカプラン−マイヤーグラフを示す。
【図16】0又は1の複合IAI状態に対するバイオマーカーZスコアレベルを示す。
【図17】AUROCが0.88である、感度対1−特異性としてプロットされる、図16で示されるデータを示す。感度は82%であり、特異性は89%であり、PPVは41%及びNPVは98%であった。
【発明を実施するための形態】
【0052】
定義
本発明は、特定の実施態様に限定されず、当然ではあるが変化し得ることを理解されたい。また、本明細書中で使用される用語は、ただ特定の実施態様を説明することを目的とするものであり、限定するものではないことも理解されたい。本願および添付の特許請求の範囲で使用される場合、「a」、「an」及び「the」という単数及び単数形の語は、例えば、場合によっては、別段の断りがない限り、複数の指示対象を含む。従って、例えば、「プローブ」への言及は、場合によっては複数のプローブ分子を含み;同様に、内容によっては、「核酸」という用語の使用は、場合によっては、実際問題として、多くの複製のその核酸分子を含む。遺伝子又はタンパク質に対する文字表記は、内容に応じて、遺伝子形態及び/又はタンパク質形態を指し得る。当業者は、本明細書中の配列、既知の配列及び遺伝コードに言及することによって、関連生体分子の核酸及びアミノ酸形態を完全に説明し得る。
【0053】
別段の断りがない限り、本明細書中で使用される技術及び科学用語は、本発明が属する技術分野の通常の技術者により一般に理解されるものと同じ意味を有する。Singletonら、Dictionary of Microbiology and Molecular Biology 第2版、J.Wiley & Sons(New York、N.Y.1994)は、当業者に対して本願で使用される用語の多くに対する指針を与える。
【0054】
「対応する」及び「対応すること」という用語及び文法的な同等物は、類似物又は類似物質を指すために本明細書中で使用され;例えば、タンパク質の2つの混合物に言及する場合、第一の混合物中のタンパク質Aは、第二の混合物中のタンパク質Aに対応するか又は第二の混合物中のタンパク質Aの対応するタンパク質であり;第一の混合物中のタンパク質Bは、第二の混合物中のタンパク質Bに対応するか又は第二の混合物中のタンパク質Bの対応するタンパク質である。
【0055】
「プロテオーム」という用語は、ある時間での生体試料中のタンパク質の大部分を叙述するために本明細書中で使用される。プロテオームの概念はゲノムとは基本的に異なる。ゲノムが実際上静的である一方で、プロテオームは内部及び外部事象に反応して継続的に変化する。
【0056】
「プロテオミックプロファイル」という用語は、ある時間における、生体試料中、例えば体液中の複数のタンパク質の発現パターンの表現に言及するために使用される。プロテオミックプロファイルは例えば質量スペクトルとして表すことができるが、タンパク質の何れかの物理化学的又は生化学的特性に基づく他の表現法も含まれる。従って、プロテオミックプロファイルは、例えば、二次元ゲル電気泳動により、例えば2−D PAGEにより調べた場合の、タンパク質の電気泳動的特性の差に基づき得、例えば二次元電気泳動ゲルにおける複数のスポットとして表され得る。差次的発現プロファイルは、具体的に特定されるタンパク質が存在しなくても重要な診断値を有し得る。例えばタンパク質マイクロアレイを用いて複数のスポット又はタンパク質を免疫ブロッティングすることによって、1個のタンパク質スポットを検出することができる。プロテオミックプロファイルは、一般に、数ピークから、50以上のピークに相当する複合プロファイルに至る範囲であり得る情報を表すか又はこのような情報を含有する。従って、例えば、プロテオミックプロファイルは、少なくとも2又は少なくとも5又は少なくとも10又は少なくとも15又は少なくとも20又は少なくとも25又は少なくとも30又は少なくとも35又は少なくとも40又は少なくとも45又は少なくとも50又は少なくとも60又は少なくとも65又は少なくとも70又は少なくとも75又は少なくとも80又は少なくとも85又は少なくとも85又は少なくとも90又は少なくとも95又は少なくとも100又は少なくとも125又は少なくとも150又は少なくとも175又は少なくとも200種類のタンパク質を含有し得るか又はこれらを表し得る。
【0057】
「病的状態」という用語は、最も広義で使用され、対象の健康を危うくする全ての変化及び現象に及ぶ。病的な母体の状態としては、羊膜内感染、例えば子癇前症などの胎児又は母体起源の状態ならびに早期陣痛及び早産が挙げられるが、これらに限定されない。病的な胎児の状態としては、ダウン症などの染色体異常(異数性)及び在胎期間及び胎児の成熟の全ての異常が挙げられるが、これらに限定されない。
【0058】
「病的[母体又は胎児の]状態の状況」という用語は、最も広い意味で本明細書中で使用され、病的状態の、欠如、存在、程度、段階、性質、進行又は軽減を指す。
【0059】
「独自の発現特性」という用語は、対応する正常生体試料(同じタイプの採取源、例えば体液から得られる。)のプロテオミックプロファイルとは統計学的に有意に異なる生体試料(例えば参照試料)のプロテオミックプロファイル内の独自の特性又はモチーフを説明するために使用される。
【0060】
「羊膜内感染(IAI)」、「羊水感染」、「羊膜炎」及び「臨床的絨毛羊膜炎」というう用語は交換可能に使用され、妊娠中の羊水及び子宮内の内容物の細菌性を含むがそれらに限定されない、急性感染を指す。
【0061】
(1)病的状態の進行の少なくともある程度の抑制、(2)病的状態の予防、(3)病的状態に関与する1以上の症状の少なくともある程度の緩和;(4)治療後の生存期間延長;及び/又は(5)治療後のある時点での死亡率低下を含むがこれらに限定されない、患者に対する利益を示す何らかの評価項目を使用して、「患者反応」を評価することができる。
【0062】
「治療」という用語は、治療処置及び予防又は防止対策の両方を指し、標的とする病的状態又は障害を予防するか又はその進行を鈍化させる(軽減する)ことを目的とする。治療を必要とする者としては、障害が既にある者ならびに障害を有しやすい者又は障害を予防すべき者が挙げられる。
【0063】
「先天性奇形」は、非遺伝的であるが出生時に存在する異常である。
【0064】
何らかの特定のタンパク質の指定には、本明細書中で使用される場合、他の種における(全ての天然変異体を含む)天然配列ホモログに加えて、全ての断片、前駆体及び天然の変異体、例えば、あるいはスプライシングを受けている及び対立遺伝子の変異体及びアイソフォーム、ならびに指定のタンパク質の可溶性形態が含まれる。従って、例えば、マクロファージ炎症性タンパク質1β(Swiss−Prot Acc.No.P13236)の存在量を試験することに言及する場合、この記述は、具体的に、Swiss−Prot Acc.No.13236という名目で記載されるタンパク質の、何らかの断片、前駆体又は天然の変異体ならびに、対象が非ヒトである場合、その非ヒトホモログ及びその天然の変異体を試験することを含む。
【0065】
詳細な説明
本発明は、母親又は胎児の体液のプロテオミックプロファイルに基づく、母体及び胎児の状態の早期の信頼性が高く非侵襲性の検査に対する方法及び手段に関する。特に、本発明は、IAI患者及び対照対象の試料中で差別的に存在するタンパク質マーカーの発見及びIAIの有無を判定するための方法及びキットにおけるこの発見の適用に基づく。これらのタンパク質マーカーは、IAI患者からの試料中で、IAIではない患者由来の試料中のレベルとは異なるレベルで見出される。従って、対照と比較した、試験試料中で見出される2以上のマーカーの量又は試験試料中の2以上のマーカーの有無から、患者のIAIの状況に関する有用な情報が提供される。
【0066】
本発明は、母親又は胎児の体液のプロテオミックプロファイルに基づく、母体及び胎児の状態の早期の信頼性が高く非侵襲性の検査のための方法及び手段にも関する。特に本発明は、妊婦又は胎児から得た体液、例えば頸管膣分泌液(CVF)中の、α−胎児性タンパク質(α−胎児性タンパク質)、インターロイキン−6(IL−6)及びインスリン増殖因子結合タンパク質−1(IGFBP−1)を測定することによる、IAIに対する早期の信頼性が高い検出のための診断及び予後診断試験を提供する。
【0067】
本発明はさらに、対象の徴候及び症状、例えば母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体又は胎児の頻脈、子宮圧痛又は羊水の悪臭を診断アルゴリズムに組み込むことがIAIの有無の判定に有用である、という発見に基づく。
【0068】
本発明は、例えば次の教科書(その内容は参照により本明細書によって明確に組み込まれる。):Proteome Research:New Frontiers in Functional Genomics(Principles and Practice),M.R.Wilkinsら編、Springer Verlag,1007;2−D Proteome Analysis Protocols,Andrew L Link,editor,Humana Press,1999;Proteome Research:Two−Dimensional Gel Electrophoresis and Identification Methods(Principles and Practice),T.Rabilloud editor,Springer Verlag,2000;Proteome Research:Mass Spectrometry(Principles and Practice),P.James editor,Springer Verlag,2001;Introduction to Proteomics,D.C.Liebler editor,Humana Press,2002;Proteomics in Practice:A Laboratory Manual of Proteome Analysis,R.Westermeierら編、John Wiley & Sons,2002に記載のような当技術分野で周知のプロテオミクス技術を利用する。
【0069】
当業者にとって当然のことながら、本発明の実施に際して、本明細書中に記載のものと同様又は同等である多くの方法及び材料を使用し得る。実際に、本発明は、記載の方法及び材料に何ら限定されない。
【0070】
1.体液で発現されるタンパク質及びポリペプチドの同定
本発明に従い、当技術分野で公知の様々な方法を使用して、体液のプロテオミクス分析を行うことができる。体液としては、例えば、頸管膣分泌液(CVF)、臍帯血、新生児血清、脳脊髄液(CSF)、羊水、血清、血漿、尿、脳脊髄液、母乳、粘液、唾液及び汗が挙げられる。
【0071】
主として、疾患において上方制御又は下方制御される検出タンパク質を検出するために、正常体液(正常試料)及び試験体液(試験試料)など、様々な起源由来の試料のタンパク質パターン(プロテオームマップ)を比較する。次いで、例えば免疫アッセイ、ペプチド−質量フィンガープリント法及び/又は質量分析及び配列決定法を用いて、これらのタンパク質を同定及び詳細に特性評価するために切り出すことができるか又は、関心のある疾患の診断のためにもしくは疾患の有無を確認するために、正常及び/又は疾患−特異的なプロテオームマップを直接使用することができる。
【0072】
比較分析において、タンパク質の相対レベル又は存在量を正確に表し、正確な結果を得るために、正常及び試験試料を完全に同じように処理することが重要である。総タンパク質の必要量は、使用する分析技術に依存し、当業者により容易に決定することができる。生体試料中に存在するタンパク質は、一般にそれらのpI及び分子量に従い、二次元ゲル電気泳動(2−DE)により分離される。等電点(一次元ゲル電気泳動)を用いて、タンパク質を最初にそれらの電荷によって分離する。この段階は、例えば、市販の固定化pH勾配(IPG)ストリップを用いて行うことができる。第二次元は通常のSDS−PAGE分析であり、ここでは等電点で分離済みのIPGストリップを試料として使用する。2−DE分離後、クーマシーブルー又は銀染色などの従来からの色素を用いてタンパク質を可視化し、公知の技術及び例えばBio−Rad 10GS800密度計及びPDQUESTソフトウェア(両者とも市販されている。)などの機器を用いて画像化することができる。
【0073】
次に、個々のスポットをゲルから切り出し、脱色して、トリプシン消化する。質量分析(MS)によってペプチド混合物を分析することができる。あるいは、例えばキャピラリー高圧液体クロマトグラフィー(HPLC)によりペプチドを分離することができ、個々に又はプール中の何れかでMSにより分析することができる。
【0074】
質量分析器は、イオン源、質量分析器、イオン検出器及びデータ収集ユニットから構成される。まず、イオン源においてペプチドをイオン化する。次いで、質量分析器においてそれらの質量電荷比に従い、イオン化ペプチドを分離し、分離イオンを検出する。質量分析は、特にマトリックス支援レーザー脱離イオン化/飛行時間型質量分析(MALDI−TOF)及びエレクトロスプレーイオン化(ESI)法の発明以来、タンパク質分析において広く使用されている。例えば、MALDI−TOF及び三重又は四重極型−TOF又はESIと組み合わせたイオントラップ質量分析計を含め、質量分析器にはいくつかの種類がある。このようにして、例えば、Q−Tof−2質量分析器は、全質量スペクトル範囲にわたりイオンを同時検出できる直交飛行時間分析装置を使用する。さらなる詳細については、例えばChemusevichら、J.Mass Spectrom.36:849−865(2001)を参照のこと。必要に応じて、質量分析又はエドマン分解のある種の改変法など、当技術分野で公知の技術によって、ペプチド断片及びそれらが由来するタンパク質全長のアミノ酸配列を調べることができる。
【0075】
2.羊膜内感染及び関連合併症の早期検出
羊膜内感染(IAI)は、妊娠中の羊水及び子宮内の内容物の急性細菌感染である。前向き研究から、全出産の4%から10%でIAIが発症することが示されている(Newton,E.R.,Prihoda,T.J.及びGibbs,R.S.:Logistic regression analysis of risk factors for intra−amniotic infection.Obstet.Gynecol.73:571,1989;Soper,D.E.,Mayhall,C.G.及びDalton,H.P.:Risk factors for intraamniotic infection:a prospective epidemicologic study.American Journal of Obstetrics and Gynecology 161:562,1989;及びLopez−Zeno,J.A.,Peaceman,A.M.,Adashek,J.A.及びSocol,M.L.:A controlled trial of a program for the active management of labor.N.Engl.J.Med.326:450,1992)。IAIを説明するために使用される他の用語としては、羊水感染、羊膜炎及び臨床的絨毛羊膜炎が挙げられる。羊膜内感染は、母体発熱、子宮圧痛、白血球増加及び胎児の頻脈によって臨床的に診断され、組織学的絨毛羊膜炎とは区別されるべきである。羊膜内感染は母体及び新生児死亡例の重要な原因である。羊膜内感染は周産期における発熱発症例の10−40%を占め、早期新生児敗血症及び肺炎例の20−40%に関与する(Newton,E.R.:Chorioamnionitis and intraamniotic infection.Clin.Obstet.Gynecol.36:795、1993)。母体の菌血症はIAI患者の2−6%で発症し、分娩後の感染死亡率が上昇する。IAI患者では機能障害分娩及び帝王切開出産のリスクも上昇する。Duffらは、分娩中に羊膜内感染を発症した患者のうち、75%で機能障害分娩が起こり、34%が帝王切開出産となったことを報告した(Duff,P.,Sanders,R.及びGibbs,R.S.:The course of labor in term pregnancies with chorioamnionitis.American Journal of Obstetrics and Gynecology 147:391、1983)。羊膜内感染はまた、特に早期新生児において、新生児有病率及び死亡率の上昇にも関与する。一般に、IAIである母親から出生した低出生体重児では、周産期死亡率が3倍から4倍上昇する(Gibbs,R.S.,Castillo,M.A.及びRodgers,P.J.:Management of Acute Chorioamnionitis.American Journal of Obstetrics and Gynecology 136:709,1980;Gilstrap,L.C.,III,Leveno,K.J.,Cox,S.M.,Burris,J.S.,Mashburn,M.及びRosenfeld,C.R.:Intrapartum treatment of acute chorioamnionitis: impact on neonatal sepsis.Am.J.Obstet.Gynecol.159:579,1988)。呼吸窮迫症候群、脳室内出血及び新生児敗血症も増加する(Morales,W.J.:The effect of chorioamnionitis on the developmental outcome of preterm infants at one year.Obstetrics and Gynecology 70:183、1987)。最近、IAIは新生児の脳室周囲白質軟化症及び脳性麻痺とも関連付けられており;大脳白質損傷及び脳性麻痺のリスクは、羊膜内感染の場合では9倍高い(Bejar,R.,Wozniak,P.,Allard,M.,Benirschke,K.,Vaucher,Y.,Coen,R.,Berry,C.、Schragg,P.,Villegas,I.及びResnik,R.:Antenatal origin of neurologic damage in newborn infants.I.Preterm infants.Am.J.Obstet.Gynecol.159:357,1988;Grether,J.K.及びNelson,K.B.:Maternal infection and cerebral palsy in infants of normal birth weight.JAMA 278:207,1997)。最後に、亜臨床的IAIは、胎膜が完全である早期陣痛において少なくとも10%の女性で認められており、このことから、IAIが、未熟児の重要かつおそらくは予防可能な原因であることが示唆される(Romero,R.,Avila,C.,Brekus,C.A.及びMorotti,R.:The role of systemic and intrauterine infection in preterm parturition.Annuals of the New York Academy of Sciences 622:355,1991)。Newtonによる文献レビューにおいて、臨床的IAIの発症率は、妊娠27週未満で41%、妊娠27−37週で15%及び妊娠38週以上では2%であることが明らかになった(Newtonら、上出)。胎膜が完全であり羊膜内感染の臨床兆候がなく早期陣痛が起こった全女性の10−20%の羊水から(Romeroら、上出)、及び23−24週で妊娠終了となった早期陣痛女性の最大67%で、下部生殖管に対する常在細菌も回収された(Watts、D.H.,Krohn,M.A.、Hillier,S.L.及びEschenbach,D.A.:The association of occult amniotic fluid infection with gestational age and neonatal outcome among women in preterm labor.Obstet Gynecol 79:351,1992)。これらの患者のうち殆どが迅速にに出産に至り、多くにおいて臨床的に明白なIAIが発現する。これらの知見から、最初に亜臨床的子宮内感染の上行が早期陣痛に先行し、超早産の重要な原因となり得るという仮説が支持される。
【0076】
早産は、妊娠満37週になる前の出生として定義される。米国における早産の発生率は、全生児出生の10−11%であり、早期陣痛の積極的治療にもかかわらず増加している。全体に、未熟児及びその事象は、先天性奇形によるものではない周産期死亡の80%に関与し、国家のヘルスケア予算に対して毎年およそ50億ドルの負担を課している。早産に対するリスク因子としては、非白人種、若年層、社会経済的地位の低さ、母体の体重が55kgを下回ること、未経産、妊娠第1三半期の出血、多胎妊娠が挙げられる(Meis P J,Michielutte R,Peters TJら、Factors associated with preterm birth in Cardiff,Wales:II.Indicated and spontaneous preterm birth.Am J Obstet Gynecol 173:597−602,1995)。
【0077】
残念ながら、自然早産に対するリスクがある患者の予測は、全般的に期待を裏切るものであった(Creasy RK,Iams JD.Preterm labor and delivery.In Maternal−Fetal Medicine,Creasy RK,Resnik R(編).W.B.Saunders Company,Philadelphia,Pa.第4版,1999.498−531ページ)。早産リスクが最大である集団を特定し、それにより早期介入を行って利益を得られる可能性があるという以前の試みには、リスク採点指標、子宮頸管の胎児フィブロネクチンの生化学的検出、子宮頸管長の超音波測定及び家庭での子宮活動の監視が含まれていた。これらのプログラムは、費用が嵩み、かつ、どの患者が早期介入又は予防から利益を得ることができるかを正確に予測することが不可能であることが障壁となっている。全て、陽性適中率がおよそ30%と不良であり、殆どの患者が、満期分娩時に「リスクあり」と判定される。子宮収縮を抑制するための薬物治療を含む介入は有効ではあるが、早期陣痛を早期に高い信頼性で診断することに依存する。従って、早産が関与する多大な費用及び新生児死亡率及び有病率を低下させるためには、早産リスクが最大である患者を特定するための早期の信頼性が高いマーカーが必要である。
【0078】
3.体液中のバイオマーカーを用いた羊膜内感染の早期検出及び診断
A)本発明は、例えば、頸管膣分泌液(CVF)、羊水、血清、血漿、尿、脳脊髄液、母乳、粘液又は唾液などの体液のプロテオミック分析による、羊膜内感染の診断のための、早期の信頼性が高い非侵襲性の方法を提供する。ある実施態様において、本発明は、免疫アッセイ又は免疫アッセイパネルによる羊膜内感染の診断のための早期の信頼性が高い非侵襲性の方法を提供する。ある実施態様において、本発明は、CVFのプロテオミック分析による羊膜内感染の診断のための早期の信頼性が高い非侵襲性の方法を提供する。
【0079】
非限定例として、本発明は、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される1以上のタンパク質の1つのレベル又は量を、妊婦対象から得られた母体頸管膣分泌液試料において試験することを含む、妊婦対象における羊膜内感染の診断のための方法を提供する。羊膜内感染の診断は、IAIがない対照検体に対する、IAI陽性と判定される患者検体中の上述のタンパク質のレベル、量又は存在量の統計学的有意差に基づき得る。ある種の実施態様において、対象の徴候及び症状を診断アルゴリズムに組み込むことによって、羊膜内感染の診断が促進され得る。例えば、母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体及び/又は胎児の頻脈、子宮圧痛及び/又は羊水の悪臭を含むがこれらに限定されない、徴候及び症状の組み込みが、本診断アルゴリズムに含まれ得る。
表1:IAIに対するバイオマーカー

【0080】
上述のように、本発明の内容において、「プロテオミックプロファイル」という用語は、ある時間における、生体試料、例えば体液中の複数のタンパク質の発現パターンの表現に言及するために使用される。プロテオミックプロファイルは、例えば免疫アッセイ結果のパネルとして表すことができるが、タンパク質の何れかの物理化学的又は生化学的特性に基づく他の表現法も含まれる。体液のプロテオームに存在するタンパク質の全て又は一部を同定し、配列決定することは可能であるが、これは、本発明に従い作成されるプロテオミックプロファイルの診断用途に必要ではない。特定の疾患の診断は、正常プロテオミックプロファイルと、診断しようとする疾患又は病的状態が存在する場合の、同じ状況下で得られる同じ体液のプロテオミックプロファイルとの間の特徴的な差異(独自の発現特性)に基づき得る。独自の発現特性は、同じタイプの採取源から得られる対応する正常生体試料のプロテオミックプロファイルとは統計学的に有意に異なる、試験生体試料又は参照生体試料のプロテオミックプロファイル内の何らかの独自の特性又はモチーフであり得る。哺乳動物対象から得られる試験試料のプロテオミックプロファイルを病的な母体又は胎児状態の独自の発現特性の特徴を含む参照試料のプロテオミックプロファイルと比較した際に、参照試料と共通する独自の発現特性を有する場合、哺乳動物対象はこのような病的状態であると診断される。
【0081】
診断しようとする対象から得られる体液のプロテオミックプロファイルを、同じように得られ、処理された同じ種類の正常体液のプロテオミックプロファイルと比較することによって、特定の病的な母体/胎児の状態を診断することができる。試験試料のプロテオミックプロファイルが正常試料のプロテオミックプロファイルと基本的に同じである場合、対象は、対象となる病的な母体/胎児の状態がないとみなされる。正常試料のプロテオミックプロファイルに対して、試験試料のプロテオミックプロファイルが独自の発現特性を示す場合、対象は問題となっている母体/胎児の状態があると診断される。
【0082】
あるいは又はさらに、試験試料のプロテオミックプロファイルを、問題となっている病的な母体/胎児状態があると独立して診断された対象の体液から得られた参照試料のプロテオミックプロファイルと比較し得る。この場合、試験試料のプロテオミックプロファイルが、独自の発現特性を示す少なくとも1つの特性又は特性の組み合わせを参照試料のプロテオミックプロファイルと共有する場合、対象は、病的状態があると診断される。
【0083】
本発明の方法において、正常生体試料のプロテオミックプロファイルは、重要な診断の役割を果たす。上で考察されるように、試験試料のプロテオミックプロファイルが正常生体試料のプロテオミックプロファイルと基本的に同じである場合、患者は、特定しようとする病的な母体/胎児状態がないと診断される。副作用を起こす可能性があり得るか又は患者、胎児もしくは新生児を危険にさらし得る、不必要な治療又は介入を患者に対して行わなくてもよくなるため、この「陰性」診断は非常に意味がある。差が統計学的に有意であるか否かを判定するためにデータを解析する。
【0084】
下記の実施例で詳述する結果は、頸管膣分泌液(CVF)の正常プロテオミックプロファイルとは統計学的に有意に異なる羊膜内感染(IAI)のプロテオミックプロファイルの特徴を与える。さらに、本実施例は、IAIの発現マーカー及び独自の発現特性の特徴を与える。
【0085】
本発明の非侵襲性の診断方法を行うために特に有利な体液は、頸管膣分泌液(CVF)である。CVFは、水、電解質、低分子量有機化合物(グルコース、アミノ酸及び脂質)、細胞(白血球、リンパ球及び上皮細胞)及び子宮頸部により主に合成される多数のタンパク質及びタンパク質分解酵素からなる複合体液である。(Blandauら、The Biology of the Cervix.University of Chicago Press:Chicago,1973;p xi,450p)。CVFはまた、ムチン、デフェンシン、補体因子、免疫グロブリン、ラクトフェリン及びコレクチンを含む膣細胞からの分泌物も含有する(Blandauら、上出)。CVFは、膣、頸管及び子宮領域を含め、女性生殖管全体を流れ、円滑化する。CVFは、外来病原体に対する防御の最前線を形成し、生殖能力を示すものであり、授精、妊娠及び陣痛を促進する(Blandauら、上出;Bigelow,J.L.ら、Hum Reprod 2004,19,(4),889−92)。CVFはまた、ラクトバチルス・クリスパータス(Lactobacilli crispatus)及びラクトバチルス・バギナリス(Lactobacilli vaginalis)などの微生物叢も含有する。この微生物叢からの分泌液はCVFのpHを低下させ、これによりその抗病原体活性が促進される(Blandauら、上出)。膣の微生物叢における何らかの不均衡又は外部微生物叢の侵入の結果、細菌性膣症となる。細菌性膣症に反応して、頸管及び膣内上皮によるIL−1a、IL−1f3、IL−10、IL−8及びTNF−ctなどのいくつかのサイトカインのCVFへの分泌が変化する。(Mattsby−Baltzer,Iら、Acta Obstet Gynecol Scand 1998,77,(7),701−6;Eschenbach,D.A.ら、J Clin Microbiol 1989,27,(2)、251−6)。細菌性膣症の阻止不良は子宮頸癌(Mikamo,Hら、J Infect Chemother 1999,5,(2),82−85)、骨盤内炎症性疾患(Ness,R.B.ら、Am J Epidemiol 2005,162,(6),585−90.)、子宮内膜炎(Haggerty,C.L.ら、Clin Infect Dis 2004,39,(7),990−5;Morris,M.ら、Bjog 2001,108,(5)、439−50)及び卵管性不妊(Morrisら、上出)と正の相関が認められている。妊婦における細菌性膣症は、早期陣痛及び早産のリスク上昇と相関が認められている(Gravett,M.G.ら、Jama 1986,256,(14),1899−903)。
【0086】
CVFに存在するサイトカイン及び他の防御分子はまた、膣におけるHIVなどの性感染性免疫不全ウイルス及び単純ヘルペスウイルス(HSV)の感染、複製及び増殖においても重要な役割を果たす(Poli,G.ら、AIDS Res Hum Retroviruses 1992,8,(2),191−7;Zara,F.ら、Sex Transm Infect 2004,80,(2),108−12;John,M.ら、J Infect Dis 2005,192,(10),1731−40)。CVFの陽イオン性ポリペプチド断片の分析により、抗HIV活性に関与する20種類のポリペプチドが同定されている(Venkataraman,N.ら、J Immunol 2005,175,(11)、7560−7)。以前の研究においても、HIVビリオンを捕捉する際の、従って感染を防御する際の、CVFについての役割が特定されている(Maher,D.ら、Proc Natl Acad Sci USA 2005,102,(32),11504−9;Quinones−Mateu,M.Eら、Aids 2003,17,(16),F39−48)。最近の研究から、CVF中の一部の免疫応答分子と、早産に至る亜臨床的前期破水(PROM)の発生率との間の相関が検出されている(Helmig,B.R.ら、J Matern Fetal Neonatal Med 2002,12,(4),237−46;Ogino,M.ら、J Obstet Gynaecol Res 2005,31,(5),421−6)。妊娠中、CVFは、絨毛−脱落膜接触面の破壊又は同時分泌の何れかによる、子宮由来の羊水(AF)を含有し得る。このCVFへのAFの「漏出」は、女性において早産を予測するために使用されてきた胎児フィブロネクチンの存在についての現在の非侵襲性診断に対する基礎となっている(Swamy,G.K.ら、J Reprod Med 2005,50,(11),851−6)。
【0087】
CVFは、その回収方法が、AFの回収方法、即ち羊水穿刺に比べて非常に侵襲性の小さいものであるため、妊婦において母体及び胎児の健康状態を監視するための重要な診断部位の候補である。本明細書中で特定されるバイオマーカー及びバイオマーカー群又はそれらの組み合わせは、妊婦対象における羊膜内感染の信頼性の高い検出における有益な診断ツールを提供する。
【0088】
プロテオミックプロファイルを比較するための統計学的方法は当技術分野で周知である。例えば、免疫アッセイによって、一連のバイオマーカーに対するタンパク質発現レベルを定量することができる。適切なアルゴリズムを用いて、試験試料のプロテオミックプロファイル(パターン)を参照又は正常試料のプロテオミックプロファイル(パターン)と照合することによって、2種類のプロファイルの特徴的な発現特性又は実質的な同一性の有無を判定することができる。プロテオミックパターンを分析するための統計学的方法は、例えば、Petricoin IIIら、The Lancet 359:572−77(2002).;Issaqら、Biochem Biophys Commun 292:587−92(2002);Ballら、Bioinformatics 18:395−404(2002);及びLiら、Clinical Chemistry Journal,48:1296−1304(2002)において開示されている。
【0089】
(B)本発明は、例えば、頸管膣分泌液(CVF)、羊水、血清、血漿、尿、脳脊髄液、母乳、粘液又は唾液などの体液のプロテオミック分析による、羊膜内感染の診断のための早期の信頼性が高い非侵襲性の方法を提供する。ある実施態様において、本発明は、免疫アッセイによる、羊膜内感染の診断のための早期の信頼性が高い非侵襲性の方法を提供する。ある実施態様において、本発明は、CVFのプロテオミック分析による、羊膜内感染の診断のための早期の信頼性が高い非侵襲性の方法を提供する。
【0090】
非限定例として、本発明は、妊婦対象から得られる母体の頸管膣分泌液試料中で、少なくともα−胎児性タンパク質、IL−6及びIGFBP1の存在量を試験することを含む、妊婦対象における羊膜内感染の診断のための方法を提供する。羊膜内感染の診断は、IAIを有さない対照検体に対する、IAI陽性と判定されている患者検体中のこれらのタンパク質の存在量の統計学的有意差に基づく。
【0091】
上述のとおり、本発明の内容において、「プロテオミックプロファイル」という用語は、ある時間における、生体試料中、例えば体液中の複数のタンパク質の発現パターンの表現に言及するために使用される。プロテオミックプロファイルは例えば質量スペクトルとして表すことができるが、タンパク質の何れかの物理化学的又は生化学的特性に基づく他の表現法も含まれる。体液のプロテオームに存在するタンパク質の全て又は一部を同定し、配列決定することは可能であるが、これは、本発明に従い作成されるプロテオミックプロファイルの診断用途に必要ではない。特定の疾患の診断は、診断しようとする疾患又は病的状態が存在する場合、正常プロテオミックプロファイルと、同じ状況下で得られる同じ体液のプロテオミックプロファイルとの間の特徴的な差異(独自の発現特性)に基づき得る。独自の発現特性は、同じタイプの採取源から得られる対応する正常生体試料のプロテオミックプロファイルとは統計学的に有意に異なる試験生体試料又は参照生体試料のプロテオミックプロファイル内の何らかの独自の特性又はモチーフであり得る。例えば、プロテオミックプロファイルが質量スペクトル形態で与えられる場合、独自の発現特性とは、一般に、対応する正常試料の質量スペクトルとは質的又は量的に異なるピーク又はピークの組み合わせである。従って、質量スペクトルにおける新しいピーク又は新しいピークの組み合わせの出現又は質量スペクトルにおける、既存のピークもしくは既存のピークの組み合わせの大きさもしくは形の何らかの統計学的に有意な変化又は既存のピークの消失は、独自の発現特性とみなすことができる。哺乳動物対象から得られる試験試料のプロテオミックプロファイルを、病的な母体又は胎児の状態の独自の発現特性の特徴を含む参照試料のプロテオミックプロファイルと比較する際、哺乳動物対象が参照試料と同じ独自の発現特性を有する場合、その哺乳動物対象は、このような病的状態を有すると診断される。
【0092】
診断しようとする対象から得られる体液のプロテオミックプロファイルを、同じように得られ、処理された同じ種類の正常体液のプロテオミックプロファイルと比較することによって、特定の病的な母体/胎児の状態を診断することができる。試験試料のプロテオミックプロファイルが正常試料のプロテオミックプロファイルと基本的に同じである場合、その対象は対象となる病的な母体/胎児の状態がないとみなされる。正常試料のプロテオミックプロファイルに対して、試験試料のプロテオミックプロファイルが独自の発現特性を示す場合、その対象は、問題となる母体/胎児の状態があると診断される。
【0093】
あるいは又はさらに、試験試料のプロテオミックプロファイルを、問題となる病的な母体/胎児の状態があると独立して診断された対象の体液から得られた参照試料のプロテオミックプロファイルと比較し得る。この場合、試験試料のプロテオミックプロファイルが、参照試料のプロテオミックプロファイルと、独自の発現特性を表す少なくとも1つの特性又は特性の組み合わせを共有する場合、対象は病的状態があると診断される。
【0094】
本発明の方法において、正常生体試料のプロテオミックプロファイルは重要な診断的役割を果たす。上記で考察されるように、試験試料のプロテオミックプロファイルが、正常生体試料のプロテオミックプロファイルと基本的に同じである場合、患者は特定しようとする病的な母体/胎児の状態がないと診断される。副作用を起こす可能性があり得るか又は患者、胎児もしくは新生児を危険にさらし得る、不必要な治療又は介入を患者に対して行わなくてもよくなるため、この「陰性」診断は非常に意味がある。差が統計学的に有意であるか否かを判定するためにデータを解析する。
【0095】
従来のタンパク質分離法を用いて、基本的に同じ発現レベルで正常及び病的なプロテオームの両方で見出されるタンパク質(アルブミン及び免疫グロブリンなどの共通するタンパク質)を分析前に除去することによって、本発明の診断方法の感度を向上させることができる。独自の発現特性の一部ではないこのような共通タンパク質を除去すると、感度及び診断精度が向上する。あるいは又はさらに、診断判定を行うために、一般に、機械用のスペクトル選択アルゴリズムを用いて、結果のコンピュータ解析中、共通するタンパク質の発現特性を排除することができる(又はシグナルを除去することができる。)。
【0096】
下記実施例で詳述する結果は、頸管膣分泌液(CVF)の正常プロテオミックプロファイルとは統計学的に有意に異なる羊膜内感染(IAI)のプロテオミックプロファイルの特徴を与える。さらに、本実施例は、IAIの発現マーカー及び独自の発現特性の特徴を与える。
【0097】
本発明の非侵襲性の診断方法を行うために特に有利な体液は頸管膣分泌液(CVF)である。CVFは、水、電解質、低分子量有機化合物(グルコース、アミノ酸及び脂質)、細胞(白血球、リンパ球及び上皮細胞)及び子宮頸部により主に合成される多数のタンパク質及びタンパク質分解酵素からなる複合体液である(Blandauら、The Biology of the cervix.University of Chicago Press:Chicago,1973;p xi,450p)。CVFはまた、ムチン、デフェンシン、補体因子、免疫グロブリン、ラクトフェリン及びコレクチンを含む膣細胞からの分泌物も含有する(Blandauら、上出)。CVFは、膣、頸管及び子宮領域を含め、女性生殖管全体を流れ、円滑化する。CVFは、外来病原体に対する防御の最前線を形成し、生殖能力を示すものであり、授精、妊娠及び陣痛を促進する(Blandauら、上出;Bigelow,J.L.ら、Hum Reprod 2004,19,(4),889−92)。CVFはまた、ラクトバチルス・クリスパータス(Lactobacilli crispatus)及びラクトバチルス・バギナリス(Lactobacilli vaginalis)などの微生物叢も含有する。この微生物叢からの分泌液はCVFのpHを低下させ、これによりその抗病原体活性が促進される(Blandauら、上出)。膣の微生物叢における何らかの不均衡又は外部微生物叢の侵入の結果、細菌性膣症となる。細菌性膣症に反応して、頸管及び膣内上皮によるIL−1α、IL−1β、IL−10、IL−6及びTNF−αなどのいくつかのサイトカインのCVFへの分泌が変化する(Mattsby−Baltzer,Iら、Acta Obstet Gynecol Scand 1998,77,(7),701−6;Eschenbach,D.A.ら、J Clin Microbiol 1989,27,(2)、251−6)。細菌性膣症の阻止不良は子宮頸癌(Mikamo,Hら、J Infect Chemother 1999,5,(2),82−85)、骨盤内炎症性疾患(Ness,R.B.ら、Am J Epidemiol 2005,162,(6),585−90.)、子宮内膜炎(Haggerty,C.L.ら、Clin Infect Dis 2004,39,(7),990−5;Morris,M.ら,Bjog 2001,108,(5),439−50)及び卵管性不妊(Morrisら、上出)と正の相関が認められている。妊婦における細菌性膣症は、早期陣痛及び早産のリスク上昇と相関が認められている(Gravett,M.G.ら、Jama 1986,256,(14)、1899−903)。
【0098】
CVFに存在するサイトカイン及び他の防御分子はまた、膣におけるHIVなどの性感染性免疫不全ウイルス及び単純ヘルペスウイルス(HSV)の感染、複製及び増殖においても重要な役割を果たす(Poli,G.ら、AIDS Res Hum Retroviruses 1992,8,(2),191−7;Zara,F.ら、Sex Transm Infect 2004,80,(2),108−12;John,M.ら、J Infect Dis 2005,192,(10),1731−40)。CVFの陽イオン性ポリペプチド断片の分析により、抗HIV活性に関与する20種類のポリペプチドが同定された(Venkataraman,N.ら、J Immunol 2005,175,(11),7560−7)。以前の研究においても、HIVビリオンを捕捉する際の、従って感染を防御する際の、CVFについての役割が特定された(Maher,D.ら、Proc Natl Acad Sci USA 2005,102,(32)、11504−9;Quinones−Mateu,M.Eら、Aids 2003、17,(16),F39−48)。最近の研究から、CVF中の一部の免疫応答分子と早産に至る亜臨床的前期破水(PROM)の発生率との間に相関が検出された(Helmig,B.R.ら、J Matern Fetal Neonatal Med 2002,12,(4),237−46;Ogino,M.ら、J Obstet Gynaecol Res 2005,31,(5),421−6)。妊娠中、CVFは、絨毛−脱落膜接触面の破壊又は同時分泌の何れかによる、子宮由来の羊水(AF)を含有し得る。このCVFへのAFの「漏出」は、女性において早産を予測するために使用されてきた胎児フィブロネクチンの存在についての現在の非侵襲性診断に対する基礎となっている(Swamy,G.K.ら、J Reprod Med 2005,50,(11),851−6)。
【0099】
CVFは、その回収方法が、AFの回収方法、即ち羊水穿刺に比べて非常に侵襲性の小さいものであるため、妊婦において母体及び胎児の健康状態を監視するための重要な診断部位の候補である。本明細書中で特定されるバイオマーカーの組み合わせは、妊婦対象における羊膜内感染の信頼性の高い検出における有益な診断ツールを提供する。
【0100】
プロテオミックプロファイルを比較するための統計学的方法は当技術分野で周知である。例えば、質量スペクトルの場合、プロテオミックプロファイルは、スペクトルの水平軸に沿った、キーとなる質量/電荷(M/Z)位置でのピーク振幅値により定義される。従って、特徴的なプロテオミックプロファイルは、例えば、あるM/Z値でのスペクトル振幅の組み合わせにより形成されるパターンを特徴とし得る。適切なアルゴリズムを用いて、試験試料のプロテオミックプロファイル(パターン)を参照又は正常試料のプロテオミックプロファイル(パターン)と照合することによって、2種類のプロファイルの特徴的な発現特性又は実質的な同一性の有無を判定することができる。プロテオミックパターンを分析するための統計学的方法は、例えば、Petricoin IIIら、The Lancet 359:572−77(2002).;Issaqら、Biochem Biophys Commun 292:587−92(2002);Ballら、Bioinformatics 18:395−404(2002);及びLiら、Clinical Chemistry Journal,48:1296−1304(2002)において開示されている。
【0101】
4.タンパク質アレイ
上記で考察される診断及びスクリーニングアッセイは両者ともタンパク質アレイを用いて行うことができる。近年、タンパク質アレイは、タンパク質を検出し、それらの発現レベルを監視し、タンパク質相互作用及び機能を調べるための強力な手段として幅広く認識されている。自動化手段を用いて、多くの判定を同時に行うことができる場合、これらによりハイスループットタンパク質分析が可能となる。DNAアレイに対して元来開発されたマイクロアレイ又はチップ方式において、大量のデータを生成させながら最小限の材料を用いてこのような判定を行うことができる。
【0102】
2Dゲル電気泳動及び質量分析によるプロテオーム分析は非常に有効であるものの、必要とされる高い感度が常に得られるわけではなく、このため、少量発現される多くのタンパク質を見逃す可能性がある。タンパク質マイクロアレイにより、それらが高効率であることに加えて、感度が高くなる。
【0103】
タンパク質アレイは、当技術分野で周知の様々な共有及び非共有結合化学を用いて、ガラス、シリコン、プラスチックマイクロウェル、ニトロセルロース、PVDF膜及びマイクロビーズなどの固体表面上にタンパク質を固定化することによって形成される。固体支持体は、カップリング手順の前後で化学的に安定であり、良好なスポット形態を可能にし、非特異的結合を最小とすべきものであり、検出システムにおいてバックグラウンドに寄与してはならず、様々な検出システムと適合性がなければならない。
【0104】
一般に、タンパク質マイクロアレイは、DNAアレイの読み取りのために一般に使用されるものと同じ検出方法を使用する。同様に、DNAマイクロアレイを読み取るために使用されるものと同じ機器がタンパク質アレイに適用可能である。
【0105】
従って、捕捉アレイ(例えば抗体アレイ)は、正常及び病的な体液などの2種類の異なる採取源からの蛍光標識タンパク質を用いてプローブすることができる。この場合、読み取りは、標的タンパク質の発現レベルの変化の反映としての、蛍光シグナルの変化に基づく。代替的な読み取り法としては、蛍光共鳴エネルギー移動、表面プラズモン共鳴、ローリングサークルDNA増幅、共鳴光散乱、酵素反応及び原子間力顕微鏡法が挙げられるが、これらに限定されない。
【0106】
さらなる詳細については、例えば、Zhou H,ら、Trends Biotechnol.19:S34−9(2001);Zhuら、Current Opin.Chem.Biol.5:40−45−(2001);Wilson及びNock,Angew Chem Int Ed Engl 42:494−500(2003);及びSchweitzer及びKingsmore,Curr Opin Biotechnol 13:14−9(2002)を参照のこと。生体分子アレイは、2002年6月18日発行の米国特許第6,406,921号(この開示全体が、参照により本明細書によって明確に組み込まれる。)でも開示されている。
【0107】
5.免疫アッセイ
本発明の診断アッセイは、当技術分野で周知の様々な免疫アッセイ方式の形態で行うこともできる。本発明のある実施態様には、個体から体液、例えば頸管膣分泌液を得て;本明細書中に記載の免疫アッセイシステムを用いて体液中の本明細書中に記載の1以上のタンパク質の量を測定し;この体液中の本明細書中に記載の1以上のタンパク質の量を、羊膜内感染状態がない健康な個体における本明細書中に記載の1以上のタンパク質の参照レベルと比較する段階を含み、本明細書中に記載の1以上のタンパク質量の、参照レベルを上回る上昇から、個体が羊膜内感染に罹患していることが示される、個体における羊膜内感染を診断するための方法が含まれる。
【0108】
ある実施態様において、1段階アッセイ(試料+検出抗体の同時温置)が有用である。別の実施態様において、2段階アッセイ(試料及び検出抗体の順次温置)が有用である。2段階アッセイは、他のタンパク質分子が検出抗体への結合に競合し得る場合に好ましい。均一系免疫アッセイにおいて、抗原と抗体との間の免疫学的反応及び検出の両方を均一系反応で行うことができる。不均一系免疫アッセイには少なくとも1つの分離段階が含まれ、これにより未反応試薬と反応性生物を区別することが可能になる。
【0109】
免疫測定、「二部位」又は「サンドイッチ」免疫アッセイと呼ばれる免疫アッセイの実施態様において、検体において異なるエピトープに結合する2つの抗体と検体が結合するか又はこの2つの抗体間でサンドイッチされる。このような免疫アッセイの代表例としては、酵素免疫アッセイ又は酵素免疫測定アッセイ(EIA又はELISA)、免疫放射定量アッセイ(IRMA)、蛍光免疫アッセイ、ラテラルフローアッセイ、拡散免疫アッセイ、免疫沈降アッセイ及び磁気分離アッセイ(MSA)が挙げられる。このようなある1つのアッセイにおいて、「捕捉」抗体と呼ばれる第一の抗体を、タンパク質カップリング又はタンパク質結合面、コロイド金属粒子、酸化鉄粒子又はポリマー性ビーズなどの固体支持体に結合させる。ポリマー性ビーズの一例はラテックス粒子である。このような実施態様において、当技術分野で公知の手順を用いて、捕捉抗体を固体支持体に結合させるか又は捕捉抗体で個体支持体を被覆する。あるいは、固体支持体に結合されているか又は固体支持体を被覆するさらなる抗体により認識されるリガンドと捕捉抗体がカップリングされる。リガンドを介したさらなる抗体への捕捉抗体の結合は、固体支持体上に間接的に捕捉抗体を固定化する。このようなリガンドの例はフルオレセインである。
【0110】
当技術分野で公知の手順を用いて、「検出」抗体と称される第二の抗体を、標識とカップリングさせるか又は複合化させる。この目的に適切な標識の例としては、化学発光剤、発色剤、エネルギー移動剤、酵素、酵素反応の基質、蛍光剤及び放射性同位体が挙げられる。ある実施態様において、標識には、第二の抗体とカップリングさせるビオチンなどの第一のタンパク質及び酵素とカップリングさせるストレプトアビジンなどの第二のタンパク質が含まれる。第二のタンパク質は第一のタンパク質に結合する。基質が提供された際に酵素が検出可能なシグナルを生成させ、測定されるシグナル量が、検体に結合される第二の抗体の量に対応することになる。酵素の例としては、アルカリホスファターゼ、アミラーゼ、ルシフェラーゼ、カタラーゼ、β−ガラクトシダーゼ、グルコースオキシダーゼ、グルコース−6−リン酸デヒドロゲナーゼ、ヘキソキナーゼ、ホースラディッシュペルオキシダーゼ、ラクタマーゼ、ウレアーゼ及びリンゴ酸デヒドロゲナーゼが挙げられるが、これらに限定されない。適切な基質としては、TMB(3,3’,5,5’−テトラメチルベンジジン、OPD(o−フェニレンジアミン)及びABTS(2,2’−アジノ−ビス(3−エチルベンズチアゾリン−6−スルホン酸)が挙げられるが、これらに限定されない。
【0111】
「サンドイッチ」方式において、アッセイされている抗原は2種類の異なる抗体の間で保持される。この方法において、固体表面を最初に固相抗体で被覆する。次に、抗原(即ち診断タンパク質)を含有する試験試料又は被測定抗原を含有する組成物を添加し、抗原を被結合抗体と反応させる。未結合の抗原を全て洗い流す。次に、既知の量の酵素標識抗体を被結合抗体と反応させる。反応後、過剰な未結合の酵素連結抗体を全て洗い流す。次に、本アッセイで使用される酵素に対する基質を添加し、基質と酵素との間の反応により色の変化が生じる。視覚的な色の変化量が、特異的な酵素と複合化した被結合抗体の直接測定法であり、それ故に被験試料中に存在する抗原の測定法である。
【0112】
競合アッセイとしてELISAを使用することもできる。競合アッセイ方式において、測定しようとする抗原を含有する試験検体を正確な量の酵素−標識抗原と混合し、固体表面に連結されている抗−抗原抗体への結合に対して両者が競合する。酵素に対する基質を添加する前に、過剰な遊離酵素−標識抗原を洗い流す。酵素−基質相互作用により生じた色の強度量が、被験試料中の抗原量の尺度である。均一系免疫アッセイとしては、例えば酵素増幅免疫アッセイ技術(EMIT)が挙げられ、これには一般に、測定しようとする化合物を含む生体試料、測定しようとする化合物の酵素標識化分子、測定しようとする化合物に結合する特異的抗体及び特異的酵素発色基質が含まれる。典型的なEMITにおいて、過剰な特異的抗体を生体試料に添加する。生体試料が検出しようとするタンパク質を含有する場合、このようなタンパク質は抗体に結合する。次に、測定した量の対応する酵素−標識タンパク質を混合物に添加する。試料中のタンパク質分子に占有されていない抗体結合部位は、添加した酵素−標識タンパク質分子に占有される。結果として、遊離型の酵素−標識タンパク質のみが基質上で作用し得るので、酵素活性が低下する。無色から有色型に変換される基質の量から、混合物中に残存する遊離型酵素の量を決定する。試料中の検出しようとするタンパク質が高濃度であるほど、吸収読み取り値が高くなる。試料中のタンパク質が少ないほど、酵素活性が低くなり、結果として吸収読み取り値が低くなる。Ag−酵素複合体がAb−結合である場合、酵素標識の不活性化によって、EMITは、他の免疫アッセイ法で必要とされるような未結合化合物からの結合化合物の分離を行うことなく試験を行うことができる独自の系となる。
【0113】
本明細書中に記載のシステム及び方法の様々な実施態様において有用な抗体には、市販の抗体及び抗体断片ならびに指定の標的タンパク質上の適切なエピトープに結合するように作製された何らかの新規抗体が含まれる。全ての実施態様において、本発明に従い使用しようとする抗体は、頸管膣分泌液中に存在する本明細書中に記載のバイオマーカーの1以上の特異的なアイソフォームに結合しなければならない。本明細書中で例示される様々な実施態様で使用される抗体は、モノクローナル又はポリクローナルの性質を有するものである。他の抗体及び抗体断片、例えば、組み換え抗体、キメラ抗体、ヒト化抗体、Fab又はFv断片ならびにスクリーニングファージディスプレイライブラリにより選択される断片などの抗体断片なども、本明細書中に記載の組成物及び方法において有用である。
【0114】
現在、モノクローナルならびにポリクローナル抗体の調製のための方法は十分に確立されている(Harlow E.ら、1988.Antibodies.New York:Cold Spring Harbour Laboratory)。ある実施態様において、組み換えヒトLBP、その合成断片又は、ヒト血清から精製され得るようなLBPに対して抗体を生成させる。標準的な免疫付与及び採血手段を用いてマウス、ラット、ウサギ、ヤギ、ヒツジ、ロバ及びウマを含むが限定されない様々な種においてポリクローナル抗体を生成させる。高力価の動物血液を、硫酸アンモニウムでの沈殿などの通常の選択的塩析手段によって分画化し、標準的な方法に従い、プロテイン−A−セファロース及びレプチン−セファロースカラム上での連続的アフィニティークロマトグラフィーによって、特異的な免疫グロブリン画分を分離する。次に、特異性及び関連分子との交差反応性の欠如について、精製したポリクローナルならびにモノクローナル抗体の特徴を調べる。このような特性評価は、抗体結合に対する、未標識の潜在的な交差反応物レベルが高い競合において、タンパク質、例えば、放射性同位体又はビオチンなどのトレーサーで標識されるLBPを用いて、標準的な方法によって行われる。いくつかの実施態様において、特異性が非常に高い抗体画分を得るために又はポリクローナルプールから親和性がより高い抗体画分を選択するために、さらなる精製が必要とされる。モノクローナル抗体の場合、特に組み換え分子又はペプチド抗原を免疫付与のために使用する場合は、免疫原だけではなく天然循環分子に対して良好な結合特性及び特異性を持つ抗体の選択に注意が必要である。還元条件及び非還元条件下での、十分に確立されたドデシル硫酸ナトリウム−ポリアクリルアミドゲル電気泳動(SDS−PAGE)及びウエスタン免疫ブロット方法など、他の標準的な方法によって、交差反応性実験をさらに評価する。高速液体クロマトグラフィー(HPLC)により分画化された血清試料中で検出されるタンパク質の免疫学的反応性の評価は、検出されたタンパク質の分子量プロファイルを大まかに明らかにするためにも使用される(Gravett MGら、JAMA 2004;292:462−469;Khosravi MJら、Clin Biochem 1995;28:407−414)。
【0115】
モノクローナル抗体は、Kohler及びMilsteinの最初の技術(Kohler G.,Milstein C.Nature 256:495,1975)に基づく、十分に確立された標準的実験室手段((Laboratory Techniques in Biochemistry and Molecular Biology,編:R.H.Burdon及びP.H.van Kinppenberg;Elsevier Publishers Biomedical Division,1985中の)P.Tijssenによる「Practice and Theory of Enzyme Immunoassays」)に従い調製される。この技術は、免疫付与した動物から脾臓細胞を取り出し、骨髄腫細胞との融合又はエプスタイン−バーウイルス形質転換により抗体産生細胞を不死化し、次いで望ましい抗体を発現するクローンについてスクリーニングすることによって行われるが、当技術分野で公知の他の技術も使用される。抗体は、特異的なDNAでの免疫付与を含むが限定されない、当業者にとって公知の他のアプローチによっても作製される。
【0116】
本明細書中に記載の免疫アッセイでの使用の場合、標準的な抗体精製スキームを用いて抗体を精製する。様々な実施態様において、モノクローナル及びポリクローナルの両抗体とも、プロテイン−Aカラム上でのアフィニティークロマトグラフィーによって精製される。あるいは、標準的な方法を用いて、固定化抗原タンパク質を含有するゲルカラム上でのアフィニティークロマトグラフィーによって抗体が精製される。
【0117】
本明細書中に記載のシステム及び方法における使用に適切な抗体の選択に対する別の留意事項は、捕捉抗体及び検出抗体が、あるタンパク質分子に同時に結合できることである。MIP1bを含むある実施態様において、例えば捕捉抗体の抗MIP1b結合部位は検出抗体が結合するエピトープとは異なり、従って捕捉及び検出抗体に同時に結合し、特定のバイオマーカーを検出することが可能になる。エピトープの重複が顕著であり、その結果結合反応が不良となる場合、捕捉又は検出抗体としてバイオマーカーに対する異なる抗体を選択することは当業者の技術の範囲内である。いくつかの実施態様において、タンパク質表面上で抗体結合部位は完全に利用可能ではなく、例えばこのタンパク質は1以上の他のタンパク質との複合体で試料中に主に存在し、捕捉又は検出抗体への結合のために接近しにくい。このような環境においては、部分的なタンパク質変性又は緩衝液変異など、当技術分野で公知の技術を使用して抗体結合部位を露出させる。
【0118】
当技術分野で公知のように、必要な分析的及び/又は固相分離の必要条件に応じて、標準的な非共有又は共有結合法を用いて、捕捉抗体を様々な固相支持体とカップリングさせるか又は連結させる。固体支持体は、試験管、ビーズ、微小粒子、ろ紙、膜、ガラスフィルター、磁性粒子、ガラスもしくはシリコンチップ又は他の材料の形態及び当業者にとって公知のアプローチである。微小粒子、特に抗体で直接被覆されている磁気化粒子(磁性粒子−捕捉抗体)又は普遍的な結合剤(例えば、アビジン又は抗種抗体)で標識されている粒子の使用は、アッセイ温置時間を大幅に短くするために有用である。当技術分野で公知の他の代替アプローチとともにこれらによって、必要な感度を制限することなく数分以内にアッセイを完了できるようになる。磁気化粒子の使用又は同様のアプローチの使用により、広く利用可能な免疫分析装置において技術を便利に自動化することができる。
【0119】
タンパク質断片の検出のために使用される検出抗体は、レポーター分子と直接カップリングされるか又は二次検出系により間接的に検出される。後者は、標識された抗種抗体により認識される抗体及び他の形態の免疫学的又は非免疫学的架橋及びシグナル増幅検出系(例えばビオチン−ストレプトアビジン技術)を含む、当技術分野で公知のいくつかの異なる原理に基づく。アッセイ感度及び低レベルの再現性及び性能を顕著に向上させるために、シグナル増幅アプローチが使用される。直接又は間接的抗体カップリングに使用される標識は、何らかの検出可能なレポーター分子である。適切な標識の例は、フルオロフォア、発光標識、金属錯体及び放射性標識ならびに酵素などの他の適切な試薬により検出され得る部分又は発光性基質との酵素などの直接的もしくは間接的標識の様々な組み合わせなど、免疫学的及び非免疫学的検出系の分野で広く使用されるものである。
【0120】
本発明の方法の様々な実施態様において、何らかの試料及び抗体の体積及び温置時間を変更することは当技術分野の者の技術の範囲内である。これらの方法及び系には、従来の免疫アッセイで使用される一般的な改法及び当業者にとって公知の何らかの変更が含まれる。様々な実施態様において、アッセイデザインは、特定のアッセイ適用及びスピード、感度、精度及び利便性に対する必要性に応じて、均一系又は不均一系である。
【0121】
上述の免疫アッセイに加えて、他の免疫アッセイ(例えば、オクタロニープレート又はウエスタンブロットは、タンパク質ゲル又はフィルター上のタンパク質スポット上で行われ得る。)が当技術分野で公知であり、診断としての利用法が見出され得る。
【0122】
本発明の別の態様は免疫アッセイキットに関する。ある実施態様において、免疫アッセイキットは、本明細書中に記載のタンパク質の2以上の検出用の抗体及び試薬を含む。ある態様において、本発明は、捕捉抗体及び検出抗体を含むサンドイッチ免疫アッセイキットを含む。捕捉抗体及び検出抗体はモノクローナル又はポリクローナルであり得る。別の態様において、本発明は、免疫フロークロマトグラフィーを用いた免疫クロマトグラフィーストリップ(ICS)試験などのラテラルフロー装置を含む診断キットを含む。ラテラルフロー装置は、全般的に米国特許第4、943,522号;同第4,861,711号;同第4,857,453号;同第4,855,240号;同第4,775,636号;同第4,703,017号;同第4,361、537号;同第4,235,601号;同第4,168,146号;同第4,094,647号(これらのそれぞれの内容全体が、参照により組み込まれる。)に記載されるとおり、ラテラルフローアッセイ技術を利用する。また別の態様において、本免疫アッセイキットは、例えば、別個の容器中で、(a)新生児敗血症などの特定の母体/胎児の状態の診断で使用されるポリペプチドに対して結合特異性を有するモノクローナル抗体;(b)及び抗抗体免疫グロブリンを含み得る。この免疫アッセイキットは、本明細書中で提供される様々な方法の実施に対して使用され得る。モノクローナル抗体及び抗抗体免疫グロブリンは、約0.001mgから約100グラムの量、より好ましくは約0.01mgから約1グラムの量で提供され得る。抗抗体免疫グロブリンは、ポリクローナル免疫グロブリン、プロテインA又はプロテインG又はそれらの機能的断片であり得、これらは、当技術分野で公知の方法により使用前に標識され得る。本診断キットは、試験におけるバックグラウンド干渉を低下させるために必要な物質、シグナルを増強させるための物質、関心のある臨床転帰の予測値を生成するためのマーカー値を組み合わせて内挿するためのソフトウェア及びアルゴリズム、試験を行うための装置、較正曲線及びチャート、標準曲線及びチャートなどをさらに含み得る。本試験キットは、何らかの適切な方式で、一般には試験を行うための印刷された説明シートとともに1つの容器中に全ての要素が入っている状態で包装され得る。
【0123】
6.診断及び治療法
本発明の診断方法は、乳児及び/又は母親の生存に非常に重要であることが多い迅速な治療決断を行うための、開業医にとって有益なツールである。従って、例えば妊婦が早期陣痛の症状を示す場合、羊膜内感染があるか否かを判定するために診断テストを実施することが重要である。本明細書中の迅速かつ非侵襲性の診断テストにより、羊膜内感染の存在が確認される場合、医師は、早産児生存の可能性を向上させ、母体の健康に対するリスクを抑えるために緊急措置をとる必要がある。現在のところ利用可能な羊膜内感染に対する非侵襲性試験はない。
【0124】
羊膜内感染に対する試験が陰性である場合、早産が依然として予想されるものであるか否かという疑問が残る。現在、単一マーカーの胎児フィブロネクチン(fFN)試験がこの目的に使用されることがある。妊娠患者のCVF中にfFNがないことは、少なくともさらに2週間妊娠が継続するであろうという優れた指標である。しかしfFNの存在に基づき(陽性試験)、早産が起こりそうであるか否かを信頼性高く予想することはできない。本発明の複数マーカーによる診断テストは、陰性及び陽性試験結果の場合の両方において早産の可能性の信頼性のある予測因子を提供する。
【0125】
あるいは、患者が早産の症状を示し、診断テスト(本明細書中の試験又は臨床診療で使用される何らかの他の試験の何れか)を使用して早産の可能性を評価する場合、羊膜内感染の有無に関する情報を提供し、医師がよりよい治療決定を行い得るようにするためのフォローアップとして羊膜内感染に対する試験を行うことができる。
【0126】
本明細書中で特定されるタンパク質の発現レベルの測定又は取得後、アッセイ結果、知見、診断、予測及び/又は治療法の推奨は通常、記録され、例えば、技術者、医師及び/又は患者に伝達される。ある種の実施態様において、コンピュータを使用してこのような情報を関係者、例えば患者及び/又は担当医などに伝達する。いくつかの実施態様において、本アッセイを行うか又はアッセイ結果もしくは診断が伝達される国又は管轄とは異なる国又は管轄においてアッセイ結果が分析される。
【0127】
好ましい実施態様において、試験対象中での本明細書中の1以上のバイオマーカーの発現レベルに基づく診断、予測及び/又は治療法の推奨を、アッセイが完了し、診断及び/又は予測を出した後できるだけ迅速に対象に伝達する。ある種の実施態様において、診断、予測及び/又は治療法の推奨はさらに、対象が示す徴候及び症状に基づく。ある実施態様において、IAIを示す徴候及び症状としては、母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体又は胎児の頻脈、子宮圧痛又は羊水の悪臭が挙げられるが、これらに限定されない。IAIを示すその他の徴候及び症状は当技術分野で公知である。本明細書中に記載の方法において特定され定量される1以上のバイオマーカーが、1以上のパネルに含有され得る。パネルを含むバイオマーカーの数としては、1種類のバイオマーカー、2種類のバイオマーカー、3種類のバイオマーカー、4種類のバイオマーカー、5種類のバイオマーカー、6種類のバイオマーカー、7種類のバイオマーカー、8種類のバイオマーカー、9種類のバイオマーカー、10種類のバイオマーカー、11種類のバイオマーカー、12種類のバイオマーカー、13種類のバイオマーカー、14種類のバイオマーカー、15種類のバイオマーカー、16種類のバイオマーカー、17種類のバイオマーカー、18種類のバイオマーカー、19種類のバイオマーカー、20種類のバイオマーカーなどが挙げられ得る。
【0128】
好ましい実施態様において、本発明は、頸管膣分泌液(CVF)中のα−胎児性タンパク質、インターロイキン−6(IL−6)及びインスリン増殖因子結合タンパク質−1(IGFBP−1)濃度を測定する免疫クロマトグラフィー試験である羊膜内感染試験(ProteoGenix羊膜内感染試験(PG−IAI))に関する。本試験は、特発性早期陣痛が起こり、膜が完全であり、22週0日から36週6日の間に試料採取された妊婦においてIAIのリスクを評価する際に補助的なものとして特に有用であり、IAIが疑われる者に対する患者管理を優先するために使用することができる。
【0129】
特定の実施態様において、本試験はラテラルフローカートリッジに格納され、ラテラルフローリーダーを用いてPG−IAIバイオマーカーシグナル強度が測定される。スワブ回収キットを用いて非侵襲性のCVFスワブを使用してCVFを回収する。
【0130】
ラテラルフロー装置に対する試験性能を見積もるために、ELISAプラットフォームを用いた現在の臨床的/分析的研究からのデータを使用した。最良モデルは2種類のCVFバイオマーカー、すなわちα−胎児性タンパク質及びIL−6の質量濃度を使用した。さらなるCVFバイオマーカーであるIGFBP1は、この2種類のバイオマーカーによるリスク評価に対するゲートキーパーとなると認識されている。IGFBP1はそれ自身においてIAIに対する診断とはなり得ないが、これによりIAI偽陽性患者の結果の29%が排除され、診断テストの特異性が大きく向上する。
【0131】
結果及び/又は関連情報は対象の担当医師により対象に伝達され得る。あるいは、結果は、書面のレポートを提供することなどにより書面で、eメール又は電話などの電子的伝達形態を含む何らかの伝達手段によって、試験対象に直接伝達され得る。eメール伝達の場合など、コンピュータの使用によって伝達が促進され得る。ある種の実施態様において、遠隔通信における熟練技術者がよく精通しているであろうコンピュータハードウェア及びソフトウェアの組み合わせを使用して、診断テストの結果及び/又は試験から導かれる結論及び/又は試験に基づく治療法の推奨を含有する通信物を作成し、対象に自動的に送達し得る。医療向けの伝達システムの一例は米国特許第6,283,761号に記載されているが、本発明は、この特定の伝達システムを使用する方法に限定されない。本発明の方法のある種の実施態様において、試料のアッセイ、疾患の診断及びアッセイ結果又は診断の伝達を含む方法段階の全て又は一部が多様な(例えば外来)管轄で行われ得る。
【0132】
診断を促進するために、本発明の本明細書中で与えられる1以上のバイオマーカーの参照及び/又は対象バイオマーカープロファイル又は発現レベルを、限定されないが、とりわけVCRで読むことのできるもののようなアナログテープ、CD−ROM、DVD−ROM、USBフラッシュメディア、例えばフラッシュドライブなどの、電子的に又は機械読み取り可能な媒体に含有される表示装置上に表示することができる。このような機械読み取り可能な媒体はまた、臨床的パラメータ及び古典的な検査リスク因子の測定などのさらなる試験結果も含有し得るが、これらに限定されない。あるいは又はさらに、機械読み取り可能な媒体はまた、病歴及び何らかの関連家族歴などの対象情報も含み得る。
【0133】
微生物学及び治療:IAIは、真正細菌、マイコプラズマ種及び真菌を含む多菌性感染であることが多い。IAIにおける羊水からの培養又は16S rDNA PCRにより最も高頻度に回収される微生物には、ガードネレラ・バジナリス(Gardnerella vaginalis)、バクテロイデス・ビビウス(Bacteroides bivius)、フゾバクテリウム・ヌクレアーツム(Fusobacterium nucleatum)、ペプトストロプトコッカス属(Peptostroptococcus sp.)、プロボテラ・ビブス(Provotella bivus)、その他のグラム陰性嫌気性菌、カンジダならびに生殖器マイコプラズマ、マイコプラズマ・ホミニス(Mycoplasma hominis)及びウレアプラズマ・ウレアリチカム(Ureaplasma urealyticum)が含まれていた(DiGiulio DBら、PLoS ONE 3(8):e3056;Han,Yiping W.ら、J.Clin.Microbiol.2009 47:38−47)。標的となる抗生物質療法は、診断確定後すぐに分娩期に開始すべきである。
【0134】
本願で引用される特許及び参考文献は全てそれらの全体において参照により本明細書によって組み込まれる。
【実施例】
【0135】
次の実施例は、単なる説明目的のために与えらるものであり、本発明の範囲を何ら限定するものではない。当業者は、本発明の範囲内で変更することができる様々なパラメータを認めるであろう。
【実施例1】
【0136】
免疫アッセイを用いた羊膜内感染の頸管膣分泌液バイオマーカーの同定
早期陣痛が現れている患者から、個々の患者検体を回収した。対応する羊水検体を使用して、羊水培養(好気性、嫌気性及びマイコプラズマ種)及び羊水16SリボソームDNAの有無に基づき、羊膜内感染(IAI)を呈する者又は非IAIである者として患者を分類した。
【0137】
頸管膣分泌液スワブ回収。ポリエステルスワブ(Puritan、Guilford、ME)で頸管口を拭うことによって頸管膣分泌液を回収し、次いでこれを約1mLの検体回収緩衝液の入った容器に入れた。輸送のために検体を−70℃で凍結させ、次いで凍結融解し、270xgで15分間遠心し、長期保存のために再分注した。
【0138】
GROα:CVF検体の希釈。下記のQuantikine Human CXCL1/GROct免疫アッセイキットでの検査前に、アッセイ緩衝液(2.67mM KCl、1.47mM KH2PO4、137.93mM NaCl、8.06mM Na2HPO4−7H2O、0.15%BSA、0.05%v/v Tween−20、0.075%v/v ProClin 950、pH7.3+0.3)中で頸管膣分泌液(CVF)検体を1:50に希釈した。
【0139】
CVF検体中のGROαの検出。希釈後、製造者の説明書に対して一部変更を加え、試料として検体をR&D SystemsのQuantikine Human CXCL1/GROct免疫アッセイキット(カタログ番号DGR00)に供した。簡潔に述べると、試薬、対照及び試料を室温(RT)にした。GROct標準物質を5mLアッセイ緩衝液中で再構成し、1000pg/mL溶液を得た。この溶液を穏やかに撹拌しながら室温にて15分間温置した。温置後、750μLの1000pg/mL溶液を750μLのアッセイ緩衝液に加えて希釈し、500pg/mLの溶液を得た。この過程をさらに4回繰り返し、250pg/mL、125pg/mL、62.5pg/mL及び31.25pg/mLの溶液を得た。50μLのアッセイ希釈液RD1Uを各ウェルに添加した。200μLの標準物質を3つ組で適切なウェルに添加した。200μLの対照及び試料を2つ組で適切なウェルに添加した。これらのウェルを接着ストリップで覆い、RTで2時間温置した。接着ストリップを取り外し、BioTek ELx50プレート洗浄器を用いて、ウェルを400μLの1x洗浄緩衝液で3回洗浄し、各洗浄と洗浄の間に1分間温置した。ウェルを上下逆にしてペーパータオル上に叩きつけることによって残存液を全て除去した。200μLのGROct複合物を各ウェルに添加した。ウェルを接着ストリップで覆い、2−8℃で2時間温置した。この接着ストリップを取り外し、前と同じようにウェルを洗浄した。前と同じように残存液を全て除去した。200μLの基質溶液を各ウェルに添加した。これらのウェルをアルミホイルで覆い、RTで20分間温置した。50μLの停止溶液を各ウェルに添加した。BioTek Synergy2プレートリーダー及びBioTek Gen5ソフトウェアを用いて、450nm及び540nmでプレートの読み取りを行った。
【0140】
CVF検体中のGROαの定量。Gen5ソフトウェアを用いて、標準曲線を作成するために4パラメータ非線形回帰分析を行った。次いでこの標準曲線を使用して、免疫アッセイキットでのCVF検体の測定においてGROαの濃度を計算した。CVF検体中のGROαの最終濃度を計算するため、最初の検体希釈を考慮に入れるために、計算した濃度に50を乗じた。31.25pg/mLの標準物質のΔOD(OD450−OD540)読み取り値よりもΔOD読み取り値が低かった検体は何れも濃度を31.25pg/mLとし、これに50を乗じた。次いで、下記のとおり、統計学的方法を用いてデータを解析した。図1は、IAI感染(n=14)対非感染患者(n=95)における、GROα(アッセイ1)の自然対数値を示す箱ひげ図を示す。
【0141】
CVF検体の希釈。下記のQuantikineヒトIL−6免疫アッセイキットでの検査前に、標準物質希釈液RD6F中で頸管膣分泌液(CVF)検体を1:100に希釈した。
【0142】
CVF検体中のIL−6の検出。希釈後、製造者の説明書に対して一部変更を加え、試料として検体をR&D SystemsのQuantikineヒトIL−6免疫アッセイキット(カタログ番号D6050)に供した。簡潔に述べると、試薬、対照及び試料を室温(RT)にした。IL−6標準物質を5mLの標準物質希釈液RD6Fで再構成し、300pg/mLの溶液を得た。この溶液を穏やかに撹拌しながら室温にて15分間温置した。温置後、333μLの300pg/mL溶液を667μLの標準物質希釈液RD6Fに加えて希釈し、100pg/mLの溶液を得た。500μLの100pg/mL溶液を500μLの標準物質希釈液RD6Fに加えて希釈し、50pg/mLの溶液を得た。2倍希釈をさらに4回繰り返し、25pg/mL、12.5pg/mL、6.25pg/mL及び3.12pg/mLの溶液を得た。100μLのアッセイ希釈液RD1Wを各ウェルに添加した。100μLの標準物質を3つ組で適切なウェルに添加した。100μLの対照及び試料を2つ組で適切なウェルに添加した。これらのウェルを接着ストリップで覆い、RTで2時間温置した。接着ストリップを取り外し、BioTek ELx50プレート洗浄器を用いて、ウェルを400μLの1x洗浄緩衝液で4回洗浄した。ウェルを上下逆にしてペーパータオル上に叩きつけることによって残存液を全て除去した。200μLのIL−6複合物を各ウェルに添加した。これらのウェルを接着ストリップで覆い、RTで2時間温置した。接着ストリップを取り外し、前と同じようにウェルを洗浄した。前と同じように残存液を全て除去した。200μLの基質溶液を各ウェルに添加した。これらのウェルをアルミホイルで覆い、RTで20分間温置した。50μLの停止溶液を各ウェルに添加した。BioTek Synergy2プレートリーダー及びBioTek Gen5ソフトウェアを用いて450nm及び540nmでプレートの読み取りを行った。
【0143】
CVF検体中のIL−6定量。Gen5ソフトウェアを用いて、標準曲線を作成するために4パラメータ非線形回帰分析を行った。次いでこの標準曲線を使用して、免疫アッセイキットでのCVF検体の測定においてIL−6の濃度を計算した。CVF検体中のIL−6の最終濃度を計算するため、最初の検体希釈を考慮にいれるために、計算した濃度に100を乗じた。3.12pg/mLの標準物質のΔOD(OD450−OD540)読み取り値よりもΔOD読み取り値が低かった検体は何れも濃度を3.12pg/mLとし、これに100を乗じた。ΔOD読み取り値が300pg/mLの標準物質のΔOD読み取り値よりも高かった検体は全て、より高い希釈率で希釈し、そのキットで再び測定した。次いで、下記のとおり統計学的方法を用いてデータを解析した。図7は、IAI感染(n=14)対非感染患者(n=95)における、IL−6の自然対数値を示す箱ひげ図を示す。
【0144】
LBP:CVF検体の希釈。下記のヒトLBP ELISAキットにおける検査前に、アッセイ緩衝液(2.67mM KCl、1.47mM KH2PO4、137.93mM NaCl、8.06mM Na2HPO4−7H2O、0.15%BSA、0.05%v/v Tween−20、0.075%v/v ProClin950、pH7.3+0.3)中で頸管膣分泌液(CVF)検体を1:50に希釈した。
【0145】
CVF検体中のLBPの検出。希釈後、製造者の説明書に対して一部変更を加え、試料として検体をCell SciencesのヒトLBP ELISAキット(カタログ番号CKH113)に供した。簡潔に述べると、試薬、対照及び試料を室温(RT)に。ヒトLBP標準物質を30μL蒸留水で再構成した。次に、再構成したヒトLBP標準物質を1570μLアッセイ緩衝液に加えて希釈し、50ng/mLの溶液を得た。350μLの50ng/mL溶液を350μLのアッセイ緩衝液に加えて希釈し、25ng/mLの溶液を得た。2倍希釈をさらに4回繰り返し、12.5ng/mL、6.25ng/mL、3.125ng/mL及び1.56ng/mLの溶液を得た。100μLの標準物質を3つ組で適切なウェルに添加した。100μLの対照及び試料を2つ組で適切なウェルに添加した。これらのウェルを接着ストリップで覆い、振盪しながらRTで1時間温置した。接着ストリップを取り外し、BioTek ELx50プレート洗浄器を用いて、300μLの洗浄緩衝液でウェルを3回洗浄した。ウェルを上下逆にしてペーパータオル上に叩きつけることによって残存液を全て除去した。100μLの検出抗体を各ウェルに添加した。これらのウェルを接着ストリップで覆い、振盪しながらRTで1時間温置した。接着ストリップを取り外し、前と同じようにウェルを洗浄した。前と同じように残存液を全て除去した。100μLの基質溶液を各ウェルに添加した。これらのウェルをアルミホイルで覆い、RTで12−15分間温置した。100μLの停止溶液を各ウェルに添加した。BioTek Synergy2プレートリーダー及びBioTek Gen5ソフトウェアを用いて450nm及び620nmでプレートの読み取りを行った。図8は、IAI感染(n=14)対非感染患者(n=95)における、LBPの自然対数値を示す。
【0146】
CVF検体中のLBPの定量。Gen5ソフトウェアを用いて、標準曲線を作成するために4パラメータ非線形回帰分析を行った。次いでこの標準曲線を使用して、免疫アッセイキットでのCVF検体の測定においてLBPの濃度を計算した。CVF検体中のLBPの最終濃度を計算するため、最初の検体希釈を考慮にいれるために、計算した濃度に50を乗じた。1.56ng/mLの標準物質のΔOD(OD450−OD620)読み取り値よりもΔOD読み取り値が低かった検体は何れも濃度を1.56ng/mLとし、これに50を乗じた。ΔOD読み取り値が50ng/mLの標準物質のΔOD読み取り値よりも高い検体は全て、より高い希釈率で希釈し、そのキットで再び測定した。次いで、下記のとおり統計学的方法を用いてデータを解析した。
【0147】
A1AG:CVF検体の希釈。下記のヒトオロソムコイド(α−1−酸性糖タンパク質)ELISA定量キットでの検査前に、頸管膣分泌液(CVF)検体を1%ミルク入りのPBS中で20 1:200に希釈した。
【0148】
CVF検体中のA1AGの検出。希釈後、製造者の説明書に対して一部変更を加え、試料として検体をGenWayのヒトオロソムコイド(α−1−酸性糖タンパク質)ELISA定量キット(カタログ番号40−288−22927F)に供した。簡潔に述べると、試薬、対照及び試料を室温(RT)にした。被覆緩衝液(0.05M炭酸−重炭酸塩、pH9.4)中で被覆抗体を5μg/mLに希釈した。MaxiSorp面を有するImmuno LockWells(Nunc、カタログ番号446469)にこの5μg/mL被覆溶液100μLを添加した。これらのウェルをRTで1時間温置し、次いでBioTek ELx50プレート洗浄器を用いて、300μLの洗浄溶液(50mM Tris−HCl、0.14M NaCl、0.05%Tween 20)で3回洗浄した。ウェルを上下逆にしてペーパータオル上に叩きつけることによって残存液を全て除去した。200μLの1%ミルク入りPBSを各ウェルに添加し、ウェルをRTで1時間温置した。次いでウェルを前と同じように洗浄し、前と同じように残存液を全て除去した。1%ミルク入りPBS中で標準物質を250ng/mLに希釈した。次に、400μLの250ng/mL溶液を400μLの1%ミルク入りPBSに加えて希釈し、125ng/mLの溶液を得た。2倍希釈をさらに5回繰り返し、62.5ng/mL、31.25ng/mL、15.625ng/mL、7.8125ng/mL及び3.90625ng/mLの溶液を得た。100μLの標準物質を3つ組で適切なウェルに添加した。100μLの対照及び試料を2つ組で適切なウェルに添加した。これらのウェルを接着ストリップで覆い、RTで1時間温置した。接着ストリップを取り外し、BioTek ELx50プレート洗浄器を用いて300μLの洗浄溶液でウェルを5回洗浄した。前と同じように残存液を全て除去した。1%ミルク入りPBS中でHRP複合物を480ng/mLになるように希釈した。次に、100μLの希釈HRP複合物を各ウェルに添加した。これらのウェルを接着ストリップで覆い、RTで1時間温置した。接着ストリップを取り外し、前と同じようにウェルを洗浄した。
【0149】
前と同じように残存液を全て除去した。100μLの1−Step Ultra TMB ELISA(Thermo Scientific、カタログ番号34028)を各ウェルに添加した。これらのウェルをアルミホイルで覆い、RTで2.75分間温置した。TMB基質に対する停止試薬100μL(Sigma、カタログ番号S5814−100mL)を各ウェルに添加した。BioTek Synergy2プレートリーダー及びBioTek Gen5ソフトウェアを用いてプレートを450nmで読み取った。図6は、IAI感染(n=14)対非感染患者(n=95)における、A1AGの自然対数値を示す箱ひげ図を示す。
【0150】
CVF検体中のA1AGの定量。Gen5ソフトウェアを用いて、標準曲線を作成するために4パラメータ非線形回帰分析を行った。次いでこの標準曲線を使用して、免疫アッセイキットでのCVF検体の測定においてA1AGの濃度を計算した。CVF検体中のA1AGの最終濃度を計算するため、最初の検体希釈を考慮にいれるために、計算した濃度に200を乗じた。3.90625ng/mLの標準物質のOD450読み取り値よりもOD450読み取り値が低かった検体は全て、濃度を3.90625ng/mLとし、これに200を乗じた。
【0151】
250ng/mLの標準的物質のOD450読み取り値よりもOD450読み取り値が高い検体は全て、より高い希釈率で希釈し、そのキットで再び測定した。次いで、下記のとおり統計学的方法を用いてデータを解析した。
【0152】
CVF検体中のMIP−1β、AFP、B2MG、MCP−1、TIMP−1及びVCAM−1の検出及び定量
多重免疫アッセイ技術(Luminex xMAP)を用いてCVF検体中のMIP−1β、AFP、B2MG、MCP−1、TIMP−1及びVCAM−1の濃度を測定するために、外部検査実験室(Rules Based Medicine)と契約を結んだ。次に、下記のとおり、統計学的方法を用いて、この検査実験室により提供されたデータを解析した。図2は、IAI感染(n=14)対非感染患者(n=95)における、MIP 1bの自然対数値を示す箱ひげ図を示す。図3は、IAI感染(n=14)対非感染患者(n=95)における、MCP−1の自然対数値を示す箱ひげ図を示す。図4は、IAI感染(n=14)対非感染患者(n=95)における、B2MGの自然対数値を示す箱ひげ図を示す。図5は、IAI感染(n=14)対非感染患者(n=95)における、TIMP−1の自然対数値を示す箱ひげ図を示す。IAI感染(n=14)対非感染患者(n=95)における、AFPの自然対数値を示す箱ひげ図は図9で示す。IAI感染(n=14)対非感染患者(n=95)における、VCAM−1の自然対数値を示す箱ひげ図を図10で示す。
【0153】
データの統計学的解析。次のように個々のバイオマーカー比較を行った:複合参照定義を介して判定された感染状態対象対非感染状態の対象を群分けした。外れ値の影響を低下させるために自然対数変換データを用いて、群間比較を行うための一元配置ANOVAを行った。次にWilcoxinの順位付けに基づく(rank−based)検定を行って群間で比較した。最後に、判別能力を評価するために受信者動作特性(ROC)曲線を作成した。
【0154】
ロジスティック回帰を用いてバイオマーカーをモデルに組み合わせた。Wilcoxin検定においてp<0.20であったマーカーを、多重マーカーモデルにおいて検討した。モデルベースのROC曲線を作成し、多重マーカーモデルに対して個々のマーカーについての性能を比較するために使用した。ROC曲線下面積を最大にし、80%感度及び特異性の最低限受容可能な基準に曲線が確実に合致するようにすることが目的であった。有望なモデルに基づき、リスクスコアを算出した。リスクスコアにおける閾値は多重マーカーモデルの感度/特異性を最大化するものを選択した。
【0155】
10種類のバイオマーカーに対する個々の受信者動作特性曲線下の面積を表2で示す(「AUROC」の列)。図11及び12で示されるIAI対非IAIの判別のためのロジスティック回帰モデルを確立するために、他のバイオマーカーと組み合わせてこれらのマーカーを使用した。このモデルにおける各マーカーに対するパラメータを下記表3で示す。多重マーカーモデルにおいて行ったバイオマーカーの様々な組み合わせは、ある程度、個々のモデル性能を上回る。
表2.羊膜内感染の予測に関連する個々のバイオマーカーに対するAUROC及びp−値

表3.最尤推定値の解析

【実施例2】
【0156】
羊膜内感染に対するリスクを有するものとして患者を分類するために個々のバイオマーカー濃度に対するカットオフを使用することができるか否かを評価するために、CVFバイオマーカーに対する開発セットデータ(development set data)を解析した。個々のCVFバイオマーカー濃度は、質量単位として直接表すか又はこれらの質量単位の正規化値として表す。個々のバイオマーカーに対して及びバイオマーカーの組み合わせに対して、定量値を解析した。カットオフアプローチにより、ラテラルフロー装置としてCVF IAI試験を形式化することができる。ラテラルフロー方式において、ラテラルフローリーダーにおけるバンド強度を測定することによって、バイオマーカーレベルが定量的にスコア化される。
【0157】
xMAP(商標)技術に基づく個別解析用(single−analyte)ELISA及び多重液体ビーズアレイの組み合わせを使用して、IAIのバイオマーカーを特定した。ProteoGenix IAI Specimen Banking Trialにおいて、IAI有病率が15%であるヒト頸管膣分泌液検体のコホート(N=112)を集めた。羊膜内感染状態を定めるために、好気性、嫌気性及びマイコプラズマ培養によって、ならびに自社の16S rDNA PCR試験を用いて、これらの対象からの羊水を試験した。ロジスティック回帰分析、ならびに主成分分析を用いて、非IAI患者とIAI患者を判別することが可能な上位8種類のCVFバイオマーカーを選択するために、CVFにおけるELISA及びxMAP(商標)免疫アッセイデータを解析した。これらの8種類のバイオマーカーから、本発明に従い、最後の3種類を選択した。
【0158】
ラテラルフロー読み取りを模擬再現するために、ELISA実験からのデータを使用した。IAIに対するリスクを評価するための補助手段としてCVF IAI試験を使用することが目的なので、カットオフは感度を最大化するように選択した。IAIの診断を確認するために、羊水グルコース、グラム染色又は培養などの他の一般に利用可能な試験を使用し得る。このカットオフアプローチにより、PG−IAI試験の結果を感染に対する高リスク又は低リスクなど二元的な結果として報告することが可能になる。
【0159】
現時点での最良モデルでは、僅か2種類のバイオマーカー、すなわちα−胎児性タンパク質及びIL−6の質量濃度を使用する。検出可能なアルブミンが存在しないか(6/298)又は溶血が大きい(11/292)患者検体をデータセットから排除した。培養又は16S rDNAの複合参照標準物質に基づくと、このデータセットにおいて23例の感染例及び258例の非感染例があった。
【0160】
結果を図13及び14で示す。バイオマーカー濃度を対数変換し、Zスコアを計算した。このELISAデータセットにおいて1.0のZスコア合計カットオフを使用した。この2種類のバイオマーカーのZスコアの合計を定め、順位付けしてカットオフを定めた。感度は82%、特異性は85%、PPVは33%及びNPVは98%であった。AUROCは0.86であった。
【0161】
前記2種類のバイオマーカーリスク因子パネルに対するゲートキーパーとなる、さらなるCVFバイオマーカー、インスリン増殖因子結合タンパク質−1(IGFBP−1)を特定した。IGFBP−1バイオマーカーはIAIに対する診断用ではないが、(複合参照標準に基づき)多くのIAI偽陽性結果を排除し、PG−IAIリスク因子試験の特異性を顕著に向上させる。
【0162】
IGFBP−1は、胎膜の破裂を検出するための頸管膣分泌液中のバイオマーカーとして使用されている(AmnioSure Test;Medix Biochemica actim(商標)Prom Test)。IGFBP−1の濃度は、羊水中では頸管膣分泌液よりも1000から10,000倍高い。ProteoGenixコホートにおいて、早期破水(PROM)がないことは、羊歯状結晶試験(Fern)、ニトラジン、液体貯留(pooling)及び/又はAmnioSure検査が陰性であることにより確認した。下記のカプラン−マイヤーグラフで示されるように、CVF IGFBP1の濃度が3μg/mLより高い値であることは、非IAIの早産と一致する。結果を図15で示す。
【0163】
検出可能なアルブミン(6/298)がなく、溶血が大きいか(11/292)又はIGFBP1濃度が3μg/mLより高い(15/281)患者検体をデータセットから排除した。培養及び/又は16S rDNAの複合参照標準に基づくと、このデータセットにおいて、23例の感染例及び243例の非感染例があった。この2種類の診断バイオマーカー濃度を対数変換し、Zスコアを計算した。1.0のZスコア合計カットオフを使用した。この2種類のバイオマーカーのZスコアの合計を定め、順位付けしてカットオフを定めた。感度は82%、特異性は89%、PPVは41%及びNPVは98%であった。AUROCは0.86から0.89に上昇した。38例の偽陽性患者検体のうち11例(29%)が排除され、その結果、特異性が85%から89%に上昇し、PPVが33%から41%に上昇した。N=266の患者コホートにおいて、17%が高リスクスコアを有した。結果を図16及び17に示す。
【0164】
前述の発明を明確にし、理解可能にするためにある程度詳細に説明してきたが、本発明の真の範囲から逸脱することなく形態及び詳細の様々な変更が行われ得ることは、本開示を読むことから当業者にとって明らかとなろう。例えば、上記の技術及び機器を様々な組み合わせで使用することができる。本願で引用する、全ての刊行物、特許、特許願書及び/又はその他の書類は、各々の刊行物、特許、特許願書及び/又はその他の書類が、全目的のために参照により組み込まれるものであることが個々に示されるかのように、同じ程度、全目的のために参照により組み込まれる
【特許請求の範囲】
【請求項1】
(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の対応するレベルに対して、該2以上のタンパク質のレベルを妊娠雌哺乳動物対象から得られた頸管膣分泌液の試料中で測定することと、
(b)該試料中の各該2以上のタンパク質の該レベルのそれぞれが、該正常頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、
を含む、妊娠雌哺乳動物対象における羊膜内感染の診断のための方法。
【請求項2】
前記2以上のタンパク質がα−胎児性タンパク質(AFP)及びインターロイキン−6(IL−6)を含む、請求項1に記載の方法であって、前記対象から得られた頸管膣分泌液の試料中でIGF−結合タンパク質−1(IGFBP−1)レベルを測定することと;
(b)該試料中のAFP、IL−6及びIGFBP−1のそれぞれの該レベルのそれぞれが、該正常頸管膣分泌液中のAFP、IL−6及びIGFBP−1のそれぞれの対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中のAFP、IL−6及びIGFBP−1のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、
をさらに含む、請求項1に記載の方法。
【請求項3】
前記対象がヒト患者である、請求項1又は請求項2に記載の方法。
【請求項4】
前記タンパク質のうち少なくとも3種類の存在量を試験することを含む、請求項1に記載の方法。
【請求項5】
前記タンパク質のうち少なくとも4種類の存在量を試験することを含む、請求項1又は請求項2に記載の方法。
【請求項6】
マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のレベルを測定することと、該試料中の該2以上の選択されたタンパク質の該レベルのそれぞれが、正常頸管膣分泌液中の2以上の選択されたタンパク質のそれぞれの対応するレベルに対して頸管膣分泌液試料中で統計学的有意差を示す場合、該対象を羊膜内感染と診断することと、を含む、請求項1に記載の方法。
【請求項7】
前記試料中の該タンパク質全てのレベルが、前記正常頸管膣分泌液中の前記タンパク質の対応するレベルに対して、頸管膣分泌液試料中で統計学的有意差を示す場合、前記対象を羊膜内感染と診断することを含む、請求項6に記載の方法。
【請求項8】
免疫アッセイ、タンパク質アレイ、免疫クロマトグラフィー試験、質量分析又はそれらの組み合わせの使用を含む方法によって前記レベルが測定される、請求項1から7の何れかに記載の方法。
【請求項9】
前記レベルが、ラテラルフロー装置を使用した免疫クロマトグラフィー試験を用いて測定される、請求項8に記載の方法。
【請求項10】
増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための抗体及び試薬を含む、免疫アッセイキット。
【請求項11】
増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、IGF結合タンパク質−1(IGFBP−1)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される3以上のタンパク質の検出のための抗体及び試薬を含む、免疫アッセイキット。
【請求項12】
マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための抗体及び試薬を含む、免疫アッセイキット。
【請求項13】
前記タンパク質の全ての検出のための抗体及び試薬を含む、請求項10から12の何れかに記載の免疫アッセイキット。
【請求項14】
α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)の検出のための抗体及び試薬を含む免疫アッセイキット。
【請求項15】
α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)の検出のための1以上のクロマトグラフィーストリップを含む、免疫クロマトグラフィー試験装置。
【請求項16】
前記試験ストリップが、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)に対する抗体を含む、請求項15に記載の免疫クロマトグラフィー試験装置。
【請求項17】
ラテラルフロー装置である、請求項15又は請求項16に記載の免疫クロマトグラフィー試験装置。
【請求項18】
増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための2以上のクロマトグラフィーストリップを含む、免疫クロマトグラフィー試験装置。
【請求項19】
前記試験ストリップが、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質に対する抗体を含む、請求項18に記載の免疫クロマトグラフィー試験装置。
【請求項20】
ラテラルフロー装置である、請求項19に記載の免疫クロマトグラフィー試験装置。
【請求項21】
増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、IGF結合タンパク質−1(IGFBP−1)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される3以上のタンパク質の検出のための3以上のクロマトグラフィーストリップを含む、免疫クロマトグラフィー試験装置。
【請求項22】
前記試験ストリップが、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、IGF結合タンパク質−1(IGFBP−1)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される3以上のタンパク質に対する抗体を含む、請求項21に記載の免疫クロマトグラフィー試験装置。
【請求項23】
ラテラルフロー装置である、請求項22に記載の免疫クロマトグラフィー試験装置。
【請求項24】
マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための2以上のクロマトグラフィーストリップを含む、免疫クロマトグラフィー試験装置。
【請求項25】
前記試験ストリップが、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質に対する抗体を含む、請求項24に記載の免疫クロマトグラフィー試験装置。
【請求項26】
ラテラルフロー装置である、請求項25に記載の免疫クロマトグラフィー試験装置。
【請求項27】
(a)正常頸管膣分泌液中の増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の対応するレベルに対して、又は羊膜内感染を示すことが分かっている頸管膣分泌液の該2以上のタンパク質の対応するレベルに対して、前記対象から得られる頸管膣分泌液の試料中で該2以上のタンパク質のレベルを測定することと、
(b)該試料中の該2以上のタンパク質の該レベルのそれぞれが、該正常頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、
を含む、羊膜内感染を示す徴候及び症状を調べるための方法。
【請求項28】
前記徴候及び症状が、母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体及び/又は胎児の頻脈、子宮圧痛及び/又は羊水の悪臭を含む、請求項27に記載の方法。
【請求項29】
マクロファージ炎症性タンパク質1β(MIP1b)及びα−1−酸性糖タンパク質(A1AG)のレベルを測定することと、正常頸管膣分泌液中のMIP1b及びA1AGの対応するレベルに対して頸管膣分泌液試料中でMIP1b及びA1AGの該レベルがそれぞれ統計学的有意差を示す場合、前記対象を羊膜内感染と診断することとを含む、請求項1に記載の方法。
【請求項30】
マクロファージ炎症性タンパク質1β(MIP1b)及び増殖調節癌遺伝子α(GRO−a)のレベルを測定することと、正常頸管膣分泌液中のMIP1b及びGRO−aの対応するレベルに対して、頸管膣分泌液試料中でMIP1b及びGRO−aの該レベルが統計学的有意差を示す場合、前記対象を羊膜内感染と診断することとを含む、請求項1に記載の方法。
【請求項31】
α−1−酸性糖タンパク質(A1AG)及び増殖調節癌遺伝子α(GRO−a)のレベルを測定することと、正常頸管膣分泌液中のA1AG及びGRO−aの対応するレベルに対して、頸管膣分泌液試料中でA1AG及びGRO−aの該レベルが統計学的有意差を示す場合、前記対象を羊膜内感染と診断することとを含む、請求項1に記載の方法。
【請求項32】
(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中のα−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF−結合タンパク質−1(IGFBP−1)のレベルに対して、前記対象から得られる頸管膣分泌液の試料中でAFP、IL−6及びIGFBP−1のレベルを測定することと、
(b)該試料中のAFP、IL−6及びIGFBP−1の該レベルのそれぞれが、該正常頸管膣分泌液中のAFP、IL−6及びIGFBP−1の対応するレベルに対して統計学的有意差を示すと判断されるか、又は羊膜内感染を示すことが分かっている該頸管膣分泌液中のAFP、IL−6及びIGFBP−1の対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、
を含む、羊膜内感染を示す徴候及び症状を調べるための方法。
【請求項33】
徴候及び症状が、母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体及び/又は胎児の頻脈、子宮圧痛及び/又は羊水の悪臭を含む、請求項32に記載の方法。
【請求項1】
(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中の、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の対応するレベルに対して、該2以上のタンパク質のレベルを妊娠雌哺乳動物対象から得られた頸管膣分泌液の試料中で測定することと、
(b)該試料中の各該2以上のタンパク質の該レベルのそれぞれが、該正常頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、
を含む、妊娠雌哺乳動物対象における羊膜内感染の診断のための方法。
【請求項2】
前記2以上のタンパク質がα−胎児性タンパク質(AFP)及びインターロイキン−6(IL−6)を含む、請求項1に記載の方法であって、前記対象から得られた頸管膣分泌液の試料中でIGF−結合タンパク質−1(IGFBP−1)レベルを測定することと;
(b)該試料中のAFP、IL−6及びIGFBP−1のそれぞれの該レベルのそれぞれが、該正常頸管膣分泌液中のAFP、IL−6及びIGFBP−1のそれぞれの対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中のAFP、IL−6及びIGFBP−1のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、
をさらに含む、請求項1に記載の方法。
【請求項3】
前記対象がヒト患者である、請求項1又は請求項2に記載の方法。
【請求項4】
前記タンパク質のうち少なくとも3種類の存在量を試験することを含む、請求項1に記載の方法。
【請求項5】
前記タンパク質のうち少なくとも4種類の存在量を試験することを含む、請求項1又は請求項2に記載の方法。
【請求項6】
マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質のレベルを測定することと、該試料中の該2以上の選択されたタンパク質の該レベルのそれぞれが、正常頸管膣分泌液中の2以上の選択されたタンパク質のそれぞれの対応するレベルに対して頸管膣分泌液試料中で統計学的有意差を示す場合、該対象を羊膜内感染と診断することと、を含む、請求項1に記載の方法。
【請求項7】
前記試料中の該タンパク質全てのレベルが、前記正常頸管膣分泌液中の前記タンパク質の対応するレベルに対して、頸管膣分泌液試料中で統計学的有意差を示す場合、前記対象を羊膜内感染と診断することを含む、請求項6に記載の方法。
【請求項8】
免疫アッセイ、タンパク質アレイ、免疫クロマトグラフィー試験、質量分析又はそれらの組み合わせの使用を含む方法によって前記レベルが測定される、請求項1から7の何れかに記載の方法。
【請求項9】
前記レベルが、ラテラルフロー装置を使用した免疫クロマトグラフィー試験を用いて測定される、請求項8に記載の方法。
【請求項10】
増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための抗体及び試薬を含む、免疫アッセイキット。
【請求項11】
増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、IGF結合タンパク質−1(IGFBP−1)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される3以上のタンパク質の検出のための抗体及び試薬を含む、免疫アッセイキット。
【請求項12】
マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための抗体及び試薬を含む、免疫アッセイキット。
【請求項13】
前記タンパク質の全ての検出のための抗体及び試薬を含む、請求項10から12の何れかに記載の免疫アッセイキット。
【請求項14】
α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)の検出のための抗体及び試薬を含む免疫アッセイキット。
【請求項15】
α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)の検出のための1以上のクロマトグラフィーストリップを含む、免疫クロマトグラフィー試験装置。
【請求項16】
前記試験ストリップが、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF結合タンパク質−1(IGFBP−1)に対する抗体を含む、請求項15に記載の免疫クロマトグラフィー試験装置。
【請求項17】
ラテラルフロー装置である、請求項15又は請求項16に記載の免疫クロマトグラフィー試験装置。
【請求項18】
増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための2以上のクロマトグラフィーストリップを含む、免疫クロマトグラフィー試験装置。
【請求項19】
前記試験ストリップが、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質に対する抗体を含む、請求項18に記載の免疫クロマトグラフィー試験装置。
【請求項20】
ラテラルフロー装置である、請求項19に記載の免疫クロマトグラフィー試験装置。
【請求項21】
増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、IGF結合タンパク質−1(IGFBP−1)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される3以上のタンパク質の検出のための3以上のクロマトグラフィーストリップを含む、免疫クロマトグラフィー試験装置。
【請求項22】
前記試験ストリップが、増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、IGF結合タンパク質−1(IGFBP−1)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される3以上のタンパク質に対する抗体を含む、請求項21に記載の免疫クロマトグラフィー試験装置。
【請求項23】
ラテラルフロー装置である、請求項22に記載の免疫クロマトグラフィー試験装置。
【請求項24】
マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の検出のための2以上のクロマトグラフィーストリップを含む、免疫クロマトグラフィー試験装置。
【請求項25】
前記試験ストリップが、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質に対する抗体を含む、請求項24に記載の免疫クロマトグラフィー試験装置。
【請求項26】
ラテラルフロー装置である、請求項25に記載の免疫クロマトグラフィー試験装置。
【請求項27】
(a)正常頸管膣分泌液中の増殖調節癌遺伝子α(GRO−a)、マクロファージ炎症性タンパク質1β(MIP1b)、α−1−酸性糖タンパク質(A1AG)、α−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)、リポ多糖結合タンパク質(LBP)、血管細胞接着分子−1(VCAM−1)、単球走化性ペプチド−1(MCP−1)、β−2−ミクログロブリン(B2MG)及び組織メタロプロテイナーゼ阻害物質−1(TIMP−1)からなる群から選択される2以上のタンパク質の対応するレベルに対して、又は羊膜内感染を示すことが分かっている頸管膣分泌液の該2以上のタンパク質の対応するレベルに対して、前記対象から得られる頸管膣分泌液の試料中で該2以上のタンパク質のレベルを測定することと、
(b)該試料中の該2以上のタンパク質の該レベルのそれぞれが、該正常頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示すと判断されるか又は羊膜内感染を示すことが分かっている該頸管膣分泌液中の該2以上のタンパク質のそれぞれの対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、
を含む、羊膜内感染を示す徴候及び症状を調べるための方法。
【請求項28】
前記徴候及び症状が、母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体及び/又は胎児の頻脈、子宮圧痛及び/又は羊水の悪臭を含む、請求項27に記載の方法。
【請求項29】
マクロファージ炎症性タンパク質1β(MIP1b)及びα−1−酸性糖タンパク質(A1AG)のレベルを測定することと、正常頸管膣分泌液中のMIP1b及びA1AGの対応するレベルに対して頸管膣分泌液試料中でMIP1b及びA1AGの該レベルがそれぞれ統計学的有意差を示す場合、前記対象を羊膜内感染と診断することとを含む、請求項1に記載の方法。
【請求項30】
マクロファージ炎症性タンパク質1β(MIP1b)及び増殖調節癌遺伝子α(GRO−a)のレベルを測定することと、正常頸管膣分泌液中のMIP1b及びGRO−aの対応するレベルに対して、頸管膣分泌液試料中でMIP1b及びGRO−aの該レベルが統計学的有意差を示す場合、前記対象を羊膜内感染と診断することとを含む、請求項1に記載の方法。
【請求項31】
α−1−酸性糖タンパク質(A1AG)及び増殖調節癌遺伝子α(GRO−a)のレベルを測定することと、正常頸管膣分泌液中のA1AG及びGRO−aの対応するレベルに対して、頸管膣分泌液試料中でA1AG及びGRO−aの該レベルが統計学的有意差を示す場合、前記対象を羊膜内感染と診断することとを含む、請求項1に記載の方法。
【請求項32】
(a)正常頸管膣分泌液又は羊膜内感染を示すことが分かっている頸管膣分泌液中のα−胎児性タンパク質(AFP)、インターロイキン−6(IL−6)及びIGF−結合タンパク質−1(IGFBP−1)のレベルに対して、前記対象から得られる頸管膣分泌液の試料中でAFP、IL−6及びIGFBP−1のレベルを測定することと、
(b)該試料中のAFP、IL−6及びIGFBP−1の該レベルのそれぞれが、該正常頸管膣分泌液中のAFP、IL−6及びIGFBP−1の対応するレベルに対して統計学的有意差を示すと判断されるか、又は羊膜内感染を示すことが分かっている該頸管膣分泌液中のAFP、IL−6及びIGFBP−1の対応するレベルに対して統計学的有意差を示さないと判断される場合、該対象を羊膜内感染と診断することと、
を含む、羊膜内感染を示す徴候及び症状を調べるための方法。
【請求項33】
徴候及び症状が、母体発熱(≧37.8℃)、母体白血球増加(≧15,000/mm3)、母体及び/又は胎児の頻脈、子宮圧痛及び/又は羊水の悪臭を含む、請求項32に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公表番号】特表2013−512434(P2013−512434A)
【公表日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願番号】特願2012−541067(P2012−541067)
【出願日】平成22年11月22日(2010.11.22)
【国際出願番号】PCT/US2010/003052
【国際公開番号】WO2011/065976
【国際公開日】平成23年6月3日(2011.6.3)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.フロッピー
【出願人】(595166549)ホロジック,インコーポレイテッド (2)
【氏名又は名称原語表記】HOLOGIC,INC.
【Fターム(参考)】
【公表日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願日】平成22年11月22日(2010.11.22)
【国際出願番号】PCT/US2010/003052
【国際公開番号】WO2011/065976
【国際公開日】平成23年6月3日(2011.6.3)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.フロッピー
【出願人】(595166549)ホロジック,インコーポレイテッド (2)
【氏名又は名称原語表記】HOLOGIC,INC.
【Fターム(参考)】
[ Back to top ]

