耐アルカリ性バチルスハロデュランス菌より組成を制御可能なキシロオリゴ糖を製造する方法
【課題】耐アルカリ性バチルスハロデュランス菌より組成を制御可能なキシロオリゴ糖を製造する方法の提供。
【解決手段】本発明は耐アルカリ性バチルスハロデュランス菌(Bacillus halodurans)より制御可能な組成のキシロオリゴ糖を製造する方法を提供し、それによると、植物材料を利用して耐アルカリ性バチルスハロデュランス菌を培養して、耐アルカリ性、耐高温のキシラナーゼを取得し、さらに該キシリナーゼとキシラン原料を反応させてキシロオリゴ糖を得る。並びに該植物材料の違いを利用し、異なるキシロオリゴ糖組成の最終製品を得られる。該植物材料は、カバ材、トウモロコシの穂軸、フスマ、サトウキビバガス、藁、アルカリ処理フスマ、或いはこれらの任意の組合せとされる。
【解決手段】本発明は耐アルカリ性バチルスハロデュランス菌(Bacillus halodurans)より制御可能な組成のキシロオリゴ糖を製造する方法を提供し、それによると、植物材料を利用して耐アルカリ性バチルスハロデュランス菌を培養して、耐アルカリ性、耐高温のキシラナーゼを取得し、さらに該キシリナーゼとキシラン原料を反応させてキシロオリゴ糖を得る。並びに該植物材料の違いを利用し、異なるキシロオリゴ糖組成の最終製品を得られる。該植物材料は、カバ材、トウモロコシの穂軸、フスマ、サトウキビバガス、藁、アルカリ処理フスマ、或いはこれらの任意の組合せとされる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、一種のキシロオリゴ糖の製造方法に係り、特に一種の、異なるキシロオリゴ糖の組成比を制御可能である製造方法に関する。
【背景技術】
【0002】
一般にオリゴ糖の長所は、腸内微生物群を改善し、腸内腐敗物質の発生を減らし、血液内脂質過多を改善し、コレステロールを減らし、便秘現象を減らし、虫歯を防止し、免疫賦活性を増強し、カルシウムの吸収を促進する、等である。キシロオリゴ糖とフラクトオリゴ糖、ガラクトオリゴ糖、異麦芽オリゴ糖等は低消化性オリゴ糖に属し、人体が代謝できないが、多種類の機能特性を有し、例えば、腸内ビフィルス菌を増殖させ、虫歯を引き起こしにくい。このためそれは腸のプロバイオティクス、特にビフィズス菌及び乳酸桿菌を増殖させることができ、これらのオリゴ糖はプレバイオティクス(prebiotics)に属し、プロバイオティクスの生長を促進する物質である。
【0003】
キシロオリゴ糖(xylooligosaccharide) は、2〜7個のキシロース(xylose)がグリコシド結合してなるオリゴ糖の総称である。キシロオリゴ糖はオリゴ糖中で、ビフィルス菌を増殖させる機能が最も優れている一種であり、その他の同類のオリゴ糖の5−20倍である。
【0004】
現在市場には、すでにキシロオリゴ糖の製品が市販され、キシロオリゴ糖は植物材料、例えば、フスマ(wheat bran)、トウモロコシの穂軸(corn-cob)より製造される。植物材料の組成中には大量のキシラン(xylan) が含有され、キシラン主鎖上の側鎖は、キシラン以外の糖類、例えばグルクロン酸(glucuronic acid) で組成されている。オリゴ糖(oligosaccharide) の組成中にただキシランと多くの側鎖しかない時、相対的に低重合度のオリゴ糖のみ製造可能である。
【0005】
キシロオリゴ糖の工業上の製造方法は、キシラン(xylan) をキシラナーゼ(xylanase)を利用して分解することで得られ、キシランは植物体内に大量に存在する半セルロースであり、キシラナーゼは前述のキシランを分解できる酵素である。ガーベラの茎と煙草中に長鎖形式のキシランが見られ、且つキシロースのみで組成されている。工業応用上、キシランの形式はアラビノキシラン(arabinoxylan)が主であり、この種のキシランはフスマ或いはトウモロコシの穂軸のような農業副産物中より得られ、グルクロノアラビノキシラン(glucuronoarabinoxylan) は針葉樹材(softwood)中に見られ、グルクロノキシランは広葉樹材(hardwood)中に見られる。工業上、これらのキシランを含有する糖類の応用は、キシロース以外に、アラビノース(arabinose) 、グルクロン酸、4-O- メチルグルクロン酸、ブドウ糖、半ラクトースが添加される。キシロースとその他の糖類は、その特性がソース植物のタイプにより違いがある。
【0006】
市販されているキシロオリゴ糖製品の組成成分は、主に、キシロバイオース、キシロトリオース及び比較的高い重合度のオリゴ糖とされ、そのうち、キシロバイオース、キシロトリオースは人体のプロバイオティクスを活性化させる最も重要な成分である。工業上、製造コストを下げるために、便宜な原料であるフスマ或いはトウモロコシの穂軸である特定の微生物( 例えば Aspergillus niger、Bacillus halodurans 等) を誘導してこれらの酵素を分泌させ、さらに直接粗酵素液でキシロオリゴ糖に富む原料例えばトウモロコシの穂軸を触媒反応で加水分解してキシロオリゴ糖となす。
【0007】
前述のキシロオリゴ糖はキシロース数の異なる低重合糖混合物であり、異なるキシロース数で構成されたキシロオリゴ糖はその機能性も異なる。一般に、キシロオリゴ糖の乳酸菌とビフィズス菌に対する培養効果はキシロースの数が少ないキシロオリゴ糖ほど良好であり、キシロース数が多いほどキシロオリゴ糖の利用率は漸減する。最近の研究によると、ラクトバチルス ブレビス菌(Lactobacillus brevis)はキシロビオース(xylobiose) を好み、ビフィドバクテリウム‐アドレッセンティス菌(Bifidobacterium adolescentis)はキシロトリオース(xylotriose)及びキシロテトラオース(xylotetraose)を偏好する(非特許文献1)。このほかの研究は、ビフィドバクテリウム‐アドレッセンティス菌のキシロオリゴ糖に対する利用性が、キシロトリオースが最良であり、その次に、キシロトリオースが良いことを示し(非特許文献2)、ビフィドバクテリウム‐アドレッセンティス菌を24時間培養した後に、全体のキシロオリゴ糖に対する利用率は77%であり、各組成の利用率は、キシロトリオースが90%で、キシロバイオースが84%、キシロテトラオースが83%で、キシロペンタオース(xylopentaose)が71%であった。ビフィドバクテリウム‐アドレッセンティス菌はキシロオリゴ糖のある環境下で、繁殖速度はその他のビフィズス菌B.Longum,B.infantis, and B.breveより遥かに高い。キシロオリゴ糖中のキシロースは、効果はキシロオリゴ糖のように良くはないが、ビフィルス菌により消化利用され得る。さらにキシロースはグリコニュートリエント(糖鎖栄養素)の8つの成分のうちの一つであり、抗細菌と抗黴菌の機能を有し、特に、グラム陰性菌及び白色連鎖球菌に対抗し、また、腸内プロバイオティクスの生長を助ける。
【0008】
キシランはアルカリ性環境下での可溶性が最高であり、また、キシラナーゼは応用中に実行する前処理過程が、通常高温過程を経る必要があり、ゆえに、アルカリ性環境下で活性を喪失せず、及び、耐アルカリ性で、耐高温のキシラナーゼを取得できることは明かに最も重要である。
【0009】
このため、もし、耐熱耐アルカリ性のキシラナーゼを利用し、さらにキシロオリゴ糖中のキシロース数組成比を制御できる製造方法があれば、異なる用途(例えば異なる種類の乳酸菌の増殖に用いる)の応用に対して、大きく貢献することができる。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】文献名 Moura et al.,LWT-Food Science and Technology,40(2007)963-972
【非特許文献2】文献名 Gullon al.,J.Agric.Food Chem.56(2008) 7482-7487
【発明の概要】
【発明が解決しようとする課題】
【0011】
前述の周知技術の問題を解決するため、本発明の目的は、一種の、キシロオリゴ糖の組成を制御可能なバチルスハロデュランス菌(Bacillus halodurans) を提供することにあり、それはすでに2011年9月26日に中華人民共和国典型培養物保藏中心(CHINA CENTER FOR TYPE CULTURE COLLECTION (CCTCC))に寄託され、その寄託コードはCCTCC M 2011330である。この耐アルカリ性バチルスハロデュランス菌は二種類の耐熱耐アルカリ性キシラナーゼを分泌し得て、該耐熱耐アルカリ性キシラナーゼはキシラナーゼxyn45(SEQ ID NO.:1) 或いはキシラナーゼxyn23(SEQ ID NO.:2) とされる。
【課題を解決するための手段】
【0012】
本発明は前述の耐アルカリ性バチルスハロデュランス菌より組成制御可能なキシロオリゴ糖を製造する方法は、そのステップが、植物材料を使用し高pH値下で耐アルカリ性バチルスハロデュランス菌を培養し、該耐アルカリ性バチルスハロデュランス菌中より酵素組合せを取得し、該酵素組合せはキシラナーゼxyn45(SEQ ID NO.:1) 及びキシラナーゼxyn23(SEQ ID NO.:2) を包含する。該酵素組合せとキシラン(xylan) 原料を酵素反応させ、キシロオリゴ糖を取得し、該キシロオリゴ糖は、キシロール、キシロバイオース、キシロトリオース、重合度4以上のキシラン及びその任意の組合せで組成された群より選択される。該植物材料はカバ材、トウモロコシの穂軸、フスマ、サトウキビバガス、藁、アルカリ処理フスマで組成された群より選択される。該高pH値の範囲は、8〜11とされる。該酵素組合せは、本実施例中では酵素液とされ、それは該耐アルカリ性バチルスハロデュランス菌を遠心処理して上澄み液を得て、該上澄み液を硫酸アンモニウムで沈殿させた後に、再懸濁させ並びに透析して得られた液体である。該キシラン原料は、トウモロコシの穂軸とされる。該酵素反応の条件は、摂氏30〜80度、pH4〜11とされる。該植物材料がアルカリ処理されたフスマとされる時、該キシロオリゴ糖中のキシロバイオースの比率は32%以上とされる。該植物材料がトウモロコシの穂軸とされる時、該キシロオリゴ糖中のキシロバイオースの比率は27%以上とされる。また、酵素反応時間が4時間以内で終わる時、該キシロオリゴ糖中のキシロトリオースの比率は8.6%以上となる。
【発明の効果】
【0013】
本発明の方法により製造されたキシロオリゴ糖は抗細菌、抗黴菌及び腸内プロバイオティクスの生長を助けるという長所のほかに、異なるキシロース数の組成比率を制御できる特色を有し、キシロオリゴ糖のキシロース数比率により異なる種類の乳酸菌保健食品、飲食品中に組み合わせることで、各種のキシロオリゴ糖成分に最大の利用を達成させられる。
【図面の簡単な説明】
【0014】
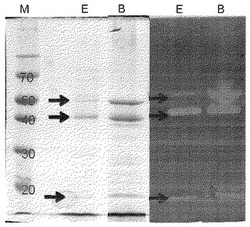
【図1】異なる培地の下で耐アルカリ性バチルスハロデュランス菌の分泌のタンパク質ゲル電気泳動及び酵素活性電気泳動分析結果を示し、EとBはそれぞれカバ材キシラン含有のエマーソン培地とバーグミネラル塩培地での培養を、Mは既知の分子量のマーカーを代表する。
【図2】異なる誘導基質の下で耐アルカリ性バチルスハロデュランス菌の分泌のタンパク質ゲル電気泳動及び酵素活性電気泳動分析結果を示し、C、W及びW1はそれぞれトウモロコシの穂軸、フスマ、及びアルカリ処理したフスマのエマーソン培地、Mは既知の分子量のマーカーを代表する。
【図3】実施例一A中のキシランとキシラナーゼの反応前の基質中の水可溶性成分及び反応後の溶液中の製品のHPLC分析スペクトルを示し、Aはキシランとキシラナーゼ反応前、Bはキシラナーゼ反応4時間後、Cはキシラナーゼ反応24時間後、Dはキシリナーゼ反応47時間後を代表する。
【図4】実施例二中のキシランとキシラナーゼの反応前の基質中の水可溶性成分及び反応15時間後の溶液中の製品のHPLC分析スペクトルであり、Aはキシランとキシラナーゼ反応前、Bはキシラナーゼ反応15時間後を代表する。
【発明を実施するための形態】
【0015】
本発明の技術内容、構造特徴、達成する目的を詳細に説明するため、以下に実施例を挙げて説明する。以下に述べることは、本発明の実施例にすぎず、本発明の実施の範囲を限定するものではなく、本発明の特許請求の範囲に基づきなし得る同等の変化と修飾は、いずれも本発明の権利のカバーする範囲内に属するものとする。
【0016】
本発明は耐アルカリ性バチルスハロデュランス菌(Bacillus halodurans) (寄託コードCCTCC M 2011330)のエンドキシラナーゼ(endo-xylanases)により異なる組成のキシロオリゴ糖を製造する。
【0017】
本発明で使用する耐アルカリ性バチルスハロデュランス菌は、パルプ工場の廃水処理場でスクリーニングして得られ、大量の耐熱耐アルカリ性キシラナーゼを分泌でき、これらキシラナーゼは、それは二種類の活性タンパク質を有し、SDS−PAGE分析ゲル片における所在位置は、45kDaと23kDaであり、このためそれぞれxyn45(SEQ ID NO.:1) とxyn23(SEQ ID NO.:2) と称され、それぞれエンドキシラナーゼ(endo-xylanases)に属する。xyn45 とxyn23yはそれぞれ第10と第11ファミリーのグリコシルヒドロラーゼ(glycosyl hydrolases) に属し、第10ファミリーのグリコシルヒドロラーゼの特性は、分子量が比較的大きく(>30kD) 、酸性pI値(低pI値)に属し、構造が比較的大きく且つ弛緩している。第11ファミリーのグリコシルヒドロラーゼの特性は、分子量が比較的小さく(<30kD) 、アルカリ性pI値(高pI値)に属し、構造が比較的小さく且つ緊密である。xyn45 とxyn23 は広範なpH値と耐高温の応用範囲を有し、摂氏70度でpH4〜11の間でいずれも活性を有する。xyn23 はpH7の時に活性が最高の温度は摂氏60度であるが、摂氏70度の時の活性は最大活性の90%を有する。xyn45 はpH7の時、高活性を示す温度が非常に広く、範囲は摂氏42−75度であり、活性最高の温度は摂氏70度である。総合すると、これら二種類の酵素は摂氏30−80度でいずれも50%以上の活性を有し、最良の温度は摂氏72度である。これら二種類の酵素はpH4〜11でいずれも60%以上の活性を有する。これら二種類のグリコシルヒドロラーゼを単独或いは混合使用すると、いずれもキシランを加水分解して重合度(DP)が比較的小さいオリゴ糖となすことができ、これにより、キシロオリゴ糖を製造するのに用いることのできる理想的なキシラナーゼである。
【0018】
本発明の実施例では、異なる植物材料で耐アルカリ性バチルスハロデュランス菌のキシラナーゼ分泌を誘導し、比率の異なる二種類のキシラナーゼxyn45(SEQ ID NO.:1) とキシラナーゼxyn23(SEQ ID NO.:2) を含む酵素組合せを獲る。その後、同じキシラン原料に作用させて、組成の異なるキシロオリゴ糖を獲る。組成の異なるキシロオリゴ糖はその機能性も異なり、既存の技術において、単一酵素を生物触媒とするのとは異なり、すなわち、本発明は異なる誘導材料により酵素組成を調整することで、異なる組成のキシロオリゴ糖を獲得する製造方法である。
【0019】
耐アルカリ性バチルスハロデュランス菌のキシラナーゼ分泌を誘導する植物材料は、キシランを含有する任意の材料、例えば、カバ材、トウモロコシの穂軸、フスマ、サトウキビバガス、藁、アルカリ処理フスマとされ、好ましくは、カバ材、アルカリ処理されたフスマ、トウモロコシの穂軸、最も好ましくはアルカリ処理されたフスマ及びトウモロコシの穂軸とされる。
【0020】
耐アルカリ性バチルスハロデュランス菌の培養基は通常、基礎培養基例えばエマーソン培地(Emerson medium)或いはバーグミネラル塩培地(Berg's mineral salts medium) に、キシランを加えて組成される。キシランは誘導基質とされ、バチルスハロデュランス菌(Bacillus halodurans) のキシラナーゼ分泌を誘導し、これら二種類の培地(キシランを含有しない)の組成は以下のとおりである。
【0021】
エマーソン培地は、0.55%酵母抽出物(Yeast extract) 、0.5%ペプトン、0.02%の硫酸マグネシウム(MgSO4 )、0.1%のリン酸水素二カリウム(K2 HPO4 )で組成され、さらに1Mの水酸化ナトリウムでpH値が10となるように調整される。
【0022】
バーグミネラル塩培地は、0.2%の硝酸ナトリウム(NaNO3 )、0.1%の酵母抽出物、0.05%のリン酸水素二カリウム、0.02%の硫酸マグネシウム水和物(MgSO4 ・7H2 O)、0.002%の塩化マンガン(MnCl)、0.002%の塩化カルシウム(CaCl2 )で組成される。さらに25%の炭酸ナトリウム(Na2 CO3 )でpH値が10.5となるように調整される。
【0023】
これら二種類の培地に2%カバ材キシラン(Birchwood xylan) を加え、滅菌後に耐アルカリ性バチルスハロデュランス菌を培養し、500 ミリリットル三角フラスコで摂氏37度の培養箱中で200rpmで揺らして120時間培養し、遠心分離により得られた上澄み液を硫酸アンモニウムで90%の飽和度の下で沈殿させ、13000rpmで遠心分離の後の沈殿物を、0.1mM Tris−HClバッファ溶液(pH7.0)で再懸濁させ、得られた酵素液を薄膜(Cellu Sep membranes) で透析した後、タンパク質ゲル電気泳動(SDS−PAGE)及び酵素活性電気泳動(zymogram)を実行し、結果を図1に示した。そのうち、Eはエマーソン培地を代表し、Bはバーグミネラル塩培地を代表し、Mはマーカー(marker)を代表する。
【0024】
図1から分かるように、これら二種類のカバ材キシランを含有する培地はいずれも耐アルカリ性バチルスハロデュランス菌を誘導して、酵素活性を有するキシラナーゼxyn45 とxyn23 を分泌させた。ただし、異なる培地を使用すると得られるタンパク質含有量と酵素活性は異なり、カバ材キシラン含有のバーグミネラル塩培地を使用すると、タンパク質濃度0.5 g/L 、酵素活性(摂氏55度で測定)が53 U/mL であった。カバ材キシラン含有のエマーソン培地を使用すると、タンパク質濃度2.4 g/L 、酵素活性(摂氏55度で測定)が211 U/mLであった。明かに、エマーソン培地を使用することで、比較的多くの酵素タンパク質及びキシラナーゼ活性を得られる。
【0025】
さらにエマーソン培地を基礎とし、それぞれ異なるキシラン原料を使用し、すなわち、2 %トウモロコシの穂軸、フスマ及びアルカリ処理フスマを誘導基質とし、耐アルカリ性バチルスハロデュランス菌を培養してキシラナーゼを分泌させ、得られた酵素液をタンパク質ゲル電気泳動及び酵素活性電気泳動分析した結果を、図2に示した。そのうち、C、W、及びW1はそれぞれトウモロコシの穂軸、フスマ及びアルカリ処理フスマを含むエマーソン培地を代表し、Mは既知の分子量のマーカーとされる。結果は、トウモロコシの穂軸或いはフスマを使用した培地の誘導により得られるキシラナーゼはxyn45 がメインであり、xyn23 のタンパク質点及び活性はいずれも非常に不明確であり、ただし、アルカリ処理したフスマで誘導して得られたキシラナーゼxyn45 とxyn23 はいずれもあり、前述のカバ材キシランの培地と比較すると、得られるxyn23 はさらに明確である。これらの結果から、異なる植物原料の誘導下で、耐アルカリ性バチルスハロデュランス菌の分泌するキシラナーゼxyn45 とxyn23 の比率は顕著に異なることが示された。
【0026】
以下に異なる植物材料の誘導下で耐アルカリ性バチルスハロデュランス菌が分泌するキシラナーゼxyn45 とxyn23 の発生比率を示す。トウモロコシの穂軸で誘導して発生したキシラナーゼxyn45 とxyn23 の比率は90:10であった。カバ材キシランで誘導して発生したキシラナーゼxyn45 とxyn23 の比率は70:30であった。フスマで誘導して発生したキシラナーゼxyn45 とxyn23 の比率は70:30であった。アルカリ処理フスマで誘導して発生したキシラナーゼxyn45 とxyn23 の比率は50:50であった。
【0027】
前述の二種類のキシラナーゼxyn45 とxyn23 の組成比率の違いにより、同じキシラン原料に作用させて得られるキシロオリゴ糖製品組成比率も同じでなく、キシラン原料は任意のキシラン含有の材料、例えばカバ材、トウモロコシの穂軸、フスマ、サトウキビバガス、藁、アルカリ処理フスマとされ、好ましくはフスマ及びトウモロコシの穂軸、最も好ましくはトウモロコシの穂軸とされる。
【0028】
以下に実施例一から三を挙げて本発明についてさらに詳しく説明するが、これらの実施例は明細書の内容を支持するためのもので、本発明の範囲を制限するためのものではない。
【0029】
[実施例一A]
アルカリ処理したフスマを耐アルカリ性バチルスハロデュランス菌のキシラナーゼ分泌を誘導する材料とする。
キシラナーゼの製造:まず耐アルカリ性バチルスハロデュランス菌のキシラナーゼの分泌を誘導する基質を製造する。すなわち、固体−液体比が1対10の方式でフスマと1%の水酸化ナゴリウムを混合し、摂氏121度の高圧釜で10分間滅菌し、その後、純水で洗浄してpH7とし、余剰物を乾燥することでアルカリ処理したフスマを獲る。続いて、250ミリリットルの三角フラスコ(Erlenmeyer flask)に100ミリリットルのエマーソン培地を入れた。該エマーソン培地は、0.55%酵母抽出物、0.5%ペプトン、0.02%硫酸マグネシウム、及び0.1%リン酸水素二カリウムを包含し、さらにpHが10となるように調整されている。2%の上述のアルカリ処理したフスマを加え、全体の混合物を、摂氏121度の高圧釜で30分間滅菌する。三角フラスコを室温まで冷却した後、10%(v/v)の耐アルカリ性バチルスハロデュランス菌を接種し、摂氏37度の培養箱で170rpmで振動して4〜5日培養する。その後、菌液を13000rpmで摂氏4度で30分間遠心分離し、上澄み液を硫酸アンモニウムで90%の飽和度の下で沈殿させ、13000rpmで遠心分離した後の沈殿物を0.1mMのTris−HClバッファ溶液(pH7.0)で再懸濁させ、透析後に粗酵素液となす。この粗酵素液の単位体積の活性は179U/mL(摂氏37度で測定)であった。
キシランの製造:トウモロコシの穂軸を研磨して15%の水酸化ナトリウム(NaOH)で固体−液体比が1対20の下で、摂氏90度で90分間処理し、得られた上澄み液を酢酸(acetic acid) で中和してpH5.0となし、その後、3倍体積の95%のエタノールを加えて60分間浸漬させ、得られた沈殿物はキシランである。このキシランを基質とし、前述のようにして得られたキシラナーゼの作用の下で、キシランを分解してキシロオリゴ糖を発生させる。
キシラナーゼの反応でキシロオリゴ糖を製造する条件:基質用量は2%(w/v)、酵素用量8.95 U/mL、反応温度は摂氏50度、pH 8.0。得られた製品をHPLC(High-performance liquid chromatography)分析した。そのうち、HPLCの機器構造は以下のとおりである。カラム(Column)はBioRad column Aminex HPX-87H(300mm × 7.8mm) 、カラム温度は摂氏65度、検出器(Detector)は屈折率検出器(RI detector) とされる。移動相(Mobile phase)は5mM 硫酸(H2 SO4 )、流速は0.6ml/minとされる。
図3はキシランとキシラナーゼ反応前の基質中の水可溶性成分及び反応後の溶液中の製品のHPLC分析スペクトルであり、図中、A〜Dのスペクトルはそれぞれキシランとキシラナーゼの反応前、反応4時間、反応24時間、反応47時間のスペクトルを代表する。
製品組成の時間に伴う変化は下表のとおりである。
【表1】

*DP1は非キシロースの単糖(アラビノース、ブドウ糖等)を代表する。
**DP>4は重合度が4より大きいキシロオリゴ糖を代表する。
反応前の基質の水可溶成分は7.45 g/Lとされ、いずれも重合度が4より大きいキシロオリゴ糖成分であり、重合度が3より小さいキシロオリゴ糖の存在は無い。反応後に増加する水可溶性キシロオリゴ糖はキシラナーゼが形成する加水分解物とされ、これにより計算して得られた24時間の転化率(キシラナーゼ反応が形成するキシロオリゴ糖生産率)は56.4%であり、47時間では61.5%である。もし、反応前アルカリ処理アルカリ処理で得られる水可溶性キシロオリゴ糖を包含すると、総キシロオリゴ糖生産率は第24時間は93.7%とされ、反応47時間後には98.7%となる。
前述の総キシロオリゴ糖生産率計算方式:基質用量2%(w/v)は20g/Lに相当し、24時間と47時間反応の後のキシロオリゴ糖総量はそれぞれ18.73g/Lと19.74g/Lである。これにより、総キシロオリゴ糖生産率は反応24時間後には18.73/20×100%=93.7%、反応48時間後には19.74/20×100%=98.7%である。
キシラナーゼ反応の時間に伴う変化はキシロトリオースがまず生産され、その後、キシロバイオース濃度が急速に増加し、キシロトリオースは分解されてキシロバイオースとキシロースになり後期に濃度は下降する。反応24時間の後、各オリゴ糖の比率変化は大きくなくなり、反応は緩慢となる。この結果から分かるように、比較的高い比率のキシロトリオースを得ようとすれば、反応は比較的早く(2時間から4時間)終了する必要があり、この時、転化率(キシロオリゴ糖生産率)は少し低いが、平均すると約42.5%ある。
【0030】
[実施例一B]
実施例一Aの酵素液で、濃度試験を行う。
キシラナーゼの製造及びキシランの製造は実施例Aと同じである。
キシラナーゼ反応でキシロオリゴ糖を製造する条件:基質用量は2%(w/v)、酵素用量17.5 U/mL、反応温度は摂氏50度、pH 8.0。得られた製品をHPLC(High-performance liquid chromatography)分析した。
反応15時間の後、製品組成(濃度及び百分率)は以下のとおりである。
【表2】

*DP1は非キシロースの単糖(アラビノース、ブドウ糖等)を代表する。
**DP>4は重合度が4より大きいキシロオリゴ糖を代表する。
実施例一Aと比較すると、キシラナーゼ用量は8.95U/mLから17.5U/mLにアップする。これにより反応速度は比較的速くなり、反応15時間後に実施例一Aの反応24時間後の結果に相当する結果が得られた。最終製品は重合度が4より小さいキシロオリゴ糖中、キシロバイオースが絶大な部分(32%以上)を占め、キシロース及びその他の単糖を合わせてもただ5%しかなく、キシロトリオースは5〜6%の間である。
【0031】
[実施例二]
トウモロコシの穂軸を耐アルカリ性バチルスハロデュランス菌のキシラナーゼ分泌誘導材料となす。
キシラナーゼの製造:250ミリリットルの三角フラスコに100ミリリットルのエマーソン培地を入れる。該エマーソン培地は、0.55%酵母抽出物、0.5%ペプトン、0.02%硫酸マグネシウム、及び0.1%リン酸水素二カリウムを包含し、さらにpHが10となるように調整される。2%の上述のトウモロコシの穂軸粉末を加え、全体の混合物を、摂氏121度の高圧釜で30分間滅菌する。三角フラスコが室温まで冷却された後、10%(v/v)の耐アルカリ性バチルスハロデュランス菌を接種し、摂氏37度の培養箱で170rpmで振動して4〜5日培養する。その後、菌液を13000rpmで摂氏4度で30分間遠心分離し、その上澄み液を硫酸アンモニウムで90%の飽和度の下で沈殿させ、13000rpmで遠心分離した後の沈殿物を0.1mMのTris−HClバッファ溶液(pH7.0)で再懸濁させ、透析後に粗酵素液となす。この粗酵素液の単位体積の活性は128U/mL(摂氏37度で測定)であった。
キシランの製造は実施例一Aと同じである。
キシラナーゼの反応でキシロオリゴ糖を製造する条件:基質用量は2%(w/v)、キシラナーゼ用量は17.5U/mL、反応温度は摂氏50度、pH 8.0。得られた製品をHPLC(High-performance liquid chromatography)分析した。
図4はキシランとキシラナーゼ反応前の基質中の水可溶性成分及び15時間反応後の溶液中の製品のHPLC分析スペクトルであり、図中、Aはキシランとキシラナーゼの反応前、Bはキシラナーゼ反応15時間後のスペクトルである。
反応15時間の後、製品組成(濃度及び百分率)は以下のとおりである。
第1次実験
【表3】

第2次実験
【表4】

*DP1は非キシロースの単糖(アラビノース、ブドウ糖等)を代表する。
**DP>4は重合度が4より大きいキシロオリゴ糖を代表する。
本実施例から分かるように、トウモロコシの穂軸で培養した耐アルカリ性バチルスハロデュランス菌より得られる酵素液でキシランを分解して得られるキシロオリゴ糖成分は、キシロバイオース比率が比較的低く(約27%)、キシロース及びその他の単糖を合わせると比較的高い約9%であり、キシロトリオースは約7%を維持する。
【0032】
[実施例三]
実施例一の酵素液で、キシラナーゼの耐アルカリ性を試験する。
酵素の製造及びキシランの製造は実施例一と同じである。
酵素反応でキシロオリゴ糖を製造する条件:基質用量2% w/v、酵素用量17.9U/mL、反応温度摂氏50度、pH値はそれぞれ9、10及び11である。得られる製品をHPLCで分析する。
反応15時間の後、製品組成(濃度及び百分率)は以下のとおり。
【表5】

*DP1は非キシロースの単糖(アラビノース、ブドウ糖等)を代表する。
**DP>4は重合度が4より大きいキシロオリゴ糖を代表する。
実施例一Bと比較すると、pH値は高くなり反応速度は遅くなり、これにより転化率は下降する。アルカリ処理したフスマで耐アルカリ性バチルスハロデュランス菌を培養して得られる酵素液は、単糖(主にはキシロース)比率が比較的低いが、キシロバイオースのキシロトリオースに対する比率は高pH値での反応時に僅かに下降する。本実施例は酵素はアルカリ条件下でもなおキシロオリゴ糖製造の能力を有することを示す。
実施例一Aから分かるように、アルカリ処理したフスマをキシラナーゼ発生を誘導する植物材料となす時、時間の増加(0〜47時間)に伴い、キシロースとキシロバイオースの比率は増加し、それぞれ1.59〜4.39%及び21.79〜35.65%であり、キシロトリオースの比率は、2時間後の9.58から47時間後の5.31%に漸減する。実施例二でトウモロコシの穂軸をキシラナーゼ発生を誘導する植物材料となし、実施例一B中のその他の条件を同じにした結果と比較すると、トウモロコシの穂軸を使用して発生するキシロースの比率は7.10%と比較的高く、アルカリ処理したフスマではただ3.62%である。トウモロコシの穂軸を使用して発生するキシロバイオースの比率は比較的低く27.47%で、アルカリ処理したフスマは32.24%である。ゆえに、必要により適当な材料を選択することで、必要なキシロース数のキシロオリゴ糖組成比率を達成でき、並びに実施例三の結果により、酵素はアルカリ性環境下で反応できることを示す。
【技術分野】
【0001】
本発明は、一種のキシロオリゴ糖の製造方法に係り、特に一種の、異なるキシロオリゴ糖の組成比を制御可能である製造方法に関する。
【背景技術】
【0002】
一般にオリゴ糖の長所は、腸内微生物群を改善し、腸内腐敗物質の発生を減らし、血液内脂質過多を改善し、コレステロールを減らし、便秘現象を減らし、虫歯を防止し、免疫賦活性を増強し、カルシウムの吸収を促進する、等である。キシロオリゴ糖とフラクトオリゴ糖、ガラクトオリゴ糖、異麦芽オリゴ糖等は低消化性オリゴ糖に属し、人体が代謝できないが、多種類の機能特性を有し、例えば、腸内ビフィルス菌を増殖させ、虫歯を引き起こしにくい。このためそれは腸のプロバイオティクス、特にビフィズス菌及び乳酸桿菌を増殖させることができ、これらのオリゴ糖はプレバイオティクス(prebiotics)に属し、プロバイオティクスの生長を促進する物質である。
【0003】
キシロオリゴ糖(xylooligosaccharide) は、2〜7個のキシロース(xylose)がグリコシド結合してなるオリゴ糖の総称である。キシロオリゴ糖はオリゴ糖中で、ビフィルス菌を増殖させる機能が最も優れている一種であり、その他の同類のオリゴ糖の5−20倍である。
【0004】
現在市場には、すでにキシロオリゴ糖の製品が市販され、キシロオリゴ糖は植物材料、例えば、フスマ(wheat bran)、トウモロコシの穂軸(corn-cob)より製造される。植物材料の組成中には大量のキシラン(xylan) が含有され、キシラン主鎖上の側鎖は、キシラン以外の糖類、例えばグルクロン酸(glucuronic acid) で組成されている。オリゴ糖(oligosaccharide) の組成中にただキシランと多くの側鎖しかない時、相対的に低重合度のオリゴ糖のみ製造可能である。
【0005】
キシロオリゴ糖の工業上の製造方法は、キシラン(xylan) をキシラナーゼ(xylanase)を利用して分解することで得られ、キシランは植物体内に大量に存在する半セルロースであり、キシラナーゼは前述のキシランを分解できる酵素である。ガーベラの茎と煙草中に長鎖形式のキシランが見られ、且つキシロースのみで組成されている。工業応用上、キシランの形式はアラビノキシラン(arabinoxylan)が主であり、この種のキシランはフスマ或いはトウモロコシの穂軸のような農業副産物中より得られ、グルクロノアラビノキシラン(glucuronoarabinoxylan) は針葉樹材(softwood)中に見られ、グルクロノキシランは広葉樹材(hardwood)中に見られる。工業上、これらのキシランを含有する糖類の応用は、キシロース以外に、アラビノース(arabinose) 、グルクロン酸、4-O- メチルグルクロン酸、ブドウ糖、半ラクトースが添加される。キシロースとその他の糖類は、その特性がソース植物のタイプにより違いがある。
【0006】
市販されているキシロオリゴ糖製品の組成成分は、主に、キシロバイオース、キシロトリオース及び比較的高い重合度のオリゴ糖とされ、そのうち、キシロバイオース、キシロトリオースは人体のプロバイオティクスを活性化させる最も重要な成分である。工業上、製造コストを下げるために、便宜な原料であるフスマ或いはトウモロコシの穂軸である特定の微生物( 例えば Aspergillus niger、Bacillus halodurans 等) を誘導してこれらの酵素を分泌させ、さらに直接粗酵素液でキシロオリゴ糖に富む原料例えばトウモロコシの穂軸を触媒反応で加水分解してキシロオリゴ糖となす。
【0007】
前述のキシロオリゴ糖はキシロース数の異なる低重合糖混合物であり、異なるキシロース数で構成されたキシロオリゴ糖はその機能性も異なる。一般に、キシロオリゴ糖の乳酸菌とビフィズス菌に対する培養効果はキシロースの数が少ないキシロオリゴ糖ほど良好であり、キシロース数が多いほどキシロオリゴ糖の利用率は漸減する。最近の研究によると、ラクトバチルス ブレビス菌(Lactobacillus brevis)はキシロビオース(xylobiose) を好み、ビフィドバクテリウム‐アドレッセンティス菌(Bifidobacterium adolescentis)はキシロトリオース(xylotriose)及びキシロテトラオース(xylotetraose)を偏好する(非特許文献1)。このほかの研究は、ビフィドバクテリウム‐アドレッセンティス菌のキシロオリゴ糖に対する利用性が、キシロトリオースが最良であり、その次に、キシロトリオースが良いことを示し(非特許文献2)、ビフィドバクテリウム‐アドレッセンティス菌を24時間培養した後に、全体のキシロオリゴ糖に対する利用率は77%であり、各組成の利用率は、キシロトリオースが90%で、キシロバイオースが84%、キシロテトラオースが83%で、キシロペンタオース(xylopentaose)が71%であった。ビフィドバクテリウム‐アドレッセンティス菌はキシロオリゴ糖のある環境下で、繁殖速度はその他のビフィズス菌B.Longum,B.infantis, and B.breveより遥かに高い。キシロオリゴ糖中のキシロースは、効果はキシロオリゴ糖のように良くはないが、ビフィルス菌により消化利用され得る。さらにキシロースはグリコニュートリエント(糖鎖栄養素)の8つの成分のうちの一つであり、抗細菌と抗黴菌の機能を有し、特に、グラム陰性菌及び白色連鎖球菌に対抗し、また、腸内プロバイオティクスの生長を助ける。
【0008】
キシランはアルカリ性環境下での可溶性が最高であり、また、キシラナーゼは応用中に実行する前処理過程が、通常高温過程を経る必要があり、ゆえに、アルカリ性環境下で活性を喪失せず、及び、耐アルカリ性で、耐高温のキシラナーゼを取得できることは明かに最も重要である。
【0009】
このため、もし、耐熱耐アルカリ性のキシラナーゼを利用し、さらにキシロオリゴ糖中のキシロース数組成比を制御できる製造方法があれば、異なる用途(例えば異なる種類の乳酸菌の増殖に用いる)の応用に対して、大きく貢献することができる。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】文献名 Moura et al.,LWT-Food Science and Technology,40(2007)963-972
【非特許文献2】文献名 Gullon al.,J.Agric.Food Chem.56(2008) 7482-7487
【発明の概要】
【発明が解決しようとする課題】
【0011】
前述の周知技術の問題を解決するため、本発明の目的は、一種の、キシロオリゴ糖の組成を制御可能なバチルスハロデュランス菌(Bacillus halodurans) を提供することにあり、それはすでに2011年9月26日に中華人民共和国典型培養物保藏中心(CHINA CENTER FOR TYPE CULTURE COLLECTION (CCTCC))に寄託され、その寄託コードはCCTCC M 2011330である。この耐アルカリ性バチルスハロデュランス菌は二種類の耐熱耐アルカリ性キシラナーゼを分泌し得て、該耐熱耐アルカリ性キシラナーゼはキシラナーゼxyn45(SEQ ID NO.:1) 或いはキシラナーゼxyn23(SEQ ID NO.:2) とされる。
【課題を解決するための手段】
【0012】
本発明は前述の耐アルカリ性バチルスハロデュランス菌より組成制御可能なキシロオリゴ糖を製造する方法は、そのステップが、植物材料を使用し高pH値下で耐アルカリ性バチルスハロデュランス菌を培養し、該耐アルカリ性バチルスハロデュランス菌中より酵素組合せを取得し、該酵素組合せはキシラナーゼxyn45(SEQ ID NO.:1) 及びキシラナーゼxyn23(SEQ ID NO.:2) を包含する。該酵素組合せとキシラン(xylan) 原料を酵素反応させ、キシロオリゴ糖を取得し、該キシロオリゴ糖は、キシロール、キシロバイオース、キシロトリオース、重合度4以上のキシラン及びその任意の組合せで組成された群より選択される。該植物材料はカバ材、トウモロコシの穂軸、フスマ、サトウキビバガス、藁、アルカリ処理フスマで組成された群より選択される。該高pH値の範囲は、8〜11とされる。該酵素組合せは、本実施例中では酵素液とされ、それは該耐アルカリ性バチルスハロデュランス菌を遠心処理して上澄み液を得て、該上澄み液を硫酸アンモニウムで沈殿させた後に、再懸濁させ並びに透析して得られた液体である。該キシラン原料は、トウモロコシの穂軸とされる。該酵素反応の条件は、摂氏30〜80度、pH4〜11とされる。該植物材料がアルカリ処理されたフスマとされる時、該キシロオリゴ糖中のキシロバイオースの比率は32%以上とされる。該植物材料がトウモロコシの穂軸とされる時、該キシロオリゴ糖中のキシロバイオースの比率は27%以上とされる。また、酵素反応時間が4時間以内で終わる時、該キシロオリゴ糖中のキシロトリオースの比率は8.6%以上となる。
【発明の効果】
【0013】
本発明の方法により製造されたキシロオリゴ糖は抗細菌、抗黴菌及び腸内プロバイオティクスの生長を助けるという長所のほかに、異なるキシロース数の組成比率を制御できる特色を有し、キシロオリゴ糖のキシロース数比率により異なる種類の乳酸菌保健食品、飲食品中に組み合わせることで、各種のキシロオリゴ糖成分に最大の利用を達成させられる。
【図面の簡単な説明】
【0014】
【図1】異なる培地の下で耐アルカリ性バチルスハロデュランス菌の分泌のタンパク質ゲル電気泳動及び酵素活性電気泳動分析結果を示し、EとBはそれぞれカバ材キシラン含有のエマーソン培地とバーグミネラル塩培地での培養を、Mは既知の分子量のマーカーを代表する。
【図2】異なる誘導基質の下で耐アルカリ性バチルスハロデュランス菌の分泌のタンパク質ゲル電気泳動及び酵素活性電気泳動分析結果を示し、C、W及びW1はそれぞれトウモロコシの穂軸、フスマ、及びアルカリ処理したフスマのエマーソン培地、Mは既知の分子量のマーカーを代表する。
【図3】実施例一A中のキシランとキシラナーゼの反応前の基質中の水可溶性成分及び反応後の溶液中の製品のHPLC分析スペクトルを示し、Aはキシランとキシラナーゼ反応前、Bはキシラナーゼ反応4時間後、Cはキシラナーゼ反応24時間後、Dはキシリナーゼ反応47時間後を代表する。
【図4】実施例二中のキシランとキシラナーゼの反応前の基質中の水可溶性成分及び反応15時間後の溶液中の製品のHPLC分析スペクトルであり、Aはキシランとキシラナーゼ反応前、Bはキシラナーゼ反応15時間後を代表する。
【発明を実施するための形態】
【0015】
本発明の技術内容、構造特徴、達成する目的を詳細に説明するため、以下に実施例を挙げて説明する。以下に述べることは、本発明の実施例にすぎず、本発明の実施の範囲を限定するものではなく、本発明の特許請求の範囲に基づきなし得る同等の変化と修飾は、いずれも本発明の権利のカバーする範囲内に属するものとする。
【0016】
本発明は耐アルカリ性バチルスハロデュランス菌(Bacillus halodurans) (寄託コードCCTCC M 2011330)のエンドキシラナーゼ(endo-xylanases)により異なる組成のキシロオリゴ糖を製造する。
【0017】
本発明で使用する耐アルカリ性バチルスハロデュランス菌は、パルプ工場の廃水処理場でスクリーニングして得られ、大量の耐熱耐アルカリ性キシラナーゼを分泌でき、これらキシラナーゼは、それは二種類の活性タンパク質を有し、SDS−PAGE分析ゲル片における所在位置は、45kDaと23kDaであり、このためそれぞれxyn45(SEQ ID NO.:1) とxyn23(SEQ ID NO.:2) と称され、それぞれエンドキシラナーゼ(endo-xylanases)に属する。xyn45 とxyn23yはそれぞれ第10と第11ファミリーのグリコシルヒドロラーゼ(glycosyl hydrolases) に属し、第10ファミリーのグリコシルヒドロラーゼの特性は、分子量が比較的大きく(>30kD) 、酸性pI値(低pI値)に属し、構造が比較的大きく且つ弛緩している。第11ファミリーのグリコシルヒドロラーゼの特性は、分子量が比較的小さく(<30kD) 、アルカリ性pI値(高pI値)に属し、構造が比較的小さく且つ緊密である。xyn45 とxyn23 は広範なpH値と耐高温の応用範囲を有し、摂氏70度でpH4〜11の間でいずれも活性を有する。xyn23 はpH7の時に活性が最高の温度は摂氏60度であるが、摂氏70度の時の活性は最大活性の90%を有する。xyn45 はpH7の時、高活性を示す温度が非常に広く、範囲は摂氏42−75度であり、活性最高の温度は摂氏70度である。総合すると、これら二種類の酵素は摂氏30−80度でいずれも50%以上の活性を有し、最良の温度は摂氏72度である。これら二種類の酵素はpH4〜11でいずれも60%以上の活性を有する。これら二種類のグリコシルヒドロラーゼを単独或いは混合使用すると、いずれもキシランを加水分解して重合度(DP)が比較的小さいオリゴ糖となすことができ、これにより、キシロオリゴ糖を製造するのに用いることのできる理想的なキシラナーゼである。
【0018】
本発明の実施例では、異なる植物材料で耐アルカリ性バチルスハロデュランス菌のキシラナーゼ分泌を誘導し、比率の異なる二種類のキシラナーゼxyn45(SEQ ID NO.:1) とキシラナーゼxyn23(SEQ ID NO.:2) を含む酵素組合せを獲る。その後、同じキシラン原料に作用させて、組成の異なるキシロオリゴ糖を獲る。組成の異なるキシロオリゴ糖はその機能性も異なり、既存の技術において、単一酵素を生物触媒とするのとは異なり、すなわち、本発明は異なる誘導材料により酵素組成を調整することで、異なる組成のキシロオリゴ糖を獲得する製造方法である。
【0019】
耐アルカリ性バチルスハロデュランス菌のキシラナーゼ分泌を誘導する植物材料は、キシランを含有する任意の材料、例えば、カバ材、トウモロコシの穂軸、フスマ、サトウキビバガス、藁、アルカリ処理フスマとされ、好ましくは、カバ材、アルカリ処理されたフスマ、トウモロコシの穂軸、最も好ましくはアルカリ処理されたフスマ及びトウモロコシの穂軸とされる。
【0020】
耐アルカリ性バチルスハロデュランス菌の培養基は通常、基礎培養基例えばエマーソン培地(Emerson medium)或いはバーグミネラル塩培地(Berg's mineral salts medium) に、キシランを加えて組成される。キシランは誘導基質とされ、バチルスハロデュランス菌(Bacillus halodurans) のキシラナーゼ分泌を誘導し、これら二種類の培地(キシランを含有しない)の組成は以下のとおりである。
【0021】
エマーソン培地は、0.55%酵母抽出物(Yeast extract) 、0.5%ペプトン、0.02%の硫酸マグネシウム(MgSO4 )、0.1%のリン酸水素二カリウム(K2 HPO4 )で組成され、さらに1Mの水酸化ナトリウムでpH値が10となるように調整される。
【0022】
バーグミネラル塩培地は、0.2%の硝酸ナトリウム(NaNO3 )、0.1%の酵母抽出物、0.05%のリン酸水素二カリウム、0.02%の硫酸マグネシウム水和物(MgSO4 ・7H2 O)、0.002%の塩化マンガン(MnCl)、0.002%の塩化カルシウム(CaCl2 )で組成される。さらに25%の炭酸ナトリウム(Na2 CO3 )でpH値が10.5となるように調整される。
【0023】
これら二種類の培地に2%カバ材キシラン(Birchwood xylan) を加え、滅菌後に耐アルカリ性バチルスハロデュランス菌を培養し、500 ミリリットル三角フラスコで摂氏37度の培養箱中で200rpmで揺らして120時間培養し、遠心分離により得られた上澄み液を硫酸アンモニウムで90%の飽和度の下で沈殿させ、13000rpmで遠心分離の後の沈殿物を、0.1mM Tris−HClバッファ溶液(pH7.0)で再懸濁させ、得られた酵素液を薄膜(Cellu Sep membranes) で透析した後、タンパク質ゲル電気泳動(SDS−PAGE)及び酵素活性電気泳動(zymogram)を実行し、結果を図1に示した。そのうち、Eはエマーソン培地を代表し、Bはバーグミネラル塩培地を代表し、Mはマーカー(marker)を代表する。
【0024】
図1から分かるように、これら二種類のカバ材キシランを含有する培地はいずれも耐アルカリ性バチルスハロデュランス菌を誘導して、酵素活性を有するキシラナーゼxyn45 とxyn23 を分泌させた。ただし、異なる培地を使用すると得られるタンパク質含有量と酵素活性は異なり、カバ材キシラン含有のバーグミネラル塩培地を使用すると、タンパク質濃度0.5 g/L 、酵素活性(摂氏55度で測定)が53 U/mL であった。カバ材キシラン含有のエマーソン培地を使用すると、タンパク質濃度2.4 g/L 、酵素活性(摂氏55度で測定)が211 U/mLであった。明かに、エマーソン培地を使用することで、比較的多くの酵素タンパク質及びキシラナーゼ活性を得られる。
【0025】
さらにエマーソン培地を基礎とし、それぞれ異なるキシラン原料を使用し、すなわち、2 %トウモロコシの穂軸、フスマ及びアルカリ処理フスマを誘導基質とし、耐アルカリ性バチルスハロデュランス菌を培養してキシラナーゼを分泌させ、得られた酵素液をタンパク質ゲル電気泳動及び酵素活性電気泳動分析した結果を、図2に示した。そのうち、C、W、及びW1はそれぞれトウモロコシの穂軸、フスマ及びアルカリ処理フスマを含むエマーソン培地を代表し、Mは既知の分子量のマーカーとされる。結果は、トウモロコシの穂軸或いはフスマを使用した培地の誘導により得られるキシラナーゼはxyn45 がメインであり、xyn23 のタンパク質点及び活性はいずれも非常に不明確であり、ただし、アルカリ処理したフスマで誘導して得られたキシラナーゼxyn45 とxyn23 はいずれもあり、前述のカバ材キシランの培地と比較すると、得られるxyn23 はさらに明確である。これらの結果から、異なる植物原料の誘導下で、耐アルカリ性バチルスハロデュランス菌の分泌するキシラナーゼxyn45 とxyn23 の比率は顕著に異なることが示された。
【0026】
以下に異なる植物材料の誘導下で耐アルカリ性バチルスハロデュランス菌が分泌するキシラナーゼxyn45 とxyn23 の発生比率を示す。トウモロコシの穂軸で誘導して発生したキシラナーゼxyn45 とxyn23 の比率は90:10であった。カバ材キシランで誘導して発生したキシラナーゼxyn45 とxyn23 の比率は70:30であった。フスマで誘導して発生したキシラナーゼxyn45 とxyn23 の比率は70:30であった。アルカリ処理フスマで誘導して発生したキシラナーゼxyn45 とxyn23 の比率は50:50であった。
【0027】
前述の二種類のキシラナーゼxyn45 とxyn23 の組成比率の違いにより、同じキシラン原料に作用させて得られるキシロオリゴ糖製品組成比率も同じでなく、キシラン原料は任意のキシラン含有の材料、例えばカバ材、トウモロコシの穂軸、フスマ、サトウキビバガス、藁、アルカリ処理フスマとされ、好ましくはフスマ及びトウモロコシの穂軸、最も好ましくはトウモロコシの穂軸とされる。
【0028】
以下に実施例一から三を挙げて本発明についてさらに詳しく説明するが、これらの実施例は明細書の内容を支持するためのもので、本発明の範囲を制限するためのものではない。
【0029】
[実施例一A]
アルカリ処理したフスマを耐アルカリ性バチルスハロデュランス菌のキシラナーゼ分泌を誘導する材料とする。
キシラナーゼの製造:まず耐アルカリ性バチルスハロデュランス菌のキシラナーゼの分泌を誘導する基質を製造する。すなわち、固体−液体比が1対10の方式でフスマと1%の水酸化ナゴリウムを混合し、摂氏121度の高圧釜で10分間滅菌し、その後、純水で洗浄してpH7とし、余剰物を乾燥することでアルカリ処理したフスマを獲る。続いて、250ミリリットルの三角フラスコ(Erlenmeyer flask)に100ミリリットルのエマーソン培地を入れた。該エマーソン培地は、0.55%酵母抽出物、0.5%ペプトン、0.02%硫酸マグネシウム、及び0.1%リン酸水素二カリウムを包含し、さらにpHが10となるように調整されている。2%の上述のアルカリ処理したフスマを加え、全体の混合物を、摂氏121度の高圧釜で30分間滅菌する。三角フラスコを室温まで冷却した後、10%(v/v)の耐アルカリ性バチルスハロデュランス菌を接種し、摂氏37度の培養箱で170rpmで振動して4〜5日培養する。その後、菌液を13000rpmで摂氏4度で30分間遠心分離し、上澄み液を硫酸アンモニウムで90%の飽和度の下で沈殿させ、13000rpmで遠心分離した後の沈殿物を0.1mMのTris−HClバッファ溶液(pH7.0)で再懸濁させ、透析後に粗酵素液となす。この粗酵素液の単位体積の活性は179U/mL(摂氏37度で測定)であった。
キシランの製造:トウモロコシの穂軸を研磨して15%の水酸化ナトリウム(NaOH)で固体−液体比が1対20の下で、摂氏90度で90分間処理し、得られた上澄み液を酢酸(acetic acid) で中和してpH5.0となし、その後、3倍体積の95%のエタノールを加えて60分間浸漬させ、得られた沈殿物はキシランである。このキシランを基質とし、前述のようにして得られたキシラナーゼの作用の下で、キシランを分解してキシロオリゴ糖を発生させる。
キシラナーゼの反応でキシロオリゴ糖を製造する条件:基質用量は2%(w/v)、酵素用量8.95 U/mL、反応温度は摂氏50度、pH 8.0。得られた製品をHPLC(High-performance liquid chromatography)分析した。そのうち、HPLCの機器構造は以下のとおりである。カラム(Column)はBioRad column Aminex HPX-87H(300mm × 7.8mm) 、カラム温度は摂氏65度、検出器(Detector)は屈折率検出器(RI detector) とされる。移動相(Mobile phase)は5mM 硫酸(H2 SO4 )、流速は0.6ml/minとされる。
図3はキシランとキシラナーゼ反応前の基質中の水可溶性成分及び反応後の溶液中の製品のHPLC分析スペクトルであり、図中、A〜Dのスペクトルはそれぞれキシランとキシラナーゼの反応前、反応4時間、反応24時間、反応47時間のスペクトルを代表する。
製品組成の時間に伴う変化は下表のとおりである。
【表1】

*DP1は非キシロースの単糖(アラビノース、ブドウ糖等)を代表する。
**DP>4は重合度が4より大きいキシロオリゴ糖を代表する。
反応前の基質の水可溶成分は7.45 g/Lとされ、いずれも重合度が4より大きいキシロオリゴ糖成分であり、重合度が3より小さいキシロオリゴ糖の存在は無い。反応後に増加する水可溶性キシロオリゴ糖はキシラナーゼが形成する加水分解物とされ、これにより計算して得られた24時間の転化率(キシラナーゼ反応が形成するキシロオリゴ糖生産率)は56.4%であり、47時間では61.5%である。もし、反応前アルカリ処理アルカリ処理で得られる水可溶性キシロオリゴ糖を包含すると、総キシロオリゴ糖生産率は第24時間は93.7%とされ、反応47時間後には98.7%となる。
前述の総キシロオリゴ糖生産率計算方式:基質用量2%(w/v)は20g/Lに相当し、24時間と47時間反応の後のキシロオリゴ糖総量はそれぞれ18.73g/Lと19.74g/Lである。これにより、総キシロオリゴ糖生産率は反応24時間後には18.73/20×100%=93.7%、反応48時間後には19.74/20×100%=98.7%である。
キシラナーゼ反応の時間に伴う変化はキシロトリオースがまず生産され、その後、キシロバイオース濃度が急速に増加し、キシロトリオースは分解されてキシロバイオースとキシロースになり後期に濃度は下降する。反応24時間の後、各オリゴ糖の比率変化は大きくなくなり、反応は緩慢となる。この結果から分かるように、比較的高い比率のキシロトリオースを得ようとすれば、反応は比較的早く(2時間から4時間)終了する必要があり、この時、転化率(キシロオリゴ糖生産率)は少し低いが、平均すると約42.5%ある。
【0030】
[実施例一B]
実施例一Aの酵素液で、濃度試験を行う。
キシラナーゼの製造及びキシランの製造は実施例Aと同じである。
キシラナーゼ反応でキシロオリゴ糖を製造する条件:基質用量は2%(w/v)、酵素用量17.5 U/mL、反応温度は摂氏50度、pH 8.0。得られた製品をHPLC(High-performance liquid chromatography)分析した。
反応15時間の後、製品組成(濃度及び百分率)は以下のとおりである。
【表2】

*DP1は非キシロースの単糖(アラビノース、ブドウ糖等)を代表する。
**DP>4は重合度が4より大きいキシロオリゴ糖を代表する。
実施例一Aと比較すると、キシラナーゼ用量は8.95U/mLから17.5U/mLにアップする。これにより反応速度は比較的速くなり、反応15時間後に実施例一Aの反応24時間後の結果に相当する結果が得られた。最終製品は重合度が4より小さいキシロオリゴ糖中、キシロバイオースが絶大な部分(32%以上)を占め、キシロース及びその他の単糖を合わせてもただ5%しかなく、キシロトリオースは5〜6%の間である。
【0031】
[実施例二]
トウモロコシの穂軸を耐アルカリ性バチルスハロデュランス菌のキシラナーゼ分泌誘導材料となす。
キシラナーゼの製造:250ミリリットルの三角フラスコに100ミリリットルのエマーソン培地を入れる。該エマーソン培地は、0.55%酵母抽出物、0.5%ペプトン、0.02%硫酸マグネシウム、及び0.1%リン酸水素二カリウムを包含し、さらにpHが10となるように調整される。2%の上述のトウモロコシの穂軸粉末を加え、全体の混合物を、摂氏121度の高圧釜で30分間滅菌する。三角フラスコが室温まで冷却された後、10%(v/v)の耐アルカリ性バチルスハロデュランス菌を接種し、摂氏37度の培養箱で170rpmで振動して4〜5日培養する。その後、菌液を13000rpmで摂氏4度で30分間遠心分離し、その上澄み液を硫酸アンモニウムで90%の飽和度の下で沈殿させ、13000rpmで遠心分離した後の沈殿物を0.1mMのTris−HClバッファ溶液(pH7.0)で再懸濁させ、透析後に粗酵素液となす。この粗酵素液の単位体積の活性は128U/mL(摂氏37度で測定)であった。
キシランの製造は実施例一Aと同じである。
キシラナーゼの反応でキシロオリゴ糖を製造する条件:基質用量は2%(w/v)、キシラナーゼ用量は17.5U/mL、反応温度は摂氏50度、pH 8.0。得られた製品をHPLC(High-performance liquid chromatography)分析した。
図4はキシランとキシラナーゼ反応前の基質中の水可溶性成分及び15時間反応後の溶液中の製品のHPLC分析スペクトルであり、図中、Aはキシランとキシラナーゼの反応前、Bはキシラナーゼ反応15時間後のスペクトルである。
反応15時間の後、製品組成(濃度及び百分率)は以下のとおりである。
第1次実験
【表3】

第2次実験
【表4】

*DP1は非キシロースの単糖(アラビノース、ブドウ糖等)を代表する。
**DP>4は重合度が4より大きいキシロオリゴ糖を代表する。
本実施例から分かるように、トウモロコシの穂軸で培養した耐アルカリ性バチルスハロデュランス菌より得られる酵素液でキシランを分解して得られるキシロオリゴ糖成分は、キシロバイオース比率が比較的低く(約27%)、キシロース及びその他の単糖を合わせると比較的高い約9%であり、キシロトリオースは約7%を維持する。
【0032】
[実施例三]
実施例一の酵素液で、キシラナーゼの耐アルカリ性を試験する。
酵素の製造及びキシランの製造は実施例一と同じである。
酵素反応でキシロオリゴ糖を製造する条件:基質用量2% w/v、酵素用量17.9U/mL、反応温度摂氏50度、pH値はそれぞれ9、10及び11である。得られる製品をHPLCで分析する。
反応15時間の後、製品組成(濃度及び百分率)は以下のとおり。
【表5】

*DP1は非キシロースの単糖(アラビノース、ブドウ糖等)を代表する。
**DP>4は重合度が4より大きいキシロオリゴ糖を代表する。
実施例一Bと比較すると、pH値は高くなり反応速度は遅くなり、これにより転化率は下降する。アルカリ処理したフスマで耐アルカリ性バチルスハロデュランス菌を培養して得られる酵素液は、単糖(主にはキシロース)比率が比較的低いが、キシロバイオースのキシロトリオースに対する比率は高pH値での反応時に僅かに下降する。本実施例は酵素はアルカリ条件下でもなおキシロオリゴ糖製造の能力を有することを示す。
実施例一Aから分かるように、アルカリ処理したフスマをキシラナーゼ発生を誘導する植物材料となす時、時間の増加(0〜47時間)に伴い、キシロースとキシロバイオースの比率は増加し、それぞれ1.59〜4.39%及び21.79〜35.65%であり、キシロトリオースの比率は、2時間後の9.58から47時間後の5.31%に漸減する。実施例二でトウモロコシの穂軸をキシラナーゼ発生を誘導する植物材料となし、実施例一B中のその他の条件を同じにした結果と比較すると、トウモロコシの穂軸を使用して発生するキシロースの比率は7.10%と比較的高く、アルカリ処理したフスマではただ3.62%である。トウモロコシの穂軸を使用して発生するキシロバイオースの比率は比較的低く27.47%で、アルカリ処理したフスマは32.24%である。ゆえに、必要により適当な材料を選択することで、必要なキシロース数のキシロオリゴ糖組成比率を達成でき、並びに実施例三の結果により、酵素はアルカリ性環境下で反応できることを示す。
【特許請求の範囲】
【請求項1】
寄託コードCCTCC M 2011330であるキシロオリゴ糖の組成を制御可能な耐アルカリ性バチルスハロデュランス菌(Bacillus halodurans) 。
【請求項2】
請求項1記載の耐アルカリ性バチルスハロデュランス菌において、該耐アルカリ性バチルスハロデュランス菌は2種類の耐熱耐アルカリ性キシラナーゼを分泌でき、該耐熱耐アルカリ性キシラナーゼはキシラナーゼxyn45(SEQ ID NO.:1) 及びキシラナーゼxyn23(SEQ ID NO.:2) とされることを特徴とする、耐アルカリ性バチルスハロデュランス菌。
【請求項3】
請求項1記載の耐アルカリ性バチルスハロデュランス菌で組成制御可能なキシロオリゴ糖を製造する方法において、そのステップは、
(1)植物材料で高pH値の下で耐アルカリ性バチルスハロデュランス菌を培養するステップ、
(2)該耐アルカリ性バチルスハロデュランス菌中よりキシラナーゼxyn45(SEQ ID NO.:1) とキシラナーゼxyn23(SEQ ID NO.:2) を包含する酵素組合せを取得するステップ、
(3)該酵素組合せとキシラン原料を酵素反応させるステップ、
(4)キシロース、キシロバイオース、キシロトリオース、重合度4以上のキシラン及びそれらの任意の組合せで組成される群より選択したキシロオリゴ糖を取得するステップ、
を包含することを特徴とする方法。
【請求項4】
請求項3記載の方法において、(1)のステップの該植物材料は、カバ材、トウモロコシの穂軸、フスマ、サトウキビバガス、藁、アルカリ処理フスマで組成される群より選択することを特徴とする方法。
【請求項5】
請求項3記載の方法において、(1)のステップの該高pH値の範囲は8〜11とすることを特徴とする方法。
【請求項6】
請求項3記載の方法において、(2)のステップの該酵素組合せは該耐アルカリ性バチルスハロデュランス菌を遠心処理して上澄み液を取り、該上澄み液を硫酸アンモニウムで沈殿させた後に再懸濁させ並びに透析して得た液体であることを特徴とする方法。
【請求項7】
請求項3記載の方法において、(3)のステップの該キシラン原料はカバ材、トウモロコシの穂軸、フスマ、サトウキビバガス、藁、アルカリ処理フスマで組成した群より選択することを特徴とする方法。
【請求項8】
請求項3又は7記載の方法において、(3)のステップの該キシラン原料はトウモロコシの穂軸とすることを特徴とする方法。
【請求項9】
請求項3記載の方法において、(3)のステップの該酵素反応の条件は摂氏30〜80度、pH4〜11とすることを特徴とする方法。
【請求項10】
請求項3記載の方法において、該植物材料をアルカリ処理したフスマとする時、該キシロオリゴ糖中のキシロバイオースの比率は32%以上であることを特徴とする方法。
【請求項11】
請求項3記載の方法において、該植物材料をトウモロコシの穂軸とする時、該キシロオリゴ糖中のキシロバイオースの比率は27%以上であることを特徴とする方法。
【請求項12】
請求項10記載の方法において、該酵素反応の時間を4時間内で終了する時、該キシロオリゴ糖中のキシロトリオースの比率は8.6%以上であることを特徴とする方法。
【請求項1】
寄託コードCCTCC M 2011330であるキシロオリゴ糖の組成を制御可能な耐アルカリ性バチルスハロデュランス菌(Bacillus halodurans) 。
【請求項2】
請求項1記載の耐アルカリ性バチルスハロデュランス菌において、該耐アルカリ性バチルスハロデュランス菌は2種類の耐熱耐アルカリ性キシラナーゼを分泌でき、該耐熱耐アルカリ性キシラナーゼはキシラナーゼxyn45(SEQ ID NO.:1) 及びキシラナーゼxyn23(SEQ ID NO.:2) とされることを特徴とする、耐アルカリ性バチルスハロデュランス菌。
【請求項3】
請求項1記載の耐アルカリ性バチルスハロデュランス菌で組成制御可能なキシロオリゴ糖を製造する方法において、そのステップは、
(1)植物材料で高pH値の下で耐アルカリ性バチルスハロデュランス菌を培養するステップ、
(2)該耐アルカリ性バチルスハロデュランス菌中よりキシラナーゼxyn45(SEQ ID NO.:1) とキシラナーゼxyn23(SEQ ID NO.:2) を包含する酵素組合せを取得するステップ、
(3)該酵素組合せとキシラン原料を酵素反応させるステップ、
(4)キシロース、キシロバイオース、キシロトリオース、重合度4以上のキシラン及びそれらの任意の組合せで組成される群より選択したキシロオリゴ糖を取得するステップ、
を包含することを特徴とする方法。
【請求項4】
請求項3記載の方法において、(1)のステップの該植物材料は、カバ材、トウモロコシの穂軸、フスマ、サトウキビバガス、藁、アルカリ処理フスマで組成される群より選択することを特徴とする方法。
【請求項5】
請求項3記載の方法において、(1)のステップの該高pH値の範囲は8〜11とすることを特徴とする方法。
【請求項6】
請求項3記載の方法において、(2)のステップの該酵素組合せは該耐アルカリ性バチルスハロデュランス菌を遠心処理して上澄み液を取り、該上澄み液を硫酸アンモニウムで沈殿させた後に再懸濁させ並びに透析して得た液体であることを特徴とする方法。
【請求項7】
請求項3記載の方法において、(3)のステップの該キシラン原料はカバ材、トウモロコシの穂軸、フスマ、サトウキビバガス、藁、アルカリ処理フスマで組成した群より選択することを特徴とする方法。
【請求項8】
請求項3又は7記載の方法において、(3)のステップの該キシラン原料はトウモロコシの穂軸とすることを特徴とする方法。
【請求項9】
請求項3記載の方法において、(3)のステップの該酵素反応の条件は摂氏30〜80度、pH4〜11とすることを特徴とする方法。
【請求項10】
請求項3記載の方法において、該植物材料をアルカリ処理したフスマとする時、該キシロオリゴ糖中のキシロバイオースの比率は32%以上であることを特徴とする方法。
【請求項11】
請求項3記載の方法において、該植物材料をトウモロコシの穂軸とする時、該キシロオリゴ糖中のキシロバイオースの比率は27%以上であることを特徴とする方法。
【請求項12】
請求項10記載の方法において、該酵素反応の時間を4時間内で終了する時、該キシロオリゴ糖中のキシロトリオースの比率は8.6%以上であることを特徴とする方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−157350(P2012−157350A)
【公開日】平成24年8月23日(2012.8.23)
【国際特許分類】
【出願番号】特願2011−250324(P2011−250324)
【出願日】平成23年11月16日(2011.11.16)
【出願人】(503004699)國立中正大學 (2)
【Fターム(参考)】
【公開日】平成24年8月23日(2012.8.23)
【国際特許分類】
【出願日】平成23年11月16日(2011.11.16)
【出願人】(503004699)國立中正大學 (2)
【Fターム(参考)】
[ Back to top ]

