耐酸性乳酸生成微生物
【課題】 乳酸生成遺伝子を組み込んだ組換えベクター、及び耐酸性乳酸生成微生物の提供。
【解決手段】 ビフィドバクテリア属又はラクトバシルス属に属する微生物由来の乳酸デヒドロゲナーゼ遺伝子及びプロモーターが組み込まれた組換えベクターで、ビフィドバクテリウム属に属する微生物がビフィドバクテリウム・ロンガムであり、プロモーターがグリセルアルデヒド3リン酸デヒドロゲナーゼ遺伝子由来である組換えベクター、並びに該組換えベクターで形質転換した耐酸性乳酸生成微生物で、pH6以下の条件でも乳酸発酵することができる酵母菌又はカビを提供する。
【解決手段】 ビフィドバクテリア属又はラクトバシルス属に属する微生物由来の乳酸デヒドロゲナーゼ遺伝子及びプロモーターが組み込まれた組換えベクターで、ビフィドバクテリウム属に属する微生物がビフィドバクテリウム・ロンガムであり、プロモーターがグリセルアルデヒド3リン酸デヒドロゲナーゼ遺伝子由来である組換えベクター、並びに該組換えベクターで形質転換した耐酸性乳酸生成微生物で、pH6以下の条件でも乳酸発酵することができる酵母菌又はカビを提供する。
【発明の詳細な説明】
【0001】
【発明の属する技術分野】本発明は、所定の乳酸生成遺伝子を組み込んだ組換えベクター、及び該ベクターで形質転換した耐酸性乳酸生成微生物に関する。
【0002】
【従来の技術】乳酸は、醸造、漬物などの食品用途、医薬、農薬、化粧品などの化学原料用途、さらに繊維仕上げ、塗料、溶剤、生分解性プラスチックなどの工業用途等に使用されており、需要増加が期待されている。
【0003】従来より、乳酸発酵には乳酸菌が使用されているが、乳酸菌が乳酸発酵することのできるpH範囲は6〜7であるため、乳酸が生成されてpHが6以下になると、それ以上乳酸を生成することができなくなる。従って、高濃度の乳酸を得るためには、発酵中に生成する乳酸をアルカリ(例えば炭酸カルシウム、アンモニア、水酸化ナトリウム等)で中和する必要がある。
【0004】しかし、アルカリで中和すると、乳酸塩を乳酸に戻す工程が必要であり副産物を生じること等により、その処理にコストがかかる。また、バイポーラ膜と呼ばれる特殊なイオン交換膜を用いると、副産物を生じることなく乳酸塩を乳酸とアルカリに戻すことができるが、バイポーラ膜は高価なうえ効率が悪いという問題がある。
【0005】
【発明が解決しようとする課題】本発明は、所定の乳酸生成遺伝子を組み込んだ組換えベクター、及び該ベクターで形質転換した耐酸性乳酸生成微生物を提供することを目的とする。
【0006】
【課題を解決するための手段】本発明者は、上記課題を解決するため鋭意研究を行った結果、乳酸デヒドロゲナーゼ遺伝子及びプロモーターを組み込んだ組換えベクターを構築し、該ベクターを耐酸性の宿主微生物に導入することにより、酸性条件でも乳酸生産性の高い微生物を得ることに成功し、本発明を完成するに至った。
【0007】すなわち、本発明は、ビフィドバクテリウム属又はラクトバシルス属に属する微生物由来の乳酸デヒドロゲナーゼ遺伝子及びプロモーターが組み込まれた組換えベクターである。ビフィドバクテリウム属に属する微生物としては、ビフィドバクテリウム・ロンガムが挙げられ、プロモーターとしては例えばグリセルアルデヒド3リン酸デヒドロゲナーゼ遺伝子のプロモーターが挙げられる。また、前記組換えベクターとしては、下記の制限酵素地図を有し、かつ7480bpの長さを有するものが挙げられる。
【0008】
【化2】

【0009】上記宿主微生物としては、pH6以下の条件でも乳酸発酵することができるもの、例えば酵母菌又はカビが挙げられる。以下、本発明を詳細に説明する。
【0010】
【発明の実施の形態】本発明は、特定の乳酸生成遺伝子が組み込まれた組換えベクターである。また本発明は、耐酸性を有する微生物(耐酸性微生物)に前記組換えベクターを導入してなる耐酸性乳酸生成微生物である。
【0011】1.乳酸生成遺伝子を含む組換えベクターの調製(1)乳酸生成遺伝子のクローニング本発明において使用する乳酸生成遺伝子は特に限定されるものではなく、例えばビフィドバクテリウム属に属する微生物(例えばビフィドバクテリウム・ロンガム(Bifidobacterium longum))、ラクトバシルス属に属する微生物(例えばラクトバシルス・アシドフィラス(Lactobacillus acidophilus))などを採取源とし、mRNAから調製されたcDNAライブラリーからクローニングすることができる。乳酸生成遺伝子としては、例えば乳酸デヒドロゲナーゼ(LDH)遺伝子が挙げられる。
【0012】mRNAの調製は、通常行われる手法により行うことができる。例えば、上記微生物から、グアニジウムチオシアネート-トリフルオロ酢酸セシウム法などにより全RNAを抽出した後、オリゴdT-セルロースやポリU-セファロース等を用いたアフィニティーカラム法により、あるいはバッチ法によりポリ(A)+RNA(mRNA)を得ることができる。さらに、ショ糖密度勾配遠心法等によりポリ(A)+RNAをさらに分画してもよい。
【0013】このようにして得られたmRNAを鋳型として、オリゴdTプライマー及び逆転写酵素を用いて一本鎖cDNAを合成した後、さらに二本鎖cDNAを合成する。次に、得られた二本鎖cDNAを適当なクローニングベクターに組み込んで組換えベクターを作製する。そしてこの組換えベクターを用いて大腸菌等を形質転換し、テトラサイクリン耐性、アンピシリン耐性等を指標として形質転換体を選択することにより、cDNAのライブラリーを得ることができる。
【0014】上記のようにして得られる形質転換体から目的のDNAを有する株を選択するには、例えば、LDHの一部のアミノ酸配列に対応する縮重センスプライマー及び縮重アンチセンスプライマーを合成し、これを用いてPCRを行い、得られた断片をプローブとしてcDNAライブラリーからスクリーニングする方法を採用することができる。あるいはλファージ(λgt11等)を用いた場合は、λgt11 インサート増幅用のプライマーを用いてPCRを行う方法を採用することができる。但し、本発明においてはこれらのプライマーに限定されるものではない。なお、プライマーは化学合成により調製することができる。
【0015】このようにして得られたDNA増幅断片を、32P、35S又はビオチン等で標識してプローブとし、これを形質転換体のDNAを変性固定したニトロセルロースフィルターとハイブリダイズさせ、得られたポジティブ株を検索することによりスクリーニングすることができる。好ましくは、クローニングした部分配列を鋳型としてPCRを行い、より長い部分配列を取得する。その取得した配列を参考としてPCRによりプローブを作製し、cDNAライブラリーから該遺伝子をスクリーニングすることが望ましい。
【0016】次に、得られたクローンから全長のcDNAをクローニングする。cDNAのクローニングには、例えばRACE(Rapid Amplification of cDNA ends)法が用いられる。RACE法とは、cDNA の5'又は3'欠失部位をPCRにより迅速に回収する方法である。なお、RACE法は、市販のキット(MarathonTM cDNA Amplification Kit(Clonetech社))を用いて行うこともできる。
【0017】cDNAの塩基配列の決定及び確認は、マキサム-ギルバートの化学修飾法、又はM13ファージを用いるジデオキシヌクレオチド鎖終結法等の公知手法により行うことができるが、通常は自動塩基配列決定装置(例えばApplied Biosystems社製ABI373シークエンサー等)を用いて配列決定が行われる。
【0018】一旦本発明において使用する乳酸生成遺伝子の塩基配列が確定されると、その後は化学合成によって、又はクローニングされたcDNAを鋳型としたPCRによって、あるいは該塩基配列を有するDNA断片をプローブとしてハイブリダイズさせることによって、当該遺伝子を得ることができる。さらに、部位特定変異誘発等によって乳酸生成遺伝子の変異体を合成することもできる。遺伝子に変異を導入するには、Kunkel法、Gapped duplex法等の公知の手法又はこれに準ずる方法を採用することができる。例えば、部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutant-K(TAKARA社製)やMutant-G(TAKARA社製))などを用いて、あるいは、TAKARA社のLA PCR in vitro Mutagenesis シリーズキットを用いて変異の導入が行われる。
【0019】(2) 組換えベクターの構築本発明の組換えベクターは、適当なベクターに乳酸遺伝子を連結(挿入)することにより得ることができる。乳酸生成遺伝子を挿入するためのベクターは、宿主中で複製可能なものであれば特に限定されず、例えば、プラスミド DNA、ファージ DNA等が挙げられる。
【0020】プラスミド DNAとしては、大腸菌由来のプラスミド(例えばpBR322, pBR325,pUC118, pUC119, pUC18, pUC19等)、枯草菌由来のプラスミド(例えばpUB110,pTP5,等)、酵母由来のプラスミド(例えばYEp13, YEp24, YCp50等)などが挙げられ、ファージDNAとしてはλファージ(Charon4A、Charon21A、EMBL3、EMBL4、λgt10、λgt11、λZAP等)が挙げられる。さらに、レトロウイルス又はワクシニアウイルスなどの動物ウイルス、バキュロウイルスなどの昆虫ウイルスベクターを用いることもできる。ベクターに乳酸生成遺伝子を挿入するには、まず、精製されたDNAを適当な制限酵素で切断し、適当なベクター DNAの制限酵素部位又はマルチクローニングサイトに挿入してベクターに連結する方法などが採用される。
【0021】本発明において使用する乳酸生成遺伝子は、その遺伝子の機能が発揮されるようにベクターに組み込まれることが必要である。そこで、本発明のベクターには、プロモーター、乳酸生成遺伝子、ターミネーターのほか、所望によりエンハンサーなどのシスエレメント、スプライシングシグナル、ポリA付加シグナル、選択マーカー、リボソーム結合配列(SD配列)などを連結することができる。なお、選択マーカーとしては、例えばジヒドロ葉酸還元酵素遺伝子、アンピシリン耐性遺伝子、ネオマイシン耐性遺伝子等が挙げられる。
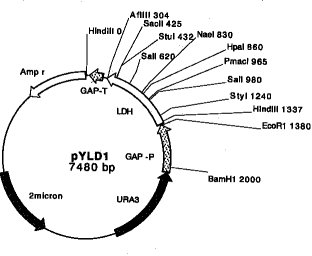
【0022】例えば、本発明において使用する組換えベクターは、乳酸生成遺伝子の上流にグリセルアルデヒド3-リン酸デヒドロゲナーゼ遺伝子(GAP遺伝子)のプロモーター(GAP-P)を、下流にGAP遺伝子のターミネーター(GAP-T)及びアンピシリン耐性遺伝子(Ampr)を連結して遺伝子発現カセットを作製し、このカセットを、予めURA3遺伝子及び2μm oriを連結しておいたプラスミドに連結することにより、7480bpの長さを有する組換えベクターを構築することができる(図1;pYLD1)。
【0023】図1において、各制限酵素名の次に記載されている数字は、アンピシリン抵抗性マーカー遺伝子のHindIII切断位置を0としたときの切断位置を示す。なお、上記組換えベクターpYLD1は大腸菌に導入され(名称:「E. coli pYLD1」)、工業技術院生命工学工業技術研究所(茨城県つくば市東1丁目1番3号)に、FERM P-17621として寄託されている(寄託日:平成11年10月26日)。
【0024】2.耐酸性乳酸生成微生物の調製(1)耐酸性微生物本発明において、「耐酸性微生物」とは、酸性条件、好ましくはpHが6以下、さらに好ましくはpH2〜5で乳酸発酵を行うことができる微生物を意味する。本発明に使用する微生物は、耐酸性を有し、かつ乳酸生成を行うことができる限り、特に限定されるものではなく、天然から採取されたものも含まれる。本発明では、乳酸生成遺伝子を組み込んだ組換えベクターを上記耐酸性微生物に導入して形質転換体を得、乳酸生成遺伝子が機能するように操作することもできる。「乳酸生成遺伝子が機能する」とは、該遺伝子が組み込まれたベクターを導入した宿主(微生物)を培養して乳酸を生成させたときに、乳酸の蓄積により培地のpHが酸性になっても(特に、pH6以下に下がっても)当該発現が維持されて乳酸を生成し得るように発現することを意味する。
【0025】本発明において宿主として使用される乳酸生成微生物は、例えば、サッカロミセス属等の酵母、あるいはリゾプス属に属するカビなどが挙げられるが(例えば下記微生物参照)、これらの微生物に限定されるものではない。
■ 酵母菌サッカロミセス属:サッカロミセス・セレビシエ(Saccharomyces cerevisiae)、サッカロミセス・クルーベリ(Saccharomyces kluyveri)、サッカロミセス・パラドキサス(Saccharomyces paradoxus)、サッカロミセス・パストリアヌス(Saccharomyces pastorianus)クルーベルマイセス属:クルーベルマイセス・ラクティス(Kluyveromyces lactis)、クルーベルマイセス・マルキシアヌス(Kluyveromyces marxianus)、ピキア属:ピキア・パストリス(Pichia pastoris)
■ カビリゾプス属:リゾプス・デレマー(Rhyzopus delemer)アスペルギルス属:アスペルギルス・ニガー(Aspergillus niger)、アスペルギルス・オリザ(Aspergillus oryzae)
【0026】(2) 形質転換耐酸性乳酸生成微生物(耐酸性乳酸発酵微生物ともいう)を得るための形質転換は、上記手法により得られた耐酸性微生物に、乳酸生成遺伝子を含む本発明の組換えベクターを導入し得る方法であれば特に限定されるものではない。例えば、酢酸リチウム法、カルシウムイオンを用いる方法(Proc. Natl. Acad. Sci., USA, 69, 2110, 1972)、エレクトロポレーション法等の通常行われる遺伝子工学的手法により形質転換を行う。
【0027】3.乳酸発酵本発明の耐酸性乳酸生成微生物は、培養して乳酸を生成させると、乳酸の蓄積により培地のpHが酸性になっても(特に、pH6以下に下がっても)当該発現が維持されて乳酸を生成し得るように機能する。従って、耐酸性乳酸生成微生物を用いると、中和剤を使用せずに乳酸発酵することができる。
【0028】本発明において乳酸発酵に使用される糖化原料としては、さつまいも、ジャガイモ、トウモロコシ等が挙げられる。これらの原料を洗浄及び破砕した後、液化・糖化槽に入れ、90〜120℃、好ましくは120℃の蒸気で5〜30分、好ましくは15分処理する。
【0029】原料に対し0.5〜2.5倍の水を加えた後、市販の酵素(例えばターマミル(ノバ社)及びスミチーム(新日本化学社))を原料重量に対して0.5〜1%添加する。温度50〜95℃、好ましくは60℃で15〜20時間保持すれば原料の液化、糖化が完了する。
【0030】上記のようにして得られた液を遠心分離にかけ、固形分(リグニン等)を分離し、原液とする。なお、デンプン原料としてブドウ糖を用いる場合はこれまでの工程を省略し、原液として直接使用することができる。この液を基質溶液として菌体培養及び発酵に使用する。
【0031】培養のための培地は、通常は糖類、ペプトン、酵母エキスを含む。好ましくは、0.1〜10%グルコース、0.1〜10%ペプトン、0.1〜10%酵母エキスを含み、さらに好ましくは約2%のグルコース、約2%のペプトン、約1%の酵母エキスが使用される。
【0032】また、培地として予め濾過除菌したものを用いることができ、特に乳酸菌用培地としてMRS培地又はGYP培地等を用いることができる。更に、コーンスターチ製造の副産物であるコーンスティープリカーを使用することも可能である。発酵条件は以下の通りである。
【0033】温度:25〜33℃、好ましくは30℃菌体密度:10〜30%、好ましくは25%(湿重量ベース)
基質濃度:5〜20%、好ましくは10%(バッチ発酵の初期濃度)
発酵時間:10〜30時間、好ましくは20〜24時間
【0034】本発明の耐酸性乳酸生成微生物は、1種類単独でもよく、複数種を混合して用いることもできる。複数種を混合する場合は、互いに同一の属に属する微生物であっても異なる属に属する微生物であってもよい。また、混合比率は任意に設定することができ、特に限定されるものではないが、それぞれ均等(例えば3種類の微生物を用いるときは1:1:1)となるようにすることが好ましい。
【0035】上記条件で発酵させることにより、1〜10%の乳酸が得られる。乳酸の収率は、例えば、Fキット(ベーリンガー社)などの市販のキットを用いて測定することができる。本発明においては、上記発酵の際に炭酸カルシウム、水酸化ナトリウム、アンモニアなどの中和剤を添加する必要はない。
【0036】この発酵液を遠心分離装置又はフィルターにかけて菌体と液分とを分離し、乳酸の液分の採取(精製・濃縮)を行う。液分の精製・濃縮は、一般に海水や食品の脱塩に広く採用されているイオン交換膜を利用した電気透析装置(例えばアシライザー(旭化成社))により行うことができる。
【0037】本発明に使用されるイオン交換膜は特に限定されず、従来より公知のイオン交換膜が使用できる。例えば、陽イオン交換膜としてはスルホン酸基、カルボン酸基、さらにこれらのイオン交換基が複数混在した陽イオン交換膜が挙げられる。また、陰イオン交換膜としては4級アンモニウム基、1級アミノ基、2級アミノ基、3級アミノ基、さらにこれらのイオン交換基が複数混在した陰イオン交換膜が挙げられる。これらの陽イオン及び陰イオン交換膜は、重合型、縮合型、均一型及び不均一型のいずれでもよく、さらに、補強心材の有無や、炭化水素系のものであるか否か、フッ素系のものであるか否かを問わず、材料・製造方法に由来するイオン交換膜の種類、形式などに関係なく任意に選択することができる。本発明において、電気透析装置は電極間に陰イオン交換膜と陽イオン交換膜とを交互に配列して濃縮室と脱塩室とを形成することによって構成されるものが好ましい。
【0038】なお、電気透析時の各種液の温度は、通常、20〜45℃、好ましくは35〜40℃の範囲である。電気透析を行うと、イオン性物質と非イオン性物質を分離すると同時に乳酸を濃縮することが可能である。この工程により、発酵液中のアルコール、残糖、タンパク質等を分離し、乳酸濃度を濃縮することができる。例えば、電気透析処理により5〜10%の乳酸を25〜30%に濃縮できる。
【0039】電気透析で除去できなかったアミノ酸、無機イオン(K,Ca,Mg等)、有機酸(クエン酸、リンゴ酸等)は、クロマト分離装置、イオン交換装置により除去することができる。クロマト分離装置としては、例えば固定層式、移動層式、類似的移動層式等が挙げられる。
【0040】最後に、溶液中の水分を蒸発装置で蒸発させ、50〜90%濃度の乳酸製品を製造することができる。なお、発酵液の精製・濃縮は、上記の方法に限定されるものではなく、蒸留法によっても行うことができる。
【0041】
【実施例】以下、実施例により本発明をさらに具体的に説明する。但し、本発明はこれら実施例にその技術的範囲が限定されるものではない。
〔実施例1〕組換えベクターの構築及び形質転換1. 組換えベクターの構築(1) 乳酸遺伝子のクローニングB. longum 由来LDHのN末端アミノ酸配列から32mer(5'-ACIGCICCIG CICCIATIACIGCIAGTTTI GT-3'(配列番号1))のオリゴヌクレオチドを作製した。B. longum aM101-2株の染色体DNAの4.2kb HindIII断片から上記オリゴヌクレオチドを用いてコロニーハイブリダイゼーションを行いLDH遺伝子の部分断片を得、pUC19にクローン化した。全長断片を取得するため、pUBL1の0.3kbのHindIII-SacI断片にハイブリダイズする0.9kbのSalI-SacI断片をpUC118にクローン化した。これらクローンをHindIIIで処理した後連結を行い、Gene Cleanキット(Bio 101)により全長LDH遺伝子(Gene, 85(1989) 161-168)を取得した。
【0042】(2) 各遺伝子のプラスミドへの連結得られたLDH遺伝子とpKK223-3由来のtacプロモーターをpUC118に連結した。このプラスミドからEcoRI、XhoIサイトでLDH遺伝子を切り出した後、GAPプロモーター、GAPターミネーターを含んでいる酵母発現用ベクターpCHIのEcoRI、SalIサイトに連結した。連結にはTakaraの「ligation kit ver. 2」を用い16℃で3時間反応させた。反応後コンピーテントセルである大腸菌DH5αに形質転換を行い、LB/アンピシリンプレートに撒き、37℃で一晩培養を行い、形質転換株を得た。得られたクローンからアルカリSDS法によりプラスミドの精製、抽出を行い、酵母発現用LDHベクターであるpYDL1を取得した(図1)。
【0043】なお、本発明の組換えベクターpYLD1は大腸菌に導入され(名称:「E. coli pYLD1」)、工業技術院生命工学工業技術研究所(茨城県つくば市東1丁目1番3号)に、FERM P-17621として寄託されている(寄託日:平成11年10月26日)。
【0044】2.組換えベクターの宿主への導入宿主である酵母Saccharomyces cerevisiae YPH500株をYPD培地にて30℃で対数増殖期(O.D. 1.0以下)まで培養を行い、集菌(3000rpm, 2分)及びTEバッファー(10mM Tris, 1mM EDTA, pH7.5)による洗浄を行った後、0.5Mの酢酸リチウム液に懸濁した。上記菌体100μlにpYDL1約1μgとキャリアーDNA(サケ精子DNA)を1μg添加した。これに800μlのTLP(40% PEG、0.1M酢酸リチウム、10mM Tris、1mMEDTA)を加え、室温に40分静置した後、42℃で10分間熱ショックを与えた。その後菌体を遠心分離し(1200rpm)TEバッファーで洗浄を行い、200μlのTEに懸濁した後選択培地で30℃で2日間培養を行い、形質転換株(YPLD1)を取得した。
【0045】〔実施例2〕 乳酸発酵乳酸発酵の原料であるさつまいも(100g)を洗浄及び破砕した後、液化・糖化槽に入れ、ターマミル(ノバ社)1%と水100gを加えて95℃で2時間処理した。続いてスミチーム(新日本化学社)0.53を添加し、約12時間反応させ、原料の液化及び糖化を行った。
【0046】上記のようにして得られた原液を遠心分離(10,000rpm)にかけ、固形分(リグニン等)を分離した。これを発酵原液とし、実施例1で得られた乳酸生成菌YPLD1を用いて以下の発酵に使用した。培地は、通常は糖類2%、ペプトン2%、酵母エキス1%をそれぞれ含むYPD培地を用いた。培地に上記発酵原液10%を加え、発酵を行った。発酵は、温度30℃、菌体密度2%(湿重量ベース)、基質濃度5%(バッチ発酵の初期濃度)、発酵時間20〜24時間で行った。その結果、2%の乳酸が得られた。
【0047】この発酵液を遠心分離装置又はフィルターにかけて菌体と液分とを分離し、乳酸の液分の採取(精製・濃縮)を行った。液分の精製・濃縮は、旭化成社のマイクローグMF(PSP-103)装置を用いた。電気透析後、除去できなかったアミノ酸、無機イオン(K,Ca,Mg等)、有機酸(クエン酸、リンゴ酸等)を、クロマトグラフィー(擬似移動層クロマト装置トレソーーネ(オルガノ社))にかけて除去した。
【0048】蒸発缶(実験室用エバポレーター)により水分を蒸発させ、90%の乳酸水溶液を得た。比較対照として、耐酸性ではない酵母菌(YPH-500)を用いて、上記と同様の乳酸発酵を行った。その結果、乳酸生成量は0%であった。
【0049】
【発明の効果】本発明により、乳酸生成遺伝子が組み込まれた組換えベクター、及び該ベクターを含む耐酸性乳酸生成微生物が提供される。本発明の微生物を用いて乳酸発酵を行うと、アンモニア等のアルカリ(中和剤)を添加・回収する工程がないため操作が簡便であり、生産性が上昇し、さらに、高価なバイポーラ膜を使用する必要がないためコスト低減を図ることができる。従って、本発明の微生物は高生産性乳酸発酵用として有用である。
【0050】
【配列表】
SEQUENCE LISTING <110> Toyota Motor Corporation<120> Acid-resisting and lactic acid-producing microorganisms<130> P99-0593<140><141><160> 1<170> PatentIn Ver. 2.0<210> 1<211> 32<212> DNA<213> Artificial Sequence<220> <223> Synthetic DNA<220><221> modified base<222> 3<223> i<220><221> modified base<222> 6<223> i<220><221> modified base<222> 9<223> i<220><221> modified base<222> 12<223> i<220><221> modified base<222> 15<223> i<220><221> modified base<222> 18<223> i<220><221> modified base<222> 21<223> i<220><221> modified base<222> 24<223> i<220><221> modified base<222> 30<223> i<400> acngcnccng cnccnatnac ngcnagtttn gt 32
【0051】
【配列表フリーテキスト】配列番号1:合成DNA
【図面の簡単な説明】
【図1】プラスミドpYLD1の構築図である。
【0001】
【発明の属する技術分野】本発明は、所定の乳酸生成遺伝子を組み込んだ組換えベクター、及び該ベクターで形質転換した耐酸性乳酸生成微生物に関する。
【0002】
【従来の技術】乳酸は、醸造、漬物などの食品用途、医薬、農薬、化粧品などの化学原料用途、さらに繊維仕上げ、塗料、溶剤、生分解性プラスチックなどの工業用途等に使用されており、需要増加が期待されている。
【0003】従来より、乳酸発酵には乳酸菌が使用されているが、乳酸菌が乳酸発酵することのできるpH範囲は6〜7であるため、乳酸が生成されてpHが6以下になると、それ以上乳酸を生成することができなくなる。従って、高濃度の乳酸を得るためには、発酵中に生成する乳酸をアルカリ(例えば炭酸カルシウム、アンモニア、水酸化ナトリウム等)で中和する必要がある。
【0004】しかし、アルカリで中和すると、乳酸塩を乳酸に戻す工程が必要であり副産物を生じること等により、その処理にコストがかかる。また、バイポーラ膜と呼ばれる特殊なイオン交換膜を用いると、副産物を生じることなく乳酸塩を乳酸とアルカリに戻すことができるが、バイポーラ膜は高価なうえ効率が悪いという問題がある。
【0005】
【発明が解決しようとする課題】本発明は、所定の乳酸生成遺伝子を組み込んだ組換えベクター、及び該ベクターで形質転換した耐酸性乳酸生成微生物を提供することを目的とする。
【0006】
【課題を解決するための手段】本発明者は、上記課題を解決するため鋭意研究を行った結果、乳酸デヒドロゲナーゼ遺伝子及びプロモーターを組み込んだ組換えベクターを構築し、該ベクターを耐酸性の宿主微生物に導入することにより、酸性条件でも乳酸生産性の高い微生物を得ることに成功し、本発明を完成するに至った。
【0007】すなわち、本発明は、ビフィドバクテリウム属又はラクトバシルス属に属する微生物由来の乳酸デヒドロゲナーゼ遺伝子及びプロモーターが組み込まれた組換えベクターである。ビフィドバクテリウム属に属する微生物としては、ビフィドバクテリウム・ロンガムが挙げられ、プロモーターとしては例えばグリセルアルデヒド3リン酸デヒドロゲナーゼ遺伝子のプロモーターが挙げられる。また、前記組換えベクターとしては、下記の制限酵素地図を有し、かつ7480bpの長さを有するものが挙げられる。
【0008】
【化2】

【0009】上記宿主微生物としては、pH6以下の条件でも乳酸発酵することができるもの、例えば酵母菌又はカビが挙げられる。以下、本発明を詳細に説明する。
【0010】
【発明の実施の形態】本発明は、特定の乳酸生成遺伝子が組み込まれた組換えベクターである。また本発明は、耐酸性を有する微生物(耐酸性微生物)に前記組換えベクターを導入してなる耐酸性乳酸生成微生物である。
【0011】1.乳酸生成遺伝子を含む組換えベクターの調製(1)乳酸生成遺伝子のクローニング本発明において使用する乳酸生成遺伝子は特に限定されるものではなく、例えばビフィドバクテリウム属に属する微生物(例えばビフィドバクテリウム・ロンガム(Bifidobacterium longum))、ラクトバシルス属に属する微生物(例えばラクトバシルス・アシドフィラス(Lactobacillus acidophilus))などを採取源とし、mRNAから調製されたcDNAライブラリーからクローニングすることができる。乳酸生成遺伝子としては、例えば乳酸デヒドロゲナーゼ(LDH)遺伝子が挙げられる。
【0012】mRNAの調製は、通常行われる手法により行うことができる。例えば、上記微生物から、グアニジウムチオシアネート-トリフルオロ酢酸セシウム法などにより全RNAを抽出した後、オリゴdT-セルロースやポリU-セファロース等を用いたアフィニティーカラム法により、あるいはバッチ法によりポリ(A)+RNA(mRNA)を得ることができる。さらに、ショ糖密度勾配遠心法等によりポリ(A)+RNAをさらに分画してもよい。
【0013】このようにして得られたmRNAを鋳型として、オリゴdTプライマー及び逆転写酵素を用いて一本鎖cDNAを合成した後、さらに二本鎖cDNAを合成する。次に、得られた二本鎖cDNAを適当なクローニングベクターに組み込んで組換えベクターを作製する。そしてこの組換えベクターを用いて大腸菌等を形質転換し、テトラサイクリン耐性、アンピシリン耐性等を指標として形質転換体を選択することにより、cDNAのライブラリーを得ることができる。
【0014】上記のようにして得られる形質転換体から目的のDNAを有する株を選択するには、例えば、LDHの一部のアミノ酸配列に対応する縮重センスプライマー及び縮重アンチセンスプライマーを合成し、これを用いてPCRを行い、得られた断片をプローブとしてcDNAライブラリーからスクリーニングする方法を採用することができる。あるいはλファージ(λgt11等)を用いた場合は、λgt11 インサート増幅用のプライマーを用いてPCRを行う方法を採用することができる。但し、本発明においてはこれらのプライマーに限定されるものではない。なお、プライマーは化学合成により調製することができる。
【0015】このようにして得られたDNA増幅断片を、32P、35S又はビオチン等で標識してプローブとし、これを形質転換体のDNAを変性固定したニトロセルロースフィルターとハイブリダイズさせ、得られたポジティブ株を検索することによりスクリーニングすることができる。好ましくは、クローニングした部分配列を鋳型としてPCRを行い、より長い部分配列を取得する。その取得した配列を参考としてPCRによりプローブを作製し、cDNAライブラリーから該遺伝子をスクリーニングすることが望ましい。
【0016】次に、得られたクローンから全長のcDNAをクローニングする。cDNAのクローニングには、例えばRACE(Rapid Amplification of cDNA ends)法が用いられる。RACE法とは、cDNA の5'又は3'欠失部位をPCRにより迅速に回収する方法である。なお、RACE法は、市販のキット(MarathonTM cDNA Amplification Kit(Clonetech社))を用いて行うこともできる。
【0017】cDNAの塩基配列の決定及び確認は、マキサム-ギルバートの化学修飾法、又はM13ファージを用いるジデオキシヌクレオチド鎖終結法等の公知手法により行うことができるが、通常は自動塩基配列決定装置(例えばApplied Biosystems社製ABI373シークエンサー等)を用いて配列決定が行われる。
【0018】一旦本発明において使用する乳酸生成遺伝子の塩基配列が確定されると、その後は化学合成によって、又はクローニングされたcDNAを鋳型としたPCRによって、あるいは該塩基配列を有するDNA断片をプローブとしてハイブリダイズさせることによって、当該遺伝子を得ることができる。さらに、部位特定変異誘発等によって乳酸生成遺伝子の変異体を合成することもできる。遺伝子に変異を導入するには、Kunkel法、Gapped duplex法等の公知の手法又はこれに準ずる方法を採用することができる。例えば、部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutant-K(TAKARA社製)やMutant-G(TAKARA社製))などを用いて、あるいは、TAKARA社のLA PCR in vitro Mutagenesis シリーズキットを用いて変異の導入が行われる。
【0019】(2) 組換えベクターの構築本発明の組換えベクターは、適当なベクターに乳酸遺伝子を連結(挿入)することにより得ることができる。乳酸生成遺伝子を挿入するためのベクターは、宿主中で複製可能なものであれば特に限定されず、例えば、プラスミド DNA、ファージ DNA等が挙げられる。
【0020】プラスミド DNAとしては、大腸菌由来のプラスミド(例えばpBR322, pBR325,pUC118, pUC119, pUC18, pUC19等)、枯草菌由来のプラスミド(例えばpUB110,pTP5,等)、酵母由来のプラスミド(例えばYEp13, YEp24, YCp50等)などが挙げられ、ファージDNAとしてはλファージ(Charon4A、Charon21A、EMBL3、EMBL4、λgt10、λgt11、λZAP等)が挙げられる。さらに、レトロウイルス又はワクシニアウイルスなどの動物ウイルス、バキュロウイルスなどの昆虫ウイルスベクターを用いることもできる。ベクターに乳酸生成遺伝子を挿入するには、まず、精製されたDNAを適当な制限酵素で切断し、適当なベクター DNAの制限酵素部位又はマルチクローニングサイトに挿入してベクターに連結する方法などが採用される。
【0021】本発明において使用する乳酸生成遺伝子は、その遺伝子の機能が発揮されるようにベクターに組み込まれることが必要である。そこで、本発明のベクターには、プロモーター、乳酸生成遺伝子、ターミネーターのほか、所望によりエンハンサーなどのシスエレメント、スプライシングシグナル、ポリA付加シグナル、選択マーカー、リボソーム結合配列(SD配列)などを連結することができる。なお、選択マーカーとしては、例えばジヒドロ葉酸還元酵素遺伝子、アンピシリン耐性遺伝子、ネオマイシン耐性遺伝子等が挙げられる。
【0022】例えば、本発明において使用する組換えベクターは、乳酸生成遺伝子の上流にグリセルアルデヒド3-リン酸デヒドロゲナーゼ遺伝子(GAP遺伝子)のプロモーター(GAP-P)を、下流にGAP遺伝子のターミネーター(GAP-T)及びアンピシリン耐性遺伝子(Ampr)を連結して遺伝子発現カセットを作製し、このカセットを、予めURA3遺伝子及び2μm oriを連結しておいたプラスミドに連結することにより、7480bpの長さを有する組換えベクターを構築することができる(図1;pYLD1)。
【0023】図1において、各制限酵素名の次に記載されている数字は、アンピシリン抵抗性マーカー遺伝子のHindIII切断位置を0としたときの切断位置を示す。なお、上記組換えベクターpYLD1は大腸菌に導入され(名称:「E. coli pYLD1」)、工業技術院生命工学工業技術研究所(茨城県つくば市東1丁目1番3号)に、FERM P-17621として寄託されている(寄託日:平成11年10月26日)。
【0024】2.耐酸性乳酸生成微生物の調製(1)耐酸性微生物本発明において、「耐酸性微生物」とは、酸性条件、好ましくはpHが6以下、さらに好ましくはpH2〜5で乳酸発酵を行うことができる微生物を意味する。本発明に使用する微生物は、耐酸性を有し、かつ乳酸生成を行うことができる限り、特に限定されるものではなく、天然から採取されたものも含まれる。本発明では、乳酸生成遺伝子を組み込んだ組換えベクターを上記耐酸性微生物に導入して形質転換体を得、乳酸生成遺伝子が機能するように操作することもできる。「乳酸生成遺伝子が機能する」とは、該遺伝子が組み込まれたベクターを導入した宿主(微生物)を培養して乳酸を生成させたときに、乳酸の蓄積により培地のpHが酸性になっても(特に、pH6以下に下がっても)当該発現が維持されて乳酸を生成し得るように発現することを意味する。
【0025】本発明において宿主として使用される乳酸生成微生物は、例えば、サッカロミセス属等の酵母、あるいはリゾプス属に属するカビなどが挙げられるが(例えば下記微生物参照)、これらの微生物に限定されるものではない。
【0026】(2) 形質転換耐酸性乳酸生成微生物(耐酸性乳酸発酵微生物ともいう)を得るための形質転換は、上記手法により得られた耐酸性微生物に、乳酸生成遺伝子を含む本発明の組換えベクターを導入し得る方法であれば特に限定されるものではない。例えば、酢酸リチウム法、カルシウムイオンを用いる方法(Proc. Natl. Acad. Sci., USA, 69, 2110, 1972)、エレクトロポレーション法等の通常行われる遺伝子工学的手法により形質転換を行う。
【0027】3.乳酸発酵本発明の耐酸性乳酸生成微生物は、培養して乳酸を生成させると、乳酸の蓄積により培地のpHが酸性になっても(特に、pH6以下に下がっても)当該発現が維持されて乳酸を生成し得るように機能する。従って、耐酸性乳酸生成微生物を用いると、中和剤を使用せずに乳酸発酵することができる。
【0028】本発明において乳酸発酵に使用される糖化原料としては、さつまいも、ジャガイモ、トウモロコシ等が挙げられる。これらの原料を洗浄及び破砕した後、液化・糖化槽に入れ、90〜120℃、好ましくは120℃の蒸気で5〜30分、好ましくは15分処理する。
【0029】原料に対し0.5〜2.5倍の水を加えた後、市販の酵素(例えばターマミル(ノバ社)及びスミチーム(新日本化学社))を原料重量に対して0.5〜1%添加する。温度50〜95℃、好ましくは60℃で15〜20時間保持すれば原料の液化、糖化が完了する。
【0030】上記のようにして得られた液を遠心分離にかけ、固形分(リグニン等)を分離し、原液とする。なお、デンプン原料としてブドウ糖を用いる場合はこれまでの工程を省略し、原液として直接使用することができる。この液を基質溶液として菌体培養及び発酵に使用する。
【0031】培養のための培地は、通常は糖類、ペプトン、酵母エキスを含む。好ましくは、0.1〜10%グルコース、0.1〜10%ペプトン、0.1〜10%酵母エキスを含み、さらに好ましくは約2%のグルコース、約2%のペプトン、約1%の酵母エキスが使用される。
【0032】また、培地として予め濾過除菌したものを用いることができ、特に乳酸菌用培地としてMRS培地又はGYP培地等を用いることができる。更に、コーンスターチ製造の副産物であるコーンスティープリカーを使用することも可能である。発酵条件は以下の通りである。
【0033】温度:25〜33℃、好ましくは30℃菌体密度:10〜30%、好ましくは25%(湿重量ベース)
基質濃度:5〜20%、好ましくは10%(バッチ発酵の初期濃度)
発酵時間:10〜30時間、好ましくは20〜24時間
【0034】本発明の耐酸性乳酸生成微生物は、1種類単独でもよく、複数種を混合して用いることもできる。複数種を混合する場合は、互いに同一の属に属する微生物であっても異なる属に属する微生物であってもよい。また、混合比率は任意に設定することができ、特に限定されるものではないが、それぞれ均等(例えば3種類の微生物を用いるときは1:1:1)となるようにすることが好ましい。
【0035】上記条件で発酵させることにより、1〜10%の乳酸が得られる。乳酸の収率は、例えば、Fキット(ベーリンガー社)などの市販のキットを用いて測定することができる。本発明においては、上記発酵の際に炭酸カルシウム、水酸化ナトリウム、アンモニアなどの中和剤を添加する必要はない。
【0036】この発酵液を遠心分離装置又はフィルターにかけて菌体と液分とを分離し、乳酸の液分の採取(精製・濃縮)を行う。液分の精製・濃縮は、一般に海水や食品の脱塩に広く採用されているイオン交換膜を利用した電気透析装置(例えばアシライザー(旭化成社))により行うことができる。
【0037】本発明に使用されるイオン交換膜は特に限定されず、従来より公知のイオン交換膜が使用できる。例えば、陽イオン交換膜としてはスルホン酸基、カルボン酸基、さらにこれらのイオン交換基が複数混在した陽イオン交換膜が挙げられる。また、陰イオン交換膜としては4級アンモニウム基、1級アミノ基、2級アミノ基、3級アミノ基、さらにこれらのイオン交換基が複数混在した陰イオン交換膜が挙げられる。これらの陽イオン及び陰イオン交換膜は、重合型、縮合型、均一型及び不均一型のいずれでもよく、さらに、補強心材の有無や、炭化水素系のものであるか否か、フッ素系のものであるか否かを問わず、材料・製造方法に由来するイオン交換膜の種類、形式などに関係なく任意に選択することができる。本発明において、電気透析装置は電極間に陰イオン交換膜と陽イオン交換膜とを交互に配列して濃縮室と脱塩室とを形成することによって構成されるものが好ましい。
【0038】なお、電気透析時の各種液の温度は、通常、20〜45℃、好ましくは35〜40℃の範囲である。電気透析を行うと、イオン性物質と非イオン性物質を分離すると同時に乳酸を濃縮することが可能である。この工程により、発酵液中のアルコール、残糖、タンパク質等を分離し、乳酸濃度を濃縮することができる。例えば、電気透析処理により5〜10%の乳酸を25〜30%に濃縮できる。
【0039】電気透析で除去できなかったアミノ酸、無機イオン(K,Ca,Mg等)、有機酸(クエン酸、リンゴ酸等)は、クロマト分離装置、イオン交換装置により除去することができる。クロマト分離装置としては、例えば固定層式、移動層式、類似的移動層式等が挙げられる。
【0040】最後に、溶液中の水分を蒸発装置で蒸発させ、50〜90%濃度の乳酸製品を製造することができる。なお、発酵液の精製・濃縮は、上記の方法に限定されるものではなく、蒸留法によっても行うことができる。
【0041】
【実施例】以下、実施例により本発明をさらに具体的に説明する。但し、本発明はこれら実施例にその技術的範囲が限定されるものではない。
〔実施例1〕組換えベクターの構築及び形質転換1. 組換えベクターの構築(1) 乳酸遺伝子のクローニングB. longum 由来LDHのN末端アミノ酸配列から32mer(5'-ACIGCICCIG CICCIATIACIGCIAGTTTI GT-3'(配列番号1))のオリゴヌクレオチドを作製した。B. longum aM101-2株の染色体DNAの4.2kb HindIII断片から上記オリゴヌクレオチドを用いてコロニーハイブリダイゼーションを行いLDH遺伝子の部分断片を得、pUC19にクローン化した。全長断片を取得するため、pUBL1の0.3kbのHindIII-SacI断片にハイブリダイズする0.9kbのSalI-SacI断片をpUC118にクローン化した。これらクローンをHindIIIで処理した後連結を行い、Gene Cleanキット(Bio 101)により全長LDH遺伝子(Gene, 85(1989) 161-168)を取得した。
【0042】(2) 各遺伝子のプラスミドへの連結得られたLDH遺伝子とpKK223-3由来のtacプロモーターをpUC118に連結した。このプラスミドからEcoRI、XhoIサイトでLDH遺伝子を切り出した後、GAPプロモーター、GAPターミネーターを含んでいる酵母発現用ベクターpCHIのEcoRI、SalIサイトに連結した。連結にはTakaraの「ligation kit ver. 2」を用い16℃で3時間反応させた。反応後コンピーテントセルである大腸菌DH5αに形質転換を行い、LB/アンピシリンプレートに撒き、37℃で一晩培養を行い、形質転換株を得た。得られたクローンからアルカリSDS法によりプラスミドの精製、抽出を行い、酵母発現用LDHベクターであるpYDL1を取得した(図1)。
【0043】なお、本発明の組換えベクターpYLD1は大腸菌に導入され(名称:「E. coli pYLD1」)、工業技術院生命工学工業技術研究所(茨城県つくば市東1丁目1番3号)に、FERM P-17621として寄託されている(寄託日:平成11年10月26日)。
【0044】2.組換えベクターの宿主への導入宿主である酵母Saccharomyces cerevisiae YPH500株をYPD培地にて30℃で対数増殖期(O.D. 1.0以下)まで培養を行い、集菌(3000rpm, 2分)及びTEバッファー(10mM Tris, 1mM EDTA, pH7.5)による洗浄を行った後、0.5Mの酢酸リチウム液に懸濁した。上記菌体100μlにpYDL1約1μgとキャリアーDNA(サケ精子DNA)を1μg添加した。これに800μlのTLP(40% PEG、0.1M酢酸リチウム、10mM Tris、1mMEDTA)を加え、室温に40分静置した後、42℃で10分間熱ショックを与えた。その後菌体を遠心分離し(1200rpm)TEバッファーで洗浄を行い、200μlのTEに懸濁した後選択培地で30℃で2日間培養を行い、形質転換株(YPLD1)を取得した。
【0045】〔実施例2〕 乳酸発酵乳酸発酵の原料であるさつまいも(100g)を洗浄及び破砕した後、液化・糖化槽に入れ、ターマミル(ノバ社)1%と水100gを加えて95℃で2時間処理した。続いてスミチーム(新日本化学社)0.53を添加し、約12時間反応させ、原料の液化及び糖化を行った。
【0046】上記のようにして得られた原液を遠心分離(10,000rpm)にかけ、固形分(リグニン等)を分離した。これを発酵原液とし、実施例1で得られた乳酸生成菌YPLD1を用いて以下の発酵に使用した。培地は、通常は糖類2%、ペプトン2%、酵母エキス1%をそれぞれ含むYPD培地を用いた。培地に上記発酵原液10%を加え、発酵を行った。発酵は、温度30℃、菌体密度2%(湿重量ベース)、基質濃度5%(バッチ発酵の初期濃度)、発酵時間20〜24時間で行った。その結果、2%の乳酸が得られた。
【0047】この発酵液を遠心分離装置又はフィルターにかけて菌体と液分とを分離し、乳酸の液分の採取(精製・濃縮)を行った。液分の精製・濃縮は、旭化成社のマイクローグMF(PSP-103)装置を用いた。電気透析後、除去できなかったアミノ酸、無機イオン(K,Ca,Mg等)、有機酸(クエン酸、リンゴ酸等)を、クロマトグラフィー(擬似移動層クロマト装置トレソーーネ(オルガノ社))にかけて除去した。
【0048】蒸発缶(実験室用エバポレーター)により水分を蒸発させ、90%の乳酸水溶液を得た。比較対照として、耐酸性ではない酵母菌(YPH-500)を用いて、上記と同様の乳酸発酵を行った。その結果、乳酸生成量は0%であった。
【0049】
【発明の効果】本発明により、乳酸生成遺伝子が組み込まれた組換えベクター、及び該ベクターを含む耐酸性乳酸生成微生物が提供される。本発明の微生物を用いて乳酸発酵を行うと、アンモニア等のアルカリ(中和剤)を添加・回収する工程がないため操作が簡便であり、生産性が上昇し、さらに、高価なバイポーラ膜を使用する必要がないためコスト低減を図ることができる。従って、本発明の微生物は高生産性乳酸発酵用として有用である。
【0050】
【配列表】
SEQUENCE LISTING <110> Toyota Motor Corporation<120> Acid-resisting and lactic acid-producing microorganisms<130> P99-0593<140><141><160> 1<170> PatentIn Ver. 2.0<210> 1<211> 32<212> DNA<213> Artificial Sequence<220> <223> Synthetic DNA<220><221> modified base<222> 3<223> i<220><221> modified base<222> 6<223> i<220><221> modified base<222> 9<223> i<220><221> modified base<222> 12<223> i<220><221> modified base<222> 15<223> i<220><221> modified base<222> 18<223> i<220><221> modified base<222> 21<223> i<220><221> modified base<222> 24<223> i<220><221> modified base<222> 30<223> i<400> acngcnccng cnccnatnac ngcnagtttn gt 32
【0051】
【配列表フリーテキスト】配列番号1:合成DNA
【図面の簡単な説明】
【図1】プラスミドpYLD1の構築図である。
【特許請求の範囲】
【請求項1】 ビフィドバクテリウム属又はラクトバシルス属に属する微生物由来の乳酸デヒドロゲナーゼ遺伝子及びプロモーターが組み込まれた組換えベクター。
【請求項2】 ビフィドバクテリウム属に属する微生物がビフィドバクテリウム・ロンガムである請求項1記載の組換えベクター。
【請求項3】 プロモーターがグリセルアルデヒド3リン酸デヒドロゲナーゼ遺伝子のプロモーターである請求項1又は2記載の組換えベクター。
【請求項4】 下記の制限酵素地図を有し、かつ7480bpの長さを有する組換えベクター。
【化1】

【請求項5】 請求項1〜4のいずれか1項に記載の組換えベクターを含む耐酸性乳酸生成微生物。
【請求項6】 pH6以下の条件下で乳酸発酵することができる請求項5記載の耐酸性乳酸生成微生物。
【請求項7】 微生物が酵母菌又はカビである請求項5又は6記載の耐酸性乳酸生成微生物。
【請求項1】 ビフィドバクテリウム属又はラクトバシルス属に属する微生物由来の乳酸デヒドロゲナーゼ遺伝子及びプロモーターが組み込まれた組換えベクター。
【請求項2】 ビフィドバクテリウム属に属する微生物がビフィドバクテリウム・ロンガムである請求項1記載の組換えベクター。
【請求項3】 プロモーターがグリセルアルデヒド3リン酸デヒドロゲナーゼ遺伝子のプロモーターである請求項1又は2記載の組換えベクター。
【請求項4】 下記の制限酵素地図を有し、かつ7480bpの長さを有する組換えベクター。
【化1】

【請求項5】 請求項1〜4のいずれか1項に記載の組換えベクターを含む耐酸性乳酸生成微生物。
【請求項6】 pH6以下の条件下で乳酸発酵することができる請求項5記載の耐酸性乳酸生成微生物。
【請求項7】 微生物が酵母菌又はカビである請求項5又は6記載の耐酸性乳酸生成微生物。
【図1】




【公開番号】特開2001−204468(P2001−204468A)
【公開日】平成13年7月31日(2001.7.31)
【国際特許分類】
【出願番号】特願2000−18953(P2000−18953)
【出願日】平成12年1月27日(2000.1.27)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【Fターム(参考)】
【公開日】平成13年7月31日(2001.7.31)
【国際特許分類】
【出願日】平成12年1月27日(2000.1.27)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【Fターム(参考)】
[ Back to top ]

