肝炎を治療するための医薬組成物及びその用途
【課題】本発明は、肝炎を治療するための医薬組成物に関する。
【技術手段】活性成分として用いられるルシッドワン、及び医薬で認められているベクターが含まれており、ルシッドワンは天然化合物シクロペンタンジオンであるため、本発明の医薬組成物による副作用が比較的に低いこと、そして、本発明は該医薬組成物の用途にも関する。
【技術手段】活性成分として用いられるルシッドワン、及び医薬で認められているベクターが含まれており、ルシッドワンは天然化合物シクロペンタンジオンであるため、本発明の医薬組成物による副作用が比較的に低いこと、そして、本発明は該医薬組成物の用途にも関する。
【発明の詳細な説明】
【技術分野】
【0001】
本考案は、肝炎を治療するための医薬組成物に関わり、特に、アルコール性肝炎を治療するための医薬組成物に関する。
【背景技術】
【0002】
肝臓は、人の体で最も重要な器官の一つであり、薬物の代謝、アミノ酸の代謝、脂質の代謝や解糖作用など、多くの重要な生理機能を果たし、急性・慢性肝臓疾患が広く重要視されるようになったが、肝臓疾患の治療効果を高めるための方法は、更に研究すべき余地が残されている。アルコール性肝臓疾患(alcoholic liver disease、ALD)を例として、多くの研究によると、ヘムオキシゲナーゼ(heme oxygenase)、腫瘍壊死因子(tumor necrosis factor、TNF)と活性酸素(reactive oxygen species、ROS)は、アルコール性肝臓疾患と密接に関わっていると指摘されたが、いまのところ、アルコール性肝臓疾患に対する有効な治療法がないようである。
【0003】
近年、化学合成薬の服用で、患者に対する副作用発生のリストが次第に重要視されるように、天然化合物を基本の代替薬として用いれ、学術界や医療界で大きく注目されている。ルシッドワン(lucidone)は、クスノキ科植物(Lauraceae)の実から抽出して得られた天然化合物シクロペンタンジオン(cyclopentenedione)であり、一般的には、ルシッドワンは高度の抗酸化潜在力があると思われているが、ルシッドワンによるアルコール性肝臓疾患治療の研究はまだないようである。
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、肝炎治療用医薬組成物を提供し、特に、アルコール性肝炎を治療するための有効方法を提供することを目的とする。
本発明において、薬物の副作用リスクを下降させるために、肝炎治療用医薬組成物を、天然化合物を活性成分として提供することをもう一つの目的とする。
【課題を解決するための手段】
【0005】
上述の目的を達成させるため、本発明は、活性成分として用いられる有效量のルシッドワン、及び及医薬で認められているベクターが含まれている肝炎治療用医薬組成物を提供する。
好適な該肝炎は、アルコール性肝炎であることをいう。
好適な該医薬組成物は、ルシッドワン1〜2 wt%、及び医薬で認められているベクター98〜99 wt%が含まれていることを特徴とする。
好適な該ベクターは、澱粉、乳糖、ショ糖、微結晶セルロースまたはカルボキシメチルセルロースであることを特徴とする。
好適な該医薬組成物は更に、医薬で認められている添加剤が含まれており、該添加剤はアミノ酸、ビタミンまたはミネラルであることを特徴とする。
好適な該医薬組成物は、錠剤、カプセル、皮膚パッチ剤、懸濁剤、粉末、鼻吸入剤、スプレー剤または注射剤であることを特徴とする。
本発明は更に、被験物質を該医薬組成物に接触させることが含まれているアルコールによる酸化ストレス低減方法を提供する。
好適な該被験物質は、哺乳動物であることをいう。
好適な該哺乳動物は、人類であることをいう。
上述の内容をまとめると、本発明は、ルシッドワンを活性成分とし、肝炎に治療効果がある医薬組成物であり、はっきりと言えば、アルコール性肝炎を治療する効果があるということであり、そして、ルシッドワンは天然化合物なので、薬物の副作用リスクを大幅に低下させることができる。
【図面の簡単な説明】
【0006】
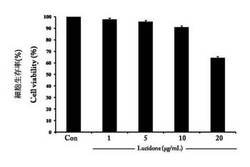
【図1A】HepG2細胞モデルのルシッドワン細胞毒性測試結果を表す。
【図1B】HepG2細胞モデルのアルコール細胞毒性測試結果を表す。
【図2A】HepG2細胞モデルASTの含有量を表す。
【図2B】HepG2細胞モデルALTの含有量を表す。
【図2C】HepG2細胞モデルTNF-αの含有量を表す。
【図3A】HepG2細胞モデル活性酸素の含有量を表す。
【図3B】HepG2細胞モデル一酸化窒素の含有量を表す。
【図4A】HepG2細胞モデルGSHの含有量を表す。
【図4B】HepG2細胞モデル脂質過酸化程度を表す。
【図5A】HepG2細胞モデルHO-1タンパク質量を表す。
【図5B】HepG2細胞モデルHO-1 mRNA量を表す。
【図6A】HepG2細胞モデルNrf-2の移動程度を表す。
【図6B】HepG2細胞モデルにおけるNrf-2とAREの結合活性を表す。
【発明を実施するための形態】
【0007】
従来の研究によると、アルコールは、肝炎を発症させる恐れがあり、それに伴い、体内で様々な酸化ストレスが増え、炎症も起こるが、例えば、グルタチオン(glutathione)含有量の低下、脂質過酸化(lipid peroxidation)反応の増加、血中腫瘍壊死因子-α(TNF-α)、一酸化窒素、活性酸素 (reactive oxygen species)やプロスタグランジンE2(prostaglandin-E2)の含有量増加などがあり、細胞内のヘムオキシゲナーゼ(heme
oxygenase)量や転写因子Nrf-2 (transcription factor NF-E2 related factor-2)の活性化も、酸化ストレスを増加させた対象とされている。アスパラギン酸アミノ基転移酵素 (aspartate aminotransferase、AST)とアラニンアミノ基転移酵素(Alanine aminotransferase、ALT)は、肝臓細胞に存在している二つの酵素で、通常、肝細胞毀損で破裂したときだけに、血清中に放出されるため、血清中ASTとALTの含有量増加には、肝機能異常(肝炎)の重要指標となる。
【0008】
本発明でいう“治療” は、肝炎に罹った者を対象に、本発明の医薬組成物で取り扱うことをいい、詳しく言えば、アルコール性肝炎に罹った者を対象に、肝炎に罹った個体に対して、本発明の医薬組成物で取り扱い、当該疾患・症状への完治、緩和、解消、治療、予防を目的とし、本発明でいう “肝炎治療”とは、該個体の血清中ASTとALTの含有量を低下させ、または該個体の血清中ASTとALT含有量の増加を避けることを指標とするが、本発明でいう “活性成分”は、本発明の医薬組成物は実際に当該治療効果がある成分をいい、本発明でいう “有效量” は、該治療を行うために、単独使用、またはそのほかの薬物との併用で、本発明の医薬組成物が提供される量をいう。
【0009】
本発明でいう “医薬で認められているベクター” は、所属分野で知られ、しかも本発明の医薬組成物の活性成分效果に影響しないベクターをいい、例えば、澱粉、乳糖、ショ糖、微結晶セルロースまたはカルボキシメチルセルロースであり、しかし、それに限らないが、本発明の医薬組成物は更に、医薬で認められている添加剤を配合して、本発明の個体に余分な栄養を補充できるが、それはアミノ酸、ビタミンまたはミネラルが含まれるが、それに限らないが、該ビタミンは、ビタミンB群、ビタミンC、ビタミンEまたはその組合せが含まれるが、それに限らないが、本発明の医薬組成物は、錠剤、カプセル、皮膚パッチ剤、懸濁剤、粉末、鼻吸入剤、スプレー剤または注射剤でもよいが、それを制限する必要はない。本発明の医薬組成物は原則として、従来のよく知られている方法で投薬されるが、好適な投薬方法は経口投与であり、本発明の医薬組成物の投与量は、取扱い待ちの患者の年齢、健康状態、治療コース及び/または症状によって使用される。
【実施例1】
【0010】
実施例1: 実験材料及びその方法
(化学試薬と抗体)
本発明に使用されるルシッドワンは、従来のよく知られている方法で純化されたもので、その純度は、高速液体クロマトグラフィー(high-performance liquid chromatography、HPLC)と核磁気共鳴(1H-NMR)により、99%以上に達していると確認されている。アルコール、クルミン(curcumin、純度99%)とグリース試薬(Griess reagent)を米国Sigma-Aldrich(St. Louis、Mo、USA)から、マウス抗HO-1モノクローナル抗体とウサギ抗Nrf-2ポリクローナル抗体は、米国Abcam(Cambridge、MA、USA)から、マウス抗アクチン(actin)モノクローナル抗体は、米国Sigma-Aldrich(St. Louis、Mo、USA)から購入した。
【0011】
(実験マウス)
ヒトHepG2肝ガン細胞(human hepatocarcinoma
cells、米国American Type
Culture Collection (ATCC、Manassas、VA、USA)から購入)は正常状態で、MEM(minimum
essential medium)培養液にて培養され、栄養や必要な抗生物質を補充するために、10%ウシ胎児血清(FBS)、ブドウ糖4.5g/L、グルタチオン(glutamine) 4 mM、ペニシリン(penicillin、100 units/mL)とストレプトマイシン(streptomycin、100 μg/mL)を添加し、37℃、5%CO2の環境に静置して培養される。実験設計により、正常状態で培養されたHepG2細胞には更に、違った濃度のルシッドワン(1、5または10 μg/mL)とクルミン(10 μg/mL)を加えて共に培養し、そして、実験設計により、アルコール100 mMを添加して12〜24時間培養する。
【0012】
(実験マウス)
実験マウスは、Charles
River(台北、台湾)から購入した、年齢四週間、ICR系のオスマウス(25±5公克)で、実験を行う前、環境に適応させるように、実験マウスに餌と水を無制限に供給するという実験室の恒常条件で、少なくとも一週間飼育するが、動物実験の取り扱いはすべて、実験動物飼養管理(Guide for the Care and Use of Laboratory Animals) 及び関連する台湾の動物保護法、また、現地の道徳委員会の許可を得て行われている。80%アルコールまたはルシッドワンを該実験マウス(1 mL/Kg)に投与する方法は、次のように、アルコール経口投与、アルコール腹腔内注射(intra-peritoneal injection)、アルコールとルシッドワン経口投与、アルコールとルシッドワン腹腔内注射(intra-peritoneal injection)法がある。
【0013】
(MTT 試験)
本試験に用いられるMTT(3-[4,5-dimethyl-thiazol-2-yl]-
2,5-diphenyl tetrazolium bromide)は、米国Sigma- Aldrich(St. Louis、Mo、USA)から購入、MTT試験は、生物学で細胞生存率または細胞増殖を測定るためによく用いられている方法であり、その原理は、生きた細胞の糸粒体のコハク脱水素酵素との働きで、MTTのtetrazoliumを濃青色の代謝物にし、そこへ更に、ジメチルスルホキシド(DMSO)を加え、細胞に蓄積された濃青色の代謝物を溶出したあと、濃青色の代謝物量を分光光度計で測定し、生きた細胞数を間接的に推定できることである。MTT試験手順は、所属分野の従来のよく知られている実験手順で行われるが、簡単に言えば、実験設計により、該HepG2細胞を24時間培養した後、培養液を取り除き、MTT添加の新鮮なMEM 培養液(MTT (10 μg/mL)
10 μlと新鮮なMEM 90 μl培養液との混合)を培養皿に入れたあと、37℃で、該HepG2細胞を1時間培養するが、最後に、分光光度計(ELISA microplate reader、μQuant、Bio-Tek instruments、Inc.、Winooski、VT、USA)を波長570 nmにし、濃青色の代謝物量を測定するが、それにより、細胞の生存率を間接的に算出できる。
【0014】
(ALTとASTの濃度測定)
市販の測定キット (Randox Laboratories、Antrim、UK)で、HepG2細胞培養後の培養液、及びマウス実験におけるマウス血清中ALTとAST濃度を測定する。簡単に言えば、実験設計に従って培養されたHepG2細胞の培養液と実験マウスの血清を取り、該測定キット及び推奨の実験手順により、分光光度計(ELISA
microplate reader、μQuant、Bio-Tek instruments、Inc.、Winooski、VT、USA)で、波長340 nmの吸光度を測定するが、そうすると、ALTとAST濃度が算出でき、酵素活性を表す單位(U/L)の結果が表される。
【0015】
(脂質過酸化程度の測定)
市販の脂質過酸化測定キット(Oxford
Biomedical Research、Oxford、MI、USA)で、細胞内の脂質酸化の障害程度を定量的に測定するが、簡単に言えば、細胞溶解液(lysis buffer) 200 μlで細胞を溶解させる(lysed)が、毎140 μlの細胞破砕液(cell lysate)に、アセトニトリル(acetonitrile)に溶けたN-メチル-2-フェニルインドール(N-methyl-2-phenylindole)
455 μlと塩酸(HCL、37%)105 μlを混合し、45℃で60分間静置する。マロンジアルデヒド(malondialdehyde、MDA)は、高度不飽和脂肪酸(polyunsaturated fatty acid)が酸化、破砕された主産物であり、本実験では、マロンジアルデヒドと反応して生成された、安定した発色団(chromophore)であるN-メチル-2-フェニルインドールを用い、最大吸収波長535 nmにて、マロンジアルデヒドの形成を測定し、脂質過酸化指標とするが、そして、上述と同様の方法で、実験マウス血清中の脂質過酸化程度を測定する。
【0016】
(グルタチオン含有量の測定)
市販のGSH-96穴プレート比色分析キット(96-well plate colorimetric GSH
assay kit、Oxis International、Foster City、CA、USA)で、グルタチオン(GSH)含有量を測定する。簡単に言えば、塩酸に溶けた発色剤(chromogenic reagent) 40 μlを、非タンパク質肝細胞溶解液(non proteinhepatocyte lysate)
40 μlの中に入れ、それから更に、水酸化ナトリウム(NaOH、30%)40 μlと顕色剤(color developer) 4 0μlと緩衝液を加えて、一つの混合液に混合するが、次は、該混合液をやさしくvortexしたあと、室温にて10分間静置するが、最後は、分光光度計(ELISA microplate
reader、μQuant、Bio-Tek instruments、Inc.、Winooski、VT、USA)で、波長412 nmの吸光度を測定し、濃度既知のGSH吸光度曲線とを比較して、GSHの含有量を判別するが、上述と同様の方法で、実験マウス血清中のグルタチオン含有量を測定する。
【0017】
(グリースによる亜硝酸塩の測定及び腫瘍壊死因子-αの測定)
グリース反応(Griess reaction)により細胞培養上清とマウス血清中に蓄積された亜硝酸塩を測定、一酸化窒素の生成量を間接的に測定する。細胞培養上清及び血清中腫瘍壊死因子-α量の測定は、市販のヒト腫瘍壊死因子-α ELISAキット (human TNF-α
ELISA kit)で行われるが、簡単に言えば、該HepG2細胞を96穴プレートに1×107 cells/well の濃度でそれぞれ培養し、そして、実験設計により、ルシッドワンとアルコールを添加して、共に24時間培養するが、培養された培養液は、該キットのワーク試薬(work reagent)で、1: 2の割合で希釈したあと、毎100 μl希釈後の培養液に対して、該キットの使用規則に従ってELISA反応を行うが、その後、分光光度計で波長450 nmの吸光度を測定し、腫瘍壊死因子-αの含有量を判定するが、マウス実験では、マウス血清の測定は、上述と同様に、該キットの使用規則に従って、適当に希釈してから、腫瘍壊死因子-αの含有量測定を行う。
【0018】
(細胞内活性酸素の蓄積量測定)
市販の蛍光検索子DCF-DA
(dihydrodichloro- fluorescein
diacetate; Sigma、USA)で、細胞内活性酸素(ROS)の蓄積量を測定する。簡単に言えば、細胞(1×107)をリン酸緩衝液で潤したあと、DCF-DA10μmを加えて、37℃で4時間培養したあと、蛍光分光光度計(fluorescence
spectrophotometer)で蛍光量(488 nm/530
nm)を測定する。
【0019】
(細胞質抽出液と細胞核抽出液の製造)
細胞質抽出液と細胞核抽出液の製造は、所属分野でよく知られている実験手順により、市販の実験キット(protocol#78833 Nuclear and Cytoplasmic
Extraction Reagent kit)を用い、市販のタンパク質分析試薬(protein assay reagent、Bio-Rad)で、タンパク質濃度を測定して行われる。
【0020】
(ウェスタンブロット法)
本発明のウェスタンブロット法定は、所属分野でよく知られている実験手順により行われるが、その中、該抗体とエンハンスド化学発光試薬(enhanced chemiluminescene regents、ECL、Pierce)で免疫ブロット法(immunoblotting)を行い、それから、イメージング装置(imaging device、Viogene Biotek、Sunnyvale、CA、USA)でその結果を観察する。
【0021】
(電気泳動移動度シフト解析法)
電気泳動移動度シフト解析法 (Electrophoretic mobility shift assay,EMSA)は、既知の実験方法で行われるが、簡単に言えば、所使用的オリゴヌクレオチドプローブ:
Nrf-2センスプライマー 5'- CAG
CAG GAC ATG GAT TTG ATT GAC -3'、アンチセンスプライマー5'-AGA AAA GGC TCC ATC CTC CCG AAC
-3'は、TRI Biotech (Taipei、Taiwan)で合成されたが、続いて、TE緩衝液に加えて、94°Cで5分間加熱したあと、次第に3時間冷却し、二つのプライマーを結合し、細胞核抽出物(20μg/ml)と二つのプライマーNrf-2オリゴヌクレオチド20 ng (結合緩衝液5 μlを加え)を室温で30分間反応させたあと、6 %ネイティブ ポリアクリルアミドゲル(native
polyacrylamide gel)で、DNA/タンパク質複合体を分離させ、それから、Light-Shift Chemiluminescent EMSA Kit
(Pierce Biotechnology Inc.、Rockford、USA)で複合体を顕像し、更にVL Chemi-Smart
3000 (Viogene Biotek)システムで、発光強度イメージを測定する。
【0022】
(RNA抽出及びリアルタイム定量ポリメナーゼ連鎖反応)
Trizol試薬(Invitrogen Life Technologies、Carlsbad、CA、USA)で、細胞の総リボ核酸(total RNA)を抽出し、逆転写酵素ポリメナーゼ連鎖反応で、HO-1とβ-actin (β-アクチン) のメッセンジャーリボ核酸(mRNA)をcDNAに逆転写し、それから、リアルタイム定量ポリメナーゼ連鎖反応(real time-PCR、Applied Biosystems)で、HO-1量とβ-actin量を定量的に測定する。
【0023】
該リアルタイム定量ポリメナーゼ連鎖反応は、DNA染色剤である緑の核酸ゲル染色試薬(SYBR
Green)で、PCR産物を測定する。温度サイクル(thermal cycle)は、96℃で3分間、それから96℃で 1分、50℃ 30秒、72℃で90秒を40サイクル実施し、プライマー配列は、HO-1センス5’-TGC GGT GCA GCT CTT CTG-3’、HO-1アンチセンス5’-GCA ACC CGA CAG CAT GC-3’、β-actinセンス5’-ACC CAC ACT GTG CCC ATC TA-3’、β-actinアンチセンス5’-CGG AAC CGC TCA TTG CC-3’となり、β-actinは、ハウスキーピング遺伝子(housekeeping gene)で、細胞内での大量の安定した遺伝子であり、それをHO-1量の標準化にする。
【実施例2】
【0024】
実施例2: HepG2細胞モデルで見た、アルコール性酸化ストレスと肝炎に対抗するルシッドワンの効果
本実施例は、HepG2細胞をモデルシステム(model system)として、アルコールによる酸化ストレスの発生に対抗するルシッドワンの効果を測定する。
【0025】
(細胞毒性)
まず、ルシッドワンとアルコールの細胞毒性を測定する。ルシッドワンの細胞毒性測定では、該細胞培養法に応じて、培養されたHepG2細胞を5群別に分け、それぞれの培養液にルシッドワン0μg/ml、1μg/ml、5μg/ml、10μg/mlまたは20 μg/mlを加え、共に24時間培養するが、アルコールの細胞毒性測定では、該細胞培養法に応じて、培養されたHepG2細胞を6群別に分け、それぞれの培養液にアルコール0mM、10 mM、50 mM、100 mM、200 mMまたは500 mMを加え、共に24時間培養するが、ルシッドワンやアルコールも添加されない該群別は、本実施例の対照群(すなわち、ルシッドワン0 μg/mlとアルコール0 mMの場合)とし、更にMTT 試験で細胞の生存率を測定する(実施例1(MTT 試験)参照)。
【0026】
ルシッドワンの細胞毒性測定結果は、図1Aに示されているが、そのデータによると、実験群20 μg/mlは対照群に比べて、細胞の生存率が約40%低下し、ルシッドワン濃度10μg/ml以下の場合は、細胞毒性がないと分かった。そして、図1Bに示されるように、実験群のアルコール添加量が100 mM以上である場合は、細胞毒性があったと示されている。
【0027】
(HepG2細胞モデルの実験設計)
正常状態で培養されている該HepG2細胞を群分けにし、それぞれルシッドワン0μg/ml、1μg/ml、5μg/ml、10 μg/ml (0 μg/mlは陰性対照群)またはクルミン10μg/ml (curcuminは、既知の天然抗酸化化合物で、本発明では陽性対照群として用いられるもの)を加え、共に1時間培養したあと、更にアルコール (100 mM)を加え、24時間培養して、酸化ストレスの発生を促進させるようにする。実験群と各対照群の配置は表一に示す。
【0028】
【表1】

【0029】
(培養後の培養液におけるALT、ASTと腫瘍壊死因子-αの含有量)
実験後のHepG2細胞培養液におけるALT、ASTと腫瘍壊死因子-α
(TNF-α)の含有量を測定する(実施例1(ALT和ASTの濃度測定)と(腫瘍壊死因子-αの測定)を参照)。
【0030】
図2A〜Cはそれぞれ、ALT、ASTとTNF-αの含有量変化(その中、conは、空白対照群(blank control)を表し、該群別の細胞には、ルシッドワン、クルミンまたはアルコールによる取り扱いはないが、詳しくは該HepG2細胞モデルの実験設計を参照)が示されており、図2A〜Cに示すように、陰性対照群の細胞培養液におけるALT、ASTとTNF-αの含有量が顕著に増加したので、アルコールによるHepG2細胞の炎症反応が発生し、細胞損傷もあったと示され、ルシッドワンは、用量依存(dose-dependent)モデルで、アルコールによるALT、ASTとTNF-α含有量の増加を低減させたので、その効果は、既知の天然抗酸化物クルミンとほぼ同様である。
【0031】
(培養後の培養液における活性酸素と一酸化窒素の含有量)
実験後のHepG2細胞培養液における活性酸素と一酸化窒素の含有量を測定する(実施例1(細胞内活性酸素の蓄積量測定)と(グリースによる亜硝酸塩の測定)を参照)。
【0032】
図3Aは、各群別のHepG2細胞の活性酸素含有量を示し、蛍光検索子DCF-DAの蛍光強度で活性酸素の含有量を表し、図3Bは、各群別のHepG2細胞の一酸化窒素生成量を示し、亜硝酸塩の生成量で一酸化窒素生成量を表している。
図3Aと図3Bに示すように、それぞれの陰性対照群の細胞培養液における活性酸素と一酸化窒素の含有量が顕著に増加し、アルコールによるHepG2細胞の酸化ストレスが発生したと示され、該実験結果から見ると、活性酸素と一酸化窒素含有量の増加は、細胞が損傷し、ASTとALTの放出された原因になると思われる。そして、ルシッドワンは、用量依存(dose-dependent)モデルにより、アルコールによるALT、ASTとTNF-α含有量の増加を低減させたため、その効果は既知の天然抗酸化物クルミンとほぼ同様、またはそれより優れている。
【0033】
(培養後の培養液におけるGSHの消耗及び脂質過酸化現象)
実験後のHepG2細胞培養液における活性酸素と一酸化窒素の含有量を測定する(実施例1(HepG2細胞モデルの実験設計)、(脂質過酸化程度の測定)と(グルタチオン含有量の測定)を参照)。
【0034】
図4Aに示されるように、アルコールは、細胞内のGSH濃度を低下させ、HepG2細胞は、アルコールによる酸化ストレスに応じて、GSH含有量が消耗したと示されている。あらかじめ、ルシッドワンまたはクルミンを加え、共に培養して、このような現象が避けられたことで、ルシッドワンやクルミンは、アルコールによる酸化ストレスに対抗する効果があることを意味している。
【0035】
図4Bに示すように、アルコールは、細胞内の大量な脂質過酸化現象を発生させたが、ルシッドワンやクルミンは、脂質過酸化の発生を大幅に減少された。
【0036】
(HepG2細胞のHO-1 mRNA量及びタンパク質量)
ヘムオキシゲナーゼは、哺乳類動物の組織でよく見られるストレス反応酵素(stress-responsive enzyme)であり、ヘム(heme)を胆緑素(biliverdin)、遊離した鉄イオン(Fe2+)と一酸化炭素(carbon
monoxide)に分解する酵素であり、ヘム、重金属、サイトカイン(cytokine)、発がん性化学物質とアルコールなどの刺激に応答して誘導発生される酵素である。
【0037】
実験後のHepG2細胞内の細胞質抽出液におけるHO-1 mRNA及びタンパク質量を測定する(実施例1に述べられた関連關実験方法を参照)。
【0038】
図5Aと図5Bに示すように、アルコールは、HepG2細胞のHO-1のタンパク質量(図5A)とmRNA量(図5B)を増加させたが、図5Aにおいて、空白対照群のHO-1タンパク質量をもとに、それに対する各実験群、陽性対照群と陰性対照群HO-1量の相対量(相対強度)を算出したあと、図5Aの下方にあるバーチャートを作成し、その量は、所属分野でよく知られているソフト解析のウェスタンブロット法で得られた結果を示すためのカラー強度で表示されている。図5Bは、空白対照群のHO-1 mRNA量をもとに、それに対する各実験群、陽性対照群と陰性対照群のHO-1量の相対量を算出したあと、作成されている。
【0039】
当該結果は、アルコールによる細胞の酸化ストレス発生に関する該実験結果に一致している。ルシッドワンとクルミンは、細胞内HO-1のタンパク質量(図5A)とmRNA量(第5B圖)を更に大幅に増加させたことで、ルシッドワンはクルミンと同じように、HO-1総量を増加させて、酸化ストレスに対する細胞防御能力を高めることを表している。
【0040】
(HepG2細胞のNrf-2の移動現象及びAREとの結合活性)
転写因子Nrf-2
(transcription factor NF-E2 related factor-2)は、抗酸化剤応答要素(antioxidant response element,ARE)誘導の抗酸化剤遺伝子において重要な役割を担っている。転写因子Nrf-2 は通常、抑制系蛋白Keap-1と結合し、活性を有さない複合体となり、細胞質に隔離されるが、転写因子Nrf-2 は、酸化ストレスの刺激に応答して、抑制系蛋白Keap-1から脱離し、活性化するようになる。活性化された転写因子Nrf-2は、移動(translocation)し、細胞核へ入り、目的遺伝子のプロモーターにある抗酸化剤応答要素と結合して、該目的遺伝子の反応を促すことになっている。
【0041】
HO-1は、ARE誘導の抗酸化剤遺伝子の一つであり、上述の実験結果から、ルシッドワンがHO-1 mRNA量とタンパク質量を増加させたことが分かった。本実験は、実験後のHepG2細胞の細胞質と細胞核抽出液におけるNrf-2含有量、及びNrf-2とAREの結合活性を測定する(実施例1に述べられた関連実験方法を参照)。
【0042】
図6Aに示すように、ウェスタンブロット法で、細胞質と細胞核内のNrf-2含有量を測定したところ、結果表示の色が深いほど、Nrf-2の含有量が高いことを示しており、その中、空白対照群の細胞核のNrf-2含有量をもとに、それに対する各実験群、陽性対照群と陰性対照群における細胞核内のNrf-2含有量の相対量を算出したあと、図6Aの下方にあるバーチャートを作成し、該含有量は、所属分野でよく知られているソフト解析ウェスタンブロット法で得られた結果を示すためのカラー強度で表示されている。結果によると、アルコールによるNrf-2の移動は顕著に認められないが、ルシッドワンはNrf-2の移動を促したことで、ルシッドワンは、Nrf-2の活性化を促し、細胞の有する抗酸化力を高めたことを表している。
【0043】
図6Bは、電気泳動移動度シフト解析法(EMSA)でNrf-2とAREの結合活性を示している。結果によると、ルシッドワンは、用量依存モデルで、Nrf-2とAREの結合活性を顕著に高めたことが認められたことで、当該結果はNrf-2移動増加の実験結果と一致している。
【実施例3】
【0044】
実施例3: マウスモデルで見た、アルコール性酸化ストレスと肝炎に対抗するルシッドワンの効果
【0045】
(実験設計)
該マウスを群分けにし、ルシッドワン100mg/Kg/dayの投与量を、腹腔注射で投与し、計七日間連続投与、最後日はルシッドワンを投与したあと、80%アルコール1 mL/Kgの投与量を、経口または腹腔注射で投与し、12時間ごとに一回投与し、三回投与すること。実験群のマウスには、生理食塩水に溶けた1%ジメチルスルホキシド(DMSO)を投与する。
【0046】
(実験で見たマウス血清中ALT、AST、一化窒素とTNF-αの含有量)
該実験設計により、アルコールによる肝炎発症のマウス血清を取り、実施例1に述べられた実験方法により、ALT、AST、一酸化窒素とTNF-αの含有量を測定する。実験結果は表2に示す。
【0047】
【表2】

表中の数値は、±標準偏差で表し、実験マウス数は、各群5匹とする。
†対照群及びアルコール投与のみの群別比較値を表し、差の大きさを示すP value ≦0.01
*アルコール投与のみ、及びアルコールとルシッドワン投与の群別比較値を表し、差の大きさを示すP value ≦0.01
【0048】
表2において、ルシッドワン不投与群のマウス実験結果によると、アルコールで、マウス体内の肝細胞毒(hepatotoxicity)を引き起こし、血清中ALT、AST、一酸化窒素とTNF-α含有量が高まったと分かった。あらかじめ、ルシッドワン投与のマウス血清中ALT、AST、一酸化窒素とTNF-αの含有量は、対照群に比べて、顕著な変化が認められないことで、ルシッドワンは、アルコールによるマウス肝炎発症への予防効果があることを示しており、当該結果は、該実施例におけるHepG2細胞の実験結果に一致している。
【0049】
(実験で見たマウスGSH含有量と脂質過酸化程度)
該実験設計により、アルコールによる肝炎発症のマウス血清と肝臓組織を取り、実施例1に述べられた実験方法により、GSH含有量と脂質過酸化程度を測定する。得られた結果は表3に示す。
【0050】
【表3】

表中の数値は、±標準偏差で表し、実験マウス数は、各群5匹とする。
†対照群及びアルコール投与のみの群別比較値を表し、差の大きさを示すP value ≦0.01
*アルコール投与のみ、及びアルコールとルシッドワン投与の群別比較値を表し、差の大きさを示すP value ≦0.01
【0051】
表3の実験結果によると、アルコール投与のマウスは、GSH含有量が低下した傾向があり、あらかじめ、ルシッドワンを投与して、その状況発生が避けられたが、そして、アルコール投与のマウスの血清中MDA濃度が高まったことで、脂質過酸化程度の向上を表し、あらかじめ、ルシッドワンを投与して、脂質過酸化程度が避けられた。該結果をまとめると、あらかじめ、ルシッドワン投与のマウスは、ルシッドワン不投与のマウスより、アルコールによる酸化ストレスに対抗する能力がよいと分かった。
【技術分野】
【0001】
本考案は、肝炎を治療するための医薬組成物に関わり、特に、アルコール性肝炎を治療するための医薬組成物に関する。
【背景技術】
【0002】
肝臓は、人の体で最も重要な器官の一つであり、薬物の代謝、アミノ酸の代謝、脂質の代謝や解糖作用など、多くの重要な生理機能を果たし、急性・慢性肝臓疾患が広く重要視されるようになったが、肝臓疾患の治療効果を高めるための方法は、更に研究すべき余地が残されている。アルコール性肝臓疾患(alcoholic liver disease、ALD)を例として、多くの研究によると、ヘムオキシゲナーゼ(heme oxygenase)、腫瘍壊死因子(tumor necrosis factor、TNF)と活性酸素(reactive oxygen species、ROS)は、アルコール性肝臓疾患と密接に関わっていると指摘されたが、いまのところ、アルコール性肝臓疾患に対する有効な治療法がないようである。
【0003】
近年、化学合成薬の服用で、患者に対する副作用発生のリストが次第に重要視されるように、天然化合物を基本の代替薬として用いれ、学術界や医療界で大きく注目されている。ルシッドワン(lucidone)は、クスノキ科植物(Lauraceae)の実から抽出して得られた天然化合物シクロペンタンジオン(cyclopentenedione)であり、一般的には、ルシッドワンは高度の抗酸化潜在力があると思われているが、ルシッドワンによるアルコール性肝臓疾患治療の研究はまだないようである。
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、肝炎治療用医薬組成物を提供し、特に、アルコール性肝炎を治療するための有効方法を提供することを目的とする。
本発明において、薬物の副作用リスクを下降させるために、肝炎治療用医薬組成物を、天然化合物を活性成分として提供することをもう一つの目的とする。
【課題を解決するための手段】
【0005】
上述の目的を達成させるため、本発明は、活性成分として用いられる有效量のルシッドワン、及び及医薬で認められているベクターが含まれている肝炎治療用医薬組成物を提供する。
好適な該肝炎は、アルコール性肝炎であることをいう。
好適な該医薬組成物は、ルシッドワン1〜2 wt%、及び医薬で認められているベクター98〜99 wt%が含まれていることを特徴とする。
好適な該ベクターは、澱粉、乳糖、ショ糖、微結晶セルロースまたはカルボキシメチルセルロースであることを特徴とする。
好適な該医薬組成物は更に、医薬で認められている添加剤が含まれており、該添加剤はアミノ酸、ビタミンまたはミネラルであることを特徴とする。
好適な該医薬組成物は、錠剤、カプセル、皮膚パッチ剤、懸濁剤、粉末、鼻吸入剤、スプレー剤または注射剤であることを特徴とする。
本発明は更に、被験物質を該医薬組成物に接触させることが含まれているアルコールによる酸化ストレス低減方法を提供する。
好適な該被験物質は、哺乳動物であることをいう。
好適な該哺乳動物は、人類であることをいう。
上述の内容をまとめると、本発明は、ルシッドワンを活性成分とし、肝炎に治療効果がある医薬組成物であり、はっきりと言えば、アルコール性肝炎を治療する効果があるということであり、そして、ルシッドワンは天然化合物なので、薬物の副作用リスクを大幅に低下させることができる。
【図面の簡単な説明】
【0006】
【図1A】HepG2細胞モデルのルシッドワン細胞毒性測試結果を表す。
【図1B】HepG2細胞モデルのアルコール細胞毒性測試結果を表す。
【図2A】HepG2細胞モデルASTの含有量を表す。
【図2B】HepG2細胞モデルALTの含有量を表す。
【図2C】HepG2細胞モデルTNF-αの含有量を表す。
【図3A】HepG2細胞モデル活性酸素の含有量を表す。
【図3B】HepG2細胞モデル一酸化窒素の含有量を表す。
【図4A】HepG2細胞モデルGSHの含有量を表す。
【図4B】HepG2細胞モデル脂質過酸化程度を表す。
【図5A】HepG2細胞モデルHO-1タンパク質量を表す。
【図5B】HepG2細胞モデルHO-1 mRNA量を表す。
【図6A】HepG2細胞モデルNrf-2の移動程度を表す。
【図6B】HepG2細胞モデルにおけるNrf-2とAREの結合活性を表す。
【発明を実施するための形態】
【0007】
従来の研究によると、アルコールは、肝炎を発症させる恐れがあり、それに伴い、体内で様々な酸化ストレスが増え、炎症も起こるが、例えば、グルタチオン(glutathione)含有量の低下、脂質過酸化(lipid peroxidation)反応の増加、血中腫瘍壊死因子-α(TNF-α)、一酸化窒素、活性酸素 (reactive oxygen species)やプロスタグランジンE2(prostaglandin-E2)の含有量増加などがあり、細胞内のヘムオキシゲナーゼ(heme
oxygenase)量や転写因子Nrf-2 (transcription factor NF-E2 related factor-2)の活性化も、酸化ストレスを増加させた対象とされている。アスパラギン酸アミノ基転移酵素 (aspartate aminotransferase、AST)とアラニンアミノ基転移酵素(Alanine aminotransferase、ALT)は、肝臓細胞に存在している二つの酵素で、通常、肝細胞毀損で破裂したときだけに、血清中に放出されるため、血清中ASTとALTの含有量増加には、肝機能異常(肝炎)の重要指標となる。
【0008】
本発明でいう“治療” は、肝炎に罹った者を対象に、本発明の医薬組成物で取り扱うことをいい、詳しく言えば、アルコール性肝炎に罹った者を対象に、肝炎に罹った個体に対して、本発明の医薬組成物で取り扱い、当該疾患・症状への完治、緩和、解消、治療、予防を目的とし、本発明でいう “肝炎治療”とは、該個体の血清中ASTとALTの含有量を低下させ、または該個体の血清中ASTとALT含有量の増加を避けることを指標とするが、本発明でいう “活性成分”は、本発明の医薬組成物は実際に当該治療効果がある成分をいい、本発明でいう “有效量” は、該治療を行うために、単独使用、またはそのほかの薬物との併用で、本発明の医薬組成物が提供される量をいう。
【0009】
本発明でいう “医薬で認められているベクター” は、所属分野で知られ、しかも本発明の医薬組成物の活性成分效果に影響しないベクターをいい、例えば、澱粉、乳糖、ショ糖、微結晶セルロースまたはカルボキシメチルセルロースであり、しかし、それに限らないが、本発明の医薬組成物は更に、医薬で認められている添加剤を配合して、本発明の個体に余分な栄養を補充できるが、それはアミノ酸、ビタミンまたはミネラルが含まれるが、それに限らないが、該ビタミンは、ビタミンB群、ビタミンC、ビタミンEまたはその組合せが含まれるが、それに限らないが、本発明の医薬組成物は、錠剤、カプセル、皮膚パッチ剤、懸濁剤、粉末、鼻吸入剤、スプレー剤または注射剤でもよいが、それを制限する必要はない。本発明の医薬組成物は原則として、従来のよく知られている方法で投薬されるが、好適な投薬方法は経口投与であり、本発明の医薬組成物の投与量は、取扱い待ちの患者の年齢、健康状態、治療コース及び/または症状によって使用される。
【実施例1】
【0010】
実施例1: 実験材料及びその方法
(化学試薬と抗体)
本発明に使用されるルシッドワンは、従来のよく知られている方法で純化されたもので、その純度は、高速液体クロマトグラフィー(high-performance liquid chromatography、HPLC)と核磁気共鳴(1H-NMR)により、99%以上に達していると確認されている。アルコール、クルミン(curcumin、純度99%)とグリース試薬(Griess reagent)を米国Sigma-Aldrich(St. Louis、Mo、USA)から、マウス抗HO-1モノクローナル抗体とウサギ抗Nrf-2ポリクローナル抗体は、米国Abcam(Cambridge、MA、USA)から、マウス抗アクチン(actin)モノクローナル抗体は、米国Sigma-Aldrich(St. Louis、Mo、USA)から購入した。
【0011】
(実験マウス)
ヒトHepG2肝ガン細胞(human hepatocarcinoma
cells、米国American Type
Culture Collection (ATCC、Manassas、VA、USA)から購入)は正常状態で、MEM(minimum
essential medium)培養液にて培養され、栄養や必要な抗生物質を補充するために、10%ウシ胎児血清(FBS)、ブドウ糖4.5g/L、グルタチオン(glutamine) 4 mM、ペニシリン(penicillin、100 units/mL)とストレプトマイシン(streptomycin、100 μg/mL)を添加し、37℃、5%CO2の環境に静置して培養される。実験設計により、正常状態で培養されたHepG2細胞には更に、違った濃度のルシッドワン(1、5または10 μg/mL)とクルミン(10 μg/mL)を加えて共に培養し、そして、実験設計により、アルコール100 mMを添加して12〜24時間培養する。
【0012】
(実験マウス)
実験マウスは、Charles
River(台北、台湾)から購入した、年齢四週間、ICR系のオスマウス(25±5公克)で、実験を行う前、環境に適応させるように、実験マウスに餌と水を無制限に供給するという実験室の恒常条件で、少なくとも一週間飼育するが、動物実験の取り扱いはすべて、実験動物飼養管理(Guide for the Care and Use of Laboratory Animals) 及び関連する台湾の動物保護法、また、現地の道徳委員会の許可を得て行われている。80%アルコールまたはルシッドワンを該実験マウス(1 mL/Kg)に投与する方法は、次のように、アルコール経口投与、アルコール腹腔内注射(intra-peritoneal injection)、アルコールとルシッドワン経口投与、アルコールとルシッドワン腹腔内注射(intra-peritoneal injection)法がある。
【0013】
(MTT 試験)
本試験に用いられるMTT(3-[4,5-dimethyl-thiazol-2-yl]-
2,5-diphenyl tetrazolium bromide)は、米国Sigma- Aldrich(St. Louis、Mo、USA)から購入、MTT試験は、生物学で細胞生存率または細胞増殖を測定るためによく用いられている方法であり、その原理は、生きた細胞の糸粒体のコハク脱水素酵素との働きで、MTTのtetrazoliumを濃青色の代謝物にし、そこへ更に、ジメチルスルホキシド(DMSO)を加え、細胞に蓄積された濃青色の代謝物を溶出したあと、濃青色の代謝物量を分光光度計で測定し、生きた細胞数を間接的に推定できることである。MTT試験手順は、所属分野の従来のよく知られている実験手順で行われるが、簡単に言えば、実験設計により、該HepG2細胞を24時間培養した後、培養液を取り除き、MTT添加の新鮮なMEM 培養液(MTT (10 μg/mL)
10 μlと新鮮なMEM 90 μl培養液との混合)を培養皿に入れたあと、37℃で、該HepG2細胞を1時間培養するが、最後に、分光光度計(ELISA microplate reader、μQuant、Bio-Tek instruments、Inc.、Winooski、VT、USA)を波長570 nmにし、濃青色の代謝物量を測定するが、それにより、細胞の生存率を間接的に算出できる。
【0014】
(ALTとASTの濃度測定)
市販の測定キット (Randox Laboratories、Antrim、UK)で、HepG2細胞培養後の培養液、及びマウス実験におけるマウス血清中ALTとAST濃度を測定する。簡単に言えば、実験設計に従って培養されたHepG2細胞の培養液と実験マウスの血清を取り、該測定キット及び推奨の実験手順により、分光光度計(ELISA
microplate reader、μQuant、Bio-Tek instruments、Inc.、Winooski、VT、USA)で、波長340 nmの吸光度を測定するが、そうすると、ALTとAST濃度が算出でき、酵素活性を表す單位(U/L)の結果が表される。
【0015】
(脂質過酸化程度の測定)
市販の脂質過酸化測定キット(Oxford
Biomedical Research、Oxford、MI、USA)で、細胞内の脂質酸化の障害程度を定量的に測定するが、簡単に言えば、細胞溶解液(lysis buffer) 200 μlで細胞を溶解させる(lysed)が、毎140 μlの細胞破砕液(cell lysate)に、アセトニトリル(acetonitrile)に溶けたN-メチル-2-フェニルインドール(N-methyl-2-phenylindole)
455 μlと塩酸(HCL、37%)105 μlを混合し、45℃で60分間静置する。マロンジアルデヒド(malondialdehyde、MDA)は、高度不飽和脂肪酸(polyunsaturated fatty acid)が酸化、破砕された主産物であり、本実験では、マロンジアルデヒドと反応して生成された、安定した発色団(chromophore)であるN-メチル-2-フェニルインドールを用い、最大吸収波長535 nmにて、マロンジアルデヒドの形成を測定し、脂質過酸化指標とするが、そして、上述と同様の方法で、実験マウス血清中の脂質過酸化程度を測定する。
【0016】
(グルタチオン含有量の測定)
市販のGSH-96穴プレート比色分析キット(96-well plate colorimetric GSH
assay kit、Oxis International、Foster City、CA、USA)で、グルタチオン(GSH)含有量を測定する。簡単に言えば、塩酸に溶けた発色剤(chromogenic reagent) 40 μlを、非タンパク質肝細胞溶解液(non proteinhepatocyte lysate)
40 μlの中に入れ、それから更に、水酸化ナトリウム(NaOH、30%)40 μlと顕色剤(color developer) 4 0μlと緩衝液を加えて、一つの混合液に混合するが、次は、該混合液をやさしくvortexしたあと、室温にて10分間静置するが、最後は、分光光度計(ELISA microplate
reader、μQuant、Bio-Tek instruments、Inc.、Winooski、VT、USA)で、波長412 nmの吸光度を測定し、濃度既知のGSH吸光度曲線とを比較して、GSHの含有量を判別するが、上述と同様の方法で、実験マウス血清中のグルタチオン含有量を測定する。
【0017】
(グリースによる亜硝酸塩の測定及び腫瘍壊死因子-αの測定)
グリース反応(Griess reaction)により細胞培養上清とマウス血清中に蓄積された亜硝酸塩を測定、一酸化窒素の生成量を間接的に測定する。細胞培養上清及び血清中腫瘍壊死因子-α量の測定は、市販のヒト腫瘍壊死因子-α ELISAキット (human TNF-α
ELISA kit)で行われるが、簡単に言えば、該HepG2細胞を96穴プレートに1×107 cells/well の濃度でそれぞれ培養し、そして、実験設計により、ルシッドワンとアルコールを添加して、共に24時間培養するが、培養された培養液は、該キットのワーク試薬(work reagent)で、1: 2の割合で希釈したあと、毎100 μl希釈後の培養液に対して、該キットの使用規則に従ってELISA反応を行うが、その後、分光光度計で波長450 nmの吸光度を測定し、腫瘍壊死因子-αの含有量を判定するが、マウス実験では、マウス血清の測定は、上述と同様に、該キットの使用規則に従って、適当に希釈してから、腫瘍壊死因子-αの含有量測定を行う。
【0018】
(細胞内活性酸素の蓄積量測定)
市販の蛍光検索子DCF-DA
(dihydrodichloro- fluorescein
diacetate; Sigma、USA)で、細胞内活性酸素(ROS)の蓄積量を測定する。簡単に言えば、細胞(1×107)をリン酸緩衝液で潤したあと、DCF-DA10μmを加えて、37℃で4時間培養したあと、蛍光分光光度計(fluorescence
spectrophotometer)で蛍光量(488 nm/530
nm)を測定する。
【0019】
(細胞質抽出液と細胞核抽出液の製造)
細胞質抽出液と細胞核抽出液の製造は、所属分野でよく知られている実験手順により、市販の実験キット(protocol#78833 Nuclear and Cytoplasmic
Extraction Reagent kit)を用い、市販のタンパク質分析試薬(protein assay reagent、Bio-Rad)で、タンパク質濃度を測定して行われる。
【0020】
(ウェスタンブロット法)
本発明のウェスタンブロット法定は、所属分野でよく知られている実験手順により行われるが、その中、該抗体とエンハンスド化学発光試薬(enhanced chemiluminescene regents、ECL、Pierce)で免疫ブロット法(immunoblotting)を行い、それから、イメージング装置(imaging device、Viogene Biotek、Sunnyvale、CA、USA)でその結果を観察する。
【0021】
(電気泳動移動度シフト解析法)
電気泳動移動度シフト解析法 (Electrophoretic mobility shift assay,EMSA)は、既知の実験方法で行われるが、簡単に言えば、所使用的オリゴヌクレオチドプローブ:
Nrf-2センスプライマー 5'- CAG
CAG GAC ATG GAT TTG ATT GAC -3'、アンチセンスプライマー5'-AGA AAA GGC TCC ATC CTC CCG AAC
-3'は、TRI Biotech (Taipei、Taiwan)で合成されたが、続いて、TE緩衝液に加えて、94°Cで5分間加熱したあと、次第に3時間冷却し、二つのプライマーを結合し、細胞核抽出物(20μg/ml)と二つのプライマーNrf-2オリゴヌクレオチド20 ng (結合緩衝液5 μlを加え)を室温で30分間反応させたあと、6 %ネイティブ ポリアクリルアミドゲル(native
polyacrylamide gel)で、DNA/タンパク質複合体を分離させ、それから、Light-Shift Chemiluminescent EMSA Kit
(Pierce Biotechnology Inc.、Rockford、USA)で複合体を顕像し、更にVL Chemi-Smart
3000 (Viogene Biotek)システムで、発光強度イメージを測定する。
【0022】
(RNA抽出及びリアルタイム定量ポリメナーゼ連鎖反応)
Trizol試薬(Invitrogen Life Technologies、Carlsbad、CA、USA)で、細胞の総リボ核酸(total RNA)を抽出し、逆転写酵素ポリメナーゼ連鎖反応で、HO-1とβ-actin (β-アクチン) のメッセンジャーリボ核酸(mRNA)をcDNAに逆転写し、それから、リアルタイム定量ポリメナーゼ連鎖反応(real time-PCR、Applied Biosystems)で、HO-1量とβ-actin量を定量的に測定する。
【0023】
該リアルタイム定量ポリメナーゼ連鎖反応は、DNA染色剤である緑の核酸ゲル染色試薬(SYBR
Green)で、PCR産物を測定する。温度サイクル(thermal cycle)は、96℃で3分間、それから96℃で 1分、50℃ 30秒、72℃で90秒を40サイクル実施し、プライマー配列は、HO-1センス5’-TGC GGT GCA GCT CTT CTG-3’、HO-1アンチセンス5’-GCA ACC CGA CAG CAT GC-3’、β-actinセンス5’-ACC CAC ACT GTG CCC ATC TA-3’、β-actinアンチセンス5’-CGG AAC CGC TCA TTG CC-3’となり、β-actinは、ハウスキーピング遺伝子(housekeeping gene)で、細胞内での大量の安定した遺伝子であり、それをHO-1量の標準化にする。
【実施例2】
【0024】
実施例2: HepG2細胞モデルで見た、アルコール性酸化ストレスと肝炎に対抗するルシッドワンの効果
本実施例は、HepG2細胞をモデルシステム(model system)として、アルコールによる酸化ストレスの発生に対抗するルシッドワンの効果を測定する。
【0025】
(細胞毒性)
まず、ルシッドワンとアルコールの細胞毒性を測定する。ルシッドワンの細胞毒性測定では、該細胞培養法に応じて、培養されたHepG2細胞を5群別に分け、それぞれの培養液にルシッドワン0μg/ml、1μg/ml、5μg/ml、10μg/mlまたは20 μg/mlを加え、共に24時間培養するが、アルコールの細胞毒性測定では、該細胞培養法に応じて、培養されたHepG2細胞を6群別に分け、それぞれの培養液にアルコール0mM、10 mM、50 mM、100 mM、200 mMまたは500 mMを加え、共に24時間培養するが、ルシッドワンやアルコールも添加されない該群別は、本実施例の対照群(すなわち、ルシッドワン0 μg/mlとアルコール0 mMの場合)とし、更にMTT 試験で細胞の生存率を測定する(実施例1(MTT 試験)参照)。
【0026】
ルシッドワンの細胞毒性測定結果は、図1Aに示されているが、そのデータによると、実験群20 μg/mlは対照群に比べて、細胞の生存率が約40%低下し、ルシッドワン濃度10μg/ml以下の場合は、細胞毒性がないと分かった。そして、図1Bに示されるように、実験群のアルコール添加量が100 mM以上である場合は、細胞毒性があったと示されている。
【0027】
(HepG2細胞モデルの実験設計)
正常状態で培養されている該HepG2細胞を群分けにし、それぞれルシッドワン0μg/ml、1μg/ml、5μg/ml、10 μg/ml (0 μg/mlは陰性対照群)またはクルミン10μg/ml (curcuminは、既知の天然抗酸化化合物で、本発明では陽性対照群として用いられるもの)を加え、共に1時間培養したあと、更にアルコール (100 mM)を加え、24時間培養して、酸化ストレスの発生を促進させるようにする。実験群と各対照群の配置は表一に示す。
【0028】
【表1】

【0029】
(培養後の培養液におけるALT、ASTと腫瘍壊死因子-αの含有量)
実験後のHepG2細胞培養液におけるALT、ASTと腫瘍壊死因子-α
(TNF-α)の含有量を測定する(実施例1(ALT和ASTの濃度測定)と(腫瘍壊死因子-αの測定)を参照)。
【0030】
図2A〜Cはそれぞれ、ALT、ASTとTNF-αの含有量変化(その中、conは、空白対照群(blank control)を表し、該群別の細胞には、ルシッドワン、クルミンまたはアルコールによる取り扱いはないが、詳しくは該HepG2細胞モデルの実験設計を参照)が示されており、図2A〜Cに示すように、陰性対照群の細胞培養液におけるALT、ASTとTNF-αの含有量が顕著に増加したので、アルコールによるHepG2細胞の炎症反応が発生し、細胞損傷もあったと示され、ルシッドワンは、用量依存(dose-dependent)モデルで、アルコールによるALT、ASTとTNF-α含有量の増加を低減させたので、その効果は、既知の天然抗酸化物クルミンとほぼ同様である。
【0031】
(培養後の培養液における活性酸素と一酸化窒素の含有量)
実験後のHepG2細胞培養液における活性酸素と一酸化窒素の含有量を測定する(実施例1(細胞内活性酸素の蓄積量測定)と(グリースによる亜硝酸塩の測定)を参照)。
【0032】
図3Aは、各群別のHepG2細胞の活性酸素含有量を示し、蛍光検索子DCF-DAの蛍光強度で活性酸素の含有量を表し、図3Bは、各群別のHepG2細胞の一酸化窒素生成量を示し、亜硝酸塩の生成量で一酸化窒素生成量を表している。
図3Aと図3Bに示すように、それぞれの陰性対照群の細胞培養液における活性酸素と一酸化窒素の含有量が顕著に増加し、アルコールによるHepG2細胞の酸化ストレスが発生したと示され、該実験結果から見ると、活性酸素と一酸化窒素含有量の増加は、細胞が損傷し、ASTとALTの放出された原因になると思われる。そして、ルシッドワンは、用量依存(dose-dependent)モデルにより、アルコールによるALT、ASTとTNF-α含有量の増加を低減させたため、その効果は既知の天然抗酸化物クルミンとほぼ同様、またはそれより優れている。
【0033】
(培養後の培養液におけるGSHの消耗及び脂質過酸化現象)
実験後のHepG2細胞培養液における活性酸素と一酸化窒素の含有量を測定する(実施例1(HepG2細胞モデルの実験設計)、(脂質過酸化程度の測定)と(グルタチオン含有量の測定)を参照)。
【0034】
図4Aに示されるように、アルコールは、細胞内のGSH濃度を低下させ、HepG2細胞は、アルコールによる酸化ストレスに応じて、GSH含有量が消耗したと示されている。あらかじめ、ルシッドワンまたはクルミンを加え、共に培養して、このような現象が避けられたことで、ルシッドワンやクルミンは、アルコールによる酸化ストレスに対抗する効果があることを意味している。
【0035】
図4Bに示すように、アルコールは、細胞内の大量な脂質過酸化現象を発生させたが、ルシッドワンやクルミンは、脂質過酸化の発生を大幅に減少された。
【0036】
(HepG2細胞のHO-1 mRNA量及びタンパク質量)
ヘムオキシゲナーゼは、哺乳類動物の組織でよく見られるストレス反応酵素(stress-responsive enzyme)であり、ヘム(heme)を胆緑素(biliverdin)、遊離した鉄イオン(Fe2+)と一酸化炭素(carbon
monoxide)に分解する酵素であり、ヘム、重金属、サイトカイン(cytokine)、発がん性化学物質とアルコールなどの刺激に応答して誘導発生される酵素である。
【0037】
実験後のHepG2細胞内の細胞質抽出液におけるHO-1 mRNA及びタンパク質量を測定する(実施例1に述べられた関連關実験方法を参照)。
【0038】
図5Aと図5Bに示すように、アルコールは、HepG2細胞のHO-1のタンパク質量(図5A)とmRNA量(図5B)を増加させたが、図5Aにおいて、空白対照群のHO-1タンパク質量をもとに、それに対する各実験群、陽性対照群と陰性対照群HO-1量の相対量(相対強度)を算出したあと、図5Aの下方にあるバーチャートを作成し、その量は、所属分野でよく知られているソフト解析のウェスタンブロット法で得られた結果を示すためのカラー強度で表示されている。図5Bは、空白対照群のHO-1 mRNA量をもとに、それに対する各実験群、陽性対照群と陰性対照群のHO-1量の相対量を算出したあと、作成されている。
【0039】
当該結果は、アルコールによる細胞の酸化ストレス発生に関する該実験結果に一致している。ルシッドワンとクルミンは、細胞内HO-1のタンパク質量(図5A)とmRNA量(第5B圖)を更に大幅に増加させたことで、ルシッドワンはクルミンと同じように、HO-1総量を増加させて、酸化ストレスに対する細胞防御能力を高めることを表している。
【0040】
(HepG2細胞のNrf-2の移動現象及びAREとの結合活性)
転写因子Nrf-2
(transcription factor NF-E2 related factor-2)は、抗酸化剤応答要素(antioxidant response element,ARE)誘導の抗酸化剤遺伝子において重要な役割を担っている。転写因子Nrf-2 は通常、抑制系蛋白Keap-1と結合し、活性を有さない複合体となり、細胞質に隔離されるが、転写因子Nrf-2 は、酸化ストレスの刺激に応答して、抑制系蛋白Keap-1から脱離し、活性化するようになる。活性化された転写因子Nrf-2は、移動(translocation)し、細胞核へ入り、目的遺伝子のプロモーターにある抗酸化剤応答要素と結合して、該目的遺伝子の反応を促すことになっている。
【0041】
HO-1は、ARE誘導の抗酸化剤遺伝子の一つであり、上述の実験結果から、ルシッドワンがHO-1 mRNA量とタンパク質量を増加させたことが分かった。本実験は、実験後のHepG2細胞の細胞質と細胞核抽出液におけるNrf-2含有量、及びNrf-2とAREの結合活性を測定する(実施例1に述べられた関連実験方法を参照)。
【0042】
図6Aに示すように、ウェスタンブロット法で、細胞質と細胞核内のNrf-2含有量を測定したところ、結果表示の色が深いほど、Nrf-2の含有量が高いことを示しており、その中、空白対照群の細胞核のNrf-2含有量をもとに、それに対する各実験群、陽性対照群と陰性対照群における細胞核内のNrf-2含有量の相対量を算出したあと、図6Aの下方にあるバーチャートを作成し、該含有量は、所属分野でよく知られているソフト解析ウェスタンブロット法で得られた結果を示すためのカラー強度で表示されている。結果によると、アルコールによるNrf-2の移動は顕著に認められないが、ルシッドワンはNrf-2の移動を促したことで、ルシッドワンは、Nrf-2の活性化を促し、細胞の有する抗酸化力を高めたことを表している。
【0043】
図6Bは、電気泳動移動度シフト解析法(EMSA)でNrf-2とAREの結合活性を示している。結果によると、ルシッドワンは、用量依存モデルで、Nrf-2とAREの結合活性を顕著に高めたことが認められたことで、当該結果はNrf-2移動増加の実験結果と一致している。
【実施例3】
【0044】
実施例3: マウスモデルで見た、アルコール性酸化ストレスと肝炎に対抗するルシッドワンの効果
【0045】
(実験設計)
該マウスを群分けにし、ルシッドワン100mg/Kg/dayの投与量を、腹腔注射で投与し、計七日間連続投与、最後日はルシッドワンを投与したあと、80%アルコール1 mL/Kgの投与量を、経口または腹腔注射で投与し、12時間ごとに一回投与し、三回投与すること。実験群のマウスには、生理食塩水に溶けた1%ジメチルスルホキシド(DMSO)を投与する。
【0046】
(実験で見たマウス血清中ALT、AST、一化窒素とTNF-αの含有量)
該実験設計により、アルコールによる肝炎発症のマウス血清を取り、実施例1に述べられた実験方法により、ALT、AST、一酸化窒素とTNF-αの含有量を測定する。実験結果は表2に示す。
【0047】
【表2】

表中の数値は、±標準偏差で表し、実験マウス数は、各群5匹とする。
†対照群及びアルコール投与のみの群別比較値を表し、差の大きさを示すP value ≦0.01
*アルコール投与のみ、及びアルコールとルシッドワン投与の群別比較値を表し、差の大きさを示すP value ≦0.01
【0048】
表2において、ルシッドワン不投与群のマウス実験結果によると、アルコールで、マウス体内の肝細胞毒(hepatotoxicity)を引き起こし、血清中ALT、AST、一酸化窒素とTNF-α含有量が高まったと分かった。あらかじめ、ルシッドワン投与のマウス血清中ALT、AST、一酸化窒素とTNF-αの含有量は、対照群に比べて、顕著な変化が認められないことで、ルシッドワンは、アルコールによるマウス肝炎発症への予防効果があることを示しており、当該結果は、該実施例におけるHepG2細胞の実験結果に一致している。
【0049】
(実験で見たマウスGSH含有量と脂質過酸化程度)
該実験設計により、アルコールによる肝炎発症のマウス血清と肝臓組織を取り、実施例1に述べられた実験方法により、GSH含有量と脂質過酸化程度を測定する。得られた結果は表3に示す。
【0050】
【表3】

表中の数値は、±標準偏差で表し、実験マウス数は、各群5匹とする。
†対照群及びアルコール投与のみの群別比較値を表し、差の大きさを示すP value ≦0.01
*アルコール投与のみ、及びアルコールとルシッドワン投与の群別比較値を表し、差の大きさを示すP value ≦0.01
【0051】
表3の実験結果によると、アルコール投与のマウスは、GSH含有量が低下した傾向があり、あらかじめ、ルシッドワンを投与して、その状況発生が避けられたが、そして、アルコール投与のマウスの血清中MDA濃度が高まったことで、脂質過酸化程度の向上を表し、あらかじめ、ルシッドワンを投与して、脂質過酸化程度が避けられた。該結果をまとめると、あらかじめ、ルシッドワン投与のマウスは、ルシッドワン不投与のマウスより、アルコールによる酸化ストレスに対抗する能力がよいと分かった。
【特許請求の範囲】
【請求項1】
活性成分として用いられる有效量のルシッドワン、及び医薬で認められているベクターが含まれていることを特徴とする肝炎治療用医薬組成物。
【請求項2】
該肝炎は、アルコール性肝炎であることを特徴とする請求項1に記載の医薬組成物。
【請求項3】
ルシッドワン1〜2wt%、及び医薬で認められているベクター98〜99wt%が含まれていることを特徴とする請求項1に記載の医薬組成物。
【請求項4】
該ベクターは、澱粉、乳糖、ショ糖、微結晶セルロースまたはカルボキシメチルセルロースであることを特徴とする請求項1に記載の医薬組成物。
【請求項5】
更に、医薬で認められている添加剤が含まれており、該添加剤は、アミノ酸、ビタミンまたはミネラルであることを特徴とする請求項1に記載の医薬組成物。
【請求項6】
錠剤、カプセル、皮膚パッチ剤、懸濁剤、粉末、鼻吸入剤、スプレー剤または注射剤であることを特徴とする請求項1に記載の医薬組成物。
【請求項7】
被験物質を請求項1〜6のいずれかの一つに記載の医薬組成物に接触させることが含まれていることを特徴とするアルコールによる酸化ストレス低減方法。
【請求項8】
該被験物質は、哺乳動物であることを特徴とする請求項7に記載の方法。
【請求項9】
該哺乳動物は、人類であることを特徴とする請求項7に記載の方法。
【請求項1】
活性成分として用いられる有效量のルシッドワン、及び医薬で認められているベクターが含まれていることを特徴とする肝炎治療用医薬組成物。
【請求項2】
該肝炎は、アルコール性肝炎であることを特徴とする請求項1に記載の医薬組成物。
【請求項3】
ルシッドワン1〜2wt%、及び医薬で認められているベクター98〜99wt%が含まれていることを特徴とする請求項1に記載の医薬組成物。
【請求項4】
該ベクターは、澱粉、乳糖、ショ糖、微結晶セルロースまたはカルボキシメチルセルロースであることを特徴とする請求項1に記載の医薬組成物。
【請求項5】
更に、医薬で認められている添加剤が含まれており、該添加剤は、アミノ酸、ビタミンまたはミネラルであることを特徴とする請求項1に記載の医薬組成物。
【請求項6】
錠剤、カプセル、皮膚パッチ剤、懸濁剤、粉末、鼻吸入剤、スプレー剤または注射剤であることを特徴とする請求項1に記載の医薬組成物。
【請求項7】
被験物質を請求項1〜6のいずれかの一つに記載の医薬組成物に接触させることが含まれていることを特徴とするアルコールによる酸化ストレス低減方法。
【請求項8】
該被験物質は、哺乳動物であることを特徴とする請求項7に記載の方法。
【請求項9】
該哺乳動物は、人類であることを特徴とする請求項7に記載の方法。
【図1A】


【図1B】


【図2A】


【図2B】


【図2C】


【図3A】


【図3B】


【図4A】


【図4B】


【図5A】


【図5B】


【図6A】


【図6B】




【図1B】


【図2A】


【図2B】


【図2C】


【図3A】


【図3B】


【図4A】


【図4B】


【図5A】


【図5B】


【図6A】


【図6B】


【公開番号】特開2012−12343(P2012−12343A)
【公開日】平成24年1月19日(2012.1.19)
【国際特許分類】
【出願番号】特願2010−150976(P2010−150976)
【出願日】平成22年7月1日(2010.7.1)
【出願人】(510035635)台灣利得生物科技股▲ふん▼有限公司 (3)
【Fターム(参考)】
【公開日】平成24年1月19日(2012.1.19)
【国際特許分類】
【出願日】平成22年7月1日(2010.7.1)
【出願人】(510035635)台灣利得生物科技股▲ふん▼有限公司 (3)
【Fターム(参考)】
[ Back to top ]

