肝癌マーカー
【課題】感度が高く選択性の高い肝癌マーカーを提供すること。
【解決手段】以下の式(1)のいずれかで表される糖鎖からなる肝癌マーカー。

式中、Xはフコースであり、nは1又は0、mは1又は0であり、n+m=1である。
【解決手段】以下の式(1)のいずれかで表される糖鎖からなる肝癌マーカー。

式中、Xはフコースであり、nは1又は0、mは1又は0であり、n+m=1である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、特定の構造を有するN結合型糖鎖からなる肝癌マーカー及び被検者から採取した体液中の該マーカー量を指標とする肝癌診断のための測定方法に関するものである。
【背景技術】
【0002】
癌の進行とともに血液中の糖タンパク質糖鎖の構造が変化することは知られており、すでにCA19−9やシアリルLewisX(SLX)抗原など、多くの糖鎖マーカーが診断マーカーとして利用されている。しかしながらこれら腫瘍マーカーは正常人にも微量、また時には高濃度で存在することがあり、腫瘍マーカーの値だけで癌を判定するのは困難であった。
【0003】
一方、内視鏡やPET、MRIと画像診断は癌判定の精度は高いものの、患者に対する苦痛が大きく、または費用負担が大きいなどの理由で、健常人が定期的に受ける診断として普及していないのが実情である。
【0004】
自覚症状のない初期癌の患者が癌の進行を知るためには、画像診断よりも簡便でかつ費用のかからない血液検査が望ましいが、現在血中マーカーは精度の悪さから健康診断など健常人が受ける定期診断では実施されていない。これを実施すると擬陽性と判定される健常者が続出し、もし陽性と判定されれば画像診断などの追加検査が必要になり、病院の診断能力を超えてしまうためである。
【0005】
これまで血液中の癌マーカーのスクリーニングは癌血清、癌組織を免疫し、抗体をとる方法が主流であった。この方法は感度が高いという利点がある反面、抗体は抗原糖鎖の一部分(3〜4糖)しか認識しないため、構造選択性が小さいという欠点があった。近年、分析装置の高機能・高感度化に伴い、抗原・抗体反応に頼らず、血液中の抗原を機械的に分離・検出し、癌の進行に伴い増加する(または減少する)マーカーを探す動きが盛んである。池中一裕らは蛍光標識した糖鎖を液体クロマトグラフィーで分離・検出し、アウターフコースを有する3本鎖N結合型糖鎖が肺癌患者の血中に増加することを見出している(特許文献1を参照)。また、Liuらは肝癌患者の血中で3本鎖N結合型糖鎖が増加することを見出している(非特許文献1を参照)。
【0006】
しかしながら癌進行に伴い血中で変化する糖鎖は非常に微量であり、これを他の夾雑物と分離して検出することは極めて困難である。現在、質量分析装置を使った糖鎖分析が盛んであるが、検出感度に劣る糖鎖を高感度で検出することは非常に難しかった。
【特許文献1】特開2001−289860(出願2000−106609)
【非特許文献1】LIU, DESMYTER et al., HEPATOLOGY, vol. 46, No.5, pp1429-(2007)
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、肝癌の早期診断を目的として、感度が高く選択性の高い肝癌マーカーを提供することを課題とする。さらには、該肝癌マーカーの被検者から採取した体液中の量を指標として肝癌の診断のための測定法を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは上記課題を解決すべく検討した結果、被検者の血液中の糖タンパク質N結合型糖鎖のうち、特定の構造を有するN結合型糖鎖が、肝癌患者の血液中で著しく増加し、肝硬変患者及び健常者と明確に判別できることを見出し、本発明に到達した。
【0009】
即ち、本発明の要旨は、以下のとおりである。
[1]以下の式(1)〜(3)のいずれかで表される糖鎖からなる肝癌マーカー。
【化1】

式中、Xはフコースであり、nは1又は0、mは1又は0であり、n+m=1である。
【化2】

【化3】

式中、Xはフコースであり、p、s、tはそれぞれ1又は0であり、p+s+t=1である。
[2]被検者から採取された体液中の[1]に記載の肝癌マーカーの量または前記肝癌マーカーの量に基づいて算出される値を指標とすることを特徴とする肝癌診断のための測定方法。
[3]前記肝癌マーカーの量に基づいて算出される値が、前記肝癌マーカーの量と、体液中の含有量が健常者と肝癌患者で有意な差がない糖鎖の量との比を用いて算出した値であることを特徴とする[2]に記載の方法。
[4]前記肝癌マーカーの量に基づいて算出される値が、前記肝癌マーカー量、または前
記肝癌マーカー量と前記体液中の含有量が健常者と肝癌患者で有意な差がない糖鎖の量との比を用いて算出した値を、同一の被検者から採取された血液中の血小板数で補正して算出した値であることを特徴とする[2]または[3]に記載の方法。
【発明の効果】
【0010】
本発明の肝癌マーカーの被検者体液中量を測定することにより、肝癌患者と肝硬変患者、その他の疾患患者及び健常者を明確に判別することが可能となる。
【発明を実施するための最良の形態】
【0011】
<肝癌マーカー>
本発明の肝癌マーカーは、上記の化学構造式1〜3のいずれかで表される糖鎖からなる。式(1)の糖鎖において、Xはフコースであり、nは1又は0、mは1又は0であり、n+m=1である。フコースの結合は、α1→3結合であることが好ましい。式(1)に示す糖鎖を、以下「A3G3Fo2」と称することがある。また、式(2)で表される糖鎖を、以下「A4G4Fo」と称することがある。また、式(3)で表される糖鎖において、Xはフコースであり、p、s、tはそれぞれ1又は0であり、p+s+t=1である。フコースの結合は、α1→3結合であることが好ましい。式(3)に示す糖鎖を、以下「A4G4Fo2」と称することがある。
本発明の肝癌マーカーは、癌化した肝細胞に多く含まれるタンパク質に結合している糖鎖である。
【0012】
<肝癌診断のための測定法>
本発明はさらに上記肝癌マーカーの量または前記肝癌マーカーの量に基づいて算出される値を指標とする肝癌診断のための測定法も含む。本測定法の検体としては、肝癌の可能性がある被検者から採取した体液が用いられる。体液としては、血液、リンパ液、髄液、尿及びその処理物などが用いられるが、好ましくは血液、さらに好ましくは該血液を分離して得られる血清が用いられる。
【0013】
該検体中の本発明の肝癌マーカーである糖鎖(以下、「マーカー糖鎖」と称することがある)の含有量を測定するためには、該検体に含まれるマーカー糖鎖を、これが結合するタンパク質から切り離す必要がある。マーカー糖鎖をタンパク質から切り離す方法としては、それ自体公知の通常用いられる方法が挙げられるが、具体的には、ヒドラジン分解法や、酵素(N−グリカナーゼ)消化法等が挙げられる。これらのうち、定量的に糖鎖を切断するにはヒドラジン分解法が好ましく、例えば、Y. Otake et al., J Biochem (Tokyo)
129 (2001) 537-42に記載の方法等が好ましく用いられる。ここで、ヒドラジン分解法を用いた場合には、ヒドラジン分解によって脱離したアセチル基を再アセチル化する必要がある。具体的には、例えば、K. Tanabe et al., Anal. Biochem. 348 (2006) 324-6.記載の方法等が用いられる。
【0014】
かくして遊離されたマーカー糖鎖を、必要に応じて標識する。標識方法は特に限定されるものではないが、質量分析法器を使う場合はイオン化効率を高めるTMAPA (tirmethyl(4-aminophenyl)ammonium chloride)が特に好ましく、蛍光検出器を使う場合は2-aminopyridineが好ましい。誘導体化方法はTMAPAの場合は例えば、M. Okamoto et al., Rapid Commun Mass Spectrom 9 (1995) 641-3.に記載の方法が用いられ、2-aminopyridineの場合はY. Otake et al., J Biochem (Tokyo) 129 (2001) 537-42に記載の方法等が用いられる。
【0015】
肝癌マーカーである糖鎖の検出及び含有量の測定方法は、本発明のマーカー糖鎖が検出及び測定できる方法であれば特に制限はないが、高速液体クロマトグラフィー、質量分析、核磁気共鳴、本発明のマーカー糖鎖特異的抗体を用いる方法が挙げられる。本発明のマーカー糖鎖は、血清中に存在する類似の糖鎖と分離することが非常に困難であるため、液
体クロマトグラフィーと質量分析装置を合せて検出、測定すること(以下、「LC−MS法」と称することがある)が望ましい。
【0016】
LC−MS法を用いた本発明のマーカー糖鎖測定方法としては、例えば、以下に詳述する方法が用いられる。液体クロマトグラフィーは安定的に送液できるものであればどのような仕様でもよく、特に限定されるものではない。イオン化法はESIの他、APCIなどでもよいが、ESIが最も好ましい。質量分析装置は四重極型以外、TOF型、イオントラップ型、磁場型、フーリエ変換型のいずれでもよいが、定量性の高い四重極型、感度の高いTOF型、イオントラップ型が特に好ましい。
【0017】
用いるカラムは複数の糖鎖を分離できるものであれば、順相、逆相、吸着いずれのタイプでもよいが、好ましくは逆相系のC8、C18、C30カラムがよく、さらに好ましくはC30カラムがよい。カラムのサイズは特に限定されないが、流速を小さくし、感度を高められる内径が2.1mm以下のものが好ましく、さらには1.5mm以下のものが特に好ましい。
【0018】
溶離液はカラムの性質によって最適なものが選択されるが、C30カラムを使用する場合は、例えば溶離液Aに5mM酢酸アンモニウム水溶液(pH=4)、溶離液Bには5mM酢酸アンモニウム水溶液(pH=4)90%+アセトニトリル10%の混合液などが使われ、サンプル注入前にB液0%〜30%(=A液 100%〜70%:以下A液濃度は省略)溶液で十分平衡化する必要がある。平衡化時のB液濃度は10〜25%が好ましいが、特に15〜20%が好ましい。
【0019】
サンプル溶液を約20μL注入し、注入と同時に溶離液組成をB液約20%から直線的に約50分かけて約50%まで変化させる。さらに50分から60分までB液組成を約50%一定にすることができるが、グラジエント条件はカラムの種類により制約を受けるものであるため、特に限定されるものではない。質量分析器の測定条件は、本発明のマーカー糖鎖が分離できる範囲であれば、特に限定されるものではないが、例えば、キャピラリー電圧(イオン化電圧)を4000V、ネブライザーガス圧を45psi、ドライガス流量及び温度を10L/分、350℃とすると良好に検出することができる。
【0020】
検出方法は質量分析装置が四重極タイプの場合、SIM(Selective Ion Monitoring)が最も好ましく、この場合検出イオンは、本発明のマーカー糖鎖のいずれか、あるいは内部標準として他の糖鎖を用いる場合にはそのm/z等のイオンに設定する。具体的には、例えば、本発明のマーカー糖鎖であるA3G3Fo2(式(1))では、m/z=2433.0、A4G4Fo(式(2))ではm/z=2652.0、A4G4Fo2(式(3))ではm/z=2798.1等である。また、内部標準として、A3G3を用いる場合は、m/z=2140.9、A3G3Foを用いる場合には、m/z=2286.9、A4G4を用いる場合には、m/z=2506.0等のイオンに設定する。
ここで、A3G3は式(1)においてn=0、m=0かつFucα1が存在しない糖鎖であり、A3G3Foは式(1)においてn=0かつm=0である糖鎖であり、A4G4は式(2)においてFucα1が存在しない糖鎖である。
【0021】
TOF型、イオントラップ型の場合はスキャンモードでもよく、この場合は質量範囲を400〜4000に設定することが好ましい。マーカー糖鎖は上述の分析条件において以下の保持時間及びm/zに検出されるが、これらは選択するカラム、溶離液によって変わるため、特に限定されるものではない。また検出するイオンも親イオンに限定されるものではなく、フラグメントイオン、負荷イオン、2量体イオンなど関連イオンであってもよい。
【0022】
上記の方法により検出されたマーカー糖鎖は、その含有量を特定し、該検体の提供患者の肝癌の可能性が判断される。本発明の肝癌診断のための測定法では、マーカー糖鎖の含有量は絶対量を必ずしも求めることはなく、上記方法などで検出された個々のマーカー糖鎖固有のピークを数値化することによって求めることができる。この具体的な方法としては、検出された各ピークの高さを数値化する方法と、ピーク面積を数値化する方法等があり、どちらかに限定されるものではないが、好ましくはピーク面積を数値化する方法が精度がよい。かくして求められるピークを数値化したものを、以下「ピーク強度」と称することがある。
【0023】
本発明の肝癌診断のための測定法では、上述したマーカー糖鎖の量を指標とする方法と共に、上述したマーカー糖鎖の量に基づいて算出される値を指標とする方法も好ましく用いられる。この具体的な算出方法としては、本発明の測定法で指標とする数値が、被検者の体内の状態を正確に反映するように補正する方法であればいかなるものでもよいが、例えば、処理をする血清液量を使って補正する方法や、処理をするタンパク質重量で補正する方法などがある。さらには病気によって変動しない、もしくは変動が小さい、すなわち、体液中の含有量が健常者と肝癌患者で有意な差がない糖鎖の量(以下、「内部標準」と称することがある)を基準にして、マーカー糖鎖の量との比をとる方法も有効である。
【0024】
本発明の測定法について、さらに詳細に説明する。
例えば、上記分析条件において、被検者から採取した体液から検出したマーカー糖鎖A4G4Fo (m/z=2652.0, Rt (保持時間)=23分)のピーク強度と、A4G4Foの基本骨格の構造を有するため、内部標準とした A4G4 (m/z =2506.0, Rt =24分)のピーク強度との比をとった場合、0.4以上であれば肝硬変または肝癌の可能性が高く、1.0以上、さらには1.2以上であれば肝癌の可能性が高いといえる。また、被検者から採取した体液から検出したマーカー糖鎖A3G3Fo2(m/z = 2433.0, Rt = 26分)のピーク強度と、A3G3Fo2の基本骨格の構造を有するため、内部標準としたA3G3 (m/z =2140.9, Rt=31分)のピーク強度との比をとった場合、0.02以上であれば、肝硬変または肝癌と判定され、0.04以上であれば肝癌の可能性が高いといえる。
【0025】
被検者から採取した体液から検出したマーカー糖鎖A4G4Fo2(m/z = 2798.1, Rt = 21分)のピーク強度と、A4G4Fo2の基本骨格の構造を有するため内部標準とした A4G4 (m/z =2506.0, Rt =24分)のピーク強度との比をとった場合、0.1以上、さらには0.15以上であれば、肝硬変または肝癌である可能性が高く、0.2以上、さらには0.4以上であれば肝癌である可能性があるといえる。上記で内部標準とする糖鎖は病気によって変動が少ない糖鎖であれば特に制限はないが、マーカー糖鎖の基本骨格であるものを選択することが好ましい。またピーク強度及びピーク強度比は分析装置に起因するため、特に上述の閾値に限定されるものではなく、健常者と肝硬変または肝癌の患者の血中含量を上記の方法で測定し、有意差が見られる値を適宜選択することができる。
【0026】
上述したマーカー糖鎖の量に基づいて算出される値としては、検体として血清を用いた場合には、上記マーカー糖鎖の量または内部標準で補正した値を、さらに同一被検者から取得した血液中の血小板数で補正した値を用いることも好ましい。これは、本願発明のマーカー糖鎖は、癌を発病しなくても、肝機能の低下(本明細書中では「肝硬変」と称することがある)によってある程度増加するので、これを補正するために行う。肝機能が低下すると、それに比例して血小板濃度が低下することはすでに知られている。よって血小板濃度を肝機能の指標として、本発明のマーカー糖鎖量と血小板数をプロットすると、より一層、肝癌と肝硬変患者がクリアに分離される。
【0027】
補正の方法は、特に限定されるものではないが、例えば、電気抵抗検出法によって測定した血小板数(万個/μL)をもとに、以下補正式1あるいは2により値を算出する方法
を用いることができる。
(補正式1)
補正値 = マーカー糖鎖ピーク強度 × 係数 + 血小板数
(補正式2)
補正値 = マーカー糖鎖ピーク強度 × 血小板数
【0028】
式中、「マーカー糖鎖ピーク強度」はピーク高さまたは面積そのもの、もしくは内部標準との比を示す。補正式1の「係数」は糖鎖ピーク強度と血小板数の値を調整するもので、使用する分析方法によって異なる。上述の分析方法を使うならば、本係数は30〜50、好ましくは40とすることができる。
【実施例】
【0029】
次に、本発明を実施例により更に詳細に説明するが、本発明はその要旨を超えない限り以下の実施例に限定されるものではない。
【0030】
実施例1 肝臓疾患患者及び健常者の血清中に存在する糖鎖の検出及び含有量の測定
初めに患者及び健常者を以下の5グループに分類した。
グループ1(Normal):健常者10名
グループ2(Con1):肝臓病以外の病気(胃または結腸の良性ポリープ)をもつ患者10名
グループ3(Con2):肝炎、自己免疫性肝炎などの肝臓病をもつが、肝硬変、肝癌を発病していない患者8名
グループ4(LC):肝硬変患者9名
グループ5(HCC):肝癌患者13名
【0031】
次に各患者の血清1mlに対しアセトンを9ml加え、4,000×G、20分、4℃で遠心分離し、タンパク質を沈殿させた。血清タンパク質を十分乾燥させた後、沈殿物約20mgに無水ヒドラジン(東京化成社製)500μLを加え、5mLチューブ内で95℃、10時間加熱した。その後、文献(K. Tanabe et al., Anal Biochem 348 (2006) 324-6.)に記載の方法従い、再アセチル化を行った後、文献 ADDIN EN.CITE ADDIN EN.CITE.DATA ( M. Okamoto,et al., Rapid Commun Mass Spectrom 9 (1995) 641-3、及びM. Okamoto, et al., Anal Chem 69 (1997) 2919-26)に記載の方法に従い、糖鎖誘導体化を行った。さらに文献(Y. Otake, et al., J Biochem (Tokyo) 129 (2001) 537-42)に記載の方法に従い、末端シアル酸を糖鎖から切断し、液体クロマトグラフィー(Agilent HP1100、Agilent technologies社製)、及び質量分析装置(HP1100 series、Agilent technologies社製)にて該糖鎖を定量した。
【0032】
液体クロマトグラフィーのカラムは野村化学製DevelosilC30(内径1.5mm,長さ150mm,粒径3μm)を用い、溶離液にはA液:5mM酢酸アンモニウム(pH=4)水溶液,B液:5mM酢酸アンモニウム(pH=4)水溶液90%+アセトニトリル10%を使用し、50分かけてB液比率を18%から45%まで直線的に変化させた後、さらに10分間B液比率を45%に維持した。カラムオーブン温度は40℃、流速は0.1ml/分とした。質量分析はポジティブモードとし、キャピラリーボルテージ:4000V,ネブライザーガス量:45psi,ドライガス10L/分(350℃)にて測定した。
【0033】
検出(質量分析装置)はSelective Ion Modeで行い、高分岐型フコース含有糖鎖及びその骨格構造を検出できる6イオン(m/z=2140.9 (A3G3), m/z=2286.9 (A3G3Fo), m/z=2433.0 (A3G3Fo2), m/z=2506.0 (A4G4), m/z=2652.0 (A4G4Fo), m/z=2798.1 (A4G4Fo2))を選択した。
【0034】
検出されたピークの構造同定は下記の通り進めた。まずA4G4Foは、検出される質量数からHexANc (N-Acetyl glcosamineまたはN-Acetyl galactosamine)が7分子、Hexose (Mannose, Galactose またはGlucose)が6分子、Fucoseが1分子からなると判断した。既知のN結合型糖鎖の基本骨格と照合し、この構成糖をもつ糖鎖構造はA4G4骨格(tetraantennary)にfucoseが1分子結合したものと推測した。過去に人血清糖鎖を分析した例(2-aminopyridine標識糖鎖:Y. Otake, et al., J Biochem (Tokyo) 129 (2001) 537-42)ではこの構成糖の糖鎖はA4G4Foが主成分であった。α1-3/4フコシダーゼ消化を該糖鎖に対して実施したところ、フコースが切断したため、本糖鎖は推定通り、Lewis-AまたはX構造をもつA4G4Foであると決定した。
【0035】
次にA4G4Fo2は検出された質量数からこれはHexANcが7分子、Hexoseが6分子、Fucoseが2分子からなる糖鎖と判断した。既知のN結合型糖鎖の基本骨格と照合した結果、この糖鎖構造はA4G4にfucoseが2分子結合したものと推測した。α1-3/4フコシダーゼ消化を該糖鎖に対して実施したところ、フコースが切断したため、本糖鎖は推定通り、Lewis-AまたはX構造をもつA4G4Fo2であると決定した。
【0036】
A3G3Fo, A3G3Fo2も同様の手法で構造を決定した。尚、A3G3, A4G4は市販の標準糖鎖をTMAPA標識化し、質量数及びLC保持時間が、推定ピークと完全に一致することを確認した。
【0037】
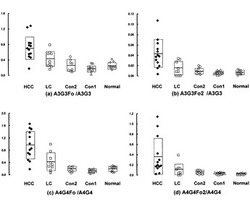
各マーカー糖鎖、及びその他の糖鎖の検体含有量は、上記で取得される個々のピーク面積を、その糖鎖骨格である構造を有する糖鎖(A3G3あるいはA4G4)のピーク面積で除して正規化した。この結果を図1に示す。図1に示すとおり、A3G3Fo2(図1(b))、A4G4Fo(図1(c))及びA4G4Fo2(図1(d))はいずれも肝癌患者の血清において有意な増加が認められた。また既に肝癌患者の血清中で増加が認められることが開示されているA3G3Fo(図1(a))と比較すると、より優位な差であるように見られた。
【0038】
さらに、このうち、A4G4Foについては、血小板数で補正した値を測定した。血小板数は電気抵抗検出法(Sysmex Journal vol. 22, No. 1 (1999) 43-60に記載の方法)により行った。また、本血小板数を用いた補正は、上述した補正式1を用いて、係数40として行った。この結果を図3に示す。血小板数で補正を行うと、肝癌患者群と肝硬変患者群の比較がより一層有意となった。
【0039】
実施例2 本発明の肝癌マーカーの優位性検討
実施例1で測定した肝癌患者、肝硬変患者、その他の疾患患者及び健常者の血清に含まれる本発明の肝癌マーカーである、A3G3Fo2(式1)、A4G4Fo(式2)及びA4G4Fo2(式3)及びA3G3Foについて、以下3指標で比較した。
1.肝癌患者群と肝硬変患者群間のT検定
2.肝癌患者群と肝硬変患者群のマーカー糖鎖ピーク強度の比(平均強度比)
3.ROC(Receiver Operating Characteristic Curve)解析
【0040】
その結果を表1に示す。T検定では本発明のマーカー糖鎖であるA3G3Fo2 (p=0.0086)、A4G4Fo (p=0.0065)が、既に肝癌患者の血清中での増加が報告されているA3G3Fo の値(p=0.018)を下回り、より肝癌と肝硬変を区別する診断に本発明の糖鎖が優位であることを示した。なお、A4G4Fo/pltはA4G4Foを血小板数で補正した値(補正式1、係数40)を指標とした場合を示すが、この場合、p=0.00089となり、肝癌患者群と肝硬変患者群とでよりいっそう明確な差が得られた。
【0041】
また癌患者群と肝硬変患者群のピーク強度比は、本発明のマーカー糖鎖であるA3G3Fo2(3.1倍)、 A4G4Fo (2.3倍)及びA4G4Fo2 (3.7倍)での値が、既に肝癌患者の結成中での増加
が報告されているA3G3Fo (1.7倍)の値を上回り、より肝癌と肝硬変を区別する診断に本発明の糖鎖が優位であることを示した。
【0042】
ROC解析の結果でも、本発明のマーカー糖鎖であるA3G3Fo2(90.3%)及びA4G4Fo (92.8%)の値が、A3G3Fo (89.4%)を上回り、より肝癌と肝硬変を区別する診断に本発明の糖鎖が優位であることを示した。
【0043】
【表1】

【0044】
比較例1 他臓器癌患者の血清中の本発明のマーカー糖鎖含有量の測定
本発明のマーカー糖鎖が、肝癌、肝硬変の診断に適したものであることを確認するために、直腸癌、胃癌、膵臓癌患者についても、実施例1と同様の手法で、血清中のA3G3Fo2、A4G4Fo 、A4G4Fo2、及び、コントロールとして肝癌患者の血清中での増加が報告されているA3G3Foの含有量を測定した。この結果を、実施例1に記載のグループ1(健常者)及びグループ2肝臓病以外の病気(胃または結腸の良性ポリープ)をもつ患者の測定値と比較した。各マーカー糖鎖およびコントロールの糖鎖の測定値は、上記で取得される個々のピーク面積を、その糖鎖骨格である構造を有する糖鎖(A3G3あるいはA4G4)のピーク面積で除して正規化した。この結果を図2に示す。
グループ6(CCC):直腸癌患者 7名
グループ7(MK):胃癌患者 6名
グループ8(PK):膵臓癌患者 6名
【0045】
図2より、本発明のマーカー糖鎖は、一部の患者で、健常者または他の疾患患者に比べて、胃癌患者及び膵臓癌患者の血清中に多く検出されるものの(例えば、図2の各カラムの四角で囲った範囲以外の値)、多くは他の疾患患者あるいは健常者と血清中の含有量に差異が見られないことが確認された。
【産業上の利用可能性】
【0046】
国内の年間の癌死亡者数は約30万人に上るが、多くは自覚症状が出たときにはすでに癌が進行し、手遅れとなるケースが多い。癌は早期に発見できれば治療できる病気であり、早期発見が最大の治療法である。本発明の肝癌マーカーは、被検者の血液等に含有される糖鎖の含有量を測定することにより、肝癌と肝硬変あるいはその他の疾患と明確に区別することができるため、肝癌の早期発見に非常に有効な手段である。
【図面の簡単な説明】
【0047】
【図1】本発明のマーカー糖鎖、及びその他の糖鎖の肝癌、肝臓疾患、その他の疾患及び健常者の検体含有量を示すグラフである。
【図2】本発明のマーカー糖鎖、及びその他の糖鎖の直腸癌、胃癌、膵臓癌及び健常者の検体含有量を示すグラフである。
【図3】本発明のマーカー糖鎖、及びその他の糖鎖の肝癌、肝臓疾患、その他の疾患及び健常者の検体含有量を、血小板数により補正した値を示すグラフである。
【技術分野】
【0001】
本発明は、特定の構造を有するN結合型糖鎖からなる肝癌マーカー及び被検者から採取した体液中の該マーカー量を指標とする肝癌診断のための測定方法に関するものである。
【背景技術】
【0002】
癌の進行とともに血液中の糖タンパク質糖鎖の構造が変化することは知られており、すでにCA19−9やシアリルLewisX(SLX)抗原など、多くの糖鎖マーカーが診断マーカーとして利用されている。しかしながらこれら腫瘍マーカーは正常人にも微量、また時には高濃度で存在することがあり、腫瘍マーカーの値だけで癌を判定するのは困難であった。
【0003】
一方、内視鏡やPET、MRIと画像診断は癌判定の精度は高いものの、患者に対する苦痛が大きく、または費用負担が大きいなどの理由で、健常人が定期的に受ける診断として普及していないのが実情である。
【0004】
自覚症状のない初期癌の患者が癌の進行を知るためには、画像診断よりも簡便でかつ費用のかからない血液検査が望ましいが、現在血中マーカーは精度の悪さから健康診断など健常人が受ける定期診断では実施されていない。これを実施すると擬陽性と判定される健常者が続出し、もし陽性と判定されれば画像診断などの追加検査が必要になり、病院の診断能力を超えてしまうためである。
【0005】
これまで血液中の癌マーカーのスクリーニングは癌血清、癌組織を免疫し、抗体をとる方法が主流であった。この方法は感度が高いという利点がある反面、抗体は抗原糖鎖の一部分(3〜4糖)しか認識しないため、構造選択性が小さいという欠点があった。近年、分析装置の高機能・高感度化に伴い、抗原・抗体反応に頼らず、血液中の抗原を機械的に分離・検出し、癌の進行に伴い増加する(または減少する)マーカーを探す動きが盛んである。池中一裕らは蛍光標識した糖鎖を液体クロマトグラフィーで分離・検出し、アウターフコースを有する3本鎖N結合型糖鎖が肺癌患者の血中に増加することを見出している(特許文献1を参照)。また、Liuらは肝癌患者の血中で3本鎖N結合型糖鎖が増加することを見出している(非特許文献1を参照)。
【0006】
しかしながら癌進行に伴い血中で変化する糖鎖は非常に微量であり、これを他の夾雑物と分離して検出することは極めて困難である。現在、質量分析装置を使った糖鎖分析が盛んであるが、検出感度に劣る糖鎖を高感度で検出することは非常に難しかった。
【特許文献1】特開2001−289860(出願2000−106609)
【非特許文献1】LIU, DESMYTER et al., HEPATOLOGY, vol. 46, No.5, pp1429-(2007)
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、肝癌の早期診断を目的として、感度が高く選択性の高い肝癌マーカーを提供することを課題とする。さらには、該肝癌マーカーの被検者から採取した体液中の量を指標として肝癌の診断のための測定法を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは上記課題を解決すべく検討した結果、被検者の血液中の糖タンパク質N結合型糖鎖のうち、特定の構造を有するN結合型糖鎖が、肝癌患者の血液中で著しく増加し、肝硬変患者及び健常者と明確に判別できることを見出し、本発明に到達した。
【0009】
即ち、本発明の要旨は、以下のとおりである。
[1]以下の式(1)〜(3)のいずれかで表される糖鎖からなる肝癌マーカー。
【化1】

式中、Xはフコースであり、nは1又は0、mは1又は0であり、n+m=1である。
【化2】

【化3】

式中、Xはフコースであり、p、s、tはそれぞれ1又は0であり、p+s+t=1である。
[2]被検者から採取された体液中の[1]に記載の肝癌マーカーの量または前記肝癌マーカーの量に基づいて算出される値を指標とすることを特徴とする肝癌診断のための測定方法。
[3]前記肝癌マーカーの量に基づいて算出される値が、前記肝癌マーカーの量と、体液中の含有量が健常者と肝癌患者で有意な差がない糖鎖の量との比を用いて算出した値であることを特徴とする[2]に記載の方法。
[4]前記肝癌マーカーの量に基づいて算出される値が、前記肝癌マーカー量、または前
記肝癌マーカー量と前記体液中の含有量が健常者と肝癌患者で有意な差がない糖鎖の量との比を用いて算出した値を、同一の被検者から採取された血液中の血小板数で補正して算出した値であることを特徴とする[2]または[3]に記載の方法。
【発明の効果】
【0010】
本発明の肝癌マーカーの被検者体液中量を測定することにより、肝癌患者と肝硬変患者、その他の疾患患者及び健常者を明確に判別することが可能となる。
【発明を実施するための最良の形態】
【0011】
<肝癌マーカー>
本発明の肝癌マーカーは、上記の化学構造式1〜3のいずれかで表される糖鎖からなる。式(1)の糖鎖において、Xはフコースであり、nは1又は0、mは1又は0であり、n+m=1である。フコースの結合は、α1→3結合であることが好ましい。式(1)に示す糖鎖を、以下「A3G3Fo2」と称することがある。また、式(2)で表される糖鎖を、以下「A4G4Fo」と称することがある。また、式(3)で表される糖鎖において、Xはフコースであり、p、s、tはそれぞれ1又は0であり、p+s+t=1である。フコースの結合は、α1→3結合であることが好ましい。式(3)に示す糖鎖を、以下「A4G4Fo2」と称することがある。
本発明の肝癌マーカーは、癌化した肝細胞に多く含まれるタンパク質に結合している糖鎖である。
【0012】
<肝癌診断のための測定法>
本発明はさらに上記肝癌マーカーの量または前記肝癌マーカーの量に基づいて算出される値を指標とする肝癌診断のための測定法も含む。本測定法の検体としては、肝癌の可能性がある被検者から採取した体液が用いられる。体液としては、血液、リンパ液、髄液、尿及びその処理物などが用いられるが、好ましくは血液、さらに好ましくは該血液を分離して得られる血清が用いられる。
【0013】
該検体中の本発明の肝癌マーカーである糖鎖(以下、「マーカー糖鎖」と称することがある)の含有量を測定するためには、該検体に含まれるマーカー糖鎖を、これが結合するタンパク質から切り離す必要がある。マーカー糖鎖をタンパク質から切り離す方法としては、それ自体公知の通常用いられる方法が挙げられるが、具体的には、ヒドラジン分解法や、酵素(N−グリカナーゼ)消化法等が挙げられる。これらのうち、定量的に糖鎖を切断するにはヒドラジン分解法が好ましく、例えば、Y. Otake et al., J Biochem (Tokyo)
129 (2001) 537-42に記載の方法等が好ましく用いられる。ここで、ヒドラジン分解法を用いた場合には、ヒドラジン分解によって脱離したアセチル基を再アセチル化する必要がある。具体的には、例えば、K. Tanabe et al., Anal. Biochem. 348 (2006) 324-6.記載の方法等が用いられる。
【0014】
かくして遊離されたマーカー糖鎖を、必要に応じて標識する。標識方法は特に限定されるものではないが、質量分析法器を使う場合はイオン化効率を高めるTMAPA (tirmethyl(4-aminophenyl)ammonium chloride)が特に好ましく、蛍光検出器を使う場合は2-aminopyridineが好ましい。誘導体化方法はTMAPAの場合は例えば、M. Okamoto et al., Rapid Commun Mass Spectrom 9 (1995) 641-3.に記載の方法が用いられ、2-aminopyridineの場合はY. Otake et al., J Biochem (Tokyo) 129 (2001) 537-42に記載の方法等が用いられる。
【0015】
肝癌マーカーである糖鎖の検出及び含有量の測定方法は、本発明のマーカー糖鎖が検出及び測定できる方法であれば特に制限はないが、高速液体クロマトグラフィー、質量分析、核磁気共鳴、本発明のマーカー糖鎖特異的抗体を用いる方法が挙げられる。本発明のマーカー糖鎖は、血清中に存在する類似の糖鎖と分離することが非常に困難であるため、液
体クロマトグラフィーと質量分析装置を合せて検出、測定すること(以下、「LC−MS法」と称することがある)が望ましい。
【0016】
LC−MS法を用いた本発明のマーカー糖鎖測定方法としては、例えば、以下に詳述する方法が用いられる。液体クロマトグラフィーは安定的に送液できるものであればどのような仕様でもよく、特に限定されるものではない。イオン化法はESIの他、APCIなどでもよいが、ESIが最も好ましい。質量分析装置は四重極型以外、TOF型、イオントラップ型、磁場型、フーリエ変換型のいずれでもよいが、定量性の高い四重極型、感度の高いTOF型、イオントラップ型が特に好ましい。
【0017】
用いるカラムは複数の糖鎖を分離できるものであれば、順相、逆相、吸着いずれのタイプでもよいが、好ましくは逆相系のC8、C18、C30カラムがよく、さらに好ましくはC30カラムがよい。カラムのサイズは特に限定されないが、流速を小さくし、感度を高められる内径が2.1mm以下のものが好ましく、さらには1.5mm以下のものが特に好ましい。
【0018】
溶離液はカラムの性質によって最適なものが選択されるが、C30カラムを使用する場合は、例えば溶離液Aに5mM酢酸アンモニウム水溶液(pH=4)、溶離液Bには5mM酢酸アンモニウム水溶液(pH=4)90%+アセトニトリル10%の混合液などが使われ、サンプル注入前にB液0%〜30%(=A液 100%〜70%:以下A液濃度は省略)溶液で十分平衡化する必要がある。平衡化時のB液濃度は10〜25%が好ましいが、特に15〜20%が好ましい。
【0019】
サンプル溶液を約20μL注入し、注入と同時に溶離液組成をB液約20%から直線的に約50分かけて約50%まで変化させる。さらに50分から60分までB液組成を約50%一定にすることができるが、グラジエント条件はカラムの種類により制約を受けるものであるため、特に限定されるものではない。質量分析器の測定条件は、本発明のマーカー糖鎖が分離できる範囲であれば、特に限定されるものではないが、例えば、キャピラリー電圧(イオン化電圧)を4000V、ネブライザーガス圧を45psi、ドライガス流量及び温度を10L/分、350℃とすると良好に検出することができる。
【0020】
検出方法は質量分析装置が四重極タイプの場合、SIM(Selective Ion Monitoring)が最も好ましく、この場合検出イオンは、本発明のマーカー糖鎖のいずれか、あるいは内部標準として他の糖鎖を用いる場合にはそのm/z等のイオンに設定する。具体的には、例えば、本発明のマーカー糖鎖であるA3G3Fo2(式(1))では、m/z=2433.0、A4G4Fo(式(2))ではm/z=2652.0、A4G4Fo2(式(3))ではm/z=2798.1等である。また、内部標準として、A3G3を用いる場合は、m/z=2140.9、A3G3Foを用いる場合には、m/z=2286.9、A4G4を用いる場合には、m/z=2506.0等のイオンに設定する。
ここで、A3G3は式(1)においてn=0、m=0かつFucα1が存在しない糖鎖であり、A3G3Foは式(1)においてn=0かつm=0である糖鎖であり、A4G4は式(2)においてFucα1が存在しない糖鎖である。
【0021】
TOF型、イオントラップ型の場合はスキャンモードでもよく、この場合は質量範囲を400〜4000に設定することが好ましい。マーカー糖鎖は上述の分析条件において以下の保持時間及びm/zに検出されるが、これらは選択するカラム、溶離液によって変わるため、特に限定されるものではない。また検出するイオンも親イオンに限定されるものではなく、フラグメントイオン、負荷イオン、2量体イオンなど関連イオンであってもよい。
【0022】
上記の方法により検出されたマーカー糖鎖は、その含有量を特定し、該検体の提供患者の肝癌の可能性が判断される。本発明の肝癌診断のための測定法では、マーカー糖鎖の含有量は絶対量を必ずしも求めることはなく、上記方法などで検出された個々のマーカー糖鎖固有のピークを数値化することによって求めることができる。この具体的な方法としては、検出された各ピークの高さを数値化する方法と、ピーク面積を数値化する方法等があり、どちらかに限定されるものではないが、好ましくはピーク面積を数値化する方法が精度がよい。かくして求められるピークを数値化したものを、以下「ピーク強度」と称することがある。
【0023】
本発明の肝癌診断のための測定法では、上述したマーカー糖鎖の量を指標とする方法と共に、上述したマーカー糖鎖の量に基づいて算出される値を指標とする方法も好ましく用いられる。この具体的な算出方法としては、本発明の測定法で指標とする数値が、被検者の体内の状態を正確に反映するように補正する方法であればいかなるものでもよいが、例えば、処理をする血清液量を使って補正する方法や、処理をするタンパク質重量で補正する方法などがある。さらには病気によって変動しない、もしくは変動が小さい、すなわち、体液中の含有量が健常者と肝癌患者で有意な差がない糖鎖の量(以下、「内部標準」と称することがある)を基準にして、マーカー糖鎖の量との比をとる方法も有効である。
【0024】
本発明の測定法について、さらに詳細に説明する。
例えば、上記分析条件において、被検者から採取した体液から検出したマーカー糖鎖A4G4Fo (m/z=2652.0, Rt (保持時間)=23分)のピーク強度と、A4G4Foの基本骨格の構造を有するため、内部標準とした A4G4 (m/z =2506.0, Rt =24分)のピーク強度との比をとった場合、0.4以上であれば肝硬変または肝癌の可能性が高く、1.0以上、さらには1.2以上であれば肝癌の可能性が高いといえる。また、被検者から採取した体液から検出したマーカー糖鎖A3G3Fo2(m/z = 2433.0, Rt = 26分)のピーク強度と、A3G3Fo2の基本骨格の構造を有するため、内部標準としたA3G3 (m/z =2140.9, Rt=31分)のピーク強度との比をとった場合、0.02以上であれば、肝硬変または肝癌と判定され、0.04以上であれば肝癌の可能性が高いといえる。
【0025】
被検者から採取した体液から検出したマーカー糖鎖A4G4Fo2(m/z = 2798.1, Rt = 21分)のピーク強度と、A4G4Fo2の基本骨格の構造を有するため内部標準とした A4G4 (m/z =2506.0, Rt =24分)のピーク強度との比をとった場合、0.1以上、さらには0.15以上であれば、肝硬変または肝癌である可能性が高く、0.2以上、さらには0.4以上であれば肝癌である可能性があるといえる。上記で内部標準とする糖鎖は病気によって変動が少ない糖鎖であれば特に制限はないが、マーカー糖鎖の基本骨格であるものを選択することが好ましい。またピーク強度及びピーク強度比は分析装置に起因するため、特に上述の閾値に限定されるものではなく、健常者と肝硬変または肝癌の患者の血中含量を上記の方法で測定し、有意差が見られる値を適宜選択することができる。
【0026】
上述したマーカー糖鎖の量に基づいて算出される値としては、検体として血清を用いた場合には、上記マーカー糖鎖の量または内部標準で補正した値を、さらに同一被検者から取得した血液中の血小板数で補正した値を用いることも好ましい。これは、本願発明のマーカー糖鎖は、癌を発病しなくても、肝機能の低下(本明細書中では「肝硬変」と称することがある)によってある程度増加するので、これを補正するために行う。肝機能が低下すると、それに比例して血小板濃度が低下することはすでに知られている。よって血小板濃度を肝機能の指標として、本発明のマーカー糖鎖量と血小板数をプロットすると、より一層、肝癌と肝硬変患者がクリアに分離される。
【0027】
補正の方法は、特に限定されるものではないが、例えば、電気抵抗検出法によって測定した血小板数(万個/μL)をもとに、以下補正式1あるいは2により値を算出する方法
を用いることができる。
(補正式1)
補正値 = マーカー糖鎖ピーク強度 × 係数 + 血小板数
(補正式2)
補正値 = マーカー糖鎖ピーク強度 × 血小板数
【0028】
式中、「マーカー糖鎖ピーク強度」はピーク高さまたは面積そのもの、もしくは内部標準との比を示す。補正式1の「係数」は糖鎖ピーク強度と血小板数の値を調整するもので、使用する分析方法によって異なる。上述の分析方法を使うならば、本係数は30〜50、好ましくは40とすることができる。
【実施例】
【0029】
次に、本発明を実施例により更に詳細に説明するが、本発明はその要旨を超えない限り以下の実施例に限定されるものではない。
【0030】
実施例1 肝臓疾患患者及び健常者の血清中に存在する糖鎖の検出及び含有量の測定
初めに患者及び健常者を以下の5グループに分類した。
グループ1(Normal):健常者10名
グループ2(Con1):肝臓病以外の病気(胃または結腸の良性ポリープ)をもつ患者10名
グループ3(Con2):肝炎、自己免疫性肝炎などの肝臓病をもつが、肝硬変、肝癌を発病していない患者8名
グループ4(LC):肝硬変患者9名
グループ5(HCC):肝癌患者13名
【0031】
次に各患者の血清1mlに対しアセトンを9ml加え、4,000×G、20分、4℃で遠心分離し、タンパク質を沈殿させた。血清タンパク質を十分乾燥させた後、沈殿物約20mgに無水ヒドラジン(東京化成社製)500μLを加え、5mLチューブ内で95℃、10時間加熱した。その後、文献(K. Tanabe et al., Anal Biochem 348 (2006) 324-6.)に記載の方法従い、再アセチル化を行った後、文献 ADDIN EN.CITE ADDIN EN.CITE.DATA ( M. Okamoto,et al., Rapid Commun Mass Spectrom 9 (1995) 641-3、及びM. Okamoto, et al., Anal Chem 69 (1997) 2919-26)に記載の方法に従い、糖鎖誘導体化を行った。さらに文献(Y. Otake, et al., J Biochem (Tokyo) 129 (2001) 537-42)に記載の方法に従い、末端シアル酸を糖鎖から切断し、液体クロマトグラフィー(Agilent HP1100、Agilent technologies社製)、及び質量分析装置(HP1100 series、Agilent technologies社製)にて該糖鎖を定量した。
【0032】
液体クロマトグラフィーのカラムは野村化学製DevelosilC30(内径1.5mm,長さ150mm,粒径3μm)を用い、溶離液にはA液:5mM酢酸アンモニウム(pH=4)水溶液,B液:5mM酢酸アンモニウム(pH=4)水溶液90%+アセトニトリル10%を使用し、50分かけてB液比率を18%から45%まで直線的に変化させた後、さらに10分間B液比率を45%に維持した。カラムオーブン温度は40℃、流速は0.1ml/分とした。質量分析はポジティブモードとし、キャピラリーボルテージ:4000V,ネブライザーガス量:45psi,ドライガス10L/分(350℃)にて測定した。
【0033】
検出(質量分析装置)はSelective Ion Modeで行い、高分岐型フコース含有糖鎖及びその骨格構造を検出できる6イオン(m/z=2140.9 (A3G3), m/z=2286.9 (A3G3Fo), m/z=2433.0 (A3G3Fo2), m/z=2506.0 (A4G4), m/z=2652.0 (A4G4Fo), m/z=2798.1 (A4G4Fo2))を選択した。
【0034】
検出されたピークの構造同定は下記の通り進めた。まずA4G4Foは、検出される質量数からHexANc (N-Acetyl glcosamineまたはN-Acetyl galactosamine)が7分子、Hexose (Mannose, Galactose またはGlucose)が6分子、Fucoseが1分子からなると判断した。既知のN結合型糖鎖の基本骨格と照合し、この構成糖をもつ糖鎖構造はA4G4骨格(tetraantennary)にfucoseが1分子結合したものと推測した。過去に人血清糖鎖を分析した例(2-aminopyridine標識糖鎖:Y. Otake, et al., J Biochem (Tokyo) 129 (2001) 537-42)ではこの構成糖の糖鎖はA4G4Foが主成分であった。α1-3/4フコシダーゼ消化を該糖鎖に対して実施したところ、フコースが切断したため、本糖鎖は推定通り、Lewis-AまたはX構造をもつA4G4Foであると決定した。
【0035】
次にA4G4Fo2は検出された質量数からこれはHexANcが7分子、Hexoseが6分子、Fucoseが2分子からなる糖鎖と判断した。既知のN結合型糖鎖の基本骨格と照合した結果、この糖鎖構造はA4G4にfucoseが2分子結合したものと推測した。α1-3/4フコシダーゼ消化を該糖鎖に対して実施したところ、フコースが切断したため、本糖鎖は推定通り、Lewis-AまたはX構造をもつA4G4Fo2であると決定した。
【0036】
A3G3Fo, A3G3Fo2も同様の手法で構造を決定した。尚、A3G3, A4G4は市販の標準糖鎖をTMAPA標識化し、質量数及びLC保持時間が、推定ピークと完全に一致することを確認した。
【0037】
各マーカー糖鎖、及びその他の糖鎖の検体含有量は、上記で取得される個々のピーク面積を、その糖鎖骨格である構造を有する糖鎖(A3G3あるいはA4G4)のピーク面積で除して正規化した。この結果を図1に示す。図1に示すとおり、A3G3Fo2(図1(b))、A4G4Fo(図1(c))及びA4G4Fo2(図1(d))はいずれも肝癌患者の血清において有意な増加が認められた。また既に肝癌患者の血清中で増加が認められることが開示されているA3G3Fo(図1(a))と比較すると、より優位な差であるように見られた。
【0038】
さらに、このうち、A4G4Foについては、血小板数で補正した値を測定した。血小板数は電気抵抗検出法(Sysmex Journal vol. 22, No. 1 (1999) 43-60に記載の方法)により行った。また、本血小板数を用いた補正は、上述した補正式1を用いて、係数40として行った。この結果を図3に示す。血小板数で補正を行うと、肝癌患者群と肝硬変患者群の比較がより一層有意となった。
【0039】
実施例2 本発明の肝癌マーカーの優位性検討
実施例1で測定した肝癌患者、肝硬変患者、その他の疾患患者及び健常者の血清に含まれる本発明の肝癌マーカーである、A3G3Fo2(式1)、A4G4Fo(式2)及びA4G4Fo2(式3)及びA3G3Foについて、以下3指標で比較した。
1.肝癌患者群と肝硬変患者群間のT検定
2.肝癌患者群と肝硬変患者群のマーカー糖鎖ピーク強度の比(平均強度比)
3.ROC(Receiver Operating Characteristic Curve)解析
【0040】
その結果を表1に示す。T検定では本発明のマーカー糖鎖であるA3G3Fo2 (p=0.0086)、A4G4Fo (p=0.0065)が、既に肝癌患者の血清中での増加が報告されているA3G3Fo の値(p=0.018)を下回り、より肝癌と肝硬変を区別する診断に本発明の糖鎖が優位であることを示した。なお、A4G4Fo/pltはA4G4Foを血小板数で補正した値(補正式1、係数40)を指標とした場合を示すが、この場合、p=0.00089となり、肝癌患者群と肝硬変患者群とでよりいっそう明確な差が得られた。
【0041】
また癌患者群と肝硬変患者群のピーク強度比は、本発明のマーカー糖鎖であるA3G3Fo2(3.1倍)、 A4G4Fo (2.3倍)及びA4G4Fo2 (3.7倍)での値が、既に肝癌患者の結成中での増加
が報告されているA3G3Fo (1.7倍)の値を上回り、より肝癌と肝硬変を区別する診断に本発明の糖鎖が優位であることを示した。
【0042】
ROC解析の結果でも、本発明のマーカー糖鎖であるA3G3Fo2(90.3%)及びA4G4Fo (92.8%)の値が、A3G3Fo (89.4%)を上回り、より肝癌と肝硬変を区別する診断に本発明の糖鎖が優位であることを示した。
【0043】
【表1】

【0044】
比較例1 他臓器癌患者の血清中の本発明のマーカー糖鎖含有量の測定
本発明のマーカー糖鎖が、肝癌、肝硬変の診断に適したものであることを確認するために、直腸癌、胃癌、膵臓癌患者についても、実施例1と同様の手法で、血清中のA3G3Fo2、A4G4Fo 、A4G4Fo2、及び、コントロールとして肝癌患者の血清中での増加が報告されているA3G3Foの含有量を測定した。この結果を、実施例1に記載のグループ1(健常者)及びグループ2肝臓病以外の病気(胃または結腸の良性ポリープ)をもつ患者の測定値と比較した。各マーカー糖鎖およびコントロールの糖鎖の測定値は、上記で取得される個々のピーク面積を、その糖鎖骨格である構造を有する糖鎖(A3G3あるいはA4G4)のピーク面積で除して正規化した。この結果を図2に示す。
グループ6(CCC):直腸癌患者 7名
グループ7(MK):胃癌患者 6名
グループ8(PK):膵臓癌患者 6名
【0045】
図2より、本発明のマーカー糖鎖は、一部の患者で、健常者または他の疾患患者に比べて、胃癌患者及び膵臓癌患者の血清中に多く検出されるものの(例えば、図2の各カラムの四角で囲った範囲以外の値)、多くは他の疾患患者あるいは健常者と血清中の含有量に差異が見られないことが確認された。
【産業上の利用可能性】
【0046】
国内の年間の癌死亡者数は約30万人に上るが、多くは自覚症状が出たときにはすでに癌が進行し、手遅れとなるケースが多い。癌は早期に発見できれば治療できる病気であり、早期発見が最大の治療法である。本発明の肝癌マーカーは、被検者の血液等に含有される糖鎖の含有量を測定することにより、肝癌と肝硬変あるいはその他の疾患と明確に区別することができるため、肝癌の早期発見に非常に有効な手段である。
【図面の簡単な説明】
【0047】
【図1】本発明のマーカー糖鎖、及びその他の糖鎖の肝癌、肝臓疾患、その他の疾患及び健常者の検体含有量を示すグラフである。
【図2】本発明のマーカー糖鎖、及びその他の糖鎖の直腸癌、胃癌、膵臓癌及び健常者の検体含有量を示すグラフである。
【図3】本発明のマーカー糖鎖、及びその他の糖鎖の肝癌、肝臓疾患、その他の疾患及び健常者の検体含有量を、血小板数により補正した値を示すグラフである。
【特許請求の範囲】
【請求項1】
以下の式(1)〜(3)のいずれかで表される糖鎖からなる肝癌マーカー。
【化1】

式中、Xはフコースであり、nは1又は0、mは1又は0であり、n+m=1である。
【化2】

【化3】

式中、Xはフコースであり、p、s、tはそれぞれ1又は0であり、p+s+t=1である。
【請求項2】
被検者から採取された体液中の請求項1に記載の肝癌マーカーの量または前記肝癌マーカーの量に基づいて算出される値を指標とすることを特徴とする肝癌診断のための測定方法。
【請求項3】
前記肝癌マーカーの量に基づいて算出される値が、前記肝癌マーカーの量と、体液中の含有量が健常者と肝癌患者で有意な差がない糖鎖の量との比を用いて算出し
た値であることを特徴とする請求項2に記載の方法。
【請求項4】
前記肝癌マーカーの量に基づいて算出される値が、前記肝癌マーカー量、または前記肝癌マーカー量と前記体液中の含有量が健常者と肝癌患者で有意な差がない糖鎖の量との比を用いて算出した値を、同一の被検者から採取された血液中の血小板数で補正して算出した値であることを特徴とする請求項2または3に記載の方法。
【請求項1】
以下の式(1)〜(3)のいずれかで表される糖鎖からなる肝癌マーカー。
【化1】

式中、Xはフコースであり、nは1又は0、mは1又は0であり、n+m=1である。
【化2】

【化3】

式中、Xはフコースであり、p、s、tはそれぞれ1又は0であり、p+s+t=1である。
【請求項2】
被検者から採取された体液中の請求項1に記載の肝癌マーカーの量または前記肝癌マーカーの量に基づいて算出される値を指標とすることを特徴とする肝癌診断のための測定方法。
【請求項3】
前記肝癌マーカーの量に基づいて算出される値が、前記肝癌マーカーの量と、体液中の含有量が健常者と肝癌患者で有意な差がない糖鎖の量との比を用いて算出し
た値であることを特徴とする請求項2に記載の方法。
【請求項4】
前記肝癌マーカーの量に基づいて算出される値が、前記肝癌マーカー量、または前記肝癌マーカー量と前記体液中の含有量が健常者と肝癌患者で有意な差がない糖鎖の量との比を用いて算出した値を、同一の被検者から採取された血液中の血小板数で補正して算出した値であることを特徴とする請求項2または3に記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2009−222670(P2009−222670A)
【公開日】平成21年10月1日(2009.10.1)
【国際特許分類】
【出願番号】特願2008−69836(P2008−69836)
【出願日】平成20年3月18日(2008.3.18)
【出願人】(304028346)国立大学法人 香川大学 (285)
【出願人】(504261077)大学共同利用機関法人自然科学研究機構 (156)
【出願人】(000005968)三菱化学株式会社 (4,356)
【Fターム(参考)】
【公開日】平成21年10月1日(2009.10.1)
【国際特許分類】
【出願日】平成20年3月18日(2008.3.18)
【出願人】(304028346)国立大学法人 香川大学 (285)
【出願人】(504261077)大学共同利用機関法人自然科学研究機構 (156)
【出願人】(000005968)三菱化学株式会社 (4,356)
【Fターム(参考)】
[ Back to top ]

