肝線維症の存在及び/又は肝線維症の重症度の判定方法、判定マーカー、判定用キット、肝線維症の治療の効果予測方法、効果予測マーカー、並びに効果予測用キット
【課題】肝線維症の存在の判定、肝線維症の重症度の判定、及び肝線維症の治療効果の予測を正確、簡便且つ迅速に行う方法が求められていた。
【解決手段】本発明は、被験者から得られた試料に含まれるマイクロRNAを測定する工程を含む肝線維症の存在及び/又は肝線維症の重症度の判定方法、肝線維症の存在及び/又は肝線維症の重症度の判定マーカー、肝線維症の存在及び/又は肝線維症重症度の判定用キット、肝線維症の治療の効果予測方法、肝線維症の治療の効果予測マーカー、並びに肝線維症の治療の効果予測用キットである。
【解決手段】本発明は、被験者から得られた試料に含まれるマイクロRNAを測定する工程を含む肝線維症の存在及び/又は肝線維症の重症度の判定方法、肝線維症の存在及び/又は肝線維症の重症度の判定マーカー、肝線維症の存在及び/又は肝線維症重症度の判定用キット、肝線維症の治療の効果予測方法、肝線維症の治療の効果予測マーカー、並びに肝線維症の治療の効果予測用キットである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、マイクロRNAを用いた、肝線維症の存在及び/又は肝線維症の重症度の判定方法、判定マーカー、判定用キット、肝線維症の治療の効果予測方法、治療効果予測マーカー、並びに治療効果予測用キットに関する。
【背景技術】
【0002】
肝線維症とは、肝血管の周囲に存在する星細胞(「伊東細胞」とも呼称される。)が活性化して細胞外マトリクスを過剰に分泌することで、肝臓中に線維構造が生じる疾患である。肝線維症が重症化するにつれて肝臓中の線維構造が拡大し、肝機能に障害が生じ、肝硬変に至ることもある。これまで肝線維症の存在及び/又は肝線維症の重症度の判定は、被験者の肝臓の組織の一部を取り出す肝生検と呼ばれる手法で行われてきた。該手法は肝生検で取り出された組織を染色することで線維化の有無を判断するものであり、患者にとっては大きな負担となっていた。
【0003】
そこで、肝線維症の存在や、その重症度を簡易に判定するための研究開発が行われている。例えば、肝線維化の過程で発現が変動する遺伝子の発現量又は該遺伝子にコードされるタンパク質量を測定する肝線維化ステージの判定方法(特許文献1参照)や、肝線維症に罹患した患者の肝臓で特異的に反映する遺伝子からなる疾患マーカー(特許文献2参照)等である。
【0004】
ところで、マイクロRNA(以下、「miRNA」と呼称する場合もある。)とは、細胞内に存在し、タンパクへの翻訳がなされない、長さが20塩基〜30塩基程度の1本鎖RNAである。マイクロRNAは一部のmRNAに相補的な配列を有しており、mRNAとマイクロRNAとが結合することで該mRNAの翻訳の抑制や該mRNAの分解を引き起こすことから、マイクロRNAにより遺伝子の発現が制御されていると考えられる。
【0005】
マイクロRNAは細胞内の多くの遺伝子の発現制御を行っているため、マイクロRNAの発現の変化は疾患の発生や進行等に関連する。そこで、マイクロRNAを用いて疾患を判定や検出をする方法が開発されている。例えば、マイクロRNAを用いて婦人科癌を判定する方法(特許文献3参照)、マイクロRNAの発現量の変動を測定して膀胱癌を検出する方法(特許文献4参照)、マイクロRNAの発現から肝細胞癌のサブタイプを決定する方法(特許文献5参照)等である。
【0006】
一方、肝線維症の発症や進展と関連して発現が変化するマイクロRNAもいくつか知られている。例えば、肝線維症で発現量が増加するマイクロRNAとしてmiR-27a、miR-27b及びmiR-30が、発現量が減少するマイクロRNAとしてmiR-9、miR-721及びmiR-301が知られている(非特許文献1参照)。また、miR-199ファミリー及びmiR-200ファミリーの発現が肝線維化の進展に関係するとの報告もある(非特許文献2参照)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2007―315752号公報
【特許文献2】特開2003−259877号公報
【特許文献3】特開2010−154843号公報
【特許文献4】特開2009−100687号公報
【特許文献5】特開2010−528659号公報
【非特許文献】
【0008】
【非特許文献1】S Bala, et al., “Emerging role of microRNAs in liver diseases”, WorldJ. Gastroenterol., Vol.15, No.45, 2009年12月7日発行, p.5634
【非特許文献2】日本癌学会,「69th Annual Meeting of the Japanese Cancer AssociationProceedings」, 2010年8月23日発行,p.91
【発明の概要】
【発明が解決しようとする課題】
【0009】
特許文献1及び特許文献2に記載の方法では、肝線維化が進んだ肝臓組織で得られた組織で特異的に発現している遺伝子をマーカーとして用いるため、判定には肝組織が必要であり、肝生検を行わなければ判定できないことから、患者負担は非常に大きかった。
【0010】
また、非特許文献1及び非特許文献2において肝線維化に関連するmiRNAが知られていたが、これらのmiRNAの発現は、肝線維症の存在や重症化を正確に反映しておらず、また、肝線維症の治療効果の予測に用いることができるものではなかった。
【0011】
肝線維症に対する治療はインターフェロン等さまざまな薬剤を用いて行われるが、治療の効果は患者によって個人差があり、治療を施す前に治療効果を予測することが必要である。しかし、治療効果を正確に予測する方法は開発されていなかった。
【0012】
このように、肝線維症の存在の判定、肝線維症の重症度の判定、及び肝線維症の治療効果の予測を正確、簡便且つ迅速に行う方法が求められていた。
【課題を解決するための手段】
【0013】
本発明の肝線維症の存在及び/又は肝線維症の重症度の判定方法は、被験者から得られた試料に含まれる、miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する工程を含む、被験者における肝線維症の存在及び/又は肝線維症の重症度の判定方法である。
【0014】
また、本発明の別の肝線維症の存在及び/又は肝線維症の重症度の判定方法は、被験者から得られた試料に含まれるmiR-221及び/又はmiR-222を測定する工程を含む、肝線維症の存在及び/又は肝線維症の重症度の判定方法である。
【0015】
また、本発明の肝線維症の存在及び/又は肝線維症の重症度の判定方法において、試料は、被験者の組織及び/又は体液であり得る。さらに、本発明の肝線維症の存在及び/又は肝線維症の重症度の判定方法において、被験者は、ヒト又は動物であり得る。
【0016】
本発明の肝線維症の存在及び/又は肝線維症の重症度の判定マーカーは、miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を含む。
【0017】
本発明の肝線維症の存在及び/又は肝線維症重症度の判定用キットは、被験者から得られた試料に含まれる、miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する測定手段を少なくとも含む。さらに、本発明の肝線維症の存在及び/又は肝線維症重症度の判定用キットにおいて、被験者はヒト又は動物であり得る。
【0018】
本発明の肝線維症の治療の効果予測方法は、被験者から得られた試料に含まれる、miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する工程を含む、被験者における肝線維症の治療の効果予測方法である。また、本発明において、効果を予測する治療は、インターフェロンを用いた治療であり得る。
【0019】
また、本発明の肝線維症の治療の効果予測方法において、試料は、被験者の組織及び/又は体液であり得る。さらに、本発明の肝線維症の治療の効果予測方法において、被験者は、ヒト又は動物であり得る。
【0020】
また、本発明の肝線維症の治療の効果予測マーカーは、miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を含む。
【0021】
さらに、本発明の肝線維症の治療の効果予測用キットは、被験者から得られた試料に含まれる、miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する測定手段を少なくとも含む。本発明の肝線維症の治療の効果予測用キットにおいて、被験者は、ヒト又は動物であり得る。
【発明の効果】
【0022】
本発明者らが特定したmiRNAは、肝線維症の発症により発現量が亢進又は低下し、肝線維症の重症化を反映してさらに発現量が変化する。したがって、該miRNAを用いた本発明により、被験者における肝線維症の存在及び/又は肝線維症の重症化を正確に判定することができる。
【0023】
また、被験者において発現したmiRNAは、細胞から血液中に分泌されることが知られている。したがって、肝組織だけでなく、採取が容易な血液を試料として用いることができるため、本発明による判定又は予測は、迅速性、簡便性に優れる。
【0024】
また、本発明者らが特定したmiRNAは、肝線維症の治療効果が高い患者と、治療効果が低い患者との間で発現量の差がみられる。したがって、該miRNAを用いた本発明により治療を施す前に治療効果を予測することで、肝患者個人毎に有効な治療法を選択することができる。
【図面の簡単な説明】
【0025】
【図1】肝線維症重症化群において有意に発現が変化したmiRNAと、該miRNAの発現量の倍率変化値とを示す図面である。
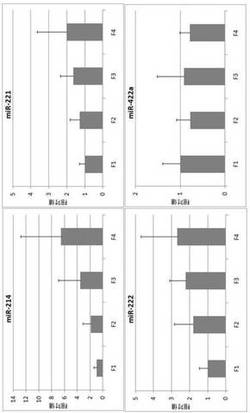
【図2】肝線維症の各ステージにおけるmiRNAの発現量の変化を示す図面である。
【図3】肝線維症のステージのうち、F1〜F2とF3〜F4との間、及び、F1とF2〜F4との間でのmiRNAの発現量の変化を示す図面である。
【図4】肝線維症モデルマウスにおけるmiR-222の発現量の変化を示す図面である。
【図5】別の肝線維症モデルマウスにおけるmiR-222の発現量の変化を示す図面である。
【図6】星細胞の活性化と、miR-221及びmiR-222の発現量の変化との関連性を示す図面である。
【図7】各細胞におけるmiR-221及びmiR-222の発現量を示す図面である。
【図8】インターフェロンを用いた治療でウイルス学的完治が得られた群と得られなかった群との間で有意に発現が変化したmiRNAと、該miRNAの発現量の倍率変化値とを示す図面である。
【発明を実施するための形態】
【0026】
本発明は、肝線維症の存在及び/又は肝線維症の重症度の判定方法、肝線維症の存在及び/又は肝線維症の重症度の判定マーカー、及び肝線維症の存在及び/又は肝線維症重症度の判定用キットである。本発明では、miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数が用いられる。
【0027】
また、本発明において用いられるmiRNAは、上記のmiRNAと実質的に同一の塩基配列を有するRNAを含む。実質的に同一の配列を有するRNAとは、前記のmiRNAに対して1又は複数の塩基が欠失、置換、又は付加されたmiRNAであり、且つ肝線維症の存在及び/又は肝線維症の重症度の判定に用いられ得るRNAである。
【0028】
本発明において用いられるmiRNAの一例として、ヒトが有するmiRNAの塩基配列を配列番号:1〜配列番号:4に示す。配列番号:1はヒトmiR-221の、配列番号:2はヒトmiR-222の、配列番号:3はヒトmiR-214の、配列番号:4はヒトmiR-422aの塩基配列である。
【0029】
本発明における被験者とは、肝障害、特に肝線維症の疑いのある被験者が含まれるが健常者であっても構わない。また、被験者とは、ヒト及びヒト以外の動物を含む。ヒト以外の動物は特に制限されないが、例えば、イヌ、ネコ、サル、ウシ、ブタ、ヤギ、ヒツジ、ウサギ、マウス、ラット等の哺乳類が挙げられる。
【0030】
本発明では試料に含まれる特定のmiRNAを測定することで肝線維症の存在を判定することができる。例えば、被験者から得られた試料から測定されたmiRNA量と、健常者から得られた試料から測定されたmiRNA量とを測定し、作成されるROC曲線からカットオフ値を設定することで、肝線維症の存在を判定することができる。
【0031】
また、本発明で測定対象となるmiRNAは、肝線維症が重症化するに従って発現量が亢進又は低下する。したがって、例えば、新犬山分類による線維化ステージ(F0: 線維化なし,F1:門脈域の線維性拡大,F2:線維性架橋形成,F3:小葉のひずみを伴う線維性架橋形成,F4:肝硬変)に基づいて肝線維症の重症度を判定することができる。まず、各線維化ステージに属する患者から得られた試料に含まれるmiRNA量を測定し、各ステージに対応するmiRNA量の範囲を決定する。さらに、被験者から得られた試料に含まれるmiRNA量が前記のように決定された範囲のうち、どの範囲に属するかによって、該被験者の肝線維症の重症度が判定される。また、新犬山分類以外の分類を用いることも可能である。
【0032】
また、肝線維症を罹患する被験者に対しては、治療中又は治療後にmiRNAの発現量を測定することで該治療が有効であったか否かを判定することができる。該治療が有効であった場合には、肝線維症が軽症化するため、測定されるmiRNAの発現量が肝線維症の軽症化に従って減少又は増加するためである。
【0033】
別の本発明は、肝線維症の治療の効果予測方法、肝線維症の治療の効果予測マーカー、並びに肝線維症の治療の効果予測用キットである。本発明では、miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数が用いられる。
【0034】
また、本発明において用いられるmiRNAは、上記のmiRNAと実質的に同一の配列を有するRNAを含む。実質的に同一の配列を有するRNAとは、前記のmiRNAに対して1又は複数の塩基が欠失、置換、又は付加されたmiRNAであり、且つ肝線維症の治療効果予測に用いられ得るRNAである。
【0035】
本発明において用いられるmiRNAの一例として、ヒトが有するmiRNAの塩基配列を配列番号:5〜配列番号:7に示す。配列番号:5はヒトmiR-660の、配列番号:6はヒトmiR-324-5pの、配列番号:7はヒトmiR-532-5pの塩基配列である。
【0036】
肝線維症は、主に肝炎が進行することによって発症する。肝炎は、ウイルス感染により発症するウイルス性肝炎と、ウイルス感染によらない非ウイルス性肝炎とにわけられる。ウイルス性肝炎の原因ウイルスとしては、A型肝炎ウイルス、B型肝炎ウイルス、C型肝炎ウイルス、D型肝炎ウイルス、E型肝炎ウイルス等が挙げられる。
【0037】
インターフェロンを用いた治療は、主にウイルス性肝炎の進行によって発症する肝線維症に対して行われる。しかし、インターフェロンを用いた治療の効果は患者によって個人差があるため、治療を施す前に治療効果を予測することが有効である。本発明の肝線維症の治療の効果予測方法、肝線維症の治療効果予測マーカー、及び肝線維症の治療の効果予測用キットは、ウイルス性肝炎を原因とする肝線維症に用いることができる。なかでも、C型肝炎を原因とする肝線維症に用いることができる。
【0038】
インターフェロンとは、ウイルス等の病原体の侵入に対して宿主から分泌されるタンパク質であり、サイトカインの一種である。インターフェロンとは、大きく、インターフェロンα、インターフェロンβ、インターフェロンγ、インターフェロンω、インターフェロンε、インターフェロンκ、及びインターフェロンλに分類される。
【0039】
肝線維症の治療に用いられ得るインターフェロンとしては、具体的には、インターフェロンα(IFNα)、インターフェロンα2a(IFNα2a)、インターフェロンα2b(IFNα2b)、ペグインターフェロンα2a(PEG-IFNα2a)、ペグインターフェロンα2b(PEG-IFNα2b)、コンセンサスインターフェロンα(C-IFNα)、インターフェロンβ(IFNβ)、インターフェロンβ1a(IFNβ1a)、インターフェロンβ1b(IFNβ1b)、インターフェロンγ(IFN-γ)、インターフェロンγ1a(IFNγ1a)、インターフェロンγn1(IFNγn1)等が挙げられる。
【0040】
また、肝線維症の治療においてインターフェロンと併用して、又は単独で投与され得る薬剤として、リバリビン、グリチルリチン酸、ウルソデオキシコール酸、ヒストンデアセチラーゼ阻害剤等が挙げられる。ヒストンデアセチラーゼ阻害剤としては、トリコスタチンA、酪酸、アピシジン、バルプロ酸等が挙げられる。本発明は、特にインターフェロンを用いた治療の効果を予測するのに有効であるが、インターフェロン以外を用いた治療法であっても、インターフェロンと同様又は類似の作用機序を持った治療法であれば本発明の適用は可能である。
【0041】
本発明における被験者とは、肝障害、特に肝線維症を患う被験者が好ましい。また、被験者は、ヒト及びヒト以外の動物を含む。ヒト以外の動物は特に制限されないが、例えば、イヌ、ネコ、サル、ウシ、ブタ、ヤギ、ヒツジ、ウサギ、マウス、ラット等の哺乳類が挙げられる。
【0042】
本発明では試料に含まれる特定のmiRNAを測定することで、肝線維症の治療の効果を予測することができる。例えば、治療が完治した患者から得られた試料から測定されたmiRNA量と、治療が完治しなかった患者から得られた試料から測定されたmiRNA量とを測定し、作成されるROC曲線からカットオフ値を設定することで、治療効果の有無を予測することができる。
【0043】
本発明の肝線維症の存在及び/又は肝線維症の重症度の判定方法、並びに、本発明の肝線維症の治療の効果予測方法では、被験者から得られた試料における特定のmiRNAの発現量を測定する。具体的には、被験者から得られた試料からRNAを抽出し、該RNAの中に特定のmiRNAがどれだけ含まれているかを測定する。試料からのRNAの抽出は、グアニジン―塩化セシウム法、チオシアン酸グアニジン―フェノール―クロロホルム法等の公知の方法を用いることができる。
【0044】
被験者から得られる試料は、組織又は体液であり得る。組織としては、肝生体検査で得られる肝臓組織であることが好ましい。また、体液としては、血液、リンパ液、細胞間浸潤液、尿、涙、唾液等が挙げられ、なかでも血液が好ましい。本発明で用いられるmiRNAは肝臓組織から血液中に放出されるため、血液を試料として用いることが可能である。
【0045】
本発明において試料に含まれるmiRNAを測定する方法としては、定量的PCR法、ノーザンブロット法、マイクロアレイ法等の公知の方法を用いることができる。
【0046】
定量的PCR法としては、逆転写リアルタイムPCR法を用いることができる。逆転写リアルタイムPCR法では、例えば、測定対象となるmiRNAに相補的な配列を含む逆転写用プライマー及び逆転写酵素を用いてDNAを合成し、さらに蛍光標識プローブを用いたPCR法によってmiRNAが定量的に測定される。また、これらの反応を1ステップで行うこともできる。
【0047】
ノーザンブロット法としては、抽出したRNAを電気泳動によって展開し、これをメンブレンに転写し、測定対象となるmiRNAに相補的な配列を含む標識プローブをハイブリダイズさせることによって定量的に測定される。
【0048】
マイクロアレイ法としては、例えば、測定対象のmiRNAに相補的な配列を含むプローブを基板上に固定化し、抽出したRNAを標識し、該RNAを基板上に固定化したプローブとハイブリダイズすることで定量的に測定される。
【0049】
本発明の肝線維症の存在及び/又は肝線維症重症度の判定用キット、並びに肝線維症の治療の効果予測用キットは、被験者から得られた試料に含まれる特定のmiRNAを測定する測定手段を少なくとも含む。測定手段としては、例えば、測定対象のmiRNAに相補的な配列を含み該配列を増幅し得るPCR用のプライマーや、測定対象のmiRNAに相補的な配列を含んだリアルタイムPCR用の蛍光プローブや、測定対象のmiRNAに相補的な配列を含むノーザンブロット用の標識プローブや、測定対象のmiRNAに相補的な配列を含み基板上に固定化され得るマイクロアレイ用のプローブ等が挙げられる。
【0050】
また、本発明のキットにおいては、上述の測定手段の他に、試料からRNAを抽出するために必要な試薬、定量的逆転写PCR法に必要な試薬、ノーザンブロット法に必要な試薬、マイクロアレイ法に必要な試薬等を含み得る。
【0051】
また、本発明は肝線維症の治療薬の候補物質のスクリーニングに用いることもできる。候補物質が肝線維症を軽減するか否かを、本発明を用いて評価することができる。
【実施例】
【0052】
肝線維症の存在及び/又は肝線維症の重症度の判定について
(1)miRNAの網羅的測定
C型肝炎患者である被験者から15G Tru-cut針を用いた肝生検で得られた肝組織を試料とした。該試料を、RNAlater
(登録商標、Applied
Biosystems社)に速やかに浸透し2時間室温で静置した後、マイナス30℃で保存し、その後mirVana miRNA isolation kit(登録商標、Applied Biosystems社)を用いて、試料に含まれるRNAを抽出した。
【0053】
抽出したRNAのうち、10μgをテンプレートとして3D-Gene Human miRNA Oligo chip v10.1 (東レ株式会社)を用いてmiRNAの発現量を網羅的に測定した。チップは、miRNAのデータベースであるmiRBase Release 11.0から選定したヒト約850種のマイクロRNAを検出するセンス鎖オリゴヌクレオチドがスポットされたものを用いた。
【0054】
被験者は、肝生検から新犬山分類による線維化ステージに従って分類した。F1と診断された被験者は11名、F2と診断された被験者は4名、F3と診断された被験者は5名、F4と診断された被験者は2名であった。F1又はF2と診断された被験者を肝線維化軽症群、F3又はF4と診断された被験者を肝線維化重症群とし、それぞれの群の被験者から得られた試料に含まれるmiRNAの発現量を比較した。
【0055】
miRNAの発現の倍率変化(Fold Change)が、t検定によるp値が0.01未満であったもののうち、肝線維化重症群で発現量が亢進しているものはmiR-222、及びmiR-214、肝線維化重症群で発現が低下しているものはmiR-422aであった。それぞれのmiRNAの倍率変化値を図1に示す。その一方、非特許文献1にて肝線維症に関連して発現が亢進するとの報告のあるmiR-21、miR-27a、miR-27b、及びmiR-30、低下すると報告のあるmiR-9、miR-29b、miR-122、miR-721、及びmiR-301の発現量の変化には有意差が得られなかった。
【0056】
(2)定量RT-PCRによるmiRNAの測定
C型肝炎患者である被験者から肝生検で得られた肝組織を試料とした。該試料からmirVana miRNA isolation kit(登録商標、Applied
Biosystems社)を用いて、試料に含まれるRNAを抽出し、miRNAを含んだRNA画分を分離した。抽出したRNAは濃度を測定した後2ng/μLに希釈し、10ngをテンプレートとして、TaqMan(登録商標) MicroRNA Assay(Applied Biosystems社)により解析を行なった。(1)で用いた試料に、新たに17名の被験者から得られた試料を加えた合計35検体(F1は17例,F2は8例,F3は8例,F4は2例)について定量 RT-PCRを用いてmiRNAを測定した。
【0057】
各ステージにおけるmiRNAの発現量の変化を、F1を1とした相対値で図2に示す。(1)で有意に発現量が亢進していたmiR-222、miR-214、及びmiR-222のサブタイプであるmiR-221は、各ステージにおける発現量が有意に亢進したが(ヨンクヒール・タプストラ検定,p<0.01)、miR-422aの発現量の変化には有意差が得られなかった。
【0058】
また、上記のmiRNAについてF1-F2とF3-F4との間、F1とF2-F4との間で発現量を比較した。miRNAの発現量の変化をF1-F2及びF1を1とした相対値で図3に示す。miR-214、miR-221、及びmiR-222の発現量は肝線維化の進行に伴って有意に亢進したが、miR-422aの発現量の変化には有意差が得られなかった。
【0059】
(3)マウス線維化モデルにおけるmiRNAの測定
マウス(C57BL/6、雄)にメチオニン・コリン欠乏食(MCDD、MP Biomedicals社)、又は、コントロールとしてメチオニン・コリンを含む飼料(MCCD、MP Biomedicals社)を、それぞれ7匹ずつ5週間供与して又は15週間供与して肝臓の線維化を伴う脂肪性肝炎モデルを作製した。また、別の肝線維化動物モデルとして、チオアセトアミド(TAA、Sigma Chemical社)を体重20 gあたり4 mgの濃度で週3回、腹腔内に4週間又は8週間投与した。マウスを屠殺後、試料として肝臓を採取しマイナス80℃で保存した。採取した肝臓からmiRNeasy mini kit(Qiagen社)を用いてmiRNAを含むRNA分画を抽出した。
【0060】
抽出したRNAは濃度測定後、2 ng/μLに希釈し、10 ngをテンプレートとしてTaqMan(登録商標)MicroRNA Assay(Applied Biosystems社)を用いて、試料に含まれるmiR-222を測定した。MCDDによる結果を図4に、TAAによる結果を図5に示す。MCDDを供与したマウスの肝臓におけるmiR-222の発現量は、供与5週目にコントロールに比べて1.6倍、供与15週目にコントロールに比べて2.6倍に有意に増加した(p<0.01)。また、TAAを投与したマウスの肝臓では、miR-222の発現量は、投与8週目にコントロールに比べて1.4倍に有意に増加した(p<0.01)。これらの結果から、試料に含まれるmiR-222を測定することで、肝線維症の存在及び/又は重症度を判定することができることがわかった。
【0061】
(4)マウス星細胞の培養におけるmiRNAの測定
マウス(C57BL/6、雄)の肝臓から星細胞を分離した。マウス肝臓を門脈からSC-1溶液により灌流して脱血した後、0.05重量%プロナーゼ(登録商標、Merck社)を含むSC-2溶液で37℃、5分間、0.025重量%コラゲナーゼ(Roche Diagnostics社)を含むSC-2溶液で37℃、10分間消化を行った。SC-1溶液の組成は、8,000 mg/L NaCl、400 mg/L KCl、88.17 mg/L NaH2PO42H2O、120.45 mg/L Na2HPO4、2,380
mg/L HEPES、350 mg/L NaHCO3、190 mg/L EGTA、900 mg/L glucoseであり、pH 7.3であった。SC-2溶液の組成は、8,000
mg/L NaCl、400 mg/L KCl、88.17
mg/L NaH2PO42H2O、120.45
mg/L Na2HPO4、2,380 mg/L HEPES、350 mg/L NaHCO3、560 mg/L CaCl22H2Oであり、pH 7.3であった。
【0062】
消化された肝臓を取り出した後、ビーカー内で0.05重量%のプロナーゼ(登録商標、Merck社)と0.05重量%のコラゲナーゼ、20μg/mlのDNaseI(Roche Diagnostics社)を含むSC-2溶液で撹拌しながら37℃、30分間消化を行った。ここで得られた消化産物を150μmのメッシュを用いて濾過後、遠心(500xg、8分間、20℃)を2回行い、未消化の細胞群を集めた。
【0063】
さらに、ナイコデンツ(Axis-shield社)4 gを14
ml GBSS/A溶液に溶かしたナイコデンツ溶液と、細胞を浮遊させたGBSS/B溶液とを混合させ全量を50 mlとした。GBSS/A溶液の組成は、370
mg/L KCl、210 mg/L MgCl26H2O、70
mg/L MgSO47H2O、150 mg/L Na2HPO412H2O、30 mg/L KH2PO4、990
mg/L glucose、227 mg/L NaHCO3、225 mg/L CaCl22H2Oであり、pH
7.3であった。GBSS/B溶液の組成は、8,000
mg/L NaCl、370 mg/L KCl、210
mg/L MgCl26H2O、70 mg/L MgSO47H2O、150 mg/L Na2HPO412H2O、30 mg/L KH2PO4、990
mg/L glucose、227 mg/L NaHCO3、225 mg/L CaCl22H2Oであり、pH
7.3であった。
【0064】
ナイコデンツ混合液を15 mlチューブ4本へ分注した後、最上層にGBSS/Bを1 ml上乗せして、1300xg、15分間、4℃で遠心した。溶液の中間層に星細胞を含む分画が得られた。得られた星細胞を遠心洗浄した後、10重量%ウシ胎児血清を含むDulbecco's Modified Eagle Medium
(DMEM、Sigma Chemical社)中に浮遊させた。この浮遊液をプラスチックシャーレに注入し、5容量%CO2存在下、37℃の培養器で培養を開始した。星細胞は数時間でシャーレ上に接着した。星細胞は、培養1日目に細胞内にビタミンA顆粒が観察され、典型的な形態を呈する。培養後の時間経過と伴に形態が変化し肥大化し、星細胞内のビタミンA顆粒は消失する。この現象は、肝臓内における星細胞の活性化が細胞培養系で再現されることを示している。
【0065】
培養1、4、7日目のそれぞれのマウス星細胞からmiRNeasy mini kit(Qiagen社)を用いてmiRNAを含むRNA分画を抽出した。抽出したRNAからReverTraAceキット(東洋紡績株式会社)を用いてcDNAを合成し、コラーゲン1A1、及び活性化星細胞のマーカーとして用いられるα―Smooth Muscle Actin(α―SMA)の発現を定量的PCRにより測定した。
【0066】
また、抽出したRNAは濃度測定後2 ng/μlに希釈し、10 ngをテンプレートとしてTaqMan(登録商標) MicroRNA Assay(Applied Biosystems社)を用いてmiR-221及びmiR-222を測定した。
【0067】
コラーゲン1A1、α―SMA、miR-221及びmiR-222の発現量の変化を図6に示す。コラーゲン1A1の発現量は、培養1日目の発現量に対し、培養4日目には38.3倍、培養7日目には61.3倍に有意に増加した。また、α―SMAの発現は、培養1日目の発現量に対し、培養4日目には6.1倍、培養7日目には6.9倍に有意に増加した。したがって、培養に伴い星細胞が活性化していることが確認された。
【0068】
一方、miR-221の発現は、培養1日目の細胞に対して、培養4日目の細胞では6.1倍、培養7日目の細胞では26.8倍に有意に増加した(p<0.01)。また、miR-222の発現は、培養1日目の細胞に対して、培養4日目の細胞では4.1倍、培養7日目の細胞では13.9倍に有意に増加した(p<0.01)。したがって、これらの結果から、miR-221とmiR-222は、マウス星細胞の活性化に伴って発現が増加するmiRNAであることが明らかとなった。
【0069】
(5)各細胞におけるmiRNAの測定
星細胞、線維芽細胞、肝癌細胞における上記miRNAを測定した。ヒト星細胞LX-2(Gut.
2005;54:142-151.で報告されたヒト星細胞由来不死化された星細胞株)、マウス線維芽細胞NIH3T3(Dr. Ikedaにより提供。)、及びヒト肝癌細胞Huh7(原発性肝癌由来の高分化型肝癌細胞株)は、マウス星細胞と同様に10%ウシ胎児血清を含むDMEMで培養した。ヒト肝癌細胞HepG2 (JHSFより入手したヒト肝癌由来細胞株;JCRB1054)は、10%ウシ胎児血清、1 mM sodium pyruvate(Invitrogen社)、及び1% non-essentail amino acids(Invitrogen社)を含むMEM(Invitrogen社)で培養した。
【0070】
細胞からのRNA抽出は、miRNeasy mini kit(Qiagen、Valencia、CA、USA)を用いて行い、抽出したRNAは濃度測定後、2 ng/μlに希釈し、10 ngをテンプレートとしてTaqMan(登録商標)MicroRNA Assay(Applied Biosystems社)を用いてmiR-221及びmiR-222の発現を測定した。
【0071】
測定結果を図7に示す。ヒト星細胞における発現は、ヒト肝癌細胞HepG2に比べ、miR-221では9.5倍、miR-222では6.0倍と非常に高かった。miR-221及びmiR-222はHuh7やHepG2などの肝癌細胞で発現しているとの報告があるが、それらの細胞に比べヒト星細胞でさらに高発現していることが判明した。したがって、これらmiRNAは肝線維症の存在及び/又は肝線維症の重症度の判定に用いることができることが明らかとなった。
【0072】
肝線維症の治療の効果予測について
(1)miRNAの網羅的測定
C型肝炎患者である被験者から15G Tru-cut針を用いた肝生検で得られた肝組織を試料とした。該試料を、RNAlater
(登録商標、Applied
Biosystems社)に速やかに浸透し2時間室温で静置した後、マイナス30℃で保存し、その後mirVana miRNA isolation kit(登録商標、Applied Biosystems社)を用いて、試料に含まれるRNAを抽出した。
【0073】
抽出したRNAのうち、10μgをテンプレートとして3D-Gene Human miRNA Oligo chip v10.1 (東レ株式会社)を用いてmiRNAの発現量を網羅的に測定した。チップは、miRNAのデータベースであるmiRBase Release 11.0から選定したヒト約850種のマイクロRNAを検出するセンス鎖オリゴヌクレオチドがスポットされたものを用いた。
【0074】
C型肝炎患者である被験者に対し、1.5μg/kgのPEG-IFN-α2b、又は180μgのPEG-IFN-α2aを週1回、600mg〜1,000 mgのリバビリンを連日、48週間投与し、治療終了6ヶ月後に血中のHCV
RNAが陰性であった症例をウイルス学的完治とした。ウイルス学的完治が得られた症例(13例)と得られなかった症例(9例)の間で肝組織におけるmiRNAの発現を解析した結果を図8に示す。発現が有意(p<0.01)に低下したmiRNAは、miR-660、miR-324-5p、及びmiR-532-5pであった。
【産業上の利用可能性】
【0075】
本発明は、肝線維症の存在及び/又は肝線維症の重症度の判定や、肝線維症の治療の効果予測に利用することができる。
【技術分野】
【0001】
本発明は、マイクロRNAを用いた、肝線維症の存在及び/又は肝線維症の重症度の判定方法、判定マーカー、判定用キット、肝線維症の治療の効果予測方法、治療効果予測マーカー、並びに治療効果予測用キットに関する。
【背景技術】
【0002】
肝線維症とは、肝血管の周囲に存在する星細胞(「伊東細胞」とも呼称される。)が活性化して細胞外マトリクスを過剰に分泌することで、肝臓中に線維構造が生じる疾患である。肝線維症が重症化するにつれて肝臓中の線維構造が拡大し、肝機能に障害が生じ、肝硬変に至ることもある。これまで肝線維症の存在及び/又は肝線維症の重症度の判定は、被験者の肝臓の組織の一部を取り出す肝生検と呼ばれる手法で行われてきた。該手法は肝生検で取り出された組織を染色することで線維化の有無を判断するものであり、患者にとっては大きな負担となっていた。
【0003】
そこで、肝線維症の存在や、その重症度を簡易に判定するための研究開発が行われている。例えば、肝線維化の過程で発現が変動する遺伝子の発現量又は該遺伝子にコードされるタンパク質量を測定する肝線維化ステージの判定方法(特許文献1参照)や、肝線維症に罹患した患者の肝臓で特異的に反映する遺伝子からなる疾患マーカー(特許文献2参照)等である。
【0004】
ところで、マイクロRNA(以下、「miRNA」と呼称する場合もある。)とは、細胞内に存在し、タンパクへの翻訳がなされない、長さが20塩基〜30塩基程度の1本鎖RNAである。マイクロRNAは一部のmRNAに相補的な配列を有しており、mRNAとマイクロRNAとが結合することで該mRNAの翻訳の抑制や該mRNAの分解を引き起こすことから、マイクロRNAにより遺伝子の発現が制御されていると考えられる。
【0005】
マイクロRNAは細胞内の多くの遺伝子の発現制御を行っているため、マイクロRNAの発現の変化は疾患の発生や進行等に関連する。そこで、マイクロRNAを用いて疾患を判定や検出をする方法が開発されている。例えば、マイクロRNAを用いて婦人科癌を判定する方法(特許文献3参照)、マイクロRNAの発現量の変動を測定して膀胱癌を検出する方法(特許文献4参照)、マイクロRNAの発現から肝細胞癌のサブタイプを決定する方法(特許文献5参照)等である。
【0006】
一方、肝線維症の発症や進展と関連して発現が変化するマイクロRNAもいくつか知られている。例えば、肝線維症で発現量が増加するマイクロRNAとしてmiR-27a、miR-27b及びmiR-30が、発現量が減少するマイクロRNAとしてmiR-9、miR-721及びmiR-301が知られている(非特許文献1参照)。また、miR-199ファミリー及びmiR-200ファミリーの発現が肝線維化の進展に関係するとの報告もある(非特許文献2参照)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2007―315752号公報
【特許文献2】特開2003−259877号公報
【特許文献3】特開2010−154843号公報
【特許文献4】特開2009−100687号公報
【特許文献5】特開2010−528659号公報
【非特許文献】
【0008】
【非特許文献1】S Bala, et al., “Emerging role of microRNAs in liver diseases”, WorldJ. Gastroenterol., Vol.15, No.45, 2009年12月7日発行, p.5634
【非特許文献2】日本癌学会,「69th Annual Meeting of the Japanese Cancer AssociationProceedings」, 2010年8月23日発行,p.91
【発明の概要】
【発明が解決しようとする課題】
【0009】
特許文献1及び特許文献2に記載の方法では、肝線維化が進んだ肝臓組織で得られた組織で特異的に発現している遺伝子をマーカーとして用いるため、判定には肝組織が必要であり、肝生検を行わなければ判定できないことから、患者負担は非常に大きかった。
【0010】
また、非特許文献1及び非特許文献2において肝線維化に関連するmiRNAが知られていたが、これらのmiRNAの発現は、肝線維症の存在や重症化を正確に反映しておらず、また、肝線維症の治療効果の予測に用いることができるものではなかった。
【0011】
肝線維症に対する治療はインターフェロン等さまざまな薬剤を用いて行われるが、治療の効果は患者によって個人差があり、治療を施す前に治療効果を予測することが必要である。しかし、治療効果を正確に予測する方法は開発されていなかった。
【0012】
このように、肝線維症の存在の判定、肝線維症の重症度の判定、及び肝線維症の治療効果の予測を正確、簡便且つ迅速に行う方法が求められていた。
【課題を解決するための手段】
【0013】
本発明の肝線維症の存在及び/又は肝線維症の重症度の判定方法は、被験者から得られた試料に含まれる、miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する工程を含む、被験者における肝線維症の存在及び/又は肝線維症の重症度の判定方法である。
【0014】
また、本発明の別の肝線維症の存在及び/又は肝線維症の重症度の判定方法は、被験者から得られた試料に含まれるmiR-221及び/又はmiR-222を測定する工程を含む、肝線維症の存在及び/又は肝線維症の重症度の判定方法である。
【0015】
また、本発明の肝線維症の存在及び/又は肝線維症の重症度の判定方法において、試料は、被験者の組織及び/又は体液であり得る。さらに、本発明の肝線維症の存在及び/又は肝線維症の重症度の判定方法において、被験者は、ヒト又は動物であり得る。
【0016】
本発明の肝線維症の存在及び/又は肝線維症の重症度の判定マーカーは、miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を含む。
【0017】
本発明の肝線維症の存在及び/又は肝線維症重症度の判定用キットは、被験者から得られた試料に含まれる、miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する測定手段を少なくとも含む。さらに、本発明の肝線維症の存在及び/又は肝線維症重症度の判定用キットにおいて、被験者はヒト又は動物であり得る。
【0018】
本発明の肝線維症の治療の効果予測方法は、被験者から得られた試料に含まれる、miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する工程を含む、被験者における肝線維症の治療の効果予測方法である。また、本発明において、効果を予測する治療は、インターフェロンを用いた治療であり得る。
【0019】
また、本発明の肝線維症の治療の効果予測方法において、試料は、被験者の組織及び/又は体液であり得る。さらに、本発明の肝線維症の治療の効果予測方法において、被験者は、ヒト又は動物であり得る。
【0020】
また、本発明の肝線維症の治療の効果予測マーカーは、miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を含む。
【0021】
さらに、本発明の肝線維症の治療の効果予測用キットは、被験者から得られた試料に含まれる、miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する測定手段を少なくとも含む。本発明の肝線維症の治療の効果予測用キットにおいて、被験者は、ヒト又は動物であり得る。
【発明の効果】
【0022】
本発明者らが特定したmiRNAは、肝線維症の発症により発現量が亢進又は低下し、肝線維症の重症化を反映してさらに発現量が変化する。したがって、該miRNAを用いた本発明により、被験者における肝線維症の存在及び/又は肝線維症の重症化を正確に判定することができる。
【0023】
また、被験者において発現したmiRNAは、細胞から血液中に分泌されることが知られている。したがって、肝組織だけでなく、採取が容易な血液を試料として用いることができるため、本発明による判定又は予測は、迅速性、簡便性に優れる。
【0024】
また、本発明者らが特定したmiRNAは、肝線維症の治療効果が高い患者と、治療効果が低い患者との間で発現量の差がみられる。したがって、該miRNAを用いた本発明により治療を施す前に治療効果を予測することで、肝患者個人毎に有効な治療法を選択することができる。
【図面の簡単な説明】
【0025】
【図1】肝線維症重症化群において有意に発現が変化したmiRNAと、該miRNAの発現量の倍率変化値とを示す図面である。
【図2】肝線維症の各ステージにおけるmiRNAの発現量の変化を示す図面である。
【図3】肝線維症のステージのうち、F1〜F2とF3〜F4との間、及び、F1とF2〜F4との間でのmiRNAの発現量の変化を示す図面である。
【図4】肝線維症モデルマウスにおけるmiR-222の発現量の変化を示す図面である。
【図5】別の肝線維症モデルマウスにおけるmiR-222の発現量の変化を示す図面である。
【図6】星細胞の活性化と、miR-221及びmiR-222の発現量の変化との関連性を示す図面である。
【図7】各細胞におけるmiR-221及びmiR-222の発現量を示す図面である。
【図8】インターフェロンを用いた治療でウイルス学的完治が得られた群と得られなかった群との間で有意に発現が変化したmiRNAと、該miRNAの発現量の倍率変化値とを示す図面である。
【発明を実施するための形態】
【0026】
本発明は、肝線維症の存在及び/又は肝線維症の重症度の判定方法、肝線維症の存在及び/又は肝線維症の重症度の判定マーカー、及び肝線維症の存在及び/又は肝線維症重症度の判定用キットである。本発明では、miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数が用いられる。
【0027】
また、本発明において用いられるmiRNAは、上記のmiRNAと実質的に同一の塩基配列を有するRNAを含む。実質的に同一の配列を有するRNAとは、前記のmiRNAに対して1又は複数の塩基が欠失、置換、又は付加されたmiRNAであり、且つ肝線維症の存在及び/又は肝線維症の重症度の判定に用いられ得るRNAである。
【0028】
本発明において用いられるmiRNAの一例として、ヒトが有するmiRNAの塩基配列を配列番号:1〜配列番号:4に示す。配列番号:1はヒトmiR-221の、配列番号:2はヒトmiR-222の、配列番号:3はヒトmiR-214の、配列番号:4はヒトmiR-422aの塩基配列である。
【0029】
本発明における被験者とは、肝障害、特に肝線維症の疑いのある被験者が含まれるが健常者であっても構わない。また、被験者とは、ヒト及びヒト以外の動物を含む。ヒト以外の動物は特に制限されないが、例えば、イヌ、ネコ、サル、ウシ、ブタ、ヤギ、ヒツジ、ウサギ、マウス、ラット等の哺乳類が挙げられる。
【0030】
本発明では試料に含まれる特定のmiRNAを測定することで肝線維症の存在を判定することができる。例えば、被験者から得られた試料から測定されたmiRNA量と、健常者から得られた試料から測定されたmiRNA量とを測定し、作成されるROC曲線からカットオフ値を設定することで、肝線維症の存在を判定することができる。
【0031】
また、本発明で測定対象となるmiRNAは、肝線維症が重症化するに従って発現量が亢進又は低下する。したがって、例えば、新犬山分類による線維化ステージ(F0: 線維化なし,F1:門脈域の線維性拡大,F2:線維性架橋形成,F3:小葉のひずみを伴う線維性架橋形成,F4:肝硬変)に基づいて肝線維症の重症度を判定することができる。まず、各線維化ステージに属する患者から得られた試料に含まれるmiRNA量を測定し、各ステージに対応するmiRNA量の範囲を決定する。さらに、被験者から得られた試料に含まれるmiRNA量が前記のように決定された範囲のうち、どの範囲に属するかによって、該被験者の肝線維症の重症度が判定される。また、新犬山分類以外の分類を用いることも可能である。
【0032】
また、肝線維症を罹患する被験者に対しては、治療中又は治療後にmiRNAの発現量を測定することで該治療が有効であったか否かを判定することができる。該治療が有効であった場合には、肝線維症が軽症化するため、測定されるmiRNAの発現量が肝線維症の軽症化に従って減少又は増加するためである。
【0033】
別の本発明は、肝線維症の治療の効果予測方法、肝線維症の治療の効果予測マーカー、並びに肝線維症の治療の効果予測用キットである。本発明では、miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数が用いられる。
【0034】
また、本発明において用いられるmiRNAは、上記のmiRNAと実質的に同一の配列を有するRNAを含む。実質的に同一の配列を有するRNAとは、前記のmiRNAに対して1又は複数の塩基が欠失、置換、又は付加されたmiRNAであり、且つ肝線維症の治療効果予測に用いられ得るRNAである。
【0035】
本発明において用いられるmiRNAの一例として、ヒトが有するmiRNAの塩基配列を配列番号:5〜配列番号:7に示す。配列番号:5はヒトmiR-660の、配列番号:6はヒトmiR-324-5pの、配列番号:7はヒトmiR-532-5pの塩基配列である。
【0036】
肝線維症は、主に肝炎が進行することによって発症する。肝炎は、ウイルス感染により発症するウイルス性肝炎と、ウイルス感染によらない非ウイルス性肝炎とにわけられる。ウイルス性肝炎の原因ウイルスとしては、A型肝炎ウイルス、B型肝炎ウイルス、C型肝炎ウイルス、D型肝炎ウイルス、E型肝炎ウイルス等が挙げられる。
【0037】
インターフェロンを用いた治療は、主にウイルス性肝炎の進行によって発症する肝線維症に対して行われる。しかし、インターフェロンを用いた治療の効果は患者によって個人差があるため、治療を施す前に治療効果を予測することが有効である。本発明の肝線維症の治療の効果予測方法、肝線維症の治療効果予測マーカー、及び肝線維症の治療の効果予測用キットは、ウイルス性肝炎を原因とする肝線維症に用いることができる。なかでも、C型肝炎を原因とする肝線維症に用いることができる。
【0038】
インターフェロンとは、ウイルス等の病原体の侵入に対して宿主から分泌されるタンパク質であり、サイトカインの一種である。インターフェロンとは、大きく、インターフェロンα、インターフェロンβ、インターフェロンγ、インターフェロンω、インターフェロンε、インターフェロンκ、及びインターフェロンλに分類される。
【0039】
肝線維症の治療に用いられ得るインターフェロンとしては、具体的には、インターフェロンα(IFNα)、インターフェロンα2a(IFNα2a)、インターフェロンα2b(IFNα2b)、ペグインターフェロンα2a(PEG-IFNα2a)、ペグインターフェロンα2b(PEG-IFNα2b)、コンセンサスインターフェロンα(C-IFNα)、インターフェロンβ(IFNβ)、インターフェロンβ1a(IFNβ1a)、インターフェロンβ1b(IFNβ1b)、インターフェロンγ(IFN-γ)、インターフェロンγ1a(IFNγ1a)、インターフェロンγn1(IFNγn1)等が挙げられる。
【0040】
また、肝線維症の治療においてインターフェロンと併用して、又は単独で投与され得る薬剤として、リバリビン、グリチルリチン酸、ウルソデオキシコール酸、ヒストンデアセチラーゼ阻害剤等が挙げられる。ヒストンデアセチラーゼ阻害剤としては、トリコスタチンA、酪酸、アピシジン、バルプロ酸等が挙げられる。本発明は、特にインターフェロンを用いた治療の効果を予測するのに有効であるが、インターフェロン以外を用いた治療法であっても、インターフェロンと同様又は類似の作用機序を持った治療法であれば本発明の適用は可能である。
【0041】
本発明における被験者とは、肝障害、特に肝線維症を患う被験者が好ましい。また、被験者は、ヒト及びヒト以外の動物を含む。ヒト以外の動物は特に制限されないが、例えば、イヌ、ネコ、サル、ウシ、ブタ、ヤギ、ヒツジ、ウサギ、マウス、ラット等の哺乳類が挙げられる。
【0042】
本発明では試料に含まれる特定のmiRNAを測定することで、肝線維症の治療の効果を予測することができる。例えば、治療が完治した患者から得られた試料から測定されたmiRNA量と、治療が完治しなかった患者から得られた試料から測定されたmiRNA量とを測定し、作成されるROC曲線からカットオフ値を設定することで、治療効果の有無を予測することができる。
【0043】
本発明の肝線維症の存在及び/又は肝線維症の重症度の判定方法、並びに、本発明の肝線維症の治療の効果予測方法では、被験者から得られた試料における特定のmiRNAの発現量を測定する。具体的には、被験者から得られた試料からRNAを抽出し、該RNAの中に特定のmiRNAがどれだけ含まれているかを測定する。試料からのRNAの抽出は、グアニジン―塩化セシウム法、チオシアン酸グアニジン―フェノール―クロロホルム法等の公知の方法を用いることができる。
【0044】
被験者から得られる試料は、組織又は体液であり得る。組織としては、肝生体検査で得られる肝臓組織であることが好ましい。また、体液としては、血液、リンパ液、細胞間浸潤液、尿、涙、唾液等が挙げられ、なかでも血液が好ましい。本発明で用いられるmiRNAは肝臓組織から血液中に放出されるため、血液を試料として用いることが可能である。
【0045】
本発明において試料に含まれるmiRNAを測定する方法としては、定量的PCR法、ノーザンブロット法、マイクロアレイ法等の公知の方法を用いることができる。
【0046】
定量的PCR法としては、逆転写リアルタイムPCR法を用いることができる。逆転写リアルタイムPCR法では、例えば、測定対象となるmiRNAに相補的な配列を含む逆転写用プライマー及び逆転写酵素を用いてDNAを合成し、さらに蛍光標識プローブを用いたPCR法によってmiRNAが定量的に測定される。また、これらの反応を1ステップで行うこともできる。
【0047】
ノーザンブロット法としては、抽出したRNAを電気泳動によって展開し、これをメンブレンに転写し、測定対象となるmiRNAに相補的な配列を含む標識プローブをハイブリダイズさせることによって定量的に測定される。
【0048】
マイクロアレイ法としては、例えば、測定対象のmiRNAに相補的な配列を含むプローブを基板上に固定化し、抽出したRNAを標識し、該RNAを基板上に固定化したプローブとハイブリダイズすることで定量的に測定される。
【0049】
本発明の肝線維症の存在及び/又は肝線維症重症度の判定用キット、並びに肝線維症の治療の効果予測用キットは、被験者から得られた試料に含まれる特定のmiRNAを測定する測定手段を少なくとも含む。測定手段としては、例えば、測定対象のmiRNAに相補的な配列を含み該配列を増幅し得るPCR用のプライマーや、測定対象のmiRNAに相補的な配列を含んだリアルタイムPCR用の蛍光プローブや、測定対象のmiRNAに相補的な配列を含むノーザンブロット用の標識プローブや、測定対象のmiRNAに相補的な配列を含み基板上に固定化され得るマイクロアレイ用のプローブ等が挙げられる。
【0050】
また、本発明のキットにおいては、上述の測定手段の他に、試料からRNAを抽出するために必要な試薬、定量的逆転写PCR法に必要な試薬、ノーザンブロット法に必要な試薬、マイクロアレイ法に必要な試薬等を含み得る。
【0051】
また、本発明は肝線維症の治療薬の候補物質のスクリーニングに用いることもできる。候補物質が肝線維症を軽減するか否かを、本発明を用いて評価することができる。
【実施例】
【0052】
肝線維症の存在及び/又は肝線維症の重症度の判定について
(1)miRNAの網羅的測定
C型肝炎患者である被験者から15G Tru-cut針を用いた肝生検で得られた肝組織を試料とした。該試料を、RNAlater
(登録商標、Applied
Biosystems社)に速やかに浸透し2時間室温で静置した後、マイナス30℃で保存し、その後mirVana miRNA isolation kit(登録商標、Applied Biosystems社)を用いて、試料に含まれるRNAを抽出した。
【0053】
抽出したRNAのうち、10μgをテンプレートとして3D-Gene Human miRNA Oligo chip v10.1 (東レ株式会社)を用いてmiRNAの発現量を網羅的に測定した。チップは、miRNAのデータベースであるmiRBase Release 11.0から選定したヒト約850種のマイクロRNAを検出するセンス鎖オリゴヌクレオチドがスポットされたものを用いた。
【0054】
被験者は、肝生検から新犬山分類による線維化ステージに従って分類した。F1と診断された被験者は11名、F2と診断された被験者は4名、F3と診断された被験者は5名、F4と診断された被験者は2名であった。F1又はF2と診断された被験者を肝線維化軽症群、F3又はF4と診断された被験者を肝線維化重症群とし、それぞれの群の被験者から得られた試料に含まれるmiRNAの発現量を比較した。
【0055】
miRNAの発現の倍率変化(Fold Change)が、t検定によるp値が0.01未満であったもののうち、肝線維化重症群で発現量が亢進しているものはmiR-222、及びmiR-214、肝線維化重症群で発現が低下しているものはmiR-422aであった。それぞれのmiRNAの倍率変化値を図1に示す。その一方、非特許文献1にて肝線維症に関連して発現が亢進するとの報告のあるmiR-21、miR-27a、miR-27b、及びmiR-30、低下すると報告のあるmiR-9、miR-29b、miR-122、miR-721、及びmiR-301の発現量の変化には有意差が得られなかった。
【0056】
(2)定量RT-PCRによるmiRNAの測定
C型肝炎患者である被験者から肝生検で得られた肝組織を試料とした。該試料からmirVana miRNA isolation kit(登録商標、Applied
Biosystems社)を用いて、試料に含まれるRNAを抽出し、miRNAを含んだRNA画分を分離した。抽出したRNAは濃度を測定した後2ng/μLに希釈し、10ngをテンプレートとして、TaqMan(登録商標) MicroRNA Assay(Applied Biosystems社)により解析を行なった。(1)で用いた試料に、新たに17名の被験者から得られた試料を加えた合計35検体(F1は17例,F2は8例,F3は8例,F4は2例)について定量 RT-PCRを用いてmiRNAを測定した。
【0057】
各ステージにおけるmiRNAの発現量の変化を、F1を1とした相対値で図2に示す。(1)で有意に発現量が亢進していたmiR-222、miR-214、及びmiR-222のサブタイプであるmiR-221は、各ステージにおける発現量が有意に亢進したが(ヨンクヒール・タプストラ検定,p<0.01)、miR-422aの発現量の変化には有意差が得られなかった。
【0058】
また、上記のmiRNAについてF1-F2とF3-F4との間、F1とF2-F4との間で発現量を比較した。miRNAの発現量の変化をF1-F2及びF1を1とした相対値で図3に示す。miR-214、miR-221、及びmiR-222の発現量は肝線維化の進行に伴って有意に亢進したが、miR-422aの発現量の変化には有意差が得られなかった。
【0059】
(3)マウス線維化モデルにおけるmiRNAの測定
マウス(C57BL/6、雄)にメチオニン・コリン欠乏食(MCDD、MP Biomedicals社)、又は、コントロールとしてメチオニン・コリンを含む飼料(MCCD、MP Biomedicals社)を、それぞれ7匹ずつ5週間供与して又は15週間供与して肝臓の線維化を伴う脂肪性肝炎モデルを作製した。また、別の肝線維化動物モデルとして、チオアセトアミド(TAA、Sigma Chemical社)を体重20 gあたり4 mgの濃度で週3回、腹腔内に4週間又は8週間投与した。マウスを屠殺後、試料として肝臓を採取しマイナス80℃で保存した。採取した肝臓からmiRNeasy mini kit(Qiagen社)を用いてmiRNAを含むRNA分画を抽出した。
【0060】
抽出したRNAは濃度測定後、2 ng/μLに希釈し、10 ngをテンプレートとしてTaqMan(登録商標)MicroRNA Assay(Applied Biosystems社)を用いて、試料に含まれるmiR-222を測定した。MCDDによる結果を図4に、TAAによる結果を図5に示す。MCDDを供与したマウスの肝臓におけるmiR-222の発現量は、供与5週目にコントロールに比べて1.6倍、供与15週目にコントロールに比べて2.6倍に有意に増加した(p<0.01)。また、TAAを投与したマウスの肝臓では、miR-222の発現量は、投与8週目にコントロールに比べて1.4倍に有意に増加した(p<0.01)。これらの結果から、試料に含まれるmiR-222を測定することで、肝線維症の存在及び/又は重症度を判定することができることがわかった。
【0061】
(4)マウス星細胞の培養におけるmiRNAの測定
マウス(C57BL/6、雄)の肝臓から星細胞を分離した。マウス肝臓を門脈からSC-1溶液により灌流して脱血した後、0.05重量%プロナーゼ(登録商標、Merck社)を含むSC-2溶液で37℃、5分間、0.025重量%コラゲナーゼ(Roche Diagnostics社)を含むSC-2溶液で37℃、10分間消化を行った。SC-1溶液の組成は、8,000 mg/L NaCl、400 mg/L KCl、88.17 mg/L NaH2PO42H2O、120.45 mg/L Na2HPO4、2,380
mg/L HEPES、350 mg/L NaHCO3、190 mg/L EGTA、900 mg/L glucoseであり、pH 7.3であった。SC-2溶液の組成は、8,000
mg/L NaCl、400 mg/L KCl、88.17
mg/L NaH2PO42H2O、120.45
mg/L Na2HPO4、2,380 mg/L HEPES、350 mg/L NaHCO3、560 mg/L CaCl22H2Oであり、pH 7.3であった。
【0062】
消化された肝臓を取り出した後、ビーカー内で0.05重量%のプロナーゼ(登録商標、Merck社)と0.05重量%のコラゲナーゼ、20μg/mlのDNaseI(Roche Diagnostics社)を含むSC-2溶液で撹拌しながら37℃、30分間消化を行った。ここで得られた消化産物を150μmのメッシュを用いて濾過後、遠心(500xg、8分間、20℃)を2回行い、未消化の細胞群を集めた。
【0063】
さらに、ナイコデンツ(Axis-shield社)4 gを14
ml GBSS/A溶液に溶かしたナイコデンツ溶液と、細胞を浮遊させたGBSS/B溶液とを混合させ全量を50 mlとした。GBSS/A溶液の組成は、370
mg/L KCl、210 mg/L MgCl26H2O、70
mg/L MgSO47H2O、150 mg/L Na2HPO412H2O、30 mg/L KH2PO4、990
mg/L glucose、227 mg/L NaHCO3、225 mg/L CaCl22H2Oであり、pH
7.3であった。GBSS/B溶液の組成は、8,000
mg/L NaCl、370 mg/L KCl、210
mg/L MgCl26H2O、70 mg/L MgSO47H2O、150 mg/L Na2HPO412H2O、30 mg/L KH2PO4、990
mg/L glucose、227 mg/L NaHCO3、225 mg/L CaCl22H2Oであり、pH
7.3であった。
【0064】
ナイコデンツ混合液を15 mlチューブ4本へ分注した後、最上層にGBSS/Bを1 ml上乗せして、1300xg、15分間、4℃で遠心した。溶液の中間層に星細胞を含む分画が得られた。得られた星細胞を遠心洗浄した後、10重量%ウシ胎児血清を含むDulbecco's Modified Eagle Medium
(DMEM、Sigma Chemical社)中に浮遊させた。この浮遊液をプラスチックシャーレに注入し、5容量%CO2存在下、37℃の培養器で培養を開始した。星細胞は数時間でシャーレ上に接着した。星細胞は、培養1日目に細胞内にビタミンA顆粒が観察され、典型的な形態を呈する。培養後の時間経過と伴に形態が変化し肥大化し、星細胞内のビタミンA顆粒は消失する。この現象は、肝臓内における星細胞の活性化が細胞培養系で再現されることを示している。
【0065】
培養1、4、7日目のそれぞれのマウス星細胞からmiRNeasy mini kit(Qiagen社)を用いてmiRNAを含むRNA分画を抽出した。抽出したRNAからReverTraAceキット(東洋紡績株式会社)を用いてcDNAを合成し、コラーゲン1A1、及び活性化星細胞のマーカーとして用いられるα―Smooth Muscle Actin(α―SMA)の発現を定量的PCRにより測定した。
【0066】
また、抽出したRNAは濃度測定後2 ng/μlに希釈し、10 ngをテンプレートとしてTaqMan(登録商標) MicroRNA Assay(Applied Biosystems社)を用いてmiR-221及びmiR-222を測定した。
【0067】
コラーゲン1A1、α―SMA、miR-221及びmiR-222の発現量の変化を図6に示す。コラーゲン1A1の発現量は、培養1日目の発現量に対し、培養4日目には38.3倍、培養7日目には61.3倍に有意に増加した。また、α―SMAの発現は、培養1日目の発現量に対し、培養4日目には6.1倍、培養7日目には6.9倍に有意に増加した。したがって、培養に伴い星細胞が活性化していることが確認された。
【0068】
一方、miR-221の発現は、培養1日目の細胞に対して、培養4日目の細胞では6.1倍、培養7日目の細胞では26.8倍に有意に増加した(p<0.01)。また、miR-222の発現は、培養1日目の細胞に対して、培養4日目の細胞では4.1倍、培養7日目の細胞では13.9倍に有意に増加した(p<0.01)。したがって、これらの結果から、miR-221とmiR-222は、マウス星細胞の活性化に伴って発現が増加するmiRNAであることが明らかとなった。
【0069】
(5)各細胞におけるmiRNAの測定
星細胞、線維芽細胞、肝癌細胞における上記miRNAを測定した。ヒト星細胞LX-2(Gut.
2005;54:142-151.で報告されたヒト星細胞由来不死化された星細胞株)、マウス線維芽細胞NIH3T3(Dr. Ikedaにより提供。)、及びヒト肝癌細胞Huh7(原発性肝癌由来の高分化型肝癌細胞株)は、マウス星細胞と同様に10%ウシ胎児血清を含むDMEMで培養した。ヒト肝癌細胞HepG2 (JHSFより入手したヒト肝癌由来細胞株;JCRB1054)は、10%ウシ胎児血清、1 mM sodium pyruvate(Invitrogen社)、及び1% non-essentail amino acids(Invitrogen社)を含むMEM(Invitrogen社)で培養した。
【0070】
細胞からのRNA抽出は、miRNeasy mini kit(Qiagen、Valencia、CA、USA)を用いて行い、抽出したRNAは濃度測定後、2 ng/μlに希釈し、10 ngをテンプレートとしてTaqMan(登録商標)MicroRNA Assay(Applied Biosystems社)を用いてmiR-221及びmiR-222の発現を測定した。
【0071】
測定結果を図7に示す。ヒト星細胞における発現は、ヒト肝癌細胞HepG2に比べ、miR-221では9.5倍、miR-222では6.0倍と非常に高かった。miR-221及びmiR-222はHuh7やHepG2などの肝癌細胞で発現しているとの報告があるが、それらの細胞に比べヒト星細胞でさらに高発現していることが判明した。したがって、これらmiRNAは肝線維症の存在及び/又は肝線維症の重症度の判定に用いることができることが明らかとなった。
【0072】
肝線維症の治療の効果予測について
(1)miRNAの網羅的測定
C型肝炎患者である被験者から15G Tru-cut針を用いた肝生検で得られた肝組織を試料とした。該試料を、RNAlater
(登録商標、Applied
Biosystems社)に速やかに浸透し2時間室温で静置した後、マイナス30℃で保存し、その後mirVana miRNA isolation kit(登録商標、Applied Biosystems社)を用いて、試料に含まれるRNAを抽出した。
【0073】
抽出したRNAのうち、10μgをテンプレートとして3D-Gene Human miRNA Oligo chip v10.1 (東レ株式会社)を用いてmiRNAの発現量を網羅的に測定した。チップは、miRNAのデータベースであるmiRBase Release 11.0から選定したヒト約850種のマイクロRNAを検出するセンス鎖オリゴヌクレオチドがスポットされたものを用いた。
【0074】
C型肝炎患者である被験者に対し、1.5μg/kgのPEG-IFN-α2b、又は180μgのPEG-IFN-α2aを週1回、600mg〜1,000 mgのリバビリンを連日、48週間投与し、治療終了6ヶ月後に血中のHCV
RNAが陰性であった症例をウイルス学的完治とした。ウイルス学的完治が得られた症例(13例)と得られなかった症例(9例)の間で肝組織におけるmiRNAの発現を解析した結果を図8に示す。発現が有意(p<0.01)に低下したmiRNAは、miR-660、miR-324-5p、及びmiR-532-5pであった。
【産業上の利用可能性】
【0075】
本発明は、肝線維症の存在及び/又は肝線維症の重症度の判定や、肝線維症の治療の効果予測に利用することができる。
【特許請求の範囲】
【請求項1】
被験者から得られた試料に含まれる、miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する工程を含む、
前記被験者における肝線維症の存在及び/又は肝線維症の重症度の判定方法
【請求項2】
前記工程が、被験者から得られた試料に含まれるmiR-221及び/又はmiR-222を測定する工程である、
請求項1に記載の肝線維症の存在及び/又は肝線維症の重症度の判定方法
【請求項3】
前記試料が前記被験者の組織及び/又は体液である、
請求項1又は2に記載の肝線維症の存在及び/又は肝線維症の重症度の判定方法
【請求項4】
前記被験者がヒト又は動物である、
請求項1〜3いずれか一項に記載の肝線維症の存在及び/又は肝線維症の重症度の判定方法
【請求項5】
miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を含む、
肝線維症の存在及び/又は肝線維症の重症度の判定マーカー
【請求項6】
被験者から得られた試料に含まれる、miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する測定手段を少なくとも含む、
肝線維症の存在及び/又は肝線維症重症度の判定用キット
【請求項7】
前記被験者がヒト又は動物である、
請求項6に記載の肝線維症の存在及び/又は肝線維症重症度の判定用キット
【請求項8】
被験者から得られた試料に含まれる、miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する工程を含む、
前記被験者における肝線維症の治療の効果予測方法
【請求項9】
前記治療がインターフェロンを用いた治療である、
請求項8に記載の肝線維症の治療の効果予測方法
【請求項10】
前記試料が前記被験者の組織及び/又は体液である、
請求項8又は9に記載の肝線維症の治療の効果予測方法
【請求項11】
前記被験者がヒト又は動物である
請求項8〜10いずれか一項に記載の肝線維症の治療の効果予測方法
【請求項12】
miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を含む、
肝線維症の治療の効果予測マーカー
【請求項13】
被験者から得られた試料に含まれる、miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する測定手段を少なくとも含む、
肝線維症の治療の効果予測用キット
【請求項14】
前記被験者がヒト又は動物である、
請求項13に記載の肝線維症の治療の効果予測用キット
【請求項1】
被験者から得られた試料に含まれる、miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する工程を含む、
前記被験者における肝線維症の存在及び/又は肝線維症の重症度の判定方法
【請求項2】
前記工程が、被験者から得られた試料に含まれるmiR-221及び/又はmiR-222を測定する工程である、
請求項1に記載の肝線維症の存在及び/又は肝線維症の重症度の判定方法
【請求項3】
前記試料が前記被験者の組織及び/又は体液である、
請求項1又は2に記載の肝線維症の存在及び/又は肝線維症の重症度の判定方法
【請求項4】
前記被験者がヒト又は動物である、
請求項1〜3いずれか一項に記載の肝線維症の存在及び/又は肝線維症の重症度の判定方法
【請求項5】
miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を含む、
肝線維症の存在及び/又は肝線維症の重症度の判定マーカー
【請求項6】
被験者から得られた試料に含まれる、miR-221、miR-222、miR-214、miR-422a、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する測定手段を少なくとも含む、
肝線維症の存在及び/又は肝線維症重症度の判定用キット
【請求項7】
前記被験者がヒト又は動物である、
請求項6に記載の肝線維症の存在及び/又は肝線維症重症度の判定用キット
【請求項8】
被験者から得られた試料に含まれる、miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する工程を含む、
前記被験者における肝線維症の治療の効果予測方法
【請求項9】
前記治療がインターフェロンを用いた治療である、
請求項8に記載の肝線維症の治療の効果予測方法
【請求項10】
前記試料が前記被験者の組織及び/又は体液である、
請求項8又は9に記載の肝線維症の治療の効果予測方法
【請求項11】
前記被験者がヒト又は動物である
請求項8〜10いずれか一項に記載の肝線維症の治療の効果予測方法
【請求項12】
miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を含む、
肝線維症の治療の効果予測マーカー
【請求項13】
被験者から得られた試料に含まれる、miR-660、miR-324-5p、miR-532-5p、及びこれらマイクロRNAと同一のファミリーに属するマイクロRNAからなる群から選ばれる1又は複数を測定する測定手段を少なくとも含む、
肝線維症の治療の効果予測用キット
【請求項14】
前記被験者がヒト又は動物である、
請求項13に記載の肝線維症の治療の効果予測用キット
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−125215(P2012−125215A)
【公開日】平成24年7月5日(2012.7.5)
【国際特許分類】
【出願番号】特願2010−281254(P2010−281254)
【出願日】平成22年12月17日(2010.12.17)
【出願人】(506122327)公立大学法人大阪市立大学 (122)
【Fターム(参考)】
【公開日】平成24年7月5日(2012.7.5)
【国際特許分類】
【出願日】平成22年12月17日(2010.12.17)
【出願人】(506122327)公立大学法人大阪市立大学 (122)
【Fターム(参考)】
[ Back to top ]

