肺癌診断用ポリペプチド、肺癌の検出方法、および治療効果の評価方法
【課題】肺癌の血清および血漿にて測定できる腫瘍マーカーとしては、CEAおよびCYFRAのほかにも、SCC、SLX、NSEおよびProGRPが臨床にて使用されている。しかしながら、NSEおよびProGRPは、小細胞肺癌特異的なものであって、非小細胞癌を検出することはできない。また、CEA、CYFRA、SCCおよびSLXにおいては、非小細胞肺癌を検出するための感度および特異度はいずれも低く、また、初期ステージの肺癌を検出することができず、早期の肺癌診断のための使用には適していない。そのため、非小細胞肺癌診断に適用できる新規バイオマーカー、とりわけ早期の肺癌診断にも使用できる肺癌診断用の新規バイオマーカーを提供する。
【解決手段】特定のアミノ酸配列を有する肺癌診断用のポリペプチドを、質量分析法により検出または測定する
。
【解決手段】特定のアミノ酸配列を有する肺癌診断用のポリペプチドを、質量分析法により検出または測定する
。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、肺癌診断用ポリペプチドならびに肺癌診断用ポリペプチドを用いた肺癌の検出方法および治療効果の評価方法に関する。
【背景技術】
【0002】
肺癌は、日本および欧米で最も死亡者数の多い癌であり、難治性である。肺癌は、小細胞肺癌および非小細胞肺癌に分けることができ、肺癌患者全体の15%が小細胞肺癌であり、残りの85%が非小細胞肺癌である。さらに、非小細胞癌は、病理組織学的に、腺癌、扁平上皮癌および大細胞癌の3つのタイプに分けることができる。
【0003】
喫煙は依然として癌の主要な危険因子である。しかしながら、近年、非喫煙者における肺癌(主に腺癌)が増加してきている。肺癌患者における5年後の生存率はわずか15%程度である。これは、初期の段階で肺癌を検出できる方法がないことに大きく起因する。肺癌患者のうち初期ステージの疾患と診断されるケースはわずか16%である。胸部X線、喀痰細胞診、およびヘリカルCTなどは肺癌検出のスクリーニングツールとして用いられてきているが、肺癌の死亡率の改善に関しては、ほとんど効果をもたらしていない。
【0004】
一方、疾患の早期発見を達成し、臨床管理を向上させるために、肺癌用血清バイオマーカーが開発されてきている(非特許文献1参照)。それにもかかわらず、その臨床有用性は限られている(非特許文献2および3参照)。CEA(carcinoembryonic antigen)およびCYFRA(cytokeratin 19 fragment)は、一部の非小細胞癌患者の血清において存在量が増加している。そのため、これらは、疾患の状態をモニターしたり、治療に対する反応を評価したりと、臨床上有効である。しかしながらこれらは、臨床診断での使用には適していない(非特許文献4参照)。なぜならば、これらは、喫煙や肺炎などの他の疾患および他の種類の癌にも関連していることが知られており、さらには、初期ステージの肺癌を検出することができないからである。
【0005】
近年、プロテオミクス技術を用いて臨床検体におけるタンパク質の発現パターンをモニタリングすることによって、癌の診断に用いられる可能性のある新規バイオマーカーの発見を可能なものとしている。癌の病原の分子基板および癌関連タンパク質の特性の理解をより深めるために、2D−DIGE、SELDI−TOF−MS、タンパク質アレイ、ICAT、iTRAQおよびMudPITなどの種々のプロテオミクスツールが、種々の生体試料の差分解析に用いられてきている(非特許文献5参照)。生体試料としては、細胞可溶化物、血清および血漿などが含まれている。
【0006】
複雑な生体試料の中から微量成分を推定バイオマーカーとして同定するために、焦点を合わせたプロテオミクス技術および目標を定めたプロテオミクス技術が注目を集めてきている。例えば、IMAC(非特許文献6参照)などのリンタンパクプロテオミクス技術、細胞表面捕捉(CSC)技術(非特許文献7および8参照)、およびグリカン構造特異的定量技術であるIGEL(非特許文献9参照)などが挙げられる。これらの技術によれば、とりわけ、血液プロテオーム試料における高感度および高スループットなプロファイリングを妨げている技術的制限を回避できる。この技術的制限の原因としては、血液プロテオーム試料自体が非常に複雑であること、タンパク質のダイナミックレンジが非常に大きいことが挙げられる。同様に、自然発生したペプチドを取り扱うプロテオミクスの一分野は、ペプチドミクスと呼ばれている。タンパク質のプロセシングまたは分解によって生じたペプチドを直接解析することは、体液中のバイオマーカーペプチドの検出に有用であると考えられている(非特許文献10参照)。また、ペプチドミクスの一環として、新規バイオマーカーを質量分析技術を利用して取得する方法もまた提案されている(非特許文献11参照)。
【0007】
これまで500種以上のプロテアーゼ/ペプチダーゼが、ヒト細胞で発現していることが知られている(非特許文献12および13参照)。これらは、細胞間領域、細胞外マトリクスおよび血液を含めた生体のあらゆる場所で働いており、他のタンパク質の機能の活性化、細胞タンパク質の分解、さらには癌の進行または抑制に関わっている(非特許文献14〜16参照)。事実、多くのマトリクスメタロプロテアーゼが種々の癌細胞で過剰発現しており、これにより、癌細胞または転移促進に都合のよい微環境の構築を助長している(非特許文献16参照)。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Gail M. H., Muenz L., McIntire K. R., Radovich B., Braunstein G., Brown P. R., Deftos L., Dnistrian A., Dunsmore M., Elashoff R., and et al., J. Natl. Cancer Inst. 1988, 80, 97-101.
【非特許文献2】McCarthy N. J., and Swain S. M., Cancer J. 2001, 7, 175-177.
【非特許文献3】Brundage M. D., Davies D. and Mackillop W. J., Chest. 2002, 122, 1037-1057.
【非特許文献4】Sung H. J. and Cho J. Y., BMB Rep. 2008, 41, 615-625.
【非特許文献5】Maurya P., Meleady P., Dowling P. and Clynes M., Anticancer Res. 2007, 27, 1247-1255.
【非特許文献6】Gamez-Pozo A., Sanchez-Navarro I., Nistal M., Calvo E., Madero R., Diaz E., Camafeita E., de Castro J., Lopez J. A., Gonzalez-Baron M., Espinosa E. and Fresno Vara J. A., PloS One 2009, 4, e7731.
【非特許文献7】Wollscheid B., Bausch-Fluck D., Henderson C., O'Brien R., Bibel M., Schiese R., Aebersold R. and Watts J. D., Nat. Biotechnol. 2009, 27, 378-386.
【非特許文献8】Schiese R., Wollscheid B. and Aebersold R., Mol. Oncol. 2009, 3, 33-44.
【非特許文献9】Ueda K., Takami S., Saichi N., Daigo Y., Ishikawa N., Kohno N., Katsumata M., Yamane A., Ota M., Sato T. A., Nakamura Y. and Nakagawa H., Mol. Cell Proteomics 2010.
【非特許文献10】Villanueva J., Nazarian A., Lawlor K. and Tempst P., Nat. Protoc. 2009, 4, 1167-1183.
【非特許文献11】Ueda K., Sato T., Daigo Y., Ishikawa N., Kohno N., Nakamura Y., and Nakagawa H., AACR-JCA 8th Joint Conference: Cancer Genomics, Epigenomics, and the Development of Novel Therapeutics, 2010.
【非特許文献12】Lopez-Otin C. and Bond J. S., J. Biol. Chem. 2008, 283, 30433-30437.
【非特許文献13】Overall C. M. and Blobel C. P., Nat. Rev. Mol. Cell Biol. 2007, 8, 245-257.
【非特許文献14】Palermo C. and Joyce J. A., Trends Pharmacol. Sci. 2008, 29, 22-28.
【非特許文献15】Lopez-Otin C. and Matrisian L. M., Nat. Rev. Cancer 2007, 7, 800-808.
【非特許文献16】Egeblad M. and Werb Z., Nat. Rev. Cancer 2002, 2, 161-174.
【発明の概要】
【発明が解決しようとする課題】
【0009】
肺癌の血清および血漿にて測定できる腫瘍マーカーとしては、上記したCEAおよびCYFRAのほかにも、SCC、SLX、NSEおよびProGRPが臨床にて使用されている。しかしながら、NSEおよびProGRPは、小細胞肺癌特異的なものであって、非小細胞癌を検出することはできない。また、CEA、CYFRA、SCCおよびSLXにおいては、非小細胞肺癌を検出するための感度および特異度はいずれも低く、また、初期ステージの肺癌を検出することができず、早期の肺癌診断のための使用には適していない。
【0010】
そのため、非小細胞肺癌診断に適用できる新規バイオマーカー、とりわけ早期の肺癌診断にも使用できるバイオマーカーの開発が強く望まれている。
【0011】
そこで、本発明は上記の問題点に鑑みてなされたものであり、その目的は、肺癌診断用の新規バイオマーカーを提供することにある。
【課題を解決するための手段】
【0012】
上述したプロテアーゼおよびペプチダーゼ活性によって、癌の進行または癌に関連した応答を非常によく反映している消化ペプチド断片が生成されるはずである。したがって、ヒト血清またはヒト血漿におけるペプチドミクスプロファイリングは、新規癌マーカー探索の有力なツールであると考えられる。
【0013】
以上を鑑み、本発明者らが鋭意検討を行った結果、ゲル濾過クロマトグラフィおよび質量分析法を用いた大規模スクリーニングによって、肺癌患者の血清中に特異的に存在するペプチドを見出し、本発明者らは本発明を完成させるに至った。
【0014】
本発明に係る肺癌診断用ポリペプチドは、上記課題を解決するために、配列番号1〜19の何れか1つに示されるアミノ酸配列からなる構成である。
【0015】
本発明に係る肺癌の検出方法は、上記課題を解決するために、生体から採取した試料において、配列番号1〜19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドの群より選択される少なくとも1つの肺癌診断用ポリペプチドを検出または測定する工程を含む構成である。
【0016】
また、本発明に係る肺癌の検出方法は、少なくとも配列番号5、12または19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドを検出または測定することが好ましい。
【0017】
また、本発明に係る肺癌の検出方法は、質量分析法により上記少なくとも1つの肺癌診断用ポリペプチドを検出または測定することが好ましい。
【0018】
また、本発明に係る肺癌の検出方法は、上記工程において、上記試料をゲル濾過クロマトグラフィに供して肺癌診断用ポリペプチド画分を取得して、得られた画分について上記少なくとも1つの肺癌診断用ポリペプチドを検出または測定することが好ましい。
【0019】
また、本発明に係る肺癌の検出方法は、上記肺癌診断用ポリペプチドの群より選択される2以上の上記肺癌診断用ポリペプチドを一度に検出または測定することが可能である。
【0020】
また、本発明に係る肺癌の検出方法は、上記試料が血液、血清または血漿であることが好ましい。
【0021】
また、本発明に係る肺癌の検出方法は、上記工程に先立って、上記試料に加熱処理を施すことが好ましい。
【0022】
本発明に係る肺癌患者における治療効果の評価方法は、治療が施される前に生体から採取した試料、および治療が施された後に生体から採取した試料において、配列番号1〜19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドの群より選択される少なくとも1つを検出または測定する第1の工程と、それぞれの検出結果を比較する第2の工程とを含む構成である。
【発明の効果】
【0023】
特定の配列からなる本発明に係る肺癌診断用ポリペプチドを用いることにより、採取した生体試料を用いて肺癌を検出することが可能となる。したがって、本発明に係る肺癌診断用ポリペプチドは、肺癌バイオマーカーとして用いることができる。
【図面の簡単な説明】
【0024】
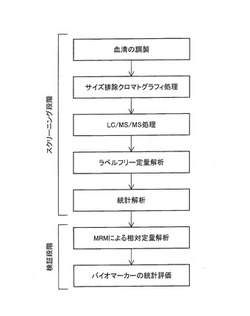
【図1】バイオマーカーペプチドのスクリーニング方法の概要を示す図である。
【図2】一実施例における血清試料のHPLCによる分離結果のスペクトルの重ね合わせを示す図である。
【図3】一実施例における血清試料のHPLCによる分離結果のスペクトルの一部を拡大して示す図である。
【図4】一実施例における血清試料の質量分析を行った結果のMSスペクトルを示す図である。
【図5】一実施例における血清試料の質量分析を行った結果について作成したクロマトグラム面を示す図である。
【図6】全クロマトグラム面をアラインメントした結果の一部を示す図である。
【図7】一実施例における健常人グループおよび肺癌患者グループの間のt検定におけるp値に従ったクラスターの階層図である。
【図8】一実施例における候補バイオマーカーペプチドについて主成分分析を行った結果を示す図である。
【図9】一実施例における最適なMRMトランジションを設定するために、76個のMRMトランジションを同時にモニタリングした結果を示す図である。
【図10】一実施例における相対定量化解析の結果を示すボックスプロットの図である。
【図11】一実施例における相対定量化解析の結果を示すROCカーブの図である。
【発明を実施するための形態】
【0025】
<1.肺癌診断用ポリペプチド>
本発明に係る肺癌診断用ポリペプチドは、配列番号1〜19の何れか1つに示されるアミノ酸配列からなるポリペプチドである。
【0026】
これらのポリペプチドは、肺癌患者由来の血清において、健常人由来の血清に比してより多く検出される。そのため、血清中の本肺癌診断用ポリペプチドの存在量を測定して健常人における存在量と比較することにより、肺癌を検出することが可能となる。すなわち、本肺癌診断用ポリペプチドは、肺癌検出用のバイオマーカーとして用いることができる。
【0027】
ここで、「肺癌」とは、ヒトの腺癌(肺腺癌)、扁平上皮癌および大細胞癌を含む非小細胞癌を指す。本発明に係る肺癌診断用ペプチドは、とりわけ、腺癌の検出に特に有効である。
【0028】
配列番号1に示されるアミノ酸配列は、ヒトアミロリド感受性カチオンチャネル4(ACCN4)タンパク質のN末端から613番目から624番目までのアミノ酸残基の配列である。このアミノ酸配列からなるポリペプチドを、本明細書では、「ACCN4 613−624」と称する。
【0029】
配列番号2〜5に示されるアミノ酸配列はそれぞれ、ヒトアポリポタンパク質A−IV(APOA4)のN末端から271番目から283番目までのアミノ酸残基の配列、268番目から284番目までのアミノ酸残基の配列、260番目から284番目までのアミノ酸残基の配列、および273番目から283番目までのアミノ酸残基の配列である。これらのアミノ酸配列からなる各ポリペプチドを、本明細書ではそれぞれ、「APOA4 271−283」、「APOA4 268−284」、「APOA4 260−284」、および「APOA4 273−283」と称する。
【0030】
配列番号6に示されるアミノ酸配列は、ヒトアポリポタンパク質E(APOE)のN末端から194番目から214番目までのアミノ酸残基の配列である。このアミノ酸配列からなるポリペプチドを、本明細書では、「APOE 194−214」と称する。
【0031】
配列番号7〜18に示されるアミノ酸配列はそれぞれ、ヒトフィブリノゲンアルファ鎖(FIBA)のN末端から1番目から16番目までのアミノ酸残基の配列、7番目から15番目までのアミノ酸残基の配列、7番目から16番目までのアミノ酸残基の配列、2番目から16番目までのアミノ酸残基の配列、5番目から15番目までのアミノ酸残基の配列、5番目から16番目までのアミノ酸残基の配列、6番目から15番目までのアミノ酸残基の配列、6番目から16番目までのアミノ酸残基の配列、4番目から15番目までのアミノ酸残基の配列、4番目から16番目までのアミノ酸残基の配列、3番目から15番目までのアミノ酸残基の配列、および3番目から16番目までのアミノ酸残基の配列である。これらのアミノ酸配列からなる各ポリペプチドを、本明細書ではそれぞれ、「FIBA 1−16」、「FIBA 7−15」、「FIBA 7−16」、「FIBA 2−16」、「FIBA 5−15」、「FIBA 5−16」、「FIBA 6−15」、「FIBA 6−16」、「FIBA 4−15」、「FIBA 4−16」、「FIBA 3−15」、および「FIBA 3−16」と称する。
【0032】
配列番号19に示されるアミノ酸配列は、ヒトlimbinタンパク質のN末端から306番目から313番目までのアミノ酸残基の配列である。このアミノ酸配列からなるポリペプチドを、本明細書では、「LBN 306−313」と称する。
【0033】
上記した各肺癌診断用ポリペプチドのアミノ酸配列を表1に示す。
【0034】
【表1】

【0035】
上記した肺癌診断用ポリペプチドのうち、ACCN4 613−624、APOA4 260−284、APOA4 273−283、FIBA 1−16、FIBA 2−16、FIBA 5−16、FIBA 6−15、FIBA 6−16、FIBA 4−16、FIBA 3−15、FIBA 3−16、およびLBN 306−313は、健常人と肺癌患者との間で血清における存在量に、より大きな有意差があるため、肺癌を検出するためのバイオマーカーとして、より好ましい。
【0036】
さらに、APOA4 273−283、FIBA 5−16、およびLBN 306−313については、肺癌の手術可能ステージ(ステージI,II,IIIa)での、感度および特異度により優れているため、とりわけ、肺癌の手術可能ステージを検出するためのバイオマーカーとして、特に好ましい。
【0037】
肺癌患者由来の血清において、健常人由来の血清に比してより多く検出されるという観点から、表2にID_001〜ID_118として示した各化合物も肺癌を検出するバイオマーカーとして用いることが可能である。表2に示した各化合物は、ヒトの血清に由来する化合物であって、対応させて示す分子量を有しているペプチドである。なお、表2に示す分子量、m/z、RT(Retention Time)およびChargeは、後述する実施例3に記載した測定法により同定した値である。また各化合物がペプチドまたは修飾ペプチドである場合にそのアミノ酸配列は、後述する実施例4に記載した測定法により同定することが可能である。なお、ID_001〜ID_118として示した各化合物は、そのイオン化における電荷および分子量から、ペプチドまたは修飾ペプチドであると推定される。
【0038】
【表2】

【0039】
すなわち、採取した被験者の血清において、表2に示される分子量を有している化合物を検出または測定することによっても、肺癌を検出することが可能である。
【0040】
なお、ID_001〜ID_118の化合物のうち、少なくともID_002(FIBA 5−16)、ID_004(FIBA 5−15)、ID_005(FIBA 7−16)、ID_007(LBN 306−313)、ID_008(FIBA 3−15)、ID_009(FIBA 1−16)、ID_010(FIBA 3−16)、ID_011(FIBA 7−15)、ID_012(FIBA 4−15)、ID_013(FIBA 2−16)、ID_015(FIBA 4−16)、ID_023(FIBA 2−16)、ID_027(ACCN4 613−624)、ID_031(FIBA 2−16)、ID_032(FIBA 6−16)、ID_033(FIBA 6−16)、ID_039(FIBA 6−15)、ID_051(FIBA 5−15)、ID_064(APOA4 260−284)、ID_069(APOA4 273−283)、ID_075(FIBA 5−16)、ID_085(APOA4 268−284)、ID_093(FIBA 5−16)、ID_099(APOA4 271−283)、ID_108(APOE 194−214)、ID_113(FIBA 3−16)、およびID_114(FIBA 2−16)についてはペプチドであって、データベース検索によってそのアミノ酸配列が同定されており、表1に示すペプチドの何れかに分類されている。
【0041】
<2.肺癌疾患の検出方法>
本発明に係る肺癌疾患の検出方法は、生体から採取した試料において、配列番号1〜19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドの群より選択される少なくとも1つの肺癌診断用ポリペプチドを検出または測定する工程を含めばよく、その他の具体的な工程、ならびに使用する器具および装置は特に限定されるものではない。
【0042】
本明細書において、「肺癌診断用ポリペプチドを測定する」とは、生体試料およびこれを精製して得られる試料における肺癌診断用ポリペプチドの存在量または濃度を測定することを意図している。
【0043】
本発明の検出方法の一例として、被験者由来の生体試料中における少なくとも1つの肺癌診断用ポリペプチドの量を測定し、対照被験者(健常者)由来の生体試料中におけるこの肺癌診断用ポリペプチドの量を測定し、両者を比較することによって、肺癌を検出することができる。具体的には、被験者由来の試料における肺癌診断用ポリペプチドの量と、健常者由来の試料における当該肺癌診断用ポリペプチドの量とを比較して、両者の間で有意な相違が見られた場合には、この被験者が肺癌に罹患しているか、または肺癌に罹患している可能性が高いと判定することができる。健常者由来の試料における当該肺癌診断用ポリペプチドの量は予め測定したものを用いることが可能である。あるいは、予め健常者由来の生体試料における肺癌診断用ポリペプチドの量を測定して、これに基づいて正常濃度範囲を定めておき、被験者由来の生体試料において肺癌診断用ポリペプチドの量がその正常濃度範囲から外れた場合に、肺癌に罹患していると判定することも可能である。
【0044】
ここで「試料」とは、生体(ヒト)から採取した試料であって、上記肺癌診断用ポリペプチドを検出または測定できる試料であれば特に制限されないが、例えば、血液、血清、および血漿などを用いることができる。中でも、血清および血漿が好ましい。
【0045】
肺癌診断用ポリペプチドを検出または測定する方法としては、肺癌診断用ポリペプチドの存在量を定量的もしくは半定量的に決定できるか、または肺癌診断用ポリペプチドの有無を決定できる限り、特に制限されるものではなく、例えば、ELISA、ウェスタンブロットおよび免疫沈降法などの免疫学的手法、ならびに質量分析法などを用いることができる。中でも、以下の観点から質量分析法が好ましい。質量分析装置を用いた質量分析法によれば、特異的な抗体を作製する必要がないため、簡便に肺癌診断用ポリペプチドを検出または測定することができる。また、質量分析装置を用いた質量分析法は、感度および精度に優れているため、より正確な判定を行うことができる。さらに、多成分同時分析が可能なマルチチャネル型の質量分析装置を用いることにより、2以上の肺癌診断用ポリペプチドを一度に検出または測定することが可能となる。2以上の肺癌診断用ポリペプチドを用いて判定を行うことによって、肺癌に罹患しているか否かについてより正確な判定を行うことが可能となる。あるいは、2以上の肺癌診断用ポリペプチドを組み合わせて判定することによって、肺癌がどのステージの状態であるか否かについてより正確な判定を行うことが可能となる。さらには、肺癌以外の他の疾患に関するバイオマーカーも同時に測定することが可能となり、一度に様々な疾患についての検出を試みることが可能となる。また、より精度よく検出をおこなうためには、タンデム質量分析装置(MS/MS)を用いることが好ましい。本発明の検出方法において用いられる質量分析装置としては定量可能であれば特に制限はなく、四重極型および飛行時間型など従来公知の型の質量分析装置を用いることが可能である。
【0046】
肺癌診断用ポリペプチドの検出または測定に用いられる試料は、生体から採取した後、肺癌診断用ポリペプチドの検出または測定を行う前に、加熱処理が施されることが好ましい。試料に加熱処理を施すことによって、試料中に含まれるタンパク質分解酵素を失活させることができる。これにより、肺癌診断用ポリペプチドが検出および測定前に分解されることを防ぐことができる。加熱処理としては、例えば100℃で10分の処理が可能である。あるいは、加熱処理の代わりに、試料を酸変性または有機溶媒沈殿法に供することによって、タンパク質分解酵素によるペプチドの分解を防止してもよい。酸変性では、例えば、1%トリフルオロ酢酸存在下で60℃に加熱してタンパク質のみを沈殿させて、その上清を、検出および測定用試料として用いればよい。また、有機溶媒沈殿法としては、例えば、アセトンおよびアセトニトリルなどの有機溶媒を血清の5〜10倍量添加することによってタンパク質のみを沈殿させて、同様にその上清を、検出および測定用試料として用いればよい。なお、効率の観点から、単純に加熱処理を行うことが好ましい。
【0047】
肺癌診断用ポリペプチドの検出または測定に用いられる試料は、質量分析に供する前に、ゲル濾過クロマトグラフィ(サイズ排除クロマトグラフィ)によって、肺癌診断用ポリペプチドを含む画分として濃縮して、この画分について肺癌診断用ポリペプチドの検出または測定を行うことが好ましい。これにより、血液試料から1ステップで質量分析に供することが可能になる。すなわち、例えばタンパク質のMS分析では必須であるトリプシン消化などのステップを全て省略することができる。したがって、肺癌診断用ポリペプチドの検出および測定を、簡便かつ迅速に行うことができる。また、ゲル濾過クロマトグラフィによる処理であれば、有機溶媒および強酸などの毒劇物を必要としないため、作業従事者における健康被害のリスクが低く、臨床検査技師などの医療従事者であっても前処理を実施することができる。さらに、ゲル濾過クロマトグラフィによる処理は、タンパク質等の高分子に対する排除効果がきわめて高い。そのため、引き続き行われる質量分析による検出工程の再現性を高めることができる。
【0048】
肺癌診断用ポリペプチドを含む画分として回収する画分は、肺癌診断用ポリペプチドを含む限りその分子量の範囲に制限はなく、例えば、分子量が1,000(Da)以上、5,000(Da)以下のペプチドを含むような画分を回収すればよい。
【0049】
これまで様々なアプローチにて、血清および血漿に適用できる疾患バイオマーカー候補タンパク質およびペプチドが同定されてきているが、それらを臨床に応用していくためには、広いダイナミックレンジを有し、正確で多検体を処理できる方法が必要である。その多くは特異的抗体を用いてのELISAの系が担っていたが、ELISAの系に使える特異的な抗体を確立することは困難であり、血清および血漿における疾患バイオマーカーの確証、追証実験を遂行することが困難な場合が多い。
【0050】
これに対して本発明の肺癌診断用バイオマーカーおよび肺癌の検出方法によれば、特異的抗体を製造することなく、多検体を正確に処理でき、高感度で肺癌を検出することができる。
【0051】
<3.肺癌患者における治療効果の評価方法>
本発明に係る肺癌患者における治療効果の評価方法は、治療が施される前に生体から採取した試料、および治療が施された後に生体から採取した試料において、配列番号1〜19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドの群より選択される少なくとも1つを検出または測定する第1の工程と、それぞれの検出結果を比較する第2の工程とを含めばよく、その他の具体的な工程、ならびに使用する器具および装置は特に限定されるものではない。
【0052】
本発明の評価方法の一例として、肺癌患者の生体試料中における少なくとも1つの肺癌診断用ポリペプチドの量を肺癌の治療開始前に予め測定し、肺癌の治療開始後に、同一患者の当該肺癌診断用ポリペプチドの量を測定し、両者を比較することによって、肺癌の治療効果を評価することができる。具体的には、治療開始前の肺癌診断用ポリペプチドの量と、治療開始後の当該肺癌診断用ポリペプチドの量とを比較して、治療開始後の当該肺癌診断用ポリペプチドの量が、健常者の生体試料中における当該肺癌診断用ポリペプチドの量に近づいており、両者(治療開始前および治療開始後)の間で有意な相違が見られた場合には、この患者に対して行った治療に効果があったと評価することができる。
【0053】
なお、肺癌診断用ポリペプチドの検出または測定に用いられる生体試料の調製および精製、ならびに肺癌診断用ポリペプチドの検出方法または測定方法は、上記<2.肺癌疾患の検出方法>の説明を援用することができる。
【0054】
以下に実施例を示し、本発明の実施の形態についてさらに詳しく説明する。もちろん、本発明は以下の実施例に限定されるものではなく、細部については様々な態様が可能であることはいうまでもない。さらに、本発明は上述した実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、それぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。また、本明細書中に記載された文献の全てが参考として援用される。
【実施例】
【0055】
以下に示す各実施例において、「肺癌」は、特に断りのない限り、肺腺癌を指すものとする。
【0056】
各実施例について詳細に説明する前に、本肺癌診断用ポリペプチドのスクリーニングの流れの概要を図1を参照して説明する。
【0057】
本肺癌診断用ポリペプチドのスクリーニングでは、まず、複数の肺癌患者および健常人から血清を採取して加熱処理することによって血清を調製した(実施例1、2)。次いで、それぞれの血清についてサイズ排除クロマトグラフィを行うことによって、特定の分子量画分を収集した(実施例2)。収集した画分についてLC/MS/MSを行い、本画分に含まれるペプチド成分を抽出した(実施例3、4)。抽出したペプチド成分について、非ラベル化定量解析を行った(実施例3)。肺癌患者からのデータと健常人からのデータとを比較し、統計解析を行うことによって、肺癌患者特異的なペプチドを選抜する(実施例3)。ここまでが、スクリーニング段階である。検証段階では、選抜した各ペプチドについて、別の肺癌患者および健常人の血清を対象として、MRM(Multiple Reaction Monitoring)による相対定量解析を行った(実施例5)。得られた結果について統計解析を行うことによって、各ペプチドの評価を行った(実施例6)。以上によって、肺癌の検出に用いられるバイオマーカーを同定した。以下、各実施例について詳細に説明する。
【0058】
〔実施例1:血清の調製〕
インフォームド・コンセントを得た上で、広島大学病院における122人の肺腺癌患者(ステージI〜IV)から、ヒト血清試料を得た。また、正常コントロール用の血清試料を、インフォームド・コンセントを得た上で、広島NTT病院において健康診断を受けている30人の健康なボランティア、および高知大学病院において健康診断を受けている36人の健康なボランティアから得た。
【0059】
血清は、一般的な手法を用いて、遠心分離(1500×g、10分間)によって全血から収集し、−80℃で保存した。
【0060】
〔実施例2:ペプチドーム画分の収集〕
全ての血清を1回だけ凍結融解させ、プロテアーゼおよびペプチダーゼによる血清中の成分の分解を防ぐため、また加熱処理中のタンパク質の凝集を避けるため、すぐに、プロテオミクスグレードの水を用いて4倍に希釈した上で100℃にて10分間インキュベートした。Spin−X 0.45μmスピンフィルタを用いて濾過した後、Prominence HPLC System(島津製作所社製)に連結している10/300 Superdex peptide column(GE Healthcare社製)に、10μlのサンプルを投入した。100mMの酢酸アンモニウムの一定流量(流速0.5ml/min)のもと、試料をHPLCに導入した。カラムを通過した試料について280nmのUV吸収を測定した。結果を図2に示す。
【0061】
図2は、16人分の血清試料に対応するゲル濾過HPLCのスペクトルを重ね合わせて示している図である。図2に示されるように、ゲル濾過HPLCでは、血清タンパク質および血清ペプチドの分離が非常に再現性よく行われていた。
【0062】
次いで、MALDI−TOF−TOF質量分析装置を用いて、サイズ排除クロマトグラフィの精度を評価した。図3は、上記ゲル濾過HPLCの1つのスペクトルの一部を拡大して示している。図3中「1」〜「10」の網掛けによって示す10個の画分(保持時間が14分から34分までの2分毎の画分)について、MALDI−TOF−TOF質量分析装置を用いて解析することによって、サイズ排除クロマトグラフィの精度を評価した。その結果を図4に示す。図4は、10個の画分(Fr.1〜Fr.10)のそれぞれについてのMSスペクトルを示す図である。図4の連続的なMSスペクトルに示されるように、ゲル濾過クロマトグラフィを行うことによって、血清タンパク質および血清ペプチドを分子量に応じて正確に分離することができている。
【0063】
図4に示す結果に基づき、図3中「5」〜「10」の網掛けによって示す6個の画分(保持時間が22分から34分まで)をペプチドーム画分と規定して収集した。これらの画分は1,000〜5,000の分子量に対応している。
【0064】
収集した画分(ペプチド試料)を、Vacuum Spin Drier(TAITEC社製)を用いて乾燥させた。
【0065】
〔実施例3:ペプチドバイオマーカーのスクリーニング〕
肺癌の初期の段階の検出に用いられ得る血清ペプチドを探索するために、健常人および肺癌患者を含む92人の血清試料の定量的ペプチドームプロファイルを取得した。92人の内訳を表3に示す。
【0066】
【表3】

【0067】
92人のうち、62人が肺癌患者である。62人の肺癌患者のうち、32人が手術可能なステージにある肺癌患者(ステージI:n=10、ステージII:n=10、ステージIIIa:n=12)であり、30人が進行ステージにある肺癌患者(ステージIIIb:n=15、ステージIV:n=15)である。これにより、肺癌の進行度を反映したバイオマーカーを取得することが可能となる。
【0068】
まず、実施例1と同様にして血清を採取した。また、実施例2と同様にしてゲル濾過クロマトグラフィによって血清試料を精製した。得られた92個のペプチド試料をそれぞれ、LC/MS/MS解析に供した。具体的には、得られたペプチド試料(乾燥させたペプチドーム画分)を、0.1%のトリフルオロ酢酸を含む2%のアセトニトリルに溶解した。このペプチド試料について、UltiMate 3000 nano−flow HPLC system(DIONEX社製)に連結したQSTAR−Elite mass spectrometer(AB Sciex社製)を用いて解析した。
【0069】
まず、L−Columnビーズを手作業で装填した100μm×200mm tip−column(GL Science社製)を用いて、ペプチド試料を分離した。ペプチド試料の分離には、流速200nl/minの溶媒A(0.1%ギ酸、2%アセトニトリル)および溶媒B(0.1%ギ酸、70%アセトニトリル)を用いた。ここで、溶媒Bは多段階の線形勾配を形成させており、95分間で溶媒Bを5%から55%まで変化させ、その後10分間で55%から95%まで変化させている。
【0070】
溶出物について、直接、1秒のMSサーベイ(m/z 400〜1800)を行ない、その中で最も強度の強かったプリカーサイオン(30カウント以上、+2〜+4の荷電状態、m/z範囲は50/2000)に対して3度のMS/MS測定を行った。なお、サーベイの条件は、SIDA=3.0、最大蓄積時間=2.0秒である。すでに標的にされていたプリカーサイオンは、40秒間の反復MS/MS取得(100mDaの質量許容度)からは除外した。
【0071】
QSTAR−Eliteにおいて得られた92個のrawデータファイル(.wiffフォーマットおよび.wiff.scanフォーマット)を、Expressionist RefinerMSモジュール(Genedata社製)に直接導入した。このモジュールを用いて、まず、図5に示すようなMSクロマトグラム面を作成した。また、全てのクロマトグラムについて、装置特異的ノイズおよび化学ノイズを実質的に差し引いて除去した。具体的には、クロマトグラム化学ノイズサブトラクションアクティビティにおいて、RT Window=3scanとして平坦化を実施した。バックグラウンドのノイズを除去するために、ピーク強度を下記のように規定した:
Intensitysubtracted=max(Intensityoriginal−Quantile−Threshold,0)
maxは引数のうち大きいものをとる関数である。ここでは、Quantile値=50%、Intensity Threshold=15cpsとした。また、少なくとも以下の何れか1つの基準を満たすシグナルをノイズピークとみなして、差し引き除去した:
・RT Window>50scan
・Minimum RT Length=4scan
・Minimum m/z length=8data point。
【0072】
次いで、各MSクロマトグラム面における保持時間(RT)グリッドを、92個のクロマトグラム面の間で正しくアラインメントした。アラインメントの結果の一部を図6に示す。アラインメントを行うことにより、複数の試料を用いた確実な定量解析を行うことができるようになる。アラインメントの際のクロマトグラムRTアラインメントアクティビティにおけるパラメータは以下の通りである:
・m/z Window=0.1Da
・RT Window=0.2min
・Gap Penalty=1
・RT search interval=5min。
【0073】
次いで、特定のクロマトグラム面では検出されないピークの位置情報も確実に取得するために、クロマトグラム積算ピーク検出アクティビティによって、一時的に平均化したクロマトグラムにおけるピークを検出した。その際のパラメータは以下の通りである:
・Summation Window=5scan
・Overlap=50
・Minimum Peak Size=4scan
・Maximum Merge Distance=10data point
・Gap/Peak Ratio=1
・Method=curvature−based peak detection
・Peak Refinement Threshold=5
・Consistency Filter Threshold=0.8
・Signal/Noise Threshold=1。
【0074】
その後、2段階の積算アイソトープクラスタリングアクティビティによって、2Dピークの中からアイソトープパターンを同定した。同一のペプチドシグナルに属する各アイソトープピークをピーククラスターとして分類した。クラスターのいくつかの例を図5中の一点破線枠で示している。第1のクラスタリングは以下の基準に沿って実施した:
・Minimum Charge=1
・Maximum Charge=10
・Maximum Missing Peaks=0
・First Allowed Gap Position=3
・Ionization=protonation
・RT Tolefance=0.1min
・m/z Tolerance=0.05Da
・Isotope Shape Tolerance=10.0
・Minimum Cluster Size Ratio=1.2。
【0075】
第2のクラスタリングは、
・Minimum Cluster Size Ratio=0.6
・Reuse Existing Clusters=ture
とした以外は第1のクラスタリングと同一のセッティングによって実施した。
【0076】
この結果、92個の血清試料から、電荷状態が+1〜+10の何れかである、重複しない12,396個のピーククラスターが検出された。
【0077】
検出された全てのクラスターピークの情報(m/z、保持時間、および強度を含む)を、ABSファイルとして出力した。
【0078】
出力されたABSファイルをExpressionist Analystモジュールにおいてロードした。さらなる統計的な検討のために、この中から、電荷状態が+2〜+6の何れかである3,537個のピーククラスターを利用した。
【0079】
血清レベルにおいて肺癌特異的な変化を示しているペプチドのピークを抽出するために、健常人グループ(n=30)と肺癌患者グループ(n=62)との間で、スチューデントのt検定を実施した。スチューデントのt検定に際して、92個の血清試料の中でみられたピーク強度のバリエーションは、それぞれの血清試料における強度の中央値を10,000に固定することによって標準化した。標準化した強度データを用いて、健常人グループと肺癌患者グループとの間で、スチューデントのt検定を実施した。この結果を図7に示す。
【0080】
図7は、スチューデントのt検定におけるp値に従ったクラスター(ペプチド)の階層図である。この検定におけるp値がp<0.01であり、2つのグループ間での強度差が5倍以上であるものを、バイオマーカーとして使用し得るペプチドのピークとして抽出した。その結果、118個のペプチドが同定された(上記表2に示すID_001〜ID_118)。
【0081】
これら118個のペプチドに関して、92人の被験者を健常人グループおよび肺癌患者グループにグループ分けするための統計的な有効性を評価するために、これら118個の候補バイオマーカーペプチドを用いて主成分分析を行った。結果を図8に示す。図8に示されるように、92人の被験者を健常人グループおよび肺癌患者グループに正しくグループ分けすることができた。すなわち、118個のペプチドの定量値は、被験者を健常人グループおよび肺癌患者グループに正確にグループ分けするのに統計的に充分であることが示された。したがって、これら118個のペプチドは、肺癌を検出するためのバイオマーカーとして使用できる。
【0082】
以上、ゲル濾過クロマトグラフィおよびLC/MS/MSを用いたバイオマーカーのスクリーニングによって、肺癌バイオマーカーとして使用できる118個のペプチドを得た。
【0083】
〔実施例4:LC/MS/MSによるペプチド配列の同定〕
QSTAR−Elite LC/MS/MSおよびMASCOTデータベース検索を用いて、包括的ペプチド配列決定を実施した。MASCOTデータベース検索は、Analyst QS 2.0 ソフトウェア(AB Sciex社製)を用いて実施した。MS/MSデータについての検索は、以下のパラメータを用いて、SwissProt57.4(20,400配列)からのヒトタンパク質データベースに対して実施した:
・Taxonomy=Homo sapiense
・Enzyme=None
・Fixed modifications=None
・Variable modifications=Oxidation(Met)
・MS tolerance=50ppm
・MS/MS tolerance=0.1Da
予測値(Expectation value)<0.05である場合に、MS/MSデータのペプチドが、その予測値に対応する配列からなるものと認定した。
【0084】
92人の被験者の血清試料に由来する230,657個のMS/MSクエリのうち、5,382個のペプチドは、MASCOTの期待値が<0.05でもって配列決定された。重複したものを除くと、424種類のペプチドが同定された。これらは、106種のタンパク質に対応するものであった。
【0085】
上述の118個のペプチドに関していえば、19個について配列を決定することができた。配列決定がなされた19個のペプチドのうち、12個のペプチドはフィブリノゲンアルファ鎖(FIBA)由来であり、4個のペプチドは、アポリポタンパク質A−IV(APOA4)由来であり、残りは、それぞれ、アミロリド感受性カチオンチャネル4(ACCN4)、アポリポタンパク質E(APOE)およびlimbin(LBM)由来であった。19個のペプチドの各アミノ酸配列は、上述の表1に示している。
【0086】
〔実施例5:MRMによる定量化〕
本ペプチドの量的再現性を評価するため、また、配列決定された19個のバイオマーカーペプチドの臨床有用性を評価するために、新たに調製した96人の被験者の血清試料について、MRM(Multiple Reaction Monitoring)法を用いて、ラベル化を伴わない相対定量化解析を実施した。96人の被験者の内訳を表4に示す。本実施例における各被験者は、表3に示した被験者とは別の被験者である。
【0087】
【表4】

【0088】
19個のペプチドそれぞれに特異的で最適なMRMトランジションを設定するために、スクリーニングの段階で検出されたプリカーサイオンのm/z値をQ1チャンネルとしてセットし、MS/MSスペクトルの中から最も強度が高かった4つのフラグメントイオンを選択して各m/z値をQ3チャンネルとしてセットした。血清ペプチドーム試料について、4000 QTRAP マススペクトロメトリを用いて、全76(19×4)個のMRMトランジションを同時にモニタリングした。
【0089】
質量分析に先立って、実施例2と同様に、採取した血清試料をSuperdexペプチドカラムクロマトグラフィ処理に供した。抽出した試料(ペプチド)を乾燥させた後、2%アセトニトリルと0.1%トリフルオロ酢酸とを含み、さらに1fmol/μlのBSAを含むトリプシン消化溶液中に溶解した。次いで、Paradigm MS4 PAL nano−flow HPLC system(AMR社製)に連結している4000 QTRAP質量分析装置(AB Sciex社製)を用いて解析した。
【0090】
ペプチド試料の分離は、L−Column ODSビーズ(化学物質評価研究機構製)を手作業で装填した100μm×100mm tip−column(GL Science社製)を用いて行った。ペプチド試料の分離には、流速200nl/minの溶媒A(0.1%ギ酸、2%アセトニトリル)および溶媒B(0.1%ギ酸、90%アセトニトリル)を用いた。ここで、溶媒Bは線形勾配を形成させており、10分間で溶媒Bを2%から100%まで変化させている。76個のモニタリングの結果を図9に示す。図9中の各クロマトグラムは、QSTSR−Elite LC/MS/MS解析において最も高い強度を示した4つのフラグメントイオンについて4000 QTRAP システムを用いてモニタリングした、4つのクロマトグラムを重ね合わせて示している。
【0091】
各ペプチドについて、特異的な溶出保持時間を決定した。そして、各ペプチドについて、4つのMRMトランジションの中から最も強いMRMクロマトグラムのピークを示す最適なMRMトランジションを選択した。それぞれのMRMトランジションの情報を表5に示す。
【0092】
【表5】

【0093】
FIBA 3−16およびFIBA 5−16の2つのペプチドは、QSTAR−Eliteおよび4000 QTRAP システムの間でのフラグメントイオンの強度が同一のオーダーを示していた。
【0094】
次に、36人の健常人(正常コントロール)由来の血清試料および60人の肺癌患者由来の血清試料を用いて、MRMによる相対定量解析を実施した。解析は、繰り返して行った。
【0095】
まず、19個のバイオマーカーペプチドのイオンおよびBSA由来の5個のペプチドのイオンを、Analyst1.5ソフトウェア(AB Sciex社製)のMRMモードによって同時にモニタリングした。MRMクロマトグラムを得た後、MultiQuantソフトウェア(AB Sciex社製)を用いて、このクロマトグラムを平滑化し、定量化した。各試料におけるMRMのピーク領域は、下記式:
標準化後のピーク領域=1000×(rawデータのピーク領域)/(5個のBSA断片におけるピーク領域の積算)
のようにして標準化した。19個のバイオマーカーペプチドの血清におけるレベルを、標準化および平均化した後のMRMクロマトグラムピーク領域から算出した。算出結果をボックスプロットとして図10に示す。図10の横軸において「N」は、健常人由来の血清試料であることを表しており、「I」〜「IV」はそれぞれ、肺癌のステージがステージI〜IVにある肺癌患者由来の血清試料であることを表している。ボックスプロットはRアルゴリズムによって作成した。それぞれにおいてボックスは、標本の25%分位点から75%分位点までを表している。ボックスを横切る線は中央点を表している。ボックスの上部および下部から出ている線の長さはそれぞれ、ボックスの長さの1.5倍の範囲内にあるデータの最大値および最小値によって規定されている。
【0096】
〔実施例6:MRMによる定量に基づく統計評価〕
肺癌の早期検出におけるバイオマーカーペプチドの有効性を評価するために、スチューデントのt検定によって、肺癌の手術可能ステージ(ステージI,II,IIIa)のグループおよび健常人グループの間で定量結果を統計的に比較評価した。結果を図10中に示している。
【0097】
図10に示されるように、19個のペプチドのうち、15個のペプチド(ACCN4 613−624、APOA4 271−283、APOA4 268−284、APOA4 260−284、APOA4 273−283、APOE 194−214、FIBA 1−16、FIBA 2−16、FIBA 5−16、FIBA 6−15、FIBA 6−16、FIBA 4−16、FIBA 3−15、FIBA 3−16、LBN 306−313)については、2つのグループ間で、血清レベルにおいて有意な差(p<0.05)を示した。一方、残りの4個のペプチド(FIBA 4−15、FIBA 5−15、FIBA 7−15およびFIBA 7−16)は、有意な差(p<0.05)を示さなかった。
【0098】
同様に、19個のペプチドについて、スチューデントのt検定によって、肺癌の進行ステージ(ステージIIIb,IV)のグループと、健常人グループとを比較した。結果を図10中に示している。
【0099】
図10に示されるように、15個のペプチド(ACCN4 613−624、APOA4 260−284、APOA4 273−283、FIBA 1−16、FIBA 7−15、FIBA 7−16、FIBA 2−16、FIBA 5−16、FIBA 6−15、FIBA 6−16、FIBA 4−15、FIBA 4−16、FIBA 3−15、FIBA 3−16、LBN 306−313)については、2つのグループ間で、血清レベルにおいて有意な差(p<0.05)を示した。一方、4個のペプチド(APOA4 268−284、APOA4 271−283、FIBA 5−15およびAPOE 194−214)は、2つのグループ間で、有意な差(p<0.05)を示さなかった。
【0100】
さらに、バイオマーカーの感度(sensitivity)および特異度(specificity)を評価するために、ROCカーブ解析を実施した。ROCカーブは、Rアルゴリズムによって作成した。カットオフ値は、(sensitivity,specificity)=(1,1)からの距離が最小となる点にセットした。解析結果の一部を図11示す。図11中、「Sens」は感度、「Spec」は特異度、「PV+」は正の予測値(positive predictive value)、そして「PV−」は負の予測値(negative predictive value)を表している。
【0101】
手術可能ステージにある肺癌患者の検出を行うための感度の値を前提とすると、FIBA 6−15、APOA4 273−283、FIBA 5−16およびLBN 306−313は、感度の値がそれぞれ、87.1%、61.3%、58.1%および58.1%であったため、優れたバイオマーカーであることが示された。なかでも、APOA4 273−283、FIBA 5−16およびLBN 306−313は、特異度がそれぞれ、88.9%、94.4%および100%と著しく高かった。したがって、これら3つのペプチドは、肺癌を初期のステージで検出できる、より効果的なバイオマーカーであることが示された。
【産業上の利用可能性】
【0102】
以上のように、本発明は、肺癌を早期に検出することができる。したがって、本発明は、診断医療分野および保健医学分野に広く利用することができる。
【技術分野】
【0001】
本発明は、肺癌診断用ポリペプチドならびに肺癌診断用ポリペプチドを用いた肺癌の検出方法および治療効果の評価方法に関する。
【背景技術】
【0002】
肺癌は、日本および欧米で最も死亡者数の多い癌であり、難治性である。肺癌は、小細胞肺癌および非小細胞肺癌に分けることができ、肺癌患者全体の15%が小細胞肺癌であり、残りの85%が非小細胞肺癌である。さらに、非小細胞癌は、病理組織学的に、腺癌、扁平上皮癌および大細胞癌の3つのタイプに分けることができる。
【0003】
喫煙は依然として癌の主要な危険因子である。しかしながら、近年、非喫煙者における肺癌(主に腺癌)が増加してきている。肺癌患者における5年後の生存率はわずか15%程度である。これは、初期の段階で肺癌を検出できる方法がないことに大きく起因する。肺癌患者のうち初期ステージの疾患と診断されるケースはわずか16%である。胸部X線、喀痰細胞診、およびヘリカルCTなどは肺癌検出のスクリーニングツールとして用いられてきているが、肺癌の死亡率の改善に関しては、ほとんど効果をもたらしていない。
【0004】
一方、疾患の早期発見を達成し、臨床管理を向上させるために、肺癌用血清バイオマーカーが開発されてきている(非特許文献1参照)。それにもかかわらず、その臨床有用性は限られている(非特許文献2および3参照)。CEA(carcinoembryonic antigen)およびCYFRA(cytokeratin 19 fragment)は、一部の非小細胞癌患者の血清において存在量が増加している。そのため、これらは、疾患の状態をモニターしたり、治療に対する反応を評価したりと、臨床上有効である。しかしながらこれらは、臨床診断での使用には適していない(非特許文献4参照)。なぜならば、これらは、喫煙や肺炎などの他の疾患および他の種類の癌にも関連していることが知られており、さらには、初期ステージの肺癌を検出することができないからである。
【0005】
近年、プロテオミクス技術を用いて臨床検体におけるタンパク質の発現パターンをモニタリングすることによって、癌の診断に用いられる可能性のある新規バイオマーカーの発見を可能なものとしている。癌の病原の分子基板および癌関連タンパク質の特性の理解をより深めるために、2D−DIGE、SELDI−TOF−MS、タンパク質アレイ、ICAT、iTRAQおよびMudPITなどの種々のプロテオミクスツールが、種々の生体試料の差分解析に用いられてきている(非特許文献5参照)。生体試料としては、細胞可溶化物、血清および血漿などが含まれている。
【0006】
複雑な生体試料の中から微量成分を推定バイオマーカーとして同定するために、焦点を合わせたプロテオミクス技術および目標を定めたプロテオミクス技術が注目を集めてきている。例えば、IMAC(非特許文献6参照)などのリンタンパクプロテオミクス技術、細胞表面捕捉(CSC)技術(非特許文献7および8参照)、およびグリカン構造特異的定量技術であるIGEL(非特許文献9参照)などが挙げられる。これらの技術によれば、とりわけ、血液プロテオーム試料における高感度および高スループットなプロファイリングを妨げている技術的制限を回避できる。この技術的制限の原因としては、血液プロテオーム試料自体が非常に複雑であること、タンパク質のダイナミックレンジが非常に大きいことが挙げられる。同様に、自然発生したペプチドを取り扱うプロテオミクスの一分野は、ペプチドミクスと呼ばれている。タンパク質のプロセシングまたは分解によって生じたペプチドを直接解析することは、体液中のバイオマーカーペプチドの検出に有用であると考えられている(非特許文献10参照)。また、ペプチドミクスの一環として、新規バイオマーカーを質量分析技術を利用して取得する方法もまた提案されている(非特許文献11参照)。
【0007】
これまで500種以上のプロテアーゼ/ペプチダーゼが、ヒト細胞で発現していることが知られている(非特許文献12および13参照)。これらは、細胞間領域、細胞外マトリクスおよび血液を含めた生体のあらゆる場所で働いており、他のタンパク質の機能の活性化、細胞タンパク質の分解、さらには癌の進行または抑制に関わっている(非特許文献14〜16参照)。事実、多くのマトリクスメタロプロテアーゼが種々の癌細胞で過剰発現しており、これにより、癌細胞または転移促進に都合のよい微環境の構築を助長している(非特許文献16参照)。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Gail M. H., Muenz L., McIntire K. R., Radovich B., Braunstein G., Brown P. R., Deftos L., Dnistrian A., Dunsmore M., Elashoff R., and et al., J. Natl. Cancer Inst. 1988, 80, 97-101.
【非特許文献2】McCarthy N. J., and Swain S. M., Cancer J. 2001, 7, 175-177.
【非特許文献3】Brundage M. D., Davies D. and Mackillop W. J., Chest. 2002, 122, 1037-1057.
【非特許文献4】Sung H. J. and Cho J. Y., BMB Rep. 2008, 41, 615-625.
【非特許文献5】Maurya P., Meleady P., Dowling P. and Clynes M., Anticancer Res. 2007, 27, 1247-1255.
【非特許文献6】Gamez-Pozo A., Sanchez-Navarro I., Nistal M., Calvo E., Madero R., Diaz E., Camafeita E., de Castro J., Lopez J. A., Gonzalez-Baron M., Espinosa E. and Fresno Vara J. A., PloS One 2009, 4, e7731.
【非特許文献7】Wollscheid B., Bausch-Fluck D., Henderson C., O'Brien R., Bibel M., Schiese R., Aebersold R. and Watts J. D., Nat. Biotechnol. 2009, 27, 378-386.
【非特許文献8】Schiese R., Wollscheid B. and Aebersold R., Mol. Oncol. 2009, 3, 33-44.
【非特許文献9】Ueda K., Takami S., Saichi N., Daigo Y., Ishikawa N., Kohno N., Katsumata M., Yamane A., Ota M., Sato T. A., Nakamura Y. and Nakagawa H., Mol. Cell Proteomics 2010.
【非特許文献10】Villanueva J., Nazarian A., Lawlor K. and Tempst P., Nat. Protoc. 2009, 4, 1167-1183.
【非特許文献11】Ueda K., Sato T., Daigo Y., Ishikawa N., Kohno N., Nakamura Y., and Nakagawa H., AACR-JCA 8th Joint Conference: Cancer Genomics, Epigenomics, and the Development of Novel Therapeutics, 2010.
【非特許文献12】Lopez-Otin C. and Bond J. S., J. Biol. Chem. 2008, 283, 30433-30437.
【非特許文献13】Overall C. M. and Blobel C. P., Nat. Rev. Mol. Cell Biol. 2007, 8, 245-257.
【非特許文献14】Palermo C. and Joyce J. A., Trends Pharmacol. Sci. 2008, 29, 22-28.
【非特許文献15】Lopez-Otin C. and Matrisian L. M., Nat. Rev. Cancer 2007, 7, 800-808.
【非特許文献16】Egeblad M. and Werb Z., Nat. Rev. Cancer 2002, 2, 161-174.
【発明の概要】
【発明が解決しようとする課題】
【0009】
肺癌の血清および血漿にて測定できる腫瘍マーカーとしては、上記したCEAおよびCYFRAのほかにも、SCC、SLX、NSEおよびProGRPが臨床にて使用されている。しかしながら、NSEおよびProGRPは、小細胞肺癌特異的なものであって、非小細胞癌を検出することはできない。また、CEA、CYFRA、SCCおよびSLXにおいては、非小細胞肺癌を検出するための感度および特異度はいずれも低く、また、初期ステージの肺癌を検出することができず、早期の肺癌診断のための使用には適していない。
【0010】
そのため、非小細胞肺癌診断に適用できる新規バイオマーカー、とりわけ早期の肺癌診断にも使用できるバイオマーカーの開発が強く望まれている。
【0011】
そこで、本発明は上記の問題点に鑑みてなされたものであり、その目的は、肺癌診断用の新規バイオマーカーを提供することにある。
【課題を解決するための手段】
【0012】
上述したプロテアーゼおよびペプチダーゼ活性によって、癌の進行または癌に関連した応答を非常によく反映している消化ペプチド断片が生成されるはずである。したがって、ヒト血清またはヒト血漿におけるペプチドミクスプロファイリングは、新規癌マーカー探索の有力なツールであると考えられる。
【0013】
以上を鑑み、本発明者らが鋭意検討を行った結果、ゲル濾過クロマトグラフィおよび質量分析法を用いた大規模スクリーニングによって、肺癌患者の血清中に特異的に存在するペプチドを見出し、本発明者らは本発明を完成させるに至った。
【0014】
本発明に係る肺癌診断用ポリペプチドは、上記課題を解決するために、配列番号1〜19の何れか1つに示されるアミノ酸配列からなる構成である。
【0015】
本発明に係る肺癌の検出方法は、上記課題を解決するために、生体から採取した試料において、配列番号1〜19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドの群より選択される少なくとも1つの肺癌診断用ポリペプチドを検出または測定する工程を含む構成である。
【0016】
また、本発明に係る肺癌の検出方法は、少なくとも配列番号5、12または19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドを検出または測定することが好ましい。
【0017】
また、本発明に係る肺癌の検出方法は、質量分析法により上記少なくとも1つの肺癌診断用ポリペプチドを検出または測定することが好ましい。
【0018】
また、本発明に係る肺癌の検出方法は、上記工程において、上記試料をゲル濾過クロマトグラフィに供して肺癌診断用ポリペプチド画分を取得して、得られた画分について上記少なくとも1つの肺癌診断用ポリペプチドを検出または測定することが好ましい。
【0019】
また、本発明に係る肺癌の検出方法は、上記肺癌診断用ポリペプチドの群より選択される2以上の上記肺癌診断用ポリペプチドを一度に検出または測定することが可能である。
【0020】
また、本発明に係る肺癌の検出方法は、上記試料が血液、血清または血漿であることが好ましい。
【0021】
また、本発明に係る肺癌の検出方法は、上記工程に先立って、上記試料に加熱処理を施すことが好ましい。
【0022】
本発明に係る肺癌患者における治療効果の評価方法は、治療が施される前に生体から採取した試料、および治療が施された後に生体から採取した試料において、配列番号1〜19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドの群より選択される少なくとも1つを検出または測定する第1の工程と、それぞれの検出結果を比較する第2の工程とを含む構成である。
【発明の効果】
【0023】
特定の配列からなる本発明に係る肺癌診断用ポリペプチドを用いることにより、採取した生体試料を用いて肺癌を検出することが可能となる。したがって、本発明に係る肺癌診断用ポリペプチドは、肺癌バイオマーカーとして用いることができる。
【図面の簡単な説明】
【0024】
【図1】バイオマーカーペプチドのスクリーニング方法の概要を示す図である。
【図2】一実施例における血清試料のHPLCによる分離結果のスペクトルの重ね合わせを示す図である。
【図3】一実施例における血清試料のHPLCによる分離結果のスペクトルの一部を拡大して示す図である。
【図4】一実施例における血清試料の質量分析を行った結果のMSスペクトルを示す図である。
【図5】一実施例における血清試料の質量分析を行った結果について作成したクロマトグラム面を示す図である。
【図6】全クロマトグラム面をアラインメントした結果の一部を示す図である。
【図7】一実施例における健常人グループおよび肺癌患者グループの間のt検定におけるp値に従ったクラスターの階層図である。
【図8】一実施例における候補バイオマーカーペプチドについて主成分分析を行った結果を示す図である。
【図9】一実施例における最適なMRMトランジションを設定するために、76個のMRMトランジションを同時にモニタリングした結果を示す図である。
【図10】一実施例における相対定量化解析の結果を示すボックスプロットの図である。
【図11】一実施例における相対定量化解析の結果を示すROCカーブの図である。
【発明を実施するための形態】
【0025】
<1.肺癌診断用ポリペプチド>
本発明に係る肺癌診断用ポリペプチドは、配列番号1〜19の何れか1つに示されるアミノ酸配列からなるポリペプチドである。
【0026】
これらのポリペプチドは、肺癌患者由来の血清において、健常人由来の血清に比してより多く検出される。そのため、血清中の本肺癌診断用ポリペプチドの存在量を測定して健常人における存在量と比較することにより、肺癌を検出することが可能となる。すなわち、本肺癌診断用ポリペプチドは、肺癌検出用のバイオマーカーとして用いることができる。
【0027】
ここで、「肺癌」とは、ヒトの腺癌(肺腺癌)、扁平上皮癌および大細胞癌を含む非小細胞癌を指す。本発明に係る肺癌診断用ペプチドは、とりわけ、腺癌の検出に特に有効である。
【0028】
配列番号1に示されるアミノ酸配列は、ヒトアミロリド感受性カチオンチャネル4(ACCN4)タンパク質のN末端から613番目から624番目までのアミノ酸残基の配列である。このアミノ酸配列からなるポリペプチドを、本明細書では、「ACCN4 613−624」と称する。
【0029】
配列番号2〜5に示されるアミノ酸配列はそれぞれ、ヒトアポリポタンパク質A−IV(APOA4)のN末端から271番目から283番目までのアミノ酸残基の配列、268番目から284番目までのアミノ酸残基の配列、260番目から284番目までのアミノ酸残基の配列、および273番目から283番目までのアミノ酸残基の配列である。これらのアミノ酸配列からなる各ポリペプチドを、本明細書ではそれぞれ、「APOA4 271−283」、「APOA4 268−284」、「APOA4 260−284」、および「APOA4 273−283」と称する。
【0030】
配列番号6に示されるアミノ酸配列は、ヒトアポリポタンパク質E(APOE)のN末端から194番目から214番目までのアミノ酸残基の配列である。このアミノ酸配列からなるポリペプチドを、本明細書では、「APOE 194−214」と称する。
【0031】
配列番号7〜18に示されるアミノ酸配列はそれぞれ、ヒトフィブリノゲンアルファ鎖(FIBA)のN末端から1番目から16番目までのアミノ酸残基の配列、7番目から15番目までのアミノ酸残基の配列、7番目から16番目までのアミノ酸残基の配列、2番目から16番目までのアミノ酸残基の配列、5番目から15番目までのアミノ酸残基の配列、5番目から16番目までのアミノ酸残基の配列、6番目から15番目までのアミノ酸残基の配列、6番目から16番目までのアミノ酸残基の配列、4番目から15番目までのアミノ酸残基の配列、4番目から16番目までのアミノ酸残基の配列、3番目から15番目までのアミノ酸残基の配列、および3番目から16番目までのアミノ酸残基の配列である。これらのアミノ酸配列からなる各ポリペプチドを、本明細書ではそれぞれ、「FIBA 1−16」、「FIBA 7−15」、「FIBA 7−16」、「FIBA 2−16」、「FIBA 5−15」、「FIBA 5−16」、「FIBA 6−15」、「FIBA 6−16」、「FIBA 4−15」、「FIBA 4−16」、「FIBA 3−15」、および「FIBA 3−16」と称する。
【0032】
配列番号19に示されるアミノ酸配列は、ヒトlimbinタンパク質のN末端から306番目から313番目までのアミノ酸残基の配列である。このアミノ酸配列からなるポリペプチドを、本明細書では、「LBN 306−313」と称する。
【0033】
上記した各肺癌診断用ポリペプチドのアミノ酸配列を表1に示す。
【0034】
【表1】

【0035】
上記した肺癌診断用ポリペプチドのうち、ACCN4 613−624、APOA4 260−284、APOA4 273−283、FIBA 1−16、FIBA 2−16、FIBA 5−16、FIBA 6−15、FIBA 6−16、FIBA 4−16、FIBA 3−15、FIBA 3−16、およびLBN 306−313は、健常人と肺癌患者との間で血清における存在量に、より大きな有意差があるため、肺癌を検出するためのバイオマーカーとして、より好ましい。
【0036】
さらに、APOA4 273−283、FIBA 5−16、およびLBN 306−313については、肺癌の手術可能ステージ(ステージI,II,IIIa)での、感度および特異度により優れているため、とりわけ、肺癌の手術可能ステージを検出するためのバイオマーカーとして、特に好ましい。
【0037】
肺癌患者由来の血清において、健常人由来の血清に比してより多く検出されるという観点から、表2にID_001〜ID_118として示した各化合物も肺癌を検出するバイオマーカーとして用いることが可能である。表2に示した各化合物は、ヒトの血清に由来する化合物であって、対応させて示す分子量を有しているペプチドである。なお、表2に示す分子量、m/z、RT(Retention Time)およびChargeは、後述する実施例3に記載した測定法により同定した値である。また各化合物がペプチドまたは修飾ペプチドである場合にそのアミノ酸配列は、後述する実施例4に記載した測定法により同定することが可能である。なお、ID_001〜ID_118として示した各化合物は、そのイオン化における電荷および分子量から、ペプチドまたは修飾ペプチドであると推定される。
【0038】
【表2】

【0039】
すなわち、採取した被験者の血清において、表2に示される分子量を有している化合物を検出または測定することによっても、肺癌を検出することが可能である。
【0040】
なお、ID_001〜ID_118の化合物のうち、少なくともID_002(FIBA 5−16)、ID_004(FIBA 5−15)、ID_005(FIBA 7−16)、ID_007(LBN 306−313)、ID_008(FIBA 3−15)、ID_009(FIBA 1−16)、ID_010(FIBA 3−16)、ID_011(FIBA 7−15)、ID_012(FIBA 4−15)、ID_013(FIBA 2−16)、ID_015(FIBA 4−16)、ID_023(FIBA 2−16)、ID_027(ACCN4 613−624)、ID_031(FIBA 2−16)、ID_032(FIBA 6−16)、ID_033(FIBA 6−16)、ID_039(FIBA 6−15)、ID_051(FIBA 5−15)、ID_064(APOA4 260−284)、ID_069(APOA4 273−283)、ID_075(FIBA 5−16)、ID_085(APOA4 268−284)、ID_093(FIBA 5−16)、ID_099(APOA4 271−283)、ID_108(APOE 194−214)、ID_113(FIBA 3−16)、およびID_114(FIBA 2−16)についてはペプチドであって、データベース検索によってそのアミノ酸配列が同定されており、表1に示すペプチドの何れかに分類されている。
【0041】
<2.肺癌疾患の検出方法>
本発明に係る肺癌疾患の検出方法は、生体から採取した試料において、配列番号1〜19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドの群より選択される少なくとも1つの肺癌診断用ポリペプチドを検出または測定する工程を含めばよく、その他の具体的な工程、ならびに使用する器具および装置は特に限定されるものではない。
【0042】
本明細書において、「肺癌診断用ポリペプチドを測定する」とは、生体試料およびこれを精製して得られる試料における肺癌診断用ポリペプチドの存在量または濃度を測定することを意図している。
【0043】
本発明の検出方法の一例として、被験者由来の生体試料中における少なくとも1つの肺癌診断用ポリペプチドの量を測定し、対照被験者(健常者)由来の生体試料中におけるこの肺癌診断用ポリペプチドの量を測定し、両者を比較することによって、肺癌を検出することができる。具体的には、被験者由来の試料における肺癌診断用ポリペプチドの量と、健常者由来の試料における当該肺癌診断用ポリペプチドの量とを比較して、両者の間で有意な相違が見られた場合には、この被験者が肺癌に罹患しているか、または肺癌に罹患している可能性が高いと判定することができる。健常者由来の試料における当該肺癌診断用ポリペプチドの量は予め測定したものを用いることが可能である。あるいは、予め健常者由来の生体試料における肺癌診断用ポリペプチドの量を測定して、これに基づいて正常濃度範囲を定めておき、被験者由来の生体試料において肺癌診断用ポリペプチドの量がその正常濃度範囲から外れた場合に、肺癌に罹患していると判定することも可能である。
【0044】
ここで「試料」とは、生体(ヒト)から採取した試料であって、上記肺癌診断用ポリペプチドを検出または測定できる試料であれば特に制限されないが、例えば、血液、血清、および血漿などを用いることができる。中でも、血清および血漿が好ましい。
【0045】
肺癌診断用ポリペプチドを検出または測定する方法としては、肺癌診断用ポリペプチドの存在量を定量的もしくは半定量的に決定できるか、または肺癌診断用ポリペプチドの有無を決定できる限り、特に制限されるものではなく、例えば、ELISA、ウェスタンブロットおよび免疫沈降法などの免疫学的手法、ならびに質量分析法などを用いることができる。中でも、以下の観点から質量分析法が好ましい。質量分析装置を用いた質量分析法によれば、特異的な抗体を作製する必要がないため、簡便に肺癌診断用ポリペプチドを検出または測定することができる。また、質量分析装置を用いた質量分析法は、感度および精度に優れているため、より正確な判定を行うことができる。さらに、多成分同時分析が可能なマルチチャネル型の質量分析装置を用いることにより、2以上の肺癌診断用ポリペプチドを一度に検出または測定することが可能となる。2以上の肺癌診断用ポリペプチドを用いて判定を行うことによって、肺癌に罹患しているか否かについてより正確な判定を行うことが可能となる。あるいは、2以上の肺癌診断用ポリペプチドを組み合わせて判定することによって、肺癌がどのステージの状態であるか否かについてより正確な判定を行うことが可能となる。さらには、肺癌以外の他の疾患に関するバイオマーカーも同時に測定することが可能となり、一度に様々な疾患についての検出を試みることが可能となる。また、より精度よく検出をおこなうためには、タンデム質量分析装置(MS/MS)を用いることが好ましい。本発明の検出方法において用いられる質量分析装置としては定量可能であれば特に制限はなく、四重極型および飛行時間型など従来公知の型の質量分析装置を用いることが可能である。
【0046】
肺癌診断用ポリペプチドの検出または測定に用いられる試料は、生体から採取した後、肺癌診断用ポリペプチドの検出または測定を行う前に、加熱処理が施されることが好ましい。試料に加熱処理を施すことによって、試料中に含まれるタンパク質分解酵素を失活させることができる。これにより、肺癌診断用ポリペプチドが検出および測定前に分解されることを防ぐことができる。加熱処理としては、例えば100℃で10分の処理が可能である。あるいは、加熱処理の代わりに、試料を酸変性または有機溶媒沈殿法に供することによって、タンパク質分解酵素によるペプチドの分解を防止してもよい。酸変性では、例えば、1%トリフルオロ酢酸存在下で60℃に加熱してタンパク質のみを沈殿させて、その上清を、検出および測定用試料として用いればよい。また、有機溶媒沈殿法としては、例えば、アセトンおよびアセトニトリルなどの有機溶媒を血清の5〜10倍量添加することによってタンパク質のみを沈殿させて、同様にその上清を、検出および測定用試料として用いればよい。なお、効率の観点から、単純に加熱処理を行うことが好ましい。
【0047】
肺癌診断用ポリペプチドの検出または測定に用いられる試料は、質量分析に供する前に、ゲル濾過クロマトグラフィ(サイズ排除クロマトグラフィ)によって、肺癌診断用ポリペプチドを含む画分として濃縮して、この画分について肺癌診断用ポリペプチドの検出または測定を行うことが好ましい。これにより、血液試料から1ステップで質量分析に供することが可能になる。すなわち、例えばタンパク質のMS分析では必須であるトリプシン消化などのステップを全て省略することができる。したがって、肺癌診断用ポリペプチドの検出および測定を、簡便かつ迅速に行うことができる。また、ゲル濾過クロマトグラフィによる処理であれば、有機溶媒および強酸などの毒劇物を必要としないため、作業従事者における健康被害のリスクが低く、臨床検査技師などの医療従事者であっても前処理を実施することができる。さらに、ゲル濾過クロマトグラフィによる処理は、タンパク質等の高分子に対する排除効果がきわめて高い。そのため、引き続き行われる質量分析による検出工程の再現性を高めることができる。
【0048】
肺癌診断用ポリペプチドを含む画分として回収する画分は、肺癌診断用ポリペプチドを含む限りその分子量の範囲に制限はなく、例えば、分子量が1,000(Da)以上、5,000(Da)以下のペプチドを含むような画分を回収すればよい。
【0049】
これまで様々なアプローチにて、血清および血漿に適用できる疾患バイオマーカー候補タンパク質およびペプチドが同定されてきているが、それらを臨床に応用していくためには、広いダイナミックレンジを有し、正確で多検体を処理できる方法が必要である。その多くは特異的抗体を用いてのELISAの系が担っていたが、ELISAの系に使える特異的な抗体を確立することは困難であり、血清および血漿における疾患バイオマーカーの確証、追証実験を遂行することが困難な場合が多い。
【0050】
これに対して本発明の肺癌診断用バイオマーカーおよび肺癌の検出方法によれば、特異的抗体を製造することなく、多検体を正確に処理でき、高感度で肺癌を検出することができる。
【0051】
<3.肺癌患者における治療効果の評価方法>
本発明に係る肺癌患者における治療効果の評価方法は、治療が施される前に生体から採取した試料、および治療が施された後に生体から採取した試料において、配列番号1〜19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドの群より選択される少なくとも1つを検出または測定する第1の工程と、それぞれの検出結果を比較する第2の工程とを含めばよく、その他の具体的な工程、ならびに使用する器具および装置は特に限定されるものではない。
【0052】
本発明の評価方法の一例として、肺癌患者の生体試料中における少なくとも1つの肺癌診断用ポリペプチドの量を肺癌の治療開始前に予め測定し、肺癌の治療開始後に、同一患者の当該肺癌診断用ポリペプチドの量を測定し、両者を比較することによって、肺癌の治療効果を評価することができる。具体的には、治療開始前の肺癌診断用ポリペプチドの量と、治療開始後の当該肺癌診断用ポリペプチドの量とを比較して、治療開始後の当該肺癌診断用ポリペプチドの量が、健常者の生体試料中における当該肺癌診断用ポリペプチドの量に近づいており、両者(治療開始前および治療開始後)の間で有意な相違が見られた場合には、この患者に対して行った治療に効果があったと評価することができる。
【0053】
なお、肺癌診断用ポリペプチドの検出または測定に用いられる生体試料の調製および精製、ならびに肺癌診断用ポリペプチドの検出方法または測定方法は、上記<2.肺癌疾患の検出方法>の説明を援用することができる。
【0054】
以下に実施例を示し、本発明の実施の形態についてさらに詳しく説明する。もちろん、本発明は以下の実施例に限定されるものではなく、細部については様々な態様が可能であることはいうまでもない。さらに、本発明は上述した実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、それぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。また、本明細書中に記載された文献の全てが参考として援用される。
【実施例】
【0055】
以下に示す各実施例において、「肺癌」は、特に断りのない限り、肺腺癌を指すものとする。
【0056】
各実施例について詳細に説明する前に、本肺癌診断用ポリペプチドのスクリーニングの流れの概要を図1を参照して説明する。
【0057】
本肺癌診断用ポリペプチドのスクリーニングでは、まず、複数の肺癌患者および健常人から血清を採取して加熱処理することによって血清を調製した(実施例1、2)。次いで、それぞれの血清についてサイズ排除クロマトグラフィを行うことによって、特定の分子量画分を収集した(実施例2)。収集した画分についてLC/MS/MSを行い、本画分に含まれるペプチド成分を抽出した(実施例3、4)。抽出したペプチド成分について、非ラベル化定量解析を行った(実施例3)。肺癌患者からのデータと健常人からのデータとを比較し、統計解析を行うことによって、肺癌患者特異的なペプチドを選抜する(実施例3)。ここまでが、スクリーニング段階である。検証段階では、選抜した各ペプチドについて、別の肺癌患者および健常人の血清を対象として、MRM(Multiple Reaction Monitoring)による相対定量解析を行った(実施例5)。得られた結果について統計解析を行うことによって、各ペプチドの評価を行った(実施例6)。以上によって、肺癌の検出に用いられるバイオマーカーを同定した。以下、各実施例について詳細に説明する。
【0058】
〔実施例1:血清の調製〕
インフォームド・コンセントを得た上で、広島大学病院における122人の肺腺癌患者(ステージI〜IV)から、ヒト血清試料を得た。また、正常コントロール用の血清試料を、インフォームド・コンセントを得た上で、広島NTT病院において健康診断を受けている30人の健康なボランティア、および高知大学病院において健康診断を受けている36人の健康なボランティアから得た。
【0059】
血清は、一般的な手法を用いて、遠心分離(1500×g、10分間)によって全血から収集し、−80℃で保存した。
【0060】
〔実施例2:ペプチドーム画分の収集〕
全ての血清を1回だけ凍結融解させ、プロテアーゼおよびペプチダーゼによる血清中の成分の分解を防ぐため、また加熱処理中のタンパク質の凝集を避けるため、すぐに、プロテオミクスグレードの水を用いて4倍に希釈した上で100℃にて10分間インキュベートした。Spin−X 0.45μmスピンフィルタを用いて濾過した後、Prominence HPLC System(島津製作所社製)に連結している10/300 Superdex peptide column(GE Healthcare社製)に、10μlのサンプルを投入した。100mMの酢酸アンモニウムの一定流量(流速0.5ml/min)のもと、試料をHPLCに導入した。カラムを通過した試料について280nmのUV吸収を測定した。結果を図2に示す。
【0061】
図2は、16人分の血清試料に対応するゲル濾過HPLCのスペクトルを重ね合わせて示している図である。図2に示されるように、ゲル濾過HPLCでは、血清タンパク質および血清ペプチドの分離が非常に再現性よく行われていた。
【0062】
次いで、MALDI−TOF−TOF質量分析装置を用いて、サイズ排除クロマトグラフィの精度を評価した。図3は、上記ゲル濾過HPLCの1つのスペクトルの一部を拡大して示している。図3中「1」〜「10」の網掛けによって示す10個の画分(保持時間が14分から34分までの2分毎の画分)について、MALDI−TOF−TOF質量分析装置を用いて解析することによって、サイズ排除クロマトグラフィの精度を評価した。その結果を図4に示す。図4は、10個の画分(Fr.1〜Fr.10)のそれぞれについてのMSスペクトルを示す図である。図4の連続的なMSスペクトルに示されるように、ゲル濾過クロマトグラフィを行うことによって、血清タンパク質および血清ペプチドを分子量に応じて正確に分離することができている。
【0063】
図4に示す結果に基づき、図3中「5」〜「10」の網掛けによって示す6個の画分(保持時間が22分から34分まで)をペプチドーム画分と規定して収集した。これらの画分は1,000〜5,000の分子量に対応している。
【0064】
収集した画分(ペプチド試料)を、Vacuum Spin Drier(TAITEC社製)を用いて乾燥させた。
【0065】
〔実施例3:ペプチドバイオマーカーのスクリーニング〕
肺癌の初期の段階の検出に用いられ得る血清ペプチドを探索するために、健常人および肺癌患者を含む92人の血清試料の定量的ペプチドームプロファイルを取得した。92人の内訳を表3に示す。
【0066】
【表3】

【0067】
92人のうち、62人が肺癌患者である。62人の肺癌患者のうち、32人が手術可能なステージにある肺癌患者(ステージI:n=10、ステージII:n=10、ステージIIIa:n=12)であり、30人が進行ステージにある肺癌患者(ステージIIIb:n=15、ステージIV:n=15)である。これにより、肺癌の進行度を反映したバイオマーカーを取得することが可能となる。
【0068】
まず、実施例1と同様にして血清を採取した。また、実施例2と同様にしてゲル濾過クロマトグラフィによって血清試料を精製した。得られた92個のペプチド試料をそれぞれ、LC/MS/MS解析に供した。具体的には、得られたペプチド試料(乾燥させたペプチドーム画分)を、0.1%のトリフルオロ酢酸を含む2%のアセトニトリルに溶解した。このペプチド試料について、UltiMate 3000 nano−flow HPLC system(DIONEX社製)に連結したQSTAR−Elite mass spectrometer(AB Sciex社製)を用いて解析した。
【0069】
まず、L−Columnビーズを手作業で装填した100μm×200mm tip−column(GL Science社製)を用いて、ペプチド試料を分離した。ペプチド試料の分離には、流速200nl/minの溶媒A(0.1%ギ酸、2%アセトニトリル)および溶媒B(0.1%ギ酸、70%アセトニトリル)を用いた。ここで、溶媒Bは多段階の線形勾配を形成させており、95分間で溶媒Bを5%から55%まで変化させ、その後10分間で55%から95%まで変化させている。
【0070】
溶出物について、直接、1秒のMSサーベイ(m/z 400〜1800)を行ない、その中で最も強度の強かったプリカーサイオン(30カウント以上、+2〜+4の荷電状態、m/z範囲は50/2000)に対して3度のMS/MS測定を行った。なお、サーベイの条件は、SIDA=3.0、最大蓄積時間=2.0秒である。すでに標的にされていたプリカーサイオンは、40秒間の反復MS/MS取得(100mDaの質量許容度)からは除外した。
【0071】
QSTAR−Eliteにおいて得られた92個のrawデータファイル(.wiffフォーマットおよび.wiff.scanフォーマット)を、Expressionist RefinerMSモジュール(Genedata社製)に直接導入した。このモジュールを用いて、まず、図5に示すようなMSクロマトグラム面を作成した。また、全てのクロマトグラムについて、装置特異的ノイズおよび化学ノイズを実質的に差し引いて除去した。具体的には、クロマトグラム化学ノイズサブトラクションアクティビティにおいて、RT Window=3scanとして平坦化を実施した。バックグラウンドのノイズを除去するために、ピーク強度を下記のように規定した:
Intensitysubtracted=max(Intensityoriginal−Quantile−Threshold,0)
maxは引数のうち大きいものをとる関数である。ここでは、Quantile値=50%、Intensity Threshold=15cpsとした。また、少なくとも以下の何れか1つの基準を満たすシグナルをノイズピークとみなして、差し引き除去した:
・RT Window>50scan
・Minimum RT Length=4scan
・Minimum m/z length=8data point。
【0072】
次いで、各MSクロマトグラム面における保持時間(RT)グリッドを、92個のクロマトグラム面の間で正しくアラインメントした。アラインメントの結果の一部を図6に示す。アラインメントを行うことにより、複数の試料を用いた確実な定量解析を行うことができるようになる。アラインメントの際のクロマトグラムRTアラインメントアクティビティにおけるパラメータは以下の通りである:
・m/z Window=0.1Da
・RT Window=0.2min
・Gap Penalty=1
・RT search interval=5min。
【0073】
次いで、特定のクロマトグラム面では検出されないピークの位置情報も確実に取得するために、クロマトグラム積算ピーク検出アクティビティによって、一時的に平均化したクロマトグラムにおけるピークを検出した。その際のパラメータは以下の通りである:
・Summation Window=5scan
・Overlap=50
・Minimum Peak Size=4scan
・Maximum Merge Distance=10data point
・Gap/Peak Ratio=1
・Method=curvature−based peak detection
・Peak Refinement Threshold=5
・Consistency Filter Threshold=0.8
・Signal/Noise Threshold=1。
【0074】
その後、2段階の積算アイソトープクラスタリングアクティビティによって、2Dピークの中からアイソトープパターンを同定した。同一のペプチドシグナルに属する各アイソトープピークをピーククラスターとして分類した。クラスターのいくつかの例を図5中の一点破線枠で示している。第1のクラスタリングは以下の基準に沿って実施した:
・Minimum Charge=1
・Maximum Charge=10
・Maximum Missing Peaks=0
・First Allowed Gap Position=3
・Ionization=protonation
・RT Tolefance=0.1min
・m/z Tolerance=0.05Da
・Isotope Shape Tolerance=10.0
・Minimum Cluster Size Ratio=1.2。
【0075】
第2のクラスタリングは、
・Minimum Cluster Size Ratio=0.6
・Reuse Existing Clusters=ture
とした以外は第1のクラスタリングと同一のセッティングによって実施した。
【0076】
この結果、92個の血清試料から、電荷状態が+1〜+10の何れかである、重複しない12,396個のピーククラスターが検出された。
【0077】
検出された全てのクラスターピークの情報(m/z、保持時間、および強度を含む)を、ABSファイルとして出力した。
【0078】
出力されたABSファイルをExpressionist Analystモジュールにおいてロードした。さらなる統計的な検討のために、この中から、電荷状態が+2〜+6の何れかである3,537個のピーククラスターを利用した。
【0079】
血清レベルにおいて肺癌特異的な変化を示しているペプチドのピークを抽出するために、健常人グループ(n=30)と肺癌患者グループ(n=62)との間で、スチューデントのt検定を実施した。スチューデントのt検定に際して、92個の血清試料の中でみられたピーク強度のバリエーションは、それぞれの血清試料における強度の中央値を10,000に固定することによって標準化した。標準化した強度データを用いて、健常人グループと肺癌患者グループとの間で、スチューデントのt検定を実施した。この結果を図7に示す。
【0080】
図7は、スチューデントのt検定におけるp値に従ったクラスター(ペプチド)の階層図である。この検定におけるp値がp<0.01であり、2つのグループ間での強度差が5倍以上であるものを、バイオマーカーとして使用し得るペプチドのピークとして抽出した。その結果、118個のペプチドが同定された(上記表2に示すID_001〜ID_118)。
【0081】
これら118個のペプチドに関して、92人の被験者を健常人グループおよび肺癌患者グループにグループ分けするための統計的な有効性を評価するために、これら118個の候補バイオマーカーペプチドを用いて主成分分析を行った。結果を図8に示す。図8に示されるように、92人の被験者を健常人グループおよび肺癌患者グループに正しくグループ分けすることができた。すなわち、118個のペプチドの定量値は、被験者を健常人グループおよび肺癌患者グループに正確にグループ分けするのに統計的に充分であることが示された。したがって、これら118個のペプチドは、肺癌を検出するためのバイオマーカーとして使用できる。
【0082】
以上、ゲル濾過クロマトグラフィおよびLC/MS/MSを用いたバイオマーカーのスクリーニングによって、肺癌バイオマーカーとして使用できる118個のペプチドを得た。
【0083】
〔実施例4:LC/MS/MSによるペプチド配列の同定〕
QSTAR−Elite LC/MS/MSおよびMASCOTデータベース検索を用いて、包括的ペプチド配列決定を実施した。MASCOTデータベース検索は、Analyst QS 2.0 ソフトウェア(AB Sciex社製)を用いて実施した。MS/MSデータについての検索は、以下のパラメータを用いて、SwissProt57.4(20,400配列)からのヒトタンパク質データベースに対して実施した:
・Taxonomy=Homo sapiense
・Enzyme=None
・Fixed modifications=None
・Variable modifications=Oxidation(Met)
・MS tolerance=50ppm
・MS/MS tolerance=0.1Da
予測値(Expectation value)<0.05である場合に、MS/MSデータのペプチドが、その予測値に対応する配列からなるものと認定した。
【0084】
92人の被験者の血清試料に由来する230,657個のMS/MSクエリのうち、5,382個のペプチドは、MASCOTの期待値が<0.05でもって配列決定された。重複したものを除くと、424種類のペプチドが同定された。これらは、106種のタンパク質に対応するものであった。
【0085】
上述の118個のペプチドに関していえば、19個について配列を決定することができた。配列決定がなされた19個のペプチドのうち、12個のペプチドはフィブリノゲンアルファ鎖(FIBA)由来であり、4個のペプチドは、アポリポタンパク質A−IV(APOA4)由来であり、残りは、それぞれ、アミロリド感受性カチオンチャネル4(ACCN4)、アポリポタンパク質E(APOE)およびlimbin(LBM)由来であった。19個のペプチドの各アミノ酸配列は、上述の表1に示している。
【0086】
〔実施例5:MRMによる定量化〕
本ペプチドの量的再現性を評価するため、また、配列決定された19個のバイオマーカーペプチドの臨床有用性を評価するために、新たに調製した96人の被験者の血清試料について、MRM(Multiple Reaction Monitoring)法を用いて、ラベル化を伴わない相対定量化解析を実施した。96人の被験者の内訳を表4に示す。本実施例における各被験者は、表3に示した被験者とは別の被験者である。
【0087】
【表4】

【0088】
19個のペプチドそれぞれに特異的で最適なMRMトランジションを設定するために、スクリーニングの段階で検出されたプリカーサイオンのm/z値をQ1チャンネルとしてセットし、MS/MSスペクトルの中から最も強度が高かった4つのフラグメントイオンを選択して各m/z値をQ3チャンネルとしてセットした。血清ペプチドーム試料について、4000 QTRAP マススペクトロメトリを用いて、全76(19×4)個のMRMトランジションを同時にモニタリングした。
【0089】
質量分析に先立って、実施例2と同様に、採取した血清試料をSuperdexペプチドカラムクロマトグラフィ処理に供した。抽出した試料(ペプチド)を乾燥させた後、2%アセトニトリルと0.1%トリフルオロ酢酸とを含み、さらに1fmol/μlのBSAを含むトリプシン消化溶液中に溶解した。次いで、Paradigm MS4 PAL nano−flow HPLC system(AMR社製)に連結している4000 QTRAP質量分析装置(AB Sciex社製)を用いて解析した。
【0090】
ペプチド試料の分離は、L−Column ODSビーズ(化学物質評価研究機構製)を手作業で装填した100μm×100mm tip−column(GL Science社製)を用いて行った。ペプチド試料の分離には、流速200nl/minの溶媒A(0.1%ギ酸、2%アセトニトリル)および溶媒B(0.1%ギ酸、90%アセトニトリル)を用いた。ここで、溶媒Bは線形勾配を形成させており、10分間で溶媒Bを2%から100%まで変化させている。76個のモニタリングの結果を図9に示す。図9中の各クロマトグラムは、QSTSR−Elite LC/MS/MS解析において最も高い強度を示した4つのフラグメントイオンについて4000 QTRAP システムを用いてモニタリングした、4つのクロマトグラムを重ね合わせて示している。
【0091】
各ペプチドについて、特異的な溶出保持時間を決定した。そして、各ペプチドについて、4つのMRMトランジションの中から最も強いMRMクロマトグラムのピークを示す最適なMRMトランジションを選択した。それぞれのMRMトランジションの情報を表5に示す。
【0092】
【表5】

【0093】
FIBA 3−16およびFIBA 5−16の2つのペプチドは、QSTAR−Eliteおよび4000 QTRAP システムの間でのフラグメントイオンの強度が同一のオーダーを示していた。
【0094】
次に、36人の健常人(正常コントロール)由来の血清試料および60人の肺癌患者由来の血清試料を用いて、MRMによる相対定量解析を実施した。解析は、繰り返して行った。
【0095】
まず、19個のバイオマーカーペプチドのイオンおよびBSA由来の5個のペプチドのイオンを、Analyst1.5ソフトウェア(AB Sciex社製)のMRMモードによって同時にモニタリングした。MRMクロマトグラムを得た後、MultiQuantソフトウェア(AB Sciex社製)を用いて、このクロマトグラムを平滑化し、定量化した。各試料におけるMRMのピーク領域は、下記式:
標準化後のピーク領域=1000×(rawデータのピーク領域)/(5個のBSA断片におけるピーク領域の積算)
のようにして標準化した。19個のバイオマーカーペプチドの血清におけるレベルを、標準化および平均化した後のMRMクロマトグラムピーク領域から算出した。算出結果をボックスプロットとして図10に示す。図10の横軸において「N」は、健常人由来の血清試料であることを表しており、「I」〜「IV」はそれぞれ、肺癌のステージがステージI〜IVにある肺癌患者由来の血清試料であることを表している。ボックスプロットはRアルゴリズムによって作成した。それぞれにおいてボックスは、標本の25%分位点から75%分位点までを表している。ボックスを横切る線は中央点を表している。ボックスの上部および下部から出ている線の長さはそれぞれ、ボックスの長さの1.5倍の範囲内にあるデータの最大値および最小値によって規定されている。
【0096】
〔実施例6:MRMによる定量に基づく統計評価〕
肺癌の早期検出におけるバイオマーカーペプチドの有効性を評価するために、スチューデントのt検定によって、肺癌の手術可能ステージ(ステージI,II,IIIa)のグループおよび健常人グループの間で定量結果を統計的に比較評価した。結果を図10中に示している。
【0097】
図10に示されるように、19個のペプチドのうち、15個のペプチド(ACCN4 613−624、APOA4 271−283、APOA4 268−284、APOA4 260−284、APOA4 273−283、APOE 194−214、FIBA 1−16、FIBA 2−16、FIBA 5−16、FIBA 6−15、FIBA 6−16、FIBA 4−16、FIBA 3−15、FIBA 3−16、LBN 306−313)については、2つのグループ間で、血清レベルにおいて有意な差(p<0.05)を示した。一方、残りの4個のペプチド(FIBA 4−15、FIBA 5−15、FIBA 7−15およびFIBA 7−16)は、有意な差(p<0.05)を示さなかった。
【0098】
同様に、19個のペプチドについて、スチューデントのt検定によって、肺癌の進行ステージ(ステージIIIb,IV)のグループと、健常人グループとを比較した。結果を図10中に示している。
【0099】
図10に示されるように、15個のペプチド(ACCN4 613−624、APOA4 260−284、APOA4 273−283、FIBA 1−16、FIBA 7−15、FIBA 7−16、FIBA 2−16、FIBA 5−16、FIBA 6−15、FIBA 6−16、FIBA 4−15、FIBA 4−16、FIBA 3−15、FIBA 3−16、LBN 306−313)については、2つのグループ間で、血清レベルにおいて有意な差(p<0.05)を示した。一方、4個のペプチド(APOA4 268−284、APOA4 271−283、FIBA 5−15およびAPOE 194−214)は、2つのグループ間で、有意な差(p<0.05)を示さなかった。
【0100】
さらに、バイオマーカーの感度(sensitivity)および特異度(specificity)を評価するために、ROCカーブ解析を実施した。ROCカーブは、Rアルゴリズムによって作成した。カットオフ値は、(sensitivity,specificity)=(1,1)からの距離が最小となる点にセットした。解析結果の一部を図11示す。図11中、「Sens」は感度、「Spec」は特異度、「PV+」は正の予測値(positive predictive value)、そして「PV−」は負の予測値(negative predictive value)を表している。
【0101】
手術可能ステージにある肺癌患者の検出を行うための感度の値を前提とすると、FIBA 6−15、APOA4 273−283、FIBA 5−16およびLBN 306−313は、感度の値がそれぞれ、87.1%、61.3%、58.1%および58.1%であったため、優れたバイオマーカーであることが示された。なかでも、APOA4 273−283、FIBA 5−16およびLBN 306−313は、特異度がそれぞれ、88.9%、94.4%および100%と著しく高かった。したがって、これら3つのペプチドは、肺癌を初期のステージで検出できる、より効果的なバイオマーカーであることが示された。
【産業上の利用可能性】
【0102】
以上のように、本発明は、肺癌を早期に検出することができる。したがって、本発明は、診断医療分野および保健医学分野に広く利用することができる。
【特許請求の範囲】
【請求項1】
配列番号1〜19の何れか1つに示されるアミノ酸配列からなる、肺癌診断用ポリペプチド。
【請求項2】
生体から採取した試料において、配列番号1〜19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドの群より選択される少なくとも1つの肺癌診断用ポリペプチドを検出または測定する工程を含む、肺癌の検出方法。
【請求項3】
少なくとも配列番号5、12または19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドを検出または測定することを特徴とする請求項2に記載の検出方法。
【請求項4】
質量分析法により上記少なくとも1つの肺癌診断用ポリペプチドを検出または測定することを特徴とする請求項2または3に記載の検出方法。
【請求項5】
上記工程において、上記試料をゲル濾過クロマトグラフィに供して肺癌診断用ポリペプチド画分を取得して、得られた画分について上記少なくとも1つの肺癌診断用ポリペプチドを検出または測定することを特徴とする請求項2〜4の何れか1項に記載の検出方法。
【請求項6】
上記肺癌診断用ポリペプチドの群より選択される2以上の上記肺癌診断用ポリペプチドを一度に検出または測定することを特徴とする請求項2〜5の何れか1項に記載の検出方法。
【請求項7】
上記試料が血液、血清または血漿であることを特徴とする請求項2〜6の何れか1項に記載の検出方法。
【請求項8】
上記工程に先立って、上記試料に加熱処理を施すことを特徴とする請求項2〜7の何れか1項に記載の検出方法。
【請求項9】
肺癌患者における治療効果の評価方法であって、
治療が施される前に生体から採取した試料、および治療が施された後に生体から採取した試料において、配列番号1〜19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドの群より選択される少なくとも1つを検出または測定する第1の工程と、
それぞれの検出結果を比較する第2の工程とを含む、治療効果の評価方法。
【請求項1】
配列番号1〜19の何れか1つに示されるアミノ酸配列からなる、肺癌診断用ポリペプチド。
【請求項2】
生体から採取した試料において、配列番号1〜19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドの群より選択される少なくとも1つの肺癌診断用ポリペプチドを検出または測定する工程を含む、肺癌の検出方法。
【請求項3】
少なくとも配列番号5、12または19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドを検出または測定することを特徴とする請求項2に記載の検出方法。
【請求項4】
質量分析法により上記少なくとも1つの肺癌診断用ポリペプチドを検出または測定することを特徴とする請求項2または3に記載の検出方法。
【請求項5】
上記工程において、上記試料をゲル濾過クロマトグラフィに供して肺癌診断用ポリペプチド画分を取得して、得られた画分について上記少なくとも1つの肺癌診断用ポリペプチドを検出または測定することを特徴とする請求項2〜4の何れか1項に記載の検出方法。
【請求項6】
上記肺癌診断用ポリペプチドの群より選択される2以上の上記肺癌診断用ポリペプチドを一度に検出または測定することを特徴とする請求項2〜5の何れか1項に記載の検出方法。
【請求項7】
上記試料が血液、血清または血漿であることを特徴とする請求項2〜6の何れか1項に記載の検出方法。
【請求項8】
上記工程に先立って、上記試料に加熱処理を施すことを特徴とする請求項2〜7の何れか1項に記載の検出方法。
【請求項9】
肺癌患者における治療効果の評価方法であって、
治療が施される前に生体から採取した試料、および治療が施された後に生体から採取した試料において、配列番号1〜19に示されるアミノ酸配列からなる肺癌診断用ポリペプチドの群より選択される少なくとも1つを検出または測定する第1の工程と、
それぞれの検出結果を比較する第2の工程とを含む、治療効果の評価方法。
【図1】


【図5】


【図7】


【図8】


【図2】


【図3】


【図4】


【図6】


【図9】


【図10】


【図11】




【図5】


【図7】


【図8】


【図2】


【図3】


【図4】


【図6】


【図9】


【図10】


【図11】


【公開番号】特開2012−51822(P2012−51822A)
【公開日】平成24年3月15日(2012.3.15)
【国際特許分類】
【出願番号】特願2010−194268(P2010−194268)
【出願日】平成22年8月31日(2010.8.31)
【出願人】(503359821)独立行政法人理化学研究所 (1,056)
【出願人】(000001993)株式会社島津製作所 (3,708)
【Fターム(参考)】
【公開日】平成24年3月15日(2012.3.15)
【国際特許分類】
【出願日】平成22年8月31日(2010.8.31)
【出願人】(503359821)独立行政法人理化学研究所 (1,056)
【出願人】(000001993)株式会社島津製作所 (3,708)
【Fターム(参考)】
[ Back to top ]

