胃保持性の経口用高用量亜鉛調製物
徐放性の亜鉛組成物は、重炭酸カリウムを含むことが好ましい。治療の必要な被験者に亜鉛を供給する方法は、被験者に徐放性亜鉛組成物を有効量投与することを含み、該亜鉛組成物は、重炭酸カリウムを含む。
【発明の詳細な説明】
【技術分野】
【0001】
<発明者>
ブルーワー,ジョージ ジェイ. 米国市民、アメリカ合衆国 ミシガン,アン アーバー;カンザー,ステイーブ エイチ. 米国市民、アメリカ合衆国 ミシガン,アン アーバー;ライオン,マックス 米国市民、アメリカ合衆国 ワシントン,シアトル;ニューサム,デビッド エイ.医学博士、米国市民 アメリカ合衆国 フロリダ,セント ピーターズバーグ;及び、クラウチ,デニス 米国市民,アメリカ合衆国 ミシガン,ビックスバーグ
<譲受人>
アデオナ ファーマシューティカル、インコーポレイテッド(デラウェア州、米国、会社)、アメリカ合衆国 48108 ミシガン,アン アーバー,バーシティ ドライブ 3930
<関連出願の記載>
2009年11月1日に出願した米国仮特許出願第61/257,034号は、引用を以て本明細書に組み込まれ、その優先権をここで主張する。
本明細書に引用を以て組み込まれる特許及び特許出願は、発明者の一人以上を記載しているか、又は譲受人としてアデオナと記載しているすべての特許及び特許出願であり、以下に記載したものを含む:
2006年1月10日出願の米国特許出願第11/621,962号。この出願は、2007年9月6日にUS2007-0207191 A1として出願公開され、米国仮特許出願第60/757,672号(2006年2月7日出願)、発明の名称「PHARMACEUTICAL COMPOSITIONS AND METHODS TO ACHIEVE AND MAINTAIN A TARGETED AND STABLE COPPER STATUS AND PREVENT AND TREAT COPPER-RELATED CENTRAL NERVOUS SYSTEM DISEASES」と、米国仮出願第60/765,812号、発明の名称「PHARMACEUTICAL COMPOSITIONS AND METHODS TO ACHIEVE AND MAINTAIN A TARGETED AND STABLE COPPER STATUS AND PREVENT AND TREAT COPPER-RELATED CENTRAL NERVOUS SYSTEM DISEASES」と、2006年1月10日出願の米国仮出願第60/757,672号、発明の名称「PHARMACEUTICAL COMPOSITIONS AND METHODS TO ACHIEVE AND MAINTAIN A TARGETED COPPER STATUS」の優先権を主張している。
2007年1月10日出願のPCT特許出願第PCT/US2007/60345号。この出願は、WO 2007/084818 A2として出願公開され、2006年2月7日出願の米国仮出願第60/765,812号、発明の名称「PHARMACEUTICAL COMPOSITIONS AND METHODS TO ACHIEVE AND MAINTAIN A TARGETED AND STABLE COPPER STATUS AND PREVENT AND TREAT COPPER-RELATED CENTRAL NERVOUS SYSTEM DISEASES」と、2006年1月10日に出願された米国仮出願第60/757,672号、発明の名称「PHARMACEUTICAL COMPOSITIONS AND METHODS TO ACHIEVE AND MAINTAIN A TARGETED COPPER STATUS」の優先権を主張している。
2007年3月12日出願の米国仮出願第60/894,388号、発明の名称「ORAL ZINC MEDICANTS USEFUL FOR SAFELY LOWERING FREE COPPER ABSORPTION AND FREE COPPER LEVELS」と、2008年3月12日出願の実用特許出願PCT/US2008/056743号、発明の名称「ORAL ZINC MEDICANTS USEFUL FOR SAFELY LOWERING FREE COPPER ABSORPTION AND FREE COPPER LEVELS」。
2009年4月15日出願の米国仮出願第61/169,684号、発明の名称「METHODS AND DEVICES FOR MEASURING DEFECTIVE CERULOPLASMIN」。
<連邦政府による資金提供を受けた研究開発の記載>
なし
<マイクロフィッシュ添付>
なし
本発明は栄養補給剤及び/又は医薬品に関する。より具体的には、本発明は、治療が必要な被験者に亜鉛を供給する栄養補給剤又は医薬品に関する。
【背景技術】
【0002】
亜鉛は必須栄養素であり、人体の中で2番目に豊富な微量元素であって、目の中では、最も豊富な微量元素である。亜鉛は、200以上の酵素の活性化と、400以上の核調節元素のDNA結合能力に必要とされる。亜鉛が、抗酸化剤として機能することは知られており、スルフヒドリル基を酸化から保護し、銅と鉄と拮抗させることで、酸化還元サイクルの結果物であるヒドロキシルラジカルの生成を減少させ、抗酸化性タンパク質メタロチオネイン(MT)を誘導することで損傷したヒドロキシル基を除去するものである。
【0003】
酸化ストレスや抗酸化能力の低下は、例えば循環器病、発がん、神経障害、炎症、中心神経系、呼吸、腎臓疾患、再かん流損傷及び黄斑変性等の病的状態に関与することが示唆されている。加齢黄斑変性症(AMD)は、米国の60歳以上の人々の失明の一番の原因である。この病気の一因は網膜色素上皮(RPE)における加齢性欠損であると考えられているが、病気の原因が未だ知られておらず、治療法がない。発明者らの研究室では、酸化防止剤カタラーゼ、MT及び亜鉛は、加齢と、単離されたヒト網膜色素上皮細胞の年齢関連性黄斑変性の兆候とによって減少することをこれまでに報告している。
【0004】
亜鉛は、前立腺の状態及び機能、免疫システム機能及び癌に対して有益な効果を有すると考えられている。
【0005】
システインは、硫黄含有化合物(例えばピルベート、タウリン及びグルタチオン)の生成のための必須アミノ酸ではないが、正常組織代謝の保護及び修復において重要である。タンパク質内でのシステインの存在は、一般的には、抗酸化活性を含む保護機能を付与すると考えられている。
【0006】
グルタチオンの合成は、主にシステインの利用可能性によって調整される。体が毒性状態(例えば過酸化物生成、電離放射線、アルキル化剤又は他の反応中間体)にあるときに、グルタチオンレベルの増加が有効である。
【0007】
未熟児は、システインレベルが低いので、高圧酸素治療の後、目の中に形成されるヒドロペルオキシドの酸化損傷の影響を受けやすい。
【0008】
Uzzoらによって示されるように、亜鉛は前立腺癌の発生及び進行を阻害することができる[Uzzo,R.G.et al.,Zinc inhibits nuclear factor-kappa B activation and sensitizes prostate cancer cells to cytotoxic agents" Clin. Cancer Res. 2002 8:3579-83.]。
【0009】
亜鉛は、多くの皮膚科学状態において医学的に有益であることが示されている。例えば、Pierard C.Franchiment et al.のランダム化されたマルチセンターの研究を参照することができる[A Multicenter Randomized Trial of Ketoconazole 2% and Zinc Pyrythione 1% Shampoos in Severe Dandruff and Seborrheic Dermatitis", Skin Pharmacal Appl Skin Physiol. 2002 15:434-41]。
【0010】
以下の米国特許、並びに本明細書及び米国特許第6,586,611号及び第7,164,035号の中で記載された全ての参考文献は、引用を以て本明細書に組み込まれる。
米国特許番号は次のとおりである。
5,844,089 Genetically Fused Globin-like Polypeptides Having Hemoglobin-like Activity
5,844,088 Hemoglobin-like Protein Comprising Genetically Fused Globin-like Polypeptides
5,801,019 DNA Encoding Fused Alpha-beta Globin Pseuodimer and Productionof Pseudotetrameric Hemoglobin
5,798,227 Co-expression of Alpha and Beta Globins
5,744,329 DNA Encoding Fused Di-beta Globins and Production of Pseudotetrameric
Hemoglobin
5,739,011 DNA for the Production of Multimeric Hemoglobins
5,599,907 Production and Use of Multimeric Hemoglobins
5,545,727 DNA Encoding Fused Di-alpha Globins and Production of Pseudotetrameric
Hemoglobin
5,401,770 Antipruritic Agents and Antipruritic Compositions Thereof
3,941,818 1: 1 Zinc Methionine Complexes
4,021,569 Method of Nutritional Supplementation For Zinc and Methionine by Ingesting 1: 1 Zinc Methionine Complexes
4,764,633 Ferric ion Catalyzed Complexation of Zinc and/or Manganese With Alpha Amino Acids
6,429,219 Treatment of Chronic Hypertension and Related Conditions with Thiol Complexes
6,586,611 Zinc-monocysteine Complex and Method of Using Zinc-cysteine
7,164,035 Zinc-monocysteine Complex and Method of Using Zinc-cysteine Complexes
6,531,608 Various Thial Complexes, Processes For Their Synthesis and ClinicalApplications
5,911,978 Hair Treatment Composition
W02007/084818 Pharmaceutical Compositions and Methods to Achieve and Maintain a Targeted and Stable Copper Status and Prevent and Treat Copper-related Central Nervous System Diseases
米国特許第5,401,770号は、外用鎮痒剤における亜鉛-システイン錯体の使用を開示している。
AREDSは、69.6mg/日の亜鉛を用いている。しかしながら、特許されたAREDSの調製物(米国特許第6,660,297号)は、視力の急速な向上に及んでいない。
Tanaka et al.,「The Inhibitory Effect And The Mechanism Of Ethanol Absorption By Zinc Complex In Mouse Gastrointestinal Tract」, Folia Pharmacological Society Japan 111, 327-336 (1998);
Zegzhda et al.,「COMPLEX COMPOUNDS OF ZINC AND CADMIUM WITH CYSTEIN」, COORDINATION CHEMISTRY, Vol. 2, No.8, pp. 1031-1035 (1976).
【発明の概要】
【0011】
本発明は、米国特許公開公報第2007/0207191A1号、特に段落92〜141、段落158、及び請求項15、30、24、25、及び36に開示されている組成物及び方法の実施例を含む。米国特許公開公報第2007/0207191A1号は、引用を以て本明細書に組み込まれる。
【0012】
譲受人は、アルツハイマー病、軽度認識障害、加齢黄斑変性症、ウィルソン病、統合失調症、ハンチントン病、ルー・ゲーリック病(筋萎縮性側索硬化症)及び他の神経変異性疾患の治療のための経口亜鉛調製物を開発し、これらに関する米国特許並びに係属中の米国出願及び国際特許出願について排他的ライセンスを有している。本願並びに本願の仮出願及び実用特許出願の共同発明者の二人、デイビッド エイ.ニューサムM.D.と、ジョージ ジェイ.ブルーアーM.D.は、神経変性疾患の治療に経口亜鉛を使用した先駆者である。ニューサムは、加齢黄斑変性症(今ではAMDの乾燥状態(dry form)の治療の標準となっている)の経口亜鉛治療の発明者及び先駆者であり、ジョージ ジェイ.ブルーアーM.D.は、ウィルソン病疾患の経口酢酸亜鉛治療の発明者及び先駆者である(現在の標準的治療で有り、Galzin(登録商標)としてFDA承認されている)。これら2人の臨床研究者は、その数十年の経験に基づいて、既存の経口亜鉛治療剤の重大な欠点に非常に精通しており、前述の関連特許出願及び本願の譲受人は、従来及び現在市販されている亜鉛製剤と比較して、はるかに優れた忍容性及び投与便宜性を有する技術的に進んだ経口亜鉛製剤を発明し、実用化した。手法は独特であり、利点は相当なものである。
【0013】
a.忍容性(tolerability)の改善
高投与量の経口亜鉛調製物は、用量依存性で胃刺激の高い発生率と関連性があり、典型的には嘔気及び腹痛として発現する。その結果、経口亜鉛調製物(例えば、AMDに対して一般的に用いられる調製物)は、一般的には、食物と共に摂取することが推奨される。その理由は、経口亜鉛が胃内の食物と結合することにより、胃刺激の可能性を減少させるからである。しかしながら、ブルーアー博士がウィルソン病患者に対して実施した多くの研究では、腸のメタロチオネインを誘導して、血清中の非セルロプラスミン結合(遊離)銅レベルを低下させる効果、ひいては、CSF/CNSコンパートメント中の銅の曝露及びレベルを低下させる効果をもたらすために、経口亜鉛治療は、食物と共に投与しなければならないことが示されている。ウィルソン病用として、ジョージ ジェイ.ブルーアーM.D.によって開発され、FDAに1997年承認された経口酢酸亜鉛カプセル調製物は、承認された元素亜鉛(elemental zinc)25mg用量の最小投与量で、45%の患者が嘔気を催し、承認された元素亜鉛50mg用量の高投与量では、91%の患者が嘔気を催した。元素亜鉛100mgの投与量では、91%の患者が嘔気を催し、18%の患者が、嘔吐した。例えば、次の文献を参照することができる。[Henderson LM, Brewer GJ, Dressman JB, Swidan SZ,DuRoss DJ, Adair CH, Barnett JL, Berardi RR, Use of zinc tolerance test and 24-hour urinary zinc content to assess oral zinc absorption, JAm Call Nutr. 1996 Feb;15(1):79-83]及び[Henderson LM, Brewer GJ, Dressman JB, Swidan SZ, DuRoss DJ, Adair CH, Barnett JL, Berardi RR., Effect of intragastric pH on the absorption of oral zinc acetate and zinc oxide in young healthy volunteers, JPEN J Parenter Enteral Nutr. 1995]。 なお、元素亜鉛50mgを供給する硫酸亜鉛を食物と共に摂取した場合も同じ効果が観察された。Sep-Oct;19(5):393-7. Samman S, Roberts,DCK, Med. Journal Australia, 1987 Vol. 146, p. 247-9.参照。
【0014】
経口亜鉛治療の場合、胃刺激の問題は、単に徐放技術及び遅延放出技術を単独で用いることによっては解決することができない。その理由は、このような方法により、亜鉛の放出が遅延すると、生物学的利用能が低下するため、亜鉛について、重要な近位腸部を迂回するか、又は近位腸部への暴露不足を生じるためであり、前記近位腸部では、亜鉛及び銅は十分に吸収されなければならず、また、腸内メタロチオネインが、血清銅、特に“血清遊離銅(serum free copper)”と称されるセルロプラスミン非結合銅に作用できるように誘導されなければならないからである。
【0015】
発明者らは、90人の被験者について観察的臨床試験を行なった。被験者の内訳は、30人の正常被験者(age-matched control)と、譲受人により支援される30人のアルツハイマー病患者と、30人のパーキンソン病患者である。アルツハイマー型患者は、正常被験者(p=0.0145)と比較して、亜臨床的及び臨床的な亜鉛欠乏状態にあり、血清銅(p=0.0000015)中の血清セルロプラスミン結合が損なわれ、セルロプラスミン非結合銅(P=0.045)の血清の割合が上昇することを見出した。発明者らはまた、パーキンソン病患者も、正常被験者(p=0.045)と比較して、血清遊離銅の割合が増加することも見出した。これらの知見は、2009年4月15日に出願された仮特許出願第61/169,684号、発明の名称「Methods and Devices for Measuring Defective Ceruloplasmin」の主題である。
【0016】
発明者らは、胃に長時間保持される胃保持性徐放技術を、この長期に亘る問題に適用することにより、経口亜鉛治療の忍容性を大きく向上させることができるようにしたもので、銅の大部分が吸収される近位腸において、生物学的利用能と、腸にメタロチオネインを誘導するのに必要な、最小限の亜鉛暴露を犠牲にすることなく、メタロチオネイン誘導する胃腸の望ましい位置を逸しない。重要なことは、賦形剤及び結合剤を用いて胃の中での保持時間を長くし、亜鉛放出を遅延させることであり、賦形剤と結合剤を組み合わせて胃液内でピルに膨張と発泡効果特性をもたらし、ピルの浮力を大きくして、胃の中での滞留時間とピル可動性を増加させるものである。好ましい実施例において、このような効果は、全てが安全であると一般的に見なされ(Generally Regarded as Safe;GRAS)、食品業界において用いられている成分及び賦形剤が100%のもので達成されることができる。更にまた、基礎成分又は制酸剤(例えば重炭酸カリウム及び重炭酸ナトリウム)を添加することにより、食物を摂取しなくても、経口亜鉛治療の忍容性が大いに改善されることを見出した。この技術を用いると、元素亜鉛の経口単位投与量を非常に多くしても忍容性を有しており、嘔気又は胃刺激を生じないことを見出した。例えば、生物学的利用能研究において、酢酸亜鉛及び硫酸亜鉛が適切に配合された胃保持性徐放性錠剤を健常被験者に施したところ、被験者は食物を摂取しなくても、150mgの元素亜鉛は忍容性が有り、4週間、嘔気又は胃刺激の不快感を生じさせなかった。
【0017】
正常で健康な試験協力者における研究結果では、食物無しで、水と共に150mgの元素亜鉛を投与したところ、良好な忍容性を示し、現在までに嘔気又は胃刺激の症例は一切観察されなかった。一方、血清亜鉛レベルの上昇は直ちに観察され、これは6時間以上持続した。
【0018】
b.利便性の改善
ウイルソン病及びAMDに対して用いられる経口亜鉛治療は、両方とも、投与が不便であるため、患者の服用率が低い問題があった。ウイルソン病の場合、経口亜鉛治療で、患者に投薬するときは、食前の少なくとも1時間と食後の少なくとも2時間は、食物を摂取してはいけない。この投薬計画では、患者に対して食物無しで、50mgの元素亜鉛(1日2回)を投与すると、多くの患者が、嘔気及び胃刺激を忍容することができず、多くのウィルソン病患者は、食物無しでは、25mgの亜鉛元素(1日3回)を摂取することを好むので、更に面倒である。このように1日3回の投与に、投与間隔の短さが加わると、嘔気と胃腸痛の発生率が90%にもなり、また最も重篤な銅感受性患者群の服薬不履行率が30%にもなり、投薬計画を実行することは、極めて困難になる。AMDの場合、1日に2回に分けて投与するのに典型的には、1日67mgの元素亜鉛が必要であるが、一般的には食物と一緒に服用したとしても、年配の患者群の場合、一般的には、既に他の医療投与も行われているため、服薬履行率が低い結果になっている。本発明の胃保持性徐放性亜鉛製剤技術をテストした試験協力健常者で達成された血清亜鉛レベルに基づくと、経口亜鉛治療における1日1回投与という長く追求されてきた目標を達成することができたと考えられ、これにより患者の服薬履行率の向上が達成される。
【0019】
好ましい実施形態において、発明者らは、非セルロースベースの腫脹/徐放剤(例えば、Carbopol 971P NF Polymer、Lubrizol、クリーブランド、オハイオ州、及び/又は、Kollidon VA64、BASF、Mutchler Inc.、ハリントンパーク、ニュージャージー州)を用いると、セルロースベースの製剤(例えば、HPMC、エチルセルロース及びハイプロメロース)と比較して、亜鉛の生物学的利用能の改善をもたらすことを見出した。セルロースベースの製剤は、非セルロースベースの製剤と比べて、亜鉛と結合するし、人体内の全身的吸収及び生物学的利用能を低下させるからである。
【0020】
好ましい実施形態において、経口亜鉛配合物(oral zinc formulation)は、アミノ酸、システインを含み、元素亜鉛の生物学的利用能を改善し、グルタチオンと同じ様に、腸及び全身でのメタロチオネインを生成するためのアミノ酸源を提供する。
【0021】
好ましい実施形態において、経口亜鉛配合物は、発泡剤(例えば、重炭酸カリウム又は重炭酸ナトリウム)を含み、調製物の胃での浮遊及び胃保持性を促進し、亜鉛調製物の胃内での運動性を付与し、放出された亜鉛が接触する胃壁への局所刺激が回避される。
【0022】
好ましい実施形態において、経口亜鉛調製物(oral zinc preparation)は、基礎成分(重炭酸カリウム又は重炭酸ナトリウム)を含み、胃又は近位胃腸の全身的治療で、亜鉛が放出される場所での局所酸性環境を還元し、放出された亜鉛による局所刺激の可能性を減少させる。
【0023】
好ましい実施形態において、亜鉛調製物は、電解質(例えば、ナトリウム、カリウム又はカルシウム)を含み、腸上皮細胞電解質チャネルを通る受動的及び能動的輸送メカニズムを介して亜鉛の生物学的利用能を改善する。
【0024】
好ましい実施形態において、経口亜鉛調製物は、胃保持性の効果の変動を減少させるために、小球体(microspheres)、細粒、又は粒子などの複数の独立した胃保持性サブユニットを放出する。
【0025】
好ましい実施形態において、経口亜鉛調製物は、クエン酸等の酸、発泡剤(クエン酸、ステアリン酸、アスコルビン酸、酢酸、又は酢酸亜鉛等の亜鉛塩等)を含み、胃内のpHとは独立して発泡効果を促進し、より早くより飛躍的な発泡を誘起し、ピル又は錠剤内に含まれる亜鉛の放出を早めることができる。
【0026】
好ましい実施形態において、経口亜鉛調製物は、亜鉛カルノシンを含んでおり、胃壁を通る亜鉛の滞留が促進される。
【0027】
好ましい実施形態において、経口亜鉛調製物について、酸性の胃環境をシミュレートした試験管内での浮遊は、8分未満であり、より好ましくは3分未満、さらに好ましくは1分未満を達成できる。
【0028】
好ましい実施形態において、経口亜鉛調製物は、糖、ポリマー又はその他のコーティング等でマイクロコートされた迅速溶解層(rapidly dissolving microcoated layer)を含んでおり、口の中での早期発泡を回避し、亜鉛錠剤の味を隠し、安定性を向上させることができる。
【0029】
好ましい実施形態において、経口亜鉛調製物は、調製物が滞留する最初の2時間の溶解中に、25mg〜100mgの元素亜鉛を放出するが、調整物は維持される。
【0030】
好ましい実施形態において、発泡性亜鉛錠剤は、不活性ガス下にて及び/又は個々にシールされたブリスター、ポーチ、又は低ユニットサイズの容器にパックされることで、安定性を向上させ、早期の発泡を防ぐことができる。
【0031】
好ましい実施形態において、経口亜鉛調製物は、胃の中に保持されている間、元素亜鉛を近位胃腸系に速やかに放出すると共に、8時間以上に亘って、亜鉛を徐々に放出して亜鉛を小腸に送達し、長時間に亘って、亜鉛を生物学的に利用可能な状態に維持する。
【0032】
好ましい実施形態において、経口亜鉛調製物は、100mg以上、好ましくは、150mg以上の元素亜鉛を含む。
【図面の簡単な説明】
【0033】
本発明の性質、目的及び効果の更なる理解のために、以下の図面に関連した詳細な説明を参照することができ、図面中、同じ要素については同じ引用番号を付している。
【0034】
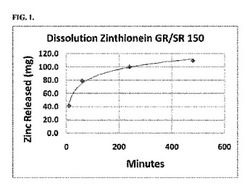
【図1】図1は、150mgの元素亜鉛(酢酸亜鉛として)を含む配合物1について、Varian VK 7010/7500/8000溶解試験機を用いて、試験管内で溶解した試験結果を示しており、前記試験機は、バスケットシステムと標準ICH溶解パラメータの温度及びpHを用い、亜鉛レベルは、Buck Scientific 210 VGP原子吸光分光光度計を用いて測定したものである。
【0035】
【図2】図2は、午前中に、食後少なくとも2時間、食前少なくとも1時間、食物無しで、16オンスのグラスの水と共に、150mgの元素亜鉛を含む配合物1を1錠摂取した4人の被験者に対して、6時間に亘って血清を採取し、得られた平均血清亜鉛レベルを示しており、亜鉛レベルは、Buck Scientific 210 VGP原子吸光分光光度計を用いて測定したものである。
【0036】
【図3】図3は、午前中に、食後少なくとも2時間、食前少なくとも1時間、食物無しで、16オンスのグラスの水と共に、150mgの元素元素を含む配合物1を1錠摂取した4人の被験者に対して、6時間に亘って血清を採取し、得られた平均血清亜鉛レベルと、100mgの元素亜鉛を与える商業的に入手可能なグルコン酸亜鉛(GNC亜鉛100)との比較を示しており、亜鉛レベルは、Buck Scientific 210 VGP原子吸光分光光度計を用いて測定したものである。図の曲線は、胃保持性を有しないセルロース含有配合物と比べて、血清内亜鉛レベルの維持で優れている。食物無しで、GNC亜鉛100製剤を摂取した患者の50%は、嘔気を催したが、配合物1の錠剤を摂取した被験者は、4週間、誰一人、嘔気を催さなかった。)
【発明を実施するための形態】
【0037】
<発明の詳細な説明>
Uzzoらの方法論を用いて、本発明の組成物の有効性の試験を行った。但し、被験者には、亜鉛の代わりに本発明の組成物を、Uzzoらを含む公開された研究で用いられた量と同じ量を投与した。
【0038】
Franchimentらと同様なランダム化した技術を用いると、本発明の組成物の臨床結果は向上すると考えられる。
【0039】
以下の表は、錠剤を一日に1回、一日に2回、一日に3回摂取するときの、錠剤当たりの各成分量を示す:
【表1】

【実施例】
【0040】
上記配合物1の錠剤は、504mgの酢酸亜鉛二水和物結晶(USP CAS 5970―45―6、Spectrum Chemicals Inc.,ニューブランズウィック州、ニュージャージー)と、100mgのL-システインHCL一水和物(USP CAS 9004―57―3、Spectrum Chemicals Inc.)と、90mgのカーボポール971P NF ポリマー(Lubrizol、クリーブランド、オハイオ州)と、150mgの粒状重炭酸カリウム(USP、CAS 144―55―8、Spectrum Chemical Inc.)と、10mgのクエン酸と9mgのステアリン酸(KIC Chemicals NF Kosher、アーモンク、ニューヨーク州)と、を混合することで作製される。錠剤は、TDP―1ベンチトップシングルタブレットプレス、及び40kn 12mmキャパシティーロータリータブレット(Minhua Pharmaceutical Machinery Company Co.Ltd.製)にて、それぞれが11mmラウンドダイセットを用いて圧縮された。錠剤の浮遊ラグタイムと浮遊時間は、pH2の、水とアクチン酸(actic acid)の水溶液に、錠剤を落下させることによって評価した。全ての錠剤の、浮遊ラグライムは30秒から1分であった。錠剤の溶解テストは、バリアンVK 7010/7500/8000溶解試験機を使用し、バスケットシステムと標準ICH溶解パラメータの温度及びpHを用いて行ったもので、亜鉛レベルは、Buck Scientific 210 VGP原子吸光分光光度計を用いて測定した。その結果、最初の1時間に錠剤から放出される元素亜鉛は約80mgであり、亜鉛放出の量及び速度として好ましい。これは、近位胃腸での滞留期間に略近い時間であり、その後、残っている亜鉛が、約8時間かかって放出される。この8時間は、人の小腸の中で滞留する時間に略等しい。
【0041】
1日1回の投与を繰り返し行ったときの生物学的利用能を調べた。実験では、4人の被験者に、4週間、毎日1錠摂取してもらった。図2は、午前中に、食後少なくとも2時間、食前少なくとも1時間、食物無しで、16オンスのグラスの水と共に、150mgの元素亜鉛を含む配合物1を1錠を摂取した4人の被験者に対して、6時間に亘って血清を採取し、得られた平均血清亜鉛レベルを示すもので、亜鉛レベルは、Buck Scientific 210 VGP原子吸光分光光度計を用いて測定した。4週間、食物無しで、配合物1を摂取した何れの被験者も、嘔気又は腹部への刺激若しくは筋けいれんの症例は観察されなかった。酢酸亜鉛の投与量として、150mgの元素亜鉛は、完全に忍容できるものとして意義がある。一方、市販されている亜鉛製剤(Galzinカプセル)の酢酸亜鉛では、50mg摂取した被験者のうち、90%が嘔気を催し、18%が嘔吐することが報告されている。例えば、次の文献を参照することができる。[Henderson LM, Brewer GJ, Dressman JB, Swidan SZ, DuRoss DJ, Adair CH, Barnett JL, Berardi RR, Use of zinc tolerance test and 24-hour urinary zinc content to assess oral zinc absorption, JAm Call Nutr. 1996 Feb;15(1):79-83]及び[Henderson LM, Brewer GJ, Dressman JB, Swidan SZ, DuRoss DJ, Adair CH, Barnett JL, Berardi RR., Effect of intragastric pH on the absorption of oral zinc acetate and zinc oxide in young healthy volunteers, JPEN J Parenter Enteral Nutr. 1995 Sep-Oct;19(5):393-7.]。配合物1によってもたらされる血清中の亜鉛量について、その量及び保持特性は、上記文献で報告されているレベルよりも大きい。配合物1は忍容性が向上し、食物無しで、150mgの元素亜鉛を1日1回投与することができ、また150mgの投与で副作用は全くないことから、より多くの量を1回で投与できる可能性があると考えられる。経口亜鉛製剤は、食物無しで摂取することを意図するため、従来忍容性の問題により、1回50mgに制限されていたので、1日に3回摂取する必要があり、それが、患者にとって不都合であり、服用率が低い結果となっていた。本発明は、食物無しで摂取することを目的とする経口亜鉛治療に対して、目的の達成をもたらすことができると考える。現在及び従来の調製剤は忍容性が低く、前記の不都合があるため、経口高用量亜鉛治療の患者(特に年配者)への適用が制限されてきたが、本発明は、アルツハイマーのAMD、軽度認知障害、パーキンソン病、血清「グリココッパー」と亜鉛欠乏が非常に問題となる糖尿病の神経障害及び糖尿病性網膜症を含む糖尿病の合併症等で、食事管理が必要な患者に対して大きな利益をもたらす。発明者らが知る限りにおいて、100mgよりも多くの量の元素亜鉛を経口投与することについて、これまで試験が行われたことはない。それ故、本発明の目的は、100mgを超える量の元素亜鉛を含む亜鉛を経口投与できる態様を明らかにすることである。より具体的には、100mgを超える量の元素亜鉛を含む製剤を経口投与しても、胃への副作用をゼロか又は少なくすることである。
【0042】
本発明の胃保持性/徐放亜鉛/システイン錠剤は、発泡(重炭酸カリウム及びクエン酸)と腫脹(カルボポール)の組合せによってもたらされる浮遊作用によって、それらのGRを達成する。これは、ほんの一例であって、他の用途でも同じ効果を達成することができる。
【0043】
発泡の場合、これらの錠剤が湿気に曝されると、早期発泡することがある。その反応では、CO2ガスを放出する。
【0044】
発明者らはこれらの錠剤を4−6週間に亘って毎日投与し、これらの錠剤が、4週間又は6週間後に、遊離銅及び/又はセルロプラスミンに作用するかどうかを観察した。
【0045】
これらの配合物では、早期の発泡が起こり得る。
【0046】
Alka-Seltzer(登録商標)等の他の発泡製品と同じ様に、早期発泡の問題は、個別包装によって解消することができる。Alka-Seltzerも熱処理された重炭酸ナトリウムを用いており、製品の成分ラベルには「重炭酸ナトリウム(熱処理)」と表示されている。
【0047】
錠剤化する前に重炭酸ナトリウムを熱処理して2〜10%の重炭酸塩を炭酸塩に変えることは一般的に行われており、各々の重炭酸塩粒の周りに保護シェルを形成して、早期発泡がしにくい平衡に到達させる。
【0048】
発明者等の知る限り、予め熱処理された市販製品は、重炭酸ナトリウムに使用されているが、重炭酸カリウムには使用されていない。
【0049】
発明者らの内の一人は、最近の試験で、25錠の錠剤を140°Fで1時間熱処理した後、乾燥剤を入れたボトル内でそれらを密封した。また熱処理していない25錠の錠剤を同様のボトルに入れた。
【0050】
3時間経過後、発明者は、各ボトルを開封した。熱処理した製剤を入れたボトル内に、圧力はなかったが、熱処理していない製剤を入れたボトルからは、ガスの放出が検出された。
【0051】
早期発泡は、配合物からクエン酸を除去することによって少なくすることができる。それは、重炭酸塩と反応し、CO2が放出するためである。酸は、胃に存在するので、この反応はある程度起こるが、その速度は、現在の配合物ほどではない。最近、発明者らは、クエン酸を含まない幾つかの錠剤を作製したが、それら製剤は20分間は浮遊しなかった。しかしながら、錠剤が20分以内に水と共に胃を通過すると、腸の中で消化されてしまい、本発明の非常に重要なGR成分が排除されることになるので、クエン酸を含まない錠剤は受け入れられないことが多い。
【0052】
発明者らは、本発明の錠剤を摂取したときに、即座に発泡する錠剤の性質が、嘔気を催さなくすることに、最も貢献すると考えている。放出されたガスにより、錠剤は、胃の中を移動できる様になり、それが、胃壁の局部刺激を減らすことができるものと考えられ、これについて、発明者ジョージ・ブルーアーは、嘔気には、IR酢酸亜鉛及びIR硫酸亜鉛カプセルが関与していると考えている。
【0053】
クエン酸が含まれないと、耐湿性包装を考慮する必要性も全くなくなるかどうかは不明である。安定性については、乾燥ボトルでも達成されることができるかもしれないが、一旦開封されたボトルや南フロリダ又はバスルームの高湿度環境に曝されたボトルを模擬したストレステストでは、破損する可能性がある(クエン酸の含有とは関係なく)。
【0054】
これは、パッケージ当たりの個別ユニットの数が少ない製品パッケージング問題を解決する。例えば、10日分が入れられたボトルにするとか、個々にブリスターパック、又はパウチパックすることができる(例えば、Alka-Seltzerは、パウチ毎に2錠有する)。
【0055】
湿度を制御するため、またCO2の発生を防止するか又は減少させるために、裏面にパンチ穴があけられたブリスターパックに、複数の錠剤が、個々に独自の収容領域を有するように密封されたものがよい。多くの抗生物質、幾つかのOTC制酸剤、及び多くの他のピル・タイプの製品が、この方法でパックされる。
【0056】
発明者らは、重炭酸カリウムの安定性を向上させることができる二つの方法を見い出した。
【0057】
1.第1は、重炭酸カリウムを熱処理し、以下の反応により、炭酸カリウム・シェル(例えば、材料の重量の2%〜10%を含む)を生成する。
【0058】
重炭酸カリウム:KHCO3
重炭酸カリウムが100°C〜120°Cに加熱されたとき、重炭酸カリウムが、K2CO3(炭酸カリウム)、H2O(水)及びCO2(二酸化炭素)に分解することを示す化学反応式は次のとおりである。
【0059】
【化1】

【0060】
熱処理された重炭酸ナトリウムは商業的に入手可能であるが、熱処理された重炭酸カリウムは、そうではない。その結晶は、アスピリンに関する米国特許第5,552,084号の請求項1に記載されているが、これがどのようにされるかは記載されていない。
【0061】
発明者らは、真空オーブンがこの処理に必要であるとは考えておらず、また、100°C〜120°Cへの加熱も必要でないだろう。簡単な対流式オーブンを使用し、140°F(60℃)で1時間加熱することで十分であると考えている。
【0062】
工程中、様々な加熱パラメータの制御と試験は、(加熱前に)開始材料の重量を測定することによって行われ、加熱後、放出されたCO2 が変換量を示し、重量を減少させる。(但し、対流式オーブンでも問題とならないように、空気中の水分が蓄積されないこと、及びオーブンは予め加熱しておくこと)。
【0063】
次に、重炭酸カリウムの安定性試験は、様々な温度で加熱した後、高RH(相対湿度)環境の中に、重炭酸カリウムを置いておき、次に重炭酸カリウムを計量して、重量変化を観察し、様々な試験と比較することによって行われる。
【0064】
材料が反応性であって、水中にCO2が放出されるものとして、例えば、水を重炭酸カリウムに加えるか、又は重炭酸カリウムを水に加えて、圧力を測定することによって、測定されることができる。
【0065】
最終的に、発明者が所望する時間枠(1分未満)内で、錠剤が容易に浮遊するかどうかを調べられるべきである。
【0066】
2.第2の方法は、重炭酸カリウム結晶をコートすることであり、重炭酸カリウム結晶を混合し、少量の酸化亜鉛でコーティングされる。
【0067】
この方法は、Arm&Hammerのメーカーに特許が付与されているが、それは酸化マグネシウムを用いたものであり、酸化亜鉛については例として記載されているが権利範囲には含まれていない。
【0068】
この方法と材料の試験方法は、米国特許第5,552,084号に記載され、取捨選択技術を用いているが、それは、不安定な重炭酸カリウムは、凝集し易いためである。
【0069】
本発明は、ウイルソン病用の経口発泡GR/IR酢酸亜鉛の配合物を含むもので嘔気等を減らす効果がある。
【0070】
明細書に開示されている全ての測定は、特に明記しない限り、地球の海水面での、標準温度及び標準圧力である。人体に使用され、又は使用することを目的とする全ての材料は、特に明記しない限り、生体適合性がある。
【0071】
上述の実施形態は、例示の目的のためのものであり、本発明の範囲は、以下の特許請求の範囲の記載によってのみ限定される。
【技術分野】
【0001】
<発明者>
ブルーワー,ジョージ ジェイ. 米国市民、アメリカ合衆国 ミシガン,アン アーバー;カンザー,ステイーブ エイチ. 米国市民、アメリカ合衆国 ミシガン,アン アーバー;ライオン,マックス 米国市民、アメリカ合衆国 ワシントン,シアトル;ニューサム,デビッド エイ.医学博士、米国市民 アメリカ合衆国 フロリダ,セント ピーターズバーグ;及び、クラウチ,デニス 米国市民,アメリカ合衆国 ミシガン,ビックスバーグ
<譲受人>
アデオナ ファーマシューティカル、インコーポレイテッド(デラウェア州、米国、会社)、アメリカ合衆国 48108 ミシガン,アン アーバー,バーシティ ドライブ 3930
<関連出願の記載>
2009年11月1日に出願した米国仮特許出願第61/257,034号は、引用を以て本明細書に組み込まれ、その優先権をここで主張する。
本明細書に引用を以て組み込まれる特許及び特許出願は、発明者の一人以上を記載しているか、又は譲受人としてアデオナと記載しているすべての特許及び特許出願であり、以下に記載したものを含む:
2006年1月10日出願の米国特許出願第11/621,962号。この出願は、2007年9月6日にUS2007-0207191 A1として出願公開され、米国仮特許出願第60/757,672号(2006年2月7日出願)、発明の名称「PHARMACEUTICAL COMPOSITIONS AND METHODS TO ACHIEVE AND MAINTAIN A TARGETED AND STABLE COPPER STATUS AND PREVENT AND TREAT COPPER-RELATED CENTRAL NERVOUS SYSTEM DISEASES」と、米国仮出願第60/765,812号、発明の名称「PHARMACEUTICAL COMPOSITIONS AND METHODS TO ACHIEVE AND MAINTAIN A TARGETED AND STABLE COPPER STATUS AND PREVENT AND TREAT COPPER-RELATED CENTRAL NERVOUS SYSTEM DISEASES」と、2006年1月10日出願の米国仮出願第60/757,672号、発明の名称「PHARMACEUTICAL COMPOSITIONS AND METHODS TO ACHIEVE AND MAINTAIN A TARGETED COPPER STATUS」の優先権を主張している。
2007年1月10日出願のPCT特許出願第PCT/US2007/60345号。この出願は、WO 2007/084818 A2として出願公開され、2006年2月7日出願の米国仮出願第60/765,812号、発明の名称「PHARMACEUTICAL COMPOSITIONS AND METHODS TO ACHIEVE AND MAINTAIN A TARGETED AND STABLE COPPER STATUS AND PREVENT AND TREAT COPPER-RELATED CENTRAL NERVOUS SYSTEM DISEASES」と、2006年1月10日に出願された米国仮出願第60/757,672号、発明の名称「PHARMACEUTICAL COMPOSITIONS AND METHODS TO ACHIEVE AND MAINTAIN A TARGETED COPPER STATUS」の優先権を主張している。
2007年3月12日出願の米国仮出願第60/894,388号、発明の名称「ORAL ZINC MEDICANTS USEFUL FOR SAFELY LOWERING FREE COPPER ABSORPTION AND FREE COPPER LEVELS」と、2008年3月12日出願の実用特許出願PCT/US2008/056743号、発明の名称「ORAL ZINC MEDICANTS USEFUL FOR SAFELY LOWERING FREE COPPER ABSORPTION AND FREE COPPER LEVELS」。
2009年4月15日出願の米国仮出願第61/169,684号、発明の名称「METHODS AND DEVICES FOR MEASURING DEFECTIVE CERULOPLASMIN」。
<連邦政府による資金提供を受けた研究開発の記載>
なし
<マイクロフィッシュ添付>
なし
本発明は栄養補給剤及び/又は医薬品に関する。より具体的には、本発明は、治療が必要な被験者に亜鉛を供給する栄養補給剤又は医薬品に関する。
【背景技術】
【0002】
亜鉛は必須栄養素であり、人体の中で2番目に豊富な微量元素であって、目の中では、最も豊富な微量元素である。亜鉛は、200以上の酵素の活性化と、400以上の核調節元素のDNA結合能力に必要とされる。亜鉛が、抗酸化剤として機能することは知られており、スルフヒドリル基を酸化から保護し、銅と鉄と拮抗させることで、酸化還元サイクルの結果物であるヒドロキシルラジカルの生成を減少させ、抗酸化性タンパク質メタロチオネイン(MT)を誘導することで損傷したヒドロキシル基を除去するものである。
【0003】
酸化ストレスや抗酸化能力の低下は、例えば循環器病、発がん、神経障害、炎症、中心神経系、呼吸、腎臓疾患、再かん流損傷及び黄斑変性等の病的状態に関与することが示唆されている。加齢黄斑変性症(AMD)は、米国の60歳以上の人々の失明の一番の原因である。この病気の一因は網膜色素上皮(RPE)における加齢性欠損であると考えられているが、病気の原因が未だ知られておらず、治療法がない。発明者らの研究室では、酸化防止剤カタラーゼ、MT及び亜鉛は、加齢と、単離されたヒト網膜色素上皮細胞の年齢関連性黄斑変性の兆候とによって減少することをこれまでに報告している。
【0004】
亜鉛は、前立腺の状態及び機能、免疫システム機能及び癌に対して有益な効果を有すると考えられている。
【0005】
システインは、硫黄含有化合物(例えばピルベート、タウリン及びグルタチオン)の生成のための必須アミノ酸ではないが、正常組織代謝の保護及び修復において重要である。タンパク質内でのシステインの存在は、一般的には、抗酸化活性を含む保護機能を付与すると考えられている。
【0006】
グルタチオンの合成は、主にシステインの利用可能性によって調整される。体が毒性状態(例えば過酸化物生成、電離放射線、アルキル化剤又は他の反応中間体)にあるときに、グルタチオンレベルの増加が有効である。
【0007】
未熟児は、システインレベルが低いので、高圧酸素治療の後、目の中に形成されるヒドロペルオキシドの酸化損傷の影響を受けやすい。
【0008】
Uzzoらによって示されるように、亜鉛は前立腺癌の発生及び進行を阻害することができる[Uzzo,R.G.et al.,Zinc inhibits nuclear factor-kappa B activation and sensitizes prostate cancer cells to cytotoxic agents" Clin. Cancer Res. 2002 8:3579-83.]。
【0009】
亜鉛は、多くの皮膚科学状態において医学的に有益であることが示されている。例えば、Pierard C.Franchiment et al.のランダム化されたマルチセンターの研究を参照することができる[A Multicenter Randomized Trial of Ketoconazole 2% and Zinc Pyrythione 1% Shampoos in Severe Dandruff and Seborrheic Dermatitis", Skin Pharmacal Appl Skin Physiol. 2002 15:434-41]。
【0010】
以下の米国特許、並びに本明細書及び米国特許第6,586,611号及び第7,164,035号の中で記載された全ての参考文献は、引用を以て本明細書に組み込まれる。
米国特許番号は次のとおりである。
5,844,089 Genetically Fused Globin-like Polypeptides Having Hemoglobin-like Activity
5,844,088 Hemoglobin-like Protein Comprising Genetically Fused Globin-like Polypeptides
5,801,019 DNA Encoding Fused Alpha-beta Globin Pseuodimer and Productionof Pseudotetrameric Hemoglobin
5,798,227 Co-expression of Alpha and Beta Globins
5,744,329 DNA Encoding Fused Di-beta Globins and Production of Pseudotetrameric
Hemoglobin
5,739,011 DNA for the Production of Multimeric Hemoglobins
5,599,907 Production and Use of Multimeric Hemoglobins
5,545,727 DNA Encoding Fused Di-alpha Globins and Production of Pseudotetrameric
Hemoglobin
5,401,770 Antipruritic Agents and Antipruritic Compositions Thereof
3,941,818 1: 1 Zinc Methionine Complexes
4,021,569 Method of Nutritional Supplementation For Zinc and Methionine by Ingesting 1: 1 Zinc Methionine Complexes
4,764,633 Ferric ion Catalyzed Complexation of Zinc and/or Manganese With Alpha Amino Acids
6,429,219 Treatment of Chronic Hypertension and Related Conditions with Thiol Complexes
6,586,611 Zinc-monocysteine Complex and Method of Using Zinc-cysteine
7,164,035 Zinc-monocysteine Complex and Method of Using Zinc-cysteine Complexes
6,531,608 Various Thial Complexes, Processes For Their Synthesis and ClinicalApplications
5,911,978 Hair Treatment Composition
W02007/084818 Pharmaceutical Compositions and Methods to Achieve and Maintain a Targeted and Stable Copper Status and Prevent and Treat Copper-related Central Nervous System Diseases
米国特許第5,401,770号は、外用鎮痒剤における亜鉛-システイン錯体の使用を開示している。
AREDSは、69.6mg/日の亜鉛を用いている。しかしながら、特許されたAREDSの調製物(米国特許第6,660,297号)は、視力の急速な向上に及んでいない。
Tanaka et al.,「The Inhibitory Effect And The Mechanism Of Ethanol Absorption By Zinc Complex In Mouse Gastrointestinal Tract」, Folia Pharmacological Society Japan 111, 327-336 (1998);
Zegzhda et al.,「COMPLEX COMPOUNDS OF ZINC AND CADMIUM WITH CYSTEIN」, COORDINATION CHEMISTRY, Vol. 2, No.8, pp. 1031-1035 (1976).
【発明の概要】
【0011】
本発明は、米国特許公開公報第2007/0207191A1号、特に段落92〜141、段落158、及び請求項15、30、24、25、及び36に開示されている組成物及び方法の実施例を含む。米国特許公開公報第2007/0207191A1号は、引用を以て本明細書に組み込まれる。
【0012】
譲受人は、アルツハイマー病、軽度認識障害、加齢黄斑変性症、ウィルソン病、統合失調症、ハンチントン病、ルー・ゲーリック病(筋萎縮性側索硬化症)及び他の神経変異性疾患の治療のための経口亜鉛調製物を開発し、これらに関する米国特許並びに係属中の米国出願及び国際特許出願について排他的ライセンスを有している。本願並びに本願の仮出願及び実用特許出願の共同発明者の二人、デイビッド エイ.ニューサムM.D.と、ジョージ ジェイ.ブルーアーM.D.は、神経変性疾患の治療に経口亜鉛を使用した先駆者である。ニューサムは、加齢黄斑変性症(今ではAMDの乾燥状態(dry form)の治療の標準となっている)の経口亜鉛治療の発明者及び先駆者であり、ジョージ ジェイ.ブルーアーM.D.は、ウィルソン病疾患の経口酢酸亜鉛治療の発明者及び先駆者である(現在の標準的治療で有り、Galzin(登録商標)としてFDA承認されている)。これら2人の臨床研究者は、その数十年の経験に基づいて、既存の経口亜鉛治療剤の重大な欠点に非常に精通しており、前述の関連特許出願及び本願の譲受人は、従来及び現在市販されている亜鉛製剤と比較して、はるかに優れた忍容性及び投与便宜性を有する技術的に進んだ経口亜鉛製剤を発明し、実用化した。手法は独特であり、利点は相当なものである。
【0013】
a.忍容性(tolerability)の改善
高投与量の経口亜鉛調製物は、用量依存性で胃刺激の高い発生率と関連性があり、典型的には嘔気及び腹痛として発現する。その結果、経口亜鉛調製物(例えば、AMDに対して一般的に用いられる調製物)は、一般的には、食物と共に摂取することが推奨される。その理由は、経口亜鉛が胃内の食物と結合することにより、胃刺激の可能性を減少させるからである。しかしながら、ブルーアー博士がウィルソン病患者に対して実施した多くの研究では、腸のメタロチオネインを誘導して、血清中の非セルロプラスミン結合(遊離)銅レベルを低下させる効果、ひいては、CSF/CNSコンパートメント中の銅の曝露及びレベルを低下させる効果をもたらすために、経口亜鉛治療は、食物と共に投与しなければならないことが示されている。ウィルソン病用として、ジョージ ジェイ.ブルーアーM.D.によって開発され、FDAに1997年承認された経口酢酸亜鉛カプセル調製物は、承認された元素亜鉛(elemental zinc)25mg用量の最小投与量で、45%の患者が嘔気を催し、承認された元素亜鉛50mg用量の高投与量では、91%の患者が嘔気を催した。元素亜鉛100mgの投与量では、91%の患者が嘔気を催し、18%の患者が、嘔吐した。例えば、次の文献を参照することができる。[Henderson LM, Brewer GJ, Dressman JB, Swidan SZ,DuRoss DJ, Adair CH, Barnett JL, Berardi RR, Use of zinc tolerance test and 24-hour urinary zinc content to assess oral zinc absorption, JAm Call Nutr. 1996 Feb;15(1):79-83]及び[Henderson LM, Brewer GJ, Dressman JB, Swidan SZ, DuRoss DJ, Adair CH, Barnett JL, Berardi RR., Effect of intragastric pH on the absorption of oral zinc acetate and zinc oxide in young healthy volunteers, JPEN J Parenter Enteral Nutr. 1995]。 なお、元素亜鉛50mgを供給する硫酸亜鉛を食物と共に摂取した場合も同じ効果が観察された。Sep-Oct;19(5):393-7. Samman S, Roberts,DCK, Med. Journal Australia, 1987 Vol. 146, p. 247-9.参照。
【0014】
経口亜鉛治療の場合、胃刺激の問題は、単に徐放技術及び遅延放出技術を単独で用いることによっては解決することができない。その理由は、このような方法により、亜鉛の放出が遅延すると、生物学的利用能が低下するため、亜鉛について、重要な近位腸部を迂回するか、又は近位腸部への暴露不足を生じるためであり、前記近位腸部では、亜鉛及び銅は十分に吸収されなければならず、また、腸内メタロチオネインが、血清銅、特に“血清遊離銅(serum free copper)”と称されるセルロプラスミン非結合銅に作用できるように誘導されなければならないからである。
【0015】
発明者らは、90人の被験者について観察的臨床試験を行なった。被験者の内訳は、30人の正常被験者(age-matched control)と、譲受人により支援される30人のアルツハイマー病患者と、30人のパーキンソン病患者である。アルツハイマー型患者は、正常被験者(p=0.0145)と比較して、亜臨床的及び臨床的な亜鉛欠乏状態にあり、血清銅(p=0.0000015)中の血清セルロプラスミン結合が損なわれ、セルロプラスミン非結合銅(P=0.045)の血清の割合が上昇することを見出した。発明者らはまた、パーキンソン病患者も、正常被験者(p=0.045)と比較して、血清遊離銅の割合が増加することも見出した。これらの知見は、2009年4月15日に出願された仮特許出願第61/169,684号、発明の名称「Methods and Devices for Measuring Defective Ceruloplasmin」の主題である。
【0016】
発明者らは、胃に長時間保持される胃保持性徐放技術を、この長期に亘る問題に適用することにより、経口亜鉛治療の忍容性を大きく向上させることができるようにしたもので、銅の大部分が吸収される近位腸において、生物学的利用能と、腸にメタロチオネインを誘導するのに必要な、最小限の亜鉛暴露を犠牲にすることなく、メタロチオネイン誘導する胃腸の望ましい位置を逸しない。重要なことは、賦形剤及び結合剤を用いて胃の中での保持時間を長くし、亜鉛放出を遅延させることであり、賦形剤と結合剤を組み合わせて胃液内でピルに膨張と発泡効果特性をもたらし、ピルの浮力を大きくして、胃の中での滞留時間とピル可動性を増加させるものである。好ましい実施例において、このような効果は、全てが安全であると一般的に見なされ(Generally Regarded as Safe;GRAS)、食品業界において用いられている成分及び賦形剤が100%のもので達成されることができる。更にまた、基礎成分又は制酸剤(例えば重炭酸カリウム及び重炭酸ナトリウム)を添加することにより、食物を摂取しなくても、経口亜鉛治療の忍容性が大いに改善されることを見出した。この技術を用いると、元素亜鉛の経口単位投与量を非常に多くしても忍容性を有しており、嘔気又は胃刺激を生じないことを見出した。例えば、生物学的利用能研究において、酢酸亜鉛及び硫酸亜鉛が適切に配合された胃保持性徐放性錠剤を健常被験者に施したところ、被験者は食物を摂取しなくても、150mgの元素亜鉛は忍容性が有り、4週間、嘔気又は胃刺激の不快感を生じさせなかった。
【0017】
正常で健康な試験協力者における研究結果では、食物無しで、水と共に150mgの元素亜鉛を投与したところ、良好な忍容性を示し、現在までに嘔気又は胃刺激の症例は一切観察されなかった。一方、血清亜鉛レベルの上昇は直ちに観察され、これは6時間以上持続した。
【0018】
b.利便性の改善
ウイルソン病及びAMDに対して用いられる経口亜鉛治療は、両方とも、投与が不便であるため、患者の服用率が低い問題があった。ウイルソン病の場合、経口亜鉛治療で、患者に投薬するときは、食前の少なくとも1時間と食後の少なくとも2時間は、食物を摂取してはいけない。この投薬計画では、患者に対して食物無しで、50mgの元素亜鉛(1日2回)を投与すると、多くの患者が、嘔気及び胃刺激を忍容することができず、多くのウィルソン病患者は、食物無しでは、25mgの亜鉛元素(1日3回)を摂取することを好むので、更に面倒である。このように1日3回の投与に、投与間隔の短さが加わると、嘔気と胃腸痛の発生率が90%にもなり、また最も重篤な銅感受性患者群の服薬不履行率が30%にもなり、投薬計画を実行することは、極めて困難になる。AMDの場合、1日に2回に分けて投与するのに典型的には、1日67mgの元素亜鉛が必要であるが、一般的には食物と一緒に服用したとしても、年配の患者群の場合、一般的には、既に他の医療投与も行われているため、服薬履行率が低い結果になっている。本発明の胃保持性徐放性亜鉛製剤技術をテストした試験協力健常者で達成された血清亜鉛レベルに基づくと、経口亜鉛治療における1日1回投与という長く追求されてきた目標を達成することができたと考えられ、これにより患者の服薬履行率の向上が達成される。
【0019】
好ましい実施形態において、発明者らは、非セルロースベースの腫脹/徐放剤(例えば、Carbopol 971P NF Polymer、Lubrizol、クリーブランド、オハイオ州、及び/又は、Kollidon VA64、BASF、Mutchler Inc.、ハリントンパーク、ニュージャージー州)を用いると、セルロースベースの製剤(例えば、HPMC、エチルセルロース及びハイプロメロース)と比較して、亜鉛の生物学的利用能の改善をもたらすことを見出した。セルロースベースの製剤は、非セルロースベースの製剤と比べて、亜鉛と結合するし、人体内の全身的吸収及び生物学的利用能を低下させるからである。
【0020】
好ましい実施形態において、経口亜鉛配合物(oral zinc formulation)は、アミノ酸、システインを含み、元素亜鉛の生物学的利用能を改善し、グルタチオンと同じ様に、腸及び全身でのメタロチオネインを生成するためのアミノ酸源を提供する。
【0021】
好ましい実施形態において、経口亜鉛配合物は、発泡剤(例えば、重炭酸カリウム又は重炭酸ナトリウム)を含み、調製物の胃での浮遊及び胃保持性を促進し、亜鉛調製物の胃内での運動性を付与し、放出された亜鉛が接触する胃壁への局所刺激が回避される。
【0022】
好ましい実施形態において、経口亜鉛調製物(oral zinc preparation)は、基礎成分(重炭酸カリウム又は重炭酸ナトリウム)を含み、胃又は近位胃腸の全身的治療で、亜鉛が放出される場所での局所酸性環境を還元し、放出された亜鉛による局所刺激の可能性を減少させる。
【0023】
好ましい実施形態において、亜鉛調製物は、電解質(例えば、ナトリウム、カリウム又はカルシウム)を含み、腸上皮細胞電解質チャネルを通る受動的及び能動的輸送メカニズムを介して亜鉛の生物学的利用能を改善する。
【0024】
好ましい実施形態において、経口亜鉛調製物は、胃保持性の効果の変動を減少させるために、小球体(microspheres)、細粒、又は粒子などの複数の独立した胃保持性サブユニットを放出する。
【0025】
好ましい実施形態において、経口亜鉛調製物は、クエン酸等の酸、発泡剤(クエン酸、ステアリン酸、アスコルビン酸、酢酸、又は酢酸亜鉛等の亜鉛塩等)を含み、胃内のpHとは独立して発泡効果を促進し、より早くより飛躍的な発泡を誘起し、ピル又は錠剤内に含まれる亜鉛の放出を早めることができる。
【0026】
好ましい実施形態において、経口亜鉛調製物は、亜鉛カルノシンを含んでおり、胃壁を通る亜鉛の滞留が促進される。
【0027】
好ましい実施形態において、経口亜鉛調製物について、酸性の胃環境をシミュレートした試験管内での浮遊は、8分未満であり、より好ましくは3分未満、さらに好ましくは1分未満を達成できる。
【0028】
好ましい実施形態において、経口亜鉛調製物は、糖、ポリマー又はその他のコーティング等でマイクロコートされた迅速溶解層(rapidly dissolving microcoated layer)を含んでおり、口の中での早期発泡を回避し、亜鉛錠剤の味を隠し、安定性を向上させることができる。
【0029】
好ましい実施形態において、経口亜鉛調製物は、調製物が滞留する最初の2時間の溶解中に、25mg〜100mgの元素亜鉛を放出するが、調整物は維持される。
【0030】
好ましい実施形態において、発泡性亜鉛錠剤は、不活性ガス下にて及び/又は個々にシールされたブリスター、ポーチ、又は低ユニットサイズの容器にパックされることで、安定性を向上させ、早期の発泡を防ぐことができる。
【0031】
好ましい実施形態において、経口亜鉛調製物は、胃の中に保持されている間、元素亜鉛を近位胃腸系に速やかに放出すると共に、8時間以上に亘って、亜鉛を徐々に放出して亜鉛を小腸に送達し、長時間に亘って、亜鉛を生物学的に利用可能な状態に維持する。
【0032】
好ましい実施形態において、経口亜鉛調製物は、100mg以上、好ましくは、150mg以上の元素亜鉛を含む。
【図面の簡単な説明】
【0033】
本発明の性質、目的及び効果の更なる理解のために、以下の図面に関連した詳細な説明を参照することができ、図面中、同じ要素については同じ引用番号を付している。
【0034】
【図1】図1は、150mgの元素亜鉛(酢酸亜鉛として)を含む配合物1について、Varian VK 7010/7500/8000溶解試験機を用いて、試験管内で溶解した試験結果を示しており、前記試験機は、バスケットシステムと標準ICH溶解パラメータの温度及びpHを用い、亜鉛レベルは、Buck Scientific 210 VGP原子吸光分光光度計を用いて測定したものである。
【0035】
【図2】図2は、午前中に、食後少なくとも2時間、食前少なくとも1時間、食物無しで、16オンスのグラスの水と共に、150mgの元素亜鉛を含む配合物1を1錠摂取した4人の被験者に対して、6時間に亘って血清を採取し、得られた平均血清亜鉛レベルを示しており、亜鉛レベルは、Buck Scientific 210 VGP原子吸光分光光度計を用いて測定したものである。
【0036】
【図3】図3は、午前中に、食後少なくとも2時間、食前少なくとも1時間、食物無しで、16オンスのグラスの水と共に、150mgの元素元素を含む配合物1を1錠摂取した4人の被験者に対して、6時間に亘って血清を採取し、得られた平均血清亜鉛レベルと、100mgの元素亜鉛を与える商業的に入手可能なグルコン酸亜鉛(GNC亜鉛100)との比較を示しており、亜鉛レベルは、Buck Scientific 210 VGP原子吸光分光光度計を用いて測定したものである。図の曲線は、胃保持性を有しないセルロース含有配合物と比べて、血清内亜鉛レベルの維持で優れている。食物無しで、GNC亜鉛100製剤を摂取した患者の50%は、嘔気を催したが、配合物1の錠剤を摂取した被験者は、4週間、誰一人、嘔気を催さなかった。)
【発明を実施するための形態】
【0037】
<発明の詳細な説明>
Uzzoらの方法論を用いて、本発明の組成物の有効性の試験を行った。但し、被験者には、亜鉛の代わりに本発明の組成物を、Uzzoらを含む公開された研究で用いられた量と同じ量を投与した。
【0038】
Franchimentらと同様なランダム化した技術を用いると、本発明の組成物の臨床結果は向上すると考えられる。
【0039】
以下の表は、錠剤を一日に1回、一日に2回、一日に3回摂取するときの、錠剤当たりの各成分量を示す:
【表1】

【実施例】
【0040】
上記配合物1の錠剤は、504mgの酢酸亜鉛二水和物結晶(USP CAS 5970―45―6、Spectrum Chemicals Inc.,ニューブランズウィック州、ニュージャージー)と、100mgのL-システインHCL一水和物(USP CAS 9004―57―3、Spectrum Chemicals Inc.)と、90mgのカーボポール971P NF ポリマー(Lubrizol、クリーブランド、オハイオ州)と、150mgの粒状重炭酸カリウム(USP、CAS 144―55―8、Spectrum Chemical Inc.)と、10mgのクエン酸と9mgのステアリン酸(KIC Chemicals NF Kosher、アーモンク、ニューヨーク州)と、を混合することで作製される。錠剤は、TDP―1ベンチトップシングルタブレットプレス、及び40kn 12mmキャパシティーロータリータブレット(Minhua Pharmaceutical Machinery Company Co.Ltd.製)にて、それぞれが11mmラウンドダイセットを用いて圧縮された。錠剤の浮遊ラグタイムと浮遊時間は、pH2の、水とアクチン酸(actic acid)の水溶液に、錠剤を落下させることによって評価した。全ての錠剤の、浮遊ラグライムは30秒から1分であった。錠剤の溶解テストは、バリアンVK 7010/7500/8000溶解試験機を使用し、バスケットシステムと標準ICH溶解パラメータの温度及びpHを用いて行ったもので、亜鉛レベルは、Buck Scientific 210 VGP原子吸光分光光度計を用いて測定した。その結果、最初の1時間に錠剤から放出される元素亜鉛は約80mgであり、亜鉛放出の量及び速度として好ましい。これは、近位胃腸での滞留期間に略近い時間であり、その後、残っている亜鉛が、約8時間かかって放出される。この8時間は、人の小腸の中で滞留する時間に略等しい。
【0041】
1日1回の投与を繰り返し行ったときの生物学的利用能を調べた。実験では、4人の被験者に、4週間、毎日1錠摂取してもらった。図2は、午前中に、食後少なくとも2時間、食前少なくとも1時間、食物無しで、16オンスのグラスの水と共に、150mgの元素亜鉛を含む配合物1を1錠を摂取した4人の被験者に対して、6時間に亘って血清を採取し、得られた平均血清亜鉛レベルを示すもので、亜鉛レベルは、Buck Scientific 210 VGP原子吸光分光光度計を用いて測定した。4週間、食物無しで、配合物1を摂取した何れの被験者も、嘔気又は腹部への刺激若しくは筋けいれんの症例は観察されなかった。酢酸亜鉛の投与量として、150mgの元素亜鉛は、完全に忍容できるものとして意義がある。一方、市販されている亜鉛製剤(Galzinカプセル)の酢酸亜鉛では、50mg摂取した被験者のうち、90%が嘔気を催し、18%が嘔吐することが報告されている。例えば、次の文献を参照することができる。[Henderson LM, Brewer GJ, Dressman JB, Swidan SZ, DuRoss DJ, Adair CH, Barnett JL, Berardi RR, Use of zinc tolerance test and 24-hour urinary zinc content to assess oral zinc absorption, JAm Call Nutr. 1996 Feb;15(1):79-83]及び[Henderson LM, Brewer GJ, Dressman JB, Swidan SZ, DuRoss DJ, Adair CH, Barnett JL, Berardi RR., Effect of intragastric pH on the absorption of oral zinc acetate and zinc oxide in young healthy volunteers, JPEN J Parenter Enteral Nutr. 1995 Sep-Oct;19(5):393-7.]。配合物1によってもたらされる血清中の亜鉛量について、その量及び保持特性は、上記文献で報告されているレベルよりも大きい。配合物1は忍容性が向上し、食物無しで、150mgの元素亜鉛を1日1回投与することができ、また150mgの投与で副作用は全くないことから、より多くの量を1回で投与できる可能性があると考えられる。経口亜鉛製剤は、食物無しで摂取することを意図するため、従来忍容性の問題により、1回50mgに制限されていたので、1日に3回摂取する必要があり、それが、患者にとって不都合であり、服用率が低い結果となっていた。本発明は、食物無しで摂取することを目的とする経口亜鉛治療に対して、目的の達成をもたらすことができると考える。現在及び従来の調製剤は忍容性が低く、前記の不都合があるため、経口高用量亜鉛治療の患者(特に年配者)への適用が制限されてきたが、本発明は、アルツハイマーのAMD、軽度認知障害、パーキンソン病、血清「グリココッパー」と亜鉛欠乏が非常に問題となる糖尿病の神経障害及び糖尿病性網膜症を含む糖尿病の合併症等で、食事管理が必要な患者に対して大きな利益をもたらす。発明者らが知る限りにおいて、100mgよりも多くの量の元素亜鉛を経口投与することについて、これまで試験が行われたことはない。それ故、本発明の目的は、100mgを超える量の元素亜鉛を含む亜鉛を経口投与できる態様を明らかにすることである。より具体的には、100mgを超える量の元素亜鉛を含む製剤を経口投与しても、胃への副作用をゼロか又は少なくすることである。
【0042】
本発明の胃保持性/徐放亜鉛/システイン錠剤は、発泡(重炭酸カリウム及びクエン酸)と腫脹(カルボポール)の組合せによってもたらされる浮遊作用によって、それらのGRを達成する。これは、ほんの一例であって、他の用途でも同じ効果を達成することができる。
【0043】
発泡の場合、これらの錠剤が湿気に曝されると、早期発泡することがある。その反応では、CO2ガスを放出する。
【0044】
発明者らはこれらの錠剤を4−6週間に亘って毎日投与し、これらの錠剤が、4週間又は6週間後に、遊離銅及び/又はセルロプラスミンに作用するかどうかを観察した。
【0045】
これらの配合物では、早期の発泡が起こり得る。
【0046】
Alka-Seltzer(登録商標)等の他の発泡製品と同じ様に、早期発泡の問題は、個別包装によって解消することができる。Alka-Seltzerも熱処理された重炭酸ナトリウムを用いており、製品の成分ラベルには「重炭酸ナトリウム(熱処理)」と表示されている。
【0047】
錠剤化する前に重炭酸ナトリウムを熱処理して2〜10%の重炭酸塩を炭酸塩に変えることは一般的に行われており、各々の重炭酸塩粒の周りに保護シェルを形成して、早期発泡がしにくい平衡に到達させる。
【0048】
発明者等の知る限り、予め熱処理された市販製品は、重炭酸ナトリウムに使用されているが、重炭酸カリウムには使用されていない。
【0049】
発明者らの内の一人は、最近の試験で、25錠の錠剤を140°Fで1時間熱処理した後、乾燥剤を入れたボトル内でそれらを密封した。また熱処理していない25錠の錠剤を同様のボトルに入れた。
【0050】
3時間経過後、発明者は、各ボトルを開封した。熱処理した製剤を入れたボトル内に、圧力はなかったが、熱処理していない製剤を入れたボトルからは、ガスの放出が検出された。
【0051】
早期発泡は、配合物からクエン酸を除去することによって少なくすることができる。それは、重炭酸塩と反応し、CO2が放出するためである。酸は、胃に存在するので、この反応はある程度起こるが、その速度は、現在の配合物ほどではない。最近、発明者らは、クエン酸を含まない幾つかの錠剤を作製したが、それら製剤は20分間は浮遊しなかった。しかしながら、錠剤が20分以内に水と共に胃を通過すると、腸の中で消化されてしまい、本発明の非常に重要なGR成分が排除されることになるので、クエン酸を含まない錠剤は受け入れられないことが多い。
【0052】
発明者らは、本発明の錠剤を摂取したときに、即座に発泡する錠剤の性質が、嘔気を催さなくすることに、最も貢献すると考えている。放出されたガスにより、錠剤は、胃の中を移動できる様になり、それが、胃壁の局部刺激を減らすことができるものと考えられ、これについて、発明者ジョージ・ブルーアーは、嘔気には、IR酢酸亜鉛及びIR硫酸亜鉛カプセルが関与していると考えている。
【0053】
クエン酸が含まれないと、耐湿性包装を考慮する必要性も全くなくなるかどうかは不明である。安定性については、乾燥ボトルでも達成されることができるかもしれないが、一旦開封されたボトルや南フロリダ又はバスルームの高湿度環境に曝されたボトルを模擬したストレステストでは、破損する可能性がある(クエン酸の含有とは関係なく)。
【0054】
これは、パッケージ当たりの個別ユニットの数が少ない製品パッケージング問題を解決する。例えば、10日分が入れられたボトルにするとか、個々にブリスターパック、又はパウチパックすることができる(例えば、Alka-Seltzerは、パウチ毎に2錠有する)。
【0055】
湿度を制御するため、またCO2の発生を防止するか又は減少させるために、裏面にパンチ穴があけられたブリスターパックに、複数の錠剤が、個々に独自の収容領域を有するように密封されたものがよい。多くの抗生物質、幾つかのOTC制酸剤、及び多くの他のピル・タイプの製品が、この方法でパックされる。
【0056】
発明者らは、重炭酸カリウムの安定性を向上させることができる二つの方法を見い出した。
【0057】
1.第1は、重炭酸カリウムを熱処理し、以下の反応により、炭酸カリウム・シェル(例えば、材料の重量の2%〜10%を含む)を生成する。
【0058】
重炭酸カリウム:KHCO3
重炭酸カリウムが100°C〜120°Cに加熱されたとき、重炭酸カリウムが、K2CO3(炭酸カリウム)、H2O(水)及びCO2(二酸化炭素)に分解することを示す化学反応式は次のとおりである。
【0059】
【化1】

【0060】
熱処理された重炭酸ナトリウムは商業的に入手可能であるが、熱処理された重炭酸カリウムは、そうではない。その結晶は、アスピリンに関する米国特許第5,552,084号の請求項1に記載されているが、これがどのようにされるかは記載されていない。
【0061】
発明者らは、真空オーブンがこの処理に必要であるとは考えておらず、また、100°C〜120°Cへの加熱も必要でないだろう。簡単な対流式オーブンを使用し、140°F(60℃)で1時間加熱することで十分であると考えている。
【0062】
工程中、様々な加熱パラメータの制御と試験は、(加熱前に)開始材料の重量を測定することによって行われ、加熱後、放出されたCO2 が変換量を示し、重量を減少させる。(但し、対流式オーブンでも問題とならないように、空気中の水分が蓄積されないこと、及びオーブンは予め加熱しておくこと)。
【0063】
次に、重炭酸カリウムの安定性試験は、様々な温度で加熱した後、高RH(相対湿度)環境の中に、重炭酸カリウムを置いておき、次に重炭酸カリウムを計量して、重量変化を観察し、様々な試験と比較することによって行われる。
【0064】
材料が反応性であって、水中にCO2が放出されるものとして、例えば、水を重炭酸カリウムに加えるか、又は重炭酸カリウムを水に加えて、圧力を測定することによって、測定されることができる。
【0065】
最終的に、発明者が所望する時間枠(1分未満)内で、錠剤が容易に浮遊するかどうかを調べられるべきである。
【0066】
2.第2の方法は、重炭酸カリウム結晶をコートすることであり、重炭酸カリウム結晶を混合し、少量の酸化亜鉛でコーティングされる。
【0067】
この方法は、Arm&Hammerのメーカーに特許が付与されているが、それは酸化マグネシウムを用いたものであり、酸化亜鉛については例として記載されているが権利範囲には含まれていない。
【0068】
この方法と材料の試験方法は、米国特許第5,552,084号に記載され、取捨選択技術を用いているが、それは、不安定な重炭酸カリウムは、凝集し易いためである。
【0069】
本発明は、ウイルソン病用の経口発泡GR/IR酢酸亜鉛の配合物を含むもので嘔気等を減らす効果がある。
【0070】
明細書に開示されている全ての測定は、特に明記しない限り、地球の海水面での、標準温度及び標準圧力である。人体に使用され、又は使用することを目的とする全ての材料は、特に明記しない限り、生体適合性がある。
【0071】
上述の実施形態は、例示の目的のためのものであり、本発明の範囲は、以下の特許請求の範囲の記載によってのみ限定される。
【特許請求の範囲】
【請求項1】
重炭酸カリウムと、100mgを超える量の元素亜鉛とを含む、人摂取用の経口投与形態の亜鉛。
【請求項2】
制酸剤として重炭酸カリウムを含む、人摂取用の経口投与形態の亜鉛。
【請求項3】
ロゼンジ又はうがい薬の他に発泡剤を含む、人経口摂取用の経口投与形態の亜鉛。
【請求項4】
最初の1時間に50mgを超える元素亜鉛を放出し、少なくとも6時間に亘って、少なくとも50mgの元素亜鉛を放出する、経口投与形態の亜鉛。
【請求項5】
少なくとも50mgの元素亜鉛と、非セルロース膨張剤とを含む、経口投与形態の亜鉛。
【請求項6】
図2に示す生物学的利用能の曲線と同様な生物学的利用能を有する、経口投与形態の亜鉛。
【請求項7】
重炭酸カリウムと、少なくとも50mgの元素亜鉛と、システインとを含む、経口投与形態の亜鉛。
【請求項8】
重炭酸カリウムと、酢酸亜鉛とを含む、胃保持性配合物。
【請求項9】
亜鉛カルノシンを含む、胃保持性配合物。
【請求項10】
明細書の表1の縦列1又は縦列2における、横列1−横列4に記載された成分を含む、組成物。
【請求項11】
前記成分は、前記縦列3に記載された範囲にある、請求項10に記載の組成物。
【請求項12】
前記成分は、前記縦列4に記載された範囲にある、請求項10に記載の組成物。
【請求項13】
前記成分は、前記縦列5に記載された範囲にある、請求項10に記載の組成物。
【請求項14】
縦列1中、横列1−横列4に記載された前記成分を含む、請求項10乃至請求項13の何れかに記載の組成物。
【請求項15】
横列1−横列5に記載された前記成分を含む、請求項10乃至請求項13の何れかに記載の組成物。
【請求項16】
横列1−横列6に記載された前記成分を含む、請求項10乃至請求項13の何れかに記載の組成物。
【請求項17】
横列1−横列4及び横列6に記載された前記成分を含む、請求項10乃至請求項13の何れかに記載の組成物。
【請求項18】
請求項10乃至請求項17の何れかの組成物で作製された錠剤。
【請求項19】
前記発泡剤は熱処理されている、請求項1乃至請求項18の何れかの発明。
【請求項20】
10錠よりも少ない量でパッケージされている、請求項18又は請求項19に記載の複数の錠剤。
【請求項21】
10錠よりも少ない量でパッケージされている、請求項18又は請求項19に記載の複数の錠剤。
【請求項22】
亜鉛欠乏症の治療を必要とする被験者に亜鉛を付与する方法であって、請求項10乃至請求項17又は請求項19の何れかの組成物の有効量を前記被験者に投与することを含む、方法。
【請求項23】
亜鉛欠乏症の治療を必要とする被験者に亜鉛を付与する方法であって、請求項18又は請求項19の錠剤を前記被験者に毎日投与することを含む、方法。
【請求項24】
亜鉛欠乏症の治療を必要とする被験者に亜鉛を付与する方法であって、請求項18又は請求項19の錠剤を前記被験者に1日に2回投与することを含む、方法。
【請求項25】
前記組成物又は錠剤は、経口投与される、請求項22乃至請求項24の何れかに記載の方法。
【請求項26】
前記の毎日投与される量は、生物学的に利用可能な25mg〜300mgの亜鉛である、請求項22乃至請求項25の何れかに記載の方法。
【請求項27】
前記1日に投与される量は、生物学的に利用可能な25mg〜300mgの亜鉛である、請求項22乃至請求項25の何れかに記載の方法。
【請求項28】
組成物は6か月間投与される、請求項22乃至請求項27の何れかに記載の方法。
【請求項29】
人に投与するのに適した医薬組成物であって、2種以上の形態の亜鉛を含む、医薬組成物。
【請求項30】
前記形態の少なくとも1つは、亜鉛塩である、請求項29に記載の医薬組成物。
【請求項31】
前記形態は、各々が異なる溶解特性を有する、請求項29又は請求項30に記載の医薬組成物。
【請求項32】
少なくとも1の遊離亜鉛塩と、タンパク質又はアミノ酸に結合された亜鉛とを含む、請求項29、請求項30、又は請求項31に記載の医薬組成物。
【請求項33】
人に投与するのに適した医薬組成物であって、2種以上の亜鉛塩を含む、医薬組成物。
【請求項34】
前記塩は、各々が異なる溶解特性を有する、請求項33に記載の医薬組成物。
【請求項35】
迅速放出、遅延放出、胃保持性及び/又は徐放性放出である、請求項29乃至請求項34の何れかに記載の医薬組成物。
【請求項36】
発泡性を有する、請求項29乃至請求項34の何れかに記載の医薬組成物。
【請求項37】
血清又はインビトロでの放出特性が、tMaxはXとYの間、AUCはZとAの間、t1/2はBとCの間にあって、少なくともF時間における1時間当たりの尿中排泄率がD%とE%の間である、亜鉛製剤。
【請求項38】
人に投与するのに適した医薬組成物であって、カルシウムチャネル阻害剤と亜鉛とを含む、医薬組成物。
【請求項39】
人に投与するのに適した医薬組成物であって、制酸剤としての重炭酸カリウムと、亜鉛とを含む、医薬組成物。
【請求項40】
人に投与するのに適した医薬組成物であって、カリウムと亜鉛とを含む、医薬組成物。
【請求項41】
亜鉛とシステインを含む人に投与するのに適した医薬組成物であって、
血清又はインビトロでの放出特性が、tMaxはXとYの間、AUCはZとAの間、t1/2はBとCの間にあって、少なくともF時間における1時間当たりの尿中排泄率がD%とE%の間である、医薬組成物。
【請求項42】
人に投与するのに適した医薬組成物であって、亜鉛含有水を含む、医薬組成物。
【請求項43】
人に投与するのに適した医薬組成物であって、蒸留水と、亜鉛と、カリウムとを含む、医薬組成物。
【請求項44】
実質的に、図面に示され、及び/又は明細書に記載された発明。
【請求項1】
重炭酸カリウムと、100mgを超える量の元素亜鉛とを含む、人摂取用の経口投与形態の亜鉛。
【請求項2】
制酸剤として重炭酸カリウムを含む、人摂取用の経口投与形態の亜鉛。
【請求項3】
ロゼンジ又はうがい薬の他に発泡剤を含む、人経口摂取用の経口投与形態の亜鉛。
【請求項4】
最初の1時間に50mgを超える元素亜鉛を放出し、少なくとも6時間に亘って、少なくとも50mgの元素亜鉛を放出する、経口投与形態の亜鉛。
【請求項5】
少なくとも50mgの元素亜鉛と、非セルロース膨張剤とを含む、経口投与形態の亜鉛。
【請求項6】
図2に示す生物学的利用能の曲線と同様な生物学的利用能を有する、経口投与形態の亜鉛。
【請求項7】
重炭酸カリウムと、少なくとも50mgの元素亜鉛と、システインとを含む、経口投与形態の亜鉛。
【請求項8】
重炭酸カリウムと、酢酸亜鉛とを含む、胃保持性配合物。
【請求項9】
亜鉛カルノシンを含む、胃保持性配合物。
【請求項10】
明細書の表1の縦列1又は縦列2における、横列1−横列4に記載された成分を含む、組成物。
【請求項11】
前記成分は、前記縦列3に記載された範囲にある、請求項10に記載の組成物。
【請求項12】
前記成分は、前記縦列4に記載された範囲にある、請求項10に記載の組成物。
【請求項13】
前記成分は、前記縦列5に記載された範囲にある、請求項10に記載の組成物。
【請求項14】
縦列1中、横列1−横列4に記載された前記成分を含む、請求項10乃至請求項13の何れかに記載の組成物。
【請求項15】
横列1−横列5に記載された前記成分を含む、請求項10乃至請求項13の何れかに記載の組成物。
【請求項16】
横列1−横列6に記載された前記成分を含む、請求項10乃至請求項13の何れかに記載の組成物。
【請求項17】
横列1−横列4及び横列6に記載された前記成分を含む、請求項10乃至請求項13の何れかに記載の組成物。
【請求項18】
請求項10乃至請求項17の何れかの組成物で作製された錠剤。
【請求項19】
前記発泡剤は熱処理されている、請求項1乃至請求項18の何れかの発明。
【請求項20】
10錠よりも少ない量でパッケージされている、請求項18又は請求項19に記載の複数の錠剤。
【請求項21】
10錠よりも少ない量でパッケージされている、請求項18又は請求項19に記載の複数の錠剤。
【請求項22】
亜鉛欠乏症の治療を必要とする被験者に亜鉛を付与する方法であって、請求項10乃至請求項17又は請求項19の何れかの組成物の有効量を前記被験者に投与することを含む、方法。
【請求項23】
亜鉛欠乏症の治療を必要とする被験者に亜鉛を付与する方法であって、請求項18又は請求項19の錠剤を前記被験者に毎日投与することを含む、方法。
【請求項24】
亜鉛欠乏症の治療を必要とする被験者に亜鉛を付与する方法であって、請求項18又は請求項19の錠剤を前記被験者に1日に2回投与することを含む、方法。
【請求項25】
前記組成物又は錠剤は、経口投与される、請求項22乃至請求項24の何れかに記載の方法。
【請求項26】
前記の毎日投与される量は、生物学的に利用可能な25mg〜300mgの亜鉛である、請求項22乃至請求項25の何れかに記載の方法。
【請求項27】
前記1日に投与される量は、生物学的に利用可能な25mg〜300mgの亜鉛である、請求項22乃至請求項25の何れかに記載の方法。
【請求項28】
組成物は6か月間投与される、請求項22乃至請求項27の何れかに記載の方法。
【請求項29】
人に投与するのに適した医薬組成物であって、2種以上の形態の亜鉛を含む、医薬組成物。
【請求項30】
前記形態の少なくとも1つは、亜鉛塩である、請求項29に記載の医薬組成物。
【請求項31】
前記形態は、各々が異なる溶解特性を有する、請求項29又は請求項30に記載の医薬組成物。
【請求項32】
少なくとも1の遊離亜鉛塩と、タンパク質又はアミノ酸に結合された亜鉛とを含む、請求項29、請求項30、又は請求項31に記載の医薬組成物。
【請求項33】
人に投与するのに適した医薬組成物であって、2種以上の亜鉛塩を含む、医薬組成物。
【請求項34】
前記塩は、各々が異なる溶解特性を有する、請求項33に記載の医薬組成物。
【請求項35】
迅速放出、遅延放出、胃保持性及び/又は徐放性放出である、請求項29乃至請求項34の何れかに記載の医薬組成物。
【請求項36】
発泡性を有する、請求項29乃至請求項34の何れかに記載の医薬組成物。
【請求項37】
血清又はインビトロでの放出特性が、tMaxはXとYの間、AUCはZとAの間、t1/2はBとCの間にあって、少なくともF時間における1時間当たりの尿中排泄率がD%とE%の間である、亜鉛製剤。
【請求項38】
人に投与するのに適した医薬組成物であって、カルシウムチャネル阻害剤と亜鉛とを含む、医薬組成物。
【請求項39】
人に投与するのに適した医薬組成物であって、制酸剤としての重炭酸カリウムと、亜鉛とを含む、医薬組成物。
【請求項40】
人に投与するのに適した医薬組成物であって、カリウムと亜鉛とを含む、医薬組成物。
【請求項41】
亜鉛とシステインを含む人に投与するのに適した医薬組成物であって、
血清又はインビトロでの放出特性が、tMaxはXとYの間、AUCはZとAの間、t1/2はBとCの間にあって、少なくともF時間における1時間当たりの尿中排泄率がD%とE%の間である、医薬組成物。
【請求項42】
人に投与するのに適した医薬組成物であって、亜鉛含有水を含む、医薬組成物。
【請求項43】
人に投与するのに適した医薬組成物であって、蒸留水と、亜鉛と、カリウムとを含む、医薬組成物。
【請求項44】
実質的に、図面に示され、及び/又は明細書に記載された発明。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2013−509443(P2013−509443A)
【公表日】平成25年3月14日(2013.3.14)
【国際特許分類】
【出願番号】特願2012−537169(P2012−537169)
【出願日】平成22年11月1日(2010.11.1)
【国際出願番号】PCT/US2010/054981
【国際公開番号】WO2011/053917
【国際公開日】平成23年5月5日(2011.5.5)
【出願人】(512114626)シンセティック バイオロジックス,インコーポレイテッド (1)
【氏名又は名称原語表記】SYNTHETIC BIOLOGICS,INC.
【Fターム(参考)】
【公表日】平成25年3月14日(2013.3.14)
【国際特許分類】
【出願日】平成22年11月1日(2010.11.1)
【国際出願番号】PCT/US2010/054981
【国際公開番号】WO2011/053917
【国際公開日】平成23年5月5日(2011.5.5)
【出願人】(512114626)シンセティック バイオロジックス,インコーポレイテッド (1)
【氏名又は名称原語表記】SYNTHETIC BIOLOGICS,INC.
【Fターム(参考)】
[ Back to top ]

