胆汁中排泄への感受性に対する候補化合物のスクリーニング方法
肝実質細胞輸送タンパク質による胆汁中排泄への感受性に対する候補化合物のスクリーニング方法。該方法は、輸送タンパク質を含む肝実質細胞の培養物を提供する段階、ここで、該培養物は、少なくとも1つの毛細胆管を有し;かつ該少なくとも1つの毛細胆管内の候補化合物の量を決定する段階を含み、ここで、該少なくとも1つの毛細胆管中の候補化合物の量は、該輸送タンパク質による胆汁中排泄に対する、該候補化合物の感受性を示す。幾つかの実施態様において、該毛細胆管中の候補化合物の量を決定することは、該輸送タンパク質の発現を阻害すること、及び該輸送タンパク質の阻害の有無で、該小管中の化合物の量を比較することを含む。該小管中の候補化合物の量の差は、該輸送タンパク質による胆汁中排泄に対する該候補化合物の感受性を示す。一実施態様において、該輸送タンパク質の発現は、該肝実質細胞内の輸送タンパク質をコード化している遺伝子のコード鎖に相当する配列を有するRNAの導入を介して阻害される。任意に、該肝実質細胞の培養物は、サンドイッチ形態の長時間培養物である。該方法は、特に、1つの試みにおける多数の候補化合物のスクリーニングに適当できる。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願情報)
本出願は、2004年5月10日に出願された米国特許出願10/842,404の利点を主張する。これは、2000年3月17日に出願された米国一般特許出願09/527,352の一部継続であり、この開示は、本明細書中にその全体において引用により取り込まれ、かつ1999年3月17日に出願された米国仮特許出願60/124,810の利点を主張し、この開示は、本明細書中にその全体において引用により取り込まれる。
(助成金の記述)
本発明は、National Institute of Healthからの助成金番号GM41935の下、政府支援の一部において作成された。従って、米国政府は、本発明において特定の権利を有する。
【0002】
(技術分野)
本開示は、胆汁中排泄への感受性に対する、主に治療薬としての使用の候補となる化合物のスクリーニング方法に関するものである。特に、幾つかの実施態様において、本開示は、インビトロにおける、胆汁中排泄への感受性に対する候補化合物のスクリーニング方法に関するものである。化合物は、ヒト、及び他の温血脊椎動物への投与用治療薬として使用されるために選択され得る。幾つかの実施態様において、本開示は、hepatobiliary disposition(制限されないが、肝摂取、及び胆汁中排泄など)に関与する輸送タンパク質の同定に関するものである。
【0003】
(略語表)
AUC - 曲線下面積
BCRP - 乳癌耐性タンパク質
BSEP - 胆汁酸塩輸出ポンプ
ClB - 胆汁クリアランス
Clin - 固有のクリアランス
cMOAT - 小管多特異的有機アニオン輸送体(canalicular multispecific organic anion transporter)
CDF - カルボキシジクロロフルオレセイン
CFDA - カルボキシジクロロフルオレセイン ジアセテート
DMEM - ダルベッコ変法イーグル培地
EDTA - エチレンジアミンテトラアセテート
HP - ヒューレットパッカード
HPLC - 高速液体クロマトグラフィー
hr - 時間
i.v. - 静脈内
i.p. - 腹腔内
Km-酵素 - 基質反応のミカエリス-メンテン定数
LC/MS - 液体クロマトグラフィー/質量分析
mg pr - ミリグラム タンパク質
min - 分
MDR2、又はMdr2 - 多剤耐性タンパク質 2
MRP2、又はMrp2 - 多剤耐性関連タンパク質 2
Ntcp - Na+/タウロコール酸共輸送ポリペプチド
OAT - 有機アニオン輸送体
OATP1 - 有機アニオン輸送ポリペプチド 1
OATP2 - 有機アニオン輸送ポリペプチド 2
OCT - 有機カチオン輸送体
P-gp - P-糖タンパク質
SD - 標準偏差
UV - 紫外
UV/VIS - 紫外/可視
Vmax - 酵素触媒反応の最大速度
【背景技術】
【0004】
門脈血内に治療薬、薬剤、又は他の化合物を吸収するための最初のパスの代謝タンパク質は、肝臓への誘導を提供する。薬剤を飲み込むと、胃、及び小腸がそれを吸収し、続いて、血液から門脈、肝臓へと流れる。次に、肝臓は、肝臓血液供給を経て、該薬剤を高濃度で順番に急速に吸収し、かつ代謝され得る。従って、多量の薬剤が、体循環、又は薬物作用部位で見られることはないであろう。さらに、最初のパスの代謝経路を通る迅速な代謝産物は、不必要な高血漿濃度の形態を導くことがある。
【0005】
従って、多くの場合、肝臓中の治療組成物は、肝実質細胞(肝細胞)による吸収、及び毛細胆管を介する胆汁中の排泄において、望ましくないが、動物の循環系から除去される。Ntcp、並びにOatp、Oat、及び/又はOctイソ型を含む肝実質細胞に内在する輸送タンパク質は、肝実質細胞内への取り込みを仲介する。前記輸送体は、治療組成物のような生体異物、並びに内在性化合物を、肝実質細胞の洞様血管膜(sinusoidal membrane)を横切って移動させる。毛細胆管は、排泄された肝実質細胞成分を受け取り、かつ胆汁を、動物からの除去のために、総胆管に輸送する肝組織内の構造体である。従って、基質の胆汁中排泄は、洞様血管膜を横切るトランスロケーション、細胞質を通り抜ける移動、及び小管膜を横切る輸送を伴う、複雑なプロセスである。
【0006】
コンビナトリアル化学技術の出現により、治療薬としての潜在性を有する非常に多くの数の化合物の同定が可能になった。しかし、肝実質細胞による取り込み、及び毛細胆管を介した排泄にとって可能性の低い候補化合物を迅速に同定することができる、胆汁中排泄への感受性に対するアッセイは、薬理活性の合成、及びスクリーニング速度に遅行している。多数のインビボ(例えば、胆管にカニューレを挿入した動物)、及びインビトロ標本(例えば、単離した灌流肝臓、単離肝実質細胞、肝実質細胞対(hepatocyte couplets)、肝形質膜ビヒクル(liver plasma membrane vesicles)、及び発現輸送タンパク質)は、胆汁中排泄プロセスの調査に使用されている。例えば、Oude Elferinkらの論文, Biochim. Biophys. Acta 1241:215-268, 1995.を参照されたい。
【0007】
さらに、Graf、及びBoyer, J.の論文, Hepatol. 10:387-394, 1990.に記載されているように、短時間(3〜8時間)の培養肝実質細胞対は、蛍光顕微鏡を利用して、蛍光化合物の胆汁中排泄の直接的調査に使用されている。しかし、生体異物の胆汁中排泄を研究する培養肝実質細胞対の適用は、基質が蛍光発色団を含む必要がある点で、限界がある。
長時間(通常、24時間より長い)培養肝実質細胞は、小管様構造を有する極性を回復することが報告されている。例えば、Barth、及びSchwarz, Proc. Natl. Acad. Sci. 79:4985-4987, 1982; Mauriceらの論文, J. Cell Sci. 90:79-92, 1988; Talaminiらの論文, Hepatology 25:167-172, 1997.を参照されたい。従来の培養条件下で保持された第一肝実質細胞は、薬物代謝、及び肝毒性の研究に使用されているが、長時間培養の肝実質細胞は、肝胆輸送研究の適切なモデルである。特に、Groothuis、及びMeijer, J.の論文Hepatology 24(Suppl. 1):3-28, 1996.及びLeCluyseらの論文, Adv. Drug Del. Rev. 22:133-186, 1996.に記載されているように、肝臓特異的機能(肝臓の輸送機能を含む)の急速な損失、並びに正常な胆汁小管網の確立、及び正常な肝実質細胞形態の維持の不全が、前記培養物中に観察されている。
【発明の開示】
【発明が解決しようとする課題】
【0008】
現在の方法では、ヒト胆汁中排泄の調査に広く適用できることが実証されていない。さらに、現在のアプローチでは、多くの薬剤候補に対する効率的な胆汁中排泄プロセスの調査に使用することができない。従って、肝摂取、及び胆汁中排泄に対する候補化合物の感受性を評価するアッセイが、長い間、必要とされている。このようなアッセイは、前記評価工程における初期の治療薬のさらなる評価から、胆汁中排泄に対して望ましくない高感受性のこれらの化合物の除外を容易にするであろう。これに対して、治療薬のさらなる試験のために、適切な候補化合物(例えば、胆汁中排泄に影響されない化合物)の迅速な同定が、長い間、必要とされている。
【課題を解決するための手段】
【0009】
(要旨)
本明細書中に、肝実質細胞輸送タンパク質による胆汁中排泄への感受性に対する候補化合物のスクリーニング方法を開示する。該方法は、複数の肝実質細胞、及び少なくとも1つの毛細胆管を含む細胞培養物を提供すること、ここで、該肝実質細胞の少なくとも1つは、輸送タンパク質を含み;該培養物に候補化合物を曝露すること;及び該少なくとも1つの毛細胆管中の該候補化合物の量を決定し、それによって、該肝実質細胞輸送タンパク質による胆汁中排泄への感受性に対する該候補化合物をスクリーニングすることを含む。好ましくは、肝実質細胞の培養物は、サンドイッチ形態の長時間培養物を含む。
【0010】
好ましくは、該毛細胆管中の候補化合物の量を測定することは、核酸を、該輸送タンパク質の発現阻害に十分な量で、該肝実質細胞内に導入することにより、該輸送タンパク質の発現を阻害することを含む。ここで、該核酸は、輸送タンパク質をコード化している遺伝子のコード鎖に相当する配列を含む。従って、また、本明細書中に、肝実質細胞タンパク質の発現を阻害する、単離した短い干渉RNA(siRNA)分子を提供する。他の実施態様において、第一及び第二細胞培養物を確立する、肝実質細胞輸送タンパク質による胆汁中排泄への感受性に対する候補化合物のスクリーニング方法を提供する。
【0011】
該第一培養物は、輸送タンパク質を発現し、かつ該第二培養物は、該輸送タンパク質の発現を少なくとも部分的に阻害する。該方法は、該第一培養液、及び該第二培養液に該候補化合物を、候補化合物の取り込みに十分な時間、曝露すること;該第一及び第二培養物を洗浄し、かつ溶解すること;各培養物から得られた溶解産物の中に存在する該候補化合物の量を決定すること、及び各培養溶解産物中の該候補化合物の量を使用して、該輸送タンパク質による胆汁中排泄への感受性に対する候補化合物を評価することを含む。
【0012】
幾つかの実施態様において、第一及び第二培養物の各々を、無処置の毛細胆管を有する該第一及び第二培養物の各々の第一分画、並びに破壊した毛細胆管を有する該第一及び第二培養物の各々の第二分画の2つの分画に分離し、かつ下記段階を含む:(i)候補化合物を、該第一及び第二培養物の各々の第一分画、並びに該第一及び第二培養物の各々の第二分画に、該候補化合物の取り込みに十分な時間(T)曝露し;(ii)該第一及び第二培養物の各々の第一及び第二分画を洗浄し、かつ溶解すること;(iii)段階(ii)の該第一及び第二培養物の各々の各分画から得られた溶解産物の中に存在する、該候補化合物の量を測定すること;(iv)該毛細胆管内の質量を、無処置の毛細胆管を有する該第一及び第二培養物の第一分画、並びに破壊した毛細胆管を有する第一及び第二培養物の第二分画からの溶解産物の中に存在する候補化合物の量の差として計算すること;及び(v)段階(iv)で計算された質量を用いて、該輸送タンパク質による胆汁中排泄への感受性に対する候補化合物を評価することである。
【0013】
別の実施態様において、肝実質細胞中のタンパク質発現の阻害方法を提供する。該方法は、タンパク質を発現する肝実質細胞を提供すること、及びオリゴヌクレオチドを、該タンパク質の発現阻害に十分な量で、該肝実質細胞内に導入することを含み、ここで、該オリゴヌクレオチドは、該タンパク質をコード化している遺伝子のコード鎖に相当するヌクレオチド配列を含む。
従って、本開示主題の目的は、胆汁中排泄への感受性に対する候補化合物の迅速なスクリーニング方法を提供することである。
【0014】
本開示主題のさらなる目的は、インビボにおいて、胆汁中排泄への感受性に対する候補化合物のスクリーニング方法を提供することである。
また、本開示主題のさらなる目的は、1つの試みにおいて、多くの候補化合物のスクリーニングを容易にする、胆汁中排泄への感受性に対する候補化合物のスクリーニング方法を提供することである。
また、本開示主題のさらなる目的は、胆汁中排泄への感受性に対する候補化合物のハイスループットなスクリーニング方法を提供することである。
【0015】
さらにまた、本開示主題のさらなる目的は、肝実質細胞中の1以上の特定タンパク質の発現を選択的に抑制する方法を提供し、例えば、薬剤の取り込みに関与する肝臓タンパク質の同定など、これらの機能分析、並びに他のタンパク質、及び分子との相互作用を含む、これらのタンパク質の研究を容易にする。
これらの目的、及び他の目的は、本開示主題により、全体的に、又は部分的に達成される。本開示主題の目的の幾つかは、本明細書中の上記に記載されている。他の目的は、本明細書中の下記に示した最も良い、添付の実験室内実施例、及び図面と関連して、説明が進むにつれて明らかになるであろう。
【発明を実施するための最良の形態】
【0016】
(配列表の簡単な説明)
配列番号:1は、ラットMrp2のポリヌクレオチド配列である。
配列番号:2は、ラットMrp3のポリヌクレオチド配列である。
配列番号:3は、ラットMrp2のコード鎖の短い分節に相当するsiRNAのポリヌクレオチド配列である。本明細書中では、siMRP2AB1と呼ぶ。
配列番号:4は、ラットMrp2のコード鎖の短い分節に相当するsiRNAのポリヌクレオチド配列である。本明細書中では、siMRP2AB2と呼ぶ。
配列番号:5は、ラットMrp2のコード鎖の短い分節に相当するsiRNAのポリヌクレオチド配列である。本明細書中では、siMRP2AB3と呼ぶ。
配列番号:6は、ラットMrp3のコード鎖の短い分節に相当するsiRNAのポリヌクレオチド配列である。本明細書中では、siMRP3と呼ぶ。
配列番号:7は、ホタル(フォチナス ピラリス(Photinus pyralis))ルシフェラーゼ(siFL)のコード鎖の短い分節に相当するsiRNAのポリヌクレオチド配列である。
【0017】
(詳細な説明)
本開示主題に従って、胆汁中排泄への感受性に対する候補化合物、又は基質のスクリーニング方法を提供する。該方法は、培養物中の複数の肝実質細胞を提供すること、ここで、該培養物は、小管スペースを有する少なくとも1つの毛細胆管を含み、かつ該肝実質細胞の少なくとも1つは、輸送タンパク質を含み;該培養物に候補化合物を曝露すること;及び該少なくとも1つの毛細胆管の小管スペース内の該候補化合物の量を決定することを含み、該少なくとも1つの毛細胆管の小管スペース内の該候補化合物の量は、該輸送タンパク質による胆汁中排泄に対する候補化合物の感受性を示している。
【0018】
当業者に明らかなように、インビボにおいて、基質の胆汁中排泄は、洞様血管膜を横切るトランスロケーション、細胞質を通り抜ける移動、及び小管膜を横切る輸送を伴う。従って、本開示の好ましい肝実質細胞培養物において、インビボにおける肝実質細胞により示される機能特性を証明する。例えば、類洞又は小管の輸送系、或いは、洞様血管及び小管、双方の輸送系などの肝臓輸送系の確立が、本発明に従って、特に意図される。典型的な輸送タンパク質系は、下記のものを含むが、これらに制限されない:NTCP、OATPイソ型(OATP1A2、OATP1B1、OATP1B3、及びOATP2B1を含むが、これらに制限されない。)、OATイソ型(OAT2、及びOAT4を含むが、これらに制限されない。)、OCTイソ型(OCT1、及びOCT3を含むが、これらに制限されない。)、BSEP、MRPイソ型(MRP1、MRP2(配列番号:1のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP3(配列番号:2のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP4、MRP5、MRP6、MRP7、MRP8、及びMRP9を含むが、これらに制限されない。)、MDRイソ型(MDR1、MDR2、及びMDR3を含むが、これらに制限されない。)、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せである。
【0019】
ヒトタンパク質に対する、一般に受け入れられているタンパク質名の用語は、全て大文字で記載されることが要求される。一方、他の生物体のタンパク質は、通常、最初の文字のみ大文字で書かれたタンパク質名で記載される。しかし、便宜上、ヒトタンパク質、及び他の種からのタンパク質、双方を参照する場合、本明細書中に開示したタンパク質名は、時々、全て大文字で記載する。本明細書中に開示した全てのタンパク質は、大文字型にかかわらず、他に特定することのない限り、全ての種を含むことが意図される。
【0020】
さらに、また、肝実質細胞培養物中の少なくとも1つの毛細胆管の確立、及び正常な肝実質細胞形態の確立を、本開示に従って提供する。好ましくは、該培養物は、複数の毛細胆管を含む。さらに好ましくは、複数の毛細胆管は、小管網を含む。下記で詳細に論じる、該少なくとも1つの毛細胆管の小管スペース内の候補化合物の量は、胆汁中排泄に対する該候補化合物の感受性を示す。
下記用語は、当業者に十分に理解されると考えられるが、下記規定は、本開示主題の説明を容易にするために説明される。
【0021】
用語"候補化合物"、又は"候補基質"は、胆汁中排泄に対する化合物の感受性の特徴付けが望ましい、全ての化合物を意味する。典型的な候補化合物、又は基質は、薬剤及び他の治療薬などの生体異物、発癌性物質、及び環境汚染物質、並びに、ステロイド、脂肪酸、及びプロスタグランジンなどの生物体内生物質を含む。
本明細書中に開示した主題の方法に従って、候補薬剤、及び他の治療薬は、温血脊椎動物の治療に有用であることが意図される。従って、本明細書中に開示した主題は、哺乳動物、及び鳥類に関わる。
【0022】
意図されるものは、ヒトなどの哺乳動物、並びに絶滅の危機のある重要な哺乳動物(シベリア虎など)、ヒトにとって経済的に重要な動物(ヒトによって消費される農園で飼育される動物)、及び/又は社会的に重要な動物(ペットとして、又は動物園で保護される動物)、例えば、ヒト以外の食肉動物(猫、及び犬など)、豚(豚、雄豚、野豚)、反芻動物(畜牛、雄牛、羊、キリン、鹿、山羊、バイソン、ラクダなど)、及び馬などの治療である。また、意図されるものは、動物園に保護された絶滅の危機のある鳥、並びに、家禽、さらに詳細には家畜化した家禽、すなわち、七面鳥、鶏、カモ、ガチョウ、ホロホロ鳥(guinea fowl)等の家禽の種類の鳥の治療を含む、鳥の治療であり、それらはまた、全てヒトにとって経済的に重要である。従って、意図されるものは、家畜化した豚(豚、及び雄豚)、反芻動物、馬、家禽等を含むがこれらに限定されない家畜の治療を含む。
【0023】
用語"胆汁中排泄"は、肝実質細胞(肝細胞)による吸収、及び該毛細胆管を介する胆汁中の排泄により、基質が動物の循環系から除去される生物学的プロセスを意味する。該肝実質細胞内への取り込みは、下記のものを含む、肝実質細胞に内在する輸送系により仲介される:NTCP、OATPイソ型(OATP1A2、OATP1B1、OATP1B3、及びOATP2B1を含むが、これらに制限されない。)、OATイソ型(OAT2、及びOAT4を含むが、これらに制限されない。)、OCTイソ型(OCT1、及びOCT3を含むが、これらに制限されない。)、BSEP、MRPイソ型(MRP1、MRP2(配列番号:1のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP3(配列番号:2のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP4、MRP5、MRP6、MRP7、MRP8、及びMRP9を含むが、これらに制限されない。)、MDRイソ型(MDR1、MDR2、及びMDR3を含むが、これらに制限されない。)、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せである。毛細胆管は、排泄される成分を該肝実質細胞から受け取り、かつ該胆汁を、動物からの除去のために胆管に輸送する、肝組織内の構造体である。
【0024】
本明細書中、及び請求項中に使用される句"候補化合物の量"、及び/又は句"少なくとも1つの毛細胆管中の候補化合物の量を決定すること"は、本開示のアッセイに従って、肝実質細胞により吸収され、かつ少なくとも1つの毛細胆管内に排泄される候補化合物の任意量を意味する。例えば、"量"は、本主題に従って候補化合物を培養物に曝露後、少なくとも1つの毛細胆管中に存在する候補化合物が実質的にないことを意味し得る。また、"量"は、本主題に従って候補化合物を培養物に曝露後、少なくとも1つの毛細胆管中に実質的に存在する、全ての候補化合物を意味し得る。従って、句"少なくとも1つの毛細胆管中の候補化合物の量"は、高度に排泄されず、大量に排泄され、かつ大量にかつ迅速に排泄される候補化合物を示すように使用される。
【0025】
また、句"少なくとも1つの毛細胆管中の候補化合物の量を決定すること"は、胆汁中排泄指数計算、及び胆汁クリアランス計算の使用を引用することを意味する。また、句"少なくとも1つの毛細胆管中の候補化合物の量を決定すること"は、以下に記載されている本開示アッセイのハイスループットの実施態様に記載されているように、少なくとも1つの毛細胆管中への候補化合物の取り込みによる、マーカー化合物の減少量の検出を意味し得る。従って、"少なくとも1つの毛細胆管中の候補化合物の量"の定量的、及び定性的測定は、本開示主題の範囲内であることが意図される。
【0026】
また、句"候補化合物の量"、及び/又は句"少なくとも1つの毛細胆管中の候補化合物の量を決定すること"は、例えば、候補化合物類、又は一連の候補化合物をスクリーニングし、かつ続いて、該類、又は一連のもののうちの該候補化合物の胆汁中排泄への感受性の順位付けを確立することを意味する。従って、該候補化合物、或いは前記順位付けにより、排泄に対して小さいか又は低い感受性が観測される化合物が、治療薬としてのさらなる実験、又は開発に選択され得ることは、本主題の好ましい実施態様に従って意図される。一方、前記順位付けにより、排泄に対して高いか又は大きい感受性が観測される化合物は、治療薬としてのさらなる実験、又は開発から除外され得る。
【0027】
しかし、当業者に既に明らかであるように、化合物が胆汁中排泄に対して感受性があるという特性は、必ずしも、治療薬としての該化合物のさらなる開発を妨げるものではない。実際、治療薬としての特定の候補化合物の開発を進めるかどうかという決定は、限定されないが該候補化合物の生物活性を含む、多くの要因に基づく。胆汁中排泄への感受性は、重要な要因であるが、当業者に一般的に考慮される唯一の要因ではない。それゆえ、本発明の方法に従って、胆汁中排泄への感受性の特性は、治療薬としての候補化合物の開発を進めるか否かの評価において、当業者に使用されることが望ましいデータを提供する。
【0028】
本明細書中で使用されるように、句"二本鎖RNA"は、二本鎖を形成するワトソン-クリック塩基対合の少なくとも一部分のRNA分子を意味する。そのようなものとして、該用語は、完全な、又は部分的のみの二本鎖、どちらかのRNA分子を含むことが理解される。例証的な二本鎖RNAは、分子間ハイブリダイゼーションにより部分的に、又は完全に二本鎖である、少なくとも2つの異なったRNA鎖を包含した分子を含むが、これらに制限されない。さらに、該用語は、分子内ハイブリダイゼーションにより二本鎖領域を形成することができる(例えば、ヘアピン)、一本鎖RNA分子を包含する。従って、本明細書中で使用されるように、句"分子間ハイブリダイゼーション"、及び"分子内ハイブリダイゼーション"は、二本鎖形成に関与するヌクレオチドが、それぞれ、異なる分子、又は同一分子に存在する、二本鎖分子を意味する。
【0029】
本明細書中で使用されるように、句"二本鎖領域"は、ヌクレオチド間の水素結合を介した二本鎖構造内にある、核酸分子の任意領域を意味する。これは、当業者に理解されるように、シトシンとグアノシンとの間、アデノシンをチミジンとの間、アデノシンとウラシルとの間、及び任意の他の核酸二本鎖間の水素結合を含むが、これらに制限されない。該二本鎖領域の長さは、連続した15塩基対から数千塩基対まで、変化することができる。一実施態様において、該二本鎖領域は、少なくとも15塩基対であり、他の実施態様において、15〜50塩基対であり、さらに他の実施態様において、15〜30塩基対である。さらに他の実施態様において、該二本鎖領域の長さは、19、21、22、25、及び30塩基対からなる群から選択される。代表的な実施態様において、該二本鎖領域の長さは、19塩基対である。上記のように、該二本鎖領域の形成は、分子間ハイブリダイゼーション(すなわち、2以上の異なるRNA分子が関わる)か、又は分子内ハイブリダイゼーションを介して、相補的RNA鎖(例えば、センス鎖とアンチセンス鎖)のハイブリダイゼーションから生じる。後者は、一本鎖RNA分子が、同一RNA分子内で互いにハイブリダイズすることができる自己相補的領域を含む場合に生じ得る。通常、これらの自己相補的領域は、該分子内ハイブリダイゼーションにより、"ヘアピン"と呼ばれるものを形成するように、ヌクレオチドの短い範囲(例えば、約5〜10個のヌクレオチド)に分離される。
【0030】
本明細書中で使用されているように、用語"阻害する"、"抑制する"、"下方制御する"、"ノックダウンする"、及びこれらの文法的変化形は、同義的に使用され、かつ遺伝子発現、又は1以上の遺伝子産物をコードしているRNAのレベルを、本開示主題の核酸分子の欠如において観測されるもの以下に低下させる活性を意味する。一実施態様において、siRNA分子を用いた阻害は、標的RNAの安定状態レベルの低下をもたらす。他の実施態様において、siRNA分子を用いた阻害は、標的遺伝子の発現レベルが、RNAi応答を媒介することができない不活性化又は減弱化分子の存在下で観測されるレベル以下となる。他の実施態様において、本開示主題のsiRNA分子を用いた遺伝子発現の阻害は、それが欠如しているよりも、siRNA分子の存在下の方が大きい。また、他の実施態様において、遺伝子発現の阻害は、遺伝子によりコード化されているmRNAの分解(例えば、siRNAにより媒介されるRNAiにより)の促進速度と関連している。
【0031】
用語"標識化合物"、及び"ラベル化基質"は、同義的に使用され、かつ蛍光又は化学発光分光測光法、シンチレーション分光法、クロマトグラフィー、液体クロマトグラフィー/質量分析(LC/MS)、及び比色分析などの標準的な検出技術を用いて容易に検出することができる化合物を意味する。従って、例証的な標識化合物には、蛍光発生又は蛍光化合物、化学発光化合物、比色定量用化合物、UV/VIS吸収化合物、放射性核種、及びそれらの組合せがあるが、これらに制限されない。
【0032】
一般的に、本明細書中に記載した胆汁中排泄プロセスを通して、大量に吸収され、かつ排泄される治療的組成物は、対象に与える治療効果において微小変化を有する。従って、評価工程における初期の治療薬としてのさらなる評価から、好ましくない高感受性化合物の除外を容易にするために、肝実質細胞の取り込み、及び胆汁中排泄への化合物の感受性を、インビトロ試験で確立することが非常に望ましい。本開示の胆汁中排泄アッセイは、このような試験を提供する。
【0033】
本開示主題の方法の使用にとって、培養液中でのラット肝実質細胞が好ましい;しかし、当業者に明らかであるように、肝実質細胞の適切な供給源すべてが、本主題の範囲内にあることが意図される。例証的な供給源は、上記の温血脊椎動物である。特に、例証的な供給源は、ヒト、サル、類人猿、ネコ、イヌ、ブタ、雄ブタ、ウシ、雄ウシ、ヒツジ、ウマ、シチメンチョウ、ニワトリ、カモ、及びガンであるが、これらに制限されない。さらに、該肝実質細胞培養物は、純粋である必要はなく、むしろ、特定のアッセイに所望されるように、他の細胞種を含み得る。限定されない例において、該肝実質細胞培養物は、肝細胞の他の種をさらに含み得る。幾つかの実施態様において、他の肝細胞培養物は、肝実質細胞とともに、クップファー細胞を含む。
【0034】
本主題の胆汁中排泄アッセイ方法は、少なくとも1つの肝実質細胞層が、マトリックスの2つの層の間に形成された、肝実質細胞のサンドイッチ培養物を確立することを任意に含む。サンドイッチ培養物としての形態は、該培養物にとって好ましい形態であり、当業者に明らかであるように、適切な形態全てが、本開示の範囲内であることが意図される。例えば、少なくとも1つの毛細胆管が形成され、かつ肝実質細胞の機能特性が確立される、培養物中の肝実質細胞のクラスター、集合体、又は他の会合体又は郡は、本開示の範囲内にあることが意図される。好ましくは、該培養物形態は、複数の毛細胆管の形成を促進する。さらに好ましくは、該培養物形態は、小管網の形成を促進する。本明細書中で詳細に論じられているように、該毛細胆管の小管スペース中の候補化合物の量は、該候補化合物の胆汁中排泄への感受性を示す。
【0035】
加えて、好ましいサンドイッチ形態において、肝実質細胞は、マトリックスの2つの層、又は足場の間の単層中で培養される。しかし、また、該肝実質細胞は、該マトリックス内に埋め込まれ得るか、又は一次元、二次元、及び三次元の肝実質細胞集合体が形成されるように、該マトリックスを介して、垂直に、平行に、対角線上に、又はこれらの任意の組合せで、不均一に広がり得る。本開示に従って、該肝実質細胞培養物は、適切なマトリックスとともに、肝実質細胞を混合し、かつ該混合物を、マルチウェルプレートなどの適切な培養容器に入れることにより形成され得る。
【0036】
該肝実質細胞の培養物にとって、コラーゲンが、好ましい基質、又は足場であり、当業者に明らかであるように、天然、合成、又はそれらの組合せの適切な基質、又は足場が、本開示主題の範囲内であることが意図される。例えば、制限されないが、ラミニン、及びベッドフォード, マサチューセッツのCollaborative Biomedical Products社から登録商標MATRIGEL(登録商標)で売られている、生物学的細胞培養物基質を誘導化した基底膜を含む、他の生物学的基質は、適切な基質、又は足場材料であることが意図される。また、ポリマーなどの様々な材料から一般的に製造される合成マトリックス培地材料、基質材料、又は足場材料も、本主題の範囲内にあることが意図される。また、肝実質細胞の培養に使用される、特定のマトリックスに用いる成分材料の変形物も、本開示の方法に従って意図される。
【0037】
培養肝実質細胞を、"長時間培養物"として培養することが好ましい。"長時間培養物"は、少なくとも約12時間培養した肝実質細胞を意味する。さらに好ましくは、"長時間培養物"は、少なくとも約24時間、少なくとも約48時間、又は少なくとも約72時間培養した肝実質細胞を意味する。さらに好ましくは、"長時間培養物"は、少なくとも約96時間培養した肝実質細胞を意味する。さらに好ましくは、特にヒト肝実質細胞の培養物を用いて、約168〜240時間(すなわち、7〜10日間)培養した肝実質細胞を意味する。長時間培養は、毛細胆管の形成、及び該肝実質細胞内の機能特性の確立を促進する。
【0038】
用語"調節する"は、1以上のタンパク質、又はタンパク質サブユニットをコードしている遺伝子の発現レベル、或いはRNA分子、又は相当するRNA分子のレベルを変化させることを意味する。或いは、発現、レベル、又は活性が、モジュレータの非存在下で観測されるものよりも大きく、又は小さくなるように、1以上のタンパク質、又はタンパク質サブユニットの活性を、上方制御、又は下方制御する。例えば、用語"調節する"は、"阻害する"、又は"抑制する"を意味するが、語"調節する"の使用は、この定義に制限されない。
【0039】
用語"RNA"は、少なくとも1個のリボヌクレオチド残基を含む分子を意味する。"リボヌクレオチド"は、β-D-リボフラノース部位の2'位にヒドロキシル基を有するヌクレオチドを意味する。該用語は、二本鎖RNA、一本鎖RNA、二本鎖及び一本鎖領域、双方を有するRNA、部分的に精製したRNAなどの単離RNA、本質的に純粋なRNA、合成RNA、組換え技術により製造されたRNA、並びに1以上のヌクレオチドを追加、削除、置換、及び/又は変更した、自然発生的RNAとは異なる変化RNA、又は類似体RNAを包含する。前記変化は、siRNAの末端に、又は内部に、例えば、該RNAの1以上のヌクレオチドで、非ヌクレオチド物質の追加を含み得る。また、本開示主題のRNA分子のヌクレオチドは、非自然発生的ヌクレオチド、又は化学的に合成したヌクレオチド、又はデオキシヌクレオチドのような、非標準的なヌクレオチドを含む。これらの変化RNAは、類似体、又は自然発生的RNAの類似体と呼ばれ得る。
【0040】
用語"低分子干渉RNA"、"短干渉RNA"、"低分子ヘアピンRNA"、"siRNA"、及びshRNAは、同義的に使用され、かつRNA干渉、又は遺伝子サイレンシングを媒介することができる、全ての核酸分子を意味する。例えば、Bass, Nature 411:428-429, 2001; Elbashirらの論文, Nature 411:494-498, 2001a;及びPCT 国際公開番号WO 00/44895, WO 01/36646, WO 99/32619, WO 00/01846, WO 01/29058, WO 99/07409, 及びWO 00/44914を参照されたい。本開示主題のsiRNA分子の制限されない例を、配列番号:3、4、及び5に示す。一実施態様において、該siRNAは、相補的センス、及びアンチセンス領域を含む二本鎖ポリヌクレオチド分子を含み、該アンチセンス領域は、標的核酸分子の領域に対して相補的な配列を含む(例えば、Mrp2、又はMrp3をコードしているmRNA)。他の実施態様において、該siRNAは、自己相補的センス、及びアンチセンス領域を有する一本鎖ポリヌクレオチドを含み、該アンチセンス領域は、標的核酸分子の領域に対して相補的な配列を含む。他の実施態様において、該siRNAは、自己相補的センス、及びアンチセンス領域を含む1以上のループ構造、及び軸を有する一本鎖ポリヌクレオチドを含み、該アンチセンス領域は、標的核酸分子の領域に対して相補的な配列を含み、かつ該ポリヌクレオチドは、インビボ、又はインビトロで処理され、RNAiを媒介することができる活性siRNAを生じ得る。本明細書中で使用するように、siRNA分子は、RNAのみを含む分子に制限される必要はなく、さらに、化学的に改質したヌクレオチド、及び非ヌクレオチドをさらに含む。
【0041】
用語"輸送タンパク質"は、分子を、細胞(例えば、肝実質細胞)内に(タンパク質の取り込み)、及び細胞外に(タンパク質の流出)運搬する機能を有するポリペプチド、並びに、分子を細胞内に輸送(例えば、トランスロケーションタンパク質)、及び他の関連輸送活性を有するポリペプチドを意味する。
年来の特許法の慣習に続いて、用語"a"、及び"an"は、請求項を含む本出願中において使用される場合、"1以上"を意味する。
【0042】
(比較実施態様)
本開示主題の一実施態様に従って、複製肝実質細胞培養物、好ましくはサンドイッチ形態を確立した。第一培養物を、標準緩衝液に曝露し、かつ第二培養物を、Ca2+フリー緩衝液に曝露した。該Ca2+フリー緩衝液への曝露は、肝実質細胞の単層中の接着作用、又は接合部の複合体を破壊することにより、該毛細胆管を該肝実質細胞単層内に分離する。該Ca2+フリー緩衝液への曝露は、該接着作用、又は接合部の複合体を破壊する好ましい方法であり、該毛細胆管を実質的に分離する。一方、当業者に明らかなように、該接着作用、又は接合部の複合体を破壊し、該毛細胆管の実質的分離を促進するための、全ての適切な方法は、本開示の範囲内であることが意図される。例証的な技術は、制限されないが、細胞間の結合部位と相互作用するペプチドの該培養物への投与を含み、それによって隣接する細胞を結合から抑制する。
【0043】
次に、候補化合物、又は化合物を、各培養物に加える。該候補化合物は、Ca2+フリー緩衝液で処理された培養物中の毛細胆管内に保持され得ない。従って、この培養物中において、候補化合物は、肝実質細胞内に吸収され、かつ該肝実質細胞の細胞質内に保持され得る。しかし、該小管膜を横切って肝実質細胞により排泄される該候補化合物の任意量が、該緩衝液培地中に流出し、かつ該緩衝液培地が除去される時に、除去されるであろう。対照的に、該毛細胆管が無処置である該肝実質細胞サンドイッチ培養物に、候補化合物を投与する場合、該細胞により吸収され、かつ該細胞により排泄される任意の候補化合物は、該肝実質細胞の細胞質内、及び該毛細胆管内に維持される。
【0044】
次に、該無処置の毛細胆管内に存在する候補化合物の量を測定することが望ましい。該干渉培地を、該培養物から除去し、かつ該培養物を洗浄して溶解する。下記の実験室内実施例に記載されているように、該細胞の該培養物中への溶解を、該培養物を撹拌して合わせた適切な溶解緩衝液の添加により達成され得る。好ましい溶解緩衝液は、界面活性剤を含む。望ましい測定は、無処置の毛細胆管を有する培養物から得られた溶解物と比べて、(例えば、Ca2+フリー培地への曝露により)破壊した毛細胆管を有する培養物からの溶解物中に存在する候補基質の量を比較することにより得られる。2つの特定の計算が、該培養物の比較、及び該無処置の毛細胆管中に残存する候補化合物の量の決定に利用されている。上述したように、該無処置の毛細胆管中の候補化合物の量は、候補化合物の胆汁中排泄への感受性を示す。
【0045】
1つの計算は、胆汁中排泄指標として記載する。該候補化合物の取り込み、及び排泄の計算は、以下のものである:100%×{(無処置の毛細胆管を有する培養物中の取り込み−該Ca2+フリー培養物中のみの肝実質細胞内の取り込み)÷(無処置の毛細胆管を有する培養物中の取り込み)}。他の計算は、胆汁クリアランス計算である。以下のように行われる:(無処置の毛細胆管を有する培養物中の取り込み−該Ca2+フリー培養物中のみの肝実質細胞内の取り込み)÷(インキュベーション時間×該緩衝液培地中の候補化合物の濃度)。幾つかの実施態様において、胆汁クリアランス値は、培地中の毛細胆管の質量と曲線下面積(AUC)との比として計算され得る。該AUCは、時間0〜時間T(時間は、任意の所望単位で測定され得る。通常、分で測定される。)の該培地中の候補化合物の積分値(例えば、生体異物濃度)を示す。実際、用語AUGは、下記式を意味し得る。
【0046】
【数1−1】

この式は、Gibaldi及びPerrierにより、the Pharmacokinetics, 第二版(Marcel Dekker社 1982) (pp. 13-14)に説明されている。
【0047】
下記の実験室内実施例に記載されているように、本主題のインビトロアッセイと、胆汁中排泄に対する標準的インビボアッセイとの比較した時に、胆汁クリアランスが、排泄の正確で所望される評価を提供することが決定された。特に、インビトロ胆汁クリアランス計算は、(1)高度に排泄されず;(2)大量に排泄され;かつ(3)大量にかつ迅速に排泄される候補基質のうち、十分な相違があった。従って、該胆汁クリアランス計算の使用は、本開示主題の重要な態様を含む。
【0048】
幾つかの実施態様において、第一及び第二培養物は、肝摂取、及び胆汁クリアランス、又は排泄への感受性に対する候補化合物をスクリーニングする方法への使用に対して確立される。1つの培養物中の細胞は、発現する1以上の肝実質細胞輸送タンパク質から、少なくとも部分的に阻害される。上記に直接記載した手順は、一般的に理解され、かつ胆汁中排泄への感受性に関する決定は、阻害された肝実質細胞輸送タンパク質により、該候補化合物が、肝摂取、及び胆汁クリアランス、又は排泄へのその感受性に関して評価されることを除いて、前述のように決定される。
【0049】
幾つかの実施態様において、第一及び第二培養物の各々を、無処置の毛細胆管を有する該第一及び第二培養物の各々の第一分画、並びに破壊した毛細胆管を有する該第一及び第二培養物の各々の第二分画の2つの分画に分離し、かつ下記を含む:かつ(i)候補化合物を、該第一及び第二培養物の各々の第一分画、並びに該第一及び第二培養物の各々の第二分画に、該候補化合物の取り込みに十分な時間(T)曝露し;(ii)該第一及び第二培養物の各々の第一及び第二分画を洗浄し、かつ溶解すること;(iii)段階(ii)の該第一及び第二培養物の各々の各分画から得られた溶解産物の中に存在する、該候補化合物の量を測定すること;(iv)該毛細胆管内の質量を、無処置の毛細胆管を有する該第一及び第二培養物の第一分画、並びに破壊した毛細胆管を有する第一及び第二培養物の第二分画からの溶解産物の中に存在する候補化合物の量の差として計算すること;及び(v)段階(iv)で計算された質量を用いて、該輸送タンパク質による胆汁中排泄への感受性に対する候補化合物を評価することである。
【0050】
研究に受け入れられる典型的な輸送タンパク質は、下記のものを含むが、これらに制限されない:げっ歯類、又はヒトNTCP、OATPイソ型(OATP1A2、OATP1B1、OATP1B3、及びOATP2B1を含むが、これらに制限されない。)、OATイソ型(OAT2、及びOAT4を含むが、これらに制限されない。)、OCTイソ型(OCT1、及びOCT3を含むが、これらに制限されない。)、BSEP、MRPイソ型(MRP1、MRP2(配列番号:1のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP3(配列番号:2のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP4、MRP5、MRP6、MRP7、MRP8、及びMRP9を含むが、これらに制限されない。)、MDRイソ型(MDR1、MDR2、及びMDR3を含むが、これらに制限されない。)、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せである。
【0051】
幾つかの実施態様において、該肝実質細胞輸送タンパク質の発現を阻害することは、2つの培養物のうちの1つの培養物中の該肝実質細胞の少なくとも1つに、対象の該肝実質細胞輸送タンパク質の発現を少なくとも部分的に阻害するのに十分な量で(例えば、10%)、RNAを導入することを含む。RNAは、阻害される肝実質細胞輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含み得る。この方法は、短い二本鎖RNA分子の能力の利点があり、細胞の遺伝子の下方制御を生じ、処理は、RNA干渉と呼ばれ、かつ本明細書中に詳細に記載した。
【0052】
当業者は、対象の輸送タンパク質の発現阻害の別の手順を、容易に認識するであろう。そのようなこれらの手順は、同様に、本明細書中に開示された方法により包含される。例えば、モルホリノオリゴヌクレオチドを使用して、タンパク質の発現を過渡的に阻害することができる。本明細書中で使用されるように、"モルホリノオリゴヌクレオチド"は、リボ核酸、及びデオキシリボ核酸ポリヌクレオチドに結合可能な塩基を支持する骨格を有するポリマー分子を意味する。幾つかの実施態様において、該ポリマーは、ペントース糖骨格部位を欠き、かつさらに、ヌクレオチド、及びヌクレオシドの典型であるホスホジエステル結合により結合したリボース、又はデオキシリボース骨格を欠く。代わりに、該モルホリノオリゴヌクレオチドは、環窒素を通して結合を有する窒素を含む6員環を含む。モルホリノオリゴヌクレオチドは、最小の交差反応を有する、ヌクレアーゼ分解、塩濃度に無関係の標的配列へのハイブリダイズ、及び標的配列への高特異性に対して強い体制を示す。特性の再調査にとって、モルホリノオリゴヌクレオチドの特徴、及び応用は、Summerton & Weller, Antisense Nucleic Drug Dev 7: 187-95, 1997、及びSummerton, Biochim Biophys Acta 1489(1): 141-58, 1999を参照されたい。これらは、本明細書中に引用により、これらの全体において取り込まれている。
【0053】
(代謝産物アッセイの実施態様)
本開示の方法の肝実質細胞において、特定の代謝活性(相I(Phase I)活性と呼ばれる。)は、実質的に低下され得る。胆汁輸送の維持に加えて、代謝活性の実質的低下は、親候補化合物の胆汁中排泄、対、代謝産物、又は該親候補化合物の代謝産物の間で違いがあり得るという点で、本開示のインビトロ胆汁中排泄アッセイの利点を示す。この特徴は、本開示の重要な態様を含む。
【0054】
本明細書中に開示した代謝産物アッセイの好ましい実施態様に従って、該方法は、肝実質細胞の2つの培養物の第一セット、及び第二セットを、好ましくは、コラーゲンと、肝実質細胞の少なくとも1つの層内に形成された少なくとも1つの毛細胆管の2つの層との間にサンドイッチされた、肝実質細胞の少なくとも1つの層を含む各培養物を用いて確立することを含む。該培養物の第一セットは、無処置の毛細胆管を含み、かつ該培養物の第二セットは、破壊した毛細胆管を含む。
【0055】
次に、代謝酵素活性、及び/又は輸送系を、培養物の第一、及び第二セットの各々のうちの1つの該培養物の肝実質細胞内に、相I肝酵素活性を上方制御することが知られている誘導因子を用いて、技術的に認められる技術に従って誘発させる。その同じことに関連した例証的な誘導因子、及び技術は、Parkinson, A. (1996) Casarett、及びDoullの技術の生態異物の生体内変換(Parkinson, A. (1996) Biotransformation of 生体異物s in Casarett and Doull's Toxicology)に記載されている。毒物の基礎科学(The Basic Science of Poisons), 第5版. (Klaassen, C.D. ed.) pp. 113-186, McGraw Hill, New York, 及びLeCluyseらによる, (1996) 薬剤吸収、及び代謝モデルにおける培養ラット肝実質細胞(cultured rat hepatocytes, in Models for Assessing Drug Absorption and Metabolism)(Borchardtらの文献. eds) pp 121-160, Plenum Press, New York、各々の内容は、本明細書中に引用により取り込まれている。
【0056】
候補親化合物を、培養物の第一、及び第二セットに、該候補親化合物が取り込まれるのに十分な時間、曝露する。培養物の各セットを洗浄し、次に溶解する。不活性代謝酵素を有する培養物の各セット中の培養物から得られた溶解物に存在する候補親化合物の量を決定する。また、活性代謝酵素を有する培養物の各セット中の培養物から得られた溶解物に存在する候補親化合物の代謝産物の量を決定する。
【0057】
該培養溶解産物中の候補親化合物の量を用いて、不活性代謝酵素を有する該培養物の胆汁クリアランス値を計算する。次に、計算された胆汁クリアランス値を用いて、上述のように、胆汁中排泄への該候補親化合物の感受性を決定する。該培養溶解産物中の候補親化合物の代謝産物の量を用いて、活性代謝酵素を有する該培養物の胆汁クリアランス値を計算する。次に、計算された胆汁クリアランス値を用いて、上述のように、胆汁中排泄への該代謝産物の感受性を決定する。
【0058】
(ハイスループットアッセイの実施態様)
幾つかの実施態様において、本開示主題は、ハイスループット肝摂取、及び胆汁中排泄アッセイに関連するものである。前記アッセイは、好ましくは、上述のように、内生洞様血管又は小管の輸送系、洞様血管及び小管の輸送系の双方、又は代謝タンパク質系に対する基質である標識化合物と合わせた、培養肝実質細胞の使用を伴う。例証的な輸送系は、下記のものを含むが、これらに制限されない:げっ歯類、又はヒトNTCP、OATPイソ型(OATP1A2、OATP1B1、OATP1B3、及びOATP2B1を含むが、これらに制限されない。)、OATイソ型(OAT2、及びOAT4を含むが、これらに制限されない。)、OCTイソ型(OCT1、及びOCT3を含むが、これらに制限されない。)、BSEP、MRPイソ型(MRP1、MRP2(配列番号:1のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP3(配列番号:2のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP4、MRP5、MRP6、MRP7、MRP8、及びMRP9を含むが、これらに制限されない。)、MDRイソ型(MDR1、MDR2、及びMDR3を含むが、これらに制限されない。)、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せである。特に、候補化合物を、下記の実験室内実施例に記載した細胞培養物、及び化合物投与技術に従って、標識化合物とともに肝実質細胞培養物に投与する。
【0059】
次に、候補化合物と該標識化合物との間の取り込み、及び排泄の競合を評価する。すなわち、培養物中の毛細胆管内の標識化合物量の十分な投入(例えば、該標識化合物からのシグナルを、測定、又は検出)は、該候補化合物(該標識化合物と対比して)が、大量に吸収され、かつ排泄されることを示し得る。
次に、該候補化合物の肝摂取、及び胆汁中排泄への感受性の順位付けを確立する。従って、本開示主題のハイスループットアッセイの好ましい実施態様に従って、肝摂取、及び/又は胆汁中排泄への小さい又は低い感受性が前記順位付けにより観察される該候補化合物、又は化合物は、治療薬としてのさらなる実験、又は開発のために選択され得ることが意図され、一方、排泄への高い又は大きい感受性が前記順位付けにより観察される化合物は、治療薬としてのさらなる実験、又は開発から除外され得ることが意図される。
【0060】
例証的な標識化合物は、蛍光MRP2基質、カルボキシジクロロフルオレセインを含む。好ましくは、カルボキシジクロロフルオレセインジアセテートが、該肝実質細胞原形質膜内に迅速に浸透するために、蛍光発生前駆体として利用される。カルボキシジクロロフルオレセインジアセテートは、細胞内エステラーゼにより、肝実質細胞の細胞質中で迅速に高蛍光生成物カルボキシジクロロフルオレセインに加水分解される。これは、Haugland, 分子プローブ:蛍光プローブ、及び探索化学物質のハンドブック(Molecular Probes: Handbook of Fluorescent Probes and Research Chemicals) (1992-1994), p.134, Molecular Probes, Inc., 1992.に記載されている。
【0061】
カルボキシジクロロフルオレセインの蛍光は、pHに感受性があり、従って、アッセイの幾つかは、カルボキシジクロロフルオレセイン蛍光の強度に基づき、pHの効果を考慮すべきである。しかし、0.3 pH単位未満の相違が、肝実質細胞対の細胞質ゾルと毛細胆管との間に見られることが観察されている。カルボキシジクロロフルオレセインは、酸性オルガネラのpH決定に使用されているが、その蛍光強度は、pH 7.1〜pH 7.4の間で顕著な変化はない。pH 7.4でのカルボキシジクロロフルオレセインの蛍光は、pH 7.1でのそれよりも、最大蛍光波長で約10-20%だけ高い。従って、カルボキシジクロロフルオレセインの蛍光は、定性的プローブとして使用され、カルボキシジクロロフルオレセイン細胞分布を局在させるので、細胞質ゾルと小管との間のわずかなpH勾配は、本明細書中に開示した主題のハイスループットアッセイの適用に影響を与えない。
【0062】
さらなる標識化合物は、フルオレセインラベル化タウロコール酸、下記の本明細書中に示した実験室内実施例に記載されている、肝実質細胞により迅速かつ大量に吸収され、かつ該毛細胆管に排泄される胆汁酸;Boyer、及びSoroka, Gastroenterology 109:1600-1611 (1995); rhodamine 123に記載されているコリルグリシルアミド(cholylglycylamido)フルオレセイン、他の蛍光胆汁酸;P-gp;及びカルボキシフルオレセインジアセテート(CFDA)を含むが、これらに制限されない。
【0063】
本明細書中に開示した方法は、技術的に公知であるような、ICN Pharmaceuticals社(コスタメサ, カリフォルニア州)から利用可能な96ウェル、又は384ウェルマイクロタイタープレートなどの標準的マルチウェルアッセイプレート中で行われ得る。従って、肝摂取、及び/又は胆汁中排泄への感受性に対する複数の候補化合物を、マルチウェルプレートの複数のウェル内で同時にスクリーニングすることができる。
【0064】
幾つかの実施態様において、上記方法は、該候補化合物と該標識化合物、又はラベル化基質との競合が、より一般的に全ての胆汁輸送、及び排泄系に対してよりもむしろ、特定の輸送タンパク質による取り込み、及び排泄に対するように変更される。幾つかの実施態様において、該競合は、少なくとも1つの肝実質細胞輸送タンパク質が、少なくとも部分的に阻害された後に生じる。該ラベル化基質は、該輸送タンパク質による輸送に感受的であることが公知のものとして選択される。該ラベル化基質の該毛細胆管中の減少量は、輸送タンパク質による、該候補化合物の胆汁中排泄への感受性を示す。
【0065】
幾つかの実施態様において、該輸送タンパク質の阻害は、該輸送タンパク質の発現を阻害することにより提供される。該輸送タンパク質の発現阻害は、2つの培養物のうちの1つの培養物中の該肝実質細胞の少なくとも1つに、対象の該肝実質細胞輸送タンパク質の発現を少なくとも部分的に阻害するのに十分な量で(例えば、10%)、RNAを導入することを含む。該RNAは、阻害される肝実質細胞輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含み得る。この方法は、短い二本鎖RNA分子の能力の利点があり、細胞の遺伝子の下方制御を生じ、処理は、RNA干渉と呼ばれ、かつ本明細書中に詳細に記載した。
【0066】
他の実施態様において、特定のタンパク質の発現を阻害する別の技術を使用する。例えば、モルホリノオリゴヌクレオチドを、対象のタンパク質を発現する細胞に投与することができる。該モルホリノオリゴヌクレオチドは、対象のタンパク質に特異的に結合する。対象のタンパク質をコードしている核酸(例えば、mRNA)への該モルホリノポリヌクレオチドの結合は、該タンパク質の発現阻害を起こす。
【0067】
(RNA干渉を用いた肝実質細胞輸送タンパク質発現の阻害)
本開示主題は、短い二本鎖RNA分子の能力の利点があり、細胞の遺伝子の下方制御を生じ、処理は、RNA干渉と呼ばれる。本明細書中で使用されるように、"RNA干渉"(RNAi)は、低分子干渉RNA (siRNA)により媒介される、配列特異的な転写後遺伝子サイレンシングのプロセスを意味する。一般的なFireらの論文, Nature 391:806-811, 1998を参照されたい。転写後遺伝子サイレンシングのプロセスは、他の遺伝子の発現を抑制するように展開された、展開的に保存された細胞防御機序であると考えられれる(Fire, Trends Genet 15:358-363, 1999)。
【0068】
RNAiは、特定のウイルス(特に、該二本鎖RNAウイルス、又はライフサイクルが二本鎖RNA中間体を含むこれらのウイルス)による感染、或いは該二本鎖RNA種に対して、一本鎖RNA、又はウイルスゲノムRNAを特異的に低下させる宿主ゲノム内へのトランスポゾン成分のランダムな組込みから生じる二本鎖RNA (dsRNA)分子の製造に対して、細胞、及び生物体を保護するように展開し得る
【0069】
細胞内の長いdsRNAの存在は、リボヌクレアーゼIII酵素Dicerの活性を刺激する。Dicerは、dsRNAの分解を触媒し、低分子干渉RNAs (siRNA)と呼ばれる短い長さのdsRNAに変化させる(Bernsteinらの論文, Nature 409:363-366, 2001)。Dicerを媒介した分解から生じる該低分子干渉RNAは、一般に、約21-23 ヌクレオチド長さであり、約19塩基対二本鎖を含む。分解後に、該siRNAは、RNA誘導サイレンシング複合体(RISC)と呼ばれるエンドヌクレアーゼ複合体内に組込まれる。RISCは、細胞内に存在し、該siRNA二本鎖のアンチセンス鎖に相補的である一本鎖RNAの開裂を媒介することができる。Elbashirらに従って、該標的RNAの開裂は、該siRNAのアンチセンス鎖に相補的な一本鎖RNAの領域の中央付近で起こる(Elbashirらの論文, Genes Dev 15:188-200, 2001b)。
【0070】
RNAiは、幾つかの細胞種、及び生物体内に表されている。Fireら, 1998は、C.エレガンス(C. elegans)のRNAiを記載した。Wianny & Zernicka-Goetz, Nature Cell Biol 2:70-75, 1999は、マウス胚のdsRNAにより媒介されるRNAiを開示している。また、Hammondら, Nature 404:293-296, 2000は、ショウジョウバエ細胞のRNAiの誘導を、これらの細胞内にdsRNAをトランスフェクトすることにより可能にした。Elbashirら. Nature 411:494-498, 2001aは、合成21ヌクレオチドRNAの二本鎖の導入により、人胚腎臓、及びHeLa細胞を含む培養哺乳動物細胞中のRNAiの存在を示した。
【0071】
他の研究は、siRNA二本鎖の標的相補鎖の5'-リン酸が、siRNa活性を促進し、かつATPが、該siRNAの5'-リン酸部位の維持に利用されることを示している(Nykanenらの論文, Cell 107:309-321, 2001)。siRNA分子内に導入される場合に許容され得る他の改質は、糖‐リン酸骨格の改質、又は少なくとも1つの窒素又は硫黄へテロ原子を有するヌクレオシドの置換(PCT 国際公開番号WO 00/44914、及びWO 01/68836)、並びに二本鎖RNA依存タンパク質キナーゼ(PKR)、特異的2'-アミノ又は2'-O-メチルヌクレオチド、及び2'-O又は4'-Cメチレンの活性を阻害し得る特定のヌクレオチド架橋を含むヌクレオチド(カナダ特許出願第2,359,180号)を含む。
【0072】
dsRNA、及びRNAiの使用を開示している他の引例は、下記のものを含む:PCT国際公開番号WO 01/75164(ショウジョウバエの細胞を用いたインビトロRNAi系、及び特定の機能遺伝子及び特定の治療的応用のための特異的siRNA分子の使用);WO 01/36646(dsRNA分子を用いた、哺乳動物細胞の特定の遺伝子発現の阻害方法);WO 99/32619 (遺伝子発現阻害に使用するための、dsRNA分子の細胞内への導入方法);WO 01/92513(RNAiを向上させる因子を用いた、遺伝子抑制の媒介方法);WO 02/44321(合成siRNA構築体);WO 00/63364、及びWO 01/04313(ポリヌクレオチド配列の機能を阻害する方法、及び組成物);並びにWO 02/055692、及びWO 02/055693(RNAiを用いた遺伝子発現の阻害方法)である。
【0073】
幾つかの実施態様において、本開示主題は、対象の1以上の肝実質細胞タンパク質の発現を、少なくとも部分的に阻害するRNAiを利用する。好ましくは、正常の発現量の少なくとも約10%阻害である。幾つかの実施態様において、該方法は、RNAを、該肝実質細胞輸送タンパク質の発現阻害に十分な量で、前記複数の肝実質細胞の少なくとも1つに導入することを含み、ここで、該RNAは、肝実質細胞輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含む。幾つかの実施態様において、該肝実質細胞は、生物体、好ましくは、哺乳動物内に存在し、かつ該RNAは、該生物体内に導入される。制限されない例として、該遺伝子は、下記のものをコードし得る:ヒト、又はげっ歯類NTCP、OATPイソ型(OATP1A2、OATP1B1、OATP1B3、及びOATP2B1を含むが、これらに制限されない。)、OATイソ型(OAT2、及びOAT4を含むが、これらに制限されない。)、OCTイソ型(OCT1、及びOCT3を含むが、これらに制限されない。)、BSEP、MRPイソ型(MRP1、MRP2(配列番号:1のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP3(配列番号:2のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP4、MRP5、MRP6、MRP7、MRP8、及びMRP9を含むが、これらに制限されない。)、MDRイソ型(MDR1、MDR2、及びMDR3を含むが、これらに制限されない。)、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せである。
【0074】
該RNAは、該肝実質細胞輸送タンパク質をコードしている遺伝子のコード鎖に相当するリボヌクレオチド配列を含有した第一鎖、及び該第一鎖に相補的なリボヌクレオチド配列を含有した第二鎖を含む、二本鎖領域を有し得る。該第一鎖、及び第二鎖は、互いにハイブリダイズし、二本鎖分子を形成する。該二本鎖領域は、少なくとも15塩基対長さ、幾つかの実施態様において、15〜50塩基対長さであり得る。幾つかの実施態様において、該二本鎖領域は、15〜30塩基対長さである。
【0075】
幾つかの実施態様において、該RNAは、好ましくは、少なくとも19塩基にわたって相補的である、分子内自己ハイブリダイゼーションにより二本鎖領域を形成している一本鎖を含む。幾つかの実施態様において、該RNAは、少なくとも19塩基にわたって相補的である、分子間ハイブリダイゼーションにより二本鎖領域を形成している2つの別個の鎖を含む。例証的なRNAは、配列番号:3、4、及び5のうちの1つのヌクレオチド配列を有するものである。
【0076】
当業者は、全ての適切な一般的技術を使用して、該RNAを肝実質細胞内に導入することができることを認識するであろう。幾つかの実施態様において、該RNAをコードしているベクターを、前記複数の肝実質細胞の少なくとも1つに導入する。例えば、該RNAをコードしているベクターを、該肝実質細胞内にトランスフェクトすることができ、次に該RNAを、細胞ポリメラーゼにより転写する。
【0077】
幾つかの実施態様において、該RNAをコードしている核酸を含む組換えウイルスを製造することができる。次に、肝実質細胞内への該RNAの導入は、肝実質細胞を、該組換えアデノウイルスで感染させることを含む。肝実質細胞ポリメラーゼは、該肝実質細胞内のRNAの発現を生じるRNAを転写する。組換えウイルス技術は、当業者に公知である。当業者は、多くの因子が、本明細書中でさらに詳細に論じる必要のない本開示主題に使用される組換えウイルス製造の最適化に必要な適切なウイルス、及びベクター成分の選択に関与することを、容易に理解するであろう。1つの制限されない例として、組換えアデノウイルスは、siRNAをコードしているDNAを含むように処理され得る。該ウイルスは、肝実質細胞が、該組換えアデノウイルスにより感染され、該siRNAを転写し、かつ該感染肝実質細胞内に過渡的に発現され得るように、不完全な複製となるように処理され得る。組換えウイルス製造の詳細、及び使用は、米国特許出願第10/195,034号、及びPCT特許出願第US02/22010号で見ることができ、これらの全体において、本明細書中に引用により取り込まれている。或いは、例えば、pSILENCER ADENO 1.0-CMV SYSTEM(商標) (Ambion, オースチン, テキサス州, USA)のような、組換えウイルスを製造するための市販のキットを使用することができる。
【0078】
本開示主題は、単離siRNA分子をさらに含み、それは、特定の肝実質細胞輸送タンパク質の発現を阻害する。例証的な実施態様において、該肝実質細胞輸送タンパク質は、下記のものを含む:ヒト、又はげっ歯類NTCP、OATPイソ型(OATP1A2、OATP1B1、OATP1B3、及びOATP2B1を含むが、これらに制限されない。)、OATイソ型(OAT2、及びOAT4を含むが、これらに制限されない。)、OCTイソ型(OCT1、及びOCT3を含むが、これらに制限されない。)、BSEP、MRPイソ型(MRP1、MRP2(配列番号:1のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP3(配列番号:2のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP4、MRP5、MRP6、MRP7、MRP8、及びMRP9を含むが、これらに制限されない。)、MDRイソ型(MDR1、MDR2、及びMDR3を含むが、これらに制限されない。)、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せである。
【0079】
該siRNA分子は、センス領域、及びアンチセンス領域を含むことができ、該アンチセンス領域は、該肝実質細胞輸送タンパク質をコードしているRNA配列に相補的な核酸配列を含み、かつ該センス領域は、該アンチセンス領域に相補的な核酸配列を含む。該siRNA分子は、該siRNA分子のセンス領域、及びアンチセンス領域から構築される。代表的な実施態様において、該センス領域は、配列番号:3、4、及び5のいずれか1つのヌクレオチドの部分列を、連続して19〜30個含み、かつ該アンチセンス領域は、該センス領域の逆相補体を含む。該センス領域、及び該アンチセンス領域は、好ましくは2〜8ヌクレオチド長さの3'-突出末端をさらに含み得る。該3'-突出末端ヌクレオチドは、1以上の化学的に改質されたヌクレオチドを含む。
【0080】
幾つかの実施態様において、該センス領域、及び該アンチセンス領域は、リンカー分子を介して、共有結合している。幾つかの実施態様において、該リンカー分子は、ポリヌクレオチドリンカーであり、例えば、5〜9個のヌクレオチドのポリヌクレオチドリンカーである。幾つかの実施態様において、該リンカー分子は、非ヌクレオチドリンカーである。また、siRNAを含むキャリアを提供する。代表的なキャリアは、例えば、水、生理食塩水、ブドウ糖、グリセロール、エタノールなど、及びこれらの組み合わせを含み。該キャリアは、湿潤剤、又は乳化剤、及びpH緩衝剤などの補助剤をさらに含み得る。
【0081】
下記実験室内実施例は、本発明の好ましい様式の説明を含んでいる。下記実験室内実施例の特定の態様は、本発明者らにより発見され、かつ考慮された技術、及び手順の条件で記載され、本発明の実施によく作用する。これらの実験室内実施例は、本発明者らの標準的な実験室内実施の使用を通して例示される。本会時、及び当業者の一般的水準の観点から、当業者は、下記実験室内実施例が、模範的なもののみであることが意図され、多くの変化、改質、及び変更が、本発明の精神、及び範囲から外れることなく使用されることを認識するであろう。
【実施例】
【0082】
(実験室内実施例)
下記実験室内実施例は、サンドイッチ‐培養ラット肝実質細胞(本発明の方法)、及びインビボにおけるラット(標準)の胆汁中排泄の相関の確立に関するものである。胆汁中排泄特徴の様々な範囲を表す5つのモデル基質を選択し、インビボにおけるラットと、本明細書中に開示した方法に従って、サンドイッチ‐培養肝実質細胞を用いたインビトロとで、胆汁に排泄される量の割合の関係を調べた。5つのモデル基質は、イヌリン、サリチル酸塩、メトトレキセート、[D-pen2,5] エンケファリン、及びタウロコール酸を含む。
【0083】
加えて、264W94、及びその代謝産物のインビボ、及びインビトロにおける胆汁中排泄の比較を、実施例4に示した。化合物2169W94は、ラット、及びヒトにおける、264W94のO-脱メチル化代謝産物であり、ウリンジン-5'-ジホスホフルクロニックアシッド(urindine-5'-diphosphoflucuronic acid)でさらに接合され、グルクロニド接合体を形成し得る。(Silverらの論文, ISSX Proceedings, (サンディエゴ, カリフォルニア州 USA) pp. 387, 1996)。化合物264W94、及び2169W94の構造式を、図9に示した。最後に、サンドイッチ‐培養ラット肝実質細胞(SCRH)における、MRP2、及びMRP3発現調節のためのsiRNAの使用を開示する。
【0084】
(実施例1−4に使用した物質、及び方法)
(化学物質)
[3H]タウロコール酸 (3.4 Ci/mmol; 純度 > 97%), -[14C]サリチル酸塩 (55.5 mCi/mmol; 純度 > 99%)、及び[3H][D-pen2,5] エンケファリン(36 Ci/mmol; 純度 > 97%0を、Dupont New England Nuclear (ボストン, マサチューセッツ州)から得た。[3H]メトトレキセート(13.7 Ci/mmol; 純度 > 99%)、及び[3H]イヌリン (1.3 Ci/mmol; 純度 97%)を、Amersham International plc (バッキンガムシア, イングランド)から得た。化合物[14C]264W94((3R, 5R)-3-ブチル-3-エチル-2,3,4,5-テトラヒドロ-7, 8-ジメトキシ-5-フェニル-1, 4-ベンゾチアゼピン-1, 1-ジオキシド; 45.5 mCi/mmol; 純度 > 99%)、及び[14C]2169W94 ((3R, 5R)-3-エチル-2,3,4,5-テトラヒドロ-7-メトキシ-8-ヒドロキシ-5-フェニル-1, 4-ベンゾチアゼピン-1, 1-ジオキシド; 43.7 mCi/mmol; 純度 > 99%)を、Glaxo Wellcome社(リサーチ・トライアングル・パーク, ノースカロライナ州)から得た。コラゲナーゼ (I型, 種類I)を、Worthington Biochemical社から得た(フリーホルド, ニュージャージー州)。ダルベッコ変法イーグル培地(Dulbecco's modified Eagles' medium (DMEM))、ウシ胎児血清、及びインスリンを、Gibco (グランドアイランド, ニューヨーク州)から得た。ラット‐尾コラーゲン (I型)を、Collaborative Biomedical Research (ベッドフォード, マサチューセッツ州)から得た。他の全ての化学物質、及び試薬は、分析等級であり、かつ商業的提供先から容易に利用可能である。
【0085】
(動物)
Charles River Laboratory (ローリー, ノースカロライナ州)の雄ウィスターラット(250-280 g)を、肝臓供与体として使用した。ラットを、ステンレス‐スチールかごに個々に収容し、研究を行う前に、12時間交互に、光、及び暗のサイクルを少なくとも1週間持続させ、使用まで、適宜に餌を与えた。胆管挿入ラット(200-250g)を、Charles River (ローリー, ノースカロライナ州))から得た。ノースカロライナ州の大学(チャペルヒル, チャペルヒル, ノースカロライナ州)の研究機関内の動物の管理および使用に関する委員会(The Institutional Animal Care and Use Committee)は、全ての手順を認可した。
【0086】
(培養皿の調製)
プラスチック培養皿 (60 mm)を、該肝実質細胞培養物を調製する前に、少なくとも1日、ラット‐尾コラーゲンでプレコートした。ゲル化コラーゲン基体を得るために、氷冷中和化コラーゲン溶液(0.1 ml, 1.5 mg/ml, pH 7.4)を、各培養皿上に分散させた。新しいコート化皿を、37℃の加湿インキュベーター内に約1時間置いて、該マトリックス材料をゲル化し、続いて3 mlのDMEMを各皿に加え、かつ加湿インキュベーター内に保存した。
【0087】
(ラット肝実質細胞の培養物)
肝実質細胞を、2段階の灌流方法で単離した。簡潔に言うと、ラットを、門脈挿入前に、ケタミン、及びキシラジン(それぞれ、60、及び12mg/kg i.p.)を用いて麻酔した。該肝臓を、インサイツで、コラゲナーゼI型(0.5 mg/ml)を含む酸素添加Ca2+フリーのクレープス-ヘンゼライト重炭酸緩衝液を用いて10分間灌流した。該肝臓被膜を、ピンセットで除去した。該肝臓を100 mlのDMEM中で穏やかに振盪させることにより、該肝実質細胞を放出させた。
【0088】
該放出細胞を、無菌ナイロンメッシュ(70-μm)を通して濾過した。該肝実質細胞懸濁液を、50xgで3分間延伸した。該細胞ペレットを、25 mlのDMEM、及び等量の、ピスカタウェイ, ニュージャージー州のPharmacia社で登録商標PERCOLLとして売られている、90%の等張性ポリビニルピロリドン‐コート化シリカコロイド遠心培地(pH 7.4) を用いて再懸濁化した。得られた細胞懸濁液を、約70〜150xgで、5分間遠心した。該ペレットを、50 mlのDMEMで再懸濁化し、かつ該細胞懸濁液を、50xgで3分間の遠心により、1つのチューブ内に混ぜ合わせた。肝実質細胞生存度を、トリパンブルー除外により決定した。90%よりも大きい生存度を有する肝実質細胞調製物を、さらなる研究に利用した。
【0089】
肝実質細胞懸濁液を、5% ウシ胎仔血清、1 μMデキサメタゾン、及び4 mg/L インスリンを含むDMEMを用いて調製した。肝実質細胞懸濁液を、約2-3 x 106 細胞/60-mm皿の密度で、プレコート化皿に加えた。該細胞のプレーティング後約1時間、該培地を吸引し、かつ3-mlの新しいDMEMを加えた。輸送研究のために、コラーゲンを被せずに3〜5時間播種した肝実質細胞を、3時間、又は短時間の培養肝実質細胞と規定した。
【0090】
サンドイッチ‐培養肝実質細胞を調製するために、該細胞の播種24時間後に、中和化コラーゲン溶液(0.1 ml, 約1.5〜約3.0 mg/ml, pH 7.4)を、該単層に加えた。コラーゲン被覆を有する培養物を、加湿インキュベーター中、37℃で45分間インキュベートして、DMEM添加前に該コラーゲンをゲル化させた。該細胞を播種した後、第4日目まで、培地を毎日変えた。これらの肝実質細胞を、96時間、又は長時間培養肝実質細胞と呼ぶ。
【0091】
(サンドイッチ‐培養肝実質細胞中の累積取り込み研究)
コラーゲン‐サンドイッチ形態中で培養した肝実質細胞を、3 mlの標準緩衝液、又はCa2+フリー緩衝液中、37℃で10分間インキュベートした。該インキュベーション緩衝液の除去後に、各皿に、基質を含む3 mlの標準緩衝液を添加して取り込みを開始した。指定時間のインキュベート後に、該インキュベーション溶液を吸引し、かつ3 mlの氷冷標準緩衝液で4回洗浄して細胞外基質を除去することにより、累積取り込みを終了させた。洗浄後、培養皿に、2 mlの1%トリトンX-100溶液を加え、かつ該皿を室温で20分間、振盪器で振盪させることにより、該細胞を溶解した。溶解物の一定分量(1 ml)を、液体シンチレーション分光測定により分析した。Bio-Rad DCタンパク質アッセイキット(Bio-Rad Laboratories, ハーキュリーズ, カリフォルニア州)を使用し、標準としてウシ血清アルブミンを用いて、該培養抽出物中の該タンパク質濃度を決定した。トリトン X-100 (1%)は、該アッセイに干渉しなかった。前述した細胞非存在下の適切なコントロール皿において決定された基質取り込みを減算することにより、細胞単層内への基質取り込みに対する全ての値を、該コラーゲンへの非特異的結合に対して補正した。
【0092】
(264W94の静脈内投与、及び2169W94の経口投与後のラットにおける胆汁中排泄)
[14C]264W94を、濃度0.125 mg/mLで、無菌水/ポリプロピレングリコール400/エタノール(2:1:1 v/v/v)の混合液中の溶液として製剤した。前投与量胆汁の回収後に、[14C]264W94溶液を、尾静脈注射により投与した(0.1 mg/kg)。2169W94研究のために、[14C]2169W94を、水中の0.5% (w/v)メチルセルロースの0.1 mg/mLの濃度で、懸濁液として調製した。前投与量胆汁の回収の後に、[14C]2169W94懸濁液を、胃管栄養法(1.0 mg/kg)により投与した。全てのラットを、個々のプラスチック代謝かご内に置き、該ラットの動きを自由にさせた。胆汁を、氷に囲まれたポリプロピレン溶液内に回収した。該264W94研究のために、該胆汁容器を、該投与量後8、及び24時間で変えた。以前の研究は、試料が、氷上で24時間安定であることを示している。分析まで、胆汁試料を-20℃で保存した。
【0093】
(分析手順)
264W94、又は2169W94を含む、細胞溶解物、又は胆汁試料の一定分量を。2倍量の氷冷アセトニトリルと混合し、遠心して、沈殿タンパク質を除去した。該上清を、室温で窒素下で留去し、かつ50 mM 酢酸アンモニウム/アセトニトリル/トリフルオロ酢酸(95:5:0.1 v:v:v)とアセトニトリルとの70/30混合液100μL中で再構成した。該試料抽出液を、WATERS(商標)SYMMETRYTM C18カラム(3.9 x 150 mm)に注入し、かつ50 mM 酢酸アンモニウム(pH 4.0)とアセトニトリルとの85/15混合液で溶離した;該アセトニトリルの割合は、WATERS(商標)600E System Controllerにより、20分の時間で55%に、続いて、次の10分間で100%に増加させた。
【0094】
該HPLCから溶離した放射性炭素を、オンライン放射活性検出器 (RADIOMATIC FLO-ONE/BETA(商標)Radio-Chromatography Detector Series 500 TR Series, Packard Instrument Co.)を用いて定量した。精製標準化合物と比較して、264W94、2169W94、及び2169W94グルクロニドのピークを同定した。これらの条件下で、これらの3つの成分の基線分類を達成した。各ピークにおいて、該溶離放射活性を、全注入放射活性に対して規格化することにより、該3つの成分の濃度を決定した。
【0095】
(データ分析)
取り込みデータを、該タンパク質含有量に対して規格化し、かつ肝実質細胞の3〜4回の別々の調製からの平均SDとして表した。Ca2+の存在、及び非存在下での10分の累積基質取り込みの平均値間の統計的相違を、周知のスチューデントt検定の使用により決定した。P値<0.05は、有意であると考えられる。
インビボにおける胆汁クリアランス、ClB (ml/分/kg body weight)を、式1に従って計算した。
【数1−2】

式中、量胆汁(0-T)は、多くの薬剤が系統的循環から排除された場合の0〜時間Tの胆汁中に回収された親薬剤の量を表し、かつAUC0-Tは、血漿濃度‐時間曲線の0〜時間T(分)の領域を表す。
【0096】
胆汁中排泄が支配的排除過程であると仮定して、肝臓性質のよく活動しているモデルに基づく式2に従って、インビボにおける固有の胆汁クリアランス(ClBin, ml/分/kg体重)を概算した(Pangらの論文, J. Pharmacokinet. Biopharm. 5:625-653, 1977)。
【数2】

式中、Qは、ラット肝血漿/血液、40-70 ml/分/kg体重{(血流量 x (1-ヘマトクリット値)}を表し;Pollackらの論文, J. Pharmacol. Exp. Ther. 18:197-202, (1989)、かつClBは、論文に報告されているモデル化合物の胆汁クリアランス、又は式1から計算された胆汁クリアランスを表す。
【0097】
該単層中の基質の胆汁中排泄を、式3の胆汁中排泄指数により定量的に評価した。
【数3】

式中、取り込み標準、及び取り込みCa2+フリーは、それぞれ、標準緩衝液、及びCa2+フリー緩衝液において前インキュベートした該肝実質細胞単層中の10分間隔の基質の累積取り込みを表す。
【0098】
該サンドイッチ‐培養肝実質細胞の胆汁クリアランス、ClB(培養物) (ml/分/kg /体重)を、式4に従って計算した。
【数4】

式中、時間インキュベーションは10分であり、かつ濃度培地は、インキュベーション培地中の最初の基質の独活を表す。幾つかの実施態様において、胆汁クリアランス値は、培地中の毛細胆管の質量と曲線下面積 (AUC)との比として計算され得る。該AUCは、時間0〜時間T(時間は、任意の所望単位で測定され得る。通常、分で測定される。)の該培地中の候補化合物の積分値(例えば、生体異物濃度)を示す。実際、用語AUGは、下記式を意味し得る。
【0099】
【数5】

この式は、Gibaldi及びPerrierにより、the Pharmacokinetics, 第二版(Marcel Dekker社 1982) (pp. 13-14)に説明されている。全ての計算において、肝臓組織中のラット肝臓重量、及びタンパク質含有量を、それぞれ、体重の40 g/kg、及び肝臓重量の0.20 g/gと仮定した(Seglenらの論文, Methods in Cell Biology (第13版, Prescott D. M. Eds.) pp. 30-78, Academic Press, ニューヨーク, 1976)。
【0100】
(実施例の結果のまとめ)
本主題に従う長時間サンドイッチ‐培養肝実質細胞の5つのモデル基質の胆汁中排泄は、インビボにおける胆汁中排泄特徴と一致した。該胆汁中排泄指数計算を利用した、該培養肝実質細胞の胆汁中排泄の定量は、上記に記載した。簡潔に言うと、該胆汁中排泄指数は、該毛細胆管に保持された基質の割合を表す。実験室内実施例の結果は、胆汁中に排泄された投与量の割合に基づき、インビボにおける胆汁中排泄を無視することができる化合物(例えば、イヌリン, サリチル酸塩)が、低い胆汁中排泄指数(ほぼゼロ)を有することを示している。インビボにおいてさらに大量に排泄される化合物(例えば、メトトレキセート、[D-pen2,5]エンケファリン、及びタウロコール酸)は、高い胆汁中排泄指数(約50%)を有する。
【0101】
該胆汁中排泄指数とインビボにおける胆汁中に排泄される投与量の割合との関係は、全体的な相関を明らかにする。メトトレキセート、及び[D-pen2,5]エンケファリンは、胆汁中に"高度に"排泄される化合物を代表する(それぞれ、1時間で、静脈投与量の約60%、及び70%が回収される。)。対照的に、タウロコール酸は、静脈投与量のほぼ全てが、1時間未満で胆汁中に排泄されるので、"迅速かつ大量に"排泄される。従って、該胆汁中排泄指数は、大量対無視できるか又は低い胆汁中排泄となる化合物を識別することができる。
【0102】
しかし、該胆汁中排泄指数は、メトトレキセート(胆汁中排泄指数:約55%)、又は[D-pen2,5]エンケファリン(胆汁中排泄指数:約42%)などの胆汁中に高度に排泄される化合物と、タウロコール酸 (胆汁中排泄指数:約56%)などの胆汁中に"迅速かつ大量に"排泄される化合物とを識別することができなと思われる。該胆汁中排泄指数におけるこの限界は、この指数が、小管排泄機能により支配的に決定される事実のためであり得る。インビボにおいて、胆汁中に排泄される静脈投与基質の割合は、洞様血管取り込み活性、小管排泄活性、並びに他の競合排除過程により決定される。
【0103】
胆汁クリアランスは、インビボ、及びインビトロにおける胆汁中排泄の関係の比較にとって、さらに有効なパラメータを表す。該インビボにおける胆汁クリアランスは、時間Tで胆汁中に排泄される量と、時間0〜T間の血漿AUCの比として、実験室内実施例で計算した。ほとんどの投与量は、時間Tで排除されるため、該胆汁クリアランスは、時間0〜時間無限大で計算された胆汁クリアランスを概算している。この状況で計算された胆汁クリアランスは、固有の胆汁クリアランスの機能、および肝血漿/血流速度である。血漿流動作用の排除のために、固有の胆汁クリアランスを、肝臓性質の"よく活動している"モデルに基づいて計算した(Pang、及びRollanの論文, J. Pharmacokinet. Biopharm. 5:625-653, 1977)。同様に、インビボにおける胆汁クリアランスを、該肝実質細胞単層の小管網中に排泄される量とインキュベーション培地におけるAUCとの比として計算した。従って、幾つかの実施態様において、胆汁クリアランス値は、培地中の毛細胆管の質量と曲線下面積(AUC)との比として計算され得る。該AUCは、時間0〜時間T(時間は、任意の所望単位で測定され得る。通常、分で測定される。)の該培地中の候補化合物の積分値(例えば、生体異物濃度)を示す。実際、用語AUGは、下記式を意味し得る。
【0104】
【数6】

この式は、Gibaldi及びPerrierにより、the Pharmacokinetics, 第二版(Marcel Dekker社 1982) (pp. 13-14)に説明されている。
【0105】
該サンドイッチ‐培養肝実質細胞において、インキュベーション培地は、同時間での皿中の全ての肝実質細胞に利用しやすい。従って、インビトロにおいて計算された胆汁クリアランスは、固有の胆汁クリアランスを表すべきである。しかし、胆汁中排泄は2つの過程、該洞様血管膜を横切る取り込み、及び該小管膜を横切る排泄に関与するので、正確な固有胆汁クリアランスは、該小管膜を横切る輸送により決定され、かつ細胞内基質濃度に基づいて計算されるべきである。従って、実験室内実施例において計算された、インビボ、及びインビトロにおける"固有"のクリアランスは、"見かけ上の"固有の胆汁クリアランス値と呼ばれ得る。これは、該過程、洞様血管取り込み、又は小管取り込みにおける最も遅い段階により速度制限されるであろう。
【0106】
インビトロにおける胆汁クリアランスと、インビボにおける固有の胆汁クリアランスとの間の相関は、5つのモデル基質に対して高かった(r2=0.9865)。インビボにおける固有の胆汁クリアランスに従って、5つのモデル基質を、3つのグループに分類することができる:胆汁中に排泄されない化合物(イヌリン、及びサリチル酸塩;約0 ml/分/kg);胆汁中に高度の排泄される化合物(メトトレキセート、及び[D-pen2,5]エンケファリン, それぞれ、約17.3 ml/分/kg、及び約34.4 ml/分/kg);及び胆汁中に迅速かつ大量に排泄される化合物(タウロコール酸, 約116.9 ml/分/kg)である。インビトロにおいて概算された胆汁クリアランスは、化合物のこれらの3つのグループ(それぞれ、約0、4〜13、及び56 ml/分/kg)に適切に区別した。これらの結果は、該胆汁クリアランスが、インビボ、及びインビトロにおける胆汁中排泄間の関係を、該胆汁中排泄指数と比較してさらに正確に特徴付けしていることを示唆する。
【0107】
実施例5は、siRNA利用を記載し、第一肝実質細胞における薬剤輸送体機能を調節した。Mrp2 siRNA (siMrp2)を用いたSCRHの処置により、本質的に一時的なMrp2-不足モデルを製造した:小管Mrp2発現の抑制は、カルボキシジクロロフルオレセイン(CDF)の胆汁中排泄を大きく減少させた。しかし、CDFは、Mrp3の高発現レベルの維持のために、これらの細胞から効率的に排泄された。siMrp3-処置SCRHを用いて、一時的なMrp3-不足モデルを確立した。これは、一般に、インビボモデルでは利用できない。Mrp3ノックダウンは、胆汁中へのCDF 排泄の経路の向け直しを生じる。従って、siMrp3-処置SCRHの小管蛍光は、コントロール細胞中よりも高かった。SCRH のsiRNA処置による、全体的な薬剤輸送体の調節は、特に特異的阻害剤が利用できない場合に、薬剤輸送タンパク質の調節、及び機能の研究のために提供され、肝胆薬剤性質の決定において、薬剤輸送体の補完的な役割を解明し、かつ薬剤輸送体との特異的相互作用の効果を規定する。
【0108】
(実施例1)
(培養肝実質細胞中の累積取り込み)
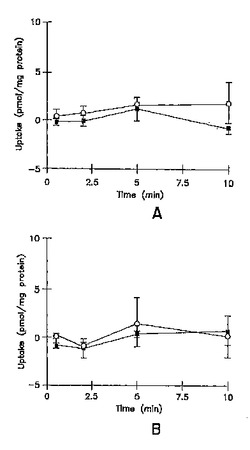
イヌリンの累積取り込みは、短時間、又は長時間の全てのインキュベーション時間で無視できた(最初の加えられた基質の0.01%未満)(図1A、及び1B)。3時間培養肝実質細胞において、サリチル酸塩、メトトレキセート、及び[D-pen2.5]エンケファリンの累積取り込みは、標準緩衝液、及びCa2+フリー緩衝液において、有意な差異はなかった(図2A、3A、及び4A;p>0.05)。しかし、Ca2+フリー緩衝液と比較して、標準緩衝液中におけるタウロコール酸のわずかに高い累積取り込みが観察された(図5A);10分で、標準緩衝液中の累積取り込みは、Ca2+フリー緩衝液中よりも約10%高かった(p = 0.0352)。96時間培養肝実質細胞において、細胞外Ca2+は、サリチル酸塩の累積取り込みに効果がなかった(図2B, p > 0.05)。しかし、標準緩衝液中のメトトレキセート、[D-pen2.5]エンケファリン、及びタウロコール酸の取り込みは、Ca2+フリー緩衝液中よりもわずかに高かった(図3B、4B、及び5B;p<0.05)
【0109】
(実施例2)
(ラットの胆汁中に排泄される投与量の割合と、培養肝実質細胞の胆汁中排泄指数との間の関係)
5つのモデル基質を選択し、ラットのインビボにおいて、胆汁中に排泄投与量の割合と、サンドイッチ培養肝実質細胞の胆汁中排泄との間の関係を調べた。静脈投与後のラット胆汁中に排泄される投与量の割合に関する情報は、論文から得た。胆汁中へのイヌリン、及びサリチル酸塩分泌の程度は、無視できる(Erikssonらの論文, Acta. Physiol. Scand. 95:1-5, 1975; Laznicekandらの論文, Eur. J. Drug Met. Pharmacokinet. 19:21-26, 1994)。メトトレキセート投与量22 μmol/kgの約50〜60%(Bremnesらの論文, Cancer Res. 49:2460-2464, 1989; Masudaらの論文, Cancer Res. 57:3506-10, 1997)、及び[D-pen2,5]エンケファリン投与量14.5 μmol/kgの70%(Chenらの論文, Pharm. Res. 14:345-350, 1997)が、1時間で、無変化の薬剤としてラット胆汁中に排泄された。タウロコール酸の胆汁中排泄は、メトトレキセート、及び[D-pen2,5]エンケファリンよりも迅速かつ大量であった。1時間において、実質的に該投与量の100%が、ラット胆汁中に回収された(Inoueらの論文, Biochim. Biophys. Acta. 833:211-216, 1985)。
【0110】
該サンドイッチ‐内容肝実質細胞の胆汁中排泄は、図3B〜5Bの10分累積取り込みデータに基づき、式3からの該胆汁中排泄指数として定量的に表現され得る。イヌリン、及びサリチル酸塩の胆汁中排泄指数は、無視できるものと想定した。なぜならば、イヌリン、及びサリチル酸塩の累積取り込みにおいて、標準緩衝液とCa2+フリー緩衝液との間で、統計的な有意差がなかったためである(p > 0.05)。メトトレキセート、[D-pen2,5]エンケファリン、及びタウロコール酸の胆汁中排泄指数は、それぞれ、55.4±18.3%、42.4±6.5%、及び56.4±5.2%であった。インビボにおけるラットの胆汁中に排泄される投与量の割合と、インビトロ系において測定された胆汁中排泄指数との間の関係を、図6Aに示した。該胆汁中排泄指数は、インビボにおける無視できる胆汁中排泄となる化合物(例えば、イヌリン、及びサリチル酸塩)に対して、非常に低かった。対照的に、該胆汁中排泄指数は、インビボにおいて胆汁に排泄される化合物(例えば、メトトレキセート、[D-pen2,5]エンケファリン、及びタウロコール酸)に対して、中程度に高かった。
【0111】
(実施例3)
(インビボにおける胆汁クリアランスの相関)
イヌリン、サリチル酸塩、メトトレキセート、及びタウロコール酸のインビボにおける胆汁クリアランス(ml/分/kg 体重)は、それぞれ、0.035 (Uteschらの論文, Vitro Cell. Dev. Biol. 27A:858-863, 1991)、〜0 (Laznicekandらの論文, Eur. J. Drug Met. Pharmacokinet. 19:21-26, 1994)、12.1 (Masudaらの論文, Cancer Res. 57:3506-10, 1997)、及び29.8 (Inoueらの論文, Biochim. Biophys. Acta. 833:211-216, 1985)であった。 [D-pen2,5]エンケファリンのインビボにおける胆汁クリアランス18.5 ml/分/kgは、Chen、及びPollackにより報告されているデータから、式1に基づいて計算した(Chen、及びPollackの論文, Pharm. Res. 14:345-350, 1997)。これらのインビボにおける胆汁クリアランス値に基づいて、イヌリン、サリチル酸塩、メトトレキセート、[D-pen2,5]エンケファリン、及びタウロコール酸の固有のクリアランスを、式2から計算した(それぞれ、0.04、0. 17.3、34.4、及び116.9 ml/分/kg)。
【0112】
10分累積取り込みデータ(図1B〜5B)に基づいて式4から計算した、インビボにおけるイヌリン、サリチル酸塩、メトトレキセート、[D-pen2,5]エンケファリン、及びタウロコール酸の胆汁クリアランスは、それぞれ、〜0、 〜0、4.1±1.0、12.6±2.2、及び56.2±6.0 ml/分/kgであった。5つのモデル化合物にとって、インビボにおける固有の胆汁クリアランスは、インビトロにおける胆汁クリアランス(r2 = 0.9865)とよい相関があった(図6B)。
【0113】
(実施例4)
(インビボ、及びインビトロにおける、264W94、及びその代謝産物の胆汁中排泄の比較)
化合物264W94、及び2169W94の構造式を、図9に示した。化合物2169W94は、ラット、及びヒトにおける、264W94のO-脱メチル化代謝産物であり、ウリンジン-5'-ジホスホフルクロニックアシッド(urindine-5'-diphosphoflucuronic acid)でさらに接合され、グルクロニド接合体を形成し得る。(Silverらの論文, ISSX Proceedings, (サンディエゴ, カリフォルニア州 USA) pp. 387, 1996)。
【0114】
[14C]264W94のラットへの静脈内投与(0.24 μmol/kg)後、24時間で、264W94も2169W94も検出されなかった。しかし、全投与放射活性の35.4% (n=2)が、第一の時間で胆汁中に回収された。胆汁中に回収された放射活性の約30.0%は、2169W94グルクロニドであった;胆汁中の放射活性の残り70%は、未同定の代謝産物を示した。[14C]264W94のラットへの経口投与(2.4 μmol/kg)後、24時間で、2169W94は、該胆汁中に検出されなかった。しかし、全投与放射活性の66.4% (n=2)が、8時間で胆汁中に回収された。胆汁中の放射活性の約88.7%は、2169W94グルクロニド接合体の形態であった。これらのインビボにおける結果は、264W94、及びそのO-脱メチル化産物2169W94が、無視できる胆汁中排泄であるが、2169W94のグルクロニド接合体が、ラットにおける大量の胆汁中排泄となることを示している。
【0115】
3時間、及び96時間の培養肝実質細胞における、264W94、及び代謝産物の胆汁中排泄を決定するために、肝実質細胞単層を、3 μMの[14C]264W94、又は[14C]2169W94を含む標準緩衝液中で累積取り込みを行う前に、標準、又はCa2+フリー緩衝液中でインキュベートした(図7、および8)。3時間の培養肝実質細胞において、264W94、又は2169W94の全放射活性により測定された累積取り込みは、標準緩衝液、又はCa2+フリー緩衝液中で前インキュベートした肝実質細胞と類似していた(p > 0.05)。これは、短時間の培養肝実質細胞での264W94、及び2169W94の取り込みが、Ca2+フリー緩衝液中の該単層の前インキュベーションに影響されないことを示唆している。96時間の培養肝実質細胞において、全放射活性により測定された264W94の10分累積取り込みは、標準緩衝液、又はCa2+フリー緩衝液中で前インキュベートした単層に有意な差がなかった(p > 0.05)。
【0116】
10分での該細胞溶解物のHPLC分析は、全放射活性の73.0%が、264W94の形態であり、かつ3.3%が、2169W94 グルクロニド接合体であることを示した;2169W94は、該溶解物中に検出されなかった。96時間のサンドイッチ培養肝実質細胞において、2169W94の10分取り込みは、Ca2+の非存在下よりも、Ca2+の存在下で約70%大きかった。該10分の細胞溶解物において、全放射活性の約16.7%は、2169W94の形態であり、かつ約58.5が、グルクロニド接合体であった。化合物2169W94は、グルクロニド接合体を形成し、長時間の培養肝実質細胞において胆汁小管網中に排泄される。
【0117】
本開示主題のインビボにおける胆汁中排泄アッセイの利用をさらに特徴付け、インビボにおける薬剤代謝産物の胆汁中排泄を予測するために、インビトロ、及びインビボにおける264W94、及びそのO-脱メチル化代謝産物269W694、及び2169W94 グルクロニドの胆汁中排泄を調べた。以前のラット及びヒト肝臓ミクロソーム、正確に切断した肝臓切片、及びcDNAで行ったインビトロ研究は、264W94が、8-メトキシ位置でO-脱メチル化された代謝産物を形成することを示した。試験された幾つかのシトクロムp450アイソザイムの間で、CYP3A4が、264W94の代謝に最初に関与するアイソザイムであった(Silverらの論文, ISSX Proceedings (San Diego, カリフォルニア州 USA) p. 387, 1996)。
【0118】
インビボにおける性質研究は、264W94も、そのO-脱メチル化代謝産物2169W94も、胆汁中に排出されないことを示した。しかし、2169W94グルクロニド接合体が、他の未同定の代謝産物とともに、胆汁中に大量に排出された。長時間のサンドイッチ‐培養肝実質細胞における264W94の胆汁中排泄の欠如は、264W94の無視できるインビボの胆汁中排泄と一致している。
【0119】
インビボにおいて、264W94等量の約35%が、264W94の静脈内投与後1時間で、代謝産物として胆汁中に排泄される。しかし、培養肝実質細胞において、264W94 代謝産物の胆汁中排泄は、無視できる(図7B)。264W94の代謝産物にとって、インビボ、及びインビトロにおける胆汁中排泄のこの明らかな相違は、代謝活性の相違により、説明され得る。インビボにおいて、264W94は、O-脱メチル化され、2169W94を形成し;かつ次に、2169W94は、ウリジン-5'-ジホスホグルクロニックアシッドと接合し、2169W94 グルクロニドを形成する。このグルクロニド接合体は、胆汁中に排泄される全量の30%を占める。264W94とともにインキュベートした、長時間のサンドイッチ‐培養肝実質細胞の溶解物において、インキュベートした全量の約3%のみが、2169W94 グルクロニド接合体として検出された。これらの結果は、長時間の培養肝実質細胞が、O-脱メチル化反応できないことを示している。従って、無視できるグルクロニド接合体が形成され、かつ該胆汁中に排泄された。
【0120】
しかし、264W94のO-脱メチル化代謝産物2169W94とともに該単層をインキュベーションした後に、2169W94の58.5%が、グルクロニド接合体に変換され、かつ該培養肝実質細胞において有意な胆汁中排泄が観察された(図8B)。本開示主題に従って使用される長時間のサンドイッチ‐培養肝実質細胞において、明らかに、O-メチル化のような相I代謝活性は、有意に低下するが、グルクロニド接合のような相II代謝活性は、少なくとも部分的に維持される。従って、この実験室内実施例は、本開示主題のアッセイが、インビボにおける、その親形態の基質の胆汁中排泄の予測に使用されることをさらに示している。実際、インビボにおける代謝産物の胆汁中排泄を研究し、かつ予測する、今回のインビトロアッセイ方法の応用は、該単層の代謝活性の状態の考察を要求する。
【0121】
(実施例5)
(サンドイッチ‐培養ラット肝実質細胞における、siRNAによるMRP2、及びMRP3の発現の阻害)
本開示に先立って、重要な薬剤輸送遺伝子の発現を特異的にノックダウンするように、第一肝実質細胞にsiRNAを使用しなかった。従って、本実施例の目的は、siRNAを利用して、Mrp2、及びMrp3の発現を調節し、かつサンドイッチ‐培養肝実質細胞(SCRH)の機能的重要性を解明することである。
【0122】
(物質、及び方法)
(ヒト肝芽腫(HepG2)細胞、及び第一ラット肝実質細胞の細胞培養物)
HepG2細胞を、ダルベッコ変法イーグル培地/F-12プラス10% FBS中に維持した。ラット肝実質細胞を、雄のウィスターラット(220-300g)から、インサイツでコラゲナーゼ灌流により単離した(Annaertらの論文, Drug Metab Dispos 29:1277-1283, 2001)。細胞を、ラット尾I型コラーゲンでプレコートしたポリスチレン6-ウェルプレート上に、1ウェルにつき1.5x106の密度で播種した;プレート24時間後に、ゲル化コラーゲンの上層を被せた。ラット肝実質細胞培養物を、0.1 M デキサメタゾン、及び0.1% ITS 培養補助剤(6.25 mg/mL インスリン、6.25 mg/mL トランスフェリン、6.25 g/mL 亜セレン酸、5.35 mg/mL リノール酸、及び1.25 g/mL BSA)で補ったダルベッコ変法イーグル培地中に維持した。培地を、24時間ごとに変えた。
【0123】
(siRNAの合成)
ラットMrp2、及びMrp3を標的とするsiRNA配列を、T7 RNA ポリメラーゼプロトコルのためのRNAi OligoRetriever (www.cshl.org/public/SCIENCE/hannon.htmL)を用いて選択した。一本鎖RNAを、T7-MEGASHORTSCRIPT(商標)高収率転写キット(Ambion社, オースチン, テキサス州 USA)を用いて、製造業者の説明書に従って合成した。二本鎖siRNAを製造するために、一本鎖RNAのセンス、及びアンチセンス等モルを変性させ、かつサーモサイクラーでアニールした(95C, 5分; 70C, 5分; 50C, 5 min; 25C, 5分)。siRNAの完全性を、2%アガロースゲルを用いて試験した。Mrp2を標的とする、下記の3つのsiRNAアンチセンス配列を合成した:siMrp2AB1 = GGCUAUAUCUGUGCAAUCCUA (配列番号:3; アンチセンス鎖においてUA 3' 突出 、及びセンス鎖においてAA 3' 突出)、siMrp2AB2 = GGCUAGGAAGCAGUACACCAU (配列番号:4; アンチセンス鎖においてAU 3' 突出、及びセンス鎖においてAA 3' 突出)、siMrp2AB3 = GGCAGUAGGGUGGUGGUCCAU (配列番号:5; アンチセンス鎖においてAU 3' 突出、及びセンス鎖においてUG 3' 突出)である。Mrp3を標的とする下記アンチセンス配列を使用した:GGUCCAAGGACCUGCCUCCCA (配列番号:6; アンチセンス鎖においてCA 3' 突出、センス鎖においてAG 3' 突出)である。ホタル(Photinus pyralis) ルシフェラーゼ (siFL)を標的とするsiRNA配列[アンチセンス = GUGCGCUGCUGGUGCCAACUU (配列番号:7; 両鎖においてUU 3'突出)]を、このプロトコルにとって公知の有力な配列から適合させた(Miyagishi、及びTairaの論文, Nat. Biotechnol. 20:497-500, 2002)。
【0124】
(siRNAの細胞内追跡)
LABELIT(登録商標)siRNA追跡細胞内局在化キット(Mirus Corporation, マディソン, ウィスコンシン州 USA)を用いて、siRNAを、一段階化学反応でCy3色素に共有結合的に結合させた。10g siRNAを、10 lの再構成Cy3ラベル試薬とともに、37Cで1時間インキュベートした。ラベル化siRNAを、通常のエタノール沈殿法により、過剰のCy3を除去して精製した。Cy3ラベル化siRNAを、下記siRNAトランスフェクションのセクションで記載したようにSCRH内に移動させた。細胞画像を、Axiovert 100TV倒立顕微鏡でとった(Zeiss, Thornwood, ニューヨーク州USA)。
【0125】
(siRNAトランスフェクション)
HepG2細胞を、トランスフェクションする24時間前に、12ウェルプレート上に、1ウェルにつき2 x 105細胞の密度で播種した。1ウェルにつき、100 ngのホタルルシフェラーゼ発現プラスミド(PGL3-FL)と100 ngのレニラルシフェラーゼ発現プラスミド(PRL-TK)との混合物、及び様々な量のホタルルシフェラーゼsiRNAを使用した。特に示さない限り、SCRHのトランスフェクションは、プレート後20時間で行った。6ウェルプレート中、1ウェルにつきsiRNA (特定しない限り2 g)を使用した。siRNA、及びDNAを、TRANSMESSENGER(商標)トランスフェクション反応キット(QIAGEN社, バレンシア, カリフォルニア州 USA)を用いて、トランスフェクトするために製剤した。簡潔に言うと、siRNAを、1:2 (全RNA及び/又はDNAのg:エンハンサーのl)の比で、エンハンサーECに縮合させ、かつTransMessengerを用いて、1:4 (RNA及び/又はDNAのg:TransMessengerのl)の比で製剤し、続いて、細胞とともにインキュベートした。HepG2のトランスフェクションのために、siRNAとともに一晩インキュベートした後に、培地を変えた。SCRHのトランスフェクションのために、細胞を、siRNAとともに4時間インキュベートし、次にコラーゲンで被せた。肝実質細胞内へのsiRNA送達は、上層コラーゲンの被覆前で、より効率的であった。トランスフェクション効率を、48時間後に試験した。
【0126】
(ルシフェラーゼ活性アッセイ)
ルシフェラーゼを、DUAL-LUCIFERASE(登録商標)レポーターアッセイ系(Promega社, マディソン, ウィスコンシン州 USA)で測定した。簡潔に言うと、HepG2細胞を、100 lの不動態溶解緩衝液(passive lysis buffer)中に溶解した。20l細胞溶解液を、100 l ルシフェラーゼアッセイ試薬IIと混合し、ホタルルシフェラーゼ活性を測定した。次に、停止、及びグロー試薬(Stop and Glo Reagent )(100 l)を加え、かつ混合し、レニラルシフェラーゼ活性を測定した。発光強度を、MONOLIGHT(商標)3010照度計(BD Biosciences, サンジュース, カリフォルニア州 USA)を用いて測定した。
【0127】
(免疫ブロット分析)
細胞を、トランスフェクション前48時間で収集し、かつ1% SDS、1mM EDTA、さらにCOMPLETE(商標)プロテアーゼインヒビターカクテル(Roche Diagnostics, マンハイム, ドイツ)中に溶解した。透明な細胞溶解液のタンパク質濃度を、BCAタンパク質アッセイ試薬キットを用いて決定した(Pierce Biotech社, ロックフォード, IL)。1レーンにつき全タンパク質50gを、NuPAGE 4−12% ビス−トリスゲル (Invitrogen Life Technology, カールズバッド, カリフォルニア州 USA)の電気泳動により分離し、かつポリビニリドンジフルオリド膜上に移動させた。下記抗体を使用して、該膜を探索した:抗-Mrp2 (M2III-6, Alexis Biochemicals, サインディエゴ, カリフォルニア州 USA);抗-Mrp3 (Dr. Yuichi Sugiyamaからの贈り物);抗-ラディキシン (Chemicon International社, Temecula, カリフォルニア州 USA), 抗−β−アクチン(MAB1501, Chemicon)である。
【0128】
(CDF性質を有するMrp2、及びMrp3機能の評価)
細胞を、ハンクス液 (HBSS, 2 mL, 37C)で二度洗浄し、かつ2 M CDF ジアセテート(Molecular Probes, ユージーン, オレゴン州 USA)とともにインキュベート(10分, 1.5 mL, 37C)し、続いて、冷HBSS (2 mL, 4C)で二度洗浄した。細胞画像を、Axiovert 100TV倒立顕微鏡でとった。細胞+毛細胆管、及び細胞中のCDFの蓄積を、それぞれ、標準のHBSS、及びCa2+フリーHBSSで前インキュベート(10分, 2 mL, 37C)したSCRHで評価した(Liuらの論文, J. Pharmacol. Exp. Ther. 289:1592-1599, 1999)。その後、SCRHを、CDF ジアセテートとともにインキュベートした(10分, 2 mL, 37C)。siMrp2処置SCRHにおいて、次に、細胞を冷HBSS (2 mL, 4C)で4回洗浄し、かつ溶解した(1mL, リン酸緩衝生理食塩水中0.5% トリトンX-100)。siMrp3処置SCRHにおいて、CDF ジアセテートとインキュベートした後に、細胞を、温HBSS (2 mL, 37C)で4回洗浄し、かつHBSS とともにインキュベートし(30分, 10分ごとにHBSSを交換, 2 mL, 37C)、細胞内CDFの時間を考慮して、適切な基底外排泄を起こし、冷HBSS を用いてSCRHを4回洗浄し、かつ該細胞を溶解した(上記のように)。溶解液中のCDF蛍光を、蛍光分光測光法で定量した(λex = 485 nm, λem = 590 nm);タンパク質濃度を、BCA法キット(上記)で決定した。
【0129】
(乳酸デヒドロゲナーゼ活性アッセイ)
機能研究の前に、細胞外培地への細胞内酵素の漏出が細胞生存度に反比例的に関連している乳酸デヒドロゲナーゼ活性に対して、細胞培地を評価した。乳酸デヒドロゲナーゼ活性を、ピルビン酸から乳酸への乳酸デヒドロゲナーゼ触媒還元、その後の残存ピルビン酸と2,4−ジニトロフェニルヒドラジンとの接合、及びアルカリ性pHでの該ピルビン酸-2,4-ジニトロフェニルヒドラゾン接合体の分光光度的検出(λ = 500 nm)を利用したキット500‐C (Sigma Diagnostics, セントルイス, ミズーリ州 USA)を用いて評価した(Cabaud、及びWroblewskiの論文, Am. J. Clin. Pathol. 30:234-236, 1958)。
(統計)
データは、他に示す場合を除いて、平均± SDで報告した。統計的有意性を、チューキーのポスト‐ホック試験(Tukey's post-hoc test )を用いて、one-way、又はtwo-way ANOVAで評価した。全ての場合において、p < 0.05が、有意であると判断した。
【0130】
(結果)
siRNA活性、送達、有効性、及び毒性の検証を最初に調べた。証明されたノックダウン作用を有するホタルルシフェラーゼ標的siRNA(siFL)を合成し、かつHepG2細胞中のPGL3-FLプラスミドから発現されるホタル ルシフェラーゼの発現のノックダウン作用を試験するために使用した。HepG2細胞を、0.2、0.5、及び1.0 gのsiFLで処置した;トランスフェクション後48時間で、ホタルルシフェラーゼのレニラルシフェラーゼ規格化活性が、それぞれ、74%、89%、及び94%減少した(図10)。
Cy3ラベル化siRNAを使用して、コラーゲン被覆後の肝実質細胞へのsiRNA送達を試験した。siRNAは、被覆前に肝実質細胞内にうまく送達された(図11)。しかし、被覆後では、該肝実質細胞内に送達されなかった。
【0131】
予備研究で、3つの異なるトランスフェクション時間点(3時間、12時間、及び24時間)のノックダウン作用を評価した;最大効果は、プレート後12時間、及び24時間で観察された。本研究において、すべてのトランスフェクションは、プレート後20時間で行った(すなわち、細胞をコラーゲンで被せる24時間前)。
培養3日後に、輸送タンパク質レベル、及び機能を評価した時間、乳酸デヒドロゲナーゼ活性は、siMrp2、又はsiMrp3 siRNAでトランスフェクトしたSCRHにおいて上昇しなかった(94 ± 13, 87 ± 3% トランスフェクトしていないコントロールSCRH, 平均 ± SEM)。
【0132】
SCRH へのsiRNAの効率的送達を確実にするために、細胞をラット尾コラーゲンで被せ、かつ細胞内siRNAをcy3ラベルで追跡する前後で、該第一肝実質細胞をプレートし、その後の異なる時間点でのトランスフェクションを試験することにより、トランスフェクション方法論を開発した。Mrp2に対する3つの異なるsiRNA配列(本明細書中、及び図中で一般的にsiMrp2と呼ぶ)、siMrp2AB2 (配列番号:4)、及びsiMrp2AB3 (SEQ ID NO:5)を合成した。Mrp2 cDNA (配列番号:1)の1158-1178番目のヌクレオチドを標的とするsiMrp2AB1が、もっとも強い作用を有し、siFLトランスフェクトSCRH、又は非トランスフェクトSCRHと比較して、内生Mrp2発現において平均50%(最大79%)還元を示した(図12A、及び12B)。また、siMrp2AB2は、有意なノックダウン作用を示した(40 ± 20%)。siMrp2AB3は、Mrp2タンパク質のみを適度にノックダウンした(26 ± 18%)。意外にも、これらの3つの配列の等量混合物は、最小のノックダウン作用を示した(〜13%還元)。
【0133】
Mrp2機能の低下は、蛍光Mrp2基質カルボキシジクロロフルオレセイン (CDF) (図13B)を用いる蛍光顕微鏡検査により立証される。非蛍光CDFジアセテートは、肝実質細胞内に受動的に分散され、そこで、蛍光CDFに加水分解され、Mrp2により小管膜を横切って活動的に排泄され、かつSCRHの小管網に蓄積される(Kikuchiらの論文, Nat. Genet. 31:320-325, 2002)。siMrp2で処置されたSCRHの小管網中の蛍光は、ホタルルシフェラーゼ (siFL)で処置したSCRH、又は非トランスフェクトSCRHと比較して、顕著に低下する(〜45%)。
【0134】
コントロール非トランスフェクト細胞+毛細胆管内のCDFの蓄積は、細胞内のみよりも有意に高い(80.4 ± 3.9 対 67 ± 5.5 pmol/mg タンパク質/10分)。これは、胆汁小管網中のCDFの明らかな蓄積を示している。対照的に、siMrp2トランスフェクトSCRHにおいて、細胞+毛細胆管中のCDFの蓄積は、細胞のみのCDF蓄積との有意な違いはなかった(78.3 ± 6.3 対 71.1 ± 7.8)。該胆汁小管網中のCDF蓄積に起因する、細胞+毛細胆管に蓄積されるCDFのパーセントフラクションは、siMrp2トランスフェクトSCRHにおいて、〜45%低かった (9.3% 対 16.5%)
【0135】
siMrp2処置細胞のノックダウン作用の特異性を評価するために、Mrp3 (配列番号:2)の発現、Mrp2 (配列番号:1)に対して45%同定のタンパク質を調査した。免疫ブロット分析データは、siMrp2AB1 (配列番号:3)、siMrp2AB2 (配列番号:4)、及びsiMrp2AB3 (SEQ ID NO:5)、これらの3つの混合物、又はsiFL (配列番号:7)で処置されたSCRHにおいて、Mrp3の発現レベルが、非トランスフェクト細胞のそれと同じであることを示した(それぞれ、89±11、96±15、86±11、89±19、96±6%非トランスフェクトコントロール;図12A、及び12B)。
【0136】
ラディキシンは、げっ歯類肝臓において主要なエズリン-ラディキシン-モエシン(ERM)タンパク質であり、主に胆汁小管膜に局在している。SCRHにおいて、ラディキシン(該小管膜のMrp2の正確な局在化に必要なタンパク質)の発現は、培養時間で、増加した(1日目の発現に対して、2日目= 111、3日目= 153、4日目= 189%発現)。ラディキシン発現レベルは、siMrp2、又はsiFLで処置したSCRHにおいて、非トランスフェクトSCRHと比較して変化はなかった(siMrp2AB1 = 95 ± 17、siMrp2AB2 = 100 ± 8、siMrp2AB3 = 103 ± 7、siMrp2Abmix = 101 ± 8、siFL = 103 ± 10% 非トランスフェクトコントロール)。従って、siMrp2処置SCRHにおける、小管網へのCDF流出の低下は、Mrp3、又はラディキシンの変化のためではなかった。むしろ、Mrp2抑制の直接的結果であった。
【0137】
SCRH におけるMrp3 (配列番号:2)の抑制の結果を調査するために、Mrp3発現を、上記と同じアプローチを利用して調節した。SCRHを、Mrp3 cDNAの1950〜1970番目のヌクレオチドを標的とするsiRNA (本明細書中、及び図中で一般的にsiMrp3と呼ぶ;配列番号:6)を用いて処置した。免疫ブロット分析は、siFL (配列番号:7)、及び非トランスフェクト細胞と比較して、Mrp2発現に変化はなく、Mrp3タンパク質発現の低下を確認した(図13A)。Mrp3基質でもあるCDFを用いた機能アッセイは、小管網内のCDF蛍光が、siFLトランスフェクト、又は非トランスフェクト細胞のものよりも強いことを示した(図13B)。
【0138】
CDF ジアセテートとインキュベートしたすぐ後に、細胞+毛細胆管、及び細胞のみ、双方のCDF蓄積における、Mrp3ノックダウンの明らかな作用は記録されなかった。相違は、30分の洗い流し後に明らかになり、肝実質細胞中に蓄積されたCDFは、適切に基底外排泄された(図13D)。siMrp3トランスフェクト細胞+毛細胆管内のCDF蓄積は、コントロールの非トランスフェクト細胞+毛細胆管のものよりも有意に大きい(32.3 ± 2.5 対 24.4 ± 4.3 pmol/mg タンパク質/10分)。対照的に、細胞のみのCDF蓄積は、Mrp3ノックダウンにより変化しなかった(13.7 ± 2.2 対 15.6 ± 4.0 pmol/mg タンパク質/10分)。30分洗い流し後のCDFの胆汁中排泄指数は、〜60%に増加した(57.5 対 36.2%)。
【0139】
(考察)
化学的に合成したsiRNAは、商業的に利用可能であるが、T7 RNAポリメラーゼ方法は、予備スクリーニング用の少量のsiRNAの合成にとってコスト的に有効な方法であることを示した(Donze and Picard, Nucleic Acids Res. 30:e46, 2002)。この方法で製造されるsiRNA性質を保証にするために、証明されたノックダウン作用を有するホタルルシフェラーゼ (siFL)を標的とするsiRNAを合成し、かつHepG2細胞内のPGL3-FLプラスミドから発現されるホタルルシフェラーゼの発現のノックダウン作用を試験するために使用した。ホタルルシフェラーゼ活性は、siFLによる投与量依存方法において低下した。これは、T7 RNA ポリメラーゼ方法により合成されたsiRNAが、有意なンノックダウン作用を有することを示している。
【0140】
Mrp2の発現、又は局在化の変更は、Mrp2機能の変化を導き得る。インビボ研究は、げっ歯類肝臓の有力な胆汁小管エズリン-ラディキシン-モエシンタンパク質であるラディキシンが、Mrp2のC末端細胞質ドメインに直接結合することを示している;ラディキシンとMrp2との相互作用は、小管膜におけるMrp2の正確な局在化を必要とする(Kocherらの論文, Lab. Invest. 79:1161-1170, 1999; Kojimaらの論文, J. Hepatol. 39:693-702, 2003)。マウスにおいて、ラディキシンがノックアウトされた場合、Mrp2は、局在化を誤り、かつ正常に機能しなくなった(Kikuchiらの論文, Nat. Genet. 31:320-325, 2002)。コラゲナーゼで肝実質細胞を単離した後、Mrp2は内部移行する。SCRHにおいて、Mrp2は、培養時間で、小管膜に再局在化する(Zhangらの論文, AAPS Pharm. Sci. 3:Abstract 1522-1059, 2001)。SCRH中のラディキシンの発現は、培養時間で増加し、これは、該小管膜へのMrp2の再局在化と一致する。ラディキシン発現レベルは、siMrp2で処置したSCRHにおいて、siFLで処置したもの、又は非トランスフェクトSCRHと比較した場合、変化はない。これらのデータは、siMrp2によるMrp2機能の調節がラディキシン経路を介して媒介される可能性を除外する。
【0141】
siMrp2を用いたSCRHの処置は、一時的なMrp2ノックダウンマウスを本質的に製造する(図12A、および13A)。定性的に、Mrp2機能の低下は、蛍光Mrp2基質 CDFを用いて、蛍光顕微鏡検査により立証される。siMrp2で処置したSCRHの小管網中の蛍光は、siFL、又は非トランスフェクト細胞で処置したSCRHと比較して、顕著に減少する。定性的に、siMrp2を用いたSCRHのトランスフェクションは、毛細胆管に見られる細胞+毛細胆管のCDFのフラクションを、16.5から9.3%に減少する。CDF 胆汁中排泄 (〜45%)減少の程度は、Mrp2ノックダウン(〜50%)の程度と良い一致を示す。減少したCDF性質は、siMrp2トランスフェクトSCRHの培地中での乳酸デヒドロゲナーゼ活性における増加の欠如により示されているように、Mrp2タンパク質レベルの低下のためであり、かつ損なわれた細胞生存度のためでない。
【0142】
Mrp3のノックダウンは、siFL でトランスフェクトされた細胞、又は非トランスフェクト細胞と比較して、Mrp2の発現を変えなかった(図13A)。Mrp3基質でもあるCDFを用いた機能アッセイは、小管網中のCDF蛍光が、siFLトランスフェクト、又は非トランスフェクト細胞のものよりも強いことを示している(図13B)。siMrp3を用いたSCRHのトランスフェクションは、細胞+毛細胆管中のCDFの蓄積を有意に増加させ(しかし、細胞のみではそうならない。)(図13D)、毛細胆管中に見られる細胞+毛細胆管に蓄積されたCDFのフラクションを〜60%増加する結果を示した。Mrp3のノックダウンは、胆汁中へのCDF排泄の経路の向け直しを生じる。従って、siMrp3-処置SCRHの小管蛍光は、コントロール細胞中よりも高かった。siMrp3処置SCRHは、一時的なMrp3ノックダウンモデルを表す。これは、インビボにおいてまだ利用できないものである。
【0143】
本件急により証明されたものとして、RNA干渉は、薬剤性質の特異的タンパク質の役割の研究における強力なツールである。肝クリアランスにおける輸送タンパク質の役割に関する現在の知識の大部分は、3種類の実験設定から来る:組換え発現系、及びノックアウト/変異動物である。多くのプログラムが、輸送体機能の研究におけるこれらのツールで作られているが、現在の実験系は、下記で論じる制限がある。これらの制限の多くは、RNA干渉に関連しない。
【0144】
組換えタンパク質は、宿主細胞の転写、翻訳、及び翻訳後修飾の違いのために、常に、対象の種のにおける代表的なインビボタンパク質でないかもしれない。例えば、多くのATP結合カセット輸送体発現のためのホストシステムとして頻繁に使用されるSf9細胞は、組換えタンパク質を、多くグリコシル化(underglycosylate)し、低分子の輸送体を生じる(Germannらの論文, Biochemistry 29:2295-2303, 1990)。さらに、最近の調査は、特定の化合物が、所定の原形質膜ドメインで、2以上の輸送体の基質となり得ることを示している。例えば、Mrp2、及び該乳癌耐性タンパク質、双方が、肝小管膜を横切って、生体異物の硫酸抱合体を胆汁中に排泄する(Xiongらの論文, J. Pharmacol. Exp. Ther. 295:512-518, 2000)。同様に、肝摂取は、2以上の輸送体により媒介され得る。オピオイドペプチド[D-ペニシラミン2,5]エンケファリンは、3つ全ての有機アニオン輸送ポリペプチドイソ型により、肝実質細胞内に吸収される(Cattoriらの論文, Pflugers Arch. 443:188-195, 2001)。従って、組換え輸送体による化合物の輸送の重要性の正確なインビボにおける解釈は、非常に困難であり得る。
【0145】
ノックアウト、又は自然発生的変異動物は、インビボにおける個々の輸送体の役割の理解を非常に促進させている。これらの動物の補足的な輸送機序の上方制御は、データ解釈を混乱させ得る。例えば、Mrp2不足EHBRラットにおいて、タウロコール酸の胆汁中排泄は、正常に機能しない。これは、Mrp2が、この胆汁酸の胆汁中排泄を媒介するためでなく、基底外部Mrp3が、これらのラットの肝臓において高度に上方制御され、胆汁中排泄にとって利用可能な基質を制限する、より効率的な基底外排泄を起こすためである(Akitaらの論文, Pharm. Res. 18:1119-1125, 2001)。ノックアウト、又は変異動物から得られたデータの解釈は、補足的な経路における考慮の潜在的変化を取り入れなければならず、常に、よく理解されるものではないかもしれない。
【0146】
ここに示したように、RNA干渉は、対象のタンパク質の特異的かつ迅速なノックダウンを可能にする。siMrp2を用いたSCRHのトランスフェクションは、Mrp2タンパク質を減少させたが、密接に関連したMrp3を減少させなかった。同様に、Mrp3のノックダウンは、Mrp2タンパク質レベルに影響されなかった。自然発生的変異Mrp2、例えばEHBRラットにおいて、Mrp3は、該肝臓において高度に上方制御される(Akitaらの論文, Pharm. Res. 18:1119-1125, 2001)。しかし、Mrp2のノックダウンは、siMrp2を用いた肝実質細胞のトランスフェクション後2日で、Mrp3タンパク質レベルを変化させなかった。siRNAを用いたタンパク質ノックダウンの割合は、該タンパク質の半減期により影響され、明らかにMrp2にとって、Mrp3の顕著な増加が生じる前にMrp2レベルの有意な低下が達成され得るのに十分な短さである。
【0147】
全体的な、SCRHのsiRNA処置による薬剤輸送体の調節は、薬剤輸送タンパク質の発現、及び機能の研究にとって、実行可能なアプローチである。RNA干渉は、輸送タンパク質の研究用に現在使用される実験計画に、独特の利点を提供する。siRNAの主な利点は、ノックダウンの特異性、及び主要細胞の補足的な輸送機序の発現維持であり、他の関連タンパク質の発現を維持する。
【0148】
(引用文献)
下記リストの引用文献、並びに本明細書中に引用した全ての引用文献は、本明細書中で使用される方法論、技術、及び/又は組成物を補足し、説明し、背景を提供し、又は教示する範囲に対して、本明細書中に引用により取り込まれる。
Akita らの論文, Pharm. Res. 18:1119-1125, 2001.
Annaert らの論文, Drug Metab. Dispos. 29:1277-1283, 2001.
Bass, Nature 411:428-429, 2001.
Bernstein らの論文, Nature 409:363-366, 2001.
Boyer、及びSorokaの論文, Gastroenterology 109:1600-1611, 1995.
Bremnes らの論文, Cancer Res. 49:2460-2464, 1989.
Cabaud、及びWroblewskiの論文, Am. J. Clin. Pathol. 30:234-236, 1958.
カナダ特許出願第2,359,180号
Cattori らの論文, Pflugers Arch. 443:188-195, 2001.
Chen らの論文, Pharm. Res. 14:345-350, 1997.
Donze、及びPicardの論文, 核酸s Res. 30:e46, 2002.
Dunn らの論文, FASEB J. 3:174-177, 1989.
Elbashir らの論文 Nature 411:494-498, 2001a.
Elbashir らの論文, Genes Dev 15:188-200, 2001b.
Eriksson らの論文, Acta. Physiol. Scand. 95:1-5, 1975.
Fire らの論文, Nature 391:806-811, 1998.
Fireの論文, Trends Genet 15:358-363, 1999.
Germann らの論文, Biochemistry 29:2295-2303, 1990.
Hammond らの論文, Nature 404:293-296, 2000.
Haugland, 分子プローブ:蛍光プローブ、及び調査化学物質のハンドブック(Molecular Probes: Handbook of Fluorescent Probes and Research Chemicals)(1992-1994), p.134, Molecular Probes, Inc., 1992.
Inoue らの論文, Biochim. Biophys. Acta. 833:211-216, 1985.
Kikuchi らの論文, Nat. Genet. 31:320-325, 2002.
Kocher らの論文, Lab. Invest. 79:1161-1170, 1999.
Kojima らの論文, J. Hepatol. 39:693-702, 2003.
Kool らの論文, Proc. Natl. Acad. Sci. USA 96:6914-6919 1999.
Laznicekand らの論文, Eur. J. Drug Met. Pharmacokinet. 19:21-26, 1994.
LeCluyse らの論文, Am. J. Physiol. 266(Cell Physiol. 35):C1764-1774, 1994.
LeCluyse らの論文, 薬剤吸収、及び代謝を評価するモデルの培養ラット肝実質細胞(Cultured rat hepatocytes, in Models for Assessing Drug Absorption and Metabolism)(Borchard らの論文 eds), pp 121-160, Plenum Press, New York, 1996.
【0149】
Liu らの論文, Pharm. Res. Init.13:S-393 (8003), 1996.
Liu らの論文, Hepatology 24:370A (973), 1996.
Liu らの論文, Pharm. Res. 24:S-459 (3007), 1997.
Liu らの論文, Hepatology 26:297A (675), 1997.
Liu らの論文, Pharm. Sci. 1:S-119, 1998.
Liu らの論文, Pharm. Res., 15:1533-1539, 1998.
Liu らの論文, J. Pharmacol. Exp. Ther. 289:1592-1599, 1999.
Masuda らの論文, Cancer Res. 57:3506-10, 1997.
Miyagishi、及びTairaの論文, Nat. Biotechnol. 20:497-500, 2002.
Norris らの論文, N. Eng. J. Med. 334:231-238, 1996.
Nykanen らの論文, Cell 107:309-321, 2001.
Pang らの論文, J. Pharmacokinet. Biopharm. 5:625-653, 1977.
Parkinson, A., Casarett、及びDoullの技術における生態異物の生体内変換(Biotransformation of Xenobiotics in Casarett and Doull's Toxicology). 毒物の基礎科学(The Basic Science of Poisons), 第5版. (Klaassen, C.D. ed.) pp. 113-186, McGraw Hill, New York, 1996.
【0150】
PCT 国際公開番号WO 99/32619.
PCT 国際公開番号WO 99/07409.
PCT 国際公開番号WO 00/01846.
PCT 国際公開番号WO 00/44895.
PCT 国際公開番号WO 00/44914.
PCT 国際公開番号WO 00/63364.
PCT 国際公開番号WO 01/04313.
PCT 国際公開番号WO 01/29058.
PCT 国際公開番号WO 01/36646.
PCT 国際公開番号WO 02/44321.
PCT 国際公開番号WO 01/68836.
PCT 国際公開番号WO 01/75164.
PCT 国際公開番号WO 01/92513.
PCT 国際公開番号WO 02/055692.
PCT 国際公開番号WO 02/055693.
【0151】
Pollack らの論文, J. Pharmacol. Exp. Ther. 18:197-202, 1989.
Sandusky らの論文, Histopathology 41:65-74, 2002.
Seglen, 細胞生物学の方法(Methods in Cell Biology)(第13版., Prescott D. M. Eds.) pp. 30-78, Academic Press, New York, 1976.
Sidhu らの論文, Pharmacogenetics 5:24-36, 1993.
Silver らの論文, ISSX Proceedings (サンディエゴ, カリフォルニア州 USA) pp. 387,1996.
Summerton & Weller, Antisense Nucleic Acid Drug Dev 7:187-95, 1997.
Summerton, Biochim Biophys Acta 1489(1):141-58, 1999.
Utesch らの論文, In Vitro Cell Dev. Biol. 27A:858-863, 1991.
Wianny & Zernicka-Goetz, Nature Cell Biol 2:70-75, 1999.
Xiong らの論文, J. Pharmacol. Exp. Ther. 295:512-518, 2000.
Zhang らの論文, AAPS Pharm. Sci. 3:Abstract 1522-1059, 2001.
本発明の様々な詳細は、本発明の範囲から外れることなく変化され得ることが理解されるであろう。さらに、先の記載は、説明の目的のみのためであり、請求項に規定した発明の制限を目的とするものではない。
【図面の簡単な説明】
【0152】
【図1】図1Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]イヌリン(1 μM)の累積取り込みを示すグラフである。 図1Bは、96時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]イヌリン(1 μM)の累積取り込みを示すグラフである。
【図2】図2Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[14C]サリチル酸塩(1 μM)の累積取り込みを示すグラフである。 図2Bは、96時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[14C]サリチル酸塩(1 μM)の累積取り込みを示すグラフである。
【図3】図3Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]メトトレキセート(1 μM)の累積取り込みを示すグラフである。 図3Bは、96時間サンドイッチ形態で培養した肝実質細胞における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]メトトレキセート(1 μM)の累積取り込みを示すグラフである。
【図4】図4Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H][D-pen2,5]エンケファリン (15 μM)の累積取り込みを示すグラフである。 図4Bは、96時間サンドイッチ形態で培養した肝実質細胞における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H][D-pen2,5]エンケファリン (15 μM)の累積取り込みを示すグラフである。
【図5】図5Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]タウロコール酸 (1 μM)の累積取り込みを示すグラフである。 図5Bは、96時間サンドイッチ形態で培養した肝実質細胞における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]タウロコール酸 (1 μM)の累積取り込みを示すグラフである。
【図6】図6Aは、下記モデル基質に対する、インビボにおけるラット胆汁に排泄される投与量の割合と、96時間培養肝実質細胞における胆汁中排泄指数との間の関係を示すグラフである:イヌリン(□)、サリチル酸塩(◆)、メトトレキセート(○)、[D-pen2,5]エンケファリン(▲)、及びタウロコール酸 (●)である。該胆汁中排泄指数を、式3に基づいて、10分累積取り込みデータ(図1A〜5B)から計算した。破線は、該データに適合する線形回帰方程式である。 図6Bは、下記モデル基質に対する、インビボにおけるラット胆汁に排泄される投与量の割合と、インビボにおける固有の胆汁クリアランス、及びインビトロにおける96時間サンドイッチ培養した肝実質細胞における胆汁クリアランスとの間の関係を示すグラフである:イヌリン(□)、サリチル酸塩(◆)、メトトレキセート(○)、[D-pen2,5]エンケファリン(▲)、及びタウロコール酸 (●)である。該インビボにおける固有の胆汁クリアランスを、論文のインビボにおける胆汁クリアランス値に基づいて、式2から計算した。該インビトロにおける胆汁クリアランスを、式4から計算した。破線は、該データに適合する線形回帰方程式である。
【0153】
【図7】図7Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]264W94 (3 μM)の累積取り込みを示すグラフである。 図7Bは、96時間サンドイッチ形態で培養した肝実質細胞における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]264W94 (3 μM)の累積取り込みを示すグラフである。
【図8】図8Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]2169W94 (3 μM)の累積取り込みを示すグラフである。 図8Bは、96時間サンドイッチ形態で培養した肝実質細胞における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]2169W94 (3 μM)の累積取り込みを示すグラフである。
【図9】図9Aは、化合物264W94の化学構造式を示し、アスタリスク記号は、均等に取り込まれた14C位置を示す。 図9Bは、化合物2169W94の化学構造式を示し、アスタリスク記号は、均等に取り込まれた14C位置を示す。
【図10】図10は、T7 RNAポリメラーゼ方法で合成されたsiFLのノックダウン作用を示すグラフである。ホタルルシフェラーゼ活性は、0.2、0.5、又は1.0のsiFLを加えた、 PGL3-FL (ホタルルシフェラーゼ)、及びPRL-TK (レニラルシフェラーゼ)プラスミドでトランスフェクトしたHepG2で試験した;活性は、レニラルシフェラーゼの活性に対して規格化した。PGL3-FL、及びPRL-TKプラスミドのみを、コントロールのトランスフェクションに使用した。
【図11】図11は、siRNAの細胞内追跡を示す。siFL、及びsiMrp2を、Cy3試薬でラベル化し、かつコラーゲン被覆前に、SCRH内にトランスフェクトした。画像は、トランスフェクション後24時間でとった。
【図12A】図12Aは、ラット尾コラーゲンでコートした6ウェル培養プレート上のSCRHのトランスフェクションに使用したsiMrp2処置SCRH (1ウェルにつき2μg)における、Mrp2、Mrp3、ラディキシン、及びアクチンの発現の代表的免疫ブロットである;免疫ブロット分析を、該トランスフェクション後48時間で行った;NTCは、非トランスフェクトコントロールである。
【図12B】図12Bは、siRNA処置細胞中のアクチン規格化Mrp2と非トランスフェクトコントロールとの相対的発現比を表す。平均± SD (n = 4), *p < 0.05 siRNAトランスフェクト対非トランスフェクトコントロール、p < 0.05 siMrp2トランスフェクト対siFL(チューキーのポスト‐ホック試験を用いたone-way ANOVA)
【図13A】図13Aは、siMrp2、siMrp3、siFLで処置したSCRH、及び非トランスフェクトSCRHのMrp2、及びMrp3発現の免疫ブロット分析を示す。
【図13B】図13Bは、siRNAで処置したSCRHの小管網中のCDF蛍光を示す。光顕微鏡画像(左パネル)、及び蛍光顕微鏡画像(右パネル)は、(a) 非トランスフェクト細胞、(b) siFL、(c) siMrp2、及び(d) siMrp3ランスフェクト細胞に並べて示した。
【図13C】図13Cは、2 μM CDF ジアセテートとともに10分インキュベートした直後の標準ハンクス液(HBSS, 細胞+毛細胆管, 閉じた棒)、及びCa2+フリーHBSS(細胞のみ, 開放棒)中のsiMrp2、siFLトランスフェクト、及び非トランスフェクトSCRHのCDF蓄積を示す。
【図13D】図13Dは、2 μM CDF ジアセテートで10分インキュベーション、及び 30分の洗い流し後のsiMrp3、siFLトランスフェクト、及び非トランスフェクトSCRHにおける、細胞+毛細胆管中のCDF蓄積(閉じた棒)、及び細胞のみ(開放棒)を示すグラフである。NTC =非トランスフェクト。平均± SD (n = 6), *p < 0.05 細胞+毛細胆管対細胞のみ, †p < 0.05 siMrp2トランスフェクト対NTC, ‡p < 0.05 siMrp2トランスフェクト対siFLトランスフェクト(チューキーのポスト‐ホック試験を用いたone-way ANOVA)。
【技術分野】
【0001】
(関連出願情報)
本出願は、2004年5月10日に出願された米国特許出願10/842,404の利点を主張する。これは、2000年3月17日に出願された米国一般特許出願09/527,352の一部継続であり、この開示は、本明細書中にその全体において引用により取り込まれ、かつ1999年3月17日に出願された米国仮特許出願60/124,810の利点を主張し、この開示は、本明細書中にその全体において引用により取り込まれる。
(助成金の記述)
本発明は、National Institute of Healthからの助成金番号GM41935の下、政府支援の一部において作成された。従って、米国政府は、本発明において特定の権利を有する。
【0002】
(技術分野)
本開示は、胆汁中排泄への感受性に対する、主に治療薬としての使用の候補となる化合物のスクリーニング方法に関するものである。特に、幾つかの実施態様において、本開示は、インビトロにおける、胆汁中排泄への感受性に対する候補化合物のスクリーニング方法に関するものである。化合物は、ヒト、及び他の温血脊椎動物への投与用治療薬として使用されるために選択され得る。幾つかの実施態様において、本開示は、hepatobiliary disposition(制限されないが、肝摂取、及び胆汁中排泄など)に関与する輸送タンパク質の同定に関するものである。
【0003】
(略語表)
AUC - 曲線下面積
BCRP - 乳癌耐性タンパク質
BSEP - 胆汁酸塩輸出ポンプ
ClB - 胆汁クリアランス
Clin - 固有のクリアランス
cMOAT - 小管多特異的有機アニオン輸送体(canalicular multispecific organic anion transporter)
CDF - カルボキシジクロロフルオレセイン
CFDA - カルボキシジクロロフルオレセイン ジアセテート
DMEM - ダルベッコ変法イーグル培地
EDTA - エチレンジアミンテトラアセテート
HP - ヒューレットパッカード
HPLC - 高速液体クロマトグラフィー
hr - 時間
i.v. - 静脈内
i.p. - 腹腔内
Km-酵素 - 基質反応のミカエリス-メンテン定数
LC/MS - 液体クロマトグラフィー/質量分析
mg pr - ミリグラム タンパク質
min - 分
MDR2、又はMdr2 - 多剤耐性タンパク質 2
MRP2、又はMrp2 - 多剤耐性関連タンパク質 2
Ntcp - Na+/タウロコール酸共輸送ポリペプチド
OAT - 有機アニオン輸送体
OATP1 - 有機アニオン輸送ポリペプチド 1
OATP2 - 有機アニオン輸送ポリペプチド 2
OCT - 有機カチオン輸送体
P-gp - P-糖タンパク質
SD - 標準偏差
UV - 紫外
UV/VIS - 紫外/可視
Vmax - 酵素触媒反応の最大速度
【背景技術】
【0004】
門脈血内に治療薬、薬剤、又は他の化合物を吸収するための最初のパスの代謝タンパク質は、肝臓への誘導を提供する。薬剤を飲み込むと、胃、及び小腸がそれを吸収し、続いて、血液から門脈、肝臓へと流れる。次に、肝臓は、肝臓血液供給を経て、該薬剤を高濃度で順番に急速に吸収し、かつ代謝され得る。従って、多量の薬剤が、体循環、又は薬物作用部位で見られることはないであろう。さらに、最初のパスの代謝経路を通る迅速な代謝産物は、不必要な高血漿濃度の形態を導くことがある。
【0005】
従って、多くの場合、肝臓中の治療組成物は、肝実質細胞(肝細胞)による吸収、及び毛細胆管を介する胆汁中の排泄において、望ましくないが、動物の循環系から除去される。Ntcp、並びにOatp、Oat、及び/又はOctイソ型を含む肝実質細胞に内在する輸送タンパク質は、肝実質細胞内への取り込みを仲介する。前記輸送体は、治療組成物のような生体異物、並びに内在性化合物を、肝実質細胞の洞様血管膜(sinusoidal membrane)を横切って移動させる。毛細胆管は、排泄された肝実質細胞成分を受け取り、かつ胆汁を、動物からの除去のために、総胆管に輸送する肝組織内の構造体である。従って、基質の胆汁中排泄は、洞様血管膜を横切るトランスロケーション、細胞質を通り抜ける移動、及び小管膜を横切る輸送を伴う、複雑なプロセスである。
【0006】
コンビナトリアル化学技術の出現により、治療薬としての潜在性を有する非常に多くの数の化合物の同定が可能になった。しかし、肝実質細胞による取り込み、及び毛細胆管を介した排泄にとって可能性の低い候補化合物を迅速に同定することができる、胆汁中排泄への感受性に対するアッセイは、薬理活性の合成、及びスクリーニング速度に遅行している。多数のインビボ(例えば、胆管にカニューレを挿入した動物)、及びインビトロ標本(例えば、単離した灌流肝臓、単離肝実質細胞、肝実質細胞対(hepatocyte couplets)、肝形質膜ビヒクル(liver plasma membrane vesicles)、及び発現輸送タンパク質)は、胆汁中排泄プロセスの調査に使用されている。例えば、Oude Elferinkらの論文, Biochim. Biophys. Acta 1241:215-268, 1995.を参照されたい。
【0007】
さらに、Graf、及びBoyer, J.の論文, Hepatol. 10:387-394, 1990.に記載されているように、短時間(3〜8時間)の培養肝実質細胞対は、蛍光顕微鏡を利用して、蛍光化合物の胆汁中排泄の直接的調査に使用されている。しかし、生体異物の胆汁中排泄を研究する培養肝実質細胞対の適用は、基質が蛍光発色団を含む必要がある点で、限界がある。
長時間(通常、24時間より長い)培養肝実質細胞は、小管様構造を有する極性を回復することが報告されている。例えば、Barth、及びSchwarz, Proc. Natl. Acad. Sci. 79:4985-4987, 1982; Mauriceらの論文, J. Cell Sci. 90:79-92, 1988; Talaminiらの論文, Hepatology 25:167-172, 1997.を参照されたい。従来の培養条件下で保持された第一肝実質細胞は、薬物代謝、及び肝毒性の研究に使用されているが、長時間培養の肝実質細胞は、肝胆輸送研究の適切なモデルである。特に、Groothuis、及びMeijer, J.の論文Hepatology 24(Suppl. 1):3-28, 1996.及びLeCluyseらの論文, Adv. Drug Del. Rev. 22:133-186, 1996.に記載されているように、肝臓特異的機能(肝臓の輸送機能を含む)の急速な損失、並びに正常な胆汁小管網の確立、及び正常な肝実質細胞形態の維持の不全が、前記培養物中に観察されている。
【発明の開示】
【発明が解決しようとする課題】
【0008】
現在の方法では、ヒト胆汁中排泄の調査に広く適用できることが実証されていない。さらに、現在のアプローチでは、多くの薬剤候補に対する効率的な胆汁中排泄プロセスの調査に使用することができない。従って、肝摂取、及び胆汁中排泄に対する候補化合物の感受性を評価するアッセイが、長い間、必要とされている。このようなアッセイは、前記評価工程における初期の治療薬のさらなる評価から、胆汁中排泄に対して望ましくない高感受性のこれらの化合物の除外を容易にするであろう。これに対して、治療薬のさらなる試験のために、適切な候補化合物(例えば、胆汁中排泄に影響されない化合物)の迅速な同定が、長い間、必要とされている。
【課題を解決するための手段】
【0009】
(要旨)
本明細書中に、肝実質細胞輸送タンパク質による胆汁中排泄への感受性に対する候補化合物のスクリーニング方法を開示する。該方法は、複数の肝実質細胞、及び少なくとも1つの毛細胆管を含む細胞培養物を提供すること、ここで、該肝実質細胞の少なくとも1つは、輸送タンパク質を含み;該培養物に候補化合物を曝露すること;及び該少なくとも1つの毛細胆管中の該候補化合物の量を決定し、それによって、該肝実質細胞輸送タンパク質による胆汁中排泄への感受性に対する該候補化合物をスクリーニングすることを含む。好ましくは、肝実質細胞の培養物は、サンドイッチ形態の長時間培養物を含む。
【0010】
好ましくは、該毛細胆管中の候補化合物の量を測定することは、核酸を、該輸送タンパク質の発現阻害に十分な量で、該肝実質細胞内に導入することにより、該輸送タンパク質の発現を阻害することを含む。ここで、該核酸は、輸送タンパク質をコード化している遺伝子のコード鎖に相当する配列を含む。従って、また、本明細書中に、肝実質細胞タンパク質の発現を阻害する、単離した短い干渉RNA(siRNA)分子を提供する。他の実施態様において、第一及び第二細胞培養物を確立する、肝実質細胞輸送タンパク質による胆汁中排泄への感受性に対する候補化合物のスクリーニング方法を提供する。
【0011】
該第一培養物は、輸送タンパク質を発現し、かつ該第二培養物は、該輸送タンパク質の発現を少なくとも部分的に阻害する。該方法は、該第一培養液、及び該第二培養液に該候補化合物を、候補化合物の取り込みに十分な時間、曝露すること;該第一及び第二培養物を洗浄し、かつ溶解すること;各培養物から得られた溶解産物の中に存在する該候補化合物の量を決定すること、及び各培養溶解産物中の該候補化合物の量を使用して、該輸送タンパク質による胆汁中排泄への感受性に対する候補化合物を評価することを含む。
【0012】
幾つかの実施態様において、第一及び第二培養物の各々を、無処置の毛細胆管を有する該第一及び第二培養物の各々の第一分画、並びに破壊した毛細胆管を有する該第一及び第二培養物の各々の第二分画の2つの分画に分離し、かつ下記段階を含む:(i)候補化合物を、該第一及び第二培養物の各々の第一分画、並びに該第一及び第二培養物の各々の第二分画に、該候補化合物の取り込みに十分な時間(T)曝露し;(ii)該第一及び第二培養物の各々の第一及び第二分画を洗浄し、かつ溶解すること;(iii)段階(ii)の該第一及び第二培養物の各々の各分画から得られた溶解産物の中に存在する、該候補化合物の量を測定すること;(iv)該毛細胆管内の質量を、無処置の毛細胆管を有する該第一及び第二培養物の第一分画、並びに破壊した毛細胆管を有する第一及び第二培養物の第二分画からの溶解産物の中に存在する候補化合物の量の差として計算すること;及び(v)段階(iv)で計算された質量を用いて、該輸送タンパク質による胆汁中排泄への感受性に対する候補化合物を評価することである。
【0013】
別の実施態様において、肝実質細胞中のタンパク質発現の阻害方法を提供する。該方法は、タンパク質を発現する肝実質細胞を提供すること、及びオリゴヌクレオチドを、該タンパク質の発現阻害に十分な量で、該肝実質細胞内に導入することを含み、ここで、該オリゴヌクレオチドは、該タンパク質をコード化している遺伝子のコード鎖に相当するヌクレオチド配列を含む。
従って、本開示主題の目的は、胆汁中排泄への感受性に対する候補化合物の迅速なスクリーニング方法を提供することである。
【0014】
本開示主題のさらなる目的は、インビボにおいて、胆汁中排泄への感受性に対する候補化合物のスクリーニング方法を提供することである。
また、本開示主題のさらなる目的は、1つの試みにおいて、多くの候補化合物のスクリーニングを容易にする、胆汁中排泄への感受性に対する候補化合物のスクリーニング方法を提供することである。
また、本開示主題のさらなる目的は、胆汁中排泄への感受性に対する候補化合物のハイスループットなスクリーニング方法を提供することである。
【0015】
さらにまた、本開示主題のさらなる目的は、肝実質細胞中の1以上の特定タンパク質の発現を選択的に抑制する方法を提供し、例えば、薬剤の取り込みに関与する肝臓タンパク質の同定など、これらの機能分析、並びに他のタンパク質、及び分子との相互作用を含む、これらのタンパク質の研究を容易にする。
これらの目的、及び他の目的は、本開示主題により、全体的に、又は部分的に達成される。本開示主題の目的の幾つかは、本明細書中の上記に記載されている。他の目的は、本明細書中の下記に示した最も良い、添付の実験室内実施例、及び図面と関連して、説明が進むにつれて明らかになるであろう。
【発明を実施するための最良の形態】
【0016】
(配列表の簡単な説明)
配列番号:1は、ラットMrp2のポリヌクレオチド配列である。
配列番号:2は、ラットMrp3のポリヌクレオチド配列である。
配列番号:3は、ラットMrp2のコード鎖の短い分節に相当するsiRNAのポリヌクレオチド配列である。本明細書中では、siMRP2AB1と呼ぶ。
配列番号:4は、ラットMrp2のコード鎖の短い分節に相当するsiRNAのポリヌクレオチド配列である。本明細書中では、siMRP2AB2と呼ぶ。
配列番号:5は、ラットMrp2のコード鎖の短い分節に相当するsiRNAのポリヌクレオチド配列である。本明細書中では、siMRP2AB3と呼ぶ。
配列番号:6は、ラットMrp3のコード鎖の短い分節に相当するsiRNAのポリヌクレオチド配列である。本明細書中では、siMRP3と呼ぶ。
配列番号:7は、ホタル(フォチナス ピラリス(Photinus pyralis))ルシフェラーゼ(siFL)のコード鎖の短い分節に相当するsiRNAのポリヌクレオチド配列である。
【0017】
(詳細な説明)
本開示主題に従って、胆汁中排泄への感受性に対する候補化合物、又は基質のスクリーニング方法を提供する。該方法は、培養物中の複数の肝実質細胞を提供すること、ここで、該培養物は、小管スペースを有する少なくとも1つの毛細胆管を含み、かつ該肝実質細胞の少なくとも1つは、輸送タンパク質を含み;該培養物に候補化合物を曝露すること;及び該少なくとも1つの毛細胆管の小管スペース内の該候補化合物の量を決定することを含み、該少なくとも1つの毛細胆管の小管スペース内の該候補化合物の量は、該輸送タンパク質による胆汁中排泄に対する候補化合物の感受性を示している。
【0018】
当業者に明らかなように、インビボにおいて、基質の胆汁中排泄は、洞様血管膜を横切るトランスロケーション、細胞質を通り抜ける移動、及び小管膜を横切る輸送を伴う。従って、本開示の好ましい肝実質細胞培養物において、インビボにおける肝実質細胞により示される機能特性を証明する。例えば、類洞又は小管の輸送系、或いは、洞様血管及び小管、双方の輸送系などの肝臓輸送系の確立が、本発明に従って、特に意図される。典型的な輸送タンパク質系は、下記のものを含むが、これらに制限されない:NTCP、OATPイソ型(OATP1A2、OATP1B1、OATP1B3、及びOATP2B1を含むが、これらに制限されない。)、OATイソ型(OAT2、及びOAT4を含むが、これらに制限されない。)、OCTイソ型(OCT1、及びOCT3を含むが、これらに制限されない。)、BSEP、MRPイソ型(MRP1、MRP2(配列番号:1のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP3(配列番号:2のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP4、MRP5、MRP6、MRP7、MRP8、及びMRP9を含むが、これらに制限されない。)、MDRイソ型(MDR1、MDR2、及びMDR3を含むが、これらに制限されない。)、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せである。
【0019】
ヒトタンパク質に対する、一般に受け入れられているタンパク質名の用語は、全て大文字で記載されることが要求される。一方、他の生物体のタンパク質は、通常、最初の文字のみ大文字で書かれたタンパク質名で記載される。しかし、便宜上、ヒトタンパク質、及び他の種からのタンパク質、双方を参照する場合、本明細書中に開示したタンパク質名は、時々、全て大文字で記載する。本明細書中に開示した全てのタンパク質は、大文字型にかかわらず、他に特定することのない限り、全ての種を含むことが意図される。
【0020】
さらに、また、肝実質細胞培養物中の少なくとも1つの毛細胆管の確立、及び正常な肝実質細胞形態の確立を、本開示に従って提供する。好ましくは、該培養物は、複数の毛細胆管を含む。さらに好ましくは、複数の毛細胆管は、小管網を含む。下記で詳細に論じる、該少なくとも1つの毛細胆管の小管スペース内の候補化合物の量は、胆汁中排泄に対する該候補化合物の感受性を示す。
下記用語は、当業者に十分に理解されると考えられるが、下記規定は、本開示主題の説明を容易にするために説明される。
【0021】
用語"候補化合物"、又は"候補基質"は、胆汁中排泄に対する化合物の感受性の特徴付けが望ましい、全ての化合物を意味する。典型的な候補化合物、又は基質は、薬剤及び他の治療薬などの生体異物、発癌性物質、及び環境汚染物質、並びに、ステロイド、脂肪酸、及びプロスタグランジンなどの生物体内生物質を含む。
本明細書中に開示した主題の方法に従って、候補薬剤、及び他の治療薬は、温血脊椎動物の治療に有用であることが意図される。従って、本明細書中に開示した主題は、哺乳動物、及び鳥類に関わる。
【0022】
意図されるものは、ヒトなどの哺乳動物、並びに絶滅の危機のある重要な哺乳動物(シベリア虎など)、ヒトにとって経済的に重要な動物(ヒトによって消費される農園で飼育される動物)、及び/又は社会的に重要な動物(ペットとして、又は動物園で保護される動物)、例えば、ヒト以外の食肉動物(猫、及び犬など)、豚(豚、雄豚、野豚)、反芻動物(畜牛、雄牛、羊、キリン、鹿、山羊、バイソン、ラクダなど)、及び馬などの治療である。また、意図されるものは、動物園に保護された絶滅の危機のある鳥、並びに、家禽、さらに詳細には家畜化した家禽、すなわち、七面鳥、鶏、カモ、ガチョウ、ホロホロ鳥(guinea fowl)等の家禽の種類の鳥の治療を含む、鳥の治療であり、それらはまた、全てヒトにとって経済的に重要である。従って、意図されるものは、家畜化した豚(豚、及び雄豚)、反芻動物、馬、家禽等を含むがこれらに限定されない家畜の治療を含む。
【0023】
用語"胆汁中排泄"は、肝実質細胞(肝細胞)による吸収、及び該毛細胆管を介する胆汁中の排泄により、基質が動物の循環系から除去される生物学的プロセスを意味する。該肝実質細胞内への取り込みは、下記のものを含む、肝実質細胞に内在する輸送系により仲介される:NTCP、OATPイソ型(OATP1A2、OATP1B1、OATP1B3、及びOATP2B1を含むが、これらに制限されない。)、OATイソ型(OAT2、及びOAT4を含むが、これらに制限されない。)、OCTイソ型(OCT1、及びOCT3を含むが、これらに制限されない。)、BSEP、MRPイソ型(MRP1、MRP2(配列番号:1のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP3(配列番号:2のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP4、MRP5、MRP6、MRP7、MRP8、及びMRP9を含むが、これらに制限されない。)、MDRイソ型(MDR1、MDR2、及びMDR3を含むが、これらに制限されない。)、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せである。毛細胆管は、排泄される成分を該肝実質細胞から受け取り、かつ該胆汁を、動物からの除去のために胆管に輸送する、肝組織内の構造体である。
【0024】
本明細書中、及び請求項中に使用される句"候補化合物の量"、及び/又は句"少なくとも1つの毛細胆管中の候補化合物の量を決定すること"は、本開示のアッセイに従って、肝実質細胞により吸収され、かつ少なくとも1つの毛細胆管内に排泄される候補化合物の任意量を意味する。例えば、"量"は、本主題に従って候補化合物を培養物に曝露後、少なくとも1つの毛細胆管中に存在する候補化合物が実質的にないことを意味し得る。また、"量"は、本主題に従って候補化合物を培養物に曝露後、少なくとも1つの毛細胆管中に実質的に存在する、全ての候補化合物を意味し得る。従って、句"少なくとも1つの毛細胆管中の候補化合物の量"は、高度に排泄されず、大量に排泄され、かつ大量にかつ迅速に排泄される候補化合物を示すように使用される。
【0025】
また、句"少なくとも1つの毛細胆管中の候補化合物の量を決定すること"は、胆汁中排泄指数計算、及び胆汁クリアランス計算の使用を引用することを意味する。また、句"少なくとも1つの毛細胆管中の候補化合物の量を決定すること"は、以下に記載されている本開示アッセイのハイスループットの実施態様に記載されているように、少なくとも1つの毛細胆管中への候補化合物の取り込みによる、マーカー化合物の減少量の検出を意味し得る。従って、"少なくとも1つの毛細胆管中の候補化合物の量"の定量的、及び定性的測定は、本開示主題の範囲内であることが意図される。
【0026】
また、句"候補化合物の量"、及び/又は句"少なくとも1つの毛細胆管中の候補化合物の量を決定すること"は、例えば、候補化合物類、又は一連の候補化合物をスクリーニングし、かつ続いて、該類、又は一連のもののうちの該候補化合物の胆汁中排泄への感受性の順位付けを確立することを意味する。従って、該候補化合物、或いは前記順位付けにより、排泄に対して小さいか又は低い感受性が観測される化合物が、治療薬としてのさらなる実験、又は開発に選択され得ることは、本主題の好ましい実施態様に従って意図される。一方、前記順位付けにより、排泄に対して高いか又は大きい感受性が観測される化合物は、治療薬としてのさらなる実験、又は開発から除外され得る。
【0027】
しかし、当業者に既に明らかであるように、化合物が胆汁中排泄に対して感受性があるという特性は、必ずしも、治療薬としての該化合物のさらなる開発を妨げるものではない。実際、治療薬としての特定の候補化合物の開発を進めるかどうかという決定は、限定されないが該候補化合物の生物活性を含む、多くの要因に基づく。胆汁中排泄への感受性は、重要な要因であるが、当業者に一般的に考慮される唯一の要因ではない。それゆえ、本発明の方法に従って、胆汁中排泄への感受性の特性は、治療薬としての候補化合物の開発を進めるか否かの評価において、当業者に使用されることが望ましいデータを提供する。
【0028】
本明細書中で使用されるように、句"二本鎖RNA"は、二本鎖を形成するワトソン-クリック塩基対合の少なくとも一部分のRNA分子を意味する。そのようなものとして、該用語は、完全な、又は部分的のみの二本鎖、どちらかのRNA分子を含むことが理解される。例証的な二本鎖RNAは、分子間ハイブリダイゼーションにより部分的に、又は完全に二本鎖である、少なくとも2つの異なったRNA鎖を包含した分子を含むが、これらに制限されない。さらに、該用語は、分子内ハイブリダイゼーションにより二本鎖領域を形成することができる(例えば、ヘアピン)、一本鎖RNA分子を包含する。従って、本明細書中で使用されるように、句"分子間ハイブリダイゼーション"、及び"分子内ハイブリダイゼーション"は、二本鎖形成に関与するヌクレオチドが、それぞれ、異なる分子、又は同一分子に存在する、二本鎖分子を意味する。
【0029】
本明細書中で使用されるように、句"二本鎖領域"は、ヌクレオチド間の水素結合を介した二本鎖構造内にある、核酸分子の任意領域を意味する。これは、当業者に理解されるように、シトシンとグアノシンとの間、アデノシンをチミジンとの間、アデノシンとウラシルとの間、及び任意の他の核酸二本鎖間の水素結合を含むが、これらに制限されない。該二本鎖領域の長さは、連続した15塩基対から数千塩基対まで、変化することができる。一実施態様において、該二本鎖領域は、少なくとも15塩基対であり、他の実施態様において、15〜50塩基対であり、さらに他の実施態様において、15〜30塩基対である。さらに他の実施態様において、該二本鎖領域の長さは、19、21、22、25、及び30塩基対からなる群から選択される。代表的な実施態様において、該二本鎖領域の長さは、19塩基対である。上記のように、該二本鎖領域の形成は、分子間ハイブリダイゼーション(すなわち、2以上の異なるRNA分子が関わる)か、又は分子内ハイブリダイゼーションを介して、相補的RNA鎖(例えば、センス鎖とアンチセンス鎖)のハイブリダイゼーションから生じる。後者は、一本鎖RNA分子が、同一RNA分子内で互いにハイブリダイズすることができる自己相補的領域を含む場合に生じ得る。通常、これらの自己相補的領域は、該分子内ハイブリダイゼーションにより、"ヘアピン"と呼ばれるものを形成するように、ヌクレオチドの短い範囲(例えば、約5〜10個のヌクレオチド)に分離される。
【0030】
本明細書中で使用されているように、用語"阻害する"、"抑制する"、"下方制御する"、"ノックダウンする"、及びこれらの文法的変化形は、同義的に使用され、かつ遺伝子発現、又は1以上の遺伝子産物をコードしているRNAのレベルを、本開示主題の核酸分子の欠如において観測されるもの以下に低下させる活性を意味する。一実施態様において、siRNA分子を用いた阻害は、標的RNAの安定状態レベルの低下をもたらす。他の実施態様において、siRNA分子を用いた阻害は、標的遺伝子の発現レベルが、RNAi応答を媒介することができない不活性化又は減弱化分子の存在下で観測されるレベル以下となる。他の実施態様において、本開示主題のsiRNA分子を用いた遺伝子発現の阻害は、それが欠如しているよりも、siRNA分子の存在下の方が大きい。また、他の実施態様において、遺伝子発現の阻害は、遺伝子によりコード化されているmRNAの分解(例えば、siRNAにより媒介されるRNAiにより)の促進速度と関連している。
【0031】
用語"標識化合物"、及び"ラベル化基質"は、同義的に使用され、かつ蛍光又は化学発光分光測光法、シンチレーション分光法、クロマトグラフィー、液体クロマトグラフィー/質量分析(LC/MS)、及び比色分析などの標準的な検出技術を用いて容易に検出することができる化合物を意味する。従って、例証的な標識化合物には、蛍光発生又は蛍光化合物、化学発光化合物、比色定量用化合物、UV/VIS吸収化合物、放射性核種、及びそれらの組合せがあるが、これらに制限されない。
【0032】
一般的に、本明細書中に記載した胆汁中排泄プロセスを通して、大量に吸収され、かつ排泄される治療的組成物は、対象に与える治療効果において微小変化を有する。従って、評価工程における初期の治療薬としてのさらなる評価から、好ましくない高感受性化合物の除外を容易にするために、肝実質細胞の取り込み、及び胆汁中排泄への化合物の感受性を、インビトロ試験で確立することが非常に望ましい。本開示の胆汁中排泄アッセイは、このような試験を提供する。
【0033】
本開示主題の方法の使用にとって、培養液中でのラット肝実質細胞が好ましい;しかし、当業者に明らかであるように、肝実質細胞の適切な供給源すべてが、本主題の範囲内にあることが意図される。例証的な供給源は、上記の温血脊椎動物である。特に、例証的な供給源は、ヒト、サル、類人猿、ネコ、イヌ、ブタ、雄ブタ、ウシ、雄ウシ、ヒツジ、ウマ、シチメンチョウ、ニワトリ、カモ、及びガンであるが、これらに制限されない。さらに、該肝実質細胞培養物は、純粋である必要はなく、むしろ、特定のアッセイに所望されるように、他の細胞種を含み得る。限定されない例において、該肝実質細胞培養物は、肝細胞の他の種をさらに含み得る。幾つかの実施態様において、他の肝細胞培養物は、肝実質細胞とともに、クップファー細胞を含む。
【0034】
本主題の胆汁中排泄アッセイ方法は、少なくとも1つの肝実質細胞層が、マトリックスの2つの層の間に形成された、肝実質細胞のサンドイッチ培養物を確立することを任意に含む。サンドイッチ培養物としての形態は、該培養物にとって好ましい形態であり、当業者に明らかであるように、適切な形態全てが、本開示の範囲内であることが意図される。例えば、少なくとも1つの毛細胆管が形成され、かつ肝実質細胞の機能特性が確立される、培養物中の肝実質細胞のクラスター、集合体、又は他の会合体又は郡は、本開示の範囲内にあることが意図される。好ましくは、該培養物形態は、複数の毛細胆管の形成を促進する。さらに好ましくは、該培養物形態は、小管網の形成を促進する。本明細書中で詳細に論じられているように、該毛細胆管の小管スペース中の候補化合物の量は、該候補化合物の胆汁中排泄への感受性を示す。
【0035】
加えて、好ましいサンドイッチ形態において、肝実質細胞は、マトリックスの2つの層、又は足場の間の単層中で培養される。しかし、また、該肝実質細胞は、該マトリックス内に埋め込まれ得るか、又は一次元、二次元、及び三次元の肝実質細胞集合体が形成されるように、該マトリックスを介して、垂直に、平行に、対角線上に、又はこれらの任意の組合せで、不均一に広がり得る。本開示に従って、該肝実質細胞培養物は、適切なマトリックスとともに、肝実質細胞を混合し、かつ該混合物を、マルチウェルプレートなどの適切な培養容器に入れることにより形成され得る。
【0036】
該肝実質細胞の培養物にとって、コラーゲンが、好ましい基質、又は足場であり、当業者に明らかであるように、天然、合成、又はそれらの組合せの適切な基質、又は足場が、本開示主題の範囲内であることが意図される。例えば、制限されないが、ラミニン、及びベッドフォード, マサチューセッツのCollaborative Biomedical Products社から登録商標MATRIGEL(登録商標)で売られている、生物学的細胞培養物基質を誘導化した基底膜を含む、他の生物学的基質は、適切な基質、又は足場材料であることが意図される。また、ポリマーなどの様々な材料から一般的に製造される合成マトリックス培地材料、基質材料、又は足場材料も、本主題の範囲内にあることが意図される。また、肝実質細胞の培養に使用される、特定のマトリックスに用いる成分材料の変形物も、本開示の方法に従って意図される。
【0037】
培養肝実質細胞を、"長時間培養物"として培養することが好ましい。"長時間培養物"は、少なくとも約12時間培養した肝実質細胞を意味する。さらに好ましくは、"長時間培養物"は、少なくとも約24時間、少なくとも約48時間、又は少なくとも約72時間培養した肝実質細胞を意味する。さらに好ましくは、"長時間培養物"は、少なくとも約96時間培養した肝実質細胞を意味する。さらに好ましくは、特にヒト肝実質細胞の培養物を用いて、約168〜240時間(すなわち、7〜10日間)培養した肝実質細胞を意味する。長時間培養は、毛細胆管の形成、及び該肝実質細胞内の機能特性の確立を促進する。
【0038】
用語"調節する"は、1以上のタンパク質、又はタンパク質サブユニットをコードしている遺伝子の発現レベル、或いはRNA分子、又は相当するRNA分子のレベルを変化させることを意味する。或いは、発現、レベル、又は活性が、モジュレータの非存在下で観測されるものよりも大きく、又は小さくなるように、1以上のタンパク質、又はタンパク質サブユニットの活性を、上方制御、又は下方制御する。例えば、用語"調節する"は、"阻害する"、又は"抑制する"を意味するが、語"調節する"の使用は、この定義に制限されない。
【0039】
用語"RNA"は、少なくとも1個のリボヌクレオチド残基を含む分子を意味する。"リボヌクレオチド"は、β-D-リボフラノース部位の2'位にヒドロキシル基を有するヌクレオチドを意味する。該用語は、二本鎖RNA、一本鎖RNA、二本鎖及び一本鎖領域、双方を有するRNA、部分的に精製したRNAなどの単離RNA、本質的に純粋なRNA、合成RNA、組換え技術により製造されたRNA、並びに1以上のヌクレオチドを追加、削除、置換、及び/又は変更した、自然発生的RNAとは異なる変化RNA、又は類似体RNAを包含する。前記変化は、siRNAの末端に、又は内部に、例えば、該RNAの1以上のヌクレオチドで、非ヌクレオチド物質の追加を含み得る。また、本開示主題のRNA分子のヌクレオチドは、非自然発生的ヌクレオチド、又は化学的に合成したヌクレオチド、又はデオキシヌクレオチドのような、非標準的なヌクレオチドを含む。これらの変化RNAは、類似体、又は自然発生的RNAの類似体と呼ばれ得る。
【0040】
用語"低分子干渉RNA"、"短干渉RNA"、"低分子ヘアピンRNA"、"siRNA"、及びshRNAは、同義的に使用され、かつRNA干渉、又は遺伝子サイレンシングを媒介することができる、全ての核酸分子を意味する。例えば、Bass, Nature 411:428-429, 2001; Elbashirらの論文, Nature 411:494-498, 2001a;及びPCT 国際公開番号WO 00/44895, WO 01/36646, WO 99/32619, WO 00/01846, WO 01/29058, WO 99/07409, 及びWO 00/44914を参照されたい。本開示主題のsiRNA分子の制限されない例を、配列番号:3、4、及び5に示す。一実施態様において、該siRNAは、相補的センス、及びアンチセンス領域を含む二本鎖ポリヌクレオチド分子を含み、該アンチセンス領域は、標的核酸分子の領域に対して相補的な配列を含む(例えば、Mrp2、又はMrp3をコードしているmRNA)。他の実施態様において、該siRNAは、自己相補的センス、及びアンチセンス領域を有する一本鎖ポリヌクレオチドを含み、該アンチセンス領域は、標的核酸分子の領域に対して相補的な配列を含む。他の実施態様において、該siRNAは、自己相補的センス、及びアンチセンス領域を含む1以上のループ構造、及び軸を有する一本鎖ポリヌクレオチドを含み、該アンチセンス領域は、標的核酸分子の領域に対して相補的な配列を含み、かつ該ポリヌクレオチドは、インビボ、又はインビトロで処理され、RNAiを媒介することができる活性siRNAを生じ得る。本明細書中で使用するように、siRNA分子は、RNAのみを含む分子に制限される必要はなく、さらに、化学的に改質したヌクレオチド、及び非ヌクレオチドをさらに含む。
【0041】
用語"輸送タンパク質"は、分子を、細胞(例えば、肝実質細胞)内に(タンパク質の取り込み)、及び細胞外に(タンパク質の流出)運搬する機能を有するポリペプチド、並びに、分子を細胞内に輸送(例えば、トランスロケーションタンパク質)、及び他の関連輸送活性を有するポリペプチドを意味する。
年来の特許法の慣習に続いて、用語"a"、及び"an"は、請求項を含む本出願中において使用される場合、"1以上"を意味する。
【0042】
(比較実施態様)
本開示主題の一実施態様に従って、複製肝実質細胞培養物、好ましくはサンドイッチ形態を確立した。第一培養物を、標準緩衝液に曝露し、かつ第二培養物を、Ca2+フリー緩衝液に曝露した。該Ca2+フリー緩衝液への曝露は、肝実質細胞の単層中の接着作用、又は接合部の複合体を破壊することにより、該毛細胆管を該肝実質細胞単層内に分離する。該Ca2+フリー緩衝液への曝露は、該接着作用、又は接合部の複合体を破壊する好ましい方法であり、該毛細胆管を実質的に分離する。一方、当業者に明らかなように、該接着作用、又は接合部の複合体を破壊し、該毛細胆管の実質的分離を促進するための、全ての適切な方法は、本開示の範囲内であることが意図される。例証的な技術は、制限されないが、細胞間の結合部位と相互作用するペプチドの該培養物への投与を含み、それによって隣接する細胞を結合から抑制する。
【0043】
次に、候補化合物、又は化合物を、各培養物に加える。該候補化合物は、Ca2+フリー緩衝液で処理された培養物中の毛細胆管内に保持され得ない。従って、この培養物中において、候補化合物は、肝実質細胞内に吸収され、かつ該肝実質細胞の細胞質内に保持され得る。しかし、該小管膜を横切って肝実質細胞により排泄される該候補化合物の任意量が、該緩衝液培地中に流出し、かつ該緩衝液培地が除去される時に、除去されるであろう。対照的に、該毛細胆管が無処置である該肝実質細胞サンドイッチ培養物に、候補化合物を投与する場合、該細胞により吸収され、かつ該細胞により排泄される任意の候補化合物は、該肝実質細胞の細胞質内、及び該毛細胆管内に維持される。
【0044】
次に、該無処置の毛細胆管内に存在する候補化合物の量を測定することが望ましい。該干渉培地を、該培養物から除去し、かつ該培養物を洗浄して溶解する。下記の実験室内実施例に記載されているように、該細胞の該培養物中への溶解を、該培養物を撹拌して合わせた適切な溶解緩衝液の添加により達成され得る。好ましい溶解緩衝液は、界面活性剤を含む。望ましい測定は、無処置の毛細胆管を有する培養物から得られた溶解物と比べて、(例えば、Ca2+フリー培地への曝露により)破壊した毛細胆管を有する培養物からの溶解物中に存在する候補基質の量を比較することにより得られる。2つの特定の計算が、該培養物の比較、及び該無処置の毛細胆管中に残存する候補化合物の量の決定に利用されている。上述したように、該無処置の毛細胆管中の候補化合物の量は、候補化合物の胆汁中排泄への感受性を示す。
【0045】
1つの計算は、胆汁中排泄指標として記載する。該候補化合物の取り込み、及び排泄の計算は、以下のものである:100%×{(無処置の毛細胆管を有する培養物中の取り込み−該Ca2+フリー培養物中のみの肝実質細胞内の取り込み)÷(無処置の毛細胆管を有する培養物中の取り込み)}。他の計算は、胆汁クリアランス計算である。以下のように行われる:(無処置の毛細胆管を有する培養物中の取り込み−該Ca2+フリー培養物中のみの肝実質細胞内の取り込み)÷(インキュベーション時間×該緩衝液培地中の候補化合物の濃度)。幾つかの実施態様において、胆汁クリアランス値は、培地中の毛細胆管の質量と曲線下面積(AUC)との比として計算され得る。該AUCは、時間0〜時間T(時間は、任意の所望単位で測定され得る。通常、分で測定される。)の該培地中の候補化合物の積分値(例えば、生体異物濃度)を示す。実際、用語AUGは、下記式を意味し得る。
【0046】
【数1−1】

この式は、Gibaldi及びPerrierにより、the Pharmacokinetics, 第二版(Marcel Dekker社 1982) (pp. 13-14)に説明されている。
【0047】
下記の実験室内実施例に記載されているように、本主題のインビトロアッセイと、胆汁中排泄に対する標準的インビボアッセイとの比較した時に、胆汁クリアランスが、排泄の正確で所望される評価を提供することが決定された。特に、インビトロ胆汁クリアランス計算は、(1)高度に排泄されず;(2)大量に排泄され;かつ(3)大量にかつ迅速に排泄される候補基質のうち、十分な相違があった。従って、該胆汁クリアランス計算の使用は、本開示主題の重要な態様を含む。
【0048】
幾つかの実施態様において、第一及び第二培養物は、肝摂取、及び胆汁クリアランス、又は排泄への感受性に対する候補化合物をスクリーニングする方法への使用に対して確立される。1つの培養物中の細胞は、発現する1以上の肝実質細胞輸送タンパク質から、少なくとも部分的に阻害される。上記に直接記載した手順は、一般的に理解され、かつ胆汁中排泄への感受性に関する決定は、阻害された肝実質細胞輸送タンパク質により、該候補化合物が、肝摂取、及び胆汁クリアランス、又は排泄へのその感受性に関して評価されることを除いて、前述のように決定される。
【0049】
幾つかの実施態様において、第一及び第二培養物の各々を、無処置の毛細胆管を有する該第一及び第二培養物の各々の第一分画、並びに破壊した毛細胆管を有する該第一及び第二培養物の各々の第二分画の2つの分画に分離し、かつ下記を含む:かつ(i)候補化合物を、該第一及び第二培養物の各々の第一分画、並びに該第一及び第二培養物の各々の第二分画に、該候補化合物の取り込みに十分な時間(T)曝露し;(ii)該第一及び第二培養物の各々の第一及び第二分画を洗浄し、かつ溶解すること;(iii)段階(ii)の該第一及び第二培養物の各々の各分画から得られた溶解産物の中に存在する、該候補化合物の量を測定すること;(iv)該毛細胆管内の質量を、無処置の毛細胆管を有する該第一及び第二培養物の第一分画、並びに破壊した毛細胆管を有する第一及び第二培養物の第二分画からの溶解産物の中に存在する候補化合物の量の差として計算すること;及び(v)段階(iv)で計算された質量を用いて、該輸送タンパク質による胆汁中排泄への感受性に対する候補化合物を評価することである。
【0050】
研究に受け入れられる典型的な輸送タンパク質は、下記のものを含むが、これらに制限されない:げっ歯類、又はヒトNTCP、OATPイソ型(OATP1A2、OATP1B1、OATP1B3、及びOATP2B1を含むが、これらに制限されない。)、OATイソ型(OAT2、及びOAT4を含むが、これらに制限されない。)、OCTイソ型(OCT1、及びOCT3を含むが、これらに制限されない。)、BSEP、MRPイソ型(MRP1、MRP2(配列番号:1のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP3(配列番号:2のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP4、MRP5、MRP6、MRP7、MRP8、及びMRP9を含むが、これらに制限されない。)、MDRイソ型(MDR1、MDR2、及びMDR3を含むが、これらに制限されない。)、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せである。
【0051】
幾つかの実施態様において、該肝実質細胞輸送タンパク質の発現を阻害することは、2つの培養物のうちの1つの培養物中の該肝実質細胞の少なくとも1つに、対象の該肝実質細胞輸送タンパク質の発現を少なくとも部分的に阻害するのに十分な量で(例えば、10%)、RNAを導入することを含む。RNAは、阻害される肝実質細胞輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含み得る。この方法は、短い二本鎖RNA分子の能力の利点があり、細胞の遺伝子の下方制御を生じ、処理は、RNA干渉と呼ばれ、かつ本明細書中に詳細に記載した。
【0052】
当業者は、対象の輸送タンパク質の発現阻害の別の手順を、容易に認識するであろう。そのようなこれらの手順は、同様に、本明細書中に開示された方法により包含される。例えば、モルホリノオリゴヌクレオチドを使用して、タンパク質の発現を過渡的に阻害することができる。本明細書中で使用されるように、"モルホリノオリゴヌクレオチド"は、リボ核酸、及びデオキシリボ核酸ポリヌクレオチドに結合可能な塩基を支持する骨格を有するポリマー分子を意味する。幾つかの実施態様において、該ポリマーは、ペントース糖骨格部位を欠き、かつさらに、ヌクレオチド、及びヌクレオシドの典型であるホスホジエステル結合により結合したリボース、又はデオキシリボース骨格を欠く。代わりに、該モルホリノオリゴヌクレオチドは、環窒素を通して結合を有する窒素を含む6員環を含む。モルホリノオリゴヌクレオチドは、最小の交差反応を有する、ヌクレアーゼ分解、塩濃度に無関係の標的配列へのハイブリダイズ、及び標的配列への高特異性に対して強い体制を示す。特性の再調査にとって、モルホリノオリゴヌクレオチドの特徴、及び応用は、Summerton & Weller, Antisense Nucleic Drug Dev 7: 187-95, 1997、及びSummerton, Biochim Biophys Acta 1489(1): 141-58, 1999を参照されたい。これらは、本明細書中に引用により、これらの全体において取り込まれている。
【0053】
(代謝産物アッセイの実施態様)
本開示の方法の肝実質細胞において、特定の代謝活性(相I(Phase I)活性と呼ばれる。)は、実質的に低下され得る。胆汁輸送の維持に加えて、代謝活性の実質的低下は、親候補化合物の胆汁中排泄、対、代謝産物、又は該親候補化合物の代謝産物の間で違いがあり得るという点で、本開示のインビトロ胆汁中排泄アッセイの利点を示す。この特徴は、本開示の重要な態様を含む。
【0054】
本明細書中に開示した代謝産物アッセイの好ましい実施態様に従って、該方法は、肝実質細胞の2つの培養物の第一セット、及び第二セットを、好ましくは、コラーゲンと、肝実質細胞の少なくとも1つの層内に形成された少なくとも1つの毛細胆管の2つの層との間にサンドイッチされた、肝実質細胞の少なくとも1つの層を含む各培養物を用いて確立することを含む。該培養物の第一セットは、無処置の毛細胆管を含み、かつ該培養物の第二セットは、破壊した毛細胆管を含む。
【0055】
次に、代謝酵素活性、及び/又は輸送系を、培養物の第一、及び第二セットの各々のうちの1つの該培養物の肝実質細胞内に、相I肝酵素活性を上方制御することが知られている誘導因子を用いて、技術的に認められる技術に従って誘発させる。その同じことに関連した例証的な誘導因子、及び技術は、Parkinson, A. (1996) Casarett、及びDoullの技術の生態異物の生体内変換(Parkinson, A. (1996) Biotransformation of 生体異物s in Casarett and Doull's Toxicology)に記載されている。毒物の基礎科学(The Basic Science of Poisons), 第5版. (Klaassen, C.D. ed.) pp. 113-186, McGraw Hill, New York, 及びLeCluyseらによる, (1996) 薬剤吸収、及び代謝モデルにおける培養ラット肝実質細胞(cultured rat hepatocytes, in Models for Assessing Drug Absorption and Metabolism)(Borchardtらの文献. eds) pp 121-160, Plenum Press, New York、各々の内容は、本明細書中に引用により取り込まれている。
【0056】
候補親化合物を、培養物の第一、及び第二セットに、該候補親化合物が取り込まれるのに十分な時間、曝露する。培養物の各セットを洗浄し、次に溶解する。不活性代謝酵素を有する培養物の各セット中の培養物から得られた溶解物に存在する候補親化合物の量を決定する。また、活性代謝酵素を有する培養物の各セット中の培養物から得られた溶解物に存在する候補親化合物の代謝産物の量を決定する。
【0057】
該培養溶解産物中の候補親化合物の量を用いて、不活性代謝酵素を有する該培養物の胆汁クリアランス値を計算する。次に、計算された胆汁クリアランス値を用いて、上述のように、胆汁中排泄への該候補親化合物の感受性を決定する。該培養溶解産物中の候補親化合物の代謝産物の量を用いて、活性代謝酵素を有する該培養物の胆汁クリアランス値を計算する。次に、計算された胆汁クリアランス値を用いて、上述のように、胆汁中排泄への該代謝産物の感受性を決定する。
【0058】
(ハイスループットアッセイの実施態様)
幾つかの実施態様において、本開示主題は、ハイスループット肝摂取、及び胆汁中排泄アッセイに関連するものである。前記アッセイは、好ましくは、上述のように、内生洞様血管又は小管の輸送系、洞様血管及び小管の輸送系の双方、又は代謝タンパク質系に対する基質である標識化合物と合わせた、培養肝実質細胞の使用を伴う。例証的な輸送系は、下記のものを含むが、これらに制限されない:げっ歯類、又はヒトNTCP、OATPイソ型(OATP1A2、OATP1B1、OATP1B3、及びOATP2B1を含むが、これらに制限されない。)、OATイソ型(OAT2、及びOAT4を含むが、これらに制限されない。)、OCTイソ型(OCT1、及びOCT3を含むが、これらに制限されない。)、BSEP、MRPイソ型(MRP1、MRP2(配列番号:1のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP3(配列番号:2のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP4、MRP5、MRP6、MRP7、MRP8、及びMRP9を含むが、これらに制限されない。)、MDRイソ型(MDR1、MDR2、及びMDR3を含むが、これらに制限されない。)、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せである。特に、候補化合物を、下記の実験室内実施例に記載した細胞培養物、及び化合物投与技術に従って、標識化合物とともに肝実質細胞培養物に投与する。
【0059】
次に、候補化合物と該標識化合物との間の取り込み、及び排泄の競合を評価する。すなわち、培養物中の毛細胆管内の標識化合物量の十分な投入(例えば、該標識化合物からのシグナルを、測定、又は検出)は、該候補化合物(該標識化合物と対比して)が、大量に吸収され、かつ排泄されることを示し得る。
次に、該候補化合物の肝摂取、及び胆汁中排泄への感受性の順位付けを確立する。従って、本開示主題のハイスループットアッセイの好ましい実施態様に従って、肝摂取、及び/又は胆汁中排泄への小さい又は低い感受性が前記順位付けにより観察される該候補化合物、又は化合物は、治療薬としてのさらなる実験、又は開発のために選択され得ることが意図され、一方、排泄への高い又は大きい感受性が前記順位付けにより観察される化合物は、治療薬としてのさらなる実験、又は開発から除外され得ることが意図される。
【0060】
例証的な標識化合物は、蛍光MRP2基質、カルボキシジクロロフルオレセインを含む。好ましくは、カルボキシジクロロフルオレセインジアセテートが、該肝実質細胞原形質膜内に迅速に浸透するために、蛍光発生前駆体として利用される。カルボキシジクロロフルオレセインジアセテートは、細胞内エステラーゼにより、肝実質細胞の細胞質中で迅速に高蛍光生成物カルボキシジクロロフルオレセインに加水分解される。これは、Haugland, 分子プローブ:蛍光プローブ、及び探索化学物質のハンドブック(Molecular Probes: Handbook of Fluorescent Probes and Research Chemicals) (1992-1994), p.134, Molecular Probes, Inc., 1992.に記載されている。
【0061】
カルボキシジクロロフルオレセインの蛍光は、pHに感受性があり、従って、アッセイの幾つかは、カルボキシジクロロフルオレセイン蛍光の強度に基づき、pHの効果を考慮すべきである。しかし、0.3 pH単位未満の相違が、肝実質細胞対の細胞質ゾルと毛細胆管との間に見られることが観察されている。カルボキシジクロロフルオレセインは、酸性オルガネラのpH決定に使用されているが、その蛍光強度は、pH 7.1〜pH 7.4の間で顕著な変化はない。pH 7.4でのカルボキシジクロロフルオレセインの蛍光は、pH 7.1でのそれよりも、最大蛍光波長で約10-20%だけ高い。従って、カルボキシジクロロフルオレセインの蛍光は、定性的プローブとして使用され、カルボキシジクロロフルオレセイン細胞分布を局在させるので、細胞質ゾルと小管との間のわずかなpH勾配は、本明細書中に開示した主題のハイスループットアッセイの適用に影響を与えない。
【0062】
さらなる標識化合物は、フルオレセインラベル化タウロコール酸、下記の本明細書中に示した実験室内実施例に記載されている、肝実質細胞により迅速かつ大量に吸収され、かつ該毛細胆管に排泄される胆汁酸;Boyer、及びSoroka, Gastroenterology 109:1600-1611 (1995); rhodamine 123に記載されているコリルグリシルアミド(cholylglycylamido)フルオレセイン、他の蛍光胆汁酸;P-gp;及びカルボキシフルオレセインジアセテート(CFDA)を含むが、これらに制限されない。
【0063】
本明細書中に開示した方法は、技術的に公知であるような、ICN Pharmaceuticals社(コスタメサ, カリフォルニア州)から利用可能な96ウェル、又は384ウェルマイクロタイタープレートなどの標準的マルチウェルアッセイプレート中で行われ得る。従って、肝摂取、及び/又は胆汁中排泄への感受性に対する複数の候補化合物を、マルチウェルプレートの複数のウェル内で同時にスクリーニングすることができる。
【0064】
幾つかの実施態様において、上記方法は、該候補化合物と該標識化合物、又はラベル化基質との競合が、より一般的に全ての胆汁輸送、及び排泄系に対してよりもむしろ、特定の輸送タンパク質による取り込み、及び排泄に対するように変更される。幾つかの実施態様において、該競合は、少なくとも1つの肝実質細胞輸送タンパク質が、少なくとも部分的に阻害された後に生じる。該ラベル化基質は、該輸送タンパク質による輸送に感受的であることが公知のものとして選択される。該ラベル化基質の該毛細胆管中の減少量は、輸送タンパク質による、該候補化合物の胆汁中排泄への感受性を示す。
【0065】
幾つかの実施態様において、該輸送タンパク質の阻害は、該輸送タンパク質の発現を阻害することにより提供される。該輸送タンパク質の発現阻害は、2つの培養物のうちの1つの培養物中の該肝実質細胞の少なくとも1つに、対象の該肝実質細胞輸送タンパク質の発現を少なくとも部分的に阻害するのに十分な量で(例えば、10%)、RNAを導入することを含む。該RNAは、阻害される肝実質細胞輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含み得る。この方法は、短い二本鎖RNA分子の能力の利点があり、細胞の遺伝子の下方制御を生じ、処理は、RNA干渉と呼ばれ、かつ本明細書中に詳細に記載した。
【0066】
他の実施態様において、特定のタンパク質の発現を阻害する別の技術を使用する。例えば、モルホリノオリゴヌクレオチドを、対象のタンパク質を発現する細胞に投与することができる。該モルホリノオリゴヌクレオチドは、対象のタンパク質に特異的に結合する。対象のタンパク質をコードしている核酸(例えば、mRNA)への該モルホリノポリヌクレオチドの結合は、該タンパク質の発現阻害を起こす。
【0067】
(RNA干渉を用いた肝実質細胞輸送タンパク質発現の阻害)
本開示主題は、短い二本鎖RNA分子の能力の利点があり、細胞の遺伝子の下方制御を生じ、処理は、RNA干渉と呼ばれる。本明細書中で使用されるように、"RNA干渉"(RNAi)は、低分子干渉RNA (siRNA)により媒介される、配列特異的な転写後遺伝子サイレンシングのプロセスを意味する。一般的なFireらの論文, Nature 391:806-811, 1998を参照されたい。転写後遺伝子サイレンシングのプロセスは、他の遺伝子の発現を抑制するように展開された、展開的に保存された細胞防御機序であると考えられれる(Fire, Trends Genet 15:358-363, 1999)。
【0068】
RNAiは、特定のウイルス(特に、該二本鎖RNAウイルス、又はライフサイクルが二本鎖RNA中間体を含むこれらのウイルス)による感染、或いは該二本鎖RNA種に対して、一本鎖RNA、又はウイルスゲノムRNAを特異的に低下させる宿主ゲノム内へのトランスポゾン成分のランダムな組込みから生じる二本鎖RNA (dsRNA)分子の製造に対して、細胞、及び生物体を保護するように展開し得る
【0069】
細胞内の長いdsRNAの存在は、リボヌクレアーゼIII酵素Dicerの活性を刺激する。Dicerは、dsRNAの分解を触媒し、低分子干渉RNAs (siRNA)と呼ばれる短い長さのdsRNAに変化させる(Bernsteinらの論文, Nature 409:363-366, 2001)。Dicerを媒介した分解から生じる該低分子干渉RNAは、一般に、約21-23 ヌクレオチド長さであり、約19塩基対二本鎖を含む。分解後に、該siRNAは、RNA誘導サイレンシング複合体(RISC)と呼ばれるエンドヌクレアーゼ複合体内に組込まれる。RISCは、細胞内に存在し、該siRNA二本鎖のアンチセンス鎖に相補的である一本鎖RNAの開裂を媒介することができる。Elbashirらに従って、該標的RNAの開裂は、該siRNAのアンチセンス鎖に相補的な一本鎖RNAの領域の中央付近で起こる(Elbashirらの論文, Genes Dev 15:188-200, 2001b)。
【0070】
RNAiは、幾つかの細胞種、及び生物体内に表されている。Fireら, 1998は、C.エレガンス(C. elegans)のRNAiを記載した。Wianny & Zernicka-Goetz, Nature Cell Biol 2:70-75, 1999は、マウス胚のdsRNAにより媒介されるRNAiを開示している。また、Hammondら, Nature 404:293-296, 2000は、ショウジョウバエ細胞のRNAiの誘導を、これらの細胞内にdsRNAをトランスフェクトすることにより可能にした。Elbashirら. Nature 411:494-498, 2001aは、合成21ヌクレオチドRNAの二本鎖の導入により、人胚腎臓、及びHeLa細胞を含む培養哺乳動物細胞中のRNAiの存在を示した。
【0071】
他の研究は、siRNA二本鎖の標的相補鎖の5'-リン酸が、siRNa活性を促進し、かつATPが、該siRNAの5'-リン酸部位の維持に利用されることを示している(Nykanenらの論文, Cell 107:309-321, 2001)。siRNA分子内に導入される場合に許容され得る他の改質は、糖‐リン酸骨格の改質、又は少なくとも1つの窒素又は硫黄へテロ原子を有するヌクレオシドの置換(PCT 国際公開番号WO 00/44914、及びWO 01/68836)、並びに二本鎖RNA依存タンパク質キナーゼ(PKR)、特異的2'-アミノ又は2'-O-メチルヌクレオチド、及び2'-O又は4'-Cメチレンの活性を阻害し得る特定のヌクレオチド架橋を含むヌクレオチド(カナダ特許出願第2,359,180号)を含む。
【0072】
dsRNA、及びRNAiの使用を開示している他の引例は、下記のものを含む:PCT国際公開番号WO 01/75164(ショウジョウバエの細胞を用いたインビトロRNAi系、及び特定の機能遺伝子及び特定の治療的応用のための特異的siRNA分子の使用);WO 01/36646(dsRNA分子を用いた、哺乳動物細胞の特定の遺伝子発現の阻害方法);WO 99/32619 (遺伝子発現阻害に使用するための、dsRNA分子の細胞内への導入方法);WO 01/92513(RNAiを向上させる因子を用いた、遺伝子抑制の媒介方法);WO 02/44321(合成siRNA構築体);WO 00/63364、及びWO 01/04313(ポリヌクレオチド配列の機能を阻害する方法、及び組成物);並びにWO 02/055692、及びWO 02/055693(RNAiを用いた遺伝子発現の阻害方法)である。
【0073】
幾つかの実施態様において、本開示主題は、対象の1以上の肝実質細胞タンパク質の発現を、少なくとも部分的に阻害するRNAiを利用する。好ましくは、正常の発現量の少なくとも約10%阻害である。幾つかの実施態様において、該方法は、RNAを、該肝実質細胞輸送タンパク質の発現阻害に十分な量で、前記複数の肝実質細胞の少なくとも1つに導入することを含み、ここで、該RNAは、肝実質細胞輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含む。幾つかの実施態様において、該肝実質細胞は、生物体、好ましくは、哺乳動物内に存在し、かつ該RNAは、該生物体内に導入される。制限されない例として、該遺伝子は、下記のものをコードし得る:ヒト、又はげっ歯類NTCP、OATPイソ型(OATP1A2、OATP1B1、OATP1B3、及びOATP2B1を含むが、これらに制限されない。)、OATイソ型(OAT2、及びOAT4を含むが、これらに制限されない。)、OCTイソ型(OCT1、及びOCT3を含むが、これらに制限されない。)、BSEP、MRPイソ型(MRP1、MRP2(配列番号:1のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP3(配列番号:2のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP4、MRP5、MRP6、MRP7、MRP8、及びMRP9を含むが、これらに制限されない。)、MDRイソ型(MDR1、MDR2、及びMDR3を含むが、これらに制限されない。)、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せである。
【0074】
該RNAは、該肝実質細胞輸送タンパク質をコードしている遺伝子のコード鎖に相当するリボヌクレオチド配列を含有した第一鎖、及び該第一鎖に相補的なリボヌクレオチド配列を含有した第二鎖を含む、二本鎖領域を有し得る。該第一鎖、及び第二鎖は、互いにハイブリダイズし、二本鎖分子を形成する。該二本鎖領域は、少なくとも15塩基対長さ、幾つかの実施態様において、15〜50塩基対長さであり得る。幾つかの実施態様において、該二本鎖領域は、15〜30塩基対長さである。
【0075】
幾つかの実施態様において、該RNAは、好ましくは、少なくとも19塩基にわたって相補的である、分子内自己ハイブリダイゼーションにより二本鎖領域を形成している一本鎖を含む。幾つかの実施態様において、該RNAは、少なくとも19塩基にわたって相補的である、分子間ハイブリダイゼーションにより二本鎖領域を形成している2つの別個の鎖を含む。例証的なRNAは、配列番号:3、4、及び5のうちの1つのヌクレオチド配列を有するものである。
【0076】
当業者は、全ての適切な一般的技術を使用して、該RNAを肝実質細胞内に導入することができることを認識するであろう。幾つかの実施態様において、該RNAをコードしているベクターを、前記複数の肝実質細胞の少なくとも1つに導入する。例えば、該RNAをコードしているベクターを、該肝実質細胞内にトランスフェクトすることができ、次に該RNAを、細胞ポリメラーゼにより転写する。
【0077】
幾つかの実施態様において、該RNAをコードしている核酸を含む組換えウイルスを製造することができる。次に、肝実質細胞内への該RNAの導入は、肝実質細胞を、該組換えアデノウイルスで感染させることを含む。肝実質細胞ポリメラーゼは、該肝実質細胞内のRNAの発現を生じるRNAを転写する。組換えウイルス技術は、当業者に公知である。当業者は、多くの因子が、本明細書中でさらに詳細に論じる必要のない本開示主題に使用される組換えウイルス製造の最適化に必要な適切なウイルス、及びベクター成分の選択に関与することを、容易に理解するであろう。1つの制限されない例として、組換えアデノウイルスは、siRNAをコードしているDNAを含むように処理され得る。該ウイルスは、肝実質細胞が、該組換えアデノウイルスにより感染され、該siRNAを転写し、かつ該感染肝実質細胞内に過渡的に発現され得るように、不完全な複製となるように処理され得る。組換えウイルス製造の詳細、及び使用は、米国特許出願第10/195,034号、及びPCT特許出願第US02/22010号で見ることができ、これらの全体において、本明細書中に引用により取り込まれている。或いは、例えば、pSILENCER ADENO 1.0-CMV SYSTEM(商標) (Ambion, オースチン, テキサス州, USA)のような、組換えウイルスを製造するための市販のキットを使用することができる。
【0078】
本開示主題は、単離siRNA分子をさらに含み、それは、特定の肝実質細胞輸送タンパク質の発現を阻害する。例証的な実施態様において、該肝実質細胞輸送タンパク質は、下記のものを含む:ヒト、又はげっ歯類NTCP、OATPイソ型(OATP1A2、OATP1B1、OATP1B3、及びOATP2B1を含むが、これらに制限されない。)、OATイソ型(OAT2、及びOAT4を含むが、これらに制限されない。)、OCTイソ型(OCT1、及びOCT3を含むが、これらに制限されない。)、BSEP、MRPイソ型(MRP1、MRP2(配列番号:1のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP3(配列番号:2のポリヌクレオチドによりコード化されている代表的な実施態様)、MRP4、MRP5、MRP6、MRP7、MRP8、及びMRP9を含むが、これらに制限されない。)、MDRイソ型(MDR1、MDR2、及びMDR3を含むが、これらに制限されない。)、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せである。
【0079】
該siRNA分子は、センス領域、及びアンチセンス領域を含むことができ、該アンチセンス領域は、該肝実質細胞輸送タンパク質をコードしているRNA配列に相補的な核酸配列を含み、かつ該センス領域は、該アンチセンス領域に相補的な核酸配列を含む。該siRNA分子は、該siRNA分子のセンス領域、及びアンチセンス領域から構築される。代表的な実施態様において、該センス領域は、配列番号:3、4、及び5のいずれか1つのヌクレオチドの部分列を、連続して19〜30個含み、かつ該アンチセンス領域は、該センス領域の逆相補体を含む。該センス領域、及び該アンチセンス領域は、好ましくは2〜8ヌクレオチド長さの3'-突出末端をさらに含み得る。該3'-突出末端ヌクレオチドは、1以上の化学的に改質されたヌクレオチドを含む。
【0080】
幾つかの実施態様において、該センス領域、及び該アンチセンス領域は、リンカー分子を介して、共有結合している。幾つかの実施態様において、該リンカー分子は、ポリヌクレオチドリンカーであり、例えば、5〜9個のヌクレオチドのポリヌクレオチドリンカーである。幾つかの実施態様において、該リンカー分子は、非ヌクレオチドリンカーである。また、siRNAを含むキャリアを提供する。代表的なキャリアは、例えば、水、生理食塩水、ブドウ糖、グリセロール、エタノールなど、及びこれらの組み合わせを含み。該キャリアは、湿潤剤、又は乳化剤、及びpH緩衝剤などの補助剤をさらに含み得る。
【0081】
下記実験室内実施例は、本発明の好ましい様式の説明を含んでいる。下記実験室内実施例の特定の態様は、本発明者らにより発見され、かつ考慮された技術、及び手順の条件で記載され、本発明の実施によく作用する。これらの実験室内実施例は、本発明者らの標準的な実験室内実施の使用を通して例示される。本会時、及び当業者の一般的水準の観点から、当業者は、下記実験室内実施例が、模範的なもののみであることが意図され、多くの変化、改質、及び変更が、本発明の精神、及び範囲から外れることなく使用されることを認識するであろう。
【実施例】
【0082】
(実験室内実施例)
下記実験室内実施例は、サンドイッチ‐培養ラット肝実質細胞(本発明の方法)、及びインビボにおけるラット(標準)の胆汁中排泄の相関の確立に関するものである。胆汁中排泄特徴の様々な範囲を表す5つのモデル基質を選択し、インビボにおけるラットと、本明細書中に開示した方法に従って、サンドイッチ‐培養肝実質細胞を用いたインビトロとで、胆汁に排泄される量の割合の関係を調べた。5つのモデル基質は、イヌリン、サリチル酸塩、メトトレキセート、[D-pen2,5] エンケファリン、及びタウロコール酸を含む。
【0083】
加えて、264W94、及びその代謝産物のインビボ、及びインビトロにおける胆汁中排泄の比較を、実施例4に示した。化合物2169W94は、ラット、及びヒトにおける、264W94のO-脱メチル化代謝産物であり、ウリンジン-5'-ジホスホフルクロニックアシッド(urindine-5'-diphosphoflucuronic acid)でさらに接合され、グルクロニド接合体を形成し得る。(Silverらの論文, ISSX Proceedings, (サンディエゴ, カリフォルニア州 USA) pp. 387, 1996)。化合物264W94、及び2169W94の構造式を、図9に示した。最後に、サンドイッチ‐培養ラット肝実質細胞(SCRH)における、MRP2、及びMRP3発現調節のためのsiRNAの使用を開示する。
【0084】
(実施例1−4に使用した物質、及び方法)
(化学物質)
[3H]タウロコール酸 (3.4 Ci/mmol; 純度 > 97%), -[14C]サリチル酸塩 (55.5 mCi/mmol; 純度 > 99%)、及び[3H][D-pen2,5] エンケファリン(36 Ci/mmol; 純度 > 97%0を、Dupont New England Nuclear (ボストン, マサチューセッツ州)から得た。[3H]メトトレキセート(13.7 Ci/mmol; 純度 > 99%)、及び[3H]イヌリン (1.3 Ci/mmol; 純度 97%)を、Amersham International plc (バッキンガムシア, イングランド)から得た。化合物[14C]264W94((3R, 5R)-3-ブチル-3-エチル-2,3,4,5-テトラヒドロ-7, 8-ジメトキシ-5-フェニル-1, 4-ベンゾチアゼピン-1, 1-ジオキシド; 45.5 mCi/mmol; 純度 > 99%)、及び[14C]2169W94 ((3R, 5R)-3-エチル-2,3,4,5-テトラヒドロ-7-メトキシ-8-ヒドロキシ-5-フェニル-1, 4-ベンゾチアゼピン-1, 1-ジオキシド; 43.7 mCi/mmol; 純度 > 99%)を、Glaxo Wellcome社(リサーチ・トライアングル・パーク, ノースカロライナ州)から得た。コラゲナーゼ (I型, 種類I)を、Worthington Biochemical社から得た(フリーホルド, ニュージャージー州)。ダルベッコ変法イーグル培地(Dulbecco's modified Eagles' medium (DMEM))、ウシ胎児血清、及びインスリンを、Gibco (グランドアイランド, ニューヨーク州)から得た。ラット‐尾コラーゲン (I型)を、Collaborative Biomedical Research (ベッドフォード, マサチューセッツ州)から得た。他の全ての化学物質、及び試薬は、分析等級であり、かつ商業的提供先から容易に利用可能である。
【0085】
(動物)
Charles River Laboratory (ローリー, ノースカロライナ州)の雄ウィスターラット(250-280 g)を、肝臓供与体として使用した。ラットを、ステンレス‐スチールかごに個々に収容し、研究を行う前に、12時間交互に、光、及び暗のサイクルを少なくとも1週間持続させ、使用まで、適宜に餌を与えた。胆管挿入ラット(200-250g)を、Charles River (ローリー, ノースカロライナ州))から得た。ノースカロライナ州の大学(チャペルヒル, チャペルヒル, ノースカロライナ州)の研究機関内の動物の管理および使用に関する委員会(The Institutional Animal Care and Use Committee)は、全ての手順を認可した。
【0086】
(培養皿の調製)
プラスチック培養皿 (60 mm)を、該肝実質細胞培養物を調製する前に、少なくとも1日、ラット‐尾コラーゲンでプレコートした。ゲル化コラーゲン基体を得るために、氷冷中和化コラーゲン溶液(0.1 ml, 1.5 mg/ml, pH 7.4)を、各培養皿上に分散させた。新しいコート化皿を、37℃の加湿インキュベーター内に約1時間置いて、該マトリックス材料をゲル化し、続いて3 mlのDMEMを各皿に加え、かつ加湿インキュベーター内に保存した。
【0087】
(ラット肝実質細胞の培養物)
肝実質細胞を、2段階の灌流方法で単離した。簡潔に言うと、ラットを、門脈挿入前に、ケタミン、及びキシラジン(それぞれ、60、及び12mg/kg i.p.)を用いて麻酔した。該肝臓を、インサイツで、コラゲナーゼI型(0.5 mg/ml)を含む酸素添加Ca2+フリーのクレープス-ヘンゼライト重炭酸緩衝液を用いて10分間灌流した。該肝臓被膜を、ピンセットで除去した。該肝臓を100 mlのDMEM中で穏やかに振盪させることにより、該肝実質細胞を放出させた。
【0088】
該放出細胞を、無菌ナイロンメッシュ(70-μm)を通して濾過した。該肝実質細胞懸濁液を、50xgで3分間延伸した。該細胞ペレットを、25 mlのDMEM、及び等量の、ピスカタウェイ, ニュージャージー州のPharmacia社で登録商標PERCOLLとして売られている、90%の等張性ポリビニルピロリドン‐コート化シリカコロイド遠心培地(pH 7.4) を用いて再懸濁化した。得られた細胞懸濁液を、約70〜150xgで、5分間遠心した。該ペレットを、50 mlのDMEMで再懸濁化し、かつ該細胞懸濁液を、50xgで3分間の遠心により、1つのチューブ内に混ぜ合わせた。肝実質細胞生存度を、トリパンブルー除外により決定した。90%よりも大きい生存度を有する肝実質細胞調製物を、さらなる研究に利用した。
【0089】
肝実質細胞懸濁液を、5% ウシ胎仔血清、1 μMデキサメタゾン、及び4 mg/L インスリンを含むDMEMを用いて調製した。肝実質細胞懸濁液を、約2-3 x 106 細胞/60-mm皿の密度で、プレコート化皿に加えた。該細胞のプレーティング後約1時間、該培地を吸引し、かつ3-mlの新しいDMEMを加えた。輸送研究のために、コラーゲンを被せずに3〜5時間播種した肝実質細胞を、3時間、又は短時間の培養肝実質細胞と規定した。
【0090】
サンドイッチ‐培養肝実質細胞を調製するために、該細胞の播種24時間後に、中和化コラーゲン溶液(0.1 ml, 約1.5〜約3.0 mg/ml, pH 7.4)を、該単層に加えた。コラーゲン被覆を有する培養物を、加湿インキュベーター中、37℃で45分間インキュベートして、DMEM添加前に該コラーゲンをゲル化させた。該細胞を播種した後、第4日目まで、培地を毎日変えた。これらの肝実質細胞を、96時間、又は長時間培養肝実質細胞と呼ぶ。
【0091】
(サンドイッチ‐培養肝実質細胞中の累積取り込み研究)
コラーゲン‐サンドイッチ形態中で培養した肝実質細胞を、3 mlの標準緩衝液、又はCa2+フリー緩衝液中、37℃で10分間インキュベートした。該インキュベーション緩衝液の除去後に、各皿に、基質を含む3 mlの標準緩衝液を添加して取り込みを開始した。指定時間のインキュベート後に、該インキュベーション溶液を吸引し、かつ3 mlの氷冷標準緩衝液で4回洗浄して細胞外基質を除去することにより、累積取り込みを終了させた。洗浄後、培養皿に、2 mlの1%トリトンX-100溶液を加え、かつ該皿を室温で20分間、振盪器で振盪させることにより、該細胞を溶解した。溶解物の一定分量(1 ml)を、液体シンチレーション分光測定により分析した。Bio-Rad DCタンパク質アッセイキット(Bio-Rad Laboratories, ハーキュリーズ, カリフォルニア州)を使用し、標準としてウシ血清アルブミンを用いて、該培養抽出物中の該タンパク質濃度を決定した。トリトン X-100 (1%)は、該アッセイに干渉しなかった。前述した細胞非存在下の適切なコントロール皿において決定された基質取り込みを減算することにより、細胞単層内への基質取り込みに対する全ての値を、該コラーゲンへの非特異的結合に対して補正した。
【0092】
(264W94の静脈内投与、及び2169W94の経口投与後のラットにおける胆汁中排泄)
[14C]264W94を、濃度0.125 mg/mLで、無菌水/ポリプロピレングリコール400/エタノール(2:1:1 v/v/v)の混合液中の溶液として製剤した。前投与量胆汁の回収後に、[14C]264W94溶液を、尾静脈注射により投与した(0.1 mg/kg)。2169W94研究のために、[14C]2169W94を、水中の0.5% (w/v)メチルセルロースの0.1 mg/mLの濃度で、懸濁液として調製した。前投与量胆汁の回収の後に、[14C]2169W94懸濁液を、胃管栄養法(1.0 mg/kg)により投与した。全てのラットを、個々のプラスチック代謝かご内に置き、該ラットの動きを自由にさせた。胆汁を、氷に囲まれたポリプロピレン溶液内に回収した。該264W94研究のために、該胆汁容器を、該投与量後8、及び24時間で変えた。以前の研究は、試料が、氷上で24時間安定であることを示している。分析まで、胆汁試料を-20℃で保存した。
【0093】
(分析手順)
264W94、又は2169W94を含む、細胞溶解物、又は胆汁試料の一定分量を。2倍量の氷冷アセトニトリルと混合し、遠心して、沈殿タンパク質を除去した。該上清を、室温で窒素下で留去し、かつ50 mM 酢酸アンモニウム/アセトニトリル/トリフルオロ酢酸(95:5:0.1 v:v:v)とアセトニトリルとの70/30混合液100μL中で再構成した。該試料抽出液を、WATERS(商標)SYMMETRYTM C18カラム(3.9 x 150 mm)に注入し、かつ50 mM 酢酸アンモニウム(pH 4.0)とアセトニトリルとの85/15混合液で溶離した;該アセトニトリルの割合は、WATERS(商標)600E System Controllerにより、20分の時間で55%に、続いて、次の10分間で100%に増加させた。
【0094】
該HPLCから溶離した放射性炭素を、オンライン放射活性検出器 (RADIOMATIC FLO-ONE/BETA(商標)Radio-Chromatography Detector Series 500 TR Series, Packard Instrument Co.)を用いて定量した。精製標準化合物と比較して、264W94、2169W94、及び2169W94グルクロニドのピークを同定した。これらの条件下で、これらの3つの成分の基線分類を達成した。各ピークにおいて、該溶離放射活性を、全注入放射活性に対して規格化することにより、該3つの成分の濃度を決定した。
【0095】
(データ分析)
取り込みデータを、該タンパク質含有量に対して規格化し、かつ肝実質細胞の3〜4回の別々の調製からの平均SDとして表した。Ca2+の存在、及び非存在下での10分の累積基質取り込みの平均値間の統計的相違を、周知のスチューデントt検定の使用により決定した。P値<0.05は、有意であると考えられる。
インビボにおける胆汁クリアランス、ClB (ml/分/kg body weight)を、式1に従って計算した。
【数1−2】

式中、量胆汁(0-T)は、多くの薬剤が系統的循環から排除された場合の0〜時間Tの胆汁中に回収された親薬剤の量を表し、かつAUC0-Tは、血漿濃度‐時間曲線の0〜時間T(分)の領域を表す。
【0096】
胆汁中排泄が支配的排除過程であると仮定して、肝臓性質のよく活動しているモデルに基づく式2に従って、インビボにおける固有の胆汁クリアランス(ClBin, ml/分/kg体重)を概算した(Pangらの論文, J. Pharmacokinet. Biopharm. 5:625-653, 1977)。
【数2】

式中、Qは、ラット肝血漿/血液、40-70 ml/分/kg体重{(血流量 x (1-ヘマトクリット値)}を表し;Pollackらの論文, J. Pharmacol. Exp. Ther. 18:197-202, (1989)、かつClBは、論文に報告されているモデル化合物の胆汁クリアランス、又は式1から計算された胆汁クリアランスを表す。
【0097】
該単層中の基質の胆汁中排泄を、式3の胆汁中排泄指数により定量的に評価した。
【数3】

式中、取り込み標準、及び取り込みCa2+フリーは、それぞれ、標準緩衝液、及びCa2+フリー緩衝液において前インキュベートした該肝実質細胞単層中の10分間隔の基質の累積取り込みを表す。
【0098】
該サンドイッチ‐培養肝実質細胞の胆汁クリアランス、ClB(培養物) (ml/分/kg /体重)を、式4に従って計算した。
【数4】

式中、時間インキュベーションは10分であり、かつ濃度培地は、インキュベーション培地中の最初の基質の独活を表す。幾つかの実施態様において、胆汁クリアランス値は、培地中の毛細胆管の質量と曲線下面積 (AUC)との比として計算され得る。該AUCは、時間0〜時間T(時間は、任意の所望単位で測定され得る。通常、分で測定される。)の該培地中の候補化合物の積分値(例えば、生体異物濃度)を示す。実際、用語AUGは、下記式を意味し得る。
【0099】
【数5】

この式は、Gibaldi及びPerrierにより、the Pharmacokinetics, 第二版(Marcel Dekker社 1982) (pp. 13-14)に説明されている。全ての計算において、肝臓組織中のラット肝臓重量、及びタンパク質含有量を、それぞれ、体重の40 g/kg、及び肝臓重量の0.20 g/gと仮定した(Seglenらの論文, Methods in Cell Biology (第13版, Prescott D. M. Eds.) pp. 30-78, Academic Press, ニューヨーク, 1976)。
【0100】
(実施例の結果のまとめ)
本主題に従う長時間サンドイッチ‐培養肝実質細胞の5つのモデル基質の胆汁中排泄は、インビボにおける胆汁中排泄特徴と一致した。該胆汁中排泄指数計算を利用した、該培養肝実質細胞の胆汁中排泄の定量は、上記に記載した。簡潔に言うと、該胆汁中排泄指数は、該毛細胆管に保持された基質の割合を表す。実験室内実施例の結果は、胆汁中に排泄された投与量の割合に基づき、インビボにおける胆汁中排泄を無視することができる化合物(例えば、イヌリン, サリチル酸塩)が、低い胆汁中排泄指数(ほぼゼロ)を有することを示している。インビボにおいてさらに大量に排泄される化合物(例えば、メトトレキセート、[D-pen2,5]エンケファリン、及びタウロコール酸)は、高い胆汁中排泄指数(約50%)を有する。
【0101】
該胆汁中排泄指数とインビボにおける胆汁中に排泄される投与量の割合との関係は、全体的な相関を明らかにする。メトトレキセート、及び[D-pen2,5]エンケファリンは、胆汁中に"高度に"排泄される化合物を代表する(それぞれ、1時間で、静脈投与量の約60%、及び70%が回収される。)。対照的に、タウロコール酸は、静脈投与量のほぼ全てが、1時間未満で胆汁中に排泄されるので、"迅速かつ大量に"排泄される。従って、該胆汁中排泄指数は、大量対無視できるか又は低い胆汁中排泄となる化合物を識別することができる。
【0102】
しかし、該胆汁中排泄指数は、メトトレキセート(胆汁中排泄指数:約55%)、又は[D-pen2,5]エンケファリン(胆汁中排泄指数:約42%)などの胆汁中に高度に排泄される化合物と、タウロコール酸 (胆汁中排泄指数:約56%)などの胆汁中に"迅速かつ大量に"排泄される化合物とを識別することができなと思われる。該胆汁中排泄指数におけるこの限界は、この指数が、小管排泄機能により支配的に決定される事実のためであり得る。インビボにおいて、胆汁中に排泄される静脈投与基質の割合は、洞様血管取り込み活性、小管排泄活性、並びに他の競合排除過程により決定される。
【0103】
胆汁クリアランスは、インビボ、及びインビトロにおける胆汁中排泄の関係の比較にとって、さらに有効なパラメータを表す。該インビボにおける胆汁クリアランスは、時間Tで胆汁中に排泄される量と、時間0〜T間の血漿AUCの比として、実験室内実施例で計算した。ほとんどの投与量は、時間Tで排除されるため、該胆汁クリアランスは、時間0〜時間無限大で計算された胆汁クリアランスを概算している。この状況で計算された胆汁クリアランスは、固有の胆汁クリアランスの機能、および肝血漿/血流速度である。血漿流動作用の排除のために、固有の胆汁クリアランスを、肝臓性質の"よく活動している"モデルに基づいて計算した(Pang、及びRollanの論文, J. Pharmacokinet. Biopharm. 5:625-653, 1977)。同様に、インビボにおける胆汁クリアランスを、該肝実質細胞単層の小管網中に排泄される量とインキュベーション培地におけるAUCとの比として計算した。従って、幾つかの実施態様において、胆汁クリアランス値は、培地中の毛細胆管の質量と曲線下面積(AUC)との比として計算され得る。該AUCは、時間0〜時間T(時間は、任意の所望単位で測定され得る。通常、分で測定される。)の該培地中の候補化合物の積分値(例えば、生体異物濃度)を示す。実際、用語AUGは、下記式を意味し得る。
【0104】
【数6】

この式は、Gibaldi及びPerrierにより、the Pharmacokinetics, 第二版(Marcel Dekker社 1982) (pp. 13-14)に説明されている。
【0105】
該サンドイッチ‐培養肝実質細胞において、インキュベーション培地は、同時間での皿中の全ての肝実質細胞に利用しやすい。従って、インビトロにおいて計算された胆汁クリアランスは、固有の胆汁クリアランスを表すべきである。しかし、胆汁中排泄は2つの過程、該洞様血管膜を横切る取り込み、及び該小管膜を横切る排泄に関与するので、正確な固有胆汁クリアランスは、該小管膜を横切る輸送により決定され、かつ細胞内基質濃度に基づいて計算されるべきである。従って、実験室内実施例において計算された、インビボ、及びインビトロにおける"固有"のクリアランスは、"見かけ上の"固有の胆汁クリアランス値と呼ばれ得る。これは、該過程、洞様血管取り込み、又は小管取り込みにおける最も遅い段階により速度制限されるであろう。
【0106】
インビトロにおける胆汁クリアランスと、インビボにおける固有の胆汁クリアランスとの間の相関は、5つのモデル基質に対して高かった(r2=0.9865)。インビボにおける固有の胆汁クリアランスに従って、5つのモデル基質を、3つのグループに分類することができる:胆汁中に排泄されない化合物(イヌリン、及びサリチル酸塩;約0 ml/分/kg);胆汁中に高度の排泄される化合物(メトトレキセート、及び[D-pen2,5]エンケファリン, それぞれ、約17.3 ml/分/kg、及び約34.4 ml/分/kg);及び胆汁中に迅速かつ大量に排泄される化合物(タウロコール酸, 約116.9 ml/分/kg)である。インビトロにおいて概算された胆汁クリアランスは、化合物のこれらの3つのグループ(それぞれ、約0、4〜13、及び56 ml/分/kg)に適切に区別した。これらの結果は、該胆汁クリアランスが、インビボ、及びインビトロにおける胆汁中排泄間の関係を、該胆汁中排泄指数と比較してさらに正確に特徴付けしていることを示唆する。
【0107】
実施例5は、siRNA利用を記載し、第一肝実質細胞における薬剤輸送体機能を調節した。Mrp2 siRNA (siMrp2)を用いたSCRHの処置により、本質的に一時的なMrp2-不足モデルを製造した:小管Mrp2発現の抑制は、カルボキシジクロロフルオレセイン(CDF)の胆汁中排泄を大きく減少させた。しかし、CDFは、Mrp3の高発現レベルの維持のために、これらの細胞から効率的に排泄された。siMrp3-処置SCRHを用いて、一時的なMrp3-不足モデルを確立した。これは、一般に、インビボモデルでは利用できない。Mrp3ノックダウンは、胆汁中へのCDF 排泄の経路の向け直しを生じる。従って、siMrp3-処置SCRHの小管蛍光は、コントロール細胞中よりも高かった。SCRH のsiRNA処置による、全体的な薬剤輸送体の調節は、特に特異的阻害剤が利用できない場合に、薬剤輸送タンパク質の調節、及び機能の研究のために提供され、肝胆薬剤性質の決定において、薬剤輸送体の補完的な役割を解明し、かつ薬剤輸送体との特異的相互作用の効果を規定する。
【0108】
(実施例1)
(培養肝実質細胞中の累積取り込み)
イヌリンの累積取り込みは、短時間、又は長時間の全てのインキュベーション時間で無視できた(最初の加えられた基質の0.01%未満)(図1A、及び1B)。3時間培養肝実質細胞において、サリチル酸塩、メトトレキセート、及び[D-pen2.5]エンケファリンの累積取り込みは、標準緩衝液、及びCa2+フリー緩衝液において、有意な差異はなかった(図2A、3A、及び4A;p>0.05)。しかし、Ca2+フリー緩衝液と比較して、標準緩衝液中におけるタウロコール酸のわずかに高い累積取り込みが観察された(図5A);10分で、標準緩衝液中の累積取り込みは、Ca2+フリー緩衝液中よりも約10%高かった(p = 0.0352)。96時間培養肝実質細胞において、細胞外Ca2+は、サリチル酸塩の累積取り込みに効果がなかった(図2B, p > 0.05)。しかし、標準緩衝液中のメトトレキセート、[D-pen2.5]エンケファリン、及びタウロコール酸の取り込みは、Ca2+フリー緩衝液中よりもわずかに高かった(図3B、4B、及び5B;p<0.05)
【0109】
(実施例2)
(ラットの胆汁中に排泄される投与量の割合と、培養肝実質細胞の胆汁中排泄指数との間の関係)
5つのモデル基質を選択し、ラットのインビボにおいて、胆汁中に排泄投与量の割合と、サンドイッチ培養肝実質細胞の胆汁中排泄との間の関係を調べた。静脈投与後のラット胆汁中に排泄される投与量の割合に関する情報は、論文から得た。胆汁中へのイヌリン、及びサリチル酸塩分泌の程度は、無視できる(Erikssonらの論文, Acta. Physiol. Scand. 95:1-5, 1975; Laznicekandらの論文, Eur. J. Drug Met. Pharmacokinet. 19:21-26, 1994)。メトトレキセート投与量22 μmol/kgの約50〜60%(Bremnesらの論文, Cancer Res. 49:2460-2464, 1989; Masudaらの論文, Cancer Res. 57:3506-10, 1997)、及び[D-pen2,5]エンケファリン投与量14.5 μmol/kgの70%(Chenらの論文, Pharm. Res. 14:345-350, 1997)が、1時間で、無変化の薬剤としてラット胆汁中に排泄された。タウロコール酸の胆汁中排泄は、メトトレキセート、及び[D-pen2,5]エンケファリンよりも迅速かつ大量であった。1時間において、実質的に該投与量の100%が、ラット胆汁中に回収された(Inoueらの論文, Biochim. Biophys. Acta. 833:211-216, 1985)。
【0110】
該サンドイッチ‐内容肝実質細胞の胆汁中排泄は、図3B〜5Bの10分累積取り込みデータに基づき、式3からの該胆汁中排泄指数として定量的に表現され得る。イヌリン、及びサリチル酸塩の胆汁中排泄指数は、無視できるものと想定した。なぜならば、イヌリン、及びサリチル酸塩の累積取り込みにおいて、標準緩衝液とCa2+フリー緩衝液との間で、統計的な有意差がなかったためである(p > 0.05)。メトトレキセート、[D-pen2,5]エンケファリン、及びタウロコール酸の胆汁中排泄指数は、それぞれ、55.4±18.3%、42.4±6.5%、及び56.4±5.2%であった。インビボにおけるラットの胆汁中に排泄される投与量の割合と、インビトロ系において測定された胆汁中排泄指数との間の関係を、図6Aに示した。該胆汁中排泄指数は、インビボにおける無視できる胆汁中排泄となる化合物(例えば、イヌリン、及びサリチル酸塩)に対して、非常に低かった。対照的に、該胆汁中排泄指数は、インビボにおいて胆汁に排泄される化合物(例えば、メトトレキセート、[D-pen2,5]エンケファリン、及びタウロコール酸)に対して、中程度に高かった。
【0111】
(実施例3)
(インビボにおける胆汁クリアランスの相関)
イヌリン、サリチル酸塩、メトトレキセート、及びタウロコール酸のインビボにおける胆汁クリアランス(ml/分/kg 体重)は、それぞれ、0.035 (Uteschらの論文, Vitro Cell. Dev. Biol. 27A:858-863, 1991)、〜0 (Laznicekandらの論文, Eur. J. Drug Met. Pharmacokinet. 19:21-26, 1994)、12.1 (Masudaらの論文, Cancer Res. 57:3506-10, 1997)、及び29.8 (Inoueらの論文, Biochim. Biophys. Acta. 833:211-216, 1985)であった。 [D-pen2,5]エンケファリンのインビボにおける胆汁クリアランス18.5 ml/分/kgは、Chen、及びPollackにより報告されているデータから、式1に基づいて計算した(Chen、及びPollackの論文, Pharm. Res. 14:345-350, 1997)。これらのインビボにおける胆汁クリアランス値に基づいて、イヌリン、サリチル酸塩、メトトレキセート、[D-pen2,5]エンケファリン、及びタウロコール酸の固有のクリアランスを、式2から計算した(それぞれ、0.04、0. 17.3、34.4、及び116.9 ml/分/kg)。
【0112】
10分累積取り込みデータ(図1B〜5B)に基づいて式4から計算した、インビボにおけるイヌリン、サリチル酸塩、メトトレキセート、[D-pen2,5]エンケファリン、及びタウロコール酸の胆汁クリアランスは、それぞれ、〜0、 〜0、4.1±1.0、12.6±2.2、及び56.2±6.0 ml/分/kgであった。5つのモデル化合物にとって、インビボにおける固有の胆汁クリアランスは、インビトロにおける胆汁クリアランス(r2 = 0.9865)とよい相関があった(図6B)。
【0113】
(実施例4)
(インビボ、及びインビトロにおける、264W94、及びその代謝産物の胆汁中排泄の比較)
化合物264W94、及び2169W94の構造式を、図9に示した。化合物2169W94は、ラット、及びヒトにおける、264W94のO-脱メチル化代謝産物であり、ウリンジン-5'-ジホスホフルクロニックアシッド(urindine-5'-diphosphoflucuronic acid)でさらに接合され、グルクロニド接合体を形成し得る。(Silverらの論文, ISSX Proceedings, (サンディエゴ, カリフォルニア州 USA) pp. 387, 1996)。
【0114】
[14C]264W94のラットへの静脈内投与(0.24 μmol/kg)後、24時間で、264W94も2169W94も検出されなかった。しかし、全投与放射活性の35.4% (n=2)が、第一の時間で胆汁中に回収された。胆汁中に回収された放射活性の約30.0%は、2169W94グルクロニドであった;胆汁中の放射活性の残り70%は、未同定の代謝産物を示した。[14C]264W94のラットへの経口投与(2.4 μmol/kg)後、24時間で、2169W94は、該胆汁中に検出されなかった。しかし、全投与放射活性の66.4% (n=2)が、8時間で胆汁中に回収された。胆汁中の放射活性の約88.7%は、2169W94グルクロニド接合体の形態であった。これらのインビボにおける結果は、264W94、及びそのO-脱メチル化産物2169W94が、無視できる胆汁中排泄であるが、2169W94のグルクロニド接合体が、ラットにおける大量の胆汁中排泄となることを示している。
【0115】
3時間、及び96時間の培養肝実質細胞における、264W94、及び代謝産物の胆汁中排泄を決定するために、肝実質細胞単層を、3 μMの[14C]264W94、又は[14C]2169W94を含む標準緩衝液中で累積取り込みを行う前に、標準、又はCa2+フリー緩衝液中でインキュベートした(図7、および8)。3時間の培養肝実質細胞において、264W94、又は2169W94の全放射活性により測定された累積取り込みは、標準緩衝液、又はCa2+フリー緩衝液中で前インキュベートした肝実質細胞と類似していた(p > 0.05)。これは、短時間の培養肝実質細胞での264W94、及び2169W94の取り込みが、Ca2+フリー緩衝液中の該単層の前インキュベーションに影響されないことを示唆している。96時間の培養肝実質細胞において、全放射活性により測定された264W94の10分累積取り込みは、標準緩衝液、又はCa2+フリー緩衝液中で前インキュベートした単層に有意な差がなかった(p > 0.05)。
【0116】
10分での該細胞溶解物のHPLC分析は、全放射活性の73.0%が、264W94の形態であり、かつ3.3%が、2169W94 グルクロニド接合体であることを示した;2169W94は、該溶解物中に検出されなかった。96時間のサンドイッチ培養肝実質細胞において、2169W94の10分取り込みは、Ca2+の非存在下よりも、Ca2+の存在下で約70%大きかった。該10分の細胞溶解物において、全放射活性の約16.7%は、2169W94の形態であり、かつ約58.5が、グルクロニド接合体であった。化合物2169W94は、グルクロニド接合体を形成し、長時間の培養肝実質細胞において胆汁小管網中に排泄される。
【0117】
本開示主題のインビボにおける胆汁中排泄アッセイの利用をさらに特徴付け、インビボにおける薬剤代謝産物の胆汁中排泄を予測するために、インビトロ、及びインビボにおける264W94、及びそのO-脱メチル化代謝産物269W694、及び2169W94 グルクロニドの胆汁中排泄を調べた。以前のラット及びヒト肝臓ミクロソーム、正確に切断した肝臓切片、及びcDNAで行ったインビトロ研究は、264W94が、8-メトキシ位置でO-脱メチル化された代謝産物を形成することを示した。試験された幾つかのシトクロムp450アイソザイムの間で、CYP3A4が、264W94の代謝に最初に関与するアイソザイムであった(Silverらの論文, ISSX Proceedings (San Diego, カリフォルニア州 USA) p. 387, 1996)。
【0118】
インビボにおける性質研究は、264W94も、そのO-脱メチル化代謝産物2169W94も、胆汁中に排出されないことを示した。しかし、2169W94グルクロニド接合体が、他の未同定の代謝産物とともに、胆汁中に大量に排出された。長時間のサンドイッチ‐培養肝実質細胞における264W94の胆汁中排泄の欠如は、264W94の無視できるインビボの胆汁中排泄と一致している。
【0119】
インビボにおいて、264W94等量の約35%が、264W94の静脈内投与後1時間で、代謝産物として胆汁中に排泄される。しかし、培養肝実質細胞において、264W94 代謝産物の胆汁中排泄は、無視できる(図7B)。264W94の代謝産物にとって、インビボ、及びインビトロにおける胆汁中排泄のこの明らかな相違は、代謝活性の相違により、説明され得る。インビボにおいて、264W94は、O-脱メチル化され、2169W94を形成し;かつ次に、2169W94は、ウリジン-5'-ジホスホグルクロニックアシッドと接合し、2169W94 グルクロニドを形成する。このグルクロニド接合体は、胆汁中に排泄される全量の30%を占める。264W94とともにインキュベートした、長時間のサンドイッチ‐培養肝実質細胞の溶解物において、インキュベートした全量の約3%のみが、2169W94 グルクロニド接合体として検出された。これらの結果は、長時間の培養肝実質細胞が、O-脱メチル化反応できないことを示している。従って、無視できるグルクロニド接合体が形成され、かつ該胆汁中に排泄された。
【0120】
しかし、264W94のO-脱メチル化代謝産物2169W94とともに該単層をインキュベーションした後に、2169W94の58.5%が、グルクロニド接合体に変換され、かつ該培養肝実質細胞において有意な胆汁中排泄が観察された(図8B)。本開示主題に従って使用される長時間のサンドイッチ‐培養肝実質細胞において、明らかに、O-メチル化のような相I代謝活性は、有意に低下するが、グルクロニド接合のような相II代謝活性は、少なくとも部分的に維持される。従って、この実験室内実施例は、本開示主題のアッセイが、インビボにおける、その親形態の基質の胆汁中排泄の予測に使用されることをさらに示している。実際、インビボにおける代謝産物の胆汁中排泄を研究し、かつ予測する、今回のインビトロアッセイ方法の応用は、該単層の代謝活性の状態の考察を要求する。
【0121】
(実施例5)
(サンドイッチ‐培養ラット肝実質細胞における、siRNAによるMRP2、及びMRP3の発現の阻害)
本開示に先立って、重要な薬剤輸送遺伝子の発現を特異的にノックダウンするように、第一肝実質細胞にsiRNAを使用しなかった。従って、本実施例の目的は、siRNAを利用して、Mrp2、及びMrp3の発現を調節し、かつサンドイッチ‐培養肝実質細胞(SCRH)の機能的重要性を解明することである。
【0122】
(物質、及び方法)
(ヒト肝芽腫(HepG2)細胞、及び第一ラット肝実質細胞の細胞培養物)
HepG2細胞を、ダルベッコ変法イーグル培地/F-12プラス10% FBS中に維持した。ラット肝実質細胞を、雄のウィスターラット(220-300g)から、インサイツでコラゲナーゼ灌流により単離した(Annaertらの論文, Drug Metab Dispos 29:1277-1283, 2001)。細胞を、ラット尾I型コラーゲンでプレコートしたポリスチレン6-ウェルプレート上に、1ウェルにつき1.5x106の密度で播種した;プレート24時間後に、ゲル化コラーゲンの上層を被せた。ラット肝実質細胞培養物を、0.1 M デキサメタゾン、及び0.1% ITS 培養補助剤(6.25 mg/mL インスリン、6.25 mg/mL トランスフェリン、6.25 g/mL 亜セレン酸、5.35 mg/mL リノール酸、及び1.25 g/mL BSA)で補ったダルベッコ変法イーグル培地中に維持した。培地を、24時間ごとに変えた。
【0123】
(siRNAの合成)
ラットMrp2、及びMrp3を標的とするsiRNA配列を、T7 RNA ポリメラーゼプロトコルのためのRNAi OligoRetriever (www.cshl.org/public/SCIENCE/hannon.htmL)を用いて選択した。一本鎖RNAを、T7-MEGASHORTSCRIPT(商標)高収率転写キット(Ambion社, オースチン, テキサス州 USA)を用いて、製造業者の説明書に従って合成した。二本鎖siRNAを製造するために、一本鎖RNAのセンス、及びアンチセンス等モルを変性させ、かつサーモサイクラーでアニールした(95C, 5分; 70C, 5分; 50C, 5 min; 25C, 5分)。siRNAの完全性を、2%アガロースゲルを用いて試験した。Mrp2を標的とする、下記の3つのsiRNAアンチセンス配列を合成した:siMrp2AB1 = GGCUAUAUCUGUGCAAUCCUA (配列番号:3; アンチセンス鎖においてUA 3' 突出 、及びセンス鎖においてAA 3' 突出)、siMrp2AB2 = GGCUAGGAAGCAGUACACCAU (配列番号:4; アンチセンス鎖においてAU 3' 突出、及びセンス鎖においてAA 3' 突出)、siMrp2AB3 = GGCAGUAGGGUGGUGGUCCAU (配列番号:5; アンチセンス鎖においてAU 3' 突出、及びセンス鎖においてUG 3' 突出)である。Mrp3を標的とする下記アンチセンス配列を使用した:GGUCCAAGGACCUGCCUCCCA (配列番号:6; アンチセンス鎖においてCA 3' 突出、センス鎖においてAG 3' 突出)である。ホタル(Photinus pyralis) ルシフェラーゼ (siFL)を標的とするsiRNA配列[アンチセンス = GUGCGCUGCUGGUGCCAACUU (配列番号:7; 両鎖においてUU 3'突出)]を、このプロトコルにとって公知の有力な配列から適合させた(Miyagishi、及びTairaの論文, Nat. Biotechnol. 20:497-500, 2002)。
【0124】
(siRNAの細胞内追跡)
LABELIT(登録商標)siRNA追跡細胞内局在化キット(Mirus Corporation, マディソン, ウィスコンシン州 USA)を用いて、siRNAを、一段階化学反応でCy3色素に共有結合的に結合させた。10g siRNAを、10 lの再構成Cy3ラベル試薬とともに、37Cで1時間インキュベートした。ラベル化siRNAを、通常のエタノール沈殿法により、過剰のCy3を除去して精製した。Cy3ラベル化siRNAを、下記siRNAトランスフェクションのセクションで記載したようにSCRH内に移動させた。細胞画像を、Axiovert 100TV倒立顕微鏡でとった(Zeiss, Thornwood, ニューヨーク州USA)。
【0125】
(siRNAトランスフェクション)
HepG2細胞を、トランスフェクションする24時間前に、12ウェルプレート上に、1ウェルにつき2 x 105細胞の密度で播種した。1ウェルにつき、100 ngのホタルルシフェラーゼ発現プラスミド(PGL3-FL)と100 ngのレニラルシフェラーゼ発現プラスミド(PRL-TK)との混合物、及び様々な量のホタルルシフェラーゼsiRNAを使用した。特に示さない限り、SCRHのトランスフェクションは、プレート後20時間で行った。6ウェルプレート中、1ウェルにつきsiRNA (特定しない限り2 g)を使用した。siRNA、及びDNAを、TRANSMESSENGER(商標)トランスフェクション反応キット(QIAGEN社, バレンシア, カリフォルニア州 USA)を用いて、トランスフェクトするために製剤した。簡潔に言うと、siRNAを、1:2 (全RNA及び/又はDNAのg:エンハンサーのl)の比で、エンハンサーECに縮合させ、かつTransMessengerを用いて、1:4 (RNA及び/又はDNAのg:TransMessengerのl)の比で製剤し、続いて、細胞とともにインキュベートした。HepG2のトランスフェクションのために、siRNAとともに一晩インキュベートした後に、培地を変えた。SCRHのトランスフェクションのために、細胞を、siRNAとともに4時間インキュベートし、次にコラーゲンで被せた。肝実質細胞内へのsiRNA送達は、上層コラーゲンの被覆前で、より効率的であった。トランスフェクション効率を、48時間後に試験した。
【0126】
(ルシフェラーゼ活性アッセイ)
ルシフェラーゼを、DUAL-LUCIFERASE(登録商標)レポーターアッセイ系(Promega社, マディソン, ウィスコンシン州 USA)で測定した。簡潔に言うと、HepG2細胞を、100 lの不動態溶解緩衝液(passive lysis buffer)中に溶解した。20l細胞溶解液を、100 l ルシフェラーゼアッセイ試薬IIと混合し、ホタルルシフェラーゼ活性を測定した。次に、停止、及びグロー試薬(Stop and Glo Reagent )(100 l)を加え、かつ混合し、レニラルシフェラーゼ活性を測定した。発光強度を、MONOLIGHT(商標)3010照度計(BD Biosciences, サンジュース, カリフォルニア州 USA)を用いて測定した。
【0127】
(免疫ブロット分析)
細胞を、トランスフェクション前48時間で収集し、かつ1% SDS、1mM EDTA、さらにCOMPLETE(商標)プロテアーゼインヒビターカクテル(Roche Diagnostics, マンハイム, ドイツ)中に溶解した。透明な細胞溶解液のタンパク質濃度を、BCAタンパク質アッセイ試薬キットを用いて決定した(Pierce Biotech社, ロックフォード, IL)。1レーンにつき全タンパク質50gを、NuPAGE 4−12% ビス−トリスゲル (Invitrogen Life Technology, カールズバッド, カリフォルニア州 USA)の電気泳動により分離し、かつポリビニリドンジフルオリド膜上に移動させた。下記抗体を使用して、該膜を探索した:抗-Mrp2 (M2III-6, Alexis Biochemicals, サインディエゴ, カリフォルニア州 USA);抗-Mrp3 (Dr. Yuichi Sugiyamaからの贈り物);抗-ラディキシン (Chemicon International社, Temecula, カリフォルニア州 USA), 抗−β−アクチン(MAB1501, Chemicon)である。
【0128】
(CDF性質を有するMrp2、及びMrp3機能の評価)
細胞を、ハンクス液 (HBSS, 2 mL, 37C)で二度洗浄し、かつ2 M CDF ジアセテート(Molecular Probes, ユージーン, オレゴン州 USA)とともにインキュベート(10分, 1.5 mL, 37C)し、続いて、冷HBSS (2 mL, 4C)で二度洗浄した。細胞画像を、Axiovert 100TV倒立顕微鏡でとった。細胞+毛細胆管、及び細胞中のCDFの蓄積を、それぞれ、標準のHBSS、及びCa2+フリーHBSSで前インキュベート(10分, 2 mL, 37C)したSCRHで評価した(Liuらの論文, J. Pharmacol. Exp. Ther. 289:1592-1599, 1999)。その後、SCRHを、CDF ジアセテートとともにインキュベートした(10分, 2 mL, 37C)。siMrp2処置SCRHにおいて、次に、細胞を冷HBSS (2 mL, 4C)で4回洗浄し、かつ溶解した(1mL, リン酸緩衝生理食塩水中0.5% トリトンX-100)。siMrp3処置SCRHにおいて、CDF ジアセテートとインキュベートした後に、細胞を、温HBSS (2 mL, 37C)で4回洗浄し、かつHBSS とともにインキュベートし(30分, 10分ごとにHBSSを交換, 2 mL, 37C)、細胞内CDFの時間を考慮して、適切な基底外排泄を起こし、冷HBSS を用いてSCRHを4回洗浄し、かつ該細胞を溶解した(上記のように)。溶解液中のCDF蛍光を、蛍光分光測光法で定量した(λex = 485 nm, λem = 590 nm);タンパク質濃度を、BCA法キット(上記)で決定した。
【0129】
(乳酸デヒドロゲナーゼ活性アッセイ)
機能研究の前に、細胞外培地への細胞内酵素の漏出が細胞生存度に反比例的に関連している乳酸デヒドロゲナーゼ活性に対して、細胞培地を評価した。乳酸デヒドロゲナーゼ活性を、ピルビン酸から乳酸への乳酸デヒドロゲナーゼ触媒還元、その後の残存ピルビン酸と2,4−ジニトロフェニルヒドラジンとの接合、及びアルカリ性pHでの該ピルビン酸-2,4-ジニトロフェニルヒドラゾン接合体の分光光度的検出(λ = 500 nm)を利用したキット500‐C (Sigma Diagnostics, セントルイス, ミズーリ州 USA)を用いて評価した(Cabaud、及びWroblewskiの論文, Am. J. Clin. Pathol. 30:234-236, 1958)。
(統計)
データは、他に示す場合を除いて、平均± SDで報告した。統計的有意性を、チューキーのポスト‐ホック試験(Tukey's post-hoc test )を用いて、one-way、又はtwo-way ANOVAで評価した。全ての場合において、p < 0.05が、有意であると判断した。
【0130】
(結果)
siRNA活性、送達、有効性、及び毒性の検証を最初に調べた。証明されたノックダウン作用を有するホタルルシフェラーゼ標的siRNA(siFL)を合成し、かつHepG2細胞中のPGL3-FLプラスミドから発現されるホタル ルシフェラーゼの発現のノックダウン作用を試験するために使用した。HepG2細胞を、0.2、0.5、及び1.0 gのsiFLで処置した;トランスフェクション後48時間で、ホタルルシフェラーゼのレニラルシフェラーゼ規格化活性が、それぞれ、74%、89%、及び94%減少した(図10)。
Cy3ラベル化siRNAを使用して、コラーゲン被覆後の肝実質細胞へのsiRNA送達を試験した。siRNAは、被覆前に肝実質細胞内にうまく送達された(図11)。しかし、被覆後では、該肝実質細胞内に送達されなかった。
【0131】
予備研究で、3つの異なるトランスフェクション時間点(3時間、12時間、及び24時間)のノックダウン作用を評価した;最大効果は、プレート後12時間、及び24時間で観察された。本研究において、すべてのトランスフェクションは、プレート後20時間で行った(すなわち、細胞をコラーゲンで被せる24時間前)。
培養3日後に、輸送タンパク質レベル、及び機能を評価した時間、乳酸デヒドロゲナーゼ活性は、siMrp2、又はsiMrp3 siRNAでトランスフェクトしたSCRHにおいて上昇しなかった(94 ± 13, 87 ± 3% トランスフェクトしていないコントロールSCRH, 平均 ± SEM)。
【0132】
SCRH へのsiRNAの効率的送達を確実にするために、細胞をラット尾コラーゲンで被せ、かつ細胞内siRNAをcy3ラベルで追跡する前後で、該第一肝実質細胞をプレートし、その後の異なる時間点でのトランスフェクションを試験することにより、トランスフェクション方法論を開発した。Mrp2に対する3つの異なるsiRNA配列(本明細書中、及び図中で一般的にsiMrp2と呼ぶ)、siMrp2AB2 (配列番号:4)、及びsiMrp2AB3 (SEQ ID NO:5)を合成した。Mrp2 cDNA (配列番号:1)の1158-1178番目のヌクレオチドを標的とするsiMrp2AB1が、もっとも強い作用を有し、siFLトランスフェクトSCRH、又は非トランスフェクトSCRHと比較して、内生Mrp2発現において平均50%(最大79%)還元を示した(図12A、及び12B)。また、siMrp2AB2は、有意なノックダウン作用を示した(40 ± 20%)。siMrp2AB3は、Mrp2タンパク質のみを適度にノックダウンした(26 ± 18%)。意外にも、これらの3つの配列の等量混合物は、最小のノックダウン作用を示した(〜13%還元)。
【0133】
Mrp2機能の低下は、蛍光Mrp2基質カルボキシジクロロフルオレセイン (CDF) (図13B)を用いる蛍光顕微鏡検査により立証される。非蛍光CDFジアセテートは、肝実質細胞内に受動的に分散され、そこで、蛍光CDFに加水分解され、Mrp2により小管膜を横切って活動的に排泄され、かつSCRHの小管網に蓄積される(Kikuchiらの論文, Nat. Genet. 31:320-325, 2002)。siMrp2で処置されたSCRHの小管網中の蛍光は、ホタルルシフェラーゼ (siFL)で処置したSCRH、又は非トランスフェクトSCRHと比較して、顕著に低下する(〜45%)。
【0134】
コントロール非トランスフェクト細胞+毛細胆管内のCDFの蓄積は、細胞内のみよりも有意に高い(80.4 ± 3.9 対 67 ± 5.5 pmol/mg タンパク質/10分)。これは、胆汁小管網中のCDFの明らかな蓄積を示している。対照的に、siMrp2トランスフェクトSCRHにおいて、細胞+毛細胆管中のCDFの蓄積は、細胞のみのCDF蓄積との有意な違いはなかった(78.3 ± 6.3 対 71.1 ± 7.8)。該胆汁小管網中のCDF蓄積に起因する、細胞+毛細胆管に蓄積されるCDFのパーセントフラクションは、siMrp2トランスフェクトSCRHにおいて、〜45%低かった (9.3% 対 16.5%)
【0135】
siMrp2処置細胞のノックダウン作用の特異性を評価するために、Mrp3 (配列番号:2)の発現、Mrp2 (配列番号:1)に対して45%同定のタンパク質を調査した。免疫ブロット分析データは、siMrp2AB1 (配列番号:3)、siMrp2AB2 (配列番号:4)、及びsiMrp2AB3 (SEQ ID NO:5)、これらの3つの混合物、又はsiFL (配列番号:7)で処置されたSCRHにおいて、Mrp3の発現レベルが、非トランスフェクト細胞のそれと同じであることを示した(それぞれ、89±11、96±15、86±11、89±19、96±6%非トランスフェクトコントロール;図12A、及び12B)。
【0136】
ラディキシンは、げっ歯類肝臓において主要なエズリン-ラディキシン-モエシン(ERM)タンパク質であり、主に胆汁小管膜に局在している。SCRHにおいて、ラディキシン(該小管膜のMrp2の正確な局在化に必要なタンパク質)の発現は、培養時間で、増加した(1日目の発現に対して、2日目= 111、3日目= 153、4日目= 189%発現)。ラディキシン発現レベルは、siMrp2、又はsiFLで処置したSCRHにおいて、非トランスフェクトSCRHと比較して変化はなかった(siMrp2AB1 = 95 ± 17、siMrp2AB2 = 100 ± 8、siMrp2AB3 = 103 ± 7、siMrp2Abmix = 101 ± 8、siFL = 103 ± 10% 非トランスフェクトコントロール)。従って、siMrp2処置SCRHにおける、小管網へのCDF流出の低下は、Mrp3、又はラディキシンの変化のためではなかった。むしろ、Mrp2抑制の直接的結果であった。
【0137】
SCRH におけるMrp3 (配列番号:2)の抑制の結果を調査するために、Mrp3発現を、上記と同じアプローチを利用して調節した。SCRHを、Mrp3 cDNAの1950〜1970番目のヌクレオチドを標的とするsiRNA (本明細書中、及び図中で一般的にsiMrp3と呼ぶ;配列番号:6)を用いて処置した。免疫ブロット分析は、siFL (配列番号:7)、及び非トランスフェクト細胞と比較して、Mrp2発現に変化はなく、Mrp3タンパク質発現の低下を確認した(図13A)。Mrp3基質でもあるCDFを用いた機能アッセイは、小管網内のCDF蛍光が、siFLトランスフェクト、又は非トランスフェクト細胞のものよりも強いことを示した(図13B)。
【0138】
CDF ジアセテートとインキュベートしたすぐ後に、細胞+毛細胆管、及び細胞のみ、双方のCDF蓄積における、Mrp3ノックダウンの明らかな作用は記録されなかった。相違は、30分の洗い流し後に明らかになり、肝実質細胞中に蓄積されたCDFは、適切に基底外排泄された(図13D)。siMrp3トランスフェクト細胞+毛細胆管内のCDF蓄積は、コントロールの非トランスフェクト細胞+毛細胆管のものよりも有意に大きい(32.3 ± 2.5 対 24.4 ± 4.3 pmol/mg タンパク質/10分)。対照的に、細胞のみのCDF蓄積は、Mrp3ノックダウンにより変化しなかった(13.7 ± 2.2 対 15.6 ± 4.0 pmol/mg タンパク質/10分)。30分洗い流し後のCDFの胆汁中排泄指数は、〜60%に増加した(57.5 対 36.2%)。
【0139】
(考察)
化学的に合成したsiRNAは、商業的に利用可能であるが、T7 RNAポリメラーゼ方法は、予備スクリーニング用の少量のsiRNAの合成にとってコスト的に有効な方法であることを示した(Donze and Picard, Nucleic Acids Res. 30:e46, 2002)。この方法で製造されるsiRNA性質を保証にするために、証明されたノックダウン作用を有するホタルルシフェラーゼ (siFL)を標的とするsiRNAを合成し、かつHepG2細胞内のPGL3-FLプラスミドから発現されるホタルルシフェラーゼの発現のノックダウン作用を試験するために使用した。ホタルルシフェラーゼ活性は、siFLによる投与量依存方法において低下した。これは、T7 RNA ポリメラーゼ方法により合成されたsiRNAが、有意なンノックダウン作用を有することを示している。
【0140】
Mrp2の発現、又は局在化の変更は、Mrp2機能の変化を導き得る。インビボ研究は、げっ歯類肝臓の有力な胆汁小管エズリン-ラディキシン-モエシンタンパク質であるラディキシンが、Mrp2のC末端細胞質ドメインに直接結合することを示している;ラディキシンとMrp2との相互作用は、小管膜におけるMrp2の正確な局在化を必要とする(Kocherらの論文, Lab. Invest. 79:1161-1170, 1999; Kojimaらの論文, J. Hepatol. 39:693-702, 2003)。マウスにおいて、ラディキシンがノックアウトされた場合、Mrp2は、局在化を誤り、かつ正常に機能しなくなった(Kikuchiらの論文, Nat. Genet. 31:320-325, 2002)。コラゲナーゼで肝実質細胞を単離した後、Mrp2は内部移行する。SCRHにおいて、Mrp2は、培養時間で、小管膜に再局在化する(Zhangらの論文, AAPS Pharm. Sci. 3:Abstract 1522-1059, 2001)。SCRH中のラディキシンの発現は、培養時間で増加し、これは、該小管膜へのMrp2の再局在化と一致する。ラディキシン発現レベルは、siMrp2で処置したSCRHにおいて、siFLで処置したもの、又は非トランスフェクトSCRHと比較した場合、変化はない。これらのデータは、siMrp2によるMrp2機能の調節がラディキシン経路を介して媒介される可能性を除外する。
【0141】
siMrp2を用いたSCRHの処置は、一時的なMrp2ノックダウンマウスを本質的に製造する(図12A、および13A)。定性的に、Mrp2機能の低下は、蛍光Mrp2基質 CDFを用いて、蛍光顕微鏡検査により立証される。siMrp2で処置したSCRHの小管網中の蛍光は、siFL、又は非トランスフェクト細胞で処置したSCRHと比較して、顕著に減少する。定性的に、siMrp2を用いたSCRHのトランスフェクションは、毛細胆管に見られる細胞+毛細胆管のCDFのフラクションを、16.5から9.3%に減少する。CDF 胆汁中排泄 (〜45%)減少の程度は、Mrp2ノックダウン(〜50%)の程度と良い一致を示す。減少したCDF性質は、siMrp2トランスフェクトSCRHの培地中での乳酸デヒドロゲナーゼ活性における増加の欠如により示されているように、Mrp2タンパク質レベルの低下のためであり、かつ損なわれた細胞生存度のためでない。
【0142】
Mrp3のノックダウンは、siFL でトランスフェクトされた細胞、又は非トランスフェクト細胞と比較して、Mrp2の発現を変えなかった(図13A)。Mrp3基質でもあるCDFを用いた機能アッセイは、小管網中のCDF蛍光が、siFLトランスフェクト、又は非トランスフェクト細胞のものよりも強いことを示している(図13B)。siMrp3を用いたSCRHのトランスフェクションは、細胞+毛細胆管中のCDFの蓄積を有意に増加させ(しかし、細胞のみではそうならない。)(図13D)、毛細胆管中に見られる細胞+毛細胆管に蓄積されたCDFのフラクションを〜60%増加する結果を示した。Mrp3のノックダウンは、胆汁中へのCDF排泄の経路の向け直しを生じる。従って、siMrp3-処置SCRHの小管蛍光は、コントロール細胞中よりも高かった。siMrp3処置SCRHは、一時的なMrp3ノックダウンモデルを表す。これは、インビボにおいてまだ利用できないものである。
【0143】
本件急により証明されたものとして、RNA干渉は、薬剤性質の特異的タンパク質の役割の研究における強力なツールである。肝クリアランスにおける輸送タンパク質の役割に関する現在の知識の大部分は、3種類の実験設定から来る:組換え発現系、及びノックアウト/変異動物である。多くのプログラムが、輸送体機能の研究におけるこれらのツールで作られているが、現在の実験系は、下記で論じる制限がある。これらの制限の多くは、RNA干渉に関連しない。
【0144】
組換えタンパク質は、宿主細胞の転写、翻訳、及び翻訳後修飾の違いのために、常に、対象の種のにおける代表的なインビボタンパク質でないかもしれない。例えば、多くのATP結合カセット輸送体発現のためのホストシステムとして頻繁に使用されるSf9細胞は、組換えタンパク質を、多くグリコシル化(underglycosylate)し、低分子の輸送体を生じる(Germannらの論文, Biochemistry 29:2295-2303, 1990)。さらに、最近の調査は、特定の化合物が、所定の原形質膜ドメインで、2以上の輸送体の基質となり得ることを示している。例えば、Mrp2、及び該乳癌耐性タンパク質、双方が、肝小管膜を横切って、生体異物の硫酸抱合体を胆汁中に排泄する(Xiongらの論文, J. Pharmacol. Exp. Ther. 295:512-518, 2000)。同様に、肝摂取は、2以上の輸送体により媒介され得る。オピオイドペプチド[D-ペニシラミン2,5]エンケファリンは、3つ全ての有機アニオン輸送ポリペプチドイソ型により、肝実質細胞内に吸収される(Cattoriらの論文, Pflugers Arch. 443:188-195, 2001)。従って、組換え輸送体による化合物の輸送の重要性の正確なインビボにおける解釈は、非常に困難であり得る。
【0145】
ノックアウト、又は自然発生的変異動物は、インビボにおける個々の輸送体の役割の理解を非常に促進させている。これらの動物の補足的な輸送機序の上方制御は、データ解釈を混乱させ得る。例えば、Mrp2不足EHBRラットにおいて、タウロコール酸の胆汁中排泄は、正常に機能しない。これは、Mrp2が、この胆汁酸の胆汁中排泄を媒介するためでなく、基底外部Mrp3が、これらのラットの肝臓において高度に上方制御され、胆汁中排泄にとって利用可能な基質を制限する、より効率的な基底外排泄を起こすためである(Akitaらの論文, Pharm. Res. 18:1119-1125, 2001)。ノックアウト、又は変異動物から得られたデータの解釈は、補足的な経路における考慮の潜在的変化を取り入れなければならず、常に、よく理解されるものではないかもしれない。
【0146】
ここに示したように、RNA干渉は、対象のタンパク質の特異的かつ迅速なノックダウンを可能にする。siMrp2を用いたSCRHのトランスフェクションは、Mrp2タンパク質を減少させたが、密接に関連したMrp3を減少させなかった。同様に、Mrp3のノックダウンは、Mrp2タンパク質レベルに影響されなかった。自然発生的変異Mrp2、例えばEHBRラットにおいて、Mrp3は、該肝臓において高度に上方制御される(Akitaらの論文, Pharm. Res. 18:1119-1125, 2001)。しかし、Mrp2のノックダウンは、siMrp2を用いた肝実質細胞のトランスフェクション後2日で、Mrp3タンパク質レベルを変化させなかった。siRNAを用いたタンパク質ノックダウンの割合は、該タンパク質の半減期により影響され、明らかにMrp2にとって、Mrp3の顕著な増加が生じる前にMrp2レベルの有意な低下が達成され得るのに十分な短さである。
【0147】
全体的な、SCRHのsiRNA処置による薬剤輸送体の調節は、薬剤輸送タンパク質の発現、及び機能の研究にとって、実行可能なアプローチである。RNA干渉は、輸送タンパク質の研究用に現在使用される実験計画に、独特の利点を提供する。siRNAの主な利点は、ノックダウンの特異性、及び主要細胞の補足的な輸送機序の発現維持であり、他の関連タンパク質の発現を維持する。
【0148】
(引用文献)
下記リストの引用文献、並びに本明細書中に引用した全ての引用文献は、本明細書中で使用される方法論、技術、及び/又は組成物を補足し、説明し、背景を提供し、又は教示する範囲に対して、本明細書中に引用により取り込まれる。
Akita らの論文, Pharm. Res. 18:1119-1125, 2001.
Annaert らの論文, Drug Metab. Dispos. 29:1277-1283, 2001.
Bass, Nature 411:428-429, 2001.
Bernstein らの論文, Nature 409:363-366, 2001.
Boyer、及びSorokaの論文, Gastroenterology 109:1600-1611, 1995.
Bremnes らの論文, Cancer Res. 49:2460-2464, 1989.
Cabaud、及びWroblewskiの論文, Am. J. Clin. Pathol. 30:234-236, 1958.
カナダ特許出願第2,359,180号
Cattori らの論文, Pflugers Arch. 443:188-195, 2001.
Chen らの論文, Pharm. Res. 14:345-350, 1997.
Donze、及びPicardの論文, 核酸s Res. 30:e46, 2002.
Dunn らの論文, FASEB J. 3:174-177, 1989.
Elbashir らの論文 Nature 411:494-498, 2001a.
Elbashir らの論文, Genes Dev 15:188-200, 2001b.
Eriksson らの論文, Acta. Physiol. Scand. 95:1-5, 1975.
Fire らの論文, Nature 391:806-811, 1998.
Fireの論文, Trends Genet 15:358-363, 1999.
Germann らの論文, Biochemistry 29:2295-2303, 1990.
Hammond らの論文, Nature 404:293-296, 2000.
Haugland, 分子プローブ:蛍光プローブ、及び調査化学物質のハンドブック(Molecular Probes: Handbook of Fluorescent Probes and Research Chemicals)(1992-1994), p.134, Molecular Probes, Inc., 1992.
Inoue らの論文, Biochim. Biophys. Acta. 833:211-216, 1985.
Kikuchi らの論文, Nat. Genet. 31:320-325, 2002.
Kocher らの論文, Lab. Invest. 79:1161-1170, 1999.
Kojima らの論文, J. Hepatol. 39:693-702, 2003.
Kool らの論文, Proc. Natl. Acad. Sci. USA 96:6914-6919 1999.
Laznicekand らの論文, Eur. J. Drug Met. Pharmacokinet. 19:21-26, 1994.
LeCluyse らの論文, Am. J. Physiol. 266(Cell Physiol. 35):C1764-1774, 1994.
LeCluyse らの論文, 薬剤吸収、及び代謝を評価するモデルの培養ラット肝実質細胞(Cultured rat hepatocytes, in Models for Assessing Drug Absorption and Metabolism)(Borchard らの論文 eds), pp 121-160, Plenum Press, New York, 1996.
【0149】
Liu らの論文, Pharm. Res. Init.13:S-393 (8003), 1996.
Liu らの論文, Hepatology 24:370A (973), 1996.
Liu らの論文, Pharm. Res. 24:S-459 (3007), 1997.
Liu らの論文, Hepatology 26:297A (675), 1997.
Liu らの論文, Pharm. Sci. 1:S-119, 1998.
Liu らの論文, Pharm. Res., 15:1533-1539, 1998.
Liu らの論文, J. Pharmacol. Exp. Ther. 289:1592-1599, 1999.
Masuda らの論文, Cancer Res. 57:3506-10, 1997.
Miyagishi、及びTairaの論文, Nat. Biotechnol. 20:497-500, 2002.
Norris らの論文, N. Eng. J. Med. 334:231-238, 1996.
Nykanen らの論文, Cell 107:309-321, 2001.
Pang らの論文, J. Pharmacokinet. Biopharm. 5:625-653, 1977.
Parkinson, A., Casarett、及びDoullの技術における生態異物の生体内変換(Biotransformation of Xenobiotics in Casarett and Doull's Toxicology). 毒物の基礎科学(The Basic Science of Poisons), 第5版. (Klaassen, C.D. ed.) pp. 113-186, McGraw Hill, New York, 1996.
【0150】
PCT 国際公開番号WO 99/32619.
PCT 国際公開番号WO 99/07409.
PCT 国際公開番号WO 00/01846.
PCT 国際公開番号WO 00/44895.
PCT 国際公開番号WO 00/44914.
PCT 国際公開番号WO 00/63364.
PCT 国際公開番号WO 01/04313.
PCT 国際公開番号WO 01/29058.
PCT 国際公開番号WO 01/36646.
PCT 国際公開番号WO 02/44321.
PCT 国際公開番号WO 01/68836.
PCT 国際公開番号WO 01/75164.
PCT 国際公開番号WO 01/92513.
PCT 国際公開番号WO 02/055692.
PCT 国際公開番号WO 02/055693.
【0151】
Pollack らの論文, J. Pharmacol. Exp. Ther. 18:197-202, 1989.
Sandusky らの論文, Histopathology 41:65-74, 2002.
Seglen, 細胞生物学の方法(Methods in Cell Biology)(第13版., Prescott D. M. Eds.) pp. 30-78, Academic Press, New York, 1976.
Sidhu らの論文, Pharmacogenetics 5:24-36, 1993.
Silver らの論文, ISSX Proceedings (サンディエゴ, カリフォルニア州 USA) pp. 387,1996.
Summerton & Weller, Antisense Nucleic Acid Drug Dev 7:187-95, 1997.
Summerton, Biochim Biophys Acta 1489(1):141-58, 1999.
Utesch らの論文, In Vitro Cell Dev. Biol. 27A:858-863, 1991.
Wianny & Zernicka-Goetz, Nature Cell Biol 2:70-75, 1999.
Xiong らの論文, J. Pharmacol. Exp. Ther. 295:512-518, 2000.
Zhang らの論文, AAPS Pharm. Sci. 3:Abstract 1522-1059, 2001.
本発明の様々な詳細は、本発明の範囲から外れることなく変化され得ることが理解されるであろう。さらに、先の記載は、説明の目的のみのためであり、請求項に規定した発明の制限を目的とするものではない。
【図面の簡単な説明】
【0152】
【図1】図1Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]イヌリン(1 μM)の累積取り込みを示すグラフである。 図1Bは、96時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]イヌリン(1 μM)の累積取り込みを示すグラフである。
【図2】図2Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[14C]サリチル酸塩(1 μM)の累積取り込みを示すグラフである。 図2Bは、96時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[14C]サリチル酸塩(1 μM)の累積取り込みを示すグラフである。
【図3】図3Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]メトトレキセート(1 μM)の累積取り込みを示すグラフである。 図3Bは、96時間サンドイッチ形態で培養した肝実質細胞における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]メトトレキセート(1 μM)の累積取り込みを示すグラフである。
【図4】図4Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H][D-pen2,5]エンケファリン (15 μM)の累積取り込みを示すグラフである。 図4Bは、96時間サンドイッチ形態で培養した肝実質細胞における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H][D-pen2,5]エンケファリン (15 μM)の累積取り込みを示すグラフである。
【図5】図5Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]タウロコール酸 (1 μM)の累積取り込みを示すグラフである。 図5Bは、96時間サンドイッチ形態で培養した肝実質細胞における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]タウロコール酸 (1 μM)の累積取り込みを示すグラフである。
【図6】図6Aは、下記モデル基質に対する、インビボにおけるラット胆汁に排泄される投与量の割合と、96時間培養肝実質細胞における胆汁中排泄指数との間の関係を示すグラフである:イヌリン(□)、サリチル酸塩(◆)、メトトレキセート(○)、[D-pen2,5]エンケファリン(▲)、及びタウロコール酸 (●)である。該胆汁中排泄指数を、式3に基づいて、10分累積取り込みデータ(図1A〜5B)から計算した。破線は、該データに適合する線形回帰方程式である。 図6Bは、下記モデル基質に対する、インビボにおけるラット胆汁に排泄される投与量の割合と、インビボにおける固有の胆汁クリアランス、及びインビトロにおける96時間サンドイッチ培養した肝実質細胞における胆汁クリアランスとの間の関係を示すグラフである:イヌリン(□)、サリチル酸塩(◆)、メトトレキセート(○)、[D-pen2,5]エンケファリン(▲)、及びタウロコール酸 (●)である。該インビボにおける固有の胆汁クリアランスを、論文のインビボにおける胆汁クリアランス値に基づいて、式2から計算した。該インビトロにおける胆汁クリアランスを、式4から計算した。破線は、該データに適合する線形回帰方程式である。
【0153】
【図7】図7Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]264W94 (3 μM)の累積取り込みを示すグラフである。 図7Bは、96時間サンドイッチ形態で培養した肝実質細胞における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]264W94 (3 μM)の累積取り込みを示すグラフである。
【図8】図8Aは、3時間培養した肝実質細胞単層における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]2169W94 (3 μM)の累積取り込みを示すグラフである。 図8Bは、96時間サンドイッチ形態で培養した肝実質細胞における、標準緩衝液(閉じた記号)、及びCa2+フリー緩衝液(開放記号)中の[3H]2169W94 (3 μM)の累積取り込みを示すグラフである。
【図9】図9Aは、化合物264W94の化学構造式を示し、アスタリスク記号は、均等に取り込まれた14C位置を示す。 図9Bは、化合物2169W94の化学構造式を示し、アスタリスク記号は、均等に取り込まれた14C位置を示す。
【図10】図10は、T7 RNAポリメラーゼ方法で合成されたsiFLのノックダウン作用を示すグラフである。ホタルルシフェラーゼ活性は、0.2、0.5、又は1.0のsiFLを加えた、 PGL3-FL (ホタルルシフェラーゼ)、及びPRL-TK (レニラルシフェラーゼ)プラスミドでトランスフェクトしたHepG2で試験した;活性は、レニラルシフェラーゼの活性に対して規格化した。PGL3-FL、及びPRL-TKプラスミドのみを、コントロールのトランスフェクションに使用した。
【図11】図11は、siRNAの細胞内追跡を示す。siFL、及びsiMrp2を、Cy3試薬でラベル化し、かつコラーゲン被覆前に、SCRH内にトランスフェクトした。画像は、トランスフェクション後24時間でとった。
【図12A】図12Aは、ラット尾コラーゲンでコートした6ウェル培養プレート上のSCRHのトランスフェクションに使用したsiMrp2処置SCRH (1ウェルにつき2μg)における、Mrp2、Mrp3、ラディキシン、及びアクチンの発現の代表的免疫ブロットである;免疫ブロット分析を、該トランスフェクション後48時間で行った;NTCは、非トランスフェクトコントロールである。
【図12B】図12Bは、siRNA処置細胞中のアクチン規格化Mrp2と非トランスフェクトコントロールとの相対的発現比を表す。平均± SD (n = 4), *p < 0.05 siRNAトランスフェクト対非トランスフェクトコントロール、p < 0.05 siMrp2トランスフェクト対siFL(チューキーのポスト‐ホック試験を用いたone-way ANOVA)
【図13A】図13Aは、siMrp2、siMrp3、siFLで処置したSCRH、及び非トランスフェクトSCRHのMrp2、及びMrp3発現の免疫ブロット分析を示す。
【図13B】図13Bは、siRNAで処置したSCRHの小管網中のCDF蛍光を示す。光顕微鏡画像(左パネル)、及び蛍光顕微鏡画像(右パネル)は、(a) 非トランスフェクト細胞、(b) siFL、(c) siMrp2、及び(d) siMrp3ランスフェクト細胞に並べて示した。
【図13C】図13Cは、2 μM CDF ジアセテートとともに10分インキュベートした直後の標準ハンクス液(HBSS, 細胞+毛細胆管, 閉じた棒)、及びCa2+フリーHBSS(細胞のみ, 開放棒)中のsiMrp2、siFLトランスフェクト、及び非トランスフェクトSCRHのCDF蓄積を示す。
【図13D】図13Dは、2 μM CDF ジアセテートで10分インキュベーション、及び 30分の洗い流し後のsiMrp3、siFLトランスフェクト、及び非トランスフェクトSCRHにおける、細胞+毛細胆管中のCDF蓄積(閉じた棒)、及び細胞のみ(開放棒)を示すグラフである。NTC =非トランスフェクト。平均± SD (n = 6), *p < 0.05 細胞+毛細胆管対細胞のみ, †p < 0.05 siMrp2トランスフェクト対NTC, ‡p < 0.05 siMrp2トランスフェクト対siFLトランスフェクト(チューキーのポスト‐ホック試験を用いたone-way ANOVA)。
【特許請求の範囲】
【請求項1】
肝実質細胞輸送タンパク質による胆汁中排泄への感受性に対する候補化合物のスクーリング方法であって、
(a)複数の肝実質細胞、及び少なくとも1つの毛細胆管を含む細胞培養物を提供すること、ここで、該肝実質細胞の少なくとも1つは、輸送タンパク質を含み;
(b)該培養物に候補化合物を曝露すること;及び
(c)該少なくとも1つの毛細胆管中の該候補化合物の量を決定し、それによって、該肝実質細胞輸送タンパク質による胆汁中排泄への感受性に対する該候補化合物をスクリーニングすることを含む、前記方法。
【請求項2】
前記肝実質細胞が、ラット、ヒト、サル、類人猿、ネコ、イヌ、ブタ、雄ブタ、ウシ、雄ウシ、ヒツジ、ウマ、シチメンチョウ、ニワトリ、カモ、及びガンからなる群から選択された供給源から単離されたものである、請求項1記載の方法。
【請求項3】
前記肝実質細胞の培養物が、肝実質細胞の長時間培養物をさらに含む、請求項1記載の方法。
【請求項4】
前記肝実質細胞の培養物が、小管網をさらに含む、請求項1記載の方法。
【請求項5】
前記肝実質細胞の培養物が、肝実質細胞のクラスター、肝実質細胞の凝集体、肝実質細胞の少なくとも1つの層、及びそれらの組合せからなる群から選択された形態を有するものとして、さらに特徴付けられる、請求項1記載の方法。
【請求項6】
前記肝実質細胞が、マトリックス内に埋め込まれている、請求項5記載の方法。
【請求項7】
前記肝実質細胞の培養物が、肝実質細胞のサンドイッチ培養物をさらに含み、該サンドイッチ培養物は、肝実質細胞の少なくとも1つの層、及び該肝実質細胞の少なくとも1つの層とともに少なくとも1つの毛細胆管を含む、請求項5記載の方法。
【請求項8】
前記肝実質細胞のサンドイッチ培養物が、肝実質細胞の長時間サンドイッチ培養物を含む、請求項7記載の方法。
【請求項9】
前記肝実質細胞の少なくとも1つの層が、マトリックスの2つの層間に挟まれている、請求項7記載の方法。
【請求項10】
前記マトリックスが、生物学的マトリックス培地、合成マトリックス培地培地、及びそれらの組合せからなる群から選択される、請求項9記載の方法。
【請求項11】
前記生物学的マトリックス培地が、コラーゲン、ラミニン、基底膜誘導化複合体、それらの誘導体、及びそれらの組合せからなる群から選択される、請求項10記載の方法。
【請求項12】
前記輸送タンパク質が、NTCP、OATP1A1、OATP1A2、OATP1A4、OATPB2、OATP1B1、OATP1B3、OATP2B1、OAT2、OAT3、OAT4、OCT1、OCT3、OCTN1、OCTN2、BSEP、MRP1、MRP2、MRP3、MRP4、MRP5、MRP6、MRP7、MRP8、MRP9、MDR1、MDR1A/B、MDR2、MDR3、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せからなる群から選択される、請求項1記載の方法。
【請求項13】
複数の候補化合物を同時にスクリーニングすることをさらに含む、請求項1記載の方法。
【請求項14】
前記少なくとも1つの毛細胆管中の前記候補化合物の量を決定することが:
(a)取り込み、該候補化合物、及び予め選択された量のラベル化基質を可能にするのに十分な時間、該培養液に同時に曝露すること;
(b)該培養物を洗浄すること;及び
(c)少なくとも1つの毛細胆管中に存在する該ラベル化基質の量を決定して、該肝実質細胞輸送タンパク質による胆汁中排泄に対する該候補化合物と該ラベル化基質との間の競合を評価することを含み、該予め選択された量のラベル化基質と比較して、該少なくとも1つの毛細胆管中のラベル化基質の減少量の存在が、該輸送タンパク質による胆汁中排泄への該候補化合物の感受性を示す、請求項1記載の方法。
【請求項15】
前記ラベル化基質が、蛍光発生化合物、蛍光化合物、化学発光化合物、比色定量用化合物、放射標識化合物、及びそれらの組合せからなる群から選択される、請求項13記載の方法。
【請求項16】
前記少なくとも1つの毛細胆管中の該候補化合物の量を決定することが:該肝実質細胞輸送タンパク質の発現を阻害し、かつ少なくとも1つの毛細胆管中に存在する該候補化合物の量を検出することを含み、該肝実質細胞輸送タンパク質の発現が、阻害されない場合、該少なくとも1つの毛細胆管中の該候補化合物と比較して、該少なくとも1つの毛細胆管中の該ラベル化基質の減少量の存在が、該肝実質細胞輸送タンパク質による胆汁中排泄への該候補化合物の感受性を示す、請求項1記載の方法。
【請求項17】
前記肝実質細胞輸送タンパク質の発現を阻害することが、リボ核酸(RNA)を、該肝実質細胞輸送タンパク質の発現阻害に十分な量で、複数の肝実質細胞の少なくとも1つに導入することを含み、ここで、該RNAは、該輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含んでいる、請求項16記載の方法。
【請求項18】
前記遺伝子が、NTCP、OATP1A1、OATP1A2、OATP1A4、OATPB2、OATP1B1、OATP1B3、OATP2B1、OAT2、OAT3、OAT4、OCT1、OCT3、OCTN1、OCTN2、BSEP、MRP1、MRP2、MRP3、MRP4、MRP5、MRP6、MRP7、MRP8、MRP9、MDR1、MDR1A/B、MDR2、MDR3、BCRP、ABCG5、ABCG8、及びFIC-1からなる群から選択されたポリペプチドをコード化している、請求項17記載の方法。
【請求項19】
前記遺伝子が、配列番号:1、及び2のいずれか1つのヌクレオチド配列を含む、請求項18記載の方法。
【請求項20】
前記RNAが、前記肝実質細胞輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含む第一鎖と、該第一鎖に相補的なリボヌクレオチド配列を含む第二鎖とを含有した二本鎖領域を含み、かつ該第一鎖と該第二鎖とが、互いにハイブリダイズして、二本鎖分子を形成する、請求項17記載の方法。
【請求項21】
前記二本鎖領域が、少なくとも15塩基対長さである、請求項20記載の方法。
【請求項22】
前記二本鎖領域が、15〜50塩基対長さである、請求項21記載の方法。
【請求項23】
前記二本鎖領域が、15〜30塩基対長さである、請求項22記載の方法。
【請求項24】
前記RNAが、分子内自己ハイブリダイゼーションにより二本鎖領域を形成している一本鎖を含む、請求項17記載の方法。
【請求項25】
前記二本鎖領域が、少なくとも19塩基にわたって相補的である、請求項24記載の方法。
【請求項26】
前記RNAが、分子間ハイブリダイゼーションにより二本鎖領域を形成している2つの別個の鎖を含み、該二本鎖領域は、少なくとも19塩基にわたって相補的である、請求項20記載の方法。
【請求項27】
前記RNAが、配列番号:3、4、及び5のいずれか1つのヌクレオチド配列を含む、請求項17記載の方法。
【請求項28】
前記輸送タンパク質をコード化している遺伝子の発現が、少なくとも10%阻害される、請求項17記載の方法。
【請求項29】
前記RNAをコード化しているベクターを、前記複数の肝実質細胞の少なくとも1つの中に導入することをさらに含む、請求項17記載の方法。
【請求項30】
前記RNAを、前記複数の肝実質細胞の少なくとも1つの中に導入することは、前記RNAを、前記複数の肝実質細胞の少なくとも1つの中にトランスフェクトすることを含む、請求項17記載の方法。
【請求項31】
前記RNAを、前記複数の肝実質細胞の少なくとも1つの中に導入することは、前記複数の肝実質細胞の少なくとも1つを、前記RNAをコード化している組換えウイルスで感染させることを含む、請求項17記載の方法。
【請求項32】
前記少なくとも1つの毛細胆管中の前記候補化合物の量が、該培養物中の胆汁クリアランス値を計算することにより決定される、請求項1記載の方法。
【請求項33】
肝実質細胞輸送タンパク質による胆汁中排泄への感受性に対する候補化合物をスクリーニングする方法であって:
(a)第一及び第二細胞培養物を確立すること、ここで、各第一及び第二培養物は、複数の肝実質細胞、及び少なくとも1つの毛細胆管を含み、該第一培養物は、輸送タンパク質を発現し、かつ該第二培養物は、該輸送タンパク質の発現を少なくとも部分的に阻害し;
(b)該第一培養液、及び該第二培養液に候補化合物を、該候補化合物の取り込みに十分な時間、曝露すること;
(c)該第一及び第二培養物を洗浄し、かつ溶解すること;
(d)段階(c)の各培養物から得られた溶解産物の中に存在する該候補化合物の量を決定すること、及び各培養溶解産物中の該候補化合物の量を使用して、該輸送タンパク質による胆汁中排泄への感受性に対する候補化合物を評価することを含む、前記方法。
【請求項34】
第一及び第二培養物の各々を、無処置の毛細胆管を有する該第一及び第二培養物の各々の第一分画、並びに破壊した毛細胆管を有する該第一及び第二培養物の各々の第二分画の、2つの分画に分離し、かつ下記段階を含む、請求項33記載の方法:
(i)候補化合物を、該第一及び第二培養物の各々の第一分画、並びに該第一及び第二培養物の各々の第二分画に、該候補化合物の取り込みに十分な時間(T)曝露し;
(ii)該第一及び第二培養物の各々の第一及び第二分画を洗浄し、かつ溶解すること;
(iii)段階(ii)の該第一及び第二培養物の各々の各分画から得られた溶解産物の中に存在する、該候補化合物の量を測定すること;v
(iv)該毛細胆管内の質量を、無処置の毛細胆管を有する該第一及び第二培養物の第一分画、並びに破壊した毛細胆管を有する第一及び第二培養物の第二分画からの溶解産物の中に存在する候補化合物の量の差として計算すること;及び
(v)段階(iv)で計算された質量を用いて、該輸送タンパク質による胆汁中排泄への感受性に対する候補化合物を評価すること。
【請求項35】
前記肝実質細胞が、ラット、ヒト、サル、類人猿、ネコ、イヌ、ブタ、雄ブタ、ウシ、雄ウシ、ヒツジ、ウマ、シチメンチョウ、ニワトリ、カモ、及びガンからなる群から選択された供給源から単離されたものである、請求項33記載の方法。
【請求項36】
前記肝実質細胞の第一及び第二培養物の各々が、肝実質細胞の長時間培養物をさらに含む、請求項33記載の方法。
【請求項37】
前記肝実質細胞の第一及び第二培養物が、小管網をさらに含む、請求項33記載の方法。
【請求項38】
前記肝実質細胞の第一及び第二培養物が、肝実質細胞のクラスター、肝実質細胞の凝集体、肝実質細胞の少なくとも1つの層、及びそれらの組合せからなる群から選択された形態を有するものとして、さらに特徴付けられる、請求項33記載の方法。
【請求項39】
前記肝実質細胞が、マトリックス内に埋め込まれている、請求項38記載の方法。
【請求項40】
前記肝実質細胞の第一及び第二培養物が、肝実質細胞のサンドイッチ培養物をさらに含み、該サンドイッチ培養物は、肝実質細胞の少なくとも1つの層、及び該肝実質細胞の少なくとも1つの層内に少なくとも1つの毛細胆管を含む、請求項38記載の方法。
【請求項41】
前記サンドイッチ培養物が、長時間サンドイッチ培養物をさらに含む、請求項40記載の方法。
【請求項42】
前記肝実質細胞の少なくとも1つの層が、マトリックスの2つの層間に挟まれている、請求項40記載の方法。
【請求項43】
前記マトリックスが、生物学的マトリックス培地、合成マトリックス培地培地、及びそれらの組合せからなる群から選択される、請求項42記載の方法。
【請求項44】
前記生物学的マトリックス培地が、コラーゲン、ラミニン、基底膜誘導化複合体、それらの誘導体、及びそれらの組合せからなる群から選択される、請求項43記載の方法。
【請求項45】
前記輸送タンパク質が、NTCP、OATP1A1、OATP1A2、OATP1A4、OATPB2、OATP1B1、OATP1B3、OATP2B1、OAT2、OAT3、OAT4、OCT1、OCT3、OCTN1、OCTN2、BSEP、MRP1、MRP2、MRP3、MRP4、MRP5、MRP6、MRP7、MRP8、MRP9、MDR1、MDR1A/B、MDR2、MDR3、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せからなる群から選択される、請求項33記載の方法。
【請求項46】
胆汁中排泄への感受性に対する複数の候補化合物を同時にスクリーニングすることをさらに含む、請求項33記載の方法。
【請求項47】
前記第二培養中の物肝実質細胞輸送タンパク質の発現を阻害することが、リボ核酸(RNA)を、該肝実質細胞輸送タンパク質の発現阻害に十分な量で、複数の肝実質細胞の少なくとも1つに導入することを含み、ここで、該RNAは、該輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含んでいる、請求項33記載の方法。
【請求項48】
前記遺伝子が、NTCP、OATP1A1、OATP1A2、OATP1A4、OATPB2、OATP1B1、OATP1B3、OATP2B1、OAT2、OAT3、OAT4、OCT1、OCT3、OCTN1、OCTN2、BSEP、MRP1、MRP2、MRP3、MRP4、MRP5、MRP6、MRP7、MRP8、MRP9、MDR1、MDR1A/B、MDR2、MDR3、BCRP、ABCG5、ABCG8、及びFIC-1からなる群から選択されたポリペプチドをコード化している、請求項47記載の方法。
【請求項49】
前記遺伝子が、配列番号:1、及び2のいずれか1つのヌクレオチド配列を含む、請求項48記載の方法。
【請求項50】
前記RNAが、前記肝実質細胞輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含む第一鎖と、該第一鎖に相補的なリボヌクレオチド配列とを含む第二鎖とを含有した二本鎖領域を含み、かつ該第一鎖と該第二鎖とが、互いにハイブリダイズして、二本鎖分子を形成する、請求項47記載の方法。
【請求項51】
前記二本鎖領域が、少なくとも15塩基対長さである、請求項50記載の方法。
【請求項52】
前記二本鎖領域が、15〜50塩基対長さである、請求項51記載の方法。
【請求項53】
前記二本鎖領域が、15〜30塩基対長さである、請求項52記載の方法。
【請求項54】
前記RNAが、分子内自己ハイブリダイゼーションにより二本鎖領域を形成している一本鎖を含む、請求項47記載の方法。
【請求項55】
前記二本鎖領域が、少なくとも19塩基にわたって相補的である、請求項54記載の方法。
【請求項56】
前記RNAが、分子間ハイブリダイゼーションにより二本鎖領域を形成している2つの別個の鎖を含み、該二本鎖領域が、少なくとも19塩基にわたって相補的である、請求項50記載の方法。
【請求項57】
前記RNAが、配列番号:3、4、及び5のいずれか1つのヌクレオチド配列を含む、請求項47記載の方法。
【請求項58】
前記肝実質細胞輸送タンパク質をコード化している遺伝子の発現が、少なくとも10%阻害される、請求項46記載の方法。
【請求項59】
前記RNAをコード化しているベクターを、前記第二培養物中の複数の肝実質細胞の少なくとも1つの中に導入することをさらに含む、請求項47記載の方法。
【請求項60】
前記RNAを、前記第二培養物中の複数の肝実質細胞の少なくとも1つの中に導入することが、前記RNAを、前記第二培養物中の複数の肝実質細胞の少なくとも1つの中にトランスフェクトすることを含む、請求項47記載の方法。
【請求項61】
前記RNAを、前記第二培養物中の複数の肝実質細胞の少なくとも1つの中に導入することが、前記RNAをコード化している組換えウイルスで、前記第二培養物中の複数の肝実質細胞の少なくとも1つを感染させることを含む、請求項47記載の方法。
【請求項62】
肝実質細胞中のタンパク質発現の阻害方法であって:
(a)タンパク質を発現する肝実質細胞を提供すること;及び
(b)オリゴヌクレオチドを、該タンパク質の発現阻害に十分な量で、該肝実質細胞内に導入することを含み、ここで、該オリゴヌクレオチドは、該タンパク質をコード化している遺伝子のコード鎖に相当するヌクレオチド配列を含んでいる、前記方法。
【請求項63】
前記肝実質細胞が、生物体内に存在し、かつ前記オリゴヌクレオチドが、該生物体内に導入される、請求項62記載の方法。
【請求項64】
前記生物体が、哺乳動物である、請求項63記載の方法。
【請求項65】
前記オリゴヌクレオチドが、リボ核酸(RNA)である、請求項62記載の方法。
【請求項66】
前記RNAをコード化しているベクターを、前記肝実質細胞内に導入することをさらに含む、請求項65記載の方法。
【請求項67】
前記肝実質細胞が、培養物中に存在する、請求項62記載の方法。
【請求項68】
前記肝実質細胞が、ラット、ヒト、サル、類人猿、ネコ、イヌ、ブタ、雄ブタ、ウシ、雄ウシ、ヒツジ、ウマ、シチメンチョウ、ニワトリ、カモ、及びガンからなる群から選択された供給源から単離されたものである、請求項62記載の方法。
【請求項69】
前記肝実質細胞の培養物が、肝実質細胞の長時間培養物をさらに含む、請求項67記載の方法。
【請求項70】
前記肝実質細胞の培養物が、小管網をさらに含む、請求項67記載の方法。
【請求項71】
前記肝実質細胞の培養物が、肝実質細胞のクラスター、肝実質細胞の凝集体、肝実質細胞の少なくとも1つの層、及びそれらの組合せからなる群から選択された形態を有するものとして、さらに特徴付けられる、請求項67記載の方法。
【請求項72】
前記肝実質細胞が、マトリックス内に埋め込まれている、請求項71記載の方法。
【請求項73】
前記肝実質細胞の培養物が、肝実質細胞のサンドイッチ培養物をさらに含み、該サンドイッチ培養物は、肝実質細胞の少なくとも1つの層、及び該肝実質細胞の少なくとも1つの層とともに少なくとも1つの毛細胆管を含む、請求項71記載の方法。
【請求項74】
前記肝実質細胞のサンドイッチ培養物が、肝実質細胞の長時間サンドイッチ培養物をさらに含む、請求項73記載の方法。
【請求項75】
前記肝実質細胞の少なくとも1つの層が、マトリックスの2つの層間に挟まれている、請求項73記載の方法。
【請求項76】
前記マトリックスが、生物学的マトリックス培地、合成マトリックス培地培地、及びそれらの組合せからなる群から選択される、請求項75記載の方法。
【請求項77】
前記生物学的マトリックス培地が、コラーゲン、ラミニン、基底膜誘導化複合体、それらの誘導体、及びそれらの組合せからなる群から選択される、請求項75記載の方法。
【請求項78】
前記タンパク質が、輸送タンパク質である、請求項62記載の方法。
【請求項79】
前記輸送タンパク質が、ヒト輸送タンパク質である、請求項78記載の方法。
【請求項80】
前記輸送タンパク質が、げっ歯類の輸送タンパク質である、請求項78記載の方法。
【請求項81】
前記輸送タンパク質が、NTCP, OATP1A2, OATP1B1, OATP1B3, OATP2B1, OAT2, OAT4, OCT1, OCT3, OCTN1, OCTN2, BSEP, MRP1, MRP2, MRP3, MRP4, MRP5, MRP6, MRP7, MRP8, MRP9, MDR1, MDR3, BCRP, ABCG5, ABCG8, FIC-1, and それらの組合せからなる群から選択される、請求項79記載の方法。
【請求項82】
前記遺伝子が、NTCP、OATP1A2、OATP1B1、OATP1B3、OATP2B1、OAT2、OAT4、OCT1、OCT3、OCTN1、OCTN2、BSEP、MRP1、MRP2、MRP3、MRP4、MRP5、MRP6、MRP7、MRP8、MRP9、MDR1、MDR3、BCRP、ABCG5、ABCG8、及びFIC-1からなる群から選択される、請求項79記載の方法。
【請求項83】
前記輸送タンパク質が、Ntcp、Oatp1a1、Oatp1a4、Oatpb2、Oat2、Oat3、Oct1、Octn1、Octn2、Bsep、Mrp1、Mrp2、Mrp3、Mrp4、Mrp5、Mrp6、Mrp7、Mrp8、Mrp9、Mdr1a/b、Mdr2、Bcrp、及びそれらの組合せからなる群から選択される、請求項80記載の方法。
【請求項84】
前記遺伝子が、Ntcp、Oatp1a1、Oatp1a4、Oatpb2、Oat2、Oat3、Oct1、Octn1、Octn2、Bsep、Mrp1、Mrp2、Mrp3、Mrp4、Mrp5、Mrp6、Mrp7、Mrp8、Mrp9、Mdr1a/b、Mdr2、及びBcrpからなる群から選択される、請求項80記載の方法。
【請求項85】
前記遺伝子が、配列番号:1、及び2のいずれか1つのヌクレオチド配列を含む、請求項84記載の方法。
【請求項86】
前記RNAが、前記肝実質細胞輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含む第一鎖と、該第一鎖に相補的なリボヌクレオチド配列を含む第二鎖とを含有した二本鎖領域を含み、かつ該第一鎖と該第二鎖とが、互いにハイブリダイズして、二本鎖分子を形成する、請求項65記載の方法。
【請求項87】
前記二本鎖領域が、少なくとも15塩基対長さである、請求項86記載の方法。
【請求項88】
前記二本鎖領域が、15〜50塩基対長さである、請求項87記載の方法。
【請求項89】
前記二本鎖領域が、15〜30塩基対長さである、請求項88記載の方法。
【請求項90】
前記RNAが、分子内自己ハイブリダイゼーションにより二本鎖領域を形成している一本鎖を含む、請求項86記載の方法。
【請求項91】
前記二本鎖領域が、少なくとも19塩基にわたって相補的である、請求項90記載の方法。
【請求項92】
前記RNAが、分子間ハイブリダイゼーションにより二本鎖領域を形成している2つの別個の鎖を含む、請求項86記載の方法。
【請求項93】
前記二本鎖領域が、少なくとも19塩基にわたって相補的である、請求項92記載の方法。
【請求項94】
前記RNAが、配列番号:3,4、及び5のいずれか1つのヌクレオチド配列を含む、請求項65記載の方法。
【請求項95】
前記タンパク質をコード化している遺伝子の発現が、少なくとも10%阻害される、請求項62記載の方法。
【請求項96】
前記オリゴヌクレオチドを、前記肝実質細胞内に導入することが、前記オリゴヌクレオチドを、前記肝実質細胞内にトランスフェクトすることを含む、請求項62記載の方法。
【請求項97】
肝実質細胞タンパク質の発現を阻害する、単離した短い干渉RNA(siRNA)分子。
【請求項98】
前記タンパク質が、肝実質細胞輸送タンパク質である、請求項97記載のsiRNA分子。
【請求項99】
前記肝実質細胞輸送タンパク質が、ヒト肝実質細胞輸送タンパク質である、請求項98記載のsiRNA分子。
【請求項100】
前記肝実質細胞輸送タンパク質が、げっ歯類の肝実質細胞輸送タンパク質である、請求項98記載のsiRNA分子。
【請求項101】
前記肝実質細胞輸送タンパク質が、NTCP、OATP1A2、OATP1B1、OATP1B3、OATP2B1、OAT2、OAT4、OCT1、OCT3、OCTN1、OCTN2、BSEP、MRP1、MRP2、MRP3、MRP4、MRP5、MRP6、MRP7、MRP8、MRP9、MDR1、MDR3、BCRP、ABCG5、ABCG8、及びFIC-1からなる群から選択されたものである、請求項99記載のsiRNA分子。
【請求項102】
前記肝実質細胞輸送タンパク質が、Ntcp、Oatp1a1、Oatp1a4、Oatpb2、Oat2、Oat3、Oct1、Octn1、Octn2、Bsep、Mrp1、Mrp2、Mrp3、Mrp4、Mrp5、Mrp6、Mrp7、Mrp8、Mrp9、Mdr1a/b、Mdr2、及びBcrpからなる群から選択されたものである、請求項100記載のsiRNA分子。
【請求項103】
前記siRNA分子が、センス領域、及びアンチセンス領域を含み、ここで、該アンチセンス領域は、前記肝実質細胞輸送タンパク質をコード化しているRNA配列に相補的な核酸配列を含み、かつ該センス領域は、該アンチセンス領域に相補的な核酸配列を含んでいる、請求項97記載のsiRNA分子。
【請求項104】
前記siRNA分子のセンス領域、及びアンチセンス領域から構築されている、請求項103記載のsiRNA分子。
【請求項105】
前記センス領域、及び前記アンチセンス領域が、リンカー分子を介して、共有結合している、請求項104記載のsiRNA分子。
【請求項106】
前記リンカー分子が、ポリヌクレオチドリンカーである、請求項105記載のsiRNA分子。
【請求項107】
前記ポリヌクレオチドリンカーが、5〜9個のヌクレオチドを含む、請求項106記載のsiRNA分子。
【請求項108】
前記リンカー分子が、非ヌクレオチドリンカーである、請求項105記載のsiRNA分子。
【請求項109】
前記センス領域が、配列番号:3、4、及び5のいずれか1つのヌクレオチドの部分列を、連続して19〜30個含み、かつ前記アンチセンス領域が、該センス領域の逆相補体を含んでいる、請求項103記載のsiRNA分子。
【請求項110】
前記センス領域、及び前記アンチセンス領域の少なくとも1つが、3'-突出末端を含む、請求項103記載のsiRNA分子。
【請求項111】
前記3'-突出末端の各々が、2〜8個のヌクレオチドを含む、請求項110記載のsiRNA分子。
【請求項112】
前記3'-突出末端ヌクレオチドが、1以上の化学的に改質されたヌクレオチドを含む、請求項110記載のsiRNA分子。
【請求項113】
請求項95記載のsiRNA分子、及びキャリアを含む、組成物。
【請求項114】
請求項97記載のsiRNA分子の少なくとも1つをコード化している核酸配列を含む、発現ベクター。
【請求項115】
請求項114記載の発現ベクターを含む、哺乳動物細胞。
【請求項116】
ヒト細胞である、請求項115記載の哺乳動物細胞。
【請求項117】
肝実質細胞である、請求項115記載の哺乳動物細胞。
【請求項118】
請求項114記載の発現ベクターを含む、組換えウイルス。
【請求項119】
組換えアデノウイルスである、請求項118記載の組換えウイルス。
【請求項1】
肝実質細胞輸送タンパク質による胆汁中排泄への感受性に対する候補化合物のスクーリング方法であって、
(a)複数の肝実質細胞、及び少なくとも1つの毛細胆管を含む細胞培養物を提供すること、ここで、該肝実質細胞の少なくとも1つは、輸送タンパク質を含み;
(b)該培養物に候補化合物を曝露すること;及び
(c)該少なくとも1つの毛細胆管中の該候補化合物の量を決定し、それによって、該肝実質細胞輸送タンパク質による胆汁中排泄への感受性に対する該候補化合物をスクリーニングすることを含む、前記方法。
【請求項2】
前記肝実質細胞が、ラット、ヒト、サル、類人猿、ネコ、イヌ、ブタ、雄ブタ、ウシ、雄ウシ、ヒツジ、ウマ、シチメンチョウ、ニワトリ、カモ、及びガンからなる群から選択された供給源から単離されたものである、請求項1記載の方法。
【請求項3】
前記肝実質細胞の培養物が、肝実質細胞の長時間培養物をさらに含む、請求項1記載の方法。
【請求項4】
前記肝実質細胞の培養物が、小管網をさらに含む、請求項1記載の方法。
【請求項5】
前記肝実質細胞の培養物が、肝実質細胞のクラスター、肝実質細胞の凝集体、肝実質細胞の少なくとも1つの層、及びそれらの組合せからなる群から選択された形態を有するものとして、さらに特徴付けられる、請求項1記載の方法。
【請求項6】
前記肝実質細胞が、マトリックス内に埋め込まれている、請求項5記載の方法。
【請求項7】
前記肝実質細胞の培養物が、肝実質細胞のサンドイッチ培養物をさらに含み、該サンドイッチ培養物は、肝実質細胞の少なくとも1つの層、及び該肝実質細胞の少なくとも1つの層とともに少なくとも1つの毛細胆管を含む、請求項5記載の方法。
【請求項8】
前記肝実質細胞のサンドイッチ培養物が、肝実質細胞の長時間サンドイッチ培養物を含む、請求項7記載の方法。
【請求項9】
前記肝実質細胞の少なくとも1つの層が、マトリックスの2つの層間に挟まれている、請求項7記載の方法。
【請求項10】
前記マトリックスが、生物学的マトリックス培地、合成マトリックス培地培地、及びそれらの組合せからなる群から選択される、請求項9記載の方法。
【請求項11】
前記生物学的マトリックス培地が、コラーゲン、ラミニン、基底膜誘導化複合体、それらの誘導体、及びそれらの組合せからなる群から選択される、請求項10記載の方法。
【請求項12】
前記輸送タンパク質が、NTCP、OATP1A1、OATP1A2、OATP1A4、OATPB2、OATP1B1、OATP1B3、OATP2B1、OAT2、OAT3、OAT4、OCT1、OCT3、OCTN1、OCTN2、BSEP、MRP1、MRP2、MRP3、MRP4、MRP5、MRP6、MRP7、MRP8、MRP9、MDR1、MDR1A/B、MDR2、MDR3、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せからなる群から選択される、請求項1記載の方法。
【請求項13】
複数の候補化合物を同時にスクリーニングすることをさらに含む、請求項1記載の方法。
【請求項14】
前記少なくとも1つの毛細胆管中の前記候補化合物の量を決定することが:
(a)取り込み、該候補化合物、及び予め選択された量のラベル化基質を可能にするのに十分な時間、該培養液に同時に曝露すること;
(b)該培養物を洗浄すること;及び
(c)少なくとも1つの毛細胆管中に存在する該ラベル化基質の量を決定して、該肝実質細胞輸送タンパク質による胆汁中排泄に対する該候補化合物と該ラベル化基質との間の競合を評価することを含み、該予め選択された量のラベル化基質と比較して、該少なくとも1つの毛細胆管中のラベル化基質の減少量の存在が、該輸送タンパク質による胆汁中排泄への該候補化合物の感受性を示す、請求項1記載の方法。
【請求項15】
前記ラベル化基質が、蛍光発生化合物、蛍光化合物、化学発光化合物、比色定量用化合物、放射標識化合物、及びそれらの組合せからなる群から選択される、請求項13記載の方法。
【請求項16】
前記少なくとも1つの毛細胆管中の該候補化合物の量を決定することが:該肝実質細胞輸送タンパク質の発現を阻害し、かつ少なくとも1つの毛細胆管中に存在する該候補化合物の量を検出することを含み、該肝実質細胞輸送タンパク質の発現が、阻害されない場合、該少なくとも1つの毛細胆管中の該候補化合物と比較して、該少なくとも1つの毛細胆管中の該ラベル化基質の減少量の存在が、該肝実質細胞輸送タンパク質による胆汁中排泄への該候補化合物の感受性を示す、請求項1記載の方法。
【請求項17】
前記肝実質細胞輸送タンパク質の発現を阻害することが、リボ核酸(RNA)を、該肝実質細胞輸送タンパク質の発現阻害に十分な量で、複数の肝実質細胞の少なくとも1つに導入することを含み、ここで、該RNAは、該輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含んでいる、請求項16記載の方法。
【請求項18】
前記遺伝子が、NTCP、OATP1A1、OATP1A2、OATP1A4、OATPB2、OATP1B1、OATP1B3、OATP2B1、OAT2、OAT3、OAT4、OCT1、OCT3、OCTN1、OCTN2、BSEP、MRP1、MRP2、MRP3、MRP4、MRP5、MRP6、MRP7、MRP8、MRP9、MDR1、MDR1A/B、MDR2、MDR3、BCRP、ABCG5、ABCG8、及びFIC-1からなる群から選択されたポリペプチドをコード化している、請求項17記載の方法。
【請求項19】
前記遺伝子が、配列番号:1、及び2のいずれか1つのヌクレオチド配列を含む、請求項18記載の方法。
【請求項20】
前記RNAが、前記肝実質細胞輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含む第一鎖と、該第一鎖に相補的なリボヌクレオチド配列を含む第二鎖とを含有した二本鎖領域を含み、かつ該第一鎖と該第二鎖とが、互いにハイブリダイズして、二本鎖分子を形成する、請求項17記載の方法。
【請求項21】
前記二本鎖領域が、少なくとも15塩基対長さである、請求項20記載の方法。
【請求項22】
前記二本鎖領域が、15〜50塩基対長さである、請求項21記載の方法。
【請求項23】
前記二本鎖領域が、15〜30塩基対長さである、請求項22記載の方法。
【請求項24】
前記RNAが、分子内自己ハイブリダイゼーションにより二本鎖領域を形成している一本鎖を含む、請求項17記載の方法。
【請求項25】
前記二本鎖領域が、少なくとも19塩基にわたって相補的である、請求項24記載の方法。
【請求項26】
前記RNAが、分子間ハイブリダイゼーションにより二本鎖領域を形成している2つの別個の鎖を含み、該二本鎖領域は、少なくとも19塩基にわたって相補的である、請求項20記載の方法。
【請求項27】
前記RNAが、配列番号:3、4、及び5のいずれか1つのヌクレオチド配列を含む、請求項17記載の方法。
【請求項28】
前記輸送タンパク質をコード化している遺伝子の発現が、少なくとも10%阻害される、請求項17記載の方法。
【請求項29】
前記RNAをコード化しているベクターを、前記複数の肝実質細胞の少なくとも1つの中に導入することをさらに含む、請求項17記載の方法。
【請求項30】
前記RNAを、前記複数の肝実質細胞の少なくとも1つの中に導入することは、前記RNAを、前記複数の肝実質細胞の少なくとも1つの中にトランスフェクトすることを含む、請求項17記載の方法。
【請求項31】
前記RNAを、前記複数の肝実質細胞の少なくとも1つの中に導入することは、前記複数の肝実質細胞の少なくとも1つを、前記RNAをコード化している組換えウイルスで感染させることを含む、請求項17記載の方法。
【請求項32】
前記少なくとも1つの毛細胆管中の前記候補化合物の量が、該培養物中の胆汁クリアランス値を計算することにより決定される、請求項1記載の方法。
【請求項33】
肝実質細胞輸送タンパク質による胆汁中排泄への感受性に対する候補化合物をスクリーニングする方法であって:
(a)第一及び第二細胞培養物を確立すること、ここで、各第一及び第二培養物は、複数の肝実質細胞、及び少なくとも1つの毛細胆管を含み、該第一培養物は、輸送タンパク質を発現し、かつ該第二培養物は、該輸送タンパク質の発現を少なくとも部分的に阻害し;
(b)該第一培養液、及び該第二培養液に候補化合物を、該候補化合物の取り込みに十分な時間、曝露すること;
(c)該第一及び第二培養物を洗浄し、かつ溶解すること;
(d)段階(c)の各培養物から得られた溶解産物の中に存在する該候補化合物の量を決定すること、及び各培養溶解産物中の該候補化合物の量を使用して、該輸送タンパク質による胆汁中排泄への感受性に対する候補化合物を評価することを含む、前記方法。
【請求項34】
第一及び第二培養物の各々を、無処置の毛細胆管を有する該第一及び第二培養物の各々の第一分画、並びに破壊した毛細胆管を有する該第一及び第二培養物の各々の第二分画の、2つの分画に分離し、かつ下記段階を含む、請求項33記載の方法:
(i)候補化合物を、該第一及び第二培養物の各々の第一分画、並びに該第一及び第二培養物の各々の第二分画に、該候補化合物の取り込みに十分な時間(T)曝露し;
(ii)該第一及び第二培養物の各々の第一及び第二分画を洗浄し、かつ溶解すること;
(iii)段階(ii)の該第一及び第二培養物の各々の各分画から得られた溶解産物の中に存在する、該候補化合物の量を測定すること;v
(iv)該毛細胆管内の質量を、無処置の毛細胆管を有する該第一及び第二培養物の第一分画、並びに破壊した毛細胆管を有する第一及び第二培養物の第二分画からの溶解産物の中に存在する候補化合物の量の差として計算すること;及び
(v)段階(iv)で計算された質量を用いて、該輸送タンパク質による胆汁中排泄への感受性に対する候補化合物を評価すること。
【請求項35】
前記肝実質細胞が、ラット、ヒト、サル、類人猿、ネコ、イヌ、ブタ、雄ブタ、ウシ、雄ウシ、ヒツジ、ウマ、シチメンチョウ、ニワトリ、カモ、及びガンからなる群から選択された供給源から単離されたものである、請求項33記載の方法。
【請求項36】
前記肝実質細胞の第一及び第二培養物の各々が、肝実質細胞の長時間培養物をさらに含む、請求項33記載の方法。
【請求項37】
前記肝実質細胞の第一及び第二培養物が、小管網をさらに含む、請求項33記載の方法。
【請求項38】
前記肝実質細胞の第一及び第二培養物が、肝実質細胞のクラスター、肝実質細胞の凝集体、肝実質細胞の少なくとも1つの層、及びそれらの組合せからなる群から選択された形態を有するものとして、さらに特徴付けられる、請求項33記載の方法。
【請求項39】
前記肝実質細胞が、マトリックス内に埋め込まれている、請求項38記載の方法。
【請求項40】
前記肝実質細胞の第一及び第二培養物が、肝実質細胞のサンドイッチ培養物をさらに含み、該サンドイッチ培養物は、肝実質細胞の少なくとも1つの層、及び該肝実質細胞の少なくとも1つの層内に少なくとも1つの毛細胆管を含む、請求項38記載の方法。
【請求項41】
前記サンドイッチ培養物が、長時間サンドイッチ培養物をさらに含む、請求項40記載の方法。
【請求項42】
前記肝実質細胞の少なくとも1つの層が、マトリックスの2つの層間に挟まれている、請求項40記載の方法。
【請求項43】
前記マトリックスが、生物学的マトリックス培地、合成マトリックス培地培地、及びそれらの組合せからなる群から選択される、請求項42記載の方法。
【請求項44】
前記生物学的マトリックス培地が、コラーゲン、ラミニン、基底膜誘導化複合体、それらの誘導体、及びそれらの組合せからなる群から選択される、請求項43記載の方法。
【請求項45】
前記輸送タンパク質が、NTCP、OATP1A1、OATP1A2、OATP1A4、OATPB2、OATP1B1、OATP1B3、OATP2B1、OAT2、OAT3、OAT4、OCT1、OCT3、OCTN1、OCTN2、BSEP、MRP1、MRP2、MRP3、MRP4、MRP5、MRP6、MRP7、MRP8、MRP9、MDR1、MDR1A/B、MDR2、MDR3、BCRP、ABCG5、ABCG8、FIC-1、及びそれらの組合せからなる群から選択される、請求項33記載の方法。
【請求項46】
胆汁中排泄への感受性に対する複数の候補化合物を同時にスクリーニングすることをさらに含む、請求項33記載の方法。
【請求項47】
前記第二培養中の物肝実質細胞輸送タンパク質の発現を阻害することが、リボ核酸(RNA)を、該肝実質細胞輸送タンパク質の発現阻害に十分な量で、複数の肝実質細胞の少なくとも1つに導入することを含み、ここで、該RNAは、該輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含んでいる、請求項33記載の方法。
【請求項48】
前記遺伝子が、NTCP、OATP1A1、OATP1A2、OATP1A4、OATPB2、OATP1B1、OATP1B3、OATP2B1、OAT2、OAT3、OAT4、OCT1、OCT3、OCTN1、OCTN2、BSEP、MRP1、MRP2、MRP3、MRP4、MRP5、MRP6、MRP7、MRP8、MRP9、MDR1、MDR1A/B、MDR2、MDR3、BCRP、ABCG5、ABCG8、及びFIC-1からなる群から選択されたポリペプチドをコード化している、請求項47記載の方法。
【請求項49】
前記遺伝子が、配列番号:1、及び2のいずれか1つのヌクレオチド配列を含む、請求項48記載の方法。
【請求項50】
前記RNAが、前記肝実質細胞輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含む第一鎖と、該第一鎖に相補的なリボヌクレオチド配列とを含む第二鎖とを含有した二本鎖領域を含み、かつ該第一鎖と該第二鎖とが、互いにハイブリダイズして、二本鎖分子を形成する、請求項47記載の方法。
【請求項51】
前記二本鎖領域が、少なくとも15塩基対長さである、請求項50記載の方法。
【請求項52】
前記二本鎖領域が、15〜50塩基対長さである、請求項51記載の方法。
【請求項53】
前記二本鎖領域が、15〜30塩基対長さである、請求項52記載の方法。
【請求項54】
前記RNAが、分子内自己ハイブリダイゼーションにより二本鎖領域を形成している一本鎖を含む、請求項47記載の方法。
【請求項55】
前記二本鎖領域が、少なくとも19塩基にわたって相補的である、請求項54記載の方法。
【請求項56】
前記RNAが、分子間ハイブリダイゼーションにより二本鎖領域を形成している2つの別個の鎖を含み、該二本鎖領域が、少なくとも19塩基にわたって相補的である、請求項50記載の方法。
【請求項57】
前記RNAが、配列番号:3、4、及び5のいずれか1つのヌクレオチド配列を含む、請求項47記載の方法。
【請求項58】
前記肝実質細胞輸送タンパク質をコード化している遺伝子の発現が、少なくとも10%阻害される、請求項46記載の方法。
【請求項59】
前記RNAをコード化しているベクターを、前記第二培養物中の複数の肝実質細胞の少なくとも1つの中に導入することをさらに含む、請求項47記載の方法。
【請求項60】
前記RNAを、前記第二培養物中の複数の肝実質細胞の少なくとも1つの中に導入することが、前記RNAを、前記第二培養物中の複数の肝実質細胞の少なくとも1つの中にトランスフェクトすることを含む、請求項47記載の方法。
【請求項61】
前記RNAを、前記第二培養物中の複数の肝実質細胞の少なくとも1つの中に導入することが、前記RNAをコード化している組換えウイルスで、前記第二培養物中の複数の肝実質細胞の少なくとも1つを感染させることを含む、請求項47記載の方法。
【請求項62】
肝実質細胞中のタンパク質発現の阻害方法であって:
(a)タンパク質を発現する肝実質細胞を提供すること;及び
(b)オリゴヌクレオチドを、該タンパク質の発現阻害に十分な量で、該肝実質細胞内に導入することを含み、ここで、該オリゴヌクレオチドは、該タンパク質をコード化している遺伝子のコード鎖に相当するヌクレオチド配列を含んでいる、前記方法。
【請求項63】
前記肝実質細胞が、生物体内に存在し、かつ前記オリゴヌクレオチドが、該生物体内に導入される、請求項62記載の方法。
【請求項64】
前記生物体が、哺乳動物である、請求項63記載の方法。
【請求項65】
前記オリゴヌクレオチドが、リボ核酸(RNA)である、請求項62記載の方法。
【請求項66】
前記RNAをコード化しているベクターを、前記肝実質細胞内に導入することをさらに含む、請求項65記載の方法。
【請求項67】
前記肝実質細胞が、培養物中に存在する、請求項62記載の方法。
【請求項68】
前記肝実質細胞が、ラット、ヒト、サル、類人猿、ネコ、イヌ、ブタ、雄ブタ、ウシ、雄ウシ、ヒツジ、ウマ、シチメンチョウ、ニワトリ、カモ、及びガンからなる群から選択された供給源から単離されたものである、請求項62記載の方法。
【請求項69】
前記肝実質細胞の培養物が、肝実質細胞の長時間培養物をさらに含む、請求項67記載の方法。
【請求項70】
前記肝実質細胞の培養物が、小管網をさらに含む、請求項67記載の方法。
【請求項71】
前記肝実質細胞の培養物が、肝実質細胞のクラスター、肝実質細胞の凝集体、肝実質細胞の少なくとも1つの層、及びそれらの組合せからなる群から選択された形態を有するものとして、さらに特徴付けられる、請求項67記載の方法。
【請求項72】
前記肝実質細胞が、マトリックス内に埋め込まれている、請求項71記載の方法。
【請求項73】
前記肝実質細胞の培養物が、肝実質細胞のサンドイッチ培養物をさらに含み、該サンドイッチ培養物は、肝実質細胞の少なくとも1つの層、及び該肝実質細胞の少なくとも1つの層とともに少なくとも1つの毛細胆管を含む、請求項71記載の方法。
【請求項74】
前記肝実質細胞のサンドイッチ培養物が、肝実質細胞の長時間サンドイッチ培養物をさらに含む、請求項73記載の方法。
【請求項75】
前記肝実質細胞の少なくとも1つの層が、マトリックスの2つの層間に挟まれている、請求項73記載の方法。
【請求項76】
前記マトリックスが、生物学的マトリックス培地、合成マトリックス培地培地、及びそれらの組合せからなる群から選択される、請求項75記載の方法。
【請求項77】
前記生物学的マトリックス培地が、コラーゲン、ラミニン、基底膜誘導化複合体、それらの誘導体、及びそれらの組合せからなる群から選択される、請求項75記載の方法。
【請求項78】
前記タンパク質が、輸送タンパク質である、請求項62記載の方法。
【請求項79】
前記輸送タンパク質が、ヒト輸送タンパク質である、請求項78記載の方法。
【請求項80】
前記輸送タンパク質が、げっ歯類の輸送タンパク質である、請求項78記載の方法。
【請求項81】
前記輸送タンパク質が、NTCP, OATP1A2, OATP1B1, OATP1B3, OATP2B1, OAT2, OAT4, OCT1, OCT3, OCTN1, OCTN2, BSEP, MRP1, MRP2, MRP3, MRP4, MRP5, MRP6, MRP7, MRP8, MRP9, MDR1, MDR3, BCRP, ABCG5, ABCG8, FIC-1, and それらの組合せからなる群から選択される、請求項79記載の方法。
【請求項82】
前記遺伝子が、NTCP、OATP1A2、OATP1B1、OATP1B3、OATP2B1、OAT2、OAT4、OCT1、OCT3、OCTN1、OCTN2、BSEP、MRP1、MRP2、MRP3、MRP4、MRP5、MRP6、MRP7、MRP8、MRP9、MDR1、MDR3、BCRP、ABCG5、ABCG8、及びFIC-1からなる群から選択される、請求項79記載の方法。
【請求項83】
前記輸送タンパク質が、Ntcp、Oatp1a1、Oatp1a4、Oatpb2、Oat2、Oat3、Oct1、Octn1、Octn2、Bsep、Mrp1、Mrp2、Mrp3、Mrp4、Mrp5、Mrp6、Mrp7、Mrp8、Mrp9、Mdr1a/b、Mdr2、Bcrp、及びそれらの組合せからなる群から選択される、請求項80記載の方法。
【請求項84】
前記遺伝子が、Ntcp、Oatp1a1、Oatp1a4、Oatpb2、Oat2、Oat3、Oct1、Octn1、Octn2、Bsep、Mrp1、Mrp2、Mrp3、Mrp4、Mrp5、Mrp6、Mrp7、Mrp8、Mrp9、Mdr1a/b、Mdr2、及びBcrpからなる群から選択される、請求項80記載の方法。
【請求項85】
前記遺伝子が、配列番号:1、及び2のいずれか1つのヌクレオチド配列を含む、請求項84記載の方法。
【請求項86】
前記RNAが、前記肝実質細胞輸送タンパク質をコード化している遺伝子のコード鎖に相当するリボヌクレオチド配列を含む第一鎖と、該第一鎖に相補的なリボヌクレオチド配列を含む第二鎖とを含有した二本鎖領域を含み、かつ該第一鎖と該第二鎖とが、互いにハイブリダイズして、二本鎖分子を形成する、請求項65記載の方法。
【請求項87】
前記二本鎖領域が、少なくとも15塩基対長さである、請求項86記載の方法。
【請求項88】
前記二本鎖領域が、15〜50塩基対長さである、請求項87記載の方法。
【請求項89】
前記二本鎖領域が、15〜30塩基対長さである、請求項88記載の方法。
【請求項90】
前記RNAが、分子内自己ハイブリダイゼーションにより二本鎖領域を形成している一本鎖を含む、請求項86記載の方法。
【請求項91】
前記二本鎖領域が、少なくとも19塩基にわたって相補的である、請求項90記載の方法。
【請求項92】
前記RNAが、分子間ハイブリダイゼーションにより二本鎖領域を形成している2つの別個の鎖を含む、請求項86記載の方法。
【請求項93】
前記二本鎖領域が、少なくとも19塩基にわたって相補的である、請求項92記載の方法。
【請求項94】
前記RNAが、配列番号:3,4、及び5のいずれか1つのヌクレオチド配列を含む、請求項65記載の方法。
【請求項95】
前記タンパク質をコード化している遺伝子の発現が、少なくとも10%阻害される、請求項62記載の方法。
【請求項96】
前記オリゴヌクレオチドを、前記肝実質細胞内に導入することが、前記オリゴヌクレオチドを、前記肝実質細胞内にトランスフェクトすることを含む、請求項62記載の方法。
【請求項97】
肝実質細胞タンパク質の発現を阻害する、単離した短い干渉RNA(siRNA)分子。
【請求項98】
前記タンパク質が、肝実質細胞輸送タンパク質である、請求項97記載のsiRNA分子。
【請求項99】
前記肝実質細胞輸送タンパク質が、ヒト肝実質細胞輸送タンパク質である、請求項98記載のsiRNA分子。
【請求項100】
前記肝実質細胞輸送タンパク質が、げっ歯類の肝実質細胞輸送タンパク質である、請求項98記載のsiRNA分子。
【請求項101】
前記肝実質細胞輸送タンパク質が、NTCP、OATP1A2、OATP1B1、OATP1B3、OATP2B1、OAT2、OAT4、OCT1、OCT3、OCTN1、OCTN2、BSEP、MRP1、MRP2、MRP3、MRP4、MRP5、MRP6、MRP7、MRP8、MRP9、MDR1、MDR3、BCRP、ABCG5、ABCG8、及びFIC-1からなる群から選択されたものである、請求項99記載のsiRNA分子。
【請求項102】
前記肝実質細胞輸送タンパク質が、Ntcp、Oatp1a1、Oatp1a4、Oatpb2、Oat2、Oat3、Oct1、Octn1、Octn2、Bsep、Mrp1、Mrp2、Mrp3、Mrp4、Mrp5、Mrp6、Mrp7、Mrp8、Mrp9、Mdr1a/b、Mdr2、及びBcrpからなる群から選択されたものである、請求項100記載のsiRNA分子。
【請求項103】
前記siRNA分子が、センス領域、及びアンチセンス領域を含み、ここで、該アンチセンス領域は、前記肝実質細胞輸送タンパク質をコード化しているRNA配列に相補的な核酸配列を含み、かつ該センス領域は、該アンチセンス領域に相補的な核酸配列を含んでいる、請求項97記載のsiRNA分子。
【請求項104】
前記siRNA分子のセンス領域、及びアンチセンス領域から構築されている、請求項103記載のsiRNA分子。
【請求項105】
前記センス領域、及び前記アンチセンス領域が、リンカー分子を介して、共有結合している、請求項104記載のsiRNA分子。
【請求項106】
前記リンカー分子が、ポリヌクレオチドリンカーである、請求項105記載のsiRNA分子。
【請求項107】
前記ポリヌクレオチドリンカーが、5〜9個のヌクレオチドを含む、請求項106記載のsiRNA分子。
【請求項108】
前記リンカー分子が、非ヌクレオチドリンカーである、請求項105記載のsiRNA分子。
【請求項109】
前記センス領域が、配列番号:3、4、及び5のいずれか1つのヌクレオチドの部分列を、連続して19〜30個含み、かつ前記アンチセンス領域が、該センス領域の逆相補体を含んでいる、請求項103記載のsiRNA分子。
【請求項110】
前記センス領域、及び前記アンチセンス領域の少なくとも1つが、3'-突出末端を含む、請求項103記載のsiRNA分子。
【請求項111】
前記3'-突出末端の各々が、2〜8個のヌクレオチドを含む、請求項110記載のsiRNA分子。
【請求項112】
前記3'-突出末端ヌクレオチドが、1以上の化学的に改質されたヌクレオチドを含む、請求項110記載のsiRNA分子。
【請求項113】
請求項95記載のsiRNA分子、及びキャリアを含む、組成物。
【請求項114】
請求項97記載のsiRNA分子の少なくとも1つをコード化している核酸配列を含む、発現ベクター。
【請求項115】
請求項114記載の発現ベクターを含む、哺乳動物細胞。
【請求項116】
ヒト細胞である、請求項115記載の哺乳動物細胞。
【請求項117】
肝実質細胞である、請求項115記載の哺乳動物細胞。
【請求項118】
請求項114記載の発現ベクターを含む、組換えウイルス。
【請求項119】
組換えアデノウイルスである、請求項118記載の組換えウイルス。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9A】


【図9B】


【図10】


【図11】


【図12A】


【図12B】


【図13A】


【図13B】


【図13C】


【図13D】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9A】


【図9B】


【図10】


【図11】


【図12A】


【図12B】


【図13A】


【図13B】


【図13C】


【図13D】


【公表番号】特表2008−503204(P2008−503204A)
【公表日】平成20年2月7日(2008.2.7)
【国際特許分類】
【出願番号】特願2007−513265(P2007−513265)
【出願日】平成17年5月10日(2005.5.10)
【国際出願番号】PCT/US2005/016240
【国際公開番号】WO2005/118787
【国際公開日】平成17年12月15日(2005.12.15)
【出願人】(501345323)ザ ユニバーシティ オブ ノース カロライナ アット チャペル ヒル (52)
【氏名又は名称原語表記】THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL
【住所又は居所原語表記】308 Bynum Hall,Campus Box 4105,Chapel Hill,North Carolina 27599−4105, United States of America
【Fターム(参考)】
【公表日】平成20年2月7日(2008.2.7)
【国際特許分類】
【出願日】平成17年5月10日(2005.5.10)
【国際出願番号】PCT/US2005/016240
【国際公開番号】WO2005/118787
【国際公開日】平成17年12月15日(2005.12.15)
【出願人】(501345323)ザ ユニバーシティ オブ ノース カロライナ アット チャペル ヒル (52)
【氏名又は名称原語表記】THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL
【住所又は居所原語表記】308 Bynum Hall,Campus Box 4105,Chapel Hill,North Carolina 27599−4105, United States of America
【Fターム(参考)】
[ Back to top ]

